Другие названия и синонимы
Telmisartan.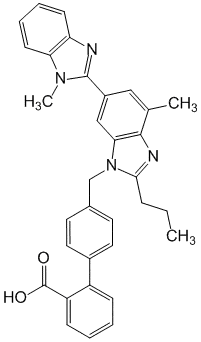
Фармакологическая группа
|
|
Латинское название
Telmisartanum ( Telmisartani).
Химическое название
4 -[[4-Метил-6-(1-метил-2-бензимидазолил)-2-пропил-1-бензимидазолил]метил]-2-бифенил-карбоновая кислота.
Используется в лечении
Код CAS
144701-48-4.
Фармакологическое действие
Антигипертензивное, блокирующее АТ1-рецепторы ангиотензина II, вазодилатирующее.
Характеристика вещества
Телмисартан - непептидный АРА II (тип AT1). Твердое вещество от белого до слегка желтоватого цвета, практически нерастворим в воде и при pH от 3 до 9 трудно растворим в сильных кислотах (за исключением соляной), растворим в сильных щелочах. Молекулярная масса - 514,63.
Фармакодинамика
Механизм действия.
Ангиотензин II образуется из ангиотензина I в реакции, катализируемой АПФ (кининаза II). Ангиотензин II является основным прессорным агентом РААС, его эффекты включают вазоконстрикцию, стимуляцию синтеза и высвобождения альдостерона, сердечную стимуляцию и реабсорбцию натрия в почках. Телмисартан блокирует сосудосуживающие и альдостеронсекретирующие эффекты ангиотензина II, избирательно блокируя связывание ангиотензина II с рецепторами AT1 во многих тканях, таких как гладкие мышцы сосудов и надпочечники. Его действие, таким образом, не зависит от путей синтеза ангиотензина II.
Во многих тканях обнаружены также рецепторы AT2, но их связь с сердечно-сосудистым гомеостазом не установлена. Телмисартан имеет гораздо большее сродство (>3000 раз) к рецепторам AT1, чем к рецепторам AT2.
Блокада РААС ингибиторами АПФ, ингибирующими биосинтез ангиотензина II из ангиотензина I, широко применяется при лечении гипертензии. Ингибиторы АПФ, кроме того, ингибируют деградацию брадикинина, реакцию, также катализируемую АПФ. Поскольку телмисартан не ингибирует АПФ (кининаза II), он не влияет на реакцию на брадикинин. Пока неизвестно, имеет ли это различие клиническое значение. Телмисартан не связывает и не блокирует рецепторы других гормонов или ионные каналы, которые, как известно, играют важную роль в регуляции функций ССС.
Блокада рецепторов ангиотензина II подавляет отрицательную регуляторную обратную связь ангиотензина II на секрецию ренина, но повышенная в результате активность ренина плазмы и уровни циркулирующего ангиотензина II не препятствуют эффекту телмисартана на АД.
Фармакодинамика.
У здоровых добровольцев телмисартан в дозе 80 мг ингибировал прессорный ответ на в/в инфузию ангиотензина II примерно на 90% при maxCmax в плазме, при этом ингибирование примерно на 40% сохранялось в течение 24.
Концентрация ангиотензина II в плазме и активность ренина в плазме увеличивались дозозависимым образом после однократного применения телмисартана у здоровых добровольцев и повторного применения у пациентов с гипертензией. Применение телмисартана в дозе до 80 мг 1 раз в день у здоровых добровольцев не влияло на концентрацию альдостерона в плазме. В исследованиях с множественными дозами у пациентов с гипертензией не было выявлено клинически значимых изменений электролитов (калий или натрий сыворотки) или метаболической функции (включая уровни Хс, триглицеридов, ЛПВП, ЛПНП, глюкозы или мочевой кислоты в сыворотке).
У 30 пациентов с гипертензией и нормальной функцией почек, получавших в течение 8 нед телмисартан 80 мг или телмисартан 80 мг в комбинации с гидрохлоротиазидом 12,5 мг, не было клинически значимых изменений почечного кровотока, СКФ, фракции фильтрации, реноваскулярного сопротивления или клиренса креатинина по сравнению с исходным уровнем.
Ангиотензин II образуется из ангиотензина I в реакции, катализируемой АПФ (кининаза II). Ангиотензин II является основным прессорным агентом РААС, его эффекты включают вазоконстрикцию, стимуляцию синтеза и высвобождения альдостерона, сердечную стимуляцию и реабсорбцию натрия в почках. Телмисартан блокирует сосудосуживающие и альдостеронсекретирующие эффекты ангиотензина II, избирательно блокируя связывание ангиотензина II с рецепторами AT1 во многих тканях, таких как гладкие мышцы сосудов и надпочечники. Его действие, таким образом, не зависит от путей синтеза ангиотензина II.
Во многих тканях обнаружены также рецепторы AT2, но их связь с сердечно-сосудистым гомеостазом не установлена. Телмисартан имеет гораздо большее сродство (>3000 раз) к рецепторам AT1, чем к рецепторам AT2.
Блокада РААС ингибиторами АПФ, ингибирующими биосинтез ангиотензина II из ангиотензина I, широко применяется при лечении гипертензии. Ингибиторы АПФ, кроме того, ингибируют деградацию брадикинина, реакцию, также катализируемую АПФ. Поскольку телмисартан не ингибирует АПФ (кининаза II), он не влияет на реакцию на брадикинин. Пока неизвестно, имеет ли это различие клиническое значение. Телмисартан не связывает и не блокирует рецепторы других гормонов или ионные каналы, которые, как известно, играют важную роль в регуляции функций ССС.
Блокада рецепторов ангиотензина II подавляет отрицательную регуляторную обратную связь ангиотензина II на секрецию ренина, но повышенная в результате активность ренина плазмы и уровни циркулирующего ангиотензина II не препятствуют эффекту телмисартана на АД.
Фармакодинамика.
У здоровых добровольцев телмисартан в дозе 80 мг ингибировал прессорный ответ на в/в инфузию ангиотензина II примерно на 90% при maxCmax в плазме, при этом ингибирование примерно на 40% сохранялось в течение 24.
Концентрация ангиотензина II в плазме и активность ренина в плазме увеличивались дозозависимым образом после однократного применения телмисартана у здоровых добровольцев и повторного применения у пациентов с гипертензией. Применение телмисартана в дозе до 80 мг 1 раз в день у здоровых добровольцев не влияло на концентрацию альдостерона в плазме. В исследованиях с множественными дозами у пациентов с гипертензией не было выявлено клинически значимых изменений электролитов (калий или натрий сыворотки) или метаболической функции (включая уровни Хс, триглицеридов, ЛПВП, ЛПНП, глюкозы или мочевой кислоты в сыворотке).
У 30 пациентов с гипертензией и нормальной функцией почек, получавших в течение 8 нед телмисартан 80 мг или телмисартан 80 мг в комбинации с гидрохлоротиазидом 12,5 мг, не было клинически значимых изменений почечного кровотока, СКФ, фракции фильтрации, реноваскулярного сопротивления или клиренса креатинина по сравнению с исходным уровнем.
Фармакокинетика
Абсорбция.
После перорального приема maxCmax телмисартана достигается через 0,5-1 Пища незначительно снижает биодоступность телмисартана с уменьшением AUC примерно на 6% при дозе 40 мг и примерно на 20% при дозе 160 мг. Абсолютная биодоступность телмисартана зависит от дозы. При 40 и 160 мг биодоступность составляет 42 и 58% соответственно. При пероральном применении телмисартана его фармакокинетика нелинейна в диапазоне доз от 20 до 160 мг, с более чем пропорциональным увеличением концентраций в плазме (Cmax и AUC) с увеличением доз. Телмисартан демонстрирует биэкспоненциальную кинетику распада с конечным Т1/2 примерно 24 сmin телмисартана в плазме при приеме 1 раз в сутки составляет примерно от 10 до 25% maxCmax. Телмисартан имеет индекс кумуляции в плазме от 1,5 до 2 при повторном приеме 1 раз в сутки.
Распределение.
Связывание телмисартана с белками плазмы высокое (>99,5%), преимущественно с альбумином и альфа1-кислым гликопротеином. Связывание с белками плазмы остается постоянным в диапазоне концентраций, достигаемом при приеме рекомендуемых доз. dVd телмисартана - примерно 500 л, что свидетельствует о дополнительном связывании с тканями.
Метаболизм и выведение.
После в/в или перорального применения телмисартана, меченого 14C, бóльшая часть введенной дозы (>97%) выводилась в неизмененном виде через желчевыводящие пути с фекалиями; в моче были обнаружены лишь незначительные количества (0,91 и 0,49% общей радиоактивности соответственно).
Телмисартан метаболизируется путем конъюгации с образованием фармакологически неактивного ацилглюкуронида; глюкуронид исходного соединения является единственным метаболитом, который был идентифицирован в плазме и моче человека. После однократного приема глюкуронид составляет примерно 11% измеренной радиоактивности в плазме. Изоферменты цитохрома P450 не участвуют в метаболизме телмисартана.
Общий плазменный клиренс телмисартана составляет >800 мл/мин. Конечный Т1/2 и общий клиренс не зависят от дозы.
Особые группы пациентов.
Нарушение функции почек. У пациентов со сниженной функцией почек корректировка дозы не требуется. Телмисартан не удаляется из крови путем гемофильтрации ( см «Меры предосторожности»).
Нарушение функции печени. У пациентов с нарушением функции печени концентрации телмисартана в плазме увеличиваются, а абсолютная биодоступность приближается к 100% ( см «Меры предосторожности»).
Пол. Концентрации телмисартана в плазме крови у женщин обычно в 2-3 раза выше, чем у мужчин. Однако в клинических испытаниях у женщин не было обнаружено значительного увеличения ответа АД или частоты возникновения ортостатической гипотензии. Коррекция дозы не требуется.
Применение в гериатрии. Фармакокинетика телмисартана не различается у пожилых людей и людей моложе 65 лет.
Применение в педиатрии. Фармакокинетику телмисартана не исследовали у пациентов в возрасте <18 лет.
Доклиническая токсикология.
Канцерогенность, мутагенность, влияние на фертильность.
Не было выявлено канцерогенности при введении телмисартана с пищей мышам и крысам в течение периода до 2 лет. Наивысшие дозы, вводимые мышам (1000 мг/кг/сут) и крысам (100 мг/кг/сут), на основе мг/м2, составляют примерно 59 и 13 МРДЧ соответственно. Эти же дозы, как было показано, обеспечивают среднюю системную экспозицию телмисартана, превышающую в >100 раз и >25 раз соответственно системную экспозицию у людей, получающих МРДЧ телмисартана (80 мг/сут).
Исследование генотоксичности не выявило каких-либо эффектов, связанных с телмисартаном, ни на генном уровне, ни на уровне хромосом. Эти исследования включали тесты на бактериальную мутагенность с Salmonella и E.coli (Ames), тест генных мутаций на клетках китайского хомячка линии V79, цитогенетический тест на клетках лимфоцитов человека и микроядерный тест у мышей.
Каких-либо связанных с ЛС эффектов на репродуктивную функцию самцов и самок крыс не было отмечено при дозе 100 мг/кг/сут (наивысшая тестируемая доза), что примерно в 13 раз превышает МРДЧ телмисартана на основе мг/м2. Эта доза у крыс приводила к средней системной экспозиции (AUC телмисартана, определенная на 6-й день беременности), по крайней мере в 50 раз превышающей среднюю системную экспозицию у человека при МРДЧ (80 мг/сут).
Клинические исследования.
Гипертензия.
Антигипертензивный эффект телмисартана был продемонстрирован в 6 основных плацебо-контролируемых клинических испытаниях, в которых изучали дозы от 20 до 160 мг; в одном из них оценивали антигипертензивные эффекты телмисартана и гидрохлоротиазида в комбинации. В исследованиях приняли участие 1773 пациента с гипертензией легкой и средней степени (дАД от 95 до 114 мм ), 1031 из которых получали телмисартан. После ежедневного приема телмисартана величина снижения АД от исходного уровня после вычитания плацебо составляла приблизительно (сАД/дАД) 6-8/6 мм при дозе 20 мг, 9-13/6-8 мм при дозе 40 мг и 12-13/7-8 мм при дозе 80 мг. Более высокие дозы (до 160 мг) не вызывали дальнейшего снижения АД.
После начала антигипертензивной терапии телмисартаном АД снижалось после приема первой дозы с максимальным снижением примерно через 4 нед. При прекращении приема телмисартана в форме таблеток АД постепенно возвращалось к исходным значениям в течение периода от нескольких дней до 1 нед. Во время длительных исследований (без контроля плацебо) эффект телмисартана сохранялся по крайней мере до 1 года. Антигипертензивный эффект телмисартана не зависит от возраста, пола, веса или ИМТ пациента. Реакция АД у темнокожих пациентов (обычно популяция с низким содержанием ренина) заметно ниже, чем у белокожих пациентов. Это верно для большинства, но не для всех АРА II и ингибиторов АПФ.
В контролируемом исследовании добавление телмисартана к гидрохлоротиазиду приводило к дополнительному дозозависимому снижению АД, которое было сходно с величиной снижения, достигаемой при монотерапии телмисартаном. Гидрохлоротиазид также оказывал дополнительное влияние на АД при добавлении к телмисартану.
Начало антигипертензивной активности отмечается в течение 3 ч после приема однократной пероральной дозы. При приеме телмисартана 1 раз в день в дозах 20, 40 и 80 мг антигипертензивный эффект сохраняется в течение всего 24-часового интервала. При суточном амбулаторном мониторинге АД и обычных измерениях АД отношение минимума к пику за 24 ч при дозах телмисартана от 40 до 80 мг составляло 70-100% как для сАД, так и для дАД. Частота симптоматического ортостаза после приема первой дозы во всех контролируемых исследованиях была низкой (0,04%).
В контролируемых исследованиях не было отмечено изменения ЧСС у пациентов, получавших телмисартан.
Испытаний телмисартана, демонстрирующих снижение риска сердечно-сосудистых заболеваний у пациентов с гипертензией, нет, но по крайней мере один фармакологически подобный препарат продемонстрировал такие преимущества.
Снижение АД уменьшает риск смертельных и нефатальных сердечно-сосудистых событий, в первую очередь инсультов и инфарктов миокарда. Эти преимущества были отмечены в контролируемых испытаниях антигипертензивных ЛС из широкого спектра фармакологических классов, включая класс, к которому принадлежит телмисартан.
Контроль высокого АД должен быть частью комплексного управления риском сердечно-сосудистых заболеваний, включая при необходимости контроль уровня липидов, контроль диабета, антитромботическую терапию, отказ от курения, физические упражнения и ограниченное потребление натрия. Многим пациентам для достижения целевого АД может потребоваться более одного ЛС.
В рандомизированных контролируемых исследованиях было показано, что многочисленные антигипертензивные ЛС из различных фармакологических классов и с различными механизмами действия снижают сердечно-сосудистую заболеваемость и смертность, и можно заключить, что именно снижение АД, а не какое-либо другое фармакологическое свойство ЛС в значительной степени ответственно за это преимущество. Самым большим и наиболее стойким преимуществом в отношении сердечно-сосудистых заболеваний было снижение риска инсульта, но также регулярно наблюдалось снижение инфаркта миокарда и смертности от сердечно-сосудистых заболеваний.
Повышенное сАД или дАД вызывают повышение риска сердечно-сосудистых заболеваний, а абсолютное увеличение риска (в мм ) больше при более высоком АД, так что даже умеренное снижение тяжелой гипертензии может дать существенную пользу. Снижение относительного риска при снижении АД одинаково для разных групп населения с различным абсолютным риском, поэтому абсолютная польза больше у пациентов с повышенным риском, независимо от их гипертензии (например, пациенты с диабетом или гиперлипидемией), и можно ожидать, что у таких пациентов будет эффективным более агрессивное лечение для снижения АД.
Некоторые антигипертензивные ЛС оказывают меньшее влияние на АД (при монотерапии) у темнокожих пациентов, а многие антигипертензивные ЛС имеют дополнительные одобренные показания и эффекты (например, при стенокардии, сердечной недостаточности или диабетической болезни почек). Эти соображения могут определять выбор терапии.
Снижение сердечно-сосудистого риска.
Основание для применения с целью снижения риска сердечно-сосудистых событий было получено в двух исследованиях. Оба исследования включали пациентов в возрасте ≥55 лет с высоким риском сердечно-сосудистых осложнений, о чем свидетельствовали наличие ИБС (75%), сахарного диабета (27%), сопровождающегося поражением органов-мишеней (например, ретинопатия, гипертрофия левого желудочка и только в исследовании ONTARGET - макро- или микроальбуминурия), инсульта (16%), заболевания периферических сосудов (13%) или транзиторной ишемической атаки (4%). Пациенты без непереносимости ингибиторов АПФ в анамнезе были включены в исследование ONTARGET, а пациенты с таким анамнезом, обычно с кашлем (90%), были включены в исследование TRANSCEND, но пациенты с протеинурией >1+ на тест-полоске были исключены из исследования TRANSCEND. В обоих исследованиях, ONTARGET и TRANSCEND, первичной 4-компонентной комбинированной конечной точкой была смертность вследствие сердечно-сосудистых событий, инфаркт миокарда, инсульт и госпитализация в связи с сердечной недостаточностью. Вторичной 3-компонентной комбинированной конечной точкой была смертность от сердечно-сосудистых причин, инфаркт миокарда и инсульт.
Исследование ONTARGET было рандомизированным, актив-контролируемым многонациональным двойным слепым исследованием с участием 25620 пациентов, которые были рандомизированы для приема телмисартана 80 мг, рамиприла 10 мг или их комбинации. В исследуемой популяции было 73% мужчин, 74% европеоидов, 14% азиатов и 57% пациентов в возрасте 65 лет и старше. Базовая терапия включала ацетилсалициловую кислоту (76%), гиполипидемические средства (64%), бета-адреноблокаторы (57%), БКК (34%), нитраты (29%) и диуретики (28%). Среднее АД при рандомизации составляло 134/77 мм Средняя продолжительность наблюдения составила около 4 лет и 6 мес. В ходе исследования 22% (n=1878) пациентов, принимавших телмисартан, прекратили активное лечение по сравнению с 24,4% (n=2095) пациентов, принимавших рамиприл, и 25,3% (n=2152) пациентов, принимавших телмисартан/рамиприл.
В исследовании TRANSCEND пациенты были рандомизированы для получения телмисартана 80 мг (n=2954) или плацебо (n=2972). Средняя продолжительность наблюдения составила 4 года и 8 мес. В исследуемой популяции было 57% мужчин, 62% европеоидов, 21% азиатов и 60% пациентов в возрасте 65 лет и старше. Базовая терапия включала ацетилсалициловую кислоту (75%), гиполипидемические средства (58%), бета-адреноблокаторы (58%), БКК (41%), нитраты (34%) и диуретики (33%). Среднее АД при рандомизации составляло 135/78 мм Во время исследования 17,7% (n=523) пациентов, принимавших телмисартан, прекратили активное лечение по сравнению с 19,4% (n=576) пациентов, получавших плацебо.
Результаты исследования TRANSCEND приведены в таблице 1, а результаты исследования ONTARGET - в таблице 2 ниже.
Таблица 1.
Частота первичных и вторичных исходов в исследовании TRANSCEND.
1 Первичная конечная точка была определена как время до первого события. В случае нескольких одновременных событий учитывались все индивидуальные события; количество пациентов с индивидуальными исходами может превышать количество пациентов с комбинированными (первичными или вторичными) исходами.
2 Для отдельных компонентов первичной комбинированной конечной точки учитывались все события, независимо от того, были ли они или нет первым событием. Поэтому они представляют собой большее, чем первые события, учитываемые для первичной или вторичной комбинированной конечной точки.
Таблица 2.
Частота первичных и вторичных исходов в исследовании ONTARGET.
Хотя частота событий в исследовании ONTARGET была схожей для телмисартана и рамиприла, на основании результатов нельзя сделать однозначный вывод, что телмисартан может не сохранить значительную долю эффекта рамиприла в снижении сердечно-сосудистых событий. Однако результаты как ONTARGET, так и TRANSCEND адекватно подтверждают, что телмисартан более эффективен, чем плацебо в этих условиях, особенно в отношении конечной точки времени до смерти от сердечно-сосудистых заболеваний, инфаркта миокарда или инсульта.
В исследовании ONTARGET не было доказательств того, что сочетание рамиприла и телмисартана снижает риск смертности от сердечно-сосудистых причин, инфаркта миокарда, инсульта или госпитализации по поводу сердечной недостаточности, больше, чем только у рамиприла; кроме того, у пациентов, получавших комбинацию рамиприла и телмисартана в исследовании ONTARGET, наблюдалось повышение частоты клинически значимых нарушений функции почек (например, острой почечной недостаточности) по сравнению с пациентами, получавшими только телмисартан или только рамиприл.
Анализ нескольких подгрупп не продемонстрировал каких-либо различий в 4-компонентной комбинированной первичной конечной точке в зависимости от возраста, пола или этнической принадлежности ни в исследовании ONTARGET, ни в исследовании TRANSCEND.
После перорального приема maxCmax телмисартана достигается через 0,5-1 Пища незначительно снижает биодоступность телмисартана с уменьшением AUC примерно на 6% при дозе 40 мг и примерно на 20% при дозе 160 мг. Абсолютная биодоступность телмисартана зависит от дозы. При 40 и 160 мг биодоступность составляет 42 и 58% соответственно. При пероральном применении телмисартана его фармакокинетика нелинейна в диапазоне доз от 20 до 160 мг, с более чем пропорциональным увеличением концентраций в плазме (Cmax и AUC) с увеличением доз. Телмисартан демонстрирует биэкспоненциальную кинетику распада с конечным Т1/2 примерно 24 сmin телмисартана в плазме при приеме 1 раз в сутки составляет примерно от 10 до 25% maxCmax. Телмисартан имеет индекс кумуляции в плазме от 1,5 до 2 при повторном приеме 1 раз в сутки.
Распределение.
Связывание телмисартана с белками плазмы высокое (>99,5%), преимущественно с альбумином и альфа1-кислым гликопротеином. Связывание с белками плазмы остается постоянным в диапазоне концентраций, достигаемом при приеме рекомендуемых доз. dVd телмисартана - примерно 500 л, что свидетельствует о дополнительном связывании с тканями.
Метаболизм и выведение.
После в/в или перорального применения телмисартана, меченого 14C, бóльшая часть введенной дозы (>97%) выводилась в неизмененном виде через желчевыводящие пути с фекалиями; в моче были обнаружены лишь незначительные количества (0,91 и 0,49% общей радиоактивности соответственно).
Телмисартан метаболизируется путем конъюгации с образованием фармакологически неактивного ацилглюкуронида; глюкуронид исходного соединения является единственным метаболитом, который был идентифицирован в плазме и моче человека. После однократного приема глюкуронид составляет примерно 11% измеренной радиоактивности в плазме. Изоферменты цитохрома P450 не участвуют в метаболизме телмисартана.
Общий плазменный клиренс телмисартана составляет >800 мл/мин. Конечный Т1/2 и общий клиренс не зависят от дозы.
Особые группы пациентов.
Нарушение функции почек. У пациентов со сниженной функцией почек корректировка дозы не требуется. Телмисартан не удаляется из крови путем гемофильтрации ( см «Меры предосторожности»).
Нарушение функции печени. У пациентов с нарушением функции печени концентрации телмисартана в плазме увеличиваются, а абсолютная биодоступность приближается к 100% ( см «Меры предосторожности»).
Пол. Концентрации телмисартана в плазме крови у женщин обычно в 2-3 раза выше, чем у мужчин. Однако в клинических испытаниях у женщин не было обнаружено значительного увеличения ответа АД или частоты возникновения ортостатической гипотензии. Коррекция дозы не требуется.
Применение в гериатрии. Фармакокинетика телмисартана не различается у пожилых людей и людей моложе 65 лет.
Применение в педиатрии. Фармакокинетику телмисартана не исследовали у пациентов в возрасте <18 лет.
Доклиническая токсикология.
Канцерогенность, мутагенность, влияние на фертильность.
Не было выявлено канцерогенности при введении телмисартана с пищей мышам и крысам в течение периода до 2 лет. Наивысшие дозы, вводимые мышам (1000 мг/кг/сут) и крысам (100 мг/кг/сут), на основе мг/м2, составляют примерно 59 и 13 МРДЧ соответственно. Эти же дозы, как было показано, обеспечивают среднюю системную экспозицию телмисартана, превышающую в >100 раз и >25 раз соответственно системную экспозицию у людей, получающих МРДЧ телмисартана (80 мг/сут).
Исследование генотоксичности не выявило каких-либо эффектов, связанных с телмисартаном, ни на генном уровне, ни на уровне хромосом. Эти исследования включали тесты на бактериальную мутагенность с Salmonella и E.coli (Ames), тест генных мутаций на клетках китайского хомячка линии V79, цитогенетический тест на клетках лимфоцитов человека и микроядерный тест у мышей.
Каких-либо связанных с ЛС эффектов на репродуктивную функцию самцов и самок крыс не было отмечено при дозе 100 мг/кг/сут (наивысшая тестируемая доза), что примерно в 13 раз превышает МРДЧ телмисартана на основе мг/м2. Эта доза у крыс приводила к средней системной экспозиции (AUC телмисартана, определенная на 6-й день беременности), по крайней мере в 50 раз превышающей среднюю системную экспозицию у человека при МРДЧ (80 мг/сут).
Клинические исследования.
Гипертензия.
Антигипертензивный эффект телмисартана был продемонстрирован в 6 основных плацебо-контролируемых клинических испытаниях, в которых изучали дозы от 20 до 160 мг; в одном из них оценивали антигипертензивные эффекты телмисартана и гидрохлоротиазида в комбинации. В исследованиях приняли участие 1773 пациента с гипертензией легкой и средней степени (дАД от 95 до 114 мм ), 1031 из которых получали телмисартан. После ежедневного приема телмисартана величина снижения АД от исходного уровня после вычитания плацебо составляла приблизительно (сАД/дАД) 6-8/6 мм при дозе 20 мг, 9-13/6-8 мм при дозе 40 мг и 12-13/7-8 мм при дозе 80 мг. Более высокие дозы (до 160 мг) не вызывали дальнейшего снижения АД.
После начала антигипертензивной терапии телмисартаном АД снижалось после приема первой дозы с максимальным снижением примерно через 4 нед. При прекращении приема телмисартана в форме таблеток АД постепенно возвращалось к исходным значениям в течение периода от нескольких дней до 1 нед. Во время длительных исследований (без контроля плацебо) эффект телмисартана сохранялся по крайней мере до 1 года. Антигипертензивный эффект телмисартана не зависит от возраста, пола, веса или ИМТ пациента. Реакция АД у темнокожих пациентов (обычно популяция с низким содержанием ренина) заметно ниже, чем у белокожих пациентов. Это верно для большинства, но не для всех АРА II и ингибиторов АПФ.
В контролируемом исследовании добавление телмисартана к гидрохлоротиазиду приводило к дополнительному дозозависимому снижению АД, которое было сходно с величиной снижения, достигаемой при монотерапии телмисартаном. Гидрохлоротиазид также оказывал дополнительное влияние на АД при добавлении к телмисартану.
Начало антигипертензивной активности отмечается в течение 3 ч после приема однократной пероральной дозы. При приеме телмисартана 1 раз в день в дозах 20, 40 и 80 мг антигипертензивный эффект сохраняется в течение всего 24-часового интервала. При суточном амбулаторном мониторинге АД и обычных измерениях АД отношение минимума к пику за 24 ч при дозах телмисартана от 40 до 80 мг составляло 70-100% как для сАД, так и для дАД. Частота симптоматического ортостаза после приема первой дозы во всех контролируемых исследованиях была низкой (0,04%).
В контролируемых исследованиях не было отмечено изменения ЧСС у пациентов, получавших телмисартан.
Испытаний телмисартана, демонстрирующих снижение риска сердечно-сосудистых заболеваний у пациентов с гипертензией, нет, но по крайней мере один фармакологически подобный препарат продемонстрировал такие преимущества.
Снижение АД уменьшает риск смертельных и нефатальных сердечно-сосудистых событий, в первую очередь инсультов и инфарктов миокарда. Эти преимущества были отмечены в контролируемых испытаниях антигипертензивных ЛС из широкого спектра фармакологических классов, включая класс, к которому принадлежит телмисартан.
Контроль высокого АД должен быть частью комплексного управления риском сердечно-сосудистых заболеваний, включая при необходимости контроль уровня липидов, контроль диабета, антитромботическую терапию, отказ от курения, физические упражнения и ограниченное потребление натрия. Многим пациентам для достижения целевого АД может потребоваться более одного ЛС.
В рандомизированных контролируемых исследованиях было показано, что многочисленные антигипертензивные ЛС из различных фармакологических классов и с различными механизмами действия снижают сердечно-сосудистую заболеваемость и смертность, и можно заключить, что именно снижение АД, а не какое-либо другое фармакологическое свойство ЛС в значительной степени ответственно за это преимущество. Самым большим и наиболее стойким преимуществом в отношении сердечно-сосудистых заболеваний было снижение риска инсульта, но также регулярно наблюдалось снижение инфаркта миокарда и смертности от сердечно-сосудистых заболеваний.
Повышенное сАД или дАД вызывают повышение риска сердечно-сосудистых заболеваний, а абсолютное увеличение риска (в мм ) больше при более высоком АД, так что даже умеренное снижение тяжелой гипертензии может дать существенную пользу. Снижение относительного риска при снижении АД одинаково для разных групп населения с различным абсолютным риском, поэтому абсолютная польза больше у пациентов с повышенным риском, независимо от их гипертензии (например, пациенты с диабетом или гиперлипидемией), и можно ожидать, что у таких пациентов будет эффективным более агрессивное лечение для снижения АД.
Некоторые антигипертензивные ЛС оказывают меньшее влияние на АД (при монотерапии) у темнокожих пациентов, а многие антигипертензивные ЛС имеют дополнительные одобренные показания и эффекты (например, при стенокардии, сердечной недостаточности или диабетической болезни почек). Эти соображения могут определять выбор терапии.
Снижение сердечно-сосудистого риска.
Основание для применения с целью снижения риска сердечно-сосудистых событий было получено в двух исследованиях. Оба исследования включали пациентов в возрасте ≥55 лет с высоким риском сердечно-сосудистых осложнений, о чем свидетельствовали наличие ИБС (75%), сахарного диабета (27%), сопровождающегося поражением органов-мишеней (например, ретинопатия, гипертрофия левого желудочка и только в исследовании ONTARGET - макро- или микроальбуминурия), инсульта (16%), заболевания периферических сосудов (13%) или транзиторной ишемической атаки (4%). Пациенты без непереносимости ингибиторов АПФ в анамнезе были включены в исследование ONTARGET, а пациенты с таким анамнезом, обычно с кашлем (90%), были включены в исследование TRANSCEND, но пациенты с протеинурией >1+ на тест-полоске были исключены из исследования TRANSCEND. В обоих исследованиях, ONTARGET и TRANSCEND, первичной 4-компонентной комбинированной конечной точкой была смертность вследствие сердечно-сосудистых событий, инфаркт миокарда, инсульт и госпитализация в связи с сердечной недостаточностью. Вторичной 3-компонентной комбинированной конечной точкой была смертность от сердечно-сосудистых причин, инфаркт миокарда и инсульт.
Исследование ONTARGET было рандомизированным, актив-контролируемым многонациональным двойным слепым исследованием с участием 25620 пациентов, которые были рандомизированы для приема телмисартана 80 мг, рамиприла 10 мг или их комбинации. В исследуемой популяции было 73% мужчин, 74% европеоидов, 14% азиатов и 57% пациентов в возрасте 65 лет и старше. Базовая терапия включала ацетилсалициловую кислоту (76%), гиполипидемические средства (64%), бета-адреноблокаторы (57%), БКК (34%), нитраты (29%) и диуретики (28%). Среднее АД при рандомизации составляло 134/77 мм Средняя продолжительность наблюдения составила около 4 лет и 6 мес. В ходе исследования 22% (n=1878) пациентов, принимавших телмисартан, прекратили активное лечение по сравнению с 24,4% (n=2095) пациентов, принимавших рамиприл, и 25,3% (n=2152) пациентов, принимавших телмисартан/рамиприл.
В исследовании TRANSCEND пациенты были рандомизированы для получения телмисартана 80 мг (n=2954) или плацебо (n=2972). Средняя продолжительность наблюдения составила 4 года и 8 мес. В исследуемой популяции было 57% мужчин, 62% европеоидов, 21% азиатов и 60% пациентов в возрасте 65 лет и старше. Базовая терапия включала ацетилсалициловую кислоту (75%), гиполипидемические средства (58%), бета-адреноблокаторы (58%), БКК (41%), нитраты (34%) и диуретики (33%). Среднее АД при рандомизации составляло 135/78 мм Во время исследования 17,7% (n=523) пациентов, принимавших телмисартан, прекратили активное лечение по сравнению с 19,4% (n=576) пациентов, получавших плацебо.
Результаты исследования TRANSCEND приведены в таблице 1, а результаты исследования ONTARGET - в таблице 2 ниже.
Таблица 1.
Частота первичных и вторичных исходов в исследовании TRANSCEND.
| Телмисартан (n=2954) vs плацебо (n=2972) | |||
| Количество событий телмисартан/плацебо | Отношение рисков (95% ДИ) | p-значение | |
| Комбинированная смертность от сердечно-сосудистых причин, инфаркта миокарда, инсульта или госпитализация по поводу сердечной недостаточности1 | 465 (15,7%)/504 (17%) | 0,92 (0,81-1,05) | 0,2129 |
| Комбинированная смертность от сердечно-сосудистых причин, инфаркта миокарда или инсульта1 | 384 (13%)/440 (4,8%) | 0,87 (0,76-1) | 0,0483 |
| Индивидуальные компоненты первичной комбинированной конечной точки | Количество событий телмисартан/плацебо | Отношение рисков (95% ДИ) | p-значение |
| Все нефатальные инфаркты миокарда2 | 114 (3,9%)/145 (4,9%) | 0,79 (0,62-1,01) | 0,0574 |
| Все нефатальные инсульты2 | 112 (3,8%)/136 (4,6%) | 0,83 (0,64-1,06) | 0,1364 |
1 Первичная конечная точка была определена как время до первого события. В случае нескольких одновременных событий учитывались все индивидуальные события; количество пациентов с индивидуальными исходами может превышать количество пациентов с комбинированными (первичными или вторичными) исходами.
2 Для отдельных компонентов первичной комбинированной конечной точки учитывались все события, независимо от того, были ли они или нет первым событием. Поэтому они представляют собой большее, чем первые события, учитываемые для первичной или вторичной комбинированной конечной точки.
Таблица 2.
Частота первичных и вторичных исходов в исследовании ONTARGET.
| Телмисартан (n=8542) vs рамиприл (n=8576) | ||
| Количество событий телмисартан/рамиприл | Отношение рисков (95% ДИ) | |
| Комбинированная смертность от сердечно-сосудистых причин, инфаркта миокарда, инсульта или госпитализация по поводу сердечной недостаточности | 1423 (16,7%)/1412 (16,5%) | 1,01 (0,93-1,1) |
| Комбинированная смертность от сердечно-сосудистых причин, инфаркта миокарда или инсульта | 1190 (13,9%)/1210 (14,1%) | 0,99 (0,9-1, 08) |
Хотя частота событий в исследовании ONTARGET была схожей для телмисартана и рамиприла, на основании результатов нельзя сделать однозначный вывод, что телмисартан может не сохранить значительную долю эффекта рамиприла в снижении сердечно-сосудистых событий. Однако результаты как ONTARGET, так и TRANSCEND адекватно подтверждают, что телмисартан более эффективен, чем плацебо в этих условиях, особенно в отношении конечной точки времени до смерти от сердечно-сосудистых заболеваний, инфаркта миокарда или инсульта.
В исследовании ONTARGET не было доказательств того, что сочетание рамиприла и телмисартана снижает риск смертности от сердечно-сосудистых причин, инфаркта миокарда, инсульта или госпитализации по поводу сердечной недостаточности, больше, чем только у рамиприла; кроме того, у пациентов, получавших комбинацию рамиприла и телмисартана в исследовании ONTARGET, наблюдалось повышение частоты клинически значимых нарушений функции почек (например, острой почечной недостаточности) по сравнению с пациентами, получавшими только телмисартан или только рамиприл.
Анализ нескольких подгрупп не продемонстрировал каких-либо различий в 4-компонентной комбинированной первичной конечной точке в зависимости от возраста, пола или этнической принадлежности ни в исследовании ONTARGET, ни в исследовании TRANSCEND.
|
|
Показания к применению
Гипертензия.
Телмисартан показан при лечении гипертензии для снижения АД.
Телмисартан можно применять отдельно или в комбинации с другими антигипертензивными ЛС.
Снижение сердечно-сосудистого риска.
Телмисартан показан для снижения риска инфаркта миокарда. инсульта или смерти от сердечно-сосудистых причин у пациентов в возрасте 55 лет и старше с высоким риском развития серьезных сердечно-сосудистых событий. которые не могут принимать ингибиторы АПФ.
Высокий риск сердечно-сосудистых событий может быть подтвержден наличием в анамнезе ИБС. заболевания периферических артерий. инсульта.транзиторной ишемической атаки или высокого риска диабета (инсулинозависимого или инсулинонезависимого) с признаками поражения органов-мишеней ( см Клинические исследования)Телмисартан можно применять в дополнение к другому необходимому лечению (например, антигипертензивной, антиагрегантной или гиполипидемической терапии) ( см Клинические исследования).
Исследования телмисартана в этих условиях не исключают того, что телмисартан может не сохранять значительную долю эффекта ингибитора АПФ, с которым его сравнивали. Сначала необходимо рассмотреть возможность применения ингибитора АПФ, и если его прием был прекращен только из-за кашля, следует еще раз попробовать применение ингибитора АПФ после того, как кашель пройдет.
Использование телмисартана с ингибитором АПФ не рекомендуется ( см «Меры предосторожности»).
Телмисартан показан при лечении гипертензии для снижения АД.
Телмисартан можно применять отдельно или в комбинации с другими антигипертензивными ЛС.
Снижение сердечно-сосудистого риска.
Телмисартан показан для снижения риска инфаркта миокарда. инсульта или смерти от сердечно-сосудистых причин у пациентов в возрасте 55 лет и старше с высоким риском развития серьезных сердечно-сосудистых событий. которые не могут принимать ингибиторы АПФ.
Высокий риск сердечно-сосудистых событий может быть подтвержден наличием в анамнезе ИБС. заболевания периферических артерий. инсульта.транзиторной ишемической атаки или высокого риска диабета (инсулинозависимого или инсулинонезависимого) с признаками поражения органов-мишеней ( см Клинические исследования)Телмисартан можно применять в дополнение к другому необходимому лечению (например, антигипертензивной, антиагрегантной или гиполипидемической терапии) ( см Клинические исследования).
Исследования телмисартана в этих условиях не исключают того, что телмисартан может не сохранять значительную долю эффекта ингибитора АПФ, с которым его сравнивали. Сначала необходимо рассмотреть возможность применения ингибитора АПФ, и если его прием был прекращен только из-за кашля, следует еще раз попробовать применение ингибитора АПФ после того, как кашель пройдет.
Использование телмисартана с ингибитором АПФ не рекомендуется ( см «Меры предосторожности»).
Противопоказания
Телмисартан противопоказан пациентам с известной гиперчувствительностью (например, анафилаксия или ангионевротический отек).
Не следует применять алискирен одновременно с телмисартаном у пациентов с диабетом ( см «Взаимодействие»).
Не следует применять алискирен одновременно с телмисартаном у пациентов с диабетом ( см «Взаимодействие»).
При беременности и кормлении грудью
Беременность.
Резюме рисков.
Телмисартан может нанести вред плоду при применении беременной женщиной. Применение ЛС, влияющих на РААС во II и III триместрах беременности, снижает функцию почек плода и увеличивает заболеваемость и смертность плода и новорожденного ( см Клинические соображения). В большинстве эпидемиологических исследований, посвященных изучению аномалий плода после экспозиции антигипертензивных средств в I триместре беременности, не обнаружено отличий ЛС, влияющих на РААС, от других антигипертензивных средств. Исследования у крыс и кроликов показали фетотоксичность телмисартана только в дозах, токсичных для матери ( см Данные). При установлении беременности необходимо как можно скорее прекратить прием телмисартана.
Предполагаемый фоновый риск серьезных врожденных дефектов и выкидыша для указанной популяции неизвестен. При любой беременности существует фоновый риск развития врожденного порока, выкидыша или других неблагоприятных исходов. В общей популяции в США оцениваемый фоновый уровень риска серьезных врожденных пороков развития и выкидыша при клинически установленной беременности составляет 2-4 и 15-20% соответственно.
Клинические соображения.
Ассоциированный с заболеванием риск для матери и/или эмбриона/плода. Гипертензия во время беременности увеличивает риск преэклампсии, гестационного диабета, преждевременных родов и осложнений при родах для матери (например, необходимость кесарева сечения и послеродовое кровотечение). Гипертензия увеличивает риск задержки внутриутробного развития плода и внутриутробной смерти. У беременных женщин с гипертензией должен осуществляться тщательный мониторинг и соответствующее лечение.
Побочные реакции плода/новорожденного.
Применение ЛС, действующих на РААС, во II и III триместрах беременности может привести к следующему: маловодие, снижение функции почек плода, приводящее к анурии и почечной недостаточности, гипоплазия легких плода, деформации скелета, включая гипоплазию черепа, гипотензию и смерть. В случае отсутствия подходящей альтернативы терапии ЛС, влияющими на РААС, у конкретной пациентки, женщина должна быть предупреждена о потенциальном риске для плода.
Пациенткам, принимающим телмисартан во время беременности, необходимо выполнять серийные УЗИ для оценки внутриамниотической среды. В зависимости от срока беременности, может потребоваться тестирование плода. При возникновении маловодия следует прекратить прием телмисартана, если это не считается спасением жизни матери. Однако следует иметь в виду, что маловодие может появиться только после того, как плод получит необратимое повреждение.
Необходимо тщательное наблюдение за состоянием младенцев, которые in utero подверглись экспозиции телмисартана, на предмет развития гипертензии, олигурии и гиперкалиемии. При возникновении олигурии или гипотензии необходимы поддержание АД и почечная перфузия. Могут потребоваться обменное переливание крови или диализ для реверсии гипотензии и/или поддержания нарушенной функции почек.
Данные.
Данные у животных. Тератогенных эффектов не наблюдалось при пероральном применении телмисартана в дозах до 50 мг/кг/сут у беременных крыс и в дозах до 45 мг/кг/сут у беременных крольчих. У крольчих эмбриолетальность, ассоциированная с материнской токсичностью (снижение прироста массы тела и потребления пищи), наблюдалась при дозе 45 мг/кг/сут (примерно в 12 раз больше МРДЧ 80 мг на основе мг/м2). У крыс телмисартан при дозах 15 мг/кг/сут (примерно в 1,9 раза больше МРДЧ на основе мг/м2), вызывающих материнскую токсичность (снижение прироста массы тела и потребления пищи), при применении на поздних сроках беременности и кормления грудью, вызывал неблагоприятные эффекты у новорожденных, включая снижение жизнеспособности, низкую массу тела при рождении, задержку созревания и снижение прибавки массы тела. Дозы, при которых не наблюдалось эффекта токсичности для развития у крыс и кроликов, 5 и 15 мг/кг/сут соответственно, примерно в 0,64 и 3,7 раза превышают МРДЧ телмисартана на основе мг/м2 (80 мг/сут).
Грудное вскармливание.
Резюме рисков.
Нет информации о присутствии телмисартана в грудном молоке, его влиянии на грудного ребенка или воздействии на выработку молока. Телмисартан присутствует в молоке лактирующих крыс ( см Данные). Из-за возможности серьезных побочных реакций у младенцев, находящихся на грудном вскармливании, включая гипотензию, гиперкалиемию и нарушение функции почек, рекомендуется прекратить грудное вскармливание во время лечения телмисартаном.
Данные.
Телмисартан обнаруживался в молоке лактирующих крыс в концентрациях, в 1,5-2 раза превышающих концентрацию в плазме, через 4-8 ч после применения.
Резюме рисков.
Телмисартан может нанести вред плоду при применении беременной женщиной. Применение ЛС, влияющих на РААС во II и III триместрах беременности, снижает функцию почек плода и увеличивает заболеваемость и смертность плода и новорожденного ( см Клинические соображения). В большинстве эпидемиологических исследований, посвященных изучению аномалий плода после экспозиции антигипертензивных средств в I триместре беременности, не обнаружено отличий ЛС, влияющих на РААС, от других антигипертензивных средств. Исследования у крыс и кроликов показали фетотоксичность телмисартана только в дозах, токсичных для матери ( см Данные). При установлении беременности необходимо как можно скорее прекратить прием телмисартана.
Предполагаемый фоновый риск серьезных врожденных дефектов и выкидыша для указанной популяции неизвестен. При любой беременности существует фоновый риск развития врожденного порока, выкидыша или других неблагоприятных исходов. В общей популяции в США оцениваемый фоновый уровень риска серьезных врожденных пороков развития и выкидыша при клинически установленной беременности составляет 2-4 и 15-20% соответственно.
Клинические соображения.
Ассоциированный с заболеванием риск для матери и/или эмбриона/плода. Гипертензия во время беременности увеличивает риск преэклампсии, гестационного диабета, преждевременных родов и осложнений при родах для матери (например, необходимость кесарева сечения и послеродовое кровотечение). Гипертензия увеличивает риск задержки внутриутробного развития плода и внутриутробной смерти. У беременных женщин с гипертензией должен осуществляться тщательный мониторинг и соответствующее лечение.
Побочные реакции плода/новорожденного.
Применение ЛС, действующих на РААС, во II и III триместрах беременности может привести к следующему: маловодие, снижение функции почек плода, приводящее к анурии и почечной недостаточности, гипоплазия легких плода, деформации скелета, включая гипоплазию черепа, гипотензию и смерть. В случае отсутствия подходящей альтернативы терапии ЛС, влияющими на РААС, у конкретной пациентки, женщина должна быть предупреждена о потенциальном риске для плода.
Пациенткам, принимающим телмисартан во время беременности, необходимо выполнять серийные УЗИ для оценки внутриамниотической среды. В зависимости от срока беременности, может потребоваться тестирование плода. При возникновении маловодия следует прекратить прием телмисартана, если это не считается спасением жизни матери. Однако следует иметь в виду, что маловодие может появиться только после того, как плод получит необратимое повреждение.
Необходимо тщательное наблюдение за состоянием младенцев, которые in utero подверглись экспозиции телмисартана, на предмет развития гипертензии, олигурии и гиперкалиемии. При возникновении олигурии или гипотензии необходимы поддержание АД и почечная перфузия. Могут потребоваться обменное переливание крови или диализ для реверсии гипотензии и/или поддержания нарушенной функции почек.
Данные.
Данные у животных. Тератогенных эффектов не наблюдалось при пероральном применении телмисартана в дозах до 50 мг/кг/сут у беременных крыс и в дозах до 45 мг/кг/сут у беременных крольчих. У крольчих эмбриолетальность, ассоциированная с материнской токсичностью (снижение прироста массы тела и потребления пищи), наблюдалась при дозе 45 мг/кг/сут (примерно в 12 раз больше МРДЧ 80 мг на основе мг/м2). У крыс телмисартан при дозах 15 мг/кг/сут (примерно в 1,9 раза больше МРДЧ на основе мг/м2), вызывающих материнскую токсичность (снижение прироста массы тела и потребления пищи), при применении на поздних сроках беременности и кормления грудью, вызывал неблагоприятные эффекты у новорожденных, включая снижение жизнеспособности, низкую массу тела при рождении, задержку созревания и снижение прибавки массы тела. Дозы, при которых не наблюдалось эффекта токсичности для развития у крыс и кроликов, 5 и 15 мг/кг/сут соответственно, примерно в 0,64 и 3,7 раза превышают МРДЧ телмисартана на основе мг/м2 (80 мг/сут).
Грудное вскармливание.
Резюме рисков.
Нет информации о присутствии телмисартана в грудном молоке, его влиянии на грудного ребенка или воздействии на выработку молока. Телмисартан присутствует в молоке лактирующих крыс ( см Данные). Из-за возможности серьезных побочных реакций у младенцев, находящихся на грудном вскармливании, включая гипотензию, гиперкалиемию и нарушение функции почек, рекомендуется прекратить грудное вскармливание во время лечения телмисартаном.
Данные.
Телмисартан обнаруживался в молоке лактирующих крыс в концентрациях, в 1,5-2 раза превышающих концентрацию в плазме, через 4-8 ч после применения.
Побочные эффекты
Опыт клинических испытаний.
Поскольку клинические испытания проводятся с различным набором условий. частота побочных реакций. наблюдаемая в этих клинических испытаниях. может не совпадать с полученной в других клинических исследованиях и наблюдаемой в клинической практике.
Гипертензия.
Безопасность телмисартана была оценена более чем у 3700 пациентов, включая 1900 пациентов, получавших лечение в течение более 6 мес, и более чем у 1300 пациентов - в течение более 1 года. Неблагоприятные реакции, как правило, носили умеренный и временный характер и редко требовали прекращения терапии.
В плацебо-контролируемых исследованиях с участием 1041 пациента. получавшего монотерапию различными дозами телмисартана (от 20 до 160 мг) в течение до 12 нед. общая частота нежелательных явлений была аналогична таковой у пациентов. получавших плацебо.
Нежелательные явления. возникавшие с частотой ≥1% у пациентов. получавших телмисартан. и с большей частотой. чем у пациентов. получавших плацебо. независимо от их причинной связи. представлены в таблице 3.
Таблица 3.
Нежелательные явления. возникавшие с частотой ≥1% у пациентов. получавших телмисартан. и с большей частотой. чем у пациентов. получавших плацебо.
Помимо нежелательных явлений. указанных в таблице. следующие события отмечались с частотой ≥1%. но были более частыми. чем в группе плацебо: гриппоподобные симптомы. диспепсия. миалгия. инфекция мочевыводящих путей. боль в животе. головная боль. головокружение. боль. усталость. кашель. гипертензия. боль в груди. тошнота и периферический отек. Прекращение терапии из-за побочных эффектов в плацебо-контролируемых клинических испытаниях потребовалось у 2,8% из 1455 пациентов, получавших телмисартан в форме таблеток, и у 6,1% из 380 пациентов, получавших плацебо.
Частота нежелательных явлений не зависела от дозы и не коррелировала с полом, возрастом или расой пациентов.
Частота возникновения кашля при приеме телмисартана в 6 плацебо-контролируемых исследованиях была идентична таковой у пациентов, получавших плацебо (1,6%).
В дополнение к перечисленным выше, нежелательные явления, которые наблюдались у более чем 0,3% из 3500 пациентов, получавших монотерапию телмисартаном в контролируемых или открытых исследованиях, перечислены ниже. Невозможно определить, были ли эти события причинно связаны с приемом телмисартана в форме таблеток.
Вегетативная нервная система. Импотенция, повышенное потоотделение, приливы крови к лицу.
Организм в целом. Аллергия, лихорадка, боль в ногах, недомогание.
Со стороны ССС. Пальпитация. ортостатический отек. стенокардия. тахикардия. отек ног. отклонение на ЭКГ от нормы.
Со стороны ЦНС. Инсомния. сонливость. мигрень. вертиго. парестезия. непроизвольные сокращения мышц. гипестезия.
Со стороны ЖКТ. Метеоризм. запор. гастрит. рвота. сухость во рту. геморрой. гастроэнтерит. энтерит. гастроэзофагеальный рефлюкс. зубная боль. неспецифические желудочно-кишечные расстройства.
Со стороны обмена веществ. Подагра, гиперхолестеринемия, сахарный диабет.
Со стороны опорно-двигательного аппарата: артрит, артралгия, судороги ног.
Нарушение психики. Тревога, депрессия, нервозность.
Механизм резистентности. Инфекция, грибковая инфекция, абсцесс, средний отит.
Со стороны респираторной системы. Астма, бронхит, ринит, одышка, носовое кровотечение.
Со стороны кожи. Дерматит, сыпь, экзема, кожный зуд.
Со стороны мочевыводящих путей. Частое мочеиспускание, цистит.
Со стороны сосудов. Нарушение мозгового кровообращения.
Со стороны органов чувств. Нарушение зрения, конъюнктивит, шум в ушах, боль в ухе.
Во время начальных клинических исследований был зарегистрирован единственный случай ангионевротического отека (среди 3781 пациента, получавшего лечение).
Клинические лабораторные отклонения.
В плацебо-контролируемых клинических испытаниях клинически значимые изменения параметров стандартных лабораторных тестов редко были связаны с приемом телмисартана в форме таблеток.
Hb: снижение Hb более чем на 2 г/дл наблюдалось у 0,8% пациентов, принимавших телмисартан, по сравнению с 0,3% пациентов, получавших плацебо. Ни один из пациентов не прекратил терапию из-за анемии.
Креатинин. Повышение уровня креатинина на 0,5 мг/дл или выше наблюдалось у 0,4% пациентов, принимавших телмисартан, по сравнению с 0,3% пациентов, получавших плацебо. Один пациент, получавший телмисартан, прекратил терапию из-за повышения уровня креатинина и азота мочевины в крови.
Ферменты печени. У пациентов, получавших телмисартан, иногда наблюдалось повышение активности ферментов печени; все заметные повышения происходили с большей частотой при приеме плацебо. Ни один из пациентов, получавших телмисартан, не прекратил терапию из-за нарушения функции печени.
Снижение сердечно-сосудистого риска.
Поскольку общие побочные реакции были хорошо охарактеризованы в исследованиях телмисартана при гипертензии. в последующих исследованиях телмисартана для снижения риска сердечно-сосудистых заболеваний были зарегистрированы только побочные эффекты. приведшие к прекращению приема. и серьезные побочные эффекты. В исследовании TRANSCEND (n=5926, период наблюдения 4 года и 8 мес) прекращение приема телмисартана из-за нежелательных явлений составило 8,4% и плацебо - 7,6%. Единственными серьезными побочными эффектами, которые по крайней мере на 1% чаще встречались при приеме телмисартана, чем при приеме плацебо, были перемежающаяся хромота (7% против 6%) и язва кожи (3% против 2%).
Постмаркетинговый опыт.
Следующие побочные реакции были выявлены во время использования телмисартана в постмаркетинговый период. Поскольку об этих реакциях сообщается добровольно от популяции неопределенного размера, не всегда возможно надежно оценить их частоту или установить причинно-следственную связь с экспозицией ЛС. Решения о включении этих реакций в маркировку обычно основываются на одном или нескольких из следующих факторов: (1) серьезность реакции, (2) частота сообщений или (3) устойчивость причинной связи с телмисартаном.
Наиболее частые спонтанно сообщаемые явления включают следующие: головная боль. головокружение. астения. кашель. тошнота. усталость. слабость. отек. отек лица. отек нижних конечностей. ангионевротический отек. крапивница. гиперчувствительность. усиление потоотделения. эритема. боль в груди. фибрилляция предсердий. застойная сердечная недостаточность. инфаркт миокарда. повышение АД. усугубление гипертензии. гипотензия (включая постуральную гипотензию). гиперкалиемия. обморок. диспепсия. диарея. боль. инфекция мочевыводящих путей. эректильная дисфункция. боль в спине. боль в животе. мышечные судороги (включая судороги ног). миалгия. брадикардия. эозинофилия. тромбоцитопения. повышение уровня мочевой кислоты. нарушение функции печени/заболевание печени. почечная недостаточность. включая острую почечную недостаточность. анемия. повышение КФК. анафилактическая реакция. боль в сухожилиях (включая тендинит. теносиновит). лекарственная сыпь (токсическая кожная сыпь. чаще всего описываемая как токсикодермия. сыпь и крапивница). гипогликемия (у больных сахарным диабетом) и ангионевротический отек (с фатальным исходом).
Сообщалось о редких случаях рабдомиолиза у пациентов, получавших АРА II, включая телмисартан.
Поскольку клинические испытания проводятся с различным набором условий. частота побочных реакций. наблюдаемая в этих клинических испытаниях. может не совпадать с полученной в других клинических исследованиях и наблюдаемой в клинической практике.
Гипертензия.
Безопасность телмисартана была оценена более чем у 3700 пациентов, включая 1900 пациентов, получавших лечение в течение более 6 мес, и более чем у 1300 пациентов - в течение более 1 года. Неблагоприятные реакции, как правило, носили умеренный и временный характер и редко требовали прекращения терапии.
В плацебо-контролируемых исследованиях с участием 1041 пациента. получавшего монотерапию различными дозами телмисартана (от 20 до 160 мг) в течение до 12 нед. общая частота нежелательных явлений была аналогична таковой у пациентов. получавших плацебо.
Нежелательные явления. возникавшие с частотой ≥1% у пациентов. получавших телмисартан. и с большей частотой. чем у пациентов. получавших плацебо. независимо от их причинной связи. представлены в таблице 3.
Таблица 3.
Нежелательные явления. возникавшие с частотой ≥1% у пациентов. получавших телмисартан. и с большей частотой. чем у пациентов. получавших плацебо.
| Телмисартан (n=1455), % | Плацебо (n=380), % | |
| Инфекция верхних дыхательных путей | 7 | 6 |
| Боль в спине | 3 | 1 |
| Синусит | 3 | 2 |
| Диарея | 3 | 2 |
| Фарингит | 1 | 0 |
Помимо нежелательных явлений. указанных в таблице. следующие события отмечались с частотой ≥1%. но были более частыми. чем в группе плацебо: гриппоподобные симптомы. диспепсия. миалгия. инфекция мочевыводящих путей. боль в животе. головная боль. головокружение. боль. усталость. кашель. гипертензия. боль в груди. тошнота и периферический отек. Прекращение терапии из-за побочных эффектов в плацебо-контролируемых клинических испытаниях потребовалось у 2,8% из 1455 пациентов, получавших телмисартан в форме таблеток, и у 6,1% из 380 пациентов, получавших плацебо.
Частота нежелательных явлений не зависела от дозы и не коррелировала с полом, возрастом или расой пациентов.
Частота возникновения кашля при приеме телмисартана в 6 плацебо-контролируемых исследованиях была идентична таковой у пациентов, получавших плацебо (1,6%).
В дополнение к перечисленным выше, нежелательные явления, которые наблюдались у более чем 0,3% из 3500 пациентов, получавших монотерапию телмисартаном в контролируемых или открытых исследованиях, перечислены ниже. Невозможно определить, были ли эти события причинно связаны с приемом телмисартана в форме таблеток.
Вегетативная нервная система. Импотенция, повышенное потоотделение, приливы крови к лицу.
Организм в целом. Аллергия, лихорадка, боль в ногах, недомогание.
Со стороны ССС. Пальпитация. ортостатический отек. стенокардия. тахикардия. отек ног. отклонение на ЭКГ от нормы.
Со стороны ЦНС. Инсомния. сонливость. мигрень. вертиго. парестезия. непроизвольные сокращения мышц. гипестезия.
Со стороны ЖКТ. Метеоризм. запор. гастрит. рвота. сухость во рту. геморрой. гастроэнтерит. энтерит. гастроэзофагеальный рефлюкс. зубная боль. неспецифические желудочно-кишечные расстройства.
Со стороны обмена веществ. Подагра, гиперхолестеринемия, сахарный диабет.
Со стороны опорно-двигательного аппарата: артрит, артралгия, судороги ног.
Нарушение психики. Тревога, депрессия, нервозность.
Механизм резистентности. Инфекция, грибковая инфекция, абсцесс, средний отит.
Со стороны респираторной системы. Астма, бронхит, ринит, одышка, носовое кровотечение.
Со стороны кожи. Дерматит, сыпь, экзема, кожный зуд.
Со стороны мочевыводящих путей. Частое мочеиспускание, цистит.
Со стороны сосудов. Нарушение мозгового кровообращения.
Со стороны органов чувств. Нарушение зрения, конъюнктивит, шум в ушах, боль в ухе.
Во время начальных клинических исследований был зарегистрирован единственный случай ангионевротического отека (среди 3781 пациента, получавшего лечение).
Клинические лабораторные отклонения.
В плацебо-контролируемых клинических испытаниях клинически значимые изменения параметров стандартных лабораторных тестов редко были связаны с приемом телмисартана в форме таблеток.
Hb: снижение Hb более чем на 2 г/дл наблюдалось у 0,8% пациентов, принимавших телмисартан, по сравнению с 0,3% пациентов, получавших плацебо. Ни один из пациентов не прекратил терапию из-за анемии.
Креатинин. Повышение уровня креатинина на 0,5 мг/дл или выше наблюдалось у 0,4% пациентов, принимавших телмисартан, по сравнению с 0,3% пациентов, получавших плацебо. Один пациент, получавший телмисартан, прекратил терапию из-за повышения уровня креатинина и азота мочевины в крови.
Ферменты печени. У пациентов, получавших телмисартан, иногда наблюдалось повышение активности ферментов печени; все заметные повышения происходили с большей частотой при приеме плацебо. Ни один из пациентов, получавших телмисартан, не прекратил терапию из-за нарушения функции печени.
Снижение сердечно-сосудистого риска.
Поскольку общие побочные реакции были хорошо охарактеризованы в исследованиях телмисартана при гипертензии. в последующих исследованиях телмисартана для снижения риска сердечно-сосудистых заболеваний были зарегистрированы только побочные эффекты. приведшие к прекращению приема. и серьезные побочные эффекты. В исследовании TRANSCEND (n=5926, период наблюдения 4 года и 8 мес) прекращение приема телмисартана из-за нежелательных явлений составило 8,4% и плацебо - 7,6%. Единственными серьезными побочными эффектами, которые по крайней мере на 1% чаще встречались при приеме телмисартана, чем при приеме плацебо, были перемежающаяся хромота (7% против 6%) и язва кожи (3% против 2%).
Постмаркетинговый опыт.
Следующие побочные реакции были выявлены во время использования телмисартана в постмаркетинговый период. Поскольку об этих реакциях сообщается добровольно от популяции неопределенного размера, не всегда возможно надежно оценить их частоту или установить причинно-следственную связь с экспозицией ЛС. Решения о включении этих реакций в маркировку обычно основываются на одном или нескольких из следующих факторов: (1) серьезность реакции, (2) частота сообщений или (3) устойчивость причинной связи с телмисартаном.
Наиболее частые спонтанно сообщаемые явления включают следующие: головная боль. головокружение. астения. кашель. тошнота. усталость. слабость. отек. отек лица. отек нижних конечностей. ангионевротический отек. крапивница. гиперчувствительность. усиление потоотделения. эритема. боль в груди. фибрилляция предсердий. застойная сердечная недостаточность. инфаркт миокарда. повышение АД. усугубление гипертензии. гипотензия (включая постуральную гипотензию). гиперкалиемия. обморок. диспепсия. диарея. боль. инфекция мочевыводящих путей. эректильная дисфункция. боль в спине. боль в животе. мышечные судороги (включая судороги ног). миалгия. брадикардия. эозинофилия. тромбоцитопения. повышение уровня мочевой кислоты. нарушение функции печени/заболевание печени. почечная недостаточность. включая острую почечную недостаточность. анемия. повышение КФК. анафилактическая реакция. боль в сухожилиях (включая тендинит. теносиновит). лекарственная сыпь (токсическая кожная сыпь. чаще всего описываемая как токсикодермия. сыпь и крапивница). гипогликемия (у больных сахарным диабетом) и ангионевротический отек (с фатальным исходом).
Сообщалось о редких случаях рабдомиолиза у пациентов, получавших АРА II, включая телмисартан.
|
|
Взаимодействие
Алискирен. Не следует применять алискирен одновременно с телмисартаном пациентам с диабетом. Необходимо избегать применения алискирена с телмисартаном у пациентов с почечной недостаточностью (СКФ <60 мл/мин).
Дигоксин. При одновременном применении телмисартана с дигоксином наблюдалось увеличение медианы maxCmax дигоксина в плазме (49%) и Сmin (20%). Поэтому при начале приема, корректировке дозы и прекращении приема телмисартана необходим мониторинг уровня дигоксина, чтобы поддерживать уровень дигоксина в терапевтических пределах.
Литий. Сообщалось об обратимом повышении концентрации лития в сыворотке и токсичности при одновременном применении лития с АРА II, включая телмисартан. Поэтому во время одновременного приема необходим мониторинг уровня лития в сыворотке крови.
НПВС, включая селективные ингибиторы ЦОГ-2. У пожилых людей со сниженным ОЦК (включая получающих диуретическую терапию) или с нарушением функции почек совместное применение НПВС, в тч селективные ингибиторы ЦОГ-2 с АРА II, включая телмисартан, могут привести к ухудшению функции почек, включая возможную острую почечную недостаточность. Эти эффекты обычно обратимы. Периодически необходимо контролировать функцию почек у пациентов, получающих телмисартан и НПВС.
Антигипертензивный эффект АРА II, включая телмисартан, может быть ослаблен НПВС, включая селективные ингибиторы ЦОГ-2.
Рамиприл и рамиприлат. Одновременный прием телмисартана 80 мг 1 раз в сутки и рамиприла 10 мг 1 раз в сутки у здоровых добровольцев увеличивает ssCss и AUC рамиприла в равновесном состоянии в 2,3 и 2,1 раза соответственно и ssCss и AUC рамиприлата в 2,4 и 1,5 раза соответственно. Напротив, ssCss и AUC телмисартана снижаются на 31 и 16% соответственно. При одновременном применении телмисартана и рамиприла ответ может быть выше из-за возможных аддитивных фармакодинамических эффектов этих ЛС, а также из-за повышения экспозиции рамиприла и рамиприлата в присутствии телмисартана.
Другие ЛС. Совместное применение телмисартана не приводило к клинически значимому взаимодействию с парацетамолом, амлодипином, глибенкламидом, симвастатином, гидрохлоротиазидом, варфарином или ибупрофеном. Телмисартан не метаболизируется системой цитохрома P450 и не оказывает влияния in vitro >in vitro на изоферменты цитохрома P450, за исключением некоторого ингибирования сYP2C19. Ожидается, что телмисартан не будет взаимодействовать с ЛС, которые ингибируют изоферменты цитохрома P450; также не ожидается, что он будет взаимодействовать с ЛС, метаболизируемыми изоферментами цитохрома P450, за исключением возможного ингибирования метаболизма ЛС, метаболизируемых сYP2C19.
Дигоксин. При одновременном применении телмисартана с дигоксином наблюдалось увеличение медианы maxCmax дигоксина в плазме (49%) и Сmin (20%). Поэтому при начале приема, корректировке дозы и прекращении приема телмисартана необходим мониторинг уровня дигоксина, чтобы поддерживать уровень дигоксина в терапевтических пределах.
Литий. Сообщалось об обратимом повышении концентрации лития в сыворотке и токсичности при одновременном применении лития с АРА II, включая телмисартан. Поэтому во время одновременного приема необходим мониторинг уровня лития в сыворотке крови.
НПВС, включая селективные ингибиторы ЦОГ-2. У пожилых людей со сниженным ОЦК (включая получающих диуретическую терапию) или с нарушением функции почек совместное применение НПВС, в тч селективные ингибиторы ЦОГ-2 с АРА II, включая телмисартан, могут привести к ухудшению функции почек, включая возможную острую почечную недостаточность. Эти эффекты обычно обратимы. Периодически необходимо контролировать функцию почек у пациентов, получающих телмисартан и НПВС.
Антигипертензивный эффект АРА II, включая телмисартан, может быть ослаблен НПВС, включая селективные ингибиторы ЦОГ-2.
Рамиприл и рамиприлат. Одновременный прием телмисартана 80 мг 1 раз в сутки и рамиприла 10 мг 1 раз в сутки у здоровых добровольцев увеличивает ssCss и AUC рамиприла в равновесном состоянии в 2,3 и 2,1 раза соответственно и ssCss и AUC рамиприлата в 2,4 и 1,5 раза соответственно. Напротив, ssCss и AUC телмисартана снижаются на 31 и 16% соответственно. При одновременном применении телмисартана и рамиприла ответ может быть выше из-за возможных аддитивных фармакодинамических эффектов этих ЛС, а также из-за повышения экспозиции рамиприла и рамиприлата в присутствии телмисартана.
Другие ЛС. Совместное применение телмисартана не приводило к клинически значимому взаимодействию с парацетамолом, амлодипином, глибенкламидом, симвастатином, гидрохлоротиазидом, варфарином или ибупрофеном. Телмисартан не метаболизируется системой цитохрома P450 и не оказывает влияния in vitro >in vitro на изоферменты цитохрома P450, за исключением некоторого ингибирования сYP2C19. Ожидается, что телмисартан не будет взаимодействовать с ЛС, которые ингибируют изоферменты цитохрома P450; также не ожидается, что он будет взаимодействовать с ЛС, метаболизируемыми изоферментами цитохрома P450, за исключением возможного ингибирования метаболизма ЛС, метаболизируемых сYP2C19.
Передозировка
В отношении передозировки у человека имеются ограниченные данные.
Симптомы. Наиболее вероятными проявлениями передозировки телмисартана могут быть гипотензия, головокружение и тахикардия; брадикардия может возникнуть из-за парасимпатической (вагусной) стимуляции.
Лечение. При возникновении симптоматической гипотензии следует назначить поддерживающее лечение. Телмисартан не удаляется гемодиализом.
Симптомы. Наиболее вероятными проявлениями передозировки телмисартана могут быть гипотензия, головокружение и тахикардия; брадикардия может возникнуть из-за парасимпатической (вагусной) стимуляции.
Лечение. При возникновении симптоматической гипотензии следует назначить поддерживающее лечение. Телмисартан не удаляется гемодиализом.
Способ применения и дозы
Внутрь. Доза подбирается индивидуально, в зависимости от тяжести заболевания, значений АД. Возможно применение сочетанно с другими антигипертензивными ЛС. Для пожилых пациентов или пациентов с почечной недостаточностью, в тч находящихся на гемодиализе, корректировка начальной дозы не требуется.
Меры предосторожности применения
Фетальная токсичность. См «Применение при беременности и кормлении грудью».
Гипотензия.
У пациентов с активированной РААС, таких как пациенты со снижением ОЦК или пациенты с пониженным содержанием натрия (например, получающие высокие дозы диуретиков), может возникнуть симптоматическая гипотензия после начала терапии телмисартаном. Необходимо либо скорректировать это состояние до начала приема телмисартана, либо начать лечение под тщательным медицинским наблюдением с уменьшенной дозы.
При развитии гипотензии пациенту следует придать положение лежа на спине и при необходимости провести в/в инфузию физиологического раствора. Транзиторный гипотензивный ответ не является противопоказанием для дальнейшего лечения, которое обычно можно без затруднения продолжить после стабилизации АД.
Гиперкалиемия.
Гиперкалиемия может возникать упациентов, принимающих АРА II, особенно у пациентов с выраженной почечной недостаточностью, сердечной недостаточностью, находящихся на заместительной почечной терапии или при приеме добавок калия, калийсберегающих диуретиков, калийсодержащих заменителей соли или других ЛС, повышающих уровень калия. Необходимо рассмотреть возможность периодического определения электролитов в сыворотке крови для выявления возможного дисбаланса электролитов, особенно у пациентов из группы риска.
Нарушение функции печени.
Поскольку бóльшая часть телмисартана выводится с желчью, можно ожидать, что у пациентов с обструктивными заболеваниями желчевыводящих путей или печеночной недостаточностью будет снижен клиренс. У этих пациентов рекомендуется начать прием телмисартана в низких дозах и медленно титровать дозу.
Нарушение функции почек.
Вследствие ингибирования РААС следует ожидать изменений функции почек у чувствительных людей. У пациентов, функция почек которых может зависеть от активности РААС (например, пациенты с тяжелой застойной сердечной недостаточностью или почечной дисфункцией), лечение ингибиторами АПФ и АРА II было ассоциировано с олигурией и/или прогрессирующей азотемией и (редко) острой почечной недостаточностью и/или смертью. О сходных результатах сообщалось при применении телмисартана.
В исследованиях ингибиторов АПФ у пациентов с односторонним или двусторонним стенозом почечной артерии наблюдалось повышение сывороточного креатинина или азота мочевины крови. Нет долгосрочных исследований применения телмисартана у пациентов с односторонним или двусторонним стенозом почечной артерии, но ожидается эффект, аналогичный эффекту, наблюдаемому при применении ингибиторов АПФ.
Двойная блокада РААС.
Двойная блокада РААС АРА II, ингибиторами АПФ или алискиреном ассоциирована с повышенным риском развития гипотензии, гиперкалиемии и изменений функции почек (включая острую почечную недостаточность) по сравнению с монотерапией.
В исследование ONTARGET было включено 25620 пациентов в возрасте ≥55 лет с атеросклеротическим заболеванием или диабетом с поражением органов-мишеней, при этом они были рандомизированы для приема только телмисартана, только рамиприла или их комбинации, медиана времени наблюдения составила 56 мес. У пациентов, получавших комбинацию телмисартана и рамиприла, не было каких-либо дополнительных преимуществ по сравнению с монотерапией, но отмечалась повышенная частота почечной дисфункции (например, острой почечной недостаточности) по сравнению с пациентами групп, получавших только телмисартан или только рамиприл.
У большинства пациентов одновременное применение двух ингибиторов РААС не дает каких-либо преимуществ. В целом следует избегать сочетанного применения ингибиторов РААС. Необходим тщательный мониторинг АД, функции почек и электролитов у пациентов, принимающих телмисартан и другие ЛС, влияющие на РААС.
Не следует принимать алискирен одновременно с телмисартаном пациентам с диабетом. Необходимо избегать применения алискирена с телмисартаном у пациентов с почечной недостаточностью (СКФ <60 мл/мин).
Применение в педиатрии.
Безопасность и эффективность у педиатрических пациентов установлены.
Новорожденные с экспозицией телмисартана in utero в анамнезе. См «Применение при беременности и кормлении грудью».
Применение в гериатрии.
Из общего числа пациентов, получавших телмисартан при гипертензии в клинических исследованиях, 551 (19%) были в возрасте от 65 до 74 лет и 130 (4%) - в возрасте 75 лет и старше. У этих пациентов не наблюдалось общих различий в эффективности и безопасности по сравнению с пациентами более молодого возраста, и другой клинический опыт не выявил различий в ответах пожилых и молодых пациентов, но нельзя исключать более высокую чувствительность некоторых пожилых людей.
Из общего числа пациентов, получавших телмисартан в исследовании снижения сердечно-сосудистого риска (ONTARGET), процент пациентов в возрасте от ≥65 до <75 лет составлял 42%; 15% пациентов были в возрасте ≥75 лет. У этих пациентов не наблюдалось общих различий в эффективности и безопасности по сравнению с более молодыми пациентами, и другой клинический опыт не выявил различий в ответах пожилых и молодых пациентов, но нельзя исключать более высокую чувствительность некоторых пожилых людей.
Печеночная недостаточность.
Следует проводить тщательный мониторинг и медленно повышать дозу у пациентов с обструктивными заболеваниями желчевыводящих путей или печеночной недостаточностью.
Гипотензия.
У пациентов с активированной РААС, таких как пациенты со снижением ОЦК или пациенты с пониженным содержанием натрия (например, получающие высокие дозы диуретиков), может возникнуть симптоматическая гипотензия после начала терапии телмисартаном. Необходимо либо скорректировать это состояние до начала приема телмисартана, либо начать лечение под тщательным медицинским наблюдением с уменьшенной дозы.
При развитии гипотензии пациенту следует придать положение лежа на спине и при необходимости провести в/в инфузию физиологического раствора. Транзиторный гипотензивный ответ не является противопоказанием для дальнейшего лечения, которое обычно можно без затруднения продолжить после стабилизации АД.
Гиперкалиемия.
Гиперкалиемия может возникать упациентов, принимающих АРА II, особенно у пациентов с выраженной почечной недостаточностью, сердечной недостаточностью, находящихся на заместительной почечной терапии или при приеме добавок калия, калийсберегающих диуретиков, калийсодержащих заменителей соли или других ЛС, повышающих уровень калия. Необходимо рассмотреть возможность периодического определения электролитов в сыворотке крови для выявления возможного дисбаланса электролитов, особенно у пациентов из группы риска.
Нарушение функции печени.
Поскольку бóльшая часть телмисартана выводится с желчью, можно ожидать, что у пациентов с обструктивными заболеваниями желчевыводящих путей или печеночной недостаточностью будет снижен клиренс. У этих пациентов рекомендуется начать прием телмисартана в низких дозах и медленно титровать дозу.
Нарушение функции почек.
Вследствие ингибирования РААС следует ожидать изменений функции почек у чувствительных людей. У пациентов, функция почек которых может зависеть от активности РААС (например, пациенты с тяжелой застойной сердечной недостаточностью или почечной дисфункцией), лечение ингибиторами АПФ и АРА II было ассоциировано с олигурией и/или прогрессирующей азотемией и (редко) острой почечной недостаточностью и/или смертью. О сходных результатах сообщалось при применении телмисартана.
В исследованиях ингибиторов АПФ у пациентов с односторонним или двусторонним стенозом почечной артерии наблюдалось повышение сывороточного креатинина или азота мочевины крови. Нет долгосрочных исследований применения телмисартана у пациентов с односторонним или двусторонним стенозом почечной артерии, но ожидается эффект, аналогичный эффекту, наблюдаемому при применении ингибиторов АПФ.
Двойная блокада РААС.
Двойная блокада РААС АРА II, ингибиторами АПФ или алискиреном ассоциирована с повышенным риском развития гипотензии, гиперкалиемии и изменений функции почек (включая острую почечную недостаточность) по сравнению с монотерапией.
В исследование ONTARGET было включено 25620 пациентов в возрасте ≥55 лет с атеросклеротическим заболеванием или диабетом с поражением органов-мишеней, при этом они были рандомизированы для приема только телмисартана, только рамиприла или их комбинации, медиана времени наблюдения составила 56 мес. У пациентов, получавших комбинацию телмисартана и рамиприла, не было каких-либо дополнительных преимуществ по сравнению с монотерапией, но отмечалась повышенная частота почечной дисфункции (например, острой почечной недостаточности) по сравнению с пациентами групп, получавших только телмисартан или только рамиприл.
У большинства пациентов одновременное применение двух ингибиторов РААС не дает каких-либо преимуществ. В целом следует избегать сочетанного применения ингибиторов РААС. Необходим тщательный мониторинг АД, функции почек и электролитов у пациентов, принимающих телмисартан и другие ЛС, влияющие на РААС.
Не следует принимать алискирен одновременно с телмисартаном пациентам с диабетом. Необходимо избегать применения алискирена с телмисартаном у пациентов с почечной недостаточностью (СКФ <60 мл/мин).
Применение в педиатрии.
Безопасность и эффективность у педиатрических пациентов установлены.
Новорожденные с экспозицией телмисартана in utero в анамнезе. См «Применение при беременности и кормлении грудью».
Применение в гериатрии.
Из общего числа пациентов, получавших телмисартан при гипертензии в клинических исследованиях, 551 (19%) были в возрасте от 65 до 74 лет и 130 (4%) - в возрасте 75 лет и старше. У этих пациентов не наблюдалось общих различий в эффективности и безопасности по сравнению с пациентами более молодого возраста, и другой клинический опыт не выявил различий в ответах пожилых и молодых пациентов, но нельзя исключать более высокую чувствительность некоторых пожилых людей.
Из общего числа пациентов, получавших телмисартан в исследовании снижения сердечно-сосудистого риска (ONTARGET), процент пациентов в возрасте от ≥65 до <75 лет составлял 42%; 15% пациентов были в возрасте ≥75 лет. У этих пациентов не наблюдалось общих различий в эффективности и безопасности по сравнению с более молодыми пациентами, и другой клинический опыт не выявил различий в ответах пожилых и молодых пациентов, но нельзя исключать более высокую чувствительность некоторых пожилых людей.
Печеночная недостаточность.
Следует проводить тщательный мониторинг и медленно повышать дозу у пациентов с обструктивными заболеваниями желчевыводящих путей или печеночной недостаточностью.
|
|
Список литературы
Fda.gov, 2021.
Входит в состав
- 163-289₽ Телминорм (Micro Labs )
- 254₽ Телмисартан (форма А) (Hetero Labs Limited )
- 211-396₽ Танидол
- 234-378₽ Телмисартан-СЗ (Северная звезда НАО )
- 213-443₽ Телсартан
- 329-532₽ Телсартан Н
- 341-521₽ Телмиста АМ (KRKA )
- 379-541₽ Микафор (HiGlance Laboratories Pvt. Ltd. )
- 333-615₽ Телсартан АМ
- 312-895₽ Телмиста Н (KRKA )
- 299-1009₽ Телпрес (3 фирмы)
- 310-1094₽ Телмиста (KRKA )
- 346-1120₽ Телзап (2 фирмы)
- 390-1102₽ Телзап АМ (2 фирмы)
- 484-1299₽ Телзап Плюс (4 фирмы)
- 458-1385₽ Телпрес Плюс (3 фирмы)
- 1222-1497₽ МикардисПлюс (3 фирмы)
- 1455-1888₽ Твинста (4 фирмы)
- 1251-2355₽ Микардис (3 фирмы)
- — Прайтор
- — ТЕЛМИСАРТАН Фармасинтез (Фармасинтез-Тюмень ООО )
- — ТЕЛМИСАРТАН-РИХТЕР
- — Тезео
- — Телминорм АМ (Micro Labs )
- — Телминорм Н (Микро Лабс Лимитед )
- — Телмисартан ШТАДА (Zhejiang Huahai Pharmaceutical Co. )
- — Телмисартан-Н ШТАДА (Zhejiang Huahai Pharmaceutical Co. )
- — Телмисартан-ТАД (2 фирмы)
- — Телмисартан-Тева (Actavis Ltd. )
- — Телмифорс (Ipca Laboratories )