Другие названия и синонимы
Valsartan.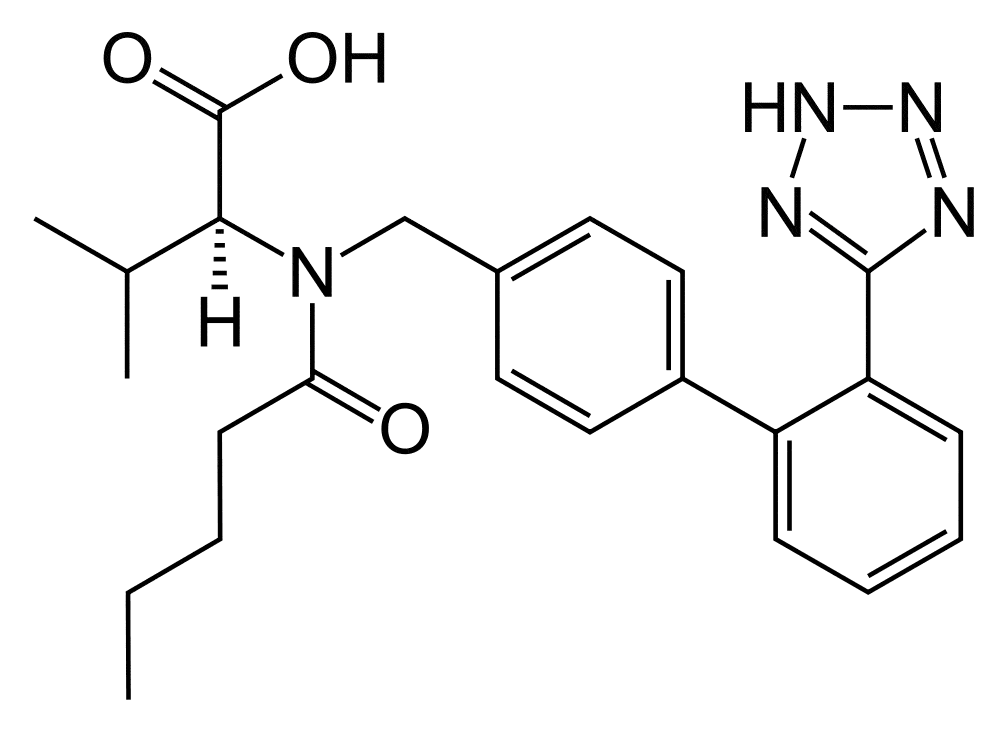
Фармакологическая группа
|
|
Латинское название
Valsartanum ( Valsartani).
Химическое название
N-[[2 -(1Н-Тетразол-5-ил)[1,1 -бифенил]-4-ил]метил]-N-валерил-L-валин.
Используется в лечении
Код CAS
137862-53-4.
Фармакологическое действие
Антигипертензивное.
Характеристика вещества
Валсартан - непептидный специфический АРА II, действующий на подтип рецепторов AT1.
Мелкий порошок белого или почти белого цвета, растворим в этаноле и метаноле, мало растворим в воде. Молекулярная масса 435,5.
Мелкий порошок белого или почти белого цвета, растворим в этаноле и метаноле, мало растворим в воде. Молекулярная масса 435,5.
Фармакодинамика
Механизм действия.
Ангиотензин II образуется из ангиотензина I в реакции, катализируемой АПФ (кининаза II). Ангиотензин II является основным прессорным агентом РААС, его эффекты включают вазоконстрикцию, стимуляцию синтеза и высвобождения альдостерона, сердечную стимуляцию и реабсорбцию натрия в почках. Валсартан блокирует сосудосуживающие и альдостеронсекретирующие эффекты ангиотензина II, избирательно блокируя связывание ангиотензина II с рецепторами AT1 во многих тканях, таких как гладкие мышцы сосудов и надпочечники. Его действие, таким образом, не зависит от путей синтеза ангиотензина II.
Во многих тканях обнаружены также рецепторы AT2, но их связь с сердечно-сосудистым гомеостазом не установлена. Валсартан имеет гораздо большее сродство (примерно в 20000 раз) к рецепторам AT1, чем к рецепторам AT2. Повышенные уровни ангиотензина II в плазме после блокады рецепторов AT1 валсартаном могут стимулировать незаблокированные рецепторы AT2. Основной метаболит валсартана не имеет существенной активности, его сродство к рецепторам AT1 примерно в 200 раз меньше, чем валсартана.
Блокада РААС ингибиторами АПФ, ингибирующими биосинтез ангиотензина II из ангиотензина I, широко применяется при лечении гипертензии. Ингибиторы АПФ, кроме того, ингибируют деградацию брадикинина, реакцию, также катализируемую АПФ. Поскольку валсартан не ингибирует АПФ (кининаза II), он не влияет на реакцию на брадикинин. Пока неизвестно, имеет ли это различие клиническое значение. Валсартан не связывает и не блокирует рецепторы других гормонов или ионные каналы, которые, как известно, играют важную роль в регуляции функций ССС.
Блокада рецепторов ангиотензина II подавляет отрицательную регуляторную обратную связь ангиотензина II на секрецию ренина, но повышенная в результате активность ренина плазмы и уровни циркулирующего ангиотензина II не препятствуют эффекту валсартана на АД.
Фармакодинамика.
Валсартан подавляет прессорный эффект инфузий ангиотензина II. Пероральная доза 80 мг подавляет прессорный эффект примерно на 80% на пике, при этом ингибирование примерно на 30% сохраняется в течение 24 Информация о влиянии бóльших доз отсутствует.
Устранение отрицательной обратной связи ангиотензина II вызывает 2-3-кратное повышение уровня ренина в плазме и, как следствие, повышение концентрации ангиотензина II в плазме у пациентов с гипертензией. После приема валсартана наблюдалось минимальное снижение уровня альдостерона в плазме и очень небольшое влияние на уровень калия в сыворотке.
В исследованиях множественных доз у пациентов с гипертензией со стабильной почечной недостаточностью и пациентов с реноваскулярной гипертензией валсартан не оказывал клинически значимого влияния на СКФ, фракцию фильтрации, клиренс креатинина или почечный плазмоток.
В исследованиях множественных доз у пациентов с гипертензией валсартан не оказывал заметного влияния на уровни общего Хс, триглицеридов натощак, глюкозы в сыворотке натощак или мочевой кислоты.
Ангиотензин II образуется из ангиотензина I в реакции, катализируемой АПФ (кининаза II). Ангиотензин II является основным прессорным агентом РААС, его эффекты включают вазоконстрикцию, стимуляцию синтеза и высвобождения альдостерона, сердечную стимуляцию и реабсорбцию натрия в почках. Валсартан блокирует сосудосуживающие и альдостеронсекретирующие эффекты ангиотензина II, избирательно блокируя связывание ангиотензина II с рецепторами AT1 во многих тканях, таких как гладкие мышцы сосудов и надпочечники. Его действие, таким образом, не зависит от путей синтеза ангиотензина II.
Во многих тканях обнаружены также рецепторы AT2, но их связь с сердечно-сосудистым гомеостазом не установлена. Валсартан имеет гораздо большее сродство (примерно в 20000 раз) к рецепторам AT1, чем к рецепторам AT2. Повышенные уровни ангиотензина II в плазме после блокады рецепторов AT1 валсартаном могут стимулировать незаблокированные рецепторы AT2. Основной метаболит валсартана не имеет существенной активности, его сродство к рецепторам AT1 примерно в 200 раз меньше, чем валсартана.
Блокада РААС ингибиторами АПФ, ингибирующими биосинтез ангиотензина II из ангиотензина I, широко применяется при лечении гипертензии. Ингибиторы АПФ, кроме того, ингибируют деградацию брадикинина, реакцию, также катализируемую АПФ. Поскольку валсартан не ингибирует АПФ (кининаза II), он не влияет на реакцию на брадикинин. Пока неизвестно, имеет ли это различие клиническое значение. Валсартан не связывает и не блокирует рецепторы других гормонов или ионные каналы, которые, как известно, играют важную роль в регуляции функций ССС.
Блокада рецепторов ангиотензина II подавляет отрицательную регуляторную обратную связь ангиотензина II на секрецию ренина, но повышенная в результате активность ренина плазмы и уровни циркулирующего ангиотензина II не препятствуют эффекту валсартана на АД.
Фармакодинамика.
Валсартан подавляет прессорный эффект инфузий ангиотензина II. Пероральная доза 80 мг подавляет прессорный эффект примерно на 80% на пике, при этом ингибирование примерно на 30% сохраняется в течение 24 Информация о влиянии бóльших доз отсутствует.
Устранение отрицательной обратной связи ангиотензина II вызывает 2-3-кратное повышение уровня ренина в плазме и, как следствие, повышение концентрации ангиотензина II в плазме у пациентов с гипертензией. После приема валсартана наблюдалось минимальное снижение уровня альдостерона в плазме и очень небольшое влияние на уровень калия в сыворотке.
В исследованиях множественных доз у пациентов с гипертензией со стабильной почечной недостаточностью и пациентов с реноваскулярной гипертензией валсартан не оказывал клинически значимого влияния на СКФ, фракцию фильтрации, клиренс креатинина или почечный плазмоток.
В исследованиях множественных доз у пациентов с гипертензией валсартан не оказывал заметного влияния на уровни общего Хс, триглицеридов натощак, глюкозы в сыворотке натощак или мочевой кислоты.
Фармакокинетика
Cmax валсартана в плазме крови достигается через 2-4 ч после приема. Валсартан демонстрирует биэкспоненциальную кинетику распада после в/в введения со средним Т1/2 около 6 Абсолютная биодоступность - около 25% (от 10 до 35%). Биодоступность в виде суспензии в 1,6 раза больше, чем в виде таблеток. При приеме в виде таблеток пища снижает экспозицию (измеренную по AUC) валсартана примерно на 40% и maxCmax в плазме примерно на 50%. Значения AUC и maxCmax валсартана увеличиваются приблизительно линейно с увеличением дозы в пределах клинического диапазона доз. Валсартан не кумулирует в плазме крови после многократного применения.
Метаболизм и выведение.
Валсартан при приеме внутрь в виде раствора преимущественно выводится с фекалиями (около 83% дозы) и мочой (около 13% дозы). Выведение осуществляется в основном в неизмененном виде, только около 20% дозы - в виде метаболитов. Основным метаболитом, составляющим около 9% дозы, является валерил-4-гидроксивалсартан. Исследования метаболизма in vitro >in vitro с участием рекомбинантных изоферментов сYP цитохрома Р450 показали, что за образование валерил-4-гидроксивалсартана отвечает изофермент сYP2C9. Валсартан не ингибирует изоферменты сYP цитохрома Р450 в клинически значимых концентрациях. Взаимодействие, опосредованное сYP 450, валсартана и ЛС, принимаемых одновременно, маловероятно из-за низкой степени метаболизма.
После в/в введения плазменный клиренс валсартана составляет около 2 л/ почечный клиренс - 0,62 л/ч (около 30% общего клиренса).
Распределение.
Vd валсартана после в/в введения в равновесном состоянии небольшой (17 л), что указывает на то, что валсартан не распределяется в тканях широко. Связывание валсартана с белками сыворотки крови высокое (95%), в основном с альбумином сыворотки.
Зависимость параметров фармакокинетики от некоторых факторов.
Педиатрические пациенты. В исследовании у педиатрических пациентов с гипертензией (n=26, от 1 года до 16 лет), получавших однократные дозы суспензии валсартана (в среднем от 0,9 до 2 мг/кг), значения клиренса (л/ч/кг) валсартана у детей были сходными с таковыми у взрослых.
Гериатрические пациенты. Экспозиция валсартана (измеренная по AUC) у пожилых людей выше на 70%, а Т1/2 больше на 35%, чем у молодых. Корректировка дозы не требуется.
Пол. Фармакокинетика валсартана существенно не различается у мужчин и женщин.
Сердечная недостаточность. Среднее время достижения maxCmax и Т1/2 валсартана у пациентов с сердечной недостаточностью схожи с теми, которые наблюдаются у здоровых добровольцев. Значения AUC и maxCmax валсартана линейно увеличиваются и почти пропорциональны увеличению дозы в пределах клинического диапазона доз (от 40 до 160 мг 2 раза в день). Средний коэффициент кумуляции составляет около 1,7. Кажущийся клиренс валсартана после перорального приема составляет примерно 4,5 л/ Возраст не влияет на кажущийся клиренс у пациентов с сердечной недостаточностью.
Почечная недостаточность. Нет очевидной корреляции между функцией почек (измеренной по клиренсу креатинина) и экспозицией валсартана (измеренной по AUC) у пациентов с различной степенью почечной недостаточности. Следовательно, коррекция дозы не требуется у пациентов с нарушением функции почек легкой и средней степени тяжести. Исследования у пациентов с тяжелым нарушением функции почек (Cl креатинина <10 мл/мин) не проводили. Валсартан не выводится из плазмы при гемодиализе. При тяжелой почечной недостаточности необходимо соблюдать осторожность при дозировании валсартана.
Печеночная недостаточность. В среднем у пациентов с хроническим заболеванием печени от легкой до умеренной степени экспозиция валсартана (оцененная по значениям AUC) вдвое выше по сравнению с экспозицией у здоровых добровольцев (с учетом возраста, пола и массы тела). Как правило, у пациентов с заболеванием печени легкой и средней степени тяжести коррекция дозы не требуется. Следует проявлять осторожность у пациентов с заболеванием печени.
Доклиническая токсикология.
Канцерогенность, мутагенность, влияние на фертильность.
Не обнаружено доказательств канцерогенности при приеме валсартана с пищей в дозах до 160 и 200 мг/кг/сут у мышей и крыс соответственно в период до 2 лет. Эти дозы для мышей и крыс примерно в 2,6 и 6 раз соответственно превышают МРДЧ из расчета на мг/м2 (в расчетах принимается пероральная доза 320 мг/сут для пациента с массой тела 60 кг).
В исследовании мутагенности не выявлено каких-либо эффектов, связанных с валсартаном, ни на генном уровне, ни на уровне хромосом. Эти анализы включали тесты на бактериальную мутагенность с Salmonella (Ames) и E.coli; тест генных мутаций на клетках китайского хомячка линии V79; цитогенетический тест на клетках яичника китайского хомячка и микроядерный тест у крыс.
Валсартан не оказывал неблагоприятного воздействия на репродуктивную функцию самцов или самок крыс при пероральных дозах до 200 мг/кг/сут. Эта доза в 6 раз превышает МРДЧ из расчета мг/м2 (в расчетах принимается пероральная доза 320 мг/сут для пациента с массой тела 60 кг).
Фармакология и токсикология у животных.
Исследования репродуктивной токсикологии.
При пероральном применении валсартана в дозах до 600 мг/кг/сут у беременных мышей и крыс и в дозах до 10 мг/кг/сут у крольчих тератогенных эффектов не наблюдалось. Однако в исследованиях, в которых беременные крысы получали валсартан в пероральных дозах 600 мг/кг/сут, токсичных для матери (снижение прибавки массы тела и потребления пищи), во время органогенеза или поздних сроков беременности и лактации, наблюдались значительное снижение массы тела плодов, массы тела детенышей при рождении, выживаемости детенышей и небольшие задержки этапов развития. У крольчих фетотоксичность ( резорбция, потеря помета, выкидыши и низкая масса тела), ассоциированные с материнской токсичностью (смертностью), наблюдалась при дозах 5 и 10 мг/кг/сут. Не наблюдалось побочных эффектов при дозах 600, 200 и 2 мг/кг/сут у мышей, крыс и кроликов, что составляет 9, 6 и 0,1 МРДЧ соответственно из расчета на мг/м2. В расчетах принимается пероральная доза 320 мг/сут для пациента с массой тела 60 кг.
Клинические исследования.
Гипертензия.
Гипертензия у взрослых.
Антигипертензивный эффект валсартана был продемонстрирован в основном в 7 плацебо- контролируемых испытаниях продолжительностью от 4 до 12 нед (1 - у пациентов старше 65 лет) при применении в дозах от 10 до 320 мг/сут у пациентов с исходным дАД 95-115 мм Исследования позволили сравнить режимы приема 160 мг/сут 1 раз в день и 2 раза в день; сравнить максимальный и минимальный эффект; сравнить (в объединенных данных) ответ в зависимости от пола, возраста и расы; и оценить дополнительные эффекты гидрохлоротиазида.
Применение валсартана у пациентов с эссенциальной гипертензией приводит к значительному снижению сАД и дАД в положении сидя, лежа и стоя, обычно с незначительными ортостатическими реакциями или без них.
У большинства пациентов после приема однократной пероральной дозы начало антигипертензивного действия наблюдается примерно в течение 2 а максимальное снижение АД достигается в течение 6 Антигипертензивный эффект сохраняется в течение 24 ч после приема, но наблюдается снижение по сравнению с максимальным эффектом при более низких дозах (40 мг), предположительно отражающее утрату ингибирования действия ангиотензина II. Однако при более высоких дозах (160 мг) разница в максимальном и минимальном эффекте незначительна. При повторных приемах снижение АД при любой дозе в основном наблюдается в течение 2 нед, а максимальное снижение обычно достигается через 4 нед. В долгосрочных исследованиях (без контроля плацебо) эффект валсартана поддерживался до 2 лет. Антигипертензивный эффект не зависит от возраста, пола или расы. Вывод относительно расы основан на объединенных данных и должен рассматриваться с осторожностью, потому что антигипертензивные ЛС, влияющие на РААС (такие как ингибиторы АПФ и АРА II), как правило, менее эффективны при низком уровне активности ренина плазмы (часто у чернокожих), чем при высокой активности ренина плазмы (часто у белокожих). В объединенных рандомизированных контролируемых испытаниях валсартана, в которых участвовали в общей сложности 140 чернокожих и 830 белокожих пациентов, валсартан и ингибитор АПФ в качестве контроля были, по крайней мере, столь же эффективны у чернокожих, как и у белокожих. Объяснение этого отличия от предыдущих результатов неясно.
Резкая отмена валсартана не была ассоциирована с быстрым повышением АД.
При применении валсартана и диуретиков тиазидного ряда отмечается аддитивный гипотензивный эффект.
В 7 исследований монотерапии валсартаном было включено более 2000 пациентов, рандомизированных для получения различных доз валсартана, и около 800 пациентов, рандомизированных в группу плацебо. Минимальный эффект при дозах ниже 80 мг не всегда отличался от наблюдаемого при приеме плацебо, но дозы 80, 160 и 320 мг вызывали дозозависимое снижение сАД и дАД с отличием от плацебо примерно на 6-9/3-5 мм при дозах от 80 до 160 мг и 9/6 мм при дозе 320 мг. В контролируемом исследовании добавление гидрохлоротиазида к валсартану в дозе 80 мг приводило к дополнительному снижению сАД и дАД примерно на 6/3 и 12/5 мм для доз гидрохлоротиазида 12,5 и 25 мг соответственно по сравнению с приемом только валсартана в дозе 80 мг.
У пациентов с неадекватным контролем АД при дозе 80 мг 1 раз в сутки дозу титровали до 160 мг 1 раз в сутки или 80 мг 2 раза в сутки, что привело к сопоставимому ответу в обеих группах.
В контролируемых исследованиях антигипертензивный эффект валсартана в дозе 80 мг 1 раз в сутки был аналогичен эффекту эналаприла в дозе 20 мг 1 раз в сутки или лизиноприла в дозе 10 мг 1 раз в сутки.
Нет испытаний валсартана, демонстрирующих снижение риска сердечно-сосудистых заболеваний у пациентов с гипертензией, но по крайней мере один фармакологически подобный препарат продемонстрировал такие преимущества.
В контролируемых исследованиях практически не наблюдалось изменений ЧСС у пациентов, получавших валсартан.
Гипертензия у педиатрических пациентов.
Антигипертензивные эффекты валсартана оценивали в двух рандомизированных двойных слепых клинических исследованиях.
В клиническом исследовании с участием 261 педиатрического пациента с гипертензией в возрасте от 6 до 16 лет пациенты с массой тела <35 кг получали 10, 40 или 80 мг валсартана в сутки (низкие, средние и высокие дозы), а пациенты с массой тела ≥35 кг - 20, 80 и 160 мг валсартана в сутки (низкие, средние и высокие дозы). Нарушения со стороны почек и мочевыводящих путей, а также эссенциальная гипертензия с ожирением или без него были наиболее частыми первопричинами гипертензии у детей, включенных в это исследование. По истечении 2 нед валсартан дозозависимо снижал как сАД, так и дАД. В целом три уровня доз валсартана (низкий, средний и высокий) значимо снижали сАД на −8, −10, −12 мм от исходного уровня соответственно. Пациенты были повторно рандомизированы для продолжения приема той же дозы валсартана или были переведены на прием плацебо. У пациентов, которые продолжали получать средние и высокие дозы валсартана, минимальное сАД было на −4 и −7 мм ниже, чем у пациентов, получавших плацебо. У пациентов, получавших низкую дозу валсартана, минимальное сАД было таким же, как у пациентов, получавших плацебо. В целом дозозависимый антигипертензивный эффект валсартана был стойким во всех демографических подгруппах.
В клиническом исследовании с участием 90 педиатрических пациентов с гипертензией в возрасте от 1 до 5 лет с аналогичным дизайном исследования были получены некоторые доказательства эффективности, но результаты безопасности, для которых нельзя было исключить связь с лечением, не позволяют дать рекомендации по применению в этой возрастной группе ( см «Побочные действия»).
Сердечная недостаточность.
Valsartan Heart Failure Trial (Val-HeFT) было многонациональным двойным слепым исследованием, в котором участвовали 5010 пациентов с сердечной недостаточностью II (62%)-IV (2%) классов по классификации NYHA и ФВЛЖ <40%, получавших исходную терапию, выбранную им врачами. Пациенты были рандомизированы в группы плацебо или валсартана (с титрованием дозы от 40 мг 2 раза в день до максимальной переносимой дозы или 160 мг 2 раза в день) и наблюдались в среднем около 2 лет. Хотя основной целью Val-HeFT было изучение эффекта валсартана при добавлении к ингибитору АПФ, около 7% пациентов не получали ингибитор АПФ. Другая традиционная терапия включала диуретики (86%), дигоксин (67%) и бета-адреноблокаторы (36%). В исследованной популяции 80% составляли мужчины, 46% пациентов были в возрасте 65 лет и старше и 89% - европеоиды. В конце исследования у пациентов в группе, получавшей валсартан, сАД было на 4 мм , а дАД - на 2 мм ниже, чем в группе плацебо. Две первичные конечные точки, которые были определены как время до первого события, включали смертность от всех причин и заболеваемость, связанную с сердечной недостаточностью, последняя определялась как смертность от всех причин, внезапная смерть при реанимации, госпитализация по поводу сердечной недостаточности и необходимость в/в введения ЛС с инотропным или сосудорасширяющим действием не менее 4 Эти результаты приведены в следующей таблице.
Таблица 1.
Хотя общий результат заболеваемости говорил о преимуществе валсартана, этот результат во многом был обусловлен тем, что 7% пациентов не получали ингибитор АПФ, как показано в следующей таблице.
Таблица 2.
Умеренный положительный результат в группе, получавшей ингибитор АПФ, был в значительной степени связан с пациентами, получавшими ингибитор АПФ в дозе, меньше рекомендованной. Таким образом, имеется мало доказательств дальнейшей клинической пользы при добавлении валсартана к терапии ингибитором АПФ в адекватной дозе.
Вторичные конечные точки в подгруппе, не получавшей ингибиторы АПФ, были следующими.
Таблица 3.
У пациентов, не получавших ингибитор АПФ, но получавших валсартан, наблюдалось увеличение ФВЛЖ и уменьшение внутреннего конечно-диастолического диаметра левого желудочка.
Эффекты в целом были одинаковыми для подгрупп, подобранных по возрасту и полу, в популяции пациентов, не получавших ингибитор АПФ. Количество чернокожих пациентов было небольшим и не позволяет провести значимую оценку в этой подгруппе пациентов.
Применение после инфаркта миокарда.
VALsartan In Аcute myocardial iNfarcTion trial (VALIANT). Рандомизированное контролируемое многонациональное двойное слепое исследование с участием 14703 пациентов с острым инфарктом миокарда, осложненным сердечной недостаточностью (признаки, симптомы или рентгенологические данные) или систолической дисфункцией левого желудочка (фракция выброса ≤40% при радиовентрикулографии или ≤35% при эхокардиографии или желудочковой контрастной ангиографии). Пациенты были рандомизированы в период от 12 ч до 10 дней после появления симптомов инфаркта миокарда в одну из трех групп лечения: валсартан (от 20 или 40 мг 2 раза в день до наивысшей переносимой дозы вплоть до максимальной 160 мг 2 раза в день), ингибитор АПФ, каптоприл (от 6,25 мг 3 раза в день до наивысшей переносимой дозы вплоть до максимальной 50 мг 3 раза в день) или сочетание валсартана и каптоприла. В группе комбинированной терапии доза валсартана была увеличена с 20 мг 2 раза в день до наивысшей переносимой дозы вплоть до максимальной 80 мг 2 раза в день; доза каптоприла была такой же, как при монотерапии. В исследуемой популяции было 69% мужчин, 94% европеоидов и 53% пациента были в возрасте 65 лет и старше. Исходная терапия включала аспирин (91%), бета-адреноблокаторы (70%), ингибиторы АПФ (40%), тромболитики (35%) и статины (34%). Средняя продолжительность лечения составила 2 года. Средняя суточная доза валсартана в группе монотерапии составляла 217 мг.
Первичной конечной точкой было время до смертности от всех причин. Вторичные конечные точки включали (1) время до сердечно-сосудистой смертности и (2) время до первого события сердечно-сосудистой смертности, повторного инфаркта или госпитализации по поводу сердечной недостаточности. Результаты представлены в следующей таблице.
Таблица 4.
Не было различий в общей смертности между тремя группами лечения. Таким образом, не было доказательств того, что сочетание ингибитора АПФ каптоприла и АРА II валсартана было полезным.
Была проведена оценка данных, чтобы посмотреть, проявляет ли валсартан не меньшую эффективность и сохраняет ли он часть эффекта каптоприла, препарата с продемонстрированным влиянием на выживаемость в этих условиях. Традиционная оценка эффекта каптоприла (основанная на объединенном анализе 3 постинфарктных исследований каптоприла и 2 других ингибиторов АПФ) показала снижение смертности на 14-16% по сравнению с плацебо. Валсартан можно было бы считать эффективным, если бы он сохранял значительную часть этого эффекта и однозначно сохранял часть этого эффекта. Как показано в таблице, верхняя граница ДИ для ОР (валсартан/каптоприл) для общей смертности или смертности от сердечно-сосудистых заболеваний составляет от 1,09 до 1,11, разница примерно от 9 до 11%, таким образом, валсартан четко демонстрирует свою эффективность. Другие вторичные конечные точки соответствовали этому выводу.
Влияние на смертность среди подгрупп в исследовании VALIANT.
Не было явных различий в смертности от всех причин в зависимости от возраста, пола, расы или исходного лечения.
Метаболизм и выведение.
Валсартан при приеме внутрь в виде раствора преимущественно выводится с фекалиями (около 83% дозы) и мочой (около 13% дозы). Выведение осуществляется в основном в неизмененном виде, только около 20% дозы - в виде метаболитов. Основным метаболитом, составляющим около 9% дозы, является валерил-4-гидроксивалсартан. Исследования метаболизма in vitro >in vitro с участием рекомбинантных изоферментов сYP цитохрома Р450 показали, что за образование валерил-4-гидроксивалсартана отвечает изофермент сYP2C9. Валсартан не ингибирует изоферменты сYP цитохрома Р450 в клинически значимых концентрациях. Взаимодействие, опосредованное сYP 450, валсартана и ЛС, принимаемых одновременно, маловероятно из-за низкой степени метаболизма.
После в/в введения плазменный клиренс валсартана составляет около 2 л/ почечный клиренс - 0,62 л/ч (около 30% общего клиренса).
Распределение.
Vd валсартана после в/в введения в равновесном состоянии небольшой (17 л), что указывает на то, что валсартан не распределяется в тканях широко. Связывание валсартана с белками сыворотки крови высокое (95%), в основном с альбумином сыворотки.
Зависимость параметров фармакокинетики от некоторых факторов.
Педиатрические пациенты. В исследовании у педиатрических пациентов с гипертензией (n=26, от 1 года до 16 лет), получавших однократные дозы суспензии валсартана (в среднем от 0,9 до 2 мг/кг), значения клиренса (л/ч/кг) валсартана у детей были сходными с таковыми у взрослых.
Гериатрические пациенты. Экспозиция валсартана (измеренная по AUC) у пожилых людей выше на 70%, а Т1/2 больше на 35%, чем у молодых. Корректировка дозы не требуется.
Пол. Фармакокинетика валсартана существенно не различается у мужчин и женщин.
Сердечная недостаточность. Среднее время достижения maxCmax и Т1/2 валсартана у пациентов с сердечной недостаточностью схожи с теми, которые наблюдаются у здоровых добровольцев. Значения AUC и maxCmax валсартана линейно увеличиваются и почти пропорциональны увеличению дозы в пределах клинического диапазона доз (от 40 до 160 мг 2 раза в день). Средний коэффициент кумуляции составляет около 1,7. Кажущийся клиренс валсартана после перорального приема составляет примерно 4,5 л/ Возраст не влияет на кажущийся клиренс у пациентов с сердечной недостаточностью.
Почечная недостаточность. Нет очевидной корреляции между функцией почек (измеренной по клиренсу креатинина) и экспозицией валсартана (измеренной по AUC) у пациентов с различной степенью почечной недостаточности. Следовательно, коррекция дозы не требуется у пациентов с нарушением функции почек легкой и средней степени тяжести. Исследования у пациентов с тяжелым нарушением функции почек (Cl креатинина <10 мл/мин) не проводили. Валсартан не выводится из плазмы при гемодиализе. При тяжелой почечной недостаточности необходимо соблюдать осторожность при дозировании валсартана.
Печеночная недостаточность. В среднем у пациентов с хроническим заболеванием печени от легкой до умеренной степени экспозиция валсартана (оцененная по значениям AUC) вдвое выше по сравнению с экспозицией у здоровых добровольцев (с учетом возраста, пола и массы тела). Как правило, у пациентов с заболеванием печени легкой и средней степени тяжести коррекция дозы не требуется. Следует проявлять осторожность у пациентов с заболеванием печени.
Доклиническая токсикология.
Канцерогенность, мутагенность, влияние на фертильность.
Не обнаружено доказательств канцерогенности при приеме валсартана с пищей в дозах до 160 и 200 мг/кг/сут у мышей и крыс соответственно в период до 2 лет. Эти дозы для мышей и крыс примерно в 2,6 и 6 раз соответственно превышают МРДЧ из расчета на мг/м2 (в расчетах принимается пероральная доза 320 мг/сут для пациента с массой тела 60 кг).
В исследовании мутагенности не выявлено каких-либо эффектов, связанных с валсартаном, ни на генном уровне, ни на уровне хромосом. Эти анализы включали тесты на бактериальную мутагенность с Salmonella (Ames) и E.coli; тест генных мутаций на клетках китайского хомячка линии V79; цитогенетический тест на клетках яичника китайского хомячка и микроядерный тест у крыс.
Валсартан не оказывал неблагоприятного воздействия на репродуктивную функцию самцов или самок крыс при пероральных дозах до 200 мг/кг/сут. Эта доза в 6 раз превышает МРДЧ из расчета мг/м2 (в расчетах принимается пероральная доза 320 мг/сут для пациента с массой тела 60 кг).
Фармакология и токсикология у животных.
Исследования репродуктивной токсикологии.
При пероральном применении валсартана в дозах до 600 мг/кг/сут у беременных мышей и крыс и в дозах до 10 мг/кг/сут у крольчих тератогенных эффектов не наблюдалось. Однако в исследованиях, в которых беременные крысы получали валсартан в пероральных дозах 600 мг/кг/сут, токсичных для матери (снижение прибавки массы тела и потребления пищи), во время органогенеза или поздних сроков беременности и лактации, наблюдались значительное снижение массы тела плодов, массы тела детенышей при рождении, выживаемости детенышей и небольшие задержки этапов развития. У крольчих фетотоксичность ( резорбция, потеря помета, выкидыши и низкая масса тела), ассоциированные с материнской токсичностью (смертностью), наблюдалась при дозах 5 и 10 мг/кг/сут. Не наблюдалось побочных эффектов при дозах 600, 200 и 2 мг/кг/сут у мышей, крыс и кроликов, что составляет 9, 6 и 0,1 МРДЧ соответственно из расчета на мг/м2. В расчетах принимается пероральная доза 320 мг/сут для пациента с массой тела 60 кг.
Клинические исследования.
Гипертензия.
Гипертензия у взрослых.
Антигипертензивный эффект валсартана был продемонстрирован в основном в 7 плацебо- контролируемых испытаниях продолжительностью от 4 до 12 нед (1 - у пациентов старше 65 лет) при применении в дозах от 10 до 320 мг/сут у пациентов с исходным дАД 95-115 мм Исследования позволили сравнить режимы приема 160 мг/сут 1 раз в день и 2 раза в день; сравнить максимальный и минимальный эффект; сравнить (в объединенных данных) ответ в зависимости от пола, возраста и расы; и оценить дополнительные эффекты гидрохлоротиазида.
Применение валсартана у пациентов с эссенциальной гипертензией приводит к значительному снижению сАД и дАД в положении сидя, лежа и стоя, обычно с незначительными ортостатическими реакциями или без них.
У большинства пациентов после приема однократной пероральной дозы начало антигипертензивного действия наблюдается примерно в течение 2 а максимальное снижение АД достигается в течение 6 Антигипертензивный эффект сохраняется в течение 24 ч после приема, но наблюдается снижение по сравнению с максимальным эффектом при более низких дозах (40 мг), предположительно отражающее утрату ингибирования действия ангиотензина II. Однако при более высоких дозах (160 мг) разница в максимальном и минимальном эффекте незначительна. При повторных приемах снижение АД при любой дозе в основном наблюдается в течение 2 нед, а максимальное снижение обычно достигается через 4 нед. В долгосрочных исследованиях (без контроля плацебо) эффект валсартана поддерживался до 2 лет. Антигипертензивный эффект не зависит от возраста, пола или расы. Вывод относительно расы основан на объединенных данных и должен рассматриваться с осторожностью, потому что антигипертензивные ЛС, влияющие на РААС (такие как ингибиторы АПФ и АРА II), как правило, менее эффективны при низком уровне активности ренина плазмы (часто у чернокожих), чем при высокой активности ренина плазмы (часто у белокожих). В объединенных рандомизированных контролируемых испытаниях валсартана, в которых участвовали в общей сложности 140 чернокожих и 830 белокожих пациентов, валсартан и ингибитор АПФ в качестве контроля были, по крайней мере, столь же эффективны у чернокожих, как и у белокожих. Объяснение этого отличия от предыдущих результатов неясно.
Резкая отмена валсартана не была ассоциирована с быстрым повышением АД.
При применении валсартана и диуретиков тиазидного ряда отмечается аддитивный гипотензивный эффект.
В 7 исследований монотерапии валсартаном было включено более 2000 пациентов, рандомизированных для получения различных доз валсартана, и около 800 пациентов, рандомизированных в группу плацебо. Минимальный эффект при дозах ниже 80 мг не всегда отличался от наблюдаемого при приеме плацебо, но дозы 80, 160 и 320 мг вызывали дозозависимое снижение сАД и дАД с отличием от плацебо примерно на 6-9/3-5 мм при дозах от 80 до 160 мг и 9/6 мм при дозе 320 мг. В контролируемом исследовании добавление гидрохлоротиазида к валсартану в дозе 80 мг приводило к дополнительному снижению сАД и дАД примерно на 6/3 и 12/5 мм для доз гидрохлоротиазида 12,5 и 25 мг соответственно по сравнению с приемом только валсартана в дозе 80 мг.
У пациентов с неадекватным контролем АД при дозе 80 мг 1 раз в сутки дозу титровали до 160 мг 1 раз в сутки или 80 мг 2 раза в сутки, что привело к сопоставимому ответу в обеих группах.
В контролируемых исследованиях антигипертензивный эффект валсартана в дозе 80 мг 1 раз в сутки был аналогичен эффекту эналаприла в дозе 20 мг 1 раз в сутки или лизиноприла в дозе 10 мг 1 раз в сутки.
Нет испытаний валсартана, демонстрирующих снижение риска сердечно-сосудистых заболеваний у пациентов с гипертензией, но по крайней мере один фармакологически подобный препарат продемонстрировал такие преимущества.
В контролируемых исследованиях практически не наблюдалось изменений ЧСС у пациентов, получавших валсартан.
Гипертензия у педиатрических пациентов.
Антигипертензивные эффекты валсартана оценивали в двух рандомизированных двойных слепых клинических исследованиях.
В клиническом исследовании с участием 261 педиатрического пациента с гипертензией в возрасте от 6 до 16 лет пациенты с массой тела <35 кг получали 10, 40 или 80 мг валсартана в сутки (низкие, средние и высокие дозы), а пациенты с массой тела ≥35 кг - 20, 80 и 160 мг валсартана в сутки (низкие, средние и высокие дозы). Нарушения со стороны почек и мочевыводящих путей, а также эссенциальная гипертензия с ожирением или без него были наиболее частыми первопричинами гипертензии у детей, включенных в это исследование. По истечении 2 нед валсартан дозозависимо снижал как сАД, так и дАД. В целом три уровня доз валсартана (низкий, средний и высокий) значимо снижали сАД на −8, −10, −12 мм от исходного уровня соответственно. Пациенты были повторно рандомизированы для продолжения приема той же дозы валсартана или были переведены на прием плацебо. У пациентов, которые продолжали получать средние и высокие дозы валсартана, минимальное сАД было на −4 и −7 мм ниже, чем у пациентов, получавших плацебо. У пациентов, получавших низкую дозу валсартана, минимальное сАД было таким же, как у пациентов, получавших плацебо. В целом дозозависимый антигипертензивный эффект валсартана был стойким во всех демографических подгруппах.
В клиническом исследовании с участием 90 педиатрических пациентов с гипертензией в возрасте от 1 до 5 лет с аналогичным дизайном исследования были получены некоторые доказательства эффективности, но результаты безопасности, для которых нельзя было исключить связь с лечением, не позволяют дать рекомендации по применению в этой возрастной группе ( см «Побочные действия»).
Сердечная недостаточность.
Valsartan Heart Failure Trial (Val-HeFT) было многонациональным двойным слепым исследованием, в котором участвовали 5010 пациентов с сердечной недостаточностью II (62%)-IV (2%) классов по классификации NYHA и ФВЛЖ <40%, получавших исходную терапию, выбранную им врачами. Пациенты были рандомизированы в группы плацебо или валсартана (с титрованием дозы от 40 мг 2 раза в день до максимальной переносимой дозы или 160 мг 2 раза в день) и наблюдались в среднем около 2 лет. Хотя основной целью Val-HeFT было изучение эффекта валсартана при добавлении к ингибитору АПФ, около 7% пациентов не получали ингибитор АПФ. Другая традиционная терапия включала диуретики (86%), дигоксин (67%) и бета-адреноблокаторы (36%). В исследованной популяции 80% составляли мужчины, 46% пациентов были в возрасте 65 лет и старше и 89% - европеоиды. В конце исследования у пациентов в группе, получавшей валсартан, сАД было на 4 мм , а дАД - на 2 мм ниже, чем в группе плацебо. Две первичные конечные точки, которые были определены как время до первого события, включали смертность от всех причин и заболеваемость, связанную с сердечной недостаточностью, последняя определялась как смертность от всех причин, внезапная смерть при реанимации, госпитализация по поводу сердечной недостаточности и необходимость в/в введения ЛС с инотропным или сосудорасширяющим действием не менее 4 Эти результаты приведены в следующей таблице.
Таблица 1.
| Плацебо (n=2499) | Валсартан (n=2511) | Отношение рисков (95% ДИ) | Номинальное p-значение | |
| Смертность от всех причин | 484 (19,4%) | 495 (19,7%) | 1,02 (0,9-1,15) | 0,8 |
| Заболеваемость, связанная с сердечной недостаточностью | 801 (32,1%) | 723 (28,8%) | 0,87 (0,79-0,97) | 0,009 |
Хотя общий результат заболеваемости говорил о преимуществе валсартана, этот результат во многом был обусловлен тем, что 7% пациентов не получали ингибитор АПФ, как показано в следующей таблице.
Таблица 2.
| Без ингибитора АПФ | С ингибитором АПФ | |||
| Плацебо (n=181) | Валсартан (n=185) | Плацебо (n=2318) | Валсартан (n=2326) | |
| События (%) | 77 (42,5%) | 46 (24,9%) | 724 (31,2%) | 677 (29,1%) |
| Отношение рисков (95% ДИ) | 0,51 (0,35; 0,73) | 0,92 (0,82; 1,02) | ||
| p-значение | 0,0002 | 0,0965 | ||
Умеренный положительный результат в группе, получавшей ингибитор АПФ, был в значительной степени связан с пациентами, получавшими ингибитор АПФ в дозе, меньше рекомендованной. Таким образом, имеется мало доказательств дальнейшей клинической пользы при добавлении валсартана к терапии ингибитором АПФ в адекватной дозе.
Вторичные конечные точки в подгруппе, не получавшей ингибиторы АПФ, были следующими.
Таблица 3.
| Плацебо (n=181) | Валсартан (n=185) | Отношение рисков (95% ДИ) | |
| Компоненты заболеваемости, связанной с сердечной недостаточностью | |||
| Смертность от всех причин | 49 (27,1%) | 32 (17,3%) | 0,59 (0,37; 0,91) |
| Внезапная смерть при реанимации | 2 (1,1%) | 1 (0,5%) | 0,47 (0,04; 5,2) |
| Лечение ХСН | 1 (0,6%) | 0 (0%) | − |
| Госпитализация при ХСН | 48 (26,5%) | 24 (13%) | 0,43 (0,27; 0,71) |
| Смертность от срдечно-сосудистых заболеваний | 40 (22,1%) | 29 (15,7%) | 0,65 (0,4; 1,05) |
| Заболеваемость без летального исхода | 49 (27,1%) | 24 (13%) | 0,42 (0,26; 0,69) |
У пациентов, не получавших ингибитор АПФ, но получавших валсартан, наблюдалось увеличение ФВЛЖ и уменьшение внутреннего конечно-диастолического диаметра левого желудочка.
Эффекты в целом были одинаковыми для подгрупп, подобранных по возрасту и полу, в популяции пациентов, не получавших ингибитор АПФ. Количество чернокожих пациентов было небольшим и не позволяет провести значимую оценку в этой подгруппе пациентов.
Применение после инфаркта миокарда.
VALsartan In Аcute myocardial iNfarcTion trial (VALIANT). Рандомизированное контролируемое многонациональное двойное слепое исследование с участием 14703 пациентов с острым инфарктом миокарда, осложненным сердечной недостаточностью (признаки, симптомы или рентгенологические данные) или систолической дисфункцией левого желудочка (фракция выброса ≤40% при радиовентрикулографии или ≤35% при эхокардиографии или желудочковой контрастной ангиографии). Пациенты были рандомизированы в период от 12 ч до 10 дней после появления симптомов инфаркта миокарда в одну из трех групп лечения: валсартан (от 20 или 40 мг 2 раза в день до наивысшей переносимой дозы вплоть до максимальной 160 мг 2 раза в день), ингибитор АПФ, каптоприл (от 6,25 мг 3 раза в день до наивысшей переносимой дозы вплоть до максимальной 50 мг 3 раза в день) или сочетание валсартана и каптоприла. В группе комбинированной терапии доза валсартана была увеличена с 20 мг 2 раза в день до наивысшей переносимой дозы вплоть до максимальной 80 мг 2 раза в день; доза каптоприла была такой же, как при монотерапии. В исследуемой популяции было 69% мужчин, 94% европеоидов и 53% пациента были в возрасте 65 лет и старше. Исходная терапия включала аспирин (91%), бета-адреноблокаторы (70%), ингибиторы АПФ (40%), тромболитики (35%) и статины (34%). Средняя продолжительность лечения составила 2 года. Средняя суточная доза валсартана в группе монотерапии составляла 217 мг.
Первичной конечной точкой было время до смертности от всех причин. Вторичные конечные точки включали (1) время до сердечно-сосудистой смертности и (2) время до первого события сердечно-сосудистой смертности, повторного инфаркта или госпитализации по поводу сердечной недостаточности. Результаты представлены в следующей таблице.
Таблица 4.
| Валсартан vs. каптоприл (n=4909) (n=4909) | Валсартан + каптоприл vs. каптоприл (n=4885) (n=4909) | |||||
| Количество смертей валсартан/каптоприл | Отношение рисков (ДИ) | р-значение | Количество смертей комбинация/каптоприл | Отношение рисков (ДИ) | р-значение | |
| Смертность от всех причин | 979 (19,9%)/958 (19,5%) | 1,001 (0,902; 1,111) | 0,98 | 941 (19,3%)/958 (19,5%) | 0,984 (0,886; 1,093) | 0,73 |
| Смертность от сердечно-сосудистых заболеваний | 827 (16,8%)/830 (16,9%) | 0,976 (0,875; 1,09) | ||||
| Смертность от сердечно-сосудистых заболеваний, госпитализация по поводу сердечной недостаточности, повторный несмертельный инфаркт миокарда | 1529 (31,1%)/1567 (31,9%) | 0,955 (0,881; 1,035) | ||||
Не было различий в общей смертности между тремя группами лечения. Таким образом, не было доказательств того, что сочетание ингибитора АПФ каптоприла и АРА II валсартана было полезным.
Была проведена оценка данных, чтобы посмотреть, проявляет ли валсартан не меньшую эффективность и сохраняет ли он часть эффекта каптоприла, препарата с продемонстрированным влиянием на выживаемость в этих условиях. Традиционная оценка эффекта каптоприла (основанная на объединенном анализе 3 постинфарктных исследований каптоприла и 2 других ингибиторов АПФ) показала снижение смертности на 14-16% по сравнению с плацебо. Валсартан можно было бы считать эффективным, если бы он сохранял значительную часть этого эффекта и однозначно сохранял часть этого эффекта. Как показано в таблице, верхняя граница ДИ для ОР (валсартан/каптоприл) для общей смертности или смертности от сердечно-сосудистых заболеваний составляет от 1,09 до 1,11, разница примерно от 9 до 11%, таким образом, валсартан четко демонстрирует свою эффективность. Другие вторичные конечные точки соответствовали этому выводу.
Влияние на смертность среди подгрупп в исследовании VALIANT.
Не было явных различий в смертности от всех причин в зависимости от возраста, пола, расы или исходного лечения.
|
|
Показания к применению
Гипертензия.
Валсартан показан при лечении гипертензии для снижения АД. Снижение АД уменьшает риск смертельных и нефатальных сердечно-сосудистых событий, в первую очередь инсультов и инфарктов миокарда. Эти преимущества были отмечены в контролируемых испытаниях антигипертензивных ЛС из широкого спектра фармакологических классов, включая класс, к которому принадлежит валсартан. Контролируемых исследований, демонстрирующих снижение риска при применении валсартана, с участием пациентов с гипертензией, не проводилось.
Контроль высокого АД должен быть частью комплексного управления риском сердечно-сосудистых заболеваний. включая при необходимости контроль уровня липидов. контроль диабета. антитромботическую терапию. отказ от курения. физические упражнения и ограниченное потребление натрия. Многим пациентам для достижения целевого АД может потребоваться более одного ЛС.
В рандомизированных контролируемых исследованиях было показано. что многочисленные антигипертензивные ЛС из различных фармакологических классов и с различными механизмами действия снижают сердечно-сосудистую заболеваемость и смертность. и можно заключить. что именно снижение АД. а не какое-либо другое фармакологическое свойство ЛС. в значительной степени ответственно за это преимущество. Самым большим и наиболее стойким преимуществом в отношении сердечно-сосудистых заболеваний было снижение риска инсульта. но также регулярно наблюдалось снижение риска инфаркта миокарда и смертности от сердечно-сосудистых заболеваний.
Повышенное сАД или дАД вызывает повышение риска сердечно-сосудистых заболеваний, а абсолютное увеличение риска в мм больше при более высоком АД, так что даже умеренное снижение тяжелой гипертензии может дать существенную пользу. Снижение ОР при снижении АД одинаково для разных групп населения с различным абсолютным риском. поэтому абсолютная польза больше у пациентов с повышенным риском. независимо от их гипертензии (например. пациенты с диабетом или гиперлипидемией). и у таких пациентов можно ожидать получить пользу от более агрессивного лечения для снижения АД.
Некоторые антигипертензивные ЛС оказывают меньшее влияние на АД (при монотерапии) у чернокожих пациентов. а многие антигипертензивные ЛС имеют дополнительные одобренные показания и эффекты (например. при стенокардии. сердечной недостаточности или диабетической болезни почек). Эти соображения могут определять выбор терапии.
Валсартан можно применять отдельно или в комбинации с другими антигипертензивными ЛС.
Сердечная недостаточность.
Валсартан показан для лечения сердечной недостаточности (класс II-IV по классификации NYHA). В контролируемых клинических испытаниях валсартан значительно сокращал количество госпитализаций по поводу сердечной недостаточности.Нет каких-либо доказательств того, что валсартан обеспечивает дополнительные преимущества при использовании с адекватной дозой ингибитора АПФ ( см Клинические исследования).
Постинфарктное состояние.
У клинически стабильных пациентов с левожелудочковой недостаточностью или дисфункцией левого желудочка после инфаркта миокарда валсартан показан для снижения смертности от сердечно-сосудистых заболеваний ( см Клинические исследования).
Валсартан показан при лечении гипертензии для снижения АД. Снижение АД уменьшает риск смертельных и нефатальных сердечно-сосудистых событий, в первую очередь инсультов и инфарктов миокарда. Эти преимущества были отмечены в контролируемых испытаниях антигипертензивных ЛС из широкого спектра фармакологических классов, включая класс, к которому принадлежит валсартан. Контролируемых исследований, демонстрирующих снижение риска при применении валсартана, с участием пациентов с гипертензией, не проводилось.
Контроль высокого АД должен быть частью комплексного управления риском сердечно-сосудистых заболеваний. включая при необходимости контроль уровня липидов. контроль диабета. антитромботическую терапию. отказ от курения. физические упражнения и ограниченное потребление натрия. Многим пациентам для достижения целевого АД может потребоваться более одного ЛС.
В рандомизированных контролируемых исследованиях было показано. что многочисленные антигипертензивные ЛС из различных фармакологических классов и с различными механизмами действия снижают сердечно-сосудистую заболеваемость и смертность. и можно заключить. что именно снижение АД. а не какое-либо другое фармакологическое свойство ЛС. в значительной степени ответственно за это преимущество. Самым большим и наиболее стойким преимуществом в отношении сердечно-сосудистых заболеваний было снижение риска инсульта. но также регулярно наблюдалось снижение риска инфаркта миокарда и смертности от сердечно-сосудистых заболеваний.
Повышенное сАД или дАД вызывает повышение риска сердечно-сосудистых заболеваний, а абсолютное увеличение риска в мм больше при более высоком АД, так что даже умеренное снижение тяжелой гипертензии может дать существенную пользу. Снижение ОР при снижении АД одинаково для разных групп населения с различным абсолютным риском. поэтому абсолютная польза больше у пациентов с повышенным риском. независимо от их гипертензии (например. пациенты с диабетом или гиперлипидемией). и у таких пациентов можно ожидать получить пользу от более агрессивного лечения для снижения АД.
Некоторые антигипертензивные ЛС оказывают меньшее влияние на АД (при монотерапии) у чернокожих пациентов. а многие антигипертензивные ЛС имеют дополнительные одобренные показания и эффекты (например. при стенокардии. сердечной недостаточности или диабетической болезни почек). Эти соображения могут определять выбор терапии.
Валсартан можно применять отдельно или в комбинации с другими антигипертензивными ЛС.
Сердечная недостаточность.
Валсартан показан для лечения сердечной недостаточности (класс II-IV по классификации NYHA). В контролируемых клинических испытаниях валсартан значительно сокращал количество госпитализаций по поводу сердечной недостаточности.Нет каких-либо доказательств того, что валсартан обеспечивает дополнительные преимущества при использовании с адекватной дозой ингибитора АПФ ( см Клинические исследования).
Постинфарктное состояние.
У клинически стабильных пациентов с левожелудочковой недостаточностью или дисфункцией левого желудочка после инфаркта миокарда валсартан показан для снижения смертности от сердечно-сосудистых заболеваний ( см Клинические исследования).
Противопоказания
Гиперчувствительность, одновременное применение алискирена у пациентов с диабетом ( см «Взаимодействие»).
При беременности и кормлении грудью
Беременность.
Категория действия на плод по FDA. D.
Применение ЛС, влияющих на РААС, во II и III триместрах беременности снижает функцию почек плода и увеличивает заболеваемость и смертность плода и новорожденного. Возникающее в результате маловодие может быть ассоциировано с гипоплазией легких плода и деформациями скелета. Возможные побочные эффекты у новорожденных включают гипоплазию черепа, анурию, гипотензию, почечную недостаточность и смерть. Эти неблагоприятные исходы обычно связаны с применением этих ЛС во II и III триместрах беременности. При установлении беременности необходимо как можно скорее прекратить прием валсартана. В большинстве эпидемиологических исследований, посвященных изучению аномалий плода после экспозиции антигипертензивных средств в I триместре, не обнаружено отличий эффектов ЛС, влияющих на РААС, и других антигипертензивных средств. Надлежащее управление материнской гипертензией во время беременности важно для оптимизации исходов как для матери, так и для плода.
В случае отсутствия подходящей альтернативы терапии ЛС, влияющими на РААС, у конкретной пациентки, женщина должна быть предупреждена о потенциальном риске для плода. Необходимо выполнять серийные УЗИ для оценки внутриамниотической среды. При возникновении маловодия следует прекратить прием валсартана, если эта терапия не является спасением жизни матери. В зависимости от срока беременности, может потребоваться тестирование плода. Однако следует иметь в виду, что маловодие может появиться только после того, как плод получит необратимое повреждение. Необходимо тщательное наблюдение за состоянием младенцев, которые in utero подверглись экспозиции валсартана, на предмет развития гипертензии, олигурии и гиперкалиемии ( см «Меры предосторожности»).
Грудное вскармливание.
Неизвестно, экскретируется ли валсартан в грудное молоко. Валсартан обнаруживается в молоке лактирующих крыс, однако уровни ЛС в грудном молоке животных могут не точно отражать уровни в грудном молоке женщин. Поскольку многие ЛС экскретируются в грудное молоко и из-за возможности побочных реакций у грудных младенцев, следует принять решение о прекращении кормления грудью или прекращении приема валсартана, принимая во внимание его важность для матери.
Категория действия на плод по FDA. D.
Применение ЛС, влияющих на РААС, во II и III триместрах беременности снижает функцию почек плода и увеличивает заболеваемость и смертность плода и новорожденного. Возникающее в результате маловодие может быть ассоциировано с гипоплазией легких плода и деформациями скелета. Возможные побочные эффекты у новорожденных включают гипоплазию черепа, анурию, гипотензию, почечную недостаточность и смерть. Эти неблагоприятные исходы обычно связаны с применением этих ЛС во II и III триместрах беременности. При установлении беременности необходимо как можно скорее прекратить прием валсартана. В большинстве эпидемиологических исследований, посвященных изучению аномалий плода после экспозиции антигипертензивных средств в I триместре, не обнаружено отличий эффектов ЛС, влияющих на РААС, и других антигипертензивных средств. Надлежащее управление материнской гипертензией во время беременности важно для оптимизации исходов как для матери, так и для плода.
В случае отсутствия подходящей альтернативы терапии ЛС, влияющими на РААС, у конкретной пациентки, женщина должна быть предупреждена о потенциальном риске для плода. Необходимо выполнять серийные УЗИ для оценки внутриамниотической среды. При возникновении маловодия следует прекратить прием валсартана, если эта терапия не является спасением жизни матери. В зависимости от срока беременности, может потребоваться тестирование плода. Однако следует иметь в виду, что маловодие может появиться только после того, как плод получит необратимое повреждение. Необходимо тщательное наблюдение за состоянием младенцев, которые in utero подверглись экспозиции валсартана, на предмет развития гипертензии, олигурии и гиперкалиемии ( см «Меры предосторожности»).
Грудное вскармливание.
Неизвестно, экскретируется ли валсартан в грудное молоко. Валсартан обнаруживается в молоке лактирующих крыс, однако уровни ЛС в грудном молоке животных могут не точно отражать уровни в грудном молоке женщин. Поскольку многие ЛС экскретируются в грудное молоко и из-за возможности побочных реакций у грудных младенцев, следует принять решение о прекращении кормления грудью или прекращении приема валсартана, принимая во внимание его важность для матери.
Побочные эффекты
Опыт клинических испытаний.
Поскольку клинические испытания проводятся в разных условиях. частота побочных эффектов. наблюдаемых в клинических испытаниях ЛС. не может быть непосредственно сравнена с частотой неблагоприятных эффектов. полученных в других клинических испытаниях. и может не отражать частоту встречаемости этих эффектов в клинической практике.
Гипертензия у взрослых.
Безопасность валсартана оценивали более чем у 4000 пациентов, включая более 400, которые лечились более 6 мес, и более 160 - более 1 года. Побочные реакции, как правило, были легкими и преходящими и лишь в редких случаях требовали прекращения терапии. Общая частота побочных реакций при приеме валсартана и плацебо была сходна.
Общая частота побочных реакций не зависела от дозы и пола, возраста, расы или режима лечения. Прекращение терапии из-за побочных эффектов потребовалось у 2,3% пациентов при приеме валсартана и 2% пациентов, получавших плацебо. Наиболее частыми причинами прекращения терапии валсартаном были головная боль и головокружение.
Побочные реакции. которые наблюдались в плацебо-контролируемых клинических испытаниях по крайней мере у 1% пациентов. получавших валсартан. и с большей частотой у пациентов. принимавших валсартан (n=2316). чем у пациентов. получавших плацебо (n=888). включали вирусную инфекцию (3% против 2%). усталость (2% против 1%) и боль в животе (2% против 1%). Головная боль. головокружение. инфекции верхних дыхательных путей. кашель. диарея. ринит. синусит. тошнота. фарингит. отек и артралгия возникали с частотой более 1%. но примерно с одинаковой частотой у пациентов. получавших плацебо и валсартан.
В исследованиях, в которых валсартан сравнивали с ингибитором АПФ с плацебо или без него, частота сухого кашля была значительно выше в группе ингибитора АПФ (7,9%), чем в группах, получавших валсартан (2,6%) или плацебо (1,5%). В исследовании с участием 129 пациентов. ограниченного пациентами. у которых был сухой кашель после того. как они получали ингибиторы АПФ. частота кашля у пациентов. получавших валсартан. гидрохлоротиазид или лизиноприл. составила 20. 19 и 69% соответственно (p <0,001).
Дозозависимые ортостатические эффекты наблюдались менее чем у 1% пациентов. Увеличение частоты головокружения наблюдалось у пациентов, получавших валсартан 320 мг (8%) по сравнению с этими показателями у пациентов, получавших 10-160 мг (от 2 до 4%).
Валсартан применяли одновременно с гидрохлоротиазидом без очевидных клинически значимых побочных эффектов.
Другие побочные реакции, возникшие в контролируемых клинических испытаниях у пациентов, получавших валсартан (>0,2% пациентов), перечислены ниже. Невозможно определить, были ли эти события связаны с валсартаном.
Организм в целом. Аллергическая реакция и астения.
Со стороны ССС. Пальпитация.
Дерматологические. Зуд и сыпь.
Со стороны пищеварительной системы. Запор, сухость во рту, диспепсия и метеоризм.
Со стороны скелетно-мышечной системы. Боль в спине, мышечные спазмы и миалгия.
Неврология и психиатрия. Беспокойство, бессонница, парестезия и сонливость.
Со стороны респираторной системы. Одышка.
Со стороны органов чувств. Головокружение.
Со стороны мочеполовой системы. Импотенция.
Другие зарегистрированные явления. которые реже наблюдались в клинических испытаниях. включали боль в груди. обморок. анорексию. рвоту и ангионевротический отек.
Гипертензия у детей.
Безопасность валсартана оценивалась более чем у 400 педиатрических пациентов в возрасте от 6 до 17 лет и более чем у 160 педиатрических пациентов в возрасте от 6 мес до 5 лет. Не было выявлено значимых различий между профилем неблагоприятных реакций у педиатрических пациентов в возрасте от 6 до 16 лет и взрослых пациентов. Головная боль и гиперкалиемия были наиболее частыми нежелательными явлениями, которые предположительно были связаны с ЛС, у детей старшего возраста (от 6 до 17 лет) и детей младшего возраста (от 6 мес до 5 лет). Гиперкалиемия в основном наблюдалась у детей с предшествующим заболеванием почек. Нейрокогнитивная оценка и оценка развития педиатрических пациентов в возрасте от 6 до 16 лет не выявили общего клинически значимого неблагоприятного воздействия после лечения валсартаном в течение периода до 1 года.
Валсартан не рекомендуется детям младше 6 лет. В исследовании (n=90) педиатрических пациентов (от 1 до 5 лет) в течение 1 года открытой расширенной фазы наблюдались две смерти и три случая повышения уровня трансаминаз во время лечения. Эти 5 событий произошли в исследуемой популяции, в которой пациенты часто имели серьезные сопутствующие заболевания. Причинно-следственная связь с валсартаном не установлена. Во втором исследовании. в котором были рандомизированы 75 детей в возрасте от 1 до 6 лет. на протяжении 1 года расширенного исследования не было зарегистрировано ни одного случая смерти и один случай заметного повышения уровня печеночных трансаминаз.
Сердечная недостаточность.
Профиль неблагоприятного воздействия валсартана у пациентов с сердечной недостаточностью соответствовал фармакологии препарата и состоянию здоровья пациентов. В исследовании Valsartan Heart Failure Trial. при сравнении валсартана в общих суточных дозах до 320 мг (n=2506) с плацебо (n=2494). 10% пациентов прекратили прием валсартана из-за побочных реакций по сравнению с 7% пациентов. получавших плацебо.
В таблице показаны побочные реакции в двойных слепых краткосрочных испытаниях сердечной недостаточности. включая первые 4 мес Valsartan Heart Failure Trial. наблюдавшиеся с частотой не менее 2%. которые были более частыми у пациентов. получавших валсартан. чем у пациентов. получавших плацебо. Все пациенты получали стандартную лекарственную терапию сердечной недостаточности, часто в виде нескольких препаратов, включая диуретики, дигиталис, бета-адреноблокатор. Около 93% пациентов получали сопутствующую терапию ингибиторами АПФ.
Таблица 5.
Прекращение приема произошло у 0,5% пациентов, получавших валсартан, и у 0,1% пациентов, получавших плацебо, в связи со следующими факторами: повышение уровня креатинина и повышение уровня калия. Другие побочные реакции при приеме валсартана с частотой более 1% и более высокой. чем плацебо. включали головную боль БДУ (БДУ = без дополнительного уточнения). тошноту. почечную недостаточность БДУ (БДУ = без дополнительного уточнения). обморок. нечеткость зрения. боль в верхней части живота и головокружение.
По долгосрочным данным Valsartan Heart Failure Trial, не было выявлено каких-либо значительных побочных реакций, не отмеченных ранее.
Применение после инфаркта миокарда.
Профиль безопасности валсартана соответствовал фармакологии препарата и фоновым заболеваниям. факторам риска сердечно-сосудистых заболеваний и клиническому течению у пациентов. получавших лечение после инфаркта миокарда. В таблице показан процент пациентов, прекративших прием в группах валсартана и каптоприла в испытании VALsartan In Acute myocardial iNfarcTion trial (VALIANT) с частотой не менее 0,5% в любой из групп лечения.
Прекращение приема из-за нарушения функции почек было отмечено у 1,1% пациентов, получавших валсартан, и у 0,8% пациентов, получавших каптоприл.
Таблица 6.
Постмаркетинговый опыт.
В постмаркетинговом периоде сообщалось о следующих дополнительных побочных реакциях.
Гиперчувствительность. Имеются редкие сообщения об ангионевротическом отеке. У некоторых из этих пациентов ранее был ангионевротический отек при приеме других ЛС, включая ингибиторы АПФ. Валсартан не следует назначать повторно пациентам, перенесшим ангионевротический отек.
Со стороны пищеварительной системы. Повышение уровня ферментов печени и очень редкие сообщения о гепатите.
Со стороны почек. Нарушение функции почек, почечная недостаточность.
Клинические лабораторные исследования. Гиперкалиемия.
Дерматологические. Алопеция, буллезный дерматит.
Со стороны крови и лимфатической системы. Очень редкие сообщения о тромбоцитопении.
Сосудистые. Васкулит.
Сообщалось о редких случаях рабдомиолиза у пациентов, получавших АРА II.
Поскольку сообщения об этих реакциях поступают добровольно от популяции неопределенного размера, не всегда можно достоверно оценить их частоту и установить причинно-следственную связь с экспозицией ЛС.
Поскольку клинические испытания проводятся в разных условиях. частота побочных эффектов. наблюдаемых в клинических испытаниях ЛС. не может быть непосредственно сравнена с частотой неблагоприятных эффектов. полученных в других клинических испытаниях. и может не отражать частоту встречаемости этих эффектов в клинической практике.
Гипертензия у взрослых.
Безопасность валсартана оценивали более чем у 4000 пациентов, включая более 400, которые лечились более 6 мес, и более 160 - более 1 года. Побочные реакции, как правило, были легкими и преходящими и лишь в редких случаях требовали прекращения терапии. Общая частота побочных реакций при приеме валсартана и плацебо была сходна.
Общая частота побочных реакций не зависела от дозы и пола, возраста, расы или режима лечения. Прекращение терапии из-за побочных эффектов потребовалось у 2,3% пациентов при приеме валсартана и 2% пациентов, получавших плацебо. Наиболее частыми причинами прекращения терапии валсартаном были головная боль и головокружение.
Побочные реакции. которые наблюдались в плацебо-контролируемых клинических испытаниях по крайней мере у 1% пациентов. получавших валсартан. и с большей частотой у пациентов. принимавших валсартан (n=2316). чем у пациентов. получавших плацебо (n=888). включали вирусную инфекцию (3% против 2%). усталость (2% против 1%) и боль в животе (2% против 1%). Головная боль. головокружение. инфекции верхних дыхательных путей. кашель. диарея. ринит. синусит. тошнота. фарингит. отек и артралгия возникали с частотой более 1%. но примерно с одинаковой частотой у пациентов. получавших плацебо и валсартан.
В исследованиях, в которых валсартан сравнивали с ингибитором АПФ с плацебо или без него, частота сухого кашля была значительно выше в группе ингибитора АПФ (7,9%), чем в группах, получавших валсартан (2,6%) или плацебо (1,5%). В исследовании с участием 129 пациентов. ограниченного пациентами. у которых был сухой кашель после того. как они получали ингибиторы АПФ. частота кашля у пациентов. получавших валсартан. гидрохлоротиазид или лизиноприл. составила 20. 19 и 69% соответственно (p <0,001).
Дозозависимые ортостатические эффекты наблюдались менее чем у 1% пациентов. Увеличение частоты головокружения наблюдалось у пациентов, получавших валсартан 320 мг (8%) по сравнению с этими показателями у пациентов, получавших 10-160 мг (от 2 до 4%).
Валсартан применяли одновременно с гидрохлоротиазидом без очевидных клинически значимых побочных эффектов.
Другие побочные реакции, возникшие в контролируемых клинических испытаниях у пациентов, получавших валсартан (>0,2% пациентов), перечислены ниже. Невозможно определить, были ли эти события связаны с валсартаном.
Организм в целом. Аллергическая реакция и астения.
Со стороны ССС. Пальпитация.
Дерматологические. Зуд и сыпь.
Со стороны пищеварительной системы. Запор, сухость во рту, диспепсия и метеоризм.
Со стороны скелетно-мышечной системы. Боль в спине, мышечные спазмы и миалгия.
Неврология и психиатрия. Беспокойство, бессонница, парестезия и сонливость.
Со стороны респираторной системы. Одышка.
Со стороны органов чувств. Головокружение.
Со стороны мочеполовой системы. Импотенция.
Другие зарегистрированные явления. которые реже наблюдались в клинических испытаниях. включали боль в груди. обморок. анорексию. рвоту и ангионевротический отек.
Гипертензия у детей.
Безопасность валсартана оценивалась более чем у 400 педиатрических пациентов в возрасте от 6 до 17 лет и более чем у 160 педиатрических пациентов в возрасте от 6 мес до 5 лет. Не было выявлено значимых различий между профилем неблагоприятных реакций у педиатрических пациентов в возрасте от 6 до 16 лет и взрослых пациентов. Головная боль и гиперкалиемия были наиболее частыми нежелательными явлениями, которые предположительно были связаны с ЛС, у детей старшего возраста (от 6 до 17 лет) и детей младшего возраста (от 6 мес до 5 лет). Гиперкалиемия в основном наблюдалась у детей с предшествующим заболеванием почек. Нейрокогнитивная оценка и оценка развития педиатрических пациентов в возрасте от 6 до 16 лет не выявили общего клинически значимого неблагоприятного воздействия после лечения валсартаном в течение периода до 1 года.
Валсартан не рекомендуется детям младше 6 лет. В исследовании (n=90) педиатрических пациентов (от 1 до 5 лет) в течение 1 года открытой расширенной фазы наблюдались две смерти и три случая повышения уровня трансаминаз во время лечения. Эти 5 событий произошли в исследуемой популяции, в которой пациенты часто имели серьезные сопутствующие заболевания. Причинно-следственная связь с валсартаном не установлена. Во втором исследовании. в котором были рандомизированы 75 детей в возрасте от 1 до 6 лет. на протяжении 1 года расширенного исследования не было зарегистрировано ни одного случая смерти и один случай заметного повышения уровня печеночных трансаминаз.
Сердечная недостаточность.
Профиль неблагоприятного воздействия валсартана у пациентов с сердечной недостаточностью соответствовал фармакологии препарата и состоянию здоровья пациентов. В исследовании Valsartan Heart Failure Trial. при сравнении валсартана в общих суточных дозах до 320 мг (n=2506) с плацебо (n=2494). 10% пациентов прекратили прием валсартана из-за побочных реакций по сравнению с 7% пациентов. получавших плацебо.
В таблице показаны побочные реакции в двойных слепых краткосрочных испытаниях сердечной недостаточности. включая первые 4 мес Valsartan Heart Failure Trial. наблюдавшиеся с частотой не менее 2%. которые были более частыми у пациентов. получавших валсартан. чем у пациентов. получавших плацебо. Все пациенты получали стандартную лекарственную терапию сердечной недостаточности, часто в виде нескольких препаратов, включая диуретики, дигиталис, бета-адреноблокатор. Около 93% пациентов получали сопутствующую терапию ингибиторами АПФ.
Таблица 5.
| Валсартан, % (n=3282) | Плацебо, % (n=2740) | |
| Головокружение | 17 | 9 |
| Гипотензия | 7 | 2 |
| Диарея | 5 | 4 |
| Артралгия | 3 | 2 |
| Усталость | 3 | 2 |
| Боль в спине | 3 | 2 |
| Постуральное головокружение | 2 | 1 |
| Гиперкалиемия | 2 | 1 |
| Постуральная гипотензия | 2 | 1 |
Прекращение приема произошло у 0,5% пациентов, получавших валсартан, и у 0,1% пациентов, получавших плацебо, в связи со следующими факторами: повышение уровня креатинина и повышение уровня калия. Другие побочные реакции при приеме валсартана с частотой более 1% и более высокой. чем плацебо. включали головную боль БДУ (БДУ = без дополнительного уточнения). тошноту. почечную недостаточность БДУ (БДУ = без дополнительного уточнения). обморок. нечеткость зрения. боль в верхней части живота и головокружение.
По долгосрочным данным Valsartan Heart Failure Trial, не было выявлено каких-либо значительных побочных реакций, не отмеченных ранее.
Применение после инфаркта миокарда.
Профиль безопасности валсартана соответствовал фармакологии препарата и фоновым заболеваниям. факторам риска сердечно-сосудистых заболеваний и клиническому течению у пациентов. получавших лечение после инфаркта миокарда. В таблице показан процент пациентов, прекративших прием в группах валсартана и каптоприла в испытании VALsartan In Acute myocardial iNfarcTion trial (VALIANT) с частотой не менее 0,5% в любой из групп лечения.
Прекращение приема из-за нарушения функции почек было отмечено у 1,1% пациентов, получавших валсартан, и у 0,8% пациентов, получавших каптоприл.
Таблица 6.
| Валсартан, % (n=4885) | Каптоприл, % (n=4879) | |
| Прекращение приема из-за неблагоприятных реакций | 5,8 | 7,7 |
| Неблагоприятные реакции | ||
| Гипотензия БДУ | 1,4 | 0,8 |
| Кашель | 0,6 | 2,5 |
| Повышение креатинина в крови | 0,6 | 0,4 |
| Сыпь БДУ | 0,2 | 0,6 |
Постмаркетинговый опыт.
В постмаркетинговом периоде сообщалось о следующих дополнительных побочных реакциях.
Гиперчувствительность. Имеются редкие сообщения об ангионевротическом отеке. У некоторых из этих пациентов ранее был ангионевротический отек при приеме других ЛС, включая ингибиторы АПФ. Валсартан не следует назначать повторно пациентам, перенесшим ангионевротический отек.
Со стороны пищеварительной системы. Повышение уровня ферментов печени и очень редкие сообщения о гепатите.
Со стороны почек. Нарушение функции почек, почечная недостаточность.
Клинические лабораторные исследования. Гиперкалиемия.
Дерматологические. Алопеция, буллезный дерматит.
Со стороны крови и лимфатической системы. Очень редкие сообщения о тромбоцитопении.
Сосудистые. Васкулит.
Сообщалось о редких случаях рабдомиолиза у пациентов, получавших АРА II.
Поскольку сообщения об этих реакциях поступают добровольно от популяции неопределенного размера, не всегда можно достоверно оценить их частоту и установить причинно-следственную связь с экспозицией ЛС.
|
|
Взаимодействие
При одновременном применении валсартана с амлодипином, атенололом, циметидином, дигоксином, фуросемидом, глибенкламидом, гидрохлоротиазидом или индометацином клинически значимого ФКВ не наблюдалось. Совместное применение валсартана и атенолола имело больший антигипертензивный эффект, чем любое из этих ЛС, но оно не снижало ЧСС больше, чем один атенолол.
Совместное применение валсартана и варфарина не изменяло фармакокинетику валсартана или продолжительность антикоагулянтного эффекта варфарина.
CYP450.
Исследования метаболизма in vitro >in vitro показывают, что взаимодействие, опосредованное сYP450, валсартана и одновременно принимаемого ЛС маловероятно из-за низкой степени метаболизма.
Транспортеры.
Результаты in vitro >in vitro исследования на ткани печени человека показывают, что валсартан является субстратом OATP1B1 и MRP2. Совместное применение ингибиторов OATP1B1 (рифампицин, циклоспорин) или MRP2 (ритонавир) может увеличить системную экспозицию валсартана.
Калий.
Одновременное применение валсартана с другими ЛС, блокирующими РААС, калийсберегающими диуретиками (например, спиронолактон, триамтерен, амилорид), добавками калия, заменителями соли, содержащими калий, или другими ЛС, которые могут повышать уровень калия (например, гепарин), может привести к повышению сывороточного калия, а у пациентов с сердечной недостаточностью - к повышению сывороточного креатинина. Если совместное применение считается необходимым, рекомендуется контролировать уровень калия в сыворотке крови.
НПВС, включая селективные ингибиторы ЦОГ-2.
У пожилых пациентов, пациентов с обезвоживанием (включая тех, кто принимает диуретики) или с нарушенной функцией почек совместное применение НПВС, включая селективные ингибиторы ЦОГ-2, с АРА II, в тч валсартаном, может привести к ухудшению функции почек, включая возможную острую почечную недостаточность. Эти эффекты обычно обратимы. Следует периодически контролировать функцию почек у пациентов, получающих валсартан и НПВС.
Антигипертензивный эффект АРА II, в тч валсартана, может быть ослаблен НПВС, включая селективные ингибиторы ЦОГ-2.
Двойная блокада РААС.
Двойная блокада РААС АРА II, ингибиторами АПФ или алискиреном ассоциирована с повышенным риском развития гипотензии, гиперкалиемии и изменений функции почек (включая острую почечную недостаточность) по сравнению с монотерапией.У большинства пациентов применение комбинации двух ингибиторов РААС не дает каких-либо дополнительных преимуществ по сравнению с монотерапией ( см Клинические исследования). В целом следует избегать сочетанного применения ингибиторов РААС. Необходим тщательный мониторинг АД, функции почек и электролитов у пациентов, принимающих валсартан и другие ЛС, влияющие на РААС.
Не следует принимать алискирен одновременно с валсартаном пациентам с диабетом. Необходимо избегать применения алискирена с валсартаном у пациентов с почечной недостаточностью (СКФ <60 мл/мин).
Литий.
Сообщалось об увеличении концентрации лития в сыворотке и токсичности лития при одновременном применении препаратов лития с АРА II, включая валсартан. При одновременном применении необходим мониторинг уровня лития в сыворотке крови.
Результаты клинических лабораторных исследований.
В контролируемых клинических исследованиях клинически важные изменения стандартных лабораторных параметров редко были связаны с приемом валсартана.
Креатинин. В контролируемых клинических испытаниях у пациентов с гипертензией незначительное повышение уровня креатинина было отмечено у 0,8% пациентов, принимавших валсартан, и у 0,6% пациентов, получавших плацебо. В исследованиях сердечной недостаточности повышение уровня креатинина более чем на 50% наблюдалось у 3,9% пациентов, получавших валсартан, по сравнению с 0,9% пациентов, получавших плацебо. У пациентов, перенесших инфаркт миокарда, удвоение сывороточного креатинина наблюдалось у 4,2% пациентов, получавших валсартан, и у 3,4% пациентов, получавших каптоприл.
Hb и гематокрит. Более чем 20% снижение Hb и гематокрита наблюдалось у 0,4 и 0,8% соответственно пациентов, получавших валсартан, по сравнению этими показателями у 0,1 и 0,1% у пациентов, получавших плацебо. Один пациент при приеме валсартана прекратил лечение в связи с развитием микроцитарной анемии.
Функциональные тесты печени. У пациентов, получавших валсартан, наблюдались эпизодические повышения (более 150%) лабораторных показателей печени. Три пациента (<0,1%), получавшие валсартан, прекратили лечение из-за повышения лабораторных показателей печени.
Нейтропения. Нейтропения наблюдалась у 1,9% пациентов, получавших валсартан, и 0,8% пациентов, получавших плацебо.
Калий сыворотки. У пациентов с гипертензией повышение уровня калия в сыворотке крови более чем на 20% наблюдалось у 4,4% пациентов, получавших валсартан, и у 2,9% пациентов, получавших плацебо. У пациентов с сердечной недостаточностью повышение уровня калия в сыворотке крови более чем на 20% наблюдалось у 10% пациентов, получавших валсартан, и у 5,1% пациентов, получавших плацебо.
Азот мочевины крови. В исследованиях сердечной недостаточности более чем 50% увеличение азота мочевины крови наблюдалось у 16,6% пациентов, получавших валсартан, по сравнению с этим показателем у 6,3% пациентов, получавших плацебо.
Совместное применение валсартана и варфарина не изменяло фармакокинетику валсартана или продолжительность антикоагулянтного эффекта варфарина.
CYP450.
Исследования метаболизма in vitro >in vitro показывают, что взаимодействие, опосредованное сYP450, валсартана и одновременно принимаемого ЛС маловероятно из-за низкой степени метаболизма.
Транспортеры.
Результаты in vitro >in vitro исследования на ткани печени человека показывают, что валсартан является субстратом OATP1B1 и MRP2. Совместное применение ингибиторов OATP1B1 (рифампицин, циклоспорин) или MRP2 (ритонавир) может увеличить системную экспозицию валсартана.
Калий.
Одновременное применение валсартана с другими ЛС, блокирующими РААС, калийсберегающими диуретиками (например, спиронолактон, триамтерен, амилорид), добавками калия, заменителями соли, содержащими калий, или другими ЛС, которые могут повышать уровень калия (например, гепарин), может привести к повышению сывороточного калия, а у пациентов с сердечной недостаточностью - к повышению сывороточного креатинина. Если совместное применение считается необходимым, рекомендуется контролировать уровень калия в сыворотке крови.
НПВС, включая селективные ингибиторы ЦОГ-2.
У пожилых пациентов, пациентов с обезвоживанием (включая тех, кто принимает диуретики) или с нарушенной функцией почек совместное применение НПВС, включая селективные ингибиторы ЦОГ-2, с АРА II, в тч валсартаном, может привести к ухудшению функции почек, включая возможную острую почечную недостаточность. Эти эффекты обычно обратимы. Следует периодически контролировать функцию почек у пациентов, получающих валсартан и НПВС.
Антигипертензивный эффект АРА II, в тч валсартана, может быть ослаблен НПВС, включая селективные ингибиторы ЦОГ-2.
Двойная блокада РААС.
Двойная блокада РААС АРА II, ингибиторами АПФ или алискиреном ассоциирована с повышенным риском развития гипотензии, гиперкалиемии и изменений функции почек (включая острую почечную недостаточность) по сравнению с монотерапией.У большинства пациентов применение комбинации двух ингибиторов РААС не дает каких-либо дополнительных преимуществ по сравнению с монотерапией ( см Клинические исследования). В целом следует избегать сочетанного применения ингибиторов РААС. Необходим тщательный мониторинг АД, функции почек и электролитов у пациентов, принимающих валсартан и другие ЛС, влияющие на РААС.
Не следует принимать алискирен одновременно с валсартаном пациентам с диабетом. Необходимо избегать применения алискирена с валсартаном у пациентов с почечной недостаточностью (СКФ <60 мл/мин).
Литий.
Сообщалось об увеличении концентрации лития в сыворотке и токсичности лития при одновременном применении препаратов лития с АРА II, включая валсартан. При одновременном применении необходим мониторинг уровня лития в сыворотке крови.
Результаты клинических лабораторных исследований.
В контролируемых клинических исследованиях клинически важные изменения стандартных лабораторных параметров редко были связаны с приемом валсартана.
Креатинин. В контролируемых клинических испытаниях у пациентов с гипертензией незначительное повышение уровня креатинина было отмечено у 0,8% пациентов, принимавших валсартан, и у 0,6% пациентов, получавших плацебо. В исследованиях сердечной недостаточности повышение уровня креатинина более чем на 50% наблюдалось у 3,9% пациентов, получавших валсартан, по сравнению с 0,9% пациентов, получавших плацебо. У пациентов, перенесших инфаркт миокарда, удвоение сывороточного креатинина наблюдалось у 4,2% пациентов, получавших валсартан, и у 3,4% пациентов, получавших каптоприл.
Hb и гематокрит. Более чем 20% снижение Hb и гематокрита наблюдалось у 0,4 и 0,8% соответственно пациентов, получавших валсартан, по сравнению этими показателями у 0,1 и 0,1% у пациентов, получавших плацебо. Один пациент при приеме валсартана прекратил лечение в связи с развитием микроцитарной анемии.
Функциональные тесты печени. У пациентов, получавших валсартан, наблюдались эпизодические повышения (более 150%) лабораторных показателей печени. Три пациента (<0,1%), получавшие валсартан, прекратили лечение из-за повышения лабораторных показателей печени.
Нейтропения. Нейтропения наблюдалась у 1,9% пациентов, получавших валсартан, и 0,8% пациентов, получавших плацебо.
Калий сыворотки. У пациентов с гипертензией повышение уровня калия в сыворотке крови более чем на 20% наблюдалось у 4,4% пациентов, получавших валсартан, и у 2,9% пациентов, получавших плацебо. У пациентов с сердечной недостаточностью повышение уровня калия в сыворотке крови более чем на 20% наблюдалось у 10% пациентов, получавших валсартан, и у 5,1% пациентов, получавших плацебо.
Азот мочевины крови. В исследованиях сердечной недостаточности более чем 50% увеличение азота мочевины крови наблюдалось у 16,6% пациентов, получавших валсартан, по сравнению с этим показателем у 6,3% пациентов, получавших плацебо.
Передозировка
Симптомы. Имеются ограниченные данные о передозировке у человека. Наиболее вероятными проявлениями передозировки могут быть гипотензия и тахикардия, брадикардия может возникнуть из-за парасимпатической (вагусной) стимуляции. Сообщалось о снижении уровня сознания, сосудистой недостаточности и шоке.
Лечение. При возникновении симптоматической гипотензии следует назначить поддерживающую терапию.
Валсартан не удаляется из плазмы при гемодиализе.
Валсартан не проявлял явно наблюдаемых побочных эффектов при однократном пероральном применении доз до 2000 мг/кг у крыс и до 1000 мг/кг у мартышек. за исключением повышенного слюноотделения и диареи у крыс и рвоты у мартышек при максимальной дозе (в 60 и 31 раз соответственно выше МРДЧ на основе мг/м2 (в расчетах принимается пероральная доза 320 мг/сут для пациента с массой тела 60 кг).
Лечение. При возникновении симптоматической гипотензии следует назначить поддерживающую терапию.
Валсартан не удаляется из плазмы при гемодиализе.
Валсартан не проявлял явно наблюдаемых побочных эффектов при однократном пероральном применении доз до 2000 мг/кг у крыс и до 1000 мг/кг у мартышек. за исключением повышенного слюноотделения и диареи у крыс и рвоты у мартышек при максимальной дозе (в 60 и 31 раз соответственно выше МРДЧ на основе мг/м2 (в расчетах принимается пероральная доза 320 мг/сут для пациента с массой тела 60 кг).
Способ применения и дозы
Внутрь. Доза зависит от заболевания, возраста, состояния пациента, в тч функции почек и печени, переносимости и сопутствующей терапии. У взрослых обычно начальная доза - 20-160 мг, 1-2 раза в сутки, максимальная суточная доза - 320 мг. У детей в возрасте от 6 до 16 лет, обычно начальная доза - 1,3 мг/кг 1 раз в сутки (всего до 40 мг).
Меры предосторожности применения
Фетальная токсичность. См «Применение при беременности и кормлении грудью».
Гипотензия.
Чрезмерная гипотензия редко наблюдалась (0,1%) у пациентов с неосложненной гипертензией, получавших только валсартан. У пациентов с активированной РААС, таких как пациенты с уменьшением ОЦК и/или пониженным содержанием натрия, получающие высокие дозы диуретиков, может возникнуть симптоматическая гипотензия. Это состояние следует скорректировать до начала приема валсартана или начать лечение под тщательным медицинским наблюдением.
Следует соблюдать осторожность при начале терапии у пациентов с сердечной недостаточностью или пациентов, перенесших инфаркт миокарда. У пациентов с сердечной недостаточностью или после инфаркта миокарда, получающих валсартан, обычно наблюдается некоторое снижение АД, но прекращение терапии из-за продолжающейся симптоматической гипотензии обычно не требуется при соблюдении инструкций по дозированию. В контролируемых исследованиях у пациентов с сердечной недостаточностью частота гипотензии у пациентов, получавших валсартан, составляла 5,5% по сравнению с этими показателями у 1,8% у пациентов, получавших плацебо. В исследовании VALsartan In Acute myocardial iNfarcTion trial (VALIANT) гипотензия у пациентов, перенесших инфаркт миокарда, привела к окончательному прекращению терапии у 1,4% пациентов, получавших валсартан, и 0,8% пациентов, получавших каптоприл.
При возникновении чрезмерной гипотензии пациенту следует придать положение лежа на спине, при необходимости - в/в инфузия физиологического раствора. Транзиторная гипотензия не является противопоказанием для дальнейшего лечения, которое обычно можно без труда продолжить после стабилизации АД.
Нарушение функции почек.
Изменения функции почек, включая острую почечную недостаточность, могут быть вызваны ЛС, ингибирующими РААС, и диуретиками. Пациенты, функция почек которых может частично зависеть от активности РААС (например, пациенты со стенозом почечной артерии, хроническим заболеванием почек, тяжелой застойной сердечной недостаточностью или снижением ОЦК), могут подвергаться особому риску развития острой почечной недостаточности при приеме валсартана. У этих пациентов необходим периодический мониторинг функции почек. Необходимо рассмотреть возможность приостановки или прекращения терапии у пациентов, у которых при приеме валсартана развивается клинически значимое снижение функции почек ( см «Взаимодействие»).
Гиперкалиемия.
У некоторых пациентов с сердечной недостаточностью наблюдается повышение уровня калия. Этот эффект обычно незначителен и преходящ, и он более вероятен у пациентов с уже существующей почечной недостаточностью. Может потребоваться уменьшение дозы и/или прекращение приема валсартана ( см «Побочные действия»).
Применение в педиатрии.
Антигипертензивные эффекты валсартана были оценены в двух рандомизированных двойных слепых клинических исследованиях с участием педиатрических пациентов в возрасте 1-5 и 6-16 лет ( см Клинические исследования).Фармакокинетика валсартана была оценена у детей в возрасте от 1 года до 16 лет ( см Фармакокинетика, Педиатрические пациенты). Валсартан в целом хорошо переносился детьми 6-16 лет, и профиль неблагоприятных эффектов был аналогичен описанному для взрослых.
У детей и подростков с гипертензией, у которых могут быть более распространены лежащие в основе почечные аномалии, следует тщательно контролировать функцию почек и уровень калия в сыворотке в соответствии с клиническими показаниями.
Валсартан не рекомендуется для приема педиатрическими пациентами в возрасте до 6 лет из-за результатов по безопасности, исходя из которых нельзя исключить связь с лечением ( см «Побочные действия», Гипертензия у детей).
Нет данных о педиатрических пациентах, находящихся на диализе или при СКФ <30 мл/мин/1,73 м2.
Имеется ограниченный клинический опыт применения валсартана у педиатрических пациентов с печеночной недостаточностью легкой и средней степени тяжести.
Ежедневное пероральное введение неонатальным/молодым крысам валсартана в таких низких дозах, как 1 мг/кг/сут (около 10% максимальной рекомендованной педиатрической дозы на основе мг/м2), с 7-го до 70-го дня постнатального периода приводило к стойкому и необратимому поражению почек. Эти почечные эффекты у новорожденных крыс представляют собой ожидаемые преувеличенные фармакологические эффекты, которые наблюдаются при приеме ЛС в течение первых 13 дней жизни. Поскольку этот период у людей совпадает с 44 нед после зачатия, считается, что указанный эффект не вызывает повышенных опасений по поводу безопасности у детей в возрасте от 6 до 16 лет.
Новорожденные с экспозицией валсартана in utero в анамнезе. При возникновении олигурии или гипотензии необходимо обратить внимание на поддержание АД и почечной перфузии. Могут потребоваться обменное переливание крови или диализ как средства устранения гипотензии и/или замещения нарушенной функции почек.
Применение в гериатрии.
В контролируемых клинических испытаниях возраст 1214 (36,2%) пациентов с гипертензией, получавших валсартан, составлял ≥65 лет, а возраст 265 (7,9%) пациентов - ≥75 лет. В общем в этой популяции пациентов не наблюдалось разницы в эффективности или безопасности валсартана, но нельзя исключать более высокую чувствительность некоторых пожилых людей.
Из 2511 пациентов с сердечной недостаточностью, рандомизированных для приема валсартана в исследовании Valsartan Heart Failure Trial 45% (1141) были в возрасте 65 лет и старше. В испытании VALsartan In Acute myocardial iNfarction trial (VALIANT) 53% (2596) из 4909 пациентов, получавших валсартан, и 51% (2515) из 4885 пациентов, получавших валсартан + каптоприл, были в возрасте 65 лет и старше. В обоих испытаниях не было заметных различий в эффективности или безопасности у пожилых и более молодых пациентов.
Почечная недостаточность.
Безопасность и эффективность валсартана у пациентов с тяжелой почечной недостаточностью (Cl креатинина ≤30 мл/мин) не установлены. У пациентов с легким (Cl креатинина 60-90 мл/мин) или умеренным (Cl креатинина 30-60 мл/мин) нарушением функции почек коррекция дозы не требуется.
Печеночная недостаточность.
Для пациентов с заболеванием печени легкой и средней степени тяжести коррекция дозы не требуется. Для пациентов с тяжелым заболеванием печени не могут быть даны рекомендации по дозированию.
Гипотензия.
Чрезмерная гипотензия редко наблюдалась (0,1%) у пациентов с неосложненной гипертензией, получавших только валсартан. У пациентов с активированной РААС, таких как пациенты с уменьшением ОЦК и/или пониженным содержанием натрия, получающие высокие дозы диуретиков, может возникнуть симптоматическая гипотензия. Это состояние следует скорректировать до начала приема валсартана или начать лечение под тщательным медицинским наблюдением.
Следует соблюдать осторожность при начале терапии у пациентов с сердечной недостаточностью или пациентов, перенесших инфаркт миокарда. У пациентов с сердечной недостаточностью или после инфаркта миокарда, получающих валсартан, обычно наблюдается некоторое снижение АД, но прекращение терапии из-за продолжающейся симптоматической гипотензии обычно не требуется при соблюдении инструкций по дозированию. В контролируемых исследованиях у пациентов с сердечной недостаточностью частота гипотензии у пациентов, получавших валсартан, составляла 5,5% по сравнению с этими показателями у 1,8% у пациентов, получавших плацебо. В исследовании VALsartan In Acute myocardial iNfarcTion trial (VALIANT) гипотензия у пациентов, перенесших инфаркт миокарда, привела к окончательному прекращению терапии у 1,4% пациентов, получавших валсартан, и 0,8% пациентов, получавших каптоприл.
При возникновении чрезмерной гипотензии пациенту следует придать положение лежа на спине, при необходимости - в/в инфузия физиологического раствора. Транзиторная гипотензия не является противопоказанием для дальнейшего лечения, которое обычно можно без труда продолжить после стабилизации АД.
Нарушение функции почек.
Изменения функции почек, включая острую почечную недостаточность, могут быть вызваны ЛС, ингибирующими РААС, и диуретиками. Пациенты, функция почек которых может частично зависеть от активности РААС (например, пациенты со стенозом почечной артерии, хроническим заболеванием почек, тяжелой застойной сердечной недостаточностью или снижением ОЦК), могут подвергаться особому риску развития острой почечной недостаточности при приеме валсартана. У этих пациентов необходим периодический мониторинг функции почек. Необходимо рассмотреть возможность приостановки или прекращения терапии у пациентов, у которых при приеме валсартана развивается клинически значимое снижение функции почек ( см «Взаимодействие»).
Гиперкалиемия.
У некоторых пациентов с сердечной недостаточностью наблюдается повышение уровня калия. Этот эффект обычно незначителен и преходящ, и он более вероятен у пациентов с уже существующей почечной недостаточностью. Может потребоваться уменьшение дозы и/или прекращение приема валсартана ( см «Побочные действия»).
Применение в педиатрии.
Антигипертензивные эффекты валсартана были оценены в двух рандомизированных двойных слепых клинических исследованиях с участием педиатрических пациентов в возрасте 1-5 и 6-16 лет ( см Клинические исследования).Фармакокинетика валсартана была оценена у детей в возрасте от 1 года до 16 лет ( см Фармакокинетика, Педиатрические пациенты). Валсартан в целом хорошо переносился детьми 6-16 лет, и профиль неблагоприятных эффектов был аналогичен описанному для взрослых.
У детей и подростков с гипертензией, у которых могут быть более распространены лежащие в основе почечные аномалии, следует тщательно контролировать функцию почек и уровень калия в сыворотке в соответствии с клиническими показаниями.
Валсартан не рекомендуется для приема педиатрическими пациентами в возрасте до 6 лет из-за результатов по безопасности, исходя из которых нельзя исключить связь с лечением ( см «Побочные действия», Гипертензия у детей).
Нет данных о педиатрических пациентах, находящихся на диализе или при СКФ <30 мл/мин/1,73 м2.
Имеется ограниченный клинический опыт применения валсартана у педиатрических пациентов с печеночной недостаточностью легкой и средней степени тяжести.
Ежедневное пероральное введение неонатальным/молодым крысам валсартана в таких низких дозах, как 1 мг/кг/сут (около 10% максимальной рекомендованной педиатрической дозы на основе мг/м2), с 7-го до 70-го дня постнатального периода приводило к стойкому и необратимому поражению почек. Эти почечные эффекты у новорожденных крыс представляют собой ожидаемые преувеличенные фармакологические эффекты, которые наблюдаются при приеме ЛС в течение первых 13 дней жизни. Поскольку этот период у людей совпадает с 44 нед после зачатия, считается, что указанный эффект не вызывает повышенных опасений по поводу безопасности у детей в возрасте от 6 до 16 лет.
Новорожденные с экспозицией валсартана in utero в анамнезе. При возникновении олигурии или гипотензии необходимо обратить внимание на поддержание АД и почечной перфузии. Могут потребоваться обменное переливание крови или диализ как средства устранения гипотензии и/или замещения нарушенной функции почек.
Применение в гериатрии.
В контролируемых клинических испытаниях возраст 1214 (36,2%) пациентов с гипертензией, получавших валсартан, составлял ≥65 лет, а возраст 265 (7,9%) пациентов - ≥75 лет. В общем в этой популяции пациентов не наблюдалось разницы в эффективности или безопасности валсартана, но нельзя исключать более высокую чувствительность некоторых пожилых людей.
Из 2511 пациентов с сердечной недостаточностью, рандомизированных для приема валсартана в исследовании Valsartan Heart Failure Trial 45% (1141) были в возрасте 65 лет и старше. В испытании VALsartan In Acute myocardial iNfarction trial (VALIANT) 53% (2596) из 4909 пациентов, получавших валсартан, и 51% (2515) из 4885 пациентов, получавших валсартан + каптоприл, были в возрасте 65 лет и старше. В обоих испытаниях не было заметных различий в эффективности или безопасности у пожилых и более молодых пациентов.
Почечная недостаточность.
Безопасность и эффективность валсартана у пациентов с тяжелой почечной недостаточностью (Cl креатинина ≤30 мл/мин) не установлены. У пациентов с легким (Cl креатинина 60-90 мл/мин) или умеренным (Cl креатинина 30-60 мл/мин) нарушением функции почек коррекция дозы не требуется.
Печеночная недостаточность.
Для пациентов с заболеванием печени легкой и средней степени тяжести коррекция дозы не требуется. Для пациентов с тяжелым заболеванием печени не могут быть даны рекомендации по дозированию.
|
|
Список литературы
Www.rxlist.com, 2021.
Входит в состав
- 163-282₽ Валсартан Медисорб
- 244-248₽ Валаар
- 259₽ Валсартан-алиум
- 226-329₽ Нортиван
- 279₽ Дуопресс
- 250-320₽ Валз (4 фирмы)
- 297₽ Валсартан-Акрихин (Polpharma )
- 175-424₽ Валсартан-СЗ (Северная звезда НАО )
- 194-420₽ Валсартан (12 фирм)
- 308₽ Валсартан-Гидрохлоротиазид-Акрихин (Polpharma )
- 300-447₽ Валз Н (4 фирмы)
- 204-641₽ Валсартан Канон
- 347-512₽ Валсартан+Гидрохлоротиазид (2 фирмы)
- 389-557₽ Валз Комби (2 фирмы)
- 295-778₽ Валсартан Зентива
- 466-640₽ Вальсакор (2 фирмы)
- 298-1177₽ Вамлосет (КРКА-Рус )
- 532-1448₽ Ко-Вамлосет (КРКА-Рус )
- 1551-2355₽ Диован (6 фирм)
- 1584-2547₽ Эксфорж (3 фирмы)
- 1543-2959₽ Ко-Эксфорж (3 фирмы)
- 2005-2649₽ Ко-Диован (7 фирм)
- 1828-4669₽ Юперио (7 фирм)
- — Амлодипин+Валсартан
- — Амлодипин+Валсартан
- — Амлодипин-Валсартан-Акрихин (Polpharma )
- — Амлодипин-Валсартан-Рихтер
- — Артинова (Sun Pharmaceutical Industries Ltd. )
- — Артинова АМ (Sun Pharmaceutical Industries Ltd. )
- — Валраксет (KRKA )
- — Валсартан А (KRKA )
- — Валсартан МС
- — Валсартан Н (KRKA )
- — Валсартан Санофи
- — Валсартан-ВЕРТЕКС
- — Валсафорс (Farmaplant Fabrication chemischer Produkte GmbH )
- — Валтеро (2 фирмы)
- — Вальсакор Н320 (KRKA )
- — Ванатекс Комби
- — Диотензин
- — Дисартан
- — Нарунел
- — Сакубитрила и валсартана гидратный комплекс натриевых солей
- — Сартавель
- — Сартавель Амло
- — Тантордио (Torrent Pharmaceuticals )
- — Тритензин
- — Эксфотанз (Фармстандарт-Лексредства )