Pharmacological Group
Latin name
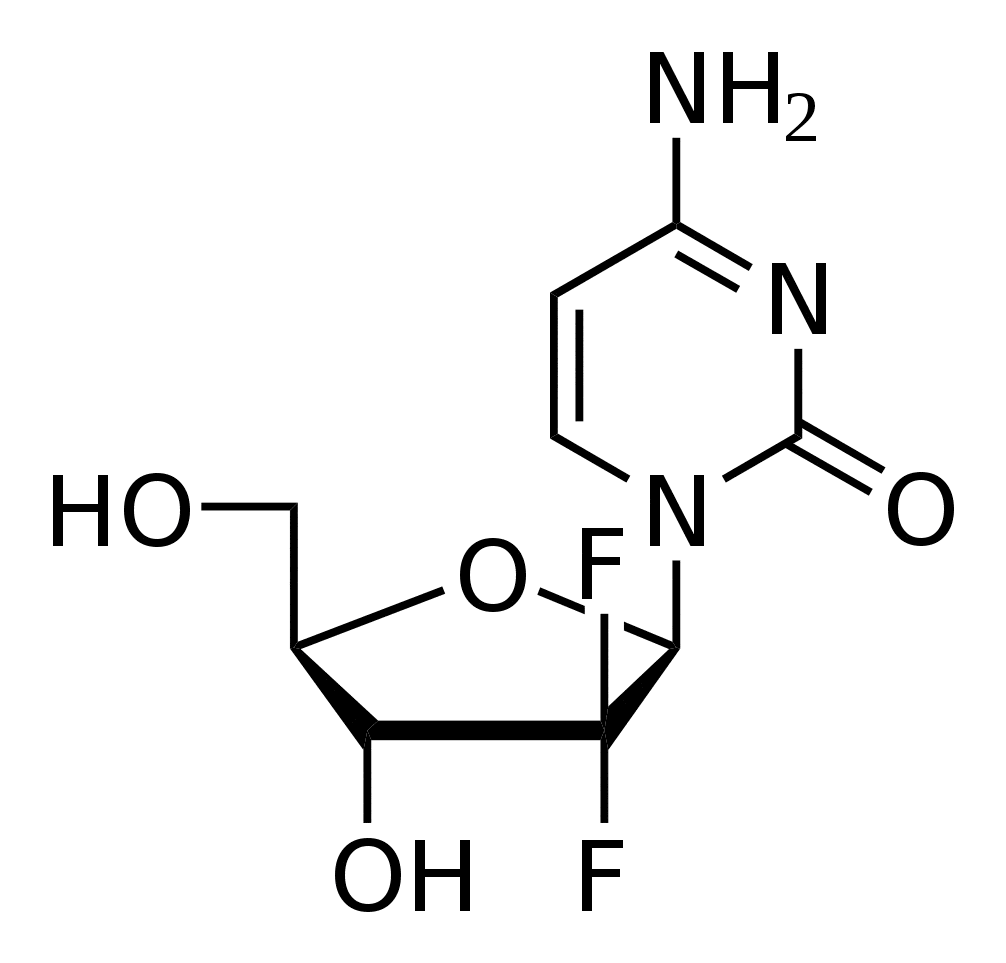
Gemcitabinum ( Gemcitabini).
Chemical name
2 -Дезокси-2 ,2 -дифторцитидин (в виде гидрохлорида).
Used in the treatment
- C79.8 Secondary malignant neoplasm of other specified sites
- C79.0 Secondary malignant neoplasm of kidney and renal pelvis
- C78.8 Secondary malignant neoplasm of other and unspecified digestive organs
- C78.0 Secondary malignant neoplasm of lung
- C78 Secondary malignant neoplasm of respiratory and digestive organs
- C67 Malignant neoplasm of bladder
- C65 Malignant neoplasm of renal pelvis
- C66 Malignant neoplasm of ureter
- C62 Malignant neoplasm of testis
- C56 Malignant neoplasm of ovary
- C53 Malignant neoplasm of cervix uteri
- C50 Malignant neoplasm of breast
- C34 Malignant neoplasm of bronchus and lung
- C25 Malignant neoplasm of pancreas
- C24 Malignant neoplasm of other and unspecified parts of biliary tract
- C68.0 Malignant neoplasm, urethra
- C79.1 Secondary malignant neoplasm of bladder and other and unspecified urinary organs
- C79.6 Secondary malignant neoplasm of ovary
CAS Code
95058-81-4.
Pharmacological action
Противоопухолевое.
Characteristics of the substance
Антиметаболит группы аналогов пиримидина. Гемцитабина гидрохлорид - белое или не совсем белое вещество, растворимое в воде, умеренно растворимое в метаноле и практически нерастворимое в этаноле и полярных органических растворителях. Молекулярная масса 299,66.
Pharmacodynamics
Цитотоксический эффект гемцитабина обусловлен комбинированным действием его активных метаболитов - ди- и трифосфатного нуклеозидов, - образующихся в результате внутриклеточной биотрансформации с участием нуклеозидкиназ.
Гемцитабина дифосфат ингибирует рибонуклеотидредуктазу, катализирующую реакции образования дезоксинуклеозидтрифосфатов, необходимых для синтеза ДНК. Гемцитабина трифосфат включается в ДНК, и ее дальнейший синтез прекращается, при этом невозможна репарация ДНК. В Т-лимфобластных клетках гемцитабин индуцирует интернуклеосомальную ДНК-фрагментацию, являющуюся одним из факторов, программирующих гибель клеток.
Обладает фазовой специфичностью действия: останавливает жизнедеятельность клеток в S-фазе и блокирует опухолевую прогрессию клеток в G1/S-фазе.
Обладает сильным радиосенсибилизирующим действием. В опытах in vitro >in vitro оказывал значительное радиосенсибилизирующее действие в концентрациях более низких, чем цитотоксические.
В исследованиях с применением тест-систем млекопитающих показано мутагенное действие гемцитабина в in vitro >in vitro тесте на клетках лимфомы мышей и кластогенный эффект в in vivo >in vivo микроядерном тесте на мышах. Однако тест Эймса, in vivo >in vivo тест обмена сестринских хроматид, in vitro >in vitro тест анализа хромосомных аберраций и in vitro >in vitro тест внепланового синтеза ДНК были негативны. В исследованиях на мышах показано влияние на фертильность (при внутрибрюшинном введении самцам гемцитабин вызывал снижение сперматогенеза, уменьшение фертильности и снижение частоты имплантации оплодотворенных яйцеклеток, у самок не вызывал нарушения фертильности, но оказывал токсическое действие), эмбриотоксическое и тератогенное действие. В опытах на кроликах вызывал пороки развития плода.
Связывание с белками плазмы незначительное (менее 10%). Объем распределения зависит от продолжительности инфузии (при кратковременном введении - 50 л/м2, при длительном - 370 л/м2) и пола. 1/2T1/2 при кратковременной инфузии составляет от 32 до 94 мин, а при продолжительной - 245-638 мин в зависимости от возраста и пола. Т1/2 терминальной фазы активного метаболита (из мононуклеарных клеток периферической крови) 1,7-19,4 Метаболизируется в клетках печени, почек, крови ферментом цитидиндеаминазой поэтапно до образования неактивного метаболита урацила (2 -дезокси−2 , 2 -дифторуридин). Сmax этого метаболита достигается через 30 мин после инфузии. Внутриклеточные метаболиты в плазме и моче не выявляются. Экскретируется в виде урацилового метаболита почками (92-98%), менее 1% - с фекалиями; в неизмененном виде почками выводится 1% дозы.
Гемцитабина дифосфат ингибирует рибонуклеотидредуктазу, катализирующую реакции образования дезоксинуклеозидтрифосфатов, необходимых для синтеза ДНК. Гемцитабина трифосфат включается в ДНК, и ее дальнейший синтез прекращается, при этом невозможна репарация ДНК. В Т-лимфобластных клетках гемцитабин индуцирует интернуклеосомальную ДНК-фрагментацию, являющуюся одним из факторов, программирующих гибель клеток.
Обладает фазовой специфичностью действия: останавливает жизнедеятельность клеток в S-фазе и блокирует опухолевую прогрессию клеток в G1/S-фазе.
Обладает сильным радиосенсибилизирующим действием. В опытах in vitro >in vitro оказывал значительное радиосенсибилизирующее действие в концентрациях более низких, чем цитотоксические.
В исследованиях с применением тест-систем млекопитающих показано мутагенное действие гемцитабина в in vitro >in vitro тесте на клетках лимфомы мышей и кластогенный эффект в in vivo >in vivo микроядерном тесте на мышах. Однако тест Эймса, in vivo >in vivo тест обмена сестринских хроматид, in vitro >in vitro тест анализа хромосомных аберраций и in vitro >in vitro тест внепланового синтеза ДНК были негативны. В исследованиях на мышах показано влияние на фертильность (при внутрибрюшинном введении самцам гемцитабин вызывал снижение сперматогенеза, уменьшение фертильности и снижение частоты имплантации оплодотворенных яйцеклеток, у самок не вызывал нарушения фертильности, но оказывал токсическое действие), эмбриотоксическое и тератогенное действие. В опытах на кроликах вызывал пороки развития плода.
Связывание с белками плазмы незначительное (менее 10%). Объем распределения зависит от продолжительности инфузии (при кратковременном введении - 50 л/м2, при длительном - 370 л/м2) и пола. 1/2T1/2 при кратковременной инфузии составляет от 32 до 94 мин, а при продолжительной - 245-638 мин в зависимости от возраста и пола. Т1/2 терминальной фазы активного метаболита (из мононуклеарных клеток периферической крови) 1,7-19,4 Метаболизируется в клетках печени, почек, крови ферментом цитидиндеаминазой поэтапно до образования неактивного метаболита урацила (2 -дезокси−2 , 2 -дифторуридин). Сmax этого метаболита достигается через 30 мин после инфузии. Внутриклеточные метаболиты в плазме и моче не выявляются. Экскретируется в виде урацилового метаболита почками (92-98%), менее 1% - с фекалиями; в неизмененном виде почками выводится 1% дозы.
Indications for use
Немелкоклеточный рак легкого. рак молочной железы. рак мочевого пузыря. рак яичников. рак поджелудочной железы. рак шейки матки.
Гемцитабин в монотерапии или в комбинации с другими противоопухолевыми средствами также проявляет активность при местно-распространенном мелкоклеточном раке легкого. местно-распространенном рефрактерном раке яичка и раке желчевыводящих путей.
Гемцитабин в монотерапии или в комбинации с другими противоопухолевыми средствами также проявляет активность при местно-распространенном мелкоклеточном раке легкого. местно-распространенном рефрактерном раке яичка и раке желчевыводящих путей.
Contraindications
Гиперчувствительность, беременность, кормление грудью.
Restrictions on use
Угнетение костномозгового кроветворения (в тч на фоне сопутствующей лучевой или химиотерапии), тяжелые нарушения функции печени и/или почек; инфекционные заболевания вирусной (в тч ветряная оспа, опоясывающий лишай), грибковой или бактериальной природы, детский возраст (безопасность и эффективность не определены).
Use during pregnancy and lactation
Противопоказано при беременности.
Категория действия на плод по FDA. D.
На время лечения следует прекратить грудное вскармливание.
Категория действия на плод по FDA. D.
На время лечения следует прекратить грудное вскармливание.
Side effects
Со стороны нервной системы и органов чувств. Головная боль, сонливость, бессонница.
Со стороны сердечно-сосудистой системы и крови (кроветворение. гемостаз): миелосупрессия (анемия. лейкопения. тромбоцитопения). снижение АД. аритмия. сердечная недостаточность. инфаркт миокарда. кровотечение (возникало. в основном. у больных раком поджелудочной железы).
Со стороны респираторной системы. Бронхоспастические реакции (одышка. затрудненное дыхание. стесненность в грудной клетке и/или стерторозное дыхание). токсическое действие на паренхиму легких или пневмонит (кашель. одышка). отек легких (кашель. затрудненное дыхание).
Со стороны органов ЖКТ. Тошнота. рвота (69% случаев). диарея (19%). запор. стоматит (≤11%). повышение активности печеночных трансаминаз и ЩФ.
Со стороны мочеполовой системы. Протеинурия. гематурия. периферические отеки (пальцев рук. ног или лодыжек). в редких случаях отеки могут носить генерализованный характер. редко - почечная недостаточность. гемолитико-уремический синдром (снижение гемоглобина. тромбоцитопения. гипербилирубинемия. гиперкреатинемия. повышение активности ЛДГ и концентрации мочевины).
Со стороны кожных покровов. Сыпь (30%), алопеция (обычно незначительная), кожные высыпания, кожный зуд.
Прочие. Часто (41%) - гриппоподобный синдром (лихорадка. головная боль. боль в спине. озноб. миалгия. слабость. анорексия. катаральные явления. потливость). инфекция (16%). менее часто - парестезия. образование экстравазата (раздражение. боль или покраснение) в месте инъекции. сонливость. редко - болезнь Гассера (черный дегтеобразный стул. кровь в моче или кале. повышенная температура тела. повышенное или сниженное мочевыделение. точечные красные пятна на коже. отечность лица. пальцев рук. ног или лодыжек. необычные кровотечения или кровоизлияния. необычная усталость или слабость. желтушность склер или кожи).
Со стороны сердечно-сосудистой системы и крови (кроветворение. гемостаз): миелосупрессия (анемия. лейкопения. тромбоцитопения). снижение АД. аритмия. сердечная недостаточность. инфаркт миокарда. кровотечение (возникало. в основном. у больных раком поджелудочной железы).
Со стороны респираторной системы. Бронхоспастические реакции (одышка. затрудненное дыхание. стесненность в грудной клетке и/или стерторозное дыхание). токсическое действие на паренхиму легких или пневмонит (кашель. одышка). отек легких (кашель. затрудненное дыхание).
Со стороны органов ЖКТ. Тошнота. рвота (69% случаев). диарея (19%). запор. стоматит (≤11%). повышение активности печеночных трансаминаз и ЩФ.
Со стороны мочеполовой системы. Протеинурия. гематурия. периферические отеки (пальцев рук. ног или лодыжек). в редких случаях отеки могут носить генерализованный характер. редко - почечная недостаточность. гемолитико-уремический синдром (снижение гемоглобина. тромбоцитопения. гипербилирубинемия. гиперкреатинемия. повышение активности ЛДГ и концентрации мочевины).
Со стороны кожных покровов. Сыпь (30%), алопеция (обычно незначительная), кожные высыпания, кожный зуд.
Прочие. Часто (41%) - гриппоподобный синдром (лихорадка. головная боль. боль в спине. озноб. миалгия. слабость. анорексия. катаральные явления. потливость). инфекция (16%). менее часто - парестезия. образование экстравазата (раздражение. боль или покраснение) в месте инъекции. сонливость. редко - болезнь Гассера (черный дегтеобразный стул. кровь в моче или кале. повышенная температура тела. повышенное или сниженное мочевыделение. точечные красные пятна на коже. отечность лица. пальцев рук. ног или лодыжек. необычные кровотечения или кровоизлияния. необычная усталость или слабость. желтушность склер или кожи).
Interaction
Другие препараты, вызывающие угнетение функции костного мозга, и лучевая терапия потенцируют эффект и аддитивно угнетают функцию костного мозга. Азатиоприн, хлорамбуцил, глюкокортикоиды, циклофосфамид, циклоспорин, меркаптопурин и другие иммунодепрессивные средства повышают риск инфекции. При введении живых вирусных вакцин возможна интенсификация репликации вакцинного вируса и усиление побочных эффектов, при введении инактивированных вакцин - подавление выработки противовирусных антител.
Overdose
Симптомы. Угнетение функции костного мозга (анемия. лейкопения или нейтропения. возможно. с инфекцией. тромбоцитопения). парестезия (ощущение онемения или покалывания в кистях или стопах). сильно выраженная кожная сыпь.
Лечение. Проводят мониторинг числа форменных элементов крови, при необходимости назначают поддерживающую терапию. При сильном угнетении функции костного мозга возможно переливание необходимых компонентов крови. Больных с развившейся лейкопенией наблюдают для выявления признаков инфекции, при необходимости назначают антибиотики. Больным с нейтропенией при повышении температуры тела антибиотики широкого спектра действия назначают эмпирически до получения результатов бактериологических исследований и соответствующих диагностических тестов. Специфический антидот отсутствует.
Лечение. Проводят мониторинг числа форменных элементов крови, при необходимости назначают поддерживающую терапию. При сильном угнетении функции костного мозга возможно переливание необходимых компонентов крови. Больных с развившейся лейкопенией наблюдают для выявления признаков инфекции, при необходимости назначают антибиотики. Больным с нейтропенией при повышении температуры тела антибиотики широкого спектра действия назначают эмпирически до получения результатов бактериологических исследований и соответствующих диагностических тестов. Специфический антидот отсутствует.
Method of drug use and dosage
В/в, капельно (в течение 30 мин), в дозе 1 г/м2 1 раз в неделю, курс - 3 нед, повторный курс через 1 нед.
Application precautions
Применение гемцитабина следует проводить под строгим контролем показателей крови (1 раз в 2 нед). При уменьшении числа лейкоцитов <1500/мм3 и тромбоцитов <100000/мм3 обязательна коррекция дозы. Показанием для отмены препарата является уменьшение числа лейкоцитов <500/мм3 и тромбоцитов <50000/мм3.
В случае подтверждения или подозрения на пневмонит, вызванный гемцитабином, лечение следует немедленно прекратить.
Женщины детородного возраста должны использовать эффективные методы контрацепции (возможность тератогенного действия).
С осторожностью применяют у людей пожилого возраста (повышен риск токсического действия на кровь), у больных, ранее получавших цитотоксические препараты или лучевую терапию. Следует воздержаться от потенциально опасных видов деятельности, требующих повышенного внимания и быстроты психических и двигательных реакций.
В период лечения не рекомендуется проведение вакцинации вирусными вакцинами. Назначение вирусных вакцин возможно не ранее 3 мес - 1 года после прекращения применения препарата. Иммунизацию пероральной вакциной против полиомиелита людей, находящихся в близком контакте с больным, особенно членов семьи, следует отсрочить.
Появление признаков угнетения костного мозга, необычных кровотечений или кровоизлияний, черного дегтеобразного стула, крови в моче или кале или точечных красных пятен на коже требуют немедленной консультации врача.
Стоматологические вмешательства необходимо завершить до начала терапии или отложить до нормализации картины крови. В ходе лечения соблюдать осторожность при использовании зубных щеток, нитей или зубочисток.
При применении гемцитабина чаще 1 раза в неделю или проведении инфузии в течение более 60 мин неблагоприятные эффекты, связанные с терапией гемцитабином, могут отмечаться более часто и быть более выраженными.
Предшествующее лечение цитостатиками увеличивает частоту и тяжесть лейкопении и тромбоцитопении (прогрессивное снижение числа лейкоцитов и тромбоцитов может происходить после завершения терапии).
Применение гемцитабина должно проводиться специально обученным медицинским персоналом с соблюдением установленных мер предосторожности при приготовлении, разбавлении инъекционных растворов (в стерильном боксе с использованием одноразовых хирургических перчаток и масок) и уничтожении игл, шприцев, флаконов, ампул и остатка неиспользованного препарата.
При случайном попадании гемцитабина на кожу и слизистые оболочки пораженный участок необходимо немедленно промыть водой с мылом или тщательно сильной струей воды соответственно.
В случае подтверждения или подозрения на пневмонит, вызванный гемцитабином, лечение следует немедленно прекратить.
Женщины детородного возраста должны использовать эффективные методы контрацепции (возможность тератогенного действия).
С осторожностью применяют у людей пожилого возраста (повышен риск токсического действия на кровь), у больных, ранее получавших цитотоксические препараты или лучевую терапию. Следует воздержаться от потенциально опасных видов деятельности, требующих повышенного внимания и быстроты психических и двигательных реакций.
В период лечения не рекомендуется проведение вакцинации вирусными вакцинами. Назначение вирусных вакцин возможно не ранее 3 мес - 1 года после прекращения применения препарата. Иммунизацию пероральной вакциной против полиомиелита людей, находящихся в близком контакте с больным, особенно членов семьи, следует отсрочить.
Появление признаков угнетения костного мозга, необычных кровотечений или кровоизлияний, черного дегтеобразного стула, крови в моче или кале или точечных красных пятен на коже требуют немедленной консультации врача.
Стоматологические вмешательства необходимо завершить до начала терапии или отложить до нормализации картины крови. В ходе лечения соблюдать осторожность при использовании зубных щеток, нитей или зубочисток.
При применении гемцитабина чаще 1 раза в неделю или проведении инфузии в течение более 60 мин неблагоприятные эффекты, связанные с терапией гемцитабином, могут отмечаться более часто и быть более выраженными.
Предшествующее лечение цитостатиками увеличивает частоту и тяжесть лейкопении и тромбоцитопении (прогрессивное снижение числа лейкоцитов и тромбоцитов может происходить после завершения терапии).
Применение гемцитабина должно проводиться специально обученным медицинским персоналом с соблюдением установленных мер предосторожности при приготовлении, разбавлении инъекционных растворов (в стерильном боксе с использованием одноразовых хирургических перчаток и масок) и уничтожении игл, шприцев, флаконов, ампул и остатка неиспользованного препарата.
При случайном попадании гемцитабина на кожу и слизистые оболочки пораженный участок необходимо немедленно промыть водой с мылом или тщательно сильной струей воды соответственно.
Included in the composition
- 8€ Gemcitabine (7 firms)
- 3.5-16.8€ Gemcitabine-Ebewe (2 firms)
- 9.2-23€ Ongecin (3 firms)
- 6.8-32€ Cytogem
- 19.6€ Gemcitabine-Teva (3 firms)
- 22.5€ Gemita (2 firms)
- 9-49€ Gemzar (3 firms)
- 26.2-41.9€ Gemcitabine medac (2 firms)
- 12.5-59.4€ Gemcitare (2 firms)
- 66.6€ Gemcitover (2 firms)
- GEMCAP
- GemTax
- — Gemcex
- — Gemcitabine Actavis
- — Gemcitabine Pliva
- — Gemcitabine hydrochloride (5 firms)
- — Gemcitabine-Rus (4 firms)
- — Gemcitera (3 firms)
- — Gemtaz (Sun Pharmaceutical Industries Ltd. )
- — Гемтаксонко (2 firms)
- — Гемцивин
- — Гемцитабин - Келун - Казфарм (Kelun-Kazpharm )
- — Гемцитабин-РОНЦ (Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина ФГБУ МЗ РФ (НМИЦ онкологии им. Н.Н. Блохина МЗ РФ) )
- — Гемцитабин-промомед