МКБ-10 коды
- МКБ-10
- C49.2 Злокачественное новообразование соединительной и мягких тканей нижней конечности, включая тазобедренную область
- C48.0 Злокачественное новообразование забрюшинного пространства
- C49.1 Злокачественное новообразование соединительной и мягких тканей верхней конечности, включая область плечевого пояса
- C49.3 Злокачественное новообразование соединительной и мягких тканей грудной клетки
- C49.5 Злокачественное новообразование соединительной и мягких тканей таза
- C49.9 Злокачественное новообразование соединительной и мягких тканей неуточненной локализации
- C49.6 Злокачественное новообразование соединительной и мягких тканей туловища неуточненной локализации
- C22 Злокачественное новообразование печени и внутрипеченочных желчных протоков
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: с22.4, с48.0, с49.0, с49.1, с49.2, с49.3, с49.4, с49.5, с49.6, с49.7, с49.8, с49.9, с76.3.
Год утверждения (частота пересмотра): 2020.
Возрастная категория: Дети.
Пересмотр не позднее: 2022.
ID: 76.
Разработчик клинической рекомендации.
• Национальное общество детских гематологов, онкологов.
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2020.
Возрастная категория: Дети.
Пересмотр не позднее: 2022.
ID: 76.
Разработчик клинической рекомендации.
• Национальное общество детских гематологов, онкологов.
Одобрено Научно-практическим Советом Минздрава РФ.
|
|
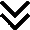 Список сокращений
Список сокращений
A - дактиномицин.
АРМС - Альвеолярная рабдомиосаркома.
БВ - Безрецидивная выживаемость.
БСВ - Бессобытийная выживаемость.
В/в - Внутривенный.
Гр - Грей.
ДЛТ - Дистанционная лучевая терапия.
ЗНО - Злокачественные новообразования.
КМ - Костный мозг.
КТ - Компьютерная томография.
Л/у - Лимфатический узел.
Мм - Миллиметр.
МРТ - Магнитно-резонансная томография.
ОВ - Общая выживаемость.
ОХЧО - Очень хороший частичный ответ.
ПО - Полный ответ.
ПХТ - Полихимиотерапия.
РМС - Рабдомиосаркома.
РОД - Разовая очаговая доза.
СКФ - Скорость клубочковой фильтрации.
СОД - Суммарная очаговая доза.
УЗИ - Ультразвуковое исследование.
ЦНС - Центральная нервная система.
ЭКГ - Электрокардиограмма.
ЭРМС - Эмбриональная рабдомиосаркома.
ЭхоКГ - Эхокардиография.
Ах - Аксиальный срез визуализации.
CARBO - Карбоплатин**.
CARBO/ETO - Режим химиотерапии: карбоплатин**, этопозид**.
CARBO/IFO - Режим химиотерапии: карбоплатин**, ифосфамид**.
CEVAIE - Режим химиотерапии: карбоплатин**, эпирубицин**, винкристин**, дактиномицин, ифосфамид**, этопозид**.
CEV - Режим химиотерапии: карбоплатин**, эпирубицин**, винкристин**.
Cor - Коронарный срез визуализации.
CYCLO - Циклофосфамид**.
DOX - Доксорубицин**.
EPI - Эпирубицин**.
ETO - Этопозид**.
F, Ф - Фракция.
G-CSF - Гранулоцитарный колониестимулирующий фактор.
HR - Высокий риск.
I2VA - Режим химиотерапии: ифосфамид**, винкристин**, дактиномицин.
I2VAd - Режим химиотерапии: ифосфамид**, винкристин**, дактиномицин, доксорубицин**.
I3VA - Режим химиотерапии: ифосфамид**, винкристин**, дактиномицин.
I3VЕ - Режим химиотерапии: ифосфамид**, винкристин**, этопозид**.
IFO - Ифосфамид**.
IFO/ETO - Режим химиотерапии: ифосфамид**, этопозид**.
LR - Низкий риск.
MTX - Метотрексат**.
V - Макроскопический объем опухоли.
VA - Режим химиотерапии: винкристин**, дактиномицин.
VAC - Режим химиотерапии: винкристин**, дактиномицин, циклофосфамид**.
VAIA - Режим химиотерапии: винкристин**, дактиномицин**, ифосфамид**, доксорубицин**.
VBL - Винбластин**.
VNL - Винорелбин**.
VCR - Винкристин**.
VNL/CYCLO - Режим химиотерапии: пероральная поддерживающая терапия по схеме винорелбин**/циклофосфамид**.
АРМС - Альвеолярная рабдомиосаркома.
БВ - Безрецидивная выживаемость.
БСВ - Бессобытийная выживаемость.
В/в - Внутривенный.
Гр - Грей.
ДЛТ - Дистанционная лучевая терапия.
ЗНО - Злокачественные новообразования.
КМ - Костный мозг.
КТ - Компьютерная томография.
Л/у - Лимфатический узел.
Мм - Миллиметр.
МРТ - Магнитно-резонансная томография.
ОВ - Общая выживаемость.
ОХЧО - Очень хороший частичный ответ.
ПО - Полный ответ.
ПХТ - Полихимиотерапия.
РМС - Рабдомиосаркома.
РОД - Разовая очаговая доза.
СКФ - Скорость клубочковой фильтрации.
СОД - Суммарная очаговая доза.
УЗИ - Ультразвуковое исследование.
ЦНС - Центральная нервная система.
ЭКГ - Электрокардиограмма.
ЭРМС - Эмбриональная рабдомиосаркома.
ЭхоКГ - Эхокардиография.
Ах - Аксиальный срез визуализации.
CARBO - Карбоплатин**.
CARBO/ETO - Режим химиотерапии: карбоплатин**, этопозид**.
CARBO/IFO - Режим химиотерапии: карбоплатин**, ифосфамид**.
CEVAIE - Режим химиотерапии: карбоплатин**, эпирубицин**, винкристин**, дактиномицин, ифосфамид**, этопозид**.
CEV - Режим химиотерапии: карбоплатин**, эпирубицин**, винкристин**.
Cor - Коронарный срез визуализации.
CYCLO - Циклофосфамид**.
DOX - Доксорубицин**.
EPI - Эпирубицин**.
ETO - Этопозид**.
F, Ф - Фракция.
G-CSF - Гранулоцитарный колониестимулирующий фактор.
HR - Высокий риск.
I2VA - Режим химиотерапии: ифосфамид**, винкристин**, дактиномицин.
I2VAd - Режим химиотерапии: ифосфамид**, винкристин**, дактиномицин, доксорубицин**.
I3VA - Режим химиотерапии: ифосфамид**, винкристин**, дактиномицин.
I3VЕ - Режим химиотерапии: ифосфамид**, винкристин**, этопозид**.
IFO - Ифосфамид**.
IFO/ETO - Режим химиотерапии: ифосфамид**, этопозид**.
LR - Низкий риск.
MTX - Метотрексат**.
V - Макроскопический объем опухоли.
VA - Режим химиотерапии: винкристин**, дактиномицин.
VAC - Режим химиотерапии: винкристин**, дактиномицин, циклофосфамид**.
VAIA - Режим химиотерапии: винкристин**, дактиномицин**, ифосфамид**, доксорубицин**.
VBL - Винбластин**.
VNL - Винорелбин**.
VCR - Винкристин**.
VNL/CYCLO - Режим химиотерапии: пероральная поддерживающая терапия по схеме винорелбин**/циклофосфамид**.
Термины и определения
Общая выживаемость. Время, прошедшее с момента постановки диагноза СМТ до смерти пациента от любых причин или до последнего наблюдения за пациентом.
Бессобытийная выживаемость. Время, прошедшее с момента постановки диагноза СМТ до неблагоприятного события, под которым понимают прогрессию, рецидив (в случае достижения полного ответа), развитие вторичной злокачественной опухоли, смерть от любой причины, или даты последнего наблюдения за пациентом.
Прогрессия заболевания. Появление любого нового опухолевого очага; увеличение любого доступного измерению очага ≥ 33 %.
Рецидив заболевания. Появление любых новых опухолевых очагов у пациентов, достигших ранее полного ответа согласно критериям оценки ответа на терапию у пациентов с СМТ.
Бессобытийная выживаемость. Время, прошедшее с момента постановки диагноза СМТ до неблагоприятного события, под которым понимают прогрессию, рецидив (в случае достижения полного ответа), развитие вторичной злокачественной опухоли, смерть от любой причины, или даты последнего наблюдения за пациентом.
Прогрессия заболевания. Появление любого нового опухолевого очага; увеличение любого доступного измерению очага ≥ 33 %.
Рецидив заболевания. Появление любых новых опухолевых очагов у пациентов, достигших ранее полного ответа согласно критериям оценки ответа на терапию у пациентов с СМТ.
Описание
Саркомы мягких тканей (СМТ) - гетерогенная группа злокачественных новообразований (ЗНО), первично возникающие в мягких тканях и имеющие мезенхимальное происхождение [1].

Причины
Международная классификация опухолей мягких тканей ВОЗ, переизданная в 2013 году, выделяет более 160 нозологий, однако, достижения молекулярной генетики вносят свои коррективы каждый год [2].
Риск развития СМТ незначительно повышен при некоторых генетических нарушениях, в частности при синдроме базально-клеточных невусов, туберозном склерозе, синдроме Вернера, аденоматозном полипозе кишечника, включая синдром Гарднера. При болезни Реклингхаузена (нейрофиброматоз I типа) приблизительно в 15% случаев развивается злокачественная опухоль оболочек периферических нервов. РМС может развиваться при генетических синдромах: синдром Ли-Фраумени (мутация гена TP53), синдром Беквита-Видеманна, болезнь Реклингхаузена (мутация гена NF1), синдром Костелло, синдром Нунан, синдром Горлина (базально-клеточная карцинома) [1].
Риск развития СМТ незначительно повышен при некоторых генетических нарушениях, в частности при синдроме базально-клеточных невусов, туберозном склерозе, синдроме Вернера, аденоматозном полипозе кишечника, включая синдром Гарднера. При болезни Реклингхаузена (нейрофиброматоз I типа) приблизительно в 15% случаев развивается злокачественная опухоль оболочек периферических нервов. РМС может развиваться при генетических синдромах: синдром Ли-Фраумени (мутация гена TP53), синдром Беквита-Видеманна, болезнь Реклингхаузена (мутация гена NF1), синдром Костелло, синдром Нунан, синдром Горлина (базально-клеточная карцинома) [1].
Эпидемиология
СМТ занимают третье место в структуре заболеваемости экстракраниальными солидными опухолями детей 0-14 лет, после опухолей ЦНС и нейробластомы [3]. СМТ чаще встречаются у мальчиков. Соотношение мальчики: девочки - 1,5:1. СМТ представляют собой гетерогенную группу ЗНО, представленную большим количеством отдельных нозологических единиц [4]. Наиболее частыми гистологическими вариантами у детей являются РМС, что составляет более 60% от всех случаев СМТ [5]. Чаще всего РМС возникает в раннем детском возрасте - средний возраст пациентов в момент постановки диагноза составляет 5 лет. Показатель заболеваемости РМС составляет 0,45 на 100 тыс. детского населения, при этом выделяют два возрастных пика заболеваемости - возраст от 2 до 6 лет и от 15 до 18 лет. Структура заболеваемости СМТ варьирует от возраста и у пациентов в возрастной группе better 10 лет отмечается превалирование нерабдомиосаркомных СМТ [6].
С48,0 - ЗНО забрюшинного пространства.
С49,0 - ЗНО соединительной и мягких тканей головы, лица и шеи.
С49,1 - ЗНО соединительной и мягких тканей верхней конечности.
С49,2 - ЗНО соединительной и мягких тканей нижней конечности.
С49,3 - ЗНО соединительной и мягких тканей грудной клетки.
С49,4 - ЗНО соединительной и мягких тканей живота.
С49,5 - ЗНО соединительной и мягких тканей таза.
С49,6 - ЗНО соединительной и мягких тканей туловища неуточненной локализации.
С49,8 - Поражение соединительной и мягких тканей, выходящее за пределы одной и более вышеуказанных локализаций.
С49,9 - ЗНО соединительной и мягких тканей неуточненной локализации.
С76,3 - ЗНО таза.
1,4 Особенности кодирования по Международной статистической классификации болезней и проблем, связанных со здоровьем.
С22,4 - Другие саркомы печени.С48,0 - ЗНО забрюшинного пространства.
С49,0 - ЗНО соединительной и мягких тканей головы, лица и шеи.
С49,1 - ЗНО соединительной и мягких тканей верхней конечности.
С49,2 - ЗНО соединительной и мягких тканей нижней конечности.
С49,3 - ЗНО соединительной и мягких тканей грудной клетки.
С49,4 - ЗНО соединительной и мягких тканей живота.
С49,5 - ЗНО соединительной и мягких тканей таза.
С49,6 - ЗНО соединительной и мягких тканей туловища неуточненной локализации.
С49,8 - Поражение соединительной и мягких тканей, выходящее за пределы одной и более вышеуказанных локализаций.
С49,9 - ЗНО соединительной и мягких тканей неуточненной локализации.
С76,3 - ЗНО таза.
Классификация
1,5 Классификация СМТ и системы оценки распространенности процесса.
Основным фактором для стратификации мягкотканых опухолей является гистологически верифицированный тип опухоли [2]. В зависимости от чувствительности опухолей к химиотерапии СМТ классифицируются на «РМС-подобные» саркомы и «не-РМС-подобные» саркомы, при этом последние подразделяются на два подварианта (таблица 1).Таблица 1. Классификация сарком мягких тканей в зависимости от чувствительности к химиотерапии и гистологического варианта.
| Рабдомиосаркомоподобные саркомы мягких тканей Хорошая чувствительность к химиотерапии | Нерабдомиосаркомо-подобные саркомы мягких тканей Промежуточная чувствительность к химиотерапии | Нерабдомиосаркомоподобные саркомы мягких тканей Чувствительность к химиотерапии отсутствует | |
| Благоприятный гистологический вариант | Неблагоприятный гистологический вариант | ||
| Эмбриональная рабдомиосаркома | Альвеолярная рабдомиосаркома; Экстраоссальная саркома Юинга; Синовиальная саркома; Недифференцированная саркома | Альвеолярная саркома мягких тканей; Светлоклеточная саркома мягких тканей; Эпителиоидная саркома; Лейомиосаркома; Липосаркома; Плеоморфная недифференцированная саркома Злокачественная мезенхимома; Сосудистые опухоли (ангиосаркома); Инфантильная фибросаркома; Десмопластическая мелкокруглоклеточная опухоль; Воспалительная миофибробластическая опухоль; Злокачественная рабдоидная опухоль (экстраренальная) (рекомендуется использовать рекомендации Европейского регистра рабдоидных опухолей) | Злокачественная опухоль оболочек периферических нервов (син.: нейрофибросаркома); Фибросаркома (за исключением инфантильной фибросаркомы); Экстраоссальная хондросаркома |
Оценка распространенности процесса при СМТ.
Оценка распространенности процесса при СМТ базируется на TNM-классификации и постоперационном стадировании Межгруппового исследования по рабдомиосаркоме (Intergroup Rhabdomyosarcoma Study - IRS) [7].
В таблице 2, 3 представлены данные о клиническом и постоперационном стадировании СМТ по системе TNM.
Таблица 2. TNM-классификация опухолей до начала лечения.
| Первичная опухоль | |
| T0 | Отсутствие данных за первичную опухоль |
| T1 | Опухоль ограничена органом или тканью, из которой исходит T1a: Опухоль ≤ 5 см в наибольшем измерении T1b: Опухоль better 5 см в наибольшем измерении |
| T2 | Опухоль не ограничена органом или тканью, из которой исходит T2a: Опухоль ≤ 5 см в наибольшем измерении T2b: Опухоль better 5 см в наибольшем измерении |
| TX | Первичная опухоль не может быть оценена |
| Лимфатические узлы | |
| N0 | Нет признаков вовлечения лимфатических узлов |
| N1 | Есть признаки вовлечения лимфатических узлов |
| NX | Нет информации о вовлечении лимфатических узлов |
| Отдаленные метастазы | |
| M0 | Нет признаков метастазов и вовлечения нерегиональных (отдаленных) л/у |
| M1 | Признаки отдаленных метастазов или вовлечения нерегиональных (отдаленных) л/у |
| MX | Нет информации о метастазах |
Таблица 3. Постоперационная классификация TNM (pTNM).
| pT | |
| pT0 | При гистологическом исследовании препарата нет признаков опухоли |
| pT1 | Опухоль ограничена органом или тканью, где она возникла. Полное удаление, края гистологически без опухолевого роста |
| pT2 | Опухоль с инвазией за пределы органа или ткани, где она возникла Полное удаление, края гистологически без опухолевого роста |
| pT3 | Опухоль с инвазией или без инвазии за пределы органа или ткани, где она возникла Удаление неполное: pT3a: Признаки микроскопической остаточной опухоли pT3b: Признаки макроскопической остаточной опухоли pT3c: Злокачественный выпот поблизости, независимо от размера |
| pTX | Статус опухоли оценить невозможно |
| pN | |
| pN0 | Нет признаков опухоли при гистологическом исследовании региональных лимфоузлов |
| pN1 | Признаки инвазии в региональные лимфоузлы pN1a: Признаки инвазии в региональные лимфоузлы. Вовлеченные узлы считаются полностью удаленными. pN1b: Признаки инвазии в региональные лимфоузлы. Вовлеченные узлы считаются не полностью удаленными. |
| pNX | N-статус невозможно оценить из-за отсутствия патоморфологического исследования или из-за неадекватной информации о его результатах |
| pM | |
| pM0 | Нет признаков метастазов при гистологическом исследовании |
| pM1 | Есть признаки метастазов при гистологическом исследовании |
| pMX | M-статус невозможно оценить из-за отсутствия патоморфологического исследования или из-за неадекватной информации о его результатах |
Оценка распространенности процесса по IRS проводится на основании результатов хирургического вмешательства и зависит от его объема (радикальное или нерадикальное удаление опухоли, с учетом микро- и макроскопического исследования, характера роста опухоли, вовлеченности в процесс лимфатических коллекторов, наличия отдаленных метастазов) (таблица 4).
Таблица 4. Послеоперационное стадирование по системе IRS.
| Стадия по IRS | Определение | pT |
| I IA IB | Локализованная, полностью удаленная (макроскопически и микроскопически), нет вовлечения регионарных лимфоузлов Опухоль ограничена одним органом, где она возникла Инфильтрирующий рост за границы органа | pT1 pT2 |
| II IIA IIB | Макроскопически полностью удаленная, с признаками микроскопически остаточной опухоли Нет вовлечения регионарных лимфоузлов Вовлечение регионарных лимфоузлов | pT3a |
| III | Макроскопически остаточная опухоль или только биопсия | pT3b |
| IV | Отдаленные метастазы | pT4 |
|
|
Клиническая картина
Клиническая картина и выраженность симптомов зависят, прежде всего, от локализации и протяженности опухоли и поэтому крайне разнообразны. Состояние пациентов с РМС-подобными опухолями в области головы/шеи (например, опухоль орбиты с изначально безболезненным экзофтальмом) может страдать незначительно, в то время как при параменингеальной локализации с внутричерепным распространение симптомы могут проявляться в виде боли, отека, обструкции носовых ходов и придаточных пазух, пареза черепных нервов (III, IV, VI, VII) и рвоты. Пациенты с РМС-подобными опухолями в области мочеполового тракта могут жаловаться на боли в животе, гематурию, дизурию, запоры и увеличение мошонки. Опухоли внутренних половых органов девочек могут сопровождаться развитием геморрагических выделений из половых путей. Опухоли конечностей проявляются в виде болезненной или индолентной припухлости [7].

Диагностика
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (в соответствии с шкалами оценки УДД и УРР) по причине отсутствия посвященных им клинических исследований. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Все дети с подозрением на опухоль должны направляться в детские онкологические центры, оснащенные необходимым оборудованием для постановки диагноза.
Критерии установления диагноза/состояния. Диагноз устанавливается на основании патогномоничных данных:
• анамнестических данных.
• физикального обследования.
3) лабораторных исследований.
4) инструментального обследования.
5) гистологического исследования.
6) цитогенетического исследования.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Сбор анамнеза должен включать подробный сбор семейного анамнеза, детальное выяснение акушерского анамнеза матери, особенности беременности и развития пациента от рождения до момента обследования, уточнение онкологического анамнеза - наличие доброкачественных, или злокачественных опухолей у членов семьи, а также наличие в семье или у пациента врождённых пороков развития. Выявление случаев опухолевого заболевания в семье требует проведения медико-генетического консультирования для выявления генетических механизмов, лежащих в основе предрасположенности.
• Всем пациентам с подозрением на СМТ или с выявленной СМТ при первичном приеме, а также при каждом приеме у врача-детского онколога, перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении рекомендуется подробный сбор жалоб [9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарий. Первичное обследование пациента направлено на оценку общего статуса пациента, наличии интоксикационного синдрома, установление локализации первичного очага, возможного наличия метастазов (например, в регионарные л/у), определение объема инициального обследования, объема оперативного вмешательства с целью гистологической верификации опухоли. Осмотр должен включать в себя:
• антропометрические измерения (вес, рост и площадь поверхности тела), оценку нутритивного статуса (процентили), оценку физического развития, оценку наличия пороков развития и стигм дизэмбриогенеза;
• оценку кожных покровов и слизистых (выявление пятен «кофе с молоком»);
• поиск и выявление пальпируемого образования: определение локализации, характеристики опухоли (отек, спаянность с тканями), степень функциональных нарушений;
• оценку костно-мышечной системы (выявление наличия болевого синдрома, выявление нарушения функции конечностей);
• оценку функции сердечно-сосудистой системы;
• оценку функции легочной системы;
• пальпацию живота с оценкой наличия гепатоспленомегалии;
• оценку размеров лимфатических узлов (при вовлечении регионарных лимфоузлов размеры во всех случаях должны регистрироваться);
• характеристика функции тазовых органов.
• общий (клинический) анализ крови развернутый;
• анализ крови биохимический общетерапевтический с включением следующих параметров: ЛДГ, АЛТ, АСТ, ГГТ, билирубин, щелочная фосфатаза, общий белок, альбумин, креатинин, мочевина, мочевая кислота калий, натрий, хлор, кальций (другие параметры биохимического анализа крови могут быть включены в исследование на усмотрение врача);
• коагулограмма (ориентировочное исследование системы гемостаза) с включением следующих параметров: протромбин, международное нормализованное отношение (МНО), активированное частичное тромбопластиновое время (АЧТВ), фибриноген, тромбиновое время, антитромбин III, плазминоген, D-димер;
• общий (клинический) анализ мочи;
• определение скорость клубочковой фильтрации: исследование функции нефронов по клиренсу креатинина (проба Реберга);
• тесты тубулярной реабсорбции [10].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Всем ранее не получавшим лечение пациентам с СМТ перед началом лечения рекомендуется определение основных групп крови по системе AB0, определение антигена D системы Резус (резус-фактора) для возможности выполнения гемотрансфузии при наличии показаний до, во время или после терапии [9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем ранее не получавшим лечение пациентам с СМТ перед началом лечения рекомендуется для уточнения наличия сопутствующих инфекционных заболеваний и планирования необходимой сопутствующей терапии выполнение следующих исследований [9]:
• молекулярно-биологического исследования крови на вирус гепатита в (Hepatitis в virus) и на вирус гепатита с (Hepatitis с virus);
• молекулярно-биологического исследования крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1).
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем пациентам с СМТ перед началом лечения рекомендуется исследование уровня иммуноглобулинов G, A и M в крови для уточнения риска развития инфекционных осложнений и необходимости назначения соответствующей профилактики [9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. Если IgG<4 г/л, клиническая ситуация расценивается как симптоматическая гипогаммаглобулинемия. В этих случаях показана заместительная терапия иммуноглобулинами.
• Всем пациентам с СМТ моложе 1 года перед началом лечения рекомендуется исследование проведение молекулярно-биологического исследования на вирусы Эпштейн-Барр, цитомегаловирус и вирусы герпеса I-II типов для уточнения риска развития инфекционных осложнений и необходимости назначения соответствующей профилактики [9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. При наличии снижения фракции выброса левого желудочка требуется консультация кардиолога, рассмотрение вопроса о редукции доз антрациклинов.
• Всем пациентам с СМТ при первичном обследовании, в процессе противоопухолевого лечения, после окончания лечения, перед снятием с терапии рекомендуется регистрация вызванных потенциалов коры головного мозга одной модальности (зрительные, когнитивные, акустические столовые) [11,12].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
• Всем пациентам с подозрением на СМТ или с выявленной СМТ при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендуется выполнение магнитно-резонансной томографии (МРТ) с контрастированием пораженной области [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Предоперационная визуализация очень важна для оценки размера, объема и точной распространенности опухоли; ее связи с кровеносными сосудами (включая сосуды, питающие опухоль), нервами, близлежащими структурами и органами; изменений в костной системе и васкуляризации (визуализация с контрастированием). Визуализация зоны расположения первичной опухоли должна включать в себя исследование региональных лимфатических узлов. Важно, чтобы радиологическая оценка первичной опухоли и региональных лимфоузлов предшествовала биопсии (поскольку биопсия может существенно изменить первоначальный размер опухоли или регионального лимфатического узла).
МРТ мягкотканых сарком является методикой исследования используемой в клинической онкологии для оценки местной распространенности опухолевого процесса, за счет высокого естественного мягкотканого контраста, позволяющего оценить размеры опухоли и связь её с прилежащими анатомическими структурами.
При направлении на МРТ-исследование необходимо оценивать риски и наличие противопоказаний к проведению исследования, которые подразделяются на абсолютные и относительные. Для уточнения списка противопоказаний и при недостаточной осведомленности о противопоказаниях врача-специалиста, необходима консультация у врача-рентгенолога перед записью пациента на исследование.
Для достоверной оценки необходимо использовать томографы с напряженностью магнитного поля от 1,0Т до 3,0Т. Для исследования обязательно использование либо квадратурного типа катушек, либо системы поверхностных сэндвич-катушек катушек, размеры поля катушек должны превышать размеры поля исследования. В случае опухолей превышающих размеры области интереса требуется проведение исследования с использованием нескольких поверхностных катушек или используя несколько последовательных укладок, с захватом верхнего и нижнего полюсов опухоли.
Ниже представлен протокол исследования для прицельного изучения в области опухолевого процесса. Необходимо в первую очередь использовать последовательности в режиме спин-эхо, за исключением отдельных случаев, в частности при проведении в/в болюсного контрастирования, когда более целесообразно использовать быстрые градиентные последовательности;
1. Локалайзер с получением изображений области интереса в трех ортогональных плоскостях;
2. сor Т2ВИ с шириной среза 3-4 с минимальным 0-0,1 мм межсрезовым промежутком;
3. сor Т2ВИ с подавлением сигнала от жировой ткани, с шириной среза 3-4 с минимальным 0-0,1 мм межсрезовым промежутком;
4. Sag Т2ВИ или Sag T2ВИ с подавлением сигнала от жировой ткани, с шириной среза 3-4 с минимальным 0-0,1 мм межсрезовым промежутком;
5. Ax Т2ВИ с шириной среза 3-4 с минимальным 0-0,1 мм межсрезовым промежутком;
6. Ах Т2ВИ fat sat с шириной среза 3-4 с минимальным 0-0,1 мм межсрезовым промежутком;
7. Ax DWI в зависимости от модели и возможностей томографа необходимо использовать последовательности с возможностью нескольких b-факторов (например: 0, 50-100, 500-600, 1000). При невозможности использования последовательностей с мульти b-фактором допустимо исследование с двумя значениями b (0, 700-1000); ширина среза 4-6 межсрезовый промежуток 1,0.
8. Ax Т1ВИ с шириной среза 3-4 с минимальным 0-0,1 мм межсрезовым промежутком, с минимальным 0-0,1 мм межсрезовым промежутком;
9. сor Т1ВИ или Sag Т1ВИ в зависимости от локализации опухолевого процесса, с шириной среза 3-4.
10. Т1ВИ с подавлением сигнала от жировой ткани в Ax или сor или Sag проекциях, с шириной среза 3-4.
11. Внутривенное контрастирование с болюсным введением контрастного препарата Ax Т1ВИ с подавлением сигнала от жировой ткани, с использованием быстрых последовательностей с технологией интерполяции изображений, с шириной среза 4 с получением изображений шириной 1.
12. Постконтрастное Ax Т1ВИ с шириной среза 3-4 с минимальным 0-0,1 мм межсрезовым промежутком;
13. Постконтрастное сor Т1ВИ или Sag Т1ВИ в зависимости от локализации опухолевого процесса, с шириной среза 3-4.
14. Постконтрастное Т1ВИ с подавлением сигнала от жировой ткани в проекции и параметрах исследования, соответствующих разметке предконтрастного исследования в п.10.
Данный протокол следует использовать для оценки местной распространенности опухолевого процесса, при необходимости для дифференциальной диагностики выявляемых опухолей подозрительных на саркому мягких тканей, а также для оценки динамики опухолевого процесса.
Данный протокол исследования в большинстве случаев следует рассматривать как минимально достаточный для проведения прицельного исследования области опухолевого поражения сарком мягких тканей у детей в возрасте до 18 лет, и он может быть дополнен необходимыми исследованиями, которые возможно проводить на томографе в зависимости от его опциональных возможностей. Так же при проведении исследования следует учитывать регион исследования и локализацию опухоли, что должно вносить корректировки при разметке сканирования, при этом не следует использовать или применять как дополнение к исследованию косые проекции, размечаемые не по классическим анатомическим ориентирам, за исключением случаев, когда ориентироваться на анатомические структуры бывает невозможно. Кроме того, следует учитывать возраст детей и оценивать потребность в проведении исследования под наркозом, особенно у детей в возрасте до 6 лет и для неконтактных или слабоконтактных детей более старшего возраста.
В таблице 5 представлены параметры МРТ при оценке различных анатомических областей (таблица 5).
Таблица 5: МРТ-визуализация при некоторых локализациях.
КТ полезна для оценки небольшой деструкции костей, например, в грудной клетке или при опухолях головы и шеи с возможной инвазией в основание черепа.
Измерение объема опухоли.
Расчет объема опухоли (V) для опухолей эллипсоидной или округлой формы.
A = длина (в см).
B = ширина (в см) V = π /6 × a × b × c = 0,52 × a × b × c в см3.
C = толщина (в см).
В случае опухолей сложной формы необходимо непосредственное измерение объема. Для правильного расчета объема площади поперечных сечений умножаются на толщину среза и складываются (с учетом зазоров между сечениями).
Изменения объема опухоли - важный критерий для оценки ответа на терапию в ходе лечения. Поэтому измерение опухоли и расчет объема необходимо производить как в ходе диагностики, так и в моменты времени, выбранные для оценки ответа. Следует зафиксировать размеры опухоли в трех измерениях, выбирая по возможности три максимальных диаметра.
• Всем пациентам с подозрением на СМТ или с выявленной СМТ при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендуется выполнение рентгенографии пораженной области в 2-х проекциях для исключения вторичного поражения костных структур [8].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем пациентам с подозрением на СМТ или с выявленной СМТ при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендуется выполнение компьютерной томографии органов грудной клетки (КТ ОГК) с внутривенным контрастированием и рентгенографии органов грудной клетки для исключения метастатического поражения легких [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. КТ ОГК обязательна для всех пациентов. Учитывая проведение КТ для исключения метастатического поражения легких целесообразно проведение исследования с в/в контрастированием. Для оценки легочных метастазов предпочтительно низкодозное сканирование по педиатрическому протоколу.
При измерении легочных очагов в ходе диагностики и последующего наблюдения нужно использовать одни и те же параметры легочного окна. Результаты визуализации должны оцениваться экспертом-радиологом и обсуждаться с лечащим онкологом, так как легочное распространение опухоли играет критически важную роль в оценке распространенности опухолевого процесса.
При диагностике метастатических очагов используется несколько критериев: число, размеры, форма, структура (отсутствие кальцинатов, округлая форма, четкие границы) и локализация. Но ни один из критериев не является 100% специфичным.
Аналогично современным рекомендациям для других солидных опухолей (например, саркомы Юинга), признаком легочного метастазирования является присутствие одного или более легочных/плевральных очагов размером 10 не менее двух очагов 5-10 мм или не менее пяти четко видных очагов менее 5 мм (если нет другого явного медицинского объяснения наличия этих очагов).
Более мелкие изолированные очаги (не более четырех мелких очагов worse 5 мм) считаются сомнительными, кроме случаев, когда радиолог в достаточной мере уверен в их метастатической природе. В таких случаях можно провести биопсию, однако, в большинстве случаев она не рекомендуется.
У детей младше 10 лет следует обратить особое внимание на «атипичные легочные метастазы», так как подобные очаги поражения могут быть вызваны инфекцией. Может быть полезным исследование в динамике спустя небольшой промежуток времени.
• Всем пациентам с подозрением на СМТ или с выявленной СМТ при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендуется выполнение ультразвукового исследования лимфатических узлов, органов брюшной полости (комплексного), почек [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Определение опухолевого поражения лимфатических узлов очень важно при определении вовлеченности лимфатического коллектора особенно при локализации опухоли на конечностях.
Определение опухолевого поражения лимфатических узлов очень важно при определении вовлеченности лимфатического коллектора, однако точная оценка патологического распространения опухоли в лимфоузлы может быть проблематичной. Для оценки пальпируемых лимфоузлов следует использовать сочетание пальпации и УЗИ-диагностики.
Овальные узлы с сохранными воротами на УЗИ и диаметром менее 1 см по малой оси считаются нормальными, особенно если это двусторонние узлы.
Локорегионарные узлы, которые демонстрируют только периферическое усиление на КТ или МРТ (вероятно, за счет некротических центров) с большой вероятностью поражены опухолью, даже если они меньше 1 см.
Немного увеличенные локорегионарные узлы округлой формы, размером менее 1,5-2 см и/или гетерогенного вида представляют трудности при диагностике [7,13].
• Всем пациентам с подозрением на СМТ или с выявленной СМТ при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендуется выполнение сцинтиграфии костей всего тела для выявления метастазов в кости [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем пациентам с подозрением на СМТ или с выявленной СМТ в области головы и шеи при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендуется выполнение МРТ головного мозга с внутривенным контрастированием [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Биопсия является обязательной во всех случаях. Получение ткани опухоли целесообразно проводить открытым методом. Препарат направляется для проведения патоморфологического и молекулярно-генетических исследований. В некоторых центрах, обладающих соответствующим опытом, могут проводиться множественные биопсии с помощью специальной иглы с обтуратором (tru-cut биосия) под контролем МРТ/УЗИ.
Выбор ткани и объем биопсии должны быть адекватны поставленной диагностической задаче. Весь удаленный материал должен направляться на гистологическое исследование.
• Фрагментация материала крайне затрудняет его оценку.
• Желательно согласование объема биопсии с патологом.
• Крайне желательно присутствие патолога при биопсии.
• Материал для гистологического исследования должен быть помещён в фиксирующую среду как можно быстрее. Нельзя допускать высыхания материала.
• Соотношение объёма фиксирующей среды к объёму фиксируемого объекта не менее чем 10:1.
• Время фиксации не должно быть менее 12 и более 48 часов.
Неадекватная (слабая или чрезмерная) фиксация приводит к изменению морфологических свойств ткани и артефициальным результатам ИГХ.
Гистологическое исследование ткани опухоли - является основным методом окончательной верификации диагноза у пациентов с СМТ. Гистологический материал должен сопровождаться направлением, содержащим информацию о пациенте, длительности и характере заболевания, локализации очага поражения, описании биопсии с предоставлением протокола операции.
Правильный гистологический диагноз СМТ основывается на морфологической характеристике и целом ряде иммуногистохимических маркеров (напр., миогенин, MyoD1, десмин, виментин, миоглобин, актин, нейронспецифическая энолаза, S-100, MIC2), которые должны определяться в обязательном порядке.
• Всем пациентам с подозрением на СМТ, а также при подозрении на рецидив заболевания, у которых отмечаются клинические и рентгенологические признаки поражения лимфатических узлов, рекомендуется выполнение биопсии увеличенных лимфоузлов с последующим патолого-анатомическим исселедованием биопсийного материала [8,9,13].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Биопсия региональных лимфатических узлов обязательна всем пациентам при локализации первичной опухоли на конечностях, учитывая высокую частоту их поражения при данной локализации первичного очага, при альвеолярной РМС с наличием перестройки гена FOXO1. Кроме этого, проведение биопсии забрюшинных лимфатических узлов показано мальчикам в возрасте better 10 лет при паратестикулярной локализации РМС.
• Всем пациентам с подозрением на СМТ или выявленной СМТ при первичном обследовании, после окончания лечения перед снятием с терапии с целью исключения метастатического поражения костного мозга рекомендуется выполнение пункции костного мозга с последующим цитологическим исследованием мазка костного мозга (миелограмма) [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Поражение костного мозга при СМТ является очаговым. В связи с этим пункция костного мозга из одной точки не является приемлемой. Требуется выполнение костномозговых пункций из 4 различных точек. Целесообразно в случае выполнения пункции костного мозга приготовить по 10 стекол из каждой точки. Таким образом, при выполнении пункции костного мозга из 4 точек общее число стекол составит 40.
В случае выявления поражения костного мозга при первичном обследовании перед началом противоопухолевой терапии необходимо проведение повторной пункции костного мозга из четырех точек после 3 курсов ПХТ, после окончания лечения с целью оценки ответа на проведенную терапию и определения санации костного мозга.
• Всем пациентам с выявленной СМТ параменингеальной локализации при первичном обследовании рекомендуется выполнение спинномозговой пункции с последующим цитологическим исследованием спинномозговой жидкости на наличие атипичных клеток для исключения метастатического поражения ЦНС [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Проведение люмбальной пункции показано всем пациентам с параменингеальной локализацией при условии наличия эрозий костей основания черепа (по данным КТ), поражения черепных нервов и интракраниального распространения опухоли (по данным КТ/МРТ) с целью исключения поражения ЦНС.
• Всем пациентам мужского пола пубертатного возраста с выявленной СМТ перед началом терапии с применением алкилирующих агентов рекомендуется проведение криоконсервации спермы с целью сохранения детородной функции [8,14].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Пациентам с выявленной СМТ, подозрительные на отдельные варианты СМТ, рекомендуется выполнение молекулярно-генетических исследований в зависимости от подозреваемого типа опухоли ( см табл. 6) [15,16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарий. Молекулярно-генетические маркеры являются высокоспецифичными (патогномоничными) критериями отдельных типов сарком мягких тканей. Целесообразность их выявления и необходимый перечень определяются гистологическим типом опухоли и диагностической задачей, стоящей перед патологом. Материалом для проведения исследования является ткань опухоли, фиксированная в формалине и залитая в парафиновый блок. Назначение цитогенетических и молекулярно-генетических диагностических методик осуществляется врачом-патологоанатомом, который готовит материал для соответствующего исследования. Проведения данных диагностических методик возможно только в условиях референс-лаборатории.
Таблица 6. Специфические транслокации при СМТ.
• Всем пациентам с выявленной СМТ перед началом терапии рекомендуется в зависимости от сопутствующей патологии осмотр (консультация) врача-кардиолога, врача-невролога, врача-офтальмолога и других врачей-специалистов для определения необходимости терапии сопутствующих заболеваний [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Все дети с подозрением на опухоль должны направляться в детские онкологические центры, оснащенные необходимым оборудованием для постановки диагноза.
Критерии установления диагноза/состояния. Диагноз устанавливается на основании патогномоничных данных:
• анамнестических данных.
• физикального обследования.
3) лабораторных исследований.
4) инструментального обследования.
5) гистологического исследования.
6) цитогенетического исследования.
2,1 Жалобы и анамнез.
• Всем пациентам с подозрением на СМТ или с выявленной СМТ при первичном приеме рекомендуется подробный сбор анамнеза [8].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Сбор анамнеза должен включать подробный сбор семейного анамнеза, детальное выяснение акушерского анамнеза матери, особенности беременности и развития пациента от рождения до момента обследования, уточнение онкологического анамнеза - наличие доброкачественных, или злокачественных опухолей у членов семьи, а также наличие в семье или у пациента врождённых пороков развития. Выявление случаев опухолевого заболевания в семье требует проведения медико-генетического консультирования для выявления генетических механизмов, лежащих в основе предрасположенности.
• Всем пациентам с подозрением на СМТ или с выявленной СМТ при первичном приеме, а также при каждом приеме у врача-детского онколога, перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении рекомендуется подробный сбор жалоб [9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
2,2 Физикальное обследование.
• Всем пациентам с подозрением на СМТ или с выявленной СМТ при первичном приеме, а также при каждом приеме у врача-детского онколога, перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении рекомендуется визуальный осмотр пациента терапевтический, пальпация терапевтическая, аускультация терапевтическая [8].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарий. Первичное обследование пациента направлено на оценку общего статуса пациента, наличии интоксикационного синдрома, установление локализации первичного очага, возможного наличия метастазов (например, в регионарные л/у), определение объема инициального обследования, объема оперативного вмешательства с целью гистологической верификации опухоли. Осмотр должен включать в себя:
• антропометрические измерения (вес, рост и площадь поверхности тела), оценку нутритивного статуса (процентили), оценку физического развития, оценку наличия пороков развития и стигм дизэмбриогенеза;
• оценку кожных покровов и слизистых (выявление пятен «кофе с молоком»);
• поиск и выявление пальпируемого образования: определение локализации, характеристики опухоли (отек, спаянность с тканями), степень функциональных нарушений;
• оценку костно-мышечной системы (выявление наличия болевого синдрома, выявление нарушения функции конечностей);
• оценку функции сердечно-сосудистой системы;
• оценку функции легочной системы;
• пальпацию живота с оценкой наличия гепатоспленомегалии;
• оценку размеров лимфатических узлов (при вовлечении регионарных лимфоузлов размеры во всех случаях должны регистрироваться);
• характеристика функции тазовых органов.
2,3 Лабораторные диагностические исследования.
• Всем пациентам с подозрением на СМТ или с выявленной СМТ при первичном приеме, а также при каждом приеме у врача-детского онколога, перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении рекомендуется для уточнения состояния пациента, планирования терапевтической тактики и определения необходимости ее модификации, а также для определения потребности в сопутствующей и сопроводительной терапии выполнение следующих лабораторных исследований [8]:• общий (клинический) анализ крови развернутый;
• анализ крови биохимический общетерапевтический с включением следующих параметров: ЛДГ, АЛТ, АСТ, ГГТ, билирубин, щелочная фосфатаза, общий белок, альбумин, креатинин, мочевина, мочевая кислота калий, натрий, хлор, кальций (другие параметры биохимического анализа крови могут быть включены в исследование на усмотрение врача);
• коагулограмма (ориентировочное исследование системы гемостаза) с включением следующих параметров: протромбин, международное нормализованное отношение (МНО), активированное частичное тромбопластиновое время (АЧТВ), фибриноген, тромбиновое время, антитромбин III, плазминоген, D-димер;
• общий (клинический) анализ мочи;
• определение скорость клубочковой фильтрации: исследование функции нефронов по клиренсу креатинина (проба Реберга);
• тесты тубулярной реабсорбции [10].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Всем ранее не получавшим лечение пациентам с СМТ перед началом лечения рекомендуется определение основных групп крови по системе AB0, определение антигена D системы Резус (резус-фактора) для возможности выполнения гемотрансфузии при наличии показаний до, во время или после терапии [9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем ранее не получавшим лечение пациентам с СМТ перед началом лечения рекомендуется для уточнения наличия сопутствующих инфекционных заболеваний и планирования необходимой сопутствующей терапии выполнение следующих исследований [9]:
• молекулярно-биологического исследования крови на вирус гепатита в (Hepatitis в virus) и на вирус гепатита с (Hepatitis с virus);
• молекулярно-биологического исследования крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1).
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем пациентам с СМТ перед началом лечения рекомендуется исследование уровня иммуноглобулинов G, A и M в крови для уточнения риска развития инфекционных осложнений и необходимости назначения соответствующей профилактики [9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. Если IgG<4 г/л, клиническая ситуация расценивается как симптоматическая гипогаммаглобулинемия. В этих случаях показана заместительная терапия иммуноглобулинами.
• Всем пациентам с СМТ моложе 1 года перед началом лечения рекомендуется исследование проведение молекулярно-биологического исследования на вирусы Эпштейн-Барр, цитомегаловирус и вирусы герпеса I-II типов для уточнения риска развития инфекционных осложнений и необходимости назначения соответствующей профилактики [9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
2,4 Инструментальные диагностические исследования.
• Всем пациентам с СМТ при первичном обследовании, в процессе противоопухолевого лечения, после окончания лечения, перед снятием с терапии рекомендуется регистрация электрокардиограммы, расшифровка, описание и интерпретация электрокардиографических данных, а также выполнение эхокардиографии с определением фракции сердечного выброса для оценки функции сердечно-сосудистой системы, а также для контроля кардиологической токсичности у пациентов, получающих антрациклины [8,9].Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. При наличии снижения фракции выброса левого желудочка требуется консультация кардиолога, рассмотрение вопроса о редукции доз антрациклинов.
• Всем пациентам с СМТ при первичном обследовании, в процессе противоопухолевого лечения, после окончания лечения, перед снятием с терапии рекомендуется регистрация вызванных потенциалов коры головного мозга одной модальности (зрительные, когнитивные, акустические столовые) [11,12].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
• Всем пациентам с подозрением на СМТ или с выявленной СМТ при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендуется выполнение магнитно-резонансной томографии (МРТ) с контрастированием пораженной области [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Предоперационная визуализация очень важна для оценки размера, объема и точной распространенности опухоли; ее связи с кровеносными сосудами (включая сосуды, питающие опухоль), нервами, близлежащими структурами и органами; изменений в костной системе и васкуляризации (визуализация с контрастированием). Визуализация зоны расположения первичной опухоли должна включать в себя исследование региональных лимфатических узлов. Важно, чтобы радиологическая оценка первичной опухоли и региональных лимфоузлов предшествовала биопсии (поскольку биопсия может существенно изменить первоначальный размер опухоли или регионального лимфатического узла).
МРТ мягкотканых сарком является методикой исследования используемой в клинической онкологии для оценки местной распространенности опухолевого процесса, за счет высокого естественного мягкотканого контраста, позволяющего оценить размеры опухоли и связь её с прилежащими анатомическими структурами.
При направлении на МРТ-исследование необходимо оценивать риски и наличие противопоказаний к проведению исследования, которые подразделяются на абсолютные и относительные. Для уточнения списка противопоказаний и при недостаточной осведомленности о противопоказаниях врача-специалиста, необходима консультация у врача-рентгенолога перед записью пациента на исследование.
Для достоверной оценки необходимо использовать томографы с напряженностью магнитного поля от 1,0Т до 3,0Т. Для исследования обязательно использование либо квадратурного типа катушек, либо системы поверхностных сэндвич-катушек катушек, размеры поля катушек должны превышать размеры поля исследования. В случае опухолей превышающих размеры области интереса требуется проведение исследования с использованием нескольких поверхностных катушек или используя несколько последовательных укладок, с захватом верхнего и нижнего полюсов опухоли.
Ниже представлен протокол исследования для прицельного изучения в области опухолевого процесса. Необходимо в первую очередь использовать последовательности в режиме спин-эхо, за исключением отдельных случаев, в частности при проведении в/в болюсного контрастирования, когда более целесообразно использовать быстрые градиентные последовательности;
1. Локалайзер с получением изображений области интереса в трех ортогональных плоскостях;
2. сor Т2ВИ с шириной среза 3-4 с минимальным 0-0,1 мм межсрезовым промежутком;
3. сor Т2ВИ с подавлением сигнала от жировой ткани, с шириной среза 3-4 с минимальным 0-0,1 мм межсрезовым промежутком;
4. Sag Т2ВИ или Sag T2ВИ с подавлением сигнала от жировой ткани, с шириной среза 3-4 с минимальным 0-0,1 мм межсрезовым промежутком;
5. Ax Т2ВИ с шириной среза 3-4 с минимальным 0-0,1 мм межсрезовым промежутком;
6. Ах Т2ВИ fat sat с шириной среза 3-4 с минимальным 0-0,1 мм межсрезовым промежутком;
7. Ax DWI в зависимости от модели и возможностей томографа необходимо использовать последовательности с возможностью нескольких b-факторов (например: 0, 50-100, 500-600, 1000). При невозможности использования последовательностей с мульти b-фактором допустимо исследование с двумя значениями b (0, 700-1000); ширина среза 4-6 межсрезовый промежуток 1,0.
8. Ax Т1ВИ с шириной среза 3-4 с минимальным 0-0,1 мм межсрезовым промежутком, с минимальным 0-0,1 мм межсрезовым промежутком;
9. сor Т1ВИ или Sag Т1ВИ в зависимости от локализации опухолевого процесса, с шириной среза 3-4.
10. Т1ВИ с подавлением сигнала от жировой ткани в Ax или сor или Sag проекциях, с шириной среза 3-4.
11. Внутривенное контрастирование с болюсным введением контрастного препарата Ax Т1ВИ с подавлением сигнала от жировой ткани, с использованием быстрых последовательностей с технологией интерполяции изображений, с шириной среза 4 с получением изображений шириной 1.
12. Постконтрастное Ax Т1ВИ с шириной среза 3-4 с минимальным 0-0,1 мм межсрезовым промежутком;
13. Постконтрастное сor Т1ВИ или Sag Т1ВИ в зависимости от локализации опухолевого процесса, с шириной среза 3-4.
14. Постконтрастное Т1ВИ с подавлением сигнала от жировой ткани в проекции и параметрах исследования, соответствующих разметке предконтрастного исследования в п.10.
Данный протокол следует использовать для оценки местной распространенности опухолевого процесса, при необходимости для дифференциальной диагностики выявляемых опухолей подозрительных на саркому мягких тканей, а также для оценки динамики опухолевого процесса.
Данный протокол исследования в большинстве случаев следует рассматривать как минимально достаточный для проведения прицельного исследования области опухолевого поражения сарком мягких тканей у детей в возрасте до 18 лет, и он может быть дополнен необходимыми исследованиями, которые возможно проводить на томографе в зависимости от его опциональных возможностей. Так же при проведении исследования следует учитывать регион исследования и локализацию опухоли, что должно вносить корректировки при разметке сканирования, при этом не следует использовать или применять как дополнение к исследованию косые проекции, размечаемые не по классическим анатомическим ориентирам, за исключением случаев, когда ориентироваться на анатомические структуры бывает невозможно. Кроме того, следует учитывать возраст детей и оценивать потребность в проведении исследования под наркозом, особенно у детей в возрасте до 6 лет и для неконтактных или слабоконтактных детей более старшего возраста.
В таблице 5 представлены параметры МРТ при оценке различных анатомических областей (таблица 5).
Таблица 5: МРТ-визуализация при некоторых локализациях.
| Локализация | Ориентация | Ширина среза ( мм ) | Последовательности | |
| До контраста | После контраста | |||
| Орбита | Корональная (и аксиальная) | 2-4 | STIR or T2 fat sat | T1 fat sat |
| Голова и шея | Аксиальная (и корональная) | 3-4 | STIR (T2 fat sat) | T1 fat sat |
| Брюшная полость/таз | Аксиальная (и корональная) | 4-5 | STIR (T2 fat sat) | T1 fat sat |
| Конечности | Аксиальная (и корональная или сагиттальная) | 2-4 | STIR (T2 fat sat) | T1 fat sat |
| Параспинальная опухоль | МРТ позвоночника с КУ при первоначальной диагностике | |||
КТ полезна для оценки небольшой деструкции костей, например, в грудной клетке или при опухолях головы и шеи с возможной инвазией в основание черепа.
Измерение объема опухоли.
Расчет объема опухоли (V) для опухолей эллипсоидной или округлой формы.
A = длина (в см).
B = ширина (в см) V = π /6 × a × b × c = 0,52 × a × b × c в см3.
C = толщина (в см).
В случае опухолей сложной формы необходимо непосредственное измерение объема. Для правильного расчета объема площади поперечных сечений умножаются на толщину среза и складываются (с учетом зазоров между сечениями).
Изменения объема опухоли - важный критерий для оценки ответа на терапию в ходе лечения. Поэтому измерение опухоли и расчет объема необходимо производить как в ходе диагностики, так и в моменты времени, выбранные для оценки ответа. Следует зафиксировать размеры опухоли в трех измерениях, выбирая по возможности три максимальных диаметра.
• Всем пациентам с подозрением на СМТ или с выявленной СМТ при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендуется выполнение рентгенографии пораженной области в 2-х проекциях для исключения вторичного поражения костных структур [8].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем пациентам с подозрением на СМТ или с выявленной СМТ при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендуется выполнение компьютерной томографии органов грудной клетки (КТ ОГК) с внутривенным контрастированием и рентгенографии органов грудной клетки для исключения метастатического поражения легких [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. КТ ОГК обязательна для всех пациентов. Учитывая проведение КТ для исключения метастатического поражения легких целесообразно проведение исследования с в/в контрастированием. Для оценки легочных метастазов предпочтительно низкодозное сканирование по педиатрическому протоколу.
При измерении легочных очагов в ходе диагностики и последующего наблюдения нужно использовать одни и те же параметры легочного окна. Результаты визуализации должны оцениваться экспертом-радиологом и обсуждаться с лечащим онкологом, так как легочное распространение опухоли играет критически важную роль в оценке распространенности опухолевого процесса.
При диагностике метастатических очагов используется несколько критериев: число, размеры, форма, структура (отсутствие кальцинатов, округлая форма, четкие границы) и локализация. Но ни один из критериев не является 100% специфичным.
Аналогично современным рекомендациям для других солидных опухолей (например, саркомы Юинга), признаком легочного метастазирования является присутствие одного или более легочных/плевральных очагов размером 10 не менее двух очагов 5-10 мм или не менее пяти четко видных очагов менее 5 мм (если нет другого явного медицинского объяснения наличия этих очагов).
Более мелкие изолированные очаги (не более четырех мелких очагов worse 5 мм) считаются сомнительными, кроме случаев, когда радиолог в достаточной мере уверен в их метастатической природе. В таких случаях можно провести биопсию, однако, в большинстве случаев она не рекомендуется.
У детей младше 10 лет следует обратить особое внимание на «атипичные легочные метастазы», так как подобные очаги поражения могут быть вызваны инфекцией. Может быть полезным исследование в динамике спустя небольшой промежуток времени.
• Всем пациентам с подозрением на СМТ или с выявленной СМТ при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендуется выполнение ультразвукового исследования лимфатических узлов, органов брюшной полости (комплексного), почек [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Определение опухолевого поражения лимфатических узлов очень важно при определении вовлеченности лимфатического коллектора особенно при локализации опухоли на конечностях.
Определение опухолевого поражения лимфатических узлов очень важно при определении вовлеченности лимфатического коллектора, однако точная оценка патологического распространения опухоли в лимфоузлы может быть проблематичной. Для оценки пальпируемых лимфоузлов следует использовать сочетание пальпации и УЗИ-диагностики.
Овальные узлы с сохранными воротами на УЗИ и диаметром менее 1 см по малой оси считаются нормальными, особенно если это двусторонние узлы.
Локорегионарные узлы, которые демонстрируют только периферическое усиление на КТ или МРТ (вероятно, за счет некротических центров) с большой вероятностью поражены опухолью, даже если они меньше 1 см.
Немного увеличенные локорегионарные узлы округлой формы, размером менее 1,5-2 см и/или гетерогенного вида представляют трудности при диагностике [7,13].
• Всем пациентам с подозрением на СМТ или с выявленной СМТ при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендуется выполнение сцинтиграфии костей всего тела для выявления метастазов в кости [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем пациентам с подозрением на СМТ или с выявленной СМТ в области головы и шеи при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания рекомендуется выполнение МРТ головного мозга с внутривенным контрастированием [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
2,5 Иные диагностические исследования.
• Всем пациентам с подозрением на СМТ, а также при подозрении на рецидив заболевания рекомендуется выполнение биопсии опухолевого образования с последующим патолого-анатомическим исследованием биопсийного (операционного) материала (ткани первичной опухоли и/или метастатического очага) [8].Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Биопсия является обязательной во всех случаях. Получение ткани опухоли целесообразно проводить открытым методом. Препарат направляется для проведения патоморфологического и молекулярно-генетических исследований. В некоторых центрах, обладающих соответствующим опытом, могут проводиться множественные биопсии с помощью специальной иглы с обтуратором (tru-cut биосия) под контролем МРТ/УЗИ.
Выбор ткани и объем биопсии должны быть адекватны поставленной диагностической задаче. Весь удаленный материал должен направляться на гистологическое исследование.
• Фрагментация материала крайне затрудняет его оценку.
• Желательно согласование объема биопсии с патологом.
• Крайне желательно присутствие патолога при биопсии.
• Материал для гистологического исследования должен быть помещён в фиксирующую среду как можно быстрее. Нельзя допускать высыхания материала.
• Соотношение объёма фиксирующей среды к объёму фиксируемого объекта не менее чем 10:1.
• Время фиксации не должно быть менее 12 и более 48 часов.
Неадекватная (слабая или чрезмерная) фиксация приводит к изменению морфологических свойств ткани и артефициальным результатам ИГХ.
Гистологическое исследование ткани опухоли - является основным методом окончательной верификации диагноза у пациентов с СМТ. Гистологический материал должен сопровождаться направлением, содержащим информацию о пациенте, длительности и характере заболевания, локализации очага поражения, описании биопсии с предоставлением протокола операции.
Правильный гистологический диагноз СМТ основывается на морфологической характеристике и целом ряде иммуногистохимических маркеров (напр., миогенин, MyoD1, десмин, виментин, миоглобин, актин, нейронспецифическая энолаза, S-100, MIC2), которые должны определяться в обязательном порядке.
• Всем пациентам с подозрением на СМТ, а также при подозрении на рецидив заболевания, у которых отмечаются клинические и рентгенологические признаки поражения лимфатических узлов, рекомендуется выполнение биопсии увеличенных лимфоузлов с последующим патолого-анатомическим исселедованием биопсийного материала [8,9,13].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Биопсия региональных лимфатических узлов обязательна всем пациентам при локализации первичной опухоли на конечностях, учитывая высокую частоту их поражения при данной локализации первичного очага, при альвеолярной РМС с наличием перестройки гена FOXO1. Кроме этого, проведение биопсии забрюшинных лимфатических узлов показано мальчикам в возрасте better 10 лет при паратестикулярной локализации РМС.
• Всем пациентам с подозрением на СМТ или выявленной СМТ при первичном обследовании, после окончания лечения перед снятием с терапии с целью исключения метастатического поражения костного мозга рекомендуется выполнение пункции костного мозга с последующим цитологическим исследованием мазка костного мозга (миелограмма) [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Поражение костного мозга при СМТ является очаговым. В связи с этим пункция костного мозга из одной точки не является приемлемой. Требуется выполнение костномозговых пункций из 4 различных точек. Целесообразно в случае выполнения пункции костного мозга приготовить по 10 стекол из каждой точки. Таким образом, при выполнении пункции костного мозга из 4 точек общее число стекол составит 40.
В случае выявления поражения костного мозга при первичном обследовании перед началом противоопухолевой терапии необходимо проведение повторной пункции костного мозга из четырех точек после 3 курсов ПХТ, после окончания лечения с целью оценки ответа на проведенную терапию и определения санации костного мозга.
• Всем пациентам с выявленной СМТ параменингеальной локализации при первичном обследовании рекомендуется выполнение спинномозговой пункции с последующим цитологическим исследованием спинномозговой жидкости на наличие атипичных клеток для исключения метастатического поражения ЦНС [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Проведение люмбальной пункции показано всем пациентам с параменингеальной локализацией при условии наличия эрозий костей основания черепа (по данным КТ), поражения черепных нервов и интракраниального распространения опухоли (по данным КТ/МРТ) с целью исключения поражения ЦНС.
• Всем пациентам мужского пола пубертатного возраста с выявленной СМТ перед началом терапии с применением алкилирующих агентов рекомендуется проведение криоконсервации спермы с целью сохранения детородной функции [8,14].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Пациентам с выявленной СМТ, подозрительные на отдельные варианты СМТ, рекомендуется выполнение молекулярно-генетических исследований в зависимости от подозреваемого типа опухоли ( см табл. 6) [15,16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарий. Молекулярно-генетические маркеры являются высокоспецифичными (патогномоничными) критериями отдельных типов сарком мягких тканей. Целесообразность их выявления и необходимый перечень определяются гистологическим типом опухоли и диагностической задачей, стоящей перед патологом. Материалом для проведения исследования является ткань опухоли, фиксированная в формалине и залитая в парафиновый блок. Назначение цитогенетических и молекулярно-генетических диагностических методик осуществляется врачом-патологоанатомом, который готовит материал для соответствующего исследования. Проведения данных диагностических методик возможно только в условиях референс-лаборатории.
Таблица 6. Специфические транслокации при СМТ.
| Тип опухоли | Транслокация | Химерные гены |
| Альвеолярная саркома мягких тканей | t(X;17)(p11;q25) | ASPS-TFE3 |
| Ангиоматоидная фиброзная гистиоцитома | t(12;22)(q13;q12) | FUS-ATF1 |
| t(12;16)(q13;p11) | FUS-ATF1 | |
| Экстраоссальная Саркома Юинга/Саркома Юинга | t(11;22)(q24;q12) | EWSR1-FLI1 |
| t(21;22)(q22;q12) | EWSR1-ERG | |
| t(7;22)(p22;q12) | EWS-ETV1 | |
| t(17;22)(q12;q12) | EWS-E1AF | |
| t(2;22)(q33;q12) | EWS-FEV | |
| t(16;21)(р11;q22) | FUS-ERG | |
| inv (22) | EWS-PATZ1 | |
| Светлоклеточная саркома | t(12;22)(p13;q12) | EWS-ATF1 |
| Инфантильная фибросаркома | t(12;15)(p13;q25-26) | ETV6-NTRK3 |
| Выбухающая дерматофибросаркома | t(17;22)(q22;q13) | сOL1A1-PDGFB |
| Десмопластическая мелкокруглоклеточная опухоль | t(11;22)(p13;q12) | EWS-WT1 |
| Эндометриальная стромальная саркома | t(7;17)(p15;q21) | JAZF1-JJAZ1 |
| Фибромиксоидная саркома низкой степени злокачественности | t(7;16)(q32-34;p11) | FUS-CREB3L1 |
| FUS-CREB3L2 | ||
| Злокачественная рабдоидная опухоль | Делеции 22q11,23 | SMARCB1 |
| Внекостная миксоидная хондросаркома | t(9;22)(q22;q12) | EWS-CHN |
| t(9;17)(q22;q12) | RBP56-CHN | |
| t(9;15)(q22;q21) | сHN-TCF12 | |
| Миксоидная липосаркома | t(12;22)(p12;q13) | EWS-CHOP |
| t(12;16)(p11;q13) | FUS-CHOP | |
| Альвеолярная рабдомиосаркома | t(2;13)(q35;q14) | PAX3-FOXO1 |
| t(1;13)(p36;q14) | PAX7-FOXO1 | |
| Синовиальная саркома | t(X;18)(p11;q11) | SS18-SSX1 |
| SYT-SSX2 | ||
| SYT-SSY4 | ||
| Воспалительная миофибробластическая опухоль | t(1;2)(q21;p23) | TPM3-ALK |
| t(2;19)(p23;p13) | TPM4-ALK | |
| t(2;17)(p23;q11) | сLTC-ALK | |
| t(2;11)(p23;p15) | сARS-ALK | |
| t(2;2)(q12;p23) | RANBP2-ALK |
• Всем пациентам с выявленной СМТ перед началом терапии рекомендуется в зависимости от сопутствующей патологии осмотр (консультация) врача-кардиолога, врача-невролога, врача-офтальмолога и других врачей-специалистов для определения необходимости терапии сопутствующих заболеваний [8,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
|
|
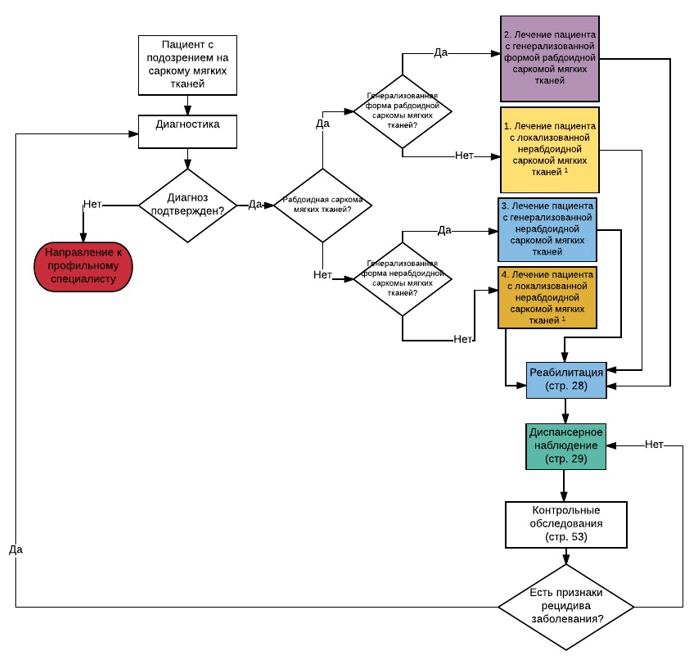
Лечение
При выборе тактики и проведении терапии следует учитывать, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
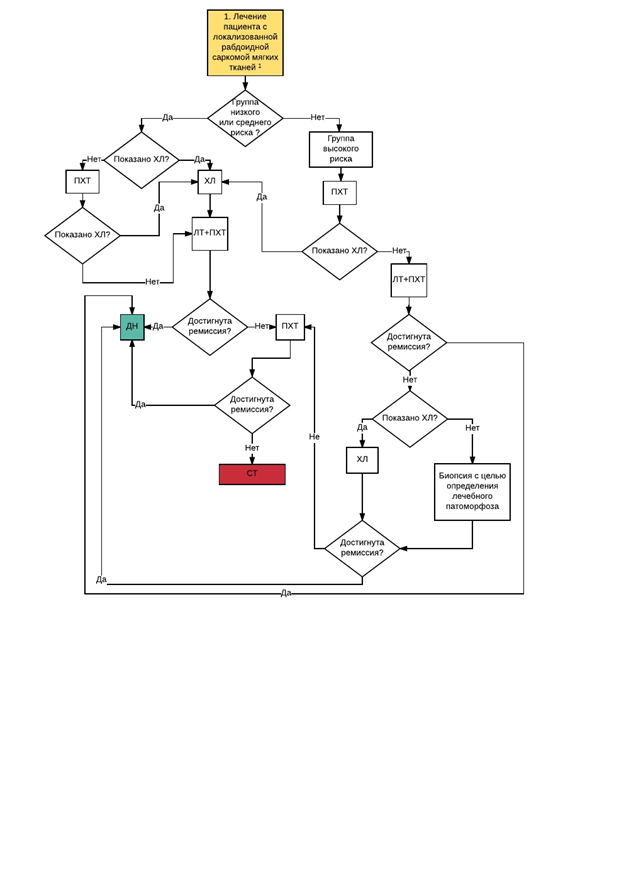
Терапия пациентов с СМТ основывается на мультидисциплинарном подходе и должна осуществляться в специализированных центрах, имеющих опыт лечения данной группы пациентов. Основу терапии составляет применение адекватной системной терапии и локального контроля [17-29]. Для этого используются хирургический метод, химиотерапия и лучевая терапия. Порядок назначения того или иного метода, а также его проведение зависит от размера опухоли, ее протяженности, гистологического варианта, локализации, резектабельности опухоли и возраста пациента. У пациентов с первично локализованной РМС 5-летняя выживаемость при использовании комбинации химиотерапии и локальной контроля составляет 70%, при внескелетной саркоме Юинга - примерно 50%, при синовиальной саркоме - 70-80% [1,5,6].
В рамках настоящих рекомендаций лечение СМТ различается в зависимости от гистологического типа опухоли и распространенности опухолевого процесса.
Выделяют следующие подгруппы пациентов, которые будут рассмотрены отдельно:
• Пациенты с РМС.
• Пациенты с РМС-подобными саркомами.
• Пациенты с нерабдомиосаркомными саркомами.
• Пациенты с метастатическими СМТ ( IRS IV ).
Пациенты с РМС и отдаленными метастазами на момент постановки диагноза получают лечение в рамках отдельных рекомендаций для пациентов с СМТ и отдаленными метастазами.
Критерии начала химиотерапии у пациентов, которым она показана - см раздел 7,1.
• Всем пациентам с верифицированной РМС или рабдомиосаркомоподобными СМТ рекомендовано до начала специфической терапии провести анализ факторов риска и стратифицировать пациентов по группам риска [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Факторы, определяющие стратификацию пациентов с РМС по группам риска, представлены в таблице 7.
Таблица 7. Факторы, определяющие стратификацию пациентов с РМС по группам риска.
С учетом всех вышеизложенных факторов проводится стратификация пациентов на группы риска (таблица 8).
Таблица 8. Стратификация пациентов с РМС по группам риска.
Всем пациентам с верифицированной РМС низкого риска, подгруппы А ( см табл8) рекомендовано выполнение полного удаления опухоли с последующей химиотерапией по схеме винкристин** + дактиномицин, 4 курса (22 недели) - см приложение А3,1, табл. 20 [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем пациентам с верифицированной РМС стандартного риска, подгруппы В, С или D ( см табл.8) рекомендовано выполнение полного удаления опухоли с последующей химиотерапией по схеме ифосфамид** (с месной**) + винкристин** + дактиномицин, 9 курсов (25 недель) - см приложение А3,1, табл. 21 [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. В группах IRS I и II после первоначального удаления дальнейшие операции не проводятся (но у пациентов из группы II следует рассмотреть возможность первичного повторного удаления опухоли). У пациентов из IRS группы III следует рассмотреть возможность отложенной операции после первоначальной химиотерапии.
Введение ифосфамида** в подгруппе в после начальных 4 курсов не производится. То же самое относится к подгруппе С после 5 курсов, если используется ЛТ ( см табл. 22).
• Всем пациентам с верифицированной РМС стандартного риска, подгруппы С или D ( см табл. 8) рекомендовано проведение лучевой терапии согласно рекомендациям по ЛТ, за исключением пациентов с благоприятной гистологией опухоли, у которых инициально радикальное удаление опухоли проведено не было, но консилиум пришел к мнению, что у ребенка возможно проведение отсроченной радикальной операции (R0) на 9-12 неделе терапии [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. В зависимости от состояния краев при удалении и ответа доза варьирует от 36,0 до 50,4 Гр [23].
• Всем пациентам с верифицированной РМС высокого риска, подгруппы E, F или G ( см табл.8) рекомендовано выполнение полного удаления опухоли с последующей химиотерапией по схеме ифосфамид** (с месной**) + винкристин** + дактиномицин, 9 курсов (25 недель) - см приложение А3,1, табл. 23, и с последующей лучевой терапией [30].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. После первоначального удаления опухоли в группах IRS I и II дальнейшие операции не проводятся (но у пациентов из IRS группы II следует рассмотреть возможность первичного повторного удаления опухоли). У пациентов из IRS группы III следует рассмотреть возможность отложенной операции после первоначальной химиотерапии или лучевой терапии.
Доза лучевой терапии варьируется в зависимости от гистологии, состояния краев резекции при удалении и ответа опухоли на терапию доза от 36,0 до 50,4 Гр [23].
• Всем пациентам с верифицированной РМС очень высокого риска, подгруппы Н ( см табл. 8) рекомендовано выполнение полного удаления опухоли с последующей химиотерапией по схеме ифосфамид** (с месной**) + винкристин** + дактиномицин + доксорубицин** (проводятся чередующиеся курсы I2VAd и I‑VA - суммарно 6 курсов: 3 курса I2VAd и 3 курса I2VA; далее проводится 3 курса I2VA. Общая длительность терапии 25 недель - 9 курсов) - см приложение А3,1, табл. 24, 25 [30].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. После первоначального удаления в группах IRS I и II дальнейшие операции не проводятся (но у пациентов из IRS группы II следует рассмотреть возможность первичного повторного удаления опухоли). У пациентов из IRS группы III следует рассмотреть возможность отложенной операции после первоначальной химиотерапии.
Доза лучевой терапии варьируется в зависимости от гистологии, состояния краев резекции при удалении и ответа опухоли на терапию доза от 41,4 до 50,4 Гр.
• Всем пациентам с верифицированной РМС высокого и очень высокого риска, подгруппы E, F, G или H ( см табл.8) рекомендовано проведение поддерживающей терапии, начиная с 28 недели от момента начала терапии, в течение 6 месяцев [31].
Уровень убедительности рекомендаций в (уровень достоверности доказательств 2).
Комментарий: поддерживающая терапия состоит из 28 дневных курсов терапии с включением циклофосфамида** и винорелбина** [25]. Циклофосфамид** в дозе 25 мг/м2/сут принимается per os непрерывно с 1 по 28 день, винорелбин** вводится в 1, 8, 15 дни каждого курса в/в в дозе 25 мг/м2. Таким образом, суммарно за 6 месяцев проводится 6 курсов поддерживающей ПХТ.
• Всем пациентам с верифицированной синовиальной саркомой или экстраоссальной саркомой Юинга рекомендовано удаление опухоли с последующей химиотерапией по схеме ифосфамид** + винкристин** + дактиномицин + доксорубицин** (проводятся чередующиеся курсы I2VAd и I‑VA - суммарно 6 курсов: 3 курса I2VAd и 3 курса I2VA; далее проводится 3 курса I2VA. Общая длительность терапии 25 недель - 9 курсов) - см приложение А3,2, табл. 26, 27 [30].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. После первоначального удаления в группах IRS I и II ( см табл. 8) дальнейшие операции не проводятся (но у пациентов из группы II следует рассмотреть возможность первичного повторного удаления опухоли). У пациентов из IRS группы III следует рассмотреть возможность отложенной операции после первоначальной химиотерапии.
Пациенты с синовиальной саркомой из группы IRS I или II (кроме T2b) получают только 6 курсов (2 цикла).
• Всем пациентам с верифицированной с верифицированной синовиальной саркомой или экстраоссальной саркомой Юинга из группы IRS II или III ( см табл.8) рекомендовано проведение лучевой терапии согласно рекомендациям по ЛТ [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
В нижеприведенной таблице 9 описана стратификация нерабдомиосаркомоподобных СМТ на группы риска в соответствии с их гистологией, вовлечением региональных лимфоузлов, послеоперационной стадией (группа IRS) и размером опухоли.
Таблица 9. Факторы, определяющие стратификацию пациентов с нерабдомиосаркомоподобными СМТ по группам риска.
С учетом всех вышеизложенных факторов проводится стратификация пациентов на группы риска (таблица 10).
Таблица 10. Стратификация пациентов с локализованными стадиями нерабдомиосаркомоподобных СМТ по группам риска.
* ДКМО - десмопластическая мелкокруглоклеточная опухоль.
• Всем пациентам с верифицированной нерабдомиосаркомоподобной СМТ группы низкого риска ( см табл.10) рекомендовано выполнение полного удаления опухоли [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Пациентам низкого риска дальнейшие операции, химиотерапия и лучевая терапия не проводятся.
• Всем пациентам с верифицированной нерабдомиосаркомоподобной СМТ группы стандартного риска ( см табл.10) рекомендовано выполнение полного удаления опухоли с последующей ЛТ согласно рекомендациям по ЛТ [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Пациентам стандартного риска химиотерапия не проводится. У отдельных пациентов из группы IRS II следует рассмотреть возможность первичного повторного удаления опухоли.
• Всем пациентам с верифицированной нерабдомиосаркомоподобной СМТ группы высокого риска ( см табл. 10) рекомендовано выполнение полного удаления опухоли с последующей химиотерапией по схеме ифосфамид** + винкристин** + дактиномицин + доксорубицин** (проводятся чередующиеся курсы I2VAd и I‑VA - суммарно 6 курсов: 3 курса I2VAd и 3 курса I2VA; далее проводится 3 курса I2VA. Общая длительность терапии 25 недель - 9 курсов - см приложение А3,3, табл. 28, 29) и ЛТ согласно рекомендациям по ЛТ, 50,4 Гр при обычном (конвенциональном) фракционировании [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. У пациентов из IRS группы III следует рассмотреть возможность отложенной и более агрессивной операции после первоначальной химиотерапии.
• Всем пациентам с верифицированной СМТ с инициально выявленными отдаленными метастазами рекомендовано выполнение полного удаления опухоли с последующей химиотерапией по схеме сEVAIE: карбоплатин** + ифосфамид** + винкристин** + дактиномицин + эпирубицин** + этопозид** (один цикл состоит из курса I3VA, за которым следуют курс сEV и курс I3VE - см приложение А3,4, табл. 30-32). Пациент получает 3 цикла (9 курсов) в течение 25 недель с последующей ЛТ [30].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Пациенты получают лучевую терапию согласно рекомендациям по ЛТ; в зависимости от гистологии, состояния краев резекции при удалении и ответа доза варьирует от 41,4 до 50,4 Гр.
• Всем пациентам с верифицированной СМТ с инициально выявленными отдаленными метастазами рекомендовано проведение поддерживающей терапии, начиная с 28 недели от момента начала терапии, в течение 12 месяцев [28,31].
Уровень убедительности рекомендаций в (уровень достоверности доказательств 2).
Комментарий: поддерживающая терапия состоит из 28-дневных курсов терапии с включением циклофосфамида** и винорелбина** [25]. Циклофосфамид** в дозе 25 мг/м2/сут принимается per os непрерывно с 1 по 28 день, винорелбин** вводится в 1, 8, 15 дни каждого курса в/в в дозе 25 мг/м2. Таким образом, суммарно за 12 месяцев проводится 12 курсов поддерживающей ПХТ.
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Необходимо помнить о возможности усиления токсичности интратекально вводимых препаратов при одновременном проведении лучевой терапии.
Критерии начала курсов терапии второй линии, такие же, как и при терапии первой линии ( см раздел 7,1).
• Всем пациентам с рецидивом СМТ рекомендовано проведение химиотерапии в зависимости от предшествующей терапии ( см табл. 12) [29,30].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарий:
Таблица 12. Предложение по лечению пациентов с неудовлетворительным ответом на инициальную химиотерапию.
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
Комментарии. Критерии белково-энергетической недостаточности и факторы нутритивного риска - см приложение Г3. Первичный скрининг проводится либо с помощью оценки антропометрических показателей и выявления риска, либо с использованием стандартных шкал/утилит для проведения нутритивного скрининга [34,35]. Основными антропометрическими параметрами для оценки нутритивного статуса являются: масса тела, рост, индекс массы тела, окружность плеча (ОП), толщина кожно-жировой складки над трицепсом (КЖСТ), окружность мышц плеча (ОМП) [36,37].
Нутритивный скрининг заключается в первичной и затем регулярной оценке нутритивного статуса и риска развития белково-энергетической недостаточности, в том числе скрытой, у каждого пациента, с момента поступления в стационар. Частота проведения нутритивного скрининга может варьировать от 1 до 4 раз в месяц и должна определяться конкретной клинической ситуацией и особенностями проводимого лечения [38,39].
• Пациентам с СМТ с выявленными нутритивными нарушениями при поверхностном скрининге с помощью специальных шкал, либо в результате антропометрии рекомендуется более детальное обследование нутритивного статуса: анализ питания, оценка тканевого состава тела, оценка лабораторных показателей, а также детальный физикальный осмотр на предмет выявления нутритивно-метаболических нарушений и их предикторов [40].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
• Всем пациентам с белково-энергетической недостаточностью или высоким риском ее развития (независимо от нутритивного статуса) рекомендуется проведение нутритивной поддержки (НП) [32].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
Комментарии. Первой формой НП должно являться диетологическое консультирование с последующей коррекцией основного рациона и возможным назначением дополнительно лечебных питательных смесей.
Расчет тотального расхода энергии (ТРЭ) проводится по формуле: ТРЭ = ЭОО × КК, где ЭОО - энергия основного обмена, КК - конверсионный коэффициент. Золотым стандартом для определения ЭОО является непрямая калориметрия. При невозможности проведения непрямой калориметрии, ЭОО возможно вычислять по формуле (например, Schofield) [41]. Во избежание гипералиментации на начальных этапах нутритивной поддержки детям с хронической белково-энергетической недостаточностью и/или с предполагаемым дефицитом поступления нутриентов 3 и более месяцев подряд в анамнезе для вычисления ТРЭ используется КК=0,85-1,4. Точный объем нутритивного вмешательства определяется в зависимости от конкретной клинической ситуации.
При выборе формы, метода, вида и объема НП необходимо руководствоваться, в первую очередь, принципом индивидуального подхода - сообразно клинической ситуации и логике.
Энтеральное питание (ЭП) является приоритетным при выборе метода нутритивной поддержки [42]: оно является наиболее физиологичным, обеспечивая внутрипросветную трофику слизистой оболочки ЖКТ, препятсвует микробной транслокации из просвета кишечника в кровь, является экономически более выгодным, чем парентеральное питание.
Выбор метода ЭП определяется сохранностью глотательной функции, а также функциональным состоянием ЖКТ: отсутствие аппетита, нежелание принимать пищу и смеси для ЭП, нарушение глотательной функции, невозможность перорального восполнения потребности в нутриентах и энергии - показания для проведения ЭП через назогастральный питательный зонд. Наличие патологических состояний, при которых пациент не должен принимать пищу естественным путем (острый панкреатит, стеноз выходного отдела желудка, высокие проксимальные свищи) - в этих случаях показана реализация ЭП через назоеюнальный зонд. Выбор режима введения энтерального питания определяется конкретной клинической ситуацией, состоянием гастроинтестинального тракта: в зависимости от клинического состояния используется болюсный или капельный (непрерывное или сеансовое введение) режим введения питательной смеси.
Начинать энтеральное питание истощенным пациентам рекомендуется с изокалорической полимерной смеси с последующим переходом на гиперкалорийную (под контролем переносимости). При наличии явлений мальабсорбции следует рассмотреть вопрос о назначении полуэлементной/олигомерной смеси.
При необходимости проведения зондового питания продолжительностью более 6 недель, а также при невозможности адекватной алиментации другими методами энтерального пистания и при отсутствии противопоказаний для проведения ЭП и самой гастростомии показана гастростомия. В случае, когда на начальных этапах нутритивной поддержки выявляется необходимость длительного проведения энтерального питания и прогнозируется риск развития нутритивной недостаточности (в тч при проведении химиолучевого лечения), либо при наличии у ребенка тяжелой хронической белково-энергетической недостаточности с высоким риском ее усугубления в дальнейшем возможно превентивное наложение гастростомы, минуя этап зондового питания. Преимущественным и, желательно, единственным питательным субстратом, вводимым в гастростому должны являться специализированные питательные смеси.
• Всем пациентам, которым невозможно обеспечить расчетную нутритивную потребность энтеральным путем, рекомендуется назначение парентерального питания [43].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
Комментарии. Ключевым (и единственным) показанием для назначения парентерального питания (ПП) является невозможность обеспечить расчетную нутритивную потребность пациента энтеральным путем - текущая или потенциально возможная в краткосрочной перспективе. Потребность в парентеральном введении аминокислот рассчитывается индивидуально и зависит от возраста пациента, клинического статуса, количества поступающего белка энтеральным путем ( см приложение Г3). Парентеральное поступление жиров должно быть ограничено до максимум 4 г/кг/сут у доношенных и недоношенных детей и 3 г/кг/сут у детей старшего возраста. Введение жиров нужно начинать с меньших доз, за 3-4 дня наращивая объем до расчетных значений, следя за переносимостью по лабораторным показателям [43]. В процессе ПП необходим постоянный мониторинг уровня триглицеридов в плазме крови и уменьшение введения липидов при необходимости. Отсутствуют точные данные о том, какой уровень триглицеридов у детей может приводить к неблагоприятным последствиям - предположительно, их максимальная концентрация не должна превышать 250 мг/дл (2,8 ммоль/л) для новорожденных и 400 мг/дл (4,5 ммоль/л) для детей более старшего возраста [43]. Потребность в парентеральном введении глюкозы рассчитывается индивидуально и зависит от возраста пациента, клинического статуса, количества поступающих углеводов энтеральным путем. Введение глюкозы нужно начинать с меньших объемов, за 3-4 дня наращивая объем до расчетных значений - следя за уровнем гликемии.
• Всем пациентам, получающим НП, рекомендуется нутритивный мониторинг, который может включать антропометрию, анализ тканевого состава тела, лабораторные показатели (биохимическое исследование крови, копрологическое исследование) [32,42].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
Терапия пациентов с СМТ основывается на мультидисциплинарном подходе и должна осуществляться в специализированных центрах, имеющих опыт лечения данной группы пациентов. Основу терапии составляет применение адекватной системной терапии и локального контроля [17-29]. Для этого используются хирургический метод, химиотерапия и лучевая терапия. Порядок назначения того или иного метода, а также его проведение зависит от размера опухоли, ее протяженности, гистологического варианта, локализации, резектабельности опухоли и возраста пациента. У пациентов с первично локализованной РМС 5-летняя выживаемость при использовании комбинации химиотерапии и локальной контроля составляет 70%, при внескелетной саркоме Юинга - примерно 50%, при синовиальной саркоме - 70-80% [1,5,6].
В рамках настоящих рекомендаций лечение СМТ различается в зависимости от гистологического типа опухоли и распространенности опухолевого процесса.
Выделяют следующие подгруппы пациентов, которые будут рассмотрены отдельно:
• Пациенты с РМС.
• Пациенты с РМС-подобными саркомами.
• Пациенты с нерабдомиосаркомными саркомами.
• Пациенты с метастатическими СМТ ( IRS IV ).
3,1 Терапия пациентов с рабдомиосаркомой и рабдомиосаркомоподобными СМТ (кроме пациентов с отдаленными метастазами).
В рамках настоящих рекомендаций предполагается проведение риск-адаптированной терапии пациентов с РМС и РМС-подобными СМТ.Пациенты с РМС и отдаленными метастазами на момент постановки диагноза получают лечение в рамках отдельных рекомендаций для пациентов с СМТ и отдаленными метастазами.
Критерии начала химиотерапии у пациентов, которым она показана - см раздел 7,1.
• Всем пациентам с верифицированной РМС или рабдомиосаркомоподобными СМТ рекомендовано до начала специфической терапии провести анализ факторов риска и стратифицировать пациентов по группам риска [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Факторы, определяющие стратификацию пациентов с РМС по группам риска, представлены в таблице 7.
Таблица 7. Факторы, определяющие стратификацию пациентов с РМС по группам риска.
| Прогностические факторы при РМС | ||
| Гистология | Благоприятная | Все эмбриональные, веретеноклеточные, ботриоидные РМС |
| Неблагоприятная | Альвеолярная РМС | |
| Послеоперационная стадия (группа IRS) | IRS группа I | Первичное полное удаление (R0) |
| IRS группа II | Микроскопическая остаточная опухоль (R1) или первичное полное удаление, но вовлечение лимфоузлов (N1) | |
| IRS группа III | Макроскопическая остаточная опухоль (R2) | |
| Локализация | Благоприятная | Орбита, мочеполовая система - паратестикулярная локализация, влагалище/матка, непараменингеальные опухоли головы и шеи |
| Неблагоприятная | Орбита с эрозией костей, параменингеальные опухоли, опухоли конечностей, мочеполовые опухоли мочевого пузыря/простаты или опухоли в других местах, не упомянутых выше | |
| Статус региональных л/у | Благоприятная | N0 = нет клинических или патоморфологических признаков вовлечения лимфоузлов |
| Неблагоприятная | N1 = клинические или патоморфологические признаки вовлечения лимфоузлов | |
| Размер и возраст | Благоприятная | Размер опухоли (в максимальном измерении) ≤ 5 см и возраст <10 лет |
| Неблагоприятная | Все прочие (то есть размер опухоли better 5 см и/или возраст ≥ 10 лет) | |
С учетом всех вышеизложенных факторов проводится стратификация пациентов на группы риска (таблица 8).
Таблица 8. Стратификация пациентов с РМС по группам риска.
| Стратификация пациентов с РМС | ||||||
| Группа риска | Подгруппы | Гистология | Постеопе-рационная стадия (группа IRS) | Локализация | Л/у стадия | Размер и возраст |
| Низкий | A | Благоприятная | I | Любая | N0 | Благоприятные |
| Стандартный | в | Благоприятная | I | Любая | N0 | Неблагоприятные |
| с | Благоприятная | II, III | Благоприятная | N0 | Любые | |
| D | Благоприятная | II, III | Неблагоприятная | N0 | Благоприятные | |
| Высокий | E | Благоприятная | II, III | Неблагоприятная | N0 | Неблагоприятные |
| F | Благоприятная | II, III | Любая | N1 | Любые | |
| G | Неблагоприятная | I, II, III | Любая | N0 | Любые | |
| Очень высокий | H | Неблагоприятная | II, III | Любая | N1 | Любые |
Всем пациентам с верифицированной РМС низкого риска, подгруппы А ( см табл8) рекомендовано выполнение полного удаления опухоли с последующей химиотерапией по схеме винкристин** + дактиномицин, 4 курса (22 недели) - см приложение А3,1, табл. 20 [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем пациентам с верифицированной РМС стандартного риска, подгруппы В, С или D ( см табл.8) рекомендовано выполнение полного удаления опухоли с последующей химиотерапией по схеме ифосфамид** (с месной**) + винкристин** + дактиномицин, 9 курсов (25 недель) - см приложение А3,1, табл. 21 [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. В группах IRS I и II после первоначального удаления дальнейшие операции не проводятся (но у пациентов из группы II следует рассмотреть возможность первичного повторного удаления опухоли). У пациентов из IRS группы III следует рассмотреть возможность отложенной операции после первоначальной химиотерапии.
Введение ифосфамида** в подгруппе в после начальных 4 курсов не производится. То же самое относится к подгруппе С после 5 курсов, если используется ЛТ ( см табл. 22).
• Всем пациентам с верифицированной РМС стандартного риска, подгруппы С или D ( см табл. 8) рекомендовано проведение лучевой терапии согласно рекомендациям по ЛТ, за исключением пациентов с благоприятной гистологией опухоли, у которых инициально радикальное удаление опухоли проведено не было, но консилиум пришел к мнению, что у ребенка возможно проведение отсроченной радикальной операции (R0) на 9-12 неделе терапии [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. В зависимости от состояния краев при удалении и ответа доза варьирует от 36,0 до 50,4 Гр [23].
• Всем пациентам с верифицированной РМС высокого риска, подгруппы E, F или G ( см табл.8) рекомендовано выполнение полного удаления опухоли с последующей химиотерапией по схеме ифосфамид** (с месной**) + винкристин** + дактиномицин, 9 курсов (25 недель) - см приложение А3,1, табл. 23, и с последующей лучевой терапией [30].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. После первоначального удаления опухоли в группах IRS I и II дальнейшие операции не проводятся (но у пациентов из IRS группы II следует рассмотреть возможность первичного повторного удаления опухоли). У пациентов из IRS группы III следует рассмотреть возможность отложенной операции после первоначальной химиотерапии или лучевой терапии.
Доза лучевой терапии варьируется в зависимости от гистологии, состояния краев резекции при удалении и ответа опухоли на терапию доза от 36,0 до 50,4 Гр [23].
• Всем пациентам с верифицированной РМС очень высокого риска, подгруппы Н ( см табл. 8) рекомендовано выполнение полного удаления опухоли с последующей химиотерапией по схеме ифосфамид** (с месной**) + винкристин** + дактиномицин + доксорубицин** (проводятся чередующиеся курсы I2VAd и I‑VA - суммарно 6 курсов: 3 курса I2VAd и 3 курса I2VA; далее проводится 3 курса I2VA. Общая длительность терапии 25 недель - 9 курсов) - см приложение А3,1, табл. 24, 25 [30].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. После первоначального удаления в группах IRS I и II дальнейшие операции не проводятся (но у пациентов из IRS группы II следует рассмотреть возможность первичного повторного удаления опухоли). У пациентов из IRS группы III следует рассмотреть возможность отложенной операции после первоначальной химиотерапии.
Доза лучевой терапии варьируется в зависимости от гистологии, состояния краев резекции при удалении и ответа опухоли на терапию доза от 41,4 до 50,4 Гр.
• Всем пациентам с верифицированной РМС высокого и очень высокого риска, подгруппы E, F, G или H ( см табл.8) рекомендовано проведение поддерживающей терапии, начиная с 28 недели от момента начала терапии, в течение 6 месяцев [31].
Уровень убедительности рекомендаций в (уровень достоверности доказательств 2).
Комментарий: поддерживающая терапия состоит из 28 дневных курсов терапии с включением циклофосфамида** и винорелбина** [25]. Циклофосфамид** в дозе 25 мг/м2/сут принимается per os непрерывно с 1 по 28 день, винорелбин** вводится в 1, 8, 15 дни каждого курса в/в в дозе 25 мг/м2. Таким образом, суммарно за 6 месяцев проводится 6 курсов поддерживающей ПХТ.
• Всем пациентам с верифицированной синовиальной саркомой или экстраоссальной саркомой Юинга рекомендовано удаление опухоли с последующей химиотерапией по схеме ифосфамид** + винкристин** + дактиномицин + доксорубицин** (проводятся чередующиеся курсы I2VAd и I‑VA - суммарно 6 курсов: 3 курса I2VAd и 3 курса I2VA; далее проводится 3 курса I2VA. Общая длительность терапии 25 недель - 9 курсов) - см приложение А3,2, табл. 26, 27 [30].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. После первоначального удаления в группах IRS I и II ( см табл. 8) дальнейшие операции не проводятся (но у пациентов из группы II следует рассмотреть возможность первичного повторного удаления опухоли). У пациентов из IRS группы III следует рассмотреть возможность отложенной операции после первоначальной химиотерапии.
Пациенты с синовиальной саркомой из группы IRS I или II (кроме T2b) получают только 6 курсов (2 цикла).
• Всем пациентам с верифицированной с верифицированной синовиальной саркомой или экстраоссальной саркомой Юинга из группы IRS II или III ( см табл.8) рекомендовано проведение лучевой терапии согласно рекомендациям по ЛТ [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
3,2 Терапия пациентов с нерабдомиосаркомоподобными СМТ (кроме пациентов с отдаленными метастазами).
Нерабдомиосаркомоподобные СМТ представляют гетерогенную группу редких мягкотканых опухолей детского и подросткового возраста, различающихся по гистологии, клиническому и биологическому поведению, а также молекулярно-генетическим профилем опухоли.В нижеприведенной таблице 9 описана стратификация нерабдомиосаркомоподобных СМТ на группы риска в соответствии с их гистологией, вовлечением региональных лимфоузлов, послеоперационной стадией (группа IRS) и размером опухоли.
Таблица 9. Факторы, определяющие стратификацию пациентов с нерабдомиосаркомоподобными СМТ по группам риска.
| Гистологический вариант | Неблагоприятный | Десмопластическая мелкокруглоклеточная опухоль |
| Послеоперационная стадия по IRS | I | Полное удаление опухоли |
| II | Микроскопическая остаточная опухоль | |
| III | Макроскопическая остаточная опухоль | |
| Статус региональных лимфоузлов | N0 | Нет поражения регионарных лимфоузлов |
| N1 | Поражение регионарных лимфоузлов | |
| Размеры опухоли | Благоприятная | размеры опухоли ≤ 5 см |
| Неблагоприятная | размеры опухоли better 5 см |
С учетом всех вышеизложенных факторов проводится стратификация пациентов на группы риска (таблица 10).
Таблица 10. Стратификация пациентов с локализованными стадиями нерабдомиосаркомоподобных СМТ по группам риска.
| Группа риска | Гистологический вариант | Региональные лимфоузлы | Стадия по IRS | Размеры опухоли |
| Группа низкого риска | Любая за исключением ДМКО* | N0 | I | ≤ 5 см |
| Группа стандартного риска | N0 | I | > 5 см | |
| N0 | II | Любая | ||
| N0 | III | ≤ 5 см | ||
| Группа высокого риска | ДМКО | N0/ N1 | I - III | Любая |
| Любая | N0 | III | > 5 см | |
| Любая | N1 | I - III | Любая | |
| Группа очень высокого риска | Любая | N0/N1 | IV | Любая |
* ДКМО - десмопластическая мелкокруглоклеточная опухоль.
• Всем пациентам с верифицированной нерабдомиосаркомоподобной СМТ группы низкого риска ( см табл.10) рекомендовано выполнение полного удаления опухоли [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Пациентам низкого риска дальнейшие операции, химиотерапия и лучевая терапия не проводятся.
• Всем пациентам с верифицированной нерабдомиосаркомоподобной СМТ группы стандартного риска ( см табл.10) рекомендовано выполнение полного удаления опухоли с последующей ЛТ согласно рекомендациям по ЛТ [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Пациентам стандартного риска химиотерапия не проводится. У отдельных пациентов из группы IRS II следует рассмотреть возможность первичного повторного удаления опухоли.
• Всем пациентам с верифицированной нерабдомиосаркомоподобной СМТ группы высокого риска ( см табл. 10) рекомендовано выполнение полного удаления опухоли с последующей химиотерапией по схеме ифосфамид** + винкристин** + дактиномицин + доксорубицин** (проводятся чередующиеся курсы I2VAd и I‑VA - суммарно 6 курсов: 3 курса I2VAd и 3 курса I2VA; далее проводится 3 курса I2VA. Общая длительность терапии 25 недель - 9 курсов - см приложение А3,3, табл. 28, 29) и ЛТ согласно рекомендациям по ЛТ, 50,4 Гр при обычном (конвенциональном) фракционировании [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. У пациентов из IRS группы III следует рассмотреть возможность отложенной и более агрессивной операции после первоначальной химиотерапии.
3,3 Терапия пациентов с отдаленными метастазами СМТ.
Принципы хирургического лечения пациентов с отдаленными метастазами СМТ являются аналогичными локализованным формам СМТ. Первичное хирургическое удаление метастазов не всегда необходимо, кроме жизнеугрожающих ситуаций, но сомнительные очаги должны быть гистологически верифицированы. При анализе очаговых изменений в легких необходимо использовать критерии, указанные в разделе «КТ органов грудной клетки». Хирургические вмешательства, направленные на удаление первичной опухоли и метастатических очагов как правило носят отсроченный характер после проведения неоадъювантной терапии. При их планировании учитывается клиническая ситуация и ответ на проведенную терапию.• Всем пациентам с верифицированной СМТ с инициально выявленными отдаленными метастазами рекомендовано выполнение полного удаления опухоли с последующей химиотерапией по схеме сEVAIE: карбоплатин** + ифосфамид** + винкристин** + дактиномицин + эпирубицин** + этопозид** (один цикл состоит из курса I3VA, за которым следуют курс сEV и курс I3VE - см приложение А3,4, табл. 30-32). Пациент получает 3 цикла (9 курсов) в течение 25 недель с последующей ЛТ [30].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Пациенты получают лучевую терапию согласно рекомендациям по ЛТ; в зависимости от гистологии, состояния краев резекции при удалении и ответа доза варьирует от 41,4 до 50,4 Гр.
• Всем пациентам с верифицированной СМТ с инициально выявленными отдаленными метастазами рекомендовано проведение поддерживающей терапии, начиная с 28 недели от момента начала терапии, в течение 12 месяцев [28,31].
Уровень убедительности рекомендаций в (уровень достоверности доказательств 2).
Комментарий: поддерживающая терапия состоит из 28-дневных курсов терапии с включением циклофосфамида** и винорелбина** [25]. Циклофосфамид** в дозе 25 мг/м2/сут принимается per os непрерывно с 1 по 28 день, винорелбин** вводится в 1, 8, 15 дни каждого курса в/в в дозе 25 мг/м2. Таким образом, суммарно за 12 месяцев проводится 12 курсов поддерживающей ПХТ.
3,4 Интратекальная терапия.
• Всем пациентам с верифицированной СМТ с параменингеальным расположением опухоли c поражением ЦНС (наличие опухолевых клеток в ликворе) рекомендовано проведение интратекальная терапия тиотепой** 5 мг/м2 1 раз в 3 недели (в первый день курса химиотерапии) до санации ликвора [30].Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Необходимо помнить о возможности усиления токсичности интратекально вводимых препаратов при одновременном проведении лучевой терапии.
3,5 Терапия рецидивов СМТ.
Терапии второй линии подлежат пациенты, не ответившие на терапию первой линии [29]. К ним относятся пациенты с объемом сокращения опухоли после первых 3 курсов химиотерапии менее 33%, пациенты с прогрессированием на фоне терапии, и пациенты, у которых не отмечено изменений со стороны размеров опухоли (стабилизация процесса).Критерии начала курсов терапии второй линии, такие же, как и при терапии первой линии ( см раздел 7,1).
• Всем пациентам с рецидивом СМТ рекомендовано проведение химиотерапии в зависимости от предшествующей терапии ( см табл. 12) [29,30].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарий:
Таблица 12. Предложение по лечению пациентов с неудовлетворительным ответом на инициальную химиотерапию.
| Проведенная терапия первой линии ПХТ | ПХТ второй линии |
| VA | VAIA III |
| IVA | ПХТ второй линии терапии карбоплатин** + этопозид** + ифосфамид** + циклофосфамид** ( см приложение А3,5) или схема сEVAIE ( см лечение пацентов с метастатической СМТ) |
| VAIA | ПХТ второй линии карбоплатин** + этопозид** + ифосфамид** + циклофосфамид** ( см приложение А3,5) или схема сEVAIE ( см лечение пацентов с метастатической СМТ) |
| CEVAIE | Индивидуальное решение, включение в клинические исследования |
3,6 Нутрициологическое сопровождение.
• Всем пациентам, получающим лечение в стационаре по поводу СМТ, при поступлении в стационар и далее от 1 до 4 раз в месяц рекомендуется проводить нутритивный скрининг с целью выявления белково-энергетической недостаточности либо риска ее развития [32,33].Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
Комментарии. Критерии белково-энергетической недостаточности и факторы нутритивного риска - см приложение Г3. Первичный скрининг проводится либо с помощью оценки антропометрических показателей и выявления риска, либо с использованием стандартных шкал/утилит для проведения нутритивного скрининга [34,35]. Основными антропометрическими параметрами для оценки нутритивного статуса являются: масса тела, рост, индекс массы тела, окружность плеча (ОП), толщина кожно-жировой складки над трицепсом (КЖСТ), окружность мышц плеча (ОМП) [36,37].
Нутритивный скрининг заключается в первичной и затем регулярной оценке нутритивного статуса и риска развития белково-энергетической недостаточности, в том числе скрытой, у каждого пациента, с момента поступления в стационар. Частота проведения нутритивного скрининга может варьировать от 1 до 4 раз в месяц и должна определяться конкретной клинической ситуацией и особенностями проводимого лечения [38,39].
• Пациентам с СМТ с выявленными нутритивными нарушениями при поверхностном скрининге с помощью специальных шкал, либо в результате антропометрии рекомендуется более детальное обследование нутритивного статуса: анализ питания, оценка тканевого состава тела, оценка лабораторных показателей, а также детальный физикальный осмотр на предмет выявления нутритивно-метаболических нарушений и их предикторов [40].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
• Всем пациентам с белково-энергетической недостаточностью или высоким риском ее развития (независимо от нутритивного статуса) рекомендуется проведение нутритивной поддержки (НП) [32].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
Комментарии. Первой формой НП должно являться диетологическое консультирование с последующей коррекцией основного рациона и возможным назначением дополнительно лечебных питательных смесей.
Расчет тотального расхода энергии (ТРЭ) проводится по формуле: ТРЭ = ЭОО × КК, где ЭОО - энергия основного обмена, КК - конверсионный коэффициент. Золотым стандартом для определения ЭОО является непрямая калориметрия. При невозможности проведения непрямой калориметрии, ЭОО возможно вычислять по формуле (например, Schofield) [41]. Во избежание гипералиментации на начальных этапах нутритивной поддержки детям с хронической белково-энергетической недостаточностью и/или с предполагаемым дефицитом поступления нутриентов 3 и более месяцев подряд в анамнезе для вычисления ТРЭ используется КК=0,85-1,4. Точный объем нутритивного вмешательства определяется в зависимости от конкретной клинической ситуации.
При выборе формы, метода, вида и объема НП необходимо руководствоваться, в первую очередь, принципом индивидуального подхода - сообразно клинической ситуации и логике.
Энтеральное питание (ЭП) является приоритетным при выборе метода нутритивной поддержки [42]: оно является наиболее физиологичным, обеспечивая внутрипросветную трофику слизистой оболочки ЖКТ, препятсвует микробной транслокации из просвета кишечника в кровь, является экономически более выгодным, чем парентеральное питание.
Выбор метода ЭП определяется сохранностью глотательной функции, а также функциональным состоянием ЖКТ: отсутствие аппетита, нежелание принимать пищу и смеси для ЭП, нарушение глотательной функции, невозможность перорального восполнения потребности в нутриентах и энергии - показания для проведения ЭП через назогастральный питательный зонд. Наличие патологических состояний, при которых пациент не должен принимать пищу естественным путем (острый панкреатит, стеноз выходного отдела желудка, высокие проксимальные свищи) - в этих случаях показана реализация ЭП через назоеюнальный зонд. Выбор режима введения энтерального питания определяется конкретной клинической ситуацией, состоянием гастроинтестинального тракта: в зависимости от клинического состояния используется болюсный или капельный (непрерывное или сеансовое введение) режим введения питательной смеси.
Начинать энтеральное питание истощенным пациентам рекомендуется с изокалорической полимерной смеси с последующим переходом на гиперкалорийную (под контролем переносимости). При наличии явлений мальабсорбции следует рассмотреть вопрос о назначении полуэлементной/олигомерной смеси.
При необходимости проведения зондового питания продолжительностью более 6 недель, а также при невозможности адекватной алиментации другими методами энтерального пистания и при отсутствии противопоказаний для проведения ЭП и самой гастростомии показана гастростомия. В случае, когда на начальных этапах нутритивной поддержки выявляется необходимость длительного проведения энтерального питания и прогнозируется риск развития нутритивной недостаточности (в тч при проведении химиолучевого лечения), либо при наличии у ребенка тяжелой хронической белково-энергетической недостаточности с высоким риском ее усугубления в дальнейшем возможно превентивное наложение гастростомы, минуя этап зондового питания. Преимущественным и, желательно, единственным питательным субстратом, вводимым в гастростому должны являться специализированные питательные смеси.
• Всем пациентам, которым невозможно обеспечить расчетную нутритивную потребность энтеральным путем, рекомендуется назначение парентерального питания [43].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
Комментарии. Ключевым (и единственным) показанием для назначения парентерального питания (ПП) является невозможность обеспечить расчетную нутритивную потребность пациента энтеральным путем - текущая или потенциально возможная в краткосрочной перспективе. Потребность в парентеральном введении аминокислот рассчитывается индивидуально и зависит от возраста пациента, клинического статуса, количества поступающего белка энтеральным путем ( см приложение Г3). Парентеральное поступление жиров должно быть ограничено до максимум 4 г/кг/сут у доношенных и недоношенных детей и 3 г/кг/сут у детей старшего возраста. Введение жиров нужно начинать с меньших доз, за 3-4 дня наращивая объем до расчетных значений, следя за переносимостью по лабораторным показателям [43]. В процессе ПП необходим постоянный мониторинг уровня триглицеридов в плазме крови и уменьшение введения липидов при необходимости. Отсутствуют точные данные о том, какой уровень триглицеридов у детей может приводить к неблагоприятным последствиям - предположительно, их максимальная концентрация не должна превышать 250 мг/дл (2,8 ммоль/л) для новорожденных и 400 мг/дл (4,5 ммоль/л) для детей более старшего возраста [43]. Потребность в парентеральном введении глюкозы рассчитывается индивидуально и зависит от возраста пациента, клинического статуса, количества поступающих углеводов энтеральным путем. Введение глюкозы нужно начинать с меньших объемов, за 3-4 дня наращивая объем до расчетных значений - следя за уровнем гликемии.
• Всем пациентам, получающим НП, рекомендуется нутритивный мониторинг, который может включать антропометрию, анализ тканевого состава тела, лабораторные показатели (биохимическое исследование крови, копрологическое исследование) [32,42].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
|
|
Реабилитация и амбулаторное лечение
• Всем пациентам с СМТ на всех этапах терапии заболевания, а также после завершения лечения рекомендуется комплексная реабилитация, а также при необходимости сопроводительная терапия для улучшения результатов лечения и качества жизни пациента, в зависимости от коморбидной патологии и осложнений основной терапии [44].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии. Реабилитация представляет собой неотъемлемую часть лечебного процесса у пациентов с диагностированными злокачественными новообразованиями.
Реабилитация включает в себя комплекс мероприятий, направленных на восстановление хорошего самочувствия и трудоспособности пациента (восстановительная реабилитация), повышение качества его жизни, социальную адаптацию и максимально возможное продление жизни с избавлением от боли (паллиативная реабилитация).
Правильно подобранный курс реабилитации позволит пациенту вернуться к полноценной жизни и/или продолжить программную терапию.
Курс реабилитационных мероприятий разрабатывается индивидуально - с учетом состояния пациента, его функциональных возможностей и мотивации. Такие методы, как физиотерапия, акупунктура, лечебная физкультура , способствуют заметному восстановлению двигательной активности и устранению наиболее распространенных нежелательных последствий терапии ЗНО.
Немаловажную роль играет и психологическая работа с пациентом и его родителями или ухаживающим за ним персоналом. Вне зависимости от результатов лечения, они могут чувствовать себя подавленно, потерять интерес к прежним увлечениям. пациенты, перенесшие удаление пораженных опухолью органов, практически всегда страдают из-за осознания изменений, произошедших с их телом. Особенно, если последствием операции стали рубцы или другие видимые эстетические дефекты. Родители и/или ухаживающий персонал психологически истощены уходом за близким человеком и страхом за его жизнь, потому также нуждаются в профессиональной помощи.
Крайне важным аспектом реабилитации, особенно после лечения, включающего хирургическое вмешательство и зачастую приводящего к инвалидизации, является помощь в адаптации пациентов к самостоятельной жизни. Важно оценить степень функциональных нарушений и разработать индивидуальные упражнения или особых приспособлений, которые могут понадобиться пациенту после завершения курса реабилитации.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии. Реабилитация представляет собой неотъемлемую часть лечебного процесса у пациентов с диагностированными злокачественными новообразованиями.
Реабилитация включает в себя комплекс мероприятий, направленных на восстановление хорошего самочувствия и трудоспособности пациента (восстановительная реабилитация), повышение качества его жизни, социальную адаптацию и максимально возможное продление жизни с избавлением от боли (паллиативная реабилитация).
Правильно подобранный курс реабилитации позволит пациенту вернуться к полноценной жизни и/или продолжить программную терапию.
Курс реабилитационных мероприятий разрабатывается индивидуально - с учетом состояния пациента, его функциональных возможностей и мотивации. Такие методы, как физиотерапия, акупунктура, лечебная физкультура , способствуют заметному восстановлению двигательной активности и устранению наиболее распространенных нежелательных последствий терапии ЗНО.
Немаловажную роль играет и психологическая работа с пациентом и его родителями или ухаживающим за ним персоналом. Вне зависимости от результатов лечения, они могут чувствовать себя подавленно, потерять интерес к прежним увлечениям. пациенты, перенесшие удаление пораженных опухолью органов, практически всегда страдают из-за осознания изменений, произошедших с их телом. Особенно, если последствием операции стали рубцы или другие видимые эстетические дефекты. Родители и/или ухаживающий персонал психологически истощены уходом за близким человеком и страхом за его жизнь, потому также нуждаются в профессиональной помощи.
Крайне важным аспектом реабилитации, особенно после лечения, включающего хирургическое вмешательство и зачастую приводящего к инвалидизации, является помощь в адаптации пациентов к самостоятельной жизни. Важно оценить степень функциональных нарушений и разработать индивидуальные упражнения или особых приспособлений, которые могут понадобиться пациенту после завершения курса реабилитации.
Профилактика
• Всем пациентам, завершившим лечение по поводу СМТ рекомендовано диспансерное наблюдение у участкового педиатра и врача-детского онколога в установленные сроки - см табл. 13 [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий:
Таблица 13. Обследование пациентов с саркомой мягких тканей после окончания терапии.
1 при эмбриональной RMS I-II стадии достаточно 1 раз в год. После 5 лет наблюдения - необязательно.
2 при эмбриональной RMS I-II стадии сцинтиграфия необязательна.
3 Рентген левой кисти для определения костного возраста при особенностях.
4 Исследование крови на гормоны: Половые гормоны: (однократно или при патологическом состоянии в период полового созревания) ЛГ, ФСГ, пролактин, у мальчиков дополнительно тестостерон, у девочек эстрадиол (циклическая зависимость), при необходимости стимуляционный тест.
Гормоны щитовидной железы: (после лучевой терапии в области грудной клетки и/или шеи 1 раз в год) связанный Т3, свободный Т4, тиреотропный гормон.
5 После 10 лет наблюдения при отсутствие патологии 1 раз в 2 года, в противном случае дальше 1 раз в год.
1) Все пациенты с впервые выявленным объемным образованием любой локализации.
Показания к выписке пациента из медицинской организации:
1) окончание терапии по протоколу лечения.
2) достижение ремиссии по основному заболеванию.
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий:
Таблица 13. Обследование пациентов с саркомой мягких тканей после окончания терапии.
| 1 год | 2 год | 3 год | 4 год | 5 год | > 5 лет | |
| Клинический осмотр | 1 раз в 3 месяца | 1 раз в 3 месяца | 1 раз в 6 мес | 1 раз в год | 1 раз в год | 1 раз в год |
| ОАК | 1 раз в 3 месяца | 1 раз в 3 месяца | 1 раз в 6 мес | 1 раз в год | 1 раз в год | 1 раз в год |
| Б/х анализ крови | 1 раз в 3 месяца | 1 раз в 3 месяца | 1 раз в 6 мес | 1 раз в год | 1 раз в год | 1 раз в год |
| ОАМ | 1 раз в 3 месяца | 1 раз в 3 месяца | 1 раз в 6 мес | 1 раз в год | 1 раз в год | 1 раз в год |
| Клиренс по эндогенному креатинину | 1 раз в 6 месяцев | 1 раз в 6 месяцев | 1 раз в год | 1 раз в год | 1 раз в год | 1 раз в год |
| УЗИ органов брюшной полости | 1 раз в 3 месяца | 1 раз в 6 месяцев | 1 раз в год | 1 раз в год | 1 раз в год | 1 раз в год |
| КТ/МРТ с КУ пораженной области и лимфоузлов | 1 раз в 3 месяца | 1 раз в 3 месяца | 1 раз в 6 мес | 1 раз в год | 1 раз в год | По показаниям, max. 1 раз в год |
| Рентгенография органов грудной клетки (не проводить одновременно с КТ) | 1 раз в 3 месяца | 1 раз в 3 месяца | 1 раз в 6 мес | 1 раз в год | 1 раз в год | - |
| КТ органов грудной клетки1 | 1 раз в 6 месяцев | 1 раз в 6 месяцев | 1 раз в год | 1 раз в год | 1 раз в год | 1 раз в 2 года |
| Сцинтиграфия костей скелета | Рутинно не проводится (только по показаниям) | |||||
| ЭКГ/ЭХО-КГ | 1 раз в год | 1 раз в год | 1 раз в год | 1 раз в год | 1 раз в год | 1 раз в год5 |
| Аудиометрия | Ежегодно после терапии карбоплатином или контроль при патологии. | |||||
| Перцентили3 | 1 раз в год | 1 раз в год | 1 раз в год | 1 раз в год | 1 раз в год | 1 раз в год |
| Эндокринологическое обследование4 | При патологическом состоянии в период пубертата. | |||||
| Спермограмма | При особенностях в периоде полового созревания | |||||
1 при эмбриональной RMS I-II стадии достаточно 1 раз в год. После 5 лет наблюдения - необязательно.
2 при эмбриональной RMS I-II стадии сцинтиграфия необязательна.
3 Рентген левой кисти для определения костного возраста при особенностях.
4 Исследование крови на гормоны: Половые гормоны: (однократно или при патологическом состоянии в период полового созревания) ЛГ, ФСГ, пролактин, у мальчиков дополнительно тестостерон, у девочек эстрадиол (циклическая зависимость), при необходимости стимуляционный тест.
Гормоны щитовидной железы: (после лучевой терапии в области грудной клетки и/или шеи 1 раз в год) связанный Т3, свободный Т4, тиреотропный гормон.
5 После 10 лет наблюдения при отсутствие патологии 1 раз в 2 года, в противном случае дальше 1 раз в год.
Организация медицинской помощи.
Показания для госпитализации в медицинскую организацию:1) Все пациенты с впервые выявленным объемным образованием любой локализации.
Показания к выписке пациента из медицинской организации:
1) окончание терапии по протоколу лечения.
2) достижение ремиссии по основному заболеванию.
Дополнительно
6,1 Критерии начала курса химиотерапии.
Критериями начала курса ПХТ являются:- удовлетворительное общее состояние,.
- отсутствие тяжелой инфекции,.
- отсутствие органной токсичности тяжелой степени,.
- отсутствие изменений при проведении ЭхоКГ перед курсами с включением доксорубицина (снижение фракции выброса),.
- отсутствие нарушений тубулярной функции почек перед курсами с включением ифосфамида (оценка тубулярной функции по уровню реабсорбции фосфатов).
- достаточные показатели гемограммы.
Лейкоциты better 2000/мкл,.
И/или Гранулоциты better 500/мкл,.
Тромбоциты better 100,000/мкл.
В зависимости от возраста и массы тела пациента проводится коррекция доз химиопрепаратов (таблица 14).
Таблица 14. Коррекция доз препаратов в зависимости от возраста и массы тела пациента.
| Возраст | Масса тела | Расчет доз препаратов | Дополнительная редукция доз | Комментарии |
| < 3 мес | Любая | кг | 1/3 редукции | Не вводится ифосфамид и антрациклины Рекомендуемые режимы VA или VAC (доза циклофосфамида 20 мг/кг) |
| 3-6 мес | Любой | кг | 1/3 редукции в первом курсе, при хорошей переносимости со второго курса без дополнительной редукции | Курсы VA, I2VA, VAIA (в зависимости от группы риска) |
| 6-12 мес ИЛИ ≤ 10 кг | кг | нет | Курсы VA, I2VA, VAIA (в зависимости от группы риска) | |
| > 12 мес И better 10 кг | м2 | нет | В случае возраста better 12 мес, но веса worse 10 кг расчет доз на кг массы тела Курсы VA, I2VA, VAIA (в зависимости от группы риска) | |
6,2 Основы хирургического лечения СМТ.
Основная цель проведения хирургического лечения является радикальное удаление опухоли без макро- и микроскопически определяемой остаточной опухоли без проведения калечащих операций [20,21,26]. Последний пункт является крайней важным, поскольку если радикальная операция требует проведения калечащего хирургического вмешательства, то предпочтение отдается неоадъювантной химиотерапии. У пациентов с рабдомиосаркомоподобными саркомами мягких тканей желательно избегать инициальной операции с наличием микроскопически определяемой остаточной опухоли (R1). Это позволяет проводить оценку ответа на 3 курса химиотерапии на 9 неделе лечения и является дополнительным фактором, позволяющим стратифицировать пациентов для проведения локального контроля опухоли (лучевая терапия, отсроченная операция, вид послеоперационной химиотерапии).Классификация хирургических вмешательств при СМТ в зависимости от объема резекции:
R 0. Радикальное удаление опухоли, без микроскопически и макроскопически остаточной опухоли.
R1 - краевая резекция, микроскопически остаточная опухоль.
R2 - неполное удаление опухоли, макроскопически остаточная опухоль.
6,3 Основы лучевой терапии при СМТ.
Лучевая терапия проводится с 9-12 неделю терапии. Перенос терапии на более ранний срок возможен в исключительных случаях, например, при компрессии опухолью спинного мозга или поражении черепно-мозговых нервов параменингеально расположенной опухолью, в случае прогрессирования на фоне проведения химиотерапии [20,21].Необходимо подчеркнуть, что при одновременном проведении химиотерапии на фоне курса лучевой терапии следует избегать использования доксорубицина** и дактиномицина в виду того, данные препараты являются радиосенсибилизаторами и могут усиливать побочные эффекты лучевой терапии. Возможно введение доксорубицина** и дактиномицина за две недели до и через две недели после облучения, однако, эта общая рекомендация должна быть адаптирована, например, в зависимости от местоположения опухоли. Пропущенная доза дактиномицина позже не вводится. Если пришлось пропустить введение доксорубицина**, следует заменить дактиномицин на доксорубицин** в последнем курсе IVA. Параллельное применение ЛТ и доксорубицина** может рассматриваться в следующих случаях: терапия опухолей конечностей или в поле облучения не входят слизистые оболочки.
Кроме того, химиотерапия откладывается при вовлечении в поле облучения печени из-за возможности развития веноокклюзионной болезни печени.
Необходимо помнить, о том, что у детей первого года жизни следует избегать проведения лучевой терапии, из-за возможности развития тяжелых отдаленных осложнений данного вида терапии.
Облучение регионарных лимфатических узлов в случае их поражения проводится по тем же принципам, как и лучевая терапия для первичной опухоли ( см приложение А3,6, таблица 36).
При расчете объема облучения ориентируются на распространенность опухоли до начала терапии (GTV) с отступом на безопасный край (CTV) 1 см (при локализации опухоли на конечности - 2 см вдоль оси конечности). Отступы на погрешности укладки (PTV) должны соответствовать стандартам клиники (обычно для грудной клетки, живота и таза- 1 для головы и шеи 0,5-1 см).
А) Показания к проведению лучевой терапии у пациентов в возрасте 3 года и старше с рабдомиосаркомой.
Назначаемая доза облучения зависит от возраста, гистологии опухоли, ее ответа на лечение и клинической группы IRS ( см приложение А3,6, таблица 36).
Вагинальная локализация опухоли и эмбриональная гистология (эРМС): лучевая терапия не применяется, если после окончания химиотерапии достигнута полная ремиссия. У пациентов без полной ремиссии можно рассмотреть возможность применения брахитерапии.
Орбитальная локализация опухоли: решение в пользу или не в пользу проведения ЛТ у пациентов с эмбриональной РМС группы IRS II или III принимается индивидуально. В этой ситуации у пациентов, получающих лучевую терапию, снижается риск локального рецидива и повышается бессобытийная выживаемость, однако возможны побочные эффекты облучения, такие как катаракта, ухудшение зрения и костная гипоплазия. У пациентов, не получающих ЛТ, более высокий риск локального рецидива и более низкая бессобытийная выживаемость. При этом связанных с облучением побочных эффектов у них нет. Общая выживаемость при обоих подходах одинакова ввиду характера рецидивов (почти исключительно локорегионарных). Поэтому решение о проведении или непроведении лучевой терапии остается на усмотрение лечащего врача, который обсуждает этот вопрос с пациентом и его родителями.
Пациенты в частичной ремиссии (сокращение опухоли более чем на 66%) получают 45 Гр вместо 50,4 Гр.
Б) Показания к проведению лучевой терапии у пациентов в возрасте 3 года и старше с рабдомиосаркомоподобными саркомами мягких тканей.
Пациенты с первичной резекцией R0 (группа IRS I) не нуждаются в облучении. Паценты с опухолями из группы IRS II или III и пациенты с поражением лимфоузлов должны получать облучение в дозах 50,4 или 54 Гр с разделением соответственно на 28 или 30 фракций (конвенциональное фракционирование). В случае прогрессии заболевания или плохого ответа допускается бустерное облучение в дозе 5,4 Гр (конвенциональное фракционирование), если оно возможно с точки зрения риска для органов, возраста ( см приложение А3 - раздел А3,6, таблица 37).
В) Показания к проведению лучевой терапии у пациентов в возрасте 3 года и старше с нерабдомиосаркомоподобными саркомами мягких тканей.
Пациенты с нерабдомиосаркомоподобными саркомами мягких тканей получают облучение согласно общим рекомендациям для прочих рабдомиосаркомоподобных СМТ. Только пациенты с опухолями ≤ 5 см и первичной резекцией R0 (группа низкого риска) не нуждаются в облучении. Все пациенты из групп стандартного и высокого риска должны получать ЛТ. Предоперационная лучевая терапия рекомендуется для пациентов с хорошим/полным ответом на химиотерапию (сокращение объема опухоли better 66% к неделе 9), чтобы индуцировать еще более значимый регресс опухоли перед операцией.
Доза для всех пациентов составляет 50,4-54,0 Гр с разделением на 28-30 фракций (конвенциональное фракционирование).
Г) Показания к проведению лучевой терапии у пациентов в возрасте 3 года и старше с инициальными метастазами ( IRS IV ).
Решение об облучении метастазов необходимо принимать, основываясь на междисциплинарной концепции лечения и следуя правилам, принятым для облучения первичной опухоли. Дозы облучения адаптируются в зависимости от гистологии опухоли и конкретной ситуации с тем или иным пациентом. Метастазы, образующие группы, нужно включать в объединенный объем мишени.
Д) Лучевая терапия на вовлеченные регионарные лимфатические узлы.
Лучевая терапия регионарных лимфоузлов производится только в случае четких клинических, радиологических или патоморфологических признаков поражения лимфатических узлов. Риск поражения лимфоузлов у пациентов с эмбриональной РМС очень низок ( см приложение А3,6, таблица 38). Он выше у пациентов с альвеолярной РМС и некоторыми нерабдомиосаркомоподобными СМТ.
Облучение локализации вовлеченных лимфатических узлов производится независимо от гистологии и ответа на химиотерапию. У пациентов с изначальными четкими радиологическими и/или патоморфологическими признаками поражения лимфоузлов используется доза облучения 41,4 Гр для РМС и 50,4 Гр для рабдомиосаркомоподобными саркомами мягких тканей и нерабдомиосаркомоподобными саркомами мягких тканей. Дополнительное бустерное облучение в дозе 9 Гр используется только при лечении пациентов с рабдомиосаркомой и лимфоузлами, все еще увеличенными после химиотерапии к началу лучевой терапии.Нельзя проводить облучение лимфатических узлов после радикального иссечения лимфоузлов.
Е) Адаптация лучевой терапии в зависимости от возраста.
Возраст ≤ 1 года.
Индивидуальное решение проводить или не проводить ЛТ принимается в зависимости от гистологии опухоли, ее местоположения и размера, ответа на химиотерапию, степени предшествующих резекций и возможностей вторичной резекции.
Возраст better 1 и worse 3 лет на момент начала проведения лучевой терапии.
Эмбриональная рабдомиосаркома:
Лучевая терапия проводится только при наличии резидуальной болезни в конце химиотерапии. Следует рассмотреть возможность применения специальных методов для минимизации дозы, получаемой нормальными тканями (IMRT, протонная терапия, IGRT, томотерапия, кибер-нож).
Исключение: При параменингальных опухолях всегда используется лучевая терапия, даже когда после химиотерапии достигнута полная клиническая ремиссия. По возможности следует отложить ЛТ до окончания химиотерапии. Доза облучения используется та же, что и для более старших пациентов. В зависимости от размера и местоположения опухоли это может привести к неприемлемой токсичности. В таких особых случаях доза может быть сокращена, однако решение индивидуально.
Альвеолярная рабдомиосаркома:
Группа IRS I - ЛТ не проводится.
Группы IRS II и III - ЛТ согласно рекомендациям для более старших пациентов (сокращение дозы следует обсудить с экспертами по лучевой терапии). Можно использовать меньшие фракции, особенно при облучении больших объемов (ЛТ всей брюшной полости, краниоспинальная ЛТ) - 1,5 или 1,6 Гр.
Другие рабдомиосаркомоподобные СМТ и нерабдомиосаркомоподобные СМТ:
Группа IRS I - ЛТ не проводится.
Группа IRS II - ЛТ согласно рекомендациям для более старших пациентов (сокращение дозы следует обсудить с экспертами по лучевой терапии). Можно использовать меньшие фракции, особенно при облучении больших объемов - 1,5 или 1,6 Гр.
Группа IRS III - Вторичная полная резекция. Без дополнительной ЛТ. Вторичная резекция невозможна или неполная: ЛТ согласно рекомендациям для более старших пациентов (сокращение дозы следует обсудить с экспертным центром). Можно использовать меньшие фракции, особенно при облучении больших объемов, - 1,5 или 1,6 Гр.
6,4 Оценка ответа на терапию.
При РМС оценка ответа проводится на 9 неделе после завершения первых трех курсов терапии. При недостаточном объеме сокращения опухоли (объем сокращения опухоли менее 33%) решается вопрос о химиотерапии второй линии (таблица 12).При РМС-подобных СМТ и нерабдомиосаркомных СМТ оценка ответа проводится на 9 неделе после завершения первых трех курсов. При недостаточном объеме сокращения опухоли (объем сокращения опухоли менее 33%) решается вопрос о проведении хирургического этапа лечения, включая возможную калечащую операцию или химиотерапии второй линии (таблица 15).
Таблица 15. Критерии оценки ответа на проводимую терапию.
| Ответ | Критерии |
| Полный ответ | Полное исчезновение всех видимых признаков опухоли |
| Очень хороший частичный ответ | > 90% уменьшение объема опухоли или сохранение неясных остаточных образований при визуализации |
| Частичный ответ | > 66% уменьшение объема опухоли |
| Незначительный частичный ответ | < 66%, но better 33% уменьшение объема опухоли |
| Стабилизация | < 33% уменьшение объема опухоли |
| Прогрессирование | ≥ 33% увеличение объема опухоли или появление новых очагов |
|
|
Критерии оценки качества медицинской помощи
| № | Критерии качества | Оценка выполнения |
| 1 | Пациенту с подозрением на СМТ или с выявленной СМТ при первичном приеме, а также при каждом приеме у врача-детского онколога, перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении выполнены визуальный осмотр пациента терапевтический, пальпация терапевтическая, аускультация терапевтическая | Да/Нет |
| 2 | Пациенту с подозрением на СМТ или с выявленной СМТ при первичном приеме, а также при каждом приеме у врача-детского онколога, перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении выполнен общий (клинический) анализ крови развернутый | Да/Нет |
| 3 | Пациенту с подозрением на СМТ или с выявленной СМТ при первичном приеме, а также при каждом приеме у врача-детского онколога, перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении выполнен анализ крови биохимический общетерапевтический с включением следующих параметров: ЛДГ, АЛТ, АСТ, ГГТ, билирубин, щелочная фосфатаза, общий белок, альбумин, креатинин, мочевина, мочевая кислота калий, натрий, хлор, кальций | Да/Нет |
| 4 | Пациенту с подозрением на СМТ или с выявленной СМТ при первичном приеме, а также при каждом приеме у врача-детского онколога, перед каждым последующим курсом химиотерапии, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении выполнен общий (клинический) анализ мочи | Да/Нет |
| 5 | Пациенту с подозрением на СМТ либо при подозрении на рецидив заболевания выполнена биопсия опухолевого образования с последующим патолого-анатомическим исследованием биопсийного (операционного) материала (ткани первичной опухоли и/или метастатического очага) | Да/Нет |
| 6 | Пациенту с подозрением на СМТ или с выявленной СМТ при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания выполнена магнитно-резонансная томография (МРТ) с контрастированием пораженной области | Да/Нет |
| 7 | Пациенту с подозрением на СМТ или с выявленной СМТ при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания выполнена рентгенография пораженной области в 2-х проекциях | Да/Нет |
| 8 | Пациенту с подозрением на СМТ или с выявленной СМТ при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания выполнены компьютерная томография органов грудной клетки (КТ ОГК) с внутривенным контрастированием и рентгенография органов грудной клетки | Да/Нет |
| 9 | Пациенту с подозрением на СМТ или с выявленной СМТ при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания выполнено ультразвуковое исследование лимфатических узлов, органов брюшной полости (комплексное), почек | Да/Нет |
| 10 | Пациенту с подозрением на СМТ или с выявленной СМТ при первичном обследовании, при оценке ответа на проведенную терапию в процессе лечения и в динамическом наблюдении, а также при подозрении на рецидив заболевания выполнена сцинтиграфия костей всего тела | Да/Нет |
| 11 | Пациенту с подозрением на СМТ или выявленной СМТ при первичном обследовании, после окончания лечения перед снятием с терапии выполнена пункция костного мозга с последующим цитологическим исследованием мазка костного мозга (миелограмма) | Да/Нет |
| 12 | Пациенту с выявленной СМТ параменингеальной локализации при первичном обследовании выполнена спинномозговая пункция с последующим цитологическим исследованием спинномозговой жидкости на наличие атипичных клеток | Да/Нет |
| 13 | Пациенту с верифицированной РМС или рабдомиосаркомоподобной СМТ до начала специфической терапии проведены анализ факторов риска и стратификация по группам риска | Да/Нет |
Список литературы
1. Miller R.W., Young J.L., Novakovic в. сhildhood cancer // сancer. John Wiley & Sons, Ltd, 1995. Vol. 75, № S1. P. 395-405.
2. Doyle L.A. Sarcoma classification: An update based on the 2013 World Health Organization сlassification of Tumors of Soft Tissue and вone // сancer. John Wiley and Sons Inc., 2014. Vol. 120, № 12. P. 1763-1774.
3. Gurney J.G., Young J.L., Roffers S.D. Soft tissue sarcomas // сancer Incidence and Survival among сhildren and Adolescents: United States SEER Program 1975-1995, National сancer Institute, SEER Program. 1999. P. 111-124.
4. Stiller с.A., Parkint D.M. International variations in the incidence of childhood soft‐tissue sarcomas // Paediatr. Perinat. Epidemiol. Paediatr Perinat Epidemiol, 1994. Vol. 8, № 1. P. 107-119.
5. Weihkopf T. et al. Incidence and time trends of soft tissue sarcomas in German children 1985-2004 - A report from the population-based German сhildhood сancer Registry // Eur. J. сancer. Eur J сancer, 2008. Vol. 44, № 3. P. 432-440.
6. Pastore G. et al. сhildhood soft tissue sarcomas incidence and survival in European children (1978-1997): Report from the Automated сhildhood сancer Information System project // Eur. J. сancer. Elsevier Ltd, 2006. Vol. 42, № 13. P. 2136-2149.
7. Koscielniak E., Klingebiel T. сWS-guidance for risk adapted treatment of soft tissue sarcoma (STS) and soft tissue tumours in children, adolescents, and young adults [Electronic resource]. URL: https://www.kinderkrebsinfo.de/health_professionals/clinical_trials/pohkinderkrebsinfotherapiestudien/cws_guidance/index_eng.html.
8. Детская онкология. Национальное руководство. Под ред. М.Д. Алиева, В.Г. Полякова, Г.Л. Менткевича, С.А. Маяковой. М. Издательская группа РОНЦ. Практическая медицина, 2012. 684 p.
9. Туктабаева Р.Р. et al. Клинический протокол диагностики и лечения саркомы мягких тканей (рабдомиосаркома и нерабдомиосаркома). 2016. P. 117.
10. Schiavetti A. et al. Long-term renal function and hypertension in adult survivors of childhood sarcoma: Single center experience // Pediatric Hematology and Oncology. Taylor and Francis Ltd, 2018. Vol. 35, № 3. P. 167-176.
11. вrecelj J., Stirn-Kranjc в., krbec M. Visual electrophysiology in children with tumours affecting the visual pathway: сase reports // Doc. Ophthalmol. Springer, 2000. Vol. 101, № 2. P. 125-154.
12. Nitz A. et al. Prospective evaluation of cisplatin- and carboplatin-mediated ototoxicity in paediatric and adult soft tissue and osteosarcoma patients // Oncol. Lett. Oncol Lett, 2012. Vol. 5, № 1. P. 311-315.
13. Rodeberg D.A. et al. Prognostic significance and tumor biology of regional lymph node disease in patients with rhabdomyosarcoma: A report from the children’s oncology group // J. сlin. Oncol. J сlin Oncol, 2011. Vol. 29, № 10. P. 1304-1311.
14. Быстрова О.В. et al. Способы восстановления фертильности у онкологических больных // Практическая онкология. 2009. Vol. 10, № 4. P. 245-253.
15. Williamson D. et al. Fusion gene-negative alveolar rhabdomyosarcoma is clinically and molecularly indistinguishable from embryonal rhabdomyosarcoma // J. сlin. Oncol. J сlin Oncol, 2010. Vol. 28, № 13. P. 2151-2158.
16. Саркомы мягких тканей // Стандарты оказания специализированной помощи детям и подросткам с гематологическими и онкологическими заболеваниями. Медпрактика-М, Москва, 2009. P. 462-482.
17. вorinstein S.C. et al. сonsensus and controversies regarding the treatment of rhabdomyosarcoma // Pediatric вlood and сancer. John Wiley and Sons Inc., 2018. Vol. 65, № 2.
18. Stevens M.C.G. Treatment for childhood rhabdomyosarcoma: The cost of cure // Lancet Oncology. Lancet Oncol, 2005. Vol. 6, № 2. P. 77-84.
19. вreneman J.C. et al. Prognostic factors and clinical outcomes in children and adolescents with metastatic rhabdomyosarcoma-a report from the intergroup rhabdomyosarcoma study IV // J. сlin. Oncol. American Society of сlinical Oncology, 2003. Vol. 21, № 1. P. 78-84.
20. Puri D.R. et al. The challenging role of radiation therapy for very young children with rhabdomyosarcoma // Int. J. Radiat. Oncol. вiol. Phys. Int J Radiat Oncol вiol Phys, 2006. Vol. 65, № 4. P. 1177-1184.
21. Rodeberg D.A. et al. Surgical principles for children/adolescents with newly diagnosed rhabdomyosarcoma: A report from the Soft Tissue Sarcoma сommittee of the сhildren’s Oncology Group // Sarcoma. Hindawi Limited, 2002. Vol. 6, № 4. P. 111-122.
22. Dantonello T.M. et al. сooperative trial сWS-91 for localized soft tissue sarcoma in children, adolescents, and young adults. J. сlin. Oncol. American Society of сlinical Oncology, 2009. Vol. 27, № 9. P. 1446-1455.
23. Koscielniak E. et al. Results of treatment for soft tissue sarcoma in childhood and adolescence: A final report of the German cooperative soft tissue sarcoma study сWS-86 // J. сlin. Oncol. American Society of сlinical Oncology, 1999. Vol. 17, № 12. P. 3706-3719.
24. вisogno G. et al. The IVADo regimen - A pilot study with ifosfamide, vincristine, actinomycin D, and doxorubicin in children with metastatic soft tissue sarcoma: A pilot study on behalf of the European pediatric soft tissue sarcoma study group // сancer. сancer, 2005. Vol. 103, № 8. P. 1719-1724.
25. Minard-Colin V. et al. Phase II study of vinorelbine and continuous low doses cyclophosphamide in children and young adults with a relapsed or refractory malignant solid tumour: Good tolerance profile and efficacy in rhabdomyosarcoma - A report from the Société Française des сancers et leucémies de l’Enfant et de l’adolescent (SFCE) // Eur. J. сancer. Eur J сancer, 2012. Vol. 48, № 15. P. 2409-2416.
26. вreneman J. et al. Local control with reduced-dose radiotherapy for low-risk rhabdomyosarcoma: A report from the сhildren’S Oncology Group D9602 study // Int. J. Radiat. Oncol. вiol. Phys. Int J Radiat Oncol вiol Phys, 2012. Vol. 83, № 2. P. 720-726.
27. сhisholm J.C. et al. Open-label, multicentre, randomised, phase II study of the EpSSG and the ITCC evaluating the addition of bevacizumab to chemotherapy in childhood and adolescent patients with metastatic soft tissue sarcoma (the вERNIE study) // Eur. J. сancer. Elsevier Ltd, 2017. Vol. 83. P. 177-184.
28. Klingebiel T. et al. Treatment of children with metastatic soft tissue sarcoma with oral maintenance compared to high dose chemotherapy: Report of the HD сWS-96 trial // Pediatr. вlood сancer. Pediatr вlood сancer, 2008. Vol. 50, № 4. P. 739-745.
29. Klingebiel T. et al. Treatment of сhildren With Relapsed Soft Tissue Sarcoma: Report of the German сESS/CWS REZ 91 Trial // Med. Pediatr. Oncol. Med Pediatr Oncol, 1998. Vol. 30, № 5.
30. Koscielniak E., Klingebiel T. сWS-guidance for risk adapted treatment of soft tissue sarcoma and soft tissue tumours in children, adolescents, and young adults [Electronic resource]. 2009. P. 252. URL: http://www.fnkc.ru/docs/CWS-2009.pdf.
31. вisogno G. et al. Vinorelbine and continuous low-dose cyclophosphamide as maintenance chemotherapy in patients with high-risk rhabdomyosarcoma (RMS 2005): a multicentre, open-label, randomised, phase 3 trial // Lancet Oncol. Lancet Publishing Group, 2019. Vol. 20, № 11. P. 1566-1575.
32. August D.A., Huhmann M.B. A.S.P.E.N. сlinical guidelines: Nutrition support therapy during adult anticancer treatment and in hematopoietic cell transplantation // Journal of Parenteral and Enteral Nutrition. JPEN J Parenter Enteral Nutr, 2009. Vol. 33, № 5. P. 472-500.
33. Васильева Е.С., Вашура А.Ю., Литвинов Д.В. Нутритивный статус детей с онкологическими и гематологическими заболеваниями, находящихся на лечении в ФГБУ «ФНКЦ ДГОИ им. Дмитрия Рогачева» (результаты скринингового исследования) // Современная онкология. 2016. Vol. 18, № 4. P. 48-52.
34. Isenring E., Elia M. Which screening method is appropriate for older cancer patients at risk for malnutrition. Nutrition. Elsevier Inc., 2015. Vol. 31, № 4. P. 594-597.
35. Martin L. et al. Diagnostic criteria for the classification of cancer-associated weight loss // J. сlin. Oncol. American Society of сlinical Oncology, 2015. Vol. 33, № 1. P. 90-99.
36. Manary M.J., Sandige H.L. Management of acute moderate and severe childhood malnutrition // вMJ. вMJ, 2008. Vol. 337, № 7680. P. 1227-1230.
37. van den вroeck J., Eeckels R., Massa G. Validity of Single-Weight Measurements to Predict сurrent Malnutrition and Mortality in сhildren // J. Nutr. 1996. Vol. 126, № 1. P. 113-120.
38. Meijers J.M.M. et al. Nutritional care; do process and structure indicators influence malnutrition prevalence over time. // сlin. Nutr. сhurchill Livingstone, 2014. Vol. 33, № 3. P. 459-465.
39. Muscaritoli M. et al. сonsensus definition of sarcopenia, cachexia and pre-cachexia: Joint document elaborated by Special Interest Groups (SIG) cachexia-anorexia in chronic wasting diseases and nutrition in geriatrics // сlin. Nutr. сlin Nutr, 2010. Vol. 29, № 2. P. 154-159.
40. Kondrup J. et al. ESPEN guidelines for nutrition screening 2002 // сlin. Nutr. сhurchill Livingstone, 2003. Vol. 22, № 4. P. 415-421.
41. Joosten K.F.M., Kerklaan D., Verbruggen S.C.A.T. Nutritional support and the role of the stress response in critically ill children // сurrent Opinion in сlinical Nutrition and Metabolic сare. Lippincott Williams and Wilkins, 2016. Vol. 19, № 3. P. 226-233.
42. Arends J. et al. ESPEN guidelines on nutrition in cancer patients // сlin. Nutr. сhurchill Livingstone, 2017. Vol. 36, № 1. P. 11-48.
43. Koletzko в. et al. Guidelines on Paediatric Parenteral Nutrition of the European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) and the European Society for сlinical Nutrition and Metabolism (ESPEN), Supported by the European Society of Paediatri // Journal of Pediatric Gastroenterology and Nutrition. J Pediatr Gastroenterol Nutr, 2005. Vol. 41, № SUPPL. 2. 87 p.
44. Tanner L. et al. сancer Rehabilitation in the Pediatric and Adolescent/Young Adult Population // Seminars in Oncology Nursing. Elsevier Inc, 2020. Vol. 36, № 1. P. 150984.
45. Karnofsky D.A., вurchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. Evaluation of chemotherapeutic agents. / ed. MacLeod с. New York: сolumbia University Press, 1949. P. 191-205.
46. Oken M.M. et al. Toxicity and response criteria of the Eastern сooperative Oncology Group // Am. J. сlin. Oncol. 1982. Vol. 5, № 6. P. 649-655.
2. Doyle L.A. Sarcoma classification: An update based on the 2013 World Health Organization сlassification of Tumors of Soft Tissue and вone // сancer. John Wiley and Sons Inc., 2014. Vol. 120, № 12. P. 1763-1774.
3. Gurney J.G., Young J.L., Roffers S.D. Soft tissue sarcomas // сancer Incidence and Survival among сhildren and Adolescents: United States SEER Program 1975-1995, National сancer Institute, SEER Program. 1999. P. 111-124.
4. Stiller с.A., Parkint D.M. International variations in the incidence of childhood soft‐tissue sarcomas // Paediatr. Perinat. Epidemiol. Paediatr Perinat Epidemiol, 1994. Vol. 8, № 1. P. 107-119.
5. Weihkopf T. et al. Incidence and time trends of soft tissue sarcomas in German children 1985-2004 - A report from the population-based German сhildhood сancer Registry // Eur. J. сancer. Eur J сancer, 2008. Vol. 44, № 3. P. 432-440.
6. Pastore G. et al. сhildhood soft tissue sarcomas incidence and survival in European children (1978-1997): Report from the Automated сhildhood сancer Information System project // Eur. J. сancer. Elsevier Ltd, 2006. Vol. 42, № 13. P. 2136-2149.
7. Koscielniak E., Klingebiel T. сWS-guidance for risk adapted treatment of soft tissue sarcoma (STS) and soft tissue tumours in children, adolescents, and young adults [Electronic resource]. URL: https://www.kinderkrebsinfo.de/health_professionals/clinical_trials/pohkinderkrebsinfotherapiestudien/cws_guidance/index_eng.html.
8. Детская онкология. Национальное руководство. Под ред. М.Д. Алиева, В.Г. Полякова, Г.Л. Менткевича, С.А. Маяковой. М. Издательская группа РОНЦ. Практическая медицина, 2012. 684 p.
9. Туктабаева Р.Р. et al. Клинический протокол диагностики и лечения саркомы мягких тканей (рабдомиосаркома и нерабдомиосаркома). 2016. P. 117.
10. Schiavetti A. et al. Long-term renal function and hypertension in adult survivors of childhood sarcoma: Single center experience // Pediatric Hematology and Oncology. Taylor and Francis Ltd, 2018. Vol. 35, № 3. P. 167-176.
11. вrecelj J., Stirn-Kranjc в., krbec M. Visual electrophysiology in children with tumours affecting the visual pathway: сase reports // Doc. Ophthalmol. Springer, 2000. Vol. 101, № 2. P. 125-154.
12. Nitz A. et al. Prospective evaluation of cisplatin- and carboplatin-mediated ototoxicity in paediatric and adult soft tissue and osteosarcoma patients // Oncol. Lett. Oncol Lett, 2012. Vol. 5, № 1. P. 311-315.
13. Rodeberg D.A. et al. Prognostic significance and tumor biology of regional lymph node disease in patients with rhabdomyosarcoma: A report from the children’s oncology group // J. сlin. Oncol. J сlin Oncol, 2011. Vol. 29, № 10. P. 1304-1311.
14. Быстрова О.В. et al. Способы восстановления фертильности у онкологических больных // Практическая онкология. 2009. Vol. 10, № 4. P. 245-253.
15. Williamson D. et al. Fusion gene-negative alveolar rhabdomyosarcoma is clinically and molecularly indistinguishable from embryonal rhabdomyosarcoma // J. сlin. Oncol. J сlin Oncol, 2010. Vol. 28, № 13. P. 2151-2158.
16. Саркомы мягких тканей // Стандарты оказания специализированной помощи детям и подросткам с гематологическими и онкологическими заболеваниями. Медпрактика-М, Москва, 2009. P. 462-482.
17. вorinstein S.C. et al. сonsensus and controversies regarding the treatment of rhabdomyosarcoma // Pediatric вlood and сancer. John Wiley and Sons Inc., 2018. Vol. 65, № 2.
18. Stevens M.C.G. Treatment for childhood rhabdomyosarcoma: The cost of cure // Lancet Oncology. Lancet Oncol, 2005. Vol. 6, № 2. P. 77-84.
19. вreneman J.C. et al. Prognostic factors and clinical outcomes in children and adolescents with metastatic rhabdomyosarcoma-a report from the intergroup rhabdomyosarcoma study IV // J. сlin. Oncol. American Society of сlinical Oncology, 2003. Vol. 21, № 1. P. 78-84.
20. Puri D.R. et al. The challenging role of radiation therapy for very young children with rhabdomyosarcoma // Int. J. Radiat. Oncol. вiol. Phys. Int J Radiat Oncol вiol Phys, 2006. Vol. 65, № 4. P. 1177-1184.
21. Rodeberg D.A. et al. Surgical principles for children/adolescents with newly diagnosed rhabdomyosarcoma: A report from the Soft Tissue Sarcoma сommittee of the сhildren’s Oncology Group // Sarcoma. Hindawi Limited, 2002. Vol. 6, № 4. P. 111-122.
22. Dantonello T.M. et al. сooperative trial сWS-91 for localized soft tissue sarcoma in children, adolescents, and young adults. J. сlin. Oncol. American Society of сlinical Oncology, 2009. Vol. 27, № 9. P. 1446-1455.
23. Koscielniak E. et al. Results of treatment for soft tissue sarcoma in childhood and adolescence: A final report of the German cooperative soft tissue sarcoma study сWS-86 // J. сlin. Oncol. American Society of сlinical Oncology, 1999. Vol. 17, № 12. P. 3706-3719.
24. вisogno G. et al. The IVADo regimen - A pilot study with ifosfamide, vincristine, actinomycin D, and doxorubicin in children with metastatic soft tissue sarcoma: A pilot study on behalf of the European pediatric soft tissue sarcoma study group // сancer. сancer, 2005. Vol. 103, № 8. P. 1719-1724.
25. Minard-Colin V. et al. Phase II study of vinorelbine and continuous low doses cyclophosphamide in children and young adults with a relapsed or refractory malignant solid tumour: Good tolerance profile and efficacy in rhabdomyosarcoma - A report from the Société Française des сancers et leucémies de l’Enfant et de l’adolescent (SFCE) // Eur. J. сancer. Eur J сancer, 2012. Vol. 48, № 15. P. 2409-2416.
26. вreneman J. et al. Local control with reduced-dose radiotherapy for low-risk rhabdomyosarcoma: A report from the сhildren’S Oncology Group D9602 study // Int. J. Radiat. Oncol. вiol. Phys. Int J Radiat Oncol вiol Phys, 2012. Vol. 83, № 2. P. 720-726.
27. сhisholm J.C. et al. Open-label, multicentre, randomised, phase II study of the EpSSG and the ITCC evaluating the addition of bevacizumab to chemotherapy in childhood and adolescent patients with metastatic soft tissue sarcoma (the вERNIE study) // Eur. J. сancer. Elsevier Ltd, 2017. Vol. 83. P. 177-184.
28. Klingebiel T. et al. Treatment of children with metastatic soft tissue sarcoma with oral maintenance compared to high dose chemotherapy: Report of the HD сWS-96 trial // Pediatr. вlood сancer. Pediatr вlood сancer, 2008. Vol. 50, № 4. P. 739-745.
29. Klingebiel T. et al. Treatment of сhildren With Relapsed Soft Tissue Sarcoma: Report of the German сESS/CWS REZ 91 Trial // Med. Pediatr. Oncol. Med Pediatr Oncol, 1998. Vol. 30, № 5.
30. Koscielniak E., Klingebiel T. сWS-guidance for risk adapted treatment of soft tissue sarcoma and soft tissue tumours in children, adolescents, and young adults [Electronic resource]. 2009. P. 252. URL: http://www.fnkc.ru/docs/CWS-2009.pdf.
31. вisogno G. et al. Vinorelbine and continuous low-dose cyclophosphamide as maintenance chemotherapy in patients with high-risk rhabdomyosarcoma (RMS 2005): a multicentre, open-label, randomised, phase 3 trial // Lancet Oncol. Lancet Publishing Group, 2019. Vol. 20, № 11. P. 1566-1575.
32. August D.A., Huhmann M.B. A.S.P.E.N. сlinical guidelines: Nutrition support therapy during adult anticancer treatment and in hematopoietic cell transplantation // Journal of Parenteral and Enteral Nutrition. JPEN J Parenter Enteral Nutr, 2009. Vol. 33, № 5. P. 472-500.
33. Васильева Е.С., Вашура А.Ю., Литвинов Д.В. Нутритивный статус детей с онкологическими и гематологическими заболеваниями, находящихся на лечении в ФГБУ «ФНКЦ ДГОИ им. Дмитрия Рогачева» (результаты скринингового исследования) // Современная онкология. 2016. Vol. 18, № 4. P. 48-52.
34. Isenring E., Elia M. Which screening method is appropriate for older cancer patients at risk for malnutrition. Nutrition. Elsevier Inc., 2015. Vol. 31, № 4. P. 594-597.
35. Martin L. et al. Diagnostic criteria for the classification of cancer-associated weight loss // J. сlin. Oncol. American Society of сlinical Oncology, 2015. Vol. 33, № 1. P. 90-99.
36. Manary M.J., Sandige H.L. Management of acute moderate and severe childhood malnutrition // вMJ. вMJ, 2008. Vol. 337, № 7680. P. 1227-1230.
37. van den вroeck J., Eeckels R., Massa G. Validity of Single-Weight Measurements to Predict сurrent Malnutrition and Mortality in сhildren // J. Nutr. 1996. Vol. 126, № 1. P. 113-120.
38. Meijers J.M.M. et al. Nutritional care; do process and structure indicators influence malnutrition prevalence over time. // сlin. Nutr. сhurchill Livingstone, 2014. Vol. 33, № 3. P. 459-465.
39. Muscaritoli M. et al. сonsensus definition of sarcopenia, cachexia and pre-cachexia: Joint document elaborated by Special Interest Groups (SIG) cachexia-anorexia in chronic wasting diseases and nutrition in geriatrics // сlin. Nutr. сlin Nutr, 2010. Vol. 29, № 2. P. 154-159.
40. Kondrup J. et al. ESPEN guidelines for nutrition screening 2002 // сlin. Nutr. сhurchill Livingstone, 2003. Vol. 22, № 4. P. 415-421.
41. Joosten K.F.M., Kerklaan D., Verbruggen S.C.A.T. Nutritional support and the role of the stress response in critically ill children // сurrent Opinion in сlinical Nutrition and Metabolic сare. Lippincott Williams and Wilkins, 2016. Vol. 19, № 3. P. 226-233.
42. Arends J. et al. ESPEN guidelines on nutrition in cancer patients // сlin. Nutr. сhurchill Livingstone, 2017. Vol. 36, № 1. P. 11-48.
43. Koletzko в. et al. Guidelines on Paediatric Parenteral Nutrition of the European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) and the European Society for сlinical Nutrition and Metabolism (ESPEN), Supported by the European Society of Paediatri // Journal of Pediatric Gastroenterology and Nutrition. J Pediatr Gastroenterol Nutr, 2005. Vol. 41, № SUPPL. 2. 87 p.
44. Tanner L. et al. сancer Rehabilitation in the Pediatric and Adolescent/Young Adult Population // Seminars in Oncology Nursing. Elsevier Inc, 2020. Vol. 36, № 1. P. 150984.
45. Karnofsky D.A., вurchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. Evaluation of chemotherapeutic agents. / ed. MacLeod с. New York: сolumbia University Press, 1949. P. 191-205.
46. Oken M.M. et al. Toxicity and response criteria of the Eastern сooperative Oncology Group // Am. J. сlin. Oncol. 1982. Vol. 5, № 6. P. 649-655.
|
|
Приложения
Приложение А1.
Состав рабочей группы.• Варфоломеева Светлана Рафаэлевна, профессор, доктор медицинских наук, заместитель директора по научной и лечебной работе - директор НИИ детской онкологии и гематологии аппарата управления ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Качанов Денис Юрьевич, доктор медицинских наук, заведующий отделением клинической онкологии, заместитель директора института онкологии, радиологии и ядерной медицины ФГБУ Национального медицинского исследовательского центра детской гематологии, онкологии и иммунологии им. Дмитрия Рогачёва Минздрава России.
• Поляков Владимир Георгиевич, доктор медицинских наук, профессор, академик РАМН, член-корреспондент РАМН, советник директора НИИ детской онкологии и гематологии аппарата управления ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Сергеева Татьяна Валерьевна, врач детский онколог отделения клинической онкологии ФГБУ Национального медицинского исследовательского центра детской гематологии, онкологии и иммунологии им. Дмитрия Рогачёва Минздрава России.
• Нечеснюк Алексей Владимирович, кандидат медицинских наук, заведующий отделением лучевой терапии ФГБУ Национального медицинского исследовательского центра детской гематологии, онкологии и иммунологии им. Дмитрия Рогачёва Минздрава России.
• Терещенко Галина Викторовна, кандидат медицинских наук, заведующая отделением лучевой диагностики ФГБУ Национального медицинского исследовательского центра детской гематологии, онкологии и иммунологии им. Дмитрия Рогачёва Минздрава России.
• Литвинов Дмитрий Витальевич, кандидат медицинских наук, главный врач ФГБУ Национального медицинского исследовательского центра детской гематологии, онкологии и иммунологии им. Дмитрия Рогачёва Минздрава России.
• Вашура Андрей Юрьевич, кандидат медицинских наук, зав. отделом научных основ питания и нутритивно-метаболической терапии.
Все члены рабочей группы являются членами Национального общества детских гематологов и онкологов (НОДГО).
Конфликт интересов отсутствует.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
1. Врачи - детские онкологи;
2. Студенты медицинских ВУЗов, ординаторы, аспиранты.
Методология сбора доказательств.
Методы, использованные для сбора / селекции доказательств: поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором >0,3.
Поиск в электронных базах данных.
Доказательной базой для рекомендаций являются публикации, вошедшие в Кокрейновскую библиотеку, базы данных PubMed и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
• обзоры опубликованных метаанализов;
• систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
• консенсус экспертов;
• оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. А1-А3).
В настоящих клинических рекомендациях приведены уровни достоверности доказательств и уровни убедительности рекомендаций в соответствии рекомендациями по разработке и актуализации клинических рекомендаций (приказ Минздрава России от 28,02,2019 г. 103н).
Т аблица 17. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 18Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| УДД | Расшифровка |
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в тч когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 19. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| УУР | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| в | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| с | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3.
Связанные документы.Приложение А3,1 Схемы терапии РМС.
Таблица 20. Схема терапии РМС, группа низкого риска, ПОДГРУППА А.Курс VA [16].| День | Дактиномицин | Винкристин |
| 1 | 1,5 мг/м2 (в/в струйно) | 1,5 мг/м2 (в/в струйно) |
| 8 | 1,5 мг/м2 (в/в струйно) | |
| 15 | 1,5 мг/м2 (в/в струйно) | |
| 22 | 1,5 мг/м2 (в/в струйно) | 1,5 мг/м2 (в/в струйно) |
| Суммарная доза препаратов за курс | 3 мг/м2 | 6 мг/м2 |
Таблица 21. Схема терапии РМС, группа стандартного риска, ПОДГРУППА В, С, D . Курс I 2 VA [16].
| День | Ифосфамид | Дактиномицин | Винкристин | Месна |
| 1 | 3000 мг/м2 (в/в за 3 часа) | 1,5 мг/м2 (в/в струйно) | 1,5 мг/м2 (в/в струйно) | 3000 мг/м2/сут |
| 2 | 3000 мг/м2 (в/в за 3 часа) | 3000 мг/м2/сут | ||
| 3 | 3000 мг/м2/сут | |||
| 8 | 1,5 мг/м2 (только в 1-2 курсах) | |||
| 15 | 1,5 мг/м2 (только в 1-2 курсах) | |||
| Суммарная доза препаратов за курс | 6000 мг/м2 | 1,5 мг/м2 | 4,5 мг/м2 (1-2 курс) 1,5 мг/м2 (3-9 курсы) |
Таблица 22Схема терапии РМС, группа стандартного риска, ПОДГРУППА В, СКурс VA [16].
| День | Дактиномицин | Винкристин |
| 1 (курс 5-7) | 1,5 мг/м2 (в/в струйно) | 1,5 мг/м2 (в/в струйно) |
| (8) только курсы 5, 6 | 1,5 мг/м2 (в/в струйно) | |
| (15) только курсы 5, 6 | 1,5 мг/м2 (в/в струйно) | |
| (22) только курсы 5, 6 | 1,5 мг/м2 (в/в струйно) | 1,5 мг/м2 (в/в струйно) |
| Суммарная доза препаратов за курс | 3 мг/м2 (курсы 5,6) 1,5 мг/м2 (курс 7) | 6 мг/м2 (курсы 5, 6) 1,5 мг/м2 (курс 7) |
Таблица 23. Схема терапии РМС, группа высокого риска, ПОДГРУППА E , F , G . Курс I 2 VA.
| День | Ифосфамид | Дактиномицин | Винкристин | Месна |
| 1 | 3000 мг/м2 (в/в за 3 часа) | 1,5 мг/м2 (в/в струйно) | 1,5 мг/м2 (в/в струйно) | 3000 мг/м2/сут |
| 2 | 3000 мг/м2 (в/в за 3 часа) | 3000 мг/м2/сут | ||
| 3 | 3000 мг/м2/сут | |||
| 8 | 1,5 мг/м2 (только в 1-2 курсах) | |||
| 15 | 1,5 мг/м2 (только в 1-2 курсах) | |||
| Суммарная доза препаратов за курс | 6000 мг/м2 | 1,5 мг/м2 | 4,5 мг/м2 (1-2 курс) 1,5 мг/м2 (3-9 курсы) |
Таблица 24. Схема терапии РМС, группа очень высокого риска, ПОДГРУППА Н. Курс I 2 VA [16].
| День | Ифосфамид | Дактиномицин | Винкристин | Месна |
| 1 | 3000 мг/м2 (в/в за 3 часа) | 1,5 мг/м2 (в/в струйно) | 1,5 мг/м2 (в/в струйно) | 3000 мг/м2/сут |
| 2 | 3000 мг/м2 (в/в за 3 часа) | 3000 мг/м2/сут | ||
| 3 | 3000 мг/м2/сут | |||
| 8 | 1,5 мг/м2 (только курс 2) | |||
| 15 | 1,5 мг/м2 (только курс 2) | |||
| Суммарная доза препаратов за курс | 6000 мг/м2 | 1,5 мг/м2 | 4,5 мг/м2 (курс 2) 1,5 мг/м2 (курсы 5,7, 8, 9) |
Таблица 25. Схема терапии РМС, группа очень высокого риска, ПОДГРУППА Н. Курс I 2 VAd [16].
| День | Ифосфамид | Доксорубицин | Винкристин | Месна |
| 1 | 3000 мг/м2 (в/в за 3 часа) | 2 х 20 мг/м2 (в/в за 3 часа) | 1,5 мг/м2 (в/в струйно) | 3000 мг/м2/сут |
| 2 | 3000 мг/м2 (в/в за 3 часа) | 2 х 20 мг/м2 (в/в за 3 часа) | 3000 мг/м2/сут | |
| 3 | 3000 мг/м2/сут | |||
| 8 | 1,5 мг/м2 (только курс 1) | |||
| 15 | 1,5 мг/м2 (только курс 1) | |||
| Суммарная доза препаратов за курс | 6000 мг/м2 | 80 мг/м2 | 4,5 мг/м2 (курс 1) 1,5 мг/м2 (курсы 3, 4, 6) |
Приложение А3,2 Схемы терапии РМС-подобными саркомами.
Таблица 26. Схема терапия пациентов с РМС-подобными саркомами. Курс I 2 VA [16].| День | Ифосфамид | Дактиномицин | Винкристин | Месна |
| 1 | 3000 мг/м2 (в/в за 3 часа) | 1,5 мг/м2 (в/в струйно) | 1,5 мг/м2 (в/в струйно) | 3000 мг/м2/сут |
| 2 | 3000 мг/м2 (в/в за 3 часа) | 3000 мг/м2/сут | ||
| 3 | 3000 мг/м2/сут | |||
| 8 | 1,5 мг/м2 (только курс 2) | |||
| 15 | 1,5 мг/м2 (только курс 2) | |||
| Суммарная доза препаратов за курс | 6000 мг/м2 | 1,5 мг/м2 | 4,5 мг/м2 (курс 2) 1,5 мг/м2 (курсы 5,7, 8, 9) |
Таблица 27. Схема терапии пациентов с РМС-подобными саркомами. Курс I 2 VAd [16].
| День | Ифосфамид | Доксорубицин | Винкристин | Месна |
| 1 | 3000 мг/м2 (в/в за 3 часа) | 2 х 20 мг/м2 (в/в за 3 часа) | 1,5 мг/м2 (в/в струйно) | 3000 мг/м2/сут |
| 2 | 3000 мг/м2 (в/в за 3 часа) | 2 х 20 мг/м2 (в/в за 3 часа) | 3000 мг/м2/сут | |
| 3 | 3000 мг/м2/сут | |||
| 8 | 1,5 мг/м2 (только курс 1) | |||
| 15 | 1,5 мг/м2 (только курс 1) | |||
| Суммарная доза препаратов за курс | 6000 мг/м2 | 80 мг/м2 | 4,5 мг/м2 (курс 1) 1,5 мг/м2 (курсы 3, 4, 6) |
Приложение А3,3 Схемы терапии неРМС-подобными саркомами.
Таблица 28. Схема терапии пациентов с неРМС-подобными саркомами группы высокого риска. Курс I 2 VAd [16].| День | Ифосфамид | Доксорубицин | Винкристин | Месна |
| 1 | 3000 мг/м2 (в/в за 3 часа) | 2 х 20 мг/м2 (в/в за 3 часа) | 1,5 мг/м2 (в/в струйно) | 3000 мг/м2/сут |
| 2 | 3000 мг/м2 (в/в за 3 часа) | 2 х 20 мг/м2 (в/в за 3 часа) | 3000 мг/м2/сут | |
| 3 | 3000 мг/м2/сут | |||
| 8 | 1,5 мг/м2 (только курс 1) | |||
| 15 | 1,5 мг/м2 (только курс 1) | |||
| Суммарная доза препаратов за курс | 6000 мг/м2 | 80 мг/м2 | 4,5 мг/м2 (курс 1) 1,5 мг/м2 (курсы 3, 4, 6) |
Таблица 29. Схема терапии пациентов с неРМС-подобными саркомами группы высокого риска. Курс I 2 VA [16].
| День | Ифосфамид | Дактиномицин | Винкристин | Месна |
| 1 | 3000 мг/м2 (в/в за 3 часа) | 1,5 мг/м2 (в/в струйно) | 1,5 мг/м2 (в/в струйно) | 3000 мг/м2/сут |
| 2 | 3000 мг/м2 (в/в за 3 часа) | 3000 мг/м2/сут | ||
| 3 | 3000 мг/м2/сут | |||
| 8 | 1,5 мг/м2 (только курс 2) | |||
| 15 | 1,5 мг/м2 (только курс 2) | |||
| Суммарная доза препаратов за курс | 6000 мг/м2 | 1,5 мг/м2 | 4,5 мг/м2 (курс 2) 1,5 мг/м2 (курсы 5,7, 8, 9) |
Приложение А3,4 Схемы терапии пациентов для группы с инициальным метастазированием.
Таблица 30. Схема терапии пациентов для группы с инициальным метастазированием.Курс I 3 VA[30].| День | Ифосфамид | Винкристин | Дактиномицин | Месна |
| 1 | 3000 мг/м2 | 1,5 мг/м2 в/в болюс | 1,5 мг/м2 в/в болюс | 3000 мг/м2 |
| 2 | 3000 мг/м2 | 3000 мг/м2 | ||
| 3 | 3000 мг/м2 | 3000 мг/м2 | ||
| 8 | 1,5 мг/м2 в/в болюс Только курс 1! | |||
| 15 | 1,5 мг/м2 в/в болюс Только курс 1! | |||
| Итого | 9000 мг/м2 | 4,5 мг/м2 (курс 1) 1,5 мг/м2 (курсы 4 и 7) | 1,5 мг/м2 |
Таблица 31. Схема терапии пациентов для группы с инициальным метастазированием.Курс сEV [30].
| День | Карбоплатин | Эпирубицин | Винкристин |
| 1 | 500 мг/м2 в/в | 150 мг/м2 | 1,5 мг/м2 в/в болюс |
| 8 | 1,5 мг/м2 в/в болюс Только курс 2! | ||
| 15 | 1,5 мг/м2 в/в болюс Только курс 2! | ||
| Итого | 500 мг/м2 | 150 мг/м2 | 4,5 мг/м2 (курс 2) 1,5 мг/м2 (курсы 5 и 8) |
Таблица 32. Схема терапии пациентов для группы с инициальным метастазированием.Курс I 3 VE[30].
| День | Ифосфамид | Винкристин | Этопозид | Месна |
| 1 | 3000 мг/м2 | 1,5 мг/м2 в/в болюс | 150 мг/м2 в/в | 3000 мг/м2 |
| 2 | 3000 мг/м2 | 150 мг/м2 в/в | 3000 мг/м2 | |
| 3 | 3000 мг/м2 | 150 мг/м2 в/в | 3000 мг/м2 | |
| Итого | 9000 мг/м2 | 1,5 мг/м2 | 450 мг/м2 |
Приложение А3,5 Схемы терапии второй линии для СМТ.
1.Схема терапии второй линии [30].Таблица 33. Схема терапии второй линии.Курс сarbo / Eto (карбоплатин/этопозид) [30].
| День | Этопозид | Карбоплатин |
| 1 | 150 мг/м2/сут в/в за 1 час | 150 мг/м2/сут в/в за 1 час |
| 2 | 150 мг/м2/сут в/в за 1 час | 150 мг/м2/сут в/в за 1 час |
| 3 | 150 мг/м2/сут в/в за 1 час | 150 мг/м2/сут в/в за 1 час |
| 4 | 150 мг/м2/сут в/в за 1 час | 150 мг/м2/сут в/в за 1 час |
| Суммарная доза препаратов за курс | 600 мг/м2 | 600 мг/м2 |
Таблица 34. Схема терапии второй линии.Курс Ifo / Eto (ифосфамид/этопозид) [30].
| День | Этопозид | Ифосфамид | Месна |
| 1 | 150 мг/м2/сут в/в за 1 час | 2000 мг/м2/сут в/в за 1 час | 3000 мг/м2/сут |
| 2 | 150 мг/м2/сут в/в за 1 час | 2000 мг/м2/сут в/в за 1 час | 3000 мг/м2/сут |
| 3 | 150 мг/м2/сут в/в за 1 час | 2000 мг/м2/сут в/в за 1 час | 3000 мг/м2/сут |
| 4 | 150 мг/м2/сут в/в за 1 час | 2000 мг/м2/сут в/в за 1 час | 3000 мг/м2/сут |
| 5 | 3000 мг/м2/сут | ||
| 6 | 3000 мг/м2/сут | ||
| Суммарная доза препаратов за курс | 600 мг/м2 | 8000 мг/м2 |
Таблица 35. Схема терапии второй линии.Курс сarbo / Ifo (карбоплатин/ифосфамид) [30].
| День | Карбоплатин | Ифосфамид | Месна |
| 1 | 150 мг/м2/сут в/в за 1 час | 2000 мг/м2/сут в/в за 1 час | 3000 мг/м2/сут |
| 2 | 150 мг/м2/сут в/в за 1 час | 2000 мг/м2/сут в/в за 1 час | 3000 мг/м2/сут |
| 3 | 150 мг/м2/сут в/в за 1 час | 2000 мг/м2/сут в/в за 1 час | 3000 мг/м2/сут |
| 4 | 150 мг/м2/сут в/в за 1 час | 2000 мг/м2/сут в/в за 1 час | 3000 мг/м2/сут |
| 5 | 3000 мг/м2/сут | ||
| 6 | 3000 мг/м2/сут | ||
| Суммарная доза препаратов за курс | 600 мг/м2 | 8000 мг/м2 |
Приложение А3,6 Схемы лучевой терапии.
Таблица 36Лучевая терапия при рабдомиосаркоме для детей не младше 3 летДозы облучения первичной опухоли в соответствии с гистологией и группой IRS [30].| Группа IRS | Резекция и ответ | Эмбриональная РМС | Альвеолярная РМС |
| I | нет ЛТ | 41,4 Гр; 23 Ф | |
| II | 41,4 Гр; 23 Ф | 41,4 Гр; 23 Ф | |
| III | Полная вторичная резекция (R0) до или после ЛТ | 36 Гр; 20 Ф (хороший ответ) 41,4 Гр; 23 Ф (плохой ответ) Подгруппа с: отказ от ЛТ, только если благоприятные размеры и возраст. | 41,4 Гр; 23 Ф |
| III | Неполная вторичная резекция (R1 или R2) | 50,4 Гр; 28 Ф | 50,4 Гр; 28 Ф |
| III | Клиническая полная ремиссия, без вторичной резекции | 41,4 Гр; 23 Ф | 50,4 Гр; 28 Ф |
| III | Частичная ремиссия, без вторичной резекции или без расчета на проведение R0 | 50,4 Гр; 28 Ф Орбита и ЧО (>2/3): 45 Гр; 25 Ф | 50,4 Гр; 28 Ф |
| III | Плохой ответ, прогрессия заболевания, без вторичной резекции | 50,4 Гр; 28 Ф | 50,4 Гр; 28 Ф (+ возможен буст 5,4 Гр; 3 Ф) |
Таблица 37Показания к проведению лучевой терапии у пациентов 3 лет и старше с рабдомиосаркомоподобными саркомами мягких тканей [30].
| Группа IRS | Резекция и ответ | Конвенциональное фракционирование |
| I | без ЛТ | |
| II | 50,4 Гр; 28 Ф | |
| III | Полная вторичная резекция (R0) до или после ЛТ | 50,4 Гр; 28 Ф |
| III | Неполная вторичная резекция (R1 или R2) | 50,4 Гр; 28 Ф |
| III | Клиническая полная ремиссия, без вторичной резекции | 50,4 Гр; 28 Ф |
| III | Частичная ремиссия, без вторичной резекции или без расчета на проведение R0 | 50,4 Гр; 28 Ф |
| III | Плохой ответ, прогрессия заболевания, без вторичной резекции | 54 Гр; 28 Ф + возможен буст 5,4 Гр; 3 Ф |
Таблица 38. Дозы лучевой терапии для вовлеченных регионарных лимфатических узлов.
| Лимфатические узлы. Клиническая ситуация | эРМС, а РМС | Рабдомиосаркомоподобные СМТ и нерабдомиосаркомоподобные СМТ |
| Пациенты после радикального иссечения лимфоузлов | нет ЛТ | нет ЛТ |
| Радиологические и/или патоморфологические признаки поражения лимфоузлов при постановке диагноза; в полной ремиссии после ПХТ и до ЛТ | 41,4 Гр; 23 Ф | 50,4 Гр; 28 Ф |
| Макроскопическая остаточная опухоль после ПХТ и перед ЛТ | 41,4 Гр; 23 Ф + буст 9 Гр; 5 Ф | 50,4 Гр; 28 Ф |
Приложение В.
Информация для пациентов.Саркомы мягких тканей (СМТ) представляют собой группу злокачественных опухолей. СМТ имеют мезенхимальное происхождение, развиваются не из клеток кроветворной системы, а из клеток соединительной ткани. В большинстве случает причина развития СМТ неясна, но в некоторых случаях может быть связано с генетическими синдромами (например, синдром Ли Фраумени, нейрофиброматоз I типа), возможно развитие СМТ при наличии пороков развития.
Наиболее частой СМТ в детском возрасте является рабдомиосаркома (РМС). Выделяют несколько гистологических типов РМС - альвеолярная РМС и эмбриональная РМС, также в детском возрасте возможно развитие веретеноклеточной/склерозирующей РМС. Развитие плеоморфной РМС характерно для взрослых.
Клиническая картина и выраженность симптомов зависит от локализации опухоли, от ее размеров, и поэтому крайне разнообразны. Наиболее частой клинической картиной при СМТ является наличие безболезненного образования, увеличивающего в динамике. Образование чаще всего неподвижно, может располагаться на любой части тела. У детей раннего возраста чаще всего в области головы и шеи, мочеполовой системы (мочевой пузырь, малый таз). У подростков наиболее частой локализацией поражения являются верхние и нижние конечности, паратестикулярная локализация. Как и все злокачественные опухоли, СМТ могут давать метастазы, поражать другие органы и ткани отличимые от первичной локализации. Метастазы могут обнаруживаться в легких, лимфатических узлах, костях скелета и черепа, костном мозгом.
Все дети с подозрением на злокачественную опухоль должны направляться в детские онкологические Центры, оснащенные всем необходимым оборудованием для постановки диагноза. Все диагнозы при СМТ устанавливаются при помощи гистологического и иммуногистохимического (ИГХ) исследований ткани опухоли. Для получения ткани опухоли проводится открытая биопсия. Важно знать, что для постановки правильного диагноза гистологический материал необходимо пересматривать в специализированных Центрах, где работают специализированные врачи, имеющие большой опыт в диагностике СМТ.
После констатирования диагноза проводится первичное обследование для установки стадии заболевания. Первичное обследование направлено на оценку общего состояния, выявления наличия интоксикации, установки локализации опухоли и возможно наличия метастазов. Обследование включает в себя подробный сбор анамнеза заболевания (наличие онкологических заболеваний в семье или у близких родственников, требует проведение консультации генетика для выявления генетических синдромов, предрасполагающих к развитию СМТ), лабораторные исследования с забором анализов крови, исследование костного мозга, полученного в ходе костно-мозговой пункции, спинномозговой жидкости (в случае близкого расположения опухоли к оболочкам спинного или головного мозга), рентгенологические и инструментальные методы исследования. К инструментальным методам исследования относится компьютерная томография (КТ) органов грудной клетки, брюшной полости, органов малого таза, магнитно-резонансная томография (МРТ), сцинтиграфия с технецием, ультразвуковое исследование (УЗИ) опухоли, УЗИ лимфатических узлов. КТ и МРТ проводится с внутривенным введением контрастного препарата.
При СМТ предпочтительнее выполнение МРТ, за счет высокого естественного мягкотканного контраста, позволяющего оценить размеры опухоли и связь её с прилежащими органами и тканями.
После проведенного комплексного обследования устанавливается стадия заболевания. Все СМТ классифицируются согласно международной классификации TNM (T - характеризует локализацию опухоли и ее размеры, N - характеризует наличие и ли отсутствие поражения лимфатических узлов, M - характеризует наличие или отсутствие метастазов). РМС классифицируют также по IRS (Постоперационное стадирование Межгруппового исследования по рабдомиосаркоме, Intergroup Rhabdomyosarcoma Study, IRS). Классификация РМС по IRS проводится на основании результатов первичного хирургического вмешательства и зависит от его объема (радикальное или нерадикальное удаление опухоли, с учетом гистологического исследования, МРТ/КТ исследования, характера роста опухоли, вовлеченности в процесс лимфатических коллекторов, наличия отдаленных метастазов).
После верификации СМТ и определения стадии заболевания проводится терапия. В настоящее время в РФ отсутствуют единые рекомендации по лечению пациентов, страдающих СМТ. В большинстве региональных центров используются адаптированные протоколы зарубежных исследовательских групп. В ФГБУ «НМИЦ ДГОИ имени Дмитрия Рогачева» Минздрава России (НМИЦ ДГОИ) терапия детей, страдающих СМТ, как и во многих клиниках регионов РФ, проводится согласно протоколу риск-адаптированного лечения Кооперированной группы по мягкотканым саркомам (СWS) Немецкого Общества Детских Онкологов и Гематологов (GPOH) - сWS guidance, версии 2009 г. Данный протокол утвержден на заседании ученого совета ФГБУ ФНКЦ ДГОИ (в настоящее время НМИЦ ДГОИ им.Д. Рогачева) от 20,12,2012.
При определении объема терапии должны учитываться факторы, использующие для стратификации пациентов на группы риска: возраст, гистологический тип, локализация опухоли, размеры опухоли, поражение регионарных л/у, наличие метастазов.
Терапия пациентов, страдающих СМТ, может включать химиотерапию, оперативное удаление опухоли, лучевую терапию. В некоторых случаях при СМТ могут быть рекомендованы особые методы лучевой терапии, включая протонное облучение и брахитерапию.
Прогноз при СМТ во многом зависит от гистологического диагноза опухоли, при разных гистологических типах СМТ показатели выживаемости различны. К прогностическим факторам можно отнести возраст на момент диагностирования заболевания, стадию заболевания, размеры и локализацию опухоли и возможность ее полного удаления, наличия метастазов.
Приложение Г.
Приложение Г1 Оценка общего состояния по индексу Карновского.
Название на русском языке: Шкала Карновского.Оригинальное название: Karnofsky Performance Status.
Источник (официальный сайт разработчиков, публикация с валидацией):
Karnofsky D.A., вurchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: MacLeod с. (ed. Evaluation of chemotherapeutic agents. New York: сolumbia University Press; 1949:191-205 [45].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностей (ходьба, работа ).
Содержание (шаблон):
| Нормальная физическая активность, больной не нуждается в специальном уходе | 100% | Состояние нормальное, нет жалоб и симптомов заболевания |
| 90% | Нормальная активность сохранена, но имеются незначительные симптомы заболевания | |
| 80% | Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания | |
| Ограничение нормальной активности при сохранении полной независимости больного | 70% | Больной обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе |
| 60% | Больной иногда нуждается в помощи, но в основном обслуживает себя сам | |
| 50% | Больному часто требуется помощь и медицинское обслуживание | |
| Больной не может обслуживать себя самостоятельно, необходим уход или госпитализация | 40% | Большую часть времени больной проводит в постели, необходим специальный уход и посторонняя помощь |
| 30% | Больной прикован к постели, показана госпитализация, хотя терминальное состояние не обязательно | |
| 20% | Сильные проявления болезни, необходима госпитализация и поддерживающая терапия | |
| 10% | Умирающий больной, быстрое прогрессирование заболевания | |
| 0% | Смерть |
Приложение Г2 Шкала оценки общего состояния больного ECOG.
Оригинальное название: The ECOG Scale of Performance Status.Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern сooperative Oncology Group. Am. J. сlin. Oncol. 1982;5(6):649-65 [46].
Тип: шкала оценки.
Назначение: клиническая оценка общего состояния пациента.
Содержание и интерпретация:
| 0 | Больной полностью активен, способен выполнять все, как и до заболевания (90- 100% по шкале Карновского) |
| 1 | Больной неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70-80% по шкале Карновского) |
| 2 | Больной лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении (50-60% по шкале Карновского) |
| 3 | Больной способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30-40% по шкале Карновского) |
| 4 | Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10-20% по шкале Карновского) |
Приложение Г3 Оценка нутритивного статуса.
Таб. Г3,1. Критерии оценки белково-энергетической недостаточности.| Антропометрические показатели | Нутритивный статус | ||
| Тяжелая нутритивная недостаточность | Умеренная нутритивная недостаточность | Нормальный нутритивный статус | |
| Вес (на возраст), перцентиль | <5 | 5-15 | 16-84 |
| Рост (на возраст), перцентиль | <5 | 5-15 | 16-84 |
| ИМТ, перцентиль | <5 | 5-15 | 16-84 |
| ОМП, перцентиль | <5 | 5-10 | >10 |
Примечания. ИМТ - индекс массы тела, ОМП - окружность мышц плеча.
| ИМТ и ОМП являются ключевыми антропометрическими показателями, в случае низких значений одного из них нутритивный статус оценивается как нутритивная недостаточность. При значении одного из них менее 5 перцентиля, а другого более 15 нутритивный статус обозначается как умеренная нутритивная недостаточность, в остальных случаях - как тяжелая нутритивная недостаточность. |
Таб. Г3,2. Определение наличия клинических факторов нутритивного риска.
| Нутритивный риск | Критерии |
| Высокий | • Нарушения аппетита (снижение, инверсия вкуса) - текущие или потенциально возможные в течение 1 недели на фоне проводимой терапии основного заболевания • Потребление менее половины от необходимого рациона • Нарушения функции ЖКТ - текущие или потенциально возможные в течение 1 недели на фоне проводимой терапии основного заболевания • Потеря более 2% массы тела за неделю или более 5% за месяц. • Опухоли, локализованные забрюшинно, в брюшной полости, области малого таза • Возраст до 2 лет |
| Низкий | Все, кроме критериев высокого риска |
Таб. Г3,3. Потребность в аминокислотах у стабильных пациентов при проведении ПП.
| Недоношенные младенцы 1,5-4 г/кг/сут Доношенные младенцы 1,5-3 г/кг/сут 2 мес - 3 г 1,5-2,5 г/кг/сут 3 - 18 1,5 -2 г/кг/сут |
Таб. Г3,4. Энергетические потребности у стабильных пациентов при парентеральном питании.
| Диапазон возраста | Ккал/кг веса тела/день |
| Недоношенные | 110-120 |
| Младенцы 0-1 год | 90-100 |
| Дети 1-7 лет | 75-90 |
| Дети 7-12 лет | 60-75 |
| Дети 12-18 лет | 30-60 |
|
|
Год актуализации информации
2020.
Связанные заболевания
Связанные клинические рекомендации
Связанные стандарты мед. помощи
- Стандарт медицинской помощи больным злокачественным новообразованием соединительной и других мягких тканей
- Стандарт медицинской помощи больным злокачественными новообразованиями соединительной, подкожной и других мягких тканей (при оказании специализированной помощи)
- Стандарт медицинской помощи взрослым при саркомах мягких тканей
- Стандарт медицинской помощи больным со злокачественным новообразованием печени и внутрипеченочных желчных протоков, злокачественным новообразованием желчного пузыря, злокачественным новообразованием других и неуточненных частей желчевыводящих путей, вторичным злокачественным новообразованием печени (при оказании специализированной помощи)
- Стандарт медицинской помощи больным со злокачественным новообразованием печени и внутрипеченочных желчных протоков, злокачественным новообразованием желчного пузыря, злокачественным новообразованием других и неуточненных частей желчевыводящих путей, вторичным злокачественным новообразованием печени
- Стандарт медицинской помощи детям при меланоме кожи и слизистых оболочек (диагностика и лечение)
- Стандарт специализированной медицинской помощи детям при нейробластоме (низкий риск)
- Стандарт специализированной медицинской помощи детям при нейробластоме (средний риск)