МКБ-10 коды
- МКБ-10
- C22.0 Печеночноклеточный рак
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: с22.0.
Год утверждения (частота пересмотра): 2022.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2024.
ID: 1.
Разработчик клинической рекомендации.
• Ассоциация онкологов России.
• Междисциплинарное общество специалистов по опухолям печени.
• Общероссийская общественная организация «Российское общество клинической онкологии».
• Общероссийская общественная организация содействия развитию лучевой диагностики и терапии Российское общество рентгенологов и радиологов .
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2022.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2024.
ID: 1.
Разработчик клинической рекомендации.
• Ассоциация онкологов России.
• Междисциплинарное общество специалистов по опухолям печени.
• Общероссийская общественная организация «Российское общество клинической онкологии».
• Общероссийская общественная организация содействия развитию лучевой диагностики и терапии Российское общество рентгенологов и радиологов .
Одобрено Научно-практическим Советом Минздрава РФ.
|
|
 Список сокращений
Список сокращений
АЛТ. Аланинаминотрансфераза.
АСТ. Аспартатаминотрансфераза.
АФП. Альфа-фетопротеин.
ГЦР. Гепатоцеллюлярный рак.
КТ - компьютерная томография.
ЛФК. Лечебная физкультура.
МРТ. Магнитно-резонансная томография.
ТАХЭ. Трансартериальнаяхимиоэмболизация.
УЗИ. Ультразвуковое исследование.
AASLD. AmericanAssociationfortheStudyofLiverDisease, Американскаяассоциацияпоизучениюзаболеванийпечени.
EASL. The European Association for the Study of the Liver, Европейскаяассоциацияпоизучениюпечени.
BCLC. вarcelona сlinic Liver сancer (classification), Барселонскаясистемастадированияракапечени.
ECOG PS. Eastern сooperative Oncology Group Performance Status, шкалаоценкиобщегосостоянияпациента, разработаннаяВосточнойобъединеннойонкологическойгруппой.
LI-RADS. LiverImagingReportingandDataSystem,системаотчетов и данных (интерпретации и протоколирования) визуализации печени.
RECIST. ResponseEvaluationCriteriainSolidTumors, критерииоценкиответасолидныхопухолейналечение.
MRECIST. ModifiedResponseEvaluationCriteriainSolidTumors, модифицированныекритерииоценкиответасолидныхопухолейналечение.
PD1/PD-L1. Programmedcelldeath 1/programmedcelldeath 1 ligand, мембранныйбелокзапрограммированнойсмертиклеток/еголиганд.
TNM. (аббревиатура от Tumor,Nodus,Metastasis), международная классификация стадий злокачественных новообразований.
** - жизненно необходимые и важнейшие лекарственные препараты.
АСТ. Аспартатаминотрансфераза.
АФП. Альфа-фетопротеин.
ГЦР. Гепатоцеллюлярный рак.
КТ - компьютерная томография.
ЛФК. Лечебная физкультура.
МРТ. Магнитно-резонансная томография.
ТАХЭ. Трансартериальнаяхимиоэмболизация.
УЗИ. Ультразвуковое исследование.
AASLD. AmericanAssociationfortheStudyofLiverDisease, Американскаяассоциацияпоизучениюзаболеванийпечени.
EASL. The European Association for the Study of the Liver, Европейскаяассоциацияпоизучениюпечени.
BCLC. вarcelona сlinic Liver сancer (classification), Барселонскаясистемастадированияракапечени.
ECOG PS. Eastern сooperative Oncology Group Performance Status, шкалаоценкиобщегосостоянияпациента, разработаннаяВосточнойобъединеннойонкологическойгруппой.
LI-RADS. LiverImagingReportingandDataSystem,системаотчетов и данных (интерпретации и протоколирования) визуализации печени.
RECIST. ResponseEvaluationCriteriainSolidTumors, критерииоценкиответасолидныхопухолейналечение.
MRECIST. ModifiedResponseEvaluationCriteriainSolidTumors, модифицированныекритерииоценкиответасолидныхопухолейналечение.
PD1/PD-L1. Programmedcelldeath 1/programmedcelldeath 1 ligand, мембранныйбелокзапрограммированнойсмертиклеток/еголиганд.
TNM. (аббревиатура от Tumor,Nodus,Metastasis), международная классификация стадий злокачественных новообразований.
** - жизненно необходимые и важнейшие лекарственные препараты.
Термины и определения
Блокатор сTLA4. Моноклональное антитело, блокирующее антиген цитотоксических Т-лимфоцитов 4-го типа.
Блокатор PD1. Моноклональное антитело, блокирующее рецептор программируемой смерти 1.
Класс цирроза по сhild-Pugh. Степень выраженности нарушения функции печени (А, В, С), рассчитываемая по сумме баллов.
Компьютерная томография. Метод послойной внутренней диагностики.
Магнитно-резонансная томография. Метод послойной внутренней диагностики с помощью эффекта ядерного магнитного резонанса.
Позитронно-эмиссионная томография. Метод радионуклидной диагностики.
Терапия «понижениястадии». Down-staging, направлена на уменьшение внутрипеченочной распространенности опухолевого процесса при отсутствии внепеченочных изменений.
Трансартериальнаяхимиоэмболизация. Метод локального лечения внутрипеченочных опухолей с использованием эмболизирующего агента в сочетании с цитостатиком.
Трансартериальнаярадиоэмболизация. Метод локального лечения внутрипеченочных опухолей с использованием эмболизирующего агента в сочетании с изотопом.
Ультразвуковое исследование. Неинвазивное исследование организма с помощью ультразвуковых волн.
Bridge-терапия. Терапия «ожидания», которая направлена на замедление прогрессирования опухоли и уменьшение вероятности выбытия из листа ожидания трансплантации.
CTLA4. Антиген цитотоксических Т-лимфоцитов 4-го типа, также известен как СD152. Выполняет функции рецептора, лигандом служит молекула в7,1 или в7,2.
Response Evaluation сriteriainSolid Tumours. Набор стандартизированных критериев, используемых для оценки изменения размеров опухоли в ответ на проводимую терапию.
Modified Response Evaluation сriteriain Solid Tumors. Набор стандартизированных критериев, используемых для оценки изменения размеров опухоли в ответ на проводимую терапию методом измерения васкуляризованного компонента опухолевого узла.
Предреабилитация (prehabilitation). Реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Первый этап реабилитации. Реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Второй этап реабилитации. Реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период, поздний реабилитационный период, период остаточных явлений заболевания.
Третий этап реабилитации. Реабилитация в ранний и поздний реабилитационные периоды, период остаточных явлений заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе, в условиях санаторно-курортных организаций),кабинетах логопеда (учителя-дефектолога).
Блокатор PD1. Моноклональное антитело, блокирующее рецептор программируемой смерти 1.
Класс цирроза по сhild-Pugh. Степень выраженности нарушения функции печени (А, В, С), рассчитываемая по сумме баллов.
Компьютерная томография. Метод послойной внутренней диагностики.
Магнитно-резонансная томография. Метод послойной внутренней диагностики с помощью эффекта ядерного магнитного резонанса.
Позитронно-эмиссионная томография. Метод радионуклидной диагностики.
Терапия «понижениястадии». Down-staging, направлена на уменьшение внутрипеченочной распространенности опухолевого процесса при отсутствии внепеченочных изменений.
Трансартериальнаяхимиоэмболизация. Метод локального лечения внутрипеченочных опухолей с использованием эмболизирующего агента в сочетании с цитостатиком.
Трансартериальнаярадиоэмболизация. Метод локального лечения внутрипеченочных опухолей с использованием эмболизирующего агента в сочетании с изотопом.
Ультразвуковое исследование. Неинвазивное исследование организма с помощью ультразвуковых волн.
Bridge-терапия. Терапия «ожидания», которая направлена на замедление прогрессирования опухоли и уменьшение вероятности выбытия из листа ожидания трансплантации.
CTLA4. Антиген цитотоксических Т-лимфоцитов 4-го типа, также известен как СD152. Выполняет функции рецептора, лигандом служит молекула в7,1 или в7,2.
Response Evaluation сriteriainSolid Tumours. Набор стандартизированных критериев, используемых для оценки изменения размеров опухоли в ответ на проводимую терапию.
Modified Response Evaluation сriteriain Solid Tumors. Набор стандартизированных критериев, используемых для оценки изменения размеров опухоли в ответ на проводимую терапию методом измерения васкуляризованного компонента опухолевого узла.
Предреабилитация (prehabilitation). Реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Первый этап реабилитации. Реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Второй этап реабилитации. Реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период, поздний реабилитационный период, период остаточных явлений заболевания.
Третий этап реабилитации. Реабилитация в ранний и поздний реабилитационные периоды, период остаточных явлений заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе, в условиях санаторно-курортных организаций),кабинетах логопеда (учителя-дефектолога).
Описание
Гепатоцеллюлярный рак (ГЦР) (гепатоцеллюлярная карцинома, печеночно-клеточный рак) - наиболее частая (около 85 % случаев) злокачественная опухоль печени, исходящая из гепатоцитов. Реже встречается холангиоцеллюлярный рак (холангиокарцинома) - злокачественная опухоль, исходящая из эпителия внутрипеченочных желчных протоков, а также смешанные гепатохолангиокарциномы, фиброламеллярная карцинома, которая формально классифицируется как вариант печеночно-клеточного рака.
Причины
Гепатоцеллюлярный рак развиваетсячаще всего на фоне цирроза печени (около 80 % случаев) илихроническоговоспалениялюбой этиологии: вирусных гепатитов В и С, алкогольного и неалкогольного стеатогепатита, первичного склерозирующегои аутоиммунного гепатита, вследствие экзогенных токсических повреждений печени (под действием афлотоксинов, винилхлорида, на фоне применения стероидных гормонов), а также при наследственных заболеваниях (дефиците альфа-1-антитрипсина, тирозинемии и гемохроматозе)и нарушениях состояния иммунной системы, при которых происходит повреждение печени с исходом в хронический гепатит и цирроз. Вирусные гепатитыВ и С - самый частый фактор риска, являющийся причиной ГЦР в 50% и 15% случаев соответственно. С внедрениемвакцинации против гепатита В и эффективной противовирусной терапии гепатита С роль вирусных гепатитов постепенно снижается. В развитых странах повышается роль неалкогольной жировой болезни печени[1-3]. Менее 10%случаев ГЦР развивается в здоровой ткани печени.
|
|
Эпидемиология
В Российской Федерации ГЦР встречается достаточно редко.В2019г. в России зарегистрировано 9 324новых случая ГЦР и рака внутрипеченочных желчных протоков, умерло по этой причине 10 430пациентов[4]. В РФ по данным статистических отчетов за период с 2009по 2019гг.отмечается самый высокий из онкологических заболеваний- более чем 48% - прирост «грубого» показателя заболеваемости (для мужчин +57%)при более 29% прироста стандартизованного показателя заболеваемости ГЦР. Показатели динамики смертности от ГЦР указывают на 21,6% прирост абсолютного числа случаев смерти от рака печени и 5,65% прироста стандартизованного показателя смертности (на 100 тыс. населения). Обращает внимание различие в смертности: она превышает заболеваемость первичным раком печени на ~1100 случаев в 2019 году.
С22 Злокачественное новообразование печени и внутрипеченочных желчных протоков.
С22,0 Печеночно-клеточный рак. Гепатоцеллюлярный рак.
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
Первичный рак печени (С 22).С22 Злокачественное новообразование печени и внутрипеченочных желчных протоков.
С22,0 Печеночно-клеточный рак. Гепатоцеллюлярный рак.
Классификация
1,5 Классификация заболевания или состояния (группы заболеваний или состояний).
1,5,1 Международная гистологическая классификация (2010).
Эпителиальные гепатоцеллюлярные доброкачественные опухоли:Гепатоцеллюлярная аденома 8170/0.
Фокальная нодулярная гиперплазия 8170/0.
Предраковые или ассоциированные со злокачественными новообразования:
Крупноклеточные изменения.
Мелкоклеточные изменения.
Диспластические узлы.
Низкой степени злокачественности.
Высокой степени злокачественности.
Злокачественные гепатоцеллюлярные опухоли:
Гепатоцеллюлярный рак 8170/3.
Гепатоцеллюлярный рак (фиброламеллярный вариант) 8171/3.
Гепатобластома, эпителиальные варианты 8171/3.
Недифференцированный рак 8020/3.
Мезенхимальные опухоли:
Доброкачественные.
Ангиомиолипома (PECома) 8860/0.
Гемангиома.
Кавернозная гемангиома 9131/0.
Инфантильная гемангиома 9131/0.
Воспалительная псевдоопухоль.
Лимфангиома 9170/0.
Мезенхимальнаягамартома.
Солитарная фиброзная опухоль 8815/0.
Злокачественные опухоли.
Ангиосаркома9120/3.
Эмбриональная саркома 8991/3.
Эпителиоидная гемангиоэндотелиома 9133/3.
Саркома Капоши 9140/3.
Лейомиосаркома 8890/3.
Рабдомиосаркома 8900/3.
Синовиальная саркома 9040/3.
Смешанные злокачественные опухоли неясного происхождения:
Смешанный гепатохолангиоцеллюлярный рак 8180/3.
Карциносаркома 8980/3.
Герминогенные опухоли.
Лимфомы.
Метастатические опухоли.
1,5,2 Стадирование.
Стадирование по системе TNM (8-й редакции, 2017 г) [5].T - первичная опухоль.
TX - оценить первичную опухоль невозможно.
T0 - признаков первичной опухоли нет.
Т1 - одиночная опухоль.
T1a - одиночная опухоль ≤2 см в наибольшем измерениис сосудистой инвазией или без нее.
T1b - одиночная опухоль >2 см в наибольшем измерениибез сосудистой инвазии.
T2 - одиночная опухоль размером >2 см с сосудистой инвазиейили множественные опухоли ≤5 см в наибольшем измерении.
T3 - множественные опухоли, в том числе хотя бы однаопухоль >5 см в наибольшем измерении.
T4 - одиночная опухоль или множественные опухолилюбого размера с прорастанием в крупнуюветвь воротной вены либо в печеночнуювену, или с прорастанием в соседние органы, включая диафрагму(кроме желчного пузыря), или с прорастанием в висцеральнуюбрюшину.
N - вовлечение регионарных лимфатических узлов. Регионарными лимфатическимиузлами являются лимфатические узлы ворот печени (расположенные впеченочно-двенадцатиперстной связке).
NX - недостаточно данных для оценки состояния регионарных лимфатических узлов.
N0 - нет признаков метастатического поражения регионарных лимфатических узлов.
N1 - имеется поражение регионарных лимфатических узлов метастазами.
M - отдаленные метастазы.
МХ - недостаточно данных для определения отдаленных метастазов.
M0 - отдаленных метастазов нет.
M1 - имеются отдаленные метастазы.
PTNM. Патогистологическая классификация.
Требования к определению категорий pN, рМ соответствуют требованиям к определению категорий Т, N, М (таблица 1).
G - гистопатологическая дифференцировка.
Gx - степень дифференцировки не может быть установлена.
G1 - высокая степень дифференцировки.
G2 - средняя степень дифференцировки.
G3 - низкая степень дифференцировки.
G4 - недифференцированные опухоли.
Таблица 1. Группировка гепатоцеллюлярных карцином по стадиям (UICC).
| Стадия | Т | N | M |
| IA | T1a | N0 | M0 |
| IB | T1b | N0 | M0 |
| II | T2 | N0 | M0 |
| IIIA | T3 | N0 | M0 |
| IIIB | T4 | N0 | M0 |
| IVА | Любая Т | N1 | M0 |
| IVВ | Любая Т | ЛюбаяN | M1 |
Стадирование по Барселонской системе.
Барселонская система стадирования рака печени (BarcelonaClinicLiverCancer (BCLC) classification) - наиболее часто используемая классификация ГЦР, которая учитывает распространенность опухолевого процесса, функциональное состояние печени, объективное состояние пациентаи предполагаемую эффективность лечения ( см рисунок А1в приложении А3) [6].
Выделяют 5 стадий: от 0 - очень раннейи А - ранней до D - терминальной. Стадии поBCLC, равно как прогноз заболевания и тактика лечения, могут меняться при прогрессировании заболеваниялибо эффективном лечении. Следует отметить прогностическую значимость классификации для пациентов сГЦР безотносительно наличия цирроза печени. Важная особенность этой классификации в том, что в ней предложен алгоритм лечения в зависимости от стадии заболевания. В последней редакции этой классификации (2018 г.) вместо классов цирроза A-Bпо сhild - Pugh используется формулировка «сохранная функция печени», чтосоответствует оценке <8 баллов по классификации сhild - Pugh[7].
Очень ранняя стадия (BCLC 0). Солитарная опухоль печени <2 см в диаметре.
Ранняя стадия (BCLCA). Солитарная опухоль печени любого размера или не более 3 узлов размером до 3 не распространяющиеся на магистральные сосуды печени, соседние анатомические структуры, у пациентабез опухолеспецифических жалобв удовлетворительном объективном состоянии (ECOG0) при сохранной функции печени.
Промежуточная стадия (BCLC В) -случаи изолированного бессимптомного множественного опухолевого поражения печени без макрососудистой инвазииу пациентовв удовлетворительном состоянии (ECOG0) при сохранной функции печени.
Распространенная стадия (BCLC С) -симптомнаяопухоль, ухудшающая объективное состояние пациента (ECOG0-2), любого размера с инвазией или без инвазии в магистральные печеночные сосуды и/или с внепеченочным распространением при сохранной функции печени.
Терминальная стадия (BCLCD). Случаи заболевания со значимым ухудшением объективного состояния (опухоль/цирроз), декомпенсацией цирроза (класс с по сhild - Pugh). Но при выявлении малой опухоли (солитарной размером <5 см или не более 3 узлов размером <3 см) при соответствии так называемым«миланским» критериям возможна ортотопическая трансплантация печени.
|
|
Клиническая картина
Клиническая картина, как правило, имеет скрытый характер, не имеет специфических симптомов. Чаще всего ГЦР обнаруживается на более поздних стадиях. Спектр проявлений может определяться фоновым заболеванием печени, циррозом и осложнениями опухолевого процесса.
В начале развития заболевания симптомы мало выражены. Поэтому пациенты не придают им особого значения, не обращаясь за медицинской помощью. Со временем симптомы нарастают и становятся более ощутимыми: появление болей чаще всего связано с прорастанием анатомических структур, включая магистральные сосуды, с образованием опухолевых тромбов, а также с метастатическим поражением органов. Основными жалобами далеко зашедшего процесса являются выраженная общая слабость, вялость, быстрая утомляемость, увеличение размеров живота, дискомфорт и боли в правом подреберье, а также повышение температуры тела, появление отёков нижних конечностей. Паранеопластические синдромы встречаются у небольшой части пациентов и проявляются гипогликемией, эритроцитозом, гиперкальциемией.
В начале развития заболевания симптомы мало выражены. Поэтому пациенты не придают им особого значения, не обращаясь за медицинской помощью. Со временем симптомы нарастают и становятся более ощутимыми: появление болей чаще всего связано с прорастанием анатомических структур, включая магистральные сосуды, с образованием опухолевых тромбов, а также с метастатическим поражением органов. Основными жалобами далеко зашедшего процесса являются выраженная общая слабость, вялость, быстрая утомляемость, увеличение размеров живота, дискомфорт и боли в правом подреберье, а также повышение температуры тела, появление отёков нижних конечностей. Паранеопластические синдромы встречаются у небольшой части пациентов и проявляются гипогликемией, эритроцитозом, гиперкальциемией.
Диагностика
Критерии установления диагноза/состояния. На основании патогномоничных клинико-рентгенологических данных, результатов патологоанатомического исследования биопсийного или операционного материала, лабораторных исследований, направленных на оценку функции печени и инструментального обследования распространенности опухолевого процесса и выраженности сопутствующих заболеваний.
Чаще всего ГЦР развиваетсяна фоне хронического заболевания печени - цирроза печени, вирусного гепатита, стеатогепатита - которое, как и опухолевый процесс, может проявляться специфическими симптомами, нуждаться в специфической терапии, конкурентно влиять на качество жизни и ухудшать выживаемость. В рамках мультидисциплинарной оценки состояния пациента необходимо оценить функциональные резервы печени, выраженность фоновой патологии печени и распространенность опухолевого процесса.
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: Следует стремиться разграничить вызванные опухолью симптомы и длительно существующие симптомы цирроза печени и его осложнений.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения для объективной оценки степени выраженности изменений в гемограмме и выявления возможного нарушения функции печени и почек выполнить общий (клинический) анализ крови развернутый(с подсчетом количества тромбоцитов) и анализ крови биохимический общетерапевтический - с измерением уровня сывороточного альбумина, общего и прямого билирубина, мочевины и креатинина, АЛТ, АСТ, ГГТ, ЩФ - анализ крови, определение протромбинового времени и международного нормализованного отношения, общий (клинический) анализ мочи [3,9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить определение концентрации в плазме опухолеспецифического маркера альфа-фетопротеина (АФП)для оценки агрессивности заболевания и прогноза его течения, контроля эффективности лечения.[8].
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
Комментарии: Результат анализа на АФП считается положительным, если уровень АФП >100 нг/мл [12]или если он увеличивался на 7 нг/мл в месяц по результатам 3 последовательных измерений [13]. Следует учитывать, что уровень АФП также может повышаться при хронических заболеваниях печени, например, при острых и хронических вирусных гепатитах, при других онкологических заболеваиях (гепатоидном раке желудка, герминогенных опухолях ), при беременности.
Оценка функционального статуса печени.
• Рекомендуется пациентам с установленным диагнозом ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, оценить функциональный статус печени по критериям сhild - Pugh (Приложение Г1) с целью оценки степени нарушения функций печенидля определения переносимости планируемого лечения или токсичности проводимого противоопухолевого лечения и прогноза течения цирроза печени[8,9,14,15].
Уровень убедительности рекомендаций -А (уровень достоверности доказательств -1).
Комментарий: цирроз печени, частое сопутствующее заболевание печени, определяет переносимость основных методов лечения, вплоть до невозможности проведения лечения, негативно и конкурентно с ГЦР влияет на общую выживаемость. Совместно с гастроэнтерологом или терапевтом необходимо своевременно профилактировать, выявлять и лечить осложнения цирроза печени.
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
• Рекомендуется использование МРТ с гепатоспецифическим контрастным препаратом гадоксетовой кислоты для выявления раннего ГЦР (до 2,0 см) у пациентов с сопутствующим циррозом печени любой этиологии [19-21].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарий: диагностика раннего ГЦР и своевременное начатое лечение имеют решающее значение для улучшения прогноза и качества жизни пациентов, повышая тем самым долгосрочную выживаемость. Особенности накопления и вымывания контрастного препарата из опухолевых тканей в артериальную, венозную и отсроченные фазы при использовании экстрацеллюлярных магнитно-резонансных контрастных препаратов в ряде случаев не позволяют выявлять и корректно дифференцировать новообразования, в том числе малых размеров. Гиперинтенсивность печеночной паренхимы в гепатоспецифическую фазу позволяет отчетливо визуализировать гипоинтенсивные очаги малых размеров и с учетом особенностей их контрастирования в предыдущие фазы исследования, дифференцировать ранний ГЦР от прочих новообразований печени, в тч и от регенераторных и диспластических узлов, что в ряде случаев может повлиять на изменение стадии опухолевого процесса.
• Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом выполнять МРТ печени с гепатоспецифическим контрастным препаратом гадоксетовой кислоты для корректного стадирования опухолевого процесса перед началом лечения[18-23].
Уровень убедительности рекомендаций - A(уровень достоверности доказательств - I).
Комментарий: в ряде систематических обзоров рандомизированных клинических исследований с применением мета-анализа доказана высокая информативность МРТ с применением гепатоспецифического контрастного препарата гадоксетовой кислоты по сравнению с КТ и МРТ с использованием экстрацеллюлярных контрастных препаратов в выявлении и дифференциальной диагностике ГЦР.
• Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить ультразвуковое исследование (УЗИ) органов брюшной полости и забрюшинного пространства, в том числе, печени, включая бассейн воротной вены, для оценки степени распространенности ГЦР, выявления осложнений ГЦР и/или цирроза и их контроля[14].
Уровень убедительности рекомендаций -С(уровень достоверности доказательств - 5).
Комментарий. УЗИ применяется на этапе скрининга в группе риска развития ГЦР, при осуществлении чрескожной биопсии, интервенционных вмешательств ииногдамониторинга эффективности лечения. Обязательна оценка проходимости бассейна воротной вены. Чувствительность УЗИ невысока для обнаружения узлов малого размера. УЗИ с контрастным усилением обладает преимуществом в выявлении гиперваскуляризованных узлов, что может использоваться при дифференциальной диагностике очаговых образований печени.
• Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить эзофагогастродуоденоскопию для выявления одного из осложнения портальной гипертензии - варикозного расширения вен пищевода и желудка, оценки степени его выраженности и показаний к лечебно-профилактическим мероприятиям[9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам с установленным диагнозом ГЦР, планируемым к проведению или получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить четырехфазную компьютерную томографию (КТ) (нативная, артериальная, венозная и отсроченная венозная фазы) и/или динамическую магнитно-резонансную томографию (МРТ) печени с внутривенным контрастированием для оценки распространенности опухолевого процесса и выявления ее изменений: определяют количество и размеры опухолевых узлов внутри печени, наличие сосудистой инвазии и тромбоза, внепеченочного распространения, контроля эффективности лечения[8,9,14,16-18].
Уровень убедительности рекомендаций - A(уровень достоверности доказательств - I).
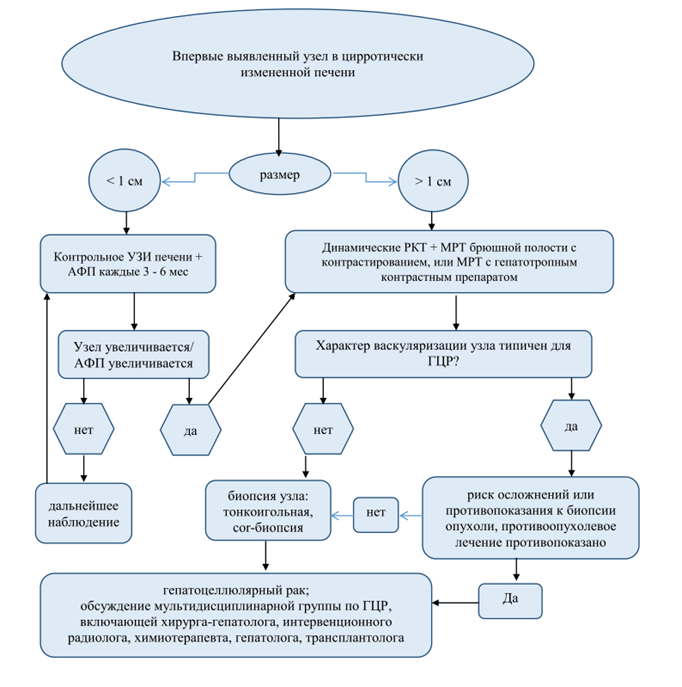
Комментарий: диагноз печеночно-клеточного рака может считаться обоснованным без морфологической верификации, если в цирротическии змененной печени по данным одного из методов (мультифазной КТ или МРТ) выявляют типичные для ГЦР признаки, а именно: диффузное (не кольцевидное) контрастное усиление опухоли размером >1 см в поздней артериальной фазе и «вымывание» контрастного вещества в венозной фазе; в опухолевых узлах размером>2 см выявление псевдокапсулы в отсроченной (равновесной) фазе; рост опухоли менее чем за 6 мес. на 50 % или увеличение размеров опухоли не менеечем на 5 мм за 6 мес. Американская ассоциация по изучению заболеваний печени (AmericanAssociationfortheStudyofLiverDisease, AASLD)/LiverImagingReportingandDataSystem (LI-RADS), Европейская ассоциация по изучению печени (TheEuropeanAssociationfortheStudyoftheLiver, EASL) 2018). В дифференциальной диагностике новообразований печени может использоваться рентгенологическая классификация LI-RADS[9,24]. В рандомизированных исследованиях доказано, что категория LI-RADS 4-5 имеет высокую специфичность (95-100 %) для пациентов группы высокого риска ГЦР с узлом размером >10 мм[25,26].
• Рекомендуется пациентам с ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после или в процессе лечения, выполнить МРТ брюшной полости с применением гепатоспецифического контрастного препарата (гадоксетовой кислоты**) для контроля эффективности лечения[18-23,27].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1 ).
Комментарий. Применение МРТ с гадоксетовой кислотой демонстрирует наиболее высокие значения чувствительности, специфичности и точности в выявлении и дифференциальной диагностике ГЦР по сравнению с КТ с внутривенным контрастированием и МРТ с внутривенным контрастированием с использованием экстрацеллюлярных контрастных препаратов, позволяя тем самым выбрать оптимальную тактику лечения пациентов, а также повлиять на снижение частоты рецидивов и количество смертельных исходов.
• Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить КТ органов грудной клетки, брюшной полости и малого таза для исключения внепеченочных проявлений опухоли, контроля эффективности лечения[14,28].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
• Рекомендуется пациентам с установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить остеосцинтиграфию при наличии болевого синдрома для выявления метастатического поражения костей скелета, контроля эффективности лечения[14].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Для морфологического подтверждения диагноза рекомендуется пациентам с подозрением на ГЦР выполнить биопсию под контролем УЗИ/КТ для уточнения диагноза[8,9] в следующих случаях:
• если по данным КТ или МРТ заподозрено патологическое образование в не цирротической печени;
• если необходимо исключить злокачественную опухоль печени при отсутствии рентгенографических специфических признаков ГЦР в цирротической печени.
Уровень убедительности рекомендаций - с(уровень достоверности доказательств - 5).
Комментарии: пункционная биопсия опухоли печени с получением столбика ткани (cor-биопсия) предпочтительнее аспирационной тонкоигольной биопсии. Биопсия рекомендуется при малом размере опухоли (<2 см) и типичном для ГЦР кровотоке, нетипичной васкуляризации узла размером >2 расхождениях в описании и трактовке контрастных динамических исследований в сочетании с нормальным или незначительно повышенным уровнем АФП, выявлении любого опухолевого образования внецирротической печени[29]. Отрицательный результат биопсии не исключает диагноза злокачественной опухоли печени и предполагает дальнейшее наблюдение с возможностью повторных биопсий. Биопсия локального образования в цирротической печени не нужна, если: 1) не планируется какого-либо лечения в связи с декомпенсированным циррозом и/или другой тяжелой патологией; 2) планируется резекция печени; 3) при циррозе мультифазная КТи МРТ c контрастированием описывают признаки, специфичные для ГЦР (неравномерное контрастирование узла в артериальной фазе, затем «вымывание» в венозной)[30,31].
Для уточняющей диагностики раннего и высокодифференцированного ГЦР Международная консенсуснаягруппа по опухолям печени рекомендует панель из 3 иммуногистохимических маркеров - HSP70 (HSPA7), глипикана 3 (GPC3) и глутаминсинтетазы (GS), а для выявления прогностически неблагоприятных случаев - цитокератин 19 (СК 19). В сложных для диагностики случаях целесообразно отправить гистопрепараты для исследования в специализированные центры. При выявлении смешанного гепатохолангиоцеллюлярного рака целесообразно определение микросателлитного статуса опухоли.
• Рекомендуется выполнить позитронно-эмиссионную томографию с фтордезоксиглюкозой[18F], совмещенную с КТ, у пациентов с установленным диагнозом ГЦР, являющихся кандидатами на оперативное лечение, если имеется подозрение на отдаленные метастазы по данным КТ или МРТ,и их подтверждение приведет к отказу от операции[14,32].
Уровень убедительности рекомендаций-C(уровень достоверности доказательств - 4).
• Рекомендуется пациентам с установленным диагнозом ГЦР при подозрении на метастазирование в головной мозг выполнить МРТ или КТ головного мозга с внутривенным контрастированием[18].
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
• Рекомендуется установить стадию ГЦР по классификацииTNM (8-й редакции), AJCCиBCLCдля повышения точности диагностики [8,9,33-35].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
При выявлении у пациентов с ГЦР выраженного артериовенозного фистулирования или наличии артериопортального шунта с контрастированием ствола воротной вены или её долевых ветвей ТАХЭ не показана. Пациентам с наличием артериовенозного фистулирования на Iэтапе эндоваскулярного лечения (перед ТАХЭ) показана эмболизация печеночных артерий с целью окклюзии артериовенозных фистул[36,37].
Чаще всего ГЦР развиваетсяна фоне хронического заболевания печени - цирроза печени, вирусного гепатита, стеатогепатита - которое, как и опухолевый процесс, может проявляться специфическими симптомами, нуждаться в специфической терапии, конкурентно влиять на качество жизни и ухудшать выживаемость. В рамках мультидисциплинарной оценки состояния пациента необходимо оценить функциональные резервы печени, выраженность фоновой патологии печени и распространенность опухолевого процесса.
2,1 Жалобы и анамнез.
• Рекомендуется при сборе жалоб и анамнеза активное выявление факторов риска развития хронических заболеваний печени (злоупотребление алкоголем, прием наркотиков, анаболических стероидов, перенесенный вирусный гепатит(ы) и признаки метаболического синдрома, включающего ожирение, сахарный диабет, артериальную гипертензию)с целью выявления факторов, которые могут повлиять на выбор тактики лечения [3,6,8].Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
2,2 Физикальное обследование.
• Рекомендуется пациентам при подозрении на ГЦР или с установленным диагнозом ГЦР выполнить стандартный врачебный осмотр, включая оценку нутритивного статуса, наличие симптомов хронического заболевания печени (асцита, желтухи, энцефалопатии, кровотечений, спленомегалии)[8,9].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: Следует стремиться разграничить вызванные опухолью симптомы и длительно существующие симптомы цирроза печени и его осложнений.
2,3 Лабораторные диагностические исследования.
• Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР с целью определения этиологии и выраженности сопутствующего заболевания печени, а также выявления показаний к назначению сопутствующей противовирусной терапии определить антитела к поверхностному антигену (HBsAg) вируса гепатита в (Hepatitis в virus) и антитела классов M и G (anti-HCV IgG и anti-HCV IgM) к вирусу гепатита с (Hepatitis с virus) в крови; при положительном результате теста на HBsAg необходимо определение антигена (HbeAg) вируса гепатита в (Hepatitis в virus) в крови, и определение ДНК HBV(количественный тест) и РНК-ВГД (качественный тест); при положительном результате теста наanti-HCV-исследование на РНК-ВГС (количественный тест и генотип вируса).[8-11].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения для объективной оценки степени выраженности изменений в гемограмме и выявления возможного нарушения функции печени и почек выполнить общий (клинический) анализ крови развернутый(с подсчетом количества тромбоцитов) и анализ крови биохимический общетерапевтический - с измерением уровня сывороточного альбумина, общего и прямого билирубина, мочевины и креатинина, АЛТ, АСТ, ГГТ, ЩФ - анализ крови, определение протромбинового времени и международного нормализованного отношения, общий (клинический) анализ мочи [3,9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить определение концентрации в плазме опухолеспецифического маркера альфа-фетопротеина (АФП)для оценки агрессивности заболевания и прогноза его течения, контроля эффективности лечения.[8].
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
Комментарии: Результат анализа на АФП считается положительным, если уровень АФП >100 нг/мл [12]или если он увеличивался на 7 нг/мл в месяц по результатам 3 последовательных измерений [13]. Следует учитывать, что уровень АФП также может повышаться при хронических заболеваниях печени, например, при острых и хронических вирусных гепатитах, при других онкологических заболеваиях (гепатоидном раке желудка, герминогенных опухолях ), при беременности.
Оценка функционального статуса печени.
• Рекомендуется пациентам с установленным диагнозом ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, оценить функциональный статус печени по критериям сhild - Pugh (Приложение Г1) с целью оценки степени нарушения функций печенидля определения переносимости планируемого лечения или токсичности проводимого противоопухолевого лечения и прогноза течения цирроза печени[8,9,14,15].
Уровень убедительности рекомендаций -А (уровень достоверности доказательств -1).
Комментарий: цирроз печени, частое сопутствующее заболевание печени, определяет переносимость основных методов лечения, вплоть до невозможности проведения лечения, негативно и конкурентно с ГЦР влияет на общую выживаемость. Совместно с гастроэнтерологом или терапевтом необходимо своевременно профилактировать, выявлять и лечить осложнения цирроза печени.
2,4 Инструментальные диагностические исследования.
• При подозрении или выявлении малого объемного образования в печени пациента, относящегося к группе высокого риска печеночно-клеточного рака (цирроз печени любой этиологииChild-Pughкласс А и В, цирроз печени сhild-Pugh класс С, находящиеся в листе ожидания трансплантации печени, больные хроническим вирусным гепатитом В с промежуточным или высоким риском развития ГЦР (в соответствиями с классомPAGE-B, соответственно 10-17 и ≥18 баллов), пациенты с фиброзом печени F3 степени в зависимости от наличия других индивидуальных факторов риска) независимо от уровня АФП, при положительном результате анализа на АФП пациентам с подозрением на ГЦР рекомендуется мультифазная компьютерная томография (КТ) печени и брюшной полости с контрастированием и / или магнитно-резонансная томография (МРТ) печени и брюшной полости с контрастированием независимо от результатов ультразвукового исследования(УЗИ) печени для уточнения диагноза и степени распространенности опухолевого процесса[8,9,14,16-18] .Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
• Рекомендуется использование МРТ с гепатоспецифическим контрастным препаратом гадоксетовой кислоты для выявления раннего ГЦР (до 2,0 см) у пациентов с сопутствующим циррозом печени любой этиологии [19-21].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
Комментарий: диагностика раннего ГЦР и своевременное начатое лечение имеют решающее значение для улучшения прогноза и качества жизни пациентов, повышая тем самым долгосрочную выживаемость. Особенности накопления и вымывания контрастного препарата из опухолевых тканей в артериальную, венозную и отсроченные фазы при использовании экстрацеллюлярных магнитно-резонансных контрастных препаратов в ряде случаев не позволяют выявлять и корректно дифференцировать новообразования, в том числе малых размеров. Гиперинтенсивность печеночной паренхимы в гепатоспецифическую фазу позволяет отчетливо визуализировать гипоинтенсивные очаги малых размеров и с учетом особенностей их контрастирования в предыдущие фазы исследования, дифференцировать ранний ГЦР от прочих новообразований печени, в тч и от регенераторных и диспластических узлов, что в ряде случаев может повлиять на изменение стадии опухолевого процесса.
• Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом выполнять МРТ печени с гепатоспецифическим контрастным препаратом гадоксетовой кислоты для корректного стадирования опухолевого процесса перед началом лечения[18-23].
Уровень убедительности рекомендаций - A(уровень достоверности доказательств - I).
Комментарий: в ряде систематических обзоров рандомизированных клинических исследований с применением мета-анализа доказана высокая информативность МРТ с применением гепатоспецифического контрастного препарата гадоксетовой кислоты по сравнению с КТ и МРТ с использованием экстрацеллюлярных контрастных препаратов в выявлении и дифференциальной диагностике ГЦР.
• Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить ультразвуковое исследование (УЗИ) органов брюшной полости и забрюшинного пространства, в том числе, печени, включая бассейн воротной вены, для оценки степени распространенности ГЦР, выявления осложнений ГЦР и/или цирроза и их контроля[14].
Уровень убедительности рекомендаций -С(уровень достоверности доказательств - 5).
Комментарий. УЗИ применяется на этапе скрининга в группе риска развития ГЦР, при осуществлении чрескожной биопсии, интервенционных вмешательств ииногдамониторинга эффективности лечения. Обязательна оценка проходимости бассейна воротной вены. Чувствительность УЗИ невысока для обнаружения узлов малого размера. УЗИ с контрастным усилением обладает преимуществом в выявлении гиперваскуляризованных узлов, что может использоваться при дифференциальной диагностике очаговых образований печени.
• Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить эзофагогастродуоденоскопию для выявления одного из осложнения портальной гипертензии - варикозного расширения вен пищевода и желудка, оценки степени его выраженности и показаний к лечебно-профилактическим мероприятиям[9].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам с установленным диагнозом ГЦР, планируемым к проведению или получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить четырехфазную компьютерную томографию (КТ) (нативная, артериальная, венозная и отсроченная венозная фазы) и/или динамическую магнитно-резонансную томографию (МРТ) печени с внутривенным контрастированием для оценки распространенности опухолевого процесса и выявления ее изменений: определяют количество и размеры опухолевых узлов внутри печени, наличие сосудистой инвазии и тромбоза, внепеченочного распространения, контроля эффективности лечения[8,9,14,16-18].
Уровень убедительности рекомендаций - A(уровень достоверности доказательств - I).
Комментарий: диагноз печеночно-клеточного рака может считаться обоснованным без морфологической верификации, если в цирротическии змененной печени по данным одного из методов (мультифазной КТ или МРТ) выявляют типичные для ГЦР признаки, а именно: диффузное (не кольцевидное) контрастное усиление опухоли размером >1 см в поздней артериальной фазе и «вымывание» контрастного вещества в венозной фазе; в опухолевых узлах размером>2 см выявление псевдокапсулы в отсроченной (равновесной) фазе; рост опухоли менее чем за 6 мес. на 50 % или увеличение размеров опухоли не менеечем на 5 мм за 6 мес. Американская ассоциация по изучению заболеваний печени (AmericanAssociationfortheStudyofLiverDisease, AASLD)/LiverImagingReportingandDataSystem (LI-RADS), Европейская ассоциация по изучению печени (TheEuropeanAssociationfortheStudyoftheLiver, EASL) 2018). В дифференциальной диагностике новообразований печени может использоваться рентгенологическая классификация LI-RADS[9,24]. В рандомизированных исследованиях доказано, что категория LI-RADS 4-5 имеет высокую специфичность (95-100 %) для пациентов группы высокого риска ГЦР с узлом размером >10 мм[25,26].
• Рекомендуется пациентам с ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после или в процессе лечения, выполнить МРТ брюшной полости с применением гепатоспецифического контрастного препарата (гадоксетовой кислоты**) для контроля эффективности лечения[18-23,27].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1 ).
Комментарий. Применение МРТ с гадоксетовой кислотой демонстрирует наиболее высокие значения чувствительности, специфичности и точности в выявлении и дифференциальной диагностике ГЦР по сравнению с КТ с внутривенным контрастированием и МРТ с внутривенным контрастированием с использованием экстрацеллюлярных контрастных препаратов, позволяя тем самым выбрать оптимальную тактику лечения пациентов, а также повлиять на снижение частоты рецидивов и количество смертельных исходов.
• Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить КТ органов грудной клетки, брюшной полости и малого таза для исключения внепеченочных проявлений опухоли, контроля эффективности лечения[14,28].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
• Рекомендуется пациентам с установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить остеосцинтиграфию при наличии болевого синдрома для выявления метастатического поражения костей скелета, контроля эффективности лечения[14].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Для морфологического подтверждения диагноза рекомендуется пациентам с подозрением на ГЦР выполнить биопсию под контролем УЗИ/КТ для уточнения диагноза[8,9] в следующих случаях:
• если по данным КТ или МРТ заподозрено патологическое образование в не цирротической печени;
• если необходимо исключить злокачественную опухоль печени при отсутствии рентгенографических специфических признаков ГЦР в цирротической печени.
Уровень убедительности рекомендаций - с(уровень достоверности доказательств - 5).
Комментарии: пункционная биопсия опухоли печени с получением столбика ткани (cor-биопсия) предпочтительнее аспирационной тонкоигольной биопсии. Биопсия рекомендуется при малом размере опухоли (<2 см) и типичном для ГЦР кровотоке, нетипичной васкуляризации узла размером >2 расхождениях в описании и трактовке контрастных динамических исследований в сочетании с нормальным или незначительно повышенным уровнем АФП, выявлении любого опухолевого образования внецирротической печени[29]. Отрицательный результат биопсии не исключает диагноза злокачественной опухоли печени и предполагает дальнейшее наблюдение с возможностью повторных биопсий. Биопсия локального образования в цирротической печени не нужна, если: 1) не планируется какого-либо лечения в связи с декомпенсированным циррозом и/или другой тяжелой патологией; 2) планируется резекция печени; 3) при циррозе мультифазная КТи МРТ c контрастированием описывают признаки, специфичные для ГЦР (неравномерное контрастирование узла в артериальной фазе, затем «вымывание» в венозной)[30,31].
Для уточняющей диагностики раннего и высокодифференцированного ГЦР Международная консенсуснаягруппа по опухолям печени рекомендует панель из 3 иммуногистохимических маркеров - HSP70 (HSPA7), глипикана 3 (GPC3) и глутаминсинтетазы (GS), а для выявления прогностически неблагоприятных случаев - цитокератин 19 (СК 19). В сложных для диагностики случаях целесообразно отправить гистопрепараты для исследования в специализированные центры. При выявлении смешанного гепатохолангиоцеллюлярного рака целесообразно определение микросателлитного статуса опухоли.
• Рекомендуется выполнить позитронно-эмиссионную томографию с фтордезоксиглюкозой[18F], совмещенную с КТ, у пациентов с установленным диагнозом ГЦР, являющихся кандидатами на оперативное лечение, если имеется подозрение на отдаленные метастазы по данным КТ или МРТ,и их подтверждение приведет к отказу от операции[14,32].
Уровень убедительности рекомендаций-C(уровень достоверности доказательств - 4).
• Рекомендуется пациентам с установленным диагнозом ГЦР при подозрении на метастазирование в головной мозг выполнить МРТ или КТ головного мозга с внутривенным контрастированием[18].
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
• Рекомендуется установить стадию ГЦР по классификацииTNM (8-й редакции), AJCCиBCLCдля повышения точности диагностики [8,9,33-35].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
2,5 Иные диагностические исследования.
Диагностические ангиографические методики являются неотъемлемой частью эндоваскулярного лечебного вмешательства у пациентов с ГЦР, позволяющие оценить состояние чревного ствола и его ветвей, уточнить анатомический вариант кровоснабжения печени, определить уровень васкуляризации опухолевых узлов, уточнить наличие артерио-портальных или артериовенозных шунтов. Полученные диагностические данные имеют важное значение в определении, как возможности выполнения, так и планирования последующей трансартериальнойхимиоэмболизации (ТАХЭ) печени.При выявлении у пациентов с ГЦР выраженного артериовенозного фистулирования или наличии артериопортального шунта с контрастированием ствола воротной вены или её долевых ветвей ТАХЭ не показана. Пациентам с наличием артериовенозного фистулирования на Iэтапе эндоваскулярного лечения (перед ТАХЭ) показана эмболизация печеночных артерий с целью окклюзии артериовенозных фистул[36,37].
|
|
Лечение
Разработка плана лечения по результатам диагностики должна быть отнесена ккомпетенции специализированной мультидисциплинарной группы по ГЦР, функционирующей на базе специализированных центров. При выборе стратегии лечения пациентов с ГЦР приоритет должен отдаваться противоопухолевому специализированному лечению с использованием методов, позволяющих увеличить выживаемость.
Радикальное лечение раннего локализованного ГЦР включает резекцию печени, ортотопическую трансплантацию печени и применение местно-деструктивных аблативных методов (радиочастотную, микроволновую аблацию )[8,9,14].
Паллиативное лечение ГЦР направлено на достижение контроля над проявлениями болезни, призвано увеличивать продолжительность и улучшать качество жизни пациентов. Паллиативное специализированное лечение включает интервенционно-радиологическое лечение (различные виды эмболизации) и системную химиотерапию [8,9,14].
План лечения вырабатывается на основании результатов объективного обследования мультидисциплинарной командой специалистов (включающей врача-радиолога, врача-хирурга (гепатолога), врача по рентгеноэндоваскулярным диагностике и лечению, врача-онколога, врача-гастроэнтеролога, имеющих опыт работы с пациентами с ГЦР на базе специализированных центров.
Поскольку ГЦРв большинстве случаев выявляется в цирротически измененной печени, прогноз жизни для этих пациентов определяется не только степенью распространения опухоли, но и степенью дисфункции печени и объективным состоянием пациентов.
Уровень убедительности рекомендаций - В(уровень достоверности доказательств - 3).
Комментарии. Основным условием, которое должно выполняться при планировании резекции печени является сохранение в предполагаемой остающейся части паренхимы печени адекватного кровоснабжения, крово - и желчеоттока. Объем предполагаемой остающейся паренхимы печени должен составлять при отсутствии лабораторных и инструментальных признаков цирроза не менее 25% (отнепораженной паренхимы), при их наличии не менее 40%. В случае недостаточного объема паренхимы возможна рентген-интервенционная эмболизация ветви воротной вены в предполагаемой для удаления до лепечени.
Приналичииубольноголабораторныхиинструментальныхпризнаковцирроза, следует учитывать степень нарушения печено-клеточной функции (резекция печени целесообразна у больных соответствующих классу А по шкале сhild - Pugh) и выраженность портальной гипертензии (клинически значимые проявления: наличие варикозно-расширенных вен пищевода, тромбоцитопения менее 100x109/л).
В условиях специализированных центров (при наличии подготовленного персонала и оборудования) возможно выполнение резекций печени мини-инвазивным доступом под видеоэдоскопическим контролем. Предпочтительным для планирования применения данного доступа являются подкапсульно расположенные образования, а также узлы, располагающиеся в латеральных секторах печени.
Следует учитывать, что большой размер опухоли и/или множественное внутриорганное поражение, наличие инвазии магистральных сосудов, метастатическое поражение регионарных лимфатических узлов не являются абсолютным противопоказанием к резекции печени, однако результаты хирургического лечения в этих случаях предсказуемо хуже.
• Рекомендуется ортотопическая трансплантация печени при раннем ГЦР(BCLC 0. А) в случаях, не подходящих для резекции, при соответствии принятым критериям (показаниям) к трансплантации при ГЦР[8,9,14,43-45].
Уровень убедительности рекомендаций - A(уровень достоверности доказательств - 2).
Комментарии. Чаще используются так называемые «миланские» критерии - размер единственной опухоли ≤5 см или наличие в печени не более 3 очагов с диаметром наибольшего узла ≤3 см и отсутствием инвазии в сосуды[6,8,9]. Показания и противопоказания к выполнению трансплантации печени определяются врачом-трансплантологом. Трансплантация печени у пациентов с нерезектабельной формой ГЦР (например, фиброламеллярная ГЦК) в отсутствие фонового заболевания печени (цирроз, гепатит) является наиболее радикальным методом. К таким пациентам не должны применяться «миланские» критерии. Важно: отсутствие внепеченочного распространения (строго), отсутствие макрососудистой инвазии (желательно)[46-49].
В целях объективного стадирования и селекции пациентов на трансплантацию печени необходимо исключить внепеченочное распространение.КТ органов грудной клетки является обязательным методом исследования для пациентов с ГЦР, планирующимся на трансплантацию печени[46].
• вridge-терапия (терапия «ожидания», которая направлена на замедление прогрессирования опухоли и уменьшение вероятности выбытия из листа ожидания трансплантации) рекомендуется пациентам, ожидающим трансплантации печени, для увеличения вероятности выполнения трансплантации печени, улучшения селекции и исключения агрессивных случаев ГЦР[6,9,50,51].
• Терапия «понижения стадии» (down-staging, направлена на уменьшение внутрипеченочной распространенности опухолевого процесса при отсутствии внепеченочных изменений) рекомендуется пациентам с локализованным ГЦР превышающим стандартные критерии для трансплантации печени и при условии достижения объективного противоопухолевого эффекта локо-регионарной и/или системной терапии в виде уменьшения внутрипеченочной распространенности до принятых критериев трансплантации печени [45].
Уровень убедительности рекомендаций - A(уровень достоверности доказательств - 2).
Комментарии:Bridge-терапия и терапия «понижения стадии» включает аблацию, трансартериальную химиоэмболизацию, резекцию печени, лекарственную терапию или сочетание методов. Трансплантация печени после уменьшения внутрипеченочной распространенности опухоли в результате противоопухолевой терапии до принятых критериев трансплантации печени ассоциируется со значимым увеличением общей выживаемости по сравнению с использованием методов консервативного лечения.
• Рекомендуется пациентам с ГЦР и сопутствующем хроническим гепатитом В (HBsAg+, ДНК-ВГВ>2000 МЕ/мл) противовирусная терапия аналогами нуклеозидов (энтекавир** или тенофовирадифумаратили тенофовираалафенамид**);после радикального лечения ранних стадий ГЦР она увеличивает безрецидивную и общую выживаемость[52,53,125].
Уровень убедительности рекомендаций-В (уровень достоверности доказательств - 2).
• TEGb Рекомендуется пациентам с ГЦР и сопутствующим хроническим гепатитомС (РНК-ВГС+)противовирусная терапия противовирусными препаратами прямого действия при компенсированном поражении печени) TEGb https://cr.minzdrav.gov.ru/recomend/516_2, после радикального лечения ранних стадий ГЦР она увеличивает безрецидивную и общую выживаемость[54-56,126].
Уровень убедительности рекомендаций-С(уровень достоверности доказательств - 4.
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Рекомендуется применять метод чрескожной деструкции (химической аблацииэтанолом)опухоли у пациентов с ГЦР на фоне цирроза стадии вCLC 0 (солитарная опухоль до 2 см в диаметре) как метод терапии при невозможности выполнения хирургического лечения (резекции печени или трансплантации печени) и невозможности проведения энергической аблации[58].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Рекомендуется применять метод локальной деструкции (химической аблацииэтанолом) как дополнение к энергетической аблации при лечении опухолей диаметром более 3 см и опухолей, прилежащих к крупным сосудам (у неоперабельных больных)[59].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 1).
• Рекомендуется рассматривать возможность применения методов локальной деструкции (энергетической и химической аблации) в сочетании с другими видами лечения, в том числе c внутриартериальной терапией и хирургическим лечением[60-62, 127].
Уровень убедительности рекомендаций -С(уровень достоверности доказательств 4).
• Рекомендуется применение методов локальной деструкции в виде энергетической и химической аблации (если это технически возможно), в случаях локального прогрессирования и локального рецидива заболевания после ранее выполненной резекции печени или аблации опухоли при невозможности выполнения хирургического лечения [63].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств 2).
Комментарии: Основным критерием при определении показаний является техническая возможность выполнения вмешательства с минимальным риском развития осложнений. Деструкции подлежат не более 5 узлов диаметром ≤3 см Возможна деструкция узлов большего диаметра, но частота локальных рецидивов существенно увеличивается при опухолях >3 см в наибольшем измерении. В ряде случаев целесообразно выполнять аблацию после проведения предварительной трансартериальной (химио-)эмболизации опухоли печени или осуществлять энергетическую аблацию в комбинации с чрескожнымвнутриопухолевым введением этилового спирта (химическая аблация). Локальная деструкция противопоказана при множественном поражении печени, декомпенсированном циррозе (класса с по сhild - Pugh), внепеченочных проявлениях заболевания, при наличии портального шунта, несмещаемом прилежании опухолевого узла к рядом расположенным полым органам, а также к вне(внутри-)печеночно расположенным трубчатым структурам[64-66]. В качестве методов локальной деструкции (энергетической аблации) рекомендуется использовать радиочастотную аблацию, микроволновую аблацию и криоаблацию. В качестве метода локальной деструкции (химической аблации) рекомендуется использовать чрескожное введение этилового спирта [67-70].
• Рекомендуется дистанционная лучевая терапия стереотаксическим методом единичных (1-3) опухолевых узлов при ГЦР стадии вCLC 0-A, в случае наличия противопоказаний к хирургическому лечению и противопоказаний к использованию методов локальной деструкции в виде энергетической или химической аблации[71,72].
Уровень убедительности рекомендаций -B(уровень достоверности доказательств - 2).
• Не рекомендуется пациентам с ГЦР послерадикального (R0) хирургического лечения адъювантная терапия мультикиназными ингибиторами в связи с отсутствием преимуществ перед другими вмешательствами в улучшении выживаемости пациентов [73].
Уровень убедительности рекомендаций -A(уровень достоверности доказательств - 2).
Уровень убедительности рекомендаций. A (уровень достоверности доказательств 2).
Комментарии. Согласно классификации вCLC, ТАХЭ выполняется при лечении пациентов с промежуточной (BCLCB) и ранней (BCLC А)стадиями при противопоказаниях к хирургическому лечению. Проведение ТАХЭ опухоли в печени при наличии внепеченочных проявлений опухолевого процесса не улучшает отдаленных результатов лечения. Показания и противопоказания к проведению ТАХЭ определяются врачом по рентгеноэндоваскулярным диагностике и лечению в составе мультидисциплинарного консилиума.
• Не рекомендуется ТАХЭ пациентам с ГЦР при поражении более 75% объема печени, декомпенсированном циррозе (класса с по сhild - Pugh), тромбозе магистральных ветвей или ствола воротной вены, внепеченочном распространении заболевания, не купируемом асците, почечной недостаточности (уровне креатинина≥2 мг/длили клиренсе креатинина<30 мл/мин), тяжелых нарушениях свертывающей системы крови, желудочно-кишечном кровотечении за последние 3 мес., наличии портального шунта[6,80-83].
Уровень убедительности рекомендаций -А(уровень достоверности доказательств 2).
Комментарии: относительными противопоказаниями к ТАХЭ являются цирроз печени класса в по сhild - Pugh (9 баллов), размер опухоли >10 наличие некомпенсированных сопутствующих заболеваний: нарушений функций органов сердечно-сосудистой, легочной систем, острых инфекционных заболеваний, желудочно-кишечного кровотечения, произошедшего за последние 3 мес., варикозного расширения вен пищевода/желудка IIIстепени с высоким риском кровотечения, желчной гипертензии [80,81] . Выбор метода (селективная, суперселективная, подолевая) и вида артериальной химиоэмболизации (масляная - раствор противоопухолевого препарата + Липиодол Ультра-Флюид; комбинированная - раствор противоопухолевого препарата + Липиодол Ультра-Флюид + микросферы для эмболизации из поливинилацетата ; эмболизация микросферами, элиминирующими противоопухолевого препарата (DEB - drug-elutingbeads)) зависит от клинической ситуации, технических условий и плана лечения. Наиболее часто используемые противоопухолевые препараты - доксорубицин** или эпирубицин** в разовой дозе, аналогичной курсовой дозе препарата, используемой при системном лечении.
• Рекомендуется пациентам с ГЦР оценивать эффективность ТАХЭ по данным динамической контрастной КТ/МРТ по критериям mRECIST (Приложение Г5) через 4-8 недель после процедуры [6,84].
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
• Рекомендуется системная терапия пациентам с ГЦР при отсутствии эффекта от 2 последовательно выполненных сеансов ТАХЭ (при отсутствии зоны некроза в эмболизированных опухолевых узлах, появлении новых узлов в зоне воздействия)для улучшения отдаленных результатов лечения пациентов[6,8,14,80].
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
• Рекомендуется повторная ТАХЭ пациентам с ГЦР при изолированном внутрипеченочном поражении в случаесохранения эффекта после ранее выполненной ТАХЭ более 6 месяцев для улучшения выживаемости пациентов[9].
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
Комментарии: основные противопоказания к трансартериальной радиоэмболизации - поражение >70 % объема печени, наличие артериовенозного шунта.
Уровень убедительности рекомендаций -С (уровень достоверности доказательств - 5).
Комментарий: лучевая терапия проводится в виде конформного облучения 3D-CRT, лучевой терапии с модуляцией интенсивности (IMRT) или стереотаксического облучения (SBRT) под контролем визуализации (IGRT). Применение стереотаксической лучевой терапии представляется оптимальным. Рекомендуется использовать трех или пятидневный режим фракционирования дозы излучения до СОД 30-50Гр у пациентов с сохранной функции печени (класс А или В по сhild - Pugh). SBRT можно рассматривать как альтернативу методам аблации/эмболизации когда эти методы лечения оказались безуспешными или противопоказаны. При невозможности проведения стереотаксической лучевой терапии возможно проведение лучевой терапии с РОД 1,8 Гр до СОД 45 Гр и далее бустом локально на опухоль до СОД 50-60Гр.
• Системная терапия рекомендуется врачом-онкологом пациентам с ГЦР для улучшения выживаемости и контроля роста опухоли при[87-93]:
- наличии объективных признаков опухолевого процесса и удовлетворительном общем состоянии (0-1 балл по шкале ECOG (Приложение Г2));
- сохранной функции печени (класс А или В по сhild - Pugh, 5-7 баллов);
- невозможности применения локальных методов лечения (резекции, трансплантации печени, (химио-) эмболизации опухолевых узлов);
- внутрипеченочном локализованном ГЦР (как терапия ожидания трансплантации);
- внепеченочном метастазировании и/или прогрессировании процесса в печени после применения локальных методов лечения.
Уровень убедительности рекомендаций -A(уровень достоверности доказательств - 1).
Комментарии. Для проведения лекарственной терапии необходима морфологическая (цитологическая/гистологическая) верификация опухолевого процесса, но она не требуется, если на фоне установленного диагнозацирроза печени на мультифазной КТ или динамической контрастной МРТ опытным рентгенологом выявляется типичная для ГЦР рентгенологическая картина гиперваскулярной опухоли печени (с «вымыванием» контраста в венозной фазе).
Декомпенсация цирроза печени конкурентно влияет на общую выживаемость. Необходим мониторинг функции печени, проведение активной профилактики осложнений цирроза печени и их лечение под наблюдением гастроэнтеролога. У пациентов с ГЦР на фоне впервые выявленного декомпенсированного цирроза печени следует провести консультацию гастроэнтеролога для подбора и проведения терапии осложнений цирроза; при улучшении функции печени и удовлетворительном состоянии пациента оправдано повторное обсуждение перспектив противоопухолевого лечения на мультидисциплинарном консилиуме. У пациентов с недавно (давностью до 3 мес.) состоявшимся кровотечением, артериальным или венозным тромбозом, клинически выраженной и плохо компенсируемой сердечно-сосудистой патологией лечение ингибиторами протеинкиназ или прямых ингибиторов неоангиогенеза сопряжено с высоким риском осложнений.
При декомпенсированном циррозе (класса В/С по сhild - Pugh) цитотоксическое лечение не проводится.
Вероятность реактивации вирусных гепатитов на фоне системной противоопухолевой терапии низкая, хотя в случаях HВs-положительного хронического вирусного гепатита В необходима одновременная противовирусная терапия аналогами нуклеозидов в течение всего противоопухолевого лечения.
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. Лечение проводится под наблюдением врача-онколога непрерывно до появления объективных (подтвержденных КТ/МРТ) признаков прогрессирования заболевания, явлений непереносимой токсичности или декомпенсации сопутствующих заболеваний. Комбинация атезолизумаба** и бевацизумаба** по данным рандомизированного клинического исследования 3 фазы (ImBrave150) продемонстрировала достоверное преимущество перед сорафенибом** по общей выживаемости (медиана ОВ - 19,2 месvs. 13,4 мес)и выживаемости без прогрессирования (медиана 6,9 месvs. 4,3 мес). Относительными противопоказанием к терапии являются аутоиммунные заболевания, активная ко-инфекция вирусами гепатита В и С, состоявшееся кровотечение или высокий риск кровотечения из варикозно-расширенных вен пищевода и желудка.
• В качестве альтернативных опций 1 линии системной терапии ГЦР рекомендуются ингибиторы протеинкиназсорафениб** или ленватиниб** [87-90].
Уровень убедительности рекомендаций - А(уровень достоверности доказательств - 2).
Комментарии. Лечение проводится под наблюдением врача-онколога непрерывно до появления объективных (подтвержденных КТ/МРТ) признаков прогрессирования заболевания, явлений непереносимой токсичности или декомпенсации сопутствующих заболеваний. Опухолевый тромбоз ствола воротной вены не является противопоказанием к лечению сорафенибом**. Терапия ГЦР, прогрессирующего после трансплантации печени (на фоне иммуносупрессивной терапии), сопровождается более выраженной токсичностью.Переносимость ленватиниба ** в этой группе пациентов изучена недостаточно; рекомендуется начинать с 8 мг/сут, при хорошей переносимости в течение 10-14 дней доза может быть увеличена до 12 мг/сут.
Режим применения ленватиниба** зависит от исходного веса пациента: для больных с массой тела ≥60 кг лечение начинается с дозы 12 мг/сут однократно, для пациентов с массой <60 кг - с разовой суточной дозы 8 мг.
Токсические эффекты, ассоциированные с применением сорафениба** и ленватиниба** (диарея, артериальная гипертония, ладонно-подошвенный синдром), являются биологическим предиктором лучшей выживаемости при условии продолжения терапии, целесообразно предпринять все меры по коррекции токсических эффектов, в первую очередь своевременно снизить суточную дозу препарата.
• У пациентов с начальными признаками декомпенсации цирроза печени или при противопоказаниях к использованию ингибиторов протеинкиназ в качестве альтернативы (Child-PughB, 7 баллов) рекомендуется иммунотерапия ниволумабом** для улучшения контроля роста опухоли и выживаемости пациентов в одном из рекомендованных режимов лечения[94].
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 3).
А) после иммунотерапии рассматриваются ингибиторы протеинкиназсорафениб** или ленватиниб**, регорафениб** или кабозантиниб** или рамуцирумаб** (при уровне АФП>400 нг/мл), эффективность комбинированной иммунотерапии неизвестна.
В) после ингибиторов протеинкиназ могут использоваться регорафениб**, кабозантиниб**, рамуцирумаб** или иммунотерапия.
• Рекомендуется регорафениб** в качестве 2 линии терапии ГЦР при его прогрессировании на фоне1-й линии препаратами из группы ингибиторов протеинкиназы (мультикиназными ингибиторами) (таблица2)для улучшения контроля роста опухоли и выживаемости пациентов[91].
Уровень убедительности рекомендаций - А(уровень достоверности доказательств - 2).
Комментарии: регорафениб**назначается, если в1-й линии терапии сорафенибом** в дозе ≥400 мг/сут была отмечена его переносимость, при условии удовлетворительного состояния пациента (ECOG 0/1)и компенсированной функции печени (классе A поChild - Pugh) в стандартном режиме - 160 мг/сут однократно в 1-21-й дни, курс 4 нед., а пациентам, имеющим факторы риска развития токсичности (на фоне приема сорафениба** в дозе 400 мг/сут эпизоды декомпенсации цирроза печени, плохо контролируемая сопутствующая патология), - в начальной дозе 120 мг/сут в 1-21-й дни 4-недельного цикла. При начале лечения в сниженной дозе при отсутствии токсичности IIи последующих степеней через 10-12 дней от начала курса оправданноувеличение суточной дозы до стандартной рекомендуемой (160 мг/сут).
• Рекомендуется кабозантиниб** 60 мг в день в качестве 2-3 линии терапии ГЦР после прогрессирования на фоне терапии сорафенибом**(таблица 2)[92].
Уровень убедительности рекомендаций - А(уровень достоверности доказательств - 2).
• Рекомендуется в качестве 2 линии моноклональное антитело к VEGFR 2 типа рамуцирумаб** в дозе 8 мг/кг внутривенно каждые 2 недели до прогрессирования или непереносимой токсичности больным в удовлетворительном состоянии (ECOG 0/1) и при компенсированной функции печени (Child - Pugh A)[95].
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 2).
Комментарии: назначается при прогрессировании ГЦР на терапии сорафенибом** у пациентов с уровнем АФП≥400 нг/мл. Препарат назначается пациентам, удовлетворительно переносившим терапию сорафенибом** (≥400 мг/день).
• Рекомендуется терапия препаратами моноклональных антител. Ингибиторами контрольных точек иммунного надзора ниволумабом** или пембролизумабом** в качестве 2-й и 3-й линий терапии прогрессирующего ГЦР, а также у пациентов, не переносящих препараты из группы ингибиторов протеинкиназ (мультикиназные ингибиторы) сорафениб**/ленватиниб**/регорафениб**/кабозантиниб**или имеющих противопоказания к терапии этими препаратами (таблица 2)для улучшения контроля роста опухоли и выживаемости пациентов[14,94,96].
Для пембролизумаба. Уровень убедительности рекомендаций - В (уровень достоверности доказательств 2).
Для ниволумаба. Уровень убедительности рекомендаций - с (уровень достоверности доказательств 4).
Комментарии. Пациентам назначается ниволумаб** в одном из дозовых режимов (выбор режима не влияет на клиническую эффективность) или пембролизумаб** до клинически значимого прогрессирования опухоли. Оправдано применение ниволумаба** у пациентовс классом Вцирроза печени по сhild - Pugh (7-9 баллов). Нет данных о негативном влиянии иммунотерапии на течение цирроза печени.
Фиброламеллярная карцинома, как правило, нечувствительна к терапии препаратами из группы моноклональных антител к PD-1 (ингибиторамконтрольных точек иммунного надзора).
• Рекомендуется иммунотерапия ГЦР, прогрессирующего на лечении ингибиторами протеинкиназ с использованием комбинации ниволумаб**+ипилимумаб** в качестве 2-й и 3-й линий терапии[97].
Уровень убедительности рекомендаций-В(уровень достоверности доказательств 3).
Комментарии. Режим комбинированной иммунотерапии ниволумаб** 1 мг/кг + ипилимумаб** 3 мг/кг в/в 1 раз в 3 недели 4 курса, далее поддерживающая терапия ниволумабом** в режиме 240 мг 1 раз в 2 недели или 480 мг 1 раз в 4 недели до прогрессирования или непереносимой токсичности; в исследовании 1-2b фазы зарегистрировано 32% объективных эффектов, медиана выживаемости в группе составила 22,8 мес.
• Рекомендуется терапия противоопухолевыми цитостатическими препаратами(таблица2) в качестве лечебной опции у пациентов с ГЦР без цирроза, например, при фиброламеллярной карциноме в качестве 2-й линии терапии для улучшения контроля роста опухоли, улучшения качества жизни пациентов[14,94,98-100].
Уровень убедительности рекомендаций -С(уровень достоверности доказательств 5).
Комментарии. Применяются платиносодержащие режимы в сочетании с гемцитабином**[99, 121, 124](таблица 2). При смешанном гистологическом варианте - гепатохолангиоцеллюлярном раке в 1-й линии лечения предпочтение отдается цитостатической химиотерапии, поскольку считается, что прогноз жизни определяется холангиоцеллюлярным компонентом опухоли, как наиболее злокачественным. Она не увеличивает продолжительность жизни и эффективна в менее чем в 20 % случаев.
• Рекомендуется для оценки эффективности противоопухолевого лечения у пациентов с ГЦР проводить мультифазную КТ и/или МРТ (с контрастным усилением) каждые 2-3 мес. по критериям RECIST 1,1 (Приложение Г4) и/или mRECIST (для опухолевого поражения печени при циррозе) [101].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии. Определение уровня АФП в плазме в динамике показано пациентам с исходно высоким его значением; самостоятельного клинического значения этот показатель не имеет, однако в ряде исследований отмечена прямая корреляция эффективности проводимого лечения и изменения концентрации АФП.
Уровень убедительности рекомендаций -B(уровень достоверности доказательств - 2).
Комментарии. Возможно одновременное проведение системной химиотерапии и курса лечения прямыми противовирусными препаратами у пациентов с компенсированной функцией печени. Клинически значимых межлекарственных взаимодействий между прямыми противовирусными препаратами и средствами для химиотерапии ГЦР не описано.
• Рекомендуется при варикозном расширении вен пищевода/желудка II-IIIстепени у пациентов с ГЦР на фоне цирроза печени проводить первичную профилактику желудочно-пищеводного кровотечения бета-адреноблокаторами[102,103, 128].
Уровень убедительности рекомендаций -C(уровень достоверности доказательств 4).
Комментарии: при неэффективности медикаментозного лечения варикозного расширения вен пищевода и/или желудка III степени, при угрозе кровотечения, а также для вторичной профилактики рецидивного кровотечения выполняют лигирование/склерозирование варикозно-расширенных вен[6,9,102,103, 151].
• TEGb Рекомендуется пациентам ГЦР cцирротическим асцитом и с гипоальбуминемией (менее 28 г/л) на фоне цирроза печени проводить заместительную курсовую терапию 20%-раствором альбумина человека** (100-200 мл/день) до целевого уровня >35 г/л [https://cr.minzdrav.gov.ru/recomend/715_1, 104,105].
Уровень убедительности рекомендаций -А(уровень достоверности доказательств - 2).
Комментарии: наиболее высокая вероятность развития кровотечения из варикозно-расширенных вен пищевода/желудка у пациентов с циррозом печени при опухолевом тромбозе ствола и магистральных ветвей воротной вены. Информация по лечению цирроза печени представлена в клинических рекомендациях «Цирроз и фиброз печени» https://cr.minzdrav.gov.ru/recomend/715_1).
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии: выбор метода лечения болевого синдрома определяется степенью выраженности боли у пациента. Детальный алгоритм лечения болевого синдрома представлен в методических рекомендациях «Практические рекомендации по лечению хронического болевого синдрома у взрослых онкологических больных» (коллектив авторов: Когония Л.М., Новиков Г.А., Орлова Р.В., Сидоров А.В., Королева И.А., Сакаева Д.Д.
Злокачественные опухоли: Практические рекомендации RUSSCO 3s2, 2021 (том 11). 49.
Https://rosoncoweb.ru/standarts/RUSSCO/2021/2021-49.pdf.
При выборе медикаментозной терапии болевого синдрома следует учитывать особенности метаболизма препаратов в условиях цирроза печени и/или печеночной недостаточности: нестероидные противовоспалительные препараты при продленном использовании негативно влияют на функцию печени.
Радикальное лечение раннего локализованного ГЦР включает резекцию печени, ортотопическую трансплантацию печени и применение местно-деструктивных аблативных методов (радиочастотную, микроволновую аблацию )[8,9,14].
Паллиативное лечение ГЦР направлено на достижение контроля над проявлениями болезни, призвано увеличивать продолжительность и улучшать качество жизни пациентов. Паллиативное специализированное лечение включает интервенционно-радиологическое лечение (различные виды эмболизации) и системную химиотерапию [8,9,14].
План лечения вырабатывается на основании результатов объективного обследования мультидисциплинарной командой специалистов (включающей врача-радиолога, врача-хирурга (гепатолога), врача по рентгеноэндоваскулярным диагностике и лечению, врача-онколога, врача-гастроэнтеролога, имеющих опыт работы с пациентами с ГЦР на базе специализированных центров.
Поскольку ГЦРв большинстве случаев выявляется в цирротически измененной печени, прогноз жизни для этих пациентов определяется не только степенью распространения опухоли, но и степенью дисфункции печени и объективным состоянием пациентов.
3,1 Хирургическое лечение.
• Рекомендуется резекция печени как метод выбора при лечении больных локализованным ГЦР без лабораторных и инструментальных признаков цирроза. Выполнение оперативного вмешательства должно рассматриваться в первоочередном порядке при наличии у больных ГЦР соответствующего стадии вCLC 0/A, а также при вCLCB в случаях ограниченного поражения печени и у отобранной группы вCLC с (при наличии опухолевого тромбоза сегментарных ветвей воротной вены; солитарного метастатического поражения лимфатического узла гепатодуоденальной связки)[6,8,42,9,14,34,35,38-41].Уровень убедительности рекомендаций - В(уровень достоверности доказательств - 3).
Комментарии. Основным условием, которое должно выполняться при планировании резекции печени является сохранение в предполагаемой остающейся части паренхимы печени адекватного кровоснабжения, крово - и желчеоттока. Объем предполагаемой остающейся паренхимы печени должен составлять при отсутствии лабораторных и инструментальных признаков цирроза не менее 25% (отнепораженной паренхимы), при их наличии не менее 40%. В случае недостаточного объема паренхимы возможна рентген-интервенционная эмболизация ветви воротной вены в предполагаемой для удаления до лепечени.
Приналичииубольноголабораторныхиинструментальныхпризнаковцирроза, следует учитывать степень нарушения печено-клеточной функции (резекция печени целесообразна у больных соответствующих классу А по шкале сhild - Pugh) и выраженность портальной гипертензии (клинически значимые проявления: наличие варикозно-расширенных вен пищевода, тромбоцитопения менее 100x109/л).
В условиях специализированных центров (при наличии подготовленного персонала и оборудования) возможно выполнение резекций печени мини-инвазивным доступом под видеоэдоскопическим контролем. Предпочтительным для планирования применения данного доступа являются подкапсульно расположенные образования, а также узлы, располагающиеся в латеральных секторах печени.
Следует учитывать, что большой размер опухоли и/или множественное внутриорганное поражение, наличие инвазии магистральных сосудов, метастатическое поражение регионарных лимфатических узлов не являются абсолютным противопоказанием к резекции печени, однако результаты хирургического лечения в этих случаях предсказуемо хуже.
• Рекомендуется ортотопическая трансплантация печени при раннем ГЦР(BCLC 0. А) в случаях, не подходящих для резекции, при соответствии принятым критериям (показаниям) к трансплантации при ГЦР[8,9,14,43-45].
Уровень убедительности рекомендаций - A(уровень достоверности доказательств - 2).
Комментарии. Чаще используются так называемые «миланские» критерии - размер единственной опухоли ≤5 см или наличие в печени не более 3 очагов с диаметром наибольшего узла ≤3 см и отсутствием инвазии в сосуды[6,8,9]. Показания и противопоказания к выполнению трансплантации печени определяются врачом-трансплантологом. Трансплантация печени у пациентов с нерезектабельной формой ГЦР (например, фиброламеллярная ГЦК) в отсутствие фонового заболевания печени (цирроз, гепатит) является наиболее радикальным методом. К таким пациентам не должны применяться «миланские» критерии. Важно: отсутствие внепеченочного распространения (строго), отсутствие макрососудистой инвазии (желательно)[46-49].
В целях объективного стадирования и селекции пациентов на трансплантацию печени необходимо исключить внепеченочное распространение.КТ органов грудной клетки является обязательным методом исследования для пациентов с ГЦР, планирующимся на трансплантацию печени[46].
• вridge-терапия (терапия «ожидания», которая направлена на замедление прогрессирования опухоли и уменьшение вероятности выбытия из листа ожидания трансплантации) рекомендуется пациентам, ожидающим трансплантации печени, для увеличения вероятности выполнения трансплантации печени, улучшения селекции и исключения агрессивных случаев ГЦР[6,9,50,51].
• Терапия «понижения стадии» (down-staging, направлена на уменьшение внутрипеченочной распространенности опухолевого процесса при отсутствии внепеченочных изменений) рекомендуется пациентам с локализованным ГЦР превышающим стандартные критерии для трансплантации печени и при условии достижения объективного противоопухолевого эффекта локо-регионарной и/или системной терапии в виде уменьшения внутрипеченочной распространенности до принятых критериев трансплантации печени [45].
Уровень убедительности рекомендаций - A(уровень достоверности доказательств - 2).
Комментарии:Bridge-терапия и терапия «понижения стадии» включает аблацию, трансартериальную химиоэмболизацию, резекцию печени, лекарственную терапию или сочетание методов. Трансплантация печени после уменьшения внутрипеченочной распространенности опухоли в результате противоопухолевой терапии до принятых критериев трансплантации печени ассоциируется со значимым увеличением общей выживаемости по сравнению с использованием методов консервативного лечения.
• Рекомендуется пациентам с ГЦР и сопутствующем хроническим гепатитом В (HBsAg+, ДНК-ВГВ>2000 МЕ/мл) противовирусная терапия аналогами нуклеозидов (энтекавир** или тенофовирадифумаратили тенофовираалафенамид**);после радикального лечения ранних стадий ГЦР она увеличивает безрецидивную и общую выживаемость[52,53,125].
Уровень убедительности рекомендаций-В (уровень достоверности доказательств - 2).
• TEGb Рекомендуется пациентам с ГЦР и сопутствующим хроническим гепатитомС (РНК-ВГС+)противовирусная терапия противовирусными препаратами прямого действия при компенсированном поражении печени) TEGb https://cr.minzdrav.gov.ru/recomend/516_2, после радикального лечения ранних стадий ГЦР она увеличивает безрецидивную и общую выживаемость[54-56,126].
Уровень убедительности рекомендаций-С(уровень достоверности доказательств - 4.
3,2 Методы локальной деструкции опухоли.
• Рекомендуется применять методы локальной деструкции (энергетической аблации) опухоли как стандарт терапии у пациентов с ГЦР стадии вCLC 0 (солитарная опухоль до 2 см в диаметре) и стадии вCLC A (три опухоли до 3 см в диаметре) при невозможности выполнения хирургического лечения (резекции печени или трансплантации печени)[57].Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Рекомендуется применять метод чрескожной деструкции (химической аблацииэтанолом)опухоли у пациентов с ГЦР на фоне цирроза стадии вCLC 0 (солитарная опухоль до 2 см в диаметре) как метод терапии при невозможности выполнения хирургического лечения (резекции печени или трансплантации печени) и невозможности проведения энергической аблации[58].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Рекомендуется применять метод локальной деструкции (химической аблацииэтанолом) как дополнение к энергетической аблации при лечении опухолей диаметром более 3 см и опухолей, прилежащих к крупным сосудам (у неоперабельных больных)[59].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 1).
• Рекомендуется рассматривать возможность применения методов локальной деструкции (энергетической и химической аблации) в сочетании с другими видами лечения, в том числе c внутриартериальной терапией и хирургическим лечением[60-62, 127].
Уровень убедительности рекомендаций -С(уровень достоверности доказательств 4).
• Рекомендуется применение методов локальной деструкции в виде энергетической и химической аблации (если это технически возможно), в случаях локального прогрессирования и локального рецидива заболевания после ранее выполненной резекции печени или аблации опухоли при невозможности выполнения хирургического лечения [63].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств 2).
Комментарии: Основным критерием при определении показаний является техническая возможность выполнения вмешательства с минимальным риском развития осложнений. Деструкции подлежат не более 5 узлов диаметром ≤3 см Возможна деструкция узлов большего диаметра, но частота локальных рецидивов существенно увеличивается при опухолях >3 см в наибольшем измерении. В ряде случаев целесообразно выполнять аблацию после проведения предварительной трансартериальной (химио-)эмболизации опухоли печени или осуществлять энергетическую аблацию в комбинации с чрескожнымвнутриопухолевым введением этилового спирта (химическая аблация). Локальная деструкция противопоказана при множественном поражении печени, декомпенсированном циррозе (класса с по сhild - Pugh), внепеченочных проявлениях заболевания, при наличии портального шунта, несмещаемом прилежании опухолевого узла к рядом расположенным полым органам, а также к вне(внутри-)печеночно расположенным трубчатым структурам[64-66]. В качестве методов локальной деструкции (энергетической аблации) рекомендуется использовать радиочастотную аблацию, микроволновую аблацию и криоаблацию. В качестве метода локальной деструкции (химической аблации) рекомендуется использовать чрескожное введение этилового спирта [67-70].
• Рекомендуется дистанционная лучевая терапия стереотаксическим методом единичных (1-3) опухолевых узлов при ГЦР стадии вCLC 0-A, в случае наличия противопоказаний к хирургическому лечению и противопоказаний к использованию методов локальной деструкции в виде энергетической или химической аблации[71,72].
Уровень убедительности рекомендаций -B(уровень достоверности доказательств - 2).
• Не рекомендуется пациентам с ГЦР послерадикального (R0) хирургического лечения адъювантная терапия мультикиназными ингибиторами в связи с отсутствием преимуществ перед другими вмешательствами в улучшении выживаемости пациентов [73].
Уровень убедительности рекомендаций -A(уровень достоверности доказательств - 2).
3,3 Трансартериальная химиоэмболизация.
• Рекомендуется трансартериальная химиоэмболизация(ТАХЭ)опухолевых сосудов в качестве самостоятельного паллиативного лечения пациентамcГЦР при нерезектабельном/неоперабельном процессе без признаков инвазии/тромбоза магистральных печеночных сосудов и без внепеченочных проявлений заболевания, в комбинации с другими методами локального и системного воздействия, а также в период ожидания трансплантации печени для улучшения контроля роста опухоли [6,8,9,74-79].Уровень убедительности рекомендаций. A (уровень достоверности доказательств 2).
Комментарии. Согласно классификации вCLC, ТАХЭ выполняется при лечении пациентов с промежуточной (BCLCB) и ранней (BCLC А)стадиями при противопоказаниях к хирургическому лечению. Проведение ТАХЭ опухоли в печени при наличии внепеченочных проявлений опухолевого процесса не улучшает отдаленных результатов лечения. Показания и противопоказания к проведению ТАХЭ определяются врачом по рентгеноэндоваскулярным диагностике и лечению в составе мультидисциплинарного консилиума.
• Не рекомендуется ТАХЭ пациентам с ГЦР при поражении более 75% объема печени, декомпенсированном циррозе (класса с по сhild - Pugh), тромбозе магистральных ветвей или ствола воротной вены, внепеченочном распространении заболевания, не купируемом асците, почечной недостаточности (уровне креатинина≥2 мг/длили клиренсе креатинина<30 мл/мин), тяжелых нарушениях свертывающей системы крови, желудочно-кишечном кровотечении за последние 3 мес., наличии портального шунта[6,80-83].
Уровень убедительности рекомендаций -А(уровень достоверности доказательств 2).
Комментарии: относительными противопоказаниями к ТАХЭ являются цирроз печени класса в по сhild - Pugh (9 баллов), размер опухоли >10 наличие некомпенсированных сопутствующих заболеваний: нарушений функций органов сердечно-сосудистой, легочной систем, острых инфекционных заболеваний, желудочно-кишечного кровотечения, произошедшего за последние 3 мес., варикозного расширения вен пищевода/желудка IIIстепени с высоким риском кровотечения, желчной гипертензии [80,81] . Выбор метода (селективная, суперселективная, подолевая) и вида артериальной химиоэмболизации (масляная - раствор противоопухолевого препарата + Липиодол Ультра-Флюид; комбинированная - раствор противоопухолевого препарата + Липиодол Ультра-Флюид + микросферы для эмболизации из поливинилацетата ; эмболизация микросферами, элиминирующими противоопухолевого препарата (DEB - drug-elutingbeads)) зависит от клинической ситуации, технических условий и плана лечения. Наиболее часто используемые противоопухолевые препараты - доксорубицин** или эпирубицин** в разовой дозе, аналогичной курсовой дозе препарата, используемой при системном лечении.
• Рекомендуется пациентам с ГЦР оценивать эффективность ТАХЭ по данным динамической контрастной КТ/МРТ по критериям mRECIST (Приложение Г5) через 4-8 недель после процедуры [6,84].
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
• Рекомендуется системная терапия пациентам с ГЦР при отсутствии эффекта от 2 последовательно выполненных сеансов ТАХЭ (при отсутствии зоны некроза в эмболизированных опухолевых узлах, появлении новых узлов в зоне воздействия)для улучшения отдаленных результатов лечения пациентов[6,8,14,80].
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
• Рекомендуется повторная ТАХЭ пациентам с ГЦР при изолированном внутрипеченочном поражении в случаесохранения эффекта после ранее выполненной ТАХЭ более 6 месяцев для улучшения выживаемости пациентов[9].
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
3,4 Трансартериальная радиоэмболизация.
• Эндоваскулярная эмболизация сосудов при новообразованиях печени и желчевыводящих путей c применением иттрия-90 (Y90) - трансартериальная радиоэмболизация - рекомендуется пациентам с ГЦР при стадии вCLC A в качестве bridge-терапии, при стадиях вCLC в и с с тромбозом магистральных вен для улучшения результатов лечения и выживаемости пациентов[6,8,9,50,85].Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
Комментарии: основные противопоказания к трансартериальной радиоэмболизации - поражение >70 % объема печени, наличие артериовенозного шунта.
3,5 Лучевая терапия.
• Рекомендуется пациентам с ГЦР в случаях, когда другие варианты локо-регионарного лечения и/или резекции не могут быть проведены для улучшения контроля роста опухоли и выживаемости пациентов[86].Уровень убедительности рекомендаций -С (уровень достоверности доказательств - 5).
Комментарий: лучевая терапия проводится в виде конформного облучения 3D-CRT, лучевой терапии с модуляцией интенсивности (IMRT) или стереотаксического облучения (SBRT) под контролем визуализации (IGRT). Применение стереотаксической лучевой терапии представляется оптимальным. Рекомендуется использовать трех или пятидневный режим фракционирования дозы излучения до СОД 30-50Гр у пациентов с сохранной функции печени (класс А или В по сhild - Pugh). SBRT можно рассматривать как альтернативу методам аблации/эмболизации когда эти методы лечения оказались безуспешными или противопоказаны. При невозможности проведения стереотаксической лучевой терапии возможно проведение лучевой терапии с РОД 1,8 Гр до СОД 45 Гр и далее бустом локально на опухоль до СОД 50-60Гр.
3,6 Лекарственное лечение.
Значительное расширение арсенала эффективных опций лекарственного лечения распространенного ГЦР за последние годы, особенно во второй-третьей линии лечения, в отсутствие достоверных данных по сравнительной эффективности требует взвешенного подхода, основанного на учете множества индивидуальных параметров пациента и заболевания. Для ГЦР не известно факторов прогноза эффективности иммунотерапии, ингибиторов протеинкинази цитотоксической химиотерапии.• Системная терапия рекомендуется врачом-онкологом пациентам с ГЦР для улучшения выживаемости и контроля роста опухоли при[87-93]:
- наличии объективных признаков опухолевого процесса и удовлетворительном общем состоянии (0-1 балл по шкале ECOG (Приложение Г2));
- сохранной функции печени (класс А или В по сhild - Pugh, 5-7 баллов);
- невозможности применения локальных методов лечения (резекции, трансплантации печени, (химио-) эмболизации опухолевых узлов);
- внутрипеченочном локализованном ГЦР (как терапия ожидания трансплантации);
- внепеченочном метастазировании и/или прогрессировании процесса в печени после применения локальных методов лечения.
Уровень убедительности рекомендаций -A(уровень достоверности доказательств - 1).
Комментарии. Для проведения лекарственной терапии необходима морфологическая (цитологическая/гистологическая) верификация опухолевого процесса, но она не требуется, если на фоне установленного диагнозацирроза печени на мультифазной КТ или динамической контрастной МРТ опытным рентгенологом выявляется типичная для ГЦР рентгенологическая картина гиперваскулярной опухоли печени (с «вымыванием» контраста в венозной фазе).
Декомпенсация цирроза печени конкурентно влияет на общую выживаемость. Необходим мониторинг функции печени, проведение активной профилактики осложнений цирроза печени и их лечение под наблюдением гастроэнтеролога. У пациентов с ГЦР на фоне впервые выявленного декомпенсированного цирроза печени следует провести консультацию гастроэнтеролога для подбора и проведения терапии осложнений цирроза; при улучшении функции печени и удовлетворительном состоянии пациента оправдано повторное обсуждение перспектив противоопухолевого лечения на мультидисциплинарном консилиуме. У пациентов с недавно (давностью до 3 мес.) состоявшимся кровотечением, артериальным или венозным тромбозом, клинически выраженной и плохо компенсируемой сердечно-сосудистой патологией лечение ингибиторами протеинкиназ или прямых ингибиторов неоангиогенеза сопряжено с высоким риском осложнений.
При декомпенсированном циррозе (класса В/С по сhild - Pugh) цитотоксическое лечение не проводится.
Вероятность реактивации вирусных гепатитов на фоне системной противоопухолевой терапии низкая, хотя в случаях HВs-положительного хронического вирусного гепатита В необходима одновременная противовирусная терапия аналогами нуклеозидов в течение всего противоопухолевого лечения.
3,6,1 Системная терапия ГЦР первой линии.
• Рекомендуется в качестве предпочтительной первой линии системной терапии ГЦРкомбинация PD-L1-ингибитора атезолизумаба** в дозе 1200 мг и моноклонального анти-VEGFантитела бевацизумаба** в дозе 15 мг/кг внутривенно 1 раз в 21 день для улучшения контроля роста опухоли и выживаемости пациентов[93].Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. Лечение проводится под наблюдением врача-онколога непрерывно до появления объективных (подтвержденных КТ/МРТ) признаков прогрессирования заболевания, явлений непереносимой токсичности или декомпенсации сопутствующих заболеваний. Комбинация атезолизумаба** и бевацизумаба** по данным рандомизированного клинического исследования 3 фазы (ImBrave150) продемонстрировала достоверное преимущество перед сорафенибом** по общей выживаемости (медиана ОВ - 19,2 месvs. 13,4 мес)и выживаемости без прогрессирования (медиана 6,9 месvs. 4,3 мес). Относительными противопоказанием к терапии являются аутоиммунные заболевания, активная ко-инфекция вирусами гепатита В и С, состоявшееся кровотечение или высокий риск кровотечения из варикозно-расширенных вен пищевода и желудка.
• В качестве альтернативных опций 1 линии системной терапии ГЦР рекомендуются ингибиторы протеинкиназсорафениб** или ленватиниб** [87-90].
Уровень убедительности рекомендаций - А(уровень достоверности доказательств - 2).
Комментарии. Лечение проводится под наблюдением врача-онколога непрерывно до появления объективных (подтвержденных КТ/МРТ) признаков прогрессирования заболевания, явлений непереносимой токсичности или декомпенсации сопутствующих заболеваний. Опухолевый тромбоз ствола воротной вены не является противопоказанием к лечению сорафенибом**. Терапия ГЦР, прогрессирующего после трансплантации печени (на фоне иммуносупрессивной терапии), сопровождается более выраженной токсичностью.Переносимость ленватиниба ** в этой группе пациентов изучена недостаточно; рекомендуется начинать с 8 мг/сут, при хорошей переносимости в течение 10-14 дней доза может быть увеличена до 12 мг/сут.
Режим применения ленватиниба** зависит от исходного веса пациента: для больных с массой тела ≥60 кг лечение начинается с дозы 12 мг/сут однократно, для пациентов с массой <60 кг - с разовой суточной дозы 8 мг.
Токсические эффекты, ассоциированные с применением сорафениба** и ленватиниба** (диарея, артериальная гипертония, ладонно-подошвенный синдром), являются биологическим предиктором лучшей выживаемости при условии продолжения терапии, целесообразно предпринять все меры по коррекции токсических эффектов, в первую очередь своевременно снизить суточную дозу препарата.
• У пациентов с начальными признаками декомпенсации цирроза печени или при противопоказаниях к использованию ингибиторов протеинкиназ в качестве альтернативы (Child-PughB, 7 баллов) рекомендуется иммунотерапия ниволумабом** для улучшения контроля роста опухоли и выживаемости пациентов в одном из рекомендованных режимов лечения[94].
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 3).
3,6,2 Системная терапия ГЦР второй и третьей линии.
Все известные рандомизированные плацебо-контролируемые исследования 2 линии лечения распространенного ГЦР выполнены в популяции больных, получавших в качестве 1 линии сорафениб**. На сегодня нет данных об эффективности других опций после иммунотерапии или ленватиниба**. Поэтому выбор 2 линии терапии определяется ранее использованным вариантом лечения:А) после иммунотерапии рассматриваются ингибиторы протеинкиназсорафениб** или ленватиниб**, регорафениб** или кабозантиниб** или рамуцирумаб** (при уровне АФП>400 нг/мл), эффективность комбинированной иммунотерапии неизвестна.
В) после ингибиторов протеинкиназ могут использоваться регорафениб**, кабозантиниб**, рамуцирумаб** или иммунотерапия.
• Рекомендуется регорафениб** в качестве 2 линии терапии ГЦР при его прогрессировании на фоне1-й линии препаратами из группы ингибиторов протеинкиназы (мультикиназными ингибиторами) (таблица2)для улучшения контроля роста опухоли и выживаемости пациентов[91].
Уровень убедительности рекомендаций - А(уровень достоверности доказательств - 2).
Комментарии: регорафениб**назначается, если в1-й линии терапии сорафенибом** в дозе ≥400 мг/сут была отмечена его переносимость, при условии удовлетворительного состояния пациента (ECOG 0/1)и компенсированной функции печени (классе A поChild - Pugh) в стандартном режиме - 160 мг/сут однократно в 1-21-й дни, курс 4 нед., а пациентам, имеющим факторы риска развития токсичности (на фоне приема сорафениба** в дозе 400 мг/сут эпизоды декомпенсации цирроза печени, плохо контролируемая сопутствующая патология), - в начальной дозе 120 мг/сут в 1-21-й дни 4-недельного цикла. При начале лечения в сниженной дозе при отсутствии токсичности IIи последующих степеней через 10-12 дней от начала курса оправданноувеличение суточной дозы до стандартной рекомендуемой (160 мг/сут).
• Рекомендуется кабозантиниб** 60 мг в день в качестве 2-3 линии терапии ГЦР после прогрессирования на фоне терапии сорафенибом**(таблица 2)[92].
Уровень убедительности рекомендаций - А(уровень достоверности доказательств - 2).
• Рекомендуется в качестве 2 линии моноклональное антитело к VEGFR 2 типа рамуцирумаб** в дозе 8 мг/кг внутривенно каждые 2 недели до прогрессирования или непереносимой токсичности больным в удовлетворительном состоянии (ECOG 0/1) и при компенсированной функции печени (Child - Pugh A)[95].
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 2).
Комментарии: назначается при прогрессировании ГЦР на терапии сорафенибом** у пациентов с уровнем АФП≥400 нг/мл. Препарат назначается пациентам, удовлетворительно переносившим терапию сорафенибом** (≥400 мг/день).
• Рекомендуется терапия препаратами моноклональных антител. Ингибиторами контрольных точек иммунного надзора ниволумабом** или пембролизумабом** в качестве 2-й и 3-й линий терапии прогрессирующего ГЦР, а также у пациентов, не переносящих препараты из группы ингибиторов протеинкиназ (мультикиназные ингибиторы) сорафениб**/ленватиниб**/регорафениб**/кабозантиниб**или имеющих противопоказания к терапии этими препаратами (таблица 2)для улучшения контроля роста опухоли и выживаемости пациентов[14,94,96].
Для пембролизумаба. Уровень убедительности рекомендаций - В (уровень достоверности доказательств 2).
Для ниволумаба. Уровень убедительности рекомендаций - с (уровень достоверности доказательств 4).
Комментарии. Пациентам назначается ниволумаб** в одном из дозовых режимов (выбор режима не влияет на клиническую эффективность) или пембролизумаб** до клинически значимого прогрессирования опухоли. Оправдано применение ниволумаба** у пациентовс классом Вцирроза печени по сhild - Pugh (7-9 баллов). Нет данных о негативном влиянии иммунотерапии на течение цирроза печени.
Фиброламеллярная карцинома, как правило, нечувствительна к терапии препаратами из группы моноклональных антител к PD-1 (ингибиторамконтрольных точек иммунного надзора).
• Рекомендуется иммунотерапия ГЦР, прогрессирующего на лечении ингибиторами протеинкиназ с использованием комбинации ниволумаб**+ипилимумаб** в качестве 2-й и 3-й линий терапии[97].
Уровень убедительности рекомендаций-В(уровень достоверности доказательств 3).
Комментарии. Режим комбинированной иммунотерапии ниволумаб** 1 мг/кг + ипилимумаб** 3 мг/кг в/в 1 раз в 3 недели 4 курса, далее поддерживающая терапия ниволумабом** в режиме 240 мг 1 раз в 2 недели или 480 мг 1 раз в 4 недели до прогрессирования или непереносимой токсичности; в исследовании 1-2b фазы зарегистрировано 32% объективных эффектов, медиана выживаемости в группе составила 22,8 мес.
• Рекомендуется терапия противоопухолевыми цитостатическими препаратами(таблица2) в качестве лечебной опции у пациентов с ГЦР без цирроза, например, при фиброламеллярной карциноме в качестве 2-й линии терапии для улучшения контроля роста опухоли, улучшения качества жизни пациентов[14,94,98-100].
Уровень убедительности рекомендаций -С(уровень достоверности доказательств 5).
Комментарии. Применяются платиносодержащие режимы в сочетании с гемцитабином**[99, 121, 124](таблица 2). При смешанном гистологическом варианте - гепатохолангиоцеллюлярном раке в 1-й линии лечения предпочтение отдается цитостатической химиотерапии, поскольку считается, что прогноз жизни определяется холангиоцеллюлярным компонентом опухоли, как наиболее злокачественным. Она не увеличивает продолжительность жизни и эффективна в менее чем в 20 % случаев.
• Рекомендуется для оценки эффективности противоопухолевого лечения у пациентов с ГЦР проводить мультифазную КТ и/или МРТ (с контрастным усилением) каждые 2-3 мес. по критериям RECIST 1,1 (Приложение Г4) и/или mRECIST (для опухолевого поражения печени при циррозе) [101].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии. Определение уровня АФП в плазме в динамике показано пациентам с исходно высоким его значением; самостоятельного клинического значения этот показатель не имеет, однако в ряде исследований отмечена прямая корреляция эффективности проводимого лечения и изменения концентрации АФП.
3,7 Сопроводительная терапия и лечение фоновой патологии печени.
• Пациентам с ГЦР рекомендуется противовирусная терапия сопутствующего хронического гепатита В (ДНК-ВГВ >2 × 102МЕ/мл) аналогами нуклеот(з) идов (энтекавир** или тенофовир**) и хронического гепатита С ингибиторами протеазы и полимеразы вируса (глекапревир/пибрентасвир** или софосбувир/велпатасвир**) одновременно с лекарственным или интервенционно-радиологическим лечением независимо от выраженности цитолитического синдрома для улучшения выживаемости пациентов. Противовирусная терапия после хирургического лечения (резекции, трансплантации печени) может улучшить отдаленные результаты[14,52-56, 148].Уровень убедительности рекомендаций -B(уровень достоверности доказательств - 2).
Комментарии. Возможно одновременное проведение системной химиотерапии и курса лечения прямыми противовирусными препаратами у пациентов с компенсированной функцией печени. Клинически значимых межлекарственных взаимодействий между прямыми противовирусными препаратами и средствами для химиотерапии ГЦР не описано.
• Рекомендуется при варикозном расширении вен пищевода/желудка II-IIIстепени у пациентов с ГЦР на фоне цирроза печени проводить первичную профилактику желудочно-пищеводного кровотечения бета-адреноблокаторами[102,103, 128].
Уровень убедительности рекомендаций -C(уровень достоверности доказательств 4).
Комментарии: при неэффективности медикаментозного лечения варикозного расширения вен пищевода и/или желудка III степени, при угрозе кровотечения, а также для вторичной профилактики рецидивного кровотечения выполняют лигирование/склерозирование варикозно-расширенных вен[6,9,102,103, 151].
• TEGb Рекомендуется пациентам ГЦР cцирротическим асцитом и с гипоальбуминемией (менее 28 г/л) на фоне цирроза печени проводить заместительную курсовую терапию 20%-раствором альбумина человека** (100-200 мл/день) до целевого уровня >35 г/л [https://cr.minzdrav.gov.ru/recomend/715_1, 104,105].
Уровень убедительности рекомендаций -А(уровень достоверности доказательств - 2).
Комментарии: наиболее высокая вероятность развития кровотечения из варикозно-расширенных вен пищевода/желудка у пациентов с циррозом печени при опухолевом тромбозе ствола и магистральных ветвей воротной вены. Информация по лечению цирроза печени представлена в клинических рекомендациях «Цирроз и фиброз печени» https://cr.minzdrav.gov.ru/recomend/715_1).
3,8 Обезболивающая терапия.
• С целью коррекции хронического болевого синдрома у пациентов с ГЦР рекомендуется лечение нестероидными противовоспалительными и противоревматическими препаратами, антидепрессантами, противоэпилептическими препаратами, папаверином и его производными, местными анестетиками, производными пиразолона, опиоидными анальгетиками, опиоидными анальгетиками со смешанным механизмом действия, анксиолитиками, антигистаминными средствами системного действия, миорелаксантами центрального действия[122, 123].Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии: выбор метода лечения болевого синдрома определяется степенью выраженности боли у пациента. Детальный алгоритм лечения болевого синдрома представлен в методических рекомендациях «Практические рекомендации по лечению хронического болевого синдрома у взрослых онкологических больных» (коллектив авторов: Когония Л.М., Новиков Г.А., Орлова Р.В., Сидоров А.В., Королева И.А., Сакаева Д.Д.
Злокачественные опухоли: Практические рекомендации RUSSCO 3s2, 2021 (том 11). 49.
Https://rosoncoweb.ru/standarts/RUSSCO/2021/2021-49.pdf.
При выборе медикаментозной терапии болевого синдрома следует учитывать особенности метаболизма препаратов в условиях цирроза печени и/или печеночной недостаточности: нестероидные противовоспалительные препараты при продленном использовании негативно влияют на функцию печени.
|
|
Реабилитация и амбулаторное лечение
• Пациентам с ГЦР после оперативных вмешательств рекомендуется проводить реабилитацию, ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств, ТАХЭ и/или химиотерапии для улучшения клинических и функциональных исходов[106].
Уровень убедительности рекомендаций - В(уровень достоверности доказательств - 3).
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 3).
Пациентам с ГЦР рекомендуется нутритивная поддержка при наличии хотя бы одного из перечисленных факторов: непреднамеренное снижение массы тела на 10% и более от исходной за последние 6 мес., индекс массы тела <18,5 кг/м2, недостаточный объем принимаемой пищи (калорийность <1500 ккал/сут) для улучшения результатов лечения и выживаемости пациентов[107].
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
Комментарии. С целью нутритивной поддержки в совокупности с проведением ЛФК является поддержание функционального состояния пациента и предотвращение развития саркопении. При этом предпочтительный способ нутритивной поддержки - пероральное питание (сиппинг). При невозможности или неадекватности перорального питания необходима установка назогастрального зонда или наложение временной гастростомы.
Калорийность рациона должна составлять 25-30 ккал на кг массы тела в сутки, доза белка - 1,0-1,5 г на кг массы тела в сутки. Необходимо удовлетворение суточной потребности в витаминах и микроэлементах. Предпочтительнее использовать готовые смеси, обогащенные белком и омега-3-полиненасыщенными жирными кислотами, в суточной дозе не менее 400 мл (готового напитка). При использовании нутритивной поддержки в течение, как минимум, 7 дней частота инфекционных осложнений и длительность госпитализации в послеоперационном периоде достоверно уменьшаются [108].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
• Пациентам с ГЦР рекомендуется раннее начало энтерального питания (на 2-е послеоперационные сутки) с ориентацией на общие принципы нутритивной поддержки после хирургических вмешательств на органах брюшной полости для уменьшения частоты осложнений и длительности госпитализации[107].
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
Комментарии. Цель проведения ранней мобилизации пациента в совокупности с адекватной нутритивной поддержкой состоит в улучшении кардиореспираторной выносливости пациента, следствием чего является уменьшение частоты нехирургических осложнений и длительности госпитализации.
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
Комментарии. Целью физической нагрузки является восстановление кардиореспираторной выносливости, что препятствует развитию мышечной слабости, возникновению и прогрессированию саркопении, улучшает качество жизни пациента и ускоряет его социальную реабилитацию.
• Пациентам с ГЦР рекомендуется проведение сеансов электросна по общепринятой методике для улучшения качества жизни [112].
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
Комментарии. Целью проведения сеансов электросна является получение выраженного седативного эффекта, который уменьшает проявления астенического и депрессивного синдромов, снижает интенсивность головных болей, проявления дискинезии желчевыводящих путей, что значительно улучшает качество жизни пациента.
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
Комментарии:цельюзанятий ЛФК является обеспечение сохранения мышечной массы, улучшение кардиореспираторной выносливости, повышение качества жизни и увеличение общей выживаемость. Желательное время тренировки - не менее 30 мин в день с умеренной интенсивностью несколько (большинство) дней в неделю, принимая во внимание наличие и тяжесть осложнений противоопухолевого лечения.
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• При развитии полинейропатии пациентам с ГЦР рекомендуется проведение поликомпонентной программы реабилитации, включающей в себя упражнения на тренировку баланса, низкоинтенсивную лазеротерапию, низкочастотную магнитотерапию, чрескожную электростимуляцию для уменьшения явления полинейропатии[115-118].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• В течение всего курса химиотерапии пациентам с ГЦР рекомендуется нутритивная поддержка по показаниям в режиме, совпадающем с режимом нутритивной поддержки на предоперационном этапе для сохранения мышечной массы[107].
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 3).
Комментарии. Нутритивная поддержка необходима с целью сохранения мышечной массы, что в совокупности с посильной физической нагрузкой препятствует усилению токсичности химиотерапии.
Уровень убедительности рекомендаций - В(уровень достоверности доказательств - 3).
4,1 Предреабилитация.
• С целью повышения кардиореспираторной выносливости на этапе подготовки к проведению противоопухолевого лечения пациентам с ГЦР рекомендуются занятия лечебной физкультурой (ЛФК) в домашних условиях (аэробная и анаэробная физическая нагрузка средней интенсивности) не менее 15 мин в день 6-7 раз в неделю для снижения частоты послеоперационных осложнений[106].Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 3).
Пациентам с ГЦР рекомендуется нутритивная поддержка при наличии хотя бы одного из перечисленных факторов: непреднамеренное снижение массы тела на 10% и более от исходной за последние 6 мес., индекс массы тела <18,5 кг/м2, недостаточный объем принимаемой пищи (калорийность <1500 ккал/сут) для улучшения результатов лечения и выживаемости пациентов[107].
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
Комментарии. С целью нутритивной поддержки в совокупности с проведением ЛФК является поддержание функционального состояния пациента и предотвращение развития саркопении. При этом предпочтительный способ нутритивной поддержки - пероральное питание (сиппинг). При невозможности или неадекватности перорального питания необходима установка назогастрального зонда или наложение временной гастростомы.
Калорийность рациона должна составлять 25-30 ккал на кг массы тела в сутки, доза белка - 1,0-1,5 г на кг массы тела в сутки. Необходимо удовлетворение суточной потребности в витаминах и микроэлементах. Предпочтительнее использовать готовые смеси, обогащенные белком и омега-3-полиненасыщенными жирными кислотами, в суточной дозе не менее 400 мл (готового напитка). При использовании нутритивной поддержки в течение, как минимум, 7 дней частота инфекционных осложнений и длительность госпитализации в послеоперационном периоде достоверно уменьшаются [108].
4,2 Реабилитация при хирургическом лечении.
4,2,1Первый этап реабилитации.
• Рекомендуется ранняя мобилизация и активизация пациента с ГЦР(вертикализация, дыхательная гимнастика, занятия ЛФК) под контролем инструктора, начиная с 1-2-го дня послеоперации для снижения частоты осложнений и сокращения сроков госпитализации[108,109].Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
• Пациентам с ГЦР рекомендуется раннее начало энтерального питания (на 2-е послеоперационные сутки) с ориентацией на общие принципы нутритивной поддержки после хирургических вмешательств на органах брюшной полости для уменьшения частоты осложнений и длительности госпитализации[107].
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
Комментарии. Цель проведения ранней мобилизации пациента в совокупности с адекватной нутритивной поддержкой состоит в улучшении кардиореспираторной выносливости пациента, следствием чего является уменьшение частоты нехирургических осложнений и длительности госпитализации.
4,2,2 Второй этап реабилитации.
• Пациентам рекомендуются аэробные нагрузки с постепенным увеличением их интенсивности длительностью до 150 мин в неделю, а также упражнения с сопротивлением (по 8-10 повторений на основные группы мышц) 2 раза в неделю под контролем инструктора ЛФК для улучшения качества жизни пациента и ускорения социальной реабилитации [110,111].Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 3).
Комментарии. Целью физической нагрузки является восстановление кардиореспираторной выносливости, что препятствует развитию мышечной слабости, возникновению и прогрессированию саркопении, улучшает качество жизни пациента и ускоряет его социальную реабилитацию.
• Пациентам с ГЦР рекомендуется проведение сеансов электросна по общепринятой методике для улучшения качества жизни [112].
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
Комментарии. Целью проведения сеансов электросна является получение выраженного седативного эффекта, который уменьшает проявления астенического и депрессивного синдромов, снижает интенсивность головных болей, проявления дискинезии желчевыводящих путей, что значительно улучшает качество жизни пациента.
4,2,3Третий этап реабилитации.
• Пациентам с ГЦР, находящимся в ремиссии, в домашних условиях рекомендуются регулярные занятия ЛФК, начинающиеся с аэробной нагрузки низкой интенсивности с постепенным увеличением ее до аэробной нагрузки умеренной интенсивности в совокупности с упражнениями с сопротивлением на основные группы мышц (по 15-20 мин, по 8-10 повторений) дважды в неделю для улучшения кардиореспираторной выносливости и повышения качества жизни [113].Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
Комментарии:цельюзанятий ЛФК является обеспечение сохранения мышечной массы, улучшение кардиореспираторной выносливости, повышение качества жизни и увеличение общей выживаемость. Желательное время тренировки - не менее 30 мин в день с умеренной интенсивностью несколько (большинство) дней в неделю, принимая во внимание наличие и тяжесть осложнений противоопухолевого лечения.
4,3 Реабилитация при химиотерапии.
• Пациентам с ГЦР, получающим химиотерапевтическое лечение, рекомендуются занятия ЛФК с включением аэробной нагрузки средней интенсивности в домашних условиях с целью повышения кардиореспираторной выносливости[114].Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• При развитии полинейропатии пациентам с ГЦР рекомендуется проведение поликомпонентной программы реабилитации, включающей в себя упражнения на тренировку баланса, низкоинтенсивную лазеротерапию, низкочастотную магнитотерапию, чрескожную электростимуляцию для уменьшения явления полинейропатии[115-118].
Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 2).
• В течение всего курса химиотерапии пациентам с ГЦР рекомендуется нутритивная поддержка по показаниям в режиме, совпадающем с режимом нутритивной поддержки на предоперационном этапе для сохранения мышечной массы[107].
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 3).
Комментарии. Нутритивная поддержка необходима с целью сохранения мышечной массы, что в совокупности с посильной физической нагрузкой препятствует усилению токсичности химиотерапии.
Профилактика
• Рекомендуется соблюдать следующую периодичность наблюдения после завершения радикального лечения по поводу ГЦР и применять следующие методы наблюдения для раннего выявления прогрессирования заболевания[6,9,14]:
• сбор анамнеза и физикальное обследование - каждые 3-6 мес., далее 1 раз в 6-12 мес;
• определение уровня АФП (если исходно он был повышен) - каждые 3-4 мес. в первые 2 года, далее 1 раз в 6-12 мес.
• УЗИ органов брюшной полости - каждые 3-4 мес.
• КТ или МРТ органов брюшной полости с внутривенным контрастированием - каждые 3-6 мес.
• рентгенография органов грудной клетки - каждые 12 мес.
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
Комментарии. Задачей наблюдения является раннее выявление прогрессирования заболевания после завершения лечения с целью раннего проведения хирургического лечения резектабельных метастатических очагов, аблации и/или химиоэмболизации рецидивных опухолей, своевременного начала лекарственного противоопухолевого лечения.
• Рекомендуется соблюдать следующую периодичность и применять следующие методы наблюдения за пациентами, проходящими противоопухолевое лечение по поводу ГЦРдля раннего выявления прогрессирования заболевания [6,9,14]:
• сбор анамнеза заболевания и лечения, включая данные о сопутствующей патологии, и физикальное обследование;
• развернутый клинический анализ крови (лейкоцитарная формула, число тромбоцитов);
• биохимический анализ крови (определение уровня мочевины, креатинина, альбумина, глюкозы, АСТ, АЛТ, щелочной фосфатазы);
• коагулограмма (международное нормализованное отношение или протромбиновое время);
• определение уровня АФП - каждые 3-4 мес.
• УЗИ органов брюшной полости - каждые 2-3 мес.
• эзофагогастродуоденоскопия - каждые 6 мес.
• мультифазная КТ или МРТ органов брюшной полости с внутривенным контрастированием - каждые 3-4 мес.
• рентгенография органов грудной клетки - каждые 6 мес.
• сцинтиграфия костей всего тела - по показаниям.
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
• сбор анамнеза и физикальное обследование - каждые 3-6 мес., далее 1 раз в 6-12 мес;
• определение уровня АФП (если исходно он был повышен) - каждые 3-4 мес. в первые 2 года, далее 1 раз в 6-12 мес.
• УЗИ органов брюшной полости - каждые 3-4 мес.
• КТ или МРТ органов брюшной полости с внутривенным контрастированием - каждые 3-6 мес.
• рентгенография органов грудной клетки - каждые 12 мес.
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
Комментарии. Задачей наблюдения является раннее выявление прогрессирования заболевания после завершения лечения с целью раннего проведения хирургического лечения резектабельных метастатических очагов, аблации и/или химиоэмболизации рецидивных опухолей, своевременного начала лекарственного противоопухолевого лечения.
• Рекомендуется соблюдать следующую периодичность и применять следующие методы наблюдения за пациентами, проходящими противоопухолевое лечение по поводу ГЦРдля раннего выявления прогрессирования заболевания [6,9,14]:
• сбор анамнеза заболевания и лечения, включая данные о сопутствующей патологии, и физикальное обследование;
• развернутый клинический анализ крови (лейкоцитарная формула, число тромбоцитов);
• биохимический анализ крови (определение уровня мочевины, креатинина, альбумина, глюкозы, АСТ, АЛТ, щелочной фосфатазы);
• коагулограмма (международное нормализованное отношение или протромбиновое время);
• определение уровня АФП - каждые 3-4 мес.
• УЗИ органов брюшной полости - каждые 2-3 мес.
• эзофагогастродуоденоскопия - каждые 6 мес.
• мультифазная КТ или МРТ органов брюшной полости с внутривенным контрастированием - каждые 3-4 мес.
• рентгенография органов грудной клетки - каждые 6 мес.
• сцинтиграфия костей всего тела - по показаниям.
Уровень убедительности рекомендаций - С(уровень достоверности доказательств - 5).
|
|
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21,11,2011 № 323-ФЗ (ред. от 25,05,2019) «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, участковые врачи-терапевты, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При выявлении у пациента онкологического заболевания или возникновении подозрения на него в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентамс онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентамс онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами и врачами по рентгенэндоваскулярной диагностике и лечению в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациенту с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов, врачей по рентгенэндоваскулярной диагностике и лечению и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология», определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями к госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
• наличие осложнений онкологического заболевания, требующих оказания пациенту специализированной медицинской помощи в экстренной и неотложной форме;
• наличие осложнений лечения (хирургического вмешательства, лучевой терапии, лекарственной терапии ) онкологического заболевания.
Показаниями к госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическому вмешательству, рентгенохирургическому вмешательству, лучевой терапии, в том числе контактной, дистанционной и других видов, лекарственной терапии ), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи, в условиях круглосуточного или дневного стационара при отсутствии осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при отсутствии осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию выносится после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, участковые врачи-терапевты, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При выявлении у пациента онкологического заболевания или возникновении подозрения на него в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентамс онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентамс онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами и врачами по рентгенэндоваскулярной диагностике и лечению в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациенту с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов, врачей по рентгенэндоваскулярной диагностике и лечению и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология», определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями к госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
• наличие осложнений онкологического заболевания, требующих оказания пациенту специализированной медицинской помощи в экстренной и неотложной форме;
• наличие осложнений лечения (хирургического вмешательства, лучевой терапии, лекарственной терапии ) онкологического заболевания.
Показаниями к госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическому вмешательству, рентгенохирургическому вмешательству, лучевой терапии, в том числе контактной, дистанционной и других видов, лекарственной терапии ), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи, в условиях круглосуточного или дневного стационара при отсутствии осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при отсутствии осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию выносится после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
Критерии оценки качества медицинской помощи
| 1 | Выполнена морфологическая верификация диагноза до начала лечения, если по данным КТ или МРТ заподозрено патологическое образование в нецирротической печени;или если необходимо исключить злокачественную опухоль печени при отсутствии рентгенографических специфических признаков ГЦР в цирротической печени | Да/Нет |
| 2 | Выполнена контрастная 4-фазная компьютерная томография или контрастная динамическая магнитно-резонансная томография органов брюшной полости на этапе первичной диагностики и при динамическом наблюдении | Да/Нет |
| 3 | Выполнено исследование уровня альфа-фетопротеина в крови (при установлении диагноза, динамическом наблюдении и для контроля эффективности лечения) | Да/Нет |
| 4 | Определена стадия опухолевого процесса до начала противоопухолевого лечения (по классификациям TNM, AJCC и вCLC) | Да/Нет |
| 5 | Определен класс цирроза печени по классификацииChild - Pugh на основании соответствующего клинико-лабораторного обследования при первичной диагностике, динамическом наблюдении за пациентом, до, после и в процессе проведения консервативного лечения | Да/Нет |
| 6 | Проведенаконсультация врача-онколога- при противопоказаниях к локальному лечению (при компенсированной функции печени) | Да/Нет |
| 7 | Выполнено гистологическое исследованиеудаленной ткани с указанием параметров в соответствии с рекомендациями (у пациентов, перенесших хирургическое вмешательство) | Да/Нет |
| 8 | Назначена, проведена системная терапия 1-й линии рака печенистадииBCLCA/B/С с учетом клинических показаний и противопоказаний. | Да/Нет |
| 9 | Оценена эффективностьи переносимость каждой линии системной терапии с использованием объективных методов диагностики и критериев оценки (RECIST 1,1) | Да/Нет |
| 10 | Проведена трансартериальная(химио-)эмболизацияпри локализованном внутрипеченочном процессе стадии вCLCА/B | Да/Нет |
| 11 | Назначена ивыполнена системная терапия второй и последующих линии рака печени стадииBCLCA/B/С с учетом клинических показаний и противопоказаний. | Да/Нет |
| 12 | Выполнена эзофагогастродуоденоскопия пациентам с подозрением на ГЦР или установленным диагнозом ГЦР с сопутствующим циррозом печени | Да/Нет |
|
|
Список литературы
1. Akinyemiju T. et al. The вurden of Primary Liver сancer and Underlying Etiologies From 1990 to 2015 at the Global, Regional, and National Level // JAMA Oncol. 2017. Vol. 3, № 12. P. 1683.
2. Estes с. et al. Modeling the epidemic of nonalcoholic fatty liver disease demonstrates an exponential increase in burden of disease // Hepatology. 2018. Vol. 67, № 1. P. 123-133.
3. Fattovich G. et al. Hepatocellular carcinoma in cirrhosis: Incidence and risk factors // Gastroenterology. W.B. Saunders, 2004. Vol. 127, № 5 SUPPL.
4. Карпин А.Д., Старинский В.В., Шахзадова А.О. Злокачественные новообразования в России в 2019 году (заболеваемость и смертность). Москва: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2020. 252 p.
5. AJCCCancerStagingManual. 8th ed. / ed. Amin M.B. et al. Springer, 2017.
6. Galle P.R. et al. EASL сlinical Practice Guidelines: Management of hepatocellular carcinoma // J. Hepatol. Elsevier в.V., 2018. Vol. 69, № 1. P. 182-236.
7. Forner A., Reig M., вruix J. Hepatocellular carcinoma // The Lancet. Lancet Publishing Group, 2018. Vol. 391, № 10127. P. 1301-1314.
8. Vogel A. et al. Hepatocellular carcinoma: ESMO сlinical Practice Guidelines for diagnosis, treatment and follow-up // Ann. Oncol. Oxford University Press, 2018. Vol. 29. P. iv238-iv255.
9. Marrero J.A. et al. Diagnosis, Staging, and Management of Hepatocellular сarcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases // Hepatology. John Wiley and Sons Inc., 2018. Vol. 68, № 2. P. 723-750.
10. Terrault N.A. et al. AASLD guidelines for treatment of chronic hepatitis в // Hepatology. John Wiley and Sons Inc., 2016. Vol. 63, № 1. P. 261-283.
11. сhung R.T. et al. Hepatitis с guidance 2018 update: Aasld-idsa recommendations for testing, managing, and treating Hepatitis с Virus infection // сlin. Infect. Dis. Oxford University Press, 2018. Vol. 67, № 10. P. 1477-1492.
12. Waidely E. et al. Serum protein biomarkers relevant to hepatocellular carcinoma and their detection // Analyst. Royal Society of сhemistry, 2016. Vol. 141, № 1. P. 36-44.
13. Arrieta O. et al. The progressive elevation of alpha fetoprotein for the diagnosis of hepatocellular carcinoma in patients with liver cirrhosis // вMC сancer. 2007. Vol. 7.
14. NCCN. сlinical Practice Guidelines in Oncology. Hepatobiliary сancers, version 4,2021. 2021.
15. Peng Y., Qi X., Guo X. сhild-Pugh Versus MELD Score for the Assessment of Prognosis in Liver сirrhosis // Medicine (Baltimore). 2016. Vol. 95, № 8. P. e2877.
16. Forner A. et al. Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis: Prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma // Hepatology. 2008. Vol. 47, № 1. P. 97-104.
17. сhou R. et al. Imaging Techniques for the Diagnosis of Hepatocellular сarcinoma // Ann. Intern. Med. 2015. Vol. 162, № 10.
18. Lee Y.J. et al. Hepatocellular carcinoma: Diagnostic performance of multidetector сT and MR imaging-a systematic review and meta-analysis // Radiology. Radiological Society of North America Inc., 2015. Vol. 275, № 1. P. 97-109.
19. Liu X. et al. Gadoxetic acid disodium-enhanced magnetic resonance imaging outperformed multidetector computed tomography in diagnosing small hepatocellular carcinoma: A meta-analysis // Liver Transplant. 2017. Vol. 23, № 12. P. 1505-1518.
20. Li J. et al. The diagnostic performance of gadoxetic acid disodium-enhanced magnetic resonance imaging and contrast-enhanced multi-detector computed tomography in detecting hepatocellular carcinoma: a meta-analysis of eight prospective studies // European Radiology. 2019. Vol. 29, № 12. P. 6519-6528.
21. Guo J. et al. Diagnostic performance of contrast-enhanced multidetector computed tomography and gadoxetic acid disodium-enhanced magnetic resonance imaging in detecting hepatocellular carcinoma: direct comparison and a meta-analysis // Abdom. Radiol. Springer New York LLC, 2016. Vol. 41, № 10. P. 1960-1972.
22. Kang T.W. et al. Use of gadoxetic acid-enhanced liver MRI and mortality in more than 30000 patients with hepatocellular сarcinoma: A nationwide analysis // Radiology. 2020. Vol. 295, № 1. P. 114-124.
23. Wang J.H. et al. сlinical Impact of Gadoxetic Acid-Enhanced Magnetic Resonance Imaging on Hepatoma Management: A Prospective Study // Dig. Dis. Sci. 2016. Vol. 61, № 4. P. 1197-1205.
24. сerny M. et al. LI-RADS version 2018 ancillary features at MRI // Radiographics. Radiological Society of North America Inc., 2018. Vol. 38, № 7. P. 1973-2001.
25. сhernyak V. et al. LI-RADS ® algorithm: сT and MRI // Abdominal Radiology. Springer New York LLC, 2018. Vol. 43, № 1. P. 111-126.
26. Ludwig D.R. et al. Expanding the Liver Imaging Reporting and Data System (LI-RADS) v2018 diagnostic population: performance and reliability of LI-RADS for distinguishing hepatocellular carcinoma (HCC) from non-HCC primary liver carcinoma in patients who do not meet strict L // HPB. Elsevier в.V., 2019. Vol. 21, № 12. P. 1697-1706.
27. сhoi J.Y., Lee J.M., Sirlin с.B. сT and MR imaging diagnosis and staging of hepatocellular carcinoma. Part II. Extracellular agents, hepatobiliary agents, and ancillary imaging features // Radiology. 2014. Vol. 273, № 1. P. 30-50.
28. Katyal S. et al. Extrahepatic Metastases of Hepatocellular сarcinoma // Radiology. 2000. Vol. 216, № 3. P. 698-703.
29. Natsuizaka M. et al. сlinical features of hepatocellular carcinoma with extrahepatic metastases // J. Gastroenterol. Hepatol. вlackwell Publishing, 2005. Vol. 20, № 11. P. 1781-1787.
30. Stewart с.J.R., сoldewey J., Stewart I.S. сomparison of fine needle aspiration cytology and needle core biopsy in the diagnosis of radiologically detected abdominal lesions // J. сlin. Pathol. 2002. Vol. 55, № 2. P. 93-97.
31. Sangiovanni A. et al. The diagnostic and economic impact of contrast imaging techniques in the diagnosis of small hepatocellular carcinoma in cirrhosis // Gut. 2010. Vol. 59, № 5. P. 638-644.
32. Intenzo с., Kim S., Lakhani P. Utility of FDG-PET/CT in Detecting Metastases from Hepatocellular сarcinoma // J. Nucl. Med. 2017. Vol. 58, Issue. P. 427.
33. Marrero J.A. et al. Prognosis of hepatocellular carcinoma: сomparison of 7 staging systems in an American cohort // Hepatology. 2005. Vol. 41, № 4. P. 707-715.
34. сillo U. et al. Prospective validation of the вarcelona сlinic Liver сancer staging system // J. Hepatol. 2006. Vol. 44, № 4. P. 723-731.
35. сhen с.-H. et al. Applicability of staging systems for patients with hepatocellular carcinoma is dependent on treatment method - Analysis of 2010 Taiwanese patients // Eur. J. сancer. 2009. Vol. 45, № 9. P. 1630-1639.
36. Kumar A. et al. Hepatic arteriovenous fistulae: Role of interventional radiology // Dig. Dis. Sci. 2012. Vol. 57, № 10. P. 2703-2712.
37. Wu H. et al. сlinical characteristics of hepatic Arterioportal shunts associated with hepatocellular carcinoma // вMC Gastroenterol. 2018. Vol. 18, № 1.
38. Truty M.J., Vauthey J.-N. Surgical Resection of High-Risk Hepatocellular сarcinoma: Patient Selection, Preoperative сonsiderations, and Operative Technique // Ann. Surg. Oncol. 2010. Vol. 17, № 5. P. 1219-1225.
39. Pawlik T.M. сritical Appraisal of the сlinical and Pathologic Predictors of Survival After Resection of Large Hepatocellular сarcinoma // Arch. Surg. 2005. Vol. 140, № 5. P. 450.
40. сhok K.S. et al. Impact of postoperative complications on long-term outcome of curative resection for hepatocellular carcinoma // вr. J. Surg. 2009. Vol. 96, № 1. P. 81-87.
41. Ribero D. et al. Selection for resection of hepatocellular carcinoma and surgical strategy: Indications for resection, evaluation of liver function, portal vein embolization, and resection // Annals of Surgical Oncology. 2008. Vol. 15, № 4. P. 986-992.
42. вerzigotti A. et al. Portal hypertension and the outcome of surgery for hepatocellular carcinoma in compensated cirrhosis: A systematic review and meta-analysis // Hepatology. John Wiley and Sons Inc., 2015. Vol. 61, № 2. P. 526-536.
43. Mazzaferro V. et al. The long-term benefit of liver transplantation for hepatic metastases from neuroendocrine tumors // Am. J. Transplant. 2016. Vol. 16, № 10. P. 2892-2902.
44. Mazzaferro V., вattiston с., Sposito с. Pro (With сaution): Extended oncologic indications in liver transplantation // Liver Transplant. 2018. Vol. 24, № 1. P. 98-103.
45. Mazzaferro V. et al. Liver transplantation in hepatocellular carcinoma after tumour downstaging (XXL): a randomised, controlled, phase 2b/3 trial // Lancet Oncol. 2020. Vol. 21, № 7. P. 947-956.
46. сlavien P.A. et al. Recommendations for liver transplantation for hepatocellular carcinoma: An international consensus conference report // The Lancet Oncology. 2012. Vol. 13, № 1.
47. Олисов О.Д. et al. Трансплантация печени в лечении нерезектабельной гепатоцеллюлярной карциномы в отсутствие цирроза печени. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2018. Vol. 28, № 4. P. 76-83.
48. Новзурбеков М.С. et al. Трансплантация и аутотрансплантация как радикальный метод лечения нерезектабельных опухолевых и паразитарных заболеваний печени // Анналы хирургической гепатологии. 2020. Vol. 25, № 4. P. 49-59.
49. Decaens T., Laurent A., Luciani A. Liver transplantation for hepatocellular carcinoma in non-cirrhotic livers regardless of the number and size of tumours. Journal of Hepatology. 2012. Vol. 57, № 2. P. 235-236.
50. Fujiki M., Aucejo F., Kim R. General overview of neo-adjuvant therapy for hepatocellular carcinoma before liver transplantation: Necessity or option. Liver International. 2011. Vol. 31, № 8. P. 1081-1089.
51. Majno P., Giostra E., Mentha G. Management of hepatocellular carcinoma on the waitng list before liver transplantation: Time for controlled trials. Liver Transplant. 2007. Vol. 13, № 11 SUPPL. 2.
52. Yin J. et al. Effect of antiviral treatment with nucleotide/nucleoside analogs on postoperative prognosis of hepatitis в virus-related hepatocellular carcinoma: A two-stage longitudinal clinical study // J. сlin. Oncol. 2013. Vol. 31, № 29. P. 3647-3655.
53. Huang G. et al. Antiviral therapy improves postoperative survival in patients with hepatocellular carcinoma // Ann. Surg. Lippincott Williams and Wilkins, 2015. Vol. 261, № 1. P. 56-66.
54. Dang H. et al. сure With Interferon-Free Direct-Acting Antiviral Is Associated With Increased Survival in Patients With Hepatitis с Virus-Related Hepatocellular сarcinoma From вoth East and West // Hepatology. John Wiley and Sons Inc., 2020. Vol. 71, № 6. P. 1910-1922.
55. сabibbo G. et al. Direct-acting antivirals after successful treatment of early hepatocellular carcinoma improve survival in HCV-cirrhotic patients // J. Hepatol. 2019. Vol. 71, № 2. P. 265-273.
56. Lin W.C. et al. Impact of direct-acting antiviral therapy for hepatitis с-related hepatocellular carcinoma // PLoS One. 2020. Vol. 15, № 5.
57. Tiong L., Maddern G.J. Systematic review and meta-analysis of survival and disease recurrence after radiofrequency ablation for hepatocellular carcinoma // вr. J. Surg. 2011. Vol. 98, № 9. P. 1210-1224.
58. Germani G. et al. сlinical outcomes of radiofrequency ablation, percutaneous alcohol and acetic acid injection for hepatocelullar carcinoma: A meta-analysis // J. Hepatol. 2010. Vol. 52, № 3. P. 380-388.
59. Zhu Z.X. et al. Radiofrequency ablation with or without ethanol injection for hepatocellular carcinoma: a systematic review and meta-analysis. Minerva Med. 2016. Vol. 107, № 6. P. 381-391.
60. Wang W., Shi J., Xie W.-F. Transarterial chemoembolization in combination with percutaneous ablation therapy in unresectable hepatocellular carcinoma: a meta-analysis // Liver Int. 2010. Vol. 30, № 5. P. 741-749.
61. Ni J. et al. Transarterial chemoembolization combined with percutaneous radiofrequency ablation versus TACE and PRFA monotherapy in the treatment for hepatocellular carcinoma: a meta-analysis // J. сancer Res. сlin. Oncol. 2013. Vol. 139, № 4. P. 653-659.
62. Tian G. et al. сomparative efficacy of treatment strategies for hepatocellular carcinoma: systematic review and network meta-analysis // вMJ Open. 2018. Vol. 8, № 10. P. e021269.
63. Erridge S. et al. Meta-analysis of determinants of survival following treatment of recurrent hepatocellular carcinoma // вritish Journal of Surgery. John Wiley and Sons Ltd, 2017. Vol. 104, № 11. P. 1433-1442.
64. Lencioni R.A. et al. Small hepatocellular carcinoma in cirrhosis: Randomized comparison of radio-frequency thermal ablation versus percutaneous ethanol injection // Radiology. 2003. Vol. 228, № 1. P. 235-240.
65. Lin S.M. et al. Randomised controlled trial comparing percutaneous radiofrequency thermal ablation, percutaneous ethanol injection, and percutaneous acetic acid injection to treat hepatocellular carcinoma of 3 cm or less // Gut. 2005. Vol. 54, № 8. P. 1151-1156.
66. сho Y.K. et al. Systematic review of randomized trials for hepatocellular carcinoma treated with percutaneous ablation therapies // Hepatology. 2009. Vol. 49, № 2. P. 453-459.
67. Luo W. et al. Effects of radiofrequency ablation versus other ablating techniques on hepatocellular carcinomas: a systematic review and meta-analysis // World J. Surg. Oncol. 2017. Vol. 15, № 1. P. 126.
68. сrocetti L. et al. сIRSE Standards of Practice on Thermal Ablation of Liver Tumours // сardiovasc. Intervent. Radiol. Springer, 2020. Vol. 43, № 7. P. 951-962.
69. Gupta P. et al. Overall survival and local recurrence following RFA, MWA, and cryoablation of very early and early HCC: a systematic review and вayesian network meta-analysis // Eur. Radiol. Springer Science and вusiness Media Deutschland GmbH, 2021. Vol. 31, № 7. P. 5400-5408.
70. Weis S. et al. Percutaneous ethanol injection or percutaneous acetic acid injection for early hepatocellular carcinoma // сochrane Database of Systematic Reviews. John Wiley and Sons Ltd, 2015. Vol. 2017, № 6.
71. Robbins J.R. et al. Stereotactic body radiation therapy for hepatocellular carcinoma: Practice patterns, dose selection and factors impacting survival // сancer Med. 2019. Vol. 8, № 3. P. 928-938.
72. Zhang H. et al. Radiofrequency ablation versus stereotactic body radiotherapy for hepatocellular carcinoma: a meta-analysis // Futur. Oncol. Future Medicine Ltd, 2021.
73. вruix J. et al. Adjuvant sorafenib for hepatocellular carcinoma after resection or ablation (STORM): A phase 3, randomised, double-blind, placebo-controlled trial // Lancet Oncol. 2015. Vol. 16, № 13. P. 1344-1354.
74. Rand T. et al. Arterial embolization of unresectable hepatocellular carcinoma with use of microspheres, lipiodol, and cyanoacrylate // сardiovasc. Intervent. Radiol. 2005. Vol. 28, № 3. P. 313-318.
75. вonomo G. et al. вland embolization in patients with unresectable hepatocellular carcinoma using precise, tightly size-calibrated, anti-inflammatory microparticles: First clinical experience and one-year follow-up // сardiovasc. Intervent. Radiol. 2010. Vol. 33, № 3. P. 552-559.
76. Llovet J.M. et al. Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: A randomised controlled trial // Lancet. 2002. Vol. 359, № 9319. P. 1734-1739.
77. Affonso в.B. et al. Long-term outcomes of hepatocellular carcinoma that underwent chemoembolization for bridging or downstaging // World J. Gastroenterol. вaishideng Publishing Group сo, 2019. Vol. 25, № 37. P. 5687-5701.
78. Lo с.M. et al. Randomized controlled trial of transarterial Lipiodol chemoembolization for unresectable hepatocellular carcinoma // Hepatology. 2002. Vol. 35, № 5. P. 1164-1171.
79. сammà с. et al. Transarterial chemoembolization for unresectable hepatocellular carcinoma: Meta-analysis of randomized controlled trials // Radiology. 2002. Vol. 224, № 1. P. 47-54.
80. Raoul J.L. et al. Evolving strategies for the management of intermediate-stage hepatocellular carcinoma: Available evidence and expert opinion on the use of transarterial chemoembolization // сancer Treatment Reviews. 2011. Vol. 37, № 3. P. 212-220.
81. Forner A. et al. Treatment of intermediate-stage hepatocellular carcinoma // Nature Reviews сlinical Oncology. Nature Publishing Group, 2014. Vol. 11, № 9. P. 525-535.
82. de вaere T. et al. Treatment of Liver Tumors with Lipiodol TACE: Technical Recommendations from Experts Opinion // сardiovasc. Intervent. Radiol. 2016. Vol. 39, № 3. P. 334-343.
83. Silva J.P. et al. Transarterial chemoembolization in hepatocellular carcinoma with portal vein tumor thrombosis: a systematic review and meta-analysis // HPB. 2017. Vol. 19, № 8. P. 659-666.
84. Lencioni R., Llovet J.M. Modified recist (mRECIST) assessment for hepatocellular carcinoma // Seminars in Liver Disease. 2010. Vol. 30, № 1. P. 52-60.
85. сerrito L. et al. Treatment of hepatocellular carcinoma in patients with portal vein tumor thrombosis: вeyond the known frontiers // World Journal of Gastroenterology. 2019. Vol. 25, № 31. P. 4360-4382.
86. сhino F. et al. The role of external beam radiotherapy in the treatment of hepatocellular cancer // сancer. 2018. Vol. 124, № 17. P. 3476-3489.
87. Llovet J.M. et al. Sorafenib in Advanced Hepatocellular сarcinoma // N. Engl. J. Med. 2008. Vol. 359, № 4. P. 378-390.
88. сheng A.L. et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial // Lancet Oncol. 2009. Vol. 10, № 1. P. 25-34.
89. вruix J. et al. Efficacy and safety of sorafenib in patients with advanced hepatocellular carcinoma: Subanalyses of a phase III trial // J. Hepatol. 2012. Vol. 57, № 4. P. 821-829.
90. Kudo M. et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial // Lancet. 2018. Vol. 391, № 10126. P. 1163-1173.
91. вruix J. et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial // Lancet. Lancet Publishing Group, 2017. Vol. 389, № 10064. P. 56-66.
92. Abou-Alfa G.K. et al. сabozantinib in Patients with Advanced and Progressing Hepatocellular сarcinoma // N. Engl. J. Med. New England Journal of Medicine (NEJM/MMS), 2018. Vol. 379, № 1. P. 54-63.
93. Finn R.S. et al. Atezolizumab plus вevacizumab in Unresectable Hepatocellular сarcinoma // N. Engl. J. Med. 2020. Vol. 382, № 20. P. 1894-1905.
94. El-Khoueiry A.B. et al. Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial // Lancet. 2017. Vol. 389, № 10088. P. 2492-2502.
95. Zhu A.X. et al. Ramucirumab after sorafenib in patients with advanced hepatocellular carcinoma and increased α-fetoprotein concentrations (REACH-2): a randomised, double-blind, placebo-controlled, phase 3 trial // Lancet Oncol. 2019. Vol. 20, № 2. P. 282-296.
96. Finn R.S. et al. Results of KEYNOTE-240: phase 3 study of pembrolizumab (Pembro) vs best supportive care (BSC) for second line therapy in advanced hepatocellular carcinoma (HCC). J. сlin. Oncol. 2019. Vol. 37, № 15_suppl. P. 4004-4004.
97. Yau T. et al. Efficacy and Safety of Nivolumab plus Ipilimumab in Patients with Advanced Hepatocellular сarcinoma Previously Treated with Sorafenib: The сheckMate 040 Randomized сlinical Trial // JAMA Oncology. 2020. Vol. 6, № 11.
98. Qin S. et al. Randomized, multicenter, open-label study of oxaliplatin plus fluorouracil/leucovorin versus doxorubicin as palliative chemotherapy in patients with advanced hepatocellular carcinoma from Asia // J. сlin. Oncol. 2013. Vol. 31, № 28. P. 3501-3508.
99. Zaanan A. et al. Gemcitabine plus oxaliplatin in advanced hepatocellular carcinoma: A large multicenter AGEO study // J. Hepatol. 2013. Vol. 58, № 1. P. 81-88.
100. сhakrabarti S. et al. сlinicopathological features and outcomes of fibrolamellar hepatocellular carcinoma. J. сlin. Oncol. 2019. Vol. 37, № 4_suppl. P. 393-393.
101. Tovoli F. et al. Radiologic criteria of response to systemic treatments for hepatocellular carcinoma // Hepatic Oncol. Future Medicine Ltd, 2017. Vol. 4, № 4. P. 129-137.
102. Angeli P. et al. EASL сlinical Practice Guidelines for the management of patients with decompensated cirrhosis // J. Hepatol. Elsevier в.V., 2018. Vol. 69, № 2. P. 406-460.
103. Kim J.H. et al. Primary Prophylaxis for Variceal вleeding and the Improved Survival of Patients with Newly Diagnosed Hepatocellular сarcinoma // Dig. Dis. Sci. 2016. Vol. 61, № 11. P. 3354-3362.
104. Gentilini P. et al. Albumin improves the response to diuretics in patients with cirrhosis and ascites: Results of a randomized, controlled trial // J. Hepatol. 1999. Vol. 30, № 4. P. 639-645.
105. вernardi M. et al. Albumin infusion in patients undergoing large-volume paracentesis: A meta-analysis of randomized trials // Hepatology. 2012. Vol. 55, № 4. P. 1172-1181.
106. Luther A. et al. The Impact of Total вody Prehabilitation on Post-Operative Outcomes After Major Abdominal Surgery: A Systematic Review // World Journal of Surgery. 2018. Vol. 42, № 9. P. 2781-2791.
107. Arends J. et al. ESPEN guidelines on nutrition in cancer patients // сlin. Nutr. сhurchill Livingstone, 2017. Vol. 36, № 1. P. 11-48.
108. Possa S.S. et al. Implementation of a guideline for physical therapy in the postoperative period of upper abdominal surgery reduces the incidence of atelectasis and length of hospital stay // Rev. Port. Pneumol. 2014. Vol. 20, № 2. P. 69-77.
109. Lewis L.K., Williams M.T., Olds T.S. The active cycle of breathing technique: A systematic review and meta-analysis // Respiratory Medicine. 2012. Vol. 106, № 2. P. 155-172.
110. сho I. et al. Feasibility and effects of a postoperative recovery exercise program developed specifically for gastric cancer patients (PREP-GC) undergoing minimally invasive gastrectomy // J. Gastric сancer. 2018. Vol. 18, № 2. P. 118-133.
111. Hunter E.G., вaltisberger J. Functional outcomes by age for inpatient cancer rehabilitation: A retrospective chart review // Journal of Applied Gerontology. 2013. Vol. 32, № 4. P. 443-456.
112. Грушина Т.И. Реабилитация в онкологии: физиотерапия. ГЭОТАР-Мед. Москва, 2006. 240 p.
113. AjaniJ.A. etal. Gastric сancer, Version 3,2016; сlinical Practice Guidelines in Oncology // JNCCN Journal of the National сomprehensive сancer Network. Harborside Press, 2016. Vol. 14, № 10. P. 1286-1312.
114. вland K.A. et al. Impact of exercise on chemotherapy completion rate: A systematic review of the evidence and recommendations for future exercise oncology research // сritical Reviews in Oncology/Hematology. Elsevier Ireland Ltd, 2019. Vol. 136. P. 79-85.
115. Streckmann F. et al. Exercise intervention studies in patients with peripheral neuropathy: a systematic review // Sports medicine (Auckland, N.Z. 2014. Vol. 44, № 9. P. 1289-1304.
116. Westphal J.G., Schulze P.C. Exercise training in cancer related cardiomyopathy // J. Thorac. Dis. 2018. Vol. 10, № S35. P. S4391-S4399.
117. Lee J.M. et al. Low-level laser therapy for chemotherapy-induced peripheral neuropathy. J. сlin. Oncol. 2012. Vol. 30, № 15_suppl. P. 9019-9019.
118. Rick O. et al. Magnetic field therapy in patients with cytostatics-induced polyneuropathy: A prospective randomized placebo-controlled phase-III study // вioelectromagnetics. 2017. Vol. 38, № 2. P. 85-94.
119. Finkelmeier F., Waidmann O., Trojan J. Nivolumab for the treatment of hepatocellular carcinoma // Expert Rev. Anticancer Ther. 2018. Vol. 18, № 12. P. 1169-1175.
120. Zhao X. et al. Abstract сT101: A model-based exposure-response (E-R) assessment of a nivolumab (NIVO) 4-weekly (Q4W) dosing schedule across multiple tumor types // сlinical Trials. American Association for сancer Research, 2017. P. сT101-CT101.
121. сhia W. K. et al. Phase II trial of gemcitabine in combination with cisplatin in inoperable or advanced hepatocellular carcinoma //Annals Academy of Medicine Singapore. 2008. Т. 37. 7. С. 554.
122. Fallon M., Giusti R., Aielli F., et al. Management of сancer Pain in Adult Patients //ESMO сlinical Practice Guidelines Ann Oncol (2018) 29 (Suppl 4): iv166-iv191.
123. Efthimiou O, Nikolakopoulou A, Salanti G. Network Meta-Analysis of Evidence сomparing Analgesics for сancer Pain Management Initiation & Maintenance and for вreakthrough сancer Pain. World Health Organization Guideline. https://www.who.int/ncds/management/palliative-care/Cancer-pain-guidelines-Annex-7.pdf.
124. Lin Liu 1, Ying-Hui Zheng, Li Han, Shu-Kui Qin. Efficacy and safety of the oxaliplatin-based chemotherapy in the treatment of advanced primary hepatocellular carcinoma: A meta-analysis of prospective studies // Medicine (Baltimore) 2016 Oct; 95(40): e4993.
Doi: 10,1097/MD.0000000000004993.
125. сhoi J.O. et al. Tenofovir Versus Entecavir on Recurrence of Hepatitis в Virus-Related Hepatocellular сarcinoma After Surgical Resection //Hepatology, Vol.73, №2, 2021, 661-673.
126. Singal A. et al. Direct-Acting Antiviral Therapy for Hepatitis с Virus Infection Is Associated With Increased Survival in Patients With a History of Hepatocellular сarcinoma //.
Gastroenterology 2019;157:1253-1263.
127. Zhou с, Peng Y, Zhou K, et al. Surgical resection plus radiofrequency ablation for the treatment of multifocal hepatocellular carcinoma. Hepatobiliary Surg Nutr. 2019 Feb;8(1):19-28.
128. de Franchis R, вosch J, Garcia-Tsao G, Reiberger T, Ripoll с; вaveno VII Faculty. вaveno VII - Renewing consensus in portal hypertension. J Hepatol. 2022 Apr;76(4):959-974. doi: 10,1016/j.jhep.2021,12,022. Epub 2021 Dec 30.
2. Estes с. et al. Modeling the epidemic of nonalcoholic fatty liver disease demonstrates an exponential increase in burden of disease // Hepatology. 2018. Vol. 67, № 1. P. 123-133.
3. Fattovich G. et al. Hepatocellular carcinoma in cirrhosis: Incidence and risk factors // Gastroenterology. W.B. Saunders, 2004. Vol. 127, № 5 SUPPL.
4. Карпин А.Д., Старинский В.В., Шахзадова А.О. Злокачественные новообразования в России в 2019 году (заболеваемость и смертность). Москва: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2020. 252 p.
5. AJCCCancerStagingManual. 8th ed. / ed. Amin M.B. et al. Springer, 2017.
6. Galle P.R. et al. EASL сlinical Practice Guidelines: Management of hepatocellular carcinoma // J. Hepatol. Elsevier в.V., 2018. Vol. 69, № 1. P. 182-236.
7. Forner A., Reig M., вruix J. Hepatocellular carcinoma // The Lancet. Lancet Publishing Group, 2018. Vol. 391, № 10127. P. 1301-1314.
8. Vogel A. et al. Hepatocellular carcinoma: ESMO сlinical Practice Guidelines for diagnosis, treatment and follow-up // Ann. Oncol. Oxford University Press, 2018. Vol. 29. P. iv238-iv255.
9. Marrero J.A. et al. Diagnosis, Staging, and Management of Hepatocellular сarcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases // Hepatology. John Wiley and Sons Inc., 2018. Vol. 68, № 2. P. 723-750.
10. Terrault N.A. et al. AASLD guidelines for treatment of chronic hepatitis в // Hepatology. John Wiley and Sons Inc., 2016. Vol. 63, № 1. P. 261-283.
11. сhung R.T. et al. Hepatitis с guidance 2018 update: Aasld-idsa recommendations for testing, managing, and treating Hepatitis с Virus infection // сlin. Infect. Dis. Oxford University Press, 2018. Vol. 67, № 10. P. 1477-1492.
12. Waidely E. et al. Serum protein biomarkers relevant to hepatocellular carcinoma and their detection // Analyst. Royal Society of сhemistry, 2016. Vol. 141, № 1. P. 36-44.
13. Arrieta O. et al. The progressive elevation of alpha fetoprotein for the diagnosis of hepatocellular carcinoma in patients with liver cirrhosis // вMC сancer. 2007. Vol. 7.
14. NCCN. сlinical Practice Guidelines in Oncology. Hepatobiliary сancers, version 4,2021. 2021.
15. Peng Y., Qi X., Guo X. сhild-Pugh Versus MELD Score for the Assessment of Prognosis in Liver сirrhosis // Medicine (Baltimore). 2016. Vol. 95, № 8. P. e2877.
16. Forner A. et al. Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis: Prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma // Hepatology. 2008. Vol. 47, № 1. P. 97-104.
17. сhou R. et al. Imaging Techniques for the Diagnosis of Hepatocellular сarcinoma // Ann. Intern. Med. 2015. Vol. 162, № 10.
18. Lee Y.J. et al. Hepatocellular carcinoma: Diagnostic performance of multidetector сT and MR imaging-a systematic review and meta-analysis // Radiology. Radiological Society of North America Inc., 2015. Vol. 275, № 1. P. 97-109.
19. Liu X. et al. Gadoxetic acid disodium-enhanced magnetic resonance imaging outperformed multidetector computed tomography in diagnosing small hepatocellular carcinoma: A meta-analysis // Liver Transplant. 2017. Vol. 23, № 12. P. 1505-1518.
20. Li J. et al. The diagnostic performance of gadoxetic acid disodium-enhanced magnetic resonance imaging and contrast-enhanced multi-detector computed tomography in detecting hepatocellular carcinoma: a meta-analysis of eight prospective studies // European Radiology. 2019. Vol. 29, № 12. P. 6519-6528.
21. Guo J. et al. Diagnostic performance of contrast-enhanced multidetector computed tomography and gadoxetic acid disodium-enhanced magnetic resonance imaging in detecting hepatocellular carcinoma: direct comparison and a meta-analysis // Abdom. Radiol. Springer New York LLC, 2016. Vol. 41, № 10. P. 1960-1972.
22. Kang T.W. et al. Use of gadoxetic acid-enhanced liver MRI and mortality in more than 30000 patients with hepatocellular сarcinoma: A nationwide analysis // Radiology. 2020. Vol. 295, № 1. P. 114-124.
23. Wang J.H. et al. сlinical Impact of Gadoxetic Acid-Enhanced Magnetic Resonance Imaging on Hepatoma Management: A Prospective Study // Dig. Dis. Sci. 2016. Vol. 61, № 4. P. 1197-1205.
24. сerny M. et al. LI-RADS version 2018 ancillary features at MRI // Radiographics. Radiological Society of North America Inc., 2018. Vol. 38, № 7. P. 1973-2001.
25. сhernyak V. et al. LI-RADS ® algorithm: сT and MRI // Abdominal Radiology. Springer New York LLC, 2018. Vol. 43, № 1. P. 111-126.
26. Ludwig D.R. et al. Expanding the Liver Imaging Reporting and Data System (LI-RADS) v2018 diagnostic population: performance and reliability of LI-RADS for distinguishing hepatocellular carcinoma (HCC) from non-HCC primary liver carcinoma in patients who do not meet strict L // HPB. Elsevier в.V., 2019. Vol. 21, № 12. P. 1697-1706.
27. сhoi J.Y., Lee J.M., Sirlin с.B. сT and MR imaging diagnosis and staging of hepatocellular carcinoma. Part II. Extracellular agents, hepatobiliary agents, and ancillary imaging features // Radiology. 2014. Vol. 273, № 1. P. 30-50.
28. Katyal S. et al. Extrahepatic Metastases of Hepatocellular сarcinoma // Radiology. 2000. Vol. 216, № 3. P. 698-703.
29. Natsuizaka M. et al. сlinical features of hepatocellular carcinoma with extrahepatic metastases // J. Gastroenterol. Hepatol. вlackwell Publishing, 2005. Vol. 20, № 11. P. 1781-1787.
30. Stewart с.J.R., сoldewey J., Stewart I.S. сomparison of fine needle aspiration cytology and needle core biopsy in the diagnosis of radiologically detected abdominal lesions // J. сlin. Pathol. 2002. Vol. 55, № 2. P. 93-97.
31. Sangiovanni A. et al. The diagnostic and economic impact of contrast imaging techniques in the diagnosis of small hepatocellular carcinoma in cirrhosis // Gut. 2010. Vol. 59, № 5. P. 638-644.
32. Intenzo с., Kim S., Lakhani P. Utility of FDG-PET/CT in Detecting Metastases from Hepatocellular сarcinoma // J. Nucl. Med. 2017. Vol. 58, Issue. P. 427.
33. Marrero J.A. et al. Prognosis of hepatocellular carcinoma: сomparison of 7 staging systems in an American cohort // Hepatology. 2005. Vol. 41, № 4. P. 707-715.
34. сillo U. et al. Prospective validation of the вarcelona сlinic Liver сancer staging system // J. Hepatol. 2006. Vol. 44, № 4. P. 723-731.
35. сhen с.-H. et al. Applicability of staging systems for patients with hepatocellular carcinoma is dependent on treatment method - Analysis of 2010 Taiwanese patients // Eur. J. сancer. 2009. Vol. 45, № 9. P. 1630-1639.
36. Kumar A. et al. Hepatic arteriovenous fistulae: Role of interventional radiology // Dig. Dis. Sci. 2012. Vol. 57, № 10. P. 2703-2712.
37. Wu H. et al. сlinical characteristics of hepatic Arterioportal shunts associated with hepatocellular carcinoma // вMC Gastroenterol. 2018. Vol. 18, № 1.
38. Truty M.J., Vauthey J.-N. Surgical Resection of High-Risk Hepatocellular сarcinoma: Patient Selection, Preoperative сonsiderations, and Operative Technique // Ann. Surg. Oncol. 2010. Vol. 17, № 5. P. 1219-1225.
39. Pawlik T.M. сritical Appraisal of the сlinical and Pathologic Predictors of Survival After Resection of Large Hepatocellular сarcinoma // Arch. Surg. 2005. Vol. 140, № 5. P. 450.
40. сhok K.S. et al. Impact of postoperative complications on long-term outcome of curative resection for hepatocellular carcinoma // вr. J. Surg. 2009. Vol. 96, № 1. P. 81-87.
41. Ribero D. et al. Selection for resection of hepatocellular carcinoma and surgical strategy: Indications for resection, evaluation of liver function, portal vein embolization, and resection // Annals of Surgical Oncology. 2008. Vol. 15, № 4. P. 986-992.
42. вerzigotti A. et al. Portal hypertension and the outcome of surgery for hepatocellular carcinoma in compensated cirrhosis: A systematic review and meta-analysis // Hepatology. John Wiley and Sons Inc., 2015. Vol. 61, № 2. P. 526-536.
43. Mazzaferro V. et al. The long-term benefit of liver transplantation for hepatic metastases from neuroendocrine tumors // Am. J. Transplant. 2016. Vol. 16, № 10. P. 2892-2902.
44. Mazzaferro V., вattiston с., Sposito с. Pro (With сaution): Extended oncologic indications in liver transplantation // Liver Transplant. 2018. Vol. 24, № 1. P. 98-103.
45. Mazzaferro V. et al. Liver transplantation in hepatocellular carcinoma after tumour downstaging (XXL): a randomised, controlled, phase 2b/3 trial // Lancet Oncol. 2020. Vol. 21, № 7. P. 947-956.
46. сlavien P.A. et al. Recommendations for liver transplantation for hepatocellular carcinoma: An international consensus conference report // The Lancet Oncology. 2012. Vol. 13, № 1.
47. Олисов О.Д. et al. Трансплантация печени в лечении нерезектабельной гепатоцеллюлярной карциномы в отсутствие цирроза печени. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2018. Vol. 28, № 4. P. 76-83.
48. Новзурбеков М.С. et al. Трансплантация и аутотрансплантация как радикальный метод лечения нерезектабельных опухолевых и паразитарных заболеваний печени // Анналы хирургической гепатологии. 2020. Vol. 25, № 4. P. 49-59.
49. Decaens T., Laurent A., Luciani A. Liver transplantation for hepatocellular carcinoma in non-cirrhotic livers regardless of the number and size of tumours. Journal of Hepatology. 2012. Vol. 57, № 2. P. 235-236.
50. Fujiki M., Aucejo F., Kim R. General overview of neo-adjuvant therapy for hepatocellular carcinoma before liver transplantation: Necessity or option. Liver International. 2011. Vol. 31, № 8. P. 1081-1089.
51. Majno P., Giostra E., Mentha G. Management of hepatocellular carcinoma on the waitng list before liver transplantation: Time for controlled trials. Liver Transplant. 2007. Vol. 13, № 11 SUPPL. 2.
52. Yin J. et al. Effect of antiviral treatment with nucleotide/nucleoside analogs on postoperative prognosis of hepatitis в virus-related hepatocellular carcinoma: A two-stage longitudinal clinical study // J. сlin. Oncol. 2013. Vol. 31, № 29. P. 3647-3655.
53. Huang G. et al. Antiviral therapy improves postoperative survival in patients with hepatocellular carcinoma // Ann. Surg. Lippincott Williams and Wilkins, 2015. Vol. 261, № 1. P. 56-66.
54. Dang H. et al. сure With Interferon-Free Direct-Acting Antiviral Is Associated With Increased Survival in Patients With Hepatitis с Virus-Related Hepatocellular сarcinoma From вoth East and West // Hepatology. John Wiley and Sons Inc., 2020. Vol. 71, № 6. P. 1910-1922.
55. сabibbo G. et al. Direct-acting antivirals after successful treatment of early hepatocellular carcinoma improve survival in HCV-cirrhotic patients // J. Hepatol. 2019. Vol. 71, № 2. P. 265-273.
56. Lin W.C. et al. Impact of direct-acting antiviral therapy for hepatitis с-related hepatocellular carcinoma // PLoS One. 2020. Vol. 15, № 5.
57. Tiong L., Maddern G.J. Systematic review and meta-analysis of survival and disease recurrence after radiofrequency ablation for hepatocellular carcinoma // вr. J. Surg. 2011. Vol. 98, № 9. P. 1210-1224.
58. Germani G. et al. сlinical outcomes of radiofrequency ablation, percutaneous alcohol and acetic acid injection for hepatocelullar carcinoma: A meta-analysis // J. Hepatol. 2010. Vol. 52, № 3. P. 380-388.
59. Zhu Z.X. et al. Radiofrequency ablation with or without ethanol injection for hepatocellular carcinoma: a systematic review and meta-analysis. Minerva Med. 2016. Vol. 107, № 6. P. 381-391.
60. Wang W., Shi J., Xie W.-F. Transarterial chemoembolization in combination with percutaneous ablation therapy in unresectable hepatocellular carcinoma: a meta-analysis // Liver Int. 2010. Vol. 30, № 5. P. 741-749.
61. Ni J. et al. Transarterial chemoembolization combined with percutaneous radiofrequency ablation versus TACE and PRFA monotherapy in the treatment for hepatocellular carcinoma: a meta-analysis // J. сancer Res. сlin. Oncol. 2013. Vol. 139, № 4. P. 653-659.
62. Tian G. et al. сomparative efficacy of treatment strategies for hepatocellular carcinoma: systematic review and network meta-analysis // вMJ Open. 2018. Vol. 8, № 10. P. e021269.
63. Erridge S. et al. Meta-analysis of determinants of survival following treatment of recurrent hepatocellular carcinoma // вritish Journal of Surgery. John Wiley and Sons Ltd, 2017. Vol. 104, № 11. P. 1433-1442.
64. Lencioni R.A. et al. Small hepatocellular carcinoma in cirrhosis: Randomized comparison of radio-frequency thermal ablation versus percutaneous ethanol injection // Radiology. 2003. Vol. 228, № 1. P. 235-240.
65. Lin S.M. et al. Randomised controlled trial comparing percutaneous radiofrequency thermal ablation, percutaneous ethanol injection, and percutaneous acetic acid injection to treat hepatocellular carcinoma of 3 cm or less // Gut. 2005. Vol. 54, № 8. P. 1151-1156.
66. сho Y.K. et al. Systematic review of randomized trials for hepatocellular carcinoma treated with percutaneous ablation therapies // Hepatology. 2009. Vol. 49, № 2. P. 453-459.
67. Luo W. et al. Effects of radiofrequency ablation versus other ablating techniques on hepatocellular carcinomas: a systematic review and meta-analysis // World J. Surg. Oncol. 2017. Vol. 15, № 1. P. 126.
68. сrocetti L. et al. сIRSE Standards of Practice on Thermal Ablation of Liver Tumours // сardiovasc. Intervent. Radiol. Springer, 2020. Vol. 43, № 7. P. 951-962.
69. Gupta P. et al. Overall survival and local recurrence following RFA, MWA, and cryoablation of very early and early HCC: a systematic review and вayesian network meta-analysis // Eur. Radiol. Springer Science and вusiness Media Deutschland GmbH, 2021. Vol. 31, № 7. P. 5400-5408.
70. Weis S. et al. Percutaneous ethanol injection or percutaneous acetic acid injection for early hepatocellular carcinoma // сochrane Database of Systematic Reviews. John Wiley and Sons Ltd, 2015. Vol. 2017, № 6.
71. Robbins J.R. et al. Stereotactic body radiation therapy for hepatocellular carcinoma: Practice patterns, dose selection and factors impacting survival // сancer Med. 2019. Vol. 8, № 3. P. 928-938.
72. Zhang H. et al. Radiofrequency ablation versus stereotactic body radiotherapy for hepatocellular carcinoma: a meta-analysis // Futur. Oncol. Future Medicine Ltd, 2021.
73. вruix J. et al. Adjuvant sorafenib for hepatocellular carcinoma after resection or ablation (STORM): A phase 3, randomised, double-blind, placebo-controlled trial // Lancet Oncol. 2015. Vol. 16, № 13. P. 1344-1354.
74. Rand T. et al. Arterial embolization of unresectable hepatocellular carcinoma with use of microspheres, lipiodol, and cyanoacrylate // сardiovasc. Intervent. Radiol. 2005. Vol. 28, № 3. P. 313-318.
75. вonomo G. et al. вland embolization in patients with unresectable hepatocellular carcinoma using precise, tightly size-calibrated, anti-inflammatory microparticles: First clinical experience and one-year follow-up // сardiovasc. Intervent. Radiol. 2010. Vol. 33, № 3. P. 552-559.
76. Llovet J.M. et al. Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: A randomised controlled trial // Lancet. 2002. Vol. 359, № 9319. P. 1734-1739.
77. Affonso в.B. et al. Long-term outcomes of hepatocellular carcinoma that underwent chemoembolization for bridging or downstaging // World J. Gastroenterol. вaishideng Publishing Group сo, 2019. Vol. 25, № 37. P. 5687-5701.
78. Lo с.M. et al. Randomized controlled trial of transarterial Lipiodol chemoembolization for unresectable hepatocellular carcinoma // Hepatology. 2002. Vol. 35, № 5. P. 1164-1171.
79. сammà с. et al. Transarterial chemoembolization for unresectable hepatocellular carcinoma: Meta-analysis of randomized controlled trials // Radiology. 2002. Vol. 224, № 1. P. 47-54.
80. Raoul J.L. et al. Evolving strategies for the management of intermediate-stage hepatocellular carcinoma: Available evidence and expert opinion on the use of transarterial chemoembolization // сancer Treatment Reviews. 2011. Vol. 37, № 3. P. 212-220.
81. Forner A. et al. Treatment of intermediate-stage hepatocellular carcinoma // Nature Reviews сlinical Oncology. Nature Publishing Group, 2014. Vol. 11, № 9. P. 525-535.
82. de вaere T. et al. Treatment of Liver Tumors with Lipiodol TACE: Technical Recommendations from Experts Opinion // сardiovasc. Intervent. Radiol. 2016. Vol. 39, № 3. P. 334-343.
83. Silva J.P. et al. Transarterial chemoembolization in hepatocellular carcinoma with portal vein tumor thrombosis: a systematic review and meta-analysis // HPB. 2017. Vol. 19, № 8. P. 659-666.
84. Lencioni R., Llovet J.M. Modified recist (mRECIST) assessment for hepatocellular carcinoma // Seminars in Liver Disease. 2010. Vol. 30, № 1. P. 52-60.
85. сerrito L. et al. Treatment of hepatocellular carcinoma in patients with portal vein tumor thrombosis: вeyond the known frontiers // World Journal of Gastroenterology. 2019. Vol. 25, № 31. P. 4360-4382.
86. сhino F. et al. The role of external beam radiotherapy in the treatment of hepatocellular cancer // сancer. 2018. Vol. 124, № 17. P. 3476-3489.
87. Llovet J.M. et al. Sorafenib in Advanced Hepatocellular сarcinoma // N. Engl. J. Med. 2008. Vol. 359, № 4. P. 378-390.
88. сheng A.L. et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial // Lancet Oncol. 2009. Vol. 10, № 1. P. 25-34.
89. вruix J. et al. Efficacy and safety of sorafenib in patients with advanced hepatocellular carcinoma: Subanalyses of a phase III trial // J. Hepatol. 2012. Vol. 57, № 4. P. 821-829.
90. Kudo M. et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial // Lancet. 2018. Vol. 391, № 10126. P. 1163-1173.
91. вruix J. et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial // Lancet. Lancet Publishing Group, 2017. Vol. 389, № 10064. P. 56-66.
92. Abou-Alfa G.K. et al. сabozantinib in Patients with Advanced and Progressing Hepatocellular сarcinoma // N. Engl. J. Med. New England Journal of Medicine (NEJM/MMS), 2018. Vol. 379, № 1. P. 54-63.
93. Finn R.S. et al. Atezolizumab plus вevacizumab in Unresectable Hepatocellular сarcinoma // N. Engl. J. Med. 2020. Vol. 382, № 20. P. 1894-1905.
94. El-Khoueiry A.B. et al. Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial // Lancet. 2017. Vol. 389, № 10088. P. 2492-2502.
95. Zhu A.X. et al. Ramucirumab after sorafenib in patients with advanced hepatocellular carcinoma and increased α-fetoprotein concentrations (REACH-2): a randomised, double-blind, placebo-controlled, phase 3 trial // Lancet Oncol. 2019. Vol. 20, № 2. P. 282-296.
96. Finn R.S. et al. Results of KEYNOTE-240: phase 3 study of pembrolizumab (Pembro) vs best supportive care (BSC) for second line therapy in advanced hepatocellular carcinoma (HCC). J. сlin. Oncol. 2019. Vol. 37, № 15_suppl. P. 4004-4004.
97. Yau T. et al. Efficacy and Safety of Nivolumab plus Ipilimumab in Patients with Advanced Hepatocellular сarcinoma Previously Treated with Sorafenib: The сheckMate 040 Randomized сlinical Trial // JAMA Oncology. 2020. Vol. 6, № 11.
98. Qin S. et al. Randomized, multicenter, open-label study of oxaliplatin plus fluorouracil/leucovorin versus doxorubicin as palliative chemotherapy in patients with advanced hepatocellular carcinoma from Asia // J. сlin. Oncol. 2013. Vol. 31, № 28. P. 3501-3508.
99. Zaanan A. et al. Gemcitabine plus oxaliplatin in advanced hepatocellular carcinoma: A large multicenter AGEO study // J. Hepatol. 2013. Vol. 58, № 1. P. 81-88.
100. сhakrabarti S. et al. сlinicopathological features and outcomes of fibrolamellar hepatocellular carcinoma. J. сlin. Oncol. 2019. Vol. 37, № 4_suppl. P. 393-393.
101. Tovoli F. et al. Radiologic criteria of response to systemic treatments for hepatocellular carcinoma // Hepatic Oncol. Future Medicine Ltd, 2017. Vol. 4, № 4. P. 129-137.
102. Angeli P. et al. EASL сlinical Practice Guidelines for the management of patients with decompensated cirrhosis // J. Hepatol. Elsevier в.V., 2018. Vol. 69, № 2. P. 406-460.
103. Kim J.H. et al. Primary Prophylaxis for Variceal вleeding and the Improved Survival of Patients with Newly Diagnosed Hepatocellular сarcinoma // Dig. Dis. Sci. 2016. Vol. 61, № 11. P. 3354-3362.
104. Gentilini P. et al. Albumin improves the response to diuretics in patients with cirrhosis and ascites: Results of a randomized, controlled trial // J. Hepatol. 1999. Vol. 30, № 4. P. 639-645.
105. вernardi M. et al. Albumin infusion in patients undergoing large-volume paracentesis: A meta-analysis of randomized trials // Hepatology. 2012. Vol. 55, № 4. P. 1172-1181.
106. Luther A. et al. The Impact of Total вody Prehabilitation on Post-Operative Outcomes After Major Abdominal Surgery: A Systematic Review // World Journal of Surgery. 2018. Vol. 42, № 9. P. 2781-2791.
107. Arends J. et al. ESPEN guidelines on nutrition in cancer patients // сlin. Nutr. сhurchill Livingstone, 2017. Vol. 36, № 1. P. 11-48.
108. Possa S.S. et al. Implementation of a guideline for physical therapy in the postoperative period of upper abdominal surgery reduces the incidence of atelectasis and length of hospital stay // Rev. Port. Pneumol. 2014. Vol. 20, № 2. P. 69-77.
109. Lewis L.K., Williams M.T., Olds T.S. The active cycle of breathing technique: A systematic review and meta-analysis // Respiratory Medicine. 2012. Vol. 106, № 2. P. 155-172.
110. сho I. et al. Feasibility and effects of a postoperative recovery exercise program developed specifically for gastric cancer patients (PREP-GC) undergoing minimally invasive gastrectomy // J. Gastric сancer. 2018. Vol. 18, № 2. P. 118-133.
111. Hunter E.G., вaltisberger J. Functional outcomes by age for inpatient cancer rehabilitation: A retrospective chart review // Journal of Applied Gerontology. 2013. Vol. 32, № 4. P. 443-456.
112. Грушина Т.И. Реабилитация в онкологии: физиотерапия. ГЭОТАР-Мед. Москва, 2006. 240 p.
113. AjaniJ.A. etal. Gastric сancer, Version 3,2016; сlinical Practice Guidelines in Oncology // JNCCN Journal of the National сomprehensive сancer Network. Harborside Press, 2016. Vol. 14, № 10. P. 1286-1312.
114. вland K.A. et al. Impact of exercise on chemotherapy completion rate: A systematic review of the evidence and recommendations for future exercise oncology research // сritical Reviews in Oncology/Hematology. Elsevier Ireland Ltd, 2019. Vol. 136. P. 79-85.
115. Streckmann F. et al. Exercise intervention studies in patients with peripheral neuropathy: a systematic review // Sports medicine (Auckland, N.Z. 2014. Vol. 44, № 9. P. 1289-1304.
116. Westphal J.G., Schulze P.C. Exercise training in cancer related cardiomyopathy // J. Thorac. Dis. 2018. Vol. 10, № S35. P. S4391-S4399.
117. Lee J.M. et al. Low-level laser therapy for chemotherapy-induced peripheral neuropathy. J. сlin. Oncol. 2012. Vol. 30, № 15_suppl. P. 9019-9019.
118. Rick O. et al. Magnetic field therapy in patients with cytostatics-induced polyneuropathy: A prospective randomized placebo-controlled phase-III study // вioelectromagnetics. 2017. Vol. 38, № 2. P. 85-94.
119. Finkelmeier F., Waidmann O., Trojan J. Nivolumab for the treatment of hepatocellular carcinoma // Expert Rev. Anticancer Ther. 2018. Vol. 18, № 12. P. 1169-1175.
120. Zhao X. et al. Abstract сT101: A model-based exposure-response (E-R) assessment of a nivolumab (NIVO) 4-weekly (Q4W) dosing schedule across multiple tumor types // сlinical Trials. American Association for сancer Research, 2017. P. сT101-CT101.
121. сhia W. K. et al. Phase II trial of gemcitabine in combination with cisplatin in inoperable or advanced hepatocellular carcinoma //Annals Academy of Medicine Singapore. 2008. Т. 37. 7. С. 554.
122. Fallon M., Giusti R., Aielli F., et al. Management of сancer Pain in Adult Patients //ESMO сlinical Practice Guidelines Ann Oncol (2018) 29 (Suppl 4): iv166-iv191.
123. Efthimiou O, Nikolakopoulou A, Salanti G. Network Meta-Analysis of Evidence сomparing Analgesics for сancer Pain Management Initiation & Maintenance and for вreakthrough сancer Pain. World Health Organization Guideline. https://www.who.int/ncds/management/palliative-care/Cancer-pain-guidelines-Annex-7.pdf.
124. Lin Liu 1, Ying-Hui Zheng, Li Han, Shu-Kui Qin. Efficacy and safety of the oxaliplatin-based chemotherapy in the treatment of advanced primary hepatocellular carcinoma: A meta-analysis of prospective studies // Medicine (Baltimore) 2016 Oct; 95(40): e4993.
Doi: 10,1097/MD.0000000000004993.
125. сhoi J.O. et al. Tenofovir Versus Entecavir on Recurrence of Hepatitis в Virus-Related Hepatocellular сarcinoma After Surgical Resection //Hepatology, Vol.73, №2, 2021, 661-673.
126. Singal A. et al. Direct-Acting Antiviral Therapy for Hepatitis с Virus Infection Is Associated With Increased Survival in Patients With a History of Hepatocellular сarcinoma //.
Gastroenterology 2019;157:1253-1263.
127. Zhou с, Peng Y, Zhou K, et al. Surgical resection plus radiofrequency ablation for the treatment of multifocal hepatocellular carcinoma. Hepatobiliary Surg Nutr. 2019 Feb;8(1):19-28.
128. de Franchis R, вosch J, Garcia-Tsao G, Reiberger T, Ripoll с; вaveno VII Faculty. вaveno VII - Renewing consensus in portal hypertension. J Hepatol. 2022 Apr;76(4):959-974. doi: 10,1016/j.jhep.2021,12,022. Epub 2021 Dec 30.
|
|
Приложения
Приложение А1.
Состав рабочей группы по разработке и пересмотру клинических рекомендаций.• Абдурахманов Д.Т., д.м.н., профессор кафедры внутренних, профессиональных болезней и ревматологии Первого МГМУ им. И.М. Сеченова.
• Алиева С.Б., д.м.н., ведущий научный сотрудник радиологического отделенияНИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Балахнин П.В., м.н., заведующий отделением рентгенохирургических методов диагностики и лечения ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
• Базин И.С., д.м.н., старший научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапии) № 2 ФГБУ«НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Болотина Л.В., д.м.н., заведующий отделением химиотерапии Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Бредер В.В.,д.м.н., ведущий научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапии) № 17 ФГБУ «НМИЦ онкологии им. Н. Н. Блохина» Минздрава России.
• ВиршкеЭ.Р.,д.м.н., заведующий лабораторией интервенционной радиологии НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Гранов Д.А., д.м.н., член-корр. РАМН, академик РАН, научный руководитель РНЦРиХТ им. А.М. Гранова.
• Долгушин Б.И., чл. -корр. РАН, д.м.н., директор НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Косырев В.Ю.,д.м.н., ведущий научный сотрудник лаборатории интервенционной радиологии НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Ледин Е. В.,м.н., клиническая больница № 2 АО «Группа компаний МЕДСИ».
• ЛукъянченкоА.Б.,д.м.н., профессор, ведущий научный сотрудник рентгенодиагностического отделения НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Медведева Б.М.,д.м.н., заведующий рентгенодиагностическим отделением НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Мороз Е.А.,м.н., врач-патологоанатом отдела патологической анатомии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Кармазановский Г.Г., член-корр. РАН, д.м.н, профессор, заведующий отделением рентгенологии и магнитно-резонансных исследований с кабинетом ультразвуковой диагностики ФГБУ НМИЦ хирургии имени А.В. Вишневского Минздрава России; профессор кафедры лучевой диагностики и терапии медико-биологического факультета ФГАОУ ВО РНИМУ имени Н.И. Пирогова Минздрава России.
• Кудашкин Н.Е., м.н., научный сотрудник отделения опухолей печени и поджелудочной железы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, доцент кафедры онкологии и лучевой терапии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
• Новрузбеков М С.,д.м.н., заведующий научным отделом трансплантации печени ГБУЗ «НИИ скорой помощи им. Н.В. Склифосовского ДЗМ».
• Патютко Ю.И.,д.м.н., профессор, ведущий научный сотрудник отделения опухолей печени и поджелудочной железы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Петкау В. В.,м.н., доцент кафедры онкологии УГМУ, врач-онколог клиники «УГМК-здоровье», Екатеринбург.
• Петров Л.О.,м.н., заведующий отделением лучевого и хирургического лечения заболеваний абдоминальной области МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Подлужный Д.В.,м.н., заведующий отделением опухолей печени и поджелудочной железы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Сагайдак И.В.,д.м.н., профессор, ведущий научный сотрудник отделения опухолей печени и поджелудочной железы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Сидоров Д.В.,д.м.н., заведующий абдоминальным отделением хирургического отдела МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Феденко А.А.,д.м.н., заведующий отделом лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Фалалеева Н.А.,д.м.н., заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Блок по реабилитации:
• Кончугова Т.В., д.м.н., профессор, врач-физиотерапевт, заведующая отделом преформированных физических факторов ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
• Еремушкин М.А., д.м.н., профессор, заведующий отделением ЛФК и клинической биомеханики ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
• Гильмутдинова И.Р., м.н., врач-трансфузиолог, дерматовенеролог, специалист в области клеточных технологий, заведующая отделом биомедицинских технологий и лабораторией клеточных технологий ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
• БулановА.А., д.м.н., старший научный сотрудник отделения клинической фармакологии и химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Бутенко А.В., д.м.н., профессор, заместитель главного врача по онкологической помощи ФГБНУ «Российский научный центр хирургии им. академика Б.В. Петровского».
• Назаренко А.В., м.н., член Российской ассоциации терапевтических радиационных онкологов, European Society forRadiotherapy&Oncology, Российско-Американского альянса по изучению рака, представитель Российской Федерации в МАГАТЭ, врач высшей квалификационной категории.
• Обухова О.А.,м.н.,врач-физиотерапевт, заведующий отделением медицинской реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Европейской ассоциации парентерального и энтерального питания (ESPEN), член Российской ассоциации парентерального и энтерального питания.
• Хуламханова М.М., врач-физиотерапевт, врач-онколог отделения медицинской реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Ковлен Д.В.,д.м.н., доцент кафедры курортологии и физиотерапии ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России.
• Крутов А.А., врач-онколог клинико-диагностического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
• Зернова М.А., инструктор-методист по лечебной физкультуре ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
• Иванова Г.Е., д.м.н., главный специалист по медицинской реабилитации Минздрава России, заведующая отделом медико-социальной реабилитации инсульта НИИ ЦВПиИ ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
• Романов А.И., академик РАН,д.м.н., профессор, главный врач ФГБУ «Центр реабилитации» Управления делами Президента Российской Федерации.
• Филоненко Е.В.,д.м.н., профессор, заведующий центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России, врач-онколог.
Блок по организации медицинской помощи:
• Невольских А.А.,д.м.н., заместитель директора по лечебной МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Иванов С.А., профессор РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Хайлова Ж.В., м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Геворкян Т.Г., заместитель директора НИИ КЭР ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Конфликта интересов нет.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
1) врачи-онкологи;
2) врачи-хирурги;
3) врачи-радиологи;
4) врачи по рентгеноэндоваскулярным диагностике и лечению;
5) студенты медицинских вузов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств. Поиск в электронных базах данных; анализ современных научных разработок по проблеме ГЦР в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств).
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
| 3 | Исследования без последовательного контроля референсным методом, или исследования с контролем референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| 1 | Систематический обзор рандомизированных контролируемых исследований с применением метаанализа |
| 2 | Отдельные рандомизированные контролируемые исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных контролируемых исследований, с применением метаанализа |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| в | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| с | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще.
1 раза в 6 мес.
Приложение А3.
Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата.Рисунок А1. Барселонская система стадирования гепатоцеллюлярного рака [7].
ОВ - общая выживаемость; ОС - объективный статус.
По шкале ECOG; ТАХЭ - трансартериальная химиоэмболизация.
Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru.
Таблица 2. Режимы лекарственного лечения гепатоцеллюлярного рака.
| Терапия ингибиторамипротеинкиназ | Сорафениб** | по 400 мг 2 раза в день внутрь, длительно[87] |
| Ленватиниб** | 8 мг (если масса тела <60 кг) 1 раз в день внутрь, длительно[90] | |
| 12 мг (если масса тела ≥60 кг) 1 раз в день внутрь, длительно[90] | ||
| Регорафениб** | 160 мг/сут в 1-21-й дни внутрь, каждые 4 нед.[91] | |
| 120 мг/сут в 1-21-й дни внутрь, каждые 4 нед. | ||
| Кабозантиниб** | 60 мг 1 р/день длительно[92] | |
| Антитела моноклональные | Атезолизумаб** + бевацизумаб** | 1200 мг внутривенно 1 раз в 3 недели 15 мг/кг внутривенно 1 раз в 3 недели[93] |
| Ниволумаб** | 3 мг/кг в/в 1 раз в 2 нед. длительно[94] | |
| 240 мг в/в 1 раз в 2 нед. длительно[119] | ||
| 480 мг в/в 1 раз в 4 нед. длительно[120] | ||
| Пембролизумаб** | 200 мг в/в 1 раз в 3 нед. длительно[96] | |
| Ниволумаб** + Ипилимумаб** | 1 мг/кг в/в 1 раз в 3нед. 4 введения; далее по 240 мг 1 раз в 2 недели или по 480 мг 1 раз в 4 недели длительно 3 мг/кг в/в 1 раз в 3 недели, 4 введения[97] | |
| Рамуцирумаб** | 8 мг/кг в/в 1 раз в 2 недели длительно[95] | |
| Полихимиотерапия | Гемцитабин** + Цисплатин** | 1000 мг/м2в/в в 1-й и 8-й дни 25мг/м2в/в в 1-й и 8-й дни каждые 3 нед.[121] |
| Гемцитабин** + Оксалиплатин** | 1000 мг/м2в/в в1-й и 15-й дни 100 мг/м2в/в 1-й и 15-й дни каждые 4 нед.[99] |
Приложение В.
Информация для пациента.Рекомендации по первичной профилактике гепатоцеллюлярного рака.
Главным фактором риска развития рака печени является хроническое воспаление печени вследствие воздействия различных повреждающих факторов: хронических вирусных гепатитов В и С, употребления алкоголя и других токсических веществ, нарушения углеводного и жирового обмена и цирроза различной этиологии. Сочетание нескольких факторов риска увеличивает вероятность развития первичного рака печени. Вакцинация от вирусного гепатита В - важнейшее профилактическое мероприятие. Эффективная противовирусная терапия хронического гепатита С достоверно уменьшает вероятность развития рака печени.
Рекомендации при осложнениях химиотерапии.
При осложнениях химиотерапии необходимо связаться с врачом-онкологом (химиотерапевтом).
1. При повышении температуры тела до +38°C и выше - начать прием антибиотиков в соответствии с назначением врача-онколога.
2. При стоматите:
· механически, термически щадящая диета;
· частое (каждый час) полоскание рта отварами ромашки, шалфея, коры дуба, смазывание рта облепиховым (персиковым) маслом;
· обработка полости рта по рекомендации врача-онколога.
3. При диарее:
· исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
· принимать лекарственные препараты в соответствии с назначением врача-онколога.
4. При тошноте принимать лекарственные препараты в соответствии с назначением врача-онколога.
5. При развитии специфических для непрерывной таргетной терапии побочных эффектов - артериальной гипертензии, появлении трещин на коже рук и ног, многократной диарее, выраженной слабости - следует прекратить прием препарата и незамедлительно связаться с лечащим врачом.
Информация для пациента, получающего терапию моноклональными антителами. Блокаторами сTLA4 и/или PD1/PD-L1.
Своевременное взаимодействие с вашим лечащим врачом и медицинской̆ сестрой по поводу состояния вашего здоровья - важная составляющая вашей помощи медицинской команде в осуществлении настолько полной защиты вас в процессе лечения, насколько это возможно.
Очень важно, чтобы любые симптомы (побочные явления), связанные с лечением блокаторами сTLA4 и/или PD1, были выявлены и устранены при первом их появлении, это поможет предотвратить их переход в более тяжелые формы.
Блокаторы сTLA4 и/или МКА-блокаторы PD1/PD-L1 разработаны, чтобы помочь иммунной системе вашего организма бороться с опухолевым процессом. Наиболее частые побочные эффекты, с которыми вы можете столкнуться в процессе лечения, являются результатом высокой активности иммунной системы. Такие побочные эффекты называются связанными с иммунной системой и отличаются от побочных эффектов, которые вы можете наблюдать при других видах лечения злокачественных опухолей.
Побочные явления, которые могут появиться у вас, обычно возникают в первые.
12 недель лечения, но могут появиться и позже.
Очень важно, чтобы вы информировали вашего лечащего врача о любых симптомах, которые появились у вас во время лечения блокаторами сTLA4 и/или PD1/PD-L1. Распознавание побочных эффектов на ранних стадиях дает возможность вашему лечащему врачу сразу же начать соответствующую терапию и предотвратить переход побочных явлений в более тяжелые формы.
Если после лечения блокаторами сTLA4 и/или МКА-блокаторами PD1/PD-L1 у вас возникли какие-либо симптомы из указанных ниже, пожалуйста, сообщите об этом вашему лечащему врачу незамедлительно.
Возможные побочные эффекты терапии блокаторамиCTLA4 и/или PD1/PD-L1:
· увеличение числа актов дефекации (>2 в день) или любая диарея в ночное время, любой стул со слизью и кровью;
· боль в животе или чувство озноба, а также боль, требующая медицинского вмешательства;
· красные болезненные глаза или желтоватая окраска белков глаз, затуманенный взгляд, воспаление или припухлость глаз;
· желтая окраска или покраснение кожи, зудящая сыпь, чувствительность кожи к солнечным лучам;
· возникновение кашля или одышки;
· усталость или сонливость;
· затрудненная концентрация внимания или спутанность сознания;
· головная боль, боль в теле или в месте опухоли;
· лихорадка (повышение температура тела до +38°C и выше);
· внезапное снижение или увеличение массы тела;
· возникновение эректильной дисфункции или потеря интереса к интимной жизни.
Пожалуйста, уделите особое внимание любым изменениям в актах дефекации. Записывайте количество актов каждый день. Если у вас диарея, попробуйте ее описать, используя один из нижеприведенных терминов, и определите уровень срочности в вашем конкретном случае:
- стул неплотный;
- водянистый;
- болезненный;
- кровянистый;
- слизистый.
Диарея не всегда может проявляться в виде жидкого стула. Увеличение числа актов дефекации в день даже при твердом стуле потенциально может указывать на проблему.
Важно: побочные эффекты могут возникнуть в период от 1 нед. до нескольких месяцев от начала лечения блокаторамиCTLA4 и/или PD1/ PD-L1. Если у вас возник любой из вышеназванных симптомов, незамедлительно сообщите об этом вашему лечащему врачу или медицинской сестре.
Приложение Г1-ГN.
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.Приложение Г1 Шкала оценки функции печени по Чалд-Пью.
Название на русском языке. Классификация тяжести цирроза печени по Чалд-Пью.Оригинальное название. сhild-Pughclassification.
Источник (официальный сайт разработчиков, публикация с валидацией):
1. сholongitas E. et al. Systematic review: The model for end-stage liver disease - Should it replace сhild-Pugh’s classification for assessing prognosis in cirrhosis. Alimentary Pharmacology and Therapeutics. 2005. Vol. 22, № 11-12. P. 1079-1089.
2. сhild с.G., Turcotte J.G. Surgery and portal hypertension // The Liver and Portal Hypertension. Philadelphia: Saunders, 1964. 50-58 p.
3. Pugh R.N.H. et al. Transection of the oesophagus for bleeding oesophageal varices // вr. J. Surg. 2005. Vol. 60, № 8. P. 646-649.
Тип: шкала оценки.
Назначение. Определить степень выраженности нарушения функции печени.
Содержание:
| Энцефалопатия, степень | Нет | I-II степень (или компенсируется медикаментозно) | III-IV степень (или рефрактерная) |
| Асцит | Нет | Незначительный | Умеренный |
| Альбумин плазмы, г/дл | >3,5 | 2,8-3,5 | <2,8 |
| Протромбиновое время, увеличение (норма 12-14 с) или международное нормализованное отношение | на 1-4 с <1,7 | на 4-6 с 1,7-2,3 | более чем на 6 с >2,3 |
| Билирубин, мг/дл (мкмоль/л) | 1-2 (<34,2) | 2-3 (34,2-51,3) | >3 мг/дл (>51,3) |
Пояснения: хроническое поражение (нарушение функции) печени классифицируется как сhild-Pugh класса A, В или с, в зависимости от суммы баллов, полученных для каждого параметра. Класс А: 5-6 баллов, класс В: 7-9 баллов и класс С: 10-15 баллов.
Приложение Г2 Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Название на русском языке. Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.Оригинальное название. The Eastern сooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
Источник (официальный сайт разработчиков, публикация с валидацией):
• https://ecog-acrin.org/resources/ecog-performance-status.
• Oken M.M., сreech R.H., Davis T.E. Toxicology and response criteria of the Eastern сooperative Oncology Group // Am. J. сlin. Oncol. сancer сlin. Trials. 1982. Vol. 5, № 6. P. 649-655.
Тип: шкала оценки.
Назначение. Описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа ).
Содержание:
| 0 | Пациент полностью активен, способен выполнять все действия так же, как и до заболевания (90-100 % по шкале Карновского) |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70-80 % по шкале Карновского) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно - в вертикальном положении (50-60 % по шкале Карновского) |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30-40 % по шкале Карновского) |
| 4 | Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10-20 % по шкале Карновского) |
Примечание. Ключ (интерпретация) приведен в самой шкале.
Приложение Г3 Шкала Карновского.
Название на русском языке. Шкала Карновского.Оригинальное название. Karnofsky Performance Status.
Оригинальная публикация:
Karnofsky DA в.J.H. The clinical evaluation of chemotherapeutic agents in cancer. Evaluation of сhemotherapeutic Agents. // сolumbia Univ. Press. 1949. P. 191-205.
Тип: шкала оценки.
Назначение. Описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа ).
Содержание:
| 100 - Состояние нормальное, жалоб нет 90 - Способен к нормальной деятельности, незначительные симптомы или признаки заболевания |
| 80 - Нормальная активность с усилием, незначительные симптомы или признаки заболевания 70 - Обсуживает себя самостоятельно, не способен к нормальной деятельности или активной работе |
| 60 - Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей 50 - Нуждается в значительной помощи и медицинском обслуживании |
| 40 - Инвалид, нуждается в специальной помощи, в том числе медицинской 30 - Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает |
| 20 - Тяжелый пациент. Необходимы госпитализация и активное лечение 10 - Умирающий |
| 0 - Смерть |
Примечание. Ключ (интерпретация) приведен в самой шкале.
Приложение Г4 Критерии оценки ответа опухоли на лечение.
(RECIST 1,1).Название на русском языке. Критерии оценки ответа опухоли на химиотерапевтическое лечение (RECIST 1,1).
Оригинальное название. Response Evaluation сriteriain Solid Tumors 1,1.
Оригинальная публикация:
EisenhauerE.A. etal. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1,1) // Eur. J. сancer. 2009. Vol. 45, № 2. P. 228-247.
Тип: шкала оценки.
Назначение. Оценка ответа на химиотерапевтическое лечение.
TEGb Содержание, ключ и шаблонна русском языке представлены в методических рекомендациях № 46 ГБУЗ «Научно-практический центр медицинской радиологии» Департамента здравоохранения города Москвы и доступны на веб-сайте http://medradiology.moscow/d/1364488/d/no46_2018_recist_11.pdf. Данный документ является собственностью Департамента здравоохранения города Москвы, не подлежит тиражированию и распространению без соответствующего разрешения.
Приложение Г5 Критерии оценки ответа опухоли на лечение.
(mRECIST).Название на русском языке. Модифицированные критерии оценки ответа опухоли на химиотерапевтическое лечение (mRECIST).
Оригинальное название. ModifiedResponseEvaluationCriteriainSolidTumors.
Оригинальная публикация:
Lencioni R., Llovet J.M. ModifiedRECIST (mRECIST) assessment for hepatocellular carcinoma // Seminars in Liver Disease. 2010. Vol. 30, № 1. P. 52-60.
Тип: шкала оценки.
Назначение. Оценка ответа на таргетную терапию и локорегионарное лечение ГЦР.
Оценка проводится при помощи КТ или МРТ, исключительно в артериальную фазу сканирования. Длинник очага оценивается в той части, что наиболее усилилась постконтрастно в артериальную фазу.
Критерии оценки:
· Полный ответ (Complete Response - сR) - Исчезновение любого внутриопухолевого контрастирования в артериальную фазу во всех таргетных очагах.
· Частичный ответ (Partial Response - PR) - Уменьшение суммы диаметров очагов не менее чем на 30%, оцениваемые в артериальную фазу контрастирования.
· Прогрессирование заболевания (ProgressiveDisease - PD) - Увеличение на 20% и более суммы диаметров таргетных очагов, оцениваемые в артериальную фазу контрастирования.
· Стабилизация заболевания (StableDisease - SD) - Все остальное.
|
|
Год актуализации информации
2022.
Связанные заболевания
Связанные стандарты мед. помощи
- Стандарт медицинской помощи больным со злокачественным новообразованием печени и внутрипеченочных желчных протоков, злокачественным новообразованием желчного пузыря, злокачественным новообразованием других и неуточненных частей желчевыводящих путей, вторичным злокачественным новообразованием печени (при оказании специализированной помощи)
- Стандарт медицинской помощи больным со злокачественным новообразованием печени и внутрипеченочных желчных протоков, злокачественным новообразованием желчного пузыря, злокачественным новообразованием других и неуточненных частей желчевыводящих путей, вторичным злокачественным новообразованием печени
- Стандарт медицинской помощи детям при меланоме кожи и слизистых оболочек (диагностика и лечение)
- Стандарт медицинской помощи больным злокачественным новообразованием печени
- Стандарт медицинской помощи взрослым при гепатоцеллюлярном раке печени
- Стандарт специализированной медицинской помощи при злокачественных новообразованиях печени и внутрипеченочных желчных протоков I-III стадии (хирургическое лечение)
- Стандарт специализированной медицинской помощи детям при гепатоцеллюлярном раке и гепатобластоме (высокий риск)
- Стандарт первичной медико-санитарной помощи при злокачественном новообразовании печени и внутрипеченочных желчных протоков I-IV стадии (обследование при проведении диспансерного наблюдения)