Другие названия и синонимы
Trimebutine.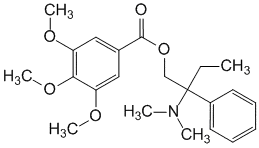
Фармакологическая группа
|
|
Латинское название
Trimebutinum ( Trimebutini).
Химическое название
2-(Диметиламино)-2-фенилбутил-3,4,5-триметоксибензоат (в виде малеата).
Используется в лечении
Код CAS
39133-31-8.
Фармакологическое действие
Регулирующее моторику ЖКТ.
Характеристика вещества
Белый или почти белый порошок, практически нерастворимый в воде, умеренно растворимый в этаноле, диэтиловом эфире, н-гексане и метаноле и легко растворимый в ацетоне и хлороформе. Молекулярная масса 387,5.
Фармакодинамика
Фармакодинамика.
Обладает умеренным сродством к опиоидным рецепторам, стимулирует регуляцию спонтанной активности и увеличивает синхронизацию между электрофизиологическими спайками и сокращениями в изолированной полоске ободочной и подвздошной кишки морских свинок. Не изменяет нормальную моторику, но регулирует отклонения от нормы деятельности кишечника.
Обладает умеренным сродством к опиоидным рецепторам, стимулирует регуляцию спонтанной активности и увеличивает синхронизацию между электрофизиологическими спайками и сокращениями в изолированной полоске ободочной и подвздошной кишки морских свинок. Не изменяет нормальную моторику, но регулирует отклонения от нормы деятельности кишечника.
Фармакокинетика
Изучение метаболизма тримебутина у крыс, собак и человека показало, что 14C-меченный тримебутин в виде малеата или его свободного основания быстро всасывается после приема внутрь. Максимум радиоактивности в плазме крови наблюдался в течение 1 ч у человека и крыс и 2-4 ч у собак.
Изучение радиоактивности плазмы у человека показало кинетическую модель с центральным и периферическим компартментами и средний 1/2T1/2 0,66 Исследование распределения в тканях продемонстрировало высокую концентрацию радиоактивно-меченного тримебутина в стенках желудка и кишечника у крыс и в основных органах метаболизма и экскреции у мышей. Плацентарный перенос без тератогенного эффекта наблюдался у крыс. Связывание с белками было менее 5% in vivo >in vivo (плазма крысы) и in vitro >in vitro (бычий сывороточный альбумин).
Тримебутин у всех видов животных выводился в основном с мочой, небольшая доля радиоактивности (5-12%) была обнаружена в фекалиях. 1/2T1/2 тримебутина из плазмы крови короткий, однако конечный 1/2T1/2 радиоактивности составлял приблизительно 10-12 ч у человека и крыс. У крыс также была продемонстрирована энтерогепатическая циркуляция.
Отмечался экстенсивный метаболизм исходного тримебутина, менее 2,4% радиоактивности в моче приходилось на неизмененное вещество у всех видов. Основным местом гидролиза эфира тримебутина и его пресистемного метаболизма у крыс и собак являлась печень. Основными метаболитами в моче у всех видов были 2-амино- (I), 2-метиламино- (II) или 2-диметиламино-2-фенилбутан-1-ол (III). Эти три метаболита и моно-N-десметилтримебутин (IV) были также обнаружены в плазме, основным метаболитом у крыс и собак было соединение III, у человека - IV. Показано, что важную роль в метаболизме играет конъюгация с сульфатом и/или глюкуроновой кислотой.
В исследовании с участием 22 здоровых добровольцев для оценки биодоступности сравнивали фармакокинетический профиль тримебутина при приеме натощак в виде 2 таблеток по 100 мг и 1 таблетки по 200 мг. Анализ результатов показал, что абсорбция тримебутина из обоих лекарственных форм была сопоставимой. Не выявлено статистически значимых различий между этими двумя формами для любого из расчетных параметров биодоступности тримебутина. Был сделан вывод, что 1 таблетка тримебутина в дозе 200 мг и 2 таблетки в дозе 100 мг, по-видимому, имеют сопоставимую биодоступность.
Доклинические исследования.
Острая токсичность.
Оценка острой токсичности тримебутина при различных способах введения приведена в таблице ниже (ЛД50, мг/кг ± стандартная ошибка). Исследования при внутрибрюшинном и в/в введении на кроликах не проводились.
Таблица.
Смерть наступала в результате остановки дыхания в течение 1 мин, 15 мин и 24 ч после в/в, внутрибрюшинного или перорального введения соответственно.
Острая токсичность при в/в введении изучалась на собаках, находящихся под наркозом, с мониторингом сердечно-сосудистой и дыхательной функции. При дозах от 1 до 20 мг/кг наблюдалось дозозависимое снижение частоты дыхания и АД.
Смерть из-за остановки дыхания наступала при дозе 49 мг/кг. Сердечная функция сохранялась в течение почти трех минут после остановки дыхания, следовательно, причиной смерти была остановка дыхания, а не воздействие на ССС.
Подострая токсичность.
Тримебутин вводили в/в в течение 4 нед крысам и собакам породы бигль в дозах 4; 8 и 16 или 4; 7 и 12,5 мг/кг/сут соответственно.
У крыс не наблюдалось специфической органной токсичности. Однако в группе получавших более высокие дозы отмечался высокий уровень смертности, половина животных погибла во время исследования. Смерть наступала всегда в течение 15 с после введения, и у животных проявлялись признаки острого поражения ЦНС. Патологоанатомическое исследование показало небольшое увеличение веса селезенки и надпочечников у самцов при дозе 16 мг/кг/сут. Места инъекций имели нормальный вид.
У собак наблюдались транзиторные, обратимые признаки воздействия на ЦНС при дозах 7 и 12,5 мг/кг/сут. У самок, получавших высокие дозы, наблюдалась общая потеря веса, в то время как у самцов снижалась прибавка в весе при дозах 7 и 12,5 мг/кг/сут. Места инъекций подопытных и контрольных животных были сопоставимы.
Хроническая токсичность.
Тримебутин вводили перорально в течение 26 нед крысам и собакам породы бигль в дозах 40; 220 и 1210 или 10; 30 и от 90 до 250 мг/кг/сут соответственно.
У крыс не наблюдалось выраженных клинических признаков или идентифицируемой специфической токсичности для органа-мишени. В группах, получавших высокие дозы, смертность была низкой. Увеличение веса снижалось при дозе 1210 мг/кг/сут у самцов и самок и у самок при дозе 220 мг/кг/сут. В конце лечения появлялось умеренное повышение уровня сывороточной ЩФ и АЛТ у самок, получавших высокие дозы. При дозе 1210 мг/кг/сут вес печени и надпочечников (относительно веса тела) были увеличены, в то время как вес почек увеличивался во всех группах, получавших высокие дозы. Патогистологическое исследование аномалий не выявило.
У собак неблагоприятные клинические признаки и потеря веса наблюдались только у животных, которым вводили дозу 250 мг/кг/сут. Дозозависимое уменьшение времени коагуляции наблюдалось при дозах 90 и 250 мг/кг/сут, что также было связано со снижением ПВ. При высоких уровнях дозы снижался уровень сывороточного альбумина и увеличивался уровень азота мочевины крови, креатинина крови, вес печени, почек или надпочечников. Патогистологических аномалий, связанных с лечением, не выявлено.
Тератогенность.
На крысах исследования на тератогенность, влияние на фертильность, общие репродуктивные исследования, а также до- и послеродовые исследования проводились при пероральном и в/м введении в дозах 100-1000 и 12,5-50 мг/кг соответственно. В исследованиях тератогенности на кроликах тримебутин вводили перорально и п/к в дозах 50-200 и 25-100 мг/кг соответственно.
В ходе этих исследований не было обнаружено тератогенных аномалий и тримебутин не оказывал неблагоприятного воздействия на фертильность, репродуктивную функцию, течение и исход беременности и развитие потомства в период лактации.
Мутагенность.
In vivo исследование мутагенности на мышах при уровнях доз 3000-12000 мг/кг и in vitro >in vitro изучение мутагенности и канцерогенности не выявили доказательств токсичности в отношении костного мозга или мутагенного и канцерогенного потенциала тримебутина.
Клинические исследования.
Клинические данные подтвердили регулирующее действие тримебутина в нижних отделах ЖКТ. Эти данные основаны на результатах электромиографии кишечника или определения времени прохождения пищи у пациентов с послеоперационной паралитической кишечной непроходимостью или у пациентов, страдающих синдромом раздраженного кишечника. Кроме того, это регулирующее действие было также подтверждено двигательной активностью сигмовидной ободочной кишки у пациентов с ее гипо- или гиперактивностью.
Синдром раздраженного кишечника.
Тримебутин широко применялся в различных клинических исследованиях с участием пациентов с синдромом раздраженного кишечника. Всего было проведено 18 исследований для оценки воздействия тримебутина, в которых участвовали 744 пациента. Одиннадцать из этих 18 исследований проводились как двойные слепые контролируемые (363 пациента), в которых сравнивали применение тримебутина и плацебо. В трех других контролируемых исследованиях (130 пациентов) препаратом сравнения для тримебутина был мебеверин, сходный с папаверином, остальные четыре исследования (251 пациент) были открытыми.
Среди контролируемых исследований три были краткосрочными (3-дневное лечение), включавшими 197 пациентов, и восемь - среднесрочными (2-4 нед лечения) с участием 166 пациентов. Дозы в этих исследованиях варьировали от 400 до 600 мг/сут в разделенных дозах с применением лекарственной формы таблетки по 100 мг. В большинстве этих исследований использовался одинарный или двойной слепой перекрестный дизайн для уменьшения погрешности при определении эффектов плацебо.
Оценка эффективности лечения осуществлялась путем определения степени тяжести каждого из симптомов (в тч боль в животе, запор, диарея) до и во время лечения по критериям «отсутствует», «легкая», «умеренная» или «тяжелая». Альтернативно оценивалась степень улучшения этих симптомов. Кроме того, регистрировалась общая оценка предпочтений пациентов в применении любого из исследуемых ЛС.
Эффект плацебо наблюдался в большинстве этих исследований в начальном периоде лечения, не наблюдалось различий в улучшении симптомов между применением тримебутина и плацебо. Однако в последующие периоды лечения тримебутин показал более высокую эффективность, чем плацебо.
Краткосрочные исследования. В одном из трех краткосрочных перекрестных исследований (3-дневное лечение) тримебутин значительно превосходил плацебо независимо от того, применялся ли он в начале лечения или был препаратом усиления. В двух других исследованиях у пациентов, получавших тримебутин для усиления лечения, значительно улучшались показатели по сравнению с применением плацебо.
Среднесрочные исследования. Семь из восьми подобных исследований были двойными слепыми перекрестными, в то время как одно - с параллельными группами. Продолжительность лечения варьировала от 2 до 4 нед, доза - от 300 до 600 мг/сут. Оценивались следующие симптомы: боль в животе, запор, диарея и вздутие живота/метеоризм. Общая оценка и предпочтение пациентов по отношению к конкретному лечению регистрировались в конце лечения.
В трех из этих исследований эффективность применения тримебутина была выше, чем у плацебо, улучшение было статистически значимым. Кроме того, анализ времени прохождения содержимого через кишечник (одно исследование) показал значительное ускорение транзита у пациентов, получавших тримебутин; среднее время прохождения сократилось с 52 до 25 ч (p<0,05).
Общая оценка тяжести симптомов, выполненная пациентом и врачом, также указала на уменьшение тяжести симптомов у большего числа пациентов, получавших тримебутин, чем при применении плацебо. Кроме того, улучшение состояния при применении тримебутина было продемонстрировано и у пациентов с наиболее тяжелыми начальными симптомами.
Результаты одного исследования показали, что эффект тримебутина становился очевидным только через 2 нед и сохранялся еще 1 нед после прекращения применения. В этом исследовании тримебутин показал значимое улучшение по сравнению с плацебо (p<0,01) в отношении чередования запоров и диареи. В других исследованиях со статистически значимым улучшением во время лечения, по сравнению с состоянием до лечения, не выявлено значительного различия между применением тримебутина и плацебо.
В других контролируемых исследованиях тримебутин сравнивали с мебеверином. Всего было проведено три исследования с участием 130 пациентов. Пациенты с синдромом раздраженного кишечника получали тримебутин в дозе 100 или 200 мг 3 раза в день и мебеверин в дозе 100 мг 3 или 4 раза в день в течение до 4 нед. Оба препарата обеспечили статистически значимое улучшение (p<0,001) симптомов синдрома раздраженного кишечника после 2 и 4 нед лечения без значительных различий между двумя группами. Однако улучшение после применения тримебутина в течение 3-й и 4-й нед лечения было более значительным (p<0,001) по сравнению с мебеверином. Переносимость обоих ЛС была хорошей.
В двойном слепом плацебо-контролируемом исследовании тримебутин (200 мг) получали перорально 11 здоровых добровольцев и 9 пациентов с синдромом раздраженного кишечника с преобладанием запоров. Постпрандиальную двигательную активность измеряли манометрически в сигмовидной кишке.
Результаты этого исследования показали, что несмотря на пероральное введение тримебутин не влиял на постпрандиальную двигательную активность сигмовидной кишки у здоровых добровольцев. Тем не менее тримебутин снижал усиление такой активности у пациентов с синдромом раздраженного кишечника с преобладанием запоров.
В другом двойном слепом перекрестном исследовании 24 пациента, страдающие хроническим идиопатическим запором, получали перорально тримебутин в дозе 200 мг/сут в течение 1 мес. Результаты показали, что время прохождения через толстую кишку значительно снижалось (p<0,05) у пациентов с «задержанным» транзитом (от (105±9) до (60±11) ч), в то время как оно не изменялось при приеме плацебо (от (103±17) до (95±10) ч). У пациентов с запором при «нормальном» времени транзита применение тримебутина или плацебо не влияло на электрическую активность ни до, ни после приема пищи.
Послеоперационная паралитическая кишечная непроходимость.
Контролируемые исследования. Было проведено 5 контролируемых и 11 открытых исследований для оценки клинических эффектов тримебутина на послеоперационную кишечную непроходимость. В этих исследованиях участвовали 1123 пациента (340 в контролируемых исследованиях и 783 - в открытых).
В контролируемых исследованиях тримебутин вводили в дозах от 100 до 400 мг в/в или в/м. Общие результаты показали, что тримебутин хорошо переносился пациентами. Интервал времени до прохождения первого кишечного газа был короче у пациентов, получавших тримебутин (52±9 ) по сравнению с плацебо (73±17) Также значительно быстрее происходило возобновление перистальтики кишечника: (68±11) ч по сравнению с (88±18) ч (p<0,05). Кроме того, у пациентов, получавших тримебутин, ощущался меньший дискомфорт в животе, чем в группе плацебо.
Побочные реакции, такие как головокружение, тошнота и/или рвота, диарея и сухость во рту, отмечались у 14 из 340 пациентов (4,1%). Эти побочные эффекты были умеренными по степени тяжести и не требовали сопутствующего приема ЛС.
Открытые исследования. В 11 открытых исследованиях возобновление газообразования наблюдалось в течение 48 ч в 66,4% случаев, в 85,4% - в течение 72 Как и в контролируемых исследованиях, тримебутин помогал улучшить послеоперационное состояние пациентов, уменьшились дискомфорт в животе и толстой кишке, боли в животе и тошнота.
Результаты этих исследований показали, что тримебутин обладал интенсивной сократительной активностью в отношении кишечника у 29 пациентов, по сравнению с 13 пациентами, не получавшими его. Клинически показано, что продолжительность паралитической кишечной непроходимости значительно снижалась у пациентов, получавших тримебутин, по сравнению с контрольной группой. Пассаж первого послеоперационного газа ускорялся в среднем на 23% при применении тримебутина. Также было отмечено, что тримебутин ослабляет симптомы, связанные с кишечной непроходимостью, такие как тошнота, рвота, вздутие живота и боли в животе.
Изучение радиоактивности плазмы у человека показало кинетическую модель с центральным и периферическим компартментами и средний 1/2T1/2 0,66 Исследование распределения в тканях продемонстрировало высокую концентрацию радиоактивно-меченного тримебутина в стенках желудка и кишечника у крыс и в основных органах метаболизма и экскреции у мышей. Плацентарный перенос без тератогенного эффекта наблюдался у крыс. Связывание с белками было менее 5% in vivo >in vivo (плазма крысы) и in vitro >in vitro (бычий сывороточный альбумин).
Тримебутин у всех видов животных выводился в основном с мочой, небольшая доля радиоактивности (5-12%) была обнаружена в фекалиях. 1/2T1/2 тримебутина из плазмы крови короткий, однако конечный 1/2T1/2 радиоактивности составлял приблизительно 10-12 ч у человека и крыс. У крыс также была продемонстрирована энтерогепатическая циркуляция.
Отмечался экстенсивный метаболизм исходного тримебутина, менее 2,4% радиоактивности в моче приходилось на неизмененное вещество у всех видов. Основным местом гидролиза эфира тримебутина и его пресистемного метаболизма у крыс и собак являлась печень. Основными метаболитами в моче у всех видов были 2-амино- (I), 2-метиламино- (II) или 2-диметиламино-2-фенилбутан-1-ол (III). Эти три метаболита и моно-N-десметилтримебутин (IV) были также обнаружены в плазме, основным метаболитом у крыс и собак было соединение III, у человека - IV. Показано, что важную роль в метаболизме играет конъюгация с сульфатом и/или глюкуроновой кислотой.
В исследовании с участием 22 здоровых добровольцев для оценки биодоступности сравнивали фармакокинетический профиль тримебутина при приеме натощак в виде 2 таблеток по 100 мг и 1 таблетки по 200 мг. Анализ результатов показал, что абсорбция тримебутина из обоих лекарственных форм была сопоставимой. Не выявлено статистически значимых различий между этими двумя формами для любого из расчетных параметров биодоступности тримебутина. Был сделан вывод, что 1 таблетка тримебутина в дозе 200 мг и 2 таблетки в дозе 100 мг, по-видимому, имеют сопоставимую биодоступность.
Доклинические исследования.
Острая токсичность.
Оценка острой токсичности тримебутина при различных способах введения приведена в таблице ниже (ЛД50, мг/кг ± стандартная ошибка). Исследования при внутрибрюшинном и в/в введении на кроликах не проводились.
Таблица.
| Путь введения | Мыши | Крысы | Кролики |
| Перорально | >5000 | >5000 | 2500±800 |
| Внутрибрюшинно | 500±46 | 550±55 | − |
| В/в | 43±3 | 16±3 | − |
Смерть наступала в результате остановки дыхания в течение 1 мин, 15 мин и 24 ч после в/в, внутрибрюшинного или перорального введения соответственно.
Острая токсичность при в/в введении изучалась на собаках, находящихся под наркозом, с мониторингом сердечно-сосудистой и дыхательной функции. При дозах от 1 до 20 мг/кг наблюдалось дозозависимое снижение частоты дыхания и АД.
Смерть из-за остановки дыхания наступала при дозе 49 мг/кг. Сердечная функция сохранялась в течение почти трех минут после остановки дыхания, следовательно, причиной смерти была остановка дыхания, а не воздействие на ССС.
Подострая токсичность.
Тримебутин вводили в/в в течение 4 нед крысам и собакам породы бигль в дозах 4; 8 и 16 или 4; 7 и 12,5 мг/кг/сут соответственно.
У крыс не наблюдалось специфической органной токсичности. Однако в группе получавших более высокие дозы отмечался высокий уровень смертности, половина животных погибла во время исследования. Смерть наступала всегда в течение 15 с после введения, и у животных проявлялись признаки острого поражения ЦНС. Патологоанатомическое исследование показало небольшое увеличение веса селезенки и надпочечников у самцов при дозе 16 мг/кг/сут. Места инъекций имели нормальный вид.
У собак наблюдались транзиторные, обратимые признаки воздействия на ЦНС при дозах 7 и 12,5 мг/кг/сут. У самок, получавших высокие дозы, наблюдалась общая потеря веса, в то время как у самцов снижалась прибавка в весе при дозах 7 и 12,5 мг/кг/сут. Места инъекций подопытных и контрольных животных были сопоставимы.
Хроническая токсичность.
Тримебутин вводили перорально в течение 26 нед крысам и собакам породы бигль в дозах 40; 220 и 1210 или 10; 30 и от 90 до 250 мг/кг/сут соответственно.
У крыс не наблюдалось выраженных клинических признаков или идентифицируемой специфической токсичности для органа-мишени. В группах, получавших высокие дозы, смертность была низкой. Увеличение веса снижалось при дозе 1210 мг/кг/сут у самцов и самок и у самок при дозе 220 мг/кг/сут. В конце лечения появлялось умеренное повышение уровня сывороточной ЩФ и АЛТ у самок, получавших высокие дозы. При дозе 1210 мг/кг/сут вес печени и надпочечников (относительно веса тела) были увеличены, в то время как вес почек увеличивался во всех группах, получавших высокие дозы. Патогистологическое исследование аномалий не выявило.
У собак неблагоприятные клинические признаки и потеря веса наблюдались только у животных, которым вводили дозу 250 мг/кг/сут. Дозозависимое уменьшение времени коагуляции наблюдалось при дозах 90 и 250 мг/кг/сут, что также было связано со снижением ПВ. При высоких уровнях дозы снижался уровень сывороточного альбумина и увеличивался уровень азота мочевины крови, креатинина крови, вес печени, почек или надпочечников. Патогистологических аномалий, связанных с лечением, не выявлено.
Тератогенность.
На крысах исследования на тератогенность, влияние на фертильность, общие репродуктивные исследования, а также до- и послеродовые исследования проводились при пероральном и в/м введении в дозах 100-1000 и 12,5-50 мг/кг соответственно. В исследованиях тератогенности на кроликах тримебутин вводили перорально и п/к в дозах 50-200 и 25-100 мг/кг соответственно.
В ходе этих исследований не было обнаружено тератогенных аномалий и тримебутин не оказывал неблагоприятного воздействия на фертильность, репродуктивную функцию, течение и исход беременности и развитие потомства в период лактации.
Мутагенность.
In vivo исследование мутагенности на мышах при уровнях доз 3000-12000 мг/кг и in vitro >in vitro изучение мутагенности и канцерогенности не выявили доказательств токсичности в отношении костного мозга или мутагенного и канцерогенного потенциала тримебутина.
Клинические исследования.
Клинические данные подтвердили регулирующее действие тримебутина в нижних отделах ЖКТ. Эти данные основаны на результатах электромиографии кишечника или определения времени прохождения пищи у пациентов с послеоперационной паралитической кишечной непроходимостью или у пациентов, страдающих синдромом раздраженного кишечника. Кроме того, это регулирующее действие было также подтверждено двигательной активностью сигмовидной ободочной кишки у пациентов с ее гипо- или гиперактивностью.
Синдром раздраженного кишечника.
Тримебутин широко применялся в различных клинических исследованиях с участием пациентов с синдромом раздраженного кишечника. Всего было проведено 18 исследований для оценки воздействия тримебутина, в которых участвовали 744 пациента. Одиннадцать из этих 18 исследований проводились как двойные слепые контролируемые (363 пациента), в которых сравнивали применение тримебутина и плацебо. В трех других контролируемых исследованиях (130 пациентов) препаратом сравнения для тримебутина был мебеверин, сходный с папаверином, остальные четыре исследования (251 пациент) были открытыми.
Среди контролируемых исследований три были краткосрочными (3-дневное лечение), включавшими 197 пациентов, и восемь - среднесрочными (2-4 нед лечения) с участием 166 пациентов. Дозы в этих исследованиях варьировали от 400 до 600 мг/сут в разделенных дозах с применением лекарственной формы таблетки по 100 мг. В большинстве этих исследований использовался одинарный или двойной слепой перекрестный дизайн для уменьшения погрешности при определении эффектов плацебо.
Оценка эффективности лечения осуществлялась путем определения степени тяжести каждого из симптомов (в тч боль в животе, запор, диарея) до и во время лечения по критериям «отсутствует», «легкая», «умеренная» или «тяжелая». Альтернативно оценивалась степень улучшения этих симптомов. Кроме того, регистрировалась общая оценка предпочтений пациентов в применении любого из исследуемых ЛС.
Эффект плацебо наблюдался в большинстве этих исследований в начальном периоде лечения, не наблюдалось различий в улучшении симптомов между применением тримебутина и плацебо. Однако в последующие периоды лечения тримебутин показал более высокую эффективность, чем плацебо.
Краткосрочные исследования. В одном из трех краткосрочных перекрестных исследований (3-дневное лечение) тримебутин значительно превосходил плацебо независимо от того, применялся ли он в начале лечения или был препаратом усиления. В двух других исследованиях у пациентов, получавших тримебутин для усиления лечения, значительно улучшались показатели по сравнению с применением плацебо.
Среднесрочные исследования. Семь из восьми подобных исследований были двойными слепыми перекрестными, в то время как одно - с параллельными группами. Продолжительность лечения варьировала от 2 до 4 нед, доза - от 300 до 600 мг/сут. Оценивались следующие симптомы: боль в животе, запор, диарея и вздутие живота/метеоризм. Общая оценка и предпочтение пациентов по отношению к конкретному лечению регистрировались в конце лечения.
В трех из этих исследований эффективность применения тримебутина была выше, чем у плацебо, улучшение было статистически значимым. Кроме того, анализ времени прохождения содержимого через кишечник (одно исследование) показал значительное ускорение транзита у пациентов, получавших тримебутин; среднее время прохождения сократилось с 52 до 25 ч (p<0,05).
Общая оценка тяжести симптомов, выполненная пациентом и врачом, также указала на уменьшение тяжести симптомов у большего числа пациентов, получавших тримебутин, чем при применении плацебо. Кроме того, улучшение состояния при применении тримебутина было продемонстрировано и у пациентов с наиболее тяжелыми начальными симптомами.
Результаты одного исследования показали, что эффект тримебутина становился очевидным только через 2 нед и сохранялся еще 1 нед после прекращения применения. В этом исследовании тримебутин показал значимое улучшение по сравнению с плацебо (p<0,01) в отношении чередования запоров и диареи. В других исследованиях со статистически значимым улучшением во время лечения, по сравнению с состоянием до лечения, не выявлено значительного различия между применением тримебутина и плацебо.
В других контролируемых исследованиях тримебутин сравнивали с мебеверином. Всего было проведено три исследования с участием 130 пациентов. Пациенты с синдромом раздраженного кишечника получали тримебутин в дозе 100 или 200 мг 3 раза в день и мебеверин в дозе 100 мг 3 или 4 раза в день в течение до 4 нед. Оба препарата обеспечили статистически значимое улучшение (p<0,001) симптомов синдрома раздраженного кишечника после 2 и 4 нед лечения без значительных различий между двумя группами. Однако улучшение после применения тримебутина в течение 3-й и 4-й нед лечения было более значительным (p<0,001) по сравнению с мебеверином. Переносимость обоих ЛС была хорошей.
В двойном слепом плацебо-контролируемом исследовании тримебутин (200 мг) получали перорально 11 здоровых добровольцев и 9 пациентов с синдромом раздраженного кишечника с преобладанием запоров. Постпрандиальную двигательную активность измеряли манометрически в сигмовидной кишке.
Результаты этого исследования показали, что несмотря на пероральное введение тримебутин не влиял на постпрандиальную двигательную активность сигмовидной кишки у здоровых добровольцев. Тем не менее тримебутин снижал усиление такой активности у пациентов с синдромом раздраженного кишечника с преобладанием запоров.
В другом двойном слепом перекрестном исследовании 24 пациента, страдающие хроническим идиопатическим запором, получали перорально тримебутин в дозе 200 мг/сут в течение 1 мес. Результаты показали, что время прохождения через толстую кишку значительно снижалось (p<0,05) у пациентов с «задержанным» транзитом (от (105±9) до (60±11) ч), в то время как оно не изменялось при приеме плацебо (от (103±17) до (95±10) ч). У пациентов с запором при «нормальном» времени транзита применение тримебутина или плацебо не влияло на электрическую активность ни до, ни после приема пищи.
Послеоперационная паралитическая кишечная непроходимость.
Контролируемые исследования. Было проведено 5 контролируемых и 11 открытых исследований для оценки клинических эффектов тримебутина на послеоперационную кишечную непроходимость. В этих исследованиях участвовали 1123 пациента (340 в контролируемых исследованиях и 783 - в открытых).
В контролируемых исследованиях тримебутин вводили в дозах от 100 до 400 мг в/в или в/м. Общие результаты показали, что тримебутин хорошо переносился пациентами. Интервал времени до прохождения первого кишечного газа был короче у пациентов, получавших тримебутин (52±9 ) по сравнению с плацебо (73±17) Также значительно быстрее происходило возобновление перистальтики кишечника: (68±11) ч по сравнению с (88±18) ч (p<0,05). Кроме того, у пациентов, получавших тримебутин, ощущался меньший дискомфорт в животе, чем в группе плацебо.
Побочные реакции, такие как головокружение, тошнота и/или рвота, диарея и сухость во рту, отмечались у 14 из 340 пациентов (4,1%). Эти побочные эффекты были умеренными по степени тяжести и не требовали сопутствующего приема ЛС.
Открытые исследования. В 11 открытых исследованиях возобновление газообразования наблюдалось в течение 48 ч в 66,4% случаев, в 85,4% - в течение 72 Как и в контролируемых исследованиях, тримебутин помогал улучшить послеоперационное состояние пациентов, уменьшились дискомфорт в животе и толстой кишке, боли в животе и тошнота.
Результаты этих исследований показали, что тримебутин обладал интенсивной сократительной активностью в отношении кишечника у 29 пациентов, по сравнению с 13 пациентами, не получавшими его. Клинически показано, что продолжительность паралитической кишечной непроходимости значительно снижалась у пациентов, получавших тримебутин, по сравнению с контрольной группой. Пассаж первого послеоперационного газа ускорялся в среднем на 23% при применении тримебутина. Также было отмечено, что тримебутин ослабляет симптомы, связанные с кишечной непроходимостью, такие как тошнота, рвота, вздутие живота и боли в животе.
|
|
Показания к применению
Лечение и облегчение симптомов при синдроме раздраженного кишечника (спастическая толстая кишка). послеоперационная паралитическая кишечная непроходимость для ускорения возобновления кишечного транзита после абдоминальной хирургии.
Противопоказания
Гиперчувствительность; беременность; детский возраст младше 12 лет.
При беременности и кормлении грудью
Тератологические исследования не выявили побочных эффектов, связанных с применением тримебутина, на течение и исход беременности у лабораторных животных как при пероральном, так и парентеральном введении. Тем не менее применение тримебутина у беременных женщин не рекомендуется.
Побочные эффекты
В клинических исследованиях побочные реакции легкой и средней степени тяжести наблюдались у 7% пациентов, получавших тримебутин. Не развивались одиночные побочные реакции у более чем 1,8% пациентов, некоторые побочные реакции могли быть связаны с состоянием пациента, а не с применением тримебутина. Обычно сообщалось о следующих побочных реакциях.
Со стороны ЖКТ. Сухость во рту. неприятный привкус. диарея. диспепсия. эпигастральные боли. тошнота и запор. о которых сообщали 3,1% пациентов.
Со стороны ЦНС. Сонливость, повышенная утомляемость, головокружение, ощущение жара/холода, головная боль - у 3,3% пациентов.
Аллергические реакции. Сыпь - у 0,4% пациентов.
Другие. Нечасто сообщалось о случаях нарушения менструального цикла, болезненного увеличения молочной железы, ощущения беспокойства, задержки мочи и легкого понижения слуха.
Со стороны ЖКТ. Сухость во рту. неприятный привкус. диарея. диспепсия. эпигастральные боли. тошнота и запор. о которых сообщали 3,1% пациентов.
Со стороны ЦНС. Сонливость, повышенная утомляемость, головокружение, ощущение жара/холода, головная боль - у 3,3% пациентов.
Аллергические реакции. Сыпь - у 0,4% пациентов.
Другие. Нечасто сообщалось о случаях нарушения менструального цикла, болезненного увеличения молочной железы, ощущения беспокойства, задержки мочи и легкого понижения слуха.
Взаимодействие
Исследования на животных показали, что тримебутин увеличивает продолжительность кураризации, вызванной d-тубокурарином. Не поступало других сообщений о взаимодействии тримебутина с другими ЛС в ходе клинических исследований или применения.
Передозировка
В настоящее время не имеется сообщений о передозировке тримебутина.
Лечение. При передозировке после перорального применения рекомендуется промывание желудка и симптоматическое лечение.
Лечение. При передозировке после перорального применения рекомендуется промывание желудка и симптоматическое лечение.
Способ применения и дозы
Внутрь, 3 раза в сутки до приема пищи, рекомендуемая суточная доза для взрослых - 600 мг.
Список литературы
Product monograph.
Входит в состав
- 251₽ Тримебутин Канон
- 381₽ Тримедат Валента
- 249-554₽ Необутин (Биннофарм Групп ООО )
- 325-746₽ Тримедат (3 фирмы)
- 516-1201₽ Необутин Ретард (Биннофарм Групп ООО )
- 632-1734₽ Тримедат форте
- — Динобутин
- — Нетугаст
- — Спазмавексим (Авексима Сибирь ООО )
- — Тримебутин
- — Тримебутин-ВЕРТЕКС
- — Тримебутин-СЗ
- — Тримебутин-Эдвансд (Эдвансд Фармасьютикалс ООО (ООО 'Эдвансд Фарма') )
- — Тримебутина малеат (5 фирм)
- — Тримебутина малеат - Лонг Шенг Фарма Лимитед (Zhejiang East-Asia Pharmaceutical Co. )
- — Тримефор