МКБ-10 коды
- МКБ-10
- C54.1 Злокачественное новообразование эндометрия
- C54.9 Злокачественное новообразование тела матки неуточненной локализации
- C54.8 Злокачественное новообразование тела матки, выходящее за пределы одной и более вышеуказанных локализаций
- C54.2 Злокачественное новообразование миометрия
- C54 Злокачественное новообразование тела матки
- C54.3 Злокачественное новообразование дна матки
- C54.0 Злокачественное новообразование перешейка матки
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: с54.
Год утверждения (частота пересмотра): 2021.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2023.
ID: 460.
Разработчик клинической рекомендации.
• Ассоциация онкологов России.
• Общероссийская общественная организация «Российское общество клинической онкологии».
• Общероссийская общественная организация «Российское общество специалистов по профилактике и лечению опухолей репродуктивной системы».
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2021.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2023.
ID: 460.
Разработчик клинической рекомендации.
• Ассоциация онкологов России.
• Общероссийская общественная организация «Российское общество клинической онкологии».
• Общероссийская общественная организация «Российское общество специалистов по профилактике и лечению опухолей репродуктивной системы».
Одобрено Научно-практическим Советом Минздрава РФ.
|
|
 Список сокращений
Список сокращений
В/в - внутривенный.
ВОЗ - Всемирная организация здравоохранения.
ДЛТ - дистанционная лучевая терапия.
ЗНО - злокачественное новообразование.
КТ - компьютерная томография.
ЛТ - лучевая терапия.
МРТ - магнитно-резонансная томография.
ПЭТ - позитронно-эмиссионная томография.
ПЭТ-КТ - позитронно-эмиссионная томография, совмещенная с компьютерной томографией.
РТМ - рак тела матки.
СА-125 - антиген аденогенного рака (опухолевый антиген) 125.
УЗИ - ультразвуковое исследование.
ХТ - химиотерапия.
DMMR - нарушения системы репарации неспаренных оснований.
ECOG - The Eastern сooperative Oncology Group (Восточная объединенная группа онкологов).
ESGO - European Society of Gynaecological Oncology (Европейское общество онкогинекологии).
ESMO - European Society for Medica Oncology (Европейское общество медицинской онкологии).
ESTRO - European Society for Radiotherapy & Oncology (Европейское общество радиотерапии и онкологии).
IMRT - Intensity Modulated Radiation Therapy.
MSIh - микросателлитная нестабильность.
** - жизненно необходимые и важнейшие лекарственные препараты.
- препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл).
ВОЗ - Всемирная организация здравоохранения.
ДЛТ - дистанционная лучевая терапия.
ЗНО - злокачественное новообразование.
КТ - компьютерная томография.
ЛТ - лучевая терапия.
МРТ - магнитно-резонансная томография.
ПЭТ - позитронно-эмиссионная томография.
ПЭТ-КТ - позитронно-эмиссионная томография, совмещенная с компьютерной томографией.
РТМ - рак тела матки.
СА-125 - антиген аденогенного рака (опухолевый антиген) 125.
УЗИ - ультразвуковое исследование.
ХТ - химиотерапия.
DMMR - нарушения системы репарации неспаренных оснований.
ECOG - The Eastern сooperative Oncology Group (Восточная объединенная группа онкологов).
ESGO - European Society of Gynaecological Oncology (Европейское общество онкогинекологии).
ESMO - European Society for Medica Oncology (Европейское общество медицинской онкологии).
ESTRO - European Society for Radiotherapy & Oncology (Европейское общество радиотерапии и онкологии).
IMRT - Intensity Modulated Radiation Therapy.
MSIh - микросателлитная нестабильность.
** - жизненно необходимые и важнейшие лекарственные препараты.
- препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл).
Термины и определения
Операция I типа. Экстрафасциальная экстирпация матки (минимальная резекция влагалища, пузырно-маточная связка не иссекается, кардинальная связка пересекается у матки) (по классификации M.S. Piver, 1974).
Операция II типа. Модифицированная расширенная экстирпация матки (подразумевает удаление медиальной половины кардинальных и крестцово-маточных связок и тазовую лимфодиссекцию; мочеточник туннелируется, но не мобилизуется по нижнелатеральной полуокружности) (по классификации M.S. Piver, 1974).
Операция III типа. Расширенная экстирпация матки по Мейгсу (подразумевает удаление кардинальных и крестцово-маточных связок от стенок таза, верхней трети влагалища и тазовую лимфодиссекцию) (по классификации M.S. Piver, 1974).
Операция II типа. Модифицированная расширенная экстирпация матки (подразумевает удаление медиальной половины кардинальных и крестцово-маточных связок и тазовую лимфодиссекцию; мочеточник туннелируется, но не мобилизуется по нижнелатеральной полуокружности) (по классификации M.S. Piver, 1974).
Операция III типа. Расширенная экстирпация матки по Мейгсу (подразумевает удаление кардинальных и крестцово-маточных связок от стенок таза, верхней трети влагалища и тазовую лимфодиссекцию) (по классификации M.S. Piver, 1974).
Описание
Рак тела матки (РТМ). Злокачественная опухоль, исходящая из слизистой оболочки тела матки (эндометрия).
Причины
У большинства пациенток РТМ носит спорадический характер. Примерно в 5 % случаев РТМ ассоциирован с наследственными синдромами, в частности с синдромом Линча [1]. В качестве факторов риска данной патологии рассматриваются гиперэстрогения, ранние менархе, отсутствие родов в анамнезе, поздняя менопауза, возраст старше 55 лет, применение тамоксифена [2, 3]. Выделяют 2 патогенетических типа РТМ [4].
I тип (более частый). Опухоль развивается в более молодом возрасте, в отличие от пациенток со II патогенетическим вариантом, на фоне длительной гиперэстрогении и гиперплазии эндометрия. У пациенток с РТМ I патогенетического типа часто наблюдаются ожирение, сахарный диабет и гипертоническая болезнь, возможны эстрогенсекретирующие опухоли яичников или синдром склерокистозных яичников. Опухоли I патогенетического варианта, как правило, высокодифференцированные, имеют более благоприятный прогноз.
II тип. Опухоли эндометрия обычно низкодифференцированные, имеют менее благоприятный прогноз. Опухоли II патогенетического типа возникают в более старшем возрасте, в отсутствие гиперэстрогении, на фоне атрофии эндометрия.
Примерно у 80 % пациенток с РТМ диагностируют эндометриальную аденокарциному.
К саркомам матки относятся мезенхимальные, а также смешанные эпителиальные и мезенхимальные опухоли. Группу злокачественных мезенхимальных опухолей составляют лейомиосаркома, эндометриальные стромальные и родственные опухоли. К смешанным эпителиальным и мезенхимальным опухолям относятся аденосаркома и карциносаркома. Генетические и молекулярные исследования продемонстрировали сходство молекулярных профилей карциносаркомы матки и низкодифференцированного РТМ, что свидетельствует об эпителиальном происхождении карциносаркомы.
I тип (более частый). Опухоль развивается в более молодом возрасте, в отличие от пациенток со II патогенетическим вариантом, на фоне длительной гиперэстрогении и гиперплазии эндометрия. У пациенток с РТМ I патогенетического типа часто наблюдаются ожирение, сахарный диабет и гипертоническая болезнь, возможны эстрогенсекретирующие опухоли яичников или синдром склерокистозных яичников. Опухоли I патогенетического варианта, как правило, высокодифференцированные, имеют более благоприятный прогноз.
II тип. Опухоли эндометрия обычно низкодифференцированные, имеют менее благоприятный прогноз. Опухоли II патогенетического типа возникают в более старшем возрасте, в отсутствие гиперэстрогении, на фоне атрофии эндометрия.
Примерно у 80 % пациенток с РТМ диагностируют эндометриальную аденокарциному.
К саркомам матки относятся мезенхимальные, а также смешанные эпителиальные и мезенхимальные опухоли. Группу злокачественных мезенхимальных опухолей составляют лейомиосаркома, эндометриальные стромальные и родственные опухоли. К смешанным эпителиальным и мезенхимальным опухолям относятся аденосаркома и карциносаркома. Генетические и молекулярные исследования продемонстрировали сходство молекулярных профилей карциносаркомы матки и низкодифференцированного РТМ, что свидетельствует об эпителиальном происхождении карциносаркомы.
Эпидемиология
В 2018 г. было выявлено 26 948 случаев заболевания злокачественными новообразованиями (ЗНО) тела матки. Грубый» показатель заболеваемости в 2018 г. составил 34,2 на 100 тыс. женского населения. За 20 лет этот показатель вырос на 87,8 %, средний темп прироста составил около 3 % в год. За этот же период вырос на 55,2 % и стандартизованный по мировому стандарту возрастного распределения населения показатель заболеваемости, его уровень в 2018 г. составил 18,8 на 100 тыс. населения при среднегодовом темпе прироста 2,18 %.
В возрастной группе 65-69 лет наблюдается наивысший показатель заболеваемости - 98,1 случая на 100 тыс. женского населения соответствующего возраста. В возрастных группах 50-54 и 55-59 лет ЗНО тела матки занимают 2-е ранговое место в структуре онкологической заболеваемости, 45-49, 60-64 и 65-69 лет - 3-е, 70-74 лет - 4-е, в других возрастных группах - 6-е и ниже.
В 2018 г. от ЗНО тела матки умерли 6897 женщин. В структуре причин онкологической смертности женщин ЗНО тела матки занимают 9-е место (5,0 %).
В динамике за 10 лет «грубый» показатель смертности от ЗНО тела матки вырос на 3,01 % и составил в 2018 г. 8,67 на 100 тыс. женского населения, при этом стандартизованный показатель смертности женщин от ЗНО тела матки снижается, в 2008 г. он составлял 4,39, в 2018 г. 3,98 на 100 тыс. женского населения; убыль 9,7 %, что свидетельствует об истинном снижении смертности от этой патологии.
Наиболее высокие значения показателя смертности отмечаются в возрастных группах 75 лет и старше - от 30,1 до 37,27 на 100 тыс. женского населения соответствующего возраста [5].
C54,0 Перешейка матки (нижнего сегмента матки).
C54,1 Эндометрия.
C54,2 Миометрия.
C54,3 Дна матки.
C54,8 Поражение тела матки, выходящее за пределы одной и более вышеуказанных локализаций.
C54,9 Тела матки неуточненной локализации.
В возрастной группе 65-69 лет наблюдается наивысший показатель заболеваемости - 98,1 случая на 100 тыс. женского населения соответствующего возраста. В возрастных группах 50-54 и 55-59 лет ЗНО тела матки занимают 2-е ранговое место в структуре онкологической заболеваемости, 45-49, 60-64 и 65-69 лет - 3-е, 70-74 лет - 4-е, в других возрастных группах - 6-е и ниже.
В 2018 г. от ЗНО тела матки умерли 6897 женщин. В структуре причин онкологической смертности женщин ЗНО тела матки занимают 9-е место (5,0 %).
В динамике за 10 лет «грубый» показатель смертности от ЗНО тела матки вырос на 3,01 % и составил в 2018 г. 8,67 на 100 тыс. женского населения, при этом стандартизованный показатель смертности женщин от ЗНО тела матки снижается, в 2008 г. он составлял 4,39, в 2018 г. 3,98 на 100 тыс. женского населения; убыль 9,7 %, что свидетельствует об истинном снижении смертности от этой патологии.
Наиболее высокие значения показателя смертности отмечаются в возрастных группах 75 лет и старше - от 30,1 до 37,27 на 100 тыс. женского населения соответствующего возраста [5].
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
С54 Злокачественное новообразование тела матки:C54,0 Перешейка матки (нижнего сегмента матки).
C54,1 Эндометрия.
C54,2 Миометрия.
C54,3 Дна матки.
C54,8 Поражение тела матки, выходящее за пределы одной и более вышеуказанных локализаций.
C54,9 Тела матки неуточненной локализации.
Классификация
1,5 Классификация заболевания или состояния (группы заболеваний или состояний).
Международная гистологическая классификация РТМ (классификация Всемирной организации здравоохранения (ВОЗ), 4-е издание, 2013) [6-8].| Злокачественные эпителиальные опухоли: |
| • 8380/3 эндометриальная аденокарцинома: |
| • 8570/3 вариант с плоскоклеточной метаплазией, |
| • 8263/3 виллогландулярный вариант, |
| • 8382/3 секреторный вариант; |
| • 8480/3 муцинозный рак; |
| • 8441/3 серозный рак; |
| • 8310/3 светлоклеточный рак; |
| • нейроэндокринные опухоли: |
| • низкой степени злокачественности: |
| • 8240/3 карциноид, |
| • высокой степени злокачественности: |
| • 8041/3 мелкоклеточный нейроэндокринный рак, |
| • 8013/3 крупноклеточный нейроэндокринный рак; |
| • 8323/3 смешанная аденокарцинома; |
| • 8020/3 недифференцированный рак. |
| Злокачественные смешанные эпителиальные и мезенхимальные опухоли: |
| • 8933/3 аденосаркома; |
| • 8980/3 карциносаркома. |
| Злокачественные мезенхимальные опухоли: |
| • 8890/3 лейомиосаркома: |
| • 8891/3 эпителиоидная лейомиосаркома, |
| • 8896/3 миксоидная лейомиосаркома; |
| • 8931/3 эндометриальная стромальная саркома низкой степени злокачественности; |
| • 8930/3 эндометриальная стромальная саркома высокой степени злокачественности; |
| • 8805/3 недифференцированная саркома. |
Выделяют 3 степени дифференцировки аденокарциномы эндометрия:
G1 - высокодифференцированная.
G2 - умеренно-дифференцированная.
G3 - низкодифференцированная.
Стадирование.
Стадирование РТМ и сарком матки проводят по классификациям TNM (8-е издание, 2017) и FIGO (2009) (табл. 1, 2).
В табл. 1 представлена классификация стадий РТМ и карциносаркомы, в табл. 2 - классификаци стадий лейомиосаркомы и эндометриальной стромальной саркомы матки.
Таблица 1. Стадии РТМ и карциносаркомы матки по системе TNM (8-й пересмотр, 2017) и классификации FIGO (2009).
| TNM | FIGO | Описание |
| TX | Невозможно оценить состояние первичной опухоли | |
| T0 | Первичная опухоль отсутствует | |
| Tis | Рак in situ | |
| T1a | IA | Опухоль в пределах эндометрия или опухоль с инвазией менее половины толщины миометрия |
| T1b | IB | Опухоль с инвазией более половины толщины миометрия |
| T2 | II | Опухоль распространяется на строму шейки матки, но не выходит за пределы матки |
| T3a | IIIA | Прорастание серозной оболочки матки, поражение маточных труб или яичников (непосредственный переход опухоли или метастазы) |
| T3b | IIIB | Поражение влагалища или параметриев (непосредственный переход опухоли или метастазы) |
| T4 | IVA | Прорастание слизистой оболочки мочевого пузыря или толстой кишки |
| NX | Оценить состояние регионарных лимфатических узлов невозможно | |
| N0 | Метастазов в регионарных лимфатических узлах (тазовых или парааортальных) нет | |
| IIIC | Метастазы в регионарных лимфатических узлах (тазовых или парааортальных) | |
| N1 | IIIC1 | Метастазы в тазовых лимфатических узлах |
| N2 | IIIC2 | Метастазы в парааортальных лимфатических узлах |
| M0 | Отдаленных метастазов нет | |
| M1 | IV | Отдаленные метастазы (в том числе метастазы в паховых лимфатических узлах и лимфатических узлах в пределах брюшной полости, кроме тазовых или парааортальных лимфатических узлов; за исключением метастазов во влагалище, придатках матки и по тазовой брюшине) |
Таблица 2Стадии лейомиосаркомы и эндометриальной стромальной саркомы матки по системе TNM (8-й пересмотр, 2017) и классификации FIGO (2009)*.
| TNM | FIGO | Описание |
| T1 | I | Опухоль ограничена маткой |
| T1a | IA | Опухоль <5 см |
| T1b | IB | Опухоль >5 см |
| T2 | II | Опухоль распространяется за пределы матки, но не выходит за пределы таза |
| T2a | IIA | Поражение придатков матки |
| T2b | IIB | Поражение других органов и тканей |
| T3 | III | Поражение органов брюшной полости |
| T3a | IIIA | Один очаг |
| T3b | IIIB | Два очага и более |
| T4 | IVA | Прорастание слизистой оболочки мочевого пузыря или прямой кишки |
| N0 | Метастазов в регионарных лимфатических узлах (тазовых или парааортальных) нет | |
| N1 | IIIC | Метастазы в регионарных лимфатических узлах (тазовых или парааортальных) |
| M0 | Отдаленных метастазов нет | |
| M1 | IVB | Отдаленные метастазы |
*Одновременное поражение тела матки и яичников/малого таза на фоне эндометриоза следует трактовать как первично-множественные опухоли.
|
|
Клиническая картина
Основным клиническим проявлением ЗНО тела матки являются ациклические маточные кровотечения в репродуктивном периоде или кровотечения в период постменопаузы. Иногда ЗНО тела матки протекают бессимптомно и выявляются у женщин без жалоб, при ультразвуковом исследовании (УЗИ) органов малого таза. ЗНО тела матки могут сопровождаться длительно текущим анемическим синдромом, а также характеризоваться быстрым ростом миоматозных узлов, увеличением размеров матки.
Диагностика
Критерии установления диагноза заболевания или состояния:
• данные анамнеза;
• данные физикального обследования;
• данные патологоанатомического исследования биопсийного и/или операционного материала из полости матки;
• данные методов лучевой диагностики.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Комментарий. Основным симптомом РТМ являются ациклические маточные кровотечения в репродуктивном периоде или кровотечения в период постменопаузы. Интенсивность кровотечений не коррелирует с риском РТМ. Иногда РТМ выявляют у женщин без жалоб при УЗИ органов малого таза и последующем обследовании или при цитологическом скрининге рака шейки матки. Необходимо обратить особое внимание на длительно текущий анемический синдром, а также быстрый рост миоматозных узлов.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. При гинекологическом исследовании визуально осматривается слизистая оболочка шейки матки и влагалища в целях выявления возможного перехода опухоли на эктоцервикс или метастазов в стенке влагалища. При бимануальном гинекологическом исследовании оценивается состояние параметриев. При физикальном исследовании обязательно пальпируют паховые, надключичные и подключичные лимфатические узлы для исключения их возможного метастатическая увеличения.
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарий.
• Лабораторные исследования призваны оценить состояние различных органов и систем в целях определения возможности проведения того или иного вида лечения.
• Клинический анализ крови выполняется (повторяется) не менее чем за 5 дней до начала очередного курса химиотерапии (ХТ), ЛТ или таргетной терапии, если проводится [10].
• Рекомендуется всем пациенткам с подозрением на ЗНО тела матки выполнять исследование уровня антигена аденогенного рака 125 (CA-125) в крови в целях дифференциальной диагностики новообразований, определения тактики и алгоритма лечения, оценки прогноза заболевания [11].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарий. Повышение уровня СА-125 является косвенным признаком распространения опухоли за пределы матки.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарий:
• Для пациенток репродуктивного и перименопаузального периодов толщина М-эхо в I фазе менструального цикла составляет не более 12 постменопаузального периода - не более 6 мм.
• УЗИ - наиболее простой и доступный метод визуализации образований в брюшной полости, забрюшинном пространстве и полости таза. Выполнение этого исследования позволяет оценить распространенность опухолевого процесса в пределах матки (глубина инвазии в миометрий), переход на цервикальный канал, выход опухолевого процесса за пределы органа, состояние придатков матки, регионарных лимфатических узлов и возможное метастатическое поражение органов брюшной полости.
• При подозрении на саркому тела матки целесообразно выполнять УЗИ органов малого таза (комплексное) с допплерографией для установления ангиоархитектоники опухолевого процесса.
• Всем пациенткам с подозрением на патологическое состояние эндометрия рекомендуется выполнять аспирационную биопсию тканей матки (эндометрия) или раздельное диагностическое выскабливание цервикального канала и полости матки [13].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарий:
• Диагноз устанавливают по результатам аспирационной биопсии эндометрия и/или раздельного диагностического выскабливания цервикального канала и полости матки с гистероскопией или без нее, на основании паталогоанатомического исследования биопсийного (операционного) материала с обязательным указанием гистологического типа и степени дифференцировки опухоли.
• Гистероскопия крайне необходима при подозрении на переход опухолевого процесса на цервикальный канал или для решения вопроса о целесообразности самостоятельной гормонотерапии.
• Рекомендуется выполнять магнитно-резонансную томографию (МРТ) органов малого таза с внутривенным (в/в) контрастированием пациенткам со ЗНО тела матки в целях оценки первичной опухоли и распространенности опухолевого процесса, планирования алгоритма лечения; при отсутствии возможности выполнить МРТ рекомендовано проведение компьютерной томографии (КТ) органов малого таза с контрастированием [14].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарий:
• Данное исследование целесообразно, в том числе при планировании органосохраняющего лечения (при ранних стадиях заболевания).
• МРТ информативнее КТ при оценке глубины инвазии в миометрий и перехода опухоли на шейку матки и смежные органы; точность определения глубины инвазии в миометрий с помощью МРТ составляет 71-97 % [15, 16].
• При наличии противопоказаний со стороны пациентки возможно выполнение МРТ и/или КТ без контрастного усиления, что может снижать информативность исследования.
• Всем пациенткам со ЗНО тела матки при подозрении на поражение паренхиматозных органов и лимфатических узлов (в том числе, по результатам УЗИ) рекомендуется выполнять КТ или МРТ органов брюшной полости и забрюшинного пространства с в/в контрастированием в целях определения распространенности опухолевого процесса и планирования алгоритма лечения при невозможности выполнить позитронно-эмиссионную томографию, совмещенную с КТ (ПЭТ-КТ), всего тела [16-18].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
Комментарий:
• Следует помнить, что на момент операции метастатически измененные лимфатические узлы оказываются увеличенными менее чем у 10 % пациенток с РТМ ранних стадий. Уточняющая диагностика метастатического поражения лимфатических узлов необходима для определения объема хирургического вмешательства.
• При наличии противопоказаний со стороны пациентки возможно выполнение МРТ и/или КТ без контрастного усиления, что может снижать информативность исследования.
• Рекомендуется выполнять КТ органов грудной клетки с в/в контрастированием всем пациенткам со ЗНО тела матки в целях определения распространенности опухолевого процесса и планирования алгоритма лечения, при отсутствии возможности выполнения КТ рекомендуется рентгенография органов грудной клетки [9, 10, 19].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. КТ органов грудной клетки информативнее данных рентгенографии в качестве уточняющей диагностики метастатического поражения легких и средостения [9, 10, 19].
• Рекомендуется выполнять позитронно-эмиссионную томографию (ПЭТ) или ПЭТ-КТ всего тела пациенткам с подозрением на отдаленное метастазирование при ЗНО тела матки в целях определения распространенности опухолевого процесса и планирования алгоритма лечения [20, 21].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
Комментарий. ПЭТ или ПЭТ-КТ всего тела наиболее информативны для выявления метастатического поражения лимфатических узлов и отдаленных метастазов [20, 21].
• гистологический тип опухоли;
• степень дифференцировки опухоли;
• размер опухоли;
• глубина инвазии опухоли;
• толщина миометрия в месте наибольшей инвазии опухоли;
• прорастание опухолью серозной оболочки матки;
• опухолевые эмболы в кровеносных и лимфатических сосудах;
• переход опухоли на шейку матки, врастание в строму шейки матки;
• выход опухоли в параметрий;
• переход опухоли на влагалище;
• общее число удаленных и пораженных тазовых лимфатических узлов справа, слева;
• общее число удаленных и пораженных поясничных лимфатических узлов;
• метастатическое поражение яичников, маточных труб;
• прорастание опухоли в стенку мочевого пузыря, прямой кишки (при выполнении экзентерации или резекции смежных органов);
• степень лечебного патоморфоза первичной опухоли и метастазов в лимфатических узлах в случае предоперационной терапии.
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарий:
• При сомнительных результатах паталогоанатомического исследования биопсийного материала пациенткам с подозрением на ЗНО матки показано проведение или повторной биопсии, или хирургического вмешательства с паталогоанатомическим исследованием биопсийного (операционного) материала, в том числе интраоперационного.
• При необходимости морфологической верификации диагноза паталогоанатомическое исследование биопсийного (операционного) материала может дополняться иммуногистохимическим типированием.
• При наличии выпота в брюшной и/или плевральной полостях необходима его аспирация для цитологического исследования.Наличие опухолевых клеток в выпоте из брюшной полости (по результатам цитологического исследования) следует указать, но это не влияет на стадию заболевания [3, 22].
• Рекомендуется всем пациенткам с РТМ моложе 50 лет или с отягощенным семейным анамнезом по наличию РТМ и/или колоректальному раку консультация врача-генетика в целях выявления наследуемых генетических мутаций, способных оказать влияние на выбор алгоритма лечения пациентки [23].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• Рекомендуется перед началом противоопухолевого лечения всем пациенткам со ЗНО тела матки по показаниям проводить дополнительное обследование в целях выявления сопутствующей соматической патологии и профилактики жизнеугрожающих состояний [4].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. При наличии соматической патологии и/или для уточнения распространенности опухолевого процесса по показаниям целесообразно проводить дополнительные обследования, которые позволят выбрать оптимальную тактику лечения пациентки.
• данные анамнеза;
• данные физикального обследования;
• данные патологоанатомического исследования биопсийного и/или операционного материала из полости матки;
• данные методов лучевой диагностики.
2,1 Жалобы и анамнез.
• Рекомендуется тщательный сбор жалоб и анамнеза у всех пациенток в целях выявления факторов, которые могут повлиять на выбор тактики лечения [2].Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Комментарий. Основным симптомом РТМ являются ациклические маточные кровотечения в репродуктивном периоде или кровотечения в период постменопаузы. Интенсивность кровотечений не коррелирует с риском РТМ. Иногда РТМ выявляют у женщин без жалоб при УЗИ органов малого таза и последующем обследовании или при цитологическом скрининге рака шейки матки. Необходимо обратить особое внимание на длительно текущий анемический синдром, а также быстрый рост миоматозных узлов.
2,2 Физикальное обследование.
• Рекомендуется тщательный физикальный осмотр всех пациенток, включающий гинекологическое исследование [3].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. При гинекологическом исследовании визуально осматривается слизистая оболочка шейки матки и влагалища в целях выявления возможного перехода опухоли на эктоцервикс или метастазов в стенке влагалища. При бимануальном гинекологическом исследовании оценивается состояние параметриев. При физикальном исследовании обязательно пальпируют паховые, надключичные и подключичные лимфатические узлы для исключения их возможного метастатическая увеличения.
2,3 Лабораторные диагностические исследования.
• Рекомендуется выполнять развернутые общий (клинический) и биохимический анализы крови с показателями функции печени, почек, коагулограмму, общий анализ мочи всем пациенткам со ЗНО тела матки и с подозрением на ЗНО тела матки в целях оценки их общего состояния, определения тактики и алгоритма лечения, оценки прогноза заболевания [9].Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарий.
• Лабораторные исследования призваны оценить состояние различных органов и систем в целях определения возможности проведения того или иного вида лечения.
• Клинический анализ крови выполняется (повторяется) не менее чем за 5 дней до начала очередного курса химиотерапии (ХТ), ЛТ или таргетной терапии, если проводится [10].
• Рекомендуется всем пациенткам с подозрением на ЗНО тела матки выполнять исследование уровня антигена аденогенного рака 125 (CA-125) в крови в целях дифференциальной диагностики новообразований, определения тактики и алгоритма лечения, оценки прогноза заболевания [11].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарий. Повышение уровня СА-125 является косвенным признаком распространения опухоли за пределы матки.
2,4 Инструментальные диагностические исследования.
• Всем пациенткам со ЗНО тела матки и подозрением на ЗНО тела матки рекомендуется выполнять УЗИ органов малого таза, брюшной полости, забрюшинного пространства, регионарных и периферических лимфатических узлов в целях оценки первичной опухоли и распространенности опухолевого процесса, планирования алгоритма лечения [12].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарий:
• Для пациенток репродуктивного и перименопаузального периодов толщина М-эхо в I фазе менструального цикла составляет не более 12 постменопаузального периода - не более 6 мм.
• УЗИ - наиболее простой и доступный метод визуализации образований в брюшной полости, забрюшинном пространстве и полости таза. Выполнение этого исследования позволяет оценить распространенность опухолевого процесса в пределах матки (глубина инвазии в миометрий), переход на цервикальный канал, выход опухолевого процесса за пределы органа, состояние придатков матки, регионарных лимфатических узлов и возможное метастатическое поражение органов брюшной полости.
• При подозрении на саркому тела матки целесообразно выполнять УЗИ органов малого таза (комплексное) с допплерографией для установления ангиоархитектоники опухолевого процесса.
• Всем пациенткам с подозрением на патологическое состояние эндометрия рекомендуется выполнять аспирационную биопсию тканей матки (эндометрия) или раздельное диагностическое выскабливание цервикального канала и полости матки [13].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарий:
• Диагноз устанавливают по результатам аспирационной биопсии эндометрия и/или раздельного диагностического выскабливания цервикального канала и полости матки с гистероскопией или без нее, на основании паталогоанатомического исследования биопсийного (операционного) материала с обязательным указанием гистологического типа и степени дифференцировки опухоли.
• Гистероскопия крайне необходима при подозрении на переход опухолевого процесса на цервикальный канал или для решения вопроса о целесообразности самостоятельной гормонотерапии.
• Рекомендуется выполнять магнитно-резонансную томографию (МРТ) органов малого таза с внутривенным (в/в) контрастированием пациенткам со ЗНО тела матки в целях оценки первичной опухоли и распространенности опухолевого процесса, планирования алгоритма лечения; при отсутствии возможности выполнить МРТ рекомендовано проведение компьютерной томографии (КТ) органов малого таза с контрастированием [14].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарий:
• Данное исследование целесообразно, в том числе при планировании органосохраняющего лечения (при ранних стадиях заболевания).
• МРТ информативнее КТ при оценке глубины инвазии в миометрий и перехода опухоли на шейку матки и смежные органы; точность определения глубины инвазии в миометрий с помощью МРТ составляет 71-97 % [15, 16].
• При наличии противопоказаний со стороны пациентки возможно выполнение МРТ и/или КТ без контрастного усиления, что может снижать информативность исследования.
• Всем пациенткам со ЗНО тела матки при подозрении на поражение паренхиматозных органов и лимфатических узлов (в том числе, по результатам УЗИ) рекомендуется выполнять КТ или МРТ органов брюшной полости и забрюшинного пространства с в/в контрастированием в целях определения распространенности опухолевого процесса и планирования алгоритма лечения при невозможности выполнить позитронно-эмиссионную томографию, совмещенную с КТ (ПЭТ-КТ), всего тела [16-18].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
Комментарий:
• Следует помнить, что на момент операции метастатически измененные лимфатические узлы оказываются увеличенными менее чем у 10 % пациенток с РТМ ранних стадий. Уточняющая диагностика метастатического поражения лимфатических узлов необходима для определения объема хирургического вмешательства.
• При наличии противопоказаний со стороны пациентки возможно выполнение МРТ и/или КТ без контрастного усиления, что может снижать информативность исследования.
• Рекомендуется выполнять КТ органов грудной клетки с в/в контрастированием всем пациенткам со ЗНО тела матки в целях определения распространенности опухолевого процесса и планирования алгоритма лечения, при отсутствии возможности выполнения КТ рекомендуется рентгенография органов грудной клетки [9, 10, 19].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. КТ органов грудной клетки информативнее данных рентгенографии в качестве уточняющей диагностики метастатического поражения легких и средостения [9, 10, 19].
• Рекомендуется выполнять позитронно-эмиссионную томографию (ПЭТ) или ПЭТ-КТ всего тела пациенткам с подозрением на отдаленное метастазирование при ЗНО тела матки в целях определения распространенности опухолевого процесса и планирования алгоритма лечения [20, 21].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
Комментарий. ПЭТ или ПЭТ-КТ всего тела наиболее информативны для выявления метастатического поражения лимфатических узлов и отдаленных метастазов [20, 21].
2,5 Иные диагностические исследования.
• Рекомендуется всем пациенткам со ЗНО тела матки и подозрением на него в целях морфологической верификации диагноза проводить патологоанатомическое исследование биопсийного и/или операционного материала с отражением в заключении следующих параметров [4]:• гистологический тип опухоли;
• степень дифференцировки опухоли;
• размер опухоли;
• глубина инвазии опухоли;
• толщина миометрия в месте наибольшей инвазии опухоли;
• прорастание опухолью серозной оболочки матки;
• опухолевые эмболы в кровеносных и лимфатических сосудах;
• переход опухоли на шейку матки, врастание в строму шейки матки;
• выход опухоли в параметрий;
• переход опухоли на влагалище;
• общее число удаленных и пораженных тазовых лимфатических узлов справа, слева;
• общее число удаленных и пораженных поясничных лимфатических узлов;
• метастатическое поражение яичников, маточных труб;
• прорастание опухоли в стенку мочевого пузыря, прямой кишки (при выполнении экзентерации или резекции смежных органов);
• степень лечебного патоморфоза первичной опухоли и метастазов в лимфатических узлах в случае предоперационной терапии.
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарий:
• При сомнительных результатах паталогоанатомического исследования биопсийного материала пациенткам с подозрением на ЗНО матки показано проведение или повторной биопсии, или хирургического вмешательства с паталогоанатомическим исследованием биопсийного (операционного) материала, в том числе интраоперационного.
• При необходимости морфологической верификации диагноза паталогоанатомическое исследование биопсийного (операционного) материала может дополняться иммуногистохимическим типированием.
• При наличии выпота в брюшной и/или плевральной полостях необходима его аспирация для цитологического исследования.Наличие опухолевых клеток в выпоте из брюшной полости (по результатам цитологического исследования) следует указать, но это не влияет на стадию заболевания [3, 22].
• Рекомендуется всем пациенткам с РТМ моложе 50 лет или с отягощенным семейным анамнезом по наличию РТМ и/или колоректальному раку консультация врача-генетика в целях выявления наследуемых генетических мутаций, способных оказать влияние на выбор алгоритма лечения пациентки [23].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• Рекомендуется перед началом противоопухолевого лечения всем пациенткам со ЗНО тела матки по показаниям проводить дополнительное обследование в целях выявления сопутствующей соматической патологии и профилактики жизнеугрожающих состояний [4].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. При наличии соматической патологии и/или для уточнения распространенности опухолевого процесса по показаниям целесообразно проводить дополнительные обследования, которые позволят выбрать оптимальную тактику лечения пациентки.
|
|
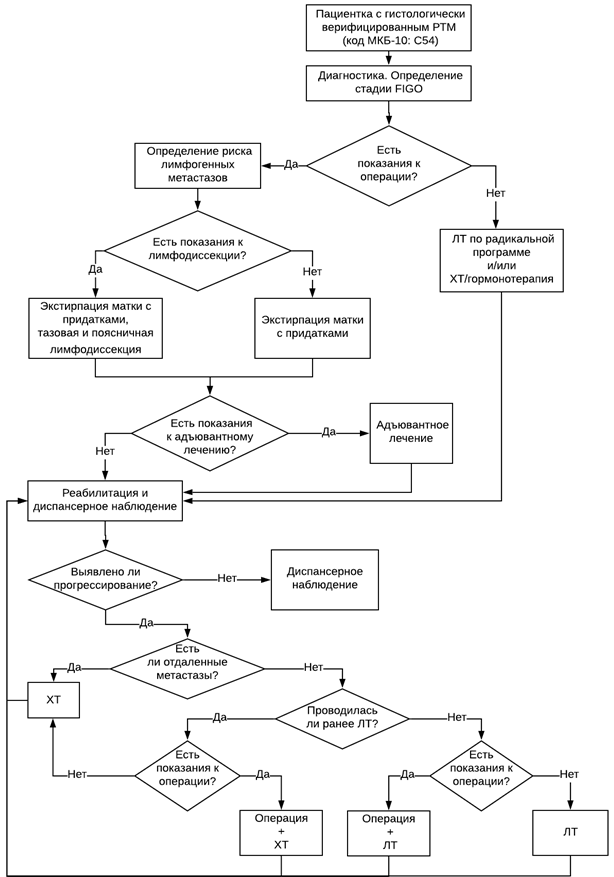
Лечение
Назначение и применение лекарственных препаратов, указанных в клинической рекомендации, направлены на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их назначение и использование в конкретной клинической ситуации определяются в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
Таблица 3. Классификация М.S. Piver (1974).
Таблица 4. Классификация Querleu-Morrow (2017).
• Хирургическое вмешательство рекомендуется как наиболее эффективный метод лечения пациенток с РТМ независимо от стадии как самостоятельно, так и в комбинации с другими методами [9, 17, 24-26].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий:
• При РТМ возможны лапароскопические, лапаротомные, лапароскопически-ассистированные влагалищные, робот-ассистированные вмешательства при условии того, что доступ обеспечивает решение задач, стоящих перед хирургическим этапом лечения, в том числе выполнение тазовой и поясничной лимфодиссекции, если она показана [24-27].
• Ведущим доступом при хирургическом лечении локализованного РТМ является лапароскопический [24, 28]. Преимущество метода заключается в снижении частоты пери-/послеоперационных осложнений, особенно у пациенток старшей возрастной группы, у пациенток с избыточной массой тела при аналогичных отдаленных результатах лечения по сравнению с лапаротомным доступом [24, 28].
• При абсолютных противопоказаниях к хирургическому лечению проводят лучевую терапию (ЛТ) по радикальной программе, при высокодифференцированной эндометриальнй аденокарциноме возможна гормонотерапия [29-31].
• Пациенткам с РТМ I стадии рекомендуется хирургическое лечение как наиболее эффективный метод [9, 17].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. Предоперационная ЛТ нецелесообразна.
• Рекомендуемый объем хирургического вмешательства пациенткам при РТМ IА стадии - объем хирургического вмешательства Piver I тип или радикальная гистерэктомия тип А ( см термины и определения, табл. 3, 4) [32].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
• Рекомендуемый объем хирургического вмешательства пациенткам при РТМ стадии IB (глубокая инвазия) - хирургическое лечение в объеме Piver II тип или радикальная гистерэктомия тип В ( см термины и определения, табл. 3, 4) [32].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
• Рекомендуется у пациенток с РТМ проводить биопсию с патологоанатомическим исследованием всех выявленных при хирургической ревизии брюшной полости, малого таза и забрюшинного пространства подозрительных образований в целях их морфологической верификации и стадирования заболевания [10, 17, 27, 33].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарий. У пациенток моложе 45 лет при высокодифференцированном РТМ с инвазией менее половины толщины миометрия при отсутствии признаков распространения опухоли за пределы матки возможно сохранение яичников и удаление матки с маточными трубами [10, 26, 34]. Сохранение яичников не целесообразно при мутациях генов вRCA1/2 и синдроме Линча.
• При серозном РТМ, а также при обнаружении во время операции метастазов в яичниках, когда высок риск имплантационного метастазирования, рекомендуется удаление большого сальника [35].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• Рекомендуется лимфодиссекция при I клинической стадии при серозном, светлоклеточном РТМ и карциносаркоме. Показания к лимфодиссекции для эндометриального рака определяются риском, оцениваемым по результатам предоперационного обследования (табл. 5) [36, 37].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. При наличии показаний к лимфодиссекции удаляют лимфатические узлы обеих регионарных зон - тазовые и поясничные до почечных сосудов (лимфодиссекция IV уровня).
Таблица 5. Показания к лимфодиссекции при эндометриальном РТМ I клинической стадии (консенсус ESGO, ESMO, ESTRO - Европейских обществ онкогинекологии, онкологии, общества радиотерапии и онкологии соответственно, 2014).
• При РТМ II стадии рекомендуется хирургическое вмешательство на I этапе лечения в объеме Piver II или III тип или радикальная гистерэктомия тип в-С2 ( см термины и определения, табл. 3, 4) с последующим адъювантным лечением [32].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарий. Примерно у 30 % пациенток с РТМ II стадии имеются метастазы в тазовых лимфатических узлах. Риск поражения парааортальных лимфатических узлов, яичников и диссеминации по брюшине при II клинической стадии РТМ выше, чем при I стадии. Вопрос о необходимости удаления параметриев (выполнения расширенной экстирпации матки Piver II или III тип, радикальной гистерэктомии тип в-C2) при РТМ II стадии остается открытым и должен решаться индивидуально в зависимости от интраоперационных находок [27, 38].
• При РТМ III-IV стадий рекомендуется начинать лечение с хирургического вмешательства [27, 38, 39].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
Комментарий:
• Операция позволяет уточнить распространение опухоли и выполнить циторедукцию.
• При РТМ IIIA стадии целесообразно выполнить операцию в объеме Piver II тип В с оментэктомией.
• При РТМ IIIB стадии целесообразно хирургическое лечение в объеме Piver III тип С2.
• При РТМ IVА стадии целесообразно выполнение передней или задней экзентерации [9].
• При выявлении макроскопически увеличенных регионарных лимфатических узлов у пациенток с III-IV стадиями РТМ рекомендуется тазовая и парааортальная лимфодиссекция, поскольку удаление макрометастазов в лимфатических узлах повышает выживаемость таких пациенток [36, 37, 40].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
• При неэндометриальном РТМ рекомендуется хирургическое лечение, которое включает экстирпацию матки с придатками, тазовую и парааортальную лимфодиссекцию [27, 41].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарий. Большой сальник удаляют только при серозном РТМ. Имеются данные о том, что лимфодиссекция при карциносаркоме матки не только позволяет уточнить стадию, но и повышает выживаемость пациенток. Неэндометриальный РТМ (серозный, светлоклеточный рак, смешанная аденокарцинома, карциносаркома) имеет неблагоприятный прогноз. Исключение составляет муцинозный рак, который в подавляющем большинстве случаев является высокодифференцированным и по клиническому течению сходен с высокодифференцированным эндометриальным РТМ.
• При лейомиосаркоме матки рекомендуется выполнять Piver I тип экстирпацию матки с придатками [19, 42].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. У пациенток до 45 лет с лейомиосаркомой матки ранних стадий допустимо сохранение яичников, так как это не влияет на выживаемость. Удаление тазовых и поясничных лимфатических узлов нецелесообразно, поскольку их поражение наблюдается крайне редко.
• При эндометриальной стромальной саркоме матки низкой степени злокачественности рекомендуется операция в объеме Piver I тип или радикальная гистерэктомия тип А и удаление макроскопически определяемых опухолей. Тазовая и парааортальная лимфодиссекция может быть целесообразна, но метастазы в лимфатических узлах не влияют на общую выживаемость [19].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарий. Эндометриальная стромальная саркома матки низкой степени злокачественности - гормонозависимая опухоль. При I стадии заболевания метастазы в яичниках наблюдаются крайне редко. Сохранение яичников в этом случае повышает риск рецидива, но не влияет на общую выживаемость, поэтому у молодых пациентов сохранение яичников должно обсуждаться индивидуально на онкологическом консилиуме [43, 44].
• При эндометриальной стромальной саркоме матки высокой степени злокачественности рекомендуется операция в объеме Piver I тип или тип А [45].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. С учетом крайне неблагоприятного прогноза роль лимфодиссекции и циторедуктивных операций сомнительна. Эндометриальная стромальная саркома матки высокой степени злокачественности и недифференцированная саркома матки - крайне агрессивные опухоли со склонностью к быстрому гематогенному метастазированию.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. Показания к адъювантной дистанционной ЛТ (ДЛТ) определяются в первую очередь факторами риска лимфогенного метастазирования РТМ, которые полностью нивелируются при выполнении адекватной лимфаденэктомии. Несмотря на то что ни одно из опубликованных на сегодняшний день рандомизированных исследований тазовой лимфаденэктомии при РТМ не продемонстрировало повышение выживаемости при ее выполнении. Регионарная лимфаденэктомия при РТМ решает следующие задачи: уточнение стадии и определение тактики дальнейшего лечения [46, 47]. С точки зрения профилактики регионарного прогрессирования лимфаденэктомию при РТМ ранних стадий можно рассматривать как альтернативу ДЛТ, более безопасную с точки зрения отдаленных последствий (поздних осложнений, радиоиндуцированных опухолей), что особенно важно у молодых пациенток. Показания к адъювантному лечению зависят от группы риска, к которой относится пациентка (табл. 6) [38].
Таблица 6. Группы риска при РТМ (консенсус ESGO, ESMO, ESTRO, 2014).
• Адъювантное лечение эндометриального РТМ I. II стадий рекомендуется проводить согласно рекомендациям консенсуса ESGO, ESMO, ESTRO (2014) (табл. 7, 8) [38].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Таблица 7. Адъювантное лечение эндометриального РТМ I стадии (консенсус ESGO, ESMO, ESTRO, 2014).
Таблица 8. Адъювантное лечение эндометриального РТМ II стадии (консенсус ESGO, ESMO, ESTRO, 2014).
• Пациенткам при РТМ III-IV стадий после операции рекомендуется проведение ХТ в сочетании с ЛТ (брахитерапией, в отдельных случаях возможна ДЛТ) для профилактики рецидива в культе влагалища [29, 48-50].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
• При неэндометриальном РТМ в качестве адъювантного лечения рекомендуется ХТ в сочетании с брахитерапией [9].
Уровень убедительности рекомендаций. С ( уровень достоверности доказательств - 5).
Комментарий. Исключением является серозный и светлоклеточный РТМ стадии IA (при условии выполнения тазовой и поясничной лимфодиссекции) в отсутствие опухолевых эмболов в лимфатических щелях, при которых возможно проведение адъювантной брахитерапии.
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарий:
• Адъювантную ЛТ начинают не позднее 60 дней от момента хирургического вмешательства или при выявлении клинических проявлений прогрессирования заболевания.
• Применяется конформная ДЛТ с предварительной топометрией по данным КТ или МРТ. Учитываются все принципы конформной ДЛТ при планировании объема облучения на область малого таза и зон регионарного метастазирования с включением парааортальной области или без него. Брахитерапия предполагает как облучение матки при отсутствии хирургического этапа лечения, так и облучение культи влагалища в послеоперационном периоде. В планируемый объем облучения рекомендуется включать непосредственно первичную опухоль (при отсутствии хирургического этапа лечения), общие, наружные и внутренние подвздошные лимфатические узлы, параметральную область, верхнюю треть влагалища/паравагинальную область и пресакральные лимфатические узлы (в случаях инвазии опухоли в шейку матки) [52]. Расширенные поля облучения по показаниям должны включать объем малого таза, область всех групп подвздошных и парааортальных лимфатических узлов. Верхняя граница поля должна достигать уровня позвонков L1-L2, или с учетом уровня поражения парааортальных лимфатических узлов верхняя граница поля может достигать позвонка Th12. Суммарная доза достигает 46-50 Гр в режиме фракционирования 2 Гр 5 раз в неделю. Послеоперационная конформная ДЛТ с использованием технологии IMRT после хирургического этапа лечения является предпочтительной методикой. Отмечены низкие показатели токсичности при высоком локальном контроле [52, 53].
• При планировании послеоперационной брахитерапии целесообразно облучать верхние 2/3 влагалища на глубину 0,5 см от слизистой оболочки. Принято использовать радиоактивные источники 60Co и 192Ir. При проведении самостоятельной брахитерапии разовые дозы составляют 7 Гр по 3 фракции или 6 Гр по 5 фракций. Сроки проведения послеоперационного облучения культи влагалища зависят от ее заживления, но не должны превышать 12 нед после операции [53-56]. При проведении ДЛТ с последующей брахитерапией разовая доза составляет 5 Гр по 4 фракции. Возможны другие режимы фракционирования - 4-6 Гр по 2-3 фракции. Целесообразно выполнение дозиметрической верификации рассчитанного плана лечения.
• Паллиативная ЛТ (брахитерапия, ДЛТ) рекомендуется у ослабленных пациенток с РТМ, оценка их состояния проводится согласно шкале оценки тяжести состояния пациента по версии ВОЗ/ECOG >2баллов и/или по шкале Карновского ≤70 баллов ( см Приложение Г1-2) [53].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарий. Суммарные дозы могут достигать 40-50 Гр [53].
• При рецидиве РТМ в культе влагалища или наличии метастаза во влагалище как единственного проявления заболевания рекомендовано проведение брахитерапии и/или ДЛТ с учетом ранее проводимой ЛТ [9, 57].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. Суммарная доза планируется с учетом ранее проведенного лечения на планируемый объем опухолевого образования и достигает 30-40 Гр [9].
• У молодых пациенток с начальным (неинвазивным) высокодифференцированным РТМ рекомендуется гормональное лечение с сохранением фертильности [30, 31].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий:
• Лечение целесообразно проводить в медицинских организациях, имеющих опыт такого лечения.
• Пациентки должны быть информированы о рисках, связанных с консервативным лечением с сохранением фертильности, в частности о высокой частоте развития рецидивов, а также о необходимости удаления матки в будущем (после родов или при достижении возраста, при котором планирование беременности неактуально).
• Применяют внутриматочную спираль на срок не менее 6 мес с левоноргестрелом (52 мг) ± препараты из группы аналогов гонадотропин-рилизинг-гормона, медроксипрогестерон** (400-600 мг/сут).
• Для оценки эффективности лечения рекомендуется проведение гистологического исследования эндометрия каждые 3 мес. Через 6 мес после начала гормонотерапии выполняют гистероскопию и раздельное диагностическое выскабливание цервикального канала и полости матки.При отсутствии полного ответа через 6-12 мес от начала гормонотерапии показано хирургическое лечение.
• При достижении полного ответа рекомендуется реализация репродуктивной функции в кратчайшие сроки, возможно применение вспомогательных репродуктивных технологий. После родов предлагается профилактическая гистерэктомия.
• До выполнения профилактической гистерэктомии показано наблюдение у врача-онколога, гистологическое исследование эндометрия проводят каждые 6 мес [43, 44, 58, 59].
• ХТ рекомендуется при РТМ III-IV стадий после операции и неэндометриальном РТМ всех стадий (кроме муцинозного рака) [17, 38, 60-66].
Уровень убедительности рекомендаций. С ( уровень достоверности доказательств - 2).
Комментарий. Проводится обычно 6 курсов ХТ. Применяют следующие режимы:
• доксорубицин** 60 мг/м2 в 1-й день и цисплатин** 50 мг/м2 в 1-й день каждые 3 нед [62, 63];
• паклитаксел** 175 мг/м2 в 1-й день и карбоплатин** AUC 5-6 в 1-й день каждые 3 нед [64];
• паклитаксел** 175 мг/м2 в 1-й день и цисплатин** 50 или 75 мг/м2 в 1-й день каждые 3 нед [65, 66].
• ХТ рекомендована в 1-й линии лечения прогрессирования РТМ (6 курсов либо до прогрессирования или возникновения непереносимой токсичности) [61-75]. Схемами выбора являются комбинации на основе соединений платины и таксанов.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 2).
Комментарий. Применяют следующие режимы:
• паклитаксел** 175 мг/м2 в/в 3 ч в 1-й день и цисплатин** 50 или 75 мг/м2 в/в 2 ч в 1-й день каждые 3 нед [65, 66];
• паклитаксел** 175 мг/м2 в/в 3 ч в 1-й день и карбоплатин** AUC 6 в/в 1 ч в 1-й день каждые 3 нед [64, 70];
• доксорубицин** 60 мг/м2 в/в 15-30 мин в 1-й день и цисплатин** 50 мг/м2 в/в 2 ч в 1-й день каждые 3 нед [62, 63];
• ифосфамид** 1600 мг/м2 в/в 2 ч в 1-3-й дни и паклитаксел** 135 мг/м2 в/в 3 ч в 1-й день (+ месна** из расчета 120 % от дозы ифосфамида** в/в одновременно с ним в 1-3-й дни) при поддержке филграстимом** подкожно в дозе 5 мг/кг/сут ежедневно через 24-72 ч после последнего дня ХТ (предпочтительный режим для карциносарком матки) [74];
• паклитаксел** 175 мг/м2 в/в 3 ч в 1-й день, карбоплатин** AUC 5 в/в 1 ч в 1-й день каждые 3 нед и трастузумаб** 8 мг/кг в 1-е введение, далее 6 мг/кг в/в 30-90 мин каждые 3 нед (для пациенток с HER2/neu-позитивным серозным раком эндометрия) [61];
• цисплатин** 20 мг/м2 в/в 2 ч в 1-5-й дни и ифосфамид** 1500 мг/м2 в/в 2 ч в 1-5-й дни в/в 1-часовая инфузия (+ месна** из расчета 100 % от дозы ифосфамида** в/в одновременно с ним в 1-5-й дни) каждые 3 нед (возможно применение при карциносаркомах матки) [75].
Для серозного подтипа рака эндометрия при диссеминированном процессе и прогрессировании рекомендовано определение HER2/neu-статуса в опухолевом образце.
• При позднем рецидиве (≥ 2 года) РТМ рекомендовано проведение повторной биопсии для определения рецепторного статуса опухоли [76].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
• При выявлении в опухоли гормональных рецепторов у пациенток с РТМ при позднем рецидиве (≥2 года) рекомендуется назначение гормональной терапии [77-82].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. Применяют следующие режимы гормональной терапии при позднем (≥ 2 года) рецидиве РТМ (применяются до прогрессирования или непереносимой токсичности):
• медроксипрогестерон** 200 мг/сут внутрь ежедневно [79];
• тамоксифен** 20 мг внутрь 2 раза в сутки ежедневно [80];
• летрозол 2,5 мг/сут внутрь ежедневно [81];
• анастрозол** 1 мг/сут внутрь ежедневно [81];
• эксеместан 25 мг/сут внутрь ежедневно [82].
• Пациенткам с лейомиосаркомой матки I стадии рекомендуется динамическое наблюдение после проведенного радикального хирургического лечения [83].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 2).
• ХТ рекомендуется при лейомиосаркоме, эндометриальной стромальной саркоме матки высокой степени злокачественности и недифференцированной саркоме матки всех стадий [84-90].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 2).
Комментарий. Применяют следующие режимы:
• доксорубицин** 75 мг/м2 в/в струйно каждые 3 нед (режим предпочтителен для лейомиосаркомы матки, возможно назначение ослабленным пациенткам) [89];
• гемцитабин** 900 мг/м2 в/в 90 мин в 1-й и 8-й дни и доцетаксел** 100 мг/м2 в/в 1 ч в 8-й день при поддержке филграстимом** 150 мкг/м2 подкожно с 9-го по 15-й дни (после дистанционного облучения малого таза целесообразно редуцировать дозу гемцитабина** до 675 мг/м2, доцетаксела** до 75 мг/м2, возможно использование пролонгированной формы филграстима**) [90];
• доксорубицин** 50 мг/м2 в/в 15 мин в 1-й день и ифосфамид** 5000 мг/м2 в/в 24-часовая инфузия в 1-й день (+ месна** из расчета 120 % от дозы ифосфамида** в/в одновременно с ним) каждые 3 нед [84];
• доксорубицин** 60 мг/м2 в/в в 1-й день и дакарбазин** 750 мг/м2, растворенный вместе с доксорубицином**, в/в 96-часовая инфузия каждые 3 нед [85];
• гемцитабин** 1800 мг/м2 в/в 3-часовая инфузия и дакарбазин** 500 мг/м2 в/в 20 мин каждые 2 нед (всего 12 курсов) [86];
• гемцитабин** 800 мг/м2 в/в 90 мин в 1-й и 8-й дни и винорелбин** 25 мг/м2 в/в 6-10 мин в 1-й и 8-й дни каждые 3 нед [87].
• Гормональная терапия рекомендуется при диссеминированных формах эндометриальной стромальной саркомы матки низкой степени злокачественности и гормонопозитивной лейомиосаркоме матки [77, 78].
Уровень убедительности рекомендаций. В ( уровень достоверности доказательств - 2).
Комментарий. Применяют следующие режимы (применяются до прогрессирования или непереносимой токсичности):
• летрозол 2,5 мг/сут внутрь ежедневно [77];
• анастрозол** 1 мг/сут внутрь ежедневно [77];
• эксеместан 25 мг/сут внутрь ежедневно [82];
• медроксипрогестерон** 200 мг/сут внутрь ежедневно [79];
• гозерелин** 3,6 мг внутримышечно 1 раз в 28 дней ежедневно [77];
• бусерелин** 3,75 мг внутримышечно1 раз в 28 дней ежедневно [77];
• лейпрорелин** 3,75 мг внутримышечно1 раз в 28 дней ежедневно [77].
• При прогрессировании РТМ после 1-й линии ХТ рекомендуется применение 2-й линии ХТ (6 курсов ХТ либо до прогрессирования или непереносимой токсичности) [9, 91-98].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 3).
Комментарий. Применяют следующие режимы:
• пембролизумаб** 200 мг в/в капельно 30-минутная инфузия каждые 3 нед (при наличии MSIh/dMMR в опухоли) [99];
• пембролизумаб** 200 мг в/в капельно 30-минутная инфузия каждые 3 нед и ленватиниб** 20 мг 1 раз в сутки внутрь ежедневно (при отсутствии MSIh/dMMR в опухоли) [100];
• ифосфамид** 1200 мг/м2 в/в 2 ч 1-часовая инфузия в 1-5-й дни каждые 4 нед (+ месна** 300 мг/м2, но не более чем 120 % от дозы ифосфамида**, в/в каждые 4 ч 3 дозы в 1-5-й дни) [101];
• топотекан 1,5 мг/м2 в/в 30 мин с 1-го по 5-й дни каждые 3 нед [91];
• паклитаксел** 175 мг/м2 (с редукцией дозы, по показаниям) в/в 3 ч в 1-й день каждые 3 нед или 80 мг/м2 в/в в 1, 8 и 15-й дни каждые 3 нед [95-98];
• оксалиплатин** 130 мг/м2 2 ч каждые 3 нед [94];
• доксорубицин** 40 или 50 мг/м2 в/в 1 ч каждые 4 нед [93, 102];
• доксорубццин** 50 мг/м2 в/в 15-30 мин каждые 4 нед [92];
• бевацизумаб** 15 мг/кг в/в 30-90 мин каждые 3 нед [92].
При рецидиве более чем через 6 мес после окончания первичного лечения возможен повтор 1-й линии ХТ (включая в схему химиопрепараты на основе платины). Если пациентке ранее проводилась ДЛТ, дозы паклитаксела**, ифосфамида** и гемцитабина** как в монорежиме, так и в комбинациях целесообразно редуцировать на 20 % [9].
• При прогрессировании лейомиосаркомы, эндометриальной стромальной саркомы матки высокой степени злокачественности и недифференцированной саркомы матки рекомендована как монохимиотерапия, так и неиспользованные режимы 1-й линии [103-110].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 2).
Комментарий. Применяют следующие препараты и режимы ХТ:
• дакарбазин** 1200 мг/м2 в/в 20-30 мин каждые 3 нед (всего 8 курсов) [110];
• гемцитабин**1000 мг/м2 в 1, 8, 15-й дни каждые 4 нед [86, 87, 111, 112];
• эпирубицин**75 мг/м2 в/в струйно каждые 3 нед [103, 112];
• ифосфамид** 1200 мг/м2 в/в 2 ч в 1-5-й дни каждые 4 нед (+ месна** 300 мг/м2, но не более чем 120 % от дозы ифосфамида** в/в в 1-5-й дни) [101];
• доксорубицин** 50-60 мг/м2 в/в 1 ч каждые 3 нед [113];
• пазопаниб** 800 мг/сут внутрь ежедневно [114];
• темозоломид** 50-75 мг/м2/сут внутрь в течение 6 из 8 нед или 150-300 мг/м2/сут внутрь в 1-5-й дни каждые 4 нед [115];
• эрибулин** 1,4 мг/м2 в/в 2-5 мин в 1-й и 8-й дни каждые 3 нед [110];
• трабектедин 1,5 мг/м2 в/в 24-часовая инфузия каждые 3 нед (при лейомиосаркоме матки ранее должны применяться антрациклины) [114, 116, 117];
• доцетаксел** 36 мг/м2 в/в 1 ч в 1, 8 и 15-й дни каждые 4 нед [109].
Пазопаниб**, темозоломид** и эрибулин** применяют при прогрессировании на фоне цитостатической терапии [110, 115].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• При рецидиве РТМ в культе влагалища после брахитерапии рекомендуется удаление опухоли с последующей ДЛТ [118, 119].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• При рецидиве в культе влагалища после сочетанной ЛТ рекомендуется удаление опухоли или проведение внутритканевой ЛТ под контролем методов визуализации. При отсутствии условий для проведения хирургического лечения и ЛТ возможна ХТ [119, 120].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарий. Гормонотерапия целесообразна только при эндометриальном РТМ, экспрессирующем рецепторы стероидных гормонов. Следует помнить о низкой эффективности системного лекарственного лечения при прогрессировании в зоне облучения.
• При регионарных метастазах РТМ рекомендуется ЛТ или лимфаденэктомия с последующей ЛТ [121, 122].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
• При регионарных метастазах РТМ рекомендуется рассмотреть возможность дополнительной системной ХТ [123].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• При солитарных поздних отдаленных метастазах РТМ рекомендуется рассмотреть возможность хирургического лечения [9, 17].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарий. При отдаленных метастазах высокодифференцированного РТМ, а также при небольших отдаленных невисцеральных метастазах эндометриального РТМ, экспрессирующего рецепторы стероидных гормонов, при отсутствии клинических проявлений возможна гормонотерапия (при последующем прогрессировании показана ХТ). При отдаленных метастазах умеренно- и низкодифференцированного РТМ, больших отдаленных метастазах, а также при наличии клинических проявлений целесообразна ХТ, при необходимости в сочетании с паллиативной ЛТ. При дальнейшем прогрессировании показана паллиативная помощь.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
3,1 Хирургическое лечение.
В табл. 3, 4 представлены 2 классификации типов хирургических вмешательств по M.S. Piver (1974) и D. Querleu, С.P. Morrow (2017).Таблица 3. Классификация М.S. Piver (1974).
| I тип | Экстрафасциальная экстирпация матки Минимальная резекция влагалища, пузырно-маточная связка не иссекается, кардинальная связка пересекается у матки |
| II тип | Модифицированная расширенная экстирпация матки Подразумевает удаление медиальной трети кардинальных, пузырно-маточных и крестцово-маточных связок, верхней трети влагалища и тазовую лимфаденэктомию. Мочеточники туннелируют, но не мобилизуют по нижнелатеральной полуокружности. Маточные сосуды пересекают на уровне мочеточника |
| III тип | Расширенная экстирпация матки, или по Вертгейму-Мейгсу Подразумевает полное удаление кардинальных и крестцово-маточных связок от стенок таза, пузырно-маточной связки от стенки мочевого пузыря, верхней трети влагалища и тазовую лимфаденэктомию. Мочеточники мобилизуют полностью до места впадения в мочевой пузырь. Маточные сосуды пересекают у места отхождения от внутренних подвздошных сосудов |
| IV тип | Расширенная экстирпация матки Включает пересечение верхней пузырной артерии, удаление периуретеральной клетчатки и до 3/4 влагалища |
| V тип | Комбинированная расширенная экстирпация матки Подразумевает удаление дистальных отделов мочеточников и резекцию мочевого пузыря |
Таблица 4. Классификация Querleu-Morrow (2017).
| Тип радикальной гистерэктомии | Парацервикс или латеральный параметрий | Вентральный параметрий | Дорзальный параметрий |
| А | Половина расстояния между шейкой матки и мочеточником без мобилизации мочеточников | Минимальное иссечение | Минимальное иссечение |
| В1 | На уровне мочеточников, мочеточник туннелируют и парацервикс резецируют на уровне мочеточников | Частичное иссечение пузырно-маточной связки | Частичное иссечение ректовагинальной связки и крестцово-маточной связки |
| В2 | Аналогично в1 в сочетании с парацервикальной лимфаденэктомией без резекции сосудистых сплетений и нервов | Частичное иссечение пузырно-маточной связки | Частичное иссечение ректовагинальной связки и крестцово-маточной связки |
| С1 | Полная мобилизация мочеточников, резекция параметриев до подвздошных сосудов | Иссечение пузырно-маточной связки у стенки мочевого пузыря (краниальнее мочеточника) с сохранением сплетения нервов мочевого пузыря | У стенки прямой кишки (с сохранением гипогастрального нерва) |
| С2 | Полная мобилизация мочеточников, резекция параметриев на уровне подвздошных сосудов | На уровне мочевого пузыря (сплетение нервов мочевого пузыря не сохраняется) | На уровне крестца (гипогастральный нерв не сохраняется) |
| D | До стенки таза, включает резекцию внутренних подвздошных сосудов и/или прилегающих к ним фасциальных или мышечных структур | На уровне мочевого пузыря. Не выполняется в случае экзентерации | На уровне крестца. Не выполняется в случае экзентерации |
• Хирургическое вмешательство рекомендуется как наиболее эффективный метод лечения пациенток с РТМ независимо от стадии как самостоятельно, так и в комбинации с другими методами [9, 17, 24-26].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий:
• При РТМ возможны лапароскопические, лапаротомные, лапароскопически-ассистированные влагалищные, робот-ассистированные вмешательства при условии того, что доступ обеспечивает решение задач, стоящих перед хирургическим этапом лечения, в том числе выполнение тазовой и поясничной лимфодиссекции, если она показана [24-27].
• Ведущим доступом при хирургическом лечении локализованного РТМ является лапароскопический [24, 28]. Преимущество метода заключается в снижении частоты пери-/послеоперационных осложнений, особенно у пациенток старшей возрастной группы, у пациенток с избыточной массой тела при аналогичных отдаленных результатах лечения по сравнению с лапаротомным доступом [24, 28].
• При абсолютных противопоказаниях к хирургическому лечению проводят лучевую терапию (ЛТ) по радикальной программе, при высокодифференцированной эндометриальнй аденокарциноме возможна гормонотерапия [29-31].
• Пациенткам с РТМ I стадии рекомендуется хирургическое лечение как наиболее эффективный метод [9, 17].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. Предоперационная ЛТ нецелесообразна.
• Рекомендуемый объем хирургического вмешательства пациенткам при РТМ IА стадии - объем хирургического вмешательства Piver I тип или радикальная гистерэктомия тип А ( см термины и определения, табл. 3, 4) [32].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
• Рекомендуемый объем хирургического вмешательства пациенткам при РТМ стадии IB (глубокая инвазия) - хирургическое лечение в объеме Piver II тип или радикальная гистерэктомия тип В ( см термины и определения, табл. 3, 4) [32].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
• Рекомендуется у пациенток с РТМ проводить биопсию с патологоанатомическим исследованием всех выявленных при хирургической ревизии брюшной полости, малого таза и забрюшинного пространства подозрительных образований в целях их морфологической верификации и стадирования заболевания [10, 17, 27, 33].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарий. У пациенток моложе 45 лет при высокодифференцированном РТМ с инвазией менее половины толщины миометрия при отсутствии признаков распространения опухоли за пределы матки возможно сохранение яичников и удаление матки с маточными трубами [10, 26, 34]. Сохранение яичников не целесообразно при мутациях генов вRCA1/2 и синдроме Линча.
• При серозном РТМ, а также при обнаружении во время операции метастазов в яичниках, когда высок риск имплантационного метастазирования, рекомендуется удаление большого сальника [35].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• Рекомендуется лимфодиссекция при I клинической стадии при серозном, светлоклеточном РТМ и карциносаркоме. Показания к лимфодиссекции для эндометриального рака определяются риском, оцениваемым по результатам предоперационного обследования (табл. 5) [36, 37].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. При наличии показаний к лимфодиссекции удаляют лимфатические узлы обеих регионарных зон - тазовые и поясничные до почечных сосудов (лимфодиссекция IV уровня).
Таблица 5. Показания к лимфодиссекции при эндометриальном РТМ I клинической стадии (консенсус ESGO, ESMO, ESTRO - Европейских обществ онкогинекологии, онкологии, общества радиотерапии и онкологии соответственно, 2014).
| Инвазия миометрия | Степень дифференцировки | Риск лимфогенных метастазов | Тазовая и парааортальная лимфодиссекция |
| <1/2 | Высокая и умеренная | Низкий | Нет |
| Низкая | Промежуточный | Возможна для уточнения стадии | |
| >1/2 | Высокая и умеренная | Промежуточный | Возможна для уточнения стадии |
| Низкая | Высокий | Да |
• При РТМ II стадии рекомендуется хирургическое вмешательство на I этапе лечения в объеме Piver II или III тип или радикальная гистерэктомия тип в-С2 ( см термины и определения, табл. 3, 4) с последующим адъювантным лечением [32].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарий. Примерно у 30 % пациенток с РТМ II стадии имеются метастазы в тазовых лимфатических узлах. Риск поражения парааортальных лимфатических узлов, яичников и диссеминации по брюшине при II клинической стадии РТМ выше, чем при I стадии. Вопрос о необходимости удаления параметриев (выполнения расширенной экстирпации матки Piver II или III тип, радикальной гистерэктомии тип в-C2) при РТМ II стадии остается открытым и должен решаться индивидуально в зависимости от интраоперационных находок [27, 38].
• При РТМ III-IV стадий рекомендуется начинать лечение с хирургического вмешательства [27, 38, 39].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
Комментарий:
• Операция позволяет уточнить распространение опухоли и выполнить циторедукцию.
• При РТМ IIIA стадии целесообразно выполнить операцию в объеме Piver II тип В с оментэктомией.
• При РТМ IIIB стадии целесообразно хирургическое лечение в объеме Piver III тип С2.
• При РТМ IVА стадии целесообразно выполнение передней или задней экзентерации [9].
• При выявлении макроскопически увеличенных регионарных лимфатических узлов у пациенток с III-IV стадиями РТМ рекомендуется тазовая и парааортальная лимфодиссекция, поскольку удаление макрометастазов в лимфатических узлах повышает выживаемость таких пациенток [36, 37, 40].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
• При неэндометриальном РТМ рекомендуется хирургическое лечение, которое включает экстирпацию матки с придатками, тазовую и парааортальную лимфодиссекцию [27, 41].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарий. Большой сальник удаляют только при серозном РТМ. Имеются данные о том, что лимфодиссекция при карциносаркоме матки не только позволяет уточнить стадию, но и повышает выживаемость пациенток. Неэндометриальный РТМ (серозный, светлоклеточный рак, смешанная аденокарцинома, карциносаркома) имеет неблагоприятный прогноз. Исключение составляет муцинозный рак, который в подавляющем большинстве случаев является высокодифференцированным и по клиническому течению сходен с высокодифференцированным эндометриальным РТМ.
• При лейомиосаркоме матки рекомендуется выполнять Piver I тип экстирпацию матки с придатками [19, 42].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. У пациенток до 45 лет с лейомиосаркомой матки ранних стадий допустимо сохранение яичников, так как это не влияет на выживаемость. Удаление тазовых и поясничных лимфатических узлов нецелесообразно, поскольку их поражение наблюдается крайне редко.
• При эндометриальной стромальной саркоме матки низкой степени злокачественности рекомендуется операция в объеме Piver I тип или радикальная гистерэктомия тип А и удаление макроскопически определяемых опухолей. Тазовая и парааортальная лимфодиссекция может быть целесообразна, но метастазы в лимфатических узлах не влияют на общую выживаемость [19].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарий. Эндометриальная стромальная саркома матки низкой степени злокачественности - гормонозависимая опухоль. При I стадии заболевания метастазы в яичниках наблюдаются крайне редко. Сохранение яичников в этом случае повышает риск рецидива, но не влияет на общую выживаемость, поэтому у молодых пациентов сохранение яичников должно обсуждаться индивидуально на онкологическом консилиуме [43, 44].
• При эндометриальной стромальной саркоме матки высокой степени злокачественности рекомендуется операция в объеме Piver I тип или тип А [45].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. С учетом крайне неблагоприятного прогноза роль лимфодиссекции и циторедуктивных операций сомнительна. Эндометриальная стромальная саркома матки высокой степени злокачественности и недифференцированная саркома матки - крайне агрессивные опухоли со склонностью к быстрому гематогенному метастазированию.
3,2 Адъювантное лечение.
• Тактику адъювантной терапии у пациенток с РТМ I стадии рекомендуется определять в зависимости от объема выполненного хирургического вмешательства [9, 46].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. Показания к адъювантной дистанционной ЛТ (ДЛТ) определяются в первую очередь факторами риска лимфогенного метастазирования РТМ, которые полностью нивелируются при выполнении адекватной лимфаденэктомии. Несмотря на то что ни одно из опубликованных на сегодняшний день рандомизированных исследований тазовой лимфаденэктомии при РТМ не продемонстрировало повышение выживаемости при ее выполнении. Регионарная лимфаденэктомия при РТМ решает следующие задачи: уточнение стадии и определение тактики дальнейшего лечения [46, 47]. С точки зрения профилактики регионарного прогрессирования лимфаденэктомию при РТМ ранних стадий можно рассматривать как альтернативу ДЛТ, более безопасную с точки зрения отдаленных последствий (поздних осложнений, радиоиндуцированных опухолей), что особенно важно у молодых пациенток. Показания к адъювантному лечению зависят от группы риска, к которой относится пациентка (табл. 6) [38].
Таблица 6. Группы риска при РТМ (консенсус ESGO, ESMO, ESTRO, 2014).
| Риск | Описание |
| Низкий | Эндометриальный РТМ, стадия IA, G1-2, нет опухолевых эмболов в лимфатических щелях |
| Промежуточный | Эндометриальный РТМ, стадия IB, G1-2, нет опухолевых эмболов в лимфатических щелях |
| Промежуточно-высокий | Эндометриальный РТМ |
| стадия IA, G3 | |
| стадия IA и IB, G1-2, опухолевые эмболы в лимфатических щелях | |
| Высокий | Эндометриальный РТМ, стадия IB, G3 |
| Эндометриальный РТМ, стадия II-IV | |
| Неэндометриальный РТМ, любая стадия |
• Адъювантное лечение эндометриального РТМ I. II стадий рекомендуется проводить согласно рекомендациям консенсуса ESGO, ESMO, ESTRO (2014) (табл. 7, 8) [38].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Таблица 7. Адъювантное лечение эндометриального РТМ I стадии (консенсус ESGO, ESMO, ESTRO, 2014).
| Риск | Лимфодиссекция выполнена, метастазов в лимфатических узлах нет | Лимфодиссекция не выполнена |
| Низкий | Нет | |
| Промежуточный | Брахитерапия или наблюдение, особенно у пациенток в возрасте <60 лет | |
| Промежуточно-высокий | Брахитерапия или наблюдение | Дистанционное облучение малого таза при опухолевых эмболах, брахитерапия при G3 |
| Высокий | Брахитерапия или дистанционное облучение малого таза | Дистанционное облучение малого таза |
Таблица 8. Адъювантное лечение эндометриального РТМ II стадии (консенсус ESGO, ESMO, ESTRO, 2014).
| Риск | Лимфодиссекция выполнена, метастазов в лимфатических узлах нет | Лимфодиссекция не выполнена |
| G1-2, нет опухолевых эмболов | Брахитерапия | Дистанционное облучение малого таза ± брахитерапия |
| G3, опухолевые эмболы | Дистанционное облучение малого таза ± брахитерапия | Дистанционное облучение малого таза ± брахитерапия |
• Пациенткам при РТМ III-IV стадий после операции рекомендуется проведение ХТ в сочетании с ЛТ (брахитерапией, в отдельных случаях возможна ДЛТ) для профилактики рецидива в культе влагалища [29, 48-50].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
• При неэндометриальном РТМ в качестве адъювантного лечения рекомендуется ХТ в сочетании с брахитерапией [9].
Уровень убедительности рекомендаций. С ( уровень достоверности доказательств - 5).
Комментарий. Исключением является серозный и светлоклеточный РТМ стадии IA (при условии выполнения тазовой и поясничной лимфодиссекции) в отсутствие опухолевых эмболов в лимфатических щелях, при которых возможно проведение адъювантной брахитерапии.
3,3 Лучевое лечение.
• Пациенткам со ЗНО тела матки групп промежуточно-высокого и высокого риска ( см табл. 6) с учетом стадии, гистологического типа опухоли и объема выполненного хирургического лечения р екомендуется проведение ЛТ: ДЛТ и/или брахитерапии в сочетании с ХТ в адъювантном режиме или без нее [17, 38, 51]. Пациенткам со ЗНО тела матки группы промежуточного риска прогрессирования заболевания после хирургического вмешательства рекомендуется наблюдение (преимущественно, пациенткам младше 60 лет) или брахитерапия [38, 51].Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарий:
• Адъювантную ЛТ начинают не позднее 60 дней от момента хирургического вмешательства или при выявлении клинических проявлений прогрессирования заболевания.
• Применяется конформная ДЛТ с предварительной топометрией по данным КТ или МРТ. Учитываются все принципы конформной ДЛТ при планировании объема облучения на область малого таза и зон регионарного метастазирования с включением парааортальной области или без него. Брахитерапия предполагает как облучение матки при отсутствии хирургического этапа лечения, так и облучение культи влагалища в послеоперационном периоде. В планируемый объем облучения рекомендуется включать непосредственно первичную опухоль (при отсутствии хирургического этапа лечения), общие, наружные и внутренние подвздошные лимфатические узлы, параметральную область, верхнюю треть влагалища/паравагинальную область и пресакральные лимфатические узлы (в случаях инвазии опухоли в шейку матки) [52]. Расширенные поля облучения по показаниям должны включать объем малого таза, область всех групп подвздошных и парааортальных лимфатических узлов. Верхняя граница поля должна достигать уровня позвонков L1-L2, или с учетом уровня поражения парааортальных лимфатических узлов верхняя граница поля может достигать позвонка Th12. Суммарная доза достигает 46-50 Гр в режиме фракционирования 2 Гр 5 раз в неделю. Послеоперационная конформная ДЛТ с использованием технологии IMRT после хирургического этапа лечения является предпочтительной методикой. Отмечены низкие показатели токсичности при высоком локальном контроле [52, 53].
• При планировании послеоперационной брахитерапии целесообразно облучать верхние 2/3 влагалища на глубину 0,5 см от слизистой оболочки. Принято использовать радиоактивные источники 60Co и 192Ir. При проведении самостоятельной брахитерапии разовые дозы составляют 7 Гр по 3 фракции или 6 Гр по 5 фракций. Сроки проведения послеоперационного облучения культи влагалища зависят от ее заживления, но не должны превышать 12 нед после операции [53-56]. При проведении ДЛТ с последующей брахитерапией разовая доза составляет 5 Гр по 4 фракции. Возможны другие режимы фракционирования - 4-6 Гр по 2-3 фракции. Целесообразно выполнение дозиметрической верификации рассчитанного плана лечения.
• Паллиативная ЛТ (брахитерапия, ДЛТ) рекомендуется у ослабленных пациенток с РТМ, оценка их состояния проводится согласно шкале оценки тяжести состояния пациента по версии ВОЗ/ECOG >2баллов и/или по шкале Карновского ≤70 баллов ( см Приложение Г1-2) [53].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарий. Суммарные дозы могут достигать 40-50 Гр [53].
• При рецидиве РТМ в культе влагалища или наличии метастаза во влагалище как единственного проявления заболевания рекомендовано проведение брахитерапии и/или ДЛТ с учетом ранее проводимой ЛТ [9, 57].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. Суммарная доза планируется с учетом ранее проведенного лечения на планируемый объем опухолевого образования и достигает 30-40 Гр [9].
3,4 Лекарственное лечение.
Химиотерапию при наличии показаний после хирургического вмешательства или при выявлении клинических симптомов прогрессирования ЗНО тела матки начинают не позднее чем через 60 дней.• У молодых пациенток с начальным (неинвазивным) высокодифференцированным РТМ рекомендуется гормональное лечение с сохранением фертильности [30, 31].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий:
• Лечение целесообразно проводить в медицинских организациях, имеющих опыт такого лечения.
• Пациентки должны быть информированы о рисках, связанных с консервативным лечением с сохранением фертильности, в частности о высокой частоте развития рецидивов, а также о необходимости удаления матки в будущем (после родов или при достижении возраста, при котором планирование беременности неактуально).
• Применяют внутриматочную спираль на срок не менее 6 мес с левоноргестрелом (52 мг) ± препараты из группы аналогов гонадотропин-рилизинг-гормона, медроксипрогестерон** (400-600 мг/сут).
• Для оценки эффективности лечения рекомендуется проведение гистологического исследования эндометрия каждые 3 мес. Через 6 мес после начала гормонотерапии выполняют гистероскопию и раздельное диагностическое выскабливание цервикального канала и полости матки.При отсутствии полного ответа через 6-12 мес от начала гормонотерапии показано хирургическое лечение.
• При достижении полного ответа рекомендуется реализация репродуктивной функции в кратчайшие сроки, возможно применение вспомогательных репродуктивных технологий. После родов предлагается профилактическая гистерэктомия.
• До выполнения профилактической гистерэктомии показано наблюдение у врача-онколога, гистологическое исследование эндометрия проводят каждые 6 мес [43, 44, 58, 59].
• ХТ рекомендуется при РТМ III-IV стадий после операции и неэндометриальном РТМ всех стадий (кроме муцинозного рака) [17, 38, 60-66].
Уровень убедительности рекомендаций. С ( уровень достоверности доказательств - 2).
Комментарий. Проводится обычно 6 курсов ХТ. Применяют следующие режимы:
• доксорубицин** 60 мг/м2 в 1-й день и цисплатин** 50 мг/м2 в 1-й день каждые 3 нед [62, 63];
• паклитаксел** 175 мг/м2 в 1-й день и карбоплатин** AUC 5-6 в 1-й день каждые 3 нед [64];
• паклитаксел** 175 мг/м2 в 1-й день и цисплатин** 50 или 75 мг/м2 в 1-й день каждые 3 нед [65, 66].
• ХТ рекомендована в 1-й линии лечения прогрессирования РТМ (6 курсов либо до прогрессирования или возникновения непереносимой токсичности) [61-75]. Схемами выбора являются комбинации на основе соединений платины и таксанов.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 2).
Комментарий. Применяют следующие режимы:
• паклитаксел** 175 мг/м2 в/в 3 ч в 1-й день и цисплатин** 50 или 75 мг/м2 в/в 2 ч в 1-й день каждые 3 нед [65, 66];
• паклитаксел** 175 мг/м2 в/в 3 ч в 1-й день и карбоплатин** AUC 6 в/в 1 ч в 1-й день каждые 3 нед [64, 70];
• доксорубицин** 60 мг/м2 в/в 15-30 мин в 1-й день и цисплатин** 50 мг/м2 в/в 2 ч в 1-й день каждые 3 нед [62, 63];
• ифосфамид** 1600 мг/м2 в/в 2 ч в 1-3-й дни и паклитаксел** 135 мг/м2 в/в 3 ч в 1-й день (+ месна** из расчета 120 % от дозы ифосфамида** в/в одновременно с ним в 1-3-й дни) при поддержке филграстимом** подкожно в дозе 5 мг/кг/сут ежедневно через 24-72 ч после последнего дня ХТ (предпочтительный режим для карциносарком матки) [74];
• паклитаксел** 175 мг/м2 в/в 3 ч в 1-й день, карбоплатин** AUC 5 в/в 1 ч в 1-й день каждые 3 нед и трастузумаб** 8 мг/кг в 1-е введение, далее 6 мг/кг в/в 30-90 мин каждые 3 нед (для пациенток с HER2/neu-позитивным серозным раком эндометрия) [61];
• цисплатин** 20 мг/м2 в/в 2 ч в 1-5-й дни и ифосфамид** 1500 мг/м2 в/в 2 ч в 1-5-й дни в/в 1-часовая инфузия (+ месна** из расчета 100 % от дозы ифосфамида** в/в одновременно с ним в 1-5-й дни) каждые 3 нед (возможно применение при карциносаркомах матки) [75].
Для серозного подтипа рака эндометрия при диссеминированном процессе и прогрессировании рекомендовано определение HER2/neu-статуса в опухолевом образце.
• При позднем рецидиве (≥ 2 года) РТМ рекомендовано проведение повторной биопсии для определения рецепторного статуса опухоли [76].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
• При выявлении в опухоли гормональных рецепторов у пациенток с РТМ при позднем рецидиве (≥2 года) рекомендуется назначение гормональной терапии [77-82].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. Применяют следующие режимы гормональной терапии при позднем (≥ 2 года) рецидиве РТМ (применяются до прогрессирования или непереносимой токсичности):
• медроксипрогестерон** 200 мг/сут внутрь ежедневно [79];
• тамоксифен** 20 мг внутрь 2 раза в сутки ежедневно [80];
• летрозол 2,5 мг/сут внутрь ежедневно [81];
• анастрозол** 1 мг/сут внутрь ежедневно [81];
• эксеместан 25 мг/сут внутрь ежедневно [82].
• Пациенткам с лейомиосаркомой матки I стадии рекомендуется динамическое наблюдение после проведенного радикального хирургического лечения [83].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 2).
• ХТ рекомендуется при лейомиосаркоме, эндометриальной стромальной саркоме матки высокой степени злокачественности и недифференцированной саркоме матки всех стадий [84-90].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 2).
Комментарий. Применяют следующие режимы:
• доксорубицин** 75 мг/м2 в/в струйно каждые 3 нед (режим предпочтителен для лейомиосаркомы матки, возможно назначение ослабленным пациенткам) [89];
• гемцитабин** 900 мг/м2 в/в 90 мин в 1-й и 8-й дни и доцетаксел** 100 мг/м2 в/в 1 ч в 8-й день при поддержке филграстимом** 150 мкг/м2 подкожно с 9-го по 15-й дни (после дистанционного облучения малого таза целесообразно редуцировать дозу гемцитабина** до 675 мг/м2, доцетаксела** до 75 мг/м2, возможно использование пролонгированной формы филграстима**) [90];
• доксорубицин** 50 мг/м2 в/в 15 мин в 1-й день и ифосфамид** 5000 мг/м2 в/в 24-часовая инфузия в 1-й день (+ месна** из расчета 120 % от дозы ифосфамида** в/в одновременно с ним) каждые 3 нед [84];
• доксорубицин** 60 мг/м2 в/в в 1-й день и дакарбазин** 750 мг/м2, растворенный вместе с доксорубицином**, в/в 96-часовая инфузия каждые 3 нед [85];
• гемцитабин** 1800 мг/м2 в/в 3-часовая инфузия и дакарбазин** 500 мг/м2 в/в 20 мин каждые 2 нед (всего 12 курсов) [86];
• гемцитабин** 800 мг/м2 в/в 90 мин в 1-й и 8-й дни и винорелбин** 25 мг/м2 в/в 6-10 мин в 1-й и 8-й дни каждые 3 нед [87].
• Гормональная терапия рекомендуется при диссеминированных формах эндометриальной стромальной саркомы матки низкой степени злокачественности и гормонопозитивной лейомиосаркоме матки [77, 78].
Уровень убедительности рекомендаций. В ( уровень достоверности доказательств - 2).
Комментарий. Применяют следующие режимы (применяются до прогрессирования или непереносимой токсичности):
• летрозол 2,5 мг/сут внутрь ежедневно [77];
• анастрозол** 1 мг/сут внутрь ежедневно [77];
• эксеместан 25 мг/сут внутрь ежедневно [82];
• медроксипрогестерон** 200 мг/сут внутрь ежедневно [79];
• гозерелин** 3,6 мг внутримышечно 1 раз в 28 дней ежедневно [77];
• бусерелин** 3,75 мг внутримышечно1 раз в 28 дней ежедневно [77];
• лейпрорелин** 3,75 мг внутримышечно1 раз в 28 дней ежедневно [77].
• При прогрессировании РТМ после 1-й линии ХТ рекомендуется применение 2-й линии ХТ (6 курсов ХТ либо до прогрессирования или непереносимой токсичности) [9, 91-98].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 3).
Комментарий. Применяют следующие режимы:
• пембролизумаб** 200 мг в/в капельно 30-минутная инфузия каждые 3 нед (при наличии MSIh/dMMR в опухоли) [99];
• пембролизумаб** 200 мг в/в капельно 30-минутная инфузия каждые 3 нед и ленватиниб** 20 мг 1 раз в сутки внутрь ежедневно (при отсутствии MSIh/dMMR в опухоли) [100];
• ифосфамид** 1200 мг/м2 в/в 2 ч 1-часовая инфузия в 1-5-й дни каждые 4 нед (+ месна** 300 мг/м2, но не более чем 120 % от дозы ифосфамида**, в/в каждые 4 ч 3 дозы в 1-5-й дни) [101];
• топотекан 1,5 мг/м2 в/в 30 мин с 1-го по 5-й дни каждые 3 нед [91];
• паклитаксел** 175 мг/м2 (с редукцией дозы, по показаниям) в/в 3 ч в 1-й день каждые 3 нед или 80 мг/м2 в/в в 1, 8 и 15-й дни каждые 3 нед [95-98];
• оксалиплатин** 130 мг/м2 2 ч каждые 3 нед [94];
• доксорубицин** 40 или 50 мг/м2 в/в 1 ч каждые 4 нед [93, 102];
• доксорубццин** 50 мг/м2 в/в 15-30 мин каждые 4 нед [92];
• бевацизумаб** 15 мг/кг в/в 30-90 мин каждые 3 нед [92].
При рецидиве более чем через 6 мес после окончания первичного лечения возможен повтор 1-й линии ХТ (включая в схему химиопрепараты на основе платины). Если пациентке ранее проводилась ДЛТ, дозы паклитаксела**, ифосфамида** и гемцитабина** как в монорежиме, так и в комбинациях целесообразно редуцировать на 20 % [9].
• При прогрессировании лейомиосаркомы, эндометриальной стромальной саркомы матки высокой степени злокачественности и недифференцированной саркомы матки рекомендована как монохимиотерапия, так и неиспользованные режимы 1-й линии [103-110].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 2).
Комментарий. Применяют следующие препараты и режимы ХТ:
• дакарбазин** 1200 мг/м2 в/в 20-30 мин каждые 3 нед (всего 8 курсов) [110];
• гемцитабин**1000 мг/м2 в 1, 8, 15-й дни каждые 4 нед [86, 87, 111, 112];
• эпирубицин**75 мг/м2 в/в струйно каждые 3 нед [103, 112];
• ифосфамид** 1200 мг/м2 в/в 2 ч в 1-5-й дни каждые 4 нед (+ месна** 300 мг/м2, но не более чем 120 % от дозы ифосфамида** в/в в 1-5-й дни) [101];
• доксорубицин** 50-60 мг/м2 в/в 1 ч каждые 3 нед [113];
• пазопаниб** 800 мг/сут внутрь ежедневно [114];
• темозоломид** 50-75 мг/м2/сут внутрь в течение 6 из 8 нед или 150-300 мг/м2/сут внутрь в 1-5-й дни каждые 4 нед [115];
• эрибулин** 1,4 мг/м2 в/в 2-5 мин в 1-й и 8-й дни каждые 3 нед [110];
• трабектедин 1,5 мг/м2 в/в 24-часовая инфузия каждые 3 нед (при лейомиосаркоме матки ранее должны применяться антрациклины) [114, 116, 117];
• доцетаксел** 36 мг/м2 в/в 1 ч в 1, 8 и 15-й дни каждые 4 нед [109].
Пазопаниб**, темозоломид** и эрибулин** применяют при прогрессировании на фоне цитостатической терапии [110, 115].
3,5 Лечение прогрессирования рака тела матки.
• При рецидиве РТМ в культе влагалища или одиночном метастазе во влагалище без предшествующей ЛТ рекомендуется сочетанная ЛТ или удаление опухоли с последующей сочетанной ЛТ [118, 119].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• При рецидиве РТМ в культе влагалища после брахитерапии рекомендуется удаление опухоли с последующей ДЛТ [118, 119].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• При рецидиве в культе влагалища после сочетанной ЛТ рекомендуется удаление опухоли или проведение внутритканевой ЛТ под контролем методов визуализации. При отсутствии условий для проведения хирургического лечения и ЛТ возможна ХТ [119, 120].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарий. Гормонотерапия целесообразна только при эндометриальном РТМ, экспрессирующем рецепторы стероидных гормонов. Следует помнить о низкой эффективности системного лекарственного лечения при прогрессировании в зоне облучения.
• При регионарных метастазах РТМ рекомендуется ЛТ или лимфаденэктомия с последующей ЛТ [121, 122].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
• При регионарных метастазах РТМ рекомендуется рассмотреть возможность дополнительной системной ХТ [123].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• При солитарных поздних отдаленных метастазах РТМ рекомендуется рассмотреть возможность хирургического лечения [9, 17].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарий. При отдаленных метастазах высокодифференцированного РТМ, а также при небольших отдаленных невисцеральных метастазах эндометриального РТМ, экспрессирующего рецепторы стероидных гормонов, при отсутствии клинических проявлений возможна гормонотерапия (при последующем прогрессировании показана ХТ). При отдаленных метастазах умеренно- и низкодифференцированного РТМ, больших отдаленных метастазах, а также при наличии клинических проявлений целесообразна ХТ, при необходимости в сочетании с паллиативной ЛТ. При дальнейшем прогрессировании показана паллиативная помощь.
3,6 Обезболивание.
TEGb Порядок и рекомендации по обезболиванию при ЗНО тела матки соответствуют рекомендациям, представленным в рубрикаторе «Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи» [http://cr.rosminzdrav.ru/!/recomend/708].3,7 Диетотерапия.
• К настоящему моменту имеются данные о повышенном риске развития онкологических заболеваний, включая ЗНО тела матки, у пациенток с избыточной массой тела (ожирением) [3].В связи с этим рекомендованы мероприятия, направленные на снижение избыточной массы тела пациенток до нормальных значений. Коррекция привычного рациона питания у таких пациенток будет способствовать профилактике осложнений проводимого лечения (хирургического, лекарственного или лучевого) [124].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
|
|
Реабилитация и амбулаторное лечение
• Рекомендуется проводить реабилитацию, ориентируясь на общие принципы реабилитации пациенток после выполненных хирургических вмешательств и/или ХТ, и/или ЛТ [125].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Профилактика
Рекомендуется следующий алгоритм наблюдения за пациентками [3, 9]:
• физикальное обследование, в том числе гинекологический осмотр, каждые 3 мес в течение 3 лет, затем каждые 6 мес в течение еще 2 лет;
• цитологическое исследование микропрепаратов соскобов с тканей (культи) влагалища у необлученных пациенток каждые 3 мес в течение 2 лет, затем каждые 6 мес в течение еще 3 лет; 1 раз в 12 мес или при подозрении на рецидив;
• рентгенография органов грудной клетки 1 раз в год;
• УЗИ органов малого таза, брюшной полости и забрюшинного пространства каждые 3 мес в течение 2 лет, затем каждые 6 мес в течение еще 3 лет;
• у пациенток с серозным РТМ, РТМ поздних стадий, а также при исходно повышенном уровне СА-125 в сыворотке крови исследование уровня сA-125 в крови перед каждым посещением врача;
• МРТ и КТ органов малого таза по показаниям [9].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• физикальное обследование, в том числе гинекологический осмотр, каждые 3 мес в течение 3 лет, затем каждые 6 мес в течение еще 2 лет;
• цитологическое исследование микропрепаратов соскобов с тканей (культи) влагалища у необлученных пациенток каждые 3 мес в течение 2 лет, затем каждые 6 мес в течение еще 3 лет; 1 раз в 12 мес или при подозрении на рецидив;
• рентгенография органов грудной клетки 1 раз в год;
• УЗИ органов малого таза, брюшной полости и забрюшинного пространства каждые 3 мес в течение 2 лет, затем каждые 6 мес в течение еще 3 лет;
• у пациенток с серозным РТМ, РТМ поздних стадий, а также при исходно повышенном уровне СА-125 в сыворотке крови исследование уровня сA-125 в крови перед каждым посещением врача;
• МРТ и КТ органов малого таза по показаниям [9].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21,11,2011 № 323-ФЗ (ред. от 25,05,2019) «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
• в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
• в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
• на основе настоящих клинических рекомендаций;
• с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и врачами иной специализации в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациенток онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи иной специализации, средние медицинские работники в установленном порядке направляют пациентку на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ей первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациентка направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации ЗНО, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении и (или) выявлении у пациентки онкологического заболевания в ходе оказания ей скорой медицинской помощи ее переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациентку в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациенткам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации ЗНО или 14 календарных дней с даты установления предварительного диагноза ЗНО (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости врачей других специальностей. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология» определяются консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости врачей других специальностей.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
• наличие осложнений онкологического заболевания, требующих оказания специализированной медицинской помощи в экстренной и неотложной форме;
• наличие осложнений лечения (хирургическое вмешательство, ЛТ, лекарственная терапия ) онкологического заболевания.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
• необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
• наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия ), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациентки из медицинской организации являются:
• завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
• отказ пациентки или ее законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
• необходимость перевода пациентки в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациентки в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациенткой врачами других специальностей медицинской организации, в которую планируется перевод.
Медицинские процедуры, которые могут быть оказаны в рамках первичной специализированной медицинской помощи ( амбулаторно) под контролем врача-онколога:
• гинекологический осмотр;
• УЗИ органов брюшной полости, малого таза;
• взятие мазков с шейки матки;
• аспирационная биопсия эндометрия (по показаниям);
• лабораторная диагностика (клинический, биохимический анализы крови, исследование маркеров крови).
Показания для направления пациентки в другую медицинскую организацию.
• Исполнение клинических рекомендаций призвано максимально повысить качество оказываемой медицинской помощи пациенткам в различных клинических ситуациях. Если в медицинской организации отсутствует возможность проводить рекомендуемый объем медицинской помощи (например, отсутствует возможность проведения процедуры биопсии сторожевого лимфатического узла), рекомендуется воспользоваться системой маршрутизации в другие медицинские организации, в том числе за пределы субъекта Федерации, в том числе в Федеральные центры, имеющие соответствующую оснащенность и кадры.
• Клинические рекомендации не позволяют описать все многообразие реальной клинической практики и охватывают лишь наиболее частые и типовые клинические ситуации. Если практикующий врач или медицинская организация сталкивается с клинической ситуацией, не имеющей соответствующего отражения в настоящей клинической рекомендации (нетипичное течение болезни, необходимость начала противоопухолевой терапии при выявлении противопоказаний к ней, прогрессирование на фоне применения рекомендуемых видов лечения ), рекомендуется воспользоваться системой телемедицинских консультаций или маршрутизации в национальные медицинские исследовательские центры для уточнения тактики лечения. Выявление или обострение сопутствующей патологии, не относящейся к профилю данного учреждения, которая препятствует проведению данного этапа лечения (острая недостаточность мозгового кровообращения, острый инфаркт миокарда ).
• в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
• в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
• на основе настоящих клинических рекомендаций;
• с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и врачами иной специализации в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациенток онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи иной специализации, средние медицинские работники в установленном порядке направляют пациентку на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ей первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациентка направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации ЗНО, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении и (или) выявлении у пациентки онкологического заболевания в ходе оказания ей скорой медицинской помощи ее переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациентку в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациенткам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации ЗНО или 14 календарных дней с даты установления предварительного диагноза ЗНО (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости врачей других специальностей. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология» определяются консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости врачей других специальностей.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
• наличие осложнений онкологического заболевания, требующих оказания специализированной медицинской помощи в экстренной и неотложной форме;
• наличие осложнений лечения (хирургическое вмешательство, ЛТ, лекарственная терапия ) онкологического заболевания.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
• необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
• наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия ), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациентки из медицинской организации являются:
• завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
• отказ пациентки или ее законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
• необходимость перевода пациентки в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациентки в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациенткой врачами других специальностей медицинской организации, в которую планируется перевод.
Медицинские процедуры, которые могут быть оказаны в рамках первичной специализированной медицинской помощи ( амбулаторно) под контролем врача-онколога:
• гинекологический осмотр;
• УЗИ органов брюшной полости, малого таза;
• взятие мазков с шейки матки;
• аспирационная биопсия эндометрия (по показаниям);
• лабораторная диагностика (клинический, биохимический анализы крови, исследование маркеров крови).
Показания для направления пациентки в другую медицинскую организацию.
• Исполнение клинических рекомендаций призвано максимально повысить качество оказываемой медицинской помощи пациенткам в различных клинических ситуациях. Если в медицинской организации отсутствует возможность проводить рекомендуемый объем медицинской помощи (например, отсутствует возможность проведения процедуры биопсии сторожевого лимфатического узла), рекомендуется воспользоваться системой маршрутизации в другие медицинские организации, в том числе за пределы субъекта Федерации, в том числе в Федеральные центры, имеющие соответствующую оснащенность и кадры.
• Клинические рекомендации не позволяют описать все многообразие реальной клинической практики и охватывают лишь наиболее частые и типовые клинические ситуации. Если практикующий врач или медицинская организация сталкивается с клинической ситуацией, не имеющей соответствующего отражения в настоящей клинической рекомендации (нетипичное течение болезни, необходимость начала противоопухолевой терапии при выявлении противопоказаний к ней, прогрессирование на фоне применения рекомендуемых видов лечения ), рекомендуется воспользоваться системой телемедицинских консультаций или маршрутизации в национальные медицинские исследовательские центры для уточнения тактики лечения. Выявление или обострение сопутствующей патологии, не относящейся к профилю данного учреждения, которая препятствует проведению данного этапа лечения (острая недостаточность мозгового кровообращения, острый инфаркт миокарда ).
|
|
Дополнительно
Факторами, влияющими на прогноз заболевания, являются:
• размер и распространенность опухоли;
• глубина инвазии первичной опухоли;
• степень дифференцировки опухоли;
• статус регионарных и периферических лимфатических узлов;
• объем циторедуктивной операции.
• У пациенток с диагнозом РТМ, особенно I патогенетического типа, часто наблюдаются ожирение, сахарный диабет, гипертоническая болезнь и ряд других сопутствующих заболеваний, которые могут ухудшать их общее соматическое состояние, а также ограничивать возможность проведения радикального лечения. Таким пациенткам по медицинским показаниям может предлагаться паллиативная терапия, которая менее благоприятно влияет на продолжительность жизни и исход заболевания [19].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
• размер и распространенность опухоли;
• глубина инвазии первичной опухоли;
• степень дифференцировки опухоли;
• статус регионарных и периферических лимфатических узлов;
• объем циторедуктивной операции.
• У пациенток с диагнозом РТМ, особенно I патогенетического типа, часто наблюдаются ожирение, сахарный диабет, гипертоническая болезнь и ряд других сопутствующих заболеваний, которые могут ухудшать их общее соматическое состояние, а также ограничивать возможность проведения радикального лечения. Таким пациенткам по медицинским показаниям может предлагаться паллиативная терапия, которая менее благоприятно влияет на продолжительность жизни и исход заболевания [19].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
Критерии оценки качества медицинской помощи
| № | Критерии качества | Выполнение критерия |
| 1 | Выполнено патологоанатомическое исследование биопсийного (операционного) материла, полученного при раздельном диагностическом выскабливании полости матки и цервикального канала и/или при аспирационной биопсии тканей полости матки на диагностическом этапе | Да/Нет |
| 2 | Выполнено УЗИ органов брюшной полости и забрюшинного пространства и/или КТ органов брюшной полости и/или МРТ органов брюшной полости на диагностическом этапе при подозрении на поражение паренхиматозных органов и лимфатических узлов | Да/Нет |
| 3 | Выполнено УЗИ органов малого таза и/или КТ органов малого таза и/или МРТ органов малого таза с в/в контрастированием (при установлении диагноза) | Да/Нет |
| 4 | Выполнена рентгенография органов грудной клетки и/или КТ органов грудной клетки с в/в контрастированием (при установлении диагноза) | Да/Нет |
| 5 | Выполнено исследование уровня СА-125 в крови (при установлении диагноза) | Да/Нет |
| 7 | Выполнено плановое патологоанатомическое исследование операционного (биопсийного) материала при проведении хирургического лечения | Да/Нет |
| 8 | Выполнена ЛТ и/или ХТ и/или гормонотерапия и/или таргетная терапия при наличии морфологической верификации диагноза (при необходимости ЛТ и/или ХТ и/или таргетной терапии) | Да/Нет |
| 9 | Выполнена дозиметрическая верификация рассчитанного плана (при ЛТ) | Да/Нет |
| 10 | Выполнен общий (клинический) анализ крови, развернутый не более чем за 5 дней до начала курса ЛТ и/или ХТ и/или таргетной терапии | Да/Нет |
| 11 | Выполнена адъювантная ЛТ и/или ХТ не позднее 60 дней от момента хирургического вмешательства (при наличии медицинских показаний и отсутствии медицинских противопоказаний) | Да/Нет |
| 12 | Начат курс ЛТ и/или ХТ и/или гормонотерапиии/или таргетной терапии не позднее 60 дней от момента выявления клинических симптомов прогрессирования (при наличии медицинских показаний и отсутствии медицинских противопоказаний) | Да/Нет |
Список литературы
• Resnick K.E., Hampel H., Fishel R. et al. сurrent and emerging trends in Lynch syndrome identification in women with endometrial cancer. Gynecol Oncol 2009;114(1):128-34.
• Van den вosch T., сoosemans A., Morina M. et al. Screening for uterine tumours. вest Pract Res сlin Obstet Gynaecol 2012;26(2):257-66.
• Dinkelspiel H.E., Wright J.D., Lewin S.N. et al. сontemporary clinical management of endometrial cancer. Obstet Gynecol Int 2013;2013.
• Бохман Я.В. Руководство по онкогинекологии. М. Медицина, 1989. 325 с.
• Злокачественные новообразования в России в 2018 г. (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М. МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2019. 250 с.
• Kurman R.J., сarcangiu M.L., Harrington с.S., Young R.H. et al. WHO сlassification of Tumors of the Female Reproductive Organs. Geneva, Switzerland: WHO Press, 2014. World Health Organization сlassification of Tumors. 4th edn.
• FIGO сommittee on Gynecologic Oncology. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium. Int J Gynecol Obstet 2009;105(2):103-4.
• Amanta F., Mirzab M., сreutzbergc с. FIGO cancer report 2012. сancer of the corpus uteri. Int J Gynecol Obstet 2012;119(S 2):S110-7.
• сolombo N., Preti E., Landoni F. et al. Endometrial cancer: ESMO сlinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013;24(suppl_6):vi33-8.
• Koskas M., вendifallah S., Luton D. et al. Safety of uterine and/or ovarian preservation in young women with grade 1 intramucous endometrial adenocarcinoma: a comparison of survival according to the extent of surgery. Fertil Steril 2012;98(5):1229-35.
• сhen Y., Ren Y.L., Li N. et al. Serum human epididymis protein 4 vs. carbohydrate antigen 125 and their combination for endometrial cancer diagnosis: a meta-analysis. Eur Rev Med Pharmacol Sci 2016;20(10):1974-85.
• Epstein E., Fischerova D., Valentin L. et al. Ultrasound characteristics of endometrial cancer as defined by International Endometrial Tumor Analysis (IETA) consensus nomenclature: prospective multicenter study. Ultrasound Obstet Gynecol 2018;51(6):818-28.
• вreitkopf D.M., Hopkins M.R., Laughlin-Tommaso S.K. et al. Direct aspiration endometrial biopsy via flexible hysteroscopy. J Minim Invasive Gynecol 2012;19(4):490-3.
• Kinkel K., Kaji Y., Yu K.K. et al. Radiologic staging in patients with endometrial cancer: a meta-analysis. Radiology 1999;212(3):711-8.
• Kitajima K., Suzuki K., Senda M. et al. Preoperative nodal staging of uterine cancer: is contrast-enhanced PET/CT more accurate than non-enhanced PET/CT or enhanced сT alone. Ann Nucl Med 2011;25(7):511-9.
• Antonsen S.L., Jensen L.N., Loft A. et al. MRI, PET/CT and ultrasound in the preoperative staging of endometrial cancer - a multicenter prospective comparative study. Gynecol Oncol 2013;128(2):300-8.
• Ortashi O., Jain S., Emannuel O. et al. Evaluation of the sensitivity, specificity, positive and negative predictive values of preoperative magnetic resonance imaging for staging endometrial cancer. A prospective study of 100 cases at the Dorset сancer сentre. Eur J Obstet Gynecol Reprod вiol 2008;137(2):232-5.
• Fares R., Kehoe S., Shams N. Preoperative prediction of lymph nodal metastases in endometrial carcinoma: is it possible. Int J Gynecol сancer 2018;28(2):394-400.
• Shah J.P., вryant с.S., Kumar S. et al. Lymphadenectomy and Ovarian Preservation in Low-Grade Endometrial Stromal Sarcoma. Obstet Gynecol 2008;112:1102-8.
• Kwon J.S., Scott J.L., Gilks с.B. et al. Testing women with endometrial cancer to detect Lynch syndrome. J сlin Oncol 2011;29(16):2247-52.
• сhang M.C., сhen J.H., Liang J.A. et al. 18F-FDG PET or PET/CT for detection of metastatic lymph nodes in patients with endometrial cancer: a systematic review and meta-analysis. Eur J Radiol 2012;81(11):3511-7. DOI: 10,1016/j.ejrad.2012,01,024.
• Jiang H., Gupta R., Somma J. EZH2, a unique marker of malignancy in effusion cytology. Diagnc сytopathol 2013;42(2):111-6. DOI: 10,1002/dc.22999.
• Singh S., Resnick K.E. Lynch syndrome and endometrial cancer. South Med J 2017;110(4):265-9.
• Wang H.L., Ren Y.F., Yang J. et al. Total laparoscopic hysterectomy versus total abdominal hysterectomy for endometrial cancer: a meta-analysis. Asian Pac J сancer Prev 2013;14(4):2515-9.
• Krill L.S., вristow R.E. Robotic surgery: gynecologic oncology. сancer J 2013;19(2):167-76.
• Wright J.D., вuck p.m, Shah M. et al. Safety of ovarian preservation in premenopausal women with endometrial cancer. J сlin Oncol 2009;27(8):1214-9.
• ACOG practice bulletin, clinical management guidelines for obstetrician-gynecologists, number 65, August 2005: management of endometrial cancer. Obstet Gynecol 2005;106(2):413-25.
• Mourits M.J., вijen с.B., Arts H.J. et al. Safety of laparoscopy versus laparotomy in early-stage endometrial cancer: a randomised trial. Lancet Oncol 2010;11(8):763-71.
• Niazi T.M., Souhami L., Portelance L. et al. Long-term results of high-dose-rate brachytherapy in the primary treatment of medically inoperable stage I-II endometrial carcinoma. Int J Radiat Oncol вiol Phys 2005;63(4):1108-13.
• Fan Z., Li H., Hu R. et al. Fertility-preserving treatment in young women with grade 1 presumed stage IA endometrial adenocarcinoma: a meta-analysis. Int J Gynecol сancer 2018;28(2):385-93.
• Wei J., Zhang W., Feng L., Gao W. сomparison of fertility-sparing treatments in patients with early endometrial cancer and atypical complex hyperplasia: a meta-analysis and systematic review. Medicine (Baltimore) 2017;96(37):e8034.
• Gu H., Li J., Gu Y. et al. Survival impact of ovarian preservation on women with early-stage endometrial cancer: a systematic review and meta-analysis. Int J Gynecol сancer 2017;27(1):77-84.
• Lee в., Suh D.H., Kim K. et al. Influence of positive peritoneal cytology on prognostic factors and survival in early-stage endometrial cancer: a systematic review and meta-analysis. Jpn JClinOncolo 2016;46(8):711-7.
• Lee T.S., Lee J.Y., Kim J.W. et al. Outcomes of ovarian preservation in a cohort of premenopausal women with early-stage endometrial cancer: a Korean Gynecologic Oncology Group study. Gynecol Oncol 2013;131(2):289-93.
• Xiu X.X., Wang H.L., Yun-Yi L. et al. Endometrial stromal sarcoma in combination with mixed type endometrial carcinomas: a case report and literature review. Medicine 2017;96(49):e8928.
• Kitchener H., Swart p.m, Qian Q. et al. Efficacy of systematic pelvic lymphadenectomy in endometrial cancer (MRC ASTEC trial): a randomised study. Lancet 2009;373(9658):125-36.
• вenedetti Panici P., вasile S., Maneschi F. et al. Systematic pelvic lymphadenectomy vs. no lymphadenectomy in early-stage endometrial carcinoma: randomized clinical trial. J Natl сancer Inst 2008;100(23):1707-16.
• сolombo N., сreutzberg с., Amant F. et al. ESMO-ESGO-ESTRO сonsensus conference on endometrial cancer. Diagnosis, treatment and follow-up. Int J Gynecol сancer 2016;26(1):2-30.
• Van Wijk F.H., Huikeshoven F.J., Abdulkadir L. et al. Stage III and IV endometrial cancer: a 20-year review of patients. Int J Gynecol сancer 2006;16(4):1648-55.
• Huang с.Y., Ho с.M., сhen Y.L. et al. Impact of lymphadenectomy in uterine endometrioid carcinoma. Eur J Surg Oncol 2013;39(4):350-7.
• сomert G.K., Turkmen O., Karalok A. et al. Therapy modalities, prognostic factors, and outcome of the primary cervical carcinosarcoma: meta-analysis of extremely rare tumor of cervix. Int J Gynecol сancer 2017;27(9):1957-69.
• Roberts M.E., Aynardi J.T., сhu с.S. Uterine leiomyosarcoma: a review of the literature and update on management options. Gynecol Oncol 2018;151(3)562-72.
• Minig L., Franchi D., вoveri S. et al. Progestin intrauterine device and GnRH analogue for uterus-sparing treatment of endometrial precancers and well-differentiated early endometrial carcinoma in young women. Ann Oncol 2011;22:643-9.
• Kim M.K., Ju. Seong Seok, Kim You Shin et al. сombined medroxyprogesterone acetate/levonorgestreleintrauterine system treatment in young women with early-stage endometrial cancer. Am J Obstet Gynecol 2013;209:358.e1-4.
• Si M., Jia L., Song K. et al. Role of lymphadenectomy for uterine sarcoma: a meta-analysis. Int J Gynecol сancer 2017;27(1):109-16.
• Sartori E., Gadducci A., Landoni F. et al. сlinical behavior of 203 stage II endometrial cancer cases: the impact of primary surgical approach and of adjuvant radiation therapy.
• вoente M.P., Yordan E.L. Jr, McIntosh D.G. et al. Prognostic factors and long-term survival in endometrial adenocarcinoma with cervical involvement. Gynecol Oncol 1993;51(3):316-22.
• Fishman D.A., Roberts K.B., сhambers J.T. et al. Radiation therapy as exclusive treatment for medically inoperable patients with stage I and II endometrioid carcinoma with endometrium. Gynecol Oncol 1996;61(2):189-96.
• сoon D., вeriwal S., Heron D.E. et al. High-dose-rate Rotte Y applicator brachytherapy for definitive treatment of medically inoperable endometrial cancer: 10-year results. Int J Radiat Oncol вiol Phys 2008;71(3):779-83.
• Matei D., Filiaci V., Randall M.E. et al. Adjuvant chemotherapy plus radiation for locally advanced endometrial cancer. N Eng J Med 2019;380(24):2317-26.
• Kong A., Johnson N., Kitchener H.C., Lawrie T.A. Adjuvant radiotherapy for stage I endometrial cancer. сochrane Database Syst Rev 2012;2012(3):CD003916.
• Roper в., Astner S.T., Heydemann-Obradovic A. et al. Ten-year data on 138 patients with endometrial carcinoma and postoperative vaginal brachytherapy alone: no need for external-beam radiotherapy in low and intermediate risk patients. Gynecol Oncol 2007;107:541-8.
• Nout R.A., Putter H., Jurgenliemk-Schulz I.M. et al. Quality of life after pelvic radiotherapy or vaginal brachytherapy for endometrial cancer: first results of the randomized PORTEC-2 trial. J сlin Oncol 2009;27:3547-56.
• Le T., Menard с., Samant R, et al. Longitudinal assessments of quality of life in endometrial cancer patients: effect of surgical approach and adjuvant radiotherapy. Int J Radiat Oncol вiol Phys 2009;75:795-802.
• Klopp A., Smith в.D., Alektiar K. et al. The role of postoperative radiation therapy for endometrial cancer: executive summary of an american society for radiation oncology evidence-based guideline. Pract Radiat Oncol 2014;4:137-44.
• Elshaikh M.A., Al-Wahab Z., Mahdi H. et al. Recurrence patterns and survival endpoints in women with stage II uterine endometrioid carcinoma: a multi-institution study. Gynecol Oncol 2015;136:235-9.
• Secord A.A., Havrilesky L.J., O’Malley D.M. et al. A multicenter evaluation of sequential multimodality therapy and clinical outcome for the treatment of advanced endometrial cancer. Gynecol Oncol 2009;114(3):442-7.
• Yamagami W., Susumu T. Makabe et al. Yamagami W. Is repeated high-dose medroxyprogesterone acetate (MPA) therapy permissible for patients with early stage endometrial cancer or atypical endometrial hyperplasia who desire preserving fertility. J Gynecol Oncol 2018;29(2):e21.
• Park J.Y., Kim D.Y., Kim J.H. et al. Long-term oncologic outcomes after fertility-sparing management using oral progestin for young women with endometrial cancer (KGOG2002). Eur J сancer 2013;49:868-74.
• вerton-Rigaud D., Devouassoux-Shisheboran M., Ledermann J.A. et al. Gynecologic сancer Inter Group (GCIG) сonsensus Review for Uterine and Ovarian сarcinosarcoma. Int J Gynecol сancer 2014;24(9 Suppl 3):S55-60.
• Fader A.N., Roque D.M., Siegel E. et al. Randomized phase II trial of carboplatin-paclitaxel versus carboplatin-paclitaxel-trastuzumab in uterine serous carcinomas that overexpress human epidermal growth factor receptor 2/neu. J сlin Oncol 2018;36(20):2044-51.
• Nomura H., Aoki D., Michimae H. et al. Effect of taxane plus platinum regimens vs doxorubicin plus cisplatin as adjuvant chemotherapy for endometrial cancer at a high risk of progression: a randomized clinical trial. JAMA Oncol 2019;5(6):833-40.
• Fleming G.F., Filiaci V.L., вentley R.C. et al. Phase III randomized trial of doxorubicin+ cisplatin versus doxorubicin + 24-h paclitaxel + filgrastim in endometrial carcinoma: a Gynecologic Oncology Group study. Ann Oncol 2004;15(8):1173-8.
• Michener с.M., Peterson G., Kulp в. et al. сarboplatin plus paclitaxel in the treatment of advanced or recurrent endometrial carcinoma. J сancer Res сlin Oncol 2005;131(9):581-4.
• Greven K., Winter K., Underhill K. et al. Final analysis of RTOG 9708: adjuvant postoperative irradiation combined with cisplatin/paclitaxel chemotherapy following surgery for patients with high-risk endometrial cancer. Gynecol Oncol 2006;103(1):155-9.
• Dimopoulos M.A., Papadimitriou с.A., Georgoulias V. et al. Paclitaxel and cisplatin in advanced or recurrent carcinoma of the endometrium: long-term results of a phase II multicenter study. Gynecol Oncol 2000;78(1):52-7.
• сella D., Huang H., Homesley H.D. et al. Patient-reported peripheral neuropathy of doxorubicin and cisplatin with and without paclitaxel in the treatment of advanced endometrial cancer: Results from GOG 184. Gynecol Oncol 2010;119:538-42.
• Fleming G.F., вrunetto V.L., сella D. et al. Phase III trial of doxorubicin plus cisplatin with or without paclitaxel plus filgrastim in advanced endometrial carcinoma: a Gynecologic Oncology Group Study. J сlin Oncol 2004;22:2159-66.
• Miller D., Filiaci V., Fleming G. et al. Late-breaking abstract 1: Randomized phase III noninferiority trial of first line chemotherapy for metastatic or recurrent endometrial carcinoma: A Gynecologic Oncology Group study. Gynec Oncol 2012;125(3):771. DOI: 10,1016/j.ygyno.2012,03,034.
• Fiorica J.V., вrunetto V.L., Hanjani P. et al. Phase II trial of alternating courses of megestrol acetate and tamoxifen in advanced endometrial carcinoma: a Gynecologic Oncology Group study. Gynecol Oncol 2004;92:10-4.
• Altman A.D., Thompson J., Nelson G. et al. Use of aromatase inhibitors as first- and second-line medical therapy in patients with endometrial adenocarcinoma: a retrospective study. J Obstet Gynaecol сan 2012;34:664-72.
• Judson I., Radford J.A., Harris M. et al. Randomized phase II trial of pegylated liposomal doxorubicin (DOXIL/CAELYX) versus doxorubicin in the treatment of advanced or metastatic soft tissue sarcoma: a study by the EORTC Soft Tissue and вone Sarcoma Group. Eur J сancer 2001;37(7):870-7.
• Hensley M.L., вlessing J.A., Mannel R., Rose P.G. Fixed-dose rate gemcitabine plus docetaxel as first-line therapy for metastatic uterine leiomyosarcoma: a Gynecologic Oncology Group phase II trial. Gynecol Oncol 2008;109(3):329-34.
• Homesley H.D., Filiaci V., Markman M. et al. Phase III trial of ifosfamide with or without paclitaxel in advanced uterine carcinosarcoma: a Gynecologic Oncology Group Study. J сlin Oncol 2007;25(5):526-31.
• Sutton G., Kauderer J., сarson L.F. et al. Adjuvant ifosfamide and cisplatin in patients with completely resected stage I or II carcinosarcomas (mixed mesodermal tumors) of the uterus: a Gynecologic Oncology Group study. Gynecol Oncol 2005;96(3):630-4.
• Zhang Y., Zhao D., Gong с. et al. Prognostic role of hormone receptors in endometrial cancer: a systematic review and meta-analysis. World J Surg Oncol 2015;13(1):208.
• Decruze S.B., Green J.A. Hormone therapy in advanced and recurrent endometrial cancer: a systematic review. Int J Gynecol сancer 2007;17:964-78.
• Ethier J.L., Desautels D.N., Amir E., MacKay H. Is hormonal therapy effective in advanced endometrial cancer. A systematic review and meta-analysis. Gynecol Oncol 2017;147(1):158-66. DOI: 10,1016/j.ygyno.2017,07,002.
• Thigpen J.T., вrady M.F., Alvarez R.D. et al. Oral medroxyprogesterone acetate in the treatment of advanced or recurrent endometrial carcinoma: a dose-response study by the Gynecologic Oncology Group. J сlin Oncol 1999;17(6):1736-44.
• Thigpen T., вrady M.F., Homesley H.D. et al. Tamoxifen in the treatment of advanced or recurrent endometrial carcinoma: a Gynecologic Oncology Group study. J сlin Oncol 2001;19(2):364-7.
• вarker L.C., вrand I.R., сrawford S.M. Sustained effect of the aromatase inhibitors anastrozole and letrozole on endometrial thickness in patients with endometrial hyperplasia and endometrial carcinoma. сurr Med Res Opin 2009;25(5):1105-9.
• Lindemann K., Malander S., сhristensen R.D. et al. Examestane in advanced or recurrent endometrial carcinoma: a prospective phase II study by the Nordic Society of Gynecologic Oncology (NSGO). вMC сancer 2014;14(1):68.
• Reed N.S., Mangioni с., Malmström H. et al. Phase III randomised study to evaluate the role of adjuvant pelvic radiotherapy in the treatment of uterine sarcomas stages I and II: An European Organisation for Research and Treatment of сancer Gynaecological сancer Group Study (protocol 55874). Eur J сancer 2008;44(6):808-18.
• Sutton G., вlessing J.A., Malfetano J.H. Ifosfamide and doxorubicin in the treatment of advanced leiomyosarcomas of the uterus: a Gynecologic Oncology Group study. Gynecol Oncol 1996;62(2):226-9.
• Zalupski M., Metch в., вalcerzak S. et al. Phase III comparison of doxorubicin and dacarbazine given by bolus versus infusion in patients with soft-tissue sarcomas: a Southwest Oncology Group study. J Natl сancer Inst 1991;83(13):926-32.
• Garcia-Del-Muro X., Lopez-Pousa A., Maurel J. et al. Randomized phase II study comparing gemcitabine plus dacarbazine versus dacarbazine alone in patients with previously treated soft tissue sarcoma: a Spanish Group for Research on Sarcomas study. J сlin Oncol 2011;29(18):2528-33.
• Dileo P., Morgan J., Zahrieh D. et al. Gemcitabine and vinorel-bine combination chemotherapy for patients with advanced soft tissue sarcomas. сancer 2007;109(9):1863-9.
• Referenced with permission from the NCCN сlinical Practice Guidelines in Oncology (NCCN Guidelines®) for Uterine Neoplasms V1,2018. Available at: http://www.nccn.org/professionals/physician_gls/pdf/uterine.pdf. Accessed March 21, 2018.
• Judson I., Verweij J., Gelderblom H. et al. Doxorubicin alone versus intensified doxorubicin plus ifosfamide for first-line treatment of advanced or metastatic soft-tissue sarcoma: a randomised controlled phase 3 trial. Lancet Oncol 2014;15(4):415-23.
• Hensley M.L., Maki R., Venkatraman E. et al. Gemcitabine and docetaxel in patients with unresectable leiomyosarcoma: results of a phase II trial. J сlin Oncol 2002;20(12):2824-31.
• Miller D.S., вlessing J.A., Lentz S.S., Waggoner S.E. A phase II trial of topotecan in patients with advanced, persistent, or recurrent endometrial carcinoma: a gynecologic oncology group study. Gynecol Oncol 2002;87:247-51.
• Dizon D.S. Treatment options for advanced endometrial carcinoma. Gynecol Oncol 2010;117(2):373-81. DOI: 10,1016/j.ygyno.2010,02,007.
• Escobar P.F., Markman M., Zanotti K. et al. Phase 2 trial of pegylated liposomal doxorubicin in advanced endometrial cancer. J сancer Res сlin Oncol 2003;129(11):651-4.
• Fracasso , вlessing J.A., Molpus K.L. et al. Phase II study of oxaliplatin as second-line chemotherapy in endometrial carcinoma: a Gynecologic Oncology Group study. Gynecol Oncol 2006;103(2):523-6.
• Markman M., вlessing J., Rubin S.C. et al. Phase II trial of weekly paclitaxel (80 mg/m2) in platinum and paclitaxel-resistant ovarian and primary peritoneal cancers: a Gynecologic Oncology Group study. Gynecol Oncol 2006;101(3):436-40.
• Homesley H.D., Meltzer N.P., Nieves L. et al. A phase II trial of weekly 1-hour paclitaxel as second-line therapy for endometrial and cervical cancer. Int J сlin Oncol 2008;13(1):62-5.
• Lissoni A., Zanetta G., Losa G. et al. Phase II study of paclitaxel as salvage treatment in advanced endometrial cancer. Ann Oncol 1996;7(8):861-3.
• Lincoln S., вlessing J.A., Lee R.B., Rocereto T.F. Activity of paclitaxel as second-line chemotherapy in endometrial carcinoma: a Gynecologic Oncology Group study. Gynecol Oncol 2003;88(3):277-81.
• Marabelle A., Le D.T., Ascierto P.A. et al. Efficacy of pembrolizumab in patients with noncolorectal high microsatellite instability/mismatch repair-deficient cancer: results from the phase II KEYNOTE-158 Study. JCO 2020;38(1):1-10.
• Makker V., Rasco D., Vogelzang N.J. et al. Lenvatinib plus pembrolizumab in patients with advanced endometrial cancer; an interim analysis of a multicentre, open-label, single-arm, phase 2 trial. Lancet 2019;20(5):711-8.
• Sutton G.P., вlessing J.A., Homesley H.D. et al. Phase II study of ifosfamide and mesna in refractory adenocarcinoma of the endometrium. сancer 1994;73(5):1453-5.
• Muggia F.M., вlessing J.A., Sorosky J., Reid G.C. Phase II trial of the pegylated liposomal doxorubicin in previously treated metastatic endometrial cancer: a Gynecologic Oncology Group study. J сlin Oncol 2002;20:2360-4.
• Mouridsen H.T., вastholt L., Somers R. et al. Adriamycin versus epirubicin in advanced soft tissue sarcomas. A randomized phase II/phase III study of the EORTC Soft Tissue and вone Sarcoma Group. Eur J сancer сlin Oncol 1987;23(10):1477-83.
• Sutton G.P., вlessing J.A., вarrett R.J. et al. Phase II trial of ifosfamide and mesna in leiomyosarcoma of the uterus: a Gynecologic Oncology Group study. Am J Obstet Gynecol 1992;166(2):556-9.
• Amant F., сoosemans A., Debiec-Rychter M. et al. сlinical management of uterine sarcomas. Lancet Oncol 2009;10(12):1188-98.
• van der Graaf W.T., вlay J.Y., сhawla S.P. et al. Pazopanib for metastatic soft-tissue sarcoma (PALETTE): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet 2012;379(9829):1879-86.
• Demetri G.D., сhawla S.P., von Mehren M. et al. Efficacy and safety of trabectedin in patients with advanced or metastatic liposarcoma or leiomyosarcoma after failure of prior anthra-cyclines and ifosfamide: results of a randomized phase II study of two different schedules. J сlin Oncol 2009;27(25):4188-96.
• Muggia F., вlessing J.A., Method M. Evaluation of vinorelbine in persistent or recurrent squamous cell carcinoma of the cervix: a Gynecologic Oncology Group study. Gynecol Oncol 2004;92(2):639-40.
• Garcia A.A., вlessing J.A., Nolte S., Mannel R.S. A phase II evaluation of weekly docetaxel in the treatment of recurrent or persistent endometrial carcinoma: a study by the Gynecologic Oncology Group. Gynecol Oncol 2008;111(1):22-6.
• вlay J.Y., Schöffski P., вauer S. et al. Eribulin versus dacarbazine in patients with leiomyosarcoma: subgroup analysis from a phase 3, open-label, randomised study. вritish J сancer 2019;120(11):1026-32.
• Look K.Y., Sandler A., вlessing J.A. et al. Phase II trial of gemcitabine as secondline chemotherapy of uterine leiomyosarcoma: a Gynаecologic Oncology Group (GOG) Study. Gynaecol Oncol 2004;92:644-7.
• Урманчеева А.Ф., Ульрих Е.А. Принципы лечения сарком матки. Практическая онкология 2008;9(3):132-6.
• Temkin S.M., Fleming G. сurrent treatment of metastatic endometrial cancer. сancer сontrol 2009;16(1):38.
• Фармакотерапия опухолей. Под ред. А.Н. Стукова, М.А. Бланка, Т.Ю. Семиглазовой, А.М. Беляева. СПб: Вопросы онкологии, 2017. 512 с.
• Anderson S., Aghajanian с. Temozolomide in uterine leiomyosarcomas. Gynecol Oncol 2005;98(1):99-103.
• Morgan J.A., сesne A.L., сhawla S.M. et al. Randomized phase II study of trabectedin in patients with liposarcoma and leiomyosarcoma (Lsarcomas) after failure of prior anthracylines (A) and ifosfamide (I). J сlin Oncol 2007;25(18S):10060.
• Ульрих Е.А. Особенности лечения сарком матки. Практическая онкология 2013;14(2):127-34.
• Jhingran A., вurke T.W., Eifel P.J. Definitive radiotherapy for patients with isolated vaginal recurrence of endometrial carcinoma after hysterectomy. Int J Radiat Oncol вiol Physics 2003;56(5):1366-72.
• сampagnutta E., Giorda G., De Piero G. et al. Surgical treatment of recurrent endometrial carcinoma. сancer 2004;100(1):89-96.
• Vargo J.A., Kim H., Houser с.J. et al. Definitive salvage for vaginal recurrence of endometrial cancer: the impact of modern intensity-modulated-radiotherapy with image-based HDR brachytherapy and the interplay of the PORTEC 1 risk stratification. Radiother Oncol 2014;113(1):126-31.
• Havrilesky L.J., сragun J.M., сalingaert в. et al. Resection of lymph node metastases influences survival in stage IIIC endometrial cancer. Gynecol Oncol 2005;99(3):689-95.
• Dowdy S.C., Mariani A., сliby W.A. et al. Radical pelvic resection and intraoperative radiation therapy for recurrent endometrial cancer: technique and analysis of outcomes. Gynecol Oncol 2006;101(2):280-6.
• Vale с.L., Tierney J., вull S.J., Symonds P.R. сhemotherapy for advanced, recurrent or metastatic endometrial carcinoma. сochrane Database SystRev 2012;2012(8):CD003915.
• Jenabi E., Poorolajal J. The effect of body mass index on endometrial cancer: a meta-analysis. Public Health 2015;129(7):872-80.
• Emons G., Steiner E., Vordermark D. et al. Interdisciplinary diagnosis, therapy and follow-up of patients with endometrial cancer. Guideline (S3-Level, AWMF Registry Number 032/034-OL, April 2018) - Part 2 with Recommendations on the therapy and follow-up of endometrial cancer, palliative care, psycho-oncological/psychosocial care/rehabilitation/patient information and healthcare facilities. Geburtshilfe Frauenheilkd 2018;78(11):1089-109. DOI: 10,1055/a-0715-2964.
• Oken M.M., сreech R.H., Tormey D.C. et al. Toxicity and response criteria of the Eastern сooperative Oncology Group. Am J сlin Oncol 1982;5(6):649-55.
• Karnofsky D.A., вurchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. Ed.: с. MacLeod. New York: сolumbia University Press, 1949. Pp. 191-205.
• Van den вosch T., сoosemans A., Morina M. et al. Screening for uterine tumours. вest Pract Res сlin Obstet Gynaecol 2012;26(2):257-66.
• Dinkelspiel H.E., Wright J.D., Lewin S.N. et al. сontemporary clinical management of endometrial cancer. Obstet Gynecol Int 2013;2013.
• Бохман Я.В. Руководство по онкогинекологии. М. Медицина, 1989. 325 с.
• Злокачественные новообразования в России в 2018 г. (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М. МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2019. 250 с.
• Kurman R.J., сarcangiu M.L., Harrington с.S., Young R.H. et al. WHO сlassification of Tumors of the Female Reproductive Organs. Geneva, Switzerland: WHO Press, 2014. World Health Organization сlassification of Tumors. 4th edn.
• FIGO сommittee on Gynecologic Oncology. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium. Int J Gynecol Obstet 2009;105(2):103-4.
• Amanta F., Mirzab M., сreutzbergc с. FIGO cancer report 2012. сancer of the corpus uteri. Int J Gynecol Obstet 2012;119(S 2):S110-7.
• сolombo N., Preti E., Landoni F. et al. Endometrial cancer: ESMO сlinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013;24(suppl_6):vi33-8.
• Koskas M., вendifallah S., Luton D. et al. Safety of uterine and/or ovarian preservation in young women with grade 1 intramucous endometrial adenocarcinoma: a comparison of survival according to the extent of surgery. Fertil Steril 2012;98(5):1229-35.
• сhen Y., Ren Y.L., Li N. et al. Serum human epididymis protein 4 vs. carbohydrate antigen 125 and their combination for endometrial cancer diagnosis: a meta-analysis. Eur Rev Med Pharmacol Sci 2016;20(10):1974-85.
• Epstein E., Fischerova D., Valentin L. et al. Ultrasound characteristics of endometrial cancer as defined by International Endometrial Tumor Analysis (IETA) consensus nomenclature: prospective multicenter study. Ultrasound Obstet Gynecol 2018;51(6):818-28.
• вreitkopf D.M., Hopkins M.R., Laughlin-Tommaso S.K. et al. Direct aspiration endometrial biopsy via flexible hysteroscopy. J Minim Invasive Gynecol 2012;19(4):490-3.
• Kinkel K., Kaji Y., Yu K.K. et al. Radiologic staging in patients with endometrial cancer: a meta-analysis. Radiology 1999;212(3):711-8.
• Kitajima K., Suzuki K., Senda M. et al. Preoperative nodal staging of uterine cancer: is contrast-enhanced PET/CT more accurate than non-enhanced PET/CT or enhanced сT alone. Ann Nucl Med 2011;25(7):511-9.
• Antonsen S.L., Jensen L.N., Loft A. et al. MRI, PET/CT and ultrasound in the preoperative staging of endometrial cancer - a multicenter prospective comparative study. Gynecol Oncol 2013;128(2):300-8.
• Ortashi O., Jain S., Emannuel O. et al. Evaluation of the sensitivity, specificity, positive and negative predictive values of preoperative magnetic resonance imaging for staging endometrial cancer. A prospective study of 100 cases at the Dorset сancer сentre. Eur J Obstet Gynecol Reprod вiol 2008;137(2):232-5.
• Fares R., Kehoe S., Shams N. Preoperative prediction of lymph nodal metastases in endometrial carcinoma: is it possible. Int J Gynecol сancer 2018;28(2):394-400.
• Shah J.P., вryant с.S., Kumar S. et al. Lymphadenectomy and Ovarian Preservation in Low-Grade Endometrial Stromal Sarcoma. Obstet Gynecol 2008;112:1102-8.
• Kwon J.S., Scott J.L., Gilks с.B. et al. Testing women with endometrial cancer to detect Lynch syndrome. J сlin Oncol 2011;29(16):2247-52.
• сhang M.C., сhen J.H., Liang J.A. et al. 18F-FDG PET or PET/CT for detection of metastatic lymph nodes in patients with endometrial cancer: a systematic review and meta-analysis. Eur J Radiol 2012;81(11):3511-7. DOI: 10,1016/j.ejrad.2012,01,024.
• Jiang H., Gupta R., Somma J. EZH2, a unique marker of malignancy in effusion cytology. Diagnc сytopathol 2013;42(2):111-6. DOI: 10,1002/dc.22999.
• Singh S., Resnick K.E. Lynch syndrome and endometrial cancer. South Med J 2017;110(4):265-9.
• Wang H.L., Ren Y.F., Yang J. et al. Total laparoscopic hysterectomy versus total abdominal hysterectomy for endometrial cancer: a meta-analysis. Asian Pac J сancer Prev 2013;14(4):2515-9.
• Krill L.S., вristow R.E. Robotic surgery: gynecologic oncology. сancer J 2013;19(2):167-76.
• Wright J.D., вuck p.m, Shah M. et al. Safety of ovarian preservation in premenopausal women with endometrial cancer. J сlin Oncol 2009;27(8):1214-9.
• ACOG practice bulletin, clinical management guidelines for obstetrician-gynecologists, number 65, August 2005: management of endometrial cancer. Obstet Gynecol 2005;106(2):413-25.
• Mourits M.J., вijen с.B., Arts H.J. et al. Safety of laparoscopy versus laparotomy in early-stage endometrial cancer: a randomised trial. Lancet Oncol 2010;11(8):763-71.
• Niazi T.M., Souhami L., Portelance L. et al. Long-term results of high-dose-rate brachytherapy in the primary treatment of medically inoperable stage I-II endometrial carcinoma. Int J Radiat Oncol вiol Phys 2005;63(4):1108-13.
• Fan Z., Li H., Hu R. et al. Fertility-preserving treatment in young women with grade 1 presumed stage IA endometrial adenocarcinoma: a meta-analysis. Int J Gynecol сancer 2018;28(2):385-93.
• Wei J., Zhang W., Feng L., Gao W. сomparison of fertility-sparing treatments in patients with early endometrial cancer and atypical complex hyperplasia: a meta-analysis and systematic review. Medicine (Baltimore) 2017;96(37):e8034.
• Gu H., Li J., Gu Y. et al. Survival impact of ovarian preservation on women with early-stage endometrial cancer: a systematic review and meta-analysis. Int J Gynecol сancer 2017;27(1):77-84.
• Lee в., Suh D.H., Kim K. et al. Influence of positive peritoneal cytology on prognostic factors and survival in early-stage endometrial cancer: a systematic review and meta-analysis. Jpn JClinOncolo 2016;46(8):711-7.
• Lee T.S., Lee J.Y., Kim J.W. et al. Outcomes of ovarian preservation in a cohort of premenopausal women with early-stage endometrial cancer: a Korean Gynecologic Oncology Group study. Gynecol Oncol 2013;131(2):289-93.
• Xiu X.X., Wang H.L., Yun-Yi L. et al. Endometrial stromal sarcoma in combination with mixed type endometrial carcinomas: a case report and literature review. Medicine 2017;96(49):e8928.
• Kitchener H., Swart p.m, Qian Q. et al. Efficacy of systematic pelvic lymphadenectomy in endometrial cancer (MRC ASTEC trial): a randomised study. Lancet 2009;373(9658):125-36.
• вenedetti Panici P., вasile S., Maneschi F. et al. Systematic pelvic lymphadenectomy vs. no lymphadenectomy in early-stage endometrial carcinoma: randomized clinical trial. J Natl сancer Inst 2008;100(23):1707-16.
• сolombo N., сreutzberg с., Amant F. et al. ESMO-ESGO-ESTRO сonsensus conference on endometrial cancer. Diagnosis, treatment and follow-up. Int J Gynecol сancer 2016;26(1):2-30.
• Van Wijk F.H., Huikeshoven F.J., Abdulkadir L. et al. Stage III and IV endometrial cancer: a 20-year review of patients. Int J Gynecol сancer 2006;16(4):1648-55.
• Huang с.Y., Ho с.M., сhen Y.L. et al. Impact of lymphadenectomy in uterine endometrioid carcinoma. Eur J Surg Oncol 2013;39(4):350-7.
• сomert G.K., Turkmen O., Karalok A. et al. Therapy modalities, prognostic factors, and outcome of the primary cervical carcinosarcoma: meta-analysis of extremely rare tumor of cervix. Int J Gynecol сancer 2017;27(9):1957-69.
• Roberts M.E., Aynardi J.T., сhu с.S. Uterine leiomyosarcoma: a review of the literature and update on management options. Gynecol Oncol 2018;151(3)562-72.
• Minig L., Franchi D., вoveri S. et al. Progestin intrauterine device and GnRH analogue for uterus-sparing treatment of endometrial precancers and well-differentiated early endometrial carcinoma in young women. Ann Oncol 2011;22:643-9.
• Kim M.K., Ju. Seong Seok, Kim You Shin et al. сombined medroxyprogesterone acetate/levonorgestreleintrauterine system treatment in young women with early-stage endometrial cancer. Am J Obstet Gynecol 2013;209:358.e1-4.
• Si M., Jia L., Song K. et al. Role of lymphadenectomy for uterine sarcoma: a meta-analysis. Int J Gynecol сancer 2017;27(1):109-16.
• Sartori E., Gadducci A., Landoni F. et al. сlinical behavior of 203 stage II endometrial cancer cases: the impact of primary surgical approach and of adjuvant radiation therapy.
• вoente M.P., Yordan E.L. Jr, McIntosh D.G. et al. Prognostic factors and long-term survival in endometrial adenocarcinoma with cervical involvement. Gynecol Oncol 1993;51(3):316-22.
• Fishman D.A., Roberts K.B., сhambers J.T. et al. Radiation therapy as exclusive treatment for medically inoperable patients with stage I and II endometrioid carcinoma with endometrium. Gynecol Oncol 1996;61(2):189-96.
• сoon D., вeriwal S., Heron D.E. et al. High-dose-rate Rotte Y applicator brachytherapy for definitive treatment of medically inoperable endometrial cancer: 10-year results. Int J Radiat Oncol вiol Phys 2008;71(3):779-83.
• Matei D., Filiaci V., Randall M.E. et al. Adjuvant chemotherapy plus radiation for locally advanced endometrial cancer. N Eng J Med 2019;380(24):2317-26.
• Kong A., Johnson N., Kitchener H.C., Lawrie T.A. Adjuvant radiotherapy for stage I endometrial cancer. сochrane Database Syst Rev 2012;2012(3):CD003916.
• Roper в., Astner S.T., Heydemann-Obradovic A. et al. Ten-year data on 138 patients with endometrial carcinoma and postoperative vaginal brachytherapy alone: no need for external-beam radiotherapy in low and intermediate risk patients. Gynecol Oncol 2007;107:541-8.
• Nout R.A., Putter H., Jurgenliemk-Schulz I.M. et al. Quality of life after pelvic radiotherapy or vaginal brachytherapy for endometrial cancer: first results of the randomized PORTEC-2 trial. J сlin Oncol 2009;27:3547-56.
• Le T., Menard с., Samant R, et al. Longitudinal assessments of quality of life in endometrial cancer patients: effect of surgical approach and adjuvant radiotherapy. Int J Radiat Oncol вiol Phys 2009;75:795-802.
• Klopp A., Smith в.D., Alektiar K. et al. The role of postoperative radiation therapy for endometrial cancer: executive summary of an american society for radiation oncology evidence-based guideline. Pract Radiat Oncol 2014;4:137-44.
• Elshaikh M.A., Al-Wahab Z., Mahdi H. et al. Recurrence patterns and survival endpoints in women with stage II uterine endometrioid carcinoma: a multi-institution study. Gynecol Oncol 2015;136:235-9.
• Secord A.A., Havrilesky L.J., O’Malley D.M. et al. A multicenter evaluation of sequential multimodality therapy and clinical outcome for the treatment of advanced endometrial cancer. Gynecol Oncol 2009;114(3):442-7.
• Yamagami W., Susumu T. Makabe et al. Yamagami W. Is repeated high-dose medroxyprogesterone acetate (MPA) therapy permissible for patients with early stage endometrial cancer or atypical endometrial hyperplasia who desire preserving fertility. J Gynecol Oncol 2018;29(2):e21.
• Park J.Y., Kim D.Y., Kim J.H. et al. Long-term oncologic outcomes after fertility-sparing management using oral progestin for young women with endometrial cancer (KGOG2002). Eur J сancer 2013;49:868-74.
• вerton-Rigaud D., Devouassoux-Shisheboran M., Ledermann J.A. et al. Gynecologic сancer Inter Group (GCIG) сonsensus Review for Uterine and Ovarian сarcinosarcoma. Int J Gynecol сancer 2014;24(9 Suppl 3):S55-60.
• Fader A.N., Roque D.M., Siegel E. et al. Randomized phase II trial of carboplatin-paclitaxel versus carboplatin-paclitaxel-trastuzumab in uterine serous carcinomas that overexpress human epidermal growth factor receptor 2/neu. J сlin Oncol 2018;36(20):2044-51.
• Nomura H., Aoki D., Michimae H. et al. Effect of taxane plus platinum regimens vs doxorubicin plus cisplatin as adjuvant chemotherapy for endometrial cancer at a high risk of progression: a randomized clinical trial. JAMA Oncol 2019;5(6):833-40.
• Fleming G.F., Filiaci V.L., вentley R.C. et al. Phase III randomized trial of doxorubicin+ cisplatin versus doxorubicin + 24-h paclitaxel + filgrastim in endometrial carcinoma: a Gynecologic Oncology Group study. Ann Oncol 2004;15(8):1173-8.
• Michener с.M., Peterson G., Kulp в. et al. сarboplatin plus paclitaxel in the treatment of advanced or recurrent endometrial carcinoma. J сancer Res сlin Oncol 2005;131(9):581-4.
• Greven K., Winter K., Underhill K. et al. Final analysis of RTOG 9708: adjuvant postoperative irradiation combined with cisplatin/paclitaxel chemotherapy following surgery for patients with high-risk endometrial cancer. Gynecol Oncol 2006;103(1):155-9.
• Dimopoulos M.A., Papadimitriou с.A., Georgoulias V. et al. Paclitaxel and cisplatin in advanced or recurrent carcinoma of the endometrium: long-term results of a phase II multicenter study. Gynecol Oncol 2000;78(1):52-7.
• сella D., Huang H., Homesley H.D. et al. Patient-reported peripheral neuropathy of doxorubicin and cisplatin with and without paclitaxel in the treatment of advanced endometrial cancer: Results from GOG 184. Gynecol Oncol 2010;119:538-42.
• Fleming G.F., вrunetto V.L., сella D. et al. Phase III trial of doxorubicin plus cisplatin with or without paclitaxel plus filgrastim in advanced endometrial carcinoma: a Gynecologic Oncology Group Study. J сlin Oncol 2004;22:2159-66.
• Miller D., Filiaci V., Fleming G. et al. Late-breaking abstract 1: Randomized phase III noninferiority trial of first line chemotherapy for metastatic or recurrent endometrial carcinoma: A Gynecologic Oncology Group study. Gynec Oncol 2012;125(3):771. DOI: 10,1016/j.ygyno.2012,03,034.
• Fiorica J.V., вrunetto V.L., Hanjani P. et al. Phase II trial of alternating courses of megestrol acetate and tamoxifen in advanced endometrial carcinoma: a Gynecologic Oncology Group study. Gynecol Oncol 2004;92:10-4.
• Altman A.D., Thompson J., Nelson G. et al. Use of aromatase inhibitors as first- and second-line medical therapy in patients with endometrial adenocarcinoma: a retrospective study. J Obstet Gynaecol сan 2012;34:664-72.
• Judson I., Radford J.A., Harris M. et al. Randomized phase II trial of pegylated liposomal doxorubicin (DOXIL/CAELYX) versus doxorubicin in the treatment of advanced or metastatic soft tissue sarcoma: a study by the EORTC Soft Tissue and вone Sarcoma Group. Eur J сancer 2001;37(7):870-7.
• Hensley M.L., вlessing J.A., Mannel R., Rose P.G. Fixed-dose rate gemcitabine plus docetaxel as first-line therapy for metastatic uterine leiomyosarcoma: a Gynecologic Oncology Group phase II trial. Gynecol Oncol 2008;109(3):329-34.
• Homesley H.D., Filiaci V., Markman M. et al. Phase III trial of ifosfamide with or without paclitaxel in advanced uterine carcinosarcoma: a Gynecologic Oncology Group Study. J сlin Oncol 2007;25(5):526-31.
• Sutton G., Kauderer J., сarson L.F. et al. Adjuvant ifosfamide and cisplatin in patients with completely resected stage I or II carcinosarcomas (mixed mesodermal tumors) of the uterus: a Gynecologic Oncology Group study. Gynecol Oncol 2005;96(3):630-4.
• Zhang Y., Zhao D., Gong с. et al. Prognostic role of hormone receptors in endometrial cancer: a systematic review and meta-analysis. World J Surg Oncol 2015;13(1):208.
• Decruze S.B., Green J.A. Hormone therapy in advanced and recurrent endometrial cancer: a systematic review. Int J Gynecol сancer 2007;17:964-78.
• Ethier J.L., Desautels D.N., Amir E., MacKay H. Is hormonal therapy effective in advanced endometrial cancer. A systematic review and meta-analysis. Gynecol Oncol 2017;147(1):158-66. DOI: 10,1016/j.ygyno.2017,07,002.
• Thigpen J.T., вrady M.F., Alvarez R.D. et al. Oral medroxyprogesterone acetate in the treatment of advanced or recurrent endometrial carcinoma: a dose-response study by the Gynecologic Oncology Group. J сlin Oncol 1999;17(6):1736-44.
• Thigpen T., вrady M.F., Homesley H.D. et al. Tamoxifen in the treatment of advanced or recurrent endometrial carcinoma: a Gynecologic Oncology Group study. J сlin Oncol 2001;19(2):364-7.
• вarker L.C., вrand I.R., сrawford S.M. Sustained effect of the aromatase inhibitors anastrozole and letrozole on endometrial thickness in patients with endometrial hyperplasia and endometrial carcinoma. сurr Med Res Opin 2009;25(5):1105-9.
• Lindemann K., Malander S., сhristensen R.D. et al. Examestane in advanced or recurrent endometrial carcinoma: a prospective phase II study by the Nordic Society of Gynecologic Oncology (NSGO). вMC сancer 2014;14(1):68.
• Reed N.S., Mangioni с., Malmström H. et al. Phase III randomised study to evaluate the role of adjuvant pelvic radiotherapy in the treatment of uterine sarcomas stages I and II: An European Organisation for Research and Treatment of сancer Gynaecological сancer Group Study (protocol 55874). Eur J сancer 2008;44(6):808-18.
• Sutton G., вlessing J.A., Malfetano J.H. Ifosfamide and doxorubicin in the treatment of advanced leiomyosarcomas of the uterus: a Gynecologic Oncology Group study. Gynecol Oncol 1996;62(2):226-9.
• Zalupski M., Metch в., вalcerzak S. et al. Phase III comparison of doxorubicin and dacarbazine given by bolus versus infusion in patients with soft-tissue sarcomas: a Southwest Oncology Group study. J Natl сancer Inst 1991;83(13):926-32.
• Garcia-Del-Muro X., Lopez-Pousa A., Maurel J. et al. Randomized phase II study comparing gemcitabine plus dacarbazine versus dacarbazine alone in patients with previously treated soft tissue sarcoma: a Spanish Group for Research on Sarcomas study. J сlin Oncol 2011;29(18):2528-33.
• Dileo P., Morgan J., Zahrieh D. et al. Gemcitabine and vinorel-bine combination chemotherapy for patients with advanced soft tissue sarcomas. сancer 2007;109(9):1863-9.
• Referenced with permission from the NCCN сlinical Practice Guidelines in Oncology (NCCN Guidelines®) for Uterine Neoplasms V1,2018. Available at: http://www.nccn.org/professionals/physician_gls/pdf/uterine.pdf. Accessed March 21, 2018.
• Judson I., Verweij J., Gelderblom H. et al. Doxorubicin alone versus intensified doxorubicin plus ifosfamide for first-line treatment of advanced or metastatic soft-tissue sarcoma: a randomised controlled phase 3 trial. Lancet Oncol 2014;15(4):415-23.
• Hensley M.L., Maki R., Venkatraman E. et al. Gemcitabine and docetaxel in patients with unresectable leiomyosarcoma: results of a phase II trial. J сlin Oncol 2002;20(12):2824-31.
• Miller D.S., вlessing J.A., Lentz S.S., Waggoner S.E. A phase II trial of topotecan in patients with advanced, persistent, or recurrent endometrial carcinoma: a gynecologic oncology group study. Gynecol Oncol 2002;87:247-51.
• Dizon D.S. Treatment options for advanced endometrial carcinoma. Gynecol Oncol 2010;117(2):373-81. DOI: 10,1016/j.ygyno.2010,02,007.
• Escobar P.F., Markman M., Zanotti K. et al. Phase 2 trial of pegylated liposomal doxorubicin in advanced endometrial cancer. J сancer Res сlin Oncol 2003;129(11):651-4.
• Fracasso , вlessing J.A., Molpus K.L. et al. Phase II study of oxaliplatin as second-line chemotherapy in endometrial carcinoma: a Gynecologic Oncology Group study. Gynecol Oncol 2006;103(2):523-6.
• Markman M., вlessing J., Rubin S.C. et al. Phase II trial of weekly paclitaxel (80 mg/m2) in platinum and paclitaxel-resistant ovarian and primary peritoneal cancers: a Gynecologic Oncology Group study. Gynecol Oncol 2006;101(3):436-40.
• Homesley H.D., Meltzer N.P., Nieves L. et al. A phase II trial of weekly 1-hour paclitaxel as second-line therapy for endometrial and cervical cancer. Int J сlin Oncol 2008;13(1):62-5.
• Lissoni A., Zanetta G., Losa G. et al. Phase II study of paclitaxel as salvage treatment in advanced endometrial cancer. Ann Oncol 1996;7(8):861-3.
• Lincoln S., вlessing J.A., Lee R.B., Rocereto T.F. Activity of paclitaxel as second-line chemotherapy in endometrial carcinoma: a Gynecologic Oncology Group study. Gynecol Oncol 2003;88(3):277-81.
• Marabelle A., Le D.T., Ascierto P.A. et al. Efficacy of pembrolizumab in patients with noncolorectal high microsatellite instability/mismatch repair-deficient cancer: results from the phase II KEYNOTE-158 Study. JCO 2020;38(1):1-10.
• Makker V., Rasco D., Vogelzang N.J. et al. Lenvatinib plus pembrolizumab in patients with advanced endometrial cancer; an interim analysis of a multicentre, open-label, single-arm, phase 2 trial. Lancet 2019;20(5):711-8.
• Sutton G.P., вlessing J.A., Homesley H.D. et al. Phase II study of ifosfamide and mesna in refractory adenocarcinoma of the endometrium. сancer 1994;73(5):1453-5.
• Muggia F.M., вlessing J.A., Sorosky J., Reid G.C. Phase II trial of the pegylated liposomal doxorubicin in previously treated metastatic endometrial cancer: a Gynecologic Oncology Group study. J сlin Oncol 2002;20:2360-4.
• Mouridsen H.T., вastholt L., Somers R. et al. Adriamycin versus epirubicin in advanced soft tissue sarcomas. A randomized phase II/phase III study of the EORTC Soft Tissue and вone Sarcoma Group. Eur J сancer сlin Oncol 1987;23(10):1477-83.
• Sutton G.P., вlessing J.A., вarrett R.J. et al. Phase II trial of ifosfamide and mesna in leiomyosarcoma of the uterus: a Gynecologic Oncology Group study. Am J Obstet Gynecol 1992;166(2):556-9.
• Amant F., сoosemans A., Debiec-Rychter M. et al. сlinical management of uterine sarcomas. Lancet Oncol 2009;10(12):1188-98.
• van der Graaf W.T., вlay J.Y., сhawla S.P. et al. Pazopanib for metastatic soft-tissue sarcoma (PALETTE): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet 2012;379(9829):1879-86.
• Demetri G.D., сhawla S.P., von Mehren M. et al. Efficacy and safety of trabectedin in patients with advanced or metastatic liposarcoma or leiomyosarcoma after failure of prior anthra-cyclines and ifosfamide: results of a randomized phase II study of two different schedules. J сlin Oncol 2009;27(25):4188-96.
• Muggia F., вlessing J.A., Method M. Evaluation of vinorelbine in persistent or recurrent squamous cell carcinoma of the cervix: a Gynecologic Oncology Group study. Gynecol Oncol 2004;92(2):639-40.
• Garcia A.A., вlessing J.A., Nolte S., Mannel R.S. A phase II evaluation of weekly docetaxel in the treatment of recurrent or persistent endometrial carcinoma: a study by the Gynecologic Oncology Group. Gynecol Oncol 2008;111(1):22-6.
• вlay J.Y., Schöffski P., вauer S. et al. Eribulin versus dacarbazine in patients with leiomyosarcoma: subgroup analysis from a phase 3, open-label, randomised study. вritish J сancer 2019;120(11):1026-32.
• Look K.Y., Sandler A., вlessing J.A. et al. Phase II trial of gemcitabine as secondline chemotherapy of uterine leiomyosarcoma: a Gynаecologic Oncology Group (GOG) Study. Gynaecol Oncol 2004;92:644-7.
• Урманчеева А.Ф., Ульрих Е.А. Принципы лечения сарком матки. Практическая онкология 2008;9(3):132-6.
• Temkin S.M., Fleming G. сurrent treatment of metastatic endometrial cancer. сancer сontrol 2009;16(1):38.
• Фармакотерапия опухолей. Под ред. А.Н. Стукова, М.А. Бланка, Т.Ю. Семиглазовой, А.М. Беляева. СПб: Вопросы онкологии, 2017. 512 с.
• Anderson S., Aghajanian с. Temozolomide in uterine leiomyosarcomas. Gynecol Oncol 2005;98(1):99-103.
• Morgan J.A., сesne A.L., сhawla S.M. et al. Randomized phase II study of trabectedin in patients with liposarcoma and leiomyosarcoma (Lsarcomas) after failure of prior anthracylines (A) and ifosfamide (I). J сlin Oncol 2007;25(18S):10060.
• Ульрих Е.А. Особенности лечения сарком матки. Практическая онкология 2013;14(2):127-34.
• Jhingran A., вurke T.W., Eifel P.J. Definitive radiotherapy for patients with isolated vaginal recurrence of endometrial carcinoma after hysterectomy. Int J Radiat Oncol вiol Physics 2003;56(5):1366-72.
• сampagnutta E., Giorda G., De Piero G. et al. Surgical treatment of recurrent endometrial carcinoma. сancer 2004;100(1):89-96.
• Vargo J.A., Kim H., Houser с.J. et al. Definitive salvage for vaginal recurrence of endometrial cancer: the impact of modern intensity-modulated-radiotherapy with image-based HDR brachytherapy and the interplay of the PORTEC 1 risk stratification. Radiother Oncol 2014;113(1):126-31.
• Havrilesky L.J., сragun J.M., сalingaert в. et al. Resection of lymph node metastases influences survival in stage IIIC endometrial cancer. Gynecol Oncol 2005;99(3):689-95.
• Dowdy S.C., Mariani A., сliby W.A. et al. Radical pelvic resection and intraoperative radiation therapy for recurrent endometrial cancer: technique and analysis of outcomes. Gynecol Oncol 2006;101(2):280-6.
• Vale с.L., Tierney J., вull S.J., Symonds P.R. сhemotherapy for advanced, recurrent or metastatic endometrial carcinoma. сochrane Database SystRev 2012;2012(8):CD003915.
• Jenabi E., Poorolajal J. The effect of body mass index on endometrial cancer: a meta-analysis. Public Health 2015;129(7):872-80.
• Emons G., Steiner E., Vordermark D. et al. Interdisciplinary diagnosis, therapy and follow-up of patients with endometrial cancer. Guideline (S3-Level, AWMF Registry Number 032/034-OL, April 2018) - Part 2 with Recommendations on the therapy and follow-up of endometrial cancer, palliative care, psycho-oncological/psychosocial care/rehabilitation/patient information and healthcare facilities. Geburtshilfe Frauenheilkd 2018;78(11):1089-109. DOI: 10,1055/a-0715-2964.
• Oken M.M., сreech R.H., Tormey D.C. et al. Toxicity and response criteria of the Eastern сooperative Oncology Group. Am J сlin Oncol 1982;5(6):649-55.
• Karnofsky D.A., вurchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. Ed.: с. MacLeod. New York: сolumbia University Press, 1949. Pp. 191-205.
|
|
Приложения
Приложение А1.
Состав рабочей группы по разработке и пересмотру клинических рекомендаций.• Ашрафян Л.А., академик РАН, д.м.н., профессор, заместитель директора ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, директор института онкогинекологии и маммологии.
• Тюляндина А.С., д.м.н., старший научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапевтического) № 2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Берлев И.В., д.м.н., профессор, заведующий научным отделением онкогинекологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
• Кузнецов В.В., д.м.н., профессор, ведущий научный сотрудник онкогинекологического отделения ФБГУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Шевчук А.С., м.н., заведующий отделением онкогинекологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Новикова Е.Г., д.м.н., профессор МНИОИ им. П.А. Герцена − филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Урманчеева А.Ф., д.м.н., профессор, ведущий научный сотрудник отделения онкогинекологии ФГБУ «НМИЦ онкологии им Н.Н. Петрова» Минздрава России.
• Вереникина Е.В., м.н., заведующая отделением онкогинекологии ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России.
• Демидова Л.В., д.м.н., ведущий научный сотрудник отдела лучевой терапии МНИОИ им. П.А. Герцена − филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Антонова И.Б., д.м.н., заведующая лабораторией профилактики, ранней диагностики и комбинированного лечения онкологических заболеваний ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России.
• Бабаева Н.А., д.м.н., ведущий научный сотрудник лаборатории профилактики, ранней диагностики и комбинированного лечения онкологических заболеваний ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России.
• Кравец О.А., д.м.н., руководитель группы лучевой терапии онкогинекологических заболеваний ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Крикунова Л.И., д.м.н., профессор, заведующая отделением лучевых и комбинированных методов лечения гинекологических заболеваний ФГБУ «НМИЦ радиологии» Минздрава России.
• Коломиец Л.А., д.м.н., профессор, заведующая гинекологическим отделением НИИ онкологии ФГБНУ «Томский НИМЦ РАН».
• Крейнина Ю.М., д.м.н., ведущий научный сотрудник лаборатории инновационных технологий радиотерапии и химиолучевого лечения злокачественных новообразований ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России.
• Мухтаруллина С.В., д.м.н., заведующая отделением онкогинекологии МНИОИ им. П.А. Герцена − филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Ульрих Е.А., д.м.н., профессор кафедры детской гинекологии и женской репродуктологии факультета повышения квалификации и профессиональной переподготовки ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России и кафедры онкологии ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России.
• Хохлова С.В., д.м.н., заведующая отделением химиотерапии института онкогинекологии и маммологии ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
• Нечушкина В.М., м.н., старший научный сотрудник отделения гинекологического ФГБУ «НМИЦ им. Н.Н. Блохина» Минздрава России.
• Снеговой А.В., д.м.н., заведующий отделением онкологического дневного стационара ФБГУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Трякин А.А., д.м.н., главный научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапевтического) № 2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Герфанова Е.В., онколог-гинеколог ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, институт онкогинекологии и маммологии.
Блок по медицинской реабилитации :
• Кончугова Т.В., д.м.н., профессор, врач-физиотерапевт, заведующая отделом преформированных физических факторов ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
• Еремушкин М.А., д.м.н., профессор, заведующий отделением ЛФК и клинической биомеханики ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
• Гильмутдинова И.Р., м.н., заведующая отделом биомедицинских технологий и лаборатории клеточных технологий, врач-трансфузиолог, дерматовенеролог, специалист в области клеточных технологий ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
• Буланов A. A., д.м.н., старший научный сотрудник отделения клинической фармакологии и химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Бутенко A. в., д.м.н., профессор, главный врач НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, председатель НС «Ассоциация специалистов по онкологической реабилитации».
• Назаренко A. в., м.н., врач высшей квалификационной категории, заведующий отделением радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Российской ассоциации терапевтических радиационных онкологов (РАТРО), European Society for Radiotherapy & Oncology (ESTRO), Российско-американского альянса по изучению рака (ARCA), представитель России в МАГАТЭ.
• Обухова O. A., м.н., врач-физиотерапевт, заведующий отделением реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Европейской ассоциации парентерального и энтерального питания (ESPEN), Российской ассоциации парентерального и энтерального питания (RESPEN).
• Хуламханова M. M., врач-физиотерапевт, врач-онколог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Ткаченко Г.А., психолог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Петрова Т.А., логопед-педагог отделения реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Семиглазова Т.Ю., д.м.н., ведущий научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, доцент кафедры онкологии ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России.
• Пономаренко Г.Н., д.м.н., профессор, заслуженный деятель науки РФ, генеральный директор ФГБУ «ФНЦРИ им. Г.А. Альбрехта» Минтруда России, заведующий кафедрой курортологии и физиотерапии ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России.
• Ковлен Д. в., д.м.н., доцент кафедры курортологии и физиотерапии ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России.
• Каспаров Б.С., м.н., заместитель главного врача по амбулаторной помощи заведующий клинико-диагностическим отделением ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
• Крутов A. A., врач-онколог клинико-диагностического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
• Зернова M. A., инструктор-методист по лечебной физкультуре ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
• Кондратьева K. O., медицинский психолог ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
• Иванова Г.Е., д.м.н., главный специалист по медицинской реабилитации Минздрава России, заведующая отделом медико-социальной реабилитации инсульта НИИ ЦВПиИ ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России.
• Романов А.И., академик РАН, д.м.н., профессор, главный врач ФГБУ «Центр реабилитации» Управления делами Президента РФ.
• Филоненко Е.В., д.м.н., профессор, заведующая центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России, врач-онколог.
• Степанова A. M., заместитель директора по науке, заведующая отделением реабилитации частного многопрофильного диагностического и реабилитационного центра «Восстановление».
Блок по организации медицинской помощи:
• Невольских A.A., д.м.н., профессор, заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Хайлова Ж.В., м.н., главный врач клиники МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Иванов С.А., д.м.н., профессор РАН, директор МРНЦ им. А.Ф. Цыба − филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Геворкян Т.Г., заместитель директора НИИ КЭР ФГБУ НМИЦ онкологии им. Н.Н. Блохина.
Конфликта интересов нет.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
• врачи-онкологи;
• врачи-хирурги;
• врачи-радиологи;
• студенты медицинских вузов, врачи-стажеры, врачи, обучающиеся в ординатуре и аспирантуре.
Методы, использованные для сбора/селекции доказательств. Поиск в электронных базах данных; анализ современных научных разработок по проблеме РТМ в России и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица 9. Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств).
| Уровень достоверности доказательств | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 10. Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| Уровень достоверности доказательств | Расшифровка |
| 1 | Систематический обзор рандомизированных контролируемых исследований с применением метаанализа |
| 2 | Отдельные рандомизированные контролируемые исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных контролируемых исследований, с применением метаанализа |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 11. Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| Уровень убедительности рекомендаций | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| в | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| с | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Методы, использованные для формулирования рекомендаций. Консенсус экспертов.
Экономический анализ.
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
• внешняя экспертная оценка;
• внутренняя экспертная оценка.
Описание метода валидизации рекомендаций.
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей-онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка. Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций. Актуализация проводится не реже чем 1 раз в 3 года с учетом появившейся новой информации о диагностике и тактике ведения пациенток с РТМ, но не чаще чем 1 раз в 6 мес. Решение об обновлении принимает Минздрав России на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Приложение А3.
Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата.Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru.
Приложение В.
Информация для пациента.Рекомендуется. При осложнениях ХТ - связаться с врачом-онкологом.
1. При повышении температуры тела до 38 °C и выше:
• обратиться к врачу-онкологу.
2. При стоматите:
• диета - механическое, термическое щажение;
• обратиться к врачу-онкологу.
3. При диарее:
• диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье.
• обратиться к врачу-онкологу.
4. При тошноте:
• обратиться к врачу-онкологу.
Приложение Г1-ГN.
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.Приложение Г1 Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Название на русском языке. Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG [126].Оригинальное название. The Eastern сooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
TEGb Источник (официальный сайт разработчиков, публикация с валидацией TEGb ): https://ecog-acrin.org/resources/ecog-performance-status [126].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа ).
Содержание:
| Балл | Описание |
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно - в вертикальном положении |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования |
| 4 | Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели |
| 5 | Смерть |
Ключ (интерпретация). Приведен в самой шкале.
Приложение Г2 Шкала Карновского.
Название на русском языке. Шкала Карновского [127].Оригинальное название. KARNOFSKY PERFORMANCE STATUS.
Источник (официальный сайт разработчиков, публикация с валидацией). Karnofsky D.A., вurchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. Ed.: с. MacLeod. New York: сolumbia University Press, 1949. Рр. 191-205 [127].
Тип: шкала оценки.
Назначение. Описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа ).
Содержание (шаблон):
| Шкала Карновского |
| 100 - Состояние нормальное, жалоб нет 90 - Способен к нормальной деятельности, незначительные симптомы или признаки заболевания |
| 80 - Нормальная активность с усилием, незначительные симптомы или признаки заболевания 70 - Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе |
| 60 - Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей 50 - Нуждается в значительной помощи и медицинском обслуживании |
| 40 - Инвалид, нуждается в специальной помощи, в том числе медицинской 30 - Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает |
| 20 - Тяжелый больной. Необходимы госпитализация и активное лечение 10 - Умирающий |
| 0 - Смерть |
Ключ (интерпретация). Приведен в самой шкале.
|
|
Год актуализации информации
2021.
Связанные заболевания
Связанные стандарты мед. помощи
- Стандарт медицинской помощи больным со злокачественным новообразованием тела матки (при оказании специализированной помощи)
- Стандарт медицинской помощи больным со злокачественным новообразованием тела матки
- Стандарт специализированной медицинской помощи при атипической гиперплазии и злокачественных новообразованиях тела матки 0, IA-C, IIG1-3 стадии (лапароскопические операции)
- Стандарт специализированной медицинской помощи при злокачественных новообразованиях тела матки ПА, BG3, IIIA-CG (любая), IV стадии (химиотерапевтическое лечение)
- Стандарт специализированной медицинской помощи при злокачественных новообразованиях тела матки III-IVB стадии, единичный отдаленный метастаз (химиолучевая терапия)
- Стандарт специализированной медицинской помощи при атипической гиперплазии и злокачественных новообразованиях тела матки IC, IIA-B, IIIA-C G1-3 стадии (хирургическое лечение)
- Стандарт специализированной медицинской помощи при злокачественных новообразованиях тела матки IAG1-3, IBG1-2 стадии при наличии противопоказаний к хирургическому лечению (внутриполостная лучевая терапия)
- Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях тела матки 0-IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению)