Другие названия и синонимы
Imatinib.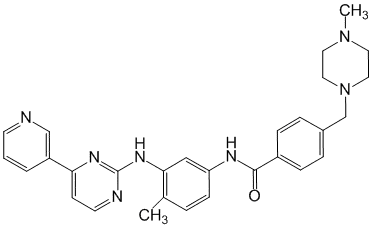
Фармакологическая группа
|
|
Латинское название
Imatinibum ( Imatinibi).
Химическое название
4-[(4-Метил-1-пиперазинил)метил]-N-[4-метил-3-[[4-(3-пиридинил)-2-пиримидинил]амино]фенил]бензамид (и в виде мезилата).
Используется в лечении
Код CAS
152459-95-5.
Фармакологическое действие
Противоопухолевое.
Характеристика вещества
Противоопухолевое средство, ингибитор протеинтирозинкиназы (Bcr-Abl тирозинкиназы) - аномального фермента, продуцируемого филадельфийской хромосомой при хроническом миелолейкозе.
Иматиниба мезилат - белый или почти белый с коричневатым или желтоватым оттенком кристаллический порошок. Растворим в водных буферных растворах при pH≤5,5; растворим очень незначительно или нерастворим в нейтральных/щелочных водных растворах. Растворимость в неводных растворителях варьирует от неограниченной до очень незначительной в диметилсульфоксиде, метаноле и этаноле; нерастворим в n-октаноле, ацетоне и ацетонитриле. Молекулярная масса 589,7.
Иматиниба мезилат - белый или почти белый с коричневатым или желтоватым оттенком кристаллический порошок. Растворим в водных буферных растворах при pH≤5,5; растворим очень незначительно или нерастворим в нейтральных/щелочных водных растворах. Растворимость в неводных растворителях варьирует от неограниченной до очень незначительной в диметилсульфоксиде, метаноле и этаноле; нерастворим в n-октаноле, ацетоне и ацетонитриле. Молекулярная масса 589,7.
Фармакодинамика
Подавляет пролиферацию и индуцирует апоптоз вcr-Abl-позитивных клеточных линий, а также молодых лейкозных клеток с положительной филадельфийской хромосомой при хроническом миелолейкозе (ХМЛ). В исследованиях по образованию колоний, проведенных ex vivo на пробах периферической крови и костного мозга показано, что иматиниб ингибирует вcr-Abl-позитивные колонии, полученные от больных хроническим миелолейкозом. В исследованиях in vivo >in vivo ингибирует опухолевый рост вcr-Abl мышиных миелоидных клеток, подвергшихся трансфекции, и вcr-Abl-позитивных лейкозных линий, полученных от больных хроническим миелолейкозом при бластном кризе. Иматиниб ингибирует также рецепторы тирозинкиназы тромбоцитарного фактора роста (PDGF) и фактора стволовых клеток (SCF), c-kit (Kit, сD117), а также подавляет клеточные реакции, опосредуемые этими факторами. In vitro иматиниб ингибирует пролиферацию и индуцирует апоптоз клеток стромальных опухолей ЖКТ, экспрессирующих c-kit мутации.
Фармакокинетика иматиниба мезилата оценивалась у здоровых добровольцев и в популяционных фармакокинетических исследованиях с включением свыше 900 пациентов.
После приема внутрь иматиниб хорошо абсорбируется, биодоступность - 98%. maxCmax достигается в течение 2-4 Связывание с белками плазмы (преимущественно с альбумином и альфа1-кислым гликопротеином) - 95%. Значение AUC иматиниба увеличивается пропорционально повышению дозы в диапазоне доз 25-1000 мг. При приеме повторных доз фармакокинетика иматиниба не изменяется. Равновесная концентрация в 1,5-2,5 раза превышает исходную концентрацию. Метаболизируется в печени преимущественно при участии фермента сYP3A4 системы цитохрома P450 с образованием основного активного метаболита - N-деметилированного производного пиперазина (величина AUC метаболита составляет 15% AUC иматиниба). Показано in vitro, что активность метаболита сравнима с активностью иматиниба. Другие изоферменты цитохрома P450 (CYP1A2, сYP2D6, сYP2C9, сYP2C19) принимают незначительное участие в метаболизме иматиниба. Т1/2 составляет 18 ч для иматиниба и 40 ч - для его активного метаболита. После приема внутрь 14C-меченого иматиниба примерно 81% дозы выводится в течение 7 дней, преимущественно с фекалиями (68%), главным образом в виде метаболитов, 13% - с мочой; в неизмененном виде - 25% (5% - с мочой, 20% - с фекалиями). Клиренс у пациентов до 50 лет и массой тела 50 кг - 8 л/ у пациентов старше 50 лет и массой тела 100 кг - 14 л/ Вариабельность клиренса (40%) не является основанием для коррекции дозы, но требует наблюдения за пациентами во избежание интоксикации.
У детей, как и у взрослых, иматиниб после приема внутрь быстро абсорбируется, Тmax - 2-4 Величина AUC у детей при приеме в диапазоне доз 260 и 340 мг/м2 сходна с таковой у взрослых при приеме в дозе 400 мг. Сравнение значений AUC0-24 ч на 8-й по сравнению с 1-м днем при дозировке 260 и 340 мг/м2 выявило кумуляцию в 1,5 и 2,2 раза соответственно после повторного приема.
По данным Physicians Desk Reference (2005), иматиниба мезилат применяется в педиатрической практике для лечения детей с положительной филадельфийской хромосомой в хронической фазе миелолейкоза при рецидиве после трансплантации стволовых клеток или при резистентности к лечению интерфероном альфа (ИФН). Эффективность и безопасность иматиниба мезилата продемонстрирована только у этих пациентов. Нет данных о применении у детей до 3 лет. Нет контролируемых испытаний у педиатрических пациентов, подтверждающих клиническую пользу, в тч улучшение связанной с заболеванием симптоматики или повышение выживаемости.
В одном открытом исследовании было обследовано 14 пациентов с ХМЛ в возрасте 3-20 лет: 3-11 лет (n=3), 12-18 (n=9), старше 18 лет (n=2). В исследуемом диапазоне доз 260-570 мг/м2/сут у детей, чьи цитогенетические данные были доступны (n=13) наблюдался цитогенетический ответ различной степени выраженности.
Во втором исследовании у детей с ХМЛ полный цитогенетический ответ наблюдался у 2 из 3 пациентов при дозах 242-257 мг/м2/сут.
По данным Physicians Desk Reference (2005), иматиниба мезилат показан также для лечения пациентов с Kit (CD117)-позитивными неоперабельными и/или метастатическими злокачественными стромальными опухолями ЖКТ у взрослых пациентов (СОЖКТ). Проведено открытое многоцентровое исследование (n=147) у пациентов 18-83 лет. Эффективность иматиниба мезилата основывается на объективной частоте ответа на лечение. Нет контролируемых испытаний, демонстрирующих клиническую пользу, в тч улучшение связанной с заболеванием симптоматики или увеличение выживаемости.
Фармакокинетика иматиниба мезилата оценивалась у здоровых добровольцев и в популяционных фармакокинетических исследованиях с включением свыше 900 пациентов.
После приема внутрь иматиниб хорошо абсорбируется, биодоступность - 98%. maxCmax достигается в течение 2-4 Связывание с белками плазмы (преимущественно с альбумином и альфа1-кислым гликопротеином) - 95%. Значение AUC иматиниба увеличивается пропорционально повышению дозы в диапазоне доз 25-1000 мг. При приеме повторных доз фармакокинетика иматиниба не изменяется. Равновесная концентрация в 1,5-2,5 раза превышает исходную концентрацию. Метаболизируется в печени преимущественно при участии фермента сYP3A4 системы цитохрома P450 с образованием основного активного метаболита - N-деметилированного производного пиперазина (величина AUC метаболита составляет 15% AUC иматиниба). Показано in vitro, что активность метаболита сравнима с активностью иматиниба. Другие изоферменты цитохрома P450 (CYP1A2, сYP2D6, сYP2C9, сYP2C19) принимают незначительное участие в метаболизме иматиниба. Т1/2 составляет 18 ч для иматиниба и 40 ч - для его активного метаболита. После приема внутрь 14C-меченого иматиниба примерно 81% дозы выводится в течение 7 дней, преимущественно с фекалиями (68%), главным образом в виде метаболитов, 13% - с мочой; в неизмененном виде - 25% (5% - с мочой, 20% - с фекалиями). Клиренс у пациентов до 50 лет и массой тела 50 кг - 8 л/ у пациентов старше 50 лет и массой тела 100 кг - 14 л/ Вариабельность клиренса (40%) не является основанием для коррекции дозы, но требует наблюдения за пациентами во избежание интоксикации.
У детей, как и у взрослых, иматиниб после приема внутрь быстро абсорбируется, Тmax - 2-4 Величина AUC у детей при приеме в диапазоне доз 260 и 340 мг/м2 сходна с таковой у взрослых при приеме в дозе 400 мг. Сравнение значений AUC0-24 ч на 8-й по сравнению с 1-м днем при дозировке 260 и 340 мг/м2 выявило кумуляцию в 1,5 и 2,2 раза соответственно после повторного приема.
По данным Physicians Desk Reference (2005), иматиниба мезилат применяется в педиатрической практике для лечения детей с положительной филадельфийской хромосомой в хронической фазе миелолейкоза при рецидиве после трансплантации стволовых клеток или при резистентности к лечению интерфероном альфа (ИФН). Эффективность и безопасность иматиниба мезилата продемонстрирована только у этих пациентов. Нет данных о применении у детей до 3 лет. Нет контролируемых испытаний у педиатрических пациентов, подтверждающих клиническую пользу, в тч улучшение связанной с заболеванием симптоматики или повышение выживаемости.
В одном открытом исследовании было обследовано 14 пациентов с ХМЛ в возрасте 3-20 лет: 3-11 лет (n=3), 12-18 (n=9), старше 18 лет (n=2). В исследуемом диапазоне доз 260-570 мг/м2/сут у детей, чьи цитогенетические данные были доступны (n=13) наблюдался цитогенетический ответ различной степени выраженности.
Во втором исследовании у детей с ХМЛ полный цитогенетический ответ наблюдался у 2 из 3 пациентов при дозах 242-257 мг/м2/сут.
По данным Physicians Desk Reference (2005), иматиниба мезилат показан также для лечения пациентов с Kit (CD117)-позитивными неоперабельными и/или метастатическими злокачественными стромальными опухолями ЖКТ у взрослых пациентов (СОЖКТ). Проведено открытое многоцентровое исследование (n=147) у пациентов 18-83 лет. Эффективность иматиниба мезилата основывается на объективной частоте ответа на лечение. Нет контролируемых испытаний, демонстрирующих клиническую пользу, в тч улучшение связанной с заболеванием симптоматики или увеличение выживаемости.
Показания к применению
Хронический миелолейкоз (бластный криз, фаза обострения и хроническая фаза) при неудаче предшествующего лечения интерфероном альфа.
Противопоказания
Гиперчувствительность.
Ограничения к использованию
Возраст до 18 лет (безопасность и эффективность применения не установлены).
При беременности и кормлении грудью
Назначать беременным женщинам можно лишь в том случае, если преимущества терапии превышают потенциальный риск для плода (адекватных и хорошо контролируемых исследований у беременных женщин не проводили). В случае применения при беременности или в период планируемой беременности необходимо предупредить пациентку о потенциальном риске для плода. Женщинам детородного возраста во время терапии необходимо использовать эффективные методы контрацепции.
Категория действия на плод по FDA. D.
Иматиниба мезилат оказывает тератогенное действие у крыс при дозах ≥100 мг/кг (примерно эквивалентно максимальной клинической дозе 800 мг/сут, в пересчете на площадь поверхности тела). Тератогенные эффекты включали следующие: экзенцефалия или энцефалоцеле, отсутствие/уменьшение фронтальных и отсутствие париетальных костей. У самок крыс при дозах ≥45 мг/кг (примерно 1/2 МРДЧ - 800 мг/сут, в пересчете на площадь поверхности тела) также наблюдались значительные постимплантационные потери (либо ранняя резорбция плода, либо мертворождение), рождение нежизнеспособных детенышей, ранняя смерть детенышей, в период 0-4 день после родов. При дозах свыше 100 мг/кг фетальные потери были отмечены у всех животных, тогда как при дозах <30 мг/кг (примерно 1/3 МРДЧ - 800 мг/сут) они не наблюдались.
Самки и самцы крыс были подвергнуты воздействию иматиниба мезилата в дозе 45 мг/кг в период внутриутробного развития, начиная с 6-го дня беременности и до окончания периода лактации. Затем эти животные не получали иматиниб около 2 мес. У этих крыс была снижена масса тела при рождении и до окончания наблюдений. Хотя нарушений фертильности у животных не наблюдалось, отмечались фетальные потери после спаривания этих самцов и самок.
В экспериментах на животных показано, что иматиниба мезилат и его метаболиты проникают в грудное молоко крыс. Так, при введении лактирующим самкам крыс в дозе 100 мг/кг иматиниб и его метаболиты экстенсивно экскретировались в грудное молоко. Концентрация в молоке была примерно в 3 раза выше, чем в плазме. Установлено, что примерно 1,5% материнской дозы экскретировалось в молоко, что эквивалентно дозе для младенца, равной 30% материнской дозы, в пересчете на площадь поверхности тела. Неизвестно, выделяется ли иматиниба мезилат и/или его метаболиты с грудным молоком у женщин. Однако с учетом возможности развития потенциально серьезных побочных реакций у ребенка в случае попадания ЛС в организм, иматиниба мезилат не следует назначать кормящим матерям.
Категория действия на плод по FDA. D.
Иматиниба мезилат оказывает тератогенное действие у крыс при дозах ≥100 мг/кг (примерно эквивалентно максимальной клинической дозе 800 мг/сут, в пересчете на площадь поверхности тела). Тератогенные эффекты включали следующие: экзенцефалия или энцефалоцеле, отсутствие/уменьшение фронтальных и отсутствие париетальных костей. У самок крыс при дозах ≥45 мг/кг (примерно 1/2 МРДЧ - 800 мг/сут, в пересчете на площадь поверхности тела) также наблюдались значительные постимплантационные потери (либо ранняя резорбция плода, либо мертворождение), рождение нежизнеспособных детенышей, ранняя смерть детенышей, в период 0-4 день после родов. При дозах свыше 100 мг/кг фетальные потери были отмечены у всех животных, тогда как при дозах <30 мг/кг (примерно 1/3 МРДЧ - 800 мг/сут) они не наблюдались.
Самки и самцы крыс были подвергнуты воздействию иматиниба мезилата в дозе 45 мг/кг в период внутриутробного развития, начиная с 6-го дня беременности и до окончания периода лактации. Затем эти животные не получали иматиниб около 2 мес. У этих крыс была снижена масса тела при рождении и до окончания наблюдений. Хотя нарушений фертильности у животных не наблюдалось, отмечались фетальные потери после спаривания этих самцов и самок.
В экспериментах на животных показано, что иматиниба мезилат и его метаболиты проникают в грудное молоко крыс. Так, при введении лактирующим самкам крыс в дозе 100 мг/кг иматиниб и его метаболиты экстенсивно экскретировались в грудное молоко. Концентрация в молоке была примерно в 3 раза выше, чем в плазме. Установлено, что примерно 1,5% материнской дозы экскретировалось в молоко, что эквивалентно дозе для младенца, равной 30% материнской дозы, в пересчете на площадь поверхности тела. Неизвестно, выделяется ли иматиниба мезилат и/или его метаболиты с грудным молоком у женщин. Однако с учетом возможности развития потенциально серьезных побочных реакций у ребенка в случае попадания ЛС в организм, иматиниба мезилат не следует назначать кормящим матерям.
|
|
Побочные эффекты
У пациентов с хроническим миелолейкозом в большинстве случаев наблюдались побочные эффекты от легкой до умеренной степени выраженности. Однако отмена иматиниба мезилата в связи с развитием нежелательных эффектов. связанных с приемом ЛС. была проведена у 4% пациентов с хронической фазой заболевания. у 5% пациентов в фазе обострения и у 5% больных при бластном кризе.
Наиболее частыми побочными эффектами. связанными с терапией иматинибом. были отеки. тошнота и рвота. миалгия и мышечный спазм. диарея. сыпь. Периферические отеки отмечались преимущественно в периорбитальной области и на нижних конечностях, они проходили при терапии диуретиками или при уменьшении дозы иматиниба мезилата. Выраженные периферические отеки наблюдались с частотой 0,9-6%. Побочные эффекты. связанные с задержкой жидкости. включая плевральный выпот. асцит. отек легких и быстрое увеличение массы тела с периферическими отеками или без них. были дозозависимыми. более часто отмечались в исследованиях при бластном кризе и в фазе обострения (у пациентов в этих исследованиях доза составляла 600 мг/сут). и у пожилых пациентов. Эти неблагоприятные эффекты также обычно устранялись после прекращения приема ЛС, при приеме диуретиков. Однако в некоторых случаях эти осложнения могут быть серьезными или угрожающими жизни. Зафиксирован один случай летального исхода у пациента с бластным кризом и появлением плеврального выпота, застойной сердечной недостаточности и почечной недостаточности.
В таблице представлены побочные эффекты, отмеченные в клинических испытаниях у пациентов, получавших иматиниба мезилат, и наблюдавшиеся у ?10% пациентов.
Таблица.
Побочные эффекты, наблюдавшиеся при проведении клинических испытаний у пациентов с хроническим лимфолейкозом.
* Другие эффекты. связанные с задержкой жидкости. включают плевральный выпот. асцит. отек легких. перикардиальный выпот. распространенный отек подкожной клетчатки (анасарка). отягощенные отеки. неспецифическую задержку жидкости.
Гематологическая токсичность. Цитопения, нейтропения и тромбоцитопения постоянно наблюдались во всех исследованиях, с большей частотой - при назначении в высоких (?750 мг) дозах (исследование Фазы I). Однако развитие цитопении у пациентов с ХМЛ зависело также от стадии заболевания. У пациентов с недавно диагностированным ХМЛ цитопения наблюдалась менее часто, чем у других пациентов. Частота нейтропении 3-4 степени (3 степень: число нейтрофилов ?0,5-1,0·109/л. 4 степень: число нейтрофилов <0,5·109/л) и тромбоцитопении (3 степень: число тромбоцитов ?10-50·109/л. 4 степень: число тромбоцитов <10·109/л) была в 2-3 раза выше при бластном кризе и в фазе обострения по сравнению с хронической фазой ХМЛ. Медиана продолжительности эпизодов нейтропении и тромбоцитопении варьировала от 2 до 3 нед и от 3 до 4 нед соответственно. Снижение дозы, либо временное прекращение лечения приводили к уменьшению проявлений гематотоксичности.
Гепатотоксичность. Выраженное повышение уровня трансаминаз или билирубина наблюдалось в 3-6% случаев и обычно контролировалось снижением дозы или временным прекращением лечения (медиана продолжительности таких эпизодов была около 1 нед). Лечение было отменено в связи с изменением лабораторных показателей функции печени менее чем у 1% пациентов. Однако зафиксирован один случай летального исхода - один больной в фазе обострения, принимавший регулярно парацетамол в связи с лихорадкой, умер от острой печеночной недостаточности.
Побочные эффекты у детей. Неблагоприятные эффекты. наблюдавшиеся у 39 детей. получавших иматиниба мезилат. были аналогичны зафиксированным у взрослых пациентов. за исключением костно-мышечных болей. наблюдавшихся реже (20,5%). также не было отмечено периферических отеков.
Побочные эффекты в других популяциях пациентов. У больных ?65 лет, не было отличий в частоте и выраженности неблагоприятных эффектов, за исключением отеков, которые наблюдались более часто. У женщин чаще наблюдалась нейтропения. а также периферические отеки. головная боль. тошнота. озноб. рвота. сыпь. усталость. Не было обнаружено расовых различий, но выборка была очень небольшой.
Наиболее частыми побочными эффектами. связанными с терапией иматинибом. были отеки. тошнота и рвота. миалгия и мышечный спазм. диарея. сыпь. Периферические отеки отмечались преимущественно в периорбитальной области и на нижних конечностях, они проходили при терапии диуретиками или при уменьшении дозы иматиниба мезилата. Выраженные периферические отеки наблюдались с частотой 0,9-6%. Побочные эффекты. связанные с задержкой жидкости. включая плевральный выпот. асцит. отек легких и быстрое увеличение массы тела с периферическими отеками или без них. были дозозависимыми. более часто отмечались в исследованиях при бластном кризе и в фазе обострения (у пациентов в этих исследованиях доза составляла 600 мг/сут). и у пожилых пациентов. Эти неблагоприятные эффекты также обычно устранялись после прекращения приема ЛС, при приеме диуретиков. Однако в некоторых случаях эти осложнения могут быть серьезными или угрожающими жизни. Зафиксирован один случай летального исхода у пациента с бластным кризом и появлением плеврального выпота, застойной сердечной недостаточности и почечной недостаточности.
В таблице представлены побочные эффекты, отмеченные в клинических испытаниях у пациентов, получавших иматиниба мезилат, и наблюдавшиеся у ?10% пациентов.
Таблица.
Побочные эффекты, наблюдавшиеся при проведении клинических испытаний у пациентов с хроническим лимфолейкозом.
| Побочные эффекты | Миелоидный бластный криз (n=260) | Фаза обострения (n=235) | Хроническая фаза, неудача лечения ИФН (n=532) | |||
| Любая степень тяжести (%) | 3/4 степень тяжести (%) | Любая степень тяжести (%) | 3/4 степень тяжести (%) | Любая степень тяжести (%) | 3/4 степень тяжести (%) | |
| Задержка жидкости | 72 | 11 | 76 | 6 | 69 | 4 |
| - периферические отеки | 66 | 6 | 74 | 3 | 67 | 2 |
| - другие эффекты, связанные с задержкой жидкости* | 22 | 6 | 15 | 4 | 7 | 2 |
| Тошнота | 71 | 5 | 73 | 5 | 63 | 3 |
| Мышечный спазм | 28 | 1 | 47 | 0,4 | 62 | 2 |
| Рвота | 54 | 4 | 58 | 3 | 36 | 2 |
| Диарея | 43 | 4 | 57 | 5 | 48 | 3 |
| Геморрагия | 53 | 19 | 49 | 11 | 30 | 2 |
| - ЦНС геморрагия | 9 | 7 | 3 | 3 | 2 | 1 |
| - ЖКТ геморрагия | 8 | 4 | 6 | 5 | 2 | 0,4 |
| Костно-мышечная боль | 42 | 9 | 49 | 9 | 38 | 2 |
| Усталость | 30 | 4 | 46 | 4 | 48 | 1 |
| Кожная сыпь | 36 | 5 | 47 | 5 | 47 | 3 |
| Повышенная температура тела | 41 | 7 | 41 | 8 | 21 | 2 |
| Артралгия | 25 | 5 | 34 | 6 | 40 | 1 |
| Головная боль | 27 | 5 | 32 | 2 | 36 | 0,6 |
| Абдоминальная боль | 30 | 6 | 33 | 4 | 32 | 1 |
| Повышение массы тела | 5 | 1 | 17 | 5 | 32 | 7 |
| Кашель | 14 | 0,8 | 27 | 0,9 | 20 | 0 |
| Диспепсия | 12 | 0 | 22 | 0 | 27 | 0 |
| Миалгия | 9 | 0 | 24 | 2 | 27 | 0,2 |
| Назофарингит | 10 | 0 | 17 | 0 | 22 | 0,2 |
| Астения | 18 | 5 | 21 | 5 | 15 | 0,2 |
| Диспноэ | 15 | 4 | 21 | 7 | 12 | 0,9 |
| Инфекции верхних дыхательных путей | 3 | 0 | 12 | 0,4 | 19 | 0 |
| Анорексия | 14 | 2 | 17 | 2 | 7 | 0 |
| Ночные поты | 13 | 0,8 | 17 | 1 | 14 | 0,2 |
| Запор | 16 | 2 | 16 | 0,9 | 9 | 0,4 |
| Головокружение | 12 | 0,4 | 13 | 0 | 16 | 0,2 |
| Фарингит | 10 | 0 | 12 | 0 | 15 | 0 |
| Инсомния | 10 | 0 | 14 | 0 | 14 | 0,2 |
| Зуд | 8 | 1 | 14 | 0,9 | 14 | 0,8 |
| Гипокалиемия | 13 | 4 | 9 | 2 | 6 | 0,8 |
| Пневмония | 13 | 7 | 10 | 7 | 4 | 1 |
| Тревога | 8 | 0,8 | 12 | 0 | 8 | 0,4 |
| Гепатотоксичность | 10 | 5 | 12 | 6 | 6 | 3 |
| Озноб | 10 | 0 | 12 | 0,4 | 10 | 0 |
| Боль в груди | 7 | 2 | 10 | 0,4 | 11 | 0,8 |
| Грипп | 0,8 | 0,4 | 6 | 0 | 11 | 0,2 |
| Синусит | 4 | 0,4 | 11 | 0,4 | 9 | 0,4 |
* Другие эффекты. связанные с задержкой жидкости. включают плевральный выпот. асцит. отек легких. перикардиальный выпот. распространенный отек подкожной клетчатки (анасарка). отягощенные отеки. неспецифическую задержку жидкости.
Гематологическая токсичность. Цитопения, нейтропения и тромбоцитопения постоянно наблюдались во всех исследованиях, с большей частотой - при назначении в высоких (?750 мг) дозах (исследование Фазы I). Однако развитие цитопении у пациентов с ХМЛ зависело также от стадии заболевания. У пациентов с недавно диагностированным ХМЛ цитопения наблюдалась менее часто, чем у других пациентов. Частота нейтропении 3-4 степени (3 степень: число нейтрофилов ?0,5-1,0·109/л. 4 степень: число нейтрофилов <0,5·109/л) и тромбоцитопении (3 степень: число тромбоцитов ?10-50·109/л. 4 степень: число тромбоцитов <10·109/л) была в 2-3 раза выше при бластном кризе и в фазе обострения по сравнению с хронической фазой ХМЛ. Медиана продолжительности эпизодов нейтропении и тромбоцитопении варьировала от 2 до 3 нед и от 3 до 4 нед соответственно. Снижение дозы, либо временное прекращение лечения приводили к уменьшению проявлений гематотоксичности.
Гепатотоксичность. Выраженное повышение уровня трансаминаз или билирубина наблюдалось в 3-6% случаев и обычно контролировалось снижением дозы или временным прекращением лечения (медиана продолжительности таких эпизодов была около 1 нед). Лечение было отменено в связи с изменением лабораторных показателей функции печени менее чем у 1% пациентов. Однако зафиксирован один случай летального исхода - один больной в фазе обострения, принимавший регулярно парацетамол в связи с лихорадкой, умер от острой печеночной недостаточности.
Побочные эффекты у детей. Неблагоприятные эффекты. наблюдавшиеся у 39 детей. получавших иматиниба мезилат. были аналогичны зафиксированным у взрослых пациентов. за исключением костно-мышечных болей. наблюдавшихся реже (20,5%). также не было отмечено периферических отеков.
Побочные эффекты в других популяциях пациентов. У больных ?65 лет, не было отличий в частоте и выраженности неблагоприятных эффектов, за исключением отеков, которые наблюдались более часто. У женщин чаще наблюдалась нейтропения. а также периферические отеки. головная боль. тошнота. озноб. рвота. сыпь. усталость. Не было обнаружено расовых различий, но выборка была очень небольшой.
|
|
Взаимодействие
Иматиниб повышает концентрацию субстратов изоферментов сYP3A4 (включая триазолобензодиазепины, БКК дигидропиридинового ряда, некоторые ингибиторы ГМГ-КоА-редуктазы , в тч симвастатин, циклоспорин, пимозид), сYP2C9 (варфарин ), сYP2D6, сYP3A5.
Ингибиторы изофермента сYP3A4 (в тч кетоконазол, итраконазол, эритромицин, кларитромицин) увеличивают концентрацию иматиниба в плазме. Показано, что у здоровых добровольцев при совместном приеме иматиниба и однократной дозы кетоконазола значения maxCmax и AUC увеличивались на 26 и 40% соответственно. Индукторы изофермента сYP3A4 (в тч фенитоин, дексаметазон, карбамазепин, рифампицин, фенобарбитал) снижают концентрацию иматиниба в плазме.
В исследованиях in vitro >in vitro показано, что иматиниб ингибирует активность изофермента сYP2D6 цитохрома Р450 в тех же концентрациях, в которых он оказывает действие на активность сYP3A4. В связи с этим возможно усиление системного воздействия препаратов-субстратов сYP2D6 при совместном применении с иматинибом; специальных исследований не проведено, следует соблюдать осторожность.
In vitro иматиниб ингибирует О-глюкуронидацию парацетамола (Ki=58,5 мкМ) при терапевтических уровнях. Системное воздействие парацетамола при совместном применении с иматинибом может возрастать; специальных исследований не проведено, следует соблюдать осторожность.
Ингибиторы изофермента сYP3A4 (в тч кетоконазол, итраконазол, эритромицин, кларитромицин) увеличивают концентрацию иматиниба в плазме. Показано, что у здоровых добровольцев при совместном приеме иматиниба и однократной дозы кетоконазола значения maxCmax и AUC увеличивались на 26 и 40% соответственно. Индукторы изофермента сYP3A4 (в тч фенитоин, дексаметазон, карбамазепин, рифампицин, фенобарбитал) снижают концентрацию иматиниба в плазме.
В исследованиях in vitro >in vitro показано, что иматиниб ингибирует активность изофермента сYP2D6 цитохрома Р450 в тех же концентрациях, в которых он оказывает действие на активность сYP3A4. В связи с этим возможно усиление системного воздействия препаратов-субстратов сYP2D6 при совместном применении с иматинибом; специальных исследований не проведено, следует соблюдать осторожность.
In vitro иматиниб ингибирует О-глюкуронидацию парацетамола (Ki=58,5 мкМ) при терапевтических уровнях. Системное воздействие парацетамола при совместном применении с иматинибом может возрастать; специальных исследований не проведено, следует соблюдать осторожность.
Передозировка
Опыт применения иматиниба в дозах свыше 800 мг ограничен. В случае передозировки необходимо наблюдение за пациентом и проведение соответствующей симптоматической терапии.
Имеется сообщение о повышении уровня сывороточного креатинина (степень тяжести 1). развитии асцита и повышении уровня печеночных трансаминаз (степень тяжести 2). повышении уровня билирубина (степень тяжести 3) у пациента с миелоидным бластным кризом. получавшего иматиниб в дозе 1200 мг в течение 6 дней. Терапия была временно приостановлена и все эти показатели полностью вернулись к исходным значениям в течение 1 нед. Лечение было возобновлено в ежедневной дозе 400 мг, при этом повторного повышения этих показателей не отмечалось.
Также имеется сообщение о развитии сильных мышечных судорог после приема иматиниба в дозе 1600 мг/сут в течение 6 дней. После временного прекращения терапии иматинибом судороги прекратились.
Имеется сообщение о повышении уровня сывороточного креатинина (степень тяжести 1). развитии асцита и повышении уровня печеночных трансаминаз (степень тяжести 2). повышении уровня билирубина (степень тяжести 3) у пациента с миелоидным бластным кризом. получавшего иматиниб в дозе 1200 мг в течение 6 дней. Терапия была временно приостановлена и все эти показатели полностью вернулись к исходным значениям в течение 1 нед. Лечение было возобновлено в ежедневной дозе 400 мг, при этом повторного повышения этих показателей не отмечалось.
Также имеется сообщение о развитии сильных мышечных судорог после приема иматиниба в дозе 1600 мг/сут в течение 6 дней. После временного прекращения терапии иматинибом судороги прекратились.
Способ применения и дозы
Внутрь (во время еды, запивая полным стаканом воды), 1 раз в сутки.
Взрослым, рекомендуемая суточная доза в стадии ремиссии - 400 мг, в стадии обострения и при бластном кризе - 600 мг. При прогрессировании заболевания, недостаточном гематологическом эффекте в течение 3 мес терапии и отсутствии серьезных побочных эффектов возможно увеличение дозы: в стадии ремиссии - до 600 мг/сут, в стадии обострения и при бластном кризе - до 800 мг/сут (по 400 мг 2 раза в сутки). Лечение - длительное, с целью достижения и поддержания клинической и гематологической ремиссии.
В случае появления нейтропении и тромбоцитопении тактика лечения зависит от стадии заболевания. В стадии ремиссии при снижении числа нейтрофилов до 1,0·109/л, тромбоцитов - до 50·109/л лечение прекращают до нормализации показателей (нейтрофилов - не менее 1,5·109/л, тромбоцитов - не менее 75·109/л), затем лечение возобновляют в прежнем режиме (400 мг/сут); если вновь происходит снижение показателей ниже границы допустимых значений, лечение возобновляют после перерыва (необходимого для восстановления показателей крови) в сниженной дозе - 300 мг/сут. При бластном кризе и в стадии обострения (режим дозирования - 600 мг/сут) в случае снижения числа нейтрофилов менее 0,5·109/л и/или числа тромбоцитов - менее 10·109/л лечение прекращают. Для дифференцирования причины, вызвавшей цитопению, проводят биопсию костного мозга; если цитопения не связана с лейкемией, дозу иматиниба мезилата снижают до 400 мг; если цитопения сохраняется в течение последующих 2 нед, дозу уменьшают до 300 мг; если цитопения продолжается до 4 нед, лечение прекращают до восстановления показателей крови (нейтрофилов - не менее 1,0·109/л, тромбоцитов - не менее 20,0·109/л), а затем возобновляют в сниженной дозе - 300 мг/сут.
При нарушении функции печени (увеличение концентрации билирубина в 3 раза по сравнению с верхней границей нормы, активности печеночных трансаминаз - в 5 раз по сравнению с верхней границей нормы) лечение прекращают, пока значения показателей не снизятся до <1,5 и <2,5 соответственно. В этом случае лечение возобновляют, снижая дозы с 400 до 300 мг и с 600 до 400 мг.
Расчет дозы для детей проводится исходя из площади поверхности тела (мг/м2). Общая суточная доза для детей не должна превышать эквивалентные дозировки для взрослых (400 и 600 мг).
Взрослым, рекомендуемая суточная доза в стадии ремиссии - 400 мг, в стадии обострения и при бластном кризе - 600 мг. При прогрессировании заболевания, недостаточном гематологическом эффекте в течение 3 мес терапии и отсутствии серьезных побочных эффектов возможно увеличение дозы: в стадии ремиссии - до 600 мг/сут, в стадии обострения и при бластном кризе - до 800 мг/сут (по 400 мг 2 раза в сутки). Лечение - длительное, с целью достижения и поддержания клинической и гематологической ремиссии.
В случае появления нейтропении и тромбоцитопении тактика лечения зависит от стадии заболевания. В стадии ремиссии при снижении числа нейтрофилов до 1,0·109/л, тромбоцитов - до 50·109/л лечение прекращают до нормализации показателей (нейтрофилов - не менее 1,5·109/л, тромбоцитов - не менее 75·109/л), затем лечение возобновляют в прежнем режиме (400 мг/сут); если вновь происходит снижение показателей ниже границы допустимых значений, лечение возобновляют после перерыва (необходимого для восстановления показателей крови) в сниженной дозе - 300 мг/сут. При бластном кризе и в стадии обострения (режим дозирования - 600 мг/сут) в случае снижения числа нейтрофилов менее 0,5·109/л и/или числа тромбоцитов - менее 10·109/л лечение прекращают. Для дифференцирования причины, вызвавшей цитопению, проводят биопсию костного мозга; если цитопения не связана с лейкемией, дозу иматиниба мезилата снижают до 400 мг; если цитопения сохраняется в течение последующих 2 нед, дозу уменьшают до 300 мг; если цитопения продолжается до 4 нед, лечение прекращают до восстановления показателей крови (нейтрофилов - не менее 1,0·109/л, тромбоцитов - не менее 20,0·109/л), а затем возобновляют в сниженной дозе - 300 мг/сут.
При нарушении функции печени (увеличение концентрации билирубина в 3 раза по сравнению с верхней границей нормы, активности печеночных трансаминаз - в 5 раз по сравнению с верхней границей нормы) лечение прекращают, пока значения показателей не снизятся до <1,5 и <2,5 соответственно. В этом случае лечение возобновляют, снижая дозы с 400 до 300 мг и с 600 до 400 мг.
Расчет дозы для детей проводится исходя из площади поверхности тела (мг/м2). Общая суточная доза для детей не должна превышать эквивалентные дозировки для взрослых (400 и 600 мг).
Меры предосторожности применения
Применение возможно только под наблюдением онколога или гематолога, имеющего опыт подобного лечения.
Задержка жидкости и отеки. Иматиниба мезилат часто вызывает отеки и задержку жидкости в организме ( см «Побочные действия»). В связи с этим пациентам необходимо регулярно следить за массой тела и признаками/симптомами задержки жидкости. При внезапном увеличении массы тела необходимо внимательно исследовать причину и назначить соответствующую терапию. У пациентов старше 65 лет вероятность развития отеков увеличивается и возрастает риск возникновения плеврального и перикардиального выпота, отека легких. Выраженные поверхностные отеки были отмечены в 0,9% случаев у пациентов с недавно диагностированным ХМЛ, получавших иматиниба мезилат, и у 2-6% других взрослых пациентов, находившихся на терапии иматиниба мезилатом. Отеки исчезают при снижении дозы и назначении диуретиков или отмене препарата.
Кровотечение. В клинических испытаниях у 0,7% пациентов с недавно диагностированным ХМЛ наблюдалось кровотечение 3/4 степени тяжести.
Гематологическая токсичность. Лечение иматиниба мезилатом ассоциировано с развитием анемии, нейтропении, тромбоцитопении. Во время терапии необходимо контролировать картину периферической крови еженедельно в течение первого месяца, 1 раз в 2 нед в течение второго месяца и каждые 2-3 мес - в последующий период. При ХМЛ риск развития цитопении зависит от стадии заболевания - увеличивается при бластном кризе и в фазе обострения.
Гепатотоксичность. Гепатотоксичность, иногда выраженная, наблюдается при лечении иматиниба мезилатом ( см «Побочные эффекты»). Во избежание развития печеночной недостаточности до начала лечения, ежемесячно или при наличии клинических признаков во время лечения следует контролировать функцию печени (активность печеночных трансаминаз и ЩФ, содержание билирубина в крови). У пациентов с печеночной недостаточностью показан тщательный контроль концентрации препарата в плазме во избежание интоксикации.
Токсичность при длительном лечении. Следует иметь в виду, что при длительной терапии иматиниба мезилатом существует потенциальный риск возникновения токсичности, в особенности в отношении печени и почек, а также оппортунистических инфекций (как следствие иммуносупрессии), поскольку эти эффекты были отмечены у животных. Так, у собак, получавших ЛС в течение 2 нед, наблюдалась выраженная гепатотоксичность, проявлявшаяся в повышении уровня печеночных ферментов, гепатоцеллюлярном некрозе, некрозе или гиперплазии желчного протока. Нефротоксичность была отмечена у обезьян, получавших ЛС в течение 2 нед; она проявлялась очаговой минерализацией и дилатацией почечных канальцев и нефрозом. У нескольких из этих животных наблюдалось повышение мочевинного азота крови и креатинина. Повышение частоты оппортунистических инфекций при постоянном приеме иматиниба было отмечено в исследованиях на лабораторных животных. В 39-недельном исследовании у обезьян прием иматиниба приводил к усугублению эффективно подавляемой малярийной инфекции у этих животных. Лимфопения наблюдалась у животных (как и у людей).
В случае развития тяжелых негематологических осложнений (таких как гепатотоксичность или задержка жидкости) необходимо отменить прием препарата до исчезновения этих побочных эффектов ( см «Способ применения и дозы»).
Иматиниб может вызывать раздражение ЖКТ, поэтому его рекомендуется принимать вместе с пищей и запивать полным стаканом воды.
Задержка жидкости и отеки. Иматиниба мезилат часто вызывает отеки и задержку жидкости в организме ( см «Побочные действия»). В связи с этим пациентам необходимо регулярно следить за массой тела и признаками/симптомами задержки жидкости. При внезапном увеличении массы тела необходимо внимательно исследовать причину и назначить соответствующую терапию. У пациентов старше 65 лет вероятность развития отеков увеличивается и возрастает риск возникновения плеврального и перикардиального выпота, отека легких. Выраженные поверхностные отеки были отмечены в 0,9% случаев у пациентов с недавно диагностированным ХМЛ, получавших иматиниба мезилат, и у 2-6% других взрослых пациентов, находившихся на терапии иматиниба мезилатом. Отеки исчезают при снижении дозы и назначении диуретиков или отмене препарата.
Кровотечение. В клинических испытаниях у 0,7% пациентов с недавно диагностированным ХМЛ наблюдалось кровотечение 3/4 степени тяжести.
Гематологическая токсичность. Лечение иматиниба мезилатом ассоциировано с развитием анемии, нейтропении, тромбоцитопении. Во время терапии необходимо контролировать картину периферической крови еженедельно в течение первого месяца, 1 раз в 2 нед в течение второго месяца и каждые 2-3 мес - в последующий период. При ХМЛ риск развития цитопении зависит от стадии заболевания - увеличивается при бластном кризе и в фазе обострения.
Гепатотоксичность. Гепатотоксичность, иногда выраженная, наблюдается при лечении иматиниба мезилатом ( см «Побочные эффекты»). Во избежание развития печеночной недостаточности до начала лечения, ежемесячно или при наличии клинических признаков во время лечения следует контролировать функцию печени (активность печеночных трансаминаз и ЩФ, содержание билирубина в крови). У пациентов с печеночной недостаточностью показан тщательный контроль концентрации препарата в плазме во избежание интоксикации.
Токсичность при длительном лечении. Следует иметь в виду, что при длительной терапии иматиниба мезилатом существует потенциальный риск возникновения токсичности, в особенности в отношении печени и почек, а также оппортунистических инфекций (как следствие иммуносупрессии), поскольку эти эффекты были отмечены у животных. Так, у собак, получавших ЛС в течение 2 нед, наблюдалась выраженная гепатотоксичность, проявлявшаяся в повышении уровня печеночных ферментов, гепатоцеллюлярном некрозе, некрозе или гиперплазии желчного протока. Нефротоксичность была отмечена у обезьян, получавших ЛС в течение 2 нед; она проявлялась очаговой минерализацией и дилатацией почечных канальцев и нефрозом. У нескольких из этих животных наблюдалось повышение мочевинного азота крови и креатинина. Повышение частоты оппортунистических инфекций при постоянном приеме иматиниба было отмечено в исследованиях на лабораторных животных. В 39-недельном исследовании у обезьян прием иматиниба приводил к усугублению эффективно подавляемой малярийной инфекции у этих животных. Лимфопения наблюдалась у животных (как и у людей).
В случае развития тяжелых негематологических осложнений (таких как гепатотоксичность или задержка жидкости) необходимо отменить прием препарата до исчезновения этих побочных эффектов ( см «Способ применения и дозы»).
Иматиниб может вызывать раздражение ЖКТ, поэтому его рекомендуется принимать вместе с пищей и запивать полным стаканом воды.
|
|
Список литературы
Physicians Desk Reference. 59-th ed. Thomson PDR. 2005. P. 2320-2325.
Входит в состав
- 4870₽ Филахромин (3 фирмы)
- 4233-6100₽ Филахромин ФС
- 11440-12765₽ Гливек (2 фирмы)
- 27100₽ Неопакс (КРКА-Рус )
- 32449₽ Иглиб
- 60500₽ Иматиб (3 фирмы)
- — Албитиниб (2 фирмы)
- — Генфатиниб (3 фирмы)
- — Гистамель
- — Глемихиб (Sun Pharmaceutical Industries Ltd. )
- — Имаглив
- — Иматиниб (15 фирм)
- — Иматиниб Гриндекс
- — Иматиниб Д-р Редди с
- — Иматиниб медак
- — Иматиниб-Актавис
- — Иматиниб-Альвоген
- — Иматиниб-Сигардис (5 фирм)
- — Иматиниб-ТЛ (Технология лекарств )
- — Иматиниб-Тева (2 фирмы)
- — Иматиниба мезилат форма X (2 фирмы)
- — Имвек
- — Цитониб
- — Цитонибонко (2 фирмы)