Другие названия и синонимы
Capecitabine.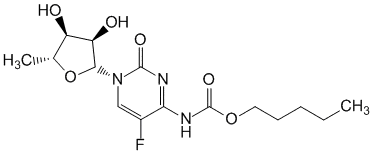
Фармакологическая группа
|
|
Латинское название
Capecitabinum ( сapecitabini).
Химическое название
5 -Дезокси-5-фтор-N-[(пентилокси)карбонил]цитидин.
Используется в лечении
- C50 Злокачественные новообразования молочной железы
- C20 Злокачественное новообразование прямой кишки
- C21 Злокачественное новообразование заднего прохода [ануса] и анального канала
- C19 Злокачественное новообразование ректосигмоидного соединения
- C18 Злокачественное новообразование ободочной кишки
- C16 Злокачественное новообразование желудка
Код CAS
154361-50-9.
Фармакологическое действие
Противоопухолевое.
Характеристика вещества
Антиметаболит, производное фторпиримидина карбамата, молекулярная масса 359,35, растворимость в воде - 26 мг/мл при 20°C.
Фармакодинамика
Активируется в ткани опухоли и оказывает на нее селективное цитотоксическое действие; in vitro >in vitro капецитабин цитотоксическим действием не обладает. В организме превращается в 5-фторурацил (5-ФУ), который подвергается дальнейшему метаболизму. Образование 5-ФУ из капецитабина происходит в ткани опухоли (под действием опухолевого ангиогенного фактора тимидинфосфорилазы), что сводит к минимуму системное воздействие 5-ФУ на здоровые ткани организма. Как здоровые, так и опухолевые клетки метаболизируют 5-ФУ в цитотоксически активные метаболиты: 5-фтор−2 -дезоксиуридина монофосфат (ФдУМФ) и 5-фторуридина трифосфат (ФУТФ). Метаболиты 5-ФУ повреждают клетки посредством двух различных механизмов. Во-первых, ФдУМФ и фолатный кофактор N5-10-метилентетрагидрофолат ковалентно связываются с тимидилатсинтетазой с образованием третичного комплекса, что нарушает образование из урацила тимидилата - предшественника тимидина (тимидина трифосфат необходим для синтеза ДНК, его недостаток приводит к угнетению клеточного деления). Во-вторых, в процессе синтеза РНК транскрипционные ферменты ядра могут ошибочно включить в нее ФУТФ вместо уридина трифосфата (УТФ), и эта метаболическая «ошибка» нарушает процессинг РНК и синтез белка.
Последовательная ферментная биотрансформация капецитабина в 5-ФУ создает в опухолевых клетках высокие концентрации последнего. После приема капецитабина внутрь больными раком толстой кишки концентрация 5-ФУ в ткани опухоли больше его концентрации в прилежащих здоровых тканях в 3,2 раза. Соотношение концентрации 5-ФУ в ткани опухоли и плазме 21,4, соотношение его концентрации в здоровых тканях и плазме 8,9. Активность тимидинфосфорилазы в первичной колоректальной опухоли в 4 раза выше, чем в прилежащих здоровых тканях. Содержание тимидинфосфорилазы, участвующей в превращении метаболита капецитабина - 5 -дезокси−5-фторуридина (5 -ДФУР) в 5-ФУ, в опухолевых клетках у больных раком молочной железы, желудка, толстой кишки, шейки матки и яичника значительно выше, чем в соответствующих здоровых тканях.
Подтверждена возможность применения капецитабина как препарата выбора при метастазирующем раке толстой (ободочной и прямой) кишки. Суммарная частота объективной ремиссии составляла 25,7% при лечении капецитабином и 16,7% при лечении по схеме - в/в кальция фолинат в дозе 20 мг/м2 с последующим в/в струйным введением 5-ФУ в дозе 425 мг/м2 в 1-5 дни через каждые 28 дней (р<0,0002). Медиана времени до прогрессирования заболевания и медиана выживаемости были сравнимы.
Подтверждена эффективность применения капецитабина в комбинации с доцетакселом для лечения местнораспространенного или метастазирующего рака молочной железы при неэффективности цитотоксической химиотерапии, включающей антрациклины. Лечение капецитабином (по 1250 мг/м2 2 раза в сутки в течение 2 нед с последующим недельным перерывом) в комбинации с доцетакселом (в/в инфузионно в течение 1 ч 75 мг/м2 1 раз в 3 нед) улучшает выживаемость, увеличивает частоту объективной ремиссии, время до прогрессирования заболевания или летального исхода.
Капецитабин не оказывает мутагенное действие in vitro >in vitro на бактериальные клетки (тест Эймса) и клетки млекопитающих (тест генной мутации на клетках китайских хомячков V79/HPRT). Показано кластогенное действие in vitro >in vitro на лимфоциты периферической крови человека. Капецитабин оказывал тератогенное действие (анофтальмия, микрофтальмия, олигодактилия, полидактилия, синдактилия, расширение желудочков мозга ) и повышал летальность эмбрионов у мышей в дозе 198 мг/кг/сут. У обезьян в дозе 90 мг/кг/сут также отмечалось увеличение гибели эмбрионов в процессе органогенеза. У самок мышей в дозе 760 мг/кг/сут вызывал снижение фертильности, у самцов - дегенеративные изменения в яичках (уменьшение количества сперматозоидов).
После приема внутрь капецитабин быстро и полностью всасывается из ЖКТ, после чего происходит его трансформация в метаболиты, 5 -дезокси−5-фторцитидин (5 -ДФЦТ) и 5 -ДФУР. Одновременный прием пищи уменьшает скорость всасывания капецитабина, однако на величину AUC 5 -ДФУР и следующего метаболита - 5-ФУ - влияет незначительно. При назначении препарата в дозе 1250 мг/м2 после приема пищи Сmax капецитабина, 5 -ДФЦТ, 5 -ДФУР, 5-ФУ и неактивного метаболита альфа-фтор-бета аланина (ФБАЛ) на 14-й день составили соответственно 4,47; 3,05; 12,1; 0,95 и 5,46 мкг/мл. Время достижения Сmax составляло 1,5; 2,0; 2,0; 2,0 и 3,34 а AUC - 7,75; 7,24; 24,6; 2,03 и 36,3 мкг/ч/мл соответственно.
Капецитабин первоначально гидролизуется с помощью карбоксилэстеразы печени в 5 -ДФЦТ, который превращается в 5 -ДФУР под действием цитидиндезаминазы печени и опухолевых тканей, и далее метаболизируется до 5-ФУ под действием тимидинфосфорилазы. 5-ФУ метаболизируется в активные метаболиты ФдУМФ и ФУТФ и менее токсичный 5-фтор−5,6-дигидро-фторурацил (под действием дигидропиримидиндегидрогеназы). Последний метаболизируется (в результате расщепления пиримидинового кольца) до неактивных метаболитов - 5-фторуреидопропионовой кислоты и ФБАЛ.
Связывание с белками (главным образом с альбумином) капецитабина, 5 -ДФЦТ, 5 -ДФУР и 5-ФУ составляет соответственно 54, 10, 62 и 10%. Т1/2 капецитабина, 5 -ДФЦТ, 5 -ДФУР, 5-ФУ и ФБАЛ составляет 0,85; 1,11; 0,66; 0,76 и 3,23 ч соответственно.
Фармакокинетические параметры капецитабина, 5 -ДФЦТ и 5 -ДФУР на 1-й и 14-й дни не отличаются, в диапазоне терапевтических доз носят дозозависимый характер, за исключением 5-ФУ. AUC 5-ФУ увеличивается к 14 дню на 30-35% и далее не возрастает.
Выводится главным образом с мочой - 95,5%; с фекалиями - 2,6%. Основным метаболитом в моче является ФБАЛ (57% принятой дозы), около 3% принятой дозы выводится с мочой в неизмененном виде. У больных с легким и умеренным нарушением функции печени, обусловленным метастатическим поражением, у пациентов пожилого возраста фармакокинетические параметры и процессы биоактивации капецитабина клинически значимо не изменяются. AUC ФБАЛ увеличивалась у больных в возрасте 65 лет и старше (увеличение возраста на 20% сопровождалось увеличением AUC ФБАЛ на 15%), что, вероятно, обусловлено изменением функции почек.
Результаты фармакокинетического исследования, проведенного у онкологических больных с различной степенью (от легкой до тяжелой) почечной недостаточности, показали, что фармакокинетика неизмененного препарата и 5-ФУ не зависит от клиренса креатинина. Клиренс креатинина влияет на величину AUC 5 -ДФУР (увеличение AUC на 35% - при снижении сl креатинина на 50%) и ФБАЛ (увеличение AUC на 114% - при снижении сl креатинина на 50%). При тяжелой почечной недостаточности (Cl креатинина менее 30 мл/мин) изменения фармакокинетических свойств не изучались.
Последовательная ферментная биотрансформация капецитабина в 5-ФУ создает в опухолевых клетках высокие концентрации последнего. После приема капецитабина внутрь больными раком толстой кишки концентрация 5-ФУ в ткани опухоли больше его концентрации в прилежащих здоровых тканях в 3,2 раза. Соотношение концентрации 5-ФУ в ткани опухоли и плазме 21,4, соотношение его концентрации в здоровых тканях и плазме 8,9. Активность тимидинфосфорилазы в первичной колоректальной опухоли в 4 раза выше, чем в прилежащих здоровых тканях. Содержание тимидинфосфорилазы, участвующей в превращении метаболита капецитабина - 5 -дезокси−5-фторуридина (5 -ДФУР) в 5-ФУ, в опухолевых клетках у больных раком молочной железы, желудка, толстой кишки, шейки матки и яичника значительно выше, чем в соответствующих здоровых тканях.
Подтверждена возможность применения капецитабина как препарата выбора при метастазирующем раке толстой (ободочной и прямой) кишки. Суммарная частота объективной ремиссии составляла 25,7% при лечении капецитабином и 16,7% при лечении по схеме - в/в кальция фолинат в дозе 20 мг/м2 с последующим в/в струйным введением 5-ФУ в дозе 425 мг/м2 в 1-5 дни через каждые 28 дней (р<0,0002). Медиана времени до прогрессирования заболевания и медиана выживаемости были сравнимы.
Подтверждена эффективность применения капецитабина в комбинации с доцетакселом для лечения местнораспространенного или метастазирующего рака молочной железы при неэффективности цитотоксической химиотерапии, включающей антрациклины. Лечение капецитабином (по 1250 мг/м2 2 раза в сутки в течение 2 нед с последующим недельным перерывом) в комбинации с доцетакселом (в/в инфузионно в течение 1 ч 75 мг/м2 1 раз в 3 нед) улучшает выживаемость, увеличивает частоту объективной ремиссии, время до прогрессирования заболевания или летального исхода.
Капецитабин не оказывает мутагенное действие in vitro >in vitro на бактериальные клетки (тест Эймса) и клетки млекопитающих (тест генной мутации на клетках китайских хомячков V79/HPRT). Показано кластогенное действие in vitro >in vitro на лимфоциты периферической крови человека. Капецитабин оказывал тератогенное действие (анофтальмия, микрофтальмия, олигодактилия, полидактилия, синдактилия, расширение желудочков мозга ) и повышал летальность эмбрионов у мышей в дозе 198 мг/кг/сут. У обезьян в дозе 90 мг/кг/сут также отмечалось увеличение гибели эмбрионов в процессе органогенеза. У самок мышей в дозе 760 мг/кг/сут вызывал снижение фертильности, у самцов - дегенеративные изменения в яичках (уменьшение количества сперматозоидов).
После приема внутрь капецитабин быстро и полностью всасывается из ЖКТ, после чего происходит его трансформация в метаболиты, 5 -дезокси−5-фторцитидин (5 -ДФЦТ) и 5 -ДФУР. Одновременный прием пищи уменьшает скорость всасывания капецитабина, однако на величину AUC 5 -ДФУР и следующего метаболита - 5-ФУ - влияет незначительно. При назначении препарата в дозе 1250 мг/м2 после приема пищи Сmax капецитабина, 5 -ДФЦТ, 5 -ДФУР, 5-ФУ и неактивного метаболита альфа-фтор-бета аланина (ФБАЛ) на 14-й день составили соответственно 4,47; 3,05; 12,1; 0,95 и 5,46 мкг/мл. Время достижения Сmax составляло 1,5; 2,0; 2,0; 2,0 и 3,34 а AUC - 7,75; 7,24; 24,6; 2,03 и 36,3 мкг/ч/мл соответственно.
Капецитабин первоначально гидролизуется с помощью карбоксилэстеразы печени в 5 -ДФЦТ, который превращается в 5 -ДФУР под действием цитидиндезаминазы печени и опухолевых тканей, и далее метаболизируется до 5-ФУ под действием тимидинфосфорилазы. 5-ФУ метаболизируется в активные метаболиты ФдУМФ и ФУТФ и менее токсичный 5-фтор−5,6-дигидро-фторурацил (под действием дигидропиримидиндегидрогеназы). Последний метаболизируется (в результате расщепления пиримидинового кольца) до неактивных метаболитов - 5-фторуреидопропионовой кислоты и ФБАЛ.
Связывание с белками (главным образом с альбумином) капецитабина, 5 -ДФЦТ, 5 -ДФУР и 5-ФУ составляет соответственно 54, 10, 62 и 10%. Т1/2 капецитабина, 5 -ДФЦТ, 5 -ДФУР, 5-ФУ и ФБАЛ составляет 0,85; 1,11; 0,66; 0,76 и 3,23 ч соответственно.
Фармакокинетические параметры капецитабина, 5 -ДФЦТ и 5 -ДФУР на 1-й и 14-й дни не отличаются, в диапазоне терапевтических доз носят дозозависимый характер, за исключением 5-ФУ. AUC 5-ФУ увеличивается к 14 дню на 30-35% и далее не возрастает.
Выводится главным образом с мочой - 95,5%; с фекалиями - 2,6%. Основным метаболитом в моче является ФБАЛ (57% принятой дозы), около 3% принятой дозы выводится с мочой в неизмененном виде. У больных с легким и умеренным нарушением функции печени, обусловленным метастатическим поражением, у пациентов пожилого возраста фармакокинетические параметры и процессы биоактивации капецитабина клинически значимо не изменяются. AUC ФБАЛ увеличивалась у больных в возрасте 65 лет и старше (увеличение возраста на 20% сопровождалось увеличением AUC ФБАЛ на 15%), что, вероятно, обусловлено изменением функции почек.
Результаты фармакокинетического исследования, проведенного у онкологических больных с различной степенью (от легкой до тяжелой) почечной недостаточности, показали, что фармакокинетика неизмененного препарата и 5-ФУ не зависит от клиренса креатинина. Клиренс креатинина влияет на величину AUC 5 -ДФУР (увеличение AUC на 35% - при снижении сl креатинина на 50%) и ФБАЛ (увеличение AUC на 114% - при снижении сl креатинина на 50%). При тяжелой почечной недостаточности (Cl креатинина менее 30 мл/мин) изменения фармакокинетических свойств не изучались.
|
|
Показания к применению
Рак молочной железы (местнораспространенный или метастазирующий). Монотерапия - при неэффективности химиотерапии препаратами из группы таксанов (паклитаксел) или антрациклинового ряда или при наличии противопоказаний к химиотерапии антрациклинами. Комбинированная терапия с доцетакселом - при неэффективности химиотерапии, включающей препараты антрациклинового ряда. Рак толстой кишки (метастазирующий).
Противопоказания
Гиперчувствительность (в тч к фторурацилу и другим фторпиримидинам в анамнезе). тяжелая почечная недостаточность (Cl креатинина ниже 30 мл/мин). дефицит дигидропиримидиндегидрогеназы. при комбинированном лечении с доцетакселом следует учитывать противопоказания к применению доцетаксела.
Ограничения к использованию
ИБС, гипербилирубинемия, метастатическое поражение печени с нарушением ее функции, пожилой или детский возраст (до 18 лет).
При беременности и кормлении грудью
Противопоказано при беременности.
Категория действия на плод по FDA. D.
На время лечения следует прекратить грудное вскармливание.
Категория действия на плод по FDA. D.
На время лечения следует прекратить грудное вскармливание.
Побочные эффекты
Со стороны нервной системы и органов чувств. Более чем у 2% больных - утомляемость. головная боль. парестезии. слабость. астения. головокружение. нарушение вкуса. периферическая нейропатия. бессонница. сонливость. усиление слезоотделения. конъюнктивит. раздражение глаз. менее чем у 2% - спутанность сознания. энцефалопатия. мозжечковая симптоматика (атаксия. дизартрия. нарушение равновесия и координации).
Со стороны сердечно-сосудистой системы (кроветворение. гемостаз): более чем у 2% больных - анемия. менее чем у 2% больных - кардиалгия. кардиомиопатия. стенокардия. ишемия миокарда. инфаркт миокарда. сердечная недостаточность. внезапная смерть. тахикардия. наджелудочковая аритмия (включая фибрилляцию предсердий). желудочковая экстрасистолия. гипо- или гипертензия. тромбофлебит. флебит. угнетение костного мозга. панцитопения.
Со стороны респираторной системы. Более чем у 2% больных - одышка. кашель. боль в горле. редко - бронхоспазм. диспноэ. респираторный дистресс-синдром. эмболия легочных сосудов.
Со стороны органов ЖКТ. Более чем у 2% больных - диарея. тошнота. рвота. стоматит. боль в животе. в эпигастрии. запор. анорексия. снижение аппетита. диспепсия. сухость во рту. метеоризм. нарушение консистенции стула (мягкий стул). кандидоз полости рта. гипербилирубинемия. менее чем у 2% больных - язвенно-воспалительное поражение слизистых оболочек (эзофагит. гастрит. дуоденит. колит. желудочно-кишечные кровотечения). Описаны случаи печеночной недостаточности и холестатического гепатита (их причинная связь с применением капецитабина не установлена).
Со стороны опорно-двигательного аппарата: более чем у 2% больных при монотерапии и более чем у 5% больных при лечении в комбинации с доцетакселом - боль в конечностях. миалгия. артралгия. боль в пояснице. отек нижних конечностей.
Со стороны кожных покровов. Более чем у 2% больных - ладонно-подошвенный синдром (онемение. парестезия. покалывание. отеки. покраснение. шелушение. образование волдырей и резкий болевой синдром). дерматит. сухость кожи. эритематозная сыпь. алопеция. зуд. очаговое шелушение. гиперпигментация. поражение ногтей. менее чем у 2% больных - трещины кожи. фотосенсибилизация. синдром. напоминающий лучевой дерматит. онихолизис. ломкость. обесцвечивание и дистрофия ногтей.
Прочие. Менее чем у 2% больных - инфекции на фоне миелосупрессии. ослабления иммунитета и нарушения целостности слизистых оболочек (бактериальные. вирусные и грибковые. местные и системные. с фатальным исходом). сепсис. боль в грудной клетке. изменение уровня АЛТ. АСТ. гипергликемия. более чем у 5% больных при лечении в комбинации с доцетакселом - дегидратация. снижение массы тела. очень редко - стеноз слезно-носового канала. носовое кровотечение.
Со стороны сердечно-сосудистой системы (кроветворение. гемостаз): более чем у 2% больных - анемия. менее чем у 2% больных - кардиалгия. кардиомиопатия. стенокардия. ишемия миокарда. инфаркт миокарда. сердечная недостаточность. внезапная смерть. тахикардия. наджелудочковая аритмия (включая фибрилляцию предсердий). желудочковая экстрасистолия. гипо- или гипертензия. тромбофлебит. флебит. угнетение костного мозга. панцитопения.
Со стороны респираторной системы. Более чем у 2% больных - одышка. кашель. боль в горле. редко - бронхоспазм. диспноэ. респираторный дистресс-синдром. эмболия легочных сосудов.
Со стороны органов ЖКТ. Более чем у 2% больных - диарея. тошнота. рвота. стоматит. боль в животе. в эпигастрии. запор. анорексия. снижение аппетита. диспепсия. сухость во рту. метеоризм. нарушение консистенции стула (мягкий стул). кандидоз полости рта. гипербилирубинемия. менее чем у 2% больных - язвенно-воспалительное поражение слизистых оболочек (эзофагит. гастрит. дуоденит. колит. желудочно-кишечные кровотечения). Описаны случаи печеночной недостаточности и холестатического гепатита (их причинная связь с применением капецитабина не установлена).
Со стороны опорно-двигательного аппарата: более чем у 2% больных при монотерапии и более чем у 5% больных при лечении в комбинации с доцетакселом - боль в конечностях. миалгия. артралгия. боль в пояснице. отек нижних конечностей.
Со стороны кожных покровов. Более чем у 2% больных - ладонно-подошвенный синдром (онемение. парестезия. покалывание. отеки. покраснение. шелушение. образование волдырей и резкий болевой синдром). дерматит. сухость кожи. эритематозная сыпь. алопеция. зуд. очаговое шелушение. гиперпигментация. поражение ногтей. менее чем у 2% больных - трещины кожи. фотосенсибилизация. синдром. напоминающий лучевой дерматит. онихолизис. ломкость. обесцвечивание и дистрофия ногтей.
Прочие. Менее чем у 2% больных - инфекции на фоне миелосупрессии. ослабления иммунитета и нарушения целостности слизистых оболочек (бактериальные. вирусные и грибковые. местные и системные. с фатальным исходом). сепсис. боль в грудной клетке. изменение уровня АЛТ. АСТ. гипергликемия. более чем у 5% больных при лечении в комбинации с доцетакселом - дегидратация. снижение массы тела. очень редко - стеноз слезно-носового канала. носовое кровотечение.
Взаимодействие
В комбинации с циклофосфамидом возможно усиление цитотоксичности (в опухолевой ткани повышается активность тимидинфосфорилазы). При одновременном приеме с кумариновыми антикоагулянтами (варфарин и фенпрокумон) возможны нарушения показателей свертывания и кровотечения (возникали в пределах от нескольких дней до нескольких месяцев от начала терапии капецитабином, в одном случае - через месяц после ее завершения). Повышает концентрацию фенитоина в плазме. Антациды, содержащие гидроксиды алюминия и магния, повышают концентрации капецитабина и 5 -ДФЦТ в плазме. Соривудин и аналоги усиливают токсичность фторпиримидинов (угнетают дигидропиримидиндегидрогеназу). Кальция фолинат, паклитаксел, доцетаксел не влияют на фармакокинетические свойства капецитабина и его метаболитов.
Передозировка
Симптомы. Тошнота. рвота. диарея. мукозит. раздражение ЖКТ и кровотечения. угнетение функции костного мозга.
Лечение. Симптоматическое.
Лечение. Симптоматическое.
Способ применения и дозы
Внутрь, запивая водой, через 30 мин после еды (не позже). Средняя суточная доза - 2500 мг/м2, в 2 приема (утром и вечером), в течение 2 нед. После недельного перерыва курс повторяют. В комбинации с доцетакселом - по 1250 мг/м2 2 раза в день в течение 2 нед, перерыв 1 нед (доцетаксел - в/в инфузионно в течение 1 ч в дозе 75 мг/м2 1 раз в 3 нед).
Суточную дозу капецитабина рассчитывают на площадь поверхности тела. При площади поверхности тела менее 1,26 м2 суммарная суточная доза составляет 3000 мг; 1,27-1,38 м2 - 3300 мг; 1,39-1,52 м2 - 3600 мг; 1,53-1,66 м2 - 4000 мг; 1,67-1,78 м2 - 4300 мг; 1,79-1,92 м2 - 4600 мг; 1,93-2,06 м2 - 5000 мг; 2,07-2,18 м2 - 5300 мг; более 2,19 м2 - 5600 мг. У больных с умеренной почечной недостаточностью (Cl креатинина - 30-50 мл/мин) или при проявлениях токсичности дозу снижают до 75 и 50% исходной как при монотерапии, так и при комбинированной терапии.
Суточную дозу капецитабина рассчитывают на площадь поверхности тела. При площади поверхности тела менее 1,26 м2 суммарная суточная доза составляет 3000 мг; 1,27-1,38 м2 - 3300 мг; 1,39-1,52 м2 - 3600 мг; 1,53-1,66 м2 - 4000 мг; 1,67-1,78 м2 - 4300 мг; 1,79-1,92 м2 - 4600 мг; 1,93-2,06 м2 - 5000 мг; 2,07-2,18 м2 - 5300 мг; более 2,19 м2 - 5600 мг. У больных с умеренной почечной недостаточностью (Cl креатинина - 30-50 мл/мин) или при проявлениях токсичности дозу снижают до 75 и 50% исходной как при монотерапии, так и при комбинированной терапии.
Меры предосторожности применения
Во время лечения необходим тщательный врачебный контроль с целью своевременного выявления признаков токсичности (диарея, тошнота, стоматит, нейтропения ). При возникновении токсических симптомов, в зависимости от их выраженности, возможно проведение симптоматической терапии, снижение дозы, перерыв в лечении или полная отмена. Токсичность I степени включает незначительное клиническое проявление побочных эффектов; II степени - диарею (4-6 раз в сутки или ночной стул), появление болезненного покраснения, отеков кистей и/или стоп с нарушением повседневной активности пациента, гипербилирубинемию в 1,5 раза выше верхней границы нормы; III степени - диарею (7-9 раз в сутки, недержание кала или синдром мальабсорбции), влажную десквамацию, изъязвление, образование пузырей, резкие боли в кистях и/или стопах, резко снижающие повседневную активность и работоспособность пациента, гипербилирубинемию в 1,5-3 раза выше верхней границы нормы; IV степени - диарею (более 10 раз в сутки, наличие примеси крови в кале, необходимость проведения парентеральной терапии), гипербилирубинемию в 3 и более раза выше верхней границы нормы.
При монотерапии при развитии токсичности I степени коррекции дозы не требуется ни в текущем, ни в последующих циклах терапии. При токсичности II степени применение капецитабина следует прервать до снижения выраженности нежелательных явлений до I степени; лечение возобновляют в дозе 100, 75 и 50% рекомендованной при первом, втором и третьем появлении признаков токсичности этой степени соответственно. При четвертом появлении - терапию прекращают и не возобновляют. При развитии признаков токсичности III степени лечение прерывают; при уменьшении побочных эффектов до I степени прием возобновляют в дозе, составляющей 75% прежней; при втором появлении признаков токсичности - 50% рекомендованной дозы; при третьем появлении - терапию отменяют. При появлении признаков токсичности IV степени лечение следует прекратить; при уменьшении побочных эффектов до I степени прием возобновляют в дозе, составляющей 50% прежней. Если дозу пришлось снизить, увеличивать ее впоследствии нельзя, при пропущенном приеме - доза не восполняется.
В случае развития токсичности при комбинированной терапии коррекцию дозы капецитабина и доцетаксела проводят по общим принципам. Если какие-либо явления токсичности не являются серьезными или не угрожают жизни (алопеция, изменение вкуса, изменение ногтей), лечение можно продолжать в той же дозе. В начале каждого цикла терапии, если ожидается отсрочка с введением доцетаксела или капецитабина, необходимо отложить введение до тех пор, пока не появится возможность возобновить терапию обоими препаратами. Если доцетаксел приходится отменить, лечение капецитабином можно продолжить в соответствии с требованиями к возобновлению терапии капецитабином.
У больных с легким и умеренным нарушением функции печени, вызванным метастазами в печень, с легкой степенью почечной недостаточности (Cl креатинина 51-80 мл/мин) коррекция начальной дозы не требуется.
На фоне ИБС во время лечения необходимо тщательное наблюдение, направленное на выявление признаков кардиотоксичности (проявляется изменениями на ЭКГ, возможны инфаркт миокарда, стенокардия, аритмия, кардиогенный шок, остановка сердца, сердечная недостаточность). Пациентам с метастазами в печень требуется лабораторный контроль ее функций. Следует иметь в виду, что с возрастом увеличивается чувствительность к токсическому действию 5-ФУ.
Необходимо воздержаться от применения в педиатрической практике, поскольку безопасность и эффективность использования у детей не определены.
Женщины детородного возраста во время лечения должны использовать надежные методы контрацепции. Если беременность возникает во время терапии, следует предупредить пациентку о возможной опасности для плода.
С осторожностью назначают больным с почечной недостаточностью. У больных с умеренно выраженной почечной недостаточностью (Cl креатинина 30-50 мл/мин) частота нежелательных побочных действий III-IV степени тяжести выше.
С осторожностью применяют у пациентов, занимающихся потенциально опасными видами деятельности, требующими концентрации внимания и быстроты психомоторных реакций.
У больных, принимающих одновременно капецитабин и пероральные антикоагулянты - производные кумарина, необходимо тщательно контролировать показатели свертываемости (протромбиновое время) и соответствующим образом корректировать дозу антикоагулянта.
При монотерапии при развитии токсичности I степени коррекции дозы не требуется ни в текущем, ни в последующих циклах терапии. При токсичности II степени применение капецитабина следует прервать до снижения выраженности нежелательных явлений до I степени; лечение возобновляют в дозе 100, 75 и 50% рекомендованной при первом, втором и третьем появлении признаков токсичности этой степени соответственно. При четвертом появлении - терапию прекращают и не возобновляют. При развитии признаков токсичности III степени лечение прерывают; при уменьшении побочных эффектов до I степени прием возобновляют в дозе, составляющей 75% прежней; при втором появлении признаков токсичности - 50% рекомендованной дозы; при третьем появлении - терапию отменяют. При появлении признаков токсичности IV степени лечение следует прекратить; при уменьшении побочных эффектов до I степени прием возобновляют в дозе, составляющей 50% прежней. Если дозу пришлось снизить, увеличивать ее впоследствии нельзя, при пропущенном приеме - доза не восполняется.
В случае развития токсичности при комбинированной терапии коррекцию дозы капецитабина и доцетаксела проводят по общим принципам. Если какие-либо явления токсичности не являются серьезными или не угрожают жизни (алопеция, изменение вкуса, изменение ногтей), лечение можно продолжать в той же дозе. В начале каждого цикла терапии, если ожидается отсрочка с введением доцетаксела или капецитабина, необходимо отложить введение до тех пор, пока не появится возможность возобновить терапию обоими препаратами. Если доцетаксел приходится отменить, лечение капецитабином можно продолжить в соответствии с требованиями к возобновлению терапии капецитабином.
У больных с легким и умеренным нарушением функции печени, вызванным метастазами в печень, с легкой степенью почечной недостаточности (Cl креатинина 51-80 мл/мин) коррекция начальной дозы не требуется.
На фоне ИБС во время лечения необходимо тщательное наблюдение, направленное на выявление признаков кардиотоксичности (проявляется изменениями на ЭКГ, возможны инфаркт миокарда, стенокардия, аритмия, кардиогенный шок, остановка сердца, сердечная недостаточность). Пациентам с метастазами в печень требуется лабораторный контроль ее функций. Следует иметь в виду, что с возрастом увеличивается чувствительность к токсическому действию 5-ФУ.
Необходимо воздержаться от применения в педиатрической практике, поскольку безопасность и эффективность использования у детей не определены.
Женщины детородного возраста во время лечения должны использовать надежные методы контрацепции. Если беременность возникает во время терапии, следует предупредить пациентку о возможной опасности для плода.
С осторожностью назначают больным с почечной недостаточностью. У больных с умеренно выраженной почечной недостаточностью (Cl креатинина 30-50 мл/мин) частота нежелательных побочных действий III-IV степени тяжести выше.
С осторожностью применяют у пациентов, занимающихся потенциально опасными видами деятельности, требующими концентрации внимания и быстроты психомоторных реакций.
У больных, принимающих одновременно капецитабин и пероральные антикоагулянты - производные кумарина, необходимо тщательно контролировать показатели свертываемости (протромбиновое время) и соответствующим образом корректировать дозу антикоагулянта.
|
|
Особые указания
При комбинированной терапии с доцетакселом при признаках гематологической токсичности лечение можно возобновить только после того, как число нейтрофилов превысит 1500/мкл (степень 0-I). Дозу доцетаксела следует уменьшить с 75 до 55 мг/м2 у больных с нейтропенией IV степени (менее 500 клеток в 1 мкл) продолжительностью более 1 нед или с фебрильной нейтропенией. Если нейтропения IV степени или фебрильная нейтропения развиваются при лечении доцетакселом в дозе 55 мг/м2, его следует отменить. Больным с исходным числом нейтрофилов менее 1500/мкл или с числом тромбоцитов менее 100000/мкл нельзя назначать комбинированную терапию капецитабином и доцетакселом. При развитии тяжелых реакций гиперчувствительности применение препаратов прекращают и назначают соответствующую терапию. При первом появлении признаков периферической нейропатии II степени токсичности дозу доцетаксела уменьшают до 55 мг/м2, при появлении токсичности III степени доцетаксел отменяют. Необходимо тщательно контролировать такие тяжелые (III или IV степени) явления токсичности, возможно связанные с применением доцетаксела, как плевральный или перикардиальный выпот или асцит. При их появлении доцетаксел следует отменить, лечение капецитабином можно продолжать без изменения дозы. Доцетаксел не следует назначать больным с уровнем билирубина, превышающим верхнюю границу нормы. Дозу доцетаксела корректируют при увеличении активности АЛТ, АСТ или ЩФ.
Дегидратацию (может быстро развиваться у больных с анорексией, астенией, тошнотой, рвотой или диареей) необходимо предупреждать или устранять в самом начале возникновения. При развитии дегидратации II степени или выше лечение капецитабином следует немедленно прервать и провести регидратацию. Лечение нельзя возобновлять до завершения регидратации и устранения или коррекции вызвавших ее факторов.
Дегидратацию (может быстро развиваться у больных с анорексией, астенией, тошнотой, рвотой или диареей) необходимо предупреждать или устранять в самом начале возникновения. При развитии дегидратации II степени или выше лечение капецитабином следует немедленно прервать и провести регидратацию. Лечение нельзя возобновлять до завершения регидратации и устранения или коррекции вызвавших ее факторов.
Входит в состав
- 2500₽ Кабецин (3 фирмы)
- 1478-7832₽ Капаметин ФС (3 фирмы)
- 4719₽ Ксалвобин (4 фирмы)
- 8724-9475₽ Кселода (5 фирм)
- 8919-10020₽ Тутабин (3 фирмы)
- 3101-16119₽ Капецитовер
- 9480-11115₽ Капецитабин (20 фирм)
- EOX
- EСX
- GEMCAP
- T-XP
- XELIRI
- XELOX (CAPOX)
- XP
- — Капецитабин Д-р Редди`с
- — Капецитабин-ТЛ (Технология лекарств )
- — Капецитабин-промомед