Другие названия и синонимы
Cefepime.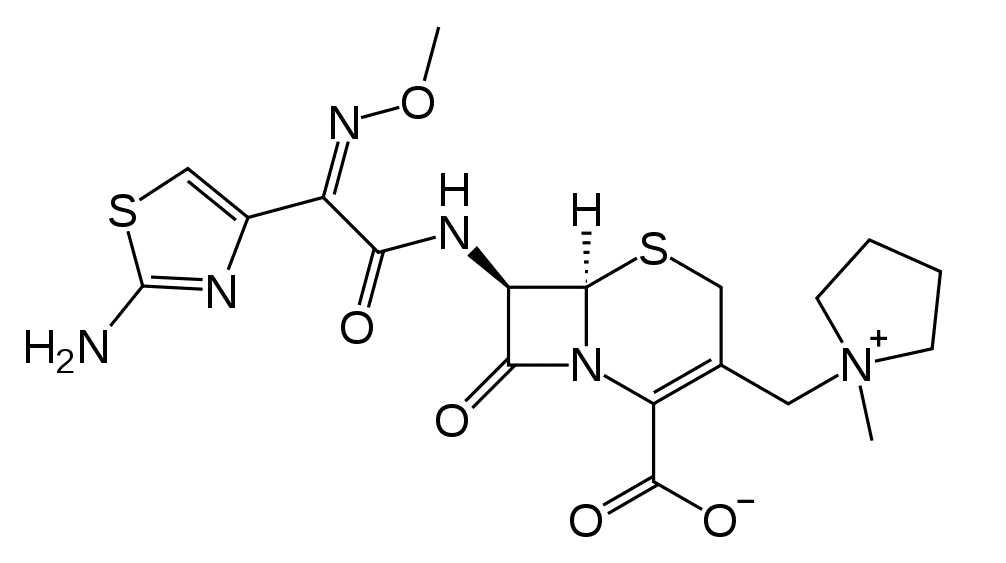
Фармакологическая группа
|
|
Латинское название
Cefepimum ( сefepimi).
Химическое название
1-[[7-[[(2-Амино-4-тиазолил)(метоксиимино)ацетил]амино]-2-карбокси-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-3-ил]метил]-1-метилпирролидиния гидроксид (внутренняя соль).
Используется в лечении
- N73.9 Воспалительные болезни женских тазовых органов неуточненные
- N39.0 Инфекция мочевыводящих путей без установленной локализации
- N12 Тубулоинтерстициальный нефрит, не уточненный как острый или хронический
- M71.1 Другие инфекционные бурситы
- M71.0 Абсцесс синовиальной сумки
- M65.0 Абсцесс оболочки сухожилия
- M65 Синовиты и тендосиновиты
- M60.0 Инфекционные миозиты
- L08.9 Местная инфекция кожи и подкожной клетчатки неуточненная
- K81 Холецистит
- K65 Перитонит
- J42 Хронический бронхит неуточненный
- J20.9 Острый бронхит неуточненный
- J18 Пневмония без уточнения возбудителя
- G00.9 Бактериальный менингит неуточненный
- R57.2 Септический шок
- Z100* КЛАСС xxii хирургическая практика
- A41.9 Септицемия неуточненная
Код CAS
88040-23-7.
Фармакологическое действие
Антибактериальное, бактерицидное.
Характеристика вещества
Цефепим в виде гидрохлорид представляет собой порошок от белого до бледно-желтого цвета, содержит в 1 мг не менее 825 и не более 911 мкг цефепима в расчете на безводное вещество. Хорошо растворим в воде.
Фармакодинамика
Полусинтетическое цефалоспориновое антибактериальное средство для парентерального введения.
Механизм действия.
Цефепим оказывает бактерицидное действие путем ингибирования синтеза бактериальной клеточной стенки. Цефепим обладает широким спектром активности in vitro >in vitro в отношении многих грамположительных и грамотрицательных бактерий. В бактериальных клетках молекулярными мишенями цефепима являются ПСБ.
Фармакодинамика.
Как и в случае с другими бета-лактамными противомикробными ЛС, было показано, что время, когда концентрация несвязанной формы цефепима в плазме превышает МПК для инфицирующего микроорганизма, наилучшим образом коррелирует с эффективностью на животных моделях инфекции. Однако взаимосвязь параметров фармакокинетики цефепима с его фармакодинамическими эффектами у пациентов не оценивалась.
Механизм действия.
Цефепим оказывает бактерицидное действие путем ингибирования синтеза бактериальной клеточной стенки. Цефепим обладает широким спектром активности in vitro >in vitro в отношении многих грамположительных и грамотрицательных бактерий. В бактериальных клетках молекулярными мишенями цефепима являются ПСБ.
Фармакодинамика.
Как и в случае с другими бета-лактамными противомикробными ЛС, было показано, что время, когда концентрация несвязанной формы цефепима в плазме превышает МПК для инфицирующего микроорганизма, наилучшим образом коррелирует с эффективностью на животных моделях инфекции. Однако взаимосвязь параметров фармакокинетики цефепима с его фармакодинамическими эффектами у пациентов не оценивалась.
Фармакокинетика
Выведение цефепима у здоровых добровольцев происходило главным образом путем почечной экскреции со средним 1/2T1/2 (± стандартное отклонение) (2±0,3) ч и общим клиренсом в организме (120±8) мл/мин. Фармакокинетика цефепима линейна в диапазоне доз от 250 мг до 2 г и не меняется в зависимости от продолжительности лечения. Отсутствуют доказательства накопления цефепима у здоровых взрослых добровольцев мужского пола (n=7), получавших клинически значимые дозы в течение 9 дней.
Фармакокинетические параметры после однократной 30-минутной в/в инфузий цефепима в дозах 500 мг, 1 и 2 г у здоровых взрослых добровольцев мужского пола (n=9) приведены в таблице 1.
Таблица 1.
Средние фармакокинетические параметры (± стандартное отклонение) при в/в введении цефепима.
Фармакокинетические параметры после однократной в/м инъекции цефепима у здоровых взрослых добровольцев мужского пола (n=6) суммированы в таблице 2.
Таблица 2.
Средние фармакокинетические параметры (± стандартное отклонение) при в/м введении цефепима.
Абсорбция.
После в/м введения цефепим полностью всасывается.
Распределение.
Средний стационарный dVd цефепима составляет (18±2) л. Связывание цефепима с белками сыворотки крови составляет приблизительно 20% и не зависит от его концентрации в сыворотке. Цефепим выделяется с женским молоком в концентрации 0,5 мкг/мл. Грудной ребенок, потребляющий примерно 1000 мл женского молока в день, будет получать примерно 0,5 мг цефепима в день.
Таблица 3.
Средняя концентрация цефепима в жидкостях и тканях организма.
Метаболизм и выведение.
Цефепим метаболизируется до N-метилпирролидона (NMП), который быстро превращается в N-оксид (NMП-N-оксид). Выведение неизмененного цефепима с мочой составляет примерно 85% от введенной дозы. Менее 1% введенной дозы определяется в моче в виде NMП, 6,8% в виде NMП-N-оксида и 2,5% в виде эпимера цефепима. Поскольку почечная экскреция является важным путем элиминации ЛС, пациентам с нарушением функции почек и пациентам, находящимся на гемодиализе, требуется коррекция дозы.
Особые группы пациентов.
Пожилой возраст. Фармакокинетика цефепима была исследована у пожилых (65 лет и старше) мужчин (n=12) и женщин (n=12), средний сl креатинина которых составлял (74±15) мл/мин. Наблюдалось снижение общего клиренса цефепима в организме в зависимости от сl креатинина. Поэтому дозу цефепима у пожилых людей следует корректировать соответствующим образом, если сl креатинина составляет ≤60 мл/мин.
Дети. Фармакокинетика цефепима была оценена у педиатрических пациентов от 2 мес до 11 лет после однократного и многократного введения каждые 8 (n=29) и каждые 12 ч (n=13) по назначению. После однократного в/в введения дозы общий клиренс в организме и ssVss составили в среднем (3,3±1) мл/мин/кг и (0,3±0,1) л/кг соответственно. Выведение неизмененного цефепима с мочой составило (60,4±30,4)% от введенной дозы, а средний почечный клиренс - (2±1,1) мл/мин/кг. Не выявлено существенного влияния возраста или пола (25 пациентов мужского пола и 17 пациентов женского пола) на общий клиренс или dVd, скорректированные по массе тела. Не наблюдалось накопления при введении цефепима в дозе 50 мг/кг каждые 12 ч (n=13), в то время как maxCmax, AUC и Т1/2 увеличивались примерно на 15% в равновесном состоянии после введения 50 мг/кг каждые 8 Воздействие цефепима после в/в введения в дозе 50 мг/кг у детей сопоставимо с воздействием цефепима у взрослых при в/в дозе 2 г. Абсолютная биодоступность цефепима после в/м введения в дозе 50 мг/кг составила (82,3±15)% у 8 пациентов.
Нарушение функции почек. Фармакокинетика цефепима была исследована у пациентов с различной степенью нарушения функции почек (n=30). Средний 1/2T1/2 у пациентов, нуждающихся в гемодиализе, составлял (13,5±2,7) а у пациентов, нуждающихся в непрерывном перитонеальном диализе, - (19±2) Общий клиренс цефепима в организме снижался пропорционально сl креатинина у пациентов с нарушением функции почек, что служит основой для рекомендаций по коррекции дозы у этой группы пациентов.
Нарушение функции печени. Фармакокинетика цефепима не изменялась у пациентов с нарушением функции печени, которые получали однократную дозу 1 г (n=11).
Микробиология.
Антимикробная активность.
Цефепим активен в отношении большинства изолятов следующих микроорганизмов, как in vitro >in vitro, так и при клинических инфекциях.
Грамотрицательные бактерии: Enterobacter spp., Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis, Pseudomonas aeruginosa.
Грамположительные бактерии: Staphylococcus aureus (только изоляты, чувствительные к метициллину), Streptococcus pneumoniae, Streptococcus pyogenes, стрептококки группы Viridans.
Имеются следующие данные in vitro >in vitro, клиническая значимость которых неизвестна. По меньшей мере 90% следующих бактерий демонстрируют МПК in vitro >in vitro, меньшую или равную пороговому значению чувствительности для цефепима в отношении изолятов аналогичного рода или группы организмов. Однако эффективность цефепима в лечении клинических инфекций, вызванных этими бактериями, не была установлена в ходе адекватных и хорошо контролируемых клинических исследований.
Грамположительные бактерии: Staphylococcus epidermidis (только изоляты, чувствительные к метициллину), Staphylococcus saprophyticus, Streptococcus agalactiae.
Большинство изолятов энтерококков, например Enterococcus faecalis, и метициллинрезистентных стафилококков устойчивы к цефепиму.
Грамотрицательные бактерии: Acinetobacter calcoaceticus, подвид lwoffii, сitrobacter diversus, сitrobacter freundii, Enterobacter agglomerans, Haemophilus influenzae, Hafnia alvei, Klebsiella oxytoca, Moraxella catarrhalis, Morganella morganii, Proteus vulgaris, Providencia rettgeri, Providencia stuartii, Serratia marcescens.
Цефепим неактивен в отношении многих изолятов Stenotrophomonas maltophilia.
Методы определения чувствительности.
При наличии возможности лаборатория клинической микробиологии должна предоставлять врачу результаты тестов на чувствительность микроорганизмов in vitro >in vitro к противомикробным ЛС, используемым в медицинских учреждениях (стационарах), в виде периодических отчетов, описывающих профиль чувствительности внутрибольничных и внебольничных патогенов. Эти отчеты должны помочь врачу в выборе соответствующего антибактериального ЛС для лечения.
Методы разведения.
Для определения МПК антимикробных ЛС используются количественные методы. Эти МПК позволяют оценить чувствительность бактерий к противомикробным соединениям. МПК следует определять с использованием стандартизированного метода исследований (разведение в бульоне и/или агаре).
Диффузионые методы.
Количественные методы, требующие измерения диаметра зоны, также дают предварительную оценку чувствительности бактерий к противомикробным соединениям. Размер зоны следует определять с использованием стандартизированного метода исследования. В этой процедуре для проверки чувствительности микроорганизмов к цефепиму используются бумажные диски, пропитанные 30 мкг цефепима.
Критерии интерпретации чувствительности микрорганизмов к цефепиму представлены в таблице 4.
Таблица 4.
Критерии интерпретации тестов на чувствительность к цефепиму.
1 Для умеренно резистентных изолятов Enterobacteriaceae следует применять дозу 2 г каждые 8 ч у пациентов с нормальной функцией почек.
2 Для Pseudomonas aeruginosa следует применять дозу 2 г в/в каждые 8 ч у пациентов с нормальной функцией почек.
3 Для изолятов, не вызывающих менингита, МПК пенициллина <0,06 мкг/мл (или диаметр зоны для оксациллина >20 мм) может служить предиктором чувствительности к цефепиму.
Чувствительность стафилоккоков к цефепиму может быть оценена по тестам только с пенициллином и либо с цефокситином, или оксациллином.
Категория Чувствительные означает, что противомикробное ЛС, вероятно, будет подавлять рост возбудителя, если достигнет необходимой для этого концентрации в очаге инфекции. Результат Умеренно резистентный указывает на неоднозначность, и если микроорганизм не полностью чувствителен к альтернативным, клинически эффективным ЛС, тест следует повторить. Данная категория подразумевает возможность клинического применения в тех органах и тканях организма, где ЛС физиологически сконцентрировано, или в ситуациях, когда можно применять высокие дозы ЛС. Эта категория также обеспечивает буферную зону, которая предотвращает возникновение серьезных расхождений в интерпретации из-за небольших неконтролируемых технических факторов. Результат Резистентные указывает, что противомикробное ЛС вряд ли будет подавлять рост возбудителя при достижении концентрации, обычно наблюдаемой в очаге инфекции, и следует выбрать другую терапию.
Канцерогенез, мутагенез, влияние на фертильность репродуктивной функции.
Исследования канцерогенности цефепима на животных не проводились.
В исследованиях хромосомных аберраций цефепим был положительным на кластогенность в первичных лимфоцитах человека, но отрицательным в клетках яичников китайского хомячка. В других тестах in vitro >in vitro (мутация бактерий и клеток млекопитающих, восстановление ДНК в первичных гепатоцитах крыс и обмен хроматидами в лимфоцитах человека) цефепим был отрицательным на генотоксические эффекты. Кроме того, оценки цефепима in vivo >in vivo у мышей (2 исследования на хромосомные аберрации и 2 микроядерных исследования) были отрицательными на кластогенность.
При п/к введении цефепима в дозах до 1000 мг/кг/сут (в 1,6 раза выше МРДЧ в рачете на площадь поверхности тела) у крыс не наблюдалось неблагоприятного воздействия на фертильность.
Клинические исследования.
Фебрильная нейтропения.
Безопасность и эффективность эмпирической монотерапии цефепимом у пациентов с фебрильной нейтропенией оценивали в двух многоцентровых рандомизированных исследованиях, в которых сравнивали применение монотерапии цефепимом (2 г в/в каждые 8 ч) и цефтазидимом (2 г в/в каждые 8 ч). В этих исследованиях приняли участие 317 пациентов, подлежавших оценке (таблица 5).
Таблица 5.
Демографические данные пациентов, подлежавших оценке (только первые эпизоды).
Таблица 6.
Объединенные показатели ответа на эмпирическую терапию у пациентов с фебрильной нейтропенией.
Существует недостаточно данных, подтверждающих эффективность монотерапии цефепимом у пациентов с высоким риском развития тяжелой инфекции (включая пациентов с недавней трансплантацией костного мозга в анамнезе, артериальной гипотензией, обусловленной гематологической злокачественной опухолью, или с тяжелой или длительной нейтропенией). Данные о пациентах с септическим шоком отсутствуют.
Осложненные внутрибрюшные инфекции.
Пациенты, госпитализированные с осложненными внутрибрюшными инфекциями, участвовали в рандомизированном двойном слепом многоцентровом исследовании, в котором сравнивали применение комбинации цефепима (2 г каждые 12 ч) с метронидазолом (в/в, 500 мг каждые 6 ч) и комбинации имипенем + циластатин (500 мг каждые 6 ч) в течение максимальной продолжительности терапии, равной 14 дням. Исследование было проведено для демонстрации эквивалентности двух методов лечения. Первичные анализы были проведены у популяции, состоящей из пациентов с хирургически подтвержденной осложненной инфекцией по крайней мере с одним изолятом патогена, выделенного до лечения, в течение 5 дней лечения и 4-6 нед наблюдения после лечения. Пациенты в группе получавших комбинацию имипенем + циластатин имели более высокие показатели по шкале APACHE II в исходном состоянии. В остальном группы лечения были в целом сопоставимы по своим характеристикам до лечения. Общая частота клинического излечения среди пациентов с первичным анализом составила 81% (51 вылеченных из 63 оцениваемых пациентов) в группе получавших комбинацию цефепим + метронидазол и 66% (62 из 94) в группе получавших комбинацию имипенем + циластатин. Наблюдаемые различия в эффективности, возможно, были обусловлены большей долей пациентов с высокими показателями по шкале APACHE II в группе получавших комбинацию имипенем + циластатин.
Фармакокинетические параметры после однократной 30-минутной в/в инфузий цефепима в дозах 500 мг, 1 и 2 г у здоровых взрослых добровольцев мужского пола (n=9) приведены в таблице 1.
Таблица 1.
Средние фармакокинетические параметры (± стандартное отклонение) при в/в введении цефепима.
| Параметр | 500 мг | 1 г | 2 г |
| Сmax, мкг/мл | 39,1 (3,5) | 81,7 (5,1) | 163,9 (25,3) |
| AUC, мкг·ч/мл | 70,8 (6,7) | 148,5 (15,1) | 284,8 (30,6) |
Фармакокинетические параметры после однократной в/м инъекции цефепима у здоровых взрослых добровольцев мужского пола (n=6) суммированы в таблице 2.
Таблица 2.
Средние фармакокинетические параметры (± стандартное отклонение) при в/м введении цефепима.
| Параметр | 500 мг | 1 г | 2 г |
| Сmax, мкг/мл | 13,9 (3,4) | 29,6 (4,4) | 57,5 (9,5) |
| Tmax, ч | 1,4 (0,9) | 1,6 (0,4) | 1,5 (0,4) |
| AUC, мкг·ч/мл | 60 (8) | 137 (11) | 262 (23) |
Абсорбция.
После в/м введения цефепим полностью всасывается.
Распределение.
Средний стационарный dVd цефепима составляет (18±2) л. Связывание цефепима с белками сыворотки крови составляет приблизительно 20% и не зависит от его концентрации в сыворотке. Цефепим выделяется с женским молоком в концентрации 0,5 мкг/мл. Грудной ребенок, потребляющий примерно 1000 мл женского молока в день, будет получать примерно 0,5 мг цефепима в день.
Таблица 3.
Средняя концентрация цефепима в жидкостях и тканях организма.
| Ткань или жидкость | Доза, путь введения | Количество пациентов | Среднее время забора проб после введения цефепима, ч | Средняя концентрация |
| Пузырная жидкость | 2 г, в/в | 6 | 1,5 | 81,4 мкг/мл |
| Слизистая оболочка бронхов | 2 г, в/в | 20 | 4,8 | 24,1 мкг/г |
| Мокрота | 2 г, в/в | 5 | 4 | 7,4 мкг/мл |
| Моча | 500 мг, в/в | 8 | 0-4 | 292 мкг/мл |
| 1 г, в/в | 12 | 0-4 | 926 мкг/мл | |
| 2 г, в/в | 12 | 0-4 | 3120 мкг/мл | |
| Желчь | 2 г, в/в | 26 | 9,4 | 17,8 мкг/мл |
| Перитонеальная жидкость | 2 г, в/в | 19 | 4,4 | 18,3 мкг/мл |
| Аппендикс | 2 г, в/в | 31 | 5,7 | 5,2 мкг/г |
| Желчный пузырь | 2 г, в/в | 38 | 8,9 | 11,9 мкг/г |
| Простата | 2 г, в/в | 5 | 1 | 31,5 мкг/г |
Метаболизм и выведение.
Цефепим метаболизируется до N-метилпирролидона (NMП), который быстро превращается в N-оксид (NMП-N-оксид). Выведение неизмененного цефепима с мочой составляет примерно 85% от введенной дозы. Менее 1% введенной дозы определяется в моче в виде NMП, 6,8% в виде NMП-N-оксида и 2,5% в виде эпимера цефепима. Поскольку почечная экскреция является важным путем элиминации ЛС, пациентам с нарушением функции почек и пациентам, находящимся на гемодиализе, требуется коррекция дозы.
Особые группы пациентов.
Пожилой возраст. Фармакокинетика цефепима была исследована у пожилых (65 лет и старше) мужчин (n=12) и женщин (n=12), средний сl креатинина которых составлял (74±15) мл/мин. Наблюдалось снижение общего клиренса цефепима в организме в зависимости от сl креатинина. Поэтому дозу цефепима у пожилых людей следует корректировать соответствующим образом, если сl креатинина составляет ≤60 мл/мин.
Дети. Фармакокинетика цефепима была оценена у педиатрических пациентов от 2 мес до 11 лет после однократного и многократного введения каждые 8 (n=29) и каждые 12 ч (n=13) по назначению. После однократного в/в введения дозы общий клиренс в организме и ssVss составили в среднем (3,3±1) мл/мин/кг и (0,3±0,1) л/кг соответственно. Выведение неизмененного цефепима с мочой составило (60,4±30,4)% от введенной дозы, а средний почечный клиренс - (2±1,1) мл/мин/кг. Не выявлено существенного влияния возраста или пола (25 пациентов мужского пола и 17 пациентов женского пола) на общий клиренс или dVd, скорректированные по массе тела. Не наблюдалось накопления при введении цефепима в дозе 50 мг/кг каждые 12 ч (n=13), в то время как maxCmax, AUC и Т1/2 увеличивались примерно на 15% в равновесном состоянии после введения 50 мг/кг каждые 8 Воздействие цефепима после в/в введения в дозе 50 мг/кг у детей сопоставимо с воздействием цефепима у взрослых при в/в дозе 2 г. Абсолютная биодоступность цефепима после в/м введения в дозе 50 мг/кг составила (82,3±15)% у 8 пациентов.
Нарушение функции почек. Фармакокинетика цефепима была исследована у пациентов с различной степенью нарушения функции почек (n=30). Средний 1/2T1/2 у пациентов, нуждающихся в гемодиализе, составлял (13,5±2,7) а у пациентов, нуждающихся в непрерывном перитонеальном диализе, - (19±2) Общий клиренс цефепима в организме снижался пропорционально сl креатинина у пациентов с нарушением функции почек, что служит основой для рекомендаций по коррекции дозы у этой группы пациентов.
Нарушение функции печени. Фармакокинетика цефепима не изменялась у пациентов с нарушением функции печени, которые получали однократную дозу 1 г (n=11).
Микробиология.
Антимикробная активность.
Цефепим активен в отношении большинства изолятов следующих микроорганизмов, как in vitro >in vitro, так и при клинических инфекциях.
Грамотрицательные бактерии: Enterobacter spp., Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis, Pseudomonas aeruginosa.
Грамположительные бактерии: Staphylococcus aureus (только изоляты, чувствительные к метициллину), Streptococcus pneumoniae, Streptococcus pyogenes, стрептококки группы Viridans.
Имеются следующие данные in vitro >in vitro, клиническая значимость которых неизвестна. По меньшей мере 90% следующих бактерий демонстрируют МПК in vitro >in vitro, меньшую или равную пороговому значению чувствительности для цефепима в отношении изолятов аналогичного рода или группы организмов. Однако эффективность цефепима в лечении клинических инфекций, вызванных этими бактериями, не была установлена в ходе адекватных и хорошо контролируемых клинических исследований.
Грамположительные бактерии: Staphylococcus epidermidis (только изоляты, чувствительные к метициллину), Staphylococcus saprophyticus, Streptococcus agalactiae.
Большинство изолятов энтерококков, например Enterococcus faecalis, и метициллинрезистентных стафилококков устойчивы к цефепиму.
Грамотрицательные бактерии: Acinetobacter calcoaceticus, подвид lwoffii, сitrobacter diversus, сitrobacter freundii, Enterobacter agglomerans, Haemophilus influenzae, Hafnia alvei, Klebsiella oxytoca, Moraxella catarrhalis, Morganella morganii, Proteus vulgaris, Providencia rettgeri, Providencia stuartii, Serratia marcescens.
Цефепим неактивен в отношении многих изолятов Stenotrophomonas maltophilia.
Методы определения чувствительности.
При наличии возможности лаборатория клинической микробиологии должна предоставлять врачу результаты тестов на чувствительность микроорганизмов in vitro >in vitro к противомикробным ЛС, используемым в медицинских учреждениях (стационарах), в виде периодических отчетов, описывающих профиль чувствительности внутрибольничных и внебольничных патогенов. Эти отчеты должны помочь врачу в выборе соответствующего антибактериального ЛС для лечения.
Методы разведения.
Для определения МПК антимикробных ЛС используются количественные методы. Эти МПК позволяют оценить чувствительность бактерий к противомикробным соединениям. МПК следует определять с использованием стандартизированного метода исследований (разведение в бульоне и/или агаре).
Диффузионые методы.
Количественные методы, требующие измерения диаметра зоны, также дают предварительную оценку чувствительности бактерий к противомикробным соединениям. Размер зоны следует определять с использованием стандартизированного метода исследования. В этой процедуре для проверки чувствительности микроорганизмов к цефепиму используются бумажные диски, пропитанные 30 мкг цефепима.
Критерии интерпретации чувствительности микрорганизмов к цефепиму представлены в таблице 4.
Таблица 4.
Критерии интерпретации тестов на чувствительность к цефепиму.
| Патогенный микроорганизм | МПК, мкг/мл | Диаметр зоны по диско-диффузионному методу, мм | ||||
| Чувствительные | Умеренно резистентные | Резистентные | Чувствительные | Умеренно резистентные | Резистентные | |
| Enterobacteriaceae | ≤2 | 4-81 | ≥16 | ≥25 | 19-24 | ≤18 |
| Pseudomonas aeruginosa2 | ≤8 | − | ≥16 | ≥18 | − | ≤17 |
| Streptococcus pneumoniae3 (изоляты, не вызывающие менингита) | ≤1 | 2 | ≥4 | − | − | − |
| Streptococcus pyogenes | ≤0,5 | − | − | ≥24 | − | − |
| Стрептококки группы Viridans | ≤1 | 2 | ≥4 | ≥24 | 22-23 | ≤21 |
1 Для умеренно резистентных изолятов Enterobacteriaceae следует применять дозу 2 г каждые 8 ч у пациентов с нормальной функцией почек.
2 Для Pseudomonas aeruginosa следует применять дозу 2 г в/в каждые 8 ч у пациентов с нормальной функцией почек.
3 Для изолятов, не вызывающих менингита, МПК пенициллина <0,06 мкг/мл (или диаметр зоны для оксациллина >20 мм) может служить предиктором чувствительности к цефепиму.
Чувствительность стафилоккоков к цефепиму может быть оценена по тестам только с пенициллином и либо с цефокситином, или оксациллином.
Категория Чувствительные означает, что противомикробное ЛС, вероятно, будет подавлять рост возбудителя, если достигнет необходимой для этого концентрации в очаге инфекции. Результат Умеренно резистентный указывает на неоднозначность, и если микроорганизм не полностью чувствителен к альтернативным, клинически эффективным ЛС, тест следует повторить. Данная категория подразумевает возможность клинического применения в тех органах и тканях организма, где ЛС физиологически сконцентрировано, или в ситуациях, когда можно применять высокие дозы ЛС. Эта категория также обеспечивает буферную зону, которая предотвращает возникновение серьезных расхождений в интерпретации из-за небольших неконтролируемых технических факторов. Результат Резистентные указывает, что противомикробное ЛС вряд ли будет подавлять рост возбудителя при достижении концентрации, обычно наблюдаемой в очаге инфекции, и следует выбрать другую терапию.
Канцерогенез, мутагенез, влияние на фертильность репродуктивной функции.
Исследования канцерогенности цефепима на животных не проводились.
В исследованиях хромосомных аберраций цефепим был положительным на кластогенность в первичных лимфоцитах человека, но отрицательным в клетках яичников китайского хомячка. В других тестах in vitro >in vitro (мутация бактерий и клеток млекопитающих, восстановление ДНК в первичных гепатоцитах крыс и обмен хроматидами в лимфоцитах человека) цефепим был отрицательным на генотоксические эффекты. Кроме того, оценки цефепима in vivo >in vivo у мышей (2 исследования на хромосомные аберрации и 2 микроядерных исследования) были отрицательными на кластогенность.
При п/к введении цефепима в дозах до 1000 мг/кг/сут (в 1,6 раза выше МРДЧ в рачете на площадь поверхности тела) у крыс не наблюдалось неблагоприятного воздействия на фертильность.
Клинические исследования.
Фебрильная нейтропения.
Безопасность и эффективность эмпирической монотерапии цефепимом у пациентов с фебрильной нейтропенией оценивали в двух многоцентровых рандомизированных исследованиях, в которых сравнивали применение монотерапии цефепимом (2 г в/в каждые 8 ч) и цефтазидимом (2 г в/в каждые 8 ч). В этих исследованиях приняли участие 317 пациентов, подлежавших оценке (таблица 5).
Таблица 5.
Демографические данные пациентов, подлежавших оценке (только первые эпизоды).
| Показатель | Цефепим (n=164) | Цефтазидим (n=153) |
| Средний возраст, лет | 56 (от 18 до 82) | 55 (от 16 до 84) |
| Мужчины | 86 (52%) | 85 (56%) |
| Женщины | 78 (48%) | 68 (44%) |
| Лейкемия | 65 (40%) | 52 (34%) |
| Другие гематологические злокачественные новообразования | 43 (26%) | 36 (24%) |
| Сóлидная опухоль | 54 (33%) | 56 (37%) |
| Среднее абсолютное снижение числа нейтрофилов, клетки/мкл | 20 (диапазон от 0 до 500) | 20 (диапазон от 0 до 500) |
| Средняя продолжительность нейтропении, дни | 6 (диапазон от 0 до 39) | 6 (диапазон от 0 до 32) |
| Внутренний венозный катетер | 97 (59%) | 86 (56%) |
| Профилактический прием антибактериальных ЛС | 62 (38%) | 64 (42%) |
| Трансплантат костного мозга | 9 (5%) | 7 (5%) |
| сАД меньше 90 мм | 7 (4%) | 2 (1%) |
Таблица 6.
Объединенные показатели ответа на эмпирическую терапию у пациентов с фебрильной нейтропенией.
| Итоговый показатель | Доля ответа на эмпирическую терапию, % | |
| Цефепим (n=164) | Цефтазидим (n=153) | |
| Первичный эпизод разрешен без изменений в лечении, новых лихорадочных эпизодов или инфекции, а пероральный прием антибиотиков позволил завершить лечение | 51 | 55 |
| Первичный эпизод разрешен без изменений в лечении, новых лихорадочных эпизодов или инфекции и без перорального приема антибиотиков после лечения | 34 | 39 |
| Выживание, любая разрешенная модификация лечения | 93 | 97 |
| Первичный эпизод разрешен без изменений в лечении, и пероральный прием антибиотиков позволил завершить лечение | 62 | 67 |
| Первичный эпизод разрешен без изменений в лечении и без перорального приема антибиотиков после лечения | 46 | 51 |
Существует недостаточно данных, подтверждающих эффективность монотерапии цефепимом у пациентов с высоким риском развития тяжелой инфекции (включая пациентов с недавней трансплантацией костного мозга в анамнезе, артериальной гипотензией, обусловленной гематологической злокачественной опухолью, или с тяжелой или длительной нейтропенией). Данные о пациентах с септическим шоком отсутствуют.
Осложненные внутрибрюшные инфекции.
Пациенты, госпитализированные с осложненными внутрибрюшными инфекциями, участвовали в рандомизированном двойном слепом многоцентровом исследовании, в котором сравнивали применение комбинации цефепима (2 г каждые 12 ч) с метронидазолом (в/в, 500 мг каждые 6 ч) и комбинации имипенем + циластатин (500 мг каждые 6 ч) в течение максимальной продолжительности терапии, равной 14 дням. Исследование было проведено для демонстрации эквивалентности двух методов лечения. Первичные анализы были проведены у популяции, состоящей из пациентов с хирургически подтвержденной осложненной инфекцией по крайней мере с одним изолятом патогена, выделенного до лечения, в течение 5 дней лечения и 4-6 нед наблюдения после лечения. Пациенты в группе получавших комбинацию имипенем + циластатин имели более высокие показатели по шкале APACHE II в исходном состоянии. В остальном группы лечения были в целом сопоставимы по своим характеристикам до лечения. Общая частота клинического излечения среди пациентов с первичным анализом составила 81% (51 вылеченных из 63 оцениваемых пациентов) в группе получавших комбинацию цефепим + метронидазол и 66% (62 из 94) в группе получавших комбинацию имипенем + циластатин. Наблюдаемые различия в эффективности, возможно, были обусловлены большей долей пациентов с высокими показателями по шкале APACHE II в группе получавших комбинацию имипенем + циластатин.
|
|
Показания к применению
Пневмония (средней и тяжелой степени), вызванная чувствительными штаммами Streptococcus pneumoniae, включая случаи, связанные с одновременной бактериемией Pseudomonas aeruginosa, Klebsiella pneumoniae или видами Enterobacter.
Фебрильная нейтропения (эмпирическая монотерапия у пациентов с высоким риском развития тяжелой инфекции. включая пациентов с недавней трансплантацией костного мозга в анамнезе. артериальной гипотензией на момент первичного осмотра. гематологической злокачественной опухолью или тяжелой или длительной нейтропенией. Существует недостаточно данных, подтверждающих эффективность монотерапии цефепимом у таких пациентов).
Неосложненные и осложненные инфекции мочевыводящих путей (включая пиелонефрит). вызванные чувствительными изолятами Escherichia coli или Klebsiella pneumoniae. когда инфекция тяжелая. или Escherichia coli. Klebsiella pneumoniae или Proteus mirabilis. когда тяжесть инфекции от легкой до умеренной. включая случаи. связанные с одновременной бактериемией. вызванной этими бактериями.
Неосложненные инфекции кожи, вызванные золотистым стафилококком (только изоляты, чувствительные к метициллину) или Streptococcus pyogenes.
Осложненные внутрибрюшные инфекции (в комбинации с метронидазолом) у взрослых. вызванные чувствительными изолятами Escherichia coli. стрептококками группы Viridans. Pseudomonas aeruginosa. Klebsiella pneumoniae. Enterobacter species или вacteroides fragilis.
Для уменьшения развития устойчивых к лечению бактерий и сохранения эффективности цефепима его следует использовать только для лечения инфекций. которые. как доказанно или сильно подозревается. вызваны чувствительными бактериями. Информацию о культуре и чувствительности следует учитывать при выборе или изменении антибактериальной терапии. В отсутствие таких данных эмпирическому выбору терапии могут способствовать местные эпидемиологические данные и особенности восприимчивости.
Фебрильная нейтропения (эмпирическая монотерапия у пациентов с высоким риском развития тяжелой инфекции. включая пациентов с недавней трансплантацией костного мозга в анамнезе. артериальной гипотензией на момент первичного осмотра. гематологической злокачественной опухолью или тяжелой или длительной нейтропенией. Существует недостаточно данных, подтверждающих эффективность монотерапии цефепимом у таких пациентов).
Неосложненные и осложненные инфекции мочевыводящих путей (включая пиелонефрит). вызванные чувствительными изолятами Escherichia coli или Klebsiella pneumoniae. когда инфекция тяжелая. или Escherichia coli. Klebsiella pneumoniae или Proteus mirabilis. когда тяжесть инфекции от легкой до умеренной. включая случаи. связанные с одновременной бактериемией. вызванной этими бактериями.
Неосложненные инфекции кожи, вызванные золотистым стафилококком (только изоляты, чувствительные к метициллину) или Streptococcus pyogenes.
Осложненные внутрибрюшные инфекции (в комбинации с метронидазолом) у взрослых. вызванные чувствительными изолятами Escherichia coli. стрептококками группы Viridans. Pseudomonas aeruginosa. Klebsiella pneumoniae. Enterobacter species или вacteroides fragilis.
Для уменьшения развития устойчивых к лечению бактерий и сохранения эффективности цефепима его следует использовать только для лечения инфекций. которые. как доказанно или сильно подозревается. вызваны чувствительными бактериями. Информацию о культуре и чувствительности следует учитывать при выборе или изменении антибактериальной терапии. В отсутствие таких данных эмпирическому выбору терапии могут способствовать местные эпидемиологические данные и особенности восприимчивости.
Противопоказания
Реакции гиперчувствительности немедленного типа к цефепиму или другим антибактериальным ЛС класса цефалоспоринов, пенициллинам или другим бета-лактамным антибиотикам.
При беременности и кормлении грудью
Категория действия на плод по FDA. В.
Адекватных и хорошо контролируемых исследований применения цефепима у беременных женщин не проводилось. Поскольку исследования репродукции животных не всегда позволяют предсказать реакцию человека, цефепим следует применять во время беременности только в случае явной необходимости.
Цефепим не оказывал тератогенное или эмбриоцидное действие при введении в период органогенеза крысам в дозах до 1000 мг/кг/сут (в 1,6 раза выше МРДЧ в расчете на площадь поверхности тела) или мышам в дозах до 1200 мг/кг (примерно равна МРДЧ в расчете на площадь поверхности тела), или кроликам в дозе 100 мг/кг (0,3 МРДЧ в расчете на площадь поверхности тела).
Цефепим не изучался для применения во время родов. Лечение следует назначать только по строгим показаниям.
Цефепим выделяется с женским грудным молоком. Следует соблюдать осторожность при назначении цефепима кормящей женщине.
Адекватных и хорошо контролируемых исследований применения цефепима у беременных женщин не проводилось. Поскольку исследования репродукции животных не всегда позволяют предсказать реакцию человека, цефепим следует применять во время беременности только в случае явной необходимости.
Цефепим не оказывал тератогенное или эмбриоцидное действие при введении в период органогенеза крысам в дозах до 1000 мг/кг/сут (в 1,6 раза выше МРДЧ в расчете на площадь поверхности тела) или мышам в дозах до 1200 мг/кг (примерно равна МРДЧ в расчете на площадь поверхности тела), или кроликам в дозе 100 мг/кг (0,3 МРДЧ в расчете на площадь поверхности тела).
Цефепим не изучался для применения во время родов. Лечение следует назначать только по строгим показаниям.
Цефепим выделяется с женским грудным молоком. Следует соблюдать осторожность при назначении цефепима кормящей женщине.
Побочные эффекты
Опыт клинических исследований.
Поскольку клинические исследования проводятся в различных условиях. частота побочных реакций. наблюдаемых в одном клиническом исследовании ЛС. не может быть напрямую сопоставлена с данными. получеными в другом клиническом исследовании. и может не отражать показатели. наблюдаемые на практике.
В клинических исследованиях с применением нескольких доз цефепима 4137 пациентов получали рекомендованные дозы (от 500 мг до 2 г в/в каждые 12 ч). Не выявлено случаев смерти или постоянной инвалидности, предположительно связанных с побочными действиями цефепима. Из-за побочных реакций прекратили применение 64 (1,5%) пациента, 33 (51%) из них сделали это из-за сыпи. Доля пациентов. получавших цефепим. которые прекратили его применение из-за побочных реакций. была аналогичной при ежедневных дозах 500 мг. 1 и 2 г каждые 12 ч (0,8. 1,1 и 2% соответственно). Однако частота прекращения применения цефепима из-за сыпи увеличивалась с увеличением рекомендуемых доз.
Побочные реакции цефепима при введении в многократных дозах (данные клинических исследований в Северной Америке. n=3125). отмечавшиеся с частотой ≥1%. включали местные побочные реакции (3%). включая флебит (1,3%). боль и/или воспаление (0,6%) и сыпь (1,1%).
С частотой менее 1%. но более 0,1% отмечались колит (включая псевдомембранозный). диарея. эритема. лихорадка. головная боль. тошнота. монилиоз полости рта. зуд. крапивница. вагинит. рвота. анемия.
При более высокой дозе (2 г каждые 8 ч) частота побочных реакций была выше у 795 пациентов, получавших эту дозу цефепима. Побочные реакции представляли собой сыпь (4%). диарею (3%). тошноту (2%). рвоту (1%). зуд (1%). лихорадку (1%) и головную боль (1%).
Отклонения в результатах лабораторных обследований. отмечавшиеся с частотой ≥1%. включали положительный тест Кумбса (без гемолиза) (16,2%). снижение уровня фосфора (2,8%). повышение уровня АЛТ (2,8%). АСТ (2,4%). эозинофилию (1,7%). аномальное АЧТВ (1,6%) и ПВ (1,4%).
С частотой менее 1%. но более 0,1% отмечались повышенный уровень ЩФ. мочевины крови. кальция. креатинина. фосфора. калия. общего билирубина. снижение уровня кальция (гипокальциемия чаще наблюдалась у пожилых пациентов. не сообщалось о клинически значимых последствиях изменения уровня кальция или фосфора). гематокрита. количества нейтрофилов. тромбоцитов. лейкоцитов.
Опыт пострегистрационных наблюдений.
Во время клинического применения цефепима после регистрации были выявлены приведенные ниже побочные реакции. однако поскольку эти реакции регистрируются в добровольном порядке в популяции неопределенного размера. не всегда возможно достоверно оценить их частоту или установить причинно-следственную связь с воздействием ЛС. В дополнение к побочным реакциям, о которых сообщалось в ходе клинических исследований, в ходе пострегистрационного применения были зарегистрированы следующие побочные реакции. Сообщалось о развитии энцефалопатии (нарушение сознания. включая спутанность сознания. галлюцинации. ступор и кому). афазии. миоклонуса. судорог и эпилептического состояния без судорог. Сообщалось о случаях анафилаксии, включая анафилактический шок, транзиторной лейкопении, нейтропении, агранулоцитоза и тромбоцитопении.
Побочные реакции, характерные для ЛС класса цефалоспоринов.
В дополнение к перечисленным выше побочным реакциям. которые наблюдались у пациентов. получавших цефепим. сообщалось о следующих побочных реакциях и изменениях лабораторных параметров. отмечавшихся при применении антибактериальных ЛС класса цефалоспоринов: синдром Стивенса-Джонсона. мультиформная эритема. токсический эпидермальный некролиз. дисфункция почек. токсическая нефропатия. апластическая анемия. гемолитическая анемия. кровотечение. дисфункция печени. включая холестаз. и панцитопения.
Поскольку клинические исследования проводятся в различных условиях. частота побочных реакций. наблюдаемых в одном клиническом исследовании ЛС. не может быть напрямую сопоставлена с данными. получеными в другом клиническом исследовании. и может не отражать показатели. наблюдаемые на практике.
В клинических исследованиях с применением нескольких доз цефепима 4137 пациентов получали рекомендованные дозы (от 500 мг до 2 г в/в каждые 12 ч). Не выявлено случаев смерти или постоянной инвалидности, предположительно связанных с побочными действиями цефепима. Из-за побочных реакций прекратили применение 64 (1,5%) пациента, 33 (51%) из них сделали это из-за сыпи. Доля пациентов. получавших цефепим. которые прекратили его применение из-за побочных реакций. была аналогичной при ежедневных дозах 500 мг. 1 и 2 г каждые 12 ч (0,8. 1,1 и 2% соответственно). Однако частота прекращения применения цефепима из-за сыпи увеличивалась с увеличением рекомендуемых доз.
Побочные реакции цефепима при введении в многократных дозах (данные клинических исследований в Северной Америке. n=3125). отмечавшиеся с частотой ≥1%. включали местные побочные реакции (3%). включая флебит (1,3%). боль и/или воспаление (0,6%) и сыпь (1,1%).
С частотой менее 1%. но более 0,1% отмечались колит (включая псевдомембранозный). диарея. эритема. лихорадка. головная боль. тошнота. монилиоз полости рта. зуд. крапивница. вагинит. рвота. анемия.
При более высокой дозе (2 г каждые 8 ч) частота побочных реакций была выше у 795 пациентов, получавших эту дозу цефепима. Побочные реакции представляли собой сыпь (4%). диарею (3%). тошноту (2%). рвоту (1%). зуд (1%). лихорадку (1%) и головную боль (1%).
Отклонения в результатах лабораторных обследований. отмечавшиеся с частотой ≥1%. включали положительный тест Кумбса (без гемолиза) (16,2%). снижение уровня фосфора (2,8%). повышение уровня АЛТ (2,8%). АСТ (2,4%). эозинофилию (1,7%). аномальное АЧТВ (1,6%) и ПВ (1,4%).
С частотой менее 1%. но более 0,1% отмечались повышенный уровень ЩФ. мочевины крови. кальция. креатинина. фосфора. калия. общего билирубина. снижение уровня кальция (гипокальциемия чаще наблюдалась у пожилых пациентов. не сообщалось о клинически значимых последствиях изменения уровня кальция или фосфора). гематокрита. количества нейтрофилов. тромбоцитов. лейкоцитов.
Опыт пострегистрационных наблюдений.
Во время клинического применения цефепима после регистрации были выявлены приведенные ниже побочные реакции. однако поскольку эти реакции регистрируются в добровольном порядке в популяции неопределенного размера. не всегда возможно достоверно оценить их частоту или установить причинно-следственную связь с воздействием ЛС. В дополнение к побочным реакциям, о которых сообщалось в ходе клинических исследований, в ходе пострегистрационного применения были зарегистрированы следующие побочные реакции. Сообщалось о развитии энцефалопатии (нарушение сознания. включая спутанность сознания. галлюцинации. ступор и кому). афазии. миоклонуса. судорог и эпилептического состояния без судорог. Сообщалось о случаях анафилаксии, включая анафилактический шок, транзиторной лейкопении, нейтропении, агранулоцитоза и тромбоцитопении.
Побочные реакции, характерные для ЛС класса цефалоспоринов.
В дополнение к перечисленным выше побочным реакциям. которые наблюдались у пациентов. получавших цефепим. сообщалось о следующих побочных реакциях и изменениях лабораторных параметров. отмечавшихся при применении антибактериальных ЛС класса цефалоспоринов: синдром Стивенса-Джонсона. мультиформная эритема. токсический эпидермальный некролиз. дисфункция почек. токсическая нефропатия. апластическая анемия. гемолитическая анемия. кровотечение. дисфункция печени. включая холестаз. и панцитопения.
Взаимодействие
Влияние на лабораторные тесты.
Введение цефепима может привести к ложноположительной реакции на глюкозу в моче при определенных методах. Рекомендуется использовать тесты на глюкозу, основанные на ферментативных реакциях глюкозооксидазы.
Во время лечения цефепимом сообщалось о положительных прямых тестах Кумбса. При развитии гемолитической анемии необходимо прекратить применение цефепима и назначить соответствующую терапию. Положительный тест Кумбса может наблюдаться у новорожденных, матери которых получали ЛС цефалоспоринового ряда до родов.
Применение многих цефалоспоринов, включая цефепим, было связано со снижением активности протромбина. К группе риска относятся пациенты с почечной или печеночной недостаточностью или плохим питанием, а также получающие длительный курс противомикробной терапии. У пациентов из группы риска следует контролировать ПВ и назначать экзогенный витамин К по показаниям.
Лекарственные взаимодействия.
Аминогликозиды. Необходимо контролировать функцию почек, если аминогликозиды должны вводиться одновременно с цефепимом из-за повышенного потенциала нефротоксичности и ототоксичности аминогликозидных антибактериальных ЛС.
Диуретики. Сообщалось о нефротоксичности после одновременного применения других цефалоспоринов с сильнодействующими диуретиками, такими как фуросемид. Необходимо контролировать функцию почек при одновременном применении цефепима с сильнодействующими диуретиками.
Введение цефепима может привести к ложноположительной реакции на глюкозу в моче при определенных методах. Рекомендуется использовать тесты на глюкозу, основанные на ферментативных реакциях глюкозооксидазы.
Во время лечения цефепимом сообщалось о положительных прямых тестах Кумбса. При развитии гемолитической анемии необходимо прекратить применение цефепима и назначить соответствующую терапию. Положительный тест Кумбса может наблюдаться у новорожденных, матери которых получали ЛС цефалоспоринового ряда до родов.
Применение многих цефалоспоринов, включая цефепим, было связано со снижением активности протромбина. К группе риска относятся пациенты с почечной или печеночной недостаточностью или плохим питанием, а также получающие длительный курс противомикробной терапии. У пациентов из группы риска следует контролировать ПВ и назначать экзогенный витамин К по показаниям.
Лекарственные взаимодействия.
Аминогликозиды. Необходимо контролировать функцию почек, если аминогликозиды должны вводиться одновременно с цефепимом из-за повышенного потенциала нефротоксичности и ототоксичности аминогликозидных антибактериальных ЛС.
Диуретики. Сообщалось о нефротоксичности после одновременного применения других цефалоспоринов с сильнодействующими диуретиками, такими как фуросемид. Необходимо контролировать функцию почек при одновременном применении цефепима с сильнодействующими диуретиками.
|
|
Передозировка
Симптомы. Энцефалопатия (нарушение сознания. включая спутанность сознания. галлюцинации. ступор и кому). миоклонус. судороги. нервно-мышечная возбудимость и эпилептический неконвульсивный статус.
Лечение. Пациенты при передозировке цефепима должны находиться под тщательным наблюдением и получать поддерживающее лечение. При наличии почечной недостаточности рекомендуется проводить гемодиализ или перитонеальный диализ, чтобы помочь в выведении цефепима из организма.
Лечение. Пациенты при передозировке цефепима должны находиться под тщательным наблюдением и получать поддерживающее лечение. При наличии почечной недостаточности рекомендуется проводить гемодиализ или перитонеальный диализ, чтобы помочь в выведении цефепима из организма.
Способ применения и дозы
В/в, в/м. При в/в применении продолжительность введения должна составлять примерно 30 минут. Максимальная доза для педиатрических пациентов не должна превышать рекомендуемую дозу для взрослых.
Необходимо корректировать дозу у пациентов с сl креатинина ≤60 мл/мин, чтобы компенсировать более медленную скорость выведения почками. У этих пациентов рекомендуемая начальная доза цефепима должна быть такой же, как у пациентов с сl креатинина >60 мл/мин, за исключением пациентов, находящихся на гемодиализе.
У пациентов, проходящих непрерывный амбулаторный перитонеальный диализ, цефепим может вводиться в рекомендуемых дозах с интервалом дозирования каждые 48 У пациентов, находящихся на гемодиализе, примерно 68% от общего количества цефепима, присутствующего в организме в начале диализа, будет удалено в течение 3 ч периода диализа.
Необходимо корректировать дозу у пациентов с сl креатинина ≤60 мл/мин, чтобы компенсировать более медленную скорость выведения почками. У этих пациентов рекомендуемая начальная доза цефепима должна быть такой же, как у пациентов с сl креатинина >60 мл/мин, за исключением пациентов, находящихся на гемодиализе.
У пациентов, проходящих непрерывный амбулаторный перитонеальный диализ, цефепим может вводиться в рекомендуемых дозах с интервалом дозирования каждые 48 У пациентов, находящихся на гемодиализе, примерно 68% от общего количества цефепима, присутствующего в организме в начале диализа, будет удалено в течение 3 ч периода диализа.
Меры предосторожности применения
Реакции гиперчувствительности.
Перед началом применения цефепима следует провести тщательное исследование, чтобы определить, были ли у пациента ранее реакции гиперчувствительности немедленного типа на цефепим, цефалоспорины, пенициллины или другие бета-лактамы. Необходимо соблюдать осторожность, если цефепим назначается пациентам, чувствительным к пенициллину, поскольку перекрестная гиперчувствительность к бета-лактамным антибактериальным ЛС была четко задокументирована и может возникать у пациентов с аллергией на пенициллин в анамнезе с частотой до 10%. Если возникает аллергическая реакция на цефепим, необходимо прекратить его применение и принять соответствующие поддерживающие меры.
Нейротоксичность.
Сообщалось о серьезных побочных реакциях, включая опасные для жизни или смертельные случаи развития энцефалопатии (нарушение сознания, включая спутанность сознания, галлюцинации, ступор и кому), афазии, миоклонуса, судорог и эпилептического статуса без судорог. Большинство таких случаев наблюдалось у пациентов с нарушением функции почек, которые не получали соответствующей коррекции дозы. Однако некоторые случаи нейротоксичности отмечались у пациентов со скорректированной дозой, соответствующей степени их почечной недостаточности. В большинстве случаев симптомы нейротоксичности были обратимыми и исчезали после отмены цефепима и/или после гемодиализа. При возникновении нейротоксичности, связанной с терапией цефепимом, необходимо прекратить его применение и принять соответствующие поддерживающие меры.
Диарея, ассоциированная с сlostridium difficile.
Сообщалось о развитии диареи, связанной с сlostridium difficile, при использовании почти всех антибактериальных ЛС, включая цефепим, которая может варьировать по степени тяжести от легкой диареи до смертельного колита. Лечение антибактериальными ЛС изменяет нормальную флору толстой кишки, приводя к чрезмерному росту сlostridium difficile, которая продуцирует токсины А и В, способствующие развитию диареи.
Штаммы сlostridium difficile, продуцирующие гипертоксин, вызывают повышенную заболеваемость и смертность, поскольку эти инфекции могут быть невосприимчивы к противомикробной терапии и потребовать проведения колэктомии. Диарею, ассоциированную с сlostridium difficile, необходимо учитывать у всех пациентов, у которых наблюдается диарея после применения антибактериальных ЛС. Необходим тщательный сбор анамнеза, поскольку сообщалось, что диарея, связанная с сlostridium difficile, может возникать в течение 2 мес после введения антибактериальных ЛС. При подозрении или подтверждении диареи, связанной с сlostridium difficile, возможно, потребуется прекратить постоянное применение антибактериальных ЛС, не направленных против сlostridium difficile. По клиническим показаниям следует назначить соответствующее дополнительное введение жидкости и электролитов, белковых добавок, а также лечение антибиотиками и хирургическое обследование.
Развитие устойчивых к ЛС бактерий.
Назначение цефепима в отсутствие доказанной или сильно подозреваемой бактериальной инфекции не принесет пользу пациенту и увеличивает риск развития лекарственно-устойчивых бактерий. Как и в случае с другими противомикробными ЛС, длительное применение цефепима может привести к чрезмерному росту невосприимчивых микроорганизмов. Необходима повторная оценка состояния пациента. В случае возникновения суперинфекции во время терапии следует принять соответствующие меры.
Особые группы пациентов.
Дети. Безопасность и эффективность применения цефепима при лечении неосложненных и осложненных инфекций мочевыводящих путей (включая пиелонефрит), неосложненных инфекций кожи и кожных структур, пневмонии, а также в качестве эмпирической терапии для пациентов с фебрильной нейтропенией были установлены в возрастных группах от 2 мес до 16 лет. Использование цефепима в этих возрастных группах подтверждается данными адекватных и хорошо контролируемых исследований цефепима у взрослых и дополнительными данными о фармакокинетике и безопасности, полученными в педиатрических исследованиях. Безопасность и эффективность у педиатрических пациентов в возрасте до 2 мес не установлены. Существует недостаточно клинических данных, подтверждающих применение цефепима у педиатрических пациентов для лечения серьезных инфекций в детской популяции, где подозреваемым или доказанным возбудителем является H.influenzae типа b. У тех пациентов, у которых имеется менингеальный посев из отдаленного очага инфекции или подозревается или задокументирован менингит, следует использовать альтернативное средство с доказанной клинической эффективностью в этих условиях.
Пожилой возраст. Из более чем 6400 взрослых, получавших цефепим в клинических исследованиях, 35% были старше 65 лет, а 16% - старше 75 лет. Когда пожилые пациенты получали обычную рекомендуемую дозу для взрослых, клиническая эффективность и безопасность были сопоставимы с клинической эффективностью и безопасностью у взрослых пациентов.
Серьезные побочные явления отмечались у пожилых пациентов с почечной недостаточностью, получавших нескорректированные дозы цефепима, включая опасные для жизни или смертельные случаи следующих заболеваний: энцефалопатия, миоклонус и судороги. Известно, что цефепим в значительной степени выводится почками, и риск побочных реакций на этот препарат может быть выше у пациентов с нарушением функции почек. Поскольку у пожилых пациентов более вероятно снижение функции почек, следует соблюдать осторожность при выборе дозы и контролировать функцию почек.
Нарушение функции почек. Необходимо скорректировать дозу цефепима у пациентов с сl креатинина ≤60 мл/мин, чтобы компенсировать более медленную скорость выведения почками.
Перед началом применения цефепима следует провести тщательное исследование, чтобы определить, были ли у пациента ранее реакции гиперчувствительности немедленного типа на цефепим, цефалоспорины, пенициллины или другие бета-лактамы. Необходимо соблюдать осторожность, если цефепим назначается пациентам, чувствительным к пенициллину, поскольку перекрестная гиперчувствительность к бета-лактамным антибактериальным ЛС была четко задокументирована и может возникать у пациентов с аллергией на пенициллин в анамнезе с частотой до 10%. Если возникает аллергическая реакция на цефепим, необходимо прекратить его применение и принять соответствующие поддерживающие меры.
Нейротоксичность.
Сообщалось о серьезных побочных реакциях, включая опасные для жизни или смертельные случаи развития энцефалопатии (нарушение сознания, включая спутанность сознания, галлюцинации, ступор и кому), афазии, миоклонуса, судорог и эпилептического статуса без судорог. Большинство таких случаев наблюдалось у пациентов с нарушением функции почек, которые не получали соответствующей коррекции дозы. Однако некоторые случаи нейротоксичности отмечались у пациентов со скорректированной дозой, соответствующей степени их почечной недостаточности. В большинстве случаев симптомы нейротоксичности были обратимыми и исчезали после отмены цефепима и/или после гемодиализа. При возникновении нейротоксичности, связанной с терапией цефепимом, необходимо прекратить его применение и принять соответствующие поддерживающие меры.
Диарея, ассоциированная с сlostridium difficile.
Сообщалось о развитии диареи, связанной с сlostridium difficile, при использовании почти всех антибактериальных ЛС, включая цефепим, которая может варьировать по степени тяжести от легкой диареи до смертельного колита. Лечение антибактериальными ЛС изменяет нормальную флору толстой кишки, приводя к чрезмерному росту сlostridium difficile, которая продуцирует токсины А и В, способствующие развитию диареи.
Штаммы сlostridium difficile, продуцирующие гипертоксин, вызывают повышенную заболеваемость и смертность, поскольку эти инфекции могут быть невосприимчивы к противомикробной терапии и потребовать проведения колэктомии. Диарею, ассоциированную с сlostridium difficile, необходимо учитывать у всех пациентов, у которых наблюдается диарея после применения антибактериальных ЛС. Необходим тщательный сбор анамнеза, поскольку сообщалось, что диарея, связанная с сlostridium difficile, может возникать в течение 2 мес после введения антибактериальных ЛС. При подозрении или подтверждении диареи, связанной с сlostridium difficile, возможно, потребуется прекратить постоянное применение антибактериальных ЛС, не направленных против сlostridium difficile. По клиническим показаниям следует назначить соответствующее дополнительное введение жидкости и электролитов, белковых добавок, а также лечение антибиотиками и хирургическое обследование.
Развитие устойчивых к ЛС бактерий.
Назначение цефепима в отсутствие доказанной или сильно подозреваемой бактериальной инфекции не принесет пользу пациенту и увеличивает риск развития лекарственно-устойчивых бактерий. Как и в случае с другими противомикробными ЛС, длительное применение цефепима может привести к чрезмерному росту невосприимчивых микроорганизмов. Необходима повторная оценка состояния пациента. В случае возникновения суперинфекции во время терапии следует принять соответствующие меры.
Особые группы пациентов.
Дети. Безопасность и эффективность применения цефепима при лечении неосложненных и осложненных инфекций мочевыводящих путей (включая пиелонефрит), неосложненных инфекций кожи и кожных структур, пневмонии, а также в качестве эмпирической терапии для пациентов с фебрильной нейтропенией были установлены в возрастных группах от 2 мес до 16 лет. Использование цефепима в этих возрастных группах подтверждается данными адекватных и хорошо контролируемых исследований цефепима у взрослых и дополнительными данными о фармакокинетике и безопасности, полученными в педиатрических исследованиях. Безопасность и эффективность у педиатрических пациентов в возрасте до 2 мес не установлены. Существует недостаточно клинических данных, подтверждающих применение цефепима у педиатрических пациентов для лечения серьезных инфекций в детской популяции, где подозреваемым или доказанным возбудителем является H.influenzae типа b. У тех пациентов, у которых имеется менингеальный посев из отдаленного очага инфекции или подозревается или задокументирован менингит, следует использовать альтернативное средство с доказанной клинической эффективностью в этих условиях.
Пожилой возраст. Из более чем 6400 взрослых, получавших цефепим в клинических исследованиях, 35% были старше 65 лет, а 16% - старше 75 лет. Когда пожилые пациенты получали обычную рекомендуемую дозу для взрослых, клиническая эффективность и безопасность были сопоставимы с клинической эффективностью и безопасностью у взрослых пациентов.
Серьезные побочные явления отмечались у пожилых пациентов с почечной недостаточностью, получавших нескорректированные дозы цефепима, включая опасные для жизни или смертельные случаи следующих заболеваний: энцефалопатия, миоклонус и судороги. Известно, что цефепим в значительной степени выводится почками, и риск побочных реакций на этот препарат может быть выше у пациентов с нарушением функции почек. Поскольку у пожилых пациентов более вероятно снижение функции почек, следует соблюдать осторожность при выборе дозы и контролировать функцию почек.
Нарушение функции почек. Необходимо скорректировать дозу цефепима у пациентов с сl креатинина ≤60 мл/мин, чтобы компенсировать более медленную скорость выведения почками.
Список литературы
Www.fda.gov и www.rxlist.com, 2021.
|
|
Входит в состав
- 41-218₽ Цефепим (10 фирм)
- 147₽ Цефепим-Джодас (Jodas Expoim Pvt. )
- 149₽ Цефомакс (2 фирмы)
- 156₽ Цепим (2 фирмы)
- 170-380₽ Максипим (Bristol-Myers Squibb S.r.L. )
- 439₽ Кефсепим (5 фирм)
- 1650₽ Максиктам-АФ (3 фирмы)
- — Винцепим (Красфарма ПАО )
- — Децефим
- — Ладеф
- — Максицеф (2 фирмы)
- — Мовизар (Youcare Pharmaceutical Group Co. )
- — Цефепим c аргинином (Shenzhen Salubris Pharmaceuticals Co. )
- — Цефепим стерильный (2 фирмы)
- — Цефепим-Аджио
- — Цефепим-Алкем
- — Цефепим-Виал (2 фирмы)
- — Цефепима гидрохлорид
- — Цефепима гидрохлорид стерильный с L-Аргинином (NCPC Orchid Pharmaceutical Co. )
- — Цефепима гидрохлорид стерильный с Аргинином - Лонг Шенг Фарма Лимитед (Цилу Антибиотикс Фармасьютикал Ко.Лтд )
- — Эфипим (4 фирмы)