МКБ-10 коды
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: с84.5, с84.6, с84.7, с84.9, с86.0, с86.5.
Год утверждения (частота пересмотра): 2020.
Возрастная категория: Взрослые , Дети.
Пересмотр не позднее: 2022.
ID: 138.
Разработчик клинической рекомендации.
• Национальное общество детских гематологов, онкологов.
• Ассоциация онкологов России.
• Российское профессиональное общество онкогематологов.
• Некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга Национальное гематологическое общество .
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2020.
Возрастная категория: Взрослые , Дети.
Пересмотр не позднее: 2022.
ID: 138.
Разработчик клинической рекомендации.
• Национальное общество детских гематологов, онкологов.
• Ассоциация онкологов России.
• Российское профессиональное общество онкогематологов.
• Некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга Национальное гематологическое общество .
Одобрено Научно-практическим Советом Минздрава РФ.
|
|
 Список сокращений
Список сокращений
ALK - киназа анапластической лимфомы.
ПТКЛн - периферическая Т-клеточная лимфома, неспецифицированная.
АИТЛ - ангиоиммунобластная Т-клеточная лимфома.
АККЛ - анапластическая крупноклеточная лимфома.
ВОЗ - Всемирная Организация Здравоохранения.
ИФТ - иммунофенотипирование.
ПЭТ/КТ - позитронная эмиссионная томография, совмещенная с компьютерной томографией.
ПТКЛ - периферические Т-клеточные лимфомы.
РФП - радиофармпрепарат.
СОЭ - скорость оседания эритроцитов.
ХТ - химиотерапия.
** - жизненно необходимые и важнейшие лекарственные препараты.
- препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл).
ПТКЛн - периферическая Т-клеточная лимфома, неспецифицированная.
АИТЛ - ангиоиммунобластная Т-клеточная лимфома.
АККЛ - анапластическая крупноклеточная лимфома.
ВОЗ - Всемирная Организация Здравоохранения.
ИФТ - иммунофенотипирование.
ПЭТ/КТ - позитронная эмиссионная томография, совмещенная с компьютерной томографией.
ПТКЛ - периферические Т-клеточные лимфомы.
РФП - радиофармпрепарат.
СОЭ - скорость оседания эритроцитов.
ХТ - химиотерапия.
** - жизненно необходимые и важнейшие лекарственные препараты.
- препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл).
Термины и определения
ECOG. Оценка общего состояния пациента по шкале, разработанной Восточной объединенной онкологической группой (Eastern сooperative Oncology Group) - см приложение Г1.
В-симптомы. Неспецифичиеские симптомы опухолевой интоксикации, включающие лихорадку выше 38°С не менее трех дней подряд без признаков воспаления; ночные профузные поты; похудание на 10% массы тела за последние 6 месяцев.
В-симптомы. Неспецифичиеские симптомы опухолевой интоксикации, включающие лихорадку выше 38°С не менее трех дней подряд без признаков воспаления; ночные профузные поты; похудание на 10% массы тела за последние 6 месяцев.
Описание
Нодальные периферические Т-клеточные лимфомы (ПТКЛ) представляют довольно редкую группу лимфопролиферативных заболеваний, субстратом которых является зрелый (посттимический) активированный Т-лимфоцит. Несмотря на различные патоморфологические и биологические особенности, нодальные Т-клеточные лимфомы за редким исключением представляют собой агрессивные заболевания с крайне неблагоприятным прогнозом [1].
Для анализа индивидуального риска раннего прогрессирования используются международный прогностический индекс IPI и скорректированный по возрасту aаIPI (табл. 6,4,1) [71], которые не потеряли своего значения в условиях современных программ лечения. Также могут применяться предикативные модели, разработанные для периферических Т-клеточных лимфом и демонстрирующих зависимость прогноза от других факторов: вовлечения костного мозга (индекс PIT) [72], индекса пролиферативной активности опухоли - Ki-67 (индекс mPIT) [73].
Таблица 6,4,1.
Прогностические индексы, применяемые у пациентов с ПТКЛ.
Полная ремиссия (ПР):
• Полное исчезновение всех проявлений заболевания, в том числе выявляемых при помощи лабораторных и лучевых методов диагностики, а также клинических симптомов, если они имели место до начала лечения.
• Размеры лимфатических узлов:
• ≤ 1,5см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были больше 1,5 см.
• ≤ 1,0см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были 1,5 - 1,1см.
• Печень, селезенка, если были увеличены до начала лечения, не пальпируются, по данным лучевых методов объемные образования в них не выявляются.
• Костный мозг без признаков опухолевого поражения. Если результат морфологического исследования костного мозга неоднозначный, наличие или отсутствие поражения должно определяться иммуногистохимически.
Для ЛХ ПР считается подтвержденной, если достигнутый эффект сохраняется не менее 3 месяцев или констатируется дальнейшее улучшение.
Неуверенная полная ремиссия (ПРн) констатируется только у больных, которым не выполнялась ПЭТ-КТ для оценки эффекта:
• Остаточные изменения, выявляемые только при помощи лучевых методов исследования (особенно это касается остаточных объемных образований в месте массивного опухолевого поражения, чаще всего в средостении), в случае сокращения опухоли более чем на 75% от исходных размеров по сумме двух наибольших её диаметров. Эти остаточные изменения не должны увеличиваться в течение более чем 3 месяцев.
• По другим показателям - соответствие критериям полной ремиссии.
Частичная ремиссия (ЧР):
• Уменьшение суммы диаметров всех измеряемых очагов (лимфоузлов и/или очагов экстранодального поражения) не менее чем на 50%. Если размеры пораженных очагов менее 3см по наибольшему диаметру, то 2 наибольших очага должны уменьшиться не менее, чем на 50% по наибольшему диаметру. При наличии более чем 6 очагов поражения более 3 достаточна оценка 6 наибольших очагов, доступных четкому измерению в двух перпендикулярных направлениях. При наличии медиастинальных и/или ретроперитонеальных очагов поражения, они обязательно должны учитываться при измерении.
• Отсутствие новых очагов поражения, отсутствие признаков увеличения какого-либо из ранее диагностированных очагов поражения.
• В случае исходного поражения костного мозга, статус костного мозга для определения ЧР не значим. Однако при сохранении поражения костного мозга в процессе и/или после завершения лечения, обязательно уточнение характеристики опухолевых клеток. Больные с исходным поражением костного мозга, у которых после завершения лечения клинически диагностируется ПР, но при этом сохраняется поражение костного мозга или костный мозг не может быть оценен, относятся к ЧР.
Стабилизация.
Показатели опухоли не соответствуют ни критериям ПР или ЧР, ни критериям прогрессирования.
Рецидив (после ПР) или прогрессирование (после ЧР или стабилизации).
• Появление новых очагов (увеличение лимфатических узлов или объемных образований экстранодальных локализаций) более 1,5 см в наибольшем измерении в процессе или после завершения лечения, вне зависимости от изменения размеров других очагов поражения.
• Увеличение как минимум одного уже известного очага более чем на 25% от минимального. Для очагов менее 1 см в наибольшем измерении - увеличение до 1,5 см и более.
Радиочувствительность является наибольшей у детей младшего возраста (до 6 лет) и в препубертатном периоде (11-13 лет). Следует ограничивать дозу на ростовые пластинки трубчатых костей (не более 20 Гр). Несимметричное облучение осевого скелета может привести к кифозу или сколиозу, тогда как симметричное облучение приводит к уменьшению роста. Чтобы избежать развития сколиоза облучение позвоночника на всем протяжении PTV должно быть симметричным. Не допустимо создавать градиент дозы в телах позвонков более 20%.
Спинной мозг.
У детей до шести лет ЦНС проходит процесс созревания и поэтому она особенно радиочувствительна. Максимальная доза на шейный отдел спинного мозга не должна превышать 20 Гр. Следует избегать доз больше 30 Гр на спинной мозг, и индивидуальное планирование должно быть направлено на минимизацию дозы на спинной мозг без влияния на запланированную дозу в мишени.
Легкие.
Толерантность легких у детей малоизучена и, по-видимому, существенно не различается у взрослых и детей школьного возраста. Доза, указанная в данных рекомендациях (12-15 Гр) для тотального облучения легкого с малой вероятностью может привести к значительному ухудшению функции легких. Тем не менее, облучение всего легкого в дозе 12 Гр у детей младше 6 лет может привести к постоянному снижению жизненной емкости легких.
Сердце.
Нарушение функции миокарда и артерий может произойти после длительного латентного периода (20 лет и более) как отдаленное последствие радиационно-индуцированной пролиферации эндотелия. Нет четкой информации о влиянии возраста на момент облучения. Облучение сердца должно быть максимально сокращено, особенно в сочетании с применением кардиотоксических антрациклинов, которые могут снизить общую толерантность сердца. Возможен фиброз и кальциноз клапанов вплоть до образования пороков. Таким образом облучаемый объем сердца и доза на сердце должны быть сведены к минимуму. Не рекомендуется превышение дозы на сердце 30 Гр.
Молочные железы.
Поздних неблагоприятных детерминированных эффектов на полностью развитые молочные железы не следует ожидать. В то же время, неразвитые ювенильные молочные железы обладают высокой радиочувствительностью. После облучения неразвитой молочной железы в дозе от 5 до 10 Гр, может возникнуть гипоплазия или аплазия всей молочной железы или ее части в подростковом возрасте.
Почки.
Почки очень радиочувствительны. Нет четкой информации о влиянии возраста на момент облучения. Рекомендуемая толерантная доза облучения всей почки составляет 12 Гр. При облучении целого органа в данной дозе не ожидается никаких существенных долгосрочных неблагоприятных последствий. Частичное облучении почки (например, верхний левый полюс почки при облучении селезенки и ножки селезенки) в дозе 20 Гр или более может привести к фиброзу верхнего полюса почки и вызвать локальные функциональные нарушения.
Печень.
Рекомендуется рассматривать толерантную дозу для всего органа 15 Гр. Это относится и к лучевой терапии печени при диссеминированном заболевании органа. Частичное облучение печени (например, при лучевой терапии верхней части парааортальной области) в дозах 20 Гр и более, не приведет к клинически значимому снижению функции печени в целом.
Щитовидная железа.
У пациентов может развиться субклинический гипотиреоз после латентного периода 3-4 года или более после облучения органа в дозе 20 Гр или более. Субклинический гипотиреоз может разрешиться спонтанно и потребность проведения терапии в данном случае является спорной. Риск снижения функции щитовидной железы возрастает с увеличением дозы облучения до 30 Гр и может привести к клиническому гипотиреозу, который потребует проведения заместительной гормональной терапии.
Яички.
Яички являются наиболее радиочувствительным органом. Доза 1-2 Гр может привести к необратимому нарушению сперматогенеза. Поэтому яички должны быть защищены вовремя облучение подвздошной и/или паховой областей с помощью современных методик облучения или путем прямого экранирования.
Яичники.
После накопленной дозы 5-10 Гр в яичниках индуцируется гибель клеток ооцитов, что приводит к бесплодию. Эндокринная недостаточность возникает после достижения более высоких доз (около 10-15 Гр). В таких случаях может потребоваться заместительная гормональная терапия в зависимости от гормонального статуса в пубертатный период. Чтобы избежать нарушения функции яичников, по крайней мере один яичник должен быть защищен от действия в том числе и рассеянного излучения. Рекомендуется рассмотреть оперативное выведение яичников из полей предполагаемого облучения (овариопексия).
Вторичные опухоли.
Лучевая терапия в детском возрасте увеличивает риск развития широкого спектра вторичных опухолей. Наиболее часто встречается рак молочной железы у женщин, которым в детском возрасте проводилась лучевая терапия на область средостения и подмышечные области. В связи с этим рекомендуется регулярное обследование молочных желез на выявление рака у женщин старше 25 лет или через 8 лет после проведения ЛТ. После облучения шейных лимфоузлов повышается риск развития опухолей, злокачественных, щитовидной железы.
Для анализа индивидуального риска раннего прогрессирования используются международный прогностический индекс IPI и скорректированный по возрасту aаIPI (табл. 6,4,1) [71], которые не потеряли своего значения в условиях современных программ лечения. Также могут применяться предикативные модели, разработанные для периферических Т-клеточных лимфом и демонстрирующих зависимость прогноза от других факторов: вовлечения костного мозга (индекс PIT) [72], индекса пролиферативной активности опухоли - Ki-67 (индекс mPIT) [73].
Таблица 6,4,1.
Прогностические индексы, применяемые у пациентов с ПТКЛ.
| Прогностический индекс | Факторы риска | Категория риска |
| IPI | - Возраст better 60 лет - ECOG ≥2 - Повышение ЛДГ - Стадия III-IV - >1 экстранодальной зоны поражения | Низкий (0-1 фактор) |
| Низкий промежуточный (2 фактора) | ||
| Высокий промежуточный (3 фактора) | ||
| Высокий (4-5 факторов) | ||
| aaIPI (для пациентов моложе 60 лет) | - ECOG ≥2 - Повышение ЛДГ - Стадия III-IV | Низкий (0 факторов) |
| Низкий промежуточный (1 фактор) | ||
| Высокий промежуточный (2 фактора) | ||
| Высокий (3 фактора) | ||
| PIT (для ПТКЛн) | - Возраст better 60 лет - ECOG ≥2 - Повышение ЛДГ - Вовлечение костного мозга | Низкий (0 факторов) |
| Низкий промежуточный (1 фактор) | ||
| Высокий промежуточный (2 фактора) | ||
| Высокий (3-4 фактора) | ||
| mPIT | - Возраст better 60 лет - ECOG ≥2 - Повышение ЛДГ - Ki67 ≥80% | Низкий (0 факторов) |
| Низкий промежуточный (1 фактор) | ||
| Высокий промежуточный (2 фактора) | ||
| Высокий (3-4 фактора) |
6,5 Оценка ответа на лечение при лимфомах.
Оценка ответа на лечение проводится в соответствии с обновленными критериями, предложенными Международной рабочей группой по лимфомам в 2007 году [59].Полная ремиссия (ПР):
• Полное исчезновение всех проявлений заболевания, в том числе выявляемых при помощи лабораторных и лучевых методов диагностики, а также клинических симптомов, если они имели место до начала лечения.
• Размеры лимфатических узлов:
• ≤ 1,5см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были больше 1,5 см.
• ≤ 1,0см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были 1,5 - 1,1см.
• Печень, селезенка, если были увеличены до начала лечения, не пальпируются, по данным лучевых методов объемные образования в них не выявляются.
• Костный мозг без признаков опухолевого поражения. Если результат морфологического исследования костного мозга неоднозначный, наличие или отсутствие поражения должно определяться иммуногистохимически.
Для ЛХ ПР считается подтвержденной, если достигнутый эффект сохраняется не менее 3 месяцев или констатируется дальнейшее улучшение.
Неуверенная полная ремиссия (ПРн) констатируется только у больных, которым не выполнялась ПЭТ-КТ для оценки эффекта:
• Остаточные изменения, выявляемые только при помощи лучевых методов исследования (особенно это касается остаточных объемных образований в месте массивного опухолевого поражения, чаще всего в средостении), в случае сокращения опухоли более чем на 75% от исходных размеров по сумме двух наибольших её диаметров. Эти остаточные изменения не должны увеличиваться в течение более чем 3 месяцев.
• По другим показателям - соответствие критериям полной ремиссии.
Частичная ремиссия (ЧР):
• Уменьшение суммы диаметров всех измеряемых очагов (лимфоузлов и/или очагов экстранодального поражения) не менее чем на 50%. Если размеры пораженных очагов менее 3см по наибольшему диаметру, то 2 наибольших очага должны уменьшиться не менее, чем на 50% по наибольшему диаметру. При наличии более чем 6 очагов поражения более 3 достаточна оценка 6 наибольших очагов, доступных четкому измерению в двух перпендикулярных направлениях. При наличии медиастинальных и/или ретроперитонеальных очагов поражения, они обязательно должны учитываться при измерении.
• Отсутствие новых очагов поражения, отсутствие признаков увеличения какого-либо из ранее диагностированных очагов поражения.
• В случае исходного поражения костного мозга, статус костного мозга для определения ЧР не значим. Однако при сохранении поражения костного мозга в процессе и/или после завершения лечения, обязательно уточнение характеристики опухолевых клеток. Больные с исходным поражением костного мозга, у которых после завершения лечения клинически диагностируется ПР, но при этом сохраняется поражение костного мозга или костный мозг не может быть оценен, относятся к ЧР.
Стабилизация.
Показатели опухоли не соответствуют ни критериям ПР или ЧР, ни критериям прогрессирования.
Рецидив (после ПР) или прогрессирование (после ЧР или стабилизации).
• Появление новых очагов (увеличение лимфатических узлов или объемных образований экстранодальных локализаций) более 1,5 см в наибольшем измерении в процессе или после завершения лечения, вне зависимости от изменения размеров других очагов поражения.
• Увеличение как минимум одного уже известного очага более чем на 25% от минимального. Для очагов менее 1 см в наибольшем измерении - увеличение до 1,5 см и более.
6,6 Особенности планирования дозы ЛТ на критические структуры при облучении пациентов младше 18 лет,.
Костная система.Радиочувствительность является наибольшей у детей младшего возраста (до 6 лет) и в препубертатном периоде (11-13 лет). Следует ограничивать дозу на ростовые пластинки трубчатых костей (не более 20 Гр). Несимметричное облучение осевого скелета может привести к кифозу или сколиозу, тогда как симметричное облучение приводит к уменьшению роста. Чтобы избежать развития сколиоза облучение позвоночника на всем протяжении PTV должно быть симметричным. Не допустимо создавать градиент дозы в телах позвонков более 20%.
Спинной мозг.
У детей до шести лет ЦНС проходит процесс созревания и поэтому она особенно радиочувствительна. Максимальная доза на шейный отдел спинного мозга не должна превышать 20 Гр. Следует избегать доз больше 30 Гр на спинной мозг, и индивидуальное планирование должно быть направлено на минимизацию дозы на спинной мозг без влияния на запланированную дозу в мишени.
Легкие.
Толерантность легких у детей малоизучена и, по-видимому, существенно не различается у взрослых и детей школьного возраста. Доза, указанная в данных рекомендациях (12-15 Гр) для тотального облучения легкого с малой вероятностью может привести к значительному ухудшению функции легких. Тем не менее, облучение всего легкого в дозе 12 Гр у детей младше 6 лет может привести к постоянному снижению жизненной емкости легких.
Сердце.
Нарушение функции миокарда и артерий может произойти после длительного латентного периода (20 лет и более) как отдаленное последствие радиационно-индуцированной пролиферации эндотелия. Нет четкой информации о влиянии возраста на момент облучения. Облучение сердца должно быть максимально сокращено, особенно в сочетании с применением кардиотоксических антрациклинов, которые могут снизить общую толерантность сердца. Возможен фиброз и кальциноз клапанов вплоть до образования пороков. Таким образом облучаемый объем сердца и доза на сердце должны быть сведены к минимуму. Не рекомендуется превышение дозы на сердце 30 Гр.
Молочные железы.
Поздних неблагоприятных детерминированных эффектов на полностью развитые молочные железы не следует ожидать. В то же время, неразвитые ювенильные молочные железы обладают высокой радиочувствительностью. После облучения неразвитой молочной железы в дозе от 5 до 10 Гр, может возникнуть гипоплазия или аплазия всей молочной железы или ее части в подростковом возрасте.
Почки.
Почки очень радиочувствительны. Нет четкой информации о влиянии возраста на момент облучения. Рекомендуемая толерантная доза облучения всей почки составляет 12 Гр. При облучении целого органа в данной дозе не ожидается никаких существенных долгосрочных неблагоприятных последствий. Частичное облучении почки (например, верхний левый полюс почки при облучении селезенки и ножки селезенки) в дозе 20 Гр или более может привести к фиброзу верхнего полюса почки и вызвать локальные функциональные нарушения.
Печень.
Рекомендуется рассматривать толерантную дозу для всего органа 15 Гр. Это относится и к лучевой терапии печени при диссеминированном заболевании органа. Частичное облучение печени (например, при лучевой терапии верхней части парааортальной области) в дозах 20 Гр и более, не приведет к клинически значимому снижению функции печени в целом.
Щитовидная железа.
У пациентов может развиться субклинический гипотиреоз после латентного периода 3-4 года или более после облучения органа в дозе 20 Гр или более. Субклинический гипотиреоз может разрешиться спонтанно и потребность проведения терапии в данном случае является спорной. Риск снижения функции щитовидной железы возрастает с увеличением дозы облучения до 30 Гр и может привести к клиническому гипотиреозу, который потребует проведения заместительной гормональной терапии.
Яички.
Яички являются наиболее радиочувствительным органом. Доза 1-2 Гр может привести к необратимому нарушению сперматогенеза. Поэтому яички должны быть защищены вовремя облучение подвздошной и/или паховой областей с помощью современных методик облучения или путем прямого экранирования.
Яичники.
После накопленной дозы 5-10 Гр в яичниках индуцируется гибель клеток ооцитов, что приводит к бесплодию. Эндокринная недостаточность возникает после достижения более высоких доз (около 10-15 Гр). В таких случаях может потребоваться заместительная гормональная терапия в зависимости от гормонального статуса в пубертатный период. Чтобы избежать нарушения функции яичников, по крайней мере один яичник должен быть защищен от действия в том числе и рассеянного излучения. Рекомендуется рассмотреть оперативное выведение яичников из полей предполагаемого облучения (овариопексия).
Вторичные опухоли.
Лучевая терапия в детском возрасте увеличивает риск развития широкого спектра вторичных опухолей. Наиболее часто встречается рак молочной железы у женщин, которым в детском возрасте проводилась лучевая терапия на область средостения и подмышечные области. В связи с этим рекомендуется регулярное обследование молочных желез на выявление рака у женщин старше 25 лет или через 8 лет после проведения ЛТ. После облучения шейных лимфоузлов повышается риск развития опухолей, злокачественных, щитовидной железы.
|
|
Причины
Этиология периферических нодальных Т-клеточных лимфом остается недостаточно изученной [2], однако некоторые нозологические формы напрямую связаны с обнаружением в крови и/или экспрессией на опухолевых клетках вируса Эптштейна-Барр [3] или человеческого Т-клеточного лимфотропного вируса I типа [4]. Также показано, что риск возникновения лимфом увеличивается при иммунодефицитных состояниях [5].
Патогенез развития Т-клеточных лимфом индивидуален в зависимости от нозологической принадлежности, наличия или отсутствия определенных хромосомных аномалий, реакции микроокружения опухоли, и включает в себя на подавление иммунного ответа и ингибирование апоптоза через различные сигнальные пути [1].
Патогенез развития Т-клеточных лимфом индивидуален в зависимости от нозологической принадлежности, наличия или отсутствия определенных хромосомных аномалий, реакции микроокружения опухоли, и включает в себя на подавление иммунного ответа и ингибирование апоптоза через различные сигнальные пути [1].
Эпидемиология
Периферические Т-клеточные лимфомы диагностируются примерно в 10% случаев всех неходжкинских лимфом [6,7]. В этой группе лимфом наиболее распространенным подтипом является периферическая Т-клеточная лимфома, неспецифицированная (ПТКЛн, 26%), ангиоиммунобластная Т-клеточная лимфома (АИТЛ, 19%), анапластическая крупноклеточная лимфома (АККЛ): позитивная по киназе анапластической лимфмы (ALK-позитивная) (7%) и ALK-негативная (6%).
• Если T-клеточное происхождение или вовлечение упоминается в связи со специфической лимфомой, следует кодировать более специфическое описание.
• с84,6 Анапластическая крупноклеточная лимфома, ALK-положительная.
• с84,7 Анапластическая крупноклеточная лимфома, ALK-отрицательная.
• с84,9 Зрелая T/NK-клеточная лимфома неуточненная.
• С86,0 Экстранодальная NK/Т-клеточная лимфома, назальный тип.
• С86,5 Ангиоиммунобластная Т-клеточная лимфома.
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
• с84,5 Другие зрелые T/NK-клеточные лимфомы.• Если T-клеточное происхождение или вовлечение упоминается в связи со специфической лимфомой, следует кодировать более специфическое описание.
• с84,6 Анапластическая крупноклеточная лимфома, ALK-положительная.
• с84,7 Анапластическая крупноклеточная лимфома, ALK-отрицательная.
• с84,9 Зрелая T/NK-клеточная лимфома неуточненная.
• С86,0 Экстранодальная NK/Т-клеточная лимфома, назальный тип.
• С86,5 Ангиоиммунобластная Т-клеточная лимфома.
Классификация
1,5 Классификация заболевания или состояния (группы заболеваний или состояний).
В пересмотренной классификации опухолей гемопоэтической и лимфоидной тканей ВОЗ 2017 г. нодальные ПТКЛ подразделяются на следующие нозологические варианты [8]:• Периферическая Т-клеточная лимфома, неспецифицированная.
• Ангиоиммунобластная Т-клеточная лимфома.
• Фолликулярная Т-клеточная лимфома.
• Нодальная периферическая Т-клеточная лимфома с TFH - фенотипом.
• Анапластическая крупноклеточная лимфома, ALK-позитивная.
• Анапластическая крупноклеточная лимфома, ALK-негативная.
• Анапластическая крупноклеточная лимфома, ассоциированная с грудными имплантами.
Морфологическое и иммуногистохимическое описание различных вариантов ПТКЛ описано в разделе 7,2 данных рекомендаций.
Кроме определения варианта ПТКЛ, у каждого пациента нодальной ПТКЛ должна быть определена стадия заболевания согласно классификации Ann Arbor [9] ( см раздел 7,3 данных рекомендаций), а также группа риска согласно одной из прогностических моделей для ПТКЛ [10] ( см раздел 7,4 данных рекомендаций).
Клиническая картина
Группа ПТКЛ гетерогенна, в связи с чем, помимо общей клинической картины (слабость, ночная потливость, повышение температуры тела, снижением массы тела), для некоторых нозологических форм специфичны определенные клинические признаки [7].
При ПТКЛн заболевание чаще манифестирует с увеличения лимфатических узлов любой локализации, вторично вовлекаются костный мозг, селезенка, экстранодальные ткани (кожа, желудочно-кишечный тракт, реже легкие, центральная нервная система), часто заболевание протекает с наличием В-симптомов.
АИТЛ - заболевание, протекающее агрессивно, со стремительной манифестацией, выраженными общими симптомами, гепатоспленомегалией, генерализованной лимфаденопатией, поражением костного мозга, поликлональной гипергаммаглобулинемией, нередко с вовлечением серозных оболочек и картиной экссудативного плеврита, асцита, артритов. Клиническая картина и данные инструментальных исследований при фолликулярной ТКЛ неотличимы от таковых при АИТЛ, однако заболевание первично возникает в лимфатических узлах, реже поражаются кожа и костный мозг [11].
При ALK+ АККЛ поражаются как лимфатические узлы, так и экстранодальные области, такие как кожа, кости, мягкие ткани, легкие и печень. Вовлечение кишечника и ЦНС редки. Около 30% пациентов имеют поражение костного мозга, иногда выявляемое только с помощью ИГХ исследования трепаната. У большинства пациентов (около 70%) заболевание дебютирует с III-IV стадии с наличием периферической/абдоминальной лимфаденопатии, часто с вовлечением экстранодальных очагов и костного мозга. Большинство пациентов имеют общие симптомы, наиболее часто лихорадку.
При ALK- АККЛ могут поражаться как лимфатические узлы, так и экстранодальные области, однако, вовлечение экстралимфатических тканей не такое частое, как при ALK+ АККЛ. У большинства пациентов заболевание манифестирует с III-IV стадии с периферической/абдоминальной лимфаденопатией, большинство пациентов имеют общие симптомы [12].
При АККЛ, ассоциированной с грудным имплантом опухолевые клетки могут локализоваться в послеоперационной сероме, или инфильтрируют фиброзную перикапсулярную ткань, при этом могут также вовлекаться локо-регионарные л/у, что и определяет клиническую картину заболевания. Около трети пациентов имеют увеличенные аксиллярные л/у, в редких случаях на момент установления диагноза болезнь имеет диссеминированный характер [13].
При ПТКЛн заболевание чаще манифестирует с увеличения лимфатических узлов любой локализации, вторично вовлекаются костный мозг, селезенка, экстранодальные ткани (кожа, желудочно-кишечный тракт, реже легкие, центральная нервная система), часто заболевание протекает с наличием В-симптомов.
АИТЛ - заболевание, протекающее агрессивно, со стремительной манифестацией, выраженными общими симптомами, гепатоспленомегалией, генерализованной лимфаденопатией, поражением костного мозга, поликлональной гипергаммаглобулинемией, нередко с вовлечением серозных оболочек и картиной экссудативного плеврита, асцита, артритов. Клиническая картина и данные инструментальных исследований при фолликулярной ТКЛ неотличимы от таковых при АИТЛ, однако заболевание первично возникает в лимфатических узлах, реже поражаются кожа и костный мозг [11].
При ALK+ АККЛ поражаются как лимфатические узлы, так и экстранодальные области, такие как кожа, кости, мягкие ткани, легкие и печень. Вовлечение кишечника и ЦНС редки. Около 30% пациентов имеют поражение костного мозга, иногда выявляемое только с помощью ИГХ исследования трепаната. У большинства пациентов (около 70%) заболевание дебютирует с III-IV стадии с наличием периферической/абдоминальной лимфаденопатии, часто с вовлечением экстранодальных очагов и костного мозга. Большинство пациентов имеют общие симптомы, наиболее часто лихорадку.
При ALK- АККЛ могут поражаться как лимфатические узлы, так и экстранодальные области, однако, вовлечение экстралимфатических тканей не такое частое, как при ALK+ АККЛ. У большинства пациентов заболевание манифестирует с III-IV стадии с периферической/абдоминальной лимфаденопатией, большинство пациентов имеют общие симптомы [12].
При АККЛ, ассоциированной с грудным имплантом опухолевые клетки могут локализоваться в послеоперационной сероме, или инфильтрируют фиброзную перикапсулярную ткань, при этом могут также вовлекаться локо-регионарные л/у, что и определяет клиническую картину заболевания. Около трети пациентов имеют увеличенные аксиллярные л/у, в редких случаях на момент установления диагноза болезнь имеет диссеминированный характер [13].
Диагностика
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (в соответствии с шкалами оценки УДД и УРР) по причине отсутствия посвященных им клинических исследований. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Критерии установления диагноза/состояния. Диагноз ПТКЛ устанавливается на основе патолого-анатомического исследований биопсийного материала с применением иммуногистохимических методов и формулируется в соответствии с пересмотренной классификацией опухолей гемопоэтической и лимфоидной тканей ВОЗ 2017 г. [1,8].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. При нодальных Т-клеточных лимфомах больной достаточно часто может предъявлять жалобы на общее недомогание, увеличение в размерах лимфатических узлов, ночную потливость, снижение массы тела, кожный зуд. Анамнез заболевания, как правило, краткосрочный (не более 6 месяцев).
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. При осмотре необходимо оценить общее состояние пациента по шкале ECOG ( см приложение Г1), а также осмотреть кожные покровы, миндалины и полость рта; пальпация должна включать в себя пальпацию всех доступных групп периферических лимфатических узлов, печени, селезенки.
• общий (клинический) анализ крови развернутый с исследованием уровней общего гемоглобина, эритроцитов, тромбоцитов, лейкоцитов в крови, с дифференцированным подсчетом лейкоцитов (лейкоцитарная формула), с исследованием уровня ретикулоцитов в крови, а также с исследованием скорости оседания эритроцитов;
• общий (клинический) анализ мочи;
• анализ крови биохимический общетерапевтический с определениями активностей лактатдегидрогеназы (ЛДГ), аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы в крови, исследованиями уровней мочевины, креатинина, альбумина, общего белка, общего билирубина, калия, натрия, общего кальция, хлоридов в крови, исследованием уровня бета-2-микроглобулина в крови (другие параметры биохимического анализа крови могут быть включены в исследование на усмотрение врача);
• исследование свертывающей системы крови (коагулограмма) с включением следующих параметров: протромбин, МНО, АЧТВ, фибриноген, тромбиновое время, антитромбин III, плазминоген, D-димер [14,15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Объем исследования включает в себя дифференциальный подсчет клеток крови с использованием автоматического анализатора; исследование морфологии эритроцитов, тромбоцитов, лейкоцитов по мазку, при необходимости - оптический подсчет количества тромбоцитов (по Фонио).
• Всем пациентам с ПТКЛ при наличии клинических или лабораторных признаков гемолиза перед проведением первой линии противоопухолевой терапии рекомендуется прямой антиглобулиновый тест (прямая проба Кумбса) [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем ранее не получавшим лечение пациентам с ПТКЛ перед проведением первой линии противоопухолевой терапии рекомендуется определение основных групп крови по системе AB0, определение антигена D системы Резус (резус-фактора) для возможности выполнения гемотрансфузии при наличии показаний до, во время или после терапии [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем ранее не получавшим лечение пациентам с ПТКЛ перед проведением первой линии противоопухолевой терапии рекомендуется для уточнения наличия сопутствующих инфекционных заболеваний и планирования необходимой сопутствующей терапии выполнение следующих исследований [1]:
• молекулярно-биологического исследования крови на вирус гепатита в (Hepatitis в virus) и на вирус гепатита с (Hepatitis с virus);
• молекулярно-биологического исследования крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1).
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем пациентам с ПТКЛ младше 18 лет до начала противоопухолевой терапии, а также всем пациентам с ПТКЛ независимо от возраста, получающим или получавшим противоопухолевую терапию, после первого эпизода тяжелой инфекции рекомендуется определение иммунного статуса - исследования уровня иммуноглобулинов G, A и M в крови для уточнения риска развития инфекционных осложнений и необходимости назначения соответствующей профилактики [1,16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. Если IgG<4 г/л, клиническая ситуация расценивается как симптоматическая гипогаммаглобулинемия. В этих случаях показана заместительная терапия иммуноглобулинами ( см раздел «Сопутствующая и сопроводительная терапия).
• Пациентам с верифицированной экстранодальной T/NK-клеточной лимфомой перед началом и после завершения специфической терапии рекомендуется молекулярно-биологическое исследование крови на вирус Эпштейна-Барра (Epstein - вarr virus) [2].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Пациентам с противопоказаниями к КТ, либо при невозможности выполнения КТ, при установлении диагноза ПТКЛ, при оценке ответа на лечение, а также при подозрении на рецидив заболевания рекомендуется для стадирования заболевания и уточнения наличия, размеров и распространенности опухолевых очагов выполнить следующие диагностические исследования [1]:
• прицельную рентгенографию органов грудной клетки в двух проекциях;
• ультразвуковое исследование лимфатических узлов и внутренних органов.
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. При ультразвуковом исследовании необходимо оценить периферические лимфатические узлы, внутрибрюшные, забрюшинные узлы, органы брюшной полости и малого таза. Лимфоузлы диаметром менее 1 см считаются непораженными, лимфоузлы диаметром 1-2 см требуют динамического наблюдения в процессе терапии, лимфоузлы диаметром более 2 см считаются пораженными.
• Всем пациентам при установлении диагноза ПТКЛ, при оценке ответа на лечение, а также при подозрении на рецидив заболевания рекомендуется при наличии возможности выполнить позитронную эмиссионную томографию, совмещенную с компьютерной томографией (ПЭТ/КТ) с туморотропными радиофармпрепаратами (РФП) или (хуже, при отсутствии технической возможности выполнит ПЭТ/КТ) позитронную эмиссионную томографию (ПЭТ) всего тела с туморотропными РФП для более точного стадирования заболевания и лучшей оценки эффекта на терапию [1,17-19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарии. Позитронная эмиссионная томография, совмещенная с компьютерной томографией (ПЭТ/КТ), высокоинформативным методом диагностики. ПЭТ/КТ, выполненная до начала лечения, позволяет не только уточнить стадию, но и более точно определить локализацию очагов поражения, особенно экстранодальные вовлечения, которые могут плохо диагностироваться при КТ, что имеет существенное значение для последующей оценки эффекта терапии индукции и качественного планирования последующей лучевой терапии и минимизации облучения здоровых тканей. При наличии возможности выполнения ПЭТ/КТ, она может быть применена в соответствии с пересмотренными критериями оценки ответа, в первую очередь у больных с минимальным объемом опухоли, а также с учетом возможной коррекции лечения.
При наличии технической возможности ПЭТ/КТ должна оцениваться по шкале Deauville ( см приложение Г2).
• Всем пациентам с установленным диагнозом ПТКЛ, которым планируется лечение по поводу впервые установленного заболевания, либо по поводу рецидива, рекомендуется для своевременного выявления сопутствующей патологии со стороны сердечно-сосудистой, дыхательной и пищеварительной систем и для определения необходимости их профилактики или лечения рекомендуется выполнить следующие исследования [1]:
• электрокардиографию;
• эхокардиографию;
• эзофагогастродуоденоскопию;
• ультразвуковую допплерографию сосудов (артерий и вен) нижних конечностей [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. Выбор ткани и объем биопсии должны быть адекватны поставленной диагностической задаче.
• Тонкоигольные биопсии лимфоидной ткани могут быть диагностически значимыми, но не всегда.
• Краевые биопсии лимфоидной ткани мало информативны.
• Фрагментация материала крайне затрудняет его оценку.
• Материал для патолого-анатомического исследования исследования должен быть помещён в фиксирующую среду как можно быстрее. Нельзя допускать высыхания материала.
• Соотношение объёма фиксирующей среды к объёму фиксируемого объекта не менее чем 10:1.
• Время фиксации не должно быть менее 12 и более 48 часов.
Неадекватная (слабая или чрезмерная) фиксация приводит к изменению морфологических свойств ткани и артефициальным результатам ИГХ.
Гистологический материал должен сопровождаться направлением, содержащим информацию о пациенте, длительности и характере заболевания, локализации очага поражения, описании биопсии [21].
Диагностические полостные операции - торакоскопия/томия, лапароскопия/томия с биопсией внутригрудных, внутрибрюшных л/у или печени проводятся только при отсутствии увеличенных периферических лимфоузлов и невозможности верификации диагноза.
Гистологические и иммуногистохимические характеристики различных ПТКЛ, а также обязательные требования к патолого-анатомическому заключению представлены в разделе 7,1 данных рекомендаций. Описание морфологической и иммуногистохимической картины различных ПТКЛ представлено в разделе 7,2 данных рекомендаций.
• Всем пациентам при подозрении или наличии подтвержденного диагноза ПТКЛ первично (для стадирования заболевания), после завершения терапии (для оценки противоопухолевого ответа), при подозрении на рецидив заболевания рекомендуется [1,2] :
• получение цитологического препарата костного мозга путем пункции, цитологическое исследование мазка костного мозга (миелограмма), а при повышении количества лимфоидных клеток, наличия атипичных лимфоцитов или клеток с бластной морфологией в костном мозге - исследование биологического материала (аспирата костного мозга) методом проточной цитофлуориметрии.
• получение гистологического препарата костного мозга (трепанобиопсия), патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов.
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. Исследование костного мозга (аспират и трепанат) также рекомендуется при появлении клинически немотивированных цитопении и лихорадки (вне зависимости от наличия исходного поражения).
У детей трепанобиопсия подвздошной кости должна обязательно проводиться под общей анестезией.
• Пациентам с верифицированной ПТКЛ с абсолютным лимфоцитозом в периферической крови при первичном обследовании рекомендуется иммунофенотипирование биологического материала (периферической крови) для дифференциальной диагностики с реактивным лимфоцитозом [22].Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарии. Выполнение иммунофенотипического исследования (ИФТ) обязательно при наличии лимфоцитоза в общем анализе крови (независимо от числа лейкоцитов), или в миелограмме, а также при преобладании лимфоидных клеток, атипичных лимфоцитов или клеток с бластной морфологией в плевральной, асцитической или других биологических жидкостях. Выполнение ИФТ позволяет быстро провести дифференциальную диагностику опухолевого и реактивного лимфоцитоза, что важно для определения дальнейшей тактики обследования пациента.
• Пациентам с верифицированной ПТКЛ при первичном обследовании и планировании терапии рекомендуется в зависимости от сопутствующей патологии осмотр (консультация) врача-кардиолога, врача-эндокринолога, врача-невропатолога, врача- инфекциониста и других врачей-специалистов для определения необходимости терапии сопутствующих заболеваний [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Пациентам с верифицированной ПТКЛ при первичном обследовании и планировании терапии рекомендуется оценить риск развития венозных тромбоэмболических осложнений (шкала оценки риска ВТЭО по Khorana - см приложение Г3 данных рекомендаций) для выявления пациентов, требующих назначения и определения способов профилактики тромботических осложнений при проведении цитостатической терапии [14,15,23-25].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 3).
• Всем женщинам детородного возраста с впервые выявленной ПТКЛ, а также с рецидивом ПТКЛ, перед началом терапии рекомендуется выполнение комплекса исследований по определению беременности для коррекции терапевтической тактики и консультации акушера-гинеколога в случае наличия беременности и желания женщины ее сохранить [1,26].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Критерии установления диагноза/состояния. Диагноз ПТКЛ устанавливается на основе патолого-анатомического исследований биопсийного материала с применением иммуногистохимических методов и формулируется в соответствии с пересмотренной классификацией опухолей гемопоэтической и лимфоидной тканей ВОЗ 2017 г. [1,8].
2,1 Жалобы и анамнез.
• Всем пациентам с подозрением на Т-клеточную лимфому, а также всем пациентам с верифицированной ПТКЛ на каждом врачебном приеме рекомендуется сбор анамнеза для оценки состояния пациента, а также для установления факторов, которые могут оказать влияние на определение лечебной тактики пациента [1,2].Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. При нодальных Т-клеточных лимфомах больной достаточно часто может предъявлять жалобы на общее недомогание, увеличение в размерах лимфатических узлов, ночную потливость, снижение массы тела, кожный зуд. Анамнез заболевания, как правило, краткосрочный (не более 6 месяцев).
2,2 Физикальное обследование.
• Всем пациентам с подозрением на ПТКЛ, или с выявленной ПТКЛ, при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив/прогрессирование заболевания рекомендуется выполнение визуального осмотра терапевтического, пальпации терапевтической и аускультации терапевтической для уточнения распространенности заболевания и оценки состояния пациента по органам и системам [1,2].Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. При осмотре необходимо оценить общее состояние пациента по шкале ECOG ( см приложение Г1), а также осмотреть кожные покровы, миндалины и полость рта; пальпация должна включать в себя пальпацию всех доступных групп периферических лимфатических узлов, печени, селезенки.
2,3 Лабораторные диагностические исследования.
• Всем пациентам с подозрением на ПТКЛ или выявленной ПТКЛ при первичном или повторном приеме, после завершения каждого цикла терапии и перед началом каждого нового цикла терапии, при оценке ремиссии после завершения терапии, при контрольных обследованиях, и при подозрении на рецидив заболевания рекомендуется для уточнения состояния пациента, планирования терапевтической тактики и определения необходимости ее модификации, а также для определения потребности в сопутствующей и сопроводительной терапии выполнить следующие диагностические исследования [1]:• общий (клинический) анализ крови развернутый с исследованием уровней общего гемоглобина, эритроцитов, тромбоцитов, лейкоцитов в крови, с дифференцированным подсчетом лейкоцитов (лейкоцитарная формула), с исследованием уровня ретикулоцитов в крови, а также с исследованием скорости оседания эритроцитов;
• общий (клинический) анализ мочи;
• анализ крови биохимический общетерапевтический с определениями активностей лактатдегидрогеназы (ЛДГ), аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы в крови, исследованиями уровней мочевины, креатинина, альбумина, общего белка, общего билирубина, калия, натрия, общего кальция, хлоридов в крови, исследованием уровня бета-2-микроглобулина в крови (другие параметры биохимического анализа крови могут быть включены в исследование на усмотрение врача);
• исследование свертывающей системы крови (коагулограмма) с включением следующих параметров: протромбин, МНО, АЧТВ, фибриноген, тромбиновое время, антитромбин III, плазминоген, D-димер [14,15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Объем исследования включает в себя дифференциальный подсчет клеток крови с использованием автоматического анализатора; исследование морфологии эритроцитов, тромбоцитов, лейкоцитов по мазку, при необходимости - оптический подсчет количества тромбоцитов (по Фонио).
• Всем пациентам с ПТКЛ при наличии клинических или лабораторных признаков гемолиза перед проведением первой линии противоопухолевой терапии рекомендуется прямой антиглобулиновый тест (прямая проба Кумбса) [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем ранее не получавшим лечение пациентам с ПТКЛ перед проведением первой линии противоопухолевой терапии рекомендуется определение основных групп крови по системе AB0, определение антигена D системы Резус (резус-фактора) для возможности выполнения гемотрансфузии при наличии показаний до, во время или после терапии [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем ранее не получавшим лечение пациентам с ПТКЛ перед проведением первой линии противоопухолевой терапии рекомендуется для уточнения наличия сопутствующих инфекционных заболеваний и планирования необходимой сопутствующей терапии выполнение следующих исследований [1]:
• молекулярно-биологического исследования крови на вирус гепатита в (Hepatitis в virus) и на вирус гепатита с (Hepatitis с virus);
• молекулярно-биологического исследования крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1).
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем пациентам с ПТКЛ младше 18 лет до начала противоопухолевой терапии, а также всем пациентам с ПТКЛ независимо от возраста, получающим или получавшим противоопухолевую терапию, после первого эпизода тяжелой инфекции рекомендуется определение иммунного статуса - исследования уровня иммуноглобулинов G, A и M в крови для уточнения риска развития инфекционных осложнений и необходимости назначения соответствующей профилактики [1,16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. Если IgG<4 г/л, клиническая ситуация расценивается как симптоматическая гипогаммаглобулинемия. В этих случаях показана заместительная терапия иммуноглобулинами ( см раздел «Сопутствующая и сопроводительная терапия).
• Пациентам с верифицированной экстранодальной T/NK-клеточной лимфомой перед началом и после завершения специфической терапии рекомендуется молекулярно-биологическое исследование крови на вирус Эпштейна-Барра (Epstein - вarr virus) [2].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
2,4 Инструментальные диагностические исследования.
• Всем пациентам при установлении диагноза ПТКЛ, при оценке ответа на лечение, а также при подозрении на рецидив заболевания рекомендуется выполнить КТ шеи, грудной клетки, органов брюшной полости и малого таза (с контрастированием) для стадирования заболевания и уточнения наличия, размеров и распространенности опухолевых очагов [1].Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Пациентам с противопоказаниями к КТ, либо при невозможности выполнения КТ, при установлении диагноза ПТКЛ, при оценке ответа на лечение, а также при подозрении на рецидив заболевания рекомендуется для стадирования заболевания и уточнения наличия, размеров и распространенности опухолевых очагов выполнить следующие диагностические исследования [1]:
• прицельную рентгенографию органов грудной клетки в двух проекциях;
• ультразвуковое исследование лимфатических узлов и внутренних органов.
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. При ультразвуковом исследовании необходимо оценить периферические лимфатические узлы, внутрибрюшные, забрюшинные узлы, органы брюшной полости и малого таза. Лимфоузлы диаметром менее 1 см считаются непораженными, лимфоузлы диаметром 1-2 см требуют динамического наблюдения в процессе терапии, лимфоузлы диаметром более 2 см считаются пораженными.
• Всем пациентам при установлении диагноза ПТКЛ, при оценке ответа на лечение, а также при подозрении на рецидив заболевания рекомендуется при наличии возможности выполнить позитронную эмиссионную томографию, совмещенную с компьютерной томографией (ПЭТ/КТ) с туморотропными радиофармпрепаратами (РФП) или (хуже, при отсутствии технической возможности выполнит ПЭТ/КТ) позитронную эмиссионную томографию (ПЭТ) всего тела с туморотропными РФП для более точного стадирования заболевания и лучшей оценки эффекта на терапию [1,17-19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарии. Позитронная эмиссионная томография, совмещенная с компьютерной томографией (ПЭТ/КТ), высокоинформативным методом диагностики. ПЭТ/КТ, выполненная до начала лечения, позволяет не только уточнить стадию, но и более точно определить локализацию очагов поражения, особенно экстранодальные вовлечения, которые могут плохо диагностироваться при КТ, что имеет существенное значение для последующей оценки эффекта терапии индукции и качественного планирования последующей лучевой терапии и минимизации облучения здоровых тканей. При наличии возможности выполнения ПЭТ/КТ, она может быть применена в соответствии с пересмотренными критериями оценки ответа, в первую очередь у больных с минимальным объемом опухоли, а также с учетом возможной коррекции лечения.
При наличии технической возможности ПЭТ/КТ должна оцениваться по шкале Deauville ( см приложение Г2).
• Всем пациентам с установленным диагнозом ПТКЛ, которым планируется лечение по поводу впервые установленного заболевания, либо по поводу рецидива, рекомендуется для своевременного выявления сопутствующей патологии со стороны сердечно-сосудистой, дыхательной и пищеварительной систем и для определения необходимости их профилактики или лечения рекомендуется выполнить следующие исследования [1]:
• электрокардиографию;
• эхокардиографию;
• эзофагогастродуоденоскопию;
• ультразвуковую допплерографию сосудов (артерий и вен) нижних конечностей [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
2,5 Иные диагностические исследования.
• Всем пациентам с подозрением на ПТКЛ, с подозрением на рецидив ПТКЛ, а также при неоднозначности трактовки противоопухолевого ответа после завершения лечения рекомендуется выполнить биопсию (взятие биопсийного материала) лимфатического узла либо другого очага поражения, патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов для верификации диагноза [1,2].Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. Выбор ткани и объем биопсии должны быть адекватны поставленной диагностической задаче.
• Тонкоигольные биопсии лимфоидной ткани могут быть диагностически значимыми, но не всегда.
• Краевые биопсии лимфоидной ткани мало информативны.
• Фрагментация материала крайне затрудняет его оценку.
• Материал для патолого-анатомического исследования исследования должен быть помещён в фиксирующую среду как можно быстрее. Нельзя допускать высыхания материала.
• Соотношение объёма фиксирующей среды к объёму фиксируемого объекта не менее чем 10:1.
• Время фиксации не должно быть менее 12 и более 48 часов.
Неадекватная (слабая или чрезмерная) фиксация приводит к изменению морфологических свойств ткани и артефициальным результатам ИГХ.
Гистологический материал должен сопровождаться направлением, содержащим информацию о пациенте, длительности и характере заболевания, локализации очага поражения, описании биопсии [21].
Диагностические полостные операции - торакоскопия/томия, лапароскопия/томия с биопсией внутригрудных, внутрибрюшных л/у или печени проводятся только при отсутствии увеличенных периферических лимфоузлов и невозможности верификации диагноза.
Гистологические и иммуногистохимические характеристики различных ПТКЛ, а также обязательные требования к патолого-анатомическому заключению представлены в разделе 7,1 данных рекомендаций. Описание морфологической и иммуногистохимической картины различных ПТКЛ представлено в разделе 7,2 данных рекомендаций.
• Всем пациентам при подозрении или наличии подтвержденного диагноза ПТКЛ первично (для стадирования заболевания), после завершения терапии (для оценки противоопухолевого ответа), при подозрении на рецидив заболевания рекомендуется [1,2] :
• получение цитологического препарата костного мозга путем пункции, цитологическое исследование мазка костного мозга (миелограмма), а при повышении количества лимфоидных клеток, наличия атипичных лимфоцитов или клеток с бластной морфологией в костном мозге - исследование биологического материала (аспирата костного мозга) методом проточной цитофлуориметрии.
• получение гистологического препарата костного мозга (трепанобиопсия), патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов.
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. Исследование костного мозга (аспират и трепанат) также рекомендуется при появлении клинически немотивированных цитопении и лихорадки (вне зависимости от наличия исходного поражения).
У детей трепанобиопсия подвздошной кости должна обязательно проводиться под общей анестезией.
• Пациентам с верифицированной ПТКЛ с абсолютным лимфоцитозом в периферической крови при первичном обследовании рекомендуется иммунофенотипирование биологического материала (периферической крови) для дифференциальной диагностики с реактивным лимфоцитозом [22].Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарии. Выполнение иммунофенотипического исследования (ИФТ) обязательно при наличии лимфоцитоза в общем анализе крови (независимо от числа лейкоцитов), или в миелограмме, а также при преобладании лимфоидных клеток, атипичных лимфоцитов или клеток с бластной морфологией в плевральной, асцитической или других биологических жидкостях. Выполнение ИФТ позволяет быстро провести дифференциальную диагностику опухолевого и реактивного лимфоцитоза, что важно для определения дальнейшей тактики обследования пациента.
• Пациентам с верифицированной ПТКЛ при первичном обследовании и планировании терапии рекомендуется в зависимости от сопутствующей патологии осмотр (консультация) врача-кардиолога, врача-эндокринолога, врача-невропатолога, врача- инфекциониста и других врачей-специалистов для определения необходимости терапии сопутствующих заболеваний [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Пациентам с верифицированной ПТКЛ при первичном обследовании и планировании терапии рекомендуется оценить риск развития венозных тромбоэмболических осложнений (шкала оценки риска ВТЭО по Khorana - см приложение Г3 данных рекомендаций) для выявления пациентов, требующих назначения и определения способов профилактики тромботических осложнений при проведении цитостатической терапии [14,15,23-25].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 3).
• Всем женщинам детородного возраста с впервые выявленной ПТКЛ, а также с рецидивом ПТКЛ, перед началом терапии рекомендуется выполнение комплекса исследований по определению беременности для коррекции терапевтической тактики и консультации акушера-гинеколога в случае наличия беременности и желания женщины ее сохранить [1,26].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
|
|
Лечение
При выборе тактики и проведении терапии следует учитывать, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
Учитывая наличие неудовлетворенных медицинских потребностей (большое количество рецидивов, недостаточная эффективность и высокая токсичность существующих методов лечения), а также интенсивное изучение новых методов диагностики и лечения, рекомендуется участие пациентов в исследовательских проектах.
Каждый цикл терапии начинается, если состояние пациента удовлетворяет следующим критериям:
• гранулоциты > 1 x 109/л,.
• тромбоциты > 100 x 109/л.
Для больных с цитопенией, обусловленной поражением костного мозга, специфическая терапия возможна и при более низких показателях лейкоцитов и тромбоцитов, однако в этих случаях должна быть обеспечена соответствующая сопроводительная терапия.
Пациент прекращает лечение по протоколу в случаях прогрессии заболевания или токсических эффектов, не позволяющих продолжать химиотерапию в необходимом объеме.
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарий. В нескольких сериях проспективных рандомизированных исследований, выполненных немецкой группы DSHNHL, продемонстрировано улучшение результатов лечения при добавлении этопозида к курсам сHOP у пациентов моложе 60 лет, особенно с нормальным уровнем ЛДГ. Применение данного режима терапии позволило добиться более высокой частоты полных ремиссий (88% против 79% в группе, получавших лечение по схеме СНОР) и более высокой выживаемости без прогрессии (69% и 58% соответственно).
• Ранее не получавшим лечение пациентам с ПТКЛн, АИТЛ или АККЛ старше 60 лет и/или с тяжелой коморбидностью рекомендовано проведение полихимиотерапии по схеме сHOP ( см приложение А3,1) [30].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарий. В ретроспективных клинических исследованиях показано, что применение стандартных режимов химиотерапии по программе сHOP-21/14 позволяет достичь 5-летней общей выживаемости и выживаемости без прогрессирования у 35% и 29% пациентов, соответственно, при этом показатели 5 - летней ОВ выше у пациентов из группы с низким IPI по сравнению с высоким риском (66% и 22% соответственно).
Больные с впервые установленным диагнозом ПТКЛ старше 60 лет чаще всего не включаются в протокол высокодозной химиотерапии. Исследования, оценивающие роль антрациклинов в лечении этой группы пациентов, остаются противоречивыми, но не позволяют на сегодняшний день исключить данную группу препаратов из терапии первой линии, в связи с чем режим сHOP остается терапией выбора. Добавление этопозида не улучшает результаты лечения пожилых пациентов в связи с высокой токсичностью схемы СНОЕР.
• Ранее не получавшим лечение пациентам с I-II стадиями экстранодальной NK/T-клеточной лимфомы, назальный тип, рекомендовано проведение одного из следующих вариантов лечения [31]:
• одновременная химиолучевая терапия: ЛТ СОД 50 Гр и выполнение редуцированного (2/3) курса DeVIC с последующей консолидацией - 3 курса DeVIC [32];
• либо ЛТ СОД 40-44 Гр и еженедельное введение цисплатина (30 мг/м2), с последующей консолидацией - 3 курса VIPD [33];
• последовательная химиолучевая терапия: ХТ по схеме VIPD с последующей ЛТ 36-44 Гр (для пожилых пациентов) [34].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
• Ранее не получавшим лечение пациентам с I-II стадиями экстранодальной NK/T-клеточной лимфомы, назальный тип, при наличии противопоказаний к ХТ рекомендовано проведение ЛТ СОД 50-55 Гр. [31].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Ранее не получавшим лечение пациентам с распространенными стадиями экстранодальной NK/T-клеточной лимфомы, назальный тип, а также с неназальными формами экстранодальной NK/T-клеточной лимфомы рекомендовано проведение химиотерапии с включением L-аспарагиназы (AspMetDex или SMILE - см приложение А3,1), +/- ЛТ 45-50 Гр с целью индукции ремиссии [31].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Пациентам 18-60 лет с ПТКЛн, АИТЛ или АККЛ, а также с вненазальной или с распространенными стадиями назальной экстранодальной NK/T-клеточной лимфомы, достигшим ПР после индукционной терапии, рекомендовано проведение стимуляции гемопоэза с мобилизацией и последующим сбором гемопоэтических стволовых клеток (ГСК), после чего проведение высокодозной терапии одним из режимов кондиционирования (описание режимов - см приложение А3,1,5) с последующей трансплантацией ГСК [35].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Пациентам с локализованными (I-II) стадиями ПТКЛн, АИТЛ или АККЛ, ответившим на индукционную терапию (достигнута частичная ремиссия или более), которым не планируется аутоТГСК, после завершения индукционной терапии, рекомендовано проведение лучевой терапии на зоны исходного поражения 30-36 Гр (в случае достижения ПР после ХТ) или 40-50 Гр (в случае достижения ЧР после ХТ) с целью консолидации достигнутого противоопухолевого ответа [36,37].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
• Пациентам с анапластической Т-клеточной лимфомой, ассоциированной с грудными имплантами, рекомендовано хирургическое удаление импланта вместе с окружающей имплант фиброзной капсулой и любым образованием, прилежащим к капсуле [38].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
• Пациентам с анапластичекой Т-клеточной лимфомой, ассоциированной с грудными имплантами, в случае очагового поражения паренхимы молочной железы и/или вовлечения региональных лимфоузлов рекомендовано проведение полихимиотерапии по схеме сHOP ( см приложение А3,1) [38].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
Комментарий. Анапластическая Т-клеточная лимфома, ассоциированная с грудными имплантами, имеет индолентное течение и, как правило, характеризуется благоприятным прогнозом, поэтому агрессивные терапевтические подходы при этом заболевании не рекомендованы. В случае возникновения заболевания только в виде выпота вокруг молочной железы послеоперационное лекарственное лечение не требуется [2].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 4).
Комментарий. Наличие остаточной опухоли после терапии в объеме менее 30% от исходной у детей до 18 лет не рассматривается как неудача и не подразумевает каких-либо модификаций лечения.
• Пациентам до 18 лет с первичной ПТКЛ ЦНС рекомендовано проведение лечения в соответствии с рекомендациями по лечению пациентов с агрессивными нефолликулярными В-клеточными лимфомами у детей с поражением ЦНС, без применения ритуксимаба** [40].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
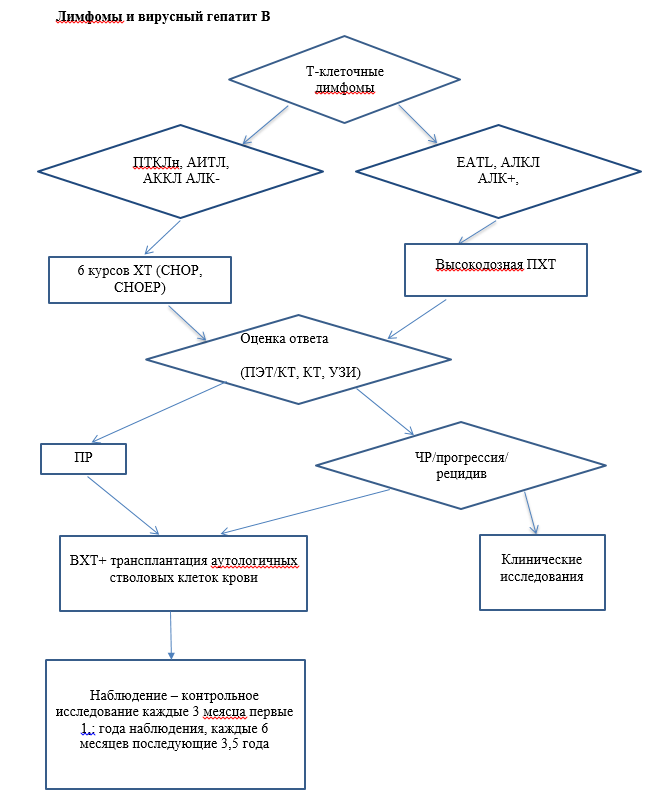
Комментарий. В клиническом исследовании 2 фазы при медиане наблюдения 6 лет общий уровень ответа на лечение составил 86% (66% полных и 20% частичных ответов), при этом достигнутые результаты лечения статистически не различались у ALK+ и ALK - АККЛ. 5- летняя общая выживаемость и безрецидивная выживаемость составили 60% и 39%, соответственно.
• Пациентам до 18 лет с поздним (продолжительность ремиссии более 1 года) рецидивом АККЛ рекомендована терапия винбластином** 6 мг/м2/нед. в течение 2 лет [43].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 4).
• Пациентам с рецидивами или рефрактерными формами ПТКЛ моложе 65 лет без тяжелой коморбидности рекомендована консультация в специализированном центре, проводящем трансплантацию аутологичных и аллогенных гемопоэтических стволовых клеток, для решения вопроса о целесообразности и возможности проведения одной из этих двух процедур и о дальнейшей тактике ведения пациента [44-51].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарий. Детям до 18 лет с ранними рецидивами АККЛ, после достижения ремиссии, показана только аллогенная ТГСК.
• Пациентам с рецидивами или рефрактерными формами ПТКЛ, за исключением пациентов, которым показана и может быть проведена терапия брентуксимабом ведотином**, рекомендуется проведение химиотерапии рецидива по одной из схем терапии второй линии на выбор лечащего врача либо (в случае планирования ауто- или алло-ТГСК) по рекомендации трансплантационного центра (описание режимов - см приложение А3,1) [37]:
• DHAP [52].
• ESHAP [53].
• GDP [54].
• ICE [55].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 4).
• Пациентам с рецидивами или рефрактерными формами ALK-позитивной АККЛ рекомендовано в качестве альтернативы цитостатической терапии применение селективного ингибитора ALK (кризотиниб** 250 мг/м2 внутрь 2 раза в день до прогрессирования) [56].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
• Пациентам с рецидивами или рефрактерными формами экстранодальной NK/T-клеточной лимфомы рекомендуется проведение химиотерапии рецидива по одной из схем терапии второй линии на основе аспарагиназы (AspMetDex или SMILE, описание режимов - см приложение А3,1) [57,58].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем пациентам c ПТКЛ со сниженной концентрацией гемоглобина крови рекомендовано лечение анемии согласно существующим профильным рекомендациям [61,62].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем пациентам c ПТКЛ, получающим противоопухолевую химио. Или лучевую терапию, рекомендована профилактика и лечение тошноты и рвоты в зависимости от эметогенного потенциала проводимого лечения согласно существующим профильным рекомендациям [63].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Пациентам с ПТКЛ с выявленной симптоматической гипогаммаглобулинемией (перенесенная тяжелая инфекция, IgG worse 4 г/л) рекомендовано проведение заместительной терапии иммуноглобулином человека нормальным 0,2-0,4 г/кг в/в каждые 3-4 недели в течение 12 месяцев [16,64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Терапия проводится под контролем уровня IgG каждые 6 месяцев, пересмотр дозы иммуноглобулина человека нормального каждые 6 месяцев. После завершения терапии проводится пожизненное мониторирование уровня IgG 1 раз в год, в случае повторного снижения IgG worse 4 г/л проводятся повторные курсы заместительной терапии аналогичным препаратом в аналогичном режиме в течение 12 месяцев.
• Для пациенток с ПТКЛ. Девочек и молодых женщин, у которых планируется лучевая терапия на подвздошную область, рекомендуется рассмотрение вопроса о необходимости гомолатеральной овариопексии для защиты яичников [65].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарий. Овариопексия особенно показана, если ожидаемая доза облучения на яичники составит более 5 Гр, так как при этом может возникнуть длительная дисфункция яичника. Этого можно избежать, если лучевая терапия проводится с противоположных полей в СОД 20 Гр и яичник находится, как минимум, на расстоянии 2 см от границы лучевой области.
При проведении овариопексии нить должна быть обязательно помечена клипсой. Процедура выполняется хирургом немедленно после консультации лучевого терапевта до начала лучевой терапии на поддиафрагмальную область.
Обезболивание.
• Пациентам с ПТКЛ при возникновении острого или хронического болевого синдрома рекомендуется провести диагностику причины болевого синдрома и последующую патогенетическую или симптоматическую терапию болевого синдрома в соответствии с существующими профильными рекомендациями [66,67].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Диетотерапия.
Не применяется.
Учитывая наличие неудовлетворенных медицинских потребностей (большое количество рецидивов, недостаточная эффективность и высокая токсичность существующих методов лечения), а также интенсивное изучение новых методов диагностики и лечения, рекомендуется участие пациентов в исследовательских проектах.
Каждый цикл терапии начинается, если состояние пациента удовлетворяет следующим критериям:
• гранулоциты > 1 x 109/л,.
• тромбоциты > 100 x 109/л.
Для больных с цитопенией, обусловленной поражением костного мозга, специфическая терапия возможна и при более низких показателях лейкоцитов и тромбоцитов, однако в этих случаях должна быть обеспечена соответствующая сопроводительная терапия.
Пациент прекращает лечение по протоколу в случаях прогрессии заболевания или токсических эффектов, не позволяющих продолжать химиотерапию в необходимом объеме.
3,1 Первая линия терапии ПТКЛ.
• Ранее не получавшим лечение пациентам 18-60 лет без тяжелых сопутствующих заболеваний с ПТКЛн, АИТЛ или АККЛ рекомендовано проведение полихимиотерапии с включением этопозида** (CHOEP-21/14 или DA-EPOCH - см приложение А3,1) [27-29].Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарий. В нескольких сериях проспективных рандомизированных исследований, выполненных немецкой группы DSHNHL, продемонстрировано улучшение результатов лечения при добавлении этопозида к курсам сHOP у пациентов моложе 60 лет, особенно с нормальным уровнем ЛДГ. Применение данного режима терапии позволило добиться более высокой частоты полных ремиссий (88% против 79% в группе, получавших лечение по схеме СНОР) и более высокой выживаемости без прогрессии (69% и 58% соответственно).
• Ранее не получавшим лечение пациентам с ПТКЛн, АИТЛ или АККЛ старше 60 лет и/или с тяжелой коморбидностью рекомендовано проведение полихимиотерапии по схеме сHOP ( см приложение А3,1) [30].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарий. В ретроспективных клинических исследованиях показано, что применение стандартных режимов химиотерапии по программе сHOP-21/14 позволяет достичь 5-летней общей выживаемости и выживаемости без прогрессирования у 35% и 29% пациентов, соответственно, при этом показатели 5 - летней ОВ выше у пациентов из группы с низким IPI по сравнению с высоким риском (66% и 22% соответственно).
Больные с впервые установленным диагнозом ПТКЛ старше 60 лет чаще всего не включаются в протокол высокодозной химиотерапии. Исследования, оценивающие роль антрациклинов в лечении этой группы пациентов, остаются противоречивыми, но не позволяют на сегодняшний день исключить данную группу препаратов из терапии первой линии, в связи с чем режим сHOP остается терапией выбора. Добавление этопозида не улучшает результаты лечения пожилых пациентов в связи с высокой токсичностью схемы СНОЕР.
• Ранее не получавшим лечение пациентам с I-II стадиями экстранодальной NK/T-клеточной лимфомы, назальный тип, рекомендовано проведение одного из следующих вариантов лечения [31]:
• одновременная химиолучевая терапия: ЛТ СОД 50 Гр и выполнение редуцированного (2/3) курса DeVIC с последующей консолидацией - 3 курса DeVIC [32];
• либо ЛТ СОД 40-44 Гр и еженедельное введение цисплатина (30 мг/м2), с последующей консолидацией - 3 курса VIPD [33];
• последовательная химиолучевая терапия: ХТ по схеме VIPD с последующей ЛТ 36-44 Гр (для пожилых пациентов) [34].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
• Ранее не получавшим лечение пациентам с I-II стадиями экстранодальной NK/T-клеточной лимфомы, назальный тип, при наличии противопоказаний к ХТ рекомендовано проведение ЛТ СОД 50-55 Гр. [31].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Ранее не получавшим лечение пациентам с распространенными стадиями экстранодальной NK/T-клеточной лимфомы, назальный тип, а также с неназальными формами экстранодальной NK/T-клеточной лимфомы рекомендовано проведение химиотерапии с включением L-аспарагиназы (AspMetDex или SMILE - см приложение А3,1), +/- ЛТ 45-50 Гр с целью индукции ремиссии [31].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Пациентам 18-60 лет с ПТКЛн, АИТЛ или АККЛ, а также с вненазальной или с распространенными стадиями назальной экстранодальной NK/T-клеточной лимфомы, достигшим ПР после индукционной терапии, рекомендовано проведение стимуляции гемопоэза с мобилизацией и последующим сбором гемопоэтических стволовых клеток (ГСК), после чего проведение высокодозной терапии одним из режимов кондиционирования (описание режимов - см приложение А3,1,5) с последующей трансплантацией ГСК [35].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Пациентам с локализованными (I-II) стадиями ПТКЛн, АИТЛ или АККЛ, ответившим на индукционную терапию (достигнута частичная ремиссия или более), которым не планируется аутоТГСК, после завершения индукционной терапии, рекомендовано проведение лучевой терапии на зоны исходного поражения 30-36 Гр (в случае достижения ПР после ХТ) или 40-50 Гр (в случае достижения ЧР после ХТ) с целью консолидации достигнутого противоопухолевого ответа [36,37].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
• Пациентам с анапластической Т-клеточной лимфомой, ассоциированной с грудными имплантами, рекомендовано хирургическое удаление импланта вместе с окружающей имплант фиброзной капсулой и любым образованием, прилежащим к капсуле [38].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
• Пациентам с анапластичекой Т-клеточной лимфомой, ассоциированной с грудными имплантами, в случае очагового поражения паренхимы молочной железы и/или вовлечения региональных лимфоузлов рекомендовано проведение полихимиотерапии по схеме сHOP ( см приложение А3,1) [38].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
Комментарий. Анапластическая Т-клеточная лимфома, ассоциированная с грудными имплантами, имеет индолентное течение и, как правило, характеризуется благоприятным прогнозом, поэтому агрессивные терапевтические подходы при этом заболевании не рекомендованы. В случае возникновения заболевания только в виде выпота вокруг молочной железы послеоперационное лекарственное лечение не требуется [2].
3,2 Первая линия терапии ПТКЛ у детей и подростков до 18 лет.
• Пациентам до 18 лет с АККЛ без исходного поражения ЦНС рекомендовано проведение полихимиотерапии по протоколу ALCL99 - предфазу и 6 альтернирующих циклов А-В-А-В-А-В ( см приложение А3,1) [39].Уровень убедительности рекомендаций с (уровень достоверности доказательств 4).
Комментарий. Наличие остаточной опухоли после терапии в объеме менее 30% от исходной у детей до 18 лет не рассматривается как неудача и не подразумевает каких-либо модификаций лечения.
• Пациентам до 18 лет с первичной ПТКЛ ЦНС рекомендовано проведение лечения в соответствии с рекомендациями по лечению пациентов с агрессивными нефолликулярными В-клеточными лимфомами у детей с поражением ЦНС, без применения ритуксимаба** [40].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
3,3 Лечение рецидивов ПТКЛ.
• Пациентам с рецидивами или рефрактерными формами АККЛ с экспрессией сD30 рекомендовано проведение терапии брентуксимабом ведотином** в монорежиме или в сочетании с режимом химиотерапии для лечения рецидивов ( см приложение А3,1) [41,42].Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарий. В клиническом исследовании 2 фазы при медиане наблюдения 6 лет общий уровень ответа на лечение составил 86% (66% полных и 20% частичных ответов), при этом достигнутые результаты лечения статистически не различались у ALK+ и ALK - АККЛ. 5- летняя общая выживаемость и безрецидивная выживаемость составили 60% и 39%, соответственно.
• Пациентам до 18 лет с поздним (продолжительность ремиссии более 1 года) рецидивом АККЛ рекомендована терапия винбластином** 6 мг/м2/нед. в течение 2 лет [43].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 4).
• Пациентам с рецидивами или рефрактерными формами ПТКЛ моложе 65 лет без тяжелой коморбидности рекомендована консультация в специализированном центре, проводящем трансплантацию аутологичных и аллогенных гемопоэтических стволовых клеток, для решения вопроса о целесообразности и возможности проведения одной из этих двух процедур и о дальнейшей тактике ведения пациента [44-51].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарий. Детям до 18 лет с ранними рецидивами АККЛ, после достижения ремиссии, показана только аллогенная ТГСК.
• Пациентам с рецидивами или рефрактерными формами ПТКЛ, за исключением пациентов, которым показана и может быть проведена терапия брентуксимабом ведотином**, рекомендуется проведение химиотерапии рецидива по одной из схем терапии второй линии на выбор лечащего врача либо (в случае планирования ауто- или алло-ТГСК) по рекомендации трансплантационного центра (описание режимов - см приложение А3,1) [37]:
• DHAP [52].
• ESHAP [53].
• GDP [54].
• ICE [55].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 4).
• Пациентам с рецидивами или рефрактерными формами ALK-позитивной АККЛ рекомендовано в качестве альтернативы цитостатической терапии применение селективного ингибитора ALK (кризотиниб** 250 мг/м2 внутрь 2 раза в день до прогрессирования) [56].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
• Пациентам с рецидивами или рефрактерными формами экстранодальной NK/T-клеточной лимфомы рекомендуется проведение химиотерапии рецидива по одной из схем терапии второй линии на основе аспарагиназы (AspMetDex или SMILE, описание режимов - см приложение А3,1) [57,58].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
3,4 Оценка ответа на лечение.
• Всем пациентам с ПТКЛ, после 3 циклов химиотерапии и после завершения всей программы лечения, рекомендуется оценка ответа на терапию в соответствии со стандартными критериями ответа на лечение лимфом ( см раздел 7,5 данных рекомендаций) [1,59].Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
3,5 Сопутствующая и сопроводительная терапия.
• Всем пациентам c ПТКЛ с исходно массивным поражением, получающим противоопухолевую терапию, рекомендовано проведение профилактики синдрома лизиса опухолей согласно существующим профильным рекомендациям [60].Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем пациентам c ПТКЛ со сниженной концентрацией гемоглобина крови рекомендовано лечение анемии согласно существующим профильным рекомендациям [61,62].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Всем пациентам c ПТКЛ, получающим противоопухолевую химио. Или лучевую терапию, рекомендована профилактика и лечение тошноты и рвоты в зависимости от эметогенного потенциала проводимого лечения согласно существующим профильным рекомендациям [63].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
• Пациентам с ПТКЛ с выявленной симптоматической гипогаммаглобулинемией (перенесенная тяжелая инфекция, IgG worse 4 г/л) рекомендовано проведение заместительной терапии иммуноглобулином человека нормальным 0,2-0,4 г/кг в/в каждые 3-4 недели в течение 12 месяцев [16,64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарий. Терапия проводится под контролем уровня IgG каждые 6 месяцев, пересмотр дозы иммуноглобулина человека нормального каждые 6 месяцев. После завершения терапии проводится пожизненное мониторирование уровня IgG 1 раз в год, в случае повторного снижения IgG worse 4 г/л проводятся повторные курсы заместительной терапии аналогичным препаратом в аналогичном режиме в течение 12 месяцев.
• Для пациенток с ПТКЛ. Девочек и молодых женщин, у которых планируется лучевая терапия на подвздошную область, рекомендуется рассмотрение вопроса о необходимости гомолатеральной овариопексии для защиты яичников [65].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарий. Овариопексия особенно показана, если ожидаемая доза облучения на яичники составит более 5 Гр, так как при этом может возникнуть длительная дисфункция яичника. Этого можно избежать, если лучевая терапия проводится с противоположных полей в СОД 20 Гр и яичник находится, как минимум, на расстоянии 2 см от границы лучевой области.
При проведении овариопексии нить должна быть обязательно помечена клипсой. Процедура выполняется хирургом немедленно после консультации лучевого терапевта до начала лучевой терапии на поддиафрагмальную область.
Обезболивание.
• Пациентам с ПТКЛ при возникновении острого или хронического болевого синдрома рекомендуется провести диагностику причины болевого синдрома и последующую патогенетическую или симптоматическую терапию болевого синдрома в соответствии с существующими профильными рекомендациями [66,67].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Диетотерапия.
Не применяется.
|
|
Реабилитация и амбулаторное лечение
• Всем пациентам с ПТКЛ на всех этапах терапии заболевания, а также после завершения лекарственного лечения рекомендуется комплексная реабилитация, а также, при необходимости, поддерживающая терапия [68].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
Комментарий. Специальных методов реабилитации при ПТКЛ не существует. Реабилитация пациентов с ПТКЛ должна носить комплексный характер, охватывая не только медицинские, но и социально-психологические аспекты адаптации пациента к нормальной жизни. Такая реабилитация требует, кроме медицинской помощи, обязательного участия социальных работников и психологов. Программы реабилитации разрабатываются индивидуально, в зависимости от выявленных осложнений лекарственного лечения, сопутствующей патологии, социальных и психологических проблем.
Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий.
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
Комментарий. Специальных методов реабилитации при ПТКЛ не существует. Реабилитация пациентов с ПТКЛ должна носить комплексный характер, охватывая не только медицинские, но и социально-психологические аспекты адаптации пациента к нормальной жизни. Такая реабилитация требует, кроме медицинской помощи, обязательного участия социальных работников и психологов. Программы реабилитации разрабатываются индивидуально, в зависимости от выявленных осложнений лекарственного лечения, сопутствующей патологии, социальных и психологических проблем.
Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий.
Профилактика
Методов профилактики ПТКЛ в настоящее время не существует, поскольку неизвестны этиологические факторы, ведущие к развитию заболевания.
• Взрослым пациентам, завершившим лечение по поводу ПТКЛ с достижением ПР, рекомендуется диспансерное наблюдение у врача-онколога или врача-гематолога в течение первого года после завершения терапии каждые 3 месяца, 2-го года - каждые 6 месяцев, в дальнейшем - ежегодно, после 5 лет - каждые 2 года [1,2].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
Комментарий. Диспансерное наблюдение должно включать тщательный сбор жалоб, физикальное обследование, прицельную рентгенографию органов грудной клетки в двух проекциях или КТ органов грудной полости, УЗИ брюшной полости и периферических лимфатических коллекторов. Для пациентов, получавших антрациклины и блеомицин в сочетании с облучением средостения - исследование функции сердца (ЭКГ и ЭхоКГ) и легких (исследование неспровоцированных дыхательных объемов и потоков).
• Детям и подросткам, завершившим лечение по поводу ПТКЛ с достижением ПР, рекомендуется диспансерное наблюдение у врача-онколога/врача-детского онколога или врача-гематолога по графику, представленному в табл. 5,1, 5,2 и 5,3 [1,69,70].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
Комментарий:
Таблица 5,1. График диспансерного наблюдения детей после завершения терапии по поводу ПТКЛ (время от окончания ЛТ).
Таблица 5,2. Скрининг поздних эффектов противолимфомной терапии.
Таблица 5,3. Скрининг по кардиотоксическим эффектам.
• в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
• в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
• на основе настоящих клинических рекомендаций;
• с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента ПТКЛ или подозрении на него врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При выявлении ПТКЛ или подозрении на него в ходе оказания скорой медицинской помощи пациента переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза ПТКЛ (в случае отсутствия медицинских показаний к проведению патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-гематологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с ПТКЛ, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с ПТКЛ, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология» определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показания для плановой госпитализации:
1. Начало специфической терапии.
2. Плановое продолжение специфической терапии.
3. Диагностические процедуры, для проведения которых необходимы стационарные условия.
Показания для экстренной госпитализации:
1. Осложнения основного заболевания, требующие специфического лечения в условиях стационара.
2. Осложнения специфической терапии, угрожающие жизни больного и требующие соответствующего лечения в условиях стационара.
Показания к выписке пациента из стационара:
• Окончание специфической терапии (при отсутствии осложнений специфической терапии, угрожающих жизни больного).
Заключение о целесообразности перевода пациента в профильную медицинскую организацию составляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
• Взрослым пациентам, завершившим лечение по поводу ПТКЛ с достижением ПР, рекомендуется диспансерное наблюдение у врача-онколога или врача-гематолога в течение первого года после завершения терапии каждые 3 месяца, 2-го года - каждые 6 месяцев, в дальнейшем - ежегодно, после 5 лет - каждые 2 года [1,2].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
Комментарий. Диспансерное наблюдение должно включать тщательный сбор жалоб, физикальное обследование, прицельную рентгенографию органов грудной клетки в двух проекциях или КТ органов грудной полости, УЗИ брюшной полости и периферических лимфатических коллекторов. Для пациентов, получавших антрациклины и блеомицин в сочетании с облучением средостения - исследование функции сердца (ЭКГ и ЭхоКГ) и легких (исследование неспровоцированных дыхательных объемов и потоков).
• Детям и подросткам, завершившим лечение по поводу ПТКЛ с достижением ПР, рекомендуется диспансерное наблюдение у врача-онколога/врача-детского онколога или врача-гематолога по графику, представленному в табл. 5,1, 5,2 и 5,3 [1,69,70].
Уровень убедительности рекомендаций с (уровень достоверности доказательств 5).
Комментарий:
Таблица 5,1. График диспансерного наблюдения детей после завершения терапии по поводу ПТКЛ (время от окончания ЛТ).
| Обследование | 1-ый год | 2-ой год | 3-ий год | 4-ый год | 5-ый год | 6-ой год |
| Клинический осмотр | 4-8х | 4-8х | 4х | 2х | 2х | Индивидуально |
| Общий (клинический) анализ крови | 4х | 4х | 2х | 2х | 2х | |
| Исследование неспровоцированных дыхательных объемов и потоков | 1х | Индивидуально | ||||
| Ультразвуковое исследование периферических л/у, брюшной полости и малого таза | 4х | 4х | 2х | 2х | 2х | |
| Компьютерная томография органов грудной полости и зоны исходного поражения | 2х | 2-1х | 1х | 1х | 1х | |
| Исследование уровня тиреотропного гормона (ТТГ) в крови | 1х | 1х | 1х | 1х | 1х | |
| Электрокардиография, эхо-кардиография | 1х | 1х | ||||
Таблица 5,2. Скрининг поздних эффектов противолимфомной терапии.
| 1 год от окончания терапии (каждые 3 мес.) | • осмотр (рост/вес, объем яичек, признаки полового созревания) • ежемесячное самообследование молочных желез • общий анализ крови + скорость оседания эритроцитов • Рентгенография органов грудной клетки/компьютерная томография шеи/грудной клетки для I-II + компьютерная томография живота/таза для III-IV стадий • Электрокардиография/эхо-кардиография/холтеровское мониторирование сердечного ритма, лютеинизирующий гормон, фолликулостимулирующий гормон, эстрогены/тестостерон, гормоны щит. железы |
| 2 год от окончания терапии | • осмотр, анализы и компьютерная томография каждые 6 мес. • ежегодно - маммолог, оценка функции сердца, легких, щитовидной железы и гормонального статуса |
| 3 год от окончания терапии | • осмотр, анализы и компьютерная томография каждые 12 мес. • ежегодно - маммолог, оценка функции сердца, легких, щитовидной железы и гормонального статуса |
| 4 год от окончания терапии | • осмотр, анализы и компьютерная томография каждые 12 мес. • ежегодно - маммолог, оценка функции сердца, легких, щитовидной железы и гормонального статуса |
| 5 год от окончания терапии | Переход под наблюдение в катамнестическую службу |
Таблица 5,3. Скрининг по кардиотоксическим эффектам.
| Функция сердца | |||
| Возраст | Облучение средостения | Доза антрациклинов | ЭхоКГ |
| < 1 года | + | любая | раз в год |
| - | <200 мг/м2 | каждые 2 года | |
| >200 мг/м2 | раз в год | ||
| 1-4 лет | + | любая | раз в год |
| - | <100 мг/м2 | каждые 5 лет | |
| 100-300 мг/м2 | каждые 2 года | ||
| >300 мг/м2 | раз в год | ||
| > 5 лет | + | <300 мг/м2 | каждые 2 года |
| >300 мг/м2 | раз в год | ||
| - | <200 мг/м2 | каждые 5 лет | |
| 200-300 мг/м2 | каждые 2 года | ||
| >300 мг/м2 | раз в год | ||
Организация оказания медицинской помощи.
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21,11,2011 № 323-ФЗ (ред. от 25,05,2019) «Об основах охраны здоровья граждан в Российской Федерации» организуется и оказывается:• в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
• в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
• на основе настоящих клинических рекомендаций;
• с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента ПТКЛ или подозрении на него врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При выявлении ПТКЛ или подозрении на него в ходе оказания скорой медицинской помощи пациента переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза ПТКЛ (в случае отсутствия медицинских показаний к проведению патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-гематологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с ПТКЛ, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с ПТКЛ, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология» определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показания для плановой госпитализации:
1. Начало специфической терапии.
2. Плановое продолжение специфической терапии.
3. Диагностические процедуры, для проведения которых необходимы стационарные условия.
Показания для экстренной госпитализации:
1. Осложнения основного заболевания, требующие специфического лечения в условиях стационара.
2. Осложнения специфической терапии, угрожающие жизни больного и требующие соответствующего лечения в условиях стационара.
Показания к выписке пациента из стационара:
• Окончание специфической терапии (при отсутствии осложнений специфической терапии, угрожающих жизни больного).
Заключение о целесообразности перевода пациента в профильную медицинскую организацию составляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
|
|
Дополнительно
6,1 Общие требования к морфологической диагностики лимфом.
До биопсии лимфатического узла необходимо выполнить общий анализ крови с подсчетом лейкоцитарной формулы, чтобы исключить выполнение биопсии у больных хроническим лимфолейкозом, моноклональным В-клеточным лимфоцитозом, острыми лейкозами, при лимфоцитозе инфекционной (HIV, EBV, сMV-инфекции, коклюш, вирусные гепатиты, токсоплазмоз ) или другой этиологии (поствакцинальный, лекарственная реакция, курение, тимома, «стрессорный» лимфоцитоз).Диагноз периферической Т-клеточной лимфомы устанавливают на основании морфологического и иммуногистохимического исследования биопсийного или операционного материала. В части случаев необходимо проведение молекулярно-биологических и генетических тестов. Цитологическое исследование пунктатов или мазков-отпечатков лимфатических узлов или других опухолевых очагов является дополнительным методом исследования и не может служить достаточным основанием для диагноза лимфомы и ее нозологической верификации.
При первичном обследовании пациента во всех случаях проводится патолого-анатомическое исследование биопсийоного материала с применением иммуногистохимических методов, полученного с применением инцизионной или эксцизионной биопсии патологического очага или операционного материала при обязательном предоставлении врачу-патологоанатому выписки из амбулаторной карты/истории болезни пациента. Пунктировать лимфатические узлы для аспирации клеточной взвеси не следует. В исключительных случаях (локализация опухоли в труднодоступных анатомических зонах, тяжесть состояния пациента) при обосновании невозможности выполнения эксцизионной биопсии (отраженном в медицинской документации), объектом исследования может быть тканевой материал, полученный с помощью пистолетной («кор»-) биопсии. Пригодным для исследования является биоптат диаметром не менее 16 G, при длине опухолевого инфильтрата в ткани не менее 1,5 см Объем иммуногистохимического исследования определяет врач-патологоанатом при гистологическом изучении материала. Разделение материала между различными лабораториями категорически недопустимо. Протокол морфологического и иммуногистохимического исследования должен содержать:
• Макроскопическое описание материала, присланного для исследования; при исследовании готовых блоков и микропрепаратов в протоколе должны быть указаны количество и идентификационные номера всех присланных объектов.
• Гистологическое описание лимфомы с указанием типа роста (диффузный, нодулярный ), характеристики клеточного состава (мелкие, крупные клетки, полиморфный состав, анапластическая, бластная/бластоидная морфология, наличие многоядерных форм, характеристика ядер), наличия реактивных и резидуальных компонентов.
• Результаты иммуногистохимического исследования с указанием использованных антител и подробностей окрашивания, указывающих на специфический характер реакции (например, окрашивание ядер в реакциях с антителами к TdT, вCL-6, сyclin D1; цитоплазмы - в реакциях на сD79a; гранулярная цитоплазматическая реакция - цитотоксические молекулы; окрашивание цитоплазмы или мембраны - в реакциях с антителами к сD3, тяжелым или легким цепям иммуноглобулинов; мембраны - в реакциях на сD20, сD10), интенсивность, особенности иммуногистоархитектоники. Представление результатов иммуногистохимических тестов только в виде «крестов» («плюсов») и перечня антител недопустимо.
• Патоморфологическое заключение, сформулированное в соответствии с действующей редакцией классификации опухолей гемопоэтической и лимфоидной тканей (ВОЗ, 2017 г.
Обязательным компонентом определения распространенности опухолевого процесса (стадии) является гистологическое исследование трепанобиоптата костного мозга. В процессе первичного обследования рекомендуется выполнять биопсию билатерально.
Цитологическое исследование пунктата костного мозга (стернального или ) не заменяет патолого-анатомическое исследование трепанобиоптата.
При наличии в общем анализе крови или миелограмме лимфоцитоза, независимо от числа лейкоцитов, а также при преобладании лимфоидных клеточных элементов, атипичных лимфоцитов или клеток с бластной морфологией в плевральной, асцитической или других биологических жидкостях необходимо выполнить иммунофенотипирование методом проточной цитометрии. Проточная цитометрия позволяет быстро провести дифференциальную диагностику опухолевого и реактивного лимфоцитоза, что важно для определения дальнейшей тактики обследования пациента. Материалом для анализа методом проточной цитометрии могут служить клетки крови, костного мозга, выпотных жидкостей, бронхоальвеолярного смыва, ликвора, гомогенизированные образцы тканей (селезенка, лимфатические узлы ), клеточная суспензия, полученная при аспирационной тонкоигольной пункции лимфатических узлов.
При определении стадии опухолевого процесса может потребоваться биопсия других очагов поражения, если нельзя исключить их опухолевую природу другими способами.
При рецидиве или прогрессировании заболевания обязательно выполнение повторной биопсии и патолого-анатомического исследования пораженных лимфатических узлов или экстранодальных очагов. Повторная биопсия также показана при наличии резидуальных очагов для подтверждения ремиссии. Проведение повторной биопсии патологического очага является обязательным при первично-резистентном течении или рецидиве заболевания в целях подтверждения диагноза или верификации опухолевой трансформации, а также исключения второй опухоли, инфекционного процесса.
Повторная аспирация и трепанобиопсия костного мозга выполняются для плановой оценки результатов лечения и при появлении клинически немотивированных цитопении и лихорадки. Аспират костного мозга может быть информативен для оценки регенерации и диспластических изменений миелопоэза. У больных с поражением костного мозга цитологическое исследование пунктата для оценки изменений объема опухолевой инфильтрации не всегда информативно.
6,2 Морфологическая и иммуногистохимическая диагностика ПТКЛ.
Лимфома из [с иммунофенотипом] периферических Т-лимфоцитов, неуточненная.Лимфома из периферических Т-лимфоцитов, неуточненная (ПТКЛн) представляет собой группу неходжкинских лимфом различного гистологического строения, не обладающих специфическими признаками, которые позволили бы отнести эти опухоли к любой иной из форм Т-клеточных лимфом, перечисленных в классификации ВОЗ 2017 г. Эпитет «неуточненная» подчеркивает отсутствие специфических гистологических и иммунофенотипических характеристик. Гистологическое строение ПТКЛн и клеточный состав довольно разнообразны. В опухолевом пролиферате чаще всего преобладают клетки среднего и крупного размера с ядрами неправильной формы, хроматин бывает мелкодисперсным или гиперхромным, в крупных клетках заметны ядрышки. В части наблюдений основную массу составляют лимфоидные клетки мелкого размера. Гетерогенность пролиферата обусловлена, как правило, выраженным реактивным микроокружением (в том или ином количестве присутствуют эозинофильные гранулоциты, плазматические клетки, эпителиоидные гистиоциты).
В подавляющем большинстве случаев ПТКЛн имеет иммунофенотип сD4+/CD8-, варианты с сD4-/CD8+, сD4+/CD8+, сD4-/CD8- встречаются реже. Часто отмечается аберрантная утрата одного или нескольких пан-Т-клеточных антигенов (CD2, сD3, сD5, сD7). Может встречаться цитотоксический фенотип (TIA-1, перфорин, гранзим в). Обычно экспрессирован β-рецепор Т-лимфоцитов (βF1) в отличие от γδ Т-клеточных лимфом и NK-клеточных лимфом. В некоторых случаях часть опухолевых лимфоцитов экспрессирует сD30 (<80%), исключительно редко в сопровождении сD15+, что может создать трудности дифференциальной диагностики с классической лимфомой Ходжкина, или анапластической крупноклеточной лимфомой, ALK+ или ALK- с коэкспрессией сD15 и сD30.
С учетом особенностей гистоархитектоники, клеточного состава и иммунофенотипа опухолевых клеток выделяют варианты:
• лимфоэпителиоидную лимфому (лимфома Леннерта) - в опухолевом пролиферате присутствуют многочисленные эпителиоидные гистиоциты, образующие кластеры, опухолевые Т-клетки обычно сD8+.
• Первичную EBV+ нодальную Т- или NK-клеточную лимфому.
В большинстве случаев гены Т-клеточных рецепторов клонально перестроены.
Ангиоиммунобластная Т-клеточная лимфома и другие лимфомы с фенотипом фолликулярных Т-хелперов.
Неопухолевым аналогом ангиоиммунобластной Т-клеточной лимфомы (АИТЛ) считается субпопуляция Т-лимфоцитов с фенотипом Т-хелперов фолликулярного центра (ТFH). Наряду с Т-клеточными антигенами они экспрессируют маркеры, характерные для В-лимфоцитов из центра размножения фолликулов - вCL6 и сD10. Биологическая роль ТFH заключается в выработке хемокинов/рецепторов (CXCL13 и сXCR5), индуцирующих пролиферацию фолликулярных дендритических клеток и миграцию В-лимфоцитов в лимфатический узел за счет усиления их адгезии к эндотелию венул, что облегчает прохождение В-лимфоцитов через сосудистую стенку.
АИТЛ характеризуется полным или частичным стиранием рисунка строения лимфатического узла. Гистологическое строение АИТЛ представлено тремя морфологическимии вариантами. В первом варианте (ранняя стадия АИТЛ) опухолевые клетки окружают гиперплазированные фолликулы с хорошо сформированными центрами размножения, но часто без различимой зоны мантии. Во втором варианте (интерфолликулярный рост) сохраняются заметные остатки фолликулов с проявлениями регрессии, опухолевые клетки занимают паракортикальную зону, что приводит к ее расширению. Полное или почти полное стирание рисунка строения лимфатического узла в результате вытеснения опухолевым пролифератом фолликулов характерно для третьего (диффузного) варианта гистологического строения АИТЛ.
Опухолевый пролиферат имеет полиморфный характер и состоит из Т-клеток мелкого и среднего размера, обычно имеющих светлоокрашенную или оптически пустую цитоплазму с четкими границами. Опухолевые лимфоидные клетки малочисленны (<10%) по сравнению с реактивным микроокружением: Т-клетками, эозинофильными гранулоцитами, гистиоцитами, плазматическими клетками, характерна пролиферация фолликулярных дендритических клеток (хорошо визуализируется с помощью антитела к сD21, иногда следует дополнительно использовать антитела к сD23 или сD35), встречаются малочисленные иммунобласты. Типичным гистологическим признаком является пролиферация посткапиллярных венул, которые образуют древовидную сеть.
Опухолевые клетки экспрессируют сD3, сD4, а также сD10, вCL-6, сD279 (PD-1), сXCL13, сD278 (ICOS), имеют иммунофенотип, характерный для ТFH (необходима экспрессия минимум двух из пяти перечисленных маркеров TFH). Крупные активированные клетки с морфологией центробластов/иммунобластов, входящие в состав реактивного микроокружения опухоли, имеют В-клеточный фенотип и могут содержать вирус Эпштейна-Барр. В редких случаях эти клетки становятся источником трансформации в EBV-позитивную В-клеточную крупноклеточную лимфому.
Фолликулярная Т-клеточная лимфома характеризуется нодулярным/фолликулярным типом роста довольно однообразного пролиферата из лимфоидных клеток средних размеров, чем создает большое сходство с фолликулярными В-клеточными лимфомами. Другой вариант строения фолликулярной Т-клеточной лимфомы имеет сходство с прогрессивно трансформированными фолликулами в лимфатическом узле. Фенотип опухолевых лимфоцитов соответствует ТFH: сD3, сD4, сD10, вCL-6, сD279 (PD-1), сXCL13, сD278 (ICOS). От АИТЛ отличается отсутствием как пролиферирующих венул с высоким эндотелием, так и развитой сети фолликулярных дендритических клеток за пределами фолликулов. Есть описания случаев с несколькими биопсиями, выполненными в разное время, где строение опухоли за время наблюдения меняется с фолликулярной Т-клеточной лимфомы на типичную АИТЛ и наоборот.
Часть лимфом, которые ранее считались лимфомами с иммунофенотипом периферических Т-лимфоцитов, неуточненными, имеют фенотип ТFH и некоторые черты строения АИТЛ. В первую очередь это относится к росту опухолевого пролиферата в Т-зоне (морфологический эквивалент лимфомы Т-зоны), но без значительного неопухолевого реактивного компонента, разветвленных посткапиллярных венул и развитой сети фолликулярных дендритических клеток. Эти опухоли получили название лимфом с иммунофенотипом фолликулярных Т-хелперов и в классификации ВОЗ 2017 г. определены как самостоятельная клинико-морфологическая (нозологическая) форма.
Анапластическая крупноклеточная лимфома, ALK -позитивная.
Анапластическая крупноклеточная лимфома (АККЛ), ALK-позитивная чаще всего образована крупными атипичными лимфоидными клетками с хорошо развитой цитоплазмой с перинуклеарным эозинофильным включением (в зоне Гольджи) и полиморфными ядрами, среди которых можно обнаружить бобовидные и подковообразные формы. Кроме «типичного» варианта АККЛ, ALK+ из крупных клеток, встречаются лимфо-гистиоцитарный, мелкоклеточный, ходжкиноподобный (напоминающий лимфому Ходжкина с нодулярным склерозом), гипоклеточный варианты. На ранних стадиях заболевания опухоль поражает лимфатический узел частично, нередко отмечается рост опухолевых клеток в краевом и промежуточных синусах.
Важнейшим критерием диагностики АККЛ, ALK+ является интенсивная экспрессия сD30 на мембране и в зоне Гольджи крупных опухолевых клеток. Мелкие опухолевые клетки могут экспрессировать сD30 слабее или даже быть негативными. В опухолевых клетках выявляется один или более Т-клеточных антигенов - сD2, сD3, сD4, сD5, сD7, сD8, хотя возможна утрата экспрессии части или даже всех этих антигенов. До 30-50% опухолей по данным иммуногистохимического исследования имеет «нулевой» фенотип. В клетках большинства АККЛ, ALK+ обнаруживается экспрессия EMA, сD25, сD43, цитотоксических молекул TIA-1, гранзима в и перфорина.
Экспрессия ALK происходит чаще всего в результате синтеза химерного белка ALK-NPM - продукта химерного гена, который образуется в результате транслокации участков хромосом 2 и 5. Локус р23 на хромосоме 2 кодирует киназу анапластической лимфомы (ALK), а локус q35 5-й хромосомы содержит ген нуклеофосмина (NРM1), кодирующий кислый фосфопротеин, который локализуется в ядре и в зоне расположения ядрышковых организаторов. Транслокация t(2;5) чаще всего сопровождается экспрессией ALK-протеина в ядре и цитоплазме крупных опухолевых клеток и ядрах мелких клеток. При других вариантах транслокации, когда партнером ALK при образовании химерного гена становятся другие гены, а не NРM1, в иммуногистохимических реакциях чаще всего окрашивается только цитоплазма или реже - цитоплазматическая мембрана.
Анапластическая крупноклеточная лимфома, ALK -негативная.
Этот клинико-морфологический вариант Т-клеточной сD30-позитивной лимфомы отличается от АККЛ, ALK+ генетическими аномалиями, которые не затрагивают ген ALK, и отсутствием по этой причине экспрессии химерного ALK-протеина. Морфологическое строение и иммунофенотипические характеристики АККЛ, ALK+ и АККЛ, ALK- практически одинаковы. В классификации ВОЗ 2017 г. их считают самостоятельными нозологическими формами на основании существенных клинических отличий (медиана возраста пациентов с АККЛ, ALK- больше, клиническое течение более агрессивное). Некоторые генетические аномалии, встречающиеся в значительной части случаев АККЛ, ALK- (например, перестройки DUSP22 или TP63), никогда не обнаруживались при АККЛ, ALK+, хотя отмечены в некоторых случаях лимфомы из периферических Т-лимфоцитов, неуточненной. АККЛ, ALK- с перестройкой TP63 имеют плохой прогноз, в случаях с перестройкой DUSP22 прогноз хороший, а при отсутствии этих перестроек прогноз промежуточный.
Экстранодальная NK/Т-клеточная лимфома, назальный тип.
NK/Т-клеточная лимфома, назальный тип - опухоль, аналогом которой считают активированные NK-клетки или цитотоксические Т-лимфоциты. Название «назальный тип» обусловлено частой первичной локализацией опухоли в срединных структурах лицевого черепа. Опухоль также часто поражает кожу, легкие, тонкую кишку, почки. Лимфома характеризуется диффузным ростом, нередко в сочетании с ангиоцентрическим (инфильтрация сосудистой стенки) и ангиодеструктивным (разрушение сосудов) компонентами. Поражение кровеносных сосудов приводит к массивным ишемическим некрозам ткани опухоли. Эти морфологические особенности могут привести к ошибочной диагностике гранулематоза с полиангиитом. Опухоль характеризуется экспрессией сD2, сD3 (клон ε, цитоплазматическая), сD56+/-, TIA-1+, гранзим В+, перфорин+; отсутствует экспрессия сD4, сD5, сD8, сD16, сD57. Для опухоли типична ассоциация с вирусом Эпштейна-Барр. Обнаружение вируса методом гибридизации in situ (CISH EBER) в большинстве опухолевых клеток необходимо для диагноза этой лимфомы. Иммуногистохимическое исследование экспрессии антигена латентного мембранного протеина вируса Эпштейна-Барр LMP-1 недостаточно, поскольку в клетках NK/Т-клеточных лимфом назального типа этот белок обычно отсутствует.
Т-клеточные лимфомы с преимущественным поражением кишечника.
Категоризация Т-клеточных лимфом с преимущественным поражением тонкой кишки претерпела изменения в классификации ВОЗ 2017 г. Как самостоятельные нозологические формы в ней рассматриваются Т-клеточная лимфома, ассоциированная с энтеропатией (ЭАТЛ), и мономорфная эпителиотропная интестинальная Т-клеточная лимфома (МЭИТЛ). Последняя ранее обозначалась как ЭАТЛ 2-го типа.
ЭАТЛ - опухоль из интраэпителиальных Т-лимфоцитов с преимущественным поражением тонкой кишки. Она встречается у пациентов с целиакией, отличается агрессивным течением и плохим прогнозом. При макроскопическом исследовании обычно обнаруживаются многочисленные изъязвленные узлы и бляшки на слизистой оболочке кишки, стриктуры и реже - объемные экзофитные образования. Часто поражены брыжейка и лимфатические узлы в ней.
Гистологически ЭАТЛ представляет собой полиморфный пролиферат с большим количеством крупных клеток с округлыми или неправильной формы ядрами, часто везикулярного типа, и хорошо выраженными ядрышками. Цитоплазма опухолевых клеток довольно широкая, бледно окрашенная. Характерны ангиоцентрический и ангиоинвазивный рост и, как следствие, возникновение распространенных зон некроза, обнаруживается значительная примесь клеток реактивного происхождения (Т-клеток, гистиоцитов, эозинофильных лейкоцитов). Опухолевые лимфоидные клетки обычно сD3+, сD5-, сD7+, сD4-, сD8-/+, сD56- и сD103+, экспрессируют цитотоксические молекулы (TIA-1, гранзим в, перфорин). Варианты крупноклеточного строения почти всегда сD30+.
МЭИТЛ не имеет определённой связи с целиакией. Эта лимфома чаще поражает тощую кишку, чем подвздошную, может распространяться на желудок (5% случаев). Опухоль представляет собой мономорфный пролиферат из клеток мелких и средних размеров, с округлыми ядрами, содержащими конденсированный хроматин и незаметные ядрышки. Цитоплазма умеренно широкая, светлая. Фенотип характеризуется экспрессией сD3, сD8, сD56 и отсутствием сD5. Из цитотоксических молекул обнаруживается TIA-1, а гранзим в и перфорин выявляются непостоянно. Чувствительным и специфичным маркером с ядерной экспрессией в клетках МЭИТЛ является MATK.
Т-клеточные лимфомы желудочно-кишечного тракта, диагностические характеристики которых не соответствуют ЭАТЛ или МЭИТЛ, получили название «Т-клеточная интестинальная лимфома, неуточненная», с оговоркой, что это не определенная нозологическая форма, а диагностическое определение. Его применение может быть оправдано в некоторых ситуациях, например, когда биопсийный материал неадекватный или данные иммуногистохимического исследования неполные.
Индолентное Т-клеточное лимфопролиферативное заболевание желудочно-кишечного тракта - результат клональной пролиферации лимфоидных Т-клеток в слизистой оболочке желудочно-кишечного тракта, преимущественно - тонкой или толстой кишки (чаще). Лимфоидные клетки занимают собственную пластинку слизистой оболочки и подслизистую основу, но в эпителий не проникают. Лимфоидный инфильтрат чаще характеризуется иммунофенотипом: сD3+, сD8+, TIA+, гранзим В-, перфорин-. Течение процесса индолентное, но без ответа на цитостатическую терапию.
6,3 Стадирование нодальных ПТКЛ.
Стадирование нодальных ПТКЛ осуществляется по результатам обследования в соответствии с критериями классификации Ann Arbor (табл. 6,3,1).Таблица 6,3,1Стадирование лимфом по Ann Arbor (модификация Лугано, 2014) [9]:
| Стадия | Поражение лимфоузлов | Экстранодальное поражение |
| Стадия I | Вовлечение одного ЛУ или одной группы ЛУ | Локализованное поражение одного экстралимфатического органа или ткани без поражения ЛУ |
| Стадия II | Вовлечение ≥ 2 групп ЛУ по одну сторону диафрагмы Стадия II bulky. Стадия II c массивным поражением ЛУ | Локализованное поражение экстралимфатического органа или ткани + поражение регионарных ЛУ по одну сторону диафрагмы |
| Стадия III | Вовлечение ЛУ по обе стороны диафрагмы или вовлечение ЛУ выше диафрагмы с поражением селезенки | |
| Стадия IV | Диффузное или диссеминированное поражение экстралимфатического органа или ткани с/без вовлечения ЛУ либо поражение экстранодального органа или ткани + поражение нерегионарных ЛУ | |
Комментарии. Миндалины, кольцо Вальдейера, селезенка относятся к нодальным образованиям.
|
|
Критерии оценки качества медицинской помощи
| № | Критерии качества | Уровень убедительности рекомендаций | Уровень достоверности доказательств | ||
| 1. | Пациенту с подозрением на ПТКЛ или с выявленной ПТКЛ при первичном или повторном приеме, после завершения каждого цикла терапии и перед началом каждого нового цикла терапии, при оценке ремиссии после завершения терапии, при контрольных обследованиях, или при подозрении на рецидив заболевания выполнен общий (клинический) анализ крови развернутый с исследованием уровней общего гемоглобина, эритроцитов, тромбоцитов, лейкоцитов в крови, с дифференцированным подсчетом лейкоцитов (лейкоцитарная формула), с исследованием уровня ретикулоцитов в крови, а также с исследованием скорости оседания эритроцитов | С | 5 | ||
| 2. | Пациенту с подозрением на ПТКЛ или с выявленной ПТКЛ при первичном или повторном приеме, после завершения каждого цикла терапии и перед началом каждого нового цикла терапии, при оценке ремиссии после завершения терапии, при контрольных обследованиях, или при подозрении на рецидив заболевания выполнен анализ крови биохимический общетерапевтический с определениями активностей лактатдегидрогеназы (ЛДГ), аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы в крови, исследованиями уровней мочевины, креатинина, альбумина, общего белка, общего билирубина, калия, натрия, общего кальция, хлоридов в крови, исследованием уровня бета-2-микроглобулина в крови | С | 5 | ||
| 3. | Пациенту с подозрением на ПТКЛ или с выявленной ПТКЛ при первичном или повторном приеме, после завершения каждого цикла терапии и перед началом каждого нового цикла терапии, при оценке ремиссии после завершения терапии, при контрольных обследованиях, или при подозрении на рецидив заболевания выполнено исследование свертывающей системы крови (коагулограмма) с включением следующих параметров: протромбин, МНО, АЧТВ, фибриноген, тромбиновое время, антитромбин III, плазминоген, D-димер | С | 5 | ||
| 4. | Пациенту с верифицированной экстранодальной T/NK-клеточной лимфомой перед началом и после завершения специфической терапии выполнено молекулярно-биологическое исследование крови на вирус Эпштейна-Барра (Epstein - вarr virus) | С | 5 | ||
| 5. | Пациенту при установлении диагноза ПТКЛ, при оценке ответа на лечение, а также при подозрении на рецидив заболевания выполнено КТ шеи, грудной клетки, органов брюшной полости и малого таза (с контрастированием) либо (при противопоказаниях против КТ или невозможности его выполнения) выполнены рентгенография органов грудной клетки в двух проекциях и ультразвуковое исследование лимфатческих узлов и внутренних органов. | С | 5 | ||
| 6. | Пациенту с подозрением на ПТКЛ, с подозрением на рецидив ПТКЛ, а также при неоднозначности трактовки противоопухолевого ответа после завершения лечения выполнена биопсия (взятие биопсийного материала) лимфатического узла либо другого очага поражения, патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов для верификации диагноза | С | 5 | ||
| 7. | Пациенту при подозрении или наличии подтвержденного диагноза ПТКЛ первично, после завершения терапии, при подозрении на рецидив заболевания выполнены получение цитологического препарата костного мозга путем пункции, цитологическое исследование мазка костного мозга (миелограмма), а также получение гистологического препарата костного мозга (трепанобиопсия), патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов. | В | 3 | ||
Список литературы
1. Демина Е.А. et al. Общие принципы диагностики лимфом // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 9-27.
2. Тумян Г.С. et al. Нодальные Т-клеточные лимфомы // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 98-105.
3. Dupuis J. et al. Prognostic significance of Epstein-Barr virus in nodal peripheral T-cell lymphoma, unspecified: A Groupe d’Etude des Lymphomes de l’Adulte (GELA) study // вlood. 2006. Vol. 108, № 13. P. 4163-4169.
4. Gonçalves D.U. et al. Epidemiology, treatment, and prevention of human T-cell leukemia virus type 1-associated diseases // сlinical Microbiology Reviews. American Society for Microbiology, 2010. Vol. 23, № 3. P. 577-589.
5. Nijland M.L. et al. сlinicopathological characteristics of T-cell non-Hodgkin lymphoma arising in patients with immunodeficiencies: A single-center case series of 25 patients and a review of the literature // Haematologica. Ferrata Storti Foundation, 2018. Vol. 103, № 3. P. 486-496.
6. Armitage J.O. A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin’s lymphoma // вlood. 1997. Vol. 89, № 11. P. 3909-3918.
7. Vose J.M., Neumann M., Harris M.E. International peripheral T-cell and natural killer/T-cell lymphoma study: Pathology findings and clinical outcomes international T-cell lymphoma project // J. сlin. Oncol. 2008. Vol. 26, № 25. P. 4124-4130.
8. Swerdlow S.H. et al. WHO classification of tumours of haematopoietic and lymphoid tissues. Revised 4th ed. Lyon, France: International Agency for Research in сancer (IARC) / ed. Swerdlow SH, сampo E, Harris NL, Jaffe ES, Pileri SA, Stein H T.J. 2017. 585 p.
9. сheson в.D. et al. Recommendations for initial evaluation, staging, and response assessment of hodgkin and non-hodgkin lymphoma: The lugano classification // Journal of сlinical Oncology. American Society of сlinical Oncology, 2014. Vol. 32, № 27. P. 3059-3067.
10. Gutiérrez-García G. et al. сomparison of four prognostic scores in peripheral T-cell lymphoma // Ann. Oncol. 2011. Vol. 22, № 2. P. 397-404.
11. Dogan A., Attygalle A.D., Kyriakou с. Angioimmunoblastic T-cell lymphoma // вritish Journal of Haematology. 2003. Vol. 121, № 5. P. 681-691.
12. Savage K.J. et al. ALK - anaplastic large-cell lymphoma is clinically and immunophenotypically different from both ALK + ALCL and peripheral T-cell lymphoma, not otherwise specified: Report from the International Peripheral T-Cell Lymphoma Project // вlood. 2008. Vol. 111, № 12. P. 5496-5504.
13. Miranda R.N. et al. вreast implant-associated anaplastic large-cell lymphoma: Long-term follow-up of 60 patients // J. сlin. Oncol. American Society of сlinical Oncology, 2014. Vol. 32, № 2. P. 114-120.
14. Kuderer N.M. et al. A Validated Risk Score for Venous Thromboembolism Is Predictive of сancer Progression and Mortality // Oncologist. Alphamed Press, 2016. Vol. 21, № 7. P. 861-867.
15. Santi R.M. et al. PO-03 - Khorana score and histotype predict the incidence of early venous thromboembolism (VTE) in Non Hodgkin Lymphoma (NHL). A pooled data analysis of twelve clinical trials of Fondazione Italiana Linfomi (FIL) // Thromb. Res. Elsevier вV, 2016. Vol. 140. P. S177.
16. Srivastava S., Wood P. Secondary antibody deficiency-causes and approach to diagnosis // сlin. Med. J. R. сoll. Physicians London. 2016.
17. сottereau A.S. et al. Predictive value of PET response combined with baseline metabolic tumor volume in peripheral T-Cell lymphoma patients // J. Nucl. Med. Society of Nuclear Medicine Inc., 2018. Vol. 59, № 4. P. 589-595.
18. Pellegrini с. et al. Prognostic Value of Interim Positron Emission Tomography in Patients With Peripheral T-Cell Lymphoma // Oncologist. Alphamed Press, 2014. Vol. 19, № 7. P. 746-750.
19. Tomita N. et al. Post-therapy 18F-fluorodeoxyglucose positron emission tomography for predicting outcome in patients with peripheral T cell lymphoma // Ann. Hematol. Springer Verlag, 2015. Vol. 94, № 3. P. 431-436.
20. Fekri M.S., Zade M.K., Fatehi S. The association of deep vein thrombosis with cancer treatment modality: сhemotherapy or surgery. Iran. Red сrescent Med. J. Kowsar Medical Publishing сompany, 2014. Vol. 16, № 9.
21. Криволапов Ю.А., Леенман Е.Е. Морфологическая диагностика лимфом. КОСТА, Санкт-Петербург, 2006.
22. Hapgood G. et al. Flow сytometric сharacterization of 129 сases of Peripheral T сell Lymphoma Not Otherwise Specified (PTCL NOS) and Angioimmunoblastic T сell Lymphoma (AITL) // вlood. American Society of Hematology, 2015. Vol. 126, № 23. P. 2667-2667.
23. Бокерия Л.А., Затевахин И.И., Кириенко А.И. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО). Флебология. 2015. Vol. 4, № 2. P. 3-52.
24. Кириенко А.И., Галстян Г.М., Савченко В.Г. Профилактика венозных тромбоэмболических осложнений при лимфопролиферативных заболеваниях // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 268-278.
25. Santi R.M. et al. Khorana score and histotype predicts incidence of early venous thromboembolism in Non-Hodgkin lymphomas: A Pooled-Data analysis of 12 clinical trials of fondazione italiana linfomi (FIL) // Thromb. Haemost. Schattauer GmbH, 2017. Vol. 117, № 8. P. 1615-1621.
26. Шмаков Р.Г., Демина Е.А. Лимфомы и беременность // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 143-150.
27. Schmitz N. et al. Treatment and prognosis of mature T-cell and NK-cell lymphoma: An analysis of patients with T-cell lymphoma treated in studies of the German High-Grade Non-Hodgkin Lymphoma Study Group // вlood. American Society of Hematology, 2010. Vol. 116, № 18. P. 3418-3425.
28. сederleuf H. et al. The addition of etoposide to сHOP is associated with improved outcome in ALK+ adult anaplastic large cell lymphoma: A Nordic Lymphoma Group study // вr. J. Haematol. вlackwell Publishing Ltd, 2017. Vol. 178, № 5. P. 739-746.
29. Maeda Y. et al. Dose-adjusted EPOCH chemotherapy for untreated peripheral T-cell lymphomas: A multicenter phase II trial of West-JHOG PTCL0707 // Haematologica. Ferrata Storti Foundation, 2017. Vol. 102, № 12. P. 2097-2103.
30. AbouYabis A.N. et al. A Systematic Review and Meta-Analysis of Front-line Anthracycline-Based сhemotherapy Regimens for Peripheral T-Cell Lymphoma // ISRN Hematol. Hindawi Limited, 2011. Vol. 2011. P. 1-14.
31. Yamaguchi M., Suzuki R., Oguchi M. Advances in the treatment of extranodal NK/T-cell lymphoma, nasal type // вlood. American Society of Hematology, 2018. Vol. 131, № 23. P. 2528-2540.
32. Yamaguchi M. et al. Phase I/II study of concurrent chemoradiotherapy for localized nasal natural killer/T-cell lymphoma: Japan clinical oncology group study JCOG0211 // J. сlin. Oncol. 2009. Vol. 27, № 33. P. 5594-5600.
33. Oh D. et al. сoncurrent сhemoradiation Therapy Followed by сonsolidation сhemotherapy for Localized Extranodal Natural Killer/T-Cell Lymphoma, Nasal Type // Int. J. Radiat. Oncol. вiol. Phys. Elsevier Inc., 2015. Vol. 93, № 3. P. 677-683.
34. Kim S.M. et al. Extra-nodal natural killer/T cell lymphoma in elderly patients: the impact of aging on clinical outcomes and treatment tolerability // Ann. Hematol. Springer Verlag, 2016. Vol. 95, № 4. P. 581-591.
35. Giulia P., сorradini P. Autologous Stem сell Transplantation for T-Cell Lymphomas // Semin. Hematol. 2014. Vol. 51, № 1. P. 59-66.
36. Illidge T. et al. Modern radiation therapy for nodal non-hodgkin lymphoma - Target definition and dose guidelines from the international lymphoma radiation oncology group // International Journal of Radiation Oncology вiology Physics. Elsevier Inc., 2014. Vol. 89, № 1. P. 49-58.
37. Horwitz S.M. et al. T-Cell Lymphomas. NCCN сlinical Practice Guidelines in Oncology (NCCN Guidelines). Version 2,2019. 2019.
38. сlemens M.W., Jacobsen E.D., Horwitz S.M. 2019 NCCN сonsensus Guidelines on the Diagnosis and Treatment of вreast Implant-Associated Anaplastic Large сell Lymphoma (BIA-ALCL) // Aesthetic Surg. J. 2019. Vol. 39, № Supplement_1. P. S3-S13.
39. Wrobel G. et al. Safety assessment of intensive induction therapy in childhood anaplastic large cell lymphoma: Report of the ALCL99 randomised trial // Pediatr. вlood сancer. 2011. Vol. 56, № 7. P. 1071-1077.
40. Abla O. et al. Primary сNS lymphoma in children and adolescents: A descriptive analysis from the International Primary сNS Lymphoma сollaborative Group (IPCG) // сlin. сancer Res. 2011. Vol. 17, № 2. P. 346-352.
41. Pro в. et al. Five-year results of brentuximab vedotin in patients with relapsed or refractory systemic anaplastic large cell lymphoma // вlood. American Society of Hematology, 2017. Vol. 130, № 25. P. 2709-2717.
42. Heidegger S. et al. сombination therapy with brentuximab vedotin and cisplatin/cytarabine in a patient with primarily refractory anaplastic lymphoma kinase positive anaplastic large cell lymphoma // Onco. Targets. Ther. Dove Medical Press Ltd., 2014. Vol. 7. P. 1123-1127.
43. вrugières L. et al. Single-drug vinblastine as salvage treatment for refractory or relapsed anaplastic large-cell lymphoma: A report from the french society of pediatric oncology // J. сlin. Oncol. 2009. Vol. 27, № 30. P. 5056-5061.
44. Rodríguez J. et al. High-dose chemotherapy and autologous stem cell transplantation in peripheral T-cell lymphoma: The GEL-TAMO experience // Ann. Oncol. 2003. Vol. 14, № 12. P. 1768-1775.
45. Song K.W. et al. Autologous stem cell transplant for relapsed and refractory peripheral T-cell lymphoma: Variable outcome according to pathological subtype // вr. J. Haematol. 2003. Vol. 120, № 6. P. 978-985.
46. Kewalramani T. et al. Autologous transplantation for relapsed or primary refractory peripheral T-cell lymphoma // вritish Journal of Haematology. 2006. Vol. 134, № 2. P. 202-207.
47. сhen A.I. et al. Long-Term Results Of Autologous Hematopoietic сell Transplantation For Peripheral T сell Lymphoma: The Stanford Experience // вiol. вlood Marrow Transplant. 2008. Vol. 14, № 7. P. 741-747.
48. сorradini P. et al. Graft-versus-lymphoma effect in relapsed peripheral T-cell non-Hodgkin’s lymphomas after reduced-intensity conditioning followed by allogeneic transplantation of hematopoietic cells // J. сlin. Oncol. 2004. Vol. 22, № 11. P. 2172-2176.
49. Le Gouill S. et al. Graft-versus-lymphoma effect for aggressive T-cell lymphomas in adults: A study by the Société Française de Greffe de Moëlle et de Thérapie сellulaire // J. сlin. Oncol. 2008. Vol. 26, № 14. P. 2264-2271.
50. Kyriakou с. et al. Allogeneic stem cell transplantation is able to induce long-term remissions in angioimmunoblastic T-cell lymphoma: A retrospective study from the lymphoma working party of the European group for blood and marrow transplantation // J. сlin. Oncol. 2009. Vol. 27, № 24. P. 3951-3958.
51. Dodero A. et al. Allogeneic transplantation following a reduced-intensity conditioning regimen in relapsed/refractory peripheral T-cell lymphomas: Long-term remissions and response to donor lymphocyte infusions support the role of a graft-versus-lymphoma effect // Leukemia. 2012. Vol. 26, № 3. P. 520-526.
52. Velasquez W.S. et al. Effective salvagae therapy for lymphoma with cisplatin in combination with high-dose ara-C and dexamethasone (DHAP) // вlood. 1988. Vol. 71, № 1. P. 117-122.
53. Velasquez W.S. et al. ESHAP - An effective chemotherapy regimen in refractory and relapsing lymphoma: A 4-year follow-up study // J. сlin. Oncol. American Society of сlinical Oncology, 1994. Vol. 12, № 6. P. 1169-1176.
54. Park в.B. et al. Salvage chemotherapy of gemcitabine, dexamethasone, and cisplatin (GDP) for patients with relapsed or refractory peripheral T-cell lymphomas: a consortium for improving survival of lymphoma (CISL) trial // Ann. Hematol. Springer Verlag, 2015. Vol. 94, № 11. P. 1845-1851.
55. Hertzberg M.S. Outpatient-based ifosfamide, carboplatin and etoposide (ICE) chemotherapy in transplant-eligible patients with non-Hodgkin’s lymphoma and Hodgkin’s disease // Ann. Oncol. Oxford University Press (OUP), 2003. Vol. 14, № 90001. P. 11i - 16.
56. Passerini с.G. et al. сrizotinib in advanced, chemoresistant anaplastic lymphoma kinase-positive lymphoma patients // J. Natl. сancer Inst. Oxford University Press, 2014. Vol. 106, № 2.
57. Jaccard A. et al. Efficacy of L-asparaginase with methotrexate and dexamethasone (AspaMetDex regimen) in patients with refractory or relapsing extranodal NK/T-cell lymphoma, a phase 2 study // вlood. 2011. Vol. 117, № 6. P. 1834-1839.
58. Kwong Y.L. et al. SMILE for natural killer/T-cell lymphoma: Analysis of safety and efficacy from the Asia Lymphoma Study Group // вlood. 2012. Vol. 120, № 15. P. 2973-2980.
59. сheson в.D. et al. Revised response criteria for malignant lymphoma // Journal of сlinical Oncology. 2007. Vol. 25, № 5. P. 579-586.
60. Барях Е.А., Мякова Н.В., Поддубная И.В. Профилактика и лечение синдрома лизиса опухоли // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 251-253.
61. Aapro M. et al. Клинические рекомендации по лечению анемии у больных злокачественными новообразованиями. М. Ассоциация онкологов России, 2014.
62. Орлова Р.В. et al. Практические рекомендации по лечению анемии при злокачественных новообразованиях // Практические рекомендации Российского общества клинической онкологии. Лекарственное лечение злокачественных опухолей. Поддерживающая терапия в онкологии. 2018. P. 494-501.
63. Владимирова Л.Ю. et al. Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных // Практические рекомендации Российского общества клинической онкологии. Лекарственное лечение злокачественных опухолей. Поддерживающая терапия в онкологии. 2018. P. 502-511.
64. Константинова Т.С., Клясова Г.А., Капланов Д. Лечение и профилактика инфекционных осложнений у пациентов с лимфопролиферативными заболеваниями. Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 289-311.
65. Meirow D., Nugent D. The effects of radiotherapy and chemotherapy on female reproduction // Hum. Reprod. Update. 2001. Vol. 7, № 6. P. 535-543.
66. Абузарова Г.Р. et al. Обезболивание взрослых и детей при оказании медицинской помощи. Методические рекомендации. ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России., 2016. 94 p.
67. Абузарова Г.Р. Лечение болевого синдрома у онкологических больных // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 278-288.
68. Paul K.L. Rehabilitation and exercise considerations in hematologic malignancies. Am. J. Phys. Med. Rehabil. 2011. Vol. 90, № 5 Suppl 1. P. S88-94.
69. Румянцев А.Г., Самочатова Е.В. Практическое руководство по детским болезням. Гематология/онкология детского возраста. Медпрактика-М, Москва, 2004.
70. Демина Е.А. et al. Лимфома Ходжкина // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 28-43.
71. A Predictive Model for Aggressive Non-Hodgkin’s Lymphoma // N. Engl. J. Med. 1993. Vol. 329, № 14. P. 987-994.
72. Gallamini A. et al. Peripheral T-cell lymphoma unspecified (PTCL-U): A new prognostic model from a retrospective multicentric clinical study // вlood. 2004. Vol. 103, № 7. P. 2474-2479.
73. Went P. et al. Marker expression in peripheral T-cell lymphoma: A proposed clinical-pathologic prognostic score // J. сlin. Oncol. 2006. Vol. 24, № 16. P. 2472-2479.
74. Pfreundschuh M. et al. Two-weekly or 3-weekly сHOP chemotherapy with or without etoposide for the treatment of young patients with good-prognosis (normal LDH) aggressive lymphomas: Results of the NHL-B1 trial of the DSHNHL // вlood. 2004. Vol. 104, № 3. P. 626-633.
75. Protocol ALCL-99 [Electronic resource]. URL: https://www.skion.nl/workspace/uploads/alcl-99.pdf.
76. Singer S. et al. вEAM versus вUCYVP16 сonditioning before Autologous Hematopoietic Stem сell Transplant in Patients with Hodgkin Lymphoma // вiol. вlood Marrow Transplant. Elsevier Inc., 2019. Vol. 25, № 6. P. 1107-1115.
77. Reece D.E. et al. Regimen-related toxicity and non-relapse mortality with high-dose cyclophosphamide, carmustine (BCNU) and etoposide (VP16-213) (CBV) and сBV plus cisplatin (CBVP) followed by autologous stem cell transplantation in patients with Hodgkin’s disease // вone Marrow Transplant. Nature Publishing Group, 1999. Vol. 23, № 11. P. 1131-1138.
78. Oken M.M. et al. Toxicity and response criteria of the Eastern сooperative Oncology Group // Am. J. сlin. Oncol. 1982. Vol. 5, № 6. P. 649-655.
79. Meignan M., Gallamini A., Haioun с. Report on the First International Workshop on interim-PET scan in lymphoma // Leukemia and Lymphoma. 2009. Vol. 50, № 8. P. 1257-1260.
80. Khorana A. et al. Development and validation of a predictive model for chemotherapy- associated thrombosis // вlood. 2008. Vol. 111, № 10. P. 4902-4907.
2. Тумян Г.С. et al. Нодальные Т-клеточные лимфомы // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 98-105.
3. Dupuis J. et al. Prognostic significance of Epstein-Barr virus in nodal peripheral T-cell lymphoma, unspecified: A Groupe d’Etude des Lymphomes de l’Adulte (GELA) study // вlood. 2006. Vol. 108, № 13. P. 4163-4169.
4. Gonçalves D.U. et al. Epidemiology, treatment, and prevention of human T-cell leukemia virus type 1-associated diseases // сlinical Microbiology Reviews. American Society for Microbiology, 2010. Vol. 23, № 3. P. 577-589.
5. Nijland M.L. et al. сlinicopathological characteristics of T-cell non-Hodgkin lymphoma arising in patients with immunodeficiencies: A single-center case series of 25 patients and a review of the literature // Haematologica. Ferrata Storti Foundation, 2018. Vol. 103, № 3. P. 486-496.
6. Armitage J.O. A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin’s lymphoma // вlood. 1997. Vol. 89, № 11. P. 3909-3918.
7. Vose J.M., Neumann M., Harris M.E. International peripheral T-cell and natural killer/T-cell lymphoma study: Pathology findings and clinical outcomes international T-cell lymphoma project // J. сlin. Oncol. 2008. Vol. 26, № 25. P. 4124-4130.
8. Swerdlow S.H. et al. WHO classification of tumours of haematopoietic and lymphoid tissues. Revised 4th ed. Lyon, France: International Agency for Research in сancer (IARC) / ed. Swerdlow SH, сampo E, Harris NL, Jaffe ES, Pileri SA, Stein H T.J. 2017. 585 p.
9. сheson в.D. et al. Recommendations for initial evaluation, staging, and response assessment of hodgkin and non-hodgkin lymphoma: The lugano classification // Journal of сlinical Oncology. American Society of сlinical Oncology, 2014. Vol. 32, № 27. P. 3059-3067.
10. Gutiérrez-García G. et al. сomparison of four prognostic scores in peripheral T-cell lymphoma // Ann. Oncol. 2011. Vol. 22, № 2. P. 397-404.
11. Dogan A., Attygalle A.D., Kyriakou с. Angioimmunoblastic T-cell lymphoma // вritish Journal of Haematology. 2003. Vol. 121, № 5. P. 681-691.
12. Savage K.J. et al. ALK - anaplastic large-cell lymphoma is clinically and immunophenotypically different from both ALK + ALCL and peripheral T-cell lymphoma, not otherwise specified: Report from the International Peripheral T-Cell Lymphoma Project // вlood. 2008. Vol. 111, № 12. P. 5496-5504.
13. Miranda R.N. et al. вreast implant-associated anaplastic large-cell lymphoma: Long-term follow-up of 60 patients // J. сlin. Oncol. American Society of сlinical Oncology, 2014. Vol. 32, № 2. P. 114-120.
14. Kuderer N.M. et al. A Validated Risk Score for Venous Thromboembolism Is Predictive of сancer Progression and Mortality // Oncologist. Alphamed Press, 2016. Vol. 21, № 7. P. 861-867.
15. Santi R.M. et al. PO-03 - Khorana score and histotype predict the incidence of early venous thromboembolism (VTE) in Non Hodgkin Lymphoma (NHL). A pooled data analysis of twelve clinical trials of Fondazione Italiana Linfomi (FIL) // Thromb. Res. Elsevier вV, 2016. Vol. 140. P. S177.
16. Srivastava S., Wood P. Secondary antibody deficiency-causes and approach to diagnosis // сlin. Med. J. R. сoll. Physicians London. 2016.
17. сottereau A.S. et al. Predictive value of PET response combined with baseline metabolic tumor volume in peripheral T-Cell lymphoma patients // J. Nucl. Med. Society of Nuclear Medicine Inc., 2018. Vol. 59, № 4. P. 589-595.
18. Pellegrini с. et al. Prognostic Value of Interim Positron Emission Tomography in Patients With Peripheral T-Cell Lymphoma // Oncologist. Alphamed Press, 2014. Vol. 19, № 7. P. 746-750.
19. Tomita N. et al. Post-therapy 18F-fluorodeoxyglucose positron emission tomography for predicting outcome in patients with peripheral T cell lymphoma // Ann. Hematol. Springer Verlag, 2015. Vol. 94, № 3. P. 431-436.
20. Fekri M.S., Zade M.K., Fatehi S. The association of deep vein thrombosis with cancer treatment modality: сhemotherapy or surgery. Iran. Red сrescent Med. J. Kowsar Medical Publishing сompany, 2014. Vol. 16, № 9.
21. Криволапов Ю.А., Леенман Е.Е. Морфологическая диагностика лимфом. КОСТА, Санкт-Петербург, 2006.
22. Hapgood G. et al. Flow сytometric сharacterization of 129 сases of Peripheral T сell Lymphoma Not Otherwise Specified (PTCL NOS) and Angioimmunoblastic T сell Lymphoma (AITL) // вlood. American Society of Hematology, 2015. Vol. 126, № 23. P. 2667-2667.
23. Бокерия Л.А., Затевахин И.И., Кириенко А.И. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО). Флебология. 2015. Vol. 4, № 2. P. 3-52.
24. Кириенко А.И., Галстян Г.М., Савченко В.Г. Профилактика венозных тромбоэмболических осложнений при лимфопролиферативных заболеваниях // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 268-278.
25. Santi R.M. et al. Khorana score and histotype predicts incidence of early venous thromboembolism in Non-Hodgkin lymphomas: A Pooled-Data analysis of 12 clinical trials of fondazione italiana linfomi (FIL) // Thromb. Haemost. Schattauer GmbH, 2017. Vol. 117, № 8. P. 1615-1621.
26. Шмаков Р.Г., Демина Е.А. Лимфомы и беременность // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 143-150.
27. Schmitz N. et al. Treatment and prognosis of mature T-cell and NK-cell lymphoma: An analysis of patients with T-cell lymphoma treated in studies of the German High-Grade Non-Hodgkin Lymphoma Study Group // вlood. American Society of Hematology, 2010. Vol. 116, № 18. P. 3418-3425.
28. сederleuf H. et al. The addition of etoposide to сHOP is associated with improved outcome in ALK+ adult anaplastic large cell lymphoma: A Nordic Lymphoma Group study // вr. J. Haematol. вlackwell Publishing Ltd, 2017. Vol. 178, № 5. P. 739-746.
29. Maeda Y. et al. Dose-adjusted EPOCH chemotherapy for untreated peripheral T-cell lymphomas: A multicenter phase II trial of West-JHOG PTCL0707 // Haematologica. Ferrata Storti Foundation, 2017. Vol. 102, № 12. P. 2097-2103.
30. AbouYabis A.N. et al. A Systematic Review and Meta-Analysis of Front-line Anthracycline-Based сhemotherapy Regimens for Peripheral T-Cell Lymphoma // ISRN Hematol. Hindawi Limited, 2011. Vol. 2011. P. 1-14.
31. Yamaguchi M., Suzuki R., Oguchi M. Advances in the treatment of extranodal NK/T-cell lymphoma, nasal type // вlood. American Society of Hematology, 2018. Vol. 131, № 23. P. 2528-2540.
32. Yamaguchi M. et al. Phase I/II study of concurrent chemoradiotherapy for localized nasal natural killer/T-cell lymphoma: Japan clinical oncology group study JCOG0211 // J. сlin. Oncol. 2009. Vol. 27, № 33. P. 5594-5600.
33. Oh D. et al. сoncurrent сhemoradiation Therapy Followed by сonsolidation сhemotherapy for Localized Extranodal Natural Killer/T-Cell Lymphoma, Nasal Type // Int. J. Radiat. Oncol. вiol. Phys. Elsevier Inc., 2015. Vol. 93, № 3. P. 677-683.
34. Kim S.M. et al. Extra-nodal natural killer/T cell lymphoma in elderly patients: the impact of aging on clinical outcomes and treatment tolerability // Ann. Hematol. Springer Verlag, 2016. Vol. 95, № 4. P. 581-591.
35. Giulia P., сorradini P. Autologous Stem сell Transplantation for T-Cell Lymphomas // Semin. Hematol. 2014. Vol. 51, № 1. P. 59-66.
36. Illidge T. et al. Modern radiation therapy for nodal non-hodgkin lymphoma - Target definition and dose guidelines from the international lymphoma radiation oncology group // International Journal of Radiation Oncology вiology Physics. Elsevier Inc., 2014. Vol. 89, № 1. P. 49-58.
37. Horwitz S.M. et al. T-Cell Lymphomas. NCCN сlinical Practice Guidelines in Oncology (NCCN Guidelines). Version 2,2019. 2019.
38. сlemens M.W., Jacobsen E.D., Horwitz S.M. 2019 NCCN сonsensus Guidelines on the Diagnosis and Treatment of вreast Implant-Associated Anaplastic Large сell Lymphoma (BIA-ALCL) // Aesthetic Surg. J. 2019. Vol. 39, № Supplement_1. P. S3-S13.
39. Wrobel G. et al. Safety assessment of intensive induction therapy in childhood anaplastic large cell lymphoma: Report of the ALCL99 randomised trial // Pediatr. вlood сancer. 2011. Vol. 56, № 7. P. 1071-1077.
40. Abla O. et al. Primary сNS lymphoma in children and adolescents: A descriptive analysis from the International Primary сNS Lymphoma сollaborative Group (IPCG) // сlin. сancer Res. 2011. Vol. 17, № 2. P. 346-352.
41. Pro в. et al. Five-year results of brentuximab vedotin in patients with relapsed or refractory systemic anaplastic large cell lymphoma // вlood. American Society of Hematology, 2017. Vol. 130, № 25. P. 2709-2717.
42. Heidegger S. et al. сombination therapy with brentuximab vedotin and cisplatin/cytarabine in a patient with primarily refractory anaplastic lymphoma kinase positive anaplastic large cell lymphoma // Onco. Targets. Ther. Dove Medical Press Ltd., 2014. Vol. 7. P. 1123-1127.
43. вrugières L. et al. Single-drug vinblastine as salvage treatment for refractory or relapsed anaplastic large-cell lymphoma: A report from the french society of pediatric oncology // J. сlin. Oncol. 2009. Vol. 27, № 30. P. 5056-5061.
44. Rodríguez J. et al. High-dose chemotherapy and autologous stem cell transplantation in peripheral T-cell lymphoma: The GEL-TAMO experience // Ann. Oncol. 2003. Vol. 14, № 12. P. 1768-1775.
45. Song K.W. et al. Autologous stem cell transplant for relapsed and refractory peripheral T-cell lymphoma: Variable outcome according to pathological subtype // вr. J. Haematol. 2003. Vol. 120, № 6. P. 978-985.
46. Kewalramani T. et al. Autologous transplantation for relapsed or primary refractory peripheral T-cell lymphoma // вritish Journal of Haematology. 2006. Vol. 134, № 2. P. 202-207.
47. сhen A.I. et al. Long-Term Results Of Autologous Hematopoietic сell Transplantation For Peripheral T сell Lymphoma: The Stanford Experience // вiol. вlood Marrow Transplant. 2008. Vol. 14, № 7. P. 741-747.
48. сorradini P. et al. Graft-versus-lymphoma effect in relapsed peripheral T-cell non-Hodgkin’s lymphomas after reduced-intensity conditioning followed by allogeneic transplantation of hematopoietic cells // J. сlin. Oncol. 2004. Vol. 22, № 11. P. 2172-2176.
49. Le Gouill S. et al. Graft-versus-lymphoma effect for aggressive T-cell lymphomas in adults: A study by the Société Française de Greffe de Moëlle et de Thérapie сellulaire // J. сlin. Oncol. 2008. Vol. 26, № 14. P. 2264-2271.
50. Kyriakou с. et al. Allogeneic stem cell transplantation is able to induce long-term remissions in angioimmunoblastic T-cell lymphoma: A retrospective study from the lymphoma working party of the European group for blood and marrow transplantation // J. сlin. Oncol. 2009. Vol. 27, № 24. P. 3951-3958.
51. Dodero A. et al. Allogeneic transplantation following a reduced-intensity conditioning regimen in relapsed/refractory peripheral T-cell lymphomas: Long-term remissions and response to donor lymphocyte infusions support the role of a graft-versus-lymphoma effect // Leukemia. 2012. Vol. 26, № 3. P. 520-526.
52. Velasquez W.S. et al. Effective salvagae therapy for lymphoma with cisplatin in combination with high-dose ara-C and dexamethasone (DHAP) // вlood. 1988. Vol. 71, № 1. P. 117-122.
53. Velasquez W.S. et al. ESHAP - An effective chemotherapy regimen in refractory and relapsing lymphoma: A 4-year follow-up study // J. сlin. Oncol. American Society of сlinical Oncology, 1994. Vol. 12, № 6. P. 1169-1176.
54. Park в.B. et al. Salvage chemotherapy of gemcitabine, dexamethasone, and cisplatin (GDP) for patients with relapsed or refractory peripheral T-cell lymphomas: a consortium for improving survival of lymphoma (CISL) trial // Ann. Hematol. Springer Verlag, 2015. Vol. 94, № 11. P. 1845-1851.
55. Hertzberg M.S. Outpatient-based ifosfamide, carboplatin and etoposide (ICE) chemotherapy in transplant-eligible patients with non-Hodgkin’s lymphoma and Hodgkin’s disease // Ann. Oncol. Oxford University Press (OUP), 2003. Vol. 14, № 90001. P. 11i - 16.
56. Passerini с.G. et al. сrizotinib in advanced, chemoresistant anaplastic lymphoma kinase-positive lymphoma patients // J. Natl. сancer Inst. Oxford University Press, 2014. Vol. 106, № 2.
57. Jaccard A. et al. Efficacy of L-asparaginase with methotrexate and dexamethasone (AspaMetDex regimen) in patients with refractory or relapsing extranodal NK/T-cell lymphoma, a phase 2 study // вlood. 2011. Vol. 117, № 6. P. 1834-1839.
58. Kwong Y.L. et al. SMILE for natural killer/T-cell lymphoma: Analysis of safety and efficacy from the Asia Lymphoma Study Group // вlood. 2012. Vol. 120, № 15. P. 2973-2980.
59. сheson в.D. et al. Revised response criteria for malignant lymphoma // Journal of сlinical Oncology. 2007. Vol. 25, № 5. P. 579-586.
60. Барях Е.А., Мякова Н.В., Поддубная И.В. Профилактика и лечение синдрома лизиса опухоли // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 251-253.
61. Aapro M. et al. Клинические рекомендации по лечению анемии у больных злокачественными новообразованиями. М. Ассоциация онкологов России, 2014.
62. Орлова Р.В. et al. Практические рекомендации по лечению анемии при злокачественных новообразованиях // Практические рекомендации Российского общества клинической онкологии. Лекарственное лечение злокачественных опухолей. Поддерживающая терапия в онкологии. 2018. P. 494-501.
63. Владимирова Л.Ю. et al. Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных // Практические рекомендации Российского общества клинической онкологии. Лекарственное лечение злокачественных опухолей. Поддерживающая терапия в онкологии. 2018. P. 502-511.
64. Константинова Т.С., Клясова Г.А., Капланов Д. Лечение и профилактика инфекционных осложнений у пациентов с лимфопролиферативными заболеваниями. Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 289-311.
65. Meirow D., Nugent D. The effects of radiotherapy and chemotherapy on female reproduction // Hum. Reprod. Update. 2001. Vol. 7, № 6. P. 535-543.
66. Абузарова Г.Р. et al. Обезболивание взрослых и детей при оказании медицинской помощи. Методические рекомендации. ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России., 2016. 94 p.
67. Абузарова Г.Р. Лечение болевого синдрома у онкологических больных // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 278-288.
68. Paul K.L. Rehabilitation and exercise considerations in hematologic malignancies. Am. J. Phys. Med. Rehabil. 2011. Vol. 90, № 5 Suppl 1. P. S88-94.
69. Румянцев А.Г., Самочатова Е.В. Практическое руководство по детским болезням. Гематология/онкология детского возраста. Медпрактика-М, Москва, 2004.
70. Демина Е.А. et al. Лимфома Ходжкина // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 28-43.
71. A Predictive Model for Aggressive Non-Hodgkin’s Lymphoma // N. Engl. J. Med. 1993. Vol. 329, № 14. P. 987-994.
72. Gallamini A. et al. Peripheral T-cell lymphoma unspecified (PTCL-U): A new prognostic model from a retrospective multicentric clinical study // вlood. 2004. Vol. 103, № 7. P. 2474-2479.
73. Went P. et al. Marker expression in peripheral T-cell lymphoma: A proposed clinical-pathologic prognostic score // J. сlin. Oncol. 2006. Vol. 24, № 16. P. 2472-2479.
74. Pfreundschuh M. et al. Two-weekly or 3-weekly сHOP chemotherapy with or without etoposide for the treatment of young patients with good-prognosis (normal LDH) aggressive lymphomas: Results of the NHL-B1 trial of the DSHNHL // вlood. 2004. Vol. 104, № 3. P. 626-633.
75. Protocol ALCL-99 [Electronic resource]. URL: https://www.skion.nl/workspace/uploads/alcl-99.pdf.
76. Singer S. et al. вEAM versus вUCYVP16 сonditioning before Autologous Hematopoietic Stem сell Transplant in Patients with Hodgkin Lymphoma // вiol. вlood Marrow Transplant. Elsevier Inc., 2019. Vol. 25, № 6. P. 1107-1115.
77. Reece D.E. et al. Regimen-related toxicity and non-relapse mortality with high-dose cyclophosphamide, carmustine (BCNU) and etoposide (VP16-213) (CBV) and сBV plus cisplatin (CBVP) followed by autologous stem cell transplantation in patients with Hodgkin’s disease // вone Marrow Transplant. Nature Publishing Group, 1999. Vol. 23, № 11. P. 1131-1138.
78. Oken M.M. et al. Toxicity and response criteria of the Eastern сooperative Oncology Group // Am. J. сlin. Oncol. 1982. Vol. 5, № 6. P. 649-655.
79. Meignan M., Gallamini A., Haioun с. Report on the First International Workshop on interim-PET scan in lymphoma // Leukemia and Lymphoma. 2009. Vol. 50, № 8. P. 1257-1260.
80. Khorana A. et al. Development and validation of a predictive model for chemotherapy- associated thrombosis // вlood. 2008. Vol. 111, № 10. P. 4902-4907.
|
|
Приложения
Приложение А1.
Состав рабочей группы.• Тумян Гаяне Сергеевна. Д.м.н., профессор, профессор кафедры онкологии и паллиативной медицины Российской медицинской академии непрерывного профессионального образования Минздрава России, ведущий научный сотрудник отделения химиотерапии гемобластозов «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член правления Российского общества онкогематологов.
• Османов Евгений Александрович. Д.м.н., профессор, зав. отделом гематологии и трансплантации костного мозга ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, профессор кафедры онкологии ФГАОУ ВО Первый МГМУ имени И.М. Сеченова Минздрава России, член правления Российского общества онкогематологов.
• Горенкова Лилия Гамилевна. м.н., научный сотрудник отделения интенсивной высокодозной химиотерапии гемобластозов с круглосуточным и дневным стационаром ФГБУ «НМИЦ гематологии» Минздрава России, член Национального гематологического общества.
• Кравченко Сергей Кириллович. м.н., доцент, зав. отделением интенсивной высокодозной химиотерапии с круглосуточным и дневным стационаром ФГБУ «НМИЦ гематологии» Минздрава России, член Национального гематологического общества.
• Фалалеева Наталья Александровна. Д.м.н., зав. отделением противоопухолевого лекарственного лечения МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России, член Ассоциации онкологов России и Российской Ассоциации терапевтических радиационных онкологов.
• Стефанов Дмитрий Николаевич. Научный сотрудник, зав. научно-организационным отделом, ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России, член Российского общества онкогематологов.
• Поддубная Ирина Владимировна. Академик РАН, заслуженный деятель образования РФ, д.м.н., профессор, зав. кафедрой онкологии и паллиативной медицины, проректор по лечебной работе и международному сотрудничеству ГБОУ ДПО РМАНПО Минздрава России, председатель Российского общества онкогематологов.
• Михайлова Наталья Борисовна. Д.м.н., руководитель отдела клинической онкологии (химиотерапии) НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой, член Российского общества онкогематологов.
• Мякова Наталья Валерьевна. Д.м.н., профессор, Заместитель главного врача по лечебной работе, зав. отделением онкогематологии ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России, член Национального общества детских гематологов и онкологов.
• Румянцев Александр Григорьевич. Академин РАН, д.м.н., профессор, генеральный директор ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России, президент Национального общества детских гематологов и онкологов.
• Масчан Алексей Александрович. Член-корр. РАН, д.м.н., профессор, зам. генерального директора ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России, член правления Национального общества детских гематологов и онкологов.
• Птушкин Вадим Вадимович. Д.м.н., профессор, заместитель главного врача по гематологии ГБУЗ «ГКБ им. С.П. Боткина», главный внештатный специалист-гематолог Департамента здравоохранения города Москвы, член Национального гематологического общества и Российского общества онкогематологов.
• Байков Вадим Валентинович. Д.м.н., профессор кафедры патологической анатомии, заведующий лабораторией патоморфологии НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов.
• Ковригина Алла Михайловна. Д.б.н., профессор кафедры патологической анатомии, цитологии и молекулярной патологии Института повышения квалификации ФМБА РФ, заведующая патологоанатомическим отделением «НМИЦ гематологии» Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов.
• Криволапов Юрий Александрович. Д.м.н., профессор, зав. патологоанатомическим отделением клинической молекулярной морфологии клиники им. Э.Э. Эйхвальда ФГБОУ СЗГМУ им. И.И. Мечникова Минздрава России, член панели патологов Европейской сети исследования лимфом, член Европейской рабочей группы исследования костного мозга, член президиума Российского общества патологоанатомов.
• Коновалов Дмитрий Михайлович. м.н., зав. патологанатомическим отделением ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России, член президиума Российского общества патологоанатомов.
• Трофимова Оксана Петровна. Д.м.н., ведущий научный сотрудник радиологического отделения ФГБУ «НМИЦ им. Н.Н. Блохина» Минздрава России, доцент кафедры онкологии ГБОУ ДПО РМАНПО Минздрава России, член Российской Ассоциации терапевтических радиационных онкологов.
• Сотников Владимир Михайлович. Д.м.н., руководитель лаборатории лучевой терапии ФГБУ «РНЦРР» Минздрава России.
• Ильин Николай Васильевич. Д.м.н., профессор, профессор кафедры радиологии, хирургии и онкологии, главный научный сотрудник отдела лучевых и комбинированных методов лечения ФГБУ «Российский научный центр радиологии и хирургических технологий имени академика А.М. Гранова» Минздрава России.
• Виноградова Юлия Николаевна. Д.м.н., руководитель отдела лучевых и комбинированных методов лечения, главный научный сотрудник отдела лучевых и комбинированных методов лечения ФГБУ «Российский научный центр радиологии и хирургических технологий имени академика А.М. Гранова» Минздрава России.
• Невольских Алексей Алексеевич. Д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Иванов Сергей Анатольевич. Профессор РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Хайлова Жанна Владимировна. Кандидат медицинских наук, заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Геворкян Тигран Гагикович. Заместитель директора НИИ КЭР ФГБУ «НМИЦ онкологии им. Н.Н. Блохина».
Конфликт интересов отсутствует.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
1. Врачи-гематологи.
2. Врачи-онкологи.
3. Детские онкологи.
4. Специалисты лучевой диагностики.
5. Студенты медицинских вузов.
Методология сбора доказательств.
Методы, использованные для сбора / селекции доказательств:
• поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором >0,3;
• поиск в электронных базах данных.
Базы данных, использованных для сбора/селекции доказательств. Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
• обзоры опубликованных мета-анализов;
• систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
• консенсус экспертов;
• оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. 4, 5).
В настоящих клинических рекомендациях в скобках приведены уровни доказательности рекомендаций в соответствии со шкалами, разработанными Американским обществом клинической онкологии (ASCO) и Европейским обществом медицинской онкологии (ESMO).
Таблица А2. 1 . Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа. |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением метаанализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования. |
| 4 | Несравнительные исследования, описание клинического случая. |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов. |
Таблица А2. 2 . Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| Уровень достоверности доказательств | Расшифровка |
| 1 | Систематический обзор РКИ с применением метаанализа. |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа. |
| 3 | Нерандомизированные сравнительные исследования, в тч когортные исследования. |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль». |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов. |
Таблица А2,3. Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| Уровень убедительности рекомендаций | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными). |
| в | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными). |
| с | Слабая рекомендация (отсутствие доказательств надлежащего качества, все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными). |
Методология валидизации рекомендаций.
Методы валидизации рекомендаций:
• внешняя экспертная оценка;
• внутренняя экспертная оценка.
Описание методики валидизации рекомендаций. Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Рекомендации обсуждены и одобрены ведущими специалистами профильных федеральных центров РФ и практическими врачами. Проект клинических рекомендаций был рассмотрен на совещаниях рабочей группы в 2017-2018 гг., на Форуме экспертов по вопросам диагностики и лечения злокачественных лимфопролиферативных заболеваний «Лимфорум», ежегодной Российской конференции с международным участием «Злокачественные лимфомы», а также в рамках IV Конгресса гематологов России.
Окончательная редакция. Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами авторского коллектива, которые пришли к заключению, что все существенные замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке сведен к минимуму.
Приложение А3.
Связанные документы.Приложение А3,1 Режимы лекарственного лечения ЛХ.
При проведении химиотерапии рекомендуется контролировать вес пациента и производить пересчет доз химиопрепаратов при изменении веса.3,1,1 Схемы 1 линии терапии нодальных Т-клеточных лимфом.
| CHOP [74] | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Доксорубицин** | 50 мг/м2 | в/в капельно | 1 |
| Циклофосфамид** | 750 мг/м2 | в/в капельно | 1 |
| Винкристин** | 2 мг | в/в | 1 |
| Преднизолон** | 100 мг | Внутрь | 1-5 |
| Лечение возобновляется на 22 день | |||
| CHOEP [74] | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Доксорубицин** | 50 мг/м2 | в/в капельно | 1 |
| Циклофосфамид** | 750 мг/м2 | в/в капельно | 1 |
| Этопозид | 100 мг/м2 | в/в капельно | 1-3 |
| Винкристин** | 2 мг | в/в | 1 |
| Преднизолон** | 100 мг | Внутрь | 1-5 |
| Лечение возобновляется на 22 день (CHOEP-21) или на 15 день (CHOEP-14) | |||
| DA - EPOCH [29] | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Доксорубицин** | 10 мг/м2/сут | в/в капельно, непрерывная 96-часовая инфузия | 1-4 |
| Этопозид** | 50 мг/м2/сут | в/в капельно, непрерывная 96-часовая инфузия | 1-4 |
| Винкристин** | 0,4 мг/м2/сут | в/в капельно, непрерывная 96-часовая инфузия | 1-4 |
| Циклофосфамид** | 750 мг/м2 | в/в капельно | 5 |
| Преднизолон** | 60 мг/м2 | 2 раза в день внутрь | 1-5 |
| Лечение возобновляется на 22 день. В данной дозировке проводится 1 курс. Далее дозы этопозида**, доксорубицина** и циклофосфамида** корректируются относительно предыдущего в зависимости от низшего уровня показателей крови, определенных во время и после проведения курса, по следующей схеме: • нейтрофилы выше 0,5 х 109/л, тромбоциты выше 25 х 109/л - увеличение доз на 25% • нейтрофилы менее 0,5 х 109/л при 1-2 измерениях, тромбоциты выше 25 х 109/л - сохранение доз предыдущего цикла • нейтрофилы менее 0,5 х 109/л при 3 и более измерениях, тромбоциты ниже 25 х 109/л - редукция доз на 25% | |||
3,1,2 Схемы терапии рецидивов нодальных Т-клеточных лимфом.
| Монотерапия брентуксимабом ведотином [41] | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Брентуксимаб ведотин** | 1,8 мг/кг | в/в в течение 30 минут | 1 |
| Введения повторяются каждые 3 недели. Если масса тела пациента превышает 100 кг, при расчете дозы следует использовать значение массы 100 кг. У больных, не кандидатов на ВХТ с аутоТГСК, при достижении стабилизации или при положительной динамике заболевания лечение продолжают до 16, но не менее 8 циклов, при отсутствии прогрессирования и с оценкой чувствительности каждые 4 введения. Полная длительность лечения составляет приблизительно 1 год. | |||
| DHAP [52] | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Дексаметазон** | 40 мг | в/в или внутрь | 1-4 |
| Цисплатин** | 100 мг/м2 | в/в кап. 24-часовая инфузия | 1 |
| Цитарабин** | 2 г/м2 | в/в кап. 2 раза в день | 2 |
| Лечение возобновляется на 22 или 29 день | |||
| DHAP + брентуксимаб ведотин [42] | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Брентуксимаб ведотин** | 1,2 мг/кг | в/в в течение 30 минут | 0 |
| Дексаметазон** | 40 мг | в/в | 2-5 |
| Цисплатин** | 70 мг/м2 | в/в кап. 22-часовая инфузия | 1 |
| Цитарабин** | 2 г/м2 | в/в кап. 2 раза в день | 2 |
| Лечение возобновляется на 22 день | |||
| ESHAP [53] | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Этопозид** | 40 мг/м2 | в/в кап. | 1-4 |
| Метилпреднизолон** | 500 мг | в/в кап | 1-5 |
| Цисплатин** | 25 мг/м2/сут | в/в непрерывная инфузия | 1-4 |
| Цитарабин** | 2000 мг/м2 | в/в кап., | 5 |
| Лечение возобновляется на 22 или 29 день | |||
| ICE [55] | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Этопозид** | 100 мг/м2 | в/в кап | 1-3 |
| Ифосфамид** | 1700 мг/м2 | в/в | 1,2 |
| 1600 мг/м2 | в/в | 3 | |
| Карбоплатин** | AUC 5 | в/в кап. | 1 |
| Лечение возобновляется на 22 день | |||
| GDP [54] | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Цисплатин** | 70 мг/м2 | в/в кап | 1 |
| Гемцитабин** | 1000 мг/м2 | в/в кап | 1, 8 |
| Дексаметазон** | 40 мг | внутрь | 1-4 |
| Лечение возобновляется на 22 день | |||
3,1,3 Схемы терапии NK/ T-клеточных лимфом.
| DeV ic [32] | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Карбоплатин** | 200 мг/м2 | в/в | 1 |
| Этопозид** | 67 мг/м2 | в/в | 1-3 |
| Ифосфамид** | 1 г/м2 | в/в | 1-3 |
| Дексаметазон | 40 мг | в/в | 1-3 |
| Лечение возобновляется на 22 день | |||
| VIPD [33] | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Цисплатин** | 33 мг/м2 | в/в | 1-3 |
| Этопозид** | 100 мг/м2 | в/в | 1-3 |
| Ифосфамид** | 1,2 г/м2 | в/в | 1-3 |
| Дексаметазон | 40 мг | в/в | 1-4 |
| Лечение возобновляется на 22 день | |||
| SMILE [58] | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Метотрексат** | 2 г/м2 | в/в капельно в течение 6 часов | 1 |
| Ифосфамид** | 1,5 г/м2 | в/в капельно | 2-4 |
| Этопозид** | 100 мг/м2 | в/в капельно | 2-4 |
| Аспарагиназа** | 6 000 МЕ/м2 | в/в капельно | 8, 10, 12, 14, 16, 18, 20 |
| Дексаметазон** | 40 мг | в/в или внутрь | 2-4 |
| Лечение возобновляется после восстановления уровня нейтрофилов | |||
| Asp MetDex [57] | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Аспарагиназа** | 6 000 МЕ/м2 | в/м | 2, 4. 6, 8 |
| Метотрексат** | 3 г/м2 | в/в капельно в течение 6 часов | 1 |
| Дексаметазон** | 40 мг | в/в или внутрь | 1-4 |
| Лечение возобновляется на 21 день | |||
3,1,4 Схема терапии АККЛ у пациентов до 18 лет.
Протокол лечения ALCL 99 [39,75] :| Предфаза (соответствуент циторедуктивной фазе протокола для лечения В-НХЛ) начинать, как только подтвержден диагноз. | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Дексаметазон** | 5 мг/м2/сут в 1 прием | в/в или внутрь | 1, 2 |
| 10 мг/м2/сут за 2 приема | в/в или внутрь | 3-5 | |
| Циклофосфамид** | 200 мг/м2 | в/в в течение 60 минут | 1, 2 |
| Инфузия | 3000 мл/м2/сут | в/в | |
| Аллопуринол** | 300 мг/м2 | Внутрь | Ежедневно, начиная с -1 дня, до завершения всего протокола лечения |
| Не менее одного раза в день оценивать б/х крови (электролиты, кальций, фосфор, мочевина), в зависимости от размеров опухоли. Определение ответа опухоли на 5-й день терапии основано на клинической оценке; рентгенологическое и ультразвуковое обследование - по показаниям | |||
| Интратекальное введение метотрексата**, цитарабина** и преднизолона** (в дозировках по возрасту - см таблицу ниже) - день 1, через полчаса после начала инфузии метотрексата** | |||
| Блок А или АМ | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Дексаметазон** | 10 мг/м2 за 2 приема | в/в или внутрь | 1-5 |
| Метотрексат** | 1 г/м2 или 3 г/м2 | в/в в течение 24 часов (10% дозы от общей дозы за 30 минут, затем 90% инфузией за 23,5часа) | 1 |
| Кальция фолинат** | 15 мг/м2 | в/в | При назначении метотрексата** 1 г/м2 - на 42, 48 и 54 час от начала инфузии метотрексата** |
| При назначении метотрексата** 3 г/м2 - начинать через 24 часа от начала инфузии метотрексата**, далее - каждые 6 часов, суммарно 12 доз (или по требованию в зависимости от уровня метотрексата**) | |||
| Ифосфамид** | 800 мг/м2 | в/в за 1 час | 1-5 (в день 1 вводить за 6 часов до начала инфузии метотрексата**) |
| Месна** | 330 мг/м2 | в/в струйно | 0, 4 и 8 час после инфузии ифосфамида** |
| Цитарабин** | 150 мг/м2 каждые 12 часов (суммарно 300 мг/м2/сут) | в/в за 1 час | 4, 5 |
| Этопозид** | 100 мг/м2 | в/в за 2 часа (разведение 0,4 мг/мл) | 4, 5 (после инфузии цитарабина**) |
| Инфузия | Защелачивание в течение 48 часов после инфузии метотрексата** | ||
| В/в или оральная гидратация в объеме 3000 мл/м2/день должна быть продолжена в течение 12 часов после введения последней дозы ифосфамида. | |||
| Пациентам, получающим метотрексат в дозе 1 г/м2 - интратекальное введение метотрексата**, цитарабина** и преднизолона** (в дозировках по возрасту - см таблицу ниже) - день 1, через полчаса после начала инфузии метотрексата** | |||
| Курс А1 начинается на 6-й день терапии. Последующие курсы начинать по восстановлении показателей периферической крови: нейтрофилы better 0,5 х 109/л, тромбоциты better 50 х 109/л, при удовлетворительном общем состоянии пациента и отсутствии лихорадки в течение более 3 дней (по данным группы вFM, в среднем, этот период занимает ~21 день). | |||
| Блок в или ВМ | |||
| Препарат | Стандартная доза | Путь введения | Дни введения |
| Дексаметазон** | 10 мг/м2 за 2 приема | в/в или внутрь | 1-5 |
| Метотрексат** | 1 г/м2 или 3 г/м2 | в/в в течение 24 часов (10% дозы от общей дозы за 30 минут, затем 90% инфузией за 23,5часа) | 1 |
| Кальция фолинат** | 15 мг/м2 | в/в | При назначении метотрексата** 1 г/м2 - на 42, 48 и 54 час от начала инфузии метотрексата** |
| При назначении метотрексата** 3 г/м2 - начинать через 24 часа от начала инфузии метотрексата**, далее - каждые 6 часов, суммарно 12 доз (или по требованию в зависимости от уровня метотрексата**) | |||
| Циклофосфамид** | 200 мг/м2 | в/в в течение 60 минут | 1-5 (в день 1 назначить за 6 часов до начала инфузии метотрексата**) |
| Доксорубицин** | 25 мг/м2 | в/в в течение 60 минут | 4, 5 |
| Инфузия | Защелачивание в течение 48 часов после инфузии метотрексата** | ||
| Пациентам, получающим метотрексат в дозе 1 г/м2 - интратекальное введение метотрексата**, цитарабина** и преднизолона** (в дозировках по возрасту - см таблицу ниже) - день 1, через полчаса после начала инфузии метотрексата | |||
| В/в или оральная гидратация в объеме 3000 мл/м2/день должна быть продолжена в течение 12 часов после введения последней дозы ифосфамида. | |||
| Курс В1 начинать по восстановлении показателей периферической крови: нейтрофилы better 0,5 х 109/л, тромбоциты better 50 х 109/л, при удовлетворительном состоянии пациента и отсутствием лихорадки в течение более 3 дней (по данным группы вFM, в среднем, этот период занимает ~21 день). | |||
| Интратекальное введение препаратов (в рамках предфазы и у пациентов, получающих метотрексат** в дозе 1 г/м2) | |||
| Возраст | Дозировка препарата | ||
| Метотрексат** | Цитарабин** | Преднизолон** | |
| <1 года | 6 мг | 16 мг | 4 мг |
| 1-2 года | 8 мг | 20 мг | 6 мг |
| 2-3 года | 10 мг | 26 мг | 8 мг |
| >3 лет | 12 мг | 30 мг | 10 мг |
3,1,5 Режимы кондиционирования при аутоТГСК.
| BEAM [76] | ||||
| Препарат | Стандартная доза | Путь введения | Дни введения | |
| Кармустин** | 300 мг/м2 | в/в кап. | -6 | |
| Цитарабин** | 100 мг/м2 каждые 12 часов | в/в кап. | -5 - -2 | |
| Этопозид** | 100 мг/м2 | в/в кап. | -5 - -2 | |
| Мелфалан** | 140 мг/м2 | в/в кап. | -1 | |
| сBV [77] | ||||
| Препарат | Стандартная доза | Путь введения | Дни введения | |
| Кармустин** | 600 мг/м2 | в/в кап. | -3 | |
| Этопозид** | 400 мг/м2 | в/в кап. | -7 - -5 | |
| Циклофосфамид** | 1800 мг/м2 | в/в кап. | -7 - -4 | |
Приложение А3,2 Рекомендации по редукции доз или увеличению промежутков при проведении миелосупрессивной цитостатической терапии.
Лечение следует проводить в полных дозах в соответствии со схемой, если в день введения химиопрепаратов уровень нейтрофилов >1 × 109/л и тромбоцитов >100 × 109, но только в том случае, если пик падения уже пройден.Если необходимый уровень нейтрофилов не достигается к плановому дню введения химиопрепаратов, введение колониестимулирующих факторов продолжается в прежних дозах до достижения уровня нейтрофилов >1 × 109 при ежедневном контроле анализов крови, далее исследование крови повторяется через день. Лечение возобновляется при достижении вышеуказанных параметров.
В том случае, если показатели крови восстанавливаются в течение последующих 14 дней, следующий цикл проводится в полных дозах.
В случае, если показатели крови не восстанавливаются дольше дополнительных 14 дней, а также в случае повторной отсрочки курса вследствие миелотоксичности более 10 дней, проводится снижение доз препаратов до 75% от исходной дозы (кроме доз винкристина**, блеомицина** и преднизолона**).
Если к плановому дню введения химиопрепаратов необходимый уровень тромбоцитов не достигается, в дальнейшем исследование крови повторяется на 3, 7, 10 и 14 дни; лечение возобновляется при достижении вышеуказанных параметров. Если показатели крови восстанавливаются в течение дополнительных 14 дней, цикл проводится в полных дозах. В случае, если показатели крови не восстанавливаются дольше дополнительных 14 дней, в следующем цикле производится редукция доз по той же схеме, как и при длительной нейтропении.
Приложение В.
Информация для пациентов.Лимфомы - это опухоли из лимфоидных клеток. Лимфома - не одна болезнь, это большая группа, включающая более 30 разных заболеваний, которые отличаются друг от друга по своим проявлениям, по течению, по ответу на лечение. Лимфомы ведут себя и лечатся совершенно по-разному. Поэтому просто слово «лимфома» ни о чем не говорит - чтобы понимать, как лечить, надо знать конкретный вариант лимфомы.
Периферическая Т-клеточная лимфома относится к группе заболеваний, которые составляют 10-15% всех лимфом человека. Название показывает, что опухоль состоит из Т-клеток. Т-лимфоциты - это самые грозные бойцы иммунитета, так как именно они уничтожают чужеродные бактерии и собственные больные клетки организма. Подобно яблоку на дереве, весь период превращения (созревания) молодой клетки в зрелый Т-лимфоцит проходит несколько этапов. На каждом этапе возможен сбой и образование больной опухолевой группы клеток. При периферической Т-клеточной лимфоме опухоль появляется на последнем этапе созревания, на уровне зрелой Т-клетки. Опухолевые Т-лимфоциты похожи на нормальные, которые находятся в периферической (циркулирующей) крови, отсюда и название - «периферическая».
Некоторые из Т-клеточных периферических лимфом имеют свои особенности, например периферическая Т-клеточная лимфома кожи чаще появляется в коже и подкожной клетчатке. Однако самая частая «периферическая Т-клеточная лимфома неуточненная» характерных особенностей не имеет и может появляться во всех органах и тканях. Проявления этой болезни совпадают с признаками других лимфом. Пациенты обычно жалуются на боль из-за роста опухоли, которая может появиться в любой точке тела. При этой болезни увеличиваются лимфатические узлы группами на шее, подмышками, в паху и в других местах. Больного могут беспокоить и такие признаки болезни, которые называются «В-симптомы»: у него поднимается температура, он быстро худеет и сильно потеет вечером и ночью. При Т-клеточных периферических лимфомах обыкновенно возникает сыпь и уплотнения в коже.
Чтобы поставить правильный диагноз, обязательно берут кусочек опухоли или увеличенный лимфатический узел для морфологического и иммуногистохимического исследования. Только такой сложный, комплексный анализ позволяет поставить точный диагноз и провести эффективное лечение.
Чтобы точно узнать, есть ли увеличенные лимфатические узлы и каково их количество в тех частях тела, которые нельзя увидеть при внешнем осмотре, необходимо сделать компьютерную томографию. Стадию болезни устанавливают по системе «Ann-Arbor», которая отражает, какие органы и лимфатические узлы поражены.
Лечить неуточненную Т-клеточную лимфому непросто. Успешно лечится около 40% случаев заболевания. В то же время врачи постоянно продолжают улучшать результаты лечения, используют новые методы и применяют новые лекарства.
Ангиоиммунобластная лимфома относится к группе Т-клеточных лимфом. Т-клетки - это самые грозные бойцы иммунитета, так как именно они уничтожают чужеродные бактерии и собственные больные клетки организма. Это довольно редкое заболевание: оно составляет 2-3% всех лимфом человека. Эта болезнь отличается и тем, что может проявляться сильной слабостью и состоянием, похожим на грипп (гриппоподобным синдромом).
Ангиоиммунобластную лимфому могут вызывать обычные болезни, например, грипп или другие острые вирусные инфекции. Другие появления болезни в целом совпадают с проявлениями иных лимфом: опухают лимфатические узлы группами на шее, подмышками, в паху и в других местах, часто увеличиваются печень и селезенка, появляется жидкость в околосердечной и окололегочной полостях. Пациенты обычно жалуются на боль из-за роста опухоли, которая может появиться в любой точке тела. Больного могут беспокоить и такие признаки болезни, которые называются «В-симптомы»: у него поднимается температура, он быстро худеет и сильно потеет вечером и ночью. Как и при других Т-клеточных лимфомах, бывает разнообразная сыпь и уплотнения в коже. Возможны также аутоиммунные осложнения.
Чтобы поставить правильный диагноз, обязательно берут кусочек опухоли или увеличенный лимфатический узел для морфологического и иммуногистохимического исследования. Только такой сложный, комплексный анализ позволяет поставить верный диагноз и провести эффективное лечение.
Чтобы точно узнать, есть ли увеличенные лимфатические узлы и каково их количество в тех частях тела, которые нельзя увидеть при внешнем осмотре, необходимо сделать компьютерную томографию. Стадию болезни устанавливают по системе «Ann-Arbor», которая отражает, какие органы и лимфатические узлы поражены.
Лечить ангиоиммунобластную лимфому непросто. Успешно лечится около 60% случаев заболевания. В то же время врачи постоянно продолжают улучшать результаты лечения, используют новые методы и применяют новые лекарства.
Анапластическая крупноклеточная лимфома относится к агрессивному классу Т-клеточных лимфом, при котором в основном увеличиваются лимфатические узлы. Название показывает, что опухоль состоит из Т-клеток, а Т-клетки (Т-лимфоциты) - это самые грозные бойцы иммунитета, так как именно они уничтожают чужеродные бактерии и собственные больные клетки организма. Подобно яблоку на дереве, весь период превращения (созревания) молодой клетки в зрелый Т-лимфоцит проходит несколько этапов. На каждом этапе возможен сбой и образование больной опухолевой группы клеток. При анапластической лимфоме опухолевые клетки настолько изменяются, что полностью теряют все признаки созревания и выглядят как молодые клетки. Это обозначается словом «анаплазия». Лимфатические узлы при этой болезни увеличиваются группами на шее, подмышками, в паху и в других местах. Больного могут беспокоить и такие признаки болезни, которые называются «В-симптомы»: у него поднимается температура, он быстро худеет и сильно потеет вечером и ночью. Возможны также аутоимунные осложнения, ошибочная реакция иммунитета на органы и ткани собственного организма, когда защитная система начинает работать против здоровых клеток.
Чтобы установить правильный диагноз, обязательно берут кусочек опухоли или увеличенный лимфатический узел для морфологического и иммуногистохимического исследования. Это очень важно для прогноза и выбора лечения. Только такой сложный, комплексный анализ позволяет поставить точный диагноз и провести эффективное лечение.
Чтобы точно узнать, есть ли увеличенные лимфатические узлы и каково их количество в тех частях тела, которые нельзя увидеть при внешнем осмотре, необходимо сделать компьютерную томографию. Стадию болезни устанавливают по системе «Ann-Arbor», которая отражает, какие органы и лимфатические узлы поражены.
Лечение анапластической крупноклеточной лимфомы зависит от наличия или отсутствия в опухоли фермента под названием «ALK». Выявляют его во время иммуногистохимического исследования лимфатического узла. Если фермент ALK есть, то лимфома называется ALK-позитивной. Такие лимфомы лечатся успешно в 70% случаев. Если более мягкими, относительно небольшими дозами лекарств не удается вылечить больного, то проводят высокодозную химиотерапию с поддержкой собственными клетками. Если фермента ALK нет, то лимфома называется ALK-негативной. Результаты лечения ALK-негативных лимфом несколько хуже, однако постоянно появляются новые препараты, которые помогают улучшить лечение таких больных.
Чтобы точно узнать, есть ли увеличенные лимфатические узлы или отдельные лимфомные опухоли во внутренних органах тех частей тела, которые нельзя увидеть при внешнем осмотре, необходимо сделать компьютерную томографию грудной клетки, брюшной полости и малого таза.
По той причине, что болезнь редкая, пока нет надежных цифровых данных об эффективном лечении. Чтобы вылечить пациента с этим заболеванием, врачи используют разнообразные проверенные схемы по лечению других лимфом, а также постоянно пробуют новые способы лечения с использованием новых препаратов.
Больного нередко беспокоят и общие симптомы: у него поднимается температура, он быстро худеет и сильно потеет вечером и ночью, эти проявления были впервые описаны при опухолях из В-клеток, поэтому они и называются «В-симптомы». Возможны также аутоимунные осложнения, когда иммунитет ошибочно начинает уничтожать здоровые клетки органов и тканей собственного организма.
Приложение Г.
Приложение Г1 Шкала оценки общего состояния пациента Восточной объединенной онкологической группы (ECOG).
Оригинальное название: The ECOG Scale of Performance Status.Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern сooperative Oncology Group. Am. J. сlin. Oncol. 1982;5(6):649-65 [78].
Тип: шкала оценки.
Назначение: клиническая оценка общего состояния пациента.
Содержание и интерпретация:
| Статус (баллы) | Описание общего состояния пациента |
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания. |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу). |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени проводит активно - в вертикальном положении. |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования. |
| 4 | Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели. |
| 5 | Смерть пациента |
Приложение Г2 Шкала визуальной оценки ПЭТ-данных.
Оригинальное название: The Deauville five point scale.Источник: Meignan M. et al. Report on the First International Workshop on Interim-PET-Scan in Lymphoma. Leuk Lymphoma. 2009;50(8):1257-1260 [79].
Тип: шкала оценки.
Назначение: оценка результатов ПЭТ/КТ исследования.
Содержание и интерпретация: для стандартизации, воспроизводимости и возможности сравнения результатов ПЭТ/КТ, полученных в различных медицинских учреждениях, при оценке эффективности лечения у больных лимфомами используется визуальный анализ ПЭТ-данных по 5-балльной шкале [79]. При этом интенсивность накопления 18F-ФДГ в патологическом очаге сравнивается с интенсивностью накопления препарата в неизмененных отделах средостения или в правой доле печени:
1 балл - характеризуется отсутствием накопления препарата в определяемом ранее патологическом очаге;
2 балла - накопление препарата в патологическом очаге не превышает по интенсивности накопление препарата в неизмененных отделах средостения;
3 балла - накопление препарата в патологическом очаге выше, чем в средостении, но не превышает накопление препарата в правой доле печени;
4 балла - накопление препарата в патологическом очаге несколько выше, чем в печени;
5 баллов - накопление препарата в патологическом очаге значительно выше, чем в печени, или определяется появление новых патологических очагов, связанных с заболеванием.
Также введено понятие Х-баллов, характеризующих наличие очагов накопления 18F-ФДГ неясного, скорее воспалительного генеза, связь которых с основным заболеванием маловероятна.
Интерпретация результатов ПЭТ по шкале Deauville проводится комплексно с учетом клинических и исходных ПЭТ-данных, этапа лечения, а также других показателей ответа на лечение.
Приложение Г3 Шкала Khorana для оценки риска ВТЭО у пациентов, получающих химиотерапию.
Оригинальное название:Источник: Development and Validation of a predictive model for chemotherapyassociated thrombosis. вlood. 2008;111(10):4902-4907 [80].
Тип: шкала оценки.
Назначение: клиническая оценка общего состояния пациента.
Содержание и интерпретация:
| ФАКТОРЫ РИСКА БАЛЛЫ | ФАКТОРЫ РИСКА БАЛЛЫ |
| Локализация опухоли Очень высокий риск (желудок, поджелудочная железа) Высокий риск (легкие, лимфома, кровь, яички, яичники, матка) | 2 1 |
| Количество тромбоцитов в крови перед началом химиотерапии ≥ 350 000/мл3 | 1 |
| Уровень гемоглобина менее 10 г/дл или использование эритропоэтинов | 1 |
| Количество лейкоцитов в крови перед началом химиотерапии better 11 000/мл3 | 1 |
| Ожирение (индекс массы тела выше 35 кг/м2) и выше | 1 |
| Риск развития ВТЭО за 2-5 мес. (%) | |
| Высокий риск, сумма баллов ≥ 3 | 6,7-7,1 |
| Средний риск, сумма баллов 1-2 | 1,8-2 |
| Низкий риск, сумма баллов 0 | 0,3-0,8 |
|
|
Год актуализации информации
2020.
Связанные заболевания
Связанные клинические рекомендации
Связанные стандарты мед. помощи
- Стандарт санаторно-курортной помощи больным злокачественными новообразованиями лимфоидной, кроветворной и родственной им тканей
- Стандарт специализированной медицинской помощи после трансплантации аллогенного костного мозга (обследование и коррекция лечения)
- Стандарт медицинской помощи больным с Т-клеточной лимфомой
- Стандарт специализированной медицинской помощи при донорстве аутологичного костного мозга
- Стандарт медицинской помощи больным с миелолейкозом и другими гемобластозами