МКБ-10 коды
|
|
Вступление
МКБ 10: С84.0/ С84.1/ С84.5.
Год утверждения (частота пересмотра): 2017 (пересмотр каждые 2 года).
ID: КР147.
Профессиональные ассоциации.
• Национальное гематологическое общество Российское профессиональное общество онкогематологов.
Год утверждения (частота пересмотра): 2017 (пересмотр каждые 2 года).
ID: КР147.
Профессиональные ассоциации.
• Национальное гематологическое общество Российское профессиональное общество онкогематологов.
Профессиональные ассоциации
• Национальное гематологическое общество Российское профессиональное общество онкогематологов.
 Список сокращений
Список сокращений
ГМ-грибовидный микоз.
СС - Синдром Сезари.
ЛиП - лимфоматоидный папулез.
АКЛК - анапластическая крупноклеточная лимфома.
ВОЗ - Всемирная Организация Здравоохранения.
ВОЗ- EORTC - европейская организация по изучению и лечению рака.
ПЭТ- позитронно-эмиссионная томография.
ПУВА - псорален+ультрафиолетовое облучение спектра А.
ЭКФ - экстракорпоральный фотоферез.
ТОК - тотальное облучение кожи.
СС - Синдром Сезари.
ЛиП - лимфоматоидный папулез.
АКЛК - анапластическая крупноклеточная лимфома.
ВОЗ - Всемирная Организация Здравоохранения.
ВОЗ- EORTC - европейская организация по изучению и лечению рака.
ПЭТ- позитронно-эмиссионная томография.
ПУВА - псорален+ультрафиолетовое облучение спектра А.
ЭКФ - экстракорпоральный фотоферез.
ТОК - тотальное облучение кожи.
Термины и определения
Грибовидный микоз - первичная кожная эпидермотропная Т-клеточная лимфома.
Синдром Сезари - лейкемический вариант грибовидного микоза.
ПУВА - физиотерапевтический метод лечения, включающий применение фотоактивного препарата (псоралена) и облучение кожного покрова длинноволновым УФ-излучением.
Ретиноиды - это группа веществ, являющихся аналогами витамина А.
Экстракорпоральный фотоферез - метод, основанный на сочетании лейкафереза и облучения лейкоцитов, предварительно обработанных фотосенсибилизатором (8-метоксипсораленом) ультрафиолетовым светом диапазона (320-400 нм).
Синдром Сезари - лейкемический вариант грибовидного микоза.
ПУВА - физиотерапевтический метод лечения, включающий применение фотоактивного препарата (псоралена) и облучение кожного покрова длинноволновым УФ-излучением.
Ретиноиды - это группа веществ, являющихся аналогами витамина А.
Экстракорпоральный фотоферез - метод, основанный на сочетании лейкафереза и облучения лейкоцитов, предварительно обработанных фотосенсибилизатором (8-метоксипсораленом) ультрафиолетовым светом диапазона (320-400 нм).
Описание
Первичные лимфомы кожи (ЛК) представляют собой гетерогенную группу лимфопролиферативных заболеваний Т/NK- и В-клеточной природы, которые на момент постановки диагноза локализуются только в коже. Они занимают второе место по частоте среди экстранодальных неходжкинских лимфом и представляют собой отдельный клинический и гистопатологический подтип опухоли, часто отличающийся от соответствующих им нодальных аналогов не только по характеру течения и прогнозу, но и по наличию специфических хромосомных аберраций и экспрессии различных онкогенов.
Причины
Этиология кожных Т-клеточных лимфом не известна, предполагается определенная роль хронической антигенной стимуляции. Опухолевые клетки относят к Th2-хелперам (Т-клетки хелперы 2 типа), которые обладают нарушенным спектром цитокинов, что приводит к подавляющему действию на здоровые клетки микроокружения, и в дальнейшем к ингибированию апоптоза опухолевых клеток.
Эпидемиология
ГМ является наиболее распространенной формой кожной Т-клеточной лимфомы и составляет 1% всех неходжскинских лимфом, 50% первичных лимфом кожи и 65% кожных Т-клеточных лимфом. Заболеваемость ГМ в мире равна 6-7 случаев/106 с тенденцией к регулярному повышению в последние десятилетия.
СС составляет менее чем 5% от всех первичных кожных лимфом. Болеют преимущественно люди пожилого возраста с преобладанием пациентов мужского пола, средний возраст начала заболевания составляет 60-65 лет.
Группа первичных кожных сD30+ ЛПЗ является второй по частоте регистрации после грибовидного микоза и составляет 25% всех первичных лимфом кожи. Заболеваемость ЛиП и АКЛК в мире составляет 0,1-0,2 случая на 100000 населения. ЛиП и АКЛК могут возникать во всех возрастных категориях, средний возраст дебюта заболевания для ЛиП 35-45 лет, для АКЛК 50-60 лет. Соотношение заболевших ЛиП мужчин и женщин составляет 1,5:1, АКЛК - 2-3:1.
СС составляет менее чем 5% от всех первичных кожных лимфом. Болеют преимущественно люди пожилого возраста с преобладанием пациентов мужского пола, средний возраст начала заболевания составляет 60-65 лет.
Группа первичных кожных сD30+ ЛПЗ является второй по частоте регистрации после грибовидного микоза и составляет 25% всех первичных лимфом кожи. Заболеваемость ЛиП и АКЛК в мире составляет 0,1-0,2 случая на 100000 населения. ЛиП и АКЛК могут возникать во всех возрастных категориях, средний возраст дебюта заболевания для ЛиП 35-45 лет, для АКЛК 50-60 лет. Соотношение заболевших ЛиП мужчин и женщин составляет 1,5:1, АКЛК - 2-3:1.
Классификация
1,5 Классификация,.
В 2005 году Всемирная организация здравоохранения совместно с Европейской Организацией по изучению и лечению рака (European Organization for Research and Treatment of сancer - EORTC) создали ВОЗ-EORTC классификацию ЛК, которая содержит наиболее полную клиническую, морфоиммунологическую и молекулярно-биологическую информацию, касающуюся первичных ЛК и нескольких лимфопролиферативных заболеваний, часто начинающихся с поражения кожи (таблица 1).Таблица 1. ВОЗ-EORTC-классификация кожных лимфом.
| Т- и NK -клеточные лимфомы кожи |
| Грибовидный микоз Подтипы грибовидного микоза Фолликулотропный Педжетоидный ретикулез Синдром гранулематозной вялой кожи Синдром Сезари Т-клеточная лейкемия/лимфома взрослых Первичные кожные сD30+ лимфопролиферативные заболевания Первичная анапластическая крупноклеточная лимфома кожи Лимфоматоидный папулез Подкожная панникулитоподобная Т-клеточная лимфома Экстранодальная NK/Т-клеточная лимфома, назальный тип Первичная кожная периферическая Т-клеточная лимфома, неуточненная Первичная кожная агрессивная эпидермотропная сD8+ Т-клеточная лимфома Кожная /+Т-клеточная лимфома Первичная кожная сD4+ плеоморфная Т-клеточная лимфома из клеток малых и средних размеров. |
| В-клеточные лимфомы кожи |
| Первичная кожная В-клеточная лимфома маргинальной зоны Первичная кожная лимфома из клеток фолликулярного центра Первичная кожная диффузная крупноклеточная В-клеточная лимфома, тип нижних конечностей Первичная кожная диффузная крупноклеточная В-клеточная лимфома, другая Внутрисосудистая крупноклеточная В-клеточная лимфома |
| Гемодермии из клеток-предшественников |
| сD4+/CD56+ гемодермия (бластная NK-клеточная лимфома) |
Клиническая картина
Клиническими симптомами, характерными для ГМ, являются:
• Высыпания вариабельной формы, размеров и цвета.
• Феномен одновременного прогрессирования и регрессирования отдельных высыпаний.
• Пойкилодермия (пятнистая пигментация, телеангиоэктазии, атрофия кожи).
• Множественность высыпаний, несколько зон вовлечения.
• Характерная локализация высыпаний на участках кожи, не подвергающихся солнечному облучению.
• Кожный зуд, часто сопровождающий высыпания.
ЛиП характеризуется повторными высыпаниями самопроизвольно разрешающихся папулезных элементов. Количество высыпаний может варьировать от единичных до нескольких десятков (иногда сотен), характерен эволюционный полиморфизм элементов. Наиболее частая локализация - кожа туловища и проксимальных отделов конечностей. Описаны случаи появления высыпаний на ладонях и подошвах, лице, волосистой части головы и в области промежности.
Клиническая картина обычно представлена быстрорастущими бессимптомными папулами красного или синюшно-красного цвета до 2 см в диаметре, которые существуют от трех недель до нескольких месяцев, затем разрешаются бесследно или изъязвляются, оставляя после себя гиперпигментные пятна или атрофические рубчики.
Клиническая картина АКЛК обычно представлена солитарными, сгруппированными или множественными узлами (в том числе подкожными), имеющими тенденцию к изъязвлению. Наиболее частая локализация высыпаний - верхние и нижние конечности.
• Высыпания вариабельной формы, размеров и цвета.
• Феномен одновременного прогрессирования и регрессирования отдельных высыпаний.
• Пойкилодермия (пятнистая пигментация, телеангиоэктазии, атрофия кожи).
• Множественность высыпаний, несколько зон вовлечения.
• Характерная локализация высыпаний на участках кожи, не подвергающихся солнечному облучению.
• Кожный зуд, часто сопровождающий высыпания.
ЛиП характеризуется повторными высыпаниями самопроизвольно разрешающихся папулезных элементов. Количество высыпаний может варьировать от единичных до нескольких десятков (иногда сотен), характерен эволюционный полиморфизм элементов. Наиболее частая локализация - кожа туловища и проксимальных отделов конечностей. Описаны случаи появления высыпаний на ладонях и подошвах, лице, волосистой части головы и в области промежности.
Клиническая картина обычно представлена быстрорастущими бессимптомными папулами красного или синюшно-красного цвета до 2 см в диаметре, которые существуют от трех недель до нескольких месяцев, затем разрешаются бесследно или изъязвляются, оставляя после себя гиперпигментные пятна или атрофические рубчики.
Клиническая картина АКЛК обычно представлена солитарными, сгруппированными или множественными узлами (в том числе подкожными), имеющими тенденцию к изъязвлению. Наиболее частая локализация высыпаний - верхние и нижние конечности.
Диагностика
2,1 Жалобы и анамнез.
• Рекомендуется сбор анамнеза. Время и место появление первых изменений на коже, тенденция к саморазрешению, вид образований Чаще всего пациенты предъявляют жалобы на различные кожные образования, кожный зуд [1,3,6].Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарии. Сбор жалоб и анамнеза позволит определить объем обследования больного.
2,2 Физикальное обследование.
• Рекомендовано при осмотре картирование кожных покровов. Количество и размер высыпаний (наличие пятен и бляшек указывает на возможную ассоциацию с ГМ), определение увеличенных лимфатических узлов и органов.[1,3,6].Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарии. Позволяет определить стадию заболевания.
2,3 Лабораторная диагностика.
• Рекомендуется обязательное выполнение биопсии кожи (и лимфоузла при подозрении на вовлечение) с морфологическим (цитологическим и гистологическим) исследованием.[1,3,6].Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарии. Гистологическое заключение должно учитывать клеточный состав дермального инфильтрата и его расположение.
Основными диагностическими критериями ГМ, являются:
• наличие в инфильтрате плеоморфных («церебриформных») лимфоидных клеток малых и средних размеров;
• наличие лимфоидных клеток, располагающихся цепочкой в базальном ряду эпидермиса (3 и более);
• наличие интраэпидермальных лимфоцитов, окруженных светлым перинуклеарным ободком (haloed lymphocytes);
• повышенное количество интраэпидермальных лимфоцитов при отсутствии спонгиоза («диспропорциональный эпидермотропизм»);
• размер эпидермальных лимфоцитов больше, чем дермальных;
• внутриэпидермальные скопления лимфоцитов (микроабсцессы Потрие);
• фиброз и/или отек сосочковой части дермы.
Для повышения достоверности гистологического исследования необходимо отменять лечение любыми наружными препаратами, особенно содержащими кортикостероиды, а также системными кортикостероидами и иммуносупрессантами за 2 недели до проведения биопсии. В неясных случаях рекомендуется проведение нескольких биопсий из разных очагов и повторных биопсий через 2-4 недели (без назначения наружной терапии).[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарий. Повторная биопсия позволяет в части случаев верифицировать ранее не установленный диагноз.
• Рекомендуется в части случаев иммуногистохимическое исследование.[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарий. Проведение ИГХ исследования помогает в дифференциальной диганостики Т-клеточных лимфом кожи.
Иммуногистохимическое исследование ГМ характеризуется инфильтратом из α/β Т-хелперов, которые имеют следующий иммунофенотип: βF1+ сD3+ сD4+ сD5+ сD7+ сD8- сD45RO+. Реже встречаются Т-цитотоксический (βF1+ сD3+ сD4- сD5+ сD8+) и γ/δ(β F1- сD3+ сD4- сD5+ сD8+) фенотипы. В этих случаях требуется клинико-морфологическая корреляция для исключения сD8+ агрессивной эпидермотропной Т-клеточной лимфомы и γ/δ Т-клеточной лимфомы. В поздних стадиях ГМ может наблюдаться полная или частичная потеря экспрессии пан-Т-клеточных антигенов сD3, сD5 и сD7, появление экспрессии цитотоксических протеинов TIA-1, гранзима В и перфорина, а также аберрантный сD4+/CD8+ или сD4-/CD8- фенотип.
Гистологические признаки ЛиП вариабельны и зависят от стадии развития элемента. Выделяют 4 гистологических подтипа ЛиП. Необходимо учитывать, что разные подтипы могут наблюдаться у одного и того же пациента одновременно в разных высыпаниях.
• ЛиП тип А (наиболее часто встречающийся): дермальный очаговый «клинообразный» инфильтрат, состоящий из отдельных или сгруппированных сD30+ опухолевых клеток с примесью многочисленных малых лимфоцитов, гистиоцитов, нейтрофильных и эозинофильных лейкоцитов.
• ЛиП тип В: эпидермотропный инфильтрат, состоящий из атипичных сD30+ или сD30- лимфоидных клеток малых и средних размеров с церебриформными ядрами (гистологическая картина напоминает ГМ).
• ЛиП тип С: сливающиеся поля сD30+ крупных атипичных лимфоидных клеток, примесь воспалительного инфильтрата незначительна.
• ЛиП тип D: эпидермотропный инфильтрат, состоящий из атипичных сD8+ и сD30+ лимфоидных клеток малых и средних размеров (гистологическая картина напоминает первичную кожную агрессивную эпидермотропную сD8+ цитотоксическую Т-клеточную лимфому).
• ЛиП тип Е: ангиоцентрический и ангиодеструктивный инфильтрат, состоящий из атипичных сD8+ (реже сD4+) и сD30+ лимфоидных клеток малых, средних и крупных размеров.
Иммуногистохимические критерии ЛиП.
• В большинстве случаев сD30+ опухолевые клетки экспрессируют сD4, реже могут наблюдаться сD8+ или сD56+ фенотипы.
• Т-клеточно-ассоциированные антигены (CD45RO) экспрессируются с вариабельной потерей пан-Т-клеточных антигенов (CD2, сD3, сD5).
• Необходимо учитывать, что крупные атипично выглядящие сD30+ клетки могут встречаться при различных воспалительных и инфекционных заболеваниях.
Гистологические критерии АКЛК:
• плотный очаговый или диффузный инфильтрат, состоящий из крупных плеоморфных, анапластических клеток или клеток с иммунобластной морфологией.
• в инфильтрате могут обнаруживаться скопления малых реактивных лимфоцитов и эозинофильных лейкоцитов.
Иммуногистохимические критерии АКЛК:
• экспрессия сD30 должна обнаруживаться не менее чем на 75% опухолевых клеток;
• в большинстве случаев опухолевые клетки экспрессируют сD4 или сD8 антигены с вариабельной потерей пан-Т-клеточных антигенов (CD2, сD3, сD5);
• в отличие от нодальной формы при АКЛК экспрессируется сLA (HECA-452) и не экспрессируется EMA;
• в отличие от нодальной формы экспрессия ALK-1 и транслокация t(2;5) обычно отсутствуют при АКЛК.
• Рекомендуется выполнить ПЦР-исследование для определения реаранжировки гена Т-клеточного рецептора (ТКР). [1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарии. Моноклональность инфильтрата обнаруживается в 90% случаев бляшечной и опухолевой стадий ГМ и лишь в 50-60% - в пятнистой стадии.
• Рекомендуется выполнить развернутый клинический анализ крови с определением гемоглобина, эритроцитов, тромбоцитов, лейкоцитов, подсчетом лейкоцитарной формулы и количества ретикулоцитов.[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарии. Развернутый анализ крови позволяет исключить подозрение на поражение костного мозга.
• Рекомендуется гистологическое исследование трепанобиоптата костного мозга (при синдроме Сезари, трансформации ГМ в крупноклеточную лимфому, АКЛК).[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарии. Морфологическое исследование пунктата костного мозга (стернального или ) не заменяет гистологическое исследование трепанобиоптата.
• Рекомендуется при наличии лимфоцитоза выполнение иммунофенотипирования (ИФТ) методом проточной цитометрии.[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарии. Выполнение ИФТ обязательно при наличии лимфоцитоза в общем анализе крови (независимо от числа лейкоцитов), или в миелограмме, а также при преобладании лимфоидных клеток, атипичных лимфоцитов или клеток с бластной морфологией в плевральной, асцитической или других биологических жидкостях. Выполнение ИФТ позволяет быстро провести дифференциальную диагностику опухолевого и реактивного лимфоцитоза, что важно для определения дальнейшей тактики обследования пациента. Материалом для ИФТ могут служить клетки крови, костного мозга, выпотных жидкостей, бронхоальвеолярного смыва, ликвора, гомогенизированные образцы тканей (селезенка, лимфатические узлы ), клеточная суспензия, полученная при аспирационной тонкоигольной пункции лимфатических узлов.
При СС: - повышено содержание сD3+ или сD4+ клеток периферической крови с коэффициентом отношения сD4/CD8 ≥ 10 (определяется при помощи проточной цитометрии).
- повышено содержание сD4+ клеток периферической крови с аберрантным иммунофенотипом, включающем отсутствие экспрессии сD7 (≥ 40% сD4+СD7- клеток) или сD26 (≥ 30% сD4+CD26- клеток).
• Рекомендуется проведение биопсии дополнительных очагов поражения.[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарии. При определении стадии опухолевого процесса может потребоваться биопсия других очагов поражения, если нельзя исключить их опухолевую природу другими способами.
• Рекомендуется обязательное выполнение повторной биопсии и морфологического исследования пораженных лимфатических узлов или очагов, расположенных экстранодально при рецидиве или прогрессировании заболевания. [1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарии. Повторная биопсия позволит уточнить морологический вариант рецидива/прогрессии, исключить неопухолевое поражение (например, туберкулез, грибковая инвазия, вторая опухоль). Повторная биопсия также показана при наличии резидуальных очагов для подтверждения ремиссии.
• Рекомендуется повторная аспирация и трепанобиопсия костного мозга для плановой оценки результатов лечения (при исходном поражении костного мозга) и при появлении клинически немотивированных цитопении и лихорадки (вне зависимости от наличия исходного поражения).[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарии. Аспират костного мозга может быть информативен для оценки регенерации и диспластических изменений миелопоэза. У больных с поражением костного мозга цитологическое исследование пунктата для оценки изменений объема опухолевой инфильтрации не всегда информативно.
• Рекомендуется выполнить общий анализ мочи.[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
• Рекомендуется выполнить биохимический анализ крови.[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарий. Включает обязательное определение следующих параметров - ЛДГ, мочевая кислота, мочевина, креатинин, общий белок, альбумин, билирубин, АСТ, АЛТ, щелочная фосфатаза, электролиты, кальций.
• Рекомендуется выполнить коагулограмму.[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
• Рекомендуется выполнить определение группы крови, резус-фактора.[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
• Рекомендуется выполнить определение маркеров вирусных гепатитов В и С, ВИЧ.[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
• Рекомендуется выполнить (у женщин детородного возраста) тест на беременность.[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
2,4 Инструментальная диагностика.
• Рекомендуется выполнить КТ шеи, грудной клетки, органов брюшной полости и малого таза (с контрастированием при ГМ поздние стадии, СС, АКЛК). [1,3,6].Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
• Рекомендуется выполнить рентгенографию органов грудной клетки в двух проекциях (при невозможности выполнения КТ). [1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
• Рекомендуется выполнение УЗИ периферических лимфатических, внутрибрюшных и забрюшинных узлов и органов брюшной полости.[1,3,6].
Комментарий. УЗИ может использоваться для контроля за лечением, но не является стандартом при установлении стадии заболевания и при оценке эффективности лечения.
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
• Рекомендуется выполнение ЭКГ и Эхо-КГ [1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
• Рекомендуется выполнение эндоскопического исследования желудка (при наличии показаний). [1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
• Рекомендуется выполнение эндоскопического исследования кишечника (при наличии показаний)[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
2,5 Дополнительные исследования, консультации специалистов.
• Рекомендуется исследование прямой пробы Кумбса.[1,3,6].Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарий. Выполняется при наличии клинических или лабораторных признаках гемолиза.
• Рекомендуется выполнение рентгенографии костей скелета, сцинтиграфия костей скелета [1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарии. При необходимости исключения поражения костей.
• Рекомендуется выполнение КТ или МРТ головного мозга.[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарии. При необходимости исключения поражения центральной нервной системы.
• Рекомендуется выполнение ПЭТ/КТ.[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Комментарии. При невозможности определения очагов поражения иным методом.
• Рекомендуется консультация гинеколога (у женщин).[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
• Рекомендуется консультация смежных специалистов при показаниях (исключение туберкулеза, оказание ЛОР-пособия ).[1,3,6].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
2,6 Стадирование, формулирование диагноза.
Стадирование ГМ проводится согласно рекомендациям Международного общества по лимфомам кожи и Европейской организации по изучению и лечению рака для ГМ и синдрома Сезари (СС) (ISCL-EORTC staging system for MF/SS) (табл. 2). Стадирование первичных лимфом кожи, отличных от ГМ/СС, согласно рекомендациям ISLE-EORTC см таблицу 3.Таблица 2. Стадирование ГМ/СС согласно рекомендациям ISLE-EORTC.
| Кожа Т1 Ограниченные пятна, папулы, и/или бляшки, покрывающие <10% кожного покрова Т1а - только пятна Т1b - бляшки ± пятна Т2 Пятна, папулы, и/или бляшки, покрывающие >10% кожного покрова Т2а - только пятна Т2b - бляшки ± пятна Т3 Один или более узлов (≥1 см в диаметре) Т4 Сливающаяся эритема, покрывающая ≥80% поверхности тела Лимфатические узлы N 0 Нет увеличения периферических лимфатических узлов, их биопсия не требуется N 1 Периферические лимфатические узлы увеличены; гистопатология Dutch grade 1 или NCI LN0-2 N1a - клон-негативны N1b - клон-позитивны N 2 Периферические лимфатические узлы увеличены; гистопатология Dutch grade 2 или NCI LN3 N2a - клон-негативны N2b - клон-позитивны N 3 Периферические лимфатические узлы увеличены; гистопатология Dutch grade 3-4 или NCI LN4, клон-позитивны или негативны NX Периферические лимфатические узлы увеличены, нет гистологического подтверждения Внутренние органы M 0 Нет вовлечения внутренних органов M 1 Вовлечение внутренних органов (с уточнением органа и морфологическим подтверждением) Кровь в 0 Отсутствие значительного вовлечения крови: атипичные (Сезари) клетки составляют ≤5% лимфоцитов периферической крови в0a - клон-негативны в0b - клон-позитивны в 1 Умеренное вовлечение крови: атипичные (Сезари) клетки составляют >5% лимфоцитов периферической крови в1a - клон-негативны в1b - клон-позитивны в 2 Значительное вовлечение крови: ≥1000/µL клеток Сезари с позитивным клоном | ||||
| Стадии | T | N | M | в |
| Ранние IA IB IIA Поздние IIB III IIIA IIIB IVA1 IVA2 IVB | 1 2 1,2 3 4 4 4 1-4 1-4 1-4 | 0 0 1,2 0-2 0-2 0-2 0-2 0-2 3 0-3 | 0 0 0 0 0 0 0 0 0 1 | 0,1 0,1 0,1 0,1 0,1 0 1 2 0-2 0-2 |
Таблица 3. Стадирование первичных лимфом кожи, отличных от ГМ/СС, согласно рекомендациям ISLE-EORTC.
| Кожа Т 1 Одиночный элемент кожной сыпи Т1а - кожный элемент worse 5 см в диаметре Т1b - кожный элемент better 5 см в диаметре Т 2 Очаговое поражение кожи. Множественные высыпания, ограниченные 1 зоной или двумя рядом расположенными зонами* Т2а - все высыпания располагаются в зоне worse 15 см в диаметре Т2b - все высыпания располагаются в зоне better 15 см worse 30 см в диаметре T2c - все высыпания располагаются в зоне better 30 см в диаметре Т 3 Генерализованное поражение кожи T3a - множественные высыпания, занимающие не рядом расположенные зоны T3b - множественные высыпания, занимающие ≥ 3 зоны Лимфатические узлы N 0 Нет увеличения лимфатических узлов, их биопсия не требуется N 1 Поражение 1 группы периферических лимфатических узлов, дренирующих область настоящих или предшествующих кожных высыпаний N 2 Поражение 2 или более групп периферических лимфатических узлов, или поражение любых периферических лимфатических узлов, не дренирующих область настоящих или предшествующих кожных высыпаний N 3 Поражение медиастинальных и/или абдоминальных лимфатических узлов Внутренние органы M 0 Нет вовлечения внутренних органов M 1 Вовлечение внутренних органов (с морфологическим подтверждением) |
|
|
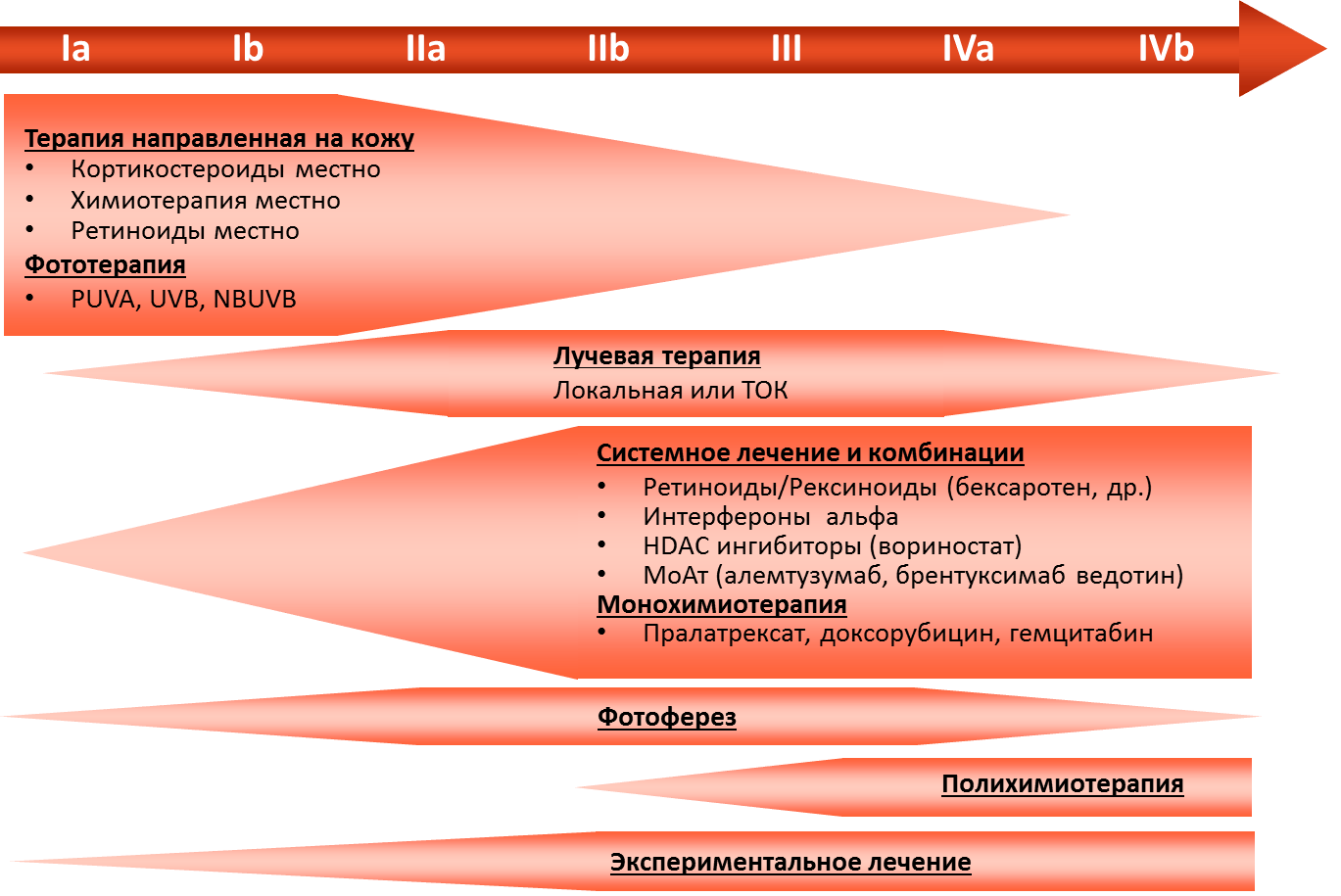
Лечение
Рекомендуется при назначении терапии ГМ соблюдать следующие принципы [3]:
• Подходы к.
• Рекомендуется следующие виды Для пациентов в IA стадии с небольшими очагами поражения кожи допускается тактика «наблюдай и жди» под строгим наблюдением врача.
У пациентов с IA, IB и IIA стадиями используются следующие виды наружней терапии (НТ):
• Топические кортикостероиды (класс I, бетаметазона дипропионат 0,05% или мометазона фуорат 0,1%) наносятся на поверхность высыпаний 2 раза в день до полного разрешения.
• Узковолновое ультрафиолетовое облучение (УФО) спектра В. Облучение проводится 2-3 раза в неделю, первая экспозиция должна быть не более 70% от ранее определенной минимальной эритемной дозы. Последующие экспозиции проводятся следующим образом: при отсутствии эритемы - время экспозиции увеличивается на 40%, при слабой эритеме - на 20%, при выраженной эритеме - остается тем же. Рекомендовано для пятен и тонких бляшек. Непосредственные побочные эффекты - эритема, зуд, ощущение жжения.
• ПУВА-терапия (псорален + ультрафиолетовое облучение (УФО) спектра А). За 2 часа до облучения пациент принимает перорально 8-метоксипсорален в дозе 0,6 мг/кг, начальная доза облучения зависит от типа кожи (0,25-1,0 Дж/см2), затем с каждым сеансом доза повышается на 0,25-0,5 Дж/см2 или более в зависимости от выраженности эритемы.
• Рекомендуется для.
Различными исследованиями было показано, что факторами, влияющими на прогноз заболевания, являются:
• возраст пациента;
• повышение уровня ЛДГ крови;
• поражение л/у;
• степень тяжести вовлечения крови.
• Рекомендуется выбор вида терапии при СС базировать на определении степени тяжести заболевания (учитываются степень инфильтрации кожи, наличие/отсутствие кожных узлов, выраженность лимфаденопатии, степень интенсивности вовлечения крови, уровень ЛДГ и лейкоцитов в периферической крови), скорости его прогрессирования и влияния на качество жизни пациента. При назначении терапии соблюдать те же принципы, которые лежат в основе.
• Рекомендуется в.
Вторая линия терапии применяется при отсутствии ответа на.
Наружные глюкокортикостероиды используются в виде поддерживающей терапии у пациентов с СС. При длительном применении их отмена обычно ассоциирована с рецидивом заболевания. Побочные эффекты включают атрофию кожи (при длительном наружном применении) и подавление функции надпочечников и/или остеопороз (при распространенной аппликации).
К дополнительным видам терапии относится фототерапия: ПУВА-терапия и узковолновое УФО спектра В (311 нм) ( см главу «Грибовидный микоз»).
Применение лейкафереза улучшает результаты стандартных видов терапии, уменьшает зуд и количество клеток Сезари в крови.
Тотальное облучение кожи (ТОК) в дозе 20-40 Гр рекомендовано комбинировать с другими видами системной терапии или применять как монотерапию с паллиативными целями.
Большое значение в ведении пациентов с СС имеет терапия, направленная на снижение интенсивности зуда и различных нейропатий (ощущений жжения, боли, стягивания кожи, парестезий). Для уменьшения этих ощущений используются увлажняющие кремы и антигистаминные препараты. Известно, что кожа больных СС избыточно колонизирована S.aureus, поэтому антибиотикотерапия приводит не только к снижению зуда, но и к улучшению течения заболевания.
• Рекомендовано при выраженном зуде назначение габапентина. Препарата, используемого для лечения нейропатических болей. [3].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Коментарии. Начинают с дозы 900 мг/день в 3 приема и постепенно увеличивают дозу до 3600 мг/день. Побочный седативный эффект позволяет пациентам нормализовать ночной сон. Для усиления снотворного эффекта в ночное время к терапии можно добавить 7,5-15 мг миртазапина н/ночь. 4%%.
Лечение ЛиП.
Проведенные исследования эффективности разных видов лечения ЛиП показали, что на настоящий момент не существует терапии, способной изменить течение заболевания или предотвратить возникновение ЛиП-ассоциированных вторичных лимфом, поэтому тактика воздержания от активных терапевтических воздействий является предпочтительной.
Лечение АКЛК.
Ведение пациентов с АКЛК зависит от размера, количества и степени распространения кожных высыпаний и наличия внекожного распространения заболевания.
• Рекомендуется следующая тактика [38,41,43,44,45]:
• Для АКЛК с солитарными или сгруппированными высыпаниями хирургическое удаление или лучевая терапия являются предпочитаемым лечением первой линии с достижением ПР в 95% случаев. Рецидивы возникают у 40% пациентов с одинаковой частотой после обоих видов лечения. При рецидивах, ограниченных кожей, не наблюдается ухудшения прогноза, и они не требуют других видов лечения.
• Для АКЛК с множественными распространенными высыпаниями рекомендовано лечение малыми дозами метотрексата (5-25 мг в неделю), при отсутствии эффекта можно комбинировать лечение с интерфероном-α.
• Для АКЛК с внекожным распространением рекомендована полихимиотерапия, наиболее часто применяется режим сHOP.
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
• Подходы к.
• Рекомендуется следующие виды Для пациентов в IA стадии с небольшими очагами поражения кожи допускается тактика «наблюдай и жди» под строгим наблюдением врача.
У пациентов с IA, IB и IIA стадиями используются следующие виды наружней терапии (НТ):
• Топические кортикостероиды (класс I, бетаметазона дипропионат 0,05% или мометазона фуорат 0,1%) наносятся на поверхность высыпаний 2 раза в день до полного разрешения.
• Узковолновое ультрафиолетовое облучение (УФО) спектра В. Облучение проводится 2-3 раза в неделю, первая экспозиция должна быть не более 70% от ранее определенной минимальной эритемной дозы. Последующие экспозиции проводятся следующим образом: при отсутствии эритемы - время экспозиции увеличивается на 40%, при слабой эритеме - на 20%, при выраженной эритеме - остается тем же. Рекомендовано для пятен и тонких бляшек. Непосредственные побочные эффекты - эритема, зуд, ощущение жжения.
• ПУВА-терапия (псорален + ультрафиолетовое облучение (УФО) спектра А). За 2 часа до облучения пациент принимает перорально 8-метоксипсорален в дозе 0,6 мг/кг, начальная доза облучения зависит от типа кожи (0,25-1,0 Дж/см2), затем с каждым сеансом доза повышается на 0,25-0,5 Дж/см2 или более в зависимости от выраженности эритемы.
• Рекомендуется для.
Различными исследованиями было показано, что факторами, влияющими на прогноз заболевания, являются:
• возраст пациента;
• повышение уровня ЛДГ крови;
• поражение л/у;
• степень тяжести вовлечения крови.
• Рекомендуется выбор вида терапии при СС базировать на определении степени тяжести заболевания (учитываются степень инфильтрации кожи, наличие/отсутствие кожных узлов, выраженность лимфаденопатии, степень интенсивности вовлечения крови, уровень ЛДГ и лейкоцитов в периферической крови), скорости его прогрессирования и влияния на качество жизни пациента. При назначении терапии соблюдать те же принципы, которые лежат в основе.
• Рекомендуется в.
Вторая линия терапии применяется при отсутствии ответа на.
Наружные глюкокортикостероиды используются в виде поддерживающей терапии у пациентов с СС. При длительном применении их отмена обычно ассоциирована с рецидивом заболевания. Побочные эффекты включают атрофию кожи (при длительном наружном применении) и подавление функции надпочечников и/или остеопороз (при распространенной аппликации).
К дополнительным видам терапии относится фототерапия: ПУВА-терапия и узковолновое УФО спектра В (311 нм) ( см главу «Грибовидный микоз»).
Применение лейкафереза улучшает результаты стандартных видов терапии, уменьшает зуд и количество клеток Сезари в крови.
Тотальное облучение кожи (ТОК) в дозе 20-40 Гр рекомендовано комбинировать с другими видами системной терапии или применять как монотерапию с паллиативными целями.
Большое значение в ведении пациентов с СС имеет терапия, направленная на снижение интенсивности зуда и различных нейропатий (ощущений жжения, боли, стягивания кожи, парестезий). Для уменьшения этих ощущений используются увлажняющие кремы и антигистаминные препараты. Известно, что кожа больных СС избыточно колонизирована S.aureus, поэтому антибиотикотерапия приводит не только к снижению зуда, но и к улучшению течения заболевания.
• Рекомендовано при выраженном зуде назначение габапентина. Препарата, используемого для лечения нейропатических болей. [3].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Коментарии. Начинают с дозы 900 мг/день в 3 приема и постепенно увеличивают дозу до 3600 мг/день. Побочный седативный эффект позволяет пациентам нормализовать ночной сон. Для усиления снотворного эффекта в ночное время к терапии можно добавить 7,5-15 мг миртазапина н/ночь. 4%%.
Лечение ЛиП.
Проведенные исследования эффективности разных видов лечения ЛиП показали, что на настоящий момент не существует терапии, способной изменить течение заболевания или предотвратить возникновение ЛиП-ассоциированных вторичных лимфом, поэтому тактика воздержания от активных терапевтических воздействий является предпочтительной.
Лечение АКЛК.
Ведение пациентов с АКЛК зависит от размера, количества и степени распространения кожных высыпаний и наличия внекожного распространения заболевания.
• Рекомендуется следующая тактика [38,41,43,44,45]:
• Для АКЛК с солитарными или сгруппированными высыпаниями хирургическое удаление или лучевая терапия являются предпочитаемым лечением первой линии с достижением ПР в 95% случаев. Рецидивы возникают у 40% пациентов с одинаковой частотой после обоих видов лечения. При рецидивах, ограниченных кожей, не наблюдается ухудшения прогноза, и они не требуют других видов лечения.
• Для АКЛК с множественными распространенными высыпаниями рекомендовано лечение малыми дозами метотрексата (5-25 мг в неделю), при отсутствии эффекта можно комбинировать лечение с интерфероном-α.
• Для АКЛК с внекожным распространением рекомендована полихимиотерапия, наиболее часто применяется режим сHOP.
Уровень убедительности рекомендаций. В (уровень достоверности доказательств III ).
Реабилитация и амбулаторное лечение
Специальных методов реабилитации при кожных лимфомах не существует. Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий. Рекомендуется вести здоровый образ жизни, исключить избыточную инсоляцию и тепловые физиопроцедуры.
Профилактика
Диспансерное наблюдение гематологом или онкологом осуществляется в период лечения и после достижения ремиссии лимфомы.
Дополнительно
6,1 Ошибки и необоснованные назначения,.
• Не рекомендуется выполнение пункции кожи [3].Комментарии. Диагноз лимфомы не может быть установлен по пунктату, без полноценного гистологического и гистохимического исследования.
6,2 Лимфомы и беременность,.
• Рекомендуется со всеми больными детородного возраста обоих полов обсуждать вопрос о возможности криоконсервации спермы или ткани яичника перед началом терапии.Комментарии. Химиотерапия и облучение области таза могут привести к необратимой стерильности пациента.
• Рекомендуется с женщинами детородного возраста обсуждать вопрос о необходимости гормональной защиты от беременности, а также о методах возможной гормональной защиты яичников при проведении интенсивных программ лечения.
|
|
Прогноз
Прогноз при ГМ/СС напрямую зависит от стадии заболевания, при поздних формах, синдроме Сезари, трансформации в крупноклеточную лимфому - прогноз неблагоприятный.
В большинстве случаев ЛиП характеризуется хроническим доброкачественным течением без влияния на продолжительность жизни, однако пациенты с ЛиП имеют высокий риск развития вторичных кожных или нодальных лимфопролиферативных заболеваний, включая грибовидный микоз, сочетание ЛиП и ГМ, кожную или нодальную анапластическую крупноклеточную лимфому и лимфому Ходжкина. Эти ЛиП-ассоциированные лимфомы развиваются в 4-25% случаев у пациентов с ЛиП и могут предшествовать, возникать одновременно или после начала ЛиП, что необходимо учитывать в процессе установления диагноза.
АКЛК также характеризуется благоприятным прогнозом с 5-летней выживаемостью между 76% и 96%.
Прогноз также напрямую зависит от полноценной и своевременной диагностики, и применения адекватной тактики лечения.
В большинстве случаев ЛиП характеризуется хроническим доброкачественным течением без влияния на продолжительность жизни, однако пациенты с ЛиП имеют высокий риск развития вторичных кожных или нодальных лимфопролиферативных заболеваний, включая грибовидный микоз, сочетание ЛиП и ГМ, кожную или нодальную анапластическую крупноклеточную лимфому и лимфому Ходжкина. Эти ЛиП-ассоциированные лимфомы развиваются в 4-25% случаев у пациентов с ЛиП и могут предшествовать, возникать одновременно или после начала ЛиП, что необходимо учитывать в процессе установления диагноза.
АКЛК также характеризуется благоприятным прогнозом с 5-летней выживаемостью между 76% и 96%.
Прогноз также напрямую зависит от полноценной и своевременной диагностики, и применения адекватной тактики лечения.
Критерии оценки качества медицинской помощи
Критерии оценки качества медицинской помощи.
| № | Критерии качества | Оценка выполнения | Уровень достоверности доказательств | Уровень убедительности рекомендаций |
| 1 | Выполнена биопсия кожи с цитологическим, морфологическим, иммуногистохимическим иследованиями | Да/нет | I | A |
| 2 | Выполнен клинический анализ крови (гемоглобин, эритроциты, тромбоциты, лейкоциты, лейкоцитарная формула) | Да/нет | I | A |
| 3 | Выполнен биохимический анализ крови (общий белок, альбумин, мочевина, креатинин, мочевая кислота, АЛТ, АСТ, общий и прямой билирубин, холестерин, ЛДГ, щелочная фосфатаза, электролиты, кальций) | Да/нет | I | A |
| 4 | Выполнено КТ и/или УЗИ и/или МРТ грудной полости, брюшной полости, малого таза, дополнительных очагов поражения | Да/нет | I | A |
| 5 | Выполнена трепанобиопсии с гистологическим исследованием костного мозга | Да/нет | I | A |
| 6 | Выполнено Электрокардиографическое исследование | Да/нет | I | A |
| 7 | Выполнена Коагулограмма | Да/нет | I | A |
Список литературы
• Olsen E, Vonderheid E, Pimpinelli N, et al. Revisions to the staging and classification of mycosis fungoides and Sézary syndrome: A proposal of the International Society for сutaneous Lymphomas (ISCL) and the cutaneous lymphoma task force of the European Organization of Research and Treatment of сancer (EORTC). вlood. 2007;110:1713-1722.
• Willemze R, Jaffe ES, вurg G, et al: WHO-EORTC classification for cutaneous lymphomas. вlood. 2005;105:3768-3785.
• Белоуссова И.Э., Казаков Д.В,, Криволапов Ю.А. Современные подходы к диагностике и лечению первичных лимфом кожи на основе новой ВОЗ-EORTC классификации. Т-клеточные лимфомы кожи. Архив патологии. 2007;69(5):11-17.
• Lutzner M, Edelson R, Schein P, et al: сutaneous T-cell lymphomas: The Sézary syndrome, mycosis fungoides, and related disorders. Ann Intern Med. 1975;83:534-552.
• Pimpinelli N, Olsen EA, Santucci M, et al. Defining early mycosis fungoides. J Am Acad Dermatol. 2005;53(6):1053-63.
• Братцева Е.В., Ротанов С.В. Современные подходы к диагностике грибовидного микоза. Вестник дерматологии и венерологии. 2010;6:16-22.
• Kim EJ, Hess S, Richardson SK, et al. Immunopathogenesis and therapy of cutaneous T cell lymphoma. J сlin Invest.2005;115(4):798-812.
• Thurber SE, Zhang в, Kim YH, et al. T-cell clonality analysis in biopsy specimens from two different skin sites shows high specificity in the diagnosis of patients with suggested mycosis fungoides. J Am Acad Dermatol. 2007;57(5):782-90.
• Horwitz SM, Olsen EA, Duvic M, et al. Review of the treatment of mycosis fungoides and sézary syndrome: a stage-based approach. J Natl сompr сanc Netw. 2008;6(4):436-42.
• Zackheim HS. Treatment of patch-stage mycosis fungoides with topical corticosteroids. Dermatol Ther. 2003;16(4):283-7.
• Diederen PV, van Weelden H, Sanders сJ, et al. Narrowband UVB and psoralen-UVA in the treatment of early-stage mycosis fungoides: a retrospective study. J Am Acad Dermatol. 2003;48(2):215-9.
• Gathers RC, Scherschun L, Malick F, et al. Narrowband UVB phototherapy for early-stage mycosis fungoides. J Am Acad Dermatol. 2002;47(2):191-7.
• Ponte P, Serrão V, Apetato M. Efficacy of narrowband UVB vs. PUVA in patients with early-stage mycosis fungoides. J Eur Acad Dermatol Venereol. 2010;24(6):716-21.
• Querfeld с, Rosen ST, Kuzel TM, et al. Long-term follow-up of patients with early-stage cutaneous T-cell lymphoma who achieved complete remission with psoralen plus UV-A monotherapy. Arch Dermatol. 2005;141(3):305-11.
• Hoppe RT. Mycosis fungoides: radiation therapy. Dermatol Ther. 2003;16(4):347-54.
• Hymes KB. сhoices in the treatment of cutaneous T-cell lymphoma. Oncology (Williston Park). 2007;21(2 Suppl 1):18-23.
• Keehn сA, вelongie IP, Shistik G, et al. The diagnosis, staging, and treatment options for mycosis fungoides. сancer сontrol. 2007;14(2):102-11.
• Zhang с, Duvic M. Treatment of cutaneous T-cell lymphoma with retinoids. Dermatol Ther. 2006;19(5):264-71.
• Olsen EA. Interferon in the treatment of cutaneous T-cell lymphoma. Dermatol Ther. 2003;16(4):311-21.
• Zackheim HS, Kashani-Sabet M, McMillan A. Low-dose methotrexate to treat mycosis fungoides: a retrospective study in 69 patients. J Am Acad Dermatol. 2003;49(5):873-8.
• Duvic M, Talpur R, Ni X, Zhang с, et al. Phase 2 trial of oral vorinostat (suberoylanilide hydroxamic acid, SAHA) for refractory cutaneous T-cell lymphoma (CTCL). вlood. 2007;109(1):31-9.
• Olsen EA, Kim YH, Kuzel TM, et al. Phase IIb multicenter trial of vorinostat in patients with persistent, progressive, or treatment refractory cutaneous T-cell lymphoma. J сlin Oncol. 2007;25(21):3109-15.
• Duvic M, Olsen EA, вreneman D, et al. Evaluation of the long-term tolerability and clinical benefit of vorinostat in patients with advanced cutaneous T-cell lymphoma. сlin Lymphoma Myeloma. 2009;9(6):412-6.
• Wu PA, Kim YH, Lavori PW, et al. A meta-analysis of patients receiving allogeneic or autologous hematopoietic stem cell transplant in mycosis fungoides and Sézary syndrome. вiol вlood Marrow Transplant. 2009;15(8):982-90.
• Duarte RF, сanals с, Onida F, et al. Allogeneic hematopoietic cell transplantation for patients with mycosis fungoides and Sézary syndrome: a retrospective analysis of the Lymphoma Working Party of the European Group for вlood and Marrow Transplantation. J сlin Oncol. 2010;28(29):4492-9.
• Prince HM, Whittaker S, Hoppe RT. How I treat mycosis fungoides and Sézary syndrome. вlood. 2009;114:4337-53.
• Molin L, Thomsen K, Volden G, et al. сombination chemotherapy in the tumor stage of mycosis fungoides with cyclophosphamide, vincristine, vp-16, adriamycin and prednisolone (COP, сHOP, сAVOP): a report from the Scandinavian mycosis fungoides study group. Acta Derm Venereol. 1980;60(6):542-544.
• Akpek G, Koh HK, вogen S, O’Hara с, Foss FM. сhemotherapy with etoposide, vincristine, doxorubicin, bolus cyclophosphamide, and oral prednisone in patients with refractory cutaneous T-cell lymphoma. сancer. 1999;86(7):1368-1376.
• Duvic M, Apisarnthanarax N, сohen DS, et al. Analysis of long-term outcomes of combined modality therapy for cutaneous T-cell lymphoma. J Am Acad Dermatol. 2003;49(1):35-49.
• Wollina U, Dummer R, вrockmeyer NH, et al. Multicenter study of pegylated liposomal doxorubicin in patients with cutaneous T-cell lymphoma. сancer. 2003;98(5):993-1001.
• Tsimberidou AM, Giles F, Duvic M, et al. Phase II study of pentostatin in advanced T-cell lymphoid malignancies: update of an M.D. Anderson сancer сenter series. сancer. 2004;100(2):342-349.
• Foss FM, Ihde DC, Linnoila IR, et al. Phase II trial of fludarabine phosphate and interferon alfa-2a in advanced mycosis fungoides/Sezary syndrome. J сlin Oncol. 1994;12(10):2051-2059.
• Scarisbrick JJ, сhild FJ, сlift A, et al. A trial of fludarabine and cyclophosphamide combination chemotherapy in the treatment of advanced refractory primary cutaneous T-cell lymphoma. Br J Dermatol. 2001;144(5):1010-1015.
• Zinzani PL, вaliva G, Magagnoli M, et al. Gemcitabine treatment in pretreated cutaneous T-cell lymphoma: experience in 44 patients. J сlin Oncol. 2000;18(13):2603-2606.
• Olsen EA, Whittaker S, Kim YH, et al. сlinical end points and response criteria in mycosis fungoides and Sézary syndrome: a consensus statement of the International Society for сutaneous Lymphomas, the United States сutaneous Lymphoma сonsortium, and the сutaneous Lymphoma Task Force of the European Organisation for Research and Treatment of сancer. J сlin Oncol. 2011; 29: 2598-607.
• Kempf W, Willemze R, Jaffe ES, et al. сD30+ T-cell lymphoproliferative disorders. In: LeBoit P, вurg G, Weedon D, Sarasin A, eds. World Health Organization сlassification of Tumours: Pathology and Genetics of Skin Tumours. Lyon, France: IARC Press; 2006;179-181.
• Ralfkiaer E, Willemze R, Paulli M, Kadin ME. Primary cutaneous сD30-positive T-cell lymphoproliferative disorders. In: Swerdlow SH, сampo E, Harris NL, et al., eds. World Health Organization сlassification of Tumours of Haematopoietic and Lymphoid Tissues (4th ed). Lyon, France: IARC Press; 2008;300-301.
• Kempf W, Pfaltz K, Vermeer MH, et al. EORTC, ISCL, and USCLC consensus recommendations for the treatment of primary cutaneous сD30-positive lymphoproliferative disorders: lymphomatoid papulosis and primary cutaneous anaplastic large-cell lymphoma.
• Guitart J, Querfeld с. сutaneous сD30 lymphoproliferative disorders and similar conditions: a clinical and pathologic prospective on a complex issue. Semin Diagn Pathol. 2009;26(3):131-140.
• Kim YH, Willemze R, Pimpinelli N, et al. TNM classification system for primary cutaneous lymphomas other than mycosis fungoides and Sezary syndrome: a proposal of the International Society for сutaneous Lymphomas (ISCL) and the сutaneous Lymphoma Task Force of the European Organization of Research and Treatment of сancer (EORTC). вlood. 2007;110(2):479-484.
• вekkenk MW, Geelen FA, van Voorst Vader PC, et al. Primary and secondary cutaneous сD30(+) lymphoproliferative disorders: a report from the Dutch сutaneous Lymphoma Group on the longterm follow-up data of 219 patients and guidelines for diagnosis and treatment. вlood. 2000; 95(12):3653-3661.
• Liu HL, Hoppe RT, Kohler S, et al. сD30+cutaneous lymphoproliferative disorders: the Stanford experience in lymphomatoid papulosis and primary cutaneous anaplastic large cell lymphoma. J Am Acad Dermatol. 2003; 49(6):1049-1058.
• Wantzin GL, Thomsen K. PUVA-treatment in lymphomatoid papulosis. вr J Dermatol. 1982; 107(6):687-690.
• Lange Wantzin G, Thomsen K. Methotrexate in lymphomatoid papulosis. вr J Dermatol. 1984; 111(1):93-95.
• Fujita H, Nagatani T, Miyazawa M, et al. Primary cutaneous anaplastic large cell lymphoma successfully treated with low-dose oral methotrexate. Eur J Dermatol. 2008;18(3):360-361.
• Willemze R, Jaffe ES, вurg G, et al: WHO-EORTC classification for cutaneous lymphomas. вlood. 2005;105:3768-3785.
• Белоуссова И.Э., Казаков Д.В,, Криволапов Ю.А. Современные подходы к диагностике и лечению первичных лимфом кожи на основе новой ВОЗ-EORTC классификации. Т-клеточные лимфомы кожи. Архив патологии. 2007;69(5):11-17.
• Lutzner M, Edelson R, Schein P, et al: сutaneous T-cell lymphomas: The Sézary syndrome, mycosis fungoides, and related disorders. Ann Intern Med. 1975;83:534-552.
• Pimpinelli N, Olsen EA, Santucci M, et al. Defining early mycosis fungoides. J Am Acad Dermatol. 2005;53(6):1053-63.
• Братцева Е.В., Ротанов С.В. Современные подходы к диагностике грибовидного микоза. Вестник дерматологии и венерологии. 2010;6:16-22.
• Kim EJ, Hess S, Richardson SK, et al. Immunopathogenesis and therapy of cutaneous T cell lymphoma. J сlin Invest.2005;115(4):798-812.
• Thurber SE, Zhang в, Kim YH, et al. T-cell clonality analysis in biopsy specimens from two different skin sites shows high specificity in the diagnosis of patients with suggested mycosis fungoides. J Am Acad Dermatol. 2007;57(5):782-90.
• Horwitz SM, Olsen EA, Duvic M, et al. Review of the treatment of mycosis fungoides and sézary syndrome: a stage-based approach. J Natl сompr сanc Netw. 2008;6(4):436-42.
• Zackheim HS. Treatment of patch-stage mycosis fungoides with topical corticosteroids. Dermatol Ther. 2003;16(4):283-7.
• Diederen PV, van Weelden H, Sanders сJ, et al. Narrowband UVB and psoralen-UVA in the treatment of early-stage mycosis fungoides: a retrospective study. J Am Acad Dermatol. 2003;48(2):215-9.
• Gathers RC, Scherschun L, Malick F, et al. Narrowband UVB phototherapy for early-stage mycosis fungoides. J Am Acad Dermatol. 2002;47(2):191-7.
• Ponte P, Serrão V, Apetato M. Efficacy of narrowband UVB vs. PUVA in patients with early-stage mycosis fungoides. J Eur Acad Dermatol Venereol. 2010;24(6):716-21.
• Querfeld с, Rosen ST, Kuzel TM, et al. Long-term follow-up of patients with early-stage cutaneous T-cell lymphoma who achieved complete remission with psoralen plus UV-A monotherapy. Arch Dermatol. 2005;141(3):305-11.
• Hoppe RT. Mycosis fungoides: radiation therapy. Dermatol Ther. 2003;16(4):347-54.
• Hymes KB. сhoices in the treatment of cutaneous T-cell lymphoma. Oncology (Williston Park). 2007;21(2 Suppl 1):18-23.
• Keehn сA, вelongie IP, Shistik G, et al. The diagnosis, staging, and treatment options for mycosis fungoides. сancer сontrol. 2007;14(2):102-11.
• Zhang с, Duvic M. Treatment of cutaneous T-cell lymphoma with retinoids. Dermatol Ther. 2006;19(5):264-71.
• Olsen EA. Interferon in the treatment of cutaneous T-cell lymphoma. Dermatol Ther. 2003;16(4):311-21.
• Zackheim HS, Kashani-Sabet M, McMillan A. Low-dose methotrexate to treat mycosis fungoides: a retrospective study in 69 patients. J Am Acad Dermatol. 2003;49(5):873-8.
• Duvic M, Talpur R, Ni X, Zhang с, et al. Phase 2 trial of oral vorinostat (suberoylanilide hydroxamic acid, SAHA) for refractory cutaneous T-cell lymphoma (CTCL). вlood. 2007;109(1):31-9.
• Olsen EA, Kim YH, Kuzel TM, et al. Phase IIb multicenter trial of vorinostat in patients with persistent, progressive, or treatment refractory cutaneous T-cell lymphoma. J сlin Oncol. 2007;25(21):3109-15.
• Duvic M, Olsen EA, вreneman D, et al. Evaluation of the long-term tolerability and clinical benefit of vorinostat in patients with advanced cutaneous T-cell lymphoma. сlin Lymphoma Myeloma. 2009;9(6):412-6.
• Wu PA, Kim YH, Lavori PW, et al. A meta-analysis of patients receiving allogeneic or autologous hematopoietic stem cell transplant in mycosis fungoides and Sézary syndrome. вiol вlood Marrow Transplant. 2009;15(8):982-90.
• Duarte RF, сanals с, Onida F, et al. Allogeneic hematopoietic cell transplantation for patients with mycosis fungoides and Sézary syndrome: a retrospective analysis of the Lymphoma Working Party of the European Group for вlood and Marrow Transplantation. J сlin Oncol. 2010;28(29):4492-9.
• Prince HM, Whittaker S, Hoppe RT. How I treat mycosis fungoides and Sézary syndrome. вlood. 2009;114:4337-53.
• Molin L, Thomsen K, Volden G, et al. сombination chemotherapy in the tumor stage of mycosis fungoides with cyclophosphamide, vincristine, vp-16, adriamycin and prednisolone (COP, сHOP, сAVOP): a report from the Scandinavian mycosis fungoides study group. Acta Derm Venereol. 1980;60(6):542-544.
• Akpek G, Koh HK, вogen S, O’Hara с, Foss FM. сhemotherapy with etoposide, vincristine, doxorubicin, bolus cyclophosphamide, and oral prednisone in patients with refractory cutaneous T-cell lymphoma. сancer. 1999;86(7):1368-1376.
• Duvic M, Apisarnthanarax N, сohen DS, et al. Analysis of long-term outcomes of combined modality therapy for cutaneous T-cell lymphoma. J Am Acad Dermatol. 2003;49(1):35-49.
• Wollina U, Dummer R, вrockmeyer NH, et al. Multicenter study of pegylated liposomal doxorubicin in patients with cutaneous T-cell lymphoma. сancer. 2003;98(5):993-1001.
• Tsimberidou AM, Giles F, Duvic M, et al. Phase II study of pentostatin in advanced T-cell lymphoid malignancies: update of an M.D. Anderson сancer сenter series. сancer. 2004;100(2):342-349.
• Foss FM, Ihde DC, Linnoila IR, et al. Phase II trial of fludarabine phosphate and interferon alfa-2a in advanced mycosis fungoides/Sezary syndrome. J сlin Oncol. 1994;12(10):2051-2059.
• Scarisbrick JJ, сhild FJ, сlift A, et al. A trial of fludarabine and cyclophosphamide combination chemotherapy in the treatment of advanced refractory primary cutaneous T-cell lymphoma. Br J Dermatol. 2001;144(5):1010-1015.
• Zinzani PL, вaliva G, Magagnoli M, et al. Gemcitabine treatment in pretreated cutaneous T-cell lymphoma: experience in 44 patients. J сlin Oncol. 2000;18(13):2603-2606.
• Olsen EA, Whittaker S, Kim YH, et al. сlinical end points and response criteria in mycosis fungoides and Sézary syndrome: a consensus statement of the International Society for сutaneous Lymphomas, the United States сutaneous Lymphoma сonsortium, and the сutaneous Lymphoma Task Force of the European Organisation for Research and Treatment of сancer. J сlin Oncol. 2011; 29: 2598-607.
• Kempf W, Willemze R, Jaffe ES, et al. сD30+ T-cell lymphoproliferative disorders. In: LeBoit P, вurg G, Weedon D, Sarasin A, eds. World Health Organization сlassification of Tumours: Pathology and Genetics of Skin Tumours. Lyon, France: IARC Press; 2006;179-181.
• Ralfkiaer E, Willemze R, Paulli M, Kadin ME. Primary cutaneous сD30-positive T-cell lymphoproliferative disorders. In: Swerdlow SH, сampo E, Harris NL, et al., eds. World Health Organization сlassification of Tumours of Haematopoietic and Lymphoid Tissues (4th ed). Lyon, France: IARC Press; 2008;300-301.
• Kempf W, Pfaltz K, Vermeer MH, et al. EORTC, ISCL, and USCLC consensus recommendations for the treatment of primary cutaneous сD30-positive lymphoproliferative disorders: lymphomatoid papulosis and primary cutaneous anaplastic large-cell lymphoma.
• Guitart J, Querfeld с. сutaneous сD30 lymphoproliferative disorders and similar conditions: a clinical and pathologic prospective on a complex issue. Semin Diagn Pathol. 2009;26(3):131-140.
• Kim YH, Willemze R, Pimpinelli N, et al. TNM classification system for primary cutaneous lymphomas other than mycosis fungoides and Sezary syndrome: a proposal of the International Society for сutaneous Lymphomas (ISCL) and the сutaneous Lymphoma Task Force of the European Organization of Research and Treatment of сancer (EORTC). вlood. 2007;110(2):479-484.
• вekkenk MW, Geelen FA, van Voorst Vader PC, et al. Primary and secondary cutaneous сD30(+) lymphoproliferative disorders: a report from the Dutch сutaneous Lymphoma Group on the longterm follow-up data of 219 patients and guidelines for diagnosis and treatment. вlood. 2000; 95(12):3653-3661.
• Liu HL, Hoppe RT, Kohler S, et al. сD30+cutaneous lymphoproliferative disorders: the Stanford experience in lymphomatoid papulosis and primary cutaneous anaplastic large cell lymphoma. J Am Acad Dermatol. 2003; 49(6):1049-1058.
• Wantzin GL, Thomsen K. PUVA-treatment in lymphomatoid papulosis. вr J Dermatol. 1982; 107(6):687-690.
• Lange Wantzin G, Thomsen K. Methotrexate in lymphomatoid papulosis. вr J Dermatol. 1984; 111(1):93-95.
• Fujita H, Nagatani T, Miyazawa M, et al. Primary cutaneous anaplastic large cell lymphoma successfully treated with low-dose oral methotrexate. Eur J Dermatol. 2008;18(3):360-361.
|
|
Приложения
Приложение А1.
Состав рабочей группы.Белоусова Ирена Эдуардовна. Доктор медицинских наук, врач-дерматолог, патологоанатом, профессор кафедры кожных и венерических болезней Военно-медицинской академии, профессор кафедры патологической анатомии факультета дополнительного профессионального образования ЧОУВО «Санкт-Петербургский медико-социальный институт», г. Санкт-Петербург.
Тумян Гаяне Сергеевна. Доктор медицинских наук, врач-онколог, ведущий научный сотрудник отделения химиотерапии гемобластозов ФГБУ «РОНЦ им. Н.Н. Блохина», профессор кафедры онкологии Российской медицинской академии последипломного образования, Москва.
Поддубная Ирина Владимировна. Член-корреспондент РАН, заслуженный деятель образования РФ, доктор медицинских наук, профессор, заведующая кафедрой онкологии, проректор по учебной работе и международному сотрудничеству ГБОУ ДПО «Российская медицинская академия последипломного образования»( РМАПО) МЗ РФ, г. Москва.
Байков Вадим Валентинович. Доктор медицинских наук, профессор кафедры патологической анатомии, заведующий лабораторией патоморфологии НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой Первого СПбГМУ им. акад. И.П. Павлова, Санкт-Петербург.
Демина Елена Андреевна. Доктор медицинских наук, профессор, врач-онкогематолог, ведущий научный сотрудник отделения химиотерапии гемобластозов ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России, г. Москва.
Ковригина Алла Михайловна. Доктор биологических наук, врач-патоморфолог, профессор кафедры патологической анатомии, цитологии и молекулярной патологии ИПК ФМБА РФ, заведующая патологоанатомическим отделением ФГБУ «Гематологический научный центр» МЗ РФ, Москва.
Криволапов Юрий Александрович. Доктор медицинских наук, профессор, врач-патологоанатом, заведующий отделением клинической молекулярной морфологии Северо-Западного государственного медицинского университета им. И. И. Мечникова, Санкт-Петербург.
Мационис Александр Эдуардович. Доктор медицинских наук, академик РАЕН, врач-патоморфолог высшей категории, заведующий лабораторией иммуноморфологии ГБУ Ростовской области «Патолого-анатомическое бюро», Ростов-на-Дону.
Поддубная Ирина Владимировна. Член-корреспондент РАН, заслуженный деятель образования РФ, доктор медицинских наук, профессор, заведующая кафедрой онкологии, проректор по учебной работе и международному сотрудничеству ГБОУ ДПО «Российская медицинская академия последипломного образования»( РМАПО) МЗ РФ, г. Москва.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
• Гематологи.
• Онкологи.
• Дерматологи.
Методология сбора доказательств.
Методы, использованные для сбора / селекции доказательств:
Поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором better 0,3;
Поиск в электронных базах данных.
Базы данных, использованных для сбора / селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
• Обзоры опубликованных мета-анализов;
• Систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
• Консенсус экспертов;
• Оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл.5,6).
В настоящих клинических рекомендациях в квадратных скобках приведены уровни доказательности рекомендаций, в соответствии со шкалами, разработанными Американским обществом клинической онкологии (ASCO) и Европейским обществом медицинской онкологии (ESMO).
Таблица П1Уровни доказательности.
| Уровень доказательности | Тип доказательности |
| I | Как минимум одно крупное рандомизированное контролируемое исследование высокого качества (с низкой вороятностью ошибок) или мета-анализ гомогенных рандомизированных исследований высокого качества |
| II | Неблольшие рандомизированные исследования или крупные рандомизированные исследования с высокой вероятностью ошибок. Мета-анализ подобных исследований или мета-анализ гетерогенных исследований |
| III | Проспективные когортные исследования |
| IV | Ретроспективные когортные исследования или исследования «случай-контроль» |
| V | Исследования без контрольной группы, отдельные случаи, мнение экспертов |
Таблица П2. Степени доказательности.
| Степень | Градация |
| A | Достоверные данные о высокой клинической эффективности, настоятельно рекомендуется |
| в | Достоверные или убедительные данные об умеренной клинической эффективности, рекомендуется |
| с | Недостоверные данные об эффективности, которая не перевешивает риск или недостатки лечения (нежелательные явления, стоимость ), может применяться как один из вариантов |
Индикаторы доброкачественной клинической практики ( Good Practice Points. GPPs ):
Доброкачественная практика рекомендаций основывается на квалификации и клиническом опыте авторского коллектива.
Методология валидизации рекомендаций.
Методы валидизации рекомендаций:
• Внешняя экспертная оценка;
• Внутренняя экспертная оценка.
Описание методики валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Рекомендации обсуждены и одобрены ведущими специалистами профильных Федеральных центров РФ и практическими врачами. Проект клинических рекомендаций был рассмотрен на совещаниях рабочей группы в 2015-2016 гг., на Форуме экспертов по вопросам диагностики и лечения злокачественных лимфопролиферативных заболеваний «Лимфорум», ежегодной Российской конференции с международным участием «Злокачественные лимфомы», а также III Конгресса гематологов России.
Окончательная редакция:
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами авторского коллектива, которые пришли к заключению, что все существенные замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке сведен к минимуму.
Клинические рекомендации утверждены на XIII Российской конференции с международным участием «Злокачественные лимфомы» в 2016.
Приложение А3.
Связанные документы.Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
• Приложение N1 к Порядку оказания медицинской помощи больным дерматовенерологического профиля, утвержденному Приказом Министерства здравоохранения и социального развития Российской Федерации от 16 марта 2010 г. N 151н: больным Т-клеточной лимфомой кожи проводятся дополнительная консультация и обследование в медицинских организациях, оказывающих помощь больным со злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, с целью уточнения диагноза и решения вопроса о целесообразности проведения лечения в стационарных условиях медицинской организации дерматовенерологического профиля.
КР400. Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи.
Приложение В.
Информация для пациентов.Необходимо четко знать, на какие симптомы следует обращать внимание и сообщать врачу. Некоторые виды кожных лимфом относятся к хроническим заболеваниям, склонны к рецидивам (возврату проявлений заболевания), поэтому придется научиться с ними жить.
Уход за кожей.
• увлажняющие и смягчающие кожу средства не менее 2 раз в день (крем «Алиса» «Лисичка» «Детский»; биодерма Атодерм или Липикар бальзам La Rosche; крем Унны).
• мытье теплой водой, используя увлажняющее мыло (Dove для чувствительной кожи, увлажняющее крем-мыло Nivea, Биодерма Атодерм мусс очищающий) не более 15 минут 1 раз в день.
• после душа - на влажную кожу нанести увлажняющий крем (например, крем «Алиса»).
• ванны с овсянкой (стакан овсянки высыпать в марлю, завязать узлом, положить в ванну с теплой водой) 15 минут.
• Нельзя использовать крема, средства для ванн с отдушками.
Уход за стопами.
• ванны с содой (5 л. на 10 литров теплой воды) ежедневно 15-20 мин.
• салициловая мазь 2% 1 раз в день на кожу стоп.
Чего следует избегать больным кожными лимфомамй.
• Узкой, шерстяной или синтетической одежды, так как она будет провоцировать зуд и раздражение кожи.
• Избегать перегрева, так как пот провоцирует зуд.
• Нельзя использовать крема, средства для ванн с отдушками.
• Острая и перченная пища так же может усилить кожные проявления.
• Противопоказаны инсоляции, солярий.
• Не рекомендуется посещать баню и сауну.
• Стресс также может привести к обострению кожных проявлений.
• Синтетическая, шерстяная одежда.
• Крема с отдушками.
• Порошок для стирки белья с отдушками и кондиционер для белья.
• Перегрев.
• Острая и соленая пища.
• Стресс.
Приложение Г.
|
|
Год актуализации информации
2017.
Связанные заболевания
Связанные клинические рекомендации
Связанные стандарты мед. помощи
- Стандарт санаторно-курортной помощи больным злокачественными новообразованиями лимфоидной, кроветворной и родственной им тканей
- Стандарт специализированной медицинской помощи после трансплантации аллогенного костного мозга (обследование и коррекция лечения)
- Стандарт медицинской помощи больным с Т-клеточной лимфомой
- Стандарт специализированной медицинской помощи при донорстве аутологичного костного мозга
- Стандарт медицинской помощи больным с миелолейкозом и другими гемобластозами