Другие названия и синонимы
Entecavir.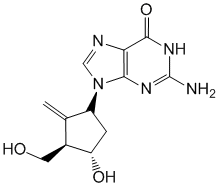
Фармакологическая группа
|
|
Латинское название
Entecavirum ( Entecaviri).
Химическое название
2-Амино-9-[(1S,3R,4S)-4-гидрокси-3-(гидроксиметил)-2-метилиденциклопентил]-6,9-дигидро-3H-пурин-6-он.
Используется в лечении
Код CAS
142217-69-4.
Фармакологическое действие
Ингибирующее обратную транскриптазу вируса гепатита в, противовирусное.
Характеристика вещества
Энтекавир - аналог нуклеозида гуанозина с селективной активностью против вируса гепатита В (ВГВ). Порошок от белого до почти белого цвета; слабо растворим в воде (2,4 мг/мл), pH насыщенного раствора в воде составляет 7,9 при (25±0,5) °C. Молекулярная масса 295,3.
Фармакодинамика
Механизм действия.
Энтекавир. Противовирусное ЛС против ВГВ ( см Микробиология).
Микробиология.
Механизм действия.
Энтекавир, аналог дезоксигуанозинового нуклеозида, обладающий активностью против обратной транскриптазы ВГВ (rt), эффективно фосфорилируется до формы активного трифосфата, имеющей внутриклеточный Т1/2 15 Конкурируя с естественным субстратом деоксигуанозинтрифосфатом, энтекавира трифосфат функционально ингибирует все три активности обратной транскриптазы ВГВ: (1) прайминг обратной транскриптазы ВГВ, (2) обратную транскрипцию негативной нити прегеномной матричной РНК и (3) синтез позитивной нити ДНК ВГВ. Энтекавира трифосфат является слабым ингибитором клеточных ДНК-полимераз α, β и δ и митохондриальной ДНК-полимеразы γ со значениями Ki от 18 до >160 мкМ.
Противовирусная активность.
Энтекавир ингибировал синтез ДНК ВГВ (снижение на 50%, EC50, полумаксимальная эффективная концентрация) в концентрации 0,004 мкМ в человеческих клетках HepG2, трансфицированных ВГВ дикого типа. Медиана значения ЕС50 для энтекавира против ламивудинрезистентного ВГВ (rtL180M, rtM204V) составляла 0,026 мкМ (диапазон 0,010-0,059 мкМ).
Совместное применение нуклеозидных/нуклеотидных ингибиторов обратной транскриптазы ВИЧ с энтекавиром вряд ли уменьшит противовирусную эффективность энтекавира против ВГВ или любого из этих ЛС против ВИЧ. В анализах комбинации ВГВ в культуре клеток абакавир, диданозин, ламивудин, ставудин, тенофовир или зидовудин не были антагонистами анти-ВГВ активности энтекавира в широком диапазоне концентраций. В антивирусных тестах на ВИЧ энтекавир не был антагонистом по отношению к активности этих шести НИОТ против ВИЧ в культуре клеток или эмтрицитабину в концентрациях, превышающих maxCmax энтекавира в 100 раз при дозе 1 мг.
Противовирусная активность против ВИЧ.
Всесторонний анализ ингибирующей активности энтекавира против линейки лабораторных и клинических изолятов ВИЧ типа 1 (ВИЧ-1) с использованием различных клеток и условий анализа показал значения ЕС50 в диапазоне от 0,026 до >10 мкМ; более низкие значения EC50 наблюдались, когда в анализе использовали пониженные уровни вируса. В культуре клеток энтекавир выбран для замещения M184I обратной транскриптазы ВИЧ в микромолярных концентрациях, что подтверждает ингибирующее действие при высоких концентрациях энтекавира. Варианты ВИЧ, содержащие замену M184V, показали снижение чувствительности к энтекавиру.
Резистентность.
В культуре клеток.
В анализах на культуре клеток для штаммов, резистентных к ламивудину, наблюдалось 8-30-кратное снижение фенотипической чувствительности к энтекавиру. Дальнейшее снижение (>70 раз) фенотипической чувствительности к энтекавиру требовало наличия аминокислотных замен rtM204I/V с или без rtL180M вместе с дополнительными заменами в остатках rtT184, rtS202 или rtM250, или комбинации этих замен с или без rtI169 замены в rt ВГВ. Резистентные к ламивудину штаммы, несущие rtL180M плюс rtM204V в сочетании с аминокислотной заменой rtA181C, приводили к снижению фенотипической чувствительности к энтекавиру в 16-122 раза.
Клинические исследования.
Пациенты, не принимавшие нуклеозидные ингибиторы.
Генотипические оценки были выполнены на поддающихся оценке образцах (>300 копий/мл ДНК ВГВ сыворотки) от 562 пациентов, принимавших энтекавир в течение периода до 96 нед в исследованиях без использования нуклеозидных ингибиторов (AI463022, AI463027 и пролонгированное исследование AI463901). К 96-й нед свидетельства появления аминокислотной замены rtS202G с заменами rtL180M и rtM204V были обнаружены в ВГВ 2 пациентов (2/562 <1%), и у 1 из них наблюдался вирусологический возврат (увеличение на ≥1 log10 выше самой низкой точки).
Кроме того, возникающие аминокислотные замены в rtM204I/V и rtL80I, rtV173L или rtL180M, которые приводили к снижению фенотипической чувствительности к энтекавиру в отсутствие изменений rtT184, rtS202 или rtM250, были обнаружены в ВГВ 3 пациентов (3/562 <1%), у которых наблюдался вирусологический возврат. Среди пациентов, которые продолжали лечение свыше 48 нед, 75% (202/269) имели ДНК ВГВ <300 копий/мл в конце дозирования (до 96 нед).
HBeAg-положительным (n=243) и HBeAg-отрицательным (n=39) пациентам, ранее не получавшим лечения, которые не смогли достичь определенного в исследовании полного ответа к 96 нед, было предложено продолжить лечение энтекавиром в пролонгированном исследовании. Полный ответ у HBeAg-положительных пациентов был <0,7 МЕq/мл (приблизительно 7-105 копий/мл) сывороточной ДНК ВГВ и убыль HBeAg, а для HBeAg-отрицательных - <0,7 МЕq/мл ДНК ВГВ и нормализация АЛТ. Пациенты получали энтекавир в дозе 1 мг 1 раз в день в течение дополнительных 144 нед. Из этих 282 пациентов 141 HBeAg-положительных и 8 HBeAg-отрицательных пациентов вошли в долгосрочное последующее пролонгированное исследование и были оценены на резистентность к энтекавиру. Из 149 пациентов, участвовавших в пролонгированном исследовании, у 88% (131/149), 92% (137/149) и 92% (137/149) был достигнут уровень сывороточной ДНК ВГВ <300 копий/мл к 144, 192 и 240-й нед (включая окончание дозирования) соответственно. Никаких новых замен, ассоциированных с резистентностью к энтекавиру, не было выявлено при сравнении генотипов оцениваемых изолятов с их соответствующими исходными изолятами. Кумулятивная вероятность развития замен rtT184, rtS202 или rtM250, ассоциированных с резистентностью к энтекавиру (в присутствии замен rtL180M и rtM204V), на 48, 96, 144, 192 и 240-й нед составила 0,2; 0,5; 1,2; 1,2; и 1,2% соответственно.
Ламивудинрезистентные пациенты.
Генотипические оценки проводились на поддающихся оценке образцах от 190 пациентов, получавших энтекавир в течение до 96 нед в исследованиях ламивудинрезистентного ВГВ (AI463026, AI463014, AI463015 и пролонгированное исследование AI463901). К 96-й нед ассоциированные с резистентностью аминокислотные замены в rtT184, rtS202 или rtM250, с изменениями rtI169 или без них, в присутствии аминокислотных замен rtM204I/V с или без rtL80V, rtV173L/M или rtL180M были обнаружены в ВГВ 22 пациентов (22/190=12%), из них у 16 был вирусологический возврат (увеличение ≥1 log10 выше самой низкой точки), у 4 никогда не было отмечено супрессии <300 копий/мл. ВГВ от 4 этих пациентов имели замены, связанные с резистентностью к энтекавиру, на исходном уровне, и были приобретены дальнейшие изменения при лечении энтекавиром. В дополнение к 22 пациентам, у 3 пациентов наблюдался вирусологический возврат с появлением rtM204I/V и rtL80V, rtV173L/M или rtL180M. Для изолятов от пациентов, у которых наблюдался вирусологический возврат с появлением замен, связанных с резистентностью (n=19), медиана значений EC50 энтекавира изменялась по сравнению с референсным значением в 19 раз на исходном уровне и в 106 раз во время вирусологического возврата. Из пациентов, которые продолжили лечение после 48 нед, 40% (31/77) имели ДНК ВГВ <300 копий/мл в конце дозирования (до 96 нед).
Ламивудинрезистентным пациентам (n=157), которые не смогли достичь определенного в исследовании полного ответа к 96-й нед, было предложено продолжить лечение энтекавиром. Пациенты получали энтекавир по 1 мг 1 раз в день в течение дополнительных 144 нед. Из этих пациентов 80 пациентов приняли участие в долгосрочном исследовании с последующим наблюдением и были оценены на резистентность к энтекавиру. К 144, 192 и 240-й нед (включая конец приема), 34% (27/80), 35% (28/80) и 36% (29/80) соответственно достигли уровня ДНК ВГВ <300 копий/мл. Кумулятивная вероятность развития замен, связанных с резистентностью к энтекавиру rtT184, rtS202 или rtM250 (в присутствии rtM204I/V с заменами rtL180M или без них) на 48, 96, 144, 192 и 240-й нед составила 6,2; 15; 36,3; 46,6 и 51,5% соответственно. В ВГВ 6 пациентов развились аминокислотные замены rtA181C/G/S/T при приеме энтекавира, и из них у 4 возникли замены, связанные с резистентностью к энтекавиру, в rtT184, rtS202 или rtM250, и у 1 была замена rtT184S на исходном уровне. Из 7 пациентов, у которых ВГВ имел замену rtA181 на исходном уровне, у 2 были также замены rtT184, rtS202 или rtM250 на исходном уровне, а еще у 2 они развились во время лечения энтекавиром.
В ходе комплексного анализа данных о резистентности к энтекавиру из 17 клинических испытаний фазы 2 и 3 возникшая замена rtA181C, ассоциированная с резистентностью к энтекавиру, была обнаружена у 5 из 1461 (0,3%) пациента во время лечения энтекавиром. Эта замена была обнаружена только в присутствии замен, ассоциированных с резистентностью к ламивудину, rtL180M плюс rtM204V.
Перекрестная резистентность.
Среди аналогов нуклеозидных ингибиторов ВГВ наблюдалась перекрестная резистентность. В анализах на клеточных культурах энтекавир имел в 8-30 раз меньшее ингибирование синтеза ДНК ВГВ для ВГВ, содержащего ламивудин- и телбивудинассоциированные с резистентностью замены rtM204I/V с или без rtL180M, чем для ВГВ дикого типа. Замены rtM204I/V с rtL80I/V, rtV173L или rtL180M или без них, которые ассоциированы с резистентностью к ламивудину и телбивудину, также вызывают снижение фенотипической чувствительности к энтекавиру. Эффективность энтекавира против ВГВ с заменами, ассоциированными с резистентностью к адефовиру, не была установлена в клинических испытаниях. Изоляты ВГВ от пациентов, резистентных к ламивудину, с неудачей при терапии энтекавиром, были чувствительны в культуре клеток к адефовиру, но оставались резистентными к ламивудину. Геномы рекомбинантных изолятов ВГВ, кодирующие замены, ассоциированные с резистентностью к адефовиру как rtA181V, так и rtN236T, имели 1,1- или 0,3-кратные сдвиги соответственно в чувствительности к энтекавиру в культуре клеток.
Энтекавир. Противовирусное ЛС против ВГВ ( см Микробиология).
Микробиология.
Механизм действия.
Энтекавир, аналог дезоксигуанозинового нуклеозида, обладающий активностью против обратной транскриптазы ВГВ (rt), эффективно фосфорилируется до формы активного трифосфата, имеющей внутриклеточный Т1/2 15 Конкурируя с естественным субстратом деоксигуанозинтрифосфатом, энтекавира трифосфат функционально ингибирует все три активности обратной транскриптазы ВГВ: (1) прайминг обратной транскриптазы ВГВ, (2) обратную транскрипцию негативной нити прегеномной матричной РНК и (3) синтез позитивной нити ДНК ВГВ. Энтекавира трифосфат является слабым ингибитором клеточных ДНК-полимераз α, β и δ и митохондриальной ДНК-полимеразы γ со значениями Ki от 18 до >160 мкМ.
Противовирусная активность.
Энтекавир ингибировал синтез ДНК ВГВ (снижение на 50%, EC50, полумаксимальная эффективная концентрация) в концентрации 0,004 мкМ в человеческих клетках HepG2, трансфицированных ВГВ дикого типа. Медиана значения ЕС50 для энтекавира против ламивудинрезистентного ВГВ (rtL180M, rtM204V) составляла 0,026 мкМ (диапазон 0,010-0,059 мкМ).
Совместное применение нуклеозидных/нуклеотидных ингибиторов обратной транскриптазы ВИЧ с энтекавиром вряд ли уменьшит противовирусную эффективность энтекавира против ВГВ или любого из этих ЛС против ВИЧ. В анализах комбинации ВГВ в культуре клеток абакавир, диданозин, ламивудин, ставудин, тенофовир или зидовудин не были антагонистами анти-ВГВ активности энтекавира в широком диапазоне концентраций. В антивирусных тестах на ВИЧ энтекавир не был антагонистом по отношению к активности этих шести НИОТ против ВИЧ в культуре клеток или эмтрицитабину в концентрациях, превышающих maxCmax энтекавира в 100 раз при дозе 1 мг.
Противовирусная активность против ВИЧ.
Всесторонний анализ ингибирующей активности энтекавира против линейки лабораторных и клинических изолятов ВИЧ типа 1 (ВИЧ-1) с использованием различных клеток и условий анализа показал значения ЕС50 в диапазоне от 0,026 до >10 мкМ; более низкие значения EC50 наблюдались, когда в анализе использовали пониженные уровни вируса. В культуре клеток энтекавир выбран для замещения M184I обратной транскриптазы ВИЧ в микромолярных концентрациях, что подтверждает ингибирующее действие при высоких концентрациях энтекавира. Варианты ВИЧ, содержащие замену M184V, показали снижение чувствительности к энтекавиру.
Резистентность.
В культуре клеток.
В анализах на культуре клеток для штаммов, резистентных к ламивудину, наблюдалось 8-30-кратное снижение фенотипической чувствительности к энтекавиру. Дальнейшее снижение (>70 раз) фенотипической чувствительности к энтекавиру требовало наличия аминокислотных замен rtM204I/V с или без rtL180M вместе с дополнительными заменами в остатках rtT184, rtS202 или rtM250, или комбинации этих замен с или без rtI169 замены в rt ВГВ. Резистентные к ламивудину штаммы, несущие rtL180M плюс rtM204V в сочетании с аминокислотной заменой rtA181C, приводили к снижению фенотипической чувствительности к энтекавиру в 16-122 раза.
Клинические исследования.
Пациенты, не принимавшие нуклеозидные ингибиторы.
Генотипические оценки были выполнены на поддающихся оценке образцах (>300 копий/мл ДНК ВГВ сыворотки) от 562 пациентов, принимавших энтекавир в течение периода до 96 нед в исследованиях без использования нуклеозидных ингибиторов (AI463022, AI463027 и пролонгированное исследование AI463901). К 96-й нед свидетельства появления аминокислотной замены rtS202G с заменами rtL180M и rtM204V были обнаружены в ВГВ 2 пациентов (2/562 <1%), и у 1 из них наблюдался вирусологический возврат (увеличение на ≥1 log10 выше самой низкой точки).
Кроме того, возникающие аминокислотные замены в rtM204I/V и rtL80I, rtV173L или rtL180M, которые приводили к снижению фенотипической чувствительности к энтекавиру в отсутствие изменений rtT184, rtS202 или rtM250, были обнаружены в ВГВ 3 пациентов (3/562 <1%), у которых наблюдался вирусологический возврат. Среди пациентов, которые продолжали лечение свыше 48 нед, 75% (202/269) имели ДНК ВГВ <300 копий/мл в конце дозирования (до 96 нед).
HBeAg-положительным (n=243) и HBeAg-отрицательным (n=39) пациентам, ранее не получавшим лечения, которые не смогли достичь определенного в исследовании полного ответа к 96 нед, было предложено продолжить лечение энтекавиром в пролонгированном исследовании. Полный ответ у HBeAg-положительных пациентов был <0,7 МЕq/мл (приблизительно 7-105 копий/мл) сывороточной ДНК ВГВ и убыль HBeAg, а для HBeAg-отрицательных - <0,7 МЕq/мл ДНК ВГВ и нормализация АЛТ. Пациенты получали энтекавир в дозе 1 мг 1 раз в день в течение дополнительных 144 нед. Из этих 282 пациентов 141 HBeAg-положительных и 8 HBeAg-отрицательных пациентов вошли в долгосрочное последующее пролонгированное исследование и были оценены на резистентность к энтекавиру. Из 149 пациентов, участвовавших в пролонгированном исследовании, у 88% (131/149), 92% (137/149) и 92% (137/149) был достигнут уровень сывороточной ДНК ВГВ <300 копий/мл к 144, 192 и 240-й нед (включая окончание дозирования) соответственно. Никаких новых замен, ассоциированных с резистентностью к энтекавиру, не было выявлено при сравнении генотипов оцениваемых изолятов с их соответствующими исходными изолятами. Кумулятивная вероятность развития замен rtT184, rtS202 или rtM250, ассоциированных с резистентностью к энтекавиру (в присутствии замен rtL180M и rtM204V), на 48, 96, 144, 192 и 240-й нед составила 0,2; 0,5; 1,2; 1,2; и 1,2% соответственно.
Ламивудинрезистентные пациенты.
Генотипические оценки проводились на поддающихся оценке образцах от 190 пациентов, получавших энтекавир в течение до 96 нед в исследованиях ламивудинрезистентного ВГВ (AI463026, AI463014, AI463015 и пролонгированное исследование AI463901). К 96-й нед ассоциированные с резистентностью аминокислотные замены в rtT184, rtS202 или rtM250, с изменениями rtI169 или без них, в присутствии аминокислотных замен rtM204I/V с или без rtL80V, rtV173L/M или rtL180M были обнаружены в ВГВ 22 пациентов (22/190=12%), из них у 16 был вирусологический возврат (увеличение ≥1 log10 выше самой низкой точки), у 4 никогда не было отмечено супрессии <300 копий/мл. ВГВ от 4 этих пациентов имели замены, связанные с резистентностью к энтекавиру, на исходном уровне, и были приобретены дальнейшие изменения при лечении энтекавиром. В дополнение к 22 пациентам, у 3 пациентов наблюдался вирусологический возврат с появлением rtM204I/V и rtL80V, rtV173L/M или rtL180M. Для изолятов от пациентов, у которых наблюдался вирусологический возврат с появлением замен, связанных с резистентностью (n=19), медиана значений EC50 энтекавира изменялась по сравнению с референсным значением в 19 раз на исходном уровне и в 106 раз во время вирусологического возврата. Из пациентов, которые продолжили лечение после 48 нед, 40% (31/77) имели ДНК ВГВ <300 копий/мл в конце дозирования (до 96 нед).
Ламивудинрезистентным пациентам (n=157), которые не смогли достичь определенного в исследовании полного ответа к 96-й нед, было предложено продолжить лечение энтекавиром. Пациенты получали энтекавир по 1 мг 1 раз в день в течение дополнительных 144 нед. Из этих пациентов 80 пациентов приняли участие в долгосрочном исследовании с последующим наблюдением и были оценены на резистентность к энтекавиру. К 144, 192 и 240-й нед (включая конец приема), 34% (27/80), 35% (28/80) и 36% (29/80) соответственно достигли уровня ДНК ВГВ <300 копий/мл. Кумулятивная вероятность развития замен, связанных с резистентностью к энтекавиру rtT184, rtS202 или rtM250 (в присутствии rtM204I/V с заменами rtL180M или без них) на 48, 96, 144, 192 и 240-й нед составила 6,2; 15; 36,3; 46,6 и 51,5% соответственно. В ВГВ 6 пациентов развились аминокислотные замены rtA181C/G/S/T при приеме энтекавира, и из них у 4 возникли замены, связанные с резистентностью к энтекавиру, в rtT184, rtS202 или rtM250, и у 1 была замена rtT184S на исходном уровне. Из 7 пациентов, у которых ВГВ имел замену rtA181 на исходном уровне, у 2 были также замены rtT184, rtS202 или rtM250 на исходном уровне, а еще у 2 они развились во время лечения энтекавиром.
В ходе комплексного анализа данных о резистентности к энтекавиру из 17 клинических испытаний фазы 2 и 3 возникшая замена rtA181C, ассоциированная с резистентностью к энтекавиру, была обнаружена у 5 из 1461 (0,3%) пациента во время лечения энтекавиром. Эта замена была обнаружена только в присутствии замен, ассоциированных с резистентностью к ламивудину, rtL180M плюс rtM204V.
Перекрестная резистентность.
Среди аналогов нуклеозидных ингибиторов ВГВ наблюдалась перекрестная резистентность. В анализах на клеточных культурах энтекавир имел в 8-30 раз меньшее ингибирование синтеза ДНК ВГВ для ВГВ, содержащего ламивудин- и телбивудинассоциированные с резистентностью замены rtM204I/V с или без rtL180M, чем для ВГВ дикого типа. Замены rtM204I/V с rtL80I/V, rtV173L или rtL180M или без них, которые ассоциированы с резистентностью к ламивудину и телбивудину, также вызывают снижение фенотипической чувствительности к энтекавиру. Эффективность энтекавира против ВГВ с заменами, ассоциированными с резистентностью к адефовиру, не была установлена в клинических испытаниях. Изоляты ВГВ от пациентов, резистентных к ламивудину, с неудачей при терапии энтекавиром, были чувствительны в культуре клеток к адефовиру, но оставались резистентными к ламивудину. Геномы рекомбинантных изолятов ВГВ, кодирующие замены, ассоциированные с резистентностью к адефовиру как rtA181V, так и rtN236T, имели 1,1- или 0,3-кратные сдвиги соответственно в чувствительности к энтекавиру в культуре клеток.
|
|
Фармакокинетика
Фармакокинетику однократной и многократных доз энтекавира оценивали у здоровых людей и пациентов с хронической инфекцией вирусом гепатита В.
Абсорбция.
После приема внутрь у здоровых людей maxCmax энтекавира в плазме наблюдались между 0,5 и 1,5 После многократного ежедневного приема в диапазоне доз от 0,1 до 1 мг ssCss и AUC в равновесном состоянии увеличивались пропорционально дозе. Равновесное состояние достигается после 6-10 дней ежедневного приема 1 раз в день с примерно 2-кратной кумуляцией. При приеме пероральной дозы 0,5 мг maxCmax в плазме в равновесном состоянии составляла 4,2 нг/мл, а сmin - 0,3 нг/мл. При приеме пероральной дозы 1 мг maxCmax составляла 8,2 нг/мл, а сmin - 0,5 нг/мл.
У здоровых людей биодоступность таблеток составляла 100% относительно перорального раствора. Пероральный раствор и таблетки могут использоваться как взаимозаменяемые.
Влияние пищи на пероральную абсорбцию. Прием внутрь 0,5 мг энтекавира с пищей с высоким содержанием жиров (945 ккал, 54,6 г жира) или с легкой пищей (379 ккал, 8,2 г жира) приводил к задержке всасывания (1-1,5 ч при приеме с пищей vs 0,75 ч при приеме натощак), снижению Сmax на 44-46% и снижению AUC на 18-20%.
Распределение.
Основываясь на фармакокинетическом профиле энтекавира после перорального приема, оцениваемый кажущийся dVd превышает общий объем воды в организме, что позволяет предположить, что энтекавир экстенсивно распределяется в ткани. Связывание энтекавира с белками сыворотки человека in vitro >in vitro составляет примерно 13%.
Метаболизм и выведение.
После введения меченного 14C-энтекавира людям и крысам не определялись окисленные или ацетилированные метаболиты, а метаболиты II фазы (конъюгаты глюкуронида и сульфата) наблюдались в незначительном количестве. Энтекавир не является субстратом, ингибитором или индуктором изоферментной системы цитохрома P450 ( см «Взаимодействие»).
После достижения maxCmax концентрация энтекавира в плазме снижалась биэкспоненциально с конечным 1/2T1/2 примерно 128-149 Наблюдаемый индекс кумуляции ЛС примерно 2 при ежедневном приеме 1 раз в день, что предполагает эффективный 1/2T1/2 примерно 24.
Энтекавир выводится преимущественно почками, в равновесном состоянии в неизмененном виде в моче определяется от 62 до 73% дозы. Почечный клиренс не зависит от дозы и колеблется от 360 до 471 мл/мин, что свидетельствует о КФ и канальцевой секреции энтекавира ( см «Взаимодействие»).
Особые группы пациентов.
Пол. Существенных гендерных различий фармакокинетики энтекавира нет.
Раса. Существенных расовых различий фармакокинетики энтекавира нет.
Пожилой возраст. Влияние возраста на фармакокинетику энтекавира оценивали после приема однократной пероральной дозы 1 мг здоровыми молодыми и пожилыми добровольцами. AUC энтекавира была на 29,3% больше у пожилых людей по сравнению с молодыми людьми. Различия в экспозиции у пожилых и молодых людей, скорее всего, были связаны с различиями в функции почек. Корректировка дозы энтекавира должна основываться предпочтительнее на функции почек пациента, а не на возрасте.
Применение в педиатрии. Фармакокинетика энтекавира в равновесном состоянии была оценена у HBeAg-положительных педиатрических пациентов в возрасте от 2 до менее 18 лет с компенсированным заболеванием печени, ранее не получавших нуклеозидные ингибиторы и получавших ламивудин. Результаты представлены в таблице 1. Экспозиция энтекавира у пациентов, ранее не получавших ингибиторы нуклеозидов, была сходна с экспозицией, достигнутой у взрослых, получавших дозы 0,5 мг 1 раз в день. Экспозиция энтекавира у пациентов, принимавших ламивудин, была такой же, как у взрослых, получавших 1 мг один раз в день.
Таблица 1.
Фармакокинетические параметры у педиатрических пациентов.
1 Пациенты получали 1 раз в день дозы от 0,015 мг/кг до максимальной 0,5 мг.
2 Пациенты получали 1 раз в день дозы от 0,030 мг/кг до максимальной 1 мг.
Нарушение функции почек. Фармакокинетику энтекавира после однократного приема в дозе 1 мг изучали у пациентов (без хронической инфекции ВГВ) с выбранной степенью нарушения функции почек, включая пациентов с почечной недостаточностью, находящихся на гемодиализе или постоянном амбулаторном перитонеальном диализе (ПАПД). Результаты показаны в таблице 2.
Таблица 2.
Фармакокинетические параметры у пациентов с выбранной степенью почечной функции.
1 Дозирование сразу после гемодиализа.
После приема однократной дозы энтекавира 1 мг за 2 ч до сеанса гемодиализа гемодиализ удалял приблизительно 13% дозы энтекавира в течение 4 ПАПД удалял примерно 0,3% дозы в течение 7 дней.
Нарушение функции печени. Фармакокинетику энтекавира после приема однократной дозы 1 мг изучали у взрослых пациентов (без хронической инфекции ВГB) с умеренной или тяжелой печеночной недостаточностью (класс в или с по классификации Чайлд-Туркотт-Пью (ЧТП). Фармакокинетика энтекавира была сходной у пациентов с нарушением функции печени и здоровых людей из контрольной группы; поэтому не рекомендуется корректировать дозу энтекавира у пациентов с печеночной недостаточностью. Фармакокинетику энтекавира не изучали у детей с нарушением функции печени.
Пациенты, перенесшие трансплантацию печени. Имеются ограниченные данные о безопасности и эффективности энтекавира у реципиентов с трансплантатом. В небольшом пилотном исследовании применения энтекавира у ВГВ-инфицированных реципиентов с трансплантатом печени, получавших стабильную дозу циклоспорина А (n=5) или такролимуса (n=4), экспозиция энтекавира была примерно в 2 раза выше, чем у здоровых людей с нормальной функцией почек. Нарушение функции почек способствовало увеличению экспозиции энтекавира у этих пациентов. Возможность ФКВ энтекавира и циклоспорина А или такролимуса официально не оценивали ( см «Меры предосторожности»).
Доклиническая токсикология.
Канцерогенность, мутагенность, влияние на фертильность.
Канцерогенность. Долгосрочные исследования канцерогенности энтекавира при пероральном применении у мышей и крыс были проведены при экспозициях примерно до 42 раз (мыши) и 35 раз (крысы) выше по сравнению с таковыми, наблюдаемыми у человека при наивысшей рекомендуемой дозе 1 мг/сут. В исследованиях на мышах и крысах энтекавир проявлял канцерогенное действие. Неизвестно, насколько предиктивными могут быть результаты исследований канцерогенности на грызунах для человека ( см «Побочные действия»).
У мышей количество аденом легких увеличивалось у самцов и самок при экспозициях в 3 и 40 раз выше, чем таковые у человека. Частота карцином легких как у самцов, так и у самок мышей увеличивалась при экспозициях в 40 раз выше таковых у человека. Развитие комбинированных аденом и карцином легких увеличивалось у самцов мышей при экспозициях в 3 раза и у самок мышей при экспозициях в 40 раз выше таковых у человека. Развитию опухоли предшествовала пролиферация пневмоцитов в легких, чего не наблюдали у крыс, собак или обезьян при применении энтекавира, что подтверждает вывод о том, что опухоли легких у мышей могут быть видоспецифичным явлением. Частота гепатоцеллюлярных карцином была повышена у самцов, и комбинированные аденомы и карциномы печени также развивались чаще при экспозициях в 3 и 40 раз выше, чем таковые у человека. Частота карциномы легких как у самцов, так и у самок мышей увеличивалась при экспозициях в 42 раза выше, чем у человека. Развитие сосудистых опухолей у самок мышей (гемангиомы яичников и матки и гемангиосаркомы селезенки) увеличивалось при экспозициях в 40 раз больше, чем таковые у человека. У крыс развитие гепатоцеллюлярных аденом увеличивалось у самок при экспозициях в 24 раза больше, чем таковые у человека; частота комбинированных аденом и карцином также увеличивалась у самок при экспозициях в 24 раза больше таковых у человека. Глиомы головного мозга индуцировались как у самцов, так и у самок при экспозициях в 35 и 24 раза больше, чем таковые у человека. Фибромы кожи индуцировались у самок при экспозициях в 4 раза выше, чем таковые у человека.
Мутагенность. Энтекавир был кластогенным при исследовании на культурах лимфоцитов человека. Энтекавир не проявлял мутагенности в тесте оценки обратных мутаций у бактерий (тест Эймса) с использованием штаммов S.typhimurium и E.coli в присутствии или в отсутствие метаболической активации, в тесте генных мутаций на клетках млекопитающих и в тесте на трансформацию клеток эмбриона сирийского хомячка. Энтекавир был также негативным в in vivo >in vivo микроядерном тесте и тесте репарации ДНК у крыс.
Влияние на фертильность. В исследованиях репродуктивной токсикологии, в которых у животных применяли энтекавир в дозе до 30 мг/кг в течение до 4 нед, не было обнаружено каких-либо доказательств нарушения фертильности у самцов или самок крыс при системных экспозициях, превышающих более чем в 90 раз таковые у человека при наивысшей рекомендуемой дозе 1 мг/сут. В токсикологических исследованиях у грызунов и собак дегенерация семенных канальцев наблюдалась при экспозициях, в 35 или более раз превышающих таковые у человека. У обезьян изменений яичек не наблюдалось.
Клинические исследования.
Исследования у взрослых пациентов продолжительностью в 48 нед.
Безопасность и эффективность энтекавира у взрослых были оценены в трех актив-контролируемых испытаниях фазы 3. Эти исследования включали 1633 пациента в возрасте 16 лет и старше с хронической инфекцией ВГB (HBsAg-позитивная сыворотка в течение не менее 6 мес), сопровождаемых доказательствами репликации вируса (обнаруживаемая ДНК ВГВ в сыворотке, измеренная с помощью гибридизации методом разветвленной ДНК или ПЦР-теста (polymerase chain reaction, PCR, полимеразная цепная реакция, ПЦР). Пациенты имели устойчиво повышенные уровни АЛТ, по крайней мере в 1,3 раза выше ВГН, и хроническое воспаление при биопсии печени, совместимое с диагнозом хронического вирусного гепатита. Безопасность и эффективность энтекавира были также оценены в исследовании 191 ВГВ-инфицированного пациента с декомпенсированным заболеванием печени и в исследовании 68 пациентов, коинфицированных ВГВ и ВИЧ.
Пациенты, ранее не принимавшие нуклеозидные ингибиторы, с компенсированным заболеванием печени.
HBeAg-положительные. Исследование AI463022 представляло собой многонациональное рандомизированное двойное слепое исследование энтекавира в дозе 0,5 мг 1 раз в день по сравнению с ламивудином 100 мг 1 раз в день в течение минимум 52 нед у 709 (из 715 рандомизированных) пациентов, ранее не получавших ингибиторы нуклеозидов, с хронической инфекцией ВГB, компенсированным заболеванием печени и выявляемым HBeAg. Средний возраст пациентов составлял 35 лет, 75% были мужчинами, 57% - представителями азиатской расы, 40% - европеоидной и 13% ранее получали интерферон альфа. Исходно у пациентов средний показатель Knodell Necroinflammatory Score составлял 7,8, уровень ДНК ВГВ в сыворотке, измеренный с помощью анализа Roche сOBAS Amplicor PCR, составлял 9,66 log10 копий/мл, а средний уровень АЛТ в сыворотке - 143 Ед/л. Парные адекватные образцы биопсии печени были доступны у 89% пациентов.
HBeAg-отрицательный (анти-HBe-положительный/ВГВ-ДНК-положительный). Исследование AI463027 - многонациональное рандомизированное двойное слепое исследование энтекавира в дозе 0,5 мг 1 раз в сутки по сравнению с ламивудином 100 мг 1 раз в сутки в течение минимум 52 нед у 638 (из 648 рандомизированных) пациентов, ранее не принимавших нуклеозидные ингибиторы, с HBeAg-отрицательной (HBeAb-положительной) хронической вирусной инфекцией гепатита В и компенсированным заболеванием печени. Средний возраст испытуемых составлял 44 года, 76% были мужчинами, 39% - представителями азиатской расы, 58% - европеоидной расы и 13% ранее получали интерферон альфа. Исходно у пациентов показатель Knodell Necroinflammatory Score составлял 7,8, уровень ДНК ВГВ в сыворотке, измеренный с помощью анализа Roche сOBAS Amplicor PCR, составлял 7,58 log10 копий/мл, а средний уровень АЛТ в сыворотке - 142 Ед/л. Парные адекватные образцы биопсии печени были доступны у 88% пациентов.
В исследованиях AI463022 и AI463027 энтекавир превосходил ламивудин по первичной конечной точке эффективности - гистологическому улучшению, определяемому как снижение на 2 или более балла по Knodell Necroinflammatory Score без ухудшения по Knodell Fibrosis Score на 48-й нед, а также по вторичным показателям эффективности, измеряемым по снижению вирусной нагрузки и нормализации АЛТ. Гистологическое улучшение и изменение показателя Ishak Fibrosis Score показаны в таблице 3. Отдельные вирусологические, биохимические и серологические показатели результатов показаны в таблице 4.
Таблица 3.
Гистологическое улучшение и изменение по Ishak Fibrosis Score на 48-й нед, у пациентов, не принимавших нуклеозидные ингибиторы, в исследованиях AI463022 и AI463027.
1 Пациенты с поддающейся оценке гистологией на исходном уровне (исходный показатель по Knodell Necroinflammatory Score ≥2).
2 Снижение на ≥2 балла по Knodell Necroinflammatory Score по сравнению с исходным уровнем без ухудшения по Knodell Fibrosis Score.
3 По Ishak Fibrosis Score улучшение = снижение на ≥1 балл по сравнению с исходным уровнем и ухудшение = увеличение на ≥1 балл по сравнению с исходным уровнем.
Таблица 4.
Выбранные вирусологические, биохимические и серологические конечные точки на 48-й нед у пациентов, не принимавших нуклеозидные ингибиторы, в исследованиях AI463022 и AI463027.
1 Roche сOBAS Amplicor PCR assay (нижний предел количественного определения = 300 копий/мл).
Гистологическое улучшение не зависело от исходного уровня ДНК ВГВ или АЛТ.
Резистентные к ламивудину пациенты с компенсированным заболеванием печени.
Исследование AI463026 было многонациональным рандомизированным двойным слепым исследованием энтекавира с участием 286 (из 293 рандомизированных) пациентов с резистентной к ламивудину хронической вирусной инфекцией гепатита в и компенсированным заболеванием печени. Пациенты, получавшие ламивудин при включении в исследование, либо переходили на прием энтекавира в дозе 1 мг 1 раз в день (не было ни периода вымывания, ни частичного перекрытия), либо продолжали принимать ламивудин в дозе 100 мг в течение как минимум 52 нед. Средний возраст пациентов составлял 39 лет, 76% были мужчинами, 37% - представителями азиатской расы, 62% - европеоидной и 52% ранее получали интерферон альфа. Медиана продолжительности предшествующей терапии ламивудином составляла 2,7 года, и 85% имели мутацию резистентности к ламивудину на исходном уровне при исследовании с помощью анализа олигонуклеотидными зондами. На исходном уровне средний показатель по Knodell Necroinflammatory Score составлял 6,5, средний уровень ДНК ВГВ в сыворотке, измеренный с помощью Roche сOBAS Amplicor PCR assay, составлял 9,36 log10 копий/мл, а средний уровень АЛТ в сыворотке - 128 Ед/л. Парные адекватные образцы биопсии печени были доступны у 87% пациентов.
Энтекавир превосходил ламивудин по первичной конечной точке гистологического улучшения (с использованием Knodell Score на 48-й нед). Эти результаты и изменение показателя Ishak Fibrosis Score показаны в таблице 5. В таблице 6 показаны отдельные вирусологические, биохимические и серологические конечные точки.
Таблица 5.
Гистологическое улучшение и изменение по Ishak Fibrosis Score на 48-й нед у пациентов, резистентных к ламивудину, в исследовании AI463026.
1 Пациенты с поддающейся оценке гистологией на исходном уровне (исходный показатель по Knodell Necroinflammatory Score ≥2).
2 Снижение на ≥2 балла по Knodell Necroinflammatory Score по сравнению с исходным уровнем без ухудшения по Knodell Fibrosis Score.
3 По Ishak Fibrosis Score улучшение = снижение на ≥1 балл по сравнению с исходным уровнем и ухудшение = увеличение на ≥1 балл по сравнению с исходным уровнем.
Таблица 6.
Выбранные вирусологические, биохимические и серологические конечные точки на 48-й нед у пациентов, резистентных к ламивудину, в исследовании AI463026.
1 Roche сOBAS Amplicor PCR assay (нижний предел количественного определения = 300 копий/мл).
Гистологическое улучшение не зависело от исходного уровня ДНК ВГВ или АЛТ.
Пациенты с декомпенсированным заболеванием печени.
Исследование AI463048 было рандомизированным открытым исследованием энтекавира в дозе 1 мг 1 раз в день в сравнении с адефовира дипивоксилом в дозе 10 мг 1 раз в день у 191 (из 195 рандомизированных) взрослых пациентов с HBeAg-положительной или HBeAg-отрицательной хронической инфекцией ВГВ и доказательствами декомпенсации функции печени, определяемой как оценка по шкале ЧТП 7 или выше. Пациенты либо не получали лечения против ВГВ, либо ранее лечились преимущественно ламивудином или интерфероном альфа.
В исследовании AI463048 100 пациентов были рандомизированы для лечения энтекавиром и 91 пациент - для лечения адефовира дипивоксилом. Два пациента, рандомизированных для лечения адефовира дипивоксилом, фактически получали лечение энтекавиром на протяжении всего исследования. Средний возраст испытуемых составлял 52 года, 74% были мужчинами, 54% - представителями азиатской расы, 33% - европеоидной и 5% - негроидной/афроамериканцы. Исходно у пациентов средний уровень ДНК ВГВ в сыворотке по данным ПЦР составлял 7,83 log10 копий/мл, а средний уровень АЛТ - 100 Ед/л; 54% пациентов были HBeAg-положительными; 35% имели генотипические признаки резистентности к ламивудину. Исходный средний балл ЧТП составлял 8,6. Результаты для выбранных конечных точек исследования на 48-й нед показаны в таблице 7.
Таблица 7.
Выбранные конечные точки на 48-й нед, пациенты с декомпенсированным заболеванием печени, исследование AI463048.
1 Конечные точки были проанализированы с использованием метода согласно назначенному лечению (ITT), леченные пациенты согласно рандомизации.
2 Roche сOBAS Amplicor PCR assay (нижний предел количественного определения = 300 копий/мл).
3 Определяется как уменьшение или отсутствие изменений по сравнению с исходным уровнем оценки по шкале ЧТП.
4 Значение - это пациенты с отклонениями от нормы на исходном уровне.
Пациенты с коинфекцией ВИЧ и ВГВ.
Исследование AI463038 было рандомизированным двойным слепым плацебо-контролируемым исследованием энтекавира в сравнении с плацебо с участием 68 пациентов, коинфицированных ВИЧ и ВГВ, у которых возник рецидив виремии ВГВ при проведении ламивудинсодержащей высокоактивной антиретровирусной терапии (ВААРТ). Пациенты продолжали получать схему ВААРТ, содержащую ламивудин (доза ламивудина 300 мг/сут), и им был назначен дополнительно либо энтекавир 1 мг 1 раз в сутки (51 пациент), либо плацебо (17 пациентов) в течение 24 нед с последующей открытой фазой в течение дополнительных 24 нед, где все испытуемые получали энтекавир. Исходно у пациентов средний уровень ДНК ВГВ в сыворотке по данным ПЦР составлял 9,13 log10 копий/мл. Девяносто девять процентов пациентов были HBeAg-положительными на исходном уровне, со средним исходным уровнем АЛТ 71,5 Ед/л. Медиана РНК ВИЧ оставалась неизменной на уровне примерно 2 log10 копий/мл в течение 24 нед слепой терапии. Вирусологические и биохимические конечные точки на 24-й нед показаны в таблице 8. Данных о пациентах с коинфекцией ВИЧ/ВГВ, не получавших ранее терапии ламивудином, нет. Энтекавир не оценивали у пациентов с коинфекцией ВИЧ/ВГВ, которые не получали одновременно эффективного лечения ВИЧ ( см «Меры предосторожности»).
Таблица 8.
Вирусологические и биохимические конечные точки на 24-й нед, исследование AI463038.
1 Все пациенты также получали схему ВААРТ, содержащую ламивудин.
2 Roche сOBAS Amplicor PCR assay (нижний предел количественного определения = 300 копий/мл).
3 Процент пациентов с аномальным уровнем АЛТ (>1±ВГН) на исходном уровне, которые достигли нормализации АЛТ (n=35 для энтекавира и n=12 для плацебо).
Для пациентов, которым первоначально был назначен энтекавир, в конце открытой фазы (48-я нед) 8% пациентов имели ДНК ВГВ <300 копий/мл по данным ПЦР, среднее изменение от исходного уровня ДНК ВГВ по данным ПЦР составило −4,2 log10 копий/мл, и у 37% пациентов с аномальным уровнем АЛТ на исходном уровне уровень АЛТ нормализовался (≤1 ВГН).
Исследования у взрослых пациентов продолжительностью более 48 нед.
Оптимальная продолжительность терапии энтекавиром неизвестна. Согласно установленным протоколом критериям клинических испытаний фазы 3, пациенты прекращали лечение энтекавиром или ламивудином через 52 нед в соответствии с определением ответа, основанным на вирусологической супрессии ВГВ (<0,7 МЕq/мл по анализу bДНК) и потере HBeAg (у HBeAg-положительных пациентов) или АЛТ <1,25 ВГН (у HBeAg-отрицательных пациентов) на 48-й нед.
Пациенты, которые достигли вирусологической супрессии, но не имели серологического ответа (HBeAg-положительные) или не достигли уровня АЛТ <1,25 ВГН (HBeAg-отрицательные), продолжали слепое дозирование в течение 96 нед или до тех пор, пока не были достигнуты критерии ответа. Эти руководящие принципы ведения пациентов, определенные протоколом, не предназначены для использования в клинической практике.
Пациенты, ранее не принимавшие нуклеозидные ингибиторы.
Из HBeAg-позитивных пациентов, ранее не получавших нуклеозидные ингибиторы (исследование AI463022), 243 (69%) пациентов, получавших энтекавир, и 164 (46%) пациентов, получавших ламивудин, продолжали слепое лечение до 96 нед. Из тех, кто продолжал слепое лечение в течение 2-го года, у 180 (74%) пациентов, получавших энтекавир, и 60 (37%) пациентов, получавших ламивудин, в конце дозирования (до 96 нед) ДНК ВГВ достигла <300 копий/мл по данным ПЦР. 193 (79%) испытуемых, получавших энтекавир, достигли уровня АЛТ ≤1±ВГН по сравнению со 112 (68%) пациентами, получавшими ламивудин, а сероконверсия HBeAg произошла у 26 (11%) пациентов, получавших энтекавир, и 20 (12%) пациентов, получавших ламивудин.
Из HBeAg-позитивных пациентов, ранее не получавших нуклеозидные ингибиторы, 74 (21%) пациента, получавших энтекавир, и 67 (19%) пациентов, получавших ламивудин, соответствовали определению ответа на 48-й нед, прекратили прием исследуемых ЛС и наблюдались после прекращения лечения в течение 24 нед. Среди респондентов ответивших на энтекавир, 26 (35%) испытуемых имели ДНК ВГВ <300 копий/мл, 55 (74%) испытуемых имели АЛТ ≤1 ВГН, и у 56 (76%) испытуемых была устойчивая сероконверсия HBeAg в конце периода наблюдения. Среди респондентов, ответивших на ламивудин, у 20 (30%) пациентов ДНК ВГВ была <300 копий/мл, у 41 (61%) испытуемых наблюдался уровень АЛТ ≤1 ВГН, а у 47 (70%) пациентов к концу периода наблюдения сохранялась сероконверсия HBeAg.
Из HBeAg-отрицательных пациентов, ранее не получавших нуклеозидные ингибиторы (исследование AI463027), 26 (8%) пациентов, получавших энтекавир, и 28 (9%) пациентов, получавших ламивудин, продолжали слепое лечение до 96 нед. В этой небольшой когорте, продолжающей лечение в течение 2-го года, 22 получавших энтекавир пациента и 16 пациентов, получавших ламивудин, имели ДНК ВГВ <300 копий/мл по данным ПЦР, а 7 и 6 пациентов соответственно имели АЛТ ≤1±ВГН в конце дозирования (до 96 нед).
Из HBeAg-отрицательных пациентов, ранее не принимавших нуклеозидные ингибиторы, 275 (85%) пациентов, принимавших энтекавир, и 245 (78%) пациентов, принимавших ламивудин, соответствовали определению ответа на 48-й нед, прекратили прием исследуемых ЛС и наблюдались после прекращения лечения в течение 24 нед. В этой когорте очень мало пациентов в каждой группе лечения имели ДНК ВГВ <300 копий/мл по данным ПЦР в конце периода наблюдения. В конце периода наблюдения у 126 (46%) пациентов, получавших энтекавир, и 84 (34%) пациентов, получавших ламивудин, был уровень АЛТ ≤1±ВГН.
Ламивудинрезистентные пациенты.
Из ламивудинрезистентных пациентов (исследование AI463026), 77 (55%) пациентов, принимавших энтекавир, и 3 (2%) пациента, принимавших ламивудин, продолжали слепое лечение до 96 нед. В этой когорте принимавших энтекавир пациентов 31 (40%) пациент достиг уровня ДНК ВГВ <300 копий/мл, 62 (81%) пациента имели АЛТ ≤1 ВГН, а 8 (10%) пациентов продемонстрировали сероконверсию HBeAg в конце дозирования.
Результаты у педиатрических пациентов.
Фармакокинетика, безопасность и противовирусная активность энтекавира у педиатрических пациентов первоначально оценивалась в исследовании AI463028. Двадцать четыре HBeAg-положительных педиатрических пациента от 2 до 18 лет с компенсированной хронической инфекцией гепатита в и повышенным уровнем АЛТ принимали энтекавир 0,015 мг/кг (до 0,5 мг) или 0,03 мг/кг (до 1 мг) 1 раз в сутки. Пятьдесят восемь процентов (14/24) пациентов, ранее не получавших лечения, и 47% (9/19) пациентов, получавших ламивудин, достигли уровня ДНК ВГВ <50 МЕ/мл на 48-й нед, а уровень АЛТ нормализовался у 83% (20/24) ранее не леченных пациентов и 95% (18 из 19) пациентов, получавших ламивудин.
Безопасность и противовирусная эффективность были подтверждены в исследовании AI463189, исследовании энтекавира у 180 педиатрических пациентов от 2 до 18 лет, ранее не получавших лечение ингибиторами нуклеозидов, с HBeAg-положительной хронической инфекцией гепатита в, компенсированным заболеванием печени и повышенным уровнем АЛТ. Пациенты были рандомизированы в соотношении 2:1 для получения слепого лечения энтекавиром от 0,015 мг/кг до 0,5 мг/сут (n=120) или плацебо (n=60). Рандомизация была стратифицирована по возрастным группам (от 2 до 6 лет, от >6 до 12 лет и от >12 до <18 лет). Исходные демографические данные и характеристики заболевания ВГВ были сопоставимы в двух группах лечения и между возрастными когортами. На момент начала исследования среднее значение ДНК ВГВ составляло 8,1 log10 МЕ/мл, а средний уровень АЛТ - 103 Ед/л. Первичная конечная точка эффективности представляла собой совокупность сероконверсии HBeAg и сывороточной ДНК ВГВ <50 МЕ/мл на 48-й нед, оцененных у первых 123 пациентов, достигших 48 нед лечения слепым методом. Двадцать четыре процента (20/82) пациентов в группе, получавшей энтекавир, и 2% (1/41) пациентов в группе, получавшей плацебо, достигли первичной конечной точки. 46% (38/82) пациентов, получавших энтекавир, и 2% (1/41) пациентов, получавших плацебо, достигли уровня ДНК ВГВ <50 МЕ/мл на 48-й нед. Нормализация АЛТ наблюдалась у 67% (55/82) пациентов, получавших энтекавир, и 22% (9/41) пациентов, получавших плацебо; 24% (20/82) пациентов, получавших энтекавир, и 12% (5/41) пациентов, получавших плацебо, имели сероконверсию HBeAg.
Абсорбция.
После приема внутрь у здоровых людей maxCmax энтекавира в плазме наблюдались между 0,5 и 1,5 После многократного ежедневного приема в диапазоне доз от 0,1 до 1 мг ssCss и AUC в равновесном состоянии увеличивались пропорционально дозе. Равновесное состояние достигается после 6-10 дней ежедневного приема 1 раз в день с примерно 2-кратной кумуляцией. При приеме пероральной дозы 0,5 мг maxCmax в плазме в равновесном состоянии составляла 4,2 нг/мл, а сmin - 0,3 нг/мл. При приеме пероральной дозы 1 мг maxCmax составляла 8,2 нг/мл, а сmin - 0,5 нг/мл.
У здоровых людей биодоступность таблеток составляла 100% относительно перорального раствора. Пероральный раствор и таблетки могут использоваться как взаимозаменяемые.
Влияние пищи на пероральную абсорбцию. Прием внутрь 0,5 мг энтекавира с пищей с высоким содержанием жиров (945 ккал, 54,6 г жира) или с легкой пищей (379 ккал, 8,2 г жира) приводил к задержке всасывания (1-1,5 ч при приеме с пищей vs 0,75 ч при приеме натощак), снижению Сmax на 44-46% и снижению AUC на 18-20%.
Распределение.
Основываясь на фармакокинетическом профиле энтекавира после перорального приема, оцениваемый кажущийся dVd превышает общий объем воды в организме, что позволяет предположить, что энтекавир экстенсивно распределяется в ткани. Связывание энтекавира с белками сыворотки человека in vitro >in vitro составляет примерно 13%.
Метаболизм и выведение.
После введения меченного 14C-энтекавира людям и крысам не определялись окисленные или ацетилированные метаболиты, а метаболиты II фазы (конъюгаты глюкуронида и сульфата) наблюдались в незначительном количестве. Энтекавир не является субстратом, ингибитором или индуктором изоферментной системы цитохрома P450 ( см «Взаимодействие»).
После достижения maxCmax концентрация энтекавира в плазме снижалась биэкспоненциально с конечным 1/2T1/2 примерно 128-149 Наблюдаемый индекс кумуляции ЛС примерно 2 при ежедневном приеме 1 раз в день, что предполагает эффективный 1/2T1/2 примерно 24.
Энтекавир выводится преимущественно почками, в равновесном состоянии в неизмененном виде в моче определяется от 62 до 73% дозы. Почечный клиренс не зависит от дозы и колеблется от 360 до 471 мл/мин, что свидетельствует о КФ и канальцевой секреции энтекавира ( см «Взаимодействие»).
Особые группы пациентов.
Пол. Существенных гендерных различий фармакокинетики энтекавира нет.
Раса. Существенных расовых различий фармакокинетики энтекавира нет.
Пожилой возраст. Влияние возраста на фармакокинетику энтекавира оценивали после приема однократной пероральной дозы 1 мг здоровыми молодыми и пожилыми добровольцами. AUC энтекавира была на 29,3% больше у пожилых людей по сравнению с молодыми людьми. Различия в экспозиции у пожилых и молодых людей, скорее всего, были связаны с различиями в функции почек. Корректировка дозы энтекавира должна основываться предпочтительнее на функции почек пациента, а не на возрасте.
Применение в педиатрии. Фармакокинетика энтекавира в равновесном состоянии была оценена у HBeAg-положительных педиатрических пациентов в возрасте от 2 до менее 18 лет с компенсированным заболеванием печени, ранее не получавших нуклеозидные ингибиторы и получавших ламивудин. Результаты представлены в таблице 1. Экспозиция энтекавира у пациентов, ранее не получавших ингибиторы нуклеозидов, была сходна с экспозицией, достигнутой у взрослых, получавших дозы 0,5 мг 1 раз в день. Экспозиция энтекавира у пациентов, принимавших ламивудин, была такой же, как у взрослых, получавших 1 мг один раз в день.
Таблица 1.
Фармакокинетические параметры у педиатрических пациентов.
| Фармакокинетический параметр | Пациенты, ранее не получавшие нуклеозидный ингибитор1 (n=24) | Пациенты, принимавшие ламивудин2(n=19) |
| сmax (нг/мл) (CV%) | 6,31 (30) | 14,48 (31) |
| AUC0-24 (нг·ч/мл) (CV%) | 18,33 (27) | 38,58 (26) |
| сmin (нг/мл) (CV%) | 0,28 (22) | 0,47 (23) |
1 Пациенты получали 1 раз в день дозы от 0,015 мг/кг до максимальной 0,5 мг.
2 Пациенты получали 1 раз в день дозы от 0,030 мг/кг до максимальной 1 мг.
Нарушение функции почек. Фармакокинетику энтекавира после однократного приема в дозе 1 мг изучали у пациентов (без хронической инфекции ВГВ) с выбранной степенью нарушения функции почек, включая пациентов с почечной недостаточностью, находящихся на гемодиализе или постоянном амбулаторном перитонеальном диализе (ПАПД). Результаты показаны в таблице 2.
Таблица 2.
Фармакокинетические параметры у пациентов с выбранной степенью почечной функции.
| Группа почечной функции | ||||||
| Фармакокинетический параметр | Исходный клиренс креатинина, мл/мин | Тяжелая степень, лечение с помощью гемодиализа1 n=6 | Тяжелая степень, лечение с помощью ПАПД, n=4 | |||
| Без нарушений >80, n=6 | Легкая степень >50-≤80, n=6 | Умеренная степень 30-50, n=6 | Тяжелая степень <30, n=6 | |||
| сmax, нг/мл (CV%) | 8,1 (30,7) | 10,4 (37,2) | 10,5 (22,7) | 15,3 (33,8) | 15,4 (56,4) | 16,6 (29,7) |
| AUC0-t, нг·ч/мл (CV%) | 27,9 (25,6) | 51,5 (22,8) | 69,5 (22,7) | 145,7 (31,5) | 233,9 (28,4) | 221,8 (11,6) |
| Почечный клиренс, мл/мин (SD) | 383,2 (101,8) | 197,9 (78,1) | 135,6 (31,6) | 40,3 (10,1) | NA | NA |
| сLT/F (кажущийся пероральный клиренс), мл/мин (SD) | 588,1 (153,7) | 309,2 (62,6) | 226,3 (60,1) | 100,6 (29,1) | 50,6 (16,5) | 35,7 (19,6) |
1 Дозирование сразу после гемодиализа.
После приема однократной дозы энтекавира 1 мг за 2 ч до сеанса гемодиализа гемодиализ удалял приблизительно 13% дозы энтекавира в течение 4 ПАПД удалял примерно 0,3% дозы в течение 7 дней.
Нарушение функции печени. Фармакокинетику энтекавира после приема однократной дозы 1 мг изучали у взрослых пациентов (без хронической инфекции ВГB) с умеренной или тяжелой печеночной недостаточностью (класс в или с по классификации Чайлд-Туркотт-Пью (ЧТП). Фармакокинетика энтекавира была сходной у пациентов с нарушением функции печени и здоровых людей из контрольной группы; поэтому не рекомендуется корректировать дозу энтекавира у пациентов с печеночной недостаточностью. Фармакокинетику энтекавира не изучали у детей с нарушением функции печени.
Пациенты, перенесшие трансплантацию печени. Имеются ограниченные данные о безопасности и эффективности энтекавира у реципиентов с трансплантатом. В небольшом пилотном исследовании применения энтекавира у ВГВ-инфицированных реципиентов с трансплантатом печени, получавших стабильную дозу циклоспорина А (n=5) или такролимуса (n=4), экспозиция энтекавира была примерно в 2 раза выше, чем у здоровых людей с нормальной функцией почек. Нарушение функции почек способствовало увеличению экспозиции энтекавира у этих пациентов. Возможность ФКВ энтекавира и циклоспорина А или такролимуса официально не оценивали ( см «Меры предосторожности»).
Доклиническая токсикология.
Канцерогенность, мутагенность, влияние на фертильность.
Канцерогенность. Долгосрочные исследования канцерогенности энтекавира при пероральном применении у мышей и крыс были проведены при экспозициях примерно до 42 раз (мыши) и 35 раз (крысы) выше по сравнению с таковыми, наблюдаемыми у человека при наивысшей рекомендуемой дозе 1 мг/сут. В исследованиях на мышах и крысах энтекавир проявлял канцерогенное действие. Неизвестно, насколько предиктивными могут быть результаты исследований канцерогенности на грызунах для человека ( см «Побочные действия»).
У мышей количество аденом легких увеличивалось у самцов и самок при экспозициях в 3 и 40 раз выше, чем таковые у человека. Частота карцином легких как у самцов, так и у самок мышей увеличивалась при экспозициях в 40 раз выше таковых у человека. Развитие комбинированных аденом и карцином легких увеличивалось у самцов мышей при экспозициях в 3 раза и у самок мышей при экспозициях в 40 раз выше таковых у человека. Развитию опухоли предшествовала пролиферация пневмоцитов в легких, чего не наблюдали у крыс, собак или обезьян при применении энтекавира, что подтверждает вывод о том, что опухоли легких у мышей могут быть видоспецифичным явлением. Частота гепатоцеллюлярных карцином была повышена у самцов, и комбинированные аденомы и карциномы печени также развивались чаще при экспозициях в 3 и 40 раз выше, чем таковые у человека. Частота карциномы легких как у самцов, так и у самок мышей увеличивалась при экспозициях в 42 раза выше, чем у человека. Развитие сосудистых опухолей у самок мышей (гемангиомы яичников и матки и гемангиосаркомы селезенки) увеличивалось при экспозициях в 40 раз больше, чем таковые у человека. У крыс развитие гепатоцеллюлярных аденом увеличивалось у самок при экспозициях в 24 раза больше, чем таковые у человека; частота комбинированных аденом и карцином также увеличивалась у самок при экспозициях в 24 раза больше таковых у человека. Глиомы головного мозга индуцировались как у самцов, так и у самок при экспозициях в 35 и 24 раза больше, чем таковые у человека. Фибромы кожи индуцировались у самок при экспозициях в 4 раза выше, чем таковые у человека.
Мутагенность. Энтекавир был кластогенным при исследовании на культурах лимфоцитов человека. Энтекавир не проявлял мутагенности в тесте оценки обратных мутаций у бактерий (тест Эймса) с использованием штаммов S.typhimurium и E.coli в присутствии или в отсутствие метаболической активации, в тесте генных мутаций на клетках млекопитающих и в тесте на трансформацию клеток эмбриона сирийского хомячка. Энтекавир был также негативным в in vivo >in vivo микроядерном тесте и тесте репарации ДНК у крыс.
Влияние на фертильность. В исследованиях репродуктивной токсикологии, в которых у животных применяли энтекавир в дозе до 30 мг/кг в течение до 4 нед, не было обнаружено каких-либо доказательств нарушения фертильности у самцов или самок крыс при системных экспозициях, превышающих более чем в 90 раз таковые у человека при наивысшей рекомендуемой дозе 1 мг/сут. В токсикологических исследованиях у грызунов и собак дегенерация семенных канальцев наблюдалась при экспозициях, в 35 или более раз превышающих таковые у человека. У обезьян изменений яичек не наблюдалось.
Клинические исследования.
Исследования у взрослых пациентов продолжительностью в 48 нед.
Безопасность и эффективность энтекавира у взрослых были оценены в трех актив-контролируемых испытаниях фазы 3. Эти исследования включали 1633 пациента в возрасте 16 лет и старше с хронической инфекцией ВГB (HBsAg-позитивная сыворотка в течение не менее 6 мес), сопровождаемых доказательствами репликации вируса (обнаруживаемая ДНК ВГВ в сыворотке, измеренная с помощью гибридизации методом разветвленной ДНК или ПЦР-теста (polymerase chain reaction, PCR, полимеразная цепная реакция, ПЦР). Пациенты имели устойчиво повышенные уровни АЛТ, по крайней мере в 1,3 раза выше ВГН, и хроническое воспаление при биопсии печени, совместимое с диагнозом хронического вирусного гепатита. Безопасность и эффективность энтекавира были также оценены в исследовании 191 ВГВ-инфицированного пациента с декомпенсированным заболеванием печени и в исследовании 68 пациентов, коинфицированных ВГВ и ВИЧ.
Пациенты, ранее не принимавшие нуклеозидные ингибиторы, с компенсированным заболеванием печени.
HBeAg-положительные. Исследование AI463022 представляло собой многонациональное рандомизированное двойное слепое исследование энтекавира в дозе 0,5 мг 1 раз в день по сравнению с ламивудином 100 мг 1 раз в день в течение минимум 52 нед у 709 (из 715 рандомизированных) пациентов, ранее не получавших ингибиторы нуклеозидов, с хронической инфекцией ВГB, компенсированным заболеванием печени и выявляемым HBeAg. Средний возраст пациентов составлял 35 лет, 75% были мужчинами, 57% - представителями азиатской расы, 40% - европеоидной и 13% ранее получали интерферон альфа. Исходно у пациентов средний показатель Knodell Necroinflammatory Score составлял 7,8, уровень ДНК ВГВ в сыворотке, измеренный с помощью анализа Roche сOBAS Amplicor PCR, составлял 9,66 log10 копий/мл, а средний уровень АЛТ в сыворотке - 143 Ед/л. Парные адекватные образцы биопсии печени были доступны у 89% пациентов.
HBeAg-отрицательный (анти-HBe-положительный/ВГВ-ДНК-положительный). Исследование AI463027 - многонациональное рандомизированное двойное слепое исследование энтекавира в дозе 0,5 мг 1 раз в сутки по сравнению с ламивудином 100 мг 1 раз в сутки в течение минимум 52 нед у 638 (из 648 рандомизированных) пациентов, ранее не принимавших нуклеозидные ингибиторы, с HBeAg-отрицательной (HBeAb-положительной) хронической вирусной инфекцией гепатита В и компенсированным заболеванием печени. Средний возраст испытуемых составлял 44 года, 76% были мужчинами, 39% - представителями азиатской расы, 58% - европеоидной расы и 13% ранее получали интерферон альфа. Исходно у пациентов показатель Knodell Necroinflammatory Score составлял 7,8, уровень ДНК ВГВ в сыворотке, измеренный с помощью анализа Roche сOBAS Amplicor PCR, составлял 7,58 log10 копий/мл, а средний уровень АЛТ в сыворотке - 142 Ед/л. Парные адекватные образцы биопсии печени были доступны у 88% пациентов.
В исследованиях AI463022 и AI463027 энтекавир превосходил ламивудин по первичной конечной точке эффективности - гистологическому улучшению, определяемому как снижение на 2 или более балла по Knodell Necroinflammatory Score без ухудшения по Knodell Fibrosis Score на 48-й нед, а также по вторичным показателям эффективности, измеряемым по снижению вирусной нагрузки и нормализации АЛТ. Гистологическое улучшение и изменение показателя Ishak Fibrosis Score показаны в таблице 3. Отдельные вирусологические, биохимические и серологические показатели результатов показаны в таблице 4.
Таблица 3.
Гистологическое улучшение и изменение по Ishak Fibrosis Score на 48-й нед, у пациентов, не принимавших нуклеозидные ингибиторы, в исследованиях AI463022 и AI463027.
| Параметр | Исследование AI463022 (HBeAg-позитивные) | Исследование AI463027 (HBeAg-негативные) | ||
| Энтекавир 0,5 мг (n=314)1, % | Ламивудин 100 мг (n=314)1, % | Энтекавир 0,5 мг (n=296)1, % | Ламивудин 100 мг (n=287)1, % | |
| Гистологическое улучшение (Knodell Scores) | ||||
| Улучшение2 | 72 | 62 | 70 | 61 |
| Без улучшения | 21 | 24 | 19 | 26 |
| Ishak Fibrosis Score | ||||
| Улучшение3 | 39 | 35 | 36 | 38 |
| Без изменения | 46 | 40 | 41 | 34 |
| Ухудшение3 | 8 | 10 | 12 | 15 |
| Отсутствующая на 48-й нед биопсия | 7 | 14 | 10 | 13 |
1 Пациенты с поддающейся оценке гистологией на исходном уровне (исходный показатель по Knodell Necroinflammatory Score ≥2).
2 Снижение на ≥2 балла по Knodell Necroinflammatory Score по сравнению с исходным уровнем без ухудшения по Knodell Fibrosis Score.
3 По Ishak Fibrosis Score улучшение = снижение на ≥1 балл по сравнению с исходным уровнем и ухудшение = увеличение на ≥1 балл по сравнению с исходным уровнем.
Таблица 4.
Выбранные вирусологические, биохимические и серологические конечные точки на 48-й нед у пациентов, не принимавших нуклеозидные ингибиторы, в исследованиях AI463022 и AI463027.
| Параметр | Исследование AI463022 (HBeAg-позитивные) | Исследование AI463027 (HBeAg-негативные) | ||
| Энтекавир 0,5 мг (n=354), % | Ламивудин 100 мг (n=355), % | Энтекавир 0,5 мг (n=325), % | Ламивудин 100 мг (n=313), % | |
| ДНК ВГВ1 | ||||
| Пропорция не определяется (<300 копий/мл) | 67 | 36 | 90 | 72 |
| Среднее изменение от исходного уровня (log10 копий/мл) | −6,86 | −5,39 | −5,04 | −4,53 |
| Нормализация АЛТ (≤1 ВГН) | 68 | 60 | 78 | 71 |
| Сероконверсия HBeAg | 21 | 18 | NA | NA |
1 Roche сOBAS Amplicor PCR assay (нижний предел количественного определения = 300 копий/мл).
Гистологическое улучшение не зависело от исходного уровня ДНК ВГВ или АЛТ.
Резистентные к ламивудину пациенты с компенсированным заболеванием печени.
Исследование AI463026 было многонациональным рандомизированным двойным слепым исследованием энтекавира с участием 286 (из 293 рандомизированных) пациентов с резистентной к ламивудину хронической вирусной инфекцией гепатита в и компенсированным заболеванием печени. Пациенты, получавшие ламивудин при включении в исследование, либо переходили на прием энтекавира в дозе 1 мг 1 раз в день (не было ни периода вымывания, ни частичного перекрытия), либо продолжали принимать ламивудин в дозе 100 мг в течение как минимум 52 нед. Средний возраст пациентов составлял 39 лет, 76% были мужчинами, 37% - представителями азиатской расы, 62% - европеоидной и 52% ранее получали интерферон альфа. Медиана продолжительности предшествующей терапии ламивудином составляла 2,7 года, и 85% имели мутацию резистентности к ламивудину на исходном уровне при исследовании с помощью анализа олигонуклеотидными зондами. На исходном уровне средний показатель по Knodell Necroinflammatory Score составлял 6,5, средний уровень ДНК ВГВ в сыворотке, измеренный с помощью Roche сOBAS Amplicor PCR assay, составлял 9,36 log10 копий/мл, а средний уровень АЛТ в сыворотке - 128 Ед/л. Парные адекватные образцы биопсии печени были доступны у 87% пациентов.
Энтекавир превосходил ламивудин по первичной конечной точке гистологического улучшения (с использованием Knodell Score на 48-й нед). Эти результаты и изменение показателя Ishak Fibrosis Score показаны в таблице 5. В таблице 6 показаны отдельные вирусологические, биохимические и серологические конечные точки.
Таблица 5.
Гистологическое улучшение и изменение по Ishak Fibrosis Score на 48-й нед у пациентов, резистентных к ламивудину, в исследовании AI463026.
| Параметр | Энтекавир 1 мг (n=124)1, % | Ламивудин 100 мг (n=116)1, % |
| Гистологическое улучшение (Knodell Scores) | ||
| Улучшение2 | 55 | 28 |
| Без улучшения | 34 | 57 |
| Ishak Fibrosis Score | ||
| Улучшение3 | 34 | 16 |
| Без улучшения | 44 | 42 |
| Ухудшение3 | 11 | 26 |
| Отсутствующая на 48-й нед биопсия | 11 | 16 |
1 Пациенты с поддающейся оценке гистологией на исходном уровне (исходный показатель по Knodell Necroinflammatory Score ≥2).
2 Снижение на ≥2 балла по Knodell Necroinflammatory Score по сравнению с исходным уровнем без ухудшения по Knodell Fibrosis Score.
3 По Ishak Fibrosis Score улучшение = снижение на ≥1 балл по сравнению с исходным уровнем и ухудшение = увеличение на ≥1 балл по сравнению с исходным уровнем.
Таблица 6.
Выбранные вирусологические, биохимические и серологические конечные точки на 48-й нед у пациентов, резистентных к ламивудину, в исследовании AI463026.
| Параметр | Энтекавир 1 мг (n=141), % | Ламивудин 100 мг (n=145), % |
| ДНК ВГВ1 | ||
| Пропорция не определяется (<300 копий/мл) | 19 | 1 |
| Среднее изменение от исходного уровня (log10 копий/мл) | −5,11 | −0,48 |
| Нормализация АЛТ (≤1 ВГН) | 61 | 15 |
| Сероконверсия HBeAg | 8 | 3 |
1 Roche сOBAS Amplicor PCR assay (нижний предел количественного определения = 300 копий/мл).
Гистологическое улучшение не зависело от исходного уровня ДНК ВГВ или АЛТ.
Пациенты с декомпенсированным заболеванием печени.
Исследование AI463048 было рандомизированным открытым исследованием энтекавира в дозе 1 мг 1 раз в день в сравнении с адефовира дипивоксилом в дозе 10 мг 1 раз в день у 191 (из 195 рандомизированных) взрослых пациентов с HBeAg-положительной или HBeAg-отрицательной хронической инфекцией ВГВ и доказательствами декомпенсации функции печени, определяемой как оценка по шкале ЧТП 7 или выше. Пациенты либо не получали лечения против ВГВ, либо ранее лечились преимущественно ламивудином или интерфероном альфа.
В исследовании AI463048 100 пациентов были рандомизированы для лечения энтекавиром и 91 пациент - для лечения адефовира дипивоксилом. Два пациента, рандомизированных для лечения адефовира дипивоксилом, фактически получали лечение энтекавиром на протяжении всего исследования. Средний возраст испытуемых составлял 52 года, 74% были мужчинами, 54% - представителями азиатской расы, 33% - европеоидной и 5% - негроидной/афроамериканцы. Исходно у пациентов средний уровень ДНК ВГВ в сыворотке по данным ПЦР составлял 7,83 log10 копий/мл, а средний уровень АЛТ - 100 Ед/л; 54% пациентов были HBeAg-положительными; 35% имели генотипические признаки резистентности к ламивудину. Исходный средний балл ЧТП составлял 8,6. Результаты для выбранных конечных точек исследования на 48-й нед показаны в таблице 7.
Таблица 7.
Выбранные конечные точки на 48-й нед, пациенты с декомпенсированным заболеванием печени, исследование AI463048.
| Параметр | Энтекавир 1 мг (n=100)1 | Адефовира пивоксил 10 мг (n=91)1 |
| ДНК ВГВ2 | ||
| Пропорция не определяется (<300 копий/мл) | 57% | 20% |
| Стабильный или улучшенный показатель шкалы ЧТП3 | 61% | 67% |
| Потеря HBsAg | 5% | 0% |
| Нормализация АЛТ (≤1 ВГН)4 | 49/78 (63%) | 33/71 (46%) |
1 Конечные точки были проанализированы с использованием метода согласно назначенному лечению (ITT), леченные пациенты согласно рандомизации.
2 Roche сOBAS Amplicor PCR assay (нижний предел количественного определения = 300 копий/мл).
3 Определяется как уменьшение или отсутствие изменений по сравнению с исходным уровнем оценки по шкале ЧТП.
4 Значение - это пациенты с отклонениями от нормы на исходном уровне.
Пациенты с коинфекцией ВИЧ и ВГВ.
Исследование AI463038 было рандомизированным двойным слепым плацебо-контролируемым исследованием энтекавира в сравнении с плацебо с участием 68 пациентов, коинфицированных ВИЧ и ВГВ, у которых возник рецидив виремии ВГВ при проведении ламивудинсодержащей высокоактивной антиретровирусной терапии (ВААРТ). Пациенты продолжали получать схему ВААРТ, содержащую ламивудин (доза ламивудина 300 мг/сут), и им был назначен дополнительно либо энтекавир 1 мг 1 раз в сутки (51 пациент), либо плацебо (17 пациентов) в течение 24 нед с последующей открытой фазой в течение дополнительных 24 нед, где все испытуемые получали энтекавир. Исходно у пациентов средний уровень ДНК ВГВ в сыворотке по данным ПЦР составлял 9,13 log10 копий/мл. Девяносто девять процентов пациентов были HBeAg-положительными на исходном уровне, со средним исходным уровнем АЛТ 71,5 Ед/л. Медиана РНК ВИЧ оставалась неизменной на уровне примерно 2 log10 копий/мл в течение 24 нед слепой терапии. Вирусологические и биохимические конечные точки на 24-й нед показаны в таблице 8. Данных о пациентах с коинфекцией ВИЧ/ВГВ, не получавших ранее терапии ламивудином, нет. Энтекавир не оценивали у пациентов с коинфекцией ВИЧ/ВГВ, которые не получали одновременно эффективного лечения ВИЧ ( см «Меры предосторожности»).
Таблица 8.
Вирусологические и биохимические конечные точки на 24-й нед, исследование AI463038.
| Параметр | Энтекавир 1 мг (n=51)1 | Плацебо (n=17)1 |
| ДНК ВГВ2 | ||
| Пропорция не определяется (<300 копий/мл) | 6% | 0 |
| Среднее изменение от исходного уровня (log10 копий/мл) | −3,65 | +0,11 |
| Нормализация АЛТ (≤1 ВГН) | 34%3 | 8%3 |
1 Все пациенты также получали схему ВААРТ, содержащую ламивудин.
2 Roche сOBAS Amplicor PCR assay (нижний предел количественного определения = 300 копий/мл).
3 Процент пациентов с аномальным уровнем АЛТ (>1±ВГН) на исходном уровне, которые достигли нормализации АЛТ (n=35 для энтекавира и n=12 для плацебо).
Для пациентов, которым первоначально был назначен энтекавир, в конце открытой фазы (48-я нед) 8% пациентов имели ДНК ВГВ <300 копий/мл по данным ПЦР, среднее изменение от исходного уровня ДНК ВГВ по данным ПЦР составило −4,2 log10 копий/мл, и у 37% пациентов с аномальным уровнем АЛТ на исходном уровне уровень АЛТ нормализовался (≤1 ВГН).
Исследования у взрослых пациентов продолжительностью более 48 нед.
Оптимальная продолжительность терапии энтекавиром неизвестна. Согласно установленным протоколом критериям клинических испытаний фазы 3, пациенты прекращали лечение энтекавиром или ламивудином через 52 нед в соответствии с определением ответа, основанным на вирусологической супрессии ВГВ (<0,7 МЕq/мл по анализу bДНК) и потере HBeAg (у HBeAg-положительных пациентов) или АЛТ <1,25 ВГН (у HBeAg-отрицательных пациентов) на 48-й нед.
Пациенты, которые достигли вирусологической супрессии, но не имели серологического ответа (HBeAg-положительные) или не достигли уровня АЛТ <1,25 ВГН (HBeAg-отрицательные), продолжали слепое дозирование в течение 96 нед или до тех пор, пока не были достигнуты критерии ответа. Эти руководящие принципы ведения пациентов, определенные протоколом, не предназначены для использования в клинической практике.
Пациенты, ранее не принимавшие нуклеозидные ингибиторы.
Из HBeAg-позитивных пациентов, ранее не получавших нуклеозидные ингибиторы (исследование AI463022), 243 (69%) пациентов, получавших энтекавир, и 164 (46%) пациентов, получавших ламивудин, продолжали слепое лечение до 96 нед. Из тех, кто продолжал слепое лечение в течение 2-го года, у 180 (74%) пациентов, получавших энтекавир, и 60 (37%) пациентов, получавших ламивудин, в конце дозирования (до 96 нед) ДНК ВГВ достигла <300 копий/мл по данным ПЦР. 193 (79%) испытуемых, получавших энтекавир, достигли уровня АЛТ ≤1±ВГН по сравнению со 112 (68%) пациентами, получавшими ламивудин, а сероконверсия HBeAg произошла у 26 (11%) пациентов, получавших энтекавир, и 20 (12%) пациентов, получавших ламивудин.
Из HBeAg-позитивных пациентов, ранее не получавших нуклеозидные ингибиторы, 74 (21%) пациента, получавших энтекавир, и 67 (19%) пациентов, получавших ламивудин, соответствовали определению ответа на 48-й нед, прекратили прием исследуемых ЛС и наблюдались после прекращения лечения в течение 24 нед. Среди респондентов ответивших на энтекавир, 26 (35%) испытуемых имели ДНК ВГВ <300 копий/мл, 55 (74%) испытуемых имели АЛТ ≤1 ВГН, и у 56 (76%) испытуемых была устойчивая сероконверсия HBeAg в конце периода наблюдения. Среди респондентов, ответивших на ламивудин, у 20 (30%) пациентов ДНК ВГВ была <300 копий/мл, у 41 (61%) испытуемых наблюдался уровень АЛТ ≤1 ВГН, а у 47 (70%) пациентов к концу периода наблюдения сохранялась сероконверсия HBeAg.
Из HBeAg-отрицательных пациентов, ранее не получавших нуклеозидные ингибиторы (исследование AI463027), 26 (8%) пациентов, получавших энтекавир, и 28 (9%) пациентов, получавших ламивудин, продолжали слепое лечение до 96 нед. В этой небольшой когорте, продолжающей лечение в течение 2-го года, 22 получавших энтекавир пациента и 16 пациентов, получавших ламивудин, имели ДНК ВГВ <300 копий/мл по данным ПЦР, а 7 и 6 пациентов соответственно имели АЛТ ≤1±ВГН в конце дозирования (до 96 нед).
Из HBeAg-отрицательных пациентов, ранее не принимавших нуклеозидные ингибиторы, 275 (85%) пациентов, принимавших энтекавир, и 245 (78%) пациентов, принимавших ламивудин, соответствовали определению ответа на 48-й нед, прекратили прием исследуемых ЛС и наблюдались после прекращения лечения в течение 24 нед. В этой когорте очень мало пациентов в каждой группе лечения имели ДНК ВГВ <300 копий/мл по данным ПЦР в конце периода наблюдения. В конце периода наблюдения у 126 (46%) пациентов, получавших энтекавир, и 84 (34%) пациентов, получавших ламивудин, был уровень АЛТ ≤1±ВГН.
Ламивудинрезистентные пациенты.
Из ламивудинрезистентных пациентов (исследование AI463026), 77 (55%) пациентов, принимавших энтекавир, и 3 (2%) пациента, принимавших ламивудин, продолжали слепое лечение до 96 нед. В этой когорте принимавших энтекавир пациентов 31 (40%) пациент достиг уровня ДНК ВГВ <300 копий/мл, 62 (81%) пациента имели АЛТ ≤1 ВГН, а 8 (10%) пациентов продемонстрировали сероконверсию HBeAg в конце дозирования.
Результаты у педиатрических пациентов.
Фармакокинетика, безопасность и противовирусная активность энтекавира у педиатрических пациентов первоначально оценивалась в исследовании AI463028. Двадцать четыре HBeAg-положительных педиатрических пациента от 2 до 18 лет с компенсированной хронической инфекцией гепатита в и повышенным уровнем АЛТ принимали энтекавир 0,015 мг/кг (до 0,5 мг) или 0,03 мг/кг (до 1 мг) 1 раз в сутки. Пятьдесят восемь процентов (14/24) пациентов, ранее не получавших лечения, и 47% (9/19) пациентов, получавших ламивудин, достигли уровня ДНК ВГВ <50 МЕ/мл на 48-й нед, а уровень АЛТ нормализовался у 83% (20/24) ранее не леченных пациентов и 95% (18 из 19) пациентов, получавших ламивудин.
Безопасность и противовирусная эффективность были подтверждены в исследовании AI463189, исследовании энтекавира у 180 педиатрических пациентов от 2 до 18 лет, ранее не получавших лечение ингибиторами нуклеозидов, с HBeAg-положительной хронической инфекцией гепатита в, компенсированным заболеванием печени и повышенным уровнем АЛТ. Пациенты были рандомизированы в соотношении 2:1 для получения слепого лечения энтекавиром от 0,015 мг/кг до 0,5 мг/сут (n=120) или плацебо (n=60). Рандомизация была стратифицирована по возрастным группам (от 2 до 6 лет, от >6 до 12 лет и от >12 до <18 лет). Исходные демографические данные и характеристики заболевания ВГВ были сопоставимы в двух группах лечения и между возрастными когортами. На момент начала исследования среднее значение ДНК ВГВ составляло 8,1 log10 МЕ/мл, а средний уровень АЛТ - 103 Ед/л. Первичная конечная точка эффективности представляла собой совокупность сероконверсии HBeAg и сывороточной ДНК ВГВ <50 МЕ/мл на 48-й нед, оцененных у первых 123 пациентов, достигших 48 нед лечения слепым методом. Двадцать четыре процента (20/82) пациентов в группе, получавшей энтекавир, и 2% (1/41) пациентов в группе, получавшей плацебо, достигли первичной конечной точки. 46% (38/82) пациентов, получавших энтекавир, и 2% (1/41) пациентов, получавших плацебо, достигли уровня ДНК ВГВ <50 МЕ/мл на 48-й нед. Нормализация АЛТ наблюдалась у 67% (55/82) пациентов, получавших энтекавир, и 22% (9/41) пациентов, получавших плацебо; 24% (20/82) пациентов, получавших энтекавир, и 12% (5/41) пациентов, получавших плацебо, имели сероконверсию HBeAg.
|
|
Показания к применению
Лечение хронического вирусного гепатита В у взрослых и детей в возрасте 2 лет и старше с признаками активной репликации вируса и либо свидетельствами стойкого повышения сывороточных аминотрансфераз (АЛТ или АСТ). либо гистологических признаков активного заболевания.
Противопоказания
Нет.
При беременности и кормлении грудью
Беременность.
Регистр беременностей.
Существует регистр беременностей, в котором отслеживаются исходы беременности у женщин, принимавших энтекавир во время беременности (Antiretroviral Pregnancy Registry, APR, Регистр беременных по антиретровирусным препаратам в США). Медицинским работникам рекомендуется регистрировать пациенток в этом регистре.
Резюме рисков.
Данных об ожидаемой беременности из APR недостаточно для адекватной оценки риска врожденных дефектов, выкидыша или неблагоприятных исходов для матери или плода. Применение энтекавира во время беременности было оценено у ограниченного числа женщин, о которых сообщалось в APR, и количество экспозиций энтекавира недостаточно для оценки риска по сравнению с контрольной группой населения. Расчетный фоновый уровень основных врожденных дефектов составляет 2,7% в контрольной группе популяции США, по данным Metropolitan Atlanta сongenital Defects Program (MACDP). О частоте выкидышей в APR не сообщалось. При любой беременности существует фоновый риск врожденного порока, потери или других неблагоприятных исходов. В общей популяции США оценочный фоновый риск выкидыша при клинически признанной беременности составляет 15-20%.
В исследованиях репродукции у животных не наблюдалось неблагоприятных эффектов энтекавира на развитие при клинически значимых экспозициях. Не наблюдалось токсичности для развития при системной экспозиции (AUC), примерно в 25 (крысы) и 200 (кролики) раз больше экспозиции при МРДЧ 1 мг/сут.
Грудное вскармливание.
Резюме рисков.
Неизвестно, присутствует ли энтекавир в грудном молоке женщин, влияет ли на продукцию грудного молока или оказывает влияние на младенца, находящегося на грудном вскармливании. При применении у лактирующих крыс энтекавир присутствовал в молоке ( см Данные). Следует учитывать преимущества грудного вскармливания для развития и здоровья наряду с клинической потребностью матери в энтекавире и любыми потенциальными побочными эффектами энтекавира или основного состояния матери для грудного ребенка.
Данные. Энтекавир экскретировался в молоко лактирующих крыс после однократного перорального приема дозы 10 мг/кг в 7-й день лактации. Содержание энтекавира в молоке составляло примерно 25% от такового в материнской плазме (на основе AUC).
Регистр беременностей.
Существует регистр беременностей, в котором отслеживаются исходы беременности у женщин, принимавших энтекавир во время беременности (Antiretroviral Pregnancy Registry, APR, Регистр беременных по антиретровирусным препаратам в США). Медицинским работникам рекомендуется регистрировать пациенток в этом регистре.
Резюме рисков.
Данных об ожидаемой беременности из APR недостаточно для адекватной оценки риска врожденных дефектов, выкидыша или неблагоприятных исходов для матери или плода. Применение энтекавира во время беременности было оценено у ограниченного числа женщин, о которых сообщалось в APR, и количество экспозиций энтекавира недостаточно для оценки риска по сравнению с контрольной группой населения. Расчетный фоновый уровень основных врожденных дефектов составляет 2,7% в контрольной группе популяции США, по данным Metropolitan Atlanta сongenital Defects Program (MACDP). О частоте выкидышей в APR не сообщалось. При любой беременности существует фоновый риск врожденного порока, потери или других неблагоприятных исходов. В общей популяции США оценочный фоновый риск выкидыша при клинически признанной беременности составляет 15-20%.
В исследованиях репродукции у животных не наблюдалось неблагоприятных эффектов энтекавира на развитие при клинически значимых экспозициях. Не наблюдалось токсичности для развития при системной экспозиции (AUC), примерно в 25 (крысы) и 200 (кролики) раз больше экспозиции при МРДЧ 1 мг/сут.
Грудное вскармливание.
Резюме рисков.
Неизвестно, присутствует ли энтекавир в грудном молоке женщин, влияет ли на продукцию грудного молока или оказывает влияние на младенца, находящегося на грудном вскармливании. При применении у лактирующих крыс энтекавир присутствовал в молоке ( см Данные). Следует учитывать преимущества грудного вскармливания для развития и здоровья наряду с клинической потребностью матери в энтекавире и любыми потенциальными побочными эффектами энтекавира или основного состояния матери для грудного ребенка.
Данные. Энтекавир экскретировался в молоко лактирующих крыс после однократного перорального приема дозы 10 мг/кг в 7-й день лактации. Содержание энтекавира в молоке составляло примерно 25% от такового в материнской плазме (на основе AUC).
Побочные эффекты
Следующие побочные реакции обсуждаются в другом разделе.
- Обострения гепатита после прекращения лечения ( см «Меры предосторожности»).
- Лактат-ацидоз и тяжелая гепатомегалия со стеатозом ( см «Меры предосторожности»).
Опыт клинических испытаний.
Поскольку клинические испытания проводятся с различным набором условий. частота встречаемости побочных реакций. наблюдаемых в этих испытаниях. не может непосредственно сравниваться с частотой в других клинических испытаниях и может не отражать наблюдаемую в клинической практике.
Опыт клинических испытаний у взрослых.
Компенсированное поражение печени.
Оценка побочных реакций основана на четырех исследованиях (AI463014. AI463022. AI463026 и AI463027). в которых 1720 пациентов с хроническим гепатитом в и компенсированным заболеванием печени получали двойную слепую терапию энтекавиром 0,5 мг/сут (n=679). энтекавиром 1 мг/сут (n=183) или ламивудином (n=858) в период до 2 лет. Медиана продолжительности терапии составила 69 нед для пациентов. получавших энтекавир. и 63 нед для пациентов. получавших ламивудин. в исследованиях AI463022 и AI463027 и 73 нед для пациентов. получавших энтекавир. и 51 нед для пациентов. получавших ламивудин. в исследованиях AI463026 и AI463014. Профили безопасности энтекавира и ламивудина в этих исследованиях были сопоставимы.
Наиболее частыми побочными реакциями любой степени тяжести (≥3%). по крайней мере. возможно. связанными с исследуемым ЛС. у пациентов. получавших энтекавир. были головная боль. утомляемость. головокружение и тошнота. Наиболее частыми побочными реакциями у пациентов, получавших ламивудин, были головная боль, утомляемость и головокружение. Один процент пациентов, получавших энтекавир, в этих четырех исследованиях по сравнению с 4% пациентов, получавших ламивудин, прекратили лечение из-за побочных эффектов или аномальных результатов лабораторных тестов.
Клинические побочные реакции средней-тяжелой степени выраженности. которые по крайней мере. возможно. были связаны с лечением во время терапии в четырех клинических исследованиях. в которых энтекавир сравнивали с ламивудином. представлены в таблице 9.
Таблица 9.
Клинические побочные реакции средней-тяжелой интенсивности (степени 2-4), зарегистрированные в четырех клинических испытаниях энтекавира в течение 2 лет.
1 Исследования AI463022 и AI463027.
2 Включает исследование AI463026 и группы лечения энтекавиром 1 мг и ламивудином в исследовании AI463014. многонациональном рандомизированном двойном слепом исследовании фазы 2. в котором применяли три дозы энтекавира (0,1. 0,5 и 1 мг) 1 раз в день в сравнении с продолжением приема ламивудина 100 мг 1 раз в день в течение периода до 52 нед у пациентов. у которых отмечалась рецидивирующая виремия при терапии ламивудином.
3 Включает события возможной, вероятной, определенной или неизвестной связи с режимом лечения.
Отклонения лабораторных тестов.
Частота отдельных возникших в связи с лечением отклонений лабораторных показателей, выявленных во время терапии в четырех клинических испытаниях энтекавира по сравнению с терапией ламивудином, показана в таблице 10.
Таблица 10.
Отклонения некоторых лабораторных показателей, появившиеся при лечении, о которых сообщалось в четырех клинических испытаниях энтекавира в течение 2 лет.
1 Исследования AI463022 и AI463027.
2 Включает исследование AI463026 и группы лечения энтекавиром 1 мг и ламивудином в исследовании AI463014. многонациональном рандомизированном двойном слепом исследования фазы 2. в котором применяли три дозы энтекавира (0,1. 0,5 и 1 мг) 1 раз в день в сравнении с продолжением приема ламивудина 100 мг 1 раз в день в течение периода до 52 нед у пациентов с рецидивирующей виремией при терапии ламивудином.
3 Включает гематологию, стандартные биохимические анализы, функциональные тесты почек и печени, ферменты поджелудочной железы и общий анализ мочи.
4 Степень 3 = 3+. значительная. ≥500 мг/дл. степень 4 = 4+. выраженная. тяжелая.
5 Степень 3 = 3+. значительная. степень 4 = ≥4+. выраженная. тяжелая. большинство.
Значение во время лечения ухудшилось по сравнению с исходным уровнем до степени 3 или 4 по всем параметрам. кроме альбумина (любое значение во время лечения <2,5 г/дл). подтвержденного повышения креатинина ≥0,5 мг/дл и АЛТ >10 ВГН и >2 от исходного уровня.
Среди пациентов, получавших энтекавир в этих исследованиях, повышение уровня АЛТ во время лечения более чем в 10 раз выше ВГН и более чем в 2 раза больше исходного уровня, как правило, разрешалось при продолжении лечения. Большинство этих обострений было ассоциировано со снижением вирусной нагрузки в ≥2 log10/мл, которое предшествовало повышению уровня АЛТ или совпадало с ним. Во время лечения рекомендуется периодический мониторинг функции печени.
Обострения гепатита после прекращения лечения.
Обострение гепатита или скачок АЛТ определялось как АЛТ. более чем в 10 раз превышающее ВГН и более чем в 2 раза превышающее референсный уровень у пациента (минимум исходного уровня или последнее измерение в конце дозирования). Для всех пациентов, которые прекратили лечение (независимо от причины), в таблице 11 представлена доля пациентов в каждом исследовании, у которых после лечения наблюдался скачок АЛТ. В этих исследованиях подгруппе пациентов было разрешено прекратить лечение на 52 неделе или позже, если они достигли ответа на терапию, определенного протоколом. Если отменить энтекавир без учета реакции на лечение, частота обострений после лечения может быть выше ( см «Меры предосторожности»).
Таблица 11.
Обострения гепатита во время последующего наблюдения без лечения у участников исследований AI463022, AI463027 и AI463026.
1 Референсный уровень - минимум исходного уровня или последнее измерение в конце дозирования. Медиана времени без лечения до обострения составила 23 нед для пациентов, получавших энтекавир, и 10 нед для пациентов, получавших ламивудин.
Декомпенсированное заболевание печени.
Исследование AI463048 представляло собой рандомизированное открытое исследование энтекавира в дозе 1 мг 1 раз в день в сравнении с адефовира дипивоксилом в дозе 10 мг 1 раз в день в течение периода до 48 нед у взрослых пациентов с хронической инфекцией ВГВ и доказательством печеночной декомпенсации.определенном как оценка 7 или выше по шкале ЧТП ( см Клинические исследования). Среди 102 пациентов. получавших энтекавир. наиболее частыми нежелательными явлениями. возникшими в ходе лечения. любой степени тяжести. независимо от причинной связи. развившимися в течение 48 нед. были периферические отеки (16%). асцит (15%). пирексия (14%). печеночная энцефалопатия (10%) и инфекции верхних дыхательных путей (10%). Клинические побочные реакции, не указанные в таблице 9, которые наблюдались в течение периода 48 нед, включали снижение уровня бикарбоната в крови (2%) и почечную недостаточность (<1%).
Восемнадцать из 102 (18%) пациентов, получавших энтекавир, и 18/89 (20%) пациентов, получавших адефовира дипивоксил, умерли в течение первых 48 нед терапии. Большинство смертей (11 в группе энтекавира и 16 в группе адефовира дипивоксила) были вызваны причинами. связанными с поражением печени. таким как печеночная недостаточность. печеночная энцефалопатия. гепаторенальный синдром и кровотечение из верхних отделов ЖКТ. Частота гепатоцеллюлярной карциномы (ГЦК) в течение 48 нед составила 6% (6/102) у пациентов, получавших энтекавир, и 8% (7/89) у пациентов, получавших адефовира дипивоксил. Пять процентов пациентов в любой группе лечения прекратили терапию из-за развития нежелательного явления в течение 48 нед.
Ни у одного из пациентов в обеих группах лечения не наблюдалось обострения печеночной недостаточности (АЛТ >2 от исходного уровня и >10 ВГН) в течение 48 нед. Одиннадцать из 102 (11%) пациентов, получавших энтекавир, и 11/89 (13%) пациентов, получавших адефовира дипивоксил, имели подтвержденное повышение креатинина сыворотки на 0,5 мг/дл в течение 48 нед.
Коинфекция ВИЧ /гепатит В.
Профиль безопасности энтекавира в дозе 1 мг (n=51) у пациентов с коинфекцией ВИЧ/гепатит В. включенных в исследование AI463038. был сходен с профилем безопасности в группе плацебо (n=17) в течение 24 нед слепого лечения и сходен с профилем. наблюдаемым у пациентов. не инфицированных ВИЧ ( см «Меры предосторожности»).
Реципиенты с трансплантатом печени.
Среди 65 пациентов. получавших энтекавир. частота и характер нежелательных явлений соответствовали тем. которые ожидались у пациентов. перенесших трансплантацию печени. и известному профилю безопасности энтекавира.
Опыт клинических испытаний в педиатрии.
Безопасность энтекавира у педиатрических пациентов от 2 до 18 лет основана на результатах двух клинических испытаний с участием пациентов с хронической инфекцией ВГВ (одно фармакокинетическое исследование фазы 2 (AI463028) и одно исследование фазы 3 (AI463189). Эти испытания предоставили опыт с участием 168 HBeAg-положительных пациентов, получавших энтекавир с медианой продолжительности 72 нед. Побочные реакции, наблюдавшиеся у педиатрических пациентов, получавших лечение энтекавиром, соответствовали тем, которые наблюдались в клинических испытаниях энтекавира у взрослых. Неблагоприятные реакции. о которых сообщалось более чем у 1% педиатрических пациентов. включали боль в животе. случаи сыпи. плохие вкусовые характеристики («ненормальный вкус продукта»). тошноту. диарею и рвоту.
Постмаркетинговый опыт.
Данные долгосрочного наблюдательного исследования.
Исследование AI463080 было рандомизированным всемирным наблюдательным открытым исследованием фазы 4 для оценки долгосрочных рисков и преимуществ лечения энтекавиром (0,5 или 1 мг/сут) по сравнению с другим стандартным лечением нуклеотидными/нуклеозидными аналогами у пациентов с хронической ВГВ-инфекцией.
В общей сложности 12378 пациентов получали лечение энтекавиром (n=6216) или другое лечение гепатита В с использованием нуклеоз(т)идов (не-энтекавир (ETV) (n=6162). Пациентов оценивали на начальном этапе, а затем каждые 6 мес в течение 10 лет. Основными клиническими исходами. оцененными в ходе исследования. были злокачественные новообразования в целом. прогрессирование гепатита в. ГЦК. злокачественные новообразования. не связанные с ГЦК. и смерть. Исследование показало. что прием энтекавира не был значимо связан с повышением риска злокачественных новообразований по сравнению с другим стандартным лечением гепатита В нуклеоз(т)идами. что оценивалось либо по совокупной конечной точке злокачественных новообразований в целом. либо по индивидуальной конечной точке злокачественных новообразований без ГЦК. Наиболее частым злокачественным новообразованием как в группе энтекавира, так и в группе не-ETV была ГЦК, за которой следовали злокачественные новообразования ЖКТ. Данные также показали. что длительное применение энтекавира не было ассоциировано с более низкой частотой прогрессирования ВГВ-заболевания или более низким уровнем смертности в целом по сравнению с другими ВГВ-нуклеоз(т)идами.Основные оценки клинических исходов событий представлены в таблице 12.
Таблица 12.
Основной анализ сроков до установленных событий - рандомизированные леченые пациенты.
Анализы были стратифицированы по географическому региону и предшествующему опыту с нуклео(т)идами ВГВ.
N=общее количество пациентов.
1 Злокачественные новообразования в целом - это комбинация событий ГЦК или злокачественного новообразования, отличного от ГЦК. Прогрессирование гепатита В, связанное с поражением печени, представляет собой комбинацию событий смерти, связанной с поражением печени, ГЦК или прогрессированием гепатита В без ГЦК.
2 95,03% ДИ для злокачественных новообразований в целом, смерти и прогрессирования гепатита В, связанного с поражением печени ВГВ; 95% ДИ для злокачественных новообразований без ГЦК и ГЦК.
3 У одного пациента до лечения был случай ГЦК, и он был исключен из анализа.
Ограничения исследования включали популяционные изменения в течение длительного периода наблюдения и более частые изменения лечения после рандомизации в группе не-ETV. Кроме того. исследование было недостаточно мощным. чтобы продемонстрировать разницу в частоте злокачественных новообразований. не связанных с ГЦК. из-за более низкой. чем ожидалось. фоновой частоты.
Неблагоприятные реакции из постмаркетинговых спонтанных отчетов.
Сообщалось о следующих побочных реакциях во время постмаркетингового применения энтекавира. Поскольку об этих реакциях сообщалось добровольно от популяции неизвестного размера, невозможно достоверно оценить их частоту или установить причинную связь с воздействием энтекавира.
Со стороны иммунной системы. Анафилактоидная реакция.
Со стороны метаболизма и нарушения питания. Лактат-ацидоз.
Со стороны печени и желчевыводящих путей. Повышение уровня трансаминаз.
Со стороны кожи и подкожной клетчатки. Алопеция, сыпь.
- Обострения гепатита после прекращения лечения ( см «Меры предосторожности»).
- Лактат-ацидоз и тяжелая гепатомегалия со стеатозом ( см «Меры предосторожности»).
Опыт клинических испытаний.
Поскольку клинические испытания проводятся с различным набором условий. частота встречаемости побочных реакций. наблюдаемых в этих испытаниях. не может непосредственно сравниваться с частотой в других клинических испытаниях и может не отражать наблюдаемую в клинической практике.
Опыт клинических испытаний у взрослых.
Компенсированное поражение печени.
Оценка побочных реакций основана на четырех исследованиях (AI463014. AI463022. AI463026 и AI463027). в которых 1720 пациентов с хроническим гепатитом в и компенсированным заболеванием печени получали двойную слепую терапию энтекавиром 0,5 мг/сут (n=679). энтекавиром 1 мг/сут (n=183) или ламивудином (n=858) в период до 2 лет. Медиана продолжительности терапии составила 69 нед для пациентов. получавших энтекавир. и 63 нед для пациентов. получавших ламивудин. в исследованиях AI463022 и AI463027 и 73 нед для пациентов. получавших энтекавир. и 51 нед для пациентов. получавших ламивудин. в исследованиях AI463026 и AI463014. Профили безопасности энтекавира и ламивудина в этих исследованиях были сопоставимы.
Наиболее частыми побочными реакциями любой степени тяжести (≥3%). по крайней мере. возможно. связанными с исследуемым ЛС. у пациентов. получавших энтекавир. были головная боль. утомляемость. головокружение и тошнота. Наиболее частыми побочными реакциями у пациентов, получавших ламивудин, были головная боль, утомляемость и головокружение. Один процент пациентов, получавших энтекавир, в этих четырех исследованиях по сравнению с 4% пациентов, получавших ламивудин, прекратили лечение из-за побочных эффектов или аномальных результатов лабораторных тестов.
Клинические побочные реакции средней-тяжелой степени выраженности. которые по крайней мере. возможно. были связаны с лечением во время терапии в четырех клинических исследованиях. в которых энтекавир сравнивали с ламивудином. представлены в таблице 9.
Таблица 9.
Клинические побочные реакции средней-тяжелой интенсивности (степени 2-4), зарегистрированные в четырех клинических испытаниях энтекавира в течение 2 лет.
| Система организма/побочная реакция | Пациенты, ранее не получавшие нуклеозидные ингибиторы1 | Пациенты, резистентные к ламивудину2 | ||
| Энтекавир 0,5 мг (n=679), % | Ламивудин 100 мг (n=668), % | Энтекавир 1 мг (n=183), % | Ламивудин 100 мг (n=190), % | |
| Любая побочная реакция 2-4-й степени3 | 15 | 18 | 22 | 23 |
| Со стороны ЖКТ | ||||
| Диарея | <1 | 0 | 1 | 0 |
| Диспепсия | <1 | <1 | 1 | 0 |
| Тошнота | <1 | <1 | <1 | 2 |
| Рвота | <1 | <1 | <1 | 0 |
| Общие | ||||
| Усталость | 1 | 1 | 3 | 3 |
| Со стороны нервной системы | ||||
| Головная боль | 2 | 2 | 4 | 1 |
| Головокружение | <1 | <1 | 0 | 1 |
| Сонливость | <1 | <1 | 0 | 0 |
| Нарушение психики | ||||
| Инсомния | <1 | <1 | 0 | <1 |
1 Исследования AI463022 и AI463027.
2 Включает исследование AI463026 и группы лечения энтекавиром 1 мг и ламивудином в исследовании AI463014. многонациональном рандомизированном двойном слепом исследовании фазы 2. в котором применяли три дозы энтекавира (0,1. 0,5 и 1 мг) 1 раз в день в сравнении с продолжением приема ламивудина 100 мг 1 раз в день в течение периода до 52 нед у пациентов. у которых отмечалась рецидивирующая виремия при терапии ламивудином.
3 Включает события возможной, вероятной, определенной или неизвестной связи с режимом лечения.
Отклонения лабораторных тестов.
Частота отдельных возникших в связи с лечением отклонений лабораторных показателей, выявленных во время терапии в четырех клинических испытаниях энтекавира по сравнению с терапией ламивудином, показана в таблице 10.
Таблица 10.
Отклонения некоторых лабораторных показателей, появившиеся при лечении, о которых сообщалось в четырех клинических испытаниях энтекавира в течение 2 лет.
| Тест | Пациенты, ранее не получавшие нуклеозидные ингибиторы1 | Пациенты, резистентные к ламивудину2 | ||
| Энтекавир 0,5 мг (n=679), % | Ламивудин 100 мг (n=668), % | Энтекавир 1 мг (n=183), % | Ламивудин 100 мг (n=190), % | |
| Любое отклонение лабораторных показателей 3-4-й степени3 | 35 | 36 | 37 | 45 |
| АЛТ >10 ВГН и >2 от исходного уровня | 2 | 4 | 2 | 11 |
| АЛТ >5 ВГН | 11 | 16 | 12 | 24 |
| Альбумин <2,5 г/дл | <1 | <1 | 0 | 2 |
| Общий билирубин ≥2,5 ВГН | 2 | 2 | 3 | 2 |
| Липаза >2,1 ВГН | 7 | 6 | 7 | 7 |
| Креатинин >3 ВГН | 0 | 0 | 0 | 0 |
| Подтвержденное повышение креатинина ≥0,5 мг/дл | 1 | 1 | 2 | 1 |
| Гипергликемия натощак >250 мг/дл | 2 | 1 | 3 | 1 |
| Глюкозурия4 | 4 | 3 | 4 | 6 |
| Гематурия5 | 9 | 10 | 9 | 6 |
| Тромбоциты <50000/мм3 | <1 | <1 | <1 | <1 |
1 Исследования AI463022 и AI463027.
2 Включает исследование AI463026 и группы лечения энтекавиром 1 мг и ламивудином в исследовании AI463014. многонациональном рандомизированном двойном слепом исследования фазы 2. в котором применяли три дозы энтекавира (0,1. 0,5 и 1 мг) 1 раз в день в сравнении с продолжением приема ламивудина 100 мг 1 раз в день в течение периода до 52 нед у пациентов с рецидивирующей виремией при терапии ламивудином.
3 Включает гематологию, стандартные биохимические анализы, функциональные тесты почек и печени, ферменты поджелудочной железы и общий анализ мочи.
4 Степень 3 = 3+. значительная. ≥500 мг/дл. степень 4 = 4+. выраженная. тяжелая.
5 Степень 3 = 3+. значительная. степень 4 = ≥4+. выраженная. тяжелая. большинство.
Значение во время лечения ухудшилось по сравнению с исходным уровнем до степени 3 или 4 по всем параметрам. кроме альбумина (любое значение во время лечения <2,5 г/дл). подтвержденного повышения креатинина ≥0,5 мг/дл и АЛТ >10 ВГН и >2 от исходного уровня.
Среди пациентов, получавших энтекавир в этих исследованиях, повышение уровня АЛТ во время лечения более чем в 10 раз выше ВГН и более чем в 2 раза больше исходного уровня, как правило, разрешалось при продолжении лечения. Большинство этих обострений было ассоциировано со снижением вирусной нагрузки в ≥2 log10/мл, которое предшествовало повышению уровня АЛТ или совпадало с ним. Во время лечения рекомендуется периодический мониторинг функции печени.
Обострения гепатита после прекращения лечения.
Обострение гепатита или скачок АЛТ определялось как АЛТ. более чем в 10 раз превышающее ВГН и более чем в 2 раза превышающее референсный уровень у пациента (минимум исходного уровня или последнее измерение в конце дозирования). Для всех пациентов, которые прекратили лечение (независимо от причины), в таблице 11 представлена доля пациентов в каждом исследовании, у которых после лечения наблюдался скачок АЛТ. В этих исследованиях подгруппе пациентов было разрешено прекратить лечение на 52 неделе или позже, если они достигли ответа на терапию, определенного протоколом. Если отменить энтекавир без учета реакции на лечение, частота обострений после лечения может быть выше ( см «Меры предосторожности»).
Таблица 11.
Обострения гепатита во время последующего наблюдения без лечения у участников исследований AI463022, AI463027 и AI463026.
| Пациенты с повышением АЛТ >10 ВГН и better 2 раза превышающее референсный уровень1 | ||
| Энтекавир | Ламивудин | |
| Пациенты, ранее не получавшие нуклеозидные ингибиторы | ||
| HBeAg-позитивные | − | − |
| HBeAg-негативные | 24/302 (8%) | 30/270 (11%) |
| Ламивудинрезистентные | 6/52 (12%) | 0/16 |
1 Референсный уровень - минимум исходного уровня или последнее измерение в конце дозирования. Медиана времени без лечения до обострения составила 23 нед для пациентов, получавших энтекавир, и 10 нед для пациентов, получавших ламивудин.
Декомпенсированное заболевание печени.
Исследование AI463048 представляло собой рандомизированное открытое исследование энтекавира в дозе 1 мг 1 раз в день в сравнении с адефовира дипивоксилом в дозе 10 мг 1 раз в день в течение периода до 48 нед у взрослых пациентов с хронической инфекцией ВГВ и доказательством печеночной декомпенсации.определенном как оценка 7 или выше по шкале ЧТП ( см Клинические исследования). Среди 102 пациентов. получавших энтекавир. наиболее частыми нежелательными явлениями. возникшими в ходе лечения. любой степени тяжести. независимо от причинной связи. развившимися в течение 48 нед. были периферические отеки (16%). асцит (15%). пирексия (14%). печеночная энцефалопатия (10%) и инфекции верхних дыхательных путей (10%). Клинические побочные реакции, не указанные в таблице 9, которые наблюдались в течение периода 48 нед, включали снижение уровня бикарбоната в крови (2%) и почечную недостаточность (<1%).
Восемнадцать из 102 (18%) пациентов, получавших энтекавир, и 18/89 (20%) пациентов, получавших адефовира дипивоксил, умерли в течение первых 48 нед терапии. Большинство смертей (11 в группе энтекавира и 16 в группе адефовира дипивоксила) были вызваны причинами. связанными с поражением печени. таким как печеночная недостаточность. печеночная энцефалопатия. гепаторенальный синдром и кровотечение из верхних отделов ЖКТ. Частота гепатоцеллюлярной карциномы (ГЦК) в течение 48 нед составила 6% (6/102) у пациентов, получавших энтекавир, и 8% (7/89) у пациентов, получавших адефовира дипивоксил. Пять процентов пациентов в любой группе лечения прекратили терапию из-за развития нежелательного явления в течение 48 нед.
Ни у одного из пациентов в обеих группах лечения не наблюдалось обострения печеночной недостаточности (АЛТ >2 от исходного уровня и >10 ВГН) в течение 48 нед. Одиннадцать из 102 (11%) пациентов, получавших энтекавир, и 11/89 (13%) пациентов, получавших адефовира дипивоксил, имели подтвержденное повышение креатинина сыворотки на 0,5 мг/дл в течение 48 нед.
Коинфекция ВИЧ /гепатит В.
Профиль безопасности энтекавира в дозе 1 мг (n=51) у пациентов с коинфекцией ВИЧ/гепатит В. включенных в исследование AI463038. был сходен с профилем безопасности в группе плацебо (n=17) в течение 24 нед слепого лечения и сходен с профилем. наблюдаемым у пациентов. не инфицированных ВИЧ ( см «Меры предосторожности»).
Реципиенты с трансплантатом печени.
Среди 65 пациентов. получавших энтекавир. частота и характер нежелательных явлений соответствовали тем. которые ожидались у пациентов. перенесших трансплантацию печени. и известному профилю безопасности энтекавира.
Опыт клинических испытаний в педиатрии.
Безопасность энтекавира у педиатрических пациентов от 2 до 18 лет основана на результатах двух клинических испытаний с участием пациентов с хронической инфекцией ВГВ (одно фармакокинетическое исследование фазы 2 (AI463028) и одно исследование фазы 3 (AI463189). Эти испытания предоставили опыт с участием 168 HBeAg-положительных пациентов, получавших энтекавир с медианой продолжительности 72 нед. Побочные реакции, наблюдавшиеся у педиатрических пациентов, получавших лечение энтекавиром, соответствовали тем, которые наблюдались в клинических испытаниях энтекавира у взрослых. Неблагоприятные реакции. о которых сообщалось более чем у 1% педиатрических пациентов. включали боль в животе. случаи сыпи. плохие вкусовые характеристики («ненормальный вкус продукта»). тошноту. диарею и рвоту.
Постмаркетинговый опыт.
Данные долгосрочного наблюдательного исследования.
Исследование AI463080 было рандомизированным всемирным наблюдательным открытым исследованием фазы 4 для оценки долгосрочных рисков и преимуществ лечения энтекавиром (0,5 или 1 мг/сут) по сравнению с другим стандартным лечением нуклеотидными/нуклеозидными аналогами у пациентов с хронической ВГВ-инфекцией.
В общей сложности 12378 пациентов получали лечение энтекавиром (n=6216) или другое лечение гепатита В с использованием нуклеоз(т)идов (не-энтекавир (ETV) (n=6162). Пациентов оценивали на начальном этапе, а затем каждые 6 мес в течение 10 лет. Основными клиническими исходами. оцененными в ходе исследования. были злокачественные новообразования в целом. прогрессирование гепатита в. ГЦК. злокачественные новообразования. не связанные с ГЦК. и смерть. Исследование показало. что прием энтекавира не был значимо связан с повышением риска злокачественных новообразований по сравнению с другим стандартным лечением гепатита В нуклеоз(т)идами. что оценивалось либо по совокупной конечной точке злокачественных новообразований в целом. либо по индивидуальной конечной точке злокачественных новообразований без ГЦК. Наиболее частым злокачественным новообразованием как в группе энтекавира, так и в группе не-ETV была ГЦК, за которой следовали злокачественные новообразования ЖКТ. Данные также показали. что длительное применение энтекавира не было ассоциировано с более низкой частотой прогрессирования ВГВ-заболевания или более низким уровнем смертности в целом по сравнению с другими ВГВ-нуклеоз(т)идами.Основные оценки клинических исходов событий представлены в таблице 12.
Таблица 12.
Основной анализ сроков до установленных событий - рандомизированные леченые пациенты.
| Конечная точка1 | Число пациентов с событием | ||
| Энтекавир (n=6216) | Не-ETV (n=6162) | Отношение рисков энтекавир: не-ETV (ДИ2) | |
| Первичные конечные точки | |||
| Злокачественные новообразования в целом | 331 | 337 | 0,93 (0,8; 1,084) |
| Прогрессирование гепатита в, связанное с поражением печени | 350 | 375 | 0,89 (0,769; 1,03) |
| Смерть | 238 | 264 | 0,85 (0,713; 1,012) |
| Вторичные конечные точки | |||
| Злокачественные новообразования без ГЦК | 95 | 81 | 1,1 (0,817; 1,478) |
| ГЦК | 2403 | 263 | 0,87 (0,727; 1,032) |
Анализы были стратифицированы по географическому региону и предшествующему опыту с нуклео(т)идами ВГВ.
N=общее количество пациентов.
1 Злокачественные новообразования в целом - это комбинация событий ГЦК или злокачественного новообразования, отличного от ГЦК. Прогрессирование гепатита В, связанное с поражением печени, представляет собой комбинацию событий смерти, связанной с поражением печени, ГЦК или прогрессированием гепатита В без ГЦК.
2 95,03% ДИ для злокачественных новообразований в целом, смерти и прогрессирования гепатита В, связанного с поражением печени ВГВ; 95% ДИ для злокачественных новообразований без ГЦК и ГЦК.
3 У одного пациента до лечения был случай ГЦК, и он был исключен из анализа.
Ограничения исследования включали популяционные изменения в течение длительного периода наблюдения и более частые изменения лечения после рандомизации в группе не-ETV. Кроме того. исследование было недостаточно мощным. чтобы продемонстрировать разницу в частоте злокачественных новообразований. не связанных с ГЦК. из-за более низкой. чем ожидалось. фоновой частоты.
Неблагоприятные реакции из постмаркетинговых спонтанных отчетов.
Сообщалось о следующих побочных реакциях во время постмаркетингового применения энтекавира. Поскольку об этих реакциях сообщалось добровольно от популяции неизвестного размера, невозможно достоверно оценить их частоту или установить причинную связь с воздействием энтекавира.
Со стороны иммунной системы. Анафилактоидная реакция.
Со стороны метаболизма и нарушения питания. Лактат-ацидоз.
Со стороны печени и желчевыводящих путей. Повышение уровня трансаминаз.
Со стороны кожи и подкожной клетчатки. Алопеция, сыпь.
|
|
Взаимодействие
Метаболизм энтекавира оценивали в исследованиях in vitro >in vitro и in vivo >in vivo. Энтекавир не является субстратом, ингибитором или индуктором системы изоферментов цитохрома P450. В концентрациях, примерно в 10000 раз выше наблюдаемых у человека, энтекавир не ингибировал ни один из основных изоферментов человека - сYP1A2, сYP2C9, сYP2C19, сYP2D6, сYP3A4, сYP2B6 и сYP2E1. В концентрациях, примерно в 340 раз превышающих наблюдаемые у человека, энтекавир не индуцировал изоферменты человека - сYP1A2, сYP2C9, сYP2C19, сYP3A4, сYP3A5 и сYP2B6. Маловероятно, что на фармакокинетику энтекавира повлияет совместное применение с ЛС, которые метаболизируются, ингибируют или индуцируют систему изоферментов цитохрома Р450. Также маловероятно, что совместное применение энтекавира будет влиять на фармакокинетику известных субстратов сYP.
Фармакокинетика энтекавира и совместно применяемого ЛС в равновесном состоянии не изменялась в исследованиях взаимодействия энтекавира с ламивудином, адефовира дипивоксилом и тенофовиром.
Поскольку энтекавир преимущественно выводится почками ( см «Фармакология»), сочетанное применение энтекавира с ЛС, которые снижают функцию почек или конкурируют за активную канальцевую секрецию, может увеличить сывороточные концентрации как энтекавира, так и ЛС, принимаемого одновременно. Сочетанное применение энтекавира с ламивудином, адефовира дипивоксилом или тенофовиром не приводило к значимому взаимодействию. Эффекты одновременного применения энтекавира с другими ЛС, выводящимися почками или влияющими на функцию почек, не оценивали, необходим тщательный мониторинг состояния пациентов на предмет выявления нежелательных явлений, если энтекавир применяют вместе с такими ЛС.
Фармакокинетика энтекавира и совместно применяемого ЛС в равновесном состоянии не изменялась в исследованиях взаимодействия энтекавира с ламивудином, адефовира дипивоксилом и тенофовиром.
Поскольку энтекавир преимущественно выводится почками ( см «Фармакология»), сочетанное применение энтекавира с ЛС, которые снижают функцию почек или конкурируют за активную канальцевую секрецию, может увеличить сывороточные концентрации как энтекавира, так и ЛС, принимаемого одновременно. Сочетанное применение энтекавира с ламивудином, адефовира дипивоксилом или тенофовиром не приводило к значимому взаимодействию. Эффекты одновременного применения энтекавира с другими ЛС, выводящимися почками или влияющими на функцию почек, не оценивали, необходим тщательный мониторинг состояния пациентов на предмет выявления нежелательных явлений, если энтекавир применяют вместе с такими ЛС.
Передозировка
Симптомы. Имеется ограниченный опыт передозировки энтекавира у пациентов. У здоровых людей, получавших однократные дозы энтекавира до 40 мг или многократные дозы до 20 мг/сут в течение до 14 дней, не было увеличения или неожидаемых побочных эффектов.
Лечение. В случае передозировки должен проводиться мониторинг состояния пациента на предмет развития токсичности и при необходимости - проведение стандартного поддерживающего лечения.
После однократного приема энтекавира в дозе 1 мг за 4-часовой сеанс гемодиализа удалялось примерно 13% дозы энтекавира.
Лечение. В случае передозировки должен проводиться мониторинг состояния пациента на предмет развития токсичности и при необходимости - проведение стандартного поддерживающего лечения.
После однократного приема энтекавира в дозе 1 мг за 4-часовой сеанс гемодиализа удалялось примерно 13% дозы энтекавира.
Способ применения и дозы
Внутрь. Режим дозирования зависит от возраста, функции почек, состояния печени, указаний в анамнезе на лечение нуклеозидными ингибиторами.
Меры предосторожности применения
Тяжелые обострения гепатита В.
Сообщалось о тяжелых обострениях гепатита в у пациентов, прекративших прием ЛС для лечения гепатита в, включая энтекавир ( см «Побочные действия»). Необходим тщательный мониторинг функции печени с последующим клиническим и лабораторным наблюдением в течение не менее нескольких месяцев у пациентов, которые прекратили терапию против гепатита В. В случае необходимости возобновление приема ЛС для лечения гепатита В может быть оправдано.
Пациенты с коинфекцией гепатита В и ВИЧ.
Энтекавир не оценивали у пациентов с коинфекцией ВИЧ/ВГВ, которые одновременно не получали эффективного лечения ВИЧ. Ограниченный клинический опыт предполагает, что существует возможность развития устойчивости к нуклеозидным ингибиторам обратной транскриптазы ВИЧ, если энтекавир используется для лечения хронической вирусной инфекции гепатита в у пациентов с ВИЧ-инфекцией, которые не проходят лечение ( см Микробиология). Поэтому терапия энтекавиром не рекомендуется пациентам с коинфекцией ВИЧ/ВГВ, которые не получают ВААРТ. Перед началом терапии энтекавиром всем пациентам необходимо пройти тестирование на антитела к ВИЧ. Энтекавир не изучали как средство от ВИЧ-инфекции и он не рекомендуется для такого использования.
Лактат-ацидоз и тяжелая гепатомегалия со стеатозом.
Сообщалось о лактат-ацидозе и тяжелой гепатомегалии со стеатозом, включая фатальные случаи, при применении аналогов нуклеозидных ингибиторов , включая энтекавир, отдельно или в сочетании с антиретровирусными ЛС. Большинство этих случаев наблюдалось у женщин. Факторами риска могут быть ожирение и длительное использование нуклеозидных ингибиторов. Особую осторожность следует проявлять при назначении аналогов нуклеозидных ингибиторов любому пациенту с известными факторами риска заболевания печени; однако сообщалось также о случаях у пациентов без известных факторов риска.
Имеются сообщения о развитии лактат-ацидоза при использовании энтекавира, часто в связи с декомпенсацией функции печени, другими серьезными заболеваниями или лекарственным воздействием. Пациенты с декомпенсированным заболеванием печени могут иметь более высокий риск развития лактат-ацидоза. Лечение энтекавиром следует приостановить у любого пациента, у которого появляются клинические или лабораторные признаки, указывающие на развитие лактат-ацидоза или выраженную гепатотоксичность (которые могут включать гепатомегалию и стеатоз даже при отсутствии заметного повышения уровня трансаминаз).
Применение в педиатрии.
Энтекавир был оценен в двух клинических испытаниях у детей в возрасте 2 лет и старше с HBeAg-положительной хронической инфекцией ВГВ и компенсированным заболеванием печени. Экспозицию энтекавира у ранее не получавших терапию нуклеозидными ингибиторами и получавших ламивудин педиатрических пациентов в возрасте от 2 лет и старше с HBeAg-положительной хронической инфекцией ВГВ и компенсированным заболеванием печени, получающих 0,015 мг/кг (до 0,5 мг 1 раз в день) или 0,03 мг/кг (до 1 мг 1 раз в день) соответственно оценивали в исследовании AI463028. Безопасность и эффективность выбранной дозы у педиатрических пациентов, ранее не получавших лечения, были подтверждены в исследовании AI463189, рандомизированном плацебо-контролируемом испытании ( см «Показания», «Побочные действия», Фармакокинетика и Клинические исследования).
Имеются ограниченные данные об использовании энтекавира у педиатрических пациентов, принимавших ламивудин; энтекавир следует применять таким пациентам только в том случае, если возможная польза оправдывает потенциальный риск для ребенка. Поскольку некоторым педиатрическим пациентам может потребоваться долгосрочное или даже пожизненное сопровождение хронического активного гепатита в, следует учитывать влияние энтекавира на будущие варианты лечения ( см Микробиология).
Эффективность и безопасность энтекавира у пациентов младше 2 лет не установлены. Использование энтекавира в этой возрастной группе не оценивали, поскольку лечение гепатита В этой возрастной группе требуется редко.
Применение в гериатрии.
Клинические исследования энтекавира не включали достаточное количество пациентов в возрасте 65 лет и старше, чтобы определить, отличается ли их ответ от такового у более молодых пациентов. Энтекавир в значительной степени выводится почками, и риск токсических реакций на это ДВ может быть выше у пациентов с нарушением функции почек. Поскольку у пожилых пациентов более вероятно снижение функции почек, следует соблюдать осторожность при выборе дозы, и может быть полезным мониторинг функции почек.
Расовые/этнические группы.
Значимых расовых различий фармакокинетики энтекавира нет. Безопасность и эффективность энтекавира в дозе 0,5 мг 1 раз в день оценивали в несравнительном открытом исследовании у HBeAg-положительных или HBeAg-отрицательных, не принимавших нуклеозидные ингибиторы представителей негроидной расы/афроамериканцев (n=40) и латиноамериканцев (n=6) с хронической инфекцией ВГВ. В этом исследовании 76% пациентов были мужчинами, средний возраст составлял 42 года, 57% были HBeAg-положительными, средний исходный уровень ДНК ВГВ составлял 7 log10МЕ/мл, а средний исходный уровень АЛТ составлял 162 Ед/л. На 48-й нед лечения 32 из 46 (70%) пациентов имели ДНК ВГВ <50 МЕ/мл (приблизительно 300 копий/мл), у 31 из 46 (67%) пациентов была нормализация АЛТ (≤1 ВГН) и у 12 из 26 (46%) HBeAg-положительных пациентов была сероконверсия HBe. Данные по безопасности были аналогичны тем, которые наблюдались в более крупных контролируемых клинических испытаниях.
Из-за небольшой численности безопасность и эффективность не были установлены для латиноамериканской популяции США.
Нарушение функции почек.
Корректировка дозы энтекавира рекомендуется для пациентов с сl креатинина менее 50 мл/мин, включая пациентов, находящихся на гемодиализе или ПАПД ( см Фармакокинетика).
Реципиенты с трансплантатом печени.
Безопасность и эффективность энтекавира оценивали в несравнительном открытом исследовании с участием 65 пациентов, которым была проведена трансплантация печени в связи с осложнениями хронической инфекции ВГВ. Пациенты с ДНК ВГВ менее 172 МЕ/мл (приблизительно 1000 копий/мл) во время трансплантации получали энтекавир 1 мг 1 раз в день в дополнение к обычному посттрансплантационному лечению, включая Ig против гепатита в. Испытуемая популяция составляла 82% мужчин, 39% представителей европеоидной расы и 37% - азиатской, со средним возрастом 49 лет; 89% пациентов имели HBeAg-отрицательное заболевание на момент трансплантации.
Четверо из 65 пациентов получали энтекавир в течение 4 нед или меньше (2 смерти, 1 повторная трансплантация и 1 нарушение протокола) и не рассматривались как подлежащие оценке. Из 61 пациента, которые получали энтекавир более 4 нед, 60 получали Ig против гепатита В после трансплантации. Пятьдесят три пациента (82% от всех 65 леченных пациентов) завершили испытание, и у них были измерения ДНК ВГВ во время или после 72 нед лечения после трансплантации. Все 53 пациента имели ДНК ВГВ <50 МЕ/мл (примерно 300 копий/мл). У восьми поддающихся оценке пациентов не было данных о ДНК ВГВ через 72 нед, в тч у 3 пациентов, которые умерли до завершения исследования. Ни у одного из пациентов не было значений ДНК ВГВ ≥50 МЕ/мл при приеме энтекавира (плюс Ig против гепатита в). Все 61 поддающихся оценке пациентов имели потерю HBsAg после трансплантации; у 2 из этих пациентов был рецидив измеримого HBsAg без рецидива виремии ВГВ. Это испытание не было разработано для того, чтобы определить, уменьшает ли добавление энтекавира к Ig против гепатита в долю пациентов с измеряемой ДНК ВГВ после трансплантации по сравнению с одним Ig против гепатита в.
Если установлено, что лечение энтекавиром необходимо реципиенту с трансплантатом печени, который получал или получает иммунодепрессант, который может повлиять на функцию почек, например циклоспорин или такролимус, необходимо тщательно контролировать функцию почек как до, так и во время лечения энтекавиром ( см Фармакокинетика).
Сообщалось о тяжелых обострениях гепатита в у пациентов, прекративших прием ЛС для лечения гепатита в, включая энтекавир ( см «Побочные действия»). Необходим тщательный мониторинг функции печени с последующим клиническим и лабораторным наблюдением в течение не менее нескольких месяцев у пациентов, которые прекратили терапию против гепатита В. В случае необходимости возобновление приема ЛС для лечения гепатита В может быть оправдано.
Пациенты с коинфекцией гепатита В и ВИЧ.
Энтекавир не оценивали у пациентов с коинфекцией ВИЧ/ВГВ, которые одновременно не получали эффективного лечения ВИЧ. Ограниченный клинический опыт предполагает, что существует возможность развития устойчивости к нуклеозидным ингибиторам обратной транскриптазы ВИЧ, если энтекавир используется для лечения хронической вирусной инфекции гепатита в у пациентов с ВИЧ-инфекцией, которые не проходят лечение ( см Микробиология). Поэтому терапия энтекавиром не рекомендуется пациентам с коинфекцией ВИЧ/ВГВ, которые не получают ВААРТ. Перед началом терапии энтекавиром всем пациентам необходимо пройти тестирование на антитела к ВИЧ. Энтекавир не изучали как средство от ВИЧ-инфекции и он не рекомендуется для такого использования.
Лактат-ацидоз и тяжелая гепатомегалия со стеатозом.
Сообщалось о лактат-ацидозе и тяжелой гепатомегалии со стеатозом, включая фатальные случаи, при применении аналогов нуклеозидных ингибиторов , включая энтекавир, отдельно или в сочетании с антиретровирусными ЛС. Большинство этих случаев наблюдалось у женщин. Факторами риска могут быть ожирение и длительное использование нуклеозидных ингибиторов. Особую осторожность следует проявлять при назначении аналогов нуклеозидных ингибиторов любому пациенту с известными факторами риска заболевания печени; однако сообщалось также о случаях у пациентов без известных факторов риска.
Имеются сообщения о развитии лактат-ацидоза при использовании энтекавира, часто в связи с декомпенсацией функции печени, другими серьезными заболеваниями или лекарственным воздействием. Пациенты с декомпенсированным заболеванием печени могут иметь более высокий риск развития лактат-ацидоза. Лечение энтекавиром следует приостановить у любого пациента, у которого появляются клинические или лабораторные признаки, указывающие на развитие лактат-ацидоза или выраженную гепатотоксичность (которые могут включать гепатомегалию и стеатоз даже при отсутствии заметного повышения уровня трансаминаз).
Применение в педиатрии.
Энтекавир был оценен в двух клинических испытаниях у детей в возрасте 2 лет и старше с HBeAg-положительной хронической инфекцией ВГВ и компенсированным заболеванием печени. Экспозицию энтекавира у ранее не получавших терапию нуклеозидными ингибиторами и получавших ламивудин педиатрических пациентов в возрасте от 2 лет и старше с HBeAg-положительной хронической инфекцией ВГВ и компенсированным заболеванием печени, получающих 0,015 мг/кг (до 0,5 мг 1 раз в день) или 0,03 мг/кг (до 1 мг 1 раз в день) соответственно оценивали в исследовании AI463028. Безопасность и эффективность выбранной дозы у педиатрических пациентов, ранее не получавших лечения, были подтверждены в исследовании AI463189, рандомизированном плацебо-контролируемом испытании ( см «Показания», «Побочные действия», Фармакокинетика и Клинические исследования).
Имеются ограниченные данные об использовании энтекавира у педиатрических пациентов, принимавших ламивудин; энтекавир следует применять таким пациентам только в том случае, если возможная польза оправдывает потенциальный риск для ребенка. Поскольку некоторым педиатрическим пациентам может потребоваться долгосрочное или даже пожизненное сопровождение хронического активного гепатита в, следует учитывать влияние энтекавира на будущие варианты лечения ( см Микробиология).
Эффективность и безопасность энтекавира у пациентов младше 2 лет не установлены. Использование энтекавира в этой возрастной группе не оценивали, поскольку лечение гепатита В этой возрастной группе требуется редко.
Применение в гериатрии.
Клинические исследования энтекавира не включали достаточное количество пациентов в возрасте 65 лет и старше, чтобы определить, отличается ли их ответ от такового у более молодых пациентов. Энтекавир в значительной степени выводится почками, и риск токсических реакций на это ДВ может быть выше у пациентов с нарушением функции почек. Поскольку у пожилых пациентов более вероятно снижение функции почек, следует соблюдать осторожность при выборе дозы, и может быть полезным мониторинг функции почек.
Расовые/этнические группы.
Значимых расовых различий фармакокинетики энтекавира нет. Безопасность и эффективность энтекавира в дозе 0,5 мг 1 раз в день оценивали в несравнительном открытом исследовании у HBeAg-положительных или HBeAg-отрицательных, не принимавших нуклеозидные ингибиторы представителей негроидной расы/афроамериканцев (n=40) и латиноамериканцев (n=6) с хронической инфекцией ВГВ. В этом исследовании 76% пациентов были мужчинами, средний возраст составлял 42 года, 57% были HBeAg-положительными, средний исходный уровень ДНК ВГВ составлял 7 log10МЕ/мл, а средний исходный уровень АЛТ составлял 162 Ед/л. На 48-й нед лечения 32 из 46 (70%) пациентов имели ДНК ВГВ <50 МЕ/мл (приблизительно 300 копий/мл), у 31 из 46 (67%) пациентов была нормализация АЛТ (≤1 ВГН) и у 12 из 26 (46%) HBeAg-положительных пациентов была сероконверсия HBe. Данные по безопасности были аналогичны тем, которые наблюдались в более крупных контролируемых клинических испытаниях.
Из-за небольшой численности безопасность и эффективность не были установлены для латиноамериканской популяции США.
Нарушение функции почек.
Корректировка дозы энтекавира рекомендуется для пациентов с сl креатинина менее 50 мл/мин, включая пациентов, находящихся на гемодиализе или ПАПД ( см Фармакокинетика).
Реципиенты с трансплантатом печени.
Безопасность и эффективность энтекавира оценивали в несравнительном открытом исследовании с участием 65 пациентов, которым была проведена трансплантация печени в связи с осложнениями хронической инфекции ВГВ. Пациенты с ДНК ВГВ менее 172 МЕ/мл (приблизительно 1000 копий/мл) во время трансплантации получали энтекавир 1 мг 1 раз в день в дополнение к обычному посттрансплантационному лечению, включая Ig против гепатита в. Испытуемая популяция составляла 82% мужчин, 39% представителей европеоидной расы и 37% - азиатской, со средним возрастом 49 лет; 89% пациентов имели HBeAg-отрицательное заболевание на момент трансплантации.
Четверо из 65 пациентов получали энтекавир в течение 4 нед или меньше (2 смерти, 1 повторная трансплантация и 1 нарушение протокола) и не рассматривались как подлежащие оценке. Из 61 пациента, которые получали энтекавир более 4 нед, 60 получали Ig против гепатита В после трансплантации. Пятьдесят три пациента (82% от всех 65 леченных пациентов) завершили испытание, и у них были измерения ДНК ВГВ во время или после 72 нед лечения после трансплантации. Все 53 пациента имели ДНК ВГВ <50 МЕ/мл (примерно 300 копий/мл). У восьми поддающихся оценке пациентов не было данных о ДНК ВГВ через 72 нед, в тч у 3 пациентов, которые умерли до завершения исследования. Ни у одного из пациентов не было значений ДНК ВГВ ≥50 МЕ/мл при приеме энтекавира (плюс Ig против гепатита в). Все 61 поддающихся оценке пациентов имели потерю HBsAg после трансплантации; у 2 из этих пациентов был рецидив измеримого HBsAg без рецидива виремии ВГВ. Это испытание не было разработано для того, чтобы определить, уменьшает ли добавление энтекавира к Ig против гепатита в долю пациентов с измеряемой ДНК ВГВ после трансплантации по сравнению с одним Ig против гепатита в.
Если установлено, что лечение энтекавиром необходимо реципиенту с трансплантатом печени, который получал или получает иммунодепрессант, который может повлиять на функцию почек, например циклоспорин или такролимус, необходимо тщательно контролировать функцию почек как до, так и во время лечения энтекавиром ( см Фармакокинетика).
|
|
Список литературы
RxList.com, 2021 г.
Входит в состав
- 5360₽ Энтекавир ШТАДА (Хемофарм ООО )
- 3590-8278₽ Энтекавир Сандоз (2 фирмы)
- 6892₽ Элгравир
- 11129₽ Бараклюд (5 фирм)
- — Энтекавир (4 фирмы)
- — Энтекавир Сан (Sun Pharmaceutical Industries Ltd. )
- — Энтекавир-СЗ
- — Энтекавира моногидрат (Hetero Drugs )