Другие названия и синонимы
Escitalopram.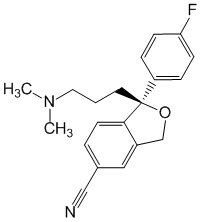
Фармакологическая группа
|
|
Латинское название
Escitalopramum ( Escitaloprami).
Химическое название
S-(+)-1-[3-(Диметиламино)пропил]-1-(п-фторфенил)-5-фталанкарбонитрил (в виде оксалата).
Используется в лечении
Код CAS
128196-01-0.
Фармакологическое действие
Антидепрессивное, ингибирующее обратный нейтральный захват серотонина.
Характеристика вещества
Антидепрессант группы СИОЗС, S-энантиомер циталопрама.
Эсциталопрама оксалат - порошок белого или слегка желтого цвета. Легко растворим в метаноле и диметилсульфоксиде, трудно растворим в воде и этаноле, незначительно растворим в этилацетате, нерастворим в гептане. Молекулярная масса - 414,40.
Эсциталопрама оксалат - порошок белого или слегка желтого цвета. Легко растворим в метаноле и диметилсульфоксиде, трудно растворим в воде и этаноле, незначительно растворим в этилацетате, нерастворим в гептане. Молекулярная масса - 414,40.
Фармакодинамика
Механизм действия.
Предполагается, что механизм антидепрессивного действия эсциталопрама, S-энантиомера рацемического циталопрама, связан с потенцированием серотонинергической активности в ЦНС в результате ингибирования обратного нейронального захвата серотонина в ЦНС.
Фармакодинамика.
В исследованиях на животных in vitro и in vivo показано, что эсциталопрам является высокоселективным СИОЗС с минимальным влиянием на обратный нейрональный захват норадреналина и дофамина. Эсциталопрам является по крайней мере в 100 раз более сильным, чем R-энантиомер, в отношении ингибирования обратного захвата 5-HT и ингибирования частоты пульсации 5-HT-нейронов. Толерантность при моделировании антидепрессивного эффекта не развивается при длительном (до 5 нед) введении крысам. Эсциталопрам не взаимодействует или обладает очень низкой аффинностью к серотониновым (5-HT1-7) или другим рецепторам, в тч к альфа- и бета-адренорецепторам, дофаминовым (D1-5), гистаминовым (H1-3), мускариновым (M1-5) и бензодиазепиновым рецепторам. Эсциталопрам также не связывается или обладает очень низкой аффинностью по отношению к различным ионным каналам, включая каналы Na+, K+, сl- и сa2+. Антагонизм к мускариновым, гистаминовым и адренергическим рецепторам, предположительно, обусловливает различные антихолинергические, седативные, кардиоваскулярные побочные эффекты других психотропных ЛС.
Предполагается, что механизм антидепрессивного действия эсциталопрама, S-энантиомера рацемического циталопрама, связан с потенцированием серотонинергической активности в ЦНС в результате ингибирования обратного нейронального захвата серотонина в ЦНС.
Фармакодинамика.
В исследованиях на животных in vitro и in vivo показано, что эсциталопрам является высокоселективным СИОЗС с минимальным влиянием на обратный нейрональный захват норадреналина и дофамина. Эсциталопрам является по крайней мере в 100 раз более сильным, чем R-энантиомер, в отношении ингибирования обратного захвата 5-HT и ингибирования частоты пульсации 5-HT-нейронов. Толерантность при моделировании антидепрессивного эффекта не развивается при длительном (до 5 нед) введении крысам. Эсциталопрам не взаимодействует или обладает очень низкой аффинностью к серотониновым (5-HT1-7) или другим рецепторам, в тч к альфа- и бета-адренорецепторам, дофаминовым (D1-5), гистаминовым (H1-3), мускариновым (M1-5) и бензодиазепиновым рецепторам. Эсциталопрам также не связывается или обладает очень низкой аффинностью по отношению к различным ионным каналам, включая каналы Na+, K+, сl- и сa2+. Антагонизм к мускариновым, гистаминовым и адренергическим рецепторам, предположительно, обусловливает различные антихолинергические, седативные, кардиоваскулярные побочные эффекты других психотропных ЛС.
Фармакокинетика
Фармакокинетика эсциталопрама носит линейный и дозозависимый характер при приеме однократной и многократных доз в диапазоне от 10 до 30 мг/сут. Биотрансформация эсциталопрама происходит преимущественно в печени, со средним конечным 1/2T1/2 около 27-32 При приеме 1 раз в сутки ssCss в плазме устанавливается в течение примерно 1 нед терапии. В равновесном состоянии уровень эсциталопрама в плазме у молодых здоровых людей в 2,2-2,5 раза превышает концентрацию после приема однократной дозы. Таблетки и раствор для приема внутрь, содержащие эсциталопрама оксалат, биоэквивалентны.
Абсорбция и распределение. При приеме внутрь однократной дозы 20 мг (таблетка или раствор) Tmах - около 5 Прием пищи не влияет на абсорбцию эсциталопрама.
Абсолютная биодоступность циталопрама составляет около 80% относительно в/в дозы, а dVd циталопрама составляет около 12 л/кг. Конкретных данных по эсциталопраму нет.
Связывание эсциталопрама с белками плазмы человека - примерно 56%.
Метаболизм и выведение. После перорального приема эсциталопрама доля вещества, выделяемого с мочой в виде эсциталопрама и S-деметилциталопрама (S-ДЦТ), составляет около 8 и 10% соответственно. Пероральный клиренс эсциталопрама - 600 мл/мин, примерно 7% из которых обусловлено почечным клиренсом.
Эсциталопрам метаболизируется с образованием S-ДЦТ и S-дидеметилциталопрама (S-ДДЦТ). В плазме крови человека преобладает эсциталопрам в неизмененном виде. ssCss метаболита эсциталопрама S-ДЦТ в плазме составляет примерно 1/3 от концентрации эсциталопрама. Уровень S-ДДЦТ не определялся у большинства испытуемых. Исследования in vitro показали, что фармакологическая активность эсциталопрама (ингибирование обратного захвата серотонина) превышает таковую S-ДЦТ по крайней мере в 7 раз, S-ДДЦТ - в 27 раз, что свидетельствует о том, что метаболиты не вносят существенного вклада в антидепрессивное действие эсциталопрама. S-ДЦТ и S-ДДЦТ также не взаимодействуют или обладают очень слабой аффиностью к серотониновым (5-HT1-7) или другим рецепторам, в тч альфа- и бета-адренорецепторам, дофаминовым (D1-5), гистаминовым (H1-3), мускариновым (M1-5) и бензодиазепиновым рецепторам. S-ДЦТ и S-ДДЦТ также не связываются с различными ионными каналам, включая каналы Na+, K+, сl- и сa2+.
Исследования in vitro >in vitro с использованием микросом печени человека показали, что сYP3A4 и сYP2C19 являются основными изоферментами, участвующими в N-деметилировании эсциталопрама.
Особые группы пациентов.
Возраст.
Подростки. В исследовании однократной дозы 10 мг эсциталопрама AUC эсциталопрама снижалась на 19%, а maxCmax увеличивалась на 26% у здоровых подростков (от 12 до 17 лет) по сравнению со взрослыми. После многократного приема циталопрама в дозе 40 мг/сут 1/2T1/2 эсциталопрама, ssCss и AUC у пациентов с большим депрессивным расстройством (БДР) (от 12 до 17 лет) были схожи с таковыми у взрослых пациентов. Корректировка дозы у подростков не требуется.
Пожилые люди. Фармакокинетику эсциталопрама у пациентов в возрасте ≥65 лет сравнивали с таковой у пациентов более молодого возраста в исследованиях при приеме однократной и многократных доз. AUC и 1/2T1/2 эсциталопрама были выше примерно на 50% у пожилых людей, а maxCmax не изменялась. 10 мг - это рекомендуемая доза для пожилых пациентов.
Пол.
Основываясь на данных исследований однократного и многократного приема эсциталопрама у пожилых, молодых людей и подростков, корректировка дозы в зависимости от пола не требуется.
Снижение функции печени.
Пероральный клиренс циталопрама снижался на 37%, а 1/2T1/2 увеличивался вдвое у пациентов со сниженной функцией печени по сравнению с этими параметрами у людей с нормальной функцией печени. 10 мг - рекомендуемая доза эсциталопрама для большинства пациентов с нарушением функции печени.
Снижение функции почек.
У пациентов с нарушением функции почек от легкой до умеренной степени пероральный клиренс циталопрама был снижен на 17% по сравнению с таковым у людей с нормальной функцией почек. Корректировка дозы у таких пациентов не требуется. Информация о фармакокинетике эсциталопрама у пациентов с выраженной почечной недостаточностью (Cl креатинина <20 мл/мин) отсутствует.
Доклиническая токсикология.
Канцерогенность, мутагенность, влияние на фертильность.
Канцерогенность. Рацемический циталопрам вводили с пищей мышам линии NMRI/BOM и крысам линии сOBS WI, получавшим его в течение 18 и 24 мес соответственно. У мышей, получавших дозы до 240 мг/кг/сут, доказательств канцерогенного действия обнаружено не было. У крыс, получавших дозы рацемического циталопрама 8 или 24 мг/кг/сут, наблюдалось увеличение случаев возникновения мелкоклеточного рака кишечника. Доза, не вызывающая этого эффекта, не установлена. Значимость полученных данных для человека неизвестна.
Мутагенность. Рацемический циталопрам проявлял мутагенную активность в in vitro тесте выявления обратных мутаций у бактерий (тест Эймса) у двух из пяти штаммов бактерий (Salmonella TA98 и TA1537) при отсутствии метаболической активации.Отмечен кластогенный эффект в in vitro тесте выявления хромосомных аберраций на клетках легких китайского хомячка в присутствии и отсутствии метаболической активации. Рацемический циталопрам не проявлял мутагенных свойств в in vitro тесте оценки прямых генных мутаций в клетках млекопитающих с гипоксантин-гуанинфосфорибозилтрансферазой (HPRT) на клетках лимфомы мыши и в двойном in vitro/in vivo тесте внепланового синтеза ДНК на клетках печени крыс.Не обнаружено кластогенной активности в in vitro тесте выявления хромосомных аберраций на культуре лимфоцитов человека и в двух in vivo микроядерных тестах у мышей.
Влияние на фертильность. При применении рацемического циталопрама внутрь у 16 самцов и 24 самок крыс до и в течение периода спаривания и беременности в дозах 32, 48 и 72 мг/кг/сут спаривание было снижено при всех исследованных дозах, а фертильность снижалась при дозах ≥32 мг/кг/сут. Продолжительность периода беременности увеличивалась при дозе 48 мг/кг/сут.
Фармакология и/или токсикология у животных.
Патологические изменения (дегенерация/атрофия) наблюдались в сетчатке крыс-альбиносов в двухлетнем исследовании канцерогенности рацемического циталопрама. Наблюдалось увеличение как частоты, так и тяжести патологии сетчатки как у самцов, так и у самок крыс, получавших 80 мг/кг/сут. Подобных результатов не было у крыс, получавших рацемический циталопрам в дозах 24 мг/кг/сут в течение двух лет, у мышей, получавших дозы рацемического циталопрама до 240 мг/кг/сут в течение 18 мес, или у собак, получавших в течение одного года дозы до 20 мг/кг/сут.
Дополнительные исследования по изучению механизма развития данной патологии не проводились, и потенциальная значимость этого эффекта у людей не установлена.
Сердечно-сосудистые изменения у собак.
В одногодичном токсикологическом исследовании 5 из 10 собак породы бигль, получавших рацемический циталопрам в пероральных дозах 8 мг/кг/сут, внезапно умерли между 17-й и 31-й нед после начала применения дозы. Случаев внезапной смерти не наблюдалось у крыс при дозах рацемического циталопрама до 120 мг/кг/сут, которые создавали уровни циталопрама и его метаболитов, ДЦТ и ДДЦТ, в плазме, аналогичные тем, которые наблюдались у собак при дозах 8 мг/кг/сут. Последующее исследование при в/в дозировании продемонстрировало, что у собак породы бигль ДДЦТ вызывал удлинение интервала QT, известный фактор риска наблюдавшегося исхода у собак.
Клинические исследования.
БДР.
Подростки.
Эффективность эсциталопрама в качестве неотложного лечения БДР у подростков была установлена в ходе 8-недельного плацебо-контролируемого исследования с гибкой дозой, в котором сравнивали эсциталопрам в дозе 10-20 мг/сут с плацебо у амбулаторных пациентов в возрасте от 12 до 17 лет включительно, которые соответствовали критериям DSM-IV для БДР. Первичным результатом было изменение от исходного уровня до конечной точки по сhildren s Depression Rating Scale - Revised (шкала для оценки детской депрессии - пересмотренная, сDRS-R). В этом исследовании эсциталопрам продемонстрировал статистически значимое большее среднее улучшение по сравнению с плацебо по сDRS-R.
Эффективность эсциталопрама при неотложном лечении БДР у подростков была установлена частично на основе экстраполяции результатов 8-недельного плацебо-контролируемого исследования с гибкой дозой рацемического циталопрама в дозе 20-40 мг/сут. В этом амбулаторном исследовании у детей и подростков в возрасте от 7 до 17 лет, которые соответствовали критериям DSM-IV для БДР, лечение циталопрамом показало статистически значимое большее среднее улучшение по сравнению с плацебо по сDRS-R; положительные результаты этого испытания в основном были получены в подростковой подгруппе.
Два дополнительных плацебо-контролируемых исследования БДР с гибкими дозами (одно исследование эсциталопрама у пациентов в возрасте от 7 до 17 лет и одно исследование циталопрама у подростков) не продемонстрировали эффективности.
Хотя эффективность поддерживающей терапии у подростков систематически не оценивалась, эффективность поддерживающей терапии может быть экстраполирована на основании данных для взрослых наряду со сравнением фармакокинетических параметров эсциталопрама у взрослых и подростков.
Взрослые.
Эффективность эсциталопрама для лечения БДР была установлена в ходе трех 8-недельных плацебо-контролируемых исследований, проведенных у амбулаторных пациентов в возрасте от 18 до 65 лет, которые соответствовали критериям DSM-IV для БДР. Первичным результатом во всех трех исследованиях было изменение от исходного уровня до конечной точки по Montgomery Asberg Depression Rating Scale (шкала оценки депрессии Монтгомери и Асберга, MADRS).
В исследовании с фиксированной дозой сравнивали эсциталопрам в дозе 10 и 20 мг/сут с плацебо и циталопрамом 40 мг/сут. В группах лечения эсциталопрамом 10 и 20 мг/сут наблюдалось статистически значимое большее среднее улучшение по сравнению с плацебо по шкале MADRS. Группы эсциталопрама 10 и 20 мг были схожи по этому критерию оценки эффективности.
Во втором исследовании с фиксированной дозой эсциталопрама 10 мг/сут и плацебо группа лечения эсциталопрамом 10 мг/сут показала статистически значимое большее среднее улучшение по сравнению с плацебо по MADRS.
В исследовании с гибкой дозой, в котором сравнивали эсциталопрам, дозу которого титровали от 10 до 20 мг/сут, с плацебо и циталопрамом, дозу которого титровали между 20 и 40 мг/сут, группа лечения эсциталопрамом показала статистически значимое большее среднее улучшение по сравнению с плацебо по MADRS.
Анализ взаимосвязи между ответом на лечение и возрастом, полом и расой не выявил какой-либо разницы восприимчивости на основе этих характеристик пациентов.
В более продолжительном исследовании 274 пациента, отвечающих критериям (DSM-IV) БДР, которые ответили на начальную 8-недельную открытую фазу лечения эсциталопрамом в дозе 10 или 20 мг/сут, были рандомизированы для продолжения лечения эсциталопрамом в той же дозе или плацебо до 36 нед наблюдения на предмет рецидива. Ответ во время открытой фазы определяли по снижению общего балла по MADRS до ≤12. Рецидив во время двойной слепой фазы определяли как увеличение общего балла по MADRS до ≥22 или прекращение лечения из-за недостаточного клинического ответа. У пациентов, продолжавших лечение эсциталопрамом, наблюдалось статистически значимое более длительное время до рецидива по сравнению с пациентами, получавшими плацебо.
Генерализованное тревожное расстройство (ГТР).
Эффективность эсциталопрама при неотложном лечении ГТР была продемонстрирована в трех 8-недельных многоцентровых плацебо-контролируемых исследованиях с гибкими дозами, в которых сравнивали эсциталопрам в дозе 10-20 мг/сут с плацебо у взрослых амбулаторных пациентов в возрасте от 18 до 80 лет, которые соответствовали критериям DSM-IV для ГТР. Во всех трех исследованиях эсциталопрам продемонстрировал статистически значимое большее среднее улучшение по сравнению с плацебо по Hamilton Anxiety Scale (шкала тревоги Гамильтона, HAM-A).
Было слишком мало пациентов из разных этнических и возрастных групп, чтобы адекватно оценить, оказывает ли эсциталопрам различные эффекты в этих группах. Не было какой-либо разницы в ответе на эсциталопрам у мужчин и женщин.
Абсорбция и распределение. При приеме внутрь однократной дозы 20 мг (таблетка или раствор) Tmах - около 5 Прием пищи не влияет на абсорбцию эсциталопрама.
Абсолютная биодоступность циталопрама составляет около 80% относительно в/в дозы, а dVd циталопрама составляет около 12 л/кг. Конкретных данных по эсциталопраму нет.
Связывание эсциталопрама с белками плазмы человека - примерно 56%.
Метаболизм и выведение. После перорального приема эсциталопрама доля вещества, выделяемого с мочой в виде эсциталопрама и S-деметилциталопрама (S-ДЦТ), составляет около 8 и 10% соответственно. Пероральный клиренс эсциталопрама - 600 мл/мин, примерно 7% из которых обусловлено почечным клиренсом.
Эсциталопрам метаболизируется с образованием S-ДЦТ и S-дидеметилциталопрама (S-ДДЦТ). В плазме крови человека преобладает эсциталопрам в неизмененном виде. ssCss метаболита эсциталопрама S-ДЦТ в плазме составляет примерно 1/3 от концентрации эсциталопрама. Уровень S-ДДЦТ не определялся у большинства испытуемых. Исследования in vitro показали, что фармакологическая активность эсциталопрама (ингибирование обратного захвата серотонина) превышает таковую S-ДЦТ по крайней мере в 7 раз, S-ДДЦТ - в 27 раз, что свидетельствует о том, что метаболиты не вносят существенного вклада в антидепрессивное действие эсциталопрама. S-ДЦТ и S-ДДЦТ также не взаимодействуют или обладают очень слабой аффиностью к серотониновым (5-HT1-7) или другим рецепторам, в тч альфа- и бета-адренорецепторам, дофаминовым (D1-5), гистаминовым (H1-3), мускариновым (M1-5) и бензодиазепиновым рецепторам. S-ДЦТ и S-ДДЦТ также не связываются с различными ионными каналам, включая каналы Na+, K+, сl- и сa2+.
Исследования in vitro >in vitro с использованием микросом печени человека показали, что сYP3A4 и сYP2C19 являются основными изоферментами, участвующими в N-деметилировании эсциталопрама.
Особые группы пациентов.
Возраст.
Подростки. В исследовании однократной дозы 10 мг эсциталопрама AUC эсциталопрама снижалась на 19%, а maxCmax увеличивалась на 26% у здоровых подростков (от 12 до 17 лет) по сравнению со взрослыми. После многократного приема циталопрама в дозе 40 мг/сут 1/2T1/2 эсциталопрама, ssCss и AUC у пациентов с большим депрессивным расстройством (БДР) (от 12 до 17 лет) были схожи с таковыми у взрослых пациентов. Корректировка дозы у подростков не требуется.
Пожилые люди. Фармакокинетику эсциталопрама у пациентов в возрасте ≥65 лет сравнивали с таковой у пациентов более молодого возраста в исследованиях при приеме однократной и многократных доз. AUC и 1/2T1/2 эсциталопрама были выше примерно на 50% у пожилых людей, а maxCmax не изменялась. 10 мг - это рекомендуемая доза для пожилых пациентов.
Пол.
Основываясь на данных исследований однократного и многократного приема эсциталопрама у пожилых, молодых людей и подростков, корректировка дозы в зависимости от пола не требуется.
Снижение функции печени.
Пероральный клиренс циталопрама снижался на 37%, а 1/2T1/2 увеличивался вдвое у пациентов со сниженной функцией печени по сравнению с этими параметрами у людей с нормальной функцией печени. 10 мг - рекомендуемая доза эсциталопрама для большинства пациентов с нарушением функции печени.
Снижение функции почек.
У пациентов с нарушением функции почек от легкой до умеренной степени пероральный клиренс циталопрама был снижен на 17% по сравнению с таковым у людей с нормальной функцией почек. Корректировка дозы у таких пациентов не требуется. Информация о фармакокинетике эсциталопрама у пациентов с выраженной почечной недостаточностью (Cl креатинина <20 мл/мин) отсутствует.
Доклиническая токсикология.
Канцерогенность, мутагенность, влияние на фертильность.
Канцерогенность. Рацемический циталопрам вводили с пищей мышам линии NMRI/BOM и крысам линии сOBS WI, получавшим его в течение 18 и 24 мес соответственно. У мышей, получавших дозы до 240 мг/кг/сут, доказательств канцерогенного действия обнаружено не было. У крыс, получавших дозы рацемического циталопрама 8 или 24 мг/кг/сут, наблюдалось увеличение случаев возникновения мелкоклеточного рака кишечника. Доза, не вызывающая этого эффекта, не установлена. Значимость полученных данных для человека неизвестна.
Мутагенность. Рацемический циталопрам проявлял мутагенную активность в in vitro тесте выявления обратных мутаций у бактерий (тест Эймса) у двух из пяти штаммов бактерий (Salmonella TA98 и TA1537) при отсутствии метаболической активации.Отмечен кластогенный эффект в in vitro тесте выявления хромосомных аберраций на клетках легких китайского хомячка в присутствии и отсутствии метаболической активации. Рацемический циталопрам не проявлял мутагенных свойств в in vitro тесте оценки прямых генных мутаций в клетках млекопитающих с гипоксантин-гуанинфосфорибозилтрансферазой (HPRT) на клетках лимфомы мыши и в двойном in vitro/in vivo тесте внепланового синтеза ДНК на клетках печени крыс.Не обнаружено кластогенной активности в in vitro тесте выявления хромосомных аберраций на культуре лимфоцитов человека и в двух in vivo микроядерных тестах у мышей.
Влияние на фертильность. При применении рацемического циталопрама внутрь у 16 самцов и 24 самок крыс до и в течение периода спаривания и беременности в дозах 32, 48 и 72 мг/кг/сут спаривание было снижено при всех исследованных дозах, а фертильность снижалась при дозах ≥32 мг/кг/сут. Продолжительность периода беременности увеличивалась при дозе 48 мг/кг/сут.
Фармакология и/или токсикология у животных.
Патологические изменения (дегенерация/атрофия) наблюдались в сетчатке крыс-альбиносов в двухлетнем исследовании канцерогенности рацемического циталопрама. Наблюдалось увеличение как частоты, так и тяжести патологии сетчатки как у самцов, так и у самок крыс, получавших 80 мг/кг/сут. Подобных результатов не было у крыс, получавших рацемический циталопрам в дозах 24 мг/кг/сут в течение двух лет, у мышей, получавших дозы рацемического циталопрама до 240 мг/кг/сут в течение 18 мес, или у собак, получавших в течение одного года дозы до 20 мг/кг/сут.
Дополнительные исследования по изучению механизма развития данной патологии не проводились, и потенциальная значимость этого эффекта у людей не установлена.
Сердечно-сосудистые изменения у собак.
В одногодичном токсикологическом исследовании 5 из 10 собак породы бигль, получавших рацемический циталопрам в пероральных дозах 8 мг/кг/сут, внезапно умерли между 17-й и 31-й нед после начала применения дозы. Случаев внезапной смерти не наблюдалось у крыс при дозах рацемического циталопрама до 120 мг/кг/сут, которые создавали уровни циталопрама и его метаболитов, ДЦТ и ДДЦТ, в плазме, аналогичные тем, которые наблюдались у собак при дозах 8 мг/кг/сут. Последующее исследование при в/в дозировании продемонстрировало, что у собак породы бигль ДДЦТ вызывал удлинение интервала QT, известный фактор риска наблюдавшегося исхода у собак.
Клинические исследования.
БДР.
Подростки.
Эффективность эсциталопрама в качестве неотложного лечения БДР у подростков была установлена в ходе 8-недельного плацебо-контролируемого исследования с гибкой дозой, в котором сравнивали эсциталопрам в дозе 10-20 мг/сут с плацебо у амбулаторных пациентов в возрасте от 12 до 17 лет включительно, которые соответствовали критериям DSM-IV для БДР. Первичным результатом было изменение от исходного уровня до конечной точки по сhildren s Depression Rating Scale - Revised (шкала для оценки детской депрессии - пересмотренная, сDRS-R). В этом исследовании эсциталопрам продемонстрировал статистически значимое большее среднее улучшение по сравнению с плацебо по сDRS-R.
Эффективность эсциталопрама при неотложном лечении БДР у подростков была установлена частично на основе экстраполяции результатов 8-недельного плацебо-контролируемого исследования с гибкой дозой рацемического циталопрама в дозе 20-40 мг/сут. В этом амбулаторном исследовании у детей и подростков в возрасте от 7 до 17 лет, которые соответствовали критериям DSM-IV для БДР, лечение циталопрамом показало статистически значимое большее среднее улучшение по сравнению с плацебо по сDRS-R; положительные результаты этого испытания в основном были получены в подростковой подгруппе.
Два дополнительных плацебо-контролируемых исследования БДР с гибкими дозами (одно исследование эсциталопрама у пациентов в возрасте от 7 до 17 лет и одно исследование циталопрама у подростков) не продемонстрировали эффективности.
Хотя эффективность поддерживающей терапии у подростков систематически не оценивалась, эффективность поддерживающей терапии может быть экстраполирована на основании данных для взрослых наряду со сравнением фармакокинетических параметров эсциталопрама у взрослых и подростков.
Взрослые.
Эффективность эсциталопрама для лечения БДР была установлена в ходе трех 8-недельных плацебо-контролируемых исследований, проведенных у амбулаторных пациентов в возрасте от 18 до 65 лет, которые соответствовали критериям DSM-IV для БДР. Первичным результатом во всех трех исследованиях было изменение от исходного уровня до конечной точки по Montgomery Asberg Depression Rating Scale (шкала оценки депрессии Монтгомери и Асберга, MADRS).
В исследовании с фиксированной дозой сравнивали эсциталопрам в дозе 10 и 20 мг/сут с плацебо и циталопрамом 40 мг/сут. В группах лечения эсциталопрамом 10 и 20 мг/сут наблюдалось статистически значимое большее среднее улучшение по сравнению с плацебо по шкале MADRS. Группы эсциталопрама 10 и 20 мг были схожи по этому критерию оценки эффективности.
Во втором исследовании с фиксированной дозой эсциталопрама 10 мг/сут и плацебо группа лечения эсциталопрамом 10 мг/сут показала статистически значимое большее среднее улучшение по сравнению с плацебо по MADRS.
В исследовании с гибкой дозой, в котором сравнивали эсциталопрам, дозу которого титровали от 10 до 20 мг/сут, с плацебо и циталопрамом, дозу которого титровали между 20 и 40 мг/сут, группа лечения эсциталопрамом показала статистически значимое большее среднее улучшение по сравнению с плацебо по MADRS.
Анализ взаимосвязи между ответом на лечение и возрастом, полом и расой не выявил какой-либо разницы восприимчивости на основе этих характеристик пациентов.
В более продолжительном исследовании 274 пациента, отвечающих критериям (DSM-IV) БДР, которые ответили на начальную 8-недельную открытую фазу лечения эсциталопрамом в дозе 10 или 20 мг/сут, были рандомизированы для продолжения лечения эсциталопрамом в той же дозе или плацебо до 36 нед наблюдения на предмет рецидива. Ответ во время открытой фазы определяли по снижению общего балла по MADRS до ≤12. Рецидив во время двойной слепой фазы определяли как увеличение общего балла по MADRS до ≥22 или прекращение лечения из-за недостаточного клинического ответа. У пациентов, продолжавших лечение эсциталопрамом, наблюдалось статистически значимое более длительное время до рецидива по сравнению с пациентами, получавшими плацебо.
Генерализованное тревожное расстройство (ГТР).
Эффективность эсциталопрама при неотложном лечении ГТР была продемонстрирована в трех 8-недельных многоцентровых плацебо-контролируемых исследованиях с гибкими дозами, в которых сравнивали эсциталопрам в дозе 10-20 мг/сут с плацебо у взрослых амбулаторных пациентов в возрасте от 18 до 80 лет, которые соответствовали критериям DSM-IV для ГТР. Во всех трех исследованиях эсциталопрам продемонстрировал статистически значимое большее среднее улучшение по сравнению с плацебо по Hamilton Anxiety Scale (шкала тревоги Гамильтона, HAM-A).
Было слишком мало пациентов из разных этнических и возрастных групп, чтобы адекватно оценить, оказывает ли эсциталопрам различные эффекты в этих группах. Не было какой-либо разницы в ответе на эсциталопрам у мужчин и женщин.
|
|
Показания к применению
БДР.Неотложное и поддерживающее лечение БДР у взрослых и подростков от 12 до 17 лет ( см Клинические исследования).
Большой депрессивный эпизод (DSM-IV) подразумевает выраженное и относительно стойкое (почти ежедневно в течение как минимум 2 нед) депрессивное или дисфорическое настроение. которое обычно мешает повседневной деятельности и включает как минимум пять из следующих девяти симптомов: подавленное настроение. потеря интереса к обычной деятельности. значительное изменение массы тела и/или аппетита. инсомния или гиперсомния. психомоторное возбуждение или заторможенность. повышенная утомляемость. чувство вины или никчемности. замедленное мышление или нарушение концентрации внимания. попытка суицида или суицидальные мысли.
ГТР.Неотложное лечение ГТР у взрослых ( см Клинические исследования).
ГТР (DSM-IV) характеризуется чрезмерной тревогой и беспокойством (тревожным ожиданием), которые сохраняются не менее 6 мес и которые человеку трудно контролировать. Это должно быть ассоциировано как минимум с 3 из следующих симптомов: возбужденное состояние или чувство взвинченности или нервозности. легкая утомляемость. трудности концентрации внимания или сосредоточения. раздражительность. мышечное напряжение и нарушение сна.
Большой депрессивный эпизод (DSM-IV) подразумевает выраженное и относительно стойкое (почти ежедневно в течение как минимум 2 нед) депрессивное или дисфорическое настроение. которое обычно мешает повседневной деятельности и включает как минимум пять из следующих девяти симптомов: подавленное настроение. потеря интереса к обычной деятельности. значительное изменение массы тела и/или аппетита. инсомния или гиперсомния. психомоторное возбуждение или заторможенность. повышенная утомляемость. чувство вины или никчемности. замедленное мышление или нарушение концентрации внимания. попытка суицида или суицидальные мысли.
ГТР.Неотложное лечение ГТР у взрослых ( см Клинические исследования).
ГТР (DSM-IV) характеризуется чрезмерной тревогой и беспокойством (тревожным ожиданием), которые сохраняются не менее 6 мес и которые человеку трудно контролировать. Это должно быть ассоциировано как минимум с 3 из следующих симптомов: возбужденное состояние или чувство взвинченности или нервозности. легкая утомляемость. трудности концентрации внимания или сосредоточения. раздражительность. мышечное напряжение и нарушение сна.
Противопоказания
Ингибиторы МАО. Применение ингибиторов МАО. предназначенных для лечения психических расстройств. с эсциталопрамом или в течение 14 дней после прекращения лечения эсциталопрамом. противопоказано из-за повышенного риска развития серотонинового синдрома. Применение эсциталопрама в течение 14 дней после прекращения приема ингибиторов МАО, предназначенных для лечения психических расстройств, также противопоказано ( см «Меры предосторожности»).
Начало приема эсциталопрама у пациента. получающего ингибиторы МАО. например линезолид или метилтиониния хлорид в/в. также противопоказано из-за повышенного риска развития серотонинового синдрома ( см «Меры предосторожности»).
Пимозид. Одновременное применение у пациентов, принимающих пимозид, противопоказано ( см «Взаимодействие»).
Гиперчувствительность к эсциталопраму или циталопраму. Эсциталопрам противопоказан пациентам с гиперчувствительностью к эсциталопраму или циталопраму.
Начало приема эсциталопрама у пациента. получающего ингибиторы МАО. например линезолид или метилтиониния хлорид в/в. также противопоказано из-за повышенного риска развития серотонинового синдрома ( см «Меры предосторожности»).
Пимозид. Одновременное применение у пациентов, принимающих пимозид, противопоказано ( см «Взаимодействие»).
Гиперчувствительность к эсциталопраму или циталопраму. Эсциталопрам противопоказан пациентам с гиперчувствительностью к эсциталопраму или циталопраму.
При беременности и кормлении грудью
Беременность.
Адекватных и строго контролируемых исследований у беременных женщин не проводилось, поэтому эсциталопрам следует применять во время беременности только в том случае, если ожидаемая польза превышает потенциальный риск для плода.
По результатам исследования эмбрио/фетального развития у крыс, введение эсциталопрама беременным крысам внутрь (56, 112 или 150 мг/кг/сут) в период органогенеза сопровождалось снижением массы тела плодов и задержкой оссификации при 2 высших дозах (примерно в 56 раз превышающих МРДЧ - 20 мг/сут, при расчете на основе площади поверхности тела в мг/м2). Токсичность для материнского организма (клинические признаки и уменьшение прибавки массы тела и потребления пищи), умеренная при дозе 56 мг/кг/сут, наблюдалась при всех уровнях доз. Доза 56 мг/кг/сут, при которой не наблюдалось влияния на развитие плода, примерно в 28 раз превышала МРДЧ, при расчете в мг/м2. Не было выявлено тератогенности ни при одной из тестируемых доз (до более чем в 75 раз выше МРДЧ, при расчете в мг/м2).
Введение беременным крысам эсциталопрама (6, 12, 24 или 48 мг/кг/сут) в период беременности и до прекращения грудного вскармливания приводило к незначительному увеличению смертности потомства и задержке роста при дозе 48 мг/кг/сут (примерно в 24 раза выше МРДЧ, при расчете в мг/м2). При этой же дозе отмечалась слабая токсичность для материнского организма (клинические признаки и уменьшение прибавки массы тела и потребления пищи). Небольшое повышенние смертности потомства наблюдалось также при дозе 24 мг/кг/сут. Доза 12 мг/кг/сут, при которой не было отмечено неблагоприятных эффектов, примерно в 6 раз выше МРДЧ, при расчете в мг/м2.
В исследованиях репродукции у животных было показано, что рацемический циталопрам оказывает неблагоприятное воздействие на развитие эмбриона/плода и постнатальное развитие, включая тератогенные эффекты, при применении в дозах, превышающих терапевтические дозы для человека.
В двух исследованиях эмбрио/фетального развития у крыс пероральное применение рацемического циталопрама у беременных животных (32, 56 и 112 мг/кг/сут) в период органогенеза сопровождалось при высокой дозе снижением эмбрио/фетального роста и выживаемости и увеличением частоты фетальных нарушений (включая нарушения развития ССС и скелета). Эта доза также была ассоциирована с токсичностью для материнского организма (клинические признаки, снижение прибавки массы тела). При дозе 56 мг/кг/сут не было отмечено неблагоприятных эффектов на развитие. В исследовании у кроликов не наблюдалось неблагоприятного воздействия на развитие эмбриона/плода при дозах рацемического циталопрама до 16 мг/кг/сут. Таким образом, тератогенные эффекты рацемического циталопрама наблюдались при дозе, токсичной для матери, у крыс и не отмечались у кроликов.
При применении у самок крыс рацемического циталопрама (4,8; 12,8 или 32 мг/кг/сут) на поздних сроках беременности и до окончания вскармливания повышенная смертность потомства в течение первых 4 дней после рождения и стойкая задержка роста потомства наблюдались при наивысшей дозе. Доза, не оказывающая эффекта, составила 12,8 мг/кг/сут. Подобные эффекты на смертность и рост потомства наблюдались при применении у самок на протяжении всей беременности и в начале лактации при дозах ≥24 мг/кг/сут. Доза, не оказывающая эффекта, в этом исследовании не определялась.
Нетератогенные эффекты.
У новорожденных, которые подвергались воздействию эсциталопрама и других СИОЗС или СИОЗСН в конце III триместра беременности матери, развивались осложнения, требующие длительной госпитализации, респираторной поддержки, питания через зонд. Такие осложнения могут проявляться немедленно после родоразрешения. Отмеченные клинические симптомы включали респираторный дистресс, цианоз, апноэ, судороги, нестабильность температуры, затруднения при кормлении, рвоту, гипогликемию, гипотонию, повышенный мышечный тонус, гиперрефлексию, тремор, нервное возбуждение, раздражительность и постоянный плач. Эти симптомы связаны либо с прямым токсическим действием СИОЗС или СИОЗСН, или, возможно, являются проявлениями синдрома отмены у новорожденного. Следует отметить, что в некоторых случаях клиническая картина была сходна с развитием серотонинового синдрома ( см «Меры предосторожности»).
У младенцев, которые подверглись воздействию СИОЗС во время беременности матери, может быть повышен риск персистирующей легочной гипертензии новорожденных (ПЛГН). ПЛГН встречается в 1-2 случаях на 1000 живорождений в популяции в целом и ассоциирована со значительной неонатальной заболеваемостью и смертностью. Некоторые недавние эпидемиологические исследования предполагают положительную статистическую связь между применением СИОЗС (включая эсциталопрам) во время беременности и ПЛГН. Другие исследования не показывают значимой статистической связи.
Следует также обратить внимание на результаты проспективного долгосрочного исследования у 201 беременной женщины с БДР в анамнезе, которые или лечились антидепрессантами, или принимали антидепрессанты менее чем за 12 нед до последнего менструального периода и находились в состоянии ремиссии. У женщин, которые прекратили прием антидепрессантов во время беременности, значительно увеличилось количество рецидивов БДР по сравнению с теми женщинами, которые продолжали принимать антидепрессанты на протяжении всей беременности.
При лечении беременной женщины эсциталопрамом врач должен тщательно учитывать как потенциальные риски приема СИОЗС, так и установленные преимущества лечения депрессии антидепрессантами. Это решение может быть принято только в индивидуальном порядке.
Роды и родоразрешение.
Влияние эсциталопрама на роды и родоразрешение у человека неизвестно.
Грудное вскармливание.
Эсциталопрам экскретируется в грудное молоко женщин. Ограниченные данные о женщинах, принимавших эсциталопрам в дозе 10-20 мг, показали, что младенцы, находившиеся исключительно на грудном вскармливании, получали примерно 3,9% дозы эсциталопрама в зависимости от массы тела матери и 1,7% дозы десметилциталопрама в зависимости от массы тела матери. Имеются два сообщения о младенцах, у которых была чрезмерная сонливость, снижение питания и потеря массы тела, ассоциированные с грудным вскармливанием матерью, принимавшей рацемический циталопрам; в одном случае сообщалось, что ребенок полностью восстановился после прекращения приема рацемического циталопрама его матерью, а во втором случае информация о последующем наблюдении отсутствовала. Следует проявлять осторожность и наблюдать за побочными реакциями у грудных детей при приеме кормящей женщиной эсциталопрама.
Адекватных и строго контролируемых исследований у беременных женщин не проводилось, поэтому эсциталопрам следует применять во время беременности только в том случае, если ожидаемая польза превышает потенциальный риск для плода.
По результатам исследования эмбрио/фетального развития у крыс, введение эсциталопрама беременным крысам внутрь (56, 112 или 150 мг/кг/сут) в период органогенеза сопровождалось снижением массы тела плодов и задержкой оссификации при 2 высших дозах (примерно в 56 раз превышающих МРДЧ - 20 мг/сут, при расчете на основе площади поверхности тела в мг/м2). Токсичность для материнского организма (клинические признаки и уменьшение прибавки массы тела и потребления пищи), умеренная при дозе 56 мг/кг/сут, наблюдалась при всех уровнях доз. Доза 56 мг/кг/сут, при которой не наблюдалось влияния на развитие плода, примерно в 28 раз превышала МРДЧ, при расчете в мг/м2. Не было выявлено тератогенности ни при одной из тестируемых доз (до более чем в 75 раз выше МРДЧ, при расчете в мг/м2).
Введение беременным крысам эсциталопрама (6, 12, 24 или 48 мг/кг/сут) в период беременности и до прекращения грудного вскармливания приводило к незначительному увеличению смертности потомства и задержке роста при дозе 48 мг/кг/сут (примерно в 24 раза выше МРДЧ, при расчете в мг/м2). При этой же дозе отмечалась слабая токсичность для материнского организма (клинические признаки и уменьшение прибавки массы тела и потребления пищи). Небольшое повышенние смертности потомства наблюдалось также при дозе 24 мг/кг/сут. Доза 12 мг/кг/сут, при которой не было отмечено неблагоприятных эффектов, примерно в 6 раз выше МРДЧ, при расчете в мг/м2.
В исследованиях репродукции у животных было показано, что рацемический циталопрам оказывает неблагоприятное воздействие на развитие эмбриона/плода и постнатальное развитие, включая тератогенные эффекты, при применении в дозах, превышающих терапевтические дозы для человека.
В двух исследованиях эмбрио/фетального развития у крыс пероральное применение рацемического циталопрама у беременных животных (32, 56 и 112 мг/кг/сут) в период органогенеза сопровождалось при высокой дозе снижением эмбрио/фетального роста и выживаемости и увеличением частоты фетальных нарушений (включая нарушения развития ССС и скелета). Эта доза также была ассоциирована с токсичностью для материнского организма (клинические признаки, снижение прибавки массы тела). При дозе 56 мг/кг/сут не было отмечено неблагоприятных эффектов на развитие. В исследовании у кроликов не наблюдалось неблагоприятного воздействия на развитие эмбриона/плода при дозах рацемического циталопрама до 16 мг/кг/сут. Таким образом, тератогенные эффекты рацемического циталопрама наблюдались при дозе, токсичной для матери, у крыс и не отмечались у кроликов.
При применении у самок крыс рацемического циталопрама (4,8; 12,8 или 32 мг/кг/сут) на поздних сроках беременности и до окончания вскармливания повышенная смертность потомства в течение первых 4 дней после рождения и стойкая задержка роста потомства наблюдались при наивысшей дозе. Доза, не оказывающая эффекта, составила 12,8 мг/кг/сут. Подобные эффекты на смертность и рост потомства наблюдались при применении у самок на протяжении всей беременности и в начале лактации при дозах ≥24 мг/кг/сут. Доза, не оказывающая эффекта, в этом исследовании не определялась.
Нетератогенные эффекты.
У новорожденных, которые подвергались воздействию эсциталопрама и других СИОЗС или СИОЗСН в конце III триместра беременности матери, развивались осложнения, требующие длительной госпитализации, респираторной поддержки, питания через зонд. Такие осложнения могут проявляться немедленно после родоразрешения. Отмеченные клинические симптомы включали респираторный дистресс, цианоз, апноэ, судороги, нестабильность температуры, затруднения при кормлении, рвоту, гипогликемию, гипотонию, повышенный мышечный тонус, гиперрефлексию, тремор, нервное возбуждение, раздражительность и постоянный плач. Эти симптомы связаны либо с прямым токсическим действием СИОЗС или СИОЗСН, или, возможно, являются проявлениями синдрома отмены у новорожденного. Следует отметить, что в некоторых случаях клиническая картина была сходна с развитием серотонинового синдрома ( см «Меры предосторожности»).
У младенцев, которые подверглись воздействию СИОЗС во время беременности матери, может быть повышен риск персистирующей легочной гипертензии новорожденных (ПЛГН). ПЛГН встречается в 1-2 случаях на 1000 живорождений в популяции в целом и ассоциирована со значительной неонатальной заболеваемостью и смертностью. Некоторые недавние эпидемиологические исследования предполагают положительную статистическую связь между применением СИОЗС (включая эсциталопрам) во время беременности и ПЛГН. Другие исследования не показывают значимой статистической связи.
Следует также обратить внимание на результаты проспективного долгосрочного исследования у 201 беременной женщины с БДР в анамнезе, которые или лечились антидепрессантами, или принимали антидепрессанты менее чем за 12 нед до последнего менструального периода и находились в состоянии ремиссии. У женщин, которые прекратили прием антидепрессантов во время беременности, значительно увеличилось количество рецидивов БДР по сравнению с теми женщинами, которые продолжали принимать антидепрессанты на протяжении всей беременности.
При лечении беременной женщины эсциталопрамом врач должен тщательно учитывать как потенциальные риски приема СИОЗС, так и установленные преимущества лечения депрессии антидепрессантами. Это решение может быть принято только в индивидуальном порядке.
Роды и родоразрешение.
Влияние эсциталопрама на роды и родоразрешение у человека неизвестно.
Грудное вскармливание.
Эсциталопрам экскретируется в грудное молоко женщин. Ограниченные данные о женщинах, принимавших эсциталопрам в дозе 10-20 мг, показали, что младенцы, находившиеся исключительно на грудном вскармливании, получали примерно 3,9% дозы эсциталопрама в зависимости от массы тела матери и 1,7% дозы десметилциталопрама в зависимости от массы тела матери. Имеются два сообщения о младенцах, у которых была чрезмерная сонливость, снижение питания и потеря массы тела, ассоциированные с грудным вскармливанием матерью, принимавшей рацемический циталопрам; в одном случае сообщалось, что ребенок полностью восстановился после прекращения приема рацемического циталопрама его матерью, а во втором случае информация о последующем наблюдении отсутствовала. Следует проявлять осторожность и наблюдать за побочными реакциями у грудных детей при приеме кормящей женщиной эсциталопрама.
|
|
Побочные эффекты
Опыт клинических испытаний.
Поскольку клинические испытания проводятся с различным набором условий. частота встречаемости побочных реакций. наблюдаемых в этих испытаниях. не может непосредственно сравниваться с частотой в других клинических испытаниях и может не отражать наблюдаемую в клинической практике.
Источники данных клинических испытаний.
Педиатрические пациенты (6-17 лет).
Данные о побочных эффектах были собраны у 576 педиатрических пациентов (286 эсциталопрам, 290 плацебо) с БДР в двойных слепых плацебо-контролируемых исследованиях. Безопасность и эффективность эсциталопрама у детей младше 12 лет не установлены.
Взрослые.
Информация о побочных эффектах эсциталопрама была собрана у 715 пациентов с БДР, которые принимали эсциталопрам, и 592 пациентов, которые принимали плацебо, в двойных слепых плацебо-контролируемых испытаниях. Кроме того, 284 пациента с БДР вновь принимали эсциталопрам в ходе открытых исследований. Информация о нежелательных явлениях эсциталопрама у пациентов с ГТР была собрана у 429 пациентов, получавших эсциталопрам, и 427 пациентов, получавших плацебо, в двойных слепых плацебо-контролируемых испытаниях.
Информация о нежелательных явлениях во время экспозиции была получена в основном путем общего опроса и зарегистрирована клиническими исследователями с использованием терминологии по своему выбору. Поэтому невозможно дать обоснованную оценку количественного соотношения пациентов. у которых наблюдались нежелательные явления. без предварительной группировки событий сходного типа в меньшее количество стандартизованных категорий событий. В следующих таблицах и перечнях для классификации нежелательных явлений, о которых сообщалось, использовалась стандартная терминология ВОЗ.
Указанная частота нежелательных реакций представляет собой долю пациентов, у которых отмечался хотя бы один случай возникшего в результате лечения нежелательного явления указанного типа. Событие считалось вызванным лечением, если оно произошло впервые или произошло ухудшение во время лечения после исходной оценки.
Нежелательные явления, ассоциированные с прекращением лечения.
БДР.
Педиатрические пациенты (6-17 лет). Побочные эффекты были ассоциированы с прекращением лечения у 3,5% из 286 пациентов, получавших эсциталопрам, и у 1% из 290 пациентов, получавших плацебо. Наиболее частым нежелательным явлением (частота по крайней мере 1% при приеме эсциталопрама и больше, чем при приеме плацебо), связанным с прекращением приема, была инсомния (1% эсциталопрам, 0% плацебо).
Взрослые пациенты. Из 715 пациентов с депрессией, получавших эсциталопрам в плацебо-контролируемых исследованиях, 6% прервали лечение из-за возникновения побочных эффектов, в сравнении с 2% из 592 пациентов, получавших плацебо. В двух исследованиях с фиксированными дозами частота прекращения приема из-за возникновения побочных эффектов у пациентов. получавших эсциталопрам в дозе 10 мг/сут. значимо не отличалась от таковой у пациентов. получавших плацебо. Частота отмены из-за нежелательных явлений у пациентов, которым была назначена фиксированная доза эсциталопрама 20 мг/сут, составила 10%, что значимо отличалось от таковой у пациентов, получавших 10 мг/сут (4%) и плацебо (3%). Побочные эффекты. явившиеся причиной прекращения лечения эсциталопрамом по крайней мере у 1% пациентов. получавших эсциталопрам. с частотой возникновения как минимум в 2 раза больше. чем при приеме плацебо. - тошнота (2%). нарушение эякуляции (2% пациентов-мужчин).
ГТР.
Взрослые пациенты. По результатам плацебо-контролируемых испытаний у больных ГТР. 8% из 429 пациентов. получавших 10-20 мг/сут эсциталопрама. прервали лечение из-за возникновения побочных эффектов. в сравнении с 4% из 427 пациентов. получавших плацебо. Побочные эффекты, явившиеся причиной прекращения лечения эсциталопрамом по крайней мере у 1% пациентов с частотой возникновения как минимум в 2 раза больше плацебо - тошнота (2%), инсомния (1%), утомляемость (1%).
Частота побочных эффектов, наблюдавшихся в плацебо-контролируемых испытаниях.
БДР.
Педиатрические пациенты (6-17 лет). Общий профиль побочных реакций у педиатрических пациентов был в целом аналогичен таковому в исследованиях у взрослых, как показано в таблице 1. Однако о следующих побочных реакциях (за исключением тех. которые указаны в таблице 1. и тех. для которых закодированные термины были неинформативными или вводящими в заблуждение) сообщалось с частотой не менее 2% при приеме эсциталопрама и более высокой. чем при приеме плацебо: боль в спине. инфекции мочевыводящих путей. рвота и заложенность носа.
Взрослые пациенты. Наиболее часто отмечаемыми побочными реакциями у пациентов. принимавших эсциталопрам (частота примерно 5% или более и примерно в 2 раза выше. чем у пациентов. принимавших плацебо). были инсомния. нарушение эякуляции (главным образом задержка эякуляции). тошнота. повышенная потливость. утомляемость и сонливость.
В таблице 1 перечислена частота. округленная до ближайшего процента. побочных эффектов. возникавших при лечении. которые были отмечены у 715 пациентов с депрессией. получавших эсциталопрам в дозах от 10 до 20 мг/сут в плацебо-контролируемых исследованиях. Включены случаи. зафиксированные у 2% или более пациентов. получавших эсциталопрам. и частота которых у пациентов. получавших эсциталопрам. была выше. чем у пациентов. получавших плацебо.
Таблица 1.
Побочные реакции, появившиеся за время лечения, наблюдавшиесяс частотой ≥2% и больше, чем при приеме плацебо, при БДР.
1 Главным образом задержка эякуляции.
2 Фиксировалось только у мужчин: n=225 (эсциталопрам), n=188 (плацебо).
3 Фиксировалось только у женщин: n=490 (эсциталопрам), n=404 (плацебо).
ГТР.
Взрослые пациенты. Наиболее часто наблюдаемыми побочными реакциями у пациентов. принимавших эсциталопрам (частота составляет примерно 5% или больше. и примерно в 2 раза выше. чем у пациентов. принимавших плацебо) были тошнота. нарушение эякуляции (в основном задержка эякуляции). инсомния. утомляемость. понижение либидо и аноргазмия.
В таблице 2 перечислены частоты. округленные до ближайшего процента. побочных эффектов. возникавших при лечении. которые наблюдались у 429 пациентов с ГТР. получавших эсциталопрам в дозах 10-20 мг/сут в плацебо-контролируемых исследованиях. Включены эффекты, отмеченные у 2% или более пациентов, получавших эсциталопрам, и частота которых превышала плацебо.
Таблица 2.
Побочные реакции, появившиеся за время лечения, наблюдавшиеся с частотой ≥2% и превышавшие плацебо, при ГТР.
1 Главным образом задержка эякуляции.
2 Фиксировалось только у мужчин: n=182 (эсциталопрам), n=195 (плацебо).
3 Фиксировалось только у женщин: n=247 (эсциталопрам), n=232 (плацебо).
Зависимость побочных эффектов от дозы.
Потенциальная зависимость частых побочных эффектов от дозы (определяемая как частота ≥5% в группах. получавших 10 или 20 мг эсциталопрама) исследовалась на основе объединенной частоты побочных реакций в 2 испытаниях с фиксированной дозой. Суммарная частота неблагоприятных эффектов в группе пациентов. получавших 10 мг эсциталопрама (66%). была схожа с таковой у пациентов. получавших плацебо (61%). в то время как частота случаев у пациентов. получавших эсциталопрам в дозе 20 мг/сут. была выше (86%). В таблице 3 представлены распространенные побочные эффекты. наблюдавшиеся в группе. получавшей 20 мг/сут эсциталопрама с частотой. примерно в 2 раза превышающей частоту побочных эффектов в группе. получавшей 10 мг/сут. и примерно в 2 раза превышавшей плацебо.
Таблица 3.
Частота общих нежелательных реакций у пациентов с БДР.
Мужская и женская сексуальная дисфункция при приеме СИОЗС.
Несмотря на то. что изменения полового влечения. сексуальной активности и сексуального удовлетворения часто возникают как проявления психического расстройства. они также могут быть следствием медикаментозного лечения. В частности, некоторые данные свидетельствуют о том, что СИОЗС могут вызывать такие нежелательные сексуальные события.
Однако надежные оценки частоты и тяжести неблагоприятных событий. связанных с сексуальным желанием. активностью и удовлетворением. получить трудно. отчасти потому. что пациенты могут неохотно их обсуждать с врачом. Соответственно, оценки частоты неудачного сексуального опыта и активности, указанные в описании, могут не соответствовать их фактической частоте.
Таблица 4.
Частота побочных эффектов в сексуальной сфере, наблюдавшихся при проведении плацебо-контролируемых клинических испытаний.
Нет адекватно разработанных исследований для изучения сексуальной дисфункции при лечении эсциталопрамом.
О приапизме сообщалось при приеме всех СИОЗС.
Хотя трудно определить точный риск сексуальной дисфункции, ассоциированной с применением СИОЗС, врачи должны регулярно спрашивать о таких возможных побочных эффектах.
Изменение жизненно важных функций.
Группы эсциталопрама и плацебо сравнивали по (1) среднему изменению от исходного уровня жизненно важных функций (пульс. сАД. дАД) и (2) доле пациентов. соответствующих критериям потенциально клинически значимых изменений по сравнению с исходным уровнем в показателях этих переменных. Этот анализ не выявил каких-либо клинически важных изменений жизненно важных функций, связанных с лечением эсциталопрамом. Кроме того, сравнение показателей жизненно важных функций в положении лежа на спине и стоя при приеме эсциталопрама и плацебо показало, что лечение эсциталопрамом не связано с ортостатическими изменениями.
Изменение массы тела.
В контролируемых испытаниях не было отмечено клинически значимых изменений массы тела у пациентов, получавших эсциталопрам, по сравнению с плацебо.
Изменение лабораторных показателей.
Группы эсциталопрама и плацебо сравнивали в отношении (1) среднего изменения исходного уровня химических элементов сыворотки. гематологии и анализа мочи. и (2) доли пациентов. соответствующих критериям потенциально клинически значимых изменений этих переменных по сравнению с исходным уровнем. Этот анализ не выявил клинически значимых изменений в параметрах лабораторных тестов, связанных с лечением эсциталопрамом.
Изменения ЭКГ.
ЭКГ в группе эсциталопрама (n=625) и плацебо (n=527) сравнивали в отношении outliers (выбросы - результаты измерения. выделяющиеся из общей выборки). которые были определены как зафиксированные у пациентов с изменениями QTc более 60 мс от исходного уровня или абсолютными значениями более 500 мс после приема дозы и у субъектов с увеличением ЧСС до более 100 уд./мин или снижением до менее 50 уд./мин с изменением на 25% от исходного уровня (выбросы при тахикардии или брадикардии соответственно). Ни у одного из пациентов в группе эсциталопрама не было зафиксировано интервала QTcF >500 мс или пролонгации >60 мс по сравнению с 0,2% пациентов в группе плацебо. Частота выбросов при тахикардии составила 0,2% в группе эсциталопрама и группе плацебо. Частота выбросов при брадикардии составила 0,5% в группе эсциталопрама и 0,2% в группе плацебо.
Интервал QTcF оценивали в рандомизированном, плацебо-контролируемом и актив-контролируемом (моксифлоксацин, 400 мг) перекрестном исследовании c многократным повышением дозы с участием 113 здоровых людей. Максимальные средние значения (95% верхний ДИ) отличия от плацебо составили 4,5 (6,4) и 10,7 (12,7) мс для 10 и 30 мг эсциталопрама, применяемых 1 раз в сутки соответственно. Основываясь на установленном соотношении «экспозиция-ответ», прогнозируемое изменение QTcF от плацебо (95% верхний ДИ) при maxCmax для дозы 20 мг - 6,6 (7,9) мс. Прием эсциталопрама в дозе 30 мг 1 раз в день приводил к увеличению средней maxCmax в 1,7 раза по сравнению со средней maxCmax для максимальной рекомендованной терапевтической дозы в равновесном состоянии (20 мг). Экспозиция при супратерапевтической дозе 30 мг аналогична ssCss, ожидаемым у медленных метаболизаторов сYP2C19 при приеме терапевтической дозы 20 мг.
Другие события, наблюдавшиеся во время премаркетинговой оценки эсциталопрама.
Ниже приводится перечень нежелательных явлений. как они определены в начале раздела. возникших во время лечения. о которых сообщили 1428 пациентов. получавших эсциталопрам в течение периода до 1 года в двойных слепых или открытых клинических испытаниях при премаркетинговой оценке эсциталопрама. Перечень не включает следующие события: перечисленные в таблицах 1 и 2. для которых связь с ЛС была отдаленной и встречавшихся с частотой менее 1% или ниже. чем плацебо. которые были настолько общими. что являются неинформативными. о которых сообщалось только один раз и вероятность того. что они представляют серьезную угрозу для жизни. была незначительной. События классифицируются по системам организма. События, имеющие большое клиническое значение, описаны в разделе «Меры предосторожности».
Со стороны ССС. Гипертензия, пальпитация.
Со стороны центральной и периферической нервной системы. Ощущение головокружения, мигрень.
Со стороны ЖКТ. Спазмы в животе, изжога, гастроэнтерит.
Общие. Аллергия, боль в груди, лихорадка, приливы крови к лицу, боль в конечностях.
Со стороны метаболизма и нарушения питания. Увеличение массы тела.
Со стороны скелетно-мышечной системы. Артралгия, миалгия, ригидность челюстных мышц.
Нарушение психики. Повышение аппетита, нарушение концентрации внимания, раздражительность.
Нарушения репродуктивной функции у женщин. Менструальный спазм, нарушение менструального цикла.
Со стороны респираторной системы. Бронхит, кашель, заложенность носа, заложенность носовых пазух, синусная головная боль.
Со стороны кожи и ее придатков. Сыпь.
Со стороны органов чувств. Нечеткость зрения, шум в ушах.
Со стороны мочеполовой системы. Частое мочеиспускание, инфекции мочевыводящих путей.
Постмаркетинговый опыт.
Побочные реакции, о которых сообщалось в постмаркетинговый период применения эсциталопрама.
Следующие дополнительные побочные реакции были выявлены из спонтанных сообщений об эсциталопраме, полученных во всем мире. Эти побочные реакции были выбраны для включения из-за сочетания серьезности, частоты сообщений или возможной причинной связи с приемом эсциталопрама и не были перечислены в других разделах. Однако, поскольку об этих реакциях сообщалось добровольно от популяции неопределенного размера, не всегда возможно надежно оценить их частоту или установить причинную связь с экспозицией ЛС.
Со стороны крови и лимфатической системы. Анемия. агранулоцитоз. апластическая анемия. гемолитическая анемия. идиопатическая тромбоцитопения пурпура. лейкопения. тромбоцитопения.
Со стороны сердца. Фибрилляция предсердий. брадикардия. сердечная недостаточность. инфаркт миокарда. тахикардия. torsade de pointes. желудочковая аритмия. желудочковая тахикардия.
Со стороны органа слуха и лабиринтные расстройства. Вертиго.
Со стороны эндокринной системы. Сахарный диабет, гиперпролактинемия, синдром неадекватной секреции АДГ.
Со стороны органа зрения. Закрытоугольная глаукома, диплопия, мидриаз, нарушение зрения.
Со стороны ЖКТ. Дисфагия, желудочно-кишечное кровотечение, гастроэзофагеальный рефлюкс, панкреатит, ректальное кровотечение.
Общие расстройства и реакции в месте введения. Ненормальная походка. астения. отек. падения. ненормальное самочувствие. недомогание.
Со стороны печени и желчевыводящих путей. Фульминантный гепатит, печеночная недостаточность, некроз печени, гепатит.
Со стороны иммунной системы. Аллергическая реакция, анафилаксия.
Исследования. Повышение билирубина. снижение массы тела. удлинение интервала QT на ЭКГ. повышение печеночных ферментов. гиперхолестеринемия. повышение МНО. снижение протромбина.
Со стороны метаболизма и нарушения питания. Гипергликемия, гипогликемия, гипокалиемия, гипонатриемия.
Со стороны скелетно-мышечной системы и соединительной ткани. Спазм мышц, ригидность мышц, мышечная слабость, рабдомиолиз.
Со стороны нервной системы. Акатизия. амнезия. атаксия. хореоатетоз. нарушение мозгового кровообращения. дизартрия. дискинезия. дистония. экстрапирамидные расстройства. припадки grand mal (или судороги). гипоэстезия. миоклонус. нистагм. паркинсонизм. синдром беспокойных ног. судороги. обморок. поздняя дискинезия. тремор.
Нарушение психики. Острый психоз. агрессия. ажитация. гнев. тревога. апатия. завершенный суицид. спутанность сознания. деперсонализация. обострение депрессии. делирий. бред. дезориентация. ощущение нереальности. галлюцинации (зрительные и слуховые). перепады настроения. нервозность. ночные кошмары. паническая реакция. паранойя. возбуждение. членовредительство или мысли о самоповреждении. попытка суицида. суицидальные мысли. суицидальные наклонности.
Со стороны почек и мочевыводящих путей. Острая почечная недостаточность, дизурия, задержка мочи.
Со стороны репродуктивной системы и грудных желез. Меноррагия, приапизм.
Беременность, послеродовой период и перинатальные состояния. Самопроизвольный выкидыш.
Со стороны респираторной системы, органов грудной клетки и средостения. Одышка, носовые кровотечения, ТЭЛА, легочная гипертензия новорожденных.
Со стороны кожи и подкожных тканей. Алопеция. ангионевротический отек. дерматит. экхимоз. многоформная эритема. реакция фоточувствительности. синдром Стивенса-Джонсона. токсический эпидермальный некролиз. крапивница.
Со стороны сосудов. ТГВ. приливы крови к лицу. гипертонический криз. гипотензия. ортостатическая гипотензия. флебит. тромбоз.
Поскольку клинические испытания проводятся с различным набором условий. частота встречаемости побочных реакций. наблюдаемых в этих испытаниях. не может непосредственно сравниваться с частотой в других клинических испытаниях и может не отражать наблюдаемую в клинической практике.
Источники данных клинических испытаний.
Педиатрические пациенты (6-17 лет).
Данные о побочных эффектах были собраны у 576 педиатрических пациентов (286 эсциталопрам, 290 плацебо) с БДР в двойных слепых плацебо-контролируемых исследованиях. Безопасность и эффективность эсциталопрама у детей младше 12 лет не установлены.
Взрослые.
Информация о побочных эффектах эсциталопрама была собрана у 715 пациентов с БДР, которые принимали эсциталопрам, и 592 пациентов, которые принимали плацебо, в двойных слепых плацебо-контролируемых испытаниях. Кроме того, 284 пациента с БДР вновь принимали эсциталопрам в ходе открытых исследований. Информация о нежелательных явлениях эсциталопрама у пациентов с ГТР была собрана у 429 пациентов, получавших эсциталопрам, и 427 пациентов, получавших плацебо, в двойных слепых плацебо-контролируемых испытаниях.
Информация о нежелательных явлениях во время экспозиции была получена в основном путем общего опроса и зарегистрирована клиническими исследователями с использованием терминологии по своему выбору. Поэтому невозможно дать обоснованную оценку количественного соотношения пациентов. у которых наблюдались нежелательные явления. без предварительной группировки событий сходного типа в меньшее количество стандартизованных категорий событий. В следующих таблицах и перечнях для классификации нежелательных явлений, о которых сообщалось, использовалась стандартная терминология ВОЗ.
Указанная частота нежелательных реакций представляет собой долю пациентов, у которых отмечался хотя бы один случай возникшего в результате лечения нежелательного явления указанного типа. Событие считалось вызванным лечением, если оно произошло впервые или произошло ухудшение во время лечения после исходной оценки.
Нежелательные явления, ассоциированные с прекращением лечения.
БДР.
Педиатрические пациенты (6-17 лет). Побочные эффекты были ассоциированы с прекращением лечения у 3,5% из 286 пациентов, получавших эсциталопрам, и у 1% из 290 пациентов, получавших плацебо. Наиболее частым нежелательным явлением (частота по крайней мере 1% при приеме эсциталопрама и больше, чем при приеме плацебо), связанным с прекращением приема, была инсомния (1% эсциталопрам, 0% плацебо).
Взрослые пациенты. Из 715 пациентов с депрессией, получавших эсциталопрам в плацебо-контролируемых исследованиях, 6% прервали лечение из-за возникновения побочных эффектов, в сравнении с 2% из 592 пациентов, получавших плацебо. В двух исследованиях с фиксированными дозами частота прекращения приема из-за возникновения побочных эффектов у пациентов. получавших эсциталопрам в дозе 10 мг/сут. значимо не отличалась от таковой у пациентов. получавших плацебо. Частота отмены из-за нежелательных явлений у пациентов, которым была назначена фиксированная доза эсциталопрама 20 мг/сут, составила 10%, что значимо отличалось от таковой у пациентов, получавших 10 мг/сут (4%) и плацебо (3%). Побочные эффекты. явившиеся причиной прекращения лечения эсциталопрамом по крайней мере у 1% пациентов. получавших эсциталопрам. с частотой возникновения как минимум в 2 раза больше. чем при приеме плацебо. - тошнота (2%). нарушение эякуляции (2% пациентов-мужчин).
ГТР.
Взрослые пациенты. По результатам плацебо-контролируемых испытаний у больных ГТР. 8% из 429 пациентов. получавших 10-20 мг/сут эсциталопрама. прервали лечение из-за возникновения побочных эффектов. в сравнении с 4% из 427 пациентов. получавших плацебо. Побочные эффекты, явившиеся причиной прекращения лечения эсциталопрамом по крайней мере у 1% пациентов с частотой возникновения как минимум в 2 раза больше плацебо - тошнота (2%), инсомния (1%), утомляемость (1%).
Частота побочных эффектов, наблюдавшихся в плацебо-контролируемых испытаниях.
БДР.
Педиатрические пациенты (6-17 лет). Общий профиль побочных реакций у педиатрических пациентов был в целом аналогичен таковому в исследованиях у взрослых, как показано в таблице 1. Однако о следующих побочных реакциях (за исключением тех. которые указаны в таблице 1. и тех. для которых закодированные термины были неинформативными или вводящими в заблуждение) сообщалось с частотой не менее 2% при приеме эсциталопрама и более высокой. чем при приеме плацебо: боль в спине. инфекции мочевыводящих путей. рвота и заложенность носа.
Взрослые пациенты. Наиболее часто отмечаемыми побочными реакциями у пациентов. принимавших эсциталопрам (частота примерно 5% или более и примерно в 2 раза выше. чем у пациентов. принимавших плацебо). были инсомния. нарушение эякуляции (главным образом задержка эякуляции). тошнота. повышенная потливость. утомляемость и сонливость.
В таблице 1 перечислена частота. округленная до ближайшего процента. побочных эффектов. возникавших при лечении. которые были отмечены у 715 пациентов с депрессией. получавших эсциталопрам в дозах от 10 до 20 мг/сут в плацебо-контролируемых исследованиях. Включены случаи. зафиксированные у 2% или более пациентов. получавших эсциталопрам. и частота которых у пациентов. получавших эсциталопрам. была выше. чем у пациентов. получавших плацебо.
Таблица 1.
Побочные реакции, появившиеся за время лечения, наблюдавшиесяс частотой ≥2% и больше, чем при приеме плацебо, при БДР.
| Побочная реакция | Эсциталопрам (n=715), % | Плацебо (n=592), % |
| Расстройства автономной нервной системы | ||
| Сухость во рту | 6 | 5 |
| Повышенная потливость | 5 | 2 |
| Расстройства центральной и периферической нервной системы | ||
| Головокружение | 5 | 3 |
| Желудочно-кишечные расстройства | ||
| Тошнота | 15 | 7 |
| Диарея | 8 | 5 |
| Запор | 3 | 1 |
| Диспепсия | 3 | 1 |
| Боль в животе | 2 | 1 |
| Общие | ||
| Гриппоподобные симптомы | 5 | 4 |
| Утомляемость | 5 | 2 |
| Нарушение психики | ||
| Инсомния | 9 | 4 |
| Сонливость | 6 | 2 |
| Снижение аппетита | 3 | 1 |
| Понижение либидо | 3 | 1 |
| Расстройства респираторной системы | ||
| Ринит | 5 | 4 |
| Синусит | 3 | 2 |
| Расстройства мочеполовой системы | ||
| Нарушение эякуляции1,2 | 9 | <1 |
| Импотенция2 | 3 | <1 |
| Аноргазмия3 | 2 | <1 |
1 Главным образом задержка эякуляции.
2 Фиксировалось только у мужчин: n=225 (эсциталопрам), n=188 (плацебо).
3 Фиксировалось только у женщин: n=490 (эсциталопрам), n=404 (плацебо).
ГТР.
Взрослые пациенты. Наиболее часто наблюдаемыми побочными реакциями у пациентов. принимавших эсциталопрам (частота составляет примерно 5% или больше. и примерно в 2 раза выше. чем у пациентов. принимавших плацебо) были тошнота. нарушение эякуляции (в основном задержка эякуляции). инсомния. утомляемость. понижение либидо и аноргазмия.
В таблице 2 перечислены частоты. округленные до ближайшего процента. побочных эффектов. возникавших при лечении. которые наблюдались у 429 пациентов с ГТР. получавших эсциталопрам в дозах 10-20 мг/сут в плацебо-контролируемых исследованиях. Включены эффекты, отмеченные у 2% или более пациентов, получавших эсциталопрам, и частота которых превышала плацебо.
Таблица 2.
Побочные реакции, появившиеся за время лечения, наблюдавшиеся с частотой ≥2% и превышавшие плацебо, при ГТР.
| Побочные эффекты | Эсциталопрам (n=429), % | Плацебо (n=427), % |
| Расстройства автономной нервной системы | ||
| Сухость во рту | 9 | 5 |
| Повышенная потливость | 4 | 1 |
| Расстройства центральной и периферической нервной системы | ||
| Головная боль | 24 | 17 |
| Парестезия | 2 | 1 |
| Желудочно-кишечные расстройства | ||
| Тошнота | 18 | 8 |
| Диарея | 8 | 6 |
| Запор | 5 | 4 |
| Диспепсия | 3 | 2 |
| Рвота | 3 | 1 |
| Боль в животе | 2 | 1 |
| Метеоризм | 2 | 1 |
| Зубная боль | 2 | 0 |
| Общие | ||
| Утомляемость | 8 | 2 |
| Гриппоподобные симптомы | 5 | 4 |
| Расстройства скелетно-мышечной системы | ||
| Боль в шее/плече | 3 | 1 |
| Нарушение психики | ||
| Сонливость | 13 | 7 |
| Инсомния | 12 | 6 |
| Понижение либидо | 7 | 2 |
| Необычные сновидения | 3 | 2 |
| Снижение аппетита | 3 | 1 |
| Летаргия | 3 | 1 |
| Расстройства респираторной системы | ||
| Зевота | 2 | 1 |
| Мочеполовые расстройства | ||
| Нарушение эякуляции1,2 | 14 | 2 |
| Аноргазмия3 | 6 | <1 |
| Менструальные расстройства | 2 | 1 |
1 Главным образом задержка эякуляции.
2 Фиксировалось только у мужчин: n=182 (эсциталопрам), n=195 (плацебо).
3 Фиксировалось только у женщин: n=247 (эсциталопрам), n=232 (плацебо).
Зависимость побочных эффектов от дозы.
Потенциальная зависимость частых побочных эффектов от дозы (определяемая как частота ≥5% в группах. получавших 10 или 20 мг эсциталопрама) исследовалась на основе объединенной частоты побочных реакций в 2 испытаниях с фиксированной дозой. Суммарная частота неблагоприятных эффектов в группе пациентов. получавших 10 мг эсциталопрама (66%). была схожа с таковой у пациентов. получавших плацебо (61%). в то время как частота случаев у пациентов. получавших эсциталопрам в дозе 20 мг/сут. была выше (86%). В таблице 3 представлены распространенные побочные эффекты. наблюдавшиеся в группе. получавшей 20 мг/сут эсциталопрама с частотой. примерно в 2 раза превышающей частоту побочных эффектов в группе. получавшей 10 мг/сут. и примерно в 2 раза превышавшей плацебо.
Таблица 3.
Частота общих нежелательных реакций у пациентов с БДР.
| Побочная реакция | Плацебо (n=311), % | Эсциталопрам 10 мг/сут (n=310), % | Эсциталопрам 20 мг/сут (n=125), % |
| Инсомния | 4 | 7 | 14 |
| Диарея | 5 | 6 | 14 |
| Сухость во рту | 3 | 4 | 9 |
| Сонливость | 1 | 4 | 9 |
| Головокружение | 2 | 4 | 7 |
| Повышенная потливость | <1 | 3 | 8 |
| Запор | 1 | 3 | 6 |
| Утомляемость | 2 | 2 | 6 |
| Диспепсия | 1 | 2 | 6 |
Мужская и женская сексуальная дисфункция при приеме СИОЗС.
Несмотря на то. что изменения полового влечения. сексуальной активности и сексуального удовлетворения часто возникают как проявления психического расстройства. они также могут быть следствием медикаментозного лечения. В частности, некоторые данные свидетельствуют о том, что СИОЗС могут вызывать такие нежелательные сексуальные события.
Однако надежные оценки частоты и тяжести неблагоприятных событий. связанных с сексуальным желанием. активностью и удовлетворением. получить трудно. отчасти потому. что пациенты могут неохотно их обсуждать с врачом. Соответственно, оценки частоты неудачного сексуального опыта и активности, указанные в описании, могут не соответствовать их фактической частоте.
Таблица 4.
Частота побочных эффектов в сексуальной сфере, наблюдавшихся при проведении плацебо-контролируемых клинических испытаний.
| Побочный эффект | Эсциталопрам | Плацебо |
| Только у мужчин | ||
| (n=407), % | (n=383), % | |
| Нарушение эякуляции (главным образом задержка эякуляции) | 12 | 1 |
| Понижение либидо | 6 | 2 |
| Импотенция | 2 | <1 |
| Только у женщин | ||
| (n=737), % | (n=636), % | |
| Понижение либидо | 3 | 1 |
| Аноргазмия | 3 | <1 |
Нет адекватно разработанных исследований для изучения сексуальной дисфункции при лечении эсциталопрамом.
О приапизме сообщалось при приеме всех СИОЗС.
Хотя трудно определить точный риск сексуальной дисфункции, ассоциированной с применением СИОЗС, врачи должны регулярно спрашивать о таких возможных побочных эффектах.
Изменение жизненно важных функций.
Группы эсциталопрама и плацебо сравнивали по (1) среднему изменению от исходного уровня жизненно важных функций (пульс. сАД. дАД) и (2) доле пациентов. соответствующих критериям потенциально клинически значимых изменений по сравнению с исходным уровнем в показателях этих переменных. Этот анализ не выявил каких-либо клинически важных изменений жизненно важных функций, связанных с лечением эсциталопрамом. Кроме того, сравнение показателей жизненно важных функций в положении лежа на спине и стоя при приеме эсциталопрама и плацебо показало, что лечение эсциталопрамом не связано с ортостатическими изменениями.
Изменение массы тела.
В контролируемых испытаниях не было отмечено клинически значимых изменений массы тела у пациентов, получавших эсциталопрам, по сравнению с плацебо.
Изменение лабораторных показателей.
Группы эсциталопрама и плацебо сравнивали в отношении (1) среднего изменения исходного уровня химических элементов сыворотки. гематологии и анализа мочи. и (2) доли пациентов. соответствующих критериям потенциально клинически значимых изменений этих переменных по сравнению с исходным уровнем. Этот анализ не выявил клинически значимых изменений в параметрах лабораторных тестов, связанных с лечением эсциталопрамом.
Изменения ЭКГ.
ЭКГ в группе эсциталопрама (n=625) и плацебо (n=527) сравнивали в отношении outliers (выбросы - результаты измерения. выделяющиеся из общей выборки). которые были определены как зафиксированные у пациентов с изменениями QTc более 60 мс от исходного уровня или абсолютными значениями более 500 мс после приема дозы и у субъектов с увеличением ЧСС до более 100 уд./мин или снижением до менее 50 уд./мин с изменением на 25% от исходного уровня (выбросы при тахикардии или брадикардии соответственно). Ни у одного из пациентов в группе эсциталопрама не было зафиксировано интервала QTcF >500 мс или пролонгации >60 мс по сравнению с 0,2% пациентов в группе плацебо. Частота выбросов при тахикардии составила 0,2% в группе эсциталопрама и группе плацебо. Частота выбросов при брадикардии составила 0,5% в группе эсциталопрама и 0,2% в группе плацебо.
Интервал QTcF оценивали в рандомизированном, плацебо-контролируемом и актив-контролируемом (моксифлоксацин, 400 мг) перекрестном исследовании c многократным повышением дозы с участием 113 здоровых людей. Максимальные средние значения (95% верхний ДИ) отличия от плацебо составили 4,5 (6,4) и 10,7 (12,7) мс для 10 и 30 мг эсциталопрама, применяемых 1 раз в сутки соответственно. Основываясь на установленном соотношении «экспозиция-ответ», прогнозируемое изменение QTcF от плацебо (95% верхний ДИ) при maxCmax для дозы 20 мг - 6,6 (7,9) мс. Прием эсциталопрама в дозе 30 мг 1 раз в день приводил к увеличению средней maxCmax в 1,7 раза по сравнению со средней maxCmax для максимальной рекомендованной терапевтической дозы в равновесном состоянии (20 мг). Экспозиция при супратерапевтической дозе 30 мг аналогична ssCss, ожидаемым у медленных метаболизаторов сYP2C19 при приеме терапевтической дозы 20 мг.
Другие события, наблюдавшиеся во время премаркетинговой оценки эсциталопрама.
Ниже приводится перечень нежелательных явлений. как они определены в начале раздела. возникших во время лечения. о которых сообщили 1428 пациентов. получавших эсциталопрам в течение периода до 1 года в двойных слепых или открытых клинических испытаниях при премаркетинговой оценке эсциталопрама. Перечень не включает следующие события: перечисленные в таблицах 1 и 2. для которых связь с ЛС была отдаленной и встречавшихся с частотой менее 1% или ниже. чем плацебо. которые были настолько общими. что являются неинформативными. о которых сообщалось только один раз и вероятность того. что они представляют серьезную угрозу для жизни. была незначительной. События классифицируются по системам организма. События, имеющие большое клиническое значение, описаны в разделе «Меры предосторожности».
Со стороны ССС. Гипертензия, пальпитация.
Со стороны центральной и периферической нервной системы. Ощущение головокружения, мигрень.
Со стороны ЖКТ. Спазмы в животе, изжога, гастроэнтерит.
Общие. Аллергия, боль в груди, лихорадка, приливы крови к лицу, боль в конечностях.
Со стороны метаболизма и нарушения питания. Увеличение массы тела.
Со стороны скелетно-мышечной системы. Артралгия, миалгия, ригидность челюстных мышц.
Нарушение психики. Повышение аппетита, нарушение концентрации внимания, раздражительность.
Нарушения репродуктивной функции у женщин. Менструальный спазм, нарушение менструального цикла.
Со стороны респираторной системы. Бронхит, кашель, заложенность носа, заложенность носовых пазух, синусная головная боль.
Со стороны кожи и ее придатков. Сыпь.
Со стороны органов чувств. Нечеткость зрения, шум в ушах.
Со стороны мочеполовой системы. Частое мочеиспускание, инфекции мочевыводящих путей.
Постмаркетинговый опыт.
Побочные реакции, о которых сообщалось в постмаркетинговый период применения эсциталопрама.
Следующие дополнительные побочные реакции были выявлены из спонтанных сообщений об эсциталопраме, полученных во всем мире. Эти побочные реакции были выбраны для включения из-за сочетания серьезности, частоты сообщений или возможной причинной связи с приемом эсциталопрама и не были перечислены в других разделах. Однако, поскольку об этих реакциях сообщалось добровольно от популяции неопределенного размера, не всегда возможно надежно оценить их частоту или установить причинную связь с экспозицией ЛС.
Со стороны крови и лимфатической системы. Анемия. агранулоцитоз. апластическая анемия. гемолитическая анемия. идиопатическая тромбоцитопения пурпура. лейкопения. тромбоцитопения.
Со стороны сердца. Фибрилляция предсердий. брадикардия. сердечная недостаточность. инфаркт миокарда. тахикардия. torsade de pointes. желудочковая аритмия. желудочковая тахикардия.
Со стороны органа слуха и лабиринтные расстройства. Вертиго.
Со стороны эндокринной системы. Сахарный диабет, гиперпролактинемия, синдром неадекватной секреции АДГ.
Со стороны органа зрения. Закрытоугольная глаукома, диплопия, мидриаз, нарушение зрения.
Со стороны ЖКТ. Дисфагия, желудочно-кишечное кровотечение, гастроэзофагеальный рефлюкс, панкреатит, ректальное кровотечение.
Общие расстройства и реакции в месте введения. Ненормальная походка. астения. отек. падения. ненормальное самочувствие. недомогание.
Со стороны печени и желчевыводящих путей. Фульминантный гепатит, печеночная недостаточность, некроз печени, гепатит.
Со стороны иммунной системы. Аллергическая реакция, анафилаксия.
Исследования. Повышение билирубина. снижение массы тела. удлинение интервала QT на ЭКГ. повышение печеночных ферментов. гиперхолестеринемия. повышение МНО. снижение протромбина.
Со стороны метаболизма и нарушения питания. Гипергликемия, гипогликемия, гипокалиемия, гипонатриемия.
Со стороны скелетно-мышечной системы и соединительной ткани. Спазм мышц, ригидность мышц, мышечная слабость, рабдомиолиз.
Со стороны нервной системы. Акатизия. амнезия. атаксия. хореоатетоз. нарушение мозгового кровообращения. дизартрия. дискинезия. дистония. экстрапирамидные расстройства. припадки grand mal (или судороги). гипоэстезия. миоклонус. нистагм. паркинсонизм. синдром беспокойных ног. судороги. обморок. поздняя дискинезия. тремор.
Нарушение психики. Острый психоз. агрессия. ажитация. гнев. тревога. апатия. завершенный суицид. спутанность сознания. деперсонализация. обострение депрессии. делирий. бред. дезориентация. ощущение нереальности. галлюцинации (зрительные и слуховые). перепады настроения. нервозность. ночные кошмары. паническая реакция. паранойя. возбуждение. членовредительство или мысли о самоповреждении. попытка суицида. суицидальные мысли. суицидальные наклонности.
Со стороны почек и мочевыводящих путей. Острая почечная недостаточность, дизурия, задержка мочи.
Со стороны репродуктивной системы и грудных желез. Меноррагия, приапизм.
Беременность, послеродовой период и перинатальные состояния. Самопроизвольный выкидыш.
Со стороны респираторной системы, органов грудной клетки и средостения. Одышка, носовые кровотечения, ТЭЛА, легочная гипертензия новорожденных.
Со стороны кожи и подкожных тканей. Алопеция. ангионевротический отек. дерматит. экхимоз. многоформная эритема. реакция фоточувствительности. синдром Стивенса-Джонсона. токсический эпидермальный некролиз. крапивница.
Со стороны сосудов. ТГВ. приливы крови к лицу. гипертонический криз. гипотензия. ортостатическая гипотензия. флебит. тромбоз.
|
|
Взаимодействие
Ингибиторы МАО. См «Противопоказания», «Меры предосторожности».
Серотонинергические ЛС. См «Противопоказания», «Меры предосторожности».
Триптаны.
Имеются редкие постмаркетинговые сообщения о серотониновом синдроме при приеме СИОЗС и триптана. Если сопутствующее лечение эсциталопрамом с триптаном клинически оправдано, рекомендуется тщательное наблюдение за пациентом, особенно во время начала лечения и увеличения дозы ( см «Меры предосторожности»).
ЛС, действующие на ЦНС.
Учитывая основные эффекты эсциталопрама на ЦНС, следует соблюдать осторожность при его приеме в сочетании с другими ЛС центрального действия.
Алкоголь.
Хотя эсциталопрам не потенцировал когнитивные и двигательные эффекты алкоголя в клинических испытаниях, употребление алкоголя пациентам, принимающим эсциталопрам, как и для других психотропных ЛС, не рекомендуется.
ЛС, нарушающие гемостаз (в тч НПВС, ацетилсалициловая кислота, варфарин).
Высвобождение серотонина тромбоцитами играет важную роль в гемостазе. Эпидемиологические исследования случай-контроль и когортного дизайна, которые продемонстрировали связь применения психотропных ЛС, препятствующих обратному захвату серотонина, и возникновения кровотечения из верхних отделов ЖКТ, также показали, что одновременное применение НПВС или ацетилсалициловой кислоты может потенцировать риск развития кровотечения. Сообщалось об изменении антикоагулянтных эффектов, включая усиление кровотечения, при одновременном применении СИОЗС и СИОЗСН с варфарином. Пациенты, получающие терапию варфарином, должны находиться под тщательным наблюдением при начале или прекращении приема эсциталопрама.
Циметидин.
У людей, которые получали рацемическую форму циталопрама в дозе 40 мг/сут в течение 21 дня, комбинированное применение 400 мг циметидина дважды в день в течение 8 дней приводило к увеличению AUC и maxCmax циталопрама на 43 и 39% соответственно. Клиническое значение этих результатов неизвестно.
Дигоксин.
У людей, которые в течение 21 дня получали рацемическую форму циталопрама в дозе 40 мг/сут, комбинированное применение циталопрама и дигоксина (однократная доза 1 мг) существенно не влияло на фармакокинетику циталопрама или дигоксина.
Литий.
Сочетанное применение рацемической формы циталопрама (40 мг/сут в течение 10 дней) и лития (30 ммоль/сут в течение 5 дней) не оказывало значимого влияния на фармакокинетику циталопрама или лития. Тем не менее, уровень лития в плазме следует контролировать с корректировкой дозы лития в соответствии со стандартной клинической практикой. Поскольку литий может усиливать серотонинергические эффекты эсциталопрама, следует соблюдать осторожность при одновременном применении эсциталопрама и лития.
Пимозид и циталопрам.
В контролируемом исследовании прием пимозида в однократной дозе 2 мг совместно с рацемической формой циталопрама в дозе 40 мг, принимаемого 1 раз в день в течение 11 дней, был ассоциирован со средним увеличением значений QTc примерно на 10 мс по сравнению с пимозидом, принимаемым отдельно. Рацемическая форма циталопрама не изменяла среднюю AUC или maxCmax пимозида. Механизм этого ФДВ неизвестен.
Суматриптан.
Имеются редкие постмаркетинговые отчеты о пациентах, у которых развилась слабость, гиперрефлексия и нарушение координации движений после приема СИОЗС и суматриптана. Если сопутствующее лечение суматриптаном и СИОЗС (например, флуоксетин, флувоксамин, пароксетин, сертралин, циталопрам, эсциталопрам) клинически оправдано, рекомендуется соответствующее наблюдение за пациентом.
Теофиллин.
Совместный прием рацемической формы циталопрама (40 мг/сут в течение 21 дня) и субстрата сYP1A2 теофиллина (однократная доза 300 мг) не влиял на фармакокинетику теофиллина. Влияние теофиллина на фармакокинетику циталопрама не оценивали.
Варфарин.
Применение рацемической формы циталопрама в дозе 40 мг/сут в течение 21 дня не влияло на фармакокинетику варфарина, субстрата сYP3A4. ПВ увеличивалось на 5%, клиническое значение этого неизвестно.
Карбамазепин.
Совместный прием рацемической формы циталопрама (40 мг/сут в течение 14 дней) и карбамазепина (титрованная доза до 400 мг/сут в течение 35 дней) не оказывал значимого влияния на фармакокинетику карбамазепина, субстрата сYP3A4. Хотя сmin циталопрама в плазме крови не изменялась, принимая во внимание ферментиндуцирующие свойства карбамазепина, следует учитывать возможность того, что карбамазепин может увеличивать клиренс эсциталопрама, если эти два ЛС применяются одновременно.
Триазолам.
Совместное применение рацемической формы циталопрама (титровано до 40 мг/сут в течение 28 дней) и субстрата сYP3A4 триазолама (однократная доза 0,25 мг) не оказывало значимого влияния на фармакокинетику циталопрама или триазолама.
Кетоконазол.
Совместный прием рацемической формы циталопрама (40 мг) и кетоконазола (200 мг) снижал maxCmax и AUC кетоконазола на 21 и 10% соответственно и не оказывал существенного влияния на фармакокинетику циталопрама.
Ритонавир.
Совместное применение разовой дозы ритонавира (600 мг), как субстрата сYP3A4, так и сильного ингибитора сYP3A4, и эсциталопрама (20 мг) не влияло на фармакокинетику ритонавира или эсциталопрама.
Данные по ингибированию изоферментов in vitro >in vitro не выявили ингибирующего эффекта эсциталопрама на сYP3A4, сYP1A2, сYP2C9, сYP2C19 и сYP2E1. Основываясь на данных in vitro, предполагается слабое ингибирующее действие эсциталопрама на метаболизм, опосредованный этой группой изоферментов цитохрома Р450 in vivo >in vivo. Хотя данные in vivo >in vivo для ответа на этот вопрос ограничены, результаты исследований взаимодействия ЛС показывают, что эсциталопрам в дозе 20 мг не оказывает ингибирующего действия на сYP3A4 и имеет умеренное ингибирующее действие на сYP2D6.
Ингибиторы сYP3A4 и сYP2C19. Исследования in vitro >in vitro показали, что сYP3A4 и сYP2C19 являются основными изоферментами, участвующими в метаболизме эсциталопрама. Однако одновременный прием эсциталопрама (20 мг) и ритонавира (600 мг), сильного ингибитора сYP3A4, не оказывал значимого влияния на фармакокинетику эсциталопрама. Поскольку эсциталопрам метаболизируется множеством ферментных систем, ингибирование одного изофермента может несущественно снижать клиренс эсциталопрама.
ЛС, метаболизируемые изоферментом сYP2D6 цитохрома Р450. Исследования in vitro >in vitro не выявили ингибирующего действия эсциталопрама на изофермент сYP2D6. Кроме того, равновесные уровни рацемической формы циталопрама существенно не различались у слабых метаболизаторов и сильных метаболизаторов сYP2D6 после многократного применения циталопрама, что позволяет предположить, что одновременный прием с эсциталопрамом ЛС, ингибирующего сYP2D6, вряд ли окажет клинически значимое влияние на метаболизм эсциталопрама. Однако имеются ограниченные данные in vivo >in vivo, предполагающие умеренный ингибирующий эффект сYP2D6 для эсциталопрама, а именно одновременное применение эсциталопрама (20 мг/сут в течение 21 дня) с трициклическим антидепрессантом дезипрамином (разовая доза 50 мг), субстратом сYP2D6, приводило к увеличению maxCmax на 40% и увеличению AUC дезипрамина на 100%. Клиническое значение этого результата неизвестно. Тем не менее следует соблюдать осторожность при одновременном применении эсциталопрама и ЛС, метаболизируемых сYP2D6.
Метопролол.
Применение эсциталопрама в дозе 20 мг/сут в течение 21 дня и бета-адреноблокатора метопролола (однократная доза 100 мг) у здоровых добровольцев приводило к увеличению maxCmax метопролола на 50% и AUC на 82%. Повышенные уровни метопролола в плазме были связаны со снижением кардиоселективности. Совместное применение эсциталопрама и метопролола не оказывало клинически значимого влияния на АД или ЧСС.
Электросудорожная терапия (ЭСТ).
Нет клинических исследований комбинированного применения ЭСТ и эсциталопрама.
Злоупотребление и зависимость.
Физическая и психологическая зависимость. Исследования на животных показывают, что вероятность злоупотребления рацемической формы циталопрама низкая. Эсциталопрам систематически не изучали у человека на предмет потенциального злоупотребления, толерантности или физической зависимости. Клинический премаркетинговый опыт оценки эсциталопрама не выявил какой-либо тенденции к лекарственнозависимому поведению. Однако эти наблюдения не были систематическими, и на основе этого ограниченного опыта невозможно предсказать, в какой степени ЛС, активное в отношении ЦНС, будет использоваться не по назначению и/или приводить к злоупотреблению в постмаркетинговый период. Поэтому при назначении эсциталопрама врач должен тщательно обследовать пациентов на предмет злоупотребления ЛС в анамнезе, и за такими пациентами следует внимательно наблюдать на предмет возникновения признаков неправильного использования или злоупотребления (например, развитие толерантности, увеличение дозы, лекарственнозависимое поведение).
Серотонинергические ЛС. См «Противопоказания», «Меры предосторожности».
Триптаны.
Имеются редкие постмаркетинговые сообщения о серотониновом синдроме при приеме СИОЗС и триптана. Если сопутствующее лечение эсциталопрамом с триптаном клинически оправдано, рекомендуется тщательное наблюдение за пациентом, особенно во время начала лечения и увеличения дозы ( см «Меры предосторожности»).
ЛС, действующие на ЦНС.
Учитывая основные эффекты эсциталопрама на ЦНС, следует соблюдать осторожность при его приеме в сочетании с другими ЛС центрального действия.
Алкоголь.
Хотя эсциталопрам не потенцировал когнитивные и двигательные эффекты алкоголя в клинических испытаниях, употребление алкоголя пациентам, принимающим эсциталопрам, как и для других психотропных ЛС, не рекомендуется.
ЛС, нарушающие гемостаз (в тч НПВС, ацетилсалициловая кислота, варфарин).
Высвобождение серотонина тромбоцитами играет важную роль в гемостазе. Эпидемиологические исследования случай-контроль и когортного дизайна, которые продемонстрировали связь применения психотропных ЛС, препятствующих обратному захвату серотонина, и возникновения кровотечения из верхних отделов ЖКТ, также показали, что одновременное применение НПВС или ацетилсалициловой кислоты может потенцировать риск развития кровотечения. Сообщалось об изменении антикоагулянтных эффектов, включая усиление кровотечения, при одновременном применении СИОЗС и СИОЗСН с варфарином. Пациенты, получающие терапию варфарином, должны находиться под тщательным наблюдением при начале или прекращении приема эсциталопрама.
Циметидин.
У людей, которые получали рацемическую форму циталопрама в дозе 40 мг/сут в течение 21 дня, комбинированное применение 400 мг циметидина дважды в день в течение 8 дней приводило к увеличению AUC и maxCmax циталопрама на 43 и 39% соответственно. Клиническое значение этих результатов неизвестно.
Дигоксин.
У людей, которые в течение 21 дня получали рацемическую форму циталопрама в дозе 40 мг/сут, комбинированное применение циталопрама и дигоксина (однократная доза 1 мг) существенно не влияло на фармакокинетику циталопрама или дигоксина.
Литий.
Сочетанное применение рацемической формы циталопрама (40 мг/сут в течение 10 дней) и лития (30 ммоль/сут в течение 5 дней) не оказывало значимого влияния на фармакокинетику циталопрама или лития. Тем не менее, уровень лития в плазме следует контролировать с корректировкой дозы лития в соответствии со стандартной клинической практикой. Поскольку литий может усиливать серотонинергические эффекты эсциталопрама, следует соблюдать осторожность при одновременном применении эсциталопрама и лития.
Пимозид и циталопрам.
В контролируемом исследовании прием пимозида в однократной дозе 2 мг совместно с рацемической формой циталопрама в дозе 40 мг, принимаемого 1 раз в день в течение 11 дней, был ассоциирован со средним увеличением значений QTc примерно на 10 мс по сравнению с пимозидом, принимаемым отдельно. Рацемическая форма циталопрама не изменяла среднюю AUC или maxCmax пимозида. Механизм этого ФДВ неизвестен.
Суматриптан.
Имеются редкие постмаркетинговые отчеты о пациентах, у которых развилась слабость, гиперрефлексия и нарушение координации движений после приема СИОЗС и суматриптана. Если сопутствующее лечение суматриптаном и СИОЗС (например, флуоксетин, флувоксамин, пароксетин, сертралин, циталопрам, эсциталопрам) клинически оправдано, рекомендуется соответствующее наблюдение за пациентом.
Теофиллин.
Совместный прием рацемической формы циталопрама (40 мг/сут в течение 21 дня) и субстрата сYP1A2 теофиллина (однократная доза 300 мг) не влиял на фармакокинетику теофиллина. Влияние теофиллина на фармакокинетику циталопрама не оценивали.
Варфарин.
Применение рацемической формы циталопрама в дозе 40 мг/сут в течение 21 дня не влияло на фармакокинетику варфарина, субстрата сYP3A4. ПВ увеличивалось на 5%, клиническое значение этого неизвестно.
Карбамазепин.
Совместный прием рацемической формы циталопрама (40 мг/сут в течение 14 дней) и карбамазепина (титрованная доза до 400 мг/сут в течение 35 дней) не оказывал значимого влияния на фармакокинетику карбамазепина, субстрата сYP3A4. Хотя сmin циталопрама в плазме крови не изменялась, принимая во внимание ферментиндуцирующие свойства карбамазепина, следует учитывать возможность того, что карбамазепин может увеличивать клиренс эсциталопрама, если эти два ЛС применяются одновременно.
Триазолам.
Совместное применение рацемической формы циталопрама (титровано до 40 мг/сут в течение 28 дней) и субстрата сYP3A4 триазолама (однократная доза 0,25 мг) не оказывало значимого влияния на фармакокинетику циталопрама или триазолама.
Кетоконазол.
Совместный прием рацемической формы циталопрама (40 мг) и кетоконазола (200 мг) снижал maxCmax и AUC кетоконазола на 21 и 10% соответственно и не оказывал существенного влияния на фармакокинетику циталопрама.
Ритонавир.
Совместное применение разовой дозы ритонавира (600 мг), как субстрата сYP3A4, так и сильного ингибитора сYP3A4, и эсциталопрама (20 мг) не влияло на фармакокинетику ритонавира или эсциталопрама.
Данные по ингибированию изоферментов in vitro >in vitro не выявили ингибирующего эффекта эсциталопрама на сYP3A4, сYP1A2, сYP2C9, сYP2C19 и сYP2E1. Основываясь на данных in vitro, предполагается слабое ингибирующее действие эсциталопрама на метаболизм, опосредованный этой группой изоферментов цитохрома Р450 in vivo >in vivo. Хотя данные in vivo >in vivo для ответа на этот вопрос ограничены, результаты исследований взаимодействия ЛС показывают, что эсциталопрам в дозе 20 мг не оказывает ингибирующего действия на сYP3A4 и имеет умеренное ингибирующее действие на сYP2D6.
Ингибиторы сYP3A4 и сYP2C19. Исследования in vitro >in vitro показали, что сYP3A4 и сYP2C19 являются основными изоферментами, участвующими в метаболизме эсциталопрама. Однако одновременный прием эсциталопрама (20 мг) и ритонавира (600 мг), сильного ингибитора сYP3A4, не оказывал значимого влияния на фармакокинетику эсциталопрама. Поскольку эсциталопрам метаболизируется множеством ферментных систем, ингибирование одного изофермента может несущественно снижать клиренс эсциталопрама.
ЛС, метаболизируемые изоферментом сYP2D6 цитохрома Р450. Исследования in vitro >in vitro не выявили ингибирующего действия эсциталопрама на изофермент сYP2D6. Кроме того, равновесные уровни рацемической формы циталопрама существенно не различались у слабых метаболизаторов и сильных метаболизаторов сYP2D6 после многократного применения циталопрама, что позволяет предположить, что одновременный прием с эсциталопрамом ЛС, ингибирующего сYP2D6, вряд ли окажет клинически значимое влияние на метаболизм эсциталопрама. Однако имеются ограниченные данные in vivo >in vivo, предполагающие умеренный ингибирующий эффект сYP2D6 для эсциталопрама, а именно одновременное применение эсциталопрама (20 мг/сут в течение 21 дня) с трициклическим антидепрессантом дезипрамином (разовая доза 50 мг), субстратом сYP2D6, приводило к увеличению maxCmax на 40% и увеличению AUC дезипрамина на 100%. Клиническое значение этого результата неизвестно. Тем не менее следует соблюдать осторожность при одновременном применении эсциталопрама и ЛС, метаболизируемых сYP2D6.
Метопролол.
Применение эсциталопрама в дозе 20 мг/сут в течение 21 дня и бета-адреноблокатора метопролола (однократная доза 100 мг) у здоровых добровольцев приводило к увеличению maxCmax метопролола на 50% и AUC на 82%. Повышенные уровни метопролола в плазме были связаны со снижением кардиоселективности. Совместное применение эсциталопрама и метопролола не оказывало клинически значимого влияния на АД или ЧСС.
Электросудорожная терапия (ЭСТ).
Нет клинических исследований комбинированного применения ЭСТ и эсциталопрама.
Злоупотребление и зависимость.
Физическая и психологическая зависимость. Исследования на животных показывают, что вероятность злоупотребления рацемической формы циталопрама низкая. Эсциталопрам систематически не изучали у человека на предмет потенциального злоупотребления, толерантности или физической зависимости. Клинический премаркетинговый опыт оценки эсциталопрама не выявил какой-либо тенденции к лекарственнозависимому поведению. Однако эти наблюдения не были систематическими, и на основе этого ограниченного опыта невозможно предсказать, в какой степени ЛС, активное в отношении ЦНС, будет использоваться не по назначению и/или приводить к злоупотреблению в постмаркетинговый период. Поэтому при назначении эсциталопрама врач должен тщательно обследовать пациентов на предмет злоупотребления ЛС в анамнезе, и за такими пациентами следует внимательно наблюдать на предмет возникновения признаков неправильного использования или злоупотребления (например, развитие толерантности, увеличение дозы, лекарственнозависимое поведение).
|
|
Передозировка
В клинических испытаниях были сообщения о передозировке эсциталопрама, включая передозировку до 600 мг, без ассоциированных фатальных исходов. Во время постмаркетинговой оценки эсциталопрама сообщалось о передозировке эсциталопрама, включая передозировку до 1000 мг. Как и в случае с другими СИОЗС, о фатальном исходе у пациента при передозировке эсциталопрама сообщалось редко.
Симптомы. наиболее часто сопутствующие передозировке эсциталопрама. отдельно или в комбинации с другими ЛС и/или алкоголем. включали судороги. кому. головокружение. гипотензию. инсомнию. тошноту. рвоту. синусовую тахикардию. сонливость и изменения ЭКГ (включая удлинение QTc и очень редкие случаи torsade de pointes). Об острой почечной недостаточности, сопутствующей передозировке, сообщалось очень редко.
Лечение: следует обеспечить и поддерживать проходимость дыхательных путей для адекватной вентиляции и оксигенации. Следует рассмотреть вопрос об эвакуации из желудка путем промывания и применения активированного угля. Рекомендуется тщательное наблюдение и мониторинг состояния сердца и показателей жизненно важных функций, а также общая симптоматическая и поддерживающая терапия. Из-за большого dVd эсциталопрама форсированный диурез, диализ, гемоперфузия и обменное переливание крови вряд ли будут эффективны. Специфического антидота эсциталопрама нет.
При лечении передозировки необходимо учитывать вовлеченность нескольких препаратов.
Симптомы. наиболее часто сопутствующие передозировке эсциталопрама. отдельно или в комбинации с другими ЛС и/или алкоголем. включали судороги. кому. головокружение. гипотензию. инсомнию. тошноту. рвоту. синусовую тахикардию. сонливость и изменения ЭКГ (включая удлинение QTc и очень редкие случаи torsade de pointes). Об острой почечной недостаточности, сопутствующей передозировке, сообщалось очень редко.
Лечение: следует обеспечить и поддерживать проходимость дыхательных путей для адекватной вентиляции и оксигенации. Следует рассмотреть вопрос об эвакуации из желудка путем промывания и применения активированного угля. Рекомендуется тщательное наблюдение и мониторинг состояния сердца и показателей жизненно важных функций, а также общая симптоматическая и поддерживающая терапия. Из-за большого dVd эсциталопрама форсированный диурез, диализ, гемоперфузия и обменное переливание крови вряд ли будут эффективны. Специфического антидота эсциталопрама нет.
При лечении передозировки необходимо учитывать вовлеченность нескольких препаратов.
Способ применения и дозы
Внутрь. Режим дозирования устанавливают строго индивидуально, в зависимости от показаний, течения заболевания, эффективности терапии, переносимости. Рекомендуемая начальная доза - 10 мг 1 раз в сутки, при необходимости доза может быть увеличена до максимальной - 20 мг/сут как минимум через 1 нед (взрослые) или 3 нед (подростки). Длительность курса лечения определяется врачом.
10 мг/сутки - рекомендуемая доза для большинства пациентов пожилого возраста и пациентов с печеночной недостаточностью. Для пациентов с легкой или умеренной почечной недостаточностью коррекция дозы не требуется. Эсциталопрам следует применять с осторожностью у пациентов с тяжелой почечной недостаточностью.
10 мг/сутки - рекомендуемая доза для большинства пациентов пожилого возраста и пациентов с печеночной недостаточностью. Для пациентов с легкой или умеренной почечной недостаточностью коррекция дозы не требуется. Эсциталопрам следует применять с осторожностью у пациентов с тяжелой почечной недостаточностью.
Меры предосторожности применения
Клиническое ухудшение и риск суицида.
У пациентов с БДР, как взрослых, так и детей, возможны обострение имеющейся депрессии и/или появление суицидальных мыслей и поведения (суицидальность) или необычные изменения в поведении, независимо от того, принимают ли они антидепрессанты или нет, и этот риск может сохраняться до тех пор, пока не наступит значительная ремиссия. Суицид - это известный риск депрессии и некоторых других психических расстройств, и сами эти расстройства являются наиболее сильными предикторами суицида. Давно существует опасение, что антидепрессанты могут играть роль в обострении депрессии и возникновении суицидальности у некоторых пациентов на ранних этапах лечения. Объединенный анализ краткосрочных плацебо-контролируемых исследований антидепрессантов (в тч СИОЗС) показал, что эти ЛС повышают риск суицидального мышления и поведения (суицидальности) у детей, подростков и молодых людей (в возрасте 18-24 лет) с БДР и другими психическими расстройствами. Краткосрочные исследования не показали увеличения риска развития суицидальности при приеме антидепрессантов по сравнению с плацебо у взрослых старше 24 лет; отмечалось снижение при приеме антидепрессантов по сравнению с плацебо у взрослых в возрасте 65 лет и старше.
Объединенный анализ плацебо-контролируемых испытаний с участием детей и подростков с БДР, обсессивно-компульсивным расстройством или другими психическими расстройствами включал в общей сложности 24 краткосрочных испытания 9 антидепрессантов у более чем 4400 пациентов. Объединенный анализ плацебо-контролируемых испытаний у взрослых с БДР или другими психическими расстройствами включал в общей сложности 295 краткосрочных испытаний (медиана продолжительности 2 мес) 11 антидепрессантов у более 77000 пациентов. Риск суицидальности у пациентов при применении ЛС значительно варьировал, но имелась тенденция к увеличению у более молодых пациентов почти для всех изученных ЛС. Были выявлены различия в абсолютном риске развития суицидальности у пациентов при разных показаниях, с наибольшей частотой у пациентов с БДР. Однако разница рисков (ЛС по сравнению с плацебо) была относительно стабильной для разных возрастных категорий и разных показаний. Эта разница рисков (разница в количестве случаев суицидальности на 1000 пролеченных пациентов между ЛС и плацебо) представлены в таблице 5.
Таблица 5.
Количество случаев суицидальности на 1000 пролеченных пациентов.
Ни в одном исследовании у педиатрических пациентов не было случаев суицида. В испытаниях у взрослых были случаи суицида, но их было недостаточно, чтобы сделать какой-либо вывод о связи ЛС и суицида.
Неизвестно, распространяется ли риск суицидальности на более длительное применение, более нескольких месяцев. Тем не менее есть существенные доказательства плацебо-контролируемых исследований поддерживающей терапии у взрослых с депрессией того, что применение антидепрессантов может отсрочить рецидив депрессии.
Все пациенты, получающие лечение антидепрессантами по любым показаниям, должны находиться под надлежащим наблюдением и пристальным вниманием на предмет клинического ухудшения, суицидальности и необычных изменений в поведении, особенно в течение первых нескольких месяцев курса лекарственной терапии или во время изменения дозы - либо ее увеличения, либо уменьшения.
Следующие симптомы - тревога, ажитация, панические атаки, инсомния, раздражительность, враждебность, агрессивность, импульсивность, акатизия (психомоторное возбуждение), гипомания и мания - были зарегистрированы у взрослых и педиатрических пациентов, получавших антидепрессанты при БДР, так же как и по другим показаниям, как психиатрическим, так и непсихиатрическим. Хотя причинно-следственная связь появления таких симптомов и обострения депрессии и/или возникновения суицидных побуждений не установлена, существует опасение, что такие симптомы могут быть предвестниками возникновения суицидального поведения.
Следует рассмотреть возможность изменения терапевтического режима, включая возможное прекращение приема ЛС, у пациентов, у которых депрессия постоянно усугубляется или внезапно возникают суицидальное поведение или симптомы, которые могут быть предвестниками обострения депрессии или суицидальности, особенно если эти симптомы являются серьезными, имеют внезапное начало или не являются частью симптомов, которые уже отмечались у пациента.
Если было принято решение о прекращении лечения, прием ЛС должен постепенно снижаться, так быстро, как это возможно, но с учетом того, что резкое прекращение может быть ассоциировано с развитием определенных симптомов.
Семьи и лица, осуществляющие уход за пациентами, получающими лечение антидепрессантами при БДР или по другим показаниям, как психиатрическим, так и непсихиатрическим, должны быть предупреждены о необходимости наблюдения за пациентами на предмет возникновения ажитации, раздражительности, необычных изменений в поведении и других симптомов, описанных выше, так же как и о возникновении суицидальности, и немедленно сообщать о таких симптомах медицинским работникам. Такой мониторинг должен включать ежедневное наблюдение со стороны членов семьи и лиц, осуществляющих уход. Рецепты на эсциталопрам должны быть выписаны для наименьшего количества таблеток в соответствии с надлежащим ведением пациента, чтобы снизить риск передозировки.
Скрининг пациентов на биполярное расстройство.
Большой депрессивный эпизод может быть начальным проявлением биполярного расстройства. Обычно считается (хотя и не установлено в контролируемых исследованиях), что лечение такого эпизода одним антидепрессантом может увеличить вероятность возникновения смешанного/маниакального эпизода у пациентов с риском биполярного расстройства. Неизвестно, отражают ли какие-либо из описанных выше симптомов такой переход. Однако до начала лечения антидепрессантом пациенты с депрессивными симптомами должны пройти соответствующий скрининг, чтобы определить, подвержены ли они риску биполярного расстройства; такой скрининг должен включать подробный психиатрический анамнез, в тч семейный анамнез суицида, биполярного расстройства и депрессии. Следует отметить, что эсциталопрам не показан для лечения биполярной депрессии.
Серотониновый синдром.
Сообщалось о развитии потенциально опасного для жизни серотонинового синдрома при приеме СИОЗСН и СИОЗС, включая эсциталопрам, в монотерапии, но особенно при одновременном применении других серотонинергических ЛС (включая триптаны, трициклические антидепрессанты, фентанил, литий, трамадол, триптофан, буспирон, амфетамины и зверобой), а также ЛС, нарушающих метаболизм серотонина (в частности, ингибиторы MAO, как которые предназначены для лечения психических расстройств, так и другие, такие как линезолид и метилтиониния хлорид для в/в введения).
Симптомы серотонинового синдрома могут включать изменения психического статуса (например, ажитация, галлюцинации, делирий и кома), вегетативную нестабильность (например, тахикардия, лабильное АД, головокружение, повышенное потоотделение, диафорез, приливы крови к лицу, гипертермия), нервно-мышечные симптомы (например, тремор, ригидность, миоклонус, гиперрефлексия, нарушение координации движений), судороги и/или желудочно-кишечные симптомы (например, тошнота, рвота, диарея). Необходим мониторинг состояния пациентов на предмет появления серотонинового синдрома.
Одновременное применение эсциталопрама с ингибиторами MAO, предназначенными для лечения психических расстройств, противопоказано. Не следует также начинать прием эсциталопрама у пациента, который применяет такие ингибиторы MAO, как линезолид или метилтиониния хлорид для в/в введения. Все отчеты о метилтиониния хлориде, которые предоставили информацию о способе его применения, включали в/в введение в диапазоне доз от 1 до 8 мг/кг. Нет сообщений о применении метилтиониния хлорида другими путями (такими как пероральные таблетки или в/м инъекция) или в более низких дозах. Могут возникнуть обстоятельства, когда у пациента, принимающего эсциталопрам, необходимо начать лечение ингибитором МАО, например линезолидом или метилтиониния хлоридом в/в. Следует прекратить прием эсциталопрама перед началом лечения ингибитором МАО ( см «Противопоказания»).
Если одновременное применение эсциталопрама с другими серотонинергическими ЛС, например триптанами, трициклическими антидепрессантами, фентанилом, литием, трамадолом, буспироном, триптофаном, амфетаминами и зверобоем, клинически оправдано, пациенты должны быть осведомлены о потенциальном повышении риска серотонинового синдрома, особенно во время начала лечения и увеличения дозы.
Терапию эсциталопрамом и любыми сопутствующими серотонинергическими ЛС следует немедленно прекратить при возникновении вышеуказанных симптомов и начать поддерживающее симптоматическое лечение.
Прекращение лечения эсциталопрамом.
Во время маркетингового периода поступали спонтанные сообщения о побочных реакциях, возникающих при прекращении приема эсциталопрама и других СИОЗС и СИОЗСН, особенно в случае резкой отмены, включая следующие: дисфорическое настроение, раздражительность, ажитация, головокружение, сенсорные нарушения (например, парестезии, такие как ощущение поражения электрическим током), тревога, спутанность сознания, головная боль, летаргия, эмоциональная лабильность, инсомния и гипомания. Хотя эти случаи, как правило, проходили самостоятельно, были сообщения о серьезных симптомах отмены.
При прекращении лечения эсциталопрамом следует проводить мониторинг состояния пациента на предмет развития этих симптомов. По возможности рекомендуется постепенное снижение дозы, а не резкое прекращение приема. Если после снижения дозы или прекращения лечения возникают непереносимые симптомы, можно рассмотреть возможность возобновления ранее назначенной дозы. Впоследствии врач может продолжить снижение дозы, но более постепенно.
Судороги.
Хотя противосудорожные эффекты рацемической формы циталопрама наблюдались в исследованиях на животных, эсциталопрам не подвергался систематической оценке у пациентов с судорожным расстройством. Эти пациенты были исключены из клинических исследований во время премаркетинговой оценки. В клинических испытаниях сообщалось о случаях развития судорог в связи с лечением эсциталопрамом. Как и другие ЛС, эффективные при лечении БДР, эсциталопрам следует с осторожностью назначать пациентам с судорожным расстройством в анамнезе.
Активация мании/гипомании.
В плацебо-контролируемых испытаниях эсциталопрама при БДР активация мании/гипомании наблюдалась у одного (0,1%) из 715 пациентов, получавших эсциталопрам, и ни у одного из 592 пациентов, получавших плацебо. Сообщалось об одном дополнительном случае гипомании в связи с лечением эсциталопрамом. Об активации мании/гипомании также сообщалось у небольшой части пациентов с большим аффективным расстройством, получавших лечение рацемической формой циталопрама и другими ЛС, эффективными при лечении БДР. Как и все ЛС, эффективные при лечении БДР, эсциталопрам следует с осторожностью применять у пациентов с манией в анамнезе.
Гипонатриемия.
Гипонатриемия может возникнуть в результате лечения СИОЗС и СИОЗСН, включая эсциталопрам. Во многих случаях эта гипонатриемия, по-видимому, является результатом синдрома неадекватной секреции АДГ, и была обратимой после прекращения приема эсциталопрама. Сообщалось о случаях содержания натрия в сыворотке ниже 110 ммоль/л, которые были обратимыми после прекращения приема циталопрама. Пожилые пациенты могут подвергаться большему риску развития гипонатриемии при приеме СИОЗСН и СИОЗС. Кроме того, пациенты, принимающие диуретики, или пациенты с недостаточным ОЦК, могут подвергаться большему риску ( см Применение в гериатрии). Следует рассмотреть возможность прекращения приема эсциталопрама у пациентов с симптоматической гипонатриемией и назначить соответствующее лечение.
Признаки и симптомы гипонатриемии включают головную боль, трудности с концентрацией внимания, нарушение памяти, спутанность сознания, слабость и неустойчивость, что может привести к падению. Признаки и симптомы, ассоциированные с более тяжелыми и/или острыми случаями включали галлюцинации, обморок, судороги, кому, остановку дыхания и смерть.
Аномальное кровотечение.
СИОЗСН и СИОЗС, включая эсциталопрам, могут увеличивать риск кровотечений. Сочетанное применение ацетилсалициловой кислоты, НПВС, варфарина и других антикоагулянтов может увеличивать этот риск. Отчеты о случаях и эпидемиологические исследования (случай-контроль и когортный дизайн) продемонстрировали связь применения ЛС, которые препятствуют обратному захвату серотонина, и возникновения желудочно-кишечных кровотечений. Кровотечения, связанные с применением СИОЗСН и СИОЗС, варьировали от экхимозов, гематом, носовых кровотечений и петехий до опасных для жизни кровоизлияний.
Пациентов следует предупредить о риске кровотечения, связанном с одновременным применением эсциталопрама и НПВС, ацетилсалициловой кислоты, варфарина или других ЛС, влияющих на коагуляцию.
Нарушение когнитивных и двигательных функций.
В исследованиях у здоровых добровольцев эсциталопрам в дозах 10 мг/сут не вызывал ухудшения интеллектуальной функции или психомоторной деятельности. Однако, поскольку любое ЛС, активное в отношении ЦНС, может снижать рассудительность, мышление или двигательные навыки, пациенты должны быть предупреждены об опасности использования механизмов, включая автомобиль, до тех пор, пока они не будут достаточно уверены, что терапия эсциталопрамом не влияет на их способность заниматься такой деятельностью.
Закрытоугольная глаукома.
Расширение зрачков, которое наблюдается после применения многих антидепрессантов, включая эсциталопрам, может вызвать приступ закрытоугольной глаукомы у пациента с анатомически узкими углами передних камер глаз, у которого не было проведено иридэктомии.
Применение у пациентов с сопутствующими заболеваниями.
Клинический опыт применения эсциталопрама у пациентов с некоторыми сопутствующими системными заболеваниями ограничен. Рекомендуется с осторожностью применять эсциталопрам у пациентов с заболеваниями или состояниями, которые вызывают изменение метаболизма или гемодинамические реакции.
Эсциталопрам не оценивали систематически у пациентов с недавним инфарктом миокарда в анамнезе или нестабильным сердечным заболеванием. Пациенты с этими диагнозами, как правило, исключались из клинических исследований в премаркетинговый период.
У пациентов с нарушением функции печени клиренс рацемической формы циталопрама снижался, а концентрации в плазме повышались. Рекомендуемая доза эсциталопрама для пациентов с нарушением функции печени составляет 10 мг/сут.
Поскольку эсциталопрам экстенсивно метаболизируется, выведение неизмененного вещества с мочой является несущественным путем выведения. Однако до тех пор, пока адекватное количество пациентов с тяжелой почечной недостаточностью не будет оценено во время хронического лечения эсциталопрамом, его следует использовать с осторожностью у таких пациентов.
Применение в педиатрии.
Безопасность и эффективность эсциталопрама были установлены у подростков (от 12 до 17 лет) для лечения БДР ( см Клинические исследования). Хотя эффективность поддерживающей терапии у подростков с БДР систематически не оценивали, эффективность поддерживающей терапии может быть экстраполирована на основании данных для взрослых, а также сравнения фармакокинетических параметров эсциталопрама у взрослых и подростков.
Безопасность и эффективность эсциталопрама у педиатрических пациентов (младше 12 лет) с БДР не установлены. Результаты 24-недельного открытого исследования безопасности с участием 118 детей (в возрасте от 7 до 11 лет) с БДР соответствовали известному профилю безопасности и переносимости эсциталопрама.
Безопасность и эффективность эсциталопрама у педиатрических пациентов младше 18 лет с ГТР не установлены.
Снижение аппетита и потеря массы тела наблюдались в связи с применением СИОЗС. Поэтому у детей и подростков, получающих лечение СИОЗС, такими как эсциталопрам, следует проводить регулярный мониторинг массы тела и роста.
Применение в гериатрии.
Приблизительно 6% из 1144 пациентов, получавших эсциталопрам в контролируемых испытаниях при БДР и ГТР, были в возрасте 60 лет и старше; пожилые пациенты в этих испытаниях получали эсциталопрам в суточной дозе от 10 до 20 мг. Число пожилых пациентов в этих испытаниях было недостаточным для адекватной оценки возможной различной эффективности и мер безопасности в зависимости от возраста. Тем не менее нельзя исключать повышенную чувствительность некоторых людей пожилого возраста к действию эсциталопрама.
Прием СИОЗС и СИОЗСН, включая эсциталопрам, был ассоциирован со случаями клинически значимой гипонатриемии у пожилых пациентов, которые могут подвергаться большему риску этого нежелательного явления ( см Гипонатриемия).
В двух фармакокинетических исследованиях 1/2T1/2 эсциталопрама был увеличен примерно на 50% у пожилых людей по сравнению с этим параметром у молодых людей, а maxCmax не изменялась ( см «Фармакология»). 10 мг/сут - рекомендуемая доза для пожилых пациентов.
Из 4422 пациентов, участвовавших в клинических исследованиях рацемического циталопрама, 1357 были в возрасте 60 лет и старше, 1034 - в возрасте 65 лет и старше и 457 - в возрасте 75 лет и старше. Каких-либо общих различий в безопасности или эффективности у этих пациентов и более молодых людей не наблюдалось, и другой зарегистрированный клинический опыт не выявил различий в ответах у пожилых и более молодых пациентов, но опять же нельзя исключать более высокую чувствительность некоторых пожилых людей.
У пациентов с БДР, как взрослых, так и детей, возможны обострение имеющейся депрессии и/или появление суицидальных мыслей и поведения (суицидальность) или необычные изменения в поведении, независимо от того, принимают ли они антидепрессанты или нет, и этот риск может сохраняться до тех пор, пока не наступит значительная ремиссия. Суицид - это известный риск депрессии и некоторых других психических расстройств, и сами эти расстройства являются наиболее сильными предикторами суицида. Давно существует опасение, что антидепрессанты могут играть роль в обострении депрессии и возникновении суицидальности у некоторых пациентов на ранних этапах лечения. Объединенный анализ краткосрочных плацебо-контролируемых исследований антидепрессантов (в тч СИОЗС) показал, что эти ЛС повышают риск суицидального мышления и поведения (суицидальности) у детей, подростков и молодых людей (в возрасте 18-24 лет) с БДР и другими психическими расстройствами. Краткосрочные исследования не показали увеличения риска развития суицидальности при приеме антидепрессантов по сравнению с плацебо у взрослых старше 24 лет; отмечалось снижение при приеме антидепрессантов по сравнению с плацебо у взрослых в возрасте 65 лет и старше.
Объединенный анализ плацебо-контролируемых испытаний с участием детей и подростков с БДР, обсессивно-компульсивным расстройством или другими психическими расстройствами включал в общей сложности 24 краткосрочных испытания 9 антидепрессантов у более чем 4400 пациентов. Объединенный анализ плацебо-контролируемых испытаний у взрослых с БДР или другими психическими расстройствами включал в общей сложности 295 краткосрочных испытаний (медиана продолжительности 2 мес) 11 антидепрессантов у более 77000 пациентов. Риск суицидальности у пациентов при применении ЛС значительно варьировал, но имелась тенденция к увеличению у более молодых пациентов почти для всех изученных ЛС. Были выявлены различия в абсолютном риске развития суицидальности у пациентов при разных показаниях, с наибольшей частотой у пациентов с БДР. Однако разница рисков (ЛС по сравнению с плацебо) была относительно стабильной для разных возрастных категорий и разных показаний. Эта разница рисков (разница в количестве случаев суицидальности на 1000 пролеченных пациентов между ЛС и плацебо) представлены в таблице 5.
Таблица 5.
Количество случаев суицидальности на 1000 пролеченных пациентов.
| Возрастной диапазон | Разница ЛС-плацебо в количестве случаев суицидальности на 1000 пролеченных пациентов |
| Повышение по сравнению с плацебо | |
| <18 лет | 14 дополнительных случаев |
| 18-24 года | 5 дополнительных случаев |
| Снижение по сравнению с плацебо | |
| 25-64 года | На 1 случай меньше |
| ≥65 лет | На 6 случаев меньше |
Ни в одном исследовании у педиатрических пациентов не было случаев суицида. В испытаниях у взрослых были случаи суицида, но их было недостаточно, чтобы сделать какой-либо вывод о связи ЛС и суицида.
Неизвестно, распространяется ли риск суицидальности на более длительное применение, более нескольких месяцев. Тем не менее есть существенные доказательства плацебо-контролируемых исследований поддерживающей терапии у взрослых с депрессией того, что применение антидепрессантов может отсрочить рецидив депрессии.
Все пациенты, получающие лечение антидепрессантами по любым показаниям, должны находиться под надлежащим наблюдением и пристальным вниманием на предмет клинического ухудшения, суицидальности и необычных изменений в поведении, особенно в течение первых нескольких месяцев курса лекарственной терапии или во время изменения дозы - либо ее увеличения, либо уменьшения.
Следующие симптомы - тревога, ажитация, панические атаки, инсомния, раздражительность, враждебность, агрессивность, импульсивность, акатизия (психомоторное возбуждение), гипомания и мания - были зарегистрированы у взрослых и педиатрических пациентов, получавших антидепрессанты при БДР, так же как и по другим показаниям, как психиатрическим, так и непсихиатрическим. Хотя причинно-следственная связь появления таких симптомов и обострения депрессии и/или возникновения суицидных побуждений не установлена, существует опасение, что такие симптомы могут быть предвестниками возникновения суицидального поведения.
Следует рассмотреть возможность изменения терапевтического режима, включая возможное прекращение приема ЛС, у пациентов, у которых депрессия постоянно усугубляется или внезапно возникают суицидальное поведение или симптомы, которые могут быть предвестниками обострения депрессии или суицидальности, особенно если эти симптомы являются серьезными, имеют внезапное начало или не являются частью симптомов, которые уже отмечались у пациента.
Если было принято решение о прекращении лечения, прием ЛС должен постепенно снижаться, так быстро, как это возможно, но с учетом того, что резкое прекращение может быть ассоциировано с развитием определенных симптомов.
Семьи и лица, осуществляющие уход за пациентами, получающими лечение антидепрессантами при БДР или по другим показаниям, как психиатрическим, так и непсихиатрическим, должны быть предупреждены о необходимости наблюдения за пациентами на предмет возникновения ажитации, раздражительности, необычных изменений в поведении и других симптомов, описанных выше, так же как и о возникновении суицидальности, и немедленно сообщать о таких симптомах медицинским работникам. Такой мониторинг должен включать ежедневное наблюдение со стороны членов семьи и лиц, осуществляющих уход. Рецепты на эсциталопрам должны быть выписаны для наименьшего количества таблеток в соответствии с надлежащим ведением пациента, чтобы снизить риск передозировки.
Скрининг пациентов на биполярное расстройство.
Большой депрессивный эпизод может быть начальным проявлением биполярного расстройства. Обычно считается (хотя и не установлено в контролируемых исследованиях), что лечение такого эпизода одним антидепрессантом может увеличить вероятность возникновения смешанного/маниакального эпизода у пациентов с риском биполярного расстройства. Неизвестно, отражают ли какие-либо из описанных выше симптомов такой переход. Однако до начала лечения антидепрессантом пациенты с депрессивными симптомами должны пройти соответствующий скрининг, чтобы определить, подвержены ли они риску биполярного расстройства; такой скрининг должен включать подробный психиатрический анамнез, в тч семейный анамнез суицида, биполярного расстройства и депрессии. Следует отметить, что эсциталопрам не показан для лечения биполярной депрессии.
Серотониновый синдром.
Сообщалось о развитии потенциально опасного для жизни серотонинового синдрома при приеме СИОЗСН и СИОЗС, включая эсциталопрам, в монотерапии, но особенно при одновременном применении других серотонинергических ЛС (включая триптаны, трициклические антидепрессанты, фентанил, литий, трамадол, триптофан, буспирон, амфетамины и зверобой), а также ЛС, нарушающих метаболизм серотонина (в частности, ингибиторы MAO, как которые предназначены для лечения психических расстройств, так и другие, такие как линезолид и метилтиониния хлорид для в/в введения).
Симптомы серотонинового синдрома могут включать изменения психического статуса (например, ажитация, галлюцинации, делирий и кома), вегетативную нестабильность (например, тахикардия, лабильное АД, головокружение, повышенное потоотделение, диафорез, приливы крови к лицу, гипертермия), нервно-мышечные симптомы (например, тремор, ригидность, миоклонус, гиперрефлексия, нарушение координации движений), судороги и/или желудочно-кишечные симптомы (например, тошнота, рвота, диарея). Необходим мониторинг состояния пациентов на предмет появления серотонинового синдрома.
Одновременное применение эсциталопрама с ингибиторами MAO, предназначенными для лечения психических расстройств, противопоказано. Не следует также начинать прием эсциталопрама у пациента, который применяет такие ингибиторы MAO, как линезолид или метилтиониния хлорид для в/в введения. Все отчеты о метилтиониния хлориде, которые предоставили информацию о способе его применения, включали в/в введение в диапазоне доз от 1 до 8 мг/кг. Нет сообщений о применении метилтиониния хлорида другими путями (такими как пероральные таблетки или в/м инъекция) или в более низких дозах. Могут возникнуть обстоятельства, когда у пациента, принимающего эсциталопрам, необходимо начать лечение ингибитором МАО, например линезолидом или метилтиониния хлоридом в/в. Следует прекратить прием эсциталопрама перед началом лечения ингибитором МАО ( см «Противопоказания»).
Если одновременное применение эсциталопрама с другими серотонинергическими ЛС, например триптанами, трициклическими антидепрессантами, фентанилом, литием, трамадолом, буспироном, триптофаном, амфетаминами и зверобоем, клинически оправдано, пациенты должны быть осведомлены о потенциальном повышении риска серотонинового синдрома, особенно во время начала лечения и увеличения дозы.
Терапию эсциталопрамом и любыми сопутствующими серотонинергическими ЛС следует немедленно прекратить при возникновении вышеуказанных симптомов и начать поддерживающее симптоматическое лечение.
Прекращение лечения эсциталопрамом.
Во время маркетингового периода поступали спонтанные сообщения о побочных реакциях, возникающих при прекращении приема эсциталопрама и других СИОЗС и СИОЗСН, особенно в случае резкой отмены, включая следующие: дисфорическое настроение, раздражительность, ажитация, головокружение, сенсорные нарушения (например, парестезии, такие как ощущение поражения электрическим током), тревога, спутанность сознания, головная боль, летаргия, эмоциональная лабильность, инсомния и гипомания. Хотя эти случаи, как правило, проходили самостоятельно, были сообщения о серьезных симптомах отмены.
При прекращении лечения эсциталопрамом следует проводить мониторинг состояния пациента на предмет развития этих симптомов. По возможности рекомендуется постепенное снижение дозы, а не резкое прекращение приема. Если после снижения дозы или прекращения лечения возникают непереносимые симптомы, можно рассмотреть возможность возобновления ранее назначенной дозы. Впоследствии врач может продолжить снижение дозы, но более постепенно.
Судороги.
Хотя противосудорожные эффекты рацемической формы циталопрама наблюдались в исследованиях на животных, эсциталопрам не подвергался систематической оценке у пациентов с судорожным расстройством. Эти пациенты были исключены из клинических исследований во время премаркетинговой оценки. В клинических испытаниях сообщалось о случаях развития судорог в связи с лечением эсциталопрамом. Как и другие ЛС, эффективные при лечении БДР, эсциталопрам следует с осторожностью назначать пациентам с судорожным расстройством в анамнезе.
Активация мании/гипомании.
В плацебо-контролируемых испытаниях эсциталопрама при БДР активация мании/гипомании наблюдалась у одного (0,1%) из 715 пациентов, получавших эсциталопрам, и ни у одного из 592 пациентов, получавших плацебо. Сообщалось об одном дополнительном случае гипомании в связи с лечением эсциталопрамом. Об активации мании/гипомании также сообщалось у небольшой части пациентов с большим аффективным расстройством, получавших лечение рацемической формой циталопрама и другими ЛС, эффективными при лечении БДР. Как и все ЛС, эффективные при лечении БДР, эсциталопрам следует с осторожностью применять у пациентов с манией в анамнезе.
Гипонатриемия.
Гипонатриемия может возникнуть в результате лечения СИОЗС и СИОЗСН, включая эсциталопрам. Во многих случаях эта гипонатриемия, по-видимому, является результатом синдрома неадекватной секреции АДГ, и была обратимой после прекращения приема эсциталопрама. Сообщалось о случаях содержания натрия в сыворотке ниже 110 ммоль/л, которые были обратимыми после прекращения приема циталопрама. Пожилые пациенты могут подвергаться большему риску развития гипонатриемии при приеме СИОЗСН и СИОЗС. Кроме того, пациенты, принимающие диуретики, или пациенты с недостаточным ОЦК, могут подвергаться большему риску ( см Применение в гериатрии). Следует рассмотреть возможность прекращения приема эсциталопрама у пациентов с симптоматической гипонатриемией и назначить соответствующее лечение.
Признаки и симптомы гипонатриемии включают головную боль, трудности с концентрацией внимания, нарушение памяти, спутанность сознания, слабость и неустойчивость, что может привести к падению. Признаки и симптомы, ассоциированные с более тяжелыми и/или острыми случаями включали галлюцинации, обморок, судороги, кому, остановку дыхания и смерть.
Аномальное кровотечение.
СИОЗСН и СИОЗС, включая эсциталопрам, могут увеличивать риск кровотечений. Сочетанное применение ацетилсалициловой кислоты, НПВС, варфарина и других антикоагулянтов может увеличивать этот риск. Отчеты о случаях и эпидемиологические исследования (случай-контроль и когортный дизайн) продемонстрировали связь применения ЛС, которые препятствуют обратному захвату серотонина, и возникновения желудочно-кишечных кровотечений. Кровотечения, связанные с применением СИОЗСН и СИОЗС, варьировали от экхимозов, гематом, носовых кровотечений и петехий до опасных для жизни кровоизлияний.
Пациентов следует предупредить о риске кровотечения, связанном с одновременным применением эсциталопрама и НПВС, ацетилсалициловой кислоты, варфарина или других ЛС, влияющих на коагуляцию.
Нарушение когнитивных и двигательных функций.
В исследованиях у здоровых добровольцев эсциталопрам в дозах 10 мг/сут не вызывал ухудшения интеллектуальной функции или психомоторной деятельности. Однако, поскольку любое ЛС, активное в отношении ЦНС, может снижать рассудительность, мышление или двигательные навыки, пациенты должны быть предупреждены об опасности использования механизмов, включая автомобиль, до тех пор, пока они не будут достаточно уверены, что терапия эсциталопрамом не влияет на их способность заниматься такой деятельностью.
Закрытоугольная глаукома.
Расширение зрачков, которое наблюдается после применения многих антидепрессантов, включая эсциталопрам, может вызвать приступ закрытоугольной глаукомы у пациента с анатомически узкими углами передних камер глаз, у которого не было проведено иридэктомии.
Применение у пациентов с сопутствующими заболеваниями.
Клинический опыт применения эсциталопрама у пациентов с некоторыми сопутствующими системными заболеваниями ограничен. Рекомендуется с осторожностью применять эсциталопрам у пациентов с заболеваниями или состояниями, которые вызывают изменение метаболизма или гемодинамические реакции.
Эсциталопрам не оценивали систематически у пациентов с недавним инфарктом миокарда в анамнезе или нестабильным сердечным заболеванием. Пациенты с этими диагнозами, как правило, исключались из клинических исследований в премаркетинговый период.
У пациентов с нарушением функции печени клиренс рацемической формы циталопрама снижался, а концентрации в плазме повышались. Рекомендуемая доза эсциталопрама для пациентов с нарушением функции печени составляет 10 мг/сут.
Поскольку эсциталопрам экстенсивно метаболизируется, выведение неизмененного вещества с мочой является несущественным путем выведения. Однако до тех пор, пока адекватное количество пациентов с тяжелой почечной недостаточностью не будет оценено во время хронического лечения эсциталопрамом, его следует использовать с осторожностью у таких пациентов.
Применение в педиатрии.
Безопасность и эффективность эсциталопрама были установлены у подростков (от 12 до 17 лет) для лечения БДР ( см Клинические исследования). Хотя эффективность поддерживающей терапии у подростков с БДР систематически не оценивали, эффективность поддерживающей терапии может быть экстраполирована на основании данных для взрослых, а также сравнения фармакокинетических параметров эсциталопрама у взрослых и подростков.
Безопасность и эффективность эсциталопрама у педиатрических пациентов (младше 12 лет) с БДР не установлены. Результаты 24-недельного открытого исследования безопасности с участием 118 детей (в возрасте от 7 до 11 лет) с БДР соответствовали известному профилю безопасности и переносимости эсциталопрама.
Безопасность и эффективность эсциталопрама у педиатрических пациентов младше 18 лет с ГТР не установлены.
Снижение аппетита и потеря массы тела наблюдались в связи с применением СИОЗС. Поэтому у детей и подростков, получающих лечение СИОЗС, такими как эсциталопрам, следует проводить регулярный мониторинг массы тела и роста.
Применение в гериатрии.
Приблизительно 6% из 1144 пациентов, получавших эсциталопрам в контролируемых испытаниях при БДР и ГТР, были в возрасте 60 лет и старше; пожилые пациенты в этих испытаниях получали эсциталопрам в суточной дозе от 10 до 20 мг. Число пожилых пациентов в этих испытаниях было недостаточным для адекватной оценки возможной различной эффективности и мер безопасности в зависимости от возраста. Тем не менее нельзя исключать повышенную чувствительность некоторых людей пожилого возраста к действию эсциталопрама.
Прием СИОЗС и СИОЗСН, включая эсциталопрам, был ассоциирован со случаями клинически значимой гипонатриемии у пожилых пациентов, которые могут подвергаться большему риску этого нежелательного явления ( см Гипонатриемия).
В двух фармакокинетических исследованиях 1/2T1/2 эсциталопрама был увеличен примерно на 50% у пожилых людей по сравнению с этим параметром у молодых людей, а maxCmax не изменялась ( см «Фармакология»). 10 мг/сут - рекомендуемая доза для пожилых пациентов.
Из 4422 пациентов, участвовавших в клинических исследованиях рацемического циталопрама, 1357 были в возрасте 60 лет и старше, 1034 - в возрасте 65 лет и старше и 457 - в возрасте 75 лет и старше. Каких-либо общих различий в безопасности или эффективности у этих пациентов и более молодых людей не наблюдалось, и другой зарегистрированный клинический опыт не выявил различий в ответах у пожилых и более молодых пациентов, но опять же нельзя исключать более высокую чувствительность некоторых пожилых людей.
|
|
Список литературы
RxList.com, 2022.
Входит в состав
- 278₽ Эсциталопрам-СЗ (Северная звезда НАО )
- 276-324₽ Эсциталопрам (Пранафарм )
- 309-382₽ Эсциталопрам-АЛСИ
- 256-637₽ Эсциталопрам Канон
- 596₽ Эйсипи
- 802-920₽ Ленуксин
- 658-1441₽ Элицея Ку-таб (KRKA )
- 874-1578₽ Элицея (2 фирмы)
- 1073-1916₽ Селектра (4 фирмы)
- 1071-2484₽ Ципралекс (2 фирмы)
- — Мирацитол (Abdi Ibrahim Ilac Sanayi ve Ticaret A.S. )
- — Эсциталопрам Сандоз
- — Эсциталопрам-Тева
- — Эсциталопрама оксалат (3 фирмы)