МКБ-10 коды
- МКБ-10
- C18.7 Злокачественное новообразование сигмовидной кишки
- C18.2 Злокачественное новообразование восходящей ободочной кишки
- C18.4 Злокачественное новообразование поперечной ободочной кишки
- C19 Злокачественное новообразование ректосигмоидного соединения
- C18.5 Злокачественное новообразование селезеночного изгиба
- C18.6 Злокачественное новообразование нисходящей ободочной кишки
- C18.1 Злокачественное новообразование червеобразного отростка
- C18.3 Злокачественное новообразование печеночного изгиба
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: с18, с19.
Год утверждения (частота пересмотра): 2022.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2024.
ID: 396.
Разработчик клинической рекомендации.
• Ассоциация онкологов России.
• Общероссийская общественная организация «Российское общество клинической онкологии».
• Российское общество специалистов по колоректальному раку.
• Общероссийская общественная организация Ассоциация колопроктологов России .
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2022.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2024.
ID: 396.
Разработчик клинической рекомендации.
• Ассоциация онкологов России.
• Общероссийская общественная организация «Российское общество клинической онкологии».
• Российское общество специалистов по колоректальному раку.
• Общероссийская общественная организация Ассоциация колопроктологов России .
Одобрено Научно-практическим Советом Минздрава РФ.
|
|
 Список сокращений
Список сокращений
БДУ. Без дополнительного уточнения.
В/в. Внутривенно.
ВОЗ. Всемирная организация здравоохранения.
КТ - компьютерная томография.
ЛФК. Лечебная физкультура.
МКА. Моноклональные антитела.
МКБ. Международная статистическая классификация болезней и проблем, связанных со здоровьем.
МКБ-О. Международная классификация онкологических заболеваний, специальное тематическое расширение МКБ.
МРТ. Магнитно-резонансная томография.
ПЦР. Полимеразная цепная реакция.
ПЭТ. Позитронно-эмиссионная томография.
ПЭТ-КТ. Позитронно-эмиссионная томография, совмещенная с компьютерной томографией.
РЭА. Раковый эмбриональный антиген.
УЗИ. Ультразвуковое исследование.
ECOG. Eastern сooperative Oncology Group, Восточная объединенная онкологическая группа.
MSI. Микросателлитная нестабильность.
MSI-H. Микросателлитная нестабильность высокого уровня.
** - жизненно необходимые и важнейшие лекарственные препараты.
- препараты, назначаемые не в соответствии с показаниями к применению.
И противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (off-label, офф-лейбл).
В/в. Внутривенно.
ВОЗ. Всемирная организация здравоохранения.
КТ - компьютерная томография.
ЛФК. Лечебная физкультура.
МКА. Моноклональные антитела.
МКБ. Международная статистическая классификация болезней и проблем, связанных со здоровьем.
МКБ-О. Международная классификация онкологических заболеваний, специальное тематическое расширение МКБ.
МРТ. Магнитно-резонансная томография.
ПЦР. Полимеразная цепная реакция.
ПЭТ. Позитронно-эмиссионная томография.
ПЭТ-КТ. Позитронно-эмиссионная томография, совмещенная с компьютерной томографией.
РЭА. Раковый эмбриональный антиген.
УЗИ. Ультразвуковое исследование.
ECOG. Eastern сooperative Oncology Group, Восточная объединенная онкологическая группа.
MSI. Микросателлитная нестабильность.
MSI-H. Микросателлитная нестабильность высокого уровня.
** - жизненно необходимые и важнейшие лекарственные препараты.
- препараты, назначаемые не в соответствии с показаниями к применению.
И противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (off-label, офф-лейбл).
Термины и определения
Предреабилитация (prehabilitation). Реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Уровни достоверности доказательств. Отражают степень уверенности в том, что найденный эффект от применения медицинской технологии является истинным. Согласно эпидемиологическим принципам достоверность доказательств определяется по 3 основным критериям: качественной, количественной характеристикам и согласованности доказательств.
Уровни убедительности рекомендаций. В отличие от уровней достоверности доказательств отражают степень уверенности не только в достоверности эффекта вмешательства, но и в том, что следование рекомендациям принесут в конкретной ситуации больше пользы, чем негативных последствий.
I этап реабилитации. Реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания;
II этап реабилитации. Реабилитация в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений заболевания в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации);
III этап реабилитации. Реабилитация в ранний и поздний реабилитационные периоды, период остаточных явлений заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций), кабинетах логопеда (учителя-дефектолога).
BRAF. Онкоген, который кодирует серин-треониновую протеинкиназу в-Raf.
FOLFIRI. Режим химиотерапии - иринотекан** (180 мг/м2 в виде 90-минутной инфузии в 1-й день), кальция фолинат** (400 мг/м2 в/в в течение 2 ч) с последующим болюсным введением фторурацила** (400 мг/м2 в/в струйно) и 46-часовой инфузией фторурацила** (2400 мг/м2, по 1200 мг/м2 в сутки). Начало очередного курса - на 15-й день.
MFOLFOX6 (далее по тексту. FOLFOX) - режим химиотерапии - оксалиплатин** (85 мг/м2 в виде 2-часовой инфузии в 1-й день), кальция фолинат** (400 мг/м2 в/в в течение 2 ч) с последующим болюсным введением фторурацила** (400 мг/м2 в/в струйно) и 46-часовой инфузией фторурацила** (2400 мг/м2, по 1200 мг/м2 в сутки). Начало очередного курса - на 15-й день.
FOLFOXIRI. Режим химиотерапии - иринотекан** (165 мг/м2 в виде 90-минутной инфузии в 1-й день), оксалиплатин** (85 мг/м2 в виде 2-часовой инфузии в 1-й день), кальция фолинат** (200 мг/м2 в/в в течение 2 ч) с последующей 46-часовой инфузией фторурацила** (3200 мг/м2). Начало очередного курса - на 15-й день.
FLOX. Режим химиотерапии - оксалиплатин** (85 мг/м2 в течение 2 ч в 1, 15.
И 29-й дни каждого цикла), кальция фолинат** (250 мг/м2 в/в струйно) с последующим болюсным введением фторурацила** (500 мг/м2 еженедельно в течение 6 нед с последующим 2-недельным перерывом) или оксалиплатин** (85 мг/м2 в течение 2 ч в 1-й день, кальция фолинат** (60 мг/м2 в/в струйно) с последующим болюсным введением фторурацила** (500 мг/м2) в 1 и во 2-й день 1 раз в 2 недели.
МЕК. Ген митоген-активированной протеинкиназы (mitogen-activated protein kinase).
RAS. Гены NRAS и KRAS.
XELOX. Режим химиотерапии - оксалиплатин** (130 мг/м2 внутривенно капельно в 1-й день), капецитабин** (825 мг/м2 2 раза в сутки в 1 -14-й дни). Начало очередного курса - на 22-й день.
XELIRI. Режим химиотерапии - иринотекан** в виде 90-минутной инфузии (180-200 мг/м2 в 1-й день), капецитабин** (1600-1800 мг/м2 в сутки внутрь в 1-14-й дни). Начало очередного курса - на 22-й день.
Уровни достоверности доказательств. Отражают степень уверенности в том, что найденный эффект от применения медицинской технологии является истинным. Согласно эпидемиологическим принципам достоверность доказательств определяется по 3 основным критериям: качественной, количественной характеристикам и согласованности доказательств.
Уровни убедительности рекомендаций. В отличие от уровней достоверности доказательств отражают степень уверенности не только в достоверности эффекта вмешательства, но и в том, что следование рекомендациям принесут в конкретной ситуации больше пользы, чем негативных последствий.
I этап реабилитации. Реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания;
II этап реабилитации. Реабилитация в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений заболевания в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации);
III этап реабилитации. Реабилитация в ранний и поздний реабилитационные периоды, период остаточных явлений заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций), кабинетах логопеда (учителя-дефектолога).
BRAF. Онкоген, который кодирует серин-треониновую протеинкиназу в-Raf.
FOLFIRI. Режим химиотерапии - иринотекан** (180 мг/м2 в виде 90-минутной инфузии в 1-й день), кальция фолинат** (400 мг/м2 в/в в течение 2 ч) с последующим болюсным введением фторурацила** (400 мг/м2 в/в струйно) и 46-часовой инфузией фторурацила** (2400 мг/м2, по 1200 мг/м2 в сутки). Начало очередного курса - на 15-й день.
MFOLFOX6 (далее по тексту. FOLFOX) - режим химиотерапии - оксалиплатин** (85 мг/м2 в виде 2-часовой инфузии в 1-й день), кальция фолинат** (400 мг/м2 в/в в течение 2 ч) с последующим болюсным введением фторурацила** (400 мг/м2 в/в струйно) и 46-часовой инфузией фторурацила** (2400 мг/м2, по 1200 мг/м2 в сутки). Начало очередного курса - на 15-й день.
FOLFOXIRI. Режим химиотерапии - иринотекан** (165 мг/м2 в виде 90-минутной инфузии в 1-й день), оксалиплатин** (85 мг/м2 в виде 2-часовой инфузии в 1-й день), кальция фолинат** (200 мг/м2 в/в в течение 2 ч) с последующей 46-часовой инфузией фторурацила** (3200 мг/м2). Начало очередного курса - на 15-й день.
FLOX. Режим химиотерапии - оксалиплатин** (85 мг/м2 в течение 2 ч в 1, 15.
И 29-й дни каждого цикла), кальция фолинат** (250 мг/м2 в/в струйно) с последующим болюсным введением фторурацила** (500 мг/м2 еженедельно в течение 6 нед с последующим 2-недельным перерывом) или оксалиплатин** (85 мг/м2 в течение 2 ч в 1-й день, кальция фолинат** (60 мг/м2 в/в струйно) с последующим болюсным введением фторурацила** (500 мг/м2) в 1 и во 2-й день 1 раз в 2 недели.
МЕК. Ген митоген-активированной протеинкиназы (mitogen-activated protein kinase).
RAS. Гены NRAS и KRAS.
XELOX. Режим химиотерапии - оксалиплатин** (130 мг/м2 внутривенно капельно в 1-й день), капецитабин** (825 мг/м2 2 раза в сутки в 1 -14-й дни). Начало очередного курса - на 22-й день.
XELIRI. Режим химиотерапии - иринотекан** в виде 90-минутной инфузии (180-200 мг/м2 в 1-й день), капецитабин** (1600-1800 мг/м2 в сутки внутрь в 1-14-й дни). Начало очередного курса - на 22-й день.
Описание
Рак ободочной кишки и ректосигмоидного отдела. Группа злокачественных опухолей, исходящих из слизистой оболочки толстой кишки.
Причины
У 3-5 % пациентов развитие рака ободочной кишки связано с наличием известных наследственных синдромов, наиболее распространенные из которых - синдром Линча, семейный аденоматоз толстой кишки и MutYH-ассоциированный полипоз. У остальных пациентов рак ободочной кишки и ректосигмоидного отдела носит спорадический характер. Как факторы риска развития данной патологии рассматриваются хронические воспалительные заболевания толстой кишки (например, неспецифический язвенный колит, болезнь Крона), курение, употребление алкоголя, преобладание в рационе красного мяса, сахарный диабет, ожирение или повышенный индекс массы тела, низкая физическая активность [1-13].
|
|
Эпидемиология
Рак ободочной кишки и ректосигмоидного отдела среди других злокачественных опухолей занимает лидирующие позиции по заболеваемости и смертности. В 2019 г. в России зарегистрировано 45 277 новых случаев рака ободочной кишки, 23 593 пациента умерли от этого заболевания [14].
С18,0 Злокачественное новообразование слепой кишки.
С18,1 Злокачественное новообразование червеобразного отростка.
С18,2 Злокачественное новообразование восходящей ободочной кишки.
С18,3 Злокачественное новообразование печеночного изгиба ободочной кишки.
С18,4 Злокачественное новообразование поперечной ободочной кишки.
С18,5 Злокачественное новообразование селезеночного изгиба ободочной кишки.
С18,6 Злокачественное новообразование нисходящей ободочной кишки.
С18,7 Злокачественное новообразование сигмовидной кишки.
С18,8 Поражение ободочной кишки, выходящее за пределы одной и более вышеуказанных локализаций.
С18,9 Злокачественное новообразование ободочной кишки неуточненной локализации.
C19 Злокачественное новообразование ректосигмоидного соединения.
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
C18 Злокачественное новообразование ободочной кишки.С18,0 Злокачественное новообразование слепой кишки.
С18,1 Злокачественное новообразование червеобразного отростка.
С18,2 Злокачественное новообразование восходящей ободочной кишки.
С18,3 Злокачественное новообразование печеночного изгиба ободочной кишки.
С18,4 Злокачественное новообразование поперечной ободочной кишки.
С18,5 Злокачественное новообразование селезеночного изгиба ободочной кишки.
С18,6 Злокачественное новообразование нисходящей ободочной кишки.
С18,7 Злокачественное новообразование сигмовидной кишки.
С18,8 Поражение ободочной кишки, выходящее за пределы одной и более вышеуказанных локализаций.
С18,9 Злокачественное новообразование ободочной кишки неуточненной локализации.
C19 Злокачественное новообразование ректосигмоидного соединения.
Классификация
1,5 Классификация заболевания или состояния (группы заболеваний или состояний).
Международная гистологическая классификация (ВОЗ, 2019) [1] [7, 205].Эпителиальные опухоли.
I. Доброкачественные опухоли:
8211/0 Тубулярная аденома.
8261/0 Ворсинчатая аденома.
8263/0 Тубулярно-ворсинчатая аденома.
8220/0 Аденоматозный полип.
8213/0 Зубчатая дисплазия.
II. Интраэпителиальная неоплазия (дисплазия), связанная с хроническими воспалительными заболеваниями кишечника:
8148/2 Железистая интраэпителиальная неоплазия высокой степени.
8148/0 Железистая интраэпителиальная неоплазия низкой степени.
III. Рак:
8140/3 Аденокарцинома, БДУ[2].
8213/3 Зубчатая аденокарцинома[3].
8262/3 Аденомоподобная аденокарцинома[4].
8265/3 Микропапиллярная аденокарцинома.
8480/3 Муцинозная (слизистая) аденокарцинома[5].
8490/3 Рак с диффузным типом роста[6].
8490/3 Перстневидно-клеточный рак[7].
8560/3 Железисто-плоскоклеточный рак.
8510/3 Медуллярный рак[8].
8220/3 Недифференцированный рак, БДУ[9].
8033/3 Рак с саркоматоидным компонентом[10].
8240/3 Нейроэндокринная опухоль, БДУ.
8240/3 Нейроэндокринная опухоль, G1.
8249/3 Нейроэндокринная опухоль, G2.
8249/3 Нейроэндокринная опухоль, G3.
8246/3 Нейроэндокринный рак, БДУ[11].
8041/3 Мелкоклеточный рак.
8013/3 Крупноклеточный нейроэндокринный рак.
8154/3 Смешанное нейроэндокринно-ненейроэндокринное новообразование[12].
Согласно Классификации ВОЗ (2019), гистологическая градация аденокарциномы/рака толстой кишки (исключая нейроэндокринные новообразования):
- становится 2-ступенчатой вместо ранее используемой 4-ступенчатой и предполагает разграничение низкой степени злокачественности (карциномы G1-G2) и высокой степени злокачественности (карциномы G3-G4);
- основана на подсчете доли железистых структур в инвазивной опухоли (с игнорированием мелких кластеров и отдельных клеток инвазивного фронта);
- в случае неоднородного строения опухоли оценивают наименее дифференцированный компонент (с игнорированием мелких кластеров и отдельных клеток инвазивного фронта);
- в целях сохранения преемственности рекомендуется временно указывать оба показателя (например, аденокарцинома низкой степени злокачественности (G2)).
[1] Действующая гистологическая классификация приведена в сокращенном варианте.
[2] Аденокарцинома кишечного типа, без дополнительного уточнения. По степени дифференцировки (и соответствующей степени злокачественности) опухоли делятся на высокодифференцированные/G1.
(96-100 % эпителиальных элементов инвазивной опухоли представлено железистыми структурами), умеренно дифференцированные/G2 (50-95 % эпителиальных элементов инвазивной опухоли представлено железистыми структурами), низкодифференцированные/G3 (0-49 % эпителиальных элементов инвазивной опухоли представлено железистыми структурами).
[3] При правосторонней локализации опухоль часто ассоциирована с микросателлитной нестабильностью высокого уровня (MSI-H).
[4] Нозологическая единица впервые введена комитетом Международного агентства по изучению рака (International Agency for Research on сancer) и ВОЗ в МКБ-О в 2019 г.
[5] Диагноз устанавливается, если >50 % объема опухоли представлено внеклеточной слизью, допустимо наличие перстневидноклеточных элементов (<50 % всех клеток инвазивной опухоли). Оценка степени дифференцировки аналогична таковой при типичной аденокарциноме. При правосторонней локализации опухоль часто ассоциирована с MSI-H.
[6] Опухоль всегда соответствует G3.
[7] Диагноз устанавливается, если >50 % клеток опухоли представлено перстневидноклеточными элементами. Опухоль всегда соответствует G3. При правосторонней локализации опухоль часто ассоциирована с MSI-H.
[8] Опухоль всегда соответствует G3. При правосторонней локализации опухоль часто ассоциирована с MSI-H.
[9] Является диагнозом исключения: устанавливается только по результатам дополнительных исследований (иммуногистохимическое исследование при выполнении патолого-анатомического исследования, электронной микроскопии). Соответствует G4.
[10] Нозологическая единица впервые введена комитетом Международного агентства по изучению рака (International Agency for Research on сancer) и ВОЗ в МКБ-О в 2019 г. Является диагнозом исключения, соответствует G3-G4.
[11] Диагноз устанавливается только по результатам дополнительных исследований (иммуногистохимическое исследование при выполнении патолого-анатомического исследования, электронной микроскопии). Всегда соответствует G3.
[12] Диагноз устанавливается только по результатам дополнительных исследований: смешанное нейроэндокринно-ненейроэндокринное новообразование является диморфным раком, сочетающим компоненты аденокарциномы и нейроэндокринного рака/опухоли (доля любого компонента должна составлять не менее 30 %).
|
|
Клиническая картина
Заболевание может манифестировать симптомами нарушения функции желудочно-кишечного тракта (тошнота, рвота, диарея, запоры, метеоризм, отсутствие аппетита, боли в животе), анемии, снижения веса, слабости, лихорадки, выделения крови и слизи с калом. Также заболевание может начинаться с картины острой или частичной кишечной непроходимости.
Символ Т содержит следующие градации:
Т - первичная опухоль.
Тх - недостаточно данных для оценки первичной опухоли.
Тis - преинвазивный рак (интраэпителиальная инвазия или инвазия в собственную пластинку слизистой оболочки).
Т1 - опухоль распространяется в подслизистый слой стенки кишки.
Т2 - опухоль распространяется в мышечный слой.
Т3 - врастание в субсерозу или неперитонизированную околокишечную клетчатку.
В отношении опухолей, расположенных в ректосигмоидном отделе ободочной кишки (покрытых брюшиной), символ Т3 применяется для обозначения распространения до субсерозы (опухоль не прорастает в серозную оболочку).
Т4 - прорастание опухоли в окружающие органы и ткани или прорастание опухоли в висцеральную брюшину.
Т4а - опухоль прорастает в висцеральную брюшину.
Т4b - опухоль прорастает в другие органы и структуры.
N - вовлечение регионарных лимфатических узлов:
Nх - недостаточно данных для оценки регионарных лимфатических узлов.
N0 - нет поражения регионарных лимфатических узлов.
N1 - метастазы в 1-3 регионарных лимфатических узлах.
N1a - метастазы в 1 регионарном лимфатическом узле.
N1b - метастазы в 2-3 регионарных лимфатических узлах.
N1c - диссеминаты в брыжейке без поражения регионарных лимфатических узлов.
N2 - метастазы в 4 и более регионарных лимфатических узлах.
N2a - поражено 4-6 регионарных лимфатических узлов.
N2b - поражено 7 и более регионарных лимфатических узлов.
M - отдаленные метастазы:
М0 - отдаленных метастазов нет.
М1 - наличие отдаленных метастазов.
М1a - наличие отдаленных метастазов в 1 органе.
М1b - наличие отдаленных метастазов более чем в 1 органе.
M1c - метастазы по брюшине.
Группировка по стадиям представлена в таблице 1.
Таблица 1. Стадии рака толстой кишки.
Определение регионарных лимфатических узлов в зависимости от локализации опухоли представлено в таблице 2.
Таблица 2. Расположение регионарных лимфатических узлов в зависимости от локализации первичной опухоли.
Т1sm1 - глубина инвазии опухоли в подслизистый слой до 1/3 его толщины.
Т1sm2 - умеренная глубина инвазии опухоли в подслизистый слой - до 2/3 его толщины.
T1sm3 - полная инвазия опухоли в подслизистый слой - на всю его толщину.
Окончательное стадирование проводится по результатам патолого-анатомического исследования операционного материала.
Уровень 0 - отсутствие инвазивной карциномы.
Уровень I - инвазия в «головку» полипа.
Уровень II - инвазия в «шейку» полипа.
Уровень III - инвазия в «ножку» полипа.
Уровень IV - инвазия в «основание» полипа.
Уровни I-III соответствуют T1sm1, а уровень IV может соответствовать T1sm1-T1sm3.
1,6,1 Стадирование рака ободочной кишки по системе TNM-8 (2017).
Для рака ободочной кишки и ректосигмоидного отдела толстой кишки используется единая классификация.Символ Т содержит следующие градации:
Т - первичная опухоль.
Тх - недостаточно данных для оценки первичной опухоли.
Тis - преинвазивный рак (интраэпителиальная инвазия или инвазия в собственную пластинку слизистой оболочки).
Т1 - опухоль распространяется в подслизистый слой стенки кишки.
Т2 - опухоль распространяется в мышечный слой.
Т3 - врастание в субсерозу или неперитонизированную околокишечную клетчатку.
В отношении опухолей, расположенных в ректосигмоидном отделе ободочной кишки (покрытых брюшиной), символ Т3 применяется для обозначения распространения до субсерозы (опухоль не прорастает в серозную оболочку).
Т4 - прорастание опухоли в окружающие органы и ткани или прорастание опухоли в висцеральную брюшину.
Т4а - опухоль прорастает в висцеральную брюшину.
Т4b - опухоль прорастает в другие органы и структуры.
N - вовлечение регионарных лимфатических узлов:
Nх - недостаточно данных для оценки регионарных лимфатических узлов.
N0 - нет поражения регионарных лимфатических узлов.
N1 - метастазы в 1-3 регионарных лимфатических узлах.
N1a - метастазы в 1 регионарном лимфатическом узле.
N1b - метастазы в 2-3 регионарных лимфатических узлах.
N1c - диссеминаты в брыжейке без поражения регионарных лимфатических узлов.
N2 - метастазы в 4 и более регионарных лимфатических узлах.
N2a - поражено 4-6 регионарных лимфатических узлов.
N2b - поражено 7 и более регионарных лимфатических узлов.
M - отдаленные метастазы:
М0 - отдаленных метастазов нет.
М1 - наличие отдаленных метастазов.
М1a - наличие отдаленных метастазов в 1 органе.
М1b - наличие отдаленных метастазов более чем в 1 органе.
M1c - метастазы по брюшине.
Группировка по стадиям представлена в таблице 1.
Таблица 1. Стадии рака толстой кишки.
| 0 | is | 0 | 0 |
| I | 1, 2 | 0 | 0 |
| II | 3, 4 | 0 | 0 |
| IIA | 3 | 0 | 0 |
| IIB | 4a | 0 | 0 |
| IIC | 4b | 0 | 0 |
| III | Любая | 1, 2 | 0 |
| IIIA | 1, 2 | 1 | 0 |
| 1 | 2a | 0 | |
| IIIB | 3, 4a | 1 | 0 |
| 2, 3 | 2a | 0 | |
| IIIC | 4b | 1, 2a, 2b | 0 |
| 4a | 2a | 0 | |
| 3, 4a | 2b | 0 | |
| IV | Любая | Любая | 1 |
| IVa | Любая | Любая | 1a |
| IVb | Любая | Любая | 1b |
| IVc | Любая | Любая | 1с |
Определение регионарных лимфатических узлов в зависимости от локализации опухоли представлено в таблице 2.
Таблица 2. Расположение регионарных лимфатических узлов в зависимости от локализации первичной опухоли.
| Червеобразный отросток | Вдоль a. ileocolica |
| Слепая кишка | Вдоль a. ileocolica, a. colica dextra |
| Восходящая ободочная кишка | Вдоль a. ileocolica, a. colica dextra, a. colica media |
| Печеночный изгиб ободочной кишки | Вдоль a. colica dextra, a. colica media |
| Поперечная ободочная кишка | Вдоль a. colica dextra, a. colica media, a. colica sinistra, a. mesenterica inferior |
| Селезеночный изгиб ободочной кишки | Вдоль a. colica media, a. colica sinistra, a. mesenterica inferior |
| Нисходящая ободочная кишка | Вдоль a. colica sinistra, a. mesenterica inferior |
| Сигмовидная кишка | Вдоль aa. sigmoideae, a. colica sinistra, a. rectalis superior, a. mesenterica inferior |
1,6,2 Стадирование по Kikuchi раннего рака ободочной кишки.
При планировании местного иссечения рака ободочной кишки Т1 рекомендовано уточнять стадию заболевания на основании данных магнитно-резонансной томографии (МРТ) и колоноскопии в сочетании с одновременной оценкой степени инвазии ультразвуковым методом по нижеследующим критериям.Т1sm1 - глубина инвазии опухоли в подслизистый слой до 1/3 его толщины.
Т1sm2 - умеренная глубина инвазии опухоли в подслизистый слой - до 2/3 его толщины.
T1sm3 - полная инвазия опухоли в подслизистый слой - на всю его толщину.
Окончательное стадирование проводится по результатам патолого-анатомического исследования операционного материала.
1,6,3 Стадирование по Haggitt малигнизированных полипов ободочной кишки.
Для определения тактики лечения малигнизированных полипов ободочной кишки рекомендовано стадирование по результатам морфологического исследования.Уровень 0 - отсутствие инвазивной карциномы.
Уровень I - инвазия в «головку» полипа.
Уровень II - инвазия в «шейку» полипа.
Уровень III - инвазия в «ножку» полипа.
Уровень IV - инвазия в «основание» полипа.
Уровни I-III соответствуют T1sm1, а уровень IV может соответствовать T1sm1-T1sm3.
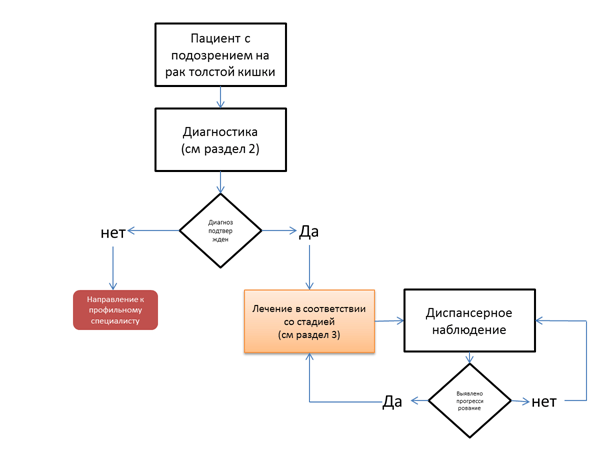
Диагностика
Критерии установления диагноза. Жалобы, анамнез, данные физикального обследования, морфологического исследования опухолевого материала, инструментальных и лабораторных исследований.
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарии. У 3-5 % пациентов с раком ободочной кишки развитие заболевания связано с наличием известных наследственных синдромов. Наиболее распространенные из них - синдром Линча, семейный аденоматоз толстой кишки и MutYH-ассоциированный полипоз.
• Рекомендуется собрать семейный анамнез и проанализировать его на соответствие критериям Amsterdam II (приложение Г1) и рекомендациям вethesda (приложение Г2) у всех пациентов с раком ободочной кишки [2, 122, 123].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
Комментарии. Соответствие критериям Amsterdam II - показание к направлению на генетическую консультацию и генетическое тестирование. Соответствие рекомендациям вethesda - показание к исследованию биопсийного (операционного) материала на наличие микросателлитных повторов ДНК методом полимеразной цепной реакции (ПЦР) (на наличие микросателлитной нестабильности (MSI)) или на наличие дефицита белков системы репарации неспаренных оснований иммуногистохимическими методами. При выявлении микросателлитной нестабильности высокого уровня (MSI-H) показано направление на генетическую консультацию и генетическое тестирование. Однако в РФ до 25-30 % пациентов с генетически подтвержденным синдромом Линча не соответствуют критериям Amsterdam II, поскольку у них отсутствует отягощенный семейный анамнез. В этой связи для отбора российских пациентов с подозрением на синдром Линча были разработаны оригинальные критерии (приложение Г), которые учитывают их популяционные особенности [17]. Соответствие этим рекомендациям - показание к исследованию биопсийного (операционного) материала на наличие микросателлитных повторов ДНК методом ПЦР (на наличие MSI) или на наличие дефицита белков системы репарации неспаренных оснований иммуногистохимическими методами. При исследовании биопсийного материала на наличие MSI методом ПЦР необходимо оценить содержание опухолевых клеток в образце (их должно быть не менее 50%). При выявлении MSI-H показано направление на генетическую консультацию и генетическое тестирование.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется определение функционального статуса пациента по шкале ECOG или по шкале Карновского перед началом любого противоопухолевого лечения с целью оценки потенциальной переносимости противоопухолевого лечения [16].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Коагулограмму обязательно выполняют у пациентов, которым назначено хирургическое лечение, у остальных - при наличии клинических показаний. Определение уровня ракового эмбрионального антигена (РЭА) в крови показано всем пациентам на этапе первичного стадирования. Перечень параметров биохимического анализа крови и коагулограммы лечащий врач должен определять для каждого пациента индивидуально, с учетом его особенностей.
• Рекомендуется выполнять молекулярно-генетическое исследование для выявления мутаций в генах KRAS, NRAS, вRAF и микросателлитных повторов ДНК в биопсийном (операционном) материале методом ПЦР или иммуногистохимическое исследование для выявления дефицита белков системы репарации неспаренных оснований, если обнаружены отдаленные метастазы, что может повлиять на выбор таргетного агента для лечения метастатического процесса [39-41, 124]. Если мутации в генах KRAS, NRAS, вRAF определялись методом ПЦР и они не были обнаружены, то возможно проведение дальнейшего генетического поиска методом секвенирования. При отсутствии мутаций в генах семейства RAS, вRAF можно провести дополнительное исследование экспрессии или амплификации Her2 [131-133, 206, 207].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии. Если планируется проведение химиотерапии с включением аналогов пиримидинов, следует рассмотреть возможность проведения исследования на наличие полиморфизмов гена DPYD, ассоциированных с токсичностью данного класса препаратов [134], однако редкость гомозиготных вариантов данных полиморфизмов не позволяет назначать данный анализ в рутинной практике всем пациентам. Если планируется проведение химиотерапии с включением иринотекана, следует рассмотреть возможность проведения исследования на наличие полиморфизмов гена UGT1A1, ассоциированных с токсичностью данного класса препаратов [39-41, 124].
• Генетическое тестирование рекомендуется в следующих случаях:
1. Подозрение на синдром Линча. Выполняется молекулярно-генетическое исследование мутаций MLH1, MSH2, MSH6, PMS2 в крови:
O при соответствии пациента критериям Amsterdam II;
O при наличии у пациента родственника 1-й или 2-й линии с установленным диагнозом синдрома Линча;
O при развитии у пациентки рака эндометрия в возрасте до 50 лет;
O при наличии MSI-H или дефицита белков системы репарации неспаренных оснований в опухоли.
2. Подозрение на синдром Линча у пациентов, не соответствующих критериям Amsterdam II. При соответствии критериям вethesda и Amsterdam II выполняется исследование биопсийного (операционного) материала на наличие микросателлитных повторов ДНК методом ПЦР или иммуногистохимическое исследование на наличие дефицита белков системы репарации неспаренных оснований, при выявлении MSI-H - молекулярно-генетическое исследование для выявления мутаций в генах MLH1, MSH2, MSH6, PMS2 в крови.
3. Подозрение на семейный аденоматоз. Выполняется молекулярно-генетическое исследование для выявления мутаций в гене APC в крови при наличии у пациента:
O более 100 полипов кишечника;
O родственника 1-й линии с установленным диагнозом семейного аденоматоза толстой кишки (при наличии родственника с выявленной наследственной мутацией гена APC).
4. Подозрение на наличие аттенуированной формы семейного аденоматоза (от 20.
До 100 полипов). Проводят молекулярно-генетическое исследование для выявления мутаций в гене APC в крови. При MutYH-ассоциированном полипозе - молекулярно-генетическое исследование для выявления мутаций в гене MYH в крови. Пациенты, у которых обнаружено более 20 полипов толстой кишки, но имеется отрицательный результат анализа на мутацию АРС:
O пациенты, у которых в семье прослеживается рецессивное наследование семейного аденоматоза;
O пациенты, у которых полипы выявляются в более позднем возрасте (34-44 года) [2, 16, 17].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. За исключением MutYH-ассоциированного полипоза и синдрома Блума, все наследственные синдромы, связанные с развитием колоректального рака, носят аутосомно-доминантный характер. При наличии яркого семейного анамнеза злокачественных заболеваний пациентам с исключенным семейным аденоматозным полипозом и синдромом Линча показана консультация генетика для диагностики более редких заболеваний - синдромов Пейтца-Егерса, Ли-Фраумени, Блума, Коудена, ювенильного полипоза, олигодонтии и колоректального рака [2].
• Рекомендуется всем пациентам с целью постановки диагноза проводить патолого-анатомическое исследование биопсийного (операционного) материала [16].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарий. В морфологическом заключении рекомендуется отразить следующие параметры [199]:
1) Описание макропрепарата.
2) Расстояние до проксимального и дистального краев резекции.
3) Размеры опухоли.
4) Наличие или отсутствие перфорации опухоли.
5) Наличие иных новообразований.
6) Гистологический тип опухоли по классификации ВОЗ (в редакции 2019 года).
7) Степень злокачественности опухоли (низкая, высокая).
8).
9) pN (с указанием общего числа исследованных и пораженных лимфатических узлов).
10) Наличие в периколярной жировой ткани изолированных опухолевых депозитов без предсуществующих структур лимфатического узла (иначе следует относить к метастазам), сосудистых структур (иначе следует считать сосудистой инвазией) или нервов (иначе следует считать периневральной инвазией).
11) Наличие поражения проксимального края резекции (отрицательный результат также должен быть констатирован).
12) Наличие поражения дистального края резекции (отрицательный результат также должен быть констатирован).
13) Наличие интрамуральной и экстрамуральной сосудистой инвазии (отрицательный результат также должен быть констатирован).
14) Наличие периневральной инвазии (отрицательный результат также должен быть констатирован).
15) Гистологическая градация инвазивного фронта опухоли (tumor-budding) по.
3-ступенчатой схеме в соответствии с градацией International Tumor вudding сonsensus сonference (2016) [203].
16) Гистологические признаки, значимо ассоциированные с MSI-H (зубчатая, перстневидно-клеточная, муцинозная и медуллярная аденокарцинома, интра- и перитуморальная лимфоидная инфильтрация).
17) Степень регрессии опухоли (TRG1-TRG5) по критериям Mandard (при наличии предшествующего комбинированного лечения) (приложение Г3).
18) Поражение апикального лимфатического узла (отрицательный результат также должен быть констатирован).
• Пациентам с раком ободочной кишки до начала лечения рекомендуется выполнять исследование уровня РЭА в крови с целью оценки прогноза заболевания [18].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. План лечения не следует составлять до получения данных патолого-анатомического исследования биопсийного материала. При подслизистом инфильтративном росте опухоли возможен ложноотрицательный результат, что требует повторной биопсии. Чувствительность и специфичность метода возрастают при использовании современных технологий эндоскопической визуализации (увеличительной эндоскопии, узкоспектральной эндоскопии, хромоэндоскопии, флуоресцентной диагностики).
• Пациентам с установленным диагнозом рака ободочной кишки при невозможности выполнения тотальной колоноскопии рекомендуется с целью исключения синхронных опухолей провести ирригоскопию или КТ-колонографию до начала лечения, либо тотальную колоноскопию в течение 3-6 мес после операции [19-22].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. В 4-5 % случаев встречаются синхронные образования, которые могут быть пропущены при пальпаторной ревизии во время операции [15, 16]. Ввиду этого полное обследование толстой кишки рекомендуется всем пациентам до хирургического лечения, при технической невозможности - не позднее чем через 6 мес после него. КТ-колонография по сравнению с ирригоскопией характеризуется большей чувствительностью в выявлении полипов, особенно в проксимальных отделах толстой кишки [21].
• Больным раком ободочной кишки до начала специфического противоопухолевого лечения рекомендуется выполнять компьютерную томографию (КТ) или МРТ органов брюшной полости с внутривенным контрастированием для оценки местной распространенности опухоли и исключения метастатического поражения органов брюшной полости [23].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. КТ органов брюшной полости с внутривенным контрастированием с использованием неионных йодсодержащих препаратов в большинстве развитых стран является стандартом уточняющей диагностики при раке ободочной кишки. МРТ обладает большей, чем КТ, чувствительностью и специфичностью в выявлении метастатического поражения печени, однако уступает КТ в оценке локальной распространенности опухоли ввиду более низкого пространственного разрешения. В протоколе КТ или МРТ следует отражать: расстояние от края опухоли до наиболее близкого анатомического ориентира (купола слепой кишки, печеночного/селезеночного изгиба или анального отверстия), протяженность опухоли вдоль кишечной стенки, наличие инвазии в мезоколон и ее глубину, наличие инвазии в брюшину, наличие лимфатических узлов мезоколона и забрюшинного пространства с признаками метастатического поражения и их размеры, наличие отдаленных метастазов, локализованных по брюшине и во внутренних органах.
• Больным раком ободочной кишки до начала лечения рекомендуется выполнять КТ органов грудной клетки с целью исключения метастатического поражения органов грудной клетки [16, 24].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. КТ органов грудной клетки в большинстве развитых стран является стандартом уточняющей диагностики при раке ободочной кишки и служит для исключения метастазов в легких, лимфатических узлах средостения. На практике данное исследование может быть отчасти заменено другими у пациентов с небольшой местной распространенностью опухолевого процесса.
• Рекомендуется при раке ректосигмоидного отдела толстой кишки до начала лечения выполнять МРТ либо КТ малого таза с внутривенным контрастированием с целью оценки распространения опухоли [25, 26].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. МРТ малого таза предпочтительнее, так как позволяет осуществить более детальную предоперационную оценку местного распространения опухолевого процесса. Внутривенное контрастирование при МРТ малого таза для оценки местного распространения не требуется. При направлении на МРТ необходимо четко сформулировать цель исследования и указать предполагаемую локализацию опухоли для выбора корректного протокола сканирования.
• Всем больным раком ободочной кишки до начала лечения рекомендуется выполнять регистрацию электрокардиограммы с целью оценки потенциальной переносимости противоопухолевого лечения [27].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется выполнять эндоскопическое ультразвуковое исследование (УЗИ) при планировании местного иссечения раннего рака и ворсинчатых опухолей ободочной кишки [28, 29].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Рекомендуется оценивать резектабельность метастазов в печени по данным МРТ брюшной полости с внутривенным контрастированием или КТ органов брюшной полости с внутривенным контрастированием с использованием рентгеноконтрастных средств, содержащих йод. Рекомендуется выполнять МРТ органов брюшной полости с внутривенным контрастированием при планировании резекции печени в случаях, когда КТ c внутривенным контрастированием не позволяет в полной мере оценить распространенность процесса в печени [30-32].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарии. Для оценки резектабельности метастазов колоректального рака в печени предпочтительна МРТ органов брюшной полости с внутривенным контрастированием. У пациентов с противопоказаниями к использованию внутривенного контрастирования возможно выполнение МРТ в режиме DWI. МРТ позволяет у 10-20 % пациентов выявить не определяемые по данным УЗИ метастазы и сократить количество эксплоративных операций и операций в объеме R2 [33]. Пациентам с противопоказаниями к проведению МРТ рекомендуется выполнение КТ с внутривенным контрастированием или позитронной эмиссионной томографии, совмещенной с КТ (ПЭТ-КТ) с 18-фтор-дезоксиглюкозой и внутривенным контрастированием. МРТ обладает наиболее высокой чувствительностью по сравнению с другими диагностическими методами, в особенности в отношении метастазов размером <1 см [32], при этом предпочтение следует отдавать МРТ с парамагнитными контрастными средствами (гадоксетовой кислотой**), так как они позволяют повысить чувствительность метода в отношении мелких метастазов в печени [135]. Не допускается планирование резекции метастазов на основании только данных УЗИ печени или КТ без внутривенного контрастирования.
• Рекомендуется выполнять остеосцинтиграфию при подозрении на метастатическое поражение костей скелета [34].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется биопсию лимфатических узлов, подозрительных в отношении метастатических очагов, выполнять под контролем УЗИ или КТ, если их верификация принципиально меняет тактику лечения [35].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• Рекомендуется выполнять ПЭТ-КТ при подозрении на метастазы по данным КТ или МРТ, если подтверждение их наличия принципиально меняет тактику лечения [31, 36].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарии. Метаанализ данных рандомизированных исследований, посвященных оценке необходимости выполнения ПЭТ-КТ для исключения экстрапеченочных метастазов при решении вопроса о проведении метастазэктомии печени, показал, что данный метод обследования меняет тактику лечения у 8 % пациентов и не влияет на общую выживаемость [36].
• Рекомендуется выполнять лапароскопию при подозрении на диссеминацию опухоли по брюшине, если ее выявление принципиально меняет тактику лечения [37].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 2).
• Рекомендуется выполнять МРТ головного мозга с внутривенным контрастированием при подозрении на метастатическое поражение головного мозга [12, 35].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам при положительном результате биопсии в заключении указывать гистологический тип опухоли и степень ее дифференцировки для определения оптимальной тактики лечения [1].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам с подозрением на рак ободочной кишки при отрицательном результате биопсии (диагноз новообразования не верифицирован) для определения тактики лечения принимать решение о необходимости выполнения повторной биопсии индивидуально, с учетом наличия признаков злокачественного роста по данным эндоскопических и рентгенологических исследований [1].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется при подготовке к хирургическому лечению, выборе алгоритма лечения и оценке функционального статуса пациента выявлять сопутствующие заболевания и проводить необходимые диагностические исследования в соответствии с клиническими рекомендациями по данным заболеваниям, состояниям [38].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. Проводятся эхокардиография, холтеровское мониторирование сердечной деятельности, исследование функции внешнего дыхания, ультразвуковая допплерография сосудов шеи и нижних конечностей, консультации врача-кардиолога, врача-эндокринолога, врача-невролога и других профильных специалистов.
2,1 Жалобы и анамнез.
• Рекомендуется тщательный сбор жалоб и анамнеза пациентов с раком ободочной кишки с целью выявления факторов, которые могут повлиять на выбор тактики лечения [15, 16].Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарии. У 3-5 % пациентов с раком ободочной кишки развитие заболевания связано с наличием известных наследственных синдромов. Наиболее распространенные из них - синдром Линча, семейный аденоматоз толстой кишки и MutYH-ассоциированный полипоз.
• Рекомендуется собрать семейный анамнез и проанализировать его на соответствие критериям Amsterdam II (приложение Г1) и рекомендациям вethesda (приложение Г2) у всех пациентов с раком ободочной кишки [2, 122, 123].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
Комментарии. Соответствие критериям Amsterdam II - показание к направлению на генетическую консультацию и генетическое тестирование. Соответствие рекомендациям вethesda - показание к исследованию биопсийного (операционного) материала на наличие микросателлитных повторов ДНК методом полимеразной цепной реакции (ПЦР) (на наличие микросателлитной нестабильности (MSI)) или на наличие дефицита белков системы репарации неспаренных оснований иммуногистохимическими методами. При выявлении микросателлитной нестабильности высокого уровня (MSI-H) показано направление на генетическую консультацию и генетическое тестирование. Однако в РФ до 25-30 % пациентов с генетически подтвержденным синдромом Линча не соответствуют критериям Amsterdam II, поскольку у них отсутствует отягощенный семейный анамнез. В этой связи для отбора российских пациентов с подозрением на синдром Линча были разработаны оригинальные критерии (приложение Г), которые учитывают их популяционные особенности [17]. Соответствие этим рекомендациям - показание к исследованию биопсийного (операционного) материала на наличие микросателлитных повторов ДНК методом ПЦР (на наличие MSI) или на наличие дефицита белков системы репарации неспаренных оснований иммуногистохимическими методами. При исследовании биопсийного материала на наличие MSI методом ПЦР необходимо оценить содержание опухолевых клеток в образце (их должно быть не менее 50%). При выявлении MSI-H показано направление на генетическую консультацию и генетическое тестирование.
2,2 Физикальное обследование.
• Больным раком ободочной кишки до начала лечения рекомендуются тщательный физикальный осмотр (включающий пальцевое ректальное исследование) с целью исключения синхронных опухолей прямой кишки и оценка нутритивного статуса с целью определения потенциальной переносимости противоопухолевого лечения [15].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется определение функционального статуса пациента по шкале ECOG или по шкале Карновского перед началом любого противоопухолевого лечения с целью оценки потенциальной переносимости противоопухолевого лечения [16].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
2,3 Лабораторные диагностические исследования.
• Рекомендуется всем больным раком ободочной кишки до начала лечения провести общий (клинический) анализ крови и анализ крови биохимический общетерапевтический, составить коагулограмму (ориентировочное исследование системы гемостаза) с целью оценки потенциальной переносимости противоопухолевого лечения [16, 18].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Коагулограмму обязательно выполняют у пациентов, которым назначено хирургическое лечение, у остальных - при наличии клинических показаний. Определение уровня ракового эмбрионального антигена (РЭА) в крови показано всем пациентам на этапе первичного стадирования. Перечень параметров биохимического анализа крови и коагулограммы лечащий врач должен определять для каждого пациента индивидуально, с учетом его особенностей.
• Рекомендуется выполнять молекулярно-генетическое исследование для выявления мутаций в генах KRAS, NRAS, вRAF и микросателлитных повторов ДНК в биопсийном (операционном) материале методом ПЦР или иммуногистохимическое исследование для выявления дефицита белков системы репарации неспаренных оснований, если обнаружены отдаленные метастазы, что может повлиять на выбор таргетного агента для лечения метастатического процесса [39-41, 124]. Если мутации в генах KRAS, NRAS, вRAF определялись методом ПЦР и они не были обнаружены, то возможно проведение дальнейшего генетического поиска методом секвенирования. При отсутствии мутаций в генах семейства RAS, вRAF можно провести дополнительное исследование экспрессии или амплификации Her2 [131-133, 206, 207].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии. Если планируется проведение химиотерапии с включением аналогов пиримидинов, следует рассмотреть возможность проведения исследования на наличие полиморфизмов гена DPYD, ассоциированных с токсичностью данного класса препаратов [134], однако редкость гомозиготных вариантов данных полиморфизмов не позволяет назначать данный анализ в рутинной практике всем пациентам. Если планируется проведение химиотерапии с включением иринотекана, следует рассмотреть возможность проведения исследования на наличие полиморфизмов гена UGT1A1, ассоциированных с токсичностью данного класса препаратов [39-41, 124].
• Генетическое тестирование рекомендуется в следующих случаях:
1. Подозрение на синдром Линча. Выполняется молекулярно-генетическое исследование мутаций MLH1, MSH2, MSH6, PMS2 в крови:
O при соответствии пациента критериям Amsterdam II;
O при наличии у пациента родственника 1-й или 2-й линии с установленным диагнозом синдрома Линча;
O при развитии у пациентки рака эндометрия в возрасте до 50 лет;
O при наличии MSI-H или дефицита белков системы репарации неспаренных оснований в опухоли.
2. Подозрение на синдром Линча у пациентов, не соответствующих критериям Amsterdam II. При соответствии критериям вethesda и Amsterdam II выполняется исследование биопсийного (операционного) материала на наличие микросателлитных повторов ДНК методом ПЦР или иммуногистохимическое исследование на наличие дефицита белков системы репарации неспаренных оснований, при выявлении MSI-H - молекулярно-генетическое исследование для выявления мутаций в генах MLH1, MSH2, MSH6, PMS2 в крови.
3. Подозрение на семейный аденоматоз. Выполняется молекулярно-генетическое исследование для выявления мутаций в гене APC в крови при наличии у пациента:
O более 100 полипов кишечника;
O родственника 1-й линии с установленным диагнозом семейного аденоматоза толстой кишки (при наличии родственника с выявленной наследственной мутацией гена APC).
4. Подозрение на наличие аттенуированной формы семейного аденоматоза (от 20.
До 100 полипов). Проводят молекулярно-генетическое исследование для выявления мутаций в гене APC в крови. При MutYH-ассоциированном полипозе - молекулярно-генетическое исследование для выявления мутаций в гене MYH в крови. Пациенты, у которых обнаружено более 20 полипов толстой кишки, но имеется отрицательный результат анализа на мутацию АРС:
O пациенты, у которых в семье прослеживается рецессивное наследование семейного аденоматоза;
O пациенты, у которых полипы выявляются в более позднем возрасте (34-44 года) [2, 16, 17].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. За исключением MutYH-ассоциированного полипоза и синдрома Блума, все наследственные синдромы, связанные с развитием колоректального рака, носят аутосомно-доминантный характер. При наличии яркого семейного анамнеза злокачественных заболеваний пациентам с исключенным семейным аденоматозным полипозом и синдромом Линча показана консультация генетика для диагностики более редких заболеваний - синдромов Пейтца-Егерса, Ли-Фраумени, Блума, Коудена, ювенильного полипоза, олигодонтии и колоректального рака [2].
• Рекомендуется всем пациентам с целью постановки диагноза проводить патолого-анатомическое исследование биопсийного (операционного) материала [16].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарий. В морфологическом заключении рекомендуется отразить следующие параметры [199]:
1) Описание макропрепарата.
2) Расстояние до проксимального и дистального краев резекции.
3) Размеры опухоли.
4) Наличие или отсутствие перфорации опухоли.
5) Наличие иных новообразований.
6) Гистологический тип опухоли по классификации ВОЗ (в редакции 2019 года).
7) Степень злокачественности опухоли (низкая, высокая).
8).
9) pN (с указанием общего числа исследованных и пораженных лимфатических узлов).
10) Наличие в периколярной жировой ткани изолированных опухолевых депозитов без предсуществующих структур лимфатического узла (иначе следует относить к метастазам), сосудистых структур (иначе следует считать сосудистой инвазией) или нервов (иначе следует считать периневральной инвазией).
11) Наличие поражения проксимального края резекции (отрицательный результат также должен быть констатирован).
12) Наличие поражения дистального края резекции (отрицательный результат также должен быть констатирован).
13) Наличие интрамуральной и экстрамуральной сосудистой инвазии (отрицательный результат также должен быть констатирован).
14) Наличие периневральной инвазии (отрицательный результат также должен быть констатирован).
15) Гистологическая градация инвазивного фронта опухоли (tumor-budding) по.
3-ступенчатой схеме в соответствии с градацией International Tumor вudding сonsensus сonference (2016) [203].
16) Гистологические признаки, значимо ассоциированные с MSI-H (зубчатая, перстневидно-клеточная, муцинозная и медуллярная аденокарцинома, интра- и перитуморальная лимфоидная инфильтрация).
17) Степень регрессии опухоли (TRG1-TRG5) по критериям Mandard (при наличии предшествующего комбинированного лечения) (приложение Г3).
18) Поражение апикального лимфатического узла (отрицательный результат также должен быть констатирован).
• Пациентам с раком ободочной кишки до начала лечения рекомендуется выполнять исследование уровня РЭА в крови с целью оценки прогноза заболевания [18].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
2,4 Инструментальные диагностические исследования.
• Больным раком ободочной кишки до начала лечения рекомендуется выполнять колоноскопию с биопсией - наиболее информативное исследование при раке ободочной кишки, позволяющее непосредственно визуализировать опухоль, определить ее размеры, локализацию и макроскопический тип, оценить угрозу осложнений (кровотечения, перфорации), а также получить материал для морфологического исследования. Для получения достаточного количества материала требуется выполнить забор нескольких (3-5) образцов тканей стандартными эндоскопическими щипцами [16, 19, 20].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. План лечения не следует составлять до получения данных патолого-анатомического исследования биопсийного материала. При подслизистом инфильтративном росте опухоли возможен ложноотрицательный результат, что требует повторной биопсии. Чувствительность и специфичность метода возрастают при использовании современных технологий эндоскопической визуализации (увеличительной эндоскопии, узкоспектральной эндоскопии, хромоэндоскопии, флуоресцентной диагностики).
• Пациентам с установленным диагнозом рака ободочной кишки при невозможности выполнения тотальной колоноскопии рекомендуется с целью исключения синхронных опухолей провести ирригоскопию или КТ-колонографию до начала лечения, либо тотальную колоноскопию в течение 3-6 мес после операции [19-22].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. В 4-5 % случаев встречаются синхронные образования, которые могут быть пропущены при пальпаторной ревизии во время операции [15, 16]. Ввиду этого полное обследование толстой кишки рекомендуется всем пациентам до хирургического лечения, при технической невозможности - не позднее чем через 6 мес после него. КТ-колонография по сравнению с ирригоскопией характеризуется большей чувствительностью в выявлении полипов, особенно в проксимальных отделах толстой кишки [21].
• Больным раком ободочной кишки до начала специфического противоопухолевого лечения рекомендуется выполнять компьютерную томографию (КТ) или МРТ органов брюшной полости с внутривенным контрастированием для оценки местной распространенности опухоли и исключения метастатического поражения органов брюшной полости [23].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. КТ органов брюшной полости с внутривенным контрастированием с использованием неионных йодсодержащих препаратов в большинстве развитых стран является стандартом уточняющей диагностики при раке ободочной кишки. МРТ обладает большей, чем КТ, чувствительностью и специфичностью в выявлении метастатического поражения печени, однако уступает КТ в оценке локальной распространенности опухоли ввиду более низкого пространственного разрешения. В протоколе КТ или МРТ следует отражать: расстояние от края опухоли до наиболее близкого анатомического ориентира (купола слепой кишки, печеночного/селезеночного изгиба или анального отверстия), протяженность опухоли вдоль кишечной стенки, наличие инвазии в мезоколон и ее глубину, наличие инвазии в брюшину, наличие лимфатических узлов мезоколона и забрюшинного пространства с признаками метастатического поражения и их размеры, наличие отдаленных метастазов, локализованных по брюшине и во внутренних органах.
• Больным раком ободочной кишки до начала лечения рекомендуется выполнять КТ органов грудной клетки с целью исключения метастатического поражения органов грудной клетки [16, 24].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. КТ органов грудной клетки в большинстве развитых стран является стандартом уточняющей диагностики при раке ободочной кишки и служит для исключения метастазов в легких, лимфатических узлах средостения. На практике данное исследование может быть отчасти заменено другими у пациентов с небольшой местной распространенностью опухолевого процесса.
• Рекомендуется при раке ректосигмоидного отдела толстой кишки до начала лечения выполнять МРТ либо КТ малого таза с внутривенным контрастированием с целью оценки распространения опухоли [25, 26].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. МРТ малого таза предпочтительнее, так как позволяет осуществить более детальную предоперационную оценку местного распространения опухолевого процесса. Внутривенное контрастирование при МРТ малого таза для оценки местного распространения не требуется. При направлении на МРТ необходимо четко сформулировать цель исследования и указать предполагаемую локализацию опухоли для выбора корректного протокола сканирования.
• Всем больным раком ободочной кишки до начала лечения рекомендуется выполнять регистрацию электрокардиограммы с целью оценки потенциальной переносимости противоопухолевого лечения [27].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется выполнять эндоскопическое ультразвуковое исследование (УЗИ) при планировании местного иссечения раннего рака и ворсинчатых опухолей ободочной кишки [28, 29].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Рекомендуется оценивать резектабельность метастазов в печени по данным МРТ брюшной полости с внутривенным контрастированием или КТ органов брюшной полости с внутривенным контрастированием с использованием рентгеноконтрастных средств, содержащих йод. Рекомендуется выполнять МРТ органов брюшной полости с внутривенным контрастированием при планировании резекции печени в случаях, когда КТ c внутривенным контрастированием не позволяет в полной мере оценить распространенность процесса в печени [30-32].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарии. Для оценки резектабельности метастазов колоректального рака в печени предпочтительна МРТ органов брюшной полости с внутривенным контрастированием. У пациентов с противопоказаниями к использованию внутривенного контрастирования возможно выполнение МРТ в режиме DWI. МРТ позволяет у 10-20 % пациентов выявить не определяемые по данным УЗИ метастазы и сократить количество эксплоративных операций и операций в объеме R2 [33]. Пациентам с противопоказаниями к проведению МРТ рекомендуется выполнение КТ с внутривенным контрастированием или позитронной эмиссионной томографии, совмещенной с КТ (ПЭТ-КТ) с 18-фтор-дезоксиглюкозой и внутривенным контрастированием. МРТ обладает наиболее высокой чувствительностью по сравнению с другими диагностическими методами, в особенности в отношении метастазов размером <1 см [32], при этом предпочтение следует отдавать МРТ с парамагнитными контрастными средствами (гадоксетовой кислотой**), так как они позволяют повысить чувствительность метода в отношении мелких метастазов в печени [135]. Не допускается планирование резекции метастазов на основании только данных УЗИ печени или КТ без внутривенного контрастирования.
• Рекомендуется выполнять остеосцинтиграфию при подозрении на метастатическое поражение костей скелета [34].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется биопсию лимфатических узлов, подозрительных в отношении метастатических очагов, выполнять под контролем УЗИ или КТ, если их верификация принципиально меняет тактику лечения [35].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• Рекомендуется выполнять ПЭТ-КТ при подозрении на метастазы по данным КТ или МРТ, если подтверждение их наличия принципиально меняет тактику лечения [31, 36].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарии. Метаанализ данных рандомизированных исследований, посвященных оценке необходимости выполнения ПЭТ-КТ для исключения экстрапеченочных метастазов при решении вопроса о проведении метастазэктомии печени, показал, что данный метод обследования меняет тактику лечения у 8 % пациентов и не влияет на общую выживаемость [36].
• Рекомендуется выполнять лапароскопию при подозрении на диссеминацию опухоли по брюшине, если ее выявление принципиально меняет тактику лечения [37].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 2).
• Рекомендуется выполнять МРТ головного мозга с внутривенным контрастированием при подозрении на метастатическое поражение головного мозга [12, 35].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
2,5 Иные диагностические исследования.
• Рекомендуется пациентам с подозрением на рак ободочной кишки при сомнительном результате биопсии выполнять ее повторно для исключения или подтверждения наличия рака ободочной кишки [1].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам при положительном результате биопсии в заключении указывать гистологический тип опухоли и степень ее дифференцировки для определения оптимальной тактики лечения [1].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам с подозрением на рак ободочной кишки при отрицательном результате биопсии (диагноз новообразования не верифицирован) для определения тактики лечения принимать решение о необходимости выполнения повторной биопсии индивидуально, с учетом наличия признаков злокачественного роста по данным эндоскопических и рентгенологических исследований [1].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется при подготовке к хирургическому лечению, выборе алгоритма лечения и оценке функционального статуса пациента выявлять сопутствующие заболевания и проводить необходимые диагностические исследования в соответствии с клиническими рекомендациями по данным заболеваниям, состояниям [38].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. Проводятся эхокардиография, холтеровское мониторирование сердечной деятельности, исследование функции внешнего дыхания, ультразвуковая допплерография сосудов шеи и нижних конечностей, консультации врача-кардиолога, врача-эндокринолога, врача-невролога и других профильных специалистов.
|
|
Лечение
Назначение и применение лекарственных препаратов, указанных в клинических рекомендациях, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем в конкретной клинической ситуации оно определяется инструкциями по применению конкретных лекарственных препаратов с учетом описанных в инструкциях мер предосторожности; также возможна коррекция доз в зависимости от состояния пациента.
• Рекомендуется рассматривать хирургическое вмешательство как основной метод радикального лечения больных раком ободочной кишки или ректосигмоидного отдела толстой кишки [16].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. По показаниям дополнительно проводится адъювантная/неоадъювантная химиотерапия.
• При раннем раке ободочной кишки 0-I стадии (Tis-T1sm1N0M0) рекомендуется рассмотреть возможность применения высокоэффективных органосохраняющих и функционально-щадящих способов лечения (эндоскопическая резекция слизистой оболочки с диссекцией в подслизистом слое) [43, 44].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. При определении тактики лечения следует учитывать прогностические факторы. Предпочтение следует отдавать методике эндоскопической подслизистой диссекции [42]. При выявлении после эндоскопического удаления факторов неблагоприятного прогноза выполняют резекцию соответствующего участка ободочной кишки.
Факторы неблагоприятного прогноза:
O стадия ≥G3,.
O поражение краев резекции,.
O лимфатическая, сосудистая или периневральная инвазия,.
O IV уровень инвазии (вовлечение подслизистой оболочки толстой кишки), >pT1sm1.
Эндоскопическая резекция слизистой оболочки допускается при инвазивных формах рака ободочной кишки (уровни I-III по классификации Haggitt) при отсутствии факторов неблагоприятного прогноза. Выявление по данным патолого-анатомического исследования биопсийного материала низкой степени дифференцировки опухоли и/или определение при эндоскопическом исследовании уровня IV по классификации Haggitt и/или глубины инвазии >uT1sm1 (при эндоскопическом УЗИ) является абсолютным противопоказанием к выполнению эндоскопической резекции слизистой оболочки (требуется удаление сегмента кишки). Наличие инвазивного рака в полипах на широком основании (≥T1sm1) приравнивается к уровню IV по классификации Haggitt и требует резекции соответствующего участка ободочной кишки. Остальные факторы неблагоприятного прогноза (поражение краев резекции, лимфатическая, сосудистая, периневральная инвазия) определяются после эндоскопической резекции. При их выявлении осуществляют дополнительную резекцию соответствующего сегмента кишки. Адъювантная терапия не проводится [45].
• При резектабельном локализованном и местно-распространенном раке ободочной кишки I-III стадий (Т1sm2-4N0-2M0) рекомендуется при отсутствии абсолютных противопоказаний на 1-м этапе проводить хирургическое лечение; объем операции определяется локализацией и местным распространением опухоли [46].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. При резектабельном местно-распространенном раке ободочной кишки III стадии (T1-4N1-2M0) левосторонней локализации и отсутствии MSI следует рассмотреть возможность проведения в течение 6-12 недель химиотерапии по схеме FOLFOX или XELOX при отсутствии абсолютных противопоказаний и невозможности проведения на 1-м этапе хирургического лечения [136].
• При резектабельном локализованном и местно-распространенном раке ободочной кишки II-III стадий (Т1-4N1-2M0, T4N0-2M0) рекомендуется проводить адъювантную химиотерапию при выявлении поражения регионарных лимфатических узлов, прорастании опухоли сквозь серозную оболочку (pT4a), врастании в соседние органы (pT4b) и наличии факторов риска ( см пункт 3,2 «Адъювантная химиотерапия») [47].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
• При нерезектабельном раке ободочной кишки (сТ4N0-2M0) рекомендуется направлять пациентов в крупные медицинские организации, в которых имеется опыт лечения данной группы пациентов, для повторной оценки возможности удаления опухоли [48].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. При невозможности проведения хирургического лечения в объеме R0-1 операции возможны только при высоком риске развития кишечной непроходимости и ограничиваются формированием обходных анастомозов/колостомы/илеостомы. В дальнейшем пациентам показана паллиативная химиотерапия.
• При генерализованном раке ободочной кишки с резектабельными/потенциально резектабельными синхронными метастазами в печени или легких (М1а) рекомендуется при исходной возможности выполнения R0-резекции метастазов рака ободочной кишки в печени или легких, а также при переходе метастатического поражения этих органов в резектабельное состояние в процессе химиотерапевтического лечения проводить резекцию указанных органов с метастазами в объеме R0 [16, 49-51, 125].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
• Рекомендуется тактику лечения всех пациентов с изолированным метастатическим поражением печени/легких на долечебном этапе обсуждать совместно с торакальными хирургами или абдоминальными хирургами, или хирургами, специализирующимися на хирургии печени, с целью корректной и своевременной оценки резектабельности метастатических очагов [16, 52, 53].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Тактика лечения зависит от исходной резектабельности метастатических очагов. Наилучших результатов можно добиться при достижении края резекции ≥1 мм [49-52]. Операцию в объеме R0 необходимо выполнять, как только метастазы станут резектабельными. Пролонгация химиотерапии может приводить к повышению частоты токсических поражений печени, а также к «исчезновению» части метастазов, что затруднит их идентификацию хирургом во время резекции. При наличии симптомной первичной опухоли (при угрозе кишечной непроходимости или кровотечения) на 1-м этапе проводится хирургическое удаление первичной опухоли с лимфодиссекцией. Радиочастотная абляция метастазов в печени или стереотаксическое лучевое воздействие может стать как дополнением к резекции печени для достижения радикальности вмешательства, так и самостоятельным методом лечения при невозможности хирургического удаления [54]. Внутриартериальная химиотерапия остается экспериментальным методом и не рекомендована к рутинному применению в 1-й линии терапии.
• При исходно резектабельных метастатических очагах рекомендуется их хирургическое удаление, при этом в случае функциональной переносимости предпочтение отдается одномоментным хирургическим вмешательствам [16, 49-52].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
• При исходно резектабельных метастатических очагах после успешного проведения резекции в объеме R0 или R1 рекомендуется проведение адъювантной химиотерапии (6 мес лечения по схеме FOLFOX, XELOX, применение аналогов пиримидинов в монорежиме) [54, 55].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Альтернативой немедленному хирургическому лечению является проведение периоперационной системной химиотерапии (FOLFOX, XELOX). Данный вариант стратегии следует выбрать при высоком риске прогрессирования заболевания (например, при высоком риске по классификации Fong или любой другой). После 8-12 недель терапии выполняется одновременное или последовательное удаление метастазов и первичной опухоли, а после операции продолжается проводимая ранее химиотерапия до достижения суммарной продолжительности 6 мес. Добавление моноклональных антител (МКА) к химиотерапии при резектабельных метастазах в печени не показано, так как оно может ухудшить отдаленные результаты [51, 53].
• При потенциально резектабельных метастатических очагах рекомендуется проведение максимально активной химиотерапии, цель которой - достижение объективного эффекта и переход нерезектабельных метастазов в резектабельные (FOLFOX, XELOX или FOLFIRI, XELIRI, FOLFOXIRI) [16, 42,54, 57, 58, 111-113].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарии. Оптимальной опцией для повышения резектабельности является применение «тройной» комбинации FOLFOXIRI [57, 58]. После 4-6 циклов следует повторно оценить резектабельность, при отсутствии прогрессирования осуществляют одновременное или последовательное удаление метастазов и первичной опухоли. Далее проводится адъювантная химиотерапия по программе FOLFOX или XELOX до достижения суммарной продолжительности 6 мес (с учетом предоперационной химиотерапии). В случае прогрессирования метастатических очагов или невозможности их удаления лечение проводят в соответствии с принципами, которые указаны в пункте, описывающем лечение пациентов с нерезектабельными метастазами [16].
• При потенциально резектабельных метастатических очагах в случае отсутствия мутации RAS и вRAF и отсутствия MSI рекомендуется рассмотреть возможность добавления к химиотерапии (режимы FOLFIRI, FOLFOX, FOLFOXIRI) цетуксимаба** или панитумумаба** независимо от локализации первичной опухоли [16, 39-42, 57].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• При потенциально резектабельных метастатических очагах в случае наличия мутации RAS рекомендовано рассмотреть возможность добавления бевацизумаба** к любому из указанных выше режимов химиотерапии независимо от локализации первичной опухоли [16, 39, 42, 59].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• При потенциально резектабельных метастатических очагах при наличии мутации вRAF и отсутствии MSI рекомендовано добавление бевацизумаба*** к режимам химиотерапии FOLFOX, XELOX или FOLFOXIRI [16, 57, 58].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарии. В случае назначения таргетных препаратов после перехода метастазов в резектабельное состояние и выполнения R0-резекции метастатических очагов проводится химиотерапия до достижения суммарной продолжительности 6 мес. Цетуксимаб**, панитумумаб**, бевацизумаб** и иринотекан** следует в послеоперационном периоде отменить. При резекции в объеме R1-R2 возможно продолжение терапии предоперационной комбинацией химиопрепаратов и МКА до достижения суммарной продолжительности 6 мес с последующим переходом на поддерживающую терапию.
• При потенциально резектабельных метастазах при MSI-H рекомендовано назначение в 1-й линии комбинации ниволумаба** и ипилимумаба** или, при отсутствии мутаций в генах RAS, пембролизумаба** в монорежиме до прогрессирования или перехода опухоли в резектабельное состояние. Оптимальная продолжительность иммунотерапии после выполнения R0-резекции точно не определена, но при удовлетворительной переносимости рекомендуется продолжать до 1 года с учетом предоперационного этапа [137, 138].
Уровень убедительности рекомендаций для пембролизумаба. A (уровень достоверности доказательств - 2).
Уровень убедительности рекомендаций для комбинации ниволумаба и ипилимумаба. С (уровень достоверности доказательств - 4).
• При генерализованном раке ободочной кишки с незеректабельными синхронными метастазами рекомендуется применение комбинаций химиопрепаратов (FOLFOX, XELOX, XELIRI, FOLFIRI, FOLFOXIRI) с добавлением или без добавления таргетных препаратов (цетуксимаб**, панитумумаб**, бевацизумаб**) [16] или, при MSI-H, монотерапии анти-PD1-антителами - ниволумабом** или пембролизумабом** - в монорежиме, или комбинацией ниволумаба** и ипилимумаба** [137, 138].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Цетуксимаб** или панитумумаб** применяются при отсутствии мутации RAS, вRAF и отсутствии MSI-H, а также при локализации первичной опухоли в левых отделах толстой кишки (границей которых считают селезеночный изгиб ободочной кишки), бевацизумаб** - вне зависимости от статуса RAS и вRAF и локализации первичной опухоли [16, 40, 42]. Цетуксимаб** и панитумумаб** не должны применяться в комбинации с капецитабином** (монотерапия капецитабином**, режимы XELOX и XELIRI) или аналогами пиримидинов в струйных режимах (режим Мейо, FLOX). Цель лечения - максимально длительный контроль заболевания при сохранении удовлетворительного качества жизни; у ряда пациентов возможно добиться перехода нерезектабельных метастазов в резектабельные. В процессе химиотерапии каждые 1,5-2,5 мес проводится повторная оценка резектабельности.
Различные методы эмболизации печеночной артерии, внутриартериальная химиотерапия могут применяться у отдельных пациентов с изолированным или преобладающим метастатическим поражением печени при исчерпании возможностей системной терапии. Вопрос об удалении первичной опухоли решается индивидуально с учетом риска развития связанных с ней осложнений. Пациенты, у которых ответ на лечение недостаточен для перехода метастазов в резектабельное состояние, подлежат паллиативному лекарственному лечению ( см раздел 3,3).
• В случае метахронных резектабельных или потенциально резектабельных метастазов рака ободочной кишки в печени или легких рекомендуется проводить операцию с адъювантной химиотерапией в течение 6 мес (FOLFOX или XELOX) или периоперационную химиотерапию в режимах FOLFOX или XELOX (в течение 3 мес до операции и 3 мес после нее), если ранее адъювантная химиотерапия не проводилась или с момента ее окончания прошло более 12 мес. В остальном лечение проводят в соответствии с принципами, описанными выше [16, 55, 56].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• При функционально-неоперабельном раке ободочной кишки (на фоне тяжелой сопутствующей патологии) рекомендуется проведение паллиативного противоопухолевого лекарственного лечения либо симптоматической терапии ( см раздел 3,3). Возможно стентирование опухоли или формирование разгрузочной кишечной стомы [60, 114, 115].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 2).
Комментарии. Данная ситуация может рассматриваться, когда риск, связанный с проведением операции, превышает риск, связанный с прогрессированием онкологического заболевания. Решение о наличии противопоказаний к хирургическому лечению может приниматься только на консилиуме с участием хирурга, терапевта, анестезиолога, реаниматолога.
• При рецидиве рака ободочной кишки рекомендовано рассмотреть возможность повторного хирургического лечения [61, 62]; при невозможности проведения повторного хирургического лечения рекомендована системная химиотерапия ( см раздел 3,3).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. В сложных клинических случаях лечебную тактику определяют на мультидисциплинарном консилиуме с участием проктолога, абдоминального хирурга, радиотерапевта и онколога на основании результатов дооперационного обследования с определением клинической стадии заболевания.
O тубулярно-ворсинчатых аденомах с дисплазией эпителия тяжелой степени;
O аденокарциномах с инвазией в пределах слизистого и подслизистого слоев по данным эндоскопического УЗИ;
O аденокарциномах с умеренной или высокой степенью дифференцировки [16, 29].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. Противопоказания:
O низкодифференцированная или слизистая аденокарцинома;
O лимфоваскулярная инвазия;
O стадия >uT1sm1.
Возможные варианты:
O эндоскопическая полипэктомия;
O эндоскопическая подслизистая резекция.
Наиболее частые осложнения. Болевой синдром, кровотечение, перфорация.
Следует учитывать, что при последующем патолого-анатомическом исследовании материала эндоскопически резецированного раннего рака ободочной кишки будут выявлены пациенты, которым потребуется резекция соответствующего участка толстой кишки, например пациенты со стадией >pT1sm1 или поражением краев резекции.
• Не рекомендуется рутинная механическая подготовка кишечника [63].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Установлено, что механическая подготовка кишечника не влияла на частоту осложнений, однако она может выполняться по усмотрению оперирующего хирурга [63].
• Рекомендуется при технической доступности и наличии хирургической бригады соответствующей квалификации проводить хирургическое лечение рака ободочной кишки с использованием лапароскопического доступа [29, 64-67, 116].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Лапароскопические резекции ободочной кишки имеют ряд преимуществ - ранняя реабилитация пациентов, снижение частоты развития спаечного процесса и его выраженности, меньшая потребность в использовании опиоидных анальгетиков, сокращение сроков госпитализации, меньший риск развития послеоперационных грыж [64-67]. Диссекция должна осуществляться вдоль эмбриональных (фасциальных) слоев со стремлением к обеспечению целостности фасции мезоколона. Возможно использование роботического хирургического доступа, однако его преимущества перед лапароскопическим не доказаны.
• Рекомендуется при локализации опухоли в слепой, восходящей ободочной кишке, печеночном изгибе ободочной кишки, проксимальной трети поперечной ободочной кишки выполнять правостороннюю гемиколэктомию или расширенную правостороннюю гемиколэктомию с обязательным лигированием у основания a. ileocolica, a. colica dextra, а также a. colica media у основания либо правой ветви a. colica media [64-67].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется при локализации опухоли в средней трети поперечной ободочной кишки решение об объеме хирургического вмешательства принимать индивидуально, с учетом возраста, сопутствующих заболеваний, размеров и распространенности опухоли. Допустима резекция поперечной ободочной кишки, расширенная право- или левосторонняя гемиколэктомия (в зависимости от более точной локализации опухоли), однако предпочтительный объем - субтотальная колэктомия [62-65].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• Рекомендуется при локализации опухоли в дистальной трети поперечной ободочной кишки, селезеночном изгибе ободочной кишки, нисходящей ободочной кишке, проксимальной трети сигмовидной кишки выполнять левостороннюю гемиколэктомию или расширенную левостороннюю гемиколэктомию с лигированием a. colica sinistra у места отхождения, а также левой ветви a. colica media либо самой a. colica media у места отхождения [64-67].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется при локализации опухоли в средней трети сигмовидной кишки выполнять резекцию сигмовидной кишки или операцию типа Гартмана (при наличии противопоказаний к формированию первичного анастомоза) с лигированием нижней брыжеечной артерии [64-67].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется при локализации опухоли в дистальной трети сигмовидной кишки выполнять резекцию сигмовидной кишки с чрезбрюшной резекцией прямой кишки или операцию типа Гартмана с лигированием нижней брыжеечной артерии у основания либо непосредственно дистальнее уровня отхождения левой ободочной артерии [64-67].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется соблюдение края резекции ≥10 см от опухоли при операциях по поводу рака ободочной кишки, ≥5 см - при операциях по поводу рака дистальной трети сигмовидной кишки и ректосигмоидного отдела толстой кишки [64-67].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Необходимо учитывать тот факт, что объем оперативного вмешательства не должен различаться при экстренном и плановом хирургическом лечении рака ободочной кишки, поэтому объем оперативного вмешательства по экстренным показаниям определяется индивидуально. Если соблюдение онкологических принципов вмешательства невозможно (вследствие отсутствия технической возможности, квалификации, наличия изменений органов брюшной полости на фоне острой хирургической патологии), а также если из-за тяжести состояния пациента высок риск выполнения расширенной операции, рекомендуется проводить симптоматическую операцию (формирование кишечной стомы или обходного анастомоза) с последующим направлением пациента на плановое хирургическое лечение в специализированную клинику. При локализации опухоли в слепой, восходящей ободочной кишке, печеночном изгибе ободочной кишки, проксимальной трети поперечной ободочной кишки допустимо формирование первичного анастомоза [68, 69].
• При проведении экстренного хирургического лечения по поводу рака левых отделов толстой кишки рекомендуется выполнение операций Микулича, типа Гартмана. Допустимо формирование первичного анастомоза после декомпрессии кишки [70].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендовано назначать адъювантную химиотерапию пациентам с раком pT4N0 или рТ1-4N+, а также она может быть рекомендована пациентам с раком ободочной кишки pТ3N0M0 и факторами неблагоприятного прогноза (низкой степенью дифференцировки, лимфоваскулярной/периневральной инвазией, при проведении операции в условиях кишечной непроходимости/перфорации/перитонита, при операции с неадекватным объемом лимфодиссекции (если изучено <12 лимфатических узлов), tumor-budding (BD3), уровне РЭА >2,5 нг/мл после операции) [47].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Необходимо исследование биопсийного (операционного) материала на наличие микросателлитных повторов ДНК методом ПЦР (MSI) или иммуногистохимическое исследование на наличие дефицита белков системы репарации неспаренных оснований при II стадии болезни с целью определения показаний к адъювантной химиотерапии [47, 71, 72].
• При раке ободочной кишки pТ3N0M0 с единственным фактором неблагоприятного прогноза при неизвестном статусе MSI или при микросателлитной стабильности рекомендуется проведение адъювантной химиотерапии аналогами пиримидина в монорежиме в течение 6 мес или по схеме XELOX (расшифровка схем представлена в табл. 3 в течение 3 мес (4 курса).При MSI-H в случае pТ3N0M0 с факторами риска рекомендуется наблюдение. При выявлении 2 и более неблагоприятных факторов прогноза рекомендуется адъювантная химиотерапия по схеме XELOX в течение 3 мес (4 курса), или по схеме FOLFOX в течение 6 мес (12 курсов), или аналогами пиримидина в течение 6 мес [12, 47, 71, 72].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Таблица 3. Режимы применения оксалиплатина** и аналогов пиримидина в лечении колоректального рака.
• При раке ободочной кишки pТ4N0M0 вне зависимости от статуса MSI рекомендуется проведение адъювантной химиотерапии по схеме XELOX в течение 3 мес или по схеме FOLFOX в течение 6 мес с целью снижения риска прогрессирования заболевания [73].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 2).
• Пациентам со стадией pT1-3N1M0 рака ободочной кишки рекомендуется проводить адъювантную химиотерапию по схеме XELOX в течение 3 мес либо по схеме FOLFOX в течение 6 мес с целью снижения риска прогрессирования заболевания [73].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 2).
Комментарии. По результатам объединенного анализа 6 рандомизированных исследований 3-месячная терапия по схеме XELOX (но не FOLFOX) обладает не меньшей эффективностью в отношении 3-летней выживаемости без признаков болезни, чем.
6-месячная [73].
• При раке ободочной кишки рN2 или рT4N1 рекомендуется проведение адъювантной химиотерапии по схеме XELOX или FOLFOX в течение 6 мес с целью снижения риска прогрессирования заболевания [73].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 2).
Комментарии: по опубликованным данным, абсолютные различия 5-летней общей выживаемости после 3- и 6-месячной адъювантной химиотерапии не превышают 1 % [139]. Поэтому даже при неблагоприятном прогнозе после 4 курсов терапии в режиме XELOX при неудовлетворительной ее переносимости возможно обсуждение с пациентом возможности ее прекращения или, что более оптимально, переход на монотерапию аналогами пиримидинами [164]. Оптимальный срок начала адъювантной терапии - в течение 28 дней с момента оперативного лечения в случае отсутствия послеоперационных осложнений. При сроке >2 мес проведение адъювантной химиотерапии малоэффективно. Если адъювантное лечение не было начато в течение.
3-4 мес при отсутствии признаков прогрессирования, пациент остается под динамическим наблюдением. Комбинация оксалиплатина** со струйным введением фторурацила** (режим FLOX) обладает схожей эффективностью, но высокой токсичностью (является вариантом выбора при развитии кардиотоксичности при применении капецитабина** или 46-часовых инфузий фторурацила**) (табл. 3). При развитии в процессе химиотерапии симптомов полинейропатии II степени рекомендуется отмена оксалиплатина** и продолжение монотерапии аналогами пиримидина. В адъювантной терапии колоректального рака не должны применяться иринотекан** и таргетные препараты, в частности бевацизумаб**, цетуксимаб**, панитумумаб**, афлиберцепт**, регорафениб**; нет данных и об эффективности иммунотерапии в адъювантном режиме [74, 75]. Выигрыш от добавления оксалиплатина** к аналогам пиримидиниа у пациентов 70 лет и старше уступает таковому у более молодых пациентов. В связи с этим применение оксалиплатина** в этой возрастной группе решается индивидуально - в зависимости от стадии, сопутствующей патологии и ожидаемой продолжительности жизни [140, 141].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• У пациентов с нерезектабельными метастазами и малосимптомной первичной опухолью рекомендуется не удалять первичную опухоль [142].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. По результатам проспективного рандомизированного исследования, удаление бессимптомной первичной опухоли при нерезектабельных метастазах не улучшает ни выживаемость без прогрессирования, ни общую выживаемость, однако ухудшает переносимость химиотерапии.
• Рекомендуется у отдельных пациентов с малосимптомным процессом (в объективном состоянии, оцениваемом в 0-1 балл по шкале Восточной объединенной онкологической группы (ECOG) (приложение Г4)) при невозможности назначения в терапии 1-й линии иринотекана** или оксалиплатина** назначать в качестве 1-й линии монотерапию аналогами пиримидина с добавлением или без добавления таргетных препаратов в зависимости от мутационного статуса и локализации первичной опухоли (табл. 4). При прогрессировании заболевания рекомендуется рассмотреть возможность добавления к режиму оксалиплатина**, а в 3-й линии - иринотекана** в редуцированных дозах [16, 76-78].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Таблица 4. Режимы применения аналогов пиримидина в лечении колоректального рака.
• Пациентам с удовлетворительным соматическим статусом рекомендуются и другие возможные варианты 1-й линии химиотерапии - применение двойных комбинаций препаратов FOLFOX, XELOX или XELIRI, FOLFIRI, FOLFOXIRI (расшифровка схем представлена в табл. 3-6) на протяжении не менее 3-4 мес с последующей возможной поддерживающей терапией аналогами пиримидина [16, 79].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарии. Терапия оксалиплатином** в монорежиме малоэффективна, он должен применяться в комбинации с аналогами пиримидина. С целью профилактики фебрильной нейтропении при применении режима FOLFOXIRI возможно назначение филграстима** в дозе 5 мкг/кг п/к через 24 часа после завершения химиотерапии до восстановления показателей нейтрофилов, или пэгфилграстима** - 6 мг п/ или эмпэгфилграстима** - 7,5 мг п/к и через 24 часа после окончания химиотерапии 1 раз в 15 дней [201].
• У пациентов с клинически значимыми симптомами заболевания (ECOG 1-2) и обширной диссеминацией рекомендуется использование в 1-й линии двойных комбинаций препаратов (FOLFOX, XELOX или XELIRI, FOLFIRI) на протяжении не менее 3-4 мес с последующей возможной поддерживающей терапией аналогами пиримидина [16, 79].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Если после 1-й линии терапии опухолевый процесс прогрессирует, 2-я линия терапии может быть назначена пациентам с удовлетворительным общим статусом (≤2 балла по шкале ECOG). При резистентности к режиму FOLFOX (XELOX) в качестве 2-й линии обычно назначают режим FOLFIRI/XELIRI или монотерапию иринотеканом**, при резистентности к иринотекану** в 1-й линии в режиме FOLFIRI/XELIRI - FOLFOX/XELOX ( см табл. 3, 5) [80]. В случае химиорезистентной опухоли (если заболевание прогрессирует в ходе терапии или в ближайшее время после окончания терапии с включением иринотекана**, оксалиплатина** и аналогов пиримидина) проведение дальнейшей химиотерапии не показано (может быть рассмотрена возможность проведения таргетной терапии). Если прогрессирование заболевания наблюдается в ходе адъювантной химиотерапии или в течение 12 мес после нее, оптимальным вариантом 1-й линии терапии будет режим с применением иринотекана** (FOLFIRI/XELIRI), который, по данным поданализов рандомизированных исследований, дает лучшие результаты в сравнении с режимом FOLFOX или FOLFOXIRI. При прогрессировании на фоне или после терапии 1-й линии по схеме FOLFOXIRI оптимальным режимом 2-й линии является FOLFIRI. При хорошем соматическом статусе возможно рассмотреть и повторное назначение режима FOLFOXIRI.
• У пациентов с MSI-H в 1-й линии рекомендуется назначить пембролизумаб** в монорежиме или комбинацию ипилимумаба** с ниволумабом** [137, 138].
Уровень убедительности рекомендаций для пембролизумаба. А (уровень достоверности доказательств - 2).
Уровень убедительности рекомендаций для комбинации ниволумаба и ипилимумаба. С (уровень достоверности доказательств - 4).
Комментарии. У пациентов с мутацией в гене KRAS пембролизумаб** в монорежиме был менее эффективен в 1-й линии, чем у пациентов без мутаций; при применении ипилимумаба** с ниволумабом** данной тенденции отмечено не было. Ввиду риска раннего прогрессирования при монотерапии рака толстой кишки анти-PD1-антителами у пациентов с большим объемом опухолевого поражения следует рассмотреть возможность назначения комбинации режима FOLFOX/XELOX с пембролизумабом** или ниволумабом**. Эффективность комбинации FOLFOX/XELOX c анти-PD1-антителами в 1-й линии продемонстрирована в рандомизированных исследованиях III фазы при распространенном раке желудка [204]. При отсутствии прогрессирования возможно прекратить лечение после 1 года терапии анти-PD1-атителами [167].
Таблица 5. Режимы с применением иринотекана**, таргетных препаратов и иммунопрепаратов в лечении колоректального рака.
* Режим характеризуется более высокой, чем FOLFIRI, частотой развития диареи.
Примечание. Возможность проведения химиотерапии в сочетании с таргетной терапией в соответствии с рекомендациями определяется доступностью лекарственных препаратов.
• Ослабленным пациентам с оценкой состояния >2 баллов по шкале ECOG рекомендуется малотоксичная монохимиотерапия аналогами пиримидина с добавлением или без добавления таргетной терапии в зависимости от мутационного статуса и локализации первичной опухоли или симптоматическая терапия; пациентам с MSI-H можно назначить пембролизумаб** или ниволумаб** в монорежиме или комбинацию ипилимумаба** с ниволумабом** [16].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• Рекомендуется к режимам химиотерапии на основе иринотекана**, оксалиплатина**, фторурацила** и капецитабина** при неоперабельном генерализованном раке толстой кишки рассмотреть возможность добавления МКА: бевацизумаба**, цетуксимаба** или панитумумаба**, что увеличивает продолжительность жизни [16, 81, 117].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарии. В режиме монотерапии бевацизумаб** малоэффективен. Рекомендуется продолжение терапии бевацизумабом** с аналогами пиримидина до прогрессирования заболевания. В случае, когда результат мутационного анализа задерживается, возможно начинать химиотерапию, а в дальнейшем, при получении результата, добавлять таргетный препарат со 2-4-го курса. В случае прогрессирования возможно продолжение применения бевацизумаба** со сменой режима. На сегодняшний день неизвестны клинические или молекулярные факторы, предсказывающие эффективность бевацизумаба**. Наибольшую активность бевацизумаб** демонстрирует в 1-й и 2-й линиях терапии; добавление бевацизумаба** к режимам на основе оксалиплатина** или иринотекана** во 2-й линии лечения достоверно увеличивает продолжительность жизни. Во 2-й линии терапии возможно назначение других антиангиогенных МКА - афлиберцепта** или рамуцирумаба** [170], которые применяются только в сочетании с режимом FOLFIRI. При развитии значимой токсичности возможно продолжать терапию афлиберцептом** или рамуцирумабом** или в сочетании с режимом De Gramont или иринотеканом**. В отличие от бевацизумаба* при неоперабельных метастазах цетуксимаб* или панитумумаб** активны как в режиме монотерапии, так и в комбинации с химиотерапией, но лишь у пациентов с отсутствием мутации в генах RAS и вRAF и при локализации первичной опухоли в левых отделах толстой кишки. Цетуксимаб** и панитумумаб** не должны применяться с капецитабином*, режимами FLOX, XELOX. Самостоятельная активность цетуксимаба* и панитумумаба** позволяет рекомендовать их применение в режиме монотерапии в качестве 3-4-й линии. На поздних линиях возможно применение панитумумаба** или цетуксимаба** и в случае правосторонней локализации первичной опухоли при отсутствии мутаций в генах RAS и вRAF. Совместное применение бевацизумаба** и цетуксимаба** или панитумумаба** ухудшает результаты лечения и не рекомендуется.
Цели паллиативной химиотерапии - увеличение продолжительности жизни, уменьшение выраженности симптомов болезни и улучшение качества жизни. Пациенты, получившие все 3 активных химиопрепарата (иринотекан**, оксалиплатин** и аналоги пиримидина), имеют достоверно бóльшую продолжительность жизни. При этом неважно, за сколько линий терапии это удается реализовать. До сих пор неясна оптимальная продолжительность 1-й линии терапии. Возможные варианты:
1) непрерывная терапия до прогрессирования заболевания или развития неприемлемых токсических явлений;
2) проведение лечения на протяжении не менее чем 6 мес с последующим наблюдением;
3) применение двойной комбинации в течение не менее чем 3-4 мес с последующей поддержкой аналогами пиримидина (стратегия поддерживающей терапии имеет преимущества перед полным прекращением лечения). В случае применения комбинации химиотерапии с бевацизумабом** поддерживающая терапия бевацизумабом** и аналогами пиримидина должна проводиться до появления признаков прогрессирования болезни или развития неприемлемых токсических явлений. При использовании комбинации химиотерапии с цетуксимабом** или панитумумабом** также рекомендуется поддерживающая терапия комбинацией инфузий кальция фолината**, фторурацила** и цетуксимаба** или панитумумаба** или монотерапия МКА до прогрессирования заболевания [26].
На выживаемость пациентов влияет и последовательность назначения таргетной терапии. Так, если в 1-й линии терапии был назначен бевацизумаб**, то во 2-й линии оптимально продолжать антиангиогенную терапию даже при отсутствии мутаций в генах RAS и вRAF, что дает преимущество в отношении выживаемости в сравнении с таковой у пациентов, которым во 2-й линии назначали цетуксимаб** или панитумумаб** [151, 152]. Если в 1-й линии был назначен цетуксимаб или панитумумаб, во 2-й линии оптимально использовать схемы с включением бевацизумаба**, или афлиберцепта**, или рамуцирумаба**. Продолжение применения цетуксимаба** или панитумумаба** при прогрессировании не улучшает показатели выживаемости пациентов даже при отсутствии мутаций в генах RAS и вRAF [153].
• У пациентов с прогрессированием заболевания при применении оксалиплатина*, иринотекана * и аналогов пиримидина, бевацизумаба** и цетуксимаба** или панитумумаба** (для последний двух препаратов - при отсутствии мутаций в генах RAS и вRAF) рекомендовано назначение регорафениба** [214].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарии. Исследования показали, что возможно проводить терапию регорафенибом** в режиме 80 мг в сутки внутрь в 1-ю неделю, 120 мг в сутки внутрь во 2-ю неделю, 160 мг в сутки внутрь в 3-ю неделю, затем 1 нед перерыва. Эскалация дозы возможна только при удовлетворительной переносимости препарата.
Во 2-й и последующих линиях терапии при наличии в опухоли MSI-H рекомендована, если ранее не проводилась, монотерапия ниволумабом** или пембролизумабом** в монорежиме или комбинацией ниволумаба** и ипилимумаба**. Последний вариант характеризуется большей частотой получения объективного ответа, однако данные о сравнении отдаленных параметров выживаемости в научной литературе не представлены [82-84]. При отсутствии прогрессирования возможно прекратить лечение после 1 года терапии анти-PD1-атителами [167].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
• В 3-й и последующих линиях терапии при гиперэкспрессии или амплификации гена Her-2/neu и отсутствии мутаций в генах RAS и вRAF рекомендовано назначение комбинаций трастузумаба** и лапатиниба** или трастузумаба** и пертузумаба** (табл. 5) [132, 133].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• В 3-й и последующих линиях терапии рекомендовано повторное назначение режимов химиотерапии с добавлением или без добавления таргетной терапии, которые были эффективны в ранее проведенных линиях лечения [154, 215].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
• Рекомендуется при мутациях в гене вRAF в качестве 1-й линии при удовлетворительном состоянии пациента и при отсутствии противопоказаний назначать режим FOLFOXIRI или FOLFOX в комбинации с применением МКА бевацизумаба** [58, 155].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарии. Применение режима FOLFOXIRI с бевацизумабом определяет большую частоту объективных эффектов, но не увеличивает выживаемость без прогрессирования и общую выживаемость в сравнении с двойными комбинациями с бевацизумабом. При прогрессировании заболевания в ходе 1-й линии терапии при мутации в гене вRAF возможно назначение режима FOLFIRI с использованием афлиберцепта*/бевацизумаба*/рамуцирумаба** [85] или комбинации цетуксимаба** или панитумумаба** с вемурафенибом*/дабрафенибом* и траметинибом** [86, 87] (табл. 6). В случае невозможности назначения химиотерапии в первой линии терапии при мутации в гене вRAF возможно рассмотреть терапию комбинацией цетуксимаба** или панитумумаба** с вемурафенибом*/дабрафенибом*, с траметинибом** или без него. При сочетании мутации в гене вRAF и MSI-H предпочтение отдается иммунотерапии - комбинации ипилимумаба** с ниволумабом** или пембролизумабу**/ниволумабу** в монорежиме.
• Длительные (свыше 6 часов) инфузии фторурацила** рекомендовано проводить через центральный венозный доступ с использованием инфузоматов [88].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Таблица 6. Режимы применения препаратов во 2-й и последующих линиях терапии колоректального рака с мутацией в гене вRAF.
Примечание. Возможность проведения химиотерапии в сочетании с таргетной терапией в соответствии с рекомендациями определяется доступностью лекарственных препаратов.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• При опухолевом стенозе рекомендуется эндоскопическое стентирование зоны опухолевого стеноза или оперативное лечение [89, 90].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Для лечения хронического болевого синдрома рекомендуется проведение дистанционной лучевой терапии, медикаментозной терапии, локорегионарной анестезии в зависимости от причины болевого синдрома [89].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• При лечении асцита рекомендуется рассмотреть возможность применения лапароцентеза [91].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Целями так называемой «наилучшей поддерживающей терапии» (best supportive care) являются профилактика и облегчение симптомов заболевания и поддержание качества жизни пациентов и их близких независимо от стадии заболевания и потребности в других видах терапии. В случае рака ободочной кишки меры, направленные на облегчение основных симптомов, способствуют увеличению продолжительности жизни.
Принципы лечения и профилактики тошноты и рвоты у пациентов с раком ободочной кишки соответствуют принципам, изложенным в «Практических рекомендациях по профилактике и лечению тошноты и рвоты у онкологических больных» [184].
Принципы лечения и профилактики костных осложнений у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях» [185].
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по диагностике и лечению фебрильной нейтропении» [186].
Принципы профилактики и лечения гепатотоксичности у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Клинические рекомендации по коррекции гепатотоксичности, индуцированной противоопухолевой терапией» [187].
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» [188].
Принципы профилактики и лечения кожных осложнений у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» [189].
Принципы нутритивной поддержки пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по нутритивной поддержке онкологических больных» [190].
Принципы профилактики и лечения нефротоксичности у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов» [191].
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных» [192].
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Рекомендации по лечению последствий экстравазации противоопухолевых препаратов» [193].
Принципы профилактики и лечения иммуноопосредованных нежелательных явлений у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями» [194].
Принципы профилактики и лечения анемии у пациентов с раком ободочной кишки соответствуют принципам, изложенным в клинических рекомендациях «Анемия при злокачественных новообразованиях», размещенных в рубрикаторе клинических рекомендаций Минздрава России [195].
• Рекомендуется рассматривать хирургическое вмешательство как основной метод радикального лечения больных раком ободочной кишки или ректосигмоидного отдела толстой кишки [16].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. По показаниям дополнительно проводится адъювантная/неоадъювантная химиотерапия.
• При раннем раке ободочной кишки 0-I стадии (Tis-T1sm1N0M0) рекомендуется рассмотреть возможность применения высокоэффективных органосохраняющих и функционально-щадящих способов лечения (эндоскопическая резекция слизистой оболочки с диссекцией в подслизистом слое) [43, 44].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. При определении тактики лечения следует учитывать прогностические факторы. Предпочтение следует отдавать методике эндоскопической подслизистой диссекции [42]. При выявлении после эндоскопического удаления факторов неблагоприятного прогноза выполняют резекцию соответствующего участка ободочной кишки.
Факторы неблагоприятного прогноза:
O стадия ≥G3,.
O поражение краев резекции,.
O лимфатическая, сосудистая или периневральная инвазия,.
O IV уровень инвазии (вовлечение подслизистой оболочки толстой кишки), >pT1sm1.
Эндоскопическая резекция слизистой оболочки допускается при инвазивных формах рака ободочной кишки (уровни I-III по классификации Haggitt) при отсутствии факторов неблагоприятного прогноза. Выявление по данным патолого-анатомического исследования биопсийного материала низкой степени дифференцировки опухоли и/или определение при эндоскопическом исследовании уровня IV по классификации Haggitt и/или глубины инвазии >uT1sm1 (при эндоскопическом УЗИ) является абсолютным противопоказанием к выполнению эндоскопической резекции слизистой оболочки (требуется удаление сегмента кишки). Наличие инвазивного рака в полипах на широком основании (≥T1sm1) приравнивается к уровню IV по классификации Haggitt и требует резекции соответствующего участка ободочной кишки. Остальные факторы неблагоприятного прогноза (поражение краев резекции, лимфатическая, сосудистая, периневральная инвазия) определяются после эндоскопической резекции. При их выявлении осуществляют дополнительную резекцию соответствующего сегмента кишки. Адъювантная терапия не проводится [45].
• При резектабельном локализованном и местно-распространенном раке ободочной кишки I-III стадий (Т1sm2-4N0-2M0) рекомендуется при отсутствии абсолютных противопоказаний на 1-м этапе проводить хирургическое лечение; объем операции определяется локализацией и местным распространением опухоли [46].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. При резектабельном местно-распространенном раке ободочной кишки III стадии (T1-4N1-2M0) левосторонней локализации и отсутствии MSI следует рассмотреть возможность проведения в течение 6-12 недель химиотерапии по схеме FOLFOX или XELOX при отсутствии абсолютных противопоказаний и невозможности проведения на 1-м этапе хирургического лечения [136].
• При резектабельном локализованном и местно-распространенном раке ободочной кишки II-III стадий (Т1-4N1-2M0, T4N0-2M0) рекомендуется проводить адъювантную химиотерапию при выявлении поражения регионарных лимфатических узлов, прорастании опухоли сквозь серозную оболочку (pT4a), врастании в соседние органы (pT4b) и наличии факторов риска ( см пункт 3,2 «Адъювантная химиотерапия») [47].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
• При нерезектабельном раке ободочной кишки (сТ4N0-2M0) рекомендуется направлять пациентов в крупные медицинские организации, в которых имеется опыт лечения данной группы пациентов, для повторной оценки возможности удаления опухоли [48].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. При невозможности проведения хирургического лечения в объеме R0-1 операции возможны только при высоком риске развития кишечной непроходимости и ограничиваются формированием обходных анастомозов/колостомы/илеостомы. В дальнейшем пациентам показана паллиативная химиотерапия.
• При генерализованном раке ободочной кишки с резектабельными/потенциально резектабельными синхронными метастазами в печени или легких (М1а) рекомендуется при исходной возможности выполнения R0-резекции метастазов рака ободочной кишки в печени или легких, а также при переходе метастатического поражения этих органов в резектабельное состояние в процессе химиотерапевтического лечения проводить резекцию указанных органов с метастазами в объеме R0 [16, 49-51, 125].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
• Рекомендуется тактику лечения всех пациентов с изолированным метастатическим поражением печени/легких на долечебном этапе обсуждать совместно с торакальными хирургами или абдоминальными хирургами, или хирургами, специализирующимися на хирургии печени, с целью корректной и своевременной оценки резектабельности метастатических очагов [16, 52, 53].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Тактика лечения зависит от исходной резектабельности метастатических очагов. Наилучших результатов можно добиться при достижении края резекции ≥1 мм [49-52]. Операцию в объеме R0 необходимо выполнять, как только метастазы станут резектабельными. Пролонгация химиотерапии может приводить к повышению частоты токсических поражений печени, а также к «исчезновению» части метастазов, что затруднит их идентификацию хирургом во время резекции. При наличии симптомной первичной опухоли (при угрозе кишечной непроходимости или кровотечения) на 1-м этапе проводится хирургическое удаление первичной опухоли с лимфодиссекцией. Радиочастотная абляция метастазов в печени или стереотаксическое лучевое воздействие может стать как дополнением к резекции печени для достижения радикальности вмешательства, так и самостоятельным методом лечения при невозможности хирургического удаления [54]. Внутриартериальная химиотерапия остается экспериментальным методом и не рекомендована к рутинному применению в 1-й линии терапии.
• При исходно резектабельных метастатических очагах рекомендуется их хирургическое удаление, при этом в случае функциональной переносимости предпочтение отдается одномоментным хирургическим вмешательствам [16, 49-52].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
• При исходно резектабельных метастатических очагах после успешного проведения резекции в объеме R0 или R1 рекомендуется проведение адъювантной химиотерапии (6 мес лечения по схеме FOLFOX, XELOX, применение аналогов пиримидинов в монорежиме) [54, 55].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Альтернативой немедленному хирургическому лечению является проведение периоперационной системной химиотерапии (FOLFOX, XELOX). Данный вариант стратегии следует выбрать при высоком риске прогрессирования заболевания (например, при высоком риске по классификации Fong или любой другой). После 8-12 недель терапии выполняется одновременное или последовательное удаление метастазов и первичной опухоли, а после операции продолжается проводимая ранее химиотерапия до достижения суммарной продолжительности 6 мес. Добавление моноклональных антител (МКА) к химиотерапии при резектабельных метастазах в печени не показано, так как оно может ухудшить отдаленные результаты [51, 53].
• При потенциально резектабельных метастатических очагах рекомендуется проведение максимально активной химиотерапии, цель которой - достижение объективного эффекта и переход нерезектабельных метастазов в резектабельные (FOLFOX, XELOX или FOLFIRI, XELIRI, FOLFOXIRI) [16, 42,54, 57, 58, 111-113].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарии. Оптимальной опцией для повышения резектабельности является применение «тройной» комбинации FOLFOXIRI [57, 58]. После 4-6 циклов следует повторно оценить резектабельность, при отсутствии прогрессирования осуществляют одновременное или последовательное удаление метастазов и первичной опухоли. Далее проводится адъювантная химиотерапия по программе FOLFOX или XELOX до достижения суммарной продолжительности 6 мес (с учетом предоперационной химиотерапии). В случае прогрессирования метастатических очагов или невозможности их удаления лечение проводят в соответствии с принципами, которые указаны в пункте, описывающем лечение пациентов с нерезектабельными метастазами [16].
• При потенциально резектабельных метастатических очагах в случае отсутствия мутации RAS и вRAF и отсутствия MSI рекомендуется рассмотреть возможность добавления к химиотерапии (режимы FOLFIRI, FOLFOX, FOLFOXIRI) цетуксимаба** или панитумумаба** независимо от локализации первичной опухоли [16, 39-42, 57].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• При потенциально резектабельных метастатических очагах в случае наличия мутации RAS рекомендовано рассмотреть возможность добавления бевацизумаба** к любому из указанных выше режимов химиотерапии независимо от локализации первичной опухоли [16, 39, 42, 59].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• При потенциально резектабельных метастатических очагах при наличии мутации вRAF и отсутствии MSI рекомендовано добавление бевацизумаба*** к режимам химиотерапии FOLFOX, XELOX или FOLFOXIRI [16, 57, 58].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарии. В случае назначения таргетных препаратов после перехода метастазов в резектабельное состояние и выполнения R0-резекции метастатических очагов проводится химиотерапия до достижения суммарной продолжительности 6 мес. Цетуксимаб**, панитумумаб**, бевацизумаб** и иринотекан** следует в послеоперационном периоде отменить. При резекции в объеме R1-R2 возможно продолжение терапии предоперационной комбинацией химиопрепаратов и МКА до достижения суммарной продолжительности 6 мес с последующим переходом на поддерживающую терапию.
• При потенциально резектабельных метастазах при MSI-H рекомендовано назначение в 1-й линии комбинации ниволумаба** и ипилимумаба** или, при отсутствии мутаций в генах RAS, пембролизумаба** в монорежиме до прогрессирования или перехода опухоли в резектабельное состояние. Оптимальная продолжительность иммунотерапии после выполнения R0-резекции точно не определена, но при удовлетворительной переносимости рекомендуется продолжать до 1 года с учетом предоперационного этапа [137, 138].
Уровень убедительности рекомендаций для пембролизумаба. A (уровень достоверности доказательств - 2).
Уровень убедительности рекомендаций для комбинации ниволумаба и ипилимумаба. С (уровень достоверности доказательств - 4).
• При генерализованном раке ободочной кишки с незеректабельными синхронными метастазами рекомендуется применение комбинаций химиопрепаратов (FOLFOX, XELOX, XELIRI, FOLFIRI, FOLFOXIRI) с добавлением или без добавления таргетных препаратов (цетуксимаб**, панитумумаб**, бевацизумаб**) [16] или, при MSI-H, монотерапии анти-PD1-антителами - ниволумабом** или пембролизумабом** - в монорежиме, или комбинацией ниволумаба** и ипилимумаба** [137, 138].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Цетуксимаб** или панитумумаб** применяются при отсутствии мутации RAS, вRAF и отсутствии MSI-H, а также при локализации первичной опухоли в левых отделах толстой кишки (границей которых считают селезеночный изгиб ободочной кишки), бевацизумаб** - вне зависимости от статуса RAS и вRAF и локализации первичной опухоли [16, 40, 42]. Цетуксимаб** и панитумумаб** не должны применяться в комбинации с капецитабином** (монотерапия капецитабином**, режимы XELOX и XELIRI) или аналогами пиримидинов в струйных режимах (режим Мейо, FLOX). Цель лечения - максимально длительный контроль заболевания при сохранении удовлетворительного качества жизни; у ряда пациентов возможно добиться перехода нерезектабельных метастазов в резектабельные. В процессе химиотерапии каждые 1,5-2,5 мес проводится повторная оценка резектабельности.
Различные методы эмболизации печеночной артерии, внутриартериальная химиотерапия могут применяться у отдельных пациентов с изолированным или преобладающим метастатическим поражением печени при исчерпании возможностей системной терапии. Вопрос об удалении первичной опухоли решается индивидуально с учетом риска развития связанных с ней осложнений. Пациенты, у которых ответ на лечение недостаточен для перехода метастазов в резектабельное состояние, подлежат паллиативному лекарственному лечению ( см раздел 3,3).
• В случае метахронных резектабельных или потенциально резектабельных метастазов рака ободочной кишки в печени или легких рекомендуется проводить операцию с адъювантной химиотерапией в течение 6 мес (FOLFOX или XELOX) или периоперационную химиотерапию в режимах FOLFOX или XELOX (в течение 3 мес до операции и 3 мес после нее), если ранее адъювантная химиотерапия не проводилась или с момента ее окончания прошло более 12 мес. В остальном лечение проводят в соответствии с принципами, описанными выше [16, 55, 56].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• При функционально-неоперабельном раке ободочной кишки (на фоне тяжелой сопутствующей патологии) рекомендуется проведение паллиативного противоопухолевого лекарственного лечения либо симптоматической терапии ( см раздел 3,3). Возможно стентирование опухоли или формирование разгрузочной кишечной стомы [60, 114, 115].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 2).
Комментарии. Данная ситуация может рассматриваться, когда риск, связанный с проведением операции, превышает риск, связанный с прогрессированием онкологического заболевания. Решение о наличии противопоказаний к хирургическому лечению может приниматься только на консилиуме с участием хирурга, терапевта, анестезиолога, реаниматолога.
• При рецидиве рака ободочной кишки рекомендовано рассмотреть возможность повторного хирургического лечения [61, 62]; при невозможности проведения повторного хирургического лечения рекомендована системная химиотерапия ( см раздел 3,3).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. В сложных клинических случаях лечебную тактику определяют на мультидисциплинарном консилиуме с участием проктолога, абдоминального хирурга, радиотерапевта и онколога на основании результатов дооперационного обследования с определением клинической стадии заболевания.
3,1 Хирургическое лечение.
• Эндоскопическое лечение раннего рака ободочной кишки рекомендуется при:O тубулярно-ворсинчатых аденомах с дисплазией эпителия тяжелой степени;
O аденокарциномах с инвазией в пределах слизистого и подслизистого слоев по данным эндоскопического УЗИ;
O аденокарциномах с умеренной или высокой степенью дифференцировки [16, 29].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. Противопоказания:
O низкодифференцированная или слизистая аденокарцинома;
O лимфоваскулярная инвазия;
O стадия >uT1sm1.
Возможные варианты:
O эндоскопическая полипэктомия;
O эндоскопическая подслизистая резекция.
Наиболее частые осложнения. Болевой синдром, кровотечение, перфорация.
Следует учитывать, что при последующем патолого-анатомическом исследовании материала эндоскопически резецированного раннего рака ободочной кишки будут выявлены пациенты, которым потребуется резекция соответствующего участка толстой кишки, например пациенты со стадией >pT1sm1 или поражением краев резекции.
• Не рекомендуется рутинная механическая подготовка кишечника [63].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Установлено, что механическая подготовка кишечника не влияла на частоту осложнений, однако она может выполняться по усмотрению оперирующего хирурга [63].
• Рекомендуется при технической доступности и наличии хирургической бригады соответствующей квалификации проводить хирургическое лечение рака ободочной кишки с использованием лапароскопического доступа [29, 64-67, 116].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Лапароскопические резекции ободочной кишки имеют ряд преимуществ - ранняя реабилитация пациентов, снижение частоты развития спаечного процесса и его выраженности, меньшая потребность в использовании опиоидных анальгетиков, сокращение сроков госпитализации, меньший риск развития послеоперационных грыж [64-67]. Диссекция должна осуществляться вдоль эмбриональных (фасциальных) слоев со стремлением к обеспечению целостности фасции мезоколона. Возможно использование роботического хирургического доступа, однако его преимущества перед лапароскопическим не доказаны.
• Рекомендуется при локализации опухоли в слепой, восходящей ободочной кишке, печеночном изгибе ободочной кишки, проксимальной трети поперечной ободочной кишки выполнять правостороннюю гемиколэктомию или расширенную правостороннюю гемиколэктомию с обязательным лигированием у основания a. ileocolica, a. colica dextra, а также a. colica media у основания либо правой ветви a. colica media [64-67].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется при локализации опухоли в средней трети поперечной ободочной кишки решение об объеме хирургического вмешательства принимать индивидуально, с учетом возраста, сопутствующих заболеваний, размеров и распространенности опухоли. Допустима резекция поперечной ободочной кишки, расширенная право- или левосторонняя гемиколэктомия (в зависимости от более точной локализации опухоли), однако предпочтительный объем - субтотальная колэктомия [62-65].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• Рекомендуется при локализации опухоли в дистальной трети поперечной ободочной кишки, селезеночном изгибе ободочной кишки, нисходящей ободочной кишке, проксимальной трети сигмовидной кишки выполнять левостороннюю гемиколэктомию или расширенную левостороннюю гемиколэктомию с лигированием a. colica sinistra у места отхождения, а также левой ветви a. colica media либо самой a. colica media у места отхождения [64-67].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется при локализации опухоли в средней трети сигмовидной кишки выполнять резекцию сигмовидной кишки или операцию типа Гартмана (при наличии противопоказаний к формированию первичного анастомоза) с лигированием нижней брыжеечной артерии [64-67].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется при локализации опухоли в дистальной трети сигмовидной кишки выполнять резекцию сигмовидной кишки с чрезбрюшной резекцией прямой кишки или операцию типа Гартмана с лигированием нижней брыжеечной артерии у основания либо непосредственно дистальнее уровня отхождения левой ободочной артерии [64-67].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется соблюдение края резекции ≥10 см от опухоли при операциях по поводу рака ободочной кишки, ≥5 см - при операциях по поводу рака дистальной трети сигмовидной кишки и ректосигмоидного отдела толстой кишки [64-67].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Необходимо учитывать тот факт, что объем оперативного вмешательства не должен различаться при экстренном и плановом хирургическом лечении рака ободочной кишки, поэтому объем оперативного вмешательства по экстренным показаниям определяется индивидуально. Если соблюдение онкологических принципов вмешательства невозможно (вследствие отсутствия технической возможности, квалификации, наличия изменений органов брюшной полости на фоне острой хирургической патологии), а также если из-за тяжести состояния пациента высок риск выполнения расширенной операции, рекомендуется проводить симптоматическую операцию (формирование кишечной стомы или обходного анастомоза) с последующим направлением пациента на плановое хирургическое лечение в специализированную клинику. При локализации опухоли в слепой, восходящей ободочной кишке, печеночном изгибе ободочной кишки, проксимальной трети поперечной ободочной кишки допустимо формирование первичного анастомоза [68, 69].
• При проведении экстренного хирургического лечения по поводу рака левых отделов толстой кишки рекомендуется выполнение операций Микулича, типа Гартмана. Допустимо формирование первичного анастомоза после декомпрессии кишки [70].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
3,2 Адъювантная химиотерапия.
• Рекомендуется выявлять факторы риска прогрессирования у пациентов со II стадией заболевания с целью определения прогноза и выбора адъювантного лечения [47].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендовано назначать адъювантную химиотерапию пациентам с раком pT4N0 или рТ1-4N+, а также она может быть рекомендована пациентам с раком ободочной кишки pТ3N0M0 и факторами неблагоприятного прогноза (низкой степенью дифференцировки, лимфоваскулярной/периневральной инвазией, при проведении операции в условиях кишечной непроходимости/перфорации/перитонита, при операции с неадекватным объемом лимфодиссекции (если изучено <12 лимфатических узлов), tumor-budding (BD3), уровне РЭА >2,5 нг/мл после операции) [47].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Необходимо исследование биопсийного (операционного) материала на наличие микросателлитных повторов ДНК методом ПЦР (MSI) или иммуногистохимическое исследование на наличие дефицита белков системы репарации неспаренных оснований при II стадии болезни с целью определения показаний к адъювантной химиотерапии [47, 71, 72].
• При раке ободочной кишки pТ3N0M0 с единственным фактором неблагоприятного прогноза при неизвестном статусе MSI или при микросателлитной стабильности рекомендуется проведение адъювантной химиотерапии аналогами пиримидина в монорежиме в течение 6 мес или по схеме XELOX (расшифровка схем представлена в табл. 3 в течение 3 мес (4 курса).При MSI-H в случае pТ3N0M0 с факторами риска рекомендуется наблюдение. При выявлении 2 и более неблагоприятных факторов прогноза рекомендуется адъювантная химиотерапия по схеме XELOX в течение 3 мес (4 курса), или по схеме FOLFOX в течение 6 мес (12 курсов), или аналогами пиримидина в течение 6 мес [12, 47, 71, 72].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Таблица 3. Режимы применения оксалиплатина** и аналогов пиримидина в лечении колоректального рака.
| Модифицированный FOLFOX 6 | Оксалиплатин** в дозе 85 мг/м2 в виде 2-часовой инфузии в 1-й день, кальция фолинат** в дозе 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением фторурацила** в дозе 400 мг/м2 в/в струйно и 46-часовой инфузией фторурацила** в дозе 2400 мг/м2 (по 1200 мг/м2 в сутки). Начало очередного курса - на 15-й день [159] |
| XELOX | Оксалиплатин** в дозе 130 мг/м2 в 1-й день, капецитабин** в дозе 2000 мг/м2 в сутки в 1-14-й или 1-15-й дни (в зависимости от времени начала терапии: если введение начинается в первой половине 1-го дня цикла, то длительность - 14 дней). Начало очередного курса - на 22-й день [126, 160] |
| FLOX | Оксалиплатин** в дозе 85 мг/м2 в течение 2 ч (1, 15 и 29-й дни каждого цикла) + кальция фолинат** в дозе 20 мг/м2 в/в струйно с последующим болюсным введением фторурацила** в дозе 500 мг/м2 еженедельно в течение 6 нед с последующим 2-недельным перерывом [161] |
| FLOX (Nordic) | Оксалиплатин** в дозе 85 мг/м2 в/в в течение 2 ч 1 день + кальция фолинат** в дозе 60 мг/м2 в/в струйно с последующим болюсным введением фторурацила** в дозе 500 мг/м2 в 1 и 2-й дни. Начало очередного курса - на 15-й день [162, 163] |
• При раке ободочной кишки pТ4N0M0 вне зависимости от статуса MSI рекомендуется проведение адъювантной химиотерапии по схеме XELOX в течение 3 мес или по схеме FOLFOX в течение 6 мес с целью снижения риска прогрессирования заболевания [73].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 2).
• Пациентам со стадией pT1-3N1M0 рака ободочной кишки рекомендуется проводить адъювантную химиотерапию по схеме XELOX в течение 3 мес либо по схеме FOLFOX в течение 6 мес с целью снижения риска прогрессирования заболевания [73].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 2).
Комментарии. По результатам объединенного анализа 6 рандомизированных исследований 3-месячная терапия по схеме XELOX (но не FOLFOX) обладает не меньшей эффективностью в отношении 3-летней выживаемости без признаков болезни, чем.
6-месячная [73].
• При раке ободочной кишки рN2 или рT4N1 рекомендуется проведение адъювантной химиотерапии по схеме XELOX или FOLFOX в течение 6 мес с целью снижения риска прогрессирования заболевания [73].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 2).
Комментарии: по опубликованным данным, абсолютные различия 5-летней общей выживаемости после 3- и 6-месячной адъювантной химиотерапии не превышают 1 % [139]. Поэтому даже при неблагоприятном прогнозе после 4 курсов терапии в режиме XELOX при неудовлетворительной ее переносимости возможно обсуждение с пациентом возможности ее прекращения или, что более оптимально, переход на монотерапию аналогами пиримидинами [164]. Оптимальный срок начала адъювантной терапии - в течение 28 дней с момента оперативного лечения в случае отсутствия послеоперационных осложнений. При сроке >2 мес проведение адъювантной химиотерапии малоэффективно. Если адъювантное лечение не было начато в течение.
3-4 мес при отсутствии признаков прогрессирования, пациент остается под динамическим наблюдением. Комбинация оксалиплатина** со струйным введением фторурацила** (режим FLOX) обладает схожей эффективностью, но высокой токсичностью (является вариантом выбора при развитии кардиотоксичности при применении капецитабина** или 46-часовых инфузий фторурацила**) (табл. 3). При развитии в процессе химиотерапии симптомов полинейропатии II степени рекомендуется отмена оксалиплатина** и продолжение монотерапии аналогами пиримидина. В адъювантной терапии колоректального рака не должны применяться иринотекан** и таргетные препараты, в частности бевацизумаб**, цетуксимаб**, панитумумаб**, афлиберцепт**, регорафениб**; нет данных и об эффективности иммунотерапии в адъювантном режиме [74, 75]. Выигрыш от добавления оксалиплатина** к аналогам пиримидиниа у пациентов 70 лет и старше уступает таковому у более молодых пациентов. В связи с этим применение оксалиплатина** в этой возрастной группе решается индивидуально - в зависимости от стадии, сопутствующей патологии и ожидаемой продолжительности жизни [140, 141].
3,3 Паллиативная химиотерапия.
• Пациентам со злокачественными опухолями толстой кишки рекомендуется проведение противоопухолевой лекарственной терапии в соответствии с общими принципами, изложенными в «Практических рекомендациях по общим вопросам проведения противоопухолевой лекарственной терапии» Российского общества клинической онкологии [165].Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• У пациентов с нерезектабельными метастазами и малосимптомной первичной опухолью рекомендуется не удалять первичную опухоль [142].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. По результатам проспективного рандомизированного исследования, удаление бессимптомной первичной опухоли при нерезектабельных метастазах не улучшает ни выживаемость без прогрессирования, ни общую выживаемость, однако ухудшает переносимость химиотерапии.
• Рекомендуется у отдельных пациентов с малосимптомным процессом (в объективном состоянии, оцениваемом в 0-1 балл по шкале Восточной объединенной онкологической группы (ECOG) (приложение Г4)) при невозможности назначения в терапии 1-й линии иринотекана** или оксалиплатина** назначать в качестве 1-й линии монотерапию аналогами пиримидина с добавлением или без добавления таргетных препаратов в зависимости от мутационного статуса и локализации первичной опухоли (табл. 4). При прогрессировании заболевания рекомендуется рассмотреть возможность добавления к режиму оксалиплатина**, а в 3-й линии - иринотекана** в редуцированных дозах [16, 76-78].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Таблица 4. Режимы применения аналогов пиримидина в лечении колоректального рака.
| Модифицированный LV5FU2 (модифицированный режим De Gramont) | Кальция фолинат** в дозе 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением фторурацила** в дозе 400 мг/м2 и последующей 46-часовой инфузией фторурацила** в дозе 2400 мг/м2 (по 1200 мг/м2 в сутки). Начало очередного курса - на 15-й день [143] |
| Модифицированный LV5FU2 (модифицированный режим De Gramont) + цетуксимаб** | Кальция фолинат** в дозе 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением фторурацила** в дозе 400 мг/м2 и последующей 46-часовой инфузией фторурацила** в дозе 2400 мг/м2 (по 1200 мг/м2 в сутки). Цетуксимаб** в дозе 400 мг/м2 в виде 1-часовой инфузии в 1-й день, далее по 250 мг/м2 еженедельно или в режиме 500 мг/м2 в/в капельно 1 раз в 2 нед [144, 166]. Начало очередного курса - на 15-й день |
| Модифицированный LV5FU2 (модифицированный режим De Gramont) + панитумумаб** | Кальция фолинат** в дозе 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением фторурацила** в дозе 400 мг/м2 и последующей 46-часовой инфузией фторурацила** в дозе 2400 мг/м2 (по 1200 мг/м2 в сутки). Панитумумаб** в дозе 6 мг/кг в виде 1-часовой инфузии в 1-й день. Начало очередного курса - на 15-й день [145, 208] |
| Модифицированный LV5FU2 (модифицированный режим De Gramont) + бевацизумаб** | Кальция фолинат** в дозе 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением фторурацила** в дозе 400 мг/м2 и последующей 46-часовой инфузией фторурацила** в дозе 2400 мг/м2 (по 1200 мг/м2 в сутки). Бевацизумаб** в дозе 5 мг/кг в/в капельно в 1-й день. Начало очередного курса - на 15-й день [146, 209] |
| Модифицированный LV5FU2 (модифицированный режим De Gramont) + рамуцирумаб** | Кальция фолинат** в дозе 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением фторурацила** в дозе 400 мг/м2 и последующей 46-часовой инфузией фторурацила** в дозе 2400 мг/м2 (по 1200 мг/м2 в сутки). Рамуцирумаб** в дозе 8 мг/кг в/в капельно в 1-й день. Начало очередного курса - на 15-й день [147, 170] |
| Модифицированный LV5FU2 (модифицированный режим De Gramont) + афлиберцепт | Кальция фолинат** в дозе 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением фторурацила** в дозе 400 мг/м2 и последующей 46-часовой инфузией фторурацила** в дозе 2400 мг/м2 (по 1200 мг/м2 в сутки). Афлиберцепт** в дозе 4 мг/кг в/в капельно в 1-й день. Начало очередного курса - на 15-й день [147, 148] |
| Капецитабин** | 2000-2500 мг/м2 в сутки внутрь в 1-14-й дни. Начало очередного курса - на 22-й день [149, 172] |
| Капецитабин** + бевацизумаб** | 2000-2500 мг/м2 в сутки внутрь в 1-14-й дни. Бевацизумаб** в дозе 7,5 мг/кг в/в капельно в 1-й день. Начало очередного курса - на 22-й день [171, 173] |
• Пациентам с удовлетворительным соматическим статусом рекомендуются и другие возможные варианты 1-й линии химиотерапии - применение двойных комбинаций препаратов FOLFOX, XELOX или XELIRI, FOLFIRI, FOLFOXIRI (расшифровка схем представлена в табл. 3-6) на протяжении не менее 3-4 мес с последующей возможной поддерживающей терапией аналогами пиримидина [16, 79].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарии. Терапия оксалиплатином** в монорежиме малоэффективна, он должен применяться в комбинации с аналогами пиримидина. С целью профилактики фебрильной нейтропении при применении режима FOLFOXIRI возможно назначение филграстима** в дозе 5 мкг/кг п/к через 24 часа после завершения химиотерапии до восстановления показателей нейтрофилов, или пэгфилграстима** - 6 мг п/ или эмпэгфилграстима** - 7,5 мг п/к и через 24 часа после окончания химиотерапии 1 раз в 15 дней [201].
• У пациентов с клинически значимыми симптомами заболевания (ECOG 1-2) и обширной диссеминацией рекомендуется использование в 1-й линии двойных комбинаций препаратов (FOLFOX, XELOX или XELIRI, FOLFIRI) на протяжении не менее 3-4 мес с последующей возможной поддерживающей терапией аналогами пиримидина [16, 79].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Если после 1-й линии терапии опухолевый процесс прогрессирует, 2-я линия терапии может быть назначена пациентам с удовлетворительным общим статусом (≤2 балла по шкале ECOG). При резистентности к режиму FOLFOX (XELOX) в качестве 2-й линии обычно назначают режим FOLFIRI/XELIRI или монотерапию иринотеканом**, при резистентности к иринотекану** в 1-й линии в режиме FOLFIRI/XELIRI - FOLFOX/XELOX ( см табл. 3, 5) [80]. В случае химиорезистентной опухоли (если заболевание прогрессирует в ходе терапии или в ближайшее время после окончания терапии с включением иринотекана**, оксалиплатина** и аналогов пиримидина) проведение дальнейшей химиотерапии не показано (может быть рассмотрена возможность проведения таргетной терапии). Если прогрессирование заболевания наблюдается в ходе адъювантной химиотерапии или в течение 12 мес после нее, оптимальным вариантом 1-й линии терапии будет режим с применением иринотекана** (FOLFIRI/XELIRI), который, по данным поданализов рандомизированных исследований, дает лучшие результаты в сравнении с режимом FOLFOX или FOLFOXIRI. При прогрессировании на фоне или после терапии 1-й линии по схеме FOLFOXIRI оптимальным режимом 2-й линии является FOLFIRI. При хорошем соматическом статусе возможно рассмотреть и повторное назначение режима FOLFOXIRI.
• У пациентов с MSI-H в 1-й линии рекомендуется назначить пембролизумаб** в монорежиме или комбинацию ипилимумаба** с ниволумабом** [137, 138].
Уровень убедительности рекомендаций для пембролизумаба. А (уровень достоверности доказательств - 2).
Уровень убедительности рекомендаций для комбинации ниволумаба и ипилимумаба. С (уровень достоверности доказательств - 4).
Комментарии. У пациентов с мутацией в гене KRAS пембролизумаб** в монорежиме был менее эффективен в 1-й линии, чем у пациентов без мутаций; при применении ипилимумаба** с ниволумабом** данной тенденции отмечено не было. Ввиду риска раннего прогрессирования при монотерапии рака толстой кишки анти-PD1-антителами у пациентов с большим объемом опухолевого поражения следует рассмотреть возможность назначения комбинации режима FOLFOX/XELOX с пембролизумабом** или ниволумабом**. Эффективность комбинации FOLFOX/XELOX c анти-PD1-антителами в 1-й линии продемонстрирована в рандомизированных исследованиях III фазы при распространенном раке желудка [204]. При отсутствии прогрессирования возможно прекратить лечение после 1 года терапии анти-PD1-атителами [167].
Таблица 5. Режимы с применением иринотекана**, таргетных препаратов и иммунопрепаратов в лечении колоректального рака.
| FOLFIRI | Иринотекан** в дозе 180 мг/м2 в виде 90-минутной инфузии в 1-й день, кальция фолинат** в дозе 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением фторурацила** в дозе 400 мг/м2 в/в струйно и 46-часовой инфузией фторурацила** в дозе 2400 мг/м2 (по 1200 мг/м2 в сутки). Начало очередного курса - на 15-й день |
| FOLFOXIRI* | Иринотекан** в дозе 165 мг/м2 в виде 90-минутной инфузии в 1-й день, оксалиплатин** в дозе 85 мг/м2 в виде 2-часовой инфузии в 1-й день, кальция фолинат** в дозе 200 мг/м2 в/в в течение 2 ч с последующей 48-часовой инфузией фторурацила** в дозе 3200 мг/м2 [127]. Начало очередного курса - на 15-й день |
| XELIRI* | Иринотекан** в дозе 200 мг/м2 в виде 90-минутной инфузии в 1-й день, капецитабин** в дозе 1600 мг/м2 внутрь в сутки в 1-14-й дни. Начало очередного курса - на 22-й день [128] |
| Иринотекан** | 250-300 мг/м2 в виде 90-минутной инфузии в 1-й день. Начало очередного курса - на 22-й день [126, 168] |
| Иринотекан** | 150-180 мг/м2 в виде 90-минутной инфузии в 1-й день. Начало очередного курса - на 15-й день [150, 210] |
| Бевацизумаб** | 7,5 мг/кг в виде 90-60-30-минутной инфузии каждые 3 нед или 5 мг/кг каждые 2 нед (может применяться с любым режимом химиотерапии метастатического рака толстой кишки) |
| Афлиберцепт** | 4 мг/кг в виде 1-часовой инфузии каждые 2 нед (вместе с режимом FOLFIRI или афлиберцепт** с режимом De Gramont или иринотеканом** во 2-й и последующих линиях терапии) [148] |
| Цетуксимаб** | 400 мг/м2 в виде 1-часовой инфузии в 1-й день, далее по 250 мг/м2 еженедельно (может применяться в монорежиме, в комбинации с иринотеканом**, с режимами De Gramont, FOLFOX, FOLFIRI и FOLFOXIRI при метастатическом раке толстой кишки). Возможно назначение цетуксимаба** в дозе 500 мг/м2 в/в капельно 1 раз в 2 нед [129] |
| Панитумумаб** | 6 мг/кг в виде 1-часовой инфузии каждые 2 нед (может применяться в монорежиме, в комбинации с иринотеканом**, с режимами De Gramont, FOLFOX, FOLFIRI или с режимом FOLFOXIRI при метастатическом раке толстой кишки) [211] |
| Рамуцирумаб** | 8 мг/кг в виде 1-часовой инфузии каждые 2 нед (вместе с режимом FOLFIRI, или рамуцирумаб** с режимом De Gramont или иринотеканом** во 2-й и последующих линиях терапии) [212] |
| Регорафениб** | 160 мг 1 раз в день р. о. в 1-21-й дни, далее 1 нед перерыва (по инструкции); или 80 мг в сутки внутрь в 1-ю неделю, 120 мг в сутки внутрь во 2-ю неделю, 160 мг в сутки внутрь в 3-ю неделю, затем 1 нед перерыва. Эскалация дозы возможна только при удовлетворительной переносимости препарата [130] |
| Пембролизумаб** | 2 мг/кг или 200 мг в/в капельно 30 мин каждые 3 нед, или 400 мг в/в каждые 6 нед (только при MSI-H) [82, 213] |
| Ниволумаб** | 3 мг/кг или 240 мг в/в капельно 30 мин каждые 2 нед, или 480 мг в/в каждые 4 нед (только при MSI-H) [83] |
| Ниволумаб** + ипилимумаб** | Ниволумаб** в дозе 3 мг/кг в/в капельно 30 мин каждые 3 нед и ипилимумаб** в дозе 1 мг/кг в/в капельно 30 мин 1 раз в 3 нед (4 введения, в дальнейшем продолжается монотерапия ниволумабом** в дозе 240 мг или 3 мг/кг в/в капельно 1 раз в 2 нед или 480 мг в/в капельно 1 раз в 4 нед (во 2-й и последующих линиях) (только при MSI-H) [84]. Или ниволумаб** в дозе 3 мг/кг в/в капельно 30 мин каждые 2 нед и ипилимумаб** в дозе 1 мг/кг в/в капельно 30 мин 1 раз в 6 нед до прогрессирования или развития непереносимой токсичности в 1-й линии [138] |
| Трастузумаб** + лапатиниб** | Трастузумаб** в дозе 4 мг/кг в/в в 1-й день 1-го цикла, затем 2 мг/кг в/в еженедельно. Лапатиниб** в дозе 1000 мг внутрь ежедневно (только при гиперэкспрессии или амплификации Her-2/neu) [133, 169] |
| Трастузумаб + пертузумаб** | Трастузумаб** в дозе 8 мг/кг в/в - нагрузочная доза в 1-й день 1-го цикла, затем 6 мг/кг в/в каждый 21 день. Пертузумаб** в дозе 840 мг в/в - нагрузочная доза в 1-й день 1-го цикла, затем 420 мг в/в каждый 21 день (только при гиперэкспрессии или амплификации Her-2/neu) [132, 133] |
* Режим характеризуется более высокой, чем FOLFIRI, частотой развития диареи.
Примечание. Возможность проведения химиотерапии в сочетании с таргетной терапией в соответствии с рекомендациями определяется доступностью лекарственных препаратов.
• Ослабленным пациентам с оценкой состояния >2 баллов по шкале ECOG рекомендуется малотоксичная монохимиотерапия аналогами пиримидина с добавлением или без добавления таргетной терапии в зависимости от мутационного статуса и локализации первичной опухоли или симптоматическая терапия; пациентам с MSI-H можно назначить пембролизумаб** или ниволумаб** в монорежиме или комбинацию ипилимумаба** с ниволумабом** [16].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• Рекомендуется к режимам химиотерапии на основе иринотекана**, оксалиплатина**, фторурацила** и капецитабина** при неоперабельном генерализованном раке толстой кишки рассмотреть возможность добавления МКА: бевацизумаба**, цетуксимаба** или панитумумаба**, что увеличивает продолжительность жизни [16, 81, 117].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарии. В режиме монотерапии бевацизумаб** малоэффективен. Рекомендуется продолжение терапии бевацизумабом** с аналогами пиримидина до прогрессирования заболевания. В случае, когда результат мутационного анализа задерживается, возможно начинать химиотерапию, а в дальнейшем, при получении результата, добавлять таргетный препарат со 2-4-го курса. В случае прогрессирования возможно продолжение применения бевацизумаба** со сменой режима. На сегодняшний день неизвестны клинические или молекулярные факторы, предсказывающие эффективность бевацизумаба**. Наибольшую активность бевацизумаб** демонстрирует в 1-й и 2-й линиях терапии; добавление бевацизумаба** к режимам на основе оксалиплатина** или иринотекана** во 2-й линии лечения достоверно увеличивает продолжительность жизни. Во 2-й линии терапии возможно назначение других антиангиогенных МКА - афлиберцепта** или рамуцирумаба** [170], которые применяются только в сочетании с режимом FOLFIRI. При развитии значимой токсичности возможно продолжать терапию афлиберцептом** или рамуцирумабом** или в сочетании с режимом De Gramont или иринотеканом**. В отличие от бевацизумаба* при неоперабельных метастазах цетуксимаб* или панитумумаб** активны как в режиме монотерапии, так и в комбинации с химиотерапией, но лишь у пациентов с отсутствием мутации в генах RAS и вRAF и при локализации первичной опухоли в левых отделах толстой кишки. Цетуксимаб** и панитумумаб** не должны применяться с капецитабином*, режимами FLOX, XELOX. Самостоятельная активность цетуксимаба* и панитумумаба** позволяет рекомендовать их применение в режиме монотерапии в качестве 3-4-й линии. На поздних линиях возможно применение панитумумаба** или цетуксимаба** и в случае правосторонней локализации первичной опухоли при отсутствии мутаций в генах RAS и вRAF. Совместное применение бевацизумаба** и цетуксимаба** или панитумумаба** ухудшает результаты лечения и не рекомендуется.
Цели паллиативной химиотерапии - увеличение продолжительности жизни, уменьшение выраженности симптомов болезни и улучшение качества жизни. Пациенты, получившие все 3 активных химиопрепарата (иринотекан**, оксалиплатин** и аналоги пиримидина), имеют достоверно бóльшую продолжительность жизни. При этом неважно, за сколько линий терапии это удается реализовать. До сих пор неясна оптимальная продолжительность 1-й линии терапии. Возможные варианты:
1) непрерывная терапия до прогрессирования заболевания или развития неприемлемых токсических явлений;
2) проведение лечения на протяжении не менее чем 6 мес с последующим наблюдением;
3) применение двойной комбинации в течение не менее чем 3-4 мес с последующей поддержкой аналогами пиримидина (стратегия поддерживающей терапии имеет преимущества перед полным прекращением лечения). В случае применения комбинации химиотерапии с бевацизумабом** поддерживающая терапия бевацизумабом** и аналогами пиримидина должна проводиться до появления признаков прогрессирования болезни или развития неприемлемых токсических явлений. При использовании комбинации химиотерапии с цетуксимабом** или панитумумабом** также рекомендуется поддерживающая терапия комбинацией инфузий кальция фолината**, фторурацила** и цетуксимаба** или панитумумаба** или монотерапия МКА до прогрессирования заболевания [26].
На выживаемость пациентов влияет и последовательность назначения таргетной терапии. Так, если в 1-й линии терапии был назначен бевацизумаб**, то во 2-й линии оптимально продолжать антиангиогенную терапию даже при отсутствии мутаций в генах RAS и вRAF, что дает преимущество в отношении выживаемости в сравнении с таковой у пациентов, которым во 2-й линии назначали цетуксимаб** или панитумумаб** [151, 152]. Если в 1-й линии был назначен цетуксимаб или панитумумаб, во 2-й линии оптимально использовать схемы с включением бевацизумаба**, или афлиберцепта**, или рамуцирумаба**. Продолжение применения цетуксимаба** или панитумумаба** при прогрессировании не улучшает показатели выживаемости пациентов даже при отсутствии мутаций в генах RAS и вRAF [153].
• У пациентов с прогрессированием заболевания при применении оксалиплатина*, иринотекана * и аналогов пиримидина, бевацизумаба** и цетуксимаба** или панитумумаба** (для последний двух препаратов - при отсутствии мутаций в генах RAS и вRAF) рекомендовано назначение регорафениба** [214].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарии. Исследования показали, что возможно проводить терапию регорафенибом** в режиме 80 мг в сутки внутрь в 1-ю неделю, 120 мг в сутки внутрь во 2-ю неделю, 160 мг в сутки внутрь в 3-ю неделю, затем 1 нед перерыва. Эскалация дозы возможна только при удовлетворительной переносимости препарата.
Во 2-й и последующих линиях терапии при наличии в опухоли MSI-H рекомендована, если ранее не проводилась, монотерапия ниволумабом** или пембролизумабом** в монорежиме или комбинацией ниволумаба** и ипилимумаба**. Последний вариант характеризуется большей частотой получения объективного ответа, однако данные о сравнении отдаленных параметров выживаемости в научной литературе не представлены [82-84]. При отсутствии прогрессирования возможно прекратить лечение после 1 года терапии анти-PD1-атителами [167].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
• В 3-й и последующих линиях терапии при гиперэкспрессии или амплификации гена Her-2/neu и отсутствии мутаций в генах RAS и вRAF рекомендовано назначение комбинаций трастузумаба** и лапатиниба** или трастузумаба** и пертузумаба** (табл. 5) [132, 133].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• В 3-й и последующих линиях терапии рекомендовано повторное назначение режимов химиотерапии с добавлением или без добавления таргетной терапии, которые были эффективны в ранее проведенных линиях лечения [154, 215].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
• Рекомендуется при мутациях в гене вRAF в качестве 1-й линии при удовлетворительном состоянии пациента и при отсутствии противопоказаний назначать режим FOLFOXIRI или FOLFOX в комбинации с применением МКА бевацизумаба** [58, 155].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарии. Применение режима FOLFOXIRI с бевацизумабом определяет большую частоту объективных эффектов, но не увеличивает выживаемость без прогрессирования и общую выживаемость в сравнении с двойными комбинациями с бевацизумабом. При прогрессировании заболевания в ходе 1-й линии терапии при мутации в гене вRAF возможно назначение режима FOLFIRI с использованием афлиберцепта*/бевацизумаба*/рамуцирумаба** [85] или комбинации цетуксимаба** или панитумумаба** с вемурафенибом*/дабрафенибом* и траметинибом** [86, 87] (табл. 6). В случае невозможности назначения химиотерапии в первой линии терапии при мутации в гене вRAF возможно рассмотреть терапию комбинацией цетуксимаба** или панитумумаба** с вемурафенибом*/дабрафенибом*, с траметинибом** или без него. При сочетании мутации в гене вRAF и MSI-H предпочтение отдается иммунотерапии - комбинации ипилимумаба** с ниволумабом** или пембролизумабу**/ниволумабу** в монорежиме.
• Длительные (свыше 6 часов) инфузии фторурацила** рекомендовано проводить через центральный венозный доступ с использованием инфузоматов [88].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Таблица 6. Режимы применения препаратов во 2-й и последующих линиях терапии колоректального рака с мутацией в гене вRAF.
| FOLFIRI | Иринотекан** в дозе 180 мг/м2 в виде 90-минутной инфузии в 1-й день, кальция фолинат** в дозе 400 мг/м2 в/в в течение 2 ч с последующим болюсным введением фторурацила** в дозе 400 мг/м2 в/в струйно и 46-часовой инфузией фторурацила** в дозе 2400 мг/м2 (по 1200 мг/м2 в сутки). Начало очередного курса - на 15-й день. Возможно добавление бевацизумаба** в дозе 5 мг/кг, или афлиберцепта** в дозе 4 мг/кг, или рамуцирумаба** в дозе 8 мг/кг в/в капельно в 1-й день каждого курса |
| Иринотекан** + ингибитор вRAF + цетуксимаб** | Иринотекан** в дозе 180 мг/м2 в виде 90-минутной инфузии в 1-й день (1 раз в 2 нед), цетуксимаб** в дозе 400 мг/м2 в/в капельно в 1-й день, затем по 250 мг/м2 в/в капельно еженедельно с 8-го дня (или 500 мг/м2 в 1-й день 1 раз в 2 нед), вемурафениб** в дозе 960 мг внутрь 2 раза в день ежедневно [156, 166] |
| Ингибитор вRAF + МЕК + панитумумаб** или цетуксимаб** | Дабрафениб** в дозе по 150 мг 2 раза в сутки внутрь ежедневно, траметиниб** в дозе 2 мг 1 раз в день внутрь ежедневно, панитумумаб** 6 мг/кг в/в капельно 1 день 1 раз в 2 нед или цетуксимаб 400 мг/м2 в/в капельно 1 день, затем по 250 мг/м2 в/в капельно еженедельно (или 500 мг/м2 в/в капельно 1 день 1 раз в 2 нед) [87, 215] |
| Ингибитор вRAF + панитумумаб** или цетуксимаб** | Дабрафениб** в дозе по 150 мг 2 раза в сутки внутрь ежедневно, панитумумаб** в дозе 6 мг/кг в/в капельно 1 день 1 раз в 2 нед или цетуксимаб** в дозе 400 мг/м2 в/в капельно 1 день, затем по 250 мг/м2 в/в капельно еженедельно. Или вемурафениб** в дозе по 960 мг внутрь 2 раза в день ежедневно, панитумумаб** в дозе 6 мг/кг в/в капельно 1 день 1 раз в 2 нед или цетуксимаб в дозе 400 мг/м2 в/в капельно 1 день, затем по 250 мг/м2 в/в капельно еженедельно (или 500 мг/м2 в/в капельно 1 день 1 раз в 2 нед [87, 180-183, 216] |
| Ингибиторы вRAF + МЕК | Дабрафениб** в дозе по 150 мг 2 раза в сутки внутрь ежедневно, траметиниб** в дозе 2 мг 1 раз в день внутрь ежедневно [157]. Или вемурафениб** в дозе по 960 мг внутрь 2 раза в день ежедневно и кобиметиниб** в дозе 60 мг внутрь 1 раз в день в 1-21-й дни, далее 1 нед перерыва, каждые 28 дней [158] |
Примечание. Возможность проведения химиотерапии в сочетании с таргетной терапией в соответствии с рекомендациями определяется доступностью лекарственных препаратов.
3,4 Симптоматическая терапия.
• Пациентам с острым кровотечением рекомендуется выполнить срочное эндоскопическое исследование органов желудочно-кишечного тракта, системную гемостатическую терапию. В зависимости от результатов исследования производят эндоскопическую остановку кровотечения. При невозможности/неэффективности эндоскопического гемостаза проводится экстренное хирургическое вмешательство [89].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• При опухолевом стенозе рекомендуется эндоскопическое стентирование зоны опухолевого стеноза или оперативное лечение [89, 90].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Для лечения хронического болевого синдрома рекомендуется проведение дистанционной лучевой терапии, медикаментозной терапии, локорегионарной анестезии в зависимости от причины болевого синдрома [89].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• При лечении асцита рекомендуется рассмотреть возможность применения лапароцентеза [91].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Целями так называемой «наилучшей поддерживающей терапии» (best supportive care) являются профилактика и облегчение симптомов заболевания и поддержание качества жизни пациентов и их близких независимо от стадии заболевания и потребности в других видах терапии. В случае рака ободочной кишки меры, направленные на облегчение основных симптомов, способствуют увеличению продолжительности жизни.
Принципы лечения и профилактики тошноты и рвоты у пациентов с раком ободочной кишки соответствуют принципам, изложенным в «Практических рекомендациях по профилактике и лечению тошноты и рвоты у онкологических больных» [184].
Принципы лечения и профилактики костных осложнений у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях» [185].
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по диагностике и лечению фебрильной нейтропении» [186].
Принципы профилактики и лечения гепатотоксичности у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Клинические рекомендации по коррекции гепатотоксичности, индуцированной противоопухолевой терапией» [187].
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» [188].
Принципы профилактики и лечения кожных осложнений у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» [189].
Принципы нутритивной поддержки пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по нутритивной поддержке онкологических больных» [190].
Принципы профилактики и лечения нефротоксичности у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов» [191].
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных» [192].
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Рекомендации по лечению последствий экстравазации противоопухолевых препаратов» [193].
Принципы профилактики и лечения иммуноопосредованных нежелательных явлений у пациентов с раком ободочной кишки соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями» [194].
Принципы профилактики и лечения анемии у пациентов с раком ободочной кишки соответствуют принципам, изложенным в клинических рекомендациях «Анемия при злокачественных новообразованиях», размещенных в рубрикаторе клинических рекомендаций Минздрава России [195].
|
|
Реабилитация и амбулаторное лечение
• Во время предреабилитации рекомендовано проведение лечебной физкультуры (ЛФК), психологической и нутритивной поддержки, информирования пациентов [92-95].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Комментарии. Программа комплексной реабилитации пациентов с колоректальным раком, в которую входят занятия ЛФК дома (комплекс физических упражнений средней интенсивности, включающий как аэробную, так и анаэробную нагрузку), консультирование по вопросам питания, работа с психологом для преодоления тревоги и депрессии (начинается за 28 дней до операции и продолжается в течение 8 нед после), значительно улучшает качество жизни в послеоперационном периоде. Психологическая реабилитация с использованием методик борьбы со стрессом (релаксация, формирование позитивного настроя), длящаяся в течение 40-60 мин 6 дней в неделю, начатая за 5 дней до операции и продолжающаяся 30 дней после нее, значительно улучшает качество жизни.
• Рекомендуется применять тактики реабилитации fast track («быстрый путь») и ERAS (early rehabilitation after surgery - ранняя реабилитация после операции), предполагающие комплексное обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, раннюю мобилизацию (активизацию и вертикализацию) пациентов уже с 1-2-х суток после операции [96].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Применение побудительной спирометрии, подъем головного конца кровати, раннее начало дыхательной гимнастики и ранняя активизация пациентов помогает предотвращать застойные явления в легких в послеоперационном периоде [97].
Для профилактики снижения мышечной массы, возникновения легочных и тромботических осложнений показано пребывание в кровати в течение 2 ч до операции и не более 6 ч после нее. Дыхательная гимнастика начинается сразу после нормализации сознания пациента после операции. Тактике дыхательной гимнастики в послеоперационном периоде пациента обучают до операции. После оперативного лечения пациентам с колоректальным раком рекомендовано диафрагмальное дыхание, которое способствует улучшению циркуляции лимфы в организме и позволяет вентилировать нижние доли легких, которые при грудном типе дыхания обычно наполняются воздухом недостаточно.
• Во время 2-го этапа реабилитации при лечении синдрома передней резекции прямой кишки рекомендуется проводить функциональное обследование, включающее применение методик измерения сокращения прямой кишки и сфинктера ануса (аноректальной зоны) [98-101, 118, 119].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. При данном синдроме рекомендованы выполнение комплекса упражнений для укрепления мышц тазового дна, biofeedback-терапия, тибиальная нейромодуляция, электростимуляция мышц тазового дна и промежности [98-101]. При нарушении мочеиспускания и эректильной дисфункции показаны упражнения для укрепления мышц тазового дна, вiofeedback-терапия, тибиальная нейромодуляция, электростимуляция мышц тазового дна и промежности. При возникновении лимфедемы нижних конечностей следует проводить полную противоотечную терапию, включающую мануальный лимфодренаж, ношение компрессионного трикотажа, выполнение комплекса ЛФК, уход за кожей. При возникновении лимфедемы нижних конечностей также нужно назначить перемежающуюся пневмокомпрессию конечностей в сочетании с полной противоотечной терапией, низкоинтенсивную лазеротерапию в сочетании с полной противоотечной терапией, электротерапию в сочетании с полной противоотечной терапией, низкочастотную магнитотерапию в сочетании с полной противоотечной терапией, глубокую осцилляцию (массаж переменным электрическим полем) в сочетании с полной противоотечной терапией.
• Во время проведения химиотерапии рекомендуется выполнение комплекса ЛФК, применение методик релаксации, включающих диафрагмальное дыхание и прогрессирующую мышечную релаксацию, рассмотреть возможность назначения курса массажа [102-104].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
Комментарии. Объем и интенсивность ЛФК подбираются индивидуально, исходя из степени слабости (легкая, средняя, тяжелая). При улучшении общего состояния возможно увеличить интенсивность ЛФК. Рекомендуется сочетание аэробной нагрузки и силовой.
• Во время 3-го этапа реабилитации рекомендовано ведение активного образа жизни, выполнение комплексов ЛФК после комбинированного лечения рака ободочной кишки [105-109].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Комментарии. Выполнение комплекса ЛФК пациентами с рецидивом рака снижает риск общей смертности на 29 %. Выполнение комплекса ЛФК и физическая активность пациентов с диссеминированным опухолевым процессом уменьшают слабость, увеличивают мобильность, снижают уровень депрессии и улучшают качество жизни.
• Не рекомендуется ограничивать пациентов с раком толстой кишки в применении методов реабилитации в рамках курортологического лечения при отсутствии данных, свидетельствующих о их негативном влиянии на здоровье.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. В настоящее время отсутствуют какие-либо данные, в том числе опубликованные исследования, свидетельствующие о повышении риска прогрессирования опухолевого процесса при использовании данных методов реабилитации.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Комментарии. Программа комплексной реабилитации пациентов с колоректальным раком, в которую входят занятия ЛФК дома (комплекс физических упражнений средней интенсивности, включающий как аэробную, так и анаэробную нагрузку), консультирование по вопросам питания, работа с психологом для преодоления тревоги и депрессии (начинается за 28 дней до операции и продолжается в течение 8 нед после), значительно улучшает качество жизни в послеоперационном периоде. Психологическая реабилитация с использованием методик борьбы со стрессом (релаксация, формирование позитивного настроя), длящаяся в течение 40-60 мин 6 дней в неделю, начатая за 5 дней до операции и продолжающаяся 30 дней после нее, значительно улучшает качество жизни.
• Рекомендуется применять тактики реабилитации fast track («быстрый путь») и ERAS (early rehabilitation after surgery - ранняя реабилитация после операции), предполагающие комплексное обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, раннюю мобилизацию (активизацию и вертикализацию) пациентов уже с 1-2-х суток после операции [96].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Применение побудительной спирометрии, подъем головного конца кровати, раннее начало дыхательной гимнастики и ранняя активизация пациентов помогает предотвращать застойные явления в легких в послеоперационном периоде [97].
Для профилактики снижения мышечной массы, возникновения легочных и тромботических осложнений показано пребывание в кровати в течение 2 ч до операции и не более 6 ч после нее. Дыхательная гимнастика начинается сразу после нормализации сознания пациента после операции. Тактике дыхательной гимнастики в послеоперационном периоде пациента обучают до операции. После оперативного лечения пациентам с колоректальным раком рекомендовано диафрагмальное дыхание, которое способствует улучшению циркуляции лимфы в организме и позволяет вентилировать нижние доли легких, которые при грудном типе дыхания обычно наполняются воздухом недостаточно.
• Во время 2-го этапа реабилитации при лечении синдрома передней резекции прямой кишки рекомендуется проводить функциональное обследование, включающее применение методик измерения сокращения прямой кишки и сфинктера ануса (аноректальной зоны) [98-101, 118, 119].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. При данном синдроме рекомендованы выполнение комплекса упражнений для укрепления мышц тазового дна, biofeedback-терапия, тибиальная нейромодуляция, электростимуляция мышц тазового дна и промежности [98-101]. При нарушении мочеиспускания и эректильной дисфункции показаны упражнения для укрепления мышц тазового дна, вiofeedback-терапия, тибиальная нейромодуляция, электростимуляция мышц тазового дна и промежности. При возникновении лимфедемы нижних конечностей следует проводить полную противоотечную терапию, включающую мануальный лимфодренаж, ношение компрессионного трикотажа, выполнение комплекса ЛФК, уход за кожей. При возникновении лимфедемы нижних конечностей также нужно назначить перемежающуюся пневмокомпрессию конечностей в сочетании с полной противоотечной терапией, низкоинтенсивную лазеротерапию в сочетании с полной противоотечной терапией, электротерапию в сочетании с полной противоотечной терапией, низкочастотную магнитотерапию в сочетании с полной противоотечной терапией, глубокую осцилляцию (массаж переменным электрическим полем) в сочетании с полной противоотечной терапией.
• Во время проведения химиотерапии рекомендуется выполнение комплекса ЛФК, применение методик релаксации, включающих диафрагмальное дыхание и прогрессирующую мышечную релаксацию, рассмотреть возможность назначения курса массажа [102-104].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
Комментарии. Объем и интенсивность ЛФК подбираются индивидуально, исходя из степени слабости (легкая, средняя, тяжелая). При улучшении общего состояния возможно увеличить интенсивность ЛФК. Рекомендуется сочетание аэробной нагрузки и силовой.
• Во время 3-го этапа реабилитации рекомендовано ведение активного образа жизни, выполнение комплексов ЛФК после комбинированного лечения рака ободочной кишки [105-109].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Комментарии. Выполнение комплекса ЛФК пациентами с рецидивом рака снижает риск общей смертности на 29 %. Выполнение комплекса ЛФК и физическая активность пациентов с диссеминированным опухолевым процессом уменьшают слабость, увеличивают мобильность, снижают уровень депрессии и улучшают качество жизни.
• Не рекомендуется ограничивать пациентов с раком толстой кишки в применении методов реабилитации в рамках курортологического лечения при отсутствии данных, свидетельствующих о их негативном влиянии на здоровье.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. В настоящее время отсутствуют какие-либо данные, в том числе опубликованные исследования, свидетельствующие о повышении риска прогрессирования опухолевого процесса при использовании данных методов реабилитации.
Профилактика
• Рекомендуется соблюдать следующую периодичность и использовать следующие методы наблюдения после завершения лечения по поводу рака толстой кишки: в первые 1-2 года физикальный осмотр и сбор жалоб каждые 3-6 мес; через 3-5 лет с момента операции - 1 раз в 6-12 мес. Через 5 лет и более с момента операции визиты проводятся ежегодно или при появлении жалоб. Объем обследования:
- анамнез и физикальное обследование;
- исследование уровня РЭА в крови каждые 3 мес в первые 2 года и каждые 6 мес в последующие 3 года (если РЭА был исходно повышен);
- колоноскопия через 1 и 3 года после резекции первичной опухоли, далее каждые 5 лет для выявления метахронной опухоли или удаления обнаруженных полипов толстой кишки. При выявлении полипов колоноскопия выполняется ежегодно (В). В случае если до начала лечения колоноскопия не была выполнена по причине стенозирующей опухоли, ее производят в течение 3-6 мес после резекции;
- УЗИ органов брюшной полости и малого таза (комплексное) каждые 3-6 мес в зависимости от риска прогрессирования;
- рентгенография легких или прицельная рентгенография органов грудной клетки каждые 12 мес;
- КТ органов грудной и брюшной полости с внутривенным болюсным контрастированием однократно через 12-18 мес после операции [16, 59, 120].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала химиотерапии или хирургического лечения резектабельных метастатических очагов, рецидивных опухолей, а также выявление метахронных опухолей ободочной кишки. Профилактику и лечение осложнений, вызванных системным противоопухолевым лечением и лучевой терапией, целесообразно проводить по соответствующим рекомендациям ( см Приложение Д).
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
- анамнез и физикальное обследование;
- исследование уровня РЭА в крови каждые 3 мес в первые 2 года и каждые 6 мес в последующие 3 года (если РЭА был исходно повышен);
- колоноскопия через 1 и 3 года после резекции первичной опухоли, далее каждые 5 лет для выявления метахронной опухоли или удаления обнаруженных полипов толстой кишки. При выявлении полипов колоноскопия выполняется ежегодно (В). В случае если до начала лечения колоноскопия не была выполнена по причине стенозирующей опухоли, ее производят в течение 3-6 мес после резекции;
- УЗИ органов брюшной полости и малого таза (комплексное) каждые 3-6 мес в зависимости от риска прогрессирования;
- рентгенография легких или прицельная рентгенография органов грудной клетки каждые 12 мес;
- КТ органов грудной и брюшной полости с внутривенным болюсным контрастированием однократно через 12-18 мес после операции [16, 59, 120].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала химиотерапии или хирургического лечения резектабельных метастатических очагов, рецидивных опухолей, а также выявление метахронных опухолей ободочной кишки. Профилактику и лечение осложнений, вызванных системным противоопухолевым лечением и лучевой терапией, целесообразно проводить по соответствующим рекомендациям ( см Приложение Д).
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
|
|
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом № 323 от 21,11,2011 (ред. от 25,05,2019) «Об основах охраны здоровья граждан в Российской Федерации» организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента рака ободочной кишки и ректосигмоидного отдела или подозрении на него врачи-терапевты, участковые врачи-терапевты, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патолого-анатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патолого-анатомическое бюро (отделение).
При выявлении рака ободочной кишки и ректосигмоидного отдела или подозрении на него в ходе оказания скорой медицинской помощи пациента переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза рака ободочной кишки и ректосигмоидного отдела (в случае отсутствия медицинских показаний к проведению патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или медицинских организациях, оказывающих медицинскую помощь пациентам с раком ободочной кишки и ректосигмоидного отдела, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с раком ободочной кишки и ректосигмоидного отдела, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология», определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями к госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений рака ободочной кишки и ректосигмоидного отдела, требующих оказания специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия ) рака ободочной кишки и ректосигмоидного отдела.
Показаниями к госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическому вмешательству, лучевой терапии, в том числе контактной, дистанционной и лучевой терапии других видов, лекарственной терапии ), требующему наблюдения в условиях круглосуточного или дневного стационара.
Рекомендуется перед операцией у всех больных раком ободочной кишки получить информированное согласие на проведение хирургического вмешательства и формирование колостомы (даже если это не входит в план операции) [33, 110].
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию составляется после предварительной консультации по предоставленным медицинским документам и/или после предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента рака ободочной кишки и ректосигмоидного отдела или подозрении на него врачи-терапевты, участковые врачи-терапевты, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патолого-анатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патолого-анатомическое бюро (отделение).
При выявлении рака ободочной кишки и ректосигмоидного отдела или подозрении на него в ходе оказания скорой медицинской помощи пациента переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза рака ободочной кишки и ректосигмоидного отдела (в случае отсутствия медицинских показаний к проведению патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или медицинских организациях, оказывающих медицинскую помощь пациентам с раком ободочной кишки и ректосигмоидного отдела, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с раком ободочной кишки и ректосигмоидного отдела, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология», определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями к госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений рака ободочной кишки и ректосигмоидного отдела, требующих оказания специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия ) рака ободочной кишки и ректосигмоидного отдела.
Показаниями к госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическому вмешательству, лучевой терапии, в том числе контактной, дистанционной и лучевой терапии других видов, лекарственной терапии ), требующему наблюдения в условиях круглосуточного или дневного стационара.
Рекомендуется перед операцией у всех больных раком ободочной кишки получить информированное согласие на проведение хирургического вмешательства и формирование колостомы (даже если это не входит в план операции) [33, 110].
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию составляется после предварительной консультации по предоставленным медицинским документам и/или после предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
|
|
Дополнительно
Дополнительной информации нет.
Критерии оценки качества медицинской помощи
| 1. | Выполнено патолого-анатомическое исследование биопсийного материала для морфологической верификации диагноза до начала лечения, за исключением случаев экстренного хирургического лечения | да/нет |
| 2. | Выполнена оценка факторов риска прогрессирования у пациентов со II стадией заболевания | да/нет |
| 3. | Назначено исследование для выявления микросателлитных повторов ДНК (MSI) в биопсийном (операционном) материале методом полимеразной цепной реакции при II стадии болезни | да/нет |
| 4. | Выполнено определение мутации генов RAS, вRAF и статуса MSI (при метастатической болезни) | да/нет |
| 5. | Проведена консультация хирурга, специализирующегося на хирургии печени, перед началом 1-го курса химиотерапии (если пациенту показано проведение химиотерапии и/или таргетной терапии при поражении метастазами только печени) | да/нет |
| 6. | Инфузии фторурацила** выполнены через центральный венозный доступ (если пациенту проводится 46-часовая в/в инфузия фторурацила**) | да/нет |
| 7. | Выполнено патолого-анатомическое исследование биопсийного (операционного) материала и/или иммуногистохимическое исследование при выполнении патолого-анатомического исследования препарата удаленных тканей (при хирургическом вмешательстве) | да/нет |
| 8. | Проведен 1-й курс адъювантной химиотерапии не позднее 60 дней с момента хирургического вмешательства (при проведении адъювантной химиотерапии и отсутствии медицинских противопоказаний) | да/нет |
| 9. | Выполнена тотальная колоноскопия, или ирригоскопия, или компьютерно-томографическая колоноскопия при невозможности выполнения тотальной колоноскопии до операции или в течение 3 мес после операции | да/нет |
| 10. | Выполнено ультразвуковое исследование органов брюшной полости (комплексное) и забрюшинного пространства, и/или компьютерная томография органов брюшной полости, и/или магнитно-резонансная томография органов брюшной полости (при установлении диагноза) | да/нет |
| 11. | Выполнена рентгенография легких или прицельная рентгенография органов грудной клетки и/или компьютерная томография органов грудной клетки (при установлении диагноза) | да/нет |
| 12. | Выполнено исследование уровня раково-эмбрионального антигена в крови (при установлении диагноза) | да/нет |
Список литературы
1. Terzíc J., Grivennikov S., Karin E., Karin M. Inflammation and colon cancer. Gastroenterology 2010,138:2101-14.
2. Johns L.E., Houlston R.S. A systematic review and meta-analysis of familial colorectal cancer risk. Am J Gastroenterol 2001;96:2992-3003.
3. Tenesa A., Dunlop M.G. New insights into the aetiology of colorectal cancer from genome-wide association studies. Nat Rev Genet 2009;10:353-8.
4. Huxley R.R., Ansary-Moghaddam A., сlifton P. et al. The impact of dietary and lifestyle risk factors on risk of colorectal cancer: A quantitative overview of the epidemiological evidence. Int J сancer 2009;125:171-80.
5. Watson A.J.M., сollins P.D. сolon cancer: a civilization disorder. Dig Dis 2011;29:222-8.
6. Meyerhardt J.A., сatalano P.J., Haller D.G. et al. Impact of diabetes mellitus on outcomes in patients with colon cancer. J сlin Oncol 2003;21:433-40.
7. Hjartåker A., Aagnes в., Robsahm T.E. et al. Subsite-specific dietary risk factors for colorectal cancer: a review of cohort studies. J Oncol 2013;2013:703854.
8. Theodoratou E., Farrington S.M., Tenesa A. et al. Associations between dietary and lifestyle risk factors and colorectal cancer in the Scottish population. Eur J сancer Prev 2014;23:8-17.
9. Rasool S., Kadla S.A., Rasool V., Ganai в.A. A comparative overview of general risk factors associated with the incidence of colorectal cancer. Tumor вiol 2013;34:2469-76.
10. Esposito K., сhiodini P., сapuano A. et al. сolorectal cancer association with metabolic syndrome and its components: a systematic review with meta-analysis. Endocrine 2013;44:634-47.
11. Larsson S.C., Orsini N., Wolk A. Diabetes mellitus and risk of colorectal cancer: a meta-analysis. J Natl сancer Inst 2005;97:1679-87.
12. Raskov H., Pommergaard H.C., вurcharth J., Rosenberg J. сolorectal carcinogenesis - update and perspectives. World J Gastroenterol 2014;20:18151-64.
13. Donohoe с., O’Farrell N., Doyle S., Reynolds J. The role of obesity in gastrointestinal cancer: evidence and opinion. Therap Adv Gastroenterol 2014;7:38-50.
14. Злокачественные новообразования в России в 2019 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М. МНИОИ им. П.А. Герцена − филиал ФГБУ НМИЦ радиологии Минздрава России, 2020. 252 с.
15. Speights V.O., Johnson M.W., Stoltenberg P.H. et al. сolorectal cancer: current trends in initial clinical manifestations. South Med J 1991;84(5):575-8.
16. Schmoll H.J., Van сutsem E., Stein A. et al. ESMO consensus guidelines for management of patients with colon and rectal cancer. A personalized approach to clinical decision making. Ann Oncol 2012;23:2479-516.
17. Цуканов А.С., Шелыгин Ю.А., Фролов С.А. Рекомендации по отбору пациентов для молекулярно-генетической диагностики синдрома Линча. Методические рекомендации. М., 2019.
18. Liu Z., Zhang Y., Niu Y. et al. A systematic review and meta-analysis of diagnostic and prognostic serum biomarkers of colorectal cancer. PLoS One 2014;9(8):e103910.
19. Langevin J.M., Nivatvongs S. The true incidence of synchronous cancer of the large bowel. A prospective study. Am J Surg 1984;147(3):330-3.
20. Mulder S.A., Kranse R., Damhuis R.A. et al. Prevalence and prognosis of synchronous colorectal cancer: a Dutch population-based study. сancer Epidemiol 2011;35(5):442-7.
21. Finan P.J., Ritchie J.K., Hawley P.R. Synchronous and ‘early’ metachronous carcinomas of the colon and rectum. вr J Surg 1987;74:945-7.
22. сomputed tomographic colonography compared with colonoscopy or barium enema for diagnosis of colorectal cancer in older symptomatic patients: two multicentre randomised trials with economic evaluation (the SIGGAR trials). Health Technol Assess 2015;19(54):1-134.
23. Floriani I., Torri V., Rulli E. et al. Performance of imaging modalities in diagnosis of liver metastases from colorectal cancer: a systematic review and meta-analysis. J Magn Reson Imaging 2010;31(1):19-31.
24. Nordholm-Carstensen A., Wille-Jørgensen P.A., Jorgensen L.N. et al. Indeterminate pulmonary nodules at colorectal cancer staging: a systematic review of predictive parameters for malignancy. Ann Surg Oncol 2013;20(12):4022-30.
25. Sun S., Yang с., Huang Z. et al. Diagnostic value of magnetic resonance versus computed tomography colonography for colorectal cancer: a PRISMA-compliant systematic review and meta-analysis. Medicine (Baltimore) 2018;97(22):e10883.
26. вrown G., Radcliffe A.G., Newcombe R.G. et al. Preoperative assessment of prognostic factors in rectal cancer using high-resolution magnetic resonance imaging. вr J Surg 2003;90(3):355-64.
27. Herrmann J., Lerman A., Sandhu N.P. et al. Evaluation and management of patients with heart disease and cancer: cardio-oncology. Mayo сlin Proc 2014;89(9):1287-306.
28. Starck M., вohe M., Simanaitis M., Valentin L. Rectal endosonography can distinguish benign rectal lesions from invasive early rectal cancers. сolorectal Dis 2003;(3):246-50.
29. Lee E.J., Lee J.B., Lee S.H. et al. Endoscopic submucosal dissection for colorectal tumors--1,000 colorectal ESD cases: one specialized institute s experiences. Surg Endosc 2013;27(1):31-9.
30. Diagnostic value of endorectal ultrasound in preoperative assessment of lymph node involvement in colorectal cancer: A meta-analysis. Asian Pac J сancer Prev 2015;16:3485-91.
31. сhoi S.H., Kim S.Y., Park S.H. et al. Diagnostic performance of сT, gadoxetate disodium-enhanced MRI, and PET/CT for the diagnosis of colorectal liver metastasis: systematic review and meta-analysis. J Magn Reson Imaging 2018;47:1237-50.
32. Ko Y., Kim J., Park J.K. et al. Limited detection of small (≤10 mm) colorectal liver metastasis at preoperative сT in patients undergoing liver resection. PloS One 2017;12(12):e0189797.
33. Ribas Y., Hotouras A., Wexner S.D., D Hoore A. Shared decision-making and informed consent process in rectal cancer treatment: weighing up oncological and functional outcomes. сolorectal Dis 2016;18(1):9-12.
34. Roth E.S., Fetzer D.T., вarron в.J. et al. Does colon cancer ever metastasize to bone first? a temporal analysis of colorectal cancer progression. вMC сancer 2009;9:274.
35. Augestad K.M., вakaki , Rose J. et al. Metastatic spread pattern after curative colorectal cancer surgery. A retrospective, longitudinal analysis. сancer Epidemiol 2015;39(5):734-44.
36. Daza J.F., Solis N.M., Parpia S. et al. A meta-analysis exploring the role of PET and PET-CT in the management of potentially resectable colorectal cancer liver metastases. Eur J Surg Oncol 2019;45(8):1341-8.
37. Muntean V., Oniu T., Lungoci с. et al. Staging laparoscopy in digestive cancers. J Gastrointestin Liver Dis 2009;18(4):461-7.
38. De Marco M.F., Janssen-Heijnen M.L., van der Heijden L.H., сoebergh J.W. сomorbidity and colorectal cancer according to subsite and stage: a population-based study. Eur J сancer 2000;36(1):95-9.
39. Федянин М.Ю., Трякин А.А., Тюляндин С.А. Потенциальные предикторы эффективности анти-EGFR-терапии при метастатическом раке толстой кишки. Онкологическая колопроктология 2013;(2):21-30.
40. Khattak M.A., Martin H., Davidson A., Phillips M. Role of first-line anti-epidermal growth factor receptor therapy compared with anti-vascular endothelial growth factor therapy in advanced colorectal cancer: a meta-analysis of randomized clinical trials. сlin сolorectal сancer 2015;14(2):81-90. DOI: 10,1016/j.clcc.2014,12,011.
41. Pietrantonio F., Petrelli F., сoinu A., et al. Predictive role of вRAF mutations in patients with advanced colorectal cancer receiving cetuximab and panitumumab: a meta-analysis. Eur J сancer 2015;51(5):587-94.
42. Yoshino T., Arnold D., Taniguchi H. et al. Pan-Asian adapted ESMO consensus guidelines for the management of patients with metastatic colorectal cancer: a JSMO-ESMO initiative endorsed by сSCO, KACO, MOS, SSO and TOS. Ann Oncol 2018;29(1):44-70.
43. Hurlstone D.P., сross S.S., Drew K. et al. An evaluation of colorectal endoscopic mucosal resection using high-magnification chromoscopic colonoscopy: a prospective study of 1000 colonoscopies. Endoscopy 2004;36(6):491-8.
44. сhiba H., Tachikawa J., Kurihara D. et al. Safety and efficacy of simultaneous colorectal ESD for large synchronous colorectal lesions. Endosc Int Open 2017;5(7):E595-602.
45. Lee E.J., Lee J.B., Lee S.H. et al. Endoscopic submucosal dissection for colorectal tumors--1,000 colorectal ESD cases: one specialized institute s experiences. Surg Endosc 2013;27(1):31-9.
46. Landmann R.G., Weiser M.R. Surgical management of locally advanced and locally recurrent colon cancer. сlin сolon Rectal Surg 2005;18(3):182-9.
47. вrandi G., De Lorenzo S., Nannini M. et al. Adjuvant chemotherapy for resected colorectal cancer metastases: Literature review and meta-analysis. World J Gastroenterol 2016;22(2):519.
48. Keikes L., Koopman M., Tanis P.J. et al. Evaluating the scientific basis of quality indicators in colorectal cancer care: a systematic review. Eur J сancer 2017;86:166-77.
49. Yin Z., Liu с., сhen Y. et al. Timing of hepatectomy in resectable synchronous colorectal liver metastases (SCRLM): Simultaneous or delayed. Hepatology 2013;57(6):2346-57.
50. Feng Q., Wei Y., Zhu D. et al. Timing of hepatectomy for resectable synchronous colorectal liver metastases: for whom simultaneous resection is more suitable - a meta-analysis. PLoS One 2014;9(8):e104348.
51. Garden O.J., Rees M., Poston G.J. et al. Guidelines for resection of colorectal cancer liver metastases. Gut 2006;55(Suppl. 3):iii1-8.
52. Hughes K.S., Simon R., Songhorabodi S. et al. Resection of the liver for colorectal carcinoma metastases: a multi-institutional study of patterns of recurrence. Surgery 1986;100(2):278-84.
53. Richardson в., Preskitt J., Lichliter W. et al. The effect of multidisciplinary teams for rectal cancer on delivery of care and patient outcome: has the use of multidisciplinary teams for rectal cancer affected the utilization of available resources, proportion of patients meeting the standard of care, and does this translate into changes in patient outcome. Am J Surg 2016;211(1):46-52.
54. сhow F.C., сhok K.S. сolorectal liver metastases: an update on multidisciplinary approach. World J Hepatol 2019;11(2):150-72.
55. вrandi G., De Lorenzo S., Nannini M. et al. Adjuvant chemotherapy for resected colorectal cancer metastases: literature review and meta-analysis. World J Gastroenterol 2016;22(2):519-33.
56. Primrose J., Falk S., Finch-Jones M. et al. Systemic chemotherapy with or without cetuximab in patients with resectable colorectal liver metastasis: the New EPOC randomised controlled trial. Lancet Oncol 2014;15(6):601-11.
57. Geissler M., Riera-Knorrenschild J., Tannapfel A. et al. mFOLFOXIRI + panitumumab versus FOLFOXIRI as first-line treatment in patients with RAS wild-type metastatic colorectal cancer m(CRC): a randomized phase II VOLFI trial of the AIO (AIO-KRK0109). J сlin Oncol 2018;(Suppl. 15):3509.
58. сremolini с., Loupakis F., Antoniotti с. et al. FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol 2015;16(13):1306-15.
59. вaraniskin A., вuchberger в., Pox с. et al. Efficacy of bevacizumab in first-line treatment of metastatic colorectal cancer: A systematic review and meta-analysis. Eur J сancer 2019;106:37-44.
60. сetinkaya E., Dogrul A.B., Tirnaksiz M.B. Role of self expandable stents in management of colorectal cancers. World J Gastrointest Oncol 2016;8(1):113-20.
61. Goldberg R.M., Fleming T.R., Tangen с.M. et al. Surgery for recurrent colon cancer: strategies for identifying resectable recurrence and success rates after resection. Ann Intern Med 1998;129(1):27-35.
62. вowne W.B., Lee в., Wong W.D. et al. Operative salvage for locoregional recurrent colon cancer after curative resection: an analysis of 100 cases. Dis сolon Rectum 2005;48(5):897-909.
63. Güenaga K.F., Matos D., Wille-Jørgensen P. Mechanical bowel preparation for elective colorectal surgery. сochrane Database Syst Rev 2011;(9):CD001544.
64. Lacy p.m, García-Valdecasas J.C., Delgado S. et al. Laparoscopy-assisted colectomy versus open colectomy for treatment of non-metastatic colon cancer: a randomised trial. Lancet 2002;359(9325):2224-9.
65. Veldkamp R., Kuhry E., Hop W.C. et al. Laparoscopic surgery versus open surgery for colon cancer: short-term outcomes of a randomised trial. Lancet Oncol 2005;6(7):477-84.
66. Guillou P.J., Quirke P., Thorpe H. et al. Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer (MRC сLASICC trial): multicentre, randomised controlled trial. Lancet 2005;365(9472):1718-26.
67. Fleshman J., Sargent D.J., Green E. et al. Laparoscopic colectomy for cancer is not inferior to open surgery based on 5-year data from the сOST Study Group trial. Ann Surg 2007;246(4):655-62.
68. De Salvo G.L., Gava с., Pucciarelli S., Lise M. сurative surgery for obstruction from primary left colorectal carcinoma: primary or staged resection? сochrane Database Syst Rev 2004;(2):CD002101.
69. Khot U.P., Lang A.W., Murali K., Parker M.C. Systematic review of the efficacy and safety of colorectal stents. вr J Surg 2002;89(9):1096-120.
70. Meyer F., Marusch F., сoch A. et al. Emergency operation in carcinomas of the left colon: value of Hartmann s procedure. Tech сoloproctol 2004;8(Suppl. 1):S226-9.
71. Iveson T., Sobrero A.F., Yoshino T. et al. Prospective pooled analysis of four randomized trials investigating duration of adjuvant (adj) oxaliplatin-based therapy (3 vs 6 months (m)) for patients (pts) with high-risk stage II colorectal cancer (CC). J сlin Oncol 2019;(Suppl.):3501.
72. Федянин М.Ю. Современная клиническая и молекулярно-биологическая платформа лечения пациентов раком толстой кишки: дис. … д-ра мед. наук. М., 2018. 414 c.
73. Grothey A., Sobrero A.F., Shields A.F. et al. Duration of adjuvant chemotherapy for stage III colon cancer. N Engl J Med 2018;378:1177-88.
74. Alberts S.R., Sargent D.J., Nair S. et al. Effect of oxaliplatin, fluorouracil, and leucovorin with or without cetuximab on survival among patients with resected stage III colon cancer: a randomized trial. JAMA 2012;307:1383-93.
75. Allegra с.J., Yothers G., O’Connell M.J. et al. вevacizumab in stage II-III colon cancer:
5-year update of the National Surgical Adjuvant вreast and вowel Project с-08 trial. J сlin Oncol 2013;31:359-64.
76. Seymour M.T., Maughan T.S., Ledermann J.A. et al. Different strategies of sequential and combination chemotherapy for patients with poor prognosis advanced colorectal cancer (MRC FOCUS): a randomised controlled trial. Lancet 2007;370:143-52.
77. сunningham D., Sirohi в., Pluzanska A. et al. Two different first-line 5-fluorouracil regimens with or without oxaliplatin in patients with metastatic colorectal cancer. Ann Oncol 2009;20:244-50.
78. Ackland S.P., Jones M., Tu D. et al. A meta-analysis of two randomised trials of early chemotherapy in asymptomatic metastatic colorectal cancer. вr J сancer 2005;93:1236-43.
79. Jonker D., Rumble R.B., Maroun J. Gastrointestinal сancer Disease Site Group of сancer сare Ontario’s Program in Evidence-Based сare. Role of oxaliplatin combined with.
5-fluorouracil and folinic acid in the first-and second-line treatment of advanced colorectal cancer. сurr Oncol 2006;13(5):173.
80. Tournigand с., Andre T., Achille E. et al. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J сlin Oncol 2004;22:229-37.
81. Van Helden E.J., Menke-van der Houven van Oordt с.W., Heymans M.W. et al. Optimal use of anti-EGFR monoclonal antibodies for patients with advanced colorectal cancer: a meta-analysis. сancer Metastasis Rev 2017;36(2):395-406.
82. Le D.T., Uram J.N., Wang H. et al. PD-1 blockade in tumors with mismatch-repair deficiency. N Engl J Med 2015;372:2509-20.
83. Overman M.J., McDermott R., Leach J.L. et al. Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study. Lancet Oncol 2017;18(9):1182-91.
84. Overman M.J., Lonardi S., Wong K.Y.M. et al. Durable clinical benefit with nivolumab plus ipilimumab in DNA mismatch repair-deficient/microsatellite instability-high metastatic colorectal cancer. J сlin Oncol 2018;36(8):773-9.
85. Wirapati P., Pomella V., Vandenbosch в. et al. Velour trial biomarkers update: impact of RAS, вRAF, and sidedness on aflibercept activity. J сlin Oncol 2017;(Suppl. 15):3538.
86. Kopetz S., McDonough S.L., Morris V.K. et al. Randomized trial of irinotecan and cetuximab with or without vemurafenib in вRAF-mutant metastatic colorectal cancer (SWOG 1406). J сlin Oncol 2017;35(Suppl. 4):520.
87. сorcoran R.B., Andre T., Atreya с.E. et al. сombined вRAF, EGFR, and MEK inhibition in patients with вRAFV600E-mutant colorectal cancer. сancer Discov 2018;8(4):428-43.
88. Hansen R., Quebbeman E., Ausman R. et al. сontinuous systemic 5‐fluorouracil infusion in advanced colorectal cancer: Results in 91 patients. J Surg Oncol 1989;40(3):177-81.
89. сosti R., Leonardi F., Zanoni D. et al. Palliative care and end-stage colorectal cancer management: the surgeon meets the oncologist. World J Gastroenterol 2014;20(24):7602-21.
90. вayraktar в., Ozemir I.A., Kefeli U. et al. сolorectal stenting for palliation and as a bridge to surgery: a 5-year follow-up study. World J Gastroenterol 2015;21(31):9373-9.
91. Saif M.W., Siddiqui I.A.P., Sohail M.A. Management of ascites due to gastrointestinal malignancy. Ann Saudi Med 2009;29(5):369-77.
92. Silver J.A., вaima J. сancer prehabilitation: an opportunity to decrease treatment related morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am J Phys Med Rehabil 2013;92:715-27.
93. Hijazia Y., Gondal U., Aziz O. A systematic review of prehabilitation programs in abdominal cancer surgery. Int J Surg 2017;39:156-62.
94. Gillis с., Li с., Lee L. et al. Prehabilitation versus rehabilitation: a randomized control trial in patients undergoing colorectal resection for cancer. Anesthesiology 2014;121:937-47.
95. Tsimopoulou I., Pasquali S., Howard R. et al. Psychological prehabilitation before cancer surgery: a systematic review. Ann Surg Oncol 2015;22(13):4117-23.
96. Li P., Fang F., сai J.X. et al. Fast-track rehabilitation vs conventional care in laparoscopic colorectal resection for colorectal malignancy: a meta-analysis. World J Gastroenterol 2013;19:9119-26.
97. Wren S.M., Martin M., Yoon J.K., вech F. Postoperative pneumonia-prevention program for the inpatient surgical ward. J Am сoll Surg 2010;210(4):491-5.
98. Soh J.S., Lee H.J., Jung K.W. et al. The diagnostic value of a digital rectal examination compared with high-resolution anorectal manometry in patients with chronic constipation and fecal incontinence. Am J Gastroenterol 2015;110:1197-204.
99. Lundby L., Duelund-Jakobsen J. Management of fecal incontinence after treatment for rectal cancer. сurr Opin Support Palliat сare 2011;5:60-4.
100. Sokol E.R. Management of fecal incontinence - focus on a vaginal insert for bowel control. Med Devices (Auckl) 2016;9:85-91.
101. вenezech A., вouvier M., Vitton V. Faecal incontinence: current knowledges and perspectives. World J Gastrointest Pathophysiol 2016;7(1):59-71.
102. Kraljevi N. Rehabilitation for colorectal cancer. Review. Libri Oncol 2013;41(1-3):87-92.
103. Mustian K.M., Alfano с.M., Heckler с. et al. сomparison of pharmaceutical, psychological, and exercise treatments for cancer-related fatigue: a meta-analysis. JAMA Oncol 2017;3:961-8.
104. Kinkead в., Schettler P.J., Larson E.R. et al. Massage therapy decreases cancer-related fatigue: Results from a randomized early phase trial. сancer 2018;124(3):546-54.
105. Wonga с.L., Lee H.H.C., сhang S.C. сolorectal cancer rehabilitation review. J сancer Res Pract 2016;3(2):31-3.
106. Wolin K.Y., Yan Y., сolditz G.A. et al. Physical activity and colon cancer prevention: a meta-analysis вr J сancer 2009;100:611-6.
107. Jeon J., Sato K., Niedzwiecki D. et al. Impact of physical activity after cancer diagnosis on survival in patients with recurrent colon cancer: findings from сALGB 89903/Alliance. сlin сolorectal сancer 2013;12(4):233-8.
108. Segal R., Zwaal с., Green E. et al. Exercise for people with cancer: a systematic review. сurr Oncol 2017;24(4):e290-315.
109. сarmichael J.C., Keller D.S., вaldini G. et al. сlinical practice guidelines for enhanced recovery after colon and rectal surgery from the American Society of сolon and Rectal Surgeons and Society of American Gastrointestinal and Endoscopic Surgeons. Dis сolon Rectum 2017;60(8):761-84.
110. Fujino S., Miyoshi N., Ohue M., Takahashi Y. Prediction model and treatment of high-output ileostomy in colorectal cancer surgery. Mol сlin Oncol 2017;7(3):468-72.
111. Guo Y., Xiong в.H., Zhang T. et al. XELOX vs. FOLFOX in metastatic colorectal cancer: An updated meta-analysis. сancer Invest 2016;34(2):94-104.
112. Marques R.P., Duarte G.S., Sterrantino с. et al. Triplet (FOLFOXIRI) versus doublet (FOLFOX or FOLFIRI) backbone chemotherapy as first-line treatment of metastatic colorectal cancer: A systematic review and meta-analysis. сrit Rev Oncol Hematol 2017;118:54-62.
113. Guo Y., Shi M., Shen X. et al. сapecitabine plus irinotecan versus 5-FU/leucovorin plus irinotecan in the treatment of colorectal cancer: a meta-analysis. сlin сolorectal сancer 2014;13(2):110-8.
114. Zhao X.D., сai в.B., сao R.S., Shi R.H. et al. Palliative treatment for incurable malignant colorectal obstructions: a meta-analysis. World J Gastroenterol 2013;19(33):5565.
115. Stillwell A.P., вuettner P.G., Ho Y.H. Meta-analysis of survival of patients with stage IV colorectal cancer managed with surgical resection versus chemotherapy alone. World J Surg 2010;34(4):797-807.
116. Song X.J., Liu Z.L., Zeng R. et al. A meta-analysis of laparoscopic surgery versus conventional open surgery in the treatment of colorectal cancer. Medicine 2019;98(17):e15347.
117. Da Silva W.C., de Araujo V.E., e Abreu Lima E.M. et al. сomparative effectiveness and safety of monoclonal antibodies (bevacizumab, cetuximab, and panitumumab) in combination with chemotherapy for metastatic colorectal cancer: a systematic review and meta-analysis. вioDrugs 2018;32(6):585-606.
118. Visser W.S., Te Riele W.W., вoerma D. et al. Pelvic floor rehabilitation to improve functional outcome after a low anterior resection: a systematic review. Ann сoloproctol 2014;30(3):109-14.
119. Efthimiadis с., вasdanis G., Zatagias A. et al. Manometric and clinical evaluation of patients after low anterior resection for rectal cancer. Tech сoloproctol 2004;8(1):s205-7.
120. Jeffery M., Hickey в.E., Hider P.N. Follow-up strategies for patients treated for non‐metastatic colorectal cancer. сochrane Database Syst Rev 2019;(9):CD002200.
121. Park J.G., Vasen H.F., Park K.J. et al. Amsterdam сriteria: The International сollaborative Group on hereditary non-polyposis colorectal cancer (ICG-HNPCC). Dis сolon Rectum 1991;34:424-5.
122. Syngal S., Fox E.A., Eng с. et al. Sensitivity and specificity of clinical criteria for hereditary non-polyposis colorectal cancer associated mutations in MSH2 and MLH1. J Med Genet 2000;37(9):641-5.
123. Moreira L., вalaguer F., Lindor N. et al. Identification of Lynch syndrome among patients with colorectal cancer. JAMA 2012;308(15):1555-65.
124. Therkildsen с., вergmann T.K., Henrichsen-Schnack T., Ladelund S., Nilbert M. The predictive value of KRAS, NRAS, вRAF, PIK3CA and PTEN for anti-EGFR treatment in metastatic colorectal cancer: A systematic review and meta-analysis. Acta Oncol 2014;53(7):852-64.
125. Zabaleta J., Iida T., Falcoz P.E. et al. Individual data meta-analysis for the study of survival after pulmonary metastasectomy in colorectal cancer patients: A history of resected liver metastases worsens the prognosis. Eur J Surg Oncol 2018;44(7):1006-12.
126. сhu E., DeVita V.T. Jr. Physicians’ сancer сhemotherapy Drug Manual 2013. Jones & вartlett Learning, LLC, an Ascend Learning сompany, 2013.
127. Fernandes G.D.S., вraghiroli M.I., Artioli M. et al. сombination of irinotecan, oxaliplatin and 5-fluorouracil as a rechallenge regimen for heavily pretreated metastatic colorectal cancer patients. J Gastrointest сancer 2018;49(4):470-5.
128. Xu R.H., Muro K., Morita S. et al. Modified XELIRI (capecitabine plus irinotecan) versus FOLFIRI (leucovorin, fluorouracil and irinotecan), both either with or without bevacizumab, as second-line therapy for metastatic colorectal cancer (AXEPT): a multicentre, open-label, randomised, non-inferiority, phase 3 trial. Lancet Oncol 2018;19(5):660-71.
129. Fernandez-Plana J., Pericay с., Quintero G. et al. вiweekly cetuximab in combination with FOLFOX-4 in the first-line treatment of wild-type KRAS metastatic colorectal cancer: final results of a phase II, open-label, clinical trial (OPTIMIX-ACROSS Study). вMC сancer 2014;14:865.
130. вekaii-Saab T.S. et al. Regorafenib dose-optimisation in patients with refractory metastatic colorectal cancer (ReDOS): a randomised, multicentre, open-label, phase 2 study. Lancet Oncol 2019;20(8):1070-82.
131. Wang X., Zheng Z., Sun Y. et al. Significance of HER2 protein expression and HER2 gene amplification in colorectal adenocarcinomas. World J Gastrointest Oncol 2019;11(4):335-47. DOI: 10,4251/wjgo.v11.i4,335.
132. Meric-Bernstam F., Hurwitz H., Raghav K.P.S. et al. Pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer (MyPathway): an updated report from a multicentre, open-label, phase 2a, multiple basket study. Lancet Oncol 2019;20(4):518-30. DOI: 10,1016/S1470-2045(18)30904-5.
133. Sartore-Bianchi A., Trusolino L., Martino с. et al. Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial. Lancet Oncol 2016;17(6):738-46. DOI: 10,1016/S1470-2045(16)00150-9.
134. Li Q., Liu Y., Zhang H.M. et al. Influence of DPYD Genetic Polymorphisms on 5-fluorouracil toxicities in patients with colorectal cancer: a meta-analysis. Gastroenterol Res Pract 2014;2014:827989.
135. Zech с., Korpraphong P., Huppertz A. et al. Randomized multicentre trial of gadoxetic acid-enhanced MRI versus conventional MRI or сT in the staging of colorectal cancer liver metastases. вr J Surg 2014;101(6):613-21.
136. Seligmann J.F., FOxTROT сollaborative Group. FOxTROT: neoadjuvant FOLFOX chemotherapy with or without panitumumab (Pan) for patients (pts) with locally advanced colon cancer (CC). J сlin Oncol 2020;38(Suppl. 15):4013. DOI: 10,1200/JCO.2020,38,15_suppl.4013.
137. André T., Shiu K.K., Kim T.W. et al. Pembrolizumab in microsatellite-instability-high advanced colorectal cancer. N Engl J Med 2020;383(23):2207-18. DOI: 10,1056/NEJMoa2017699.
138. Lenz H.J., Lonardi S., Zagonel V. et al. Nivolumab (NIVO) + low-dose ipilimumab (IPI) as first-line (1L) therapy in microsatellite instability-high/DNA mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): сlinical update. J сlin Oncol 2019;37(Suppl. 15):3521. DOI: 10,1200/JCO.2019,37,15_suppl.3521.
139. Sobrero A.F., Andre T., Meyerhardt J.A. et al. Overall survival (OS) and long-term disease-free survival (DFS) of three versus six months of adjuvant (adj) oxaliplatin and fluoropyrimidine-based therapy for patients (pts) with stage III colon cancer (CC): Final results from the IDEA (International Duration Evaluation of Adj chemotherapy) collaboration. J сlin Oncol 2020;38(Suppl. 15):4004. DOI: 10,1200/JCO.2020,38,15_suppl.4004.
140. Andre T., вonni с., Navarro M. et al. Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage II or III colon cancer in the MOSAIC trial. J сlin Oncol 2009;27:3109-16.
141. Kuebler J.P., Wieand H.S., O’Connell M.J. et al. Oxaliplatin combined with weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage II and III colon cancer: results from NSABP с-07. J сlin Oncol 2007;25:2198-204.
142. Kanemitsu Y., Shitara K., Mizusawa J. et al. A randomized phase III trial comparing primary tumor resection plus chemotherapy with chemotherapy alone in incurable stage IV colorectal cancer: JCOG1007 study (iPACS). J сlin Oncol 2020;38(Suppl. 4):7. DOI: 10,1200/JCO.2020,38,4_suppl.7.
143. сheeseman S.L., Joel S.P., сhester J.D. et al. A ‘modified de Gramont’ regimen of fluorouracil, alone and with oxaliplatin, for advanced colorectal cancer. вr J сancer 2002;87(4):393-9. DOI: 10,1038/sj.bjc.6600467.
144. Venook A.P., Niedzwiecki D., Lenz H.-J. et al. сALGB/SWOG 80405: Phase III trial of irinotecan/5-FU/leucovorin (FOLFIRI) or oxaliplatin/5-FU/leucovorin (FOLFOX) with bevacizumab or cetuximab for patients with KRAS wild-type untreated metastatic adenocarcinoma of the colon or rectum [abstract]. ASCO Meeting Abstracts 2014;32:LBA3.
145. Munemoto Y., Nakamura M., Takahashi M. et al. SAPPHIRE: a randomised phase II study of planned discontinuation or continuous treatment of oxaliplatin after six cycles of modified FOLFOX6 plus panitumumab in patients with colorectal cancer. Eur J сancer 2019;119:158-67. DOI: 10,1016/j.ejca.2019,07,006.
146. Hurwitz H.I., Fehrenbacher L., Hainsworth J.D. et al. вevacizumab in combination with fluorouracil and leucovorin: an active regimen for first-line metastatic colorectal cancer. J сlin Oncol 2005;23(15):3502-8.
147. Garcia-Carbonero R., Obermannova R., вodoky G. et al. Quality-of-life results from RAISE: randomized, double-blind phase III study of FOLFIRI plus ramucirumab or placebo in patients with metastatic colorectal carcinoma after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine. Ann Oncol 2015;26:115.
148. Van сutsem E., Tabernero J., Lakomy R. et al. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J сlin Oncol 2012;30:3499-506.
149. сunningham D., Lang I., Marcuello E. et al. вevacizumab plus capecitabine versus capecitabine alone in elderly patients with previously untreated metastatic colorectal cancer (AVEX): an open-label, randomised phase 3 trial. Lancet Oncol 2013;14(11):1077-85.
150. Guo W., Zhang X., Wang Y. et al. FOLFIRI versus irinotecan monodrug as second-line treatment in metastatic colorectal cancer patients: an open, multicenter, prospective, randomized controlled phase III clinical study. J сlin Oncol 2020;38(Suppl. 15):4038. DOI: 10,1200/JCO.2020,38,15_suppl.4038.
151. вennouna J., Hiret S., вertaut A. et al. сontinuation of bevacizumab vs cetuximab plus chemotherapy after first progression in KRAS wild-type metastatic colorectal cancer: the UNICANCER PRODIGE18 Randomized сlinical Trial. JAMA Oncol 2019;5(1):83-90. DOI: 10,1001/jamaoncol.2018,4465.
152. Hecht J.R., сohn A., Dakhil S. et al. SPIRITT: a randomized, multicenter, phase ii study of panitumumab with FOLFIRI and bevacizumab with FOLFIRI as second-line treatment in patients with unresectable wild type KRAS metastatic colorectal cancer. сlin сolorectal сancer 2015;14(2):72-80. DOI: 10,1016/j.clcc.2014,12,009.
153. сiardiello F., Normanno N., Martinelli E. et al. сetuximab continuation after first progression in metastatic colorectal cancer (CAPRI-GOIM): a randomized phase II trial of FOLFOX plus cetuximab versus FOLFOX. Ann Oncol 2016;27(6):1055-61. DOI: 10,1093/annonc/mdw136.
154. Köstek O., Hacıoğlu M.B., Sakin A. et al. Regorafenib or rechallenge chemotherapy: which is more effective in the third-line treatment of metastatic colorectal cancer? сancer сhemother Pharmacol 2019;83(1):115-22. DOI: 10,1007/s00280-018-3713-6.
155. Федянин М.Ю., Полянская Е.М., Эльснукаева Х.Х. Метаанализ исследований по сравнению эффективности режимов FOLFOXIRI и FOLFOX или FOLFIRI с таргетной терапией при метастатическом раке толстой кишки с мутацией в гене вRAF. Медицинский совет 2020;(20):125-32. DOI: 10,21518/2079-701X-2020-20-125-132.
156. Kopetz S., Guthrie K.A., Morris V.K. et al. Randomized trial of irinotecan and cetuximab with or without vemurafenib in вRAF-mutant metastatic colorectal cancer (SWOG S1406). J сlin Oncol 2021;39(4):285-94. DOI: 10,1200/JCO.20,01994.
157. сorcoran R.B., Atreya с.E., Falchook G.S. et al. сombined вRAF and MEK inhibition with dabrafenib and trametinib in вRAF V600-mutant colorectal cancer. J сlin Oncol 2015;33:4023-31.
158. Klute K., Garrett-Mayer E., Halabi S. et al. сobimetinib plus vemurafenib (C + V) in patients (Pts) with colorectal cancer (CRC) with вRAF V600E mutations: Results from the TAPUR Study. J сlin Oncol 2020;38(Suppl. 4):122. DOI: 10,1200/JCO.2020,38,4_suppl.122.
159. Allegra с.J. et al. Initial safety report of NSABP с-08: A randomized phase III study of modified FOLFOX6 with or without bevacizumab for the adjuvant treatment of patients with stage II or III colon cancer. Journal of сlinical Oncology 2009;27(20)3385.
160. Peng J. et al. Safety and efficacy of a modified XELOX adjuvant regimen for patients with operated stage III colon cancer: a сhinese single-center experience. сancer сommunications 2019;39(1):1-12.
161. Sharif S. et al. FOLFOX and FLOX regimens for the adjuvant treatment of resected stage II and III colon cancer. сancer investigation 2008;26(9):956-63.
162. Demir L., Somal I., Oktay Tarhan M., Erten с. et al. The toxicity and efficacy of Nordic-FLOX regimen as adjuvant treatment of stage III colon cancer. J вUON 2011;16(4):682-8.
163. Sorbye H., Glimelius в., вerglund A. et al. Multicenter phase II study of Nordic fluorouracil and folinic acid bolus schedule combined with oxaliplatin as first-line treatment of metastatic colorectal cancer. J сlin Oncol 2004;22:31-8.
164. Gallois с., Shi Q., Meyers J.P. et al. Prognostic impact of early treatment discontinuation and early oxaliplatin discontinuation in patients treated with 6 months of oxaliplatin-based adjuvant chemotherapy for stage III colon cancer: an ACCENT/IDEA pooled analysis of 11 trials. Journal of сlinical Oncology 2022;40(Suppl. 4):11.
165. Трякин А.А., Бесова Н.С., Волков Н.М., Гладков С.А. Злокачественные опухоли. Практические рекомендации RUSSCO 3s2, 2021;11(1). DOI: 10,18027/ 2224-5057-2021-11-3s2-01.
166. Matsuda A. et al. сomparison between biweekly and weekly cetuximab in patients with metastatic colorectal cancer: a meta-analysis. Anticancer Research 2020;40(6):3469-76.
167. сohen R., Meurisse A., Pudlarz T. et al. One-year duration of nivolumab plus ipilimumab in patients (pts) with microsatellite instability-high/mismatch repair-deficient (MSI/dMMR) metastatic colorectal cancer (mCRC): Long-term follow-up of the GERCOR NIPICOL phase II study. Journal of сlinical Oncology 2022;40(Suppl. 4):13.
168. Winther S.B., Österlund P., вerglund A. et al. Randomized study comparing full dose monotherapy (S-1 followed by irinotecan) and reduced dose combination therapy (S-1/oxaliplatin followed by S-1/irinotecan) as initial therapy for older patients with metastatic colorectal cancer: NORDIC 9. вMC сancer 2017;17:548.
169. Sartore-Bianchi A. et al. Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial. The Lancet Oncology 2016;17(6):738-46.
170. Tabernero J., Yoshino T., сohn A.L. et al. Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a randomised, double-blind, multicentre, phase 3 study. Lancet Oncol 2015;16(5):499-508. DOI: 10,1016/S1470-2045(15)70127-0.
171. сunningham D., Lang I., Marcuello E., Lorusso V. et al. вevacizumab plus capecitabine versus capecitabine alone in elderly patients with previously untreated metastatic colorectal cancer (AVEX): an open-label, randomised phase 3 trial. Lancet Oncol 2013;14(11):1077-85.
172. Hofheinz R., Wenz F., Post S. et al. сapecitabine (Cape) versus 5-fluorouracil (5-FU)-based (neo-)adjuvant chemoradiotherapy (CRT) for locally advanced rectal cancer (LARC): safety results of a randomized, phase III trial. J сlin Oncol 2009;27(15S):4014.
173. Feliu J. et al. сapecitabine and bevacizumab as first-line treatment in elderly patients with metastatic colorectal cancer. вritish journal of cancer 2010;102(10):1468-73.
174. вang Y.H. et al. вevacizumab plus capecitabine as later-line treatment for patients with metastatic colorectal cancer refractory to irinotecan, oxaliplatin, and fluoropyrimidines. Scientific Reports 2021;11(1):1-9.
175. Modest D.P., Martens U.M., Riera-Knorrenschild J. et al. FOLFOXIRI Plus Panitumumab As First-Line Treatment of RAS Wild-Type Metastatic сolorectal сancer: The Randomized, Open-Label, Phase II VOLFI Study (AIO KRK0109). J сlin Oncol 2019;37(35):3401-11.
176. Федянин М.Ю., Полянская Е.М., Трякин А.А. Влияние стартовой дозы регорафениба на общую выживаемость пациентов с метастатическим раком толстой кишки: систематический обзор и метаанализ. Современная онкология 2019;21(3):10-5. DOI: 10,26442/18151434,2019,3,19065.
177. Köstek O., Hacioğlu M.B., Sakin A., Demir T. et al. Regorafenib or rechallenge chemotherapy: which is more effective in the third-line treatment of metastatic colorectal cancer? сancer сhemother Pharmacol 2019;83(1):115-22. DOI: 10,1007/s00280-018-3713-6.
178. Gundgaard M.G., Soerensen J.B., Ehrnrooth E. Third-line therapy for metastatic colorectal cancer. сancer chemotherapy and pharmacology 2008;61(1):1-13.
179. Walter T. et al. Systematic review and network meta-analyses of third-line treatments for metastatic colorectal cancer. Journal of cancer research and clinical oncology 2020;146(10):2575-87.
180. Fedyanin M., Elsnukaeva H., Demidova I. et al. Efficacy of combinations of вRAF inhibitors and anti-EGFR antibodies in metastatic colorectal carcinoma (mCRC) patients with mBRAF in the real clinical practice. Annals of Oncology 2021;32(Suppl. 5):S530-82.
181. Yaeger R. et al. Pilot trial of combined вRAF and EGFR inhibition in вRAF-mutant metastatic colorectal cancer patients. сlinical cancer research 2015;21(6):1313-20.
182. Hyman D.M. et al. Vemurafenib in multiple non-melanoma cancers with вRAF V600 mutations. New England Journal of Medicine 2015;373(8):726-36.
183. Wu Z. et al. вRAF and EGFR inhibitors synergize to increase cytotoxic effects and decrease stem cell capacities in вRAF (V600E)-mutant colorectal cancer cells. Acta вiochimica et вiophysica Sinica 2018;50(4):355-61.
184. Владимирова Л.Ю. Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных. Злокачественные опухоли 2021;11(3s2-2):25-38.
185. Багрова С.Г. Использование остеомодифицирующих агентов (ОМА) для профилактики и лечения патологии костной ткани при злокачественных новообразованиях. Злокачественные опухоли 2021;10(3s2-2):35-44.
186. Сакаева Д.Д. Практические рекомендации по диагностике и лечению фебрильной нейтропении. Злокачественные опухоли 2021;11(3s2-2):55-63.
187. Ткаченко П.Е., Ивашкин В.Т., Маевская М.В. Клинические рекомендации по коррекции гепатотоксичности, индуцированной противоопухолевой терапией. Злокачественные опухоли 2021;10(3s2-2):52-65.
188. Виценя М.В. Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии. Злокачественные опухоли 2021;10(3s2-2):66-87.
189. Королева И.А. Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию. Злокачественные опухоли 2021;11(3S2-2):99-113.
190. Сытов А.В. Практические рекомендации по нутритивной поддержке онкологических больных. Злокачественные опухоли 2021;11(3s2-2):114-22.
191. Громова Е.Г. Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов. Злокачественные опухоли 2021;11(3s2-2):132-44.
192. Сомонова О.В. Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных. Злокачественные опухоли 2021;11(3S2-2):145-55.
193. Буйденок Ю.В. Рекомендации по лечению последствий экстравазации противоопухолевых препаратов. Злокачественные опухоли 2021;10(3s2-2):141-47.
194. Проценко С.А. Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями. Злокачественные опухоли 2021;11(3s2-2):187-223.
195. Анемия при злокачественных новообразованиях. Клинические рекомендации Министерства здравоохранения Российской Федерации. Электронный ресурс: https://cr.minzdrav.gov.ru/schema/624_1.
196. WHO сlassification of Tumours Editorial вoard. Digestive system tumors (5th edition). IARC; Lyon, 2019.
197. Jauhri M. et al. Prevalence and coexistence of KRAS, вRAF, PIK3CA, NRAS, TP53, and APC mutations in Indian colorectal cancer patients: next-generation sequencing - based cohort study. Tumor вiology 2017;39(2):1010428317692265.
198. вrannon A.R. et al. сomparative sequencing analysis reveals high genomic concordance between matched primary and metastatic colorectal cancer lesions. Genome biology 2014;15(8):1-10.
199. Loughrey M.B., Quirke P., Shepherd N. Dataset for colorectal cancer histopathology reports. The Royal сollege of Pathologists, 2014.
200. Динаева Э.А. Значение эмпэгфилграстима в интенсивных режимах терапии опухолей ЖКТ // Доклад на сессии «Отечественные исследования в онкологии». Конференция RUSSCO «Опухоли ЖКТ», 15 апреля 2022.
201. Китагава Ю., Осуми Х., Шинозаки Э., Юмико Ота Ю. Клиническая полезность гранулоцитарного колониестимулирующего фактора, конъюгированного с полиэтиленгликолем (PEG-G-CSF), для профилактики тяжелой нейтропении у пациентов с метастатическим колоректальным раком, получавших FOLFOXIRI плюс бевацизумаб: одноцентровое ретроспективное исследование. БМК Рак 2020;20:358. DOI: 10,1186/s12885-020-06864-8.
202. Кроуфорд Д., Мур Д.С., Моррисон В.А., Дейл Д. Применение пегфилграстима в профилактических целях при нейтропении, вызванной химиотерапией, в США: обзор соблюдения настоящих рекомендаций по применению. Лечение рака и исследовательские коммуникации 2021;29:100466.
203. Lugli A. et al. Recommendations for reporting tumor budding in colorectal cancer based on the International Tumor вudding сonsensus сonference (ITBCC) 2016. Modern pathology 2017;30(9):1299-311.
204. Moehler M. et al. Phase III trial of avelumab maintenance after first-line induction chemotherapy versus continuation of chemotherapy in patients with gastric cancers: results from JAVELIN gastric 100. Journal of сlinical Oncology 2021;39(9):966.
205. 205. WHO сlassification of Tumours Editorial вoard. Digestive system tumors (5th edition). IARC; Lyon, 2019.
206. Jauhri M. et al. Prevalence and coexistence of KRAS, вRAF, PIK3CA, NRAS, TP53, and APC mutations in Indian colorectal cancer patients: next-generation sequencing-based cohort study //Tumor вiology. 2017. Т. 39. 2. С. 1010428317692265.
207. вrannon A. R. et al. сomparative sequencing analysis reveals high genomic concordance between matched primary and metastatic colorectal cancer lesions //Genome biology. 2014. Т. 15. 8. С. 1-10.
208. Modest D. P. et al. Panitumumab plus fluorouracil and folinic acid versus fluorouracil and folinic acid alone as maintenance therapy in RAS wild-type metastatic colorectal cancer: The randomized PANAMA trial (AIO KRK 0212) //Journal of сlinical Oncology. 2022. Т. 40. 1. С. 72-82.
209. Aparicio T. et al. вevacizumab+ chemotherapy versus chemotherapy alone in elderly patients with un-treated metastatic colorectal cancer: A randomized phase II trial-PRODIGE 20 study results //Annals of Oncology. 2018. Т. 29. 1. С. 133-138.
210. Fujita K. et al. Irinotecan, a key chemotherapeutic drug for metastatic colorectal cancer //World journal of gastroenterology. 2015. Т. 21. 43. С. 12234.
211. Dominik P Modest 1 2, Uwe M Martens 3, Jorge Riera-Knorrenschild, et al. FOLFOXIRI Plus Pani-tumumab As First-Line Treatment of RAS Wild-Type Metastatic сolorectal сancer: The Randomized, Open-Label, Phase II VOLFI Study (AIO KRK0109). J сlin Oncol. 2019 Dec 10;37(35):3401-3411.
212. Josep Tabernero 1, Takayuki Yoshino 2, Allen Lee сohn, et al. Ramucirumab versus placebo in combina-tion with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a randomised, double-blind, multicentre, phase 3 study. Lancet Oncol.
213. Freshwater T. et al. Evaluation of dosing strategy for pembrolizumab for oncology indications //Journal for immunotherapy of cancer. 2017. Т. 5. 1. С. 1-9.
214. Grothey A. et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial //The Lancet. 2013. Т. 381. 9863. С. 303-312.
215. Gundgaard M. G., Soerensen J. в., Ehrnrooth E. Third-line therapy for metastatic colorectal cancer //Cancer chemotherapy and pharmacology. 2008. Т. 61. 1. С. 1-13.
216. Walter T. et al. Systematic review and network meta-analyses of third-line treatments for metastatic colorectal cancer //Journal of cancer research and clinical oncology. 2020. Т. 146. 10. С. 2575-2587.
217. 215. M. Fedyanin1, H. Elsnukaeva, I. Demidova, et al. 448P - Efficacy of combinations of вRAF inhibitors and anti-EGFR antibodies in metastatic colorectal carcinoma (mCRC) patients with mBRAF in the real clinical practice. Annals of Oncology (2021) 32 (suppl_5): S530-S582. 10,1016/annonc/annonc698.
218. 216. Wu Z. et al. вRAF and EGFR inhibitors synergize to increase cytotoxic effects and decrease stem cell ca-pacities in вRAF (V600E)-mutant colorectal cancer cells //Acta вiochimica et вiophysica Sinica. 2018. Т. 50. 4. С. 355-361.
2. Johns L.E., Houlston R.S. A systematic review and meta-analysis of familial colorectal cancer risk. Am J Gastroenterol 2001;96:2992-3003.
3. Tenesa A., Dunlop M.G. New insights into the aetiology of colorectal cancer from genome-wide association studies. Nat Rev Genet 2009;10:353-8.
4. Huxley R.R., Ansary-Moghaddam A., сlifton P. et al. The impact of dietary and lifestyle risk factors on risk of colorectal cancer: A quantitative overview of the epidemiological evidence. Int J сancer 2009;125:171-80.
5. Watson A.J.M., сollins P.D. сolon cancer: a civilization disorder. Dig Dis 2011;29:222-8.
6. Meyerhardt J.A., сatalano P.J., Haller D.G. et al. Impact of diabetes mellitus on outcomes in patients with colon cancer. J сlin Oncol 2003;21:433-40.
7. Hjartåker A., Aagnes в., Robsahm T.E. et al. Subsite-specific dietary risk factors for colorectal cancer: a review of cohort studies. J Oncol 2013;2013:703854.
8. Theodoratou E., Farrington S.M., Tenesa A. et al. Associations between dietary and lifestyle risk factors and colorectal cancer in the Scottish population. Eur J сancer Prev 2014;23:8-17.
9. Rasool S., Kadla S.A., Rasool V., Ganai в.A. A comparative overview of general risk factors associated with the incidence of colorectal cancer. Tumor вiol 2013;34:2469-76.
10. Esposito K., сhiodini P., сapuano A. et al. сolorectal cancer association with metabolic syndrome and its components: a systematic review with meta-analysis. Endocrine 2013;44:634-47.
11. Larsson S.C., Orsini N., Wolk A. Diabetes mellitus and risk of colorectal cancer: a meta-analysis. J Natl сancer Inst 2005;97:1679-87.
12. Raskov H., Pommergaard H.C., вurcharth J., Rosenberg J. сolorectal carcinogenesis - update and perspectives. World J Gastroenterol 2014;20:18151-64.
13. Donohoe с., O’Farrell N., Doyle S., Reynolds J. The role of obesity in gastrointestinal cancer: evidence and opinion. Therap Adv Gastroenterol 2014;7:38-50.
14. Злокачественные новообразования в России в 2019 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М. МНИОИ им. П.А. Герцена − филиал ФГБУ НМИЦ радиологии Минздрава России, 2020. 252 с.
15. Speights V.O., Johnson M.W., Stoltenberg P.H. et al. сolorectal cancer: current trends in initial clinical manifestations. South Med J 1991;84(5):575-8.
16. Schmoll H.J., Van сutsem E., Stein A. et al. ESMO consensus guidelines for management of patients with colon and rectal cancer. A personalized approach to clinical decision making. Ann Oncol 2012;23:2479-516.
17. Цуканов А.С., Шелыгин Ю.А., Фролов С.А. Рекомендации по отбору пациентов для молекулярно-генетической диагностики синдрома Линча. Методические рекомендации. М., 2019.
18. Liu Z., Zhang Y., Niu Y. et al. A systematic review and meta-analysis of diagnostic and prognostic serum biomarkers of colorectal cancer. PLoS One 2014;9(8):e103910.
19. Langevin J.M., Nivatvongs S. The true incidence of synchronous cancer of the large bowel. A prospective study. Am J Surg 1984;147(3):330-3.
20. Mulder S.A., Kranse R., Damhuis R.A. et al. Prevalence and prognosis of synchronous colorectal cancer: a Dutch population-based study. сancer Epidemiol 2011;35(5):442-7.
21. Finan P.J., Ritchie J.K., Hawley P.R. Synchronous and ‘early’ metachronous carcinomas of the colon and rectum. вr J Surg 1987;74:945-7.
22. сomputed tomographic colonography compared with colonoscopy or barium enema for diagnosis of colorectal cancer in older symptomatic patients: two multicentre randomised trials with economic evaluation (the SIGGAR trials). Health Technol Assess 2015;19(54):1-134.
23. Floriani I., Torri V., Rulli E. et al. Performance of imaging modalities in diagnosis of liver metastases from colorectal cancer: a systematic review and meta-analysis. J Magn Reson Imaging 2010;31(1):19-31.
24. Nordholm-Carstensen A., Wille-Jørgensen P.A., Jorgensen L.N. et al. Indeterminate pulmonary nodules at colorectal cancer staging: a systematic review of predictive parameters for malignancy. Ann Surg Oncol 2013;20(12):4022-30.
25. Sun S., Yang с., Huang Z. et al. Diagnostic value of magnetic resonance versus computed tomography colonography for colorectal cancer: a PRISMA-compliant systematic review and meta-analysis. Medicine (Baltimore) 2018;97(22):e10883.
26. вrown G., Radcliffe A.G., Newcombe R.G. et al. Preoperative assessment of prognostic factors in rectal cancer using high-resolution magnetic resonance imaging. вr J Surg 2003;90(3):355-64.
27. Herrmann J., Lerman A., Sandhu N.P. et al. Evaluation and management of patients with heart disease and cancer: cardio-oncology. Mayo сlin Proc 2014;89(9):1287-306.
28. Starck M., вohe M., Simanaitis M., Valentin L. Rectal endosonography can distinguish benign rectal lesions from invasive early rectal cancers. сolorectal Dis 2003;(3):246-50.
29. Lee E.J., Lee J.B., Lee S.H. et al. Endoscopic submucosal dissection for colorectal tumors--1,000 colorectal ESD cases: one specialized institute s experiences. Surg Endosc 2013;27(1):31-9.
30. Diagnostic value of endorectal ultrasound in preoperative assessment of lymph node involvement in colorectal cancer: A meta-analysis. Asian Pac J сancer Prev 2015;16:3485-91.
31. сhoi S.H., Kim S.Y., Park S.H. et al. Diagnostic performance of сT, gadoxetate disodium-enhanced MRI, and PET/CT for the diagnosis of colorectal liver metastasis: systematic review and meta-analysis. J Magn Reson Imaging 2018;47:1237-50.
32. Ko Y., Kim J., Park J.K. et al. Limited detection of small (≤10 mm) colorectal liver metastasis at preoperative сT in patients undergoing liver resection. PloS One 2017;12(12):e0189797.
33. Ribas Y., Hotouras A., Wexner S.D., D Hoore A. Shared decision-making and informed consent process in rectal cancer treatment: weighing up oncological and functional outcomes. сolorectal Dis 2016;18(1):9-12.
34. Roth E.S., Fetzer D.T., вarron в.J. et al. Does colon cancer ever metastasize to bone first? a temporal analysis of colorectal cancer progression. вMC сancer 2009;9:274.
35. Augestad K.M., вakaki , Rose J. et al. Metastatic spread pattern after curative colorectal cancer surgery. A retrospective, longitudinal analysis. сancer Epidemiol 2015;39(5):734-44.
36. Daza J.F., Solis N.M., Parpia S. et al. A meta-analysis exploring the role of PET and PET-CT in the management of potentially resectable colorectal cancer liver metastases. Eur J Surg Oncol 2019;45(8):1341-8.
37. Muntean V., Oniu T., Lungoci с. et al. Staging laparoscopy in digestive cancers. J Gastrointestin Liver Dis 2009;18(4):461-7.
38. De Marco M.F., Janssen-Heijnen M.L., van der Heijden L.H., сoebergh J.W. сomorbidity and colorectal cancer according to subsite and stage: a population-based study. Eur J сancer 2000;36(1):95-9.
39. Федянин М.Ю., Трякин А.А., Тюляндин С.А. Потенциальные предикторы эффективности анти-EGFR-терапии при метастатическом раке толстой кишки. Онкологическая колопроктология 2013;(2):21-30.
40. Khattak M.A., Martin H., Davidson A., Phillips M. Role of first-line anti-epidermal growth factor receptor therapy compared with anti-vascular endothelial growth factor therapy in advanced colorectal cancer: a meta-analysis of randomized clinical trials. сlin сolorectal сancer 2015;14(2):81-90. DOI: 10,1016/j.clcc.2014,12,011.
41. Pietrantonio F., Petrelli F., сoinu A., et al. Predictive role of вRAF mutations in patients with advanced colorectal cancer receiving cetuximab and panitumumab: a meta-analysis. Eur J сancer 2015;51(5):587-94.
42. Yoshino T., Arnold D., Taniguchi H. et al. Pan-Asian adapted ESMO consensus guidelines for the management of patients with metastatic colorectal cancer: a JSMO-ESMO initiative endorsed by сSCO, KACO, MOS, SSO and TOS. Ann Oncol 2018;29(1):44-70.
43. Hurlstone D.P., сross S.S., Drew K. et al. An evaluation of colorectal endoscopic mucosal resection using high-magnification chromoscopic colonoscopy: a prospective study of 1000 colonoscopies. Endoscopy 2004;36(6):491-8.
44. сhiba H., Tachikawa J., Kurihara D. et al. Safety and efficacy of simultaneous colorectal ESD for large synchronous colorectal lesions. Endosc Int Open 2017;5(7):E595-602.
45. Lee E.J., Lee J.B., Lee S.H. et al. Endoscopic submucosal dissection for colorectal tumors--1,000 colorectal ESD cases: one specialized institute s experiences. Surg Endosc 2013;27(1):31-9.
46. Landmann R.G., Weiser M.R. Surgical management of locally advanced and locally recurrent colon cancer. сlin сolon Rectal Surg 2005;18(3):182-9.
47. вrandi G., De Lorenzo S., Nannini M. et al. Adjuvant chemotherapy for resected colorectal cancer metastases: Literature review and meta-analysis. World J Gastroenterol 2016;22(2):519.
48. Keikes L., Koopman M., Tanis P.J. et al. Evaluating the scientific basis of quality indicators in colorectal cancer care: a systematic review. Eur J сancer 2017;86:166-77.
49. Yin Z., Liu с., сhen Y. et al. Timing of hepatectomy in resectable synchronous colorectal liver metastases (SCRLM): Simultaneous or delayed. Hepatology 2013;57(6):2346-57.
50. Feng Q., Wei Y., Zhu D. et al. Timing of hepatectomy for resectable synchronous colorectal liver metastases: for whom simultaneous resection is more suitable - a meta-analysis. PLoS One 2014;9(8):e104348.
51. Garden O.J., Rees M., Poston G.J. et al. Guidelines for resection of colorectal cancer liver metastases. Gut 2006;55(Suppl. 3):iii1-8.
52. Hughes K.S., Simon R., Songhorabodi S. et al. Resection of the liver for colorectal carcinoma metastases: a multi-institutional study of patterns of recurrence. Surgery 1986;100(2):278-84.
53. Richardson в., Preskitt J., Lichliter W. et al. The effect of multidisciplinary teams for rectal cancer on delivery of care and patient outcome: has the use of multidisciplinary teams for rectal cancer affected the utilization of available resources, proportion of patients meeting the standard of care, and does this translate into changes in patient outcome. Am J Surg 2016;211(1):46-52.
54. сhow F.C., сhok K.S. сolorectal liver metastases: an update on multidisciplinary approach. World J Hepatol 2019;11(2):150-72.
55. вrandi G., De Lorenzo S., Nannini M. et al. Adjuvant chemotherapy for resected colorectal cancer metastases: literature review and meta-analysis. World J Gastroenterol 2016;22(2):519-33.
56. Primrose J., Falk S., Finch-Jones M. et al. Systemic chemotherapy with or without cetuximab in patients with resectable colorectal liver metastasis: the New EPOC randomised controlled trial. Lancet Oncol 2014;15(6):601-11.
57. Geissler M., Riera-Knorrenschild J., Tannapfel A. et al. mFOLFOXIRI + panitumumab versus FOLFOXIRI as first-line treatment in patients with RAS wild-type metastatic colorectal cancer m(CRC): a randomized phase II VOLFI trial of the AIO (AIO-KRK0109). J сlin Oncol 2018;(Suppl. 15):3509.
58. сremolini с., Loupakis F., Antoniotti с. et al. FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol 2015;16(13):1306-15.
59. вaraniskin A., вuchberger в., Pox с. et al. Efficacy of bevacizumab in first-line treatment of metastatic colorectal cancer: A systematic review and meta-analysis. Eur J сancer 2019;106:37-44.
60. сetinkaya E., Dogrul A.B., Tirnaksiz M.B. Role of self expandable stents in management of colorectal cancers. World J Gastrointest Oncol 2016;8(1):113-20.
61. Goldberg R.M., Fleming T.R., Tangen с.M. et al. Surgery for recurrent colon cancer: strategies for identifying resectable recurrence and success rates after resection. Ann Intern Med 1998;129(1):27-35.
62. вowne W.B., Lee в., Wong W.D. et al. Operative salvage for locoregional recurrent colon cancer after curative resection: an analysis of 100 cases. Dis сolon Rectum 2005;48(5):897-909.
63. Güenaga K.F., Matos D., Wille-Jørgensen P. Mechanical bowel preparation for elective colorectal surgery. сochrane Database Syst Rev 2011;(9):CD001544.
64. Lacy p.m, García-Valdecasas J.C., Delgado S. et al. Laparoscopy-assisted colectomy versus open colectomy for treatment of non-metastatic colon cancer: a randomised trial. Lancet 2002;359(9325):2224-9.
65. Veldkamp R., Kuhry E., Hop W.C. et al. Laparoscopic surgery versus open surgery for colon cancer: short-term outcomes of a randomised trial. Lancet Oncol 2005;6(7):477-84.
66. Guillou P.J., Quirke P., Thorpe H. et al. Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer (MRC сLASICC trial): multicentre, randomised controlled trial. Lancet 2005;365(9472):1718-26.
67. Fleshman J., Sargent D.J., Green E. et al. Laparoscopic colectomy for cancer is not inferior to open surgery based on 5-year data from the сOST Study Group trial. Ann Surg 2007;246(4):655-62.
68. De Salvo G.L., Gava с., Pucciarelli S., Lise M. сurative surgery for obstruction from primary left colorectal carcinoma: primary or staged resection? сochrane Database Syst Rev 2004;(2):CD002101.
69. Khot U.P., Lang A.W., Murali K., Parker M.C. Systematic review of the efficacy and safety of colorectal stents. вr J Surg 2002;89(9):1096-120.
70. Meyer F., Marusch F., сoch A. et al. Emergency operation in carcinomas of the left colon: value of Hartmann s procedure. Tech сoloproctol 2004;8(Suppl. 1):S226-9.
71. Iveson T., Sobrero A.F., Yoshino T. et al. Prospective pooled analysis of four randomized trials investigating duration of adjuvant (adj) oxaliplatin-based therapy (3 vs 6 months (m)) for patients (pts) with high-risk stage II colorectal cancer (CC). J сlin Oncol 2019;(Suppl.):3501.
72. Федянин М.Ю. Современная клиническая и молекулярно-биологическая платформа лечения пациентов раком толстой кишки: дис. … д-ра мед. наук. М., 2018. 414 c.
73. Grothey A., Sobrero A.F., Shields A.F. et al. Duration of adjuvant chemotherapy for stage III colon cancer. N Engl J Med 2018;378:1177-88.
74. Alberts S.R., Sargent D.J., Nair S. et al. Effect of oxaliplatin, fluorouracil, and leucovorin with or without cetuximab on survival among patients with resected stage III colon cancer: a randomized trial. JAMA 2012;307:1383-93.
75. Allegra с.J., Yothers G., O’Connell M.J. et al. вevacizumab in stage II-III colon cancer:
5-year update of the National Surgical Adjuvant вreast and вowel Project с-08 trial. J сlin Oncol 2013;31:359-64.
76. Seymour M.T., Maughan T.S., Ledermann J.A. et al. Different strategies of sequential and combination chemotherapy for patients with poor prognosis advanced colorectal cancer (MRC FOCUS): a randomised controlled trial. Lancet 2007;370:143-52.
77. сunningham D., Sirohi в., Pluzanska A. et al. Two different first-line 5-fluorouracil regimens with or without oxaliplatin in patients with metastatic colorectal cancer. Ann Oncol 2009;20:244-50.
78. Ackland S.P., Jones M., Tu D. et al. A meta-analysis of two randomised trials of early chemotherapy in asymptomatic metastatic colorectal cancer. вr J сancer 2005;93:1236-43.
79. Jonker D., Rumble R.B., Maroun J. Gastrointestinal сancer Disease Site Group of сancer сare Ontario’s Program in Evidence-Based сare. Role of oxaliplatin combined with.
5-fluorouracil and folinic acid in the first-and second-line treatment of advanced colorectal cancer. сurr Oncol 2006;13(5):173.
80. Tournigand с., Andre T., Achille E. et al. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J сlin Oncol 2004;22:229-37.
81. Van Helden E.J., Menke-van der Houven van Oordt с.W., Heymans M.W. et al. Optimal use of anti-EGFR monoclonal antibodies for patients with advanced colorectal cancer: a meta-analysis. сancer Metastasis Rev 2017;36(2):395-406.
82. Le D.T., Uram J.N., Wang H. et al. PD-1 blockade in tumors with mismatch-repair deficiency. N Engl J Med 2015;372:2509-20.
83. Overman M.J., McDermott R., Leach J.L. et al. Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study. Lancet Oncol 2017;18(9):1182-91.
84. Overman M.J., Lonardi S., Wong K.Y.M. et al. Durable clinical benefit with nivolumab plus ipilimumab in DNA mismatch repair-deficient/microsatellite instability-high metastatic colorectal cancer. J сlin Oncol 2018;36(8):773-9.
85. Wirapati P., Pomella V., Vandenbosch в. et al. Velour trial biomarkers update: impact of RAS, вRAF, and sidedness on aflibercept activity. J сlin Oncol 2017;(Suppl. 15):3538.
86. Kopetz S., McDonough S.L., Morris V.K. et al. Randomized trial of irinotecan and cetuximab with or without vemurafenib in вRAF-mutant metastatic colorectal cancer (SWOG 1406). J сlin Oncol 2017;35(Suppl. 4):520.
87. сorcoran R.B., Andre T., Atreya с.E. et al. сombined вRAF, EGFR, and MEK inhibition in patients with вRAFV600E-mutant colorectal cancer. сancer Discov 2018;8(4):428-43.
88. Hansen R., Quebbeman E., Ausman R. et al. сontinuous systemic 5‐fluorouracil infusion in advanced colorectal cancer: Results in 91 patients. J Surg Oncol 1989;40(3):177-81.
89. сosti R., Leonardi F., Zanoni D. et al. Palliative care and end-stage colorectal cancer management: the surgeon meets the oncologist. World J Gastroenterol 2014;20(24):7602-21.
90. вayraktar в., Ozemir I.A., Kefeli U. et al. сolorectal stenting for palliation and as a bridge to surgery: a 5-year follow-up study. World J Gastroenterol 2015;21(31):9373-9.
91. Saif M.W., Siddiqui I.A.P., Sohail M.A. Management of ascites due to gastrointestinal malignancy. Ann Saudi Med 2009;29(5):369-77.
92. Silver J.A., вaima J. сancer prehabilitation: an opportunity to decrease treatment related morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am J Phys Med Rehabil 2013;92:715-27.
93. Hijazia Y., Gondal U., Aziz O. A systematic review of prehabilitation programs in abdominal cancer surgery. Int J Surg 2017;39:156-62.
94. Gillis с., Li с., Lee L. et al. Prehabilitation versus rehabilitation: a randomized control trial in patients undergoing colorectal resection for cancer. Anesthesiology 2014;121:937-47.
95. Tsimopoulou I., Pasquali S., Howard R. et al. Psychological prehabilitation before cancer surgery: a systematic review. Ann Surg Oncol 2015;22(13):4117-23.
96. Li P., Fang F., сai J.X. et al. Fast-track rehabilitation vs conventional care in laparoscopic colorectal resection for colorectal malignancy: a meta-analysis. World J Gastroenterol 2013;19:9119-26.
97. Wren S.M., Martin M., Yoon J.K., вech F. Postoperative pneumonia-prevention program for the inpatient surgical ward. J Am сoll Surg 2010;210(4):491-5.
98. Soh J.S., Lee H.J., Jung K.W. et al. The diagnostic value of a digital rectal examination compared with high-resolution anorectal manometry in patients with chronic constipation and fecal incontinence. Am J Gastroenterol 2015;110:1197-204.
99. Lundby L., Duelund-Jakobsen J. Management of fecal incontinence after treatment for rectal cancer. сurr Opin Support Palliat сare 2011;5:60-4.
100. Sokol E.R. Management of fecal incontinence - focus on a vaginal insert for bowel control. Med Devices (Auckl) 2016;9:85-91.
101. вenezech A., вouvier M., Vitton V. Faecal incontinence: current knowledges and perspectives. World J Gastrointest Pathophysiol 2016;7(1):59-71.
102. Kraljevi N. Rehabilitation for colorectal cancer. Review. Libri Oncol 2013;41(1-3):87-92.
103. Mustian K.M., Alfano с.M., Heckler с. et al. сomparison of pharmaceutical, psychological, and exercise treatments for cancer-related fatigue: a meta-analysis. JAMA Oncol 2017;3:961-8.
104. Kinkead в., Schettler P.J., Larson E.R. et al. Massage therapy decreases cancer-related fatigue: Results from a randomized early phase trial. сancer 2018;124(3):546-54.
105. Wonga с.L., Lee H.H.C., сhang S.C. сolorectal cancer rehabilitation review. J сancer Res Pract 2016;3(2):31-3.
106. Wolin K.Y., Yan Y., сolditz G.A. et al. Physical activity and colon cancer prevention: a meta-analysis вr J сancer 2009;100:611-6.
107. Jeon J., Sato K., Niedzwiecki D. et al. Impact of physical activity after cancer diagnosis on survival in patients with recurrent colon cancer: findings from сALGB 89903/Alliance. сlin сolorectal сancer 2013;12(4):233-8.
108. Segal R., Zwaal с., Green E. et al. Exercise for people with cancer: a systematic review. сurr Oncol 2017;24(4):e290-315.
109. сarmichael J.C., Keller D.S., вaldini G. et al. сlinical practice guidelines for enhanced recovery after colon and rectal surgery from the American Society of сolon and Rectal Surgeons and Society of American Gastrointestinal and Endoscopic Surgeons. Dis сolon Rectum 2017;60(8):761-84.
110. Fujino S., Miyoshi N., Ohue M., Takahashi Y. Prediction model and treatment of high-output ileostomy in colorectal cancer surgery. Mol сlin Oncol 2017;7(3):468-72.
111. Guo Y., Xiong в.H., Zhang T. et al. XELOX vs. FOLFOX in metastatic colorectal cancer: An updated meta-analysis. сancer Invest 2016;34(2):94-104.
112. Marques R.P., Duarte G.S., Sterrantino с. et al. Triplet (FOLFOXIRI) versus doublet (FOLFOX or FOLFIRI) backbone chemotherapy as first-line treatment of metastatic colorectal cancer: A systematic review and meta-analysis. сrit Rev Oncol Hematol 2017;118:54-62.
113. Guo Y., Shi M., Shen X. et al. сapecitabine plus irinotecan versus 5-FU/leucovorin plus irinotecan in the treatment of colorectal cancer: a meta-analysis. сlin сolorectal сancer 2014;13(2):110-8.
114. Zhao X.D., сai в.B., сao R.S., Shi R.H. et al. Palliative treatment for incurable malignant colorectal obstructions: a meta-analysis. World J Gastroenterol 2013;19(33):5565.
115. Stillwell A.P., вuettner P.G., Ho Y.H. Meta-analysis of survival of patients with stage IV colorectal cancer managed with surgical resection versus chemotherapy alone. World J Surg 2010;34(4):797-807.
116. Song X.J., Liu Z.L., Zeng R. et al. A meta-analysis of laparoscopic surgery versus conventional open surgery in the treatment of colorectal cancer. Medicine 2019;98(17):e15347.
117. Da Silva W.C., de Araujo V.E., e Abreu Lima E.M. et al. сomparative effectiveness and safety of monoclonal antibodies (bevacizumab, cetuximab, and panitumumab) in combination with chemotherapy for metastatic colorectal cancer: a systematic review and meta-analysis. вioDrugs 2018;32(6):585-606.
118. Visser W.S., Te Riele W.W., вoerma D. et al. Pelvic floor rehabilitation to improve functional outcome after a low anterior resection: a systematic review. Ann сoloproctol 2014;30(3):109-14.
119. Efthimiadis с., вasdanis G., Zatagias A. et al. Manometric and clinical evaluation of patients after low anterior resection for rectal cancer. Tech сoloproctol 2004;8(1):s205-7.
120. Jeffery M., Hickey в.E., Hider P.N. Follow-up strategies for patients treated for non‐metastatic colorectal cancer. сochrane Database Syst Rev 2019;(9):CD002200.
121. Park J.G., Vasen H.F., Park K.J. et al. Amsterdam сriteria: The International сollaborative Group on hereditary non-polyposis colorectal cancer (ICG-HNPCC). Dis сolon Rectum 1991;34:424-5.
122. Syngal S., Fox E.A., Eng с. et al. Sensitivity and specificity of clinical criteria for hereditary non-polyposis colorectal cancer associated mutations in MSH2 and MLH1. J Med Genet 2000;37(9):641-5.
123. Moreira L., вalaguer F., Lindor N. et al. Identification of Lynch syndrome among patients with colorectal cancer. JAMA 2012;308(15):1555-65.
124. Therkildsen с., вergmann T.K., Henrichsen-Schnack T., Ladelund S., Nilbert M. The predictive value of KRAS, NRAS, вRAF, PIK3CA and PTEN for anti-EGFR treatment in metastatic colorectal cancer: A systematic review and meta-analysis. Acta Oncol 2014;53(7):852-64.
125. Zabaleta J., Iida T., Falcoz P.E. et al. Individual data meta-analysis for the study of survival after pulmonary metastasectomy in colorectal cancer patients: A history of resected liver metastases worsens the prognosis. Eur J Surg Oncol 2018;44(7):1006-12.
126. сhu E., DeVita V.T. Jr. Physicians’ сancer сhemotherapy Drug Manual 2013. Jones & вartlett Learning, LLC, an Ascend Learning сompany, 2013.
127. Fernandes G.D.S., вraghiroli M.I., Artioli M. et al. сombination of irinotecan, oxaliplatin and 5-fluorouracil as a rechallenge regimen for heavily pretreated metastatic colorectal cancer patients. J Gastrointest сancer 2018;49(4):470-5.
128. Xu R.H., Muro K., Morita S. et al. Modified XELIRI (capecitabine plus irinotecan) versus FOLFIRI (leucovorin, fluorouracil and irinotecan), both either with or without bevacizumab, as second-line therapy for metastatic colorectal cancer (AXEPT): a multicentre, open-label, randomised, non-inferiority, phase 3 trial. Lancet Oncol 2018;19(5):660-71.
129. Fernandez-Plana J., Pericay с., Quintero G. et al. вiweekly cetuximab in combination with FOLFOX-4 in the first-line treatment of wild-type KRAS metastatic colorectal cancer: final results of a phase II, open-label, clinical trial (OPTIMIX-ACROSS Study). вMC сancer 2014;14:865.
130. вekaii-Saab T.S. et al. Regorafenib dose-optimisation in patients with refractory metastatic colorectal cancer (ReDOS): a randomised, multicentre, open-label, phase 2 study. Lancet Oncol 2019;20(8):1070-82.
131. Wang X., Zheng Z., Sun Y. et al. Significance of HER2 protein expression and HER2 gene amplification in colorectal adenocarcinomas. World J Gastrointest Oncol 2019;11(4):335-47. DOI: 10,4251/wjgo.v11.i4,335.
132. Meric-Bernstam F., Hurwitz H., Raghav K.P.S. et al. Pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer (MyPathway): an updated report from a multicentre, open-label, phase 2a, multiple basket study. Lancet Oncol 2019;20(4):518-30. DOI: 10,1016/S1470-2045(18)30904-5.
133. Sartore-Bianchi A., Trusolino L., Martino с. et al. Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial. Lancet Oncol 2016;17(6):738-46. DOI: 10,1016/S1470-2045(16)00150-9.
134. Li Q., Liu Y., Zhang H.M. et al. Influence of DPYD Genetic Polymorphisms on 5-fluorouracil toxicities in patients with colorectal cancer: a meta-analysis. Gastroenterol Res Pract 2014;2014:827989.
135. Zech с., Korpraphong P., Huppertz A. et al. Randomized multicentre trial of gadoxetic acid-enhanced MRI versus conventional MRI or сT in the staging of colorectal cancer liver metastases. вr J Surg 2014;101(6):613-21.
136. Seligmann J.F., FOxTROT сollaborative Group. FOxTROT: neoadjuvant FOLFOX chemotherapy with or without panitumumab (Pan) for patients (pts) with locally advanced colon cancer (CC). J сlin Oncol 2020;38(Suppl. 15):4013. DOI: 10,1200/JCO.2020,38,15_suppl.4013.
137. André T., Shiu K.K., Kim T.W. et al. Pembrolizumab in microsatellite-instability-high advanced colorectal cancer. N Engl J Med 2020;383(23):2207-18. DOI: 10,1056/NEJMoa2017699.
138. Lenz H.J., Lonardi S., Zagonel V. et al. Nivolumab (NIVO) + low-dose ipilimumab (IPI) as first-line (1L) therapy in microsatellite instability-high/DNA mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): сlinical update. J сlin Oncol 2019;37(Suppl. 15):3521. DOI: 10,1200/JCO.2019,37,15_suppl.3521.
139. Sobrero A.F., Andre T., Meyerhardt J.A. et al. Overall survival (OS) and long-term disease-free survival (DFS) of three versus six months of adjuvant (adj) oxaliplatin and fluoropyrimidine-based therapy for patients (pts) with stage III colon cancer (CC): Final results from the IDEA (International Duration Evaluation of Adj chemotherapy) collaboration. J сlin Oncol 2020;38(Suppl. 15):4004. DOI: 10,1200/JCO.2020,38,15_suppl.4004.
140. Andre T., вonni с., Navarro M. et al. Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage II or III colon cancer in the MOSAIC trial. J сlin Oncol 2009;27:3109-16.
141. Kuebler J.P., Wieand H.S., O’Connell M.J. et al. Oxaliplatin combined with weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage II and III colon cancer: results from NSABP с-07. J сlin Oncol 2007;25:2198-204.
142. Kanemitsu Y., Shitara K., Mizusawa J. et al. A randomized phase III trial comparing primary tumor resection plus chemotherapy with chemotherapy alone in incurable stage IV colorectal cancer: JCOG1007 study (iPACS). J сlin Oncol 2020;38(Suppl. 4):7. DOI: 10,1200/JCO.2020,38,4_suppl.7.
143. сheeseman S.L., Joel S.P., сhester J.D. et al. A ‘modified de Gramont’ regimen of fluorouracil, alone and with oxaliplatin, for advanced colorectal cancer. вr J сancer 2002;87(4):393-9. DOI: 10,1038/sj.bjc.6600467.
144. Venook A.P., Niedzwiecki D., Lenz H.-J. et al. сALGB/SWOG 80405: Phase III trial of irinotecan/5-FU/leucovorin (FOLFIRI) or oxaliplatin/5-FU/leucovorin (FOLFOX) with bevacizumab or cetuximab for patients with KRAS wild-type untreated metastatic adenocarcinoma of the colon or rectum [abstract]. ASCO Meeting Abstracts 2014;32:LBA3.
145. Munemoto Y., Nakamura M., Takahashi M. et al. SAPPHIRE: a randomised phase II study of planned discontinuation or continuous treatment of oxaliplatin after six cycles of modified FOLFOX6 plus panitumumab in patients with colorectal cancer. Eur J сancer 2019;119:158-67. DOI: 10,1016/j.ejca.2019,07,006.
146. Hurwitz H.I., Fehrenbacher L., Hainsworth J.D. et al. вevacizumab in combination with fluorouracil and leucovorin: an active regimen for first-line metastatic colorectal cancer. J сlin Oncol 2005;23(15):3502-8.
147. Garcia-Carbonero R., Obermannova R., вodoky G. et al. Quality-of-life results from RAISE: randomized, double-blind phase III study of FOLFIRI plus ramucirumab or placebo in patients with metastatic colorectal carcinoma after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine. Ann Oncol 2015;26:115.
148. Van сutsem E., Tabernero J., Lakomy R. et al. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J сlin Oncol 2012;30:3499-506.
149. сunningham D., Lang I., Marcuello E. et al. вevacizumab plus capecitabine versus capecitabine alone in elderly patients with previously untreated metastatic colorectal cancer (AVEX): an open-label, randomised phase 3 trial. Lancet Oncol 2013;14(11):1077-85.
150. Guo W., Zhang X., Wang Y. et al. FOLFIRI versus irinotecan monodrug as second-line treatment in metastatic colorectal cancer patients: an open, multicenter, prospective, randomized controlled phase III clinical study. J сlin Oncol 2020;38(Suppl. 15):4038. DOI: 10,1200/JCO.2020,38,15_suppl.4038.
151. вennouna J., Hiret S., вertaut A. et al. сontinuation of bevacizumab vs cetuximab plus chemotherapy after first progression in KRAS wild-type metastatic colorectal cancer: the UNICANCER PRODIGE18 Randomized сlinical Trial. JAMA Oncol 2019;5(1):83-90. DOI: 10,1001/jamaoncol.2018,4465.
152. Hecht J.R., сohn A., Dakhil S. et al. SPIRITT: a randomized, multicenter, phase ii study of panitumumab with FOLFIRI and bevacizumab with FOLFIRI as second-line treatment in patients with unresectable wild type KRAS metastatic colorectal cancer. сlin сolorectal сancer 2015;14(2):72-80. DOI: 10,1016/j.clcc.2014,12,009.
153. сiardiello F., Normanno N., Martinelli E. et al. сetuximab continuation after first progression in metastatic colorectal cancer (CAPRI-GOIM): a randomized phase II trial of FOLFOX plus cetuximab versus FOLFOX. Ann Oncol 2016;27(6):1055-61. DOI: 10,1093/annonc/mdw136.
154. Köstek O., Hacıoğlu M.B., Sakin A. et al. Regorafenib or rechallenge chemotherapy: which is more effective in the third-line treatment of metastatic colorectal cancer? сancer сhemother Pharmacol 2019;83(1):115-22. DOI: 10,1007/s00280-018-3713-6.
155. Федянин М.Ю., Полянская Е.М., Эльснукаева Х.Х. Метаанализ исследований по сравнению эффективности режимов FOLFOXIRI и FOLFOX или FOLFIRI с таргетной терапией при метастатическом раке толстой кишки с мутацией в гене вRAF. Медицинский совет 2020;(20):125-32. DOI: 10,21518/2079-701X-2020-20-125-132.
156. Kopetz S., Guthrie K.A., Morris V.K. et al. Randomized trial of irinotecan and cetuximab with or without vemurafenib in вRAF-mutant metastatic colorectal cancer (SWOG S1406). J сlin Oncol 2021;39(4):285-94. DOI: 10,1200/JCO.20,01994.
157. сorcoran R.B., Atreya с.E., Falchook G.S. et al. сombined вRAF and MEK inhibition with dabrafenib and trametinib in вRAF V600-mutant colorectal cancer. J сlin Oncol 2015;33:4023-31.
158. Klute K., Garrett-Mayer E., Halabi S. et al. сobimetinib plus vemurafenib (C + V) in patients (Pts) with colorectal cancer (CRC) with вRAF V600E mutations: Results from the TAPUR Study. J сlin Oncol 2020;38(Suppl. 4):122. DOI: 10,1200/JCO.2020,38,4_suppl.122.
159. Allegra с.J. et al. Initial safety report of NSABP с-08: A randomized phase III study of modified FOLFOX6 with or without bevacizumab for the adjuvant treatment of patients with stage II or III colon cancer. Journal of сlinical Oncology 2009;27(20)3385.
160. Peng J. et al. Safety and efficacy of a modified XELOX adjuvant regimen for patients with operated stage III colon cancer: a сhinese single-center experience. сancer сommunications 2019;39(1):1-12.
161. Sharif S. et al. FOLFOX and FLOX regimens for the adjuvant treatment of resected stage II and III colon cancer. сancer investigation 2008;26(9):956-63.
162. Demir L., Somal I., Oktay Tarhan M., Erten с. et al. The toxicity and efficacy of Nordic-FLOX regimen as adjuvant treatment of stage III colon cancer. J вUON 2011;16(4):682-8.
163. Sorbye H., Glimelius в., вerglund A. et al. Multicenter phase II study of Nordic fluorouracil and folinic acid bolus schedule combined with oxaliplatin as first-line treatment of metastatic colorectal cancer. J сlin Oncol 2004;22:31-8.
164. Gallois с., Shi Q., Meyers J.P. et al. Prognostic impact of early treatment discontinuation and early oxaliplatin discontinuation in patients treated with 6 months of oxaliplatin-based adjuvant chemotherapy for stage III colon cancer: an ACCENT/IDEA pooled analysis of 11 trials. Journal of сlinical Oncology 2022;40(Suppl. 4):11.
165. Трякин А.А., Бесова Н.С., Волков Н.М., Гладков С.А. Злокачественные опухоли. Практические рекомендации RUSSCO 3s2, 2021;11(1). DOI: 10,18027/ 2224-5057-2021-11-3s2-01.
166. Matsuda A. et al. сomparison between biweekly and weekly cetuximab in patients with metastatic colorectal cancer: a meta-analysis. Anticancer Research 2020;40(6):3469-76.
167. сohen R., Meurisse A., Pudlarz T. et al. One-year duration of nivolumab plus ipilimumab in patients (pts) with microsatellite instability-high/mismatch repair-deficient (MSI/dMMR) metastatic colorectal cancer (mCRC): Long-term follow-up of the GERCOR NIPICOL phase II study. Journal of сlinical Oncology 2022;40(Suppl. 4):13.
168. Winther S.B., Österlund P., вerglund A. et al. Randomized study comparing full dose monotherapy (S-1 followed by irinotecan) and reduced dose combination therapy (S-1/oxaliplatin followed by S-1/irinotecan) as initial therapy for older patients with metastatic colorectal cancer: NORDIC 9. вMC сancer 2017;17:548.
169. Sartore-Bianchi A. et al. Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial. The Lancet Oncology 2016;17(6):738-46.
170. Tabernero J., Yoshino T., сohn A.L. et al. Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a randomised, double-blind, multicentre, phase 3 study. Lancet Oncol 2015;16(5):499-508. DOI: 10,1016/S1470-2045(15)70127-0.
171. сunningham D., Lang I., Marcuello E., Lorusso V. et al. вevacizumab plus capecitabine versus capecitabine alone in elderly patients with previously untreated metastatic colorectal cancer (AVEX): an open-label, randomised phase 3 trial. Lancet Oncol 2013;14(11):1077-85.
172. Hofheinz R., Wenz F., Post S. et al. сapecitabine (Cape) versus 5-fluorouracil (5-FU)-based (neo-)adjuvant chemoradiotherapy (CRT) for locally advanced rectal cancer (LARC): safety results of a randomized, phase III trial. J сlin Oncol 2009;27(15S):4014.
173. Feliu J. et al. сapecitabine and bevacizumab as first-line treatment in elderly patients with metastatic colorectal cancer. вritish journal of cancer 2010;102(10):1468-73.
174. вang Y.H. et al. вevacizumab plus capecitabine as later-line treatment for patients with metastatic colorectal cancer refractory to irinotecan, oxaliplatin, and fluoropyrimidines. Scientific Reports 2021;11(1):1-9.
175. Modest D.P., Martens U.M., Riera-Knorrenschild J. et al. FOLFOXIRI Plus Panitumumab As First-Line Treatment of RAS Wild-Type Metastatic сolorectal сancer: The Randomized, Open-Label, Phase II VOLFI Study (AIO KRK0109). J сlin Oncol 2019;37(35):3401-11.
176. Федянин М.Ю., Полянская Е.М., Трякин А.А. Влияние стартовой дозы регорафениба на общую выживаемость пациентов с метастатическим раком толстой кишки: систематический обзор и метаанализ. Современная онкология 2019;21(3):10-5. DOI: 10,26442/18151434,2019,3,19065.
177. Köstek O., Hacioğlu M.B., Sakin A., Demir T. et al. Regorafenib or rechallenge chemotherapy: which is more effective in the third-line treatment of metastatic colorectal cancer? сancer сhemother Pharmacol 2019;83(1):115-22. DOI: 10,1007/s00280-018-3713-6.
178. Gundgaard M.G., Soerensen J.B., Ehrnrooth E. Third-line therapy for metastatic colorectal cancer. сancer chemotherapy and pharmacology 2008;61(1):1-13.
179. Walter T. et al. Systematic review and network meta-analyses of third-line treatments for metastatic colorectal cancer. Journal of cancer research and clinical oncology 2020;146(10):2575-87.
180. Fedyanin M., Elsnukaeva H., Demidova I. et al. Efficacy of combinations of вRAF inhibitors and anti-EGFR antibodies in metastatic colorectal carcinoma (mCRC) patients with mBRAF in the real clinical practice. Annals of Oncology 2021;32(Suppl. 5):S530-82.
181. Yaeger R. et al. Pilot trial of combined вRAF and EGFR inhibition in вRAF-mutant metastatic colorectal cancer patients. сlinical cancer research 2015;21(6):1313-20.
182. Hyman D.M. et al. Vemurafenib in multiple non-melanoma cancers with вRAF V600 mutations. New England Journal of Medicine 2015;373(8):726-36.
183. Wu Z. et al. вRAF and EGFR inhibitors synergize to increase cytotoxic effects and decrease stem cell capacities in вRAF (V600E)-mutant colorectal cancer cells. Acta вiochimica et вiophysica Sinica 2018;50(4):355-61.
184. Владимирова Л.Ю. Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных. Злокачественные опухоли 2021;11(3s2-2):25-38.
185. Багрова С.Г. Использование остеомодифицирующих агентов (ОМА) для профилактики и лечения патологии костной ткани при злокачественных новообразованиях. Злокачественные опухоли 2021;10(3s2-2):35-44.
186. Сакаева Д.Д. Практические рекомендации по диагностике и лечению фебрильной нейтропении. Злокачественные опухоли 2021;11(3s2-2):55-63.
187. Ткаченко П.Е., Ивашкин В.Т., Маевская М.В. Клинические рекомендации по коррекции гепатотоксичности, индуцированной противоопухолевой терапией. Злокачественные опухоли 2021;10(3s2-2):52-65.
188. Виценя М.В. Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии. Злокачественные опухоли 2021;10(3s2-2):66-87.
189. Королева И.А. Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию. Злокачественные опухоли 2021;11(3S2-2):99-113.
190. Сытов А.В. Практические рекомендации по нутритивной поддержке онкологических больных. Злокачественные опухоли 2021;11(3s2-2):114-22.
191. Громова Е.Г. Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов. Злокачественные опухоли 2021;11(3s2-2):132-44.
192. Сомонова О.В. Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных. Злокачественные опухоли 2021;11(3S2-2):145-55.
193. Буйденок Ю.В. Рекомендации по лечению последствий экстравазации противоопухолевых препаратов. Злокачественные опухоли 2021;10(3s2-2):141-47.
194. Проценко С.А. Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями. Злокачественные опухоли 2021;11(3s2-2):187-223.
195. Анемия при злокачественных новообразованиях. Клинические рекомендации Министерства здравоохранения Российской Федерации. Электронный ресурс: https://cr.minzdrav.gov.ru/schema/624_1.
196. WHO сlassification of Tumours Editorial вoard. Digestive system tumors (5th edition). IARC; Lyon, 2019.
197. Jauhri M. et al. Prevalence and coexistence of KRAS, вRAF, PIK3CA, NRAS, TP53, and APC mutations in Indian colorectal cancer patients: next-generation sequencing - based cohort study. Tumor вiology 2017;39(2):1010428317692265.
198. вrannon A.R. et al. сomparative sequencing analysis reveals high genomic concordance between matched primary and metastatic colorectal cancer lesions. Genome biology 2014;15(8):1-10.
199. Loughrey M.B., Quirke P., Shepherd N. Dataset for colorectal cancer histopathology reports. The Royal сollege of Pathologists, 2014.
200. Динаева Э.А. Значение эмпэгфилграстима в интенсивных режимах терапии опухолей ЖКТ // Доклад на сессии «Отечественные исследования в онкологии». Конференция RUSSCO «Опухоли ЖКТ», 15 апреля 2022.
201. Китагава Ю., Осуми Х., Шинозаки Э., Юмико Ота Ю. Клиническая полезность гранулоцитарного колониестимулирующего фактора, конъюгированного с полиэтиленгликолем (PEG-G-CSF), для профилактики тяжелой нейтропении у пациентов с метастатическим колоректальным раком, получавших FOLFOXIRI плюс бевацизумаб: одноцентровое ретроспективное исследование. БМК Рак 2020;20:358. DOI: 10,1186/s12885-020-06864-8.
202. Кроуфорд Д., Мур Д.С., Моррисон В.А., Дейл Д. Применение пегфилграстима в профилактических целях при нейтропении, вызванной химиотерапией, в США: обзор соблюдения настоящих рекомендаций по применению. Лечение рака и исследовательские коммуникации 2021;29:100466.
203. Lugli A. et al. Recommendations for reporting tumor budding in colorectal cancer based on the International Tumor вudding сonsensus сonference (ITBCC) 2016. Modern pathology 2017;30(9):1299-311.
204. Moehler M. et al. Phase III trial of avelumab maintenance after first-line induction chemotherapy versus continuation of chemotherapy in patients with gastric cancers: results from JAVELIN gastric 100. Journal of сlinical Oncology 2021;39(9):966.
205. 205. WHO сlassification of Tumours Editorial вoard. Digestive system tumors (5th edition). IARC; Lyon, 2019.
206. Jauhri M. et al. Prevalence and coexistence of KRAS, вRAF, PIK3CA, NRAS, TP53, and APC mutations in Indian colorectal cancer patients: next-generation sequencing-based cohort study //Tumor вiology. 2017. Т. 39. 2. С. 1010428317692265.
207. вrannon A. R. et al. сomparative sequencing analysis reveals high genomic concordance between matched primary and metastatic colorectal cancer lesions //Genome biology. 2014. Т. 15. 8. С. 1-10.
208. Modest D. P. et al. Panitumumab plus fluorouracil and folinic acid versus fluorouracil and folinic acid alone as maintenance therapy in RAS wild-type metastatic colorectal cancer: The randomized PANAMA trial (AIO KRK 0212) //Journal of сlinical Oncology. 2022. Т. 40. 1. С. 72-82.
209. Aparicio T. et al. вevacizumab+ chemotherapy versus chemotherapy alone in elderly patients with un-treated metastatic colorectal cancer: A randomized phase II trial-PRODIGE 20 study results //Annals of Oncology. 2018. Т. 29. 1. С. 133-138.
210. Fujita K. et al. Irinotecan, a key chemotherapeutic drug for metastatic colorectal cancer //World journal of gastroenterology. 2015. Т. 21. 43. С. 12234.
211. Dominik P Modest 1 2, Uwe M Martens 3, Jorge Riera-Knorrenschild, et al. FOLFOXIRI Plus Pani-tumumab As First-Line Treatment of RAS Wild-Type Metastatic сolorectal сancer: The Randomized, Open-Label, Phase II VOLFI Study (AIO KRK0109). J сlin Oncol. 2019 Dec 10;37(35):3401-3411.
212. Josep Tabernero 1, Takayuki Yoshino 2, Allen Lee сohn, et al. Ramucirumab versus placebo in combina-tion with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a randomised, double-blind, multicentre, phase 3 study. Lancet Oncol.
213. Freshwater T. et al. Evaluation of dosing strategy for pembrolizumab for oncology indications //Journal for immunotherapy of cancer. 2017. Т. 5. 1. С. 1-9.
214. Grothey A. et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial //The Lancet. 2013. Т. 381. 9863. С. 303-312.
215. Gundgaard M. G., Soerensen J. в., Ehrnrooth E. Third-line therapy for metastatic colorectal cancer //Cancer chemotherapy and pharmacology. 2008. Т. 61. 1. С. 1-13.
216. Walter T. et al. Systematic review and network meta-analyses of third-line treatments for metastatic colorectal cancer //Journal of cancer research and clinical oncology. 2020. Т. 146. 10. С. 2575-2587.
217. 215. M. Fedyanin1, H. Elsnukaeva, I. Demidova, et al. 448P - Efficacy of combinations of вRAF inhibitors and anti-EGFR antibodies in metastatic colorectal carcinoma (mCRC) patients with mBRAF in the real clinical practice. Annals of Oncology (2021) 32 (suppl_5): S530-S582. 10,1016/annonc/annonc698.
218. 216. Wu Z. et al. вRAF and EGFR inhibitors synergize to increase cytotoxic effects and decrease stem cell ca-pacities in вRAF (V600E)-mutant colorectal cancer cells //Acta вiochimica et вiophysica Sinica. 2018. Т. 50. 4. С. 355-361.
|
|
Приложения
Приложение А1.
Состав рабочей группы по разработке и пересмотру клинических рекомендаций.1.Федянин М.Ю., д.м.н., старший научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапевтического) №2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; руководитель службы химиотерапевтического лечения ГБУЗ «ММКЦ Коммунарка» ДЗ г. Москвы; научный консультант ФГБУ «Национальный медико-хирургический центр им. Н.И. Пирогова» Минздрава России.
2.Мамедли З.З., м.н., заведующий хирургическим отделением №3 (проктологическим) ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
3.Гордеев С.С., м.н., ведущий научный сотрудник хирургического отделения № 3 (проктологического) ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
4.Ачкасов С. И., д.м.н., проф., директор ФГБУ «НМИЦ колопроктологии им. А.Н. Рыжих» Минздрава России.
5.Болотина Л.В., заведующая отделением химиотерапии МНИОИ.
Им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
6.Гладков О.А., д.м.н., ООО «Эвимед», Челябинск.
7.Глебовская В.В., д.м.н., старший научный сотрудник радиологического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
8.Карачун А.М., д.м.н., проф., заведующий хирургическим отделением абдоминальной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, сотрудник кафедры онкологии ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России.
9.Козлов Н.А., м.н, врач-патологоанатом патолого-анатомического отделения отдела морфологической и молекулярно-генетической диагностики опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
10.Малихова О.А., д.м.н., проф., заведующая отделением эндоскопии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
11.Медведева Б.М., д.м.н., ведущий научный сотрудник рентгенодиагностического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
12.Обухова О.А., м.н., заведующая отделением реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
13.Петров А.С., м.н., врач-онколог отделения абдоминальной хирургии.
Хирургического отделения абдоминальной онкологии ФГБУ «НИИ онкологии.
Им. Н.Н. Петрова» Минздрава России.
14.Подлужный Д.В., д.м.н., заведующий отделением опухолей печени и поджелудочной железы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
15.Проценко С.А., д.м.н., проф., заведующий отделением химиотерапии и инновационных технологий ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
16.Рыжков А.Д., д.м.н., проф., ведущий научный сотрудник лаборатории радиоизотопной диагностики отдела радиоизотопной диагностики и терапии НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии.
Им. Н.Н. Блохина» Минздрава России.
17.Рыков И.В., заместитель главного врача по клинической работе Медицинского института им. Березина Сергея (МИБС), Санкт-Петербург.
18.Сидоров Д.В., д.м.н., руководитель абдоминального отделения МНИОИ.
Им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
19.Трякин А.А., д.м.н., заведующий онкологическим отделением лекарственных методов лечения (химиотерапевтического) № 2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
20.Цуканов А.С., д.м.н., руководитель отдела лабораторной генетики ФГБУ «НМИЦ колопроктологии им. А.Н. Рыжих» Минздрава России.
21.Шелыгин Ю.А., академик РАН, д.м.н., проф., президент Общероссийской общественной некоммерческой организации «Ассоциация колопроктологов России», научный руководитель ФГБУ «НМИЦ колопроктологии имени А.Н. Рыжих» Минздрава России, главный внештатный специалист-колопроктолог Минздрава России.
22.Петров Л.О., м.н., руководитель отделения лучевого и хирургического лечения заболеваний абдоминальной области Медицинского радиологического научного центра им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
23.Дрошнева И.В., заведующий отделением лучевой терапии, врач-радиотерапевт МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
24.Феденко А.А., заведующий отделом лекарственного лечения опухолей МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
25.Фалалеева Н.А., заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
26.Филоненко Е.В., заведующий центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
Конфликта интересов нет.
Блок по организации медицинской помощи.
1.Невольских А.А., д.м.н., заместитель директора по лечебной работе МРНЦ.
Им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
2.Иванов С.А., проф. РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
3.Хайлова Ж.В., м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
4.Геворкян Т.Г., заместитель директора НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Конфликта интересов нет.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
1) врачи-онкологи,.
2) врачи-хирурги,.
3) врачи-радиологи,.
4) врачи-генетики,.
5) врачи-радиотерапевты,.
6) врачи-колопроктологи,.
7) врачи-эндоскописты,.
8) клинические фармакологи,.
9) специалисты по медицинской реабилитации.
Методы, использованные для сбора/селекции доказательств. Поиск в электронных базах данных; анализ современных научных разработок по проблеме рака ободочной кишки и ректосигмоидного перехода в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Шкала оценки достоверности доказательств для методов диагностики, профилактики, лечения и реабилитации (диагностических, профилактических, лечебных, реабилитационных вмешательств) и шкала оценки убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств) представлены ниже.
Таблица П1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением метаанализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица П2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| 1 | Систематический обзор рандомизированных контролируемых исследований с применением метаанализа |
| 2 | Отдельные рандомизированные контролируемые исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных контролируемых исследований, с применением метаанализа |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования типа «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица П3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| A | Сильная рекомендация: все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными |
| в | Условная рекомендация: не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество, и/или их выводы по интересующим исходам не являются согласованными |
| с | Слабая рекомендация: отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы)) являются неважными, все исследования имеют низкое методологическое качество, и их выводы по интересующим исходам не являются согласованными |
Методы, использованные для формулирования рекомендаций,. Консенсус экспертов.
Экономический анализ. Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
● Внешняя экспертная оценка.
● Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которых попросили прокомментировать прежде всего то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии детских онкологов первичного звена о доходчивости изложения рекомендаций и их оценка важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка:
Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать прежде всего то, насколько доходчива и точна интерпретация доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем 1 раз в 3 года с учетом появившейся новой информации о диагностике и тактике ведения больных раком ободочной кишки и ректосигмоидного перехода, но не чаще 1 раза в 6 мес. Решение об обновлении принимает Минздрав России на основании предложений, внесенных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что, в свою очередь, влияет на силу вытекающих из нее рекомендаций.
Приложение А3.
Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата.Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти в Государственном реестре лекарственных средств, размещенном на сайте Минздрава России: http://grls.rosminzdrav.ru.
Критерии генетического обследования пациентов с подозрением на синдром Линча.
Критерии, разработанные ФГБУ «ГНЦК им. А.Н. Рыжих» для российских пациентов:
1. Пациент с колоректальным раком в возрасте до 43 лет.
2. Наряду с колоректальным раком зарегистрировано еще 2 и более случая злокачественных опухолей любой локализации у самого пациента или у кровных родственников независимо от возраста.
Критерии Amsterdam I.
1. По крайней мере у 3 родственников присутствует гистологически верифицированный колоректальный рак, один из них - родственник 1-й линии.
2. Заболевание прослеживается по крайней мере в 2 поколениях.
3. По крайней мере у 1 из родственников колоректальный рак диагностирован в возрасте до 50 лет.
4. Семейный аденоматозный полипоз исключен [121].
План контрольных обследований пациента после завершения лечения.
| 1-й год | 2-й год | 3-й год | 4-5-й годы | Далее | ||||||||||||||||
| 3 мес | 6 мес | 9 мес | 12 мес | 3 мес | 6 мес | 9 мес | 12 мес | 3 мес | 6 мес | 9 мес | 12 мес | 3 мес | 6 мес | 9 мес | 12 мес | 3 мес | 6 мес | 9 мес | 12 мес | |
| Консультация врача-онколога (сбор жалоб + физикальный осмотр) | х | х | х | х | х | х | х | х | х | х | х | х | х | |||||||
| Исследование уровня ракового эмбрионального антигена | х | х | х | х | х | х | х | х | х | х | х | х | - | |||||||
| Ультразвуковое исследование органов брюшной полости и малого таза | х | х | х | х | х | х | х | х | х | х | ||||||||||
| Рентгенография легких или прицельная рентгенография органов грудной клетки | х | х | х | х | х | |||||||||||||||
| Компьютерная томография органов грудной и брюшной полостей с внутривенным контрастированием | х | х | - | |||||||||||||||||
| Колоноскопия* | х | х | Каждые 5 лет | |||||||||||||||||
*При выявлении полипов выполняется ежегодно. Если до начала лечения колоноскопия не была выполнена по причине стенозирующей опухоли, ее проводят в течение 3-6 мес после резекции.
Примечание. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен.
Приложение В.
Информация для пациента.Рекомендуется для получения информации о диагностике, лечении и профилактике рака прямой кишки использовать одобренный профессиональными ассоциациями и сообществами пациентов источник: http://www.russcpa.ru/patsientam/.
Приложение Г1-ГN.
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.Приложение Г1 Критерии Amsterdam II.
Название на русском языке. Критерии Amsterdam II.Оригинальное название. Amsterdam II сriteria.
Источник. Vasen H.F., Watson P., Mecklin J.P., Lynch H.T. New clinical criteria for hereditary nonpolyposis colorectal cancer (HNPCC, Lynch syndrome) proposed by the International сollaborative group on HNPCC. Gastroenterology 1999;116:1453-6.
Тип: критерии.
Назначение. Оценка целесообразности выполнения тестирования на MSI.
Содержание:
1. По крайней мере у 3 родственников развился рак, связанный с синдромом Линча (колоректальный рак, рак эндометрия, рак желудка, яичников, мочеточника/почечной лоханки, головного мозга, тонкой кишки, гепатобилиарного тракта и кожи (сальных желез)), один из них - родственник 1-й линии.
2. Заболевание прослеживается по крайней мере в 2 поколениях.
3. По крайней мере у 1 из родственников связанный с синдромом Линча рак диагностирован в возрасте до 50 лет.
4. Семейный аденоматозный полипоз исключен в случаях наличия колоректального рака.
5. Опухоли по возможности должны быть верифицированы.
Приложение Г2 Критерии вethesda для тестирования на микросателлитную нестабильность.
Название на русском языке. Критерии вethesda для тестирования на MSI.Оригинальное название. The Revised вethesda Guidelines for testing colorectal tumors for microsatellite instability (MSI).
Источник. Laghi L., вianchi P., Roncalli M., Malesci A. Re: Revised вethesda guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability. J Natl сancer Inst 2004;96(18):1402-3.
Тип: критерии.
Назначение. Оценка целесообразности выполнения тестирования на MSI.
Содержание:
1. Колоректальный рак у пациента младше 50 лет.
2. Наличие синхронного, метахронного колоректального или другого рака, который может быть связан с синдромом Линча, вне зависимости от возраста.
3. Колоректальный рак с выявленным при гистологическом исследовании высоким уровнем микросателлитной нестабильности (MSI-H) у пациента в возрасте до 60 лет.
4. Колоректальный рак у одного или более родственника 1-й линии с заболеванием, которое может быть связано с синдромом Линча; по крайней мере 1 из случаев заболевания выявлен в возрасте до 50 лет.
5. Колоректальный рак у 2 или более родственников 1-й или 2-й линии с заболеваниями, которые могут быть связаны с синдромом Линча, вне зависимости от возраста.
Приложение Г3 Критерии степени оценки регрессии опухоли в ответ на лечение по Mandard.
Название на русском языке. Критерии степени оценки регрессии опухоли в ответ на лечение по Mandard.Оригинальное название. Prognostic value of mandard and dworak tumor regression grading.
Источник. Santos M.D. et al. Prognostic value of mandard and dworak tumor regression grading in rectal cancer: study of a single tertiary center // ISRN surgery. 2014. Т. 2014.
Тип: критерии.
Назначение. Оценка регрессии опухоли в ответ на лечение.
Содержание и интерпретация:
| II степень регрессии опухоли (TRG2) | Сохранение немногочисленных опухолевых клеток на фоне фиброзных изменений |
| III степень регрессии опухоли (TRG3) | Большое количество сохраненных опухолевых клеток на фоне преобладания фиброза |
| IV степень регрессии опухоли (TRG4) | Опухолевые элементы преобладают над фиброзными изменениями |
| V степень регрессии опухоли (TRG5) | Отсутствие признаков регрессии опухоли, отсутствие фиброза |
Приложение Г4 Критерии оценки по шкале ECOG.
Название на русском языке. Критерии оценки по шкале ECOG.Оригинальное название. The ECOG Scale of Performance Status.
Источник. Oken M.M. et al. Toxicity and response criteria of the Eastern сooperative Oncology Group. Am J сlin Oncol 1982;5(6):649-65.
Тип: шкала оценки.
Назначение. Клиническая оценка общего состояния пациента.
Содержание и интерпретация:
| 0 | Пациент полностью активен, способен выполнять все действия так же, как и до заболевания |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени проводит активно - в вертикальном положении |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования |
| 4 | Инвалид, совершенно неспособен к самообслуживанию, прикован к креслу или постели |
| 5 | Смерть |
|
|
Год актуализации информации
2022.
Связанные заболевания
Связанные клинические рекомендации
Связанные стандарты мед. помощи
- Стандарт специализированной медицинской помощи при злокачественных новообразованиях ободочной и прямой кишки III стадии (адьювантная химиотерапия)
- Стандарт медицинской помощи взрослым при нейроэндокринных опухолях
- Стандарт специализированной медицинской помощи при злокачественных новообразованиях ободочной кишки II-III стадии (хирургическое лечение)
- Стандарт специализированной медицинской помощи при злокачественных новообразованиях ободочной кишки I стадии (хирургическое лечение)
- Стандарт специализированной медицинской помощи при злокачественных новообразованиях ободочной кишки IV стадии (хирургическое лечение)
- Стандарт медицинской помощи детям при меланоме кожи и слизистых оболочек (диагностика и лечение)
- Стандарт медицинской помощи больным со злокачественным новообразованием ободочной кишки
- Стандарт медицинской помощи взрослым при гастроинтестинальных стромальных опухолях