Pharmacological Group
Latin name
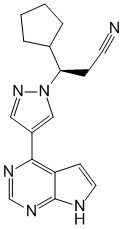
Ruxolitinibum ( Ruxolitinibi).
Chemical name
(3R)-3-циклопентил-3-[4-(7H-пирроло[2,3-d]пиримидин-4-ил)пиразол-1-ил]пропаннитрил.
Used in the treatment
CAS Code
941678-49-5.
Pharmacological action
Противоопухолевое.
Characteristics of the substance
Противоопухолевое средство, ингибитор протеинкиназы. Руксолитиниба фосфат - порошок от белого или почти белого до светло-розового цвета, растворяется в водных буферных растворах с рН от 1 до 8. Молекулярная масса 404,36.
Pharmacodynamics
Фармакодинамика.
Руксолитиниб является селективным ингибитором JAK-киназ (Janus Associated Kinases - JAKs) - JAK1 и JAK2. Данные киназы способствуют передаче сигналов от многочисленных цитокинов и факторов роста, играющих важную роль в гемопоэзе и функции иммунной системы.
Активированные JAK-киназы, воздействуя на цитокиновые рецепторы, активируют STAT-белки (STATs) (переносчики сигнала и активаторы транскрипции), которые в результате активации транспортируются внутрь ядра и модулируют экспрессию генов. Дисрегуляция пути JAK-STAT ассоциирована с некоторыми видами злокачественных новообразований и увеличением пролиферации и выживаемости злокачественных клеток.
Миелофиброз и истинная полицитемия - миелопролиферативные заболевания, связанные с дисрегуляцией сигнального пути JAK1 и JAK2. Как полагают, основой дисрегуляции является высокий уровень циркулирующих цитокинов, которые активируют путь JAK-STAT, приводя к патологическим функциональным мутациям, таким как JAK2V617F, и к подавлению отрицательных регуляторных механизмов. У пациентов с миелофиброзом обнаруживается дисрегуляция сигнального пути JAK, независимо от наличия мутации JAK2V617F. Активирующие мутации сигнального пути JAK2 (V617F или экзона 12) обнаруживаются у >95% пациентов с истинной полицитемией.
Руксолитиниб ингибирует цитокининдуцированное фосфорилирование STAT3 в цельной крови как у здоровых добровольцев, так и у пациентов с миелофиброзом или истинной полицитемией. Руксолитиниб приводит к максимальному ингибированию фосфорилирования STAT3 через 2 ч после введения, которое возвращается к исходному показателю через 8 ч у здоровых добровольцев и пациентов с миелофиброзом, что указывает на отсутствие кумуляции как исходного вещества, так и его метаболитов.
Исходное повышение концентрации маркеров воспалительного процесса, таких как ФНО-альфа, ИЛ-6 и С-реактивный белок, наблюдающееся у пациентов с миелофиброзом, снижается после лечения руксолитинибом. У пациентов с миелофиброзом не отмечается формирования резистентности к фармакодинамическим эффектам руксолитиниба. Аналогично у пациентов с истинной полицитемией наблюдается исходное повышение концентрации маркеров воспалительного процесса, снижавшееся после лечения руксолитинибом.
RxList.com (обновление 2021 г.
Механизм действия.
Сигнальные пути JAK-STAT играют роль в регуляции развития, пролиферации и активации нескольких типов иммунных клеток, вовлеченных в патогенез развития острой реакции «трансплантат против хозяина». В модели острой реакции «трансплантат против хозяина» у мышей пероральное введение руксолитиниба было ассоциировано со снижением экспрессии воспалительных цитокинов в гомогенатах толстой кишки и снижением инфильтрации иммунных клеток в толстой кишке.
В клиническом исследовании не отмечалось удлинения интервала QT/QTc при применении руксолитиниба однократно в супратерапевтических дозах (200 мг), что указывает на отсутствие влияния на реполяризацию сердца.
RxList.com (2016 г.
Исследование интервала QT. Влияние однократных доз руксолитиниба 25 и 200 мг на интервал QTc было оценено в рандомизированном плацебо- и актив-контролируемом (моксифлоксацин 400 мг) перекрестном всестороннем исследовании с 4 периодами у 47 здоровых добровольцев. В исследовании с доказанной способностью обнаруживать малые эффекты верхняя граница одностороннего 95% ДИ для наибольшего плацебо-скорректированного корригированного интервала QTc с коррекцией по формуле Fridericia (QTcF) была ниже порогового значения 10 мс. Доза 200 мг достаточна для представления клинического сценария при высокой экспозиции.
Руксолитиниб является селективным ингибитором JAK-киназ (Janus Associated Kinases - JAKs) - JAK1 и JAK2. Данные киназы способствуют передаче сигналов от многочисленных цитокинов и факторов роста, играющих важную роль в гемопоэзе и функции иммунной системы.
Активированные JAK-киназы, воздействуя на цитокиновые рецепторы, активируют STAT-белки (STATs) (переносчики сигнала и активаторы транскрипции), которые в результате активации транспортируются внутрь ядра и модулируют экспрессию генов. Дисрегуляция пути JAK-STAT ассоциирована с некоторыми видами злокачественных новообразований и увеличением пролиферации и выживаемости злокачественных клеток.
Миелофиброз и истинная полицитемия - миелопролиферативные заболевания, связанные с дисрегуляцией сигнального пути JAK1 и JAK2. Как полагают, основой дисрегуляции является высокий уровень циркулирующих цитокинов, которые активируют путь JAK-STAT, приводя к патологическим функциональным мутациям, таким как JAK2V617F, и к подавлению отрицательных регуляторных механизмов. У пациентов с миелофиброзом обнаруживается дисрегуляция сигнального пути JAK, независимо от наличия мутации JAK2V617F. Активирующие мутации сигнального пути JAK2 (V617F или экзона 12) обнаруживаются у >95% пациентов с истинной полицитемией.
Руксолитиниб ингибирует цитокининдуцированное фосфорилирование STAT3 в цельной крови как у здоровых добровольцев, так и у пациентов с миелофиброзом или истинной полицитемией. Руксолитиниб приводит к максимальному ингибированию фосфорилирования STAT3 через 2 ч после введения, которое возвращается к исходному показателю через 8 ч у здоровых добровольцев и пациентов с миелофиброзом, что указывает на отсутствие кумуляции как исходного вещества, так и его метаболитов.
Исходное повышение концентрации маркеров воспалительного процесса, таких как ФНО-альфа, ИЛ-6 и С-реактивный белок, наблюдающееся у пациентов с миелофиброзом, снижается после лечения руксолитинибом. У пациентов с миелофиброзом не отмечается формирования резистентности к фармакодинамическим эффектам руксолитиниба. Аналогично у пациентов с истинной полицитемией наблюдается исходное повышение концентрации маркеров воспалительного процесса, снижавшееся после лечения руксолитинибом.
RxList.com (обновление 2021 г.
Механизм действия.
Сигнальные пути JAK-STAT играют роль в регуляции развития, пролиферации и активации нескольких типов иммунных клеток, вовлеченных в патогенез развития острой реакции «трансплантат против хозяина». В модели острой реакции «трансплантат против хозяина» у мышей пероральное введение руксолитиниба было ассоциировано со снижением экспрессии воспалительных цитокинов в гомогенатах толстой кишки и снижением инфильтрации иммунных клеток в толстой кишке.
В клиническом исследовании не отмечалось удлинения интервала QT/QTc при применении руксолитиниба однократно в супратерапевтических дозах (200 мг), что указывает на отсутствие влияния на реполяризацию сердца.
RxList.com (2016 г.
Исследование интервала QT. Влияние однократных доз руксолитиниба 25 и 200 мг на интервал QTc было оценено в рандомизированном плацебо- и актив-контролируемом (моксифлоксацин 400 мг) перекрестном всестороннем исследовании с 4 периодами у 47 здоровых добровольцев. В исследовании с доказанной способностью обнаруживать малые эффекты верхняя граница одностороннего 95% ДИ для наибольшего плацебо-скорректированного корригированного интервала QTc с коррекцией по формуле Fridericia (QTcF) была ниже порогового значения 10 мс. Доза 200 мг достаточна для представления клинического сценария при высокой экспозиции.
Pharmacokinetics
Абсорбция. Руксолитиниб относится к 1-му классу молекул по биофармацевтической классификационной системе (Biopharmaceutical сlassification System) с высокой проницаемостью, высокой растворимостью и быстрым растворением. В клинических исследованиях руксолитиниб быстро всасывался после приема внутрь с Tmах приблизительно 1 Абсорбция руксолитиниба составляет 95% или более. Средняя Сmах и AUC повышаются пропорционально в диапазоне доз от 5 до 200 мг. При применении руксолитиниба одновременно с пищей с высоким содержанием жиров наблюдались клинически незначимые изменения фармакокинетики руксолитиниба: средняя Сmах незначительно снижалась (24%), в то время как AUC практически не изменялась (повышалась на 4%).
RxList.com (2016 г.
Абсорбция. В клинических исследованиях руксолитиниб быстро всасывался после приема внутрь с Tmах в пределах 1-2.
RxList.com (обновление 2021 г.
Средняя maxCmax руксолитиниба варьировала от 205 до 7100 нМ, а AUC - от 862 нМ·ч до 30700 нМ·ч в диапазоне однократных доз от 5 до 200 мг.
Распределение. Средний ssVss составил около 75 л у пациентов с миелофиброзом и истинной полицитемией. В клинически значимых концентрациях связь руксолитиниба с белками in vitro >in vitro (в основном с альбумином) составила приблизительно 97%. В исследовании у животных было показано, что руксолитиниб не проникает через ГЭБ.
RxList.com (2016 г.
Распределение. Средний ssVss составил 72 л у пациентов с миелофиброзом (межиндивидуальная вариабельность - 29%) и 75 л у пациентов с истинной полицитемией (межиндивидуальная вариабельность - 23%).
Биотрансформация/метаболизм. Руксолитиниб является субстратом изофермента сYP3A4. После приема внутрь в крови циркулирует 60% руксолитиниба в неизмененном виде. В крови человека определены 2 основных активных метаболита руксолитиниба, представляющих 25 и 11% AUC. Фармакологическая активность руксолитиниба на 18% складывается из активности его метаболитов. В клинически значимых концентрациях руксолитиниб не ингибирует изоферменты сYP1A2, сYP2B6, сYP2C8, сYP2C9, сYP2C19, сYP2D6 или сYP3A4 и не является сильным индуктором изоферментов сYP1A2, сYP2B6 или сYP3A4.
RxList.com (2016 г.
Метаболизм. В in vitro >in vitro исследованиях показано, что руксолитиниб метаболизируется посредством изофермента сYP3A4 и в меньшей степени - сYP2C9.
Элиминация. После введения однократной дозы меченого радиоактивной меткой руксолитиниба бóльшая часть (74%) радиоактивности определялась в моче (выводилась почками), и 22% выводилось через кишечник. Неизмененное вещество составило менее чем 1% общего выведенного препарата. 1/2T1/2 руксолитиниба составлял приблизительно 3.
RxList.com (2016 г.
Элиминация. 1/2T1/2 руксолитиниб + метаболиты - примерно 5,8.
Линейность/нелинейность фармакокинетики. Фармакокинетика руксолитиниба изменяется пропорционально вводимым (однократно, многократно) дозам.
Фармакокинетика у отдельных групп пациентов.
Влияние возраста, пола или расы. Не выявлено значительных различий в фармакокинетике руксолитиниба в зависимости от пола и расы. Клиренс руксолитиниба у пациентов с миелофиброзом составляет 17,7 л/ч у женщин и 22,1 л/ч у мужчин (межиндивидуальная вариабельность - 39%). У пациентов с истинной полицитемией клиренс руксолитиниба составляет 12,7 л/ч (межиндивидуальная вариабельность - 42%); не выявлено влияния пола, возраста или расы на клиренс при приеме ЛС внутрь.
RxList.com (обновление 2021 г.
Клиренс руксолитиниба (коэффициент вариации, %) у пациентов с острой реакцией «трансплантат против хозяина» составил 11,9 л/ч (43%).
Пациенты в возрасте ≤18 лет. Эффективность и безопасность руксолитиниба у пациентов младше 18 лет не установлена.
Нарушение функции почек. AUC метаболитов руксолитиниба повышается с увеличением степени тяжести нарушения функции почек и достигает существенных значений у пациентов с терминальной стадией почечной недостаточности, нуждающихся в гемодиализе. Руксолитиниб не выводится посредством диализа. Для пациентов с тяжелой и терминальной стадиями почечной недостаточности (Cl креатинина менее 30 мл/мин) рекомендуется коррекция дозы руксолитиниба.
Нарушение функции печени. AUC руксолитиниба повышалась у пациентов с нарушением функции печени легкой, средней и тяжелой степени соответственно на 87, 28 и 65% по сравнению с нормальной функцией печени, при этом отсутствует явная взаимосвязь со степенью тяжести нарушения функции печени, определяемой по шкале Чайлд-Пью. Конечный 1/2T1/2 удлинен у пациентов с нарушением функции печени по сравнению со здоровыми добровольцами (4,1-5 ч против 2,8 ч). У пациентов с нарушением функции печени рекомендуется снижение дозы руксолитиниба.
RxList.com (2016 г.
Абсорбция. В клинических исследованиях руксолитиниб быстро всасывался после приема внутрь с Tmах в пределах 1-2.
RxList.com (обновление 2021 г.
Средняя maxCmax руксолитиниба варьировала от 205 до 7100 нМ, а AUC - от 862 нМ·ч до 30700 нМ·ч в диапазоне однократных доз от 5 до 200 мг.
Распределение. Средний ssVss составил около 75 л у пациентов с миелофиброзом и истинной полицитемией. В клинически значимых концентрациях связь руксолитиниба с белками in vitro >in vitro (в основном с альбумином) составила приблизительно 97%. В исследовании у животных было показано, что руксолитиниб не проникает через ГЭБ.
RxList.com (2016 г.
Распределение. Средний ssVss составил 72 л у пациентов с миелофиброзом (межиндивидуальная вариабельность - 29%) и 75 л у пациентов с истинной полицитемией (межиндивидуальная вариабельность - 23%).
Биотрансформация/метаболизм. Руксолитиниб является субстратом изофермента сYP3A4. После приема внутрь в крови циркулирует 60% руксолитиниба в неизмененном виде. В крови человека определены 2 основных активных метаболита руксолитиниба, представляющих 25 и 11% AUC. Фармакологическая активность руксолитиниба на 18% складывается из активности его метаболитов. В клинически значимых концентрациях руксолитиниб не ингибирует изоферменты сYP1A2, сYP2B6, сYP2C8, сYP2C9, сYP2C19, сYP2D6 или сYP3A4 и не является сильным индуктором изоферментов сYP1A2, сYP2B6 или сYP3A4.
RxList.com (2016 г.
Метаболизм. В in vitro >in vitro исследованиях показано, что руксолитиниб метаболизируется посредством изофермента сYP3A4 и в меньшей степени - сYP2C9.
Элиминация. После введения однократной дозы меченого радиоактивной меткой руксолитиниба бóльшая часть (74%) радиоактивности определялась в моче (выводилась почками), и 22% выводилось через кишечник. Неизмененное вещество составило менее чем 1% общего выведенного препарата. 1/2T1/2 руксолитиниба составлял приблизительно 3.
RxList.com (2016 г.
Элиминация. 1/2T1/2 руксолитиниб + метаболиты - примерно 5,8.
Линейность/нелинейность фармакокинетики. Фармакокинетика руксолитиниба изменяется пропорционально вводимым (однократно, многократно) дозам.
Фармакокинетика у отдельных групп пациентов.
Влияние возраста, пола или расы. Не выявлено значительных различий в фармакокинетике руксолитиниба в зависимости от пола и расы. Клиренс руксолитиниба у пациентов с миелофиброзом составляет 17,7 л/ч у женщин и 22,1 л/ч у мужчин (межиндивидуальная вариабельность - 39%). У пациентов с истинной полицитемией клиренс руксолитиниба составляет 12,7 л/ч (межиндивидуальная вариабельность - 42%); не выявлено влияния пола, возраста или расы на клиренс при приеме ЛС внутрь.
RxList.com (обновление 2021 г.
Клиренс руксолитиниба (коэффициент вариации, %) у пациентов с острой реакцией «трансплантат против хозяина» составил 11,9 л/ч (43%).
Пациенты в возрасте ≤18 лет. Эффективность и безопасность руксолитиниба у пациентов младше 18 лет не установлена.
Нарушение функции почек. AUC метаболитов руксолитиниба повышается с увеличением степени тяжести нарушения функции почек и достигает существенных значений у пациентов с терминальной стадией почечной недостаточности, нуждающихся в гемодиализе. Руксолитиниб не выводится посредством диализа. Для пациентов с тяжелой и терминальной стадиями почечной недостаточности (Cl креатинина менее 30 мл/мин) рекомендуется коррекция дозы руксолитиниба.
Нарушение функции печени. AUC руксолитиниба повышалась у пациентов с нарушением функции печени легкой, средней и тяжелой степени соответственно на 87, 28 и 65% по сравнению с нормальной функцией печени, при этом отсутствует явная взаимосвязь со степенью тяжести нарушения функции печени, определяемой по шкале Чайлд-Пью. Конечный 1/2T1/2 удлинен у пациентов с нарушением функции печени по сравнению со здоровыми добровольцами (4,1-5 ч против 2,8 ч). У пациентов с нарушением функции печени рекомендуется снижение дозы руксолитиниба.
Indications for use
Миелофиброз. Лечение пациентов с миелофиброзом, включая первичный миелофиброз и вторичный миелофиброз, развившийся вследствие истинной полицитемии и эссенциальной тромбоцитемии.
Полицитемия истинная. Лечение пациентов с истинной полицитемией, резистентных к терапии препаратами гидроксимочевины.
RxList.com (обновление 2021 г.
Миелофиброз. Лечение миелофиброза со средним или высоким риском, включая первичный миелофиброз, миелофиброз вследствие истинной полицитемии и миелофиброз после эссенциальной тромбоцитемии у взрослых.
Истинная полицитемия. Лечение истинной полицитемии у взрослых при резистентности или непереносимости гидроксимочевины.
Острая болезнь «трансплантат против хозяина». Лечение стероидорезистентной острой реакции «трансплантат против хозяина» у взрослых и детей старше 12 лет.
Полицитемия истинная. Лечение пациентов с истинной полицитемией, резистентных к терапии препаратами гидроксимочевины.
RxList.com (обновление 2021 г.
Миелофиброз. Лечение миелофиброза со средним или высоким риском, включая первичный миелофиброз, миелофиброз вследствие истинной полицитемии и миелофиброз после эссенциальной тромбоцитемии у взрослых.
Истинная полицитемия. Лечение истинной полицитемии у взрослых при резистентности или непереносимости гидроксимочевины.
Острая болезнь «трансплантат против хозяина». Лечение стероидорезистентной острой реакции «трансплантат против хозяина» у взрослых и детей старше 12 лет.
Contraindications
Повышенная чувствительность к руксолитинибу, беременность и период кормления грудью, возраст младше 18 лет.
RxList.com (обновление 2021 г.
Нет.
RxList.com (обновление 2021 г.
Нет.
Restrictions on use
Следует соблюдать осторожность при применении руксолитиниба у пациентов с тяжелой почечной недостаточностью и пациентов на гемодиализе, пациентов с печеночной недостаточностью, пациентов с тяжелыми инфекционными заболеваниями в стадии обострения, также у пациентов с тромбоцитопенией, анемией и нейтропенией. Следует соблюдать осторожность при применении руксолитиниба одновременно с сильными ингибиторами изофермента сYP3A4.
Use during pregnancy and lactation
Руксолитиниб противопоказан к применению в период беременности и грудного вскармливания.
Пациенткам фертильного возраста во время терапии руксолитинибом рекомендовано использовать методы контрацепции. В случае наступления беременности во время терапии руксолитинибом необходимо тщательно оценить соотношение польза/риск индивидуально для каждой пациентки, с учетом новейших известных данных об эмбриотоксичности руксолитиниба.
RxList.com (2016 г.
Категория действия на плод по FDA - с.
Адекватные и строго контролируемые исследования руксолитиниба у беременных женщин не проводились. В исследованиях эмбриофетальной токсичности применение руксолитиниба приводило к увеличению поздней резорбции и снижению веса плода при токсичных для материнского организма дозах. Руксолитиниб следует использовать во время беременности только в случае, если ожидаемый эффект терапии превышает потенциальный риск для плода.
Неизвестно, экскретируется ли руксолитиниб в молоко женщин. Руксолитиниб и/или его метаболиты экскретируются в молоко лактирующих крыс в концентрациях, в 13 раз превышающих плазменные в организме самок. Поскольку многие ЛС могут выделяться с грудным молоком и из-за потенциальной возможности тяжелых побочных реакций у младенцев, находящихся на грудном вскармливании, следует принять решение о прекращении грудного вскармливания или отказе от руксолитиниба, принимая во внимание значение ЛС для матери.
RxList.com (обновление 2021 г.
Беременность.
Резюме рисков. Когда беременным крысам и крольчихам вводили руксолитиниб в период органогенеза, неблагоприятные исходы для развития возникали при дозах, связанных с материнской токсичностью.
Нет исследований с использованием руксолитиниба у беременных женщин для информирования о рисках, связанных с его приемом.
Предполагаемый риск серьезных врожденных дефектов и выкидыша у женщин неизвестен. Неблагоприятные исходы беременности возникают независимо от состояния здоровья матери и приема ЛС. Фоновый риск серьезных врожденных дефектов в общей популяции в США составляет от 2 до 4%, а выкидыша - от 15 до 20% при клинически установленных беременностях.
Грудное вскармливание.
Резюме рисков. Нет данных относительно присутствия руксолитиниба в грудном молоке, воздействия на ребенка, находящегося на грудном вскармливании, или воздействия на выработку молока. Поскольку многие ЛС присутствуют в материнском молоке и из-за возможности развития тромбоцитопении и анемии, показанной для руксолитиниба в исследованиях у людей, необходимо прекратить грудное вскармливание во время лечения руксолитинибом и в течение 2 нед после последней дозы.
Пациенткам фертильного возраста во время терапии руксолитинибом рекомендовано использовать методы контрацепции. В случае наступления беременности во время терапии руксолитинибом необходимо тщательно оценить соотношение польза/риск индивидуально для каждой пациентки, с учетом новейших известных данных об эмбриотоксичности руксолитиниба.
RxList.com (2016 г.
Категория действия на плод по FDA - с.
Адекватные и строго контролируемые исследования руксолитиниба у беременных женщин не проводились. В исследованиях эмбриофетальной токсичности применение руксолитиниба приводило к увеличению поздней резорбции и снижению веса плода при токсичных для материнского организма дозах. Руксолитиниб следует использовать во время беременности только в случае, если ожидаемый эффект терапии превышает потенциальный риск для плода.
Неизвестно, экскретируется ли руксолитиниб в молоко женщин. Руксолитиниб и/или его метаболиты экскретируются в молоко лактирующих крыс в концентрациях, в 13 раз превышающих плазменные в организме самок. Поскольку многие ЛС могут выделяться с грудным молоком и из-за потенциальной возможности тяжелых побочных реакций у младенцев, находящихся на грудном вскармливании, следует принять решение о прекращении грудного вскармливания или отказе от руксолитиниба, принимая во внимание значение ЛС для матери.
RxList.com (обновление 2021 г.
Беременность.
Резюме рисков. Когда беременным крысам и крольчихам вводили руксолитиниб в период органогенеза, неблагоприятные исходы для развития возникали при дозах, связанных с материнской токсичностью.
Нет исследований с использованием руксолитиниба у беременных женщин для информирования о рисках, связанных с его приемом.
Предполагаемый риск серьезных врожденных дефектов и выкидыша у женщин неизвестен. Неблагоприятные исходы беременности возникают независимо от состояния здоровья матери и приема ЛС. Фоновый риск серьезных врожденных дефектов в общей популяции в США составляет от 2 до 4%, а выкидыша - от 15 до 20% при клинически установленных беременностях.
Грудное вскармливание.
Резюме рисков. Нет данных относительно присутствия руксолитиниба в грудном молоке, воздействия на ребенка, находящегося на грудном вскармливании, или воздействия на выработку молока. Поскольку многие ЛС присутствуют в материнском молоке и из-за возможности развития тромбоцитопении и анемии, показанной для руксолитиниба в исследованиях у людей, необходимо прекратить грудное вскармливание во время лечения руксолитинибом и в течение 2 нед после последней дозы.
Side effects
Нежелательные явления (НЯ), отмечавшиеся при применении руксолитиниба в ходе клинических исследований.
НЯ сгруппированы в соответствии с классификацией органов и систем органов MedDRA >MedDRA, в пределах каждой группы перечислены в порядке уменьшения частоты встречаемости.
Для оценки частоты встречаемости использованы следующие критерии (согласно классификации ВОЗ): очень часто (≥1/10). часто (≥1/100. <1/10). нечасто (≥1/1000. <1/100). редко (≥1/10000. <1/1000). очень редко (<1/10000).
В клинических исследованиях тяжесть НЯ оценивалась согласно Общей терминологии критериев нежелательных явлений:
1 - легкая степень.
2 - средняя степень.
3 - тяжелая степень.
4 - крайне тяжелая (жизнеугрожающая) степень.
Миелофиброз.
Инфекционные и паразитарные заболевания. Очень часто - инфекции мочевыводящих путей. в частности цистит. уросепсис. пиурия. инфекции почек. часто - опоясывающий герпес. нечасто - туберкулез.
Со стороны крови и лимфатической системы: очень часто - анемия (в тч 3-й степени тяжести (>80-65 г/л). 4-й степени тяжести (<65 г/л). тромбоцитопения. нейтропения. кровотечения. внутричерепные кровоизлияния. подкожные кровоизлияния. синяки. включая ушибы. экхимозы. гематомы. в тч периорбитальная гематома. повышенная склонность к синякам. петехии. пурпура. часто - тромбоцитопения 4-й степени тяжести (<25·109/л). 3-й степени тяжести (50-25·109/л). нейтропения 4-й степени тяжести (<0,5·109/л). 3-й степени тяжести (<1-0,5·109/л).
Со стороны обмена веществ и питания:очень часто. Гиперхолестеринемия (1-й, 2-й степени тяжести), увеличение массы тела.
Со стороны нервной системы. Очень часто - головокружение, вертиго, головная боль; часто - нарушение равновесия; нечасто - болезнь Меньера.
Со стороны ЖКТ. Часто - метеоризм.
Со стороны печени и желчевыводящих путей. Очень часто - повышение активности АЛТ, повышение активности ACT; часто - повышение активности АЛТ 3-й степени (в 5-20 раз выше нормы).
При применении руксолитиниба было получено сообщение о случае развития прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ). При подозрении на развитие ПМЛ следует прекратить применение руксолитиниба.
После прекращения терапии руксолитинибом некоторые пациенты с миелофиброзом испытывали следующие НЯ: лихорадка. респираторный дистресс-синдром. артериальная гипотензия. ДВС-синдром или полиорганная недостаточность.
Истинная полицитемия.
Инфекционные и паразитарные заболевания. Часто - назофарингит, опоясывающий герпес, инфекции мочевыводящих путей.
Со стороны крови и лимфатической системы: очень часто - анемия. тромбоцитопения. часто - тромбоцитопения 3-й степени тяжести (50-25·109/л). нечасто - анемия 3-й степени тяжести (>80-65 г/л). 4-й степени тяжести (<65 г/л). тромбоцитопения 4-й степени тяжести (<25·109/л).
Со стороны обмена веществ и питания. Очень часто - гиперхолестеринемия (1-й, 2-й степени тяжести), гипертриглицеридемия (1-й степени тяжести); часто - увеличение массы тела.
Со стороны нервной системы. Очень часто - головная боль, головокружение.
Со стороны дыхательной системы, органов грудной клетки и средостения. Очень часто - одышка, в тч одышка при физической нагрузке; часто - кашель, носовое кровотечение.
Со стороны ЖКТ. Очень часто - абдоминальная боль, диарея; часто - запор, тошнота.
Со стороны печени и желчевыводящих путей. Очень часто - повышение активности АЛТ, повышение активности ACT; нечасто - повышение активности АЛТ 3-й степени (в 5-20 раз выше нормы).
Со стороны скелетно-мышечной системы и соединительной ткани. Очень часто - мышечные спазмы; часто - артралгия.
Со стороны сосудов. Часто - выраженное повышение АД.
Общие расстройства и нарушения в месте ведения. Очень часто - усталость; часто - астения, отек, в тч периферические отеки.
Если любые из указанных в описании побочных эффектов усугубляются или вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
RxList.com (2016 г.
Поскольку клинические исследования проводятся в разных условиях. частота встречаемости побочных действий в клинических исследованиях ЛС не может быть непосредственно сравнена с количественной оценкой неблагоприятных эффектов. наблюдавшихся в других клинических испытаниях. и может не отражать частоту встречаемости этих эффектов в клинической практике.
Опыт клинических испытаний при миелофиброзе.
Безопасность руксолитиниба оценивалась у 617 пациентов в 6 клинических исследованиях с медианой продолжительности наблюдения 10,9 мес, включая 301 пациента с миелофиброзом в 2 исследованиях фазы 3.
В этих 2 исследованиях фазы 3 медиана продолжительности экспозиции руксолитиниба была 9,5 мес (диапазон от 0,5 до 17 мес), 89% пациентов получали руксолитиниб в течение более 6 мес и 25% - в течение более 12 мес. 111 пациентов начали лечение с 15 мг руксолитиниба 2 раза в день и 190 пациентов - с 20 мг 2 раза в день. Из пациентов. начавших прием ЛС с 15 мг 2 раза в день (количество тромбоцитов до лечения от 100 до 200·109/л) и 20 мг 2 раза в день (количество тромбоцитов до лечения более 200·109/л). 65 и 25% пациентов соответственно потребовалось снижение дозы ниже стартовой в течение первых 8 нед терапии.
В двойном слепом рандомизированном плацебо-контролируемом исследовании у 155 пациентов, получавших руксолитиниб, наиболее частыми побочными реакциями были тромбоцитопения и анемия. Развитие тромбоцитопении, анемии и нейтропении носило дозозависимый характер. Тремя наиболее частыми негематологическими побочными реакциями были подкожные гематомы, головокружение и головная боль.
Прекращение лечения в результате развития нежелательных явлений. независимо от причины. было зафиксировано у 11% пациентов. получавших руксолитиниб. и 11% пациентов. получавших плацебо.
В двойном слепом плацебо-контролируемом исследовании в период рандомизации наиболее распространенными побочными реакциями всех степеней тяжести в соответствии с критериями Национального института рака (CTCAE1) или 3-4-й степени (приведены в скобках. через /). возникавшими у пациентов с миелофиброзом. которые получали руксолитиниб (n=155). в сравнении с плацебо (n=151) были следующие (в процентах).
Синяки2 - 23 (<1/0) и 15 (0/0).
Головокружение3 - 18 (<1/0) и 7 (0/0).
Головная боль - 15 (0/0) и 5 (0/0).
Инфекции мочевыводящих путей4 - 9 (0/0) и 5 (<1/<1).
Увеличение массы тела5 - 7 (<1/0) и 1 (<1/0).
Метеоризм - 5 (0/0) и <1 (0/0).
Herpes Zoster6 - 2 (0/0) и <1 (0/0).
1 Критерии стандартной терминологии нежелательных явлений сTCAE, версия 3,0.
2 Включает ушиб. экхимоз. гематому. в тч в месте инъекции. периорбитальную гематому. повышенную склонность к синякам. петехии. пурпуру.
3 Включает головокружение. постуральное головокружение. вертиго. нарушение равновесия. болезнь Меньера. лабиринтит.
4 Включает инфекции мочевыводящих путей. цистит. уросепсис. бактериальные инфекции мочевыводящих путей. инфекции почек. пиурию. выявление бактерий в моче. наличие нитритов в моче.
5 В тч аномальное.
6 Включает Herpes Zoster и постгерпетическую невралгию.
Описание отдельных нежелательных лекарственных реакций.
Анемия. В 2 клинических исследованиях фазы 3 медиана времени до начала развития первого НЯ 2-й степени или выше (в соответствии с сTCAE) - анемии - составила примерно 6 нед. У одного пациента (<1%) лечение было прекращено из-за развития анемии. У пациентов. получавших руксолитиниб. уровень Hb снижался до значений. примерно на 1,5-2 г/дл ниже исходного уровня. после 8-12 нед терапии. а затем постепенно повышался и сохранялся на уровне. который был приблизительно на 1 г/дл ниже исходного. Эта картина наблюдалась у больных независимо от того, проводили ли им трансфузию во время терапии или нет.
В рандомизированном плацебо-контролируемом исследовании у 60% пациентов, принимавших руксолитиниб, и 38% пациентов из группы плацебо было проведено переливание эритроцитарной массы в период рандомизации. Среди пациентов. которым проводили трансфузию. медиана количества переливаний в месяц составила 1,2 у больных. получавших руксолитиниб. и 1,7 у больных. получавших плацебо.
Тромбоцитопения. В двух клинических исследованиях фазы 3 у пациентов, у которых развилась тромбоцитопения 3-й или 4-й степени, медиана времени до ее развития была примерно 8 нед. Тромбоцитопения была обычно обратимой при снижении дозы или временном прерывании приема руксолитиниба. Медиана времени до восстановления количества тромбоцитов выше 50·109/л составила 14 дней. Трансфузия тромбоцитов была проведена у 5% пациентов, получавших руксолитиниб, и у 4% пациентов, находившихся на контрольном режиме. Прекращение лечения из-за развития тромбоцитопении было отмечено в <1% случаев у пациентов, получавших руксолитиниб, и у <1% пациентов, находившихся на контрольном режиме. У пациентов с количеством тромбоцитов от 100·109/л до 200·109/л до начала лечения руксолитинибом была более высокая частота тромбоцитопении 3-й или 4-й степени по сравнению с пациентами. у которых количество тромбоцитов было больше чем 200·109/л (17 против 7%).
Нейтропения. В 2 клинических исследованиях фазы 3 у 1% больных был временно прекращен прием или снижена доза руксолитиниба из-за развития нейтропении.
Ниже представлены отклонения гематологических лабораторных показателей. наблюдавшиеся в плацебо-контролируемом исследовании1 и отмеченные при гематологических неблагоприятных реакциях всех степеней тяжести по классификации сTCAE2 3-й и 4-й степени (приведены в скобках. через /) у пациентов с миелофиброзом. которые получали руксолитиниб (n=155). в сравнении с плацебо (n=151) (в процентах).
Тромбоцитопения - 70 (9/4) и 31 (1/0).
Анемия - 96 (34/11) и 87 (16/3).
Нейтропения - 19 (5/2) и 4 (<1/1).
1 Представленные величины являются наибольшими отклонениями, независимо от исходного уровня.
2 Критерии стандартной терминологии нежелательных явлений сTCAE, версия 3,0.
Дополнительные данные плацебо-контролируемого исследования.
У 25% пациентов, получавших руксолитиниб, и 7% пациентов, получавших плацебо, отмечались отклонения АЛТ степени 1 (вновь развившиеся или ухудшение показателей). Повышение АЛТ 2-й степени и больше при приеме руксолитиниба составляло 2%, 3-й и 4-й степени - 1%.
У 17% пациентов, получавших руксолитиниб, и 6% больных, получавших плацебо, отмечались отклонения АСТ (вновь развившиеся или ухудшение показателей). Увеличение АСТ 2-й степени при приеме руксолитиниба было <1%, 3-й или 4-й степени - не отмечалось.
У 17% пациентов, получавших руксолитиниб, и <1% пациентов, получавших плацебо, отмечались отклонения уровня Хс (вновь развившиеся или ухудшение показателей). Повышение Хс 2-й степени при приеме руксолитиниба было <1%, 3-й или 4-й степени - не отмечалось.
Опыт клинических исследований при истинной полицитемии.
В рандомизированном открытом актив-контролируемом исследовании 110 пациентов с истинной полицитемией. при резистентности или непереносимости гидроксимочевины. получали руксолитиниб. и 111 пациентов получали наилучшую доступную терапию. Наиболее частой побочной лекарственной реакцией была анемия.
Прекращение приема ЛС из-за развития неблагоприятных событий, независимо от причины, наблюдалось у 4% пациентов, получавших руксолитиниб.
В открытом актив-контролируемом исследовании сроком до 32 нед в период рандомизации у пациентов с истинной полицитемией были отмечены следующие. связанные с лечением. неблагоприятные реакции. наблюдавшиеся у ≥ 6% пациентов. принимавших руксолитиниб (n=110). всех степеней тяжести в соответствии с критериями сTCAE1 или 3-й и 4-й степени (приведены в скобках. через /) в сравнении с наилучшей имеющейся терапией (n=111) (в процентах).
Головная боль - 16 (<1) и 19 (<1).
Боль в животе2 - 15 (<1) и 15 (<1).
Диарея - 15 (0) и 7 (<1).
Головокружение3 - 15 (0) и 13 (0).
Усталость - 15 (0) и 15 (3).
Зуд - 14 (<1) и 23 (4).
Диспноэ4 - 13 (3) и 4 (0).
Мышечные спазмы - 12 (<1) и 5 (0).
Назофарингит - 9 (0) и 8 (0).
Запор - 8 (0) и 3 (0).
Кашель - 8 (0) и 5 (0).
Эдема5 - 8 (0) и 7 (0).
Артралгия - 7 (0) и 6 (<1).
Астения - 7 (0) и 11 (2).
Носовое кровотечение - 6 (0) и 3 (0).
Herpes Zoster6 - 6 (<1) и 0 (0).
Тошнота - 6 (0) и 4 (0).
1 Критерии стандартной терминологии нежелательных явлений сTCAE, версия 3,0.
2 Включает боль в нижней и верхней части живота.
3 Включает головокружение и вертиго.
4 Включает одышку и одышку при физической нагрузке.
5 Включает отеки, в тч периферические.
6 Включает Herpes Zoster и постгерпетическую невралгию.
Другие клинически важные. возникавшие в связи с лечением. НЯ. наблюдавшиеся менее чем у 6% пациентов. получавших руксолитиниб: увеличение массы тела. гипертензия. инфекции мочевыводящих путей.
Далее представлены отклонения отдельных важных лабораторных показателей. зафиксированные в открытом актив-контролируемом исследовании до 32 нед в период рандомизации1 у пациентов с истинной полицитемией. получавших руксолитиниб (n=110). всех степеней тяжести в соответствии с критериями сTCAE2 или 3-й и 4-й степени (приведены в скобках. через /) в сравнении с наилучшей имеющийся терапией (n=111) (в процентах).
Гематология. Анемия - 72 (<1/<1) и 58 (0/0).
Тромбоцитопения - 27 (5/<1) и 24 (3/<1).
Нейтропения - 3 (0/<1) и 10 (<1/0).
Биохимия. Гиперхолестеринемия - 35 (0/0) и 8 (0/0).
Повышение - АЛТ 25 (<1/0) и 16 (0/0).
Повышение АСТ - 23 (0/0) и 23 (<1/0).
Гипертриглицеридемия - 15 (0/0) и 13 (0/0).
1 Представленные величины являются наибольшими отклонениями, независимо от исходного уровня.
2 Критерии стандартной терминологии нежелательных явлений сTCAE, версия 3,0.
RxList.com (обновление 2021 г.
Следующие клинически значимые побочные реакции более подробно описаны в разделе «Меры предосторожности».
Тромбоцитопения, анемия и нейтропения ( см «Меры предосторожности»);
- риск инфекции ( см «Меры предосторожности»);
- симптомы обострения после приостановки или прекращения лечения руксолитинибом ( см «Меры предосторожности»);
- немеланомный рак кожи ( см «Меры предосторожности»).
Опыт клинических испытаний при острой болезни «трансплантат против хозяина».
В открытом исследовании с участием одной группы 71 взрослый пациент (в возрасте 18-73 лет) принимал руксолитиниб для лечения острой болезни «трансплантат против хозяина» вместе со стероидами с или без других иммунодепрессантов. Медиана продолжительности лечения руксолитинибом составила 46 дней (диапазон 4-382 дня).
Фатальных побочных реакций при приеме руксолитиниба не было. Побочная реакция, приведшая к прекращению лечения, возникла у 31% пациентов. Наиболее частой побочной реакцией, приводящей к прекращению лечения, была инфекция (10%). В таблице 1 представлены побочные реакции, кроме лабораторных отклонений.
Таблица 1.
Острое заболевание «трансплантат против хозяина»: негематологические побочные реакции, возникавшие у ≥15% пациентов в открытом однокогортном исследовании.
1 Отдельные лабораторные отклонения перечислены в Таблице 2 ниже.
2 Общие терминологические критерии нежелательных явлений сTCAE, версия 4,03.
Отдельные лабораторные отклонения во время лечения руксолитинибом показаны в Таблице 2.
Таблица 2.
Острое заболевание «трансплантат против хозяина»: отдельные лабораторные отклонения, ухудшающиеся по сравнению с исходным уровнем в открытом однокогортном исследовании.
1 Общие терминологические критерии нежелательных явлений сTCAE, версия 4,03.
НЯ сгруппированы в соответствии с классификацией органов и систем органов MedDRA >MedDRA, в пределах каждой группы перечислены в порядке уменьшения частоты встречаемости.
Для оценки частоты встречаемости использованы следующие критерии (согласно классификации ВОЗ): очень часто (≥1/10). часто (≥1/100. <1/10). нечасто (≥1/1000. <1/100). редко (≥1/10000. <1/1000). очень редко (<1/10000).
В клинических исследованиях тяжесть НЯ оценивалась согласно Общей терминологии критериев нежелательных явлений:
1 - легкая степень.
2 - средняя степень.
3 - тяжелая степень.
4 - крайне тяжелая (жизнеугрожающая) степень.
Миелофиброз.
Инфекционные и паразитарные заболевания. Очень часто - инфекции мочевыводящих путей. в частности цистит. уросепсис. пиурия. инфекции почек. часто - опоясывающий герпес. нечасто - туберкулез.
Со стороны крови и лимфатической системы: очень часто - анемия (в тч 3-й степени тяжести (>80-65 г/л). 4-й степени тяжести (<65 г/л). тромбоцитопения. нейтропения. кровотечения. внутричерепные кровоизлияния. подкожные кровоизлияния. синяки. включая ушибы. экхимозы. гематомы. в тч периорбитальная гематома. повышенная склонность к синякам. петехии. пурпура. часто - тромбоцитопения 4-й степени тяжести (<25·109/л). 3-й степени тяжести (50-25·109/л). нейтропения 4-й степени тяжести (<0,5·109/л). 3-й степени тяжести (<1-0,5·109/л).
Со стороны обмена веществ и питания:очень часто. Гиперхолестеринемия (1-й, 2-й степени тяжести), увеличение массы тела.
Со стороны нервной системы. Очень часто - головокружение, вертиго, головная боль; часто - нарушение равновесия; нечасто - болезнь Меньера.
Со стороны ЖКТ. Часто - метеоризм.
Со стороны печени и желчевыводящих путей. Очень часто - повышение активности АЛТ, повышение активности ACT; часто - повышение активности АЛТ 3-й степени (в 5-20 раз выше нормы).
При применении руксолитиниба было получено сообщение о случае развития прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ). При подозрении на развитие ПМЛ следует прекратить применение руксолитиниба.
После прекращения терапии руксолитинибом некоторые пациенты с миелофиброзом испытывали следующие НЯ: лихорадка. респираторный дистресс-синдром. артериальная гипотензия. ДВС-синдром или полиорганная недостаточность.
Истинная полицитемия.
Инфекционные и паразитарные заболевания. Часто - назофарингит, опоясывающий герпес, инфекции мочевыводящих путей.
Со стороны крови и лимфатической системы: очень часто - анемия. тромбоцитопения. часто - тромбоцитопения 3-й степени тяжести (50-25·109/л). нечасто - анемия 3-й степени тяжести (>80-65 г/л). 4-й степени тяжести (<65 г/л). тромбоцитопения 4-й степени тяжести (<25·109/л).
Со стороны обмена веществ и питания. Очень часто - гиперхолестеринемия (1-й, 2-й степени тяжести), гипертриглицеридемия (1-й степени тяжести); часто - увеличение массы тела.
Со стороны нервной системы. Очень часто - головная боль, головокружение.
Со стороны дыхательной системы, органов грудной клетки и средостения. Очень часто - одышка, в тч одышка при физической нагрузке; часто - кашель, носовое кровотечение.
Со стороны ЖКТ. Очень часто - абдоминальная боль, диарея; часто - запор, тошнота.
Со стороны печени и желчевыводящих путей. Очень часто - повышение активности АЛТ, повышение активности ACT; нечасто - повышение активности АЛТ 3-й степени (в 5-20 раз выше нормы).
Со стороны скелетно-мышечной системы и соединительной ткани. Очень часто - мышечные спазмы; часто - артралгия.
Со стороны сосудов. Часто - выраженное повышение АД.
Общие расстройства и нарушения в месте ведения. Очень часто - усталость; часто - астения, отек, в тч периферические отеки.
Если любые из указанных в описании побочных эффектов усугубляются или вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
RxList.com (2016 г.
Поскольку клинические исследования проводятся в разных условиях. частота встречаемости побочных действий в клинических исследованиях ЛС не может быть непосредственно сравнена с количественной оценкой неблагоприятных эффектов. наблюдавшихся в других клинических испытаниях. и может не отражать частоту встречаемости этих эффектов в клинической практике.
Опыт клинических испытаний при миелофиброзе.
Безопасность руксолитиниба оценивалась у 617 пациентов в 6 клинических исследованиях с медианой продолжительности наблюдения 10,9 мес, включая 301 пациента с миелофиброзом в 2 исследованиях фазы 3.
В этих 2 исследованиях фазы 3 медиана продолжительности экспозиции руксолитиниба была 9,5 мес (диапазон от 0,5 до 17 мес), 89% пациентов получали руксолитиниб в течение более 6 мес и 25% - в течение более 12 мес. 111 пациентов начали лечение с 15 мг руксолитиниба 2 раза в день и 190 пациентов - с 20 мг 2 раза в день. Из пациентов. начавших прием ЛС с 15 мг 2 раза в день (количество тромбоцитов до лечения от 100 до 200·109/л) и 20 мг 2 раза в день (количество тромбоцитов до лечения более 200·109/л). 65 и 25% пациентов соответственно потребовалось снижение дозы ниже стартовой в течение первых 8 нед терапии.
В двойном слепом рандомизированном плацебо-контролируемом исследовании у 155 пациентов, получавших руксолитиниб, наиболее частыми побочными реакциями были тромбоцитопения и анемия. Развитие тромбоцитопении, анемии и нейтропении носило дозозависимый характер. Тремя наиболее частыми негематологическими побочными реакциями были подкожные гематомы, головокружение и головная боль.
Прекращение лечения в результате развития нежелательных явлений. независимо от причины. было зафиксировано у 11% пациентов. получавших руксолитиниб. и 11% пациентов. получавших плацебо.
В двойном слепом плацебо-контролируемом исследовании в период рандомизации наиболее распространенными побочными реакциями всех степеней тяжести в соответствии с критериями Национального института рака (CTCAE1) или 3-4-й степени (приведены в скобках. через /). возникавшими у пациентов с миелофиброзом. которые получали руксолитиниб (n=155). в сравнении с плацебо (n=151) были следующие (в процентах).
Синяки2 - 23 (<1/0) и 15 (0/0).
Головокружение3 - 18 (<1/0) и 7 (0/0).
Головная боль - 15 (0/0) и 5 (0/0).
Инфекции мочевыводящих путей4 - 9 (0/0) и 5 (<1/<1).
Увеличение массы тела5 - 7 (<1/0) и 1 (<1/0).
Метеоризм - 5 (0/0) и <1 (0/0).
Herpes Zoster6 - 2 (0/0) и <1 (0/0).
1 Критерии стандартной терминологии нежелательных явлений сTCAE, версия 3,0.
2 Включает ушиб. экхимоз. гематому. в тч в месте инъекции. периорбитальную гематому. повышенную склонность к синякам. петехии. пурпуру.
3 Включает головокружение. постуральное головокружение. вертиго. нарушение равновесия. болезнь Меньера. лабиринтит.
4 Включает инфекции мочевыводящих путей. цистит. уросепсис. бактериальные инфекции мочевыводящих путей. инфекции почек. пиурию. выявление бактерий в моче. наличие нитритов в моче.
5 В тч аномальное.
6 Включает Herpes Zoster и постгерпетическую невралгию.
Описание отдельных нежелательных лекарственных реакций.
Анемия. В 2 клинических исследованиях фазы 3 медиана времени до начала развития первого НЯ 2-й степени или выше (в соответствии с сTCAE) - анемии - составила примерно 6 нед. У одного пациента (<1%) лечение было прекращено из-за развития анемии. У пациентов. получавших руксолитиниб. уровень Hb снижался до значений. примерно на 1,5-2 г/дл ниже исходного уровня. после 8-12 нед терапии. а затем постепенно повышался и сохранялся на уровне. который был приблизительно на 1 г/дл ниже исходного. Эта картина наблюдалась у больных независимо от того, проводили ли им трансфузию во время терапии или нет.
В рандомизированном плацебо-контролируемом исследовании у 60% пациентов, принимавших руксолитиниб, и 38% пациентов из группы плацебо было проведено переливание эритроцитарной массы в период рандомизации. Среди пациентов. которым проводили трансфузию. медиана количества переливаний в месяц составила 1,2 у больных. получавших руксолитиниб. и 1,7 у больных. получавших плацебо.
Тромбоцитопения. В двух клинических исследованиях фазы 3 у пациентов, у которых развилась тромбоцитопения 3-й или 4-й степени, медиана времени до ее развития была примерно 8 нед. Тромбоцитопения была обычно обратимой при снижении дозы или временном прерывании приема руксолитиниба. Медиана времени до восстановления количества тромбоцитов выше 50·109/л составила 14 дней. Трансфузия тромбоцитов была проведена у 5% пациентов, получавших руксолитиниб, и у 4% пациентов, находившихся на контрольном режиме. Прекращение лечения из-за развития тромбоцитопении было отмечено в <1% случаев у пациентов, получавших руксолитиниб, и у <1% пациентов, находившихся на контрольном режиме. У пациентов с количеством тромбоцитов от 100·109/л до 200·109/л до начала лечения руксолитинибом была более высокая частота тромбоцитопении 3-й или 4-й степени по сравнению с пациентами. у которых количество тромбоцитов было больше чем 200·109/л (17 против 7%).
Нейтропения. В 2 клинических исследованиях фазы 3 у 1% больных был временно прекращен прием или снижена доза руксолитиниба из-за развития нейтропении.
Ниже представлены отклонения гематологических лабораторных показателей. наблюдавшиеся в плацебо-контролируемом исследовании1 и отмеченные при гематологических неблагоприятных реакциях всех степеней тяжести по классификации сTCAE2 3-й и 4-й степени (приведены в скобках. через /) у пациентов с миелофиброзом. которые получали руксолитиниб (n=155). в сравнении с плацебо (n=151) (в процентах).
Тромбоцитопения - 70 (9/4) и 31 (1/0).
Анемия - 96 (34/11) и 87 (16/3).
Нейтропения - 19 (5/2) и 4 (<1/1).
1 Представленные величины являются наибольшими отклонениями, независимо от исходного уровня.
2 Критерии стандартной терминологии нежелательных явлений сTCAE, версия 3,0.
Дополнительные данные плацебо-контролируемого исследования.
У 25% пациентов, получавших руксолитиниб, и 7% пациентов, получавших плацебо, отмечались отклонения АЛТ степени 1 (вновь развившиеся или ухудшение показателей). Повышение АЛТ 2-й степени и больше при приеме руксолитиниба составляло 2%, 3-й и 4-й степени - 1%.
У 17% пациентов, получавших руксолитиниб, и 6% больных, получавших плацебо, отмечались отклонения АСТ (вновь развившиеся или ухудшение показателей). Увеличение АСТ 2-й степени при приеме руксолитиниба было <1%, 3-й или 4-й степени - не отмечалось.
У 17% пациентов, получавших руксолитиниб, и <1% пациентов, получавших плацебо, отмечались отклонения уровня Хс (вновь развившиеся или ухудшение показателей). Повышение Хс 2-й степени при приеме руксолитиниба было <1%, 3-й или 4-й степени - не отмечалось.
Опыт клинических исследований при истинной полицитемии.
В рандомизированном открытом актив-контролируемом исследовании 110 пациентов с истинной полицитемией. при резистентности или непереносимости гидроксимочевины. получали руксолитиниб. и 111 пациентов получали наилучшую доступную терапию. Наиболее частой побочной лекарственной реакцией была анемия.
Прекращение приема ЛС из-за развития неблагоприятных событий, независимо от причины, наблюдалось у 4% пациентов, получавших руксолитиниб.
В открытом актив-контролируемом исследовании сроком до 32 нед в период рандомизации у пациентов с истинной полицитемией были отмечены следующие. связанные с лечением. неблагоприятные реакции. наблюдавшиеся у ≥ 6% пациентов. принимавших руксолитиниб (n=110). всех степеней тяжести в соответствии с критериями сTCAE1 или 3-й и 4-й степени (приведены в скобках. через /) в сравнении с наилучшей имеющейся терапией (n=111) (в процентах).
Головная боль - 16 (<1) и 19 (<1).
Боль в животе2 - 15 (<1) и 15 (<1).
Диарея - 15 (0) и 7 (<1).
Головокружение3 - 15 (0) и 13 (0).
Усталость - 15 (0) и 15 (3).
Зуд - 14 (<1) и 23 (4).
Диспноэ4 - 13 (3) и 4 (0).
Мышечные спазмы - 12 (<1) и 5 (0).
Назофарингит - 9 (0) и 8 (0).
Запор - 8 (0) и 3 (0).
Кашель - 8 (0) и 5 (0).
Эдема5 - 8 (0) и 7 (0).
Артралгия - 7 (0) и 6 (<1).
Астения - 7 (0) и 11 (2).
Носовое кровотечение - 6 (0) и 3 (0).
Herpes Zoster6 - 6 (<1) и 0 (0).
Тошнота - 6 (0) и 4 (0).
1 Критерии стандартной терминологии нежелательных явлений сTCAE, версия 3,0.
2 Включает боль в нижней и верхней части живота.
3 Включает головокружение и вертиго.
4 Включает одышку и одышку при физической нагрузке.
5 Включает отеки, в тч периферические.
6 Включает Herpes Zoster и постгерпетическую невралгию.
Другие клинически важные. возникавшие в связи с лечением. НЯ. наблюдавшиеся менее чем у 6% пациентов. получавших руксолитиниб: увеличение массы тела. гипертензия. инфекции мочевыводящих путей.
Далее представлены отклонения отдельных важных лабораторных показателей. зафиксированные в открытом актив-контролируемом исследовании до 32 нед в период рандомизации1 у пациентов с истинной полицитемией. получавших руксолитиниб (n=110). всех степеней тяжести в соответствии с критериями сTCAE2 или 3-й и 4-й степени (приведены в скобках. через /) в сравнении с наилучшей имеющийся терапией (n=111) (в процентах).
Гематология. Анемия - 72 (<1/<1) и 58 (0/0).
Тромбоцитопения - 27 (5/<1) и 24 (3/<1).
Нейтропения - 3 (0/<1) и 10 (<1/0).
Биохимия. Гиперхолестеринемия - 35 (0/0) и 8 (0/0).
Повышение - АЛТ 25 (<1/0) и 16 (0/0).
Повышение АСТ - 23 (0/0) и 23 (<1/0).
Гипертриглицеридемия - 15 (0/0) и 13 (0/0).
1 Представленные величины являются наибольшими отклонениями, независимо от исходного уровня.
2 Критерии стандартной терминологии нежелательных явлений сTCAE, версия 3,0.
RxList.com (обновление 2021 г.
Следующие клинически значимые побочные реакции более подробно описаны в разделе «Меры предосторожности».
Тромбоцитопения, анемия и нейтропения ( см «Меры предосторожности»);
- риск инфекции ( см «Меры предосторожности»);
- симптомы обострения после приостановки или прекращения лечения руксолитинибом ( см «Меры предосторожности»);
- немеланомный рак кожи ( см «Меры предосторожности»).
Опыт клинических испытаний при острой болезни «трансплантат против хозяина».
В открытом исследовании с участием одной группы 71 взрослый пациент (в возрасте 18-73 лет) принимал руксолитиниб для лечения острой болезни «трансплантат против хозяина» вместе со стероидами с или без других иммунодепрессантов. Медиана продолжительности лечения руксолитинибом составила 46 дней (диапазон 4-382 дня).
Фатальных побочных реакций при приеме руксолитиниба не было. Побочная реакция, приведшая к прекращению лечения, возникла у 31% пациентов. Наиболее частой побочной реакцией, приводящей к прекращению лечения, была инфекция (10%). В таблице 1 представлены побочные реакции, кроме лабораторных отклонений.
Таблица 1.
Острое заболевание «трансплантат против хозяина»: негематологические побочные реакции, возникавшие у ≥15% пациентов в открытом однокогортном исследовании.
| Побочные реакции1 | Руксолитиниб (n=71) | |
| Все степени2, % | Степень 3-4, % | |
| Инфекции | 55 | 41 |
| Отек | 51 | 13 |
| Кровотечение | 49 | 20 |
| Усталость | 37 | 14 |
| Бактериальные инфекции | 32 | 28 |
| Одышка | 32 | 7 |
| Вирусные инфекции | 31 | 14 |
| Тромбоз | 25 | 11 |
| Диарея | 24 | 7 |
| Сыпь | 23 | 3 |
| Головная боль | 21 | 4 |
| Гипертензия | 20 | 13 |
1 Отдельные лабораторные отклонения перечислены в Таблице 2 ниже.
2 Общие терминологические критерии нежелательных явлений сTCAE, версия 4,03.
Отдельные лабораторные отклонения во время лечения руксолитинибом показаны в Таблице 2.
Таблица 2.
Острое заболевание «трансплантат против хозяина»: отдельные лабораторные отклонения, ухудшающиеся по сравнению с исходным уровнем в открытом однокогортном исследовании.
| Лабораторный параметр | Руксолитиниб (n=71) | |
| Худшая оценка в период лечения | ||
| Все степени1, % | Степень 3-4, % | |
| Гематология | ||
| Анемия | 75 | 45 |
| Тромбоцитопения | 75 | 61 |
| Нейтропения | 58 | 40 |
| Биохимия | ||
| Повышение АЛТ | 48 | 8 |
| Повышение АСТ | 48 | 6 |
| Гипертриглицеридемия | 11 | 1 |
1 Общие терминологические критерии нежелательных явлений сTCAE, версия 4,03.
Interaction
Средства, которые могут изменить концентрацию руксолитиниба в плазме крови.
Сильные ингибиторы изофермента сYP3A4. У здоровых добровольцев прием кетоконазола, сильного ингибитора изофермента сYP3A4, в дозе 200 мг 2 раза в день в течение 4 дней приводил к повышению AUC руксолитиниба на 91% и удлинению 1/2T1/2 с 3,7 до 6.
В случае применения с сильными ингибиторами изофермента сYP3A4 общая суточная доза руксолитиниба должна быть снижена приблизительно на 50%.
За пациентами необходимо осуществлять тщательное наблюдение на предмет снижения количества форменных элементов крови, при необходимости рекомендуется дальнейшая коррекция дозы на основании данных эффективности и безопасности.
RxList.com (2016 г.
Сильные ингибиторы изофермента сYP3A4. В испытании у 16 здоровых добровольцев, которые принимали однократную дозу руксолитиниба 10 мг в 1-й день, а также ту же дозу руксолитиниба в 5-й день совместно с кетоконазолом (сильным ингибитором изофермента сYP3A4) 200 мг 2 раза в день со 2-го по 5-й день, кетоконазол повышал maxCmax руксолитиниба на 33% , AUC - на 91% и удлинял 1/2T1/2 руксолитиниба с 3,7 до 6.
Слабые и умеренные ингибиторы изофермента сYP3A4. Прием эритромицина, умеренного ингибитора изофермента сYP3A4, в дозе 500 мг 2 раза в день у здоровых добровольцев в течение 4 дней приводил к повышению на 27% AUC руксолитиниба.
RxList.com (2016 г.
Слабые и умеренные ингибиторы изофермента сYP3A4. В испытании у 15 здоровых добровольцев, которые принимали однократную дозу руксолитиниба 10 мг в 1-й день, а также ту же дозу руксолитиниба в 5-й день совместно с эритромицином (умеренным ингибитором изофермента сYP3A4) 500 мг 2 раза в день со 2-го по 5-й день, эритромицин приводил к повышению maxCmax руксолитиниба на 8% и AUC - на 27%.
Коррекция дозы не требуется при одновременном применении руксолитиниба со слабыми или умеренными ингибиторами изофермента сYP3A4 (в тч эритромицин). В начале терапии руксолитинибом одновременно с умеренными ингибиторами изофермента сYP3A4 требуется тщательное наблюдение за пациентами и оценка количества форменных элементов крови.
Двойные умеренные ингибиторы изоферментов сYP2C9 и сYP3A4. На основании результатов моделирования лекарственного взаимодействия, ожидается увеличение AUC руксолитиниба в 2,9 и 4,3 раза при одновременном применении с флуконазолом в дозах 200 и 400 мг соответственно. Дозу руксолитиниба следует уменьшить на 50% при одновременном применении с двойными умеренными ингибиторами изоферментов сYP2C9 и сYP3A4. Следует избегать одновременного применения руксолитиниба с флуконазолом в дозе, превышающей 200 мг в день.
RxList.com (2016 г.
Флуконазол. Результаты моделирования с использованием физиологической модели фармакокинетики свидетельствуют о том, что флуконазол (двойной ингибитор изоферментов сYP2C9 и сYP3A4) повышает AUC руксолитиниба в равновесном состоянии приблизительно от 100 до 300% при одновременном применении 10 мг руксолитиниба 2 раза в день с флуконазолом в дозах от 100 до 400 мг 1 раз в день соответственно.
Индукторы изофермента сYP3A4. В начале лечения одновременно с индукторами изофермента сYP3A4 коррекция дозы не рекомендована. Если эффективность терапии руксолитинибом снижается при одновременной терапии индукторами изофермента сYP3A4, необходимо рассмотреть постепенное увеличение дозы руксолитиниба.
У здоровых добровольцев, получавших рифампицин (сильный индуктор изофермента сYP3A4) в дозе 600 мг 1 раз в день в течение 10 дней, AUC руксолитиниба после приема однократной дозы уменьшалась на 71%, и 1/2T1/2 снижался с 3,3 до 1,7 Относительное количество активных метаболитов повышалось по отношению к исходному веществу.
RxList.com (2016 г.
Индукторы изофермента сYP3A4. В исследовании у 12 здоровых добровольцев, получавших однократную дозу руксолитиниба 50 мг в 1-й день, а также однократную дозу руксолитиниба 50 мг на 13-й день совместно с рифампицином (сильным индуктором изофермента сYP3A4) в дозе 600 мг с 3-го по 13-й день рифампицин снижал maxCmax и AUC руксолитиниба на 32 и 61% соответственно. Кроме того, относительная экспозиция активных метаболитов руксолитиниба повышалась на 100%.
Коррекция дозы не рекомендована. Однако необходим периодический мониторинг пациентов и коррекция дозы руксолитиниба на основании данных безопасности и эффективности.
Р-gp и другие белки-переносчики. Не рекомендуется коррекция дозы при применении руксолитиниба одновременно с ЛС, взаимодействующими с Р-gp и другими белками-переносчиками.
Другие изученные лекарственные взаимодействия.
Субстраты сYP3A4. Исследование у здоровых добровольцев продемонстрировало отсутствие клинически значимого фармакокинетического взаимодействия руксолитиниба с мидазоламом (субстрат изофермента сYP3A4).
Пероральные контрацептивы. Исследование у здоровых добровольцев продемонстрировало отсутствие влияния руксолитиниба на фармакокинетику пероральных контрацептивов, содержащих этинилэстрадиол и левоноргестрел, в связи с чем не ожидается снижение эффективности пероральных контрацептивов с данной комбинацией действующих веществ при одновременном применении с руксолитинибом.
RxList.com (2016 г.
In vitro исследования. In vitro руксолитиниб и его метаболит M18 не ингибируют сYP1A2, сYP2C8, сYP2B6, сYP2C9, сYP2C19, сYP2D6 или сYP3A4. Руксолитиниб не является индуктором сYP1A2, сYP3A4 или сYP2B6 в клинически значимых концентрациях.
In vitro руксолитиниб и его метаболит M18 не ингибируют транспортные системы Р-gp, вCRP, OATP1B1, OATP1B3, OCT1, OCT2, OAT1 и OAT3 в клинически значимых концентрациях. Руксолитиниб не является субстратом для Р-gp-переносчика.
Сильные ингибиторы изофермента сYP3A4. У здоровых добровольцев прием кетоконазола, сильного ингибитора изофермента сYP3A4, в дозе 200 мг 2 раза в день в течение 4 дней приводил к повышению AUC руксолитиниба на 91% и удлинению 1/2T1/2 с 3,7 до 6.
В случае применения с сильными ингибиторами изофермента сYP3A4 общая суточная доза руксолитиниба должна быть снижена приблизительно на 50%.
За пациентами необходимо осуществлять тщательное наблюдение на предмет снижения количества форменных элементов крови, при необходимости рекомендуется дальнейшая коррекция дозы на основании данных эффективности и безопасности.
RxList.com (2016 г.
Сильные ингибиторы изофермента сYP3A4. В испытании у 16 здоровых добровольцев, которые принимали однократную дозу руксолитиниба 10 мг в 1-й день, а также ту же дозу руксолитиниба в 5-й день совместно с кетоконазолом (сильным ингибитором изофермента сYP3A4) 200 мг 2 раза в день со 2-го по 5-й день, кетоконазол повышал maxCmax руксолитиниба на 33% , AUC - на 91% и удлинял 1/2T1/2 руксолитиниба с 3,7 до 6.
Слабые и умеренные ингибиторы изофермента сYP3A4. Прием эритромицина, умеренного ингибитора изофермента сYP3A4, в дозе 500 мг 2 раза в день у здоровых добровольцев в течение 4 дней приводил к повышению на 27% AUC руксолитиниба.
RxList.com (2016 г.
Слабые и умеренные ингибиторы изофермента сYP3A4. В испытании у 15 здоровых добровольцев, которые принимали однократную дозу руксолитиниба 10 мг в 1-й день, а также ту же дозу руксолитиниба в 5-й день совместно с эритромицином (умеренным ингибитором изофермента сYP3A4) 500 мг 2 раза в день со 2-го по 5-й день, эритромицин приводил к повышению maxCmax руксолитиниба на 8% и AUC - на 27%.
Коррекция дозы не требуется при одновременном применении руксолитиниба со слабыми или умеренными ингибиторами изофермента сYP3A4 (в тч эритромицин). В начале терапии руксолитинибом одновременно с умеренными ингибиторами изофермента сYP3A4 требуется тщательное наблюдение за пациентами и оценка количества форменных элементов крови.
Двойные умеренные ингибиторы изоферментов сYP2C9 и сYP3A4. На основании результатов моделирования лекарственного взаимодействия, ожидается увеличение AUC руксолитиниба в 2,9 и 4,3 раза при одновременном применении с флуконазолом в дозах 200 и 400 мг соответственно. Дозу руксолитиниба следует уменьшить на 50% при одновременном применении с двойными умеренными ингибиторами изоферментов сYP2C9 и сYP3A4. Следует избегать одновременного применения руксолитиниба с флуконазолом в дозе, превышающей 200 мг в день.
RxList.com (2016 г.
Флуконазол. Результаты моделирования с использованием физиологической модели фармакокинетики свидетельствуют о том, что флуконазол (двойной ингибитор изоферментов сYP2C9 и сYP3A4) повышает AUC руксолитиниба в равновесном состоянии приблизительно от 100 до 300% при одновременном применении 10 мг руксолитиниба 2 раза в день с флуконазолом в дозах от 100 до 400 мг 1 раз в день соответственно.
Индукторы изофермента сYP3A4. В начале лечения одновременно с индукторами изофермента сYP3A4 коррекция дозы не рекомендована. Если эффективность терапии руксолитинибом снижается при одновременной терапии индукторами изофермента сYP3A4, необходимо рассмотреть постепенное увеличение дозы руксолитиниба.
У здоровых добровольцев, получавших рифампицин (сильный индуктор изофермента сYP3A4) в дозе 600 мг 1 раз в день в течение 10 дней, AUC руксолитиниба после приема однократной дозы уменьшалась на 71%, и 1/2T1/2 снижался с 3,3 до 1,7 Относительное количество активных метаболитов повышалось по отношению к исходному веществу.
RxList.com (2016 г.
Индукторы изофермента сYP3A4. В исследовании у 12 здоровых добровольцев, получавших однократную дозу руксолитиниба 50 мг в 1-й день, а также однократную дозу руксолитиниба 50 мг на 13-й день совместно с рифампицином (сильным индуктором изофермента сYP3A4) в дозе 600 мг с 3-го по 13-й день рифампицин снижал maxCmax и AUC руксолитиниба на 32 и 61% соответственно. Кроме того, относительная экспозиция активных метаболитов руксолитиниба повышалась на 100%.
Коррекция дозы не рекомендована. Однако необходим периодический мониторинг пациентов и коррекция дозы руксолитиниба на основании данных безопасности и эффективности.
Р-gp и другие белки-переносчики. Не рекомендуется коррекция дозы при применении руксолитиниба одновременно с ЛС, взаимодействующими с Р-gp и другими белками-переносчиками.
Другие изученные лекарственные взаимодействия.
Субстраты сYP3A4. Исследование у здоровых добровольцев продемонстрировало отсутствие клинически значимого фармакокинетического взаимодействия руксолитиниба с мидазоламом (субстрат изофермента сYP3A4).
Пероральные контрацептивы. Исследование у здоровых добровольцев продемонстрировало отсутствие влияния руксолитиниба на фармакокинетику пероральных контрацептивов, содержащих этинилэстрадиол и левоноргестрел, в связи с чем не ожидается снижение эффективности пероральных контрацептивов с данной комбинацией действующих веществ при одновременном применении с руксолитинибом.
RxList.com (2016 г.
In vitro исследования. In vitro руксолитиниб и его метаболит M18 не ингибируют сYP1A2, сYP2C8, сYP2B6, сYP2C9, сYP2C19, сYP2D6 или сYP3A4. Руксолитиниб не является индуктором сYP1A2, сYP3A4 или сYP2B6 в клинически значимых концентрациях.
In vitro руксолитиниб и его метаболит M18 не ингибируют транспортные системы Р-gp, вCRP, OATP1B1, OATP1B3, OCT1, OCT2, OAT1 и OAT3 в клинически значимых концентрациях. Руксолитиниб не является субстратом для Р-gp-переносчика.
Overdose
Симптомы. Применение руксолитиниба однократно в дозе до 200 мг переносилось удовлетворительно. Превышение рекомендуемых доз ассоциировалось с усилением миелосупрессии, что проявлялось лейкопенией, анемией и тромбоцитопенией.
Лечение. При развитии нежелательных явлений, связанных с передозировкой руксолитиниба, необходимо применить соответствующее поддерживающее лечение.
Гемодиализ неэффективен.
Антидот к руксолитинибу неизвестен.
Лечение. При развитии нежелательных явлений, связанных с передозировкой руксолитиниба, необходимо применить соответствующее поддерживающее лечение.
Гемодиализ неэффективен.
Антидот к руксолитинибу неизвестен.
Method of drug use and dosage
Внутрь. Рекомендуемая начальная доза руксолитиниба при лечении пациентов с миелофиброзом - 15 мг 2 раза в день для пациентов с количеством тромбоцитов 100-200·109/л и 20 мг 2 раза в день для пациентов с количеством тромбоцитов >200·109/л.
Максимальная рекомендуемая начальная доза у пациентов с количеством тромбоцитов 50-100·109/л - 5 мг 2 раза в день с последующей коррекцией дозы, которую проводят с осторожностью.
Рекомендуемая начальная доза руксолитиниба при лечении пациентов с истинной полицитемией - 10 мг 2 раза в день.
RxList.com (обновление 2021 г.
Внутрь. Дозу подбирают индивидуально, в зависимости от показаний, гематологических показателей, функции печени, эффективности лечения.
Максимальная рекомендуемая начальная доза у пациентов с количеством тромбоцитов 50-100·109/л - 5 мг 2 раза в день с последующей коррекцией дозы, которую проводят с осторожностью.
Рекомендуемая начальная доза руксолитиниба при лечении пациентов с истинной полицитемией - 10 мг 2 раза в день.
RxList.com (обновление 2021 г.
Внутрь. Дозу подбирают индивидуально, в зависимости от показаний, гематологических показателей, функции печени, эффективности лечения.
Application precautions
Снижение количества форменных элементов крови.
Лечение руксолитинибом может приводить к развитию гематологических нежелательных реакций, включающих тромбоцитопению, анемию и нейтропению. До начала лечения руксолитинибом необходимо провести общий анализ крови.
RxList.com (обновление 2021 г.
Тромбоцитопения, анемия и нейтропения.
Необходимо провести полный анализ крови перед лечением и проводить мониторинг крови каждые 2-4 нед до стабилизации доз, а затем в соответствии с клиническими показаниями.
Тромбоцитопения. У пациентов со сниженным количеством тромбоцитов (<200·109/л) в начале терапии приблизительно в 2 раза возрастает вероятность развития тромбоцитопении во время лечения руксолитинибом. В клинических исследованиях у пациентов с миелофиброзом тромбоцитопения 3-й или 4-й степени тяжести развивалась приблизительно к 8-й нед терапии. Тромбоцитопения в целом обратима и обычно корректируется снижением дозы или временным прекращением приема руксолитиниба. Количество тромбоцитов восстанавливалось до значений более 50·109/л в течение 14 дней. Тем не менее в некоторых случаях может потребоваться трансфузия концентратов тромбоцитов.
У пациентов с истинной полицитемией тромбоцитопения отмечалась реже (24,5%), чем у пациентов с миелофиброзом (69,8%). Тромбоцитопения 3-й и 4-й степени тяжести отмечалась у 5,54% пациентов с истинной полицитемией и у 11,6% пациентов с миелофиброзом.
Анемия. При развитии анемии может потребоваться переливание эритроцитарной массы. Кроме того, необходимо оценить необходимость коррекции дозы или прерывания лечения руксолитинибом. Примерно 50% пациентов с миелофиброзом, участвовавших в клинических исследованиях и получавших руксолитиниб, и 37% пациентов в группе контроля в ходе исследования потребовалось переливание эритроцитарной массы. У пациентов, получавших руксолитиниб, концентрация Hb достигала максимально низкого уровня (на 15-20 г/л ниже исходного показателя) на 8-12-й нед терапии. В дальнейшем концентрация Hb постепенно повышалась и сохранялась на уровне на 10 г/л ниже исходной (до начала лечения). Данная тенденция наблюдалась независимо от того, получал ли пациент гемотрансфузию во время терапии.
У пациентов с истинной полицитемией анемия отмечалась реже (46,8%), чем у пациентов с миелофиброзом (82,4%). Анемия 3-й и 4-й степени тяжести отмечалась у 1,8% пациентов с истинной полицитемией и у 42,5% пациентов с миелофиброзом.
Нейтропения. У пациентов с миелофиброзом нейтропения 3-й и 4-й степени развивалась приблизительно к 12-й нед терапии. В целом нейтропения (абсолютное число нейтрофилов <0,5·109/л), в случае ее развития, была обратима и корректировалась временной отменой приема руксолитиниба. У пациентов с истинной полицитемией нейтропения была отмечена у 2 пациентов, при этом у одного из пациентов отмечено развитие нейтропении 4-й степени тяжести.
Кровотечения. Кровотечения (включая внутричерепные кровоизлияния, желудочно-кишечные кровотечения, подкожные кровоизлияния, петехии, пурпуру и другие кровотечения) были зарегистрированы у 32,6% пациентов, получавших руксолитиниб. 65,3% всех кровотечений составляли случаи развития подкожных гематом, которые отмечались у 21,3% пациентов. Частота развития кровотечений 3-й и 4-й степени тяжести составляла 4,7%. Случаи развития внутричерепных кровоизлияний были отмечены у 1% пациентов, желудочно-кишечных кровотечений - у 5% пациентов, кровотечений вследствие других причин (в тч носовое кровотечение, послеоперационные кровотечения и гематурия) - у 13,3% пациентов, получавших руксолитиниб.
Инфекции. Перед применением руксолитиниба следует оценить наличие/риск развития тяжелых бактериальных, микобактериальных, грибковых и вирусных инфекций. У пациентов, получавших руксолитиниб, сообщалось о случаях развития туберкулеза. Следует помнить о возможности развития активной или латентной формы туберкулеза. Не следует начинать терапию руксолитинибом до разрешения тяжелого активного инфекционного процесса. Следует тщательно наблюдать пациентов, получающих руксолитиниб, на предмет развития симптомов инфекции и в случае необходимости незамедлительно начинать соответствующее лечение.
RxList.com (обновление 2021 г.
Риск развития инфекции.
Наблюдались тяжелые бактериальные, микобактериальные, грибковые и вирусные инфекции.
Туберкулез. Перед началом приема руксолитиниба пациенты должны быть обследованы на предмет наличия факторов риска туберкулеза, а пациенты с повышенным риском должны быть проверены на латентную инфекцию. Факторы риска включают, помимо прочего, предыдущее проживание или поездки в страны с высокой распространенностью туберкулеза, тесный контакт с человеком с активным туберкулезом, а также наличие активного или латентного туберкулеза в анамнезе, при невозможности подтвердить адекватный курс лечения.
Для пациентов с признаками активного или латентного туберкулеза необходимо проконсультироваться с врачом, имеющим опыт лечения туберкулеза, прежде чем начинать прием руксолитиниба. Решение о продолжении лечения руксолитинибом во время лечения активного туберкулеза должно основываться на оценке общего риска и пользы.
У пациентов с хроническим вирусным гепатитом В, получающих руксолитиниб, отмечалось увеличение титра ДНК вируса гепатита В как с, так и без сопровождающего увеличения активности ACT и АЛТ. Неизвестно влияние руксолитиниба на репликацию ДНК вируса гепатита В. Лечение и контроль состояния пациентов с хроническим вирусным гепатитом В следует проводить в соответствии с общепринятыми стандартами клинической практики.
Опоясывающий герпес. Перед применением руксолитиниба врачу следует обучить пациента своевременному выявлению ранних симптомов опоясывающего герпеса, сообщив о необходимости раннего начала лечения.
Прогрессирующая мультифокальная лейкоэнцефалопатия. При применении руксолитиниба было получено сообщение о случае развития ПМЛ. При подозрении на развитие ПМЛ следует прекратить применение руксолитиниба.
Злокачественные новообразования кожи, за исключением меланомы. При применении руксолитиниба сообщалось о случаях развития злокачественных новообразований кожи, за исключением меланомы, в тч базальноклеточной и плоскоклеточной карциномы, а также карциномы из клеток Меркеля. В большинстве случаев у таких пациентов в анамнезе проводилось продолжительное лечение препаратами гидроксимочевины или ранее были выявлены злокачественные новообразования кожи, за исключением меланомы, или предраковые поражения кожи. Причинно-следственная связь с применением руксолитиниба не была установлена. Рекомендуется проводить периодическое обследование кожных покровов у пациентов с повышенным риском развития злокачественных новообразований кожи.
Синдром отмены. После прекращения терапии руксолитинибом симптомы миелофиброза (такие как усталость, боль в костях, лихорадка, зуд, ночная потливость, симптоматическая спленомегалия и снижение массы тела) могут возвращаться. В клинических исследованиях общая шкала симптомов миелофиброза постепенно возвращалась к исходным показателям в течение 7 дней после прекращения применения.
RxList.com (2016 г.
Симптомы обострения миелофиброза после приостановки или прекращения лечения руксолитинибом. После прекращения терапии руксолитинибом симптомы миелофиброза обычно возвращаются к исходным в течение примерно 1 нед. У некоторых пациентов были случаи одной или более из следующих неблагоприятных реакций после прекращения приема руксолитиниба: лихорадка, респираторный дистресс-синдром, гипотензия, ДВС или полиорганная недостаточность. Если один или более из этих симптомов отмечаются после прекращения лечения или во время снижения дозы руксолитиниба, необходимо оценить и лечить интеркуррентные заболевания и рассмотреть возможность возобновления приема или увеличение дозы руксолитиниба. Следует проинструктировать пациентов о том, чтобы не прерывать и не прекращать терапию руксолитинибом без консультации с врачом. При прекращении или прерывании терапии руксолитинибом по иным, нежели тромбоцитопения или нейтропения, причинам предпочтительнее снизить дозу постепенно, нежели резко прекратить лечение.
RxList.com (обновление 2021 г.
Повышение уровня липидов. Лечение руксолитинибом было ассоциировано с повышением липидных параметров, включая общий Хс, Хс ЛПНП и триглицериды. Влияние этого повышения липидных параметров на сердечно-сосудистую заболеваемость и смертность не было определено у пациентов, получавших руксолитиниб. Следует оценить липидные параметры примерно через 8-12 нед после начала терапии руксолитинибом. Необходим мониторинг и лечение в соответствии с клиническими рекомендациями по лечению гиперлипидемии.
Особые группы пациентов.
Нарушение функции почек. У пациентов с миелофиброзом и нарушением функции почек тяжелой степени (Cl креатинина менее 30 мл/мин) рекомендуемая начальная доза, основанная на числе тромбоцитов, должна быть снижена приблизительно на 50%. Рекомендуемая начальная доза при лечении пациентов с истинной полицитемией и нарушением функции почек тяжелой степени составляет 5 мг 2 раза в день внутрь.
Пациенты с нарушением функции почек тяжелой степени, получающие руксолитиниб, должны тщательно наблюдаться, и при необходимости доза ЛС должна быть снижена во избежание развития нежелательных лекарственных реакций.
Имеются ограниченные данные по применению руксолитиниба у пациентов с терминальной стадией почечной недостаточности на гемодиализе. У данной категории пациентов с миелофиброзом лечение следует начинать с приема однократной дозы 15 или 20 мг (на основании количества тромбоцитов), с последующими однократными дозами после каждой процедуры гемодиализа при тщательной оценке соотношения польза/риск.
У пациентов с истинной полицитемией и терминальной стадией почечной недостаточности на гемодиализе лечение следует начинать с приема однократной дозы 10 мг после процедуры гемодиализа только в день ее проведения при тщательном контроле состояния и оценке соотношения польза/риск.
RxList.com (2016 г.
Почечная недостаточность. Безопасность и фармакокинетика однократной дозы руксолитиниба (25 мг) были оценены в исследовании у здоровых добровольцев (Cl креатинина 72-164 мл/мин (n=8) и людей с легкой (Cl креатинина 53-83 мл/мин (n=8), умеренной (Cl креатинина 38-57 мл/мин (n=8), тяжелой почечной недостаточностью (Cl креатинина 15-51 мл/мин (n=8), а также у 8 дополнительных субъектов с терминальной стадией почечной недостаточности, требующей проведения гемодиализа.
Фармакокинетика руксолитиниба была схожей при различной степени почечной недостаточности и нормальной функции почек. Однако значения AUC метаболитов руксолитиниба в плазме увеличивались при увеличении степени тяжести почечной недостаточности. Это было наиболее заметно у людей с терминальной стадией почечной недостаточности, нуждающихся в гемодиализе. Изменение фармакодинамического показателя, ингибирование р.
STAT3 согласуется с соответствующим увеличением экспозиции метаболита. Руксолитиниб не удаляется с помощью диализа; однако удаление некоторых активных метаболитов путем диализа не может быть исключено.
При приеме руксолитиниба пациентами с умеренной (Cl креатинина 30-59 мл/мин) или тяжелой почечной недостаточностью (Cl креатинина 15-29 мл/мин) с количеством тромбоцитов от 100·109/л и 150·109/л и пациентами с терминальной стадией заболевания почек, находящихся на диализе, рекомендуется снижение дозы.
RxList.com (обновление 2021 г.
После перорального приема руксолитиниба в однократной дозе 25 мг общая AUC руксолитиниба и его активных метаболитов увеличилась в 1,3; 1,5 и 1,9 раза у пациентов с легкой, умеренной и тяжелой почечной недостаточностью соответственно, по сравнению с таковой у людей с нормальной функцией почек (Cl креатинина ≥90 мл/мин). Кроме того, общая AUC руксолитиниба и его активных метаболитов увеличилась в 1,6 раза у пациентов с терминальной стадией почечной недостаточности после диализа, по сравнению с таковой у пациентов с нормальной функцией почек (Cl креатинина ≥90 мл/мин).
Нарушение функции печени. У пациентов с нарушением функции печени рекомендуемая начальная доза, основанная на числе тромбоцитов, должна быть снижена приблизительно на 50%. Пациенты с диагностированным нарушением функции печени тяжелой степени, получающие руксолитиниб, должны тщательно наблюдаться, и при необходимости доза ЛС должна быть снижена во избежание развития нежелательных лекарственных реакций.
RxList.com (2016 г.
Печеночная недостаточность. Безопасность и фармакокинетика однократной дозы руксолитиниба (25 мг) были оценены в исследовании у здоровых добровольцев (n=8) и у пациентов с легкой (класс А по классификации Чайлд-Пью (n=8), умеренной (класс В по классификации Чайлд-Пью (n=8) или тяжелой печеночной недостаточностью (класс с по классификации Чайлд-Пью (n=8). Среднее значение AUC руксолитиниба было увеличено на 87, 28 и 65% соответственно у пациентов с легкой, средней и тяжелой печеночной недостаточностью по сравнению с пациентами с нормальной функцией печени. Терминальный 1/2T1/2 был пролонгирован у пациентов с печеночной недостаточностью по сравнению со здоровыми добровольцами (4,1-5 ч против 2,8 ч). Изменение фармакодинамического показателя, ингибирование STAT3 согласуется с соответствующим увеличением в экспозиции руксолитиниба, за исключением группы с тяжелой (класс с по классификации Чайлд-Пью) печеночной недостаточностью, где фармакодинамическая активность у некоторых людей была более продолжительной, чем ожидалось на основе плазменных концентраций руксолитиниба.
При приеме руксолитиниба пациентами с любой степенью печеночной недостаточности и с количеством тромбоцитов между 100·109/л и 150·109/л рекомендуется снижение дозы.
RxList.com (обновление 2021 г.
Печеночная недостаточность. После перорального приема руксолитиниба в однократной дозе 25 мг AUC руксолитиниба увеличивалась у пациентов с легкой (класс А по классификации Чайлд-Пью), умеренной (класс В по классификации Чайлд-Пью) и тяжелой (класс С по классификации Чайлд-Пью) печеночной недостаточностью в 1,9; 1,3 и 1,7 раза соответственно по сравнению с таковой у людей с нормальной функцией печени.
Не наблюдалось клинически значимого эффекта фармакокинетики руксолитиниба в отношении нарушения функции печени (общий билирубин >ВГН и любое значение АЛТ) у пациентов с острой реакцией «трансплантат против хозяина».
Пациенты в возрасте ≤18 лет. Безопасность и эффективность руксолитиниба у пациентов в возрасте ≤18 лет не установлена.
RxList.com (обновление 2021 г.
Применение в педиатрии. Безопасность и эффективность руксолитиниба для лечения миелофиброза или истинной полицитемии у педиатрических пациентов не установлены.
Безопасность и эффективность руксолитиниба для лечения стероидорезистентной острой реакции «трансплантат против хозяина» были установлены для лечения детей 12 лет и старше. Применение руксолитиниба у педиатрических пациентов со стероидорезистентной острой реакцией «трансплантат против хозяина» подтверждается данными адекватного и хорошо контролируемого исследования руксолитиниба у взрослых, а также дополнительными данными по фармакокинетике и безопасности у педиатрических пациентов.
Руксолитиниб был оценен в несравнительном исследовании с увеличением дозы (NCT01164163) у 27 педиатрических пациентов с рецидивирующими или рефрактерными сóлидными опухолями (когорта A) и у 20 пациентов с лейкемиями или миелопролиферативными новообразованиями (когорта в). Средний возраст пациентов составлял 14 лет (от 2 до 21 года), включая 18 детей (от 2 до <12 лет) и 14 подростков (от 12 до <17 лет). Тестируемые уровни доз составляли 15, 21, 29, 39 или 50 мг/м2 2 раза в день в 28-дневных циклах с участием до 6 пациентов в группе каждой дозы.
В целом 38 (81%) пациентов получали не более одного цикла руксолитиниба, в то время как 3, 1, 2 и 3 пациента получали 2, 3, 4 и 5 или более циклов соответственно. Определенная протоколом максимальная переносимая доза не наблюдалась, но, поскольку несколько пациентов лечились в течение нескольких циклов, переносимость при продолжении применения не оценивалась должным образом, чтобы установить рекомендуемую дозу в фазе 2 выше, чем рекомендуемая доза для взрослых. Профиль безопасности у детей был аналогичен профилю безопасности у взрослых.
Данные о токсичности у неполовозрелых животных. Введение руксолитиниба молодым крысам оказывало влияние на рост и показатели костей. При введении в дозах от 1,5 до 75 мг/кг/сут, начиная с 7-го дня постнатального развития (эквивалент новорожденного человека) возникали признаки переломов при дозах ≥30 мг/кг/сут, влияние на массу тела и другие показатели костной ткани (например, содержание минералов в костях, периферическая количественная КТ и рентгеновский анализ) наблюдалось при дозах ≥5 мг/кг/сут. При введении в дозах от 5 до 60 мг/кг/сут, начиная с 21-го дня послеродового периода (эквивалент 2-3-летнего возраста человека), влияние на массу тела и кости наблюдалось при дозах ≥15 мг/кг/сут и считалось неблагоприятным при дозе 60 мг/кг/сут. Влияние на самцов было более сильным, чем на самок во всех возрастных группах, и эффекты, как правило, были более серьезными, когда введение было начато в ранний постнатальный период. Эти результаты наблюдались при экспозициях, которые составляют не менее 27% от клинической экспозиции при максимальной рекомендуемой дозе 25 мг 2 раза в день.
Пациенты в возрасте ≥65 лет. Коррекция дозы ЛС не требуется.
RxList.com (2016 г.
Применение в гериатрии. Из общего числа пациентов с миелофиброзом в клинических исследованиях руксолитиниба 51,9% были в возрасте 65 лет и старше. Не обнаружено различий в безопасности и эффективности руксолитиниба между пациентами этого возраста и более молодыми пациентами.
RxList.com (обновление 2021 г.
Применение в гериатрии. Клинические исследования руксолитиниба у пациентов с острой реакцией «трансплантат против хозяина» не включали достаточное количество пациентов в возрасте 65 лет и старше, чтобы определить, реагируют ли они иначе, чем более молодые взрослые.
Влияние на способность управлять транспортными средствами и/или механизмами. Исследования влияния руксолитиниба на способность к управлению транспортными средствами и/или механизмами не проводились. Учитывая возможность развития некоторых побочных эффектов на фоне приема руксолитиниба (головокружение), пациентам следует соблюдать осторожность при управлении транспортными средствами и занятиях другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания.
Лечение руксолитинибом может приводить к развитию гематологических нежелательных реакций, включающих тромбоцитопению, анемию и нейтропению. До начала лечения руксолитинибом необходимо провести общий анализ крови.
RxList.com (обновление 2021 г.
Тромбоцитопения, анемия и нейтропения.
Необходимо провести полный анализ крови перед лечением и проводить мониторинг крови каждые 2-4 нед до стабилизации доз, а затем в соответствии с клиническими показаниями.
Тромбоцитопения. У пациентов со сниженным количеством тромбоцитов (<200·109/л) в начале терапии приблизительно в 2 раза возрастает вероятность развития тромбоцитопении во время лечения руксолитинибом. В клинических исследованиях у пациентов с миелофиброзом тромбоцитопения 3-й или 4-й степени тяжести развивалась приблизительно к 8-й нед терапии. Тромбоцитопения в целом обратима и обычно корректируется снижением дозы или временным прекращением приема руксолитиниба. Количество тромбоцитов восстанавливалось до значений более 50·109/л в течение 14 дней. Тем не менее в некоторых случаях может потребоваться трансфузия концентратов тромбоцитов.
У пациентов с истинной полицитемией тромбоцитопения отмечалась реже (24,5%), чем у пациентов с миелофиброзом (69,8%). Тромбоцитопения 3-й и 4-й степени тяжести отмечалась у 5,54% пациентов с истинной полицитемией и у 11,6% пациентов с миелофиброзом.
Анемия. При развитии анемии может потребоваться переливание эритроцитарной массы. Кроме того, необходимо оценить необходимость коррекции дозы или прерывания лечения руксолитинибом. Примерно 50% пациентов с миелофиброзом, участвовавших в клинических исследованиях и получавших руксолитиниб, и 37% пациентов в группе контроля в ходе исследования потребовалось переливание эритроцитарной массы. У пациентов, получавших руксолитиниб, концентрация Hb достигала максимально низкого уровня (на 15-20 г/л ниже исходного показателя) на 8-12-й нед терапии. В дальнейшем концентрация Hb постепенно повышалась и сохранялась на уровне на 10 г/л ниже исходной (до начала лечения). Данная тенденция наблюдалась независимо от того, получал ли пациент гемотрансфузию во время терапии.
У пациентов с истинной полицитемией анемия отмечалась реже (46,8%), чем у пациентов с миелофиброзом (82,4%). Анемия 3-й и 4-й степени тяжести отмечалась у 1,8% пациентов с истинной полицитемией и у 42,5% пациентов с миелофиброзом.
Нейтропения. У пациентов с миелофиброзом нейтропения 3-й и 4-й степени развивалась приблизительно к 12-й нед терапии. В целом нейтропения (абсолютное число нейтрофилов <0,5·109/л), в случае ее развития, была обратима и корректировалась временной отменой приема руксолитиниба. У пациентов с истинной полицитемией нейтропения была отмечена у 2 пациентов, при этом у одного из пациентов отмечено развитие нейтропении 4-й степени тяжести.
Кровотечения. Кровотечения (включая внутричерепные кровоизлияния, желудочно-кишечные кровотечения, подкожные кровоизлияния, петехии, пурпуру и другие кровотечения) были зарегистрированы у 32,6% пациентов, получавших руксолитиниб. 65,3% всех кровотечений составляли случаи развития подкожных гематом, которые отмечались у 21,3% пациентов. Частота развития кровотечений 3-й и 4-й степени тяжести составляла 4,7%. Случаи развития внутричерепных кровоизлияний были отмечены у 1% пациентов, желудочно-кишечных кровотечений - у 5% пациентов, кровотечений вследствие других причин (в тч носовое кровотечение, послеоперационные кровотечения и гематурия) - у 13,3% пациентов, получавших руксолитиниб.
Инфекции. Перед применением руксолитиниба следует оценить наличие/риск развития тяжелых бактериальных, микобактериальных, грибковых и вирусных инфекций. У пациентов, получавших руксолитиниб, сообщалось о случаях развития туберкулеза. Следует помнить о возможности развития активной или латентной формы туберкулеза. Не следует начинать терапию руксолитинибом до разрешения тяжелого активного инфекционного процесса. Следует тщательно наблюдать пациентов, получающих руксолитиниб, на предмет развития симптомов инфекции и в случае необходимости незамедлительно начинать соответствующее лечение.
RxList.com (обновление 2021 г.
Риск развития инфекции.
Наблюдались тяжелые бактериальные, микобактериальные, грибковые и вирусные инфекции.
Туберкулез. Перед началом приема руксолитиниба пациенты должны быть обследованы на предмет наличия факторов риска туберкулеза, а пациенты с повышенным риском должны быть проверены на латентную инфекцию. Факторы риска включают, помимо прочего, предыдущее проживание или поездки в страны с высокой распространенностью туберкулеза, тесный контакт с человеком с активным туберкулезом, а также наличие активного или латентного туберкулеза в анамнезе, при невозможности подтвердить адекватный курс лечения.
Для пациентов с признаками активного или латентного туберкулеза необходимо проконсультироваться с врачом, имеющим опыт лечения туберкулеза, прежде чем начинать прием руксолитиниба. Решение о продолжении лечения руксолитинибом во время лечения активного туберкулеза должно основываться на оценке общего риска и пользы.
У пациентов с хроническим вирусным гепатитом В, получающих руксолитиниб, отмечалось увеличение титра ДНК вируса гепатита В как с, так и без сопровождающего увеличения активности ACT и АЛТ. Неизвестно влияние руксолитиниба на репликацию ДНК вируса гепатита В. Лечение и контроль состояния пациентов с хроническим вирусным гепатитом В следует проводить в соответствии с общепринятыми стандартами клинической практики.
Опоясывающий герпес. Перед применением руксолитиниба врачу следует обучить пациента своевременному выявлению ранних симптомов опоясывающего герпеса, сообщив о необходимости раннего начала лечения.
Прогрессирующая мультифокальная лейкоэнцефалопатия. При применении руксолитиниба было получено сообщение о случае развития ПМЛ. При подозрении на развитие ПМЛ следует прекратить применение руксолитиниба.
Злокачественные новообразования кожи, за исключением меланомы. При применении руксолитиниба сообщалось о случаях развития злокачественных новообразований кожи, за исключением меланомы, в тч базальноклеточной и плоскоклеточной карциномы, а также карциномы из клеток Меркеля. В большинстве случаев у таких пациентов в анамнезе проводилось продолжительное лечение препаратами гидроксимочевины или ранее были выявлены злокачественные новообразования кожи, за исключением меланомы, или предраковые поражения кожи. Причинно-следственная связь с применением руксолитиниба не была установлена. Рекомендуется проводить периодическое обследование кожных покровов у пациентов с повышенным риском развития злокачественных новообразований кожи.
Синдром отмены. После прекращения терапии руксолитинибом симптомы миелофиброза (такие как усталость, боль в костях, лихорадка, зуд, ночная потливость, симптоматическая спленомегалия и снижение массы тела) могут возвращаться. В клинических исследованиях общая шкала симптомов миелофиброза постепенно возвращалась к исходным показателям в течение 7 дней после прекращения применения.
RxList.com (2016 г.
Симптомы обострения миелофиброза после приостановки или прекращения лечения руксолитинибом. После прекращения терапии руксолитинибом симптомы миелофиброза обычно возвращаются к исходным в течение примерно 1 нед. У некоторых пациентов были случаи одной или более из следующих неблагоприятных реакций после прекращения приема руксолитиниба: лихорадка, респираторный дистресс-синдром, гипотензия, ДВС или полиорганная недостаточность. Если один или более из этих симптомов отмечаются после прекращения лечения или во время снижения дозы руксолитиниба, необходимо оценить и лечить интеркуррентные заболевания и рассмотреть возможность возобновления приема или увеличение дозы руксолитиниба. Следует проинструктировать пациентов о том, чтобы не прерывать и не прекращать терапию руксолитинибом без консультации с врачом. При прекращении или прерывании терапии руксолитинибом по иным, нежели тромбоцитопения или нейтропения, причинам предпочтительнее снизить дозу постепенно, нежели резко прекратить лечение.
RxList.com (обновление 2021 г.
Повышение уровня липидов. Лечение руксолитинибом было ассоциировано с повышением липидных параметров, включая общий Хс, Хс ЛПНП и триглицериды. Влияние этого повышения липидных параметров на сердечно-сосудистую заболеваемость и смертность не было определено у пациентов, получавших руксолитиниб. Следует оценить липидные параметры примерно через 8-12 нед после начала терапии руксолитинибом. Необходим мониторинг и лечение в соответствии с клиническими рекомендациями по лечению гиперлипидемии.
Особые группы пациентов.
Нарушение функции почек. У пациентов с миелофиброзом и нарушением функции почек тяжелой степени (Cl креатинина менее 30 мл/мин) рекомендуемая начальная доза, основанная на числе тромбоцитов, должна быть снижена приблизительно на 50%. Рекомендуемая начальная доза при лечении пациентов с истинной полицитемией и нарушением функции почек тяжелой степени составляет 5 мг 2 раза в день внутрь.
Пациенты с нарушением функции почек тяжелой степени, получающие руксолитиниб, должны тщательно наблюдаться, и при необходимости доза ЛС должна быть снижена во избежание развития нежелательных лекарственных реакций.
Имеются ограниченные данные по применению руксолитиниба у пациентов с терминальной стадией почечной недостаточности на гемодиализе. У данной категории пациентов с миелофиброзом лечение следует начинать с приема однократной дозы 15 или 20 мг (на основании количества тромбоцитов), с последующими однократными дозами после каждой процедуры гемодиализа при тщательной оценке соотношения польза/риск.
У пациентов с истинной полицитемией и терминальной стадией почечной недостаточности на гемодиализе лечение следует начинать с приема однократной дозы 10 мг после процедуры гемодиализа только в день ее проведения при тщательном контроле состояния и оценке соотношения польза/риск.
RxList.com (2016 г.
Почечная недостаточность. Безопасность и фармакокинетика однократной дозы руксолитиниба (25 мг) были оценены в исследовании у здоровых добровольцев (Cl креатинина 72-164 мл/мин (n=8) и людей с легкой (Cl креатинина 53-83 мл/мин (n=8), умеренной (Cl креатинина 38-57 мл/мин (n=8), тяжелой почечной недостаточностью (Cl креатинина 15-51 мл/мин (n=8), а также у 8 дополнительных субъектов с терминальной стадией почечной недостаточности, требующей проведения гемодиализа.
Фармакокинетика руксолитиниба была схожей при различной степени почечной недостаточности и нормальной функции почек. Однако значения AUC метаболитов руксолитиниба в плазме увеличивались при увеличении степени тяжести почечной недостаточности. Это было наиболее заметно у людей с терминальной стадией почечной недостаточности, нуждающихся в гемодиализе. Изменение фармакодинамического показателя, ингибирование р.
STAT3 согласуется с соответствующим увеличением экспозиции метаболита. Руксолитиниб не удаляется с помощью диализа; однако удаление некоторых активных метаболитов путем диализа не может быть исключено.
При приеме руксолитиниба пациентами с умеренной (Cl креатинина 30-59 мл/мин) или тяжелой почечной недостаточностью (Cl креатинина 15-29 мл/мин) с количеством тромбоцитов от 100·109/л и 150·109/л и пациентами с терминальной стадией заболевания почек, находящихся на диализе, рекомендуется снижение дозы.
RxList.com (обновление 2021 г.
После перорального приема руксолитиниба в однократной дозе 25 мг общая AUC руксолитиниба и его активных метаболитов увеличилась в 1,3; 1,5 и 1,9 раза у пациентов с легкой, умеренной и тяжелой почечной недостаточностью соответственно, по сравнению с таковой у людей с нормальной функцией почек (Cl креатинина ≥90 мл/мин). Кроме того, общая AUC руксолитиниба и его активных метаболитов увеличилась в 1,6 раза у пациентов с терминальной стадией почечной недостаточности после диализа, по сравнению с таковой у пациентов с нормальной функцией почек (Cl креатинина ≥90 мл/мин).
Нарушение функции печени. У пациентов с нарушением функции печени рекомендуемая начальная доза, основанная на числе тромбоцитов, должна быть снижена приблизительно на 50%. Пациенты с диагностированным нарушением функции печени тяжелой степени, получающие руксолитиниб, должны тщательно наблюдаться, и при необходимости доза ЛС должна быть снижена во избежание развития нежелательных лекарственных реакций.
RxList.com (2016 г.
Печеночная недостаточность. Безопасность и фармакокинетика однократной дозы руксолитиниба (25 мг) были оценены в исследовании у здоровых добровольцев (n=8) и у пациентов с легкой (класс А по классификации Чайлд-Пью (n=8), умеренной (класс В по классификации Чайлд-Пью (n=8) или тяжелой печеночной недостаточностью (класс с по классификации Чайлд-Пью (n=8). Среднее значение AUC руксолитиниба было увеличено на 87, 28 и 65% соответственно у пациентов с легкой, средней и тяжелой печеночной недостаточностью по сравнению с пациентами с нормальной функцией печени. Терминальный 1/2T1/2 был пролонгирован у пациентов с печеночной недостаточностью по сравнению со здоровыми добровольцами (4,1-5 ч против 2,8 ч). Изменение фармакодинамического показателя, ингибирование STAT3 согласуется с соответствующим увеличением в экспозиции руксолитиниба, за исключением группы с тяжелой (класс с по классификации Чайлд-Пью) печеночной недостаточностью, где фармакодинамическая активность у некоторых людей была более продолжительной, чем ожидалось на основе плазменных концентраций руксолитиниба.
При приеме руксолитиниба пациентами с любой степенью печеночной недостаточности и с количеством тромбоцитов между 100·109/л и 150·109/л рекомендуется снижение дозы.
RxList.com (обновление 2021 г.
Печеночная недостаточность. После перорального приема руксолитиниба в однократной дозе 25 мг AUC руксолитиниба увеличивалась у пациентов с легкой (класс А по классификации Чайлд-Пью), умеренной (класс В по классификации Чайлд-Пью) и тяжелой (класс С по классификации Чайлд-Пью) печеночной недостаточностью в 1,9; 1,3 и 1,7 раза соответственно по сравнению с таковой у людей с нормальной функцией печени.
Не наблюдалось клинически значимого эффекта фармакокинетики руксолитиниба в отношении нарушения функции печени (общий билирубин >ВГН и любое значение АЛТ) у пациентов с острой реакцией «трансплантат против хозяина».
Пациенты в возрасте ≤18 лет. Безопасность и эффективность руксолитиниба у пациентов в возрасте ≤18 лет не установлена.
RxList.com (обновление 2021 г.
Применение в педиатрии. Безопасность и эффективность руксолитиниба для лечения миелофиброза или истинной полицитемии у педиатрических пациентов не установлены.
Безопасность и эффективность руксолитиниба для лечения стероидорезистентной острой реакции «трансплантат против хозяина» были установлены для лечения детей 12 лет и старше. Применение руксолитиниба у педиатрических пациентов со стероидорезистентной острой реакцией «трансплантат против хозяина» подтверждается данными адекватного и хорошо контролируемого исследования руксолитиниба у взрослых, а также дополнительными данными по фармакокинетике и безопасности у педиатрических пациентов.
Руксолитиниб был оценен в несравнительном исследовании с увеличением дозы (NCT01164163) у 27 педиатрических пациентов с рецидивирующими или рефрактерными сóлидными опухолями (когорта A) и у 20 пациентов с лейкемиями или миелопролиферативными новообразованиями (когорта в). Средний возраст пациентов составлял 14 лет (от 2 до 21 года), включая 18 детей (от 2 до <12 лет) и 14 подростков (от 12 до <17 лет). Тестируемые уровни доз составляли 15, 21, 29, 39 или 50 мг/м2 2 раза в день в 28-дневных циклах с участием до 6 пациентов в группе каждой дозы.
В целом 38 (81%) пациентов получали не более одного цикла руксолитиниба, в то время как 3, 1, 2 и 3 пациента получали 2, 3, 4 и 5 или более циклов соответственно. Определенная протоколом максимальная переносимая доза не наблюдалась, но, поскольку несколько пациентов лечились в течение нескольких циклов, переносимость при продолжении применения не оценивалась должным образом, чтобы установить рекомендуемую дозу в фазе 2 выше, чем рекомендуемая доза для взрослых. Профиль безопасности у детей был аналогичен профилю безопасности у взрослых.
Данные о токсичности у неполовозрелых животных. Введение руксолитиниба молодым крысам оказывало влияние на рост и показатели костей. При введении в дозах от 1,5 до 75 мг/кг/сут, начиная с 7-го дня постнатального развития (эквивалент новорожденного человека) возникали признаки переломов при дозах ≥30 мг/кг/сут, влияние на массу тела и другие показатели костной ткани (например, содержание минералов в костях, периферическая количественная КТ и рентгеновский анализ) наблюдалось при дозах ≥5 мг/кг/сут. При введении в дозах от 5 до 60 мг/кг/сут, начиная с 21-го дня послеродового периода (эквивалент 2-3-летнего возраста человека), влияние на массу тела и кости наблюдалось при дозах ≥15 мг/кг/сут и считалось неблагоприятным при дозе 60 мг/кг/сут. Влияние на самцов было более сильным, чем на самок во всех возрастных группах, и эффекты, как правило, были более серьезными, когда введение было начато в ранний постнатальный период. Эти результаты наблюдались при экспозициях, которые составляют не менее 27% от клинической экспозиции при максимальной рекомендуемой дозе 25 мг 2 раза в день.
Пациенты в возрасте ≥65 лет. Коррекция дозы ЛС не требуется.
RxList.com (2016 г.
Применение в гериатрии. Из общего числа пациентов с миелофиброзом в клинических исследованиях руксолитиниба 51,9% были в возрасте 65 лет и старше. Не обнаружено различий в безопасности и эффективности руксолитиниба между пациентами этого возраста и более молодыми пациентами.
RxList.com (обновление 2021 г.
Применение в гериатрии. Клинические исследования руксолитиниба у пациентов с острой реакцией «трансплантат против хозяина» не включали достаточное количество пациентов в возрасте 65 лет и старше, чтобы определить, реагируют ли они иначе, чем более молодые взрослые.
Влияние на способность управлять транспортными средствами и/или механизмами. Исследования влияния руксолитиниба на способность к управлению транспортными средствами и/или механизмами не проводились. Учитывая возможность развития некоторых побочных эффектов на фоне приема руксолитиниба (головокружение), пациентам следует соблюдать осторожность при управлении транспортными средствами и занятиях другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания.
References
Www.grls.rosminzdrav.ru, 2015, www.rxlist.com, 2016, www.rxlist.com, 2021.
Included in the composition
- 1440€ Jaakafi (3 firms)