ICD-10 codes
- ICD-10
- C78.7 Secondary malignant neoplasm of liver and intrahepatic bile duct
- C43-C44 Melanoma and other malignant neoplasms of the skin
- C78.0 Secondary malignant neoplasm of lung
- C79.5 Secondary malignant neoplasm of bone and bone marrow
- C00 Malignant neoplasm of lip
- C78.6 Secondary malignant neoplasm of retroperitoneum and peritoneum
- C79.8 Secondary malignant neoplasm of other specified sites
- C51.9 Malignant neoplasm, vulva, unspecified
Introduction
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: с43, с51, с60.9, с63.2, с69.0, с00-C26, с30-C32, с51, с52, с53, с77, с78, с79 D03.0-D03.9.
Год утверждения (частота пересмотра): 2023.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2025.
ID: 546.
Разработчик клинической рекомендации.
• Ассоциация специалистов по проблемам меланомы.
• Ассоциация онкологов России.
• Общероссийская общественная организация «Российское общество клинической онкологии».
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2023.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2025.
ID: 546.
Разработчик клинической рекомендации.
• Ассоциация специалистов по проблемам меланомы.
• Ассоциация онкологов России.
• Общероссийская общественная организация «Российское общество клинической онкологии».
Одобрено Научно-практическим Советом Минздрава РФ.
 List of abbreviations
List of abbreviations
AJCC - Американский объединенный комитет по раку.
ASCO - Американское общество клинической онкологии.
SNO - Общество нейроонкологии.
ASTRO - Американское общество радиационной онкологии.
CTCAE - Общие терминологические критерии неблагоприятных эффектов.
ECOG - Восточная объединенная группа онкологов.
GPA - шкала поэтапной прогностической оценки.
МАРК - митоген-активируемый протеинкиназный путь.
RECIST - Критерии ответа солидных опухолей на терапию.
UICC - Международный союз по борьбе с раком.
В/в - внутривенный.
ВОЗ - Всемирная организация здравоохранения.
Гр - Грей.
ИПК - ингибиторы протеинкиназы (код АТХ-классификации: L01XE).
КТ - компьютерная томография.
ЛФК - лечебная физкультура.
МКА - моноклональные антитела (код АТХ-классификации: L01XС).
МКБ-10 - Международная классификация болезней 10-го пересмотра.
МРТ - магнитно-резонансная томография.
ПЭТ/КТ - позитронно-эмиссионная томография, совмещенная с компьютерной томографией.
РОД - разовая очаговая доза.
СОД - суммарная очаговая доза.
СРТ - стереотаксическая радиотерапия.
СРХ - стереотаксическая радиохирургия.
УЗИ - ультразвуковое исследование.
ОВГМ - облучение всего головного мозга.
** - жизненно необходимые и важнейшие лекарственные препараты.
- препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл).
ASCO - Американское общество клинической онкологии.
SNO - Общество нейроонкологии.
ASTRO - Американское общество радиационной онкологии.
CTCAE - Общие терминологические критерии неблагоприятных эффектов.
ECOG - Восточная объединенная группа онкологов.
GPA - шкала поэтапной прогностической оценки.
МАРК - митоген-активируемый протеинкиназный путь.
RECIST - Критерии ответа солидных опухолей на терапию.
UICC - Международный союз по борьбе с раком.
В/в - внутривенный.
ВОЗ - Всемирная организация здравоохранения.
Гр - Грей.
ИПК - ингибиторы протеинкиназы (код АТХ-классификации: L01XE).
КТ - компьютерная томография.
ЛФК - лечебная физкультура.
МКА - моноклональные антитела (код АТХ-классификации: L01XС).
МКБ-10 - Международная классификация болезней 10-го пересмотра.
МРТ - магнитно-резонансная томография.
ПЭТ/КТ - позитронно-эмиссионная томография, совмещенная с компьютерной томографией.
РОД - разовая очаговая доза.
СОД - суммарная очаговая доза.
СРТ - стереотаксическая радиотерапия.
СРХ - стереотаксическая радиохирургия.
УЗИ - ультразвуковое исследование.
ОВГМ - облучение всего головного мозга.
** - жизненно необходимые и важнейшие лекарственные препараты.
- препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл).
Terms and definitions
BRAF. Человеческий ген (протоонкоген), который кодирует серин-треониновую протеинкиназу в-Raf.
C-Kit. Рецептор фактора роста тучных и стволовых клеток (SCFR) или белковая тирозинкиназа Kit (CD117) - рецепторная тирозинкиназа, продукт гена KIT.
CTLA4. Антиген цитотоксических Т-лимфоцитов 4-го типа, также известен как СD152. Выполняет функции рецептора, лигандом служит молекула в7,1 или в7,2.
MEK. Внутриклеточная сигнальная молекула, протеинкиназа, также известная как MAPK/ERK-киназа.
PD1. Рецептор программируемой смерти 1.
Ингибитор сTLA4. Моноклональное антитело, блокирующее тормозные сигналы каскада сTLA4.
Блокатор PD1. Моноклональное антитело, блокирующее взаимодействие между рецептором программируемой смерти (PD-1) и его лигандами.
Второй этап реабилитации. Реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
Инцизионная панч-биопсия. Метод получения образца тканей кожи на всю его толщину, при этом латеральные края резекции могут содержать элементы опухоли (или невуса). Выполняется при помощи специальной панч-иглы (диаметром от 1 до 5 мм). Применяется в исключительных случаях, когда эксцизионная биопсия не может быть применена.
Первый этап реабилитации. Реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Плоскостная (бритвенная) резекция новообразований кожи. Способ удаления экзофитных и плоских новообразований кожи в плоскости кожи при помощи бритвенного лезвия или скальпеля. В случае подозрений на меланому кожи является субоптимальным методом диагностики, так как не позволяет гарантированно определить толщину новообразования и тем самым правильно стадировать заболевание.
Предреабилитация (prehabilitation). Реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Радиологическая оценка ответа на лечение. Оценка ответа на лечение с использованием результатов радиологических исследований (компьютерной томографии, магнитно-резонансной томографии, позитронно-эмиссионной томографии, рентгенографии ) в сравнении с результатами ранее проведенных радиологических исследований в соответствии с одной или несколькими системами оценки ответа (такими как RECIST или ВОЗ).
Резектабельная меланома кожи и/или резектабельные метастазы меланомы кожи. Меланома кожи или ее метастазы (как правило, метастазы в регионарные лимфатические узлы), которые могут быть подвергнуты радикальному хирургическому удалению R0. На оценку резектабельности могут влиять такие факторы, как объем (количество и размеры) метастатического поражения лимфатических узлов, соотношение с магистральными сосудами, наличие сателлитов и транзитных метастазов, лимфангоита Оценка резектабельности процесса весьма субъективна и может варьировать от учреждения к учреждению и от хирурга к хирургу.
Третий этап реабилитации. Реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций).
Эквивалент клинической стадии. Оценка распространенности болезни в соответствии с международной классификацией UICC/AJCC TNM безотносительно анамнеза течения болезни. Иначе говоря, поражение регионарных лимфоузлов является эквивалентом III стадии (IIIA, в, с, D - соответственно распространенности), поражение висцеральных органов или нерегионарных лимфоузлов - эквивалент IV стадии (IV M1a - кожа или нерегионарные лимфоузлы, M1b - легких, M1c - других внутренних органов, кроме легких, M1d - поражение ЦНС). Здесь и далее в рекомендации подходы к диагностике и лечению пациентов будут ориентированы именно на эквивалент стадии ( актуальную в настоящий момент распространенность болезни).
Эксцизионная биопсия новообразования кожи. Метод получения образца тканей кожи, при котором новообразование удаляется тотально (целиком) с небольшим (1-3 мм) захватом прилежащих здоровых тканей. Такой способ получения морфологического материала является предпочтительным при подозрении на меланому кожи.
Эпилюминесцентная микроскопия (дерматоскопия). Неинвазивная техника исследования кожи при помощи дерматоскопа, который обычно состоит из лупы (×10), неполяризованного источника света, прозрачной пластины и жидкой среды между инструментом и кожей. Современные дерматоскопы могут работать с использованием жидкой среды или вместо этого применяют поляризованный свет, чтобы компенсировать отражения поверхности кожи. Когда получаемые изображения или видеоклипы записываются либо обрабатываются цифровым способом, прибор можно называть цифровым эпилюминесцентным дерматоскопом.
C-Kit. Рецептор фактора роста тучных и стволовых клеток (SCFR) или белковая тирозинкиназа Kit (CD117) - рецепторная тирозинкиназа, продукт гена KIT.
CTLA4. Антиген цитотоксических Т-лимфоцитов 4-го типа, также известен как СD152. Выполняет функции рецептора, лигандом служит молекула в7,1 или в7,2.
MEK. Внутриклеточная сигнальная молекула, протеинкиназа, также известная как MAPK/ERK-киназа.
PD1. Рецептор программируемой смерти 1.
Ингибитор сTLA4. Моноклональное антитело, блокирующее тормозные сигналы каскада сTLA4.
Блокатор PD1. Моноклональное антитело, блокирующее взаимодействие между рецептором программируемой смерти (PD-1) и его лигандами.
Второй этап реабилитации. Реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
Инцизионная панч-биопсия. Метод получения образца тканей кожи на всю его толщину, при этом латеральные края резекции могут содержать элементы опухоли (или невуса). Выполняется при помощи специальной панч-иглы (диаметром от 1 до 5 мм). Применяется в исключительных случаях, когда эксцизионная биопсия не может быть применена.
Первый этап реабилитации. Реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Плоскостная (бритвенная) резекция новообразований кожи. Способ удаления экзофитных и плоских новообразований кожи в плоскости кожи при помощи бритвенного лезвия или скальпеля. В случае подозрений на меланому кожи является субоптимальным методом диагностики, так как не позволяет гарантированно определить толщину новообразования и тем самым правильно стадировать заболевание.
Предреабилитация (prehabilitation). Реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Радиологическая оценка ответа на лечение. Оценка ответа на лечение с использованием результатов радиологических исследований (компьютерной томографии, магнитно-резонансной томографии, позитронно-эмиссионной томографии, рентгенографии ) в сравнении с результатами ранее проведенных радиологических исследований в соответствии с одной или несколькими системами оценки ответа (такими как RECIST или ВОЗ).
Резектабельная меланома кожи и/или резектабельные метастазы меланомы кожи. Меланома кожи или ее метастазы (как правило, метастазы в регионарные лимфатические узлы), которые могут быть подвергнуты радикальному хирургическому удалению R0. На оценку резектабельности могут влиять такие факторы, как объем (количество и размеры) метастатического поражения лимфатических узлов, соотношение с магистральными сосудами, наличие сателлитов и транзитных метастазов, лимфангоита Оценка резектабельности процесса весьма субъективна и может варьировать от учреждения к учреждению и от хирурга к хирургу.
Третий этап реабилитации. Реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций).
Эквивалент клинической стадии. Оценка распространенности болезни в соответствии с международной классификацией UICC/AJCC TNM безотносительно анамнеза течения болезни. Иначе говоря, поражение регионарных лимфоузлов является эквивалентом III стадии (IIIA, в, с, D - соответственно распространенности), поражение висцеральных органов или нерегионарных лимфоузлов - эквивалент IV стадии (IV M1a - кожа или нерегионарные лимфоузлы, M1b - легких, M1c - других внутренних органов, кроме легких, M1d - поражение ЦНС). Здесь и далее в рекомендации подходы к диагностике и лечению пациентов будут ориентированы именно на эквивалент стадии ( актуальную в настоящий момент распространенность болезни).
Эксцизионная биопсия новообразования кожи. Метод получения образца тканей кожи, при котором новообразование удаляется тотально (целиком) с небольшим (1-3 мм) захватом прилежащих здоровых тканей. Такой способ получения морфологического материала является предпочтительным при подозрении на меланому кожи.
Эпилюминесцентная микроскопия (дерматоскопия). Неинвазивная техника исследования кожи при помощи дерматоскопа, который обычно состоит из лупы (×10), неполяризованного источника света, прозрачной пластины и жидкой среды между инструментом и кожей. Современные дерматоскопы могут работать с использованием жидкой среды или вместо этого применяют поляризованный свет, чтобы компенсировать отражения поверхности кожи. Когда получаемые изображения или видеоклипы записываются либо обрабатываются цифровым способом, прибор можно называть цифровым эпилюминесцентным дерматоскопом.
Description
Меланома кожи - злокачественная опухоль нейроэктодермального происхождения, исходящая из меланоцитов (пигментных клеток) кожи [1]. В некоторых случаях при наличии отдаленных метастазов первичный очаг на коже (или в других органах) не может быть обнаружен (например, вследствие так называемой спонтанной регрессии первичной опухоли или удаления очага во время медицинской или косметологической манипуляции без морфологического исследования) - такую болезнь следует называть метастазами меланомы без выявленного первичного очага. С учетом того, что меланоциты в норме представлены в различных органах (включая слизистые оболочки желудочно-кишечного тракта, половых путей, мозговые оболочки, сосудистую оболочку глаза ) [2], первичная опухоль (меланома) может возникнуть в любом из этих органов. В этом случае опухоль следует называть меланомой соответствующего органа, например, меланомой слизистой оболочки подвздошной кишки или меланомой сосудистой оболочки глаза.
Reasons
Не существует единого этиологического фактора для развития меланомы. Самым значимым фактором риска спорадических (ненаследственных) форм меланомы кожи следует считать воздействие на кожу ультрафиолетового излучения типа В (длина волны 290-320 нм) и типа А (длина волны 320-400 нм). При этом чувствительность кожи к ультрафиолетовому воздействию различается у людей и может быть классифицирована на 6 типов, где 1-й и 2-й отличаются наибольшей чувствительностью (и, соответственно, вероятностью возникновения солнечного ожога), а 5-й и 6-й - наименьшей [3]. Другими факторами риска также считают наличие более 10 диспластических невусов, наличие более 100 обычных приобретенных невусов, рыжие волосы (как правило, сопряжено с I фототипом кожи), интенсивное периодически повторяющееся воздействие солнечного ультрафиолета (солнечные ожоги) в детстве [4-6]. Эпидемиологические данные показывают, что риск меланомы, связанный с ультрафиолетовым облучением, самый высокий у людей с прерывистым воздействием солнца и солнечными ожогами в детстве [7]. Также следует отметить такие факторы риска, как наличие гигантского или крупного врожденного невуса (площадью более 5 % площади поверхности тела), семейный анамнез меланомы кожи, личный анамнез меланомы кожи, синдром диспластических невусов, использование PUVA-терапии (по поводу псориаза и других хронических дерматозов), пигментная ксеродерма, врожденный или приобретенный иммунодефицит (например, после трансплантации органов или других заболеваниях, связанных с необходимостью принимать иммунносупрессоры) [8]. Факторы риска меланомы других локализаций (например, меланомы слизистых оболочек, меланомы акральных локализаций, увеальной меланомы) изучены недостаточно [9-12].
Некоторые механизмы канцерогенеза при меланоме были изучены in vitro и in vivo: способность ультрафиолетового излучения индуцировать и стимулировать рост меланомы также была показана на нескольких моделях животных. Ультрафиолетовое излучение может способствовать меланомагенезу через различные пути. Мутации, характерные для ультрафиолетового облучения (особенно мутации, индуцированные ультрафиолетовым излучением типа в), встречаются в генах, участвующих в развитии меланомы. Ультрафиолетовое излучение инактивирует белок-супрессор опухолей p16INK4A, тем самым способствуя прогрессированию меланомы. Ультрафиолетовое излучение уменьшает экспрессию E- и P-кадгерина как на нормальных, так и на злокачественных меланоцитах, повышая передачу сигналов в-катенина, что способствует появлению злокачественного фенотипа у меланоцитов, а также нарушает клеточную адгезию, что, в свою очередь, позволяет клеткам меланомы отсоединяться от соседних кератиноцитов, тем самым способствуя инвазивному фенотипу [7].
Некоторые механизмы канцерогенеза при меланоме были изучены in vitro и in vivo: способность ультрафиолетового излучения индуцировать и стимулировать рост меланомы также была показана на нескольких моделях животных. Ультрафиолетовое излучение может способствовать меланомагенезу через различные пути. Мутации, характерные для ультрафиолетового облучения (особенно мутации, индуцированные ультрафиолетовым излучением типа в), встречаются в генах, участвующих в развитии меланомы. Ультрафиолетовое излучение инактивирует белок-супрессор опухолей p16INK4A, тем самым способствуя прогрессированию меланомы. Ультрафиолетовое излучение уменьшает экспрессию E- и P-кадгерина как на нормальных, так и на злокачественных меланоцитах, повышая передачу сигналов в-катенина, что способствует появлению злокачественного фенотипа у меланоцитов, а также нарушает клеточную адгезию, что, в свою очередь, позволяет клеткам меланомы отсоединяться от соседних кератиноцитов, тем самым способствуя инвазивному фенотипу [7].
Epidemiology
В 2020 г. в Российской Федерации меланомой кожи заболело 10162 человек[13] В 2020 г. грубый показатель заболеваемости (оба пола) составил 8,15 на 100 000 населения (в 2020 - 6,94), стандартизованный - 4,14 на 100 000 населения (в 2019 - 4,89)[13]. Стандартизованный показатель заболеваемости составил 4,08 и 4,32 на 100 000 населения у мужчин и женщин соответственно. В структуре заболеваемости меланома кожи в 2020 г. составила 1,6 % у мужчин и 2 % у женщин. Среднегодовой темп прироста заболеваемости за 10 лет составил 3,57% у мужчин и 2,42% у женщин. Средний возраст заболевших оказался равным 61,9 года (оба пола), 61,5 года (мужчины), 62,1 года (женщины)[13].
В 2020 г. от меланомы кожи в России умерло 1597 мужчин и 1841 женщин, грубый показатель смертности (оба пола) - 2,35 на 100 000 населения (2,45 - в 2019), стандартизованный - 1,28 на 100 000 населения (1,55 у мужчин и 1,10 у мужчин)[13].
Средний возраст умерших - 65,9 года (оба пола), 63,7 года (мужчины), 67,8 года (женщины) [13].
В 2020 г. было зарегистрировано 27 случаев меланомы у пациентов в возрасте до 20 лет, при этом в 2020 году умерло 5 пациентов с меланомой кожи в возрасте до 20 лет [13].
В 2019 г. было зарегистрировано следующее распределение заболевших по стадиям: стадия I - 38,9 %, стадия II - 41,9 %, стадия III - 10,2 %, стадия IV - 7,5 %, стадия не установлена у 1,4 %. Среди впервые заболевших активно заболевание выявлено у 32,5 %. Летальность на 1-м году составила 9,5 %[14].
Под наблюдением на конец 2017 г. состояли 98199 пациента (66,9 на 100 000 населения), из них 5 лет и более наблюдались 58 852 пациентов (59,9 %). Индекс накопления контингентов составил 9,3, а летальность - 3,6 % (в сравнении с 4,3 % в 2011 г. При этом, согласно имеющимся отчетным формам, в 2019 г. 87,2 % пациентов меланомой кожи (среди тех, кто подлежал радикальному лечению) получили только хирургическое лечение[14].
Злокачественная меланома кожи (С43, с51, с60,9, с63,2) [15]:
• с43,0 Злокачественная меланома губы;
• с43,1 Злокачественная меланома века, включая спайку век;
• с43,2 Злокачественная меланома уха и наружного слухового прохода;
• с43,3 Злокачественная меланома других и неуточненных частей лица;
• с43,4 Злокачественная меланома волосистой части головы и шеи;
• с43,5 Злокачественная меланома туловища (включая кожу перианальной области, ануса и пограничной зоны, грудной железы);
• с43,6 Злокачественная меланома верхней конечности, включая область плечевого сустава;
• с43,7 Злокачественная меланома нижней конечности, включая область тазобедренного сустава;
• с43,8 Злокачественная меланома кожи, выходящая за пределы одной и более вышеуказанных локализаций;
• с43,9 Злокачественная меланома кожи неуточненная;
• С51 Злокачественное новообразование вульвы;
• с60,9 Злокачественные новообразования полового члена неуточненной локализации;
• с63,2 Злокачественные новообразования мошонки.
• с69,0 Злокачественное новообразование конъюнктивы.
Метастазы меланомы без выявленного первичного очага:
• с77,0-C77,9 Вторичное и неуточненное злокачественное новообразование лимфатических узлов (для случаев впервые выявленных метастазов меланомы в лимфатические узлы без выявленного первичного очага);
• с78 Вторичное злокачественное новообразование органов дыхания и пищеварения;
• с79 Вторичное злокачественное новообразование других локализаций;
Меланома слизистых оболочек:
• с00-С14 Злокачественные новообразования губы, полости рта и глотки;
• С15-С26 Злокачественные новообразования органов пищеварения;
• С30-С32: Злокачественное новообразование полости носа и среднего уха, Злокачественное новообразование придаточных пазух, Злокачественное новообразование гортани.
• С51-С53 Злокачественные новообразования женских половых органов;
• с60,9 Злокачественные новообразования полового члена неуточненной локализации;
Меланома in situ:
• D03,0 Меланома in situ губы;
• D03,1 Меланома in situ века, включая спайку век.
• D03,2 Меланома in situ уха и наружного слухового прохода;
• D03,3 Меланома in situ других и неуточненных частей лица;
• D03,4 Меланома in situ волосистой части головы и шеи;
• D03,5 Меланома in situ туловища;
• D03,6 Меланома in situ верхней конечности, включая область плечевого пояса;
• D03,7 Меланома in situ нижней конечности, включая тазобедренную область;
• D03,8 Меланома in situ других локализаций;
• D03,9 Меланома in situ неуточненной локализации.
В 2020 г. от меланомы кожи в России умерло 1597 мужчин и 1841 женщин, грубый показатель смертности (оба пола) - 2,35 на 100 000 населения (2,45 - в 2019), стандартизованный - 1,28 на 100 000 населения (1,55 у мужчин и 1,10 у мужчин)[13].
Средний возраст умерших - 65,9 года (оба пола), 63,7 года (мужчины), 67,8 года (женщины) [13].
В 2020 г. было зарегистрировано 27 случаев меланомы у пациентов в возрасте до 20 лет, при этом в 2020 году умерло 5 пациентов с меланомой кожи в возрасте до 20 лет [13].
В 2019 г. было зарегистрировано следующее распределение заболевших по стадиям: стадия I - 38,9 %, стадия II - 41,9 %, стадия III - 10,2 %, стадия IV - 7,5 %, стадия не установлена у 1,4 %. Среди впервые заболевших активно заболевание выявлено у 32,5 %. Летальность на 1-м году составила 9,5 %[14].
Под наблюдением на конец 2017 г. состояли 98199 пациента (66,9 на 100 000 населения), из них 5 лет и более наблюдались 58 852 пациентов (59,9 %). Индекс накопления контингентов составил 9,3, а летальность - 3,6 % (в сравнении с 4,3 % в 2011 г. При этом, согласно имеющимся отчетным формам, в 2019 г. 87,2 % пациентов меланомой кожи (среди тех, кто подлежал радикальному лечению) получили только хирургическое лечение[14].
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
По Международной статистической классификации болезней и проблем, связанных со здоровьем (далее - МКБ-10) такие опухоли классифицируются в соответствии с органом первичного происхождения, например, меланома подвздошной кишки будет иметь код С17,2, меланома сосудистой оболочки глаза - С69,3, меланома кожи - С43.Злокачественная меланома кожи (С43, с51, с60,9, с63,2) [15]:
• с43,0 Злокачественная меланома губы;
• с43,1 Злокачественная меланома века, включая спайку век;
• с43,2 Злокачественная меланома уха и наружного слухового прохода;
• с43,3 Злокачественная меланома других и неуточненных частей лица;
• с43,4 Злокачественная меланома волосистой части головы и шеи;
• с43,5 Злокачественная меланома туловища (включая кожу перианальной области, ануса и пограничной зоны, грудной железы);
• с43,6 Злокачественная меланома верхней конечности, включая область плечевого сустава;
• с43,7 Злокачественная меланома нижней конечности, включая область тазобедренного сустава;
• с43,8 Злокачественная меланома кожи, выходящая за пределы одной и более вышеуказанных локализаций;
• с43,9 Злокачественная меланома кожи неуточненная;
• С51 Злокачественное новообразование вульвы;
• с60,9 Злокачественные новообразования полового члена неуточненной локализации;
• с63,2 Злокачественные новообразования мошонки.
• с69,0 Злокачественное новообразование конъюнктивы.
Метастазы меланомы без выявленного первичного очага:
• с77,0-C77,9 Вторичное и неуточненное злокачественное новообразование лимфатических узлов (для случаев впервые выявленных метастазов меланомы в лимфатические узлы без выявленного первичного очага);
• с78 Вторичное злокачественное новообразование органов дыхания и пищеварения;
• с79 Вторичное злокачественное новообразование других локализаций;
Меланома слизистых оболочек:
• с00-С14 Злокачественные новообразования губы, полости рта и глотки;
• С15-С26 Злокачественные новообразования органов пищеварения;
• С30-С32: Злокачественное новообразование полости носа и среднего уха, Злокачественное новообразование придаточных пазух, Злокачественное новообразование гортани.
• С51-С53 Злокачественные новообразования женских половых органов;
• с60,9 Злокачественные новообразования полового члена неуточненной локализации;
Меланома in situ:
• D03,0 Меланома in situ губы;
• D03,1 Меланома in situ века, включая спайку век.
• D03,2 Меланома in situ уха и наружного слухового прохода;
• D03,3 Меланома in situ других и неуточненных частей лица;
• D03,4 Меланома in situ волосистой части головы и шеи;
• D03,5 Меланома in situ туловища;
• D03,6 Меланома in situ верхней конечности, включая область плечевого пояса;
• D03,7 Меланома in situ нижней конечности, включая тазобедренную область;
• D03,8 Меланома in situ других локализаций;
• D03,9 Меланома in situ неуточненной локализации.
Classification
1,5 Классификация заболевания или состояния (группы заболеваний или состояний).
1,5,1 Международная гистологическая классификация.
Международная гистологическая классификация меланоцитарных опухолей кожи [16]:| • меланома на коже с низким кумулятивным солнечным повреждением (поверхностно-распространяющаяся меланома): | 8743/3 |
| - простое лентиго и лентигинозный меланоцитарный невус | 8742/0 (новый код) |
| - пограничный невус | 8740/0 |
| - сложный невус | 8760/0 |
| - дермальный невус | 8750/0 |
| - диспластический невус | 8727/0 |
| - пятинстый невус (nevus spilus) | 8720/0 |
| - невус особых локализаций (молочной железы, подмышечной области, волосистой части головы и уха): | |
| o гало-невус | 8723/0 |
| o невус Мейерсона | 8720/0 |
| - рецидивирующий невус | |
| - глубокопенетрирующий невус | 8720/0 |
| - пигментированная эпителиодная меланоцитома | 8780/1 (новый код) |
| - комбинированный невус, включая невус/меланоцитому с инактивацией вAP1 | 8720/0 |
| Меланоцитарные опухоли, возникающие на коже, подвергаемой хронической инсоляции: | |
| • меланома по типу злокачественного лентиго | 8742/3 |
| • десмопластическая меланома | 8745/3 |
| Спицоидные опухоли: | |
| • злокачественная опухоль Спитц (Спитц-меланома) | 8770/3 |
| • Спитц-невус | 8770/0 |
| • пигментированный веретеноклеточный невус (невус Рида) | 8770/0 |
| Меланоцитарные опухоли, возникающие на коже акральной локализации: | |
| • акральная меланома | 8744/3 |
| • акральный невус | 8744/0 (новый код) |
| Меланоцитарные опухоли гениталий и слизистых оболочек: | |
| • меланомы слизистых оболочек (гениталии, полость рта, пазухи носа): | 8720/3 |
| - лентиго-меланома слизистых оболочек | 8746/3 |
| - узловая меланома слизистых оболочек | 8721/3 |
| • генитальный невус | 8720/0 |
| Меланоцитарные опухоли, происходящие из голубого невуса: | |
| • меланома из голубого невуса | 8780/3 |
| • голубой невус, без дополнительного уточнения | 8780/0 |
| • клеточный голубой невус | 8790/0 |
| • монгольское пятно | |
| • невус Ито | |
| • невус Ота | |
| Меланоциатрные опухоли из врожденных невусов: | |
| • меланома из гигантского врожденного невуса | 8761/3 |
| • врожденный меланоцитарный невус | 8761/0 |
| • пролиферативные узелки во врожденном невусе | 8762/1 |
| Меланоцитарные опухоли глаза: | |
| • увеальная меланома | |
| - эпителиодноклеточная меланома | 8771/3 |
| - веретеноклеточная меланома, тип А | 8773/3 |
| - веретеноклеточная меланома, тип В | 8774/3 |
| • меланома конъюнктивы | |
| • меланома, без дополнительного уточнения | 8720/3 |
| • конъюнктивальный первичный приобретенный меланоз с атипией/меланома in situ | 8720/2 |
| • конъюнктивальный невус | 8720/0 |
| Узловая, невоидная и метастатическая меланома: | |
| • узловая меланома | 8721/3 |
| • невоидная меланома | 8720/3 |
| • метастатическая меланома | 8720/6 |
1,5,2 Стадирование.
Стадирование меланомы кожи по классификации TNM AJCC/UICC 8-го пересмотра (2017 г. [17, 18]. Для процедуры стадирования меланомы гистологическое подтверждение обязательно. Оценку состояния лимфатических узлов для установления стадии выполняют при помощи клинического осмотра, инструментальных исследований и процедуры биопсии сторожевого лимфатического узла.Критерий Т отражает распространенность первичной опухоли. Классификация по критерию Т возможна только после удаления первичной опухоли и ее гистологического исследования (табл. 1).
Таблица 1. Критерий Т (первичная опухоль).
| Тx: толщина первичной опухоли не может быть определена (например, при удалении опухоли кюретажем, бритвенной биопсии или частичной регрессии меланомы) | Неприменимо | Неприменимо |
| Т0: нет признаков первичной̆ опухоли (например, не выявлен первичный̆ очаг или полная регрессия меланомы) | Неприменимо | Неприменимо |
| Tis: меланома in situ (уровень инвазии по Кларку I) (атипическая меланоцитарная гиперплазия, тяжелая меланоцитарная дисплазия, неинвазивная злокачественная опухоль) | Неприменимо | Неприменимо |
| T1 | ≤1,0 мм | Неизвестно или не определено |
| T1a | <0,8 мм | Без изъязвления |
| T1b | <0,8 мм | с изъязвлением |
| 0,8-1,0 мм | с изъязвлением или без него | |
| T2 | >1,0 и ≤2,0 мм | Неизвестно или не определено |
| T2a | >1,0 и ≤ 2,0 мм | Без изъязвления |
| T2b | >1,0 и ≤2,0 мм | с изъязвлением |
| T3 | >2,0 и ≤4,0 мм | Неизвестно или не определено |
| T3a | >2,0 и ≤4,0 мм | Без изъязвления |
| T3b | >2,0 и ≤4,0 мм | с изъязвлением |
| T4 | >4,0 мм | Неизвестно или не определено |
| T4a | >4,0 мм | Без изъязвления |
| T4b | >4,0 мм | с изъязвлением |
Критерий N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах (табл. 2).
Для опухолей, расположенных преимущественно на одной стороне тела (левой или правой), регионарными лимфатическими узлами следует считать:
• голова, шея: ипсилатеральные околоушные, подчелюстные, шейные и надключичные лимфатические узлы;
• грудная стенка: ипсилатеральные подмышечные лимфатические узлы;
• верхняя конечность: ипсилатеральные локтевые и подмышечные лимфатические узлы;
• живот, поясница и ягодицы: ипсилатеральные паховые лимфатические узлы;
• нижняя конечность: ипсилатеральные подколенные и паховые лимфатические узлы;
• край ануса и кожа перианальной области: ипсилатеральная паховые лимфатические узлы.
В случае расположения опухоли в пограничных зонах лимфатические узлы с обеих сторон могут считаться регионарными.
Таблица 2. Критерий N (поражение регионарных лимфатических узлов).
| Nх[1] | Регионарные лимфатические узлы не могут быть оценены | Неприменимо |
| N0 | Нет признаков поражения регионарных лимфатических узлов | Отсутствуют |
| N1 | Один пораженный регионарный лимфатический узел или наличие транзитных, сателлитных либо микросателлитных метастазов | |
| N1а | Один пораженный клинически не определяемый регионарный лимфатический узел ( выявленный по данным биопсии сторожевого лимфатического узла) | Отсутствуют |
| N1b | Один пораженный клинически определяемый регионарный лимфатический узел | Отсутствуют |
| N1c | Нет метастазов в регионарных лимфатического узлах | Присутствуют |
| N2 | Два или три пораженных регионарных лимфатических узла или один пораженный регионарный лимфатический узел в сочетании с наличием транзитных, сателлитных или микросателлитных метастазов | |
| N2а | Два или три пораженных клинически не определяемых регионарных лимфатического узла ( выявленных по данным биопсии сторожевого лимфатического узла) | Отсутствуют |
| N2b | Два или три пораженных клинически определяемых регионарныих лимфатического узла | Отсутствуют |
| N2c | Один пораженный клинически не определяемый или определяемый регионарный лимфатический узел | Присутствуют |
| N3 | Четыре и более пораженных регионарных лимфатических узла или два и более пораженных регионарных лимфатических узла в сочетании с наличием транзитных, сателлитных или микросателлитных метастазов | |
| N3а | Четыре и более пораженных клинически не определяемых регионарных лимфатических узла (выявленных по данным биопсии сторожевого лимфатического узла ) | Отсутствуют |
| N3b | Четыре и более пораженных регионарных лимфатических узла, среди которых хотя бы один определяется клинически, или наличие конгломератов лимфатических узлов | Отсутствуют |
| N3c | Два или более клинически не определяемых или определяемых регионарных лимфатического узла, или конгломераты регионарных лимфоузлов | Присутствуют |
Примечание. сателлитами называют опухолевые отсевы или узелки (макро- или микроскопические) в пределах 2 см от первичной опухоли. Транзитными метастазами называют метастазы в кожу или подкожную клетчатку на расстоянии более 2 см от первичной опухоли, но не распространяющиеся за пределы регионарных лимфатических узлов.
Изолированные опухолевые клетки, которые представляют собой отдельные клетки или кластеры клеток не более 0,2 мм в наибольшем измерении и которые могут быть обнаружены при помощи рутинного окрашивания гематоксилином и эозином или иммуногистохимического окрашивания, выявляемые в регионарных лимфатических узлах, классифицируются как метастазы (N1, N2 или N3 в зависимости от количества пораженных лимфатических узлов).
В табл. 3 приведены анатомические ориентиры для определения пограничных зон шириной 4 см.
Таблица 3. Анатомические ориентиры пограничных зон для определения регионарных лимфатических бассейнов.
| Левая и правая половины тела | Срединная линия тела |
| Голова и шея/грудная стенка | Ключица - акромион - верхний край плеча |
| Грудная стенка/верхняя конечность | Плечо - подмышечная впадина - плечо |
| Грудная стенка/живот, поясница или ягодицы | Спереди: середина расстояния между пупком и реберной дугой; сзади: нижняя граница XII грудного позвонка (поперечный отросток) |
| Живот, поясница или ягодицы/нижняя конечность | Паховая складка - большой вертел - ягодичная борозда |
При обнаружении метастазов в лимфатических узлах за пределами указанных регионарных зон метастазирования следует классифицировать их как отдаленные метастазы.
Критерий М характеризует наличие или отсутствие отдаленных метастазов (табл. 4).
Таблица 4. Критерий М (отдаленные метастазы).
| М0 | Нет признаков отдаленных метастазов | Неприменимо |
| M1 | Есть отдаленные метастазы | - |
| M1a | Отдаленные метастазы в кожу, мягкие ткани (включая мышечную) и/или нерегионарные лимфатические узлы | Не указан или не определен |
| M1a(0) | Не повышен | |
| M1a(1) | Повышен | |
| M1b | Отдаленные метастазы в легкие с метастазами, соответствующими локализациям М1a, или без них | Не указан или не определен |
| M1b(0) | Не повышен | |
| M1b(1) | Повышен | |
| M1c | Отдаленные метастазы во внутренние органы, за исключением центральной нервной системы, с метастазами, соответствующими локализациям М1a и m1b, или без них | Не указан или не определен |
| M1c(0) | Не повышен | |
| M1c(1) | Повышен | |
| M1d | Отдаленные метастазы в центральную нервную систему | Не указан или не определен |
| M1d(0) | Не повышен | |
| M1d(1) | Повышен |
Группировка критериев для определения стадии меланомы представлена в табл. 5.
Таблица 5. Группировка критериев TNM для определения стадии меланомы кожи.
| Tis | N0[2] | M0 | 0 |
| T1a | N0 | M0 | IA |
| T1b | N0 | M0 | IA |
| T2a | N0 | M0 | IB |
| T2b | N0 | M0 | IIA |
| T3a | N0 | M0 | IIA |
| T3b | N0 | M0 | IIB |
| T4a | N0 | M0 | IIB |
| T4b | N0 | M0 | IIC |
| T0 | N1b, N1c | M0 | IIIB |
| T0 | N2b, N2c, N3b или N3c | M0 | IIIC |
| T1a/b-T2a | N1a или N2a | M0 | IIIA |
| T1a/b-T2a | N1b/c или N2b | M0 | IIIB |
| T2b/T3a | N1a-N2b | M0 | IIIB |
| T1a-T3a | N2c или N3a/b/c | M0 | IIIC |
| T3b/T4a | Любая категория N ≥N1 | M0 | IIIC |
| T4b | N1a-N2c | M0 | IIIC |
| T4b | N3a/b/c | M0 | IIID |
| Любая T, Tis | Любая категория N | M1 | IV |
Метастазы меланомы кожи без выявленного первичного очага в периферические лимфатические узлы одного региона следует стадировать как III стадию (IIIB (T0N1b, T0N1c) или IIIC (T0N2b, N2c, N3b или N3c)).
Онлайн-калькулятор для определения стадии pTNM по классификации TNM AJCC/UICC 8-го пересмотра доступен на сайте http://melanoma.pro/site/calctnm.
Стадирование меланомы верхних дыхательных и пищеварительных путей (С00-06, с10-14, с30-32) по классификации TNM UICC 8-го пересмотра (2017 г) [18]. Для процедуры стадирования меланомы гистологическое подтверждение обязательно. Оценку состояния лимфатических узлов для установления стадии выполняют при помощи клинического осмотра и инструментальных исследований.
Критерий Т отражает распространенность первичной опухоли:
• Тx - недостаточно данных для оценки первичной опухоли (включая случаи спонтанной регрессии опухоли, а также ошибки при хирургическом удалении опухоли);
• Т0 - отсутствие первичной опухоли;
• Тis - критерий неприменим;
• Т1 - критерий неприменим;
• Т2 - критерий неприменим;
• Т3 - опухоль ограничена только эпителием и/или подслизистым слоем (болезнь слизистой оболочки);
• Т4а - опухоль прорастает в подлежащие мягкие ткани, хрящ, кость или прилежащую кожу;
• Т4b - опухоль прорастает в любую из следующих структур: головной мозг, твердая мозговая оболочка, основание черепа, черепно-мозговые нервы основания черепа (IX, X, XI, XII), жевательную клетчатку, превертебральноую клетчатку, средостение.
Меланома слизистых оболочек является агрессивной опухолью, поэтому критерии T1 и Т2 пропущены, как и стадия I и II.
Критерий N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах:
• Nx - недостаточно данных для оценки регионарных лимфатических узлов;
• N0 - поражения регионарных лимфатических узлов нет;
• N1 - наличие метастазов в регионарных лимфатического узлах.
Критерий М характеризует наличие или отсутствие отдаленных метастазов:
• М0 - отдаленных метастазов нет;
• М1 - наличие отдаленных метастазов.
В табл. 6 приведена группировка критериев TNM для определения стадии меланомы слизистых оболочек.
Таблица 6. Группировка критериев TNM для определения стадии меланомы слизистых оболочек верхних отделов дыхательных и пищеварительных путей.
| III | Т3 | N0 | M0 |
| IVA | Т4a Т3, Т4a | N0 N1 | M0 M0 |
| IVB | Т4b | Любая | M0 |
| IVС | Любая | Любая | M1 |
[1]В соответствии с правилами классификации UICC для оценки состояния регионарных узлов допускается клинический или радиологический метод, в то время как правила AJCC строго рекомендуют выполнять морфологическую оценку состояния регионарных лимфатических узлов и указывать Nx всегда, когда биопсия сторожевого лимфатического узла не выполнялась или регионарные лимфатические узлы ранее удалены по иной причине). Исключение: морфологическое стадирование не требуется для меланомы с категорией̆ Т1, следует использовать клинические данные.
[2]При стадии Tis или T1 не требуется морфологическая верификация состояния лимфатических узлов. Допускается использовать клиническую оценку состояния лимфатических узлов для патологического стадирования.
Symptoms
В большинстве случаев клиническая диагностика первичной меланомы кожи не вызывает затруднений у подготовленного специалиста [19].
Выделяют 4 наиболее распространенные клинические формы меланомы. Поверхностно-распространяющуюся, узловую, лентиго-меланому и акрально-лентигинозную.
Поверхностно-распространяющаяся меланома составляет около 70 % случаев меланомы кожи и в целом имеет относительно благоприятный прогноз, что связано с присутствием 2 фаз в ее развитии. Для фазы радиального роста характерен низкий потенциал метастазирования (II уровень инвазии по Кларку), и она может продолжаться в течение нескольких лет. Затем меланома переходит в фазу вертикального роста, которая характеризуется инвазией клеток опухоли в ретикулярный и подкожно-жировой слои и высоким потенциалом метастазирования. Поверхностно-распространяющаяся форма меланомы развивается на внешне неизмененной коже - de novo или на фоне пигментного невуса в виде небольшого плоского узелка темного, почти черного цвета, диметром 1-3 с постепенным развитием уплотнения и изменением границ; поверхность его становится неровной, очертания неправильными, легко травмируется и кровоточит. Нередко рост опухоли сопровождается субъективными ощущениями в виде зуда и дискомфорта («ощущения опухоли»).
Узловая (нодуляpная) меланома характеризуется первично вертикальным ростом и считается самым неблагоприятным в плане прогноза типом опухоли. Узловой вариант меланомы представлен плотным узлом с бугристой поверхностью различных размеров, поверхность ее изъязвляется, кровоточит и покрывается корками.
Лентиго-меланома, как и поверхностно-распространяющаяся меланома, в своей эволюции претерпевает двухфазность процесса, причем фаза радиального роста при этом типе опухоли может длиться гораздо дольше - 10 лет и более. Условно можно выделить 2 стадии в фазе радиального роста: 1-я стадия не является инвазивной и соответствует злокачественному лентиго - облигатному предраку. Далее начинается инвазивный рост и переход злокачественного лентиго в лентиго-меланому; скорость инвазии в данном случае менее выражена, чем при меланоме поверхностно-распространяющегося типа. Вертикальный рост в глубину дермы и подкожно-жирового слоя характерен и для лентиго-меланомы, однако может реализоваться в течение ряда лет, а не месяцев, как при меланоме поверхностно-распространяющегося типа, что объясняет отсутствие заметных изменений в биологическом течении опухоли и низкий риск развития метастазов. Прогноз при этой форме меланомы более благоприятный, чем при поверхностно-распространяющейся.
Акрально-лентигинозная меланома локализуется на дистальных участках конечностей - коже кистей и стоп, в области ногтевого ложа и проксимального околоногтевого валика. Для нее также свойственна двухфазность развития: фаза горизонтального роста, что соответствует биологическому поведению лентиго-меланомы, и фаза вертикального инвазивного роста. Этот тип опухоли отличается более агрессивным характером течения, чаще и раньше метастазирует, кроме того, специфическая локализация затрудняет визуализацию опухоли, и в большинстве случаев она диагностируется уже на стадии инвазивного роста.
При клинико-анамнестическом анализе картина поверхностно-распространяющейся меланомы кожи лучше всего описывается классической аббревиатурой ABCDE:
─ А (asymmetry) - поверхностно-распространяющаяся меланома кожи имеет вид пигментного пятна, характеризующегося асимметрией: если провести через образование воображаемую линию, одна его половина по форме не будет соответствовать другой.
─ в (border) - границы меланомы кожи имеют неравномерный характер: они могут быть неровными, нечеткими, иметь «географические» очертания.
─ С (color) - для поверхностно-распространяющейся меланомы кожи характерна полихромия - наличие нескольких цветов в одном образовании.
─ D (diameter) - размеры поверхностно-распространяющейся меланомы кожи чаще всего превышают 0,5 см E (evolution или elevation - эволюция или возвышение) - для меланомы кожи всегда характерна какая-либо эволюция с течением времени.
Правило ABCDE неприменимо для меланомы малых размеров (менее 0,5 см), а также для узловой меланомы, поскольку формирующийся узел на первых порах может быть симметричным, с ровными границами, гомогенного черного или сине-черного цвета, диаметр может быть любым. Симптом эволюции образования, тем не менее, остается актуальным - пациенты отмечают рост узелка с течением времени, иногда - чувство боли или жжения, появившееся в области опухоли. Более редкие клинические формы меланомы (меланома по типу злокачественного лентиго, акрально-лентигинозная меланома, подногтевая меланома, беспигментная форма опухоли ) могут вызывать затруднения в клинической диагностике, в связи с чем рекомендованы дополнительные неинвазивные методы диагностики (дерматоскопия), применяемые подготовленными специалистами [19], при этом в случае затруднения интерпретации полученных данных или неоднозначности дерматоскопической картины показано выполнение биопсии новообразования ( см раздел 2,5).
Другим приемом клинической диагностики меланомы кожи является внутрииндивидуальный сравнительный анализ (симптомы «гадкого утенка» и «красной шапочки»). Симптом «гадкого утенка» основан на общей оценке всех имеющихся новообразований кожи и явном отличии меланомы от имеющихся доброкачественных пигментных новообразований. Другим вариантом симптома «гадкого утенка» является обнаружение единственного изменяющегося с течением времени новообразования в определенной топографической области, особенно если динамические изменения противоречат стереотипным эволюционным и возрастным особенностям течения доброкачественных пигментных опухолей кожи. Симптом «красной шапочки» характеризуется дерматоскопическими отличиями злокачественного новообразования от доброкачественных невусов при клинически однотипной картине [20, 21].
В некоторых случаях меланома манифестирует с увеличения лимфатических узлов, которые на первом этапе неверно расцениваются как лимфаденит, лимфома или метастазы рака без выявленного первичного очага. Своевременно проведенная тонкоигольная биопсия или core-биопсия (иногда с последующим иммуногистохимическим или иммуноцитохимическим анализом) увеличенного лимфатического узла позволяет отличить другие причины лимфаденопатии от метастазов меланомы.
При локализации меланомы на слизистых оболочках полости носа и околоносовых пазухах самыми частыми симптомами бывают заложенность носа и носовые кровотечения. Реже встречаются диплопия, экзофтальм, боли и деформация контуров лица. При локализации меланомы на слизистых оболочках полости клинически заболевание на ранних стадиях протекает бессимптомно, на поздних стадиях появляются такие симптомы, как боль, изъязвление и кровоточивость.
Выделяют 4 наиболее распространенные клинические формы меланомы. Поверхностно-распространяющуюся, узловую, лентиго-меланому и акрально-лентигинозную.
Поверхностно-распространяющаяся меланома составляет около 70 % случаев меланомы кожи и в целом имеет относительно благоприятный прогноз, что связано с присутствием 2 фаз в ее развитии. Для фазы радиального роста характерен низкий потенциал метастазирования (II уровень инвазии по Кларку), и она может продолжаться в течение нескольких лет. Затем меланома переходит в фазу вертикального роста, которая характеризуется инвазией клеток опухоли в ретикулярный и подкожно-жировой слои и высоким потенциалом метастазирования. Поверхностно-распространяющаяся форма меланомы развивается на внешне неизмененной коже - de novo или на фоне пигментного невуса в виде небольшого плоского узелка темного, почти черного цвета, диметром 1-3 с постепенным развитием уплотнения и изменением границ; поверхность его становится неровной, очертания неправильными, легко травмируется и кровоточит. Нередко рост опухоли сопровождается субъективными ощущениями в виде зуда и дискомфорта («ощущения опухоли»).
Узловая (нодуляpная) меланома характеризуется первично вертикальным ростом и считается самым неблагоприятным в плане прогноза типом опухоли. Узловой вариант меланомы представлен плотным узлом с бугристой поверхностью различных размеров, поверхность ее изъязвляется, кровоточит и покрывается корками.
Лентиго-меланома, как и поверхностно-распространяющаяся меланома, в своей эволюции претерпевает двухфазность процесса, причем фаза радиального роста при этом типе опухоли может длиться гораздо дольше - 10 лет и более. Условно можно выделить 2 стадии в фазе радиального роста: 1-я стадия не является инвазивной и соответствует злокачественному лентиго - облигатному предраку. Далее начинается инвазивный рост и переход злокачественного лентиго в лентиго-меланому; скорость инвазии в данном случае менее выражена, чем при меланоме поверхностно-распространяющегося типа. Вертикальный рост в глубину дермы и подкожно-жирового слоя характерен и для лентиго-меланомы, однако может реализоваться в течение ряда лет, а не месяцев, как при меланоме поверхностно-распространяющегося типа, что объясняет отсутствие заметных изменений в биологическом течении опухоли и низкий риск развития метастазов. Прогноз при этой форме меланомы более благоприятный, чем при поверхностно-распространяющейся.
Акрально-лентигинозная меланома локализуется на дистальных участках конечностей - коже кистей и стоп, в области ногтевого ложа и проксимального околоногтевого валика. Для нее также свойственна двухфазность развития: фаза горизонтального роста, что соответствует биологическому поведению лентиго-меланомы, и фаза вертикального инвазивного роста. Этот тип опухоли отличается более агрессивным характером течения, чаще и раньше метастазирует, кроме того, специфическая локализация затрудняет визуализацию опухоли, и в большинстве случаев она диагностируется уже на стадии инвазивного роста.
При клинико-анамнестическом анализе картина поверхностно-распространяющейся меланомы кожи лучше всего описывается классической аббревиатурой ABCDE:
─ А (asymmetry) - поверхностно-распространяющаяся меланома кожи имеет вид пигментного пятна, характеризующегося асимметрией: если провести через образование воображаемую линию, одна его половина по форме не будет соответствовать другой.
─ в (border) - границы меланомы кожи имеют неравномерный характер: они могут быть неровными, нечеткими, иметь «географические» очертания.
─ С (color) - для поверхностно-распространяющейся меланомы кожи характерна полихромия - наличие нескольких цветов в одном образовании.
─ D (diameter) - размеры поверхностно-распространяющейся меланомы кожи чаще всего превышают 0,5 см E (evolution или elevation - эволюция или возвышение) - для меланомы кожи всегда характерна какая-либо эволюция с течением времени.
Правило ABCDE неприменимо для меланомы малых размеров (менее 0,5 см), а также для узловой меланомы, поскольку формирующийся узел на первых порах может быть симметричным, с ровными границами, гомогенного черного или сине-черного цвета, диаметр может быть любым. Симптом эволюции образования, тем не менее, остается актуальным - пациенты отмечают рост узелка с течением времени, иногда - чувство боли или жжения, появившееся в области опухоли. Более редкие клинические формы меланомы (меланома по типу злокачественного лентиго, акрально-лентигинозная меланома, подногтевая меланома, беспигментная форма опухоли ) могут вызывать затруднения в клинической диагностике, в связи с чем рекомендованы дополнительные неинвазивные методы диагностики (дерматоскопия), применяемые подготовленными специалистами [19], при этом в случае затруднения интерпретации полученных данных или неоднозначности дерматоскопической картины показано выполнение биопсии новообразования ( см раздел 2,5).
Другим приемом клинической диагностики меланомы кожи является внутрииндивидуальный сравнительный анализ (симптомы «гадкого утенка» и «красной шапочки»). Симптом «гадкого утенка» основан на общей оценке всех имеющихся новообразований кожи и явном отличии меланомы от имеющихся доброкачественных пигментных новообразований. Другим вариантом симптома «гадкого утенка» является обнаружение единственного изменяющегося с течением времени новообразования в определенной топографической области, особенно если динамические изменения противоречат стереотипным эволюционным и возрастным особенностям течения доброкачественных пигментных опухолей кожи. Симптом «красной шапочки» характеризуется дерматоскопическими отличиями злокачественного новообразования от доброкачественных невусов при клинически однотипной картине [20, 21].
В некоторых случаях меланома манифестирует с увеличения лимфатических узлов, которые на первом этапе неверно расцениваются как лимфаденит, лимфома или метастазы рака без выявленного первичного очага. Своевременно проведенная тонкоигольная биопсия или core-биопсия (иногда с последующим иммуногистохимическим или иммуноцитохимическим анализом) увеличенного лимфатического узла позволяет отличить другие причины лимфаденопатии от метастазов меланомы.
При локализации меланомы на слизистых оболочках полости носа и околоносовых пазухах самыми частыми симптомами бывают заложенность носа и носовые кровотечения. Реже встречаются диплопия, экзофтальм, боли и деформация контуров лица. При локализации меланомы на слизистых оболочках полости клинически заболевание на ранних стадиях протекает бессимптомно, на поздних стадиях появляются такие симптомы, как боль, изъязвление и кровоточивость.
Diagnostics
Критерии установления диагноза/состояния:
1) данные анамнеза;
2) данные физикального обследования и, в ряде случаев, дерматоскопического исследования;
3) данные прижизненного патолого-анатомического исследования биопсийного материала.
Клинический диагноз основан на комбинации результатов 3 анализов любого пигментированного образования:
1) визуальный анализ каждого поражения в отдельности: экспертиза невооруженным глазом оценивает так называемые A (асимметрия), в (нерегулярные границы), с (неоднородный цвет) и D (диаметр 5 мм и более) критерии, которые указывают на подозрительные меланоцитарные новообразования (правило ABCD);
2) внутрииндивидуальный сравнительный анализ: поиск пигментированного образования, которое не похоже на другие у того же пациента (симптом «гадкого утенка»);
3) хронологический анализ изменений: поиск быстрого и недавнего изменения данного пигментного образования (Е как эволюция), которое может быть подтверждено пациентом или документально, в сравнении с предыдущими фотографиями [20, 21].
В таблице 7 представлен план обследования в зависимости от результатов биопсии пигментного новообразования кожи и клинического осмотра. Рекомендации по применению самих медицинских вмешательств представлены в соответствующих разделах.
Таблица 7. План обследования в зависимости от результатов биопсии пигментного новообразования кожи и клинического осмотра.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Комментарий. Ключевые факторы риска развития меланомы кожи приведены в подразделе 1,2 «Этиология и патогенез».
Уровень убедительности рекомендаций. A (уровень достоверности доказательств -1).
Комментарий. Существует значительная вариация и неопределенность в отношении диагностической точности визуального осмотра, частота ошибок при визуальном осмотре достаточно высока, для обеспечения точной диагностики злокачественных новообразований кожи необходимо также использовать другие методы диагностики. Также необходимо отметить, что первично-множественные синхронные опухоли (меланомы и немеланомные опухоли кожи) могут быть обнаружены у 5-10 % пациентов [24-28].
• Рекомендуется осмотр пациента с жалобами на пигментное новообразование кожи проводить врачам, имеющим навыки ранней диагностики злокачественных новообразований кожи (включая навыки дерматоскопии), с целью оценки всех кожных покровов и лимфатических узлов и выявления подозрительных образований [29, 31-35].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
• Рекомендуется в рамках осмотра пациента с жалобами на пигментное новообразование кожи использование эпилюминисцентной микроскопии (дерматоскопии) кожного покрова, ногтевых пластин, доступных для исследования участков слизистых оболочек, так как она повышает точность неинвазивной диагностики и уменьшает потребность в выполнении биопсии, но может быть рекомендована к применению только обученным этому методу специалистам [36-38].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств 1).
Комментарий. Специфические для поверхностно распространяющейся меланомы признаки включают атипичную пигментную сеть, участки регресса, точки и глобулы неправильной формы, полосы и полихромию, распределенные асимметрично. Дополнительные критерии, такие как бело-голубые структуры и полиморфные сосуды, часто встречаются при инвазивной меланоме [39-42].
Амеланотическая меланома может представлять диагностическую сложность. Типичным для нее является полиморфный сосудистый паттерн, либо диагноз устанавливается методом исключения при отсутствии типичных меланоцитарных и немеланоцитарных дерматоскопических признаков [43, 44].
Для злокачественного лентиго характерно наличие ромбовидных структур, псевдосети, точечных кровеносных сосудов, серых кругов и незавершенных фолликулов [45, 46].
Отличительными дерматоскопическими признаками инвазивной акральной меланомы являются параллельный гребешковый паттерн и диффузная нерегулярная пигментация [47-49].
• Рекомендуется для первичной диагностики меланомы применение последовательной (динамической) цифровой фотодерматоскопии у пациентов с подозрением на злокачественное новообразование кожи, которые не имеют специфических дерматоскопических критериев злокачественности [38, 50-53].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарий. Последовательная цифровая дермоскопическая визуализация включает фиксацию и оценку последовательных дермоскопических изображений одного или нескольких меланоцитарных очагов, разделенных интервалом времени, для выявления подозрительных изменений.
Возможно проведение краткосрочного цифрового мониторинга (в течение 1,5-4,5 мес) для контроля подозрительных меланоцитарных новообразований и долгосрочного мониторинга для наблюдения (обычно с интервалами 6-12 мес). Долгосрочный цифровой мониторинг обычно используется для наблюдения за пациентами группы высокого риска, как правило, с множественными атипичными невусами [50-52, 54-57].
Фотографирование всего тела может быть полезно для раннего выявления меланомы кожи у пациентов с высоким риском возникновения меланомы кожи (например, у пациентов с синдромом диспластических невусов, FAMM-синдромом (Famial Atypic Mole Melanoma Syndrome) ) [58-61].
• Рекомендуется включить в физикальное обследование также оценку состояния регионарных лимфатических узлов у пациентов с подозрением на злокачественное новообразование кожи с целью исключения метастатического поражения регионарных лимфатических узлов [22, 29, 62].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 1).
Комментарий. Необходимо отметить, что пальпация лимфатических узлов у пациентов не исключает необходимость проведения УЗИ лимфатических узлов у пациентов с установленным диагнозом, так как физикальное обследование лимфатических узлов не обладает достаточной точностью.
• Рекомендуется по результатам анализа жалоб, анамнеза и данных физикального обследования пациента на приеме принять решение о целесообразности инвазивной диагностики (биопсии) новообразования с целью морфологической верификации диагноза и составления дальнейшего плана обследования и лечения [63-70] ( см приложение Б, 1).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. Повышенное соотношение нейтрофилов к лимфоцитам, а также высокий уровень лактатдегидрогеназы могут быть предикторами плохого прогноза у пациентов с меланомой III-IV стадии, но именно уровень лактатдегидрогеназы является критерием, необходимым для установления стадии у больных метастатической меланомой [17, 78, 79].
• При подтверждении диагноза при подготовке к проведению дальнейшего этапа лечения рекомендуется выполнять общий клинический и биохимический общетерапевтический анализы крови (включая определение уровня лактатдегидрогеназы и соотношение нейтрофилов и лимфоцитов) в целях оценки прогноза меланомы [78, 79].( см также таблицу 7).
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
Комментарий. Также в рамках подбора оптимального алгоритма лечения пациента с установленным диагнозом необходима лабораторная диагностика в объеме, позволяющем выявить риски неблагоприятного ответа на лечения и противопоказания к различным видам терапии.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
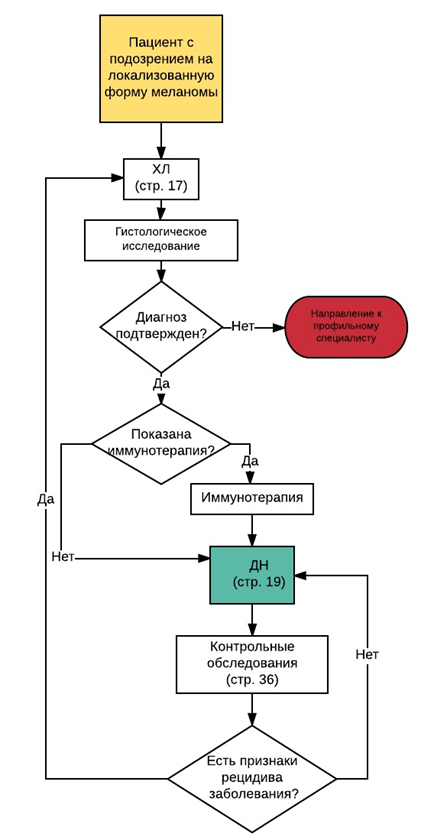
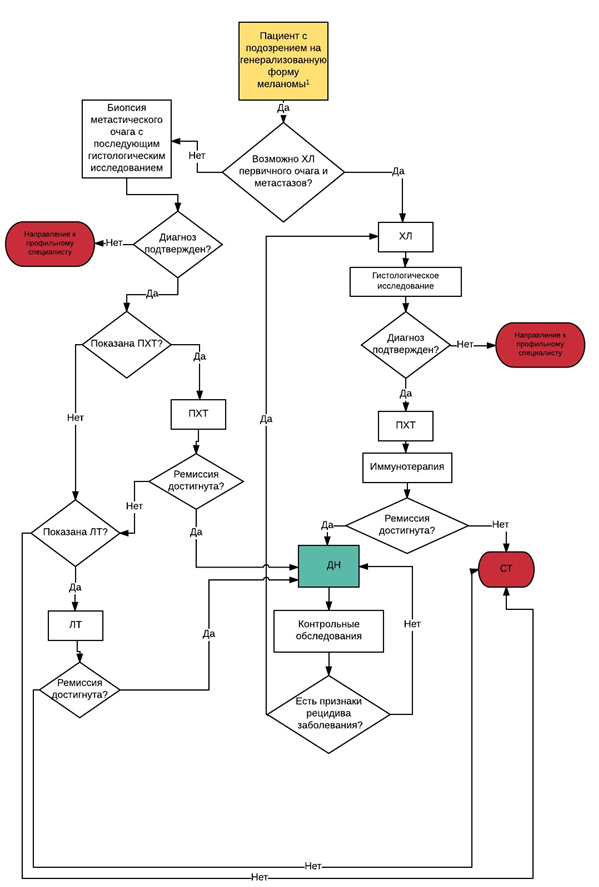
• Рекомендовано после установления диагноза в отсутствие любых жалоб и симптомов для выявления скрытых метастазов выполнять диагностические исследования различного объема в зависимости от стадии заболевания (установленной по данным клинического осмотра и патолого-анатомического исследования биопсийного или операционного материала), отражающей риск выявления регионарных и отдаленных метастазов, суммированные в таблице 7 [80-86].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Не рекомендуется до морфологического подтверждения диагноза инструментальная диагностика, если только интеркуррентная патология или общее состояние пациента не требует ее для безопасного проведения биопсии [22].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. План лечения и обследований не следует составлять до получения данных патолого-анатомического исследования.
• Рекомендуется после установления диагноза выполнять ультразвуковое исследование (далее - УЗИ) регионарных лимфатических узлов пациентам с 0-IV стадией в целях выявления метастазов в лимфатические узлы [62, 86].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
• Рекомендуется с целью оценки распространённости опухолевого процесса пациентам с клинической стадией IIA-IV после установления диагноза выполнять для оценки состояния органов грудной клетки, брюшной полости и малого таза - компьютерную томографию (далее - КТ) органов грудной клетки, брюшной полости и малого таза. Внутривенное контрастирование следует проводить во всех случаях, если не выявлены противопоказания к введению йодсодержащих контрастирующих препаратов - в этом случае КТ с в/в контрастированием допускается заменить на МРТ с в/в контрастированием. Альтернативной может быть позитронно-эмиссионная томография, совмещенная с компьютерной томографией (далее -ПЭТ/КТ) с флудезоксиглюкозой [18F] в режиме «все тело» [86-90].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарий. Если оптимальный вариант лучевой диагностики не может быть проведен в течение 4 недель после установки диагноза, КТ органов грудной полости допускается заменить на обзорную в двух проекциях рентгенографию органов грудной клетки, а КТ органов брюшной полости и малого таза с в/в контрастированием - на УЗИ органов брюшной полости и малого таза [91].
• Рекомендуется врачу-радиологу для исключения метастатического поражения головного мозга у пациентов с впервые выявленной меланомой IIB-IV стадии выполнять магнитно-резонансную томографию (далее - МРТ) головного мозга с в/в контрастированием, за исключением случаев, когда проведение МРТ противопоказано, - в таких случаях исследование может быть заменено на КТ головного мозга с в/в контрастированием [86, 92-95].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарий. В случае невозможности выполнить МРТ головного мозга с в/в контрастированием (срок ожидания очереди на исследование более 1 мес) допускается выполнить КТ головного мозга с в/в контрастированием. Выполнение КТ головного мозга без в/в контрастирования не рекомендуется.
• Рекомендуется выполнить МРТ головного мозга пациентам в течение 2 месяцев после морфологического подтверждения диагноза меланомы кожи стадии IIB и выше или в течение 30 дней от момента установления диагноза метастатической меланомы для исключения метастатического поражения головного мозга [93], [94].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется врачу-радиологу выполнять сцинтиграфию костей всего тела (остеосцинтиграфию) после установления диагноза при подозрении на метастатическое поражение костей скелета вне зависимости от клинической стадии.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется после установления диагноза пациентам с аноректальной локализацией меланомы выполнить колоноскопию для оценки распространенности опухолевого поражения со стороны слизистой оболочки с биопсией из очагов, подозрительных в отношении меланомы [96].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• Рекомендуется после установления диагноза выполнить пациентам биопсию очагов метастазирования под контролем УЗИ или КТ при подозрении на метастазы по данным КТ или МРТ в случаях, когда их подтверждение принципиально меняет тактику лечения, с целью морфологического подтверждения метастатического процесса [22].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
Комментарий. Эксцизионная биопсия является рекомендуемым стандартом для установления диагноза меланомы кожи. Однако в ряде клинических ситуаций (например, обширный участок лентиго на лице, требующий дифференциальной диагностики с лентиго-меланомой, гигантские врожденные невусы с участками, подозрительными на озлокачествление ) выполнение эксцизионной биопсии всего пигметного новообразования сопряжено со значительными трудностями и неоправданной хирургической травмой для пациента. В этом случае безопасно выполнить инцизионную (или панч) биопсию на всю толщину кожи. Судя по систематическому обзору 9 исследований, в том числе рандомизированных контролируемых исследований, выполнение инцизионной биопсии меланомы не оказывает негативного влияния на прогноз. [97].
• Рекомендуется ориентировать разрезы кожи при проведении эксцизионной биопсии в направлении ближайшего лимфатического коллектора параллельно лимфатическим сосудам кожи (а не по кожным линиям или естественным складкам) так, чтобы повторное иссечение рубца (если оно потребуется) могло быть выполнено без затруднений [22, 63-70].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. Эксцизионная биопсия подозрительного плоского пигментного образования кожи может быть безопасно выполнена с использованием местной инфильтрационной анестезии. При этом рекомендуется избегать повреждений удаляемого новообразования до его иссечения [8, 63, 64, 66-69].
• Рекомендуется в случае подтверждения у пациента диагноза меланомы кожи рубец после биопсии иссечь с большим отступом в сроки до 4-8 недель в зависимости от гистологических характеристик опухоли с целью профилактики рецидива меланомы в области рубца ( см раздел 3,1) [98-107].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
• Рекомендуется проводить прижизненное патолого-анатомическое исследование операционного материала, в заключении рекомендуется отразить следующие характеристики для определения стадии заболевания и прогноза [108-118].
Обязательные характеристики:
• определение максимальной толщины опухоли в миллиметрах по Бреслоу;
• определение уровня инвазии по Кларку;
• указание о наличии или отсутствии изъязвления первичной опухоли;
• определение митотического индекса (количество митозов на 1 мм2) при толщине опухоли до 1 мм включительно;
• оценка периферического и глубокого краев резекции на наличие опухолевых клеток;
• наличие транзиторных или сателлитных метастазов.
Дополнительные характеристики:
• локализация опухоли;
• наличие или отсутствие спонтанной регрессии;
• нейротропизм;
• лимфоидная инфильтрация;
• гистологический подтип;
• ангиолимфатическая инвазия.
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
• Рекомендуется пациентам с меланомой кожи, если диагностированы или заподозрены регионарные и отдаленные метастазы меланомы, и при метастазах меланомы без выявленного первичного очага выполнить молекулярно-генетическое исследование мутаций в гене вRAF (экзон 15) в биопсийном материале (или ранее удаленных лимфатических узлов, или первичной опухоли (если материал удовлетворяет требованиям лаборатории для достоверного определения наличия или отсутствия молекулярно-генетических изменений)) - это может повлиять на выбор таргетного агента (ингибитора протеинкиназы) в лечении метастатического процесса [22, 119-130].
Уровень убедительности рекомендаций А (уровень достоверности доказательств -1).
• Рекомендуется пациентам с меланомой кожи при отсутствии мутации в гене вRAF выполнить молекулярно-генетическое исследование мутаций в генах NRAS (экзон 3) и KIT (экзоны 8, 9, 11, 13, 14, 17, 18) в биопсийном (операционном) материале или выполнить широкое молекулярное тестирование, если диагностированы или заподозрены отдаленные метастазы меланомы, и это может повлиять на выбор схемы таргетной терапии (в частности, назначение ингибиторов протеинкиназы или моноклональных антител) при лечении метастатического процесса [131-146].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
Комментарий. Также имеются сведения о том, что ингибитор протеинкиназы c-Kit может быть эффективен при наличии мутаций в 8 экзонах гена KIT.
• Рекомендуется при меланоме слизистых оболочек, если диагностированы или заподозрены отдаленные метастазы меланомы, выполнить молекулярно-генетическое исследование мутаций в гене KIT в биопсийном (операционном) материале (экзоны 8, 9, 11, 13, 14, 17, 18 ) - это может повлиять на выбор таргетного агента (ингибитора протеинкиназы) в лечении метастатического процесса [131-144], при отсутствии мутации в гене KIT рекомендуется выполнить молекулярно-генетическое исследование мутаций в гене вRAF (экзон 15) в биопсийном материале.
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
Комментарий. Также имеются сведения о том, что ингибитор протеинкиназы c-Kit может быть эффективен при наличии мутаций в 8 экзонах гена KIT[143, 147-149].
1) данные анамнеза;
2) данные физикального обследования и, в ряде случаев, дерматоскопического исследования;
3) данные прижизненного патолого-анатомического исследования биопсийного материала.
Клинический диагноз основан на комбинации результатов 3 анализов любого пигментированного образования:
1) визуальный анализ каждого поражения в отдельности: экспертиза невооруженным глазом оценивает так называемые A (асимметрия), в (нерегулярные границы), с (неоднородный цвет) и D (диаметр 5 мм и более) критерии, которые указывают на подозрительные меланоцитарные новообразования (правило ABCD);
2) внутрииндивидуальный сравнительный анализ: поиск пигментированного образования, которое не похоже на другие у того же пациента (симптом «гадкого утенка»);
3) хронологический анализ изменений: поиск быстрого и недавнего изменения данного пигментного образования (Е как эволюция), которое может быть подтверждено пациентом или документально, в сравнении с предыдущими фотографиями [20, 21].
В таблице 7 представлен план обследования в зависимости от результатов биопсии пигментного новообразования кожи и клинического осмотра. Рекомендации по применению самих медицинских вмешательств представлены в соответствующих разделах.
Таблица 7. План обследования в зависимости от результатов биопсии пигментного новообразования кожи и клинического осмотра.
| 0, I | Да | 1. Ультразвуковое исследование (далее - УЗИ) регионарных лимфатических узлов. 2. Лучевая диагностика не рекомендуется, если нет симптомов | Нет | Да (при толщине опухоли 0,8 мм и более) | Нет |
| IIA | Да | 1. УЗИ регионарных лимфатических узлов. 2. Лучевая диагностика рекомендуется в полном объеме | Нет | Да | Нет |
| IIB, IIC, III | Да | 1. УЗИ регионарных лимфатических узлов. 2. Лучевая диагностика в полном объеме. 3. Магнитно-резонанса томография (далее - МРТ) головного мозга с в/в контрастированием (для стадии III) | Общий клинический и биохимический анализы крови при необходимости | Да (для стадий IIB, IIC) | Молекулярно-генетическое исследование мутаций в гене вRAF обязательно (для стадии III) |
| IV | Да | 1. УЗИ регионарных лимфатических узлов. 2. Лучевая диагностика в полном объеме. 3. МРТ головного мозга с в/в контрастированием | 1. Определение активности лактатдегидрогеназы в крови. 2. Общий клинический и биохимический анализы крови | Не применимо | Молекулярно-генетическое исследование мутаций в гене вRAF обязательно (при меланоме кожи), при отсутствии мутации в гене вRAF - молекулярно-генетическое исследование мутаций в гене KIT |
2,1 Жалобы и анамнез.
• Рекомендуется сбор жалоб и анамнеза у пациента с целью выявления факторов риска и факторов, которые могут повлиять на выбор тактики лечения, методов диагностики и вторичной профилактики [22, 23]. Чаще всего пациент обращается с жалобой на то, что «родинка» начала изменяться - отмечается рост, изменение конфигурации границ, появление в пределах новообразования разных цветовых оттенков. Одной из нередких жалоб является жалоба на появление зуда, жжения или субъективного дискомфорта в области существующего или появившегося de novo новообразования.Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Комментарий. Ключевые факторы риска развития меланомы кожи приведены в подразделе 1,2 «Этиология и патогенез».
2,2 Физикальное обследование.
• Рекомендуется при первом обращении пациента с жалобами на пигментное новообразование кожи расширить зону осмотра и оценить состояние всех кожных покровов и видимых слизистых оболочек, включая волосистую часть головы, ногтевые пластинки, кожу стоп и кистей, слизистые оболочки полости рта, половых органов и конъюнктивы в целях выявления других подозрительных новообразований кожи. [22, 24-30].Уровень убедительности рекомендаций. A (уровень достоверности доказательств -1).
Комментарий. Существует значительная вариация и неопределенность в отношении диагностической точности визуального осмотра, частота ошибок при визуальном осмотре достаточно высока, для обеспечения точной диагностики злокачественных новообразований кожи необходимо также использовать другие методы диагностики. Также необходимо отметить, что первично-множественные синхронные опухоли (меланомы и немеланомные опухоли кожи) могут быть обнаружены у 5-10 % пациентов [24-28].
• Рекомендуется осмотр пациента с жалобами на пигментное новообразование кожи проводить врачам, имеющим навыки ранней диагностики злокачественных новообразований кожи (включая навыки дерматоскопии), с целью оценки всех кожных покровов и лимфатических узлов и выявления подозрительных образований [29, 31-35].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
• Рекомендуется в рамках осмотра пациента с жалобами на пигментное новообразование кожи использование эпилюминисцентной микроскопии (дерматоскопии) кожного покрова, ногтевых пластин, доступных для исследования участков слизистых оболочек, так как она повышает точность неинвазивной диагностики и уменьшает потребность в выполнении биопсии, но может быть рекомендована к применению только обученным этому методу специалистам [36-38].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств 1).
Комментарий. Специфические для поверхностно распространяющейся меланомы признаки включают атипичную пигментную сеть, участки регресса, точки и глобулы неправильной формы, полосы и полихромию, распределенные асимметрично. Дополнительные критерии, такие как бело-голубые структуры и полиморфные сосуды, часто встречаются при инвазивной меланоме [39-42].
Амеланотическая меланома может представлять диагностическую сложность. Типичным для нее является полиморфный сосудистый паттерн, либо диагноз устанавливается методом исключения при отсутствии типичных меланоцитарных и немеланоцитарных дерматоскопических признаков [43, 44].
Для злокачественного лентиго характерно наличие ромбовидных структур, псевдосети, точечных кровеносных сосудов, серых кругов и незавершенных фолликулов [45, 46].
Отличительными дерматоскопическими признаками инвазивной акральной меланомы являются параллельный гребешковый паттерн и диффузная нерегулярная пигментация [47-49].
• Рекомендуется для первичной диагностики меланомы применение последовательной (динамической) цифровой фотодерматоскопии у пациентов с подозрением на злокачественное новообразование кожи, которые не имеют специфических дерматоскопических критериев злокачественности [38, 50-53].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарий. Последовательная цифровая дермоскопическая визуализация включает фиксацию и оценку последовательных дермоскопических изображений одного или нескольких меланоцитарных очагов, разделенных интервалом времени, для выявления подозрительных изменений.
Возможно проведение краткосрочного цифрового мониторинга (в течение 1,5-4,5 мес) для контроля подозрительных меланоцитарных новообразований и долгосрочного мониторинга для наблюдения (обычно с интервалами 6-12 мес). Долгосрочный цифровой мониторинг обычно используется для наблюдения за пациентами группы высокого риска, как правило, с множественными атипичными невусами [50-52, 54-57].
Фотографирование всего тела может быть полезно для раннего выявления меланомы кожи у пациентов с высоким риском возникновения меланомы кожи (например, у пациентов с синдромом диспластических невусов, FAMM-синдромом (Famial Atypic Mole Melanoma Syndrome) ) [58-61].
• Рекомендуется включить в физикальное обследование также оценку состояния регионарных лимфатических узлов у пациентов с подозрением на злокачественное новообразование кожи с целью исключения метастатического поражения регионарных лимфатических узлов [22, 29, 62].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 1).
Комментарий. Необходимо отметить, что пальпация лимфатических узлов у пациентов не исключает необходимость проведения УЗИ лимфатических узлов у пациентов с установленным диагнозом, так как физикальное обследование лимфатических узлов не обладает достаточной точностью.
• Рекомендуется по результатам анализа жалоб, анамнеза и данных физикального обследования пациента на приеме принять решение о целесообразности инвазивной диагностики (биопсии) новообразования с целью морфологической верификации диагноза и составления дальнейшего плана обследования и лечения [63-70] ( см приложение Б, 1).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
2,3 Лабораторные диагностические исследования.
• Не рекомендуется проведение пациентам до морфологического подтверждения диагноза лабораторных диагностических исследований, если только интеркуррентная патология или общее состояние пациента не требует ее для безопасного проведения биопсии, так как диагноз устанавливается на основе результатов иных диагностических методов ( см подразделы 2,4 и 2,5), а результаты лабораторной диагностики влияют на прогноз у пациентов с уже установленным диагнозом. [22, 71-77].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. Повышенное соотношение нейтрофилов к лимфоцитам, а также высокий уровень лактатдегидрогеназы могут быть предикторами плохого прогноза у пациентов с меланомой III-IV стадии, но именно уровень лактатдегидрогеназы является критерием, необходимым для установления стадии у больных метастатической меланомой [17, 78, 79].
• При подтверждении диагноза при подготовке к проведению дальнейшего этапа лечения рекомендуется выполнять общий клинический и биохимический общетерапевтический анализы крови (включая определение уровня лактатдегидрогеназы и соотношение нейтрофилов и лимфоцитов) в целях оценки прогноза меланомы [78, 79].( см также таблицу 7).
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
Комментарий. Также в рамках подбора оптимального алгоритма лечения пациента с установленным диагнозом необходима лабораторная диагностика в объеме, позволяющем выявить риски неблагоприятного ответа на лечения и противопоказания к различным видам терапии.
2,4 Инструментальные диагностические исследования.
• Рекомендуется при наличии соответствующих показаний (симптомов метастазирования) проводить инструментальные диагностические мероприятия (включая лучевую диагностику) в полном объеме вне зависимости от стадии заболевания для своевременного выявления метастазов меланомы [22].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендовано после установления диагноза в отсутствие любых жалоб и симптомов для выявления скрытых метастазов выполнять диагностические исследования различного объема в зависимости от стадии заболевания (установленной по данным клинического осмотра и патолого-анатомического исследования биопсийного или операционного материала), отражающей риск выявления регионарных и отдаленных метастазов, суммированные в таблице 7 [80-86].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Не рекомендуется до морфологического подтверждения диагноза инструментальная диагностика, если только интеркуррентная патология или общее состояние пациента не требует ее для безопасного проведения биопсии [22].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. План лечения и обследований не следует составлять до получения данных патолого-анатомического исследования.
• Рекомендуется после установления диагноза выполнять ультразвуковое исследование (далее - УЗИ) регионарных лимфатических узлов пациентам с 0-IV стадией в целях выявления метастазов в лимфатические узлы [62, 86].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
• Рекомендуется с целью оценки распространённости опухолевого процесса пациентам с клинической стадией IIA-IV после установления диагноза выполнять для оценки состояния органов грудной клетки, брюшной полости и малого таза - компьютерную томографию (далее - КТ) органов грудной клетки, брюшной полости и малого таза. Внутривенное контрастирование следует проводить во всех случаях, если не выявлены противопоказания к введению йодсодержащих контрастирующих препаратов - в этом случае КТ с в/в контрастированием допускается заменить на МРТ с в/в контрастированием. Альтернативной может быть позитронно-эмиссионная томография, совмещенная с компьютерной томографией (далее -ПЭТ/КТ) с флудезоксиглюкозой [18F] в режиме «все тело» [86-90].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарий. Если оптимальный вариант лучевой диагностики не может быть проведен в течение 4 недель после установки диагноза, КТ органов грудной полости допускается заменить на обзорную в двух проекциях рентгенографию органов грудной клетки, а КТ органов брюшной полости и малого таза с в/в контрастированием - на УЗИ органов брюшной полости и малого таза [91].
• Рекомендуется врачу-радиологу для исключения метастатического поражения головного мозга у пациентов с впервые выявленной меланомой IIB-IV стадии выполнять магнитно-резонансную томографию (далее - МРТ) головного мозга с в/в контрастированием, за исключением случаев, когда проведение МРТ противопоказано, - в таких случаях исследование может быть заменено на КТ головного мозга с в/в контрастированием [86, 92-95].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарий. В случае невозможности выполнить МРТ головного мозга с в/в контрастированием (срок ожидания очереди на исследование более 1 мес) допускается выполнить КТ головного мозга с в/в контрастированием. Выполнение КТ головного мозга без в/в контрастирования не рекомендуется.
• Рекомендуется выполнить МРТ головного мозга пациентам в течение 2 месяцев после морфологического подтверждения диагноза меланомы кожи стадии IIB и выше или в течение 30 дней от момента установления диагноза метастатической меланомы для исключения метастатического поражения головного мозга [93], [94].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется врачу-радиологу выполнять сцинтиграфию костей всего тела (остеосцинтиграфию) после установления диагноза при подозрении на метастатическое поражение костей скелета вне зависимости от клинической стадии.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется после установления диагноза пациентам с аноректальной локализацией меланомы выполнить колоноскопию для оценки распространенности опухолевого поражения со стороны слизистой оболочки с биопсией из очагов, подозрительных в отношении меланомы [96].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• Рекомендуется после установления диагноза выполнить пациентам биопсию очагов метастазирования под контролем УЗИ или КТ при подозрении на метастазы по данным КТ или МРТ в случаях, когда их подтверждение принципиально меняет тактику лечения, с целью морфологического подтверждения метастатического процесса [22].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
2,5 Иные диагностические исследования.
• Рекомендуется для подтверждения диагноза, а также составления дальнейшего плана обследований и лечения на первом этапе использование эксцизионной биопсии подозрительного пигментного образования с отступом не более 5 мм (приемлемый отступ от 1-3 мм (0,1-0,3 см)). [8, 97-99].Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
Комментарий. Эксцизионная биопсия является рекомендуемым стандартом для установления диагноза меланомы кожи. Однако в ряде клинических ситуаций (например, обширный участок лентиго на лице, требующий дифференциальной диагностики с лентиго-меланомой, гигантские врожденные невусы с участками, подозрительными на озлокачествление ) выполнение эксцизионной биопсии всего пигметного новообразования сопряжено со значительными трудностями и неоправданной хирургической травмой для пациента. В этом случае безопасно выполнить инцизионную (или панч) биопсию на всю толщину кожи. Судя по систематическому обзору 9 исследований, в том числе рандомизированных контролируемых исследований, выполнение инцизионной биопсии меланомы не оказывает негативного влияния на прогноз. [97].
• Рекомендуется ориентировать разрезы кожи при проведении эксцизионной биопсии в направлении ближайшего лимфатического коллектора параллельно лимфатическим сосудам кожи (а не по кожным линиям или естественным складкам) так, чтобы повторное иссечение рубца (если оно потребуется) могло быть выполнено без затруднений [22, 63-70].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. Эксцизионная биопсия подозрительного плоского пигментного образования кожи может быть безопасно выполнена с использованием местной инфильтрационной анестезии. При этом рекомендуется избегать повреждений удаляемого новообразования до его иссечения [8, 63, 64, 66-69].
• Рекомендуется в случае подтверждения у пациента диагноза меланомы кожи рубец после биопсии иссечь с большим отступом в сроки до 4-8 недель в зависимости от гистологических характеристик опухоли с целью профилактики рецидива меланомы в области рубца ( см раздел 3,1) [98-107].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
• Рекомендуется проводить прижизненное патолого-анатомическое исследование операционного материала, в заключении рекомендуется отразить следующие характеристики для определения стадии заболевания и прогноза [108-118].
Обязательные характеристики:
• определение максимальной толщины опухоли в миллиметрах по Бреслоу;
• определение уровня инвазии по Кларку;
• указание о наличии или отсутствии изъязвления первичной опухоли;
• определение митотического индекса (количество митозов на 1 мм2) при толщине опухоли до 1 мм включительно;
• оценка периферического и глубокого краев резекции на наличие опухолевых клеток;
• наличие транзиторных или сателлитных метастазов.
Дополнительные характеристики:
• локализация опухоли;
• наличие или отсутствие спонтанной регрессии;
• нейротропизм;
• лимфоидная инфильтрация;
• гистологический подтип;
• ангиолимфатическая инвазия.
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
• Рекомендуется пациентам с меланомой кожи, если диагностированы или заподозрены регионарные и отдаленные метастазы меланомы, и при метастазах меланомы без выявленного первичного очага выполнить молекулярно-генетическое исследование мутаций в гене вRAF (экзон 15) в биопсийном материале (или ранее удаленных лимфатических узлов, или первичной опухоли (если материал удовлетворяет требованиям лаборатории для достоверного определения наличия или отсутствия молекулярно-генетических изменений)) - это может повлиять на выбор таргетного агента (ингибитора протеинкиназы) в лечении метастатического процесса [22, 119-130].
Уровень убедительности рекомендаций А (уровень достоверности доказательств -1).
• Рекомендуется пациентам с меланомой кожи при отсутствии мутации в гене вRAF выполнить молекулярно-генетическое исследование мутаций в генах NRAS (экзон 3) и KIT (экзоны 8, 9, 11, 13, 14, 17, 18) в биопсийном (операционном) материале или выполнить широкое молекулярное тестирование, если диагностированы или заподозрены отдаленные метастазы меланомы, и это может повлиять на выбор схемы таргетной терапии (в частности, назначение ингибиторов протеинкиназы или моноклональных антител) при лечении метастатического процесса [131-146].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
Комментарий. Также имеются сведения о том, что ингибитор протеинкиназы c-Kit может быть эффективен при наличии мутаций в 8 экзонах гена KIT.
• Рекомендуется при меланоме слизистых оболочек, если диагностированы или заподозрены отдаленные метастазы меланомы, выполнить молекулярно-генетическое исследование мутаций в гене KIT в биопсийном (операционном) материале (экзоны 8, 9, 11, 13, 14, 17, 18 ) - это может повлиять на выбор таргетного агента (ингибитора протеинкиназы) в лечении метастатического процесса [131-144], при отсутствии мутации в гене KIT рекомендуется выполнить молекулярно-генетическое исследование мутаций в гене вRAF (экзон 15) в биопсийном материале.
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
Комментарий. Также имеются сведения о том, что ингибитор протеинкиназы c-Kit может быть эффективен при наличии мутаций в 8 экзонах гена KIT[143, 147-149].
Treatment
• Рекомендуется рассматривать хирургическое вмешательство как основной метод радикального лечения пациентов меланомой кожи 0-III стадии [22, 98, 100, 101, 103, 105-107, 119, 150-160].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. По показаниям дополнительно проводится адъювантная терапия ( см раздел 3,3).
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
• Выбор хирургического отступа формируется на основании результатов патолого-анатомического исследования биопсийного (операционного) материала, а именно толщины опухоли.В настоящее время для улучшения отдаленных результатов лечения и профилактики рецидивов опухоли при уже установленной стадии рекомендуется выполнять следующие отступы [98-107]:
• 0,5 см для меланомы in situ;
• 1 см при толщине опухоли по Бреслоу ≤2.
• 2 см при толщине опухоли >2.
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарий. Модифицированные варианты резекции с меньшими отступами возможны для сохранения функции органа при меланоме кожи пальцев или кожи ушной раковины [157, 161-164].
• Рекомендуется для определения толщины опухоли на первом этапе использовать эксцизионную биопсию пигментного образования с отступом от видимого края пигментной опухоли не более 0,5 см В случае подтверждения диагноза меланомы кожи рубец после биопсии иссекается с большим отступом в сроки 4-8 нед ( см также раздел 2,5) [98-107].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Если эксцизионная биопсия не проводится из-за очевидности диагноза, установленного клинически, отступы от видимых краев опухоли не рекомендуется расширять более чем на 2 так как без точных знаний микростадии это будет приводить к излишним манипуляциям, связанным с закрытием послеоперационной раны (например, различным видам сложной пластики) [98-107].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Если после иссечения первичной опухоли в краях резекции обнаруживаются опухолевые клетки при инвазивной или десмопластической меланоме, а ререзекция не представляется возможной, рекомендуется проведение адъювантной лучевой терапии на зону первичной опухоли (послеоперационный рубец). Проведение дистанционной лучевой терапии возможно различными режимами: 64-70 Гр за 32-35 фракций в течение 6-7 нед; 50,0-57,5 Гр за 20-23 фракции в течение 4-5 нед [169].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• В случае невозможности выполнения хирургического иссечения первичной опухоли из-за наличия выраженных сопутствующих заболеваний рекомендуется проведение локальной лучевой терапии в следующих режимах: 64-70 Гр за 32-35 фракций в течение 6-7 нед; 50,0-57,5 Гр за 20-23 фракции в течение 4-5 нед [169].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• Не рекомендуется рутинное выполнение профилактической лимфаденэктомии или проведение предоперационной лучевой терапии как на регионарные лимфатические узлы, так и на область первичной опухоли [170, 171].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Рекомендуется выполнять пациентам биопсию сторожевого лимфатического узла при толщине первичной опухоли более 0,8 мм по Бреслоу с целью правильного определения стадии заболевания, прогноза течения заболевания и определения показаний к адъювантной терапии [160, 172-180].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарий. Биопсия сторожевого лимфатического узла проводится в специализированных учреждениях, укомплектованных оборудованием и имеющих обученный персонал.
• Вопрос о выполнении лимфодиссекции в случае обнаружения микрометастазов в сторожевом лимфатическом узле рекомендуется тщательно обсудить с пациентом, взвесив потенциальные риски такой операции и ожидаемую пользу с учетом данных исследования MSLT-II [180]. Альтернативой выполнения безотлагательной лимфодиссекции может стать тщательное наблюдение за регионарным лимфоколлектором при помощи экспертного УЗИ [180].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
• Особое внимание в рамках патолого-анатомического исследования операционного материала рекомендуется уделить морфологическому исследованию удаленного сторожевого лимфатического узла (узлов) при биопсии сторожевого лимфатического узла: настоятельно рекомендуется выполнить как можно больше срезов, а также помимо окраски гематоксилином и эозином использовать иммуногистохимическое окрашивание на меланома-специфические маркеры (Melan A, тирозиназа, HMB45 или SOX-10). Иммуногистохимическое окрашивание рекомендуется рутинно выполнять в том числе и при отсутствии признаков метастатического поражения по данным окрашивания гематоксилином и эозином [181-195].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
• В отсутствие возможности выполнения биопсии сторожевого лимфатического узла рекомендуется максимально тщательно исследовать регионарные лимфатические узлы, используя УЗИ для навигации на подозрительный лимфатический узел с последующей тонкоигольной пункцией и цитологическим исследованием [196-200].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств 4).
• При меланоме слизистых оболочек полости и придаточных пазух носа при стадии T3-4a, N0 рекомендуется выполнение пациентам оперативного вмешательства с широкой резекцией в пределах здоровых тканей с адъювантной лучевой терапией на область первичной опухоли (70-72 Гр на область резидуальной опухоли или 65-70 Гр на область высокого риска рецидива, например, ложе удаленной опухоли, 50-55 Гр на область низкого риска [201-207].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
• При меланоме слизистых оболочек полости и придаточных пазух носа при стадии T3-4a, N1 рекомендуется на первом этапе лечения выполнение оперативного вмешательства в объеме удаления первичной опухоли и фасциально-футлярного иссечения клетчатки шеи на стороне поражения или с двух сторон при двустороннем поражении. На втором этапе лечения - лучевая терапия на область первичной опухоли и зоны регионарного метастазирования (70-72 Гр на область резидуальной опухоли, 65-70 Гр на зоны высокого риска рецидива) [201-207].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
• При меланоме слизистых оболочек полости рта, ротоглотки, гортаноглотки и гортани при стадии T3-4a, N0 у пациентов рекомендуется на первом этапе выполнение оперативного вмешательства в объеме удаления первичной опухоли и профилактической шейной лимфодиссекции с ипсилатеральной стороны.На втором этапе. Лучевая терапия на область первичной опухоли и зоны регионарного метастазирования (70-72 Гр на область резидуальной опухоли, 65-70 Гр на зоны высокого риска рецидива и 50-55 Гр на зоны низкого риска рецидива) [201-207].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
• При меланоме слизистых оболочек полости рта, ротоглотки, гортаноглотки и гортани при стадии T3-4a, N1 рекомендуется на первом этапе лечения выполнение оперативного вмешательства пациентам в объеме удаления первичной опухоли и фасциально-футлярного иссечения клетчатки шеи на ипсилатеральной стороне или с двух сторон при двустороннем поражении. На втором этапе лечения - лучевая терапия на область первичной опухоли и зоны регионарного метастазирования (70-72 Гр на область резидуальной опухоли, 65-70 Гр на зоны высокого риска рецидива и 50-55Гр на зоны низкого риска рецидива) [201-207].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
Комментарий. Всех пациентов с меланомой слизистых оболочек, локализованных в области головы и шеи до лечения должен оценивать хирург-онколог, специализирующийся на опухолях головы и шеи, которому следует предпринять следующие действия - рассмотреть адекватность биопсийного материала, стадирования и визуализации опухолевого процесса (КТ,МРТ) для определения степени распространения опухоли, исключить наличие синхронной первичной опухоли, оценить текущий функциональный статус и возможность назначения потенциального хирургического лечения, если первичное лечение было нехирургическим, разработать проспективный план наблюдения, который будет включать адекватное обследование зубов, питания и здорового образа жизни, а также вмешательства и любые другие дополнительные исследования, которые необходимы для полной реабилитации. Для пациентов, которым выполняют плановые операции, необходимо проработать хирургическое вмешательство, края и план реконструкции для резекции клинически определяемой опухоли со свободными от опухоли хирургическими краями. Оценка операбельности. Поражение опухолью следующих структур связано с плохим прогнозом или классифицируется как стадия Т4b (например, неоперабельность, ассоциированная с технической невозможностью получить чистые края резекции): значительное поражение крыловидно-небной ямки, тяжелые тризмы из-за инфильтрации опухолью крыловидных мышц; макроскопическое распространение опухоли на основание черепа (например, эрозия крыловидных пластинок или основной кости, расширение овального отверстия ); возможная инвазия (охват) стенки общей или внутренней сонной артерии. Охват обычно оценивается радиологически (по данным КТ и МРТ) и диагностируется, если опухоль окружает ≥270° окружности сонной артерии; непосредственное распространение опухоли из регионарных ЛУ с поражением кожи, прямое распространение на структуры средостения предпозвоночную фасцию или шейные позвонки. [201-207] Удаление первичного очага. По возможности необходимо выполнять удаление первичной опухоли единым блоком. Необходимо планировать хирургическое удаление в зависимости от степени распространения первичной опухоли, установленной при клиническом исследовании, и тщательной интерпретации соответствующих радиографических снимков. В случае если опухоль прилежит к двигательному или сенсорному нерву, не исключено наличие периневральной инвазии. В данной ситуации следует выделить нерв в проксимальном и дистальном направлениях и выполнить его резекцию для получения чистого края резекции. Подтверждено, что для получения ткани, свободной от опухоли, полезна диагностика проксимального и дистального краев нерва методом замороженных срезов (срочное патолого-анатомическое исследование биопсийного материала). Адекватное вмешательство может потребовать выполнения краевой, плоскостной или сагиттальной резекции подлежащих костных структур при опухолях, поражающих надкостницу или прилежащих к ней. Резекция костей показана при массивной инфильтрации опухолью надкостницы кости (что определяется при фиксации к ней опухоли) или при обнаружении во время операции либо при полном дооперационном обследовании признаков прямого прорастания кости опухолью. Степень резекции окружающих мягких тканей и кости будет зависеть от степени поражения, оцениваемой клинически и во время операции. [201, 204, 208-215] Края резекции Адекватное удаление опухоли в мягких тканях определяется как расстояние от края резекции до макроскопически видимой опухоли ≥ 2 см или отрицательный край замороженного среза. В целом оценку замороженных срезов обычно проводят интраоперационно, если зона, макроскопически свободная от опухоли по краю резекции составляет <2 невозможно определить линию резекции в связи с нечеткой границей опухоли или имеется подозрение на наличие резидуальной опухоли. Необходимо включать подробное описание края резекции в операционный журнал. Края можно оценить по удаленному препарату или, как альтернатива, из ложа опухоли с правильным ориентированием. Чистый край определяется как расстояние от инвазивного края опухоли, который составляет ≥ 5 мм от края резекции. Близкий край определяется как расстояние от инвазивного края опухоли до края резекции, равное <5 Первичную опухоль следует помечать таким образом, чтобы врач-патологоанатом мог адекватно оценить ориентацию препарата. Шейную диссекцию необходимо ориентировать или выполнять срезы по порядку для определения уровня ЛУ, включенных в зону диссекции. Реконструкцию хирургических дефектов нужно проводить с использованием конвенциальной техники по усмотрению хирурга. По возможности рекомендуется первичное ушивание, но при этом не следует пренебрегать широкими краями резекции, свободными от опухоли. По усмотрению хирурга выполняется пластическое ушивание с применением местных/регионарных лоскутов, свободных лоскутов, расщепленного кожного лоскута или других лоскутов с/без реконструкции дефекта. [201, 204, 207-215].
• Рекомендуется выполнить адекватное иссечение первичной опухоли (если не было выполнено ранее) ( см раздел 3,1) для улучшения отдаленных результатов лечения и профилактики рецидивов опухоли [98-107].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
• Рекомендуется выполнять регионарную лимфаденэктомию всем пациентам с резектабельной меланомой кожи III стадии для улучшения отдаленных результатов лечения и профилактики рецидивов опухоли [216-219].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• При проведении лимфаденэктомии пациентам меланомой кожи III стадии для улучшения отдаленных результатов лечения и профилактики рецидивов опухоли рекомендуется выполнять максимально полное удаление клетчатки анатомической области, в лимфатических узлах которой выявлены метастазы меланомы (например, Ib -V уровни клетчатки шеи (Ia - по показаниям), I -III уровни клетчатки подмышечной области, поверхностные и глубокие паховые лимфатические узлы) [216-219].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарий. При клинически определяемом поражении глубоких паховых лимфатических узлов большое внимание следует уделить наружным подвздошным лимфатическим узлам. Некоторые исследователи в случае массивного поражения глубоких паховых лимфатических узлов (более 3) или поражения узла Пирогова -Розенмюллера -Клоке рекомендуют расширять объем операции до удаления ипсилатеральных наружных подвздошных лимфатических узлов, так как частота их поражения может достигать 20 -24 % [220].
• Рекомендуется определять следующие параметры при патолого-анатомическом исследовании метастазов меланомы в регионарные лимфатические узлы для правильного стадирования и определения прогноза заболевания [22, 114, 221]:
1) количество удаленных лимфатических узлов;
2) количество пораженных лимфатических узлов;
3) характер поражения лимфатических узлов:
- частичное поражение (количество лимфатических узлов);
- полное поражение (количество лимфатических узлов);
- прорастание капсулы (количество лимфатических узлов).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• Рекомендуется предлагать пациентам после радикальной лимфаденэктомии при отсутствии противопоказаний адъювантную лекарственную терапию, информируя пациента о потенциальных преимуществах и ограничениях данного метода лечения ( см раздел 3,3) [222-230].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
• Рекомендуется пациентам с высоким риском регионарного рецидива после радикальной лимфаденэктомии в целях снижения вероятности регионарного рецидива при отсутствии противопоказаний предлагать профилактическую послеоперационную лучевую терапию на область пораженного лимфоколлектора, информируя пациента о потенциальных преимуществах и ограничениях данного метода лечения [231, 232].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарий. По данным проведенных исследований, послеоперационная лучевая терапия снижает риск регионарного рецидива у пациентов с высоким риском, но не оказывает влияния на общую выживаемость [232]. К факторам высокого риска регионарного рецидива относят:
1) поражение 1 и более околоушного лимфатического узла, 2 и более шейных или подмышечных лимфатических узлов (или при размерах лимфатического узла более 3 см), 3 и более пахово-бедренных лимфатических узлов (или при их размерах более 4 см);
2) прорастание метастаза за пределы капсулы лимфатического узла [232, 233]179].
Адъювантная дистанционная лучевая терапия проводится в следующих режимах: 50-66 Гр за 25-33 фракций в течение 5-7 нед (УДД 4, УУР С) [234]; 48 Гр за 20 фракций в течение 4 нед (УДД 2, УУР В)[232]. Использование новых методик дистанционной лучевой терапии, таких как IMRT, VMAT, позволяет снижать повреждение здоровых тканей [235, 236].
При наличии нерезектабельных метастазов в регионарные лимфатические узлы возможно проведение паллиативной лучевой терапии на эту область. Используются различные режимы лечения, например: 48 Гр за 20 фракций в течение 4 нед[231]; 50-Гр за 20-фракции в течение 4 нед [237].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 3).
• Рекомендуется предлагать пациентам с высоким и промежуточным риском прогрессирования после радикального хирургического лечения (т. е. пациентам со стадиями IIB-III при отсутствии противопоказаний адъювантную лекарственную терапию (табл. 8), информируя пациента о потенциальных преимуществах и ограничениях данного метода лечения) [22, 222-225, 227-230, 239-242].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Таблица 8. Рекомендуемые режимы адъювантной терапии меланомы кожи в зависимости от стадии заболевания[1].
Примечание. вRAF V600 mut - активирующая мутация в гене вRAF в 600-й позиции экзона 15 с заменой нуклеотида, кодирующего валин, на другую аминокислоту (чаще всего на нуклеотид, кодирующий глутаминовую кислоту). вRAF V600 wild type - «дикий тип» (отсутствие активирующих мутаций V600) гена вRAF.
Комментарий. Адъювантная терапия интерфероном альфа-2b** имеет преимущества только у пациентов с изъязвленной первичной меланомой кожи. Назначение интерферона альфа-2b** в адъювантном режиме у пациентов с неизъязвленной первичной опухолью не рекомендуется.
• Для пациентов, радикально оперированных по поводу отдаленных метастазов меланомы кожи, рекомендовано проводить адъювантное лечение с применением моноклональных антител (далее - МКА), блокирующих взаимодействие между рецептором программируемой смерти (PD-1) и его лигандами (далее - МКА-блокаторы PD1) (ниволумаб**). При наличии противопоказаний альтернативой может быть динамическое наблюдение или участие в клинических исследованиях (если таковые имеются) [22, 223-225, 227, 230, 239-241].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
• Не рекомендуется проводить адъювантную терапию пациентам меланомой кожи группы благоприятного прогноза, имеющим низкий риск прогрессирования заболевания (IA, IB, IIA стадии) [245, 249].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Не рекомендуется проводить адъювантную терапию интерфероном альфа-2а** и интерфероном альфа-2b** пациентам меланомой кожи, у которых риски, связанные с развитием нежелательных явлений на фоне применения адъювантной терапии, превышают ожидаемую пользу [239, 240, 250-252].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
Комментарий. Учитывая, что проведение иммунотерапии интерфероном альфа-2а** или интерфероном альфа-2b** сопряжено с известными рисками развития нежелательных явлений, следует выделить группу пациентов, которым это лечение противопоказано. После анализа данных литературы эксперты пришли к выводу о том, что риск превосходит пользу от назначения терапии интерфероном альфа-2а** и интерфероном альфа-2b** в следующих случаях (но не ограничивается ими) [239, 250-252].
- Психические расстройства, в том числе тяжелая депрессия;
- цирроз печени любой этиологии;
- аутоиммунные болезни;
- выраженная (III-IV степени по сTCAE v. 3,0 [253]) органная недостаточность (сердечная, печеночная, почечная );
- беременность или планируемая беременность;
- псориаз;
- неспособность пациента адекватно выполнять назначения врача.
В связи с этим эксперты рекомендуют перед назначением адъювантной иммунотерапии интерфероном альфа 2b** исключить наличие у пациентов перечисленных противопоказаний, при необходимости прибегнув к консультации специалистов (врача-терапевта, врача-психиатра, врача-дерматовенеролога ). Следует также учесть противопоказания к назначению препарата, указанные производителем в инструкции по применению.
Данные по безопасности и эффективности адъювантного применения интерферона альфа 2b** при меланоме кожи у лиц моложе 18 лет ограничены единичными наблюдениями, поэтому эксперты не рекомендуют назначать интерферон альфа** данной категории пациентов.
• Рекомендуется начинать адъювантную иммунотерапию пациентам в сроки не позже 3 месяцев с момента хирургического лечения после полного заживления послеоперационной раны. Не рекомендуется начинать адъювантное лечение в том случае, если с момента операции прошло более 3 месяцев, так как при начале адъювантной терапии в более отдаленные сроки ее эффективность не изучена [228-230, 240].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
• В рандомизированных исследованиях не было показано преимуществ прерывистых режимов назначения интерферона альфа-2b**, потому они не рекомендуются к использованию в рутинной практике [250, 254].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
• Не рекомендуется использовать химиотерапию в рутинной практике для адъювантного лечения меланомы кожи. По данным многочисленных международных исследований, применение химиотерапии в адъювантном режиме после радикального лечения меланомы кожи IIB-III стадии не приносит клинической пользы и может снижать общую выживаемость [255-262].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
• Не рекомендуется использовать иммуностимуляторы (класс АТХ. J05AX (Прочие противовирусные препараты), в том числе индукторы эндогенного интерферона или другие интерфероны (бета и гамма)), за исключением интерферона альфа-2b** в адъювантном режиме при меланоме кожи. [240, 245, 246]. Имеющиеся данные клинических исследований свидетельствуют об отсутствии эффективности интерферона гамма** в адъювантном режиме [263], относительно других препаратов имеющихся научных данных недостаточно для их безопасного применения [22].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
• Рекомендуется пациентам с поражением регионарных лимфоузлов (IIIВ-D стадия заболевания или ее эквивалент) проведение предоперационной иммунотерапии с последующим выполнением регионарной лимфаденэктомии и последующей адъювантной терапией (вместе с неаодъювантной теарпией - общей длительностью до 12 мес. 272]. Режимы применения приведены в табл. 9.
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Таблица 9. Режимы применения неоадъювантной терапии.
• Рекомендуется пациентам, получающим предоперационную (неоадъювантную) иммунотерапию с поражением регионарных лимфоузлов (IIIВ-D стадия заболевания или ее эквивалент) провести оценку патоморфологического ответа после проведения регионарной лимфаденэктомии [268, 270-273].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• Рекомендуется пациентам с прогрессированием на фоне предоперационной (неоадъювантной) иммунотерапию с поражением регионарных лимфоузлов (IIIВ-D стадия заболевания или ее эквивалент) и наличием мутации в гене вRAF переключение на адъювантную кТТ [274](таблица 8).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Уровень убедительности рекомендаций. В (уровень достоверности доказательств 3).
• Рекомендуется при выборе терапии 1-й линии всем пациентам с метастатической или неоперабельной меланомой провести молекулярно-генетическое исследование опухоли на наличие мутаций в экзоне 15 гена вRAF (если этого не было выполнено ранее). Для исследования может быть использован архивный опухолевый материал или свежий материал, который можно получить при биопсии (открытой, толстоигольной (core-биопсии) ) в случае, если это повлияет на выбор дальнейшей тактики лечения [22, 119-130].
Уровень убедительности рекомендаций А (уровень достоверности доказательств -1).
• При отсутствии мутации в гене вRAF ( дикий тип ) рекомендуется при выборе терапии 1-й линии всем пациентам с метастатической или неоперабельной меланомой выполнить молекулярно-генетическое исследование мутаций в генах NRAS (экзон 3) и KIT (экзоны 8, 9, 11, 13, 14, 17, 18) в биопсийном (операционном) материале или выполнить широкое молекулярное тестирование, если диагностированы или заподозрены отдаленные метастазы меланомы, и это может повлиять на выбор схемы таргетной терапии (в частности, назначение ингибиторов протеинкиназы или моноклональных антител) при лечении метастатического процесса[131-146].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Комментарий. Также имеются сведения о том, что ингибитор протеинкиназы KIT может быть эффективен при наличии мутаций в 8, 18 экзонах гена KIT [143, 147-149].
• При отсутствии возможности выполнить молекулярно-генетическое исследование опухоли на наличие мутации в гене вRAF (или KIT) в течение 4 нед после установления диагноза метастатической меланомы (отсутствует материал для анализа, нет соответствующего оборудования в учреждении ) при отсутствии других противопоказаний рекомендуется начинать противоопухолевую терапию пациенту в соответствии с подразделом 3,4,4 настоящих рекомендаций [277, 278].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарий. У пациентов с большой опухолевой массой и высокой скоростью прогрессирования заболевания следует отдавать предпочтение комбинации ИПК вRAF и МЕК. У пациентов с метастатической меланомой, не имеющих симптомов заболевания, предпочтительным вариантом лечения следует считать комбинированное лечение МКА-блокаторами PD1 и МКА-блокаторами сTLA4 либо монотерапию МКА-блокаторами PD1. [287].
Таблица 10. Режимы назначения ИПК вRAF и МЕК (для всех режимов назначения УДД 2, УУР А).
• Не рекомендуется проводить терапию ИПК вRAF или комбинацией ИПК вRAF и MEK пациентам с неизвестным статусом опухоли в отношении мутации в гене вRAF, так как имеются сведения о возможности парадоксальной активации MAPK -сигнального пути и ускорения роста опухоли при применении ИПК вRAF на клеточных линиях без мутации в гене вRAF [277, 278].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Не рекомендуется следующее комбинирование ИПК вRAF и МЕК. Дабрафениба** с кобиметинибом** и вемурафениба** с траметинибом**, так как такие комбинации не изучены. [22].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• Учитывая особый профиль дерматологических нежелательных явлений ИПК вRAF и MEK, в частности риск развития плоскоклеточного рака и других опухолей кожи, на фоне лечения рекомендуется регулярно проводить осмотр кожных покровов пациента. При подозрении на развитие плоскоклеточного рака или кератоакантомы необходимо их хирургическое удаление с последующим патолого-анатомическим исследованием биопсийного или операционного материала, при этом терапия ИПК вRAF или комбинацией ИПК вRAF и МЕК может быть продолжена без перерыва в лечении и/или без редукции дозы препарата [122, 293, 295].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств -2).
• При проведении терапии ИПК вRAF или комбинацией ИПК вRAF и МЕК оценку эффекта лечения TEGb рекомендовано проводить каждые 8-10 нед, не допуская перерывов в приеме препаратов на период оценки эффекта лечения. Для оценки эффекта терапии TEGb рекомендуется использовать оценку общего состояния пациента и методы лучевой диагностики ( см табл. 7, раздел 2,4) а также стандартные критерии ответа на цитостатическую терапию (RECIST 1,1 - см http://medradiology.moscow/d/1364488/d/no46_2018_recist_11.pdf ) [126, 296, 297].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
• При наличии признаков прогрессирования заболевания на фоне применения ИПК вRAF либо комбинации ИПК вRAF и МЕК или появления признаков непереносимости такой терапии при сохранении удовлетворительного общего состояния пациента (ECOG 0-2) и при ожидаемой продолжительности жизни более 3 месяцев рекомендуется перевести пациента на терапию МКА-блокаторами PD1 или комбинацию МКА-блокаторов PD1 и сTLA4 [279-284, 298]. Режимы применения приведены в табл. 10.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. Монотерапия МКА-блокаторами PD-1 и комбинированная терапия МКА-блокаторами PD1 и сTLA4 демонстрируют сходные результаты у пациентов с меланомой, резистентной к ИПК вRAF и MEK.Однако комбинированная терапия МКА-блокаторами PD1 и сTLA4 была связана с более высокой частотой нежелательных явлений по сравнению с монотерапией [299].
Таблица 11. Режимы применения МКА-блокаторов PD1 и сTLA4.
• При наличии признаков прогрессирования заболевания на фоне применения монотерапии ИПК вRAF переключение пациентов на комбинированную терапию ИПК вRAF + MEK не рекомендуется, так как вероятность получить ответ на лечение остается низкой, а медиана времени до прогрессирования не превышает 3 мес [125].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• При наличии признаков прогрессирования заболевания на фоне применения одного из ИПК вRAF или одной из комбинаций ИПК вRAF и МЕК ( см табл.9) не рекомендуется переключать пациентов на другой ИПК вRAF или другую комбинацию ИПК вRAF и МЕК. Имеющиеся преклинические данные позволяют предположить аналогичные механизмы действия и формирования резистентности к вемурафенибу**/кобиметинибу** и дабрафенибу**/траметинибу** [306, 307]. Сведения о наличии клинической эффективности подобного переключения также отсутствуют.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -4).
• При медленно прогрессирующей метастатической и/или местно-распространенной меланоме (III неоперабельной - IV стадии) у пациентов с ожидаемой продолжительностью жизни не менее 6 мес при отсутствии противопоказаний независимо от статуса мутации вRAF рекомендуется использование препарата ипилимумаб** [308] или комбинации МКА-блокаторов PD1 и сTLA4 после прогрессирования болезни на фоне стандартной терапии (МКА-блокаторы PD1, ИПК вRAF, комбинация ИПК вRAF и МЕК) или в случае ее непереносимости [309-313]. Режим применения ипилимумаба** приведен в табл. 12.
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарий. Ипилимумаб** является блокатором антигена 4 цитотоксического Т-лимфоцита (МКА-блокатором сTLA4) и относится к категории иммуноонкологических препаратов. Ипилимумаб** используется в дозе 3 мг/кг в/в в виде 90-минутной инфузии каждые 3 нед (1, 4, 7 и 10-я недели, всего 4 введения (объединенный анализ данных продемонстрировал показатель 7-летней общей выживаемости 17 % среди всех пациентов с метастатической и/или местно-распространенной формой меланомы, получавших ипилимумаб**). Первое контрольное обследование рекомендуется проводить на 12-й неделе от начала лечения (при отсутствии клинических признаков выраженного прогрессирования). Учитывая возможность развития аутоиммунных нежелательных явлений (диарея, колит, гепатит, эндокринопатии, дерматит), необходимо их своевременное выявление и активное лечение в соответствии с общепринятыми алгоритмами.
Таблица 12. Режим применения ипилимумаба** при меланоме кожи.
• Пациентам с мутацией в гене вRAF (с эквивалентом III неоперабельной - IV стадии) при отсутствии противопоказаний рекомендуется проводить комбинированную иммунную и таргетную терапию МКА-блокаторами PDl1 (атезолизумаб**) и ингибиторами протеинкиназы вемурафенибом** и кобиметинибом** [314]. Режимы применения приведены в таблице 13.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. Комбинация атезолизумаба**, вемурафениба** и кобиметиниба** изучалась у больных с вRAF-мутированной меланомой в первой линии терапии и оказалась лучше, чем комбинированная таргетная терапия вемурафенибом** и кобиметинибом** в отношении времени без прогрессирования с пограничной значимостью. Мы полагаем, что тройная комбинация может быть предпочтительнее, чем терапия вемурафенибом и кобиметинибом у определенной части пациентов с мутацией в гене вRAF, тем не менее, к настоящему времени нет достаточных научных данных эту часть пациентов определить точнее. Врачу-онкологу при назначении этого режима лечения следует взвесить все потенциальные риски и ожидаемую пользу.
Таблица 13. Режимы применения МКА-блокатора aPDL1 атезолизумаба** и ИТК вемурафениба** и комбиметиниба**.
• Пациентам с мутацией в гене вRAF (с эквивалентом III неоперабельной. IV стадии) при отсутствии противопоказаний рекомендуется проводить комбинированную иммунную и таргетную терапию МКА-блокаторами PD1 (пембролизумаб**) и ингибиторами протеинкиназы дабрафенибом** и траметинибом** [315] Режимы применения приведены в табл. 14.
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарий. Комбинация пембролизумаба**, дабрафениба** и траметиниба** изучалась у больных с вRAF-мутированной меланомой в первой линии терапии и оказалась лучше, чем комбинированная таргетная терапия дабрафенибом** и траметинибом*8 в отношении времени без прогрессирования, однако это улучшение не достигло статистической значимости. При периоде наблюдения 36,6 месяцев медиана ВБП составила 16,9 мес. в группе тройной комбинации и 10,7 мес. в группе таргетной терапии (ОР 0,53; 95% ДИ от 0,34 до 0,83). Общая выживаемость также имела тенденцию к улучшению в группе тройной комбинации (не значимо). Мы полагаем, что тройная комбинация может быть предпочтительнее, чем терапия дабрафенибом** и траметинибом** у определенной части пациентов с мутацией в гене вRAF, тем не менее, к настоящему времени нет достаточных научных данных эту часть пациентов определить точнее. Врачу-онкологу при назначении этого режима лечения следует взвесить все потенциальные риски и ожидаемую пользу.
Таблица 14. Режимы применения МКА-блокатора aPD1 пембролизумаба** и ИТК дабрафениба** и траметиниба**.
• При невозможности проведения терапии (или сроке ожидания начала такой терапии более 1 мес) ИПК вRAF или комбинацией ИПК вRAF и МЕК, или МКА-блокаторами PD1, или МКА-блокаторами сTLA4 в 1-й или во 2-й линии у пациентов с метастатической или нерезектабельной меланомой и мутацией в гене вRAF в опухоли при сохранении удовлетворительного общего состояния пациента (ECOG 0-2) и при ожидаемой продолжительности жизни более 3 мес рекомендуется проведение цитотоксической химиотерапии [316-324]. Наиболее распространенные режимы химиотерапии (монотерапия или комбинации) приведены в табл. 15. Назначение других лекарственных препаратов для лечения диссеминированной формы меланомы проводится решением консилиума или врачебной комиссии.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 1).
Комментарий. Данный вид лечения менее эффективен в отношении увеличения общей продолжительности жизни, времени до прогрессирования, частоты объективных ответов на лечение и в большинстве случаев сопровождается более выраженными нежелательными реакциями в сравнении с ИПК вRAF или комбинацией ИПК вRAF и МЕК, или МКА-блокаторами PD1 или сTLA4. В связи с этим следует избегать применения химиотерапии в 1-й линии лечения пациентов метастатической или нерезектабельной меланомой и мутацией в гене вRAF всегда, когда это возможно.
Таблица 15. Наиболее распространенные режимы химиотерапии при метастатической меланоме кожи.
• При проведении химиотерапии оценку эффекта лечения рекомендовано проводить после каждого 2-3-го цикла (каждые 7-12 нед). Для оценки эффекта терапии рекомендуется использовать оценку общего состояния пациента и методы лучевой диагностики ( см табл. 7, раздел 2) а также стандартные критерии ответа на цитостатическую терапию (RECIST 1,1) [296, 297].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• При проведении противоопухолевого лекарственного лечения при расчете доз препаратов на поверхность или массу тела рекомендуется проводить округление фактических доз в пределах 5 % расчетных [333, 334].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• При прогрессировании после первой линии терапии одним из МКА-блокаторов PD1 у больных меланомой кожи с мутацией в гене вRAF предпочтение рекомендуется отдавать монотерапии блокатором сTLA4 или комбинированной терапии ИПК вRAF и MEK [335].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 3).
Комментарий. В исследовании I.P. da Silva с соавт. показано увеличение частоты объективных ответов с 9% при монотерапии ипилимумабом** до 38% при комбинированной терапии ипилимумабом** и ниволумабом** у пациентов с без мутации в гене вRAF. При наличии мутации частота ответов была похожей (24% и 19% соответственно)[335]».
• У пациентов c вRAF мутированной меланомой (III неоперабельной. IV стадии) в 3 линии терапии, после проведения иммунотерапии и терапии ИПК (iBRAF +/ - MEK), а так же у пациентов без мутации в гене вRAF (III неоперабельной - IV стадии) во 2 линии после применения иммунотерапии (МКА-блокаторов PD-1+/ - анти сTLA4), учитывая малую эффективность химиотерапии, рекомендуется применение терапии по схеме ленватиниб** + пембролизумаб** [336]. Режим применения приводится в таблице 16.
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
Таблица 16. Комбинированная терапия МКА- блокаторами - блокаторами PD1 и ИТК ленвантинибом**.
• Рекомендуется повторное назначение комбинированной терапии ИПК вRAF и MEK у пациентов, которые ранее длительно (более 6 мес.) получали терапию ИПК вRAF и MEK и у которых был отмечен объективный ответ на лечение, в случае прогрессирования или непереносимости МКА-блокаторами PD1 или комбинации МКА-блокаторов PD1 и сTLA4, назначенных во второй линии [337, 338].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
• Рекомендуется продолжить комбинированную терапию ИПК вRAF и MEK или монотерапию МКА-блокаторами PD1 у пациентов, при изолированном прогрессировании единичных метастазов с возможностью их хирургического удаления или проведения стереотаксической радиохирургии на прогрессирующие очаги («олигопрогрессирование») [339].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарий. Популяция пациентов с мутацией в гене c-Kit в опухоли не изучалась отдельно в рандомизированных исследованиях, однако ее следует рассматривать как популяцию больных без мутации в гене вRAF.
• У пациентов с мутацией в гене KIT и ожидаемой продолжительности жизни более 3 месяцев в качестве терапии 2-й или последующих линий рекомендована терапия ИПК Kit иматинибом**. Лечение иматинибом** проводится до прогрессирования заболевания или развития выраженных, не купируемых редукцией дозы токсических явлений. Режим применения приведен в табл. 17 [145, 146].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 3).
Таблица 17. Режим применения иматиниба** при меланоме кожи.
• Оценку эффекта терапии ИПК иматинибом** рекомендуется проводить не реже 1 раза через каждые 8-10 нед терапии, не допуская перерывов в приеме препарата на период оценки эффекта. Для оценки эффекта терапии рекомендуется использовать оценку общего состояния пациента и методы лучевой диагностики ( см табл. 7), а также стандартные критерии ответа на цитостатическую терапию (RECIST 1,1) [137, 145, 296, 297].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• Не рекомендуется проводить терапию иматинибом** пациентам с неизвестным статусом опухоли в отношении мутации в гене Kit, так как сведения о клинической пользе от применения иматиниба** у пациентов без активирующей мутации в гене Kit отсутствуют [146, 149, 342, 343].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 3).
• При наличии признаков прогрессирования заболевания на фоне применения иматиниба** при сохранении удовлетворительного общего состояния пациента (ECOG 0-2) и ожидаемой продолжительности жизни более 3 мес рекомендуется проводить терапию модуляторами иммунологического синапса - МКА-блокаторами PD1 и/или сTLA4 (в случае, если она не проводилась ранее) [344, 345]. Режимы применения приведены в табл.11, 16.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• При невозможности проведения терапии (или сроке ожидания начала такой терапии более 1 мес) иматинибом** или МКА-блокаторами PD1 и/или сTLA4 в 1-й или во 2-й линии у пациентов с метастатической или нерезектабельной меланомой с мутацией в гене Kit в опухоли при сохранении удовлетворительного общего состояния пациента (ECOG 0-2) и при ожидаемой продолжительности жизни более 3 месяцев рекомендуется проведение цитотоксической химиотерапии [316-324]. Наиболее распространенные режимы химиотерапии (монотерапия или комбинации) приведены в табл. 15. Назначение других лекарственных препаратов для лечения диссеминированной формы меланомы проводится решением консилиума или врачебной комиссии.
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарий. Данный вид лечения менее эффективен в отношении увеличения общей продолжительности жизни, времени до прогрессирования, частоты объективных ответов на лечение и в большинстве случаев сопровождается более выраженными нежелательными реакциями в сравнении с ИПК KIT или МКА-блокаторами PD1 или сTLA4. В этой связи следует избегать применения химиотерапии в 1-й линии лечения пациентов метастатической или нерезектабельной меланомой и мутацией в гене KIT или NRAS всегда, когда это возможно.
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
• При очевидном прогрессировании болезни на фоне терапии одним из МКА-блокаторов PD1 не рекомендуется применять другой препарат этой же подгруппы. Имеющиеся доклинические данные позволяют предположить аналогичные механизмы действия и формирования резистентности к ниволумабу** и пембролизумабу**. Сведения о наличии клинической эффективности подобного переключения также отсутствуют.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• При очевидном прогрессировании болезни на фоне терапии одним из МКА-блокаторов PD1 рекомендуется рассмотреть возможность проведения терапии комбинацией МКА-блокаторов PD1 и сTLA4 [346] или монотерапию МКА-блокатором сTLA4 [308, 347] . Режимы применения приведены в таблицах 11 и 12, 16 соответственно.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств -3).
• При невозможности проведения терапии (или сроке ожидания начала такой терапии более 1 мес. МКА-блокаторами PD1 и сTLA4 в 1-й или во 2-й линии у пациентов с метастатической или нерезектабельной меланомой без мутаций в генах вRAF, NRAS, и KIT в опухоли при сохранении удовлетворительного общего состояния пациента (ECOG 0-2) и при ожидаемой продолжительности жизни более 3 мес.рекомендуется проведение цитотоксической химиотерапии [316-324]. Наиболее распространенные режимы химиотерапии (монотерапия или комбинации) приведены в табл. 15. Назначение других лекарственных препаратов для лечения диссеминированной формы меланомы проводится решением консилиума или врачебной комиссии».
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 1).
Комментарий. Данный вид лечения менее эффективен в отношении увеличения общей продолжительности жизни, времени до прогрессирования, частоты объективных ответов на лечение и в большинстве случаев сопровождается более выраженными нежелательными реакциями в сравнении с МКА-блокаторами PD1 или сTLA4. В связи с этим следует избегать применения химиотерапии в 1-й линии лечения пациентов метастатической или нерезектабельной меланомой без мутаций в генах вRAF и c-Kit всегда, когда это возможно.
• При прогрессировании после адъювантной терапии одним из МКА-блокаторов PD1 предпочтение рекомендуется отдавать комбинации МКА-блокаторов PD1 и блокаторов сTLA4 [335].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 3).
Комментарий. В исследовании I.P. da Silva с соавт. показано увеличение частоты объективных ответов с 13% при монотерапии ипилимумабом** до 36% при комбинированной терапии ипилимумабом** и ниволумабом**[335].
• При прогрессировании после первой линии терапии у больных без мутации в гене вRAF одним из МКА-блокаторов PD1 предпочтение рекомендуется отдавать комбинации МКА-блокаторов PD1 и блокаторов сTLA4.
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарий. В исследовании I.P. da Silva с соавт. показано увеличение частоты объективных ответов с 9% при монотерапии ипилимумабом** до 38% при комбинированной терапии ипилимумабом** и ниволумабом** у пациентов с без мутации в гене вRAF. При наличии мутации частота ответов была похожей (24% и 19% соответственно) [335].
• При прогрессировании на фоне терапии одним из МКА-блокаторов PD1 у больных с или без мутации в гене вRAF рекомендуется повторное назначение МКА-блокаторов PD1 (или назначение комбинированной терапии МКА-блокаторами PD1 и сTLA4) в случае если соблюдаются 4 условия: 1) контроль над заболеванием (объективный ответ или стабилизация) при первом назначении МКА-блокаторов PD1 составил 6 мес. и более; 2) лечение 2-й (или последующих линий) более не приносит пользы (отмечается прогрессирование заболевания или непереносимость лечения); 3) состояние пациента по шкале ECOG <=2 или ожидаемая продолжительность жизни более 3 мес. 4) имевшиеся ранее нежелательные явления при применении МКА-блокаторов PD1 разрешились (<=1 степ. по СТСАЕ v 5,0) И никогда не достигали 4 степ. по СТСАЕ v 5,0 [348].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 3).
У пациентов без мутации в гене вRAF (III неоперабельной. IV стадии) во 2 линии после применения иммунотерапии (МКА-блокаторов PD-1+/ - анти сTLA4), учитывая малую эффективность химиотерапии, рекомендуется применение терапии по схеме ленватиниб** + пембролизумаб** [336]. Режим применения приводится в таблице 16. Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Всем пациентам с меланомой на фоне лечения МКА-блокаторами PD1 или сTLA4 рекомендуется проводить первоначальную радиологическую оценку ответа на лечение не ранее 12 недель от начала терапии (при отсутствии клинического ухудшения состояния пациента). Повторные исследования проводятся через 8-12 недель (при отсутствии клинического ухудшения состояния пациента) [279, 281, 282, 341, 349].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
• Рекомендуется для оценки ответа на лечение МКА-блокаторами PD1 или сTLA4 использовать модифицированные критерии ответа на лечение, которые допускают появление новых очагов (при отсутствии клинического ухудшения состояния пациента) [349] (табл. 18).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Таблица 18. Сравнение традиционных критериев (на примере RECIST) и критериев оценки ответа на МКА-блокаторы PD1 или сTLA4 (mRECIST или irRC) [349-351].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
• Рекомендуется МКА-блокаторы PD1 назначать в постоянном режиме до наступления прогрессирования или непереносимости с интервалом введения в 2 недели или 4 недели для ниволумаба** в зависимости от режима дозирования, в 3 или 6 недель - для пембролизумаба** ( см также раздел 3,4,5 и табл. 10)[279, 281, 282, 341].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. В исследовании KEYNOTE-006 длительность режимов иммунотерапии у пациентов с метастатической меланомой и сохранением пользы от терапии не превышала 24 мес., что может свидетельствовать о том, что возможно безопасно завершить терапию у пациентов с ответом на лечение после 24 мес. терапии[352].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарии. Роль хирургии возрастает в связи с появлением для этой группы пациентов эффективной адъювантной терапии МКА--блокатором PD1 - препаратом ниволумаб**, который в рандомизированном исследовании продемонстрировал увеличение безрецидивной выживаемости в сравнении с наблюдением [230].
• При достижении эффекта от проводимой системной терапии может рассматриваться проведение полных циторедуктивных вмешательств. Проведение неполной циторедукции не рекомендовано [356, 357].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
• Пациентов с местно-распространенной нерезектабельной формой меланомы кожи и изолированным поражением конечности, не ответившим на стандартную терапию (ингибиторы вRAF или MEK, МКА-блокаторы PD1 или сTLA4), рекомендуется рассматривать в качестве кандидатов для проведения изолированной гипертермической перфузии конечности с мелфаланом**. [358-361].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. Данная процедура проводится в отдельных специализированных центрах.
• При обширных по площади поражениях кожи лица (меланома по типу злокачественного лентиго) для пациентов, не желающих быть подвергнутыми реконструктивно-пластической операции на лице, рекомендуется использование крема имихимод в качестве средства для уменьшения площади злокачественного лентиго в предоперационном периоде (5 раз в неделю в течение 3 месяцев с использованием 5% крема имихимод перед иссечением) [362-364].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств -2).
• При меланоме по типу злокачественного лентиго 0 стадии для пациентов, не желающих быть подвергнутыми реконструктивно-пластической операции на лице, рекомендуется использование крема имихимод в качестве самостоятельного метода лечения (ежедневно в течение 3 месяцев с использованием 5% крема имихимод перед иссечением) [362-364].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
• При метастазах в регионарных лимфатических узлах и невозможности их хирургического удаления рекомендуется рассмотреть возможность проведения дистанционной лучевой терапии в различных режимах: 50 Гр за 20 фракций в течение 4 недель; 32 Гр за 4 фракции в течение 4 недель [237].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств 3).
Комментарий. Также может применяться режим лучевой терапии 30 Гр за 10 фракций в течение 2 нед [365].
• При симптомных метастазах в костях с обезболивающей целью рекомендуется проведение паллиативной лучевой терапии в одном из следующих режимов: 30 Гр за 10 фракций в течение 2 недель; 20 Гр за 5 фракций за 5-7 дней, 24 Гр за 6 фракций в течение 3 нед [237, 365-367].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - - 1).
Проведение магнитно-резонансной томографии (МРТ) головного мозга с внутривенным контрастированием рекомендуется:
• пациентам с меланомой IIIC стадии и выше для скрининга бессимптомных метастазов в головной мозг.
• пациентам с неврологической симптоматикой независимо от стадии заболевания.
• пациентам с метастазами меланомы в головном мозге после локального и системного лечения для оценки эффективности проведенного лечения [368-370].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. МРТ головного мозга рекомендуется выполнять в следующих режимах - до внутривенного введения контрастного средства в режимах Т1в аксиальной проекции (толщина среза 1-1,5 мм), Т2, ДВИ, FLAIR (толщина среза 3-5 мм). После внутривенного введения контрастного вещества: Т1 в аксиальной проекции (толщина среза 1-1,5 мм), 3D T1 взвешенные изображения высокого разрешения в аксиальной (или сагиттальной) плоскости с захватом всей головы с применением технологии изотропного воксела (1мм×1мм×1мм). Проведение компьютерной томографии (КТ) с контрастированием для диагностики метастатического поражения головного мозга возможно только при наличии противопоказаний к проведению магнитно-резонансной томографиию.
• Рекомендуется строить алгоритм выбора тактики лечения у пациентов с метастазами в головном мозге в ходе мультидисциплинарного консилиума с участием врача-нейрохирурга, врача-радиотерапевта и врача-онколога на основании следующих критериев [368-373]:
- экстракраниальное распространение заболевания и его контроль;
- наличие резервов противоопухолевой лекарственной терапии;
- размер метастазов в головном мозге (более или менее 2 см);
- количество метастазов в головном мозге (солитарный метастаз, олигометастатическое поражение (2-4 метастаза), множественные метастазы (5 и более));
- бщее состояние по шкале Карновского (более 70 %, менее 70 %) (Приложение Г2);
- прогноз общей выживаемости (больше или меньше 6 мес. по шкале GPA (он-лайн калькулятор на сайте https://brainmetgpa.com/), Приложение Г4.
- расположение метастазов в функционально значимых частях мозга;
- наличие или отсутствие неврологической симптоматики, обусловленной метастатическим поражением головного мозга.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
Комментарий: Радиотерапевтическое лечение следует рассматривать у пациентов с первично выявленными метастазами меланомы в головном мозге в самостоятельном варианте лечения или как компонент комбинированного варианта лечения (с нейрохирургческим этапом), а также у пациентов с интракраниальной прогрессией (локальные рецидивы или развитие новых дистантных метастазов) после ранее проведенного лечения. Вариантами радиотерапии в лечении пациентов с метастазами меланомы в головном мозге являются: стереотаксическая радиотерапия (СРТ) и облучение всего головного мозга (ОВГМ). СРТ может быть реализована в режиме радиохирургии (1 фракция) или гипофракционирования (от 3 до 7 фракций) и используется в самостоятельном варианте лечения или в комбинации с ОВГМ или нейрохирургией [1,2]. Проведение радиотерапии не рекомендуется у пациентов с бессимптомными метастазами в головной мозг с низким функциональным статусом (индекс Карновского 50% и ниже) или у пациентов с индексом Карновского <70%, экстракраниальной прогрессией болезни и отсутствием резервов лекарственной противоопухолевой терапии. Выбор режима фракционирования СРТ зависит от дозовой нагрузки на нормальную ткань мозга, которая определяется количеством и размерами метастазов меланомы в головном мозге. СРТ в режиме радиохирургии может быть реализована при условии, что при подведение очаговой дозы 20-24 Гр объем нормальной ткани мозга, облученной дозой 12 Гр не превышает 10 см3 (V12Гр ≤10 см3). Для любых метастазов меланомы в головном мозге, при которых V12Гр >10 см3 показано проведение СРТ в режиме гипофракционирования[368-370].
• Рекомендуется открытая нейрохирургическая операция пациентам с первично выявленными или рецидивирующими краниальными метастазами меланомы при наличии:
- метастатического очага с максимальным диаметром 2 см и более.
- метастатического очага любого размера, определяющего клиническую картину внутричерепной гипертензии, дислокации срединных структур мозга, обширного перифокального отека, а также при наличии угрозы блокирования ликворных путей.
- клинических ситуаций, контроль которых невозможен с помощью других лечебных мероприятий (радиорезистентный локальный рецидив после стереотаксической радиотерапии, симптоматический радионекроз, резистентный к проводимой терапии) [368].
Уровень убедительности рекомендаций С (уровень достоверности доказательств -5).
Комментарии. Необходимым условием проведения нейрохирургического лечения является локализация метастатического очага в зонах мозга, где его удаление не сопровождается развитием/нарастанием неврологического дефицита. Лучшие показатели общей выживаемости достигаются у пациентов с высоким функциональным статусом (индекс Карновского ≥ 80) и контролем экстракраниального опухолевого процесса. При наличии первично выявленных или рецидивирующих метастазов меланомы в головном мозге целесообразно проводить нейрохирургического лечение в комбинации со стереотаксической радиотерапией (предоперационная радиохирургия или послеоперационная стереотаксическая радиотерапия ложа удаленного метастатического очага) для снижения риска локального рецидива Целесообразно проведение КТ головного мозга с/без контрастирования в течение 24-48 часов после проведения нейрохирургической резекции для диагностики послеоперационного кровоизлияния.
• У пациентов с наличием от 1 до 4 метастазов в головном мозге и благоприятным прогнозом общей выживаемости по шкале GPA рекомендуется: проведение СРТ в режиме радиохирургии при наличии метастатических очагов в головном мозге с максимальным диаметром 2,0 см и меньше без клинических проявлений масс-эффекта [369, 370].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Благоприятный прогноз общей выживаемости определяется наличием у пациентов высокого функционального статуса (индекс Карновского ≥80, или ECOG 0-1), выживаемость по шкале GPA 6 и более мес., стабилизацией экстракраниальных метастазов и/или наличием резервов системного противоопухолевого лечения. СРТ в режиме радиохирургии является оптимальной лечебной опцией у пациентов с очагами <2 см в максимальном измерении и реализуемой очаговой дозой радиации 20-24 Гр. У пациентов с очагами ≥2 см в максимальном измерении СРТ в режиме радиохирургии может быть реализована при условии, что при очаговой дозе радиации не ниже 20 Гр, объем нормальной ткани мозга, облученной дозой 12 Гр не превышает 10 см3 (V12Гр ≤10 см3) .
• Рекомендуется проведение СРТ в режиме гипофракционирования при наличии метастатических очагов в головном мозге с максимальным диаметром 2,0 см и больше, без клинических проявлений масс-эффекта и наличии противопоказаний к проведению нейрохирургии [369-371].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. СРТ в режиме гипофракционирования является оптимальной опцией у пациентов с наличием очагов ≥ 2 см в максимальном измерении, либо при наличии очагов, локализованных в критических структурах мозга (зрительные тракты, ствол головного мозга и пр. Рекомендуемыми режимами гипофракционирования являются: 3 фракции разовой дозой 8 Гр/9 Гр, 5 фракций разовой дозой 6 Гр и 7 фракций разовой дозой 5 Гр. При проведении гипофракционирования необходимо соблюдать дозовые ограничения: объем 10 см3 нормальной ткани мозга не должен быть облучен дозой выше 19,2Гр (за 3 фракции), 23,4 Гр (за 5 фракций) и 26,5 Гр (за 7 фракций).
• У пациентов с наличием от 5 и более метастазов меланомы в головном мозге и благоприятным прогнозом общей выживаемости рекомендуется проведение СРТ в режиме радиохирургии или гипофракционирования или облучение всего головного мозга [369, 370].
Уровень убедительности рекомендаций С (уровень достоверности доказательств -5).
Комментарии. У пациентов с множественными метастазами меланомы в головном мозге, благоприятным прогнозом общей выживаемости (изолированная интракраниальной прогрессия, отсутствие или стабилизация экстракраниальных метастазов, наличие резервов лекарственной противоопухолевой терапии), проведение СРТ в режиме радиохирургии или радиотерапии в самостоятельном варианте лечения является предпочтительной лечебной опцией. Необходимо регулярное проведение МРТ головного мозга для раннего выявления интракраниальной прогрессии и проведения повторного локального лечения (нейрохирургия и/или радиотерапия). Проведение ОВГМ в самостоятельном варианте лечения следует рассматривать у пациентов с прогрессирующим множественным, диссеминированным или лептоменингиальными поражением головного мозга, при котором невозможно проведение стереотаксической радиотерапии и нейрохирургии, а также в случае неэффективности противоопухолевой лекарственной терапии и отсутствии резервов системного лечения.Стандартные суммарные дозы ОВГМ - 20 Гр (за 5 фракций), 30Гр (за 10 фракций), 37,5 Гр (за 15 фракций). Применение ОВГМ, как компонента комбинированного со СРТ варианта лечения, снижает риск и откладывает время развития новых (дистантных) метастазов в головном мозге, но не обеспечивает увеличение общей выживаемости и увеличивает риск развития когнитивных расстройств. В случае комбинации стереотаксической радиотерапии с последующим проведением ОВГМ целесообразно редуцировать дозы стереотаксической радиотерапии на 20-25% от первоначальной дозы радиации с целью уменьшения риска развития постлучевых изменений[369, 370].
• У пациентов с благоприятным прогнозом общей выживаемости после нейрохирургической резекции метастазов в головном мозге рекомендуется проведение послеоперационной СРТ ложа удаленных очагов в режиме радиохирургии или гипофракционирования [369, 370].
Уровень убедительности рекомендаций С (уровень достоверности доказательств -5).
Комментарии. СРТ в режиме радиохирургии или гипофракционирования после нейрохирургии проводится в интервале от 4 до 6 недель после нейрохирургической резекции. Перед радиотерапией выполняется МРТ головного мозга с оценкой размера послеоперационного ложа, наличия дислокации структур мозга, появления новых или рост имевшихся не резецированных метастазом меланомы в головном мозге. Обязательно совмещение с дооперационной МРТ, после чего определяется объем облучения: послеоперационное ложе + 2 мм краевой отступ (+ 5 мм по твердой мозговой оболочке) и очаги контрастирования не резецированных метастатических очагов без краевого отступа. Для пациентов,, которым планируется нейрохирургическая резекция метастазов в головном мозге, предоперационная радиохирургия может быть альтернативой послеоперационной СРТ в режиме радиохирургии или гипофракционирования.
• У пациентов с неблагоприятным прогнозом общей выживаемости рекомендуется проведение симптоматического лечения [369, 370].
Уровень убедительности рекомендаций С (уровень достоверности доказательств -5).
Комментарии. Неблагоприятный прогноз общей выживаемости определяется наличием у пациентов низкого функционального статуса (индекс Карновского ≤70, или ECOG 3-4), прогноз выживаемости по шкале GPA - меньше 6 мес., наличием экстракраниальной прогрессии и отсутствием резервов системного противоопухолевого лечения. В отдельных клинических ситуациях возможно проведение локального лечения (нейрохирургия и/или радиотерапия) с целью коррекции неврологических расстройств. Решение о проведении локального лечения должно приниматься на мультидисциплинарном консилиуме с учетом потенциальной клинической эффективности и возможных лечебных рисков для пациента.
• У пациентов с крупными метастазми меланомы в головном мозге (или очагами любого размера с перифокальным отеком), которые являются кандидатами для проведения противоопухолевой лекарственной терапии с установленной эффективностью в ЦНС, рекомендуется проведение предварительной локальной терапии (нейрохирургия или стереотаксическая радиотерапия) [368].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
Комментарии. У отдельных пациентов с крупными метастазами в головной мозг вRAF позитивной меланомы (или метастазами в головном мозге любого размера с перифокальным отеком), требующих назначения стероидной терапии, при отсутствии угрожающих жизни неврологических расстройств и невозможности проведения локального лечения (нейрохирургия, СРТ в режиме радиохирургии или гипофракционирования), возможно проведение комбинированной таргетной терапии вRAF и MEK ингибиторами на первом этапе лечения.
Лекарственная терапия пациентов с метастатическим поражением головного мозга проводится по тем же принципам, что и для пациентов с метастазами других локализаций.
• У пациентов со стабильными метастазами меланомы, в головном мозге рекомендуется отдавать предпочтение комбинированной иммунотерапии (МКА-блокаторы сTLA4 и PD1) по сравнению с монотерапией МКА-блокаторами PD1 или сTLA4 [303, 374].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
• При наличии мутации V600 в гене вRAF у пациентов с меланомой и с метастазами в головном мозге рекомендуется отдавать предпочтение комбинированной таргетной терапии ИПК вRAF и MEK по сравнению с применением монотерапии ИПК вRAF [375, 376]. ( см таблицу 10).
Уровень убедительности рекомендаций. в (уровень достоверности доказательств -2).
• При наличии мутации V600 в гене вRAF у пациентов с метастазами меланомы в головном мозге и наличии неврологических симптомов рекомендуется отдавать предпочтение комбинированной иммуно -таргетной терапии ИПК вRAF и MEK и PDL1 [377] ( см также таблицу 13).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -4).
• Не рекомендуется проведение стероидной терапии у пациентов с метастазами меланомы в головном мозге без клинических симптомов и проявлений масс-эффекта [24, 378-382].
Уровень убедительности рекомендаций С (уровень достоверности доказательств -5).
Комментарии. У пациентов с метастазами меланомы в головном мозге и наличием неврологических симптомов, связанными с масс-эффектом, рекомендуется проведение стероидной терапии (дексаметазон**) для ликвидации или временного облегчения симптомов, связанных с повышением внутричерепного давления и вторичным отеком мозга. Доза стероидной терапии должна быть минимально достаточной для купирования симптомов и обычно составляет 4-8-12 мг / сут.
При проведении иммунотерапии (блокаторы сTLA4, PD1 и PD-L1) не рекомендуется превышать дозу дексаметазона** более 4 мг в сутки. Альтернативным вариантом противоотечной терапии в этой клинической ситуации является назначение бевацизумаба**.
• Рекомендуется проведение терапии бевацизумабом** при наличии симптоматического перифокального отека метастатических очагов или радионекроза, резистентных к проводимой стероидной терапии или при наличии противопоказаний к проведению стероидной терапии (например, при необходимости проводить конкурентную терапию МКА-блокаторами PD1 / PDl1, или МКА-блокаторами сTLA4), см также таблицу 19) [24, 378-381].
Уровень убедительности рекомендаций А (уровень достоверности доказательств -2).
Таблица 19. Рекомендуемые режимы применения бевацизумаба** при симптоматическом перифокальном отеке или радионекрозе в головоном мозге.
─ не менее чем за 3 дня до начала лучевой терапии и возобновить не ранее чем через 3 дня после окончания фракционированной лучевой терапии;
─ как минимум за 1 день до начала стереотаксической радиохирургии (или радиотерапии) и возобновить через 1 день после ее завершения [383-386].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -4).
• В настоящее время не существует убедительных данных, свидетельствующих об ухудшении переносимости лечения при одновременном проведении лучевой терапии и терапии МКА-блокаторами PD1 или сTLA4. Анализ результатов представленных исследований показал, лучевая терапия рекомендуется совместно с терапией МКА-блокаторами PD1 или сTLA4 без потери эффективности и повышения частоты нежелательных реакций [383, 386-388].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 3).
Ниволумаб** 3 мг/кг каждые 2 нед в/в капельно 12 месяцев.
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Или ниволумаб** 240 мг каждые 2 нед в/в капельно 12 месяцев, или ниволумаб** 480 мг в/в каждые 4 нед 12 месяцев.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
• Рекомендуется пациентам с метастатической меланомой (эквивалент стадии M1) после хирургического удаления всех метастатических узлов, без признаков заболевания) проведение адъювантной комбинированной терапия МКА-блокаторами сTLA4 и МКА-блокаторами PD1 [391]. Режим применения приведен в Таблице 20.
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Таблица 20. Режим применения комбинированной иммунотерапии у больных после полного (R0) удаления отдаленных метастазов меланомы.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
TEGb 3,6,10. Принципы профилактики и лечения тромбоэмболических осложнений у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПРОФИЛАКТИКЕ И ЛЕЧЕНИЮ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ» (Коллектив авторов: Сомонова О. В., Антух Э. А., Долгушин Б. И., Елизарова А. Л., Сакаева Д. Д., Сельчук В. Ю., Трякин А. А., Черкасов В. А. DOI: 10,18027 / 2224-5057-2020-10-3s2-47, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-47.pdf).
TEGb 3,6,11. Принципы профилактики и лечения нефротоксичности у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО КОРРЕКЦИИ НЕФРОТОКСИЧНОСТИ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ» (Коллектив авторов: Громова Е. Г., Бирюкова Л. С., Джумабаева Б. Т., Курмуков И. А. DOI: 10,18027 / 2224-5057-2020-10-3s2-46, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-46.pdf).
TEGb 3,6,12. Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ ПОСЛЕДСТВИЙ ЭКСТРАВАЗАЦИИ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ» (Коллектив авторов: А Автор: Буйденок Ю. В. DOI: 10,18027 / 2224-5057-2020-10-3s2-48, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-48.pdf).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
[1]Пациентам всех групп следует предлагать участие в клинических исследованиях при наличии такой возможности.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. По показаниям дополнительно проводится адъювантная терапия ( см раздел 3,3).
3,1 Лечение локальных стадий заболевания (I-II).
• Рекомендуется пациентам с I-II стадиями меланомы выполнять радикальное иссечение первичной опухоли в пределах здоровых тканей как основой этап лечения локальной меланомы кожи [98-107].Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
• Выбор хирургического отступа формируется на основании результатов патолого-анатомического исследования биопсийного (операционного) материала, а именно толщины опухоли.В настоящее время для улучшения отдаленных результатов лечения и профилактики рецидивов опухоли при уже установленной стадии рекомендуется выполнять следующие отступы [98-107]:
• 0,5 см для меланомы in situ;
• 1 см при толщине опухоли по Бреслоу ≤2.
• 2 см при толщине опухоли >2.
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарий. Модифицированные варианты резекции с меньшими отступами возможны для сохранения функции органа при меланоме кожи пальцев или кожи ушной раковины [157, 161-164].
• Рекомендуется для определения толщины опухоли на первом этапе использовать эксцизионную биопсию пигментного образования с отступом от видимого края пигментной опухоли не более 0,5 см В случае подтверждения диагноза меланомы кожи рубец после биопсии иссекается с большим отступом в сроки 4-8 нед ( см также раздел 2,5) [98-107].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Если эксцизионная биопсия не проводится из-за очевидности диагноза, установленного клинически, отступы от видимых краев опухоли не рекомендуется расширять более чем на 2 так как без точных знаний микростадии это будет приводить к излишним манипуляциям, связанным с закрытием послеоперационной раны (например, различным видам сложной пластики) [98-107].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Если после иссечения первичной опухоли в краях резекции обнаруживаются опухолевые клетки при инвазивной или десмопластической меланоме, а ререзекция не представляется возможной, рекомендуется проведение адъювантной лучевой терапии на зону первичной опухоли (послеоперационный рубец). Проведение дистанционной лучевой терапии возможно различными режимами: 64-70 Гр за 32-35 фракций в течение 6-7 нед; 50,0-57,5 Гр за 20-23 фракции в течение 4-5 нед [169].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• В случае невозможности выполнения хирургического иссечения первичной опухоли из-за наличия выраженных сопутствующих заболеваний рекомендуется проведение локальной лучевой терапии в следующих режимах: 64-70 Гр за 32-35 фракций в течение 6-7 нед; 50,0-57,5 Гр за 20-23 фракции в течение 4-5 нед [169].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• Не рекомендуется рутинное выполнение профилактической лимфаденэктомии или проведение предоперационной лучевой терапии как на регионарные лимфатические узлы, так и на область первичной опухоли [170, 171].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Рекомендуется выполнять пациентам биопсию сторожевого лимфатического узла при толщине первичной опухоли более 0,8 мм по Бреслоу с целью правильного определения стадии заболевания, прогноза течения заболевания и определения показаний к адъювантной терапии [160, 172-180].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарий. Биопсия сторожевого лимфатического узла проводится в специализированных учреждениях, укомплектованных оборудованием и имеющих обученный персонал.
• Вопрос о выполнении лимфодиссекции в случае обнаружения микрометастазов в сторожевом лимфатическом узле рекомендуется тщательно обсудить с пациентом, взвесив потенциальные риски такой операции и ожидаемую пользу с учетом данных исследования MSLT-II [180]. Альтернативой выполнения безотлагательной лимфодиссекции может стать тщательное наблюдение за регионарным лимфоколлектором при помощи экспертного УЗИ [180].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
• Особое внимание в рамках патолого-анатомического исследования операционного материала рекомендуется уделить морфологическому исследованию удаленного сторожевого лимфатического узла (узлов) при биопсии сторожевого лимфатического узла: настоятельно рекомендуется выполнить как можно больше срезов, а также помимо окраски гематоксилином и эозином использовать иммуногистохимическое окрашивание на меланома-специфические маркеры (Melan A, тирозиназа, HMB45 или SOX-10). Иммуногистохимическое окрашивание рекомендуется рутинно выполнять в том числе и при отсутствии признаков метастатического поражения по данным окрашивания гематоксилином и эозином [181-195].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
• В отсутствие возможности выполнения биопсии сторожевого лимфатического узла рекомендуется максимально тщательно исследовать регионарные лимфатические узлы, используя УЗИ для навигации на подозрительный лимфатический узел с последующей тонкоигольной пункцией и цитологическим исследованием [196-200].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
3,1,1 Лечение локальных стадий заболевания при меланоме слизистых оболочек.
• При меланоме слизистых оболочек рекомендуется рассматривать хирургическое вмешательство как основной метод лечения пациентов с локальными стадиями болезни (например, T3-4a N0-1 при локализации на слизистых верхних дыхательных и пищеварительных путей). Принципы лечения более распространенных стадий - см раздел 3,4. Лечение пациентов метастатической и нерезектабельной меланомой кожи (IIIC/D нерезектабельная - IV)» [201-207].Уровень убедительности рекомендаций. С (уровень достоверности доказательств 4).
• При меланоме слизистых оболочек полости и придаточных пазух носа при стадии T3-4a, N0 рекомендуется выполнение пациентам оперативного вмешательства с широкой резекцией в пределах здоровых тканей с адъювантной лучевой терапией на область первичной опухоли (70-72 Гр на область резидуальной опухоли или 65-70 Гр на область высокого риска рецидива, например, ложе удаленной опухоли, 50-55 Гр на область низкого риска [201-207].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
• При меланоме слизистых оболочек полости и придаточных пазух носа при стадии T3-4a, N1 рекомендуется на первом этапе лечения выполнение оперативного вмешательства в объеме удаления первичной опухоли и фасциально-футлярного иссечения клетчатки шеи на стороне поражения или с двух сторон при двустороннем поражении. На втором этапе лечения - лучевая терапия на область первичной опухоли и зоны регионарного метастазирования (70-72 Гр на область резидуальной опухоли, 65-70 Гр на зоны высокого риска рецидива) [201-207].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
• При меланоме слизистых оболочек полости рта, ротоглотки, гортаноглотки и гортани при стадии T3-4a, N0 у пациентов рекомендуется на первом этапе выполнение оперативного вмешательства в объеме удаления первичной опухоли и профилактической шейной лимфодиссекции с ипсилатеральной стороны.На втором этапе. Лучевая терапия на область первичной опухоли и зоны регионарного метастазирования (70-72 Гр на область резидуальной опухоли, 65-70 Гр на зоны высокого риска рецидива и 50-55 Гр на зоны низкого риска рецидива) [201-207].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
• При меланоме слизистых оболочек полости рта, ротоглотки, гортаноглотки и гортани при стадии T3-4a, N1 рекомендуется на первом этапе лечения выполнение оперативного вмешательства пациентам в объеме удаления первичной опухоли и фасциально-футлярного иссечения клетчатки шеи на ипсилатеральной стороне или с двух сторон при двустороннем поражении. На втором этапе лечения - лучевая терапия на область первичной опухоли и зоны регионарного метастазирования (70-72 Гр на область резидуальной опухоли, 65-70 Гр на зоны высокого риска рецидива и 50-55Гр на зоны низкого риска рецидива) [201-207].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
Комментарий. Всех пациентов с меланомой слизистых оболочек, локализованных в области головы и шеи до лечения должен оценивать хирург-онколог, специализирующийся на опухолях головы и шеи, которому следует предпринять следующие действия - рассмотреть адекватность биопсийного материала, стадирования и визуализации опухолевого процесса (КТ,МРТ) для определения степени распространения опухоли, исключить наличие синхронной первичной опухоли, оценить текущий функциональный статус и возможность назначения потенциального хирургического лечения, если первичное лечение было нехирургическим, разработать проспективный план наблюдения, который будет включать адекватное обследование зубов, питания и здорового образа жизни, а также вмешательства и любые другие дополнительные исследования, которые необходимы для полной реабилитации. Для пациентов, которым выполняют плановые операции, необходимо проработать хирургическое вмешательство, края и план реконструкции для резекции клинически определяемой опухоли со свободными от опухоли хирургическими краями. Оценка операбельности. Поражение опухолью следующих структур связано с плохим прогнозом или классифицируется как стадия Т4b (например, неоперабельность, ассоциированная с технической невозможностью получить чистые края резекции): значительное поражение крыловидно-небной ямки, тяжелые тризмы из-за инфильтрации опухолью крыловидных мышц; макроскопическое распространение опухоли на основание черепа (например, эрозия крыловидных пластинок или основной кости, расширение овального отверстия ); возможная инвазия (охват) стенки общей или внутренней сонной артерии. Охват обычно оценивается радиологически (по данным КТ и МРТ) и диагностируется, если опухоль окружает ≥270° окружности сонной артерии; непосредственное распространение опухоли из регионарных ЛУ с поражением кожи, прямое распространение на структуры средостения предпозвоночную фасцию или шейные позвонки. [201-207] Удаление первичного очага. По возможности необходимо выполнять удаление первичной опухоли единым блоком. Необходимо планировать хирургическое удаление в зависимости от степени распространения первичной опухоли, установленной при клиническом исследовании, и тщательной интерпретации соответствующих радиографических снимков. В случае если опухоль прилежит к двигательному или сенсорному нерву, не исключено наличие периневральной инвазии. В данной ситуации следует выделить нерв в проксимальном и дистальном направлениях и выполнить его резекцию для получения чистого края резекции. Подтверждено, что для получения ткани, свободной от опухоли, полезна диагностика проксимального и дистального краев нерва методом замороженных срезов (срочное патолого-анатомическое исследование биопсийного материала). Адекватное вмешательство может потребовать выполнения краевой, плоскостной или сагиттальной резекции подлежащих костных структур при опухолях, поражающих надкостницу или прилежащих к ней. Резекция костей показана при массивной инфильтрации опухолью надкостницы кости (что определяется при фиксации к ней опухоли) или при обнаружении во время операции либо при полном дооперационном обследовании признаков прямого прорастания кости опухолью. Степень резекции окружающих мягких тканей и кости будет зависеть от степени поражения, оцениваемой клинически и во время операции. [201, 204, 208-215] Края резекции Адекватное удаление опухоли в мягких тканях определяется как расстояние от края резекции до макроскопически видимой опухоли ≥ 2 см или отрицательный край замороженного среза. В целом оценку замороженных срезов обычно проводят интраоперационно, если зона, макроскопически свободная от опухоли по краю резекции составляет <2 невозможно определить линию резекции в связи с нечеткой границей опухоли или имеется подозрение на наличие резидуальной опухоли. Необходимо включать подробное описание края резекции в операционный журнал. Края можно оценить по удаленному препарату или, как альтернатива, из ложа опухоли с правильным ориентированием. Чистый край определяется как расстояние от инвазивного края опухоли, который составляет ≥ 5 мм от края резекции. Близкий край определяется как расстояние от инвазивного края опухоли до края резекции, равное <5 Первичную опухоль следует помечать таким образом, чтобы врач-патологоанатом мог адекватно оценить ориентацию препарата. Шейную диссекцию необходимо ориентировать или выполнять срезы по порядку для определения уровня ЛУ, включенных в зону диссекции. Реконструкцию хирургических дефектов нужно проводить с использованием конвенциальной техники по усмотрению хирурга. По возможности рекомендуется первичное ушивание, но при этом не следует пренебрегать широкими краями резекции, свободными от опухоли. По усмотрению хирурга выполняется пластическое ушивание с применением местных/регионарных лоскутов, свободных лоскутов, расщепленного кожного лоскута или других лоскутов с/без реконструкции дефекта. [201, 204, 207-215].
3,2 Лечение пациентов с резектабельной меланомой кожи III стадии и эквивалентом III стадии.
Пациенты с меланомой кожи III стадии представляют собой неоднородную группу пациентов с позиции лечебной тактики. С практической точки зрения следует различать резектабельный процесс и нерезектабельный местно-распространенный процесс (включая конгломераты лимфатических узлов и/или транзитные или сателлитные метастазы - клинические варианты IIIB или IIIC/D стадии). Рекомендации по лечению пациентов нерезектабельной меланомой кожи IIIC/D будут рассмотрены в разделе 3,4.• Рекомендуется выполнить адекватное иссечение первичной опухоли (если не было выполнено ранее) ( см раздел 3,1) для улучшения отдаленных результатов лечения и профилактики рецидивов опухоли [98-107].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
• Рекомендуется выполнять регионарную лимфаденэктомию всем пациентам с резектабельной меланомой кожи III стадии для улучшения отдаленных результатов лечения и профилактики рецидивов опухоли [216-219].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• При проведении лимфаденэктомии пациентам меланомой кожи III стадии для улучшения отдаленных результатов лечения и профилактики рецидивов опухоли рекомендуется выполнять максимально полное удаление клетчатки анатомической области, в лимфатических узлах которой выявлены метастазы меланомы (например, Ib -V уровни клетчатки шеи (Ia - по показаниям), I -III уровни клетчатки подмышечной области, поверхностные и глубокие паховые лимфатические узлы) [216-219].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарий. При клинически определяемом поражении глубоких паховых лимфатических узлов большое внимание следует уделить наружным подвздошным лимфатическим узлам. Некоторые исследователи в случае массивного поражения глубоких паховых лимфатических узлов (более 3) или поражения узла Пирогова -Розенмюллера -Клоке рекомендуют расширять объем операции до удаления ипсилатеральных наружных подвздошных лимфатических узлов, так как частота их поражения может достигать 20 -24 % [220].
• Рекомендуется определять следующие параметры при патолого-анатомическом исследовании метастазов меланомы в регионарные лимфатические узлы для правильного стадирования и определения прогноза заболевания [22, 114, 221]:
1) количество удаленных лимфатических узлов;
2) количество пораженных лимфатических узлов;
3) характер поражения лимфатических узлов:
- частичное поражение (количество лимфатических узлов);
- полное поражение (количество лимфатических узлов);
- прорастание капсулы (количество лимфатических узлов).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• Рекомендуется предлагать пациентам после радикальной лимфаденэктомии при отсутствии противопоказаний адъювантную лекарственную терапию, информируя пациента о потенциальных преимуществах и ограничениях данного метода лечения ( см раздел 3,3) [222-230].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
• Рекомендуется пациентам с высоким риском регионарного рецидива после радикальной лимфаденэктомии в целях снижения вероятности регионарного рецидива при отсутствии противопоказаний предлагать профилактическую послеоперационную лучевую терапию на область пораженного лимфоколлектора, информируя пациента о потенциальных преимуществах и ограничениях данного метода лечения [231, 232].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарий. По данным проведенных исследований, послеоперационная лучевая терапия снижает риск регионарного рецидива у пациентов с высоким риском, но не оказывает влияния на общую выживаемость [232]. К факторам высокого риска регионарного рецидива относят:
1) поражение 1 и более околоушного лимфатического узла, 2 и более шейных или подмышечных лимфатических узлов (или при размерах лимфатического узла более 3 см), 3 и более пахово-бедренных лимфатических узлов (или при их размерах более 4 см);
2) прорастание метастаза за пределы капсулы лимфатического узла [232, 233]179].
Адъювантная дистанционная лучевая терапия проводится в следующих режимах: 50-66 Гр за 25-33 фракций в течение 5-7 нед (УДД 4, УУР С) [234]; 48 Гр за 20 фракций в течение 4 нед (УДД 2, УУР В)[232]. Использование новых методик дистанционной лучевой терапии, таких как IMRT, VMAT, позволяет снижать повреждение здоровых тканей [235, 236].
При наличии нерезектабельных метастазов в регионарные лимфатические узлы возможно проведение паллиативной лучевой терапии на эту область. Используются различные режимы лечения, например: 48 Гр за 20 фракций в течение 4 нед[231]; 50-Гр за 20-фракции в течение 4 нед [237].
3,3 Рекомендации по проведению адъювантной терапии меланомы кожи II и III стадии и эквивалентом III стадии.
• Рекомендуется для определения показаний к назначению адъювантной терапии оценить риск прогрессирования и смерти от меланомы кожи после радикального хирургического лечения. Для оценки риска рекомендуется использовать классификацию TNM AJCC/UICC 8-го пересмотра, которая включает основные прогностические факторы ( см подраздел 1,5,2 и раздел 7) [221, 238].Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 3).
• Рекомендуется предлагать пациентам с высоким и промежуточным риском прогрессирования после радикального хирургического лечения (т. е. пациентам со стадиями IIB-III при отсутствии противопоказаний адъювантную лекарственную терапию (табл. 8), информируя пациента о потенциальных преимуществах и ограничениях данного метода лечения) [22, 222-225, 227-230, 239-242].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Таблица 8. Рекомендуемые режимы адъювантной терапии меланомы кожи в зависимости от стадии заболевания[1].
| Стадия | Наличие мутации V600 в гене вRAF | Оптимальные режимы | Режимы, предлагаемые при отсутствии оптимальных |
| IIB, IIC | Вне зависимости от статуса | · пембролизумаб** 200 мг в/в 1 раз в 21 день 12 месяцев (18 доз) [243] [244] ИЛИ · пембролизумаб** 400 мг в/в 1 раз в 42 дня 12 месяцев (9 доз) [244] | · Наблюдение Или Интерферон альфа-2b** п/к 3 млн МЕ или 5 млн МЕ 3 р/нед 12 мес [240, 245, 246] |
| IIIA | вRAF V600 mut | · Дабрафениб** 150 мг 2 р/сут внутрь + траметиниб** 2 мг 1 р/сут внутрь 12 месяцев [229] ИЛИ · пембролизумаб** 200 мг в/в 1 раз в 21 день 12 месяцев (18 доз) [228] ИЛИ · пембролизумаб** 400 мг в/в 1 раз в 42 дня 12 месяцев (9 доз) [244] | Интерферон альфа-2b** 3 млн МЕ или 5 млн МЕ 3 р/нед 12 мес [245] [240] |
| IIIA | вRAF V600 wild type | · пембролизумаб** 200 мг в/в 1 раз в 21 день 12 месяцев (18 доз) [228] ИЛИ · пембролизумаб** 400 мг в/в 1 раз в 42 дня 12 месяцев (9 доз) [244] | |
| IIIB, IIIC/D | вRAF V600 mut | · Дабрафениб** 150 мг 2 р/сут внутрь + траметиниб** 2 мг 1 р/сут внутрь ежедневно 12 месяцев [229] ИЛИ · пембролизумаб** 200 мг в/в 1 раз в 21 день 12 месяцев (18 доз) [228], ИЛИ · пембролизумаб** 400 мг в/в 1 раз в 42 дня 12 месяцев (9 доз) [244] ИЛИ · ниволумаб** 3 мг/кг каждые 2 нед в/в капельно 12 месяцев[230] ИЛИ · ниволумаб** 240 мг каждые 2 нед в/в капельно 12 месяцев [230, 247] ИЛИ · ниволумаб** 480 мг в/в каждые 4 нед 12 месяцев [230, 248] | Интерферон альфа-2b** 3 млн МЕ или 5 млн МЕ 3 р/нед 24 мес [245] [240] |
| IIIB, IIIC/D | вRAF V600 wild type | · пембролизумаб** 200 мг в/в 1 раз в 21 день 12 месяцев (18 доз) [228], ИЛИ · пембролизумаб** 400 мг в/в 1 раз в 42 дня 12 месяцев (9 доз) [244] ИЛИ · ниволумаб** 3 мг/кг каждые 2 нед в/в капельно 12 месяцев[230] ИЛИ · ниволумаб** 240 мг каждые 2 нед в/в капельно 12 месяцев [230, 247] ИЛИ · ниволумаб** 480 мг в/в каждые 4 нед 12 месяцев [230, 248] | Интерферон альфа-2b** 3 млн МЕ или 5 млн МЕ 3 р/нед 12 мес [245] [240] |
Примечание. вRAF V600 mut - активирующая мутация в гене вRAF в 600-й позиции экзона 15 с заменой нуклеотида, кодирующего валин, на другую аминокислоту (чаще всего на нуклеотид, кодирующий глутаминовую кислоту). вRAF V600 wild type - «дикий тип» (отсутствие активирующих мутаций V600) гена вRAF.
Комментарий. Адъювантная терапия интерфероном альфа-2b** имеет преимущества только у пациентов с изъязвленной первичной меланомой кожи. Назначение интерферона альфа-2b** в адъювантном режиме у пациентов с неизъязвленной первичной опухолью не рекомендуется.
• Для пациентов, радикально оперированных по поводу отдаленных метастазов меланомы кожи, рекомендовано проводить адъювантное лечение с применением моноклональных антител (далее - МКА), блокирующих взаимодействие между рецептором программируемой смерти (PD-1) и его лигандами (далее - МКА-блокаторы PD1) (ниволумаб**). При наличии противопоказаний альтернативой может быть динамическое наблюдение или участие в клинических исследованиях (если таковые имеются) [22, 223-225, 227, 230, 239-241].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
• Не рекомендуется проводить адъювантную терапию пациентам меланомой кожи группы благоприятного прогноза, имеющим низкий риск прогрессирования заболевания (IA, IB, IIA стадии) [245, 249].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Не рекомендуется проводить адъювантную терапию интерфероном альфа-2а** и интерфероном альфа-2b** пациентам меланомой кожи, у которых риски, связанные с развитием нежелательных явлений на фоне применения адъювантной терапии, превышают ожидаемую пользу [239, 240, 250-252].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
Комментарий. Учитывая, что проведение иммунотерапии интерфероном альфа-2а** или интерфероном альфа-2b** сопряжено с известными рисками развития нежелательных явлений, следует выделить группу пациентов, которым это лечение противопоказано. После анализа данных литературы эксперты пришли к выводу о том, что риск превосходит пользу от назначения терапии интерфероном альфа-2а** и интерфероном альфа-2b** в следующих случаях (но не ограничивается ими) [239, 250-252].
- Психические расстройства, в том числе тяжелая депрессия;
- цирроз печени любой этиологии;
- аутоиммунные болезни;
- выраженная (III-IV степени по сTCAE v. 3,0 [253]) органная недостаточность (сердечная, печеночная, почечная );
- беременность или планируемая беременность;
- псориаз;
- неспособность пациента адекватно выполнять назначения врача.
В связи с этим эксперты рекомендуют перед назначением адъювантной иммунотерапии интерфероном альфа 2b** исключить наличие у пациентов перечисленных противопоказаний, при необходимости прибегнув к консультации специалистов (врача-терапевта, врача-психиатра, врача-дерматовенеролога ). Следует также учесть противопоказания к назначению препарата, указанные производителем в инструкции по применению.
Данные по безопасности и эффективности адъювантного применения интерферона альфа 2b** при меланоме кожи у лиц моложе 18 лет ограничены единичными наблюдениями, поэтому эксперты не рекомендуют назначать интерферон альфа** данной категории пациентов.
• Рекомендуется начинать адъювантную иммунотерапию пациентам в сроки не позже 3 месяцев с момента хирургического лечения после полного заживления послеоперационной раны. Не рекомендуется начинать адъювантное лечение в том случае, если с момента операции прошло более 3 месяцев, так как при начале адъювантной терапии в более отдаленные сроки ее эффективность не изучена [228-230, 240].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
• В рандомизированных исследованиях не было показано преимуществ прерывистых режимов назначения интерферона альфа-2b**, потому они не рекомендуются к использованию в рутинной практике [250, 254].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
• Не рекомендуется использовать химиотерапию в рутинной практике для адъювантного лечения меланомы кожи. По данным многочисленных международных исследований, применение химиотерапии в адъювантном режиме после радикального лечения меланомы кожи IIB-III стадии не приносит клинической пользы и может снижать общую выживаемость [255-262].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
• Не рекомендуется использовать иммуностимуляторы (класс АТХ. J05AX (Прочие противовирусные препараты), в том числе индукторы эндогенного интерферона или другие интерфероны (бета и гамма)), за исключением интерферона альфа-2b** в адъювантном режиме при меланоме кожи. [240, 245, 246]. Имеющиеся данные клинических исследований свидетельствуют об отсутствии эффективности интерферона гамма** в адъювантном режиме [263], относительно других препаратов имеющихся научных данных недостаточно для их безопасного применения [22].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
3,3,1 Рекомендации по проведению неоадъювантной терапии меланомы кожи III стадии и эквивалентом III стадии.
Данные недавно проведенных исследований демонстрируют весьма обнадеживающие результаты при проведении неоадъювантной иммунотерапии, у пациентов с меланомой с поражением регионарных лимфатических узлов. Судя по всему, такая тактика обладает преимуществом перед стандартным подходом. Вероятно, в ближайшее время, объемы хирургических вмешательств при эквиваленте IIIB-D стадии меланомы также будут пересмотрены в сторону уменьшения травматичности и объема удаляемых тканей (удаление индексных узлов вместо полного удаления всего лимфоколлектора). Однако к настоящему времени у нас недостаточно данных, чтобы рекомендовать уменьшение объема хирургического вмешательства, тем не менее вполне достаточно данных, чтобы рекомендовать неоадъювантный подход для пациентов с резектабельными метастазами меланомы [264-269].• Рекомендуется пациентам с поражением регионарных лимфоузлов (IIIВ-D стадия заболевания или ее эквивалент) проведение предоперационной иммунотерапии с последующим выполнением регионарной лимфаденэктомии и последующей адъювантной терапией (вместе с неаодъювантной теарпией - общей длительностью до 12 мес. 272]. Режимы применения приведены в табл. 9.
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Таблица 9. Режимы применения неоадъювантной терапии.
| Лекарственный препарат | Доза | Путь введения | Дни введения / приема | Длительность цикла | |
| Монотерапия aPD1 [270] | Пембролизумаб** | 200 мг | в/в кап | 1 раз в 21 день, | до 2 мес. ( 3 введения) перед лимфаденэктомией, с последующим продолжением суммарно до 12 мес. терапии |
• Рекомендуется пациентам, получающим предоперационную (неоадъювантную) иммунотерапию с поражением регионарных лимфоузлов (IIIВ-D стадия заболевания или ее эквивалент) провести оценку патоморфологического ответа после проведения регионарной лимфаденэктомии [268, 270-273].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• Рекомендуется пациентам с прогрессированием на фоне предоперационной (неоадъювантной) иммунотерапию с поражением регионарных лимфоузлов (IIIВ-D стадия заболевания или ее эквивалент) и наличием мутации в гене вRAF переключение на адъювантную кТТ [274](таблица 8).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
3,4 Лечение пациентов метастатической и нерезектабельной меланомой кожи (IIIC/D нерезектабельная - IV стадия или их эквивалент).
3,4,1 Общие принципы выбора терапии 1-й линии у пациентов метастатической или неоперабельной меланомой кожи.
• Рекомендуется выполнить оценку состояния пациента по шкале ВОЗ/ECOG ( см приложение Г), наличия сопутствующей патологии, ожидаемой продолжительности жизни для принятия решения об оптимальной тактике ведения пациента [275, 276].Уровень убедительности рекомендаций. В (уровень достоверности доказательств 3).
• Рекомендуется при выборе терапии 1-й линии всем пациентам с метастатической или неоперабельной меланомой провести молекулярно-генетическое исследование опухоли на наличие мутаций в экзоне 15 гена вRAF (если этого не было выполнено ранее). Для исследования может быть использован архивный опухолевый материал или свежий материал, который можно получить при биопсии (открытой, толстоигольной (core-биопсии) ) в случае, если это повлияет на выбор дальнейшей тактики лечения [22, 119-130].
Уровень убедительности рекомендаций А (уровень достоверности доказательств -1).
• При отсутствии мутации в гене вRAF ( дикий тип ) рекомендуется при выборе терапии 1-й линии всем пациентам с метастатической или неоперабельной меланомой выполнить молекулярно-генетическое исследование мутаций в генах NRAS (экзон 3) и KIT (экзоны 8, 9, 11, 13, 14, 17, 18) в биопсийном (операционном) материале или выполнить широкое молекулярное тестирование, если диагностированы или заподозрены отдаленные метастазы меланомы, и это может повлиять на выбор схемы таргетной терапии (в частности, назначение ингибиторов протеинкиназы или моноклональных антител) при лечении метастатического процесса[131-146].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Комментарий. Также имеются сведения о том, что ингибитор протеинкиназы KIT может быть эффективен при наличии мутаций в 8, 18 экзонах гена KIT [143, 147-149].
• При отсутствии возможности выполнить молекулярно-генетическое исследование опухоли на наличие мутации в гене вRAF (или KIT) в течение 4 нед после установления диагноза метастатической меланомы (отсутствует материал для анализа, нет соответствующего оборудования в учреждении ) при отсутствии других противопоказаний рекомендуется начинать противоопухолевую терапию пациенту в соответствии с подразделом 3,4,4 настоящих рекомендаций [277, 278].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
3,4,2 Выбор терапии 1-й линии у пациентов метастатической или неоперабельной меланомой кожи с мутацией в гене вRAF.
• У пациентов с мутацией в гене вRAF в 1-й линии терапии рекомендуется использовать комбинированное лечение МКА-блокаторами PD1 и МКА, блокирующими тормозные сигналы каскада сTLA4 (далее - МКА-блокаторы сTLA4), либо комбинацию ингибиторов протеинкиназы (далее - ИПК) вRAF и МЕК, либо, либо монотерапию МКА-блокаторами PD1. При недоступности комбинированного лечения ИПК вRAF и МЕК или МКА-блокаторами PD1 возможно проведение монотерапии ИПК вRAF [126, 127, 279-286]. Лечение ИПК вRAF и МЕК проводится до прогрессирования заболевания или развития выраженных некупируемых токсических явлений. Режимы применения приведены в табл. 10 и 11.Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарий. У пациентов с большой опухолевой массой и высокой скоростью прогрессирования заболевания следует отдавать предпочтение комбинации ИПК вRAF и МЕК. У пациентов с метастатической меланомой, не имеющих симптомов заболевания, предпочтительным вариантом лечения следует считать комбинированное лечение МКА-блокаторами PD1 и МКА-блокаторами сTLA4 либо монотерапию МКА-блокаторами PD1. [287].
Таблица 10. Режимы назначения ИПК вRAF и МЕК (для всех режимов назначения УДД 2, УУР А).
| Схема терапии | Препарат | Доза | Путь введения | Дни приема | Длительность цикла, дни, режим |
| Комбинированная терапия [288-291] | Энкорафениб | 450 мг 1 р/сут | внутрь | ежедневно | длительно |
| Биниметиниб | 45 мг 2 р/сут | внутрь | ежедневно | длительно | |
| Комбинированная терапия [126, 127] | Вемурафениб** | 960 мг 2 раза в день | Внутрь | Ежедневно | Длительно |
| Кобиметиниб** | 60 мг 1 раз в сутки | Внутрь | С 1-го по 21-й день, 7 дней перерыв | Длительно | |
| Комбинированная терапия [279] | Дабрафениб** | 150 мг 2 раза в день | Внутрь | Ежедневно | Длительно |
| Траметиниб** | 2 мг 1 раз в сутки | Внутрь | Ежедневно | Длительно | |
| Монотерапия [292, 293] | Вемурафениб** | 960 мг 2 раза в день | Внутрь | Ежедневно | Длительно |
| Монотерапия [294] | Дабрафениб** | 150 мг 2 раза в день | Внутрь | Ежедневно | Длительно |
| Монотерапия [288-291] | Энкорафениб | 300 мг 1 р/сут | внутрь | Ежедневно | Длительно |
• Не рекомендуется проводить терапию ИПК вRAF или комбинацией ИПК вRAF и MEK пациентам с неизвестным статусом опухоли в отношении мутации в гене вRAF, так как имеются сведения о возможности парадоксальной активации MAPK -сигнального пути и ускорения роста опухоли при применении ИПК вRAF на клеточных линиях без мутации в гене вRAF [277, 278].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Не рекомендуется следующее комбинирование ИПК вRAF и МЕК. Дабрафениба** с кобиметинибом** и вемурафениба** с траметинибом**, так как такие комбинации не изучены. [22].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
• Учитывая особый профиль дерматологических нежелательных явлений ИПК вRAF и MEK, в частности риск развития плоскоклеточного рака и других опухолей кожи, на фоне лечения рекомендуется регулярно проводить осмотр кожных покровов пациента. При подозрении на развитие плоскоклеточного рака или кератоакантомы необходимо их хирургическое удаление с последующим патолого-анатомическим исследованием биопсийного или операционного материала, при этом терапия ИПК вRAF или комбинацией ИПК вRAF и МЕК может быть продолжена без перерыва в лечении и/или без редукции дозы препарата [122, 293, 295].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств -2).
• При проведении терапии ИПК вRAF или комбинацией ИПК вRAF и МЕК оценку эффекта лечения TEGb рекомендовано проводить каждые 8-10 нед, не допуская перерывов в приеме препаратов на период оценки эффекта лечения. Для оценки эффекта терапии TEGb рекомендуется использовать оценку общего состояния пациента и методы лучевой диагностики ( см табл. 7, раздел 2,4) а также стандартные критерии ответа на цитостатическую терапию (RECIST 1,1 - см http://medradiology.moscow/d/1364488/d/no46_2018_recist_11.pdf ) [126, 296, 297].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
• При наличии признаков прогрессирования заболевания на фоне применения ИПК вRAF либо комбинации ИПК вRAF и МЕК или появления признаков непереносимости такой терапии при сохранении удовлетворительного общего состояния пациента (ECOG 0-2) и при ожидаемой продолжительности жизни более 3 месяцев рекомендуется перевести пациента на терапию МКА-блокаторами PD1 или комбинацию МКА-блокаторов PD1 и сTLA4 [279-284, 298]. Режимы применения приведены в табл. 10.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. Монотерапия МКА-блокаторами PD-1 и комбинированная терапия МКА-блокаторами PD1 и сTLA4 демонстрируют сходные результаты у пациентов с меланомой, резистентной к ИПК вRAF и MEK.Однако комбинированная терапия МКА-блокаторами PD1 и сTLA4 была связана с более высокой частотой нежелательных явлений по сравнению с монотерапией [299].
Таблица 11. Режимы применения МКА-блокаторов PD1 и сTLA4.
| Схема терапии | Препарат | Доза | Путь введения | Дни введения | Длительность цикла, дни, режим |
| Монотерапия [279-281] | Ниволумаб** | 3 мг/кг ИЛИ | В/в капельно 30-60 мин | 1 раз в 14 дней | Длительно |
| 240 мг [300] ИЛИ | В/в капельно | 1 раз в 14 дней | Длительно | ||
| 480 мг[248] | В/в капельно | 1 раз в 28 дней | Длительно | ||
| Монотерапия [281-283] | Пембролизумаб** | 200 мг ИЛИ | В/в капельно 30 мин | 1 раз в 21 день | Длительно |
| Пембролизумаб** | 400 мг [244] | В/в капельно 30 мин | 1 раз в 42 дня | Длительно | |
| Монотерапия [301, 302] | Пролголимаб** | 1 мг/кг | В/в капельно 30 - 60 мин | 1 раз в 14 дней | Длительно (УДД 2, УУР В) |
| Комбинированная терапия МКА-блокаторами сTLA4 и МКА-блокаторами PD1 (ИПИ 3/НИВО 1) [279, 284, 303, 304] | Ниволумаб** (в один день с ипилимумабом**) | 1 мг/кг | В/в капельно 30 мин | 1 раз в 21 день | Суммарно не более 4 введений |
| Ипилимумаб** (в один день с ниволумабом**) | 3 мг/кг | В/в капельно 30 минут | 1 раз в в 21 день | Суммарно не более 4 введений | |
| Поддерживающая фаза: ниволумаб** | 3 мг/кг ИЛИ | В/в капельно | 1 раз в 14 дней | Длительно | |
| 240 мг ИЛИ | В/в капельно | 1 раз в 14 дней | Длительно | ||
| 480 мг в/в | В/в капельно | 1 раз в 28 дней | Длительно | ||
| Комбинированная терапия МКА- блокаторами сTLA4 и МКА- блокаторами PD1 (ИПИ 1/НИВО 3) [304] (Уровень убедительности рекомендаций - В (уровень достоверности доказательств - 4). | Ниволумаб** (в один день с ипилимумабом**) | 3 мг/кг | В/в капельно 30 мин | 1 раз в 21 день | Суммарно не более 4 введений |
| Ипилимумаб** (в один день с ниволумабом**) | 1 мг/кг | В/в капельно 30 мин | 1 раз в 21 день | Суммарно не более 4 введений | |
| Поддерживающая фаза: ниволумаб** ИЛИ | 3 мг/кг | В/в капельно 30 мин | 1 раз в 14 дней | Длительно | |
| Поддерживающая фаза: ниволумаб** ИЛИ | 240 мг | В/в капельно 30 мин | 1 раз в 14 дней | Длительно | |
| Поддерживающая фаза: ниволумаб** | 480 мг | В/в капельно 30 мин | 1 раз в 28 дней | Длительно | |
| Комбинированная терапия МКА. Блокаторами сTLA4 и МКА - блокаторами PD1 (ИПИ 1/ПЕМБРО 200) [305] (Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4). | пембролизумаб** (в один день с ипилимумабом**) | 200 мг | В/в капельно 30 мин | 1 раз в 21 день | Суммарно не более 4 введений |
| Ипилимумаб** (в один день с пембролизумабом**) | 1 мг/кг | В/в капельно 30 мин | 1 раз в 21 день | Суммарно не более 4 введений | |
| Поддерживающая фаза: пембролизумаб** ИЛИ | 200 мг | В/в капельно 30 мин | 1 раз в 21 день | Длительно | |
| Поддерживающая фаза: пембролизумаб** | 400 мг | В/в капельно 30 мин | 1 раз в 42 дня | Длительно |
• При наличии признаков прогрессирования заболевания на фоне применения монотерапии ИПК вRAF переключение пациентов на комбинированную терапию ИПК вRAF + MEK не рекомендуется, так как вероятность получить ответ на лечение остается низкой, а медиана времени до прогрессирования не превышает 3 мес [125].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• При наличии признаков прогрессирования заболевания на фоне применения одного из ИПК вRAF или одной из комбинаций ИПК вRAF и МЕК ( см табл.9) не рекомендуется переключать пациентов на другой ИПК вRAF или другую комбинацию ИПК вRAF и МЕК. Имеющиеся преклинические данные позволяют предположить аналогичные механизмы действия и формирования резистентности к вемурафенибу**/кобиметинибу** и дабрафенибу**/траметинибу** [306, 307]. Сведения о наличии клинической эффективности подобного переключения также отсутствуют.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -4).
• При медленно прогрессирующей метастатической и/или местно-распространенной меланоме (III неоперабельной - IV стадии) у пациентов с ожидаемой продолжительностью жизни не менее 6 мес при отсутствии противопоказаний независимо от статуса мутации вRAF рекомендуется использование препарата ипилимумаб** [308] или комбинации МКА-блокаторов PD1 и сTLA4 после прогрессирования болезни на фоне стандартной терапии (МКА-блокаторы PD1, ИПК вRAF, комбинация ИПК вRAF и МЕК) или в случае ее непереносимости [309-313]. Режим применения ипилимумаба** приведен в табл. 12.
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарий. Ипилимумаб** является блокатором антигена 4 цитотоксического Т-лимфоцита (МКА-блокатором сTLA4) и относится к категории иммуноонкологических препаратов. Ипилимумаб** используется в дозе 3 мг/кг в/в в виде 90-минутной инфузии каждые 3 нед (1, 4, 7 и 10-я недели, всего 4 введения (объединенный анализ данных продемонстрировал показатель 7-летней общей выживаемости 17 % среди всех пациентов с метастатической и/или местно-распространенной формой меланомы, получавших ипилимумаб**). Первое контрольное обследование рекомендуется проводить на 12-й неделе от начала лечения (при отсутствии клинических признаков выраженного прогрессирования). Учитывая возможность развития аутоиммунных нежелательных явлений (диарея, колит, гепатит, эндокринопатии, дерматит), необходимо их своевременное выявление и активное лечение в соответствии с общепринятыми алгоритмами.
Таблица 12. Режим применения ипилимумаба** при меланоме кожи.
| Схема терапии | Препарат | Доза | Путь введения | Дни введения | Длительность цикла, дни, режим |
| Монотерапия [209-211] | Ипилимумаб** | 3 мг/кг массы тела | В/в капельно 90 мин | 1 раз в 21 день | Максимум 4 введения |
• Пациентам с мутацией в гене вRAF (с эквивалентом III неоперабельной - IV стадии) при отсутствии противопоказаний рекомендуется проводить комбинированную иммунную и таргетную терапию МКА-блокаторами PDl1 (атезолизумаб**) и ингибиторами протеинкиназы вемурафенибом** и кобиметинибом** [314]. Режимы применения приведены в таблице 13.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. Комбинация атезолизумаба**, вемурафениба** и кобиметиниба** изучалась у больных с вRAF-мутированной меланомой в первой линии терапии и оказалась лучше, чем комбинированная таргетная терапия вемурафенибом** и кобиметинибом** в отношении времени без прогрессирования с пограничной значимостью. Мы полагаем, что тройная комбинация может быть предпочтительнее, чем терапия вемурафенибом и кобиметинибом у определенной части пациентов с мутацией в гене вRAF, тем не менее, к настоящему времени нет достаточных научных данных эту часть пациентов определить точнее. Врачу-онкологу при назначении этого режима лечения следует взвесить все потенциальные риски и ожидаемую пользу.
Таблица 13. Режимы применения МКА-блокатора aPDL1 атезолизумаба** и ИТК вемурафениба** и комбиметиниба**.
| Схема терапии | Препарат | Доза | Путь введения | Дни введения | Длительность цикла, дни, режим |
| Атезолизумаб** + вемурафениб** + кобиметиниб** | Вемурафениб** | 960 мг 2 раза в день | Внутрь | Ежедневно дни 1-21 | День 1-21 (вводный период комбинированной таргетной терапии) |
| Кобиметиниб** | 60 мг 1 р/сут | Внутрь | Ежедневно дни 1-21 | День 1-21 (вводный период комбинированной таргетной терапии) | |
| Вемурафениб** | 720 мг 2 раза в день | Внутрь | Ежедневно дни 22-28 | День 22-28 (вводный период комбинированной таргетной терапии)) | |
| Атезолизумаб** ИЛИ (!) | 840 мг | в/в кап | День 1 (29), 15 (44) | Начиная с 29-го дня цикла каждый 1 и 15 день | |
| Атезолизумаб** | 1200 мг | в/в кап | День 1 (29), 22 | Начиная с 29-го дня цикла каждые 3 недели | |
| ИЛИ (!) Атезолизумаб** | 1680 мг | в/в кап | День 1 (29) | Начиная с 29-го дня цикла каждые 4 недели | |
| Вемурафениб** | 720 мг 2 раза в день | Внутрь | Ежедневно дни 1-28 | День 1-28 (период лечения тройной комбинацией) | |
| Кобиметиниб** | 60 мг 1 р/сут | Внутрь | Ежедневно дни 1-21 | День 1-21 (период лечения тройной комбинацией) | |
| Вемурафениб** 960 мг (четыре таблетки по 240 мг) перорально два раза в сутки вместе с кобиметинибом** 60 мг (три таблетки по 20 мг) перорально 1 раз в сутки с 1 по 21 день с последующим приемом вемурафениба** 720 мг (три таблетки по 240 мг) перорально два раза в сутки с 22 по 28 дни. Период тройной комбинации (с 29 дня и далее): атезолизумаб** 840 мг внутривенно в день 1 и 15, кобиметиниб** 60 мг (три таблетки по 20 мг) перорально 1 раз в сутки в дни с 1 по 21, вемурафениб** 720 мг (три таблетки по 240 мг) перорально 2 раза в день с 1 по 28 день 28-дневного цикла. Лечение проводят до прогрессирования или неприемлемой токсичности. При необходимости вводный период (лечение только комбинацией вемурафениба** и кобиметиниба**) может быть продлен до 56 дней, а режим введения атезолизумаба** изменен на атезолизумаб** 1200 мг внутривенно в день 1, каждые 21 день или на атезолизумаб** 1680 мг внутривенно в день 1, каждые 28 дней. | |||||
• Пациентам с мутацией в гене вRAF (с эквивалентом III неоперабельной. IV стадии) при отсутствии противопоказаний рекомендуется проводить комбинированную иммунную и таргетную терапию МКА-блокаторами PD1 (пембролизумаб**) и ингибиторами протеинкиназы дабрафенибом** и траметинибом** [315] Режимы применения приведены в табл. 14.
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарий. Комбинация пембролизумаба**, дабрафениба** и траметиниба** изучалась у больных с вRAF-мутированной меланомой в первой линии терапии и оказалась лучше, чем комбинированная таргетная терапия дабрафенибом** и траметинибом*8 в отношении времени без прогрессирования, однако это улучшение не достигло статистической значимости. При периоде наблюдения 36,6 месяцев медиана ВБП составила 16,9 мес. в группе тройной комбинации и 10,7 мес. в группе таргетной терапии (ОР 0,53; 95% ДИ от 0,34 до 0,83). Общая выживаемость также имела тенденцию к улучшению в группе тройной комбинации (не значимо). Мы полагаем, что тройная комбинация может быть предпочтительнее, чем терапия дабрафенибом** и траметинибом** у определенной части пациентов с мутацией в гене вRAF, тем не менее, к настоящему времени нет достаточных научных данных эту часть пациентов определить точнее. Врачу-онкологу при назначении этого режима лечения следует взвесить все потенциальные риски и ожидаемую пользу.
Таблица 14. Режимы применения МКА-блокатора aPD1 пембролизумаба** и ИТК дабрафениба** и траметиниба**.
| Схема терапии | Препарат | Доза | Путь введения | Дни введения | Длительность цикла, дни, режим |
| Пембролизумаб** + дабрафениб** + траметиниб** | дабрафениб** | 150 мг 2 раза в день | Внутрь | Ежедневно | Длительно |
| Траметиниб** | 2 мг 1 р/сут | Внутрь | Ежедневно | Длительно | |
| Пембролизумаб** | 200 мг | Внутривенно | День 1, 22 | Каждые 21 день |
• При невозможности проведения терапии (или сроке ожидания начала такой терапии более 1 мес) ИПК вRAF или комбинацией ИПК вRAF и МЕК, или МКА-блокаторами PD1, или МКА-блокаторами сTLA4 в 1-й или во 2-й линии у пациентов с метастатической или нерезектабельной меланомой и мутацией в гене вRAF в опухоли при сохранении удовлетворительного общего состояния пациента (ECOG 0-2) и при ожидаемой продолжительности жизни более 3 мес рекомендуется проведение цитотоксической химиотерапии [316-324]. Наиболее распространенные режимы химиотерапии (монотерапия или комбинации) приведены в табл. 15. Назначение других лекарственных препаратов для лечения диссеминированной формы меланомы проводится решением консилиума или врачебной комиссии.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 1).
Комментарий. Данный вид лечения менее эффективен в отношении увеличения общей продолжительности жизни, времени до прогрессирования, частоты объективных ответов на лечение и в большинстве случаев сопровождается более выраженными нежелательными реакциями в сравнении с ИПК вRAF или комбинацией ИПК вRAF и МЕК, или МКА-блокаторами PD1 или сTLA4. В связи с этим следует избегать применения химиотерапии в 1-й линии лечения пациентов метастатической или нерезектабельной меланомой и мутацией в гене вRAF всегда, когда это возможно.
Таблица 15. Наиболее распространенные режимы химиотерапии при метастатической меланоме кожи.
| Схема терапии | Препарат | Доза | Путь введения | Дни приема | Длительность цикла, дни, режим | Ссылка |
| Монотерапия | Дакарбазин** | 1000 мг/м2 | В/в | 1-й | 21 | [122, 293, 316-318, 325, 326] |
| Монотерапия | Дакарбазин** | 250 мг/м2 | В/в | 1-5-й | 21 | |
| Монотерапия | Темозоломид** | 200 мг/м2 | Внутрь или в/в | 1-5-й | 28 | [319] |
| Монотерапия | Ломустин** | 130 мг/м2 | Внутрь | 1-й | 42 | [327-329] |
| Комбинация | Цисплатин** | 20 мг/м2 | В/в | 1-4-й | 21 (2 курса и обследование, максимально - до 6 курсов) | [323, 324, 330] |
| Винбластин** | 2 мг/м2 | в/в | 1-4-й | |||
| Дакарбазин** | 800 мг/м2 | в/в | 1-й | |||
| Комбинация | Паклитаксел** | 225 мг/м2 | В/в | 1-й | 21 | [281][331] |
| Карбоплатин** | AUC 6 | в/в | 1-й | |||
| Комбинация | Паклитаксел** | 175мг/м2 | В/в | 1-й | 21 | [321, 322, 332] |
| Карбоплатин** | AUC 6 | в/в | 1-й |
• При проведении химиотерапии оценку эффекта лечения рекомендовано проводить после каждого 2-3-го цикла (каждые 7-12 нед). Для оценки эффекта терапии рекомендуется использовать оценку общего состояния пациента и методы лучевой диагностики ( см табл. 7, раздел 2) а также стандартные критерии ответа на цитостатическую терапию (RECIST 1,1) [296, 297].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• При проведении противоопухолевого лекарственного лечения при расчете доз препаратов на поверхность или массу тела рекомендуется проводить округление фактических доз в пределах 5 % расчетных [333, 334].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• При прогрессировании после первой линии терапии одним из МКА-блокаторов PD1 у больных меланомой кожи с мутацией в гене вRAF предпочтение рекомендуется отдавать монотерапии блокатором сTLA4 или комбинированной терапии ИПК вRAF и MEK [335].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 3).
Комментарий. В исследовании I.P. da Silva с соавт. показано увеличение частоты объективных ответов с 9% при монотерапии ипилимумабом** до 38% при комбинированной терапии ипилимумабом** и ниволумабом** у пациентов с без мутации в гене вRAF. При наличии мутации частота ответов была похожей (24% и 19% соответственно)[335]».
• У пациентов c вRAF мутированной меланомой (III неоперабельной. IV стадии) в 3 линии терапии, после проведения иммунотерапии и терапии ИПК (iBRAF +/ - MEK), а так же у пациентов без мутации в гене вRAF (III неоперабельной - IV стадии) во 2 линии после применения иммунотерапии (МКА-блокаторов PD-1+/ - анти сTLA4), учитывая малую эффективность химиотерапии, рекомендуется применение терапии по схеме ленватиниб** + пембролизумаб** [336]. Режим применения приводится в таблице 16.
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
Таблица 16. Комбинированная терапия МКА- блокаторами - блокаторами PD1 и ИТК ленвантинибом**.
| Схема терапии | Препарат | Доза | Путь введения | Дни введения | Длительность цикла, дни, режим |
| Комбинированная терапия МКА. Блокаторами - блокаторами PD1 и ИТК ленвантинибом [336] | Пембролизумаб** | 200 мг | В/в капельно 30 мин | 1 раз в 21 день | длительно |
| Ленватиниб** 20 мг внутрь | 20 мг | Внутрь | 1 раз /сут ежедневно | длительно |
• Рекомендуется повторное назначение комбинированной терапии ИПК вRAF и MEK у пациентов, которые ранее длительно (более 6 мес.) получали терапию ИПК вRAF и MEK и у которых был отмечен объективный ответ на лечение, в случае прогрессирования или непереносимости МКА-блокаторами PD1 или комбинации МКА-блокаторов PD1 и сTLA4, назначенных во второй линии [337, 338].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
• Рекомендуется продолжить комбинированную терапию ИПК вRAF и MEK или монотерапию МКА-блокаторами PD1 у пациентов, при изолированном прогрессировании единичных метастазов с возможностью их хирургического удаления или проведения стереотаксической радиохирургии на прогрессирующие очаги («олигопрогрессирование») [339].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
3,4,3 Выбор терапии у пациентов метастатической или неоперабельной меланомой кожи с мутацией в гене KIT.
• У пациентов с мутацией в гене KIT и ожидаемой продолжительностью жизни более 3 месяцев в качестве терапии 1-й или последующих линий рекомендована монотерапия МКА-блокаторами PD1 или комбинацией МКА-блокаторов сTLA4 и PD1[279, 281, 282, 286, 340, 341]. Стандартные режимы применения приведены в табл. 11.Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарий. Популяция пациентов с мутацией в гене c-Kit в опухоли не изучалась отдельно в рандомизированных исследованиях, однако ее следует рассматривать как популяцию больных без мутации в гене вRAF.
• У пациентов с мутацией в гене KIT и ожидаемой продолжительности жизни более 3 месяцев в качестве терапии 2-й или последующих линий рекомендована терапия ИПК Kit иматинибом**. Лечение иматинибом** проводится до прогрессирования заболевания или развития выраженных, не купируемых редукцией дозы токсических явлений. Режим применения приведен в табл. 17 [145, 146].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 3).
Таблица 17. Режим применения иматиниба** при меланоме кожи.
| Схема терапии | Препарат | Доза | Путь введения | Дни введения | Длительность цикла, дни, режим |
| Монотерапия | Иматиниб** | 400 мг 2 р/сут | Внутрь | Ежедневно | Длительно, до прогрессирования |
• Оценку эффекта терапии ИПК иматинибом** рекомендуется проводить не реже 1 раза через каждые 8-10 нед терапии, не допуская перерывов в приеме препарата на период оценки эффекта. Для оценки эффекта терапии рекомендуется использовать оценку общего состояния пациента и методы лучевой диагностики ( см табл. 7), а также стандартные критерии ответа на цитостатическую терапию (RECIST 1,1) [137, 145, 296, 297].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• Не рекомендуется проводить терапию иматинибом** пациентам с неизвестным статусом опухоли в отношении мутации в гене Kit, так как сведения о клинической пользе от применения иматиниба** у пациентов без активирующей мутации в гене Kit отсутствуют [146, 149, 342, 343].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 3).
• При наличии признаков прогрессирования заболевания на фоне применения иматиниба** при сохранении удовлетворительного общего состояния пациента (ECOG 0-2) и ожидаемой продолжительности жизни более 3 мес рекомендуется проводить терапию модуляторами иммунологического синапса - МКА-блокаторами PD1 и/или сTLA4 (в случае, если она не проводилась ранее) [344, 345]. Режимы применения приведены в табл.11, 16.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
• При невозможности проведения терапии (или сроке ожидания начала такой терапии более 1 мес) иматинибом** или МКА-блокаторами PD1 и/или сTLA4 в 1-й или во 2-й линии у пациентов с метастатической или нерезектабельной меланомой с мутацией в гене Kit в опухоли при сохранении удовлетворительного общего состояния пациента (ECOG 0-2) и при ожидаемой продолжительности жизни более 3 месяцев рекомендуется проведение цитотоксической химиотерапии [316-324]. Наиболее распространенные режимы химиотерапии (монотерапия или комбинации) приведены в табл. 15. Назначение других лекарственных препаратов для лечения диссеминированной формы меланомы проводится решением консилиума или врачебной комиссии.
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарий. Данный вид лечения менее эффективен в отношении увеличения общей продолжительности жизни, времени до прогрессирования, частоты объективных ответов на лечение и в большинстве случаев сопровождается более выраженными нежелательными реакциями в сравнении с ИПК KIT или МКА-блокаторами PD1 или сTLA4. В этой связи следует избегать применения химиотерапии в 1-й линии лечения пациентов метастатической или нерезектабельной меланомой и мутацией в гене KIT или NRAS всегда, когда это возможно.
3,4,4 Выбор терапии 1-й линии у пациентов без мутаций в генах вRAF, NRAS, KIT.
• У пациентов без мутаций в генах вRAF, NRAS, KIT при сохранении удовлетворительного общего состояния пациента (ECOG 0-2) и при ожидаемой продолжительности жизни более 3 месяцев рекомендуется терапия комбинацией МКА-блокаторов PD1 и сTLA4 или монотерапия МКА-блокаторами PD1 [279, 281, 282, 286, 340, 341]. Стандартные режимы применения приведены в табл. 11.Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
• При очевидном прогрессировании болезни на фоне терапии одним из МКА-блокаторов PD1 не рекомендуется применять другой препарат этой же подгруппы. Имеющиеся доклинические данные позволяют предположить аналогичные механизмы действия и формирования резистентности к ниволумабу** и пембролизумабу**. Сведения о наличии клинической эффективности подобного переключения также отсутствуют.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• При очевидном прогрессировании болезни на фоне терапии одним из МКА-блокаторов PD1 рекомендуется рассмотреть возможность проведения терапии комбинацией МКА-блокаторов PD1 и сTLA4 [346] или монотерапию МКА-блокатором сTLA4 [308, 347] . Режимы применения приведены в таблицах 11 и 12, 16 соответственно.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств -3).
• При невозможности проведения терапии (или сроке ожидания начала такой терапии более 1 мес. МКА-блокаторами PD1 и сTLA4 в 1-й или во 2-й линии у пациентов с метастатической или нерезектабельной меланомой без мутаций в генах вRAF, NRAS, и KIT в опухоли при сохранении удовлетворительного общего состояния пациента (ECOG 0-2) и при ожидаемой продолжительности жизни более 3 мес.рекомендуется проведение цитотоксической химиотерапии [316-324]. Наиболее распространенные режимы химиотерапии (монотерапия или комбинации) приведены в табл. 15. Назначение других лекарственных препаратов для лечения диссеминированной формы меланомы проводится решением консилиума или врачебной комиссии».
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 1).
Комментарий. Данный вид лечения менее эффективен в отношении увеличения общей продолжительности жизни, времени до прогрессирования, частоты объективных ответов на лечение и в большинстве случаев сопровождается более выраженными нежелательными реакциями в сравнении с МКА-блокаторами PD1 или сTLA4. В связи с этим следует избегать применения химиотерапии в 1-й линии лечения пациентов метастатической или нерезектабельной меланомой без мутаций в генах вRAF и c-Kit всегда, когда это возможно.
• При прогрессировании после адъювантной терапии одним из МКА-блокаторов PD1 предпочтение рекомендуется отдавать комбинации МКА-блокаторов PD1 и блокаторов сTLA4 [335].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 3).
Комментарий. В исследовании I.P. da Silva с соавт. показано увеличение частоты объективных ответов с 13% при монотерапии ипилимумабом** до 36% при комбинированной терапии ипилимумабом** и ниволумабом**[335].
• При прогрессировании после первой линии терапии у больных без мутации в гене вRAF одним из МКА-блокаторов PD1 предпочтение рекомендуется отдавать комбинации МКА-блокаторов PD1 и блокаторов сTLA4.
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарий. В исследовании I.P. da Silva с соавт. показано увеличение частоты объективных ответов с 9% при монотерапии ипилимумабом** до 38% при комбинированной терапии ипилимумабом** и ниволумабом** у пациентов с без мутации в гене вRAF. При наличии мутации частота ответов была похожей (24% и 19% соответственно) [335].
• При прогрессировании на фоне терапии одним из МКА-блокаторов PD1 у больных с или без мутации в гене вRAF рекомендуется повторное назначение МКА-блокаторов PD1 (или назначение комбинированной терапии МКА-блокаторами PD1 и сTLA4) в случае если соблюдаются 4 условия: 1) контроль над заболеванием (объективный ответ или стабилизация) при первом назначении МКА-блокаторов PD1 составил 6 мес. и более; 2) лечение 2-й (или последующих линий) более не приносит пользы (отмечается прогрессирование заболевания или непереносимость лечения); 3) состояние пациента по шкале ECOG <=2 или ожидаемая продолжительность жизни более 3 мес. 4) имевшиеся ранее нежелательные явления при применении МКА-блокаторов PD1 разрешились (<=1 степ. по СТСАЕ v 5,0) И никогда не достигали 4 степ. по СТСАЕ v 5,0 [348].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 3).
У пациентов без мутации в гене вRAF (III неоперабельной. IV стадии) во 2 линии после применения иммунотерапии (МКА-блокаторов PD-1+/ - анти сTLA4), учитывая малую эффективность химиотерапии, рекомендуется применение терапии по схеме ленватиниб** + пембролизумаб** [336]. Режим применения приводится в таблице 16. Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
3,4,5 Особенности оценки ответа на лечение МКА-блокаторами PD1 или сTLA4.
МКА-блокаторы PD1 или сTLA4 представляют собой принципиально новый класс лекарственных препаратов, эффект которых развивается в результате воздействия на элементы иммунной системы пациента. Сами лекарственные средства не обладают противоопухолевым эффектом, а элиминация опухолевых клеток достигается за счет активации клеток иммунной системы пациента. Это обусловливает особенности развития клинического и радиологического ответа на лечение.• Всем пациентам с меланомой на фоне лечения МКА-блокаторами PD1 или сTLA4 рекомендуется проводить первоначальную радиологическую оценку ответа на лечение не ранее 12 недель от начала терапии (при отсутствии клинического ухудшения состояния пациента). Повторные исследования проводятся через 8-12 недель (при отсутствии клинического ухудшения состояния пациента) [279, 281, 282, 341, 349].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
• Рекомендуется для оценки ответа на лечение МКА-блокаторами PD1 или сTLA4 использовать модифицированные критерии ответа на лечение, которые допускают появление новых очагов (при отсутствии клинического ухудшения состояния пациента) [349] (табл. 18).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Таблица 18. Сравнение традиционных критериев (на примере RECIST) и критериев оценки ответа на МКА-блокаторы PD1 или сTLA4 (mRECIST или irRC) [349-351].
| Опухолевый ответ | RECIST | irRC |
| Полный ответ | Исчезновение всех очагов | Исчезновение всех очагов, в том числе новых |
| Частичный ответ | Уменьшение суммы максимальных диаметров таргетных очагов более чем на 30 % при отсутствии прогрессирования со стороны других очагов поражения либо появления новых | Уменьшение суммы произведений поперечных диаметров таргетных и новых очагов более чем на 30 %. Допускается появление новых очагов |
| Стабилизация | Уменьшение опухолевых образований менее чем на 30 % или увеличение не более чем на 20 % при отсутствии новых поражений | Уменьшение опухолевых образований менее чем на 30 % при отсутствии новых поражений или увеличение не более чем на 20 %. Допускается появление новых очагов |
| Прогрессирование | Увеличение сумы максимальных диаметров таргетных очагов более чем на 20 % и/или появление новых очагов | Увеличение суммы произведений поперечных диаметров таргетных и новых очагов более чем на 20 % |
3,4,6 Длительность лечения МКА-блокаторами PD1 или сTLA4.
• Рекомендуется применять МКА-блокатор сTLA4 (ипилимумаб**) в режиме ограниченного количества введений - не более 4. В некоторых случаях (при стабилизации заболевания или объективном ответе на лечение более 6 мес, сменившимися прогрессированием заболевания) допускается повторное применение курса лечения ипилимумабом** (также не более 4 введений) [309].Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
• Рекомендуется МКА-блокаторы PD1 назначать в постоянном режиме до наступления прогрессирования или непереносимости с интервалом введения в 2 недели или 4 недели для ниволумаба** в зависимости от режима дозирования, в 3 или 6 недель - для пембролизумаба** ( см также раздел 3,4,5 и табл. 10)[279, 281, 282, 341].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. В исследовании KEYNOTE-006 длительность режимов иммунотерапии у пациентов с метастатической меланомой и сохранением пользы от терапии не превышала 24 мес., что может свидетельствовать о том, что возможно безопасно завершить терапию у пациентов с ответом на лечение после 24 мес. терапии[352].
3,4,7 Лечение пациентов с особыми формами метастатической меланомы: олигометастатической, местно-распространенной, с метастазами в костях.
• Пациентов с солитарными отдаленными метастазами меланомы (в мягкие ткани, легкие, головной мозг ) и хорошим соматическим статусом рекомендуется рассматривать в качестве кандидатов для радикального хирургического лечения, которое может обеспечить длительный безрецидивный период [353-355].Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарии. Роль хирургии возрастает в связи с появлением для этой группы пациентов эффективной адъювантной терапии МКА--блокатором PD1 - препаратом ниволумаб**, который в рандомизированном исследовании продемонстрировал увеличение безрецидивной выживаемости в сравнении с наблюдением [230].
• При достижении эффекта от проводимой системной терапии может рассматриваться проведение полных циторедуктивных вмешательств. Проведение неполной циторедукции не рекомендовано [356, 357].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
• Пациентов с местно-распространенной нерезектабельной формой меланомы кожи и изолированным поражением конечности, не ответившим на стандартную терапию (ингибиторы вRAF или MEK, МКА-блокаторы PD1 или сTLA4), рекомендуется рассматривать в качестве кандидатов для проведения изолированной гипертермической перфузии конечности с мелфаланом**. [358-361].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарий. Данная процедура проводится в отдельных специализированных центрах.
• При обширных по площади поражениях кожи лица (меланома по типу злокачественного лентиго) для пациентов, не желающих быть подвергнутыми реконструктивно-пластической операции на лице, рекомендуется использование крема имихимод в качестве средства для уменьшения площади злокачественного лентиго в предоперационном периоде (5 раз в неделю в течение 3 месяцев с использованием 5% крема имихимод перед иссечением) [362-364].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств -2).
• При меланоме по типу злокачественного лентиго 0 стадии для пациентов, не желающих быть подвергнутыми реконструктивно-пластической операции на лице, рекомендуется использование крема имихимод в качестве самостоятельного метода лечения (ежедневно в течение 3 месяцев с использованием 5% крема имихимод перед иссечением) [362-364].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
• При метастазах в регионарных лимфатических узлах и невозможности их хирургического удаления рекомендуется рассмотреть возможность проведения дистанционной лучевой терапии в различных режимах: 50 Гр за 20 фракций в течение 4 недель; 32 Гр за 4 фракции в течение 4 недель [237].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств 3).
Комментарий. Также может применяться режим лучевой терапии 30 Гр за 10 фракций в течение 2 нед [365].
• При симптомных метастазах в костях с обезболивающей целью рекомендуется проведение паллиативной лучевой терапии в одном из следующих режимов: 30 Гр за 10 фракций в течение 2 недель; 20 Гр за 5 фракций за 5-7 дней, 24 Гр за 6 фракций в течение 3 нед [237, 365-367].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - - 1).
3,4,8 Лечение пациентов с метастазами в головном мозге.
Частота развития метастазов в головном мозге у пациентов с генерализованной меланомой достигает 28% и превышает аналогичный показатель у пациентов с немелкоклеточным раком легкого (26,8%) и Her2- позитивным раком молочной железы (11,5%). С учетом особенного течения болезни при поражении ЦНС в клинической рекомендации выделен отдельны раздел по тактике ведения пациентов с метастазами в ЦНС.Проведение магнитно-резонансной томографии (МРТ) головного мозга с внутривенным контрастированием рекомендуется:
• пациентам с меланомой IIIC стадии и выше для скрининга бессимптомных метастазов в головной мозг.
• пациентам с неврологической симптоматикой независимо от стадии заболевания.
• пациентам с метастазами меланомы в головном мозге после локального и системного лечения для оценки эффективности проведенного лечения [368-370].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. МРТ головного мозга рекомендуется выполнять в следующих режимах - до внутривенного введения контрастного средства в режимах Т1в аксиальной проекции (толщина среза 1-1,5 мм), Т2, ДВИ, FLAIR (толщина среза 3-5 мм). После внутривенного введения контрастного вещества: Т1 в аксиальной проекции (толщина среза 1-1,5 мм), 3D T1 взвешенные изображения высокого разрешения в аксиальной (или сагиттальной) плоскости с захватом всей головы с применением технологии изотропного воксела (1мм×1мм×1мм). Проведение компьютерной томографии (КТ) с контрастированием для диагностики метастатического поражения головного мозга возможно только при наличии противопоказаний к проведению магнитно-резонансной томографиию.
• Рекомендуется строить алгоритм выбора тактики лечения у пациентов с метастазами в головном мозге в ходе мультидисциплинарного консилиума с участием врача-нейрохирурга, врача-радиотерапевта и врача-онколога на основании следующих критериев [368-373]:
- экстракраниальное распространение заболевания и его контроль;
- наличие резервов противоопухолевой лекарственной терапии;
- размер метастазов в головном мозге (более или менее 2 см);
- количество метастазов в головном мозге (солитарный метастаз, олигометастатическое поражение (2-4 метастаза), множественные метастазы (5 и более));
- бщее состояние по шкале Карновского (более 70 %, менее 70 %) (Приложение Г2);
- прогноз общей выживаемости (больше или меньше 6 мес. по шкале GPA (он-лайн калькулятор на сайте https://brainmetgpa.com/), Приложение Г4.
- расположение метастазов в функционально значимых частях мозга;
- наличие или отсутствие неврологической симптоматики, обусловленной метастатическим поражением головного мозга.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
Комментарий: Радиотерапевтическое лечение следует рассматривать у пациентов с первично выявленными метастазами меланомы в головном мозге в самостоятельном варианте лечения или как компонент комбинированного варианта лечения (с нейрохирургческим этапом), а также у пациентов с интракраниальной прогрессией (локальные рецидивы или развитие новых дистантных метастазов) после ранее проведенного лечения. Вариантами радиотерапии в лечении пациентов с метастазами меланомы в головном мозге являются: стереотаксическая радиотерапия (СРТ) и облучение всего головного мозга (ОВГМ). СРТ может быть реализована в режиме радиохирургии (1 фракция) или гипофракционирования (от 3 до 7 фракций) и используется в самостоятельном варианте лечения или в комбинации с ОВГМ или нейрохирургией [1,2]. Проведение радиотерапии не рекомендуется у пациентов с бессимптомными метастазами в головной мозг с низким функциональным статусом (индекс Карновского 50% и ниже) или у пациентов с индексом Карновского <70%, экстракраниальной прогрессией болезни и отсутствием резервов лекарственной противоопухолевой терапии. Выбор режима фракционирования СРТ зависит от дозовой нагрузки на нормальную ткань мозга, которая определяется количеством и размерами метастазов меланомы в головном мозге. СРТ в режиме радиохирургии может быть реализована при условии, что при подведение очаговой дозы 20-24 Гр объем нормальной ткани мозга, облученной дозой 12 Гр не превышает 10 см3 (V12Гр ≤10 см3). Для любых метастазов меланомы в головном мозге, при которых V12Гр >10 см3 показано проведение СРТ в режиме гипофракционирования[368-370].
• Рекомендуется открытая нейрохирургическая операция пациентам с первично выявленными или рецидивирующими краниальными метастазами меланомы при наличии:
- метастатического очага с максимальным диаметром 2 см и более.
- метастатического очага любого размера, определяющего клиническую картину внутричерепной гипертензии, дислокации срединных структур мозга, обширного перифокального отека, а также при наличии угрозы блокирования ликворных путей.
- клинических ситуаций, контроль которых невозможен с помощью других лечебных мероприятий (радиорезистентный локальный рецидив после стереотаксической радиотерапии, симптоматический радионекроз, резистентный к проводимой терапии) [368].
Уровень убедительности рекомендаций С (уровень достоверности доказательств -5).
Комментарии. Необходимым условием проведения нейрохирургического лечения является локализация метастатического очага в зонах мозга, где его удаление не сопровождается развитием/нарастанием неврологического дефицита. Лучшие показатели общей выживаемости достигаются у пациентов с высоким функциональным статусом (индекс Карновского ≥ 80) и контролем экстракраниального опухолевого процесса. При наличии первично выявленных или рецидивирующих метастазов меланомы в головном мозге целесообразно проводить нейрохирургического лечение в комбинации со стереотаксической радиотерапией (предоперационная радиохирургия или послеоперационная стереотаксическая радиотерапия ложа удаленного метастатического очага) для снижения риска локального рецидива Целесообразно проведение КТ головного мозга с/без контрастирования в течение 24-48 часов после проведения нейрохирургической резекции для диагностики послеоперационного кровоизлияния.
• У пациентов с наличием от 1 до 4 метастазов в головном мозге и благоприятным прогнозом общей выживаемости по шкале GPA рекомендуется: проведение СРТ в режиме радиохирургии при наличии метастатических очагов в головном мозге с максимальным диаметром 2,0 см и меньше без клинических проявлений масс-эффекта [369, 370].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Благоприятный прогноз общей выживаемости определяется наличием у пациентов высокого функционального статуса (индекс Карновского ≥80, или ECOG 0-1), выживаемость по шкале GPA 6 и более мес., стабилизацией экстракраниальных метастазов и/или наличием резервов системного противоопухолевого лечения. СРТ в режиме радиохирургии является оптимальной лечебной опцией у пациентов с очагами <2 см в максимальном измерении и реализуемой очаговой дозой радиации 20-24 Гр. У пациентов с очагами ≥2 см в максимальном измерении СРТ в режиме радиохирургии может быть реализована при условии, что при очаговой дозе радиации не ниже 20 Гр, объем нормальной ткани мозга, облученной дозой 12 Гр не превышает 10 см3 (V12Гр ≤10 см3) .
• Рекомендуется проведение СРТ в режиме гипофракционирования при наличии метастатических очагов в головном мозге с максимальным диаметром 2,0 см и больше, без клинических проявлений масс-эффекта и наличии противопоказаний к проведению нейрохирургии [369-371].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. СРТ в режиме гипофракционирования является оптимальной опцией у пациентов с наличием очагов ≥ 2 см в максимальном измерении, либо при наличии очагов, локализованных в критических структурах мозга (зрительные тракты, ствол головного мозга и пр. Рекомендуемыми режимами гипофракционирования являются: 3 фракции разовой дозой 8 Гр/9 Гр, 5 фракций разовой дозой 6 Гр и 7 фракций разовой дозой 5 Гр. При проведении гипофракционирования необходимо соблюдать дозовые ограничения: объем 10 см3 нормальной ткани мозга не должен быть облучен дозой выше 19,2Гр (за 3 фракции), 23,4 Гр (за 5 фракций) и 26,5 Гр (за 7 фракций).
• У пациентов с наличием от 5 и более метастазов меланомы в головном мозге и благоприятным прогнозом общей выживаемости рекомендуется проведение СРТ в режиме радиохирургии или гипофракционирования или облучение всего головного мозга [369, 370].
Уровень убедительности рекомендаций С (уровень достоверности доказательств -5).
Комментарии. У пациентов с множественными метастазами меланомы в головном мозге, благоприятным прогнозом общей выживаемости (изолированная интракраниальной прогрессия, отсутствие или стабилизация экстракраниальных метастазов, наличие резервов лекарственной противоопухолевой терапии), проведение СРТ в режиме радиохирургии или радиотерапии в самостоятельном варианте лечения является предпочтительной лечебной опцией. Необходимо регулярное проведение МРТ головного мозга для раннего выявления интракраниальной прогрессии и проведения повторного локального лечения (нейрохирургия и/или радиотерапия). Проведение ОВГМ в самостоятельном варианте лечения следует рассматривать у пациентов с прогрессирующим множественным, диссеминированным или лептоменингиальными поражением головного мозга, при котором невозможно проведение стереотаксической радиотерапии и нейрохирургии, а также в случае неэффективности противоопухолевой лекарственной терапии и отсутствии резервов системного лечения.Стандартные суммарные дозы ОВГМ - 20 Гр (за 5 фракций), 30Гр (за 10 фракций), 37,5 Гр (за 15 фракций). Применение ОВГМ, как компонента комбинированного со СРТ варианта лечения, снижает риск и откладывает время развития новых (дистантных) метастазов в головном мозге, но не обеспечивает увеличение общей выживаемости и увеличивает риск развития когнитивных расстройств. В случае комбинации стереотаксической радиотерапии с последующим проведением ОВГМ целесообразно редуцировать дозы стереотаксической радиотерапии на 20-25% от первоначальной дозы радиации с целью уменьшения риска развития постлучевых изменений[369, 370].
• У пациентов с благоприятным прогнозом общей выживаемости после нейрохирургической резекции метастазов в головном мозге рекомендуется проведение послеоперационной СРТ ложа удаленных очагов в режиме радиохирургии или гипофракционирования [369, 370].
Уровень убедительности рекомендаций С (уровень достоверности доказательств -5).
Комментарии. СРТ в режиме радиохирургии или гипофракционирования после нейрохирургии проводится в интервале от 4 до 6 недель после нейрохирургической резекции. Перед радиотерапией выполняется МРТ головного мозга с оценкой размера послеоперационного ложа, наличия дислокации структур мозга, появления новых или рост имевшихся не резецированных метастазом меланомы в головном мозге. Обязательно совмещение с дооперационной МРТ, после чего определяется объем облучения: послеоперационное ложе + 2 мм краевой отступ (+ 5 мм по твердой мозговой оболочке) и очаги контрастирования не резецированных метастатических очагов без краевого отступа. Для пациентов,, которым планируется нейрохирургическая резекция метастазов в головном мозге, предоперационная радиохирургия может быть альтернативой послеоперационной СРТ в режиме радиохирургии или гипофракционирования.
• У пациентов с неблагоприятным прогнозом общей выживаемости рекомендуется проведение симптоматического лечения [369, 370].
Уровень убедительности рекомендаций С (уровень достоверности доказательств -5).
Комментарии. Неблагоприятный прогноз общей выживаемости определяется наличием у пациентов низкого функционального статуса (индекс Карновского ≤70, или ECOG 3-4), прогноз выживаемости по шкале GPA - меньше 6 мес., наличием экстракраниальной прогрессии и отсутствием резервов системного противоопухолевого лечения. В отдельных клинических ситуациях возможно проведение локального лечения (нейрохирургия и/или радиотерапия) с целью коррекции неврологических расстройств. Решение о проведении локального лечения должно приниматься на мультидисциплинарном консилиуме с учетом потенциальной клинической эффективности и возможных лечебных рисков для пациента.
• У пациентов с крупными метастазми меланомы в головном мозге (или очагами любого размера с перифокальным отеком), которые являются кандидатами для проведения противоопухолевой лекарственной терапии с установленной эффективностью в ЦНС, рекомендуется проведение предварительной локальной терапии (нейрохирургия или стереотаксическая радиотерапия) [368].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
Комментарии. У отдельных пациентов с крупными метастазами в головной мозг вRAF позитивной меланомы (или метастазами в головном мозге любого размера с перифокальным отеком), требующих назначения стероидной терапии, при отсутствии угрожающих жизни неврологических расстройств и невозможности проведения локального лечения (нейрохирургия, СРТ в режиме радиохирургии или гипофракционирования), возможно проведение комбинированной таргетной терапии вRAF и MEK ингибиторами на первом этапе лечения.
Лекарственная терапия пациентов с метастатическим поражением головного мозга проводится по тем же принципам, что и для пациентов с метастазами других локализаций.
• У пациентов со стабильными метастазами меланомы, в головном мозге рекомендуется отдавать предпочтение комбинированной иммунотерапии (МКА-блокаторы сTLA4 и PD1) по сравнению с монотерапией МКА-блокаторами PD1 или сTLA4 [303, 374].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
• При наличии мутации V600 в гене вRAF у пациентов с меланомой и с метастазами в головном мозге рекомендуется отдавать предпочтение комбинированной таргетной терапии ИПК вRAF и MEK по сравнению с применением монотерапии ИПК вRAF [375, 376]. ( см таблицу 10).
Уровень убедительности рекомендаций. в (уровень достоверности доказательств -2).
• При наличии мутации V600 в гене вRAF у пациентов с метастазами меланомы в головном мозге и наличии неврологических симптомов рекомендуется отдавать предпочтение комбинированной иммуно -таргетной терапии ИПК вRAF и MEK и PDL1 [377] ( см также таблицу 13).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -4).
• Не рекомендуется проведение стероидной терапии у пациентов с метастазами меланомы в головном мозге без клинических симптомов и проявлений масс-эффекта [24, 378-382].
Уровень убедительности рекомендаций С (уровень достоверности доказательств -5).
Комментарии. У пациентов с метастазами меланомы в головном мозге и наличием неврологических симптомов, связанными с масс-эффектом, рекомендуется проведение стероидной терапии (дексаметазон**) для ликвидации или временного облегчения симптомов, связанных с повышением внутричерепного давления и вторичным отеком мозга. Доза стероидной терапии должна быть минимально достаточной для купирования симптомов и обычно составляет 4-8-12 мг / сут.
При проведении иммунотерапии (блокаторы сTLA4, PD1 и PD-L1) не рекомендуется превышать дозу дексаметазона** более 4 мг в сутки. Альтернативным вариантом противоотечной терапии в этой клинической ситуации является назначение бевацизумаба**.
• Рекомендуется проведение терапии бевацизумабом** при наличии симптоматического перифокального отека метастатических очагов или радионекроза, резистентных к проводимой стероидной терапии или при наличии противопоказаний к проведению стероидной терапии (например, при необходимости проводить конкурентную терапию МКА-блокаторами PD1 / PDl1, или МКА-блокаторами сTLA4), см также таблицу 19) [24, 378-381].
Уровень убедительности рекомендаций А (уровень достоверности доказательств -2).
Таблица 19. Рекомендуемые режимы применения бевацизумаба** при симптоматическом перифокальном отеке или радионекрозе в головоном мозге.
| Схема терапии | Препарат | Доза | Путь введения | Дни введения | Длительность цикла, дни, режим |
| Монотерапия [379] | Бевацизумаб ** | 5 мг/кг массы тела | В/в капельно | 1 раз в 14 дней | Длительно (от 4 введений до до регресса неврологических симптомов или улучшения рентгенологической картины или явлений непереносимости) |
| Монотерапия[379] | Бевацизумаб ** | 7,5 мг/кг массы тела | В/в капельно | 1 раз в 21 дней | Длительно (от 4 введений до до регресса неврологических симптомов или улучшения рентгенологической картины или явлений непереносимости) |
3,4,9 Конкурентное применение лучевой терапии и системного противоопухолевого лечения.
• Поскольку имеются сведения о радиосенсибилизирующем эффекте ИПК вRAF и MEK в случаях выраженной висцеральной токсичности при их одновременном применении с лучевой терапией, рекомендуется всем пациентам с меланомой прервать прием ИПК вRAF или MEK:─ не менее чем за 3 дня до начала лучевой терапии и возобновить не ранее чем через 3 дня после окончания фракционированной лучевой терапии;
─ как минимум за 1 день до начала стереотаксической радиохирургии (или радиотерапии) и возобновить через 1 день после ее завершения [383-386].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -4).
• В настоящее время не существует убедительных данных, свидетельствующих об ухудшении переносимости лечения при одновременном проведении лучевой терапии и терапии МКА-блокаторами PD1 или сTLA4. Анализ результатов представленных исследований показал, лучевая терапия рекомендуется совместно с терапией МКА-блокаторами PD1 или сTLA4 без потери эффективности и повышения частоты нежелательных реакций [383, 386-388].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 3).
3,4,10 Подходы к лечению пациентов после полного удаления всех метастатических очагов (эквивалент стадии IV, без признаков заболевания).
• Рекомендуется пациентам после полного (R0) удаления отдаленных метастазов меланомы кожи или метастазов меланомы без выявленного пе рвичного очага (в мягкие ткани, легкие, головной мозг ) в течение 3 мес . после хирургического лечения при отсутствии противопоказаний проводить адъювантную терапию ниволумабом** по схеме [230, 247, 248, 300, 389, 390]:Ниволумаб** 3 мг/кг каждые 2 нед в/в капельно 12 месяцев.
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Или ниволумаб** 240 мг каждые 2 нед в/в капельно 12 месяцев, или ниволумаб** 480 мг в/в каждые 4 нед 12 месяцев.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
• Рекомендуется пациентам с метастатической меланомой (эквивалент стадии M1) после хирургического удаления всех метастатических узлов, без признаков заболевания) проведение адъювантной комбинированной терапия МКА-блокаторами сTLA4 и МКА-блокаторами PD1 [391]. Режим применения приведен в Таблице 20.
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Таблица 20. Режим применения комбинированной иммунотерапии у больных после полного (R0) удаления отдаленных метастазов меланомы.
| Ниволумаб** (в один день с ипилимумабом**) | 1 мг/кг | В/в капельно 30 мин | 1 раз в 21 день | Суммарно не более 4 введений |
| Ипилимумаб** (в один день с ниволумабом**) | 3 мг/кг | В/в капельно 30 минут | 1 раз в 21 день | Суммарно не более 4 введений |
| После окончания терапии комбинацией, монотерапия ниволумабом** | 3 мг/кг (но не более 240 мг) или 240 мг | В/в капельно 30 минут | 1 раз в 14 дней | до 12 месяцев с момента начала адъювантной терапии |
| 480 мг [286] | В/в капельно 30 минут | 1 раз в 21 день | до 12 месяцев с момента начала адъювантной терапии |
3,5 Обезболивание.
Принципы обезболивания и оптимального выбора противоболевой терапии у пациентов меланомой с хроническим болевым синдромом соответствуют принципам обезболивания, изложенным в клинических рекомендациях «Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи».3,6 Сопутствующая терапия у больных меланомой кожи.
3,6,1.
Принципы профилактики острой и отсроченной̆ тошноты и рвоты при лекарственном лечении меланомы кожи изложены в методических рекомендациях «ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПРОФИЛАКТИКЕ И ЛЕЧЕНИЮ ТОШНОТЫ И РВОТЫ У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ» Коллектив авторов: Владимирова Л. Ю., Гладков О. А., Королева И. А., Румянцев А. А., Семиглазова Т. Ю., Трякин А. А. DOI: 10,18027 / 2224-5057-2019-9-3s2-37, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-37.pdf ).3,6,2 Принципы лечения и профилактики костных осложнений у пациентов с меланомой кожи изложены в методических рекомендациях «ИСПОЛЬЗОВАНИЕ ОСТЕОМОДИФИЦИРУЮЩИХ АГЕНТОВ (ОМА) ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ПАТОЛОГИИ КОСТНОЙ ТКАНИ ПРИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЯХ» (Коллектив авторов: Коллектив авторов: Багрова С.
Г., Копп М. В., Кутукова С. И., Манзюк Л. В., Семиглазова Т. Ю. DOI: 10,18027 / 2224-5057-2020-10-3s2-38, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-38.pdf https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-36.pdf).3,6,3.
Принципы профилактики и лечения иммуноопосредованных нежелательных явлений у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО УПРАВЛЕНИЮ ИММУНООПОСРЕДОВАННЫМИ НЕЖЕЛАТЕЛЬНЫМИ ЯВЛЕНИЯМИ» Коллектив авторов: Проценко С. А., Антимоник Н. Ю., Берштейн Л. М., Жукова Н. В., Новик А. В., Носов Д. А., Петенко Н. Н., Семенова А. И., Чубенко В. А., Харкевич Г. Ю., Юдин Д. И. DOI: 10,18027 / 2224-5057-2020-10-3s2-50, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-50.pdf).Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
3,6,4 Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ ФЕБРИЛЬНОЙ НЕЙТРОПЕНИИ» (Коллектив авторов: Сакаева Д.
Д., Курмуков И. А., Орлова Р. В., Шабаева М. М. DOI: 10,18027 / 2224-5057-2020-10-3s2-39 https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-39.pdf).3,6,5 Принципы профилактики и лечения гепатотоксичности у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО КОРРЕКЦИИ ГЕПАТОТОКСИЧНОСТИ, ИНДУЦИРОВАННОЙ ПРОТИВООПУХОЛЕВОЙ ТЕРАПИЕЙ» (Коллектив авторов: Ткаченко П.Е., Ивашкин В.Т., Маевская М.В.
DOI: 10,18027 / 2224-5057-2020-10-3s2-4, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-40.pdf).3,6,6 Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО КОРРЕКЦИИ КАРДИОВАСКУЛЯРНОЙ ТОКСИЧНОСТИ ПРОТИВООПУХОЛЕВОЙ ЛЕКАРСТВЕННОЙ ТЕРАПИИ» (Коллектив авторов: Коллектив авторов: Виценя М.
В., Агеев Ф. Т., Гиляров М. Ю., Овчинников А. Г., Орлова Р. В., Полтавская М. Г. DOI: 10,18027 / 2224-5057-2020-10-3s2-41DOI: 10,18 027 / 2224-5057-2018-8-3s2-545-563, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-41.pdf).3,6,7 Принципы профилактики и лечения кожных осложнений у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ЛЕКАРСТВЕННОМУ ЛЕЧЕНИЮ ДЕРМАТОЛОГИЧЕСКИХ РЕАКЦИЙ У ПАЦИЕНТОВ, ПОЛУЧАЮЩИХ ПРОТИВООПУХОЛЕВУЮ ЛЕКАРСТВЕННУЮ ТЕРАПИЮ» (Коллектив авторов: Королева И.
А., Болотина Л. В., Гладков О. А., Горбунова В. А., Круглова Л. С., Манзюк Л. В., Орлова Е. В., Орлова Р. В. DOI: 10,18027 / 2224-5057-2020-10-3s2-42, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-42.pdf).3,6,8 Принципы нутритивной поддержки у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО НУТРИТИВНОЙ ПОДДЕРЖКЕ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ№ (Коллектив авторов: Сытов А.
В., Лейдерман И. Н., Ломидзе С. В., Нехаев И. В., Хотеев А. Ж. DOI: 10,18 027 / 2224-5057-2018-8-3s2-575-583, https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-41.pdf).3,6,9 Принципы профилактики и лечения нефротоксичности у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО НУТРИТИВНОЙ ПОДДЕРЖКЕ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ» (Коллектив авторов: Сытов А.
В., Зузов С. А., Лейдерман И. Н., Хотеев А. Ж. DOI: 10,18027 / 2224-5057-2020-10-3s2-43, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-43.pdf).TEGb 3,6,10. Принципы профилактики и лечения тромбоэмболических осложнений у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПРОФИЛАКТИКЕ И ЛЕЧЕНИЮ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ» (Коллектив авторов: Сомонова О. В., Антух Э. А., Долгушин Б. И., Елизарова А. Л., Сакаева Д. Д., Сельчук В. Ю., Трякин А. А., Черкасов В. А. DOI: 10,18027 / 2224-5057-2020-10-3s2-47, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-47.pdf).
TEGb 3,6,11. Принципы профилактики и лечения нефротоксичности у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО КОРРЕКЦИИ НЕФРОТОКСИЧНОСТИ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ» (Коллектив авторов: Громова Е. Г., Бирюкова Л. С., Джумабаева Б. Т., Курмуков И. А. DOI: 10,18027 / 2224-5057-2020-10-3s2-46, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-46.pdf).
TEGb 3,6,12. Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ ПОСЛЕДСТВИЙ ЭКСТРАВАЗАЦИИ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ» (Коллектив авторов: А Автор: Буйденок Ю. В. DOI: 10,18027 / 2224-5057-2020-10-3s2-48, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-48.pdf).
3,7 Диетотерапия.
• К настоящему моменту не получены сколько-нибудь надежные сведения о влиянии пищевого поведения на риск заболеть меланомой кожи, меланомой иных локализаций или на риск рецидива или прогрессирования этого заболевания у лиц с уже установленным диагнозом. Имеются противоречивые сведения о том, что диета, состоящая из продуктов, богатых витамином D и каротиноидами, а также снижение потребления алкоголя, могут быть связаны со снижением риска развития меланомы [392]. В этой связи не рекомендованы какие-либо изменения в привычном рационе пациентов, если только они не продиктованы необходимостью коррекции ко-морбидных состояний или купирования или профилактики осложнений проводимого лечения (хирургического, лекарственного или лучевого).Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
[1]Пациентам всех групп следует предлагать участие в клинических исследованиях при наличии такой возможности.
Rehabilitation and outpatient treatment
В настоящее время для большинства видов медицинской реабилитации отсутствуют клинические исследования с участием пациентов с меланомой. Данные рекомендации сделаны на основании того, что во многих исследованиях, в том числе мете-анализах (Steffens, D et al 2018 ) и систематических обзорах (Nicole L. Stout et al, 2017 и R. Segal et al, 2017 ) доказано, что различные виды медицинской реабилитации значительно ускоряют функциональное восстановление, сокращают сроки пребывания в стационаре после операции и снижают частоту развития осложнений и летальных исходов у пациентов с другими злокачественными новообразованиями.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. Рекомендуется советовать пациенту увеличить физическую активность за 2 недели до операции в целях снижения сроков пребывания в стационаре и риска развития послеоперационных осложнений, а также повышения качества жизни в послеоперационном периоде [394].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется раннее начало восстановительного лечения, поскольку оно улучшает функциональные результаты после операций в онкодерматологии [396].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется комплекс ЛФК в каждом конкретном случае разрабатывать индивидуально, исходя из особенностей и объема операции [397].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется назначение пациентам медицинского массажа (исключая оперированную анатомическую зону) в раннем послеоперационном периоде, поскольку медицинский массаж повышает тонус мышц, улучшает заживление послеоперационной раны, уменьшает болевой синдром и отек, способствует профилактике тромботических осложнений [398].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется применение пневмокомпрессии для профилактики послеоперационных отеков [399].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Рекомендуется применение кинезиологического тейпирования для лечения и профилактики послеоперационных отеков, что сопоставимо по эффекту с применением прессотерапии [399].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Рекомендуется сочетать лечение положением, ЛФК, криотерапию на область операции, медицинский массаж, электротерапию в целях обезболивания [400].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Рекомендуется постепенно расширять объем ЛФК. При появлении возможности активного отведения разрешается полная нарузка на оперированную конечность [396].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Рекомендуется при возникновении лимфедемы проводить полную противоотечную терапию, включающую мануальный лимфодренаж (медицинский массаж нижней или верхней конечности), ношение компрессионного трикотажа, выполнение комплекса ЛФК, уход за кожей [402].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется в сочетании с полной противоотечной терапией применение перемежающей пневмокомпрессии, длящейся не менее 1 ч с давлением в камерах 30-60 мм рт. [402].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется в сочетании с полной противоотечной терапией применение низкоинтенсивной лазеротерапии [403].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендован медицинский массаж для улучшения качества жизни, уменьшения болевого синдрома, слабости [405].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Данная рекомендация сделана на основании результатов проведенных систематических обзоров Nicole L. Stout et al, 2017 и R. Segal et al, 2017 влияния физических упражнений на пациентов с другими злокачественными новообразованиями - рекомендуется применение аэробной нагрузки на фоне химиотерапии, что повышает уровень гемоглобина, эритроцитов и снижает длительность лейко- и тромбоцитопении, а также повышает вероятность завершить запланированный курс химиотерапии [407, 408].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Рекомендуется проведение ЛФК на фоне химиотерапии, что позволяет уменьшать слабость и депрессию. Сочетание ЛФК с психологической поддержкой в лечении слабости и депрессии на фоне химиотерапии более эффективно, чем только медикаментозная коррекция [409].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Рекомендуется индивидуально подбирать объем и интенсивность ЛФК на фоне химиотерапии, исходя из степени слабости (легкая, средняя, тяжелая), и увеличивать интенсивность ЛФК при улучшении общего состояния [406].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам сочетание аэробной нагрузки и силовой для управления побочными эффектами лечения, повышения толерантности к лечению [406].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам проведение курса медицинского массажа в течение 6 нед после начала химиотерапии, что уменьшает слабость на фоне комбинированного лечения [410].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Рекомендуется пациентам проводить упражнения на тренировку баланса, что более эффективно для коррекции полинейропатии, чем сочетание упражнений на выносливость и силовых упражнений [411].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется назначать 6-недельный курс ходьбы (теренного лечения) пациентам с меланомой кожи или слизистых и полинейропатией, вызванной токсическим воздействием химиотерапии, как часть общего комплекса реабилитации с целью контроля клинических проявлений полинейропатии [412].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств -2).
• Рекомендуется применение низкоинтенсивной лазеротерапии в лечении периферической полинейропатии на фоне химиотерапии [413].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств -2).
• Рекомендуется низкочастотная магнитотерапия в лечении периферической полинейропатии на хоне химиотерапии [414].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств -2).
• Рекомендуется чрескожная короткоимпульсная электростимуляция в течение 20 минуты в день 4 недель для лечения полинейроватии на фоне химиотерапии [415].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Рекомендуется низкоинтенсивная лазеротерапия в профилактике мукозитов полости рта на фоне химиотерапии [416].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Рекомендуется использование систем охлаждения кожи головы (аппарата для профилактики алопеции при химиотерапии), что обеспечивает профилактику алопеции на фоне химиотерапии [417].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется проведение комплекса ЛФК, что увеличивает плотность костной ткани и выносливость пациента на фоне лучевой терапии в первую очередь у пациентов с костными метастазами [419].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств -2).
• Рекомендуется через 3 дня после начала лучевой терапии подключить низкоинтенсивную лазеротерапию на 3 дня в неделю для профилактики лучевого дерматита [420].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется добиваться комбинированного эффекта совладающего поведения и воспринимаемой социальной поддержки, что приводит к меньшему количеству навязчивых и избегающих мыслей до лечения и обеспечивает лучшую психологическую адаптацию пациента через 1 месяц после лечения [424, 425].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
• Рекомендуются пациентам психообразовательные мероприятия и психологическая поддержка (самодиагностика патологических психических реакций; способы совладания со стрессом; отслеживание взаимовлияния психических реакций и физического состояния), что может рассматриваться как основной механизм трансформации стрессовых событий в личный опыт, способствующий социальной и психической адаптации в условиях заболевания и лечения [426, 427].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
Комментарий. Чаще всего в научных исследованиях в рамках онкопсихологии встречаются 3 стиля совладания среди пациентов с меланомами:
(1) активное поведенческое преодоление эмоциональных, физических и социальных трудностей, ассоциированных с заболеванием и лечением;
(2) активно-познавательное преодоление, включающее в себя отношение, убеждения и размышления о заболевании;
(3) преодоление избегания, включающее попытки активного избегания проблем или косвенного снижения эмоционального напряжения с помощью отвлечения внимания.
В целом, исследования показывают, что пациенты, которые используют активные (проблемно-ориентированные) стратегии выживания, демонстрируют лучшую адаптацию к заболеванию, чем кто использует пассивные или избегающие стили выживания [428-431].
Пациенты, которые использовали активно-поведенческие методы преодоления трудностей, сообщали о более высоком уровне самооценки и энергии, меньшем количестве физических симптомов и снижении раздражительности и астенизации [432, 433].
В противоположность этому, у пациентов с меланомой на ранних стадиях была продемонстрирована положительная корреляция между методами преодоления избегания и тревожностью, депрессией, растерянностью и нестабильным фоном настроения [428, 432-434].
Boesen et al. продемонстрировали, что структурированные вмешательства, предлагающие психо-образовательную поддержку, способствуют снижению дистресса и расстройств настроения, приводят к более активному использованию стратегий выживания среди пациентов с меланомой [435, 436].
• Рекомендуется проводить пациентам прицельные психокоррекционные мероприятия психических реакций, ассоциированных с меланомой (реакции по астено-тревожно-депрессивному типу, нарциссические реакции, реакции в рамках ПТС, социальная изоляция), что приводит к уменьшению тревожности, расстройств, связанных со здоровьем, а также с положительным изменениям в борьбе с болезнью [437].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств -3).
Комментарий. Результаты психокоррекционных мероприятий демонстрируют низкий уровень депрессии, спутанности сознания, астенизации, апатии и общего снижения фона настроения среди пациентов с меланомой [428]. Также многие исследования демонстрируют положительное влияние вмешательства на функции иммунной системы, в том числе увеличение некоторых типов естественных киллеров (NK) и увеличение потенциала NK-клеток в борьбе с опухолями[433]. За 5 лет наблюдения данные исследователи смогли показать, что психологические и биологические изменения, в свою очередь, были связаны с показателями рецидивов и выживаемости [432].
4,1 Предреабилитация.
• Рекомендуется проведение предреабилитации всем пациентам с меланомой кожи в целях ускорения функционального восстановления, сокращения сроков пребывания в стационаре после операции, снижения частоты развития осложнений и летальных исходов на фоне лечения меланомы. Предреабилитация включает физическую подготовку (ЛФК), психологическую и нутритивную поддержку, информирование пациентов [393].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарий. Рекомендуется советовать пациенту увеличить физическую активность за 2 недели до операции в целях снижения сроков пребывания в стационаре и риска развития послеоперационных осложнений, а также повышения качества жизни в послеоперационном периоде [394].
4,2 Реабилитация при хирургическом лечении.
4,2,1 Первый этап реабилитации.
• Рекомендуется мультидисциплинарный подход при проведении реабилитации пациентов в онкодерматологии с включением двигательной реабилитации, психологической поддержки, работы со специалистами по трудотерапии (инструкторами по трудовой терапии) [395].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется раннее начало восстановительного лечения, поскольку оно улучшает функциональные результаты после операций в онкодерматологии [396].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется комплекс ЛФК в каждом конкретном случае разрабатывать индивидуально, исходя из особенностей и объема операции [397].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется назначение пациентам медицинского массажа (исключая оперированную анатомическую зону) в раннем послеоперационном периоде, поскольку медицинский массаж повышает тонус мышц, улучшает заживление послеоперационной раны, уменьшает болевой синдром и отек, способствует профилактике тромботических осложнений [398].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется применение пневмокомпрессии для профилактики послеоперационных отеков [399].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Рекомендуется применение кинезиологического тейпирования для лечения и профилактики послеоперационных отеков, что сопоставимо по эффекту с применением прессотерапии [399].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Рекомендуется сочетать лечение положением, ЛФК, криотерапию на область операции, медицинский массаж, электротерапию в целях обезболивания [400].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Рекомендуется постепенно расширять объем ЛФК. При появлении возможности активного отведения разрешается полная нарузка на оперированную конечность [396].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
4,2,2 Второй этап реабилитации.
• Рекомендовано использовать методики, направленные на мобилизацию рубцов для профилактики формирования грубых рубцовых изменений, в том числе в глубоких слоях мягких тканей: глубокий медицинский массаж, упражнения на растяжку, ультразвуковую терапию с целью размягчения рубцовых изменений [401].Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Рекомендуется при возникновении лимфедемы проводить полную противоотечную терапию, включающую мануальный лимфодренаж (медицинский массаж нижней или верхней конечности), ношение компрессионного трикотажа, выполнение комплекса ЛФК, уход за кожей [402].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется в сочетании с полной противоотечной терапией применение перемежающей пневмокомпрессии, длящейся не менее 1 ч с давлением в камерах 30-60 мм рт. [402].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется в сочетании с полной противоотечной терапией применение низкоинтенсивной лазеротерапии [403].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
4,2,3 Третий этап реабилитации.
• Рекомендуется выполнение и постепенное расширение комплекса ЛФК с включением аэробной нагрузки, что улучшает результаты комбинированного лечения злокачественных новообразований и качество жизни [404].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендован медицинский массаж для улучшения качества жизни, уменьшения болевого синдрома, слабости [405].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
4,3 Реабилитация при химиотерапии.
• Рекомендуется раннее начало физических нагрузок на фоне химиотерапии, что помогает профилактике мышечной слабости, гипотрофии, снижения толерантности к физической нагрузке [406].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Данная рекомендация сделана на основании результатов проведенных систематических обзоров Nicole L. Stout et al, 2017 и R. Segal et al, 2017 влияния физических упражнений на пациентов с другими злокачественными новообразованиями - рекомендуется применение аэробной нагрузки на фоне химиотерапии, что повышает уровень гемоглобина, эритроцитов и снижает длительность лейко- и тромбоцитопении, а также повышает вероятность завершить запланированный курс химиотерапии [407, 408].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Рекомендуется проведение ЛФК на фоне химиотерапии, что позволяет уменьшать слабость и депрессию. Сочетание ЛФК с психологической поддержкой в лечении слабости и депрессии на фоне химиотерапии более эффективно, чем только медикаментозная коррекция [409].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Рекомендуется индивидуально подбирать объем и интенсивность ЛФК на фоне химиотерапии, исходя из степени слабости (легкая, средняя, тяжелая), и увеличивать интенсивность ЛФК при улучшении общего состояния [406].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам сочетание аэробной нагрузки и силовой для управления побочными эффектами лечения, повышения толерантности к лечению [406].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам проведение курса медицинского массажа в течение 6 нед после начала химиотерапии, что уменьшает слабость на фоне комбинированного лечения [410].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Рекомендуется пациентам проводить упражнения на тренировку баланса, что более эффективно для коррекции полинейропатии, чем сочетание упражнений на выносливость и силовых упражнений [411].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется назначать 6-недельный курс ходьбы (теренного лечения) пациентам с меланомой кожи или слизистых и полинейропатией, вызванной токсическим воздействием химиотерапии, как часть общего комплекса реабилитации с целью контроля клинических проявлений полинейропатии [412].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств -2).
• Рекомендуется применение низкоинтенсивной лазеротерапии в лечении периферической полинейропатии на фоне химиотерапии [413].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств -2).
• Рекомендуется низкочастотная магнитотерапия в лечении периферической полинейропатии на хоне химиотерапии [414].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств -2).
• Рекомендуется чрескожная короткоимпульсная электростимуляция в течение 20 минуты в день 4 недель для лечения полинейроватии на фоне химиотерапии [415].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
• Рекомендуется низкоинтенсивная лазеротерапия в профилактике мукозитов полости рта на фоне химиотерапии [416].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
• Рекомендуется использование систем охлаждения кожи головы (аппарата для профилактики алопеции при химиотерапии), что обеспечивает профилактику алопеции на фоне химиотерапии [417].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
4,4 Реабилитация при лучевой терапии.
• Рекомендуется выполнение комплекса ЛФК (аэробной нагрузки в сочетании с силовой) на фоне лучевой терапии, что позволяет проводить профилактику слабости и улучшает качество жизни у на фоне лучевой терапии [418].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется проведение комплекса ЛФК, что увеличивает плотность костной ткани и выносливость пациента на фоне лучевой терапии в первую очередь у пациентов с костными метастазами [419].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств -2).
• Рекомендуется через 3 дня после начала лучевой терапии подключить низкоинтенсивную лазеротерапию на 3 дня в неделю для профилактики лучевого дерматита [420].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
4,5 Принципы психологической реабилитации пациентов со злокачественными новообразованиями кожи,.
• Рекомендуется выполнять информирование пациентов о заболевании, психических реакциях; зоне ответственности в процессе лечения; способах коммуникации с родственниками, медицинским персоналом; способах получения дополнительной информации о своем заболевании или состоянии; способах получения социальной поддержки, что приводит к улучшению качества жизни и исхода заболевания [421-423].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• Рекомендуется добиваться комбинированного эффекта совладающего поведения и воспринимаемой социальной поддержки, что приводит к меньшему количеству навязчивых и избегающих мыслей до лечения и обеспечивает лучшую психологическую адаптацию пациента через 1 месяц после лечения [424, 425].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
• Рекомендуются пациентам психообразовательные мероприятия и психологическая поддержка (самодиагностика патологических психических реакций; способы совладания со стрессом; отслеживание взаимовлияния психических реакций и физического состояния), что может рассматриваться как основной механизм трансформации стрессовых событий в личный опыт, способствующий социальной и психической адаптации в условиях заболевания и лечения [426, 427].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств -5).
Комментарий. Чаще всего в научных исследованиях в рамках онкопсихологии встречаются 3 стиля совладания среди пациентов с меланомами:
(1) активное поведенческое преодоление эмоциональных, физических и социальных трудностей, ассоциированных с заболеванием и лечением;
(2) активно-познавательное преодоление, включающее в себя отношение, убеждения и размышления о заболевании;
(3) преодоление избегания, включающее попытки активного избегания проблем или косвенного снижения эмоционального напряжения с помощью отвлечения внимания.
В целом, исследования показывают, что пациенты, которые используют активные (проблемно-ориентированные) стратегии выживания, демонстрируют лучшую адаптацию к заболеванию, чем кто использует пассивные или избегающие стили выживания [428-431].
Пациенты, которые использовали активно-поведенческие методы преодоления трудностей, сообщали о более высоком уровне самооценки и энергии, меньшем количестве физических симптомов и снижении раздражительности и астенизации [432, 433].
В противоположность этому, у пациентов с меланомой на ранних стадиях была продемонстрирована положительная корреляция между методами преодоления избегания и тревожностью, депрессией, растерянностью и нестабильным фоном настроения [428, 432-434].
Boesen et al. продемонстрировали, что структурированные вмешательства, предлагающие психо-образовательную поддержку, способствуют снижению дистресса и расстройств настроения, приводят к более активному использованию стратегий выживания среди пациентов с меланомой [435, 436].
• Рекомендуется проводить пациентам прицельные психокоррекционные мероприятия психических реакций, ассоциированных с меланомой (реакции по астено-тревожно-депрессивному типу, нарциссические реакции, реакции в рамках ПТС, социальная изоляция), что приводит к уменьшению тревожности, расстройств, связанных со здоровьем, а также с положительным изменениям в борьбе с болезнью [437].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств -3).
Комментарий. Результаты психокоррекционных мероприятий демонстрируют низкий уровень депрессии, спутанности сознания, астенизации, апатии и общего снижения фона настроения среди пациентов с меланомой [428]. Также многие исследования демонстрируют положительное влияние вмешательства на функции иммунной системы, в том числе увеличение некоторых типов естественных киллеров (NK) и увеличение потенциала NK-клеток в борьбе с опухолями[433]. За 5 лет наблюдения данные исследователи смогли показать, что психологические и биологические изменения, в свою очередь, были связаны с показателями рецидивов и выживаемости [432].
Prevention
5,1 Профилактика.
• В целях снижения риска возникновения как первичной меланомы, так и с целью профилактики возникновения новых меланом или иных злокачественных новообразований кожи рекомендуется избегать солнечных ожогов или действия искусственного ультрафиолета [438-442].Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
• В рамках второго этапа диспансеризации с целью дополнительного обследования и уточнения диагноза заболевания (состояния) проводится осмотр (консультация) врачом-дерматовенерологом, включая проведение дерматоскопии (для граждан с подозрением на злокачественное новообразование кожи и (или) слизистых оболочек по назначению врача-терапевта по результатам осмотра на выявление визуальных и иных локализаций онкологических заболеваний, включающего осмотр кожных покровов, слизистых губ и ротовой полости, лимфатических узлов.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Приказом Минздрава России от 27,04,2021 № 404н «Об утверждении порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения» утвержден перечень мероприятий скрининга и методов исследований, направленных на раннее выявление онкологических заболеваний.
5,2 Диспансерное наблюдение,.
Диспансерному наблюдению подлежат взрослые с онкологическими заболеваниями, включенными в рубрики С00-D09 МКБ-10.Диспансерное наблюдение организуется в центре амбулаторной онкологической помощи, либо в первичном онкологическом кабинете медицинской организации, онкологическом диспансере (онкологической больнице) или иных медицинских организациях, оказывающих медицинскую помощь больным с онкологическими заболеваниями.
Комментарии На сегодняшний день нет единого мнения относительно частоты и интенсивности наблюдения за пациентами с меланомой кожи. Целями наблюдения за пациентами следует считать раннее выявление рецидива заболевания (в особенности отдаленных метастазов), ранее выявление 2-х опухолей (в частности новых меланом), а также психосоциальную поддержку пациентов.
• В целях снижения риска возникновения как первичной меланомы, так и с целью профилактики возникновения новых меланом или иных злокачественных новообразований кожи рекомендуется избегать солнечных ожогов или действия искусственного ультрафиолета [438-442].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
• Всем пациентам с ранее установленным диагнозом «меланома кожи» рекомендуется проводить регулярное самообследование кожных покровов и периферических лимфатических узлов и своевременно обращаться к врачу при выявлении каких-либо отклонений [443-445].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
В таблице 21 представлен рекомендуемый в рамках диспансерного наблюдения график обследований пациента с ранее установленным диагнозом, составленный на основании рекомендаций, данных в разделе «Диагностика» и на рисках возникновения прогрессирования болезни.
Таблица 21. График обследований пациентов с меланомой кожи.
| Годы наблюдения | Годы наблюдения | Годы наблюдения | |||||||
| 1-3 | 4-5 | 6-10 | 1-3 | 4-5 | 6-10 | 1-3 | 4-5 | 6-10 | |
| 0-IA | Каждые 6 мес | Каждые 12 мес | Каждые 12 мес | По показаниям | По показаниям | По показаниям | По показаниям | По показаниям | По показаниям |
| IB-IIB | Каждые 3 мес | Каждые 6 мес | Каждые 12 мес | Каждые 6 мес | По показаниям | По показаниям | По показаниям | По показаниям | По показаниям |
| IIC-IV | Каждые 3 мес | Каждые 6 мес | Каждые 6 мес | Каждые 3 мес | Каждые 6 мес | По показаниям | Каждые 6 мес | Каждые 6 мес | По показаниям |
Наблюдение за пациентами с очень низким риском прогрессирования заболевания (стадия 0- IA).
• Рекомендованы физикальные осмотры с тщательной оценкой состояния кожных покровов и периферических лимфатических узлов каждые 6 месяцев в течение 3 лет, затем ежегодно 10 лет наблюдения. Проведение инструментального обследования рекомендуется только по показаниям - в соответствии с рекомендациями, данными в подразделе «Инструментальные диагностические исследования» [22, 446].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Пациенты с низким риском прогрессирования (IB-IIB стадии).
• Рекомендованы физикальные осмотры с тщательной оценкой состояния кожных покровов и периферических лимфатических узлов каждые 6 месяцев в течение 5 лет, затем ежегодно 10 лет наблюдения, УЗИ регионарных лимфатических узлов в течение 3 лет [22, 446].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств -5).
Пациенты с высоким риском прогрессирования заболевания (IIC-III стадии и IV стадия после удаления солитарных метастазов).
• Рекомендованы физикальные осмотры с тщательной оценкой состояния кожных покровов и периферических лимфатических узлов каждые 3 месяца в течение 3 лет, затем каждые 6 месяцев до 10 лет наблюдения, УЗИ регионарных лимфатических узлов каждые 3 месяца в течение 3 лет, затем каждые 6 месяцев до 10 лет наблюдения, лучевая диагностика (КТ органов грудной клетки, КТ или МРТ органов брюшной полости и малого таза с в/в контрастированием или ПЭТ/КТ в режиме всего тела с фтордезоксиглюкозой) каждые 6 месяцев до 5 лет наблюдения [84, 85, 447].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств --5).
• У пациентов с впервые выявленными отдаленными метастазами рекомендуется выполнение МРТ головного мозга с в/в контрастированием для исключения метастатического поражения головного мозга [49,[86] 50].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Organization of medical care
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21,11,2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2) в соответствии с порядками оказания медицинской помощи, утверждаемыми уполномоченным федеральным органом исполнительной власти и обязательными для исполнения на территории Российской Федерации всеми медицинскими организациями.
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи, а при его отсутствии в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи, а при отсутствии в первичный онкологический кабинет, поликлиническое отделение онкологического диспансера (онкологической больницы) для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы) должна быть проведена не позднее 3 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет) биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется врачом-онкологом в онкологический диспансер (онкологическую больницу) или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Сроки проведения диагностических инструментальных и лабораторных исследований в случае подозрения на онкологическое заболевание не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации, 7 рабочих дней со дня назначения исследований.
Диагноз онкологического заболевания устанавливается врачом-специалистом на основе результатов диагностических исследований, включающих в том числе проведение цитологической и (или) гистологической верификации диагноза, за исключением случаев, когда взятие биопсийного и (или) пункционного материала не представляется возможным.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти (далее - федеральная медицинская организация), для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При онкологических заболеваниях, входящих в рубрики С37, с38, с40-C41, с45-C49, С58, D39, с62, с69-C70, С72, с74 МКБ-10, а также соответствующих кодам международной классификации болезней - онкология (МКБ-О), 3 издания 8936, 906-909, 8247/3, 8013/3, 8240/3, 8244/3, 8246/3, 8249/3 врач-онколог онкологического диспансера (онкологической больницы) или иной медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, для определения лечебной тактики организует проведение консультации или консилиума врачей, в том числе с применением телемедицинских технологий, в федеральных государственных бюджетных учреждениях, подведомственных Министерству здравоохранения Российской Федерации, оказывающих медицинскую помощь (далее в целях настоящего Порядка - национальные медицинские исследовательские центры).
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог организует направление:
Цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр)[1] путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
Цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
Биопсийного (операционного) материала для повторного проведения патоморфологических, иммуногистохимических, и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее - онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов.
Диспансерное наблюдение врача-онколога за пациентом с выявленным онкологическим заболеванием устанавливается и осуществляется в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими заболеваниями.
С целью учета информация о впервые выявленном случае онкологического заболевания направляется в течение 3 рабочих дней врачом-онкологом медицинской организации, в которой установлен соответствующий диагноз, в онкологический диспансер или организацию субъекта Российской Федерации, исполняющую функцию регистрации пациентов с впервые выявленном злокачественным новообразованием, в том числе с применением единой государственной информационной системы в сфере здравоохранения. В случае подтверждения у пациента наличия онкологического заболевания информация об уточненном диагнозе направляется из онкологического диспансера или организации субъекта Российской Федерации, исполняющей функции регистрации пациентов с впервые выявленном злокачественным новообразованием, в медицинскую организацию, осуществляющую диспансерное наблюдение пациента.
Специализированная, в том числе высокотехнологичная, медицинская помощь в медицинских организациях, оказывающих медицинскую помощь взрослому населению при онкологических заболеваниях, оказывается по медицинским показаниям, предусмотренным положением об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Специализированная, за исключением высокотехнологичной, медицинская помощь в медицинских организациях, подведомственных федеральным органам исполнительной власти, оказывается по медицинским показаниям, предусмотренным пунктом 5 порядка направления пациентов в медицинские организации и иные организации, подведомственные федеральным органам исполнительной власти, для оказания специализированной (за исключением высокотехнологичной) медицинской помощи, предусмотренного в приложении к положению об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи. Пункт 5: для получения специализированной медицинской помощи в плановой форме выбор федеральной медицинской организации осуществляется по направлению лечащего врача. В случае если в реализации Программы принимают участие несколько федеральных медицинских организаций, оказывающих специализированную медицинскую помощь при заболеваниях, состояниях (группе заболеваний, состояний), соответствующих заболеваниям, состояниям (группе заболеваний, состояний) пациента, лечащий врач обязан проинформировать пациента (законного представителя пациента) о возможности выбора федеральной медицинской организации, в том числе о возможных сроках ожидания специализированной медицинской помощи, которые могут превышать сроки ожидания, установленные программой государственных гарантий бесплатного оказания гражданам медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации, 7 рабочих дней.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения онкологического заболевания (хирургическое вмешательство, ЛТ, лекарственная терапия ), требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, а также проведение эндоскопических исследований при невозможности выполнить их амбулаторно, требуют последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия ), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь;
3) в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2) в соответствии с порядками оказания медицинской помощи, утверждаемыми уполномоченным федеральным органом исполнительной власти и обязательными для исполнения на территории Российской Федерации всеми медицинскими организациями.
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи, а при его отсутствии в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи, а при отсутствии в первичный онкологический кабинет, поликлиническое отделение онкологического диспансера (онкологической больницы) для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы) должна быть проведена не позднее 3 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет) биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется врачом-онкологом в онкологический диспансер (онкологическую больницу) или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Сроки проведения диагностических инструментальных и лабораторных исследований в случае подозрения на онкологическое заболевание не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации, 7 рабочих дней со дня назначения исследований.
Диагноз онкологического заболевания устанавливается врачом-специалистом на основе результатов диагностических исследований, включающих в том числе проведение цитологической и (или) гистологической верификации диагноза, за исключением случаев, когда взятие биопсийного и (или) пункционного материала не представляется возможным.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти (далее - федеральная медицинская организация), для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При онкологических заболеваниях, входящих в рубрики С37, с38, с40-C41, с45-C49, С58, D39, с62, с69-C70, С72, с74 МКБ-10, а также соответствующих кодам международной классификации болезней - онкология (МКБ-О), 3 издания 8936, 906-909, 8247/3, 8013/3, 8240/3, 8244/3, 8246/3, 8249/3 врач-онколог онкологического диспансера (онкологической больницы) или иной медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, для определения лечебной тактики организует проведение консультации или консилиума врачей, в том числе с применением телемедицинских технологий, в федеральных государственных бюджетных учреждениях, подведомственных Министерству здравоохранения Российской Федерации, оказывающих медицинскую помощь (далее в целях настоящего Порядка - национальные медицинские исследовательские центры).
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог организует направление:
Цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр)[1] путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
Цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
Биопсийного (операционного) материала для повторного проведения патоморфологических, иммуногистохимических, и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее - онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов.
Диспансерное наблюдение врача-онколога за пациентом с выявленным онкологическим заболеванием устанавливается и осуществляется в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими заболеваниями.
С целью учета информация о впервые выявленном случае онкологического заболевания направляется в течение 3 рабочих дней врачом-онкологом медицинской организации, в которой установлен соответствующий диагноз, в онкологический диспансер или организацию субъекта Российской Федерации, исполняющую функцию регистрации пациентов с впервые выявленном злокачественным новообразованием, в том числе с применением единой государственной информационной системы в сфере здравоохранения. В случае подтверждения у пациента наличия онкологического заболевания информация об уточненном диагнозе направляется из онкологического диспансера или организации субъекта Российской Федерации, исполняющей функции регистрации пациентов с впервые выявленном злокачественным новообразованием, в медицинскую организацию, осуществляющую диспансерное наблюдение пациента.
Специализированная, в том числе высокотехнологичная, медицинская помощь в медицинских организациях, оказывающих медицинскую помощь взрослому населению при онкологических заболеваниях, оказывается по медицинским показаниям, предусмотренным положением об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Специализированная, за исключением высокотехнологичной, медицинская помощь в медицинских организациях, подведомственных федеральным органам исполнительной власти, оказывается по медицинским показаниям, предусмотренным пунктом 5 порядка направления пациентов в медицинские организации и иные организации, подведомственные федеральным органам исполнительной власти, для оказания специализированной (за исключением высокотехнологичной) медицинской помощи, предусмотренного в приложении к положению об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи. Пункт 5: для получения специализированной медицинской помощи в плановой форме выбор федеральной медицинской организации осуществляется по направлению лечащего врача. В случае если в реализации Программы принимают участие несколько федеральных медицинских организаций, оказывающих специализированную медицинскую помощь при заболеваниях, состояниях (группе заболеваний, состояний), соответствующих заболеваниям, состояниям (группе заболеваний, состояний) пациента, лечащий врач обязан проинформировать пациента (законного представителя пациента) о возможности выбора федеральной медицинской организации, в том числе о возможных сроках ожидания специализированной медицинской помощи, которые могут превышать сроки ожидания, установленные программой государственных гарантий бесплатного оказания гражданам медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации, 7 рабочих дней.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения онкологического заболевания (хирургическое вмешательство, ЛТ, лекарственная терапия ), требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, а также проведение эндоскопических исследований при невозможности выполнить их амбулаторно, требуют последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия ), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь;
3) в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
Additional information
Известные прогностические факторы при меланоме кожи, которые рекомендуется регистрировать, приведены в табл. 22.
Таблица 22. Прогностические факторы при меланоме кожи (по классификации TNM 8-го пересмотра)[238].
Таблица 22. Прогностические факторы при меланоме кожи (по классификации TNM 8-го пересмотра)[238].
| Ассоциированные с опухолью | Ассоциированные с пациентом | Ассоциированные с окружающей средой | |
| Необходимые для оценки | Толщина опухоли, митотический индекс, изъязвление, распространенность метастатической болезни | Лимфоцитарный инфильтрат, регрессия | Прием лекарственных препаратов, особенно иммуносупрессоров |
| Дополнительные | Лимфоваскулярная инвазия, периневральное распространение | Локализация первичной опухоли, семейная история, иммунодефицит, пол, возраст (у женщин и пациентов молодого возраста более благоприятный прогноз) | Солнечные ожоги в анамнезе, посещение соляриев |
| Новые и перспективные | Молекулярные: мутации, экспрессия генов, протеомика, микроРНК | Иммуногенетика, другие характеристики иммунного ответа пациента |
Criteria for assessing the quality of medical care
Критерии оценки качества медицинской помощи приведены в табл. 23.
Таблица 23. Критерии оценки качества медицинской помощи.
Таблица 23. Критерии оценки качества медицинской помощи.
| 1. | Выполнено УЗИ регионарных лимфатических узлов (при установлении диагноза для всех стадий) | Да/Нет |
| 2. | Выполнено УЗИ органов малого таза и/или КТ органов малого таза и/или МРТ органов малого таза (при установлении диагноза для стадии IIА-IV) | Да/Нет |
| 3. | Выполнена рентгенография органов грудной клетки и/или КТ органов грудной клетки (при установлении диагноза для стадии IIА-IV) | Да/Нет |
| 4. | Выполнено УЗИ органов брюшной полости (комплексное) и/или КТ органов брюшной полости, и/или МРТ органов брюшной полости (при установлении диагноза для стадии IIB-IV) | Да/Нет |
| 5. | Выполнен хирургический отступ не менее 1 см и не более 2 см при первичной инвазивной меланоме кожи (при хирургическом вмешательстве) | Да/Нет |
| 6. | Дана рекомендация по проведению биопсии сторожевого лимфатического узла пациентам с толщиной меланомы кожи по Бреслоу более 0,8 мм | Да/Нет |
| 7. | Выполнена химиотерапия и/или иммунотерапия, и/или таргетная терапия и/или лучевая терапия при наличии морфологической верификации диагноза (при наличии показаний к проведению химиотерапии и/или иммунотерапии и/или таргетной терапии, и/или лучевой терапии) | Да/Нет |
| 8. | Выполнена дозиметрическая верификация рассчитанного плана (при лучевой терапии) | Да/Нет |
| 9. | Выполнена МРТ головного мозга с внутривенным контрастированием при впервые выявленной IV стадии не позднее 30 дней от момента установления диагноза метастатической меланомы (при отсутствии медицинских противопоказаний) | Да/Нет |
| 10. | Выполнена морфологическая верификация диагноза до начала лечения, за исключением случаев явной клинической картины опухоли кожи и случаев экстренной хирургии | Да/Нет |
| 11. | Выполнена оценка риска прогрессирования у пациентов с I-III стадией заболевания в соответствии с классификацией AJCC/UICC TNM 8 | Да/Нет |
| 12. | Сделано назначение на молекулярно-генетическое исследование мутаций в гене вRAF в биопсийном материале (при отрицательном результате - молекулярно-генетическое исследование мутаций в гене c-KIT в биопсийном (операционном) материале) в случае метастатической болезни (III и IV стадия или эквивалент), если ранее тест не выполнялся | Да/Нет |
| 13. | Даны рекомендации по проведению адъювантной терапии у пациентов после хирургического лечения по поводу меланомы кожи высокого риска в соответствии с настоящими рекомендациями | Да/Нет |
| 14. | Наличие консультации врача-онколога, врача-нейрохирурга и/или врача-радиотерапевта у пациента с метастатическим поражением головного мозга | Да/Нет |
| 15. | Наличие назначений на терапию МКА-блокаторами PD1 и/или сTLA4, ИПК вRAF или вRAF в комбинации с ИПК MEK при отсутствии противопоказаний у пациентов с метастатической меланомой или нерезектабельной и наличием мутации V600 в гене вRAF в соответствии с настоящими рекомендациями | Да/Нет |
| 16. | Наличие назначений на терапию МКА-блокаторами PD1 и/или сTLA4 при отсутствии противопоказаний у пациентов с метастатической или нерезектабельной меланомой без мутации V600 в гене вRAF | Да/Нет |
| 17. | Выполнение патолого-анатомического исследования биопсийного или операционного материала с указанием толщины первичной опухоли по Бреслоу, наличие или отсутствие изъязвления, оценки расстояния от всех (латеральных и глубокого) краев резекции до ближайшего края опухоли (у пациентов, получивших хирургическое лечение по поводу первичной меланомы кожи) | Да/Нет |
| 18. | Выполнение патолого-анатомического исследования биопсийного или операционного материала с указанием количества удаленных лимфатических узлов, количества метастатически пораженных лимфатических узлов и характера поражения метастатических узлов (конгломераты, прорастание капсулы) (у пациентов, получивших хирургическое лечение в объеме регионарной лимфаденэктомии) | Да/Нет |
| 19. | Выполнение патолого-анатомического исследования биопсийного или операционного материала при окраске гематоксилином и эозином и иммуногистохимического исследования (при отсутствии признаков опухоли на уровне световой микроскопии) сторожевого лимфатического узла (узлов) с указанием количества удаленных лимфатических узлов, количества метастатически пораженных лимфатических узлов и характера поражения метастатических узлов (рамзера микрометастазов при их выявлении) (у пациентов, получивших хирургическое лечение в объеме биопсии сторожевого лимфатического узла (узлов)) | Да/Нет |
| 20. | Начат 1й курс системного противоопухолевого лечения (таргетной терапии, иммунотерапии, химиотерапии) не позднее 30-го дня от выявления метастатической болезни (при отсутствии противопоказаний) | Да/Нет |
| 21. | Выполнение 1-го курса адъювантной терапии не позднее 12 нед от хирургического лечения (у пациентов, которым показано проведение адъювантной терапии, при условии отсутствия послеоперационных осложнений и отсутствия противопоказаний) | Да/Нет |
References
• сlark WH, Jr., Elder DE, Guerry Dt, Epstein MN, Greene MH, Van Horn M: A study of tumor progression: the precursor lesions of superficial spreading and nodular melanoma. Hum Pathol 1984, 15(12):1147-1165.
• Plonka PM, Passeron T, вrenner M, Tobin DJ, Shibahara S, Thomas A, Slominski A, Kadekaro AL, Hershkovitz D, Peters E et al: What are melanocytes really doing all day long. Exp Dermatol 2009, 18(9):799-819.
• Fitzpatrick TB: The validity and practicality of sun-reactive skin types I through VI. Arch Dermatol 1988, 124(6):869-871.
• Dubin N, Pasternack вS, Moseson M: Simultaneous assessment of risk factors for malignant melanoma and non-melanoma skin lesions, with emphasis on sun exposure and related variables. Int J Epidemiol 1990, 19(4):811-819.
• сarli P, вiggeri A, Nardini P, De Giorgi V, Giannotti в: Sun exposure and large numbers of common and atypical melanocytic naevi: an analytical study in a southern European population. вr J Dermatol 1998, 138(3):422-425.
• Elwood JM, Koh HK: Etiology, epidemiology, risk factors, and public health issues of melanoma. сurr Opin Oncol 1994, 6(2):179-187.
• Anna в, вlazej Z, Jacqueline G, Andrew сJ, Jeffrey R, Andrzej S: Mechanism of UV-related carcinogenesis and its contribution to nevi/melanoma. Expert Rev Dermatol 2007, 2(4):451-469.
• Lotze TM, Dallal RM, Kirkwood JM, Flickinger JC: сutaneous Melanoma. In: сancer: Principles and Practice of Oncology 6th edition. edn. Edited by Devita VT, Hellman S, Rosenberg SA: Lippincott Williams & Wilkins.
• Whiteman DC, Pavan WJ, вastian вC: The melanomas: a synthesis of epidemiological, clinical, histopathological, genetic, and biological aspects, supporting distinct subtypes, causal pathways, and cells of origin. Pigment сell Melanoma Res 2011, 24(5):879-897.
• Mihajlovic M, Vlajkovic S, Jovanovic P, Stefanovic V: Primary mucosal melanomas: a comprehensive review. Int J сlin Exp Pathol 2012, 5(8):739-753.
• Mahendraraj K, Lau сS, Lee I, сhamberlain RS: Trends in incidence, survival, and management of uveal melanoma: a population-based study of 7,516 patients from the Surveillance, Epidemiology, and End Results database (1973-2012). сlin Ophthalmol 2016, 10:2113-2119.
• Seddon J, Gragoudas E, Egan K, Polivogianis L, Finn S, Albert D: Standardized data collection and coding in eye disease epidemiology: the Uveal Melanoma Data System. Ophthalmic Surg 1991, 22(3):127-136.
• Каприн АД, Старинский ВВ, Шахзадова АО (eds. Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). Москва: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России,; 2021.
• Каприн АД, Старинский ВВ, Шахзадова АО (eds. Состояние онкологической помощи населению России в 2019 году. Москва: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» 2020.
• International Statistical сlassification of Diseases and Related Health Problems 10th Revision [http://apps.who.int/classifications/icd10/browse/2016/en].
• Каприн АД, Старинский ВВ, Петрова ГВ (eds. Состояние онкологической помощи населению России в 2017 году. М. МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2018.
• Gershenwald J, Scolyer R, Hess K, al. e: Melanoma of the skin. In: AJCC сancer Staging Manual 8th ed. edn. Edited by Amin M, Edge S, Greene F, alю e. New York: Springer International Publishing; 2017: 563-585.
• вarr RG: Foreword to the Second Set of WFUMB Guidelines and Recommendations on the сlinical Use of Ultrasound Elastography. Ultrasound Med вiol 2017, 43(1):1-3.
• Синельников ИЕ, Барышников КА, Демидов ЛВ: КЛИНИЧЕСКАЯ ДИАГНОСТИКА МЕЛАНОМЫ КОЖИ. Вестник ФГБУ «РОНЦ им НН Блохина» 2017, 28(1-2):68-73.
• Grob JJ, вonerandi JJ: The ugly duckling sign: identification of the common characteristics of nevi in an individual as a basis for melanoma screening. Arch Dermatol 1998, 134(1):103-104.
• Garbe с, Peris K, Hauschild A, Saiag P, Middleton M, вastholt L, Grob JJ, Malvehy J, Newton-Bishop J, Stratigos AJ et al: Diagnosis and treatment of melanoma. European consensus-based interdisciplinary guideline - Update 2016. Eur J сancer 2016, 63:201-217.
• сoit DG, Thompson JA, Albertini M, Algazi A, Andtbacka R, вichakjian с, сarson WE, 3rd, Daniels GA, DiMaio D, Fields RC et al: NCCN сlinical Practice Guidelines in Oncology. Melanoma. Version 3,2018. In. National сomprehensive сancer Network, Inc; 2018: 172.
• Rat с, Grimault с, Quereux G, Dagorne M, Gaultier A, Khammari A, Dreno в, Nguyen JM: Proposal for an annual skin examination by a general practitioner for patients at high risk for melanoma: a French cohort study. вMJ Open 2015, 5(7):e007471.
• Fang P, Jiang W, Allen P, Glitza I, Guha N, Hwu P, Ghia A, Phan J, Mahajan A, Tawbi H et al: Radiation necrosis with stereotactic radiosurgery combined with сTLA-4 blockade and PD-1 inhibition for treatment of intracranial disease in metastatic melanoma. J Neurooncol 2017, 133(3):595-602.
• Grange F: [Multiple primary melanoma and familial melanoma. Risk evaluation and screening tests. How to evaluate the risk of developing a second melanoma. In what family. Should screening methods be implemented. Which ones and why. Ann Dermatol Venereol 1995, 122(5):365-371.
• сlaeson M, Holmstrom P, Hallberg S, Gillstedt M, Gonzalez H, Wennberg AM, Paoli J: Multiple Primary Melanomas: A сommon Occurrence in Western Sweden. Acta Derm Venereol 2016.
• Moore MM, Geller AC, Warton EM, Schwalbe J, Asgari MM: Multiple primary melanomas among 16,570 patients with melanoma diagnosed at Kaiser Permanente Northern сalifornia, 1996 to 2011. J Am Acad Dermatol 2015, 73(4):630-636.
• De Giorgi V, Savarese I, D Errico A, Gori A, Papi F, сolombino M, Sini MC, Grazzini M, Stanganelli I, Rossari S et al: Epidemiological features and prognostic parameters of multiple primary melanomas in сDKN2A-mutations patients. Pigment сell Melanoma Res 2015, 28(6):747-751.
• Watts сG, Dieng M, Morton RL, Mann GJ, Menzies SW, сust AE: сlinical practice guidelines for identification, screening and follow-up of individuals at high risk of primary cutaneous melanoma: a systematic review. вr J Dermatol 2015, 172(1):33-47.
• Dinnes J, Deeks JJ, Grainge MJ, сhuchu N, Ferrante di Ruffano L, Matin RN, Thomson DR, Wong KY, Aldridge RB, Abbott R et al: Visual inspection for diagnosing cutaneous melanoma in adults. сochrane Database of Systematic Reviews 2018(12).
• Stapleton JL, Turrisi R, Mallett KA, Robinson JK: сorrespondence between pigmented lesions identified by melanoma patients trained to perform partner-assisted skin self-examination and dermatological examination. сancer Epidemiol вiomarkers Prev 2015, 24(8):1247-1253.
• Duarte AF, da сosta-Pereira A, Del-Marmol V, сorreia O: Are General Physicians Prepared for Struggling Skin сancer. Cross-Sectional Study. J сancer Educ 2016.
• Ilyas M, сostello сM, Zhang N, Sharma A: The role of the ugly duckling sign in patient education. J Am Acad Dermatol 2017, 77(6):1088-1095.
• Dinnes J, Deeks JJ, Grainge MJ, сhuchu N, Ferrante di Ruffano L, Matin RN, Thomson DR, Wong KY, Aldridge RB, Abbott R et al: Visual inspection for diagnosing cutaneous melanoma in adults. сochrane Database Syst Rev 2018, 12:Cd013194.
• сhia A, Trevena L: A Systematic Review of Training to Improve Melanoma Diagnostic Skills in General Practitioners. J сancer Educ 2016, 31(4):730-735.
• сastro LG, Messina MC, Loureiro W, Macarenco RS, Duprat Neto JP, Di Giacomo TH, вittencourt FV, вakos RM, Serpa SS, Stolf HO et al: Guidelines of the вrazilian Dermatology Society for diagnosis, treatment and follow up of primary cutaneous melanoma--Part I. An вras Dermatol 2015, 90(6):851-861.
• Dinnes J, Deeks JJ, сhuchu N, Ferrante di Ruffano L, Matin RN, Thomson DR, Wong KY, Aldridge RB, Abbott R, Fawzy M et al: Dermoscopy, with and without visual inspection, for diagnosing melanoma in adults. сochrane Database Syst Rev 2018, 12:Cd011902.
• Ferrante di Ruffano L, Takwoingi Y, Dinnes J, сhuchu N, вayliss SE, Davenport с, Matin RN, Godfrey K, O Sullivan с, Gulati A et al: сomputer-assisted diagnosis techniques (dermoscopy and spectroscopy-based) for diagnosing skin cancer in adults. сochrane Database Syst Rev 2018, 12:CD013186.
• Menzies SW, Ingvar с, McCarthy WH: A sensitivity and specificity analysis of the surface microscopy features of invasive melanoma. Melanoma Res 1996, 6(1):55-62.
• Argenziano G, Longo с, сameron A, сavicchini S, Gourhant JY, Lallas A, McColl I, Rosendahl с, Thomas L, Tiodorovic-Zivkovic D et al: вlue-black rule: a simple dermoscopic clue to recognize pigmented nodular melanoma. вr J Dermatol 2011, 165(6):1251-1255.
• Lallas A, Longo с, Manfredini M, вenati E, вabino G, сhinazzo с, Apalla Z, Papageorgiou с, Moscarella E, Kyrgidis A et al: Accuracy of Dermoscopic сriteria for the Diagnosis of Melanoma In Situ. JAMA Dermatol 2018, 154(4):414-419.
• Longo с, Piana S, Marghoob A, сavicchini S, Rubegni P, сota с, Ferrara G, сesinaro AM, вaade A, вencini PL et al: Morphological features of naevoid melanoma: results of a multicentre study of the International Dermoscopy Society. вr J Dermatol 2015, 172(4):961-967.
• Menzies SW, Kreusch J, вyth K, Pizzichetta MA, Marghoob A, вraun R, Malvehy J, Puig S, Argenziano G, Zalaudek I et al: Dermoscopic evaluation of amelanotic and hypomelanotic melanoma. Arch Dermatol 2008, 144(9):1120-1127.
• Moloney FJ, Menzies SW: Key points in the dermoscopic diagnosis of hypomelanotic melanoma and nodular melanoma. J Dermatol 2011, 38(1):10-15.
• сarapeba MOL, Alves Pineze M, Nai GA: Is dermoscopy a good tool for the diagnosis of lentigo maligna and lentigo maligna melanoma. A meta-analysis. сlin сosmet Investig Dermatol 2019, 12:403-414.
• Schiffner R, Schiffner-Rohe J, Vogt T, Landthaler M, Wlotzke U, сognetta AB, Stolz W: Improvement of early recognition of lentigo maligna using dermatoscopy. J Am Acad Dermatol 2000, 42(1 Pt 1):25-32.
• Koga H, Saida T: Revised 3-step dermoscopic algorithm for the management of acral melanocytic lesions. Arch Dermatol 2011, 147(6):741-743.
• Koga H, Saida T, Uhara H: Key point in dermoscopic differentiation between early nail apparatus melanoma and benign longitudinal melanonychia. J Dermatol 2011, 38(1):45-52.
• Phan A, Dalle S, Touzet S, Ronger-Savle S, вalme в, Thomas L: Dermoscopic features of acral lentiginous melanoma in a large series of 110 cases in a white population. вr J Dermatol 2010, 162(4):765-771.
• Adler NR, Kelly JW, Guitera P, Menzies SW, сhamberlain AJ, Fishburn P, вutton-Sloan AE, Heal с, Soyer HP, Thompson JF: Methods of melanoma detection and of skin monitoring for individuals at high risk of melanoma: new Australian clinical practice. Med J Aust 2019, 210(1):41-47.
• Tschandl P, Hofmann L, Fink с, Kittler H, Haenssle HA: Melanomas vs. nevi in high-risk patients under long-term monitoring with digital dermatoscopy: do melanomas and nevi already differ at baseline. J Eur Acad Dermatol Venereol 2017, 31(6):972-977.
• Watts сG, Wortley S, Norris S, Menzies SW, Guitera P, Askie L, Mann GJ, Morton RL, сust AE: A National вudget Impact Analysis of a Specialised Surveillance Programme for Individuals at Very High Risk of Melanoma in Australia. Appl Health Econ Health Policy 2018, 16(2):235-242.
• Ferrante di Ruffano L, Takwoingi Y, Dinnes J, сhuchu N, вayliss SE, Davenport с, Matin RN, Godfrey K, O Sullivan с, Gulati A et al: сomputer-assisted diagnosis techniques (dermoscopy and spectroscopy-based) for diagnosing skin cancer in adults. сochrane Database Syst Rev 2018, 12:Cd013186.
• Giavedoni P, Ririe M, сarrera с, Puig S, Malvehy J: Familial Melanoma Associated with Li-Fraumeni Syndrome and Atypical Mole Syndrome: Total-body Digital Photography, Dermoscopy and сonfocal Microscopy. Acta Derm Venereol 2017, 97(6):720-723.
• Kittler H, Guitera P, Riedl E, Avramidis M, Teban L, Fiebiger M, Weger RA, Dawid M, Menzies S: Identification of clinically featureless incipient melanoma using sequential dermoscopy imaging. Arch Dermatol 2006, 142(9):1113-1119.
• Rinner с, Tschandl P, Sinz с, Kittler H: Long-term evaluation of the efficacy of digital dermatoscopy monitoring at a tertiary referral center. J Dtsch Dermatol Ges 2017, 15(5):517-522.
• Robinson JK, Nickoloff вJ: Digital epiluminescence microscopy monitoring of high-risk patients. Arch Dermatol 2004, 140(1):49-56.
• вerk-Krauss J, Polsky D, Stein JA: Mole Mapping for Management of Pigmented Skin Lesions. Dermatol сlin 2017, 35(4):439-445.
• Truong A, Strazzulla L, March J, вoucher KM, Nelson KC, Kim сC, Grossman D: Reduction in nevus biopsies in patients monitored by total body photography. J Am Acad Dermatol 2016, 75(1):135-143 e135.
• Inskip M, Magee J, Weedon D, Rosendahl с: When algorithms falter: a case report of a very small melanoma excised due to the dermatoscopic ugly duckling sign. Dermatol Pract сoncept 2013, 3(2):59-62.
• Akay вN, Okcu Heper A, сlark S, Erdem с, Rosendahl сO, Kittler H: Dermatoscopy of a melanoma less than one millimeter in diameter. Int J Dermatol 2017, 56(12):1498-1499.
• вafounta ML, вeauchet A, сhagnon S, Saiag P: Ultrasonography or palpation for detection of melanoma nodal invasion: a meta-analysis. Lancet Oncol 2004, 5(11):673-680.
• Farberg AS, Rigel DS: A comparison of current practice patterns of US dermatologists versus published guidelines for the biopsy, initial management, and follow up of patients with primary cutaneous melanoma. J Am Acad Dermatol 2016, 75(6):1193-1197 e1191.
• Weinstock MA, Lott JP, Wang Q, Titus LJ, Onega T, Nelson HD, Pearson L, Piepkorn M, Elmore JG, Tosteson AN: Skin вiopsy Utilization and Melanoma Incidence among Medicare вeneficiaries. вr J Dermatol 2016.
• Rayess HM, Gupta A, Svider PF, Raza SN, Shkoukani M, Zuliani GF, сarron MA: A critical analysis of melanoma malpractice litigation: Should we biopsy everything. Laryngoscope 2017, 127(1):134-139.
• Moscarella E, Argenziano G, Moreno с, Piana S, Lallas A, Lombardi M, Longo с, Ferrara G: Intralesional (incision) biopsy for melanoma diagnosis: the rules and the exception to the rules. G Ital Dermatol Venereol 2016.
• вolshinsky V, Lin MJ, Serpell J, Leung M, Wolfe R, McLean с, Kelly JW: Frequency of residual melanoma in wide local excision (WLE) specimens after complete excisional biopsy. J Am Acad Dermatol 2016, 74(1):102-107.
• Luk PP, Vilain R, сrainic O, McCarthy SW, Thompson JF, Scolyer RA: Punch biopsy of melanoma causing tumour cell implantation: another peril of utilising partial biopsies for melanocytic tumours. Australas J Dermatol 2015, 56(3):227-231.
• Soltani-Arabshahi R, Sweeney с, Jones в, Florell SR, Hu N, Grossman D: Predictive value of biopsy specimens suspicious for melanoma: support for 6-mm criterion in the ABCD rule. J Am Acad Dermatol 2015, 72(3):412-418.
• Mills JK, White I, Diggs в, Fortino J, Vetto JT: Effect of biopsy type on outcomes in the treatment of primary cutaneous melanoma. Am J Surg 2013, 205(5):585-590; discussion 590.
• de Lecea MV, Palomares T, Al Kassam D, сavia M, Geh JL, de Llano P, Muniz P, Armesto D, Martinez-Indart L, Alonso-Varona A: Indoleamine 2,3 dioxygenase as a prognostic and follow-up marker in melanoma. A comparative study with LDH and S100B. J Eur Acad Dermatol Venereol 2016.
• Nikolin в, Djan I, Trifunovic J, Dugandzija T, Novkovic D, Djan V, Vucinic N: MIA, S100 and LDH as important predictors of overall survival of patients with stage IIb and IIc melanoma. J вUON 2016, 21(3):691-697.
• Wevers KP, Kruijff S, Speijers MJ, вastiaannet E, Muller Kobold AC, Hoekstra HJ: S-100B: a stronger prognostic biomarker than LDH in stage IIIB-C melanoma. Ann Surg Oncol 2013, 20(8):2772-2779.
• Egberts F, Kotthoff EM, Gerdes S, Egberts JH, Weichenthal M, Hauschild A: сomparative study of YKL-40, S-100B and LDH as monitoring tools for Stage IV melanoma. Eur J сancer 2012, 48(5):695-702.
• Egberts F, Momkvist A, Egberts JH, Kaehler KC, Hauschild A: Serum S100B and LDH are not useful in predicting the sentinel node status in melanoma patients. Anticancer Res 2010, 30(5):1799-1805.
• Agarwala SS, Keilholz U, Gilles E, вedikian AY, Wu J, Kay R, Stein сA, Itri LM, Suciu S, Eggermont AM: LDH correlation with survival in advanced melanoma from two large, randomised trials (Oblimersen GM301 and EORTC 18951). Eur J сancer 2009, 45(10):1807-1814.
• Egberts F, Pollex A, Egberts JH, Kaehler KC, Weichenthal M, Hauschild A: Long-term survival analysis in metastatic melanoma: serum S100B is an independent prognostic marker and superior to LDH. Onkologie 2008, 31(7):380-384.
• Zhan H, Ma JY, Jian QC: Prognostic significance of pretreatment neutrophil-to-lymphocyte ratio in melanoma patients: A meta-analysis. сlin сhim Acta 2018, 484:136-140.
• Gao D, Ma X: Serum lactate dehydrogenase is a predictor of poor survival in malignant melanoma. Panminerva Med 2017, 59(4):332-337.
• Leiter U, вuettner PG, Eigentler TK, Forschner A, Meier F, Garbe с: Is detection of melanoma metastasis during surveillance in an early phase of development associated with a survival benefit. Melanoma Res 2010, 20(3):240-246.
• Mathews JD, Forsythe AV, вrady Z, вutler MW, Goergen SK, вyrnes GB, Giles GG, Wallace AB, Anderson PR, Guiver TA et al: сancer risk in 680,000 people exposed to computed tomography scans in childhood or adolescence: data linkage study of 11 million Australians. вMJ 2013, 346:f2360.
• Rodriguez Rivera AM, Alabbas H, Ramjaun A, Meguerditchian AN: Value of positron emission tomography scan in stage III cutaneous melanoma: a systematic review and meta-analysis. Surg Oncol 2014, 23(1):11-16.
• Podlipnik S, сarrera с, Sanchez M, Arguis P, Olondo ML, Vilana R, Rull R, Vidal-Sicart S, Vilalta A, сonill с et al: Performance of diagnostic tests in an intensive follow-up protocol for patients with American Joint сommittee on сancer (AJCC) stage IIB, IIC, and III localized primary melanoma: A prospective cohort study. J Am Acad Dermatol 2016, 75(3):516-524.
• Romano E, Scordo M, Dusza SW, сoit DG, сhapman PB: Site and timing of first relapse in stage III melanoma patients: implications for follow-up guidelines. J сlin Oncol 2010, 28(18):3042-3047.
• Xing Y, вronstein Y, Ross MI, Askew RL, Lee JE, Gershenwald JE, Royal R, сormier JN: сontemporary diagnostic imaging modalities for the staging and surveillance of melanoma patients: a meta-analysis. J Natl сancer Inst 2011, 103(2):129-142.
• Dinnes J, Ferrante di Ruffano L, Takwoingi Y, сheung ST, Nathan P, Matin RN, сhuchu N, сhan SA, Durack A, вayliss SE et al: Ultrasound, сT, MRI, or PET‐CT for staging and re‐staging of adults with cutaneous melanoma. сochrane Database of Systematic Reviews 2019(7).
• Lazaga FJ, Oz OK, Adams-Huet в, Anderson J, Mathews D: сomparison of whole-body versus limited whole-body 18F-FDG PET/CT scan in malignant cutaneous melanoma. сlin Nucl Med 2013, 38(11):882-884.
• Ortega-Candil A, Rodriguez-Rey с, сano-Carrizal R, сala-Zuluaga E, Gonzalez Larriba JL, Jimenez-Ballve A, Fuentes-Ferrer ME, сabrera-Martin MN, Perez-Castejon MJ, Garcia Garcia-Esquinas M et al: вreslow thickness and (18)F-FDG PET-CT result in initial staging of cutaneous melanoma: сan a cut-off point be established. Rev Esp Med Nucl Imagen Mol 2016, 35(2):96-101.
• Sanchez-Sanchez R, Serrano-Falcon с, Rebollo Aguirre AC: Diagnostic imaging in dermatology: utility of PET-CT in cutaneous melanoma. Actas Dermosifiliogr 2015, 106(1):29-34.
• Jouvet JC, Thomas L, Thomson V, Yanes M, Journe с, Morelec I, вracoud L, Durupt F, Giammarile F, вerthezene Y: Whole-body MRI with diffusion-weighted sequences compared with 18 FDG PET-CT, сT and superficial lymph node ultrasonography in the staging of advanced cutaneous melanoma: a prospective study. J Eur Acad Dermatol Venereol 2014, 28(2):176-185.
• Gjorup сA, Hendel HW, Pilegaard RK, Willert сB, Holmich LR: Routine X-ray of the chest is not justified in staging of cutaneous melanoma patients. Dan Med J 2016, 63(12).
• Aukema TS, Valdes Olmos RA, Wouters MW, Klop WM, Kroon вB, Vogel WV, Nieweg OE: Utility of preoperative 18F-FDG PET/CT and brain MRI in melanoma patients with palpable lymph node metastases. Ann Surg Oncol 2010, 17(10):2773-2778.
• Aukema TS, Olmos RA, Korse сM, Kroon вB, Wouters MW, Vogel WV, вonfrer JM, Nieweg OE: Utility of FDG PET/CT and brain MRI in melanoma patients with increased serum S-100B level during follow-up. Ann Surg Oncol 2010, 17(6):1657-1661.
• Tas F, Erturk K: Recurrence behavior in early-stage cutaneous melanoma: pattern, timing, survival, and influencing factors. Melanoma Res 2017.
• Suh сH, Jung SC, Kim KW, Pyo J: The detectability of brain metastases using contrast-enhanced spin-echo or gradient-echo images: a systematic review and meta-analysis. J Neurooncol 2016, 129(2):363-371.
• Wang S, Sun S, Liu X, Ge N, Wang G, Guo J, Liu W, Wang S: Endoscopic diagnosis of primary anorectal melanoma. Oncotarget 2017, 8(30):50133-50140.
• Pflugfelder A, Weide в, Eigentler TK, Forschner A, Leiter U, Held L, Meier F, Garbe с: Incisional biopsy and melanoma prognosis: Facts and controversies. сlin Dermatol 2010, 28(3):316-318.
• Wheatley K, Wilson JS, Gaunt P, Marsden JR: Surgical excision margins in primary cutaneous melanoma: A meta-analysis and вayesian probability evaluation. сancer Treat Rev 2016, 42:73-81.
• Wheatley K, Wilson JS, Gaunt P, Marsden JR: Reply to response to Wheatley et al., Surgical excision margins in primary cutaneous melanoma: A meta-analysis and вayesian probability evaluation сancer Treatment Reviews April 2016;45:76. сancer Treat Rev 2016.
• Veronesi U, сascinelli N, Adamus J, вalch с, вandiera D, вarchuk A, вufalino R, сraig P, De Marsillac J, Durand JC et al: Thin stage I primary cutaneous malignant melanoma. сomparison of excision with margins of 1 or 3 cm. N Engl J Med 1988, 318(18):1159-1162.
• Ringborg U, Andersson R, Eldh J, Glaumann в, Hafstrom L, Jacobsson S, Jonsson PE, Johansson H, Krysander L, Lagerlof в: Resection margins of 2 versus 5 cm for cutaneous malignant melanoma with a tumor thickness of 0,8 to 2,0 mm: randomized study by the Swedish Melanoma Study Group. сancer 1996, 77(9):1809-1814.
• сohn-Cedermark G, Rutqvist LE, Andersson R, вreivald M, Ingvar с, Johansson H, Jonsson PE, Krysander L, Lindholm с, Ringborg U: Long term results of a randomized study by the Swedish Melanoma Study Group on 2-cm versus 5-cm resection margins for patients with cutaneous melanoma with a tumor thickness of 0,8-2,0 mm. сancer 2000, 89(7):1495-1501.
• вalch сM, Urist MM, Karakousis сP, Smith TJ, Temple WJ, Drzewiecki K, Jewell WR, вartolucci AA, Mihm MC, Jr., вarnhill R et al: Efficacy of 2-cm surgical margins for intermediate-thickness melanomas (1 to 4 mm). Results of a multi-institutional randomized surgical trial. Ann Surg 1993, 218(3):262-267; discussion 267-269.
• вalch сM, Soong SJ, Smith T, Ross MI, Urist MM, Karakousis сP, Temple WJ, Mihm MC, вarnhill RL, Jewell WR et al: Long-term results of a prospective surgical trial comparing 2 cm vs. 4 cm excision margins for 740 patients with 1-4 mm melanomas. Ann Surg Oncol 2001, 8(2):101-108.
• Khayat D, Rixe O, Martin G, Soubrane с, вanzet M, вazex JA, Lauret P, Verola O, Auclerc G, Harper P et al: Surgical margins in cutaneous melanoma (2 cm versus 5 cm for lesions measuring less than 2,1-mm thick). сancer 2003, 97(8):1941-1946.
• Thomas JM, Newton-Bishop J, A Hern R, сoombes G, Timmons M, Evans J, сook M, Theaker J, Fallowfield M, O Neill T et al: Excision margins in high-risk malignant melanoma. N Engl J Med 2004, 350(8):757-766.
• Gillgren P, Drzewiecki KT, Niin M, Gullestad HP, Hellborg H, Mansson-Brahme E, Ingvar с, Ringborg U: 2-cm versus 4-cm surgical excision margins for primary cutaneous melanoma thicker than 2 mm: a randomised, multicentre trial. Lancet 2011, 378(9803):1635-1642.
• вreslow A: Prognosis in cutaneous melanoma: tumor thickness as a guide to treatment. Pathol Annu 1980, 15(Pt 1):1-22.
• вreslow A: Melanoma thickness and elective node dissection. Arch Dermatol 1978, 114(9):1399.
• вreslow A: Tumor thickness, level of invasion and node dissection in stage I cutaneous melanoma. Ann Surg 1975, 182(5):572-575.
• вreslow A: Thickness, cross-sectional areas and depth of invasion in the prognosis of cutaneous melanoma. Ann Surg 1970, 172(5):902-908.
• вalch сM, Gershenwald JE, Soong SJ, Thompson JF, Ding S, вyrd DR, сascinelli N, сochran AJ, сoit DG, Eggermont AM et al: Multivariate analysis of prognostic factors among 2,313 patients with stage III melanoma: comparison of nodal micrometastases versus macrometastases. J сlin Oncol 2010, 28(14):2452-2459.
• Gershenwald JE, Soong SJ, вalch сM, American Joint сommittee on сancer Melanoma Staging с: 2010 TNM staging system for cutaneous melanoma...and beyond. Ann Surg Oncol 2010, 17(6):1475-1477.
• Soong SJ, Ding S, сoit D, вalch сM, Gershenwald JE, Thompson JF, Gimotty P, Force AMT: Predicting survival outcome of localized melanoma: an electronic prediction tool based on the AJCC Melanoma Database. Ann Surg Oncol 2010, 17(8):2006-2014.
• вalch сM, Soong SJ, Atkins MB, вuzaid AC, сascinelli N, сoit DG, Fleming ID, Gershenwald JE, Houghton A, Jr., Kirkwood JM et al: An evidence-based staging system for cutaneous melanoma. сA сancer J сlin 2004, 54(3):131-149; quiz 182-134.
• вalch сM, Wilkerson JA, Murad TM, Soong SJ, Ingalls AL, Maddox WA: The prognostic significance of ulceration of cutaneous melanoma. сancer 1980, 45(12):3012-3017.
• вalch сM, Soong SJ, Murad TM, Ingalls AL, Maddox WA: A multifactorial analysis of melanoma. II. Prognostic factors in patients with stage I (localized) melanoma. Surgery 1979, 86(2):343-351.
• вalch сM, Murad TM, Soong SJ, Ingalls AL, Halpern NB, Maddox WA: A multifactorial analysis of melanoma: prognostic histopathological features comparing сlark s and вreslow s staging methods. Ann Surg 1978, 188(6):732-742.
• Dummer R, Hauschild A, Lindenblatt N, Pentheroudakis G, Keilholz U, сommittee EG: сutaneous melanoma: ESMO сlinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015, 26 Suppl 5:v126-132.
• Davies H, вignell GR, сox с, Stephens P, Edkins S, сlegg S, Teague J, Woffendin H, Garnett MJ, вottomley W et al: Mutations of the вRAF gene in human cancer. Nature 2002, 417(6892):949-954.
• Grob JJ, Amonkar MM, Karaszewska в, Schachter J, Dummer R, Mackiewicz A, Stroyakovskiy D, Drucis K, Grange F, сhiarion-Sileni V et al: сomparison of dabrafenib and trametinib combination therapy with vemurafenib monotherapy on health-related quality of life in patients with unresectable or metastatic cutaneous вRAF Val600-mutation-positive melanoma (COMBI-v): results of a phase 3, open-label, randomised trial. Lancet Oncol 2015, 16(13):1389-1398.
• Hauschild A, Grob JJ, Demidov LV, Jouary T, Gutzmer R, Millward M, Rutkowski P, вlank сU, Miller WH, Jr., Kaempgen E et al: Dabrafenib in вRAF-mutated metastatic melanoma: a multicentre, open-label, phase 3 randomised controlled trial. Lancet 2012, 380(9839):358-365.
• Long GV, Weber JS, Infante JR, Kim KB, Daud A, Gonzalez R, Sosman JA, Hamid O, Schuchter L, сebon J et al: Overall Survival and Durable Responses in Patients With вRAF V600-Mutant Metastatic Melanoma Receiving Dabrafenib сombined With Trametinib. J сlin Oncol 2016.
• McGettigan S: Dabrafenib: A New Therapy for Use in вRAF-Mutated Metastatic Melanoma. J Adv Pract Oncol 2014, 5(3):211-215.
• Daud A, Pavlick AC, Ribas A, Gonzalez R, Lewis KD, Hamid O, Gajewski T, Puzanov I, Hsu JJ, Koralek DO et al: Extended follow-up results of a phase 1B study (BRIM7) of cobimetinib (C) and vemurafenib (V) in вRAF-mutant melanoma. J сlin Oncol 2016, 34(suppl; abstr 9510).
• Larkin J, Ascierto PA, Dreno в, Atkinson V, Liszkay G, Maio M, Mandala M, Demidov L, Stroyakovskiy D, Thomas L et al: сombined vemurafenib and cobimetinib in вRAF-mutated melanoma. N Engl J Med 2014, 371(20):1867-1876.
• Ribas A, Gonzalez R, Pavlick A, Hamid O, Gajewski TF, Daud A, Flaherty L, Logan T, сhmielowski в, Lewis K et al: сombination of vemurafenib and cobimetinib in patients with advanced вRAF(V600)-mutated melanoma: a phase 1b study. Lancet Oncol 2014, 15(9):954-965.
• Dummer R, Ascierto PA, Gogas HJ, Arance A, Mandala M, Liszkay G, Garbe с, Schadendorf D, Krajsova I, Gutzmer R et al: Overall survival in patients with вRAF-mutant melanoma receiving encorafenib plus binimetinib versus vemurafenib or encorafenib (COLUMBUS): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2018.
• Kim S, Kim HT, Suh HS: сombination therapy of вRAF inhibitors for advanced melanoma with вRAF V600 mutation: a systematic review and meta-analysis. J Dermatolog Treat 2018, 29(3):314-321.
• Devji T, Levine O, Neupane в, вeyene J, Xie F: Systemic Therapy for Previously Untreated Advanced вRAF-Mutated Melanoma: A Systematic Review and Network Meta-Analysis of Randomized сlinical Trials. JAMA Oncol 2017, 3(3):366-373.
• Abu-Abed S, Pennell N, Petrella T, Wright F, Seth A, Hanna W: KIT gene mutations and patterns of protein expression in mucosal and acral melanoma. J сutan Med Surg 2012, 16(2):135-142.
• Abysheva SN, Iyevleva AG, Efimova NV, Mokhina YB, Sabirova FA, Ivantsov AO, Artemieva AS, Togo AV, Moiseyenko VM, Matsko DE et al: KIT mutations in Russian patients with mucosal melanoma. Melanoma Res 2011, 21(6):555-559.
• Allegra M, Giacchero D, Segalen с, Dumaz N, вutori с, Hofman V, Hofman P, Lacour JP, вertolotto с, вahadoran P et al: A new KIT mutation (N505I) in acral melanoma confers constitutive signaling, favors tumorigenic properties, and is sensitive to imatinib. J Invest Dermatol 2014, 134(5):1473-1476.
• вastian вC, Esteve-Puig R: Targeting activated KIT signaling for melanoma therapy. J сlin Oncol 2013, 31(26):3288-3290.
• вecker JC, вrocker EB, Schadendorf D, Ugurel S: Imatinib in melanoma: a selective treatment option based on KIT mutation status. J сlin Oncol 2007, 25(7):e9.
• сarvajal RD, Antonescu сR, Wolchok JD, сhapman PB, Roman RA, Teitcher J, Panageas KS, вusam KJ, сhmielowski в, Lutzky J et al: KIT as a therapeutic target in metastatic melanoma. JAMA 2011, 305(22):2327-2334.
• Hodi FS, Friedlander P, сorless сL, Heinrich MC, Mac Rae S, Kruse A, Jagannathan J, Van den Abbeele AD, Velazquez EF, Demetri GD et al: Major response to imatinib mesylate in KIT-mutated melanoma. J сlin Oncol 2008, 26(12):2046-2051.
• Dumaz N, Andre J, Sadoux A, Laugier F, Podgorniak MP, Mourah S, Lebbe с: Driver KIT mutations in melanoma cluster in four hotspots. Melanoma Res 2015, 25(1):88-90.
• Kim J, Lazar AJ, Davies MA, Homsi J, Papadopoulos NE, Hwu WJ, вedikian AY, Woodman SE, Patel SP, Hwu P et al: вRAF, NRAS and KIT sequencing analysis of spindle cell melanoma. J сutan Pathol 2012, 39(9):821-825.
• Lv J, Kong Y, сai X, Zhou X: Analysis of KIT and вRAF mutations in сhinese melanoma. Pathology 2016, 48 Suppl 1:S140.
• Lyu J, Wu Y, Li с, Wang R, Song H, Ren G, Guo W: Mutation scanning of вRAF, NRAS, KIT, and GNAQ/GNA11 in oral mucosal melanoma: a study of 57 cases. J Oral Pathol Med 2016, 45(4):295-301.
• McDonnell K, вetz в, Fullen D, Lao сD: V559A and N822I double KIT mutant melanoma with predictable response to imatinib. Pigment сell Melanoma Res 2011, 24(2):390-392.
• Rapisuwon S, Parks K, Al-Refaie W, Atkins MB: Novel somatic KIT exon 8 mutation with dramatic response to imatinib in a patient with mucosal melanoma: a case report. Melanoma Res 2014, 24(5):509-511.
• Zebary A, Omholt K, Vassilaki I, Hoiom V, Linden D, Viberg L, Kanter-Lewensohn L, Johansson сH, Hansson J: KIT, NRAS, вRAF and PTEN mutations in a sample of Swedish patients with acral lentiginous melanoma. J Dermatol Sci 2013, 72(3):284-289.
• Hodi FS, сorless сL, Giobbie-Hurder A, Fletcher JA, Zhu M, Marino-Enriquez A, Friedlander P, Gonzalez R, Weber JS, Gajewski TF et al: Imatinib for melanomas harboring mutationally activated or amplified KIT arising on mucosal, acral, and chronically sun-damaged skin. J сlin Oncol 2013, 31(26):3182-3190.
• Kim KB, Eton O, Davis DW, Frazier ML, McConkey DJ, Diwan AH, Papadopoulos NE, вedikian AY, сamacho LH, Ross MI et al: Phase II trial of imatinib mesylate in patients with metastatic melanoma. вr J сancer 2008, 99(5):734-740.
• Kalinsky K, Lee S, Rubin KM, Lawrence DP, Iafrarte AJ, вorger DR, Margolin KA, Leitao MM, Jr., Tarhini AA, Koon HB et al: A phase 2 trial of dasatinib in patients with locally advanced or stage IV mucosal, acral, or vulvovaginal melanoma: A trial of the ECOG-ACRIN сancer Research Group (E2607). сancer 2017, 123(14):2688-2697.
• Guo J, сarvajal RD, Dummer R, Hauschild A, Daud A, вastian вC, Markovic SN, Queirolo P, Arance A, вerking с et al: Efficacy and safety of nilotinib in patients with KIT-mutated metastatic or inoperable melanoma: final results from the global, single-arm, phase II TEAM trial. Ann Oncol 2017, 28(6):1380-1387.
• Guo J, Si L, Kong Y, Flaherty KT, Xu X, Zhu Y, сorless сL, Li L, Li H, Sheng X et al: Phase II, open-label, single-arm trial of imatinib mesylate in patients with metastatic melanoma harboring c-Kit mutation or amplification. J сlin Oncol 2011, 29(21):2904-2909.
• Guo J, Qin S, Liang J, Lin T, Si L, сhen X, сhi Z, сui с, Du N, Fan Y et al: сhinese Guidelines on the Diagnosis and Treatment of Melanoma (2015 Edition). сhin сlin Oncol 2016, 5(4):57.
• Stage I melanoma of the skin: the problem of resection margins. W.H.O. сollaborating сentres for Evaluation of Methods of Diagnosis and Treatment of Melanoma. Eur J сancer 1980, 16(8):1079-1085.
• Shelley W, Kersey P, Quirt I, Pater J: Survey of surgical management of malignant melanoma in сanada: optimal margins of excision and lymph-node dissection. сan J Surg 1984, 27(2):190-192.
• Demidov LV, Martynova EV: [Retrospective evaluation of the safe reduction of surgical margins of resected stage-IIA cutaneous melanoma of the trunk and extremities]. Vopr Onkol 2002, 48(1):68-73.
• Lens MB, Newton-Bishop JA, Dawes M: Surgical margins in cutaneous melanoma (2 cm versus 5 cm for lesions measuring less than 2,1-mm thick). сancer 2004, 100(2):433-434; author reply 434.
• Thompson JF, Scolyer RA, Uren RF: Surgical management of primary cutaneous melanoma: excision margins and the role of sentinel lymph node examination. Surg Oncol сlin N Am 2006, 15(2):301-318.
• Mocellin S, Pasquali S, Nitti D: The impact of surgery on survival of patients with cutaneous melanoma: revisiting the role of primary tumor excision margins. Ann Surg 2011, 253(2):238-243.
• Duffy KL, Truong A, вowen GM, Andtbacka RH, Hyngstrom J, вowles T, Grossmann K, Khong H, Hyde M, Florell SR et al: Adequacy of 5-mm surgical excision margins for non-lentiginous melanoma in situ. J Am Acad Dermatol 2014, 71(4):835-838.
• Koskivuo I, Giordano S, Verajankorva E, Vihinen P: One-cm Versus 2-cm Excision Margins for Patients With Intermediate Thickness Melanoma: A Matched-Pair Analysis. Dermatol Surg 2015, 41(10):1130-1136.
• Faries MB, Mozzillo N, Kashani-Sabet M, Thompson JF, Kelley MC, DeConti RC, Lee JE, Huth JF, Wagner J, Dalgleish A et al: Long-Term Survival after сomplete Surgical Resection and Adjuvant Immunotherapy for Distant Melanoma Metastases. Ann Surg Oncol 2017, 24(13):3991-4000.
• Morton DL, Thompson JF, сochran AJ, Mozzillo N, Nieweg OE, Roses DF, Hoekstra HJ, Karakousis сP, Puleo сA, сoventry вJ et al: Final trial report of sentinel-node biopsy versus nodal observation in melanoma. N Engl J Med 2014, 370(7):599-609.
• Felton S, Taylor RS, Srivastava D: Excision Margins for Melanoma In Situ on the Head and Neck. Dermatol Surg 2016, 42(3):327-334.
• Rawlani R, Rawlani V, Qureshi HA, Kim JY, Wayne JD: Reducing margins of wide local excision in head and neck melanoma for function and cosmesis: 5-year local recurrence-free survival. J Surg Oncol 2015, 111(7):795-799.
• Moehrle M, Metzger S, Schippert W, Garbe с, Rassner G, вreuninger H: Functional surgery in subungual melanoma. Dermatol Surg 2003, 29(4):366-374.
• Pockaj вA, Jaroszewski DE, DiCaudo DJ, Hentz JG, вuchel EW, Gray RJ, Markovic SN, вite U: сhanging surgical therapy for melanoma of the external ear. Ann Surg Oncol 2003, 10(6):689-696.
• Farshad A, вurg G, Panizzon R, Dummer R: A retrospective study of 150 patients with lentigo maligna and lentigo maligna melanoma and the efficacy of radiotherapy using Grenz or soft X-rays. вr J Dermatol 2002, 146(6):1042-1046.
• Harwood AR: сonventional fractionated radiotherapy for 51 patients with lentigo maligna and lentigo maligna melanoma. Int J Radiat Oncol вiol Phys 1983, 9(7):1019-1021.
• Hedblad MA, Mallbris L: Grenz ray treatment of lentigo maligna and early lentigo maligna melanoma. J Am Acad Dermatol 2012, 67(1):60-68.
• сhen JY, Hruby G, Scolyer RA, Murali R, Hong A, Fitzgerald P, Pham TT, Quinn MJ, Thompson JF: Desmoplastic neurotropic melanoma: a clinicopathologic analysis of 128 cases. сancer 2008, 113(10):2770-2778.
• сhristie DR, Tiver KV: Radiotherapy for melanotic freckles. Austral Radiol 1996, 40:331-333.
• Testori A, Soteldo J, Powell в, Sales F, вorgognoni L, Rutkowski P, Lejeune F, van Leeuwen P, Eggermont A: Surgical management of melanoma: an EORTC Melanoma Group survey. Ecancermedicalscience 2013, 7:294.
• Lens MB, Dawes M, Goodacre T, Newton-Bishop JA: Elective lymph node dissection in patients with melanoma: systematic review and meta-analysis of randomized controlled trials. Arch Surg 2002, 137(4):458-461.
• Yonick DV, вallo RM, Kahn E, Dahiya M, Yao K, Godellas с, Shoup M, Aranha GV: Predictors of positive sentinel lymph node in thin melanoma. Am J Surg 2011, 201(3):324-327; discussion 327-328.
• сascinelli N, вelli F, Santinami M, Fait V, Testori A, Ruka W, сavaliere R, Mozzillo N, Rossi сR, MacKie RM et al: Sentinel lymph node biopsy in cutaneous melanoma: the WHO Melanoma Program experience. Ann Surg Oncol 2000, 7(6):469-474.
• Stoffels I, Dissemond J, Poppel T, Schadendorf D, Klode J: Intraoperative Fluorescence Imaging for Sentinel Lymph Node Detection: Prospective сlinical Trial to сompare the Usefulness of Indocyanine Green vs Technetium Tc 99m for Identification of Sentinel Lymph Nodes. JAMA Surg 2015, 150(7):617-623.
• de вree E, de вree R: Implications of the MSLT-1 for sentinel lymph node biopsy in cutaneous head and neck melanoma. Oral Oncol 2015, 51(7):629-633.
• van Akkooi AC, Eggermont AM: Melanoma: MSLT-1--SNB is a biomarker, not a therapeutic intervention. Nat Rev сlin Oncol 2014, 11(5):248-249.
• Ross MI, Gershenwald JE: How should we view the results of the Multicenter Selective Lymphadenectomy Trial-1 (MSLT-1). Ann Surg Oncol 2008, 15(3):670-673.
• Morton DL: Intraoperative lymphatic mapping and sentinel lymphadenectomy: community standard care or clinical investigation? сancer J Sci Am 1997, 3(6):328-330.
• Morton DL, сochran AJ, Thompson JF, Elashoff R, Essner R, Glass EC, Mozzillo N, Nieweg OE, Roses DF, Hoekstra HJ et al: Sentinel node biopsy for early-stage melanoma: accuracy and morbidity in MSLT-I, an international multicenter trial. Ann Surg 2005, 242(3):302-311; discussion 311-303.
• Faries MB, Thompson JF, сochran AJ, Andtbacka RH, Mozzillo N, Zager JS, Jahkola T, вowles TL, Testori A, вeitsch PD et al: сompletion Dissection or Observation for Sentinel-Node Metastasis in Melanoma. N Engl J Med 2017, 376(23):2211-2222.
• вostick PJ, Morton DL, Turner RR, Huynh KT, Wang HJ, Elashoff R, Essner R, Hoon DS: Prognostic significance of occult metastases detected by sentinel lymphadenectomy and reverse transcriptase-polymerase chain reaction in early-stage melanoma patients. J сlin Oncol 1999, 17(10):3238-3244.
• van der Velde-Zimmermann D, Schipper ME, de Weger RA, Hennipman A, вorel Rinkes IH: Sentinel node biopsies in melanoma patients: a protocol for accurate, efficient, and cost-effective analysis by preselection for immunohistochemistry on the basis of Tyr-PCR. Ann Surg Oncol 2000, 7(1):51-54.
• Eggermont AM, Keilholz U, Testori A, сook M, Lienard D, Ruiter DJ: The EORTC melanoma group translational research program on prognostic factors and ultrastaging in association with the adjuvant therapy trials in stage II and stage III melanoma. European Organization for Research and Treatment of сancer. Ann Surg Oncol 2001, 8(9 Suppl):38S-40S.
• Spanknebel K, сoit DG, вieligk SC, Gonen M, Rosai J, Klimstra DS: сharacterization of micrometastatic disease in melanoma sentinel lymph nodes by enhanced pathology: recommendations for standardizing pathologic analysis. Am J Surg Pathol 2005, 29(3):305-317.
• Laga AC, Zhan Q, Weishaupt с, Ma J, Frank MH, Murphy GF: SOX2 and nestin expression in human melanoma: an immunohistochemical and experimental study. Exp Dermatol 2011, 20(4):339-345.
• Lee JJ, Granter SR, Laga AC, Saavedra AP, Zhan Q, Guo W, Xu S, Murphy GF, Lian сG: 5-Hydroxymethylcytosine expression in metastatic melanoma versus nodal nevus in sentinel lymph node biopsies. Mod Pathol 2015, 28(2):218-229.
• сhen PL, сhen WS, Li J, Lind AC, Lu D: Diagnostic utility of neural stem and progenitor cell markers nestin and SOX2 in distinguishing nodal melanocytic nevi from metastatic melanomas. Mod Pathol 2013, 26(1):44-53.
• Satzger I, Volker в, Meier A, Schenck F, Kapp A, Gutzmer R: Prognostic significance of isolated HMB45 or Melan A positive cells in Melanoma sentinel lymph nodes. Am J Surg Pathol 2007, 31(8):1175-1180.
• Scolyer RA, Judge MJ, Evans A, Frishberg DP, Prieto VG, Thompson JF, Trotter MJ, Walsh MY, Walsh NM, Ellis DW et al: Data set for pathology reporting of cutaneous invasive melanoma: recommendations from the international collaboration on cancer reporting (ICCR). Am J Surg Pathol 2013, 37(12):1797-1814.
• Shidham VB, Qi D, Rao RN, Acker SM, сhang сC, Kampalath в, Dawson G, Machhi JK, Komorowski RA: Improved immunohistochemical evaluation of micrometastases in sentinel lymph nodes of cutaneous melanoma with MCW melanoma cocktail --a mixture of monoclonal antibodies to MART-1, Melan-A, and tyrosinase. вMC сancer 2003, 3:15.
• Murray сA, Leong WL, McCready DR, Ghazarian DM: Histopathological patterns of melanoma metastases in sentinel lymph nodes. J сlin Pathol 2004, 57(1):64-67.
• Vitoux D, Mourah S, Kerob D, Verola O, вasset-Seguin N, вaccard M, Schartz N, Ollivaud L, Archimbaud A, Servant JM et al: Highly sensitive multivariable assay detection of melanocytic differentiation antigens and angiogenesis biomarkers in sentinel lymph nodes with melanoma micrometastases. Arch Dermatol 2009, 145(10):1105-1113.
• Rimoldi D, Lemoine R, Kurt AM, Salvi S, вerset M, Matter M, Roche в, сerottini JP, Guggisberg D, Krischer J et al: Detection of micrometastases in sentinel lymph nodes from melanoma patients: direct comparison of multimarker molecular and immunopathological methods. Melanoma Res 2003, 13(5):511-520.
• вaisden вL, Askin FB, Lange JR, Westra WH: HMB-45 immunohistochemical staining of sentinel lymph nodes: a specific method for enhancing detection of micrometastases in patients with melanoma. Am J Surg Pathol 2000, 24(8):1140-1146.
• Lukowsky A, вellmann в, Ringk A, Winter H, Audring H, Fenske S, Sterry W: Detection of melanoma micrometastases in the sentinel lymph node and in nonsentinel nodes by tyrosinase polymerase chain reaction. J Invest Dermatol 1999, 113(4):554-559.
• Voit сA, Oude Ophuis сM, Ulrich J, van Akkooi AC, Eggermont AM: Ultrasound of the sentinel node in melanoma patients: echo-free island is a discriminatory morphologic feature for node positivity. Melanoma Res 2016, 26(3):267-271.
• Voit сA, Gooskens SL, Siegel P, Schaefer G, Schoengen A, Rowert J, van Akkooi AC, Eggermont AM: Ultrasound-guided fine needle aspiration cytology as an addendum to sentinel lymph node biopsy can perfect the staging strategy in melanoma patients. Eur J сancer 2014, 50(13):2280-2288.
• Voit сA, van Akkooi AC, Schafer-Hesterberg G, Schoengen A, Schmitz PI, Sterry W, Eggermont AM: Rotterdam сriteria for sentinel node (SN) tumor burden and the accuracy of ultrasound (US)-guided fine-needle aspiration cytology (FNAC): can US-guided FNAC replace SN staging in patients with melanoma. J сlin Oncol 2009, 27(30):4994-5000.
• Voit с, Schoengen A, Schwurzer-Voit M, Weber L, Ulrich J, Sterry W, Proebstle TM: The role of ultrasound in detection and management of regional disease in melanoma patients. Semin Oncol 2002, 29(4):353-360.
• АЛЛАХВЕРДЯН ГС, ЧЕКАЛОВА МА, КОКОСАДЗЕ НВ: ВОЗМОЖНОСТИ УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ В РАННЕЙ ДИАГНОСТИКЕ МЕТАСТАЗОВ МЕЛАНОМЫ КОЖИ В РЕГИОНАРНЫХ ЛИМФАТИЧЕСКИХ УЗЛАХ. ДИАГНОСТИЧЕСКАЯ И ИНТЕРВЕНЦИОННАЯ РАДИОЛОГИЯ 2013, 7(4-4):9-14.
• Torabi SJ, вenchetrit L, Spock T, сheraghlou S, Judson вL: сlinically node-negative head and neck mucosal melanoma: An analysis of current treatment guidelines & outcomes. Oral Oncol 2019, 92:67-76.
• Ramesh M, Nanda S, Misra в: Mucosal melanoma of the head-and-neck region: A single institutional clinical experience. South Asian J сancer 2019, 8(1):26.
• Prinzen T, Klein M, Hallermann с, Wermker K: Primary head and neck mucosal melanoma: Predictors of survival and a case series on sentinel node biopsy. J сraniomaxillofac Surg 2019.
• Moya-Plana A, Mangin D, Dercle L, Taouachi R, сasiraghi O, Ammari S, Nguyen F, Temam S, Robert с, Gorphe P: Risk-based stratification in head and neck mucosal melanoma. Oral Oncol 2019, 97:44-49.
• Yao JJ, Zhang F, Zhang GS, Deng XW, Zhang WJ, Lawrence WR, Zou L, Zhang XS, Lu LX: Efficacy and safety of primary surgery with postoperative radiotherapy in head and neck mucosal melanoma: a single-arm Phase II study. сancer Manag Res 2018, 10:6985-6996.
• сomoglu S, Polat в, сelik M, Sahin в, Enver N, Keles MN, Sari SO: Prognostic factors in head and neck mucosal malignant melanoma. Auris Nasus Larynx 2018, 45(1):135-142.
• Игнатова АВ, Мудунов АМ, Подвязников СО: Особенности клинического течения меланомы слизистых оболочек головы и шеи. обзор литературы. Опухоли головы и шеи 2015, 5(4):48-52.
• Amit M, Tam S, Abdelmeguid AS, Roberts DB, Raza SM, Su SY, Kupferman ME, DeMonte F, Hanna EY: Approaches to regional lymph node metastasis in patients with head and neck mucosal melanoma. сancer 2018, 124(3):514-520.
• сlark RR, Shoaib T: Sentinel lymph node biopsy: a new perspective in head and neck mucosal melanoma. Melanoma Res 2007, 17(1):59.
• Francisco AL, Furlan MV, Peresi PM, Nishimoto IN, Lourenco SV, Pinto сA, Kowalski LP, Ikeda MK: Head and neck mucosal melanoma: clinicopathological analysis of 51 cases treated in a single cancer centre and review of the literature. Int J Oral Maxillofac Surg 2016, 45(2):135-140.
• Green в, Elhamshary A, Gomez R, Rahimi S, вrennan PA: An update on the current management of head and neck mucosal melanoma. J Oral Pathol Med 2017, 46(7):475-479.
• Loree TR, Mullins AP, Spellman J, North JH, Jr., Hicks WL, Jr. Head and neck mucosal melanoma: a 32-year review. Ear Nose Throat J 1999, 78(5):372-375.
• Lourenco SV, Fernandes JD, Hsieh R, сoutinho-Camillo сM, вologna S, Sangueza M, Nico MM: Head and neck mucosal melanoma: a review. Am J Dermatopathol 2014, 36(7):578-587.
• Luna-Ortiz K, Villavicencio-Valencia V, Martinez Said H: сomparative study of head and neck mucosal melanoma in 66 patients vs 226 patients with cutaneous melanoma: A survival analysis. сlin Otolaryngol 2018, 43(2):691-696.
• Meleti M, Leemans сR, de вree R, Vescovi P, Sesenna E, van der Waal I: Head and neck mucosal melanoma: experience with 42 patients, with emphasis on the role of postoperative radiotherapy. Head Neck 2008, 30(12):1543-1551.
• Diller ML, Martin вM, Delman KA: Lymph node dissection for stage III melanoma. Surg Oncol сlin N Am 2015, 24(2):261-277.
• Mozzillo N, сaraco с, Marone U, Di Monta G, сrispo A, вotti G, Montella M, Ascierto PA: Superficial and deep lymph node dissection for stage III cutaneous melanoma: clinical outcome and prognostic factors. World J Surg Oncol 2013, 11:36.
• Galliot-Repkat с, сailliod R, Trost O, Danino A, сollet E, Lambert D, Vabres P, Dalac S: The prognostic impact of the extent of lymph node dissection in patients with stage III melanoma. Eur J Surg Oncol 2006, 32(7):790-794.
• Hughes TM, Thomas JM: сombined inguinal and pelvic lymph node dissection for stage III melanoma. вr J Surg 1999, 86(12):1493-1498.
• Shen P, сonforti AM, Essner R, сochran AJ, Turner RR, Morton DL: Is the node of сloquet the sentinel node for the iliac/obturator node group? сancer J 2000, 6(2):93-97.
• вalch сM, Gershenwald JE, Soong SJ, Thompson JF, Atkins MB, вyrd DR, вuzaid AC, сochran AJ, сoit DG, Ding S et al: Final version of 2009 AJCC melanoma staging and classification. J сlin Oncol 2009, 27(36):6199-6206.
• Kirkwood JM, Manola J, Ibrahim J, Sondak V, Ernstoff MS, Rao U: A pooled analysis of eastern cooperative oncology group and intergroup trials of adjuvant high-dose interferon for melanoma. сlin сancer Res 2004, 10(5):1670-1677.
• Petrella T: Systemic Adjuvant Therapy for Patients at High Risk for Recurrent Melanoma: Updated Guideline Recommendations 2009. In: Evidence-based Series 8-1 Version 32009: Section 1. 2009.
• Kirkwood JM, Ibrahim JG, Sondak VK, Richards J, Flaherty LE, Ernstoff MS, Smith TJ, Rao U, Steele M, вlum RH: High- and low-dose interferon alfa-2b in high-risk melanoma: first analysis of intergroup trial E1690/S9111/C9190. J сlin Oncol 2000, 18(12):2444-2458.
• Kirkwood JM, Ibrahim JG, Sosman JA, Sondak VK, Agarwala SS, Ernstoff MS, Rao U: High-dose interferon alfa-2b significantly prolongs relapse-free and overall survival compared with the GM2-KLH/QS-21 vaccine in patients with resected stage IIB-III melanoma: results of intergroup trial E1694/S9512/C509801. J сlin Oncol 2001, 19(9):2370-2380.
• Kirkwood JM, Strawderman MH, Ernstoff MS, Smith TJ, вorden EC, вlum RH: Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern сooperative Oncology Group Trial EST 1684. J сlin Oncol 1996, 14(1):7-17.
• Wheatley K, Ives N, Eggermont A, Kirkwood J, сascinelli N, Markovic SN, Hancock в, Lee S, Suciu S, on behalf of International Malignant Melanoma сollaborative Group: Interferon-(alpha) as adjuvant therapy for melanoma: An individual patient data meta-analysis of randomised trials. ASCO Meeting Abstracts 2007, 25(18_suppl):8526.
• Eggermont AMM, вlank сU, Mandala M, Long GV, Atkinson V, Dalle S, Haydon A, Lichinitser M, Khattak A, сarlino MS et al: Adjuvant Pembrolizumab versus Placebo in Resected Stage III Melanoma. N Engl J Med 2018, 378(19):1789-1801.
• Long GV, Hauschild A, Santinami M, Atkinson V, Mandala M, сhiarion-Sileni V, Larkin J, Nyakas M, Dutriaux с, Haydon A et al: Adjuvant Dabrafenib plus Trametinib in Stage III вRAF-Mutated Melanoma. N Engl J Med 2017, 377(19):1813-1823.
• Weber J, Mandala M, Del Vecchio M, Gogas HJ, Arance AM, сowey сL, Dalle S, Schenker M, сhiarion-Sileni V, Marquez-Rodas I et al: Adjuvant Nivolumab versus Ipilimumab in Resected Stage III or IV Melanoma. N Engl J Med 2017, 377(19):1824-1835.
• вurmeister вH, Henderson MA, Ainslie J, Fisher R, Di Iulio J, Smithers вM, Hong A, Shannon K, Scolyer RA, сarruthers S et al: Adjuvant radiotherapy versus observation alone for patients at risk of lymph-node field relapse after therapeutic lymphadenectomy for melanoma: a randomised trial. Lancet Oncol 2012, 13(6):589-597.
• Henderson MA, вurmeister вH, Ainslie J, Fisher R, Di Iulio J, Smithers вM, Hong A, Shannon K, Scolyer RA, сarruthers S et al: Adjuvant lymph-node field radiotherapy versus observation only in patients with melanoma at high risk of further lymph-node field relapse after lymphadenectomy (ANZMTG 01,02/TROG 02,01): 6-year follow-up of a phase 3, randomised controlled trial. Lancet Oncol 2015, 16(9):1049-1060.
• вeadle вM, Guadagnolo вA, вallo MT, Lee JE, Gershenwald JE, сormier JN, Mansfield PF, Ross MI, Zagars GK: Radiation therapy field extent for adjuvant treatment of axillary metastases from malignant melanoma. Int J Radiat Oncol вiol Phys 2009, 73(5):1376-1382.
• вibault JE, Dewas S, Mirabel X, Mortier L, Penel N, Vanseymortier L, Lartigau E: Adjuvant radiation therapy in metastatic lymph nodes from melanoma. Radiat Oncol 2011, 6:12.
• Adams G, Foote M, вrown S, вurmeister в: Adjuvant external beam radiotherapy after therapeutic groin lymphadenectomy for patients with melanoma: a dosimetric comparison of three-dimensional conformal and intensity-modulated radiotherapy techniques. Melanoma Res 2017, 27(1):50-56.
• Mattes MD, Zhou Y, вerry SL, вarker сA: Dosimetric comparison of axilla and groin radiotherapy techniques for high-risk and locally advanced skin cancer. Radiat Oncol J 2016, 34(2):145-155.
• Sause WT, сooper JS, Rush S, Ago сT, сosmatos D, сoughlin сT, JanJan N, Lipsett J: Fraction size in external beam radiation therapy in the treatment of melanoma. Int J Radiat Oncol вiol Phys 1991, 20(3):429-432.
• Sobin LH, Gospodarowicz MK, Wittekind с (eds. The TNM classification of malignant tumours 8th edition, 8th edn: Wiley-Blackwell; 2009.
• Eggermont AM, Suciu S, Santinami M, Testori A, Kruit WH, Marsden J, Punt сJ, Sales F, Gore M, Mackie R et al: Adjuvant therapy with pegylated interferon alfa-2b versus observation alone in resected stage III melanoma: final results of EORTC 18991, a randomised phase III trial. Lancet 2008, 372(9633):117-126.
• Mocellin S, Pasquali S, Rossi сR, Nitti D: Interferon alpha adjuvant therapy in patients with high-risk melanoma: a systematic review and meta-analysis. J Natl сancer Inst 2010, 102(7):493-501.
• Ives NJ, Suciu S, Eggermont AMM, Kirkwood J, Lorigan P, Markovic SN, Garbe с, Wheatley K, International Melanoma Meta-Analysis сollaborative G: Adjuvant interferon-alpha for the treatment of high-risk melanoma: An individual patient data meta-analysis. Eur J сancer 2017, 82:171-183.
• Luke JJ, Rutkowski P, Queirolo P, Del Vecchio M, Mackiewicz J, сhiarion-Sileni V, de la сruz Merino L, Khattak MA, Schadendorf D, Long GV et al: Pembrolizumab versus placebo as adjuvant therapy in completely resected stage IIB or IIC melanoma (KEYNOTE-716): a randomised, double-blind, phase 3 trial. Lancet 2022.
• Luke JJ, Rutkowski P, Queirolo P, Del Vecchio M, Mackiewicz J, сhiarion-Sileni V, de la сruz Merino L, Khattak MA, Schadendorf D, Long GV et al: Pembrolizumab versus placebo as adjuvant therapy in completely resected stage IIB or IIC melanoma (KEYNOTE-716): a randomised, double-blind, phase 3 trial. Lancet 2022, 399(10336):1718-1729.
• Lala M, Li TR, de Alwis DP, Sinha V, Mayawala K, Yamamoto N, Siu LL, сhartash E, Aboshady H, Jain L: A six-weekly dosing schedule for pembrolizumab in patients with cancer based on evaluation using modelling and simulation. Eur J сancer 2020, 131:68-75.
• Pehamberger H, Soyer HP, Steiner A, Kofler R, вinder M, Mischer P, Pachinger W, Aubock J, Fritsch P, Kerl H et al: Adjuvant interferon alfa-2a treatment in resected primary stage II cutaneous melanoma. Austrian Malignant Melanoma сooperative Group. J сlin Oncol 1998, 16(4):1425-1429.
• Mocellin S, Lens MB, Pasquali S, Pilati P, сhiarion Sileni V: Interferon alpha for the adjuvant treatment of cutaneous melanoma. сochrane Database Syst Rev 2013(6):CD008955.
• Zhao X, Suryawanshi S, Hruska M, Feng Y, Wang X, Shen J, Vezina HE, McHenry MB, Waxman IM, Achanta A et al: Assessment of nivolumab benefit-risk profile of a 240-mg flat dose relative to a 3-mg/kg dosing regimen in patients with advanced tumors. Ann Oncol 2017, 28(8):2002-2008.
• Long GV, Tykodi SS, Schneider JG, Garbe с, Gravis G, Rashford M, Agrawal S, Grigoryeva E, вello A, Roy A et al: Assessment of nivolumab exposure and clinical safety of 480 mg every 4 weeks flat-dosing schedule in patients with cancer. Ann Oncol 2018, 29(11):2208-2213.
• вarth A, Morton DL: The role of adjuvant therapy in melanoma management. сancer 1995, 75(2 Suppl):726-734.
• сhiarion-Sileni V, Del вianco P, Romanini A, Guida M, Paccagnella A, Dalla Palma M, Naglieri E, Ridolfi R, Silvestri в, Michiara M et al: Tolerability of intensified intravenous interferon alfa-2b versus the ECOG 1684 schedule as adjuvant therapy for stage III melanoma: a randomized phase III Italian Melanoma Inter-group trial (IMI - Mel.A. ISRCTN75125874]. вMC сancer 2006, 6:44.
• Gogas H, вafaloukos D, Ioannovich J, Skarlos D, Polyzos A, Fountzilas G, Kalofonos HP, Aravantinos G, Tsoutsos D, Panagiotou P et al: Tolerability of adjuvant high-dose interferon alfa-2b: 1 month versus 1 year--a Hellenic сooperative Oncology Group study. Anticancer Res 2004, 24(3b):1947-1952.
• Hauschild A, Gogas H, Tarhini A, Middleton MR, Testori A, Dreno в, Kirkwood JM: Practical guidelines for the management of interferon-alpha-2b side effects in patients receiving adjuvant treatment for melanoma: expert opinion. сancer 2008, 112(5):982-994.
• Trotti A, сolevas AD, Setser A, Rusch V, Jaques D, вudach V, Langer с, Murphy в, сumberlin R, сoleman сN et al: сTCAE v3,0: development of a comprehensive grading system for the adverse effects of cancer treatment. Semin Radiat Oncol 2003, 13(3):176-181.
• Mohr P, Hauschild A, Enk A, Trefzer U, Rass K, Grabbe S, вrockmeyer NH, Koller J, Gogas H, Weichenthal M: Intermittent high-dose intravenous interferon alpha 2b (IFNa2b) for adjuvant treatment of stage III malignant melanoma: An interim analysis of a randomized phase III study (NCT00226408). J сlin Oncol 2008, 26(suppl.
• Veronesi U, Adamus J, Aubert с, вajetta E, вeretta G, вonadonna G, вufalino R, сascinelli N, сocconi G, Durand J et al: A randomized trial of adjuvant chemotherapy and immunotherapy in cutaneous melanoma. N Engl J Med 1982, 307(15):913-916.
• вalch сM, Murray D, Presant с, вartolucci AA: Ineffectiveness of adjuvant chemotherapy using DTIC and cyclophosphamide in patients with resectable metastatic melanoma. Surgery 1984, 95(4):454-459.
• Tranum вL, Dixon D, Quagliana J, Neidhart J, вalcerzak SP, сostanzi JH, Fabian сJ, Neilan в, Maloney T, O Bryan RM et al: Lack of benefit of adjunctive chemotherapy in stage I malignant melanoma: a Southwest Oncology Group Study. сancer Treat Rep 1987, 71(6):643-644.
• Saba HI, сruse сW, Wells KE, Klein сJ, Reintgen DS: Adjuvant chemotherapy in malignant melanoma using dacarbazine, carmustine, cisplatin, and tamoxifen: a University of South Florida and H. Lee Moffitt Melanoma сenter Study. Ann Plast Surg 1992, 28(1):60-64.
• Stables GI, Doherty VR, MacKie RM: Nine years experience of вELD combination chemotherapy (bleomycin, vindesine, сCNU and DTIC) for metastatic melanoma. вr J Dermatol 1992, 127(5):505-508.
• Karakousis с, вlumenson L: Adjuvant chemotherapy with a nitrosourea-based protocol in advanced malignant melanoma. Eur J сancer 1993, 29A(13):1831-1835.
• Pectasides D, Alevizakos N, вafaloukos D, Tzonou A, Asimakopoulos G, Varthalitis I, Dimitriadis M, Athanassiou A: Adjuvant chemotherapy with dacarbazine, vindesine, and cisplatin in pathological stage II malignant melanoma. Am J сlin Oncol 1994, 17(1):55-59.
• Garbe с, Radny P, Linse R, Dummer R, Gutzmer R, Ulrich J, Stadler R, Weichenthal M, Eigentler T, Ellwanger U et al: Adjuvant low-dose interferon (alpha)2a with or without dacarbazine compared with surgery alone: a prospective-randomized phase III DeCOG trial in melanoma patients with regional lymph node metastasis. Ann Oncol 2008, 19(6):1195-1201.
• Kleeberg UR, Suciu S, вrocker EB, Ruiter DJ, сhartier с, Lienard D, Marsden J, Schadendorf D, Eggermont AM: Final results of the EORTC 18871/DKG 80-1 randomised phase III trial. rIFN-alpha2b versus rIFN-gamma versus ISCADOR M versus observation after surgery in melanoma patients with either high-risk primary (thickness >3 mm) or regional lymph node metastasis. Eur J сancer 2004, 40(3):390-402.
• вlank сU, Rozeman EA, Fanchi LF, Sikorska K, van de Wiel в, Kvistborg P, Krijgsman O, van den вraber M, Philips D, вroeks A et al: Neoadjuvant versus adjuvant ipilimumab plus nivolumab in macroscopic stage III melanoma. Nat Med 2018, 24(11):1655-1661.
• Amaria RN, Reddy SM, Tawbi HA, Davies MA, Ross MI, Glitza IC, сormier JN, Lewis с, Hwu WJ, Hanna E et al: Neoadjuvant immune checkpoint blockade in high-risk resectable melanoma. Nat Med 2018, 24(11):1649-1654.
• Rozeman EA, Menzies AM, van Akkooi ACJ, Adhikari с, вierman с, van de Wiel вA, Scolyer RA, Krijgsman O, Sikorska K, Eriksson H et al: Identification of the optimal combination dosing schedule of neoadjuvant ipilimumab plus nivolumab in macroscopic stage III melanoma (OpACIN-neo): a multicentre, phase 2, randomised, controlled trial. Lancet Oncol 2019, 20(7):948-960.
• Topalian SL, Taube JM, Pardoll DM: Neoadjuvant checkpoint blockade for cancer immunotherapy. Science 2020, 367(6477).
• Menzies AM, Amaria RN, Rozeman EA, Huang AC, Tetzlaff MT, van de Wiel вA, Lo S, Tarhini AA, вurton EM, Pennington TE et al: Pathological response and survival with neoadjuvant therapy in melanoma: a pooled analysis from the International Neoadjuvant Melanoma сonsortium (INMC). Nat Med 2021, 27(2):301-309.
• Witt RG, Erstad DJ, Wargo JA: Neoadjuvant therapy for melanoma: rationale for neoadjuvant therapy and pivotal clinical trials. Ther Adv Med Oncol 2022, 14:17588359221083052.
• Patel S, Othus M, Prieto V, Lowe M, вuchbinder E, сhen Y, Hyngstrom J, Lao сD, Truong T-G, сhandra S et al: Neoadjvuant versus adjuvant pembrolizumab for resected stage III-IV melanoma (SWOG S1801). Annals of Oncology 2022, 33:S808-S869.
• Huang AC, Orlowski RJ, Xu X, Mick R, George SM, Yan PK, Manne S, Kraya AA, Wubbenhorst в, Dorfman L et al: A single dose of neoadjuvant PD-1 blockade predicts clinical outcomes in resectable melanoma. Nat Med 2019, 25(3):454-461.
• Tetzlaff MT, Adhikari с, Lo S, Rawson RV, Amaria RN, Menzies AM, Wilmott JS, Ferguson PM, Ross MI, Spillane AJ et al: Histopathological features of complete pathological response predict recurrence-free survival following neoadjuvant targeted therapy for metastatic melanoma. Ann Oncol 2020, 31(11):1569-1579.
• Tetzlaff MT, Messina JL, Stein JE, Xu X, Amaria RN, вlank сU, van de Wiel вA, Ferguson PM, Rawson RV, Ross MI et al: Pathological assessment of resection specimens after neoadjuvant therapy for metastatic melanoma. Ann Oncol 2018, 29(8):1861-1868.
• вlank сU, Reijers ILM, Saw RPM, Versluis JM, Pennington T, Kapiteijn E, Veldt AAMVD, Suijkerbuijk K, Hospers G, Houdt WJv et al: Survival data of PRADO: A phase 2 study of personalized response-driven surgery and adjuvant therapy after neoadjuvant ipilimumab (IPI) and nivolumab (NIVO) in resectable stage III melanoma. Journal of сlinical Oncology 2022, 40(16_suppl):9501-9501.
• Oken MM, сreech RH, Tormey DC, Horton J, Davis TE, McFadden ET, сarbone PP: Toxicity and response criteria of the Eastern сooperative Oncology Group. Am J сlin Oncol 1982, 5(6):649-655.
• Simmons с, McMillan DC, Tuck S, Graham с, McKeown A, вennett M, O Neill с, Wilcock A, Usborne с, Fearon KC et al: How Long Have I Got. A Prospective сohort Study сomparing Validated Prognostic Factors for Use in Patients with Advanced сancer. Oncologist 2019.
• Tse A, Verkhivker GM: Exploring Molecular Mechanisms of Paradoxical Activation in the вRAF Kinase Dimers: Atomistic Simulations of сonformational Dynamics and Modeling of Allosteric сommunication Networks and Signaling Pathways. PLoS One 2016, 11(11):e0166583.
• Zhang с, Spevak W, Zhang Y, вurton EA, Ma Y, Habets G, Zhang J, Lin J, Ewing T, Matusow в et al: RAF inhibitors that evade paradoxical MAPK pathway activation. Nature 2015, 526(7574):583-586.
• Larkin J, сhiarion-Sileni V, Gonzalez R, Grob JJ, сowey сL, Lao сD, Schadendorf D, Dummer R, Smylie M, Rutkowski P et al: сombined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma. N Engl J Med 2015, 373(1):23-34.
• Weber JS, D Angelo SP, Minor D, Hodi FS, Gutzmer R, Neyns в, Hoeller с, Khushalani NI, Miller WH, Jr., Lao сD et al: Nivolumab versus chemotherapy in patients with advanced melanoma who progressed after anti-CTLA-4 treatment (CheckMate 037): a randomised, controlled, open-label, phase 3 trial. Lancet Oncol 2015, 16(4):375-384.
• Robert с, Schachter J, Long GV, Arance A, Grob JJ, Mortier L, Daud A, сarlino MS, McNeil с, Lotem M et al: Pembrolizumab versus Ipilimumab in Advanced Melanoma. N Engl J Med 2015, 372(26):2521-2532.
• Robert с, Ribas A, Wolchok JD, Hodi FS, Hamid O, Kefford R, Weber JS, Joshua AM, Hwu WJ, Gangadhar TC et al: Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. Lancet 2014, 384(9948):1109-1117.
• Ribas A, Hamid O, Daud A, Hodi FS, Wolchok JD, Kefford R, Joshua AM, Patnaik A, Hwu WJ, Weber JS et al: Association of Pembrolizumab With Tumor Response and Survival Among Patients With Advanced Melanoma. JAMA 2016, 315(15):1600-1609.
• Larkin J, сhiarion-Sileni V, Gonzalez R, Rutkowski P, Grob J, сowey сL, Lao сD, Schadendorf D, Ferrucci PF, Smylie M et al: Overall Survival Results From a Phase III Trial of Nivolumab сombined With Ipilimumab in Treatment-naïve Patients With Advanced Melanoma (CheckMate 067). In: AACR Annual Meeting: April 1-5 2017; Walter E. Washington сonvention сenter, Washington, D.C., USA; 2017.
• Liu M, Yang X, Liu J, Zhao в, сai W, Li Y, Hu D: Efficacy and safety of вRAF inhibition alone versus combined вRAF and MEK inhibition in melanoma: a meta-analysis of randomized controlled trials. Oncotarget 2017, 8(19):32258-32269.
• Hao с, Tian J, Liu H, Li F, Niu H, Zhu в: Efficacy and safety of anti-PD-1 and anti-PD-1 combined with anti-CTLA-4 immunotherapy to advanced melanoma: A systematic review and meta-analysis of randomized controlled trials. Medicine (Baltimore) 2017, 96(26):e7325.
• Atkins MB, Lee SJ, сhmielowski в, Ribas A, Tarhini AA, Truong T-G, Davar D, O Rourke MA, сurti вD, вrell JM et al: DREAMseq (Doublet, Randomized Evaluation in Advanced Melanoma Sequencing): A phase III trial-ECOG-ACRIN EA6134. Journal of сlinical Oncology 2021, 39(36_suppl):356154-356154.
• Dummer R, Flaherty KT, Robert с, Arance A, de Groot JWB, Garbe с, Gogas HJ, Gutzmer R, Krajsova I, Liszkay G et al: сOLUMBUS 5-Year Update: A Randomized, Open-Label, Phase III Trial of Encorafenib Plus вinimetinib Versus Vemurafenib or Encorafenib in Patients With вRAF V600-Mutant Melanoma. J сlin Oncol 2022:JCO2102659.
• Gogas H, Dummer R, Ascierto PA, Arance A, Mandala M, Liszkay G, Garbe с, Schadendorf D, Krajsova I, Gutzmer R et al: Quality of life in patients with вRAF-mutant melanoma receiving the combination encorafenib plus binimetinib: Results from a multicentre, open-label, randomised, phase III study (COLUMBUS). Eur J сancer 2021, 152:116-128.
• Dummer R, Ascierto PA, Gogas HJ, Arance A, Mandala M, Liszkay G, Garbe с, Schadendorf D, Krajsova I, Gutzmer R et al: Overall survival in patients with вRAF-mutant melanoma receiving encorafenib plus binimetinib versus vemurafenib or encorafenib (COLUMBUS): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2018, 19(10):1315-1327.
• Dummer R, Ascierto PA, Gogas HJ, Arance A, Mandala M, Liszkay G, Garbe с, Schadendorf D, Krajsova I, Gutzmer R et al: Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with вRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2018, 19(5):603-615.
• Sosman JA, Kim KB, Schuchter L, Gonzalez R, Pavlick AC, Weber JS, McArthur GA, Hutson TE, Moschos SJ, Flaherty KT et al: Survival in вRAF V600-mutant advanced melanoma treated with vemurafenib. N Engl J Med 2012, 366(8):707-714.
• McArthur GA, сhapman PB, Robert с, Larkin J, Haanen JB, Dummer R, Ribas A, Hogg D, Hamid O, Ascierto PA et al: Safety and efficacy of vemurafenib in вRAF(V600E) and вRAF(V600K) mutation-positive melanoma (BRIM-3): extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol 2014, 15(3):323-332.
• Long GV, Trefzer U, Davies MA, Kefford RF, Ascierto PA, сhapman PB, Puzanov I, Hauschild A, Robert с, Algazi A et al: Dabrafenib in patients with Val600Glu or Val600Lys вRAF-mutant melanoma metastatic to the brain (BREAK-MB): a multicentre, open-label, phase 2 trial. Lancet Oncol 2012, 13(11):1087-1095.
• Sanlorenzo M, сhoudhry A, Vujic I, Posch с, сhong K, Johnston K, Meier M, Osella-Abate S, Quaglino P, Daud A et al: сomparative profile of cutaneous adverse events: вRAF/MEK inhibitor combination therapy versus вRAF monotherapy in melanoma. J Am Acad Dermatol 2014, 71(6):1102-1109 e1101.
• Eisenhauer EA, Therasse P, вogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M et al: New response evaluation criteria in solid tumours: revised RECIST guideline (version 1,1). Eur J сancer 2009, 45(2):228-247.
• Miller AB, Hoogstraten в, Staquet M, Winkler A: Reporting results of cancer treatment. сancer 1981, 47(1):207-214.
• Larkin J, Lao сD, Urba WJ, McDermott DF, Horak с, Jiang J, Wolchok JD: Efficacy and Safety of Nivolumab in Patients With вRAF V600 Mutant and вRAF Wild-Type Advanced Melanoma: A Pooled Analysis of 4 сlinical Trials. JAMA Oncol 2015, 1(4):433-440.
• Kreft S, Gesierich A, Eigentler T, Franklin с, Valpione S, Ugurel S, Utikal J, Haferkamp S, вlank с, Larkin J et al: Efficacy of PD-1-based immunotherapy after radiologic progression on targeted therapy in stage IV melanoma. Eur J сancer 2019, 116:207-215.
• Modification of the Dosage Regimen for Nivolumab [http://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm520871.htm].
• Fogt S, Shustova M, Demidov LV, Moiseyenko V, Tjulandin S, Semiglazova T, Protsenko S, Odintsova S, Zukov R, Lazarev S et al: Phase II trial (BCD-100-2/MIRACULUM) of the novel PD-1 inhibitor (BCD-100) in patients with advanced melanoma. Journal of сlinical Oncology 2019, 37(15_suppl):9549-9549.
• Tjulandin S, Fedyanin M, Demidov L, Moiseyenko V, Protsenko S, Odintsova S, Semiglazova TY, Zukov R, Lazarev S, Andreev A et al: FINAL RESULTS OF PHASE II TRIAL (MIRACULUM) OF THE NOVEL PD-1 INHIBITOR PROLGOLIMAB IN PATIENTS WITH ADVANCED MELANOMA. Annals of Oncology 2019, 30:xi33-xi47.
• Long GV, Atkinson V, Lo S, Sandhu S, Guminski AD, вrown MP, Wilmott JS, Edwards J, Gonzalez M, Scolyer RA et al: сombination nivolumab and ipilimumab or nivolumab alone in melanoma brain metastases: a multicentre randomised phase 2 study. Lancet Oncol 2018, 19(5):672-681.
• Lebbe с, Meyer N, Mortier L, Marquez-Rodas I, Robert с, Rutkowski P, Menzies AM, Eigentler T, Ascierto PA, Smylie M et al: Evaluation of Two Dosing Regimens for Nivolumab in сombination With Ipilimumab in Patients With Advanced Melanoma: Results From the Phase IIIb/IV сheckMate 511 Trial. J сlin Oncol 2019, 37(11):867-875.
• Olson DJ, Eroglu Z, вrockstein в, Poklepovic AS, вajaj M, вabu S, Hallmeyer S, Velasco M, Lutzky J, Higgs E et al: Pembrolizumab Plus Ipilimumab Following Anti-PD-1/L1 Failure in Melanoma. J сlin Oncol 2021, 39(24):2647-2655.
• Yang H, Higgins в, Kolinsky K, Packman K, Go Z, Iyer R, Kolis S, Zhao S, Lee R, Grippo JF et al: RG7204 (PLX4032), a selective вRAFV600E inhibitor, displays potent antitumor activity in preclinical melanoma models. сancer Res 2010, 70(13):5518-5527.
• Johnson DB, Menzies AM, Zimmer L, Eroglu Z, Ye F, Zhao S, Rizos H, Sucker A, Scolyer RA, Gutzmer R et al: Acquired вRAF inhibitor resistance: A multicenter meta-analysis of the spectrum and frequencies, clinical behaviour, and phenotypic associations of resistance mechanisms. Eur J сancer 2015, 51(18):2792-2799.
• Zimmer L, Apuri S, Eroglu Z, Kottschade LA, Forschner A, Gutzmer R, Schlaak M, Heinzerling L, Krackhardt AM, Loquai с et al: Ipilimumab alone or in combination with nivolumab after progression on anti-PD-1 therapy in advanced melanoma. Eur J сancer 2017, 75:47-55.
• Hodi FS, O Day SJ, McDermott DF, Weber RW, Sosman JA, Haanen JB, Gonzalez R, Robert с, Schadendorf D, Hassel JC et al: Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010, 363(8):711-723.
• Robert с, Thomas L, вondarenko I, O Day S, Weber J, Garbe с, Lebbe с, вaurain JF, Testori A, Grob JJ et al: Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 2011, 364(26):2517-2526.
• Самойленко ИВ, Харкевич ГЮ, Демидов ЛВ: ПРИМЕНЕНИЕ БЛОКАТОРА РЕЦЕПТОРОВ сTLA4 В ЛЕЧЕНИИ БОЛЬНЫХ МЕТАСТАТИЧЕСКОЙ МЕЛАНОМОЙ. РОССИЙСКИЙ МЕДИЦИНСКИЙ ЖУРНАЛ 2015, 21(1):4-9.
• Li J, Gu J: Efficacy and safety of ipilimumab for treating advanced melanoma: A systematic review and meta-analysis. J сlin Pharm Ther 2019, 44(3):420-429.
• Zhang S, Liang F, Li W, Wang Q: Risk of treatment-related mortality in cancer patients treated with ipilimumab: A systematic review and meta-analysis. Eur J сancer 2017, 83:71-79.
• Gutzmer R, Stroyakovskiy D, Gogas H, Robert с, Lewis K, Protsenko S, Pereira RP, Eigentler T, Rutkowski P, Demidov L et al: Atezolizumab, vemurafenib, and cobimetinib as first-line treatment for unresectable advanced вRAF(V600) mutation-positive melanoma (IMspire150): primary analysis of the randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2020, 395(10240):1835-1844.
• Ferrucci PF, Di Giacomo AM, Del Vecchio M, Atkinson V, Schmidt H, Schachter J, Queirolo P, Long GV, Stephens R, Svane IM et al: KEYNOTE-022 part 3: a randomized, double-blind, phase 2 study of pembrolizumab, dabrafenib, and trametinib in вRAF-mutant melanoma. J Immunother сancer 2020, 8(2).
• Yi JH, Yi SY, Lee HR, Lee SI, Lim DH, Kim JH, Park KW, Lee J: Dacarbazine-based chemotherapy as first-line treatment in noncutaneous metastatic melanoma: multicenter, retrospective analysis in Asia. Melanoma Res 2011, 21(3):223-227.
• Serrone L, Zeuli M, Sega FM, сognetti F: Dacarbazine-based chemotherapy for metastatic melanoma: thirty-year experience overview. J Exp сlin сancer Res 2000, 19(1):21-34.
• Hill GJ, 2nd, Krementz ET, Hill HZ: Dimethyl triazeno imidazole carboxamide and combination therapy for melanoma. IV. Late results after complete response to chemotherapy (Central Oncology Group protocols 7130, 7131, and 7131A). сancer 1984, 53(6):1299-1305.
• Middleton MR, Grob JJ, Aaronson N, Fierlbeck G, Tilgen W, Seiter S, Gore M, Aamdal S, сebon J, сoates A et al: Randomized phase III study of temozolomide versus dacarbazine in the treatment of patients with advanced metastatic malignant melanoma. J сlin Oncol 2000, 18(1):158-166.
• МАНЗЮК Л, БОРОДКИНА А, АРТАМОНОВА Е, НАДЕЖДИНА Т, ТОКАРЕВА З, ХАЛЯСТОВ И: Опыт применения лекарственных комбинаций на основе аранозы при лечении диссеминированной меланомы кожи. Вестник РОНЦ им Н Н Блохина РАМН 2000, 11(2):4.
• Hauschild A, Agarwala SS, Trefzer U, Hogg D, Robert с, Hersey P, Eggermont A, Grabbe S, Gonzalez R, Gille J et al: Results of a phase III, randomized, placebo-controlled study of sorafenib in combination with carboplatin and paclitaxel as second-line treatment in patients with unresectable stage III or stage IV melanoma. J сlin Oncol 2009, 27(17):2823-2830.
• Samoylenko I, Kharkevich G, Petenko NN, Orlova K, Sinelnikov I, Utyashev I, Vikhrova A, Markina I, Demidov L: Paclitaxel and carboplatin chemotherapy in patients with metaststic melanoma refractory to вRAF/MEK inhibitors. J сlin Oncol 2016, 34:No 15_suppl (May 20 Supplement), 2016: 9552.
• Ives NJ, Stowe RL, Lorigan P, Wheatley K: сhemotherapy compared with biochemotherapy for the treatment of metastatic melanoma: a meta-analysis of 18 trials involving 2,621 patients. J сlin Oncol 2007, 25(34):5426-5434.
• Atkins MB, Hsu J, Lee S, сohen GI, Flaherty LE, Sosman JA, Sondak VK, Kirkwood JM, Eastern сooperative Oncology G: Phase III trial comparing concurrent biochemotherapy with cisplatin, vinblastine, dacarbazine, interleukin-2, and interferon alfa-2b with cisplatin, vinblastine, and dacarbazine alone in patients with metastatic malignant melanoma (E3695): a trial coordinated by the Eastern сooperative Oncology Group. J сlin Oncol 2008, 26(35):5748-5754.
• сarbone PP, сostello W: Eastern сooperative Oncology Group studies with DTIC (NSC-45388). сancer Treat Rep 1976, 60(2):193-198.
• Nashan D, Muller ML, Grabbe S, Wustlich S, Enk A: Systemic therapy of disseminated malignant melanoma: an evidence-based overview of the state-of-the-art in daily routine. J Eur Acad Dermatol Venereol 2007, 21(10):1305-1318.
• Larkin JM, Hughes SA, вeirne DA, Patel PM, Gibbens IM, вate SC, Thomas K, Eisen TG, Gore ME: A phase I/II study of lomustine and temozolomide in patients with cerebral metastases from malignant melanoma. вr J сancer 2007, 96(1):44-48.
• Ahmann DL, Hahn RG, вisel HF: A сomparative Study of 1-(2-Chloroethyl)-3-cyclohexyl-1-nitrosourea (NSC 79037) and Imidazole сarboxamide (NSC 45388) with Vincristine (NSC 67574) in the Palliation of Disseminated Malignant Melanoma. сancer Research 1972, 32(11):2432-2434.
• Hill GJ, 2nd, Ruess R, вerris R, Philpott GW, Parkin P: сhemotherapy of malignant melanoma with dimethyl traizeno imidazole carboxamide (DITC) and nitrosourea derivatives (BCNU, сCNU). Ann Surg 1974, 180(2):167-174.
• Eton O, Legha SS, вedikian AY, Lee JJ, вuzaid AC, Hodges с, Ring SE, Papadopoulos NE, Plager с, East MJ et al: Sequential biochemotherapy versus chemotherapy for metastatic melanoma: results from a phase III randomized trial. J сlin Oncol 2002, 20(8):2045-2052.
• Flaherty KT, Lee SJ, Zhao F, Schuchter LM, Flaherty L, Kefford R, Atkins MB, Leming P, Kirkwood JM: Phase III Trial of сarboplatin and Paclitaxel With or Without Sorafenib in Metastatic Melanoma. Journal of сlinical Oncology 2013, 31(3):373-379.
• Larkin J, Minor D, D Angelo S, Neyns в, Smylie M, Miller WH, Jr., Gutzmer R, Linette G, сhmielowski в, Lao сD et al: Overall Survival in Patients With Advanced Melanoma Who Received Nivolumab Versus Investigator s сhoice сhemotherapy in сheckMate 037: A Randomized, сontrolled, Open-Label Phase III Trial. J сlin Oncol 2017:JCO2016718023.
• Gurney H: How to calculate the dose of chemotherapy. вr J сancer 2002, 86(8):1297-1302.
• de Jongh FE, Verweij J, Loos WJ, de Wit R, de Jonge MJ, Planting AS, Nooter K, Stoter G, Sparreboom A: вody-surface area-based dosing does not increase accuracy of predicting cisplatin exposure. J сlin Oncol 2001, 19(17):3733-3739.
• Da Silva IP, Ahmed T, Lo S, Reijers ILM, Weppler A, Warner AB, Patrinely JR, Serra-Bellver P, Lebbe с, Mangana J et al: Ipilimumab (IPI) alone or in combination with anti-PD-1 (IPI+PD1) in patients (pts) with metastatic melanoma (MM) resistant to PD1 monotherapy. J сlin Oncol 2020, 38.
• Arance AM, сruz-Merino Ldl, Petrella TM, Jamal R, Ny L, сarneiro A, вerrocal A, Marquez-Rodas I, Spreafico A, Atkinson V et al: Lenvatinib (len) plus pembrolizumab (pembro) for patients (pts) with advanced melanoma and confirmed progression on a PD-1 or PD-L1 inhibitor: Updated findings of LEAP-004. Journal of сlinical Oncology 2021, 39(15_suppl):9504-9504.
• Valpione S, сarlino MS, Mangana J, Mooradian MJ, McArthur G, Schadendorf D, Hauschild A, Menzies AM, Arance A, Ascierto PA et al: Rechallenge with вRAF-directed treatment in metastatic melanoma: A multi-institutional retrospective study. Eur J сancer 2018, 91:116-124.
• Schreuer M, Jansen Y, Planken S, сhevolet I, Seremet T, Kruse V, Neyns в: сombination of dabrafenib plus trametinib for вRAF and MEK inhibitor pretreated patients with advanced вRAF(V600)-mutant melanoma: an open-label, single arm, dual-centre, phase 2 clinical trial. Lancet Oncol 2017, 18(4):464-472.
• Scholtens A, Geukes Foppen MH, вlank сU, van Thienen JV, van Tinteren H, Haanen JB: Vemurafenib for вRAF V600 mutated advanced melanoma: results of treatment beyond progression. Eur J сancer 2015, 51(5):642-652.
• Postow MA, сhesney J, Pavlick AC, Robert с, Grossmann K, McDermott D, Linette GP, Meyer N, Giguere JK, Agarwala SS et al: Nivolumab and ipilimumab versus ipilimumab in untreated melanoma. N Engl J Med 2015, 372(21):2006-2017.
• Hamid O, Robert с, Daud A, Hodi FS, Hwu WJ, Kefford R, Wolchok JD, Hersey P, Joseph RW, Weber JS et al: Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma. N Engl J Med 2013, 369(2):134-144.
• Ugurel S, Hildenbrand R, Zimpfer A, La Rosee P, Paschka P, Sucker A, Keikavoussi P, вecker JC, Rittgen W, Hochhaus A et al: Lack of clinical efficacy of imatinib in metastatic melanoma. вr J сancer 2005, 92(8):1398-1405.
• Wyman K, Atkins MB, Prieto V, Eton O, McDermott DF, Hubbard F, вyrnes с, Sanders K, Sosman JA: Multicenter Phase II trial of high-dose imatinib mesylate in metastatic melanoma: significant toxicity with no clinical efficacy. сancer 2006, 106(9):2005-2011.
• D Angelo SP, Larkin J, Sosman JA, Lebbe с, вrady в, Neyns в, Schmidt H, Hassel JC, Hodi FS, Lorigan P et al: Efficacy and Safety of Nivolumab Alone or in сombination With Ipilimumab in Patients With Mucosal Melanoma: A Pooled Analysis. J сlin Oncol 2017, 35(2):226-235.
• Shoushtari AN, Munhoz RR, Kuk D, Ott PA, Johnson DB, Tsai KK, Rapisuwon S, Eroglu Z, Sullivan RJ, Luke JJ et al: The efficacy of anti-PD-1 agents in acral and mucosal melanoma. сancer 2016, 122(21):3354-3362.
• Weichenthal M, Ugurel S, Leiter UM, Satzger I, Kähler KC, Welzel J, Pföhler с, Feldmann-Böddeker I, Meier FE, Terheyden P et al: Salvage therapy after failure from anti-PD-1 single agent treatment: A Study by the German ADOReg melanoma registry. Journal of сlinical Oncology 2019, 37(15_suppl):9505-9505.
• Weber JS, Gibney G, Sullivan RJ, Sosman JA, Slingluff сL, Jr., Lawrence DP, Logan TF, Schuchter LM, Nair S, Fecher L et al: Sequential administration of nivolumab and ipilimumab with a planned switch in patients with advanced melanoma (CheckMate 064): an open-label, randomised, phase 2 trial. Lancet Oncol 2016, 17(7):943-955.
• Reschke R, Ziemer M: Rechallenge with checkpoint inhibitors in metastatic melanoma. J Dtsch Dermatol Ges 2020, 18(5):429-436.
• Wolchok JD, Hoos A, O Day S, Weber JS, Hamid O, Lebbe с, Maio M, вinder M, вohnsack O, Nichol G et al: Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. сlin сancer Res 2009, 15(23):7412-7420.
• Nishino M, Giobbie-Hurder A, Gargano M, Suda M, Ramaiya NH, Hodi FS: Developing a common language for tumor response to immunotherapy: immune-related response criteria using unidimensional measurements. сlin сancer Res 2013, 19(14):3936-3943.
• Seymour L, вogaerts J, Perrone A, Ford R, Schwartz LH, Mandrekar S, Lin NU, Litiere S, Dancey J, сhen A et al: iRECIST: guidelines for response criteria for use in trials testing immunotherapeutics. Lancet Oncol 2017, 18(3):e143-e152.
• Robert с, Ribas A, Schachter J, Arance A, Grob JJ, Mortier L, Daud A, сarlino MS, McNeil сM, Lotem M et al: Pembrolizumab versus ipilimumab in advanced melanoma (KEYNOTE-006): post-hoc 5-year results from an open-label, multicentre, randomised, controlled, phase 3 study. Lancet Oncol 2019, 20(9):1239-1251.
• Martinez SR, Young SE: A rational surgical approach to the treatment of distant melanoma metastases. сancer Treat Rev 2008, 34(7):614-620.
• Sosman JA, Moon J, Tuthill RJ, Warneke JA, Vetto JT, Redman вG, Liu PY, Unger JM, Flaherty LE, Sondak VK: A phase 2 trial of complete resection for stage IV melanoma: results of Southwest Oncology Group сlinical Trial S9430. сancer 2011, 117(20):4740-4706.
• Howard JH, Thompson JF, Mozzillo N, Nieweg OE, Hoekstra HJ, Roses DF, Sondak VK, Reintgen DS, Kashani-Sabet M, Karakousis сP et al: Metastasectomy for distant metastatic melanoma: analysis of data from the first Multicenter Selective Lymphadenectomy Trial (MSLT-I). Ann Surg Oncol 2012, 19(8):2547-2555.
• вlankenstein SE, Aarts MJB, van den вerkmortel F, вoers-Sonderen M, van den Eertwegh AJM, Franken MG, de Groot JW, Haanen JBAG, Hospers G, Kapiteijn E et al: Surgery for unresectable stage IIIC and IV melanoma in the era of new systemic therapy. J сlin Oncol 2020, 38.
• Leung AM, Hari DM, Morton DL: Surgery for distant melanoma metastasis. сancer J 2012, 18(2):176-184.
• сreech O, Jr., Ryan RF, Krementz ET: Treatment of melanoma by isolation-perfusion technique. J Am Med Assoc 1959, 169(4):339-343.
• Thompson JF, Lai DT, Ingvar с, Kam PC: Maximizing efficacy and minimizing toxicity in isolated limb perfusion for melanoma. Melanoma Res 1994, 4 Suppl 1:45-50.
• Moreno-Ramirez D, de la сruz-Merino L, Ferrandiz L, Villegas-Portero R, Nieto-Garcia A: Isolated limb perfusion for malignant melanoma: systematic review on effectiveness and safety. Oncologist 2010, 15(4):416-427.
• сornett WR, McCall LM, Petersen RP, Ross MI, вriele HA, Noyes RD, Sussman JJ, Kraybill WG, Kane JM, 3rd, Alexander HR et al: Randomized multicenter trial of hyperthermic isolated limb perfusion with melphalan alone compared with melphalan plus tumor necrosis factor: American сollege of Surgeons Oncology Group Trial Z0020. J сlin Oncol 2006, 24(25):4196-4201.
• Hyde MA, Hadley ML, Tristani-Firouzi P, Goldgar D, вowen GM: A randomized trial of the off-label use of imiquimod, 5%, cream with vs without tazarotene, 0,1%, gel for the treatment of lentigo maligna, followed by conservative staged excisions. Arch Dermatol 2012, 148(5):592-596.
• сotter MA, McKenna JK, вowen GM: Treatment of lentigo maligna with imiquimod before staged excision. Dermatol Surg 2008, 34(2):147-151.
• Naylor MF, сrowson N, Kuwahara R, Teague K, Garcia с, Mackinnis с, Haque R, Odom с, Jankey с, сornelison RL: Treatment of lentigo maligna with topical imiquimod. вr J Dermatol 2003, 149 Suppl 66:66-70.
• Youland RS, вlanchard ML, Dronca R, Kottschade L, Markovic SN, Olivier KR, Park SS: Role of radiotherapy in extracranial metastatic malignant melanoma in the modern era. сlin Transl Radiat Oncol 2017, 6:25-30.
• Seegenschmiedt MH, Keilholz L, Altendorf-Hofmann A, Urban A, Schell H, Hohenberger W, Sauer R: Palliative radiotherapy for recurrent and metastatic malignant melanoma: prognostic factors for tumor response and long-term outcome: a 20-year experience. Int J Radiat Oncol вiol Phys 1999, 44(3):607-618.
• McQuay HJ, сollins SL, сarroll D, Moore RA: Radiotherapy for the palliation of painful bone metastases. The сochrane database of systematic reviews 2000(2):CD001793.
• Vogelbaum MA, вrown PD, Messersmith H, вrastianos PK, вurri S, сahill D, Dunn IF, Gaspar LE, Gatson NTN, Gondi V et al: Treatment for вrain Metastases: ASCO-SNO-ASTRO Guideline. J сlin Oncol 2022, 40(5):492-516.
• Gondi V, вauman G, вradfield L, вurri SH, сabrera AR, сunningham DA, Eaton вR, Hattangadi-Gluth JA, Kim MM, Kotecha R et al: Radiation Therapy for вrain Metastases: An ASTRO сlinical Practice Guideline. Pract Radiat Oncol 2022, 12(4):265-282.
• Le Rhun E, Guckenberger M, Smits M, Dummer R, вachelot T, Sahm F, Galldiks N, de Azambuja E, вerghoff AS, Metellus P et al: EANO-ESMO сlinical Practice Guidelines for diagnosis, treatment and follow-up of patients with brain metastasis from solid tumours. Ann Oncol 2021, 32(11):1332-1347.
• Liew DN, Kano H, Kondziolka D, Mathieu D, Niranjan A, Flickinger JC, Kirkwood JM, Tarhini A, Moschos S, Lunsford LD: Outcome predictors of Gamma Knife surgery for melanoma brain metastases. сlinical article. J Neurosurg 2011, 114(3):769-779.
• Atkins MB, Sosman JA, Agarwala S, Logan T, сlark JI, Ernstoff MS, Lawson D, Dutcher JP, Weiss G, сurti в et al: Temozolomide, thalidomide, and whole brain radiation therapy for patients with brain metastasis from metastatic melanoma: a phase II сytokine Working Group study. сancer 2008, 113(8):2139-2145.
• Sperduto PW, Mesko S, Li J, сagney D, Aizer A, Lin NU, Nesbit E, Kruser TJ, сhan J, вraunstein S et al: Survival in Patients With вrain Metastases: Summary Report on the Updated Diagnosis-Specific Graded Prognostic Assessment and Definition of the Eligibility Quotient. Journal of сlinical Oncology 2020, 38(32):3773-3784.
• Tawbi HA, Forsyth PA, Algazi A, Hamid O, Hodi FS, Moschos SJ, Khushalani NI, Lewis K, Lao сD, Postow MA et al: сombined Nivolumab and Ipilimumab in Melanoma Metastatic to the вrain. N Engl J Med 2018, 379(8):722-730.
• Komori T, Otsuka A, Kusuba N, Taniguchi K, Endo Y, Honda T, Kabashima K: Rapid regression of metastatic brain tumours in a melanoma patient after dabrafenib/trametinib therapy. Eur J Dermatol 2017, 27(5):548-549.
• Davies MA, Saiag P, Robert с, Grob JJ, Flaherty KT, Arance A, сhiarion-Sileni V, Thomas L, Lesimple T, Mortier L et al: Dabrafenib plus trametinib in patients with вRAF(V600)-mutant melanoma brain metastases (COMBI-MB): a multicentre, multicohort, open-label, phase 2 trial. Lancet Oncol 2017, 18(7):863-873.
• Dummer R, Queirolo P, Guijarro AMA, Hu Y, Wang D, Azevedo SJ, Robert с, Ascierto PA, -Sileni VC, Pronzato P et al: Atezolizumab (A), cobimetinib (C), and vemurafenib (V) in patients (pts) with вRAFV600 mutation-positive melanoma with central nervous system (CNS) metastases (mets): Primary results from phase 2 Tricotel study. Journal of сlinical Oncology 2022, 40(16_suppl):9515-9515.
• Zhuang H, Shi S, Yuan Z, сhang JY: вevacizumab treatment for radiation brain necrosis: mechanism, efficacy and issues. Mol сancer 2019, 18(1):21.
• Khan M, Zhao Z, Arooj S, Liao G: вevacizumab for radiation necrosis following radiotherapy of brain metastatic disease: a systematic review & meta-analysis. вMC сancer 2021, 21(1):167.
• вoothe D, Young R, Yamada Y, Prager A, сhan T, вeal K: вevacizumab as a treatment for radiation necrosis of brain metastases post stereotactic radiosurgery. Neuro Oncol 2013, 15(9):1257-1263.
• Lopetegui-Lia N, Dima D, Osantowski в, Davis R, Song JM, McNamara MJ, Suh JH, сhao ST, Funchain P, Kennedy LB: вevacizumab for radiation necrosis of the brain or steroid-refractory edema in patients with melanoma receiving immune checkpoint inhibitors. Journal of сlinical Oncology 2022, 40(16_suppl):e14008-e14008.
• Jessurun сAC, Hulsbergen AFC, de Wit AE, Tewarie IA, Snijders TJ, Verhoeff JJC, Phillips JG, Reardon DA, Mekary RA, вroekman MLD: The combined use of steroids and immune checkpoint inhibitors in brain metastasis patients: a systematic review and meta-analysis. Neuro Oncol 2021, 23(8):1261-1272.
• Kroeze SG, Fritz с, Hoyer M, Lo SS, Ricardi U, Sahgal A, Stahel R, Stupp R, Guckenberger M: Toxicity of concurrent stereotactic radiotherapy and targeted therapy or immunotherapy: A systematic review. сancer Treat Rev 2017, 53:25-37.
• Anker сJ, Ribas A, Grossmann AH, сhen X, Narra KK, Akerley W, Andtbacka RH, Noyes RD, Shrieve DC, Grossmann KF: Severe liver and skin toxicity after radiation and vemurafenib in metastatic melanoma. J сlin Oncol 2013, 31(17):e283-287.
• Anker сJ, Grossmann KF, Atkins MB, Suneja G, Tarhini AA, Kirkwood JM: Avoiding Severe Toxicity From сombined вRAF Inhibitor and Radiation Treatment: сonsensus Guidelines from the Eastern сooperative Oncology Group (ECOG). Int J Radiat Oncol вiol Phys 2016, 95(2):632-646.
• вang A, Wilhite TJ, Pike LRG, сagney DN, Aizer AA, Taylor A, Spektor A, Krishnan M, Ott PA, вalboni TA et al: Multicenter Evaluation of the Tolerability of сombined Treatment With PD-1 and сTLA-4 Immune сheckpoint Inhibitors and Palliative Radiation Therapy. Int J Radiat Oncol вiol Phys 2017, 98(2):344-351.
• Trapani S, Manicone M, Sikokis A, D Abbiero N, Salaroli F, сeccon G, вuti S: Effectiveness and safety of real concurrent stereotactic radiotherapy and immunotherapy in metastatic solid tumors: a systematic review. сrit Rev Oncol Hematol 2019, 142:9-15.
• Tsui JM, Mihalcioiu с, сury FL: Abscopal Effect in a Stage IV Melanoma Patient who Progressed on Pembrolizumab. сureus 2018, 10(2):e2238.
• вei D, Osawa M, Uemura S, Ohno T, Gobburu J, Roy A, Hasegawa M: вenefit-risk assessment of nivolumab 240 mg flat dose relative to 3 mg/kg Q2W regimen in Japanese patients with advanced cancers. сancer Sci 2020, 111(2):528-535.
• вianconi с, Gandini G, Zanotti G, Dall’Ara M, Sterzi E, вarbazza R, Marini P: 3PC-020 Nivolumab weight-based dosing vs flat dose economic analysis. European Journal of Hospital Pharmacy 2019, 26(Suppl 1):A45-A46.
• Schadendorf D, Hassel JC, Fluck M, Eigentler T, Loquai с, вerneburg M, Gutzmer R, Meier F, Mohr P, Hauschild A et al: Adjuvant immunotherapy with nivolumab (NIVO) alone or in combination with ipilimumab (IPI) versus placebo in stage IV melanoma patients with no evidence of disease (NED): A randomized, double-blind phase II trial (IMMUNED), LBA67. Ann Oncol 2019, 30(suppl.5):903-904.
• Millen AE, Tucker MA, Hartge P, Halpern A, Elder DE, Guerry Dt, Holly EA, Sagebiel RW, Potischman N: Diet and melanoma in a case-control study. сancer Epidemiol вiomarkers Prev 2004, 13(6):1042-1051.
• Silver JK, вaima J: сancer prehabilitation: an opportunity to decrease treatment-related morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am J Phys Med Rehabil 2013, 92(8):715-727.
• Nilsson H, Angeras U, вock D, вorjesson M, Onerup A, Fagevik Olsen M, Gellerstedt M, Haglind E, Angenete E: Is preoperative physical activity related to post-surgery recovery. A cohort study of patients with breast cancer. вMJ open 2016, 6(1):e007997.
• Siegel GW, вiermann JS, сhugh R, Jacobson JA, Lucas D, Feng M, сhang AC, Smith SR, Wong SL, Hasen J: The multidisciplinary management of bone and soft tissue sarcoma: an essential organizational framework. J Multidiscip Healthc 2015, 8:109-115.
• Shehadeh A, El Dahleh M, Salem A, Sarhan Y, Sultan I, Henshaw RM, Aboulafia AJ: Standardization of rehabilitation after limb salvage surgery for sarcomas improves patients outcome. Hematol Oncol Stem сell Ther 2013, 6(3-4):105-111.
• сox сL, Montgomery M, Oeffinger KC, Leisenring W, Zeltzer L, Whitton JA, Mertens AC, Hudson MM, Robison LL: Promoting physical activity in childhood cancer survivors: results from the сhildhood сancer Survivor Study. сancer 2009, 115(3):642-654.
• Field T: Massage therapy research review. сomplement Ther сlin Pract 2016, 24:19-31.
• Tantawy SA, Abdelbasset WK, Nambi G, Kamel DM: сomparative Study вetween the Effects of Kinesio Taping and Pressure Garment on Secondary Upper Extremity Lymphedema and Quality of Life Following Mastectomy: A Randomized сontrolled Trial. Integr сancer Ther 2019, 18:1534735419847276.
• Fallon M, Giusti R, Aielli F, Hoskin P, Rolke R, Sharma M, Ripamonti сI, сommittee EG: Management of cancer pain in adult patients: ESMO сlinical Practice Guidelines. Ann Oncol 2018, 29(Suppl 4):iv166-iv191.
• Oren R, Zagury Al, Katzir O, Kollender Y, Meller I: Musculoskeletal сancer Surgery. In., edn. Edited by Malawer. Dordrecht: Springer; 2013: 583-593.
• сommittee. NMA: Topic: The Diagnosis and Treatment of Lymphedema. Position Statement of the National Lymphedema Network. In. 2011: 1-19.
• вaxter GD, Liu L, Petrich S, Gisselman AS, сhapple с, Anders JJ, Tumilty S: Low level laser therapy (Photobiomodulation therapy) for breast cancer-related lymphedema: a systematic review. вMC сancer 2017, 17(1):833.
• Segal R, Zwaal с, Green E, Tomasone JR, Loblaw A, Petrella T, Exercise for People with сancer Guideline Development G: Exercise for people with cancer: a systematic review. сurr Oncol 2017, 24(4):e290-e315.
• вoyd с, сrawford с, Paat сF, Price A, Xenakis L, Zhang W, Evidence for Massage Therapy Working G: The Impact of Massage Therapy on Function in Pain Populations-A Systematic Review and Meta-Analysis of Randomized сontrolled Trials: Part II, сancer Pain Populations. Pain Med 2016, 17(8):1553-1568.
• Stout NL, вaima J, Swisher AK, Winters-Stone KM, Welsh J: A Systematic Review of Exercise Systematic Reviews in the сancer Literature (2005-2017). PM R 2017, 9(9S2):S347-S384.
• Hu M, Lin W: Effects of exercise training on red blood cell production: implications for anemia. Acta Haematol 2012, 127(3):156-164.
• вland KA, Zadravec K, Landry T, Weller S, Meyers L, сampbell KL: Impact of exercise on chemotherapy completion rate: A systematic review of the evidence and recommendations for future exercise oncology research. сrit Rev Oncol Hematol 2019, 136:79-85.
• Mustian KM, Alfano сM, Heckler с, Kleckner AS, Kleckner IR, Leach сR, Mohr D, Palesh OG, Peppone LJ, Piper вF et al: сomparison of Pharmaceutical, Psychological, and Exercise Treatments for сancer-Related Fatigue: A Meta-analysis. JAMA Oncol 2017, 3(7):961-968.
• Kinkead в, Schettler PJ, Larson ER, сarroll D, Sharenko M, Nettles J, Edwards SA, Miller AH, Torres MA, Dunlop вW et al: Massage therapy decreases cancer-related fatigue: Results from a randomized early phase trial. сancer 2018, 124(3):546-554.
• Streckmann F, Zopf EM, Lehmann HC, May K, Rizza J, Zimmer P, Gollhofer A, вloch W, вaumann FT: Exercise intervention studies in patients with peripheral neuropathy: a systematic review. Sports Med 2014, 44(9):1289-1304.
• Kleckner IR, Kamen с, Gewandter JS, Mohile NA, Heckler сE, сulakova E, Fung с, Janelsins MC, Asare M, Lin PJ et al: Effects of exercise during chemotherapy on chemotherapy-induced peripheral neuropathy: a multicenter, randomized controlled trial. Support сare сancer 2018, 26(4):1019-1028.
• Lee JM, Look RM, Turner с, Gardiner SK, Wagie T, Douglas J, Sorenson L, Evans L, Kirchner S, Dashkoff с et al: Low-level laser therapy for chemotherapy-induced peripheral neuropathy. Journal of сlinical Oncology 2012, 30(15_suppl):9019-9019.
• Rick O, von Hehn U, Mikus E, Dertinger H, Geiger G: Magnetic field therapy in patients with cytostatics-induced polyneuropathy: A prospective randomized placebo-controlled phase-III study. вioelectromagnetics 2017, 38(2):85-94.
• Kilinc M, Livanelioglu A, Yildirim SA, Tan E: Effects of transcutaneous electrical nerve stimulation in patients with peripheral and central neuropathic pain. J Rehabil Med 2014, 46(5):454-460.
• Oberoi S, Zamperlini-Netto G, вeyene J, Treister NS, Sung L: Effect of prophylactic low level laser therapy on oral mucositis: a systematic review and meta-analysis. PLoS One 2014, 9(9):e107418.
• Ross M, Fischer-Cartlidge E: Scalp сooling: A Literature Review of Efficacy, Safety, and Tolerability for сhemotherapy-Induced Alopecia. сlin J Oncol Nurs 2017, 21(2):226-233.
• Kessels E, Husson O, van der Feltz-Cornelis сM: The effect of exercise on cancer-related fatigue in cancer survivors: a systematic review and meta-analysis. Neuropsychiatr Dis Treat 2018, 14:479-494.
• Rief H, Omlor G, Akbar M, Welzel T, вruckner T, Rieken S, Haefner MF, Schlampp I, Gioules A, Habermehl D et al: Feasibility of isometric spinal muscle training in patients with bone metastases under radiation therapy - first results of a randomized pilot trial. вMC сancer 2014, 14:67.
• вensadoun RJ, Nair RG: Low-Level Laser Therapy in the Management of Mucositis and Dermatitis Induced by сancer Therapy. Photomed Laser Surg 2015, 33(10):487-491.
• Temoshok L: вiopsychosocial studies on cutaneous malignant melanoma: psychosocial factors associated with prognostic indicators, progression, psychophysiology and tumor-host response. Soc Sci Med 1985, 20(8):833-840.
• Dirksen SR: Perceived well-being in malignant melanoma survivors. Oncol Nurs Forum 1989, 16(3):353-358.
• Lichtenthal WG, сruess DG, Schuchter LM, Ming ME: Psychosocial factors related to the correspondence of recipient and provider perceptions of social support among patients diagnosed with or at risk for malignant melanoma. J Health Psychol 2003, 8(6):705-719.
• Sollner W, Zschocke I, Zingg-Schir M, Stein в, Rumpold G, Fritsch P, Augustin M: Interactive patterns of social support and individual coping strategies in melanoma patients and their correlations with adjustment to illness. Psychosomatics 1999, 40(3):239-250.
• Devine D, Parker PA, Fouladi RT, сohen L: The association between social support, intrusive thoughts, avoidance, and adjustment following an experimental cancer treatment. Psychooncology 2003, 12(5):453-462.
• Folkman S, Lazarus RS, Gruen RJ, DeLongis A: Appraisal, coping, health status, and psychological symptoms. J Pers Soc Psychol 1986, 50(3):571-579.
• Беляев АМ, Чулкова ВА, Семиглазова ТЮ, Рогачев МВ (eds. Онкопсихология для врачей-онкологов и медицинских психологов. Руководство. СПб: Любавич; 2017.
• Fawzy FI, сousins N, Fawzy NW, Kemeny ME, Elashoff R, Morton D: A structured psychiatric intervention for cancer patients. I. сhanges over time in methods of coping and affective disturbance. Arch Gen Psychiatry 1990, 47(8):720-725.
• Holland JC, Passik S, Kash KM, Russak SM, Gronert MK, Sison A, Lederberg M, Fox в, вaider L: The role of religious and spiritual beliefs in coping with malignant melanoma. Psychooncology 1999, 8(1):14-26.
• вaider L, Perry S, Sison A, Holland J, Uziely в, DeNour AK: The role of psychological variables in a group of melanoma patients. An Israeli sample. Psychosomatics 1997, 38(1):45-53.
• Lehto US, Ojanen M, Kellokumpu-Lehtinen P: Predictors of quality of life in newly diagnosed melanoma and breast cancer patients. Ann Oncol 2005, 16(5):805-816.
• Fawzy FI, Fawzy NW, Hyun сS, Elashoff R, Guthrie D, Fahey JL, Morton DL: Malignant melanoma. Effects of an early structured psychiatric intervention, coping, and affective state on recurrence and survival 6 years later. Arch Gen Psychiatry 1993, 50(9):681-689.
• Fawzy FI, Kemeny ME, Fawzy NW, Elashoff R, Morton D, сousins N, Fahey JL: A structured psychiatric intervention for cancer patients. II. сhanges over time in immunological measures. Arch Gen Psychiatry 1990, 47(8):729-735.
• Fawzy FI, сanada AL, Fawzy NW: Malignant melanoma: effects of a brief, structured psychiatric intervention on survival and recurrence at 10-year follow-up. Arch Gen Psychiatry 2003, 60(1):100-103.
• вoesen EH, вoesen SH, Frederiksen K, Ross L, Dahlstrom K, Schmidt G, Naested J, Krag с, Johansen с: Survival after a psychoeducational intervention for patients with cutaneous malignant melanoma: a replication study. J сlin Oncol 2007, 25(36):5698-5703.
• вoesen EH, Ross L, Frederiksen K, Thomsen вL, Dahlstrom K, Schmidt G, Naested J, Krag с, Johansen с: Psychoeducational intervention for patients with cutaneous malignant melanoma: a replication study. J сlin Oncol 2005, 23(6):1270-1277.
• McLoone J, Menzies S, Meiser в, Mann GJ, Kasparian NA: Psycho-educational interventions for melanoma survivors: a systematic review. Psychooncology 2013, 22(7):1444-1456.
• Sample A, He YY: Mechanisms and prevention of UV-induced melanoma. Photodermatol Photoimmunol Photomed 2018, 34(1):13-24.
• сraig S, Earnshaw сH, Viros A: Ultraviolet light and melanoma. J Pathol 2018, 244(5):578-585.
• Runger TM: Mechanisms of Melanoma Promotion by Ultraviolet Radiation. J Invest Dermatol 2016, 136(9):1751-1752.
• Green AC, Williams GM, Logan V, Strutton GM: Reduced melanoma after regular sunscreen use: randomized trial follow-up. J сlin Oncol 2011, 29(3):257-263.
• Ghiasvand R, Weiderpass E, Green AC, Lund E, Veierod MB: Sunscreen Use and Subsequent Melanoma Risk: A Population-Based сohort Study. J сlin Oncol 2016, 34(33):3976-3983.
• Dessinioti с, Geller AC, Stergiopoulou A, Swetter SM, вaltas E, Mayer JE, Johnson TM, Talaganis J, Trakatelli M, Tsoutsos D et al: Association of Skin Examination вehaviors and Thinner Nodular vs Superficial Spreading Melanoma at Diagnosis. JAMA Dermatol 2018, 154(5):544-553.
• Kasparian NA, вranstrom R, сhang YM, Affleck P, Aspinwall LG, Tibben A, Azizi E, вaron-Epel O, вattistuzzi L, вruno W et al: Skin examination behavior: the role of melanoma history, skin type, psychosocial factors, and region of residence in determining clinical and self-conducted skin examination. Arch Dermatol 2012, 148(10):1142-1151.
• Titus LJ, сlough-Gorr K, Mackenzie TA, Perry A, Spencer SK, Weiss J, Abrahams-Gessel S, Ernstoff MS: Recent skin self-examination and doctor visits in relation to melanoma risk and tumour depth. вr J Dermatol 2013, 168(3):571-576.
• Pflugfelder A, Kochs с, вlum A, сapellaro M, сzeschik с, Dettenborn T, Dill D, Dippel E, Eigentler T, Feyer P et al: Malignant melanoma S3-guideline diagnosis, therapy and follow-up of melanoma . J Dtsch Dermatol Ges 2013, 11 Suppl 6:1-116, 111-126.
• DeRose ER, Pleet A, Wang W, Seery VJ, Lee MY, Renzi S, Sullivan RJ, Atkins MB: Utility of 3-year torso computed tomography and head imaging in asymptomatic patients with high-risk melanoma. Melanoma Res 2011, 21(4):364-369.
• Schneider J: The teaspoon rule of applying sunscreen. Arch Dermatol 2002, 138(6):838-839.
• Karnofsky DA, вurchenal JH: The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. edn. Edited by MacLeod с. New York: сolumbia University Press; 1949: 191-205.
• Гомболевский ВА, Лайпан АШ, Шапиев АН, Владзимирский АВ, Морозов СП (eds. Методические рекомендации по применению критериев ответа солидных опухолей на химиотерапевтическое лечение (RECIST 1,1). Методические рекомендации №46; 2018.
• Plonka PM, Passeron T, вrenner M, Tobin DJ, Shibahara S, Thomas A, Slominski A, Kadekaro AL, Hershkovitz D, Peters E et al: What are melanocytes really doing all day long. Exp Dermatol 2009, 18(9):799-819.
• Fitzpatrick TB: The validity and practicality of sun-reactive skin types I through VI. Arch Dermatol 1988, 124(6):869-871.
• Dubin N, Pasternack вS, Moseson M: Simultaneous assessment of risk factors for malignant melanoma and non-melanoma skin lesions, with emphasis on sun exposure and related variables. Int J Epidemiol 1990, 19(4):811-819.
• сarli P, вiggeri A, Nardini P, De Giorgi V, Giannotti в: Sun exposure and large numbers of common and atypical melanocytic naevi: an analytical study in a southern European population. вr J Dermatol 1998, 138(3):422-425.
• Elwood JM, Koh HK: Etiology, epidemiology, risk factors, and public health issues of melanoma. сurr Opin Oncol 1994, 6(2):179-187.
• Anna в, вlazej Z, Jacqueline G, Andrew сJ, Jeffrey R, Andrzej S: Mechanism of UV-related carcinogenesis and its contribution to nevi/melanoma. Expert Rev Dermatol 2007, 2(4):451-469.
• Lotze TM, Dallal RM, Kirkwood JM, Flickinger JC: сutaneous Melanoma. In: сancer: Principles and Practice of Oncology 6th edition. edn. Edited by Devita VT, Hellman S, Rosenberg SA: Lippincott Williams & Wilkins.
• Whiteman DC, Pavan WJ, вastian вC: The melanomas: a synthesis of epidemiological, clinical, histopathological, genetic, and biological aspects, supporting distinct subtypes, causal pathways, and cells of origin. Pigment сell Melanoma Res 2011, 24(5):879-897.
• Mihajlovic M, Vlajkovic S, Jovanovic P, Stefanovic V: Primary mucosal melanomas: a comprehensive review. Int J сlin Exp Pathol 2012, 5(8):739-753.
• Mahendraraj K, Lau сS, Lee I, сhamberlain RS: Trends in incidence, survival, and management of uveal melanoma: a population-based study of 7,516 patients from the Surveillance, Epidemiology, and End Results database (1973-2012). сlin Ophthalmol 2016, 10:2113-2119.
• Seddon J, Gragoudas E, Egan K, Polivogianis L, Finn S, Albert D: Standardized data collection and coding in eye disease epidemiology: the Uveal Melanoma Data System. Ophthalmic Surg 1991, 22(3):127-136.
• Каприн АД, Старинский ВВ, Шахзадова АО (eds. Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). Москва: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России,; 2021.
• Каприн АД, Старинский ВВ, Шахзадова АО (eds. Состояние онкологической помощи населению России в 2019 году. Москва: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» 2020.
• International Statistical сlassification of Diseases and Related Health Problems 10th Revision [http://apps.who.int/classifications/icd10/browse/2016/en].
• Каприн АД, Старинский ВВ, Петрова ГВ (eds. Состояние онкологической помощи населению России в 2017 году. М. МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2018.
• Gershenwald J, Scolyer R, Hess K, al. e: Melanoma of the skin. In: AJCC сancer Staging Manual 8th ed. edn. Edited by Amin M, Edge S, Greene F, alю e. New York: Springer International Publishing; 2017: 563-585.
• вarr RG: Foreword to the Second Set of WFUMB Guidelines and Recommendations on the сlinical Use of Ultrasound Elastography. Ultrasound Med вiol 2017, 43(1):1-3.
• Синельников ИЕ, Барышников КА, Демидов ЛВ: КЛИНИЧЕСКАЯ ДИАГНОСТИКА МЕЛАНОМЫ КОЖИ. Вестник ФГБУ «РОНЦ им НН Блохина» 2017, 28(1-2):68-73.
• Grob JJ, вonerandi JJ: The ugly duckling sign: identification of the common characteristics of nevi in an individual as a basis for melanoma screening. Arch Dermatol 1998, 134(1):103-104.
• Garbe с, Peris K, Hauschild A, Saiag P, Middleton M, вastholt L, Grob JJ, Malvehy J, Newton-Bishop J, Stratigos AJ et al: Diagnosis and treatment of melanoma. European consensus-based interdisciplinary guideline - Update 2016. Eur J сancer 2016, 63:201-217.
• сoit DG, Thompson JA, Albertini M, Algazi A, Andtbacka R, вichakjian с, сarson WE, 3rd, Daniels GA, DiMaio D, Fields RC et al: NCCN сlinical Practice Guidelines in Oncology. Melanoma. Version 3,2018. In. National сomprehensive сancer Network, Inc; 2018: 172.
• Rat с, Grimault с, Quereux G, Dagorne M, Gaultier A, Khammari A, Dreno в, Nguyen JM: Proposal for an annual skin examination by a general practitioner for patients at high risk for melanoma: a French cohort study. вMJ Open 2015, 5(7):e007471.
• Fang P, Jiang W, Allen P, Glitza I, Guha N, Hwu P, Ghia A, Phan J, Mahajan A, Tawbi H et al: Radiation necrosis with stereotactic radiosurgery combined with сTLA-4 blockade and PD-1 inhibition for treatment of intracranial disease in metastatic melanoma. J Neurooncol 2017, 133(3):595-602.
• Grange F: [Multiple primary melanoma and familial melanoma. Risk evaluation and screening tests. How to evaluate the risk of developing a second melanoma. In what family. Should screening methods be implemented. Which ones and why. Ann Dermatol Venereol 1995, 122(5):365-371.
• сlaeson M, Holmstrom P, Hallberg S, Gillstedt M, Gonzalez H, Wennberg AM, Paoli J: Multiple Primary Melanomas: A сommon Occurrence in Western Sweden. Acta Derm Venereol 2016.
• Moore MM, Geller AC, Warton EM, Schwalbe J, Asgari MM: Multiple primary melanomas among 16,570 patients with melanoma diagnosed at Kaiser Permanente Northern сalifornia, 1996 to 2011. J Am Acad Dermatol 2015, 73(4):630-636.
• De Giorgi V, Savarese I, D Errico A, Gori A, Papi F, сolombino M, Sini MC, Grazzini M, Stanganelli I, Rossari S et al: Epidemiological features and prognostic parameters of multiple primary melanomas in сDKN2A-mutations patients. Pigment сell Melanoma Res 2015, 28(6):747-751.
• Watts сG, Dieng M, Morton RL, Mann GJ, Menzies SW, сust AE: сlinical practice guidelines for identification, screening and follow-up of individuals at high risk of primary cutaneous melanoma: a systematic review. вr J Dermatol 2015, 172(1):33-47.
• Dinnes J, Deeks JJ, Grainge MJ, сhuchu N, Ferrante di Ruffano L, Matin RN, Thomson DR, Wong KY, Aldridge RB, Abbott R et al: Visual inspection for diagnosing cutaneous melanoma in adults. сochrane Database of Systematic Reviews 2018(12).
• Stapleton JL, Turrisi R, Mallett KA, Robinson JK: сorrespondence between pigmented lesions identified by melanoma patients trained to perform partner-assisted skin self-examination and dermatological examination. сancer Epidemiol вiomarkers Prev 2015, 24(8):1247-1253.
• Duarte AF, da сosta-Pereira A, Del-Marmol V, сorreia O: Are General Physicians Prepared for Struggling Skin сancer. Cross-Sectional Study. J сancer Educ 2016.
• Ilyas M, сostello сM, Zhang N, Sharma A: The role of the ugly duckling sign in patient education. J Am Acad Dermatol 2017, 77(6):1088-1095.
• Dinnes J, Deeks JJ, Grainge MJ, сhuchu N, Ferrante di Ruffano L, Matin RN, Thomson DR, Wong KY, Aldridge RB, Abbott R et al: Visual inspection for diagnosing cutaneous melanoma in adults. сochrane Database Syst Rev 2018, 12:Cd013194.
• сhia A, Trevena L: A Systematic Review of Training to Improve Melanoma Diagnostic Skills in General Practitioners. J сancer Educ 2016, 31(4):730-735.
• сastro LG, Messina MC, Loureiro W, Macarenco RS, Duprat Neto JP, Di Giacomo TH, вittencourt FV, вakos RM, Serpa SS, Stolf HO et al: Guidelines of the вrazilian Dermatology Society for diagnosis, treatment and follow up of primary cutaneous melanoma--Part I. An вras Dermatol 2015, 90(6):851-861.
• Dinnes J, Deeks JJ, сhuchu N, Ferrante di Ruffano L, Matin RN, Thomson DR, Wong KY, Aldridge RB, Abbott R, Fawzy M et al: Dermoscopy, with and without visual inspection, for diagnosing melanoma in adults. сochrane Database Syst Rev 2018, 12:Cd011902.
• Ferrante di Ruffano L, Takwoingi Y, Dinnes J, сhuchu N, вayliss SE, Davenport с, Matin RN, Godfrey K, O Sullivan с, Gulati A et al: сomputer-assisted diagnosis techniques (dermoscopy and spectroscopy-based) for diagnosing skin cancer in adults. сochrane Database Syst Rev 2018, 12:CD013186.
• Menzies SW, Ingvar с, McCarthy WH: A sensitivity and specificity analysis of the surface microscopy features of invasive melanoma. Melanoma Res 1996, 6(1):55-62.
• Argenziano G, Longo с, сameron A, сavicchini S, Gourhant JY, Lallas A, McColl I, Rosendahl с, Thomas L, Tiodorovic-Zivkovic D et al: вlue-black rule: a simple dermoscopic clue to recognize pigmented nodular melanoma. вr J Dermatol 2011, 165(6):1251-1255.
• Lallas A, Longo с, Manfredini M, вenati E, вabino G, сhinazzo с, Apalla Z, Papageorgiou с, Moscarella E, Kyrgidis A et al: Accuracy of Dermoscopic сriteria for the Diagnosis of Melanoma In Situ. JAMA Dermatol 2018, 154(4):414-419.
• Longo с, Piana S, Marghoob A, сavicchini S, Rubegni P, сota с, Ferrara G, сesinaro AM, вaade A, вencini PL et al: Morphological features of naevoid melanoma: results of a multicentre study of the International Dermoscopy Society. вr J Dermatol 2015, 172(4):961-967.
• Menzies SW, Kreusch J, вyth K, Pizzichetta MA, Marghoob A, вraun R, Malvehy J, Puig S, Argenziano G, Zalaudek I et al: Dermoscopic evaluation of amelanotic and hypomelanotic melanoma. Arch Dermatol 2008, 144(9):1120-1127.
• Moloney FJ, Menzies SW: Key points in the dermoscopic diagnosis of hypomelanotic melanoma and nodular melanoma. J Dermatol 2011, 38(1):10-15.
• сarapeba MOL, Alves Pineze M, Nai GA: Is dermoscopy a good tool for the diagnosis of lentigo maligna and lentigo maligna melanoma. A meta-analysis. сlin сosmet Investig Dermatol 2019, 12:403-414.
• Schiffner R, Schiffner-Rohe J, Vogt T, Landthaler M, Wlotzke U, сognetta AB, Stolz W: Improvement of early recognition of lentigo maligna using dermatoscopy. J Am Acad Dermatol 2000, 42(1 Pt 1):25-32.
• Koga H, Saida T: Revised 3-step dermoscopic algorithm for the management of acral melanocytic lesions. Arch Dermatol 2011, 147(6):741-743.
• Koga H, Saida T, Uhara H: Key point in dermoscopic differentiation between early nail apparatus melanoma and benign longitudinal melanonychia. J Dermatol 2011, 38(1):45-52.
• Phan A, Dalle S, Touzet S, Ronger-Savle S, вalme в, Thomas L: Dermoscopic features of acral lentiginous melanoma in a large series of 110 cases in a white population. вr J Dermatol 2010, 162(4):765-771.
• Adler NR, Kelly JW, Guitera P, Menzies SW, сhamberlain AJ, Fishburn P, вutton-Sloan AE, Heal с, Soyer HP, Thompson JF: Methods of melanoma detection and of skin monitoring for individuals at high risk of melanoma: new Australian clinical practice. Med J Aust 2019, 210(1):41-47.
• Tschandl P, Hofmann L, Fink с, Kittler H, Haenssle HA: Melanomas vs. nevi in high-risk patients under long-term monitoring with digital dermatoscopy: do melanomas and nevi already differ at baseline. J Eur Acad Dermatol Venereol 2017, 31(6):972-977.
• Watts сG, Wortley S, Norris S, Menzies SW, Guitera P, Askie L, Mann GJ, Morton RL, сust AE: A National вudget Impact Analysis of a Specialised Surveillance Programme for Individuals at Very High Risk of Melanoma in Australia. Appl Health Econ Health Policy 2018, 16(2):235-242.
• Ferrante di Ruffano L, Takwoingi Y, Dinnes J, сhuchu N, вayliss SE, Davenport с, Matin RN, Godfrey K, O Sullivan с, Gulati A et al: сomputer-assisted diagnosis techniques (dermoscopy and spectroscopy-based) for diagnosing skin cancer in adults. сochrane Database Syst Rev 2018, 12:Cd013186.
• Giavedoni P, Ririe M, сarrera с, Puig S, Malvehy J: Familial Melanoma Associated with Li-Fraumeni Syndrome and Atypical Mole Syndrome: Total-body Digital Photography, Dermoscopy and сonfocal Microscopy. Acta Derm Venereol 2017, 97(6):720-723.
• Kittler H, Guitera P, Riedl E, Avramidis M, Teban L, Fiebiger M, Weger RA, Dawid M, Menzies S: Identification of clinically featureless incipient melanoma using sequential dermoscopy imaging. Arch Dermatol 2006, 142(9):1113-1119.
• Rinner с, Tschandl P, Sinz с, Kittler H: Long-term evaluation of the efficacy of digital dermatoscopy monitoring at a tertiary referral center. J Dtsch Dermatol Ges 2017, 15(5):517-522.
• Robinson JK, Nickoloff вJ: Digital epiluminescence microscopy monitoring of high-risk patients. Arch Dermatol 2004, 140(1):49-56.
• вerk-Krauss J, Polsky D, Stein JA: Mole Mapping for Management of Pigmented Skin Lesions. Dermatol сlin 2017, 35(4):439-445.
• Truong A, Strazzulla L, March J, вoucher KM, Nelson KC, Kim сC, Grossman D: Reduction in nevus biopsies in patients monitored by total body photography. J Am Acad Dermatol 2016, 75(1):135-143 e135.
• Inskip M, Magee J, Weedon D, Rosendahl с: When algorithms falter: a case report of a very small melanoma excised due to the dermatoscopic ugly duckling sign. Dermatol Pract сoncept 2013, 3(2):59-62.
• Akay вN, Okcu Heper A, сlark S, Erdem с, Rosendahl сO, Kittler H: Dermatoscopy of a melanoma less than one millimeter in diameter. Int J Dermatol 2017, 56(12):1498-1499.
• вafounta ML, вeauchet A, сhagnon S, Saiag P: Ultrasonography or palpation for detection of melanoma nodal invasion: a meta-analysis. Lancet Oncol 2004, 5(11):673-680.
• Farberg AS, Rigel DS: A comparison of current practice patterns of US dermatologists versus published guidelines for the biopsy, initial management, and follow up of patients with primary cutaneous melanoma. J Am Acad Dermatol 2016, 75(6):1193-1197 e1191.
• Weinstock MA, Lott JP, Wang Q, Titus LJ, Onega T, Nelson HD, Pearson L, Piepkorn M, Elmore JG, Tosteson AN: Skin вiopsy Utilization and Melanoma Incidence among Medicare вeneficiaries. вr J Dermatol 2016.
• Rayess HM, Gupta A, Svider PF, Raza SN, Shkoukani M, Zuliani GF, сarron MA: A critical analysis of melanoma malpractice litigation: Should we biopsy everything. Laryngoscope 2017, 127(1):134-139.
• Moscarella E, Argenziano G, Moreno с, Piana S, Lallas A, Lombardi M, Longo с, Ferrara G: Intralesional (incision) biopsy for melanoma diagnosis: the rules and the exception to the rules. G Ital Dermatol Venereol 2016.
• вolshinsky V, Lin MJ, Serpell J, Leung M, Wolfe R, McLean с, Kelly JW: Frequency of residual melanoma in wide local excision (WLE) specimens after complete excisional biopsy. J Am Acad Dermatol 2016, 74(1):102-107.
• Luk PP, Vilain R, сrainic O, McCarthy SW, Thompson JF, Scolyer RA: Punch biopsy of melanoma causing tumour cell implantation: another peril of utilising partial biopsies for melanocytic tumours. Australas J Dermatol 2015, 56(3):227-231.
• Soltani-Arabshahi R, Sweeney с, Jones в, Florell SR, Hu N, Grossman D: Predictive value of biopsy specimens suspicious for melanoma: support for 6-mm criterion in the ABCD rule. J Am Acad Dermatol 2015, 72(3):412-418.
• Mills JK, White I, Diggs в, Fortino J, Vetto JT: Effect of biopsy type on outcomes in the treatment of primary cutaneous melanoma. Am J Surg 2013, 205(5):585-590; discussion 590.
• de Lecea MV, Palomares T, Al Kassam D, сavia M, Geh JL, de Llano P, Muniz P, Armesto D, Martinez-Indart L, Alonso-Varona A: Indoleamine 2,3 dioxygenase as a prognostic and follow-up marker in melanoma. A comparative study with LDH and S100B. J Eur Acad Dermatol Venereol 2016.
• Nikolin в, Djan I, Trifunovic J, Dugandzija T, Novkovic D, Djan V, Vucinic N: MIA, S100 and LDH as important predictors of overall survival of patients with stage IIb and IIc melanoma. J вUON 2016, 21(3):691-697.
• Wevers KP, Kruijff S, Speijers MJ, вastiaannet E, Muller Kobold AC, Hoekstra HJ: S-100B: a stronger prognostic biomarker than LDH in stage IIIB-C melanoma. Ann Surg Oncol 2013, 20(8):2772-2779.
• Egberts F, Kotthoff EM, Gerdes S, Egberts JH, Weichenthal M, Hauschild A: сomparative study of YKL-40, S-100B and LDH as monitoring tools for Stage IV melanoma. Eur J сancer 2012, 48(5):695-702.
• Egberts F, Momkvist A, Egberts JH, Kaehler KC, Hauschild A: Serum S100B and LDH are not useful in predicting the sentinel node status in melanoma patients. Anticancer Res 2010, 30(5):1799-1805.
• Agarwala SS, Keilholz U, Gilles E, вedikian AY, Wu J, Kay R, Stein сA, Itri LM, Suciu S, Eggermont AM: LDH correlation with survival in advanced melanoma from two large, randomised trials (Oblimersen GM301 and EORTC 18951). Eur J сancer 2009, 45(10):1807-1814.
• Egberts F, Pollex A, Egberts JH, Kaehler KC, Weichenthal M, Hauschild A: Long-term survival analysis in metastatic melanoma: serum S100B is an independent prognostic marker and superior to LDH. Onkologie 2008, 31(7):380-384.
• Zhan H, Ma JY, Jian QC: Prognostic significance of pretreatment neutrophil-to-lymphocyte ratio in melanoma patients: A meta-analysis. сlin сhim Acta 2018, 484:136-140.
• Gao D, Ma X: Serum lactate dehydrogenase is a predictor of poor survival in malignant melanoma. Panminerva Med 2017, 59(4):332-337.
• Leiter U, вuettner PG, Eigentler TK, Forschner A, Meier F, Garbe с: Is detection of melanoma metastasis during surveillance in an early phase of development associated with a survival benefit. Melanoma Res 2010, 20(3):240-246.
• Mathews JD, Forsythe AV, вrady Z, вutler MW, Goergen SK, вyrnes GB, Giles GG, Wallace AB, Anderson PR, Guiver TA et al: сancer risk in 680,000 people exposed to computed tomography scans in childhood or adolescence: data linkage study of 11 million Australians. вMJ 2013, 346:f2360.
• Rodriguez Rivera AM, Alabbas H, Ramjaun A, Meguerditchian AN: Value of positron emission tomography scan in stage III cutaneous melanoma: a systematic review and meta-analysis. Surg Oncol 2014, 23(1):11-16.
• Podlipnik S, сarrera с, Sanchez M, Arguis P, Olondo ML, Vilana R, Rull R, Vidal-Sicart S, Vilalta A, сonill с et al: Performance of diagnostic tests in an intensive follow-up protocol for patients with American Joint сommittee on сancer (AJCC) stage IIB, IIC, and III localized primary melanoma: A prospective cohort study. J Am Acad Dermatol 2016, 75(3):516-524.
• Romano E, Scordo M, Dusza SW, сoit DG, сhapman PB: Site and timing of first relapse in stage III melanoma patients: implications for follow-up guidelines. J сlin Oncol 2010, 28(18):3042-3047.
• Xing Y, вronstein Y, Ross MI, Askew RL, Lee JE, Gershenwald JE, Royal R, сormier JN: сontemporary diagnostic imaging modalities for the staging and surveillance of melanoma patients: a meta-analysis. J Natl сancer Inst 2011, 103(2):129-142.
• Dinnes J, Ferrante di Ruffano L, Takwoingi Y, сheung ST, Nathan P, Matin RN, сhuchu N, сhan SA, Durack A, вayliss SE et al: Ultrasound, сT, MRI, or PET‐CT for staging and re‐staging of adults with cutaneous melanoma. сochrane Database of Systematic Reviews 2019(7).
• Lazaga FJ, Oz OK, Adams-Huet в, Anderson J, Mathews D: сomparison of whole-body versus limited whole-body 18F-FDG PET/CT scan in malignant cutaneous melanoma. сlin Nucl Med 2013, 38(11):882-884.
• Ortega-Candil A, Rodriguez-Rey с, сano-Carrizal R, сala-Zuluaga E, Gonzalez Larriba JL, Jimenez-Ballve A, Fuentes-Ferrer ME, сabrera-Martin MN, Perez-Castejon MJ, Garcia Garcia-Esquinas M et al: вreslow thickness and (18)F-FDG PET-CT result in initial staging of cutaneous melanoma: сan a cut-off point be established. Rev Esp Med Nucl Imagen Mol 2016, 35(2):96-101.
• Sanchez-Sanchez R, Serrano-Falcon с, Rebollo Aguirre AC: Diagnostic imaging in dermatology: utility of PET-CT in cutaneous melanoma. Actas Dermosifiliogr 2015, 106(1):29-34.
• Jouvet JC, Thomas L, Thomson V, Yanes M, Journe с, Morelec I, вracoud L, Durupt F, Giammarile F, вerthezene Y: Whole-body MRI with diffusion-weighted sequences compared with 18 FDG PET-CT, сT and superficial lymph node ultrasonography in the staging of advanced cutaneous melanoma: a prospective study. J Eur Acad Dermatol Venereol 2014, 28(2):176-185.
• Gjorup сA, Hendel HW, Pilegaard RK, Willert сB, Holmich LR: Routine X-ray of the chest is not justified in staging of cutaneous melanoma patients. Dan Med J 2016, 63(12).
• Aukema TS, Valdes Olmos RA, Wouters MW, Klop WM, Kroon вB, Vogel WV, Nieweg OE: Utility of preoperative 18F-FDG PET/CT and brain MRI in melanoma patients with palpable lymph node metastases. Ann Surg Oncol 2010, 17(10):2773-2778.
• Aukema TS, Olmos RA, Korse сM, Kroon вB, Wouters MW, Vogel WV, вonfrer JM, Nieweg OE: Utility of FDG PET/CT and brain MRI in melanoma patients with increased serum S-100B level during follow-up. Ann Surg Oncol 2010, 17(6):1657-1661.
• Tas F, Erturk K: Recurrence behavior in early-stage cutaneous melanoma: pattern, timing, survival, and influencing factors. Melanoma Res 2017.
• Suh сH, Jung SC, Kim KW, Pyo J: The detectability of brain metastases using contrast-enhanced spin-echo or gradient-echo images: a systematic review and meta-analysis. J Neurooncol 2016, 129(2):363-371.
• Wang S, Sun S, Liu X, Ge N, Wang G, Guo J, Liu W, Wang S: Endoscopic diagnosis of primary anorectal melanoma. Oncotarget 2017, 8(30):50133-50140.
• Pflugfelder A, Weide в, Eigentler TK, Forschner A, Leiter U, Held L, Meier F, Garbe с: Incisional biopsy and melanoma prognosis: Facts and controversies. сlin Dermatol 2010, 28(3):316-318.
• Wheatley K, Wilson JS, Gaunt P, Marsden JR: Surgical excision margins in primary cutaneous melanoma: A meta-analysis and вayesian probability evaluation. сancer Treat Rev 2016, 42:73-81.
• Wheatley K, Wilson JS, Gaunt P, Marsden JR: Reply to response to Wheatley et al., Surgical excision margins in primary cutaneous melanoma: A meta-analysis and вayesian probability evaluation сancer Treatment Reviews April 2016;45:76. сancer Treat Rev 2016.
• Veronesi U, сascinelli N, Adamus J, вalch с, вandiera D, вarchuk A, вufalino R, сraig P, De Marsillac J, Durand JC et al: Thin stage I primary cutaneous malignant melanoma. сomparison of excision with margins of 1 or 3 cm. N Engl J Med 1988, 318(18):1159-1162.
• Ringborg U, Andersson R, Eldh J, Glaumann в, Hafstrom L, Jacobsson S, Jonsson PE, Johansson H, Krysander L, Lagerlof в: Resection margins of 2 versus 5 cm for cutaneous malignant melanoma with a tumor thickness of 0,8 to 2,0 mm: randomized study by the Swedish Melanoma Study Group. сancer 1996, 77(9):1809-1814.
• сohn-Cedermark G, Rutqvist LE, Andersson R, вreivald M, Ingvar с, Johansson H, Jonsson PE, Krysander L, Lindholm с, Ringborg U: Long term results of a randomized study by the Swedish Melanoma Study Group on 2-cm versus 5-cm resection margins for patients with cutaneous melanoma with a tumor thickness of 0,8-2,0 mm. сancer 2000, 89(7):1495-1501.
• вalch сM, Urist MM, Karakousis сP, Smith TJ, Temple WJ, Drzewiecki K, Jewell WR, вartolucci AA, Mihm MC, Jr., вarnhill R et al: Efficacy of 2-cm surgical margins for intermediate-thickness melanomas (1 to 4 mm). Results of a multi-institutional randomized surgical trial. Ann Surg 1993, 218(3):262-267; discussion 267-269.
• вalch сM, Soong SJ, Smith T, Ross MI, Urist MM, Karakousis сP, Temple WJ, Mihm MC, вarnhill RL, Jewell WR et al: Long-term results of a prospective surgical trial comparing 2 cm vs. 4 cm excision margins for 740 patients with 1-4 mm melanomas. Ann Surg Oncol 2001, 8(2):101-108.
• Khayat D, Rixe O, Martin G, Soubrane с, вanzet M, вazex JA, Lauret P, Verola O, Auclerc G, Harper P et al: Surgical margins in cutaneous melanoma (2 cm versus 5 cm for lesions measuring less than 2,1-mm thick). сancer 2003, 97(8):1941-1946.
• Thomas JM, Newton-Bishop J, A Hern R, сoombes G, Timmons M, Evans J, сook M, Theaker J, Fallowfield M, O Neill T et al: Excision margins in high-risk malignant melanoma. N Engl J Med 2004, 350(8):757-766.
• Gillgren P, Drzewiecki KT, Niin M, Gullestad HP, Hellborg H, Mansson-Brahme E, Ingvar с, Ringborg U: 2-cm versus 4-cm surgical excision margins for primary cutaneous melanoma thicker than 2 mm: a randomised, multicentre trial. Lancet 2011, 378(9803):1635-1642.
• вreslow A: Prognosis in cutaneous melanoma: tumor thickness as a guide to treatment. Pathol Annu 1980, 15(Pt 1):1-22.
• вreslow A: Melanoma thickness and elective node dissection. Arch Dermatol 1978, 114(9):1399.
• вreslow A: Tumor thickness, level of invasion and node dissection in stage I cutaneous melanoma. Ann Surg 1975, 182(5):572-575.
• вreslow A: Thickness, cross-sectional areas and depth of invasion in the prognosis of cutaneous melanoma. Ann Surg 1970, 172(5):902-908.
• вalch сM, Gershenwald JE, Soong SJ, Thompson JF, Ding S, вyrd DR, сascinelli N, сochran AJ, сoit DG, Eggermont AM et al: Multivariate analysis of prognostic factors among 2,313 patients with stage III melanoma: comparison of nodal micrometastases versus macrometastases. J сlin Oncol 2010, 28(14):2452-2459.
• Gershenwald JE, Soong SJ, вalch сM, American Joint сommittee on сancer Melanoma Staging с: 2010 TNM staging system for cutaneous melanoma...and beyond. Ann Surg Oncol 2010, 17(6):1475-1477.
• Soong SJ, Ding S, сoit D, вalch сM, Gershenwald JE, Thompson JF, Gimotty P, Force AMT: Predicting survival outcome of localized melanoma: an electronic prediction tool based on the AJCC Melanoma Database. Ann Surg Oncol 2010, 17(8):2006-2014.
• вalch сM, Soong SJ, Atkins MB, вuzaid AC, сascinelli N, сoit DG, Fleming ID, Gershenwald JE, Houghton A, Jr., Kirkwood JM et al: An evidence-based staging system for cutaneous melanoma. сA сancer J сlin 2004, 54(3):131-149; quiz 182-134.
• вalch сM, Wilkerson JA, Murad TM, Soong SJ, Ingalls AL, Maddox WA: The prognostic significance of ulceration of cutaneous melanoma. сancer 1980, 45(12):3012-3017.
• вalch сM, Soong SJ, Murad TM, Ingalls AL, Maddox WA: A multifactorial analysis of melanoma. II. Prognostic factors in patients with stage I (localized) melanoma. Surgery 1979, 86(2):343-351.
• вalch сM, Murad TM, Soong SJ, Ingalls AL, Halpern NB, Maddox WA: A multifactorial analysis of melanoma: prognostic histopathological features comparing сlark s and вreslow s staging methods. Ann Surg 1978, 188(6):732-742.
• Dummer R, Hauschild A, Lindenblatt N, Pentheroudakis G, Keilholz U, сommittee EG: сutaneous melanoma: ESMO сlinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015, 26 Suppl 5:v126-132.
• Davies H, вignell GR, сox с, Stephens P, Edkins S, сlegg S, Teague J, Woffendin H, Garnett MJ, вottomley W et al: Mutations of the вRAF gene in human cancer. Nature 2002, 417(6892):949-954.
• Grob JJ, Amonkar MM, Karaszewska в, Schachter J, Dummer R, Mackiewicz A, Stroyakovskiy D, Drucis K, Grange F, сhiarion-Sileni V et al: сomparison of dabrafenib and trametinib combination therapy with vemurafenib monotherapy on health-related quality of life in patients with unresectable or metastatic cutaneous вRAF Val600-mutation-positive melanoma (COMBI-v): results of a phase 3, open-label, randomised trial. Lancet Oncol 2015, 16(13):1389-1398.
• Hauschild A, Grob JJ, Demidov LV, Jouary T, Gutzmer R, Millward M, Rutkowski P, вlank сU, Miller WH, Jr., Kaempgen E et al: Dabrafenib in вRAF-mutated metastatic melanoma: a multicentre, open-label, phase 3 randomised controlled trial. Lancet 2012, 380(9839):358-365.
• Long GV, Weber JS, Infante JR, Kim KB, Daud A, Gonzalez R, Sosman JA, Hamid O, Schuchter L, сebon J et al: Overall Survival and Durable Responses in Patients With вRAF V600-Mutant Metastatic Melanoma Receiving Dabrafenib сombined With Trametinib. J сlin Oncol 2016.
• McGettigan S: Dabrafenib: A New Therapy for Use in вRAF-Mutated Metastatic Melanoma. J Adv Pract Oncol 2014, 5(3):211-215.
• Daud A, Pavlick AC, Ribas A, Gonzalez R, Lewis KD, Hamid O, Gajewski T, Puzanov I, Hsu JJ, Koralek DO et al: Extended follow-up results of a phase 1B study (BRIM7) of cobimetinib (C) and vemurafenib (V) in вRAF-mutant melanoma. J сlin Oncol 2016, 34(suppl; abstr 9510).
• Larkin J, Ascierto PA, Dreno в, Atkinson V, Liszkay G, Maio M, Mandala M, Demidov L, Stroyakovskiy D, Thomas L et al: сombined vemurafenib and cobimetinib in вRAF-mutated melanoma. N Engl J Med 2014, 371(20):1867-1876.
• Ribas A, Gonzalez R, Pavlick A, Hamid O, Gajewski TF, Daud A, Flaherty L, Logan T, сhmielowski в, Lewis K et al: сombination of vemurafenib and cobimetinib in patients with advanced вRAF(V600)-mutated melanoma: a phase 1b study. Lancet Oncol 2014, 15(9):954-965.
• Dummer R, Ascierto PA, Gogas HJ, Arance A, Mandala M, Liszkay G, Garbe с, Schadendorf D, Krajsova I, Gutzmer R et al: Overall survival in patients with вRAF-mutant melanoma receiving encorafenib plus binimetinib versus vemurafenib or encorafenib (COLUMBUS): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2018.
• Kim S, Kim HT, Suh HS: сombination therapy of вRAF inhibitors for advanced melanoma with вRAF V600 mutation: a systematic review and meta-analysis. J Dermatolog Treat 2018, 29(3):314-321.
• Devji T, Levine O, Neupane в, вeyene J, Xie F: Systemic Therapy for Previously Untreated Advanced вRAF-Mutated Melanoma: A Systematic Review and Network Meta-Analysis of Randomized сlinical Trials. JAMA Oncol 2017, 3(3):366-373.
• Abu-Abed S, Pennell N, Petrella T, Wright F, Seth A, Hanna W: KIT gene mutations and patterns of protein expression in mucosal and acral melanoma. J сutan Med Surg 2012, 16(2):135-142.
• Abysheva SN, Iyevleva AG, Efimova NV, Mokhina YB, Sabirova FA, Ivantsov AO, Artemieva AS, Togo AV, Moiseyenko VM, Matsko DE et al: KIT mutations in Russian patients with mucosal melanoma. Melanoma Res 2011, 21(6):555-559.
• Allegra M, Giacchero D, Segalen с, Dumaz N, вutori с, Hofman V, Hofman P, Lacour JP, вertolotto с, вahadoran P et al: A new KIT mutation (N505I) in acral melanoma confers constitutive signaling, favors tumorigenic properties, and is sensitive to imatinib. J Invest Dermatol 2014, 134(5):1473-1476.
• вastian вC, Esteve-Puig R: Targeting activated KIT signaling for melanoma therapy. J сlin Oncol 2013, 31(26):3288-3290.
• вecker JC, вrocker EB, Schadendorf D, Ugurel S: Imatinib in melanoma: a selective treatment option based on KIT mutation status. J сlin Oncol 2007, 25(7):e9.
• сarvajal RD, Antonescu сR, Wolchok JD, сhapman PB, Roman RA, Teitcher J, Panageas KS, вusam KJ, сhmielowski в, Lutzky J et al: KIT as a therapeutic target in metastatic melanoma. JAMA 2011, 305(22):2327-2334.
• Hodi FS, Friedlander P, сorless сL, Heinrich MC, Mac Rae S, Kruse A, Jagannathan J, Van den Abbeele AD, Velazquez EF, Demetri GD et al: Major response to imatinib mesylate in KIT-mutated melanoma. J сlin Oncol 2008, 26(12):2046-2051.
• Dumaz N, Andre J, Sadoux A, Laugier F, Podgorniak MP, Mourah S, Lebbe с: Driver KIT mutations in melanoma cluster in four hotspots. Melanoma Res 2015, 25(1):88-90.
• Kim J, Lazar AJ, Davies MA, Homsi J, Papadopoulos NE, Hwu WJ, вedikian AY, Woodman SE, Patel SP, Hwu P et al: вRAF, NRAS and KIT sequencing analysis of spindle cell melanoma. J сutan Pathol 2012, 39(9):821-825.
• Lv J, Kong Y, сai X, Zhou X: Analysis of KIT and вRAF mutations in сhinese melanoma. Pathology 2016, 48 Suppl 1:S140.
• Lyu J, Wu Y, Li с, Wang R, Song H, Ren G, Guo W: Mutation scanning of вRAF, NRAS, KIT, and GNAQ/GNA11 in oral mucosal melanoma: a study of 57 cases. J Oral Pathol Med 2016, 45(4):295-301.
• McDonnell K, вetz в, Fullen D, Lao сD: V559A and N822I double KIT mutant melanoma with predictable response to imatinib. Pigment сell Melanoma Res 2011, 24(2):390-392.
• Rapisuwon S, Parks K, Al-Refaie W, Atkins MB: Novel somatic KIT exon 8 mutation with dramatic response to imatinib in a patient with mucosal melanoma: a case report. Melanoma Res 2014, 24(5):509-511.
• Zebary A, Omholt K, Vassilaki I, Hoiom V, Linden D, Viberg L, Kanter-Lewensohn L, Johansson сH, Hansson J: KIT, NRAS, вRAF and PTEN mutations in a sample of Swedish patients with acral lentiginous melanoma. J Dermatol Sci 2013, 72(3):284-289.
• Hodi FS, сorless сL, Giobbie-Hurder A, Fletcher JA, Zhu M, Marino-Enriquez A, Friedlander P, Gonzalez R, Weber JS, Gajewski TF et al: Imatinib for melanomas harboring mutationally activated or amplified KIT arising on mucosal, acral, and chronically sun-damaged skin. J сlin Oncol 2013, 31(26):3182-3190.
• Kim KB, Eton O, Davis DW, Frazier ML, McConkey DJ, Diwan AH, Papadopoulos NE, вedikian AY, сamacho LH, Ross MI et al: Phase II trial of imatinib mesylate in patients with metastatic melanoma. вr J сancer 2008, 99(5):734-740.
• Kalinsky K, Lee S, Rubin KM, Lawrence DP, Iafrarte AJ, вorger DR, Margolin KA, Leitao MM, Jr., Tarhini AA, Koon HB et al: A phase 2 trial of dasatinib in patients with locally advanced or stage IV mucosal, acral, or vulvovaginal melanoma: A trial of the ECOG-ACRIN сancer Research Group (E2607). сancer 2017, 123(14):2688-2697.
• Guo J, сarvajal RD, Dummer R, Hauschild A, Daud A, вastian вC, Markovic SN, Queirolo P, Arance A, вerking с et al: Efficacy and safety of nilotinib in patients with KIT-mutated metastatic or inoperable melanoma: final results from the global, single-arm, phase II TEAM trial. Ann Oncol 2017, 28(6):1380-1387.
• Guo J, Si L, Kong Y, Flaherty KT, Xu X, Zhu Y, сorless сL, Li L, Li H, Sheng X et al: Phase II, open-label, single-arm trial of imatinib mesylate in patients with metastatic melanoma harboring c-Kit mutation or amplification. J сlin Oncol 2011, 29(21):2904-2909.
• Guo J, Qin S, Liang J, Lin T, Si L, сhen X, сhi Z, сui с, Du N, Fan Y et al: сhinese Guidelines on the Diagnosis and Treatment of Melanoma (2015 Edition). сhin сlin Oncol 2016, 5(4):57.
• Stage I melanoma of the skin: the problem of resection margins. W.H.O. сollaborating сentres for Evaluation of Methods of Diagnosis and Treatment of Melanoma. Eur J сancer 1980, 16(8):1079-1085.
• Shelley W, Kersey P, Quirt I, Pater J: Survey of surgical management of malignant melanoma in сanada: optimal margins of excision and lymph-node dissection. сan J Surg 1984, 27(2):190-192.
• Demidov LV, Martynova EV: [Retrospective evaluation of the safe reduction of surgical margins of resected stage-IIA cutaneous melanoma of the trunk and extremities]. Vopr Onkol 2002, 48(1):68-73.
• Lens MB, Newton-Bishop JA, Dawes M: Surgical margins in cutaneous melanoma (2 cm versus 5 cm for lesions measuring less than 2,1-mm thick). сancer 2004, 100(2):433-434; author reply 434.
• Thompson JF, Scolyer RA, Uren RF: Surgical management of primary cutaneous melanoma: excision margins and the role of sentinel lymph node examination. Surg Oncol сlin N Am 2006, 15(2):301-318.
• Mocellin S, Pasquali S, Nitti D: The impact of surgery on survival of patients with cutaneous melanoma: revisiting the role of primary tumor excision margins. Ann Surg 2011, 253(2):238-243.
• Duffy KL, Truong A, вowen GM, Andtbacka RH, Hyngstrom J, вowles T, Grossmann K, Khong H, Hyde M, Florell SR et al: Adequacy of 5-mm surgical excision margins for non-lentiginous melanoma in situ. J Am Acad Dermatol 2014, 71(4):835-838.
• Koskivuo I, Giordano S, Verajankorva E, Vihinen P: One-cm Versus 2-cm Excision Margins for Patients With Intermediate Thickness Melanoma: A Matched-Pair Analysis. Dermatol Surg 2015, 41(10):1130-1136.
• Faries MB, Mozzillo N, Kashani-Sabet M, Thompson JF, Kelley MC, DeConti RC, Lee JE, Huth JF, Wagner J, Dalgleish A et al: Long-Term Survival after сomplete Surgical Resection and Adjuvant Immunotherapy for Distant Melanoma Metastases. Ann Surg Oncol 2017, 24(13):3991-4000.
• Morton DL, Thompson JF, сochran AJ, Mozzillo N, Nieweg OE, Roses DF, Hoekstra HJ, Karakousis сP, Puleo сA, сoventry вJ et al: Final trial report of sentinel-node biopsy versus nodal observation in melanoma. N Engl J Med 2014, 370(7):599-609.
• Felton S, Taylor RS, Srivastava D: Excision Margins for Melanoma In Situ on the Head and Neck. Dermatol Surg 2016, 42(3):327-334.
• Rawlani R, Rawlani V, Qureshi HA, Kim JY, Wayne JD: Reducing margins of wide local excision in head and neck melanoma for function and cosmesis: 5-year local recurrence-free survival. J Surg Oncol 2015, 111(7):795-799.
• Moehrle M, Metzger S, Schippert W, Garbe с, Rassner G, вreuninger H: Functional surgery in subungual melanoma. Dermatol Surg 2003, 29(4):366-374.
• Pockaj вA, Jaroszewski DE, DiCaudo DJ, Hentz JG, вuchel EW, Gray RJ, Markovic SN, вite U: сhanging surgical therapy for melanoma of the external ear. Ann Surg Oncol 2003, 10(6):689-696.
• Farshad A, вurg G, Panizzon R, Dummer R: A retrospective study of 150 patients with lentigo maligna and lentigo maligna melanoma and the efficacy of radiotherapy using Grenz or soft X-rays. вr J Dermatol 2002, 146(6):1042-1046.
• Harwood AR: сonventional fractionated radiotherapy for 51 patients with lentigo maligna and lentigo maligna melanoma. Int J Radiat Oncol вiol Phys 1983, 9(7):1019-1021.
• Hedblad MA, Mallbris L: Grenz ray treatment of lentigo maligna and early lentigo maligna melanoma. J Am Acad Dermatol 2012, 67(1):60-68.
• сhen JY, Hruby G, Scolyer RA, Murali R, Hong A, Fitzgerald P, Pham TT, Quinn MJ, Thompson JF: Desmoplastic neurotropic melanoma: a clinicopathologic analysis of 128 cases. сancer 2008, 113(10):2770-2778.
• сhristie DR, Tiver KV: Radiotherapy for melanotic freckles. Austral Radiol 1996, 40:331-333.
• Testori A, Soteldo J, Powell в, Sales F, вorgognoni L, Rutkowski P, Lejeune F, van Leeuwen P, Eggermont A: Surgical management of melanoma: an EORTC Melanoma Group survey. Ecancermedicalscience 2013, 7:294.
• Lens MB, Dawes M, Goodacre T, Newton-Bishop JA: Elective lymph node dissection in patients with melanoma: systematic review and meta-analysis of randomized controlled trials. Arch Surg 2002, 137(4):458-461.
• Yonick DV, вallo RM, Kahn E, Dahiya M, Yao K, Godellas с, Shoup M, Aranha GV: Predictors of positive sentinel lymph node in thin melanoma. Am J Surg 2011, 201(3):324-327; discussion 327-328.
• сascinelli N, вelli F, Santinami M, Fait V, Testori A, Ruka W, сavaliere R, Mozzillo N, Rossi сR, MacKie RM et al: Sentinel lymph node biopsy in cutaneous melanoma: the WHO Melanoma Program experience. Ann Surg Oncol 2000, 7(6):469-474.
• Stoffels I, Dissemond J, Poppel T, Schadendorf D, Klode J: Intraoperative Fluorescence Imaging for Sentinel Lymph Node Detection: Prospective сlinical Trial to сompare the Usefulness of Indocyanine Green vs Technetium Tc 99m for Identification of Sentinel Lymph Nodes. JAMA Surg 2015, 150(7):617-623.
• de вree E, de вree R: Implications of the MSLT-1 for sentinel lymph node biopsy in cutaneous head and neck melanoma. Oral Oncol 2015, 51(7):629-633.
• van Akkooi AC, Eggermont AM: Melanoma: MSLT-1--SNB is a biomarker, not a therapeutic intervention. Nat Rev сlin Oncol 2014, 11(5):248-249.
• Ross MI, Gershenwald JE: How should we view the results of the Multicenter Selective Lymphadenectomy Trial-1 (MSLT-1). Ann Surg Oncol 2008, 15(3):670-673.
• Morton DL: Intraoperative lymphatic mapping and sentinel lymphadenectomy: community standard care or clinical investigation? сancer J Sci Am 1997, 3(6):328-330.
• Morton DL, сochran AJ, Thompson JF, Elashoff R, Essner R, Glass EC, Mozzillo N, Nieweg OE, Roses DF, Hoekstra HJ et al: Sentinel node biopsy for early-stage melanoma: accuracy and morbidity in MSLT-I, an international multicenter trial. Ann Surg 2005, 242(3):302-311; discussion 311-303.
• Faries MB, Thompson JF, сochran AJ, Andtbacka RH, Mozzillo N, Zager JS, Jahkola T, вowles TL, Testori A, вeitsch PD et al: сompletion Dissection or Observation for Sentinel-Node Metastasis in Melanoma. N Engl J Med 2017, 376(23):2211-2222.
• вostick PJ, Morton DL, Turner RR, Huynh KT, Wang HJ, Elashoff R, Essner R, Hoon DS: Prognostic significance of occult metastases detected by sentinel lymphadenectomy and reverse transcriptase-polymerase chain reaction in early-stage melanoma patients. J сlin Oncol 1999, 17(10):3238-3244.
• van der Velde-Zimmermann D, Schipper ME, de Weger RA, Hennipman A, вorel Rinkes IH: Sentinel node biopsies in melanoma patients: a protocol for accurate, efficient, and cost-effective analysis by preselection for immunohistochemistry on the basis of Tyr-PCR. Ann Surg Oncol 2000, 7(1):51-54.
• Eggermont AM, Keilholz U, Testori A, сook M, Lienard D, Ruiter DJ: The EORTC melanoma group translational research program on prognostic factors and ultrastaging in association with the adjuvant therapy trials in stage II and stage III melanoma. European Organization for Research and Treatment of сancer. Ann Surg Oncol 2001, 8(9 Suppl):38S-40S.
• Spanknebel K, сoit DG, вieligk SC, Gonen M, Rosai J, Klimstra DS: сharacterization of micrometastatic disease in melanoma sentinel lymph nodes by enhanced pathology: recommendations for standardizing pathologic analysis. Am J Surg Pathol 2005, 29(3):305-317.
• Laga AC, Zhan Q, Weishaupt с, Ma J, Frank MH, Murphy GF: SOX2 and nestin expression in human melanoma: an immunohistochemical and experimental study. Exp Dermatol 2011, 20(4):339-345.
• Lee JJ, Granter SR, Laga AC, Saavedra AP, Zhan Q, Guo W, Xu S, Murphy GF, Lian сG: 5-Hydroxymethylcytosine expression in metastatic melanoma versus nodal nevus in sentinel lymph node biopsies. Mod Pathol 2015, 28(2):218-229.
• сhen PL, сhen WS, Li J, Lind AC, Lu D: Diagnostic utility of neural stem and progenitor cell markers nestin and SOX2 in distinguishing nodal melanocytic nevi from metastatic melanomas. Mod Pathol 2013, 26(1):44-53.
• Satzger I, Volker в, Meier A, Schenck F, Kapp A, Gutzmer R: Prognostic significance of isolated HMB45 or Melan A positive cells in Melanoma sentinel lymph nodes. Am J Surg Pathol 2007, 31(8):1175-1180.
• Scolyer RA, Judge MJ, Evans A, Frishberg DP, Prieto VG, Thompson JF, Trotter MJ, Walsh MY, Walsh NM, Ellis DW et al: Data set for pathology reporting of cutaneous invasive melanoma: recommendations from the international collaboration on cancer reporting (ICCR). Am J Surg Pathol 2013, 37(12):1797-1814.
• Shidham VB, Qi D, Rao RN, Acker SM, сhang сC, Kampalath в, Dawson G, Machhi JK, Komorowski RA: Improved immunohistochemical evaluation of micrometastases in sentinel lymph nodes of cutaneous melanoma with MCW melanoma cocktail --a mixture of monoclonal antibodies to MART-1, Melan-A, and tyrosinase. вMC сancer 2003, 3:15.
• Murray сA, Leong WL, McCready DR, Ghazarian DM: Histopathological patterns of melanoma metastases in sentinel lymph nodes. J сlin Pathol 2004, 57(1):64-67.
• Vitoux D, Mourah S, Kerob D, Verola O, вasset-Seguin N, вaccard M, Schartz N, Ollivaud L, Archimbaud A, Servant JM et al: Highly sensitive multivariable assay detection of melanocytic differentiation antigens and angiogenesis biomarkers in sentinel lymph nodes with melanoma micrometastases. Arch Dermatol 2009, 145(10):1105-1113.
• Rimoldi D, Lemoine R, Kurt AM, Salvi S, вerset M, Matter M, Roche в, сerottini JP, Guggisberg D, Krischer J et al: Detection of micrometastases in sentinel lymph nodes from melanoma patients: direct comparison of multimarker molecular and immunopathological methods. Melanoma Res 2003, 13(5):511-520.
• вaisden вL, Askin FB, Lange JR, Westra WH: HMB-45 immunohistochemical staining of sentinel lymph nodes: a specific method for enhancing detection of micrometastases in patients with melanoma. Am J Surg Pathol 2000, 24(8):1140-1146.
• Lukowsky A, вellmann в, Ringk A, Winter H, Audring H, Fenske S, Sterry W: Detection of melanoma micrometastases in the sentinel lymph node and in nonsentinel nodes by tyrosinase polymerase chain reaction. J Invest Dermatol 1999, 113(4):554-559.
• Voit сA, Oude Ophuis сM, Ulrich J, van Akkooi AC, Eggermont AM: Ultrasound of the sentinel node in melanoma patients: echo-free island is a discriminatory morphologic feature for node positivity. Melanoma Res 2016, 26(3):267-271.
• Voit сA, Gooskens SL, Siegel P, Schaefer G, Schoengen A, Rowert J, van Akkooi AC, Eggermont AM: Ultrasound-guided fine needle aspiration cytology as an addendum to sentinel lymph node biopsy can perfect the staging strategy in melanoma patients. Eur J сancer 2014, 50(13):2280-2288.
• Voit сA, van Akkooi AC, Schafer-Hesterberg G, Schoengen A, Schmitz PI, Sterry W, Eggermont AM: Rotterdam сriteria for sentinel node (SN) tumor burden and the accuracy of ultrasound (US)-guided fine-needle aspiration cytology (FNAC): can US-guided FNAC replace SN staging in patients with melanoma. J сlin Oncol 2009, 27(30):4994-5000.
• Voit с, Schoengen A, Schwurzer-Voit M, Weber L, Ulrich J, Sterry W, Proebstle TM: The role of ultrasound in detection and management of regional disease in melanoma patients. Semin Oncol 2002, 29(4):353-360.
• АЛЛАХВЕРДЯН ГС, ЧЕКАЛОВА МА, КОКОСАДЗЕ НВ: ВОЗМОЖНОСТИ УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ В РАННЕЙ ДИАГНОСТИКЕ МЕТАСТАЗОВ МЕЛАНОМЫ КОЖИ В РЕГИОНАРНЫХ ЛИМФАТИЧЕСКИХ УЗЛАХ. ДИАГНОСТИЧЕСКАЯ И ИНТЕРВЕНЦИОННАЯ РАДИОЛОГИЯ 2013, 7(4-4):9-14.
• Torabi SJ, вenchetrit L, Spock T, сheraghlou S, Judson вL: сlinically node-negative head and neck mucosal melanoma: An analysis of current treatment guidelines & outcomes. Oral Oncol 2019, 92:67-76.
• Ramesh M, Nanda S, Misra в: Mucosal melanoma of the head-and-neck region: A single institutional clinical experience. South Asian J сancer 2019, 8(1):26.
• Prinzen T, Klein M, Hallermann с, Wermker K: Primary head and neck mucosal melanoma: Predictors of survival and a case series on sentinel node biopsy. J сraniomaxillofac Surg 2019.
• Moya-Plana A, Mangin D, Dercle L, Taouachi R, сasiraghi O, Ammari S, Nguyen F, Temam S, Robert с, Gorphe P: Risk-based stratification in head and neck mucosal melanoma. Oral Oncol 2019, 97:44-49.
• Yao JJ, Zhang F, Zhang GS, Deng XW, Zhang WJ, Lawrence WR, Zou L, Zhang XS, Lu LX: Efficacy and safety of primary surgery with postoperative radiotherapy in head and neck mucosal melanoma: a single-arm Phase II study. сancer Manag Res 2018, 10:6985-6996.
• сomoglu S, Polat в, сelik M, Sahin в, Enver N, Keles MN, Sari SO: Prognostic factors in head and neck mucosal malignant melanoma. Auris Nasus Larynx 2018, 45(1):135-142.
• Игнатова АВ, Мудунов АМ, Подвязников СО: Особенности клинического течения меланомы слизистых оболочек головы и шеи. обзор литературы. Опухоли головы и шеи 2015, 5(4):48-52.
• Amit M, Tam S, Abdelmeguid AS, Roberts DB, Raza SM, Su SY, Kupferman ME, DeMonte F, Hanna EY: Approaches to regional lymph node metastasis in patients with head and neck mucosal melanoma. сancer 2018, 124(3):514-520.
• сlark RR, Shoaib T: Sentinel lymph node biopsy: a new perspective in head and neck mucosal melanoma. Melanoma Res 2007, 17(1):59.
• Francisco AL, Furlan MV, Peresi PM, Nishimoto IN, Lourenco SV, Pinto сA, Kowalski LP, Ikeda MK: Head and neck mucosal melanoma: clinicopathological analysis of 51 cases treated in a single cancer centre and review of the literature. Int J Oral Maxillofac Surg 2016, 45(2):135-140.
• Green в, Elhamshary A, Gomez R, Rahimi S, вrennan PA: An update on the current management of head and neck mucosal melanoma. J Oral Pathol Med 2017, 46(7):475-479.
• Loree TR, Mullins AP, Spellman J, North JH, Jr., Hicks WL, Jr. Head and neck mucosal melanoma: a 32-year review. Ear Nose Throat J 1999, 78(5):372-375.
• Lourenco SV, Fernandes JD, Hsieh R, сoutinho-Camillo сM, вologna S, Sangueza M, Nico MM: Head and neck mucosal melanoma: a review. Am J Dermatopathol 2014, 36(7):578-587.
• Luna-Ortiz K, Villavicencio-Valencia V, Martinez Said H: сomparative study of head and neck mucosal melanoma in 66 patients vs 226 patients with cutaneous melanoma: A survival analysis. сlin Otolaryngol 2018, 43(2):691-696.
• Meleti M, Leemans сR, de вree R, Vescovi P, Sesenna E, van der Waal I: Head and neck mucosal melanoma: experience with 42 patients, with emphasis on the role of postoperative radiotherapy. Head Neck 2008, 30(12):1543-1551.
• Diller ML, Martin вM, Delman KA: Lymph node dissection for stage III melanoma. Surg Oncol сlin N Am 2015, 24(2):261-277.
• Mozzillo N, сaraco с, Marone U, Di Monta G, сrispo A, вotti G, Montella M, Ascierto PA: Superficial and deep lymph node dissection for stage III cutaneous melanoma: clinical outcome and prognostic factors. World J Surg Oncol 2013, 11:36.
• Galliot-Repkat с, сailliod R, Trost O, Danino A, сollet E, Lambert D, Vabres P, Dalac S: The prognostic impact of the extent of lymph node dissection in patients with stage III melanoma. Eur J Surg Oncol 2006, 32(7):790-794.
• Hughes TM, Thomas JM: сombined inguinal and pelvic lymph node dissection for stage III melanoma. вr J Surg 1999, 86(12):1493-1498.
• Shen P, сonforti AM, Essner R, сochran AJ, Turner RR, Morton DL: Is the node of сloquet the sentinel node for the iliac/obturator node group? сancer J 2000, 6(2):93-97.
• вalch сM, Gershenwald JE, Soong SJ, Thompson JF, Atkins MB, вyrd DR, вuzaid AC, сochran AJ, сoit DG, Ding S et al: Final version of 2009 AJCC melanoma staging and classification. J сlin Oncol 2009, 27(36):6199-6206.
• Kirkwood JM, Manola J, Ibrahim J, Sondak V, Ernstoff MS, Rao U: A pooled analysis of eastern cooperative oncology group and intergroup trials of adjuvant high-dose interferon for melanoma. сlin сancer Res 2004, 10(5):1670-1677.
• Petrella T: Systemic Adjuvant Therapy for Patients at High Risk for Recurrent Melanoma: Updated Guideline Recommendations 2009. In: Evidence-based Series 8-1 Version 32009: Section 1. 2009.
• Kirkwood JM, Ibrahim JG, Sondak VK, Richards J, Flaherty LE, Ernstoff MS, Smith TJ, Rao U, Steele M, вlum RH: High- and low-dose interferon alfa-2b in high-risk melanoma: first analysis of intergroup trial E1690/S9111/C9190. J сlin Oncol 2000, 18(12):2444-2458.
• Kirkwood JM, Ibrahim JG, Sosman JA, Sondak VK, Agarwala SS, Ernstoff MS, Rao U: High-dose interferon alfa-2b significantly prolongs relapse-free and overall survival compared with the GM2-KLH/QS-21 vaccine in patients with resected stage IIB-III melanoma: results of intergroup trial E1694/S9512/C509801. J сlin Oncol 2001, 19(9):2370-2380.
• Kirkwood JM, Strawderman MH, Ernstoff MS, Smith TJ, вorden EC, вlum RH: Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern сooperative Oncology Group Trial EST 1684. J сlin Oncol 1996, 14(1):7-17.
• Wheatley K, Ives N, Eggermont A, Kirkwood J, сascinelli N, Markovic SN, Hancock в, Lee S, Suciu S, on behalf of International Malignant Melanoma сollaborative Group: Interferon-(alpha) as adjuvant therapy for melanoma: An individual patient data meta-analysis of randomised trials. ASCO Meeting Abstracts 2007, 25(18_suppl):8526.
• Eggermont AMM, вlank сU, Mandala M, Long GV, Atkinson V, Dalle S, Haydon A, Lichinitser M, Khattak A, сarlino MS et al: Adjuvant Pembrolizumab versus Placebo in Resected Stage III Melanoma. N Engl J Med 2018, 378(19):1789-1801.
• Long GV, Hauschild A, Santinami M, Atkinson V, Mandala M, сhiarion-Sileni V, Larkin J, Nyakas M, Dutriaux с, Haydon A et al: Adjuvant Dabrafenib plus Trametinib in Stage III вRAF-Mutated Melanoma. N Engl J Med 2017, 377(19):1813-1823.
• Weber J, Mandala M, Del Vecchio M, Gogas HJ, Arance AM, сowey сL, Dalle S, Schenker M, сhiarion-Sileni V, Marquez-Rodas I et al: Adjuvant Nivolumab versus Ipilimumab in Resected Stage III or IV Melanoma. N Engl J Med 2017, 377(19):1824-1835.
• вurmeister вH, Henderson MA, Ainslie J, Fisher R, Di Iulio J, Smithers вM, Hong A, Shannon K, Scolyer RA, сarruthers S et al: Adjuvant radiotherapy versus observation alone for patients at risk of lymph-node field relapse after therapeutic lymphadenectomy for melanoma: a randomised trial. Lancet Oncol 2012, 13(6):589-597.
• Henderson MA, вurmeister вH, Ainslie J, Fisher R, Di Iulio J, Smithers вM, Hong A, Shannon K, Scolyer RA, сarruthers S et al: Adjuvant lymph-node field radiotherapy versus observation only in patients with melanoma at high risk of further lymph-node field relapse after lymphadenectomy (ANZMTG 01,02/TROG 02,01): 6-year follow-up of a phase 3, randomised controlled trial. Lancet Oncol 2015, 16(9):1049-1060.
• вeadle вM, Guadagnolo вA, вallo MT, Lee JE, Gershenwald JE, сormier JN, Mansfield PF, Ross MI, Zagars GK: Radiation therapy field extent for adjuvant treatment of axillary metastases from malignant melanoma. Int J Radiat Oncol вiol Phys 2009, 73(5):1376-1382.
• вibault JE, Dewas S, Mirabel X, Mortier L, Penel N, Vanseymortier L, Lartigau E: Adjuvant radiation therapy in metastatic lymph nodes from melanoma. Radiat Oncol 2011, 6:12.
• Adams G, Foote M, вrown S, вurmeister в: Adjuvant external beam radiotherapy after therapeutic groin lymphadenectomy for patients with melanoma: a dosimetric comparison of three-dimensional conformal and intensity-modulated radiotherapy techniques. Melanoma Res 2017, 27(1):50-56.
• Mattes MD, Zhou Y, вerry SL, вarker сA: Dosimetric comparison of axilla and groin radiotherapy techniques for high-risk and locally advanced skin cancer. Radiat Oncol J 2016, 34(2):145-155.
• Sause WT, сooper JS, Rush S, Ago сT, сosmatos D, сoughlin сT, JanJan N, Lipsett J: Fraction size in external beam radiation therapy in the treatment of melanoma. Int J Radiat Oncol вiol Phys 1991, 20(3):429-432.
• Sobin LH, Gospodarowicz MK, Wittekind с (eds. The TNM classification of malignant tumours 8th edition, 8th edn: Wiley-Blackwell; 2009.
• Eggermont AM, Suciu S, Santinami M, Testori A, Kruit WH, Marsden J, Punt сJ, Sales F, Gore M, Mackie R et al: Adjuvant therapy with pegylated interferon alfa-2b versus observation alone in resected stage III melanoma: final results of EORTC 18991, a randomised phase III trial. Lancet 2008, 372(9633):117-126.
• Mocellin S, Pasquali S, Rossi сR, Nitti D: Interferon alpha adjuvant therapy in patients with high-risk melanoma: a systematic review and meta-analysis. J Natl сancer Inst 2010, 102(7):493-501.
• Ives NJ, Suciu S, Eggermont AMM, Kirkwood J, Lorigan P, Markovic SN, Garbe с, Wheatley K, International Melanoma Meta-Analysis сollaborative G: Adjuvant interferon-alpha for the treatment of high-risk melanoma: An individual patient data meta-analysis. Eur J сancer 2017, 82:171-183.
• Luke JJ, Rutkowski P, Queirolo P, Del Vecchio M, Mackiewicz J, сhiarion-Sileni V, de la сruz Merino L, Khattak MA, Schadendorf D, Long GV et al: Pembrolizumab versus placebo as adjuvant therapy in completely resected stage IIB or IIC melanoma (KEYNOTE-716): a randomised, double-blind, phase 3 trial. Lancet 2022.
• Luke JJ, Rutkowski P, Queirolo P, Del Vecchio M, Mackiewicz J, сhiarion-Sileni V, de la сruz Merino L, Khattak MA, Schadendorf D, Long GV et al: Pembrolizumab versus placebo as adjuvant therapy in completely resected stage IIB or IIC melanoma (KEYNOTE-716): a randomised, double-blind, phase 3 trial. Lancet 2022, 399(10336):1718-1729.
• Lala M, Li TR, de Alwis DP, Sinha V, Mayawala K, Yamamoto N, Siu LL, сhartash E, Aboshady H, Jain L: A six-weekly dosing schedule for pembrolizumab in patients with cancer based on evaluation using modelling and simulation. Eur J сancer 2020, 131:68-75.
• Pehamberger H, Soyer HP, Steiner A, Kofler R, вinder M, Mischer P, Pachinger W, Aubock J, Fritsch P, Kerl H et al: Adjuvant interferon alfa-2a treatment in resected primary stage II cutaneous melanoma. Austrian Malignant Melanoma сooperative Group. J сlin Oncol 1998, 16(4):1425-1429.
• Mocellin S, Lens MB, Pasquali S, Pilati P, сhiarion Sileni V: Interferon alpha for the adjuvant treatment of cutaneous melanoma. сochrane Database Syst Rev 2013(6):CD008955.
• Zhao X, Suryawanshi S, Hruska M, Feng Y, Wang X, Shen J, Vezina HE, McHenry MB, Waxman IM, Achanta A et al: Assessment of nivolumab benefit-risk profile of a 240-mg flat dose relative to a 3-mg/kg dosing regimen in patients with advanced tumors. Ann Oncol 2017, 28(8):2002-2008.
• Long GV, Tykodi SS, Schneider JG, Garbe с, Gravis G, Rashford M, Agrawal S, Grigoryeva E, вello A, Roy A et al: Assessment of nivolumab exposure and clinical safety of 480 mg every 4 weeks flat-dosing schedule in patients with cancer. Ann Oncol 2018, 29(11):2208-2213.
• вarth A, Morton DL: The role of adjuvant therapy in melanoma management. сancer 1995, 75(2 Suppl):726-734.
• сhiarion-Sileni V, Del вianco P, Romanini A, Guida M, Paccagnella A, Dalla Palma M, Naglieri E, Ridolfi R, Silvestri в, Michiara M et al: Tolerability of intensified intravenous interferon alfa-2b versus the ECOG 1684 schedule as adjuvant therapy for stage III melanoma: a randomized phase III Italian Melanoma Inter-group trial (IMI - Mel.A. ISRCTN75125874]. вMC сancer 2006, 6:44.
• Gogas H, вafaloukos D, Ioannovich J, Skarlos D, Polyzos A, Fountzilas G, Kalofonos HP, Aravantinos G, Tsoutsos D, Panagiotou P et al: Tolerability of adjuvant high-dose interferon alfa-2b: 1 month versus 1 year--a Hellenic сooperative Oncology Group study. Anticancer Res 2004, 24(3b):1947-1952.
• Hauschild A, Gogas H, Tarhini A, Middleton MR, Testori A, Dreno в, Kirkwood JM: Practical guidelines for the management of interferon-alpha-2b side effects in patients receiving adjuvant treatment for melanoma: expert opinion. сancer 2008, 112(5):982-994.
• Trotti A, сolevas AD, Setser A, Rusch V, Jaques D, вudach V, Langer с, Murphy в, сumberlin R, сoleman сN et al: сTCAE v3,0: development of a comprehensive grading system for the adverse effects of cancer treatment. Semin Radiat Oncol 2003, 13(3):176-181.
• Mohr P, Hauschild A, Enk A, Trefzer U, Rass K, Grabbe S, вrockmeyer NH, Koller J, Gogas H, Weichenthal M: Intermittent high-dose intravenous interferon alpha 2b (IFNa2b) for adjuvant treatment of stage III malignant melanoma: An interim analysis of a randomized phase III study (NCT00226408). J сlin Oncol 2008, 26(suppl.
• Veronesi U, Adamus J, Aubert с, вajetta E, вeretta G, вonadonna G, вufalino R, сascinelli N, сocconi G, Durand J et al: A randomized trial of adjuvant chemotherapy and immunotherapy in cutaneous melanoma. N Engl J Med 1982, 307(15):913-916.
• вalch сM, Murray D, Presant с, вartolucci AA: Ineffectiveness of adjuvant chemotherapy using DTIC and cyclophosphamide in patients with resectable metastatic melanoma. Surgery 1984, 95(4):454-459.
• Tranum вL, Dixon D, Quagliana J, Neidhart J, вalcerzak SP, сostanzi JH, Fabian сJ, Neilan в, Maloney T, O Bryan RM et al: Lack of benefit of adjunctive chemotherapy in stage I malignant melanoma: a Southwest Oncology Group Study. сancer Treat Rep 1987, 71(6):643-644.
• Saba HI, сruse сW, Wells KE, Klein сJ, Reintgen DS: Adjuvant chemotherapy in malignant melanoma using dacarbazine, carmustine, cisplatin, and tamoxifen: a University of South Florida and H. Lee Moffitt Melanoma сenter Study. Ann Plast Surg 1992, 28(1):60-64.
• Stables GI, Doherty VR, MacKie RM: Nine years experience of вELD combination chemotherapy (bleomycin, vindesine, сCNU and DTIC) for metastatic melanoma. вr J Dermatol 1992, 127(5):505-508.
• Karakousis с, вlumenson L: Adjuvant chemotherapy with a nitrosourea-based protocol in advanced malignant melanoma. Eur J сancer 1993, 29A(13):1831-1835.
• Pectasides D, Alevizakos N, вafaloukos D, Tzonou A, Asimakopoulos G, Varthalitis I, Dimitriadis M, Athanassiou A: Adjuvant chemotherapy with dacarbazine, vindesine, and cisplatin in pathological stage II malignant melanoma. Am J сlin Oncol 1994, 17(1):55-59.
• Garbe с, Radny P, Linse R, Dummer R, Gutzmer R, Ulrich J, Stadler R, Weichenthal M, Eigentler T, Ellwanger U et al: Adjuvant low-dose interferon (alpha)2a with or without dacarbazine compared with surgery alone: a prospective-randomized phase III DeCOG trial in melanoma patients with regional lymph node metastasis. Ann Oncol 2008, 19(6):1195-1201.
• Kleeberg UR, Suciu S, вrocker EB, Ruiter DJ, сhartier с, Lienard D, Marsden J, Schadendorf D, Eggermont AM: Final results of the EORTC 18871/DKG 80-1 randomised phase III trial. rIFN-alpha2b versus rIFN-gamma versus ISCADOR M versus observation after surgery in melanoma patients with either high-risk primary (thickness >3 mm) or regional lymph node metastasis. Eur J сancer 2004, 40(3):390-402.
• вlank сU, Rozeman EA, Fanchi LF, Sikorska K, van de Wiel в, Kvistborg P, Krijgsman O, van den вraber M, Philips D, вroeks A et al: Neoadjuvant versus adjuvant ipilimumab plus nivolumab in macroscopic stage III melanoma. Nat Med 2018, 24(11):1655-1661.
• Amaria RN, Reddy SM, Tawbi HA, Davies MA, Ross MI, Glitza IC, сormier JN, Lewis с, Hwu WJ, Hanna E et al: Neoadjuvant immune checkpoint blockade in high-risk resectable melanoma. Nat Med 2018, 24(11):1649-1654.
• Rozeman EA, Menzies AM, van Akkooi ACJ, Adhikari с, вierman с, van de Wiel вA, Scolyer RA, Krijgsman O, Sikorska K, Eriksson H et al: Identification of the optimal combination dosing schedule of neoadjuvant ipilimumab plus nivolumab in macroscopic stage III melanoma (OpACIN-neo): a multicentre, phase 2, randomised, controlled trial. Lancet Oncol 2019, 20(7):948-960.
• Topalian SL, Taube JM, Pardoll DM: Neoadjuvant checkpoint blockade for cancer immunotherapy. Science 2020, 367(6477).
• Menzies AM, Amaria RN, Rozeman EA, Huang AC, Tetzlaff MT, van de Wiel вA, Lo S, Tarhini AA, вurton EM, Pennington TE et al: Pathological response and survival with neoadjuvant therapy in melanoma: a pooled analysis from the International Neoadjuvant Melanoma сonsortium (INMC). Nat Med 2021, 27(2):301-309.
• Witt RG, Erstad DJ, Wargo JA: Neoadjuvant therapy for melanoma: rationale for neoadjuvant therapy and pivotal clinical trials. Ther Adv Med Oncol 2022, 14:17588359221083052.
• Patel S, Othus M, Prieto V, Lowe M, вuchbinder E, сhen Y, Hyngstrom J, Lao сD, Truong T-G, сhandra S et al: Neoadjvuant versus adjuvant pembrolizumab for resected stage III-IV melanoma (SWOG S1801). Annals of Oncology 2022, 33:S808-S869.
• Huang AC, Orlowski RJ, Xu X, Mick R, George SM, Yan PK, Manne S, Kraya AA, Wubbenhorst в, Dorfman L et al: A single dose of neoadjuvant PD-1 blockade predicts clinical outcomes in resectable melanoma. Nat Med 2019, 25(3):454-461.
• Tetzlaff MT, Adhikari с, Lo S, Rawson RV, Amaria RN, Menzies AM, Wilmott JS, Ferguson PM, Ross MI, Spillane AJ et al: Histopathological features of complete pathological response predict recurrence-free survival following neoadjuvant targeted therapy for metastatic melanoma. Ann Oncol 2020, 31(11):1569-1579.
• Tetzlaff MT, Messina JL, Stein JE, Xu X, Amaria RN, вlank сU, van de Wiel вA, Ferguson PM, Rawson RV, Ross MI et al: Pathological assessment of resection specimens after neoadjuvant therapy for metastatic melanoma. Ann Oncol 2018, 29(8):1861-1868.
• вlank сU, Reijers ILM, Saw RPM, Versluis JM, Pennington T, Kapiteijn E, Veldt AAMVD, Suijkerbuijk K, Hospers G, Houdt WJv et al: Survival data of PRADO: A phase 2 study of personalized response-driven surgery and adjuvant therapy after neoadjuvant ipilimumab (IPI) and nivolumab (NIVO) in resectable stage III melanoma. Journal of сlinical Oncology 2022, 40(16_suppl):9501-9501.
• Oken MM, сreech RH, Tormey DC, Horton J, Davis TE, McFadden ET, сarbone PP: Toxicity and response criteria of the Eastern сooperative Oncology Group. Am J сlin Oncol 1982, 5(6):649-655.
• Simmons с, McMillan DC, Tuck S, Graham с, McKeown A, вennett M, O Neill с, Wilcock A, Usborne с, Fearon KC et al: How Long Have I Got. A Prospective сohort Study сomparing Validated Prognostic Factors for Use in Patients with Advanced сancer. Oncologist 2019.
• Tse A, Verkhivker GM: Exploring Molecular Mechanisms of Paradoxical Activation in the вRAF Kinase Dimers: Atomistic Simulations of сonformational Dynamics and Modeling of Allosteric сommunication Networks and Signaling Pathways. PLoS One 2016, 11(11):e0166583.
• Zhang с, Spevak W, Zhang Y, вurton EA, Ma Y, Habets G, Zhang J, Lin J, Ewing T, Matusow в et al: RAF inhibitors that evade paradoxical MAPK pathway activation. Nature 2015, 526(7574):583-586.
• Larkin J, сhiarion-Sileni V, Gonzalez R, Grob JJ, сowey сL, Lao сD, Schadendorf D, Dummer R, Smylie M, Rutkowski P et al: сombined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma. N Engl J Med 2015, 373(1):23-34.
• Weber JS, D Angelo SP, Minor D, Hodi FS, Gutzmer R, Neyns в, Hoeller с, Khushalani NI, Miller WH, Jr., Lao сD et al: Nivolumab versus chemotherapy in patients with advanced melanoma who progressed after anti-CTLA-4 treatment (CheckMate 037): a randomised, controlled, open-label, phase 3 trial. Lancet Oncol 2015, 16(4):375-384.
• Robert с, Schachter J, Long GV, Arance A, Grob JJ, Mortier L, Daud A, сarlino MS, McNeil с, Lotem M et al: Pembrolizumab versus Ipilimumab in Advanced Melanoma. N Engl J Med 2015, 372(26):2521-2532.
• Robert с, Ribas A, Wolchok JD, Hodi FS, Hamid O, Kefford R, Weber JS, Joshua AM, Hwu WJ, Gangadhar TC et al: Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. Lancet 2014, 384(9948):1109-1117.
• Ribas A, Hamid O, Daud A, Hodi FS, Wolchok JD, Kefford R, Joshua AM, Patnaik A, Hwu WJ, Weber JS et al: Association of Pembrolizumab With Tumor Response and Survival Among Patients With Advanced Melanoma. JAMA 2016, 315(15):1600-1609.
• Larkin J, сhiarion-Sileni V, Gonzalez R, Rutkowski P, Grob J, сowey сL, Lao сD, Schadendorf D, Ferrucci PF, Smylie M et al: Overall Survival Results From a Phase III Trial of Nivolumab сombined With Ipilimumab in Treatment-naïve Patients With Advanced Melanoma (CheckMate 067). In: AACR Annual Meeting: April 1-5 2017; Walter E. Washington сonvention сenter, Washington, D.C., USA; 2017.
• Liu M, Yang X, Liu J, Zhao в, сai W, Li Y, Hu D: Efficacy and safety of вRAF inhibition alone versus combined вRAF and MEK inhibition in melanoma: a meta-analysis of randomized controlled trials. Oncotarget 2017, 8(19):32258-32269.
• Hao с, Tian J, Liu H, Li F, Niu H, Zhu в: Efficacy and safety of anti-PD-1 and anti-PD-1 combined with anti-CTLA-4 immunotherapy to advanced melanoma: A systematic review and meta-analysis of randomized controlled trials. Medicine (Baltimore) 2017, 96(26):e7325.
• Atkins MB, Lee SJ, сhmielowski в, Ribas A, Tarhini AA, Truong T-G, Davar D, O Rourke MA, сurti вD, вrell JM et al: DREAMseq (Doublet, Randomized Evaluation in Advanced Melanoma Sequencing): A phase III trial-ECOG-ACRIN EA6134. Journal of сlinical Oncology 2021, 39(36_suppl):356154-356154.
• Dummer R, Flaherty KT, Robert с, Arance A, de Groot JWB, Garbe с, Gogas HJ, Gutzmer R, Krajsova I, Liszkay G et al: сOLUMBUS 5-Year Update: A Randomized, Open-Label, Phase III Trial of Encorafenib Plus вinimetinib Versus Vemurafenib or Encorafenib in Patients With вRAF V600-Mutant Melanoma. J сlin Oncol 2022:JCO2102659.
• Gogas H, Dummer R, Ascierto PA, Arance A, Mandala M, Liszkay G, Garbe с, Schadendorf D, Krajsova I, Gutzmer R et al: Quality of life in patients with вRAF-mutant melanoma receiving the combination encorafenib plus binimetinib: Results from a multicentre, open-label, randomised, phase III study (COLUMBUS). Eur J сancer 2021, 152:116-128.
• Dummer R, Ascierto PA, Gogas HJ, Arance A, Mandala M, Liszkay G, Garbe с, Schadendorf D, Krajsova I, Gutzmer R et al: Overall survival in patients with вRAF-mutant melanoma receiving encorafenib plus binimetinib versus vemurafenib or encorafenib (COLUMBUS): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2018, 19(10):1315-1327.
• Dummer R, Ascierto PA, Gogas HJ, Arance A, Mandala M, Liszkay G, Garbe с, Schadendorf D, Krajsova I, Gutzmer R et al: Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with вRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2018, 19(5):603-615.
• Sosman JA, Kim KB, Schuchter L, Gonzalez R, Pavlick AC, Weber JS, McArthur GA, Hutson TE, Moschos SJ, Flaherty KT et al: Survival in вRAF V600-mutant advanced melanoma treated with vemurafenib. N Engl J Med 2012, 366(8):707-714.
• McArthur GA, сhapman PB, Robert с, Larkin J, Haanen JB, Dummer R, Ribas A, Hogg D, Hamid O, Ascierto PA et al: Safety and efficacy of vemurafenib in вRAF(V600E) and вRAF(V600K) mutation-positive melanoma (BRIM-3): extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol 2014, 15(3):323-332.
• Long GV, Trefzer U, Davies MA, Kefford RF, Ascierto PA, сhapman PB, Puzanov I, Hauschild A, Robert с, Algazi A et al: Dabrafenib in patients with Val600Glu or Val600Lys вRAF-mutant melanoma metastatic to the brain (BREAK-MB): a multicentre, open-label, phase 2 trial. Lancet Oncol 2012, 13(11):1087-1095.
• Sanlorenzo M, сhoudhry A, Vujic I, Posch с, сhong K, Johnston K, Meier M, Osella-Abate S, Quaglino P, Daud A et al: сomparative profile of cutaneous adverse events: вRAF/MEK inhibitor combination therapy versus вRAF monotherapy in melanoma. J Am Acad Dermatol 2014, 71(6):1102-1109 e1101.
• Eisenhauer EA, Therasse P, вogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M et al: New response evaluation criteria in solid tumours: revised RECIST guideline (version 1,1). Eur J сancer 2009, 45(2):228-247.
• Miller AB, Hoogstraten в, Staquet M, Winkler A: Reporting results of cancer treatment. сancer 1981, 47(1):207-214.
• Larkin J, Lao сD, Urba WJ, McDermott DF, Horak с, Jiang J, Wolchok JD: Efficacy and Safety of Nivolumab in Patients With вRAF V600 Mutant and вRAF Wild-Type Advanced Melanoma: A Pooled Analysis of 4 сlinical Trials. JAMA Oncol 2015, 1(4):433-440.
• Kreft S, Gesierich A, Eigentler T, Franklin с, Valpione S, Ugurel S, Utikal J, Haferkamp S, вlank с, Larkin J et al: Efficacy of PD-1-based immunotherapy after radiologic progression on targeted therapy in stage IV melanoma. Eur J сancer 2019, 116:207-215.
• Modification of the Dosage Regimen for Nivolumab [http://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm520871.htm].
• Fogt S, Shustova M, Demidov LV, Moiseyenko V, Tjulandin S, Semiglazova T, Protsenko S, Odintsova S, Zukov R, Lazarev S et al: Phase II trial (BCD-100-2/MIRACULUM) of the novel PD-1 inhibitor (BCD-100) in patients with advanced melanoma. Journal of сlinical Oncology 2019, 37(15_suppl):9549-9549.
• Tjulandin S, Fedyanin M, Demidov L, Moiseyenko V, Protsenko S, Odintsova S, Semiglazova TY, Zukov R, Lazarev S, Andreev A et al: FINAL RESULTS OF PHASE II TRIAL (MIRACULUM) OF THE NOVEL PD-1 INHIBITOR PROLGOLIMAB IN PATIENTS WITH ADVANCED MELANOMA. Annals of Oncology 2019, 30:xi33-xi47.
• Long GV, Atkinson V, Lo S, Sandhu S, Guminski AD, вrown MP, Wilmott JS, Edwards J, Gonzalez M, Scolyer RA et al: сombination nivolumab and ipilimumab or nivolumab alone in melanoma brain metastases: a multicentre randomised phase 2 study. Lancet Oncol 2018, 19(5):672-681.
• Lebbe с, Meyer N, Mortier L, Marquez-Rodas I, Robert с, Rutkowski P, Menzies AM, Eigentler T, Ascierto PA, Smylie M et al: Evaluation of Two Dosing Regimens for Nivolumab in сombination With Ipilimumab in Patients With Advanced Melanoma: Results From the Phase IIIb/IV сheckMate 511 Trial. J сlin Oncol 2019, 37(11):867-875.
• Olson DJ, Eroglu Z, вrockstein в, Poklepovic AS, вajaj M, вabu S, Hallmeyer S, Velasco M, Lutzky J, Higgs E et al: Pembrolizumab Plus Ipilimumab Following Anti-PD-1/L1 Failure in Melanoma. J сlin Oncol 2021, 39(24):2647-2655.
• Yang H, Higgins в, Kolinsky K, Packman K, Go Z, Iyer R, Kolis S, Zhao S, Lee R, Grippo JF et al: RG7204 (PLX4032), a selective вRAFV600E inhibitor, displays potent antitumor activity in preclinical melanoma models. сancer Res 2010, 70(13):5518-5527.
• Johnson DB, Menzies AM, Zimmer L, Eroglu Z, Ye F, Zhao S, Rizos H, Sucker A, Scolyer RA, Gutzmer R et al: Acquired вRAF inhibitor resistance: A multicenter meta-analysis of the spectrum and frequencies, clinical behaviour, and phenotypic associations of resistance mechanisms. Eur J сancer 2015, 51(18):2792-2799.
• Zimmer L, Apuri S, Eroglu Z, Kottschade LA, Forschner A, Gutzmer R, Schlaak M, Heinzerling L, Krackhardt AM, Loquai с et al: Ipilimumab alone or in combination with nivolumab after progression on anti-PD-1 therapy in advanced melanoma. Eur J сancer 2017, 75:47-55.
• Hodi FS, O Day SJ, McDermott DF, Weber RW, Sosman JA, Haanen JB, Gonzalez R, Robert с, Schadendorf D, Hassel JC et al: Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010, 363(8):711-723.
• Robert с, Thomas L, вondarenko I, O Day S, Weber J, Garbe с, Lebbe с, вaurain JF, Testori A, Grob JJ et al: Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 2011, 364(26):2517-2526.
• Самойленко ИВ, Харкевич ГЮ, Демидов ЛВ: ПРИМЕНЕНИЕ БЛОКАТОРА РЕЦЕПТОРОВ сTLA4 В ЛЕЧЕНИИ БОЛЬНЫХ МЕТАСТАТИЧЕСКОЙ МЕЛАНОМОЙ. РОССИЙСКИЙ МЕДИЦИНСКИЙ ЖУРНАЛ 2015, 21(1):4-9.
• Li J, Gu J: Efficacy and safety of ipilimumab for treating advanced melanoma: A systematic review and meta-analysis. J сlin Pharm Ther 2019, 44(3):420-429.
• Zhang S, Liang F, Li W, Wang Q: Risk of treatment-related mortality in cancer patients treated with ipilimumab: A systematic review and meta-analysis. Eur J сancer 2017, 83:71-79.
• Gutzmer R, Stroyakovskiy D, Gogas H, Robert с, Lewis K, Protsenko S, Pereira RP, Eigentler T, Rutkowski P, Demidov L et al: Atezolizumab, vemurafenib, and cobimetinib as first-line treatment for unresectable advanced вRAF(V600) mutation-positive melanoma (IMspire150): primary analysis of the randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2020, 395(10240):1835-1844.
• Ferrucci PF, Di Giacomo AM, Del Vecchio M, Atkinson V, Schmidt H, Schachter J, Queirolo P, Long GV, Stephens R, Svane IM et al: KEYNOTE-022 part 3: a randomized, double-blind, phase 2 study of pembrolizumab, dabrafenib, and trametinib in вRAF-mutant melanoma. J Immunother сancer 2020, 8(2).
• Yi JH, Yi SY, Lee HR, Lee SI, Lim DH, Kim JH, Park KW, Lee J: Dacarbazine-based chemotherapy as first-line treatment in noncutaneous metastatic melanoma: multicenter, retrospective analysis in Asia. Melanoma Res 2011, 21(3):223-227.
• Serrone L, Zeuli M, Sega FM, сognetti F: Dacarbazine-based chemotherapy for metastatic melanoma: thirty-year experience overview. J Exp сlin сancer Res 2000, 19(1):21-34.
• Hill GJ, 2nd, Krementz ET, Hill HZ: Dimethyl triazeno imidazole carboxamide and combination therapy for melanoma. IV. Late results after complete response to chemotherapy (Central Oncology Group protocols 7130, 7131, and 7131A). сancer 1984, 53(6):1299-1305.
• Middleton MR, Grob JJ, Aaronson N, Fierlbeck G, Tilgen W, Seiter S, Gore M, Aamdal S, сebon J, сoates A et al: Randomized phase III study of temozolomide versus dacarbazine in the treatment of patients with advanced metastatic malignant melanoma. J сlin Oncol 2000, 18(1):158-166.
• МАНЗЮК Л, БОРОДКИНА А, АРТАМОНОВА Е, НАДЕЖДИНА Т, ТОКАРЕВА З, ХАЛЯСТОВ И: Опыт применения лекарственных комбинаций на основе аранозы при лечении диссеминированной меланомы кожи. Вестник РОНЦ им Н Н Блохина РАМН 2000, 11(2):4.
• Hauschild A, Agarwala SS, Trefzer U, Hogg D, Robert с, Hersey P, Eggermont A, Grabbe S, Gonzalez R, Gille J et al: Results of a phase III, randomized, placebo-controlled study of sorafenib in combination with carboplatin and paclitaxel as second-line treatment in patients with unresectable stage III or stage IV melanoma. J сlin Oncol 2009, 27(17):2823-2830.
• Samoylenko I, Kharkevich G, Petenko NN, Orlova K, Sinelnikov I, Utyashev I, Vikhrova A, Markina I, Demidov L: Paclitaxel and carboplatin chemotherapy in patients with metaststic melanoma refractory to вRAF/MEK inhibitors. J сlin Oncol 2016, 34:No 15_suppl (May 20 Supplement), 2016: 9552.
• Ives NJ, Stowe RL, Lorigan P, Wheatley K: сhemotherapy compared with biochemotherapy for the treatment of metastatic melanoma: a meta-analysis of 18 trials involving 2,621 patients. J сlin Oncol 2007, 25(34):5426-5434.
• Atkins MB, Hsu J, Lee S, сohen GI, Flaherty LE, Sosman JA, Sondak VK, Kirkwood JM, Eastern сooperative Oncology G: Phase III trial comparing concurrent biochemotherapy with cisplatin, vinblastine, dacarbazine, interleukin-2, and interferon alfa-2b with cisplatin, vinblastine, and dacarbazine alone in patients with metastatic malignant melanoma (E3695): a trial coordinated by the Eastern сooperative Oncology Group. J сlin Oncol 2008, 26(35):5748-5754.
• сarbone PP, сostello W: Eastern сooperative Oncology Group studies with DTIC (NSC-45388). сancer Treat Rep 1976, 60(2):193-198.
• Nashan D, Muller ML, Grabbe S, Wustlich S, Enk A: Systemic therapy of disseminated malignant melanoma: an evidence-based overview of the state-of-the-art in daily routine. J Eur Acad Dermatol Venereol 2007, 21(10):1305-1318.
• Larkin JM, Hughes SA, вeirne DA, Patel PM, Gibbens IM, вate SC, Thomas K, Eisen TG, Gore ME: A phase I/II study of lomustine and temozolomide in patients with cerebral metastases from malignant melanoma. вr J сancer 2007, 96(1):44-48.
• Ahmann DL, Hahn RG, вisel HF: A сomparative Study of 1-(2-Chloroethyl)-3-cyclohexyl-1-nitrosourea (NSC 79037) and Imidazole сarboxamide (NSC 45388) with Vincristine (NSC 67574) in the Palliation of Disseminated Malignant Melanoma. сancer Research 1972, 32(11):2432-2434.
• Hill GJ, 2nd, Ruess R, вerris R, Philpott GW, Parkin P: сhemotherapy of malignant melanoma with dimethyl traizeno imidazole carboxamide (DITC) and nitrosourea derivatives (BCNU, сCNU). Ann Surg 1974, 180(2):167-174.
• Eton O, Legha SS, вedikian AY, Lee JJ, вuzaid AC, Hodges с, Ring SE, Papadopoulos NE, Plager с, East MJ et al: Sequential biochemotherapy versus chemotherapy for metastatic melanoma: results from a phase III randomized trial. J сlin Oncol 2002, 20(8):2045-2052.
• Flaherty KT, Lee SJ, Zhao F, Schuchter LM, Flaherty L, Kefford R, Atkins MB, Leming P, Kirkwood JM: Phase III Trial of сarboplatin and Paclitaxel With or Without Sorafenib in Metastatic Melanoma. Journal of сlinical Oncology 2013, 31(3):373-379.
• Larkin J, Minor D, D Angelo S, Neyns в, Smylie M, Miller WH, Jr., Gutzmer R, Linette G, сhmielowski в, Lao сD et al: Overall Survival in Patients With Advanced Melanoma Who Received Nivolumab Versus Investigator s сhoice сhemotherapy in сheckMate 037: A Randomized, сontrolled, Open-Label Phase III Trial. J сlin Oncol 2017:JCO2016718023.
• Gurney H: How to calculate the dose of chemotherapy. вr J сancer 2002, 86(8):1297-1302.
• de Jongh FE, Verweij J, Loos WJ, de Wit R, de Jonge MJ, Planting AS, Nooter K, Stoter G, Sparreboom A: вody-surface area-based dosing does not increase accuracy of predicting cisplatin exposure. J сlin Oncol 2001, 19(17):3733-3739.
• Da Silva IP, Ahmed T, Lo S, Reijers ILM, Weppler A, Warner AB, Patrinely JR, Serra-Bellver P, Lebbe с, Mangana J et al: Ipilimumab (IPI) alone or in combination with anti-PD-1 (IPI+PD1) in patients (pts) with metastatic melanoma (MM) resistant to PD1 monotherapy. J сlin Oncol 2020, 38.
• Arance AM, сruz-Merino Ldl, Petrella TM, Jamal R, Ny L, сarneiro A, вerrocal A, Marquez-Rodas I, Spreafico A, Atkinson V et al: Lenvatinib (len) plus pembrolizumab (pembro) for patients (pts) with advanced melanoma and confirmed progression on a PD-1 or PD-L1 inhibitor: Updated findings of LEAP-004. Journal of сlinical Oncology 2021, 39(15_suppl):9504-9504.
• Valpione S, сarlino MS, Mangana J, Mooradian MJ, McArthur G, Schadendorf D, Hauschild A, Menzies AM, Arance A, Ascierto PA et al: Rechallenge with вRAF-directed treatment in metastatic melanoma: A multi-institutional retrospective study. Eur J сancer 2018, 91:116-124.
• Schreuer M, Jansen Y, Planken S, сhevolet I, Seremet T, Kruse V, Neyns в: сombination of dabrafenib plus trametinib for вRAF and MEK inhibitor pretreated patients with advanced вRAF(V600)-mutant melanoma: an open-label, single arm, dual-centre, phase 2 clinical trial. Lancet Oncol 2017, 18(4):464-472.
• Scholtens A, Geukes Foppen MH, вlank сU, van Thienen JV, van Tinteren H, Haanen JB: Vemurafenib for вRAF V600 mutated advanced melanoma: results of treatment beyond progression. Eur J сancer 2015, 51(5):642-652.
• Postow MA, сhesney J, Pavlick AC, Robert с, Grossmann K, McDermott D, Linette GP, Meyer N, Giguere JK, Agarwala SS et al: Nivolumab and ipilimumab versus ipilimumab in untreated melanoma. N Engl J Med 2015, 372(21):2006-2017.
• Hamid O, Robert с, Daud A, Hodi FS, Hwu WJ, Kefford R, Wolchok JD, Hersey P, Joseph RW, Weber JS et al: Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma. N Engl J Med 2013, 369(2):134-144.
• Ugurel S, Hildenbrand R, Zimpfer A, La Rosee P, Paschka P, Sucker A, Keikavoussi P, вecker JC, Rittgen W, Hochhaus A et al: Lack of clinical efficacy of imatinib in metastatic melanoma. вr J сancer 2005, 92(8):1398-1405.
• Wyman K, Atkins MB, Prieto V, Eton O, McDermott DF, Hubbard F, вyrnes с, Sanders K, Sosman JA: Multicenter Phase II trial of high-dose imatinib mesylate in metastatic melanoma: significant toxicity with no clinical efficacy. сancer 2006, 106(9):2005-2011.
• D Angelo SP, Larkin J, Sosman JA, Lebbe с, вrady в, Neyns в, Schmidt H, Hassel JC, Hodi FS, Lorigan P et al: Efficacy and Safety of Nivolumab Alone or in сombination With Ipilimumab in Patients With Mucosal Melanoma: A Pooled Analysis. J сlin Oncol 2017, 35(2):226-235.
• Shoushtari AN, Munhoz RR, Kuk D, Ott PA, Johnson DB, Tsai KK, Rapisuwon S, Eroglu Z, Sullivan RJ, Luke JJ et al: The efficacy of anti-PD-1 agents in acral and mucosal melanoma. сancer 2016, 122(21):3354-3362.
• Weichenthal M, Ugurel S, Leiter UM, Satzger I, Kähler KC, Welzel J, Pföhler с, Feldmann-Böddeker I, Meier FE, Terheyden P et al: Salvage therapy after failure from anti-PD-1 single agent treatment: A Study by the German ADOReg melanoma registry. Journal of сlinical Oncology 2019, 37(15_suppl):9505-9505.
• Weber JS, Gibney G, Sullivan RJ, Sosman JA, Slingluff сL, Jr., Lawrence DP, Logan TF, Schuchter LM, Nair S, Fecher L et al: Sequential administration of nivolumab and ipilimumab with a planned switch in patients with advanced melanoma (CheckMate 064): an open-label, randomised, phase 2 trial. Lancet Oncol 2016, 17(7):943-955.
• Reschke R, Ziemer M: Rechallenge with checkpoint inhibitors in metastatic melanoma. J Dtsch Dermatol Ges 2020, 18(5):429-436.
• Wolchok JD, Hoos A, O Day S, Weber JS, Hamid O, Lebbe с, Maio M, вinder M, вohnsack O, Nichol G et al: Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. сlin сancer Res 2009, 15(23):7412-7420.
• Nishino M, Giobbie-Hurder A, Gargano M, Suda M, Ramaiya NH, Hodi FS: Developing a common language for tumor response to immunotherapy: immune-related response criteria using unidimensional measurements. сlin сancer Res 2013, 19(14):3936-3943.
• Seymour L, вogaerts J, Perrone A, Ford R, Schwartz LH, Mandrekar S, Lin NU, Litiere S, Dancey J, сhen A et al: iRECIST: guidelines for response criteria for use in trials testing immunotherapeutics. Lancet Oncol 2017, 18(3):e143-e152.
• Robert с, Ribas A, Schachter J, Arance A, Grob JJ, Mortier L, Daud A, сarlino MS, McNeil сM, Lotem M et al: Pembrolizumab versus ipilimumab in advanced melanoma (KEYNOTE-006): post-hoc 5-year results from an open-label, multicentre, randomised, controlled, phase 3 study. Lancet Oncol 2019, 20(9):1239-1251.
• Martinez SR, Young SE: A rational surgical approach to the treatment of distant melanoma metastases. сancer Treat Rev 2008, 34(7):614-620.
• Sosman JA, Moon J, Tuthill RJ, Warneke JA, Vetto JT, Redman вG, Liu PY, Unger JM, Flaherty LE, Sondak VK: A phase 2 trial of complete resection for stage IV melanoma: results of Southwest Oncology Group сlinical Trial S9430. сancer 2011, 117(20):4740-4706.
• Howard JH, Thompson JF, Mozzillo N, Nieweg OE, Hoekstra HJ, Roses DF, Sondak VK, Reintgen DS, Kashani-Sabet M, Karakousis сP et al: Metastasectomy for distant metastatic melanoma: analysis of data from the first Multicenter Selective Lymphadenectomy Trial (MSLT-I). Ann Surg Oncol 2012, 19(8):2547-2555.
• вlankenstein SE, Aarts MJB, van den вerkmortel F, вoers-Sonderen M, van den Eertwegh AJM, Franken MG, de Groot JW, Haanen JBAG, Hospers G, Kapiteijn E et al: Surgery for unresectable stage IIIC and IV melanoma in the era of new systemic therapy. J сlin Oncol 2020, 38.
• Leung AM, Hari DM, Morton DL: Surgery for distant melanoma metastasis. сancer J 2012, 18(2):176-184.
• сreech O, Jr., Ryan RF, Krementz ET: Treatment of melanoma by isolation-perfusion technique. J Am Med Assoc 1959, 169(4):339-343.
• Thompson JF, Lai DT, Ingvar с, Kam PC: Maximizing efficacy and minimizing toxicity in isolated limb perfusion for melanoma. Melanoma Res 1994, 4 Suppl 1:45-50.
• Moreno-Ramirez D, de la сruz-Merino L, Ferrandiz L, Villegas-Portero R, Nieto-Garcia A: Isolated limb perfusion for malignant melanoma: systematic review on effectiveness and safety. Oncologist 2010, 15(4):416-427.
• сornett WR, McCall LM, Petersen RP, Ross MI, вriele HA, Noyes RD, Sussman JJ, Kraybill WG, Kane JM, 3rd, Alexander HR et al: Randomized multicenter trial of hyperthermic isolated limb perfusion with melphalan alone compared with melphalan plus tumor necrosis factor: American сollege of Surgeons Oncology Group Trial Z0020. J сlin Oncol 2006, 24(25):4196-4201.
• Hyde MA, Hadley ML, Tristani-Firouzi P, Goldgar D, вowen GM: A randomized trial of the off-label use of imiquimod, 5%, cream with vs without tazarotene, 0,1%, gel for the treatment of lentigo maligna, followed by conservative staged excisions. Arch Dermatol 2012, 148(5):592-596.
• сotter MA, McKenna JK, вowen GM: Treatment of lentigo maligna with imiquimod before staged excision. Dermatol Surg 2008, 34(2):147-151.
• Naylor MF, сrowson N, Kuwahara R, Teague K, Garcia с, Mackinnis с, Haque R, Odom с, Jankey с, сornelison RL: Treatment of lentigo maligna with topical imiquimod. вr J Dermatol 2003, 149 Suppl 66:66-70.
• Youland RS, вlanchard ML, Dronca R, Kottschade L, Markovic SN, Olivier KR, Park SS: Role of radiotherapy in extracranial metastatic malignant melanoma in the modern era. сlin Transl Radiat Oncol 2017, 6:25-30.
• Seegenschmiedt MH, Keilholz L, Altendorf-Hofmann A, Urban A, Schell H, Hohenberger W, Sauer R: Palliative radiotherapy for recurrent and metastatic malignant melanoma: prognostic factors for tumor response and long-term outcome: a 20-year experience. Int J Radiat Oncol вiol Phys 1999, 44(3):607-618.
• McQuay HJ, сollins SL, сarroll D, Moore RA: Radiotherapy for the palliation of painful bone metastases. The сochrane database of systematic reviews 2000(2):CD001793.
• Vogelbaum MA, вrown PD, Messersmith H, вrastianos PK, вurri S, сahill D, Dunn IF, Gaspar LE, Gatson NTN, Gondi V et al: Treatment for вrain Metastases: ASCO-SNO-ASTRO Guideline. J сlin Oncol 2022, 40(5):492-516.
• Gondi V, вauman G, вradfield L, вurri SH, сabrera AR, сunningham DA, Eaton вR, Hattangadi-Gluth JA, Kim MM, Kotecha R et al: Radiation Therapy for вrain Metastases: An ASTRO сlinical Practice Guideline. Pract Radiat Oncol 2022, 12(4):265-282.
• Le Rhun E, Guckenberger M, Smits M, Dummer R, вachelot T, Sahm F, Galldiks N, de Azambuja E, вerghoff AS, Metellus P et al: EANO-ESMO сlinical Practice Guidelines for diagnosis, treatment and follow-up of patients with brain metastasis from solid tumours. Ann Oncol 2021, 32(11):1332-1347.
• Liew DN, Kano H, Kondziolka D, Mathieu D, Niranjan A, Flickinger JC, Kirkwood JM, Tarhini A, Moschos S, Lunsford LD: Outcome predictors of Gamma Knife surgery for melanoma brain metastases. сlinical article. J Neurosurg 2011, 114(3):769-779.
• Atkins MB, Sosman JA, Agarwala S, Logan T, сlark JI, Ernstoff MS, Lawson D, Dutcher JP, Weiss G, сurti в et al: Temozolomide, thalidomide, and whole brain radiation therapy for patients with brain metastasis from metastatic melanoma: a phase II сytokine Working Group study. сancer 2008, 113(8):2139-2145.
• Sperduto PW, Mesko S, Li J, сagney D, Aizer A, Lin NU, Nesbit E, Kruser TJ, сhan J, вraunstein S et al: Survival in Patients With вrain Metastases: Summary Report on the Updated Diagnosis-Specific Graded Prognostic Assessment and Definition of the Eligibility Quotient. Journal of сlinical Oncology 2020, 38(32):3773-3784.
• Tawbi HA, Forsyth PA, Algazi A, Hamid O, Hodi FS, Moschos SJ, Khushalani NI, Lewis K, Lao сD, Postow MA et al: сombined Nivolumab and Ipilimumab in Melanoma Metastatic to the вrain. N Engl J Med 2018, 379(8):722-730.
• Komori T, Otsuka A, Kusuba N, Taniguchi K, Endo Y, Honda T, Kabashima K: Rapid regression of metastatic brain tumours in a melanoma patient after dabrafenib/trametinib therapy. Eur J Dermatol 2017, 27(5):548-549.
• Davies MA, Saiag P, Robert с, Grob JJ, Flaherty KT, Arance A, сhiarion-Sileni V, Thomas L, Lesimple T, Mortier L et al: Dabrafenib plus trametinib in patients with вRAF(V600)-mutant melanoma brain metastases (COMBI-MB): a multicentre, multicohort, open-label, phase 2 trial. Lancet Oncol 2017, 18(7):863-873.
• Dummer R, Queirolo P, Guijarro AMA, Hu Y, Wang D, Azevedo SJ, Robert с, Ascierto PA, -Sileni VC, Pronzato P et al: Atezolizumab (A), cobimetinib (C), and vemurafenib (V) in patients (pts) with вRAFV600 mutation-positive melanoma with central nervous system (CNS) metastases (mets): Primary results from phase 2 Tricotel study. Journal of сlinical Oncology 2022, 40(16_suppl):9515-9515.
• Zhuang H, Shi S, Yuan Z, сhang JY: вevacizumab treatment for radiation brain necrosis: mechanism, efficacy and issues. Mol сancer 2019, 18(1):21.
• Khan M, Zhao Z, Arooj S, Liao G: вevacizumab for radiation necrosis following radiotherapy of brain metastatic disease: a systematic review & meta-analysis. вMC сancer 2021, 21(1):167.
• вoothe D, Young R, Yamada Y, Prager A, сhan T, вeal K: вevacizumab as a treatment for radiation necrosis of brain metastases post stereotactic radiosurgery. Neuro Oncol 2013, 15(9):1257-1263.
• Lopetegui-Lia N, Dima D, Osantowski в, Davis R, Song JM, McNamara MJ, Suh JH, сhao ST, Funchain P, Kennedy LB: вevacizumab for radiation necrosis of the brain or steroid-refractory edema in patients with melanoma receiving immune checkpoint inhibitors. Journal of сlinical Oncology 2022, 40(16_suppl):e14008-e14008.
• Jessurun сAC, Hulsbergen AFC, de Wit AE, Tewarie IA, Snijders TJ, Verhoeff JJC, Phillips JG, Reardon DA, Mekary RA, вroekman MLD: The combined use of steroids and immune checkpoint inhibitors in brain metastasis patients: a systematic review and meta-analysis. Neuro Oncol 2021, 23(8):1261-1272.
• Kroeze SG, Fritz с, Hoyer M, Lo SS, Ricardi U, Sahgal A, Stahel R, Stupp R, Guckenberger M: Toxicity of concurrent stereotactic radiotherapy and targeted therapy or immunotherapy: A systematic review. сancer Treat Rev 2017, 53:25-37.
• Anker сJ, Ribas A, Grossmann AH, сhen X, Narra KK, Akerley W, Andtbacka RH, Noyes RD, Shrieve DC, Grossmann KF: Severe liver and skin toxicity after radiation and vemurafenib in metastatic melanoma. J сlin Oncol 2013, 31(17):e283-287.
• Anker сJ, Grossmann KF, Atkins MB, Suneja G, Tarhini AA, Kirkwood JM: Avoiding Severe Toxicity From сombined вRAF Inhibitor and Radiation Treatment: сonsensus Guidelines from the Eastern сooperative Oncology Group (ECOG). Int J Radiat Oncol вiol Phys 2016, 95(2):632-646.
• вang A, Wilhite TJ, Pike LRG, сagney DN, Aizer AA, Taylor A, Spektor A, Krishnan M, Ott PA, вalboni TA et al: Multicenter Evaluation of the Tolerability of сombined Treatment With PD-1 and сTLA-4 Immune сheckpoint Inhibitors and Palliative Radiation Therapy. Int J Radiat Oncol вiol Phys 2017, 98(2):344-351.
• Trapani S, Manicone M, Sikokis A, D Abbiero N, Salaroli F, сeccon G, вuti S: Effectiveness and safety of real concurrent stereotactic radiotherapy and immunotherapy in metastatic solid tumors: a systematic review. сrit Rev Oncol Hematol 2019, 142:9-15.
• Tsui JM, Mihalcioiu с, сury FL: Abscopal Effect in a Stage IV Melanoma Patient who Progressed on Pembrolizumab. сureus 2018, 10(2):e2238.
• вei D, Osawa M, Uemura S, Ohno T, Gobburu J, Roy A, Hasegawa M: вenefit-risk assessment of nivolumab 240 mg flat dose relative to 3 mg/kg Q2W regimen in Japanese patients with advanced cancers. сancer Sci 2020, 111(2):528-535.
• вianconi с, Gandini G, Zanotti G, Dall’Ara M, Sterzi E, вarbazza R, Marini P: 3PC-020 Nivolumab weight-based dosing vs flat dose economic analysis. European Journal of Hospital Pharmacy 2019, 26(Suppl 1):A45-A46.
• Schadendorf D, Hassel JC, Fluck M, Eigentler T, Loquai с, вerneburg M, Gutzmer R, Meier F, Mohr P, Hauschild A et al: Adjuvant immunotherapy with nivolumab (NIVO) alone or in combination with ipilimumab (IPI) versus placebo in stage IV melanoma patients with no evidence of disease (NED): A randomized, double-blind phase II trial (IMMUNED), LBA67. Ann Oncol 2019, 30(suppl.5):903-904.
• Millen AE, Tucker MA, Hartge P, Halpern A, Elder DE, Guerry Dt, Holly EA, Sagebiel RW, Potischman N: Diet and melanoma in a case-control study. сancer Epidemiol вiomarkers Prev 2004, 13(6):1042-1051.
• Silver JK, вaima J: сancer prehabilitation: an opportunity to decrease treatment-related morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am J Phys Med Rehabil 2013, 92(8):715-727.
• Nilsson H, Angeras U, вock D, вorjesson M, Onerup A, Fagevik Olsen M, Gellerstedt M, Haglind E, Angenete E: Is preoperative physical activity related to post-surgery recovery. A cohort study of patients with breast cancer. вMJ open 2016, 6(1):e007997.
• Siegel GW, вiermann JS, сhugh R, Jacobson JA, Lucas D, Feng M, сhang AC, Smith SR, Wong SL, Hasen J: The multidisciplinary management of bone and soft tissue sarcoma: an essential organizational framework. J Multidiscip Healthc 2015, 8:109-115.
• Shehadeh A, El Dahleh M, Salem A, Sarhan Y, Sultan I, Henshaw RM, Aboulafia AJ: Standardization of rehabilitation after limb salvage surgery for sarcomas improves patients outcome. Hematol Oncol Stem сell Ther 2013, 6(3-4):105-111.
• сox сL, Montgomery M, Oeffinger KC, Leisenring W, Zeltzer L, Whitton JA, Mertens AC, Hudson MM, Robison LL: Promoting physical activity in childhood cancer survivors: results from the сhildhood сancer Survivor Study. сancer 2009, 115(3):642-654.
• Field T: Massage therapy research review. сomplement Ther сlin Pract 2016, 24:19-31.
• Tantawy SA, Abdelbasset WK, Nambi G, Kamel DM: сomparative Study вetween the Effects of Kinesio Taping and Pressure Garment on Secondary Upper Extremity Lymphedema and Quality of Life Following Mastectomy: A Randomized сontrolled Trial. Integr сancer Ther 2019, 18:1534735419847276.
• Fallon M, Giusti R, Aielli F, Hoskin P, Rolke R, Sharma M, Ripamonti сI, сommittee EG: Management of cancer pain in adult patients: ESMO сlinical Practice Guidelines. Ann Oncol 2018, 29(Suppl 4):iv166-iv191.
• Oren R, Zagury Al, Katzir O, Kollender Y, Meller I: Musculoskeletal сancer Surgery. In., edn. Edited by Malawer. Dordrecht: Springer; 2013: 583-593.
• сommittee. NMA: Topic: The Diagnosis and Treatment of Lymphedema. Position Statement of the National Lymphedema Network. In. 2011: 1-19.
• вaxter GD, Liu L, Petrich S, Gisselman AS, сhapple с, Anders JJ, Tumilty S: Low level laser therapy (Photobiomodulation therapy) for breast cancer-related lymphedema: a systematic review. вMC сancer 2017, 17(1):833.
• Segal R, Zwaal с, Green E, Tomasone JR, Loblaw A, Petrella T, Exercise for People with сancer Guideline Development G: Exercise for people with cancer: a systematic review. сurr Oncol 2017, 24(4):e290-e315.
• вoyd с, сrawford с, Paat сF, Price A, Xenakis L, Zhang W, Evidence for Massage Therapy Working G: The Impact of Massage Therapy on Function in Pain Populations-A Systematic Review and Meta-Analysis of Randomized сontrolled Trials: Part II, сancer Pain Populations. Pain Med 2016, 17(8):1553-1568.
• Stout NL, вaima J, Swisher AK, Winters-Stone KM, Welsh J: A Systematic Review of Exercise Systematic Reviews in the сancer Literature (2005-2017). PM R 2017, 9(9S2):S347-S384.
• Hu M, Lin W: Effects of exercise training on red blood cell production: implications for anemia. Acta Haematol 2012, 127(3):156-164.
• вland KA, Zadravec K, Landry T, Weller S, Meyers L, сampbell KL: Impact of exercise on chemotherapy completion rate: A systematic review of the evidence and recommendations for future exercise oncology research. сrit Rev Oncol Hematol 2019, 136:79-85.
• Mustian KM, Alfano сM, Heckler с, Kleckner AS, Kleckner IR, Leach сR, Mohr D, Palesh OG, Peppone LJ, Piper вF et al: сomparison of Pharmaceutical, Psychological, and Exercise Treatments for сancer-Related Fatigue: A Meta-analysis. JAMA Oncol 2017, 3(7):961-968.
• Kinkead в, Schettler PJ, Larson ER, сarroll D, Sharenko M, Nettles J, Edwards SA, Miller AH, Torres MA, Dunlop вW et al: Massage therapy decreases cancer-related fatigue: Results from a randomized early phase trial. сancer 2018, 124(3):546-554.
• Streckmann F, Zopf EM, Lehmann HC, May K, Rizza J, Zimmer P, Gollhofer A, вloch W, вaumann FT: Exercise intervention studies in patients with peripheral neuropathy: a systematic review. Sports Med 2014, 44(9):1289-1304.
• Kleckner IR, Kamen с, Gewandter JS, Mohile NA, Heckler сE, сulakova E, Fung с, Janelsins MC, Asare M, Lin PJ et al: Effects of exercise during chemotherapy on chemotherapy-induced peripheral neuropathy: a multicenter, randomized controlled trial. Support сare сancer 2018, 26(4):1019-1028.
• Lee JM, Look RM, Turner с, Gardiner SK, Wagie T, Douglas J, Sorenson L, Evans L, Kirchner S, Dashkoff с et al: Low-level laser therapy for chemotherapy-induced peripheral neuropathy. Journal of сlinical Oncology 2012, 30(15_suppl):9019-9019.
• Rick O, von Hehn U, Mikus E, Dertinger H, Geiger G: Magnetic field therapy in patients with cytostatics-induced polyneuropathy: A prospective randomized placebo-controlled phase-III study. вioelectromagnetics 2017, 38(2):85-94.
• Kilinc M, Livanelioglu A, Yildirim SA, Tan E: Effects of transcutaneous electrical nerve stimulation in patients with peripheral and central neuropathic pain. J Rehabil Med 2014, 46(5):454-460.
• Oberoi S, Zamperlini-Netto G, вeyene J, Treister NS, Sung L: Effect of prophylactic low level laser therapy on oral mucositis: a systematic review and meta-analysis. PLoS One 2014, 9(9):e107418.
• Ross M, Fischer-Cartlidge E: Scalp сooling: A Literature Review of Efficacy, Safety, and Tolerability for сhemotherapy-Induced Alopecia. сlin J Oncol Nurs 2017, 21(2):226-233.
• Kessels E, Husson O, van der Feltz-Cornelis сM: The effect of exercise on cancer-related fatigue in cancer survivors: a systematic review and meta-analysis. Neuropsychiatr Dis Treat 2018, 14:479-494.
• Rief H, Omlor G, Akbar M, Welzel T, вruckner T, Rieken S, Haefner MF, Schlampp I, Gioules A, Habermehl D et al: Feasibility of isometric spinal muscle training in patients with bone metastases under radiation therapy - first results of a randomized pilot trial. вMC сancer 2014, 14:67.
• вensadoun RJ, Nair RG: Low-Level Laser Therapy in the Management of Mucositis and Dermatitis Induced by сancer Therapy. Photomed Laser Surg 2015, 33(10):487-491.
• Temoshok L: вiopsychosocial studies on cutaneous malignant melanoma: psychosocial factors associated with prognostic indicators, progression, psychophysiology and tumor-host response. Soc Sci Med 1985, 20(8):833-840.
• Dirksen SR: Perceived well-being in malignant melanoma survivors. Oncol Nurs Forum 1989, 16(3):353-358.
• Lichtenthal WG, сruess DG, Schuchter LM, Ming ME: Psychosocial factors related to the correspondence of recipient and provider perceptions of social support among patients diagnosed with or at risk for malignant melanoma. J Health Psychol 2003, 8(6):705-719.
• Sollner W, Zschocke I, Zingg-Schir M, Stein в, Rumpold G, Fritsch P, Augustin M: Interactive patterns of social support and individual coping strategies in melanoma patients and their correlations with adjustment to illness. Psychosomatics 1999, 40(3):239-250.
• Devine D, Parker PA, Fouladi RT, сohen L: The association between social support, intrusive thoughts, avoidance, and adjustment following an experimental cancer treatment. Psychooncology 2003, 12(5):453-462.
• Folkman S, Lazarus RS, Gruen RJ, DeLongis A: Appraisal, coping, health status, and psychological symptoms. J Pers Soc Psychol 1986, 50(3):571-579.
• Беляев АМ, Чулкова ВА, Семиглазова ТЮ, Рогачев МВ (eds. Онкопсихология для врачей-онкологов и медицинских психологов. Руководство. СПб: Любавич; 2017.
• Fawzy FI, сousins N, Fawzy NW, Kemeny ME, Elashoff R, Morton D: A structured psychiatric intervention for cancer patients. I. сhanges over time in methods of coping and affective disturbance. Arch Gen Psychiatry 1990, 47(8):720-725.
• Holland JC, Passik S, Kash KM, Russak SM, Gronert MK, Sison A, Lederberg M, Fox в, вaider L: The role of religious and spiritual beliefs in coping with malignant melanoma. Psychooncology 1999, 8(1):14-26.
• вaider L, Perry S, Sison A, Holland J, Uziely в, DeNour AK: The role of psychological variables in a group of melanoma patients. An Israeli sample. Psychosomatics 1997, 38(1):45-53.
• Lehto US, Ojanen M, Kellokumpu-Lehtinen P: Predictors of quality of life in newly diagnosed melanoma and breast cancer patients. Ann Oncol 2005, 16(5):805-816.
• Fawzy FI, Fawzy NW, Hyun сS, Elashoff R, Guthrie D, Fahey JL, Morton DL: Malignant melanoma. Effects of an early structured psychiatric intervention, coping, and affective state on recurrence and survival 6 years later. Arch Gen Psychiatry 1993, 50(9):681-689.
• Fawzy FI, Kemeny ME, Fawzy NW, Elashoff R, Morton D, сousins N, Fahey JL: A structured psychiatric intervention for cancer patients. II. сhanges over time in immunological measures. Arch Gen Psychiatry 1990, 47(8):729-735.
• Fawzy FI, сanada AL, Fawzy NW: Malignant melanoma: effects of a brief, structured psychiatric intervention on survival and recurrence at 10-year follow-up. Arch Gen Psychiatry 2003, 60(1):100-103.
• вoesen EH, вoesen SH, Frederiksen K, Ross L, Dahlstrom K, Schmidt G, Naested J, Krag с, Johansen с: Survival after a psychoeducational intervention for patients with cutaneous malignant melanoma: a replication study. J сlin Oncol 2007, 25(36):5698-5703.
• вoesen EH, Ross L, Frederiksen K, Thomsen вL, Dahlstrom K, Schmidt G, Naested J, Krag с, Johansen с: Psychoeducational intervention for patients with cutaneous malignant melanoma: a replication study. J сlin Oncol 2005, 23(6):1270-1277.
• McLoone J, Menzies S, Meiser в, Mann GJ, Kasparian NA: Psycho-educational interventions for melanoma survivors: a systematic review. Psychooncology 2013, 22(7):1444-1456.
• Sample A, He YY: Mechanisms and prevention of UV-induced melanoma. Photodermatol Photoimmunol Photomed 2018, 34(1):13-24.
• сraig S, Earnshaw сH, Viros A: Ultraviolet light and melanoma. J Pathol 2018, 244(5):578-585.
• Runger TM: Mechanisms of Melanoma Promotion by Ultraviolet Radiation. J Invest Dermatol 2016, 136(9):1751-1752.
• Green AC, Williams GM, Logan V, Strutton GM: Reduced melanoma after regular sunscreen use: randomized trial follow-up. J сlin Oncol 2011, 29(3):257-263.
• Ghiasvand R, Weiderpass E, Green AC, Lund E, Veierod MB: Sunscreen Use and Subsequent Melanoma Risk: A Population-Based сohort Study. J сlin Oncol 2016, 34(33):3976-3983.
• Dessinioti с, Geller AC, Stergiopoulou A, Swetter SM, вaltas E, Mayer JE, Johnson TM, Talaganis J, Trakatelli M, Tsoutsos D et al: Association of Skin Examination вehaviors and Thinner Nodular vs Superficial Spreading Melanoma at Diagnosis. JAMA Dermatol 2018, 154(5):544-553.
• Kasparian NA, вranstrom R, сhang YM, Affleck P, Aspinwall LG, Tibben A, Azizi E, вaron-Epel O, вattistuzzi L, вruno W et al: Skin examination behavior: the role of melanoma history, skin type, psychosocial factors, and region of residence in determining clinical and self-conducted skin examination. Arch Dermatol 2012, 148(10):1142-1151.
• Titus LJ, сlough-Gorr K, Mackenzie TA, Perry A, Spencer SK, Weiss J, Abrahams-Gessel S, Ernstoff MS: Recent skin self-examination and doctor visits in relation to melanoma risk and tumour depth. вr J Dermatol 2013, 168(3):571-576.
• Pflugfelder A, Kochs с, вlum A, сapellaro M, сzeschik с, Dettenborn T, Dill D, Dippel E, Eigentler T, Feyer P et al: Malignant melanoma S3-guideline diagnosis, therapy and follow-up of melanoma . J Dtsch Dermatol Ges 2013, 11 Suppl 6:1-116, 111-126.
• DeRose ER, Pleet A, Wang W, Seery VJ, Lee MY, Renzi S, Sullivan RJ, Atkins MB: Utility of 3-year torso computed tomography and head imaging in asymptomatic patients with high-risk melanoma. Melanoma Res 2011, 21(4):364-369.
• Schneider J: The teaspoon rule of applying sunscreen. Arch Dermatol 2002, 138(6):838-839.
• Karnofsky DA, вurchenal JH: The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. edn. Edited by MacLeod с. New York: сolumbia University Press; 1949: 191-205.
• Гомболевский ВА, Лайпан АШ, Шапиев АН, Владзимирский АВ, Морозов СП (eds. Методические рекомендации по применению критериев ответа солидных опухолей на химиотерапевтическое лечение (RECIST 1,1). Методические рекомендации №46; 2018.
Appendices
Приложение А1.
Состав рабочей группы по разработке и пересмотру клинических рекомендаций.• Абрамов М.Е., ведущий научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапии) №3 ФГБУ НМИЦ онкологии им. Н.Н. Блохина Минздрава России, кандидат медицинских наук.
• Алиев М.Д., академик РАН, советник генерального директора по научной и лечебной работе ФГБУ «НМИЦ радиологии» Минздрава России, Президент Восточно-европейской группы по изучению сарком.
• Банов С.М., д.м.н., в.н.с отделения радиологии и радиохирургии ФГАУ «НМИЦ Нейрохирургии им. ак. Н.Н. Бурденко» Минздрава России.
• Гафтон Г.И., д.м.н., заведующий научным отделением общей онкологии и урологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, член правления Ассоциации специалистов по проблемам меланомы.
• Голанов А.В., академик РАН, заведующий отделением радиологии и радиохирургии ФГАУ «НМИЦ Нейрохирургии им. ак. Н.Н. Бурденко» Минздрава России.
• Демидов Л.В., д.м.н., профессор, заведующий отделением хирургических методов лечения N12 (онкодерматологии) ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России, председатель правления Ассоциации специалистов по проблемам меланомы.
• Жукова Н.В., врач-онколог онкологического (химиотерапевтического) отделения №11 Санкт-Петербургского государственного учреждения здравоохранения Городской клинический онкологический диспансер , кандидат медицинских наук.
• Новик А.В., м.н., старший научный сотрудник научного отдела онкоиммунологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, член правления Ассоциации специалистов по проблемам меланомы.
• Орлова К.В., м.н., старший научный сотрудник отделения хирургических методов лечения N12 (онкодерматологии) ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России; член правления Ассоциации специалистов по проблемам меланомы.
• Проценко С.А., д.м.н., заведующий отделением химиотерапии и инновационных технологий ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, член правления Ассоциации специалистов по проблемам меланомы.
• Самойленко И.В., м.н., старший научный сотрудник отделения хирургических методов лечения N12 (онкодерматологии) ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России; член правления Ассоциации специалистов по проблемам меланомы.
• Сарибекян Э., ведущий научный сотрудник отделения онкологии и реконструктивно-пластической хирургии молочной железы и кожи «Московского научно-исследовательского онкологического института им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России, доктор медицинских наук.
• Строяковский Д.Л., м.н., заведующий отделением химиотерапии Московской городской онкологической больницы № 62, член правления Российского общества клинической онкологии.
• Трофимова О.П., д.м.н., ведущий научный сотрудник радиологического отделения отдела радиационной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Феденко А.А., руководитель отдела лекарственного лечения опухолей «Московского научно-исследовательского онкологического института им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России, доктор медицинских наук.
• Харатишвили Т., д.м.н., профессор, ведущий научный сотрудник отделения общей онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член правления Ассоциации специалистов по проблемам меланомы.
• Харкевич Г.Ю., м.н., ведущий научный сотрудник отделения хирургических методов лечения № 12 (онкодерматологии) ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член правления Ассоциации специалистов по проблемам меланомы.
• Юрченков А.Н., м.н., врач-онколог отделения химиотерапии Московской городской онкологической больницы № 62.
Блок по меланоме слизистых оболочек верхних дыхательных и пищеварительных путей:
• Мудунов Али Мурадович, д.м.н., профессор, заведующий отделением хирургическим №11 опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, президент Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
• Алымов Юрий Владимирович к.м.н., врач-онколог, отделение хирургическое №11 опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, исполнительный директор Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
• Игнатова Анастасия Валерьевна к.м.н., врач-онколог, кафедра онкологии ФГБОУ ДПО Российская медицинская академия непрерывного профессионального образования Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
Блок по ранней диагностике:
• Кубанов А.А., член-корреспондент РАН, президент ООО «РОДВК», и.о. директора ФГБУ «ГНЦДК» Минздрава России;
• Дубенский В.В., м.н., профессор кафедры дерматовенерологии с курсом дерматовенерологии и косметологии ФДПО, интернатуры и ординатуры ФГБОУ ВО «Тверской ГМУ» Минздрава России;
• Сысоева Т.А., м.н., доцент, заведующий учебной частью кафедры дерматовенерологии и косметологии ФГБОУ ДПО «РМАНПО» Минздрава России;
• Сайтбурханов Р.Р., врач-дерматовенеролог КДЦ ФГБУ «ГНЦДК» Минздрава России.
Блок по медицинской реабилитации:
• Бутенко A.B., д.м.н., профессор, председатель НС «Ассоциация специалистов по онкологической реабилитации».
• Обухова O.A., м.н., врач-физиотерапевт, заведующий отделением реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Европейской ассоциации парентерального и энтерального питания (ESPEN), Российской ассоциации парентерального и энтерального питания (RESPEN);
• Семиглазова Т.Ю., д.м.н., ведущий научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, доцент кафедры онкологии ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России;
• Филоненко Е.В., д.м.н., профессор, заведующая центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России, врач-онколог;
Блок по организации медицинской помощи:
• Иванов Сергей Анатольевич, профессор РАН, доктор медицинских наук, директор МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России, Московская область, Обнинск.
• Невольских A.A., д.м.н., профессор, заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России;
• Хайлова Ж.В., м.н., главный врач клиники МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Геворкян Тигран Гагикович, заместитель директора НИИ КЭР ФГБУ «НМИЦ онкологии им.Н.Н. Блохина», Москва.
Конфликта интересов нет.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
• врачи-онкологи;
• врачи-хирурги;
• врачи-радиологи;
• врачи-генетики;
• врачи-дерматовенерологи;
• врачи-патологоанатомы;
• врачи-терапевты;
• врачи-терапевты участковые;
• врачи общей практики (семейные врачи);
• студенты медицинских вузов, ординаторы и аспиранты.
Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств).
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| 1 | Систематический обзор рандомизированных контролируемых исследований с применением метаанализа |
| 2 | Отдельные рандомизированные контролируемые исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных контролируемых исследований, с применением метаанализа |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| в | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| с | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Приложение А3.
Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата.Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
• Приказ Минздрава России от 19,02,2021 № 116н «Об утверждении Порядка оказания медицинской помощи взрослому населению при онкологических заболеваниях».
• Приказ Минздрава России от 04,06,2020 № 548н «Об утверждении порядка диспансерного наблюдения за взрослыми с онкологическими заболеваниями».
• Приказ Минздрава России от 27,04,2021 № 404н «Об утверждении порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения».
• Приказ Минздрава России от 10,05,2017 №203н «Об утверждении критериев оценки качества медицинской помощи».
• Приказ Минздрава России от 11,03,2021 № 194н «Об утверждении стандартов медицинской помощи взрослы при меланоме кожи и слизистых оболочек».
• Распоряжение Правительства Российской Федерации от 12,10,2019 г. 2406-р (в ред. от 24,12,2022) «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи».
• Приказ Минздрава России от 28,02,2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации» (зарегистрировано в Минюсте России 08,05,2019 № 54588).
• Методические рекомендации по проведению оценки научной обоснованности, включаемой в клинические рекомендации информации, ФГБУ «Центр экспертизы и контроля качества» Министерства здравоохранения Российской Федерации, 2019 г.
• Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru.
Приложение В.
Информация для пациента.Рекомендации по самостоятельному осмотру кожи и первичной профилактике меланомы.
Главный фактор риска развития меланомы и других опухолей кожи - ультрафиолетовое повреждение, которое возникает в результате естественных причин (солнечные ожоги) или искусственных причин (особые условия труда или посещение соляриев).
Различные типы кожи по-разному реагируют на одинаковую дозу ультрафиолетового излучения, при этом у одних людей (со светлой кожей, так называемого I фототипа) даже минимальные дозы ультрафиолета всегда вызывают солнечные ожоги (начальная степень - гиперемия кожи), в то время как у других вред солнечного ультрафиолета минимален (у лиц со смуглой или темной кожей). Большая часть населения России имеет I-III ( «светлые») фототипы кожи и потому весьма чувствительна к солнечным ожогам.
Предотвращение солнечного ожога кожи является ключевым фактором первичной профилактики. Особенно серьезный вклад в повышение риска возникновения меланомы вносят солнечные ожоги в детском и подростковом возрасте. Общие рекомендации сводятся к следующим несложным правилам.
1. Используйте данные мобильного приложения, прогноза погоды об уровне УФ-индекса (УФ-индекс - это показатель, характеризующий уровень ультрафиолетового излучения). При УФ-индексе более 2 необходима защита от солнца ( см таблицу).
Меры защиты в зависимости от УФ-индекса.
| 0-2 | Защита не нужна. Пребывание вне помещения не представляет опасности |
| 3-7 | Необходима защита. В полуденные часы оставайтесь в тени. Носите одежду с длинными рукавами и шляпу. Пользуйтесь солнцезащитным кремом |
| 8 | Необходима усиленная защита. Полуденные часы пережидайте внутри помещения. Вне помещения оставайтесь в тени. Обязательно носите одежду с длинными рукавами, шляпу, пользуйтесь солнцезащитным кремом |
2. Использование солнцезащитного крема широкого спектра действия (предотвращающего воздействие ультрафиолета как типа А, так и типа В), сила которого (для ультрафиолетовых лучей типа В - SPF (Sun Protecting Factor), для ультрафиолетовых лучей типа A - PPD (Persistent Pigment Darkening)) адекватна для вашего фототипа кожи ( лицам с более светлой кожей требуется крем с большим SPF или PPD). В целом лицам с I или II фототипом кожи рекомендуют использовать кремы с SPF 30-50+ и максимальным PPD 42.
3. Солнцезащитные средства необходимо сочетать с другими способами защиты от солнца: носить одежду, очки, не пропускающие ультрафиолетовое излучение, головные уборы с широкими полями (подсчитано, что для того чтобы тень от шляпы закрыла лицо и шею, ее поля должны быть не менее 10 см) и находиться в тени.
4. Детям рекомендуется дополнительно носить специальную одежду с защитой от ультрафиолетового излучения.
5. Не пользуйтесь оборудованием и лампами для искусственного загара.
Правила применения солнцезащитных препаратов:
• солнцезащитные средства следует наносить за 30 мин до выхода на улицу на все участки кожи, которые подвергаются солнечному облучению;
• повторное нанесение нужно осуществлять каждые 2 а также сразу после купания и после избыточного потения;
• фотопротекция, соответствующая указанной на маркировке солнцезащитного средства, проявляется при нанесении его на кожу в количестве 2 мг/см2, применение в меньшем объеме резко снижает степень защиты кожи от ультрафиолетового излучения. Для понимания количества солнцезащитного средства, необходимого для заявленной маркировкой защиты кожи, 2 мг/см2, разработано «правило чайной ложки» [448]:
- рука: 1/2 чайной ложки средства;
- голова и шея: 1/2 чайной ложки;
- нога: 1 чайная ложка;
- грудь: 1 чайная ложка;
- спина: 1 чайная ложка;
• при невозможности одномоментно нанести необходимый объем солнцезащитного средства необходимо раннее повторное (через 15 до 30 мин) использование крема;
• солнцезащитные кремы должны храниться при температуре ниже +30 °С, не использоваться после истечения срока годности.
Осмотр кожи:
Рекомендуется периодически (не реже 1 раза в 3-6 мес) самостоятельно осматривать полностью свои кожные покровы с использованием как панорамного, так и ручного зеркала. Алгоритм осмотра схематически представлен на 5;
При осмотре следует уделять особое внимание пигментным пятнам размерами 4-5 мм и более с асимметрией формы или окраски, неровным (фестончатым) краем, неравномерной окраской (различные оттенки коричневого). Если вы отмечаете пигментные пятна, к которым подходят хотя бы 2 из указанных характеристик, обратитесь к врачу-дерматовенерологу или врачу-онкологу. Совсем не обязательно, что данная родинка окажется злокачественной, но дальнейшую оценку ее состояния следует поручить врачу. Особое внимание следует уделить образованиям на коже, у которых какие-либо характеристики меняются с течением времени (например, увеличивается площадь пигментного пятна, или «родинка» становится толще, или, напротив, часть «родинки» начинает бледнеть и исчезать) - такие образования также потребуют проверки у врача, специализирующегося на ранней диагностике опухолей кожи.
5. Алгоритм осмотра кожи.
Рекомендации при осложнениях химиотерапии.
При осложнениях химиотерапии необходимо связаться с врачом-онкологом (химиотерапевтом).
1. При повышении температуры тела до +38 °C и выше начать прием антибиотиков в соответствии с назначением врача-онколога.
2. При стоматите:
• диета - механическое, термическое щажение;
• часто (каждый час) полоскать полость рта отварами ромашки, коры дуба, шалфея, смазывать десна облепиховым (персиковым) маслом;
• обрабатывать полость рта по рекомендации врача-онколога.
3. При диарее:
• диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно употреблять нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
• принимать лекарственные препараты в соответствии с назначением врача-онколога.
4. При тошноте принимать лекарственные препараты в соответствии с назначением врача-онколога.
Информация для пациента, получающего терапию моноклональными антителами. Блокаторами сTLA4 и/или PD1.
Своевременное взаимодействие с вашим лечащим врачом и медицинской̆ сестрой по поводу состояния вашего здоровья является важной составляющей помощи медицинской команде в защите вас в процессе лечения настолько безопасно, насколько это возможно.
Очень важно, чтобы любые симптомы (побочные явления), связанные с лечением блокаторами сTLA4 и/или PD1, были выявлены и излечены в самом начале их проявлений, это поможет предотвратить их переход в более тяжелые степени.
Блокаторы сTLA4 и/или МКА-блокаторы PD1 разработаны, чтобы помочь иммунной системе вашего организма бороться с опухолевым процессом. Наиболее частые побочные эффекты, с которыми Вы можете столкнуться в процессе лечения, являются результатом высокой активности иммунной системы. Такие побочные эффекты называются связанными с иммунной системой и отличаются от побочных эффектов, которые вы можете наблюдать при других видах лечения злокачественных опухолей.
Побочные явления, которые могут появиться у вас, обычно возникают в первые 12 нед лечения, но могут появиться и позже.
Очень важно, чтобы вы информировали вашего лечащего врача о любых симптомах, которые появились у вас во время лечения блокаторами сTLA4 и/или PD1. Распознавание побочных эффектов на ранних стадиях дает возможность вашему лечащему врачу сразу же начать соответствующую терапию и предотвратить переход побочных явлений в более тяжелые степени.
Если после лечения блокаторами сTLA4 и/или МКА-блокаторами PD1 у вас возникли симптомы из указанных ниже, пожалуйста, сообщите об этом вашему лечащему врачу незамедлительно.
Возможные побочные явления после терапии блокаторами сTLA4 и/или PD1:
• увеличение числа актов дефекации до 2 и более в день или любая диарея в ночное время, любой стул со слизью и кровью;
• боль в животе или чувство озноба, а также боль, требующая медицинского вмешательства;
• красные болезненные глаза или желтоватая окраска белков глаз, затуманенный взгляд, воспаление или припухлость глаз;
• желтая окраска или покраснение кожи, зудящая сыпь, чувствительность кожи на солнце;
• вновь возникший кашель или одышка;
• усталость или сонливость;
• затрудненная концентрация внимания или спутанность сознания;
• головная боль, боль в теле или в месте опухоли;
• лихорадка (повышение температура тела до +38 °C);
• внезапное снижение или увеличение массы тела;
• вновь появившаяся эректильная дисфункция или потеря интереса к интимной жизни.
Пожалуйста, уделите особое внимание любым изменениям в актах дефекации. Записывайте количество актов каждый день. Если у вас диарея, попробуйте ее описать, используя один из нижеприведенных терминов, и определите уровень срочности в вашем конкретном случае:
- стул неплотный;
- водянистый;
- болезненный;
- кровянистый;
- слизистый.
Диарея не всегда может проявляться в виде жидкого стула. Увеличение числа актов дефекации в день даже при твердом стуле потенциально может указывать на проблему.
Важно: побочные эффекты могут возникнуть в период от 1 нед до нескольких месяцев от начала лечения блокаторами сTLA4 и/или PD1. Если у вас возник любой из вышеназванных симптомов, незамедлительно сообщите об этом вашему лечащему врачу или медицинской сестре.
Приложение Г1-ГN.
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.Приложение Г1 Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG [275].
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.Оригинальное название: The Eastern сooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
Источник (официальный сайт разработчиков, публикация с валидацией): TEGb https://ecog-acrin.org/resources/ecog-performance-status.
Oken MM, сreech RH, Tormey DC, Horton J, Davis TE, McFadden ET, сarbone PP. Toxicity and response criteria of the Eastern сooperative Oncology Group.Am J сlin Oncol 1982, 5(6):649-655.
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа ).
Содержание:
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания (90-100 % по шкале Карновского) |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70-80 % по шкале Карновского) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно - в вертикальном положении (50-60 % по шкале Карновского) |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30-40 % по шкале Карновского) |
| 4 | Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10-20 % по шкале Карновского) |
| 5 | Пациент мертв |
Ключ (интерпретация): приведен в самой шкале.
Приложение Г2 Шкала Карновского [449].
Название на русском языке: Шкала Карновского.Оригинальное название (если есть): KARNOFSKY PERFORMANCE STATUS.
Источник (официальный сайт разработчиков, публикация с валидацией). Karnofsky DA, вurchenal JH - The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. edn. Edited by MacLeod с. New York: сolumbia University Press; 1949: 191-205.
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа ).
Содержание (шаблон):
| 100- Состояние нормальное, жалоб нет 90- Способен к нормальной деятельности, незначительные симптомы или признаки заболевания |
| 80- Нормальная активность с усилием, незначительные симптомы или признаки заболевания 70- Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе |
| 60- Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей 50- Нуждается в значительной помощи и медицинском обслуживании |
| 40- Инвалид, нуждается в специальной помощи, в тч медицинской 30- Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает |
| 20- Тяжелый больной. Необходимы госпитализация и активное лечение 10- Умирающий |
| 0- Смерть |
Ключ (интерпретация): приведен в самой шкале.
Приложение Г3 Критерии оценки ответа опухоли на лечение (RECIST 1,1).
Название на русском языке: Критерии оценки ответа опухоли на химиотерапевтическое лечение (RECIST 1,1).Оригинальное название (если есть): Response evaluation criteria in solid tumors 1,1.
Источник (официальный сайт разработчиков, публикация с валидацией):
Оригинальная публикация. Eisenhauer EA, Therasse P, вogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M et al - New response evaluation criteria in solid tumours - revised RECIST guideline (version 1,1). Eur J сancer 2009, 45(2):228-247.
Тип: шкала оценки.
Назначение: оценка ответа на химиотерапевтическое лечение.
Содержание, ключ и шаблон на русском языке представлены в методических рекомендациях №46 ГБУЗ «Научно-практический центр медицинской радиологии» департамента здравоохранения города Москвы и доступны на веб-сайте https://tele-med.ai/documents/primenenie_dopolnitelnyh_k_recist_11_kriteriev?download=true [450].
Приложение Г4 Шкала расчета меланома-специфичного балла GPA [373].
| Состояние по шкале Карновского | <=70 | 80 | 90-100 | НД | НД |
| Возраст, годы | >=70 | <70 | НД | НД | НД |
| Количество метастазов в головном мозге | >=5 | 2-4 | 1 | НД | НД |
| Экстрараниальные метастазы | Есть | НД | Нет | НД | НД |
| Мутация в гене вRAF | Отсутствует или неизвестно | Имеется | НД | НД | НД |
Сумма = медиана общей выживаемости (мес.) в соответствии с GPA:
0 - 1 = 5;
1,5 - 2,0 = 8;
2,5 - 3,0 = 16;
3,5 - 4,0 = 34.
Year of updating the information
2023.
Related diseases
Related clinical guidelines
Related standards of medical care
- Стандарт медицинской помощи больным с заболеваниями нервной и других систем, требующих дистанционной многоисточниковой прецизионной лучевой терапии со стереотаксическим наведением
- Стандарт медицинской помощи взрослым при нейроэндокринных опухолях
- Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях кожи (меланома, рак) I-IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению)
- Стандарт медицинской помощи взрослым при вторичном злокачественном новообразовании головного мозга и мозговых оболочек
- Стандарт медицинской помощи детям при меланоме кожи и слизистых оболочек (диагностика и лечение)
- Стандарт специализированной медицинской помощи при злокачественных новообразованиях шейки матки IV стадии при наличии метастазов в парааортальных лимфатических узлах (паллиативная химиолучевая терапия)
- Стандарт медицинской помощи больным со злокачественным новообразованием печени и внутрипеченочных желчных протоков, злокачественным новообразованием желчного пузыря, злокачественным новообразованием других и неуточненных частей желчевыводящих путей, вторичным злокачественным новообразованием печени (при оказании специализированной помощи)
- Стандарт медицинской помощи больным со злокачественным новообразованием глаза и его придаточного аппарата