Другие названия и синонимы
Saxagliptin.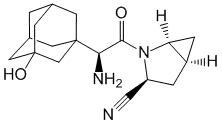
Фармакологическая группа
|
|
Латинское название
Saxagliptinum ( Saxagliptini).
Химическое название
(1S,3S,5S)-2-[(2S)-2-Амино-2-(3-гидрокси-1-адамантил)ацетил]-2-азабицикло[3.1.0]гексан-3-карбонитрил (в виде моногидрата).
Используется в лечении
Код CAS
361442-04-8.
Характеристика вещества
Гипогликемическое средство для перорального применения - ингибитор ДПП-4.
RxList.com (2016 г.
Саксаглиптина моногидрат - кристаллический порошок от белого до светло-желтого или светло-коричневого цвета, негигроскопичен. Плохо растворим в воде при температуре (24±3) °C, слабо растворим в этилацетате, растворим в метаноле, этаноле, изопропиловом спирте, ацетонитриле, ацетоне и ПЭГ 400. Молекулярная масса - 333,43.
RxList.com (2016 г.
Саксаглиптина моногидрат - кристаллический порошок от белого до светло-желтого или светло-коричневого цвета, негигроскопичен. Плохо растворим в воде при температуре (24±3) °C, слабо растворим в этилацетате, растворим в метаноле, этаноле, изопропиловом спирте, ацетонитриле, ацетоне и ПЭГ 400. Молекулярная масса - 333,43.
Фармакодинамика
Фармакодинамика.
Механизм действия.
Саксаглиптин - мощный селективный обратимый конкурентный ингибитор ДПП-4. У пациентов с сахарным диабетом типа 2 (СД2) прием саксаглиптина приводит к подавлению активности фермента ДПП-4 в течение 24 После приема глюкозы внутрь ингибирование ДПП-4 приводит к 2-3-кратному увеличению концентрации ГПП-1 и ГИП, уменьшению концентрации глюкагона и усилению глюкозозависимой ответной реакции бета-клеток, что приводит к повышению концентрации инсулина и С-пептида. Высвобождение инсулина бета-клетками поджелудочной железы и снижение высвобождения глюкагона из панкреатических альфа-клеток приводит к снижению гликемии натощак и постпрандиальной гликемии.
Клиническая эффективность и безопасность.
В двойных слепых рандомизированных контролируемых клинических исследованиях терапию саксаглиптином получали более 17000 пациентов с СД2.
Гликемический контроль.
Эффективность и безопасность применения саксаглиптина при приеме в дозах 2,5; 5 и 10 мг 1 раз в сутки изучены в шести двойных слепых плацебо-контролируемых исследованиях с участием 4148 пациентов с СД2. Прием саксаглиптина сопровождался статистически значимым улучшением показателей 1cHbA1c, глюкозы плазмы крови натощак (ГПН) и постпрандиальной глюкозы (ППГ) плазмы крови по сравнению с контролем.
Саксаглиптин назначался в виде монотерапии или комбинированной терапии. Комбинированная терапия саксаглиптином назначалась дополнительно пациентам, некомпенсированным при проведении монотерапии метформином, глибенкламидом, тиазолидиндионами или инсулином, или в качестве стартовой комбинации с метформином пациентам, некомпенсированным на диете и физических упражнениях. При приеме саксаглиптина в дозе 5 мг снижение HbА1с было отмечено через 4 нед и ГПН - через 2 нед.
В группе пациентов, получавших саксаглиптин в комбинации с метформином, глибенкламидом или тиазолидиндионами, снижение HbA1с также отмечалось через 4 нед и ГПН - через 2 нед.
В исследовании комбинированной терапии саксаглиптином и инсулином (в тч в комбинации с метформином) с участием 455 пациентов с СД2 продемонстрировано существенное снижение HbA1с и ППГ по сравнению с плацебо.
В исследовании терапии саксаглиптином в комбинации с метформином и производными сульфонилмочевины с участием 257 пациентов с СД2 продемонстрировано значимое снижение 1cHbA1c и ППГ по сравнению с плацебо в комбинации с метформином и производными сульфонилмочевины.
Влияние саксаглиптина на липидный профиль сходно с таковым плацебо. На фоне терапии саксаглиптином не отмечено увеличение массы тела.
В прямом сравнительном исследовании с участием 858 пациентов с СД2 добавление саксаглиптина 5 мг к метформину по сравнению с добавлением глипизида к метформину продемонстрировало сравнимое снижение 1cHbA1c, однако было ассоциировано с достоверно меньшим числом эпизодов гипогликемии - 3% случаев по сравнению с 36,3% при добавлении глипизида, а также отсутствием увеличения массы тела у пациентов, получающих терапию саксаглиптином (−1,1 кг от исходного уровня в группе саксаглиптина, +1,1 кг в группе глипизида).
К 104-й неделе терапии по меньшей мере один эпизод гипогликемии возник у 3,5% пациентов в группе саксаглиптина и метформина и у 38,4% в группе глипизида и метформина; изменение массы тела от исходного уровня составило −1,5 кг и +1,3 кг соответственно.
Сердечно-сосудистые исходы.
В исследовании SAVOR (Оценка сердечно-сосудистых исходов у пациентов с сахарным диабетом, принимающих саксаглиптин) были изучены сердечно-сосудистые исходы у 16492 пациентов с СД2 (12959 пациентов с подтвержденными сердечно-сосудистыми заболеваниями (ССЗ), 3533 пациента с множественными факторами риска сердечно-сосудистых осложнений) и значениями 6,5% ≤HbA1c<12%. Пациенты были рандомизированы в две группы для терапии саксаглиптином (8280 пациентов) или плацебо (8212 пациентов) в дополнение к стандартной для каждого региона терапии, направленной на контроль 1cHbA1c и факторов сердечно-сосудистого риска. Было показано, что саксаглиптин не увеличивает риск сердечно-сосудистых осложнений (таких как смерть от ССЗ, нефатальный инфаркт миокарда, нефатальный ишемический инсульт) по сравнению с плацебо при добавлении к стандартной базовой терапии (относительный риск [ОР]: 1,00; 95% ДИ: 0,89, 1,12). Также было показано, что добавление саксаглиптина к базовой терапии не увеличивает риск комбинированной конечной точки, включавшей в себя смерть от ССЗ, нефатальный инфаркт миокарда, нефатальный ишемический инсульт, госпитализацию по поводу ХСН, нестабильной стенокардии или реваскуляризации коронарных артерий по сравнению с плацебо (ОР: 1,02; 95% ДИ: 0,94, 1,11). Общая смертность была сопоставимой в группах саксаглиптина и плацебо (ОР: 1,11; 95% ДИ: 0,96, 1,27).
В исследовании было отмечено увеличение частоты госпитализации по поводу ХСН в группе саксаглиптина (3,5%, 289 пациентов) по сравнению с группой плацебо (2,8%, 228 пациентов) с номинальной статистической значимостью ( без выполнения поправки для множественных конечных точек) (ОР: 1,27; 95% ДИ: 1,07, 1,51; Р=0,007). У пациентов с ХСН или почечной недостаточностью, получавших саксаглиптин, не была отмечена более высокая частота первичной конечной точки, вторичной конечной точки и общей смертности по сравнению с группой плацебо.
В группе саксаглиптина динамика значения HbAlc была достоверно более выраженной, а процент пациентов, достигших целевого значения HbAlc, был выше, чем в группе плацебо. При этом интенсификация гипогликемической терапии или добавление инсулина в группе саксаглиптина потребовались значительно меньшему количеству пациентов, чем в группе плацебо.
Механизм действия.
Саксаглиптин - мощный селективный обратимый конкурентный ингибитор ДПП-4. У пациентов с сахарным диабетом типа 2 (СД2) прием саксаглиптина приводит к подавлению активности фермента ДПП-4 в течение 24 После приема глюкозы внутрь ингибирование ДПП-4 приводит к 2-3-кратному увеличению концентрации ГПП-1 и ГИП, уменьшению концентрации глюкагона и усилению глюкозозависимой ответной реакции бета-клеток, что приводит к повышению концентрации инсулина и С-пептида. Высвобождение инсулина бета-клетками поджелудочной железы и снижение высвобождения глюкагона из панкреатических альфа-клеток приводит к снижению гликемии натощак и постпрандиальной гликемии.
Клиническая эффективность и безопасность.
В двойных слепых рандомизированных контролируемых клинических исследованиях терапию саксаглиптином получали более 17000 пациентов с СД2.
Гликемический контроль.
Эффективность и безопасность применения саксаглиптина при приеме в дозах 2,5; 5 и 10 мг 1 раз в сутки изучены в шести двойных слепых плацебо-контролируемых исследованиях с участием 4148 пациентов с СД2. Прием саксаглиптина сопровождался статистически значимым улучшением показателей 1cHbA1c, глюкозы плазмы крови натощак (ГПН) и постпрандиальной глюкозы (ППГ) плазмы крови по сравнению с контролем.
Саксаглиптин назначался в виде монотерапии или комбинированной терапии. Комбинированная терапия саксаглиптином назначалась дополнительно пациентам, некомпенсированным при проведении монотерапии метформином, глибенкламидом, тиазолидиндионами или инсулином, или в качестве стартовой комбинации с метформином пациентам, некомпенсированным на диете и физических упражнениях. При приеме саксаглиптина в дозе 5 мг снижение HbА1с было отмечено через 4 нед и ГПН - через 2 нед.
В группе пациентов, получавших саксаглиптин в комбинации с метформином, глибенкламидом или тиазолидиндионами, снижение HbA1с также отмечалось через 4 нед и ГПН - через 2 нед.
В исследовании комбинированной терапии саксаглиптином и инсулином (в тч в комбинации с метформином) с участием 455 пациентов с СД2 продемонстрировано существенное снижение HbA1с и ППГ по сравнению с плацебо.
В исследовании терапии саксаглиптином в комбинации с метформином и производными сульфонилмочевины с участием 257 пациентов с СД2 продемонстрировано значимое снижение 1cHbA1c и ППГ по сравнению с плацебо в комбинации с метформином и производными сульфонилмочевины.
Влияние саксаглиптина на липидный профиль сходно с таковым плацебо. На фоне терапии саксаглиптином не отмечено увеличение массы тела.
В прямом сравнительном исследовании с участием 858 пациентов с СД2 добавление саксаглиптина 5 мг к метформину по сравнению с добавлением глипизида к метформину продемонстрировало сравнимое снижение 1cHbA1c, однако было ассоциировано с достоверно меньшим числом эпизодов гипогликемии - 3% случаев по сравнению с 36,3% при добавлении глипизида, а также отсутствием увеличения массы тела у пациентов, получающих терапию саксаглиптином (−1,1 кг от исходного уровня в группе саксаглиптина, +1,1 кг в группе глипизида).
К 104-й неделе терапии по меньшей мере один эпизод гипогликемии возник у 3,5% пациентов в группе саксаглиптина и метформина и у 38,4% в группе глипизида и метформина; изменение массы тела от исходного уровня составило −1,5 кг и +1,3 кг соответственно.
Сердечно-сосудистые исходы.
В исследовании SAVOR (Оценка сердечно-сосудистых исходов у пациентов с сахарным диабетом, принимающих саксаглиптин) были изучены сердечно-сосудистые исходы у 16492 пациентов с СД2 (12959 пациентов с подтвержденными сердечно-сосудистыми заболеваниями (ССЗ), 3533 пациента с множественными факторами риска сердечно-сосудистых осложнений) и значениями 6,5% ≤HbA1c<12%. Пациенты были рандомизированы в две группы для терапии саксаглиптином (8280 пациентов) или плацебо (8212 пациентов) в дополнение к стандартной для каждого региона терапии, направленной на контроль 1cHbA1c и факторов сердечно-сосудистого риска. Было показано, что саксаглиптин не увеличивает риск сердечно-сосудистых осложнений (таких как смерть от ССЗ, нефатальный инфаркт миокарда, нефатальный ишемический инсульт) по сравнению с плацебо при добавлении к стандартной базовой терапии (относительный риск [ОР]: 1,00; 95% ДИ: 0,89, 1,12). Также было показано, что добавление саксаглиптина к базовой терапии не увеличивает риск комбинированной конечной точки, включавшей в себя смерть от ССЗ, нефатальный инфаркт миокарда, нефатальный ишемический инсульт, госпитализацию по поводу ХСН, нестабильной стенокардии или реваскуляризации коронарных артерий по сравнению с плацебо (ОР: 1,02; 95% ДИ: 0,94, 1,11). Общая смертность была сопоставимой в группах саксаглиптина и плацебо (ОР: 1,11; 95% ДИ: 0,96, 1,27).
В исследовании было отмечено увеличение частоты госпитализации по поводу ХСН в группе саксаглиптина (3,5%, 289 пациентов) по сравнению с группой плацебо (2,8%, 228 пациентов) с номинальной статистической значимостью ( без выполнения поправки для множественных конечных точек) (ОР: 1,27; 95% ДИ: 1,07, 1,51; Р=0,007). У пациентов с ХСН или почечной недостаточностью, получавших саксаглиптин, не была отмечена более высокая частота первичной конечной точки, вторичной конечной точки и общей смертности по сравнению с группой плацебо.
В группе саксаглиптина динамика значения HbAlc была достоверно более выраженной, а процент пациентов, достигших целевого значения HbAlc, был выше, чем в группе плацебо. При этом интенсификация гипогликемической терапии или добавление инсулина в группе саксаглиптина потребовались значительно меньшему количеству пациентов, чем в группе плацебо.
Фармакокинетика
У пациентов с СД2 и здоровых добровольцев отмечены сходные параметры фармакокинетики саксаглиптина и его основного метаболита. Саксаглиптин быстро абсорбировался после приема внутрь натощак с достижением maxCmax саксаглиптина и основного метаболита в плазме в течение 2 и 4 ч соответственно. При увеличении дозы саксаглиптина было отмечено пропорциональное увеличение maxCmax и величины AUC саксаглиптина и его основного метаболита. После однократного приема саксаглиптина внутрь в дозе 5 мг здоровыми добровольцами средние значения AUC саксаглиптина и его основного метаболита составили 78 и 214 нг·ч/мл, а значения maxCmax в плазме - 24 и 47 нг/мл соответственно.
Средняя продолжительность конечного 1/2T1/2 саксаглиптина и его основного метаболита составила 2,5 и 3,1 ч соответственно, а средняя величина 1/2T1/2 ингибирования ДПП-4 плазмы - 27 Ингибирование активности ДПП-4 в плазме в течение по крайней мере 24 ч после приема саксаглиптина обусловлено его высоким сродством к ДПП-4 и длительным связыванием с ним. Заметной кумуляции саксаглиптина и его основного метаболита при длительном приеме препарата 1 раз в день не наблюдалось. Не было выявлено зависимости клиренса саксаглиптина и его основного метаболита от дозы и длительности терапии при приеме саксаглиптина 1 раз в день в дозах от 2,5 до 400 мг на протяжении 14 дней.
Всасывание.
После приема внутрь всасывалось не менее 75% принятой дозы саксаглиптина. Прием пищи не оказывал существенное влияние на фармакокинетику саксаглиптина у здоровых добровольцев. Прием пищи с высоким содержанием жиров не оказывал влияние на maxCmax саксаглиптина, тогда как AUC увеличивалась на 27% по сравнению с приемом натощак. maxTmax для саксаглиптина увеличивалось приблизительно на 0,5 ч при приеме вместе с пищей по сравнению с приемом натощак. Однако эти изменения не являются клинически значимыми.
RxList.com (обновление 2021 г.
Всасывание.
Среднее maxTmax после приема саксаглиптина в дозе 5 мг 1 раз в сутки составляло 2 ч для саксаглиптина и 4 ч для его активного метаболита. Прием с пищей с высоким содержанием жиров приводил к увеличению maxTmax саксаглиптина примерно на 20 мин по сравнению с приемом натощак. Саксаглиптин можно применять вне зависимости от приема пищи.
Распределение.
Связывание саксаглиптина и его основного метаболита с белками сыворотки крови незначительно, поэтому можно предположить, что распределение саксаглиптина при изменениях белкового состава сыворотки крови, отмечающихся при печеночной или почечной недостаточности, не будет подвержено значительным изменениям.
Метаболизм.
Саксаглиптин метаболизируется главным образом при участии изоферментов сYP3A4/5 цитохрома Р450 с образованием активного основного метаболита, ингибирующее действие которого в отношении ДПП-4 выражено в 2 раза слабее, чем у саксаглиптина.
Выведение.
Саксаглиптин выводится с мочой и желчью. После однократного приема дозы 50 мг меченного 14C-саксаглиптина 24% дозы выводились почками в виде неизмененного саксаглиптина и 36% - в виде основного метаболита саксаглиптина. Общая радиоактивность, обнаруженная в моче, соответствовала 75% принятой дозы саксаглиптина. Средний почечный клиренс саксаглиптина составил около 230 мл/мин, среднее значение КФ - примерно 120 мл/мин. Для основного метаболита почечный клиренс был сопоставим со средними значениями КФ.
Около 22% общей радиоактивности было обнаружено в фекалиях.
RxList.com (обновление 2021 г.
Выведение.
В общей сложности 22% введенной радиоактивности было обнаружено в фекалиях, что представляет собой часть дозы саксаглиптина, выведенной с желчью и/или неабсорбированного из ЖКТ ЛС. После однократного перорального приема здоровыми добровольцами саксаглиптина в дозе 5 мг значения конечного Т1/2 из плазмы составили 2,5 и 3,1 ч для саксаглиптина и его активного метаболита соответственно.
Особые группы пациентов.
Нарушение функции почек. У пациентов с легкой степенью почечной недостаточности величина AUC саксаглиптина и его основного метаболита были соответственно в 1,2 и 1,7 раза выше, чем аналогичные показатели у лиц с нормальной функцией почек. Данное увеличение значений AUC не является клинически значимым, поэтому коррекция дозы не требуется.
У пациентов с почечной недостаточностью умеренной и тяжелой степени, а также у пациентов на гемодиализе величины AUC саксаглиптина и его основного метаболита были соответственно в 2,1 и 4,5 раза выше, чем аналогичные показатели у лиц с нормальной функцией почек. Для пациентов с умеренным и тяжелым нарушением функции почек, а также для пациентов на гемодиализе доза саксаглиптина должна составлять 2,5 мг 1 раз в сутки ( см «Меры предосторожности»).
RxList.com (обновление 2021 г.
Нарушение функции почек. Открытое исследование однократной дозы было проведено для оценки фармакокинетики саксаглиптина (доза 10 мг) у людей с различной степенью ХПН по сравнению с людьми с нормальной функцией почек. Дозировка 10 мг не является утвержденной дозировкой. Степень почечной недостаточности не влияла на maxCmax саксаглиптина или его метаболита.
Нарушение функции печени. У пациентов с легким, умеренным и тяжелым нарушением функции печени не было выявлено клинически значимых изменений параметров фармакокинетики саксаглиптина, поэтому коррекция дозы для таких пациентов не требуется.
RxList.com (обновление 2021 г.
Нарушение функции печени. После приема однократной дозы 10 мг саксаглиптина у пациентов с нарушением функции печени (классы A, в и с по шкале Чайлд-Пью) значения maxCmax и AUC саксаглиптина были на 8 и 77% соответственно выше по сравнению со здоровыми людьми из подобранных контрольных групп. Дозировка 10 мг не является утвержденной дозировкой. Соответствующие значения maxCmax и AUC активного метаболита были на 59 и 33% ниже соответственно по сравнению со здоровыми людьми из подобранных контрольных групп. Эти различия не считаются клинически значимыми.
Пациенты пожилого возраста. У пациентов 65-80 лет не было выявлено клинически значимых различий параметров фармакокинетики саксаглиптина по сравнению с пациентами более молодого возраста (18-40 лет), поэтому коррекция дозы у пожилых пациентов не требуется. Однако следует учитывать, что у этой категории пациентов более вероятно снижение функции почек ( см «Меры предосторожности»).
RxList.com (обновление 2021 г.
Пациенты пожилого возраста. Корректировка дозы только на основании возраста не рекомендуется. У пожилых людей (65-80 лет) средние геометрические значения maxCmax и AUC саксаглиптина были на 23 и 59% выше, чем у молодых людей (18-40 лет). Различия в фармакокинетике активного метаболита у пожилых и молодых людей в целом отражали различия, наблюдаемые в фармакокинетике саксаглиптина. Разница между фармакокинетикой саксаглиптина и активного метаболита у молодых и пожилых людей, вероятно, связана с множеством факторов, включая снижение функции почек и метаболических возможностей с возрастом. На основе популяционного фармакокинетического анализа, возраст не был идентифицирован как значимая ковариата кажущегося клиренса саксаглиптина и его активного метаболита.
RxList.com (2016 г.
ИМТ. Не рекомендуется корректировка дозы в зависимости от ИМТ, который не был идентифицирован как значимая ковариата кажущегося клиренса саксаглиптина или его активного метаболита на основе популяционного фармакокинетического анализа.
Пол. Корректировка дозы в зависимости от пола не требуется. Не обнаружено различий в фармакокинетике саксаглиптина между мужчинами и женщинами. Значения экспозиции активного метаболита приблизительно на 25% выше у женщин по сравнению с таковыми у мужчин, но эта разница вряд ли будет иметь клиническое значение. На основе популяционного фармакокинетического анализа, пол не был идентифицирован как значимая ковариата кажущегося клиренса саксаглиптина и его активного метаболита.
Раса и этническая принадлежность. Корректировка дозы в зависимости от расы не рекомендуется. По данным популяционного фармакокинетического анализа, при сравнении фармакокинетики саксаглиптина и его активного метаболита у 309 участников европеоидной расы и 105 испытуемых неевропеоидной расы (включавших шесть расовых групп) значимых различий в фармакокинетике саксаглиптина и его активного метаболита между этими двумя популяциями обнаружено не было.
Средняя продолжительность конечного 1/2T1/2 саксаглиптина и его основного метаболита составила 2,5 и 3,1 ч соответственно, а средняя величина 1/2T1/2 ингибирования ДПП-4 плазмы - 27 Ингибирование активности ДПП-4 в плазме в течение по крайней мере 24 ч после приема саксаглиптина обусловлено его высоким сродством к ДПП-4 и длительным связыванием с ним. Заметной кумуляции саксаглиптина и его основного метаболита при длительном приеме препарата 1 раз в день не наблюдалось. Не было выявлено зависимости клиренса саксаглиптина и его основного метаболита от дозы и длительности терапии при приеме саксаглиптина 1 раз в день в дозах от 2,5 до 400 мг на протяжении 14 дней.
Всасывание.
После приема внутрь всасывалось не менее 75% принятой дозы саксаглиптина. Прием пищи не оказывал существенное влияние на фармакокинетику саксаглиптина у здоровых добровольцев. Прием пищи с высоким содержанием жиров не оказывал влияние на maxCmax саксаглиптина, тогда как AUC увеличивалась на 27% по сравнению с приемом натощак. maxTmax для саксаглиптина увеличивалось приблизительно на 0,5 ч при приеме вместе с пищей по сравнению с приемом натощак. Однако эти изменения не являются клинически значимыми.
RxList.com (обновление 2021 г.
Всасывание.
Среднее maxTmax после приема саксаглиптина в дозе 5 мг 1 раз в сутки составляло 2 ч для саксаглиптина и 4 ч для его активного метаболита. Прием с пищей с высоким содержанием жиров приводил к увеличению maxTmax саксаглиптина примерно на 20 мин по сравнению с приемом натощак. Саксаглиптин можно применять вне зависимости от приема пищи.
Распределение.
Связывание саксаглиптина и его основного метаболита с белками сыворотки крови незначительно, поэтому можно предположить, что распределение саксаглиптина при изменениях белкового состава сыворотки крови, отмечающихся при печеночной или почечной недостаточности, не будет подвержено значительным изменениям.
Метаболизм.
Саксаглиптин метаболизируется главным образом при участии изоферментов сYP3A4/5 цитохрома Р450 с образованием активного основного метаболита, ингибирующее действие которого в отношении ДПП-4 выражено в 2 раза слабее, чем у саксаглиптина.
Выведение.
Саксаглиптин выводится с мочой и желчью. После однократного приема дозы 50 мг меченного 14C-саксаглиптина 24% дозы выводились почками в виде неизмененного саксаглиптина и 36% - в виде основного метаболита саксаглиптина. Общая радиоактивность, обнаруженная в моче, соответствовала 75% принятой дозы саксаглиптина. Средний почечный клиренс саксаглиптина составил около 230 мл/мин, среднее значение КФ - примерно 120 мл/мин. Для основного метаболита почечный клиренс был сопоставим со средними значениями КФ.
Около 22% общей радиоактивности было обнаружено в фекалиях.
RxList.com (обновление 2021 г.
Выведение.
В общей сложности 22% введенной радиоактивности было обнаружено в фекалиях, что представляет собой часть дозы саксаглиптина, выведенной с желчью и/или неабсорбированного из ЖКТ ЛС. После однократного перорального приема здоровыми добровольцами саксаглиптина в дозе 5 мг значения конечного Т1/2 из плазмы составили 2,5 и 3,1 ч для саксаглиптина и его активного метаболита соответственно.
Особые группы пациентов.
Нарушение функции почек. У пациентов с легкой степенью почечной недостаточности величина AUC саксаглиптина и его основного метаболита были соответственно в 1,2 и 1,7 раза выше, чем аналогичные показатели у лиц с нормальной функцией почек. Данное увеличение значений AUC не является клинически значимым, поэтому коррекция дозы не требуется.
У пациентов с почечной недостаточностью умеренной и тяжелой степени, а также у пациентов на гемодиализе величины AUC саксаглиптина и его основного метаболита были соответственно в 2,1 и 4,5 раза выше, чем аналогичные показатели у лиц с нормальной функцией почек. Для пациентов с умеренным и тяжелым нарушением функции почек, а также для пациентов на гемодиализе доза саксаглиптина должна составлять 2,5 мг 1 раз в сутки ( см «Меры предосторожности»).
RxList.com (обновление 2021 г.
Нарушение функции почек. Открытое исследование однократной дозы было проведено для оценки фармакокинетики саксаглиптина (доза 10 мг) у людей с различной степенью ХПН по сравнению с людьми с нормальной функцией почек. Дозировка 10 мг не является утвержденной дозировкой. Степень почечной недостаточности не влияла на maxCmax саксаглиптина или его метаболита.
Нарушение функции печени. У пациентов с легким, умеренным и тяжелым нарушением функции печени не было выявлено клинически значимых изменений параметров фармакокинетики саксаглиптина, поэтому коррекция дозы для таких пациентов не требуется.
RxList.com (обновление 2021 г.
Нарушение функции печени. После приема однократной дозы 10 мг саксаглиптина у пациентов с нарушением функции печени (классы A, в и с по шкале Чайлд-Пью) значения maxCmax и AUC саксаглиптина были на 8 и 77% соответственно выше по сравнению со здоровыми людьми из подобранных контрольных групп. Дозировка 10 мг не является утвержденной дозировкой. Соответствующие значения maxCmax и AUC активного метаболита были на 59 и 33% ниже соответственно по сравнению со здоровыми людьми из подобранных контрольных групп. Эти различия не считаются клинически значимыми.
Пациенты пожилого возраста. У пациентов 65-80 лет не было выявлено клинически значимых различий параметров фармакокинетики саксаглиптина по сравнению с пациентами более молодого возраста (18-40 лет), поэтому коррекция дозы у пожилых пациентов не требуется. Однако следует учитывать, что у этой категории пациентов более вероятно снижение функции почек ( см «Меры предосторожности»).
RxList.com (обновление 2021 г.
Пациенты пожилого возраста. Корректировка дозы только на основании возраста не рекомендуется. У пожилых людей (65-80 лет) средние геометрические значения maxCmax и AUC саксаглиптина были на 23 и 59% выше, чем у молодых людей (18-40 лет). Различия в фармакокинетике активного метаболита у пожилых и молодых людей в целом отражали различия, наблюдаемые в фармакокинетике саксаглиптина. Разница между фармакокинетикой саксаглиптина и активного метаболита у молодых и пожилых людей, вероятно, связана с множеством факторов, включая снижение функции почек и метаболических возможностей с возрастом. На основе популяционного фармакокинетического анализа, возраст не был идентифицирован как значимая ковариата кажущегося клиренса саксаглиптина и его активного метаболита.
RxList.com (2016 г.
ИМТ. Не рекомендуется корректировка дозы в зависимости от ИМТ, который не был идентифицирован как значимая ковариата кажущегося клиренса саксаглиптина или его активного метаболита на основе популяционного фармакокинетического анализа.
Пол. Корректировка дозы в зависимости от пола не требуется. Не обнаружено различий в фармакокинетике саксаглиптина между мужчинами и женщинами. Значения экспозиции активного метаболита приблизительно на 25% выше у женщин по сравнению с таковыми у мужчин, но эта разница вряд ли будет иметь клиническое значение. На основе популяционного фармакокинетического анализа, пол не был идентифицирован как значимая ковариата кажущегося клиренса саксаглиптина и его активного метаболита.
Раса и этническая принадлежность. Корректировка дозы в зависимости от расы не рекомендуется. По данным популяционного фармакокинетического анализа, при сравнении фармакокинетики саксаглиптина и его активного метаболита у 309 участников европеоидной расы и 105 испытуемых неевропеоидной расы (включавших шесть расовых групп) значимых различий в фармакокинетике саксаглиптина и его активного метаболита между этими двумя популяциями обнаружено не было.
|
|
Показания к применению
Сахарный диабет типа 2 в дополнение к диете и физическим упражнениям для улучшения гликемического контроля в качестве:
- монотерапии;
- стартовой комбинированной терапии с метформином;
- добавления к монотерапии метформином, тиазолидиндионами, производными сульфонилмочевины, инсулином (в тч в комбинации с метформином) при отсутствии адекватного гликемического контроля на данной терапии;
- добавления к комбинации метформина и производных сульфонилмочевины при отсутствии адекватного гликемического контроля на данной терапии.
- монотерапии;
- стартовой комбинированной терапии с метформином;
- добавления к монотерапии метформином, тиазолидиндионами, производными сульфонилмочевины, инсулином (в тч в комбинации с метформином) при отсутствии адекватного гликемического контроля на данной терапии;
- добавления к комбинации метформина и производных сульфонилмочевины при отсутствии адекватного гликемического контроля на данной терапии.
Противопоказания
Повышенная индивидуальная чувствительность. серьезные реакции повышенной чувствительности (анафилаксия или ангионевротический отек) к ингибиторам ДПП-4. сахарный диабет типа 1 (применение не изучено). диабетический кетоацидоз. беременность. лактация. возраст до 18 лет (безопасность и эффективность не изучены).
RxList.com (обновление 2021 г.
Серьезные реакции гиперчувствительности на саксаглиптин в анамнезе, такие как анафилаксия, ангионевротический отек или эксфолиативные поражения кожи ( см «Побочные действия» и «Меры предосторожности»).
RxList.com (обновление 2021 г.
Серьезные реакции гиперчувствительности на саксаглиптин в анамнезе, такие как анафилаксия, ангионевротический отек или эксфолиативные поражения кожи ( см «Побочные действия» и «Меры предосторожности»).
Ограничения к использованию
Почечная недостаточность умеренной и тяжелой степени; пожилые пациенты; совместное применение с производными сульфонилмочевины или инсулином; пациенты с панкреатитом в анамнезе (связь между приемом саксаглиптина и повышенным риском развития панкреатита не установлена).
При беременности и кормлении грудью
В связи с тем, что применение саксаглиптина в период беременности не изучено, не следует назначать его в период беременности.
Неизвестно, проникает ли саксаглиптин в грудное молоко. В связи с тем что не исключена возможность проникновения саксаглиптина в грудное молоко, следует прекратить грудное вскармливание на период лечения саксаглиптином или отменить терапию, учитывая соотношение риска для ребенка и пользы для матери.
RxList.com (2016 г.
Категория действия на плод по FDA - в.
Адекватные и строго контролируемые исследования применения саксаглиптина у беременных женщин не проводились. Применение при беременности возможно только в случае необходимости.
Саксаглиптин секретируется в молоко лактирующих крыс приблизительно в соотношении 1:1 с концентрацией его в плазме.
RxList.com (обновление 2021 г.
Применение при беременности.
Резюме рисков. Ограниченных данных о применении саксаглиптина у беременных женщин недостаточно для определения риска развития серьезных врожденных дефектов или выкидышей, связанных с его приемом.
Каких-либо неблагоприятных эффектов на развитие, независимых от материнской токсичности, не наблюдалось, когда саксаглиптин вводили беременным крысам и кроликам в период органогенеза, а также беременным и лактирующим крысам в пре- и постнатальный период. Предполагаемый фоновый риск серьезных врожденных дефектов составляет от 6 до 10% у женщин с прегестационным диабетом с 1cHbA1c более 7 и достигает 20-25% у женщин с 1cHbA1c более 10. Предполагаемый фоновый риск выкидыша у женщин с прегестационным диабетом неизвестен. В общей популяции в США оцениваемый фоновый уровень риска серьезных врожденных пороков развития и выкидыша при клинически установленной беременности составляет 2-4 и 15-20% соответственно.
Клинические соображения.
Связанный с заболеванием риск для матери и/или эмбриона/плода. Существуют риски для матери и плода, связанные с плохо контролируемым диабетом во время беременности. Плохо контролируемый сахарный диабет во время беременности увеличивает риск развития диабетического кетоацидоза, преэклампсии, самопроизвольных абортов, преждевременных родов, мертворождения и осложнений при родах у матери. Плохо контролируемый диабет увеличивает для плода риск серьезных врожденных дефектов, мертворождения и осложнений, связанных с макросомией.
Период лактации.
Резюме рисков. Нет данных о присутствии саксаглиптина в грудном молоке женщин, его влиянии на грудного ребенка или влиянии на выработку молока.
Следует учитывать преимущества грудного вскармливания для развития и здоровья, а также клиническую необходимость применения матерью саксаглиптина и возможность неблагоприятные последствий для грудного ребенка или состояния матери.
Неизвестно, проникает ли саксаглиптин в грудное молоко. В связи с тем что не исключена возможность проникновения саксаглиптина в грудное молоко, следует прекратить грудное вскармливание на период лечения саксаглиптином или отменить терапию, учитывая соотношение риска для ребенка и пользы для матери.
RxList.com (2016 г.
Категория действия на плод по FDA - в.
Адекватные и строго контролируемые исследования применения саксаглиптина у беременных женщин не проводились. Применение при беременности возможно только в случае необходимости.
Саксаглиптин секретируется в молоко лактирующих крыс приблизительно в соотношении 1:1 с концентрацией его в плазме.
RxList.com (обновление 2021 г.
Применение при беременности.
Резюме рисков. Ограниченных данных о применении саксаглиптина у беременных женщин недостаточно для определения риска развития серьезных врожденных дефектов или выкидышей, связанных с его приемом.
Каких-либо неблагоприятных эффектов на развитие, независимых от материнской токсичности, не наблюдалось, когда саксаглиптин вводили беременным крысам и кроликам в период органогенеза, а также беременным и лактирующим крысам в пре- и постнатальный период. Предполагаемый фоновый риск серьезных врожденных дефектов составляет от 6 до 10% у женщин с прегестационным диабетом с 1cHbA1c более 7 и достигает 20-25% у женщин с 1cHbA1c более 10. Предполагаемый фоновый риск выкидыша у женщин с прегестационным диабетом неизвестен. В общей популяции в США оцениваемый фоновый уровень риска серьезных врожденных пороков развития и выкидыша при клинически установленной беременности составляет 2-4 и 15-20% соответственно.
Клинические соображения.
Связанный с заболеванием риск для матери и/или эмбриона/плода. Существуют риски для матери и плода, связанные с плохо контролируемым диабетом во время беременности. Плохо контролируемый сахарный диабет во время беременности увеличивает риск развития диабетического кетоацидоза, преэклампсии, самопроизвольных абортов, преждевременных родов, мертворождения и осложнений при родах у матери. Плохо контролируемый диабет увеличивает для плода риск серьезных врожденных дефектов, мертворождения и осложнений, связанных с макросомией.
Период лактации.
Резюме рисков. Нет данных о присутствии саксаглиптина в грудном молоке женщин, его влиянии на грудного ребенка или влиянии на выработку молока.
Следует учитывать преимущества грудного вскармливания для развития и здоровья, а также клиническую необходимость применения матерью саксаглиптина и возможность неблагоприятные последствий для грудного ребенка или состояния матери.
Побочные эффекты
Побочные эффекты саксаглиптина в исследованиях контроля гликемии.
Приведены побочные эффекты, выявленные у пациентов с СД2 при приеме саксаглиптина в дозе 5 мг, по данным объединенного анализа 5 плацебо-контролируемых клинических исследований. Общая частота нежелательных явлений при приеме саксаглиптина в дозе 5 мг в режиме монотерапии и в режиме добавления к терапии метформином. тиазолидиндионом или глибенкламидом была сопоставима с таковой в группе плацебо.
Шкала частоты побочных реакций: очень часто (≥1/10). часто (≥1/100. <1/10). нечасто (≥1/1000. <1/100). редко (≥1/10000. <1/1000). очень редко (<1/10000).
Инфекции и инвазии. Часто - инфекции верхних дыхательных путей, инфекции мочевыводящих путей, гастроэнтерит, синусит.
Со стороны ЖКТ. Часто - рвота.
Со стороны нервной системы. Часто - головная боль.
Частота реакций гиперчувствительности. отмеченных к 24-й неделе терапии. составила 1,5% у пациентов. получавших саксаглиптин 5 мг. и 0,4% у пациентов. получавших плацебо. Реакции гиперчувствительности, возникшие у пациентов, принимавших саксаглиптин, не требовали госпитализации и были расценены лечащими врачами как не представлявшие угрозу жизни.
Побочные эффекты саксаглиптина при комбинированной терапии в исследованиях контроля гликемии.
В исследовании по комбинированному применению саксаглиптина и глибенкламида частота подтвержденных эпизодов гипогликемии составила 0,8% в группе саксаглиптина 5 мг и 0,7% в группе плацебо. Частота подтвержденных эпизодов гипогликемии у пациентов. получавших саксаглиптин 5 мг в ходе двух исследований саксаглиптина в режиме монотерапии. исследовании по комбинированной терапии саксаглиптином и метформином. а также в исследовании по комбинированному применению саксаглиптина и тиазолидиндионов. была сопоставима с таковой на фоне плацебо.
В исследовании по применению комбинации саксаглиптина и инсулина общая частота развития гипогликемии составила 18,4% в группе саксаглиптина 5 мг и 19,9% в группе плацебо. при этом частота подтвержденных эпизодов гипогликемии. сопровождаемых симптомами. составила 5,3 и 3,3% соответственно.
В исследовании по применению саксаглиптина в комбинации с метформином и производными сульфонилмочевины общая частота развития гипогликемии составила 10,1% у пациентов. получавших саксаглиптин 5 мг. и 6,3% у пациентов. получавших плацебо. частота подтвержденных случаев гипогликемии составила 1,6 и 0% соответственно.
В исследовании по применению саксаглиптина совместно с тиазолидиндионами частота периферических отеков была выше в группе саксаглиптина 5 мг по сравнению с группой плацебо (8,1 и 4,3% соответственно). Периферические отеки были слабо или умеренно выраженными и не приводили к прекращению лечения. Частота периферических отеков у пациентов. принимавших саксаглиптин в дозе 5 мг в ходе клинических исследований монотерапии саксаглиптином и комбинированной терапии с метформином или глибенкламидом. была сопоставима с таковой на фоне плацебо (1,7 и 2,4% соответственно).
При стартовой комбинированной терапии саксаглиптином в дозе 5 мг и метформином часто отмечались случаи назофарингита и головной боли. Частота назофарингита была выше на фоне комбинированной терапии (6,9%) по сравнению с монотерапией саксаглиптином 10 мг (4,2%) и метформином (4%). Головная боль отмечалась чаще в группе пациентов на комбинированной терапии метформином и саксаглиптином 5 мг (7,5%) по сравнению с группами монотерапии саксаглиптином 10 мг (6,3%) и метформином (5,2%).
Побочные эффекты саксаглиптина в исследовании SAVOR.
В исследовании SAVOR 8240 пациентов получали саксаглиптин в дозе 2,5 или 5 мг один раз в сутки, а 8173 пациента получали плацебо. Средняя длительность терапии саксаглиптином независимо от перерывов в лечении составила 1,8 года. У 3698 пациентов (45%) длительность терапии саксаглиптином составила 2-3 года.
Общая частота нежелательных явлений в этом исследовании в группе пациентов, принимавших саксаглиптин (72,5%), была сопоставима с частотой нежелательных явлений в группе плацебо (72,2%). Частота отмены терапии из-за нежелательных явлений была сопоставима у пациентов, принимавших саксаглиптин (4,9%) и плацебо (5%).
В исследовании SAVOR оценивалось влияние саксаглиптина на частоту сердечно-сосудистых осложнений. Было показано. что добавление саксаглиптина к терапии не увеличивает риск сердечно-сосудистых осложнений (таких как сердечно-сосудистая смертность. нефатальный инфаркт миокарда. нефатальный ишемический инсульт) у пациентов с СД2 по сравнению с плацебо (ОР: 1,00. 95% ДИ: 0,89. 1,12. Р<0,001 для гипотезы сопоставимости саксаглиптина и плацебо).
Частота панкреатита, подтвержденного в соответствии с протоколом исследования, составила 0,3% в группах саксаглиптина и плацебо в популяции всех рандомизированных пациентов. Частота реакций гиперчувствительности составила 1,1% в группах саксаглиптина и плацебо.
Гипогликемия.
Общая частота случаев гипогликемии (отмеченных в дневниках пациентов) в исследовании SAVOR составила 17,1% в группе саксаглиптина и 14,8% в группе плацебо.
Доля пациентов, у которых на фоне терапии возникла тяжелая гипогликемия (гипогликемия, потребовавшая помощи третьих лиц), была выше в группе саксаглиптина по сравнению с группой плацебо (2,1 и 1,6% соответственно).
Повышенный риск гипогликемии в целом. а также тяжелой гипогликемии в группе саксаглиптина главным образом отмечен у пациентов. получавших препараты сульфонилмочевины. но не у пациентов. получавших инсулин или метформин в качестве базовой терапии.
Повышенный риск гипогликемии в целом, а также тяжелой гипогликемии главным образом отмечен у пациентов с исходным значением 1cHbA1c <7%.
Постмаркетинговое применение.
В ходе постмаркетингового применения саксаглиптина зарегистрированы следующие побочные эффекты: острый панкреатит и реакции гиперчувствительности, включая анафилаксию, ангионевротический отек, сыпь и крапивницу. Достоверно оценить частоту развития данных явлений невозможно, поскольку сообщения получены спонтанно, от популяции неустановленного размера ( см «Противопоказания», «Меры предосторожности»).
Лабораторные исследования.
В клинических исследованиях частота изменений лабораторных показателей при приеме саксаглиптина в дозе 5 мг и плацебо была сопоставимой. Отмечалось небольшое снижение числа лимфоцитов, при этом среднее абсолютное число лимфоцитов оставалось стабильным и в пределах нормальных значений при ежедневном приеме саксаглиптина продолжительностью до 102 нед. Уменьшение количества лимфоцитов не сопровождалось клинически значимыми нежелательными реакциями. Клиническое значение уменьшения числа лимфоцитов на фоне терапии саксаглиптином неизвестно.
В исследовании SAVOR снижение количества лимфоцитов в группе саксаглиптина отмечено у 0,5% пациентов, в группе плацебо - у 0,4% пациентов.
RxList.com (обновление 2021 г.
Следующие серьезные побочные реакции описаны далее:
- панкреатит ( см «Меры предосторожности»);
- сердечная недостаточность ( см «Меры предосторожности»);
- гипогликемия при одновременном применении сульфонилмочевины или инсулина ( см «Меры предосторожности»);
- реакции гиперчувствительности ( см «Меры предосторожности»);
- тяжелая артралгия, приводящая к инвалидности ( см «Меры предосторожности»);
- буллезный пемфигоид ( см «Меры предосторожности»).
RxList.com (2016 г.
Опыт клинических исследований.
Поскольку клинические исследования проводятся с различным набором условий. частота встречаемости побочных реакций. наблюдаемых в этих исследованиях. не может непосредственно сравниваться с частотой в других клинических испытаниях. и невозможно прогнозировать возникновение побочных эффектов в клинической практике.
Побочные реакции в ходе испытаний эффективности.
Приведены объединенные данные 5 плацебо-контролируемых клинических испытаний. Эти данные отражают экспозицию саксаглиптина у 882 пациентов при средней продолжительности лечения саксаглиптином 21 нед. Средний возраст пациентов составил 55 лет, 1,4% были 75 лет и старше, 48,4% составляли мужчины. В популяции было 67,5% представителей европеоидной расы, 4,6% - негроидной, 17,4% - азиатской, представителей других рас - 10,5 и 9,8% были латиноамериканцами. Исходно у участников исследований был диабет, протекавший в среднем 5,2 года, и средний уровень 1cHbA1c составлял 8,2%. В начале исследований функция почек оценивалась как нормальная или с умеренно выраженной недостаточностью (СКФ ≥60 мл/мин/1,73 м2) у 91% этих пациентов.
Далее представлены наиболее общие неблагоприятные реакции, за исключением гипогликемии, отмеченные в ходе 5 плацебо-контролируемых клинических испытаний* и связанные с саксаглиптином. Эти побочные реакции происходили чаще при приеме пациентами саксаглиптина в дозе 5 мг (n=882), чем в группе плацебо (n=799), и отмечались у ≥5% пациентов, получавших саксаглиптин.
Рядом с названием указано количество больных (в процентах), у которых был зафиксирован данный побочный эффект, в скобках - частота эффекта в группе плацебо.
Инфекции верхних дыхательных путей: 7,7% (7,6%).
Инфекции мочевыводящих путей: 6,8% (6,1%).
Головная боль: 6,5% (5,9%).
* 5 плацебо-контролируемых 24-недельных испытаний включают 2 исследования монотерапии и испытания комбинированной терапии: одно - с метформином, одно - с тиазолидиндионом и одно - с глибенкламидом.
У пациентов. получавших саксаглиптин в дозе 2,5 мг. головная боль (6,5%) была единственной неблагоприятной реакцией. которая отмечалась с частотой ≥5% и чаще. чем у пациентов. получавших плацебо.
Частота периферических отеков при приеме саксаглиптина в дозе 2,5 мг составляла 3,1%. Не было сообщений о прекращении терапии саксаглитином в связи с развитием неблагоприятных реакций в виде периферических отеков. Частота периферических отеков при приеме саксаглиптина в дозе 2,5 и 5 мг в сравнении с плацебо составила 3,6 и 2% по сравнению с 3% при монотерапии и 2,1 и 2,1% против 2,2% при добавлении к терапии метформином. и 2,4 и 1,2% по сравнению с 2,2% при дополнении к терапии глибенкламидом.
Частота развития переломов составила 1 и 0,6 на 100 пациенто-лет соответственно при приеме саксаглиптина (объединенный анализ доз 2,5; 5 и 10 мг) и плацебо. Доза саксаглиптина 10 мг не является утвержденной дозировкой. Частота переломов у пациентов, принимавших саксаглиптин, не увеличивалась со временем. Не установлена причинная связь, и доклинические исследования не показали нежелательное влияние саксаглиптина на костную ткань.
В ходе клинической программы наблюдалось развитие тромбоцитопении, соответствующей диагнозу идиопатическая тромбоцитопеническая пурпура. Связь развития этого явления с приемом саксаглиптина неизвестна.
Прекращение терапии из-за неблагоприятных эффектов было отмечено у 2,2; 3,3 и 1,8% пациентов, получавших саксаглиптин в дозе 2,5; 5 мг и плацебо соответственно. Наиболее частые побочные эффекты (отмечены по крайней мере у 2 пациентов. получавших саксаглиптин в дозе 2,5 или 5 мг). ассоциированные с преждевременным прекращением терапии. включали лимфопению (0,1 и 0,5 против 0% соответственно). сыпь (0,2 и 0,3 по сравнению с 0,3%). повышение креатинина в крови (0,3 и 0 против 0%) и КФК крови (0,1 и 0,2 против 0%).
Побочные реакции при сопутствующем применении инсулина.
В испытаниях при дополнении к инсулину частота побочных эффектов. в тч серьезных. и случаев прекращения лечения из-за побочных эффектов была сходной для саксаглиптина и плацебо. за исключением подтвержденной гипогликемии.
Гипогликемия.
Сведения о гипогликемии как побочном явлении были основаны на всех сообщениях о развитии гипогликемии. Одновременное измерение уровня глюкозы не было необходимым, или уровень был нормальным у некоторых пациентов. Таким образом, не представляется возможным окончательно определить, отражают ли эти отчеты истинную гипогликемию.
В исследовании при комбинированной терапии саксаглиптином с глибенкламидом общая частота отмеченной гипогликемии была выше на фоне саксаглиптина 2,5 и 5 мг (13,3 и 14,6%) по сравнению с плацебо (10,1%). Частота подтвержденной гипогликемии в данном исследовании. определяемая как симптомы гипогликемии. сопровождающиеся уровнем глюкозы в крови из пальца ≤50 мг/дл. составляла 2,4 и 0,8% при приеме саксаглиптина в дозе 2,5 и 5 мг и 0,7% в группе плацебо. Частота зарегистрированных случаев гипогликемии на фоне саксаглиптина 2,5 и 5 мг в сравнении с плацебо составила 4 и 5,6% против 4,1% соответственно. 7,8 и 5,8% по сравнению с 5% при дополнении к терапии метформином. 4,1 и 2,7% против 3,8% при дополнении к терапии тиазолидиндионом. Частота зарегистрированной гипогликемии составила 3,4% у пациентов при приеме саксаглиптина в дозе 5 мг плюс метформин и 4% у пациентов, получавших только метформин.
В актив-контролируемом сравнительном исследовании комбинированной терапии саксаглиптином в дозе 5 мг с глипизидом при отсутствии адекватного гликемического контроля у пациентов на терапии только метформином частота зарегистрированных случаев гипогликемии составила 3% (19 случаев у 13 пациентов) при приеме саксаглиптина 5 мг по сравнению с 36,3% (750 случаев у 156 пациентов) при приеме глипизида. Подтвержденная симптоматическая гипогликемия (сопровождается уровнем глюкозы в крови из пальца ≤50 мг/дл) не была зарегистрирована ни у одного из пациентов. получавших лечение саксаглиптином. и была отмечена у 35 пациентов. получавших глипизид (8,1%) (р <0,0001).
В испытании при комбинированном лечении с инсулином общая частота гипогликемии составила 18,4% для саксаглиптинa 5 мг и 19,9% для плацебо. Однако частота подтвержденной симптоматической гипогликемии (сопровождается уровнем глюкозы в крови из пальца ≤50 мг/дл) была выше при приеме саксаглиптина 5 мг (5,3%) по сравнению с плацебо (3,3%).
В испытании с дополнением к метформину плюс производное сульфонилмочевины общая частота гипогликемии составила 10,1% для саксаглиптина 5 мг и 6,3% для плацебо. Подтвержденная гипогликемия была зарегистрирована у 1,6% пациентов, получавших саксаглиптин, и ни у одного из пациентов, получавших плацебо.
Реакции гиперчувствительности.
По объединенным данным 5 плацебо-контролируемых 24-недельных клинических испытаний. связанные с гиперчувствительностью реакции. такие как крапивница и отек лица. были зарегистрированы у 1,5. 1,5 и 0,4% пациентов. получавших саксаглиптин в дозе 2,5 и 5 мг и плацебо соответственно. Ни один из этих случаев у пациентов, получавших саксаглиптин, не потребовал госпитализации или не был расценен врачами как жизнеугрожающий. Один пациент прекратил лечение в связи с развитием генерализованной крапивницы и отека лица.
Почечная недостаточность.
В испытании SAVOR побочные реакции. связанные с нарушением функции почек. в тч лабораторные изменения ( удвоение креатинина сыворотки по сравнению с исходным уровнем и креатинин сыворотки >6 мг/дл). были зарегистрированы у 5,8% (483/8280) пациентов. принимавших саксаглиптин. и 5,1% (422/8212) пациентов. получавших плацебо. Наиболее часто сообщалось о побочных реакциях. включающих нарушение функции почек (2,1 против 1,9%). острую почечную недостаточность (1,4 против 1,2%) и почечную недостаточность (0,8 против 0,9%). при сравнении групп саксаглиптина с группами плацебо соответственно. От исходного уровня до конца лечения среднее снижение СКФ составило 2,5 мл/мин/1,73 м2 для пациентов, находившихся на лечении саксаглиптином, и 2,4 мл/мин/1,73 м2 для пациентов, принимавших плацебо. У большего числа участников. рандомизированных в группу саксаглиптина (421/5227. 8,1%) в сравнении с участниками. рандомизированными в группу плацебо (344/5073. 6,8%) СКФ изменялась от >50 мл/мин ( нормальная функция почек или легкая степень почечной недостаточности) до ≤50 мл/мин ( умеренная или тяжелая почечная недостаточность). Соотношение пациентов с побочными реакциями со стороны почек увеличивалось в зависимости от степени исходного нарушения функции почек и с увеличением возраста, независимо от проводимого лечения.
Инфекции.
В открытой контролируемой базе данных клинического испытания саксаглиптина на сегодняшний день имеется 6 (0,12%) отчетов о развитии туберкулеза у 4959 пациентов. получавших лечение саксаглиптином (1,1 случая на 1000 пациенто-лет) по сравнению с отсутствием отчетов о случаях туберкулеза у 2868 пациентов. получавших препараты сравнения. Два из этих шести случаев были подтверждены лабораторным тестированием. В остальных случаях имелась ограниченная информация или предполагаемые диагнозы туберкулеза. Все случаи зафиксированы за пределами США и Западной Европы. Один случай произошел в Канаде у пациента родом из Индонезии, который недавно посещал Индонезию. Продолжительность лечения саксаглиптином до сообщения о туберкулезе колебалась от 144 до 929 дней. Количество лимфоцитов после лечения находилось в пределах референсного интервала в четырех случаях. У одного пациента была лимфопения до начала приема саксаглиптина, которая оставалась стабильной на протяжении всего лечения саксаглиптином. Еще у одного пациента имелось снижение количества лимфоцитов ниже нормы примерно за четыре месяца до сообщения о туберкулезе. Не было спонтанных сообщений о туберкулезе, связанных с использованием саксаглиптина. Причинность не была оценена, и на сегодняшний день слишком мало случаев, чтобы определить, является ли туберкулез связанным с использованием саксаглиптина.
В открытой контролируемой базе данных клинического испытания саксаглиптина имеется один случай потенциальной оппортунистической инфекции у пациента. принимавшего саксаглиптин. у которого развился сальмонеллезный сепсис предположительно пищевого происхождения с фатальным исходом после примерно 600 дней терапии саксаглиптином. Не было никаких спонтанных сообщений о развитии оппортунистических инфекций, связанных с использованием саксаглиптина.
Жизненно важные признаки.
Не отмечалось изменений жизненно важных признаков у пациентов, получавших саксаглиптин.
Лабораторные тесты.
Абсолютное количество лимфоцитов.
Согласно объединенным данным пяти плацебо-контролируемых клинических исследований, при приеме саксаглиптина наблюдалось дозозависимое снижение абсолютного количества лимфоцитов. От исходного среднего значения абсолютного количества лимфоцитов около 2200 клеток/мкл среднее снижение через 24 нед составило приблизительно 100 и 120 клеток/мкл при приеме саксаглиптина в дозе 5 и 10 мг соответственно по сравнению с плацебо. Сходные эффекты были отмечены при приеме саксаглиптина в дозе 5 мг в комбинации с метформином по сравнению с одним метформином. Не наблюдалось различия при приеме саксаглиптина 2,5 мг по сравнению с плацебо. Доля пациентов. у которых было зарегистрировано количество лимфоцитов ≤750 клеток/мкл. составила 0,5. 1,5. 1,4 и 0,4% при приеме саксаглиптина в дозе 2,5. 5. 10 мг и плацебо соответственно. У большинства пациентов при повторной экспозиции саксаглиптина рецидива не наблюдалось, хотя у некоторых пациентов отмечалось рекуррентное снижение, что привело к прекращению лечения саксаглиптином. Снижение количества лимфоцитов не было связано с клинически существенными побочными реакциями. Доза 10 мг не является утвержденной дозировкой.
В испытании SAVOR наблюдалось снижение этого показателя примерно на 84 клетки/мкл на фоне саксаглиптина по сравнению с плацебо. Доля пациентов, у которых было зафиксировано снижение количества лимфоцитов до ≤750 клеток/мкл, составила 1,6% (136/8280) и 1% (78/8212) при приеме саксаглиптина и плацебо соответственно.
Клиническая значимость снижения количества лимфоцитов по сравнению с плацебо неизвестна. При наличии клинических показаний, например необычные или продолжительные инфекции, количество лимфоцитов следует измерять. Эффект саксаглиптина на количество лимфоцитов у больных с изменениями количества лимфоцитов (например ВИЧ-инфекция) неизвестен.
Постмаркетинговый опыт.
Дополнительные побочные реакции были выявлены в ходе применения саксаглиптина в постмаркетинговый период. Поскольку сообщения об этих реакциях поступают добровольно от популяции неопределенного размера. как правило. не представляется возможным достоверно оценить их частоту или установить причинно-следственную связь с воздействием ЛС.
- Реакции гиперчувствительности, включая анафилаксию, ангиоэдему и эксфолиативные кожные заболевания ( см «Противопоказания» и «Меры предосторожности»);
- острый панкреатит ( см «Меры предосторожности»);
- тяжелая и инвалидизирующая артралгия ( см «Меры предосторожности).
RxList.com (обновление 2021 г.
- Буллезный пемфигоид;
- рабдомиолиз.
Приведены побочные эффекты, выявленные у пациентов с СД2 при приеме саксаглиптина в дозе 5 мг, по данным объединенного анализа 5 плацебо-контролируемых клинических исследований. Общая частота нежелательных явлений при приеме саксаглиптина в дозе 5 мг в режиме монотерапии и в режиме добавления к терапии метформином. тиазолидиндионом или глибенкламидом была сопоставима с таковой в группе плацебо.
Шкала частоты побочных реакций: очень часто (≥1/10). часто (≥1/100. <1/10). нечасто (≥1/1000. <1/100). редко (≥1/10000. <1/1000). очень редко (<1/10000).
Инфекции и инвазии. Часто - инфекции верхних дыхательных путей, инфекции мочевыводящих путей, гастроэнтерит, синусит.
Со стороны ЖКТ. Часто - рвота.
Со стороны нервной системы. Часто - головная боль.
Частота реакций гиперчувствительности. отмеченных к 24-й неделе терапии. составила 1,5% у пациентов. получавших саксаглиптин 5 мг. и 0,4% у пациентов. получавших плацебо. Реакции гиперчувствительности, возникшие у пациентов, принимавших саксаглиптин, не требовали госпитализации и были расценены лечащими врачами как не представлявшие угрозу жизни.
Побочные эффекты саксаглиптина при комбинированной терапии в исследованиях контроля гликемии.
В исследовании по комбинированному применению саксаглиптина и глибенкламида частота подтвержденных эпизодов гипогликемии составила 0,8% в группе саксаглиптина 5 мг и 0,7% в группе плацебо. Частота подтвержденных эпизодов гипогликемии у пациентов. получавших саксаглиптин 5 мг в ходе двух исследований саксаглиптина в режиме монотерапии. исследовании по комбинированной терапии саксаглиптином и метформином. а также в исследовании по комбинированному применению саксаглиптина и тиазолидиндионов. была сопоставима с таковой на фоне плацебо.
В исследовании по применению комбинации саксаглиптина и инсулина общая частота развития гипогликемии составила 18,4% в группе саксаглиптина 5 мг и 19,9% в группе плацебо. при этом частота подтвержденных эпизодов гипогликемии. сопровождаемых симптомами. составила 5,3 и 3,3% соответственно.
В исследовании по применению саксаглиптина в комбинации с метформином и производными сульфонилмочевины общая частота развития гипогликемии составила 10,1% у пациентов. получавших саксаглиптин 5 мг. и 6,3% у пациентов. получавших плацебо. частота подтвержденных случаев гипогликемии составила 1,6 и 0% соответственно.
В исследовании по применению саксаглиптина совместно с тиазолидиндионами частота периферических отеков была выше в группе саксаглиптина 5 мг по сравнению с группой плацебо (8,1 и 4,3% соответственно). Периферические отеки были слабо или умеренно выраженными и не приводили к прекращению лечения. Частота периферических отеков у пациентов. принимавших саксаглиптин в дозе 5 мг в ходе клинических исследований монотерапии саксаглиптином и комбинированной терапии с метформином или глибенкламидом. была сопоставима с таковой на фоне плацебо (1,7 и 2,4% соответственно).
При стартовой комбинированной терапии саксаглиптином в дозе 5 мг и метформином часто отмечались случаи назофарингита и головной боли. Частота назофарингита была выше на фоне комбинированной терапии (6,9%) по сравнению с монотерапией саксаглиптином 10 мг (4,2%) и метформином (4%). Головная боль отмечалась чаще в группе пациентов на комбинированной терапии метформином и саксаглиптином 5 мг (7,5%) по сравнению с группами монотерапии саксаглиптином 10 мг (6,3%) и метформином (5,2%).
Побочные эффекты саксаглиптина в исследовании SAVOR.
В исследовании SAVOR 8240 пациентов получали саксаглиптин в дозе 2,5 или 5 мг один раз в сутки, а 8173 пациента получали плацебо. Средняя длительность терапии саксаглиптином независимо от перерывов в лечении составила 1,8 года. У 3698 пациентов (45%) длительность терапии саксаглиптином составила 2-3 года.
Общая частота нежелательных явлений в этом исследовании в группе пациентов, принимавших саксаглиптин (72,5%), была сопоставима с частотой нежелательных явлений в группе плацебо (72,2%). Частота отмены терапии из-за нежелательных явлений была сопоставима у пациентов, принимавших саксаглиптин (4,9%) и плацебо (5%).
В исследовании SAVOR оценивалось влияние саксаглиптина на частоту сердечно-сосудистых осложнений. Было показано. что добавление саксаглиптина к терапии не увеличивает риск сердечно-сосудистых осложнений (таких как сердечно-сосудистая смертность. нефатальный инфаркт миокарда. нефатальный ишемический инсульт) у пациентов с СД2 по сравнению с плацебо (ОР: 1,00. 95% ДИ: 0,89. 1,12. Р<0,001 для гипотезы сопоставимости саксаглиптина и плацебо).
Частота панкреатита, подтвержденного в соответствии с протоколом исследования, составила 0,3% в группах саксаглиптина и плацебо в популяции всех рандомизированных пациентов. Частота реакций гиперчувствительности составила 1,1% в группах саксаглиптина и плацебо.
Гипогликемия.
Общая частота случаев гипогликемии (отмеченных в дневниках пациентов) в исследовании SAVOR составила 17,1% в группе саксаглиптина и 14,8% в группе плацебо.
Доля пациентов, у которых на фоне терапии возникла тяжелая гипогликемия (гипогликемия, потребовавшая помощи третьих лиц), была выше в группе саксаглиптина по сравнению с группой плацебо (2,1 и 1,6% соответственно).
Повышенный риск гипогликемии в целом. а также тяжелой гипогликемии в группе саксаглиптина главным образом отмечен у пациентов. получавших препараты сульфонилмочевины. но не у пациентов. получавших инсулин или метформин в качестве базовой терапии.
Повышенный риск гипогликемии в целом, а также тяжелой гипогликемии главным образом отмечен у пациентов с исходным значением 1cHbA1c <7%.
Постмаркетинговое применение.
В ходе постмаркетингового применения саксаглиптина зарегистрированы следующие побочные эффекты: острый панкреатит и реакции гиперчувствительности, включая анафилаксию, ангионевротический отек, сыпь и крапивницу. Достоверно оценить частоту развития данных явлений невозможно, поскольку сообщения получены спонтанно, от популяции неустановленного размера ( см «Противопоказания», «Меры предосторожности»).
Лабораторные исследования.
В клинических исследованиях частота изменений лабораторных показателей при приеме саксаглиптина в дозе 5 мг и плацебо была сопоставимой. Отмечалось небольшое снижение числа лимфоцитов, при этом среднее абсолютное число лимфоцитов оставалось стабильным и в пределах нормальных значений при ежедневном приеме саксаглиптина продолжительностью до 102 нед. Уменьшение количества лимфоцитов не сопровождалось клинически значимыми нежелательными реакциями. Клиническое значение уменьшения числа лимфоцитов на фоне терапии саксаглиптином неизвестно.
В исследовании SAVOR снижение количества лимфоцитов в группе саксаглиптина отмечено у 0,5% пациентов, в группе плацебо - у 0,4% пациентов.
RxList.com (обновление 2021 г.
Следующие серьезные побочные реакции описаны далее:
- панкреатит ( см «Меры предосторожности»);
- сердечная недостаточность ( см «Меры предосторожности»);
- гипогликемия при одновременном применении сульфонилмочевины или инсулина ( см «Меры предосторожности»);
- реакции гиперчувствительности ( см «Меры предосторожности»);
- тяжелая артралгия, приводящая к инвалидности ( см «Меры предосторожности»);
- буллезный пемфигоид ( см «Меры предосторожности»).
RxList.com (2016 г.
Опыт клинических исследований.
Поскольку клинические исследования проводятся с различным набором условий. частота встречаемости побочных реакций. наблюдаемых в этих исследованиях. не может непосредственно сравниваться с частотой в других клинических испытаниях. и невозможно прогнозировать возникновение побочных эффектов в клинической практике.
Побочные реакции в ходе испытаний эффективности.
Приведены объединенные данные 5 плацебо-контролируемых клинических испытаний. Эти данные отражают экспозицию саксаглиптина у 882 пациентов при средней продолжительности лечения саксаглиптином 21 нед. Средний возраст пациентов составил 55 лет, 1,4% были 75 лет и старше, 48,4% составляли мужчины. В популяции было 67,5% представителей европеоидной расы, 4,6% - негроидной, 17,4% - азиатской, представителей других рас - 10,5 и 9,8% были латиноамериканцами. Исходно у участников исследований был диабет, протекавший в среднем 5,2 года, и средний уровень 1cHbA1c составлял 8,2%. В начале исследований функция почек оценивалась как нормальная или с умеренно выраженной недостаточностью (СКФ ≥60 мл/мин/1,73 м2) у 91% этих пациентов.
Далее представлены наиболее общие неблагоприятные реакции, за исключением гипогликемии, отмеченные в ходе 5 плацебо-контролируемых клинических испытаний* и связанные с саксаглиптином. Эти побочные реакции происходили чаще при приеме пациентами саксаглиптина в дозе 5 мг (n=882), чем в группе плацебо (n=799), и отмечались у ≥5% пациентов, получавших саксаглиптин.
Рядом с названием указано количество больных (в процентах), у которых был зафиксирован данный побочный эффект, в скобках - частота эффекта в группе плацебо.
Инфекции верхних дыхательных путей: 7,7% (7,6%).
Инфекции мочевыводящих путей: 6,8% (6,1%).
Головная боль: 6,5% (5,9%).
* 5 плацебо-контролируемых 24-недельных испытаний включают 2 исследования монотерапии и испытания комбинированной терапии: одно - с метформином, одно - с тиазолидиндионом и одно - с глибенкламидом.
У пациентов. получавших саксаглиптин в дозе 2,5 мг. головная боль (6,5%) была единственной неблагоприятной реакцией. которая отмечалась с частотой ≥5% и чаще. чем у пациентов. получавших плацебо.
Частота периферических отеков при приеме саксаглиптина в дозе 2,5 мг составляла 3,1%. Не было сообщений о прекращении терапии саксаглитином в связи с развитием неблагоприятных реакций в виде периферических отеков. Частота периферических отеков при приеме саксаглиптина в дозе 2,5 и 5 мг в сравнении с плацебо составила 3,6 и 2% по сравнению с 3% при монотерапии и 2,1 и 2,1% против 2,2% при добавлении к терапии метформином. и 2,4 и 1,2% по сравнению с 2,2% при дополнении к терапии глибенкламидом.
Частота развития переломов составила 1 и 0,6 на 100 пациенто-лет соответственно при приеме саксаглиптина (объединенный анализ доз 2,5; 5 и 10 мг) и плацебо. Доза саксаглиптина 10 мг не является утвержденной дозировкой. Частота переломов у пациентов, принимавших саксаглиптин, не увеличивалась со временем. Не установлена причинная связь, и доклинические исследования не показали нежелательное влияние саксаглиптина на костную ткань.
В ходе клинической программы наблюдалось развитие тромбоцитопении, соответствующей диагнозу идиопатическая тромбоцитопеническая пурпура. Связь развития этого явления с приемом саксаглиптина неизвестна.
Прекращение терапии из-за неблагоприятных эффектов было отмечено у 2,2; 3,3 и 1,8% пациентов, получавших саксаглиптин в дозе 2,5; 5 мг и плацебо соответственно. Наиболее частые побочные эффекты (отмечены по крайней мере у 2 пациентов. получавших саксаглиптин в дозе 2,5 или 5 мг). ассоциированные с преждевременным прекращением терапии. включали лимфопению (0,1 и 0,5 против 0% соответственно). сыпь (0,2 и 0,3 по сравнению с 0,3%). повышение креатинина в крови (0,3 и 0 против 0%) и КФК крови (0,1 и 0,2 против 0%).
Побочные реакции при сопутствующем применении инсулина.
В испытаниях при дополнении к инсулину частота побочных эффектов. в тч серьезных. и случаев прекращения лечения из-за побочных эффектов была сходной для саксаглиптина и плацебо. за исключением подтвержденной гипогликемии.
Гипогликемия.
Сведения о гипогликемии как побочном явлении были основаны на всех сообщениях о развитии гипогликемии. Одновременное измерение уровня глюкозы не было необходимым, или уровень был нормальным у некоторых пациентов. Таким образом, не представляется возможным окончательно определить, отражают ли эти отчеты истинную гипогликемию.
В исследовании при комбинированной терапии саксаглиптином с глибенкламидом общая частота отмеченной гипогликемии была выше на фоне саксаглиптина 2,5 и 5 мг (13,3 и 14,6%) по сравнению с плацебо (10,1%). Частота подтвержденной гипогликемии в данном исследовании. определяемая как симптомы гипогликемии. сопровождающиеся уровнем глюкозы в крови из пальца ≤50 мг/дл. составляла 2,4 и 0,8% при приеме саксаглиптина в дозе 2,5 и 5 мг и 0,7% в группе плацебо. Частота зарегистрированных случаев гипогликемии на фоне саксаглиптина 2,5 и 5 мг в сравнении с плацебо составила 4 и 5,6% против 4,1% соответственно. 7,8 и 5,8% по сравнению с 5% при дополнении к терапии метформином. 4,1 и 2,7% против 3,8% при дополнении к терапии тиазолидиндионом. Частота зарегистрированной гипогликемии составила 3,4% у пациентов при приеме саксаглиптина в дозе 5 мг плюс метформин и 4% у пациентов, получавших только метформин.
В актив-контролируемом сравнительном исследовании комбинированной терапии саксаглиптином в дозе 5 мг с глипизидом при отсутствии адекватного гликемического контроля у пациентов на терапии только метформином частота зарегистрированных случаев гипогликемии составила 3% (19 случаев у 13 пациентов) при приеме саксаглиптина 5 мг по сравнению с 36,3% (750 случаев у 156 пациентов) при приеме глипизида. Подтвержденная симптоматическая гипогликемия (сопровождается уровнем глюкозы в крови из пальца ≤50 мг/дл) не была зарегистрирована ни у одного из пациентов. получавших лечение саксаглиптином. и была отмечена у 35 пациентов. получавших глипизид (8,1%) (р <0,0001).
В испытании при комбинированном лечении с инсулином общая частота гипогликемии составила 18,4% для саксаглиптинa 5 мг и 19,9% для плацебо. Однако частота подтвержденной симптоматической гипогликемии (сопровождается уровнем глюкозы в крови из пальца ≤50 мг/дл) была выше при приеме саксаглиптина 5 мг (5,3%) по сравнению с плацебо (3,3%).
В испытании с дополнением к метформину плюс производное сульфонилмочевины общая частота гипогликемии составила 10,1% для саксаглиптина 5 мг и 6,3% для плацебо. Подтвержденная гипогликемия была зарегистрирована у 1,6% пациентов, получавших саксаглиптин, и ни у одного из пациентов, получавших плацебо.
Реакции гиперчувствительности.
По объединенным данным 5 плацебо-контролируемых 24-недельных клинических испытаний. связанные с гиперчувствительностью реакции. такие как крапивница и отек лица. были зарегистрированы у 1,5. 1,5 и 0,4% пациентов. получавших саксаглиптин в дозе 2,5 и 5 мг и плацебо соответственно. Ни один из этих случаев у пациентов, получавших саксаглиптин, не потребовал госпитализации или не был расценен врачами как жизнеугрожающий. Один пациент прекратил лечение в связи с развитием генерализованной крапивницы и отека лица.
Почечная недостаточность.
В испытании SAVOR побочные реакции. связанные с нарушением функции почек. в тч лабораторные изменения ( удвоение креатинина сыворотки по сравнению с исходным уровнем и креатинин сыворотки >6 мг/дл). были зарегистрированы у 5,8% (483/8280) пациентов. принимавших саксаглиптин. и 5,1% (422/8212) пациентов. получавших плацебо. Наиболее часто сообщалось о побочных реакциях. включающих нарушение функции почек (2,1 против 1,9%). острую почечную недостаточность (1,4 против 1,2%) и почечную недостаточность (0,8 против 0,9%). при сравнении групп саксаглиптина с группами плацебо соответственно. От исходного уровня до конца лечения среднее снижение СКФ составило 2,5 мл/мин/1,73 м2 для пациентов, находившихся на лечении саксаглиптином, и 2,4 мл/мин/1,73 м2 для пациентов, принимавших плацебо. У большего числа участников. рандомизированных в группу саксаглиптина (421/5227. 8,1%) в сравнении с участниками. рандомизированными в группу плацебо (344/5073. 6,8%) СКФ изменялась от >50 мл/мин ( нормальная функция почек или легкая степень почечной недостаточности) до ≤50 мл/мин ( умеренная или тяжелая почечная недостаточность). Соотношение пациентов с побочными реакциями со стороны почек увеличивалось в зависимости от степени исходного нарушения функции почек и с увеличением возраста, независимо от проводимого лечения.
Инфекции.
В открытой контролируемой базе данных клинического испытания саксаглиптина на сегодняшний день имеется 6 (0,12%) отчетов о развитии туберкулеза у 4959 пациентов. получавших лечение саксаглиптином (1,1 случая на 1000 пациенто-лет) по сравнению с отсутствием отчетов о случаях туберкулеза у 2868 пациентов. получавших препараты сравнения. Два из этих шести случаев были подтверждены лабораторным тестированием. В остальных случаях имелась ограниченная информация или предполагаемые диагнозы туберкулеза. Все случаи зафиксированы за пределами США и Западной Европы. Один случай произошел в Канаде у пациента родом из Индонезии, который недавно посещал Индонезию. Продолжительность лечения саксаглиптином до сообщения о туберкулезе колебалась от 144 до 929 дней. Количество лимфоцитов после лечения находилось в пределах референсного интервала в четырех случаях. У одного пациента была лимфопения до начала приема саксаглиптина, которая оставалась стабильной на протяжении всего лечения саксаглиптином. Еще у одного пациента имелось снижение количества лимфоцитов ниже нормы примерно за четыре месяца до сообщения о туберкулезе. Не было спонтанных сообщений о туберкулезе, связанных с использованием саксаглиптина. Причинность не была оценена, и на сегодняшний день слишком мало случаев, чтобы определить, является ли туберкулез связанным с использованием саксаглиптина.
В открытой контролируемой базе данных клинического испытания саксаглиптина имеется один случай потенциальной оппортунистической инфекции у пациента. принимавшего саксаглиптин. у которого развился сальмонеллезный сепсис предположительно пищевого происхождения с фатальным исходом после примерно 600 дней терапии саксаглиптином. Не было никаких спонтанных сообщений о развитии оппортунистических инфекций, связанных с использованием саксаглиптина.
Жизненно важные признаки.
Не отмечалось изменений жизненно важных признаков у пациентов, получавших саксаглиптин.
Лабораторные тесты.
Абсолютное количество лимфоцитов.
Согласно объединенным данным пяти плацебо-контролируемых клинических исследований, при приеме саксаглиптина наблюдалось дозозависимое снижение абсолютного количества лимфоцитов. От исходного среднего значения абсолютного количества лимфоцитов около 2200 клеток/мкл среднее снижение через 24 нед составило приблизительно 100 и 120 клеток/мкл при приеме саксаглиптина в дозе 5 и 10 мг соответственно по сравнению с плацебо. Сходные эффекты были отмечены при приеме саксаглиптина в дозе 5 мг в комбинации с метформином по сравнению с одним метформином. Не наблюдалось различия при приеме саксаглиптина 2,5 мг по сравнению с плацебо. Доля пациентов. у которых было зарегистрировано количество лимфоцитов ≤750 клеток/мкл. составила 0,5. 1,5. 1,4 и 0,4% при приеме саксаглиптина в дозе 2,5. 5. 10 мг и плацебо соответственно. У большинства пациентов при повторной экспозиции саксаглиптина рецидива не наблюдалось, хотя у некоторых пациентов отмечалось рекуррентное снижение, что привело к прекращению лечения саксаглиптином. Снижение количества лимфоцитов не было связано с клинически существенными побочными реакциями. Доза 10 мг не является утвержденной дозировкой.
В испытании SAVOR наблюдалось снижение этого показателя примерно на 84 клетки/мкл на фоне саксаглиптина по сравнению с плацебо. Доля пациентов, у которых было зафиксировано снижение количества лимфоцитов до ≤750 клеток/мкл, составила 1,6% (136/8280) и 1% (78/8212) при приеме саксаглиптина и плацебо соответственно.
Клиническая значимость снижения количества лимфоцитов по сравнению с плацебо неизвестна. При наличии клинических показаний, например необычные или продолжительные инфекции, количество лимфоцитов следует измерять. Эффект саксаглиптина на количество лимфоцитов у больных с изменениями количества лимфоцитов (например ВИЧ-инфекция) неизвестен.
Постмаркетинговый опыт.
Дополнительные побочные реакции были выявлены в ходе применения саксаглиптина в постмаркетинговый период. Поскольку сообщения об этих реакциях поступают добровольно от популяции неопределенного размера. как правило. не представляется возможным достоверно оценить их частоту или установить причинно-следственную связь с воздействием ЛС.
- Реакции гиперчувствительности, включая анафилаксию, ангиоэдему и эксфолиативные кожные заболевания ( см «Противопоказания» и «Меры предосторожности»);
- острый панкреатит ( см «Меры предосторожности»);
- тяжелая и инвалидизирующая артралгия ( см «Меры предосторожности).
RxList.com (обновление 2021 г.
- Буллезный пемфигоид;
- рабдомиолиз.
|
|
Взаимодействие
Анализ данных клинических исследований позволяет предполагать, что риск клинически значимых взаимодействий саксаглиптина с другими ЛС при их совместном применении невелик.
Метаболизм саксаглиптина преимущественно опосредован системой изоферментов сYP3A4/5 цитохрома Р450. В исследованиях in vitro >in vitro было показано, что саксаглиптин и его основной метаболит не ингибируют изоферменты сYP1A2, сYP2А6, сYP2В6, сYP2С8, сYP2С9, сYP2С19, сYP2D6, сYP2Е1 и сYP3А4 и не индуцируют изоферменты сYP1A2, сYP2В6, сYP2С9 и сYP3А4.
RxList.com (обновление 2021 г.
Следовательно, не ожидается, что саксаглиптин изменит метаболический клиренс одновременно принимаемых ЛС, которые метаболизируются этими изоферментами.
RxList.com (2016 г.
Саксаглиптин - субстрат Р-gp, но не является значимым ингибитором или индуктором Р-gp.
В исследованиях с участием здоровых добровольцев фармакокинетические показатели саксаглиптина и его основного метаболита значимо не изменялись под влиянием метформина, глибенкламида, пиоглитазона, дигоксина, симвастатина, дилтиазема, кетоконазола, омепразола, комбинации алюминия гидроксида, магния гидроксида и симетикона, а также фамотидина. Саксаглиптин значимо не изменяет фармакокинетические показатели метформина, глибенкламида, пиоглитазона, дигоксина, симвастатина, дилтиазема, кетоконазола и перорального комбинированного (эстроген + гестаген) контрацептивного средства.
RxList.com (обновление 2021 г.
Дапаглифлозин. В исследованиях взаимодействия in vivo >in vivo показано, что при одновременном применении саксаглиптина в разовой дозе 5 мг и дапаглифлозина в разовой дозе 10 мг фармакокинетические показатели саксаглиптина и его основного метаболита значимо не изменялись.
Кетоконазол. В исследованиях взаимодействия in vivo >in vivo показано, что при одновременном применении саксаглиптина в разовой дозе 100 мг и кетоконазола в дозе 200 мг 2 раза в сутки в течение 9 дней значения геометрических отношений (соотношение с/без одновременного приема ЛС) AUC и maxCmax составляли 2,45 и 1,62 для саксаглиптина и 0,12 и 0,05 для его активного метаболита 5-гидроксисаксаглиптина (нет эффекта = 1), при дозе саксаглиптина 20 мг и кетоконазола 200 мг 2 раза в сутки в течение 7 дней эти величины составляли 3,67 и 2,44 для саксаглиптина (для 5-гидроксисаксаглиптина не определены). Следует ограничить дозу саксаглиптина до 2,5 мг 1 раз в день при назначении с саксаглиптином - сильным ингибитором сYP3A4/5.
Влияние индукторов изоферментов сYP3A4/5 на фармакокинетику саксаглиптина не изучено. Однако совместное применение саксаглиптина и индукторов изоферментов сYP3A4/5, таких как карбамазепин, дексаметазон, фенобарбитал, фенитоин и рифампицин, может приводить к уменьшению концентрации саксаглиптина в плазме и увеличению концентрации его основного метаболита.
Изучение влияния курения, диетического питания, приема растительных препаратов и употребления алкоголя на терапию саксаглиптином не проводилось.
Метаболизм саксаглиптина преимущественно опосредован системой изоферментов сYP3A4/5 цитохрома Р450. В исследованиях in vitro >in vitro было показано, что саксаглиптин и его основной метаболит не ингибируют изоферменты сYP1A2, сYP2А6, сYP2В6, сYP2С8, сYP2С9, сYP2С19, сYP2D6, сYP2Е1 и сYP3А4 и не индуцируют изоферменты сYP1A2, сYP2В6, сYP2С9 и сYP3А4.
RxList.com (обновление 2021 г.
Следовательно, не ожидается, что саксаглиптин изменит метаболический клиренс одновременно принимаемых ЛС, которые метаболизируются этими изоферментами.
RxList.com (2016 г.
Саксаглиптин - субстрат Р-gp, но не является значимым ингибитором или индуктором Р-gp.
В исследованиях с участием здоровых добровольцев фармакокинетические показатели саксаглиптина и его основного метаболита значимо не изменялись под влиянием метформина, глибенкламида, пиоглитазона, дигоксина, симвастатина, дилтиазема, кетоконазола, омепразола, комбинации алюминия гидроксида, магния гидроксида и симетикона, а также фамотидина. Саксаглиптин значимо не изменяет фармакокинетические показатели метформина, глибенкламида, пиоглитазона, дигоксина, симвастатина, дилтиазема, кетоконазола и перорального комбинированного (эстроген + гестаген) контрацептивного средства.
RxList.com (обновление 2021 г.
Дапаглифлозин. В исследованиях взаимодействия in vivo >in vivo показано, что при одновременном применении саксаглиптина в разовой дозе 5 мг и дапаглифлозина в разовой дозе 10 мг фармакокинетические показатели саксаглиптина и его основного метаболита значимо не изменялись.
Кетоконазол. В исследованиях взаимодействия in vivo >in vivo показано, что при одновременном применении саксаглиптина в разовой дозе 100 мг и кетоконазола в дозе 200 мг 2 раза в сутки в течение 9 дней значения геометрических отношений (соотношение с/без одновременного приема ЛС) AUC и maxCmax составляли 2,45 и 1,62 для саксаглиптина и 0,12 и 0,05 для его активного метаболита 5-гидроксисаксаглиптина (нет эффекта = 1), при дозе саксаглиптина 20 мг и кетоконазола 200 мг 2 раза в сутки в течение 7 дней эти величины составляли 3,67 и 2,44 для саксаглиптина (для 5-гидроксисаксаглиптина не определены). Следует ограничить дозу саксаглиптина до 2,5 мг 1 раз в день при назначении с саксаглиптином - сильным ингибитором сYP3A4/5.
Влияние индукторов изоферментов сYP3A4/5 на фармакокинетику саксаглиптина не изучено. Однако совместное применение саксаглиптина и индукторов изоферментов сYP3A4/5, таких как карбамазепин, дексаметазон, фенобарбитал, фенитоин и рифампицин, может приводить к уменьшению концентрации саксаглиптина в плазме и увеличению концентрации его основного метаболита.
Изучение влияния курения, диетического питания, приема растительных препаратов и употребления алкоголя на терапию саксаглиптином не проводилось.
Передозировка
Симптомов интоксикации не описано при длительном приеме саксаглиптина в дозах, до 80 раз превышающих рекомендованные.
Лечение. В случае передозировки следует применять симптоматическую терапию. Саксаглиптин и его основной метаболит выводятся из организма при помощи гемодиализа (скорость выведения: 23% дозы за 4 ч).
RxList.com (2016 г.
В контролируемых клинических испытаниях при приеме саксаглиптина здоровыми людьми перорально 1 раз в день в дозе до 400 мг/сут в течение 2 нед (в 80 раз превышает МРДЧ) не было отмечено дозозависимых клинических побочных реакций и клинически значимого влияния на интервал QTc или ритм сердца.
Лечение. В случае передозировки следует применять симптоматическую терапию. Саксаглиптин и его основной метаболит выводятся из организма при помощи гемодиализа (скорость выведения: 23% дозы за 4 ч).
RxList.com (2016 г.
В контролируемых клинических испытаниях при приеме саксаглиптина здоровыми людьми перорально 1 раз в день в дозе до 400 мг/сут в течение 2 нед (в 80 раз превышает МРДЧ) не было отмечено дозозависимых клинических побочных реакций и клинически значимого влияния на интервал QTc или ритм сердца.
Способ применения и дозы
Внутрь, независимо от приема пищи, рекомендуемая доза саксаглиптина - 5 мг 1 раз в сутки.
RxList.com (обновление 2021 г.
Рекомендуемая доза саксаглиптина - 2,5 или 5 мг 1 раз в сутки.
RxList.com (обновление 2021 г.
Рекомендуемая доза саксаглиптина - 2,5 или 5 мг 1 раз в сутки.
Меры предосторожности применения
Применение саксаглиптина в составе тройной терапии с метформином и тиазолидиндионами не изучалось.
Применение в комбинации с препаратами, которые могут вызвать гипогликемию. Производные сульфонилмочевины и инсулин могут вызвать гипогликемию, поэтому для уменьшения риска гипогликемии при одновременном применении с саксаглиптином может потребоваться снижение дозы производных сульфонилмочевины или инсулина.
RxList.com (обновление 2021 г.
Частота подтвержденной гипогликемии увеличивалась по сравнению с плацебо, используемым в сочетании с сульфонилмочевиной или с инсулином ( см «Побочные действия»).
Реакции гиперчувствительности. В ходе постмаркетингового применения саксаглиптина отмечены серьезные реакции гиперчувствительности, включая анафилаксию и ангионевротический отек. При развитии серьезной реакции гиперчувствительности следует прекратить применение саксаглиптина, оценить другие возможные причины развития явления и назначить альтернативную терапию сахарного диабета ( см «Противопоказания» и «Побочные действия»).
RxList.com (обновление 2021 г.
Реакции гиперчувствительности. Реакции гиперчувствительности, включая анафилаксию, ангионевротический отек и эксфолиативные поражения кожи, отмеченные у пациентов в постмаркетинговый период, развивались в течение первых 3 мес после начала лечения саксаглиптином, при этом имеются некоторые сообщения о возникновении их после первой дозы.
Если подозревается серьезная реакция гиперчувствительности, необходимо прекратить прием саксаглиптина.
Следует соблюдать осторожность у пациентов с ангионевротическим отеком в анамнезе, получавшим другой ингибитор ДПП-4, поскольку неизвестно, имеется ли у таких пациентов предрасположенность к развитию ангионевротического отека при приеме саксаглиптина.
Панкреатит. В рамках постмаркетингового применения саксаглиптина получены спонтанные сообщения о случаях острого панкреатита. Пациенты, принимающие саксаглиптин, должны быть проинформированы о характерном симптоме острого панкреатита - продолжительной, интенсивной боли в области живота. При подозрении на развитие панкреатита следует прекратить прием саксаглиптина ( см «Ограничения к применению» и «Побочные действия»).
Частота случаев панкреатита в исследовании SAVOR, подтвержденного в соответствии с протоколом исследования, составила 0,3% в группах саксаглиптина и плацебо в популяции всех рандомизированных пациентов.
RxList.com (2016 г.
Панкреатит. В исследовании сердечно-сосудистых исходов у участников исследования с подтвержденными атеросклеротическими ССЗ или множественными факторами риска атеросклеротических ССЗ (испытание SAVOR) случаи выраженного острого панкреатита были подтверждены у 17 из 8240 (0,2%) пациентов, получавших саксаглиптин, по сравнению с 9 из 8173 (0,1%) пациентов, получавших плацебо. Предсуществующие факторы риска развития панкреатита были установлены у 88% (15/17) пациентов, получавших саксаглиптин, и у 100% (9/9) - получавших плацебо.
После начала приема саксаглиптина необходимо наблюдать за пациентами для выявления признаков и симптомов панкреатита. При подозрении на панкреатит прием саксаглиптина следует немедленно прекратить и принять соответствующие меры. Неизвестно, подвергаются ли повышенному риску развития панкреатита пациенты с панкреатитом в анамнезе при использовании саксаглиптина.
Сердечная недостаточность. В исследовании SAVOR было отмечено увеличение частоты госпитализации по поводу сердечной недостаточности в группе саксаглиптина по сравнению с группой плацебо, хотя причинно-следственная связь не установлена. Следует соблюдать осторожность при применении саксаглиптина у пациентов с факторами риска госпитализации по поводу сердечной недостаточности, такими как сердечная недостаточность или почечная недостаточность умеренной и тяжелой степени в анамнезе. Пациенты должны быть проинформированы о характерных симптомах сердечной недостаточности и необходимости немедленно сообщать о таких симптомах ( см «Фармакодинамика»).
RxList.com (2016 г.
Сердечная недостаточность. В исследовании сердечно-сосудистых исходов у участников исследования с подтвержденными атеросклеротическими ССЗ или множественными факторами риска атеросклеротических ССЗ (испытание SAVOR) большее количество пациентов, рандомизированных в группу лечения саксаглиптином (289/8280, 3,5%), было госпитализировано по поводу сердечной недостаточности по сравнению с пациентами, рандомизированными в группу плацебо (228/8212, 2,8%). При анализе времени до первого события риск госпитализации по поводу сердечной недостаточности был выше в группе саксаглиптина (ОР: 1,27; 95% ДИ: 1,07, 1,51). Пациенты с предшествующей сердечной недостаточностью и пациенты с почечной недостаточностью имели более высокий риск госпитализации по поводу сердечной недостаточности, независимо от проводимого лечения.
Следует рассмотреть риски и преимущества терапии у пациентов с повышенным риском развития сердечной недостаточности до начала приема саксаглиптинa. Необходимо наблюдать за пациентами для выявления признаков и симптомов сердечной недостаточности во время лечения. Пациенты должны быть проинформированы о характерных симптомах сердечной недостаточности и необходимости немедленно сообщать о таких симптомах. При развитии сердечной недостаточности следует руководствоваться действующими стандартами медицинской помощи и рассмотреть возможность прекращения приема саксаглиптина.
Артралгия. В постмаркетинговых сообщениях описана боль в суставах, в тч сильная, при применении ингибиторов ДПП-4. У пациентов наблюдалось облегчение симптомов после прекращения приема саксаглиптина, а у отдельных пациентов отмечался рецидив симптомов при возобновлении применения того же или другого ингибитора ДПП-4. Возникновение симптомов после начала применения препарата может быть быстрым или отмечаться на фоне длительной терапии. При развитии сильной боли в суставах следует оценить целесообразность продолжения приема саксаглиптина в каждом отдельном случае.
RxList.com (обновление 2021 г.
Тяжелая и инвалидизирующая артралгия. В постмаркетинговый период сообщалось о тяжелой и инвалидизирующей артралгии у пациентов, принимающих ингибиторы ДПП-4. Время до появления симптомов после начала лекарственной терапии варьировало от одного дня до нескольких лет. Следует рассматривать прием ингибитора ДПП-4 как возможную причину сильной боли в суставах и при необходимости отменить его прием.
Буллезный пемфигоид. Сообщалось о постмаркетинговых случаях буллезного пемфигоида, требующих госпитализации, при применении ингибитора ДПП-4. В этих случаях пациенты обычно выздоравливали после местного или системного иммуносупрессивного лечения и прекращения приема ингибитора ДПП-4. Следует рекомендовать пациентам сообщать о появлении волдырей или эрозий при приеме саксаглиптина. Если есть подозрение на развитие буллезного пемфигоида, прием саксаглиптина следует прекратить и рассмотреть вопрос о направлении к дерматологу для диагностики и соответствующего лечения.
RxList.com (2016 г.
Макроваскулярные осложнения. Не проведено клинических исследований по установлению убедительных доказательств снижения риска макрососудистых осложнений при терапии саксаглиптином или любым другим противодиабетическим ЛС.
Применение у особых групп пациентов.
Пациенты с нарушением функции почек. Для пациентов с почечной недостаточностью легкой степени (Cl креатинина >50 мл/мин) коррекция дозы не требуется. Для пациентов с умеренной или тяжелой почечной недостаточностью (Cl креатинина ≤50 мл/мин), а также для пациентов на гемодиализе рекомендуется коррекция дозы.
Применение саксаглиптина у пациентов на перитонеальном диализе не изучено.
Перед началом терапии саксаглиптином и в процессе лечения рекомендуется проводить оценку функции почек.
RxList.com (обновление 2021 г.
Пациенты с нарушением функции почек. В 12-недельном рандомизированном плацебо-контролируемом исследовании саксаглиптин в дозе 2,5 мг получали 85 пациентов с умеренным (n=48) или тяжелым (n=18) нарушением функции почек или терминальной стадией почечной недостаточности (n=19). Частота нежелательных явлений, в тч серьезных нежелательных явлений и прекращения приема из-за нежелательных явлений, была сходной в группе пациентов, получавших саксаглиптин, и в группе плацебо. Общая частота зарегистрированной гипогликемии составила 20% среди пациентов, получавших саксаглиптин в дозе 2,5 мг, и 22% среди пациентов, получавших плацебо. Четыре пациента, получавших саксаглиптин (4,7%), и три пациента, получавших плацебо (3,5%), сообщили по крайней мере об одном эпизоде подтвержденной симптоматической гипогликемии (уровень глюкозы при взятии крови из пальца ≤50 мг/дл).
Дозировка саксаглиптина для пациентов с почечной недостаточностью. Для пациентов с рСКФ ≥45 мл/мин/1,73 м2 корректировка дозы не рекомендуется. Доза составляет 2,5 мг 1 раз в день для пациентов с рСКФ <45 мл/мин/1,73 м2 (включая пациентов с умеренной или тяжелой почечной недостаточностью или терминальной стадией почечной недостаточности, требующей гемодиализа). Саксаглиптин следует назначать после гемодиализа.
Пациенты с нарушением функции печени. При нарушении функции печени легкой, умеренной и тяжелой степени коррекция дозы не требуется.
Пациенты пожилого возраста. Из 16492 пациентов, рандомизированных в исследовании SAVOR, 8561 пациент (51,9%) был в возрасте 65 лет и старше, и 2330 пациентов (14,1%) были в возрасте 75 лет и старше. Из них 4290 пациентов в возрасте 65 лет и старше и 1169 пациентов в возрасте 75 лет и старше получали саксаглиптин. По данным клинических исследований, показатели эффективности и безопасности у пациентов в возрасте 65 лет и старше, 75 лет и старше не отличались от аналогичных показателей у пациентов более молодого возраста. Коррекция дозы у пожилых пациентов не требуется. Однако при выборе дозы следует учитывать, что у этой категории пациентов более вероятно снижение функции почек.
RxList.com (обновление 2021 г.
Пациенты пожилого возраста. В 7 двойных слепых контролируемых клинических исследованиях безопасности и эффективности саксаглиптина из 11301 пациента, рандомизированного в группу пациентов, получавших саксаглиптин, в общей сложности 4751 (42,0%) были в возрасте 65 лет и старше и 1210 (10,7%) были в возрасте 75 лет и старше. Каких-либо общих различий в безопасности или эффективности у пациентов ≥65 лет и более молодых не наблюдалось. Хотя этот клинический опыт не выявил различий в ответе на лечение у пожилых и более молодых пациентов, нельзя исключать более высокую чувствительность некоторых пожилых людей.
Саксаглиптин и его активный метаболит частично выводятся почками. Поскольку у пожилых пациентов более вероятно снижение функции почек, следует соблюдать осторожность при выборе дозы для пожилых людей, учитывая функцию почек.
Дети. Безопасность и эффективность применения у пациентов младше 18 лет не изучалась.
Одновременное применение с сильными ингибиторами сYP3A4/5.
При одновременном применении с сильными ингибиторами сYP3A4/5, такими как кетоконазол, атазанавир, кларитромицин, индинавир, итраконазол, нефазодон, нелфинавир, ритонавир, саквинавир и телитромицин, рекомендуемая доза составляет 2,5 мг 1 раз в сутки.
Влияние на способность к вождению автотранспорта и управлению механизмами. Исследования по изучению влияния саксаглиптина на способность к вождению автотранспорта и управлению механизмами не проводились.
Следует учитывать, что саксаглиптин может вызывать головокружение.
Применение в комбинации с препаратами, которые могут вызвать гипогликемию. Производные сульфонилмочевины и инсулин могут вызвать гипогликемию, поэтому для уменьшения риска гипогликемии при одновременном применении с саксаглиптином может потребоваться снижение дозы производных сульфонилмочевины или инсулина.
RxList.com (обновление 2021 г.
Частота подтвержденной гипогликемии увеличивалась по сравнению с плацебо, используемым в сочетании с сульфонилмочевиной или с инсулином ( см «Побочные действия»).
Реакции гиперчувствительности. В ходе постмаркетингового применения саксаглиптина отмечены серьезные реакции гиперчувствительности, включая анафилаксию и ангионевротический отек. При развитии серьезной реакции гиперчувствительности следует прекратить применение саксаглиптина, оценить другие возможные причины развития явления и назначить альтернативную терапию сахарного диабета ( см «Противопоказания» и «Побочные действия»).
RxList.com (обновление 2021 г.
Реакции гиперчувствительности. Реакции гиперчувствительности, включая анафилаксию, ангионевротический отек и эксфолиативные поражения кожи, отмеченные у пациентов в постмаркетинговый период, развивались в течение первых 3 мес после начала лечения саксаглиптином, при этом имеются некоторые сообщения о возникновении их после первой дозы.
Если подозревается серьезная реакция гиперчувствительности, необходимо прекратить прием саксаглиптина.
Следует соблюдать осторожность у пациентов с ангионевротическим отеком в анамнезе, получавшим другой ингибитор ДПП-4, поскольку неизвестно, имеется ли у таких пациентов предрасположенность к развитию ангионевротического отека при приеме саксаглиптина.
Панкреатит. В рамках постмаркетингового применения саксаглиптина получены спонтанные сообщения о случаях острого панкреатита. Пациенты, принимающие саксаглиптин, должны быть проинформированы о характерном симптоме острого панкреатита - продолжительной, интенсивной боли в области живота. При подозрении на развитие панкреатита следует прекратить прием саксаглиптина ( см «Ограничения к применению» и «Побочные действия»).
Частота случаев панкреатита в исследовании SAVOR, подтвержденного в соответствии с протоколом исследования, составила 0,3% в группах саксаглиптина и плацебо в популяции всех рандомизированных пациентов.
RxList.com (2016 г.
Панкреатит. В исследовании сердечно-сосудистых исходов у участников исследования с подтвержденными атеросклеротическими ССЗ или множественными факторами риска атеросклеротических ССЗ (испытание SAVOR) случаи выраженного острого панкреатита были подтверждены у 17 из 8240 (0,2%) пациентов, получавших саксаглиптин, по сравнению с 9 из 8173 (0,1%) пациентов, получавших плацебо. Предсуществующие факторы риска развития панкреатита были установлены у 88% (15/17) пациентов, получавших саксаглиптин, и у 100% (9/9) - получавших плацебо.
После начала приема саксаглиптина необходимо наблюдать за пациентами для выявления признаков и симптомов панкреатита. При подозрении на панкреатит прием саксаглиптина следует немедленно прекратить и принять соответствующие меры. Неизвестно, подвергаются ли повышенному риску развития панкреатита пациенты с панкреатитом в анамнезе при использовании саксаглиптина.
Сердечная недостаточность. В исследовании SAVOR было отмечено увеличение частоты госпитализации по поводу сердечной недостаточности в группе саксаглиптина по сравнению с группой плацебо, хотя причинно-следственная связь не установлена. Следует соблюдать осторожность при применении саксаглиптина у пациентов с факторами риска госпитализации по поводу сердечной недостаточности, такими как сердечная недостаточность или почечная недостаточность умеренной и тяжелой степени в анамнезе. Пациенты должны быть проинформированы о характерных симптомах сердечной недостаточности и необходимости немедленно сообщать о таких симптомах ( см «Фармакодинамика»).
RxList.com (2016 г.
Сердечная недостаточность. В исследовании сердечно-сосудистых исходов у участников исследования с подтвержденными атеросклеротическими ССЗ или множественными факторами риска атеросклеротических ССЗ (испытание SAVOR) большее количество пациентов, рандомизированных в группу лечения саксаглиптином (289/8280, 3,5%), было госпитализировано по поводу сердечной недостаточности по сравнению с пациентами, рандомизированными в группу плацебо (228/8212, 2,8%). При анализе времени до первого события риск госпитализации по поводу сердечной недостаточности был выше в группе саксаглиптина (ОР: 1,27; 95% ДИ: 1,07, 1,51). Пациенты с предшествующей сердечной недостаточностью и пациенты с почечной недостаточностью имели более высокий риск госпитализации по поводу сердечной недостаточности, независимо от проводимого лечения.
Следует рассмотреть риски и преимущества терапии у пациентов с повышенным риском развития сердечной недостаточности до начала приема саксаглиптинa. Необходимо наблюдать за пациентами для выявления признаков и симптомов сердечной недостаточности во время лечения. Пациенты должны быть проинформированы о характерных симптомах сердечной недостаточности и необходимости немедленно сообщать о таких симптомах. При развитии сердечной недостаточности следует руководствоваться действующими стандартами медицинской помощи и рассмотреть возможность прекращения приема саксаглиптина.
Артралгия. В постмаркетинговых сообщениях описана боль в суставах, в тч сильная, при применении ингибиторов ДПП-4. У пациентов наблюдалось облегчение симптомов после прекращения приема саксаглиптина, а у отдельных пациентов отмечался рецидив симптомов при возобновлении применения того же или другого ингибитора ДПП-4. Возникновение симптомов после начала применения препарата может быть быстрым или отмечаться на фоне длительной терапии. При развитии сильной боли в суставах следует оценить целесообразность продолжения приема саксаглиптина в каждом отдельном случае.
RxList.com (обновление 2021 г.
Тяжелая и инвалидизирующая артралгия. В постмаркетинговый период сообщалось о тяжелой и инвалидизирующей артралгии у пациентов, принимающих ингибиторы ДПП-4. Время до появления симптомов после начала лекарственной терапии варьировало от одного дня до нескольких лет. Следует рассматривать прием ингибитора ДПП-4 как возможную причину сильной боли в суставах и при необходимости отменить его прием.
Буллезный пемфигоид. Сообщалось о постмаркетинговых случаях буллезного пемфигоида, требующих госпитализации, при применении ингибитора ДПП-4. В этих случаях пациенты обычно выздоравливали после местного или системного иммуносупрессивного лечения и прекращения приема ингибитора ДПП-4. Следует рекомендовать пациентам сообщать о появлении волдырей или эрозий при приеме саксаглиптина. Если есть подозрение на развитие буллезного пемфигоида, прием саксаглиптина следует прекратить и рассмотреть вопрос о направлении к дерматологу для диагностики и соответствующего лечения.
RxList.com (2016 г.
Макроваскулярные осложнения. Не проведено клинических исследований по установлению убедительных доказательств снижения риска макрососудистых осложнений при терапии саксаглиптином или любым другим противодиабетическим ЛС.
Применение у особых групп пациентов.
Пациенты с нарушением функции почек. Для пациентов с почечной недостаточностью легкой степени (Cl креатинина >50 мл/мин) коррекция дозы не требуется. Для пациентов с умеренной или тяжелой почечной недостаточностью (Cl креатинина ≤50 мл/мин), а также для пациентов на гемодиализе рекомендуется коррекция дозы.
Применение саксаглиптина у пациентов на перитонеальном диализе не изучено.
Перед началом терапии саксаглиптином и в процессе лечения рекомендуется проводить оценку функции почек.
RxList.com (обновление 2021 г.
Пациенты с нарушением функции почек. В 12-недельном рандомизированном плацебо-контролируемом исследовании саксаглиптин в дозе 2,5 мг получали 85 пациентов с умеренным (n=48) или тяжелым (n=18) нарушением функции почек или терминальной стадией почечной недостаточности (n=19). Частота нежелательных явлений, в тч серьезных нежелательных явлений и прекращения приема из-за нежелательных явлений, была сходной в группе пациентов, получавших саксаглиптин, и в группе плацебо. Общая частота зарегистрированной гипогликемии составила 20% среди пациентов, получавших саксаглиптин в дозе 2,5 мг, и 22% среди пациентов, получавших плацебо. Четыре пациента, получавших саксаглиптин (4,7%), и три пациента, получавших плацебо (3,5%), сообщили по крайней мере об одном эпизоде подтвержденной симптоматической гипогликемии (уровень глюкозы при взятии крови из пальца ≤50 мг/дл).
Дозировка саксаглиптина для пациентов с почечной недостаточностью. Для пациентов с рСКФ ≥45 мл/мин/1,73 м2 корректировка дозы не рекомендуется. Доза составляет 2,5 мг 1 раз в день для пациентов с рСКФ <45 мл/мин/1,73 м2 (включая пациентов с умеренной или тяжелой почечной недостаточностью или терминальной стадией почечной недостаточности, требующей гемодиализа). Саксаглиптин следует назначать после гемодиализа.
Пациенты с нарушением функции печени. При нарушении функции печени легкой, умеренной и тяжелой степени коррекция дозы не требуется.
Пациенты пожилого возраста. Из 16492 пациентов, рандомизированных в исследовании SAVOR, 8561 пациент (51,9%) был в возрасте 65 лет и старше, и 2330 пациентов (14,1%) были в возрасте 75 лет и старше. Из них 4290 пациентов в возрасте 65 лет и старше и 1169 пациентов в возрасте 75 лет и старше получали саксаглиптин. По данным клинических исследований, показатели эффективности и безопасности у пациентов в возрасте 65 лет и старше, 75 лет и старше не отличались от аналогичных показателей у пациентов более молодого возраста. Коррекция дозы у пожилых пациентов не требуется. Однако при выборе дозы следует учитывать, что у этой категории пациентов более вероятно снижение функции почек.
RxList.com (обновление 2021 г.
Пациенты пожилого возраста. В 7 двойных слепых контролируемых клинических исследованиях безопасности и эффективности саксаглиптина из 11301 пациента, рандомизированного в группу пациентов, получавших саксаглиптин, в общей сложности 4751 (42,0%) были в возрасте 65 лет и старше и 1210 (10,7%) были в возрасте 75 лет и старше. Каких-либо общих различий в безопасности или эффективности у пациентов ≥65 лет и более молодых не наблюдалось. Хотя этот клинический опыт не выявил различий в ответе на лечение у пожилых и более молодых пациентов, нельзя исключать более высокую чувствительность некоторых пожилых людей.
Саксаглиптин и его активный метаболит частично выводятся почками. Поскольку у пожилых пациентов более вероятно снижение функции почек, следует соблюдать осторожность при выборе дозы для пожилых людей, учитывая функцию почек.
Дети. Безопасность и эффективность применения у пациентов младше 18 лет не изучалась.
Одновременное применение с сильными ингибиторами сYP3A4/5.
При одновременном применении с сильными ингибиторами сYP3A4/5, такими как кетоконазол, атазанавир, кларитромицин, индинавир, итраконазол, нефазодон, нелфинавир, ритонавир, саквинавир и телитромицин, рекомендуемая доза составляет 2,5 мг 1 раз в сутки.
Влияние на способность к вождению автотранспорта и управлению механизмами. Исследования по изучению влияния саксаглиптина на способность к вождению автотранспорта и управлению механизмами не проводились.
Следует учитывать, что саксаглиптин может вызывать головокружение.
|
|
Список литературы
Www.grls.rosminzdrav.ru, 2016 и www.rxlist.com, 2016, www.rxlist.com 2021.
Входит в состав
- 1725-1837₽ Онглиза (4 фирмы)
- 2826-3407₽ Комбоглиз Пролонг (2 фирмы)
- — Кутерн (2 фирмы)