МКБ-10 коды
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: с73.
Год утверждения (частота пересмотра): 2020.
Возрастная категория: Взрослые , Дети.
Пересмотр не позднее: 2022.
ID: 332.
Разработчик клинической рекомендации.
• Ассоциация онкологов России.
• Ассоциации эндокринных хирургов.
• Общероссийская общественная организация Российское общество специалистов по опухолям головы и шеи .
• Российская ассоциация эндокринологов.
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2020.
Возрастная категория: Взрослые , Дети.
Пересмотр не позднее: 2022.
ID: 332.
Разработчик клинической рекомендации.
• Ассоциация онкологов России.
• Ассоциации эндокринных хирургов.
• Общероссийская общественная организация Российское общество специалистов по опухолям головы и шеи .
• Российская ассоциация эндокринологов.
Одобрено Научно-практическим Советом Минздрава РФ.
|
|
 Список сокращений
Список сокращений
МРЩЖ - медуллярный рак щитовидной железы.
МЭН - множественная эндокринная неоплазия.
ДЛТ - дистанционная лучевая терапия.
КТ - компьютерная томография.
РЭА - раковый эмбриональный антиген.
МРТ - магнитно-резонансная томография.
ПЭТ - позитронно-эмиссионная томография.
ТАБ - тонкоигольная аспирационная биопсия.
УЗИ - ультразвуковое исследование.
ЩЖ - щитовидная железа.
RET - rearranged during transfection.
МЭН - множественная эндокринная неоплазия.
ДЛТ - дистанционная лучевая терапия.
КТ - компьютерная томография.
РЭА - раковый эмбриональный антиген.
МРТ - магнитно-резонансная томография.
ПЭТ - позитронно-эмиссионная томография.
ТАБ - тонкоигольная аспирационная биопсия.
УЗИ - ультразвуковое исследование.
ЩЖ - щитовидная железа.
RET - rearranged during transfection.
Термины и определения
Центральная лимфаденэктомия. Хирургическое удаление регионарных лимфатических узлов и окружающей трахею клетчатки VI уровня шеи с включением в блок преларингеальных (Дельфийских), претрахеальных и паратрахеальных лимфатических узлов с обеих сторон.
Классификация TIRADS ( Thyroid Imaging Reporting and Data System ). Стандартизированная система описания протокола ультразвукового исследования щитовидной железы.
Bethesda Thyroid сlassification, 2009, 2017. Стандартизированная система описания протокола цитологического исследования пунктатов щитовидной железы.
RECIST 1,1. Response Evaluation сriteria in Solid Tumors - критерии оценки ответа солидных опухолей на лечение, версия 1,1.
Классификация TIRADS ( Thyroid Imaging Reporting and Data System ). Стандартизированная система описания протокола ультразвукового исследования щитовидной железы.
Bethesda Thyroid сlassification, 2009, 2017. Стандартизированная система описания протокола цитологического исследования пунктатов щитовидной железы.
RECIST 1,1. Response Evaluation сriteria in Solid Tumors - критерии оценки ответа солидных опухолей на лечение, версия 1,1.
Описание
Медуллярный рак щитовидной железы (МРЩЖ) - опухоль из секретирующих кальцитонин парафолликулярных С-клеток щитовидной железы (ЩЖ), которые происходят из нейроэктодермы, эмбриональной закладки, отличающейся от мезодермального происхождения А- и В-клеток ЩЖ [1].
Причины
Этиология МРЩЖ в рамках синдрома множественных эндокринных неоплазий (МЭН) 2-го типа связана с мутацией гена RET 10-й хромосомы, кодирующего трансмембранно расположенный рецептор тирозинкиназы. Активация данного рецептора приводит к бесконтрольной пролиферации С-клеток. Мутация наследуется по аутосомно-доминантному типу. Ген RET состоит из 12 экзонов (исследованы мутации экзонов 5, 7-11, 13-16, мутации экзонов 6 и 12 пока не описаны как причина МРЩЖ), до 2012 г. описаны 160 вариантов мутаций в экзонах 5, 7-11, 13-16 (чаще всего 10, 11, 13-16), их перечень постоянно пополняется. Различные точки и варианты мутаций обусловливают развитие разнообразных проявлений синдрома МЭН 2-го типа, а также определяют время манифестации и агрессивность каждого типа опухоли. В результате накопления данных о статусе конкретных мутаций появилась возможность персонализированного прогнозирования течения различных проявлений заболеваний и выработки индивидуальной лечебной тактики в рамках синдрома МЭН 2-го типа у конкретного пациента и членов его семьи.
Абсолютно ясно, что плановая диагностика генетического дефекта у членов семьи с известной мутацией предполагает возможность раннего доклинического выявления синдромальных проявлений, своевременного планирования лечебных мероприятий, что ассоциируется с лучшими прогностическими показателями.
Выделяют синдром Сиппла (МЭН типа 2А) и синдром Горлина (МЭН типа 2В).
Наиболее распространенным из наследственных вариантов является синдром МЭН 2А. МРЩЖ как первичное проявление данного синдрома развивается в возрасте от 5 до 25 лет, фенотипическая пенетрантность МРЩЖ при этой форме МЭН 2а составляет 100 %. Одно- либо двусторонняя феохромоцитома и первичный гиперпаратиреоз развиваются в 55-75 и 15-30 % случаев соответственно. Наиболее редкими проявлениями являются болезнь Гиршпрунга (аганглиоз толстой кишки) и кожный лихеноидный амилоидоз.
Ранее выделялась изолированная семейная форма МРЩЖ (сейчас - вариант МЭН типа 2А), которая отличается изолированным поражением ЩЖ (как правило, в нескольких поколениях без других проявлений классического синдрома МЭН типа 2А). Однако описаны случаи поздней манифестации феохромоцитомы у одного из пробандов в семьях с семейным изолированным МРЩЖ. В связи с этим большинство исследователей предлагает считать семейную форму МРЩЖ вариантом синдрома МЭН типа 2А с низкой пенетрантностью феохромоцитомы. МРЩЖ при этой форме, как правило, развивается позже, протекает менее агрессивно, фенотипическая пенетрантность МРЩЖ при семейной изолированной форме может быть не абсолютной (часть пациентов с мутацией не имеют МРЩЖ).
Наиболее агрессивное течение МРЩЖ наблюдается при синдроме МЭН типа 2В. Другие проявления МЭН типа 2В: ранняя манифестация феохромоцитомы (начиная.
С 12-летнего возраста) и яркие физикальные фенотипические признаки, среди которых марфаноподобная внешность, гипермобильность суставов; множественные ганглионевриномы конъюнктивы, слизистой оболочки языка, рта, пищевода и кишечника, роговичного нерва; деформация стоп, грудной клетки.
При спорадическом МРЩЖ соматические мутации гена RET описаны в 25-40 % случаев, также описаны соматические мутации генов H-RAS и K-RAS. Имеются данные о том, что, в отличие от герминальных, соматические мутации не всегда являются инициирующими, они в большей степени ответственны за прогрессирование опухолей. Таким образом, к развитию данного заболевания могут быть причастны еще неизвестные факторы [2; 3].
Абсолютно ясно, что плановая диагностика генетического дефекта у членов семьи с известной мутацией предполагает возможность раннего доклинического выявления синдромальных проявлений, своевременного планирования лечебных мероприятий, что ассоциируется с лучшими прогностическими показателями.
Выделяют синдром Сиппла (МЭН типа 2А) и синдром Горлина (МЭН типа 2В).
Наиболее распространенным из наследственных вариантов является синдром МЭН 2А. МРЩЖ как первичное проявление данного синдрома развивается в возрасте от 5 до 25 лет, фенотипическая пенетрантность МРЩЖ при этой форме МЭН 2а составляет 100 %. Одно- либо двусторонняя феохромоцитома и первичный гиперпаратиреоз развиваются в 55-75 и 15-30 % случаев соответственно. Наиболее редкими проявлениями являются болезнь Гиршпрунга (аганглиоз толстой кишки) и кожный лихеноидный амилоидоз.
Ранее выделялась изолированная семейная форма МРЩЖ (сейчас - вариант МЭН типа 2А), которая отличается изолированным поражением ЩЖ (как правило, в нескольких поколениях без других проявлений классического синдрома МЭН типа 2А). Однако описаны случаи поздней манифестации феохромоцитомы у одного из пробандов в семьях с семейным изолированным МРЩЖ. В связи с этим большинство исследователей предлагает считать семейную форму МРЩЖ вариантом синдрома МЭН типа 2А с низкой пенетрантностью феохромоцитомы. МРЩЖ при этой форме, как правило, развивается позже, протекает менее агрессивно, фенотипическая пенетрантность МРЩЖ при семейной изолированной форме может быть не абсолютной (часть пациентов с мутацией не имеют МРЩЖ).
Наиболее агрессивное течение МРЩЖ наблюдается при синдроме МЭН типа 2В. Другие проявления МЭН типа 2В: ранняя манифестация феохромоцитомы (начиная.
С 12-летнего возраста) и яркие физикальные фенотипические признаки, среди которых марфаноподобная внешность, гипермобильность суставов; множественные ганглионевриномы конъюнктивы, слизистой оболочки языка, рта, пищевода и кишечника, роговичного нерва; деформация стоп, грудной клетки.
При спорадическом МРЩЖ соматические мутации гена RET описаны в 25-40 % случаев, также описаны соматические мутации генов H-RAS и K-RAS. Имеются данные о том, что, в отличие от герминальных, соматические мутации не всегда являются инициирующими, они в большей степени ответственны за прогрессирование опухолей. Таким образом, к развитию данного заболевания могут быть причастны еще неизвестные факторы [2; 3].
Эпидемиология
МРЩЖ составляет около 4-6 % всех случаев рака ЩЖ. Однако при современном скрининг-зависимом росте заболеваемости дифференцированным раком ЩЖ (в основном за счет папиллярных микрокарцином) относительная доля МРЩЖ в некоторых странах уменьшается до 1-3 %.
В 20-25 % случаев МРЩЖ выявляют в рамках синдрома МЭН 2-го типа, в остальных случаях он является спорадическим заболеванием [4, 5].
Диффузную закладку С-клеток в ЩЖ по происхождению и функции можно считать самостоятельным органом - например, таким же, как околощитовидные железы. Это объясняет несколько иные свойства С-клеточных опухолей. МРЩЖ и опухоли ЩЖ из.
А- и В-клеток объединяет лишь локализация, и на этом их сходство заканчивается. Нейроэндокринная природа МРЩЖ - причина принципиального иных подходов к его диагностике и лечению.
В 20-25 % случаев МРЩЖ выявляют в рамках синдрома МЭН 2-го типа, в остальных случаях он является спорадическим заболеванием [4, 5].
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
С73. Злокачественное новообразование щитовидной железы.Диффузную закладку С-клеток в ЩЖ по происхождению и функции можно считать самостоятельным органом - например, таким же, как околощитовидные железы. Это объясняет несколько иные свойства С-клеточных опухолей. МРЩЖ и опухоли ЩЖ из.
А- и В-клеток объединяет лишь локализация, и на этом их сходство заканчивается. Нейроэндокринная природа МРЩЖ - причина принципиального иных подходов к его диагностике и лечению.
Классификация
1,5 Классификация заболевания или состояния (группы заболеваний или состояний).
Этиологическая классификация.1. Спорадический МРЩЖ.
2. Генетически детерминированный МРЩЖ:
• синдром Сиппла (МЭН типа 2А), в том числе семейный МРЩЖ;
• синдром Горлина (МЭН типа 2В).
Международная гистологическая классификация опухолей щитовидной железы (ВОЗ, 4-е изд., 2017).
8345/3 Медуллярный рак.
8346/3 Смешанный медуллярно-фолликулярный рак.
Стадирование по TNM дифференцированного рака ЩЖ, в рамках которого рассматривается МРЩЖ ( American Joint сommittee on сancer, 8-е изд., 2017) (табл. 1).
T - первичная опухоль.
TX - недостаточно данных для оценки первичной опухоли.
T0 - первичная опухоль не определяется.
Tl - опухоль до 2 см в наибольшем измерении, ограниченная тканью ЩЖ.
T1a. Опухоль <1 ограниченная тканью ЩЖ.
T1b - опухоль >1 но <2 см в диаметре, ограниченная тканью ЩЖ.
Т2 - опухоль размером >2, но <4 см в наибольшем измерении, ограниченная тканью ЩЖ.
ТЗ - опухоль >4 см в наибольшем измерении, ограниченная тканью ЩЖ, или любая опухоль с минимальным распространением за пределы капсулы (в m. sternothyroideus или мягкие ткани около щитовидной железы).
Т3а - опухоль размером >4 ограниченная тканью ЩЖ.
Т3b. Любого размера опухоль с макроскопическим распространением за пределы капсулы ЩЖ с инвазией только в подподъязычные мышцы (грудино-подъязычную, грудино-щитовидную, щитоподъязычную или лопаточно-подъязычную).
Т4 - массивное распространение опухоли за пределы капсулы ЩЖ.
Т4а. Опухоль прорастает в капсулу ЩЖ и распространяется на любую из следующих структур - подкожные мягкие ткани, гортань, трахею, пищевод, возвратный гортанный нерв.
Т4b. Опухоль распространяется на предпозвоночную фасцию, сосуды средостения или оболочку сонной артерии.
N - наличие или отсутствие метастазов в регионарных лимфатических узлах.
NX - недостаточно данных для оценки регионарных лимфатических узлов.
N0 - нет признаков метастатического поражения регионарных лимфатических узлов.
N0 a. Один или несколько лимфатических узлов с цитологическим или патологоанатомическим подтверждением отсутствия опухоли.
N0 b. Отсутствие радиологических или клинических признаков метастатического поражения регионарных лимфатических узлов.
N1 - имеется поражение регионарных лимфатических узлов метастазами.
N1a. Метастазы в лимфатических узлах VI или VII уровней (претрахеальных и паратрахеальных, преларингеальных или верхних средостенных). Как одностороннее, так и двустороннее поражение.
N1b. Метастазы в шейных лимфатических узлах на одной стороне, или с обеих сторон, или на противоположной стороне (на I, II, III, IV или V уровне), или в заглоточных лимфатических узлах.
М - наличие или отсутствие отдаленных метастазов.
М0 - нет признаков отдаленных метастазов.
М1 - имеются отдаленные метастазы.
Таблица 1Группировка по стадиям дифференцированного рака щитовидной железы по системе TNM.
| До 55 лет | |||
| Стадия I | Т любая | N любая | М0 |
| Стадия II | Т любая | N любая | Ml |
| 55 лет и старше | |||
| Стадия I | T1 T2 | N0/Nx N0 | M0 M0 |
| Стадия II | T1 T2 T3a/b | N1 N1 N любая | M0 M0 M0 |
| Стадия III | T4a | N любая | M0 |
| Стадия IVА | Т4b | N любая | M0 |
| Стадия IVВ | Т4b | N любая | М1 |
|
|
Клиническая картина
Чаще всего МРЩЖ не имеет специфической клинической картины, наиболее типично сочетание узлового зоба и, в запущенных случаях, дисфагии и нарушений фонации. Исключением является МРЩЖ с наличием синдромальных проявлений МЭН, не связанных с патологией ЩЖ:
• гормональных проявлений гиперкатехоламинемии при феохромоцитоме - кризовой артериальной гипертензии, ортостатического головокружения, симптоматического диабета;
• при синдроме МЭН типа 2А - амилоидной лихенификации кожи, при болезни Гиршпрунга - обстипации, кишечной непроходимости;
• при синдроме МЭН типа 2В - ярких физикальных фенотипических признаков, среди которых марфаноподобная внешность, гипермобильность суставов, множественных ганглионеврином конъюнктивы, слизистых оболочек языка, рта, деформации стоп, грудной клетки [4].
• гормональных проявлений гиперкатехоламинемии при феохромоцитоме - кризовой артериальной гипертензии, ортостатического головокружения, симптоматического диабета;
• при синдроме МЭН типа 2А - амилоидной лихенификации кожи, при болезни Гиршпрунга - обстипации, кишечной непроходимости;
• при синдроме МЭН типа 2В - ярких физикальных фенотипических признаков, среди которых марфаноподобная внешность, гипермобильность суставов, множественных ганглионеврином конъюнктивы, слизистых оболочек языка, рта, деформации стоп, грудной клетки [4].
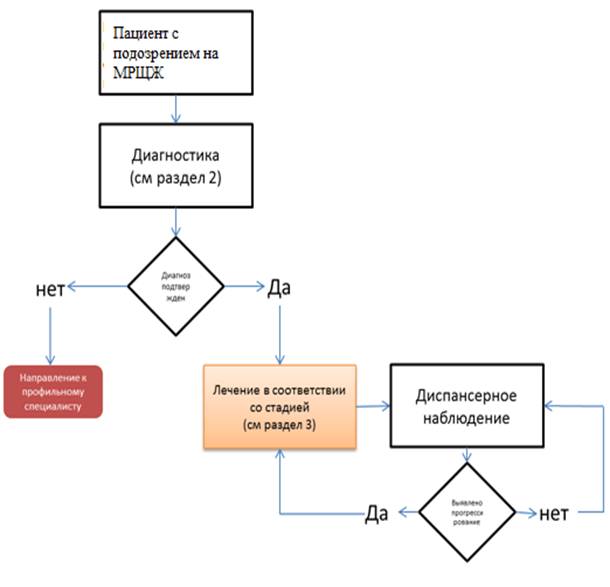
Диагностика
Критерии установления диагноза:
• на дооперационном этапе. Комплексная оценка уровня базального кальцитонина, результатов ультразвукового исследования (УЗИ) и тонкоигольной аспирационной биопсии (ТАБ) (в том числе со смывом на кальцитонин из узла или здоровой ткани доли), при необходимости - результатов генетического исследования на наличие мутаций RET. Результаты цитологического исследования и УЗИ могут быть ложноотрицательными [2; 6];
• на послеоперационном этапе. Оценка результатов планового патологоанатомического исследования, по показаниям - иммуногистохимического исследования [4].
Несмотря на широкое внедрение в клиническую практику высокоинформативных лабораторных и инструментальных методов обследования, МРЩЖ, как и 10 лет назад, диагностируется на III и IV стадиях более чем в 50 % случаев.
Основными методами первичной диагностики МРЩЖ являются исследование уровня базального кальцитонина крови, УЗИ, ТАБ, в том числе с оценкой уровня кальцитонина в смыве из пункционной иглы [2; 6].
• На догоспитальном этапе диагностики МРЩЖ всем пациентам с узловым образованием в щитовидной железе рекомендован сбор анамнеза для исключения факторов, определяющих принадлежность к группе риска МРЩЖ [6].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств 5).
Комментарии. К факторам риска наличия МРЩЖ относятся.
Уровень убедительности рекомендаций. с (уровень достоверности доказательств 5).
Комментарии. На сегодняшний день выделяют физикальные синдромальные проявления генетических синдромов, в состав которых входит МРЩЖ:
• при синдроме МЭН типа 2А:
• амилоидная лихенификации кожи;
• симптомов болезни Гиршпрунга - обстипации, кишечной непроходимости;
• при синдроме МЭН типа 2В:
• марфаноподобной внешности, гипермобильности суставов;
• множественных ганглионеврином конъюнктивы, слизистых оболочек языка, полости рта;
• деформации стоп, грудной клетки ;
Также могут отмечаться симптомы гиперкортицизма, связанные с эктопической продукцией адренокортикотропного гормона, и симптомы эндокринозависимой диареи [4; 3].
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 2).
Комментарии. Оценка базальной концентрации кальцитонина в крови как метод диагностики МРЩЖ значительно превосходит по чувствительности и специфичности УЗИ и ТАБ. Это исследование может изменить показания к ТАБ (размер, смыв на кальцитонин из иглы), поэтому должно проводиться на первичном этапе обследования.
Определение базального (строго натощак) уровня кальцитонина, в отличие от УЗИ и ТАБ, имеет очень высокую чувствительность - по данным большинства исследований, 98-100 %. Тем не менее при незначительном повышении уровня кальцитонина (выше верхней границы нормы в 2,0-2,5 раза) могут быть получены ложноположительные результаты. Специфичность зависит от амплитуды повышения базального кальцитонина. Показательно исследование сonstante и соавт. (2007) с участием 5817 пациентов с узловым зобом. Авторы продемонстрировали, что при абсолютной чувствительности при незначительном повышении базального кальцитонина специфичность достаточно невысока. Так, при повышении кальцитонина до 20 нг/мл (без учета гендерных различий) МРЩЖ выявлен у только 3,4 % пациентов, при повышении до 50-100 нг/мл - у 50 % и только при уровне >100 нг/мл - у 100 % пациентов. Данное исследование указало на необходимость экспертной оценки диагноза МРЩЖ при незначительном повышении уровня базального кальцитонина [8].
• Концентрацию кальцитонина рекомендовано оценивать с учетом гендерных, возрастных и методологических различий, определяющих верхнюю границу нормы, с целью адекватной интерпретации результатов [9].
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 3).
Комментарии. Референсные значения варьируют в зависимости от пола, верхняя граница этих значений выше у мужчин, возможно ввиду большего количества с-клеток по сравнению с таковым у женщин. Так, при использовании большинства методов верхняя граница нормального уровня базального кальцитонина у женщин составляет до 5 нг/мл, у мужчин - до 12 нг/мл.
Учитывая значительную вариабельность результатов анализа при использовании разных наборов, желательно при ведении одного пациента пользоваться одним и тем же набором. При изменении метода исследования оптимально использовать оба метода.
• Цитологическое подтверждение диагноза не рекомендуется при наличии узлового зоба с повышением уровня базального кальцитонина >100 пг/мл, так как указанный уровень кальцитонина является высокоспецифичным признаком МРЩЖ [8].
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 2).
Комментарии. Определение кальцитонина является экономически оправданным, однако очень важна информированность о других состояниях, при которых выявляется гиперкальцитонинемия (кроме МРЩЖ). Наиболее часто выявляется незначительное превышение референсных значений базального уровня кальцитонина при вторичной (неопухолевой) С-клеточной гиперплазии в перифокальной зоне опухоли ЩЖ (при папиллярном раке, В-клеточных опухолях), на фоне аутоиммунного поражения ЩЖ, почечной недостаточности, гиперкальциемии различного генеза (гиперпаратиреоидного, лекарственного, метастатического) [10, 11, 4].
• При высоком нормальном уровне кальцитонина (<100 пг/мл) и/или неопределенных результатах ТАБ рекомендовано определить наличие значимо высокой концентрации кальцитонина в смыве из пункционной иглы. [12, 13].
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 3).
• Всем пациентам, имеющим диагноз МРЩЖ или семейный анамнез МРЩЖ или синдрома МЭН 2-го типа, рекомендовано генетическое исследование для определения герминальной мутации RET с целью определения прогноза заболевания [14].
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 3).
Комментарии. Анализ на наличие герминальной мутации RET дифференцирует спорадические случаи и наследственные формы МРЩЖ. Отдельные мутации могут указывать на предрасположенность к определенному фенотипу и клиническому течению. Это является важным, так как пациенту часто показано специальное наблюдение для раннего выявления феохромоцитомы и первичного гиперпаратиреоза. У родственников пациента существует риск развития МРЩЖ, ранняя диагностика предотвращает метазирование. При обнаружении мутации RET обсуждается вопрос о проведении профилактической тиреоидэктомии и интраоперационной ревизии околощитовидных желез. Приблизительно у 95 % пациентов с МЭН типов 2А и 2B и у 88 % пациентов с семейной формой МРЩЖ удается выявить мутацию RET. Кроме того, она обнаруживается в 1-7 % очевидных спорадических случаев и с высокой вероятностью - у пациентов с многофокусным поражением ЩЖ и/или с МРЩЖ в детском возрасте [3, 2].
Уровень убедительности рекомендаций с. (уровень достоверности доказательств 5).
Комментарии. Принятая почти во всем мире шкала оценки вероятности рака ЩЖ TIRADS (Thyroid Imaging Reporting and Data System) имеет меньшую чувствительность и специфичность в отношении МРЩЖ, чем в отношении дифференцированного рака ЩЖ. Такие признаки, как солидное строение, гипоэхогенность, неровность контуров, наличие микрокальцинатов встречаются реже, чем при папиллярном раке ЩЖ. Часть исследователей продемонстрировали семиотику TIRADS II типа, типичных доброкачественных изменений (гетерогенности структуры с жидкостными зонами и ровным четким контуром, доброкачественного узла, при этом вероятность рака ЩЖ 0-4 %) у 20-25 % пациентов с МРЩЖ. Таким образом, роль УЗИ при МРЩЖ заключается в выявлении узла ЩЖ, оценке состояния шейного лимфоколлектора и определении показаний к ТАБ [15, 16].
• Данные цитологического исследования при узловом зобе рекомендовано соотнести с уровнем базального кальцитонина и, при необходимости, с результатами генетического исследования на наличие мутаций RET с целью повышения диагностической точности [3].
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
Комментарии. Данные об информативности ТАБ при МРЩЖ достаточно вариабельны. Выборки исследований, ориентированных на цитологов экспертного уровня, показали относительно высокую чувствительность ТАБ (86-89 %), более широкие выборки в исследованиях популяционного характера, рассчитанные на усредненный уровень специалистов, дали более пессимистичную оценку - 30-50 %. Очевидно, что информативность ТАБ при МРЩЖ неудовлетворительна.
• Предоперационная компьютерная томография (КТ) шеи и органов грудной клетки и трехфазная КТ печени с контрастным усилением или МРТ с контрастным усилением рекомендованы всем пациентам с МРЩЖ при наличии регионарных метастазов в лимфатических узлах (N1) или при сывороточном уровне кальцитонина >400 пг/мл с целью исключения отдаленных метастазов [2].
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
• ПЭТ с флудезоксиглюкозой [18F] и визуализация рецепторов к соматостатину не рекомендуются как рутинные методы для первоначального скрининга на предмет наличия метастазов МРЩЖ у пациентов, у которых данные ТАБ и/или уровень кальцитонина позволяют поставить или заподозрить диагноз МРЩЖ [2].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с МРЩЖ рекомендовано обязательное предоперационное обследование с целью обнаружения феохромоцитомы [17 ].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств 5).
Комментарий. Оперативное лечение по поводу МРЩЖ и, что особенно важно, анестезиологическое пособие при недиагностированной феохромоцитоме ассоциировано с крайне высоким риском фатальных событий.
При МРЩЖ в рамках синдрома МЭН 2-го типа описаны феохромоцитомы исключительно надпочечниковой локализации, в связи с чем обследование для выявления внеабдоминальной локализации этой опухоли не рекомендовано. Для исключения феохромоцитомы может использоваться любой из следующих критериев:
• отрицательный тест на наличие мутации RET;
• нормальный уровень свободных метанефринов в плазме крови или фракционироввнных метанефринов в суточной моче;
• отсутствие патологических изменений надпочечников по данным КТ или МРТ.
• на дооперационном этапе. Комплексная оценка уровня базального кальцитонина, результатов ультразвукового исследования (УЗИ) и тонкоигольной аспирационной биопсии (ТАБ) (в том числе со смывом на кальцитонин из узла или здоровой ткани доли), при необходимости - результатов генетического исследования на наличие мутаций RET. Результаты цитологического исследования и УЗИ могут быть ложноотрицательными [2; 6];
• на послеоперационном этапе. Оценка результатов планового патологоанатомического исследования, по показаниям - иммуногистохимического исследования [4].
Несмотря на широкое внедрение в клиническую практику высокоинформативных лабораторных и инструментальных методов обследования, МРЩЖ, как и 10 лет назад, диагностируется на III и IV стадиях более чем в 50 % случаев.
Основными методами первичной диагностики МРЩЖ являются исследование уровня базального кальцитонина крови, УЗИ, ТАБ, в том числе с оценкой уровня кальцитонина в смыве из пункционной иглы [2; 6].
2,1 Жалобы и анамнез.
Большинство случаев МРЩЖ выявляют при определении уровня кальцитонина у пациентов с узловым зобом, семейным анамнезом МРЩЖ, при обследовании по поводу феохромоцитомы. Меньшая часть случаев диагностируется в связи с отягощенным личным или семейным анамнезом, наличием жалоб на изменение голоса, обнаружением увеличенных шейных лимфатических узлов или отдаленных метастазов, выявлением характерных физикальных признаков синдрома МЭН типов 2А и 2В ( см выше).• На догоспитальном этапе диагностики МРЩЖ всем пациентам с узловым образованием в щитовидной железе рекомендован сбор анамнеза для исключения факторов, определяющих принадлежность к группе риска МРЩЖ [6].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств 5).
Комментарии. К факторам риска наличия МРЩЖ относятся.
2,2 Физикальное обследование.
• Физикальное обследование при МРЩЖ рекомендовано всем пациентам с целью выявления специфических симптомов и синдромов [4].Уровень убедительности рекомендаций. с (уровень достоверности доказательств 5).
Комментарии. На сегодняшний день выделяют физикальные синдромальные проявления генетических синдромов, в состав которых входит МРЩЖ:
• при синдроме МЭН типа 2А:
• амилоидная лихенификации кожи;
• симптомов болезни Гиршпрунга - обстипации, кишечной непроходимости;
• при синдроме МЭН типа 2В:
• марфаноподобной внешности, гипермобильности суставов;
• множественных ганглионеврином конъюнктивы, слизистых оболочек языка, полости рта;
• деформации стоп, грудной клетки ;
Также могут отмечаться симптомы гиперкортицизма, связанные с эктопической продукцией адренокортикотропного гормона, и симптомы эндокринозависимой диареи [4; 3].
2,3 Лабораторные диагностические исследования.
• С целью исключения МРЩЖ пациентам с узловым образованием в ЩЖ, феохромоцитомой или другими синдромальными или физикальными признаками синдрома МЭН 2-го типа рекомендовано определение базальной концентрации кальцитонина в крови [7].Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 2).
Комментарии. Оценка базальной концентрации кальцитонина в крови как метод диагностики МРЩЖ значительно превосходит по чувствительности и специфичности УЗИ и ТАБ. Это исследование может изменить показания к ТАБ (размер, смыв на кальцитонин из иглы), поэтому должно проводиться на первичном этапе обследования.
Определение базального (строго натощак) уровня кальцитонина, в отличие от УЗИ и ТАБ, имеет очень высокую чувствительность - по данным большинства исследований, 98-100 %. Тем не менее при незначительном повышении уровня кальцитонина (выше верхней границы нормы в 2,0-2,5 раза) могут быть получены ложноположительные результаты. Специфичность зависит от амплитуды повышения базального кальцитонина. Показательно исследование сonstante и соавт. (2007) с участием 5817 пациентов с узловым зобом. Авторы продемонстрировали, что при абсолютной чувствительности при незначительном повышении базального кальцитонина специфичность достаточно невысока. Так, при повышении кальцитонина до 20 нг/мл (без учета гендерных различий) МРЩЖ выявлен у только 3,4 % пациентов, при повышении до 50-100 нг/мл - у 50 % и только при уровне >100 нг/мл - у 100 % пациентов. Данное исследование указало на необходимость экспертной оценки диагноза МРЩЖ при незначительном повышении уровня базального кальцитонина [8].
• Концентрацию кальцитонина рекомендовано оценивать с учетом гендерных, возрастных и методологических различий, определяющих верхнюю границу нормы, с целью адекватной интерпретации результатов [9].
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 3).
Комментарии. Референсные значения варьируют в зависимости от пола, верхняя граница этих значений выше у мужчин, возможно ввиду большего количества с-клеток по сравнению с таковым у женщин. Так, при использовании большинства методов верхняя граница нормального уровня базального кальцитонина у женщин составляет до 5 нг/мл, у мужчин - до 12 нг/мл.
Учитывая значительную вариабельность результатов анализа при использовании разных наборов, желательно при ведении одного пациента пользоваться одним и тем же набором. При изменении метода исследования оптимально использовать оба метода.
• Цитологическое подтверждение диагноза не рекомендуется при наличии узлового зоба с повышением уровня базального кальцитонина >100 пг/мл, так как указанный уровень кальцитонина является высокоспецифичным признаком МРЩЖ [8].
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 2).
Комментарии. Определение кальцитонина является экономически оправданным, однако очень важна информированность о других состояниях, при которых выявляется гиперкальцитонинемия (кроме МРЩЖ). Наиболее часто выявляется незначительное превышение референсных значений базального уровня кальцитонина при вторичной (неопухолевой) С-клеточной гиперплазии в перифокальной зоне опухоли ЩЖ (при папиллярном раке, В-клеточных опухолях), на фоне аутоиммунного поражения ЩЖ, почечной недостаточности, гиперкальциемии различного генеза (гиперпаратиреоидного, лекарственного, метастатического) [10, 11, 4].
• При высоком нормальном уровне кальцитонина (<100 пг/мл) и/или неопределенных результатах ТАБ рекомендовано определить наличие значимо высокой концентрации кальцитонина в смыве из пункционной иглы. [12, 13].
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 3).
• Всем пациентам, имеющим диагноз МРЩЖ или семейный анамнез МРЩЖ или синдрома МЭН 2-го типа, рекомендовано генетическое исследование для определения герминальной мутации RET с целью определения прогноза заболевания [14].
Уровень убедительности рекомендаций - в (уровень достоверности доказательств - 3).
Комментарии. Анализ на наличие герминальной мутации RET дифференцирует спорадические случаи и наследственные формы МРЩЖ. Отдельные мутации могут указывать на предрасположенность к определенному фенотипу и клиническому течению. Это является важным, так как пациенту часто показано специальное наблюдение для раннего выявления феохромоцитомы и первичного гиперпаратиреоза. У родственников пациента существует риск развития МРЩЖ, ранняя диагностика предотвращает метазирование. При обнаружении мутации RET обсуждается вопрос о проведении профилактической тиреоидэктомии и интраоперационной ревизии околощитовидных желез. Приблизительно у 95 % пациентов с МЭН типов 2А и 2B и у 88 % пациентов с семейной формой МРЩЖ удается выявить мутацию RET. Кроме того, она обнаруживается в 1-7 % очевидных спорадических случаев и с высокой вероятностью - у пациентов с многофокусным поражением ЩЖ и/или с МРЩЖ в детском возрасте [3, 2].
2,4 Инструментальные диагностические исследования.
• Предоперационное УЗИ шеи c целью оценки характера поражения ЩЖ рекомендовано всем пациентам, у которых результаты ТАБ или уровень кальцитонина позволяют поставить или заподозрить диагноз МРЩЖ [15].Уровень убедительности рекомендаций с. (уровень достоверности доказательств 5).
Комментарии. Принятая почти во всем мире шкала оценки вероятности рака ЩЖ TIRADS (Thyroid Imaging Reporting and Data System) имеет меньшую чувствительность и специфичность в отношении МРЩЖ, чем в отношении дифференцированного рака ЩЖ. Такие признаки, как солидное строение, гипоэхогенность, неровность контуров, наличие микрокальцинатов встречаются реже, чем при папиллярном раке ЩЖ. Часть исследователей продемонстрировали семиотику TIRADS II типа, типичных доброкачественных изменений (гетерогенности структуры с жидкостными зонами и ровным четким контуром, доброкачественного узла, при этом вероятность рака ЩЖ 0-4 %) у 20-25 % пациентов с МРЩЖ. Таким образом, роль УЗИ при МРЩЖ заключается в выявлении узла ЩЖ, оценке состояния шейного лимфоколлектора и определении показаний к ТАБ [15, 16].
• Данные цитологического исследования при узловом зобе рекомендовано соотнести с уровнем базального кальцитонина и, при необходимости, с результатами генетического исследования на наличие мутаций RET с целью повышения диагностической точности [3].
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
Комментарии. Данные об информативности ТАБ при МРЩЖ достаточно вариабельны. Выборки исследований, ориентированных на цитологов экспертного уровня, показали относительно высокую чувствительность ТАБ (86-89 %), более широкие выборки в исследованиях популяционного характера, рассчитанные на усредненный уровень специалистов, дали более пессимистичную оценку - 30-50 %. Очевидно, что информативность ТАБ при МРЩЖ неудовлетворительна.
• Предоперационная компьютерная томография (КТ) шеи и органов грудной клетки и трехфазная КТ печени с контрастным усилением или МРТ с контрастным усилением рекомендованы всем пациентам с МРЩЖ при наличии регионарных метастазов в лимфатических узлах (N1) или при сывороточном уровне кальцитонина >400 пг/мл с целью исключения отдаленных метастазов [2].
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
• ПЭТ с флудезоксиглюкозой [18F] и визуализация рецепторов к соматостатину не рекомендуются как рутинные методы для первоначального скрининга на предмет наличия метастазов МРЩЖ у пациентов, у которых данные ТАБ и/или уровень кальцитонина позволяют поставить или заподозрить диагноз МРЩЖ [2].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с МРЩЖ рекомендовано обязательное предоперационное обследование с целью обнаружения феохромоцитомы [17 ].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств 5).
Комментарий. Оперативное лечение по поводу МРЩЖ и, что особенно важно, анестезиологическое пособие при недиагностированной феохромоцитоме ассоциировано с крайне высоким риском фатальных событий.
При МРЩЖ в рамках синдрома МЭН 2-го типа описаны феохромоцитомы исключительно надпочечниковой локализации, в связи с чем обследование для выявления внеабдоминальной локализации этой опухоли не рекомендовано. Для исключения феохромоцитомы может использоваться любой из следующих критериев:
• отрицательный тест на наличие мутации RET;
• нормальный уровень свободных метанефринов в плазме крови или фракционироввнных метанефринов в суточной моче;
• отсутствие патологических изменений надпочечников по данным КТ или МРТ.
2,5 Иные диагностические исследования.
Не предусмотрено.|
|
Лечение
Назначение и применение лекарственных препаратов, указанных в клинической рекомендации, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• В случае постановки диагноза МРЩЖ после гемитиреоидэктомии повторная операция - тотальная тиреоидэктомия с удалением центральной клетчатки шеи (VI уровня) - рекомендована при мультицентрическом росте опухоли, наличии опухолевой ткани в крае резекции, наличии опухоли в контралатеральной доле ЩЖ по данным ТАБ или смыва на кальцитонин, клинических данных о метастазировании в регионарные лимфатические узлы, наличии мутации RET, семейном анамнезе синдрома МЭН 2-го типа или увеличении уровня кальцитонина при послеоперационном наблюдении [2].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с МРЩЖ и клиническими данными о метастазировании в лимфатические узлы боковой клетчатки шеи (выявленных при УЗИ метастазах в боковых треугольниках шеи) при отсутствии отдаленных метастазов или ограниченных отдаленных метастазах рекомендована тотальная тиреоидэктомия с удалением клетчатки центральной (VI уровня) и боковой (II, III, IV, V уровней) зоны шеи c целью повышения выживаемости [6].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При наличии отдаленных метастазов агрессивное хирургическое вмешательство нерекомендовано, но может проводиться в некоторых случаях с целью предотвращения или ликвидации компрессионного и болевого синдрома с условием максимального сохранения жизненно важных функций - речи, глотания, функции околощитовидных желез [6].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств 5).
• В качестве препарата выбора для системной терапии распространенных форм МРЩЖ с целью повышения выживаемости рекомендован вандетаниб** 300 мг 1 раз в сутки перорально [18,] с учетом переносимости.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарий. При непереносимости или отсутствии эффективности вандетаниб** может быть заменен на кабозантиниб 140 мг 1 раз в сутки перорально до прогрессирования или неприемлемой токсичности [19]. Таргетная терапия ингибиторами протеинкиназ назначается пациентам при доказанном прогрессировании опухоли (RECIST 1,1) в случаях:
• неоперабельного МРЩЖ;
• метастазов МРЩЖ;
• угрожающих жизни симптомов;
• развития паранеопластических эндокринных синдромов (диареи, АКТГ-зависимого гиперкортицизма).
Изолированное повышение уровня кальцитонина и РЭА без наличия документированных метастазов не является основанием для назначения системной терапии. От назначения системной терапии целесообразно воздержаться также при небольших, медленно прогрессирующих метастазах и времени удвоения уровня кальцитонина и РЭА >2 лет.
При метастатическом поражении костей скелета при выраженном болевом синдроме или угрозе переломов при невозможности хирургического лечения с паллиативной целью рекомендована дистанционной лучевой терапии (ДЛТ) [20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При МРЩЖ с костными метастазами с целью снижения риска патологических переломов и симптомов болезни рекомендована терапия бисфосфонатами [21].
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 4).
При наличии солитарных метастазов в головном мозге рекомендовано хирургическое лечение, а также проведение стереотаксической лучевой терапии [22, 23].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
Диетотерапия.
Не применяется.
3,1 Хирургическое лечение.
• При отсутствии данных о регионарном или отдаленном метастазировании у пациентов с МРЩЖ рекомендована тиреоидэктомия с удалением паратрахеальной клетчатки VI уровня с целью снижения риска рецидива и адекватного стадирования заболевания [6].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• В случае постановки диагноза МРЩЖ после гемитиреоидэктомии повторная операция - тотальная тиреоидэктомия с удалением центральной клетчатки шеи (VI уровня) - рекомендована при мультицентрическом росте опухоли, наличии опухолевой ткани в крае резекции, наличии опухоли в контралатеральной доле ЩЖ по данным ТАБ или смыва на кальцитонин, клинических данных о метастазировании в регионарные лимфатические узлы, наличии мутации RET, семейном анамнезе синдрома МЭН 2-го типа или увеличении уровня кальцитонина при послеоперационном наблюдении [2].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с МРЩЖ и клиническими данными о метастазировании в лимфатические узлы боковой клетчатки шеи (выявленных при УЗИ метастазах в боковых треугольниках шеи) при отсутствии отдаленных метастазов или ограниченных отдаленных метастазах рекомендована тотальная тиреоидэктомия с удалением клетчатки центральной (VI уровня) и боковой (II, III, IV, V уровней) зоны шеи c целью повышения выживаемости [6].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При наличии отдаленных метастазов агрессивное хирургическое вмешательство нерекомендовано, но может проводиться в некоторых случаях с целью предотвращения или ликвидации компрессионного и болевого синдрома с условием максимального сохранения жизненно важных функций - речи, глотания, функции околощитовидных желез [6].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3,2 Медикаментозное лечение.
• Пациентам с МРЩЖ после тиреоидэктомии рекомендована заместительная (не супрессивная) терапия левотироксином натрия** с целевым уровнем тиреотропного гормона в пределах от 0,5 до 2,5 мЕд/л [2].Уровень убедительности рекомендаций. С (уровень достоверности доказательств 5).
• В качестве препарата выбора для системной терапии распространенных форм МРЩЖ с целью повышения выживаемости рекомендован вандетаниб** 300 мг 1 раз в сутки перорально [18,] с учетом переносимости.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарий. При непереносимости или отсутствии эффективности вандетаниб** может быть заменен на кабозантиниб 140 мг 1 раз в сутки перорально до прогрессирования или неприемлемой токсичности [19]. Таргетная терапия ингибиторами протеинкиназ назначается пациентам при доказанном прогрессировании опухоли (RECIST 1,1) в случаях:
• неоперабельного МРЩЖ;
• метастазов МРЩЖ;
• угрожающих жизни симптомов;
• развития паранеопластических эндокринных синдромов (диареи, АКТГ-зависимого гиперкортицизма).
Изолированное повышение уровня кальцитонина и РЭА без наличия документированных метастазов не является основанием для назначения системной терапии. От назначения системной терапии целесообразно воздержаться также при небольших, медленно прогрессирующих метастазах и времени удвоения уровня кальцитонина и РЭА >2 лет.
При метастатическом поражении костей скелета при выраженном болевом синдроме или угрозе переломов при невозможности хирургического лечения с паллиативной целью рекомендована дистанционной лучевой терапии (ДЛТ) [20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• При МРЩЖ с костными метастазами с целью снижения риска патологических переломов и симптомов болезни рекомендована терапия бисфосфонатами [21].
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 4).
При наличии солитарных метастазов в головном мозге рекомендовано хирургическое лечение, а также проведение стереотаксической лучевой терапии [22, 23].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
3,3 Обезболивание.
Порядок обезболивания и рекомендации по его проведению при МРЩЖ соответствуют рекомендациям «Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи», представленным в рубрикаторе клинических рекомендаций Минздрава России.Диетотерапия.
Не применяется.
Реабилитация и амбулаторное лечение
Общие принципы реабилитации пациентов после проведенных хирургических вмешательств, лучевой терапии и/или химиотерапии соответствуют рекомендациям по злокачественным новообразованиям головы и шеи, представленным в рубрикаторе клинических рекомендаций Минздрава России «Злокачественные новообразования полости рта».
Профилактика
5,1 Профилактика.
Пациентам с генетической мутацией RET группы высочайшего риска МРЩЖ рекомендуется выполнить тиреоидэктомию в возможно более ранние сроки в течение 1-го года жизни. [24].Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
Комментарии. Решение о выполнении лимфодиссекции должно быть принято на основании клинических данных о регионарном метастазировании. В настоящий момент поврежденные кодоны RET-онкогена выделены в 3 группы риска МРЩЖ (по АТА-2016):
• высочайший риск - 918-й кодон;
• высокий риск - 883-й и 634-й кодоны;
• умеренный риск - все остальные точки мутации.
• Пациентам с генетической мутацией RET группы высокого риска МРЩЖ рекомендована тиреоидэктомия в 5-летнем возрасте или ранее, если при ежегодном обследовании выявлен базальный уровень кальцитонина >40 пг/мл либо есть клинические данные о наличии узла МРЩЖ и/или метастатическом поражении лимфатических узлов шеи (в этих случаях должна выполняться и лимфодиссекция в соответствии с изложенными выше рекомендациями) [2].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с генетической мутацией RET группы умеренного риска МРЩЖ рекомендовано ежегодное обследование начиная с 5-летнего возраста. Оперативное лечение назначают при базальном уровне кальцитонина >40 пг/мл либо при получении клинических данных о наличии узла МРЩЖ и/или о метастатическом поражении лимфатических узлов шеи (в этих случаях должна выполняться и лимфодиссекция в соответствии с изложенными выше рекомендациями) [2].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
5,2 Диспансерное наблюдение.
После хирургического лечения для определения исходов и планирования долговременного ведения пациентов с МРЩЖ рекомендована послеоперационная стратификация риска с использованием протокола TNM [25].Уровень убедительности рекомендаций. с (уровень достоверности доказательств 4).
После хирургического лечения для определения исходов и планирования долговременного ведения пациентов с МРЩЖ рекомендована оценка уровня базального кальцитонина [26].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств 4).
После хирургического лечения для определения исходов и планирования долговременного ведения пациентов с МРЩЖ при отсутствии биохимической ремиссии рекомендована оценка времени удвоения уровня базального кальцитонина и ракового эмбрионального антигена (РЭА) [27].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств 4).
• После операции с целью исключения прогрессирования болезни уровень опухолевых маркеров - кальцитонина и РЭА - рекомендовано впервые исследовать через 2-3 мес, затем один раз в 6-12 месяцев [6].
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 4).
Комментарий. Основным критерием биохимической ремиссии считается базальный уровень кальцитонина <10 пг/мл, риск персистенции МРЩЖ расценивается как минимальный. В случае достижения биохимической ремиссии целесообразно пожизненное наблюдение пациентов с ежегодной оценкой уровня кальцитонина без выполнения каких-либо других топических исследований.
• Пациентам с отсутствием послеоперационной биохимической ремиссии и уровнем кальцитонина <150 пг/мл рекомендовано выполнение УЗИ шеи c целью выявления структурного рецидива [4].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств 5).
Комментарий. После хирургического лечения невысоким, но определяемым считается уровень кальцитонина worse 150 пг / мл. Такой уровень может быть ассоциирован только с местно-.
Распространенным процессом. Отдаленные метастазы в данной ситуации возможны, однако при подобном уровне кальцитонина они единичны, обычно небольшого размера и, как правило, трудно верифицируемы.
• При послеоперационном уровне кальцитонина >150 пг/мл рекомендовано выполнение УЗИ шеи, КТ органов грудной клетки с контрастированием, МРТ печени с контрастным усилением или ПЭТ всего тела с целью выявления структурного прогрессирования заболевания [4].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии: Достоверно повышенным уровнем кальцитонина после хирургического лечения считается значение >150 пг/мл. Чем выше уровень кальцитонина, тем больше вероятность отдаленных метастазов. Выполнение ПЭТ с 18F-DOPA и соматотостатин-рецепторной сцинтиграфии позволяет более точно стадировать заболевание.
|
|
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21,11,2011 № 323-ФЗ (ред. от 25,05,2019) «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
• в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
• в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
• на основе настоящих клинических рекомендаций;
• с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента онкологического заболевания или подозрении на него врачи-терапевты, участковые врачи-терапевты, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации медуллярного рака ЩЖ, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При выявлении у пациента онкологического заболевания или возникновении подозрении на него в ходе оказания скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты патологоанатомической верификации МРЩЖ или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний к проведению патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология», определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями к госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений онкологического заболевания, требующих оказания пациенту специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения (хирургического вмешательства, лучевой терапии, лекарственной терапии ) онкологического заболевания.
Показаниями к госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическому вмешательству, лучевой терапии, в том числе контактной, ДЛТ и других видов, лекарственной терапии ), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при отсутствии осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при отсутствии осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию выносится после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
• в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
• в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
• на основе настоящих клинических рекомендаций;
• с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента онкологического заболевания или подозрении на него врачи-терапевты, участковые врачи-терапевты, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации медуллярного рака ЩЖ, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При выявлении у пациента онкологического заболевания или возникновении подозрении на него в ходе оказания скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты патологоанатомической верификации МРЩЖ или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний к проведению патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология», определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями к госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений онкологического заболевания, требующих оказания пациенту специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения (хирургического вмешательства, лучевой терапии, лекарственной терапии ) онкологического заболевания.
Показаниями к госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическому вмешательству, лучевой терапии, в том числе контактной, ДЛТ и других видов, лекарственной терапии ), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при отсутствии осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при отсутствии осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию выносится после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
Дополнительно
Факторы, влияющие на исход медуллярного РЩЖ:
• распространенность опухолевого процесса;
• локализация метастатических очагов;
• локализация мутаций в гене RET.
• этиологический вариант медуллярного РЩЖ: спорадический или генетически детерменированный.
• развитие нежелательных явлений препаратов для таргетной терапии.
• распространенность опухолевого процесса;
• локализация метастатических очагов;
• локализация мутаций в гене RET.
• этиологический вариант медуллярного РЩЖ: спорадический или генетически детерменированный.
• развитие нежелательных явлений препаратов для таргетной терапии.
|
|
Критерии оценки качества медицинской помощи
| № | Критерии качества | Уровень убедительности рекомендаций | Уровень достоверности доказательств | |
| 1. | Выполнено исследование уровня кальцитонина в сыворотке крови при узловом зобе (при установлении диагноза) | А | 1 | |
| 2. | Оценены клинические и анамнестические признаки наличия у пациента рака щитовидной железы | В | 2 | |
| 3. | Выполнено исследование уровня кальцитонина в смыве тонкоигольной аспирационной биопсии при высоком нормальном уровне базального кальцитонина | В | 2 | |
| 4. | Проведено предоперационное исключение феохромоцитомы или подтверждено ее наличие | А | 1 | |
| 5. | Выбран и выполнен оптимальный объем оперативного вмешательства в соответствии с предоперационным стадированием медуллярного рака щитовидной железы | В | 3 | |
| 6. | Проведена заместительная гормональная терапия после хирургического вмешательства | В | 2 | |
| 7. | Выполнены компьютерная томография орагнов грудной клетки, магнитно-резонансная томография печени, позитронно-эмиссионная томография всего тела стадирования распространенности процесса при уровне послеоперационного кальцитонина >150 пг/мл | С | 4 | |
| 8. | Проведено лечение мультикиназными ингибиторами в соответствии с наличием показаний, касающихся распространенности и агрессивности персистирования медуллярного рака щитовидной железы | В | 2 | |
Список литературы
• Бржезовский В.Ж. Опухоли щитовидной железы. В кн. А.И. Пачес Опухоли головы и шеи. 5-е изд., доп. и перераб. М. Практическая медицина, 2013. С. 339-359.
• Диагностика и лечение медуллярного рака щитовидной железы. национальные клинические рекомендации. опухоли головы и шеи. 2013;(4):36-45.
• Газизова Д.О., Бельцевич Д.Г. Современный взгляд на проблему диагностики и лечения медуллярного рака щитовидной железы. Эндокринная хирургия 2013;(3):4-21.
• Wells S.A. Revised American Thyroid Association Guidelines for the Management of MTC (2015). Thyroid 2015;25(6):567-610.
• Howlader N., Noone p.m, Krapcho M. et al. (eds). SEER сancer Statistics Review, 1975-2014, National сancer Institute. Available at: https://seer.cancer.gov/csr/1975_2014.
• NCCN сlinical Practice Guidelines in Oncology (NCCN Guidelines®). Thyroid сarcinoma. Version 2,2019.
• Аllelein, S., Ehlers, M., Morneau, с. (2017). Measurement of вasal Serum сalcitonin for the Diagnosis of Medullary Thyroid сancer. Hormone and Metabolic Research, 50(01), 23-28.
• сostante G., Meringolo D., Durante с. et al. Predictive value of serum calcitonin levels for preoperative diagnosis of medullary thyroid carcinoma in a cohort of 5817 consecutive patients with thyroid nodules. J сlin Endocrinol Metab 2007;92:450-5.
• вasuyau, J.-P. (2004). Reference Intervals for Serum сalcitonin in Men, Women, and сhildren. сlinical сhemistry, 50(10), 1828-1830. doi:10,1373/clinchem.2003,026963.
• Yocum M.W., вutterfield J.H., Gharib H. Increased plasma calcitonin levels in systemic mast cell disease. Mayo сlin Proc 1994;69:987-90.
• Schuetz M., Duan H., Wahl K. et al. T lymphocyte cytokine production patterns in Hashimoto patients with elevated calcitonin levels and their relationship to tumor initiation. Anticancer Res 2006;26:4591-6.
• вoi F., Maurelli I., Pinna G. et al. сalcitonin measurement in wash-out fluid from fine needle aspiration of neck masses in patients with primary and metastatic medullary thyroid carcinoma. J сlin Endocrinol Metab 2007;92:2115-8.
• Kudo T., Miyauchi A., Ito Y. et al. Diagnosis of medullary thyroid carcinoma by calcitonin measurement in fine-needle aspiration biopsy specimens. Thyroid 2007;17:635-8.
• Elisei R., сosci в., Romei с. et al. Prognostic significance of somatic RET oncogene mutations in sporadic medullary thyroid cancer: a 10-year follow-up study. J сlin Endocrinol Metab 2008;93:682-7.
• Alexander E.K., сooper D. The importance, and important limitations, of ultrasound imaging for evaluating thyroid nodules. JAMA Intern Med 2013;173:1796-7.
• Friedrich-Rust M., Meyer G., Dauth N. et al. Interobserver agreement of Thyroid Imaging Reporting and Data System (TIRADS) and strain elastography for the assessment of thyroid nodules. PLoS One 2013;8:e77927.
• Roy, M., сhen, H., & Sippel, R. S. (2013). сurrent Understanding and Management of Medullary Thyroid сancer. The Oncologist, 18(10), 1093-1100.
• Trimboli, P., сastellana, M., Virili, с., Giorgino, F., & Giovanella, L. (2018). Efficacy of Vandetanib in Treating Locally Advanced or Metastatic Medullary Thyroid сarcinoma According to RECIST сriteria: A Systematic Review and Meta-Analysis. Frontiers in Endocrinology.
• Elisei R., Schlumberger M.J., Muller S.P. et al. сabozantinib in progressive medullary thyroid cancer. J сlin Oncol 2013;31:3639-46.
• Terezakis S.A., Lee N.Y. The role of radiation therapy in the treatment of medullary thyroid cancer. J Natl сompr сanc Netw 2010;8:532-40.
• Vitale G., Fonderico F., Martignetti A. et al. Pamidronate improves the quality of life and induces clinical remission of bone metastases in patients with thyroid cancer. вr J сancer 2001;84:1586-90.
• Kim I.Y., Kondziolka D., Niranjan A. Gamma knife radiosurgery for metastatic brain tumors from thyroid cancer. J Neurooncol 2009;93:355-9.
• вorcek P., Asa S.L., Gentili F. et al. вrain metastasis from medullary thyroid carcinoma. вMJ сase Rep 2010;pii:bcr0920103301.
• Tavares MR, Toledo SP, Montenegro FL, et al. Surgical approach to medullary thyroid carcinoma associated with multiple endocrine neoplasia type 2. сlinics (Sao Paulo). 2012;67 Suppl 1(Suppl 1):149-154. doi:10,6061/clinics/2012(sup01)25.
• Mathiesen, J. S., Kroustrup, J. P., Vestergaard, P., et al. (2019). Survival and long-term biochemical cure in medullary thyroid carcinoma in Denmark 1997-2014: A nationwide study. Thyroid.
• Pellegriti, G., Leboulleux, S., вaudin, E. et al. Long-term outcome of medullary thyroid carcinoma in patients with normal postoperative medical imaging. вr J сancer 88, 1537-1542 (2003).
• вarbet J., сampion L., Kraeber-Bodere F., сhatal J.F. Prognostic impact of serum calcitonin and carcinoembryonic antigen doubling-times in patients with medullary thyroid carcinoma. J сlin Endocrinol Metab 2005;90:6077-84.
• Диагностика и лечение медуллярного рака щитовидной железы. национальные клинические рекомендации. опухоли головы и шеи. 2013;(4):36-45.
• Газизова Д.О., Бельцевич Д.Г. Современный взгляд на проблему диагностики и лечения медуллярного рака щитовидной железы. Эндокринная хирургия 2013;(3):4-21.
• Wells S.A. Revised American Thyroid Association Guidelines for the Management of MTC (2015). Thyroid 2015;25(6):567-610.
• Howlader N., Noone p.m, Krapcho M. et al. (eds). SEER сancer Statistics Review, 1975-2014, National сancer Institute. Available at: https://seer.cancer.gov/csr/1975_2014.
• NCCN сlinical Practice Guidelines in Oncology (NCCN Guidelines®). Thyroid сarcinoma. Version 2,2019.
• Аllelein, S., Ehlers, M., Morneau, с. (2017). Measurement of вasal Serum сalcitonin for the Diagnosis of Medullary Thyroid сancer. Hormone and Metabolic Research, 50(01), 23-28.
• сostante G., Meringolo D., Durante с. et al. Predictive value of serum calcitonin levels for preoperative diagnosis of medullary thyroid carcinoma in a cohort of 5817 consecutive patients with thyroid nodules. J сlin Endocrinol Metab 2007;92:450-5.
• вasuyau, J.-P. (2004). Reference Intervals for Serum сalcitonin in Men, Women, and сhildren. сlinical сhemistry, 50(10), 1828-1830. doi:10,1373/clinchem.2003,026963.
• Yocum M.W., вutterfield J.H., Gharib H. Increased plasma calcitonin levels in systemic mast cell disease. Mayo сlin Proc 1994;69:987-90.
• Schuetz M., Duan H., Wahl K. et al. T lymphocyte cytokine production patterns in Hashimoto patients with elevated calcitonin levels and their relationship to tumor initiation. Anticancer Res 2006;26:4591-6.
• вoi F., Maurelli I., Pinna G. et al. сalcitonin measurement in wash-out fluid from fine needle aspiration of neck masses in patients with primary and metastatic medullary thyroid carcinoma. J сlin Endocrinol Metab 2007;92:2115-8.
• Kudo T., Miyauchi A., Ito Y. et al. Diagnosis of medullary thyroid carcinoma by calcitonin measurement in fine-needle aspiration biopsy specimens. Thyroid 2007;17:635-8.
• Elisei R., сosci в., Romei с. et al. Prognostic significance of somatic RET oncogene mutations in sporadic medullary thyroid cancer: a 10-year follow-up study. J сlin Endocrinol Metab 2008;93:682-7.
• Alexander E.K., сooper D. The importance, and important limitations, of ultrasound imaging for evaluating thyroid nodules. JAMA Intern Med 2013;173:1796-7.
• Friedrich-Rust M., Meyer G., Dauth N. et al. Interobserver agreement of Thyroid Imaging Reporting and Data System (TIRADS) and strain elastography for the assessment of thyroid nodules. PLoS One 2013;8:e77927.
• Roy, M., сhen, H., & Sippel, R. S. (2013). сurrent Understanding and Management of Medullary Thyroid сancer. The Oncologist, 18(10), 1093-1100.
• Trimboli, P., сastellana, M., Virili, с., Giorgino, F., & Giovanella, L. (2018). Efficacy of Vandetanib in Treating Locally Advanced or Metastatic Medullary Thyroid сarcinoma According to RECIST сriteria: A Systematic Review and Meta-Analysis. Frontiers in Endocrinology.
• Elisei R., Schlumberger M.J., Muller S.P. et al. сabozantinib in progressive medullary thyroid cancer. J сlin Oncol 2013;31:3639-46.
• Terezakis S.A., Lee N.Y. The role of radiation therapy in the treatment of medullary thyroid cancer. J Natl сompr сanc Netw 2010;8:532-40.
• Vitale G., Fonderico F., Martignetti A. et al. Pamidronate improves the quality of life and induces clinical remission of bone metastases in patients with thyroid cancer. вr J сancer 2001;84:1586-90.
• Kim I.Y., Kondziolka D., Niranjan A. Gamma knife radiosurgery for metastatic brain tumors from thyroid cancer. J Neurooncol 2009;93:355-9.
• вorcek P., Asa S.L., Gentili F. et al. вrain metastasis from medullary thyroid carcinoma. вMJ сase Rep 2010;pii:bcr0920103301.
• Tavares MR, Toledo SP, Montenegro FL, et al. Surgical approach to medullary thyroid carcinoma associated with multiple endocrine neoplasia type 2. сlinics (Sao Paulo). 2012;67 Suppl 1(Suppl 1):149-154. doi:10,6061/clinics/2012(sup01)25.
• Mathiesen, J. S., Kroustrup, J. P., Vestergaard, P., et al. (2019). Survival and long-term biochemical cure in medullary thyroid carcinoma in Denmark 1997-2014: A nationwide study. Thyroid.
• Pellegriti, G., Leboulleux, S., вaudin, E. et al. Long-term outcome of medullary thyroid carcinoma in patients with normal postoperative medical imaging. вr J сancer 88, 1537-1542 (2003).
• вarbet J., сampion L., Kraeber-Bodere F., сhatal J.F. Prognostic impact of serum calcitonin and carcinoembryonic antigen doubling-times in patients with medullary thyroid carcinoma. J сlin Endocrinol Metab 2005;90:6077-84.
|
|
Приложения
Приложение А1.
Состав рабочей группы по разработке и пересмотру клинических рекомендаций.• Бельцевич Дмитрий Германович , д.м.н., профессор, главный научный сотрудник отдела хирургии; адрес: Россия, 117036, Москва, ул. Дм. Ульянова, д. 11; ORCID: 0000-0001-7098-4584; eLibrary SPIN: 4475-6327; e-mail: belts67@gmail.com.
• Мудунов Али Мурадович, д.м.н., профессор, заведующий отделом опухолей головы и шеи НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, президент Российского общества специалистов по опухолям головы и шеи; ORCID: 0000-0002-0918-3857; eLibrary SPIN: 3516-6616, e-mail: ali.mudunov@info.ru.
• Ванушко Владимир Эдуардович, д.м.н., главный научный сотрудник отдела хирургии; ORCID: 0000-0001-6338-7490; eLibrary SPIN: 6097-8990; e-mail: vanushko@gmail.com.
• Румянцев Павел Олегович, д.м.н., заведующий отделом радионуклидной диагностики и терапии, член Российского общества специалистов по опухолям головы и шеи; ORCID: 0000-0002-7721-634X; eLibrary SPIN: 7085-7976; e-mail: pavelrum@gmail.com.
• Мельниченко Галина Афанасьевна, академик РАН, д.м.н., профессор, директор Института клинической эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России; ORCID: 0000-0002-5634-7877; eLibrary SPIN: 8615-0038; e-mail: teofrast2000@mail.ru.
• Кузнецов Николай Сергеевич, д.м.н., профессор, заведующий отделом эндокринной хирургии; eLibrary SPIN: 8412-1098; e-mail: kuznetsovnikolays@yandex.ru.
• Подвязников Сергей Олегович, д.м.н., профессор, ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, вице-президент Российского общества специалистов по опухолям головы и шеи.
• Алымов Юрий Владимирович, к.м.н., врач-онколог хирургического отделения опухолей головы и шеи НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, исполнительный директор Российского общества специалистов по опухолям головы и шеи; ORCID: 0000-0002-6851-9867, e-mail: allmedperevod@gmail.com.
• Поляков Андрей Павлович, д.м.н., руководитель отделения микрохирургии МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России, член Российского общества специалистов по опухолям головы и шеи; ORCID: 0000-0002-5894-1917; e-mail: appolyakov@mail.ru.
• Слепцов Илья Валерьевич , д.м.н., профессор кафедры хирургии с курсом хирургической эндокринологии Института усовершенствования врачей, заместитель директора по медицинской части; ORCID: 0000-0002-1903-5081; eLibrary SPIN: 2481-4331; e-mail: newsurgery@yandex.ru.
• Черников Роман Анатольевич, д.м.н., заведующий отделением эндокринологии и эндокринной хирургии; ORCID: 0000-0002-3001-664X; eLibrary SPIN-код: 7093-1088;
E-mail: yaddd@yandex.ru.
• Фадеев Валентин Викторович, член-корреспондент РАН, д.м.н., профессор, заведующий кафедрой эндокринологии; ORCID: 0000-0002-3026-6315; eLibrary SPIN: 6825-8417; e-mail: walfad@mail.ru.
• Болотин Михаил Викторович, к.м.н., cтарший научный сотрудник хирургического отделения опухолей головы и шеи НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Российского общества специалистов по опухолям головы и шеи.
• Севрюков Феликс Евгеньевич, заведующий отделом лучевого и хирургического лечения заболеваний головы и шеи МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Крылов Валерий Васильевич, д.м.н, Заведующий отделением радиохирургического лечения открытыми нуклидами МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Феденко Александр Александрович, заведующий Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Болотина Лариса Владимировна, заведующий Отделения химиотерапии Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Фалалеева Наталья Александровна, заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Филоненко Елена Вячеславовна, заведующий Центра лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Невольских Алексей Алексеевич , д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Иванов Сергей Анатольевич , профессор РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Хайлова Жанна Владимировна, к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Геворкян Тигран Гагикович, заместитель директора НИИ КЭР ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Жаров Андрей Александрович, патологоанатом ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
• Врачи-эндокринологи;
• Врачи-онкологи (хирурги, химиотерапевты, радиологи);
• врачи-хирурги.
• врачи-патологоанатомы.
• Врачи-рентгенологи.
• Врачи-радиологи.
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 3Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| УДД | Расшифровка |
| 1 | Систематический обзор рандомизированных клинических исследований с применением метаанализа |
| 2 | Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 4. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| УУР | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| в | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| с | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем 1 раз в 3 года, а также при появлении новых данных с позиций доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации, при наличии обоснованных дополнений/замечаний к ранее утвержденным рекомендациям, но не чаще 1 раза в 6 мес.
Приложение А3.
Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата.Профилактическая тиреоидэктомия. В это понятие входит тиреоидэктомия у пациентов с отсутствием клинических проявлений МРЩЖ с доказанной мутацией RET без узловых образований ЩЖ размером >5 измененных лимфатических узлов по данным УЗИ и с уровнем базального кальцитонина <40 пг/мл. Основная цель профилактической тиреоидэктомии - предотвращение метастазирования. Метод позволяет избежать проведения центральной лимфодиссекции, которая ассоциирована с более высоким риском гипопаратиреоза и повреждения возвратных гортанных нервов. Оптимальные сроки выполнения профилактической тиреоидэктомии определяются на основании статуса мутации RET (сведений о поврежденном кодоне), в группе умеренного риска - на основании данных о подъеме уровня кальцитонина. У некоторых пациентов с синдромом МЭН типа 2В, несмотря на профилактическую тиреоидэктомию, выполненную вскоре после рождения, появляются метастазы МРЩЖ.
В настоящий момент поврежденные кодоны RET-онкогена выделены в 3 группы риска МРЩЖ (по АТА-2016):
• высочайший риск - 918-й кодон;
• высокий риск - 883-й и 634-й кодоны;
• умеренный риск - все остальные точки мутации.
Приложение В.
Информация для пациента.• При обнаруженной наследственной мутации при медуллярном раке щитовидной железы молекулярно-генетический анализ проводится не только пациенту, но и его кровным родственникам (детям, сибсам, родителям);
• При планировании беременности пациентам с подозрением и или доказанным семейным вариантом рака щитовидной железы следует получить консультацию врача-генетика.
Приложение Г1-ГN.
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.Шаблон включения клинических шкал оценки, вопросников и других.
Оценочных инструментов состояния пациента.
Название на русском языке:
Оригинальное название (если есть):
Источник (официальный сайт разработчиков, публикация с.
Валидацией):
Тип (подчеркнуть):
• шкала оценки.
• индекс.
• вопросник.
• другое (уточнить):________________________________________________.
Назначение:
Оценочный инструмент, содержание:
Ключ (интерпретация):
Пояснения (при необходимости).
Приложение Г1. Критерии оценки ответа солидных опухолей на лечение.
По RECIST 1,1 (Response Evaluation сriteria in Solid Tumors).
Название на русском языке: Критерии оценки эффективности лечения при солидных опухолях.
Оригинальное название: Response Evaluation сriteria In Solid Tumours (version 1,1).
Источник: Eisenhauer E. A., Therasse P., вogaerts J., Schwartz L. H., Sargent D., Ford R. et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1,1). European Journal of сancer. 2009. 45 (2): 228-247. Epub 23 December 2008.
Тип: шкала оценки.
Назначение: оценка ответа на противоопухолевое лечение.
Содержание (шаблон) и ключи (интерпретация):
Общий ответ по отношению к выявляемым опухолевым массам.
| Полный ответ (complete response, сR) | Полное исчезновение всех опухолевых поражений в течение 4 нед. с момента документации полного ответа |
| Частичный ответ (partial response, PR) | Уменьшение по сравнению с исходным значением на 50 % и более суммы измерений 2 наибольших перпендикулярных диаметров, что определяется в 2 наблюдениях по крайней мере в течение 4 нед. При этом должны отсутствовать признаки прогрессирования заболевания |
| Прогрессирование заболевания (progressive disease, PD) | Увеличение размеров опухоли, появление любого нового очага, или нового выпота, или асцита, связанного с опухолью |
| Стабилизация заболевания (stable disease, SD) | Несоответствие критериям сR или PR при отсутствии PD |
Оценка размеров основного опухолевого очага.
| Полный ответ (complete response, сR) | Исчезновение всех основных очагов. Любой из увеличенных лимфатических узлов (основных или дополнительных) должен иметь короткую ось <10 мм |
| Частичный ответ (partial response, PR) | Уменьшение суммы диаметров основных очагов не менее чем на 30 % |
| Прогрессирование заболевания (progressive disease, PD) | Увеличение на 20 % и более суммы диаметров основных очагов, которая в абсолютном выражении составляет не менее 5 появление одного или нескольких новых очагов |
| Стабилизация заболевания (stable disease, SD) | Несоответствие критериям сR или PR при отсутствии PD |
Оценка метастатических очагов.
| Полный ответ (complete response, сR) | Исчезновение всех дополнительных очагов и нормализация уровня опухолевых маркеров. Все лимфатические узлы должны иметь размер <10 мм по короткой оси |
| Сомнительный ответ (non-CR/non-PD) | сохранение одного или нескольких нетаргетных очагов и/или сохранение уровня опухолевого маркера выше нормы |
| Прогрессирование заболевания (progressive disease, PD) | Однозначное прогрессирование дополнительных очагов, появление одного или нескольких новых очагов |
Пояснения: отсутствуют.
|
|
Год актуализации информации
2020.
Связанные заболевания
Связанные клинические рекомендации
Связанные стандарты мед. помощи
- Стандарт медицинской помощи взрослым при нейроэндокринных опухолях
- Стандарт медицинской помощи больным со злокачественным новообразованием щитовидной железы (при оказании специализированной помощи)
- Стандарт медицинской помощи больным со злокачественным новообразованием щитовидной железы
- Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях щитовидной железы 0-IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению)
- Стандарт специализированной медицинской помощи при злокачественных новообразованиях щитовидной железы III-IV стадии (послеоперационная лучевая терапия)
- Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях щитовидной железы 0-IV стадии (обследование при проведении диспансерного наблюдения)