Pharmacological Group
Latin name
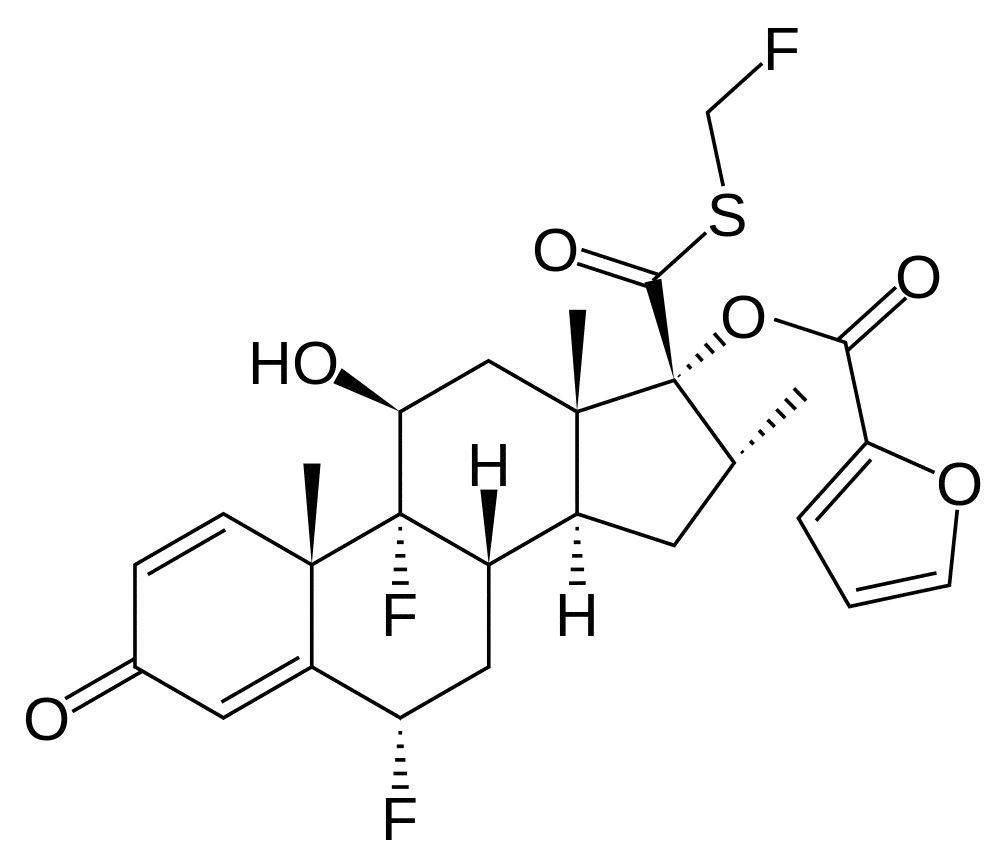
Fluticasoni furoas ( Fluticasoni furoatis).
Chemical name
(6альфа,11бета,16альфа,17альфа)-6,9-дифтор-17-([(фтор-метил)тио]карбонил)-11-гидрокси-16-метил-3-оксоандроста-1,4-диен-17-ил 2-фуранкарбоксилат.
Used in the treatment
CAS Code
80474-14-2.
Pharmacological action
Противовоспалительное местное, глюкокортикоидное.
Characteristics of the substance
Синтетический фторированный ГКС. Белый порошок, практически нерастворим в воде, молекулярная масса 538,6 Да.
Pharmacodynamics
Механизм действия.
Флутиказона фуроат представляет собой синтетический трифторированный ГКС с выраженной противовоспалительной активностью. Точный механизм воздействия флутиказона фуроата на симптомы ринита неизвестен. Было показано, что ГКС обладают широким спектром действия на различные типы клеток (например, тучные клетки, эозинофилы, нейтрофилы, макрофаги, лимфоциты) и медиаторы (например, гистамин, эйкозаноиды, ЛТ, цитокины), участвующие в реакциях воспаления. Специфические эффекты флутиказона фуроата, продемонстрированные в моделях in vitro >in vitro и in vivo >in vivo, включали активацию ответа на ГКС, ингибирование провоспалительных факторов транскрипции, таких как NFkB, и ингибирование антигениндуцированной эозинофилии легких у сенсибилизированных крыс. Было показано in vitro >in vitro, что флутиказона фуроат проявляет аффинность связывания с глюкокортикоидными рецепторами человека, которая примерно в 29,9 раза выше, чем у дексаметазона, и в 1,7 раза выше, чем у флутиказона пропионата. Клиническая значимость этих результатов неизвестна.
Фармакодинамика.
Функция надпочечников.
Влияние флутиказона фуроата в виде назального спрея на функцию надпочечников оценивали в четырех контролируемых клинических исследованиях у пациентов с круглогодичным аллергическим ринитом. Два 6-недельных клинических исследования были разработаны специально для оценки влияния флутиказона фуроата в виде назального спрея на ГГНС с оценкой как 24-часовой экскреции кортизола с мочой, так и уровня кортизола в сыворотке крови у госпитализированных пациентов. Кроме того, одно 52-недельное исследование безопасности и одно 12-недельное исследование безопасности и эффективности включали оценку 24-часовой экскреции кортизола с мочой. Дизайн исследований и их результаты описаны ниже. Во всех четырех иследованиях определение флутиказона фуроата в сыворотке, как правило, было ниже предела количественного определения, поэтому соблюдение режима лечения подтверждалось оценкой эффективности.
Клинические исследования, специально разработанные для оценки эффекта на ГГНС. В 6-недельном рандомизированном двойном слепом исследовании с параллельными группами у взрослых и подростков в возрасте 12 лет и старше с круглогодичным аллергическим ринитом сравнивали применение флутиказона фуроата в виде назального спрея в дозе 110 мкг и плацебо или преднизолона в дозе 10 мг перорально 1 раз в день в течение последних 7 дней периода лечения в группе положительного контроля. Функцию надпочечников оценивали по 24-часовой экскреции кортизола с мочой до и после 6 нед лечения, а также по серийным уровням кортизола в сыворотке. Пациенты были госпитализированы для сбора данных об уровне кортизола в моче в течение 24 Через 6 нед применения средняя 24-часовая экскреция кортизола с мочой в группе, получавшей флутиказона фуроат (n=43), изменилась по сравнению с исходным уровнем на −1,16 мкг/сут по сравнению с −3,48 мкг/сут в группе плацебо (n=42). Разница с группой плацебо составила 2,32 мкг/сут (95% ДИ: −6,76; 11,39). Данные по уровню кортизола в моче не были доступны для группы положительного контроля (преднизолон). После 6 нед лечения наблюдалось изменение среднего (0-24 ч) уровня кортизола в сыворотке крови от исходного уровня на −0,38 и 0,08 мкг/дл в группе, получавшей флутиказона фуроат (n=43), и группе плацебо (n=44) соответственно с разницей 0,47 мкг/дл (95% ДИ: −1,31; 0,37). Для сравнения, в группе лечения с положительным контролем (преднизолон, n=12) наблюдалось изменение среднего уровня кортизола в сыворотке (0-24 ч) по сравнению с исходным уровнем на −4,49 мкг/дл с разницей между группами преднизолона и плацебо −4,57 мкг/дл (95% ДИ: −5,83; −3,31).
Второе 6-недельное исследование, проведенное с участием детей от 2 до 11 лет, имело дизайн, аналогичный исследованию у взрослых, включая оценку функции надпочечников, но не включало группу положительного контроля (преднизолон). Пациенты получали назально 1 раз в день флутиказона фуроат в дозе 110 мкг или плацебо. Через 6 нед произошло изменение средней 24-часовой экскреции кортизола с мочой в группе, получавшей флутиказона фуроат (n=43), на 0,49 мкг/сут по сравнению с 1,92 мкг/сут в группе плацебо (n=41) с разницей между группами −1,43 мкг/сут (95% ДИ: −5,21; 2,35). Наблюдалось изменение среднего уровня кортизола в сыворотке крови через 6 нед (0-24 ч) от исходного уровня на −0,34 и −0,23 мкг/дл в группах получавших флутиказона фуроат (n=48) и плацебо (n=47) соответственно с разницей между группами −0,11 мкг/дл (95% ДИ: −0,88; 0,66).
Дополнительная оценка действия на ГГНС. В 52-недельном исследовании безопасности у подростков и взрослых от 12 лет и старше с круглогодичным аллергическим ринитом сравнивали назальное применение флутиказона фуроата в дозе 110 мкг (n=605) и плацебо (n=201). Функцию надпочечников оценивали по 24-часовой экскреции кортизола с мочой у пациентов, получавших флутиказона фуроат (n=370) или плацебо (n=120) до и после 52 нед лечения. Через 52 нед применения среднее изменение суточной экскреции кортизола с мочой по сравнению с исходным уровнем составило 5,84 мкг/сут в группе получавших флутиказона фуроат и 3,34 мкг/сут в группе плацебо. Отличие от плацебо составило 2,5 мкг/сут (95% ДИ: ≤5,49; 10,49).
В 12-недельном исследовании безопасности и эффективности у детей от 2 до 11 лет с круглогодичным аллергическим ринитом назальный спрей флутиказона фуроата в дозе 55 (n=185) и 110 (n=185) мкг сравнивали с плацебо (n=188). Функцию надпочечников оценивали путем измерения 24-часового содержания свободного кортизола в моче у пациентов от 6 до 11 лет (от 103 до 109 пациентов в группе) до и после 12 нед применения. Через 12 нед наблюдалось снижение средней 24-часовой экскреции кортизола с мочой по сравнению с исходным уровнем в группе получавших флутиказона фуроат в дозе 55 мкг (n=109) на −2,93 мкг/сут и в группе получавших флутиказона фуроат в дозе 110 мкг (n=103) на −2,07 мкг/сут по сравнению с увеличением в группе плацебо (n=107) на 0,08 мкг/сут. Разница по сравнению с плацебо в группах получавших флутиказона фуроат в дозе 55 и 110 мкг составила −3,01 мкг/сут (95% ДИ: −6,16; 0,13) и −2,14 мкг/сут (95% ДИ: −5,33; 1,04) соответственно.
Принимая во внимание в целом вышеописанные результаты оценки действия на ГГНС, нельзя исключить влияние интраназального введения флутиказона фуроата на функцию надпочечников, особенно у детей.
Влияние на ССС.
Не отмечено влияния применения флутиказона фуроата на интервал QTc. Действие однократной ингаляционной дозы флутиказона фуроата 4000 мкг на интервал QTc оценивали в течение 24 ч у 40 здоровых мужчин и женщин в плацебо-контролируемом перекрестном иследовании с положительным контролем (однократная доза моксифлоксацина 400 мг перорально). Максимальное среднее изменение QTcF по сравнению с исходным уровнем после применения флутиказона фуроата было сходно с наблюдаемым при применении плацебо с разницей в 0,788 мс (90% ДИ: −1,802; 3,378). В то же время, прием моксифлоксацина в дозе 400 мг приводил к удлинению максимального среднего изменения QTcF по сравнению с плацебо на 9,929 мс (90% ДИ: 7,339; 12,520). Хотя однократная доза флутиказона фуроата не влияла на интервал QTc, эффекты флутиказона фуроата в равновесном состояния и после однократной дозы могут не совпадать. Влияние флутиказона фуроата на интервал QTc после многократного приема неизвестно.
Флутиказона фуроат представляет собой синтетический трифторированный ГКС с выраженной противовоспалительной активностью. Точный механизм воздействия флутиказона фуроата на симптомы ринита неизвестен. Было показано, что ГКС обладают широким спектром действия на различные типы клеток (например, тучные клетки, эозинофилы, нейтрофилы, макрофаги, лимфоциты) и медиаторы (например, гистамин, эйкозаноиды, ЛТ, цитокины), участвующие в реакциях воспаления. Специфические эффекты флутиказона фуроата, продемонстрированные в моделях in vitro >in vitro и in vivo >in vivo, включали активацию ответа на ГКС, ингибирование провоспалительных факторов транскрипции, таких как NFkB, и ингибирование антигениндуцированной эозинофилии легких у сенсибилизированных крыс. Было показано in vitro >in vitro, что флутиказона фуроат проявляет аффинность связывания с глюкокортикоидными рецепторами человека, которая примерно в 29,9 раза выше, чем у дексаметазона, и в 1,7 раза выше, чем у флутиказона пропионата. Клиническая значимость этих результатов неизвестна.
Фармакодинамика.
Функция надпочечников.
Влияние флутиказона фуроата в виде назального спрея на функцию надпочечников оценивали в четырех контролируемых клинических исследованиях у пациентов с круглогодичным аллергическим ринитом. Два 6-недельных клинических исследования были разработаны специально для оценки влияния флутиказона фуроата в виде назального спрея на ГГНС с оценкой как 24-часовой экскреции кортизола с мочой, так и уровня кортизола в сыворотке крови у госпитализированных пациентов. Кроме того, одно 52-недельное исследование безопасности и одно 12-недельное исследование безопасности и эффективности включали оценку 24-часовой экскреции кортизола с мочой. Дизайн исследований и их результаты описаны ниже. Во всех четырех иследованиях определение флутиказона фуроата в сыворотке, как правило, было ниже предела количественного определения, поэтому соблюдение режима лечения подтверждалось оценкой эффективности.
Клинические исследования, специально разработанные для оценки эффекта на ГГНС. В 6-недельном рандомизированном двойном слепом исследовании с параллельными группами у взрослых и подростков в возрасте 12 лет и старше с круглогодичным аллергическим ринитом сравнивали применение флутиказона фуроата в виде назального спрея в дозе 110 мкг и плацебо или преднизолона в дозе 10 мг перорально 1 раз в день в течение последних 7 дней периода лечения в группе положительного контроля. Функцию надпочечников оценивали по 24-часовой экскреции кортизола с мочой до и после 6 нед лечения, а также по серийным уровням кортизола в сыворотке. Пациенты были госпитализированы для сбора данных об уровне кортизола в моче в течение 24 Через 6 нед применения средняя 24-часовая экскреция кортизола с мочой в группе, получавшей флутиказона фуроат (n=43), изменилась по сравнению с исходным уровнем на −1,16 мкг/сут по сравнению с −3,48 мкг/сут в группе плацебо (n=42). Разница с группой плацебо составила 2,32 мкг/сут (95% ДИ: −6,76; 11,39). Данные по уровню кортизола в моче не были доступны для группы положительного контроля (преднизолон). После 6 нед лечения наблюдалось изменение среднего (0-24 ч) уровня кортизола в сыворотке крови от исходного уровня на −0,38 и 0,08 мкг/дл в группе, получавшей флутиказона фуроат (n=43), и группе плацебо (n=44) соответственно с разницей 0,47 мкг/дл (95% ДИ: −1,31; 0,37). Для сравнения, в группе лечения с положительным контролем (преднизолон, n=12) наблюдалось изменение среднего уровня кортизола в сыворотке (0-24 ч) по сравнению с исходным уровнем на −4,49 мкг/дл с разницей между группами преднизолона и плацебо −4,57 мкг/дл (95% ДИ: −5,83; −3,31).
Второе 6-недельное исследование, проведенное с участием детей от 2 до 11 лет, имело дизайн, аналогичный исследованию у взрослых, включая оценку функции надпочечников, но не включало группу положительного контроля (преднизолон). Пациенты получали назально 1 раз в день флутиказона фуроат в дозе 110 мкг или плацебо. Через 6 нед произошло изменение средней 24-часовой экскреции кортизола с мочой в группе, получавшей флутиказона фуроат (n=43), на 0,49 мкг/сут по сравнению с 1,92 мкг/сут в группе плацебо (n=41) с разницей между группами −1,43 мкг/сут (95% ДИ: −5,21; 2,35). Наблюдалось изменение среднего уровня кортизола в сыворотке крови через 6 нед (0-24 ч) от исходного уровня на −0,34 и −0,23 мкг/дл в группах получавших флутиказона фуроат (n=48) и плацебо (n=47) соответственно с разницей между группами −0,11 мкг/дл (95% ДИ: −0,88; 0,66).
Дополнительная оценка действия на ГГНС. В 52-недельном исследовании безопасности у подростков и взрослых от 12 лет и старше с круглогодичным аллергическим ринитом сравнивали назальное применение флутиказона фуроата в дозе 110 мкг (n=605) и плацебо (n=201). Функцию надпочечников оценивали по 24-часовой экскреции кортизола с мочой у пациентов, получавших флутиказона фуроат (n=370) или плацебо (n=120) до и после 52 нед лечения. Через 52 нед применения среднее изменение суточной экскреции кортизола с мочой по сравнению с исходным уровнем составило 5,84 мкг/сут в группе получавших флутиказона фуроат и 3,34 мкг/сут в группе плацебо. Отличие от плацебо составило 2,5 мкг/сут (95% ДИ: ≤5,49; 10,49).
В 12-недельном исследовании безопасности и эффективности у детей от 2 до 11 лет с круглогодичным аллергическим ринитом назальный спрей флутиказона фуроата в дозе 55 (n=185) и 110 (n=185) мкг сравнивали с плацебо (n=188). Функцию надпочечников оценивали путем измерения 24-часового содержания свободного кортизола в моче у пациентов от 6 до 11 лет (от 103 до 109 пациентов в группе) до и после 12 нед применения. Через 12 нед наблюдалось снижение средней 24-часовой экскреции кортизола с мочой по сравнению с исходным уровнем в группе получавших флутиказона фуроат в дозе 55 мкг (n=109) на −2,93 мкг/сут и в группе получавших флутиказона фуроат в дозе 110 мкг (n=103) на −2,07 мкг/сут по сравнению с увеличением в группе плацебо (n=107) на 0,08 мкг/сут. Разница по сравнению с плацебо в группах получавших флутиказона фуроат в дозе 55 и 110 мкг составила −3,01 мкг/сут (95% ДИ: −6,16; 0,13) и −2,14 мкг/сут (95% ДИ: −5,33; 1,04) соответственно.
Принимая во внимание в целом вышеописанные результаты оценки действия на ГГНС, нельзя исключить влияние интраназального введения флутиказона фуроата на функцию надпочечников, особенно у детей.
Влияние на ССС.
Не отмечено влияния применения флутиказона фуроата на интервал QTc. Действие однократной ингаляционной дозы флутиказона фуроата 4000 мкг на интервал QTc оценивали в течение 24 ч у 40 здоровых мужчин и женщин в плацебо-контролируемом перекрестном иследовании с положительным контролем (однократная доза моксифлоксацина 400 мг перорально). Максимальное среднее изменение QTcF по сравнению с исходным уровнем после применения флутиказона фуроата было сходно с наблюдаемым при применении плацебо с разницей в 0,788 мс (90% ДИ: −1,802; 3,378). В то же время, прием моксифлоксацина в дозе 400 мг приводил к удлинению максимального среднего изменения QTcF по сравнению с плацебо на 9,929 мс (90% ДИ: 7,339; 12,520). Хотя однократная доза флутиказона фуроата не влияла на интервал QTc, эффекты флутиказона фуроата в равновесном состояния и после однократной дозы могут не совпадать. Влияние флутиказона фуроата на интервал QTc после многократного приема неизвестно.
Pharmacokinetics
Абсорбция.
После интраназального введения флутиказона фуроата большая часть дозы в конечном итоге проглатывается и подвергается неполной абсорбции и экстенсивному первичному метаболизму в печени и кишечнике, что приводит к незначительному системному воздействию. При максимальной рекомендуемой интраназальной дозе 110 мкг 1 раз в день в течение 12 мес у взрослых и до 12 нед у детей концентрация флутиказона фуроата в плазме, как правило, не поддается количественному определению при использовании чувствительных методов анализа с пределом количественного определения 10 пг/мл. Однако в отдельных случаях (<0,3%) флутиказона фуроат был обнаружен в концентрациях выше 500 пг/мл, а в одном случае концентрация достигала 1430 пг/мл в ходе 52-недельного исследования. Не выявлено связи между этими концентрациями и уровнями кортизола у этих субъектов. Причины таких высоких концентраций неизвестны.
Абсолютную биодоступность оценивали у 16 пациентов мужского и женского пола после применения флутиказона фуроата в сверхтерапевтических дозах (880 мкг интраназально с интервалом 8 10 доз или 2640 мкг/сут). Средняя абсолютная биодоступность составила 0,5% (90% ДИ: 0,34; 0,74%).
Из-за низкой биодоступности при интраназальном введении большинство фармакокинетических данных было получено при других путях введения. Исследования, проведенные с использованием перорального раствора и в/в введения радиоактивно меченного препарата, показали, что не менее 30% флутиказона фуроата всасывается и затем быстро выводится из плазмы. Пероральная биодоступность составляет в среднем 1,26%, а бóльшая часть циркулирующей радиоактивности связана с неактивными метаболитами.
Распределение.
После в/в введения средний ssVss составляет 608 л. Связывание флутиказона фуроата с белками плазмы человека превышает 99%.
Метаболизм.
Исследования in vivo >in vivo не выявили признаков отщепления фуроатного остатка с образованием флутиказона. Флутиказона фуроат выводится (общий плазменный клиренс 58,7 л/ч) из системного кровотока в основном путем метаболизма в печени с участием сYP3A4. Основным путем метаболизма является гидролиз S-фторметилкарботиоатной группы с образованием неактивного метаболита 17β-карбоновой кислоты.
Элиминация.
Флутиказона фуроат и его метаболиты выводятся в основном с калом, составляя примерно 100 и 90% дозы, введенной перорально и в/в соответственно. Выведение с мочой составляет примерно 1 и 2% соответственно. 1/2T1/2 после в/в введения составил в среднем 15,1.
Особые группы пациентов.
Флутиказона фуроат обычно не поддается количественному определению в плазме после интраназального применения в дозе 110 мкг 1 раз в сутки, за исключением отдельных случаев очень высокого уровня в плазме крови. В целом поддающиеся количественному определению уровни (>10 пг/мл) наблюдались у <31% пациентов 12 лет и старше и у <16% детей от 2 до 11 лет после интраназального введения в дозе 110 мкг 1 раз в день и у <7 % детей после интраназального введения в дозе 55 мкг 1 раз в день. Не было доказательств того, что наличие или отсутствие обнаруживаемых уровней флутиказона фуроата было связано с полом, возрастом или расой.
Печеночная недостаточность. Фармакокинетика флутиказона фуроата после интраназального введения у пациентов с печеночной недостаточностью не оценивалась. Имеющиеся данные по ингаляционному применению комбинации вилантерол + флутиказона фуроат применимы к интраназальному введению флутиказона фуроата. После повторного ингаляционного введения комбинации вилантерол + флутиказона фуроат 25/200 мкг (12,5/100 мкг в группе с тяжелыми нарушениями) в течение 7 дней системное воздействие флутиказона фуроата (AUC) увеличилось на 34, 83 и 75% у пациентов с легкой, средней и тяжелой печеночной недостаточностью соответственно по сравнению со здоровыми людьми. У пациентов с умеренной печеночной недостаточностью, получавших комбинацию вилантерол + флутиказона фуроат (25/200 мкг), средний уровень кортизола в сыворотке (0-24 ч) был снижен на 34% (90% ДИ: 11; 51%) по сравнению со здоровыми субъектами. У пациентов с тяжелой печеночной недостаточностью, получавших комбинацию вилантерол + флутиказона фуроат (12,5/100 мкг), средний уровень кортизола в сыворотке (0-24 ч) повышался на 14% (90% ДИ: −16; 55%) по сравнению со здоровыми субъектами.
Почечная недостаточность. Флутиказона фуроат не обнаруживается в моче у здоровых добровольцев после интраназального введения. Менее 1% дозы выводится с мочой.
Канцерогенность, мутагенность, влияние на фертильность.
Флутиказона фуроат не вызывал связанного с лечением увеличения частоты возникновения опухолей в 2-летних ингаляционных исследованиях на крысах и мышах в дозах до 9 и 19 мкг/кг/сут соответственно (меньше, чем интраназальная МРДЧ для взрослых и детей в пересчете на площадь поверхности тела).
Флутиказона фуроат не вызывал генной мутации у бактерий или хромосомных повреждений в тесте на мутацию клеток млекопитающих в клетках мышиной лимфомы L5178Y in vitro >in vitro. Также не было выявлено признаков генотоксичности в микроядерном тесте in vivo >in vivo на крысах.
В исследованиях репродуктивной функции, проведенных на самцах и самках крыс при ингаляции флутиказона фуроата в дозах до 24 и 91 мкг/кг/сут соответственно (примерно в 2 и 7 раз больше интраназальной МРДЧ у взрослых в расчете на площадь поверхности тела), признаков нарушения фертильности не наблюдалось).
Клинические исследования.
Сезонный и круглогодичный аллергический ринит.
Взрослые и подростки в возрасте 12 лет и старше.
Эффективность и безопасность применения назального спрея флутиказона фуроата оценивали в пяти рандомизированных двойных слепых с параллельными группами, многоцентровых, плацебо-контролируемых клинических исследованиях продолжительностью от 2 до 4 нед у взрослых и подростков в возрасте 12 лет и старше с симптомами сезонного или круглогодичного аллергического ринита. Эти исследования включали одно 2-недельное по подбору доз у пациентов с сезонным аллергическим ринитом, три 2-недельных подтверждающих исследования эффективности у пациентов с сезонным аллергическим ринитом и одно 4-недельное исследование эффективности у пациентов с круглогодичным аллергическим ринитом. В исследования были включены 1829 пациентов (697 мужчин и 1132 женщины). Около 75% пациентов были представителями европеоидной расы, средний возраст составлял 36 лет. Из общего числа 722 пациента получали флутиказона фуроат в дозе 110 мкг 1 раз в день по 2 впрыскивания в каждую ноздрю.
Оценка эффективности основывалась на общей оценке назальных симптомов (TNSS). TNSS рассчитывается как сумма оценок пациентов по 4 отдельным назальным симптомам (ринорея, заложенность носа, чихание и зуд в носу) по шкале тяжести от 0 до 3 баллов (0 - отсутствует, 1 - легкая, 2 - умеренная, 3 - тяжелая), как ретроспективная (rTNSS) или мгновенная (iTNSS). Для оценки rTNSS пациенты должны были регистрировать тяжесть симптомов за предыдущие 12 для оценки iTNSS требовалось регистрировать тяжесть симптомов непосредственно перед применением следующей дозы. Утренние и вечерние баллы rTNSS усреднялись в течение периода лечения, основной конечной точкой эффективности было изменение исходного уровня rTNSS по сравнению с плацебо. Показатель утренней iTNSS (AM iTNSS) является оценкой в конце 24-часового интервала дозирования и показателем того, сохранялся ли эффект в течение 24-часового интервала дозирования.
Были оценены дополнительные вторичные переменные эффективности, включая общую оценку глазных симптомов (TOSS) и опросник качества жизни при риноконъюнктивите (RQLQ). TOSS рассчитывается как сумма оценок пациентов по трем отдельным глазным симптомам (зуд/жжение, слезотечение и покраснение) по шкале тяжести от 0 до 3 баллов (0 - отсутствует, 1 - легкая, 2 - умеренная, 3 - тяжелая), как ретроспективная (rTOSS) или мгновенная (iTOSS). Оценки rTOSS и AM iTOSS проводили как описано выше для TNSS. Восприятие пациентами качества жизни, связанного с конкретным заболеванием, оценивали с помощью опросника RQLQ по 28 пунктам в 7 областях (активность, сон, не носовые/глазные симптомы, практические проблемы, назальные симптомы, глазные симптомы и эмоциональная оценка) по 7-балльной шкале, где 0 - отсутствие нарушений и 6 - максимальное ухудшение. Общий балл RQLQ рассчитывали на основе среднего значения всех показателей. Абсолютная разница ≥0,5 в среднем изменении от исходного уровня по сравнению с плацебо считается минимально важной разницей (MID) для RQLQ.
Исследование по подбору доз. В этом 2-недельном исследовании оценивали эффективность применения 4 доз флутиказона фуроата (440, 220, 110 и 55 мкг) у пациентов с сезонным аллергическим ринитом. Каждая из 4 доз назального спрея продемонстрировала большее и статичиски значимое снижение rTNSS, чем плацебо (таблица 1).
Таблица 1.
Среднее изменение общей оценки назальных симптомов по сравнению с исходным уровнем за 2 нед у пациентов с сезонным аллергическим ринитом.
Каждая из 4 доз назального спрея флутиказона фуроата также продемонстрировала большее снижение AM iTNSS, чем плацебо, и разница между каждой из 4 групп, получавших флутиказона фуроат и плацебо была статистически значимой, что указывает на то, что эффект сохранялся в течение 24-часового интервал дозирования.
Сезонный аллергический ринит. Проведены три клинических исследования для оценки эффективности применения назального спрея флутиказона фуроата в дозе 110 мкг 1 раз в день по сравнению с плацебо у пациентов с сезонным аллергическим ринитом в течение 2-недельного периода лечения. Во всех трех исследованиях флутиказона фуроат 110 мкг продемонстрировал большее по сравнению с исходным уровнем снижение показателей rTNSS и AM iTNSS, чем плацебо, и разница с плацебо была статистически значимой. Что касается симптомов глазных заболеваний, во всех трех исследованиях сезонного аллергического ринита флутиказона фуроат продемонстрировал большее снижение rTOSS по сравнению с исходным уровнем, чем плацебо, и разница с плацебо была статистически значимой. Это же относится и к оценке по RQLQ, разница в среднем значении общего показателя RQLQ по сравнению с исходным уровнем между группами, получавшими флутиказона фуроат и плацебо, варьировала от −0,6 до −0,7 в трех исследованиях, что соответствовало критерию MID. Результаты репрезентативного исследования эффективности у пациентов с сезонным аллергическим ринитом представлены в таблице 2.
Круглогодичный аллергический ринит. Проведено одно 4-недельное клиническое исследование для оценки эффективности применения назального спрея флутиказона фуроата в дозе 110 мкг 1 раз в день по сравнению с плацебо у пациентов с круглогодичным аллергическим ринитом. Флутиказона фуроат продемонстрировал большее и статистическое значимое снижение по сравнению с исходным уровнем в оценках rTNSS и AM iTNSS, чем плацебо. Как и в случае сезонного аллергического ринита, улучшение назальных симптомов при применении флутиказона фуроата у пациентов с круглогодичным аллергическим ринитом сохранялось в течение полных 24 ч по оценке AM iTNSS непосредственно перед введением следующей дозы. Однако в отличие от сезонного аллергического ринита, у пациентов с круглогодичным аллергическим ринитом, получавших флутиказона фуроат в дозе 110 мкг, не наблюдалось статистически значимого улучшения по сравнению с исходным уровнем в оценках rTOSS или RQLQ по сравнению с плацебо. Кроме того, среднее изменение общего балла по RQLQ по сравнению с исходным уровнем между группами, получавшими флутиказона фуроат и плацебо, составило −0,23, что не соответствовало минимально значимой разнице ≥0,5. Результаты клинического исследования эффективности у пациентов с круглогодичным аллергическим ринитом представлены в таблице 2.
Таблица 2.
Средние изменения показателей эффективности у взрослых и подростков с сезонным или круглогодичным аллергическим ринитом.
Начало действия оценивали по частоте оценок iTNSS после первой дозы в клинических исследованиях у пациентов с сезонным и круглогодичным аллергическим ринитом. Начало действия обычно наблюдалось в течение 24 ч у пациентов с сезонным аллергическим ринитом. У больных круглогодичным ринитом начало действия наблюдалось через 4 дня лечения. Продолжающееся улучшение симптомов наблюдалось в течение примерно 1 и 3 нед у пациентов с сезонным или круглогодичным аллергическим ринитом соответственно.
Педиатрические пациенты в возрасте от 2 до 11 лет.
Эффективность и безопасность применения назального спрея флутиказона фуроата оценивали у 1112 детей (633 мальчика и 479 девочек) в среднем возрасте 8 лет с сезонным или круглогодичным аллергическим ринитом в двух контролируемых клинических исследованиях. Пациенты получали флутиказона фуроат в дозе 55 или 110 мкг 1 раз в день в течение 2-12 нед (n=369 для каждой дозы). Исследования по дизайну были аналогичны проведенным с участием подростков и взрослых, однако определение эффективности проводилось на основе данных TNSS, сообщаемых пациентом или родителем/опекуном, для детей в возрасте от 6 до 12 лет. Дети, получавшие флутиказона фуроат, как правило, демонстрировали большее уменьшение назальных симптомов, чем получавшие плацебо. При сезонном аллергическом рините разница в rTNSS была статистически значимой только для дозы 110 мкг. При круглогодичном аллергическом рините разница в rTNSS была статистически значимой только для дозы 55 мкг. Изменения rTOSS в исследовании сезонного аллергического ринита не были статистически значимыми по сравнению с плацебо для любой дозы. rTOSS не оценивали в исследовании круглогодичного аллергического ринита. В таблице 3 представлены результаты клинических исследований эффективности у детей в возрасте от 6 до 12 лет с круглогодичным аллергическим ринитом и сезонным аллергическим ринитом. Эффективность у детей в возрасте от 2 до 6 лет подтверждалась числовым снижением rTNSS.
Таблица 3.
Средние изменения переменных эффективности у педиатрических пациентов в возрасте от 6 до <12 лет с сезонным или круглогодичным аллергическим ринитом.
После интраназального введения флутиказона фуроата большая часть дозы в конечном итоге проглатывается и подвергается неполной абсорбции и экстенсивному первичному метаболизму в печени и кишечнике, что приводит к незначительному системному воздействию. При максимальной рекомендуемой интраназальной дозе 110 мкг 1 раз в день в течение 12 мес у взрослых и до 12 нед у детей концентрация флутиказона фуроата в плазме, как правило, не поддается количественному определению при использовании чувствительных методов анализа с пределом количественного определения 10 пг/мл. Однако в отдельных случаях (<0,3%) флутиказона фуроат был обнаружен в концентрациях выше 500 пг/мл, а в одном случае концентрация достигала 1430 пг/мл в ходе 52-недельного исследования. Не выявлено связи между этими концентрациями и уровнями кортизола у этих субъектов. Причины таких высоких концентраций неизвестны.
Абсолютную биодоступность оценивали у 16 пациентов мужского и женского пола после применения флутиказона фуроата в сверхтерапевтических дозах (880 мкг интраназально с интервалом 8 10 доз или 2640 мкг/сут). Средняя абсолютная биодоступность составила 0,5% (90% ДИ: 0,34; 0,74%).
Из-за низкой биодоступности при интраназальном введении большинство фармакокинетических данных было получено при других путях введения. Исследования, проведенные с использованием перорального раствора и в/в введения радиоактивно меченного препарата, показали, что не менее 30% флутиказона фуроата всасывается и затем быстро выводится из плазмы. Пероральная биодоступность составляет в среднем 1,26%, а бóльшая часть циркулирующей радиоактивности связана с неактивными метаболитами.
Распределение.
После в/в введения средний ssVss составляет 608 л. Связывание флутиказона фуроата с белками плазмы человека превышает 99%.
Метаболизм.
Исследования in vivo >in vivo не выявили признаков отщепления фуроатного остатка с образованием флутиказона. Флутиказона фуроат выводится (общий плазменный клиренс 58,7 л/ч) из системного кровотока в основном путем метаболизма в печени с участием сYP3A4. Основным путем метаболизма является гидролиз S-фторметилкарботиоатной группы с образованием неактивного метаболита 17β-карбоновой кислоты.
Элиминация.
Флутиказона фуроат и его метаболиты выводятся в основном с калом, составляя примерно 100 и 90% дозы, введенной перорально и в/в соответственно. Выведение с мочой составляет примерно 1 и 2% соответственно. 1/2T1/2 после в/в введения составил в среднем 15,1.
Особые группы пациентов.
Флутиказона фуроат обычно не поддается количественному определению в плазме после интраназального применения в дозе 110 мкг 1 раз в сутки, за исключением отдельных случаев очень высокого уровня в плазме крови. В целом поддающиеся количественному определению уровни (>10 пг/мл) наблюдались у <31% пациентов 12 лет и старше и у <16% детей от 2 до 11 лет после интраназального введения в дозе 110 мкг 1 раз в день и у <7 % детей после интраназального введения в дозе 55 мкг 1 раз в день. Не было доказательств того, что наличие или отсутствие обнаруживаемых уровней флутиказона фуроата было связано с полом, возрастом или расой.
Печеночная недостаточность. Фармакокинетика флутиказона фуроата после интраназального введения у пациентов с печеночной недостаточностью не оценивалась. Имеющиеся данные по ингаляционному применению комбинации вилантерол + флутиказона фуроат применимы к интраназальному введению флутиказона фуроата. После повторного ингаляционного введения комбинации вилантерол + флутиказона фуроат 25/200 мкг (12,5/100 мкг в группе с тяжелыми нарушениями) в течение 7 дней системное воздействие флутиказона фуроата (AUC) увеличилось на 34, 83 и 75% у пациентов с легкой, средней и тяжелой печеночной недостаточностью соответственно по сравнению со здоровыми людьми. У пациентов с умеренной печеночной недостаточностью, получавших комбинацию вилантерол + флутиказона фуроат (25/200 мкг), средний уровень кортизола в сыворотке (0-24 ч) был снижен на 34% (90% ДИ: 11; 51%) по сравнению со здоровыми субъектами. У пациентов с тяжелой печеночной недостаточностью, получавших комбинацию вилантерол + флутиказона фуроат (12,5/100 мкг), средний уровень кортизола в сыворотке (0-24 ч) повышался на 14% (90% ДИ: −16; 55%) по сравнению со здоровыми субъектами.
Почечная недостаточность. Флутиказона фуроат не обнаруживается в моче у здоровых добровольцев после интраназального введения. Менее 1% дозы выводится с мочой.
Канцерогенность, мутагенность, влияние на фертильность.
Флутиказона фуроат не вызывал связанного с лечением увеличения частоты возникновения опухолей в 2-летних ингаляционных исследованиях на крысах и мышах в дозах до 9 и 19 мкг/кг/сут соответственно (меньше, чем интраназальная МРДЧ для взрослых и детей в пересчете на площадь поверхности тела).
Флутиказона фуроат не вызывал генной мутации у бактерий или хромосомных повреждений в тесте на мутацию клеток млекопитающих в клетках мышиной лимфомы L5178Y in vitro >in vitro. Также не было выявлено признаков генотоксичности в микроядерном тесте in vivo >in vivo на крысах.
В исследованиях репродуктивной функции, проведенных на самцах и самках крыс при ингаляции флутиказона фуроата в дозах до 24 и 91 мкг/кг/сут соответственно (примерно в 2 и 7 раз больше интраназальной МРДЧ у взрослых в расчете на площадь поверхности тела), признаков нарушения фертильности не наблюдалось).
Клинические исследования.
Сезонный и круглогодичный аллергический ринит.
Взрослые и подростки в возрасте 12 лет и старше.
Эффективность и безопасность применения назального спрея флутиказона фуроата оценивали в пяти рандомизированных двойных слепых с параллельными группами, многоцентровых, плацебо-контролируемых клинических исследованиях продолжительностью от 2 до 4 нед у взрослых и подростков в возрасте 12 лет и старше с симптомами сезонного или круглогодичного аллергического ринита. Эти исследования включали одно 2-недельное по подбору доз у пациентов с сезонным аллергическим ринитом, три 2-недельных подтверждающих исследования эффективности у пациентов с сезонным аллергическим ринитом и одно 4-недельное исследование эффективности у пациентов с круглогодичным аллергическим ринитом. В исследования были включены 1829 пациентов (697 мужчин и 1132 женщины). Около 75% пациентов были представителями европеоидной расы, средний возраст составлял 36 лет. Из общего числа 722 пациента получали флутиказона фуроат в дозе 110 мкг 1 раз в день по 2 впрыскивания в каждую ноздрю.
Оценка эффективности основывалась на общей оценке назальных симптомов (TNSS). TNSS рассчитывается как сумма оценок пациентов по 4 отдельным назальным симптомам (ринорея, заложенность носа, чихание и зуд в носу) по шкале тяжести от 0 до 3 баллов (0 - отсутствует, 1 - легкая, 2 - умеренная, 3 - тяжелая), как ретроспективная (rTNSS) или мгновенная (iTNSS). Для оценки rTNSS пациенты должны были регистрировать тяжесть симптомов за предыдущие 12 для оценки iTNSS требовалось регистрировать тяжесть симптомов непосредственно перед применением следующей дозы. Утренние и вечерние баллы rTNSS усреднялись в течение периода лечения, основной конечной точкой эффективности было изменение исходного уровня rTNSS по сравнению с плацебо. Показатель утренней iTNSS (AM iTNSS) является оценкой в конце 24-часового интервала дозирования и показателем того, сохранялся ли эффект в течение 24-часового интервала дозирования.
Были оценены дополнительные вторичные переменные эффективности, включая общую оценку глазных симптомов (TOSS) и опросник качества жизни при риноконъюнктивите (RQLQ). TOSS рассчитывается как сумма оценок пациентов по трем отдельным глазным симптомам (зуд/жжение, слезотечение и покраснение) по шкале тяжести от 0 до 3 баллов (0 - отсутствует, 1 - легкая, 2 - умеренная, 3 - тяжелая), как ретроспективная (rTOSS) или мгновенная (iTOSS). Оценки rTOSS и AM iTOSS проводили как описано выше для TNSS. Восприятие пациентами качества жизни, связанного с конкретным заболеванием, оценивали с помощью опросника RQLQ по 28 пунктам в 7 областях (активность, сон, не носовые/глазные симптомы, практические проблемы, назальные симптомы, глазные симптомы и эмоциональная оценка) по 7-балльной шкале, где 0 - отсутствие нарушений и 6 - максимальное ухудшение. Общий балл RQLQ рассчитывали на основе среднего значения всех показателей. Абсолютная разница ≥0,5 в среднем изменении от исходного уровня по сравнению с плацебо считается минимально важной разницей (MID) для RQLQ.
Исследование по подбору доз. В этом 2-недельном исследовании оценивали эффективность применения 4 доз флутиказона фуроата (440, 220, 110 и 55 мкг) у пациентов с сезонным аллергическим ринитом. Каждая из 4 доз назального спрея продемонстрировала большее и статичиски значимое снижение rTNSS, чем плацебо (таблица 1).
Таблица 1.
Среднее изменение общей оценки назальных симптомов по сравнению с исходным уровнем за 2 нед у пациентов с сезонным аллергическим ринитом.
| Лечение | n | Исходный уровень | Изменение от исходного уровня | Отличие от плацебо | ||
| Различие средних значений, определенных методом наименьших квадратов | 95% ДИ | Значение p | ||||
| Флутиказона фуроат, 440 мкг | 130 | 9,6 | −4,02 | −2,19 | −2,75; −1,62 | <0,001 |
| Флутиказона фуроат, 220 мкг | 129 | 9,5 | −3,19 | −1,36 | −1,93; −0,79 | <0,001 |
| Флутиказона фуроат, 110 mкг | 127 | 9,5 | −3,84 | −2,01 | −2,58; −1,44 | <0,001 |
| Флутиказона фуроат, 55 мкг | 125 | 9,6 | −3,5 | −1,68 | −2,25; −1,1 | <0,001 |
| Плацебо | 128 | 9,6 | −1,83 | − | − | − |
Каждая из 4 доз назального спрея флутиказона фуроата также продемонстрировала большее снижение AM iTNSS, чем плацебо, и разница между каждой из 4 групп, получавших флутиказона фуроат и плацебо была статистически значимой, что указывает на то, что эффект сохранялся в течение 24-часового интервал дозирования.
Сезонный аллергический ринит. Проведены три клинических исследования для оценки эффективности применения назального спрея флутиказона фуроата в дозе 110 мкг 1 раз в день по сравнению с плацебо у пациентов с сезонным аллергическим ринитом в течение 2-недельного периода лечения. Во всех трех исследованиях флутиказона фуроат 110 мкг продемонстрировал большее по сравнению с исходным уровнем снижение показателей rTNSS и AM iTNSS, чем плацебо, и разница с плацебо была статистически значимой. Что касается симптомов глазных заболеваний, во всех трех исследованиях сезонного аллергического ринита флутиказона фуроат продемонстрировал большее снижение rTOSS по сравнению с исходным уровнем, чем плацебо, и разница с плацебо была статистически значимой. Это же относится и к оценке по RQLQ, разница в среднем значении общего показателя RQLQ по сравнению с исходным уровнем между группами, получавшими флутиказона фуроат и плацебо, варьировала от −0,6 до −0,7 в трех исследованиях, что соответствовало критерию MID. Результаты репрезентативного исследования эффективности у пациентов с сезонным аллергическим ринитом представлены в таблице 2.
Круглогодичный аллергический ринит. Проведено одно 4-недельное клиническое исследование для оценки эффективности применения назального спрея флутиказона фуроата в дозе 110 мкг 1 раз в день по сравнению с плацебо у пациентов с круглогодичным аллергическим ринитом. Флутиказона фуроат продемонстрировал большее и статистическое значимое снижение по сравнению с исходным уровнем в оценках rTNSS и AM iTNSS, чем плацебо. Как и в случае сезонного аллергического ринита, улучшение назальных симптомов при применении флутиказона фуроата у пациентов с круглогодичным аллергическим ринитом сохранялось в течение полных 24 ч по оценке AM iTNSS непосредственно перед введением следующей дозы. Однако в отличие от сезонного аллергического ринита, у пациентов с круглогодичным аллергическим ринитом, получавших флутиказона фуроат в дозе 110 мкг, не наблюдалось статистически значимого улучшения по сравнению с исходным уровнем в оценках rTOSS или RQLQ по сравнению с плацебо. Кроме того, среднее изменение общего балла по RQLQ по сравнению с исходным уровнем между группами, получавшими флутиказона фуроат и плацебо, составило −0,23, что не соответствовало минимально значимой разнице ≥0,5. Результаты клинического исследования эффективности у пациентов с круглогодичным аллергическим ринитом представлены в таблице 2.
Таблица 2.
Средние изменения показателей эффективности у взрослых и подростков с сезонным или круглогодичным аллергическим ринитом.
| Лечение | n | Исходный уровень | Изменение по сранению с исходным уровнем, определенное методом наименьших квадратов | Отличие от плацебо | ||
| Различие средних значений, определенных методом наименьших квадратов | 95% ДИ | Значение p | ||||
| rTNSS | ||||||
| Сезонный аллергический ринит | ||||||
| Флутиказона фуроат, 110 мкг | 151 | 9,6 | −3,55 | −1,47 | −2,01; −0,94 | <0,001 |
| Плацебо | 147 | 9,9 | −2,07 | − | − | − |
| Круглогодичный аллергический ринит | ||||||
| Флутиказона фуроат, 110 мкг | 149 | 8,6 | −2,78 | −0,71 | −1,2; −0,21 | 0,005 |
| Плацебо | 153 | 8,7 | −2,08 | − | − | − |
| iTNSS | ||||||
| Сезонный аллергический ринит | ||||||
| Флутиказона фуроат, 110 мкг | 151 | 9,4 | −2,9 | −1,38 | −1,9; −0,85 | <0,001 |
| Плацебо | 147 | 9,3 | −1,53 | − | − | − |
| Круглогодичный аллергический ринит | ||||||
| Флутиказона фуроат, 110 мкг | 149 | 8,2 | −2,45 | −0,71 | −1,2; −0,21 | 0,006 |
| Плацебо | 153 | 8,3 | −1,75 | − | − | − |
| rTOOS | ||||||
| Сезонный аллергический ринит | ||||||
| Флутиказона фуроат, 110 мкг | 151 | 6,6 | −2,23 | −0,6 | −1,01; −0,19 | 0,004 |
| Плацебо | 147 | 6,5 | −1,63 | − | − | − |
| Круглогодичный аллергический ринит | ||||||
| Флутиказона фуроат, 110 мкг | 149 | 4,8 | −1,39 | −0,15 | −0,52; 0,22 | 0,428 |
| Плацебо | 153 | 5 | −1,24 | − | − | − |
| RQLQ | ||||||
| Сезонный аллергический ринит | ||||||
| Флутиказона фуроат, 110 мкг | 144 | 3,9 | −1,77 | −0,6 | −0,93; −0,28 | <0,001 |
| Плацебо | 144 | 3,9 | −1,16 | − | − | − |
| Круглогодичный аллергический ринит | ||||||
| Флутиказона фуроат, 110 мкг | 143 | 3,5 | −1,41 | −0,23 | −0,59; 0,13 | 0,214 |
| Плацебо | 151 | 3,4 | −1,18 | − | − | − |
Начало действия оценивали по частоте оценок iTNSS после первой дозы в клинических исследованиях у пациентов с сезонным и круглогодичным аллергическим ринитом. Начало действия обычно наблюдалось в течение 24 ч у пациентов с сезонным аллергическим ринитом. У больных круглогодичным ринитом начало действия наблюдалось через 4 дня лечения. Продолжающееся улучшение симптомов наблюдалось в течение примерно 1 и 3 нед у пациентов с сезонным или круглогодичным аллергическим ринитом соответственно.
Педиатрические пациенты в возрасте от 2 до 11 лет.
Эффективность и безопасность применения назального спрея флутиказона фуроата оценивали у 1112 детей (633 мальчика и 479 девочек) в среднем возрасте 8 лет с сезонным или круглогодичным аллергическим ринитом в двух контролируемых клинических исследованиях. Пациенты получали флутиказона фуроат в дозе 55 или 110 мкг 1 раз в день в течение 2-12 нед (n=369 для каждой дозы). Исследования по дизайну были аналогичны проведенным с участием подростков и взрослых, однако определение эффективности проводилось на основе данных TNSS, сообщаемых пациентом или родителем/опекуном, для детей в возрасте от 6 до 12 лет. Дети, получавшие флутиказона фуроат, как правило, демонстрировали большее уменьшение назальных симптомов, чем получавшие плацебо. При сезонном аллергическом рините разница в rTNSS была статистически значимой только для дозы 110 мкг. При круглогодичном аллергическом рините разница в rTNSS была статистически значимой только для дозы 55 мкг. Изменения rTOSS в исследовании сезонного аллергического ринита не были статистически значимыми по сравнению с плацебо для любой дозы. rTOSS не оценивали в исследовании круглогодичного аллергического ринита. В таблице 3 представлены результаты клинических исследований эффективности у детей в возрасте от 6 до 12 лет с круглогодичным аллергическим ринитом и сезонным аллергическим ринитом. Эффективность у детей в возрасте от 2 до 6 лет подтверждалась числовым снижением rTNSS.
Таблица 3.
Средние изменения переменных эффективности у педиатрических пациентов в возрасте от 6 до <12 лет с сезонным или круглогодичным аллергическим ринитом.
| Лечение | n | Исходный уровень | Изменение по сранению с исходным уровнем, определенное методом наименьших квадратов | Отличие от плацебо | ||
| Различие средних значений, определенных методом наименьших квадратов | 95% ДИ | Значение p | ||||
| rTNSS | ||||||
| Сезонный аллергический ринит | ||||||
| Флутиказона фуроат, 55 мкг | 151 | 8,6 | −2,71 | −0,16 | −0,69; 0,37 | 0,553 |
| Флутиказона фуроат, 110 мкг | 146 | 8,5 | −3,16 | −0,62 | −1,15; −0,08 | 0,025 |
| Плацебо | 149 | 8,4 | −2,54 | − | − | − |
| Круглогодичный аллергический ринит | ||||||
| Флутиказона фуроат, 55 мкг | 144 | 8,5 | −4,16 | −0,75 | −1,24; −0,27 | 0,003 |
| Флутиказона фуроат, 110 мкг | 140 | 8,6 | −3,86 | −0,45 | −0,95; 0,04 | 0,073 |
| Плацебо | 147 | 8,5 | −3,41 | − | − | − |
| iTNSS | ||||||
| Сезонный аллергический ринит | ||||||
| Флутиказона фуроат, 55 мкг | 151 | 8,4 | −2,37 | −0,23 | −0,77; 0,3 | 0,389 |
| Флутиказона фуроат, 110 мкг | 146 | 8,3 | −2,8 | −0,67 | −1,21; −0,13 | 0,015 |
| Плацебо | 149 | 8,4 | −2,13 | − | − | − |
| Круглогодичный аллергический ринит | ||||||
| Флутиказона фуроат, 55 мкг | 144 | 8,3 | −3,62 | −0,75 | −1,24; −0,27 | 0,002 |
| Флутиказона фуроат, 110 мкг | 140 | 8,3 | −3,52 | −0,65 | −1,14; −0,16 | 0,009 |
| Плацебо | 147 | 8,3 | −2,87 | − | − | − |
| rTOSS | ||||||
| Сезонный аллергический ринит | ||||||
| Флутиказона фуроат, 55 мкг | 151 | 4,4 | −1,26 | 0,04 | −0,33; 0,41 | 0,826 |
| Флутиказона фуроат, 110 мкг | 146 | 4,1 | −1,45 | −0,15 | −0,52; 0,22 | 0,426 |
| Плацебо | 149 | 3,8 | −1,3 | − | − | − |
Indications for use
Симптоматическое лечение сезонного и круглогодичного аллергического ринита у пациентов ≥2 лет.
Contraindications
Гиперчувствительность.
Use during pregnancy and lactation
Категория действия на плод по FDA. С.
Было показано, что ГКС оказывают тератогенное действие на лабораторных животных при системном введении в относительно низких дозировках. Тератогенных эффектов у крыс и кроликов при ингаляционном введении флутиказона фуроата в дозах до 91 и 8 мкг/кг/сут соответственно (примерно в 7 раз больше и равно интраназальной МРДЧ для взрослых в пересчете на площадь поверхности тела соответственно). Также не наблюдалось влияния на дородовое или постнатальное развитие крыс, получавших до 27 мкг/кг/сут путем ингаляции во время беременности и лактации (примерно в 2 раза больше МРДЧ для взрослых в пересчете на площадь поверхности тела).
Адекватных и строго контролируемых исследований с участием беременных женщин не проводилось. Флутиказона фуроат следует использовать во время беременности только в том случае, если потенциальная польза оправдывает потенциальный риск для плода.
У младенцев, рожденных от матерей, получавших ГКС во время беременности, может возникать гипофункция надпочечников. Такие дети должны находиться под тщательным наблюдением.
Неизвестно, проникает ли флутиказона фуроат в женское молоко. Однако другие ГКС обнаруживались в грудном молоке. Поскольку отсутствуют данные контролируемых исследований по интраназальному применению флутиказона фуроата, следует соблюдать осторожность при его назначении кормящим женщинам.
Было показано, что ГКС оказывают тератогенное действие на лабораторных животных при системном введении в относительно низких дозировках. Тератогенных эффектов у крыс и кроликов при ингаляционном введении флутиказона фуроата в дозах до 91 и 8 мкг/кг/сут соответственно (примерно в 7 раз больше и равно интраназальной МРДЧ для взрослых в пересчете на площадь поверхности тела соответственно). Также не наблюдалось влияния на дородовое или постнатальное развитие крыс, получавших до 27 мкг/кг/сут путем ингаляции во время беременности и лактации (примерно в 2 раза больше МРДЧ для взрослых в пересчете на площадь поверхности тела).
Адекватных и строго контролируемых исследований с участием беременных женщин не проводилось. Флутиказона фуроат следует использовать во время беременности только в том случае, если потенциальная польза оправдывает потенциальный риск для плода.
У младенцев, рожденных от матерей, получавших ГКС во время беременности, может возникать гипофункция надпочечников. Такие дети должны находиться под тщательным наблюдением.
Неизвестно, проникает ли флутиказона фуроат в женское молоко. Однако другие ГКС обнаруживались в грудном молоке. Поскольку отсутствуют данные контролируемых исследований по интраназальному применению флутиказона фуроата, следует соблюдать осторожность при его назначении кормящим женщинам.
Side effects
Системное и местное применение ГКС может привести к развитию таких побочных реакций. как носовое кровотечение. изъязвления. инфекция. вызванная сandida albicans. нарушение заживления ран и перфорация носовой перегородки. катаракта и глаукома. иммуносупрессия. реакции со стороны ГГНС. включая замедление роста ( см «Меры предосторожности»).
Опыт клинических исследований.
Приведенные ниже данные отражают воздействие назального спрея флутиказона фуроата у 1563 пациентов с сезонным или круглогодичным аллергическим ринитом в 9 контролируемых клинических исследованиях продолжительностью от 2 до 12 нед. Данные по взрослым и подросткам основаны на 6 клинических исследованиях. в которых 768 пациентов с сезонным или круглогодичным аллергическим ринитом (473 женщины и 295 мужчин в возрасте 12 лет и старше) получали интраназально флутиказона фуроат в дозе 110 мкг 1 раз в день в течение 2-6 нед. Среди взрослых и подростков, получавших флутиказона фуроат, 82% были представителями европеоидной расы, 5% - афроамериканцами и 13% - представителями других этнических групп. Данные о педиатрических пациентах основаны на 3 клинических исследованиях. в которых 795 детей с сезонным или круглогодичным ринитом (352 девочки и 443 мальчика от 2 до 11 лет) получали флутиказона фуроат в дозе 55 или 110 мкг 1 раз в день в течение от 2 до 12 нед. Среди детей, получавших флутиказона фуроат, 75% были представителями европеоидной расы, 11% - афроамериканцами и 14% - представителями других этнических групп.
Поскольку клинические исследования проводятся в различных условиях. частота побочных реакций. наблюдаемая в одном исследовании. не может быть напрямую сопоставлена с данными другого клинического исследования. и может не отражать частоту. наблюдаемую на практике.
Взрослые и подростки в возрасте 12 лет и старше.
В целом побочные реакции были зарегистрированы примерно с одинаковой частотой у пациентов, получавших интраназально флутиказона фуроат и плацебо. Менее 3% пациентов в клинических исследованиях прекратили лечение из-за побочных реакций. Частота отмены среди пациентов, получавших флутиказона фуроат, была такой же или ниже, чем у получавших плацебо. В таблице 4 представлены часто наблюдавшиеся побочные реакции (>1% в любой группе пациентов, получавших флутиказона фуроат), которые возникали чаще по сравнению с получавшими плацебо.
Таблица 4.
Побочные реакции с частотой >1% в контролируемых клинических исследованиях продолжительностью от 2 до 6 нед с назальным применением флутиказона фуроата у взрослых и подростков с сезонным или круглогодичным аллергическим ринитом.
Не наблюдалось различий в частоте побочных реакций в зависимости от пола или расы. Клинические исследования не включали достаточное количество пациентов в возрасте ≥65 лет, чтобы определить отличие их реакций от таковых у более молодых пациентов.
Дети от 2 до 11 лет.
В 3 клинических исследованиях с участием детей от 2 до 12 лет в целом побочные реакции регистрировались примерно с одинаковой частотой у получавших интраназально флутиказона фуроат и плацебо. В таблице 5 представлены часто наблюдавшиеся побочные реакции (>3% в любой группе пациентов, получавших флутиказона фуроат), которые возникали чаще по сравнению с получавшими плацебо.
Таблица 5.
Побочные реакции с частотой >3% в контролируемых клинических исследованиях продолжительностью от 2 до 12 нед с назальным применением флутиказона фуроата у детей с сезонным или круглогодичным аллергическим ринитом.
Не наблюдалось различий в частоте побочных реакций в зависимости от пола или расы. Пирексия чаще отмечалась у детей от 2 до 6 лет по сравнению с детьми от 6 до 12 лет.
Долгосрочное (52 нед) исследование безопасности.
В 52-недельном плацебо-контролируемом долгосрочном исследовании безопасности 605 пациентов (307 женщин и 298 мужчин ≥12 лет) с круглогодичным аллергическим ринитом получали интраназально флутиказона фуроат в дозе 110 мкг 1 раз в день в течение 12 мес. а 201 получали плацебо. Большинство побочных реакций были схожими по типу и частоте в этих группах лечения. однако носовые кровотечения возникали чаще у пациентов. получавших флутиказона фуроат (123 из 605. 20%). чем у получавших плацебо (17 из 201. 8%). Носовое кровотечение, как правило, было более тяжелым у получавших флутиказона фуроат. Все 17 сообщений об случаях носового кровотечения у пациентов. получавших плацебо. были легкой степени тяжести. в то время как 83. 39 и 1 из 123 случаев носового кровотечения у пациентов. получавших флутиказона фуроат. имели легкую. среднюю и тяжелую степень соответственно. Ни у одного пациента во время этого исследования не отмечалось перфорации носовой перегородки.
Результаты пострегистрационного наблюдения.
В дополнение к побочным реакциям. о которых сообщалось в ходе клинических исследований назального применения флутиказона фуроата. во время пострегистрационного применения были выявлены приведенные ниже побочные реакции. Поскольку сообщения об этих реакциях поступали в добровольном порядке от популяции неустановленного размера. не всегда возможно достоверно оценить их частоту или установить причинно-следственную связь с воздействием флутиказона фуроата. Эти реакции были выбраны для включения либо из-за их серьезности, частоты сообщений, причинно-следственной связи с применением флутиказона фуроата, или комбинации этих факторов.
Со стороны иммунной системы. Реакции гиперчувствительности, включая анафилаксию, ангионевротический отек, сыпь и крапивницу.
Со стороны органов дыхания, грудной клетки и средостения. Риналгия, дискомфорт в носу (в тч жжение в носу, раздражение носа и болезненность в носу), сухость в носу и перфорация носовой перегородки.
Опыт клинических исследований.
Приведенные ниже данные отражают воздействие назального спрея флутиказона фуроата у 1563 пациентов с сезонным или круглогодичным аллергическим ринитом в 9 контролируемых клинических исследованиях продолжительностью от 2 до 12 нед. Данные по взрослым и подросткам основаны на 6 клинических исследованиях. в которых 768 пациентов с сезонным или круглогодичным аллергическим ринитом (473 женщины и 295 мужчин в возрасте 12 лет и старше) получали интраназально флутиказона фуроат в дозе 110 мкг 1 раз в день в течение 2-6 нед. Среди взрослых и подростков, получавших флутиказона фуроат, 82% были представителями европеоидной расы, 5% - афроамериканцами и 13% - представителями других этнических групп. Данные о педиатрических пациентах основаны на 3 клинических исследованиях. в которых 795 детей с сезонным или круглогодичным ринитом (352 девочки и 443 мальчика от 2 до 11 лет) получали флутиказона фуроат в дозе 55 или 110 мкг 1 раз в день в течение от 2 до 12 нед. Среди детей, получавших флутиказона фуроат, 75% были представителями европеоидной расы, 11% - афроамериканцами и 14% - представителями других этнических групп.
Поскольку клинические исследования проводятся в различных условиях. частота побочных реакций. наблюдаемая в одном исследовании. не может быть напрямую сопоставлена с данными другого клинического исследования. и может не отражать частоту. наблюдаемую на практике.
Взрослые и подростки в возрасте 12 лет и старше.
В целом побочные реакции были зарегистрированы примерно с одинаковой частотой у пациентов, получавших интраназально флутиказона фуроат и плацебо. Менее 3% пациентов в клинических исследованиях прекратили лечение из-за побочных реакций. Частота отмены среди пациентов, получавших флутиказона фуроат, была такой же или ниже, чем у получавших плацебо. В таблице 4 представлены часто наблюдавшиеся побочные реакции (>1% в любой группе пациентов, получавших флутиказона фуроат), которые возникали чаще по сравнению с получавшими плацебо.
Таблица 4.
Побочные реакции с частотой >1% в контролируемых клинических исследованиях продолжительностью от 2 до 6 нед с назальным применением флутиказона фуроата у взрослых и подростков с сезонным или круглогодичным аллергическим ринитом.
| Побочная реакция | Частота побочных реакций у взрослых и подростков ≥12 лет, n (%) | |
| Плацебо (носитель) (n=774) | Флутиказона фуроат, 110 мкг, 1 раз в день (n=768) | |
| Головная боль | 54 (7) | 72 (9) |
| Носовое кровотечение | 32 (4) | 45 (6) |
| Фаринголарингеальная боль | 8 (1) | 15 (2) |
| Изъязвление слизистой оболочки носа | 3 (<1) | 11 (1) |
| Боль в спине | 7 (<1) | 9 (1) |
Не наблюдалось различий в частоте побочных реакций в зависимости от пола или расы. Клинические исследования не включали достаточное количество пациентов в возрасте ≥65 лет, чтобы определить отличие их реакций от таковых у более молодых пациентов.
Дети от 2 до 11 лет.
В 3 клинических исследованиях с участием детей от 2 до 12 лет в целом побочные реакции регистрировались примерно с одинаковой частотой у получавших интраназально флутиказона фуроат и плацебо. В таблице 5 представлены часто наблюдавшиеся побочные реакции (>3% в любой группе пациентов, получавших флутиказона фуроат), которые возникали чаще по сравнению с получавшими плацебо.
Таблица 5.
Побочные реакции с частотой >3% в контролируемых клинических исследованиях продолжительностью от 2 до 12 нед с назальным применением флутиказона фуроата у детей с сезонным или круглогодичным аллергическим ринитом.
| Побочная реакция | Частота побочных реакций у детей от 2 до <12 лет, n (%) | ||
| Плацебо (носитель) (n=429) | Флутиказона фуроат, 55 мкг, 1 раз в день (n=369) | Флутиказона фуроат, 110 мкг, 1 раз в день (n=426) | |
| Головная боль | 31 (7) | 28 (8) | 33 (8) |
| Назофарингит | 21 (5) | 20 (5) | 21 (5) |
| Носовое кровотечение | 19 (4) | 17 (5) | 17 (4) |
| Гипертермия | 7 (2) | 17 (5) | 19 (4) |
| Фаринголарингеальная боль | 14 (3) | 16 (4) | 12 (3) |
| Кашель | 12 (3) | 12 (3) | 16 (4) |
Не наблюдалось различий в частоте побочных реакций в зависимости от пола или расы. Пирексия чаще отмечалась у детей от 2 до 6 лет по сравнению с детьми от 6 до 12 лет.
Долгосрочное (52 нед) исследование безопасности.
В 52-недельном плацебо-контролируемом долгосрочном исследовании безопасности 605 пациентов (307 женщин и 298 мужчин ≥12 лет) с круглогодичным аллергическим ринитом получали интраназально флутиказона фуроат в дозе 110 мкг 1 раз в день в течение 12 мес. а 201 получали плацебо. Большинство побочных реакций были схожими по типу и частоте в этих группах лечения. однако носовые кровотечения возникали чаще у пациентов. получавших флутиказона фуроат (123 из 605. 20%). чем у получавших плацебо (17 из 201. 8%). Носовое кровотечение, как правило, было более тяжелым у получавших флутиказона фуроат. Все 17 сообщений об случаях носового кровотечения у пациентов. получавших плацебо. были легкой степени тяжести. в то время как 83. 39 и 1 из 123 случаев носового кровотечения у пациентов. получавших флутиказона фуроат. имели легкую. среднюю и тяжелую степень соответственно. Ни у одного пациента во время этого исследования не отмечалось перфорации носовой перегородки.
Результаты пострегистрационного наблюдения.
В дополнение к побочным реакциям. о которых сообщалось в ходе клинических исследований назального применения флутиказона фуроата. во время пострегистрационного применения были выявлены приведенные ниже побочные реакции. Поскольку сообщения об этих реакциях поступали в добровольном порядке от популяции неустановленного размера. не всегда возможно достоверно оценить их частоту или установить причинно-следственную связь с воздействием флутиказона фуроата. Эти реакции были выбраны для включения либо из-за их серьезности, частоты сообщений, причинно-следственной связи с применением флутиказона фуроата, или комбинации этих факторов.
Со стороны иммунной системы. Реакции гиперчувствительности, включая анафилаксию, ангионевротический отек, сыпь и крапивницу.
Со стороны органов дыхания, грудной клетки и средостения. Риналгия, дискомфорт в носу (в тч жжение в носу, раздражение носа и болезненность в носу), сухость в носу и перфорация носовой перегородки.
Interaction
Флутиказона фуроат выводится путем экстенсивного метаболизма первого прохождения, опосредованного сYP3A4. В исследовании лекарственного взаимодействия интраназальной формы флутиказона фуроата и ингибитора сYP3A4 кетоконазола, применяемого в дозе 200 мг 1 раз в день в течение 7 дней, у 6 из 20 пациентов, получавших флутиказона фуроат и кетоконазол, были поддающиеся измерению, но низкие уровни флутиказона фуроата по сравнению с 1 из 20 пациентов, получавших флутиказона фуроат и плацебо. По результатам этого исследования и данным о низком системном воздействии, было отмечено 5% снижение 24-часового уровня кортизола в сыворотке крови при совместном применении кетоконазола по сравнению с плацебо. Данные этого исследования следует интерпретировать с осторожностью, поскольку оно проводилось с применением кетоконазола в дозе 200 мг 1 раз в сутки, а не 400 мг, которая является максимально рекомендуемой дозой. Поэтому необходимо соблюдать осторожность при одновременном применении флутиказона фуроата и кетоконазола или других сильных ингибиторов сYP3A4.
Основываясь на данных, полученных при применении флутиказона пропионата, который метаболизируется с участием сYP3A4, не рекомендуется совместное применение флутиказона фуроата и сильного ингибитора сYP3A4 ритонавира из-за риска развития системных эффектов, вторичных по отношению к увеличению экспозиции флутиказона фуроата. Высокая экспозиция ГКС увеличивает вероятность развития системных побочных эффектов, таких как уменьшение уровня кортизола.
Данные об индукции и ингибировании ферментов свидетельствуют о том, что флутиказона фуроат вряд ли значительно изменит опосредованный сYР450 метаболизм других ЛС при клинически значимых интраназальных дозах.
Основываясь на данных, полученных при применении флутиказона пропионата, который метаболизируется с участием сYP3A4, не рекомендуется совместное применение флутиказона фуроата и сильного ингибитора сYP3A4 ритонавира из-за риска развития системных эффектов, вторичных по отношению к увеличению экспозиции флутиказона фуроата. Высокая экспозиция ГКС увеличивает вероятность развития системных побочных эффектов, таких как уменьшение уровня кортизола.
Данные об индукции и ингибировании ферментов свидетельствуют о том, что флутиказона фуроат вряд ли значительно изменит опосредованный сYР450 метаболизм других ЛС при клинически значимых интраназальных дозах.
Overdose
Хроническая передозировка может привести к появлению признаков/симптомов гиперкортицизма ( см «Меры предосторожности»). Отсутствуют данные о последствиях острой или хронической передозировки при интраназальном применении флутиказона фуроата. Из-за низкой системной биодоступности и отсутствия острых системных реакций. связанных с его применением в клинических исследованиях (при дозах до 440 мкг/сут в течение 2 нед. в 4 раза выше МРДЧ). маловероятно. что при передозировке потребуется какое-либо другое лечение. кроме наблюдения.
Интраназальное введение флутиказона фуроата в дозах до 2640 мкг/сут (в 24 раза выше МРДЧ для взрослых) проводили у здоровых добровольцев в течение 3 дней. Исследования с однократным и многократным ингаляционным введением флутиказона фуроата в дозах от 50 до 4000 мкг показали снижение среднего уровня кортизола в сыворотке при дозах ≥500 мкг. Средняя летальная доза при пероральном введении у мышей и крыс составляла >2000 мг/кг (приблизительно в 74000 и 147000 раз выше интраназальной МРДЧ у взрослых и в 52000 и 105000 раз соответственно выше интраназальной МРДЧ у детей в пересчете на площадь поверхности тела).
Острая передозировка флутиказона фуроата в интраназальной лекарственной форме маловероятна, учитывая его низкое содержание и биодоступность.
Интраназальное введение флутиказона фуроата в дозах до 2640 мкг/сут (в 24 раза выше МРДЧ для взрослых) проводили у здоровых добровольцев в течение 3 дней. Исследования с однократным и многократным ингаляционным введением флутиказона фуроата в дозах от 50 до 4000 мкг показали снижение среднего уровня кортизола в сыворотке при дозах ≥500 мкг. Средняя летальная доза при пероральном введении у мышей и крыс составляла >2000 мг/кг (приблизительно в 74000 и 147000 раз выше интраназальной МРДЧ у взрослых и в 52000 и 105000 раз соответственно выше интраназальной МРДЧ у детей в пересчете на площадь поверхности тела).
Острая передозировка флутиказона фуроата в интраназальной лекарственной форме маловероятна, учитывая его низкое содержание и биодоступность.
Method of drug use and dosage
Интраназально, дозу титруют индивидуально до минимально эффективной для снижения возможности развития побочных реакций.
Application precautions
Местные назальные эффекты.
Носовое кровотечение и изъязвление носа наблюдались чаще у пациентов, получавших флутиказона фуроат, по сравнению с плацебо в клинических исследованиях продолжительностью от 2 до 52 нед, а некоторые случаи носового кровотечения были более тяжелыми.
Кандидозная инфекция.
Признаки локализованной инфекции носа, вызванной сandida albicans, были обнаружены при осмотре носа у 7 из 2745 пациентов, получавших интраназально флутиказона фуроат в ходе клинических исследований, и о них сообщалось как о побочном действии у 3 пациентов. При развитии такой инфекции может потребоваться соответствующее местное лечение и прекращение применения флутиказона фуроата. В связи с этим пациенты, получающие флутиказона фуроат в течение нескольких месяцев или дольше, должны периодически обследоваться на наличие инфекции сandida albicans или других признаков неблагоприятного воздействия на слизистую оболочку носа.
Перфорация носовой перегородки.
Сообщалось о пострегистрационных случаях перфорации носовой перегородки у пациентов после интраназального применения флутиказона фуроата.
Нарушение заживления ран.
Из-за ингибирования заживления ран при действии ГКС пациентам, перенесшим недавние язвы носа, операции на носу или травмы носа, не следует использовать интраназально флутиказона фуроат до окончания заживления.
Глаукома и катаракта.
Назальное и ингаляционное применение ГКС может привести к развитию глаукомы и/или катаракты. Поэтому необходим тщательный мониторинг у пациентов с изменением зрения или с повышенным ВГД, глаукомой и/или катарактой в анамнезе.
Глаукому и формирование катаракты оценивали путем измерения ВГД и осмотра с помощью щелевой лампы в 1 контролируемом 12-месячном исследовании с участием 806 подростков и взрослых ≥12 лет и в 1 контролируемом 12-недельном исследовании с участием 558 детей от 2 до 11 лет. Пациенты с круглогодичным аллергическим ринитом получали либо интраназально флутиказона фуроат (110 мкг 1 раз в день для взрослых и подростков и 55 или 110 мкг 1 раз в день для детей), либо плацебо. ВГД оставалось в пределах нормы (<21 мм ) у ≥98% пациентов в любой группе лечения в обоих исследованиях. Однако в 12-месячном исследовании с участием подростков и взрослых у 12 пациентов, получавших флутиказона фуроат в дозе 110 мкг 1 раз в день, показатели ВГД превышали нормальный уровень (≥21 мм ). В том же исследовании у 7 пациентов (6 пациентов получали флутиказона фуроат в дозе 110 мкг 1 раз в день и 1 пациент получал плацебо) была выявлена катаракта, которой не было на исходном уровне.
Реакции гиперчувствительности, включая анафилаксию.
После назального применения флутиказона фуроата могут возникать реакции гиперчувствительности, включая анафилаксию, ангионевротический отек, сыпь и крапивницу. Необходимо прекратить его применение, если возникают такие реакции ( см «Противопоказания»).
Иммуносупрессия.
Пациенты, получающие ЛС, которые подавляют иммунную систему, более восприимчивы к инфекциям, чем здоровые люди. Ветряная оспа и корь, например, могут иметь более серьезное или даже фатальное течение у восприимчивых детей или взрослых, принимающих ГКС. У детей или взрослых, у которых не было этих заболеваний или которые не были должным образом иммунизированы, следует проявлять особую осторожность, чтобы избежать воздействия ГКС. Неизвестно каким образом доза, путь и продолжительность введения ГКС влияют на риск развития диссеминированной инфекции. Вклад основного заболевания и/или предшествующего лечения ГКС в развитие этого риска также неизвестен. При контакте с ветряной оспой, может быть показана профилактика с помощью Ig для серотерапии ветряной оспы (VZIG). Если пациент заразился корью, может быть показана профилактика комбинированным в/м Ig. При развитии ветряной оспы или кори, можно рассмотреть возможность лечения противовирусными ЛС.
ГКС должны применяться с осторожностью у пациентов с активной или латентной туберкулезной инфекцией дыхательных путей, нелеченными местными или системными грибковыми или бактериальными инфекциями, системными вирусными или паразитарными инфекциями или простым герпесом глаз из-за возможности ухудшения состояния при этих инфекциях.
Влияние на ГГНС.
Гиперкортицизм и угнетение функции надпочечников. При применении интраназальных ГКС в дозах, превышающих рекомендуемые, или у восприимчивых лиц в рекомендуемых дозах, могут развиваться системные эффекты, такие как гиперкортицизм и угнетение функции надпочечников. Если такие изменения происходят, дозу флутиказона фуроата следует отменять медленно, в соответствии с принятыми процедурами прекращения пероральной терапии ГКС.
Замена системного ГКС местным может сопровождаться признаками надпочечниковой недостаточности. Кроме того, у некоторых пациентов могут возникать симптомы отмены, например боль в суставах и/или мышцах, усталость, депрессия. Пациенты, ранее длительно получавшие системные ГКС и переведенные на местное применение, должны находиться под тщательным наблюдением на предмет острой надпочечниковой недостаточности в ответ на стресс. У пациентов с астмой или другими клиническими состояниями, требующими длительного лечения системными ГКС, быстрое снижение дозы может вызвать серьезное обострение симптомов.
Совместное прменение ингибиторов сYP3A4.
Одновременное применение флутиказона фуроата и ритонавира не рекомендуется из-за риска развития системных эффектов, вторичных по отношению к повышенному воздействию флутиказона фуроата. Необходимо соблюдать осторожность при одновременном применении интраназального флутиказона фуроата и других сильных ингибиторов сYP3A4, таких как кетоконазол ( см «Взаимодействие»).
Особые группы пациентов.
Дети. ГКС могут вызывать замедление роста при введении детям. Необходимо регулярно контролировать рост у педиатрических пациентов, получающих назально флутиказона фуроат. В контролируемых клинических исследования по интраназальному применению флутиказона фуроата приняли участие 1224 пациента от 2 до 11 лет и 344 подростка от 12 до 17 лет. Безопасность и эффективность назального применения флутиказона фуроата у детей младше 2 лет не установлены.
Контролируемые клинические исследования показали, что интраназальные ГКС могут вызывать замедление роста у детей. Этот эффект наблюдался при отсутствии лабораторных данных о подавлении ГГНС, что позволяет предположить, что скорость роста является более чувствительным индикатором системного воздействия ГКС у детей, чем некоторые обычно используемые тесты функции ГГНС. Долгосрочные эффекты замедления роста, связанные с интраназальными ГКС, включая влияние на конечный рост взрослого человека, неизвестны. Потенциал «догоняющего» роста после прекращения интраназального применения ГКС недостаточно изучен. Следует регулярно контролировать рост детей, получающих интраназальные ГКС, включая флутиказона фуроат (например, с помощью ростомера). Потенциальные эффекты влияния на рост при длительном лечении следует сопоставлять с полученными клиническими преимуществами и риском/пользой альтернативного лечения. Чтобы свести к минимуму системные эффекты интраназальных ГКС, включая флутиказона фуроат, дозу у каждого пациента следует титровать до самой низкой, которая эффективно контролирует симптомы.
В рандомизированном двойном слепом многоцентровом плацебо-контролируемом клиническом исследовании с параллельными группами в течение 1 года оценивалось влияние интраназального флутиказона фуроата в дозе 110 мкг 1 раз в день на скорость роста у 474 детей препубертатного возраста (девочки от 5 до 7,5 года и мальчики от 5 до 8,5 года) с использованием ростомера. Средняя скорость роста в течение 52-недельного периода применения была ниже у пациентов, получавших интраназально флутиказона фуроат (5,19 см/год по сравнению с 5,46 см/год в группе плацебо). Средняя разница составила −0,27 см/год (95% ДИ: −0,48; −0,06).
Пожилой возраст. Клинические исследования назального применения флутиказона фуроата не включали достаточное количество субъектов в возрасте ≥65 лет, чтобы определить отличия в их ответе от такового у более молодых субъектов. Другие сообщения о клиническом опыте не выявили различий в реакции у пожилых и более молодых пациентов. В целом назначать дозы для пожилых пациентов необходимо с осторожностью, обычно начиная с нижнего предела диапазона доз, учитывая большую частоту случаев снижения функции печени, почек или сердца, а также сопутствующие заболевания или другую лекарственную терапию.
Печеночная недостаточность. Необходимо соблюдать осторожность при интраназальном применении флутиказона фуроата у пациентов с умеренной или тяжелой печеночной недостаточностью.
Почечная недостаточность. Коррекции дозы у пациентов с почечной недостаточностью не требуется.
Носовое кровотечение и изъязвление носа наблюдались чаще у пациентов, получавших флутиказона фуроат, по сравнению с плацебо в клинических исследованиях продолжительностью от 2 до 52 нед, а некоторые случаи носового кровотечения были более тяжелыми.
Кандидозная инфекция.
Признаки локализованной инфекции носа, вызванной сandida albicans, были обнаружены при осмотре носа у 7 из 2745 пациентов, получавших интраназально флутиказона фуроат в ходе клинических исследований, и о них сообщалось как о побочном действии у 3 пациентов. При развитии такой инфекции может потребоваться соответствующее местное лечение и прекращение применения флутиказона фуроата. В связи с этим пациенты, получающие флутиказона фуроат в течение нескольких месяцев или дольше, должны периодически обследоваться на наличие инфекции сandida albicans или других признаков неблагоприятного воздействия на слизистую оболочку носа.
Перфорация носовой перегородки.
Сообщалось о пострегистрационных случаях перфорации носовой перегородки у пациентов после интраназального применения флутиказона фуроата.
Нарушение заживления ран.
Из-за ингибирования заживления ран при действии ГКС пациентам, перенесшим недавние язвы носа, операции на носу или травмы носа, не следует использовать интраназально флутиказона фуроат до окончания заживления.
Глаукома и катаракта.
Назальное и ингаляционное применение ГКС может привести к развитию глаукомы и/или катаракты. Поэтому необходим тщательный мониторинг у пациентов с изменением зрения или с повышенным ВГД, глаукомой и/или катарактой в анамнезе.
Глаукому и формирование катаракты оценивали путем измерения ВГД и осмотра с помощью щелевой лампы в 1 контролируемом 12-месячном исследовании с участием 806 подростков и взрослых ≥12 лет и в 1 контролируемом 12-недельном исследовании с участием 558 детей от 2 до 11 лет. Пациенты с круглогодичным аллергическим ринитом получали либо интраназально флутиказона фуроат (110 мкг 1 раз в день для взрослых и подростков и 55 или 110 мкг 1 раз в день для детей), либо плацебо. ВГД оставалось в пределах нормы (<21 мм ) у ≥98% пациентов в любой группе лечения в обоих исследованиях. Однако в 12-месячном исследовании с участием подростков и взрослых у 12 пациентов, получавших флутиказона фуроат в дозе 110 мкг 1 раз в день, показатели ВГД превышали нормальный уровень (≥21 мм ). В том же исследовании у 7 пациентов (6 пациентов получали флутиказона фуроат в дозе 110 мкг 1 раз в день и 1 пациент получал плацебо) была выявлена катаракта, которой не было на исходном уровне.
Реакции гиперчувствительности, включая анафилаксию.
После назального применения флутиказона фуроата могут возникать реакции гиперчувствительности, включая анафилаксию, ангионевротический отек, сыпь и крапивницу. Необходимо прекратить его применение, если возникают такие реакции ( см «Противопоказания»).
Иммуносупрессия.
Пациенты, получающие ЛС, которые подавляют иммунную систему, более восприимчивы к инфекциям, чем здоровые люди. Ветряная оспа и корь, например, могут иметь более серьезное или даже фатальное течение у восприимчивых детей или взрослых, принимающих ГКС. У детей или взрослых, у которых не было этих заболеваний или которые не были должным образом иммунизированы, следует проявлять особую осторожность, чтобы избежать воздействия ГКС. Неизвестно каким образом доза, путь и продолжительность введения ГКС влияют на риск развития диссеминированной инфекции. Вклад основного заболевания и/или предшествующего лечения ГКС в развитие этого риска также неизвестен. При контакте с ветряной оспой, может быть показана профилактика с помощью Ig для серотерапии ветряной оспы (VZIG). Если пациент заразился корью, может быть показана профилактика комбинированным в/м Ig. При развитии ветряной оспы или кори, можно рассмотреть возможность лечения противовирусными ЛС.
ГКС должны применяться с осторожностью у пациентов с активной или латентной туберкулезной инфекцией дыхательных путей, нелеченными местными или системными грибковыми или бактериальными инфекциями, системными вирусными или паразитарными инфекциями или простым герпесом глаз из-за возможности ухудшения состояния при этих инфекциях.
Влияние на ГГНС.
Гиперкортицизм и угнетение функции надпочечников. При применении интраназальных ГКС в дозах, превышающих рекомендуемые, или у восприимчивых лиц в рекомендуемых дозах, могут развиваться системные эффекты, такие как гиперкортицизм и угнетение функции надпочечников. Если такие изменения происходят, дозу флутиказона фуроата следует отменять медленно, в соответствии с принятыми процедурами прекращения пероральной терапии ГКС.
Замена системного ГКС местным может сопровождаться признаками надпочечниковой недостаточности. Кроме того, у некоторых пациентов могут возникать симптомы отмены, например боль в суставах и/или мышцах, усталость, депрессия. Пациенты, ранее длительно получавшие системные ГКС и переведенные на местное применение, должны находиться под тщательным наблюдением на предмет острой надпочечниковой недостаточности в ответ на стресс. У пациентов с астмой или другими клиническими состояниями, требующими длительного лечения системными ГКС, быстрое снижение дозы может вызвать серьезное обострение симптомов.
Совместное прменение ингибиторов сYP3A4.
Одновременное применение флутиказона фуроата и ритонавира не рекомендуется из-за риска развития системных эффектов, вторичных по отношению к повышенному воздействию флутиказона фуроата. Необходимо соблюдать осторожность при одновременном применении интраназального флутиказона фуроата и других сильных ингибиторов сYP3A4, таких как кетоконазол ( см «Взаимодействие»).
Особые группы пациентов.
Дети. ГКС могут вызывать замедление роста при введении детям. Необходимо регулярно контролировать рост у педиатрических пациентов, получающих назально флутиказона фуроат. В контролируемых клинических исследования по интраназальному применению флутиказона фуроата приняли участие 1224 пациента от 2 до 11 лет и 344 подростка от 12 до 17 лет. Безопасность и эффективность назального применения флутиказона фуроата у детей младше 2 лет не установлены.
Контролируемые клинические исследования показали, что интраназальные ГКС могут вызывать замедление роста у детей. Этот эффект наблюдался при отсутствии лабораторных данных о подавлении ГГНС, что позволяет предположить, что скорость роста является более чувствительным индикатором системного воздействия ГКС у детей, чем некоторые обычно используемые тесты функции ГГНС. Долгосрочные эффекты замедления роста, связанные с интраназальными ГКС, включая влияние на конечный рост взрослого человека, неизвестны. Потенциал «догоняющего» роста после прекращения интраназального применения ГКС недостаточно изучен. Следует регулярно контролировать рост детей, получающих интраназальные ГКС, включая флутиказона фуроат (например, с помощью ростомера). Потенциальные эффекты влияния на рост при длительном лечении следует сопоставлять с полученными клиническими преимуществами и риском/пользой альтернативного лечения. Чтобы свести к минимуму системные эффекты интраназальных ГКС, включая флутиказона фуроат, дозу у каждого пациента следует титровать до самой низкой, которая эффективно контролирует симптомы.
В рандомизированном двойном слепом многоцентровом плацебо-контролируемом клиническом исследовании с параллельными группами в течение 1 года оценивалось влияние интраназального флутиказона фуроата в дозе 110 мкг 1 раз в день на скорость роста у 474 детей препубертатного возраста (девочки от 5 до 7,5 года и мальчики от 5 до 8,5 года) с использованием ростомера. Средняя скорость роста в течение 52-недельного периода применения была ниже у пациентов, получавших интраназально флутиказона фуроат (5,19 см/год по сравнению с 5,46 см/год в группе плацебо). Средняя разница составила −0,27 см/год (95% ДИ: −0,48; −0,06).
Пожилой возраст. Клинические исследования назального применения флутиказона фуроата не включали достаточное количество субъектов в возрасте ≥65 лет, чтобы определить отличия в их ответе от такового у более молодых субъектов. Другие сообщения о клиническом опыте не выявили различий в реакции у пожилых и более молодых пациентов. В целом назначать дозы для пожилых пациентов необходимо с осторожностью, обычно начиная с нижнего предела диапазона доз, учитывая большую частоту случаев снижения функции печени, почек или сердца, а также сопутствующие заболевания или другую лекарственную терапию.
Печеночная недостаточность. Необходимо соблюдать осторожность при интраназальном применении флутиказона фуроата у пациентов с умеренной или тяжелой печеночной недостаточностью.
Почечная недостаточность. Коррекции дозы у пациентов с почечной недостаточностью не требуется.
References
Www.rxlist.com, 2022.
Included in the composition
- 8.6-11.6€ Avamys (2 firms)
- 13.9-22.8€ Relvar Ellipta (Glaxo Operations UK Limited )
- 37.6-45.3€ Треледжи эллипта (Glaxo Operations UK Limited )