Pharmacological Group
Latin name
Micafunginum ( Micafungini).
Chemical name
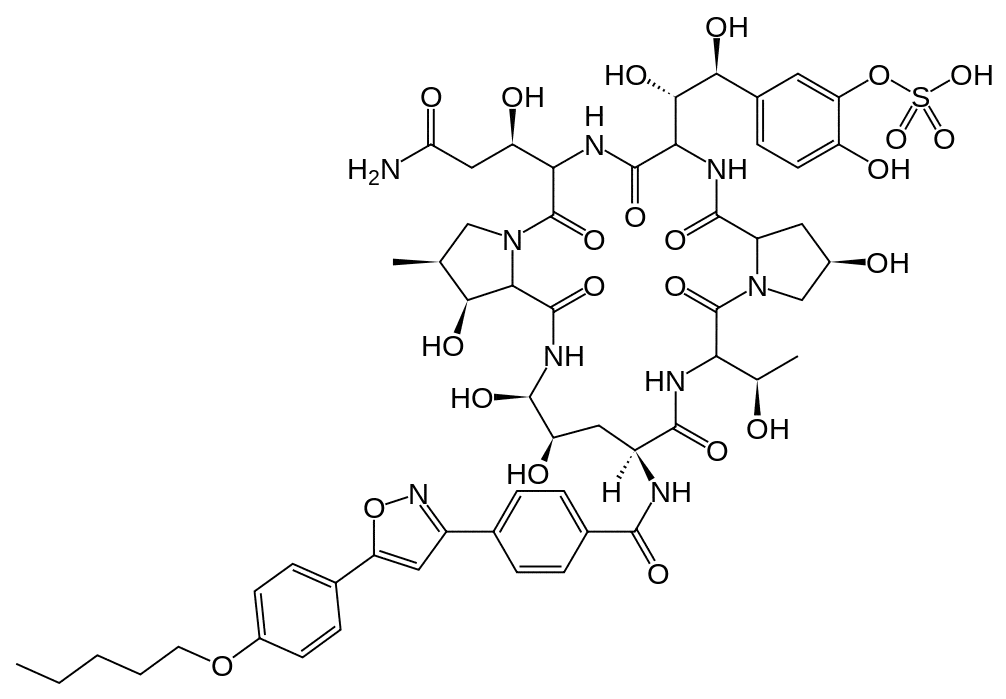
(5-[(1S,2S)-2-[(3S,6S,9S,11R,15S,18S,20R,21R,24S,25S,26S)-3-[(1R)-2-Карбамоил-1-гидроксиэтил]-11,20,21,25-тетрагидрокси-15-[(1R)-1-гидроксиэтил]-26-метил-2,5,8,14,17,23-гексаоксо-18-[(4-(5-[4-(пентилокси)фенил]-1,2-оксазол-3-ил)бензол)амидо]-1,4,7,13,16,22-гексаазатрицикло[22.3.0.09,13]гептакозан-6-ил]-1,2-дигидроксиэтил]-2-гидроксифенил)оксидансульфоновая кислота.
Used in the treatment
CAS Code
235114-32-6.
Characteristics of the substance
Микафунгин натрия представляет собой полусинтетический липопептид (эхинокандин), полученный химической модификацией продукта ферментации сoleophoma empetri F-11899.
Pharmacodynamics
Фармакодинамика.
Механизм действия.
Микафунгин неконкурентно ингибирует синтез 1,3-β-D-глюкана, важного компонента клеточной стенки грибов. 1,3-β-D-глюкан отсутствует в клетках млекопитающих. Микафунгин обладает фунгицидной активностью в отношении грибов рода сandida spp. и значительно ингибирует активный рост Aspergillus spp.
Спектр активности.
Микафунгин in vitro >in vitro активен в отношении различных видов сandida spp., в тч сandida albicans, сandida glabrata, сandida tropicalis, сandida krusei, сandida kefyr, сandida parapsilosis, сandida guilliermondii, сandida lusitaniae и чувствительных к микафунгину видов из рода Aspergillus spp. Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger, Aspergillus terreus, Aspergillus nidulans, Aspergillus versicolor, а также диморфных грибов (Histoplasma capsulatum, вlastomyces dermatitidis, сoccidioides immitis).
Микафунгин in vitro >in vitro неактивен против сryptococcus spp., Pseudallescheria spp., Scedosporium spp., Fusarium spp., Trichosporon spp., Zygomycetes spp.
Вероятность развития вторичной резистентности к микафунгину является очень низкой.
Таблица 1.
Минимальная ингибирующая концентрация микафунгина для грибов рода сandida.
Механизм действия.
Микафунгин неконкурентно ингибирует синтез 1,3-β-D-глюкана, важного компонента клеточной стенки грибов. 1,3-β-D-глюкан отсутствует в клетках млекопитающих. Микафунгин обладает фунгицидной активностью в отношении грибов рода сandida spp. и значительно ингибирует активный рост Aspergillus spp.
Спектр активности.
Микафунгин in vitro >in vitro активен в отношении различных видов сandida spp., в тч сandida albicans, сandida glabrata, сandida tropicalis, сandida krusei, сandida kefyr, сandida parapsilosis, сandida guilliermondii, сandida lusitaniae и чувствительных к микафунгину видов из рода Aspergillus spp. Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger, Aspergillus terreus, Aspergillus nidulans, Aspergillus versicolor, а также диморфных грибов (Histoplasma capsulatum, вlastomyces dermatitidis, сoccidioides immitis).
Микафунгин in vitro >in vitro неактивен против сryptococcus spp., Pseudallescheria spp., Scedosporium spp., Fusarium spp., Trichosporon spp., Zygomycetes spp.
Вероятность развития вторичной резистентности к микафунгину является очень низкой.
Таблица 1.
Минимальная ингибирующая концентрация микафунгина для грибов рода сandida.
| Вид грибов рода сandida | Минимальная ингибирующая концентрация, мг/мл (Европейские данные) |
| сandida albicans | 0,007-0,25 |
| сandida glabrata | 0,007-0,12 |
| сandida tropicalis | 0,007-0,12 |
| сandida krusei | 0,015-0,12 |
| сandida kefyr | 0,03-0,06 |
| сandida parapsilosis | 0,12-2 |
| сandida guilliermondii | 0,5 |
| сandida lusitaniae | 0,12-0,25 |
| сandida spp. (в тч С. famata,С. dubliniensis, С. lipolytica, С. pelliculosa, С. rugosa, С. stellatoidea и с.zeylanoides) | 0,015-0,5 |
Pharmacokinetics
Микафунгин вводят в/в. В диапазоне суточных доз 12,5-200 мг и 3-8 мг/кг микафунгин характеризуется линейной фармакокинетикой. Нет данных о системной кумуляции при повторном введении, ssCss устанавливается в течение 4-5 дней с начала применения.
Распределение.
После в/в введения концентрация микафунгина биэкспоненциально снижается. Микафунгин быстро распределяется в тканях. В системном кровотоке микафунгин активно связывается с белками плазмы (>99%), главным образом с альбумином. Связывание с альбумином остается стабильным в диапазоне концентраций 10-100 мкг/мл. Vss - 18-19 л.
Метаболизм.
Микафунгин циркулирует в системном кровотоке преимущественно в неизмененном виде. Было показано, что микафунгин метаболизируется с образованием нескольких соединений; из них М1 (катехоловая форма), М2 (метоксипроизводное М1) и М5 (образуется в результате гидроксилирования боковой цепи) производные микафунгина определяются в небольших количествах в системном кровотоке. Метаболиты не оказывают существенное влияние на эффективность микафунгина.
Несмотря на то что in vitro >in vitro микафунгин может метаболизироваться изоферментами сYP3A, гидроксилирование при участии изоферментов сYP3A не является основным путем метаболизма микафунгина in vivo >in vivo.
Элиминация и экскреция.
T1/2 микафунгина составляет 10-17 не меняется в диапазоне доз до 8 мг/кг после однократного и повторных введений. Общий клиренс у здоровых добровольцев и взрослых пациентов как при однократном, так и при повторных введениях составил 0,15-0,3 мл/мин/кг и не зависел от дозы. Через 28 дней после однократного введения 25 мг 14С-микафунгина здоровым добровольцам 11,6% радиоактивной метки обнаруживали в моче и 71% - в фекалиях, что свидетельствует о преимущественно непочечной элиминации микафунгина. Метаболиты М1 и М2 обнаруживались в плазме в следовых концентрациях, а метаболит М5 составил 6,5% от исходного соединения.
Различные группы пациентов.
Дети. У детей AUC пропорциональна дозе микафунгина в диапазоне 0,5-4 мг/кг. Клиренс зависит от возраста: средние величины клиренса у детей младшего возраста (2-11 лет) примерно в 1,3 раза выше, чем у детей старшего возраста (12-17 лет) и взрослых. Средний клиренс у недоношенных новорожденных (около 26 нед) примерно в 5 раз больше, чем у взрослых.
Пожилые пациенты. При инфузионном введении 50 мг микафунгина в течение 1 ч фармакокинетические параметры у лиц пожилого возраста (66-78 лет) существенно не отличались от таковых у молодых (20-24 года).
Нарушение функции печени. В исследовании, проводившемся с участием 8 пациентов с нарушением функции печени средней степени тяжести (индекс Чайлд-Пью - 7-9), фармакокинетика микафунгина незначительно отличалась от фармакокинетики у 8 здоровых добровольцев. В исследовании, проводившемся с участием 8 пациентов с тяжелой печеночной недостаточностью (индекс Чайлд-Пью - 10-12), наблюдалась сниженная концентрация микафунгина в плазме и повышенная концентрация в плазме гидроксиметаболита (М5) по сравнению с данными, полученными у 8 здоровых добровольцев.
Нарушение функции почек. Тяжелая почечная недостаточность (КФ <30 мл/мин) не оказывала существенное влияние на фармакокинетику микафунгина.
Пол/раса. Пол и раса не оказывали существенное влияние на фармакокинетические параметры микафунгина.
Распределение.
После в/в введения концентрация микафунгина биэкспоненциально снижается. Микафунгин быстро распределяется в тканях. В системном кровотоке микафунгин активно связывается с белками плазмы (>99%), главным образом с альбумином. Связывание с альбумином остается стабильным в диапазоне концентраций 10-100 мкг/мл. Vss - 18-19 л.
Метаболизм.
Микафунгин циркулирует в системном кровотоке преимущественно в неизмененном виде. Было показано, что микафунгин метаболизируется с образованием нескольких соединений; из них М1 (катехоловая форма), М2 (метоксипроизводное М1) и М5 (образуется в результате гидроксилирования боковой цепи) производные микафунгина определяются в небольших количествах в системном кровотоке. Метаболиты не оказывают существенное влияние на эффективность микафунгина.
Несмотря на то что in vitro >in vitro микафунгин может метаболизироваться изоферментами сYP3A, гидроксилирование при участии изоферментов сYP3A не является основным путем метаболизма микафунгина in vivo >in vivo.
Элиминация и экскреция.
T1/2 микафунгина составляет 10-17 не меняется в диапазоне доз до 8 мг/кг после однократного и повторных введений. Общий клиренс у здоровых добровольцев и взрослых пациентов как при однократном, так и при повторных введениях составил 0,15-0,3 мл/мин/кг и не зависел от дозы. Через 28 дней после однократного введения 25 мг 14С-микафунгина здоровым добровольцам 11,6% радиоактивной метки обнаруживали в моче и 71% - в фекалиях, что свидетельствует о преимущественно непочечной элиминации микафунгина. Метаболиты М1 и М2 обнаруживались в плазме в следовых концентрациях, а метаболит М5 составил 6,5% от исходного соединения.
Различные группы пациентов.
Дети. У детей AUC пропорциональна дозе микафунгина в диапазоне 0,5-4 мг/кг. Клиренс зависит от возраста: средние величины клиренса у детей младшего возраста (2-11 лет) примерно в 1,3 раза выше, чем у детей старшего возраста (12-17 лет) и взрослых. Средний клиренс у недоношенных новорожденных (около 26 нед) примерно в 5 раз больше, чем у взрослых.
Пожилые пациенты. При инфузионном введении 50 мг микафунгина в течение 1 ч фармакокинетические параметры у лиц пожилого возраста (66-78 лет) существенно не отличались от таковых у молодых (20-24 года).
Нарушение функции печени. В исследовании, проводившемся с участием 8 пациентов с нарушением функции печени средней степени тяжести (индекс Чайлд-Пью - 7-9), фармакокинетика микафунгина незначительно отличалась от фармакокинетики у 8 здоровых добровольцев. В исследовании, проводившемся с участием 8 пациентов с тяжелой печеночной недостаточностью (индекс Чайлд-Пью - 10-12), наблюдалась сниженная концентрация микафунгина в плазме и повышенная концентрация в плазме гидроксиметаболита (М5) по сравнению с данными, полученными у 8 здоровых добровольцев.
Нарушение функции почек. Тяжелая почечная недостаточность (КФ <30 мл/мин) не оказывала существенное влияние на фармакокинетику микафунгина.
Пол/раса. Пол и раса не оказывали существенное влияние на фармакокинетические параметры микафунгина.
Indications for use
Пациенты любого возраста. Лечение инвазивного кандидоза. профилактика кандидоза у пациентов после аллогенной трансплантации кроветворных стволовых клеток или больных. у которых предполагается нейтропения (количество нейтрофилов <500/мкл) в течение 10 дней и более.
Дополнительно для взрослых, в тч пожилых и подростков ≥16 лет. Лечение кандидоза пищевода у пациентов, которым требуется в/в применение противогрибковых ЛС.
Дополнительно для взрослых, в тч пожилых и подростков ≥16 лет. Лечение кандидоза пищевода у пациентов, которым требуется в/в применение противогрибковых ЛС.
Contraindications
Гиперчувствительность к микафунгину, другим эхинокандинам.
Restrictions on use
Применение микафунгина может сопровождаться значительным ухудшением функции печени (увеличение активности АЛТ, ACT или концентрации общего билирубина, более чем в 3 раза превышающее ВГН) как у здоровых добровольцев, так и у пациентов. В отдельных случаях отмечали более тяжелую дисфункцию печени (гепатит или печеночная недостаточность с летальным исходом). У пациентов в возрасте до 2 лет увеличен риск гепатотоксичности.
У крыс при применении препарата в течение ≥3 мес наблюдалось появление локальных очагов измененных гепатоцитов и формирование печеночно-клеточных опухолей. Значимость этого факта для клинического применения микафунгина у пациентов не установлена. В процессе лечения микафунгином необходимо обеспечить тщательный мониторинг функции печени. Для того, чтобы свести к минимуму риск адаптивной регенерации и, как следствие, возможного последующего образования опухолей печени, при значительном или персистирующем повышении активности AЛT/ACT рекомендуется отмена микафунгина.
Лечение микафунгином следует проводить, тщательно взвешивая соотношение риска и пользы, особенно у пациентов с тяжелым нарушением функции печени или хроническими заболеваниями печени, которые представляют собой предопухолевые состояния, такие как выраженный фиброз печени, цирроз, вирусный гепатит, болезни печени у новорожденных или врожденные ферментопатии, а также в случае одновременного применения ЛС, оказывающих гепатотоксическое и/или генотоксическое действие.
У крыс при применении препарата в течение ≥3 мес наблюдалось появление локальных очагов измененных гепатоцитов и формирование печеночно-клеточных опухолей. Значимость этого факта для клинического применения микафунгина у пациентов не установлена. В процессе лечения микафунгином необходимо обеспечить тщательный мониторинг функции печени. Для того, чтобы свести к минимуму риск адаптивной регенерации и, как следствие, возможного последующего образования опухолей печени, при значительном или персистирующем повышении активности AЛT/ACT рекомендуется отмена микафунгина.
Лечение микафунгином следует проводить, тщательно взвешивая соотношение риска и пользы, особенно у пациентов с тяжелым нарушением функции печени или хроническими заболеваниями печени, которые представляют собой предопухолевые состояния, такие как выраженный фиброз печени, цирроз, вирусный гепатит, болезни печени у новорожденных или врожденные ферментопатии, а также в случае одновременного применения ЛС, оказывающих гепатотоксическое и/или генотоксическое действие.
Use during pregnancy and lactation
Категория действия на плод по FDA. с.
Клинического опыта применения микафунгина у беременных нет. Поэтому его следует применять во время беременности, только после тщательной оценки соотношения риск/польза.
Неизвестно, проникает ли микафунгин в грудное молоко. Решение о продолжении/прекращении грудного вскармливания или о продолжении/прекращении лечения микафунгином следует принимать, учитывая пользу грудного вскармливания для ребенка и лечения для матери.
Клинического опыта применения микафунгина у беременных нет. Поэтому его следует применять во время беременности, только после тщательной оценки соотношения риск/польза.
Неизвестно, проникает ли микафунгин в грудное молоко. Решение о продолжении/прекращении грудного вскармливания или о продолжении/прекращении лечения микафунгином следует принимать, учитывая пользу грудного вскармливания для ребенка и лечения для матери.
Side effects
При анализе данных по безопасности в зависимости от пола или расы не было выявлено клинически значимых различий.
Нежелательные реакции по разным органам и системам с указанием частоты приведены ниже: часто (1/100. <1/10). нечасто (≥1/1000. <1/100). редко (≥1/10000. до 1/1000). частота неизвестна (имеющиеся данные не позволяют определить частоту).
Со стороны крови и лимфатической системы. Часто - лейкопения. нейтропения. анемия. нечасто - панцитопения. тромбоцитопения. эозинофилия. гипоальбуминемия. редко - гемолитическая анемия. гемолиз. частота неизвестна - диссеминированное внутрисосудистое свертывание.
Со стороны иммунной системы. Нечасто - анафилактические/анафилактоидные реакции, реакции гиперчувствительности.
Со стороны обмена веществ и питания. Часто - гипокалиемия. гипомагниемия. гипокальциемия. нечасто - гипонатриемия. гиперкалиемия. гипофосфатемия. анорексия.
Со стороны психики. Нечасто - бессонница, тревожность, нарушение сознания.
Со стороны нервной системы. Часто - головная боль; нечасто - сонливость, тремор, головокружение, извращение вкуса.
Со стороны сердца. Нечасто - тахикардия, учащенное сердцебиение, брадикардия.
Со стороны сосудов. Часто - флебит (преимущественно у ВИЧ-инфицированных пациентов с периферическими катетерами); нечасто - артериальная гипотензия, артериальная гипертензия, гиперемия; частота неизвестна - шок.
Со стороны дыхательной системы, органов грудной клетки и средостения. Нечасто - одышка.
Со стороны ЖКТ. Часто - тошнота. рвота. диарея. боль в животе. нечасто - диспепсия. запоры.
Со стороны печени и желчевыводящих путей. Часто - повышение активности ЩФ. АЛТ. АСТ. концентрации билирубина в сыворотке крови (включая гипербилирубинемию). изменение функциональных печеночных тестов. нечасто - печеночная недостаточность. повышение активности ГГТ. желтуха. холестаз. гепатомегалия. гепатит. частота неизвестна - гепатоцеллюлярные поражения. в тч случаи летального исхода.
Со стороны кожи и подкожной клетчатки. Часто - сыпь. нечасто - крапивница. зуд. эритема. гипергидроз. частота неизвестна - токсические высыпания на коже. мультиформная эритема. синдром Стивенса-Джонсона. токсический эпидермальный некролиз.
Со стороны почек и мочевыводящих путей. Нечасто - повышение концентрации креатинина. мочевины в сыворотке крови. прогрессирование почечной недостаточности. частота неизвестна - нарушение функции почек. острая почечная недостаточность.
Общие расстройства и нарушения в месте введения. Часто - гипертермия. озноб. нечасто - образование тромба. боль в месте инъекции. воспаление в месте инфузии. периферический отек.
Лабораторные и инструментальные данные. Нечасто - повышение активности ЛДГ в сыворотке крови.
Дети.
Частота некоторых нежелательных реакций, перечисленных ниже, у детей была выше, чем у взрослых. Кроме того, у детей до 1 года в два раза чаще, чем у детей старшего возраста, выявляли увеличение активности АЛТ, АСТ и ЩФ.
Со стороны крови и лимфатической системы. Часто - тромбоцитопения.
Со стороны сердца. Часто - тахикардия.
Со стороны сосудов. Часто - артериальная гипертензия, артериальная гипотензия.
Со стороны печени и желчевыводящих путей. Часто - гипербилирубинемия, гепатомегалия.
Со стороны почек и мочевыводящих путей. Часто - острая почечная недостаточность, повышение концентрации мочевины в сыворотке крови.
Нежелательные реакции по разным органам и системам с указанием частоты приведены ниже: часто (1/100. <1/10). нечасто (≥1/1000. <1/100). редко (≥1/10000. до 1/1000). частота неизвестна (имеющиеся данные не позволяют определить частоту).
Со стороны крови и лимфатической системы. Часто - лейкопения. нейтропения. анемия. нечасто - панцитопения. тромбоцитопения. эозинофилия. гипоальбуминемия. редко - гемолитическая анемия. гемолиз. частота неизвестна - диссеминированное внутрисосудистое свертывание.
Со стороны иммунной системы. Нечасто - анафилактические/анафилактоидные реакции, реакции гиперчувствительности.
Со стороны обмена веществ и питания. Часто - гипокалиемия. гипомагниемия. гипокальциемия. нечасто - гипонатриемия. гиперкалиемия. гипофосфатемия. анорексия.
Со стороны психики. Нечасто - бессонница, тревожность, нарушение сознания.
Со стороны нервной системы. Часто - головная боль; нечасто - сонливость, тремор, головокружение, извращение вкуса.
Со стороны сердца. Нечасто - тахикардия, учащенное сердцебиение, брадикардия.
Со стороны сосудов. Часто - флебит (преимущественно у ВИЧ-инфицированных пациентов с периферическими катетерами); нечасто - артериальная гипотензия, артериальная гипертензия, гиперемия; частота неизвестна - шок.
Со стороны дыхательной системы, органов грудной клетки и средостения. Нечасто - одышка.
Со стороны ЖКТ. Часто - тошнота. рвота. диарея. боль в животе. нечасто - диспепсия. запоры.
Со стороны печени и желчевыводящих путей. Часто - повышение активности ЩФ. АЛТ. АСТ. концентрации билирубина в сыворотке крови (включая гипербилирубинемию). изменение функциональных печеночных тестов. нечасто - печеночная недостаточность. повышение активности ГГТ. желтуха. холестаз. гепатомегалия. гепатит. частота неизвестна - гепатоцеллюлярные поражения. в тч случаи летального исхода.
Со стороны кожи и подкожной клетчатки. Часто - сыпь. нечасто - крапивница. зуд. эритема. гипергидроз. частота неизвестна - токсические высыпания на коже. мультиформная эритема. синдром Стивенса-Джонсона. токсический эпидермальный некролиз.
Со стороны почек и мочевыводящих путей. Нечасто - повышение концентрации креатинина. мочевины в сыворотке крови. прогрессирование почечной недостаточности. частота неизвестна - нарушение функции почек. острая почечная недостаточность.
Общие расстройства и нарушения в месте введения. Часто - гипертермия. озноб. нечасто - образование тромба. боль в месте инъекции. воспаление в месте инфузии. периферический отек.
Лабораторные и инструментальные данные. Нечасто - повышение активности ЛДГ в сыворотке крови.
Дети.
Частота некоторых нежелательных реакций, перечисленных ниже, у детей была выше, чем у взрослых. Кроме того, у детей до 1 года в два раза чаще, чем у детей старшего возраста, выявляли увеличение активности АЛТ, АСТ и ЩФ.
Со стороны крови и лимфатической системы. Часто - тромбоцитопения.
Со стороны сердца. Часто - тахикардия.
Со стороны сосудов. Часто - артериальная гипертензия, артериальная гипотензия.
Со стороны печени и желчевыводящих путей. Часто - гипербилирубинемия, гепатомегалия.
Со стороны почек и мочевыводящих путей. Часто - острая почечная недостаточность, повышение концентрации мочевины в сыворотке крови.
Interaction
Микафунгин обладает низким потенциалом взаимодействия с ЛС, которые метаболизируются с участием изоферментов сYP3A.
Микафунгин нельзя смешивать или вводить пациентам одновременно с другими ЛС, за исключением 0,9% раствора натрия хлорида и 5% раствора декстрозы.
При одновременном применении микафунгина с такими ЛС, как микофенолата мофетил, циклоспорин, такролимус, преднизолон, сиролимус, нифедипин, флуконазол, ритонавир, рифампицин, итраконазол, вориконазол и амфотерицин в, коррекция режима дозирования микафунгина не требуется.
При сочетанном применении с микафунгином AUC итраконазола, сиролимуса и нифедипина незначительно увеличивалась - на 22, 21 и 18% соответственно.
Совместное применение микафунгина и амфотерицина В дезоксихолата ассоциировалось с 30% повышением экспозиции амфотерицина В дезоксихолата. Поскольку это может иметь клиническое значение, к такому совместному применению следует прибегать только в том случае, если польза явно превышает риск, с тщательным контролем токсичности амфотерицина В дезоксихолата.
Пациентам, получающим сиролимус, нифедипин или итраконазол в комбинации с микафунгином, необходим мониторинг с целью выявления токсического действия сиролимуса, нифедипина или итраконазола и при необходимости - снижения дозы указанных ЛС.
Микафунгин нельзя смешивать или вводить пациентам одновременно с другими ЛС, за исключением 0,9% раствора натрия хлорида и 5% раствора декстрозы.
При одновременном применении микафунгина с такими ЛС, как микофенолата мофетил, циклоспорин, такролимус, преднизолон, сиролимус, нифедипин, флуконазол, ритонавир, рифампицин, итраконазол, вориконазол и амфотерицин в, коррекция режима дозирования микафунгина не требуется.
При сочетанном применении с микафунгином AUC итраконазола, сиролимуса и нифедипина незначительно увеличивалась - на 22, 21 и 18% соответственно.
Совместное применение микафунгина и амфотерицина В дезоксихолата ассоциировалось с 30% повышением экспозиции амфотерицина В дезоксихолата. Поскольку это может иметь клиническое значение, к такому совместному применению следует прибегать только в том случае, если польза явно превышает риск, с тщательным контролем токсичности амфотерицина В дезоксихолата.
Пациентам, получающим сиролимус, нифедипин или итраконазол в комбинации с микафунгином, необходим мониторинг с целью выявления токсического действия сиролимуса, нифедипина или итраконазола и при необходимости - снижения дозы указанных ЛС.
Overdose
Нет данных о передозировке микафунгина.
Лечение. В случае возможной передозировки следует применять общие поддерживающие меры и симптоматическое лечение. Микафунгин характеризуется высокой степенью связывания с белками и не выводится при диализе.
Лечение. В случае возможной передозировки следует применять общие поддерживающие меры и симптоматическое лечение. Микафунгин характеризуется высокой степенью связывания с белками и не выводится при диализе.
Method of drug use and dosage
В/в. Режим дозирования микафунгина определяется с учетом показаний, возраста и массы тела пациента.
Application precautions
При введении микафунгина возможны анафилактические/анафилактоидные реакции, включая шок. При их возникновении необходимо прекратить инфузию микафунгина и назначить необходимое лечение.
При применении микафунгина возможно появление эксфолиативных кожных реакций, таких как синдром Стивенса-Джонсона и токсический эпидермальный некролиз. Если у пациентов развивается сыпь, их состояние следует тщательно контролировать и прекратить применение микафунгина в случае его ухудшения.
В редких случаях у пациентов на фоне лечения микафунгином наблюдались гемолиз, включая острый внутрисосудистый, и гемолитическая анемия.
При появлении клинических или лабораторных признаков гемолиза следует обеспечить тщательный мониторинг состояния пациента и оценить соотношение риска и пользы продолжения лечения.
При использовании микафунгина отмечено изменение функции почек, в тч развитие почечной недостаточности, поэтому во время лечения необходимо обеспечить тщательный мониторинг функции почек.
Влияние на способность управлять транспортными средствами и работать с механизмами. Никаких исследований по оценке влияния микафунгина на способность управлять транспортными средствами и работу с механизмами не проводилось. Однако возможно возникновение нежелательных реакций, которые могут отрицательно повлиять на способность управлять транспортными средствами и работать с механизмами.
При применении микафунгина возможно появление эксфолиативных кожных реакций, таких как синдром Стивенса-Джонсона и токсический эпидермальный некролиз. Если у пациентов развивается сыпь, их состояние следует тщательно контролировать и прекратить применение микафунгина в случае его ухудшения.
В редких случаях у пациентов на фоне лечения микафунгином наблюдались гемолиз, включая острый внутрисосудистый, и гемолитическая анемия.
При появлении клинических или лабораторных признаков гемолиза следует обеспечить тщательный мониторинг состояния пациента и оценить соотношение риска и пользы продолжения лечения.
При использовании микафунгина отмечено изменение функции почек, в тч развитие почечной недостаточности, поэтому во время лечения необходимо обеспечить тщательный мониторинг функции почек.
Влияние на способность управлять транспортными средствами и работать с механизмами. Никаких исследований по оценке влияния микафунгина на способность управлять транспортными средствами и работу с механизмами не проводилось. Однако возможно возникновение нежелательных реакций, которые могут отрицательно повлиять на способность управлять транспортными средствами и работать с механизмами.
References
Обобщенные материалы www.grls.rosminzdrav.ru, 2014.
Included in the composition
- 25.3€ Микафунгин ПСК (ПСК Фарма ООО )
- 36.6-67€ Mycamine (3 firms)
- — Микафунгин (7 firms)
- — Микафунгин Дж (2 firms)
- — Микафунгин Канон
- — Микафунгин-Бинергия (Армавирская биофабрика ФКП )
- — Микафунгин-Тева (Actavis Italy S.p.A. )
- — Микафунгин-натив (2 firms)
- — Микафуцид (2 firms)