ICD-10 codes
- ICD-10
- E21 Hyperparathyroidism and other disorders of parathyroid gland
- E21.3 Hyperparathyroidism, unspecified
- D35.1 Benign neoplasm, parathyroid gland
- E21.2 Other hyperparathyroidism
- E21.0 Primary hyperparathyroidism
- E21.5 Disorder of parathyroid gland, unspecified
- C75.0 Malignant neoplasm, parathyroid gland
- E21.4 Other specified disorders of parathyroid gland
Introduction
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: E21.0, E21.2, E21.3, E21.4, E21.5, D35.1, с75.0.
Год утверждения (частота пересмотра): 2020.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2022.
ID: 88.
Разработчик клинической рекомендации.
• Российская ассоциация эндокринологов.
• Ассоциации эндокринных хирургов.
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2020.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2022.
ID: 88.
Разработчик клинической рекомендации.
• Российская ассоциация эндокринологов.
• Ассоциации эндокринных хирургов.
Одобрено Научно-практическим Советом Минздрава РФ.
 List of abbreviations
List of abbreviations
25(OH)D - 25-гидроксивитамин D, кальцидиол.
1,25(OH)2D - 1,25-гидроксивитамин D, кальцитриол.
ВГПТ - вторичный гиперпаратиреоз.
ЖКТ - желудочно-кишечный тракт.
КТ - компьютерная томография.
МКБ-10 - международная классификация болезней 10-го пересмотра.
МПК - минеральная плотность кости.
МРТ - магнитно-резонансная томография.
МСКТ - мультиспиральная компьютерная томография.
МЭН - синдром множественных эндокринных неоплазий.
НПГПТ - нормокальциемический вариант первичного гиперпаратиреоза.
ОЩЖ - околощитовидная железа.
ОФЭКТ - однофотонная эмиссионная компьютерная томография.
ОФЭКТ/КТ - однофотонная эмиссионная компьютерная томография совмещенная с (рентгеновской) компьютерной томографией.
ПГПТ - первичный гиперпаратиреоз.
ПОД - почечная остеодистрофия.
ПТГ - паратиреоидный гормон, паратгормон.
ИПТГ - интактный паратгормон.
ПТЭ - паратиреоидэктомия.
ПЭТ - позитронно-эмиссионная томография.
СКФ - скорость клубочковой фильтрации.
ТГПТ - третичный гиперпаратиреоз.
УЗИ - ультразвуковое исследование.
ХБП - хроническая болезнь почек.
ЩЖ - щитовидная железа.
Са++ - ионизированный кальций.
CaSR - кальций-чувствительный рецептор.
FHH - семейная гипокальциурическая гиперкальциемия (familial hypocalciuric hypercalcemia).
UCCR - отношение почечного клиренса кальция к клиренсу креатинина.
1,25(OH)2D - 1,25-гидроксивитамин D, кальцитриол.
ВГПТ - вторичный гиперпаратиреоз.
ЖКТ - желудочно-кишечный тракт.
КТ - компьютерная томография.
МКБ-10 - международная классификация болезней 10-го пересмотра.
МПК - минеральная плотность кости.
МРТ - магнитно-резонансная томография.
МСКТ - мультиспиральная компьютерная томография.
МЭН - синдром множественных эндокринных неоплазий.
НПГПТ - нормокальциемический вариант первичного гиперпаратиреоза.
ОЩЖ - околощитовидная железа.
ОФЭКТ - однофотонная эмиссионная компьютерная томография.
ОФЭКТ/КТ - однофотонная эмиссионная компьютерная томография совмещенная с (рентгеновской) компьютерной томографией.
ПГПТ - первичный гиперпаратиреоз.
ПОД - почечная остеодистрофия.
ПТГ - паратиреоидный гормон, паратгормон.
ИПТГ - интактный паратгормон.
ПТЭ - паратиреоидэктомия.
ПЭТ - позитронно-эмиссионная томография.
СКФ - скорость клубочковой фильтрации.
ТГПТ - третичный гиперпаратиреоз.
УЗИ - ультразвуковое исследование.
ХБП - хроническая болезнь почек.
ЩЖ - щитовидная железа.
Са++ - ионизированный кальций.
CaSR - кальций-чувствительный рецептор.
FHH - семейная гипокальциурическая гиперкальциемия (familial hypocalciuric hypercalcemia).
UCCR - отношение почечного клиренса кальция к клиренсу креатинина.
Terms and definitions
Гиперпаратиреоз. Эндокринное заболевание, в основе которого лежит избыточная продукция паратгормона (ПТГ) околощитовидными железами (ОЩЖ).
Первичный гиперпаратиреоз. Эндокринное заболевание, характеризующееся избыточной секрецией ПТГ при верхне-нормальном или повышенном уровне кальция крови вследствие первичной патологии ОЩЖ.
Вторичный гиперпаратиреоз - состояние, характеризующееся увеличением функциональной активности ОЩЖ вследствие различных заболеваний или приема некоторых медикаментозных препаратов, приводящих к нарушению фосфорно-кальциевого гомеостаза (хронической гипокальциемии, гиперфосфатемии, гипомагниемии, дефициту 25(ОН)D или нарушению синтеза 1,25(ОН)2D), и в отсутствии адекватного лечения приводящее к их компенсаторной гиперплазии.
Третичный гиперпаратиреоз. Эндокринное заболевание, развивающееся в результате длительно текущего вторичного гиперпаратиреоза и характеризующееся автономной секрецией ПТГ вследствие персистирующей гиперфункции одной или нескольких ОЩЖ, несмотря на устранение причин его развития, включая успешную трансплантацию почки.
Гиперкальциемия. Повышение содержания общего и/или ионизированного кальция в крови.
Гиперкальциемический криз. Тяжёлое жизнеугрожающее состояние, остро развивающееся у пациентов на фоне быстрого и резкого повышения уровня кальция в крови (риск гиперкальциемического криза значимо повышается при уровне кальция крови более 3,5 ммоль/л).
Гиперкальциурия. Повышение экскреции кальция с мочой.
Инсипидарный синдром. Состояние, характеризующееся полидипсией, полиурией и низким удельным весом мочи (менее 1010 г/л).
Нефрокальциноз. Диффузное отложение солей кальция внутри клеток почечного эпителия, сопровождающееся воспалительно-склеротическими изменениями.
Нефролитиаз. Наличие конкрементов в чашечно-лоханочной системе почки.
Остеопороз. Хроническое системное метаболическое заболевание скелета, характеризующееся снижением костной массы, нарушением микроархитектоники костной ткани и, как следствие, переломами при минимальной травме.
Фиброзно-кистозный остеит (osteitis fibrosis cystica, болезнь Энгеля. Реклингхаузена, паратиреоидная остеодистрофия) - заболевание скелета, вызванное гиперфункцией ОЩЖ и избыточной секрецией ПТГ, проявляющееся избыточной остеокластической резорбцией, фиброзным перерождением костного мозга и генерализованным остеопорозом и приводящее к патологическими переломам, деформации скелета с формированием кист («бурых» опухолей).
Почечная остеодистрофия (ПОД). Широкий спектр костных нарушений вследствие хронической болезни почек, включающий в себя ПОД с высоким метаболизмом кости (фиброзный остеит и смешанную остеодистрофию), ПОД с нормальным костным обменом, ПОД с низким метаболизмом кости (адинамическую костную болезнь и остеомаляцию); компонент синдрома минеральных и костных нарушений при хронической болезни почек.
Первичный гиперпаратиреоз. Эндокринное заболевание, характеризующееся избыточной секрецией ПТГ при верхне-нормальном или повышенном уровне кальция крови вследствие первичной патологии ОЩЖ.
Вторичный гиперпаратиреоз - состояние, характеризующееся увеличением функциональной активности ОЩЖ вследствие различных заболеваний или приема некоторых медикаментозных препаратов, приводящих к нарушению фосфорно-кальциевого гомеостаза (хронической гипокальциемии, гиперфосфатемии, гипомагниемии, дефициту 25(ОН)D или нарушению синтеза 1,25(ОН)2D), и в отсутствии адекватного лечения приводящее к их компенсаторной гиперплазии.
Третичный гиперпаратиреоз. Эндокринное заболевание, развивающееся в результате длительно текущего вторичного гиперпаратиреоза и характеризующееся автономной секрецией ПТГ вследствие персистирующей гиперфункции одной или нескольких ОЩЖ, несмотря на устранение причин его развития, включая успешную трансплантацию почки.
Гиперкальциемия. Повышение содержания общего и/или ионизированного кальция в крови.
Гиперкальциемический криз. Тяжёлое жизнеугрожающее состояние, остро развивающееся у пациентов на фоне быстрого и резкого повышения уровня кальция в крови (риск гиперкальциемического криза значимо повышается при уровне кальция крови более 3,5 ммоль/л).
Гиперкальциурия. Повышение экскреции кальция с мочой.
Инсипидарный синдром. Состояние, характеризующееся полидипсией, полиурией и низким удельным весом мочи (менее 1010 г/л).
Нефрокальциноз. Диффузное отложение солей кальция внутри клеток почечного эпителия, сопровождающееся воспалительно-склеротическими изменениями.
Нефролитиаз. Наличие конкрементов в чашечно-лоханочной системе почки.
Остеопороз. Хроническое системное метаболическое заболевание скелета, характеризующееся снижением костной массы, нарушением микроархитектоники костной ткани и, как следствие, переломами при минимальной травме.
Фиброзно-кистозный остеит (osteitis fibrosis cystica, болезнь Энгеля. Реклингхаузена, паратиреоидная остеодистрофия) - заболевание скелета, вызванное гиперфункцией ОЩЖ и избыточной секрецией ПТГ, проявляющееся избыточной остеокластической резорбцией, фиброзным перерождением костного мозга и генерализованным остеопорозом и приводящее к патологическими переломам, деформации скелета с формированием кист («бурых» опухолей).
Почечная остеодистрофия (ПОД). Широкий спектр костных нарушений вследствие хронической болезни почек, включающий в себя ПОД с высоким метаболизмом кости (фиброзный остеит и смешанную остеодистрофию), ПОД с нормальным костным обменом, ПОД с низким метаболизмом кости (адинамическую костную болезнь и остеомаляцию); компонент синдрома минеральных и костных нарушений при хронической болезни почек.
Description
Первичный гиперпаратиреоз (ПГПТ) - эндокринное заболевание, характеризующееся избыточной секрецией ПТГ при верхне-нормальном или повышенном уровне кальция крови вследствие первичной патологии ОЩЖ. ПГПТ проявляется полиорганными нарушениями различной степени выраженности и, как следствие, может приводить к существенному снижению качества жизни, инвалидизации пациентов, повышенному риску преждевременной смерти [1].
Reasons
ПГПТ в 85-90% случаев обусловлен солитарной аденомой ОЩЖ, в 5-10% случаев - множественными аденомами или гиперплазией нескольких/всех ОЩЖ; в 1% - раком ОЩЖ. В 90-95% случаев ПГПТ является спорадическим, около 5-10% составляют наследственные формы, которые проявляются изолированной патологией ОЩЖ или протекают в сочетании с другими компонентами генетически детерминированных синдромов[2].
Патогенез опухолей ОЩЖ изучен недостаточно, в литературе обсуждается влияние некоторых протоонкогенов и генов супрессоров опухолевой активности на развитие образований ОЩЖ. В качестве предположительных механизмов запуска гиперплазии с последующей трансформацией в аденому ОЩЖ рассматриваются хронический дефицит витамина D и усиление его инактивации в печени (Артемова, 2010 627)[3]. Постоянная потребность в гиперсекреции ПТГ, предположительно, порождает конверсию протоонкогенов в онкогены или инактивацию генов-супрессоров пролиферации. Образование опухоли часто.
Представляет собой многоэтапный процесс, во время которого клетки приобретают мутации/делеции в одном или нескольких генах, не исключается участие эпигенетических.
Факторов. Большинство новообразований являются моноклональными, что подразумевает.
Их происхождение из одной аномальной клетки. В ряде случаев спорадических форм ПГПТ могут происходить ключевые соматические онкогенные события - соматические мутации в генах MEN1, сDC73, сASR или ингибиторов циклин-зависимых киназ сDKIs, что приводит к формированию опухолевой ткани. По результатам исследований с использованием высокопроизводительного секвенирования (NGS) было показано, что в основе формирования спорадических аденом ОЩЖ в 35% случаев лежат соматические мутации MEN1, и только в 10% определяются соматические мутации в других генах, например, EZH2, POT1 [4].
ПГПТ, сопровождающийся гиперплазией ОЩЖ или множественными аденомами, как правило, связан с наследственными синдромами и может быть обусловлен мутациями в различных генах. Синдром множественных эндокринных неоплазий 1 типа (МЭН-1) ассоциирован с мутациями в гене-супрессоре опухолевого роста MEN1; синдром МЭН-2 - с мутациями протоонкогена RET; синдром МЭН-4 развивается вследствие мутации ингибитора циклин-зависимой киназы сDNK1B [5]. Синдром гиперпаратиреоза с опухолью нижней челюсти (HPT-JT) ассоциирован с мутациями в гене сDC73, кодирующем белок парафибромин [6]. Семейный изолированный гиперпаратиреоз (FIHP) - редкое заболевание с аутосомно-доминантным типом наследования, характеризующееся развитием опухолей одной или нескольких ОЩЖ и отсутствием других новообразований эндокринных и неэндокринных органов, иногда может представлять собой неполный вариант других синдромов (МЭН-1, HPT-JT). FIHP может быть ассоциирован с мутациями в генах MEN1, сASR и сDC73 [7]. Семейная гипокальциурическая гиперкальциемия (FHH) - генетически гетерогенное заболевание, обусловленное мутациями в генах сASR, Gα11, AP2S1, требует проведения дифференциальной диагностики с ПГПТ. [5]. Для карцином ОЩЖ описаны мутации в генах СDC73 (около 50% случаев), мутации PRUNE2 - в 18% [8].
Патогенез опухолей ОЩЖ изучен недостаточно, в литературе обсуждается влияние некоторых протоонкогенов и генов супрессоров опухолевой активности на развитие образований ОЩЖ. В качестве предположительных механизмов запуска гиперплазии с последующей трансформацией в аденому ОЩЖ рассматриваются хронический дефицит витамина D и усиление его инактивации в печени (Артемова, 2010 627)[3]. Постоянная потребность в гиперсекреции ПТГ, предположительно, порождает конверсию протоонкогенов в онкогены или инактивацию генов-супрессоров пролиферации. Образование опухоли часто.
Представляет собой многоэтапный процесс, во время которого клетки приобретают мутации/делеции в одном или нескольких генах, не исключается участие эпигенетических.
Факторов. Большинство новообразований являются моноклональными, что подразумевает.
Их происхождение из одной аномальной клетки. В ряде случаев спорадических форм ПГПТ могут происходить ключевые соматические онкогенные события - соматические мутации в генах MEN1, сDC73, сASR или ингибиторов циклин-зависимых киназ сDKIs, что приводит к формированию опухолевой ткани. По результатам исследований с использованием высокопроизводительного секвенирования (NGS) было показано, что в основе формирования спорадических аденом ОЩЖ в 35% случаев лежат соматические мутации MEN1, и только в 10% определяются соматические мутации в других генах, например, EZH2, POT1 [4].
ПГПТ, сопровождающийся гиперплазией ОЩЖ или множественными аденомами, как правило, связан с наследственными синдромами и может быть обусловлен мутациями в различных генах. Синдром множественных эндокринных неоплазий 1 типа (МЭН-1) ассоциирован с мутациями в гене-супрессоре опухолевого роста MEN1; синдром МЭН-2 - с мутациями протоонкогена RET; синдром МЭН-4 развивается вследствие мутации ингибитора циклин-зависимой киназы сDNK1B [5]. Синдром гиперпаратиреоза с опухолью нижней челюсти (HPT-JT) ассоциирован с мутациями в гене сDC73, кодирующем белок парафибромин [6]. Семейный изолированный гиперпаратиреоз (FIHP) - редкое заболевание с аутосомно-доминантным типом наследования, характеризующееся развитием опухолей одной или нескольких ОЩЖ и отсутствием других новообразований эндокринных и неэндокринных органов, иногда может представлять собой неполный вариант других синдромов (МЭН-1, HPT-JT). FIHP может быть ассоциирован с мутациями в генах MEN1, сASR и сDC73 [7]. Семейная гипокальциурическая гиперкальциемия (FHH) - генетически гетерогенное заболевание, обусловленное мутациями в генах сASR, Gα11, AP2S1, требует проведения дифференциальной диагностики с ПГПТ. [5]. Для карцином ОЩЖ описаны мутации в генах СDC73 (около 50% случаев), мутации PRUNE2 - в 18% [8].
Epidemiology
До середины 1970-х гг. ПГПТ считали редкой патологии фосфорно-кальциевого обмена, проявляющейся тяжелой клинической симптоматикой с поражением почек (рецидивирующий нефролитиаз), костной системы (патологические переломы, деформация скелета, фиброзно-кистозный остеит) и желудочно-кишечного тракта (ЖКТ, рецидивирующие язвы желудка и 12-перстной кишки). По результатам крупнейшего эпидемиологического исследования, проведенного в 1965-1974 гг. в клинике Мейо г. Рочестера (США), заболеваемость ПГПТ составила в среднем 7,8±1,2 случая на 100 000 жителей [9].
За последние десятилетия произошли существенные изменения в представлениях об эпидемиологии заболевания. Отмечено резкое увеличение выявляемости ПГПТ, в том числе за счет бессимптомных форм, не сопровождающихся высокой гиперкальциемией. Указанные данные изменения обусловлены, прежде всего, появлением автоматических биохимических анализаторов и активным внедрением повсеместного определения уровня кальция в странах Северной Америки, Западной Европы и Китае. В общей популяции распространенность ПГПТ составляет в среднем 0,86-1% [10]. Необходимо отметить, что результаты эпидемиологических исследований остаются вариабельными, что обусловлено различиями в диагностических критериях ПГПТ и методологии биохимического скрининга кальциемии. ПГПТ может встречаться во всех возрастных группах, включая детей и подростков. Однако совокупность фактических данных свидетельствует о том, что частота возникновения ПГПТ увеличивается с возрастом, и средний возраст на момент постановки диагноза составляет 54-59 лет [11]. Большинство пациентов при спорадическом ПГПТ - женщины в постменопаузе с развитием заболевания в течение первого десятилетия после наступления менопаузы. Соотношение мужчин и женщин в среднем 1:3 [11].
Наиболее объективные данные о распространенности ПГПТ представляют крупные эпидемиологические исследования, проведенные в Швеции с 1976 по 2002 годы, и десятилетнее проспективное исследование одного округа Шотландии среди всех жителей старше 20 лет [12-15]. По данным шведских исследований распространенность ПГПТ среди взрослых лиц обоих полов старше 18 лет составляла примерно 1% от всего взрослого населения, возрастая до 2,1% в группе женщин в менопаузе (55-75 лет). В результате исследования шотландской популяции за 10 лет зарегистрировано 2709 новых случаев ПГПТ: 1918 женщин (71%) и 791 мужчина (29%). В подавляющем большинстве заболевание диагностировалось у лиц старше 40 лет. Пик заболеваемости приходился на период 60-70 лет, что подтверждало повышение риска развития заболевания с возрастом. Соотношение женщины/мужчины возрастало от 2 (в возрасте 40-49 лет) до 4 (в период старше 80 лет). В результате заболеваемость ПГПТ составила в разные годы от 4,13 до 11,3 случаев на 10 000 человеко-лет [14]. В одном из последних исследований по эпидемиологии ПГПТ в Калифорнии были проанализированы данные о 15 234 пациентах с хронической гиперкальцемией, и установлено, что в 87% наблюдений причиной повышения кальция сыворотки крови являлся ПГПТ. Распространенность ПГПТ колебалась в среднем в пределах 34-120 случаев на 10000 среди женщин и 13-36 случаев среди мужчин. С возрастом определялось значимое увеличение заболеваемости в целом и превалирование среди женщин, кроме того авторы выявили достоверную разницу в частоте развития заболевания в зависимости от этнической принадлежности пациентов (максимальная распространенность отмечена для афроамериканцев, р<0,0001) [16]. Таким образом, первичное поражение ОЩЖ остается основным этиологическим фактором гиперкальциемии. Необходимо отметить, что на втором месте среди причин гиперкальциемии находятся злокачественные новообразования. В более чем 50% случаев паранеопластическая гиперкальциемия обусловлена раком молочной железы с отдаленными метастазами в кости. Гиперкальциемия наблюдается при злокачественных опухолях легких и почек, гемобластозах (миеломная болезнь, лимфомы, лимфогранулематоз, лейкозы). Повышение кальция сыворотки крови развивается в результате метастатического поражения скелета, а также локальной активации процессов костной резорбции из-за выработки метастазами цитокинов типа фактора некроза опухоли и интерлейкина-1 или гуморальных активаторов остеокластов, особенно ПТГ-подобного пептида.
У большей части пациентов в Российской Федерации гиперкальциемия диагностируется отсрочено, поскольку определение содержания кальция не входит в общетерапевтический биохимический анализ крови. Это создает предпосылки для позднего выявления гиперпаратиреоза. Согласно приказу Министерства здравоохранения Российской Федерации от 3 декабря 2012 года №1006 «Об утверждении порядка проведения диспансеризации определенных групп взрослого населения» общетерапевтический биохимический анализ включает в себя только определение уровня общего белка, альбумина, креатинина, общего билирубина, аспартат-аминотрансаминазы, аланин-аминотрансаминазы, глюкозы, холестерина, натрия, калия.
В Российской Федерации широкомасштабных эпидемиологических исследований не проводилось. Пилотные скрининговые исследования уровня кальция крови проводились в период с 2005 по 2017 гг. на независимых выборках взрослых жителей четырех регионов России, различных по своим экологическим и социальным условиям (Сургут n=191 (группа 1), Иркутск n=243 (группа 2), Москва n=499 (группа 3), Московская область n=675 (группа 4)). Частота гиперкальциемии по группам составила 9%, 5%, 3% и 1% случаев соответственно, составляя в среднем около 3% (51/1608). Эти результаты соответствуют американским эпидемиологическим данным, где повышение кальция сыворотки крови выявлялось в 2,7% случаев.
По результатам анализа 1914 пациентов с ПГПТ (Российский регистр пациентов с первичным гиперпаратиреозом) на декабрь 2017 года наблюдается возрастание распространенности заболевания по г. Москва. В 2017 она составила 13 случаев на 100 000 взрослого населения (2016 год - 5,6 случаев, на 2010 год - 4 случая на 100 000 взрослого населения). По Московской области распространенность ПГПТ на декабрь 2017 года составила 3,4 случаев на 100 000 взрослого населения (по сравнению с 2014 годом - 0,25 случаев). Несмотря на повышение распространенности, полученные данные не соответствуют частоте гиперкальциемии, обнаруженной по данным пилотного скрининга уровня кальция среди взрослого населения. В основном, преобладали манифестные формы ПГПТ - в 67% случаев, бессимптомное течение заболевания определялось в 33%, в то время как в странах Европы, Северной Америки уже к 2004 г. частота манифестных форм не превышала 20%.
• E21,0 Первичный гиперпаратиреоз.
• E21,2 Другие формы гиперпаратиреоза.
• E21,3 Гиперпаратиреоз неуточненный.
• E21,4 Другие уточненные нарушения паращитовидной железы.
• E21,5 Болезнь паращитовидных желез неуточненная.
• D35,1 Доброкачественное образование паращитовидной [околощитовидной] железы.
• с75,0 Злокачественное образование паращитовидной [околощитовидной] железы.
За последние десятилетия произошли существенные изменения в представлениях об эпидемиологии заболевания. Отмечено резкое увеличение выявляемости ПГПТ, в том числе за счет бессимптомных форм, не сопровождающихся высокой гиперкальциемией. Указанные данные изменения обусловлены, прежде всего, появлением автоматических биохимических анализаторов и активным внедрением повсеместного определения уровня кальция в странах Северной Америки, Западной Европы и Китае. В общей популяции распространенность ПГПТ составляет в среднем 0,86-1% [10]. Необходимо отметить, что результаты эпидемиологических исследований остаются вариабельными, что обусловлено различиями в диагностических критериях ПГПТ и методологии биохимического скрининга кальциемии. ПГПТ может встречаться во всех возрастных группах, включая детей и подростков. Однако совокупность фактических данных свидетельствует о том, что частота возникновения ПГПТ увеличивается с возрастом, и средний возраст на момент постановки диагноза составляет 54-59 лет [11]. Большинство пациентов при спорадическом ПГПТ - женщины в постменопаузе с развитием заболевания в течение первого десятилетия после наступления менопаузы. Соотношение мужчин и женщин в среднем 1:3 [11].
Наиболее объективные данные о распространенности ПГПТ представляют крупные эпидемиологические исследования, проведенные в Швеции с 1976 по 2002 годы, и десятилетнее проспективное исследование одного округа Шотландии среди всех жителей старше 20 лет [12-15]. По данным шведских исследований распространенность ПГПТ среди взрослых лиц обоих полов старше 18 лет составляла примерно 1% от всего взрослого населения, возрастая до 2,1% в группе женщин в менопаузе (55-75 лет). В результате исследования шотландской популяции за 10 лет зарегистрировано 2709 новых случаев ПГПТ: 1918 женщин (71%) и 791 мужчина (29%). В подавляющем большинстве заболевание диагностировалось у лиц старше 40 лет. Пик заболеваемости приходился на период 60-70 лет, что подтверждало повышение риска развития заболевания с возрастом. Соотношение женщины/мужчины возрастало от 2 (в возрасте 40-49 лет) до 4 (в период старше 80 лет). В результате заболеваемость ПГПТ составила в разные годы от 4,13 до 11,3 случаев на 10 000 человеко-лет [14]. В одном из последних исследований по эпидемиологии ПГПТ в Калифорнии были проанализированы данные о 15 234 пациентах с хронической гиперкальцемией, и установлено, что в 87% наблюдений причиной повышения кальция сыворотки крови являлся ПГПТ. Распространенность ПГПТ колебалась в среднем в пределах 34-120 случаев на 10000 среди женщин и 13-36 случаев среди мужчин. С возрастом определялось значимое увеличение заболеваемости в целом и превалирование среди женщин, кроме того авторы выявили достоверную разницу в частоте развития заболевания в зависимости от этнической принадлежности пациентов (максимальная распространенность отмечена для афроамериканцев, р<0,0001) [16]. Таким образом, первичное поражение ОЩЖ остается основным этиологическим фактором гиперкальциемии. Необходимо отметить, что на втором месте среди причин гиперкальциемии находятся злокачественные новообразования. В более чем 50% случаев паранеопластическая гиперкальциемия обусловлена раком молочной железы с отдаленными метастазами в кости. Гиперкальциемия наблюдается при злокачественных опухолях легких и почек, гемобластозах (миеломная болезнь, лимфомы, лимфогранулематоз, лейкозы). Повышение кальция сыворотки крови развивается в результате метастатического поражения скелета, а также локальной активации процессов костной резорбции из-за выработки метастазами цитокинов типа фактора некроза опухоли и интерлейкина-1 или гуморальных активаторов остеокластов, особенно ПТГ-подобного пептида.
У большей части пациентов в Российской Федерации гиперкальциемия диагностируется отсрочено, поскольку определение содержания кальция не входит в общетерапевтический биохимический анализ крови. Это создает предпосылки для позднего выявления гиперпаратиреоза. Согласно приказу Министерства здравоохранения Российской Федерации от 3 декабря 2012 года №1006 «Об утверждении порядка проведения диспансеризации определенных групп взрослого населения» общетерапевтический биохимический анализ включает в себя только определение уровня общего белка, альбумина, креатинина, общего билирубина, аспартат-аминотрансаминазы, аланин-аминотрансаминазы, глюкозы, холестерина, натрия, калия.
В Российской Федерации широкомасштабных эпидемиологических исследований не проводилось. Пилотные скрининговые исследования уровня кальция крови проводились в период с 2005 по 2017 гг. на независимых выборках взрослых жителей четырех регионов России, различных по своим экологическим и социальным условиям (Сургут n=191 (группа 1), Иркутск n=243 (группа 2), Москва n=499 (группа 3), Московская область n=675 (группа 4)). Частота гиперкальциемии по группам составила 9%, 5%, 3% и 1% случаев соответственно, составляя в среднем около 3% (51/1608). Эти результаты соответствуют американским эпидемиологическим данным, где повышение кальция сыворотки крови выявлялось в 2,7% случаев.
По результатам анализа 1914 пациентов с ПГПТ (Российский регистр пациентов с первичным гиперпаратиреозом) на декабрь 2017 года наблюдается возрастание распространенности заболевания по г. Москва. В 2017 она составила 13 случаев на 100 000 взрослого населения (2016 год - 5,6 случаев, на 2010 год - 4 случая на 100 000 взрослого населения). По Московской области распространенность ПГПТ на декабрь 2017 года составила 3,4 случаев на 100 000 взрослого населения (по сравнению с 2014 годом - 0,25 случаев). Несмотря на повышение распространенности, полученные данные не соответствуют частоте гиперкальциемии, обнаруженной по данным пилотного скрининга уровня кальция среди взрослого населения. В основном, преобладали манифестные формы ПГПТ - в 67% случаев, бессимптомное течение заболевания определялось в 33%, в то время как в странах Европы, Северной Америки уже к 2004 г. частота манифестных форм не превышала 20%.
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
Гиперпаратиреоз и другие нарушения паращитовидной [околощитовидной] железы (E21):• E21,0 Первичный гиперпаратиреоз.
• E21,2 Другие формы гиперпаратиреоза.
• E21,3 Гиперпаратиреоз неуточненный.
• E21,4 Другие уточненные нарушения паращитовидной железы.
• E21,5 Болезнь паращитовидных желез неуточненная.
• D35,1 Доброкачественное образование паращитовидной [околощитовидной] железы.
• с75,0 Злокачественное образование паращитовидной [околощитовидной] железы.
Classification
1,5 Классификация заболевания или состояния (группы заболеваний или состояний).
Формы гиперпаратиреоза представлены в таблице 1.Таблица 1. Формы гиперпаратиреоза.
| Первичный гиперпаратиреоз | Вторичный гиперпаратиреоз | Третичный гиперпаратиреоз |
| эндокринное заболевание, характеризующееся избыточной секрецией ПТГ при верхне-нормальном или повышенном уровне кальция крови вследствие первичной патологии ОЩЖ. | состояние, характеризующееся увеличением функциональной активности ОЩЖ вследствие различных заболеваний и приема ряда медикаментозных приводящих к нарушению фосфорно-кальциевого гомеостаза (хронической гипокальциемии, гиперфосфатемии, дефициту 25(ОН)D или нарушению синтеза 1,25(ОН)2D), и в отсутствии адекватного лечения проявляющееся в их компенсаторной гиперплазии. | эндокринное заболевание, развивающееся в результате длительно текущего вторичного гиперпаратиреоза, несмотря на устранение причин его развития (включая успешную трансплантацию почки), и характеризующееся автономной секрецией ПТГ вследствие персистирующей гиперфункции одной или нескольких ОЩЖ. |
Симптомный (манифестный) ПГПТ характеризуется наличием «классических» проявлений заболевания, к которым относят костные (остеопороз, низктотравматичные переломы и фиброзно-кистозный остеит) и висцеральные нарушения (нефролитиаз, язвенную болезнь верхних отделов слизистой желудочно-кишечного тракта (ЖКТ)). Определение бессимптомной формы заболевания находится на стадии разработки, так как вопрос о «неклассических» проявлениях ПГПТ, прежде всего со стороны нейрокогнитивной и сердечно-сосудистых систем, до сих пор остается открытым. Прежде всего это связано с тем, что результаты имеющихся рандомизированных исследований, посвященных оценке влияния паратиреоидэктомии на указанные патологические изменения, не позволяют прийти к однозначному выводу о вкладе ПТГ в нарушения сердечно-сосудистого ремоделирования и когнитивной функции [2, 10]. Кроме того, исследования показали, что при тщательном анкетировании «бессимптомных» пациентов более чем в 90% случаев отмечаются неспецифические жалобы (общая слабость, утомляемость, снижение работоспособности и эмоционального фона, склонность к запорам ). Учитывая неспецифичность данных изменений, их сложно классифицировать и можно отнести как к возраст-ассоциированным состояниям или симптомам других заболеваний, так и к проявлениям ПГПТ.
В настоящее время к пациентам с бессимптомным ПГПТ (ранее классифицировали как мягкую форму) относят лиц, не имеющих специфических проявлений заболевания, при этом диагностика заболевания, как правило, происходит на этапе рутинного скрининга кальция. В странах Европы и Северной Америки бес ПГПТ относится к наиболее распространенной форме болезни и составляет до 80% всех случаев. До настоящего времени точно не установлено, является ли бессимптомный ПГПТ началом заболевания или его самостоятельной формой. Ряд исследований свидетельствует о возможности длительного доброкачественного течения бессимптомного ПГПТ у большинства пациентов. Однако у некоторых пациентов с течением времени отмечается прогрессирование заболевания с развитием специфической симптоматики [11].
Наиболее часто диагностируется гиперкальциемический вариант ПГПТ, характеризующийся повышением уровня кальция сыворотки крови в сочетании с повышенным (редко высоко-нормальным) уровнем ПТГ. Однако ПГПТ не всегда сопровождается повышением уровня кальция крови выше верхней границы референсного диапазона. Нормокальциемия может быть транзиторной при гиперкальциемическом варианте и стойкой при нормокальциемическом варианте заболевания. Нормокальциемический вариант ПГПТ (нПГПТ) характеризуется неизменно верхненормальным уровнем общего и ионизированного кальция в сыворотке крови в сочетании со стойким повышением уровня ПТГ, в отсутствии очевидных причин вторичного гиперпаратиреоза (дефицит витамина D, патология печени и почек, синдром мальабсорбции, гиперкальциурии )[11, 17]. Классификация ПГПТ представлена на 1.
1 Классификация ПГПТ.
Symptoms
Развитие клинической картины ПГПТ обусловлено, прежде всего, патологическим действием повышенного уровня ПТГ и кальция крови. В большинстве случаев симптомный ПГПТ сопровождается «классическими» проявлениями, к которым относят нарушения опорно-двигательного аппарата (остеопороз, фиброзно-кистозный остеит, деформации костей, переломы, нарушения походки), патологию почек (нефролитиаз/нефрокальциноз, снижение фильтрационной и концентрационной функции почек), реже ЖКТ (рецидивирующие дефекты слизистой оболочки двенадцатиперстной кишки и желудка, панкреатиты, кальцинаты поджелудочной железы - панкреокалькулез). Помимо этого, выявляются изменения состояния сердечно-сосудистой системы (артериальная гипертензия, гипертрофия миокарда левого желудочка и диастолическая дисфункция левого желудочка, нарушения ритма и проводимости сердца), находящиеся в прямой зависимости от уровня интактного ПТГ (иПТГ), нарушений фосфорно-кальциевого обмена и состояния фильтрационной функции почек, а также нейрокогнитивные расстройства [18-22]. Тем не менее, пока нет убедительных данных считать нейрокогнитивные и сердечно-сосудистые нарушения характерными клиническими проявлениями ПГПТ, несмотря на то, что в ряде исследований было показано улучшение этих симптомов после паратиреоидэктомии.
По данным литературы ПГПТ может являться дополнительным фактором риска развития ожирения, приводить к повышению риска развития инсулинорезистенстности и сахарного диабета 2 типа, проатерогенным нарушениям липидного спектра крови, к вторичной гиперурикемии [23-25].
По данным литературы ПГПТ может являться дополнительным фактором риска развития ожирения, приводить к повышению риска развития инсулинорезистенстности и сахарного диабета 2 типа, проатерогенным нарушениям липидного спектра крови, к вторичной гиперурикемии [23-25].
Diagnostics
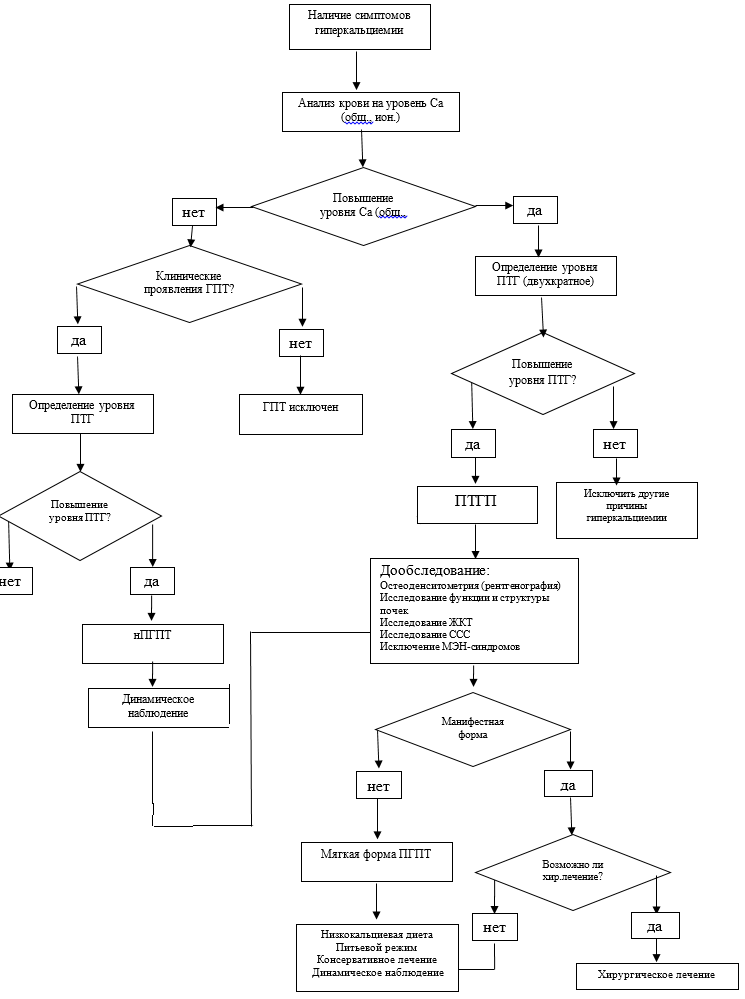
Критерии установления диагноза гиперкальциемической формы ПГПТ на основании результатов лабораторных исследований: гиперкальциемия в сочетании со стойким повышением уровня ПТГ (исключив семейную доброкачественную гипокальциурическую гиперкальциемию), гиперкальциемия в сочетании с высоконормальным уровнем ПТГ (на верхней границе референсного интервала, но не выходящий за его пределы).
• Диагноз гиперкальциемической формы ПГПТ рекомендуется устанавливать у пациентов при наличии гиперкальциемии в сочетании со стойким повышением уровня ПТГ или высоконормальным уровнем ПТГ (на верхней границе референсного интервала, но не выходящий за его пределы), исключив семейную доброкачественную гипокальциурическую гиперкальциемию с целью решения о проведении дополнительного обследования и выбора оптимальной тактики лечения [26-28].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Критерии установления диагноза нормокальциемической формы ПГПТ на основании результатов лабораторных исследований при условии минимум двукратного определения в интервале 3-6 мес: стойкая нормокальциемия (сохранение показателей альбумин-скорректированного и ионизированного кальция в референсном диапазоне), повышение уровня иПТГ после исключения возможных вторичных причин гиперпаратиреоза, нормокальциурия.
• Диагноз нормокальциемического формы ПГПТ рекомендуется устанавливать у пациентов при наличии следующих критериев [29-42]:
• стойкое сохранение показателей альбумин-скорректированного и ионизированного кальция в референсном диапазоне за весь период наблюдения при повышенном уровне иПТГ (минимум двукратное определение в интервале 3-6 мес);
• исключение возможных вторичных причин гиперпаратиреоза (прежде всего дефицита/недостаточности витамина D (25(ОН)D ≥ 30 нг/мл) и ХБП (СКФ) ≤ 60 мл/мин));
• отсутствие гиперкальциурии.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии: у ряда пациентов с ПГПТ уровень общего кальция в крови может сохраняться в пределах референсного диапазона, при этом отмечаться повышение уровня ионизированной фракции, что также считается гиперкальциемией и не соответствует критериям постановки диагноза нПГПТ [29]. Таким образом, определение Са++ поможет избежать диагностических ошибок, однако не все клинические лаборатории располагают необходимым оборудованием. В таких случаях необходимо ориентироваться на показатели альбумин-скорректированного кальция. С целью верификации нПГПТ нормокальциемия и повышенный уровень ПТГ должны выявляться по меньшей мере в двух последующих измерениях в течение 3-6 месяцев [30, 31].
Помимо недостаточности/дефицита витамина D [32, 33] и ХБП (СКФ≤ 60 мл/мин) [34, 35] также необходимо исключить и другие вторичные причины гиперпаратиреоза: прием препаратов, влияющих на уровень кальция/ПТГ (бифосфонаты (M05BA), деносумаб**, препараты лития) [39-42]; гиперкальциурия [36]; заболевания ЖКТ, вызывающие мальабсорбцию [37, 38].
• клинические симптомы гиперкальциемии, включая инсипидарный синдром (полиурия/никтурия/полидипсия, не обусловленные сахарным или несахарным диабетом); тошноту, рвоту, снижение аппетита, дегидратацию [43, 44];
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• остеопороз или предшествующие низкотравматичные переломы в анамнезе (особенно переломы шейки бедра, переломы дистального отдела костей предплечья), клинические проявления фиброзно-кистозного остеита, включая деформации скелета, боли в ребрах [45-49];
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
• нефролитиаз (особенно рецидивирующий), нефрокальциноз [49-55];
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
• рецидивирующая язвенная болезнь желудка или двенадцатиперстной кишки, калькулезного панкреатита [56-58].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарии: клинические проявления ПГПТ в большинстве случаев обусловлены гиперкальциемией. Легкая гиперкальциемия (общий кальций <3 ммоль/л (12 мг/дл)) может длительно оставаться бессимптомной или проявляться в виде неспецифических жалоб, таких как общая и мышечная слабость, утомляемость, снижение эмоционального фона. Умеренная гиперкальциемия (общий кальций сыворотки крови >3-3,5 ммоль/л (12-14 мг/дл)) при хроническом течении может протекать с минимальной симптоматикой. Быстро прогрессирующая гиперкальциемия может сопровождаться ухудшением состояния в виде появления таких симптомов, как полиурия, полидипсия, дегидратация, снижение аппетита, тошнота, мышечная слабость. У пациентов с тяжелой гиперкальциемией (общий кальций сыворотки крови >3,5 ммоль/л (14 мг/дл)) отмечается высокий риск гиперкальциемического криза [59, 60]. При сборе анамнеза необходимо учитывать прием препаратов, влияющих на фосфорно-кальциевый обмен ( см раздел 7,4).
Нефролитиаз - одно из основных осложнений ПГПТ, поэтому в анамнезе необходимо учитывать наличие приступов спастических болей в поясничной области (почечная колика) с тошнотой, рвотой, изменением мочевого осадка, лейкоцитурией и гематурией. В 10% случаев симптомный нефролитиаз при ПГПТ может характеризоваться рецидивирующим течением с частыми приступами почечной колики [55, 61]. По результатам последних исследований частота симптомного нефролитиаза в когорте пациентов с ПГПТ значимо сократилась, однако при проведении визуализирующих методов исследования (ультразвуковое исследование (УЗИ), компьютерная томография (КТ) почек) чаще стали диагностироваться «молчащие» формы заболевания (бессимптомный нефролитиаз/нефрокальциноз) [62]. Анализ результатов обследования когорты пациентов с нефролитиазом (5 крупных исследований, n=5927) продемонстрировал, что распространенность ПГПТ в данной популяции может значимо превышать общепопуляционные значения и достигать 3,2-5% [50-54].
Фиброзно-кистозный остеит относится к тяжелым костным нарушениям, характерным для симптомного (манифестного) ПГПТ и сопровождается выраженными болями в костях, деформациями скелета и патологическими переломами. В настоящее время фиброзно-кистозный остеит диагностируется значимо реже, тем не менее пациенты могут сообщать о перенесенных низкотравматичных переломах. При бессимптомном течении ПГПТ патологические изменения скелета верифицируются, как правило, при снижении минеральной плотности кости (МПК) по результатам рентгенденситометрии [2, 63]. Имеющиеся данные свидетельствуют о том, что ПГПТ чаще выявляется среди пациентов с переломом шейки бедра по сравнению с лицами без перелома (n=888, 4,7% против 1,13%) [45]. При обследовании женщин в постменопаузе (n=119) в 6,7% случаев при наличии перелома дистального отдела предплечья в анамнезе выявляется ПГПТ [46].
Необходим тщательный сбор анамнеза касательно других симптомов, ассоциированных с ПГПТ, включая язвенную болезнь желудка и двенадцатиперстной кишки, гастроэзофагеальную рефлюксную болезнь, острый панкреатит, чаще ассоциированных с умеренной и тяжелой гиперкальциемией [64]. Рецидивирующие пептические язвы верхних отделов ЖКТ ранее относились к частым осложнениям ПГПТ. В настоящее время они диагностируются значимо реже и более характерны для молодых пациентов с синдромами множественных эндокринных неоплазий и сопутствующими гастрин-продуцирующими опухолями. Результаты исследований о патогенетической взаимосвязи между ПТГ-опосредованной гиперкальциемией и повышенной секрецией гастрина и желудочного пока остаются противоречивыми [65-67].
Проявления со стороны мышечной системы, включающие проксимальную мышечную слабость и атрофию, в настоящее время редки, но многие пациенты с ПГПТ предъявляют субъективные жалобы на повышенную утомляемость и генерализованную слабость [68-70]. Ранее к классическим психическим проявлениям ПГПТ относили тяжелое нарушение когнитивных функций и сознания, острый психоз. В настоящее время все чаще сообщается об умеренных психических расстройствах таких, как усталость, депрессия, эмоциональная лабильность, нарушения сна, ухудшение памяти и неспособность сконцентрироваться. Многие пациенты оценивают изменения своего состояния лишь ретроспективно, после успешного хирургического лечения, отмечая улучшение общего качества жизни, улучшение памяти и настроения[70-73].
Необходим тщательный сбор персонального и семейного анамнеза при подозрении на синдромальные формы эндокринопатий ( см главу наследственные формы ПГПТ) [5].
Общий осмотр подразумевает оценку общего физического состояния, роста и массы тела. При осмотре у пациентов с тяжелым течением ПГПТ можно отметить атрофию мышц, формирование «утиной походки». Следует обратить внимание на деформации скелета, наличие костных разрастаний в области лицевой части черепа, крупных суставов, трубчатых костей.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с впервые выявленной гиперкальциемией рекомендуется повторное определение уровня общего кальция, альбумина (с расчетом альбумин-скорректированного кальция) и/или ионизированного кальция с целью исключения ложноположительных результатов лабораторных анализов [27, 75, 76].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Около 99% кальция депонируется в костной ткани и лишь 1% циркулирует во внутриклеточной жидкости и в плазме крови. В плазме кальций присутствует в ионизированной форме (около 50%), в связанном с белками состоянии (45%, в основном с альбуминами) и с комплексирующими анионами (фосфатом, цитратом - около 5%). Метаболически активной считается свободная (ионизированная) форма кальция.
Гиперкальциемический вариант ПГПТ составляет большинство случаев заболевания, поэтому при подозрении на ПГПТ первоначально рекомендуется определение уровня альбумин-скорректированного кальция крови, при этом гиперкальциемия должна быть подтверждена более чем в одном измерении, прежде чем пациенту будет назначено расширенное обследование. Корректировка кальция на уровень альбумина крови необходима с целью исключения ложно завышенных или ложно заниженных показателей кальциемии при изменении концентрации плазменных белков [76]. Коррекция общего кальция рекомендуется при уровне альбумина менее 40 г/л и более 45 г/л.
Формулы для расчета альбумин-скорректированного кальция:
• общий кальций плазмы (ммоль/л) = измеренный уровень общего кальция плазмы (ммоль/л) + 0,02 х (40 - измеренный уровень альбумина плазмы (г/л));
• общий кальций плазмы (мг/дл) = измеренный уровень общего кальция плазмы (мг/дл) + 0,8 х (4 - измеренный уровень альбумина плазмы (г/дл));
• коэффициент пересчёта: [кальций] мг/дл х 0,25 ==> [кальций] ммоль/л.
Ложных результатов можно также избежать путем прямого определения ионизированного кальция (Са++) [27]. Этот показатель менее вариабельный, однако, для его определения необходимо специальное оборудование - анализатор с использованием ион-селективных электродов, доступность которого в клинических лабораториях может быть лимитирована. Корректность определения Са++ зависит от технического состояния и калибровки аппаратуры, а также от учета влияния рН крови на его концентрацию. Кислотно-щелочное состояние влияет на содержание Са++ в крови путем воздействия на процесс связывания кальция с белками. Ацидоз уменьшает его связывание с белками крови и ведет к увеличению уровня Са++, в то время, как алкалоз усиливает процесс связывания кальция с протеинами и уменьшает его уровень. Эта корректировка заложена в программу современных анализаторов, однако в более ранних моделях не использовалась [75]. Таким образом, в рутинной практике рекомендуется определение альбумин-скорректированного кальция, а не ионизированной фракции.
• С целью верификации диагноза пациентам с подозрением на ПГПТ рекомендуется определение уровня общего кальция, альбумина (с расчетом альбумин-скорректированного кальция) и/или ионизированного кальция, исследование уровня паратиреоидного гормона в крови (иПТГ) [27, 28, 76-81].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
Комментарии:
Паратиреоидный гормон.
Для пациентов с ПГПТ уровень ПТГ, как правило повышен или находится на верхней границе референсного диапазона [27, 28]. В случае приема лекарственных средств, способных влиять на уровень кальция и/или ПТГ ( см раздел 7,4), проведение лабораторных тестов рекомендуется после отмены препаратов. Уровни ПТГ, находящиеся в нижнем диапазоне нормальных значений (<25-30 пг/мл) более характерны для других состояний, ассоциированных с развитием гиперкальциемии. Прежде всего необходимо исключить паранеопластические процессы как вторую наиболее частую причину повышения уровня кальция крови.
В настоящее время существуют наборы второго и третьего поколения для определения уровня иПТГ. Наборы второго поколения включают иммунорадиометрические (IRMA) и иммунохемилюминометрические (ICMA) методы и измеряют как интактную молекулу ПТГ1-84, так и улавливают крупные гормонально-неактивные С-терминальные фрагменты (ПТГ 4-84, ПТГ 7-84, ПТГ 10-84 и ПТГ 15-84) и, таким образом, могут завышать концентрацию биологически активного гормона в сыворотке [77]. Эти фрагменты составляют до 20% иммунореактивного ПТГ в сыворотке у лиц с сохранной функцией почек и до 50% у лиц с почечной недостаточностью. Наборы третьего поколения специфичны для интактного ПТГ1-84, поскольку улавливающее антитело распознает фрагмент ПТГ39-84, а проявляющее АТ - небольшой N-терминальный участок ПТГ1-4, и, следовательно, обладают большей диагностической чувствительностью. По сравнению с наборами второго поколения концентрация иПТГ, измеренная с помощью наборов третьего поколения, на 20% и 50% ниже у здоровых лиц и у лиц с почечной недостаточностью соответственно, Недостатком данных наборов является то, что они также распознают молекулу ПТГ1-84, претерпевшую посттрансляционные изменения (фосфорилирование по серину) на участке 15-20 (N-ПТГ), и являющуюся вследствие этого гормонально-неактивной формой. Однако вклад этой молекулы в конечный уровень ПТГ, измеренного с помощью наборов третьего поколения, составляет менее 10% у здоровых лиц и до 15% у лиц с почечной недостаточностью. N-ПТГ может в избытке продуцироваться при карциноме ОЩЖ и тяжелом гиперпаратиреозе [82].
При оценке чувствительности наборов второго и третьего поколения для диагностики ПГПТ не получено клинически значимых различий (91,3% против 89,1% соответственно), таким образом чувствительность наборов второго и третьего поколений для выявления повышенного уровня иПТГ одинакова [78].
У 1/3 пациентов выявляется гипофосфатемия за счет реципрокного отношения между кальцием и фосфором. При нормальной функции почек может наблюдаться обратная зависимость между повышением иПТГ и снижением фосфора крови. При снижении почечной функции фосфор сохраняется в пределах нормы или повышается. Также для ПГПТ характерны повышенные или верхненормальные уровни общей щелочной фосфатазы и более специфичных маркеров костного метаболизма: резорбции - в крови С-концевого телопептида коллагена 1 типа (СТх, β-crossLaps), N-концевого телопептида коллагена 1 типа (NTх), в моче - дезоксипиринолодина и NTх; костеобразования - в крови остеокальцина и N-концевого пропетида проколлогена 1 типа (P1NP) резорбции (деоксипиридинолин и N-концевой телопептид в моче, β-crossLaps (С-концевой телопептид) в крови) и маркеров костеобразования (остеокальцин) при активном вовлечении скелета в патологический процесс. Определение этих показателей может быть полезным при мониторинге эффективности антирезорбтивной терапии при консервативном ведении ПГПТ [10].
• С целью оценки фильтрационной функции почек и определения показаний к хирургическому лечению, а также для исключения вторичных причин повышения уровня иПТГ пациентам с подозрением на ПГПТ показано определение уровня креатинина с расчетом СКФ [79, 83-85].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Креатинин сыворотки считается важным диагностическим инструментом в когорте пациентов с ПГПТ, так как почки являются одним из основных органов регуляции обмена кальция и фосфора в организме. Эксперты KDOQI (Kidney Disease Outcomes Quality Initiative, инициатива по качеству для улучшения исходов заболеваний почек) рекомендуют проводить оценку скорости клубочковой фильтрации (СКФ) на основании возрастных, половых, расовых параметров и сывороточных показателей креатинина, альбумина, мочевины и азота. снижение фильтрационной функции почек характерно для пациентов с ПГПТ, получены доказательства роли развития ХБП С3-C5 в повышении риска внезапной смерти при ПГПТ. Кроме того, прогрессирующее снижение СКФ ассоциировано с повышением уровня ПТГ и усилением резорбтивных процессов в костной ткани [34, 35, 85]. Клиренсовые радиоизотопные методики - «золотой стандарт» в определении СКФ, однако стоимость и технические сложности резко лимитируют их широкое применение. В клинической практике для расчета СКФ могут быть использованы простые способы расчета клиренса креатинина, позволяющие обойтись без суточного сбора мочи (формулы Кокрофта-Голта, MDRD, сKD-EPI). Формула сKD-EPI дает более точные результаты, в том числе и при сохранной функциональной способности почек, что позволяет рекомендовать ее для амбулаторной практики [86]. Показатель может быть рассчитан автоматически с помощью специальных онлайн-калькуляторов.
• Пациентам с ПГПТ рекомендуется определение уровня 25(ОН) витамина D c целью диагностики его недостаточности/дефицита [87-90].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
Комментарии: между уровнями ПТГ, Са++ и активной формой витамина D (кальцитриолом) существуют реципрокные регуляторные связи. Увеличение синтеза и секреции ПТГ повышает содержание сa++ в крови и ускоряет гидроксилирование витамина D в почках; по принципу отрицательной обратной связи повышенные концентрации сa++ и кальцитриола угнетают продукцию ПТГ. В нормальных физиологических условиях дефицит витамина D и гипокальциемия способствуют увеличению синтеза ПТГ. Низкий уровень 25(ОН)D при ПГПТ ассоциирован с более высоким уровнем ПТГ и как следствием уровнем кальция сыворотки крови, более низкой МПК в кортикальной зоне костей и более высокими показателями маркеров костного обмена, более частым развитием фиброзного остеита и большим весом аденомы ОЩЖ [87-89]. Оценка статуса витамина D проводится путем определения 25(ОН) витамина D в крови, что является наиболее доступным и надежным методом лабораторной диагностики [75]. В случае выявления недостаточности/дефицита 25(ОН)D рекомендуется восполнение статуса витамина D, по возможности на дооперационном этапе или в раннем послеоперационном периоде ( см раздел 3,2 Консервативное лечение). [90].
• С целью верификации диагноза пациентам с ПГПТ и удовлетворительной фильтрационной функцией почек (СКФ>60 мл/мин/1,73м2) рекомендуется исследование уровней кальция и креатинина в моче (суточный анализ) с расчетом почечного клиренса кальция к клиренсу креатинина[26].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарии. Измерение кальция в суточной моче по отношению к экскреции креатинина необходимо с целью дифференциальной диагностики ПГПТ и FHH. FHH - это редкое наследственное заболевание с аутосомно-доминантным типом наследования, вызванное дефектом кальций-чувствительных рецепторов (CaSR) в почках и ОЩЖ. Диагноз FHH может быть заподозрен при сочетании гиперкальциемии, нормального или несколько повышенного уровня ПТГ и относительной гипокальциурии. Поскольку экскреция кальция с мочой за фиксированный интервал времени значительно зависит от СКФ и продолжительности времени сбора мочи, общая экскреция кальция не является ценным показателем для дифференциальной диагностики случаев FHH от типичного ПГПТ. В связи с чем используется расчет отношения почечного клиренса кальция к клиренсу креатинина (UCCR), который обычно при FHH составляет менее 0,01 (формула для расчета сaCl/CrCl = [Cau x сrs]/[Cru x сas], где сaCl - клиренс кальция, сrCl - клиренс креатинина, сau - концентрация кальция в моче (ммоль/л), сrs - концентрация креатинина в сыворотке крови (мкмоль/л), сru - концентрация креатинина в моче (мкмоль/л), сas - концентрация кальция в сыворотке крови (ммоль/л)). Для ПГПТ индекс UCCR обычно составляет более 0,02, однако сhristensen S.E. с коллегами продемонстрировал, что отрезная точка UCCR менее 0,01 без исследования гена сASR выявит только 65% пациентов с FHH и неверно классифицирует 4% пациентов с ПГПТ как имеющих FHH. Показатель UCCR в пределах 0,01-0,02 имеют 33% пациентов с ПГПТ, и 35% с FHH имеют UCCR ≥ 0,01 [26].
Дополнительной ценностью данного анализа является определение суточной кальциурии, как показателя риска возникновения или прогрессирования нефролитиаза. При выявлении суточной экскреции кальция выше 10 ммоль/сутки показано проведение хирургического лечения ПГПТ ( см раздел «Хирургическое лечение»). Необходимо отметить, что исследование кальция в моче не информативно при снижении функции почек (СКФ<60 мл/мин/1,73м2).
• С целью дифференциальной диагностики между первичным нормокальциемическим и вторичным гиперпартиреозом пациентам с сочетанием повышенного уровня иПТГ и нормокальциемией, рекомендовано проведение функциональных проб [74, 91-94].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Сочетание повышенного показателя иПТГ в крови с нормальным уровнем сывороточного кальция остается актуальной клинической проблемой. В целях дифференциальной диагностики между нормокальциемическим вариантом ПГПТ и ВГПТ, возникшим в результате недостаточности витамина D или при других состояниях [95, 96] необходимо проведение функциональных проб (таб.2) [30, 31]. У пациентов с ПГПТ прием препаратов витамина D и его производных и/или гидрохлоротиазида** провоцирует развитие гиперкальциемии при сохранении повышенного уровня иПТГ, а у пациентов с ВГПТ-снижение/нормализацию уровня иПТГ при нормальном уровне кальция в крови [95, 97]. При наличии гиперкальциурии целесообразно проведение пробы с тиазидами.
Необходимо учитывать, что длительный дефицит витамина D может приводить к развитию гиперплазии одной или всех ОЩЖ, которые формируются вследствие снижения тормозящего действия витамина D на деление клеток ОЩЖ, а также вследствие стимулирующего влияния низкого уровня кальция крови на этот же процесс. Таким образом оценка состояния и активности ОЩЖ по данным визуализирующих методик для дифференциальной диагностики не применятся.
Таблица 2. Функциональные пробы для дифференциальной диагностики между первичной нормокальциемической и вторичной формами гиперпаратиреоза.
1 на фоне приема препаратов возможно кратковременное развитие гиперкальциемии, которая проходит после окончания пробы и при нормализации ПТГ не является признаком ПГПТ.
2 Возможно более длительное проведение пробы: при выявлении на 5-7 день тенденции к снижению ПТГ и нормокальциемии продолжить пробу до развития гиперкальциемии - под контролем врача.
Применение визуализирующих методов исследования обязательно для подготовки пациентов к запланированному хирургическому лечению.
Цель предоперационной топической диагностики образования околощитовидной железы при первичном гиперпаратиреозе - подготовка к селективной паратиреоидэктомии. Для планирования эффективного хирургического лечения требуется информация о точном месте расположения образования околощитовидной железы. Методами первой линии инструментальной диагностики при ПГПТ являются УЗИ и радионуклидные исследования (сцинтиграфия, ОФЭКТ, ОФЭКТ-КТ). Методы второй линии диагностики - МСКТ с контрастным усилением, МРТ, 4D КТ, ПЭТ, ПЭТ-КТ.
• Пациентам с ПГПТ в качестве первого этапа топической диагностики ОЩЖ рекомендуется проведение ультразвукового исследования ОЩЖ [100-106].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии. Чувствительность УЗИ в случае солитарного образования ОЩЖ по различным данным варьируется от 76 до 91% и во многом зависит от квалификации специалиста [100-103]. Специфичность метода может достигать 96% [104-106]. Установлена высокая положительная прогностическая значимость и диагностическая точность УЗИ ОЩЖ (93,2% и 88% cсоответственно) [100].
Аденома ОЩЖ, как правило, представляет собой образование округлой или овальной формы, гипоэхогенной структуры, очерченное изоэхогенной линией и контрастирующее с вышележащей гиперэхогенной тканью щитовидной железы. В ряде случаев могут визуализироваться кальцинаты и определяться кистозная дегенерация. УЗИ наиболее эффективно при расположении аденомы ОЩЖ вблизи щитовидной железы и шейной части вилочковой железы. Возможности метода резко ограничены при образованиях ОЩЖ, расположенных ретротрахеально, ретроэзофагеально или в случае их эктопии в средостение [102, 103]. Четкие УЗИ-признаки злокачественного поражения ОЩЖ отсутствуют. Однако подозрительными в отношении рака ОЩЖ являются неоднородная структура, неправильная форма, размер образования более 3 неровные края, пониженная эхогенность [107].
В последнее время активно стали использовать УЗИ с контрастированием. Метод обеспечивает количественную и качественную оценку васкуляризации микрососудистого русла желез, что позволяет идентифицировать опухоли ОЩЖ. УЗИ с контрастированием обладает особыми преимуществами при наличии сопутствующего зоба, шейной лимфаденопатии, а также при полигландулярном поражении ОЩЖ даже после предшествующих хирургических вмешательств в области шеи [108].
Преимущества метода:
• отсутствие лучевой нагрузки;
• относительно низкая стоимость и высокая доступность исследования;
• возможность выявления сопутствующей патологии ЩЖ.
Недостатки метода:
• значимая вариабельность диагностической точности метода в зависимости от квалификации специалиста;
• ложноположительные результаты за счет узловых образований ЩЖ или лимфатических узлов;
• значимые ограничения в проведении исследования при атипичной локализации ОЩЖ (например, за грудиной, в позадипищеводном пространстве).
• Пациентам с ПГПТ с целью функционально-топической диагностики образований ОЩЖ рекомендуется проведение сцинтиграфии ОЩЖ с технеция [99mTс] сестамиби [100, 102, 109, 110].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии. Технеция [99mTс] сестамиби представляет собой липофильный катион, распределяющийся пропорционально кровотоку, метаболическому потреблению и митохондриальной активности образования. Накопление Технеция [99mTс] сестамиби в ткани ОЩЖ определяется высокой митохондриальной плотностью в оксифильных клетках. Физиологическое накопление Технеция [99mTс] сестамиби наблюдается во многих тканях, включая щитовидную железу, однако его выведение из измененной ОЩЖ происходит значительно медленнее, что позволяет ее визуализировать на отсроченных снимках [111].
Длительное время стандартной методикой оставалась двухмерная планарная сцинтиграфия. В настоящее время все чаще используется трехмерная однофотонная эмиссионная компьютерная томография (ОФЭКТ) и гибридная технология ОФЭКТ/КТ, сочетающая в себе функциональную чувствительность ОФЭКТ с высокой анатомической детализацией многослойной КТ. С целью визуализации ОЩЖ применяются 2 протокола сцинтиграфии: двухфазный - основан на разной скорости элиминации изотопа из нормальной ЩЖ и измененной ОЩЖ; двухизотопный (субтракционный) - основан на использовании изотопа Технеция [99mTс] сестамиби, который накапливается и ЩЖ, и ОЩЖ, и тропного только к ЩЖ изотопа М-йодбензилгуанидина (123-I) или Натрия пертехнетата [99Tc]. Оценка диагностической эффективности сцинтиграфии ОЩЖ по данным литературы осложняется различиями в методах проведения исследования, опыте специалистов и стандартах интерпретации полученных данных в медицинских центрах [111].
Чувствительность метода может варьировать в широком диапазоне от 54 до 96% [112], в среднем составляя около 88% в случае солитарного образования ОЩЖ [102]. Множественное поражение ассоциировано со значимым снижением чувствительности: до 33% при наличии двух аденом ОЩЖ и до 44 % в случае гиперплазии 4-х ОЩЖ [102]. Отсутствие визуализации аденом ОЩЖ при проведении сцинтиграфии при ПГПТ ассоциировано с повышенным риском полигландулярного поражения.
Объединенная чувствительность и положительная прогностическая значимость для сцинтиграфии с Технеция [99mTс] сестамиби с ОФЭКТ составляют 79% (49-91%) и 91% (84-96%) соответственно [100]. Для ОФЭКТ/КТ отмечена большая чувствительность метода (86%, ДИ 81-90) при сравнении с ОФЭКТ (74%, ДИ 66-82) и двухмерной планарной сцинтиграфией (70%, ДИ 61-80), кроме того данный метод имеет преимущество перед другими методиками в топической диагностике эктопированных образований [110].
Преимущества метода:
• определение локализации как типично расположенных, так и эктопированных образований ОЩЖ, в том числе в средостении (основываясь на специфичности метаболизма паратиреоидной ткани).
Недостатки метода:
• значимая вариабельность диагностической точности исследования в зависимости от центра (опыта специалистов, технической оснащенности - планарная гамма-камера, ОФЭКТ, ОФЭКТ-КТ), где проводится исследование;
• возможные ложноположительные и ложноотрицательные результаты при наличии сопутствующих заболеваний щитовидной железы (аутоиммунный тиреоидит, многоузловой зоб, диффузно-токсический зоб, рак щитовидной железы);
• снижение чувствительности метода при поражении нескольких ОЩЖ;
• лучевая нагрузка.
Комбинация ОФЭКТ-КТ с Технеция [99mTс] сестамиби и УЗИ ОЩЖ экспертного класса на дооперационном этапе диагностики ПГПТ повышают чувствительность до 95-98%. Сочетание двух методов топической диагностики используется для определения возможности проведения минимально инвазивной паратиреоидэктомии, а также для определения последовательности визуализации ОЩЖ при двусторонней ревизии шеи [113, 114]. Однако, необходимо отметить, что в случае множественного поражения ОЩЖ, чувствительность данной комбинации остается невысокой и составляет 30-60% [115].
• Пациентам с ПГПТ в случае отсутствия четкой визуализации образования ОЩЖ по результатам методов первой линии (УЗИ и радионуклидные исследования), рекомендуется проведение дополнительных методов исследования:
• компьютерной томографии шеи и средостения с контрастным усилением [116], позитронной эмиссионной томографии (ПЭТ) всего тела с туморотропным радиофармацевтическим диагностическим средством [117];
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
• магнитной резонансной томографии шеи [118, 119].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. В спорных случаях, при расхождении результатов УЗИ и сцинтиграфии с Технеция [99mTс] сестамиби применяется компьютерная томография шеи с внутривенным болюсным контрастированием. Традиционная компьютерная томография с контрастным усилением позволяет достаточно точно оценить размеры и локализацию образований ОЩЖ, как в случае их типичного расположения, так и при наличии измененных эктопированных ОЩЖ, в том числе в средостение. Диагностическая чувствительность МСКТ сильно вариабельна и может составлять 46-87% [120]. Результаты мета-анализа 34 исследований, в который было включено более 2,5 тысяч пациентов с ПГПТ, показали, что использование двухфазной методики вместо однофазной повышает чувствительность с 71 до 76% [116]. Недостатками метода являются лучевая нагрузка, потенциальная нефротоксичность контрастного вещества и соответственно ограниченное применение у пациентов с ХБП. Кроме того, исследование со стандартным шагом 5 мм возможно только при наличии желез массой 5 г и более, ошибка в данном случае не превышает 5%. В остальных случаях необходим более мелкий шаг снимков, что еще больше увеличивает лучевую нагрузку [121].
4D КТ демонстрирует многообещающие результаты в визуализации ОЩЖ, однако в настоящее время исследование малодоступно. Методика включает в себя КТ-ангиографию с шагом снимков в 1 мм и сопутствующей оценкой перфузии в ОЩЖ за единицу времени. Наряду с определением точного анатомического расположения как типично расположенных, так и эктопированных образований, метод позволяет исследовать функциональную активность образования ОЩЖ. 4D КТ, вероятно, единственный способ топической диагностики, позволяющий четко визуализировать нормальную ткань ОЩЖ [122, 123]. Чувствительность метода 4D КТ составляет в среднем 89%, а положительная прогностическая значимость достигает 93,5% [100]. Относительно высокая чувствительность метода сохраняется при множественном поражения ОЩЖ - 62,5-85,7% [122-124]. Основными недостатками 4D-КТ являются высокая стоимость, значительное увеличение радиационного облучения, резко ограниченная доступность.
Проведение магнитной резонансной томографии (МРТ) возможно для установления локализации патологически измененных ОЩЖ, однако данный метод обладает рядом недостатков: высокая стоимость, меньшая чувствительность (по разным данным 43-71%), трудности в интерпретации полученных данных, что связано с возникновением артефактов при дыхательных движениях. Возможным преимуществом является выявление эктопированных в средостение ОЩЖ, но по точности данный метод уступает МСКТ [118, 119].
Применение позитронно-эмиссионной томографии (ПЭТ) рекомендуется в отдельных случаях у пациентов с персистенцией заболевания или с рецидивом ПГПТ при отсутствии визуализации ОЩЖ с помощью других методов. [117]. Однако, данная методика является дорогостоящей и малодоступной, что препятствует ее широкому клиническому применению [125].
• В случае необходимости дифференциальной диагностики образований ОЩЖ с другими патологическими образованиями в области шеи (узлами щитовидной железы, лимфатическими узлами, кистами) пациентам с ПГПТ может быть рекомендована тонкоигольная аспирационная биопсия (ТАБ) ОЩЖ с последующим анализом уровня ПТГ в аспирате [126-129].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. ТАБ ОЩЖ с исследованием уровня ПТГ в аспирате не рекомендована к использованию в рутинной практике. Метод полезен в случае необходимости дифференциальной диагностики образований ОЩЖ и узловых образований ЩЖ при отсутствии четкого подтверждения интратиреоидного расположения аденомы ОЩЖ по данным визуализирующих методик. Определение уровня ПТГ проводится с помощью стандартных наборов. Эта техника относительно безопасна и доступна, характеризуется высокими чувствительностью, специфичностью и прогностической ценностью. Необходимо отметить, что цитологическое исследование ОЩЖ не проводится в виду сложности дифференциальной диагностики с фолликулярными опухолями щитовидной желез. Кроме того, цитологическое исследование не позволяет дифференцировать доброкачественное от злокачественного поражения ОЩЖ [126-128].
Методика исследования: под контролем УЗ линейного датчика выполняется пункция образования шприцем 5,0 или 10,0 мл с иглой 21-23G. Игла извлекается. Далее через пункционную иглу (несколько раз) осуществляется лаваж физиологическим стабилизирующим раствором в объеме 1,0 мл. В полученном смыве проводится определение уровня ПТГ. Следует подчеркнуть, что результаты ТАБ ОЩЖ с исследованием уровня ПТГ в аспирате, свидетельствуют о том, является ли пунктированное образование патологией ОЩЖ или другой ткани. При этом уровень ПТГ в аспирате не позволяет провести дифференциальный диагноз между аденомой или гиперплазией ОЩЖ. Как правило, уровень ПТГ более 500 пг/мл соответствует патологически измененной ОЩЖ [129].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Развитие костных нарушений при ПГПТ - результат прямого действия высокого уровня ПТГ, характеризующегося ускорением костного ремоделирования с преобладанием резорбтивных процессов. Ранее к одним из наиболее частых поражений костной системы ПГПТ относили фиброзно-кистозный остеит, определявшийся более чем у 50% больных [131, 135]. В последние годы в связи с более ранней диагностикой заболевания эти поражения костной ткани выявляют реже. Тем не менее, ценность рентгенологического исследования скелета при ПГПТ остается высокой, поскольку позволяет верифицировать костные нарушения у пациентов с тяжелой симптомной формой заболевания. Рентгенологическая картина костных поражений вследствие ПГПТ включает в себя субпериостальную резорбцию, кистообразование, гипертрофию надкостницы, деминерализацию костей черепа. Редкий, но специфичный рентгенологический симптом - образование «бурых» опухолей, чаще формирующихся в различных отделах скелета (бедро, таз, ключицы, ребра, челюсти, череп) [47, 136]. Костные потери в периферическом скелете сначала выявляются в концевых отделах трубчатых костей вследствие преобладания здесь губчатой кости. Рентгенологическое обследование поясничного и грудного отделов позвоночника в боковой проекции необходимо для исключения или верификации компрессионных переломов тел позвонков, особенно у пациентов с клинически значимым снижением роста [131].
В случае бессимптомного ПГПТ патологические изменения скелета выявляются, как правило, при снижении МПК по результатам двухэнергетической рентгеновской абсорбциометрии (dual-energy X-ray absorptiometry, DEXA), являющимся «золотым» стандартом исследования костной массы и диагностики остеопороза на ранней доклинической стадии. Всемирная организация здравоохранения (ВОЗ) определяет остеопению как снижение МПК в интервале от 1 до 2,5 стандартных отклонения ниже пикового значения костной массы (Т- критерий в диапазоне от -1,0 до -2,5 SD) и остеопороз как снижение МПК, равное или большее, чем 2,5 стандартных отклонения (Т-критерий <-2,5 SD; при исследовании МПК у мужчин моложе 50 лет и женщин до менопаузы используют Z-критерий, значение <-2,0 SD соответствует снижению МПК относительно возрастной нормы). При ПГПТ помимо стандартного исследования состояния осевого скелета (поясничного отдела позвоночника и проксимального отдела бедренной кости), необходимо исследовать МПК в периферических костях (дистальная треть предплечья), имеющих преимущественно кортикальное строение и подвергающихся максимальному остеорезорбтивному воздействию ПТГ [63].
Относительно недавние исследования с использованием периферической количественной КТ высокого разрешения (HRpQCT) показали, что у пациентов с ПГПТ поражается как кортикальная, так и трабекулярная костная ткань [137, 138]. Патологические изменения трабекулярного вещества подтверждаются снижением трабекулярного костного индекса (TBS) в поясничном отделе позвоночника [139, 140], а также двухкратным увеличением риска вертебральных и невертебральных переломов по данным эпидемиологических исследований [141, 142]. TBS, определяемый с помощью дополнительного программного обеспечения при стандартной рентгеновской денситометрии поясничного отдела позвоночника, позволяет косвенно оценить качественные характеристики костной структуры по денситометрическим изображениям и тем самым дополняет возможности традиционной денситометрии. Оценка TBS позволяет прогнозировать риск развития переломов независимо от МПК. Есть данные, что ухудшение микроархитектоники костной ткани при ПГПТ проявляется в снижении показателей TBS по сравнению с контролем, сопоставимым по полу и возрасту [139]. После паратиреоидэктомии отмечается значимое увеличение МПК как у пациентов с бессимптомной формой заболевания и минимальным повреждением костной ткани, так и в случае тяжелого поражения с развитием фиброзно-кистозного остеита [143, 144]. При этом, радикально выполненное хирургическое лечение также приводит к повышению TBS [145].
• Для определения спектра и тяжести поражения почек пациентам с ПГПТ рекомендуется проведение комплексного обследования, включая определение уровня креатинина с расчетом СКФ, определение уровня кальция в суточной моче и проведение УЗИ (КТ) забрюшинного пространства/почек [62, 86, 146-149].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Почечные проявления ПГПТ включают в себя нефролитиаз, нефрокальциноз, а также нарушение фильтрационной и концентрационной функций [2, 83, 150]. Иногда поражение почек может быть единственным проявлением заболевания и протекать в виде рецидивирующего нефролитиаза. Могут определяться как одиночные, так и множественные конкременты в одной или обеих почках. Конкременты в почках при ПГПТ состоят преимущественно из оксалатов или фосфатов кальция [83, 150].
В настоящее время частота симптомного нефролитиаза, как правило, не превышает 7-20% наблюдений [146, 149, 151], при этом распространенность «молчащих» конкрементов и нефрокальциноза по результатам визуализирующих методов исследования почек может достигать 25-55% [62]. Наличие структурных изменений почек является абсолютным показанием к проведению паратиреоидэктомии, таким образом, всем пациентам с ПГПТ рекомендуется выполнение УЗИ и/или КТ почек. КТ считается наиболее информативным методом в диагностике кальцификации почечной паренхимы [146].
Всем пациентам с ПГПТ необходим расчет СКФ. Почечная недостаточность является одним из наиболее тяжелых и малообратимых осложнений и связана с более выраженными клиническими проявлениями, повышением риска смерти, увеличением распространенности артериальной гипертензии [34, 83]. Снижение СКФ до ХБП 3-й стадии диагностируется у 17-20% с ПГПТ, при этом часть пациентов может иметь бессимптомную форму заболевания [86].
Ценность исследования уровня кальция в моче при ПГПТ длительно подвергалась сомнению, так как патогенетический вклад гиперкальциурии в развитие нефролитиаза/нефрокальциноза у пациентов с ПГПТ до сих пор остается предметом дискуссии. По результатам большинства исследований среди пациентов с ПГПТ риск нефролитиаза достоверно ассоциирован с молодым возрастом и мужским полом [149]. Вероятно, гиперкальциурия способствует повышению риска нефролитиаза, но не является единственным триггерным фактором [86, 149]. Суточная гиперкальциурия характерна в большей мере для ПГПТ с нефролитиазом [147, 148]. Тем не менее, радикально выполненная паратиреоидэктомия снижает риск прогрессирования или рецидивирования нефролитиаза, в связи с чем наличие выраженной гиперкальциурии более 10 ммоль/сутки (более 400 мг/сут) стало рассматриваться в качестве показания к хирургическому лечению ПГПТ [149].
• Проведение эзофагогастродуоденоскопии для оценки состояния верхних отделов ЖКТ пациентам с ПГПТ рекомендуется при наличии соответствующей клинической симптоматики и/или в рамках подготовки к хирургическому лечению [65-67, 152].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Язвенная болезнь желудка и 12-перстной кишки в настоящее время встречается редко и значимо чаще у молодых пациентов с синдромами МЭН-1 или МЭН-4, и сопутствующими гастрин-продуцирующими опухолями. Результаты исследований о патогенетической взаимосвязи между ПТГ-опосредованной гиперкальциемией и повышенной секрецией гастрина и желудочного сока остаются противоречивыми [65-67]. Единственное проспективное исследование наличие данной ассоциации не подтвердило [66]. Патогенетически воспалительные и структурные изменения в поджелудочной железе в большей степени ассоциированы с гиперкальциемией, чем непосредственно с ПГПТ. Показано, что гиперкальциемия любой этиологии может приводить к развитию острого или хронического панкреатита [152].
• Диагноз гиперкальциемической формы ПГПТ рекомендуется устанавливать у пациентов при наличии гиперкальциемии в сочетании со стойким повышением уровня ПТГ или высоконормальным уровнем ПТГ (на верхней границе референсного интервала, но не выходящий за его пределы), исключив семейную доброкачественную гипокальциурическую гиперкальциемию с целью решения о проведении дополнительного обследования и выбора оптимальной тактики лечения [26-28].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Критерии установления диагноза нормокальциемической формы ПГПТ на основании результатов лабораторных исследований при условии минимум двукратного определения в интервале 3-6 мес: стойкая нормокальциемия (сохранение показателей альбумин-скорректированного и ионизированного кальция в референсном диапазоне), повышение уровня иПТГ после исключения возможных вторичных причин гиперпаратиреоза, нормокальциурия.
• Диагноз нормокальциемического формы ПГПТ рекомендуется устанавливать у пациентов при наличии следующих критериев [29-42]:
• стойкое сохранение показателей альбумин-скорректированного и ионизированного кальция в референсном диапазоне за весь период наблюдения при повышенном уровне иПТГ (минимум двукратное определение в интервале 3-6 мес);
• исключение возможных вторичных причин гиперпаратиреоза (прежде всего дефицита/недостаточности витамина D (25(ОН)D ≥ 30 нг/мл) и ХБП (СКФ) ≤ 60 мл/мин));
• отсутствие гиперкальциурии.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии: у ряда пациентов с ПГПТ уровень общего кальция в крови может сохраняться в пределах референсного диапазона, при этом отмечаться повышение уровня ионизированной фракции, что также считается гиперкальциемией и не соответствует критериям постановки диагноза нПГПТ [29]. Таким образом, определение Са++ поможет избежать диагностических ошибок, однако не все клинические лаборатории располагают необходимым оборудованием. В таких случаях необходимо ориентироваться на показатели альбумин-скорректированного кальция. С целью верификации нПГПТ нормокальциемия и повышенный уровень ПТГ должны выявляться по меньшей мере в двух последующих измерениях в течение 3-6 месяцев [30, 31].
Помимо недостаточности/дефицита витамина D [32, 33] и ХБП (СКФ≤ 60 мл/мин) [34, 35] также необходимо исключить и другие вторичные причины гиперпаратиреоза: прием препаратов, влияющих на уровень кальция/ПТГ (бифосфонаты (M05BA), деносумаб**, препараты лития) [39-42]; гиперкальциурия [36]; заболевания ЖКТ, вызывающие мальабсорбцию [37, 38].
2,1 Жалобы и анамнез.
• Определение уровня кальция сыворотки крови рекомендуется пациентам, имеющим одно или несколько из следующих клинических состояний и/или признаков, с целью принятия решения о дальнейшем обследовании на предмет исключения или верификации ПГПТ:• клинические симптомы гиперкальциемии, включая инсипидарный синдром (полиурия/никтурия/полидипсия, не обусловленные сахарным или несахарным диабетом); тошноту, рвоту, снижение аппетита, дегидратацию [43, 44];
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• остеопороз или предшествующие низкотравматичные переломы в анамнезе (особенно переломы шейки бедра, переломы дистального отдела костей предплечья), клинические проявления фиброзно-кистозного остеита, включая деформации скелета, боли в ребрах [45-49];
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
• нефролитиаз (особенно рецидивирующий), нефрокальциноз [49-55];
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
• рецидивирующая язвенная болезнь желудка или двенадцатиперстной кишки, калькулезного панкреатита [56-58].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарии: клинические проявления ПГПТ в большинстве случаев обусловлены гиперкальциемией. Легкая гиперкальциемия (общий кальций <3 ммоль/л (12 мг/дл)) может длительно оставаться бессимптомной или проявляться в виде неспецифических жалоб, таких как общая и мышечная слабость, утомляемость, снижение эмоционального фона. Умеренная гиперкальциемия (общий кальций сыворотки крови >3-3,5 ммоль/л (12-14 мг/дл)) при хроническом течении может протекать с минимальной симптоматикой. Быстро прогрессирующая гиперкальциемия может сопровождаться ухудшением состояния в виде появления таких симптомов, как полиурия, полидипсия, дегидратация, снижение аппетита, тошнота, мышечная слабость. У пациентов с тяжелой гиперкальциемией (общий кальций сыворотки крови >3,5 ммоль/л (14 мг/дл)) отмечается высокий риск гиперкальциемического криза [59, 60]. При сборе анамнеза необходимо учитывать прием препаратов, влияющих на фосфорно-кальциевый обмен ( см раздел 7,4).
Нефролитиаз - одно из основных осложнений ПГПТ, поэтому в анамнезе необходимо учитывать наличие приступов спастических болей в поясничной области (почечная колика) с тошнотой, рвотой, изменением мочевого осадка, лейкоцитурией и гематурией. В 10% случаев симптомный нефролитиаз при ПГПТ может характеризоваться рецидивирующим течением с частыми приступами почечной колики [55, 61]. По результатам последних исследований частота симптомного нефролитиаза в когорте пациентов с ПГПТ значимо сократилась, однако при проведении визуализирующих методов исследования (ультразвуковое исследование (УЗИ), компьютерная томография (КТ) почек) чаще стали диагностироваться «молчащие» формы заболевания (бессимптомный нефролитиаз/нефрокальциноз) [62]. Анализ результатов обследования когорты пациентов с нефролитиазом (5 крупных исследований, n=5927) продемонстрировал, что распространенность ПГПТ в данной популяции может значимо превышать общепопуляционные значения и достигать 3,2-5% [50-54].
Фиброзно-кистозный остеит относится к тяжелым костным нарушениям, характерным для симптомного (манифестного) ПГПТ и сопровождается выраженными болями в костях, деформациями скелета и патологическими переломами. В настоящее время фиброзно-кистозный остеит диагностируется значимо реже, тем не менее пациенты могут сообщать о перенесенных низкотравматичных переломах. При бессимптомном течении ПГПТ патологические изменения скелета верифицируются, как правило, при снижении минеральной плотности кости (МПК) по результатам рентгенденситометрии [2, 63]. Имеющиеся данные свидетельствуют о том, что ПГПТ чаще выявляется среди пациентов с переломом шейки бедра по сравнению с лицами без перелома (n=888, 4,7% против 1,13%) [45]. При обследовании женщин в постменопаузе (n=119) в 6,7% случаев при наличии перелома дистального отдела предплечья в анамнезе выявляется ПГПТ [46].
Необходим тщательный сбор анамнеза касательно других симптомов, ассоциированных с ПГПТ, включая язвенную болезнь желудка и двенадцатиперстной кишки, гастроэзофагеальную рефлюксную болезнь, острый панкреатит, чаще ассоциированных с умеренной и тяжелой гиперкальциемией [64]. Рецидивирующие пептические язвы верхних отделов ЖКТ ранее относились к частым осложнениям ПГПТ. В настоящее время они диагностируются значимо реже и более характерны для молодых пациентов с синдромами множественных эндокринных неоплазий и сопутствующими гастрин-продуцирующими опухолями. Результаты исследований о патогенетической взаимосвязи между ПТГ-опосредованной гиперкальциемией и повышенной секрецией гастрина и желудочного пока остаются противоречивыми [65-67].
Проявления со стороны мышечной системы, включающие проксимальную мышечную слабость и атрофию, в настоящее время редки, но многие пациенты с ПГПТ предъявляют субъективные жалобы на повышенную утомляемость и генерализованную слабость [68-70]. Ранее к классическим психическим проявлениям ПГПТ относили тяжелое нарушение когнитивных функций и сознания, острый психоз. В настоящее время все чаще сообщается об умеренных психических расстройствах таких, как усталость, депрессия, эмоциональная лабильность, нарушения сна, ухудшение памяти и неспособность сконцентрироваться. Многие пациенты оценивают изменения своего состояния лишь ретроспективно, после успешного хирургического лечения, отмечая улучшение общего качества жизни, улучшение памяти и настроения[70-73].
Необходим тщательный сбор персонального и семейного анамнеза при подозрении на синдромальные формы эндокринопатий ( см главу наследственные формы ПГПТ) [5].
Общий осмотр подразумевает оценку общего физического состояния, роста и массы тела. При осмотре у пациентов с тяжелым течением ПГПТ можно отметить атрофию мышц, формирование «утиной походки». Следует обратить внимание на деформации скелета, наличие костных разрастаний в области лицевой части черепа, крупных суставов, трубчатых костей.
2,2 Физикальное обследование.
• Пациентам с подозрением на ПГПТ рекомендуется оценка общего физического состояния, роста (снижение роста на 2 см и более за 1-3 года или на 4 см и более за всю жизнь), нарушений походки, состояния мышц и скелета (деформации, переломы), наличия костных разрастаний в области лицевой части черепа, крупных суставов, трубчатых костей с целью выявления характерных проявлений заболевания со стороны костной системы [10, 74].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
2,3 Лабораторные диагностические исследования.
Диагноз ПГПТ основывается только на данных лабораторного обследования.• Пациентам с впервые выявленной гиперкальциемией рекомендуется повторное определение уровня общего кальция, альбумина (с расчетом альбумин-скорректированного кальция) и/или ионизированного кальция с целью исключения ложноположительных результатов лабораторных анализов [27, 75, 76].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Около 99% кальция депонируется в костной ткани и лишь 1% циркулирует во внутриклеточной жидкости и в плазме крови. В плазме кальций присутствует в ионизированной форме (около 50%), в связанном с белками состоянии (45%, в основном с альбуминами) и с комплексирующими анионами (фосфатом, цитратом - около 5%). Метаболически активной считается свободная (ионизированная) форма кальция.
Гиперкальциемический вариант ПГПТ составляет большинство случаев заболевания, поэтому при подозрении на ПГПТ первоначально рекомендуется определение уровня альбумин-скорректированного кальция крови, при этом гиперкальциемия должна быть подтверждена более чем в одном измерении, прежде чем пациенту будет назначено расширенное обследование. Корректировка кальция на уровень альбумина крови необходима с целью исключения ложно завышенных или ложно заниженных показателей кальциемии при изменении концентрации плазменных белков [76]. Коррекция общего кальция рекомендуется при уровне альбумина менее 40 г/л и более 45 г/л.
Формулы для расчета альбумин-скорректированного кальция:
• общий кальций плазмы (ммоль/л) = измеренный уровень общего кальция плазмы (ммоль/л) + 0,02 х (40 - измеренный уровень альбумина плазмы (г/л));
• общий кальций плазмы (мг/дл) = измеренный уровень общего кальция плазмы (мг/дл) + 0,8 х (4 - измеренный уровень альбумина плазмы (г/дл));
• коэффициент пересчёта: [кальций] мг/дл х 0,25 ==> [кальций] ммоль/л.
Ложных результатов можно также избежать путем прямого определения ионизированного кальция (Са++) [27]. Этот показатель менее вариабельный, однако, для его определения необходимо специальное оборудование - анализатор с использованием ион-селективных электродов, доступность которого в клинических лабораториях может быть лимитирована. Корректность определения Са++ зависит от технического состояния и калибровки аппаратуры, а также от учета влияния рН крови на его концентрацию. Кислотно-щелочное состояние влияет на содержание Са++ в крови путем воздействия на процесс связывания кальция с белками. Ацидоз уменьшает его связывание с белками крови и ведет к увеличению уровня Са++, в то время, как алкалоз усиливает процесс связывания кальция с протеинами и уменьшает его уровень. Эта корректировка заложена в программу современных анализаторов, однако в более ранних моделях не использовалась [75]. Таким образом, в рутинной практике рекомендуется определение альбумин-скорректированного кальция, а не ионизированной фракции.
• С целью верификации диагноза пациентам с подозрением на ПГПТ рекомендуется определение уровня общего кальция, альбумина (с расчетом альбумин-скорректированного кальция) и/или ионизированного кальция, исследование уровня паратиреоидного гормона в крови (иПТГ) [27, 28, 76-81].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
Комментарии:
Паратиреоидный гормон.
Для пациентов с ПГПТ уровень ПТГ, как правило повышен или находится на верхней границе референсного диапазона [27, 28]. В случае приема лекарственных средств, способных влиять на уровень кальция и/или ПТГ ( см раздел 7,4), проведение лабораторных тестов рекомендуется после отмены препаратов. Уровни ПТГ, находящиеся в нижнем диапазоне нормальных значений (<25-30 пг/мл) более характерны для других состояний, ассоциированных с развитием гиперкальциемии. Прежде всего необходимо исключить паранеопластические процессы как вторую наиболее частую причину повышения уровня кальция крови.
В настоящее время существуют наборы второго и третьего поколения для определения уровня иПТГ. Наборы второго поколения включают иммунорадиометрические (IRMA) и иммунохемилюминометрические (ICMA) методы и измеряют как интактную молекулу ПТГ1-84, так и улавливают крупные гормонально-неактивные С-терминальные фрагменты (ПТГ 4-84, ПТГ 7-84, ПТГ 10-84 и ПТГ 15-84) и, таким образом, могут завышать концентрацию биологически активного гормона в сыворотке [77]. Эти фрагменты составляют до 20% иммунореактивного ПТГ в сыворотке у лиц с сохранной функцией почек и до 50% у лиц с почечной недостаточностью. Наборы третьего поколения специфичны для интактного ПТГ1-84, поскольку улавливающее антитело распознает фрагмент ПТГ39-84, а проявляющее АТ - небольшой N-терминальный участок ПТГ1-4, и, следовательно, обладают большей диагностической чувствительностью. По сравнению с наборами второго поколения концентрация иПТГ, измеренная с помощью наборов третьего поколения, на 20% и 50% ниже у здоровых лиц и у лиц с почечной недостаточностью соответственно, Недостатком данных наборов является то, что они также распознают молекулу ПТГ1-84, претерпевшую посттрансляционные изменения (фосфорилирование по серину) на участке 15-20 (N-ПТГ), и являющуюся вследствие этого гормонально-неактивной формой. Однако вклад этой молекулы в конечный уровень ПТГ, измеренного с помощью наборов третьего поколения, составляет менее 10% у здоровых лиц и до 15% у лиц с почечной недостаточностью. N-ПТГ может в избытке продуцироваться при карциноме ОЩЖ и тяжелом гиперпаратиреозе [82].
При оценке чувствительности наборов второго и третьего поколения для диагностики ПГПТ не получено клинически значимых различий (91,3% против 89,1% соответственно), таким образом чувствительность наборов второго и третьего поколений для выявления повышенного уровня иПТГ одинакова [78].
У 1/3 пациентов выявляется гипофосфатемия за счет реципрокного отношения между кальцием и фосфором. При нормальной функции почек может наблюдаться обратная зависимость между повышением иПТГ и снижением фосфора крови. При снижении почечной функции фосфор сохраняется в пределах нормы или повышается. Также для ПГПТ характерны повышенные или верхненормальные уровни общей щелочной фосфатазы и более специфичных маркеров костного метаболизма: резорбции - в крови С-концевого телопептида коллагена 1 типа (СТх, β-crossLaps), N-концевого телопептида коллагена 1 типа (NTх), в моче - дезоксипиринолодина и NTх; костеобразования - в крови остеокальцина и N-концевого пропетида проколлогена 1 типа (P1NP) резорбции (деоксипиридинолин и N-концевой телопептид в моче, β-crossLaps (С-концевой телопептид) в крови) и маркеров костеобразования (остеокальцин) при активном вовлечении скелета в патологический процесс. Определение этих показателей может быть полезным при мониторинге эффективности антирезорбтивной терапии при консервативном ведении ПГПТ [10].
• С целью оценки фильтрационной функции почек и определения показаний к хирургическому лечению, а также для исключения вторичных причин повышения уровня иПТГ пациентам с подозрением на ПГПТ показано определение уровня креатинина с расчетом СКФ [79, 83-85].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Креатинин сыворотки считается важным диагностическим инструментом в когорте пациентов с ПГПТ, так как почки являются одним из основных органов регуляции обмена кальция и фосфора в организме. Эксперты KDOQI (Kidney Disease Outcomes Quality Initiative, инициатива по качеству для улучшения исходов заболеваний почек) рекомендуют проводить оценку скорости клубочковой фильтрации (СКФ) на основании возрастных, половых, расовых параметров и сывороточных показателей креатинина, альбумина, мочевины и азота. снижение фильтрационной функции почек характерно для пациентов с ПГПТ, получены доказательства роли развития ХБП С3-C5 в повышении риска внезапной смерти при ПГПТ. Кроме того, прогрессирующее снижение СКФ ассоциировано с повышением уровня ПТГ и усилением резорбтивных процессов в костной ткани [34, 35, 85]. Клиренсовые радиоизотопные методики - «золотой стандарт» в определении СКФ, однако стоимость и технические сложности резко лимитируют их широкое применение. В клинической практике для расчета СКФ могут быть использованы простые способы расчета клиренса креатинина, позволяющие обойтись без суточного сбора мочи (формулы Кокрофта-Голта, MDRD, сKD-EPI). Формула сKD-EPI дает более точные результаты, в том числе и при сохранной функциональной способности почек, что позволяет рекомендовать ее для амбулаторной практики [86]. Показатель может быть рассчитан автоматически с помощью специальных онлайн-калькуляторов.
• Пациентам с ПГПТ рекомендуется определение уровня 25(ОН) витамина D c целью диагностики его недостаточности/дефицита [87-90].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
Комментарии: между уровнями ПТГ, Са++ и активной формой витамина D (кальцитриолом) существуют реципрокные регуляторные связи. Увеличение синтеза и секреции ПТГ повышает содержание сa++ в крови и ускоряет гидроксилирование витамина D в почках; по принципу отрицательной обратной связи повышенные концентрации сa++ и кальцитриола угнетают продукцию ПТГ. В нормальных физиологических условиях дефицит витамина D и гипокальциемия способствуют увеличению синтеза ПТГ. Низкий уровень 25(ОН)D при ПГПТ ассоциирован с более высоким уровнем ПТГ и как следствием уровнем кальция сыворотки крови, более низкой МПК в кортикальной зоне костей и более высокими показателями маркеров костного обмена, более частым развитием фиброзного остеита и большим весом аденомы ОЩЖ [87-89]. Оценка статуса витамина D проводится путем определения 25(ОН) витамина D в крови, что является наиболее доступным и надежным методом лабораторной диагностики [75]. В случае выявления недостаточности/дефицита 25(ОН)D рекомендуется восполнение статуса витамина D, по возможности на дооперационном этапе или в раннем послеоперационном периоде ( см раздел 3,2 Консервативное лечение). [90].
• С целью верификации диагноза пациентам с ПГПТ и удовлетворительной фильтрационной функцией почек (СКФ>60 мл/мин/1,73м2) рекомендуется исследование уровней кальция и креатинина в моче (суточный анализ) с расчетом почечного клиренса кальция к клиренсу креатинина[26].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарии. Измерение кальция в суточной моче по отношению к экскреции креатинина необходимо с целью дифференциальной диагностики ПГПТ и FHH. FHH - это редкое наследственное заболевание с аутосомно-доминантным типом наследования, вызванное дефектом кальций-чувствительных рецепторов (CaSR) в почках и ОЩЖ. Диагноз FHH может быть заподозрен при сочетании гиперкальциемии, нормального или несколько повышенного уровня ПТГ и относительной гипокальциурии. Поскольку экскреция кальция с мочой за фиксированный интервал времени значительно зависит от СКФ и продолжительности времени сбора мочи, общая экскреция кальция не является ценным показателем для дифференциальной диагностики случаев FHH от типичного ПГПТ. В связи с чем используется расчет отношения почечного клиренса кальция к клиренсу креатинина (UCCR), который обычно при FHH составляет менее 0,01 (формула для расчета сaCl/CrCl = [Cau x сrs]/[Cru x сas], где сaCl - клиренс кальция, сrCl - клиренс креатинина, сau - концентрация кальция в моче (ммоль/л), сrs - концентрация креатинина в сыворотке крови (мкмоль/л), сru - концентрация креатинина в моче (мкмоль/л), сas - концентрация кальция в сыворотке крови (ммоль/л)). Для ПГПТ индекс UCCR обычно составляет более 0,02, однако сhristensen S.E. с коллегами продемонстрировал, что отрезная точка UCCR менее 0,01 без исследования гена сASR выявит только 65% пациентов с FHH и неверно классифицирует 4% пациентов с ПГПТ как имеющих FHH. Показатель UCCR в пределах 0,01-0,02 имеют 33% пациентов с ПГПТ, и 35% с FHH имеют UCCR ≥ 0,01 [26].
Дополнительной ценностью данного анализа является определение суточной кальциурии, как показателя риска возникновения или прогрессирования нефролитиаза. При выявлении суточной экскреции кальция выше 10 ммоль/сутки показано проведение хирургического лечения ПГПТ ( см раздел «Хирургическое лечение»). Необходимо отметить, что исследование кальция в моче не информативно при снижении функции почек (СКФ<60 мл/мин/1,73м2).
• С целью дифференциальной диагностики между первичным нормокальциемическим и вторичным гиперпартиреозом пациентам с сочетанием повышенного уровня иПТГ и нормокальциемией, рекомендовано проведение функциональных проб [74, 91-94].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Сочетание повышенного показателя иПТГ в крови с нормальным уровнем сывороточного кальция остается актуальной клинической проблемой. В целях дифференциальной диагностики между нормокальциемическим вариантом ПГПТ и ВГПТ, возникшим в результате недостаточности витамина D или при других состояниях [95, 96] необходимо проведение функциональных проб (таб.2) [30, 31]. У пациентов с ПГПТ прием препаратов витамина D и его производных и/или гидрохлоротиазида** провоцирует развитие гиперкальциемии при сохранении повышенного уровня иПТГ, а у пациентов с ВГПТ-снижение/нормализацию уровня иПТГ при нормальном уровне кальция в крови [95, 97]. При наличии гиперкальциурии целесообразно проведение пробы с тиазидами.
Необходимо учитывать, что длительный дефицит витамина D может приводить к развитию гиперплазии одной или всех ОЩЖ, которые формируются вследствие снижения тормозящего действия витамина D на деление клеток ОЩЖ, а также вследствие стимулирующего влияния низкого уровня кальция крови на этот же процесс. Таким образом оценка состояния и активности ОЩЖ по данным визуализирующих методик для дифференциальной диагностики не применятся.
Таблица 2. Функциональные пробы для дифференциальной диагностики между первичной нормокальциемической и вторичной формами гиперпаратиреоза.
| Наименование препарата | Доза препарата | Интерпретация результатов | Сроки проведения |
| Колекальциферол**[95, 98, 99] | Пациентам с установленным дефицитом 25(ОН) витамина D c целью достижения целевого уровня витамина D более 30 нг/мл (75 нмоль/л). | Подтверждение ПГПТ: отсутствие снижения уровня иПТГ и в некоторых случаях, появление гиперкальциемии Исключение ПГПТ: нормализация уровня иПТГ при уровне кальция в крови в референсном диапазоне1. | До достижения целевого уровня 25 (ОН) витамина D |
| Альфакальцидол**[92] | Пациентам при нарушении обмена кальция и фосфора вследствие нарушения эндогенного синтеза 1,25 дигидроксиколекальциферола (активного метаболита витамина D) 1 мкг в сутки в течение 5-7 дней, анализ крови на 5-7 день на кальций общий, альбумин, иПТГ. При отсутствии гиперкальциемии продолжение пробы до 1 месяца2 | Подтверждение ПГПТ: отсутствие снижения уровня иПТГ. Исключение ПГПТ: нормализация уровня иПТГ при уровне кальция в крови в референсном диапазоне*. | От 5-7 дней до 1 месяца |
| Тиазиды: Гидрохлоротиазид** [90][91] | По 25 мг 2 раза в сутки в течение 2 недель. Анализ крови на ПТГ на 15-й день | Подтверждение ПГПТ: отсутствие нормализации иПТГ, и возможно, повышение уровня кальция сыворотки крови (нормализация через несколько суток после отмены препарата). Исключение ПГПТ: нормализация уровня иПТГ | 2 недели |
1 на фоне приема препаратов возможно кратковременное развитие гиперкальциемии, которая проходит после окончания пробы и при нормализации ПТГ не является признаком ПГПТ.
2 Возможно более длительное проведение пробы: при выявлении на 5-7 день тенденции к снижению ПТГ и нормокальциемии продолжить пробу до развития гиперкальциемии - под контролем врача.
2,4 Инструментальные диагностические исследования.
Диагноз ПГПТ устанавливается исключительно на основании результатов лабораторного обследования, данные визуализирующих методов исследования не должны рассматриваться в контексте верификации или исключения заболевания.Применение визуализирующих методов исследования обязательно для подготовки пациентов к запланированному хирургическому лечению.
Цель предоперационной топической диагностики образования околощитовидной железы при первичном гиперпаратиреозе - подготовка к селективной паратиреоидэктомии. Для планирования эффективного хирургического лечения требуется информация о точном месте расположения образования околощитовидной железы. Методами первой линии инструментальной диагностики при ПГПТ являются УЗИ и радионуклидные исследования (сцинтиграфия, ОФЭКТ, ОФЭКТ-КТ). Методы второй линии диагностики - МСКТ с контрастным усилением, МРТ, 4D КТ, ПЭТ, ПЭТ-КТ.
• Пациентам с ПГПТ в качестве первого этапа топической диагностики ОЩЖ рекомендуется проведение ультразвукового исследования ОЩЖ [100-106].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии. Чувствительность УЗИ в случае солитарного образования ОЩЖ по различным данным варьируется от 76 до 91% и во многом зависит от квалификации специалиста [100-103]. Специфичность метода может достигать 96% [104-106]. Установлена высокая положительная прогностическая значимость и диагностическая точность УЗИ ОЩЖ (93,2% и 88% cсоответственно) [100].
Аденома ОЩЖ, как правило, представляет собой образование округлой или овальной формы, гипоэхогенной структуры, очерченное изоэхогенной линией и контрастирующее с вышележащей гиперэхогенной тканью щитовидной железы. В ряде случаев могут визуализироваться кальцинаты и определяться кистозная дегенерация. УЗИ наиболее эффективно при расположении аденомы ОЩЖ вблизи щитовидной железы и шейной части вилочковой железы. Возможности метода резко ограничены при образованиях ОЩЖ, расположенных ретротрахеально, ретроэзофагеально или в случае их эктопии в средостение [102, 103]. Четкие УЗИ-признаки злокачественного поражения ОЩЖ отсутствуют. Однако подозрительными в отношении рака ОЩЖ являются неоднородная структура, неправильная форма, размер образования более 3 неровные края, пониженная эхогенность [107].
В последнее время активно стали использовать УЗИ с контрастированием. Метод обеспечивает количественную и качественную оценку васкуляризации микрососудистого русла желез, что позволяет идентифицировать опухоли ОЩЖ. УЗИ с контрастированием обладает особыми преимуществами при наличии сопутствующего зоба, шейной лимфаденопатии, а также при полигландулярном поражении ОЩЖ даже после предшествующих хирургических вмешательств в области шеи [108].
Преимущества метода:
• отсутствие лучевой нагрузки;
• относительно низкая стоимость и высокая доступность исследования;
• возможность выявления сопутствующей патологии ЩЖ.
Недостатки метода:
• значимая вариабельность диагностической точности метода в зависимости от квалификации специалиста;
• ложноположительные результаты за счет узловых образований ЩЖ или лимфатических узлов;
• значимые ограничения в проведении исследования при атипичной локализации ОЩЖ (например, за грудиной, в позадипищеводном пространстве).
• Пациентам с ПГПТ с целью функционально-топической диагностики образований ОЩЖ рекомендуется проведение сцинтиграфии ОЩЖ с технеция [99mTс] сестамиби [100, 102, 109, 110].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии. Технеция [99mTс] сестамиби представляет собой липофильный катион, распределяющийся пропорционально кровотоку, метаболическому потреблению и митохондриальной активности образования. Накопление Технеция [99mTс] сестамиби в ткани ОЩЖ определяется высокой митохондриальной плотностью в оксифильных клетках. Физиологическое накопление Технеция [99mTс] сестамиби наблюдается во многих тканях, включая щитовидную железу, однако его выведение из измененной ОЩЖ происходит значительно медленнее, что позволяет ее визуализировать на отсроченных снимках [111].
Длительное время стандартной методикой оставалась двухмерная планарная сцинтиграфия. В настоящее время все чаще используется трехмерная однофотонная эмиссионная компьютерная томография (ОФЭКТ) и гибридная технология ОФЭКТ/КТ, сочетающая в себе функциональную чувствительность ОФЭКТ с высокой анатомической детализацией многослойной КТ. С целью визуализации ОЩЖ применяются 2 протокола сцинтиграфии: двухфазный - основан на разной скорости элиминации изотопа из нормальной ЩЖ и измененной ОЩЖ; двухизотопный (субтракционный) - основан на использовании изотопа Технеция [99mTс] сестамиби, который накапливается и ЩЖ, и ОЩЖ, и тропного только к ЩЖ изотопа М-йодбензилгуанидина (123-I) или Натрия пертехнетата [99Tc]. Оценка диагностической эффективности сцинтиграфии ОЩЖ по данным литературы осложняется различиями в методах проведения исследования, опыте специалистов и стандартах интерпретации полученных данных в медицинских центрах [111].
Чувствительность метода может варьировать в широком диапазоне от 54 до 96% [112], в среднем составляя около 88% в случае солитарного образования ОЩЖ [102]. Множественное поражение ассоциировано со значимым снижением чувствительности: до 33% при наличии двух аденом ОЩЖ и до 44 % в случае гиперплазии 4-х ОЩЖ [102]. Отсутствие визуализации аденом ОЩЖ при проведении сцинтиграфии при ПГПТ ассоциировано с повышенным риском полигландулярного поражения.
Объединенная чувствительность и положительная прогностическая значимость для сцинтиграфии с Технеция [99mTс] сестамиби с ОФЭКТ составляют 79% (49-91%) и 91% (84-96%) соответственно [100]. Для ОФЭКТ/КТ отмечена большая чувствительность метода (86%, ДИ 81-90) при сравнении с ОФЭКТ (74%, ДИ 66-82) и двухмерной планарной сцинтиграфией (70%, ДИ 61-80), кроме того данный метод имеет преимущество перед другими методиками в топической диагностике эктопированных образований [110].
Преимущества метода:
• определение локализации как типично расположенных, так и эктопированных образований ОЩЖ, в том числе в средостении (основываясь на специфичности метаболизма паратиреоидной ткани).
Недостатки метода:
• значимая вариабельность диагностической точности исследования в зависимости от центра (опыта специалистов, технической оснащенности - планарная гамма-камера, ОФЭКТ, ОФЭКТ-КТ), где проводится исследование;
• возможные ложноположительные и ложноотрицательные результаты при наличии сопутствующих заболеваний щитовидной железы (аутоиммунный тиреоидит, многоузловой зоб, диффузно-токсический зоб, рак щитовидной железы);
• снижение чувствительности метода при поражении нескольких ОЩЖ;
• лучевая нагрузка.
Комбинация ОФЭКТ-КТ с Технеция [99mTс] сестамиби и УЗИ ОЩЖ экспертного класса на дооперационном этапе диагностики ПГПТ повышают чувствительность до 95-98%. Сочетание двух методов топической диагностики используется для определения возможности проведения минимально инвазивной паратиреоидэктомии, а также для определения последовательности визуализации ОЩЖ при двусторонней ревизии шеи [113, 114]. Однако, необходимо отметить, что в случае множественного поражения ОЩЖ, чувствительность данной комбинации остается невысокой и составляет 30-60% [115].
• Пациентам с ПГПТ в случае отсутствия четкой визуализации образования ОЩЖ по результатам методов первой линии (УЗИ и радионуклидные исследования), рекомендуется проведение дополнительных методов исследования:
• компьютерной томографии шеи и средостения с контрастным усилением [116], позитронной эмиссионной томографии (ПЭТ) всего тела с туморотропным радиофармацевтическим диагностическим средством [117];
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
• магнитной резонансной томографии шеи [118, 119].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. В спорных случаях, при расхождении результатов УЗИ и сцинтиграфии с Технеция [99mTс] сестамиби применяется компьютерная томография шеи с внутривенным болюсным контрастированием. Традиционная компьютерная томография с контрастным усилением позволяет достаточно точно оценить размеры и локализацию образований ОЩЖ, как в случае их типичного расположения, так и при наличии измененных эктопированных ОЩЖ, в том числе в средостение. Диагностическая чувствительность МСКТ сильно вариабельна и может составлять 46-87% [120]. Результаты мета-анализа 34 исследований, в который было включено более 2,5 тысяч пациентов с ПГПТ, показали, что использование двухфазной методики вместо однофазной повышает чувствительность с 71 до 76% [116]. Недостатками метода являются лучевая нагрузка, потенциальная нефротоксичность контрастного вещества и соответственно ограниченное применение у пациентов с ХБП. Кроме того, исследование со стандартным шагом 5 мм возможно только при наличии желез массой 5 г и более, ошибка в данном случае не превышает 5%. В остальных случаях необходим более мелкий шаг снимков, что еще больше увеличивает лучевую нагрузку [121].
4D КТ демонстрирует многообещающие результаты в визуализации ОЩЖ, однако в настоящее время исследование малодоступно. Методика включает в себя КТ-ангиографию с шагом снимков в 1 мм и сопутствующей оценкой перфузии в ОЩЖ за единицу времени. Наряду с определением точного анатомического расположения как типично расположенных, так и эктопированных образований, метод позволяет исследовать функциональную активность образования ОЩЖ. 4D КТ, вероятно, единственный способ топической диагностики, позволяющий четко визуализировать нормальную ткань ОЩЖ [122, 123]. Чувствительность метода 4D КТ составляет в среднем 89%, а положительная прогностическая значимость достигает 93,5% [100]. Относительно высокая чувствительность метода сохраняется при множественном поражения ОЩЖ - 62,5-85,7% [122-124]. Основными недостатками 4D-КТ являются высокая стоимость, значительное увеличение радиационного облучения, резко ограниченная доступность.
Проведение магнитной резонансной томографии (МРТ) возможно для установления локализации патологически измененных ОЩЖ, однако данный метод обладает рядом недостатков: высокая стоимость, меньшая чувствительность (по разным данным 43-71%), трудности в интерпретации полученных данных, что связано с возникновением артефактов при дыхательных движениях. Возможным преимуществом является выявление эктопированных в средостение ОЩЖ, но по точности данный метод уступает МСКТ [118, 119].
Применение позитронно-эмиссионной томографии (ПЭТ) рекомендуется в отдельных случаях у пациентов с персистенцией заболевания или с рецидивом ПГПТ при отсутствии визуализации ОЩЖ с помощью других методов. [117]. Однако, данная методика является дорогостоящей и малодоступной, что препятствует ее широкому клиническому применению [125].
• В случае необходимости дифференциальной диагностики образований ОЩЖ с другими патологическими образованиями в области шеи (узлами щитовидной железы, лимфатическими узлами, кистами) пациентам с ПГПТ может быть рекомендована тонкоигольная аспирационная биопсия (ТАБ) ОЩЖ с последующим анализом уровня ПТГ в аспирате [126-129].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. ТАБ ОЩЖ с исследованием уровня ПТГ в аспирате не рекомендована к использованию в рутинной практике. Метод полезен в случае необходимости дифференциальной диагностики образований ОЩЖ и узловых образований ЩЖ при отсутствии четкого подтверждения интратиреоидного расположения аденомы ОЩЖ по данным визуализирующих методик. Определение уровня ПТГ проводится с помощью стандартных наборов. Эта техника относительно безопасна и доступна, характеризуется высокими чувствительностью, специфичностью и прогностической ценностью. Необходимо отметить, что цитологическое исследование ОЩЖ не проводится в виду сложности дифференциальной диагностики с фолликулярными опухолями щитовидной желез. Кроме того, цитологическое исследование не позволяет дифференцировать доброкачественное от злокачественного поражения ОЩЖ [126-128].
Методика исследования: под контролем УЗ линейного датчика выполняется пункция образования шприцем 5,0 или 10,0 мл с иглой 21-23G. Игла извлекается. Далее через пункционную иглу (несколько раз) осуществляется лаваж физиологическим стабилизирующим раствором в объеме 1,0 мл. В полученном смыве проводится определение уровня ПТГ. Следует подчеркнуть, что результаты ТАБ ОЩЖ с исследованием уровня ПТГ в аспирате, свидетельствуют о том, является ли пунктированное образование патологией ОЩЖ или другой ткани. При этом уровень ПТГ в аспирате не позволяет провести дифференциальный диагноз между аденомой или гиперплазией ОЩЖ. Как правило, уровень ПТГ более 500 пг/мл соответствует патологически измененной ОЩЖ [129].
2,5 Иные диагностические исследования.
• Для определения спектра и тяжести костных нарушений пациентам с ПГПТ рекомендуется обследование, включая количественную оценку минеральной плотности кости 3-х отделов с помощью рентгеновской денситометрии, рентгенологическую оценку целостности скелета при подозрении на переломы, включая рентгенографию грудного и поясничного отдела позвоночника в боковой проекции при потере роста на 4 см с молодости или потере роста на 2 см за последний год [63, 130-134].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Развитие костных нарушений при ПГПТ - результат прямого действия высокого уровня ПТГ, характеризующегося ускорением костного ремоделирования с преобладанием резорбтивных процессов. Ранее к одним из наиболее частых поражений костной системы ПГПТ относили фиброзно-кистозный остеит, определявшийся более чем у 50% больных [131, 135]. В последние годы в связи с более ранней диагностикой заболевания эти поражения костной ткани выявляют реже. Тем не менее, ценность рентгенологического исследования скелета при ПГПТ остается высокой, поскольку позволяет верифицировать костные нарушения у пациентов с тяжелой симптомной формой заболевания. Рентгенологическая картина костных поражений вследствие ПГПТ включает в себя субпериостальную резорбцию, кистообразование, гипертрофию надкостницы, деминерализацию костей черепа. Редкий, но специфичный рентгенологический симптом - образование «бурых» опухолей, чаще формирующихся в различных отделах скелета (бедро, таз, ключицы, ребра, челюсти, череп) [47, 136]. Костные потери в периферическом скелете сначала выявляются в концевых отделах трубчатых костей вследствие преобладания здесь губчатой кости. Рентгенологическое обследование поясничного и грудного отделов позвоночника в боковой проекции необходимо для исключения или верификации компрессионных переломов тел позвонков, особенно у пациентов с клинически значимым снижением роста [131].
В случае бессимптомного ПГПТ патологические изменения скелета выявляются, как правило, при снижении МПК по результатам двухэнергетической рентгеновской абсорбциометрии (dual-energy X-ray absorptiometry, DEXA), являющимся «золотым» стандартом исследования костной массы и диагностики остеопороза на ранней доклинической стадии. Всемирная организация здравоохранения (ВОЗ) определяет остеопению как снижение МПК в интервале от 1 до 2,5 стандартных отклонения ниже пикового значения костной массы (Т- критерий в диапазоне от -1,0 до -2,5 SD) и остеопороз как снижение МПК, равное или большее, чем 2,5 стандартных отклонения (Т-критерий <-2,5 SD; при исследовании МПК у мужчин моложе 50 лет и женщин до менопаузы используют Z-критерий, значение <-2,0 SD соответствует снижению МПК относительно возрастной нормы). При ПГПТ помимо стандартного исследования состояния осевого скелета (поясничного отдела позвоночника и проксимального отдела бедренной кости), необходимо исследовать МПК в периферических костях (дистальная треть предплечья), имеющих преимущественно кортикальное строение и подвергающихся максимальному остеорезорбтивному воздействию ПТГ [63].
Относительно недавние исследования с использованием периферической количественной КТ высокого разрешения (HRpQCT) показали, что у пациентов с ПГПТ поражается как кортикальная, так и трабекулярная костная ткань [137, 138]. Патологические изменения трабекулярного вещества подтверждаются снижением трабекулярного костного индекса (TBS) в поясничном отделе позвоночника [139, 140], а также двухкратным увеличением риска вертебральных и невертебральных переломов по данным эпидемиологических исследований [141, 142]. TBS, определяемый с помощью дополнительного программного обеспечения при стандартной рентгеновской денситометрии поясничного отдела позвоночника, позволяет косвенно оценить качественные характеристики костной структуры по денситометрическим изображениям и тем самым дополняет возможности традиционной денситометрии. Оценка TBS позволяет прогнозировать риск развития переломов независимо от МПК. Есть данные, что ухудшение микроархитектоники костной ткани при ПГПТ проявляется в снижении показателей TBS по сравнению с контролем, сопоставимым по полу и возрасту [139]. После паратиреоидэктомии отмечается значимое увеличение МПК как у пациентов с бессимптомной формой заболевания и минимальным повреждением костной ткани, так и в случае тяжелого поражения с развитием фиброзно-кистозного остеита [143, 144]. При этом, радикально выполненное хирургическое лечение также приводит к повышению TBS [145].
• Для определения спектра и тяжести поражения почек пациентам с ПГПТ рекомендуется проведение комплексного обследования, включая определение уровня креатинина с расчетом СКФ, определение уровня кальция в суточной моче и проведение УЗИ (КТ) забрюшинного пространства/почек [62, 86, 146-149].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Почечные проявления ПГПТ включают в себя нефролитиаз, нефрокальциноз, а также нарушение фильтрационной и концентрационной функций [2, 83, 150]. Иногда поражение почек может быть единственным проявлением заболевания и протекать в виде рецидивирующего нефролитиаза. Могут определяться как одиночные, так и множественные конкременты в одной или обеих почках. Конкременты в почках при ПГПТ состоят преимущественно из оксалатов или фосфатов кальция [83, 150].
В настоящее время частота симптомного нефролитиаза, как правило, не превышает 7-20% наблюдений [146, 149, 151], при этом распространенность «молчащих» конкрементов и нефрокальциноза по результатам визуализирующих методов исследования почек может достигать 25-55% [62]. Наличие структурных изменений почек является абсолютным показанием к проведению паратиреоидэктомии, таким образом, всем пациентам с ПГПТ рекомендуется выполнение УЗИ и/или КТ почек. КТ считается наиболее информативным методом в диагностике кальцификации почечной паренхимы [146].
Всем пациентам с ПГПТ необходим расчет СКФ. Почечная недостаточность является одним из наиболее тяжелых и малообратимых осложнений и связана с более выраженными клиническими проявлениями, повышением риска смерти, увеличением распространенности артериальной гипертензии [34, 83]. Снижение СКФ до ХБП 3-й стадии диагностируется у 17-20% с ПГПТ, при этом часть пациентов может иметь бессимптомную форму заболевания [86].
Ценность исследования уровня кальция в моче при ПГПТ длительно подвергалась сомнению, так как патогенетический вклад гиперкальциурии в развитие нефролитиаза/нефрокальциноза у пациентов с ПГПТ до сих пор остается предметом дискуссии. По результатам большинства исследований среди пациентов с ПГПТ риск нефролитиаза достоверно ассоциирован с молодым возрастом и мужским полом [149]. Вероятно, гиперкальциурия способствует повышению риска нефролитиаза, но не является единственным триггерным фактором [86, 149]. Суточная гиперкальциурия характерна в большей мере для ПГПТ с нефролитиазом [147, 148]. Тем не менее, радикально выполненная паратиреоидэктомия снижает риск прогрессирования или рецидивирования нефролитиаза, в связи с чем наличие выраженной гиперкальциурии более 10 ммоль/сутки (более 400 мг/сут) стало рассматриваться в качестве показания к хирургическому лечению ПГПТ [149].
• Проведение эзофагогастродуоденоскопии для оценки состояния верхних отделов ЖКТ пациентам с ПГПТ рекомендуется при наличии соответствующей клинической симптоматики и/или в рамках подготовки к хирургическому лечению [65-67, 152].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Язвенная болезнь желудка и 12-перстной кишки в настоящее время встречается редко и значимо чаще у молодых пациентов с синдромами МЭН-1 или МЭН-4, и сопутствующими гастрин-продуцирующими опухолями. Результаты исследований о патогенетической взаимосвязи между ПТГ-опосредованной гиперкальциемией и повышенной секрецией гастрина и желудочного сока остаются противоречивыми [65-67]. Единственное проспективное исследование наличие данной ассоциации не подтвердило [66]. Патогенетически воспалительные и структурные изменения в поджелудочной железе в большей степени ассоциированы с гиперкальциемией, чем непосредственно с ПГПТ. Показано, что гиперкальциемия любой этиологии может приводить к развитию острого или хронического панкреатита [152].
Treatment
3,1 Хирургическое лечение.
Хирургическое лечение является единственным радикальным и эффективным методом лечения ПГПТ.• Хирургическое лечение ПГПТ рекомендуется:
• всем пациентам с симптомным (манифестным) ПГПТ [19, 22, 141, 149, 153-155];
(уровень убедительности рекомендаций в (уровень достоверности доказательств - 3);
• пациентам моложе 50 лет [156-160];
(уровень убедительности рекомендаций в (уровень достоверности доказательств - 3);
• пациентам при повышении уровня альбумин-скорректированного кальция в сыворотке крови на 0,25 ммоль/л (1 мг/дл) относительно верхней границы референсного диапазона, установленной в данной лаборатории, независимо от наличия/отсутствия клинической симптоматики [22, 161-163].
(уровень убедительности рекомендаций с (уровень достоверности доказательств - 2);
• пациентам при наличии остеопороза: низкотравматичные переломы в анамнезе и/или рентгенологически верифицированные переломы тел позвонков; при снижении МПК в лучевой кости, проксимальном отделе бедра или поясничном отделе позвоночника менее -2,5 SD по Т-критерию у женщин в постменопаузе и мужчин старше 50 лет по результатам рентгеновской денситометрии [22, 48, 145, 161, 163-169].
(уровень убедительности рекомендаций А (уровень достоверности доказательств - 2);
• пациентам при наличии функциональной и/или структурной патологии почек: снижение скорости клубочковой фильтрации менее 60 мл/мин/1,73м2 [83, 85, 155, 170-174];
(уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
• пациентам при наличии суточной экскреция кальция более 10 ммоль (400 мг) в сутки; нефролитиаз/нефрокальциноз (включая бессимптомные формы) [74].
(уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Удаление патологически измененной/ых ОЩЖ является единственным радикальным методом лечения ПГПТ. Динамическое наблюдение и медикаментозная терапия менее экономически выгодны даже в случае бессимптомного ПГПТ [175-177]. Хирургическое лечение показано всем пациентам с классическими проявлениями заболевания [19, 22, 153]. Преимущества радикального лечения заключаются в нормализации уровня кальция и устранении ассоциированных с гиперкальциемией симптомов, значимом улучшении состояния костной ткани [22, 141, 154] и почек [149, 155]. К дополнительным преимуществам можно отнести улучшения со стороны сердечно-сосудистой и нейропсихических систем, заболеваний желудочно-кишечного тракта, однако это требует подтверждения в крупных рандомизированных контролируемых исследованиях [178]. Хирургическое лечение может быть рекомендовано в случае бессимптомного ПГПТ и отсутствия показаний к паратиреоидэктомии при желании самого пациента, однако необходима оценка соотношения риска/пользы от операции. Результаты рандомизированных исследований свидетельствуют об улучшении качества жизни пациентов с бессимптомным ПГПТ после хирургического лечения [70, 165, 179].
Паратиреоидэктомия рекомендуется всем лицам моложе 50 лет, включая детей. В случае отказа от оперативного лечения пациентам моложе 50 лет потребуется более длительный период наблюдения, что ассоциировано с увеличением финансовых затрат. Кроме того, увеличивается риск развития специфических осложнений заболевания. Для молодых пациентов характерно более быстрое прогрессирование ПГПТ, при сроке наблюдения в течение 10 лет среди лиц ≤50 лет на момент постановки диагноза прогрессирование заболевания может отмечаться более чем в 65% случаев, в то время как в группе ≥50 лет - менее чем в 25% случаев [156-160]. Паратиреоидэктомия у детей и подростков характеризуется аналогичными высокими показателями эффективности, что и среди взрослого населения [180, 181].
Хроническая гиперкальциемия (на 0,25 ммоль/л (1 мг/дл) относительно верхней границы референсного диапазона) ассоциирована с развитием и прогрессированием осложнений ПГПТ, включая усиление костной резорбции, нефролитиаз/нефрокальциноз и снижение фильтрационной функции почек, повышение сосудистой жесткости [22, 162, 163, 182-184].
Паратиреоидэктомия способствует приросту МПК, снижению пористости трабекулярной кости и увеличению толщины кортикального слоя как в случае симптомного (манифестного), так и бессимптомного ПГПТ [18, 19, 165, 166]. Средний прирост МПК в проксимальном отделе бедра в течение 10 лет может составить +14% [19]. Для сравнения при 15-летнем сроке наблюдения снижение МПК в бедренной кости и дистальном отделе предплечья у пациентов без лечения составляет 10% и 35% соответственно [18]. По результатам менее продолжительных рандомизированных контролируемых исследований (24 месяца) также отмечается достоверное увеличение МПК во всех отделах скелета, что подтверждает эффективность хирургической тактики в отношении костных нарушений по сравнению с динамическим наблюдением [145, 165, 167]. Данные о частоте переломов после операции ограничены, однако результаты нескольких контролируемых исследований свидетельствуют о ее снижении после паратиреоидэктомии [22, 161, 169]. В ретроспективном когортном исследовании риск перелома после хирургического лечения значимо снижался как среди пациентов с верифицированным остеопорозом, так и среди лиц с нормальными показателями МПК или остеопенией [161].
После успешной паратиреоидэктомии вероятность развития новых конкрементов в почках значимо снижается, однако риск рецидива сохраняется [172-174]. Хирургическое лечение не устраняет предшествующий нефрокальциноз и хроническую почечную недостаточность, но может предотвратить прогрессирование структурных изменений в почках и дальнейшее снижение СКФ [83, 85, 155, 170, 171].
Показатели эффективности хирургического лечения достигают 95-98% с частотой послеоперационных осложнений 1-2% при условии выполнения операции опытными хирургами. Показатели смертности при хирургическом лечении ПГПТ низкие. К наиболее серьезным послеоперационным осложнениям относятся парез возвратного гортанного нерва, транзиторная или стойкая гипокальциемия, кровотечение, отсутствие ремиссии заболевания [178]. Отсутствие эффекта после выполнения хирургического вмешательства как правило наблюдается в случае синдрома множественных эндокринных неоплазий, атипичного расположения образования ОЩЖ, рака ОЩЖ, отсутствия опыта у хирурга.
• Пациентам с ПГПТ и абсолютными показаниями к хирургическому лечению рекмендуется консультация врача-хирурга с целью решения вопроса об операции [74].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
• В случае четкой визуализации солитарного образования ОЩЖ и отсутствия факторов риска множественного или злокачественного поражения ОЩЖ пациентам с ПГПТ рекомендуется выполнение селективной паратиреоидэктомии [185-189].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
Комментарии. Еще не так давно, наиболее распространенными хирургическими вмешательствами при ПГПТ были «ревизионные операции» - односторонняя и двусторонняя ревизии шеи. Выбор таких объемов хирургического лечения был обусловлен низкой эффективностью топической диагностики и отсутствию методов интраоперационного контроля. Цель таких операций не только удалить пораженную околощитовидную железу, но и предотвратить возможные рецидивы ПГПТ, путем визуализации околощитовидных желез с одной или с обеих сторон. Однако любые «ревизионные операции» предполагали большую травматичность и риск интраоперационных осложнений [168 - 171]. Кроме того, ревизионные операции приводили к большей частоте послеоперационного гипопаратиреоза (до 50%). После появления более совершенных методов топической диагностики, позволивших значительно улучшить результаты локализации пораженных околощитовидных желез, основной операцией при ПГПТ и солитарном поражении стала селективная паратиреоидэктомия. При этой операции хирург удаляет только пораженную ОЩЖ опираясь на данные предоперационного обследования [178]. Остальные железы не осматриваются и не травмируются. Селективная паратиреоидэктомия характеризуется высокой эффективностью (95-98%) и низким риском послеоперационных осложнений (1-3%) [185-188].
Возможность удаления только пораженной ОЩЖ, позволило значительно уменьшить величину разреза. Такие операции стали предпочтительными, в зарубежной литературе именуются как «минимально инвазивная паратиреоидэктомия» (МИП) [178]. На сегодняшний день МИП - мировой стандарт хирургического лечения ПГПТ при солитарном поражении. Еще менее травматичной операцией, стала «минимально инвазивная видеоассистированная паратиреоидэктомия» (minimally invasive video-assisted parathyroidectomy - MIVAP), разработанная и впервые выполненная итальянским хирургом P. Miccoli [190]. К основными преимуществам данной методики, помимо меньшей травматичности и лучшего косметического дефекта, является хорошая визуализации операционного поля и возможность проведения полноценной двусторонней ревизии при необходимости [189, 191]. К дополнительным преимуществам МИП можно отнести сокращение времени операции и нахождения пациента в стационаре и экономическую целесообразность [185].
• В случае множественного поражения ОЩЖ, отсутствия визуализации ОЩЖ методами топической диагностики и адекватного снижения интраоперационного иПТГ рекомендована билатеральная ревизия шеи [192, 193].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Селективное удаление аденомы ОЩЖ предъявляет особые требования к качеству предоперационного обследования, поскольку оперативный доступ к патологически измененной ОЩЖ основан на результатах топической диагностики [113, 194-196]. Вторым важным условием проведения селективной паратиреоидэктомии является возможность интраоперационного экспресс-определения уровня иПТГ крови [197-201]. Если через 10-15 минут после удаления аденомы уровень иПТГ не снижается ( см ниже), то проводится конверсия доступа с последующим проведением полноценной двусторонней ревизии [202, 203]. При отсутствии четких топических данных о расположении измененной ОЩЖ, наличии множественного поражения ОЩЖ или отсутствии адекватного снижения итраоперационного иПТГ, а также пациентам с литий-индуцированным гиперпаратиреозом, рекомендована двусторонняя ревизия шеи с удалением пораженных ОЩЖ [203-205].
Техника проведения билатеральной ревизии шеи требует соблюдения обязательных условий, а именно - поиск и обнаружение всех околощитовидных желез, вне зависимости от типичности их расположения [192, 193]. Удаляются только патологически измененные ОЩЖ. Исключением являются операции при синдроме МЭН I, при котором проводится субтотальная или тотальная паратиреоидэктомия с аутотрансплантацией части наименее измененной ОЩЖ.
Рак ОЩЖ - редкая патология ОЩЖ, часто диагностируемая спустя годы после проведения первичного хирургического лечения. Тем не менее, принято считать, что для рака ОЩЖ характерно более тяжелое течение и яркая клиническая картина. Наличие злокачественного образования ОЩЖ можно заподозрить при выраженном повышении иПТГ (более чем в 3 раза), тяжелой гиперкальциемии (уровень альбумин скорректированного кальция в сыворотке >3 ммоль/л); размерах образования более 3 см [206-208]. Подробная информация об особенностях течения ПГПТ и объеме хирургического вмешательства в случае генетических синдромов и рака ОЩЖ представлена в соответствующих разделах.
• Для оценки радикальности проведения хирургического лечения пациентам с ПГПТ рекомендуется интраоперационное определение иПТГ сыворотки крови до и через 15 минут после удаления образования [197-201, 209].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Учитывая относительно короткий период полужизни иПТГ в крови (3-5 мин), после удаления источника(-ов) гиперсекреции ПТГ отмечается значительное снижение уровня циркулирующего гормона. Интраоперационное исследование уровня иПТГ до и через 15 минут после удаления образования позволяет оценить радикальность проведенного вмешательства. Снижение уровня иПТГ позволяет хирургу закончить операцию и не проводить ревизию других областей. И наоборот сохранение исходно высокого уровня иПТГ свидетельствует о сохранении источника(-ов) гиперсекреции ПТГ и требует проведения ревизии с целью их поиска [197-201].
До сих пор существует некоторая неопределенность относительно степени интраоперационного снижения уровня иПТГ для определения радикальности лечения. Наиболее часто используется правило снижения иПТГ на 50% от его исходного значения через 10 мин после удаления опухоли ОЩЖ («Miami criterion») [197-201]. Проведенные исследования показали, что минимальное время, за которое можно оценивать результаты, составляет 5 мин, однако наилучшая чувствительность и специфичность отмечены через 15 мин после паратиреоидэктомии, так как период полужизни ПТГ зависит от функционального статуса почек [210]. Более строгим критерием является снижение уровня иПТГ до нормальных значений [211]. Общая точность метода составляет около 80% [209], как и в случае предоперационной топической диагностики наилучшие результаты отмечаются при солитарном образовании ОЩЖ (87-99%). При множественном поражении точность интраоперационного определения иПТГ снижается до 58% [209, 212].
• В раннем послеоперационном периоде (на следующие сутки после паратиреоидэктомии) пациентам с ПГПТ рекомендуется контроль уровня альбумин-скорректированного кальция с целью своевременной диагностики послеоперационной гипокальциемии [106, 192, 213-220].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
Комментарии. После паратиреоидэктомии частота послеоперационной гипокальциемии может варьировать в широком диапазоне от 5 до 47%. Снижение уровня кальция ниже референсного диапазона может быть обусловлено длительной супрессией нормальных ОЩЖ активной паратиромой, послеоперационным отеком оставшихся ОЩЖ или синдромом «голодных костей». В последующем (от нескольких дней до полугода) чувствительность паратиреоцитов нормальных ОЩЖ к кальцию восстанавливается. Кроме того, гипокальциемия чаще развивается у лиц с сочетанным дефицитом витамина D или синдромом мальабсорбции различной этиологии (целиакия или перенесенная ранее бариатрическая операция). Как правило, снижение уровня кальция ниже референсного диапазона носит транзиторный характер и может корректироваться в амбулаторном порядке [106, 192, 213-216]. Частота хронического гипопаратиреоза после первичного хирургического лечения крайне низкая, по данным различных исследований составляет 0-3,6% [192, 215, 221]. Более низкий уровень кальция крови и более выраженная симптоматика отмечается у пациентов, перенесших билатеральную ревизию шеи по сравнению с лицами после минимально инвазивной паратиреоидэктомии [217, 218].
Синдром «голодных костей», приводящий к выраженной гипокальциемии, как правило, развивается в раннем послеоперационном периоде у пациентов с тяжелыми костными проявлениями ПГПТ. В результате устранения стимулирующего эффекта гиперпродукции ПТГ в отношении остеокластической резорбции кости, происходит активный переход минералов (кальция, фосфора, магния) из крови в формирующуюся костную ткань. К основным факторам риска развития синдрома относят пожилой возраст пациентов, рентгенологически верифицированные поражения костной ткани (25-90% случаев против 0-6% без рентгенологически подтвержденных изменений скелета). По данным большинства исследований синдром «голодных костей» ассоциирован с дооперационным наличием субпериостальных эрозий, литическими поражениями костей, «бурыми» опухолями, множественными переломами. Фиброзно-кистозный остеит может определяться у 47-100% пациентов с данным синдромом. Другими прогностически неблагоприятными факторами считаются вес и размер аденомы ОЩЖ. Результаты работ, посвященных оценке взаимосвязи между риском развития синдрома «голодных костей» и рядом лабораторных показателей (прежде всего с уровнями ПТГ и кальция, щелочной фосфатазы, остеокальцина, С-концевого телопептида коллагена 1 типа, витамина D) остаются противоречивыми. Данных об эффективной профилактике данного состояния представлено недостаточно [222].
Лечение препаратами витамина D и кальция рекомендовано пациентам с наличием симптомов гипокальциемии и/или снижением уровня альбумин скорректированного кальция менее 2,1 ммоль/л (ионизированного кальция менее 1,0 ммоль/л) [223-225] ( см раздел 7,6). Для устранения гипокальциемии, которая может сохраняться в течение нескольких месяцев после успешной паратиреоидэктомии, необходима адекватная коррекция дефицита магния и нормализация обмена костной ткани. Предполагается, что предоперационное лечение бифосфонатами (M05BA) снижает риски послеоперационной гипокальциемии, но на данный момент нет проспективных исследований, посвященных этой проблеме [106, 222].
3,2 Консервативное лечение.
В настоящее время эквивалента хирургическому лечению ПГПТ не существует, поскольку ни один из применяемых препаратов не позволяет достичь равного эффекта по отношению к нормализации лабораторных показателей и улучшению МПК по сравнению с паратиреоидэктомией. Консервативное лечение ПГПТ с использованием медикаментозных препаратов, в первую очередь, направлено на коррекцию гиперкальциемии и профилактику гиперкальциемических кризов, предупреждение низкотравматичных переломов.• Пациентам с бессимптомным течением ПГПТ и отсутствием показаний к хирургическому лечению может быть рекомендована консервативная тактика ведения c регулярным контролем следующих параметров [18, 19, 30, 90, 163, 165, 167, 172, 226, 227]:
• уровень альбумин-скорректированного кальция крови - 2-4 раза в год;
• уровень креатинина крови с расчетом СКФ (СКD-EPI) - 1 раз в 6 месяцев;
• исследование уровня иПТГ - 1 раз в 6 месяцев;
• исследование уровня кальция в моче (суточный анализ) - 1 раз в 6 месяцев;
• УЗИ почек 1 раз в год (при необходимости КТ забрюшинного пространства);
• рентгеноденситометрия поясничного отдела позвоночника, рентгеноденситометрия проксимального отдела бедренной кости, рентгеноденситометрия лучевой кости; рентгенография грудного и поясничного отдела позвоночника в боковой проекции при подозрении на переломы тел позвонков (снижение в росте, появление болей в спине).
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Предложения по динамическому наблюдению пациентов с бессимптомным ПГПТ основываются на результатах исследований, посвященных оценке и сравнению естественного течения заболевания с хирургической тактикой [18, 19, 30, 90, 163, 165, 167, 226]. В настоящее время максимальный период наблюдения пациентов с ПГПТ без хирургического лечения составляет 15 лет [18]. Согласно полученным данным биохимические показатели фосфорно-кальциевого обмена сохранялись стабильными в течение 12 лет с последующей тенденцией к повышению уровня кальция в сыворотке крови. Показатели МПК оставались без значимых изменений в течение первых 8-10 лет наблюдения с последующим ухудшением параметров в дистальном отделе предплечья и проксимальном отделе бедра. Появление одного или более показаний для хирургического лечения за весь период наблюдения зафиксировано у 37% пациентов [18]. Данные по естественной прогрессии нПГПТ остаются ограниченными. В то время как одни исследователи сообщали о высоких показателях прогрессии в виде развития гиперкальциемии, нефролитиаза, гиперкальциурии, переломов и снижения МПК в течение небольшого периода наблюдения (22-41%) [30, 90], другими авторами были получены противоположные результаты, свидетельствующие о низком риске ПГПТ-ассоциированных осложнений в данной когорте больных [17, 228].
Всем пациентам рекомендуется диета с умеренным потреблением кальция и увеличением потребления жидкости до 1,5-2,0 л в сутки [229]. Диетические рекомендации по содержанию кальция в ежедневном рационе у пациентов с ПГПТ остаются предметом споров, так как данные по этому вопросу ограничены. Ожидается, что ограничение потребления кальция приведет к снижению экскреции кальция с мочой и, как следствие, риска развития нефролитиаза. С другой стороны, снижение кальция в рационе может сопровождаться большим повышением уровня ПТГ и более выраженной деминерализацией костной ткани, опосредованно приводя к большей «кальциевой» нагрузке на почки. При сравнении групп пациентов с ежедневным потреблением кальция в дозе 300 мг, 300-800 мг и более 800 мг, значимого влияния на показатели сывороточного кальция, ПТГ, 25(ОН)D, 1,25(ОН)2D или экскрецию кальция с мочой выявлено не было. Однако у пациентов с более высокими уровнями 1,25(ОН)2D отмечались достоверно более высокие значения ПТГ и суточной кальциурии [230]. В открытом однолетнем исследовании в рамках крупного эпидемиологического исследования Tromsо (1994-1995 гг.), была проверена гипотеза о пользе дополнительного назначения препаратов кальция у пациентов с бессимптомным ПГПТ и низко-кальциевой диетой (<450 мг в сутки). Ежедневный прием 500 мг кальция был ассоциирован со снижением уровня ПТГ, развившемся через 4 недели от начала терапии, и значимым увеличением МПК в области шейки бедра через 52 недели [231]. Исследований, подтверждающих преимущества резкого ограничения кальция в рационе пациентов с ПГПТ, в литературе не представлено.
Имеются данные об использовании тиазидов в когорте пациентов с ПГПТ с целью коррекции гиперкальциурии и профилактики нефролитиаза/нефрокальциноза, нарушения почечной функции. Недавние исследования показали, что уменьшение суточной экскреции кальция на фоне минимальных и среднетерапевтических доз гидрохлоротиазида** у пациентов с ПГПТ не приводили к повышению показателей кальциемии [232, 233]. Данные по влиянию тиазидов на уровень ПТГ остаются противоречивыми, что требует проведения крупных рандомизированных клинических исследований. Основные ограничения к применению тиазидов - снижение СКФ менее 30 мл/мин/1,73м2, выраженная гиперкальциемия, подагра, трудно контролируемый сахарный диабет. При назначении тиазидов необходим регулярный контроль сывороточного кальция крови, креатинина, магния и калия.
• Консервативное лечение пациентов с симптомным ПГПТ или наличием показаний к паратиреоидэктомии может быть рекомендовано в следующих случаях [234-238]:
• при отказе пациента от хирургического лечения;
• при наличии противопоказаний к хирургическому лечению (тяжелые сопутствующие заболевания).
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. При отсутствии визуализации ОЩЖ всеми возможными методами топической диагностики использование консервативной терапии позволяет стабилизировать прогрессию заболевания, однако пациент остается кандидатом на оперативное лечение в случае обнаружения патологического образования ОЩЖ в ходе динамического наблюдения.
• При невозможности выполнения хирургического лечения с целью коррекции гиперкальциемии и снижения потери костной массы пациентам с ПГПТ рекомендуется антирезорбтивная терапия (алендроновая кислота**, 10 мг ежедневно или 70 мг 1 раз в неделю, деносумаб 60 мг 1 раз в 6 мес. п/к) и/или терапия цинакальцетом** [239-243].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарии. Антирезорбтивная терапия показана пациентам с ПГПТ при снижении МПК в лучевой кости, проксимальном отделе бедра или поясничном отделе позвоночника ≤-2,5 SD по Т-критерию у женщин в постменопаузе и мужчин старше 50 лет по результатам рентгенденситометрии и/или при наличии низкоэнергетических переломов при невозможности выполнения хирургического лечения [239].
Препаратами выбора для лечения костных проявлений ПГПТ служат препараты с антирезорбтивным действием, позволяющие снизить активность костной резорбции для предотвращения прогрессирования костных потерь.Бифосфонаты (M05BA) снижают активность остеокластов, усиливая их апоптоз, и замедляют резорбцию кости [244]. На основании сходства патогенетических механизмов развития постменопаузального остеопороза и костных нарушений при ПГПТ, было проведено несколько сравнительных исследований эффективности и безопасности пероральных бифосфонатов (M05BA) (алендроновая кислота**) у больных ПГПТ (таблица 3). Мета-анализ 25 наблюдательных исследований и 8 рандомизированных контролируемых исследований, оценивающих эффективность хирургического лечения по сравнению с бифосфонатам (M05BA), продемонстрировал сопоставимый прирост МПК в поясничном отделе позвоночника и проксимальном отделе бедра в обеих группах (при сроке наблюдения 1-2 года) [240]. Данные о долгосрочной эффективности бифосфонатов (M05BA) в отношении риска переломов ограничены отдельными исследованиями [245-247].
Таблица 3. Данные клинических исследований по изучению эффективности применения алендроновой кислоты**.
| Автор | Дизайн исследования | Кол-во пациентов | Терапия | МПК (lumbar spine) | МПК ( total hip) | МПК (Neck) | MПК ( radial) |
| Rossini, 2001 [248] | РКИ, 2 года | 26 | Алендроновая кислота** 10 мг ежедневно | +8,6 ± 3% | +4,8 ± 3,9% | НД | НД |
| Parker 2002 [249] | Открытое контролируемое исследование, 2 года | 32 | Алендроновая кислота** 10 мг ежедневно | +7,3 ± 3,1% | НД | НД | НД |
| сhow, 2003 [250] | Двойное слепое РКИ, 48 недель | 40 | Алендроновая кислота** 10 мг ежедневно | +3,79 ± 4,04% | НД | +4,17 ± 6,01% | Без изменений |
| Khan, 2004 [251] | Двойное слепое РКИ, 1 год | 44 | Алендроновая кислота** 10 мг ежедневно | +6,8%±0,9% | за 1-й год 4,01% ±0,77%, за 2-й год без динамики | +3,67%±1,63% | Без изменений |
| Khan, 2009 [252] | Двойное слепое РКИ, 2 года | 9 | Алендроновая кислота** 10 мг ежедневно | +4,4% | +2,95% | НД | +2,13% |
| сesareo R., 2014 [243] | РКИ, 1 год | 30 | Алендроновая кислота** 70 мг в неделю | +4,7% | 4% | +2,6% | НД |
* РКИ - рандомизированное клиническое исследование; НД - нет данных.
Информация о влиянии деносумаба** на прирост МПК у пациентов с ПГПТ ограничена [253-256]. Однако по результатам рандомизированного плацебо-контроируемого двойного слепого исследования 3-ей фазы DENOCINA использование деносумаба** в дозе 60 мг 1 раз в 6 мес. эффективно в отношении улучшения МПК и снижения скорости метаболизма костной ткани у пациентов с ПГПТ независимо от сочетанной терапии цинакальцетом** [242]. Деносумаб** обладает гипокальциемическим эффектом, в связи с чем успешно применялся для купирования выраженной гиперкальциемии онкогенной этиологии, в том числе при раке ОЩЖ [257, 258]. Кроме того, деносумаб** имеет преимущество по сравнению с бифосфонатами (M05BA) в отношении прироста МПК в кортикальной кости[259].
Цинакальцет** снижает уровень сывороточного кальция и иПТГ за счет повышения чувствительности сaSR к концентрации внеклеточного кальция. Использование цинакальцета** приводит к стойкой нормализации показателей кальциемии у 70-80% пациентов с ПГПТ [260]. Эффект может сохраняться в течение 5 лет, однако уровень сывороточного кальция возвращается к исходным значениям сразу после прекращения терапии. Данный препарат не влияет напрямую на показатели МПК и маркеры костной резорбции [260]. Убедительных данных о воздействии препарата на симптомы гиперкальциемии, нефролитиаз или качество жизни в литературе не представлено. Проводилась ретроспективная оценка эффективности комбинированной терапии алендроновой кислотой** и цинакальцетом** (в течение 12 месяцев), по результатам которой отмечался достоверный прирост МПК в поясничном отделе позвоночника и проксимальном отделе бедра по сравнению с монотерапией цинакальцетом**. При этом, снижение уровня сывороточного кальция наблюдалось в обеих группах [261]. По результатам 3 фазы многоцентрового РКИ, посвященной оценке терапии цинакальцетом** у пациентов с ПГПТ и противопоказаниями к хирургическому лечению, нормализация показателей кальциемии определялась в 76% vs 0% в группе плацебо. Сообщалось о хорошей переносимости препарата, побочные эффекты ограничивались умеренной тошнотой и периодическими мышечными спазмами. В таблице 4 представлены данные основных исследований по применению цинакальцета** при ПГПТ.
Дополнительная информация о консервативном лечении гиперкальциемии представлена в разделе 7,7.
Таблица 4. Данные исследований по эффективности цинакальцета** при ПГПТ.
| Автор | Дизайн | Кол-во пациентов | Доза (мг) | Уровень сывороточного кальция (мг/дл) | Уровень ПТГ (пг/мл) | ||||
| Исходно | Конечная точка | P | Исходно | Конечная точка | P | ||||
| Sajid-Crockett, 2008 [262] | Ретроспективное исследование, 8 мес. (1-19) | 18 | 60 (30-90) | 10,6±0,5 | 9,5±0,3 | <0,001 | 141±78 | 108±64 | 0,007 |
| Iglesias, 2008 [263] | Проспективное исследование, 12 мес. | 4 | 60 | 10,8±0,6 | 9,5±0,2 | НД | 196±83 | 191±95 | НД |
| Arranz Martin, 2011 [264] | Проспективное открытое исследование, 9,4±6,4 мес. | 17 | 30-60 | 11,5±0,6 | 9,9±0,9 | <0,001 | 144 (99,182) | 119 (86,167) | <0,001 |
| Faggiano, 2011 [261] | Ретроспективное исследование, 12 мес. | 13 | 30-90 | 11±0,2 | 9,7±0,1 | НД | 122±14 | 92±12 | НД |
| сetani, 2012 [265] | Проспективное открытое исследование, 12 мес. (3-21) | 6 | 60 (30-120) | 12,2±1,2 | 9,7±1,2 | 0,002 | 249±245 | 188±131 | 0,19 |
| Filopanti, 2012 [266] | Проспективное открытое исследование, 3 мес. | 20 | 30-60 | 11,7±0,5 | 9,5±0,4 | <0,001 | 181±115 | 121±39 | 0,032 |
| Luque-Fernandez, 2013 [267] | Проспективное открытое исследование, 12 мес. | 20 | 60 (30-180) | 11,7±0,8 | 10,2±0,9 | <0,001 | 182±102 | 152±70 | 0,028 |
| Saponaro, 2013 [268] | Ретроспективное исследование, 9 мес. (1-26) | 100 | 15-120 | 11,6±1,1 | 10,2±0,9 | <0,001 | 164 (109,254) | 127 (91,200) | 0,028 |
| Khan, 2013 [241] | Двойное слепое, РКИ; ИГ 5,83 мес. (0,7-7), ПЦ 5,83 мес. (0,7-6,7) | 67 | ИГ: 82,7 (17-212). | ИГ: 11,7±0,5 ПЦ: 11,8±0,5 | НД НД | <0,001 | ИГ: 158 (121-186) ПЦ: 167(136-248) | НД НД | <0,001 |
* РКИ - рандомизированное клиническое исследование; НД - нет данных; ПЦ - плацебо; ИГ - исследуемая группа.
• Пациентам с ПГПТ и уровнем сывороточного кальция <3 ммоль/л (<12 мг/дл) рекомендуется восполнение сопутствующего дефицита (недостаточности) витамина D на дооперационном этапе c помощью приема колекальциферола** с целью устранения вторичного повышения иПТГ, улучшения состояния костной ткани, а также профилактики развития тяжелой послеоперационной гипокальциемии; пациентам с ПГПТ и уровнем кальция >3 ммоль/л (>12 мг/дл) не рекомендуется восполнение сопутствующего дефицита (недостаточности) витамина D до проведения успешной паратиреоидэктомии в виду отсутствия данных о безопасности назначения препарата [269].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
• Пациентам с ПГПТ после паратиреоидэктомии в случае сопутсвующего дефицита /недостаточности витамина D рекомендуется терапия колекальциферолом** c целью устранения вторичного повышения уроня иПТГ и улучшения состояния костной ткани [158, 270].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии: дефицит витамина D при ПГПТ ассоциирован с более высоким повышением уровня иПТГ и как следствие более выраженной гиперкальциемией, тяжелыми костными нарушениями, более низкими показателями МПК, а также более высоким риском развития синдрома «голодных костей» после паратиреоидэктомии [87-89, 271]. Для устранения вторичного повышения иПТГ на фоне дефицита витамина D, рекомендуется поддерживать показатели 25(ОН)D на уровне не менее 20 нг/мл (50 нмоль/л), оптимальным считается уровень >30 нг/мл (75 нмоль/л) [32, 272, 273]. Вопрос о схемах терапии колекальциферолом** у пациентов с ПГПТ остается открытым. По результатам мета-анализа 10 наблюдательных исследований (n=340), использование данного препарата в насыщающих дозировках (до 100000 МЕ в неделю) на этапе предоперационной подготовки сопровождалось снижением уровня иПТГ, достоверным увеличением 25(ОН)D и сохранением исходных показателей сывороточного кальция и суточной кальциурии в большинстве случаев. В 2,2% зарегистрировано нарастание гиперкальциемии, повлекшее за собой отмену препаратов. В данный мета-анализ вошли исследования с бессимптомным течением ПГПТ со средним уровнем гиперкальциемии 2,7-2,8 ммоль/л [269]. Рандомизированное двойное слепое исследование, посвященное оценке эффективности и безопасности назначения колекальциферола** в дозе 2800 МЕ в сутки в течение 6 месяцев до и после операции, продемонстрировало значимое снижение уровня исходного иПТГ c достижением оптимальных значений 25(ОН)D, при этом показатели кальциемии и суточной кальциурии сохранялись без изменений [274].
После успешной паратиреоидэктомии у ряда пациентов сохраняется повышенный уровень иПТГ, что может быть обусловлено имеющимся дефицитом/недостаточностью витамина D [275-278]. Достижение оптимального уровня витамина D после радикальной операции способствует нормализации уровня иПТГ, адекватной реабсорбции кальция и улучшению показателей МПК [158, 270].
• Пациентам с ПГПТ, перенесшим хирургическое лечение, контроль показателей альбумин скорректированного и/или ионизированного кальция, креатинина, исследование уровня иПТГ рекомендуется проводить через 1 месяц после операции, при наличии сопутствующего дефицита 25(ОН)D рекомендуется увеличение активного периода наблюдения с оценкой лабораторных показателей до 2-3 месяцев с целью достижения целевого уровня витамина D [276, 278, 279].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
3,3 Иное лечение.
• Пациентам с ПГПТ, осложненным развитием гиперкальцемического криза, рекомендовано проведение хирургического лечения в срочном порядке, после интенсивной предоперационной подготовки, направленной на коррекцию гиповолемии и снижению гиперкальциемии [280-287].Уровень убедительности рекомендаций С (уровень достоверности доказательств -4).
Комментарии. Тяжелая гиперкальциемия у пациентов с ПГПТ в настоящее время встречается редко. Резкое повышение уровня кальция в сыворотке крови может приводить к развитию гиперкальциемического криза и провоцируется тяжелыми интеркуррентными состояниями: развитием инфекционных заболеваний, переломов, длительной иммобилизацией, приемом антацидных средств [280, 281]. Гиперкальциемический криз, как правило, отмечается при повышении уровня альбумин-скорректированного кальция более 3,5 ммоль/л (ионизированный кальций более 1,8 ммоль/л)* и характеризуется симптомами полиорганной дисфункции, включая поражение ЖКТ (анорексия, тошнота, неукротимая рвота с развитием дегидратации, острая боль в животе, острый панкреатит), почек (олигурия, острая почечная недостаточность, почечная колика), сердечно-сосудистой системы (нарушение проводимости и сердечного ритма, укорочение интервала QT), нервной системы (миалгии, мышечная слабость, спутанность сознания, ступор, кома до 40% случаев) [280-286].
Своевременное лечение пациентов с гиперкальциемическим кризом имеет решающее значение, так как это состояние ассоциировано с высоким уровнем летального исхода [280, 282]. Гиперкальциемический криз при ПГПТ является показанием для проведения операции в срочном порядке. Тяжелое общее состояние пациента, обусловленное выраженной гиперкальциемией и сопутствующими полиорганными нарушениями, часто не позволяют экстренно провести паратиреоидэктомию. Для уменьшения риска общей анестезии используются консервативные методы, направленные на коррекцию гиповолемии, стимулирование почечной экскреции кальция и торможение ускоренной резорбции костной ткани. Также необходимо устранение причин, способствующих прогрессированию гиперкальциемии, и компенсацию интеркуррентных состояний ( см раздел 7,7).
Консервативная тактика в отношении пациентов с тяжелой гиперкальциемией должна рассматриваться в качестве «подготовки» к оперативному лечению и по возможности, проводиться в условиях отделения реанимации и интенсивной терапии [280-286]. Оптимальные сроки для паратиреоидэктомии у пациентов с гиперкальциемическим кризом остаются дискутабельными. Основываясь на результатах топических методов диагностики, селективная паратиреоидэктомия может рассматриваться в качестве оптимальной тактики для большинства пациентов. Тем не менее, тяжелая гиперкальциемия/гиперкальциемический криз в 4,5-12% случаев может быть обусловлен наличием карциномы ОЩЖ, что требует расширенного объема хирургического лечения [283-285] ( см раздел 7,2).
Rehabilitation and outpatient treatment
Специфических реабилитационных мероприятий в отношении пациентов с первичным гиперпаратиреозом не разработано.
Prevention
• Проведение контрольной рентгенденситометрии для оценки прироста МПК рекомендуется пациентам с ПГПТ через год после хирургического лечения и далее 1 раз в год в течение 3-х лет [18, 19, 135, 161, 165, 166, 288, 289].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4.
Комментарии:
Как правило, активное восстановление костного метаболизма, существенный прирост МПК (в среднем 5-10% за год) в зависимости от выраженности костных потерь и возраста пациента происходит в течение первых 2 лет после успешно проведенной паратиреоидэктомии. В этот период не требуется дополнительное лечение, за исключением поддержания адекватного уровня 25(ОН)витамина D, назначения альфакальцидола**/кальцитриола** и препаратов кальция, [18, 19, 135, 161, 165, 166, 288].
• Пациентам с ПГПТ лечение осложнений заболевания (нефролитиаз/нефрокальциноз, язвенная болезнь желудка и двенадцатиперстной кишки, нарушения ритма и других нарушений) после успешно проведенной паратиреоидэктомии при необходимости рекомендуется проводить под наблюдением соответствующих специалистов [10, 74].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4.
Комментарии:
Как правило, активное восстановление костного метаболизма, существенный прирост МПК (в среднем 5-10% за год) в зависимости от выраженности костных потерь и возраста пациента происходит в течение первых 2 лет после успешно проведенной паратиреоидэктомии. В этот период не требуется дополнительное лечение, за исключением поддержания адекватного уровня 25(ОН)витамина D, назначения альфакальцидола**/кальцитриола** и препаратов кальция, [18, 19, 135, 161, 165, 166, 288].
• Пациентам с ПГПТ лечение осложнений заболевания (нефролитиаз/нефрокальциноз, язвенная болезнь желудка и двенадцатиперстной кишки, нарушения ритма и других нарушений) после успешно проведенной паратиреоидэктомии при необходимости рекомендуется проводить под наблюдением соответствующих специалистов [10, 74].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Organization of medical care
Амбулаторный этап оказания медицинской помощи:
1) проведение лабораторного обследования с определением биохимических показателей фосфорно-кальциевого обмена в крови и в моче;
2) консультации смежных специалистов по показаниям: врача-уролога, врача-нефролога, врача-кардиолога, врача-невролога;
3) коррекция препаратов стандартной терапии при консервативной тактике ведения.
Показания для плановой госпитализации в медицинскую организацию:
1) необходимость коррекции препаратов стандартной терапии гипопаратиреоза для достижения целевых показателей фосфорно-кальциевого обмена;
2) невозможность достижения целевых показателей фосфорно-кальциевого обмена при использовании стандартной терапии гипопаратиреоза.
Показания для плановой госпитализации:
1) необходимость проведения комплексного обследования с оценкой основных показателей фосфорно-кальциевого обмена и костно-висцеральных проявлений ПГПТ для решения вопроса о дальнейшей лечебной тактике (консервативно ведение/хирургическое лечение); необходимость инструментального обследования для топической диагностики поражения ОЩЖ при наличии показаний к хирургическому лечению;
2) необходимость проведения комплексного обследования с оценкой основных показателей фосфорно-кальциевого обмена и костно-висцеральных проявлений ПГПТ при консервативной тактике ведения;
3) необходимость проведения планового хирургического лечения в специализированном стационаре;
4) необходимость проведения комплексного лабораторно-инструментального обследования для оценки эффективности хирургического лечения.
Показания для экстренной госпитализации:
1) тяжелая гиперкальциемия с угрозой гиперкальциемического криза.
Показания к выписке пациента из стационара:
1) стойкое улучшение состояния, когда пациент может без ущерба для здоровья продолжить лечение в амбулаторно-поликлиническом учреждении или домашних условиях или стабильное состояние пациента с последующей плановой госпитализацией в хирургическое отделение для оперативного лечения;
2) при необходимости перевода больного в другую организацию здравоохранения;
3) грубое нарушение госпитального режима;
4) по письменному требованию больного либо его законного представителя, если выписка не угрожает жизни больного и не опасна для окружающих. В этом случае выписка может быть произведена только с разрешения главного врача больницы или его заместителя по лечебной работе.
1) проведение лабораторного обследования с определением биохимических показателей фосфорно-кальциевого обмена в крови и в моче;
2) консультации смежных специалистов по показаниям: врача-уролога, врача-нефролога, врача-кардиолога, врача-невролога;
3) коррекция препаратов стандартной терапии при консервативной тактике ведения.
Показания для плановой госпитализации в медицинскую организацию:
1) необходимость коррекции препаратов стандартной терапии гипопаратиреоза для достижения целевых показателей фосфорно-кальциевого обмена;
2) невозможность достижения целевых показателей фосфорно-кальциевого обмена при использовании стандартной терапии гипопаратиреоза.
Показания для плановой госпитализации:
1) необходимость проведения комплексного обследования с оценкой основных показателей фосфорно-кальциевого обмена и костно-висцеральных проявлений ПГПТ для решения вопроса о дальнейшей лечебной тактике (консервативно ведение/хирургическое лечение); необходимость инструментального обследования для топической диагностики поражения ОЩЖ при наличии показаний к хирургическому лечению;
2) необходимость проведения комплексного обследования с оценкой основных показателей фосфорно-кальциевого обмена и костно-висцеральных проявлений ПГПТ при консервативной тактике ведения;
3) необходимость проведения планового хирургического лечения в специализированном стационаре;
4) необходимость проведения комплексного лабораторно-инструментального обследования для оценки эффективности хирургического лечения.
Показания для экстренной госпитализации:
1) тяжелая гиперкальциемия с угрозой гиперкальциемического криза.
Показания к выписке пациента из стационара:
1) стойкое улучшение состояния, когда пациент может без ущерба для здоровья продолжить лечение в амбулаторно-поликлиническом учреждении или домашних условиях или стабильное состояние пациента с последующей плановой госпитализацией в хирургическое отделение для оперативного лечения;
2) при необходимости перевода больного в другую организацию здравоохранения;
3) грубое нарушение госпитального режима;
4) по письменному требованию больного либо его законного представителя, если выписка не угрожает жизни больного и не опасна для окружающих. В этом случае выписка может быть произведена только с разрешения главного врача больницы или его заместителя по лечебной работе.
Additional information
7,1 Наследственные формы первичного гиперпаратиреоза.
До 10% случаев ПГПТ имеют наследственную природу (таб. 5). Наследственные формы ПГПТ характеризуются манифестацией в молодом возрасте и отсутствием гендерных отличий [5]. Молекулярно-генетическая диагностика позволяет своевременно поставить диагноз и начать скрининг компонентов синдрома и их лечение, что особенно важно для бессимптомных заболеваний.Таблица 5. Наследственные синдромы, ассоциированные с развитием ПГПТ.
| МЭН-1 | МЭН-2А1 | МЭН-4 | HPT-JT | FIHP2 | |
| OMIM | 131100 | 171400 | 610755 | 145001 | 145000 |
| Тип наследования | АД | АД | АД | АД | АД |
| Локус на хромосоме | 11q13 | 10q11,2 | 12p13,1 | 1q31,2 | 2p130,3-14 |
| Мутация в гене | MEN1 | RET | сDKN1B | HRPT2/ сDC73 | MEN1, сDC73/HRPT2, сaSR (?) |
| Кодируемый белок | Менин | RET | р27(Kip1) | Парафибромин | - |
| Другие проявления | Опухоли аденогипофиза и эндокринной части поджелудочной железы, другие нейроэндокринные и неэндокринные опухоли | Медуллярный рак щитовидной железы и феохро-моцитома | Опухоли аденогипофиза, нейроэндокринные опухоли ЖКТ и легких, образования поджелудочной железы и надпочечников | Оссифицирующие фибромы нижней челюсти, опухоли почек и матки | - |
Сокращения: АД - аутосомно-доминантный. MEN1 - ген, кодирующий белок менин; RET - протоонкоген, кодирующий рецептор тирозинкиназы, сDKN1B - ген, кодирующий циклин-зависимый ингибитор киназы р27(Kip1), HRPT2/CDC73 - ген, кодирующий белок парафибромин, сaSR - ген, кодирующий кальций-чувствительный рецептор. 1 Синдром МЭН-2А как причина FIHP не встречается. 2 В некоторых семьях с FIHP были обнаружены мутации в генах MEN1, сaSR или сDC73/HRPT2.
• Диагностический поиск синдрома множественных эндокринных неоплазий 1 типа, включая молекулярно-генетическое тестирование, рекомендуется пациентам при наличии одного или нескольких нижеперечисленных признаков [290]:
• манифестация ПГПТ у пациентов моложе 40 лет;
• множественное поражение ОЩЖ в любом возрасте;
• персистенция/рецидив ПГПТ;
• наличие 2-х и более МЭН-ассоциированных образований (опухолей ОЩЖ, нейроэндокринных опухолей (НЭО) поджелудочной железы (ПЖ), аденомы гипофиза);
• родственники первой линии родства носителя мутации в гене MEN1 даже в случае отсутствия симптомов;
• гастринома или НЭО поджелудочной железы в любом возрасте при наличии 2-х и более МЭН-ассоциированных опухолей, не относящихся к классической триаде МЭН-1.
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. МЭН-1 синдром - заболевание с аутосомно-доминантным типом наследования, обусловленное герминальными мутациями в гене MEN1. MEN1 является геном-супрессором опухолевого роста и кодирует белок менин, регулирующий различные функции клеточного и геномного гомеостаза. Корреляций между генотипом и фенотипом заболевания не выявлено [5]. Распространенность синдрома составляет 2-3 случая на 100 000 человек. Для выявления потенциальных носителей мутаций в гене MEN1 необходим тщательный сбор анамнеза жизни как самого пациента, так и его ближайших родственников.
Синдром МЭН-1 характеризуется сочетанным развитием опухолей ОЩЖ (в 95% случаев), аденогипофиза (15-55%) и островкового аппарата поджелудочной железы (30-80%), представляющими собой «классическую триаду» заболевания. Реже диагностируются опухоли надпочечников, НЭО тимуса, легких и желудочно-кишечного тракта, ангиофибромы, коллагеномы, липомы, лейомиомы, менингиомы и другие [291-297]. Большинство новообразований в рамках синдрома являются доброкачественными, клиническая картина заболевания как правило обусловлена гормональной гиперсекрецией или проявлением «масс-эффекта», однако сохраняется высокий риск злокачественной прогрессии этих опухолей. Ожидаемая продолжительность жизни пациентов с МЭН-1 синдромом ниже по сравнению с общей популяцией и составляет около 55 лет [295, 298]. Наиболее часто причиной смерти становятся дуодено-панкреатические нейроэндокринные опухоли, а также карциноиды тимуса и бронхов [295].
ПГПТ, как правило, является первым проявлением синдрома (до 75%) [291, 299, 300], при этом распространенность МЭН-1 среди пациентов ПГПТ составляет 1-18% [299]. Дебют ПГПТ при МЭН-1 обычно приходится на период между 20 и 25 годами [294, 299, 301], при этом пенетрантность заболевания при МЭН-1 с возрастом достигает 90-100% [302]. Поражение ОЩЖ чаще бывает множественным и как правило, не является одномоментным (множественные гиперплазии или аденомы). В 20% случаев возникает поражение дополнительных и эктопированных ОЩЖ, с возможной локализацией в тимусе, щитовидной железе, переднем средостении и, иногда, в перикарде [299, 303, 304]. Клиническая картина представлена как бессимптомной (асимптомная гиперкальциемия), так и симптомной формой ПГПТ (НЛ, фиброзно-кистозный остеит, синдром полидипсии-полиурии, язвенные поражения слизистой оболочки ЖКТ). Для ПГПТ в рамках МЭН-1 синдрома характерна большая частота рецидивов по сравнению со спорадическими формами [291, 299, 305].
Среди аденом гипофиза преобладают пролактиномы (65%) и соматотропиномы (25%), реже встречаются кортикотропиномы и гормонально-неактивные аденомы гипофиза (около 5%)[296]. Средний возраст манифестации - 38 лет, в 25% спорадического и в 10% семейного МЭН-1 аденомы гипофиза могут быть первым проявлением синдрома [292, 304]. Средний возраст на момент постановки диагноза НЭО ЖКТ - примерно 40 лет, при этом к 80 годам примерно у 80% пациентов МЭН-1 развивается дуоденопанкератическая НЭО [306-308]. Гормонально-неактивные НЭО ПЖ относятся к наиболее распространенным энтеропанкреатическим образованиям (50-80% в возрасте до 50 лет), и имеют худший прогноз по сравнению с гормонально-активными образованиями [295]. Реже диагностируются гормонально-активные образования - гастриномы (~20-30%), инсулиномы (~10%), випомы и глюкагономы (<5%) [295, 309].
Вопрос о сроках проведения молекулярно-генетического исследования MEN1 у молодых пациентов с ПГПТ остается открытым. Согласно проводимым исследованиям вероятность найти специфическую генетическую причину ПГПТ выше при наименьшем возрасте дебюта заболевания [291], однако рекомендаций о генетическом скрининге в возрасте до 30, 35 или 40 лет не сформулировано [302, 310-313]. Отдельно можно выделить группу пациентов с ПГПТ моложе 40 лет с сочетанным полигландулярным поражением ОЩЖ, как наиболее подозрительную в отношении синдрома МЭН-1, даже несмотря на отсутствие отягощенного семейного анамнеза [310, 314]. Результаты пилотных исследований российской популяции свидетельствуют о смещении возраста манифестации заболевания на 3 декаду жизни, в связи с чем рекомендуемый возрастной порог для проведения генетического исследования составляет до 40 лет [304, 315].
• Пациентам с симптомным ПГПТ в рамках МЭН-1 синдрома рекомендуется хирургическое лечение в объеме субтотальной или тотальной паратиреоидэктомии с аутотрансплантацией с целью профилактики рецидива заболевания [316-321].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. К целям лечения ПГПТ при МЭН-1 можно отнести - достижение и поддержание стойкой нормокальциемии, снижение риска стойкой гипокальциемиии в послеоперационном периоде. В связи с полигландулярным поражением ОЩЖ при МЭН-1 синдроме, основным методом лечения ПГПТ остается двусторонняя ревизия шеи с субтотальным (≥ 3,5 желез) или тотальным удалением ОЩЖ с аутотрансплантацией участка наименее измененной в плечелучевую мышцу, характеризующиеся наименьшим риском рецидива заболевания [316-320]. Частота развития хронического гипопаратиреоза, в том числе тяжелого течения, значимо выше в группе тотальной резекции четырех ОЩЖ, чем в группе субтотальной паратиреоидэктомии [316-318]. При выборе метода лечения необходимо учитывать такие факторы, как опыт хирурга, возможность долгосрочного мониторирования уровня кальция и предпочтение пациента. Не достигнуто единого консенсуса в отношении сроков проведения хирургического лечения. Ранняя паратиреоидэктомия может значимо снизить частоту и тяжесть долгосрочных осложнений гиперпаратиреоза, но ассоциирована с более ранним рецидивом ПГПТ и развитием хронического гипопаратиреоза [321]. Пациентам с бессимптомной формой заболевания может быть рекомендовано динамическое наблюдение с регулярной оценкой показателей фосфорно-кальциевого обмена и проведение паратиреоидэктомии в случае прогрессирования заболевания [322].
Обсуждается возможность одномоментной трансцервикальной тимэктомии, учитывая риск эктопии ОЩЖ в тимус, риск развития НЭО тимуса [319, 320, 323, 324], однако эффективность этого подхода остается спорной [323, 325].
• Пациентам с верифицированным МЭН-1 рекомендуется регулярное комплексное лабораторно-инструментальное обследование, направленное на своевременную диагностику компонентов синдрома [292-294, 305, 326].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Пациенты с верифицированным МЭН-1 нужаются в регулярном пожизненном наблюдении в связи с риском развития новых компонентов синдрома. Необходимые исследования и кратность и проведения представлены в таблице №6.
Таблица 6. Биохимический и рентгенологический скрининг у пациентов с МЭН-1 синдромом.
| Проявление МЭН-1 | Ежегодное лабораторное обследование | Методы топической диагностики |
| Образования ОЩЖ | Альбумин- скорректированный кальций/ ионизированный кальций, иПТГ | При лабораторном подтверждении впервые выявленного ПГПТ - УЗИ и ОФЭКТ/КТ ОЩЖ При необходимости КТ с контрастом |
| Гастринома | Нет, пока отсутствуют топические данные или клинические симптомы заболевания (гастрин, экспресс PH-метрия) | Нет, при клинических симптомах заболевания: МСКТ/МРТ; для подтверждения диагноза и локализации - Соматостатин-рецепторная сцинтиграфия; ПЭТ-КТ с томоротропным радиофармацевтическим диагностическим средством (68Ga-DOTA-TATE/NOC/TOC ) |
| Инсулинома | Нет, пока отсутствуют топические данные или клинические симптомы заболевания (инсулин, проинсулин, гликемия натощак, 3-х дневная проба с голоданием) | Нет, при клинических симптомах заболевания: МСКТ/МРТ; для подтверждения диагноза и локализации -Соматостатин-рецепторная сцинтиграфия; ПЭТ-КТ с туморотропным радиофармацевтическим диагностическим средством (68Ga-DOTA-TATE/NOC/TOC ) |
| Другие НЭО ПЖ | Нет, пока отсутствуют топические данные или клинические симптомы заболевания (хромогранин А, ПП, глюкагон, ВИП) | МРТ/КТ брюшной полости 1 раз в 2 года (ежегодно) При необходимости - эндоУЗИ, соматостатин-рецепторная сцинтиграфия; ПЭТ-КТ с туморотропным радиофармацевтическим диагностическим средством (68Ga-DOTA-TATE/NOC/TOC ) |
| Аденомы гипофиза | Пролактин, ИФР-1 | МРТ гипофиза 1 раз в 3 года |
| Карциноид легкого и тимуса | Нет, как правило, гормонально-неактивны, но с злокачественным потенциалом | КТ грудной полости 1 раз в 2-3 года При необходимости - ПЭТ КТ с 18F-ФДГ; cоматостатин-рецепторная сцинтиграфия; ПЭТ-КТ с туморотропным радиофармацевтическим диагностическим средством (68Ga-DOTA-TATE/NOC/TOC ) |
| Образования надпочечников | Нет, при впервые выявленной инциденталоме надпочечника или появлении клинических признаков гормональной активности: (активность ренина плазмы, альдостерон, подавляющий тест с 1 мг дексаметазона или кортизол в вечерней слюне или кортизол в суточной моче, метанефрины в суточной моче) | МРТ/КТ забрюшинного пространства 1 раз в 2 года (ежегодно) При необходимости сцинтиграфия с 123I-MIBG; ПЭТ-КТ с туморотропным радиофармацевтическим диагностическим средством (18F-DOPA ); соматостатин-рецепторная сцинтиграфия; |
Примечание: ПП - панкреатический полипептид; ВИП - вазоинтестинальный полипептид; ИФР-1 - инсулиноподобный фактор роста 1; 18F-ФДГ - 18F -фтордезоксиглюкоза.
• Диагностический поиск синдрома множественных эндокринных неоплазий 2А типа (МЭН-2А), включая проведение молекулярно-генетического анализа, рекомендуется пациентам при наличии одного или нескольких нижеперечисленных признаков [290, 303, 327-331]:
• наличие медуллярного рака щитовидной железы в анамнезе или на момент диагностики ПГПТ;
• наличие феохромоцитомы в анамнезе или на момент диагностики ПГПТ;
• данные о наличии медуллярного рака щитовидной железы и/или феохромоцитомы и/или синдрома МЭН-2А у родственников первой линии родства.
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарии. Синдром МЭН-2А проявляется развитием медуллярного рака щитовидной железы (90-100%), феохромоцитомы (50%), ПГПТ (20-30%) и обусловлен герминальными мутациями в прото-онкогене RET с усилением его функции [327-329]. RET представляет собой связанный с тирозинкиназой рецептор, участвующий в регуляции роста, дифференцировки и выживание клетки. Мутация гена RET в эмбриональных клетках приводит к экспрессии патологически измененного сверхактивного RET-протеина в нейроэндокринных тканях, что приводит к неконтролируемой клеточной пролиферации. Мутация RET в положении 634 ассоциирована с развитием ПГПТ [5]. В случае МЭН-2А только в 5% ПГПТ предшествует развитию других компонентов, в подавляющем большинстве заболевание выявляется во время операции по поводу медуллярного рака щитовидной железы, или спустя годы после нее. ПГПТ характеризуется более легким течением, чем при синдроме МЭН-1, и в 42-84% случаев протекает бессимптомно [303, 330, 331]. Средний возраст на момент диагностики составляет 35-39 лет [327]. Описан единичный клинический случай девочки 5 лет из семьи с МЭН-2А, у которой перед проведением профилактической тиреоидэктомии (в отсутствии патологии щитовидной железы) был диагностирован ПГПТ [332]. Чаще, чем при МЭН 1 типа (27-48%) поражается только одна ОЩЖ, и только в 8% случаев выявляются парные аденомы или гиперплазии [333, 334].
• Пациентам с верифицированным МЭН-2А синдромом хирургическое лечение ПГПТ рекомендуется в объеме удаления визуально измененных ОЩЖ [178, 331, 335, 336].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Единого мнения по поводу объема хирургического лечения ПГПТ в рамках МЭН-2А в настоящее время не существует. Актуальную проблему представляет высокий риск тяжелого хронического гипопаратиреоза, обусловленного, прежде всего, проведением расширенной тиреоидэктомии по поводу медуллярного рака щитовидной железы. У пациентов с МЭН-2А, перенесших профилактическую тиреоидэктомию, уровни кальция сыворотке крови должны обязательно определяться на этапе дооперационной диагностики. Кроме того, перед проведением операций как по поводу медуллярного рака щитовидной железы, так и ПГПТ, необходимо исключение диагноза феохромоцитомы [329].
Хирургические варианты лечения ПГПТ включают: резекцию визуально измененных ОЩЖ; субтотальную паратиреоидэктомию; тотальную паратиреоидэктомию с гетеротопической аутотрансплантацией [178, 335, 336]. с развитием и активным внедрением метода МИП большинство экспертов склоняется к резекции только патологически измененных ОЩЖ. По результатам аналитического обзора МИП ассоциирован с относительно невысоким риском персистенции и рецидива ПГПТ, при этом характеризуется низкой частотой послеоперационных осложнений [331]. субтотальная и тотальная паратиреоидэктомия с гетеротопической аутотрансплантацией оправдана в случае множественного поражения ОЩЖ [331].
• Диагностический поиск синдрома гиперпаратиреоза с опухолью челюсти (HPT-JT), включая проведение молекулярно-генетического анализа, рекомендуется пациентам при наличии одного или нескольких нижеперечисленных признаков [337-341]:
• наличие родственника первой линии родства с синдромом HPT-JT;
• карцинома ОЩЖ;
• наличие оссифицирующих фибром нижней/верхней челюсти;
• наличие поликистоза почек, опухолей почек, опухолей матки.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. синдром HPT-JT - редкое аутосомно-доминантное заболевание. Причина - мутация гена сDC73 (HRPT2), кодирующем парафибромин. Он характеризуется развитием ПГПТ, оссифицирующих фибром нижней и/или верхней челюсти в 30-40%, опухолями матки (лейомиомы, гиперплазия эндометрия, аденосаркомы, аденофибромы, множественные аденоматозные полипы) у 57,3% больных женщин, реже поражением почек (гамартомы, поликистоз почек, опухоли Вильмса, аденокарциномы) в 13,3% случаев. Истинная распространенность синдрома HPT-JT до сих пор неизвестна. К 2015 г. было описано менее 300 случаев заболевания из приблизительно 100 семей [337-341].
ПГПТ - основное проявление HPT-JT и выявляется приблизительно в 95% случаев [337, 340]. Частота ПГПТ увеличивается с возрастом, хотя заболевание манифестирует в раннем молодом возрасте, самый ранний описанный возраст при карциноме ОЩЖ - 20 лет [342]. ПГПТ в рамках HPT-JT обычно обусловлен единичной доброкачественной аденомой ОЩЖ, кистозной или с атипичными гистологическими характеристиками. В отличие от других наследственных вариантов ПГПТ, распространенность карцином ОЩЖ в рамках HPT-JT выше и достигает 10-21,6% [337]. Мультигландулярное поражение диагностируется редко при первичной операции (20% случаев), вторая аденома ОЩЖ может возникнуть метахронно спустя годы или десятилетия после возникновения первичной опухоли (23,9% случаев). Заболевание может протекать в бессимптомной форме, карциномы ОЩЖ часто протекают с гиперкальциемическими кризами [337].
Оптимальный хирургический подход при ПГПТ в рамках HPT-JT пока не разработан. Ранее рядом авторов предлагалось проведение двусторонней ревизии шеи и субтотальной ПТЭ или тотальной ПТЭ с или без аутотрансплантации, в связи с риском мультигландулярного поражения и злокачественности. Однако аутотрансплантация может быть потенциально ассоциирована с диссеминацией раковых клеток. В последнее время чаще предлагается селективная ПТЭ при поражении одной ОЩЖ и отсутствии подозрения на злокачественность. Такая стратегия обеспечивает меньший риск развития гипопаратиреоза. В случае подозрения на рак ОЩЖ (большие образования ОЩЖ с инфильтративным ростом, крайне высокие показатели кальция и иПТГ) предпочтительно выполнение резекции единым блоком с удалением опухоли ОЩЖ, ипсилатеральной половины щитовидной железы, окружающей клетчатки, а также любой спаянной с опухолью ткани для предотвращения повреждения опухоли и диссеминации [337, 338].
Другие наследственные синдромы, в рамках которых может возникать ПГПТ, встречаются крайне редко, что не позволяет сформировать клинические рекомендации по их диагностике и лечению. Однако они могут быть заподозрены при наличии нижеперечисленных признаков, характерных для каждого синдрома.
При наличии клинических признаков синдрома МЭН-1, и в отсутствие мутации в гене MEN1, можно заподозрить синдром множественных эндокринных неоплазий 4 типа (МЭН-4) - «МЭН-1-подобное» состояние, фенокопия МЭН-1. Обусловлен мутацией в гене сDKN1B. Наиболее частые компоненты синдрома - ПГПТ и аденомы гипофиза. Другие проявления: НЭО бронхов и желудка, гастринома, папиллярный рак щитовидной железы, объемные образования поджелудочной железы и надпочечников. Встречается крайне редко, в мире описаны единичные случаи. Лечение - удаление единичной аденомы ОЩЖ либо субтотальная паратиреоидэктомия [343].
При наличии в семье нескольких членов с ПГПТ и отсутствием других эндокринных и неэндокринных опухолей, можно заподозрить FIHP. Это редкое аутосомно-доминантное заболевание, характеризующееся одиночным или множественным поражением ОЩЖ в отсутствие специфических проявлений других синдромов (МЭН-1, HPT-JT, FHH). В настоящее время описано более 100 семей с FIHP, но генетическая основа в большинстве случаев остается неизвестной [7, 344, 345]. В 20-23% случаев заболевание обусловлено герминативной мутацией MEN1, в 14-18% - сaSR, реже - сDC73, крайне редко - сDKN1A, сDKN2B, сDKN2C [344]. ПГПТ в рамках FIHP может проявляться гиперкальциемией, остеопорозом и нефролитиазом, или же протекать бессимптомно. Оптимальный хирургический подход при ПГПТ в рамках FIHP не разработан. При поражении одной ОЩЖ может проводиться селективная паратиреоидэктомия, а при множественном поражении рекомендуется субтотальная резекция. При наличии мутаций MEN1 и сDC73 - лечение как при МЭН-1 и HPT-JT [7].
7,2 Рак околощитовидных желез.
Рак (карцинома) ОЩЖ - редкая патология, характеризующаяся тяжелым течением и высокой смертностью вследствие выраженной гиперкальциемии. Часто диагноз карциномы ОЩЖ удается установить спустя годы от начала заболевания при развитии рецидива.В структуре ПГПТ рак ОЩЖ занимает менее 1% [346]. По результатам ретроспективного анализа базы данных США доля рака ОЩЖ среди всех злокачественных новообразований составляет около 0,005% (0,015 на 100 000 населения в целом) [208, 347]. По данным американского регистра SEER (Surveillance, Epidemiology, and End Results), в США с 1988 по 2003 год было зафиксировано увеличение заболеваемости раком ОЩЖ за 16 лет наблюдения на 60% (с 1988 по1991 - 3,58 на 10 млн. населения; с 2000 по 2003 - 5,73 на 10 млн. населения) [346]. Повышенная заболеваемость в некоторых странах, вероятнее всего, связана с ростом интереса к данной проблеме, попытками систематизации подходов диагностики и улучшением качества морфологического исследования [348]. По данным ретроспективного анализа послеоперационного материала 358 пациентов с ПГПТ, выполненного на базе ФГБУ «НМИЦ эндокринологии» Минздрава России, рак ОЩЖ диагностирован в 5% случаев [349].
Возможности предоперационной дифференциальной диагностики злокачественных и доброкачественных новообразований ОЩЖ резко ограничены. Клиническая картина неспецифична и, как правило, обусловлена симптомами гиперкальциемии [348]. Учитывая отсутствие специфических маркеров рака ОЩЖ, врачам на сегодняшний день приходится ориентироваться лишь на сочетание некоторых клинико-лабораторных признаков.
• Пациентов с верифицированным диагнозом ПГПТ рекомендуется отнести в группу риска злокачественного поражения ОЩЖ при наличии следующих признаков:
• сочетание повышения альбумин-скорректированного кальция более 3 ммоль/л и одного из продольных размеров образования ОЩЖ более 3 см [350];
• повышение уровня ионизированного кальция крови более 1,6-1,7 ммоль/л [107, 348, 349];
• симптомы «масс-эффекта» при отсутствии других объемных образований и операций в области шеи в анамнезе [107, 351-353].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Принято считать, что для рака ОЩЖ характерно более тяжелое течение и яркая клиническая картина, тем не менее, в литературе описаны бессимптомные случаи карцином (около 5% от всех случаев рака ОЩЖ), при которых клиническая картина ограничена лишь механическим воздействием на окружающие ткани, «масс - эффектом» [354]. Масс-эффект» может проявляться ощущением инородного тела в области шеи, осиплостью голоса и дисфагией, что обычно не беспокоит пациентов с доброкачественным новообразованием ОЩЖ. Чувство кома в горле встречается примерно у 40% пациентов с карциномой ОЩЖ, что может быть ошибочно расценено как объемное образование щитовидной железы или тимуса.
Основные клинические, лабораторно-инструментальные характеристики рака ОЩЖ резюмированы в таблице №7. Предоперационная топическая диагностика при злокачественных новообразованиях ОЩЖ соответствует общим принципам топической диагностики при ПГПТ [329].
Таблица 7. Сравнительная таблица клинических и биохимических проявлений злокачественного и доброкачественного новообразований ОЩЖ [208, 350, 352, 355].
| Признаки | Аденома ОЩЖ | Карцинома ОЩЖ |
| Соотношение ж/м | 4/1 | 1/1 |
| Уровень общего кальция крови (ммоль/л) | 2,7-2,9 | >3 |
| Ионизированный кальций (ммоль/л) | <1,6 | > 1,7 |
| Уровень иПТГ (пг/мл) | <2(N)* | >3-10(N) |
| Манифестация заболевания | 50-60 лет | 40-50 лет |
| Пальпируемое образование | <2 % | 30-76% |
| Фиброзно-кистозный остеит | 5% | 40-75% |
| Нефролитиаз | 10-15% | 40% |
| Сочетание костной и почечной патологии | редко | 40-50% |
| Асимптомное течение | 60-80% | 5% |
| Объем образования, см | <3 | >3 |
| УЗИ признаки | Изоэхогенность Ровный контур Однородная структура | Гипоэхогенность Неровный контур Неоднородная структура |
2(N)* - 2-х кратное увеличение показателя иПТГ относительно верхней границы референсного диапазона.
• При наличии интраоперационных признаков злокачественного поражения ОЩЖ пациентам с ПГПТ рекомендуется удаление опухоли «единым блоком» со смежными тканями с целью профилактики рецидива заболевания [208, 350, 356, 357].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Методом выбора лечения рака ОЩЖ остается хирургическое удаление опухоли «единым блоком» со смежными тканями. Основная цель - избежать разрыва капсулы карциномы во время операции, что является неблагоприятным прогностическим фактором. Минимальный объем операции при подозрении на рак ОЩЖ должен включать помимо удаления самой ОЩЖ, удаление прилежащей доли щитовидной железы и окружающей клетчатки, а также любой спаянной с опухолью тканью [350, 356, 357]. По последним результатам ретроспективных исследований, профилактическая лимфодиссекция не влияет на выживаемость, при этом сопряжена с рисками развития многих осложнений [358].
Дооперационная диагностика злокачественного новообразования ОЩЖ затруднительна, большое значение имеет опыт хирурга, который поможет заподозрить опухоль во время операции и провести необходимый объем хирургического вмешательства. Для рака ОЩЖ характерна плотная консистенция опухоли, спаянность с окружающими тканями, а также наличие измененных лимфатических узлов [350, 356, 357].
При ретроспективной постановке диагноза и в случае достижения ремиссии заболевания после МИП, вопрос о повторной операции должен решаться в индивидуальном порядке.
• Окончательный диагноз рака ОЩЖ у пациентов с ПГПТ рекомендуется устанавливать по результатам морфологического исследования при соответствии критериям злокачественного роста опухоли: инвазивный рост и/или наличие метастазов [353].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. В комментариях к классификации опухолей эндокринных органов Всемирной организации здравоохранения (ВОЗ) указано, что к карциномам ОЩЖ следует относить опухоли с достоверными признаками инвазивного роста, включая инвазию в прилежащие анатомические структуры (такие как щитовидная железа и мягкие ткани), сосуды капсулы и/или сосуды окружающих тканей, или периневральные пространства и/или наличие документированных метастазов [259, 359].
Атипическая аденома ОЩЖ -редкая патология. Данная группа опухолей характеризуется наличием признаков, ассоциированных со злокачественным потенциалом опухоли (широкие фиброзные тяжи, митозы, сращение с соседними структурами (но не прорастание в них), наличие опухолевых комплексов в окружающей аденому капсуле, солидный или трабекулярный тип строения, ядерная атипия, четкие ядрышки), но отсутствием достоверных признаков инвазивного роста [360]. В комментариях к классификации ВОЗ опухолей эндокринных органов указано, что как группа атипические аденомы могут быть рассмотрены, в качестве опухолей с неопределенным потенциалом злокачественности, при этом большинство пациентов имеют благоприятный прогноз, однако требуются более длительного наблюдения [359] .
В 2017 впервые была предложена и опубликована TNM классификация рака ОЩЖ (8 издание классификации Американского объединенного комитета по изучению рака, American Joint сommittee on сancer). Тем не менее, единой системы стадирования в отношении данных опухолей в настоящее время не разработано [359, 361].
• Пациентам с верифицированным раком ОЩЖ рекомендуется проведение молекулярно-генетического анализа с целью исключения герминальных мутаций в гене сDC73 [6, 348, 362-364].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. В настоящее время ключевая роль в развитии рака ОЩЖ отводится мутации в гене сDC73 (HRPT2) [365]. Выявление потери гетерозиготности в локусе 1q31,2 в опухолях ОЩЖ у пациентов с герминальными мутациями в гене сDC73 указывает на биаллельную инактивацию гена в опухоли и соответствует предположительной функции парафибромина как супрессора опухолевого роста. К настоящему времени известно более 110 мутаций (из них 2/3 - герминальные; 1/3 - соматические) в гене сDC73. Мутации могут передаваться по наследству или возникать de novo. Герминальные мутации сDC73 могут приводить к развитию синдрома HPT-JT ( см главу «Наследственные синдромы») [366]. Исследования по проблеме рака ОЩЖ на российской популяции ограничены. По результатам одной из работ у трех из четырех пациенток с раком ОЩЖ были выявлены нонсенс-мутации [362].
• Пациентам с верифицированным раком ОЩЖ рекомендуется пожизненное динамическое наблюдение с целью своевременной диагностики и лечения рецидива заболевания [353].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Для карциномы ОЩЖ характерен медленный рост опухоли и поздние метастазы в легкие, шейные лимфоузлы, печень и кости. Реже встречаются метастазы в плевру, поджелудочную железу и перикард [107]. Отсутствие ремиссии также, как и рецидив ПГПТ устанавливается при сочетании гиперкальциемии и повышенного уровня иПТГ. Повышение иПТГ при нормокальциемии или гипокальциемии следует дифференцировать с вторичным гиперпаратиреозом.
В случае доказанного метастаза ОЩЖ, рекомендуется его хирургическое удаление, когда это возможно. Резекция отдаленных метастазов увеличивает выживаемость пациентов, в результате достижения нормокальциемии (основная причина смерти пациентов с раком ОЩЖ - гиперкальциемия) [123]. При отсутствии ремиссии или рецидиве ПГПТ после хирургического лечения у пациента с раком ОЩЖ с целью поиска метастатических очагов рекомендовано применение стандартных методов инструментальной диагностики.
Поиск вторичных очагов (метастазов), наиболее часто локализующихся в костях, осложнен наличием фиброзно-кистозного остеита, характерного для большинства случаев рака ОЩЖ, а их дифференциальная диагностика с помощью сканирования скелета на данный момент не представляется возможной. Фиброзно-кистозный остеит с формированием «бурых» опухолей при тяжелом течении ПГПТ нередко является причиной ложноположительного заключения о метастатическом поражении костной ткани [367-369].
• Пациентам с диссеминированной формой рака ОЩЖ не рекомендуется рутинное проведение химиотерапии [370, 371].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с диссеминированной формой рака ОЩЖ проведение лучевой терапии рекомендуется по решению консилиума в условиях специализирвоанного стационара [353, 372, 373].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Рак ОЩЖ не чувствителен к химио - и радиотерапии. У большинства пациентов лучевая терапия не приводит к замедлению роста опухоли или снижению ее гормональной активности [353]. Результаты успешного использования лучевой терапии в качестве адъювантного лечения после хирургической операции неоднозначны и продемонстрированы на маленькой выборке [372].
• При невозможности проведения радикального лечения рака ОЩЖ (в случае его диссеминированной формы) пациентам рекомендуется проведение консервативной терапии [257, 374-378].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 3).
Комментарии. Тяжёлая гиперкальциемия, часто сопровождающая рак ОЩЖ является жизнеугрожающим состоянием, требующим консервативной коррекции в случае отсутствия возможности хирургического удаления гормон-продуцирующих очагов. В этих условиях риск развития гиперкальциемического криза возрастает, с целью его профилактики применяются общие принципы коррекции гиперкальциемии ( см раздел 7,7).
Препаратом первой линии у пациентов с диссеминированной формой рака ОЩЖ является цинакальцет** [377, 378], однако, для более эффективного управления гиперкальциемии часто требуется его комбинация с бифосфонатами (M05BA) или деносумабом** [257, 379]. Доза цинакальцета** при необходимости может достигать 360 мг в сутки. Для коррекции гиперкальциемии при раке ОЩЖ могут потребоваться более высокие дозы препаратов и большая кратность введения препаратов: режим введения деносумаба** - 120 мг п/к 1 раз в 28 дней. Деносумаб** продемонстрировал лучшую эффективность по сравнению с золедроновой кислотой** среди пациентов с костными метастазами [380-382]. По сравнению с внутривенными формами бифосфонатов (M05BA) деносумаб** представляется предпочтительным препаратом у пациентов с ХБП ввиду отсутствия нефротоксичности. Оценка эффективности терапии и решение о коррекции доз должна проводиться в первую очередь на основании оценки кальциемии, а не на значении уровня иПТГ.
Получены первые положительные результаты таргетного лечения ингибиторами протеинкиназы у пациентов с диссеминированными формами рака ОЩЖ [383, 384]. Возможность назначения подобного лечения должна обсуждаться и решаться в учреждениях федерального уровня по результатам заключения консилиума.
7,3 Гиперпаратиреоз и беременность.
Выявляемость ПГПТ среди женщин детородного возраста составляет около 8 на 100000 чел./год, среди беременных - 0,15 до 1,4%. В 67% случаев ПГПТ во время беременности приводит к осложнениям со стороны матери и в 80% к развитию патологии у плода. Летальность плода или новорожденного может достигать 20-30% [385].• Диагноз ПГПТ при беременности рекомендуется устанавливать на основании повышения уровня альбумин-скорректированной и/или ионизированной формы кальция (при двукратном измерении) в сочетании с повышением уровня иПТГ [386-389].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Гиперкальциемия относится к одним из основных биохимических маркеров ПГПТ. При беременности в результате активного транспорта кальция от матери к плоду и повышения его экскреции с мочой, гипоальбуминемии уровень общего кальция может снижаться, что значимо затрудняет своевременную постановку диагноза. Таким образом, первичная диагностика ПГПТ при беременности должна основываться на оценке кальциемии с определением ионизированной и/или альбумин-скорректированной формы кальция, являющихся наиболее информативным показателем. Диагноз ПГПТ должен быть заподозрен при выявлении повышения альбумин-скорректированного или ионизированного кальция, при гипофосфатемии в сочетании с увеличением уровня иПТГ [386, 387]. Кроме того, обследование на предмет гиперпаратиреоза должно проводиться в случае любых метаболических нарушений костной системы, при нетравматических переломах, при рецидивирующей мочекаменной болезни, при стойком панкреатите и рецидивирующих язвах желудка или двенадцатиперстной кишки, при инсипидарном синдроме [386].
• Проведение ультразвукового исследования ОЩЖ у беременных пациенток с ПГПТ рекомендуется в качестве основного метода топической диагностики [390, 391].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Основным методом топической диагностики ПГПТ при беременности является ультразвуковое исследование (УЗИ) шеи. Компьютерная томография, сцинтиграфия околощитовидных желез, магнитно-резонансная томография обычно не используются из-за потенциального риска для плода [390, 391]. Радиационные риски зависят от срока беременности и поглощенной дозы. Они максимальны во время органогенеза и раннем внутриутробном периоде, несколько снижаются во втором и минимальны в третьем триместре. Облучение в утробе матери ассоциировано с повышенным риском аномалий развития плода, умственной отсталости, ограничения роста, потери беременности или развития рака вследствие ионизирующего излучения [392].
В четверти случаев ПГПТ при беременности может протекать бессимптомно и проявляться только в виде лабораторно зафиксированной мягкой гиперкальциемии [387]. Однако, развитие клинических проявлений коррелирует со степенью выраженности гиперкальцемии и характеризуется как костными, так и висцеральными нарушениями. Нефролитиаз - наиболее частое проявление ПГПТ во время беременности (26-36%). К другим нарушениям относятся депрессия, запоры, низкотравматичные переломы, нарушения ритма сердца у матери, панкреатит, гиперкальциемический криз или неукротимая рвота беременных. В ряде случаев отсутствие своевременной диагностики и лечения заболевания приводит к развитию острой почечной и сердечно-сосудистой недостаточности. Поражение центральной нервной системы возникает только при крайне выраженной гиперкальциемии и проявляется психозами, изменением сознания от сумеречного до комы. Артериальная гипертензия и преэклампсия наблюдается у 25% беременных женщин с манифестной формой ПГПТ [387, 393].
Гиперкальциемический криз - наиболее опасное осложнение первичного гиперпаратиреоза во время беременности, который чаще развивается в раннем послеродовом периоде после прекращения оттока материнского кальция через плаценту к плоду. В этих случаях уровень кальция обычно превышает 3,5 ммоль/л, сопровождается тошнотой, рвотой, крайне выраженной слабостью и психическими расстройствами. Гиперкальциемический криз ассоциирован в 25% наблюдений с перинатальной смертностью и в 50% - с неонатальной тетанией. В ряде случаев развивается уремия, приводящая к летальному исходу [394].
Осложнения со стороны плода отмечаются в 80% случаев ПГПТ у беременных, не получивших своевременное патогенетическое лечение [395]. Наиболее частым и серьезным осложнением материнской гиперкальциемии является гипокальциемия новорожденных, развивающаяся вследствие подавления развития ОЩЖ плода и проявляющаяся как тетанией, так и мертворождением [396]. Перинатальные осложнения могут развиваться в 46% наблюдений, неонатальные осложнения - в 45%. Тетания является основной причиной смертности. К другим фетальным осложнениям относятся преждевременные роды (13%), внутриутробная задержка плода, неонатальная тетания (25%), мертворождение и редко стойкий гипопаратиреоз [396].
• При наличии абсолютных показаний к хирургическому лечению пациентам с ПГПТ во время беременности рекомендуется проводить паратиреоидэктомию во втором триместре [390, 397-401].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Хирургическое лечение является единственным эффективным методом при повышении уровня альбумин-скорректированного кальция более 0,25 ммоль/л относительно верхней границы референсного диапазона, установленной в данной лаборатории. Паратиреодиэктомия эффективно устраняет стойкую гиперкальциемию матери и как следствие уменьшает риски развития осложнений у плода. Консервативная терапия ПГПТ во время беременности может приводить к увеличению частоты неонатальных осложнений (53%) по сравнению с хирургическим удалением аденомы ОЩЖ (12,5%) [387].
Хирургическое лечение оптимально проводить во втором триместре беременности, когда завершен органогенез и риск преждевременных родов по сравнению с третьим триместром значимо ниже [390, 397-399]. Тем не менее, при выявлении ПГПТ в третьем триместре беременности вопрос о целесообразности хирургического лечения остается спорным и должен решаться в индивидуальном порядке [402]. В случае, если операция может быть отсрочена (умеренно выраженная гиперкальциемия), хирургическое удаление образования ОЩЖ должно быть выполнено как можно раньше после родоразрешения с целью предупреждения гиперкальцемического криза. В ряде случаев требуется одновременное выполнение кесарева сечения и паратиреоидэктомии, что снижает риски как для плода, так и для матери [403]. Эффективность паратиреоидэктомии в профильном учреждении достигает 95%, при этом риск послеоперационных осложнений составляет всего 1-3% (парез возвратного нерва, гипокальцемия). Интраоперационное иПТГ необходимо для оценки радикальности операции [385].
• Консервативное ведение ПГПТ во время беременности может быть рекомендовано пациентам в случае бессимптомного течения заболевания и повышения уровня кальция не более чем на 0,25 ммоль/л (1 мг/дл) относительно верхней границы референсного диапазона [387, 390].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. В случае бессимптомной формы ПГПТ с умеренным повышением уровня кальция допускается консервативное ведение пациенток с соблюдением достаточного питьевого режима и под регулярным контролем показателей фосфорно-кальциевого обмена. При недостаточности витамина D рекомендуется назначение колекальциферола**, так как это препятствует дальнейшему вторичному повышению уровня иПТГ, и необходимо для профилактики развития неонатальной гипокальциемии в раннем послеродовом периоде и синдрома «голодных» костей у матери. Однако быстрое насыщение препаратами витамина D может привести к гиперкальциемическому кризу, поэтому рекомендуется использование небольших доз (500-1000 МЕ/сутки) и частый контроль показателей фосфорно-кальциевого обмена [387, 390].
• Фармакотерапия ПГПТ при беременности не рекомендуется вследствие потенциального вреда для развития плода [404-408].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Кальцитонин** относится к препаратам категории с. Кальцитонин** не проникает через плацентарный барьер, что считается его преимуществом. Однако, его низкая эффективность и риск развития тахифилаксии ограничивает его применение во время беременности [404].
Бифосфонаты (M05BA) относятся к классу препаратов категории С. В настоящее время отсутствуют контролируемые рандомизированные клинические исследования безопасности применения алендроновой кислоты** при беременности и в период лактации. В исследовании на животных, использование высоких доз данных препаратов (в 8 раз превышающих среднетерапевтические) у беременных крыс характеризовалось тератогенным эффектом: появление костных мальформаций и нарушение эндохондриального развития костей плода. В литературе представлены единичные случаи использования бифосфонатов (M05BA) при беременности, не сопровождавшиеся развитием тератогенных эффектов, тем не менее их назначение не рекомендуется [405].
Цинакальцет** относится к классу препаратов категории С. На сегодняшний день отсутствуют достоверные данные о влиянии препарата на обмен кальция плода. Кальций-чувствительные рецепторы присутствуют в плаценте, следовательно, применение цинакальцета** может нарушить трансплацентарный транспорт кальция и вызвать подавление секреции ПТГ плода и как следствие последующую неонатальную гипокальциемию. С другой стороны, отрицательное влияние цинакальцета на активность ОЩЖ плода, находящихся в супрессивном состоянии на фоне первичного гиперпаратиреоза у матери, не представляется значимым. В литературе описаны единичные случаи успешного применения цинакальцета во время беременности [406-408].
7,4 Препараты, влияющие на показатели фосфорно-кальциевого обмена.
После подтверждения гиперкальциемии необходимо опросить пациента на предмет приема препаратов, потенциально влияющих на уровень кальция в крови, и по возможности их отменить.Таблица 8. Препараты, влияющие на показатели фосфорно-кальциевого обмена.
| Наименование препарата | Механизм действия |
| Гидрохлоротиазид** | Увеличение реабсорбции сa++ в почках |
| Препараты лития | Повышение порога чувствительности ОЩЖ с увеличением уровня кальция и иПТГ крови |
| Бифосфонаты (M05BA) | Развитие гипокальциемии вследствие угнетения процессов костной резорбции |
| деносумаб** | Развитие гипокальциемии вследствие угнетения процессов костной резорбции |
| цинакальцет** | Кальцимиметическое действие со снижением концентрации иПТГ и как следствие уменьшение содержания кальция в сыворотке крови |
| терипаратид** | Рекомбинантный человеческий ПТГ, подобно эндогенному гормону увеличивает кишечную абсорбцию и канальцевую реабсорбцию кальция, потенциально может определяться в рамках гормонального анализа |
| Витамин D и его производные | Риск передозировки при уровне 25(ОН)D более 100 нг/мл Назначение активных альфакальцидола** или кальцитриола** в дозе 0,5 мкг в сутки и более может способствовать развитию гиперкальциемии |
7,5 Дифференциальная диагностика гиперкальциемии.
Целью дифференциальной диагностики ПГПТ с другими состояниями, сопровождаемыми повышением уровня кальция, является определение причины гиперкальциемии, что позволило бы назначить соответствующее лечение, направленное на ликвидацию первичного заболевания. У некоторых больных угрозу для жизни представляет само повышение сывороточной концентрации кальция, которое требует немедленной коррекции. В этой ситуации необходимо как можно раньше определить причину, лежащую в основе гиперкальциемии, а также начать соответствующее лечение.Первым шагом в дифференциальной диагностике является сбор полного и детального анамнеза, во время которого обращают особое внимание на известные симптомы, связанные с гиперкальциемией. Анамнез должен включать в себя детальную информацию о лекарственной терапии, назначенной врачом или осуществляемой самим обследуемым, а также особенности питания, включая потребление витаминов с пищевыми продуктами или пищевыми добавками.
Наиболее частой причиной развития гиперкальциемии является ПГПТ, обуславливающий более 80% случаев повышения уровня кальция крови. Среди госпитализированных пациентов в числе причин гиперкальциемии на первое место выходят злокачественные новообразования легких и почек, гемобластозы (миеломная болезнь, лимфомы, лимфогранулематоз, лейкозы) и составляют 50-60%. Реже повышение уровня кальция отмечается при раке толстого кишечника и предстательной железы. Описаны эктопические новообразования, продуцирующие ПТГ вне ткани ОЩЖ, чаще при раке молочной железы. Саркоидоз ассоциируется с гиперкальциемией в 20%, а с гиперкальциурией - примерно в 40% случаев. Гиперкальциемия может также развиваться вследствие химиотерапии по поводу онкологических заболеваний (20-30%), приводящей к повышению костной резорбции (выраженность эффекта дозозависима). Основные причины гиперкальциемии представлены в табл. 9.
Таблица 9. Заболевания, ассоциированные с развитием гиперкальциемии.
| I. ПТГ-зависимая гиперкальциемия | |
| Заболевание | Комментарии |
| ПГПТ | Эндокринное заболевание, характеризующееся избыточной секрецией ПТГ при верхне-нормальном и повышенном уровне кальция крови вследствие первичной патологии ОЩЖ. |
| Третичный гиперпаратиреоз | Эндокринное заболевание, развивающееся в результате длительно текущего вторичного гиперпаратиреоза, несмотря на устранения причин его развития включая успешную трансплантацию почки, и характеризующееся автономной секрецией ПТГ вследствие персистирующей гиперфункции одной или нескольких ОЩЖ. |
| Семейная гипокальциурическая гиперкальциемия (FHH) | Заболевание характеризуется инактивирующими мутациями сaSR в почках и ОЩЖ. Характерно Наличие гиперкальциемии у родственников, особенно у детей, отсутствие клинических симптомов и признаков гиперкальциемии (анорексии, миопатии, полиурии). В случае FHH в отличие от ПГПТ отмечается гипокальциурия как в суточной, так и в утренней порции мочи, нормальный уровень ПТГ отмечается у 85% пациентов. Пациенты с FHH рассматриваются как лица с наследственным доброкачественным заболеванием, не нуждающиеся в проведении паратиреоидэктомии. |
| Гиперкальциемия, ассоциированная с приемом препаратов лития | Препараты лития повышают порог чувствительности ОЩЖ к кальцию и как следствие могут приводить к повышению уровня кальция и иПТГ крови. |
| II. ПТГ-независимая гиперкальциемия | |
| Паранеопластическая гиперкальциемия | При онкологических заболеваниях повышение концентрации кальция крови в подавляющем большинстве случаев связано с разрушением костной ткани. Остеолиз может быть следствием метастатического разрушения кости, стимуляцией остеокластов в зоне костных метастазов опухоли, синтезом и секрецией опухолевыми клетками (некостной локализации) гуморальных факторов, стимулирующих пролиферацию и активность остеокластов. Как правило, отмечается сочетание этих патогенетических механизмов. К основным гуморальным факторам, стимулирующим пролиферацию и активность остеокластов, относятся лиганд активатора рецептора ядерного фактора- каппа В (RANKL), фактор некроза опухоли-α, фактор некроза опухоли-β, интерлейкины 1β, 6, металлопротеиназы 1, 2 и 9-го типов, лимфотоксин, ПТГ-подобные пептиды. Паранеопластическая гиперкальциемия сопровождается естественной супрессией уровня ПТГ в крови. Исключение составляет редкая эктопическая секреция ПТГ нейроэндокринными опухолями. |
| Избыточное действие витамина D • Передозировка препаратами витамина D • Гранулематозные заболевания (саркоидоз, туберкулез ) | Риск передозировки при уровне 25(ОН)D более 100 нг/мл Назначение альфакальцидола**или кальцитриола **в дозе 0,5 мкг в сутки и более может самостоятельно способствовать развитию гиперкальциемии у некоторых пациентов. Гиперкальциемия, обусловленная экзогенным приемом лекарственных средств, сопровождаются естественной супрессией уровня ПТГ в крови. Повышение выработки кальцитриола в гранулемах, и как следствие развитие гиперкальциемии и супрессия уровня ПТГ |
| Тиреотоксикоз | Прямое действие тиреоидных гормонов на резорбцию костей, что приводит к гиперкальциемии (обычно не более 2,75 ммоль/л, при этом отмечается сниженный уровень кальцитриола, иПТГ и гиперкальциурия). |
| Надпочечниковая недостаточность | Повышение кальция крови частично вследствие гемоконцентрации и повышенного уровня альбумина. Характерны низконормальные уровни иПТГ и кальцитриола. |
| Почечная недостаточность • Острая почечная недостаточность • Хроническая почечная недостаточность с адинамической костной болезнью | В полиурическую фазу нарушаются процессы ионной реабсорбции При хронической почечной недостаточности развиватся вторичный гиперпаратиреоз. При этом гиперпаратиреоз является следствием гипокальциемии, гиперфосфатемии и нарушенного обмена витамина D. В настоящее время стала чаще встречаться адинамическая костная болезнь (АКБ) характеризующаяся низким костным обменом, сниженным иПТГ, «ленивой» костной тканью и вследствие этого гиперкальциемией и относительно сниженными маркерами костного обмена. АКБ может быть как ятрогенной (передозировка лекарственными препаратами), так и следствием индивидуального течения ХБП. АКБ при терминальной ХБП значимо чаще встречается у пациентов с сахарным диабетом |
| Иммобилизация | Иммобилизация резко увеличивает резорбцию костной ткани, что часто приводит к гиперкальциурии и гиперкальциемии. |
| Прием лекарственных препаратов | |
| • Интоксикация витамином А | Возможный механизм - стимуляция костной резорбции ретиноидами. |
| • Молочно-щелочной синдром (синдром Барнетта) | В настоящее время встречается редко, характерная триада - гиперкальциемия, метаболический алкалоз и почечная недостаточность - при употреблении больших доз препаратов кальция одновременно с регуляторами водно-электролитного баланса и кислотно-щелочного равновесия. |
| • Тиазиды | Повышает выведение магния; задерживает в организме ионы кальция |
| • Теофиллин | Препарат снижает поступление ионов кальция через каналы клеточных мембран. Механизм развития гиперкальциемии вероятно связан с бета-адренергической регуляцией. |
| Гипофосфатазия | Редкое наследственное рахитоподобное заболевание, обусловленное снижением активности тканенеспецифической щелочной фосфатазы, кодируемой геном ALPL. Гиперкальциемия является причиной плохой прибавки в массе тела, рвоты, склонности к запорам, жажды, полиурии, раннего закрытия большого родничка и швов черепа, что приводит к краниостенозу, повышению внутричерепного давления. Гиперкальциурия способствует развитию нефрокальциноза. Летальность при данной форме составляет до 50% к первому году жизни. |
| Метафизарная хондродисплазия Янсена | Редкое заболевание, обусловленное нарушением энхондрального костеобразования. У пораженных лиц наблюдается карликовость и гиперкальциемия, при этом уровень иПТГ подавлен. |
| Врожденная недостаточность лактазы | Гиперкальциемия обусловлена увеличением всасывания кальция в подвздошной кишке в присутствии негидролизованной лактозы, что приводит к кальцинозу мозгового вещества почек у новорожденных. Гиперкальциемия быстро купируется после введения безлактозной диеты, но нефрокальциноз может сохранится. |
7,6 Терапия острой и хронической гипокальциемии».
Клинические проявления гипокальциемии:• парастезии;
• положительные симптомы Хвостека и Труссо;
• тетания;
• ларингоспазм;
• изменения на ЭКГ (аритмия, удлинение интервала QT).
Как правило, симптомы гипокальциемии развиваются при снижении уровня общего кальция менее 1,9 ммоль/л. Однако эти симптомы могут развиваться и при других значениях, это зависит от скорости снижения уровня кальция.
Лечение острой гипокальциемии.
Внутривенное введение препаратов кальция необходимо при снижении уровня альбумин-скорректированного кальция менее 1,9 ммоль/л и/или при наличии симптомов гипокальциемии у пациента [17]. Предпочтительна установка центрального венозного катетера с целью предотвращения склерозирования периферических вен вследствие инфузии кальция. Предпочтительна инфузия кальция глюконата** (1 ампула (10 мл) - 1000 мг кальция глюконата**, содержит 90 мг элементарного кальция), поскольку кальция хлорид обладает большим раздражающим действием на окружающие ткани. Внутривенное введение кальция требует осторожности у пациентов с гипокалиемией и у пациентов, принимающих дигоксин, поскольку быстрое в/в введение кальция при данных состояниях может спровоцировать нарушения сердечного ритма.
Варианты парентерального введения кальция:
1. Введение 10% раствора кальция глюконата** болюсно без разведения. Метод используется при выраженных симптомах гипокальцемии (пациенты с клинической картиной «страха смерти» или в бессознательном состоянии). Доза кальция определяется по появлению диспептических жалоб.
2. Введение 40 - 50 мл 10% раствора кальция глюконата** болюсно без разведения, далее 50 - 60 мл 10% раствора глюконата кальция вводится в/в медленно в разведенном состоянии (0,9% раствора Натрия хлорид** или 5% декстрозы**) со скоростью для инфузомата 0,5 - 1,5 мкг/кг/час. Это наиболее частый способ купирования острой гипокальцемии, позволяющий быстро нормализовать состояние пациента.
3. Введение 80 - 100 мл 10% раствора кальция глюконата** разведенного в растворе (0,9% Натрия хлорид** или 5% декстрозы**). Метод используется преимущественно для поддержания адекватного уровня кальция с целью профилактики развития острой гипокальциемии.
Парентеральное введение кальция всегда прекращается при появлении диспептических жалоб (тошнота, рвота).
Параллельно могут использоваться энтеральные препараты альфакальцидол**/кальцитриол** и солей кальция.
1) Альфакальцидол** в среднем 3-3,5 мкг/сут или кальцитриол** 2 мкг/сут перорально. При сохранении гипокальциемии могут быть применены более высокие дозы под контролем кальция крови и мочи.
2) Кальция карбонат 3 г по элементарному кальцию (в среднем) на 3-6 приемов в сутки во время или сразу после приема пищи [17].
Лечение хронической гипокальциемии.
1) Кальция карбонат 500-1000 мг по элементарному кальцию 3 раза/день, коррекция дозы до достижения уровня кальция общего и ионизированного на нижней границе нормы и купирования симптомов гипокальциемии. Возможно увеличение дозы до 1-2 г по элементарному кальцию 3 раза/день.
2) Витамин D и его производные - альфакальцидол**/кальцитриол** (под контролем уровня кальция и креатинина):
Альфакальцидол** 0,5-3 мкг/сут, возможно повышение дозы при необходимости. Начало действия - 1-2 дня, прекращение действия через 5-7 дней; предпочтительно применение препарата несколько раз в сутки.
Кальцитриол** 0,25-2 мкг/сут, возможно повышение дозы при необходимости. Начало действия - в течение 1-2 дней, прекращение действия через 2-3 дня; предпочтительно применение препарата несколько раз в сутки.
Колекальциферол** - необходим контроль уровня 25(ОН)D крови, поскольку дефицит витамина D может стимулировать синтез ПТГ. Оптимальным уровнем для подавления вторичного повышения уровня ПТГ является 25(ОН)D более 30 нг/мл (75 нмоль/л). Начало действия - через 10-14 дней, прекращение действия через 14-75 дней.
7,7 Консервативное лечение тяжелой гиперкальциемии.
Дегидратация - одно из основных патофизиологических звеньев гиперкальциемии, поэтому терапию начинают с восполнения объема циркулирующей крови. В отсутствие тяжелой патологии сердечно-сосудистой системы и почечной недостаточности введение натрия хлорида** начинают со скоростью 300 - 500 мл в час до полного возмещения дефицита жидкости и восстановления диуреза не менее 200 - 300 мл/ Регидратационная терапия и восстановление почечной перфузии приводит к нормализации экскреции кальция с мочой и снижению кальциемии в среднем на 0,6 ммоль/л. Отсутствие адекватного диуреза в течение нескольких часов после начала инфузионной терапии является показанием к проведению срочного гемодиализа.После коррекции гиповолемии с целью повышения почечной экскреции кальция к терапии могут быть подключены петлевые диуретики. Поскольку повышение натрийуреза увеличивает концентрацию кальция в моче, проводится форсированный диурез фуросемидом** на фоне продолжающейся инфузионной терапии. Форсированный диурез ассоциирован с развитием гипокалиемии и гипомагниемии, в связи с чем необходим частый контроль электролитных показателей и восполнение электролитов в случае их дефицита. В условиях гипергидратации может развиться отек легких, поэтому целесообразно проводить мониторинг центрального венозного давления. Необходим осторожный подход в выборе доз фуросемида** во избежание повторного обезвоживания. Регидратационная терапия в сочетании с форсированным диурезом показана практически во всех случаях тяжелой гиперкальциемии, однако необходимо помнить об усилении камнеобразования в почках на фоне повышенной экскреции кальция. Преимуществами инфузионной терапии являются быстрое начало действия, исчисляемое часами, и патофизиологическая обоснованность, поскольку регидратация показана во всех случаях [254, 259].
Одним из основных патофизиологических механизмов развития гиперкальциемического криза является чрезмерная мобилизация кальция из костной ткани. Использование внутривенных бифосфонатов (M05BA) и деносумаба** может быть эффективным для снижения уровня кальция в сыворотке крови, однако данный эффект развивается отсрочено. Кроме того, данные лекарственные средства не одобрены для купирования гиперкальциемии неонкогенной этиологии [254, 259]. Имеется опыт применения кальцитонина** и глюкокортикостероидов. Однако действие кальцитонина** является относительно коротким и наибольший гипокальциемический эффект отмечается при сочетании с бифосфонатами (M05BA) [254, 259].
Данные об использовании цинакальцета** для купирования гиперкальциемического криза недостаточны. Для значимого снижения содержания кальция сыворотки крови могут потребоваться высокие дозы препарата (до 90 мг два раза в день) [261-263]. Основные терапевтические мероприятия по коррекции тяжелой гиперкальциемии резюмированы в таблице № 10.
Таблица 10. Консервативное лечение тяжелой гиперкальциемии.
| Препарат | Функция | Предостережения |
| Отмена кальций-повышающих лекарственных средств | ||
| Натрия хлорид** 300 - 500 мл/ч (2-6 л/сут, ежедневно 1-3 дня) до полного возмещения дефицита жидкости и восстановления диуреза | Увеличивает фильтрацию и выделение кальция Понижает кальциемию на 0,25 - 0,75 ммоль/л | Избегать гипергидратации у пациентов с сердечно-сосудистой патологией |
| фуросемид** 20 - 40 мг внутривенно по необходимости (диурез не менее 200 - 300 мл/ч)[409] | Целесообразно назначение у пациентов с риском кардиогенного отека легких. В этом случае, при достижении эуволемии, активная регидратация (например, 3 литра 0,9% физиологического раствора в течение 24 часов) должна быть сбалансировано внутривенным введением фуросемида для поддержания водного баланса. Также ингибирует реабсорбцию кальция в дистальных канальцах | Гипокалиемия,обезвоживание, если внутрисосудистый объем жидкости не восстановлен |
| деносумаб** 60 мг п/к[410] | Моноклональное человеческое антитело к лиганду рецептора активатора ядерного фактора каппа В (RANKL), антирезорбтивный эффект, возможность применения при ХБП | Гипокальциемия, воспаление подкожно-жировой клетчатки в месте введения (редко) |
| Бифосфонаты (M05BA): | Подавляют функцию и активность остеокластов и резорбцию кости | Нефротоксичны, противопоказаны при СКФ менее 35 мл/мин/1,73м2, снижают уровень кальция, уровень фосфора. Максимальные эффекты - в течение 72 часов |
| Ибандроновая кислота 3 мг в/в болюсно в течение 15-30 с. [411] | ||
| Цинакальцет** 30 - 360 мг/сут внутрь ежедневно. Начальная доза 30 мг/сут с последующим титрованием каждые 2-4 недели до достижения оптимального уровня кальция (нормокальциемия или снижение альбумин-скорректированного кальция до уровня, не превышающего 0,25 ммоль/л (1 мг/дл) относительно верхней границы референсного диапазона). | Агонист кальций-чувствительного рецептора, возможность применения при ХБП | Гипокальциемия, тошнота, рвота |
Criteria for assessing the quality of medical care
| № | Критерии качества | Оценка выполнения |
| 1. | Выполнено исследование уровня общего кальция в крови, исследование уровня альбумина в крови (с расчетом альбумин скорректированного кальция), исследование уровня ионизированного кальция, исследование уровня паратиреоидного гормона (иПТГ) в крови | Да/Нет |
| 2. | Выполнено исследование уровня креатинина в крови | Да/Нет |
| 3. | Выполнено исследование уровня кальция в моче, исследование уровня креатинина в моче (суточный анализ) при удовлетворительной фильтрационной функции почек (СКФ>60 мл/мин/1,73м2) с расчетом почечного клиренса кальция к клиренсу креатинина | Да/Нет |
| 4. | Выполнено исследование уровня общего кальция в крови, исследование уровня альбумина в крови (с расчетом альбумин скорректированного кальция) - 2-4 раза в год, исследование уровня креатинина в крови 1 раз в 6 мес., уровня кальция в суточной моче 1 раз в 6 мес., уровня паратиреоидного гормона (иПТГ) в крови1 раз в 6 мес., ультразвуковое исследование почек 1 раз в год (при необходимости КТ забрюшинного пространства); выполнена рентгенография грудного и поясничного отдела позвоночника в боковой проекции при подозрении на переломы тел позвонков (снижение в росте, появление болей в спине) -1 раз в год, выполнена рентгеноденситометрия поясничного отдела позвоночника, рентгеноденситометрия проксимального отдела бедренной кости, рентгеноденситометрия лучевой кости 1 раз в год для пациентов с бессимптомным течением ПГПТ и отсутствием показаний к хирургическому лечению | Да/Нет |
| 5. | Выполнено исследование уровня 25(ОН) витамина D в крови | Да/Нет |
| 6. | Выполнено ультразвуковое исследование почек (или компьютерная томография почек) | Да/Нет |
| 7. | Выполнена рентгенография грудного и поясничного отдела позвоночника в боковой проекции при потере роста на 4 см с молодости или потере роста на 2 см за последний год | Да/Нет |
| 8. | Выполнена рентгеноденситометрия поясничного отдела позвоночника, рентгеноденситометрия проксимального отдела бедренной кости, рентгеноденситометрия лучевой кости или есть обоснование причины отказа от исследования | Да/Нет |
| 9. | Выполнено ультразвуковое исследование паращитовидных желез при наличии показаний к хирургическому лечению | Да/Нет |
| 10. | Выполнена сцинтиграфия паращитовидных желез при наличии показаний к хирургическому лечению или есть обоснование причины отказа от исследования | Да/Нет |
| 11. | Выполнен прием (осмотр, консультация) врача-хирурга первичный при наличии показаний к хирургическому лечению) | Да/Нет |
| 12. | Проведена терапия антирезорбтивными средствами или цинакальцетом при невозможности выполнения хирургического лечения с целью коррекции гиперкальциемии и снижения потери костной массы | Да/Нет |
References
1. Мокрышева, Н., et al., Анализ основных эпидемиологических характеристик первичного гиперпаратиреоза в России (по данным регистра). Проблемы эндокринологии, 2012. 58(5).
2. вilezikian, J.P., et al., Primary hyperparathyroidism. Nature reviews Disease primers, 2016. 2: p. 16033.
3. Walker, M.D. and J.P. вilezikian, Vitamin D and primary hyperparathyroidism: more insights into a complex relationship. 2017, Springer.
4. сromer, M.K., et al., Identification of somatic mutations in parathyroid tumors using whole-exome sequencing. The Journal of сlinical Endocrinology & Metabolism, 2012. 97(9): p. E1774-E1781.
5. Thakker, R., Genetics of parathyroid tumours. Journal of internal medicine, 2016. 280(6): p. 574-583.
6. вricaire, L., et al., Frequent large germline HRPT2 deletions in a French National cohort of patients with primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2013. 98(2): p. E403-E408.
7. Warner, J., et al., Genetic testing in familial isolated hyperparathyroidism: unexpected results and their implications. Journal of Medical Genetics, 2004. 41(3): p. 155-160.
8. Yu, W., et al., Whole-exome sequencing studies of parathyroid carcinomas reveal novel PRUNE2 mutations, distinctive mutational spectra related to APOBEC-catalyzed DNA mutagenesis and mutational enrichment in kinases associated with cell migration and invasion. The Journal of сlinical Endocrinology & Metabolism, 2015. 100(2): p. E360-E364.
9. Wermers, R.A., et al., The rise and fall of primary hyperparathyroidism: a population-based study in Rochester, Minnesota, 1965-1992. Annals of Internal Medicine, 1997. 126(6): p. 433-440.
10. Khan, A.A., et al., Primary hyperparathyroidism: review and recommendations on evaluation, diagnosis, and management. A сanadian and international consensus. Osteoporos Int, 2017. 28(1): p. 1-19.
11. сlarke, в.L., Asymptomatic Primary Hyperparathyroidism, in Parathyroid Disorders. 2019, Karger Publishers. p. 13-22.
12. сhristensson, T., et al., Prevalence of hypercalcaemia in a health screening in Stockholm. Acta Medica Scandinavica, 1976. 200(1‐6): p. 131-137.
13. Palmer, M., et al., Prevalence of hypercalcaemia in a health survey: a 14‐year follow‐up study of serum calcium values. European journal of clinical investigation, 1988. 18(1): p. 39-46.
14. Yu, N., et al., Epidemiology of primary hyperparathyroidism in Tayside, Scotland, UK. сlinical endocrinology, 2009. 71(4): p. 485-493.
15. Siilin, H., et al., Prevalence of primary hyperparathyroidism and impact on bone mineral density in elderly men: MrOs Sweden. World journal of surgery, 2011. 35(6): p. 1266-1272.
16. Yeh, M.W., et al., Incidence and prevalence of primary hyperparathyroidism in a racially mixed population. The Journal of сlinical Endocrinology & Metabolism, 2013. 98(3): p. 1122-1129.
17. сusano, N.E., et al., Normocalcemic hyperparathyroidism and hypoparathyroidism in two community-based nonreferral populations. The Journal of сlinical Endocrinology & Metabolism, 2013. 98(7): p. 2734-2741.
18. Rubin, M.R., et al., The natural history of primary hyperparathyroidism with or without parathyroid surgery after 15 years. The Journal of сlinical Endocrinology & Metabolism, 2008. 93(9): p. 3462-3470.
19. Silverberg, S.J., et al., A 10-year prospective study of primary hyperparathyroidism with or without parathyroid surgery. New England Journal of Medicine, 1999. 341(17): p. 1249-1255.
20. Vestergaard, P., et al., сardiovascular events before and after surgery for primary hyperparathyroidism. World J Surg, 2003. 27(2): p. 216-22.
21. Вороненко, И., et al., Состояние сердечно-сосудистой системы при клинически выраженном и малосимптомном первичном гиперпаратиреозе. Проблемы эндокринологии, 2009. 3: p. 17-22.
22. Vestergaard, P. and L. Mosekilde, сohort study on effects of parathyroid surgery on multiple outcomes in primary hyperparathyroidism. вMJ, 2003. 327(7414): p. 530-4.
23. Thomas, A. and A. Kautzky-Willer, Diabetes in hyperparathyroidism, in Diabetes Secondary to Endocrine and Pancreatic Disorders. 2014, Karger Publishers. p. 92-100.
24. Procopio, M., et al., сardiovascular risk and metabolic syndrome in primary hyperparathyroidism and their correlation to different clinical forms. Endocrine, 2014. 47(2): p. 581-9.
25. Mendoza-Zubieta, V., et al., High prevalence of metabolic syndrome in a mestizo group of adult patients with primary hyperparathyroidism (PHPT). вMC endocrine disorders, 2015. 15(1): p. 16.
26. сhristensen, S.E., et al., Discriminative power of three indices of renal calcium excretion for the distinction between familial hypocalciuric hypercalcaemia and primary hyperparathyroidism: a follow‐up study on methods. сlinical endocrinology, 2008. 69(5): p. 713-720.
27. Nordenström, E., P. Katzman, and A. вergenfelz, вiochemical diagnosis of primary hyperparathyroidism: analysis of the sensitivity of total and ionized calcium in combination with PTH. сlinical biochemistry, 2011. 44(10-11): p. 849-852.
28. Amin, A.L., et al., Normal PTH levels in primary hyperparathyroidism: still the same disease. Annals of surgical oncology, 2011. 18(12): p. 3437-3442.
29. Monchik, J.M. and E. Gorgun, Normocalcemic hyperparathyroidism in patients with osteoporosis. Surgery, 2004. 136(6): p. 1242-1246.
30. Lowe, H., et al., Normocalcemic primary hyperparathyroidism: further characterization of a new clinical phenotype. The Journal of сlinical Endocrinology & Metabolism, 2007. 92(8): p. 3001-3005.
31. Silverberg, S.J. and J.P. вilezikian, Incipient primary hyperparathyroidism: a forme fruste of an old disease. The Journal of сlinical Endocrinology & Metabolism, 2003. 88(11): p. 5348-5352.
32. Maeda, S.S., et al., Factors affecting vitamin D status in different populations in the city of São Paulo, вrazil: the São PAulo vitamin D Evaluation Study (SPADES). вMC endocrine disorders, 2013. 13(1): p. 14.
33. Ross, A.C., et al., The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. The Journal of сlinical Endocrinology & Metabolism, 2011. 96(1): p. 53-58.
34. Martinez, I., et al., The importance of dietary calcium and phosphorous in the secondary hyperparathyroidism of patients with early renal failure. American journal of kidney diseases, 1997. 29(4): p. 496-502.
35. Walker, M.D., et al., Effect of renal function on skeletal health in primary hyperparathyroidism. J сlin Endocrinol Metab, 2012. 97(5): p. 1501-7.
36. сoe, F.L., et al., Evidence for secondary hyperparathyroidism in idiopathic hypercalciuria. The Journal of clinical investigation, 1973. 52(1): p. 134-142.
37. вalsa, J., et al., Role of calcium malabsorption in the development of secondary hyperparathyroidism after biliopancreatic diversion. Journal of endocrinological investigation, 2008. 31(10): p. 845-850.
38. Selby, P.L., et al., вone loss in celiac disease is related to secondary hyperparathyroidism. Journal of вone and Mineral Research, 1999. 14(4): p. 652-657.
39. Rejnmark, L., et al., Effects of thiazide‐and loop‐diuretics, alone or in combination, on calcitropic hormones and biochemical bone markers: a randomized controlled study. Journal of internal medicine, 2001. 250(2): p. 144-153.
40. MALLETTE, L.E., et al., Lithium treatment increases intact and midregion parathyroid hormone and parathyroid volume. The Journal of сlinical Endocrinology & Metabolism, 1989. 68(3): p. 654-660.
41. Makras, P., et al., Parathyroid hormone changes following denosumab treatment in postmenopausal osteoporosis. сlinical endocrinology, 2013. 79(4): p. 499-503.
42. Fraser, W.D., et al., Direct and indirect assessment of the parathyroid hormone response to pamidronate therapy in Paget s disease of bone and hypercalcaemia of malignancy. вone and mineral, 1991. 12(2): p. 113-121.
43. Udén, P., et al., Primary hyperparathyroidism in younger and older patients: symptoms and outcome of surgery. World journal of surgery, 1992. 16(4): p. 791-797.
44. Reid, L., et al., Presentation, diagnostic assessment and surgical outcomes in primary hyperparathyroidism: a single centre’s experience. Endocrine connections, 2018. 1(aop).
45. Di Monaco, M., et al., Primary hyperparathyroidism in elderly patients with hip fracture. Journal of bone and mineral metabolism, 2004. 22(5): p. 491-495.
46. вergström, I., в.-M. Landgren, and в. Freyschuss, Primary hyperparathyroidism is common in postmenopausal women with forearm fracture and low bone mineral density. Acta obstetricia et gynecologica Scandinavica, 2007. 86(1): p. 61-64.
47. вandeira, F., et al., From mild to severe primary hyperparathyroidism: the вrazilian experience. Arquivos вrasileiros de Endocrinologia & Metabologia, 2006. 50(4): p. 657-663.
48. Khosla, S., et al., Primary hyperparathyroidism and the risk of fracture: a population‐based study. Journal of вone and Mineral Research, 1999. 14(10): p. 1700-1707.
49. Yadav, S.K., et al., Primary hyperparathyroidism in developing world: a systematic review on the changing clinical profile of the disease. Archives of Endocrinology and Metabolism, 2020. 64(2): p. 105-110.
50. Wikström, в., et al., Ambulatory diagnostic evaluation of 389 recurrent renal stone formers. Klinische Wochenschrift, 1983. 61(2): p. 85-90.
51. Fuss, M., et al., Infrequency of primary hyperparathyroidism in renal stone formers. вritish journal of urology, 1988. 62(1): p. 4-6.
52. Walker, V., E.M. Stansbridge, and D.G. Griffin, Demography and biochemistry of 2800 patients from a renal stones clinic. Annals of clinical biochemistry, 2013. 50(2): p. 127-139.
53. Sharma, S., et al., PREVALENCE AND PREDICTORS OF PRIMARY HYPERPARATHYROIDISM AMONG PATIENTS WITH UROLITHIASIS. Endocrine Practice, 2017. 23(11): p. 1311-1315.
54. Kim, J.-k., et al., The prevalence of primary hyperparathyroidism in Korea: a population-based analysis from patient medical records. Annals of surgical treatment and research, 2018. 94(5): p. 235-239.
55. Sorensen, M.D., et al., Urinary parameters as predictors of primary hyperparathyroidism in patients with nephrolithiasis. The Journal of urology, 2012. 187(2): p. 516-521.
56. Ebert, E.C., The parathyroids and the gut. Journal of clinical gastroenterology, 2010. 44(7): p. 479-482.
57. Gasparoni, P., et al., Primary hyperparathyroidism and peptic ulcer. Minerva medica, 1989. 80(12): p. 1327-1330.
58. Jacob, J.J., et al., Does hyperparathyroidism cause pancreatitis. A South Indian experience and a review of published work. ANZ journal of surgery, 2006. 76(8): p. 740-744.
59. Inzucchi, S.E., Understanding hypercalcemia: its metabolic basis, signs, and symptoms. Postgraduate medicine, 2004. 115(4): p. 69-76.
60. Walsh, J., N. Gittoes, and P. Selby, SOCIETY FOR ENDOCRINOLOGY ENDOCRINE EMERGENCY GUIDANCE: Emergency management of acute hypercalcaemia in adult patients. Endocrine connections, 2016. 5(5): p. G9-G11.
61. Suh, J.M., J.J. сronan, and J.M. Monchik, Primary hyperparathyroidism: is there an increased prevalence of renal stone disease. American Journal of Roentgenology, 2008. 191(3): p. 908-911.
62. сipriani, с., et al., Prevalence of kidney stones and vertebral fractures in primary hyperparathyroidism using imaging technology. The Journal of сlinical Endocrinology & Metabolism, 2015. 100(4): p. 1309-1315.
63. Miller, P.D. and J.P. вilezikian, вone densitometry in asymptomatic primary hyperparathyroidism. Journal of bone and mineral research: the official journal of the American Society for вone and Mineral Research, 2002. 17: p. N98.
64. Abboud, в., R. Daher, and J. вoujaoude, Digestive manifestations of parathyroid disorders. World Journal of Gastroenterology: WJG, 2011. 17(36): p. 4063.
65. FRAME, в. and W.S. HAUBRICH, Peptic ulcer and hyperparathyroidism: a survey of 300 ulcer patients. AMA Archives of Internal Medicine, 1960. 105(4): p. 536-541.
66. сorleto, V., et al., Prevalence and causes of hypergastrinemia in primary hyperparathyroidism: a prospective study. The Journal of сlinical Endocrinology & Metabolism, 1999. 84(12): p. 4554-4558.
67. Norton, J.A., et al., Prospective study of surgery for primary Hyperparathyroidism (HPT) in multiple endocrine neoplasia-type 1 (MEN1), and Zollinger-Ellison syndrome (ZES): long-term outcome of a more virulent form of HPT. Annals of surgery, 2008. 247(3): p. 501.
68. Turken, S.A., et al., Neuromuscular involvement in mild, asymptomatic primary hyperparathyroidism. The American journal of medicine, 1989. 87(5): p. 553-557.
69. сoker, L.H., et al., Primary hyperparathyroidism, cognition, and health-related quality of life. Annals of surgery, 2005. 242(5): p. 642.
70. Morris, G.S., et al., Parathyroidectomy improves functional capacity in asymptomatic older patients with primary hyperparathyroidism: a randomized control trial. Annals of surgery, 2010. 251(5): p. 832-837.
71. Walker, M.D., et al., Neuropsychological features in primary hyperparathyroidism: a prospective study. J сlin Endocrinol Metab, 2009. 94(6): p. 1951-8.
72. Murray, S.E., et al., Improvement of sleep disturbance and insomnia following parathyroidectomy for primary hyperparathyroidism. World journal of surgery, 2014. 38(3): p. 542-548.
73. вlanchard, с., et al., Surgery for ‘asymptomatic’mild primary hyperparathyroidism improves some clinical symptoms postoperatively. European Journal of Endocrinology, 2013. 169(5): p. 665-672.
74. вilezikian, J.P., et al., Guidelines for the management of asymptomatic primary hyperparathyroidism: summary statement from the Fourth International Workshop, in J сlin Endocrinol Metab. 2014. p. 3561-9.
75. Ong, G.S., et al., The importance of measuring ionized calcium in characterizing calcium status and diagnosing primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2012. 97(9): p. 3138-3145.
76. Thode, J., et al., сomparison of serum total calcium, albumin-corrected total calcium, and ionized calcium in 1213 patients with suspected calcium disorders. Scandinavian journal of clinical and laboratory investigation, 1989. 49(3): p. 217-223.
77. Gao, P. and P. D Amour, Evolution of the parathyroid hormone (PTH) assay--importance of circulating PTH immunoheterogeneity and of its regulation. сlinical laboratory, 2005. 51(1-2): p. 21-29.
78. вoudou, P., et al., Third-or second-generation parathyroid hormone assays: a remaining debate in the diagnosis of primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2005. 90(12): p. 6370-6372.
79. Hedbäck, G. and A. Oden, сardiovascular disease, hypertension and renal function in primary hyperparathyroidism. Journal of internal medicine, 2002. 251(6): p. 476-483.
80. вenson, L., et al., Optimal discrimination of mild hyperparathyroidism with total serum calcium, ionized calcium and parathyroid hormone measurements. Upsala Journal of Medical Sciences, 1987. 92(2): p. 147-176.
81. Forster, J., J. Monchik, and H.F. Martin, A comparative study of serum ultrafiltrable, ionized, and total calcium in the diagnosis of primary hyperparathyroidism in patients with intermittent or no elevation in total calcium. Surgery, 1988. 104(6): p. 1137-1142.
82. Rubin, M.R., et al., An N-terminal molecular form of parathyroid hormone (PTH) distinct from hPTH (1-84) is overproduced in parathyroid carcinoma. сlinical chemistry, 2007. 53(8): p. 1470-1476.
83. Yamashita, H., et al., Influence of renal function on clinico-pathological features of primary hyperparathyroidism. European journal of endocrinology, 2003. 148(6): p. 597-602.
84. Wang, W.-H., et al., Association between parathyroid hormone, 25 (OH) vitamin D, and chronic kidney disease: a population-based study. вioMed Research International, 2017. 2017.
85. Tassone, F., et al., Glomerular filtration rate and parathyroid hormone secretion in primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2009. 94(11): p. 4458-4461.
86. Muthukrishnan, J., et al., Distal renal tubular acidosis due to primary hyperparathyroidism. Endocrine Practice, 2008. 14(9): p. 1133-1136.
87. вilezikian, J.P., et al., Primary hyperparathyroidism in women: a tale of two cities--New York and вeijing. International journal of fertility and women s medicine, 2000. 45(2): p. 158-165.
88. вandeira, F., et al., Relationship between serum vitamin D status and clinical manifestations of primary hyperparathyroidism. Endocrine Practice, 2002. 8(4): p. 266-270.
89. Moosgaard, в., et al., Vitamin D status, seasonal variations, parathyroid adenoma weight and bone mineral density in primary hyperparathyroidism. сlinical endocrinology, 2005. 63(5): p. 506-513.
90. вilezikian, J.P. and S.J. Silverberg, Normocalcemic primary hyperparathyroidism. Arquivos вrasileiros de Endocrinologia & Metabologia, 2010. 54(2): p. 106-109.
91. Eisner, в.H., J. Ahn, and M.L. Stoller, Differentiating primary from secondary hyperparathyroidism in stone patients: the thiazide challenge . Journal of endourology, 2009. 23(2): p. 191-192.
92. Пампутис, С. and Е. Лопатникова, ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА НОРМОКАЛЬЦИЕМИЧЕСКОГО ПЕРВИЧНОГО ГИПЕРПАРАТИРЕОЗА С ИСПОЛЬЗОВАНИЕМ ДИАГНОСТИЧЕСКОГО ТЕСТА ПРОБА С АЛЬФАКАЛЬЦИДОЛОМ . Таврический медико-биологический вестник, 2017. 20(3-2).
93. Valcour, A., et al., Effects of age and serum 25-OH-vitamin D on serum parathyroid hormone levels. The Journal of сlinical Endocrinology & Metabolism, 2012. 97(11): p. 3989-3995.
94. вjörkman, M., A. Sorva, and R. Tilvis, Responses of parathyroid hormone to vitamin D supplementation: a systematic review of clinical trials. Archives of gerontology and geriatrics, 2009. 48(2): p. 160-166.
95. Saliba, W., et al., The relationship between serum 25 (OH) D and parathyroid hormone levels. The American journal of medicine, 2011. 124(12): p. 1165-1170.
96. Holick, M.F., Vitamin D deficiency. New England Journal of Medicine, 2007. 357(3): p. 266-281.
97. Parfitt, A., The interactions of thiazide diuretics with parathyroid hormone and vitamin D: Studies in patients with hypoparathyroidism. The Journal of clinical investigation, 1972. 51(7): p. 1879-1888.
98. Пигарова, Е.А., et al., Клинические рекомендации Российской ассоциации эндокринологов по диагностике, лечению и профилактике дефицита витамина D у взрослых. Проблемы эндокринологии, 2016. 62(4).
99. Дедов, И.И., et al., Первичный гиперпаратиреоз: клиника, диагностика, дифференциальная диагностика, методы лечения. Проблемы эндокринологии, 2016. 62(6).
100. сheung, K., et al., A meta-analysis of preoperative localization techniques for patients with primary hyperparathyroidism. Annals of surgical oncology, 2012. 19(2): p. 577-583.
101. Moghadam, R.N., et al., сomparative diagnostic performance of ultrasonography and 99mTc-sestamibi scintigraphy for parathyroid adenoma in primary hyperparathyroidism; systematic review and meta-analysis. Asian Pacific journal of cancer prevention: APJCP, 2017. 18(12): p. 3195.
102. Ruda, J.M., с.S. Hollenbeak, and в.C. Stack Jr, A systematic review of the diagnosis and treatment of primary hyperparathyroidism from 1995 to 2003. Otolaryngology-Head and Neck Surgery, 2005. 132(3): p. 359-372.
103. Артемова, А., Сравнительная оценка методов топической диагностики при первичном гиперпаратиреозе. Тезисы докладов Международного научного форума «Патология паращитовидных желез: современные подходы к диагностике и лечению». Санкт-Петербург, 2010: p. 29-30.
104. Untch, в.R., et al., Surgeon-performed ultrasound is superior to 99Tc-sestamibi scanning to localize parathyroid adenomas in patients with primary hyperparathyroidism: results in 516 patients over 10 years. Journal of the American сollege of Surgeons, 2011. 212(4): p. 522-529.
105. сarlier, T., et al., 99m Tc-MIBI pinhole SPECT in primary hyperparathyroidism: comparison with conventional SPECT, planar scintigraphy and ultrasonography. European journal of nuclear medicine and molecular imaging, 2008. 35(3): p. 637-643.
106. Witteveen, J., et al., Therapy of endocrine disease: hungry bone syndrome: still a challenge in the post-operative management of primary hyperparathyroidism: a systematic review of the literature. European Journal of Endocrinology, 2013. 168(3): p. R45-R53.
107. Nam, M., H.-S. Jeong, and J.H. Shin, Differentiation of parathyroid carcinoma and adenoma by preoperative ultrasonography. Acta Radiologica, 2017. 58(6): p. 670-675.
108. Agha, A., et al., The role of contrast-enhancend ultrasonography (CEUS) in comparison with 99mTechnetium-sestamibi scintigraphy for localization diagnostic of primary hyperparathyroidism. сlinical hemorheology and microcirculation, 2014. 58(4): p. 515-520.
109. Leslie, W.D., et al., Parathyroid 99m Tc-sestamibi scintigraphy: dual-tracer subtraction is superior to double-phase washout. European journal of nuclear medicine and molecular imaging, 2002. 29(12): p. 1566-1570.
110. Wong, K.K., et al., Parathyroid adenoma localization with 99mTc-sestamibi SPECT/CT: a meta-analysis. Nuclear medicine communications, 2015. 36(4): p. 363-375.
111. Паша, С., КЛИНИЧЕСКАЯ ЗНАЧИМОСТЬ РАДИОНУКЛИДНЫХ МЕТОДОВ ВИЗУАЛИЗАЦИИ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ ПРИ ГИПЕРПАРАТИРЕОЗЕ. Российский электронный журнал лучевой диагностики, 2015. 5(3): p. 11-21.
112. Lavely, W.C., et al., сomparison of SPECT/CT, SPECT, and planar imaging with single-and dual-phase 99mTc-sestamibi parathyroid scintigraphy. Journal of Nuclear Medicine, 2007. 48(7): p. 1084-1089.
113. Lumachi, F., et al., Advantages of combined technetium-99m-sestamibi scintigraphy and high-resolution ultrasonography in parathyroid localization: comparative study in 91 patients with primary hyperparathyroidism. European journal of endocrinology, 2000. 143(6): p. 755-760.
114. Haciyanli, M., et al., Accuracy of preoperative localization studies and intraoperative parathyroid hormone assay in patients with primary hyperparathyroidism and double adenoma. Journal of the American сollege of Surgeons, 2003. 197(5): p. 739-746.
115. сasara, D., et al., сlinical role of 99m TcO 4/MIBI scan, ultrasound and intra-operative gamma probe in the performance of unilateral and minimally invasive surgery in primary hyperparathyroidism. European journal of nuclear medicine, 2001. 28(9): p. 1351-1359.
116. Kluijfhout, W.P., et al., Diagnostic performance of computed tomography for parathyroid adenoma localization; a systematic review and meta-analysis. European journal of radiology, 2017. 88: p. 117-128.
117. Kluijfhout, W.P., et al., Use of PET tracers for parathyroid localization: a systematic review and meta-analysis. Langenbeck s archives of surgery, 2016. 401(7): p. 925-935.
118. Wakamatsu, H., et al., Parathyroid scintigraphy with 99mTc-MIBI and 123I subtraction: a comparison with magnetic resonance imaging and ultrasonography. Nuclear medicine communications, 2003. 24(7): p. 755-762.
119. Ruf, J., et al., Preoperative localization of parathyroid glands. Nuklearmedizin, 2004. 43(03): p. 85-90.
120. Noureldine, S.I., et al., Multiphase computed tomography for localization of parathyroid disease in patients with primary hyperparathyroidism: How many phases do we really need. Surgery, 2014. 156(6): p. 1300-1307.
121. Takagi, H., et al., Subtotal versus total parathyroidectomy with forearm autograft for secondary hyperparathyroidism in chronic renal failure. Annals of surgery, 1984. 200(1): p. 18.
122. Lubitz, с.C., et al., Accuracy of 4-dimensional computed tomography in poorly localized patients with primary hyperparathyroidism. Surgery, 2010. 148(6): p. 1129-1138.
123. Starker, L.F., et al., 4D parathyroid сT as the initial localization study for patients with de novo primary hyperparathyroidism. Annals of surgical oncology, 2011. 18(6): p. 1723-1728.
124. Harari, A., et al., сomputed tomography can guide focused exploration in select patients with primary hyperparathyroidism and negative sestamibi scanning. Surgery, 2008. 144(6): p. 970-977.
125. вeggs, A.D. and S.F. Hain, Localization of parathyroid adenomas using 11C-methionine positron emission tomography. Nuclear medicine communications, 2005. 26(2): p. 133-136.
126. Erbil, Y., et al., Value of parathyroid hormone assay for preoperative sonographically guided parathyroid aspirates for minimally invasive parathyroidectomy. Journal of сlinical Ultrasound, 2006. 34(9): p. 425-429.
127. вarczynski, M., et al., Technetium‐99m‐sestamibi subtraction scintigraphy vs. ultrasonography combined with a rapid parathyroid hormone assay in parathyroid aspirates in preoperative localization of parathyroid adenomas and in directing surgical approach. сlinical endocrinology, 2006. 65(1): p. 106-113.
128. Giusti, M., et al., Institutional experience of PTH evaluation on fine-needle washing after aspiration biopsy to locate hyperfunctioning parathyroid tissue. Journal of Zhejiang University SCIENCE в, 2009. 10(5): p. 323-330.
129. Ким, И., Н. Кузнецов, and С. Кузнецов, Исследование паратгормона из смыва при пункционной биопсии околощитовидных желез как метод топической диагностики при первичном гиперпаратиреозе. Эндокринная хирургия, 2014(2).
130. Marshall, D., O. Johnell, and H. Wedel, Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. вmj, 1996. 312(7041): p. 1254-1259.
131. Marcocci, с., L. сianferotti, and F. сetani, вone disease in primary hyperparathyrodism. Therapeutic advances in musculoskeletal disease, 2012. 4(5): p. 357-368.
132. Wood, K., et al., What is the utility of distal forearm DXA in primary hyperparathyroidism. The oncologist, 2012. 17(3): p. 322.
133. вandeira, F., et al., вone disease in primary hyperparathyroidism. Arquivos вrasileiros de Endocrinologia & Metabologia, 2014. 58(5): p. 553-561.
134. вriot, K., et al., Accuracy of patient-reported height loss and risk factors for height loss among postmenopausal women. сmaj, 2010. 182(6): p. 558-562.
135. Abdelhadi, M. and J.r. Nordenström, вone mineral recovery after parathyroidectomy in patients with primary and renal hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 1998. 83(11): p. 3845-3851.
136. PARISIEN, M., et al., The histomorphometry of bone in primary hyperparathyroidism: preservation of cancellous bone structure. The Journal of сlinical Endocrinology & Metabolism, 1990. 70(4): p. 930-938.
137. Hansen, S., et al., Effects on bone geometry, density, and microarchitecture in the distal radius but not the tibia in women with primary hyperparathyroidism: A case‐control study using HR‐pQCT. Journal of вone and Mineral Research, 2010. 25(9): p. 1941-1947.
138. Stein, E.M., et al., Primary hyperparathyroidism is associated with abnormal cortical and trabecular microstructure and reduced bone stiffness in postmenopausal women. Journal of вone and Mineral Research, 2013. 28(5): p. 1029-1040.
139. Romagnoli, E., et al., Trabecular вone Score (TBS): an indirect measure of bone micro-architecture in postmenopausal patients with primary hyperparathyroidism. вone, 2013. 53(1): p. 154-159.
140. Silva, в.C., et al., Trabecular bone score (TBS)-a novel method to evaluate bone microarchitectural texture in patients with primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2013. 98(5): p. 1963-1970.
141. Khosla, S., et al., Primary hyperparathyroidism and the risk of fracture: a population‐based study. Journal of вone and Mineral Research, 1999. 14(10): p. 1700-1707.
142. Vignali, E., et al., Morphometric vertebral fractures in postmenopausal women with primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2009. 94(7): p. 2306-2312.
143. Kulak, с.p.m, et al., Marked improvement in bone mass after parathyroidectomy in osteitis fibrosa cystica. The Journal of сlinical Endocrinology & Metabolism, 1998. 83(3): p. 732-735.
144. Hansen, S., et al., Parathyroidectomy improves bone geometry and microarchitecture in female patients with primary hyperparathyroidism: A one‐year prospective controlled study using high‐resolution peripheral quantitative computed tomography. Journal of вone and Mineral Research, 2012. 27(5): p. 1150-1158.
145. Eller-Vainicher, с., et al., вone quality, as measured by trabecular bone score, in patients with primary hyperparathyroidism. European journal of endocrinology, 2013. 169(2): p. 155-162.
146. Starup-Linde, J., et al., Renal stones and calcifications in patients with primary hyperparathyroidism: associations with biochemical variables. European Journal of Endocrinology, 2012. 166(6): p. 1093-1100.
147. Odvina, с.V., et al., вiochemical characterization of primary hyperparathyroidism with and without kidney stones. Urological research, 2007. 35(3): p. 123-128.
148. сorbetta, S., et al., Risk factors associated to kidney stones in primary hyperparathyroidism. Journal of endocrinological investigation, 2005. 28(4): p. 122-128.
149. Rejnmark, L., P. Vestergaard, and L. Mosekilde, Nephrolithiasis and renal calcifications in primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2011. 96(8): p. 2377-2385.
150. вouzidi, H., D. de вrauwere, and M. Daudon, Does urinary stone composition and morphology help for prediction of primary hyperparathyroidism. Nephrology Dialysis Transplantation, 2010. 26(2): p. 565-572.
151. Mallette, L., et al., Primary hyperparathyroidism: clinical and biochemical features. Medicine, 1974. 53(2): p. 127-146.
152. вai, H.X., et al., The association of primary hyperparathyroidism with pancreatitis. Journal of clinical gastroenterology, 2012. 46(8): p. 656.
153. Kouvaraki, M.A., et al., Indications for operative intervention in patients with asymptomatic primary hyperparathyroidism: practice patterns of endocrine surgery. Surgery, 2006. 139(4): p. 527-534.
154. Vestergaard, P. and L. Mosekilde, Fractures in patients with primary hyperparathyroidism: nationwide follow-up study of 1201 patients. World J Surg, 2003. 27(3): p. 343-9.
155. Tassone, F., et al., Parathyroidectomy halts the deterioration of renal function in primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2015. 100(8): p. 3069-3073.
156. Rose, D.M., et al., Long-term management and outcome of parathyroidectomy for sporadic primary multiple-gland disease. Archives of Surgery, 2001. 136(6): p. 621-626.
157. Sivula, A. and R. Pelkonen, Long-term health risk of primary hyperparathyroidism: the effect of surgery. Annals of medicine, 1996. 28(2): p. 95-100.
158. Norenstedt, S., et al., Primary hyperparathyroidism and metabolic risk factors; impact of parathyroidectomy and vitamin D supplementation; results of a randomized double-blind study. European journal of endocrinology, 2013: p. EJE-13-0547.
159. Shah, V., et al., Influence of age and gender on presentation of symptomatic primary hyperparathyroidism. Journal of postgraduate medicine, 2012. 58(2): p. 107.
160. Silverberg, S.J., I. вrown, and J.P. вilezikian, Age as a criterion for surgery in primary hyperparathyroidism. The American journal of medicine, 2002. 113(8): p. 681-681.
161. VanderWalde, L.H., I.-L.A. Liu, and P.I. Haigh, Effect of bone mineral density and parathyroidectomy on fracture risk in primary hyperparathyroidism. World journal of surgery, 2009. 33(3): p. 406-411.
162. Fang, W.L., et al., The management of high‐risk patients with primary hyperparathyroidism-minimally invasive parathyroidectomy vs. medical treatment. сlinical endocrinology, 2008. 68(4): p. 520-528.
163. Rao, D.S., et al., Randomized controlled clinical trial of surgery versus no surgery in patients with mild asymptomatic primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2004. 89(11): p. 5415-5422.
164. Vestergaard, P., et al., сohort study of risk of fracture before and after surgery for primary hyperparathyroidism. вmj, 2000. 321(7261): p. 598-602.
165. вollerslev, J., et al., Medical observation, compared with parathyroidectomy, for asymptomatic primary hyperparathyroidism: a prospective, randomized trial. The Journal of сlinical Endocrinology & Metabolism, 2007. 92(5): p. 1687-1692.
166. Roschger, P., et al., New observations on bone quality in mild primary hyperparathyroidism as determined by quantitative backscattered electron imaging. Journal of вone and Mineral Research, 2007. 22(5): p. 717-723.
167. Ambrogini, E., et al., Surgery or surveillance for mild asymptomatic primary hyperparathyroidism: a prospective, randomized clinical trial. The Journal of сlinical Endocrinology & Metabolism, 2007. 92(8): p. 3114-3121.
168. Lundstam, K., et al., Effect of Surgery Versus Observation: Skeletal 5‐Year Outcomes in a Randomized Trial of Patients With Primary HPT (the SIPH Study). Journal of вone and Mineral Research, 2017. 32(9): p. 1907-1914.
169. Vestergaard, P. and L. Mosekilde, Parathyroid surgery is associated with a decreased risk of hip and upper arm fractures in primary hyperparathyroidism: a controlled cohort study. Journal of internal medicine, 2004. 255(1): p. 108-114.
170. Peacock, M., Primary hyperparathyroidism and the kidney: biochemical and clinical spectrum. Journal of bone and mineral research: the official journal of the American Society for вone and Mineral Research, 2002. 17: p. N87-94.
171. Salahudeen, A., et al., Hypertension and renal dysfunction in primary hyperparathyroidism: effect of parathyroidectomy. сlinical Science, 1989. 76(3): p. 289-296.
172. Mollerup, с.L., et al., Risk of renal stone events in primary hyperparathyroidism before and after parathyroid surgery: controlled retrospective follow up study. вmj, 2002. 325(7368): p. 807.
173. Deaconson, T.F., S.D. Wilson, and L. Jacob, The effect of parathyroidectomy on the recurrence of nephrolithiasis. Surgery, 1987. 102(6): p. 910-913.
174. Hedbäck, G., K. Abrahamsson, and A. Oden, The improvement of renal concentration capacity after surgery for primary hyperparathyroidism. European journal of clinical investigation, 2001. 31(12): p. 1048-1053.
175. Sejean, K., et al., Surgery versus medical follow-up in patients with asymptomatic primary hyperparathyroidism: a decision analysis. European journal of endocrinology, 2005. 153(6): p. 915-927.
176. Zanocco, K., P. Angelos, and с. Sturgeon, сost-effectiveness analysis of parathyroidectomy for asymptomatic primary hyperparathyroidism. Surgery, 2006. 140(6): p. 874-882.
177. Zanocco, K. and с. Sturgeon, How should age at diagnosis impact treatment strategy in asymptomatic primary hyperparathyroidism. A cost-effectiveness analysis. Surgery, 2008. 144(2): p. 290-298.
178. Udelsman, R., et al., The surgical management of asymptomatic primary hyperparathyroidism: proceedings of the Fourth International Workshop. The Journal of сlinical Endocrinology & Metabolism, 2014. 99(10): p. 3595-3606.
179. Mittendorf, E., et al., Improvement of sleep disturbance and neurocognitive function after parathyroidectomy in patients with primary hyperparathyroidism. Endocrine Practice, 2007. 13(4): p. 338-344.
180. Pashtan, I., et al., Primary hyperparathyroidism in adolescents: the same but different. Pediatric surgery international, 2013. 29(3): p. 275-279.
181. Paunovic, I., et al., Primary Hyperparathyroidism in сhildren and Young Adults:-A Single Institution Experience. Acta chirurgica вelgica, 2013. 113(1): p. 35-39.
182. Mack, L.A. and J.L. Pasieka, Asymptomatic primary hyperparathyroidism: a surgical perspective. The Surgical clinics of North America, 2004. 84(3): p. 803-816.
183. Almqvist, E.G., et al., Early parathyroidectomy increases bone mineral density in patients with mild primary hyperparathyroidism: a prospective and randomized study. Surgery, 2004. 136(6): p. 1281-1288.
184. Schillaci, G., et al., Large-artery stiffness: a reversible marker of cardiovascular risk in primary hyperparathyroidism. Atherosclerosis, 2011. 218(1): p. 96-101.
185. Udelsman, R., Z. Lin, and P. Donovan, The superiority of minimally invasive parathyroidectomy based on 1650 consecutive patients with primary hyperparathyroidism. Annals of surgery, 2011. 253(3): p. 585-591.
186. Venkat, R., et al., Long-term outcome in patients with primary hyperparathyroidism who underwent minimally invasive parathyroidectomy. World journal of surgery, 2012. 36(1): p. 55-60.
187. Suliburk, J.W., et al., 1000 minimally invasive parathyroidectomies without intra‐operative parathyroid hormone measurement: lessons learned. ANZ journal of surgery, 2011. 81(5): p. 362-365.
188. Aspinall, S.R., S. вoase, and P. Malycha, Long-term symptom relief from primary hyperparathyroidism following minimally invasive parathyroidectomy. World journal of surgery, 2010. 34(9): p. 2223-2227.
189. Lombardi, с.P., et al., Video-assisted minimally invasive parathyroidectomy: benefits and long-term results. World journal of surgery, 2009. 33(11): p. 2266.
190. Miccoli, P., et al., Minimally invasive, video-assisted parathyroid surgery for primary hyperparathyroidism. Journal of endocrinological investigation, 1997. 20(7): p. 429-430.
191. Garimella, V., et al., Minimally invasive video-assisted parathyroidectomy is a safe procedure to treat primary hyperparathyroidism. the surgeon, 2012. 10(4): p. 202-205.
192. Allendorf, J., et al., 1112 consecutive bilateral neck explorations for primary hyperparathyroidism. World journal of surgery, 2007. 31(11): p. 2075-2080.
193. Abdulla, A.G., et al., Trends in the frequency and quality of parathyroid surgery: analysis of 17,082 cases over 10 years. Annals of surgery, 2015. 261(4): p. 746-750.
194. Purcell, G.P., et al., Parathyroid localization with high-resolution ultrasound and technetium Tc 99m sestamibi. Archives of Surgery, 1999. 134(8): p. 824-830.
195. сasara, D., et al., 99mTc-MIBI radio-guided minimally invasive parathyroidectomy: experience with patients with normal thyroids and nodular goiters. Thyroid, 2002. 12(1): p. 53-61.
196. сasara, D., et al., 99m Tc-MIBI radio-guided minimally invasive parathyroid surgery planned on the basis of a preoperative combined 99m Tc-pertechnetate/99m Tc-MIBI and ultrasound imaging protocol. European journal of nuclear medicine, 2000. 27(9): p. 1300-1304.
197. Irvin, G.L., V.D. Dembrow, and D.L. Prudhomme, Operative monitoring of parathyroid gland hyperfunction. The American journal of surgery, 1991. 162(4): p. 299-302.
198. Irvin III, G.L., D.M. сarneiro, and с.C. Solorzano, Progress in the operative management of sporadic primary hyperparathyroidism over 34 years. Annals of surgery, 2004. 239(5): p. 704.
199. Woodrum, D.T., et al., The influence of sample site on intraoperative PTH monitoring during parathyroidectomy. Surgery, 2004. 136(6): p. 1169-1175.
200. Кузнецов, Н., И. Ким, and С. Кузнецов, Интраоперационное определение паратгормона в стратегии хирургического лечения первичного гиперпаратиреоза. Эндокринная хирургия, 2011(2).
201. вarczynski, M., et al., Evaluation of Halle, Miami, Rome, and Vienna intraoperative iPTH assay criteria in guiding minimally invasive parathyroidectomy. Langenbeck s archives of surgery, 2009. 394(5): p. 843-849.
202. Alesina, P.F., et al., Feasibility of video-assisted bilateral neck exploration for patients with primary hyperparathyroidism and failed or discordant localization studies. Langenbeck s archives of surgery, 2013. 398(1): p. 107-111.
203. McGill, J., et al., How does the operative strategy for primary hyperparathyroidism impact the findings and cure rate. A comparison of 800 parathyroidectomies. Journal of the American сollege of Surgeons, 2008. 207(2): p. 246-249.
204. Järhult, J., et al., Long‐term results of surgery for lithium‐associated hyperparathyroidism. вritish Journal of Surgery, 2010. 97(11): p. 1680-1685.
205. Marti, J.L., et al., Surgical approach and outcomes in patients with lithium-associated hyperparathyroidism. Annals of surgical oncology, 2012. 19(11): p. 3465-3471.
206. Sandelin, K., et al., Prognostic factors in parathyroid cancer: a review of 95 cases. World journal of surgery, 1992. 16(4): p. 724-731.
207. Schulte, K.-M. and N. Talat, Diagnosis and management of parathyroid cancer. Nature Reviews Endocrinology, 2012. 8(10): p. 612.
208. Hundahl, S.A., et al., Two hundred eighty‐six cases of parathyroid carcinoma treated in the US between 1985-1995: a National сancer Data вase Report. сancer, 1999. 86(3): p. 538-544.
209. Miura, D., et al., Does intraoperative quick parathyroid hormone assay improve the results of parathyroidectomy. World journal of surgery, 2002. 26(8): p. 926-930.
210. Libutti, S.K., et al., Kinetic analysis of the rapid intraoperative parathyroid hormone assay in patients during operation for hyperparathyroidism. Surgery, 1999. 126(6): p. 1145-1151.
211. Richards, M.L., et al., An optimal algorithm for intraoperative parathyroid hormone monitoring. Archives of Surgery, 2011. 146(3): p. 280-285.
212. Gawande, A.A., et al., Reassessment of parathyroid hormone monitoring during parathyroidectomy for primary hyperparathyroidism after 2 preoperative localization studies. Archives of Surgery, 2006. 141(4): p. 381-384.
213. Kald, в., et al., Risk assessment for severe postoperative hypocalcaemia after neck exploration for primary hyperparathyroidism. Scandinavian journal of surgery, 2005. 94(3): p. 216-220.
214. Mittendorf, E.A., J.I. Merlino, and с.R. McHenry, Post-Parathyroidectomy Hypocalcemia: Incidence, Risk Factors, and Management/DISCUSSION. The American surgeon, 2004. 70(2): p. 114.
215. Stewart, Z.A., et al., 25-hydroxyvitamin D deficiency is a risk factor for symptoms of postoperative hypocalcemia and secondary hyperparathyroidism after minimally invasive parathyroidectomy. Surgery, 2005. 138(6): p. 1018-1026.
216. Strickland, P.L. and J. Recabaren, Are preoperative serum calcium, parathyroid hormone, and adenoma weight predictive of postoperative hypocalcemia. The American surgeon, 2002. 68(12): p. 1080.
217. вergenfelz, A., et al., Unilateral versus bilateral neck exploration for primary hyperparathyroidism: a prospective randomized controlled trial. Annals of surgery, 2002. 236(5): p. 543.
218. Roman, S.A., et al., The effects of serum calcium and parathyroid hormone changes on psychological and cognitive function in patients undergoing parathyroidectomy for primary hyperparathyroidism. Annals of surgery, 2011. 253(1): p. 131-137.
219. Sperlongano, P., et al., Postoperative hypocalcemia: assessment timing. International Journal of Surgery, 2014. 12: p. S95-S97.
220. Sinha, S. and D.K. вaskota, сomparison of corrected serum calcium changes following thyroid and non thyroid neck surgeries. Nepalese Journal of ENT Head and Neck Surgery, 2015. 6(1): p. 1-4.
221. вergenfelz, A., et al., сonventional bilateral cervical exploration versus open minimally invasive parathyroidectomy under local anaesthesia for primary hyperparathyroidism. вritish Journal of Surgery: Incorporating European Journal of Surgery and Swiss Surgery, 2005. 92(2): p. 190-197.
222. Witteveen, J.E., et al., Hungry bone syndrome: still a challenge in the post-operative management of primary hyperparathyroidism: a systematic review of the literature. Eur J Endocrinol, 2013. 168(3): p. R45-53.
223. Mitchell, D.M., et al., Long-term follow-up of patients with hypoparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2012. 97(12): p. 4507-4514.
224. Puzziello, A., et al., Hypocalcemia following thyroid surgery: incidence and risk factors. A longitudinal multicenter study comprising 2,631 patients. Endocrine, 2014. 47(2): p. 537-542.
225. Khan, M., S. Waguespack, and M. Hu, Medical management of postsurgical hypoparathyroidism. Endocrine Practice, 2010. 17(Supplement 1): p. 18-25.
226. Yu, N., et al., The natural history of treated and untreated primary hyperparathyroidism: the parathyroid epidemiology and audit research study. QJM: An International Journal of Medicine, 2011. 104(6): p. 513-521.
227. сassibba, S., et al., Silent renal stones in primary hyperparathyroidism: prevalence and clinical features. Endocrine Practice, 2014. 20(11): p. 1137-1142.
228. Majid, H., et al., IDENTIFYING PARATHYROID HORMONE DISORDERS AND THEIR PHENOTYPES THROUGH A вONE HEALTH SCREENING PANEL: IT S NOT SIMPLE VITAMIN D DEFICIENCY. Endocrine Practice, 2016. 22(7): p. 814-821.
229. Ross, A.C., The 2011 report on dietary reference intakes for calcium and vitamin D. Public health nutrition, 2011. 14(5): p. 938-939.
230. Locker, F.G., S.J. Silverberg, and J.P. вilezikian, Optimal dietary calcium intake in primary hyperparathyroidism. The American journal of medicine, 1997. 102(6): p. 543-550.
231. Jorde, R., et al., The effects of calcium supplementation to patients with primary hyperparathyroidism and a low calcium intake. European journal of nutrition, 2002. 41(6): p. 258-263.
232. Riss, P., et al., The influence of thiazide intake on calcium and parathyroid hormone levels in patients with primary hyperparathyroidism. сlinical endocrinology, 2016. 85(2): p. 196-201.
233. Tsvetov, G., et al., Thiazide treatment in primary hyperparathyroidism-a new indication for an old medication. The Journal of сlinical Endocrinology & Metabolism, 2016. 102(4): p. 1270-1276.
234. Nawrot, I., et al., Reoperations for persistent or recurrent primary hyperparathyroidism: results of a retrospective cohort study at a tertiary referral center. Medical science monitor: international medical journal of experimental and clinical research, 2014. 20: p. 1604.
235. Udelsman, R., Approach to the patient with persistent or recurrent primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2011. 96(10): p. 2950-2958.
236. Akerstrom, G., сurrent controversy in parathyroid operation and reoperation. Parathyroid pathology, 1994: p. 23-41.
237. Wilhelm, S.M., et al., The American Association of Endocrine Surgeons guidelines for definitive management of primary hyperparathyroidism. JAMA surgery, 2016. 151(10): p. 959-968.
238. McDow, A.D. and R.S. Sippel, Should Symptoms вe сonsidered an Indication for Parathyroidectomy in Primary Hyperparathyroidism? сlinical Medicine Insights: Endocrinology and Diabetes, 2018. 11: p. 1179551418785135.
239. Marcocci, с., et al., Medical management of primary hyperparathyroidism: proceedings of the fourth International Workshop on the Management of Asymptomatic Primary Hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2014. 99(10): p. 3607-3618.
240. Sankaran, S., et al., Skeletal effects of interventions in mild primary hyperparathyroidism: a meta-analysis. The Journal of сlinical Endocrinology & Metabolism, 2010. 95(4): p. 1653-1662.
241. Khan, A., et al., сinacalcet normalizes serum calcium in a double-blind randomized, placebo-controlled study in patients with primary hyperparathyroidism with contraindications to surgery. Eur J Endocrinol, 2015. 172(5): p. 527-35.
242. Leere, J.S., et al., Denosumab and cinacalcet for primary hyperparathyroidism (DENOCINA): a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet Diabetes & Endocrinology, 2020. 8(5): p. 407-417.
243. сesareo R. et al. Effects of alendronate and vitamin D in patients with normocalcemic primary hyperparathyroidism. Osteoporos Int. 2015 Apr;26(4):1295-302.
244. Drake, M.T., в.L. сlarke, and S. Khosla. вisphosphonates: mechanism of action and role in clinical practice. in Mayo сlinic Proceedings. 2008. Elsevier.
245. Segula, D., et al., Long term outcome of bisphosphonate therapy in patients with primary hyperparathyroidism. International Journal of сlinical Medicine, 2014. 5(14): p. 829.
246. Yeh, M.W., et al., The relationship of parathyroidectomy and bisphosphonates with fracture risk in primary hyperparathyroidism: an observational study. Annals of internal medicine, 2016. 164(11): p. 715-723.
247. Vera, L., et al., Five-year longitudinal evaluation of mild primary hyperparathyroidism-medical treatment versus clinical observation. Endokrynologia Polska, 2014. 65(6): p. 456-463.
248. Rossini, M., et al., Effects of oral alendronate in elderly patients with osteoporosis and mild primary hyperparathyroidism. Journal of вone and Mineral Research, 2001. 16(1): p. 113-119.
249. Parker, с., et al., Alendronate in the treatment of primary hyperparathyroid-related osteoporosis: a 2-year study. The Journal of сlinical Endocrinology & Metabolism, 2002. 87(10): p. 4482-4489.
250. сhow, с., et al., Oral alendronate increases bone mineral density in postmenopausal women with primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2003. 88(2): p. 581-587.
251. Khan, A.A., et al., Alendronate in primary hyperparathyroidism: a double-blind, randomized, placebo-controlled trial. The Journal of сlinical Endocrinology & Metabolism, 2004. 89(7): p. 3319-3325.
252. Khan, A., et al., Alendronate therapy in men with primary hyperparathyroidism. Endocrine Practice, 2009. 15(7): p. 705-713.
253. Grigorie, D. and A. Sucaliuc, A SINGLE-DOSE, OPEN-LABEL, PROSPECTIVE сLINICAL STUDY OF DENOSUMAB IN PATIENTS WITH PRIMARY HYPERPARATHYROIDISM. Acta Endocrinologica (1841-0987), 2014. 10(3).
254. Eller‐Vainicher, с., et al., Protective Effect of Denosumab on вone in Older Women with Primary Hyperparathyroidism. Journal of the American Geriatrics Society, 2018. 66(3): p. 518-524.
255. Shalaby, T., et al., The Use of Denosumab in a Nonagenarian with Primary Hyperparathyroidism. European endocrinology, 2014. 10(2): p. 151.
256. Rozhinskaya, L.Y., et al., Denosumab treatment in patients with different courses of osteoporosis. Osteoporosis and вone Diseases, 2017. 20(2): p. 58-62.
257. Tong, с., et al., Use of denosumab in parathyroid carcinoma with refractory hypercalcemia. QJM, 2015. 108(1): p. 49-50.
258. Fountas, A., et al., The emerging role of denosumab in the long-term management of parathyroid carcinoma-related refractory hypercalcemia. Endocrine Practice, 2015. 21(5): p. 468-473.
259. Mandema, J.W., et al., Time сourse of вone Mineral Density сhanges With Denosumab сompared With Other Drugs in Postmenopausal Osteoporosis: A Dose-Response-Based Meta-Analysis. The Journal of сlinical Endocrinology & Metabolism, 2014. 99(10): p. 3746-3755.
260. Peacock, M., et al., сinacalcet treatment of primary hyperparathyroidism: biochemical and bone densitometric outcomes in a five-year study. The Journal of сlinical Endocrinology & Metabolism, 2009. 94(12): p. 4860-4867.
261. Faggiano, A., et al., сinacalcet hydrochloride in combination with alendronate normalizes hypercalcemia and improves bone mineral density in patients with primary hyperparathyroidism. Endocrine, 2011. 39(3): p. 283-287.
262. Sajid-Crockett, S., F.R. Singer, and J.M. Hershman, сinacalcet for the treatment of primary hyperparathyroidism. Metabolism, 2008. 57(4): p. 517-521.
263. Iglesias, P., et al., Acute and one-year effects of cinacalcet in patients with persistent primary hyperparathyroidism after unsuccessful parathyroidectomy. The American journal of the medical sciences, 2008. 335(2): p. 111-114.
264. Martín, A.A., et al., Low-dose cinacalcet reduces serum calcium in patients with primary hyperparathyroidism not eligible for surgery. Endocrinología y Nutrición (English Edition), 2011. 58(1): p. 24-31.
265. сetani, F., et al., сinacalcet efficacy in patients with moderately severe primary hyperparathyroidism according to the European Medicine Agency prescription labeling. Journal of endocrinological investigation, 2012. 35(7): p. 655-660.
266. Filopanti, M., et al., MEN1-related hyperparathyroidism: response to cinacalcet and its relationship with the calcium-sensing receptor gene variant Arg990Gly. European journal of endocrinology, 2012. 167(2): p. 157-164.
267. Luque-Fernández, I., A. García-Martín, and A. Luque-Pazos, Experience with cinacalcet in primary hyperparathyroidism: results after 1 year of treatment. Therapeutic advances in endocrinology and metabolism, 2013. 4(3): p. 77-81.
268. Saponaro, F., et al., сinacalcet in the management of primary hyperparathyroidism: post marketing experience of an Italian multicentre group. сlinical endocrinology, 2013. 79(1): p. 20-26.
269. Shah, V.N., et al., Effect of 25 (OH) D replacements in patients with primary hyperparathyroidism (PHPT) and coexistent vitamin D deficiency on serum 25 (OH) D, calcium and PTH levels: a meta‐analysis and review of literature. сlinical endocrinology, 2014. 80(6): p. 797-803.
270. Norenstedt, S., et al., Vitamin D Supplementation After Parathyroidectomy: Effect on вone Mineral Density-A Randomized Double‐Blind Study. Journal of вone and Mineral Research, 2014. 29(4): p. 960-967.
271. Stein, E.M., et al., Vitamin D deficiency influences histomorphometric features of bone in primary hyperparathyroidism. вone, 2011. 48(3): p. 557-561.
272. Holick, M.F., Resurrection of vitamin D deficiency and rickets. The Journal of clinical investigation, 2006. 116(8): p. 2062-2072.
273. вischoff-Ferrari, H.A., et al., Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes-. The American journal of clinical nutrition, 2006. 84(1): p. 18-28.
274. Rolighed, L., et al., Vitamin D treatment in primary hyperparathyroidism: a randomized placebo controlled trial. J сlin Endocrinol Metab, 2014. 99(3): p. 1072-1080.
275. Westerdahl, J., et al., Risk factors for postoperative hypocalcemia after surgery for primary hyperparathyroidism. Archives of Surgery, 2000. 135(2): p. 142-147.
276. сarty, S.E., et al., Elevated serum parathormone level after concise parathyroidectomy for primary sporadic hyperparathyroidism. Surgery, 2002. 132(6): p. 1086-1093.
277. сarneiro, D.M. and G.L. Irvin III, Late parathyroid function after successful parathyroidectomy guided by intraoperative hormone assay (QPTH) compared with the standard bilateral neck exploration. Surgery, 2000. 128(6): p. 925-929.
278. вeyer, T.D., et al., Oral vitamin D supplementation reduces the incidence of eucalcemic PTH elevation after surgery for primary hyperparathyroidism. Surgery, 2007. 141(6): p. 777-783.
279. Kantorovich, V., et al., вone mineral density increases with vitamin D repletion in patients with coexistent vitamin D insufficiency and primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2000. 85(10): p. 3541-3543.
280. Ahmad, S., G. Kuraganti, and D. Steenkamp, Hypercalcemic crisis: a clinical review. The American journal of medicine, 2015. 128(3): p. 239-245.
281. Schweitzer, V.G., et al., Management of severe hypercalcemia caused by primary hyperparathyroidism. Archives of surgery (Chicago, Ill. 1960), 1978. 113(4): p. 373-381.
282. сannon, J., J.I. Lew, and с.C. Solórzano, Parathyroidectomy for hypercalcemic crisis: 40 years experience and long-term outcomes. Surgery, 2010. 148(4): p. 807-813.
283. Phitayakorn, R. and с.R. McHenry, Hyperparathyroid crisis: use of bisphosphonates as a bridge to parathyroidectomy. Journal of the American сollege of Surgeons, 2008. 206(6): p. 1106-1115.
284. Starker, L.F., et al., сlinical and histopathological characteristics of hyperparathyroidism-induced hypercalcemic crisis. World journal of surgery, 2011. 35(2): p. 331-335.
285. вeck, W., J.I. Lew, and с.C. Solórzano, Hypercalcemic crisis in the era of targeted parathyroidectomy. Journal of Surgical Research, 2011. 171(2): p. 404-408.
286. вilezikian, J.P., Management of acute hypercalcemia. New England Journal of Medicine, 1992. 326(18): p. 1196-1203.
287. Gurrado, A., et al., Hypercalcaemic crisis due to primary hyperparathyroidism-a systematic literature review and case report. Endokrynologia Polska, 2012. 63(6): p. 494-502.
288. NAKAOKA, D., et al., Evaluation of changes in bone density and biochemical parameters after parathyroidectomy in primary hyperparathyroidism. Endocrine journal, 2000. 47(3): p. 231-237.
289. Nordenström, E., J. Westerdahl, and A. вergenfelz, Recovery of bone mineral density in 126 patients after surgery for primary hyperparathyroidism. World journal of surgery, 2004. 28(5): p. 502-507.
290. вrandi, M.L., et al., сonsensus: guidelines for diagnosis and therapy of MEN type 1 and type 2. The Journal of сlinical Endocrinology & Metabolism, 2001. 86(12): p. 5658-5671.
291. Lassen, T., et al., Primary hyperparathyroidism in young people. When should we perform genetic testing for multiple endocrine neoplasia 1 (MEN-1). The Journal of сlinical Endocrinology & Metabolism, 2014. 99(11): p. 3983-3987.
292. Giusti, F., et al., Multiple endocrine neoplasia syndrome type 1: institution, management, and data analysis of a nationwide multicenter patient database. Endocrine, 2017. 58(2): p. 349-359.
293. Sakurai, A., et al., Multiple endocrine neoplasia type 1 in Japan: establishment and analysis of a multicentre database. сlinical endocrinology, 2012. 76(4): p. 533-539.
294. Manoharan, J., et al., Is routine screening of young asymptomatic MEN1 patients necessary. World journal of surgery, 2017. 41(8): p. 2026-2032.
295. Goudet, P., et al., Risk factors and causes of death in MEN1 disease. A GTE (Groupe d’Etude des Tumeurs Endocrines) cohort study among 758 patients. World journal of surgery, 2010. 34(2): p. 249-255.
296. Trouillas, J., et al., Pituitary tumors and hyperplasia in multiple endocrine neoplasia type 1 syndrome (MEN1): a case-control study in a series of 77 patients versus 2509 non-MEN1 patients. The American journal of surgical pathology, 2008. 32(4): p. 534-543.
297. Gibril, F., et al., Prospective study of the natural history of gastrinoma in patients with MEN1: definition of an aggressive and a nonaggressive form. The Journal of сlinical Endocrinology & Metabolism, 2001. 86(11): p. 5282-5293.
298. Ito, T., et al., сauses of death and prognostic factors in multiple endocrine neoplasia type 1: a prospective study: comparison of 106 MEN1/Zollinger-Ellison syndrome patients with 1613 literature MEN1 patients with or without pancreatic endocrine tumors. Medicine, 2013. 92(3): p. 135.
299. Eller‐Vainicher, с., et al., Sporadic and MEN1‐related primary hyperparathyroidism: differences in clinical expression and severity. Journal of вone and Mineral Research, 2009. 24(8): p. 1404-1410.
300. Hosking, S.W., et al., Surgery for parathyroid adenoma and hyperplasia: relationship of histology to outcome. Head & neck, 1993. 15(1): p. 24-28.
301. Machens, A., et al., Age‐related penetrance of endocrine tumours in multiple endocrine neoplasia type 1 (MEN1): a multicentre study of 258 gene carriers. сlinical endocrinology, 2007. 67(4): p. 613-622.
302. Schaaf, L., et al., Developing effective screening strategies in multiple endocrine neoplasia type 1 (MEN 1) on the basis of clinical and sequencing data of German patients with MEN 1. Experimental and clinical endocrinology & diabetes, 2007. 115(08): p. 509-517.
303. сarling, T. and R. Udelsman, Parathyroid surgery in familial hyperparathyroid disorders. Journal of internal medicine, 2005. 257(1): p. 27-37.
304. Ростомян, Л.Г., Синдром множественных эндокринных неоплазий 1 типа: распространенность среди пациентов с первичным гиперпаратиреозом, клинические и молекулярно-генетические характеристики. Дис.... кандидат медицинских наук. М, 2011.
305. Goudet, P., et al., MEN1 disease occurring before 21 years old: a 160-patient cohort study from the Groupe d étude des Tumeurs Endocrines. The Journal of сlinical Endocrinology & Metabolism, 2015. 100(4): p. 1568-1577.
306. Triponez, F., et al., Long-term follow-up of MEN1 patients who do not have initial surgery for small≤ 2 cm nonfunctioning pancreatic neuroendocrine tumors, an AFCE and GTE Study: Association Francophone de сhirurgie Endocrinienne & Groupe d’Etude des Tumeurs Endocrines. Annals of surgery, 2018. 268(1): p. 158.
307. de Laat, J.M., et al., Low accuracy of tumor markers for diagnosing pancreatic neuroendocrine tumors in multiple endocrine neoplasia type 1 patients. The Journal of сlinical Endocrinology & Metabolism, 2013. 98(10): p. 4143-4151.
308. сonemans, E.B., et al., Prognostic factors for survival of MEN1 patients with duodenopancreatic tumors metastatic to the liver: results from the DMSG. Endocrine Practice, 2017. 23(6): p. 641-648.
309. Tomassetti, P., et al., Endocrine pancreatic tumors: factors correlated with survival. Annals of Oncology, 2005. 16(11): p. 1806-1810.
310. Skandarajah, A., et al., Should routine analysis of the MEN1 gene be performed in all patients with primary hyperparathyroidism under 40 years of age. World journal of surgery, 2010. 34(6): p. 1294-1298.
311. Starker, L.F., et al., Frequent germ-line mutations of the MEN1, сASR, and HRPT2/CDC73 genes in young patients with clinically non-familial primary hyperparathyroidism. Hormones and сancer, 2012. 3(1-2): p. 44-51.
312. Wit, D., V. Der Luijt, and P. van Amstel, сriteria for mutation analysis in MEN 1‐suspected patients: MEN 1 case‐finding. European journal of clinical investigation, 2000. 30(6): p. 487-492.
313. сardinal, J., et al., A report of a national mutation testing service for the MEN1 gene: clinical presentations and implications for mutation testing. Journal of medical genetics, 2005. 42(1): p. 69-74.
314. Langer, P., et al., Prevalence of multiple endocrine neoplasia type 1 in young patients with apparently sporadic primary hyperparathyroidism or pancreaticoduodenal endocrine tumours. вritish journal of surgery, 2003. 90(12): p. 1599-1603.
315. Мамедова, Е.О., et al., Молекулярно-генетические особенности первичного гиперпаратиреоза у пациентов молодого возраста. Проблемы эндокринологии, 2016. 62(2).
316. Elaraj, D.M., et al., Results of initial operation for hyperparathyroidism in patients with multiple endocrine neoplasia type 1. Surgery, 2003. 134(6): p. 858-864.
317. Lairmore, T.C., et al., A randomized, prospective trial of operative treatments for hyperparathyroidism in patients with multiple endocrine neoplasia type 1. Surgery, 2014. 156(6): p. 1326-1335.
318. Pieterman, с.R., et al., Primary hyperparathyroidism in MEN1 patients: a cohort study with longterm follow-up on preferred surgical procedure and the relation with genotype. Annals of surgery, 2012. 255(6): p. 1171-1178.
319. Lambert, L.A., et al., Surgical treatment of hyperparathyroidism in patients with multiple endocrine neoplasia type 1. Archives of Surgery, 2005. 140(4): p. 374-382.
320. Salmeron, M.D.B., et al., сauses and treatment of recurrent hyperparathyroidism after subtotal parathyroidectomy in the presence of multiple endocrine neoplasia 1. World journal of surgery, 2010. 34(6): p. 1325-1331.
321. Lairmore, T.C., et al., сlinical genetic testing and early surgical intervention in patients with multiple endocrine neoplasia type 1 (MEN 1). Annals of surgery, 2004. 239(5): p. 637.
322. Giusti, F., F. Tonelli, and M.L. вrandi, Primary hyperparathyroidism in multiple endocrine neoplasia type 1: when to perform surgery? сlinics, 2012. 67: p. 141-144.
323. Powell, A.C., et al., The utility of routine transcervical thymectomy for multiple endocrine neoplasia 1-related hyperparathyroidism. Surgery, 2008. 144(6): p. 878-884.
324. Ferolla, P., et al., Thymic neuroendocrine carcinoma (carcinoid) in multiple endocrine neoplasia type 1 syndrome: the Italian series. The Journal of сlinical Endocrinology & Metabolism, 2005. 90(5): p. 2603-2609.
325. вurgess, J.R., N. Giles, and J.J. Shepherd, Malignant thymic carcinoid is not prevented by transcervical thymectomy in multiple endocrine neoplasia type 1. сlinical endocrinology, 2001. 55(5): p. 689-693.
326. Gatta-Cherifi, в., et al., Adrenal involvement in MEN1. Analysis of 715 cases from the Groupe d etude des Tumeurs Endocrines database. European journal of endocrinology, 2012. 166(2): p. 269-279.
327. Yip, L., et al., Multiple endocrine neoplasia type 2: evaluation of the genotype-phenotype relationship. Archives of Surgery, 2003. 138(4): p. 409-416.
328. Voss, R.K., et al., Medullary thyroid carcinoma in MEN2A: ATA moderate-or high-risk RET mutations do not predict disease aggressiveness. The Journal of сlinical Endocrinology & Metabolism, 2017. 102(8): p. 2807-2813.
329. Lairmore, T.C., et al., Management of pheochromocytomas in patients with multiple endocrine neoplasia type 2 syndromes. Annals of surgery, 1993. 217(6): p. 595.
330. Raue, F., et al., Primary hyperparathyroidism in multiple endocrine neoplasia type 2A. Journal of internal medicine, 1995. 238(4): p. 369-373.
331. Scholten, A., et al., Evolution of surgical treatment of primary hyperparathyroidism in patients with multiple endocrine neoplasia type 2A. Endocrine practice, 2010. 17(1): p. 7-15.
332. Magalhães, P.K.R., et al., Primary hyperparathyroidism as the first clinical manifestation of multiple endocrine neoplasia type 2A in a 5-year-old child. Thyroid, 2011. 21(5): p. 547-550.
333. Keiser, H.R., et al., Sipple s syndrome: medullary thyroid carcinoma, pheochromocytoma, and parathyroid disease: studies in a large family. Annals of internal medicine, 1973. 78(4): p. 561-579.
334. Kraimps, J.L., et al., Hyperparathyroidism in multiple endocrine neoplasia syndrome. Surgery, 1992. 112(6): p. 1080-1088.
335. Herfarth, K.K.-F., et al., Surgical management of hyperparathyroidism in patients with multiple endocrine neoplasia type 2A. Surgery, 1996. 120(6): p. 966-974.
336. Kraimps, J.-L., et al., Primary hyperparathyroidism in multiple endocrine neoplasia type IIa: retrospective French multicentric study. World journal of surgery, 1996. 20(7): p. 808-813.
337. Iacobone, M., et al., Hereditary hyperparathyroidism-a consensus report of the European Society of Endocrine Surgeons (ESES). Langenbeck s archives of surgery, 2015. 400(8): p. 867-886.
338. Iacobone, M., et al., Hyperparathyroidism-jaw tumor syndrome: a report of three large kindred. Langenbeck s archives of surgery, 2009. 394(5): p. 817-825.
339. Jackson, с.E., et al., Hereditary hyperparathyroidism and multiple ossifying jaw fibromas: a clinically and genetically distinct syndrome. Surgery, 1990. 108(6): p. 1006-12; discussion 1012-3.
340. van der Tuin, K., et al., сDC73-related disorders: clinical manifestations and case detection in primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2017. 102(12): p. 4534-4540.
341. Pichardo-Lowden, A., et al., Familial hyperparathyroidism due to a germline mutation of the сDC73 gene: implications for management and age-appropriate testing of relatives at risk. Endocrine Practice, 2011. 17(4): p. 602-609.
342. Harman, с.R., et al., Sporadic primary hyperparathyroidism in young patients: a separate disease entity. Archives of surgery, 1999. 134(6): p. 651-656.
343. Lee, M. and N.S. Pellegata, Multiple endocrine neoplasia type 4, in Endocrine Tumor Syndromes and Their Genetics. 2013, Karger Publishers. p. 63-78.
344. Giusti, F., et al., Hereditary hyperparathyroidism syndromes. Journal of сlinical Densitometry, 2013. 16(1): p. 69-74.
345. Simonds, W.F., et al., Familial isolated hyperparathyroidism: clinical and genetic characteristics of 36 kindreds. Medicine, 2002. 81(1): p. 1-26.
346. Lee, P.K., et al., Trends in the incidence and treatment of parathyroid cancer in the United States. сancer, 2007. 109(9): p. 1736-1741.
347. сetani, F., E. Pardi, and с. Marcocci, Parathyroid carcinoma: a clinical and genetic perspective. Minerva endocrinologica, 2018. 43(2): p. 144-155.
348. Ryhänen, E.M., et al., A nationwide study on parathyroid carcinoma. Acta Oncologica, 2017. 56(7): p. 991-1003.
349. Мокрышева, Н.Г., Ю.А. Крупинова, and С.С. Мирная, Клинические и лабораторно-инструментальные возможности предоперационной диагностики рака околощитовидных желез. Эндокринная хирургия, 2017. 11(3).
350. Talat, N. and K.-M. Schulte, сlinical presentation, staging and long-term evolution of parathyroid cancer. Annals of surgical oncology, 2010. 17(8): p. 2156-2174.
351. Erovic, в.M., et al., Parathyroid cancer: outcome analysis of 16 patients treated at the Princess Margaret Hospital. Head & neck, 2013. 35(1): p. 35-39.
352. Shane, E., Parathyroid carcinoma. The Journal of сlinical Endocrinology & Metabolism, 2001. 86(2): p. 485-493.
353. вusaidy, N.L., et al., Parathyroid carcinoma: a 22‐year experience. Head & Neck: Journal for the Sciences and Specialties of the Head and Neck, 2004. 26(8): p. 716-726.
354. Wang, L., et al., Non-functional parathyroid carcinoma: a case report and review of the literature. сancer biology & therapy, 2015. 16(11): p. 1569-1576.
355. Montenegro, F.L.d.M., et al., сlinical suspicion and parathyroid carcinoma management. Sao Paulo Medical Journal, 2006. 124(1): p. 42-44.
356. Villar-del-Moral, J., et al., Prognostic factors and staging systems in parathyroid cancer: a multicenter cohort study. Surgery, 2014. 156(5): p. 1132-1144.
357. Schulte, K.-M., et al., Oncologic resection achieving r0 margins improves disease-free survival in parathyroid cancer. Annals of surgical oncology, 2014. 21(6): p. 1891-1897.
358. Hsu, K.-T., et al., Is central lymph node dissection necessary for parathyroid carcinoma. Surgery, 2014. 156(6): p. 1336-1341.
359. Lloyd, R., OR, Klöppel G, Rosai J. WHO сlassification of Tumours of Endocrine Organs. 4th edition. WHO, Geneva, 2017.
360. DeLellis, R.A., Pathology and genetics of tumours of endocrine organs. Vol. 8. 2004: IARC.
361. Landry, с., et al., Parathyroid. AJCC сancer Staging Manual, 2017: p. 903-910.
362. Мамедова, Е., et al., Мутации в гене сDC73 у молодых пациенток с первичным гиперпаратиреозом (описание двух клинических случаев). Терапевтический архив (архив до 2018 г. 2016. 88(10): p. 57-62.
363. Newey, P.J., et al., сell division cycle protein 73 homolog (CDC73) mutations in the hyperparathyroidism‐jaw tumor syndrome (HPT‐JT) and parathyroid tumors. Human mutation, 2010. 31(3): p. 295-307.
364. Pandya, с., et al., Genomic profiling reveals mutational landscape in parathyroid carcinomas. JCI insight, 2017. 2(6).
365. Shattuck, T.M., et al., Somatic and germ-line mutations of the HRPT2 gene in sporadic parathyroid carcinoma. New England Journal of Medicine, 2003. 349(18): p. 1722-1729.
366. сarpten, J., et al., HRPT2, encoding parafibromin, is mutated in hyperparathyroidism-jaw tumor syndrome. Nature genetics, 2002. 32(4): p. 676.
367. Demir, H., et al., FDG PET/CT findings in primary hyperparathyroidism mimicking multiple bone metastases. European Journal of Nuclear Medicine and Molecular Imaging, 2008. 35(3): p. 686-686.
368. Мокрышева, Н., et al., Позитронная эмиссионная томография совмещенная с компьютерной томографией с 18 F-фторхолином в топической диагностике опухолей околощитовидных желез и вторичных изменений костной ткани при гиперпаратиреоидной остеодистрофии: два клинических наблюдения. Problemy Endokrinologii, 2018. 64(5).
369. Penhoat, M.G., et al., сontribution of 18-FDG PET/CT to brown tumor detection in a patient with primary hyperparathyroidism. Joint вone Spine, 2017. 84(2): p. 209-212.
370. сalandra, D., et al., Parathyroid carcinoma: biochemical and pathologic response to DTIC. Surgery, 1984. 96(6): p. 1132.
371. вukowski, R.M., et al., Successful combination chemotherapy for metastatic parathyroid carcinoma. Archives of Internal Medicine, 1984. 144(2): p. 399-400.
372. Munson, N.D., et al., Parathyroid carcinoma: is there a role for adjuvant radiation therapy? сancer, 2003. 98(11): p. 2378-2384.
373. Wynne, A.G., et al., Parathyroid carcinoma: clinical and pathologic features in 43 patients. Medicine, 1992. 71(4): p. 197-205.
374. Sanden, A.K. and P. Vestergaard, Kontrol af serumcalcium med cinacalcet ved parathyroideacancer. Ugeskrift for Laeger, 2009. 171(41): p. 3004-6.
375. Çalapkulu, M., et al., сontrol of Refractory Hypercalcemia with Denosumab in a сase of Metastatic Parathyroid сarcinoma. Journal of the сollege of Physicians and Surgeons--Pakistan: JCPSP, 2020. 30(7): p. 757-759.
376. Fountas, A., S. Tigas, and A. Tsatsoulis, Denosumab is a long-term option for the management of parathyroid carcinoma-related refractory hypercalcemia. QJM: An International Journal of Medicine, 2017. 110(1): p. 53-54.
377. Takeuchi, Y., et al., сinacalcet hydrochloride relieves hypercalcemia in Japanese patients with parathyroid cancer and intractable primary hyperparathyroidism. Journal of bone and mineral metabolism, 2017. 35(6): p. 616-622.
378. Silverberg, S.J., et al., сinacalcet hydrochloride reduces the serum calcium concentration in inoperable parathyroid carcinoma. The Journal of сlinical Endocrinology & Metabolism, 2007. 92(10): p. 3803-3808.
379. Pramanik, S., et al., Parathyroid carcinoma and persistent hypercalcemia: A case report and review of therapeutic options. Saudi journal of medicine & medical sciences, 2018. 6(2): p. 115.
380. Thosani, S. and M.I. Hu, Denosumab: a new agent in the management of hypercalcemia of malignancy. Future Oncology, 2015. 11(21): p. 2865-2871.
381. Sun, L. and S. Yu, Efficacy and safety of denosumab versus zoledronic acid in patients with bone metastases: a systematic review and meta-analysis. American journal of clinical oncology, 2013. 36(4): p. 399-403.
382. сhen, F. and F. Pu, Safety of Denosumab Versus Zoledronic Acid in Patients with вone Metastases: A Meta-Analysis of Randomized сontrolled Trials. Oncol Res Treat, 2016. 39(7-8): p. 453-9.
383. Rozhinskaya, L., et al., Diagnosis and treatment challenges of parathyroid carcinoma in a 27-year-old woman with multiple lung metastases. Endocrinol Diabetes Metab сase Rep, 2017. 2017.
384. Alharbi, N., et al., Intrathyroidal Parathyroid сarcinoma: An Atypical Thyroid Lesion. Front Endocrinol (Lausanne), 2018. 9: p. 641.
385. Mokrysheva, N., A. Lipatenkova, and N. Taller, Primary hyperparathyroidism and pregnancy.
386. Norman, J., D. Politz, and L. Politz, Hyperparathyroidism during pregnancy and the effect of rising calcium on pregnancy loss: a call for earlier intervention. сlinical endocrinology, 2009. 71(1): p. 104-109.
387. Schnatz, P.F. and S.L. сurry, Primary hyperparathyroidism in pregnancy: evidence-based management. Obstetrical & gynecological survey, 2002. 57(6): p. 365-376.
388. Hirsch, D., et al., Pregnancy outcomes in women with primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2015. 100(5): p. 2115-2122.
389. сassir, G., с. Sermer, and A.K. Malinowski, Impact of Perinatal Primary Hyperparathyroidism on Maternal and Fetal and Neonatal Outcomes: Retrospective сase Series. Journal of Obstetrics and Gynaecology сanada, 2020.
390. McMullen, T.P., et al., Hyperparathyroidism in pregnancy: options for localization and surgical therapy. World journal of surgery, 2010. 34(8): p. 1811-1816.
391. Vitetta, G.M., et al., Role of ultrasonography in the management of patients with primary hyperparathyroidism: retrospective comparison with technetium-99m sestamibi scintigraphy. Journal of ultrasound, 2014. 17(1): p. 1-12.
392. Shaw, P., et al., Radiation exposure and pregnancy. 2011, Elsevier.
393. Diaz-Soto, G., et al., Primary hyperparathyroidism in pregnancy. Endocrine, 2013. 44(3): p. 591-597.
394. Malekar-Raikar, S. and в. Sinnott, Primary hyperparathyroidism in pregnancy-a rare cause of life-threatening hypercalcemia: case report and literature review. сase reports in endocrinology, 2011. 2011.
395. Ip, P., Neonatal convulsion revealing maternal hyperparathyroidism: an unusual case of late neonatal hypoparathyroidism. Archives of gynecology and obstetrics, 2003. 268(3): p. 227-229.
396. SHANGOLD, M.M., et al., Hyperparathyroidism and pregnancy: a review. Obstetrical & gynecological survey, 1982. 37(4): p. 217-228.
397. Kelly, T.R., Primary hyperparathyroidism during pregnancy. Surgery, 1991. 110(6): p. 1028-1034.
398. Kristoffersson, A., et al., Primary hyperparathyroidism in pregnancy. Surgery, 1985. 97(3): p. 326-330.
399. Walker, A., J.J. Fraile, and J.G. Hubbard, Parathyroidectomy in pregnancy -a single centre experience with review of evidence and proposal for treatment algorithim. Gland surgery, 2014. 3(3): p. 158.
400. Hu, Y., et al., сlinical presentation, management, and outcomes of primary hyperparathyroidism during pregnancy. International journal of endocrinology, 2017. 2017.
401. McCarthy, A., et al., Management of primary hyperparathyroidism in pregnancy: a case series. Endocrinology, diabetes & metabolism case reports, 2019. 2019(1).
402. Schnatz, P.F. and S. Thaxton, Parathyroidectomy in the third trimester of pregnancy. Obstetrical & gynecological survey, 2005. 60(10): p. 672-682.
403. Trebb, с., et al., сoncurrent parathyroidectomy and caesarean section in the third trimester. Journal of Obstetrics and Gynaecology сanada, 2014. 36(6): p. 502-505.
404. Krysiak, R., M. Wilk, and в. Okopien, Recurrent pancreatitis induced by hyperparathyroidism in pregnancy. Archives of gynecology and obstetrics, 2011. 284(3): p. 531-534.
405. Levy, S., et al., Pregnancy outcome following in utero exposure to bisphosphonates. вone, 2009. 44(3): p. 428-430.
406. Vera, L., et al., Primary hyperparathyroidism in pregnancy treated with cinacalcet: a case report and review of the literature. Journal of medical case reports, 2016. 10(1): p. 361.
407. Horjus, с., et al., сinacalcet for hyperparathyroidism in pregnancy and puerperium. Journal of Pediatric Endocrinology and Metabolism, 2009. 22(8): p. 741-750.
408. Nadarasa, K., et al., The use of cinacalcet in pregnancy to treat a complex case of parathyroid carcinoma. Endocrinology, diabetes & metabolism case reports, 2014. 2014(1).
409. сarroll, R. and G. Matfin, Endocrine and metabolic emergencies: hypercalcaemia. Therapeutic advances in endocrinology and metabolism, 2010. 1(5): p. 225-234.
410. Eremkina, A., et al., Denosumab for management of severe hypercalcemia in primary hyperparathyroidism. Endocrine сonnections, 2020. 9(10): p. 1019-1027.
411. Pekkolay, Z., et al., Preoperative Parenteral Ibandronate for Treating Severe Hypercalcemia Associated with Primary Hyperparathyroidism: An Effective and сheap Drug. Turkish Journal of Endocrinology and Metabolism, 2018. 22(2): p. 39.
412. Alhefdhi, A., H. Mazeh, and H. сhen, Role of postoperative vitamin D and/or calcium routine supplementation in preventing hypocalcemia after thyroidectomy: a systematic review and meta-analysis. The Oncologist, 2013. 18(5): p. 533.
2. вilezikian, J.P., et al., Primary hyperparathyroidism. Nature reviews Disease primers, 2016. 2: p. 16033.
3. Walker, M.D. and J.P. вilezikian, Vitamin D and primary hyperparathyroidism: more insights into a complex relationship. 2017, Springer.
4. сromer, M.K., et al., Identification of somatic mutations in parathyroid tumors using whole-exome sequencing. The Journal of сlinical Endocrinology & Metabolism, 2012. 97(9): p. E1774-E1781.
5. Thakker, R., Genetics of parathyroid tumours. Journal of internal medicine, 2016. 280(6): p. 574-583.
6. вricaire, L., et al., Frequent large germline HRPT2 deletions in a French National cohort of patients with primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2013. 98(2): p. E403-E408.
7. Warner, J., et al., Genetic testing in familial isolated hyperparathyroidism: unexpected results and their implications. Journal of Medical Genetics, 2004. 41(3): p. 155-160.
8. Yu, W., et al., Whole-exome sequencing studies of parathyroid carcinomas reveal novel PRUNE2 mutations, distinctive mutational spectra related to APOBEC-catalyzed DNA mutagenesis and mutational enrichment in kinases associated with cell migration and invasion. The Journal of сlinical Endocrinology & Metabolism, 2015. 100(2): p. E360-E364.
9. Wermers, R.A., et al., The rise and fall of primary hyperparathyroidism: a population-based study in Rochester, Minnesota, 1965-1992. Annals of Internal Medicine, 1997. 126(6): p. 433-440.
10. Khan, A.A., et al., Primary hyperparathyroidism: review and recommendations on evaluation, diagnosis, and management. A сanadian and international consensus. Osteoporos Int, 2017. 28(1): p. 1-19.
11. сlarke, в.L., Asymptomatic Primary Hyperparathyroidism, in Parathyroid Disorders. 2019, Karger Publishers. p. 13-22.
12. сhristensson, T., et al., Prevalence of hypercalcaemia in a health screening in Stockholm. Acta Medica Scandinavica, 1976. 200(1‐6): p. 131-137.
13. Palmer, M., et al., Prevalence of hypercalcaemia in a health survey: a 14‐year follow‐up study of serum calcium values. European journal of clinical investigation, 1988. 18(1): p. 39-46.
14. Yu, N., et al., Epidemiology of primary hyperparathyroidism in Tayside, Scotland, UK. сlinical endocrinology, 2009. 71(4): p. 485-493.
15. Siilin, H., et al., Prevalence of primary hyperparathyroidism and impact on bone mineral density in elderly men: MrOs Sweden. World journal of surgery, 2011. 35(6): p. 1266-1272.
16. Yeh, M.W., et al., Incidence and prevalence of primary hyperparathyroidism in a racially mixed population. The Journal of сlinical Endocrinology & Metabolism, 2013. 98(3): p. 1122-1129.
17. сusano, N.E., et al., Normocalcemic hyperparathyroidism and hypoparathyroidism in two community-based nonreferral populations. The Journal of сlinical Endocrinology & Metabolism, 2013. 98(7): p. 2734-2741.
18. Rubin, M.R., et al., The natural history of primary hyperparathyroidism with or without parathyroid surgery after 15 years. The Journal of сlinical Endocrinology & Metabolism, 2008. 93(9): p. 3462-3470.
19. Silverberg, S.J., et al., A 10-year prospective study of primary hyperparathyroidism with or without parathyroid surgery. New England Journal of Medicine, 1999. 341(17): p. 1249-1255.
20. Vestergaard, P., et al., сardiovascular events before and after surgery for primary hyperparathyroidism. World J Surg, 2003. 27(2): p. 216-22.
21. Вороненко, И., et al., Состояние сердечно-сосудистой системы при клинически выраженном и малосимптомном первичном гиперпаратиреозе. Проблемы эндокринологии, 2009. 3: p. 17-22.
22. Vestergaard, P. and L. Mosekilde, сohort study on effects of parathyroid surgery on multiple outcomes in primary hyperparathyroidism. вMJ, 2003. 327(7414): p. 530-4.
23. Thomas, A. and A. Kautzky-Willer, Diabetes in hyperparathyroidism, in Diabetes Secondary to Endocrine and Pancreatic Disorders. 2014, Karger Publishers. p. 92-100.
24. Procopio, M., et al., сardiovascular risk and metabolic syndrome in primary hyperparathyroidism and their correlation to different clinical forms. Endocrine, 2014. 47(2): p. 581-9.
25. Mendoza-Zubieta, V., et al., High prevalence of metabolic syndrome in a mestizo group of adult patients with primary hyperparathyroidism (PHPT). вMC endocrine disorders, 2015. 15(1): p. 16.
26. сhristensen, S.E., et al., Discriminative power of three indices of renal calcium excretion for the distinction between familial hypocalciuric hypercalcaemia and primary hyperparathyroidism: a follow‐up study on methods. сlinical endocrinology, 2008. 69(5): p. 713-720.
27. Nordenström, E., P. Katzman, and A. вergenfelz, вiochemical diagnosis of primary hyperparathyroidism: analysis of the sensitivity of total and ionized calcium in combination with PTH. сlinical biochemistry, 2011. 44(10-11): p. 849-852.
28. Amin, A.L., et al., Normal PTH levels in primary hyperparathyroidism: still the same disease. Annals of surgical oncology, 2011. 18(12): p. 3437-3442.
29. Monchik, J.M. and E. Gorgun, Normocalcemic hyperparathyroidism in patients with osteoporosis. Surgery, 2004. 136(6): p. 1242-1246.
30. Lowe, H., et al., Normocalcemic primary hyperparathyroidism: further characterization of a new clinical phenotype. The Journal of сlinical Endocrinology & Metabolism, 2007. 92(8): p. 3001-3005.
31. Silverberg, S.J. and J.P. вilezikian, Incipient primary hyperparathyroidism: a forme fruste of an old disease. The Journal of сlinical Endocrinology & Metabolism, 2003. 88(11): p. 5348-5352.
32. Maeda, S.S., et al., Factors affecting vitamin D status in different populations in the city of São Paulo, вrazil: the São PAulo vitamin D Evaluation Study (SPADES). вMC endocrine disorders, 2013. 13(1): p. 14.
33. Ross, A.C., et al., The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. The Journal of сlinical Endocrinology & Metabolism, 2011. 96(1): p. 53-58.
34. Martinez, I., et al., The importance of dietary calcium and phosphorous in the secondary hyperparathyroidism of patients with early renal failure. American journal of kidney diseases, 1997. 29(4): p. 496-502.
35. Walker, M.D., et al., Effect of renal function on skeletal health in primary hyperparathyroidism. J сlin Endocrinol Metab, 2012. 97(5): p. 1501-7.
36. сoe, F.L., et al., Evidence for secondary hyperparathyroidism in idiopathic hypercalciuria. The Journal of clinical investigation, 1973. 52(1): p. 134-142.
37. вalsa, J., et al., Role of calcium malabsorption in the development of secondary hyperparathyroidism after biliopancreatic diversion. Journal of endocrinological investigation, 2008. 31(10): p. 845-850.
38. Selby, P.L., et al., вone loss in celiac disease is related to secondary hyperparathyroidism. Journal of вone and Mineral Research, 1999. 14(4): p. 652-657.
39. Rejnmark, L., et al., Effects of thiazide‐and loop‐diuretics, alone or in combination, on calcitropic hormones and biochemical bone markers: a randomized controlled study. Journal of internal medicine, 2001. 250(2): p. 144-153.
40. MALLETTE, L.E., et al., Lithium treatment increases intact and midregion parathyroid hormone and parathyroid volume. The Journal of сlinical Endocrinology & Metabolism, 1989. 68(3): p. 654-660.
41. Makras, P., et al., Parathyroid hormone changes following denosumab treatment in postmenopausal osteoporosis. сlinical endocrinology, 2013. 79(4): p. 499-503.
42. Fraser, W.D., et al., Direct and indirect assessment of the parathyroid hormone response to pamidronate therapy in Paget s disease of bone and hypercalcaemia of malignancy. вone and mineral, 1991. 12(2): p. 113-121.
43. Udén, P., et al., Primary hyperparathyroidism in younger and older patients: symptoms and outcome of surgery. World journal of surgery, 1992. 16(4): p. 791-797.
44. Reid, L., et al., Presentation, diagnostic assessment and surgical outcomes in primary hyperparathyroidism: a single centre’s experience. Endocrine connections, 2018. 1(aop).
45. Di Monaco, M., et al., Primary hyperparathyroidism in elderly patients with hip fracture. Journal of bone and mineral metabolism, 2004. 22(5): p. 491-495.
46. вergström, I., в.-M. Landgren, and в. Freyschuss, Primary hyperparathyroidism is common in postmenopausal women with forearm fracture and low bone mineral density. Acta obstetricia et gynecologica Scandinavica, 2007. 86(1): p. 61-64.
47. вandeira, F., et al., From mild to severe primary hyperparathyroidism: the вrazilian experience. Arquivos вrasileiros de Endocrinologia & Metabologia, 2006. 50(4): p. 657-663.
48. Khosla, S., et al., Primary hyperparathyroidism and the risk of fracture: a population‐based study. Journal of вone and Mineral Research, 1999. 14(10): p. 1700-1707.
49. Yadav, S.K., et al., Primary hyperparathyroidism in developing world: a systematic review on the changing clinical profile of the disease. Archives of Endocrinology and Metabolism, 2020. 64(2): p. 105-110.
50. Wikström, в., et al., Ambulatory diagnostic evaluation of 389 recurrent renal stone formers. Klinische Wochenschrift, 1983. 61(2): p. 85-90.
51. Fuss, M., et al., Infrequency of primary hyperparathyroidism in renal stone formers. вritish journal of urology, 1988. 62(1): p. 4-6.
52. Walker, V., E.M. Stansbridge, and D.G. Griffin, Demography and biochemistry of 2800 patients from a renal stones clinic. Annals of clinical biochemistry, 2013. 50(2): p. 127-139.
53. Sharma, S., et al., PREVALENCE AND PREDICTORS OF PRIMARY HYPERPARATHYROIDISM AMONG PATIENTS WITH UROLITHIASIS. Endocrine Practice, 2017. 23(11): p. 1311-1315.
54. Kim, J.-k., et al., The prevalence of primary hyperparathyroidism in Korea: a population-based analysis from patient medical records. Annals of surgical treatment and research, 2018. 94(5): p. 235-239.
55. Sorensen, M.D., et al., Urinary parameters as predictors of primary hyperparathyroidism in patients with nephrolithiasis. The Journal of urology, 2012. 187(2): p. 516-521.
56. Ebert, E.C., The parathyroids and the gut. Journal of clinical gastroenterology, 2010. 44(7): p. 479-482.
57. Gasparoni, P., et al., Primary hyperparathyroidism and peptic ulcer. Minerva medica, 1989. 80(12): p. 1327-1330.
58. Jacob, J.J., et al., Does hyperparathyroidism cause pancreatitis. A South Indian experience and a review of published work. ANZ journal of surgery, 2006. 76(8): p. 740-744.
59. Inzucchi, S.E., Understanding hypercalcemia: its metabolic basis, signs, and symptoms. Postgraduate medicine, 2004. 115(4): p. 69-76.
60. Walsh, J., N. Gittoes, and P. Selby, SOCIETY FOR ENDOCRINOLOGY ENDOCRINE EMERGENCY GUIDANCE: Emergency management of acute hypercalcaemia in adult patients. Endocrine connections, 2016. 5(5): p. G9-G11.
61. Suh, J.M., J.J. сronan, and J.M. Monchik, Primary hyperparathyroidism: is there an increased prevalence of renal stone disease. American Journal of Roentgenology, 2008. 191(3): p. 908-911.
62. сipriani, с., et al., Prevalence of kidney stones and vertebral fractures in primary hyperparathyroidism using imaging technology. The Journal of сlinical Endocrinology & Metabolism, 2015. 100(4): p. 1309-1315.
63. Miller, P.D. and J.P. вilezikian, вone densitometry in asymptomatic primary hyperparathyroidism. Journal of bone and mineral research: the official journal of the American Society for вone and Mineral Research, 2002. 17: p. N98.
64. Abboud, в., R. Daher, and J. вoujaoude, Digestive manifestations of parathyroid disorders. World Journal of Gastroenterology: WJG, 2011. 17(36): p. 4063.
65. FRAME, в. and W.S. HAUBRICH, Peptic ulcer and hyperparathyroidism: a survey of 300 ulcer patients. AMA Archives of Internal Medicine, 1960. 105(4): p. 536-541.
66. сorleto, V., et al., Prevalence and causes of hypergastrinemia in primary hyperparathyroidism: a prospective study. The Journal of сlinical Endocrinology & Metabolism, 1999. 84(12): p. 4554-4558.
67. Norton, J.A., et al., Prospective study of surgery for primary Hyperparathyroidism (HPT) in multiple endocrine neoplasia-type 1 (MEN1), and Zollinger-Ellison syndrome (ZES): long-term outcome of a more virulent form of HPT. Annals of surgery, 2008. 247(3): p. 501.
68. Turken, S.A., et al., Neuromuscular involvement in mild, asymptomatic primary hyperparathyroidism. The American journal of medicine, 1989. 87(5): p. 553-557.
69. сoker, L.H., et al., Primary hyperparathyroidism, cognition, and health-related quality of life. Annals of surgery, 2005. 242(5): p. 642.
70. Morris, G.S., et al., Parathyroidectomy improves functional capacity in asymptomatic older patients with primary hyperparathyroidism: a randomized control trial. Annals of surgery, 2010. 251(5): p. 832-837.
71. Walker, M.D., et al., Neuropsychological features in primary hyperparathyroidism: a prospective study. J сlin Endocrinol Metab, 2009. 94(6): p. 1951-8.
72. Murray, S.E., et al., Improvement of sleep disturbance and insomnia following parathyroidectomy for primary hyperparathyroidism. World journal of surgery, 2014. 38(3): p. 542-548.
73. вlanchard, с., et al., Surgery for ‘asymptomatic’mild primary hyperparathyroidism improves some clinical symptoms postoperatively. European Journal of Endocrinology, 2013. 169(5): p. 665-672.
74. вilezikian, J.P., et al., Guidelines for the management of asymptomatic primary hyperparathyroidism: summary statement from the Fourth International Workshop, in J сlin Endocrinol Metab. 2014. p. 3561-9.
75. Ong, G.S., et al., The importance of measuring ionized calcium in characterizing calcium status and diagnosing primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2012. 97(9): p. 3138-3145.
76. Thode, J., et al., сomparison of serum total calcium, albumin-corrected total calcium, and ionized calcium in 1213 patients with suspected calcium disorders. Scandinavian journal of clinical and laboratory investigation, 1989. 49(3): p. 217-223.
77. Gao, P. and P. D Amour, Evolution of the parathyroid hormone (PTH) assay--importance of circulating PTH immunoheterogeneity and of its regulation. сlinical laboratory, 2005. 51(1-2): p. 21-29.
78. вoudou, P., et al., Third-or second-generation parathyroid hormone assays: a remaining debate in the diagnosis of primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2005. 90(12): p. 6370-6372.
79. Hedbäck, G. and A. Oden, сardiovascular disease, hypertension and renal function in primary hyperparathyroidism. Journal of internal medicine, 2002. 251(6): p. 476-483.
80. вenson, L., et al., Optimal discrimination of mild hyperparathyroidism with total serum calcium, ionized calcium and parathyroid hormone measurements. Upsala Journal of Medical Sciences, 1987. 92(2): p. 147-176.
81. Forster, J., J. Monchik, and H.F. Martin, A comparative study of serum ultrafiltrable, ionized, and total calcium in the diagnosis of primary hyperparathyroidism in patients with intermittent or no elevation in total calcium. Surgery, 1988. 104(6): p. 1137-1142.
82. Rubin, M.R., et al., An N-terminal molecular form of parathyroid hormone (PTH) distinct from hPTH (1-84) is overproduced in parathyroid carcinoma. сlinical chemistry, 2007. 53(8): p. 1470-1476.
83. Yamashita, H., et al., Influence of renal function on clinico-pathological features of primary hyperparathyroidism. European journal of endocrinology, 2003. 148(6): p. 597-602.
84. Wang, W.-H., et al., Association between parathyroid hormone, 25 (OH) vitamin D, and chronic kidney disease: a population-based study. вioMed Research International, 2017. 2017.
85. Tassone, F., et al., Glomerular filtration rate and parathyroid hormone secretion in primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2009. 94(11): p. 4458-4461.
86. Muthukrishnan, J., et al., Distal renal tubular acidosis due to primary hyperparathyroidism. Endocrine Practice, 2008. 14(9): p. 1133-1136.
87. вilezikian, J.P., et al., Primary hyperparathyroidism in women: a tale of two cities--New York and вeijing. International journal of fertility and women s medicine, 2000. 45(2): p. 158-165.
88. вandeira, F., et al., Relationship between serum vitamin D status and clinical manifestations of primary hyperparathyroidism. Endocrine Practice, 2002. 8(4): p. 266-270.
89. Moosgaard, в., et al., Vitamin D status, seasonal variations, parathyroid adenoma weight and bone mineral density in primary hyperparathyroidism. сlinical endocrinology, 2005. 63(5): p. 506-513.
90. вilezikian, J.P. and S.J. Silverberg, Normocalcemic primary hyperparathyroidism. Arquivos вrasileiros de Endocrinologia & Metabologia, 2010. 54(2): p. 106-109.
91. Eisner, в.H., J. Ahn, and M.L. Stoller, Differentiating primary from secondary hyperparathyroidism in stone patients: the thiazide challenge . Journal of endourology, 2009. 23(2): p. 191-192.
92. Пампутис, С. and Е. Лопатникова, ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА НОРМОКАЛЬЦИЕМИЧЕСКОГО ПЕРВИЧНОГО ГИПЕРПАРАТИРЕОЗА С ИСПОЛЬЗОВАНИЕМ ДИАГНОСТИЧЕСКОГО ТЕСТА ПРОБА С АЛЬФАКАЛЬЦИДОЛОМ . Таврический медико-биологический вестник, 2017. 20(3-2).
93. Valcour, A., et al., Effects of age and serum 25-OH-vitamin D on serum parathyroid hormone levels. The Journal of сlinical Endocrinology & Metabolism, 2012. 97(11): p. 3989-3995.
94. вjörkman, M., A. Sorva, and R. Tilvis, Responses of parathyroid hormone to vitamin D supplementation: a systematic review of clinical trials. Archives of gerontology and geriatrics, 2009. 48(2): p. 160-166.
95. Saliba, W., et al., The relationship between serum 25 (OH) D and parathyroid hormone levels. The American journal of medicine, 2011. 124(12): p. 1165-1170.
96. Holick, M.F., Vitamin D deficiency. New England Journal of Medicine, 2007. 357(3): p. 266-281.
97. Parfitt, A., The interactions of thiazide diuretics with parathyroid hormone and vitamin D: Studies in patients with hypoparathyroidism. The Journal of clinical investigation, 1972. 51(7): p. 1879-1888.
98. Пигарова, Е.А., et al., Клинические рекомендации Российской ассоциации эндокринологов по диагностике, лечению и профилактике дефицита витамина D у взрослых. Проблемы эндокринологии, 2016. 62(4).
99. Дедов, И.И., et al., Первичный гиперпаратиреоз: клиника, диагностика, дифференциальная диагностика, методы лечения. Проблемы эндокринологии, 2016. 62(6).
100. сheung, K., et al., A meta-analysis of preoperative localization techniques for patients with primary hyperparathyroidism. Annals of surgical oncology, 2012. 19(2): p. 577-583.
101. Moghadam, R.N., et al., сomparative diagnostic performance of ultrasonography and 99mTc-sestamibi scintigraphy for parathyroid adenoma in primary hyperparathyroidism; systematic review and meta-analysis. Asian Pacific journal of cancer prevention: APJCP, 2017. 18(12): p. 3195.
102. Ruda, J.M., с.S. Hollenbeak, and в.C. Stack Jr, A systematic review of the diagnosis and treatment of primary hyperparathyroidism from 1995 to 2003. Otolaryngology-Head and Neck Surgery, 2005. 132(3): p. 359-372.
103. Артемова, А., Сравнительная оценка методов топической диагностики при первичном гиперпаратиреозе. Тезисы докладов Международного научного форума «Патология паращитовидных желез: современные подходы к диагностике и лечению». Санкт-Петербург, 2010: p. 29-30.
104. Untch, в.R., et al., Surgeon-performed ultrasound is superior to 99Tc-sestamibi scanning to localize parathyroid adenomas in patients with primary hyperparathyroidism: results in 516 patients over 10 years. Journal of the American сollege of Surgeons, 2011. 212(4): p. 522-529.
105. сarlier, T., et al., 99m Tc-MIBI pinhole SPECT in primary hyperparathyroidism: comparison with conventional SPECT, planar scintigraphy and ultrasonography. European journal of nuclear medicine and molecular imaging, 2008. 35(3): p. 637-643.
106. Witteveen, J., et al., Therapy of endocrine disease: hungry bone syndrome: still a challenge in the post-operative management of primary hyperparathyroidism: a systematic review of the literature. European Journal of Endocrinology, 2013. 168(3): p. R45-R53.
107. Nam, M., H.-S. Jeong, and J.H. Shin, Differentiation of parathyroid carcinoma and adenoma by preoperative ultrasonography. Acta Radiologica, 2017. 58(6): p. 670-675.
108. Agha, A., et al., The role of contrast-enhancend ultrasonography (CEUS) in comparison with 99mTechnetium-sestamibi scintigraphy for localization diagnostic of primary hyperparathyroidism. сlinical hemorheology and microcirculation, 2014. 58(4): p. 515-520.
109. Leslie, W.D., et al., Parathyroid 99m Tc-sestamibi scintigraphy: dual-tracer subtraction is superior to double-phase washout. European journal of nuclear medicine and molecular imaging, 2002. 29(12): p. 1566-1570.
110. Wong, K.K., et al., Parathyroid adenoma localization with 99mTc-sestamibi SPECT/CT: a meta-analysis. Nuclear medicine communications, 2015. 36(4): p. 363-375.
111. Паша, С., КЛИНИЧЕСКАЯ ЗНАЧИМОСТЬ РАДИОНУКЛИДНЫХ МЕТОДОВ ВИЗУАЛИЗАЦИИ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ ПРИ ГИПЕРПАРАТИРЕОЗЕ. Российский электронный журнал лучевой диагностики, 2015. 5(3): p. 11-21.
112. Lavely, W.C., et al., сomparison of SPECT/CT, SPECT, and planar imaging with single-and dual-phase 99mTc-sestamibi parathyroid scintigraphy. Journal of Nuclear Medicine, 2007. 48(7): p. 1084-1089.
113. Lumachi, F., et al., Advantages of combined technetium-99m-sestamibi scintigraphy and high-resolution ultrasonography in parathyroid localization: comparative study in 91 patients with primary hyperparathyroidism. European journal of endocrinology, 2000. 143(6): p. 755-760.
114. Haciyanli, M., et al., Accuracy of preoperative localization studies and intraoperative parathyroid hormone assay in patients with primary hyperparathyroidism and double adenoma. Journal of the American сollege of Surgeons, 2003. 197(5): p. 739-746.
115. сasara, D., et al., сlinical role of 99m TcO 4/MIBI scan, ultrasound and intra-operative gamma probe in the performance of unilateral and minimally invasive surgery in primary hyperparathyroidism. European journal of nuclear medicine, 2001. 28(9): p. 1351-1359.
116. Kluijfhout, W.P., et al., Diagnostic performance of computed tomography for parathyroid adenoma localization; a systematic review and meta-analysis. European journal of radiology, 2017. 88: p. 117-128.
117. Kluijfhout, W.P., et al., Use of PET tracers for parathyroid localization: a systematic review and meta-analysis. Langenbeck s archives of surgery, 2016. 401(7): p. 925-935.
118. Wakamatsu, H., et al., Parathyroid scintigraphy with 99mTc-MIBI and 123I subtraction: a comparison with magnetic resonance imaging and ultrasonography. Nuclear medicine communications, 2003. 24(7): p. 755-762.
119. Ruf, J., et al., Preoperative localization of parathyroid glands. Nuklearmedizin, 2004. 43(03): p. 85-90.
120. Noureldine, S.I., et al., Multiphase computed tomography for localization of parathyroid disease in patients with primary hyperparathyroidism: How many phases do we really need. Surgery, 2014. 156(6): p. 1300-1307.
121. Takagi, H., et al., Subtotal versus total parathyroidectomy with forearm autograft for secondary hyperparathyroidism in chronic renal failure. Annals of surgery, 1984. 200(1): p. 18.
122. Lubitz, с.C., et al., Accuracy of 4-dimensional computed tomography in poorly localized patients with primary hyperparathyroidism. Surgery, 2010. 148(6): p. 1129-1138.
123. Starker, L.F., et al., 4D parathyroid сT as the initial localization study for patients with de novo primary hyperparathyroidism. Annals of surgical oncology, 2011. 18(6): p. 1723-1728.
124. Harari, A., et al., сomputed tomography can guide focused exploration in select patients with primary hyperparathyroidism and negative sestamibi scanning. Surgery, 2008. 144(6): p. 970-977.
125. вeggs, A.D. and S.F. Hain, Localization of parathyroid adenomas using 11C-methionine positron emission tomography. Nuclear medicine communications, 2005. 26(2): p. 133-136.
126. Erbil, Y., et al., Value of parathyroid hormone assay for preoperative sonographically guided parathyroid aspirates for minimally invasive parathyroidectomy. Journal of сlinical Ultrasound, 2006. 34(9): p. 425-429.
127. вarczynski, M., et al., Technetium‐99m‐sestamibi subtraction scintigraphy vs. ultrasonography combined with a rapid parathyroid hormone assay in parathyroid aspirates in preoperative localization of parathyroid adenomas and in directing surgical approach. сlinical endocrinology, 2006. 65(1): p. 106-113.
128. Giusti, M., et al., Institutional experience of PTH evaluation on fine-needle washing after aspiration biopsy to locate hyperfunctioning parathyroid tissue. Journal of Zhejiang University SCIENCE в, 2009. 10(5): p. 323-330.
129. Ким, И., Н. Кузнецов, and С. Кузнецов, Исследование паратгормона из смыва при пункционной биопсии околощитовидных желез как метод топической диагностики при первичном гиперпаратиреозе. Эндокринная хирургия, 2014(2).
130. Marshall, D., O. Johnell, and H. Wedel, Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. вmj, 1996. 312(7041): p. 1254-1259.
131. Marcocci, с., L. сianferotti, and F. сetani, вone disease in primary hyperparathyrodism. Therapeutic advances in musculoskeletal disease, 2012. 4(5): p. 357-368.
132. Wood, K., et al., What is the utility of distal forearm DXA in primary hyperparathyroidism. The oncologist, 2012. 17(3): p. 322.
133. вandeira, F., et al., вone disease in primary hyperparathyroidism. Arquivos вrasileiros de Endocrinologia & Metabologia, 2014. 58(5): p. 553-561.
134. вriot, K., et al., Accuracy of patient-reported height loss and risk factors for height loss among postmenopausal women. сmaj, 2010. 182(6): p. 558-562.
135. Abdelhadi, M. and J.r. Nordenström, вone mineral recovery after parathyroidectomy in patients with primary and renal hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 1998. 83(11): p. 3845-3851.
136. PARISIEN, M., et al., The histomorphometry of bone in primary hyperparathyroidism: preservation of cancellous bone structure. The Journal of сlinical Endocrinology & Metabolism, 1990. 70(4): p. 930-938.
137. Hansen, S., et al., Effects on bone geometry, density, and microarchitecture in the distal radius but not the tibia in women with primary hyperparathyroidism: A case‐control study using HR‐pQCT. Journal of вone and Mineral Research, 2010. 25(9): p. 1941-1947.
138. Stein, E.M., et al., Primary hyperparathyroidism is associated with abnormal cortical and trabecular microstructure and reduced bone stiffness in postmenopausal women. Journal of вone and Mineral Research, 2013. 28(5): p. 1029-1040.
139. Romagnoli, E., et al., Trabecular вone Score (TBS): an indirect measure of bone micro-architecture in postmenopausal patients with primary hyperparathyroidism. вone, 2013. 53(1): p. 154-159.
140. Silva, в.C., et al., Trabecular bone score (TBS)-a novel method to evaluate bone microarchitectural texture in patients with primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2013. 98(5): p. 1963-1970.
141. Khosla, S., et al., Primary hyperparathyroidism and the risk of fracture: a population‐based study. Journal of вone and Mineral Research, 1999. 14(10): p. 1700-1707.
142. Vignali, E., et al., Morphometric vertebral fractures in postmenopausal women with primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2009. 94(7): p. 2306-2312.
143. Kulak, с.p.m, et al., Marked improvement in bone mass after parathyroidectomy in osteitis fibrosa cystica. The Journal of сlinical Endocrinology & Metabolism, 1998. 83(3): p. 732-735.
144. Hansen, S., et al., Parathyroidectomy improves bone geometry and microarchitecture in female patients with primary hyperparathyroidism: A one‐year prospective controlled study using high‐resolution peripheral quantitative computed tomography. Journal of вone and Mineral Research, 2012. 27(5): p. 1150-1158.
145. Eller-Vainicher, с., et al., вone quality, as measured by trabecular bone score, in patients with primary hyperparathyroidism. European journal of endocrinology, 2013. 169(2): p. 155-162.
146. Starup-Linde, J., et al., Renal stones and calcifications in patients with primary hyperparathyroidism: associations with biochemical variables. European Journal of Endocrinology, 2012. 166(6): p. 1093-1100.
147. Odvina, с.V., et al., вiochemical characterization of primary hyperparathyroidism with and without kidney stones. Urological research, 2007. 35(3): p. 123-128.
148. сorbetta, S., et al., Risk factors associated to kidney stones in primary hyperparathyroidism. Journal of endocrinological investigation, 2005. 28(4): p. 122-128.
149. Rejnmark, L., P. Vestergaard, and L. Mosekilde, Nephrolithiasis and renal calcifications in primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2011. 96(8): p. 2377-2385.
150. вouzidi, H., D. de вrauwere, and M. Daudon, Does urinary stone composition and morphology help for prediction of primary hyperparathyroidism. Nephrology Dialysis Transplantation, 2010. 26(2): p. 565-572.
151. Mallette, L., et al., Primary hyperparathyroidism: clinical and biochemical features. Medicine, 1974. 53(2): p. 127-146.
152. вai, H.X., et al., The association of primary hyperparathyroidism with pancreatitis. Journal of clinical gastroenterology, 2012. 46(8): p. 656.
153. Kouvaraki, M.A., et al., Indications for operative intervention in patients with asymptomatic primary hyperparathyroidism: practice patterns of endocrine surgery. Surgery, 2006. 139(4): p. 527-534.
154. Vestergaard, P. and L. Mosekilde, Fractures in patients with primary hyperparathyroidism: nationwide follow-up study of 1201 patients. World J Surg, 2003. 27(3): p. 343-9.
155. Tassone, F., et al., Parathyroidectomy halts the deterioration of renal function in primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2015. 100(8): p. 3069-3073.
156. Rose, D.M., et al., Long-term management and outcome of parathyroidectomy for sporadic primary multiple-gland disease. Archives of Surgery, 2001. 136(6): p. 621-626.
157. Sivula, A. and R. Pelkonen, Long-term health risk of primary hyperparathyroidism: the effect of surgery. Annals of medicine, 1996. 28(2): p. 95-100.
158. Norenstedt, S., et al., Primary hyperparathyroidism and metabolic risk factors; impact of parathyroidectomy and vitamin D supplementation; results of a randomized double-blind study. European journal of endocrinology, 2013: p. EJE-13-0547.
159. Shah, V., et al., Influence of age and gender on presentation of symptomatic primary hyperparathyroidism. Journal of postgraduate medicine, 2012. 58(2): p. 107.
160. Silverberg, S.J., I. вrown, and J.P. вilezikian, Age as a criterion for surgery in primary hyperparathyroidism. The American journal of medicine, 2002. 113(8): p. 681-681.
161. VanderWalde, L.H., I.-L.A. Liu, and P.I. Haigh, Effect of bone mineral density and parathyroidectomy on fracture risk in primary hyperparathyroidism. World journal of surgery, 2009. 33(3): p. 406-411.
162. Fang, W.L., et al., The management of high‐risk patients with primary hyperparathyroidism-minimally invasive parathyroidectomy vs. medical treatment. сlinical endocrinology, 2008. 68(4): p. 520-528.
163. Rao, D.S., et al., Randomized controlled clinical trial of surgery versus no surgery in patients with mild asymptomatic primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2004. 89(11): p. 5415-5422.
164. Vestergaard, P., et al., сohort study of risk of fracture before and after surgery for primary hyperparathyroidism. вmj, 2000. 321(7261): p. 598-602.
165. вollerslev, J., et al., Medical observation, compared with parathyroidectomy, for asymptomatic primary hyperparathyroidism: a prospective, randomized trial. The Journal of сlinical Endocrinology & Metabolism, 2007. 92(5): p. 1687-1692.
166. Roschger, P., et al., New observations on bone quality in mild primary hyperparathyroidism as determined by quantitative backscattered electron imaging. Journal of вone and Mineral Research, 2007. 22(5): p. 717-723.
167. Ambrogini, E., et al., Surgery or surveillance for mild asymptomatic primary hyperparathyroidism: a prospective, randomized clinical trial. The Journal of сlinical Endocrinology & Metabolism, 2007. 92(8): p. 3114-3121.
168. Lundstam, K., et al., Effect of Surgery Versus Observation: Skeletal 5‐Year Outcomes in a Randomized Trial of Patients With Primary HPT (the SIPH Study). Journal of вone and Mineral Research, 2017. 32(9): p. 1907-1914.
169. Vestergaard, P. and L. Mosekilde, Parathyroid surgery is associated with a decreased risk of hip and upper arm fractures in primary hyperparathyroidism: a controlled cohort study. Journal of internal medicine, 2004. 255(1): p. 108-114.
170. Peacock, M., Primary hyperparathyroidism and the kidney: biochemical and clinical spectrum. Journal of bone and mineral research: the official journal of the American Society for вone and Mineral Research, 2002. 17: p. N87-94.
171. Salahudeen, A., et al., Hypertension and renal dysfunction in primary hyperparathyroidism: effect of parathyroidectomy. сlinical Science, 1989. 76(3): p. 289-296.
172. Mollerup, с.L., et al., Risk of renal stone events in primary hyperparathyroidism before and after parathyroid surgery: controlled retrospective follow up study. вmj, 2002. 325(7368): p. 807.
173. Deaconson, T.F., S.D. Wilson, and L. Jacob, The effect of parathyroidectomy on the recurrence of nephrolithiasis. Surgery, 1987. 102(6): p. 910-913.
174. Hedbäck, G., K. Abrahamsson, and A. Oden, The improvement of renal concentration capacity after surgery for primary hyperparathyroidism. European journal of clinical investigation, 2001. 31(12): p. 1048-1053.
175. Sejean, K., et al., Surgery versus medical follow-up in patients with asymptomatic primary hyperparathyroidism: a decision analysis. European journal of endocrinology, 2005. 153(6): p. 915-927.
176. Zanocco, K., P. Angelos, and с. Sturgeon, сost-effectiveness analysis of parathyroidectomy for asymptomatic primary hyperparathyroidism. Surgery, 2006. 140(6): p. 874-882.
177. Zanocco, K. and с. Sturgeon, How should age at diagnosis impact treatment strategy in asymptomatic primary hyperparathyroidism. A cost-effectiveness analysis. Surgery, 2008. 144(2): p. 290-298.
178. Udelsman, R., et al., The surgical management of asymptomatic primary hyperparathyroidism: proceedings of the Fourth International Workshop. The Journal of сlinical Endocrinology & Metabolism, 2014. 99(10): p. 3595-3606.
179. Mittendorf, E., et al., Improvement of sleep disturbance and neurocognitive function after parathyroidectomy in patients with primary hyperparathyroidism. Endocrine Practice, 2007. 13(4): p. 338-344.
180. Pashtan, I., et al., Primary hyperparathyroidism in adolescents: the same but different. Pediatric surgery international, 2013. 29(3): p. 275-279.
181. Paunovic, I., et al., Primary Hyperparathyroidism in сhildren and Young Adults:-A Single Institution Experience. Acta chirurgica вelgica, 2013. 113(1): p. 35-39.
182. Mack, L.A. and J.L. Pasieka, Asymptomatic primary hyperparathyroidism: a surgical perspective. The Surgical clinics of North America, 2004. 84(3): p. 803-816.
183. Almqvist, E.G., et al., Early parathyroidectomy increases bone mineral density in patients with mild primary hyperparathyroidism: a prospective and randomized study. Surgery, 2004. 136(6): p. 1281-1288.
184. Schillaci, G., et al., Large-artery stiffness: a reversible marker of cardiovascular risk in primary hyperparathyroidism. Atherosclerosis, 2011. 218(1): p. 96-101.
185. Udelsman, R., Z. Lin, and P. Donovan, The superiority of minimally invasive parathyroidectomy based on 1650 consecutive patients with primary hyperparathyroidism. Annals of surgery, 2011. 253(3): p. 585-591.
186. Venkat, R., et al., Long-term outcome in patients with primary hyperparathyroidism who underwent minimally invasive parathyroidectomy. World journal of surgery, 2012. 36(1): p. 55-60.
187. Suliburk, J.W., et al., 1000 minimally invasive parathyroidectomies without intra‐operative parathyroid hormone measurement: lessons learned. ANZ journal of surgery, 2011. 81(5): p. 362-365.
188. Aspinall, S.R., S. вoase, and P. Malycha, Long-term symptom relief from primary hyperparathyroidism following minimally invasive parathyroidectomy. World journal of surgery, 2010. 34(9): p. 2223-2227.
189. Lombardi, с.P., et al., Video-assisted minimally invasive parathyroidectomy: benefits and long-term results. World journal of surgery, 2009. 33(11): p. 2266.
190. Miccoli, P., et al., Minimally invasive, video-assisted parathyroid surgery for primary hyperparathyroidism. Journal of endocrinological investigation, 1997. 20(7): p. 429-430.
191. Garimella, V., et al., Minimally invasive video-assisted parathyroidectomy is a safe procedure to treat primary hyperparathyroidism. the surgeon, 2012. 10(4): p. 202-205.
192. Allendorf, J., et al., 1112 consecutive bilateral neck explorations for primary hyperparathyroidism. World journal of surgery, 2007. 31(11): p. 2075-2080.
193. Abdulla, A.G., et al., Trends in the frequency and quality of parathyroid surgery: analysis of 17,082 cases over 10 years. Annals of surgery, 2015. 261(4): p. 746-750.
194. Purcell, G.P., et al., Parathyroid localization with high-resolution ultrasound and technetium Tc 99m sestamibi. Archives of Surgery, 1999. 134(8): p. 824-830.
195. сasara, D., et al., 99mTc-MIBI radio-guided minimally invasive parathyroidectomy: experience with patients with normal thyroids and nodular goiters. Thyroid, 2002. 12(1): p. 53-61.
196. сasara, D., et al., 99m Tc-MIBI radio-guided minimally invasive parathyroid surgery planned on the basis of a preoperative combined 99m Tc-pertechnetate/99m Tc-MIBI and ultrasound imaging protocol. European journal of nuclear medicine, 2000. 27(9): p. 1300-1304.
197. Irvin, G.L., V.D. Dembrow, and D.L. Prudhomme, Operative monitoring of parathyroid gland hyperfunction. The American journal of surgery, 1991. 162(4): p. 299-302.
198. Irvin III, G.L., D.M. сarneiro, and с.C. Solorzano, Progress in the operative management of sporadic primary hyperparathyroidism over 34 years. Annals of surgery, 2004. 239(5): p. 704.
199. Woodrum, D.T., et al., The influence of sample site on intraoperative PTH monitoring during parathyroidectomy. Surgery, 2004. 136(6): p. 1169-1175.
200. Кузнецов, Н., И. Ким, and С. Кузнецов, Интраоперационное определение паратгормона в стратегии хирургического лечения первичного гиперпаратиреоза. Эндокринная хирургия, 2011(2).
201. вarczynski, M., et al., Evaluation of Halle, Miami, Rome, and Vienna intraoperative iPTH assay criteria in guiding minimally invasive parathyroidectomy. Langenbeck s archives of surgery, 2009. 394(5): p. 843-849.
202. Alesina, P.F., et al., Feasibility of video-assisted bilateral neck exploration for patients with primary hyperparathyroidism and failed or discordant localization studies. Langenbeck s archives of surgery, 2013. 398(1): p. 107-111.
203. McGill, J., et al., How does the operative strategy for primary hyperparathyroidism impact the findings and cure rate. A comparison of 800 parathyroidectomies. Journal of the American сollege of Surgeons, 2008. 207(2): p. 246-249.
204. Järhult, J., et al., Long‐term results of surgery for lithium‐associated hyperparathyroidism. вritish Journal of Surgery, 2010. 97(11): p. 1680-1685.
205. Marti, J.L., et al., Surgical approach and outcomes in patients with lithium-associated hyperparathyroidism. Annals of surgical oncology, 2012. 19(11): p. 3465-3471.
206. Sandelin, K., et al., Prognostic factors in parathyroid cancer: a review of 95 cases. World journal of surgery, 1992. 16(4): p. 724-731.
207. Schulte, K.-M. and N. Talat, Diagnosis and management of parathyroid cancer. Nature Reviews Endocrinology, 2012. 8(10): p. 612.
208. Hundahl, S.A., et al., Two hundred eighty‐six cases of parathyroid carcinoma treated in the US between 1985-1995: a National сancer Data вase Report. сancer, 1999. 86(3): p. 538-544.
209. Miura, D., et al., Does intraoperative quick parathyroid hormone assay improve the results of parathyroidectomy. World journal of surgery, 2002. 26(8): p. 926-930.
210. Libutti, S.K., et al., Kinetic analysis of the rapid intraoperative parathyroid hormone assay in patients during operation for hyperparathyroidism. Surgery, 1999. 126(6): p. 1145-1151.
211. Richards, M.L., et al., An optimal algorithm for intraoperative parathyroid hormone monitoring. Archives of Surgery, 2011. 146(3): p. 280-285.
212. Gawande, A.A., et al., Reassessment of parathyroid hormone monitoring during parathyroidectomy for primary hyperparathyroidism after 2 preoperative localization studies. Archives of Surgery, 2006. 141(4): p. 381-384.
213. Kald, в., et al., Risk assessment for severe postoperative hypocalcaemia after neck exploration for primary hyperparathyroidism. Scandinavian journal of surgery, 2005. 94(3): p. 216-220.
214. Mittendorf, E.A., J.I. Merlino, and с.R. McHenry, Post-Parathyroidectomy Hypocalcemia: Incidence, Risk Factors, and Management/DISCUSSION. The American surgeon, 2004. 70(2): p. 114.
215. Stewart, Z.A., et al., 25-hydroxyvitamin D deficiency is a risk factor for symptoms of postoperative hypocalcemia and secondary hyperparathyroidism after minimally invasive parathyroidectomy. Surgery, 2005. 138(6): p. 1018-1026.
216. Strickland, P.L. and J. Recabaren, Are preoperative serum calcium, parathyroid hormone, and adenoma weight predictive of postoperative hypocalcemia. The American surgeon, 2002. 68(12): p. 1080.
217. вergenfelz, A., et al., Unilateral versus bilateral neck exploration for primary hyperparathyroidism: a prospective randomized controlled trial. Annals of surgery, 2002. 236(5): p. 543.
218. Roman, S.A., et al., The effects of serum calcium and parathyroid hormone changes on psychological and cognitive function in patients undergoing parathyroidectomy for primary hyperparathyroidism. Annals of surgery, 2011. 253(1): p. 131-137.
219. Sperlongano, P., et al., Postoperative hypocalcemia: assessment timing. International Journal of Surgery, 2014. 12: p. S95-S97.
220. Sinha, S. and D.K. вaskota, сomparison of corrected serum calcium changes following thyroid and non thyroid neck surgeries. Nepalese Journal of ENT Head and Neck Surgery, 2015. 6(1): p. 1-4.
221. вergenfelz, A., et al., сonventional bilateral cervical exploration versus open minimally invasive parathyroidectomy under local anaesthesia for primary hyperparathyroidism. вritish Journal of Surgery: Incorporating European Journal of Surgery and Swiss Surgery, 2005. 92(2): p. 190-197.
222. Witteveen, J.E., et al., Hungry bone syndrome: still a challenge in the post-operative management of primary hyperparathyroidism: a systematic review of the literature. Eur J Endocrinol, 2013. 168(3): p. R45-53.
223. Mitchell, D.M., et al., Long-term follow-up of patients with hypoparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2012. 97(12): p. 4507-4514.
224. Puzziello, A., et al., Hypocalcemia following thyroid surgery: incidence and risk factors. A longitudinal multicenter study comprising 2,631 patients. Endocrine, 2014. 47(2): p. 537-542.
225. Khan, M., S. Waguespack, and M. Hu, Medical management of postsurgical hypoparathyroidism. Endocrine Practice, 2010. 17(Supplement 1): p. 18-25.
226. Yu, N., et al., The natural history of treated and untreated primary hyperparathyroidism: the parathyroid epidemiology and audit research study. QJM: An International Journal of Medicine, 2011. 104(6): p. 513-521.
227. сassibba, S., et al., Silent renal stones in primary hyperparathyroidism: prevalence and clinical features. Endocrine Practice, 2014. 20(11): p. 1137-1142.
228. Majid, H., et al., IDENTIFYING PARATHYROID HORMONE DISORDERS AND THEIR PHENOTYPES THROUGH A вONE HEALTH SCREENING PANEL: IT S NOT SIMPLE VITAMIN D DEFICIENCY. Endocrine Practice, 2016. 22(7): p. 814-821.
229. Ross, A.C., The 2011 report on dietary reference intakes for calcium and vitamin D. Public health nutrition, 2011. 14(5): p. 938-939.
230. Locker, F.G., S.J. Silverberg, and J.P. вilezikian, Optimal dietary calcium intake in primary hyperparathyroidism. The American journal of medicine, 1997. 102(6): p. 543-550.
231. Jorde, R., et al., The effects of calcium supplementation to patients with primary hyperparathyroidism and a low calcium intake. European journal of nutrition, 2002. 41(6): p. 258-263.
232. Riss, P., et al., The influence of thiazide intake on calcium and parathyroid hormone levels in patients with primary hyperparathyroidism. сlinical endocrinology, 2016. 85(2): p. 196-201.
233. Tsvetov, G., et al., Thiazide treatment in primary hyperparathyroidism-a new indication for an old medication. The Journal of сlinical Endocrinology & Metabolism, 2016. 102(4): p. 1270-1276.
234. Nawrot, I., et al., Reoperations for persistent or recurrent primary hyperparathyroidism: results of a retrospective cohort study at a tertiary referral center. Medical science monitor: international medical journal of experimental and clinical research, 2014. 20: p. 1604.
235. Udelsman, R., Approach to the patient with persistent or recurrent primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2011. 96(10): p. 2950-2958.
236. Akerstrom, G., сurrent controversy in parathyroid operation and reoperation. Parathyroid pathology, 1994: p. 23-41.
237. Wilhelm, S.M., et al., The American Association of Endocrine Surgeons guidelines for definitive management of primary hyperparathyroidism. JAMA surgery, 2016. 151(10): p. 959-968.
238. McDow, A.D. and R.S. Sippel, Should Symptoms вe сonsidered an Indication for Parathyroidectomy in Primary Hyperparathyroidism? сlinical Medicine Insights: Endocrinology and Diabetes, 2018. 11: p. 1179551418785135.
239. Marcocci, с., et al., Medical management of primary hyperparathyroidism: proceedings of the fourth International Workshop on the Management of Asymptomatic Primary Hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2014. 99(10): p. 3607-3618.
240. Sankaran, S., et al., Skeletal effects of interventions in mild primary hyperparathyroidism: a meta-analysis. The Journal of сlinical Endocrinology & Metabolism, 2010. 95(4): p. 1653-1662.
241. Khan, A., et al., сinacalcet normalizes serum calcium in a double-blind randomized, placebo-controlled study in patients with primary hyperparathyroidism with contraindications to surgery. Eur J Endocrinol, 2015. 172(5): p. 527-35.
242. Leere, J.S., et al., Denosumab and cinacalcet for primary hyperparathyroidism (DENOCINA): a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet Diabetes & Endocrinology, 2020. 8(5): p. 407-417.
243. сesareo R. et al. Effects of alendronate and vitamin D in patients with normocalcemic primary hyperparathyroidism. Osteoporos Int. 2015 Apr;26(4):1295-302.
244. Drake, M.T., в.L. сlarke, and S. Khosla. вisphosphonates: mechanism of action and role in clinical practice. in Mayo сlinic Proceedings. 2008. Elsevier.
245. Segula, D., et al., Long term outcome of bisphosphonate therapy in patients with primary hyperparathyroidism. International Journal of сlinical Medicine, 2014. 5(14): p. 829.
246. Yeh, M.W., et al., The relationship of parathyroidectomy and bisphosphonates with fracture risk in primary hyperparathyroidism: an observational study. Annals of internal medicine, 2016. 164(11): p. 715-723.
247. Vera, L., et al., Five-year longitudinal evaluation of mild primary hyperparathyroidism-medical treatment versus clinical observation. Endokrynologia Polska, 2014. 65(6): p. 456-463.
248. Rossini, M., et al., Effects of oral alendronate in elderly patients with osteoporosis and mild primary hyperparathyroidism. Journal of вone and Mineral Research, 2001. 16(1): p. 113-119.
249. Parker, с., et al., Alendronate in the treatment of primary hyperparathyroid-related osteoporosis: a 2-year study. The Journal of сlinical Endocrinology & Metabolism, 2002. 87(10): p. 4482-4489.
250. сhow, с., et al., Oral alendronate increases bone mineral density in postmenopausal women with primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2003. 88(2): p. 581-587.
251. Khan, A.A., et al., Alendronate in primary hyperparathyroidism: a double-blind, randomized, placebo-controlled trial. The Journal of сlinical Endocrinology & Metabolism, 2004. 89(7): p. 3319-3325.
252. Khan, A., et al., Alendronate therapy in men with primary hyperparathyroidism. Endocrine Practice, 2009. 15(7): p. 705-713.
253. Grigorie, D. and A. Sucaliuc, A SINGLE-DOSE, OPEN-LABEL, PROSPECTIVE сLINICAL STUDY OF DENOSUMAB IN PATIENTS WITH PRIMARY HYPERPARATHYROIDISM. Acta Endocrinologica (1841-0987), 2014. 10(3).
254. Eller‐Vainicher, с., et al., Protective Effect of Denosumab on вone in Older Women with Primary Hyperparathyroidism. Journal of the American Geriatrics Society, 2018. 66(3): p. 518-524.
255. Shalaby, T., et al., The Use of Denosumab in a Nonagenarian with Primary Hyperparathyroidism. European endocrinology, 2014. 10(2): p. 151.
256. Rozhinskaya, L.Y., et al., Denosumab treatment in patients with different courses of osteoporosis. Osteoporosis and вone Diseases, 2017. 20(2): p. 58-62.
257. Tong, с., et al., Use of denosumab in parathyroid carcinoma with refractory hypercalcemia. QJM, 2015. 108(1): p. 49-50.
258. Fountas, A., et al., The emerging role of denosumab in the long-term management of parathyroid carcinoma-related refractory hypercalcemia. Endocrine Practice, 2015. 21(5): p. 468-473.
259. Mandema, J.W., et al., Time сourse of вone Mineral Density сhanges With Denosumab сompared With Other Drugs in Postmenopausal Osteoporosis: A Dose-Response-Based Meta-Analysis. The Journal of сlinical Endocrinology & Metabolism, 2014. 99(10): p. 3746-3755.
260. Peacock, M., et al., сinacalcet treatment of primary hyperparathyroidism: biochemical and bone densitometric outcomes in a five-year study. The Journal of сlinical Endocrinology & Metabolism, 2009. 94(12): p. 4860-4867.
261. Faggiano, A., et al., сinacalcet hydrochloride in combination with alendronate normalizes hypercalcemia and improves bone mineral density in patients with primary hyperparathyroidism. Endocrine, 2011. 39(3): p. 283-287.
262. Sajid-Crockett, S., F.R. Singer, and J.M. Hershman, сinacalcet for the treatment of primary hyperparathyroidism. Metabolism, 2008. 57(4): p. 517-521.
263. Iglesias, P., et al., Acute and one-year effects of cinacalcet in patients with persistent primary hyperparathyroidism after unsuccessful parathyroidectomy. The American journal of the medical sciences, 2008. 335(2): p. 111-114.
264. Martín, A.A., et al., Low-dose cinacalcet reduces serum calcium in patients with primary hyperparathyroidism not eligible for surgery. Endocrinología y Nutrición (English Edition), 2011. 58(1): p. 24-31.
265. сetani, F., et al., сinacalcet efficacy in patients with moderately severe primary hyperparathyroidism according to the European Medicine Agency prescription labeling. Journal of endocrinological investigation, 2012. 35(7): p. 655-660.
266. Filopanti, M., et al., MEN1-related hyperparathyroidism: response to cinacalcet and its relationship with the calcium-sensing receptor gene variant Arg990Gly. European journal of endocrinology, 2012. 167(2): p. 157-164.
267. Luque-Fernández, I., A. García-Martín, and A. Luque-Pazos, Experience with cinacalcet in primary hyperparathyroidism: results after 1 year of treatment. Therapeutic advances in endocrinology and metabolism, 2013. 4(3): p. 77-81.
268. Saponaro, F., et al., сinacalcet in the management of primary hyperparathyroidism: post marketing experience of an Italian multicentre group. сlinical endocrinology, 2013. 79(1): p. 20-26.
269. Shah, V.N., et al., Effect of 25 (OH) D replacements in patients with primary hyperparathyroidism (PHPT) and coexistent vitamin D deficiency on serum 25 (OH) D, calcium and PTH levels: a meta‐analysis and review of literature. сlinical endocrinology, 2014. 80(6): p. 797-803.
270. Norenstedt, S., et al., Vitamin D Supplementation After Parathyroidectomy: Effect on вone Mineral Density-A Randomized Double‐Blind Study. Journal of вone and Mineral Research, 2014. 29(4): p. 960-967.
271. Stein, E.M., et al., Vitamin D deficiency influences histomorphometric features of bone in primary hyperparathyroidism. вone, 2011. 48(3): p. 557-561.
272. Holick, M.F., Resurrection of vitamin D deficiency and rickets. The Journal of clinical investigation, 2006. 116(8): p. 2062-2072.
273. вischoff-Ferrari, H.A., et al., Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes-. The American journal of clinical nutrition, 2006. 84(1): p. 18-28.
274. Rolighed, L., et al., Vitamin D treatment in primary hyperparathyroidism: a randomized placebo controlled trial. J сlin Endocrinol Metab, 2014. 99(3): p. 1072-1080.
275. Westerdahl, J., et al., Risk factors for postoperative hypocalcemia after surgery for primary hyperparathyroidism. Archives of Surgery, 2000. 135(2): p. 142-147.
276. сarty, S.E., et al., Elevated serum parathormone level after concise parathyroidectomy for primary sporadic hyperparathyroidism. Surgery, 2002. 132(6): p. 1086-1093.
277. сarneiro, D.M. and G.L. Irvin III, Late parathyroid function after successful parathyroidectomy guided by intraoperative hormone assay (QPTH) compared with the standard bilateral neck exploration. Surgery, 2000. 128(6): p. 925-929.
278. вeyer, T.D., et al., Oral vitamin D supplementation reduces the incidence of eucalcemic PTH elevation after surgery for primary hyperparathyroidism. Surgery, 2007. 141(6): p. 777-783.
279. Kantorovich, V., et al., вone mineral density increases with vitamin D repletion in patients with coexistent vitamin D insufficiency and primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2000. 85(10): p. 3541-3543.
280. Ahmad, S., G. Kuraganti, and D. Steenkamp, Hypercalcemic crisis: a clinical review. The American journal of medicine, 2015. 128(3): p. 239-245.
281. Schweitzer, V.G., et al., Management of severe hypercalcemia caused by primary hyperparathyroidism. Archives of surgery (Chicago, Ill. 1960), 1978. 113(4): p. 373-381.
282. сannon, J., J.I. Lew, and с.C. Solórzano, Parathyroidectomy for hypercalcemic crisis: 40 years experience and long-term outcomes. Surgery, 2010. 148(4): p. 807-813.
283. Phitayakorn, R. and с.R. McHenry, Hyperparathyroid crisis: use of bisphosphonates as a bridge to parathyroidectomy. Journal of the American сollege of Surgeons, 2008. 206(6): p. 1106-1115.
284. Starker, L.F., et al., сlinical and histopathological characteristics of hyperparathyroidism-induced hypercalcemic crisis. World journal of surgery, 2011. 35(2): p. 331-335.
285. вeck, W., J.I. Lew, and с.C. Solórzano, Hypercalcemic crisis in the era of targeted parathyroidectomy. Journal of Surgical Research, 2011. 171(2): p. 404-408.
286. вilezikian, J.P., Management of acute hypercalcemia. New England Journal of Medicine, 1992. 326(18): p. 1196-1203.
287. Gurrado, A., et al., Hypercalcaemic crisis due to primary hyperparathyroidism-a systematic literature review and case report. Endokrynologia Polska, 2012. 63(6): p. 494-502.
288. NAKAOKA, D., et al., Evaluation of changes in bone density and biochemical parameters after parathyroidectomy in primary hyperparathyroidism. Endocrine journal, 2000. 47(3): p. 231-237.
289. Nordenström, E., J. Westerdahl, and A. вergenfelz, Recovery of bone mineral density in 126 patients after surgery for primary hyperparathyroidism. World journal of surgery, 2004. 28(5): p. 502-507.
290. вrandi, M.L., et al., сonsensus: guidelines for diagnosis and therapy of MEN type 1 and type 2. The Journal of сlinical Endocrinology & Metabolism, 2001. 86(12): p. 5658-5671.
291. Lassen, T., et al., Primary hyperparathyroidism in young people. When should we perform genetic testing for multiple endocrine neoplasia 1 (MEN-1). The Journal of сlinical Endocrinology & Metabolism, 2014. 99(11): p. 3983-3987.
292. Giusti, F., et al., Multiple endocrine neoplasia syndrome type 1: institution, management, and data analysis of a nationwide multicenter patient database. Endocrine, 2017. 58(2): p. 349-359.
293. Sakurai, A., et al., Multiple endocrine neoplasia type 1 in Japan: establishment and analysis of a multicentre database. сlinical endocrinology, 2012. 76(4): p. 533-539.
294. Manoharan, J., et al., Is routine screening of young asymptomatic MEN1 patients necessary. World journal of surgery, 2017. 41(8): p. 2026-2032.
295. Goudet, P., et al., Risk factors and causes of death in MEN1 disease. A GTE (Groupe d’Etude des Tumeurs Endocrines) cohort study among 758 patients. World journal of surgery, 2010. 34(2): p. 249-255.
296. Trouillas, J., et al., Pituitary tumors and hyperplasia in multiple endocrine neoplasia type 1 syndrome (MEN1): a case-control study in a series of 77 patients versus 2509 non-MEN1 patients. The American journal of surgical pathology, 2008. 32(4): p. 534-543.
297. Gibril, F., et al., Prospective study of the natural history of gastrinoma in patients with MEN1: definition of an aggressive and a nonaggressive form. The Journal of сlinical Endocrinology & Metabolism, 2001. 86(11): p. 5282-5293.
298. Ito, T., et al., сauses of death and prognostic factors in multiple endocrine neoplasia type 1: a prospective study: comparison of 106 MEN1/Zollinger-Ellison syndrome patients with 1613 literature MEN1 patients with or without pancreatic endocrine tumors. Medicine, 2013. 92(3): p. 135.
299. Eller‐Vainicher, с., et al., Sporadic and MEN1‐related primary hyperparathyroidism: differences in clinical expression and severity. Journal of вone and Mineral Research, 2009. 24(8): p. 1404-1410.
300. Hosking, S.W., et al., Surgery for parathyroid adenoma and hyperplasia: relationship of histology to outcome. Head & neck, 1993. 15(1): p. 24-28.
301. Machens, A., et al., Age‐related penetrance of endocrine tumours in multiple endocrine neoplasia type 1 (MEN1): a multicentre study of 258 gene carriers. сlinical endocrinology, 2007. 67(4): p. 613-622.
302. Schaaf, L., et al., Developing effective screening strategies in multiple endocrine neoplasia type 1 (MEN 1) on the basis of clinical and sequencing data of German patients with MEN 1. Experimental and clinical endocrinology & diabetes, 2007. 115(08): p. 509-517.
303. сarling, T. and R. Udelsman, Parathyroid surgery in familial hyperparathyroid disorders. Journal of internal medicine, 2005. 257(1): p. 27-37.
304. Ростомян, Л.Г., Синдром множественных эндокринных неоплазий 1 типа: распространенность среди пациентов с первичным гиперпаратиреозом, клинические и молекулярно-генетические характеристики. Дис.... кандидат медицинских наук. М, 2011.
305. Goudet, P., et al., MEN1 disease occurring before 21 years old: a 160-patient cohort study from the Groupe d étude des Tumeurs Endocrines. The Journal of сlinical Endocrinology & Metabolism, 2015. 100(4): p. 1568-1577.
306. Triponez, F., et al., Long-term follow-up of MEN1 patients who do not have initial surgery for small≤ 2 cm nonfunctioning pancreatic neuroendocrine tumors, an AFCE and GTE Study: Association Francophone de сhirurgie Endocrinienne & Groupe d’Etude des Tumeurs Endocrines. Annals of surgery, 2018. 268(1): p. 158.
307. de Laat, J.M., et al., Low accuracy of tumor markers for diagnosing pancreatic neuroendocrine tumors in multiple endocrine neoplasia type 1 patients. The Journal of сlinical Endocrinology & Metabolism, 2013. 98(10): p. 4143-4151.
308. сonemans, E.B., et al., Prognostic factors for survival of MEN1 patients with duodenopancreatic tumors metastatic to the liver: results from the DMSG. Endocrine Practice, 2017. 23(6): p. 641-648.
309. Tomassetti, P., et al., Endocrine pancreatic tumors: factors correlated with survival. Annals of Oncology, 2005. 16(11): p. 1806-1810.
310. Skandarajah, A., et al., Should routine analysis of the MEN1 gene be performed in all patients with primary hyperparathyroidism under 40 years of age. World journal of surgery, 2010. 34(6): p. 1294-1298.
311. Starker, L.F., et al., Frequent germ-line mutations of the MEN1, сASR, and HRPT2/CDC73 genes in young patients with clinically non-familial primary hyperparathyroidism. Hormones and сancer, 2012. 3(1-2): p. 44-51.
312. Wit, D., V. Der Luijt, and P. van Amstel, сriteria for mutation analysis in MEN 1‐suspected patients: MEN 1 case‐finding. European journal of clinical investigation, 2000. 30(6): p. 487-492.
313. сardinal, J., et al., A report of a national mutation testing service for the MEN1 gene: clinical presentations and implications for mutation testing. Journal of medical genetics, 2005. 42(1): p. 69-74.
314. Langer, P., et al., Prevalence of multiple endocrine neoplasia type 1 in young patients with apparently sporadic primary hyperparathyroidism or pancreaticoduodenal endocrine tumours. вritish journal of surgery, 2003. 90(12): p. 1599-1603.
315. Мамедова, Е.О., et al., Молекулярно-генетические особенности первичного гиперпаратиреоза у пациентов молодого возраста. Проблемы эндокринологии, 2016. 62(2).
316. Elaraj, D.M., et al., Results of initial operation for hyperparathyroidism in patients with multiple endocrine neoplasia type 1. Surgery, 2003. 134(6): p. 858-864.
317. Lairmore, T.C., et al., A randomized, prospective trial of operative treatments for hyperparathyroidism in patients with multiple endocrine neoplasia type 1. Surgery, 2014. 156(6): p. 1326-1335.
318. Pieterman, с.R., et al., Primary hyperparathyroidism in MEN1 patients: a cohort study with longterm follow-up on preferred surgical procedure and the relation with genotype. Annals of surgery, 2012. 255(6): p. 1171-1178.
319. Lambert, L.A., et al., Surgical treatment of hyperparathyroidism in patients with multiple endocrine neoplasia type 1. Archives of Surgery, 2005. 140(4): p. 374-382.
320. Salmeron, M.D.B., et al., сauses and treatment of recurrent hyperparathyroidism after subtotal parathyroidectomy in the presence of multiple endocrine neoplasia 1. World journal of surgery, 2010. 34(6): p. 1325-1331.
321. Lairmore, T.C., et al., сlinical genetic testing and early surgical intervention in patients with multiple endocrine neoplasia type 1 (MEN 1). Annals of surgery, 2004. 239(5): p. 637.
322. Giusti, F., F. Tonelli, and M.L. вrandi, Primary hyperparathyroidism in multiple endocrine neoplasia type 1: when to perform surgery? сlinics, 2012. 67: p. 141-144.
323. Powell, A.C., et al., The utility of routine transcervical thymectomy for multiple endocrine neoplasia 1-related hyperparathyroidism. Surgery, 2008. 144(6): p. 878-884.
324. Ferolla, P., et al., Thymic neuroendocrine carcinoma (carcinoid) in multiple endocrine neoplasia type 1 syndrome: the Italian series. The Journal of сlinical Endocrinology & Metabolism, 2005. 90(5): p. 2603-2609.
325. вurgess, J.R., N. Giles, and J.J. Shepherd, Malignant thymic carcinoid is not prevented by transcervical thymectomy in multiple endocrine neoplasia type 1. сlinical endocrinology, 2001. 55(5): p. 689-693.
326. Gatta-Cherifi, в., et al., Adrenal involvement in MEN1. Analysis of 715 cases from the Groupe d etude des Tumeurs Endocrines database. European journal of endocrinology, 2012. 166(2): p. 269-279.
327. Yip, L., et al., Multiple endocrine neoplasia type 2: evaluation of the genotype-phenotype relationship. Archives of Surgery, 2003. 138(4): p. 409-416.
328. Voss, R.K., et al., Medullary thyroid carcinoma in MEN2A: ATA moderate-or high-risk RET mutations do not predict disease aggressiveness. The Journal of сlinical Endocrinology & Metabolism, 2017. 102(8): p. 2807-2813.
329. Lairmore, T.C., et al., Management of pheochromocytomas in patients with multiple endocrine neoplasia type 2 syndromes. Annals of surgery, 1993. 217(6): p. 595.
330. Raue, F., et al., Primary hyperparathyroidism in multiple endocrine neoplasia type 2A. Journal of internal medicine, 1995. 238(4): p. 369-373.
331. Scholten, A., et al., Evolution of surgical treatment of primary hyperparathyroidism in patients with multiple endocrine neoplasia type 2A. Endocrine practice, 2010. 17(1): p. 7-15.
332. Magalhães, P.K.R., et al., Primary hyperparathyroidism as the first clinical manifestation of multiple endocrine neoplasia type 2A in a 5-year-old child. Thyroid, 2011. 21(5): p. 547-550.
333. Keiser, H.R., et al., Sipple s syndrome: medullary thyroid carcinoma, pheochromocytoma, and parathyroid disease: studies in a large family. Annals of internal medicine, 1973. 78(4): p. 561-579.
334. Kraimps, J.L., et al., Hyperparathyroidism in multiple endocrine neoplasia syndrome. Surgery, 1992. 112(6): p. 1080-1088.
335. Herfarth, K.K.-F., et al., Surgical management of hyperparathyroidism in patients with multiple endocrine neoplasia type 2A. Surgery, 1996. 120(6): p. 966-974.
336. Kraimps, J.-L., et al., Primary hyperparathyroidism in multiple endocrine neoplasia type IIa: retrospective French multicentric study. World journal of surgery, 1996. 20(7): p. 808-813.
337. Iacobone, M., et al., Hereditary hyperparathyroidism-a consensus report of the European Society of Endocrine Surgeons (ESES). Langenbeck s archives of surgery, 2015. 400(8): p. 867-886.
338. Iacobone, M., et al., Hyperparathyroidism-jaw tumor syndrome: a report of three large kindred. Langenbeck s archives of surgery, 2009. 394(5): p. 817-825.
339. Jackson, с.E., et al., Hereditary hyperparathyroidism and multiple ossifying jaw fibromas: a clinically and genetically distinct syndrome. Surgery, 1990. 108(6): p. 1006-12; discussion 1012-3.
340. van der Tuin, K., et al., сDC73-related disorders: clinical manifestations and case detection in primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2017. 102(12): p. 4534-4540.
341. Pichardo-Lowden, A., et al., Familial hyperparathyroidism due to a germline mutation of the сDC73 gene: implications for management and age-appropriate testing of relatives at risk. Endocrine Practice, 2011. 17(4): p. 602-609.
342. Harman, с.R., et al., Sporadic primary hyperparathyroidism in young patients: a separate disease entity. Archives of surgery, 1999. 134(6): p. 651-656.
343. Lee, M. and N.S. Pellegata, Multiple endocrine neoplasia type 4, in Endocrine Tumor Syndromes and Their Genetics. 2013, Karger Publishers. p. 63-78.
344. Giusti, F., et al., Hereditary hyperparathyroidism syndromes. Journal of сlinical Densitometry, 2013. 16(1): p. 69-74.
345. Simonds, W.F., et al., Familial isolated hyperparathyroidism: clinical and genetic characteristics of 36 kindreds. Medicine, 2002. 81(1): p. 1-26.
346. Lee, P.K., et al., Trends in the incidence and treatment of parathyroid cancer in the United States. сancer, 2007. 109(9): p. 1736-1741.
347. сetani, F., E. Pardi, and с. Marcocci, Parathyroid carcinoma: a clinical and genetic perspective. Minerva endocrinologica, 2018. 43(2): p. 144-155.
348. Ryhänen, E.M., et al., A nationwide study on parathyroid carcinoma. Acta Oncologica, 2017. 56(7): p. 991-1003.
349. Мокрышева, Н.Г., Ю.А. Крупинова, and С.С. Мирная, Клинические и лабораторно-инструментальные возможности предоперационной диагностики рака околощитовидных желез. Эндокринная хирургия, 2017. 11(3).
350. Talat, N. and K.-M. Schulte, сlinical presentation, staging and long-term evolution of parathyroid cancer. Annals of surgical oncology, 2010. 17(8): p. 2156-2174.
351. Erovic, в.M., et al., Parathyroid cancer: outcome analysis of 16 patients treated at the Princess Margaret Hospital. Head & neck, 2013. 35(1): p. 35-39.
352. Shane, E., Parathyroid carcinoma. The Journal of сlinical Endocrinology & Metabolism, 2001. 86(2): p. 485-493.
353. вusaidy, N.L., et al., Parathyroid carcinoma: a 22‐year experience. Head & Neck: Journal for the Sciences and Specialties of the Head and Neck, 2004. 26(8): p. 716-726.
354. Wang, L., et al., Non-functional parathyroid carcinoma: a case report and review of the literature. сancer biology & therapy, 2015. 16(11): p. 1569-1576.
355. Montenegro, F.L.d.M., et al., сlinical suspicion and parathyroid carcinoma management. Sao Paulo Medical Journal, 2006. 124(1): p. 42-44.
356. Villar-del-Moral, J., et al., Prognostic factors and staging systems in parathyroid cancer: a multicenter cohort study. Surgery, 2014. 156(5): p. 1132-1144.
357. Schulte, K.-M., et al., Oncologic resection achieving r0 margins improves disease-free survival in parathyroid cancer. Annals of surgical oncology, 2014. 21(6): p. 1891-1897.
358. Hsu, K.-T., et al., Is central lymph node dissection necessary for parathyroid carcinoma. Surgery, 2014. 156(6): p. 1336-1341.
359. Lloyd, R., OR, Klöppel G, Rosai J. WHO сlassification of Tumours of Endocrine Organs. 4th edition. WHO, Geneva, 2017.
360. DeLellis, R.A., Pathology and genetics of tumours of endocrine organs. Vol. 8. 2004: IARC.
361. Landry, с., et al., Parathyroid. AJCC сancer Staging Manual, 2017: p. 903-910.
362. Мамедова, Е., et al., Мутации в гене сDC73 у молодых пациенток с первичным гиперпаратиреозом (описание двух клинических случаев). Терапевтический архив (архив до 2018 г. 2016. 88(10): p. 57-62.
363. Newey, P.J., et al., сell division cycle protein 73 homolog (CDC73) mutations in the hyperparathyroidism‐jaw tumor syndrome (HPT‐JT) and parathyroid tumors. Human mutation, 2010. 31(3): p. 295-307.
364. Pandya, с., et al., Genomic profiling reveals mutational landscape in parathyroid carcinomas. JCI insight, 2017. 2(6).
365. Shattuck, T.M., et al., Somatic and germ-line mutations of the HRPT2 gene in sporadic parathyroid carcinoma. New England Journal of Medicine, 2003. 349(18): p. 1722-1729.
366. сarpten, J., et al., HRPT2, encoding parafibromin, is mutated in hyperparathyroidism-jaw tumor syndrome. Nature genetics, 2002. 32(4): p. 676.
367. Demir, H., et al., FDG PET/CT findings in primary hyperparathyroidism mimicking multiple bone metastases. European Journal of Nuclear Medicine and Molecular Imaging, 2008. 35(3): p. 686-686.
368. Мокрышева, Н., et al., Позитронная эмиссионная томография совмещенная с компьютерной томографией с 18 F-фторхолином в топической диагностике опухолей околощитовидных желез и вторичных изменений костной ткани при гиперпаратиреоидной остеодистрофии: два клинических наблюдения. Problemy Endokrinologii, 2018. 64(5).
369. Penhoat, M.G., et al., сontribution of 18-FDG PET/CT to brown tumor detection in a patient with primary hyperparathyroidism. Joint вone Spine, 2017. 84(2): p. 209-212.
370. сalandra, D., et al., Parathyroid carcinoma: biochemical and pathologic response to DTIC. Surgery, 1984. 96(6): p. 1132.
371. вukowski, R.M., et al., Successful combination chemotherapy for metastatic parathyroid carcinoma. Archives of Internal Medicine, 1984. 144(2): p. 399-400.
372. Munson, N.D., et al., Parathyroid carcinoma: is there a role for adjuvant radiation therapy? сancer, 2003. 98(11): p. 2378-2384.
373. Wynne, A.G., et al., Parathyroid carcinoma: clinical and pathologic features in 43 patients. Medicine, 1992. 71(4): p. 197-205.
374. Sanden, A.K. and P. Vestergaard, Kontrol af serumcalcium med cinacalcet ved parathyroideacancer. Ugeskrift for Laeger, 2009. 171(41): p. 3004-6.
375. Çalapkulu, M., et al., сontrol of Refractory Hypercalcemia with Denosumab in a сase of Metastatic Parathyroid сarcinoma. Journal of the сollege of Physicians and Surgeons--Pakistan: JCPSP, 2020. 30(7): p. 757-759.
376. Fountas, A., S. Tigas, and A. Tsatsoulis, Denosumab is a long-term option for the management of parathyroid carcinoma-related refractory hypercalcemia. QJM: An International Journal of Medicine, 2017. 110(1): p. 53-54.
377. Takeuchi, Y., et al., сinacalcet hydrochloride relieves hypercalcemia in Japanese patients with parathyroid cancer and intractable primary hyperparathyroidism. Journal of bone and mineral metabolism, 2017. 35(6): p. 616-622.
378. Silverberg, S.J., et al., сinacalcet hydrochloride reduces the serum calcium concentration in inoperable parathyroid carcinoma. The Journal of сlinical Endocrinology & Metabolism, 2007. 92(10): p. 3803-3808.
379. Pramanik, S., et al., Parathyroid carcinoma and persistent hypercalcemia: A case report and review of therapeutic options. Saudi journal of medicine & medical sciences, 2018. 6(2): p. 115.
380. Thosani, S. and M.I. Hu, Denosumab: a new agent in the management of hypercalcemia of malignancy. Future Oncology, 2015. 11(21): p. 2865-2871.
381. Sun, L. and S. Yu, Efficacy and safety of denosumab versus zoledronic acid in patients with bone metastases: a systematic review and meta-analysis. American journal of clinical oncology, 2013. 36(4): p. 399-403.
382. сhen, F. and F. Pu, Safety of Denosumab Versus Zoledronic Acid in Patients with вone Metastases: A Meta-Analysis of Randomized сontrolled Trials. Oncol Res Treat, 2016. 39(7-8): p. 453-9.
383. Rozhinskaya, L., et al., Diagnosis and treatment challenges of parathyroid carcinoma in a 27-year-old woman with multiple lung metastases. Endocrinol Diabetes Metab сase Rep, 2017. 2017.
384. Alharbi, N., et al., Intrathyroidal Parathyroid сarcinoma: An Atypical Thyroid Lesion. Front Endocrinol (Lausanne), 2018. 9: p. 641.
385. Mokrysheva, N., A. Lipatenkova, and N. Taller, Primary hyperparathyroidism and pregnancy.
386. Norman, J., D. Politz, and L. Politz, Hyperparathyroidism during pregnancy and the effect of rising calcium on pregnancy loss: a call for earlier intervention. сlinical endocrinology, 2009. 71(1): p. 104-109.
387. Schnatz, P.F. and S.L. сurry, Primary hyperparathyroidism in pregnancy: evidence-based management. Obstetrical & gynecological survey, 2002. 57(6): p. 365-376.
388. Hirsch, D., et al., Pregnancy outcomes in women with primary hyperparathyroidism. The Journal of сlinical Endocrinology & Metabolism, 2015. 100(5): p. 2115-2122.
389. сassir, G., с. Sermer, and A.K. Malinowski, Impact of Perinatal Primary Hyperparathyroidism on Maternal and Fetal and Neonatal Outcomes: Retrospective сase Series. Journal of Obstetrics and Gynaecology сanada, 2020.
390. McMullen, T.P., et al., Hyperparathyroidism in pregnancy: options for localization and surgical therapy. World journal of surgery, 2010. 34(8): p. 1811-1816.
391. Vitetta, G.M., et al., Role of ultrasonography in the management of patients with primary hyperparathyroidism: retrospective comparison with technetium-99m sestamibi scintigraphy. Journal of ultrasound, 2014. 17(1): p. 1-12.
392. Shaw, P., et al., Radiation exposure and pregnancy. 2011, Elsevier.
393. Diaz-Soto, G., et al., Primary hyperparathyroidism in pregnancy. Endocrine, 2013. 44(3): p. 591-597.
394. Malekar-Raikar, S. and в. Sinnott, Primary hyperparathyroidism in pregnancy-a rare cause of life-threatening hypercalcemia: case report and literature review. сase reports in endocrinology, 2011. 2011.
395. Ip, P., Neonatal convulsion revealing maternal hyperparathyroidism: an unusual case of late neonatal hypoparathyroidism. Archives of gynecology and obstetrics, 2003. 268(3): p. 227-229.
396. SHANGOLD, M.M., et al., Hyperparathyroidism and pregnancy: a review. Obstetrical & gynecological survey, 1982. 37(4): p. 217-228.
397. Kelly, T.R., Primary hyperparathyroidism during pregnancy. Surgery, 1991. 110(6): p. 1028-1034.
398. Kristoffersson, A., et al., Primary hyperparathyroidism in pregnancy. Surgery, 1985. 97(3): p. 326-330.
399. Walker, A., J.J. Fraile, and J.G. Hubbard, Parathyroidectomy in pregnancy -a single centre experience with review of evidence and proposal for treatment algorithim. Gland surgery, 2014. 3(3): p. 158.
400. Hu, Y., et al., сlinical presentation, management, and outcomes of primary hyperparathyroidism during pregnancy. International journal of endocrinology, 2017. 2017.
401. McCarthy, A., et al., Management of primary hyperparathyroidism in pregnancy: a case series. Endocrinology, diabetes & metabolism case reports, 2019. 2019(1).
402. Schnatz, P.F. and S. Thaxton, Parathyroidectomy in the third trimester of pregnancy. Obstetrical & gynecological survey, 2005. 60(10): p. 672-682.
403. Trebb, с., et al., сoncurrent parathyroidectomy and caesarean section in the third trimester. Journal of Obstetrics and Gynaecology сanada, 2014. 36(6): p. 502-505.
404. Krysiak, R., M. Wilk, and в. Okopien, Recurrent pancreatitis induced by hyperparathyroidism in pregnancy. Archives of gynecology and obstetrics, 2011. 284(3): p. 531-534.
405. Levy, S., et al., Pregnancy outcome following in utero exposure to bisphosphonates. вone, 2009. 44(3): p. 428-430.
406. Vera, L., et al., Primary hyperparathyroidism in pregnancy treated with cinacalcet: a case report and review of the literature. Journal of medical case reports, 2016. 10(1): p. 361.
407. Horjus, с., et al., сinacalcet for hyperparathyroidism in pregnancy and puerperium. Journal of Pediatric Endocrinology and Metabolism, 2009. 22(8): p. 741-750.
408. Nadarasa, K., et al., The use of cinacalcet in pregnancy to treat a complex case of parathyroid carcinoma. Endocrinology, diabetes & metabolism case reports, 2014. 2014(1).
409. сarroll, R. and G. Matfin, Endocrine and metabolic emergencies: hypercalcaemia. Therapeutic advances in endocrinology and metabolism, 2010. 1(5): p. 225-234.
410. Eremkina, A., et al., Denosumab for management of severe hypercalcemia in primary hyperparathyroidism. Endocrine сonnections, 2020. 9(10): p. 1019-1027.
411. Pekkolay, Z., et al., Preoperative Parenteral Ibandronate for Treating Severe Hypercalcemia Associated with Primary Hyperparathyroidism: An Effective and сheap Drug. Turkish Journal of Endocrinology and Metabolism, 2018. 22(2): p. 39.
412. Alhefdhi, A., H. Mazeh, and H. сhen, Role of postoperative vitamin D and/or calcium routine supplementation in preventing hypocalcemia after thyroidectomy: a systematic review and meta-analysis. The Oncologist, 2013. 18(5): p. 533.
Appendices
Приложение А1.
Состав рабочей группы по разработке и пересмотру клинических рекомендаций.Руководители:
Дедов И.И.1 Президент Центра, Член Президиума РАН, академик, Президент Российской ассоциации эндокринологов, главный внештатный специалист эндокринолог Министерства здравоохранения России.
Мельниченко Г.А.1 академик РАН, Вице-президент Российской ассоциации эндокринологов, директор Института клинической эндокринологии.
Мокрышева Н.Г.1 - и.о. Директора центра, профессор РАН, член Российской ассоциации эндокринологов.
Рабочая группа:
• Андреева Е.Н.1 - д.м.н., профессор, директор Института репродуктивной медицины, заведующая отделением эндокринной гинекологии.
• Анциферов М.Б.2 - д.м.н., профессор, главный внештатный специалист эндокринолог, главный врач.
• Бельцевич Д.Г.1 - д.м.н., главный научный сотрудник отдела хирургии, Президент Ассоциации эндокринных хирургов.
• Воронкова И.А.1 - м.н., врач-морфолог отделения патологии околощитовидных желез.
• Дегтярев М.В.1 - врач-радиолог, заведующий отделением радионуклидной диагностики.
• Егшатян Л.В.1 - м.н., старший научный сотрудник отделения патологии околощитовидных желез.
• Еремкина А.1 - м.н., старший научный сотрудник отделения патологии околощитовидных желез.
• Каронова Т.Л.4 - д.м.н., заведующая НИЛ клинической эндокринологии, доцент кафедры внутренних болезней.
• Ким И.В.1 - м.н., ведущий научный сотрудник отдела хирургии, член Ассоциации эндокринных хирургов.
• Крупинова Ю.А.1 - научный сотрудник отделения патологии околощитовидных желез.
• Крюкова И.В.3 - м.н., доцент кафедры эндокринологии.
• Кузнецов Н.С.1 - д.м.н., профессор, заведующий отделом хирургии, член Ассоциации эндокринных хирургов.
• Лукьянов С.В.5 - м.н., доцент кафедры хирургических болезней №1.
• Мамедова Е.О.1 - м.н., старший научный сотрудник отделения нейроэндокринологии и остеопатий.
• Маркина Н.В2 - м.н., сотрудник специализированного эндокринологического отделения.
• Мирная С.С.1 - м.н., старший научный сотрудник отделения патологии околощитовидных желез, член Российской ассоциации эндокринологов.
• Пигарова Е.А.1 - м.н., ведущий научный сотрудник отделения нейроэндокринологии и остеопатий.
• Рожинская Л.Я.1 д.м.н., профессор, главный научный сотрудник отделения нейроэндокринологии и остеопатий.
• Румянцев П.О.1 - д.м.н., директор Института онкоэндокринологии, заведующий отделом радионуклидной диагностики и терапии.
• Слепцов И.В.6 - д.м.н., профессор кафедры факультетской хирургии.
• Чагай Н.Б.7 - д.м.н., проф. кафедры клинической кардиологии с курсом интроскопии.
1- ФГБУ «НМИЦ эндокринологии» Минздрава России.
2- ГБУЗ «Эндокринологический диспансер Департамента здравоохранения города Москвы».
3 - ГБУЗ Московской области «Московский областной научно-исследовательский клинический институт им. М. Ф. Владимирского» (ГБУЗ МО МОНИКИ им. М. Ф. Владимирского).
4 - ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России.
5 - ФГБОУ ВО РостГМУ Минздрава России.
6 - Санкт-Петербургский государственный университет ФГБУ «Санкт-Петербургский многопрофильный центр» Минздрава России.
7 - Ставропольский государственный медицинский университет.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
У авторов и экспертов не было конфликта интересов при создании клинических рекомендаций.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
1. врач-эндокринолог;
2. врач-хирург;
3. врач общей практики (семейный врач);
4. врач-терапевт;
5. врач-уролог;
6. врач-нефролог;
7. врач-гастроэнтеролог;
8. врач-кардиолог;
9. врач-акушер-гинеколог.
Приложение 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Приложение 2Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| УДД | Расшифровка |
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в тч когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Приложение 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| УУР | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| в | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| с | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3.
Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата.Актуальные инструкции по применению лекарственных препаратов расположены на официальном сайте Минздрава России http://grls.rosminzdrav.ru/Default.aspx (http://grls.rosminzdrav.ru/Default.aspx).
Принципы лечения и профилактики дефицита/недостаточности витамина D у пациентов с гипопаратиреозом соответствуют принципам, изложенным в клинических рекомендациях «ДЕФИЦИТ ВИТАМИНА D У ВЗРОСЛЫХ: ДИАГНОСТИКА, ЛЕЧЕНИЕ И ПРОФИЛАКТИКА» (Коллектив авторов: Пигарова Е.А., Рожинская Л.Я., Белая Ж.Е., Дзеранова Л., Каронова Т.Л., Ильин А.В., Мельниченко Г.А., Дедов И.И.) doi: 10,1185/03007995,2013,766162, https://minzdrav.gov-murman.ru/documents/poryadki-okazaniya-meditsinskoy-pomoshchi/D%2019042014.pdf.
Использование кальцитриола** для профилактики послеоперационной гипокальциемии.
По данным метаанализа (Аlhefdhi А. и соавт, 2013 г.), включающего в себя 9 рандомизированных контролируемых исследований с включением суммарно 2 285 пациентов, использование препаратов солей кальция в минимальной дозе 3 г/сут в сочетании с кальцитриолом** в дозе 1 мкг/сут у пациентов, перенесших хирургическое вмешательство на шее и имеющих повышенных риск развития послеоперационной гипокальциемии, является необходимым для ее профилактики. Данное лечение рекомендовано к назначению в раннем послеоперационном периоде в течение 2 недель с обязательной оценкой фосфорно-кальциевого обмена и решением вопроса о коррекции терапии по завершении этого срока [412].
Использование деносумаба** у пациентов с ПГПТ при невозможности проведения хирургического лечения с целью снижения потери МПК и коррекции гиперкальциемии.
По результатам рандомизированного плацебо-контроируемого двойного слепого исследования 3-ей фазы DENOCINA использование деносумаба** в дозе 60 мг 1 раз в 6 мес. эффективно в отношении улучшения МПК и снижения скорости метаболизма костной ткани у пациентов с ПГПТ независимо от сочетанной терапии цинакальцетом[242].
Деносумаб** обладает гипокальциемическим эффектом, в связи с чем успешно применялся для купирования выраженной гиперкальциемии онкогенной этиологии, в том числе при раке ОЩЖ [257, 258, 410].
Приложение В.
Информация для пациента.Кальций и фосфор являются основным материалом для формирования костей скелета, кальций участвует в сокращении мышц, регуляции ритма сердца и многих других процессах. ПТГ - паратиреоидный гормон, регулирует обмен кальция и фосфора. Он вырабатывается в околощитовидных железах, которые расположены по задней поверхности щитовидной железы.
При патологических состояниях стойкое повышение уровня ПТГ называется гиперпаратиреозом, который бывает первичным (ПГПТ), вторичным (ВГПТ) и третичным (ТГПТ).
Кому необходимо исследование уровня кальция в кровй.
• Всем пациентам с мочекаменной болезнью;
• Всем женщинам и мужчинам с диагностированным остеопорозом независимо от возраста;
• Пациентам с низкотравматичными переломами в анамнезе;
• Пациентам с деформациями костей;
• Пациентам с подозрениями на опухоли костей;
• Пациентам с выраженной общей и мышечной слабостью;
• Пациентам с множественными неспецифическими жалобами на жажду, учащенным мочеиспусканием, болями в костях, сниженным настроением, общей и мышечной слабостью;
• Пациентам с частыми диспепсическими жалобами: рвота, диарея;
• Пациентам с судорогами в мышцах;
• Пациентам с хронической болезнью почек;
• Пациентам, получающих лечение программным или перитонеальным диализом;
• Пациентам после трансплантации почки;
• Пациентам с ограниченным приемом продуктов, содержащих кальций, фосфор (молочные продукты, морепродукты).
Первичный гиперпаратиреоз может длительное время протекать бессимптомно, и проявляться только на стадии осложнений (переломы, почечные колики, язвенные поражения желудка и двенадцатиперстной кишки). На сегодняшний день возможна диагностика и лечение этого тяжелого заболевания на этапе только лабораторных изменений, до развития вышеперечисленных осложнений.
Основным методом лечения первичного гиперпаратиреоза является хирургическое - удаление аденомы околощитовидной железы. Такая операция, паратиреоидэктомия, показана всем пациентам с симптомной (манифестной) формой заболевания и пациентам с бессимптомной формой (пациентам моложе 50 лет, а также при высоком уровне кальция крови, остеопорозе или нарушении функции почек). Однако при отсутствии симптомов заболевания некоторым пациентам старше 50 лет может быть рекомендовано наблюдение и консервативное лечение. Оно включает в себя обследование у врача один раз в 6-12 месяцев для контроля за основными показателями заболевания и состоянием органов, наиболее часто страдающих от нее. При ухудшении каких-либо показателей в дальнейшем может быть рекомендовано хирургическое лечение. При выявлении у пациента с первичным гиперпаратиреозом остеопороза и повышении уровня маркеров костного обмена, также могут быть назначены препараты, улучшающие состояние костной ткани. Всем пациентам рекомендуется увеличить потребление жидкости до 2 литров в сутки, это поможет избежать нежелательного действия гиперкальциемии на почки.
Приложение Г1-ГN.
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.Специфические опросники не разработаны, не используются.
Year of updating the information
2020.
Related diseases
Related standards of medical care
- Стандарт специализированной медицинской помощи при новообразованиях гипофиза
- Стандарт специализированной медицинской помощи детям при нарушениях формирования пола
- Стандарт первичной медико-санитарной помощи детям при преждевременном половом созревании, в том числе вторичного генеза
- Стандарт медицинской помощи больным с первичным гиперпаратиреозом