Другие названия и синонимы
Fosaprepitant.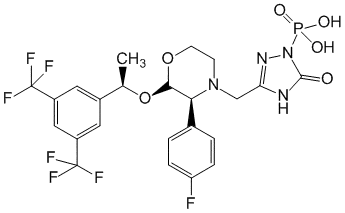
Фармакологическая группа
|
|
Латинское название
Fosaprepitantum ( Fosaprepitanti).
Химическое название
[3-([(2R,3S)-2-[(1R)-1-[3,5-бис(трифторметил)фенил]этокси]-3-(4-фторфенил)морфолин-4-ил]метил)-5-оксо-2H-1,2,4-триазол-1-ил]фосфоновая кислота (в виде димеглумина).
Используется в лечении
Код CAS
172673-20-0.
Фармакологическое действие
Противорвотное.
Характеристика вещества
Противорвотное средство. Фосапрепитант димеглумин - белый или почти белый аморфный порошок, легко растворим в воде. Молекулярная масса 1004,83.
Фармакодинамика
Фармакодинамика.
Активным метаболитом фосапрепитанта является апрепитант - селективный высокоаффинный антагонист рецепторов нейрокинина 1 (NK1) субстанции Р. Изотопные исследования показали, что избирательность связывания апрепитанта с NK1-рецепторами по крайней мере в 3000 раз выше, чем с другими ферментами, транспортными белками, ионными каналами и рецепторами, включая дофаминовые и серотониновые рецепторы, которые являются мишенями существующих ЛС для предотвращения тошноты и рвоты при химиотерапии.
В доклинических исследованиях показано, что антагонисты NK1-рецепторов предотвращают рвоту, вызванную химиотерапевтическими ЛС, такими как цисплатин, за счет центрального механизма действия. По данным, полученным в исследованиях позитронно-эмиссионной томографией (ПЭТ), апрепитант проникает в головной мозг и связывается с NK1-рецепторами мозга. Центральное действие апрепитанта обладает большой продолжительностью, причем он ингибирует как острую, так и отсроченную фазы рвоты, вызванной цисплатином, а также повышает противорвотную активность антагонистов 5-НТ3-рецепторов (например ондансетрон) и ГКС дексаметазона.
Электрофизиология сердца. В рандомизированном двойном слепом положительно-контролируемом исследовании QTc-интервала однократная доза фосапрепитанта 200 мг не влияла на величину QTc-интервала.
Доля связанных мозговых NK1-рецепторов, оцененная ПЭТ. При однократной в/в дозе фосапрепитанта 150 мг у здоровых молодых добровольцев связывание NK1-рецепторов головного мозга составляло 100% через 24 не менее 97% через 48 ч и 75% через 120 Доля связанных NK1-рецепторов коррелировала с концентрацией апрепитанта в плазме.
RxList.com (2015 г.
Доля связанных NK1-рецепторов. В двух односторонних слепых рандомизированных плацебо-контролируемых исследованиях множественных доз здоровые молодые люди получали пероральные дозы апрепитанта 10 мг (n=2), 30 мг (n=3), 100 мг (n=3) или 300 мг (n=5) 1 раз в день в течение 14 дней вместе с 2 или 3 людьми, получавшими плацебо. Как концентрация апрепитанта в плазме, так и занятость NK1-рецепторов в полосатом теле (corpus striatum) мозга, по данным ПЭТ, были оценены перед введением дозы и через 24 ч после последней дозы. При концентрациях апрепитанта в плазме »10 нг/мл и »100 нг/мл занятость рецепторов NK1 была »50 и »90% соответственно. Режим приема апрепитанта внутрь для предупреждения тошноты и рвоты, обусловленных химиотерапией, приводил к средним сmin апрепитанта в плазме >500 нг/мл, и можно было бы ожидать, основываясь на соответствующей кривой, согласно уравнению Хилла, >95% занятости NK1-рецепторов в мозге. Однако занятость рецепторов для режима предупреждения тошноты и рвоты, обусловленных химиотерапией, или режима дозирования при постоперационной тошноте и рвоте не была определена. Кроме того, не была установлена взаимосвязь между занятостью рецепторов NK1 и клинической эффективностью апрепитанта.
Активным метаболитом фосапрепитанта является апрепитант - селективный высокоаффинный антагонист рецепторов нейрокинина 1 (NK1) субстанции Р. Изотопные исследования показали, что избирательность связывания апрепитанта с NK1-рецепторами по крайней мере в 3000 раз выше, чем с другими ферментами, транспортными белками, ионными каналами и рецепторами, включая дофаминовые и серотониновые рецепторы, которые являются мишенями существующих ЛС для предотвращения тошноты и рвоты при химиотерапии.
В доклинических исследованиях показано, что антагонисты NK1-рецепторов предотвращают рвоту, вызванную химиотерапевтическими ЛС, такими как цисплатин, за счет центрального механизма действия. По данным, полученным в исследованиях позитронно-эмиссионной томографией (ПЭТ), апрепитант проникает в головной мозг и связывается с NK1-рецепторами мозга. Центральное действие апрепитанта обладает большой продолжительностью, причем он ингибирует как острую, так и отсроченную фазы рвоты, вызванной цисплатином, а также повышает противорвотную активность антагонистов 5-НТ3-рецепторов (например ондансетрон) и ГКС дексаметазона.
Электрофизиология сердца. В рандомизированном двойном слепом положительно-контролируемом исследовании QTc-интервала однократная доза фосапрепитанта 200 мг не влияла на величину QTc-интервала.
Доля связанных мозговых NK1-рецепторов, оцененная ПЭТ. При однократной в/в дозе фосапрепитанта 150 мг у здоровых молодых добровольцев связывание NK1-рецепторов головного мозга составляло 100% через 24 не менее 97% через 48 ч и 75% через 120 Доля связанных NK1-рецепторов коррелировала с концентрацией апрепитанта в плазме.
RxList.com (2015 г.
Доля связанных NK1-рецепторов. В двух односторонних слепых рандомизированных плацебо-контролируемых исследованиях множественных доз здоровые молодые люди получали пероральные дозы апрепитанта 10 мг (n=2), 30 мг (n=3), 100 мг (n=3) или 300 мг (n=5) 1 раз в день в течение 14 дней вместе с 2 или 3 людьми, получавшими плацебо. Как концентрация апрепитанта в плазме, так и занятость NK1-рецепторов в полосатом теле (corpus striatum) мозга, по данным ПЭТ, были оценены перед введением дозы и через 24 ч после последней дозы. При концентрациях апрепитанта в плазме »10 нг/мл и »100 нг/мл занятость рецепторов NK1 была »50 и »90% соответственно. Режим приема апрепитанта внутрь для предупреждения тошноты и рвоты, обусловленных химиотерапией, приводил к средним сmin апрепитанта в плазме >500 нг/мл, и можно было бы ожидать, основываясь на соответствующей кривой, согласно уравнению Хилла, >95% занятости NK1-рецепторов в мозге. Однако занятость рецепторов для режима предупреждения тошноты и рвоты, обусловленных химиотерапией, или режима дозирования при постоперационной тошноте и рвоте не была определена. Кроме того, не была установлена взаимосвязь между занятостью рецепторов NK1 и клинической эффективностью апрепитанта.
Фармакокинетика
Введение. После однократной в/в 20-минутной инфузии 150 мг фосапрепитанта здоровым добровольцам средняя AUC0-∞ апрепитанта равна 35 мкг·ч/мл и средняя Сmах апрепитанта равна 4,01 мкг/мл.
RxList.com (2015 г.
Апрепитант после введения фосапрепитанта. После однократной в/в 15-минутной инфузии фосапрепитанта в дозе 115 мг у здоровых добровольцев среднее значение AUC0-∞ апрепитанта было (35±14,3) мкг·ч/мл, а среднее значение Сmах - (3,27±1,16) мкг/мл. Концентрация апрепитанта в плазме через 24 ч после в/в введения 115 мг фосапрепитанта была сходна с наблюдаемой после приема апрепитанта внутрь в дозе 125 мг.
После однократной в/в 20-минутной инфузии фосапрепитанта в дозе 115 мг здоровым добровольцам среднее значение AUC0-∞ апрепитанта составило (37,38±14,75) мкг·ч/мл, а среднее значение Сmах - (4,15±1,15 ) мкг/мл.
Распределение. Фосапрепитант быстро метаболизируется до апрепитанта. Апрепитант связывается с белками плазмы более чем на 95%. Геометрическое среднее кажущегося ssVss у человека составляет приблизительно 66 л. Данные исследований ПЭТ показали, что апрепитант проникает через ГЭБ ( см Фармакодинамика).
RxList.com (2015 г.
Распределение. Фосапрепитант быстро превращается в апрепитант. Апрепитант более чем на 95% связывается с белками плазмы. Средний кажущийся ssVss у человека составляет приблизительно 70 л. Апрепитант проходит через ГЭБ у человека, проникает через плаценту у крыс и кроликов.
Метаболизм. Превращение фосапрепитанта в апрепитант может происходить в различных тканях. Фосапрепитант превращается в апрепитант после в/в введения в течение 30 мин после окончания инфузии. Апрепитант подвергается активному метаболизму. Исследования in vitro >in vitro с использованием микросом печени человека показывают, что апрепитант метаболизируется преимущественно с участием изофермента сYP3A4 и в незначительной степени с участием сYP1A2 и сYP2C19 и не метаболизируется посредством сYP2D6, сYP2C9 или сYP2E1. Метаболизм апрепитанта в значительной степени осуществляется путем окисления морфолинового кольца и боковых цепей. В плазме человека идентифицировано 7 метаболитов апрепитанта, которые обладают слабой активностью. Все метаболиты, которые определялись в моче, фекалиях и плазме после в/в введения 100 мг 14С-фосапрепитанта, также наблюдались после перорального приема 14С-апрепитанта. После превращения 245,4 мг фосапрепитанта димеглумина (эквивалентно 150 мг фосапрепитанта свободной кислоты) в апрепитант высвобождается 23,9 мг фосфорной кислоты и 95,3 мг меглумина.
RxList.com (2015 г.
Метаболизм. Фосапрепитант быстро превращается в апрепитант при инкубации in vitro >in vitro с препаратами печени крыс, собак и человека. Кроме того, фосапрепитант подвергается быстрой и почти полной конверсии в апрепитант в препаратах S9-фракции, полученных из других человеческих тканей, включая почки, легкие и подвздошную кишку. Таким образом, очевидно, превращение фосапрепитанта в апрепитант может происходить в различных внепеченочных тканях в дополнение к печени. У человека в/в введенный фосапрепитант быстро превращался в апрепитант - в течение 30 мин после окончания инфузии.
Апрепитант подвергается экстенсивному метаболизму. In vitro исследования с использованием микросом печени человека показали, что апрепитант метаболизируется главным образом с участием сYP3A4 и в незначительной степени - сYP1A2 и сYP2C19. Метаболизм апрепитанта осуществляется в значительной степени посредством окисления в морфолиновом кольце и его боковых цепях. Не обнаружено участие изоферментов сYP2D6, сYP2C9 и сYP2E1 в метаболизме апрепитанта. У здоровых молодых взрослых в течение 72 ч после однократной пероральной дозы 300 мг 14C-апрепитанта в плазме определяется примерно 24% радиоактивности, что указывает на значительное присутствие в плазме метаболитов. В плазме крови человека было идентифицировано 7 метаболитов апрепитанта, которые проявляли только слабую активность.
Выведение. После однократного в/в введения 100 мг 14С-фосапрепитанта здоровым добровольцам 57% радиоактивности определялось в моче и 45% - в фекалиях. Апрепитант выводится в основном в виде метаболитов, неизмененный апрепитант не выводится почками. Конечный T1/2 апрепитанта составляет примерно от 9 до13.
Фармакокинетика у особых групп пациентов.
Пол. После однократного перорального приема апрепитанта AUC0-24 и Сmах для апрепитанта были на 9 и 17% соответственно выше у женщин, чем у мужчин. Т1/2 апрепитанта у женщин было на 25% меньше, чем у мужчин, а Тmах отмечалось примерно в одно и то же время. Это различие не было признано клинически значимым. Коррекция дозы на основании половой принадлежности не требуется.
RxList.com (2015 г.
Пол. После однократного перорального приема апрепитанта AUC0-24 и Сmах были на 14 и 22% соответственно выше у женщин, чем у мужчин. Величины Тmах у женщин и мужчин были примерно одинаковы. Эти различия не являются клинически значимыми. Коррекция дозы на основании половой принадлежности не требуется.
Раса. После однократного перорального приема апрепитанта AUC0-24 приблизительно на 27 и 31% выше у латиноамериканцев по сравнению с пациентами европеоидной расы и афроамериканцами соответственно. Сmах на 19 и 29% выше у латиноамериканцев по сравнению с пациентами европеоидной расы и афроамериканцами соответственно. После однократного перорального применения апрепитанта у азиатов показано увеличение AUC0-24 и Сmах на 74 и 47% соответственно по сравнению с пациентами европеоидной расы. Коррекция дозы на основании расовой принадлежности не требуется.
RxList.com (2015 г.
Раса. После однократного перорального приема апрепитанта AUC0-24 и Сmах были приблизительно на 42 и 29% выше у латиноамериканцев по сравнению с пациентами европеоидной расы. AUC0-24 и Сmах были на 62 и 41% выше у азиатов по сравнению с пациентами европеоидной расы. Различий в величинах AUC0-24 и Сmах у пациентов европеоидной расы по сравнению с афроамериканцами не отмечено. Найденные различия не являются клинически значимыми. Коррекция дозы на основании расовой принадлежности не требуется.
Пожилые пациенты. После однократного перорального приема 125 мг апрепитанта в 1-й день и 80 мг/день со 2-го по 5-й дни AUC0-24 апрепитанта у пожилых пациентов (от 65 лет и старше) была на 21% больше в 1-й день и на 36% больше в 5-й день, чем у более молодых взрослых. У пожилых пациентов maxCmax была на 10% выше в 1-й день и на 24% выше в 5-й день, чем у более молодых взрослых. Эти различия не были признаны клинически значимыми. Коррекция дозы у пожилых пациентов не требуется.
Дети. Применение фосапрепитанта у пациентов в возрасте до 18 лет не изучалось.
ИМТ. ИМТ не влияет на фармакокинетику апрепитанта.
RxList.com (обновление 2021 г.
ИМТ. На каждые 5 кг/м2 увеличения ИМТ AUC0-24 и maxCmax апрепитанта снижаются на 11%. ИМТ испытуемых в анализе варьировал от 18 до 36 кг/м2. Это изменение не считается клинически значимым.
Печеночная недостаточность. Фосапрепитант не метаболизируется в печени, следовательно, не ожидается влияние печеночной недостаточности на превращение фосапрепитанта в апрепитант.
Пациенты с легкой и средней степенью печеночной недостаточности хорошо переносили пероральный прием апрепитанта. У пациентов с легкой степенью печеночной недостаточности (5-6 баллов по шкале Чайлд-Пью) после однократного перорального приема 125 мг апрепитанта в 1-й день и 80 мг 1 раз в день во 2-й и 3-й дни AUC0-24 апрепитанта была на 11% меньше в 1-й день и на 36% ниже в 3-й день, чем у здоровых добровольцев, получавших апрепитант в том же режиме. У пациентов со средней степенью печеночной недостаточности (7-9 баллов по шкале Чайлд-Пью) AUC0-24 апрепитанта была на 10% больше в 1-й день и на 18% больше в 3-й день, чем у здоровых добровольцев, получавших апрепитант в том же режиме. Эти различия в AUC0-24 не были сочтены клинически значимыми, поэтому коррекция дозы у пациентов с легкой и средней степенью печеночной недостаточности не требуется.
Для пациентов с тяжелой степенью печеночной недостаточности (>9 баллов по шкале Чайлд-Пью) клинических и фармакокинетических данных не имеется.
Почечная недостаточность. Пациенты с тяжелой степенью почечной недостаточности (Cl креатинина <30 мл/мин) и пациенты с терминальной стадией почечной недостаточности, нуждающиеся в гемодиализе, получали разовую дозу апрепитанта 240 мг. У пациентов с тяжелой степенью почечной недостаточности AUC0-∞ для суммарного апрепитанта (несвязанного и связанного с белками) была снижена на 21%, а maxCmax была снижена на 32% по сравнению с этими же показателями у здоровых добровольцев. У пациентов с терминальной стадией почечной недостаточности, находящихся на гемодиализе, AUC0-∞ для суммарного апрепитанта была снижена на 42%, а сmax - на 32%. В связи с небольшим снижением связывания апрепитанта с белками у пациентов с почечной недостаточностью AUC для фармакологически активного несвязанного апрепитанта у таких пациентов значительно не отличалась от таковой у здоровых добровольцев. Гемодиализ, проведенный через 4 или 48 ч после приема дозы, не оказывал значительное влияние на фармакокинетику апрепитанта: в диализате обнаруживалось менее 0,2% дозы. Коррекция дозы у пациентов с тяжелой почечной недостаточностью и пациентов с тяжелой почечной недостаточностью, находящихся на гемодиализе, не требуется.
RxList.com (2015 г.
Апрепитант после введения фосапрепитанта. После однократной в/в 15-минутной инфузии фосапрепитанта в дозе 115 мг у здоровых добровольцев среднее значение AUC0-∞ апрепитанта было (35±14,3) мкг·ч/мл, а среднее значение Сmах - (3,27±1,16) мкг/мл. Концентрация апрепитанта в плазме через 24 ч после в/в введения 115 мг фосапрепитанта была сходна с наблюдаемой после приема апрепитанта внутрь в дозе 125 мг.
После однократной в/в 20-минутной инфузии фосапрепитанта в дозе 115 мг здоровым добровольцам среднее значение AUC0-∞ апрепитанта составило (37,38±14,75) мкг·ч/мл, а среднее значение Сmах - (4,15±1,15 ) мкг/мл.
Распределение. Фосапрепитант быстро метаболизируется до апрепитанта. Апрепитант связывается с белками плазмы более чем на 95%. Геометрическое среднее кажущегося ssVss у человека составляет приблизительно 66 л. Данные исследований ПЭТ показали, что апрепитант проникает через ГЭБ ( см Фармакодинамика).
RxList.com (2015 г.
Распределение. Фосапрепитант быстро превращается в апрепитант. Апрепитант более чем на 95% связывается с белками плазмы. Средний кажущийся ssVss у человека составляет приблизительно 70 л. Апрепитант проходит через ГЭБ у человека, проникает через плаценту у крыс и кроликов.
Метаболизм. Превращение фосапрепитанта в апрепитант может происходить в различных тканях. Фосапрепитант превращается в апрепитант после в/в введения в течение 30 мин после окончания инфузии. Апрепитант подвергается активному метаболизму. Исследования in vitro >in vitro с использованием микросом печени человека показывают, что апрепитант метаболизируется преимущественно с участием изофермента сYP3A4 и в незначительной степени с участием сYP1A2 и сYP2C19 и не метаболизируется посредством сYP2D6, сYP2C9 или сYP2E1. Метаболизм апрепитанта в значительной степени осуществляется путем окисления морфолинового кольца и боковых цепей. В плазме человека идентифицировано 7 метаболитов апрепитанта, которые обладают слабой активностью. Все метаболиты, которые определялись в моче, фекалиях и плазме после в/в введения 100 мг 14С-фосапрепитанта, также наблюдались после перорального приема 14С-апрепитанта. После превращения 245,4 мг фосапрепитанта димеглумина (эквивалентно 150 мг фосапрепитанта свободной кислоты) в апрепитант высвобождается 23,9 мг фосфорной кислоты и 95,3 мг меглумина.
RxList.com (2015 г.
Метаболизм. Фосапрепитант быстро превращается в апрепитант при инкубации in vitro >in vitro с препаратами печени крыс, собак и человека. Кроме того, фосапрепитант подвергается быстрой и почти полной конверсии в апрепитант в препаратах S9-фракции, полученных из других человеческих тканей, включая почки, легкие и подвздошную кишку. Таким образом, очевидно, превращение фосапрепитанта в апрепитант может происходить в различных внепеченочных тканях в дополнение к печени. У человека в/в введенный фосапрепитант быстро превращался в апрепитант - в течение 30 мин после окончания инфузии.
Апрепитант подвергается экстенсивному метаболизму. In vitro исследования с использованием микросом печени человека показали, что апрепитант метаболизируется главным образом с участием сYP3A4 и в незначительной степени - сYP1A2 и сYP2C19. Метаболизм апрепитанта осуществляется в значительной степени посредством окисления в морфолиновом кольце и его боковых цепях. Не обнаружено участие изоферментов сYP2D6, сYP2C9 и сYP2E1 в метаболизме апрепитанта. У здоровых молодых взрослых в течение 72 ч после однократной пероральной дозы 300 мг 14C-апрепитанта в плазме определяется примерно 24% радиоактивности, что указывает на значительное присутствие в плазме метаболитов. В плазме крови человека было идентифицировано 7 метаболитов апрепитанта, которые проявляли только слабую активность.
Выведение. После однократного в/в введения 100 мг 14С-фосапрепитанта здоровым добровольцам 57% радиоактивности определялось в моче и 45% - в фекалиях. Апрепитант выводится в основном в виде метаболитов, неизмененный апрепитант не выводится почками. Конечный T1/2 апрепитанта составляет примерно от 9 до13.
Фармакокинетика у особых групп пациентов.
Пол. После однократного перорального приема апрепитанта AUC0-24 и Сmах для апрепитанта были на 9 и 17% соответственно выше у женщин, чем у мужчин. Т1/2 апрепитанта у женщин было на 25% меньше, чем у мужчин, а Тmах отмечалось примерно в одно и то же время. Это различие не было признано клинически значимым. Коррекция дозы на основании половой принадлежности не требуется.
RxList.com (2015 г.
Пол. После однократного перорального приема апрепитанта AUC0-24 и Сmах были на 14 и 22% соответственно выше у женщин, чем у мужчин. Величины Тmах у женщин и мужчин были примерно одинаковы. Эти различия не являются клинически значимыми. Коррекция дозы на основании половой принадлежности не требуется.
Раса. После однократного перорального приема апрепитанта AUC0-24 приблизительно на 27 и 31% выше у латиноамериканцев по сравнению с пациентами европеоидной расы и афроамериканцами соответственно. Сmах на 19 и 29% выше у латиноамериканцев по сравнению с пациентами европеоидной расы и афроамериканцами соответственно. После однократного перорального применения апрепитанта у азиатов показано увеличение AUC0-24 и Сmах на 74 и 47% соответственно по сравнению с пациентами европеоидной расы. Коррекция дозы на основании расовой принадлежности не требуется.
RxList.com (2015 г.
Раса. После однократного перорального приема апрепитанта AUC0-24 и Сmах были приблизительно на 42 и 29% выше у латиноамериканцев по сравнению с пациентами европеоидной расы. AUC0-24 и Сmах были на 62 и 41% выше у азиатов по сравнению с пациентами европеоидной расы. Различий в величинах AUC0-24 и Сmах у пациентов европеоидной расы по сравнению с афроамериканцами не отмечено. Найденные различия не являются клинически значимыми. Коррекция дозы на основании расовой принадлежности не требуется.
Пожилые пациенты. После однократного перорального приема 125 мг апрепитанта в 1-й день и 80 мг/день со 2-го по 5-й дни AUC0-24 апрепитанта у пожилых пациентов (от 65 лет и старше) была на 21% больше в 1-й день и на 36% больше в 5-й день, чем у более молодых взрослых. У пожилых пациентов maxCmax была на 10% выше в 1-й день и на 24% выше в 5-й день, чем у более молодых взрослых. Эти различия не были признаны клинически значимыми. Коррекция дозы у пожилых пациентов не требуется.
Дети. Применение фосапрепитанта у пациентов в возрасте до 18 лет не изучалось.
ИМТ. ИМТ не влияет на фармакокинетику апрепитанта.
RxList.com (обновление 2021 г.
ИМТ. На каждые 5 кг/м2 увеличения ИМТ AUC0-24 и maxCmax апрепитанта снижаются на 11%. ИМТ испытуемых в анализе варьировал от 18 до 36 кг/м2. Это изменение не считается клинически значимым.
Печеночная недостаточность. Фосапрепитант не метаболизируется в печени, следовательно, не ожидается влияние печеночной недостаточности на превращение фосапрепитанта в апрепитант.
Пациенты с легкой и средней степенью печеночной недостаточности хорошо переносили пероральный прием апрепитанта. У пациентов с легкой степенью печеночной недостаточности (5-6 баллов по шкале Чайлд-Пью) после однократного перорального приема 125 мг апрепитанта в 1-й день и 80 мг 1 раз в день во 2-й и 3-й дни AUC0-24 апрепитанта была на 11% меньше в 1-й день и на 36% ниже в 3-й день, чем у здоровых добровольцев, получавших апрепитант в том же режиме. У пациентов со средней степенью печеночной недостаточности (7-9 баллов по шкале Чайлд-Пью) AUC0-24 апрепитанта была на 10% больше в 1-й день и на 18% больше в 3-й день, чем у здоровых добровольцев, получавших апрепитант в том же режиме. Эти различия в AUC0-24 не были сочтены клинически значимыми, поэтому коррекция дозы у пациентов с легкой и средней степенью печеночной недостаточности не требуется.
Для пациентов с тяжелой степенью печеночной недостаточности (>9 баллов по шкале Чайлд-Пью) клинических и фармакокинетических данных не имеется.
Почечная недостаточность. Пациенты с тяжелой степенью почечной недостаточности (Cl креатинина <30 мл/мин) и пациенты с терминальной стадией почечной недостаточности, нуждающиеся в гемодиализе, получали разовую дозу апрепитанта 240 мг. У пациентов с тяжелой степенью почечной недостаточности AUC0-∞ для суммарного апрепитанта (несвязанного и связанного с белками) была снижена на 21%, а maxCmax была снижена на 32% по сравнению с этими же показателями у здоровых добровольцев. У пациентов с терминальной стадией почечной недостаточности, находящихся на гемодиализе, AUC0-∞ для суммарного апрепитанта была снижена на 42%, а сmax - на 32%. В связи с небольшим снижением связывания апрепитанта с белками у пациентов с почечной недостаточностью AUC для фармакологически активного несвязанного апрепитанта у таких пациентов значительно не отличалась от таковой у здоровых добровольцев. Гемодиализ, проведенный через 4 или 48 ч после приема дозы, не оказывал значительное влияние на фармакокинетику апрепитанта: в диализате обнаруживалось менее 0,2% дозы. Коррекция дозы у пациентов с тяжелой почечной недостаточностью и пациентов с тяжелой почечной недостаточностью, находящихся на гемодиализе, не требуется.
|
|
Показания к применению
Предупреждение острой и отсроченной тошноты и рвоты, обусловленных высокоэметогенной или умеренноэметогенной противоопухолевой химиотерапией (в сочетании с другими противорвотными средствами).
RxList.com (обновление 2021 г.
Фосапрепитант для инъекций в сочетании с другими противорвотными средствами показан взрослым для предупреждения:
- острой и отсроченной тошноты и рвоты, ассоциированных с начальным и повторным курсами высокоэметогенной противоопухолевой химиотерапии, включая высокие дозы цисплатина;
- отсроченной тошноты и рвоты, ассоциированных с начальным и повторным курсами умеренноэметогенной противоопухолевой химиотерапии.
Ограничения использования.
Фосапрепитант для инъекций не изучен для лечения установленных (развившихся) тошноты и рвоты.
RxList.com (обновление 2021 г.
Фосапрепитант для инъекций в сочетании с другими противорвотными средствами показан взрослым для предупреждения:
- острой и отсроченной тошноты и рвоты, ассоциированных с начальным и повторным курсами высокоэметогенной противоопухолевой химиотерапии, включая высокие дозы цисплатина;
- отсроченной тошноты и рвоты, ассоциированных с начальным и повторным курсами умеренноэметогенной противоопухолевой химиотерапии.
Ограничения использования.
Фосапрепитант для инъекций не изучен для лечения установленных (развившихся) тошноты и рвоты.
Противопоказания
Гиперчувствительность к фосапрепитанту или апрепитанту. одновременное применение с пимозидом. терфенадином. астемизолом и цизапридом. тяжелая печеночная недостаточность (более 9 баллов по шкале Чайлд-Пью). беременность. возраст до 18 лет.
RxList.com (обновление 2021 г.
Фосапрепитант противопоказан пациентам:
- с гиперчувствительностью. Сообщалось о реакциях гиперчувствительности, включая анафилактические реакции, приливы крови к лицу, эритему и одышку ( см «Побочные действия»);
- при приеме пимозида. Ингибирование сYP3A4 апрепитантом. активным метаболитом фосапрепитанта. может приводить к повышенным концентрациям в плазме пимозида. который является субстратом сYP3A4. потенциально вызывая серьезные или жизнеугрожающие реакции. такие как удлинение интервала QT - известная побочная реакция пимозида ( см «Меры предосторожности»).
RxList.com (обновление 2021 г.
Фосапрепитант противопоказан пациентам:
- с гиперчувствительностью. Сообщалось о реакциях гиперчувствительности, включая анафилактические реакции, приливы крови к лицу, эритему и одышку ( см «Побочные действия»);
- при приеме пимозида. Ингибирование сYP3A4 апрепитантом. активным метаболитом фосапрепитанта. может приводить к повышенным концентрациям в плазме пимозида. который является субстратом сYP3A4. потенциально вызывая серьезные или жизнеугрожающие реакции. такие как удлинение интервала QT - известная побочная реакция пимозида ( см «Меры предосторожности»).
При беременности и кормлении грудью
Не было проведено контролируемых клинических исследований по применению фосапрепитанта у беременных женщин и женщин в период грудного вскармливания. Фосапрепитант следует использовать во время беременности только в том случае, если предполагаемая польза для матери превышает потенциальный риск для плода.
Данные о выделении препарата с грудным молоком человека отсутствуют. Ввиду того, что многие ЛС выделяются с грудным молоком, и в связи с риском побочных эффектов у грудного ребенка вопрос о прекращении грудного вскармливания или прекращении применения ЛС следует решать с учетом необходимости фосапрепитанта для матери.
RxList.com (2015 г.
Категория действия на плод по FDA - в.
Применение при беременности возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода (адекватные строго контролируемые исследования безопасности применения у беременных женщин не проводились).
Апрепитант - активный метаболит фосапрепитанта - экскретируется в молоко крыс. Неизвестно, выделяется ли апрепитант с грудным молоком у женщин. При необходимости применения фосапрепитанта в период лактации следует решить вопрос о прекращении грудного вскармливания в связи с риском нежелательного влияния апрепитанта на грудного ребенка (потенциально канцерогенен, что показано в исследованиях у грызунов).
RxList.com (обновление 2021 г.
Беременность.
Резюме рисков. Недостаточно данных об использовании фосапрепитанта для инъекций у беременных женщин, чтобы определить риск, связанный с его применением. В исследованиях репродукции на животных у крыс и кроликов, подвергшихся воздействию в течение периода органогенеза при системной экспозиции (AUC), примерно эквивалентной экспозиции при рекомендуемой дозе для человека 150 мг ( см Данные), не наблюдалось неблагоприятных эффектов развития.
Предполагаемый фоновый риск серьезных врожденных дефектов и выкидыша для указанной популяции неизвестен. В общей популяции США оценочный фоновый риск серьезных врожденных дефектов и выкидыша при клинически признанных беременностях составляет от 2 до 4% и от 15 до 20% соответственно.
Данные.
Данные у животных. В исследованиях эмбриофетального развития у крыс и кроликов апрепитант вводили в период органогенеза в пероральных дозах до 1000 мг/кг 2 раза в сутки (крысы) и до максимально переносимой дозы 25 мг/кг/сут (кролики). Эмбриофетальной летальности или пороков развития ни у одного вида при любом уровне дозы не наблюдалось. Экспозиции (AUC) у беременных крыс при дозе 1000 мг/кг 2 раза в сутки и у беременных крольчих при дозе 125 мг/кг/сут были примерно эквивалентны экспозиции при рекомендуемой дозе для человека 150 мг. Апрепитант проникает через плаценту у крыс и кроликов.
Грудное вскармливание.
Резюме рисков. Исследования при лактации для оценки присутствия апрепитанта в молоке женщин, влиянии на грудного ребенка или выработку молока не проводили. Апрепитант присутствует в молоке крыс. Следует учитывать преимущества грудного вскармливания для развития и здоровья наряду с клинической потребностью матери в применении фосапрепитанта для инъекций и любыми потенциальными неблагоприятными эффектами фосапрепитанта для инъекций на состояние грудного ребенка или матери.
Репродуктивный потенциал.
Контрацепция. При введении фосапрепитанта для инъекций эффективность гормональных контрацептивов может снижаться. Следует рекомендовать женщинам с репродуктивным потенциалом, применяющим гормональные контрацептивы, использовать эффективные альтернативные или резервные негормональные средства контрацепции (например, презервативы и спермициды) во время лечения фосапрепитантом для инъекций и в течение 1 мес после последней дозы ( см «Взаимодействие»).
Данные о выделении препарата с грудным молоком человека отсутствуют. Ввиду того, что многие ЛС выделяются с грудным молоком, и в связи с риском побочных эффектов у грудного ребенка вопрос о прекращении грудного вскармливания или прекращении применения ЛС следует решать с учетом необходимости фосапрепитанта для матери.
RxList.com (2015 г.
Категория действия на плод по FDA - в.
Применение при беременности возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода (адекватные строго контролируемые исследования безопасности применения у беременных женщин не проводились).
Апрепитант - активный метаболит фосапрепитанта - экскретируется в молоко крыс. Неизвестно, выделяется ли апрепитант с грудным молоком у женщин. При необходимости применения фосапрепитанта в период лактации следует решить вопрос о прекращении грудного вскармливания в связи с риском нежелательного влияния апрепитанта на грудного ребенка (потенциально канцерогенен, что показано в исследованиях у грызунов).
RxList.com (обновление 2021 г.
Беременность.
Резюме рисков. Недостаточно данных об использовании фосапрепитанта для инъекций у беременных женщин, чтобы определить риск, связанный с его применением. В исследованиях репродукции на животных у крыс и кроликов, подвергшихся воздействию в течение периода органогенеза при системной экспозиции (AUC), примерно эквивалентной экспозиции при рекомендуемой дозе для человека 150 мг ( см Данные), не наблюдалось неблагоприятных эффектов развития.
Предполагаемый фоновый риск серьезных врожденных дефектов и выкидыша для указанной популяции неизвестен. В общей популяции США оценочный фоновый риск серьезных врожденных дефектов и выкидыша при клинически признанных беременностях составляет от 2 до 4% и от 15 до 20% соответственно.
Данные.
Данные у животных. В исследованиях эмбриофетального развития у крыс и кроликов апрепитант вводили в период органогенеза в пероральных дозах до 1000 мг/кг 2 раза в сутки (крысы) и до максимально переносимой дозы 25 мг/кг/сут (кролики). Эмбриофетальной летальности или пороков развития ни у одного вида при любом уровне дозы не наблюдалось. Экспозиции (AUC) у беременных крыс при дозе 1000 мг/кг 2 раза в сутки и у беременных крольчих при дозе 125 мг/кг/сут были примерно эквивалентны экспозиции при рекомендуемой дозе для человека 150 мг. Апрепитант проникает через плаценту у крыс и кроликов.
Грудное вскармливание.
Резюме рисков. Исследования при лактации для оценки присутствия апрепитанта в молоке женщин, влиянии на грудного ребенка или выработку молока не проводили. Апрепитант присутствует в молоке крыс. Следует учитывать преимущества грудного вскармливания для развития и здоровья наряду с клинической потребностью матери в применении фосапрепитанта для инъекций и любыми потенциальными неблагоприятными эффектами фосапрепитанта для инъекций на состояние грудного ребенка или матери.
Репродуктивный потенциал.
Контрацепция. При введении фосапрепитанта для инъекций эффективность гормональных контрацептивов может снижаться. Следует рекомендовать женщинам с репродуктивным потенциалом, применяющим гормональные контрацептивы, использовать эффективные альтернативные или резервные негормональные средства контрацепции (например, презервативы и спермициды) во время лечения фосапрепитантом для инъекций и в течение 1 мес после последней дозы ( см «Взаимодействие»).
Побочные эффекты
Ввиду того, что фосапрепитант метаболизируется до апрепитанта, при назначении фосапрепитанта возможны те же нежелательные явления, что и для апрепитанта.
Апрепитант для приема внутрь.
Наиболее часто встречающимися нежелательными явлениями. связанными с высокоэметогенной химиотерапией. у пациентов. получавших апрепитант в трехдневном режиме и наблюдаемыми с большей частотой. нежели при стандартной терапии. были икота (4,6%). повышение активности AЛT (2,8%). диспепсия (2,6%). запор (2,4%). головная боль (2%) и снижение аппетита (2%). Наиболее часто встречающимся нежелательным явлением. связанным с умеренноэметогенной химиотерапией. у пациентов. получавших апрепитант. и отмечаемым с большей частотой. нежели при стандартной терапии. была утомляемость (1,4%).
При объединенном анализе исследований высокоэметогенной и умеренноэметогенной химиотерапии у пациентов. получавших лечение апрепитантом в трехдневном режиме. наблюдались следующие. связанные с приемом апрепитанта. нежелательные явления. причем с большей частотой. чем при стандартной терапии: часто (≥1/100. <1/10). нечасто (≥1/1000. <1/100). редко (≥1/10000. <1/1000).
Инфекционные и паразитарные заболевания. Редко - кандидоз, стафилококковая инфекция.
Со стороны крови и лимфатической системы. Нечасто - анемия, фебрильная нейтропения.
Со стороны обмена веществ и питания. Часто - снижение аппетита; редко - полидипсия.
Нарушения психики. Нечасто - тревожность; редко - эйфория, дезориентация.
Со стороны нервной системы. Нечасто - головокружение, сонливость; редко - когнитивные нарушения, заторможенность, извращение вкуса.
Со стороны органа зрения. Редко - конъюнктивит.
Со стороны органа слуха и лабиринтные нарушения. Редко - шум в ушах.
Со стороны сердца: нечасто - учащенное сердцебиение; редко - брадикардия, сердечно-сосудистые нарушения.
Со стороны сосудов. Приступообразные ощущения жара (приливы).
Со стороны дыхательной системы. органов грудной клетки и средостения: часто - икота. редко - боль в горле. чиханье. кашель. синдром постназального затекания. раздражение глотки.
Со стороны ЖКТ. Часто - диспепсия. нечасто - отрыжка. тошнота. гастроэзофагеальный рефлюкс. рвота. боль в животе. сухость во рту. метеоризм. редко - твердый стул. перфоративная язва двенадцатиперстной кишки. нейтропенический колит. стоматит. вздутие живота.
Со стороны кожи и подкожных тканей. Нечасто - сыпь. акне. редко - фотосенсибилизация. повышенная потливость. себорея. повышение жирности кожи. зудящая сыпь.
Со стороны скелетно-мышечной системы и соединительной ткани. Редко - мышечные спазмы, мышечная слабость.
Со стороны почек и мочевыводящих путей. Нечасто - дизурия; редко - поллакиурия.
Общие расстройства и нарушение в месте введения. Часто - утомляемость. нечасто - слабость. дискомфорт. редко - отеки. ощущение дискомфорта в области грудной клетки. нарушение походки.
Лабораторные и инструментальные данные. Часто - повышение активности AЛТ. нечасто - повышение активности ACT. ЩФ. редко - увеличение диуреза. наличие эритроцитов в моче. гипонатриемия. уменьшение массы тела. глюкозурия. уменьшение числа нейтрофилов.
Профиль нежелательных явлений при проведении 6 циклов химиотерапии в исследованиях высокоэметогенной и умеренноэметогенной химиотерапии с применением апрепитанта был сопоставим с таковым во время первого цикла химиотерапии.
В другом исследовании с применением апрепитанта для предупреждения тошноты и рвоты, индуцированных химиотерапией, было получено сообщение о серьезном нежелательном явлении - синдроме Стивенса-Джонсона.
Фосапрепитант для в/в введения.
В ходе контролируемого клинического исследования у пациентов. получавших высокоэметогенную химиотерапию. профили безопасности фосапрепитанта. назначаемого в 1-й день. были сопоставимы с таковыми. полученными в ходе исследований применения апрепитанта перорально в трехдневном режиме.
Далее представлены дополнительные. клинически значимые. связанные с применением фосапрепитанта в дозе 150 мг побочные явления. и не отмеченные в описанных выше клинических исследованиях с применением апрепитанта внутрь (трехдневный режим).
Общие расстройства и нарушения в месте введения. Нечасто - эритема, зуд, боль в месте введения; редко - уплотнение в месте введения.
Лабораторные и инструментальные данные. Нечасто - повышение АД.
Со стороны кожи и подкожных тканей. Нечасто - эритема.
Со стороны сосудов. Нечасто - тромбофлебиты (преимущественно тромбофлебиты в месте введения).
Другие исследования.
Одноразовый прием 40 мг апрепитанта был изучен для предотвращения послеоперационной тошноты и рвоты у пациентов (не получающих химиотерапию) после проведения общей анестезии. В этих исследованиях наблюдались следующие побочные реакции. количество которых было больше. чем при приеме препарата сравнения (ондансетрон): увеличение активности АЛТ. боль в верхней части живота. атипичный шум в кишечнике. дизартрия. диспноэ. гипестезия. бессонница. миоз. тошнота. нарушения чувствительности. дискомфорт в области кишечника. снижение остроты зрения. свистящее дыхание (хрип).
Были получены сообщения о 2 серьезных нежелательных явлениях при изучении применения апрепитанта в более высоких дозах для предотвращения послеоперационной тошноты и рвоты - 1 случай запора и 1 случай частичной кишечной непроходимости.
Одно сообщение об ангионевротическом отеке и крапивнице было получено как серьезное нежелательное явление при исследовании применения апрепитанта не для предотвращения послеоперационной или вызванной химиотерапией тошноты и рвоты.
Данные пострегистрационных исследований.
В пострегистрационный период были получены сообщения о побочных эффектах, приведенных ниже. Вследствие того, что отчеты поступали от добровольцев из групп населения с неопределенной численностью, невозможно достоверно определить ожидаемую частоту или причинную связь с применением ЛС.
Со стороны кожи и кожных придатков. Зуд, сыпь, крапивница; редко - синдром Стивенса-Джонсона (токсический эпидермальный некролиз).
Со стороны иммунной системы. Реакции гиперчувствительности, включая анафилактические реакции. Были получены сообщения об аллергических реакциях немедленного типа, таких как покраснение, эритема и диспноэ, которые возникали во время инфузии фосапрепитанта ( см «Меры предосторожности»).
RxList.com (2015 г.
Опыт клинических испытаний.
Поскольку клинические испытания проводятся в разных условиях. частота возникновения неблагоприятных реакций. наблюдаемых в ходе клинического исследования ЛС. не может непосредственно сравниваться с частотой побочных эффектов в других клинических исследованиях и может не отражать частоту этих эффектов в клинической практике.
Ввиду того, что фосапрепитант при в/в введении быстро метаболизируется до апрепитанта, при назначении фосапрепитанта возможны те же нежелательные явления, что и для апрепитанта.
Безопасность фосапрепитанта оценивалась примерно у 1100 пациентов, а безопасность апрепитанта - примерно у 6500 пациентов.
Апрепитант для приема внутрь.
Высокоэметогенная химиотерапия.
В двух строго контролируемых клинических испытаниях у пациентов. получавших высокоэметогенную противоопухолевую терапию. 544 пациента принимали апрепитант в цикле 1 химиотерапии. и 413 из этих пациентов продолжали многократный курс химиотерапии до 6 циклов. Апрепитант назначали в комбинации с ондансетроном и дексаметазоном.
В цикле 1 побочные эффекты были отмечены примерно у 17% пациентов, получавших апрепитант, в сравнении с 13% пациентов, получавших стандартную терапию. Прием апрепитанта был прекращен в связи с развитием побочных реакций в 0,6% случаев (при стандартной терапии - 0,4%).
Далее представлены побочные эффекты, наблюдавшиеся у пациентов, принимавших апрепитант (n=544), с частотой ≥1% и превышающие по частоте таковые у пациентов при стандартной терапии (n= 550).
Рядом с названием указана частота встречаемости данного побочного эффекта при приеме апрепитанта, в скобках - аналогичные данные у пациентов, получавших стандартную терапию.
Со стороны респираторной системы: икота 4,6% (2,9%).
Организм в целом: слабость/утомляемость 2,9% (1,6%).
Лабораторные показатели: повышение АЛТ 2,8% (1,5%), повышение АСТ 1,1% (0,9%).
Со стороны ЖКТ: запор 2,2% (2%), диспепсия 1,5% (0,7%), диарея 1,1% (0,9%).
Со стороны нервной системы: головная боль 2,2% (1,8%).
Со стороны обмена веществ: анорексия 2% (0,5%).
В дополнительном актив-контролируемом клиническом исследовании у 1169 пациентов. получавших апрепитант при высокоэметогенной химиотерапии. профиль нежелательных эффектов был в целом похож на тот. что наблюдался в других исследованиях при высокоэметогенной химиотерапии с апрепитантом.
Умеренноэметогенная химиотерапия.
В двух строго контролируемых клинических испытаниях у пациентов. получавших умеренноэметогенную противоопухолевую терапию. 868 пациентов принимали апрепитант в цикле 1 химиотерапии. и 686 из этих пациентов продолжали курс химиотерапии до 4 циклов. В обоих исследованиях апрепитант назначали в комбинации с ондансетроном и дексаметазоном.
В объединенном анализе данных цикла 1 этих двух исследований побочные эффекты были отмечены примерно у 14% пациентов, получавших апрепитант, в сравнении с 15% пациентов, находившихся на стандартной терапии. Прием апрепитанта был прекращен в связи с развитием побочных реакций в 0,7% случаев (при стандартной терапии - 0,2%).
Далее представлены побочные эффекты, наблюдавшиеся у пациентов, принимавших апрепитант (n=868), с частотой ≥1% и превышающие по частоте таковые у пациентов при стандартной терапии (n= 846).
Рядом с названием указана частота встречаемости данного побочного эффекта при приеме апрепитанта, в скобках - аналогичные данные у пациентов, получающих стандартную терапию.
Со стороны ЖКТ: отрыжка 1% (0,1%).
Организм в целом: утомляемость 1,4% (0,9%).
Менее распространенные побочные реакции.
Побочные реакции, наблюдавшиеся при проведении высоко- и умеренноэметогенной химиотерапии у пациентов, получавших апрепитант, с частотой <1% и большей, чем при стандартной терапии.
Инфекции и инвазии: кандидоз, стафилококковая инфекция.
Со стороны крови и лимфатической системы: анемия, фебрильная нейтропения.
Со стороны обмена веществ: снижение аппетита, полидипсия.
Нарушения психики: дезориентация, эйфория, тревога.
Со стороны нервной системы: головокружение, аномальные сновидения, когнитивные расстройства, заторможенность, сонливость.
Со стороны органа зрения: конъюнктивит.
Со стороны органа слуха: шум в ушах.
Со стороны ССС: брадикардия, сердечно-сосудистые нарушения, учащенное сердцебиение.
Сосудистые нарушения: приступообразные ощущения жара, прилив крови к лицу.
Со стороны респираторной системы. органов грудной клетки и средостения: фарингит. чиханье. кашель. синдром постназального затекания. раздражение глотки.
Со стороны ЖКТ: тошнота. кислотный рефлюкс. извращение вкуса. дискомфорт в эпигастрии. запор. ГЭРБ. перфоративная язва двенадцатиперстной кишки. рвота. боль в животе. сухость во рту. вздутие живота. твердый стул. нейтропенический колит. метеоризм. стоматит.
Со стороны кожных покровов: сыпь. акне. фотосенсибилизация. повышенная потливость. повышение жирности кожи. зуд. поражение кожи.
Со стороны скелетно-мышечной системы и соединительной ткани: мышечный спазм, миалгия, мышечная слабость.
Со стороны мочеполовой системы: полиурия, дизурия, поллакиурия.
Общие расстройства и реакции в месте введения: отек. ощущение дискомфорта в области грудной клетки. недомогание. жажда. озноб. нарушение походки.
Лабораторные показатели: повышение активности ЩФ. гипергликемия. микроскопическая гематурия. гипонатриемия. уменьшение массы тела. снижение числа нейтрофилов.
В другом исследовании при индуцированных химиотерапией тошноте и рвоте было сообщено о развитии синдрома Стивенса-Джонсона как серьезного неблагоприятного эффекта у пациента. принимающего апрепитант при химиотерапии рака.
Профили неблагоприятных эффектов при многократных курсах химиотерапии в испытаниях у пациентов, получавших высоко- или умеренноэметогенную терапию до 6 циклов, были похожи на что наблюдались в цикле 1.
Фосапрепитант для в/в введения.
В ходе актив-контролируемого клинического исследования у пациентов. получавших высокоэметогенную химиотерапию. безопасность была оценена у 1143 пациентов. получавших фосапрепитант для инъекций в 1-й день. в сравнении с 1169 пациентами. получавшими апрепитант перорально в течение 3 дней. Профиль безопасности фосапрепитанта, назначаемого в 1-й день, был сопоставим с таковым, полученным в ходе исследований применения апрепитанта перорально в трехдневном режиме.
Далее представлены дополнительные. связанные с применением фосапрепитанта в дозе 150 мг. побочные явления. с частотой >0,1% и не отмечавшиеся в описанных выше клинических исследованиях с применением апрепитанта перорально (трехдневный режим).
Реакции в месте введения: эритема, зуд, уплотнение, боль в месте введения.
Со стороны ССС: повышение АД.
Со стороны кожи и подкожных тканей: эритема.
Со стороны сосудов: тромбофлебит (преимущественно в месте введения).
Другие исследования постоперационной тошноты и рвоты.
В контролируемых клинических исследованиях у больных, получавших сбалансированную общую анестезию, 564 пациента получали 40 мг апрепитанта перорально, и 538 пациентам вводили 4 мг ондансетрона в/в.
Побочные реакции были зарегистрированы примерно у 4% пациентов, получавших 40 мг апрепитанта, по сравнению с примерно 6% пациентов, получавших 4 мг ондансетрона в/в.
У пациентов, получавших апрепитант, увеличение АЛТ (1,1%) было отмечено с большей частотой, чем при введении ондансетрона (1%). Следующие дополнительные побочные реакции наблюдались у пациентов, получавших апрепитант, с частотой <1% и большей, чем при введении ондансетрона.
Со стороны нервной системы: инсомния, дизартрия, гипестезия, сенсорные нарушения.
Со стороны органа зрения: миоз, снижение остроты зрения.
Со стороны ССС: брадикардия.
Со стороны респираторной системы, органов грудной клетки и средостения: затрудненное дыхание, одышка.
Со стороны ЖКТ: боль в верхней части живота, аномальные кишечные звуки, сухость во рту, тошнота, дискомфорт в желудке.
Кроме того. в клинических исследованиях послеоперационной тошноты и рвоты у пациентов. получавших наивысшую дозу апрепитанта. было отмечено 2 случая серьезных побочных эффектов: в одном случае - запор. во втором - частичная кишечная непроходимость.
Другие исследования.
У пациентов. получавших апрепитант в исследовании. не связанном с тошнотой и рвотой. индуцированными химиотерапией или послеоперационной тошнотой и рвотой. были отмечены такие серьезные побочные эффекты. как ангиоэдема и крапивница.
Постмаркетинговые исследования.
В пострегистрационный период было сообщено о побочных эффектах, наблюдавшихся при применении фосапрепитанта и апрепитанта. Вследствие того, что отчеты поступали от добровольцев из групп населения с неопределенной численностью, невозможно достоверно определить ожидаемую частоту или причинную связь с применением ЛС.
Со стороны кожи и кожных придатков: зуд, сыпь, крапивница; редко - синдром Стивенса-Джонсона/токсический эпидермальный некролиз.
Со стороны иммунной системы: реакции гиперчувствительности, включая анафилактические реакции.
Со стороны нервной системы: были зафиксированы случаи ифосфамидиндуцированной нейротоксичности после сочетанного применения апрепитанта и ифосфамида.
RxList.com (обновление 2021 г.
Опыт клинических испытаний.
Общая безопасность фосапрепитанта для инъекций была оценена примерно у 1600 человек.
Побочные реакции при предотвращении тошноты и рвоты, ассоциированных с умеренноэметогенной противоопухолевой химиотерапией.
В актив-контролируемом клиническом исследовании с участием пациентов. получавших умеренноэметогенную противоопухолевую химиотерапию. безопасность была оценена у 504 пациентов. получавших однократную дозу фосапрепитанта для инъекций в сочетании с ондансетроном и дексаметазоном (режим фосапрепитанта). в сравнении с 497 пациентами. получавшими только ондансетрон и дексаметазон (стандартная терапия). Наиболее частые побочные реакции перечислены в таблице 1.
Таблица 1.
Наиболее частые побочные реакции у пациентов, получающих умеренноэметогенную противоопухолевую химиотерапию1.
1 Сообщалось у ≥2% пациентов, получавших режим фосапрепитанта, и чаще, чем при стандартной терапии.
2 Режим фосапрепитанта.
3 Стандартная терапия.
О реакциях в месте инфузии сообщалось у 2,2% пациентов, получавших режим фосапрепитанта, по сравнению с 0,6% пациентов, получавших стандартную терапию. Реакции в месте инфузии включали боль в месте инфузии (1,2%. 0,4%). раздражение в месте инъекции (0,2%. 0%). боль в месте прокола сосуда (0,2%. 0%) и тромбофлебит в месте инфузии ( 0,6%. 0%). о которых сообщалось при режиме фосапрепитанта. по сравнению со стандартной терапией соответственно.
Побочные реакции при предотвращении тошноты и рвоты, ассоциированных с высокоэметогенной противоопухолевой терапией.
В актив-контролируемом клиническом исследовании у пациентов. получающих высокоэметогенную противоопухолевую химиотерапию. безопасность была оценена у 1143 пациентов. получавших однократную дозу фосапрепитанта для инъекций. по сравнению с 1169 пациентами. получавшими 3-дневный режим перорально (апрепитант). Профиль безопасности в целом был сопоставим с профилем безопасности. полученным в ходе исследований применения фосапрепитанта при умеренноэметогенной противоопухолевой химиотерапии и предшествующих исследований применения апрепитанта при высокоэметогенной противоопухолевой химиотерапии. Однако реакции в месте инфузии чаще возникали у пациентов в группе фосапрепитанта (3%) по сравнению с таковыми в группе апрепитанта (0,5%). Следующие дополнительные реакции в месте инфузии наблюдались в исследовании при высокоэметогенной противоопухолевой химиотерапии и не были описаны в исследовании при умеренноэметогенной противоопухолевой химиотерапии. описанном выше: эритема в месте инфузии (0,5%. 0,1%). зуд в месте инфузии (0,3%. 0%) и уплотнение в месте инфузии (0,2%. 0,1%). о которых сообщалось в группе фосапрепитанта по сравнению с группой апрепитанта. соответственно.
Поскольку фосапрепитант превращается в апрепитант, можно ожидать, что побочные реакции, связанные с апрепитантом, также будут возникать при применении фосапрепитанта для инъекций.
Апрепитант для приема внутрь.
Наиболее часто встречающимися нежелательными явлениями. связанными с высокоэметогенной химиотерапией. у пациентов. получавших апрепитант в трехдневном режиме и наблюдаемыми с большей частотой. нежели при стандартной терапии. были икота (4,6%). повышение активности AЛT (2,8%). диспепсия (2,6%). запор (2,4%). головная боль (2%) и снижение аппетита (2%). Наиболее часто встречающимся нежелательным явлением. связанным с умеренноэметогенной химиотерапией. у пациентов. получавших апрепитант. и отмечаемым с большей частотой. нежели при стандартной терапии. была утомляемость (1,4%).
При объединенном анализе исследований высокоэметогенной и умеренноэметогенной химиотерапии у пациентов. получавших лечение апрепитантом в трехдневном режиме. наблюдались следующие. связанные с приемом апрепитанта. нежелательные явления. причем с большей частотой. чем при стандартной терапии: часто (≥1/100. <1/10). нечасто (≥1/1000. <1/100). редко (≥1/10000. <1/1000).
Инфекционные и паразитарные заболевания. Редко - кандидоз, стафилококковая инфекция.
Со стороны крови и лимфатической системы. Нечасто - анемия, фебрильная нейтропения.
Со стороны обмена веществ и питания. Часто - снижение аппетита; редко - полидипсия.
Нарушения психики. Нечасто - тревожность; редко - эйфория, дезориентация.
Со стороны нервной системы. Нечасто - головокружение, сонливость; редко - когнитивные нарушения, заторможенность, извращение вкуса.
Со стороны органа зрения. Редко - конъюнктивит.
Со стороны органа слуха и лабиринтные нарушения. Редко - шум в ушах.
Со стороны сердца: нечасто - учащенное сердцебиение; редко - брадикардия, сердечно-сосудистые нарушения.
Со стороны сосудов. Приступообразные ощущения жара (приливы).
Со стороны дыхательной системы. органов грудной клетки и средостения: часто - икота. редко - боль в горле. чиханье. кашель. синдром постназального затекания. раздражение глотки.
Со стороны ЖКТ. Часто - диспепсия. нечасто - отрыжка. тошнота. гастроэзофагеальный рефлюкс. рвота. боль в животе. сухость во рту. метеоризм. редко - твердый стул. перфоративная язва двенадцатиперстной кишки. нейтропенический колит. стоматит. вздутие живота.
Со стороны кожи и подкожных тканей. Нечасто - сыпь. акне. редко - фотосенсибилизация. повышенная потливость. себорея. повышение жирности кожи. зудящая сыпь.
Со стороны скелетно-мышечной системы и соединительной ткани. Редко - мышечные спазмы, мышечная слабость.
Со стороны почек и мочевыводящих путей. Нечасто - дизурия; редко - поллакиурия.
Общие расстройства и нарушение в месте введения. Часто - утомляемость. нечасто - слабость. дискомфорт. редко - отеки. ощущение дискомфорта в области грудной клетки. нарушение походки.
Лабораторные и инструментальные данные. Часто - повышение активности AЛТ. нечасто - повышение активности ACT. ЩФ. редко - увеличение диуреза. наличие эритроцитов в моче. гипонатриемия. уменьшение массы тела. глюкозурия. уменьшение числа нейтрофилов.
Профиль нежелательных явлений при проведении 6 циклов химиотерапии в исследованиях высокоэметогенной и умеренноэметогенной химиотерапии с применением апрепитанта был сопоставим с таковым во время первого цикла химиотерапии.
В другом исследовании с применением апрепитанта для предупреждения тошноты и рвоты, индуцированных химиотерапией, было получено сообщение о серьезном нежелательном явлении - синдроме Стивенса-Джонсона.
Фосапрепитант для в/в введения.
В ходе контролируемого клинического исследования у пациентов. получавших высокоэметогенную химиотерапию. профили безопасности фосапрепитанта. назначаемого в 1-й день. были сопоставимы с таковыми. полученными в ходе исследований применения апрепитанта перорально в трехдневном режиме.
Далее представлены дополнительные. клинически значимые. связанные с применением фосапрепитанта в дозе 150 мг побочные явления. и не отмеченные в описанных выше клинических исследованиях с применением апрепитанта внутрь (трехдневный режим).
Общие расстройства и нарушения в месте введения. Нечасто - эритема, зуд, боль в месте введения; редко - уплотнение в месте введения.
Лабораторные и инструментальные данные. Нечасто - повышение АД.
Со стороны кожи и подкожных тканей. Нечасто - эритема.
Со стороны сосудов. Нечасто - тромбофлебиты (преимущественно тромбофлебиты в месте введения).
Другие исследования.
Одноразовый прием 40 мг апрепитанта был изучен для предотвращения послеоперационной тошноты и рвоты у пациентов (не получающих химиотерапию) после проведения общей анестезии. В этих исследованиях наблюдались следующие побочные реакции. количество которых было больше. чем при приеме препарата сравнения (ондансетрон): увеличение активности АЛТ. боль в верхней части живота. атипичный шум в кишечнике. дизартрия. диспноэ. гипестезия. бессонница. миоз. тошнота. нарушения чувствительности. дискомфорт в области кишечника. снижение остроты зрения. свистящее дыхание (хрип).
Были получены сообщения о 2 серьезных нежелательных явлениях при изучении применения апрепитанта в более высоких дозах для предотвращения послеоперационной тошноты и рвоты - 1 случай запора и 1 случай частичной кишечной непроходимости.
Одно сообщение об ангионевротическом отеке и крапивнице было получено как серьезное нежелательное явление при исследовании применения апрепитанта не для предотвращения послеоперационной или вызванной химиотерапией тошноты и рвоты.
Данные пострегистрационных исследований.
В пострегистрационный период были получены сообщения о побочных эффектах, приведенных ниже. Вследствие того, что отчеты поступали от добровольцев из групп населения с неопределенной численностью, невозможно достоверно определить ожидаемую частоту или причинную связь с применением ЛС.
Со стороны кожи и кожных придатков. Зуд, сыпь, крапивница; редко - синдром Стивенса-Джонсона (токсический эпидермальный некролиз).
Со стороны иммунной системы. Реакции гиперчувствительности, включая анафилактические реакции. Были получены сообщения об аллергических реакциях немедленного типа, таких как покраснение, эритема и диспноэ, которые возникали во время инфузии фосапрепитанта ( см «Меры предосторожности»).
RxList.com (2015 г.
Опыт клинических испытаний.
Поскольку клинические испытания проводятся в разных условиях. частота возникновения неблагоприятных реакций. наблюдаемых в ходе клинического исследования ЛС. не может непосредственно сравниваться с частотой побочных эффектов в других клинических исследованиях и может не отражать частоту этих эффектов в клинической практике.
Ввиду того, что фосапрепитант при в/в введении быстро метаболизируется до апрепитанта, при назначении фосапрепитанта возможны те же нежелательные явления, что и для апрепитанта.
Безопасность фосапрепитанта оценивалась примерно у 1100 пациентов, а безопасность апрепитанта - примерно у 6500 пациентов.
Апрепитант для приема внутрь.
Высокоэметогенная химиотерапия.
В двух строго контролируемых клинических испытаниях у пациентов. получавших высокоэметогенную противоопухолевую терапию. 544 пациента принимали апрепитант в цикле 1 химиотерапии. и 413 из этих пациентов продолжали многократный курс химиотерапии до 6 циклов. Апрепитант назначали в комбинации с ондансетроном и дексаметазоном.
В цикле 1 побочные эффекты были отмечены примерно у 17% пациентов, получавших апрепитант, в сравнении с 13% пациентов, получавших стандартную терапию. Прием апрепитанта был прекращен в связи с развитием побочных реакций в 0,6% случаев (при стандартной терапии - 0,4%).
Далее представлены побочные эффекты, наблюдавшиеся у пациентов, принимавших апрепитант (n=544), с частотой ≥1% и превышающие по частоте таковые у пациентов при стандартной терапии (n= 550).
Рядом с названием указана частота встречаемости данного побочного эффекта при приеме апрепитанта, в скобках - аналогичные данные у пациентов, получавших стандартную терапию.
Со стороны респираторной системы: икота 4,6% (2,9%).
Организм в целом: слабость/утомляемость 2,9% (1,6%).
Лабораторные показатели: повышение АЛТ 2,8% (1,5%), повышение АСТ 1,1% (0,9%).
Со стороны ЖКТ: запор 2,2% (2%), диспепсия 1,5% (0,7%), диарея 1,1% (0,9%).
Со стороны нервной системы: головная боль 2,2% (1,8%).
Со стороны обмена веществ: анорексия 2% (0,5%).
В дополнительном актив-контролируемом клиническом исследовании у 1169 пациентов. получавших апрепитант при высокоэметогенной химиотерапии. профиль нежелательных эффектов был в целом похож на тот. что наблюдался в других исследованиях при высокоэметогенной химиотерапии с апрепитантом.
Умеренноэметогенная химиотерапия.
В двух строго контролируемых клинических испытаниях у пациентов. получавших умеренноэметогенную противоопухолевую терапию. 868 пациентов принимали апрепитант в цикле 1 химиотерапии. и 686 из этих пациентов продолжали курс химиотерапии до 4 циклов. В обоих исследованиях апрепитант назначали в комбинации с ондансетроном и дексаметазоном.
В объединенном анализе данных цикла 1 этих двух исследований побочные эффекты были отмечены примерно у 14% пациентов, получавших апрепитант, в сравнении с 15% пациентов, находившихся на стандартной терапии. Прием апрепитанта был прекращен в связи с развитием побочных реакций в 0,7% случаев (при стандартной терапии - 0,2%).
Далее представлены побочные эффекты, наблюдавшиеся у пациентов, принимавших апрепитант (n=868), с частотой ≥1% и превышающие по частоте таковые у пациентов при стандартной терапии (n= 846).
Рядом с названием указана частота встречаемости данного побочного эффекта при приеме апрепитанта, в скобках - аналогичные данные у пациентов, получающих стандартную терапию.
Со стороны ЖКТ: отрыжка 1% (0,1%).
Организм в целом: утомляемость 1,4% (0,9%).
Менее распространенные побочные реакции.
Побочные реакции, наблюдавшиеся при проведении высоко- и умеренноэметогенной химиотерапии у пациентов, получавших апрепитант, с частотой <1% и большей, чем при стандартной терапии.
Инфекции и инвазии: кандидоз, стафилококковая инфекция.
Со стороны крови и лимфатической системы: анемия, фебрильная нейтропения.
Со стороны обмена веществ: снижение аппетита, полидипсия.
Нарушения психики: дезориентация, эйфория, тревога.
Со стороны нервной системы: головокружение, аномальные сновидения, когнитивные расстройства, заторможенность, сонливость.
Со стороны органа зрения: конъюнктивит.
Со стороны органа слуха: шум в ушах.
Со стороны ССС: брадикардия, сердечно-сосудистые нарушения, учащенное сердцебиение.
Сосудистые нарушения: приступообразные ощущения жара, прилив крови к лицу.
Со стороны респираторной системы. органов грудной клетки и средостения: фарингит. чиханье. кашель. синдром постназального затекания. раздражение глотки.
Со стороны ЖКТ: тошнота. кислотный рефлюкс. извращение вкуса. дискомфорт в эпигастрии. запор. ГЭРБ. перфоративная язва двенадцатиперстной кишки. рвота. боль в животе. сухость во рту. вздутие живота. твердый стул. нейтропенический колит. метеоризм. стоматит.
Со стороны кожных покровов: сыпь. акне. фотосенсибилизация. повышенная потливость. повышение жирности кожи. зуд. поражение кожи.
Со стороны скелетно-мышечной системы и соединительной ткани: мышечный спазм, миалгия, мышечная слабость.
Со стороны мочеполовой системы: полиурия, дизурия, поллакиурия.
Общие расстройства и реакции в месте введения: отек. ощущение дискомфорта в области грудной клетки. недомогание. жажда. озноб. нарушение походки.
Лабораторные показатели: повышение активности ЩФ. гипергликемия. микроскопическая гематурия. гипонатриемия. уменьшение массы тела. снижение числа нейтрофилов.
В другом исследовании при индуцированных химиотерапией тошноте и рвоте было сообщено о развитии синдрома Стивенса-Джонсона как серьезного неблагоприятного эффекта у пациента. принимающего апрепитант при химиотерапии рака.
Профили неблагоприятных эффектов при многократных курсах химиотерапии в испытаниях у пациентов, получавших высоко- или умеренноэметогенную терапию до 6 циклов, были похожи на что наблюдались в цикле 1.
Фосапрепитант для в/в введения.
В ходе актив-контролируемого клинического исследования у пациентов. получавших высокоэметогенную химиотерапию. безопасность была оценена у 1143 пациентов. получавших фосапрепитант для инъекций в 1-й день. в сравнении с 1169 пациентами. получавшими апрепитант перорально в течение 3 дней. Профиль безопасности фосапрепитанта, назначаемого в 1-й день, был сопоставим с таковым, полученным в ходе исследований применения апрепитанта перорально в трехдневном режиме.
Далее представлены дополнительные. связанные с применением фосапрепитанта в дозе 150 мг. побочные явления. с частотой >0,1% и не отмечавшиеся в описанных выше клинических исследованиях с применением апрепитанта перорально (трехдневный режим).
Реакции в месте введения: эритема, зуд, уплотнение, боль в месте введения.
Со стороны ССС: повышение АД.
Со стороны кожи и подкожных тканей: эритема.
Со стороны сосудов: тромбофлебит (преимущественно в месте введения).
Другие исследования постоперационной тошноты и рвоты.
В контролируемых клинических исследованиях у больных, получавших сбалансированную общую анестезию, 564 пациента получали 40 мг апрепитанта перорально, и 538 пациентам вводили 4 мг ондансетрона в/в.
Побочные реакции были зарегистрированы примерно у 4% пациентов, получавших 40 мг апрепитанта, по сравнению с примерно 6% пациентов, получавших 4 мг ондансетрона в/в.
У пациентов, получавших апрепитант, увеличение АЛТ (1,1%) было отмечено с большей частотой, чем при введении ондансетрона (1%). Следующие дополнительные побочные реакции наблюдались у пациентов, получавших апрепитант, с частотой <1% и большей, чем при введении ондансетрона.
Со стороны нервной системы: инсомния, дизартрия, гипестезия, сенсорные нарушения.
Со стороны органа зрения: миоз, снижение остроты зрения.
Со стороны ССС: брадикардия.
Со стороны респираторной системы, органов грудной клетки и средостения: затрудненное дыхание, одышка.
Со стороны ЖКТ: боль в верхней части живота, аномальные кишечные звуки, сухость во рту, тошнота, дискомфорт в желудке.
Кроме того. в клинических исследованиях послеоперационной тошноты и рвоты у пациентов. получавших наивысшую дозу апрепитанта. было отмечено 2 случая серьезных побочных эффектов: в одном случае - запор. во втором - частичная кишечная непроходимость.
Другие исследования.
У пациентов. получавших апрепитант в исследовании. не связанном с тошнотой и рвотой. индуцированными химиотерапией или послеоперационной тошнотой и рвотой. были отмечены такие серьезные побочные эффекты. как ангиоэдема и крапивница.
Постмаркетинговые исследования.
В пострегистрационный период было сообщено о побочных эффектах, наблюдавшихся при применении фосапрепитанта и апрепитанта. Вследствие того, что отчеты поступали от добровольцев из групп населения с неопределенной численностью, невозможно достоверно определить ожидаемую частоту или причинную связь с применением ЛС.
Со стороны кожи и кожных придатков: зуд, сыпь, крапивница; редко - синдром Стивенса-Джонсона/токсический эпидермальный некролиз.
Со стороны иммунной системы: реакции гиперчувствительности, включая анафилактические реакции.
Со стороны нервной системы: были зафиксированы случаи ифосфамидиндуцированной нейротоксичности после сочетанного применения апрепитанта и ифосфамида.
RxList.com (обновление 2021 г.
Опыт клинических испытаний.
Общая безопасность фосапрепитанта для инъекций была оценена примерно у 1600 человек.
Побочные реакции при предотвращении тошноты и рвоты, ассоциированных с умеренноэметогенной противоопухолевой химиотерапией.
В актив-контролируемом клиническом исследовании с участием пациентов. получавших умеренноэметогенную противоопухолевую химиотерапию. безопасность была оценена у 504 пациентов. получавших однократную дозу фосапрепитанта для инъекций в сочетании с ондансетроном и дексаметазоном (режим фосапрепитанта). в сравнении с 497 пациентами. получавшими только ондансетрон и дексаметазон (стандартная терапия). Наиболее частые побочные реакции перечислены в таблице 1.
Таблица 1.
Наиболее частые побочные реакции у пациентов, получающих умеренноэметогенную противоопухолевую химиотерапию1.
| Побочная реакция | Фосапрепитант для инъекций, ондансетрон и дексаметазон2 (n=504) | Ондансетрон и дексаметазон3 (n=497) |
| Утомляемость | 15% | 13% |
| Диарея | 13% | 11% |
| Нейтропения | 8% | 7% |
| Астения | 4% | 3% |
| Анемия | 3% | 2% |
| Периферическая нейропатия | 3% | 2% |
| Лейкопения | 2% | 1% |
| Диспепсия | 2% | 1% |
| Инфекция мочевыводящего тракта | 2% | 1% |
| Боль в конечности | 2% | 1% |
1 Сообщалось у ≥2% пациентов, получавших режим фосапрепитанта, и чаще, чем при стандартной терапии.
2 Режим фосапрепитанта.
3 Стандартная терапия.
О реакциях в месте инфузии сообщалось у 2,2% пациентов, получавших режим фосапрепитанта, по сравнению с 0,6% пациентов, получавших стандартную терапию. Реакции в месте инфузии включали боль в месте инфузии (1,2%. 0,4%). раздражение в месте инъекции (0,2%. 0%). боль в месте прокола сосуда (0,2%. 0%) и тромбофлебит в месте инфузии ( 0,6%. 0%). о которых сообщалось при режиме фосапрепитанта. по сравнению со стандартной терапией соответственно.
Побочные реакции при предотвращении тошноты и рвоты, ассоциированных с высокоэметогенной противоопухолевой терапией.
В актив-контролируемом клиническом исследовании у пациентов. получающих высокоэметогенную противоопухолевую химиотерапию. безопасность была оценена у 1143 пациентов. получавших однократную дозу фосапрепитанта для инъекций. по сравнению с 1169 пациентами. получавшими 3-дневный режим перорально (апрепитант). Профиль безопасности в целом был сопоставим с профилем безопасности. полученным в ходе исследований применения фосапрепитанта при умеренноэметогенной противоопухолевой химиотерапии и предшествующих исследований применения апрепитанта при высокоэметогенной противоопухолевой химиотерапии. Однако реакции в месте инфузии чаще возникали у пациентов в группе фосапрепитанта (3%) по сравнению с таковыми в группе апрепитанта (0,5%). Следующие дополнительные реакции в месте инфузии наблюдались в исследовании при высокоэметогенной противоопухолевой химиотерапии и не были описаны в исследовании при умеренноэметогенной противоопухолевой химиотерапии. описанном выше: эритема в месте инфузии (0,5%. 0,1%). зуд в месте инфузии (0,3%. 0%) и уплотнение в месте инфузии (0,2%. 0,1%). о которых сообщалось в группе фосапрепитанта по сравнению с группой апрепитанта. соответственно.
Поскольку фосапрепитант превращается в апрепитант, можно ожидать, что побочные реакции, связанные с апрепитантом, также будут возникать при применении фосапрепитанта для инъекций.
|
|
Взаимодействие
Лекарственное взаимодействие после применения фосапрепитанта наиболее вероятно происходит с ЛС, которые взаимодействуют с апрепитантом. Дальнейшая информация получена по данным исследований, выполненных с апрепитантом для перорального приема, и исследований совместного применения фосапрепитанта вместе с дексаметазоном, мидазоламом или дилтиаземом.
Апрепитант является субстратом, слабым или умеренным ингибитором и индуктором изофермента сYP3А4. Апрепитант также является индуктором изофермента сYP2C9.
При однократном применении фосапрепитант в дозе 150 мг является слабым ингибитором изофермента сYP3A4 и не вызывает индукцию изофермента сYP3A4. Предполагается, что фосапрепитант в дозе 150 мг в форме для в/в введения будет вызывать меньшую или не бóльшую индукцию изофермента сYP2C9 по сравнению с приемом апрепитанта перорально.
Влияние фосапрепитанта/апрепитанта на фармакокинетику других ЛС.
Ввиду того, что апрепитант является слабым или умеренным ингибитором изофермента сYP3A4, а фосапрепитант является слабым ингибитором изофермента сYP3A4, при одновременном применении ЛС, метаболизм которых происходит при участии изофермента сYP3A4, их концентрации в плазме крови могут повышаться.
Фосапрепитант не следует применять одновременно с пимозидом, терфенадином, астемизолом или цизапридом. Ингибирование изофермента сYP3A4 под влиянием апрепитанта может привести к повышению концентрации этих ЛС в плазме и к потенциально серьезным или опасным для жизни реакциям ( см «Противопоказания»).
Было показано, что апрепитант индуцирует метаболизм S(-) варфарина и толбутамида, которые метаболизируются изоферментом сYP2C9. Одновременное назначение фосапрепитанта с этими или другими ЛС, которые метаболизируются изоферментом сYP2C9 (например фенитоин), может привести к снижению концентрации в плазме этих ЛС.
Взаимодействие фосапрепитанта с ЛС, являющимися субстратами переносчика Р-gp, маловероятно ввиду того, что в клинических исследованиях было показано отсутствие взаимодействия апрепитанта с дигоксином при пероральном приеме.
Антагонисты 5-НТ3.
В ходе клинических исследований лекарственного взаимодействия было показано, что апрепитант при приеме 125 мг в 1-й день и 80 мг во 2-й и 3-й дни не вызывает клинически значимые изменения фармакокинетики антагонистов серотониновых 5-НТ3-рецепторов - ондансетрона, гранисетрона и гидродоласетрона (активный метаболит доласетрона).
Кортикостероиды.
Дексаметазон. При совместном применении фосапрепитанта 150 мг и дексаметазона, принимаемого перорально в дозе 8 мг в 1, 2 и 3-й дни, введение фосапрепитанта в 1-й день вызвало повышение AUC дексаметазона приблизительно в 2 раза в 1-й и 2-й дни. Стандартная доза дексаметазона (при его пероральном приеме) в сочетании с фосапрепитантом 150 мг (в/в в 1-й день) должна быть снижена приблизительно на 50% для достижения экспозиции дексаметазона, аналогичной таковой при назначении без фосапрепитанта 150 мг (в/в в 1-й день).
RxList.com (2015 г.
При пероральном приеме апрепитанта по схеме 125 мг в 1-й день и 80 мг/сут со 2-го по 5-й дни сочетанно с 20 мг дексаметазона в 1-й день и 8 мг дексаметазона со 2-го по 5-й дни AUC дексаметазона увеличивалась в 2,2 раза в 1-й и 5-й дни. Дозы дексаметазона, принимаемого перорально, должны быть снижены примерно на 50% при сочетанном применении с фосапрепитантом в дозе 115 мг после апрепитанта.
Метилпреднизолон. При одновременном пероральном приеме апрепитанта в дозе 125 мг в 1-й день и 80 мг/день во 2-й и 3-й дни было отмечено увеличение AUC метилпреднизолона - субстрата изофермента сYP3A4 - в 1,3 раза в 1-й день и в 2,5 раза в 3-й день, при в/в введении метилпреднизолона в дозе 125 мг в 1-й день и при пероральном приеме в дозе 40 мг во 2-й и 3-й дни.
RxList.com (2015 г.
Доза метилпреднизолона при в/в введении должна быть снижена примерно на 25%, а пероральная доза метилпреднизолона должна быть снижена примерно на 50% при сочетанном применении 115 мг фосапрепитанта.
Химиотерапевтические препараты.
В клинических исследованиях после перорального приема апрепитанта назначались химиотерапевтические ЛС, метаболизм которых главным образом или частично происходит при участии изофермента сYP3A4: этопозид, винорелбин, доцетаксел, ифосфамид, циклофосфамид, иринотекан и паклитаксел. Дозы указанных ЛС не корректировались с учетом потенциального лекарственного взаимодействия. Следует соблюдать осторожность и тщательно контролировать состояние пациента при применении химиотерапевтических ЛС, метаболизм которых главным образом или частично происходит при участии изофермента сYP3A4. В пострегистрационных исследованиях были зафиксированы случаи нейротоксичности как возможное побочное действие ифосфамида, применяемого совместно с апрепитантом.
Доцетаксел. В отдельном исследовании фармакокинетики при пероральном приеме апрепитанта (для предупреждения тошноты и рвоты, индуцированных химиотерапией) какое-либо влияние на фармакокинетику доцетаксела отмечено не было.
Винорелбин. В отдельном исследовании фармакокинетики при пероральном приеме апрепитанта (для предупреждения тошноты и рвоты, индуцированных химиотерапией) какое-либо влияние на фармакокинетику винорелбина отмечено не было.
RxList.com (2015 г.
Из-за небольшого числа пациентов, участвовавших в клинических исследованиях и получавших субстраты сYP3A4 - винбластин, винкристин или ифосфамид, - рекомендуется соблюдение особой осторожности и тщательный мониторинг пациентов, получающих эти или другие метаболизирующиеся сYP3A4 химиотерапевтические средства, которые не были изучены.
Варфарин.
Апрепитант назначался здоровым субъектам, получавшим длительную терапию варфарином, однократно в дозе 125 мг перорально в 1-й день и 80 мг/день во 2-й и 3-й дни. Несмотря на отсутствие какого-либо влияния на AUC R(+) или S(−) варфарина в 3-й день при пероральном приеме апрепитанта, отмечалось уменьшение сmin S(−) варфарина (субстрат изофермента сYP2C9) на 34%, которое сопровождалось уменьшением ПВ на 14% (MHO) через 5 дней после окончания перорального приема апрепитанта. У пациентов, получающих длительную терапию варфарином, следует тщательно контролировать ПВ (MHO) в течение 2 нед при каждом цикле химиотерапии и особенно через 7-10 дней после начала применения фосапрепитанта.
Толбутамид.
Апрепитант при пероральном приеме в дозе 125 мг в 1-й день и 80 мг во 2-й и 3-й дни вызывает уменьшение AUC толбутамида (субстрат изофермента сYP2C9) на 23% в 4-й день, на 28% в 8-й день и на 15% в 15-й день, при этом толбутамид в однократной дозе 500 мг назначали перед началом трехдневного режима перорального приема апрепитанта и в 4, и в 8, и в 15-й дни.
Пероральные контрацептивы.
При одновременном приеме апрепитанта в капсулах по 100 мг 1 раз в день в течение 14 дней и перорального контрацептива, содержащего 35 мкг этинилэстрадиола и 1 мг норэтиндрона, отмечалось уменьшение AUC этинилэстрадиола на 43% и уменьшение AUC норэтиндрона на 8%.
В другом исследовании однократный прием перорального контрацептива, содержащего этинилэстрадиол и норэтиндрон, назначенного с 1-го по 21-й дни, сочетался с одновременным назначением апрепитанта для перорального приема по схеме - 125 мг на 8-й день и 80 мг/день на 9-й и 10-й дни, ондансетрона в дозе 32 мг в/в на 8-й день и дексаметазона, назначенного перорально в дозе 12 мг на 8-й день, и 8 мг/день, на 9, 10, 11-й дни. В исследовании AUC этинилэстрадиола уменьшалась на 19% на 10-й день, и отмечалось снижение сmin этинилэстрадиола на 64% с 9-го по 21-й дни. Несмотря на отсутствие влияния апрепитанта при пероральном приеме на AUC норэтиндрона на 10-й день, отмечалось снижение сmin норэтиндрона до 60% с 9-го по 21-й дни.
Эффективность гормональных контрацептивов в период применения и в течение 28 дней после окончания применения фосапрепитанта может быть снижена. Во время лечения фосапрепитантом и в течение 1 мес после применения фосапрепитанта следует применять альтернативные или дополнительные методы контрацепции.
Мидазолам.
При одновременном применении фосапрепитанта в дозе 150 мг в/в и мидазолама однократно перорально 2 мг в 1-й день наблюдалось увеличение AUC0-∞ мидазолама примерно в 1,8 раза. При аналогичном режиме дозирования в 4-й день отсутствовало влияние на AUC. Фосапрепитант в дозе 150 мг в/в является слабым ингибитором изофермента сYP3A4, применение его в однократной дозе в 1-й день не приводило ни к ингибированию, ни к индукции изофермента сYP3А4, в отличие от результатов, полученных в 4-й день.
RxList.com (2015 г.
Следует учитывать возможное увеличение плазменных концентраций мидазолама или других бензодиазепинов, метаболизирующихся сYP3A4 (алпразолам, триазолам) при их совместном применении с фосапрепитантом или апрепитантом.
Влияние других ЛС на фармакокинетику апрепитанта.
Апрепитант является субстратом изофермента сYP3A4, вследствие чего одновременное применение фосапрепитанта с ЛС, которые ингибируют активность изофермента сYP3A4, может привести к увеличению концентрации апрепитанта в плазме крови. Следовательно, необходимо с осторожностью назначать фосапрепитант в комбинации с сильными ингибиторами изофермента сYP3A4 (например кетоконазол), но одновременный прием апрепитанта с умеренными ингибиторами изофермента сYP3A4 (например дилтиазем) не вызывает клинически значимых изменений концентрации апрепитанта в плазме крови.
RxList.com (2015 г.
Апрепитант - субстрат изофермента сYP3A4, поэтому одновременное применение фосапрепитанта или апрепитанта с ЛС, которые ингибируют активность изофермента сYP3A4, может привести к увеличению концентрации апрепитанта в плазме крови. Следовательно, к сопутствующему применению фосапрепитанта с сильными ингибиторами изофермента сYP3A4 (например кетоконазол, итраконазол, нефазодон, тролеандомицин, кларитромицин, ритонавир, нелфинавир) следует подходить с осторожностью. Поскольку умеренные ингибиторы сYP3A4 (например дилтиазем) приводят к 2-кратному увеличению плазменной концентрации апрепитанта, следует соблюдать осторожность при сочетанном применении.
Апрепитант - субстрат изофермента сYP3A4, вследствие чего одновременное применение фосапрепитанта с ЛС, которые являются сильными индукторами изофермента сYP3A4 (например рифампицин), может привести к уменьшению его концентрации в плазме и снижению эффективности.
RxList.com (2015 г.
Апрепитант - субстрат изофермента сYP3A4, вследствие чего одновременное применение фосапрепитанта с ЛС, которые являются сильными индукторами изофермента сYP3A4 (например рифампицин, карбамазепин, фенитоин), может привести к уменьшению его концентрации в плазме и снижению эффективности.
Кетоконазол.
При назначении апрепитанта однократно перорально в дозе 125 мг в 5-й день 10-дневной схемы лечения кетоконазолом (400 мг/день), являющимся сильным ингибитором изофермента сYP3A4, AUC апрепитанта увеличилась приблизительно в 5 раз, а конечный 1/2T1/2 апрепитанта увеличился приблизительно в 3 раза. Необходимо с осторожностью назначать фосапрепитант в комбинации с сильными ингибиторами изофермента сYP3A4.
Рифампицин.
При назначении апрепитанта однократно перорально в дозе 375 мг в 9-й день 14-дневной схемы лечения рифампицином, являющимся сильным индуктором изофермента сYP3A4, AUC апрепитанта уменьшилась приблизительно в 11 раз, а конечный 1/2T1/2 апрепитанта уменьшился приблизительно в 3 раза. Одновременное применение фосапрепитанта с ЛС, которые являются сильными индукторами изофермента сYP3A4, может привести к уменьшению концентрации в плазме и снижению эффективности.
Дополнительные данные о взаимодействии.
Дилтиазем.
У пациентов с легкой и умеренной артериальной гипертензией инфузия 100 мг фосапрепитанта в течение 15 мин в комбинации с дилтиаземом в дозе 120 мг 3 раза в день приводила к увеличению AUC апрепитанта в 1,5 раза и увеличению AUC дилтиазема в 1,4 раза. Фармакокинетические эффекты приводили к небольшому, но клинически значимому понижению дАД (понижение на 16,8 мм при применении фосапрепитанта и на 10,5 мм без фосапрепитанта) и сАД (понижение на 24,4 мм при назначении фосапрепитанта и на 18,8 мм без фосапрепитанта), но не вызывали клинически значимые изменения ЧСС, интервала PR по сравнению с изменением данных показателей при приеме только дилтиазема.
В том же исследовании апрепитант назначался 1 раз в сутки в виде таблеток в дозе, сопоставимой с 230 мг апрепитанта в капсулах, и дилтиазем в дозе 120 мг 3 раза в сутки в течение 5 дней, что приводило к увеличению AUC апрепитанта в 2 раза и одновременному увеличению AUC дилтиазема в 1,7 раза. Эти фармакокинетические эффекты не приводили к клинически значимым изменениям на ЭКГ, ЧСС или АД по сравнению с изменениями данных показателей при приеме только дилтиазема.
RxList.com (2015 г.
Дилтиазем. В исследовании в/в инфузия 100 мг фосапрепитанта в сочетании с дилтиаземом в дозе 120 мг 3 раза в день у 10 пациентов с легкой и умеренной артериальной гипертензией приводила к увеличению AUC апрепитанта в 1,5 раза и увеличению AUC дилтиазема в 1,4 раза. Отмечалось также небольшое, но клинически значимое понижение дАД (понижение на (24,3±10,2) мм при применении фосапрепитанта и на (15,6±4,1) мм без фосапрепитанта) и небольшое, но клинически значимое понижение сАД (понижение на (29,5±7,9) мм при назначении фосапрепитанта и на (23,8±4,8) мм без фосапрепитанта), которые несмотря на клиническую значимость могут не вызывать клинически значимые изменения ЧСС или интервала PR по сравнению с изменениями данных показателей, вызванных только дилтиаземом.
В том же исследовании апрепитант назначался 1 раз в сутки в виде таблеток в дозе, сопоставимой с 230 мг апрепитанта в капсулах, и дилтиазем в дозе 120 мг 3 раза в сутки в течение 5 дней, что приводило к увеличению AUC апрепитанта в 2 раза и одновременному увеличению AUC дилтиазема в 1,7 раза. Эти фармакокинетические эффекты не приводили к клинически значимым изменениям на ЭКГ, ЧСС или АД по сравнению с изменениями данных показателей при приеме только дилтиазема.
Пароксетин.
Одновременный прием апрепитанта 1 раз в сутки в форме таблеток в дозе, сопоставимой с 85 мг или 170 мг апрепитанта в капсулах, и пароксетина в дозе 20 мг 1 раз в сутки приводил к уменьшению AUC приблизительно на 25% и Сmах приблизительно на 20% как для апрепитанта, так и для пароксетина.
Фосапрепитант несовместим с растворами, содержащими двухвалентные катионы (например Са2+, Mg2+), в тч с раствором Хартмана и раствором Рингера с лактатом. Лиофилизат нельзя разводить или смешивать с растворами, физическая и химическая совместимость с которыми не была доказана.
RxList.com (обновление 2021 г.
Влияние фосапрепитанта/апрепитанта на фармакокинетику других ЛС.
При в/в введении фосапрепитант, пролекарство апрепитанта, превращается в апрепитант в течение 30 мин. Следовательно, взаимодействие после введения фосапрепитанта для инъекций, вероятно, будет осуществляться с ЛС, которые взаимодействуют с пероральным апрепитантом.
Фосапрепитант, вводимый однократно в дозе 150 мг, является слабым ингибитором изофермента сYP3A4, и слабое ингибирование сYP3A4 продолжается в течение 2 дней после введения однократной дозы. Однократная доза фосапрепитанта не индуцирует сYP3A4. Апрепитант - это субстрат, ингибитор и индуктор сYP3A4. Апрепитант также является индуктором сYP2C9.
Некоторые субстраты сYP3A4 противопоказаны при применении фосапрепитанта для инъекций ( см «Противопоказания»). Может потребоваться корректировка дозы некоторых субстратов сYP3A4 и сYP2C9, как показано в таблице 2.
Таблица 2.
Влияние фосапрепитанта/апрепитанта на фармакокинетику других ЛС.
Влияние других ЛС на фармакокинетику фосапрепитанта/апрепитанта.
Апрепитант является субстратом сYP3A4. Сочетанное применение фосапрепитанта для инъекций с ЛС, которые являются ингибиторами или индукторами сYP3A4, может приводить к увеличению или снижению концентрации апрепитанта в плазме соответственно, как показано в таблице 3.
Таблица 3.
Влияние других ЛС на фармакокинетику фосапрепитанта/апрепитанта.
Фосапрепитант, принимаемый в виде однократной дозы 150 мг, является слабым ингибитором сYP3A4, слабое ингибирование сYP3A4 продолжается в течение 2 дней, при этом на 4-й день не наблюдается каких-либо доказательств ингибирования или индукции сYP3A4.
Апрепитант является субстратом, слабым или умеренным ингибитором и индуктором изофермента сYP3А4. Апрепитант также является индуктором изофермента сYP2C9.
При однократном применении фосапрепитант в дозе 150 мг является слабым ингибитором изофермента сYP3A4 и не вызывает индукцию изофермента сYP3A4. Предполагается, что фосапрепитант в дозе 150 мг в форме для в/в введения будет вызывать меньшую или не бóльшую индукцию изофермента сYP2C9 по сравнению с приемом апрепитанта перорально.
Влияние фосапрепитанта/апрепитанта на фармакокинетику других ЛС.
Ввиду того, что апрепитант является слабым или умеренным ингибитором изофермента сYP3A4, а фосапрепитант является слабым ингибитором изофермента сYP3A4, при одновременном применении ЛС, метаболизм которых происходит при участии изофермента сYP3A4, их концентрации в плазме крови могут повышаться.
Фосапрепитант не следует применять одновременно с пимозидом, терфенадином, астемизолом или цизапридом. Ингибирование изофермента сYP3A4 под влиянием апрепитанта может привести к повышению концентрации этих ЛС в плазме и к потенциально серьезным или опасным для жизни реакциям ( см «Противопоказания»).
Было показано, что апрепитант индуцирует метаболизм S(-) варфарина и толбутамида, которые метаболизируются изоферментом сYP2C9. Одновременное назначение фосапрепитанта с этими или другими ЛС, которые метаболизируются изоферментом сYP2C9 (например фенитоин), может привести к снижению концентрации в плазме этих ЛС.
Взаимодействие фосапрепитанта с ЛС, являющимися субстратами переносчика Р-gp, маловероятно ввиду того, что в клинических исследованиях было показано отсутствие взаимодействия апрепитанта с дигоксином при пероральном приеме.
Антагонисты 5-НТ3.
В ходе клинических исследований лекарственного взаимодействия было показано, что апрепитант при приеме 125 мг в 1-й день и 80 мг во 2-й и 3-й дни не вызывает клинически значимые изменения фармакокинетики антагонистов серотониновых 5-НТ3-рецепторов - ондансетрона, гранисетрона и гидродоласетрона (активный метаболит доласетрона).
Кортикостероиды.
Дексаметазон. При совместном применении фосапрепитанта 150 мг и дексаметазона, принимаемого перорально в дозе 8 мг в 1, 2 и 3-й дни, введение фосапрепитанта в 1-й день вызвало повышение AUC дексаметазона приблизительно в 2 раза в 1-й и 2-й дни. Стандартная доза дексаметазона (при его пероральном приеме) в сочетании с фосапрепитантом 150 мг (в/в в 1-й день) должна быть снижена приблизительно на 50% для достижения экспозиции дексаметазона, аналогичной таковой при назначении без фосапрепитанта 150 мг (в/в в 1-й день).
RxList.com (2015 г.
При пероральном приеме апрепитанта по схеме 125 мг в 1-й день и 80 мг/сут со 2-го по 5-й дни сочетанно с 20 мг дексаметазона в 1-й день и 8 мг дексаметазона со 2-го по 5-й дни AUC дексаметазона увеличивалась в 2,2 раза в 1-й и 5-й дни. Дозы дексаметазона, принимаемого перорально, должны быть снижены примерно на 50% при сочетанном применении с фосапрепитантом в дозе 115 мг после апрепитанта.
Метилпреднизолон. При одновременном пероральном приеме апрепитанта в дозе 125 мг в 1-й день и 80 мг/день во 2-й и 3-й дни было отмечено увеличение AUC метилпреднизолона - субстрата изофермента сYP3A4 - в 1,3 раза в 1-й день и в 2,5 раза в 3-й день, при в/в введении метилпреднизолона в дозе 125 мг в 1-й день и при пероральном приеме в дозе 40 мг во 2-й и 3-й дни.
RxList.com (2015 г.
Доза метилпреднизолона при в/в введении должна быть снижена примерно на 25%, а пероральная доза метилпреднизолона должна быть снижена примерно на 50% при сочетанном применении 115 мг фосапрепитанта.
Химиотерапевтические препараты.
В клинических исследованиях после перорального приема апрепитанта назначались химиотерапевтические ЛС, метаболизм которых главным образом или частично происходит при участии изофермента сYP3A4: этопозид, винорелбин, доцетаксел, ифосфамид, циклофосфамид, иринотекан и паклитаксел. Дозы указанных ЛС не корректировались с учетом потенциального лекарственного взаимодействия. Следует соблюдать осторожность и тщательно контролировать состояние пациента при применении химиотерапевтических ЛС, метаболизм которых главным образом или частично происходит при участии изофермента сYP3A4. В пострегистрационных исследованиях были зафиксированы случаи нейротоксичности как возможное побочное действие ифосфамида, применяемого совместно с апрепитантом.
Доцетаксел. В отдельном исследовании фармакокинетики при пероральном приеме апрепитанта (для предупреждения тошноты и рвоты, индуцированных химиотерапией) какое-либо влияние на фармакокинетику доцетаксела отмечено не было.
Винорелбин. В отдельном исследовании фармакокинетики при пероральном приеме апрепитанта (для предупреждения тошноты и рвоты, индуцированных химиотерапией) какое-либо влияние на фармакокинетику винорелбина отмечено не было.
RxList.com (2015 г.
Из-за небольшого числа пациентов, участвовавших в клинических исследованиях и получавших субстраты сYP3A4 - винбластин, винкристин или ифосфамид, - рекомендуется соблюдение особой осторожности и тщательный мониторинг пациентов, получающих эти или другие метаболизирующиеся сYP3A4 химиотерапевтические средства, которые не были изучены.
Варфарин.
Апрепитант назначался здоровым субъектам, получавшим длительную терапию варфарином, однократно в дозе 125 мг перорально в 1-й день и 80 мг/день во 2-й и 3-й дни. Несмотря на отсутствие какого-либо влияния на AUC R(+) или S(−) варфарина в 3-й день при пероральном приеме апрепитанта, отмечалось уменьшение сmin S(−) варфарина (субстрат изофермента сYP2C9) на 34%, которое сопровождалось уменьшением ПВ на 14% (MHO) через 5 дней после окончания перорального приема апрепитанта. У пациентов, получающих длительную терапию варфарином, следует тщательно контролировать ПВ (MHO) в течение 2 нед при каждом цикле химиотерапии и особенно через 7-10 дней после начала применения фосапрепитанта.
Толбутамид.
Апрепитант при пероральном приеме в дозе 125 мг в 1-й день и 80 мг во 2-й и 3-й дни вызывает уменьшение AUC толбутамида (субстрат изофермента сYP2C9) на 23% в 4-й день, на 28% в 8-й день и на 15% в 15-й день, при этом толбутамид в однократной дозе 500 мг назначали перед началом трехдневного режима перорального приема апрепитанта и в 4, и в 8, и в 15-й дни.
Пероральные контрацептивы.
При одновременном приеме апрепитанта в капсулах по 100 мг 1 раз в день в течение 14 дней и перорального контрацептива, содержащего 35 мкг этинилэстрадиола и 1 мг норэтиндрона, отмечалось уменьшение AUC этинилэстрадиола на 43% и уменьшение AUC норэтиндрона на 8%.
В другом исследовании однократный прием перорального контрацептива, содержащего этинилэстрадиол и норэтиндрон, назначенного с 1-го по 21-й дни, сочетался с одновременным назначением апрепитанта для перорального приема по схеме - 125 мг на 8-й день и 80 мг/день на 9-й и 10-й дни, ондансетрона в дозе 32 мг в/в на 8-й день и дексаметазона, назначенного перорально в дозе 12 мг на 8-й день, и 8 мг/день, на 9, 10, 11-й дни. В исследовании AUC этинилэстрадиола уменьшалась на 19% на 10-й день, и отмечалось снижение сmin этинилэстрадиола на 64% с 9-го по 21-й дни. Несмотря на отсутствие влияния апрепитанта при пероральном приеме на AUC норэтиндрона на 10-й день, отмечалось снижение сmin норэтиндрона до 60% с 9-го по 21-й дни.
Эффективность гормональных контрацептивов в период применения и в течение 28 дней после окончания применения фосапрепитанта может быть снижена. Во время лечения фосапрепитантом и в течение 1 мес после применения фосапрепитанта следует применять альтернативные или дополнительные методы контрацепции.
Мидазолам.
При одновременном применении фосапрепитанта в дозе 150 мг в/в и мидазолама однократно перорально 2 мг в 1-й день наблюдалось увеличение AUC0-∞ мидазолама примерно в 1,8 раза. При аналогичном режиме дозирования в 4-й день отсутствовало влияние на AUC. Фосапрепитант в дозе 150 мг в/в является слабым ингибитором изофермента сYP3A4, применение его в однократной дозе в 1-й день не приводило ни к ингибированию, ни к индукции изофермента сYP3А4, в отличие от результатов, полученных в 4-й день.
RxList.com (2015 г.
Следует учитывать возможное увеличение плазменных концентраций мидазолама или других бензодиазепинов, метаболизирующихся сYP3A4 (алпразолам, триазолам) при их совместном применении с фосапрепитантом или апрепитантом.
Влияние других ЛС на фармакокинетику апрепитанта.
Апрепитант является субстратом изофермента сYP3A4, вследствие чего одновременное применение фосапрепитанта с ЛС, которые ингибируют активность изофермента сYP3A4, может привести к увеличению концентрации апрепитанта в плазме крови. Следовательно, необходимо с осторожностью назначать фосапрепитант в комбинации с сильными ингибиторами изофермента сYP3A4 (например кетоконазол), но одновременный прием апрепитанта с умеренными ингибиторами изофермента сYP3A4 (например дилтиазем) не вызывает клинически значимых изменений концентрации апрепитанта в плазме крови.
RxList.com (2015 г.
Апрепитант - субстрат изофермента сYP3A4, поэтому одновременное применение фосапрепитанта или апрепитанта с ЛС, которые ингибируют активность изофермента сYP3A4, может привести к увеличению концентрации апрепитанта в плазме крови. Следовательно, к сопутствующему применению фосапрепитанта с сильными ингибиторами изофермента сYP3A4 (например кетоконазол, итраконазол, нефазодон, тролеандомицин, кларитромицин, ритонавир, нелфинавир) следует подходить с осторожностью. Поскольку умеренные ингибиторы сYP3A4 (например дилтиазем) приводят к 2-кратному увеличению плазменной концентрации апрепитанта, следует соблюдать осторожность при сочетанном применении.
Апрепитант - субстрат изофермента сYP3A4, вследствие чего одновременное применение фосапрепитанта с ЛС, которые являются сильными индукторами изофермента сYP3A4 (например рифампицин), может привести к уменьшению его концентрации в плазме и снижению эффективности.
RxList.com (2015 г.
Апрепитант - субстрат изофермента сYP3A4, вследствие чего одновременное применение фосапрепитанта с ЛС, которые являются сильными индукторами изофермента сYP3A4 (например рифампицин, карбамазепин, фенитоин), может привести к уменьшению его концентрации в плазме и снижению эффективности.
Кетоконазол.
При назначении апрепитанта однократно перорально в дозе 125 мг в 5-й день 10-дневной схемы лечения кетоконазолом (400 мг/день), являющимся сильным ингибитором изофермента сYP3A4, AUC апрепитанта увеличилась приблизительно в 5 раз, а конечный 1/2T1/2 апрепитанта увеличился приблизительно в 3 раза. Необходимо с осторожностью назначать фосапрепитант в комбинации с сильными ингибиторами изофермента сYP3A4.
Рифампицин.
При назначении апрепитанта однократно перорально в дозе 375 мг в 9-й день 14-дневной схемы лечения рифампицином, являющимся сильным индуктором изофермента сYP3A4, AUC апрепитанта уменьшилась приблизительно в 11 раз, а конечный 1/2T1/2 апрепитанта уменьшился приблизительно в 3 раза. Одновременное применение фосапрепитанта с ЛС, которые являются сильными индукторами изофермента сYP3A4, может привести к уменьшению концентрации в плазме и снижению эффективности.
Дополнительные данные о взаимодействии.
Дилтиазем.
У пациентов с легкой и умеренной артериальной гипертензией инфузия 100 мг фосапрепитанта в течение 15 мин в комбинации с дилтиаземом в дозе 120 мг 3 раза в день приводила к увеличению AUC апрепитанта в 1,5 раза и увеличению AUC дилтиазема в 1,4 раза. Фармакокинетические эффекты приводили к небольшому, но клинически значимому понижению дАД (понижение на 16,8 мм при применении фосапрепитанта и на 10,5 мм без фосапрепитанта) и сАД (понижение на 24,4 мм при назначении фосапрепитанта и на 18,8 мм без фосапрепитанта), но не вызывали клинически значимые изменения ЧСС, интервала PR по сравнению с изменением данных показателей при приеме только дилтиазема.
В том же исследовании апрепитант назначался 1 раз в сутки в виде таблеток в дозе, сопоставимой с 230 мг апрепитанта в капсулах, и дилтиазем в дозе 120 мг 3 раза в сутки в течение 5 дней, что приводило к увеличению AUC апрепитанта в 2 раза и одновременному увеличению AUC дилтиазема в 1,7 раза. Эти фармакокинетические эффекты не приводили к клинически значимым изменениям на ЭКГ, ЧСС или АД по сравнению с изменениями данных показателей при приеме только дилтиазема.
RxList.com (2015 г.
Дилтиазем. В исследовании в/в инфузия 100 мг фосапрепитанта в сочетании с дилтиаземом в дозе 120 мг 3 раза в день у 10 пациентов с легкой и умеренной артериальной гипертензией приводила к увеличению AUC апрепитанта в 1,5 раза и увеличению AUC дилтиазема в 1,4 раза. Отмечалось также небольшое, но клинически значимое понижение дАД (понижение на (24,3±10,2) мм при применении фосапрепитанта и на (15,6±4,1) мм без фосапрепитанта) и небольшое, но клинически значимое понижение сАД (понижение на (29,5±7,9) мм при назначении фосапрепитанта и на (23,8±4,8) мм без фосапрепитанта), которые несмотря на клиническую значимость могут не вызывать клинически значимые изменения ЧСС или интервала PR по сравнению с изменениями данных показателей, вызванных только дилтиаземом.
В том же исследовании апрепитант назначался 1 раз в сутки в виде таблеток в дозе, сопоставимой с 230 мг апрепитанта в капсулах, и дилтиазем в дозе 120 мг 3 раза в сутки в течение 5 дней, что приводило к увеличению AUC апрепитанта в 2 раза и одновременному увеличению AUC дилтиазема в 1,7 раза. Эти фармакокинетические эффекты не приводили к клинически значимым изменениям на ЭКГ, ЧСС или АД по сравнению с изменениями данных показателей при приеме только дилтиазема.
Пароксетин.
Одновременный прием апрепитанта 1 раз в сутки в форме таблеток в дозе, сопоставимой с 85 мг или 170 мг апрепитанта в капсулах, и пароксетина в дозе 20 мг 1 раз в сутки приводил к уменьшению AUC приблизительно на 25% и Сmах приблизительно на 20% как для апрепитанта, так и для пароксетина.
Фосапрепитант несовместим с растворами, содержащими двухвалентные катионы (например Са2+, Mg2+), в тч с раствором Хартмана и раствором Рингера с лактатом. Лиофилизат нельзя разводить или смешивать с растворами, физическая и химическая совместимость с которыми не была доказана.
RxList.com (обновление 2021 г.
Влияние фосапрепитанта/апрепитанта на фармакокинетику других ЛС.
При в/в введении фосапрепитант, пролекарство апрепитанта, превращается в апрепитант в течение 30 мин. Следовательно, взаимодействие после введения фосапрепитанта для инъекций, вероятно, будет осуществляться с ЛС, которые взаимодействуют с пероральным апрепитантом.
Фосапрепитант, вводимый однократно в дозе 150 мг, является слабым ингибитором изофермента сYP3A4, и слабое ингибирование сYP3A4 продолжается в течение 2 дней после введения однократной дозы. Однократная доза фосапрепитанта не индуцирует сYP3A4. Апрепитант - это субстрат, ингибитор и индуктор сYP3A4. Апрепитант также является индуктором сYP2C9.
Некоторые субстраты сYP3A4 противопоказаны при применении фосапрепитанта для инъекций ( см «Противопоказания»). Может потребоваться корректировка дозы некоторых субстратов сYP3A4 и сYP2C9, как показано в таблице 2.
Таблица 2.
Влияние фосапрепитанта/апрепитанта на фармакокинетику других ЛС.
| Субстраты сYP3A4 | |
| Пимозид | |
| Клиническое влияние | Повышение экспозиции пимозида |
| Вмешательство | Фосапрепитант для инъекций противопоказан ( см «Противопоказания») |
| Бензодиазепины | |
| Клиническое влияние | Повышение экспозиции мидазолама или других бензодиазепинов, метаболизирующихся посредством сYP3A4 (алпразолам, триазолам) может увеличить риск развития побочных реакций |
| Вмешательство | Мониторинг побочных реакций, связанных с бензодиазепинами |
| Дексаметазон | |
| Клиническое влияние | Повышение экспозиции дексаметазона |
| Вмешательство | Снизить дозы перорального дексаметазона примерно на 50% |
| Метилпреднизолон | |
| Клиническое влияние | Повышение экспозиции метилпреднизолона |
| Вмешательство | Снизить дозы перорального метилпреднизолона примерно на 50% в 1-й и 2-й дни у пациентов, получающих высокоэметогенную противоопухолевую химиотерапию, и в 1-й день у пациентов, получающих умеренноэметогенную противоопухолевую химиотерапию. Снизить дозу метилпреднизолона для в/в введения на 25% в 1-й и 2-й дни у пациентов, получающих высокоэметогенную противоопухолевую химиотерапию, и в 1-й день у пациентов, получающих умеренноэметогенную противоопухолевую химиотерапию |
| Химиотерапевтические ЛС, которые метаболизируются посредством сYP3A4 | |
| Клиническое влияние | Повышение экспозиции химиотерапевтических ЛС может увеличить риск развития побочных реакций |
| Вмешательство | Винбластин, винкристин, ифосфамид и другие химиотерапевтические ЛС Мониторинг побочных реакций, связанных с химиотерапией Этопозид, винорелбин, паклитаксел и доцетаксел Коррекция дозы не требуется |
| Гормональные контрацептивы | |
| Клиническое влияние | Снижение гормональной экспозиции во время применения и в течение 28 дней после окончания применения фосапрепитанта для инъекций ( см «Меры предосторожности») |
| Вмешательство | Следует использовать эффективные альтернативные или резервные методы контрацепции (такие как презервативы и спермициды) во время лечения фосапрепитантом для инъекций и в течение 1 мес после его применения |
| Примеры | Противозачаточные таблетки, кожные пластыри, имплантаты и некоторые ВМС |
| Субстраты сYP2С9 | |
| Варфарин | |
| Клиническое влияние | Снижение экспозиции варфарина и удлинение ПВ (МНО) ( см «Меры предосторожности») |
| Вмешательство | У пациентов, постоянно применяющих варфарин, мониторинг ПВ (МНО) в течение 2-недельного периода, особенно через 7-10 дней, после введения фосапрепитанта для инъекций в каждом цикле химиотерапии |
| Другие | |
| Антагонисты 5-HT3-рецепторов | |
| Клиническое влияние | Экспозиция антагонистов 5-НТ3-рецепторов не меняется |
| Вмешательство | Корректировка дозы не требуется |
| Примеры | Ондансетрон, гранисетрон, доласетрон |
Влияние других ЛС на фармакокинетику фосапрепитанта/апрепитанта.
Апрепитант является субстратом сYP3A4. Сочетанное применение фосапрепитанта для инъекций с ЛС, которые являются ингибиторами или индукторами сYP3A4, может приводить к увеличению или снижению концентрации апрепитанта в плазме соответственно, как показано в таблице 3.
Таблица 3.
Влияние других ЛС на фармакокинетику фосапрепитанта/апрепитанта.
| Умеренные и сильные ингибиторы сYP3A4 | |
| Клиническое влияние | Значительное повышение экспозиции апрепитанта может увеличить риск развития побочных реакций, связанных с фосапрепитантом для инъекций ( см «Побочные действия») |
| Вмешательство | Избегать одновременного использования фосапрепитанта для инъекций |
| Примеры | Умеренный ингибитор: дилтиазем. Сильные ингибиторы: кетоконазол, итраконазол, нефазодон, тролеандомицин, кларитромицин, ритонавир, нелфинавир |
| Сильные индукторы сYP3A4 | |
| Клиническое влияние | Уменьшение в значительной степени экспозиции апрепитанта у пациентов, постоянно принимающих сильный индуктор сYP3A4, может снизить эффективность фосапрепитанта для инъекций |
| Вмешательство | Избегать одновременного использования фосапрепитанта для инъекций |
| Примеры | Рифампицин, карбамазепин, фенитоин |
Фосапрепитант, принимаемый в виде однократной дозы 150 мг, является слабым ингибитором сYP3A4, слабое ингибирование сYP3A4 продолжается в течение 2 дней, при этом на 4-й день не наблюдается каких-либо доказательств ингибирования или индукции сYP3A4.
|
|
Передозировка
Какая-либо специфическая информация по устранению симптомов передозировки фосапрепитанта отсутствует. При однократном введении добровольцам фосапрепитанта в дозе до 200 мг в/в или приеме апрепитанта до 600 мг перорально была показана хорошая переносимость. У троих из 33 добровольцев, получавших фосапрепитант в дозе 200 мг, отмечались тромбозы в месте инъекции слабой степени выраженности. В ходе исследований, не связанных с изучением индуцированных химиотерапией тошноты и рвоты, была показана хорошая переносимость апрепитанта при его назначении пациентам в дозе 375 мг 1 раз в день в течение 42 дней. У 33 онкологических пациентов была показана хорошая переносимость апрепитанта при однократном приеме дозы 375 мг в 1-й день и 250 мг 1 раз в день со 2-го по 5-й дни.
Сообщалось о возникновении сонливости и головной боли у одного пациента, принявшего 1440 мг апрепитанта.
RxList.com (2015 г.
Симптомы. В рандомизированном контролируемом испытании 13 пациентов применяли фосапрепитант для инъекций в дозе 150 мг и по меньшей мере одну дозу апрепитанта внутрь - 125 или 80 мг. Три пациента сообщили о побочных реакциях, которые были схожи с теми, которые наблюдались во всей исследуемой популяции.
Лечение. Отмена ЛС, поддерживающая терапия и контроль состояния пациента. В связи с противорвотными действием апрепитанта ЛС, вызывающие рвоту, могут оказаться неэффективны. Специфическая информация по устранению симптомов передозировки фосапрепитанта или апрепитанта отсутствует. Апрепитант не выводится с помощью гемодиализа.
Сообщалось о возникновении сонливости и головной боли у одного пациента, принявшего 1440 мг апрепитанта.
RxList.com (2015 г.
Симптомы. В рандомизированном контролируемом испытании 13 пациентов применяли фосапрепитант для инъекций в дозе 150 мг и по меньшей мере одну дозу апрепитанта внутрь - 125 или 80 мг. Три пациента сообщили о побочных реакциях, которые были схожи с теми, которые наблюдались во всей исследуемой популяции.
Лечение. Отмена ЛС, поддерживающая терапия и контроль состояния пациента. В связи с противорвотными действием апрепитанта ЛС, вызывающие рвоту, могут оказаться неэффективны. Специфическая информация по устранению симптомов передозировки фосапрепитанта или апрепитанта отсутствует. Апрепитант не выводится с помощью гемодиализа.
Способ применения и дозы
В/в, в виде инфузии продолжительностью от 20 до 30 мин, в комбинации с ГКС и антагонистами 5-НТ3-рецепторов. Рекомендуемая доза - 150 мг примерно за 30 мин до начала химиотерапии в 1-й день.
RxList.com (обновление 2021 г.
В/в, в виде инфузии продолжительностью 20-30 мин, в комбинации с дексаметазоном и антагонистом 5-НТ3-рецепторов. Рекомендуемая доза - 150 мг примерно за 30 мин до начала химиотерапии в 1-й день.
RxList.com (обновление 2021 г.
В/в, в виде инфузии продолжительностью 20-30 мин, в комбинации с дексаметазоном и антагонистом 5-НТ3-рецепторов. Рекомендуемая доза - 150 мг примерно за 30 мин до начала химиотерапии в 1-й день.
Меры предосторожности применения
Ввиду того, что фосапрепитант быстро метаболизируется в апрепитант (является слабым или умеренным ингибитором изофермента сYP3A4), его следует с осторожностью применять у пациентов, одновременно получающих ЛС, которые метаболизируются главным образом при участии изофермента сYP3A4; некоторые химиотерапевтические ЛС метаболизируются при участии изофермента сYP3A4. Слабое ингибирующее действие фосапрепитанта 150 мг на изофермент сYP3A4 может приводить к повышению концентраций этих совместно принимаемых перорально ЛС ( см «Взаимодействие»).
RxList.com (обновление 2021 г.
Клинически значимое сYP3A4 взаимодействие.
Фосапрепитант, пролекарство апрепитанта, является слабым ингибитором сYP3A4, а апрепитант является субстратом, ингибитором и индуктором сYP3A4.
Применение фосапрепитанта для инъекций с другими ЛС, которые являются субстратами сYP3A4, может привести к повышению концентрации сопутствующего ЛС в плазме крови.
Применение пимозида с фосапрепитантом для инъекций противопоказано из-за риска значительного повышения концентрации пимозида в плазме, что может привести к удлинению интервала QT, известной неблагоприятной реакции пимозида ( см «Противопоказания»).
Применение фосапрепитанта для инъекций с сильными или умеренными ингибиторами сYP3A4 (например, кетоконазол, дилтиазем) может увеличить плазменные концентрации апрепитанта и привести к повышенному риску побочных реакций, связанных с фосапрепитантом.
Применение фосапрепитанта для инъекций с сильными индукторами сYP3A4 (например, рифампицин) может привести к снижению концентрации апрепитанта в плазме и снижению эффективности фосапрепитанта ( см Таблицу 2 и Таблицу 3 перечня потенциально значимых взаимодействий, «Взаимодействие»).
Есть единичные данные об аллергических реакциях немедленного типа, таких как покраснение, эритема и диспноэ, которые возникали во время инфузии фосапрепитанта. Эти аллергические реакции обычно исчезали после прекращения инфузии и использования соответствующей терапии. Не рекомендуется возобновлять инфузии фосапрепитанта пациентам, у которых были эти аллергические реакции.
RxList.com (2015 г.
Реакции гиперчувствительности. Имеются сообщения об аллергических реакциях немедленного типа, включая такие, как прилив крови к лицу, эритема, диспноэ, анафилаксия, которые возникали во время инфузии фосапрепитанта. Эти реакции гиперчувствительности обычно исчезали после прекращения инфузии и проведения соответствующей терапии. Не рекомендуется возобновлять инфузии фосапрепитанта пациентам, у которых эти реакции возникли после первого введения.
Одновременное назначение фосапрепитанта с варфарином перорально может привести к клинически значимому снижению МНО ПВ. У пациентов, получающих длительную терапию варфарином, следует тщательно контролировать MHO в течение 2 нед, особенно через 7-10 дней после введения фосапрепитанта при каждом цикле химиотерапии ( см «Взаимодействие»).
Эффективность гормональных контрацептивов может снизиться во время и в течение 28 дней после применения фосапрепитанта. Во время лечения фосапрепитантом и в течение 1 мес после применения фосапрепитанта следует использовать альтернативные или дополнительные методы контрацепции ( см «Взаимодействие»).
RxList.com (2015 г.
Совместное применение с гормональными контрацептивами. Эффективность гормональных контрацептивов может снизиться во время и в течение 28 дней после применения последней дозы фосапрепитанта или апрепитанта. Во время лечения фосапрепитантом или апрепитантом и в течение 1 мес после их применения следует использовать альтернативные или дополнительные методы контрацепции ( см «Взаимодействие»).
Длительное непрерывное использование фосапрепитанта для инъекций для профилактики тошноты и рвоты не рекомендуется, поскольку соответствующие клинические исследования не проведены, а также потому, что профиль лекарственного взаимодействия при непрерывном использовании может измениться.
Не требуется коррекция дозы в зависимости от возраста, пола, расовой принадлежности, а также ИМТ.
Применение у детей. Безопасность и эффективность применения фосапрепитанта у детей не изучалась.
Применение у пожилых пациентов. Согласно данным, полученным в клинических исследованиях, эффективность и безопасность апрепитанта у пожилых пациентов (возраст ≥65 лет) были сопоставимы с таковыми у более молодых пациентов (<65 лет). Коррекция дозировки у пожилых пациентов не требуется.
RxList.com (2015 г.
Пожилой возраст. В 2 строго контролируемых клинических исследованиях развития тошноты и рвоты, индуцированных химиотерапией, из общего количества пациентов (n=544), принимавших апрепитант перорально, 31% пациентов были в возрасте 65 лет и старше, в то время как 5% были в возрасте 75 лет и старше. В целом различий в эффективности и безопасности у пожилых пациентов по сравнению с молодыми выявлено не было. Бóльшая чувствительность некоторых людей старшего возраста не может быть исключена. Корректировка дозы у пожилых пациентов не требуется ( см «Фармакология»).
Пациенты с тяжелой печеночной недостаточностью. Клинические или фармакокинетические данные для пациентов с тяжелой печеночной недостаточностью (>9 баллов по шкале Чайлд-Пью) отсутствуют. Поэтому следует проявлять осторожность при применении фосапрепитанта или апрепитанта у этих больных ( см «Фармакология»).
RxList.com (обновление 2021 г.
Применение в гериатрии. Из 1649 взрослых онкологических больных, получавших в/в фосапрепитант для инъекций в клинических исследованиях при высоко- и умеренноэметогенной противоопухолевой химиотерапии, 27% были в возрасте 65 лет и старше, а 5% - в возрасте 75 лет и старше. Другой зарегистрированный клинический опыт применения фосапрепитанта для инъекций не выявил различий в ответах у пожилых и молодых пациентов. В целом, необходимо соблюдать осторожность при применении у пожилых пациентов, у них чаще встречается снижение функции печени, почек или сердца и сопутствующие заболевания или другая лекарственная терапия.
Пациенты с печеночной недостаточностью. Фармакокинетика апрепитанта у пациентов с легкой и умеренной печеночной недостаточностью была аналогична таковой у здоровых людей с нормальной функцией печени. Для пациентов с печеночной недостаточностью легкой и средней степени тяжести (оценка по шкале Чайлд-Пью от 5 до 9) коррекция дозы не требуется. Нет клинических или фармакокинетических данных у пациентов с тяжелой печеночной недостаточностью (оценка по шкале Чайлд-Пью более 9). Поэтому может потребоваться дополнительный мониторинг побочных реакций у этих пациентов при применении фосапрепитанта для инъекций.
Влияние на способность управлять транспортными средствами и работать с механизмами. Исследования по влиянию фосапрепитанта на способность управлять автомобилем и работать с механизмами не проводились. Однако некоторые побочные эффекты, связанные с использованием фосапрепитанта, могут повлиять на способность управлять автомобилем и работать с механизмами. Индивидуальные реакции при применении фосапрепитанта могут быть различными ( см «Побочные действия»).
RxList.com (обновление 2021 г.
Клинически значимое сYP3A4 взаимодействие.
Фосапрепитант, пролекарство апрепитанта, является слабым ингибитором сYP3A4, а апрепитант является субстратом, ингибитором и индуктором сYP3A4.
Применение фосапрепитанта для инъекций с другими ЛС, которые являются субстратами сYP3A4, может привести к повышению концентрации сопутствующего ЛС в плазме крови.
Применение пимозида с фосапрепитантом для инъекций противопоказано из-за риска значительного повышения концентрации пимозида в плазме, что может привести к удлинению интервала QT, известной неблагоприятной реакции пимозида ( см «Противопоказания»).
Применение фосапрепитанта для инъекций с сильными или умеренными ингибиторами сYP3A4 (например, кетоконазол, дилтиазем) может увеличить плазменные концентрации апрепитанта и привести к повышенному риску побочных реакций, связанных с фосапрепитантом.
Применение фосапрепитанта для инъекций с сильными индукторами сYP3A4 (например, рифампицин) может привести к снижению концентрации апрепитанта в плазме и снижению эффективности фосапрепитанта ( см Таблицу 2 и Таблицу 3 перечня потенциально значимых взаимодействий, «Взаимодействие»).
Есть единичные данные об аллергических реакциях немедленного типа, таких как покраснение, эритема и диспноэ, которые возникали во время инфузии фосапрепитанта. Эти аллергические реакции обычно исчезали после прекращения инфузии и использования соответствующей терапии. Не рекомендуется возобновлять инфузии фосапрепитанта пациентам, у которых были эти аллергические реакции.
RxList.com (2015 г.
Реакции гиперчувствительности. Имеются сообщения об аллергических реакциях немедленного типа, включая такие, как прилив крови к лицу, эритема, диспноэ, анафилаксия, которые возникали во время инфузии фосапрепитанта. Эти реакции гиперчувствительности обычно исчезали после прекращения инфузии и проведения соответствующей терапии. Не рекомендуется возобновлять инфузии фосапрепитанта пациентам, у которых эти реакции возникли после первого введения.
Одновременное назначение фосапрепитанта с варфарином перорально может привести к клинически значимому снижению МНО ПВ. У пациентов, получающих длительную терапию варфарином, следует тщательно контролировать MHO в течение 2 нед, особенно через 7-10 дней после введения фосапрепитанта при каждом цикле химиотерапии ( см «Взаимодействие»).
Эффективность гормональных контрацептивов может снизиться во время и в течение 28 дней после применения фосапрепитанта. Во время лечения фосапрепитантом и в течение 1 мес после применения фосапрепитанта следует использовать альтернативные или дополнительные методы контрацепции ( см «Взаимодействие»).
RxList.com (2015 г.
Совместное применение с гормональными контрацептивами. Эффективность гормональных контрацептивов может снизиться во время и в течение 28 дней после применения последней дозы фосапрепитанта или апрепитанта. Во время лечения фосапрепитантом или апрепитантом и в течение 1 мес после их применения следует использовать альтернативные или дополнительные методы контрацепции ( см «Взаимодействие»).
Длительное непрерывное использование фосапрепитанта для инъекций для профилактики тошноты и рвоты не рекомендуется, поскольку соответствующие клинические исследования не проведены, а также потому, что профиль лекарственного взаимодействия при непрерывном использовании может измениться.
Не требуется коррекция дозы в зависимости от возраста, пола, расовой принадлежности, а также ИМТ.
Применение у детей. Безопасность и эффективность применения фосапрепитанта у детей не изучалась.
Применение у пожилых пациентов. Согласно данным, полученным в клинических исследованиях, эффективность и безопасность апрепитанта у пожилых пациентов (возраст ≥65 лет) были сопоставимы с таковыми у более молодых пациентов (<65 лет). Коррекция дозировки у пожилых пациентов не требуется.
RxList.com (2015 г.
Пожилой возраст. В 2 строго контролируемых клинических исследованиях развития тошноты и рвоты, индуцированных химиотерапией, из общего количества пациентов (n=544), принимавших апрепитант перорально, 31% пациентов были в возрасте 65 лет и старше, в то время как 5% были в возрасте 75 лет и старше. В целом различий в эффективности и безопасности у пожилых пациентов по сравнению с молодыми выявлено не было. Бóльшая чувствительность некоторых людей старшего возраста не может быть исключена. Корректировка дозы у пожилых пациентов не требуется ( см «Фармакология»).
Пациенты с тяжелой печеночной недостаточностью. Клинические или фармакокинетические данные для пациентов с тяжелой печеночной недостаточностью (>9 баллов по шкале Чайлд-Пью) отсутствуют. Поэтому следует проявлять осторожность при применении фосапрепитанта или апрепитанта у этих больных ( см «Фармакология»).
RxList.com (обновление 2021 г.
Применение в гериатрии. Из 1649 взрослых онкологических больных, получавших в/в фосапрепитант для инъекций в клинических исследованиях при высоко- и умеренноэметогенной противоопухолевой химиотерапии, 27% были в возрасте 65 лет и старше, а 5% - в возрасте 75 лет и старше. Другой зарегистрированный клинический опыт применения фосапрепитанта для инъекций не выявил различий в ответах у пожилых и молодых пациентов. В целом, необходимо соблюдать осторожность при применении у пожилых пациентов, у них чаще встречается снижение функции печени, почек или сердца и сопутствующие заболевания или другая лекарственная терапия.
Пациенты с печеночной недостаточностью. Фармакокинетика апрепитанта у пациентов с легкой и умеренной печеночной недостаточностью была аналогична таковой у здоровых людей с нормальной функцией печени. Для пациентов с печеночной недостаточностью легкой и средней степени тяжести (оценка по шкале Чайлд-Пью от 5 до 9) коррекция дозы не требуется. Нет клинических или фармакокинетических данных у пациентов с тяжелой печеночной недостаточностью (оценка по шкале Чайлд-Пью более 9). Поэтому может потребоваться дополнительный мониторинг побочных реакций у этих пациентов при применении фосапрепитанта для инъекций.
Влияние на способность управлять транспортными средствами и работать с механизмами. Исследования по влиянию фосапрепитанта на способность управлять автомобилем и работать с механизмами не проводились. Однако некоторые побочные эффекты, связанные с использованием фосапрепитанта, могут повлиять на способность управлять автомобилем и работать с механизмами. Индивидуальные реакции при применении фосапрепитанта могут быть различными ( см «Побочные действия»).
|
|
Список литературы
Www.grls.rosminzdrav.ru, 2014, www.rxlist.com, 2015, www.rxlist.com, 2021.
Входит в состав
- 6100₽ Эменд В/В (2 фирмы)
- — Фосапрепитант (2 фирмы)
- — Фосапрепитант ПСК (ПСК Фарма ООО )
- — Фосапрепитант-Тева (S.K.Syndan-Pharma S.r.L. )
- — Фосапрепитанта димеглумин (Hetero Drugs )