Pharmacological Group
Latin name
Aetonogestrelum ( Aetonogestreli).
Chemical name
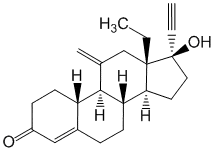
(8S,9R,10S,13S,14S,17R)-13-Этил-17-этинил-17-гидрокси-11-метилиден-2,6,7,8,9,10,12,14,15,16-декагидро-1H-циклопента[a]фенантрен-3-он.
Used in the treatment
CAS Code
54048-10-1.
Pharmacodynamics
Фармакодинамика.
Механизм действия.
Высвобождающийся этоногестрел, содержащийся в имплантате для п/к введения (который не подвергается биологическому распаду), является биологически активным метаболитом дезогестрела - прогестагена, широко применяющегося в качестве перорального контрацептивного гормонального ЛС (ОК). Структурно он является производным 19-нортестостерона и в органах-мишенях с высоким сродством связывается с рецепторами прогестерона. Контрацептивный эффект этоногестрела в основном достигается за счет подавления овуляции. Овуляций не наблюдалось в течение первых двух лет применения, и лишь редко они возникали в течение третьего года. Помимо подавления овуляции этоногестрел также вызывает повышение вязкости секрета шейки матки, препятствующее прохождению сперматозоидов.
Клиническая эффективность и безопасность.
Клинические исследования были проведены у женщин в возрасте 18-40 лет. Несмотря на отсутствие прямого сравнения, контрацептивный эффект этоногестрела в составе имплантата для п/к введения по меньшей мере сравним с контрацептивным эффектом КОК. В клинических исследованиях не были отмечены случаи беременности в течение 35057 циклов применения этоногестрела в составе имплантата; индекс Перля составил 0 (95% ДИ: 0-0,14). Тем не менее необходимо учитывать, что на практике ни один метод не обладает 100% эффективностью. Высокая степень защиты от беременности достигается помимо других причин тем, что контрацептивное действие этоногестрела в составе имплантата не зависит от строгого соблюдения женщиной режима приема. Контрацептивное действие этоногестрела является обратимым, что выражается в быстром восстановлении нормального овуляторного менструального цикла после удаления имплантата. Хотя этоногестрел подавляет овуляцию, активность яичников подавляется не полностью. Средняя концентрация эстрадиола в плазме крови остается выше значения, которое наблюдается на ранней фазе образования фолликула. В сравнительном двухлетнем исследовании МПКТ у 44 испытуемых, применявших этоногестрел в составе имплантата для п/к введения, и 29 испытуемых, применявших внутриматочную систему, не было выявлено отрицательное влияние на МПКТ. Не наблюдалось клинически значимого эффекта на метаболизм липидов.
Применение контрацептивных гормональных ЛС, содержащих прогестагены, возможно, оказывает эффект на инсулинорезистентность и толерантность к глюкозе.
Клинические исследования дополнительно подтвердили, что женщины, применяющие этоногестрел в составе имплантата для п/к введения, чаще испытывают менее болезненное менструальное кровотечение (дисменорея).
Механизм действия.
Высвобождающийся этоногестрел, содержащийся в имплантате для п/к введения (который не подвергается биологическому распаду), является биологически активным метаболитом дезогестрела - прогестагена, широко применяющегося в качестве перорального контрацептивного гормонального ЛС (ОК). Структурно он является производным 19-нортестостерона и в органах-мишенях с высоким сродством связывается с рецепторами прогестерона. Контрацептивный эффект этоногестрела в основном достигается за счет подавления овуляции. Овуляций не наблюдалось в течение первых двух лет применения, и лишь редко они возникали в течение третьего года. Помимо подавления овуляции этоногестрел также вызывает повышение вязкости секрета шейки матки, препятствующее прохождению сперматозоидов.
Клиническая эффективность и безопасность.
Клинические исследования были проведены у женщин в возрасте 18-40 лет. Несмотря на отсутствие прямого сравнения, контрацептивный эффект этоногестрела в составе имплантата для п/к введения по меньшей мере сравним с контрацептивным эффектом КОК. В клинических исследованиях не были отмечены случаи беременности в течение 35057 циклов применения этоногестрела в составе имплантата; индекс Перля составил 0 (95% ДИ: 0-0,14). Тем не менее необходимо учитывать, что на практике ни один метод не обладает 100% эффективностью. Высокая степень защиты от беременности достигается помимо других причин тем, что контрацептивное действие этоногестрела в составе имплантата не зависит от строгого соблюдения женщиной режима приема. Контрацептивное действие этоногестрела является обратимым, что выражается в быстром восстановлении нормального овуляторного менструального цикла после удаления имплантата. Хотя этоногестрел подавляет овуляцию, активность яичников подавляется не полностью. Средняя концентрация эстрадиола в плазме крови остается выше значения, которое наблюдается на ранней фазе образования фолликула. В сравнительном двухлетнем исследовании МПКТ у 44 испытуемых, применявших этоногестрел в составе имплантата для п/к введения, и 29 испытуемых, применявших внутриматочную систему, не было выявлено отрицательное влияние на МПКТ. Не наблюдалось клинически значимого эффекта на метаболизм липидов.
Применение контрацептивных гормональных ЛС, содержащих прогестагены, возможно, оказывает эффект на инсулинорезистентность и толерантность к глюкозе.
Клинические исследования дополнительно подтвердили, что женщины, применяющие этоногестрел в составе имплантата для п/к введения, чаще испытывают менее болезненное менструальное кровотечение (дисменорея).
Pharmacokinetics
Всасывание.
После п/к введения имплантата этоногестрел быстро всасывается в циркулирующую кровь. Концентрация, подавляющая овуляцию, достигаются через 1 сут. maxCmax в плазме (от 472 до 1270 пг/мл) достигается через 1-13 сут. Скорость высвобождения этоногестрела из имплантата с течением времени снижается, в результате чего его концентрация в плазме быстро снижается в течение первых нескольких месяцев после п/к введения имплантата. К концу первого года применения средняя концентрация составляет приблизительно 200 пг/мл (150-261 пг/мл) и медленно снижается до 156 пг/мл (111-202 пг/мл) к концу третьего года. Наблюдающиеся вариации концентрации в плазме частично могут быть связаны с различиями в массе тела.
Распределение.
Этоногестрел на 95,5-99% связывается с белками плазмы, преимущественно с альбумином и в меньшей степени с глобулином, связывающим половые гормоны. dVd в центральной камере и общий dVd составляют 27 и 220 л соответственно, и маловероятно, что эти показатели изменяются во время нахождения этоногестрела в составе имплантата для п/к введения в организме женщины.
Метаболизм.
Этоногестрел подвергается гидроксилированию и восстановлению. Метаболитами являются сульфаты и глюкурониды. Исследования у животных показали, что печеночно-кишечная рециркуляция, вероятно, не оказывает влияние на прогестагенную активность этоногестрела.
Выведение.
При в/в введении этоногестрела средний Т1/2 составляет приблизительно 25 а клиренс из плазмы - приблизительно 7,5 л/час. Клиренс и Т1/2 остаются постоянными во время применения этоногестрела в составе имплантата для п/к введения. Этоногестрел и его метаболиты как в форме свободных стероидов, так и в форме конъюгатов выводятся почками и через кишечник (отношение 1,5:1). После введения женщинам в период грудного вскармливания этоногестрел проникает в грудное молоко в соотношении молоко/плазма 0,44-0,5 в течение первых четырех месяцев. Средняя доза этоногестрела, поступающая в организм ребенка с грудным молоком, составляет приблизительно 0,2% от материнской суточной дозы этоногестрела (около 2,2% при пересчете на 1 кг массы тела ребенка). Показано, что концентрация постепенно и статистически значимо снижается со временем.
После п/к введения имплантата этоногестрел быстро всасывается в циркулирующую кровь. Концентрация, подавляющая овуляцию, достигаются через 1 сут. maxCmax в плазме (от 472 до 1270 пг/мл) достигается через 1-13 сут. Скорость высвобождения этоногестрела из имплантата с течением времени снижается, в результате чего его концентрация в плазме быстро снижается в течение первых нескольких месяцев после п/к введения имплантата. К концу первого года применения средняя концентрация составляет приблизительно 200 пг/мл (150-261 пг/мл) и медленно снижается до 156 пг/мл (111-202 пг/мл) к концу третьего года. Наблюдающиеся вариации концентрации в плазме частично могут быть связаны с различиями в массе тела.
Распределение.
Этоногестрел на 95,5-99% связывается с белками плазмы, преимущественно с альбумином и в меньшей степени с глобулином, связывающим половые гормоны. dVd в центральной камере и общий dVd составляют 27 и 220 л соответственно, и маловероятно, что эти показатели изменяются во время нахождения этоногестрела в составе имплантата для п/к введения в организме женщины.
Метаболизм.
Этоногестрел подвергается гидроксилированию и восстановлению. Метаболитами являются сульфаты и глюкурониды. Исследования у животных показали, что печеночно-кишечная рециркуляция, вероятно, не оказывает влияние на прогестагенную активность этоногестрела.
Выведение.
При в/в введении этоногестрела средний Т1/2 составляет приблизительно 25 а клиренс из плазмы - приблизительно 7,5 л/час. Клиренс и Т1/2 остаются постоянными во время применения этоногестрела в составе имплантата для п/к введения. Этоногестрел и его метаболиты как в форме свободных стероидов, так и в форме конъюгатов выводятся почками и через кишечник (отношение 1,5:1). После введения женщинам в период грудного вскармливания этоногестрел проникает в грудное молоко в соотношении молоко/плазма 0,44-0,5 в течение первых четырех месяцев. Средняя доза этоногестрела, поступающая в организм ребенка с грудным молоком, составляет приблизительно 0,2% от материнской суточной дозы этоногестрела (около 2,2% при пересчете на 1 кг массы тела ребенка). Показано, что концентрация постепенно и статистически значимо снижается со временем.
Indications for use
Контрацепция.
Эффективность и безопасность применения этоногестрела в составе имплантата для п/к введения подтверждены у женщин в возрасте от 18 до 40 лет.
Эффективность и безопасность применения этоногестрела в составе имплантата для п/к введения подтверждены у женщин в возрасте от 18 до 40 лет.
Contraindications
Применение этоногестрела в составе имплантата для п/к введения противопоказано при наличии у пациентов следующих состояний/заболеваний/факторов риска: повышенная чувствительность к этоногестрелу. тромбозы (артериальные и венозные) и тромбоэмболии в настоящее время или в анамнезе (в тч тромбоз. тромбофлебит глубоких вен. тромбоэмболия легочной артерии. инфаркт миокарда. ишемические или геморрагические цереброваскулярные нарушения). наличие антител к фосфолипидам. мигрень с очаговой неврологической симптоматикой. рак молочной железы. в тч в анамнезе. установленные или предполагаемые злокачественные гормонозависимые опухоли. доброкачественные или злокачественные опухоли печени в настоящее время или в анамнезе. тяжелые формы заболеваний печени (до нормализации функциональных проб печени). в тч желтуха. врожденная гипербилирубинемия. в тч в анамнезе. неконтролируемая артериальная гипертензия. кровотечение из влагалища неясной этиологии. беременность (в тч предполагаемая). детский возраст (возраст младше 18 лет. в связи с отсутствием клинических исследований у девушек младше 18 лет).
В случае возникновения любого из этих состояний впервые в период применения этоногестрела в составе имплантата для п/к введения следует немедленно прекратить его применение.
В случае возникновения любого из этих состояний впервые в период применения этоногестрела в составе имплантата для п/к введения следует немедленно прекратить его применение.
Restrictions on use
При наличии любого из состояний или факторов риска, указанных ниже, следует взвесить пользу применения этоногестрела в составе имплантата для п/к введения относительно возможных рисков для каждой женщины и обсудить эти риски с ней перед тем, как она решит начать применять имплантат. В случае ухудшения, усиления или при первом появлении любого из указанных состояний женщина должна обратиться к врачу, после чего врач должен решить вопрос о продолжении применения или отмене этоногестрела в составе имплантата для п/к введения: состояния, предшествующие тромбозу (в тч транзиторные ишемические атаки, стенокардия, осложненные поражения клапанного аппарата сердца, фибрилляция предсердий, обширная травма); сахарный диабет, в тч с диабетической ангиопатией; наследственная или приобретенная предрасположенность к артериальным тромбозам, в тч недостаточность протеина С, недостаточность протеина S, недостаточность антитромбина III; заболевания печени легкой и средней степени тяжести при нормальных показателях функциональных проб печени; терапия антикоагулянтами; тяжелая депрессия; хлоазма, в тч и в анамнезе.
Use during pregnancy and lactation
Применение этоногестрела в составе имплантата для п/к введения не показано во время беременности. В случае возникновения беременности имплантат следует удалить. При проведении доклинических исследований обнаружено, что очень высокие дозы прогестагенных соединений могут вызывать маскулинизацию плодов женского пола. Обширные эпидемиологические исследования не выявили повышенный риск развития врожденных пороков у детей, чьи матери до беременности принимали ОК, а также тератогенные эффекты в случаях, когда женщины принимали ОК на ранних сроках беременности, не зная о ней. Хотя это относится ко всем ОК, неизвестно, относится ли это также к применению этоногестрела в составе имплантата для п/к введения. Фармакологические данные ЛС, содержащих этоногестрел и дезогестрел (этоногестрел является метаболитом дезогестрела) не показали повышенного риска.
Клинические исследования показали, что этоногестрел в составе имплантата для п/к введения не влияет на образование или качество грудного молока (на концентрацию белка, лактозы или липидов). Однако известно, что небольшое количество этоногестрела проникает в грудное молоко. Исходя из среднего суточного потребления молока 150 мл/кг, средняя суточная доза этоногестрела для ребенка, рассчитанная после одного месяца высвобождения этоногестрела, составляет приблизительно 27 нг/кг/сут. Это соответствует приблизительно 2,2% материнской суточной дозы при пересчете на 1 кг массы тела и около 0,2% оцениваемой абсолютной материнской суточной дозы. В течение периода грудного вскармливания концентрация этоногестрела в молоке постепенно снижается.
Имеются долгосрочные данные о 38 детях, чьим матерям был введен имплантат с 4-й по 8-ю нед после родов. Они были на грудном вскармливании в среднем в течение 14 мес и наблюдались до 36-месячного возраста. Оценка роста, физического и психомоторного развития не выявили каких-либо различий в сравнении с грудными детьми, чьи матери применяли внутриматочные системы (n=33). Тем не менее следует контролировать развитие и рост этих детей.
Основываясь на имеющихся данных, применение этоногестрела в составе имплантата для п/к введения во время грудного вскармливания возможно, но только под наблюдением врача за развитием и ростом грудного ребенка. Имплантат для п/к введения, содержащий этоногестрел, следует вводить после 4-й нед после родов.
Клинические исследования показали, что этоногестрел в составе имплантата для п/к введения не влияет на образование или качество грудного молока (на концентрацию белка, лактозы или липидов). Однако известно, что небольшое количество этоногестрела проникает в грудное молоко. Исходя из среднего суточного потребления молока 150 мл/кг, средняя суточная доза этоногестрела для ребенка, рассчитанная после одного месяца высвобождения этоногестрела, составляет приблизительно 27 нг/кг/сут. Это соответствует приблизительно 2,2% материнской суточной дозы при пересчете на 1 кг массы тела и около 0,2% оцениваемой абсолютной материнской суточной дозы. В течение периода грудного вскармливания концентрация этоногестрела в молоке постепенно снижается.
Имеются долгосрочные данные о 38 детях, чьим матерям был введен имплантат с 4-й по 8-ю нед после родов. Они были на грудном вскармливании в среднем в течение 14 мес и наблюдались до 36-месячного возраста. Оценка роста, физического и психомоторного развития не выявили каких-либо различий в сравнении с грудными детьми, чьи матери применяли внутриматочные системы (n=33). Тем не менее следует контролировать развитие и рост этих детей.
Основываясь на имеющихся данных, применение этоногестрела в составе имплантата для п/к введения во время грудного вскармливания возможно, но только под наблюдением врача за развитием и ростом грудного ребенка. Имплантат для п/к введения, содержащий этоногестрел, следует вводить после 4-й нед после родов.
Side effects
Во время применения этоногестрела в составе имплантата для п/к введения у женщин вероятны изменения характера менструальных кровотечений, которые невозможно предсказать заранее. Они могут включать изменения частоты кровотечений (отсутствие, менее или более частые, продолжительные), интенсивности (уменьшение или увеличение) или длительности кровотечений. Отсутствие менструальноподобных кровянистых выделений наблюдалось у 20% женщин, у такого же количества женщин наблюдалось более частое и/или длительное кровотечение. Иногда сообщалось о тяжелом кровотечении. В клинических исследованиях изменение характера кровянистых выделений из влагалища было наиболее частой причиной для прекращения применения имплантата (примерно 11%). Характер кровотечений, имеющий место в течение первых трех месяцев, позволяет прогнозировать будущий характер кровотечений у большинства женщин.
Возможно связанные с применением этоногестрела в составе имплантата для п/к введения нежелательные эффекты, о которых сообщалось в клинических исследованиях, перечислены в таблице 1.
Таблица 1.
1Для описания некоторых нежелательных явлений использованы наиболее соответствующие термины MedDRA >MedDRA (версия 10,1). Синонимы или взаимосвязанные состояния не перечислены, но также должны учитываться.
Во время постмаркетингового наблюдения в редких случаях наблюдалось клинически значимое повышение АД. Также имеются сообщения о себорее. Могут развиться анафилактические реакции, крапивница и ангионевротический отек (или его более тяжелое течение) и/или более тяжелое течение наследственного ангионевротического отека.
Введение и удаление имплантата может вызвать образование кровоподтека, незначительное местное раздражение, боль или зуд. В месте рассечения может развиться фиброз, образоваться рубец или развиться абсцесс. Могут возникнуть парестезия или подобные ей явления. Сообщалось о выпадении или миграции имплантата, в тч редко - в грудную стенку. В редких случаях имплантаты были обнаружены в сосудистой сети, включая легочную артерию. В некоторых случаях, когда имплантаты были обнаружены в легочной артерии, сообщалось о боли в груди и/или одышке. В других случаях сообщалось об отсутствии симптомов ( см «Меры предосторожности»).
При удалении имплантата может потребоваться хирургическое вмешательство.
В редких случаях сообщалось о внематочной беременности ( см «Меры предосторожности»).
У женщин, применяющих КОК, были отмечены несколько (серьезных) нежелательных явлений. К ним относятся венозные тромбоэмболии, артериальные тромбоэмболии, гормонозависимые опухоли (опухоли печени, рак молочной железы) и хлоазма, некоторые из них более подробно описаны в разделе «Меры предосторожности».
Возможно связанные с применением этоногестрела в составе имплантата для п/к введения нежелательные эффекты, о которых сообщалось в клинических исследованиях, перечислены в таблице 1.
Таблица 1.
| Системно-органный класс | Нежелательные реакции1 | ||
| Очень часто (>1/10) | Часто (<1/10, ?1/100) | Нечасто (<1/100, ?1/1000) | |
| Инфекционные и паразитарные заболевания | вагинальная инфекция | - | фарингит, ринит, инфекция мочевыводящих путей (уретрит, цистит) |
| Со стороны иммунной системы | - | - | повышенная чувствительность к этоногестрелу |
| Со стороны обмена веществ и питания | - | повышение аппетита | - |
| Со стороны психики | - | эмоциональная лабильность, депрессия, нервозность, снижение либидо | тревога, бессонница |
| Со стороны нервной системы | головная боль | головокружение | мигрень, сонливость |
| Со стороны сосудов | - | приливы | - |
| Со стороны ЖКТ | - | боли в животе, тошнота, вздутие живота | рвота, запор, диарея |
| Со стороны кожи и подкожных тканей | акне | алопеция | гипертрихоз, сыпь, зуд |
| Со стороны скелетно-мышечной системы и соединительной ткани | - | - | боль в спине, артралгия, миалгия, скелетно-мышечная боль |
| Со стороны почек и мочевыводящих путей | - | - | дизурия |
| Со стороны половых органов и молочной железы | болезненность в молочных железах, боль в груди, нерегулярные менструации | дисменорея, киста яичника | выделения из влагалища, дискомфорт в области вульвы и влагалища, галакторея, увеличение молочных желез, зуд в области вульвы и влагалища |
| Общие расстройства и нарушения в месте введения | - | боль в месте расположения имплантата, реакция в месте расположения имплантата, утомляемость, гриппоподобное состояние, боль | гипертермия, отек |
| Лабораторные и инструментальные данные | увеличение массы тела | снижение массы тела | - |
1Для описания некоторых нежелательных явлений использованы наиболее соответствующие термины MedDRA >MedDRA (версия 10,1). Синонимы или взаимосвязанные состояния не перечислены, но также должны учитываться.
Во время постмаркетингового наблюдения в редких случаях наблюдалось клинически значимое повышение АД. Также имеются сообщения о себорее. Могут развиться анафилактические реакции, крапивница и ангионевротический отек (или его более тяжелое течение) и/или более тяжелое течение наследственного ангионевротического отека.
Введение и удаление имплантата может вызвать образование кровоподтека, незначительное местное раздражение, боль или зуд. В месте рассечения может развиться фиброз, образоваться рубец или развиться абсцесс. Могут возникнуть парестезия или подобные ей явления. Сообщалось о выпадении или миграции имплантата, в тч редко - в грудную стенку. В редких случаях имплантаты были обнаружены в сосудистой сети, включая легочную артерию. В некоторых случаях, когда имплантаты были обнаружены в легочной артерии, сообщалось о боли в груди и/или одышке. В других случаях сообщалось об отсутствии симптомов ( см «Меры предосторожности»).
При удалении имплантата может потребоваться хирургическое вмешательство.
В редких случаях сообщалось о внематочной беременности ( см «Меры предосторожности»).
У женщин, применяющих КОК, были отмечены несколько (серьезных) нежелательных явлений. К ним относятся венозные тромбоэмболии, артериальные тромбоэмболии, гормонозависимые опухоли (опухоли печени, рак молочной железы) и хлоазма, некоторые из них более подробно описаны в разделе «Меры предосторожности».
Interaction
Влияние других ЛС на этоногестрел, высвобождающийся из имплантата для п/к применения.
Возможно взаимодействие с ЛС-индукторами микросомальных ферментов, которое может проявляться в увеличенном клиренсе половых гормонов, что может привести к прорывному кровотечению и/или снижению контрацептивного эффекта.
Индуцирование ферментов может происходить уже после нескольких дней применения этоногестрела в составе имплантата для п/к введения. Максимальное индуцирование ферментов обычно наблюдается в течение нескольких недель. После прекращения терапии индуцирование ферментов может продолжаться приблизительно 4 нед.
Женщинам, получающим лечение одним из ЛС, индуцирующих микросомальные печеночные ферменты, следует сообщить, что эффективность этоногестрела, высвобождающегося из имплантата для п/к введения, может быть снижена. Удаление имплантата не требуется, но женщине следует рекомендовать дополнительно использовать негормональный метод контрацепции во время совместного приема таких ЛС и в течение 28 дней после их отмены, с целью получения максимальной защиты.
В литературе сообщается о перечисленных ниже взаимодействиях (в основном с КОК, но иногда сообщается также и в отношении контрацептивных гормональных ЛС, содержащих только прогестаген, включая этоногестрел в составе имплантата для п/к введения).
ЛС, увеличивающие клиренс половых гормонов (уменьшающие эффективность гормональных контрацептивов индуцированием ферментов), такими как: барбитураты, бозентан, карбамазепин, фенитоин, примидон, рифампицин; ЛС для лечения ВИЧ и вирусного гепатита С - ритонавир, эфавиренз, боцепревир, невирапин; а также, возможно, фелбамат, гризеофульвин, окскарбазепин, тонирамат; ЛС, содержащие зверобой продырявленный (Hypericum perforatum).
ЛС, оказывающие переменный эффект на клиренс половых гормонов. При совместном применении с гормональными контрацептивами многие комбинации ингибиторов протеазы ВИЧ и ННИОТ, включая комбинации с ингибиторами вируса гепатита С, могут увеличивать или уменьшать концентрацию в плазме прогестагенов, включая этоногестрел. В некоторых случаях суммарный эффект этих изменений может быть клинически значимым.
Поэтому для определения возможных взаимодействий или взаимосвязанных рекомендаций необходимо ознакомиться с информацией (инструкциями по применению) о совместно применяемых ЛС для лечения ВИЧ/вирусного гепатита С. В случае любых сомнений женщина, получающая лечение ингибиторами протеазы и ННИОТ, должна использовать дополнительный барьерный метод контрацепции.
ЛС, уменьшающие клиренс половых гормонов (ингибиторы ферментов). Совместное применение сильных (например кетоконазол, итраконазол, кларитромицин) или умеренных (например флуконазол, дилтиазем, эритромицин) ингибиторов изофермента сYP3A4 может увеличивать концентрацию прогестагенов в сыворотке крови, включая этоногестрел.
Влияние этоногестрела, высвобождающегося из имплантата для п/к применения на другие ЛС.
Контрацептивные гормональные ЛС могут влиять на метаболизм некоторых ЛС. Соответственно их концентрации в плазме и в тканях могут повышаться (например циклоспорин) или снижаться (например ламотриджин).
Возможно взаимодействие с ЛС-индукторами микросомальных ферментов, которое может проявляться в увеличенном клиренсе половых гормонов, что может привести к прорывному кровотечению и/или снижению контрацептивного эффекта.
Индуцирование ферментов может происходить уже после нескольких дней применения этоногестрела в составе имплантата для п/к введения. Максимальное индуцирование ферментов обычно наблюдается в течение нескольких недель. После прекращения терапии индуцирование ферментов может продолжаться приблизительно 4 нед.
Женщинам, получающим лечение одним из ЛС, индуцирующих микросомальные печеночные ферменты, следует сообщить, что эффективность этоногестрела, высвобождающегося из имплантата для п/к введения, может быть снижена. Удаление имплантата не требуется, но женщине следует рекомендовать дополнительно использовать негормональный метод контрацепции во время совместного приема таких ЛС и в течение 28 дней после их отмены, с целью получения максимальной защиты.
В литературе сообщается о перечисленных ниже взаимодействиях (в основном с КОК, но иногда сообщается также и в отношении контрацептивных гормональных ЛС, содержащих только прогестаген, включая этоногестрел в составе имплантата для п/к введения).
ЛС, увеличивающие клиренс половых гормонов (уменьшающие эффективность гормональных контрацептивов индуцированием ферментов), такими как: барбитураты, бозентан, карбамазепин, фенитоин, примидон, рифампицин; ЛС для лечения ВИЧ и вирусного гепатита С - ритонавир, эфавиренз, боцепревир, невирапин; а также, возможно, фелбамат, гризеофульвин, окскарбазепин, тонирамат; ЛС, содержащие зверобой продырявленный (Hypericum perforatum).
ЛС, оказывающие переменный эффект на клиренс половых гормонов. При совместном применении с гормональными контрацептивами многие комбинации ингибиторов протеазы ВИЧ и ННИОТ, включая комбинации с ингибиторами вируса гепатита С, могут увеличивать или уменьшать концентрацию в плазме прогестагенов, включая этоногестрел. В некоторых случаях суммарный эффект этих изменений может быть клинически значимым.
Поэтому для определения возможных взаимодействий или взаимосвязанных рекомендаций необходимо ознакомиться с информацией (инструкциями по применению) о совместно применяемых ЛС для лечения ВИЧ/вирусного гепатита С. В случае любых сомнений женщина, получающая лечение ингибиторами протеазы и ННИОТ, должна использовать дополнительный барьерный метод контрацепции.
ЛС, уменьшающие клиренс половых гормонов (ингибиторы ферментов). Совместное применение сильных (например кетоконазол, итраконазол, кларитромицин) или умеренных (например флуконазол, дилтиазем, эритромицин) ингибиторов изофермента сYP3A4 может увеличивать концентрацию прогестагенов в сыворотке крови, включая этоногестрел.
Влияние этоногестрела, высвобождающегося из имплантата для п/к применения на другие ЛС.
Контрацептивные гормональные ЛС могут влиять на метаболизм некоторых ЛС. Соответственно их концентрации в плазме и в тканях могут повышаться (например циклоспорин) или снижаться (например ламотриджин).
Overdose
Имплантат всегда следует удалять перед введением нового.
Симптомы. Данных о передозировке этоногестрела в составе имплантата для п/к введения не имеется. Сообщений о серьезных побочных эффектах в результате передозировки контрацептивных гормональных средств в целом не имеется.
Симптомы. Данных о передозировке этоногестрела в составе имплантата для п/к введения не имеется. Сообщений о серьезных побочных эффектах в результате передозировки контрацептивных гормональных средств в целом не имеется.
Method of drug use and dosage
П/к вводится один имплантат, содержащий этоногестрел, который может оставаться в месте введения в течение трех лет. Удаляют имплантат не позже чем через три года со дня введения. Женщину необходимо проинформировать о возможности удаления имплантата в любое время по ее желанию. После удаления имплантата немедленное введение другого приведет к продолжению контрацептивной защиты.
Application precautions
При наличии любых из перечисленных ниже состояний/факторов риска следует оценить преимущество применения прогестагена и возможные риски для каждой женщины и обсудить их с ней еще до того, как она начнет применение этоногестрела в составе имплантата для п/к введения.
В случае обострения заболеваний, ухудшения состояния или возникновения впервые любого из перечисленных ниже состояний женщине следует обратиться к врачу для решения вопроса о необходимости прекращения применения этоногестрела в составе имплантата для п/к введения.
Рак молочной железы.
Риск развития рака молочной железы увеличивается с возрастом. Во время применения ОК (в тч комбинированные) риск диагностирования рака молочной железы немного увеличивается. Этот повышенный риск постепенно снижается в течение 10 лет после прекращения применения ОК, и он не связан с длительностью применения OK, а связан с возрастом женщины, в котором она применяет ОК. Ожидаемое количество диагностированных случаев рака молочной железы у 10000 женщин, применявших КОК (в тч в течение 10 лет после прекращения их применения), относительно женщин, которые никогда их не применяли, за такой же период, рассчитанное для соответствующих возрастных групп, составило: 4,5/4 (16-19 лет), 17,5/16 (20-24 лет), 48,7/44 (25-29 лет), 110/100 (30-34 лет), 180/160 (35-39 лет) и 260/230 (40-44 лет). Риск у женщин, применяющих контрацепцию только гестагенами, возможно аналогичен риску при применении КОК. Тем не менее, данные в отношении этих методов не столь определенные. По сравнению с риском возникновения рака молочной железы на протяжении всей жизни увеличение риска, связанного с ОК, является небольшим. У женщин, применяющих ОК, диагностируются более ранние клинические стадии рака молочной железы, чем у женщин, которые никогда не применяли ОК. Повышенный риск, наблюдаемый у женщин, применяющих ОК, возможно обусловлен более ранней диагностикой, биологическими эффектами ОК или комбинацией этих двух факторов.
Заболевания печени.
В случае возникновения острых или обострения хронических заболеваний печени женщине следует обратиться к специалисту для обследования и консультации.
Тромбоз и другие сосудистые расстройства.
В ходе эпидемиологических исследований было установлено, что существует связь между применением КОК (эстроген + прогестаген) и увеличением частоты развития ВТЭ, тромбоза глубоких вен и тромбоэмболии легочной артерии и артериальной тромбоэмболии (АТЭ) (инфаркт миокарда или ишемический инсульт). Клиническая значимость этих результатов в отношении этоногесгрела (биологически активного метаболита дезогестрела), используемого в качестве контрацептивного гормонального средства, в отсутствие эстрогенного компонента неизвестна.
Ограниченные эпидемиологические данные не выявили увеличенный риск возникновения ВТЭ или АТЭ у женщин, применяющих имплантат, тем не менее, в пострегистрационный период применения были получены сообщения о ВТЭ и АТЭ у женщин, применяющих имплантаты, содержащие этоногестрел. Рекомендуется оценить факторы риска, которые, как известно, увеличивают риск венозной или артериальной тромбоэмболии.
Женщины с тромбоэмболическими заболеваниями в анамнезе должны быть предупреждены о возможности их рецидива. Имплантат следует удалить в случае подтвержденного тромбоза. Также следует рассмотреть вопрос об удалении имплантата в случае длительной иммобилизации вследствие оперативного вмешательства, травмы или заболевания.
Артериальная гипертензия.
Если в период применения этоногестрела в составе имплантата для п/к введения развивается стойкая артериальная гипертензия или значительно повышенное АД не снижается адекватно в ответ на проводимую гипотензивную терапию, следует удалить имплантат.
Влияние на углеводный обмен.
Применение контрацептивов, содержащих прогестаген, может оказывать влияние на инсулинорезистентность и толерантность к глюкозе. Поэтому женщины с сахарным диабетом должны находиться под тщательным наблюдением врача в первые месяцы применения этоногестрела в составе имплантата для п/к введения.
Хлоазма.
Иногда может возникать хлоазма, в особенности у женщин с хлоазмой беременных в анамнезе. Женщинам с предрасположенностью к хлоазме следует избегать воздействия солнечных лучей или УФ-излучения во время применения этоногестрела в составе имплантата для п/к введения.
Масса тела.
Контрацептивное действие этоногестрела в составе имплантата для п/к введения связано с концентрацией этоногестрела в плазме крови, которая в обратно пропорциональной зависимости связана с массой тела и снижается с течением времени после введения имплантата. Клинический опыт у женщин с избыточной массой тела на третьем году применения этоногестрела в составе имплантата для п/к введения ограничен. Нельзя исключить, что контрацептивный эффект у таких женщин в течение третьего года применения может быть ниже, чем у женщин с нормальной массой тела, поэтому врачу, возможно, следует предусмотреть более раннюю замену имплантата у женщин с избыточной массой тела.
Осложнения при введении.
Сообщалось о перемещении имплантата в руке относительно места введения, которое могло быть связано с глубоким введением или в результате воздействия внешних сил (например манипулирование с имплантатом или контактные виды спорта). В пострегистрационный период также редко сообщалось об имплантатах, расположенных в сосудах верхней конечности и легочной артерии, что могло быть связано с глубоким введением или внутрисосудистым введением.
В случаях, когда имплантат переместился в руке относительно места введения, его локализация может быть затруднена, и удаление может потребовать небольшой хирургической процедуры с большим разрезом или оперативного вмешательства. В случаях, когда имплантат переместился в легочную артерию, для удаления могут потребоваться внутрисосудистые или хирургические процедуры. Если в любой момент времени не удается пальпировать имплантат, то необходимо определить его местоположение и рекомендуется его удаление. Если имплантат не удален, то контрацепция и риск нежелательных эффектов, связанных с прогестагеном, могут сохраниться сверх времени, желаемого женщиной.
В результате местного воспаления или если имплантат введен не в соответствии с инструкциями, может произойти экспульсия имплантата.
Киста яичников.
При применении всех низкодозированных контрацептивных гормональных средств может происходить рост фолликулов, и иногда фолликул может достигать размера большего, чем в нормальном цикле. Обычно подобные фолликулы исчезают спонтанно и часто бессимптомно; в некоторых случаях отмечается легкая боль внизу живота. В редких случаях необходимо хирургическое вмешательство.
Внематочная беременность.
Предупреждение внематочной беременности традиционными прогестагенсодержащими контрацептивными гормональными ЛС не столь эффективно, как при применении КОК, что связано с частым возникновением овуляций во время применения этих методов. Несмотря на то что этоногестрел в составе имплантата для п/к введения подавляет овуляцию, в случае наличия у женщины аменореи или болей в животе при дифференциальной диагностике следует учитывать риск эктопической беременности.
Другие состояния.
Имеются сообщения о следующих состояниях, имевших место как при беременности, так и при применении половых стероидных гормонов, но связь с применением прогестагенов не была установлена: желтуха и/или зуд, связанные с холестазом; образование желчных камней; порфирия; системная красная волчанка; гемолитико-уремический синдром; хорея Сиденгама; герпес во время беременности; потеря слуха, связанная с отосклерозом; (наследственный) ангионевротический отек.
Медицинские обследования/консультации.
Перед началом применения или перед заменой имплантата для п/к введения, содержащего этоногестрел, следует тщательно ознакомиться с анамнезом женщины (включая семейный) и исключить беременность. Следует измерить АД, провести физикальное обследование и руководствоваться противопоказаниями ( см «Противопоказания») и предупреждениями ( см «Ограничения к применению»). Рекомендуется, чтобы женщина через три месяца после введения имплантата для п/к введения, содержащего этоногестрел, посетила врача для медицинского осмотра. Во время медицинского осмотра следует измерить АД и выяснить о существовании каких-либо вопросов, жалоб или нежелательных эффектов. Частоту и характер дальнейших периодических медицинских осмотров следует установить индивидуально для каждой женщины (не реже 1 раза в 6 мес).
Женщина должна быть информирована о том, что этоногестрел в составе имплантата для п/к введения не защищает от ВИЧ-инфекции (СПИДа) и других заболеваний, передающихся половым путем.
Снижение эффективности при совместном применении с другими ЛС.
Эффективность этоногестрела в составе имплантата для п/к введения может быть снижена при применении в сочетании с другими ЛС, при этом может уменьшиться концентрация этоногестрела в плазме ( см «Взаимодействие»).
Изменения характера кровянистых выделений.
Во время применения этоногестрела в составе имплантата для п/к введения у женщин вероятно изменение характера менструальных кровотечений. Оно может включать изменение частоты (отсутствие, менее или более частое, или продолжительное), интенсивности (уменьшение или увеличение) или длительности кровотечения. Отсутствие менструального периода наблюдалась у 20% женщин, в то время как у других 20% наблюдалось более частое и/или длительное кровотечение. Характер кровотечения, имеющий место в течение первых трех месяцев, позволяет прогнозировать его будущий характер у большинства женщин. Информирование, дополнительные объяснения и ведение индивидуального дневника помогут женщине адекватно воспринимать возникающее кровотечение. Оценку вагинального кровотечения следует проводить индивидуально. Она может включать обследование с целью исключения гинекологической патологии или беременности.
Лабораторные показатели.
Данные, полученные в отношении КОК, показали, что применение контрацептивных гормональных средств может оказывать влияние на некоторые лабораторные показатели, включая биохимические показатели функции печени, щитовидной железы, надпочечников и почек, концентрацию (транспортных) белков в плазме, например кортикостероидсвязывающего глобулина и фракции липидов/липопротеидов, показатели углеводного обмена, свертываемости крови и фибринолиза. Обычно эти изменения остаются в пределах нормальных значений. Неизвестно, в какой степени это применимо и к контрацептивным гормональным ЛС, содержащим только прогестаген.
Нарушение целостности или формы имплантата, находящегося в тканях плеча пациентки.
Имеются сообщения о нарушении целостности или формы имплантата, находящегося в тканях плеча пациентки. Исследования in vitro >in vitro показали, что в таких случаях скорость высвобождения этоногестрела может немного увеличиваться, однако данное изменение не имеет клинической значимости.
После того как имплантат был удален, необходимо убедиться, что удален целиком.
Влияние на способность управлять транспортными средствами и работать с механизмами. Реакции при управлении транспортными средствами и использовании сложной техники не изучались. Этоногестрел в составе имплантата для п/к введения может вызвать головокружение. Пациенток следует предупредить, что при возникновении головокружения не следует садиться за руль или пользоваться сложной техникой.
В случае обострения заболеваний, ухудшения состояния или возникновения впервые любого из перечисленных ниже состояний женщине следует обратиться к врачу для решения вопроса о необходимости прекращения применения этоногестрела в составе имплантата для п/к введения.
Рак молочной железы.
Риск развития рака молочной железы увеличивается с возрастом. Во время применения ОК (в тч комбинированные) риск диагностирования рака молочной железы немного увеличивается. Этот повышенный риск постепенно снижается в течение 10 лет после прекращения применения ОК, и он не связан с длительностью применения OK, а связан с возрастом женщины, в котором она применяет ОК. Ожидаемое количество диагностированных случаев рака молочной железы у 10000 женщин, применявших КОК (в тч в течение 10 лет после прекращения их применения), относительно женщин, которые никогда их не применяли, за такой же период, рассчитанное для соответствующих возрастных групп, составило: 4,5/4 (16-19 лет), 17,5/16 (20-24 лет), 48,7/44 (25-29 лет), 110/100 (30-34 лет), 180/160 (35-39 лет) и 260/230 (40-44 лет). Риск у женщин, применяющих контрацепцию только гестагенами, возможно аналогичен риску при применении КОК. Тем не менее, данные в отношении этих методов не столь определенные. По сравнению с риском возникновения рака молочной железы на протяжении всей жизни увеличение риска, связанного с ОК, является небольшим. У женщин, применяющих ОК, диагностируются более ранние клинические стадии рака молочной железы, чем у женщин, которые никогда не применяли ОК. Повышенный риск, наблюдаемый у женщин, применяющих ОК, возможно обусловлен более ранней диагностикой, биологическими эффектами ОК или комбинацией этих двух факторов.
Заболевания печени.
В случае возникновения острых или обострения хронических заболеваний печени женщине следует обратиться к специалисту для обследования и консультации.
Тромбоз и другие сосудистые расстройства.
В ходе эпидемиологических исследований было установлено, что существует связь между применением КОК (эстроген + прогестаген) и увеличением частоты развития ВТЭ, тромбоза глубоких вен и тромбоэмболии легочной артерии и артериальной тромбоэмболии (АТЭ) (инфаркт миокарда или ишемический инсульт). Клиническая значимость этих результатов в отношении этоногесгрела (биологически активного метаболита дезогестрела), используемого в качестве контрацептивного гормонального средства, в отсутствие эстрогенного компонента неизвестна.
Ограниченные эпидемиологические данные не выявили увеличенный риск возникновения ВТЭ или АТЭ у женщин, применяющих имплантат, тем не менее, в пострегистрационный период применения были получены сообщения о ВТЭ и АТЭ у женщин, применяющих имплантаты, содержащие этоногестрел. Рекомендуется оценить факторы риска, которые, как известно, увеличивают риск венозной или артериальной тромбоэмболии.
Женщины с тромбоэмболическими заболеваниями в анамнезе должны быть предупреждены о возможности их рецидива. Имплантат следует удалить в случае подтвержденного тромбоза. Также следует рассмотреть вопрос об удалении имплантата в случае длительной иммобилизации вследствие оперативного вмешательства, травмы или заболевания.
Артериальная гипертензия.
Если в период применения этоногестрела в составе имплантата для п/к введения развивается стойкая артериальная гипертензия или значительно повышенное АД не снижается адекватно в ответ на проводимую гипотензивную терапию, следует удалить имплантат.
Влияние на углеводный обмен.
Применение контрацептивов, содержащих прогестаген, может оказывать влияние на инсулинорезистентность и толерантность к глюкозе. Поэтому женщины с сахарным диабетом должны находиться под тщательным наблюдением врача в первые месяцы применения этоногестрела в составе имплантата для п/к введения.
Хлоазма.
Иногда может возникать хлоазма, в особенности у женщин с хлоазмой беременных в анамнезе. Женщинам с предрасположенностью к хлоазме следует избегать воздействия солнечных лучей или УФ-излучения во время применения этоногестрела в составе имплантата для п/к введения.
Масса тела.
Контрацептивное действие этоногестрела в составе имплантата для п/к введения связано с концентрацией этоногестрела в плазме крови, которая в обратно пропорциональной зависимости связана с массой тела и снижается с течением времени после введения имплантата. Клинический опыт у женщин с избыточной массой тела на третьем году применения этоногестрела в составе имплантата для п/к введения ограничен. Нельзя исключить, что контрацептивный эффект у таких женщин в течение третьего года применения может быть ниже, чем у женщин с нормальной массой тела, поэтому врачу, возможно, следует предусмотреть более раннюю замену имплантата у женщин с избыточной массой тела.
Осложнения при введении.
Сообщалось о перемещении имплантата в руке относительно места введения, которое могло быть связано с глубоким введением или в результате воздействия внешних сил (например манипулирование с имплантатом или контактные виды спорта). В пострегистрационный период также редко сообщалось об имплантатах, расположенных в сосудах верхней конечности и легочной артерии, что могло быть связано с глубоким введением или внутрисосудистым введением.
В случаях, когда имплантат переместился в руке относительно места введения, его локализация может быть затруднена, и удаление может потребовать небольшой хирургической процедуры с большим разрезом или оперативного вмешательства. В случаях, когда имплантат переместился в легочную артерию, для удаления могут потребоваться внутрисосудистые или хирургические процедуры. Если в любой момент времени не удается пальпировать имплантат, то необходимо определить его местоположение и рекомендуется его удаление. Если имплантат не удален, то контрацепция и риск нежелательных эффектов, связанных с прогестагеном, могут сохраниться сверх времени, желаемого женщиной.
В результате местного воспаления или если имплантат введен не в соответствии с инструкциями, может произойти экспульсия имплантата.
Киста яичников.
При применении всех низкодозированных контрацептивных гормональных средств может происходить рост фолликулов, и иногда фолликул может достигать размера большего, чем в нормальном цикле. Обычно подобные фолликулы исчезают спонтанно и часто бессимптомно; в некоторых случаях отмечается легкая боль внизу живота. В редких случаях необходимо хирургическое вмешательство.
Внематочная беременность.
Предупреждение внематочной беременности традиционными прогестагенсодержащими контрацептивными гормональными ЛС не столь эффективно, как при применении КОК, что связано с частым возникновением овуляций во время применения этих методов. Несмотря на то что этоногестрел в составе имплантата для п/к введения подавляет овуляцию, в случае наличия у женщины аменореи или болей в животе при дифференциальной диагностике следует учитывать риск эктопической беременности.
Другие состояния.
Имеются сообщения о следующих состояниях, имевших место как при беременности, так и при применении половых стероидных гормонов, но связь с применением прогестагенов не была установлена: желтуха и/или зуд, связанные с холестазом; образование желчных камней; порфирия; системная красная волчанка; гемолитико-уремический синдром; хорея Сиденгама; герпес во время беременности; потеря слуха, связанная с отосклерозом; (наследственный) ангионевротический отек.
Медицинские обследования/консультации.
Перед началом применения или перед заменой имплантата для п/к введения, содержащего этоногестрел, следует тщательно ознакомиться с анамнезом женщины (включая семейный) и исключить беременность. Следует измерить АД, провести физикальное обследование и руководствоваться противопоказаниями ( см «Противопоказания») и предупреждениями ( см «Ограничения к применению»). Рекомендуется, чтобы женщина через три месяца после введения имплантата для п/к введения, содержащего этоногестрел, посетила врача для медицинского осмотра. Во время медицинского осмотра следует измерить АД и выяснить о существовании каких-либо вопросов, жалоб или нежелательных эффектов. Частоту и характер дальнейших периодических медицинских осмотров следует установить индивидуально для каждой женщины (не реже 1 раза в 6 мес).
Женщина должна быть информирована о том, что этоногестрел в составе имплантата для п/к введения не защищает от ВИЧ-инфекции (СПИДа) и других заболеваний, передающихся половым путем.
Снижение эффективности при совместном применении с другими ЛС.
Эффективность этоногестрела в составе имплантата для п/к введения может быть снижена при применении в сочетании с другими ЛС, при этом может уменьшиться концентрация этоногестрела в плазме ( см «Взаимодействие»).
Изменения характера кровянистых выделений.
Во время применения этоногестрела в составе имплантата для п/к введения у женщин вероятно изменение характера менструальных кровотечений. Оно может включать изменение частоты (отсутствие, менее или более частое, или продолжительное), интенсивности (уменьшение или увеличение) или длительности кровотечения. Отсутствие менструального периода наблюдалась у 20% женщин, в то время как у других 20% наблюдалось более частое и/или длительное кровотечение. Характер кровотечения, имеющий место в течение первых трех месяцев, позволяет прогнозировать его будущий характер у большинства женщин. Информирование, дополнительные объяснения и ведение индивидуального дневника помогут женщине адекватно воспринимать возникающее кровотечение. Оценку вагинального кровотечения следует проводить индивидуально. Она может включать обследование с целью исключения гинекологической патологии или беременности.
Лабораторные показатели.
Данные, полученные в отношении КОК, показали, что применение контрацептивных гормональных средств может оказывать влияние на некоторые лабораторные показатели, включая биохимические показатели функции печени, щитовидной железы, надпочечников и почек, концентрацию (транспортных) белков в плазме, например кортикостероидсвязывающего глобулина и фракции липидов/липопротеидов, показатели углеводного обмена, свертываемости крови и фибринолиза. Обычно эти изменения остаются в пределах нормальных значений. Неизвестно, в какой степени это применимо и к контрацептивным гормональным ЛС, содержащим только прогестаген.
Нарушение целостности или формы имплантата, находящегося в тканях плеча пациентки.
Имеются сообщения о нарушении целостности или формы имплантата, находящегося в тканях плеча пациентки. Исследования in vitro >in vitro показали, что в таких случаях скорость высвобождения этоногестрела может немного увеличиваться, однако данное изменение не имеет клинической значимости.
После того как имплантат был удален, необходимо убедиться, что удален целиком.
Влияние на способность управлять транспортными средствами и работать с механизмами. Реакции при управлении транспортными средствами и использовании сложной техники не изучались. Этоногестрел в составе имплантата для п/к введения может вызвать головокружение. Пациенток следует предупредить, что при возникновении головокружения не следует садиться за руль или пользоваться сложной техникой.
References
Обобщенные материалы www.grls.rosminzdrav.ru, 2017.
Included in the composition
- 14.4-47.2€ NovaRing (2 firms)
- 96.8€ Implanon
- 166.4-184.7€ Implanon NXT (Organon )