Другие названия и синонимы
Nateglinide.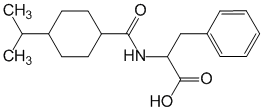
Фармакологическая группа
|
|
Латинское название
Nateglinidum ( Nateglinidi).
Химическое название
N-[[транс-4-(Метилэтил)циклогексил]карбонил]-D-фенилаланин.
Используется в лечении
Код CAS
105816-04-4.
Фармакологическое действие
Гипогликемическое.
Характеристика вещества
Натеглинид - пероральное гипогликемическое средство, используемое в лечении сахарного диабета типа 2. Белый порошок; свободно растворим в метиловом, этиловом спиртах и хлороформе; растворим в эфире, трудно растворим в ацетонитриле и октаноле, практически нерастворим в воде. Молекулярная масса 317,45.
Фармакодинамика
Натеглинид - аминокислотное производное, снижает уровень глюкозы в крови за счет стимуляции секреции инсулина в поджелудочной железе. Это действие зависит от функционального состояния бета-клеток островков поджелудочной железы. Натеглинид взаимодействует с АТФ-чувствительными калиевыми каналами бета-клеток поджелудочной железы. Последующая деполяризация мембран бета-клеток открывает кальциевые каналы, вызывая приток кальция и секрецию инсулина. Объем высвобождаемого инсулина зависит от уровня глюкозы крови и при низком уровне ее уменьшается. Натеглинид обладает высокой тканевой селективностью и низкой аффинностью к клеткам миокарда и скелетных мышц.
Натеглинид быстро всасывается и стимулирует секрецию инсулина в поджелудочной железе в течение 20 мин после перорального приема. Быстрый подъем концентрации инсулина в плазме с пиком уровня примерно в течение 1 ч после приема и снижение до исходного через 4 ч после приема наблюдается при назначении натеглинида 3 раза в сутки перед едой.
В двойных слепых контролируемых клинических испытаниях натеглинид назначали перед каждым из 3-х приемов пищи (за 10 мин до еды). Диета была основана на стандартном весоподдерживающем меню для больных диабетом с общим содержанием калорий, рассчитанным индивидуально, в зависимости от массы тела каждого пациента. После 7 нед лечения определяли уровень глюкозы плазмы на протяжении 12 ч в дневное время. Натеглинид вызывал статистически значимое снижение уровня гликемии натощак и постпрандиальной гликемии по сравнению с плацебо.
Клинические исследования.
В 8 двойных слепых рандомизированных плацебо-контролируемых или сравнительных исследованиях для выявления безопасности и эффективности натеглинида длительностью от 8 до 24 нед участвовало 3566 пациента. В этих исследованиях натеглинид назначался за 30 мин до каждого из 3-х основных приемов пищи в сутки.
Монотерапия в сравнении с плацебо.
В рандомизированных двойных слепых плацебо-контролируемых 24-недельных исследованиях пациенты с сахарным диабетом типа 2 с уровнем 1cHbA1c ≥6,8%, находящиеся только на диете, рандомизированно получали либо натеглинид (60 или 120 мг 3 раза в сутки перед едой), либо плацебо. Исходный уровень 1cHbA1c был в пределах 7,9-8,1%; 77,8% пациентов предварительно не получали пероральных гипогликемических препаратов. У пациентов, предварительно получавших гипогликемические средства, препараты были отменены за 2 мес до рандомизации. В результате исследований выявлено, что при приеме натеглинида до еды статистически значимо снижался средний уровень 1cHbA1c и средний уровень глюкозы плазмы натощак по сравнению с плацебо. Так, при приеме натеглинида в дозе 60 мг 3 раза в сутки перед едой средний уровень 1cHbA1c (n=167) изменялся на −0,3%, концентрация глюкозы плазмы натощак (n=171) на +0,022 ммоль/л по сравнению с исходными уровнями, для дозы 120 мг 3 раза в сутки: на −0,5% (n=168) и −0,249 ммоль/л (n=169) соответственно, для плацебо: +0,2% (n=168) и +0,505 ммоль/л (n=72) соответственно. Средняя разница уровня 1cHbA1c по сравнению с плацебо при приеме натеглинида в дозе 60 мг 3 раза в сутки перед едой −0,5%, концентрации глюкозы в плазме натощак −0,483 ммоль/л; для дозы 120 мг 3 раза в сутки до еды: −0,7% и −0,755 ммоль/л соответственно.
У пациентов, никогда не получавших гипогликемические препараты, и у пациентов, ранее лечившихся гипогликемическими средствами, снижение уровня 1cHbA1c и глюкозы плазмы натощак было сходным.
В этом исследовании отмечался один эпизод тяжелой гипогликемии (<1,98 ммоль/л) у пациента, получавшего 120 мг натеглинида 3 раза в сутки перед едой. Никто из пациентов, испытавших гипогликемию, не нуждался в посторонней помощи. У пациентов, получавших натеглинид, отмечалось статистически значимое увеличение массы тела по сравнению с плацебо. При приеме 60 мг натеглинида 3 раза в сутки перед едой среднее изменение массы тела по сравнению с исходным составило +0,3 кг (n=169), при дозе 120 мг 3 раза в сутки перед едой +0,9 кг (n=166), для плацебо −0,7 кг (n=170).
В другом рандомизированном двойном слепом 24-недельном сравнительном и плацебо-контролируемом исследовании пациенты с сахарным диабетом типа 2 рандомизированно получали натеглинид (120 мг 3 раза в сутки перед едой), метформин 500 мг (3 раза в сутки) и комбинацию натеглинида 120 мг (3 раза в сутки перед едой) и метформина 500 мг (3 раза в сутки) или плацебо. Исходный уровень 1cHbA1c определялся в пределах от 8,3 до 8,4%; 57% пациентов ранее не получали пероральных гипогликемических средств. При монотерапии натеглинидом значимо снижался средний уровень 1cHbA1c и средняя концентрация глюкозы в плазме натощак по сравнению с плацебо. Уровень 1cHbA1c изменялся при дозе натеглинида 120 мг 3 раза в сутки на −0,4% (n=171), причем у пациентов, впервые получающих пероральные гипогликемические средства, на −0,7% (n=99), у пациентов, ранее получавших медикаментозное лечение, на +0,004 (n=72). Результаты для плацебо: +0,4% (n=160); +0,3% (n=98); +0,6% (n=62) соответственно. Концентрация глюкозы плазмы натощак при дозе натеглинида 120 мг 3 раза в сутки уменьшалась на 0,727 ммоль/л (n=173), для плацебо увеличивалась на 0,44 ммоль/л (n=166).
Монотерапия натеглинидом в сравнении с другими пероральными гипогликемическими средствами.
Глибурид.
В 24-недельном двойном слепом контролируемом сравнительном исследовании пациенты с сахарным диабетом типа 2, получавшие сульфонилмочевину в течение ≥3 мес и имеющие уровень 1cHbA1c ≥ 6,5 %, рандомизированно получали натеглинид (60 или 120 мг 3 раза в сутки перед едой) или глибурид 10 мг 1 раз в сутки. В результате исследования выявлено, что у пациентов, получавших натеглинид, отмечался значимый рост среднего уровня 1cHbA1c и среднего уровня глюкозы в плазме натощак в сравнении с пациентами, получавшими глибурид.
Метформин.
В другом рандомизированном двойном слепом 24-недельном сравнительном и плацебо-контролируемом исследовании пациенты с сахарным диабетом типа 2 рандомизированно получали натеглинид (120 мг 3 раза в сутки перед едой), метформин (500 мг 3 раза в сутки) или плацебо. Исходный уровень 1cHbA1c находился в пределах 8,3-8,4 %; 57% пациентов ранее не получали пероральных гипогликемических средств. По результатам исследования снижение среднего уровня 1cHbA1c и средней концентрации глюкозы в плазме натощак при монотерапии метформином было значимо больше, чем снижение этих параметров при монотерапии натеглинидом. Уровень 1cHbA1c изменялся при дозе натеглинида 120 мг 3 раза в сутки на −0,4% (n=171), причем в подгруппе пациентов, впервые получающих пероральные гипогликемические средства, на −0,7% (n=99), в подгруппе пациентов, ранее получавших медикаментозное лечение, на +0,004% (n=72). Для получавших 500 мг метформина 3 раза в сутки среднее изменение уровня HbA1с составило −0,8% как в общей (n=172), так и в отдельных группах (n=98 и n=74 соответственно). Среднее изменение концентрации глюкозы в плазме у получавших натеглинид (120 мг 3 раза в сутки) составило −0,727 ммоль/л (n=173), у получавших 500 мг метформина 3 раза в сутки −1,665 ммоль/л (n=174).
Относительно плацебо (изменение массы тела −0,4 кг, n=160) монотерапия натеглинидом ассоциировалась со значимым повышением средней массы тела (+0,9 кг, n=169), тогда как монотерапия метформином сопровождалась значимым снижением массы тела (−0,1 кг, n=169). В подгруппе пациентов, не получавших ранее гипогликемических средств, снижение среднего уровня 1cHbA1c и среднего уровня глюкозы в плазме натощак при лечении натеглинидом было сходным с таковыми при монотерапии метформином. В подгруппе пациентов, предварительно получавших другие гипогликемические средства (в основном глибурид), при монотерапии натеглинидом уровень 1cHbA1c незначительно возрастал относительно исходного уровня, тогда как в группе получавших монотерапию метформином уровень 1cHbA1c снижался.
Комбинированная терапия натеглинидом.
Метформин.
В другом рандомизированном двойном слепом 24-недельном сравнительном и плацебо-контролируемом исследовании пациенты с сахарным диабетом типа 2 рандомизированно получали натеглинид (120 мг 3 раза в сутки до еды), метформин (500 мг 3 раза в сутки) или плацебо. Исходный уровень 1cHbA1c был в пределах 8,3-8,4%. 57% пациентов ранее не получали пероральных гипогликемических средств. Пациентам, ранее получавшим гипогликемическую терапию, за 2 мес до рандомизации были отменены гипогликемические препараты. В результате, натеглинид в комбинации с метформином статистически значимо и в бóльшей степени снижал уровень 1cHbA1c и концентрацию глюкозы в плазме натощак по сравнению с монотерапией натеглинидом или метформином. Среднее изменение уровня 1cHbA1c в группе получавших комбинацию натеглинида и метформина −1,5% (n=162), в группе получавших только натеглинид −0,4% (n=160). Натеглинид, один или в комбинации с метформином, значимо снижал прандиальный подъем глюкозы по сравнению с плацебо или одним метформином. Концентрация глюкозы в плазме измерялась до еды и через 2 ч после еды.
В этом исследовании отмечался один эпизод тяжелой гипогликемии (концентрация глюкозы в плазме ≤1,998 ммоль/л) у пациента, получавшего комбинацию натеглинида и метформина. Также отмечалось четыре эпизода тяжелой гипогликемии у одного пациента, получавшего метформин. В третьей группе (получавших натеглинид) пациенты не отмечали эпизодов гипогликемии, потребовавшей посторонней помощи. По сравнению с плацебо, монотерапия натеглинидом ассоциировалась со статистически значимым увеличением веса. Для плацебо изменение массы тела составляло −0,4 кг (n=160), для получавших 120 мг натеглинида 3 раза в сутки перед едой +0,9 кг (n=169). При использовании комбинации натеглинида и метформина статистически значимых изменений массы тела не наблюдалось; показатель массы тела в среднем увеличивался на 0,2 кг (n=160).
В другом 24-недельном двойном слепом плацебо-контролируемом исследовании пациенты с сахарным диабетом типа 2 с уровнем 1cHbA1c ≥6,8 % после лечения метформином (в дозе ≥1500 мг/сут в течение ≥1 мес) в начале были переведены на 2000 мг метформина в сутки на четырехнедельный период, а затем рандомизированно получали натеглинид (60 или 120 мг 3 раза в сутки перед едой) или плацебо дополнительно к метформину. Лечение комбинацией натеглинида и метформина ассоциировалось со статистически бóльшим снижением уровня 1cHbA1c в сравнении с монотерапией метформином (−0,4 и 0,6% для комбинации метформина с натеглинидом 60 и 120 мг соответственно).
Глибурид.
В 12-недельном исследовании пациентов с сахарным диабетом типа 2, недостаточно контролируемых при назначении 10 мг глибурида в сутки, добавление к лечению натеглинида (60 или 120 мг 3 раза в сутки перед едой) не вызвало никаких положительных эффектов.
Канцерогенность, мутагенность, влияние на фертильность.
Канцерогенность. Двухгодичные исследования на крысах линии Sprague-Dawley были выполнены с использованием пероральных доз натеглинида до 900 мг/кг/сут, что в 30 (для самцов крыс) и 40 (для самок крыс) раз превосходит AUC для человека при рекомендованной терапевтической дозе (120 мг 3 раза в сутки перед едой). Двухгодичные исследования на мышах линии в6C3F1 были проведены с пероральными дозами натеглинида до 400 мг/кг/сут, что в 10 (для самцов мышей) и 30 (для самок мышей) раз превосходит AUC для человека при рекомендованной терапевтической дозе натеглинида (120 мг 3 раза в сутки перед едой). Ни у крыс, ни у мышей не наблюдалось онкогенного ответа.
Мутагенность. Натеглинид не оказывал мутагенного эффекта in vitro >in vitro в тесте Эймса, в тесте на клетках лимфомы мышей, в тесте на хромосомные аберрации на клетках легких китайского хомячка, или микроядерном тесте на мышах in vivo >in vivo.
Влияние на фертильность. При назначении крысам натеглинида в дозе до 600 мг/кг (примерно в 16 раз превышающей терапевтическую дозу для человека при рекомендации 120 мг 3 раза в сутки перед едой) не отмечалось влияния на фертильность.
Натеглинид быстро всасывается и стимулирует секрецию инсулина в поджелудочной железе в течение 20 мин после перорального приема. Быстрый подъем концентрации инсулина в плазме с пиком уровня примерно в течение 1 ч после приема и снижение до исходного через 4 ч после приема наблюдается при назначении натеглинида 3 раза в сутки перед едой.
В двойных слепых контролируемых клинических испытаниях натеглинид назначали перед каждым из 3-х приемов пищи (за 10 мин до еды). Диета была основана на стандартном весоподдерживающем меню для больных диабетом с общим содержанием калорий, рассчитанным индивидуально, в зависимости от массы тела каждого пациента. После 7 нед лечения определяли уровень глюкозы плазмы на протяжении 12 ч в дневное время. Натеглинид вызывал статистически значимое снижение уровня гликемии натощак и постпрандиальной гликемии по сравнению с плацебо.
Клинические исследования.
В 8 двойных слепых рандомизированных плацебо-контролируемых или сравнительных исследованиях для выявления безопасности и эффективности натеглинида длительностью от 8 до 24 нед участвовало 3566 пациента. В этих исследованиях натеглинид назначался за 30 мин до каждого из 3-х основных приемов пищи в сутки.
Монотерапия в сравнении с плацебо.
В рандомизированных двойных слепых плацебо-контролируемых 24-недельных исследованиях пациенты с сахарным диабетом типа 2 с уровнем 1cHbA1c ≥6,8%, находящиеся только на диете, рандомизированно получали либо натеглинид (60 или 120 мг 3 раза в сутки перед едой), либо плацебо. Исходный уровень 1cHbA1c был в пределах 7,9-8,1%; 77,8% пациентов предварительно не получали пероральных гипогликемических препаратов. У пациентов, предварительно получавших гипогликемические средства, препараты были отменены за 2 мес до рандомизации. В результате исследований выявлено, что при приеме натеглинида до еды статистически значимо снижался средний уровень 1cHbA1c и средний уровень глюкозы плазмы натощак по сравнению с плацебо. Так, при приеме натеглинида в дозе 60 мг 3 раза в сутки перед едой средний уровень 1cHbA1c (n=167) изменялся на −0,3%, концентрация глюкозы плазмы натощак (n=171) на +0,022 ммоль/л по сравнению с исходными уровнями, для дозы 120 мг 3 раза в сутки: на −0,5% (n=168) и −0,249 ммоль/л (n=169) соответственно, для плацебо: +0,2% (n=168) и +0,505 ммоль/л (n=72) соответственно. Средняя разница уровня 1cHbA1c по сравнению с плацебо при приеме натеглинида в дозе 60 мг 3 раза в сутки перед едой −0,5%, концентрации глюкозы в плазме натощак −0,483 ммоль/л; для дозы 120 мг 3 раза в сутки до еды: −0,7% и −0,755 ммоль/л соответственно.
У пациентов, никогда не получавших гипогликемические препараты, и у пациентов, ранее лечившихся гипогликемическими средствами, снижение уровня 1cHbA1c и глюкозы плазмы натощак было сходным.
В этом исследовании отмечался один эпизод тяжелой гипогликемии (<1,98 ммоль/л) у пациента, получавшего 120 мг натеглинида 3 раза в сутки перед едой. Никто из пациентов, испытавших гипогликемию, не нуждался в посторонней помощи. У пациентов, получавших натеглинид, отмечалось статистически значимое увеличение массы тела по сравнению с плацебо. При приеме 60 мг натеглинида 3 раза в сутки перед едой среднее изменение массы тела по сравнению с исходным составило +0,3 кг (n=169), при дозе 120 мг 3 раза в сутки перед едой +0,9 кг (n=166), для плацебо −0,7 кг (n=170).
В другом рандомизированном двойном слепом 24-недельном сравнительном и плацебо-контролируемом исследовании пациенты с сахарным диабетом типа 2 рандомизированно получали натеглинид (120 мг 3 раза в сутки перед едой), метформин 500 мг (3 раза в сутки) и комбинацию натеглинида 120 мг (3 раза в сутки перед едой) и метформина 500 мг (3 раза в сутки) или плацебо. Исходный уровень 1cHbA1c определялся в пределах от 8,3 до 8,4%; 57% пациентов ранее не получали пероральных гипогликемических средств. При монотерапии натеглинидом значимо снижался средний уровень 1cHbA1c и средняя концентрация глюкозы в плазме натощак по сравнению с плацебо. Уровень 1cHbA1c изменялся при дозе натеглинида 120 мг 3 раза в сутки на −0,4% (n=171), причем у пациентов, впервые получающих пероральные гипогликемические средства, на −0,7% (n=99), у пациентов, ранее получавших медикаментозное лечение, на +0,004 (n=72). Результаты для плацебо: +0,4% (n=160); +0,3% (n=98); +0,6% (n=62) соответственно. Концентрация глюкозы плазмы натощак при дозе натеглинида 120 мг 3 раза в сутки уменьшалась на 0,727 ммоль/л (n=173), для плацебо увеличивалась на 0,44 ммоль/л (n=166).
Монотерапия натеглинидом в сравнении с другими пероральными гипогликемическими средствами.
Глибурид.
В 24-недельном двойном слепом контролируемом сравнительном исследовании пациенты с сахарным диабетом типа 2, получавшие сульфонилмочевину в течение ≥3 мес и имеющие уровень 1cHbA1c ≥ 6,5 %, рандомизированно получали натеглинид (60 или 120 мг 3 раза в сутки перед едой) или глибурид 10 мг 1 раз в сутки. В результате исследования выявлено, что у пациентов, получавших натеглинид, отмечался значимый рост среднего уровня 1cHbA1c и среднего уровня глюкозы в плазме натощак в сравнении с пациентами, получавшими глибурид.
Метформин.
В другом рандомизированном двойном слепом 24-недельном сравнительном и плацебо-контролируемом исследовании пациенты с сахарным диабетом типа 2 рандомизированно получали натеглинид (120 мг 3 раза в сутки перед едой), метформин (500 мг 3 раза в сутки) или плацебо. Исходный уровень 1cHbA1c находился в пределах 8,3-8,4 %; 57% пациентов ранее не получали пероральных гипогликемических средств. По результатам исследования снижение среднего уровня 1cHbA1c и средней концентрации глюкозы в плазме натощак при монотерапии метформином было значимо больше, чем снижение этих параметров при монотерапии натеглинидом. Уровень 1cHbA1c изменялся при дозе натеглинида 120 мг 3 раза в сутки на −0,4% (n=171), причем в подгруппе пациентов, впервые получающих пероральные гипогликемические средства, на −0,7% (n=99), в подгруппе пациентов, ранее получавших медикаментозное лечение, на +0,004% (n=72). Для получавших 500 мг метформина 3 раза в сутки среднее изменение уровня HbA1с составило −0,8% как в общей (n=172), так и в отдельных группах (n=98 и n=74 соответственно). Среднее изменение концентрации глюкозы в плазме у получавших натеглинид (120 мг 3 раза в сутки) составило −0,727 ммоль/л (n=173), у получавших 500 мг метформина 3 раза в сутки −1,665 ммоль/л (n=174).
Относительно плацебо (изменение массы тела −0,4 кг, n=160) монотерапия натеглинидом ассоциировалась со значимым повышением средней массы тела (+0,9 кг, n=169), тогда как монотерапия метформином сопровождалась значимым снижением массы тела (−0,1 кг, n=169). В подгруппе пациентов, не получавших ранее гипогликемических средств, снижение среднего уровня 1cHbA1c и среднего уровня глюкозы в плазме натощак при лечении натеглинидом было сходным с таковыми при монотерапии метформином. В подгруппе пациентов, предварительно получавших другие гипогликемические средства (в основном глибурид), при монотерапии натеглинидом уровень 1cHbA1c незначительно возрастал относительно исходного уровня, тогда как в группе получавших монотерапию метформином уровень 1cHbA1c снижался.
Комбинированная терапия натеглинидом.
Метформин.
В другом рандомизированном двойном слепом 24-недельном сравнительном и плацебо-контролируемом исследовании пациенты с сахарным диабетом типа 2 рандомизированно получали натеглинид (120 мг 3 раза в сутки до еды), метформин (500 мг 3 раза в сутки) или плацебо. Исходный уровень 1cHbA1c был в пределах 8,3-8,4%. 57% пациентов ранее не получали пероральных гипогликемических средств. Пациентам, ранее получавшим гипогликемическую терапию, за 2 мес до рандомизации были отменены гипогликемические препараты. В результате, натеглинид в комбинации с метформином статистически значимо и в бóльшей степени снижал уровень 1cHbA1c и концентрацию глюкозы в плазме натощак по сравнению с монотерапией натеглинидом или метформином. Среднее изменение уровня 1cHbA1c в группе получавших комбинацию натеглинида и метформина −1,5% (n=162), в группе получавших только натеглинид −0,4% (n=160). Натеглинид, один или в комбинации с метформином, значимо снижал прандиальный подъем глюкозы по сравнению с плацебо или одним метформином. Концентрация глюкозы в плазме измерялась до еды и через 2 ч после еды.
В этом исследовании отмечался один эпизод тяжелой гипогликемии (концентрация глюкозы в плазме ≤1,998 ммоль/л) у пациента, получавшего комбинацию натеглинида и метформина. Также отмечалось четыре эпизода тяжелой гипогликемии у одного пациента, получавшего метформин. В третьей группе (получавших натеглинид) пациенты не отмечали эпизодов гипогликемии, потребовавшей посторонней помощи. По сравнению с плацебо, монотерапия натеглинидом ассоциировалась со статистически значимым увеличением веса. Для плацебо изменение массы тела составляло −0,4 кг (n=160), для получавших 120 мг натеглинида 3 раза в сутки перед едой +0,9 кг (n=169). При использовании комбинации натеглинида и метформина статистически значимых изменений массы тела не наблюдалось; показатель массы тела в среднем увеличивался на 0,2 кг (n=160).
В другом 24-недельном двойном слепом плацебо-контролируемом исследовании пациенты с сахарным диабетом типа 2 с уровнем 1cHbA1c ≥6,8 % после лечения метформином (в дозе ≥1500 мг/сут в течение ≥1 мес) в начале были переведены на 2000 мг метформина в сутки на четырехнедельный период, а затем рандомизированно получали натеглинид (60 или 120 мг 3 раза в сутки перед едой) или плацебо дополнительно к метформину. Лечение комбинацией натеглинида и метформина ассоциировалось со статистически бóльшим снижением уровня 1cHbA1c в сравнении с монотерапией метформином (−0,4 и 0,6% для комбинации метформина с натеглинидом 60 и 120 мг соответственно).
Глибурид.
В 12-недельном исследовании пациентов с сахарным диабетом типа 2, недостаточно контролируемых при назначении 10 мг глибурида в сутки, добавление к лечению натеглинида (60 или 120 мг 3 раза в сутки перед едой) не вызвало никаких положительных эффектов.
Канцерогенность, мутагенность, влияние на фертильность.
Канцерогенность. Двухгодичные исследования на крысах линии Sprague-Dawley были выполнены с использованием пероральных доз натеглинида до 900 мг/кг/сут, что в 30 (для самцов крыс) и 40 (для самок крыс) раз превосходит AUC для человека при рекомендованной терапевтической дозе (120 мг 3 раза в сутки перед едой). Двухгодичные исследования на мышах линии в6C3F1 были проведены с пероральными дозами натеглинида до 400 мг/кг/сут, что в 10 (для самцов мышей) и 30 (для самок мышей) раз превосходит AUC для человека при рекомендованной терапевтической дозе натеглинида (120 мг 3 раза в сутки перед едой). Ни у крыс, ни у мышей не наблюдалось онкогенного ответа.
Мутагенность. Натеглинид не оказывал мутагенного эффекта in vitro >in vitro в тесте Эймса, в тесте на клетках лимфомы мышей, в тесте на хромосомные аберрации на клетках легких китайского хомячка, или микроядерном тесте на мышах in vivo >in vivo.
Влияние на фертильность. При назначении крысам натеглинида в дозе до 600 мг/кг (примерно в 16 раз превышающей терапевтическую дозу для человека при рекомендации 120 мг 3 раза в сутки перед едой) не отмечалось влияния на фертильность.
|
|
Фармакокинетика
Абсорбция. После приема непосредственно перед едой натеглинид быстро всасывается, maxCmax в плазме достигается в среднем в течение 1 При назначении натеглинида больным сахарным диабетом типа 2 в дозах от 60 до 240 мг 3 раза в сутки в течение 1 недели отмечалась линейная зависимость как AUC, так и maxCmax от дозы. maxTmax у этих пациентов не зависело от дозы. Абсолютная биодоступность - примерно 73%. При приеме с пищей или после еды величина абсорбции натеглинида (AUC) оставалась неизмененной, но отмечалось замедление скорости всасывания, характеризующееся снижением maxCmax и удлинением maxTmax. При приеме натеглинида натощак профили концентрации в плазме характеризуются множественными пиками. Этот эффект не наблюдается при приеме натеглинида перед едой.
Распределение. По имеющимся данным, при в/в введении натеглинида объем распределения в равновесном состоянии у здорового человека составляет примерно 10 л. Натеглинид связывается на 98% с сывороточными белками, преимущественно с альбумином, в меньшей степени - с α1-кислым гликопротеином. Величина связывания с белками плазмы не зависит от концентрации вещества в диапазоне концентраций от 0,1 до 10 мкг/мл.
Метаболизм. Перед выведением натеглинид метаболизируется с участием многофункциональной оксидазной системы. Основной путь метаболизма - гидроксилирование, следующее за связыванием с глюкуронидом. Основные метаболиты значительно слабее по гипогликемическому действию, чем натеглинид. Минорный метаболит - изопрен - по силе сходен с исходными составляющими натеглинида. По данным исследований in vitro, натеглинид в основном метаболизируется с участием цитохрома P450: изофермента сYP2C9 (70%) и сYP3A4 (30%).
Выведение. Натеглинид и его метаболиты быстро и полностью выводятся после перорального приема. В течение 6 ч примерно 75% принятой дозы натеглинида, меченного углеродом 14С, обнаруживается в моче. 83% 14С-натеглинида выводится почками, 10% - через ЖКТ. Примерно 16% натеглинида, меченного 14С, определяется в моче в неизмененном виде. Во всех исследованиях у здоровых добровольцев и у больных сахарным диабетом типа 2 концентрация натеглинида в плазме быстро снижалась, среднее время 1/2T1/2 составляло 1,5 В соответствии с таким коротким периодом полувыведения не наблюдалось очевидной кумуляции натеглинида при многократном приеме в дозах до 240 мг 3 раза в сутки в течение 7 дней.
Особые группы пациентов.
Гериатрия. Возраст не оказывал влияния на фармакокинетические свойства натеглинида. У пожилых пациентов не требуется изменения доз.
Пол. В фармакокинетике натеглинида не наблюдалось клинически значимой разницы между мужчинами и женщинами. Изменения дозы в зависимости от пола не требуется.
Раса. Результаты популяционного фармакокинетического анализа, в котором участвовали представители европеоидной, африканской и других этнических групп, показали, что расовая принадлежность оказывает минимальное воздействие на фармакокинетику натеглинида.
Почечная недостаточность. По сравнению со здоровыми людьми, больные сахарным диабетом типа 2 и со средней или тяжелой почечной недостаточностью (не находящиеся на диализе, сl креатинина - 15-50 мл/мин) показали сходные параметры клиренса, AUC и Сmax. У пациентов с сахарным диабетом типа 2 и почечной недостаточностью, находящихся на диализе, показали снижение общей лекарственной экспозиции. У пациентов, находящихся на гемодиализе, наблюдается снижение связывания с белками плазмы по сравнению со здоровыми добровольцами.
Печеночная недостаточность. Пик концентрации и AUC натеглинида у пациентов с легкой формой печеночной недостаточности, не страдающих сахарным диабетом, был на 30% выше по сравнению со здоровыми людьми. Натеглинид с осторожностью должен быть использован у людей с хроническими заболеваниями печени.
Распределение. По имеющимся данным, при в/в введении натеглинида объем распределения в равновесном состоянии у здорового человека составляет примерно 10 л. Натеглинид связывается на 98% с сывороточными белками, преимущественно с альбумином, в меньшей степени - с α1-кислым гликопротеином. Величина связывания с белками плазмы не зависит от концентрации вещества в диапазоне концентраций от 0,1 до 10 мкг/мл.
Метаболизм. Перед выведением натеглинид метаболизируется с участием многофункциональной оксидазной системы. Основной путь метаболизма - гидроксилирование, следующее за связыванием с глюкуронидом. Основные метаболиты значительно слабее по гипогликемическому действию, чем натеглинид. Минорный метаболит - изопрен - по силе сходен с исходными составляющими натеглинида. По данным исследований in vitro, натеглинид в основном метаболизируется с участием цитохрома P450: изофермента сYP2C9 (70%) и сYP3A4 (30%).
Выведение. Натеглинид и его метаболиты быстро и полностью выводятся после перорального приема. В течение 6 ч примерно 75% принятой дозы натеглинида, меченного углеродом 14С, обнаруживается в моче. 83% 14С-натеглинида выводится почками, 10% - через ЖКТ. Примерно 16% натеглинида, меченного 14С, определяется в моче в неизмененном виде. Во всех исследованиях у здоровых добровольцев и у больных сахарным диабетом типа 2 концентрация натеглинида в плазме быстро снижалась, среднее время 1/2T1/2 составляло 1,5 В соответствии с таким коротким периодом полувыведения не наблюдалось очевидной кумуляции натеглинида при многократном приеме в дозах до 240 мг 3 раза в сутки в течение 7 дней.
Особые группы пациентов.
Гериатрия. Возраст не оказывал влияния на фармакокинетические свойства натеглинида. У пожилых пациентов не требуется изменения доз.
Пол. В фармакокинетике натеглинида не наблюдалось клинически значимой разницы между мужчинами и женщинами. Изменения дозы в зависимости от пола не требуется.
Раса. Результаты популяционного фармакокинетического анализа, в котором участвовали представители европеоидной, африканской и других этнических групп, показали, что расовая принадлежность оказывает минимальное воздействие на фармакокинетику натеглинида.
Почечная недостаточность. По сравнению со здоровыми людьми, больные сахарным диабетом типа 2 и со средней или тяжелой почечной недостаточностью (не находящиеся на диализе, сl креатинина - 15-50 мл/мин) показали сходные параметры клиренса, AUC и Сmax. У пациентов с сахарным диабетом типа 2 и почечной недостаточностью, находящихся на диализе, показали снижение общей лекарственной экспозиции. У пациентов, находящихся на гемодиализе, наблюдается снижение связывания с белками плазмы по сравнению со здоровыми добровольцами.
Печеночная недостаточность. Пик концентрации и AUC натеглинида у пациентов с легкой формой печеночной недостаточности, не страдающих сахарным диабетом, был на 30% выше по сравнению со здоровыми людьми. Натеглинид с осторожностью должен быть использован у людей с хроническими заболеваниями печени.
Показания к применению
По данным Physicians Desk Reference (2005). натеглинид показан в качестве монотерапии для снижения уровня глюкозы в крови у пациентов с сахарным диабетом типа 2 (инсулинонезависимый сахарный диабет). у которых для контроля уровня гликемии недостаточно диеты и физической нагрузки и которые не лечились длительно другими гипогликемическими средствами.
Натеглинид показан также для терапии в комбинации с метформином у пациентов с неадекватным контролем уровня гликемии на фоне метформина (замещать метформин натеглинидом не рекомендуется).
Натеглинид показан также для терапии в комбинации с метформином у пациентов с неадекватным контролем уровня гликемии на фоне метформина (замещать метформин натеглинидом не рекомендуется).
Противопоказания
Гиперчувствительность, сахарный диабет типа 1, диабетический кетоацидоз (в этом случае показано лечение инсулином).
Ограничения к использованию
Детский возраст (безопасность и эффективность использования натеглинида в педиатрической практике не установлены), использование в гериатрии (не наблюдалось различий в безопасности и эффективности натеглинида у пациентов 65 лет и старше и пациентов моложе 65 лет; не исключается повышенная чувствительность некоторых пожилых пациентов к терапии натеглинидом), пациенты с умеренной или тяжелой патологией печени (применение у этой группы пациентов не исследовано).
Не следует переводить на лечение натеглинидом (или добавлять натеглинид к схеме лечения) пациентов с неадекватным контролем уровня гликемии на фоне глибурида или другого ЛС, повышающего секрецию инсулина.
Не следует переводить на лечение натеглинидом (или добавлять натеглинид к схеме лечения) пациентов с неадекватным контролем уровня гликемии на фоне глибурида или другого ЛС, повышающего секрецию инсулина.
При беременности и кормлении грудью
Натеглинид не оказывал тератогенного действия у крыс при дозах до 1000 мг/кг (примерно в 60 раз превышает терапевтическую дозу для человека при рекомендованной дозе 120 мг натеглинида 3 раза в сутки до еды). У кроликов отмечалось отрицательное воздействие на развитие эмбриона: возрастала частота агенезии желчного пузыря или «малого» желчного пузыря (в дозах от 500 мг/кг/сут, что примерно в 40 раз превышает терапевтическую дозу для человека при рекомендованной дозе 120 мг 3 раза в сутки перед едой).
Не следует применять натеглинид при беременности (адекватных и хорошо контролируемых исследований у беременных женщин не проводилось).
Влияние натеглинида на родовую деятельность и роды не установлено.
Категория действия на плод по FDA. с.
Исследования на крысах показали, что натеглинид выделяется с молоком. Соотношение AUC0-48 ч между молоком и плазмой было примерно 1:4. Во время пери- и постнатального периода у потомства крыс, получавших натеглинид в дозе 1000 мг/кг/сут (примерно в 60 раз больше терапевтической дозы для человека при рекомендованной дозе натеглинида в 120 мг 3 раза в сутки перед едой), отмечалась низкая масса тела.
Нет данных об экскреции натеглинида с женским молоком. Натеглинид не рекомендован к назначению кормящим женщинам.
Не следует применять натеглинид при беременности (адекватных и хорошо контролируемых исследований у беременных женщин не проводилось).
Влияние натеглинида на родовую деятельность и роды не установлено.
Категория действия на плод по FDA. с.
Исследования на крысах показали, что натеглинид выделяется с молоком. Соотношение AUC0-48 ч между молоком и плазмой было примерно 1:4. Во время пери- и постнатального периода у потомства крыс, получавших натеглинид в дозе 1000 мг/кг/сут (примерно в 60 раз больше терапевтической дозы для человека при рекомендованной дозе натеглинида в 120 мг 3 раза в сутки перед едой), отмечалась низкая масса тела.
Нет данных об экскреции натеглинида с женским молоком. Натеглинид не рекомендован к назначению кормящим женщинам.
Побочные эффекты
В клинических исследованиях натеглинид получали 2400 пациентов с сахарным диабетом типа 2; из них примерно 1200 пациентов были пролечены 6 мес и дольше, 190 - 1 год и дольше.
Частота случаев возникновения побочных эффектов, отмеченных более чем в 2% случаев, у пациентов, получавших натеглинид (n=1441), по сравнению с плацебо (n=458). В скобках указан % пациентов группы плацебо:
Со стороны нервной системы и органов чувств. Головокружение - 3,6% (2,2%).
Со стороны респираторной системы. Инфекции верхних дыхательных путей - 10,5% (8,1%), бронхит - 2,7% (2,6%), кашель - 2,4% (2,2%).
Со стороны органов ЖКТ. Диарея - 3,2% (3,1%).
Со стороны обмена веществ. Гипогликемия - 2,4% (0,4%).
Со стороны опорно-двигательного аппарата: артропатия - 3,3% (2,2%), случайная травма - 2,9% (1,7%).
Прочие. Боль в позвоночнике - 4,0% (3,7%), гриппоподобные симптомы - 3,6% (2,6%).
Лабораторные нарушения. Отмечался рост средней концентрации мочевой кислоты у пациентов, получавших монотерапию натеглинидом или комбинацию натеглинида с метформином, или монотерапию метформином, или монотерапию глибуридом. Сравнительная разница с плацебо составляла 0,017, 0,026, 0,017 и 0,011 ммоль/л соответственно. Клиническое значение этого явления неизвестно.
Гипогликемия встречалась относительно редко во всех схемах лечения в клинических исследованиях. Только у 0,3% пациентов натеглинид был отменен из-за гипогликемии. Симптомы со стороны ЖКТ. особенно диарея и тошнота. были не менее частыми у пациентов. получавших комбинацию натеглинида и метформина. чем у пациентов. получавших только метформин.
Частота случаев возникновения побочных эффектов, отмеченных более чем в 2% случаев, у пациентов, получавших натеглинид (n=1441), по сравнению с плацебо (n=458). В скобках указан % пациентов группы плацебо:
Со стороны нервной системы и органов чувств. Головокружение - 3,6% (2,2%).
Со стороны респираторной системы. Инфекции верхних дыхательных путей - 10,5% (8,1%), бронхит - 2,7% (2,6%), кашель - 2,4% (2,2%).
Со стороны органов ЖКТ. Диарея - 3,2% (3,1%).
Со стороны обмена веществ. Гипогликемия - 2,4% (0,4%).
Со стороны опорно-двигательного аппарата: артропатия - 3,3% (2,2%), случайная травма - 2,9% (1,7%).
Прочие. Боль в позвоночнике - 4,0% (3,7%), гриппоподобные симптомы - 3,6% (2,6%).
Лабораторные нарушения. Отмечался рост средней концентрации мочевой кислоты у пациентов, получавших монотерапию натеглинидом или комбинацию натеглинида с метформином, или монотерапию метформином, или монотерапию глибуридом. Сравнительная разница с плацебо составляла 0,017, 0,026, 0,017 и 0,011 ммоль/л соответственно. Клиническое значение этого явления неизвестно.
Гипогликемия встречалась относительно редко во всех схемах лечения в клинических исследованиях. Только у 0,3% пациентов натеглинид был отменен из-за гипогликемии. Симптомы со стороны ЖКТ. особенно диарея и тошнота. были не менее частыми у пациентов. получавших комбинацию натеглинида и метформина. чем у пациентов. получавших только метформин.
|
|
Взаимодействие
Исследования метаболизма in vitro >in vitro показали, что натеглинид в основном метаболизируется с участием цитохрома Р450: изоферментов сYP2C9 (70%) и, в меньшей степени, сYP3A4 (30%). Натеглинид - мощный ингибитор изофермента сYP2C9 in vivo >in vivo, что показано его возможностью ингибировать in vitro >in vitro метаболизм толбутамида. Метаболические последствия ингибирования сYP3A4 не были выявлены в экспериментах in vitro >in vitro.
Глибурид. В рандомизированных многодозовых перекрестных исследованиях пациентам с сахарным диабетом типа 2 назначался натеглинид 120 мг 3 раза в сутки перед едой на 1 день в комбинации с 10 мг глибурида. Не выявлено клинически явных изменений в фармакокинетике обоих веществ.
Метформин. При назначении пациентам с сахарным диабетом типа 2 натеглинида (120 мг) 3 раза в сутки перед едой в комбинации с метформином 500 мг 3 раза в сутки, не отмечалось клинически явных изменений в фармакокинетике обоих веществ.
Дигоксин. При назначении здоровым добровольцам натеглинида 120 мг 3 раза в сутки перед едой в сочетании с однократным приемом 1 мг дигоксина не отмечалось клинически явных изменений в фармакокинетике обоих веществ.
Варфарин. При назначении здоровым добровольцам 120 мг натеглинида 3 раза в сутки перед едой на 4 дня в комбинации с однократным приемом 30 мг варфарина на второй день не отмечалось изменений в фармакокинетике обоих веществ, ПВ также не менялось.
Диклофенак. Прием утром и в обед 120 мг натеглинида в комбинации с однократным приемом 75 мг диклофенака не приводил к значительным изменениям фармакокинетики обоих веществ у здоровых добровольцев.
Большая часть натеглинида (98%) прочно связывается с белками плазмы, преимущественно с альбуминами. In vitro исследования вытеснения с веществами, обладающими высокой степенью связывания, такими как фуросемид, пропранолол, каптоприл, никардипин, правастатин, глибурид, варфарин, фенитоин, ацетилсалициловая кислота, толбутамид и метформин, не показали влияния на объем связывания натеглинида с белками плазмы. Также натеглинид не оказывал влияния на связывание с белками плазмы пропранолола, глибурида, никардипина, фенитоина, ацетилсалициловой кислоты и толбутамида in vitro >in vitro. Однако в клинических условиях возможны небольшие индивидуальные отклонения.
Некоторые лекарства, в тч НПВС, салицилаты, ингибиторы МАО и неселективные бета-адреноблокаторы могут усилить гипогликемическое действие натеглинида и других гипогликемических средств.
Некоторые ЛС, включая тиазидные диуретики, кортикостероиды, аналоги тиреоидных гормонов, симпатомиметики, могут снизить гипогликемическое действие натеглинида и других пероральных гипогликемических средств. Когда эти ЛС назначаются или отменяются у пациента, получающего натеглинид, необходимо осуществлять контроль за уровнем гликемии.
Взаимодействие с пищей. Фармакокинетика натеглинида не зависит от состава пищи (содержание белков, жиров или углеродов). Однако maxCmax значительно снижается при приеме натеглинида за 10 мин до приема жидкой пищи. Натеглинид не оказывает каких-либо эффектов на пустой желудок у здоровых людей, как показал ацетаминофеновый тест.
Глибурид. В рандомизированных многодозовых перекрестных исследованиях пациентам с сахарным диабетом типа 2 назначался натеглинид 120 мг 3 раза в сутки перед едой на 1 день в комбинации с 10 мг глибурида. Не выявлено клинически явных изменений в фармакокинетике обоих веществ.
Метформин. При назначении пациентам с сахарным диабетом типа 2 натеглинида (120 мг) 3 раза в сутки перед едой в комбинации с метформином 500 мг 3 раза в сутки, не отмечалось клинически явных изменений в фармакокинетике обоих веществ.
Дигоксин. При назначении здоровым добровольцам натеглинида 120 мг 3 раза в сутки перед едой в сочетании с однократным приемом 1 мг дигоксина не отмечалось клинически явных изменений в фармакокинетике обоих веществ.
Варфарин. При назначении здоровым добровольцам 120 мг натеглинида 3 раза в сутки перед едой на 4 дня в комбинации с однократным приемом 30 мг варфарина на второй день не отмечалось изменений в фармакокинетике обоих веществ, ПВ также не менялось.
Диклофенак. Прием утром и в обед 120 мг натеглинида в комбинации с однократным приемом 75 мг диклофенака не приводил к значительным изменениям фармакокинетики обоих веществ у здоровых добровольцев.
Большая часть натеглинида (98%) прочно связывается с белками плазмы, преимущественно с альбуминами. In vitro исследования вытеснения с веществами, обладающими высокой степенью связывания, такими как фуросемид, пропранолол, каптоприл, никардипин, правастатин, глибурид, варфарин, фенитоин, ацетилсалициловая кислота, толбутамид и метформин, не показали влияния на объем связывания натеглинида с белками плазмы. Также натеглинид не оказывал влияния на связывание с белками плазмы пропранолола, глибурида, никардипина, фенитоина, ацетилсалициловой кислоты и толбутамида in vitro >in vitro. Однако в клинических условиях возможны небольшие индивидуальные отклонения.
Некоторые лекарства, в тч НПВС, салицилаты, ингибиторы МАО и неселективные бета-адреноблокаторы могут усилить гипогликемическое действие натеглинида и других гипогликемических средств.
Некоторые ЛС, включая тиазидные диуретики, кортикостероиды, аналоги тиреоидных гормонов, симпатомиметики, могут снизить гипогликемическое действие натеглинида и других пероральных гипогликемических средств. Когда эти ЛС назначаются или отменяются у пациента, получающего натеглинид, необходимо осуществлять контроль за уровнем гликемии.
Взаимодействие с пищей. Фармакокинетика натеглинида не зависит от состава пищи (содержание белков, жиров или углеродов). Однако maxCmax значительно снижается при приеме натеглинида за 10 мин до приема жидкой пищи. Натеглинид не оказывает каких-либо эффектов на пустой желудок у здоровых людей, как показал ацетаминофеновый тест.
Передозировка
В клинических исследованиях у пациентов с сахарным диабетом типа 2 натеглинид назначался в возрастающих дозировках до 720 мг/сут в течение 7 дней. Не поступало сообщений о клинически значимых побочных эффектах. Не отмечалось случаев передозировки натеглинида в клинических исследованиях. Однако прием доз, превышающих рекомендованные, может приводить к чрезмерному глюкозоснижающему эффекту с развитием симптомов гипогликемии. Симптомы гипогликемии, не сопровождающейся потерей сознания и неврологическими нарушениями, купируются приемом глюкозы перорально, уменьшением дозы и/или приемом пищи. Тяжелые гипогликемические реакции с комой, судорогами или другими неврологическими симптомами должны купироваться в/в введением глюкозы. Поскольку натеглинид прочно связывается с белками, для удаления его из крови диализ неэффективен.
Способ применения и дозы
Внутрь, за 1-30 мин до еды, перед основными приемами пищи. Рекомендованная начальная и поддерживающая доза натеглинида в качестве монотерапии или в комбинации с метформином - 120 мг 3 раза в сутки. Доза натеглинида 60 мг/сут как в качестве монотерапии, так и в комбинации с метформином может быть использована у пациентов при условии практически нормального уровня 1cHbA1c в начале лечения.
В гериатрии обычно не требуется специального уточнения дозы, однако не исключается повышенная чувствительность некоторых пациентов к терапии натеглинидом.
У пациентов с легкими формами почечной или печеночной недостаточности не требуется изменения дозы натеглинида. При умеренном или тяжелом нарушении функции печени особенности дозировки не изучались, поэтому натеглинид должен использоваться с осторожность у пациентов с умеренной или тяжелой патологией печени.
В гериатрии обычно не требуется специального уточнения дозы, однако не исключается повышенная чувствительность некоторых пациентов к терапии натеглинидом.
У пациентов с легкими формами почечной или печеночной недостаточности не требуется изменения дозы натеглинида. При умеренном или тяжелом нарушении функции печени особенности дозировки не изучались, поэтому натеглинид должен использоваться с осторожность у пациентов с умеренной или тяжелой патологией печени.
Меры предосторожности применения
Гипогликемия. Все пероральные гипогликемические средства могут вызывать гипогликемию. Частота гипогликемии зависит от тяжести диабета, контроля уровня гликемии и других особенностей пациента. Пациенты пожилого и старческого возраста, пациенты с плохим питанием, пациенты с адреналовой или питуитарной недостаточностью наиболее подвержены гипогликемическому эффекту этой терапии. Риск гипогликемии может возрастать при сильных физических нагрузках, приеме алкоголя, при недостаточном поступлении калорий (длительном или случайном) или при комбинации с другими пероральными гипогликемическими средствами. Могут возникать трудности с выявлением гипогликемии у пациентов с автономной (висцеральной) нейропатией и/или при приеме бета-адреноблокаторов. Чтобы снизить риск гипогликемии натеглинид назначается до еды; пациент, пропускающий прием пищи, должен также пропустить очередной прием натеглинида.
Влияние на печень. Натеглинид должен использоваться с осторожностью у пациентов с умеренной или тяжелой патологией печени, поскольку его применение у таких пациентов не исследовано.
Потеря контроля гликемии. Преходящая потеря контроля уровня гликемии может наблюдаться при лихорадке, инфекциях, травме, хирургическом вмешательстве. В этих случаях вместо натеглинида необходима инсулинотерапия. Может наблюдаться вторичная недостаточность или снижение эффективности натеглинида через какой-то период времени.
Лабораторные тесты. Ответ на лечение должен периодически оцениваться величиной концентрации глюкозы и уровнем 1cHbA1c.
Влияние на печень. Натеглинид должен использоваться с осторожностью у пациентов с умеренной или тяжелой патологией печени, поскольку его применение у таких пациентов не исследовано.
Потеря контроля гликемии. Преходящая потеря контроля уровня гликемии может наблюдаться при лихорадке, инфекциях, травме, хирургическом вмешательстве. В этих случаях вместо натеглинида необходима инсулинотерапия. Может наблюдаться вторичная недостаточность или снижение эффективности натеглинида через какой-то период времени.
Лабораторные тесты. Ответ на лечение должен периодически оцениваться величиной концентрации глюкозы и уровнем 1cHbA1c.
Особые указания
Информация для пациентов. Пациенты должны быть информированы о потенциальном риске использования и полезных эффектах натеглинида и альтернативных схемах лечения. Необходимо объяснить риск возникновения гипогликемии и ее лечение. Пациент должен быть проинструктирован, что принимать натеглинид необходимо за 1-30 мин до еды. Необходимо пропустить прием очередной дозы натеглинида, если пациент пропускает прием пищи, что позволяет снизить риск гипогликемии. Необходимо обговорить с пациентом взаимодействие лекарств. Пациент должен быть проинформирован о возможном взаимодействии натеглинида с другими лекарствами.
|
|
Список литературы
Physicians Desk Reference. 59th ed. Thomson PDR. 2005. P. 2375-2377.
Входит в состав
- — Натеглинид (Gedeon Richter )