Другие названия и синонимы
Exametazime.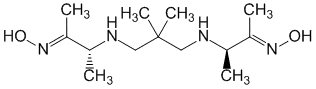
Фармакологическая группа
|
|
Латинское название
Exametazimum ( Exametazimi).
Химическое название
(±)-(3RS,3 RS)-3,3 -[(2,2-Диметилтриметилен)диимино]ди-2-бутанона (E,E)-диоксим.
Код CAS
105613-48-7.
ATX код
V09 Диагностические радиофармацевтические средства.
Фармакокинетика
Внутривенное введение.
99mTc‑эксаметазим представляет собой неполярный липофильный комплекс, имеющий низкий молекулярный вес и способный проникать через гематоэнцефалический барьер. После внутривенного введения препарат быстро выводится из крови. Содержание препарата в головном мозге достигает максимума 3,5-7,0% от введенной дозы в течение одной минуты после внутривенного введения. Около 15% дозы, накопленной в головном мозге, вымывается ко 2‑й минуте после введения, после чего уровень препарата медленно изменяется в течение 24 часов в основном в связи с процессом распада 99mTc. Препарат распределяется в головном мозге, а также в мышцах и мягких тканях. Около 20% введенной дозы обнаруживается в печени сразу после инъекции и выводится из нее с желчью. Около 40% введенной дозы выводится почками с мочой в течение 48 часов после введения, что сопровождается значительным снижением концентрации препарата в скелетных мышцах и мягких тканях.
Меченые лейкоциты.
Аутогенные лейкоциты, меченые 99mTc‑эксаметазимом in vitro >in vitro, при последующем введении в кровоток являются неинвазивным способом диагностирования различных воспалительных состояний, в результате естественной миграции лейкоцитов в очаги воспаления. После разделения лейкоцитов и введения в них метки определяется эффективность мечения, равная примерно 55%, из которых, около 78% связано с нейтрофилами.
После введения в кровоток лейкоциты, меченые 99mTc in vitro >in vitro, распределяются в печени (в течение 5 минут) и селезенке (в течение примерно 40 минут) и в общей циркуляции (последняя представляет примерно 50% от общего количества лейкоцитов).
Примерно 37% лейкоцитов, меченых 99mTc, высвобождается из кровотока через 40 минут после инъекции. Активность 99mTc понемногу уменьшается и экскретируется частично почками, частично печенью и через желчный пузырь, что приводит к аккумуляции активности в толстой кишке.
99mTc‑эксаметазим представляет собой неполярный липофильный комплекс, имеющий низкий молекулярный вес и способный проникать через гематоэнцефалический барьер. После внутривенного введения препарат быстро выводится из крови. Содержание препарата в головном мозге достигает максимума 3,5-7,0% от введенной дозы в течение одной минуты после внутривенного введения. Около 15% дозы, накопленной в головном мозге, вымывается ко 2‑й минуте после введения, после чего уровень препарата медленно изменяется в течение 24 часов в основном в связи с процессом распада 99mTc. Препарат распределяется в головном мозге, а также в мышцах и мягких тканях. Около 20% введенной дозы обнаруживается в печени сразу после инъекции и выводится из нее с желчью. Около 40% введенной дозы выводится почками с мочой в течение 48 часов после введения, что сопровождается значительным снижением концентрации препарата в скелетных мышцах и мягких тканях.
Меченые лейкоциты.
Аутогенные лейкоциты, меченые 99mTc‑эксаметазимом in vitro >in vitro, при последующем введении в кровоток являются неинвазивным способом диагностирования различных воспалительных состояний, в результате естественной миграции лейкоцитов в очаги воспаления. После разделения лейкоцитов и введения в них метки определяется эффективность мечения, равная примерно 55%, из которых, около 78% связано с нейтрофилами.
После введения в кровоток лейкоциты, меченые 99mTc in vitro >in vitro, распределяются в печени (в течение 5 минут) и селезенке (в течение примерно 40 минут) и в общей циркуляции (последняя представляет примерно 50% от общего количества лейкоцитов).
Примерно 37% лейкоцитов, меченых 99mTc, высвобождается из кровотока через 40 минут после инъекции. Активность 99mTc понемногу уменьшается и экскретируется частично почками, частично печенью и через желчный пузырь, что приводит к аккумуляции активности в толстой кишке.
Фармакодинамика
Фармакологических эффектов после внутривенного введения Церетека в рекомендованных дозах не отмечается.
Показания к применению
Церетек.
Предназначен только для диагностических целей.
Сцинтиграфия головного мозга для диагностики заболеваний. связанных с нарушением церебрального кровообращения. в частности. транзиторная ишемия головного мозга. инсульт. эпилепсия. деменция. опухолевые новообразования.
При использовании меченых лейкоцитов - для визуализации очагов воспаления различного происхождения и локализации.
Предназначен только для диагностических целей.
Сцинтиграфия головного мозга для диагностики заболеваний. связанных с нарушением церебрального кровообращения. в частности. транзиторная ишемия головного мозга. инсульт. эпилепсия. деменция. опухолевые новообразования.
При использовании меченых лейкоцитов - для визуализации очагов воспаления различного происхождения и локализации.
Противопоказания
Повышенная чувствительность к эксаметазиму или любому другому компоненту препарата.
Беременность ( см раздел «Применение при беременности и в период грудного вскармливания»).
Возраст до 18 лет, поскольку эффективность и безопасность применения у пациентов данной возрастной группы не установлены.
Беременность ( см раздел «Применение при беременности и в период грудного вскармливания»).
Возраст до 18 лет, поскольку эффективность и безопасность применения у пациентов данной возрастной группы не установлены.
При беременности и кормлении грудью
При необходимости введения радиофармацевтических препаратов женщине детородного возраста, необходимо получить достоверную информацию об отсутствии у нее беременности. Любая женщина, у которой имеется задержка менструации, должна считаться беременной, пока не доказано обратное. Следует рассмотреть возможность применения альтернативных методов, в которых не используется ионизирующее излучение.
Препарат не следует применять у беременных, за исключением тех случаев, когда предполагаемая польза для матери от его применения превышает потенциальный риск для плода.
Данные по экскреции 99mTc‑эксаметазима в грудное молоко отсутствуют;
Если введение радиофармацевтического препарата необходимо пациентке в период грудного вскармливания, следует рекомендовать ей прекратить грудное вскармливание не менее, чем на 24 часа после введения препарата.
Препарат не следует применять у беременных, за исключением тех случаев, когда предполагаемая польза для матери от его применения превышает потенциальный риск для плода.
Данные по экскреции 99mTc‑эксаметазима в грудное молоко отсутствуют;
Если введение радиофармацевтического препарата необходимо пациентке в период грудного вскармливания, следует рекомендовать ей прекратить грудное вскармливание не менее, чем на 24 часа после введения препарата.
Побочные эффекты
Нежелательные явления при введении 99mTc‑эксаметазима очень редки:
Сообщалось о развитии реакций повышенной чувствительности, сопровождающихся возникновением сыпи после внутривенного введения готового препарата. Также сообщалось о возможном развитии реакции повышенной чувствительности после введения лейкоцитов, меченых 99mTc in vivo >in vivo. Для каждого пациента воздействие ионизирующей радиации должно быть оправдано с учетом ожидаемого положительного эффекта. Радиоактивность введенного препарата должна быть такова, чтобы конечное излучение было настолько низким, насколько это возможно, с учетом необходимости получения требуемого диагностического результата. Воздействие излучения может быть связанно с развитием рака и возможностью появления наследуемых дефектов. По имеющимся на текущий момент данным для диагностических радиационных исследований такие отрицательные воздействия маловероятны из-за низкой дозы облучения. Для большинства диагностических радиационных исследований полученная доза облучения не превышает 20 мЗв. В некоторых исследованиях дозы могут быть скорректированы в сторону увеличения.
* очень часто: частота возникновения осложнения - ≥10%;
Часто:
Частота возникновения осложнения - ≥1%, <10%;
Не часто: частота возникновения осложнения - ≥0,1%, <1%;
Редко:
Частота возникновения осложнения - ≥0,01%, <0,1%;
Очень редко: частота возникновения - <0,01%;
Не известно: частота не может быть рассчитана на основании имеющихся данных.
Сообщалось о развитии реакций повышенной чувствительности, сопровождающихся возникновением сыпи после внутривенного введения готового препарата. Также сообщалось о возможном развитии реакции повышенной чувствительности после введения лейкоцитов, меченых 99mTc in vivo >in vivo. Для каждого пациента воздействие ионизирующей радиации должно быть оправдано с учетом ожидаемого положительного эффекта. Радиоактивность введенного препарата должна быть такова, чтобы конечное излучение было настолько низким, насколько это возможно, с учетом необходимости получения требуемого диагностического результата. Воздействие излучения может быть связанно с развитием рака и возможностью появления наследуемых дефектов. По имеющимся на текущий момент данным для диагностических радиационных исследований такие отрицательные воздействия маловероятны из-за низкой дозы облучения. Для большинства диагностических радиационных исследований полученная доза облучения не превышает 20 мЗв. В некоторых исследованиях дозы могут быть скорректированы в сторону увеличения.
| Система органов | Частота* Нежелательные реакцииНарушения со стороны иммунной системы | не известно повышенная чувствительность, включая сыпь, эритема, крапивница, ангионевротический отек, зуд (только для введения меченых лейкоцитов) повышенная чувствительность, включая сыпь, эритема, крапивница, ангионевротический отек, зуд, анафилактоидная реакция или анафилактоидный шок Нарушения со стороны нервной системы головная боль, головокружение, парестезия Нарушения со стороны сосудов приливы Нарушения со стороны желудочно-кишечного тракта тошнота, рвота Общие расстройства и изменения в месте инъекции астения (например, слабость, утомляемость) |
* очень часто: частота возникновения осложнения - ≥10%;
Часто:
Частота возникновения осложнения - ≥1%, <10%;
Не часто: частота возникновения осложнения - ≥0,1%, <1%;
Редко:
Частота возникновения осложнения - ≥0,01%, <0,1%;
Очень редко: частота возникновения - <0,01%;
Не известно: частота не может быть рассчитана на основании имеющихся данных.
Взаимодействие
Не выявлено. Не рекомендуется смешивать препарат с другими лекарственными средствами.
Передозировка
При применении препарата в соответствии с инструкцией по медицинскому применению передозировка маловероятна. В случае передозировки для уменьшения радиационной нагрузки на пациента необходимо стимулировать частое мочеиспускание и дефекацию.
Особые указания
Флакон с лиофилизатом содержит 1,77 мг натрия/флакон (0,354 мг/мл), что следует принять во внимание у пациентов, которые находятся на гипонатриевой диете.
Применение препарата может вызвать реакции повышенной чувствительности, включая анафилаксию. На случай их возникновения необходимо иметь в наличии необходимые препараты и оборудование для оказания немедленной медицинской помощи.
Препарат должен готовиться и применяться только квалифицированным персоналом в отделении ядерной медицины в условиях асептики.
Введение радиофармацевтических препаратов создает риски внешнего радиационного загрязнения мочой, рвотными массами Должны соблюдаться меры предосторожности при работе с радиоактивными материалами, а также условия асептики при работе с препаратом. Готовый препарат хранят в соответствии с национальными правилами по обеспечению радиационной безопасности. Любой неиспользованный радиоактивный материал утилизируют в соответствии с действующим законодательством.
Перед применением препарата, для подтверждения качества, необходимо провести определение радиохимической чистоты препарата по следующей методике:
Определение радиохимической чистоты.
В приготовленном растворе эксаметазима для инъекций могут присутствовать три потенциальные примеси. Это вторичный комплекс 99mTc‑эксаметазима, свободный пертехнетат и восстановленный-гидролизованный 99mTc. Для полного определения радиохимической чистоты раствора препарата необходимо использовать две хроматографические системы: бутан‑2‑он (МЭК) и 0,9% раствор натрия хлорида.
Пробы испытуемого раствора наносят иглой примерно в 2,5 см от нижнего края двух хроматографических полосок Varian SA (2 см (± 2 мм) × 20 см). После чего полоски сразу помещают в приготовленные хроматографические камеры, которые содержат свежий растворитель с толщиной слоя 1 для проведения восходящей хроматографии. После перемещения фронта растворителя на 14 см от старта, полоски вынимают из хроматографической камеры, высушивают и с использованием соответствующего оборудования определяют радиоактивность.
Результаты хроматографирования.
Система 1 (Varian SА: бутан‑2‑он (МЭК).
Вторичный комплекс 99mTc‑эксаметазима и восстановленный-гидролизованный 99mTc остаются на линии нанесения проб.
Липофильный комплекс 99mTc‑эксаметазима и пертехнетат перемещаются с фронтом (Rf 0,8-1,0).
Система 2 (Varian SA: 0,9% натрия хлорид).
Липофильный комплекс 99mTc‑эксаметазима, вторичный комплекс 99mTc‑эксаметазим и восстановленный-гидролизованный 99mTc остаются на старте.
Пертехнетат перемещается с Rf 0,8-1,0.
Рассчитать активность (%), обусловленную комплексом 99mTc‑эксаметазима и восстановленным-гидролизованным 99mTc по хроматограммам Системы 1 (А%). Рассчитать активность (%), обусловленную пертехнетатом по хроматограммам Системы 2 (В%).
Радиохимическая чистота (как процент липофильного комплекса 99mTc‑эксаметазима) определяется следующим образом: 100 - (А% + В%), где:
-.
А% - уровень вторичного комплекса 99mTc‑эксаметазима и восстановленного-гидролизованного 99mTc;
В% - уровень пертехнетата.
При отборе проб для проведения теста в течение 30 минут после приготовления раствора препарата можно ожидать, что радиохимическая чистота составит не менее 80%. Тест по определению радиохимической чистоты следует проводить сразу после отбора проб.
Методика выделения лейкоцитов и последующее их меченые in vitro 99mTc‑эксаметазимом.
Все операции проводить с соблюдением методов асептики.
1. В два 60 мл пластиковых негепаринизированных шприца набрать по 9 мл смеси, состоящей из раствора лимонной кислоты-цитрата декстрозы ( см.
«Примечания»).
2.
В каждый из шприцев, используя иглу‑бабочку (19G), отобрать по 51 мл крови пациента.
Закрыть шприцы стерильными наконечниками.
3.
Подготовить 5 универсальных пробирок и внести в них по 2 мл раствора гидроксиэтилкрахмала.
4. Не вставляя иглу в шприц, перенести из шприцев по 20 мл крови в каждую из 5 универсальных пробирок, содержащих гидроксиэтилкрахмал. Оставшиеся 20 мл крови перенести в пробирку, не содержащую гидроксиэтилкрахмал.
Рекомендация:
Для предупреждения образования пузырьков и вспенивания кровь осторожно сливать по стенкам пробирок.
5. Аккуратно перемешать кровь и гидроксиэтилкрахмал однократным переворачиванием пробирки.
Снять крышку с универсальной пробирки и удалить образовавшиеся пузырьки воздуха с помощью стерильной иглы. Надеть крышку и дать пробиркам отстояться в течение 30-60 минут для оседания эритроцитов.
Скорость оседания эритроцитов зависит от состояния здоровья пациента. Процесс можно считать завершенным, когда эритроциты осядут минимум на половину всего объема пробирки.
6. Параллельно, вторую пробирку, свободную от гидроксиэтилкрахмала и содержащую 20 мл цельной крови, центрифугируют при 2000 g в течение 10 минут.
Полученный супернатант содержит свободную от клеток плазму и раствор лимонной кислоты-цитрата декстрозы и хранится при комнатной температуре. Супернатант используют в качестве среды при мечении лейкоцитов.
7. После завершения процесса осаждения эритроцитов в первой пробирке осторожно, не допуская попадания эритроцитов, перенести 15 мл надосадочной жидкости (мутная жидкость бледно-желтого цвета), состоящей из плазмы с лейкоцитами и тромбоцитами, в чистые универсальные пробирки.
При отборе проб не следует пользоваться иглой во избежание случайного повреждения клеток.
8. Полученную надосадочную жидкость центрифугировать при 150 g в течение 5 минут для получения супернатанта, состоящего из плазмы с тромбоцитами, и осадка -.
«смеси» лейкоцитов.
9.
Максимально возможное количество супернатанта перенести в чистые универсальные пробирки и центрифугировать при 2000 g в течение 10 минут для получения дополнительной надосадочной жидкости, свободной от клеток плазмы. Полученная надосадочная жидкость содержит гидроксиэтилкрахмал и будет использована для промывания клеток после введения в них метки.
10. Параллельно, осторожно постукивая и вращая пробирку, отделить от стенок осадок, представляющий собой «смесь» лейкоцитов. Шприцем без иглы, поместить клетки в одну пробирку и, используя тот же шприц, добавить 1 мл супернатанта, полученного в пункте 6. Осторожно вращая пробирку, ресуспендировать клетки.
11. Используя методику, изложенную в пункте «Приготовление препарата», подготовить раствор 99mTc‑эксаметазима, путем добавления из генератора 99mTc 5 мл элюата с содержанием 99mTcO4.
500 МБк (13,5 мКи).
12. Немедленно.
Добавить 4 мл приготовленного раствора 99mTc‑эксаметазима в «смесь» лейкоцитов и супернатанта ( см пункт 10).
13. Осторожно.
Вращая пробирку, перемешать содержимое и оставить на 10 минут при комнатной температуре.
14. При необходимости немедленно нанести пробы на хроматографические полоски для проведения оценки радиохимической чистоты 99mTc‑эксаметазима в соответствии с инструкциями, изложенными в пункте «Определение радиохимической чистоты».
15. Для того чтобы остановить процесс введения меток в клетки, по окончании 10 минут в пробирку осторожно.
Добавить 10 мл надосадочной жидкости ( см пункт 9), свободной от клеток и содержащей гидроксиэтилкрахмал. Осторожным вращательным движением перемешать содержимое пробирки.
16. Центрифугировать при 150 g в течение 5 минут.
17. Отобрать и сохранить надосадочную жидкость.
Необходимо, чтобы на этой стадии вся надосадочная жидкость, содержащая несвязанный 99mTc‑эксаметазим, была максимально полностью отобрана из пробирки, для чего используют иглу с широким каналом.
18. Осторожно вращая для перемешивания, ресуспендировать смесь лейкоцитов, меченую 99mTc, в 5-10 мл супернатанта, полученного в пункте 6.
19. Измерить радиоактивности клеток и надосадочной жидкости из пункта 17. Рассчитать эффективность процесса внесения метки в процентах, которая определяется как отношение активности в клетках к сумме активностей в клетках и надосадочной жидкости.
Эффективность процесса внесения метки зависит от количества лейкоцитов у больного и колеблется в зависимости от объема пробы отобранной крови. При использовании объемов, указанных в пункте 2, предполагаемая эффективность процесса внесения метки [LE] составит около 55%.
20. Шприцем без иглы осторожно отобрать меченые клетки в пластиковый, негепаринизированный шприц и закрыть его стерильным колпачком. Измерить радиоактивность.
21. После этого меченые клетки готовы к введению, которое следует провести без промедления.
Примечания:
Для приготовления 1 л смеси раствора лимонной кислоты-цитрата декстрозы, следует перенести 22 г тринатрия цитрата, 8 г лимонной кислоты, 22,4 г декстрозы в градуированную колбу и довести объем водой для инъекций до 1,0 литра. Все операции проводить с соблюдением методов асептики.
Стерилизовать путем фильтрования через Миллипоровский фильтр (0,2 мкм).
Хранить при комнатной температуре. Допускается использование готового промышленного раствора, который необходимо хранить в соответствии с рекомендуемыми производителем условиями и использовать до истечения срока годности.
Приготовление 6% гидроксиэтилкрахмала также следует проводить с соблюдением методов асептики.
Допускается использование готового промышленного раствора, который необходимо хранить в соответствии с рекомендуемыми производителем условиями и использовать до истечения срока годности.
Важно, чтобы меченые лейкоциты тщательно отмывались перед введением их пациенту.
Влияние на способность к вождению транспортных средств и работу с машинами и механизмами.
Не установлено влияние использования препарата на способность управлять транспортными средствами, а также машинами и механизмами при применении его в соответствии с инструкцией по медицинскому применению.
Применение препарата может вызвать реакции повышенной чувствительности, включая анафилаксию. На случай их возникновения необходимо иметь в наличии необходимые препараты и оборудование для оказания немедленной медицинской помощи.
Препарат должен готовиться и применяться только квалифицированным персоналом в отделении ядерной медицины в условиях асептики.
Введение радиофармацевтических препаратов создает риски внешнего радиационного загрязнения мочой, рвотными массами Должны соблюдаться меры предосторожности при работе с радиоактивными материалами, а также условия асептики при работе с препаратом. Готовый препарат хранят в соответствии с национальными правилами по обеспечению радиационной безопасности. Любой неиспользованный радиоактивный материал утилизируют в соответствии с действующим законодательством.
Перед применением препарата, для подтверждения качества, необходимо провести определение радиохимической чистоты препарата по следующей методике:
Определение радиохимической чистоты.
В приготовленном растворе эксаметазима для инъекций могут присутствовать три потенциальные примеси. Это вторичный комплекс 99mTc‑эксаметазима, свободный пертехнетат и восстановленный-гидролизованный 99mTc. Для полного определения радиохимической чистоты раствора препарата необходимо использовать две хроматографические системы: бутан‑2‑он (МЭК) и 0,9% раствор натрия хлорида.
Пробы испытуемого раствора наносят иглой примерно в 2,5 см от нижнего края двух хроматографических полосок Varian SA (2 см (± 2 мм) × 20 см). После чего полоски сразу помещают в приготовленные хроматографические камеры, которые содержат свежий растворитель с толщиной слоя 1 для проведения восходящей хроматографии. После перемещения фронта растворителя на 14 см от старта, полоски вынимают из хроматографической камеры, высушивают и с использованием соответствующего оборудования определяют радиоактивность.
Результаты хроматографирования.
Система 1 (Varian SА: бутан‑2‑он (МЭК).
Вторичный комплекс 99mTc‑эксаметазима и восстановленный-гидролизованный 99mTc остаются на линии нанесения проб.
Липофильный комплекс 99mTc‑эксаметазима и пертехнетат перемещаются с фронтом (Rf 0,8-1,0).
Система 2 (Varian SA: 0,9% натрия хлорид).
Липофильный комплекс 99mTc‑эксаметазима, вторичный комплекс 99mTc‑эксаметазим и восстановленный-гидролизованный 99mTc остаются на старте.
Пертехнетат перемещается с Rf 0,8-1,0.
Рассчитать активность (%), обусловленную комплексом 99mTc‑эксаметазима и восстановленным-гидролизованным 99mTc по хроматограммам Системы 1 (А%). Рассчитать активность (%), обусловленную пертехнетатом по хроматограммам Системы 2 (В%).
Радиохимическая чистота (как процент липофильного комплекса 99mTc‑эксаметазима) определяется следующим образом: 100 - (А% + В%), где:
-.
А% - уровень вторичного комплекса 99mTc‑эксаметазима и восстановленного-гидролизованного 99mTc;
В% - уровень пертехнетата.
При отборе проб для проведения теста в течение 30 минут после приготовления раствора препарата можно ожидать, что радиохимическая чистота составит не менее 80%. Тест по определению радиохимической чистоты следует проводить сразу после отбора проб.
Методика выделения лейкоцитов и последующее их меченые in vitro 99mTc‑эксаметазимом.
Все операции проводить с соблюдением методов асептики.
1. В два 60 мл пластиковых негепаринизированных шприца набрать по 9 мл смеси, состоящей из раствора лимонной кислоты-цитрата декстрозы ( см.
«Примечания»).
2.
В каждый из шприцев, используя иглу‑бабочку (19G), отобрать по 51 мл крови пациента.
Закрыть шприцы стерильными наконечниками.
3.
Подготовить 5 универсальных пробирок и внести в них по 2 мл раствора гидроксиэтилкрахмала.
4. Не вставляя иглу в шприц, перенести из шприцев по 20 мл крови в каждую из 5 универсальных пробирок, содержащих гидроксиэтилкрахмал. Оставшиеся 20 мл крови перенести в пробирку, не содержащую гидроксиэтилкрахмал.
Рекомендация:
Для предупреждения образования пузырьков и вспенивания кровь осторожно сливать по стенкам пробирок.
5. Аккуратно перемешать кровь и гидроксиэтилкрахмал однократным переворачиванием пробирки.
Снять крышку с универсальной пробирки и удалить образовавшиеся пузырьки воздуха с помощью стерильной иглы. Надеть крышку и дать пробиркам отстояться в течение 30-60 минут для оседания эритроцитов.
Скорость оседания эритроцитов зависит от состояния здоровья пациента. Процесс можно считать завершенным, когда эритроциты осядут минимум на половину всего объема пробирки.
6. Параллельно, вторую пробирку, свободную от гидроксиэтилкрахмала и содержащую 20 мл цельной крови, центрифугируют при 2000 g в течение 10 минут.
Полученный супернатант содержит свободную от клеток плазму и раствор лимонной кислоты-цитрата декстрозы и хранится при комнатной температуре. Супернатант используют в качестве среды при мечении лейкоцитов.
7. После завершения процесса осаждения эритроцитов в первой пробирке осторожно, не допуская попадания эритроцитов, перенести 15 мл надосадочной жидкости (мутная жидкость бледно-желтого цвета), состоящей из плазмы с лейкоцитами и тромбоцитами, в чистые универсальные пробирки.
При отборе проб не следует пользоваться иглой во избежание случайного повреждения клеток.
8. Полученную надосадочную жидкость центрифугировать при 150 g в течение 5 минут для получения супернатанта, состоящего из плазмы с тромбоцитами, и осадка -.
«смеси» лейкоцитов.
9.
Максимально возможное количество супернатанта перенести в чистые универсальные пробирки и центрифугировать при 2000 g в течение 10 минут для получения дополнительной надосадочной жидкости, свободной от клеток плазмы. Полученная надосадочная жидкость содержит гидроксиэтилкрахмал и будет использована для промывания клеток после введения в них метки.
10. Параллельно, осторожно постукивая и вращая пробирку, отделить от стенок осадок, представляющий собой «смесь» лейкоцитов. Шприцем без иглы, поместить клетки в одну пробирку и, используя тот же шприц, добавить 1 мл супернатанта, полученного в пункте 6. Осторожно вращая пробирку, ресуспендировать клетки.
11. Используя методику, изложенную в пункте «Приготовление препарата», подготовить раствор 99mTc‑эксаметазима, путем добавления из генератора 99mTc 5 мл элюата с содержанием 99mTcO4.
500 МБк (13,5 мКи).
12. Немедленно.
Добавить 4 мл приготовленного раствора 99mTc‑эксаметазима в «смесь» лейкоцитов и супернатанта ( см пункт 10).
13. Осторожно.
Вращая пробирку, перемешать содержимое и оставить на 10 минут при комнатной температуре.
14. При необходимости немедленно нанести пробы на хроматографические полоски для проведения оценки радиохимической чистоты 99mTc‑эксаметазима в соответствии с инструкциями, изложенными в пункте «Определение радиохимической чистоты».
15. Для того чтобы остановить процесс введения меток в клетки, по окончании 10 минут в пробирку осторожно.
Добавить 10 мл надосадочной жидкости ( см пункт 9), свободной от клеток и содержащей гидроксиэтилкрахмал. Осторожным вращательным движением перемешать содержимое пробирки.
16. Центрифугировать при 150 g в течение 5 минут.
17. Отобрать и сохранить надосадочную жидкость.
Необходимо, чтобы на этой стадии вся надосадочная жидкость, содержащая несвязанный 99mTc‑эксаметазим, была максимально полностью отобрана из пробирки, для чего используют иглу с широким каналом.
18. Осторожно вращая для перемешивания, ресуспендировать смесь лейкоцитов, меченую 99mTc, в 5-10 мл супернатанта, полученного в пункте 6.
19. Измерить радиоактивности клеток и надосадочной жидкости из пункта 17. Рассчитать эффективность процесса внесения метки в процентах, которая определяется как отношение активности в клетках к сумме активностей в клетках и надосадочной жидкости.
Эффективность процесса внесения метки зависит от количества лейкоцитов у больного и колеблется в зависимости от объема пробы отобранной крови. При использовании объемов, указанных в пункте 2, предполагаемая эффективность процесса внесения метки [LE] составит около 55%.
20. Шприцем без иглы осторожно отобрать меченые клетки в пластиковый, негепаринизированный шприц и закрыть его стерильным колпачком. Измерить радиоактивность.
21. После этого меченые клетки готовы к введению, которое следует провести без промедления.
Примечания:
Для приготовления 1 л смеси раствора лимонной кислоты-цитрата декстрозы, следует перенести 22 г тринатрия цитрата, 8 г лимонной кислоты, 22,4 г декстрозы в градуированную колбу и довести объем водой для инъекций до 1,0 литра. Все операции проводить с соблюдением методов асептики.
Стерилизовать путем фильтрования через Миллипоровский фильтр (0,2 мкм).
Хранить при комнатной температуре. Допускается использование готового промышленного раствора, который необходимо хранить в соответствии с рекомендуемыми производителем условиями и использовать до истечения срока годности.
Приготовление 6% гидроксиэтилкрахмала также следует проводить с соблюдением методов асептики.
Допускается использование готового промышленного раствора, который необходимо хранить в соответствии с рекомендуемыми производителем условиями и использовать до истечения срока годности.
Важно, чтобы меченые лейкоциты тщательно отмывались перед введением их пациенту.
Влияние на способность к вождению транспортных средств и работу с машинами и механизмами.
Не установлено влияние использования препарата на способность управлять транспортными средствами, а также машинами и механизмами при применении его в соответствии с инструкцией по медицинскому применению.
|
|
Дополнительные факты
Описание было автоматически дополнено из инструкции препарата «Церетек», поскольку у самого действующего вещества нет подробного описания.
Год актуализации информации
Особые отметки:
Входит в состав
- — Теоксим, 99mТс (Диамед )
- — Церетек (2 фирмы)