МКБ-10 коды
- МКБ-10
- E10.7 Инсулинзависимый сахарный диабет с множественными осложнениями
- E10 Инсулинозависимый сахарный диабет
- E10.9 Инсулинзависимый сахарный диабет без осложнений
- E10.8 Инсулинзависимый сахарный диабет с неуточненными осложнениями
- E10.1 Инсулинзависимый сахарный диабет с кетоацидозом
- E10.4 Инсулинзависимый сахарный диабет с неврологическими осложнениями
- E10.5 Инсулинзависимый сахарный диабет с нарушениями периферического кровообращения
- E10.6 Инсулинзависимый сахарный диабет с другими уточненными осложнениями
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: E10.1, E10.2, E10.3, E10.4, E10.5, E10.6, E10.7, E10.8, E10.9.
Год утверждения (частота пересмотра): 2022.
Возрастная категория: Дети.
Пересмотр не позднее: 2024.
ID: 287.
Разработчик клинической рекомендации.
• Российская ассоциация эндокринологов.
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2022.
Возрастная категория: Дети.
Пересмотр не позднее: 2024.
ID: 287.
Разработчик клинической рекомендации.
• Российская ассоциация эндокринологов.
Одобрено Научно-практическим Советом Минздрава РФ.
|
|
 Список сокращений
Список сокращений
GADA - Glutamic Acid Decarboxylase Autoantibodies (аутоантитела к глутаматдекарбоксилазе).
IAA - Insulin Autoantibodies (аутоантитела к инсулину).
IA-2 - Insulinoma-Associated-2 Autoantibodies (аутоантитела к тирозинфосфотазе).
ICA - Islet сell сytoplasmic Autoantibodies (аутоантитела к структурам островковых клеток).
HbA1c - гликированный гемоглобин.
HLA - Human Leukocyte Antigens (человеческий лейкоцитарный антиген).
ZnT8A - Zinc Transporter 8 (аутоантитела к транспортеру цинка 8).
АГ - артериальная гипертензия.
АД - артериальное давление.
АПФ - ангиотензинпревращающий фермент.
АТ - антитела.
АТХ - анатомо-терапевтическо-химическая классификация.
ВРС - вариабельность ритма сердца.
ГК - глюкоза крови.
ДЗН - диск зрительного нерва.
ДКА - диабетический кетоацидоз.
ДМО - диабетический макулярный отек.
ДНК - дезоксирибонуклеиновая кислота.
ДН - диабетическая нефропатия.
ДПП - диабетическая периферическая полинейропатия.
ДР - диабетическая ретинопатия.
ИМТ - индекс массы тела.
ИДД - инсулин длительного действия (инсулины длительного действия и их.
Аналоги для инъекционного введения).
ИКД - инсулин короткого действия (инсулины короткого действия и их.
Аналоги для инъекционного введения).
ИСБД - инсулин сверхбыстрого действия (инсулины короткого действия и их аналоги для инъекционного введения).
ИСДД - инсулин сверхдлительного действия (инсулины длительного действия и их.
Аналоги для инъекционного введения).
ИУКД - инсулин ультракороткого действия (инсулины короткого действия и их.
Аналоги для инъекционного введения).
КАН - кардиоваскулярная форма автономной нейропатии.
ЛПВП - липопротеины высокой плотности.
ЛПНП - липопротеины низкой плотности.
МИИ - множественные инъекции инсулина.
МКБ 10 - международная классификация болезней 10-го пересмотра.
МНН - международное непатентованное наименование.
НМГ - непрерывное мониторирование глюкозы.
НПИИ - непрерывная подкожная инфузия инсулина.
НПХ - нейтральный протамин Хагедорна.
НСД - неонатальный сахарный диабет.
ПГТТ - пероральный глюкозотолерантный тест.
РСКФ - расчетная скорость клубочковой фильтрации.
СД - сахарный диабет.
СД1 - сахарный диабет 1 типа.
СД2 - сахарный диабет 2 типа.
СКФ - скорость клубочковой фильтрации.
УДД - уровень достоверности доказательств.
УУР - уровень убедительности рекомендаций.
ФМГ - флеш-мониторирование глюкозы.
ЧСС - частота сердечных сокращений.
ХБП - хроническая болезнь почек.
ХЕ - хлебная единица.
ЭКГ - электрокардиография.
** - препарат входит в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения.
*** - входит в перечень медицинских изделий при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи.
- лекарственный препарат для медицинского применения, используемый в несоответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата.
IAA - Insulin Autoantibodies (аутоантитела к инсулину).
IA-2 - Insulinoma-Associated-2 Autoantibodies (аутоантитела к тирозинфосфотазе).
ICA - Islet сell сytoplasmic Autoantibodies (аутоантитела к структурам островковых клеток).
HbA1c - гликированный гемоглобин.
HLA - Human Leukocyte Antigens (человеческий лейкоцитарный антиген).
ZnT8A - Zinc Transporter 8 (аутоантитела к транспортеру цинка 8).
АГ - артериальная гипертензия.
АД - артериальное давление.
АПФ - ангиотензинпревращающий фермент.
АТ - антитела.
АТХ - анатомо-терапевтическо-химическая классификация.
ВРС - вариабельность ритма сердца.
ГК - глюкоза крови.
ДЗН - диск зрительного нерва.
ДКА - диабетический кетоацидоз.
ДМО - диабетический макулярный отек.
ДНК - дезоксирибонуклеиновая кислота.
ДН - диабетическая нефропатия.
ДПП - диабетическая периферическая полинейропатия.
ДР - диабетическая ретинопатия.
ИМТ - индекс массы тела.
ИДД - инсулин длительного действия (инсулины длительного действия и их.
Аналоги для инъекционного введения).
ИКД - инсулин короткого действия (инсулины короткого действия и их.
Аналоги для инъекционного введения).
ИСБД - инсулин сверхбыстрого действия (инсулины короткого действия и их аналоги для инъекционного введения).
ИСДД - инсулин сверхдлительного действия (инсулины длительного действия и их.
Аналоги для инъекционного введения).
ИУКД - инсулин ультракороткого действия (инсулины короткого действия и их.
Аналоги для инъекционного введения).
КАН - кардиоваскулярная форма автономной нейропатии.
ЛПВП - липопротеины высокой плотности.
ЛПНП - липопротеины низкой плотности.
МИИ - множественные инъекции инсулина.
МКБ 10 - международная классификация болезней 10-го пересмотра.
МНН - международное непатентованное наименование.
НМГ - непрерывное мониторирование глюкозы.
НПИИ - непрерывная подкожная инфузия инсулина.
НПХ - нейтральный протамин Хагедорна.
НСД - неонатальный сахарный диабет.
ПГТТ - пероральный глюкозотолерантный тест.
РСКФ - расчетная скорость клубочковой фильтрации.
СД - сахарный диабет.
СД1 - сахарный диабет 1 типа.
СД2 - сахарный диабет 2 типа.
СКФ - скорость клубочковой фильтрации.
УДД - уровень достоверности доказательств.
УУР - уровень убедительности рекомендаций.
ФМГ - флеш-мониторирование глюкозы.
ЧСС - частота сердечных сокращений.
ХБП - хроническая болезнь почек.
ХЕ - хлебная единица.
ЭКГ - электрокардиография.
** - препарат входит в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения.
*** - входит в перечень медицинских изделий при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи.
- лекарственный препарат для медицинского применения, используемый в несоответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата.
Термины и определения
С-пептид. Полипептид, состоящий из 31 аминокислоты и образующийся при расщеплении проинсулина пептидазами.
Аутоиммунитет. Появление антител в организме против собственных структур и тканей.
Аналоги инсулина. Это форма инсулина, в которой произведены некоторые изменения в молекуле человеческого инсулина. Аналог действует так же, как инсулин, но с фармакокинетическими / фармакодинамическими различиями, которые могут давать преимущества.
Базальный режим инсулинотерапии -введение инсулина помпой*** в автоматическом режиме с заданной пользователем скоростью (постоянной или изменяющейся в течение суток) или введение пролонгированного инсулина.
Болюсы инсулина. Дискретно вводимые пользователем инсулиновой помпы дозы инсулина, необходимые для поддержания гликемии после еды и для коррекции гипергликемии.
Вариабельность гликемии. Показатель частоты, продолжительности и амплитуды изменений уровня глюкозы в крови за определенный период времени.
Гипергликемия. Уровень глюкозы в крови выше нормальных значений.
Гипогликемия. Уровень глюкозы в крови ниже нормальных значений.
Гликемия. Концентрация глюкозы в крови.
Гликированный гемоглобин. Показатель, который отражает средний уровень глюкозы в крови за последние 2-3 месяца.
Дислипидемия. Нарушение физиологического соотношения липидов крови в виде повышения уровня триглицеридов и липопротеидов низкой плотности, снижения уровня липопротеидов высокой плотности.
Инсулин. Гормон, в физиологических условиях секретируемый бета-клетками поджелудочной железы и регулирующий уровень глюкозы в крови, стимулируя поглощение глюкозы тканями.
Инсулиновая помпа***. Устройство для непрерывной подкожной инфузии инсулина.
Инфузионная система. Одноразовый комплект медицинских изделий, через который осуществляется инфузия инсулина, состоящий из резервуара для инсулина, устанавливаемой подкожно канюли (тефлоновой или стальной), а также катетера, связывающего резервуар и канюлю.
Калькулятор болюса. Математический алгоритм, позволяющий инсулиновой помпе*** рассчитать дозу болюса на еду и/или коррекцию гликемии, исходя из введенных пользователем показателей (количество углеводов в пище, гликемия) и на основе предустановленных индивидуальных коэффициентов (углеводный коэффициент, чувствительность к инсулину, целевая гликемия, время действия инсулина ).
Липодистрофия. Патологическое изменение жировой ткани в местах инъекций инсулина.
Помповая инсулинотерапия. Способ инсулинотерапии, осуществляемый путём непрерывной подкожной инфузии инсулина с помощью инсулиновой помпы***.
Прандиальный инсулин -инсулин короткого действия, вводимый на прием пищи.
Самоконтроль гликемии. Самостоятельное определение глюкозы крови пациентами в домашних условиях с помощью глюкометра или система непрерывного мониторирования глюкозы.
Хлебная единица. Количество продукта, содержащего 10-12 граммов углеводов.
Шприц-ручка -устройство для инъекций инсулина.
Аутоиммунитет. Появление антител в организме против собственных структур и тканей.
Аналоги инсулина. Это форма инсулина, в которой произведены некоторые изменения в молекуле человеческого инсулина. Аналог действует так же, как инсулин, но с фармакокинетическими / фармакодинамическими различиями, которые могут давать преимущества.
Базальный режим инсулинотерапии -введение инсулина помпой*** в автоматическом режиме с заданной пользователем скоростью (постоянной или изменяющейся в течение суток) или введение пролонгированного инсулина.
Болюсы инсулина. Дискретно вводимые пользователем инсулиновой помпы дозы инсулина, необходимые для поддержания гликемии после еды и для коррекции гипергликемии.
Вариабельность гликемии. Показатель частоты, продолжительности и амплитуды изменений уровня глюкозы в крови за определенный период времени.
Гипергликемия. Уровень глюкозы в крови выше нормальных значений.
Гипогликемия. Уровень глюкозы в крови ниже нормальных значений.
Гликемия. Концентрация глюкозы в крови.
Гликированный гемоглобин. Показатель, который отражает средний уровень глюкозы в крови за последние 2-3 месяца.
Дислипидемия. Нарушение физиологического соотношения липидов крови в виде повышения уровня триглицеридов и липопротеидов низкой плотности, снижения уровня липопротеидов высокой плотности.
Инсулин. Гормон, в физиологических условиях секретируемый бета-клетками поджелудочной железы и регулирующий уровень глюкозы в крови, стимулируя поглощение глюкозы тканями.
Инсулиновая помпа***. Устройство для непрерывной подкожной инфузии инсулина.
Инфузионная система. Одноразовый комплект медицинских изделий, через который осуществляется инфузия инсулина, состоящий из резервуара для инсулина, устанавливаемой подкожно канюли (тефлоновой или стальной), а также катетера, связывающего резервуар и канюлю.
Калькулятор болюса. Математический алгоритм, позволяющий инсулиновой помпе*** рассчитать дозу болюса на еду и/или коррекцию гликемии, исходя из введенных пользователем показателей (количество углеводов в пище, гликемия) и на основе предустановленных индивидуальных коэффициентов (углеводный коэффициент, чувствительность к инсулину, целевая гликемия, время действия инсулина ).
Липодистрофия. Патологическое изменение жировой ткани в местах инъекций инсулина.
Помповая инсулинотерапия. Способ инсулинотерапии, осуществляемый путём непрерывной подкожной инфузии инсулина с помощью инсулиновой помпы***.
Прандиальный инсулин -инсулин короткого действия, вводимый на прием пищи.
Самоконтроль гликемии. Самостоятельное определение глюкозы крови пациентами в домашних условиях с помощью глюкометра или система непрерывного мониторирования глюкозы.
Хлебная единица. Количество продукта, содержащего 10-12 граммов углеводов.
Шприц-ручка -устройство для инъекций инсулина.
|
|
Описание
Сахарный диабет (СД) - это большая группа сложных метаболических заболеваний, которая характеризуется хронической гипергликемией, обусловленной нарушением секреции или действия инсулина, или сочетанием этих нарушений. Нарушение секреции инсулина и/или снижение реакции тканей на инсулин в составе сложных гормональных процессов приводят к нарушению воздействия инсулина на ткани-мишени, что, в свою очередь, вызывает нарушения углеводного, жирового и белкового обмена. У одного и того же пациента могут одновременно наблюдаться нарушение секреции инсулина и нарушение его действия [1].
СД 1 типа (СД1) - заболевание, возникающее в результате аутоиммунной деструкции инсулинпродуцирующих β-клеток поджелудочной железы, с последующем развитием абсолютной инсулиновой недостаточности.
СД 1 типа (СД1) - заболевание, возникающее в результате аутоиммунной деструкции инсулинпродуцирующих β-клеток поджелудочной железы, с последующем развитием абсолютной инсулиновой недостаточности.
Причины
СД1 характеризуется хронической, иммуноопосредованной деструкцией β-клеток островков поджелудочной железы, которая приводит, в большинстве случаев, к абсолютному дефициту инсулина. Разрушение β-клеток происходит с различной скоростью и становится клинически значимым при разрушении примерно 90% β-клеток.
СД1 является многофакторным заболеванием, однако конкретные механизмы взаимодействия генетической предрасположенности, факторов окружающей среды, состояния иммунной системы, лежащие в основе СД1, остаются неясными.
Аутоиммунное разрушение β-клеток - сложный, многоэтапный процесс, в ходе которого активируется как клеточное, так и гуморальное звено иммунитета. Первыми инфильтрируют островки Лангерганса моноциты и макрофаги, которые выделяют провоспалительные цитокины (ИЛ-1, ИЛ-6, ФНО-α) и свободные радикалы кислорода, оксида азота, гидроксильные радикалы. Цитокины индуцируют апоптоз - запрограммированную гибель трансформированных или здоровых клеток. Оксид азота и другие радикалы повреждают дезоксирибонуклеиновую кислоту (ДНК) β-клеток. Учитывая низкую антиоксидантную ферментную защиту β-клеток, свободные радикалы вызывают денатурацию белков с деструкцией β-клеток. Активируемые провоспалительными цитокинами Т-лимфоциты распознают денатурированные белки и другие продукты разрушения β-клеток в качестве антигенов и включаются в процесс развития инсулита.
Ассоциированные с СД1 аутоантитела (АТ) являются серологическими маркерами аутоиммунной деструкции β-клеток. К ним относятся АТ к глютаматдекарбоксилазе (GADA), к тирозинфосфатазе (IA2), к инсулину (IAA) и к транспортеру цинка 8 (ZnT8A). Имеется возрастная диссоциация в появлении этих АТ: IAA и GADA чаще экспрессируются у детей в возрасте до 10 лет, в то время как IA2 и ZnT8A - в более старшем возрасте. Значение определения антител против островковых (ICA) как в прогнозировании СД1, так и в дифференциальной диагностике с другими типами СД, с появлением более сильных маркеров, снизилось.
Подверженность развитию аутоиммунного СД1 определяется множеством генов: полногеномный поиск ассоциаций позволил выявить более 60 локусов, участвующих в развитии СД1. При этом на долю главного комплекса гистосовместимости (HLA) приходится около 50% всех участвующих генетических систем. В РФ наиболее сильными предрасполагающими гаплотипами HLA-DR и DQ генов являются: 04-0301-0302, 04-0301-0304, гаплотипами среднего риска - 17(03)-0501-0201, 01-0101-0501, 16-0102-0502/4, защитными - 13-0103-0602/8, 11-0501-0301, 15-0102-0602/8. Существуют этнические различия, в том числе на территории РФ. С ростом заболеваемости СД1 в ряде стран наблюдается уменьшение относительного вклада в развитие СД1 наиболее сильных генотипов HLA, что свидетельствует об увеличении роли факторов внешней среды.
Среди других генов самый высокий вклад в формирование подверженности к СД1 вносят гены INS, PTPN22 и IL2RA. Все они участвуют в формировании аутоиммунитета в отношении панкреатических β-клеток.
Экологические триггеры (инфекционные, алиментарные или химические), инициирующие разрушение β-клеток, остаются неизвестными. Имеются сообщения, что энтеровирусная инфекция, перенесенная во время беременности либо на протяжении жизни, особенно когда заражение происходит в раннем детстве, ассоциирована с появлением островкового аутоиммунитета и СД1.
Результаты проспективных исследований у лиц с повышенным риском развития СД1 показали, что заболевание представляет собой неразрывный процесс, который последовательно прогрессирует через различные идентифицируемые стадии до появления клинических симптомов, что позволило выделить несколько стадий СД1 [2]:
Стадия 1: Аутоиммунный процесс/Нормогликемия/Отсутствие клинических проявлений. Первая стадия характеризуется наличием признаков β-клеточного аутоиммунного процесса, определяемого по наличию двух или более положительных титров аутоанитител. При этом показатели гликемии не превышают норму, а клинические проявления СД отсутствуют. Длительность первой стадии может составлять месяцы или годы. В проспективных исследованиях, у детей из групп высокого риска развития СД1, 5-летний и 10-летний риск симптоматического заболевания составляет приблизительно 44% и 70%, соответственно [3].
Стадия 2: Аутоиммунный процесс/Дисгликемия/Отсутствие клинических проявлений. На второй стадии СД1 к признакам β-клеточного аутоиммунного процесса, определяемого по наличию двух или более положительных титров аутоанитител присоединяются нарушения углеводного обмена. На этой стадии 5-летний риск развития клинического СД1 составляет примерно 75%, а риск на протяжении жизни приближается к 100% [3].
Стадия 3: Аутоиммунный процесс/Дисгликемия/Клинический СД1. Третья стадия представляет собой манифестацию СД1 с классической клинической картиной, которая может включать полиурию, полидипсию, потерю массы тела.
Примерно у 80% детей с СД1 вскоре после начала инсулинотерапии наблюдается частичная ремиссия СД1 или «медовый месяц», продолжительность которого составляет от нескольких недель до полугода, редко - в течение года и больше. Ремиссия СД является временной и не означает излечения СД1. Полная ремиссия - прекращение введения инсулина без ухудшения показателей гликемии. Частичная ремиссия - потребность в инсулине составляет менее 0,5 ЕД/кг массы тела, а концентрация гликированного гемоглобина (HbA1c) в крови менее 7%.
СД1 является многофакторным заболеванием, однако конкретные механизмы взаимодействия генетической предрасположенности, факторов окружающей среды, состояния иммунной системы, лежащие в основе СД1, остаются неясными.
Аутоиммунное разрушение β-клеток - сложный, многоэтапный процесс, в ходе которого активируется как клеточное, так и гуморальное звено иммунитета. Первыми инфильтрируют островки Лангерганса моноциты и макрофаги, которые выделяют провоспалительные цитокины (ИЛ-1, ИЛ-6, ФНО-α) и свободные радикалы кислорода, оксида азота, гидроксильные радикалы. Цитокины индуцируют апоптоз - запрограммированную гибель трансформированных или здоровых клеток. Оксид азота и другие радикалы повреждают дезоксирибонуклеиновую кислоту (ДНК) β-клеток. Учитывая низкую антиоксидантную ферментную защиту β-клеток, свободные радикалы вызывают денатурацию белков с деструкцией β-клеток. Активируемые провоспалительными цитокинами Т-лимфоциты распознают денатурированные белки и другие продукты разрушения β-клеток в качестве антигенов и включаются в процесс развития инсулита.
Ассоциированные с СД1 аутоантитела (АТ) являются серологическими маркерами аутоиммунной деструкции β-клеток. К ним относятся АТ к глютаматдекарбоксилазе (GADA), к тирозинфосфатазе (IA2), к инсулину (IAA) и к транспортеру цинка 8 (ZnT8A). Имеется возрастная диссоциация в появлении этих АТ: IAA и GADA чаще экспрессируются у детей в возрасте до 10 лет, в то время как IA2 и ZnT8A - в более старшем возрасте. Значение определения антител против островковых (ICA) как в прогнозировании СД1, так и в дифференциальной диагностике с другими типами СД, с появлением более сильных маркеров, снизилось.
Подверженность развитию аутоиммунного СД1 определяется множеством генов: полногеномный поиск ассоциаций позволил выявить более 60 локусов, участвующих в развитии СД1. При этом на долю главного комплекса гистосовместимости (HLA) приходится около 50% всех участвующих генетических систем. В РФ наиболее сильными предрасполагающими гаплотипами HLA-DR и DQ генов являются: 04-0301-0302, 04-0301-0304, гаплотипами среднего риска - 17(03)-0501-0201, 01-0101-0501, 16-0102-0502/4, защитными - 13-0103-0602/8, 11-0501-0301, 15-0102-0602/8. Существуют этнические различия, в том числе на территории РФ. С ростом заболеваемости СД1 в ряде стран наблюдается уменьшение относительного вклада в развитие СД1 наиболее сильных генотипов HLA, что свидетельствует об увеличении роли факторов внешней среды.
Среди других генов самый высокий вклад в формирование подверженности к СД1 вносят гены INS, PTPN22 и IL2RA. Все они участвуют в формировании аутоиммунитета в отношении панкреатических β-клеток.
Экологические триггеры (инфекционные, алиментарные или химические), инициирующие разрушение β-клеток, остаются неизвестными. Имеются сообщения, что энтеровирусная инфекция, перенесенная во время беременности либо на протяжении жизни, особенно когда заражение происходит в раннем детстве, ассоциирована с появлением островкового аутоиммунитета и СД1.
Результаты проспективных исследований у лиц с повышенным риском развития СД1 показали, что заболевание представляет собой неразрывный процесс, который последовательно прогрессирует через различные идентифицируемые стадии до появления клинических симптомов, что позволило выделить несколько стадий СД1 [2]:
Стадия 1: Аутоиммунный процесс/Нормогликемия/Отсутствие клинических проявлений. Первая стадия характеризуется наличием признаков β-клеточного аутоиммунного процесса, определяемого по наличию двух или более положительных титров аутоанитител. При этом показатели гликемии не превышают норму, а клинические проявления СД отсутствуют. Длительность первой стадии может составлять месяцы или годы. В проспективных исследованиях, у детей из групп высокого риска развития СД1, 5-летний и 10-летний риск симптоматического заболевания составляет приблизительно 44% и 70%, соответственно [3].
Стадия 2: Аутоиммунный процесс/Дисгликемия/Отсутствие клинических проявлений. На второй стадии СД1 к признакам β-клеточного аутоиммунного процесса, определяемого по наличию двух или более положительных титров аутоанитител присоединяются нарушения углеводного обмена. На этой стадии 5-летний риск развития клинического СД1 составляет примерно 75%, а риск на протяжении жизни приближается к 100% [3].
Стадия 3: Аутоиммунный процесс/Дисгликемия/Клинический СД1. Третья стадия представляет собой манифестацию СД1 с классической клинической картиной, которая может включать полиурию, полидипсию, потерю массы тела.
Примерно у 80% детей с СД1 вскоре после начала инсулинотерапии наблюдается частичная ремиссия СД1 или «медовый месяц», продолжительность которого составляет от нескольких недель до полугода, редко - в течение года и больше. Ремиссия СД является временной и не означает излечения СД1. Полная ремиссия - прекращение введения инсулина без ухудшения показателей гликемии. Частичная ремиссия - потребность в инсулине составляет менее 0,5 ЕД/кг массы тела, а концентрация гликированного гемоглобина (HbA1c) в крови менее 7%.
Эпидемиология
Согласно данным международной федерации сахарного диабета (IDF) на 2021 год, в мире общее число детей и подростков (до 19 лет) с СД1 составляет более 1,2 млн. человек из них более половины (54%) - дети до 15 лет. Заболеваемость СД1 растет с каждым годом и ежегодно заболевает более 108 тыс. детей в возрасте от 0 до 14 лет и более 41 тыс. подростков в возрасте от 15 до 19 лет [4].
В большинстве стран на долю СД1 у детей приходится до 90% всех случаев диабета, в то время как среди всех возрастов распространенность СД1 составляет от 5 до 10% [5].
Заболеваемость СД1 у детей значительно варьирует в различных странах [5]:
· самые высокие показатели (более 20 на 100 тыс. детского населения в год) отмечены в Скандинавских странах (Финляндия, Швеция, Норвегия) и Сардинии (Италия);
· средние (7-19 на 100 тыс. в год - в США, Новой Зеландии, Нидерландах, Испании;
· низкие (менее 7 на 100 тыс. в год) - в таких странах, как Польша, Италия (кроме Сардинии), Израиль.
К странам с наименьшим риском заболеваемости (менее 3 на 100 тыс. в год) отнесены Чили, Мексика, Китай.
Пик заболеваемости приходится на период раннего пубертата и у девочек выявляется на 1-2 года раньше, чем у мальчиков. К концу пубертатного периода заболеваемость снижается для детей обоих полов.
Общая численность пациентов с СД1 до 18 лет в Российской Федерации на 31,12,2019 г. составила 47 050 чел. (156 на 100 тыс. детского населения), заболеваемость 7063 (23 на 100 тыс. детского населения). Распространенность СД1 в 2019 гг. у детей составила 131 на 100 тыс. детского населения, у подростков - 304 на 100 тыс. подросткового населения. Заболеваемость СД1 у детей в 2019 г. составила 23 на 100 тыс. детского населения, у подростков - 27 на 100 тыс. подросткового населения [6-11].
В большинстве стран, включая Россию, регистрируется нарастание заболеваемости СД1 в детском возрасте, особенно в развивающихся странах и странах с высоким экономическим ростом. В ряде стран наблюдается непропорционально высокое нарастание заболеваемости СД1 у детей в возрасте моложе 5 лет.
E10,2 - Инсулинзависимый сахарный диабет: с поражениями почек;
E10,3 - Инсулинзависимый сахарный диабет: с поражениями глаз;
E10,4 - Инсулинзависимый сахарный диабет: с неврологическими осложнениями;
E10,5 - Инсулинзависимый сахарный диабет: с нарушениями периферического кровообращения;
E10,6 - Инсулинзависимый сахарный диабет: с другими уточненными осложнениями;
E10,7 - Инсулинзависимый сахарный диабет: с множественными осложнениями;
E10,8 - Инсулинзависимый сахарный диабет: с неуточненными осложнениями;
E10,9 - Инсулинзависимый сахарный диабет: без осложнений.
Пример формулировки диагноза: Сахарный диабет 1 типа: без осложнений (код по МКБ-10: E10,9).
В большинстве стран на долю СД1 у детей приходится до 90% всех случаев диабета, в то время как среди всех возрастов распространенность СД1 составляет от 5 до 10% [5].
Заболеваемость СД1 у детей значительно варьирует в различных странах [5]:
· самые высокие показатели (более 20 на 100 тыс. детского населения в год) отмечены в Скандинавских странах (Финляндия, Швеция, Норвегия) и Сардинии (Италия);
· средние (7-19 на 100 тыс. в год - в США, Новой Зеландии, Нидерландах, Испании;
· низкие (менее 7 на 100 тыс. в год) - в таких странах, как Польша, Италия (кроме Сардинии), Израиль.
К странам с наименьшим риском заболеваемости (менее 3 на 100 тыс. в год) отнесены Чили, Мексика, Китай.
Пик заболеваемости приходится на период раннего пубертата и у девочек выявляется на 1-2 года раньше, чем у мальчиков. К концу пубертатного периода заболеваемость снижается для детей обоих полов.
Общая численность пациентов с СД1 до 18 лет в Российской Федерации на 31,12,2019 г. составила 47 050 чел. (156 на 100 тыс. детского населения), заболеваемость 7063 (23 на 100 тыс. детского населения). Распространенность СД1 в 2019 гг. у детей составила 131 на 100 тыс. детского населения, у подростков - 304 на 100 тыс. подросткового населения. Заболеваемость СД1 у детей в 2019 г. составила 23 на 100 тыс. детского населения, у подростков - 27 на 100 тыс. подросткового населения [6-11].
В большинстве стран, включая Россию, регистрируется нарастание заболеваемости СД1 в детском возрасте, особенно в развивающихся странах и странах с высоким экономическим ростом. В ряде стран наблюдается непропорционально высокое нарастание заболеваемости СД1 у детей в возрасте моложе 5 лет.
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
E10,1 - Инсулинзависимый сахарный диабет: с кетоацидозом;E10,2 - Инсулинзависимый сахарный диабет: с поражениями почек;
E10,3 - Инсулинзависимый сахарный диабет: с поражениями глаз;
E10,4 - Инсулинзависимый сахарный диабет: с неврологическими осложнениями;
E10,5 - Инсулинзависимый сахарный диабет: с нарушениями периферического кровообращения;
E10,6 - Инсулинзависимый сахарный диабет: с другими уточненными осложнениями;
E10,7 - Инсулинзависимый сахарный диабет: с множественными осложнениями;
E10,8 - Инсулинзависимый сахарный диабет: с неуточненными осложнениями;
E10,9 - Инсулинзависимый сахарный диабет: без осложнений.
Пример формулировки диагноза: Сахарный диабет 1 типа: без осложнений (код по МКБ-10: E10,9).
|
|
Классификация
1,5 Классификация заболевания или состояния (группы заболеваний или состояний).
Классификация СД представлена в табл. 1.Таблица 1Этиологическая классификация сахарного диабета (ISPAD, 2018.
| I. СД 1 типа | - иммуноопосредованный (характеризуется наличием одного или более аутоиммунных маркеров) - идиопатический |
| II. СД 2 типа | - с преимущественной инсулинорезистентностью и относительной инсулиновой недостаточностью или - с преимущественным нарушением секреции инсулина с инсулинорезистентностью или без нее |
| III. Другие специфические типы СД | - Наиболее распространенные моногенные формы; - Генетические дефекты действия инсулина; - Болезни экзокринной функции поджелудочной железы; - Эндокринопатии; - СД, индуцированный приемом лекарственными препаратами или химическими веществами - Инфекции - Необычные формы иммунологически опосредованного СД - Другие генетические синдромы, иногда сочетающиеся с СД |
| IV. Гестационный СД | Возникает во время беременности* |
*Кроме манифестного СД.
В отличие от утвержденной в Российской Федерации классификации МКБ-10, в отечественной и зарубежной практике используются термины СД 1 типа (вместо инсулинзависимый СД) и СД 2 типа (вместо инсулиннезависимый СД).
В 2019 г. ВОЗ опубликовала новую классификацию СД, в которой появились гибридные формы СД, неклассифицируемый СД [12]. В настоящее время Российская ассоциация эндокринологов рекомендует продолжать использовать классификацию ISPAD 2018 г., с учетом возможных сложностей кодирования по МКБ-10.
Понятие тяжести СД в формулировке диагноза исключено. Тяжесть СД определяется наличием осложнений, характеристика которых указана в диагнозе.
В связи с введением индивидуализированных целей терапии понятия компенсации, субкомпенсации и декомпенсации в формулировке диагноза у пациентов с СД нецелесообразны. После полной формулировки диагноза следует указать индивидуальный целевой уровень гликемического контроля ( см в разделе 3,1 Оценка и целевые показатели гликемического контроля).
Клиническая картина
Клиническая картина СД варьирует от неургентных проявлений до тяжелой дегидратации, ДКА вплоть до развития коматозного состояния (табл. 2). Скорость прогрессирования от первых клинических проявлений до развития ДКА различается у разных пациентов, от нескольких дней у детей первых лет жизни до нескольких месяцев у подростков.
После установления диагноза и начала инсулинотерапии СД1 имеет хроническое течение с периодами компенсации углеводного обмена и фазами декомпенсации с явлениями кетоза/ДКА или без них. Декомпенсация заболевания может быть обусловлена как нарушениями в контроле заболевания со стороны пациента (редкий контроль гликемии, несоблюдение рекомендаций по питанию и режиму инсулинотерапии), прекращению подачи инсулина при использовании инсулиновой помпы*** по различным причинам, так и в следствие возникновения интеркуррентных заболеваний. При СД1 высок риск развития специфических микро- и макрососудистых осложнений.
Таблица 2Клинические проявления сахарного диабета.
После установления диагноза и начала инсулинотерапии СД1 имеет хроническое течение с периодами компенсации углеводного обмена и фазами декомпенсации с явлениями кетоза/ДКА или без них. Декомпенсация заболевания может быть обусловлена как нарушениями в контроле заболевания со стороны пациента (редкий контроль гликемии, несоблюдение рекомендаций по питанию и режиму инсулинотерапии), прекращению подачи инсулина при использовании инсулиновой помпы*** по различным причинам, так и в следствие возникновения интеркуррентных заболеваний. При СД1 высок риск развития специфических микро- и макрососудистых осложнений.
Таблица 2Клинические проявления сахарного диабета.
| · Полидипсия, полиурия · Энурез · Прогрессирующая потеря массы тела, у детей 1-го года жизни - необъяснимое отсутствие прибавки массы тела · Рецидивирующие кожные инфекции · Слабость, утомляемость · Вульвит, баланит | · Тяжелая дегидратация (сухость кожных покровов и слизистых, сниженный тургор кожи, «запавшие глаза») · Многократная рвота · Дыхание Куссмауля - равномерное редкое дыхание с глубоким шумным вдохом и усиленным выдохом · Запах ацетона в выдыхаемом воздухе · Расстройство сознания (дезориентация, прекоматозное или, реже, коматозное состояние |
Диагностика
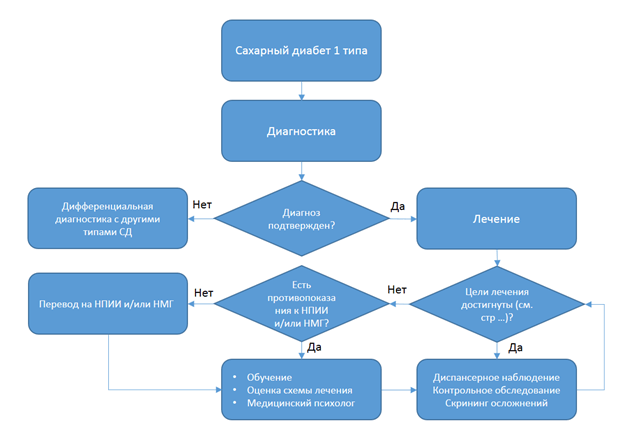
Критерии установления диагноза/состояния. Диагноз СД1 устанавливается на основании патогномоничных данных:
1) анамнестические данные и жалобы: полиурия, полидипсия, потеря массы тела (могут отсутствовать на доклинической стадии);
2) лабораторные исследования:
A. Уровень гликемии и/или HbA1c, соответствующие критериям СД (табл. 3);
B. ДКА и/или повышенный уровень кетонов в крови/моче (может отсутствовать на доклинической стадии);
C. Наличие одного или более аутоантител, ассоциированных с СД1, подтверждает диагноз СД1. При этом полное отсутствие аутоантител не исключает наличие СД1 (идиопатический).
Таблица 3Критерии установления сахарного диабета (ISPAD, 2018 [5] ).
A При отсутствии явной гипергликемии диагноз СД, поставленный на основании этих критериев, необходимо подтверждать повторными тестами.
B Уровень менее 6,5% не исключает возможности диагностики СД по уровню глюкозы. Роль самого по себе HbA1c в диагностике СД1 у детей до конца неясна.
В соответствии с рекомендациями Всемирной Организации Здравоохранения, которых придерживается Российская ассоциация эндокринологов, нормальный уровень глюкозы в плазме венозной крови натощак <6,1 ммоль/л, через 2 ч после нагрузки <7,8 ммоль/л при проведении ПГТТ. Промежуточными стадиями в процессе прогрессирования нарушений углеводного обмена от нормального гомеостаза глюкозы до клинического СД1 являются: нарушенная толерантность к глюкозе (НТГ) и нарушенная гликемия натощак (НГН). Данные состояния не являются самостоятельными нозологическими единицами, а расцениваются как «предиабет» [5,13], что отражает высокий риск развития СД.
НТГ и НГН - не взаимозаменяемые понятия, так как представляют собой разные уровни нарушения регуляции глюкозы: базального метаболизма и динамического ответа на стандартизированную нагрузку глюкозой.
Критерии диагностики НГТ и НГН [14]:
· НГН определяется как уровень глюкозы в плазме венозной крови натощак ≥6,1 и <7,0 ммоль/л;
· НТГ определяется как уровень глюкозы в плазме венозной крови через 2 ч после нагрузки ≥7,8 <11,1ммоль/л при проведении ПГТТ.
При появлении данных жалоб развитие ДКА возможно в сроки от нескольких дней до нескольких месяцев. Клиническими симптомами ДКА являются сухость кожных покровов и слизистых, запах ацетона в выдыхаемом воздухе, рвота, расстройство сознания, вплоть до коматозного состояния, равномерное редкое дыхание с глубоким шумным вдохом и усиленным выдохом (дыхание Куссмауля) [15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии:
O Не рекомендуется исследование уровня глюкозы в крови с помощью глюкометров для диагностики СД1, так как глюкометры не обладают достаточной точностью для убедительной постановки диагноза и могут привести к ошибкам при диагностике;
O В отсутствии симптомов диагностика СД1 не может основываться только на однократном измерении гликемии. Если есть сомнения в диагнозе, может потребоваться продолжительное наблюдение с исследованием гликемии натощак и/или через 2 часа после еды и/или проведение ПГТТ;
O Гипергликемия, определенная в условиях стресса, на фоне острой инфекции, травмы, хирургического вмешательства, нарушения дыхательной функции, проблем с кровообращением , может быть транзиторной и требовать лечения, но сама по себе не указывает на наличие СД.
· Рекомендуется проведение повторного исследования уровня глюкозы в крови в лабораторных условиях и/или ПГТТ при отсутствии клинических симптомов СД у пациентов с гипергликемией, для диагностики СД1 [5,14].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. ПГТТ не должен проводиться, если СД1 можно диагностировать с помощью показателей гликемии натощак, постпрандиально или в течение дня.
Правила проведения ПГТТ:
ПГТТ следует проводить утром на фоне не менее чем 3-дневного неограниченного питания и обычной физической активности. Тесту должно предшествовать ночное голодание в течение 8-10 часов (можно пить воду). Последний вечерний прием пищи должен содержать 30-50 г углеводов. После забора крови натощак испытуемый должен не более чем за 5 мин выпить раствор глюкозы из расчета 1,75 г безводной глюкозы (1,925 г моногидрата глюкозы) на кг массы тела, но не более 75 г (82,5 г), растворенных в 250-300 мл воды. В процессе теста не разрешается курение. Через 2 часа осуществляется повторный забор крови.
Для предотвращения гликолиза и ошибочных результатов определение концентрации глюкозы проводится сразу после взятия крови, или кровь должна быть центрифугирована сразу после взятия, или храниться при температуре 0-4°С, или быть взята в пробирку с консервантом (флуорид натрия).
ПГТТ не проводится:
· на фоне острого заболевания;
· на фоне кратковременного приема препаратов, повышающих уровень гликемии.
· Рекомендуется исследование уровня HbA1c в крови в лабораторных условиях у пациентов с клиническими проявлениями СД и/или гипергликемией для диагностики СД1 [5].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии:
O Определение уровня HbA1c должно проводиться методами (оборудование и наборы), сертифицированными NGSP и стандартизированными по Diabetes сontrol and сomplications Trial (DCCT);
O Значительное расхождение показателей HbA1c с уровнем глюкозы в крови может быть обусловлено наличием различных вариантов гемоглобина (гемоглобинопатия) у пациента, что влияет на результат, получаемый рядом методов и в этом случае следует использовать альтернативный метод определения НbА1с.
O В условиях, влияющих на продолжительность жизни эритроцитов (железодефицитная, серповидно-клеточная анемия, беременность, гемодиализ, недавняя кровопотеря или переливание, или терапия эритропоэтином ), для диагностики СД1 следует использовать только определение уровня глюкозы в плазме крови.
· Рекомендуется определение кетоновых тел в моче или крови у пациентов с клиническими проявлениями СД и/или гипергликемией для диагностики степени нарушения углеводного обмена [5].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. При значительном повышении кетоновых тел в крови или моче может потребоваться безотлагательное лечение, ребенок должен быть направлен к врачу-детскому эндокринологу в тот же день в связи с высоким риском развития ДКА.
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Комментарии. Наличие одного или более аутоантител, ассоциированных с СД1 (аутоантитела к глутаматдекарбоксилазе - GADA; аутоантитела к тирозинфосфатазе - IA-2; аутоантитела к транспортеру цинка 8 - ZnT8), подтверждает диагноз СД1. Отсутствие аутоантител полностью не исключает СД1 (т.н. идиопатический СД1), но может являться основанием для дообследования. Учитывая возможность наличия других типов СД, необходимо рассмотреть вопрос о проведении молекулярно-генетического исследования у детей с отрицательным титром диабетических АТ и:
· Наличием СД в семье с аутосомно-доминантным типом наследования;
· Возрастом манифестации менее 12 месяцев и особенно первые 6 месяцев жизни;
· Умеренной гипергликемией натощак (5,5-8,5 ммоль/л), особенно в младшем возрасте, без ожирения, асимптоматической;
· Длительным «медовым месяцем» свыше 1 года или необычно низкой потребностью в инсулине (менее 0,5 Ед/кг/сут) при длительности СД более года;
· Ассоциированными состояниями, такими как глухота, атрофия диска зрительных нервов (ДЗН), или синдромальные формы (митохондриальные болезни).
· Рекомендуется исследование тощакового и стимулированного уровня С-пептида и/или исследование уровня инсулина плазмы крови у пациентов с диагностированным СД для дифференциальной диагностики СД1 с другими типами СД [18].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Повышенный уровень С-пептида/инсулина не характерен для СД1 через 12-14 месяцев от начала заболевания, определяемый уровень С-пептида не характерен для СД1 через 5 лет от начала заболевания.
1) анамнестические данные и жалобы: полиурия, полидипсия, потеря массы тела (могут отсутствовать на доклинической стадии);
2) лабораторные исследования:
A. Уровень гликемии и/или HbA1c, соответствующие критериям СД (табл. 3);
B. ДКА и/или повышенный уровень кетонов в крови/моче (может отсутствовать на доклинической стадии);
C. Наличие одного или более аутоантител, ассоциированных с СД1, подтверждает диагноз СД1. При этом полное отсутствие аутоантител не исключает наличие СД1 (идиопатический).
Таблица 3Критерии установления сахарного диабета (ISPAD, 2018 [5] ).
| или II. Уровень глюкозы в плазме венозной крови натощак ≥7,0 ммоль/л. (Состояние натощак определяется как отсутствие потребления калорий в течение, по крайней мере, 8 )a |
| или III. Уровень глюкозы в плазме венозной крови через 2 ч после нагрузки ≥11,1* ммоль/л при проведении перорального глюкозотолерантного теста (ПГТТ)a |
| или IV. HbA1c ≥ 6,5% b. |
A При отсутствии явной гипергликемии диагноз СД, поставленный на основании этих критериев, необходимо подтверждать повторными тестами.
B Уровень менее 6,5% не исключает возможности диагностики СД по уровню глюкозы. Роль самого по себе HbA1c в диагностике СД1 у детей до конца неясна.
В соответствии с рекомендациями Всемирной Организации Здравоохранения, которых придерживается Российская ассоциация эндокринологов, нормальный уровень глюкозы в плазме венозной крови натощак <6,1 ммоль/л, через 2 ч после нагрузки <7,8 ммоль/л при проведении ПГТТ. Промежуточными стадиями в процессе прогрессирования нарушений углеводного обмена от нормального гомеостаза глюкозы до клинического СД1 являются: нарушенная толерантность к глюкозе (НТГ) и нарушенная гликемия натощак (НГН). Данные состояния не являются самостоятельными нозологическими единицами, а расцениваются как «предиабет» [5,13], что отражает высокий риск развития СД.
НТГ и НГН - не взаимозаменяемые понятия, так как представляют собой разные уровни нарушения регуляции глюкозы: базального метаболизма и динамического ответа на стандартизированную нагрузку глюкозой.
Критерии диагностики НГТ и НГН [14]:
· НГН определяется как уровень глюкозы в плазме венозной крови натощак ≥6,1 и <7,0 ммоль/л;
· НТГ определяется как уровень глюкозы в плазме венозной крови через 2 ч после нагрузки ≥7,8 <11,1ммоль/л при проведении ПГТТ.
2,1 Жалобы и анамнез.
Характерными для СД1 жалобами в дебюте заболевания являются жажда, учащенное мочеиспускание с явлениями ночного и дневного недержания мочи у детей раннего возраста, снижение массы тела или необъяснимое отсутствие прибавки массы тела (у детей грудного возраста), слабость, утомляемость, повторяющиеся кожные инфекции, воспалительные заболевания наружных половых органов.При появлении данных жалоб развитие ДКА возможно в сроки от нескольких дней до нескольких месяцев. Клиническими симптомами ДКА являются сухость кожных покровов и слизистых, запах ацетона в выдыхаемом воздухе, рвота, расстройство сознания, вплоть до коматозного состояния, равномерное редкое дыхание с глубоким шумным вдохом и усиленным выдохом (дыхание Куссмауля) [15].
2,2 Физикальное обследование.
Специального физикального обследования для диагностики СД1 не предусмотрено. Физикальное обследование для диагностики осложнений СД1 представлено в соответствующем разделе.2,3 Лабораторные диагностические исследования.
· Рекомендуется исследование уровня глюкозы в крови в лабораторных условиях у пациентов с клиническими проявлениями СД и/или гипергликемией для диагностики СД1 [5].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии:
O Не рекомендуется исследование уровня глюкозы в крови с помощью глюкометров для диагностики СД1, так как глюкометры не обладают достаточной точностью для убедительной постановки диагноза и могут привести к ошибкам при диагностике;
O В отсутствии симптомов диагностика СД1 не может основываться только на однократном измерении гликемии. Если есть сомнения в диагнозе, может потребоваться продолжительное наблюдение с исследованием гликемии натощак и/или через 2 часа после еды и/или проведение ПГТТ;
O Гипергликемия, определенная в условиях стресса, на фоне острой инфекции, травмы, хирургического вмешательства, нарушения дыхательной функции, проблем с кровообращением , может быть транзиторной и требовать лечения, но сама по себе не указывает на наличие СД.
· Рекомендуется проведение повторного исследования уровня глюкозы в крови в лабораторных условиях и/или ПГТТ при отсутствии клинических симптомов СД у пациентов с гипергликемией, для диагностики СД1 [5,14].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. ПГТТ не должен проводиться, если СД1 можно диагностировать с помощью показателей гликемии натощак, постпрандиально или в течение дня.
Правила проведения ПГТТ:
ПГТТ следует проводить утром на фоне не менее чем 3-дневного неограниченного питания и обычной физической активности. Тесту должно предшествовать ночное голодание в течение 8-10 часов (можно пить воду). Последний вечерний прием пищи должен содержать 30-50 г углеводов. После забора крови натощак испытуемый должен не более чем за 5 мин выпить раствор глюкозы из расчета 1,75 г безводной глюкозы (1,925 г моногидрата глюкозы) на кг массы тела, но не более 75 г (82,5 г), растворенных в 250-300 мл воды. В процессе теста не разрешается курение. Через 2 часа осуществляется повторный забор крови.
Для предотвращения гликолиза и ошибочных результатов определение концентрации глюкозы проводится сразу после взятия крови, или кровь должна быть центрифугирована сразу после взятия, или храниться при температуре 0-4°С, или быть взята в пробирку с консервантом (флуорид натрия).
ПГТТ не проводится:
· на фоне острого заболевания;
· на фоне кратковременного приема препаратов, повышающих уровень гликемии.
· Рекомендуется исследование уровня HbA1c в крови в лабораторных условиях у пациентов с клиническими проявлениями СД и/или гипергликемией для диагностики СД1 [5].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии:
O Определение уровня HbA1c должно проводиться методами (оборудование и наборы), сертифицированными NGSP и стандартизированными по Diabetes сontrol and сomplications Trial (DCCT);
O Значительное расхождение показателей HbA1c с уровнем глюкозы в крови может быть обусловлено наличием различных вариантов гемоглобина (гемоглобинопатия) у пациента, что влияет на результат, получаемый рядом методов и в этом случае следует использовать альтернативный метод определения НbА1с.
O В условиях, влияющих на продолжительность жизни эритроцитов (железодефицитная, серповидно-клеточная анемия, беременность, гемодиализ, недавняя кровопотеря или переливание, или терапия эритропоэтином ), для диагностики СД1 следует использовать только определение уровня глюкозы в плазме крови.
· Рекомендуется определение кетоновых тел в моче или крови у пациентов с клиническими проявлениями СД и/или гипергликемией для диагностики степени нарушения углеводного обмена [5].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. При значительном повышении кетоновых тел в крови или моче может потребоваться безотлагательное лечение, ребенок должен быть направлен к врачу-детскому эндокринологу в тот же день в связи с высоким риском развития ДКА.
2,3,1 Лабораторные диагностические исследования, проводимые в целях дифференциальной диагностики.
· Рекомендуется определение содержания антител к антигенам островков клеток поджелудочной железы в крови (аутоантитела к глутаматдекарбоксилазе - GADA; аутоантитела к тирозинфосфатазе - IA-2; аутоантитела к транспортеру цинка 8 - ZnT8) у пациентов с СД для дифференциальной диагностики и подтверждения СД1 в сомнительных случаях [16,17].Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Комментарии. Наличие одного или более аутоантител, ассоциированных с СД1 (аутоантитела к глутаматдекарбоксилазе - GADA; аутоантитела к тирозинфосфатазе - IA-2; аутоантитела к транспортеру цинка 8 - ZnT8), подтверждает диагноз СД1. Отсутствие аутоантител полностью не исключает СД1 (т.н. идиопатический СД1), но может являться основанием для дообследования. Учитывая возможность наличия других типов СД, необходимо рассмотреть вопрос о проведении молекулярно-генетического исследования у детей с отрицательным титром диабетических АТ и:
· Наличием СД в семье с аутосомно-доминантным типом наследования;
· Возрастом манифестации менее 12 месяцев и особенно первые 6 месяцев жизни;
· Умеренной гипергликемией натощак (5,5-8,5 ммоль/л), особенно в младшем возрасте, без ожирения, асимптоматической;
· Длительным «медовым месяцем» свыше 1 года или необычно низкой потребностью в инсулине (менее 0,5 Ед/кг/сут) при длительности СД более года;
· Ассоциированными состояниями, такими как глухота, атрофия диска зрительных нервов (ДЗН), или синдромальные формы (митохондриальные болезни).
· Рекомендуется исследование тощакового и стимулированного уровня С-пептида и/или исследование уровня инсулина плазмы крови у пациентов с диагностированным СД для дифференциальной диагностики СД1 с другими типами СД [18].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Повышенный уровень С-пептида/инсулина не характерен для СД1 через 12-14 месяцев от начала заболевания, определяемый уровень С-пептида не характерен для СД1 через 5 лет от начала заболевания.
2,4 Инструментальные диагностические исследования.
Специальных инструментальных диагностических исследований для диагностики СД1 не предусмотрено. Инструментальные диагностические исследования для диагностики осложнений и сопутствующей патологии СД1 представлены в соответствующем разделе.2,5 Иные диагностические исследования.
Не применяется.|
|
Лечение
Лечение СД1 у детей складывается из следующих основных компонентов:
· инсулинотерапия;
· обучение самоконтролю и проведение его в домашних условиях;
· питание;
· физические нагрузки;
· психологическая помощь.
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
· Рекомендуется использование амбулаторного гликемического профиля и стандартизированных показателей непрерывного мониторирования глюкозы (НМГ), включая время в диапазонах (время в целевом диапазоне, время выше целевого диапазона, время ниже целевого диапазона), у пациентов с СД1 для оценки гликемического контроля и проводимой терапии в дополнение к НbА1с (табл. 4) [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии:
Таблица 4Стандартизованные показатели непрерывного мониторирования глюкозы для клинического применения у детей с сахарным диабетом 1 типа.
A Включая значения >13,9 ммоль/л.
B Включая значения <3,0 ммоль/л.
· Рекомендуется достижение и поддержание HbA1c на уровне <7,0% у пациентов с СД1 для снижения риска развития и прогрессирования хронических осложнений СД1 (табл. 5) [22,23].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 3).
Комментарии:
Таблица 5Целевой уровень HbA1c и гликемии у детей и подростков с сахарным диабетом 1 типа (адапт. ISPAD 2018 [5]).
Последние данные свидетельствуют о том, что снижении целевого уровня НbА1с на индивидуальном и популяционном уровне приводят к снижению среднего HbA1c без увеличения частоты тяжелой гипогликемии и гипогликемической комы, даже у детей с HbA1c менее 7% [24].
· Рекомендуется при оценке гликемического контроля по стандартизированным показателям НМГ/амбулаторному гликемическому профилю, в дополнение к НbА1с достижение и поддержание времени в целевом диапазоне на уровне >70% и времени ниже целевого диапазона <4%, у пациентов с СД1 для снижения риска развития и прогрессирования микрососудистых осложнений СД1 [25,26].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 3).
· Рекомендуется индивидуализированный подход при выборе целевых уровней гликемического контроля у пациентов с СД1, ориентируясь на достижение более низкого уровня HbA1c с целью снижения необоснованного риска тяжелой гипогликемии, частых эпизодов легкой гипогликемии и сохранения качества жизни ребенка и родителей [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Выбор целевого показателя HbA1c необходимо всегда рассматривать как компромисс между риском развития гипо - и гипергликемии и их последствиями, ожидаемой пользой снижения риска в отношении обусловленных СД1 острых и хронических осложнений, предпочтений пациента и приверженности пациента терапии.
Целевые уровни глюкозы и НbА1с должны быть индивидуализированы для каждого пациента:
O Более низкий уровень НbА1с (<6,5%) допустим только при отсутствии необоснованного риска тяжелой гипогликемии, частых эпизодов легкой гипогликемии и снижения качества жизни ребенка и родителей;
O Более высокий уровень НbА1с (<7,5%) целесообразен у детей, которые не могут сообщить о симптомах гипогликемии, с нарушением восприятия гипогликемии/тяжелой гипогликемией в анамнезе, недостаточным контролем уровня глюкозы.
O У пациентов с СД1 и эпизодами тяжёлой гипогликемии за последние три месяца целесообразно повысить целевой уровень HbA1c для восстановления нормальной реакции на гипогликемию и снижения риска тяжелой гипогликемии [27].
Необходимыми условиями достижения целевого уровня гликемического контроля является:
O Регулярной контроль НbА1с;
O Использование НМГ или регулярный самоконтроль 6-10 раз в сутки;
O Регулярная оценка и коррекция лечения.
Во всех возрастных группах основной целью инсулинотерапии является достижение и поддержание близкого к физиологическому уровня инсулинемии и оптимальный гликемический контроль.
· Рекомендуется проведение заместительной инсулинотерапии человеческими генно-инженерными препаратами инсулина и их аналогами (табл. 6) у пациентов с СД1 для эффективного и безопасного достижения целевых показателей гликемического контроля [28-41].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарий:
Таблица 6Виды и профиль действия препаратов инсулина.
Дозы препаратов инсулина и схема введения подбирается индивидуально для каждого пациента исходя из возраста, профиля действия инсулина, индивидуальной переносимости и пр. на основании данных гликемического контроля (показателей гликемии и уровня НbА1с). Дозы препаратов инсулина и схема их введения может значительно варьировать между пациентами с СД1, в том числе в период ремиссии дозы препаратов инсулина могут быть минимальными, вплоть до полной отмены (полная ремиссия СД1) на определенное время, однако окончательное решение о схеме и дозах зависит строго от показателей гликемии и уровня НbА1с.
В реальной клинической практике перевод с одного препарата инсулина и его аналогов на другой происходит достаточно часто. При переводе пациента с одного инсулина на другой необходимо соблюдать следующий алгоритм требований для наилучшего обеспечения безопасности пациента [45]:
1. В случае разных МНН.
• Перевод с одного препарата инсулина и его аналогов на другой должен осуществляться строго по медицинским показаниям, только при участии врача, требует более частого самоконтроля уровня глюкозы, обучения пациента и коррекции дозы вновь назначенного инсулина.
• Перевод может быть осуществлен с одного препарата инсулина и его аналогов на другой как в рамках одной группы по АТХ-классификации, так и со сменой АТХ-группы (например, перевод с человеческого инсулина на аналог инсулина и наоборот).
2. В случае одного и того же МНН.
• Перевод пациентов с одного инсулина и его аналогов на другой с подтвержденной взаимозаменяемостью ( подтвержденной биоэквивалентностью в отношении фармакокинетики, фармакодинамики и безопасности действия), как правило, не требует более частого самоконтроля уровня глюкозы, обучения пациента и коррекции дозы вновь назначенного инсулина.
• Перевод пациентов с одного инсулина и его аналогов на другой в рамках одного МНН, но с разной фармакокинетикой и фармакодинамикой должен осуществляться по правилам, указанным для препаратов с разными МНН.
3. В случае развития нежелательных явлений как при назначении инсулинотерапии, так и переводе с одного препарата инсулина и его аналогов на другой, к которым относятся ухудшение гликемического контроля, существенное изменение потребности/дозы инсулина, развитие аллергических реакций, обязательно сообщение в Федеральную службу по надзору в сфере здравоохранения.
4.Решение о переводе с одного препарата инсулина и его аналогов на другой принимает врач с учетом актуальной инструкции по применению.
· Рекомендуется начинать инсулинотерапию как можно раньше (в течение 6 часов при наличии кетонурии/кетонемии) у пациентов с впервые диагностированным СД1 для предотвращения развития ДКА [46].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарий. При наличии клинических проявлений ДКА необходимо проведение диагностических и лечебных мероприятий в соответствии с разделом Диабетический кетоацидоз.
· Рекомендуется введение инсулина и его аналогов в интенсифицированном режиме путем множественных инъекций инсулина (МИИ) или непрерывной подкожной инфузии инсулина (НПИИ) у всех пациентов с СД1 с целью снижения риска развития микро- и макрососудистых сосудистых осложнений СД1 [47-49,49,50].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Несмотря на то, что данные об эффективности интенсифицированной инсулинотерапии в отношении риска микро - и макрососудитсых осложнений СД1 были получены у подростков и взрослых, нет никаких оснований предполагать, что эти данные не могут распространяться на детей.
· Рекомендуется индивидуализация и адаптация инсулинотерапии (вид инсулина и его аналогов, схема инсулинотерапии/настройки инсулиновой помпы***) в зависимости от профиля гликемии у пациентов с СД1 с целью оптимизации гликемического контроля [46].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарий. Независимо от метода инсулинотерапии и режима инъекций инсулина пациент и члены семьи должны пройти обучение, соответствующее возрасту, зрелости и индивидуальным потребностям ребенка и семьи.
· Рекомендуется использование ИУКД и ИСБД в качестве препаратов выбора у пациентов с СД1 (табл. 6) с целью снижения риска гипогликемии [51].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
· Рекомендуется использование ИДД и ИСДД в качестве препаратов выбора аналогов (табл. 6) у пациентов с СД1 с целью снижения уровня HbA1c и риска гипогликемии [28,29,36,40,41,52].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 2).
· Рекомендуется использовать иглы для инсулиновых шприц-ручек и инсулиновых шприцев длиной не более 6 мм у пациентов с СД1 для минимизации риска в/м введения [53-55].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Комментарии: Инъекции инсулина 4-мм иглами для инсулиновых шприц-ручек нужно делать под углом 90°, независимо от возраста, пола, ИМТ. У детей в возрасте 6 лет и младше, а также при использовании игл для инсулиновых шприц-ручек длиной >4 мм или инсулиновых шприцев, необходимо формирование кожной складки и/или угла наклона 45°, чтобы избежать в/м введения.
· Не рекомендуется применение инсулиновых шприцев у детей с СД1 младше 6 лет из-за высокого риска в/м инъекций [55-59].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется однократное использование игл для инсулиновых шприц-ручек и инсулиновых шприцев у пациентов с СД1 для обеспечения инфекционной безопасности и профилактики липодистрофий [53,55,60].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 2).
Комментарии. Согласно инструкции к инсулиновым шприц-ручкам, иглы должны использоваться однократно.
· Рекомендуется регулярно (не реже 1 раза в 6 месяцев) проводить визуальный осмотр и пальпацию мест инъекций и оценивать навыки инъекций инсулина у пациентов с СД1, получающих инсулинотерапию, с целью снижения риска формирования липодистрофии [55,58].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарий. Пациенты с СД1 и их родители должны научиться самостоятельно осматривать места инъекций и распознавать липодистрофии.
· Рекомендуется при каждой инъекции менять место введения, использовать большие области для введения инсулина у пациентов с СД1, получающих инсулинотерапию, с целью предотвращения образования липодистрофии [46,55].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Не рекомендуется введение инсулина в область липодистрофии у пациентов с СД1, получающих инсулинотерапию, для предупреждения нарушения всасывания инсулина и вариабельности гликемии [46,55].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется применение инсулиновых помп*** у пациентов с СД1 независимо от возраста с целью улучшения показателей гликемического контроля [61,62].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии. Применение НПИИ способствует эффективному и безопасному достижению целевого уровня HbA1c, снижению частоты гипогликемии, снижение вариабельности гликемии [61-63]. Использование дополнительных функций и возможностей, таких как автоматический калькулятор болюса, временная базальная скорость и считывание данных с инсулиновой помпы, способствует лучшим показателям гликемии [64-69]. При этом наибольшей эффективностью в отношении снижения уровня HbA1c без учащения эпизодов гипогликемии над МИИ и традиционным самоконтролем обладает помповая инсулинотерапия, дополненная НМГ [63,70]. Кроме того, в настоящее время существуют инсулиновые помпы с функцией прекращения (в том числе предиктивного) подачи инсулина в случае гипогликемии, способствующие сокрушению частоты, продолжительности и выраженности эпизодов гипогликемии [71-73].
Следует отметить, что НПИИ является альтернативным методом введения инсулина и при необходимости (наличие противопоказаний, отсутствии возможности ) инсулинотерапия может проводиться в режиме МИИ.
Применение помповой инсулинотерапии может быть рассмотрено у пациентов при:
O HbA1c выше индивидуального целевого показателя на фоне интенсифицированной инсулинотерапии;
O Тяжелые гипогликемии (≥1 раза за последний год), в том числе вследствие сниженной чувствительности к гипогликемиям;
O Частые эпизоды легкой гипогликемии;
O Высокая вариабельность гликемии независимо от уровня НbА1с;
O Выраженный феномен «утренней зари»;
O Наличие микрососудистых осложнений или факторов риска их развития;
O Необходимость введения малых доз инсулина;
O Значительное снижение качества жизни в связи с необходимостью/боязнью инъекций инсулина.
· Не рекомендуется применение инсулиновых помп*** у пациентов с СД1 при недостаточном уровне знаний/контроле СД, недостаточной эффективности/безопасности и приверженности НПИИ, что может привести к развитию угрожающих для жизни состояний, а именно - острого ДКА [74,75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Проведение помповой инсулинотерапии нецелесообразно в следующих условиях:
O Отказ пациента и/или законного представителя от НПИИ;
O Отсутствие возможности/способности пациента или законного представителя проводить процедуры, связанные с контролем СД и инсулиновой помпой*** включая: регулярный самоконтроль глюкозы, оценку углеводов пищи, введение инсулина, регулярную замену инфузионного набора ;
O Наличие психосоциальных проблем в семье пациента, препятствующие обучению или способные привести к неадекватному обращению с прибором, в том числе наркотическая зависимость и алкоголизм;
O Недостижение индивидуальных целевых показателей гликемического контроля и/или отсутствие значимого (более 0,5%) снижения уровня HbA1c в течение одного года после инициации помповой инсулинотерапии;
O Учащение эпизодов ДКА и тяжелой гипогликемии на фоне НПИИ;
O Индивидуальная плохая переносимость НПИИ: выраженные кожные реакции, частые окклюзии инфузионной системы или другие нежелательные явления, связанные с методом и препятствующие его использованию.
· Рекомендуется применять инсулиновые помпы*** у пациентов с СД1 в условия, позволяющих обеспечить надлежащее обучение и наблюдение пациента с целью эффективного использования данного метода и предотвращения острых осложнений помповой инсулинотерапии [74,75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Применение помповой инсулинотерапии целесообразно при соблюдении следующих условий:
O Перед переводом пациента на НПИИ необходима консультация специалиста для обсуждения основных аспектов помповой инсулинотерапии и готовности пациента, выбора инсулиновой помпы***;
O Пациент обладает достаточными навыками интенсифицированной инсулинотерапии, обучен принципам самоконтроля;
O Для эффективного и безопасного использования инициация НПИИ, обучение пациента и его дальнейшее наблюдение должно проводиться в лечебно-профилактических учреждениях, имеющих в штате необходимых квалифицированных специалистов обладающие достаточным опытом и навыками в помповой инсулинотерапии;
O Периодическое считывание информации с инсулиновых помп***, с целью структурированного представления и анализа полученных данных.
· Рекомендуется использование калькуляторов болюса у пациентов с СД1 на помповой инсулинотерапии с целью достижения лучших показателей гликемического контроля [76].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Применение калькуляторов болюса помогает определить необходимые дозы инсулина на еду и коррекцию гликемии и связано с улучшением показателей гликемического контроля, поэтому должно рекомендоваться к использованию пациентами.
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 3).
Комментарии. Контроль ГК проводится с использованием глюкометров или систем НМГ. В домашних условиях используются индивидуальные глюкометры. В настоящее время существуют глюкометры с настройкой индивидуального целевого диапазона гликемии, а также глюкометры с функцией беспроводной передачи данных об уровне глюкозы медицинским специалистам, родственникам или в установленное на смартфон пациента специальное приложение для использования при дистанционном наблюдении.
Индивидуальные глюкометры должны соответствовать ГОСТ Р ИСО 15197-2015 по аналитической и клинической точности. При уровне глюкозы плазмы крови <5,6 ммоль/л 95% измерений должны отклоняться от эталонного анализатора не более чем на ± 0,8 ммоль/л, при уровне глюкозы плазмы крови ≥5,6 ммоль/л 95% измерений должны отклоняться от эталонного анализатора не более чем на ±15%.
В условиях медицинских организаций, помимо лабораторных анализаторов, необходимо использовать глюкометры для профессионального применения (многопользовательские, госпитальные), обладающими более высокой точностью измерения по сравнению с индивидуальными глюкометрами и выдерживающие многократные циклы дезинфекции в соответствии с хорошо валидированными методами, представленными производителем .
· Рекомендуется измерение ГК глюкометром с частотой не менее 6 раз в сутки у пациентов с СД1 с целью оптимизации самоконтроля и инсулинотерапии, снижения риска осложнений, улучшения показателей гликемического контроля [77,78].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
Комментарии. Пациентам с СД1 может быть рекомендовано самостоятельное измерение ГК в следующее время:
O перед основными приемами пищи и через 2-3 часа после еды;
O перед сном, при пробуждении и ночью;
O при физических нагрузках;
O при подозрении на гипогликемию и после ее купирования;
O во время интеркуррентных заболеваний.
Рекомендуемое время и частота измерения ГК глюкометром должны быть индивидуализированы для каждого пациента с целью достижения оптимального гликемического контроля.
· Рекомендуется измерение ГК глюкометром не менее 4 раз в сутки при использовании НМГ в реальном времени и не менее 2 раз в сутки при использовании флеш-мониторинга глюкозы (ФМГ) у пациентов с СД1 с целью оценки точности данных и/или калибровки [83-87].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
Комментарии. Рост точности измерений в современных системах НМГ позволяет значительно сократить частоту традиционного самоконтроля глюкометром в пользу использования данных НМГ. ФМГ может быть использован вместо глюкометра для принятия клинических решений за исключением отдельных случаев (гипогликемии, быстрого изменения ГК или если симптомы не соответствуют показателям системы).
· Рекомендуется оценка гликемического профиля у пациентов с СД1 с целью коррекции проводимого лечения на основании данных показателей [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Пациентам или законным представителям должно быть рекомендовано фиксировать в дневниках самоконтроля данные с указанием даты и времени о показателях ГК, дозах инсулина, принятых углеводах, эпизодах гипо - и гипергликемии и других состояниях (болезнь, физические нагрузки ). Данные самоконтроля должны регулярно анализироваться пациентами и родителями, а также необходимы при проведении визитов к лечащему врачу для своевременной оценки и коррекции проводимого лечения.
С учетом большого объема информации, накапливаемого в процессе использования, и возникающими трудностями в их наглядной интерпретации специалистами, периодическое считывание данных с медицинских изделий (НМГ, инсулиновые помпы***, глюкометры) с последующим анализом, с использованием специализированного программного обеспечения способствует лучшему гликемическому контролю [69].
Особенностью систем НМГ в «слепом» режиме является ретроспективный характер получаемых за короткий промежуток времени данных. Основным назначением данного метода является объективная оценка гликемического профиля, выявление скрытых эпизодов гипо-/гипергликемий с целью коррекции проводимого лечения, а также обучение пациентов.
Особенностью систем НМГ в реальном времени является наличие сигналов тревоги, которые активируются при достижении гликемией пороговых значений, прогнозировании этих значений, а также при достижении порогового уровня скорости изменения гликемии. Некоторые модели систем НМГ в «реальном» времени передают данные об уровне глюкозы непосредственно на смартфон, откуда они могут быть сохранены на сервере в сети Интернет и использованы для удаленного мониторинга.
В свою очередь, система ФМГ не отображает данные об уровне глюкозы автоматически, а только при т.н. «сканировании» - приближении на короткое расстояние сканера к датчику системы. ФМГ предоставляет информацию о текущем уровне глюкозы, тенденции (направления и скорости) изменения глюкозы, график глюкозы за последнее и предыдущее время. В отличие от НМГ в реальном времени, ФМГ, доступный в настоящее время, не обладает сигналами тревоги.
Преимуществами НМГ в реальном времени и ФМГ является улучшение НbА1с, снижение частоты гипогликемии, снижение вариабельности гликемии, снижение времени в гипогликемии, увеличение времени в целевом диапазоне [80,81,84,88,89]. Эффективность НМГ во многом определяется частотой использования сенсора, с минимально необходимым временем 60% [90].
· Рекомендуется применение НМГ в «слепом» режиме у пациентов с СД1 с целью оценки гликемического профиля и эффективности проводимого лечения [91-93].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарии. НМГ в «слепом» режиме следует проводить кратковременно (до 14 дней) как амбулаторно, так и в условиях стационара в рамках госпитализации с целью:
O Выявления ночной гипо- и гипергликемии (феномен «утренней зари»);
O Оценки расширенного перечня показателей гликемического контроля в том числе вариабельности гликемии (время в целевом диапазоне/гипогликемии/гипергликемии, SD, сV );
O Выявления индивидуальных постпрандиальных профилей гликемии (ускоренное или замедленное всасывание углеводов из ЖКТ).
O Уточнение эффекта физической нагрузки, гиподинамии, стресса и других факторов на гликемию.
O Формирования индивидуальных рекомендаций в отношении инсулинотерапии и оптимальных алгоритмов снижения вариабельности гликемии (в том числе предотвращения гипогликемий и выраженных гипергликемий).
O В рамках клинических исследований - полноценная оценка эффекта лекарственных средств на гликемию.
· Рекомендуется применение НМГ у детей с СД1 с целью снижения НbА1с, уменьшения вариабельности гликемии, увеличения времени в целевом диапазоне, уменьшения времени ниже целевого диапазона, снижения риска гипогликемии [80-82,94].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Выбор системы НМГ может определяться индивидуальными предпочтениями пациента, а также возможностями или ограничениями конкретной системы (необходимость калибровки, длительность использования сенсора, сигналы тревоги ).
Применение НМГ следует рассмотреть у пациентов при:
O HbA1c выше индивидуального целевого показателя;
O Тяжелые гипогликемии (≥1 раза за последний год);
O Высокая вариабельность гликемии независимо от уровня НbА1с;
O Частые эпизоды легкой гипогликемии;
O Выраженное снижение качества жизни;
O Время в целевом диапазоне менее 70% по данным НМГ в «слепом» режиме.
· Рекомендуется применение НМГ в реальном времени (с функцией сигналов тревоги) у детей с СД1 младше 4-х лет (в связи с возрастными ограничениями к использованию ФМГ), у детей, которые не могут сообщить о симптомах гипо- или гипергликемии и у детей с нарушением восприятия гипогликемии для снижения риска гипогликемии [95-97].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
· Не рекомендуется применение НМГ у пациентов с СД1 при недостаточной эффективности/безопасности и приверженности НМГ с целью снижения рисков острых осложнений СД1 [74,75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Применение НМГ в реальном времени или ФМГ нецелесообразно в следующих условиях:
O Отказ пациента или законного представителя от НМГ;
O Отсутствие возможности и способности пациента и/или законного представителя активно использовать НМГ, проводить регулярный самоконтроль и выполнять рекомендации лечащего врача;
O Индивидуальная непереносимость НМГ: выраженные кожные реакции или другие нежелательные явления, связанные с методом и препятствующие его использованию;
O Недостаточное использование НМГ (<60% времени).
· Рекомендуется применение НМГ у пациентов с СД1 в условиях, позволяющих обеспечить надлежащую эффективность, обучение и наблюдение пациента, с целью снижения рисков острых осложнений СД1 [74,75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Применение НМГ целесообразно в следующих условиях:
O Перед переводом пациента на НМГ необходима консультация специалиста для обсуждения основных аспектов НМГ и готовности пациента, выбора системы НМГ;
O Пациент обладает достаточными навыками интенсифицированной инсулинотерапии, обучен принципам самоконтроля;
O Для эффективного и безопасного использования инициация НМГ, обучение пациента и его дальнейшее наблюдение должны проводиться в лечебно-профилактических учреждениях, имеющих в штате необходимых квалифицированных специалистов, обладающие достаточным опытом и навыками в НМГ;
O Периодическое считывание информации с систем НМГ и глюкометров с целью структурированного анализа полученных данных, в том числе с использованием амбулаторного гликемического профиля.
· Рекомендуется применение помповой инсулинотерапии, дополненной НМГ с остановкой (включая предиктивную) подачи инсулина при гипогликемии, у пациентов с СД1 для снижения частоты легкой и тяжелой гипогликемии [71,73,80].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Остановка введения инсулина помпой происходит автоматически в случае достижения или прогноза (предиктивно) достижения нижнего гликемического порога (устанавливаемого врачом или пациентов) по данным НМГ. Подача инсулина автоматически возобновится через 120 минут или в случае роста уровня глюкозы.
· Рекомендуется организация и регулярное проведение «Школ для пациентов с сахарным диабетом» для детей с СД1 и их родителей от момента диагностики заболевания и на всем его протяжении для достижения и поддержания целевого гликемического контроля и психосоциальных целей лечения [98].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Цели и задачи обучения должны быть конкретизированы в соответствии с актуальным состоянием пациента. Обучение должно быть адаптировано для каждого человека в соответствии с возрастом, длительностью СД, образу жизни, способности к обучению Обучение должно быть непрерывным, в «Школу для пациентов с сахарным диабетом» направляются пациенты, не проходившие обучения (первичный цикл), или уже прошедшие обучение (повторные циклы), для поддержания уровня знаний и мотивации или при появлении новых терапевтических целей и технологий.
· Рекомендуется для обучения пациентов с СД1 использовать специально разработанные структурированные программы, адресованные конкретному пациенту: СД1 на режиме многократных инъекций, СД1 на помповой инсулинотерапии с целью улучшения и поддержания показателей гликемического контроля [98,99].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Обучение может проводиться как в индивидуальном порядке, так и в группах пациентов. Содержание обучающих программ должно соответствовать принятым стандартам диагностики и лечения СД, а их структура - учитывать основные принципы педагогики. Программы подразумевают строго практическую направленность и доступность для восприятия. Обязательные разделы обучающих программ:
O общие сведения о СД;
O инсулинотерапия;
O питание;
O самоконтроль гликемии;
O физическая активность;
O гипогликемия.
Содержание и подача структурированных программ нуждается в регулярном пересмотре, чтобы соответствовать потребностям пациентов с СД1, сложившейся практике и учесть изменения в подходе к контролю СД и технологиях.
· Рекомендуется проведение обучения пациентов с СД1 квалифицированными специалистами (специально подготовленными медицинскими работниками: врачом-детским эндокринологом или медицинской сестрой) с целью улучшения и поддержания показателей гликемического контроля [75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. При наличии возможности желательно участие в обучении медицинского психолога и врача-диетолога.
· Рекомендуется реализация индивидуального плана питания у пациентов с СД1 с учетом и коррекцией прандиального инсулинас целью улучшения гликемического контроля [100].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии: Диетические рекомендации должны быть основаны на принципах здорового питания и подходить для всех детей, подростков с СД1 и их семей с целью улучшения результатов контроля СД и снижения сердечно-сосудистых рисков. Пищевые рекомендации должны быть адаптированы к культурным, этническим и семейным традициям, а также учитывать когнитивные и психосоциальные аспекты ребенка и семьи. Необходимо предоставлять пациенту рекомендации по питанию в случаях управления как регулярной, так и непредвиденной физической активностью, и для достижения индивидуальных целей в соревновательных видах спорта.
· Рекомендуется питание с достаточной калорийностью пищи с учетом необходимых питательных веществ детям с СД1 с целью поддержания идеальной массы тела, оптимизации роста и развития ребенка [100].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Профилактика избыточной массы тела и ожирения при СД1 является одной из ключевых стратегией мониторинга за здоровьем пациентов и должна включать семейный подход.
· Рекомендуется оптимальное распределение макронутриентов в питании у детей и подростков с СД1 в зависимости от индивидуальных особенностей. За счет углеводсодержащих продуктов должно покрываться 45-50% суточной энергетической потребности, жиров - <35% (в тч насыщенные жиры <10%), белков 15 - 20% [101].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется сопоставление дозы прандиального инсулина с количеством употребляемых углеводов у пациентов с СД 1, что способствует большой гибкости в питании, времени приема пищи и улучшает гликемический контроль и качество жизни [98,102].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарии. Существует несколько методов количественной оценки углеводов:
- подсчет хлебных единиц (ХЕ), когда 1 ХЕ соответствует 10, 12 или 15 грамм углеводов;
- подсчет непосредственного количества грамм углеводов.
Нет убедительных доказательств того, что один конкретный метод превосходит другой. В Российской Федерации чаще используется метод оценки углеводов по ХЕ, когда 1 ХЕ соответствует 10 г углеводов.
· Рекомендуется учет гликемического индекса пищевых продуктов и блюд при питании у пациентов с СД1, что обеспечивает улучшение гликемического контроля по сравнению с простым подсчетом общего количества углеводов в питании [103,104].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
· Рекомендуется коррекция дозы прандиального инсулина и метода его введения при употреблении в питании продуктов с высоким содержанием белков и жиров пациентам с СД1 с целью улучшения показателей гликемического контроля [103,105-107].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Комментарии. Пищевые жиры и белки влияют на раннюю и отсроченную постпрандиальную гликемию.
· Рекомендуется проведение повторного обучения в «Школе для пациентов с сахарным диабетом» у пациентов с СД1 и повторными эпизодами ДКА или частыми эпизодами гипергликемии, что чаще всего связано с бесконтрольным и беспорядочным питанием, с целью предотвращения возникновения этих острых осложнений СД [108].[123].
Уровень убедительности рекомендаций с (уровень достоверности доказательств -5).
· Рекомендуются регулярные физические нагрузки у пациентов с СД1 с целью улучшения показателей гликемического контроля [109,110].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии: К преимуществам физических нагрузок, помимо положительного влияния на HbA1c, также относится контроль веса, снижение риска сердечно-сосудистых заболеваний [111] и улучшение самочувствия [112]. Всем детям и подросткам в возрасте от 6 до 18 лет рекомендуется регулярная физическая активность продолжительностью 60 минут или более ежедневно, которая должна включать (1) аэробную активность от умеренной до интенсивной, (2) упражнения для укрепления мышечной и (3) костной ткани. Рекомендуемый уровень физических нагрузок выбирается индивидуально. Пациентам с пролиферативной ретинопатией и диабетической нефропатией следует подбирать вид физических нагрузок, не приводящий к значимому повышению артериального давления [113].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Молодые люди с впервые диагностированным СД1 по-видимому, имеют большую частоту депрессии, тревоги, психологических расстройств и расстройств питания по сравнению со своими сверстниками без СД и нуждаются в психологической поддержке.
· Рекомендуется прием (тестирование, консультация) медицинского психолога пациентам с хронически декомпенсированным СД1 вместе с родителями для диагностики психологических проблем, достижения и поддержания целей лечения [99,114,115].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Дети с рецидивирующим ДКА чаще имеют психические расстройства, чем дети с хорошим гликемическим контролем. Плохой гликемический контроль также связан с рядом других психосоциальных проблем, включая беспокойство, низкую самооценку.
· Рекомендуется индивидуальная или/и групповая клинико-психологическая коррекция детям с СД1 при наличии эмоциональных и поведенческих трудностей, выявленных при проведении тестирования на приеме медицинского психолога, с целью повышения приверженности к лечению и психологической адаптации [99,115].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
· Рекомендуется семейное клинико-психологическое консультирование детям с СД1 при наличии трудностей в детско-родительских отношениях, выявленных при проведении тестирования на приеме медицинского психолога, с целью повышения приверженности к лечению и психологической адаптации семьи [99,115].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
· инсулинотерапия;
· обучение самоконтролю и проведение его в домашних условиях;
· питание;
· физические нагрузки;
· психологическая помощь.
3,1 Оценка и целевые показатели гликемического контроля.
· Рекомендуется исследование уровня HbA1c каждые три месяца у всех пациентов с СД1 с целью оценки гликемического контроля и эффективности проводимого лечения [19,20].Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
· Рекомендуется использование амбулаторного гликемического профиля и стандартизированных показателей непрерывного мониторирования глюкозы (НМГ), включая время в диапазонах (время в целевом диапазоне, время выше целевого диапазона, время ниже целевого диапазона), у пациентов с СД1 для оценки гликемического контроля и проводимой терапии в дополнение к НbА1с (табл. 4) [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии:
Таблица 4Стандартизованные показатели непрерывного мониторирования глюкозы для клинического применения у детей с сахарным диабетом 1 типа.
| Основные | |
| Количество дней ношения устройства НМГ | ≥14 дней |
| Доля времени с активным устройством НМГ | ≥70% |
| Среднее значение уровня глюкозы | - |
| Время выше целевого диапазона: % измерений и время в диапазоне >10,0 ммоль/л (Уровень 1)a | <25% <6 ч |
| Время в целевом диапазоне: % измерений и время в диапазоне 3,9-10,0 ммоль/л | >70% >16 ч 48 м |
| Время ниже целевого диапазона: % измерений и время в диапазоне <3,9 ммоль/л (Уровень 1)b | <4% <1 ч |
| Дополнительные | |
| Индикатор контроля уровня глюкозы (Glucose management indicator [GMI]) | - |
| Коэффициент вариабельности уровня глюкозы | ≤ 36 % |
| Время выше целевого диапазона: % измерений и время в диапазоне >13,9 ммоль/л (Уровень 2) | <5% < 1 ч 12 м |
| Время ниже целевого диапазона: % измерений и время в диапазоне <3,0 ммоль/л (Уровень 2) | <1% < 15 м |
A Включая значения >13,9 ммоль/л.
B Включая значения <3,0 ммоль/л.
· Рекомендуется достижение и поддержание HbA1c на уровне <7,0% у пациентов с СД1 для снижения риска развития и прогрессирования хронических осложнений СД1 (табл. 5) [22,23].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 3).
Комментарии:
Таблица 5Целевой уровень HbA1c и гликемии у детей и подростков с сахарным диабетом 1 типа (адапт. ISPAD 2018 [5]).
| Через 2 часа после еды | 5,0-10,0 ммоль/л | |
| На ночь / ночью | 4,4-7,8 ммоль/л | |
| НbА1с | <7,0% | |
Последние данные свидетельствуют о том, что снижении целевого уровня НbА1с на индивидуальном и популяционном уровне приводят к снижению среднего HbA1c без увеличения частоты тяжелой гипогликемии и гипогликемической комы, даже у детей с HbA1c менее 7% [24].
· Рекомендуется при оценке гликемического контроля по стандартизированным показателям НМГ/амбулаторному гликемическому профилю, в дополнение к НbА1с достижение и поддержание времени в целевом диапазоне на уровне >70% и времени ниже целевого диапазона <4%, у пациентов с СД1 для снижения риска развития и прогрессирования микрососудистых осложнений СД1 [25,26].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 3).
· Рекомендуется индивидуализированный подход при выборе целевых уровней гликемического контроля у пациентов с СД1, ориентируясь на достижение более низкого уровня HbA1c с целью снижения необоснованного риска тяжелой гипогликемии, частых эпизодов легкой гипогликемии и сохранения качества жизни ребенка и родителей [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Выбор целевого показателя HbA1c необходимо всегда рассматривать как компромисс между риском развития гипо - и гипергликемии и их последствиями, ожидаемой пользой снижения риска в отношении обусловленных СД1 острых и хронических осложнений, предпочтений пациента и приверженности пациента терапии.
Целевые уровни глюкозы и НbА1с должны быть индивидуализированы для каждого пациента:
O Более низкий уровень НbА1с (<6,5%) допустим только при отсутствии необоснованного риска тяжелой гипогликемии, частых эпизодов легкой гипогликемии и снижения качества жизни ребенка и родителей;
O Более высокий уровень НbА1с (<7,5%) целесообразен у детей, которые не могут сообщить о симптомах гипогликемии, с нарушением восприятия гипогликемии/тяжелой гипогликемией в анамнезе, недостаточным контролем уровня глюкозы.
O У пациентов с СД1 и эпизодами тяжёлой гипогликемии за последние три месяца целесообразно повысить целевой уровень HbA1c для восстановления нормальной реакции на гипогликемию и снижения риска тяжелой гипогликемии [27].
Необходимыми условиями достижения целевого уровня гликемического контроля является:
O Регулярной контроль НbА1с;
O Использование НМГ или регулярный самоконтроль 6-10 раз в сутки;
O Регулярная оценка и коррекция лечения.
3,2 Инсулинотерапия.
Заместительная инсулинотерапия на сегодняшний день является основным и неотъемлемым компонентом и единственным медикаментозным методом лечения СД1 у детей.Во всех возрастных группах основной целью инсулинотерапии является достижение и поддержание близкого к физиологическому уровня инсулинемии и оптимальный гликемический контроль.
· Рекомендуется проведение заместительной инсулинотерапии человеческими генно-инженерными препаратами инсулина и их аналогами (табл. 6) у пациентов с СД1 для эффективного и безопасного достижения целевых показателей гликемического контроля [28-41].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарий:
Таблица 6Виды и профиль действия препаратов инсулина.
| Инсулины короткого действия и их аналоги для инъекционного введения | Сверхбыстрого действия (аналоги инсулина человека), ИСБД | Инсулин аспарт** (имеющий в составе вспомогательные вещества: никотинамидa и аргининa) [42,43] | 5-10 минут | 1-3 | 3-5 | Старше 1 года |
| Ультракороткого действия (аналоги инсулина человека), ИУКД | Инсулин аспарт** [36,39] | 10-20 минут | 1-3 | 3-5 | Старше 1 года | |
| Инсулин глулизин** [30,31] | Старше 6 лет | |||||
| Инсулин лизпро** 100 ЕД/мл [31-33,35] | Нет | |||||
| Короткого действия, ИКД | Инсулин растворимый человеческий генно-инженерный** [32,33] | 0,5-1 | 2-4 | 5-8 | Нет | |
| Инсулины средней продолжительности действия и их аналоги для инъекционного введения | Средней продолжительности действия (НПХ-инсулины) | Инсулин-изофан человеческий генно-инженерный** [28,29,41] | 2-4 | 4-12 | 12-24 | Нет |
| Инсулины длительного действия для инъекций и их аналоги | Длительного действия (аналоги инсулина человека), ИДД | Инсулин гларгин** 100 ЕД/мл [28,29] | 2-4 | 8-12 | 22-24 | Старше 2 лет |
| Инсулин детемир** [38,40,41] | 1-2 | 4-7 | 20-24 | |||
| Сверхдлительного действия (аналоги инсулина человека), ИСДД | Инсулин гларгин** 300 ЕД/мл [44] | 2-6 | Не выражен | 30-36 | Старше 6 лет | |
| Инсулин деглудек** [37-39] | 0,5-1,5 | Не выражен | Более 42 | Старше 1 года | ||
| Инсулины для инъекций и их аналоги средней продолжительности или длительного действия в комбинации с инсулинами короткого действия | Комбинация ИСДД и ИУКД (аналоги инсулина человека) | инсулин деглудек + инсулин аспарт** [36] | Такие же, как у инсулинов аспарт и деглудек, в комбинации они действуют раздельно | Старше 2 лет | ||
Дозы препаратов инсулина и схема введения подбирается индивидуально для каждого пациента исходя из возраста, профиля действия инсулина, индивидуальной переносимости и пр. на основании данных гликемического контроля (показателей гликемии и уровня НbА1с). Дозы препаратов инсулина и схема их введения может значительно варьировать между пациентами с СД1, в том числе в период ремиссии дозы препаратов инсулина могут быть минимальными, вплоть до полной отмены (полная ремиссия СД1) на определенное время, однако окончательное решение о схеме и дозах зависит строго от показателей гликемии и уровня НbА1с.
В реальной клинической практике перевод с одного препарата инсулина и его аналогов на другой происходит достаточно часто. При переводе пациента с одного инсулина на другой необходимо соблюдать следующий алгоритм требований для наилучшего обеспечения безопасности пациента [45]:
1. В случае разных МНН.
• Перевод с одного препарата инсулина и его аналогов на другой должен осуществляться строго по медицинским показаниям, только при участии врача, требует более частого самоконтроля уровня глюкозы, обучения пациента и коррекции дозы вновь назначенного инсулина.
• Перевод может быть осуществлен с одного препарата инсулина и его аналогов на другой как в рамках одной группы по АТХ-классификации, так и со сменой АТХ-группы (например, перевод с человеческого инсулина на аналог инсулина и наоборот).
2. В случае одного и того же МНН.
• Перевод пациентов с одного инсулина и его аналогов на другой с подтвержденной взаимозаменяемостью ( подтвержденной биоэквивалентностью в отношении фармакокинетики, фармакодинамики и безопасности действия), как правило, не требует более частого самоконтроля уровня глюкозы, обучения пациента и коррекции дозы вновь назначенного инсулина.
• Перевод пациентов с одного инсулина и его аналогов на другой в рамках одного МНН, но с разной фармакокинетикой и фармакодинамикой должен осуществляться по правилам, указанным для препаратов с разными МНН.
3. В случае развития нежелательных явлений как при назначении инсулинотерапии, так и переводе с одного препарата инсулина и его аналогов на другой, к которым относятся ухудшение гликемического контроля, существенное изменение потребности/дозы инсулина, развитие аллергических реакций, обязательно сообщение в Федеральную службу по надзору в сфере здравоохранения.
4.Решение о переводе с одного препарата инсулина и его аналогов на другой принимает врач с учетом актуальной инструкции по применению.
· Рекомендуется начинать инсулинотерапию как можно раньше (в течение 6 часов при наличии кетонурии/кетонемии) у пациентов с впервые диагностированным СД1 для предотвращения развития ДКА [46].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарий. При наличии клинических проявлений ДКА необходимо проведение диагностических и лечебных мероприятий в соответствии с разделом Диабетический кетоацидоз.
· Рекомендуется введение инсулина и его аналогов в интенсифицированном режиме путем множественных инъекций инсулина (МИИ) или непрерывной подкожной инфузии инсулина (НПИИ) у всех пациентов с СД1 с целью снижения риска развития микро- и макрососудистых сосудистых осложнений СД1 [47-49,49,50].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Несмотря на то, что данные об эффективности интенсифицированной инсулинотерапии в отношении риска микро - и макрососудитсых осложнений СД1 были получены у подростков и взрослых, нет никаких оснований предполагать, что эти данные не могут распространяться на детей.
· Рекомендуется индивидуализация и адаптация инсулинотерапии (вид инсулина и его аналогов, схема инсулинотерапии/настройки инсулиновой помпы***) в зависимости от профиля гликемии у пациентов с СД1 с целью оптимизации гликемического контроля [46].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарий. Независимо от метода инсулинотерапии и режима инъекций инсулина пациент и члены семьи должны пройти обучение, соответствующее возрасту, зрелости и индивидуальным потребностям ребенка и семьи.
· Рекомендуется использование ИУКД и ИСБД в качестве препаратов выбора у пациентов с СД1 (табл. 6) с целью снижения риска гипогликемии [51].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
· Рекомендуется использование ИДД и ИСДД в качестве препаратов выбора аналогов (табл. 6) у пациентов с СД1 с целью снижения уровня HbA1c и риска гипогликемии [28,29,36,40,41,52].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 2).
· Рекомендуется использовать иглы для инсулиновых шприц-ручек и инсулиновых шприцев длиной не более 6 мм у пациентов с СД1 для минимизации риска в/м введения [53-55].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Комментарии: Инъекции инсулина 4-мм иглами для инсулиновых шприц-ручек нужно делать под углом 90°, независимо от возраста, пола, ИМТ. У детей в возрасте 6 лет и младше, а также при использовании игл для инсулиновых шприц-ручек длиной >4 мм или инсулиновых шприцев, необходимо формирование кожной складки и/или угла наклона 45°, чтобы избежать в/м введения.
· Не рекомендуется применение инсулиновых шприцев у детей с СД1 младше 6 лет из-за высокого риска в/м инъекций [55-59].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется однократное использование игл для инсулиновых шприц-ручек и инсулиновых шприцев у пациентов с СД1 для обеспечения инфекционной безопасности и профилактики липодистрофий [53,55,60].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 2).
Комментарии. Согласно инструкции к инсулиновым шприц-ручкам, иглы должны использоваться однократно.
· Рекомендуется регулярно (не реже 1 раза в 6 месяцев) проводить визуальный осмотр и пальпацию мест инъекций и оценивать навыки инъекций инсулина у пациентов с СД1, получающих инсулинотерапию, с целью снижения риска формирования липодистрофии [55,58].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарий. Пациенты с СД1 и их родители должны научиться самостоятельно осматривать места инъекций и распознавать липодистрофии.
· Рекомендуется при каждой инъекции менять место введения, использовать большие области для введения инсулина у пациентов с СД1, получающих инсулинотерапию, с целью предотвращения образования липодистрофии [46,55].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Не рекомендуется введение инсулина в область липодистрофии у пациентов с СД1, получающих инсулинотерапию, для предупреждения нарушения всасывания инсулина и вариабельности гликемии [46,55].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
3,2,1 Помповая инсулинотерапия.
Помповая инсулинотерапия или НПИИ - современный метод инсулинотерапии, позволяющий лучше всего имитировать физиологический профиль инсулинемии. В режиме НПИИ инсулин вводится подкожно, непрерывно путем предварительно запрограммированной базальной скорости и введением отдельных болюсов на приемы пищи и в случае гипергликемии.· Рекомендуется применение инсулиновых помп*** у пациентов с СД1 независимо от возраста с целью улучшения показателей гликемического контроля [61,62].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии. Применение НПИИ способствует эффективному и безопасному достижению целевого уровня HbA1c, снижению частоты гипогликемии, снижение вариабельности гликемии [61-63]. Использование дополнительных функций и возможностей, таких как автоматический калькулятор болюса, временная базальная скорость и считывание данных с инсулиновой помпы, способствует лучшим показателям гликемии [64-69]. При этом наибольшей эффективностью в отношении снижения уровня HbA1c без учащения эпизодов гипогликемии над МИИ и традиционным самоконтролем обладает помповая инсулинотерапия, дополненная НМГ [63,70]. Кроме того, в настоящее время существуют инсулиновые помпы с функцией прекращения (в том числе предиктивного) подачи инсулина в случае гипогликемии, способствующие сокрушению частоты, продолжительности и выраженности эпизодов гипогликемии [71-73].
Следует отметить, что НПИИ является альтернативным методом введения инсулина и при необходимости (наличие противопоказаний, отсутствии возможности ) инсулинотерапия может проводиться в режиме МИИ.
Применение помповой инсулинотерапии может быть рассмотрено у пациентов при:
O HbA1c выше индивидуального целевого показателя на фоне интенсифицированной инсулинотерапии;
O Тяжелые гипогликемии (≥1 раза за последний год), в том числе вследствие сниженной чувствительности к гипогликемиям;
O Частые эпизоды легкой гипогликемии;
O Высокая вариабельность гликемии независимо от уровня НbА1с;
O Выраженный феномен «утренней зари»;
O Наличие микрососудистых осложнений или факторов риска их развития;
O Необходимость введения малых доз инсулина;
O Значительное снижение качества жизни в связи с необходимостью/боязнью инъекций инсулина.
· Не рекомендуется применение инсулиновых помп*** у пациентов с СД1 при недостаточном уровне знаний/контроле СД, недостаточной эффективности/безопасности и приверженности НПИИ, что может привести к развитию угрожающих для жизни состояний, а именно - острого ДКА [74,75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Проведение помповой инсулинотерапии нецелесообразно в следующих условиях:
O Отказ пациента и/или законного представителя от НПИИ;
O Отсутствие возможности/способности пациента или законного представителя проводить процедуры, связанные с контролем СД и инсулиновой помпой*** включая: регулярный самоконтроль глюкозы, оценку углеводов пищи, введение инсулина, регулярную замену инфузионного набора ;
O Наличие психосоциальных проблем в семье пациента, препятствующие обучению или способные привести к неадекватному обращению с прибором, в том числе наркотическая зависимость и алкоголизм;
O Недостижение индивидуальных целевых показателей гликемического контроля и/или отсутствие значимого (более 0,5%) снижения уровня HbA1c в течение одного года после инициации помповой инсулинотерапии;
O Учащение эпизодов ДКА и тяжелой гипогликемии на фоне НПИИ;
O Индивидуальная плохая переносимость НПИИ: выраженные кожные реакции, частые окклюзии инфузионной системы или другие нежелательные явления, связанные с методом и препятствующие его использованию.
· Рекомендуется применять инсулиновые помпы*** у пациентов с СД1 в условия, позволяющих обеспечить надлежащее обучение и наблюдение пациента с целью эффективного использования данного метода и предотвращения острых осложнений помповой инсулинотерапии [74,75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Применение помповой инсулинотерапии целесообразно при соблюдении следующих условий:
O Перед переводом пациента на НПИИ необходима консультация специалиста для обсуждения основных аспектов помповой инсулинотерапии и готовности пациента, выбора инсулиновой помпы***;
O Пациент обладает достаточными навыками интенсифицированной инсулинотерапии, обучен принципам самоконтроля;
O Для эффективного и безопасного использования инициация НПИИ, обучение пациента и его дальнейшее наблюдение должно проводиться в лечебно-профилактических учреждениях, имеющих в штате необходимых квалифицированных специалистов обладающие достаточным опытом и навыками в помповой инсулинотерапии;
O Периодическое считывание информации с инсулиновых помп***, с целью структурированного представления и анализа полученных данных.
· Рекомендуется использование калькуляторов болюса у пациентов с СД1 на помповой инсулинотерапии с целью достижения лучших показателей гликемического контроля [76].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Применение калькуляторов болюса помогает определить необходимые дозы инсулина на еду и коррекцию гликемии и связано с улучшением показателей гликемического контроля, поэтому должно рекомендоваться к использованию пациентами.
3,3 Мониторинг глюкозы.
· Рекомендуется проведение регулярного контроля глюкозы в крови (ГК) у пациентов с СД1 с целью достижения оптимального гликемического контроля и снижения риска осложнений СД1 [77-82].Уровень убедительности рекомендаций А (уровень достоверности доказательств - 3).
Комментарии. Контроль ГК проводится с использованием глюкометров или систем НМГ. В домашних условиях используются индивидуальные глюкометры. В настоящее время существуют глюкометры с настройкой индивидуального целевого диапазона гликемии, а также глюкометры с функцией беспроводной передачи данных об уровне глюкозы медицинским специалистам, родственникам или в установленное на смартфон пациента специальное приложение для использования при дистанционном наблюдении.
Индивидуальные глюкометры должны соответствовать ГОСТ Р ИСО 15197-2015 по аналитической и клинической точности. При уровне глюкозы плазмы крови <5,6 ммоль/л 95% измерений должны отклоняться от эталонного анализатора не более чем на ± 0,8 ммоль/л, при уровне глюкозы плазмы крови ≥5,6 ммоль/л 95% измерений должны отклоняться от эталонного анализатора не более чем на ±15%.
В условиях медицинских организаций, помимо лабораторных анализаторов, необходимо использовать глюкометры для профессионального применения (многопользовательские, госпитальные), обладающими более высокой точностью измерения по сравнению с индивидуальными глюкометрами и выдерживающие многократные циклы дезинфекции в соответствии с хорошо валидированными методами, представленными производителем .
· Рекомендуется измерение ГК глюкометром с частотой не менее 6 раз в сутки у пациентов с СД1 с целью оптимизации самоконтроля и инсулинотерапии, снижения риска осложнений, улучшения показателей гликемического контроля [77,78].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
Комментарии. Пациентам с СД1 может быть рекомендовано самостоятельное измерение ГК в следующее время:
O перед основными приемами пищи и через 2-3 часа после еды;
O перед сном, при пробуждении и ночью;
O при физических нагрузках;
O при подозрении на гипогликемию и после ее купирования;
O во время интеркуррентных заболеваний.
Рекомендуемое время и частота измерения ГК глюкометром должны быть индивидуализированы для каждого пациента с целью достижения оптимального гликемического контроля.
· Рекомендуется измерение ГК глюкометром не менее 4 раз в сутки при использовании НМГ в реальном времени и не менее 2 раз в сутки при использовании флеш-мониторинга глюкозы (ФМГ) у пациентов с СД1 с целью оценки точности данных и/или калибровки [83-87].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
Комментарии. Рост точности измерений в современных системах НМГ позволяет значительно сократить частоту традиционного самоконтроля глюкометром в пользу использования данных НМГ. ФМГ может быть использован вместо глюкометра для принятия клинических решений за исключением отдельных случаев (гипогликемии, быстрого изменения ГК или если симптомы не соответствуют показателям системы).
· Рекомендуется оценка гликемического профиля у пациентов с СД1 с целью коррекции проводимого лечения на основании данных показателей [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Пациентам или законным представителям должно быть рекомендовано фиксировать в дневниках самоконтроля данные с указанием даты и времени о показателях ГК, дозах инсулина, принятых углеводах, эпизодах гипо - и гипергликемии и других состояниях (болезнь, физические нагрузки ). Данные самоконтроля должны регулярно анализироваться пациентами и родителями, а также необходимы при проведении визитов к лечащему врачу для своевременной оценки и коррекции проводимого лечения.
С учетом большого объема информации, накапливаемого в процессе использования, и возникающими трудностями в их наглядной интерпретации специалистами, периодическое считывание данных с медицинских изделий (НМГ, инсулиновые помпы***, глюкометры) с последующим анализом, с использованием специализированного программного обеспечения способствует лучшему гликемическому контролю [69].
3,3,1 Непрерывное мониторирование глюкозы.
Системы НМГ измеряют глюкозу в интерстициальной жидкости непрерывно с частотой 5-15 минут с помощью устанавливаемых подкожно электродов (сенсоров). Доступные в настоящее время системы НМГ могут быть условно разделены на три категории: 1) НМГ в «слепом» режиме или т.н. профессиональное НМГ; 2) НМГ в реальном времени; 3) периодически сканируемое/просматриваемое НМГ (или ФМГ).Особенностью систем НМГ в «слепом» режиме является ретроспективный характер получаемых за короткий промежуток времени данных. Основным назначением данного метода является объективная оценка гликемического профиля, выявление скрытых эпизодов гипо-/гипергликемий с целью коррекции проводимого лечения, а также обучение пациентов.
Особенностью систем НМГ в реальном времени является наличие сигналов тревоги, которые активируются при достижении гликемией пороговых значений, прогнозировании этих значений, а также при достижении порогового уровня скорости изменения гликемии. Некоторые модели систем НМГ в «реальном» времени передают данные об уровне глюкозы непосредственно на смартфон, откуда они могут быть сохранены на сервере в сети Интернет и использованы для удаленного мониторинга.
В свою очередь, система ФМГ не отображает данные об уровне глюкозы автоматически, а только при т.н. «сканировании» - приближении на короткое расстояние сканера к датчику системы. ФМГ предоставляет информацию о текущем уровне глюкозы, тенденции (направления и скорости) изменения глюкозы, график глюкозы за последнее и предыдущее время. В отличие от НМГ в реальном времени, ФМГ, доступный в настоящее время, не обладает сигналами тревоги.
Преимуществами НМГ в реальном времени и ФМГ является улучшение НbА1с, снижение частоты гипогликемии, снижение вариабельности гликемии, снижение времени в гипогликемии, увеличение времени в целевом диапазоне [80,81,84,88,89]. Эффективность НМГ во многом определяется частотой использования сенсора, с минимально необходимым временем 60% [90].
· Рекомендуется применение НМГ в «слепом» режиме у пациентов с СД1 с целью оценки гликемического профиля и эффективности проводимого лечения [91-93].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарии. НМГ в «слепом» режиме следует проводить кратковременно (до 14 дней) как амбулаторно, так и в условиях стационара в рамках госпитализации с целью:
O Выявления ночной гипо- и гипергликемии (феномен «утренней зари»);
O Оценки расширенного перечня показателей гликемического контроля в том числе вариабельности гликемии (время в целевом диапазоне/гипогликемии/гипергликемии, SD, сV );
O Выявления индивидуальных постпрандиальных профилей гликемии (ускоренное или замедленное всасывание углеводов из ЖКТ).
O Уточнение эффекта физической нагрузки, гиподинамии, стресса и других факторов на гликемию.
O Формирования индивидуальных рекомендаций в отношении инсулинотерапии и оптимальных алгоритмов снижения вариабельности гликемии (в том числе предотвращения гипогликемий и выраженных гипергликемий).
O В рамках клинических исследований - полноценная оценка эффекта лекарственных средств на гликемию.
· Рекомендуется применение НМГ у детей с СД1 с целью снижения НbА1с, уменьшения вариабельности гликемии, увеличения времени в целевом диапазоне, уменьшения времени ниже целевого диапазона, снижения риска гипогликемии [80-82,94].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Выбор системы НМГ может определяться индивидуальными предпочтениями пациента, а также возможностями или ограничениями конкретной системы (необходимость калибровки, длительность использования сенсора, сигналы тревоги ).
Применение НМГ следует рассмотреть у пациентов при:
O HbA1c выше индивидуального целевого показателя;
O Тяжелые гипогликемии (≥1 раза за последний год);
O Высокая вариабельность гликемии независимо от уровня НbА1с;
O Частые эпизоды легкой гипогликемии;
O Выраженное снижение качества жизни;
O Время в целевом диапазоне менее 70% по данным НМГ в «слепом» режиме.
· Рекомендуется применение НМГ в реальном времени (с функцией сигналов тревоги) у детей с СД1 младше 4-х лет (в связи с возрастными ограничениями к использованию ФМГ), у детей, которые не могут сообщить о симптомах гипо- или гипергликемии и у детей с нарушением восприятия гипогликемии для снижения риска гипогликемии [95-97].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
· Не рекомендуется применение НМГ у пациентов с СД1 при недостаточной эффективности/безопасности и приверженности НМГ с целью снижения рисков острых осложнений СД1 [74,75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Применение НМГ в реальном времени или ФМГ нецелесообразно в следующих условиях:
O Отказ пациента или законного представителя от НМГ;
O Отсутствие возможности и способности пациента и/или законного представителя активно использовать НМГ, проводить регулярный самоконтроль и выполнять рекомендации лечащего врача;
O Индивидуальная непереносимость НМГ: выраженные кожные реакции или другие нежелательные явления, связанные с методом и препятствующие его использованию;
O Недостаточное использование НМГ (<60% времени).
· Рекомендуется применение НМГ у пациентов с СД1 в условиях, позволяющих обеспечить надлежащую эффективность, обучение и наблюдение пациента, с целью снижения рисков острых осложнений СД1 [74,75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Применение НМГ целесообразно в следующих условиях:
O Перед переводом пациента на НМГ необходима консультация специалиста для обсуждения основных аспектов НМГ и готовности пациента, выбора системы НМГ;
O Пациент обладает достаточными навыками интенсифицированной инсулинотерапии, обучен принципам самоконтроля;
O Для эффективного и безопасного использования инициация НМГ, обучение пациента и его дальнейшее наблюдение должны проводиться в лечебно-профилактических учреждениях, имеющих в штате необходимых квалифицированных специалистов, обладающие достаточным опытом и навыками в НМГ;
O Периодическое считывание информации с систем НМГ и глюкометров с целью структурированного анализа полученных данных, в том числе с использованием амбулаторного гликемического профиля.
3,4 Помповая инсулинотерапия с непрерывным мониторированием глюкозы.
Интеграция НМГ и инсулиновой помпы*** в единое устройство позволяет автоматически изменять подачу инсулина по данным сенсора - технология так же называемая «помповой инсулинотерапией с обратной связью». Возможны различные варианты управления введением инсулина по данным НМГ, которые могут использоваться отдельно или дополнять друг друга: остановка подачи инсулина непосредственно при достижении гипогликемического порога, предиктивная остановка подачи инсулина до достижения гипогликемического порога, автоматическое дозирование базального инсулина, автоматическое дозирование болюсного инсулина («микроболюсы»).· Рекомендуется применение помповой инсулинотерапии, дополненной НМГ с остановкой (включая предиктивную) подачи инсулина при гипогликемии, у пациентов с СД1 для снижения частоты легкой и тяжелой гипогликемии [71,73,80].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Остановка введения инсулина помпой происходит автоматически в случае достижения или прогноза (предиктивно) достижения нижнего гликемического порога (устанавливаемого врачом или пациентов) по данным НМГ. Подача инсулина автоматически возобновится через 120 минут или в случае роста уровня глюкозы.
3,5 Обучение.
Обучение является необходимым элементом успешного лечения и контроля СД, которое должно быть доступно для всех детей с СД1 и их родителей [75].· Рекомендуется организация и регулярное проведение «Школ для пациентов с сахарным диабетом» для детей с СД1 и их родителей от момента диагностики заболевания и на всем его протяжении для достижения и поддержания целевого гликемического контроля и психосоциальных целей лечения [98].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Цели и задачи обучения должны быть конкретизированы в соответствии с актуальным состоянием пациента. Обучение должно быть адаптировано для каждого человека в соответствии с возрастом, длительностью СД, образу жизни, способности к обучению Обучение должно быть непрерывным, в «Школу для пациентов с сахарным диабетом» направляются пациенты, не проходившие обучения (первичный цикл), или уже прошедшие обучение (повторные циклы), для поддержания уровня знаний и мотивации или при появлении новых терапевтических целей и технологий.
· Рекомендуется для обучения пациентов с СД1 использовать специально разработанные структурированные программы, адресованные конкретному пациенту: СД1 на режиме многократных инъекций, СД1 на помповой инсулинотерапии с целью улучшения и поддержания показателей гликемического контроля [98,99].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Обучение может проводиться как в индивидуальном порядке, так и в группах пациентов. Содержание обучающих программ должно соответствовать принятым стандартам диагностики и лечения СД, а их структура - учитывать основные принципы педагогики. Программы подразумевают строго практическую направленность и доступность для восприятия. Обязательные разделы обучающих программ:
O общие сведения о СД;
O инсулинотерапия;
O питание;
O самоконтроль гликемии;
O физическая активность;
O гипогликемия.
Содержание и подача структурированных программ нуждается в регулярном пересмотре, чтобы соответствовать потребностям пациентов с СД1, сложившейся практике и учесть изменения в подходе к контролю СД и технологиях.
· Рекомендуется проведение обучения пациентов с СД1 квалифицированными специалистами (специально подготовленными медицинскими работниками: врачом-детским эндокринологом или медицинской сестрой) с целью улучшения и поддержания показателей гликемического контроля [75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. При наличии возможности желательно участие в обучении медицинского психолога и врача-диетолога.
3,6 Диетотерапия.
Диетотерапия является одним из элементов лечения СД1 и рекомендуется для всех детей и подростков.· Рекомендуется реализация индивидуального плана питания у пациентов с СД1 с учетом и коррекцией прандиального инсулинас целью улучшения гликемического контроля [100].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии: Диетические рекомендации должны быть основаны на принципах здорового питания и подходить для всех детей, подростков с СД1 и их семей с целью улучшения результатов контроля СД и снижения сердечно-сосудистых рисков. Пищевые рекомендации должны быть адаптированы к культурным, этническим и семейным традициям, а также учитывать когнитивные и психосоциальные аспекты ребенка и семьи. Необходимо предоставлять пациенту рекомендации по питанию в случаях управления как регулярной, так и непредвиденной физической активностью, и для достижения индивидуальных целей в соревновательных видах спорта.
· Рекомендуется питание с достаточной калорийностью пищи с учетом необходимых питательных веществ детям с СД1 с целью поддержания идеальной массы тела, оптимизации роста и развития ребенка [100].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Профилактика избыточной массы тела и ожирения при СД1 является одной из ключевых стратегией мониторинга за здоровьем пациентов и должна включать семейный подход.
· Рекомендуется оптимальное распределение макронутриентов в питании у детей и подростков с СД1 в зависимости от индивидуальных особенностей. За счет углеводсодержащих продуктов должно покрываться 45-50% суточной энергетической потребности, жиров - <35% (в тч насыщенные жиры <10%), белков 15 - 20% [101].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется сопоставление дозы прандиального инсулина с количеством употребляемых углеводов у пациентов с СД 1, что способствует большой гибкости в питании, времени приема пищи и улучшает гликемический контроль и качество жизни [98,102].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарии. Существует несколько методов количественной оценки углеводов:
- подсчет хлебных единиц (ХЕ), когда 1 ХЕ соответствует 10, 12 или 15 грамм углеводов;
- подсчет непосредственного количества грамм углеводов.
Нет убедительных доказательств того, что один конкретный метод превосходит другой. В Российской Федерации чаще используется метод оценки углеводов по ХЕ, когда 1 ХЕ соответствует 10 г углеводов.
· Рекомендуется учет гликемического индекса пищевых продуктов и блюд при питании у пациентов с СД1, что обеспечивает улучшение гликемического контроля по сравнению с простым подсчетом общего количества углеводов в питании [103,104].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
· Рекомендуется коррекция дозы прандиального инсулина и метода его введения при употреблении в питании продуктов с высоким содержанием белков и жиров пациентам с СД1 с целью улучшения показателей гликемического контроля [103,105-107].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Комментарии. Пищевые жиры и белки влияют на раннюю и отсроченную постпрандиальную гликемию.
· Рекомендуется проведение повторного обучения в «Школе для пациентов с сахарным диабетом» у пациентов с СД1 и повторными эпизодами ДКА или частыми эпизодами гипергликемии, что чаще всего связано с бесконтрольным и беспорядочным питанием, с целью предотвращения возникновения этих острых осложнений СД [108].[123].
Уровень убедительности рекомендаций с (уровень достоверности доказательств -5).
3,7 Физические нагрузки.
Рекомендации о необходимости регулярных физических нагрузок являются неотъемлемой частью лечения СД1. Необходимо проводить постоянное обучение пациента и его семьи поведению перед, во время и после физических нагрузок в зависимости от уровня гликемии, предшествующих доз введенного инсулина, предполагаемого уровня и длительности физической нагрузки.· Рекомендуются регулярные физические нагрузки у пациентов с СД1 с целью улучшения показателей гликемического контроля [109,110].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии: К преимуществам физических нагрузок, помимо положительного влияния на HbA1c, также относится контроль веса, снижение риска сердечно-сосудистых заболеваний [111] и улучшение самочувствия [112]. Всем детям и подросткам в возрасте от 6 до 18 лет рекомендуется регулярная физическая активность продолжительностью 60 минут или более ежедневно, которая должна включать (1) аэробную активность от умеренной до интенсивной, (2) упражнения для укрепления мышечной и (3) костной ткани. Рекомендуемый уровень физических нагрузок выбирается индивидуально. Пациентам с пролиферативной ретинопатией и диабетической нефропатией следует подбирать вид физических нагрузок, не приводящий к значимому повышению артериального давления [113].
3,8 Психологическая поддержка.
· Рекомендуется прием (тестирование, консультация) медицинского психолога пациентам с СД1 для диагностики психологических проблем, адаптации к заболеванию, достижения и поддержания целей лечения [99,114,115].Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Молодые люди с впервые диагностированным СД1 по-видимому, имеют большую частоту депрессии, тревоги, психологических расстройств и расстройств питания по сравнению со своими сверстниками без СД и нуждаются в психологической поддержке.
· Рекомендуется прием (тестирование, консультация) медицинского психолога пациентам с хронически декомпенсированным СД1 вместе с родителями для диагностики психологических проблем, достижения и поддержания целей лечения [99,114,115].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Дети с рецидивирующим ДКА чаще имеют психические расстройства, чем дети с хорошим гликемическим контролем. Плохой гликемический контроль также связан с рядом других психосоциальных проблем, включая беспокойство, низкую самооценку.
· Рекомендуется индивидуальная или/и групповая клинико-психологическая коррекция детям с СД1 при наличии эмоциональных и поведенческих трудностей, выявленных при проведении тестирования на приеме медицинского психолога, с целью повышения приверженности к лечению и психологической адаптации [99,115].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
· Рекомендуется семейное клинико-психологическое консультирование детям с СД1 при наличии трудностей в детско-родительских отношениях, выявленных при проведении тестирования на приеме медицинского психолога, с целью повышения приверженности к лечению и психологической адаптации семьи [99,115].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
3,9 Обезболивание.
Не предусмотрено.3,10 Иное лечение.
Не предусмотрено.|
|
Реабилитация и амбулаторное лечение
· Рекомендуется рассмотреть возможность санаторно-курортного лечения пациенту с СД 1 в отсутствие значимой метаболической декомпенсации и без выраженных стадий осложнений для улучшения общего состояния здоровья [116,117].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Могут быть рекомендованы санаторно-курортные организации - бальнеологические курорты с питьевыми минеральными водами и водами минеральными природными для наружного бальнеотерапевтического применения. Целесообразно использование таких факторов как диетическая терапия, ЛФК. Следует соблюдать осторожность при наличии ХБП С4, пролиферативной.
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Могут быть рекомендованы санаторно-курортные организации - бальнеологические курорты с питьевыми минеральными водами и водами минеральными природными для наружного бальнеотерапевтического применения. Целесообразно использование таких факторов как диетическая терапия, ЛФК. Следует соблюдать осторожность при наличии ХБП С4, пролиферативной.
Профилактика
· Рекомендуется консультация и осмотр врача-детского эндокринолога не реже одного раза в три месяца пациентов с СД1 для оценки состояния здоровья, гликемического контроля (гликемический профиль, HbA1c), инсулинотерапии, физического и полового развития, состояния мест инъекций инсулина/введений инфузионной системы/сенсоров НМГ [118].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Амбулаторные визиты должны включать в себя периодическую оценку и регистрацию следующего:
· Общее состояние здоровья и самочувствие:
O Жалобы с особым вниманием к симптомам, связанным с осложнениями и сопутствующей патологией. При наличии симптомов или признаков, может потребоваться дополнительное обследование;
O Интеркуррентные заболевания, неотложные состояния, связанные с СД, госпитализации. При первичном обращении провести тщательный расспрос о времени появления первых симптомов заболевания, видах и дозах вводимых инсулинов, причинах и длительности госпитализаций, в том числе в случаях развития ДКА и тяжелых гипогликемий, время и методы диагностики специфических осложнений в случае их наличия, сопутствующих эндокринных и системных заболеваниях, наследственный анамнез.
· Гликемический контроль:
O Оценка уровня HbA1c за последние три месяца;
O Анализ показателей домашнего мониторинга глюкозы (показания глюкометра, НМГ, ФМГ);
O Оценка частоты/степени гипогликемии, включая определение чувствительности к гипогликемии, метод лечения гипогликемии.
· Инсулинотерапия:
O Типы и дозы инсулина;
O Коррекция инсулинотерапии с учетом уровня глюкозы, питания и физических нагрузок;
O Техника инъекции.
· Общий осмотр:
O Рост, масса тела, ИМТ и половое развитие;
O Кожные покровы (липоидный некробиоз, акантоз) и места инъекций инсулина/введений инфузионной системы/сенсоров НМГ (липодистрофии, местные реакции);
O Слизистые оболочки полости рта и зубы (кариес, гингивит);
O Наличие ограничения подвижности суставов;
O Исследование щитовидной железы, органов грудной клетки и брюшной полости (гепатомегалия), стопы (мозоли, вросшие ногти на ногах и других поражений);
O АД с учетом показателей, соответствующих возрасту.
· Острые и хронические осложнения СД1 и сопутствующая патология:
O Диабетическая ретинопатия;
O Диабетическая нефропатия;
O Диабетическая нейропатия;
O Макрососудистые осложнения;
O Диабетический кетоацидоз;
O Тяжелая гипогликемия (глюкагон** должен быть доступен для всех пациентов, родителей и лиц, обеспечивающих уход за детьми с СД1).
· Сопутствующая патология:
O Гипо- и гипертиреоз;
O Целиакия;
O Нарушения менструального цикла;
O Другие заболевания и состояния.
· Рекомендуется рассмотреть возможность дистанционного консультирования врачом-детским эндокринологом с применением телемедицинских технологий пациентов с СД1 с целью динамического наблюдения и достижения целевых показателей гликемии [119-121].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 1).
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Амбулаторные визиты должны включать в себя периодическую оценку и регистрацию следующего:
· Общее состояние здоровья и самочувствие:
O Жалобы с особым вниманием к симптомам, связанным с осложнениями и сопутствующей патологией. При наличии симптомов или признаков, может потребоваться дополнительное обследование;
O Интеркуррентные заболевания, неотложные состояния, связанные с СД, госпитализации. При первичном обращении провести тщательный расспрос о времени появления первых симптомов заболевания, видах и дозах вводимых инсулинов, причинах и длительности госпитализаций, в том числе в случаях развития ДКА и тяжелых гипогликемий, время и методы диагностики специфических осложнений в случае их наличия, сопутствующих эндокринных и системных заболеваниях, наследственный анамнез.
· Гликемический контроль:
O Оценка уровня HbA1c за последние три месяца;
O Анализ показателей домашнего мониторинга глюкозы (показания глюкометра, НМГ, ФМГ);
O Оценка частоты/степени гипогликемии, включая определение чувствительности к гипогликемии, метод лечения гипогликемии.
· Инсулинотерапия:
O Типы и дозы инсулина;
O Коррекция инсулинотерапии с учетом уровня глюкозы, питания и физических нагрузок;
O Техника инъекции.
· Общий осмотр:
O Рост, масса тела, ИМТ и половое развитие;
O Кожные покровы (липоидный некробиоз, акантоз) и места инъекций инсулина/введений инфузионной системы/сенсоров НМГ (липодистрофии, местные реакции);
O Слизистые оболочки полости рта и зубы (кариес, гингивит);
O Наличие ограничения подвижности суставов;
O Исследование щитовидной железы, органов грудной клетки и брюшной полости (гепатомегалия), стопы (мозоли, вросшие ногти на ногах и других поражений);
O АД с учетом показателей, соответствующих возрасту.
· Острые и хронические осложнения СД1 и сопутствующая патология:
O Диабетическая ретинопатия;
O Диабетическая нефропатия;
O Диабетическая нейропатия;
O Макрососудистые осложнения;
O Диабетический кетоацидоз;
O Тяжелая гипогликемия (глюкагон** должен быть доступен для всех пациентов, родителей и лиц, обеспечивающих уход за детьми с СД1).
· Сопутствующая патология:
O Гипо- и гипертиреоз;
O Целиакия;
O Нарушения менструального цикла;
O Другие заболевания и состояния.
· Рекомендуется рассмотреть возможность дистанционного консультирования врачом-детским эндокринологом с применением телемедицинских технологий пациентов с СД1 с целью динамического наблюдения и достижения целевых показателей гликемии [119-121].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 1).
Организация оказания медицинской помощи
Показания для госпитализации в медицинскую организацию:
1) Форма - плановая; условия - стационар, дневной стационар:
A. При первичном обращении по поводу стойкой гипергликемии без клинических проявлений СД и/или кетоза;
B. Декомпенсация гликемического контроля, высокая вариабельность гликемии, частые эпизоды легкой гипогликемии;
C. Комплексный скрининг осложнений, в отсутствии возможности обследования в амбулаторных условиях;
D. Перевод на НПИИ.
2) Форма - экстренная, неотложная; условия - стационар:
A. При первичном обращении по поводу гипергликемии при наличии клинических проявлений СД и/или кетоза;
B. Тяжелая гипогликемия;
C. ДКА;
D. Острое развитие специфических осложнений.
Показания к выписке пациента из медицинской организации.
1) Форма - плановая; условия - стационар, дневной стационар:
A. Достижение индивидуальных целевых показателей глюкозы с частотой измерений (временем) в целевом диапазоне не менее 50% по данным НМГ или самоконтроля ГК;
2) Форма - экстренная, неотложная; условия - стационар:
Отсутствие клинически значимых метаболических отклонений (показатели КЩС, кетоны в крови и/или моче в пределах нормы), отсутствие острой неврологической симптоматики в сочетании с достижением индивидуальных целевых показателей глюкозы с частотой измерений (временем) в целевом диапазоне не менее 50% по данным НМГ или самоконтроля ГК.
1) Форма - плановая; условия - стационар, дневной стационар:
A. При первичном обращении по поводу стойкой гипергликемии без клинических проявлений СД и/или кетоза;
B. Декомпенсация гликемического контроля, высокая вариабельность гликемии, частые эпизоды легкой гипогликемии;
C. Комплексный скрининг осложнений, в отсутствии возможности обследования в амбулаторных условиях;
D. Перевод на НПИИ.
2) Форма - экстренная, неотложная; условия - стационар:
A. При первичном обращении по поводу гипергликемии при наличии клинических проявлений СД и/или кетоза;
B. Тяжелая гипогликемия;
C. ДКА;
D. Острое развитие специфических осложнений.
Показания к выписке пациента из медицинской организации.
1) Форма - плановая; условия - стационар, дневной стационар:
A. Достижение индивидуальных целевых показателей глюкозы с частотой измерений (временем) в целевом диапазоне не менее 50% по данным НМГ или самоконтроля ГК;
2) Форма - экстренная, неотложная; условия - стационар:
Отсутствие клинически значимых метаболических отклонений (показатели КЩС, кетоны в крови и/или моче в пределах нормы), отсутствие острой неврологической симптоматики в сочетании с достижением индивидуальных целевых показателей глюкозы с частотой измерений (временем) в целевом диапазоне не менее 50% по данным НМГ или самоконтроля ГК.
Дополнительно
7,1 Осложнения.
Специфические осложнения СД в детском и подростковом возрасте - микрососудистые нарушения: диабетические ретинопатия (ДР), нефропатия (ДН), нейропатия.Факторы риска:
· большая длительность заболевания, старший возраст и пубертатный период;
· курение;
· АГ;
· дислипидемия;
· отягощенная наследственность в отношении развития осложнений;
· ожирение;
· сидячий образ жизни.
Патогенез специфических осложнений СД сложен: нарушения микроциркуляции, свертывающей и фибринолитической систем крови, системы антиоксидантной защиты, обмена белковых компонентов сосудистой стенки и проницаемости сосудов. Хроническая гипергликемия активирует процессы неферментативного гликирования белков, полиоловый путь метаболизма глюкозы и прямую глюкозотоксичность.
7,1,1 Диабетическая ретинопатия.
Диабетическая ретинопатия (ДР) - специфичное позднее нейромикрососудистое осложнение СД, развивающееся, как правило, последовательно от изменений, связанных с повышенной проницаемостью и окклюзией ретинальных сосудов до появления новообразованных сосудов и фиброглиальной ткани.Диабетический макулярный отек (ДМО). Утолщение сетчатки, связанное с накоплением жидкости в межклеточном пространстве нейроэпителия вследствие нарушения гематоретинальных барьеров и несоответствия между транссудацией жидкости, и способности к ее реабсорбции. ДМО может развиться при любой стадии.
Классификация ДР выделяет три основных стадии заболевания:
1. Непролиферативная: микроаневризмы, мелкие интраретинальные кровоизлияния, «мягкие» («ватные») экссудаты.
2. Препролиферативная: наличие хотя бы одного из 3 признаков:
O - венозные деформации в 2-х и более квадрантах.
O - умеренные ИРМА хотя бы в одном квадранте.
O - множественных ретинальные геморрагии в 4-х квадрантах глазного дна.
3. Пролиферативная (у детей редко): неоваскуляризация (и/или фиброзная пролиферация) диска зрительного нерва и/или сетчатки, преретинальные и/или витреальные кровоизлияния (гемофтальм), тракционная (или тракционно-регматогенная) отслойка сетчатки, неоваскулярная глаукома.
· Рекомендуется осмотр и консультации врача-офтальмолога ежегодно у пациентов с СД1 в возрасте ≥11 лет при длительности заболевания более 2 лет с целью выявления ДР и других диабетических изменений сетчатки [122].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Скрининг на ДР проводится с помощью определения ретинальной остроты зрения (визометрия), биомикроскопии глазного дна, офтальмоскопии при расширенном зрачке (осмотр периферии глазного дна с использованием трехзеркальной линзы Гольдмана) и биомикрофотография глазного дна с использованием фундус-камеры [123,124].
· Рекомендуется проводить скрининг на ДР чаще одного раза в год у пациентов с СД1 при высоком риске потери зрения с целью его предотвращения [123].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. В связи с потенциальным ухудшением течения ДР у пациентов с длительным плохим гликемическим контролем при его стабильном улучшении рекомендуется проводить офтальмологический мониторинг до начала интенсивного лечения и каждые три месяца в течение 6-12 месяцев после его начала, особенно если ДР перед началом интенсификации терапии находилась на умеренной непролиферативной стадии или более тяжелой, или произошло ее прогрессирование на фоне лечения.
· Рекомендуется проведение лазерной коагуляции сетчатки и интравитреальное введение средств, препятствующих новообразованию сосудов (анти-VEGF) (vascular endothelial growth factor) - ингибиторов эндотелиального фактора роста сосудов, у пациентов с СД1 и тяжелой непролиферативной ретинопатией и/или диабетическим макулярным отеком с целью предотвращения или снижения частоты и/или уровня потери зрения [123].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Несмотря на то, что не имеется достаточно литературных данных, подтверждающих эффективность и безопасность лазерной коагуляции сетчатки и интравитреального введения средств, препятствующих новообразованию сосудов (анти-VEGF) у детей с СД1, данные методы обладают доказанной эффективностью при ДР у взрослых пациентов с СД1 [125] и при ретинопатии недоношенных детей [126]. Поэтому, нет никаких оснований предполагать, что эти данные не могут распространяться на детей с СД1.
7,1,2 Диабетическая нефропатия.
Диабетическая нефропатия (ДН) - специфическое поражение почек при СД, сопровождающееся формированием узелкового гломерулосклероза, приводящего к развитию терминальной почечной недостаточности, требующей проведения заместительной почечной терапии (диализ, трансплантация).Хроническая болезнь почек (ХБП). Это персистирующее в течение трех месяцев или более поражение органа вследствие действия различных этиологических факторов, анатомической основой которого является процесс замещения нормальных анатомических структур фиброзом, приводящий к его дисфункции. [127].
ДН - результат воздействия метаболических (гипергликемия, гиперлипидемия) и гемодинамических (артериальная гипертензия (АГ), внутриклубочковая гипертензия) факторов на почечную микроциркуляцию, модулируемый генетическими факторами [127].
ДН развивается у 20-40% пациентов с СД 1 [128], типично развитие при длительности заболевания более 10 лет, однако при неблагоприятных факторах возможно более раннее развитие. ДН существенно повышает риск кардиоваскулярной патологии и стоимость лечения [129].
Классификация.
Согласно концепции ХБП, оценка стадии почечной патологии осуществляется по величине СКФ, признанной как наиболее полно отражающей количество и суммарный объем работы нефронов, в том числе связанной с выполнением неэкскреторных функций (табл. 7). Кроме того, выделяют три категории альбуминурии ( см табл. 8) [130].8) [142].
Диагноз ДН устанавливается в соответствии с ХБП по стадии снижения скорости клубочковой фильтрации и уровню альбуминурии [131].
Таблица 7. Стадии хронической болезни почек по уровню скорости клубочковой фильтрации.
| ≥90 | Высокая и оптимальная | С1 |
| 60-89 | Незначительно сниженная | С2 |
| 45-59 | Умеренно сниженная | С3а |
| 30-44 | Существенно сниженная | С3б |
| 15-29 | Резко сниженная | С4 |
| <15 | Терминальная почечная недостаточность | С5 |
СКФ - скорость клубочковой фильтрации.
Формула Шварца (модификация вedside) [132,133] для расчета СКФ у детей:
РСКФ (мл/мин/1,73 м²) = (36,2 × Рост(см)) / Креатинин плазмы крови (мкмоль/л).
· Формула Шварца была обновлена в 2009 году и в настоящее время считается лучшим методом оценки СКФ у детей.
· Для определения креатинина в сыворотке крови должны использоваться методы с калибровкой по масс-спектрометрии с изотопным разведением.
· Использование исходной формулы Шварца приводит к завышению СКФ на 20-40%.
Таблица 8Классификация хронической болезни почек по уровню альбуминурии.
| мг/ммоль | мг/г | |||
| А1 | <3 | <30 | <30 | Норма или незначительно повышена |
| А2 | 3-30 | 30-300 | 30-300 | Умеренно повышена |
| А3 | >30 | >300 | >300 | Значительно повышена* |
Примечание: А/Кр - отношение альбумин/креатинин, СЭА - скорость экскреции альбумина, *включая нефротический синдром (экскреция альбумина >2200 мг/24 час [А/Кр>2200 мг/г; >220 мг/ммоль]).
Пример формулировки диагноза:
Формулировка диагноза ДН в соответствии с классификацией ХБП:
1) Диабетическая нефропатия, ХБП С1 (2, 3. 4 или 5) А2.
2) Диабетическая нефропатия, ХБП С1 (2, 3, 4 или 5) А3.
3) Диабетическая нефропатия, ХБП С3 (4 или 5) А1 ( независимо от уровня альбуминурии).
4) Диабетическая нефропатия, ХБП С5 (лечение заместительной почечной терапией).
При нормальном уровне рСКФ и альбумина в моче (стадия С1А1) диагноз ХБП может быть выставлен только при наличии других маркеров повреждения почек [134,135].
В случае нормализации показателей альбуминурии на фоне нефропротективной терапии у пациентов с сохранной рСКФ ≥ 60 мл/мин/1,73 м2 - диагноз ДН, ХБП сохраняется с формулировкой: ДН, ХБП С1-2 А1 (регресс альбуминурии на фоне нефропротективной терапии).
Специфические симптомы ДН на стадии ХБП С1-3а А1-2 отсутствуют у большинства пациентов с СД1 (редко отмечают эпизоды повышения АД). На стадии ХБП С4-5 отмечают слабость, сонливость, быструю утомляемость, выраженные стойкие отеки, стабильно повышенное АД, тошноту, иногда рвоту без облегчения состояния. На стадии ХБП С3-5 А3 отмечают отеки стоп, голеней, иногда бедер, лица, снижение аппетита, нарастание и постоянно повышенное АД.
· Рекомендуется исследование уровня альбумина и креатинина в моче крови ежегодно у пациентов с СД1 в возрасте ≥11 лет при длительности заболевания более 2 лет для оценки соотношения альбумин/креатинин с целью своевременного выявления ДН [122].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Наличие микроальбуминурии подтверждается соотношением альбумин/креатинин от 3 до 30 мг/ммоль или от 30 до 300 мг/ г (разовая порция мочи).
Разовая порция мочи на микроальбуминурию предпочтительнее из-за известных суточных колебаний экскреции альбумина и постуральных эффектов. Сбор суточной мочи на микроальбуминурию затруднителен и мало информативен.
Вследствие биологической вариабельности необходимо использовать два из трех положительных образца утренней мочи на микроальбуминурию для ее подтверждения. Стойкая альбуминурия (протеинурия) определяется наличием изменений в двух или всех трех пробах в течение периода от 3 до 6 месяцев.
Факторами, которые могут давать ложноположительные результаты являются следующие: предшествующая физическая нагрузка, инфекции, повышенная температура тела, менструальные выделения, заболевания почек, лихорадка и выраженная гипергликемия. Аномальные (ложноположительные) результаты тестирования должны перепроверяться, так как микроальбуминурия может быть преходящей.
· Рекомендуется оценка рСКФ у пациентов с СД1 при наличии стойкой альбуминурии (протеинурии) для определения степени нарушения почечной функции [136].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии: Также следует рассмотреть целесообразность оценки рСКФ исходно при манифестации СД1 и повторно при необходимости в зависимости от клинического статуса, возраста, продолжительности СД и терапии.
· Рекомендуется использование препаратов из группы ингибиторов ангиотензинпревращающего фермента (АПФ) (табл. 9) у пациентов с СД1 и постоянной микроальбуминурией для снижения уровня и прогрессирования альбуминурии [137,138].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии:
Таблица 9Ингибиторы ангиотензинпревращающего фермента.
| ингибиторы АПФ | каптоприл** | Внутрь, 2-3 раза в день. | 0,3 мг/кг/на приём | [137] |
| эналаприл** | Внутрь, один раз в сутки. | 10-20 мг/день | [138] |
· Рекомендуется консультация врача-нефролога у пациентов с СД1 при наличии стойкой альбуминурии (протеинурии) для диагностики и лечения ХБП [136].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
7,1,3 Диабетическая нейропатия.
Диабетическая нейропатия - комплекс клинических и субклинических синдромов, каждый из которых характеризуются диффузным или очаговым поражением периферических и/или автономных нервных волокон в результате СД1. Диабетическая дистальная полинейропатия (ДПП) является наиболее распространенной генерализованной формой, при котором присутствует диффузное повреждение всех периферических моторных и сенсорных нервных волокон. Такое повреждение появляется бессимптомно, но затем прогрессирует вначале до снижения сенсорных функций и позднее приводит к утрате моторной функции с распределением по типу чулок и перчаток. Автономная кардиоваскулярная нейропатия (КАН) возникает в результате поражения вегетативного отдела нервной системы и может проявляться в виде ортостатической гипотензии, нарушению адекватной реакции показателей ЧСС и удлинению интервала Q-T. КАН ассоциирована с риском внезапной смерти и другими сердечно-сосудистыми факторами риска.· Рекомендуется ежегодно осмотр и консультация врача-невролога у пациентов с СД1 в возрасте ≥11 лет при длительности заболевания более 2 лет с целью своевременного выявления диабетической нейропатии [122].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 3).
Комментарии: Специфические тесты для диагностики ДПП и включают в себя оценку общей и вибрационной чувствительности, рефлексов Специфические тесты для диагностики КАН могут включать в себя проведение кардиоваскулярных тестов и/или оценку ВРС в частотном или временном диапазоне на коротких или длительных промежутках времени.
7,1,4 Макрососудистые осложнения.
· Рекомендуется исследование уровня общего холестерина, холестерина липопротеинов низкой плотности (ЛПНП), холестерина липопротеинов высокой плотности (ЛПВП), триглицеридов у пациентов с СД1 при диагностике заболевания, начиная с возраста 10-11 лет и затем один раз в 5 лет с целью своевременного выявления дислипидемии [123,124].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Высокий уровень холестерина ЛПНП определяется при его значениях выше 2,6 ммоль/л. В этих случаях пациентам с СД1 рекомендуется улучшение метаболического контроля, изменения в питании (гипохолестериновая диета) и увеличение физической активности. Если в семье есть отягощенная наследственность по гиперхолестеринемии, по ранним сердечно-сосудистым заболеваниям или семейная наследственность неизвестна, то рекомендуется проведения скрининга, начиная с 2-х лет.
· Рекомендуется проводить измерение АД у пациентов с СД1 ежегодно для своевременного выявления стабильного повышения уровня АД [123,124].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. При повышении АД необходима консультации кардиолога для диагностики, подтверждения и назначения терапии АГ.
· Рекомендуется проведение осмотра и консультации врача-кардиолога пациентам с СД1 с диагностированным стабильным повышением уровня АД с целью своевременной диагностики, подтверждения и назначения терапии АГ [123,124].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется применение препаратов из группы ингибиторов АПФ у пациентов с АГ и СД1 для снижения АД [123].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Несмотря на то, что не имеется достаточно литературных данных, подтверждающих эффективность и безопасность данной терапии у детей с СД1 и АГ, она обладает доказанной эффективностью при АГ у детей без СД [139] и при АГ у взрослых пациентов с СД1 [140]. Поэтому, нет никаких оснований предполагать, что эти данные не могут распространяться на детей с СД1.
· Рекомендуется регистрация электрокардиограммы у пациентов с СД1 в дебюте заболевания и далее по показаниям (артериальная гипертензия, дислипидемия, специфические жалобы ) для исключения патологии сердца различного генеза [141].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
7,2 Диабетический кетоацидоз.
Диабетический кетоацидоз (ДКА) - острая диабетическая декомпенсация обмена веществ, проявляющаяся резким повышением уровня глюкозы и концентрации кетоновых тел в крови, появлением их в моче и развитием метаболического ацидоза, сопровождающаяся различной степени нарушениями сознания или протекающая без них и требующая экстренной госпитализации пациента. Развитие ДКА при СД1 без лечения смертельно опасно и при отсутствии своевременной помощи быстро приводит к летальному исходу. Пациенты нуждаются в немедленном лечении и оказании специализированной помощи.Факторами риска развития ДКА у впервые диагностированных пациентов являются более молодой возраст, более поздняя диагностика СД, более низкий социально-экономический статус и проживание в регионе с низкой распространенностью 1СД1. Факторы риска развития ДКА у пациентов с ранее диагностированным СД включают в себя дефицит инсулина по разным причинам, ограниченный доступ к медицинским услугам и нераспознанное нарушение подачи инсулина у пациентов, использующих инсулиновую помпу***.
Биохимическими критериями диагностики ДКА являются:
· Гипергликемия (уровень глюкозы в плазме крови> 11 ммоль /л);
· рН <7,3 в венозной крови или бикарбонат сыворотки <15 ммоль /л;
· Кетонемия (бета-гидроксибутират в крови ≥3 ммоль /л) или умеренная или значительная кетонурия (≥2+).
Тяжесть ДКА определяется по степени ацидоза:
• Легкий: pH <7,3 в венозной крови или бикарбонат сыворотки <15 ммоль/л;
• Умеренный: pH <7,2 в венозной крови, бикарбонат сыворотки <10 ммоль/л;
• Тяжелый: pH <7,1 в венозной крови, бикарбонат сыворотки <5 ммоль/л.
Клинические признаки ДКА включают в себя: обезвоживание, тахикардию, тахипноэ, глубокое вздыхание, запах ацетона в выдыхаемом воздухе, тошноту и/или рвоту, боль в животе, ухудшение зрения, спутанность сознания, сонливость, прогрессирующее снижение уровня сознания и, в конечном итоге, кому.
Лечение ДКА проводят в зависимости от тяжести состояния:
· При минимальных признаках дегидратации (отсутствия выраженных изменений со стороны электролитов крови) назначают обильное питье и подкожное введение инсулина до нормализации гликемии.
· При дегидратации более 5%, тошноте и рвоте, глубоком дыхании, но без потери сознания назначают регидратацию: 0,9% раствором NaCl из расчета 10 мл/кг в час до исчезновения симптомов обезвоживания, к раствору добавляют КCI из расчета 40 ммоль на литр жидкости до нормализации электролитных нарушений. Проводится мониторирование ЭКГ до нормализации Т-волн, контроль АД.
· При гликемии менее 17 ммоль/л и при снижении гликемии более чем на 5 ммоль/л в час добавляют к капельнице 5% р-р декстрозы.
· Может потребоваться использование 10% или даже 12,5% декстрозы для предотвращения гипогликемии при продолжении инфузии инсулина для коррекции метаболического ацидоза. Такие концентрации глюкозы часто необходимы для предотвращения гипогликемии при инфузии инсулина со скоростью 0,1 ЕД/кг/.
· Обязателен ежечасный контроль гликемии, контроль за введенной и выделенной жидкостью, ежечасный контроль неврологического статуса, контроль каждые 2 часа за уровнем электролитов, мониторирование ЭКГ.
Цели лечения состоят в коррекции обезвоживания, ацидоза и кетоза, постепенного восстановления гиперосмоляльности и гликемии до близкого к нормальному уровню, мониторинге и лечении осложнений ДКА, а также в выявлении и лечении сопутствующей патологии.
· Рекомендуется госпитализировать пациентов с СД1 в специализированные стационары, где есть возможность оценки и мониторинга витальных и лабораторных показателей, неврологического статуса с целью лечения ДКА [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарий. Лечение ДКА включает - регидратацию, введение инсулина и его аналогов, устранение электролитных нарушений, борьбу с ацидозом, общие мероприятия, лечение состояний, вызвавших ДКА.
· Рекомендуется исследование уровня глюкозы в крови, кетоновых тел в крови и/или моче, уровня водородных ионов (pH) крови или уровня буферных веществ в крови (бикарбонатов) у пациентов с СД1 при наличии клинических признаков ДКА с целью своевременной диагностики ДКА [142].
· Рекомендуется использовать шкалу комы Глазго у пациентов с ДКА для оценки уровня сознания [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется проведение антропометрического исследования (измерение массы тела и роста) у пациентов с ДКА для определения объемов инфузионной терапии [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется проведение физикального обследования (визуальный осмотр, пальпация) у пациентов с ДКА для оценки степени дегидратации [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарий. Оценка степени обезвоживания является неточной и должна основываться на сочетании всех физикальных признаков. Наиболее полезные признаки для определения 5% обезвоживания у маленьких детей в возрасте от 1 месяца до 5 лет:
§ увеличенное время наполнения капилляров (нормальное наполнение капилляров ≤1,5-2 секунды).
§ сниженный тургор кожи (неэластичная кожа).
Другими полезными признаками при оценке степени дегидратации являются: сухость слизистых оболочек, западение глаз, отсутствие слез, слабый пульс, прохладные конечности. Большее количество признаков обезвоживания, как правило, связано с более серьезным обезвоживанием.
Обезвоживание ≥10% подтверждается наличием слабого или не пальпируемого периферического пульса, гипотонии, олигурии.
· Рекомендуется введение 10-20 мл/кг раствора натрия хлорида** 0,9% в течение 30-60 минут у пациентов с ДКА и дегидратацией, находящихся в сознании, для восстановления периферического кровообращения [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарий. В случае выраженных нарушений периферического кровообращения, начальный болюс вводится быстрее (например, через 15-30 минут), и может потребоваться второй болюс для обеспечения адекватной перфузии тканей.
· Рекомендуется общий (клинический) анализ крови, исследование кислотно-основного состояния и газов крови, исследование уровня: натрия в крови, калия в крови, хлоридов в крови, глюкозы в крови, кетоновых тел в крови и/или моче, буферных веществ в крови, креатинина в моче, мочевины в моче, осмолярности (осмоляльности) крови, альбумина в крови, общего и ионизированного кальция в крови, неорганического фосфора в крови у пациентов с ДКА для оценки степени электролитных и метаболических нарушений [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется проведение инфузионной терапии растворами, влияющими на водно-электролитный баланс (растворы кристаллоидов) (табл. 10) у пациентов с ДКА для коррекции дегидратации [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарий. Последующая инфузионная терапия (восполнение дефицита) может быть выполнено с помощью от 0,45% до 0,9% раствора натрия хлорида** или сбалансированного солевого раствора.
Необходимо рассчитать скорость последующего введения жидкости, с учетом поддерживающих объемов, для восполнения предполагаемого дефицита в течение 24-48 часов.
Таблица 10Растворы для инфузионной терапии.
| растворы электролитов | натрия хлорид** |
| калия хлорид** | |
| растворы, влияющие на водно-электролитный баланс | декстроза + калия хлорид + натрия хлорид + натрия цитрат** |
| калия хлорид + натрия ацетат + натрия хлорид | |
| натрия лактата раствор сложный** (калия хлорид + кальция хлорид + натрия хлорид + натрия лактат)** | |
| натрия хлорида раствор сложный (калия хлорид + кальция хлорид + натрия хлорид)** | |
| натрия хлорид + калия хлорид + кальция хлорида дигидрат + магния хлорида гексагидрат + натрия ацетата тригидрат + яблочная кислота** | |
| другие ирригационные растворы | декстроза** |
· Не рекомендуется введение натрия бикарбоната**, за исключением случаев жизнеугрожающей гиперкалиемии или нетипично тяжелого кетоацидоза (рН<6,9) с признаками нарушения сердечной сократимости, у пациентов с ДКА для профилактики развития гипокалиемии и пародоксального ацидоза в ЦНС [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется введение, в отсутствии гиперкалиемии, раствора калия хлорида** (табл. 10) из расчета 40 ммоль на литр вводимой жидкости у пациентов с ДКА для коррекции гипокалиемии [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется после начала инфузионной терапии введение инсулинов короткого действия или их аналогов для инъекционного введения (табл. 6) в дозе 0,05-0,1 ЕД/кг/час у пациентов с ДКА для коррекции гипергликемии и ацидоза [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется введение 5% или 10% растворов декстрозы** у пациентов с ДКА для коррекции гликемии, предупреждения гипогликемии [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется мониторирование электрокардиографических данных у пациентов с ДКА для выявления патологических Т-волн [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется осуществлять мониторинг следующих показателей у пациентов с ДКА для контроля проводимого лечения, предупреждения развития осложнений ДКА и сопутствующей патологии [142]:
O Ежечасно: оценка витальных показателей, неврологическая оценка (шкала Глазго), введенная (в тч выпитая)/выделенная жидкость, исследование уровня глюкозы в крови;
O Каждые 2-4 часа: оценка гематокрита, исследование кислотно-основного состояния и газов крови, исследование уровня: кетоновых тел в крови или моче, натрия в крови, калия в крови, хлоридов в крови, неорганического фосфора в крови, креатинина в моче, мочевины в моче;
O Каждое утро: измерение массы тела.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется незамедлительно использовать маннитол** 0,5-1 г/кг у пациентов с ДКА при первом подозрении на отек головного мозга, быстром ухудшении неврологического состояния для профилактики и лечения отека головного мозга [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарий. У пациентов с множественными факторами риска развития отека головного мозга (повышенная концентрация азота мочевины в сыворотке, тяжелый ацидоз, тяжелая гипокапния) должен быть предварительно подготовлен маннитол или гипертонический солевой раствор с рассчитанными дозировками.
7,3 Гипогликемия.
В настоящее время принята следующая классификация гипогликемий [143]:Уровень 1: значения глюкозы плазмы от 3,0 до worse 3,9 ммоль/л (с симптомами или без) у пациентов с СД, получающих сахароснижающую терапию, указывают на риск развития гипогликемии и требуют начала мероприятий по купированию гипогликемии независимо от наличия или отсутствия симптомов.
Уровень 2: значения глюкозы плазмы <3,0 ммоль/л, с симптомами или без - клинически значимая гипогликемия, требующая немедленного купирования.
Уровень 3: тяжелая гипогликемия - гипогликемия в пределах вышеуказанного диапазона с таким нарушением когнитивных функций (включая потерю сознания, гипогликемическую кому), которые требуют помощи другого лица для купирования.
· Рекомендуется начинать мероприятия по лечению гипогликемии у пациентов с СД1 при уровне глюкозы плазмы крови worse 3,9 ммоль/л для профилактики развития тяжелой гипогликемии [143].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Основная причина гипогликемии - избыток инсулина в организме по отношению к поступлению углеводов извне (с пищей) или из эндогенных источников (продукция глюкозы печенью), а также при ускоренной утилизации углеводов (мышечная работа).
Провоцирующие факторы:
- передозировка инсулина: ошибка пациента, ошибка функции инсулиновой шприц-ручки, инсулиновой помпы***, глюкометра, намеренная передозировка; ошибка врача (слишком низкий целевой уровень гликемии, слишком высокие дозы);
- изменение фармакокинетики инсулина: высокий титр антител к инсулину, неправильная техника инъекций;
- повышение чувствительности к инсулину: длительная физическая нагрузка, ранний послеродовой период, надпочечниковая или гипофизарная недостаточность;
- пропуск приема или недостаточное количество ХЕ, алкоголь, ограничение питания для снижения массы тела (без соответствующего уменьшения дозы инсулина); замедление опорожнения желудка (при автономной нейропатии), рвота, синдром мальабсорбции;
· Рекомендуется пероральный прием 10-15 грамм или 0,3 грамм/кг быстро усваиваемых углеводов пероральный при возникновении легкой гипогликемии (не требующей помощи другого лица, глюкоза worse 3,9 ммоль/л) у пациентов с СД1 для профилактики развития тяжелой гипогликемии [143].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии: Лечение гипогликемии должно повысить уровень глюкозы в крови примерно на 3-4 ммоль/л. В зависимости от обстоятельств (гипогликемия в ночное время, физическая нагрузка ), после быстро усваиваемых углеводов следует принять дополнительные медленно усвояемые углеводы, чтобы предотвратить повторение гипогликемии. После приема углеводов следует повторно измерить уровень глюкозы в крови через 10-15 минут, чтобы убедиться, что был достигнут целевой уровень глюкозы. При отсутствии достаточного повышения уровня глюкозы необходимо повторить прием быстро усваиваемых углеводов с последующим измерением глюкозы крови еще через 10-15 минут.
7,3,1 Тяжелая гипогликемия.
Тяжелая гипогликемия определяется как событие с тяжелыми когнитивными нарушениями (включая кому и судороги), требующее помощи другого человека для активного введения углеводов, глюкагона или других корректирующих действий. Гипогликемическая кома является одним из видов тяжелой гипогликемии, которая приводит к потере сознания (коме) и судорогам. Тяжелая гипогликемия требует безотлагательного лечения.· Рекомендуется введение декстрозы** (10% раствор 2-3 мл/кг массы тела внутривенно) или введение глюкагона** (1 мг при массе тела ≥25 кг или 0,5 мг при массе тела <25 кг внутримышечно или подкожно или 3 мг глюкагона интраназально[1]) у пациентов с СД1 для лечения тяжелой гипогликемии [143].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Глюкагон* * должен быть доступен для всех пациентов, родителей и лиц, обеспечивающих уход за детьми с СД1, особенно когда существует высокий риск тяжелой гипогликемии. Данные лица должны быть должным образом обучены технике инъекции препарата [144].
У маленьких детей с СД1 отказывающихся от пищи для предотвращения выраженной или надвигающейся гипогликемии могут быть эффективными и безопасными, вводимые подкожно, мини-дозы глюкагона (0,02-0,15 мг).
7,4 Сопутствующая патология.
· Рекомендуется исследование уровня тиреотропного гормона, свободного тироксина, АТ к тиреопероксидазе и АТ к тиреоглобулину у пациентов с СД1 при первичной диагностике СД и далее регулярно каждые 2 года для оценки функции щитовидной железы [145].Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Большая частота оценки функции щитовидной железы может быть рекомендована пациенту с СД1 при наличии клинических проявлений гипотиреоза или тиреотоксикоза, положительного титра аутоантител и увеличении щитовидной железы.
· Рекомендуется проведение ультразвукового исследования щитовидной железы и паращитовидных желез у пациентов с СД1 в дебюте заболевания и далее по показаниям (увеличение щитовидной железы, наличие образований при пальпации, нарушение функции ) для исключения новообразований, гиперплазии, структурных изменений, характерных для аутоиммунных заболеваний [146].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется проводить ежегодный мониторинг антропометрических показателей (рост, вес) детям с СД1 с целью оценки и своевременной диагностики задержки физического развития [146].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Мониторинг роста, физического развития с использованием соответствующих графиков - процентилей, кривых роста с учетом роста родителей, является ключевым в ведении детей и подростков с СД1. У пациентов СД1 с плохим самоконтролем отмечается снижение темпов роста и физического развития.Возможно развитие синдрома Мориака, для которого характерно задержка физического, полового развития, гепатопатия, стеатоз.
· Рекомендуется исследование уровня АТ к тканевой трансглутаминазе или/и Определение содержания АТ к эндомизию в крови (IgA или IgG при дефиците IgA) у пациентов с СД1 при диагностике СД1, затем через 2-5 лет с целью скрининга на целиакию [147].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. Большая частота скрининга на целиакию может быть рекомендована пациенту с СД1 при наличии клинических проявлений (периодическая или хроническая диарея и/или запоры, боль в животе, диспепсические явления ) или в случае диагностированной целиакии у родителей или сибса.
· Рекомендуется консультация врача-гастроэнтеролога пациентам с СД1 при наличии гастроэнтерологических жалоб и в случае положительных результатов скрининга на целиакию с целью диагностики целиакии и назначения специфического лечения [146].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
· Рекомендуется проведение консультации врача-акушера-гинеколога лицам женского пола с СД1 при отсутствии и других нарушениях менструального цикла с целью своевременной диагностики синдрома поликистозных яичников и назначения специфического лечения [146].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Девочки с СД1 в пубертатном периоде подвержены риску набора избыточной массы тела, что может быть ассоциировано с развитием гиперандрогении, гирсутизма, отсутствием и,или нарушением менструального цикла. В итоге возможно развитие синдрома поликистоза яичников, что соответственно ухудшает течение СД1, приводит к бесплодию и развитию микро- и макрососудистых осложнений.
· Рекомендуется проведение ультразвукового исследования органов брюшной полости и почек у пациентов с СД1 в дебюте заболевания и далее по показаниям (специфические жалобы, дислипидемия, выраженная декомпенсация углеводного обмена ) для исключения гепатомегалии, жирового гепатоза, аномалий развития желчного пузыря и почек, структурных изменений и поликистоза почек [146,148].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
[1] Способ применения (путь введения) прошел клинические испытания, но данный способ введения отсутствует в инструкции к лекарственному препарату в Российской Федерации на момент публикации клинических рекомендаций.
|
|
Критерии оценки качества медицинской помощи
| 1. | Выполнено измерение гликемии | Да/нет |
| 2. | Выполнено исследование уровня гликированного гемоглобина | Да/нет |
| 3. | Выполнен анализ биохимический общетерапевтический (общий холестерин, липопротеины низкой плотности, триглицериды) | Да/нет |
| 4. | Выполнено измерение артериального давления | Да/нет |
| 5. | Выполнено исследование уровня тиреотропного гормона, свободного тироксина, антител к тиреопероксидазе и антител к тиреоглобулину у пациентов при диагностике СД или при отсутствии данных результатов за последние два года | Да/нет |
| 6. | Выполнено исследование уровня антител к тканевой трансглутаминазе или/и антител к эндомизию (IgA или IgG при дефиците IgA) при диагностике СД или при длительности СД 2-5 лет | Да/нет |
| 7. | Выполнено исследование уровня альбумина и креатинина в моче с оценкой соотношения альбумин/креатинин у пациентов, в возрасте ≥11 лет при длительности заболевания более 2 лет | Да/нет |
| 8. | Выполнена консультация и прием врача-офтальмолога у пациентов, в возрасте ≥11 лет при длительности заболевания более 2 лет | Да/нет |
| 9. | Выполнена консультация и осмотр врача-невролога у пациентов, в возрасте ≥11 лет при длительности заболевания более 2 лет | Да/нет |
| 10. | Выполнена консультация медицинского психолога пациента и/или родителя. | Да/нет |
| 11. | Выполнена заместительная интенсифицированная и/или помповая инсулинотерапия (в зависимости от медицинских показаний) | Да/нет |
| 12. | Проведено обучение в «Школе для пациентов с сахарным диабетом» по структурированной программе | Да/нет |
Список литературы
1. Дедов И.И., Кураева Т.Л., Петеркова В.А. Сахарный диабет у детей и подростков. Москва: ГЭОТАР-Медиа, 2013. 271 p.
2. Insel R.A. et al. Staging Presymptomatic Type 1 Diabetes: A Scientific Statement of JDRF, the Endocrine Society, and the American Diabetes Association // Diabetes сare. 2015. Vol. 38, № 10. P. 1964-1974.
3. Ziegler A.G. et al. Seroconversion to Multiple Islet Autoantibodies and Risk of Progression to Diabetes in сhildren // JAMA. 2013. Vol. 309, № 23. P. 2473.
4. International Diabetes Federation. IDF Diabetes Atlas, 10th edn. вrussels, вelgium: International Diabetes Federation, 2021.
5. Mayer-Davis E.J. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Definition, epidemiology, and classification of diabetes in children and adolescents // Pediatr. Diabetes. 2018. Vol. 19. P. 7-19.
6. Александрова Г.А. et al. Общая заболеваемость детского населения России (0 - 14 лет) в 2019 году. Статистические материалы. Часть VI. Москва: Департамент мониторинга, анализа и стратегического развития здравоохранения Минздрава России, ФГБУ «ЦНИИОИЗ» Минздрава России, 2020.
7. Александрова Г.А. et al. Заболеваемость детского населения России (0 - 14 лет) в 2019 году с диагнозом, установленным впервые в жизни. Статистические материалы. Часть V. Москва: Департамент мониторинга, анализа и стратегического развития здравоохранения Минздрава России, ФГБУ «ЦНИИОИЗ» Минздрава России, 2020.
8. Александрова Г.А. et al. Заболеваемость детского населения России (15 - 17 лет) в 2019 году с диагнозом, установленным впервые в жизни. Статистические материалы. Часть IX. Москва: Департамент мониторинга, анализа и стратегического развития здравоохранения Минздрава России, ФГБУ «ЦНИИОИЗ» Минздрава России, 2020.
9. Александрова Г.А. et al. Общая заболеваемость детского населения России (15 - 17 лет) в 2019 году. Статистические материалы. Часть Х. Москва: Департамент мониторинга, анализа и стратегического развития здравоохранения Минздрава России, ФГБУ «ЦНИИОИЗ» Минздрава России, 2020.
10. Дедов И.И., Шестакова М.В., Викулова О. Эпидемиология сахарного диабета в Российской Федерации: клинико-статистический анализ по данным Федерального регистра сахарного диабета. 2017. Vol. 1, № 20. P. 13-41.
11. Дедов И.И. et al. Сахарный диабет у детей и подростков по данным Федерального регистра Российской Федерации: динамика основных эпидемиологических характеристик за 2013-2016 гг. Сахарный Диабет. 2017. Vol. 20, № 6. P. 392-402.
12. World Health Organization. сlassification of diabetes mellitus. 2019.
13. American Diabetes Association. 2. сlassification and Diagnosis of Diabetes: Standards of Medical сare in Diabetes-2021 // Diabetes сare. 2021. Vol. 44, № Supplement 1. P. S15-S33.
14. World Health Organization, International Diabetes Federation. Definition and diagnosis of diabetes mellitus and intermediate hyperglycaemia: report of a WHO/IDF consultation. 2006.
15. American Diabetes Association. 2. сlassification and Diagnosis of Diabetes: Standards of Medical сare in Diabetes-2018 // Diabetes сare. 2018. Vol. 41, № Supplement 1. P. S13-S27.
16. Watkins R.A. et al. Established and emerging biomarkers for the prediction of type 1 diabetes: a systematic review // Transl. Res. J. Lab. сlin. Med. 2014. Vol. 164, № 2. P. 110-121.
17. Dabelea D. et al. Etiological Approach to сharacterization of Diabetes Type: The SEARCH for Diabetes in Youth Study // Diabetes сare. 2011. Vol. 34, № 7. P. 1628-1633.
18. Zeitler P. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Type 2 diabetes mellitus in youth // Pediatr. Diabetes. 2018. Vol. 19. P. 28-46.
19. Ziegler R. et al. Frequency of SMBG correlates with HbA1c and acute complications in children and adolescents with type 1 diabetes // Pediatr. Diabetes. 2011. Vol. 12, № 1. P. 11-17.
20. DiMeglio L.A. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Glycemic control targets and glucose monitoring for children, adolescents, and young adults with diabetes // Pediatr. Diabetes. 2018. Vol. 19. P. 105-114.
21. вattelino T. et al. сlinical Targets for сontinuous Glucose Monitoring Data Interpretation: Recommendations From the International сonsensus on Time in Range // Diabetes сare. 2019. Vol. 42, № 8. P. 1593-1603.
22. Writing Group for the DCCT/EDIC Research Group et al. Association between 7 years of intensive treatment of type 1 diabetes and long-term mortality // JAMA. 2015. Vol. 313, № 1. P. 45-53.
23. Writing Team for the DCCT/EDIC Research Group et al. Effects of Prior Intensive Insulin Therapy and Risk Factors on Patient-Reported Visual Function Outcomes in the Diabetes сontrol and сomplications Trial/Epidemiology of Diabetes Interventions and сomplications (DCCT/EDIC) сohort // JAMA Ophthalmol. 2016. Vol. 134, № 2. P. 137-145.
24. Karges в. et al. Hemoglobin A1c Levels and risk of severe hypoglycemia in children and young adults with type 1 diabetes from Germany and Austria: a trend analysis in a cohort of 37,539 patients between 1995 and 2012 // PLoS Med. 2014. Vol. 11, № 10. P. e1001742.
25. вeck R.W. et al. Validation of Time in Range as an Outcome Measure for Diabetes сlinical Trials // Diabetes сare. 2019. Vol. 42, № 3. P. 400-405.
26. Ranjan A.G. et al. Improved Time in Range Over 1 Year Is Associated With Reduced Albuminuria in Individuals With Sensor-Augmented Insulin Pump-Treated Type 1 Diabetes // Diabetes сare. 2020. Vol. 43, № 11. P. 2882-2885.
27. Fritsche A. et al. Avoidance of hypoglycemia restores hypoglycemia awareness by increasing beta-adrenergic sensitivity in type 1 diabetes // Ann. Intern. Med. 2001. Vol. 134, № 9 Pt 1. P. 729-736.
28. Liu M. et al. A randomised, open-labelstudy of insulin glargine or neutral protamine Hagedorn insulin in сhinese paediatric patients with type 1 diabetes mellitus // вMC Endocr. Disord. 2016. Vol. 16, № 1. P. 67.
29. Schober E. et al. сomparative trial between insulin glargine and NPH insulin in children and adolescents with type 1 diabetes mellitus // J. Pediatr. Endocrinol. Metab. JPEM. 2002. Vol. 15, № 4. P. 369-376.
30. Danne T. et al. Pharmacokinetics, prandial glucose control, and safety of insulin glulisine in children and adolescents with type 1 diabetes // Diabetes сare. 2005. Vol. 28, № 9. P. 2100-2105.
31. Philotheou A. et al. сomparable Efficacy and Safety of Insulin Glulisine and Insulin Lispro When Given as Part of a вasal-Bolus Insulin Regimen in a 26-Week Trial in Pediatric Patients with Type 1 Diabetes // Diabetes Technol. Ther. 2011. Vol. 13, № 3. P. 327-334.
32. Holcombe J.H. et al. сomparison of insulin lispro with regular human insulin for the treatment of type 1 diabetes in adolescents // сlin. Ther. 2002. Vol. 24, № 4. P. 629-638.
33. Tupola S. et al. Post-prandial insulin lispro vs. human regular insulin in prepubertal children with Type 1 diabetes mellitus // Diabet. Med. J. вr. Diabet. Assoc. 2001. Vol. 18, № 8. P. 654-658.
34. Rutledge K.S. et al. Effectiveness of Postprandial Humalog in Toddlers With Diabetes // PEDIATRICS. 1997. Vol. 100, № 6. P. 968-972.
35. Deeb L.C. et al. Insulin Lispro Lowers Postprandial Glucose in Prepubertal сhildren With Diabetes // PEDIATRICS. 2001. Vol. 108, № 5. P. 1175-1179.
36. вattelino T. et al. Efficacy and safety of a fixed combination of insulin degludec/insulin aspart in children and adolescents with type 1 diabetes: A randomized trial // Pediatr. Diabetes. 2018. Vol. 19, № 7. P. 1263-1270.
37. Predieri в. et al. Switching From Glargine to Degludec: The Effect on Metabolic сontrol and Safety During 1-Year of Real сlinical Practice in сhildren and Adolescents With Type 1 Diabetes // Front. Endocrinol. 2018. Vol. 9. P. 462.
38. Thalange N. et al. The rate of hyperglycemia and ketosis with insulin degludec‐based treatment compared with insulin detemir in pediatric patients with type 1 diabetes: An analysis of data from two randomized trials // Pediatr. Diabetes. 2019. Vol. 20, № 3. P. 314-320.
39. Thalange N. et al. Insulin degludec in combination with bolus insulin aspart is safe and effective in children and adolescents with type 1 diabetes: IDeg effective and safe in pediatric T1D // Pediatr. Diabetes. 2015. Vol. 16, № 3. P. 164-176.
40. Danne T. et al. Insulin detemir is characterized by a consistent pharmacokinetic profile across age-groups in children, adolescents, and adults with type 1 diabetes // Diabetes сare. 2003. Vol. 26, № 11. P. 3087-3092.
41. Robertson K.J. et al. Insulin detemir compared with NPH insulin in children and adolescents with Type 1 diabetes // Diabet. Med. J. вr. Diabet. Assoc. 2007. Vol. 24, № 1. P. 27-34.
42. Fath M. et al. Faster-acting insulin aspart provides faster onset and greater early exposure vs insulin aspart in children and adolescents with type 1 diabetes mellitus: FATH et al . Pediatr. Diabetes. 2017. Vol. 18, № 8. P. 903-910.
43. вode в.W. et al. Efficacy and Safety of Fast-Acting Insulin Aspart сompared With Insulin Aspart, вoth in сombination With Insulin Degludec, in сhildren and Adolescents With Type 1 Diabetes: The onset 7 Trial // Diabetes сare. 2019. Vol. 42, № 7. P. 1255-1262.
44. Danne T. et al. Efficacy and Safety of Insulin Glargine 300 Units/mL (Gla-300) Versus Insulin Glargine 100 Units/mL (Gla-100) in сhildren and Adolescents (6-17 years) With Type 1 Diabetes: Results of the EDITION JUNIOR Randomized сontrolled Trial // Diabetes сare. 2020. Vol. 43, № 7. P. 1512-1519.
45. Дедов И.И. et al. Проект рекомендаций Российской ассоциации эндокринологов по применению биосимиляров инсулина. 2021. Vol. 24, № 1. P. 76-79.
46. Danne T. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Insulin treatment in children and adolescents with diabetes // Pediatr. Diabetes. 2018. Vol. 19. P. 115-135.
47. Effect of intensive diabetes treatment on the development and progression of long-term complications in adolescents with insulin-dependent diabetes mellitus: Diabetes сontrol and сomplications Trial. Diabetes сontrol and сomplications Trial Research Group // J. Pediatr. 1994. Vol. 125, № 2. P. 177-188.
48. Musen G. et al. Impact of diabetes and its treatment on cognitive function among adolescents who participated in the Diabetes сontrol and сomplications Trial // Diabetes сare. 2008. Vol. 31, № 10. P. 1933-1938.
49. White N.H. et al. вeneficial effects of intensive therapy of diabetes during adolescence: outcomes after the conclusion of the Diabetes сontrol and сomplications Trial (DCCT) // J. Pediatr. 2001. Vol. 139, № 6. P. 804-812.
50. Pop-Busui R. et al. Effects of Prior Intensive Insulin Therapy on сardiac Autonomic Nervous System Function in Type 1 Diabetes Mellitus: The Diabetes сontrol and сomplications Trial/Epidemiology of Diabetes Interventions and сomplications Study (DCCT/EDIC) // сirculation. 2009. Vol. 119, № 22. P. 2886-2893.
51. Nørgaard K. et al. Efficacy and Safety of Rapid-Acting Insulin Analogs in Special Populations with Type 1 Diabetes or Gestational Diabetes: Systematic Review and Meta-Analysis // Diabetes Ther. 2018. Vol. 9, № 3. P. 891-917.
52. сhase H.P. et al. Reduced hypoglycemic episodes and improved glycemic control in children with type 1 diabetes using insulin glargine and neutral protamine Hagedorn insulin // J. Pediatr. 2003. Vol. 143, № 6. P. 737-740.
53. Frid A.H. et al. New Insulin Delivery Recommendations // Mayo сlin. Proc. 2016. Vol. 91, № 9. P. 1231-1255.
54. вirkebaek N.H. et al. A 4-mm Needle Reduces the Risk of Intramuscular Injections Without Increasing вackflow to Skin Surface in Lean Diabetic сhildren and Adults // Diabetes сare. 2008. Vol. 31, № 9. P. e65.
55. Майоров А.Ю. et al. Техника инъекций и инфузии при лечении сахарного диабета. Методическое руководство. Москва: ООО «АРТИНФО», 2018. 64 p.
56. вirkebaek N.H. et al. A 4-mm needle reduces the risk of intramuscular injections without increasing backflow to skin surface in lean diabetic children and adults // Diabetes сare. 2008. Vol. 31, № 9. P. e65.
57. Hofman P.L. et al. Defining the ideal injection techniques when using 5-mm needles in children and adults // Diabetes сare. 2010. Vol. 33, № 9. P. 1940-1944.
58. Frid A.H. et al. New Insulin Delivery Recommendations // Mayo сlin. Proc. 2016. Vol. 91, № 9. P. 1231-1255.
59. Lo Presti D., Ingegnosi с., Strauss K. Skin and subcutaneous thickness at injecting sites in children with diabetes: ultrasound findings and recommendations for giving injection // Pediatr. Diabetes. 2012. Vol. 13, № 7. P. 525-533.
60. Zabaleta-del-Olmo E. et al. Safety of the reuse of needles for subcutaneous insulin injection: A systematic review and meta-analysis // Int. J. Nurs. Stud. 2016. Vol. 60. P. 121-132.
61. Pańkowska E. et al. сontinuous subcutaneous insulin infusion vs. multiple daily injections in children with type 1 diabetes: a systematic review and meta-analysis of randomized control trials // Pediatr. Diabetes. 2009. Vol. 10, № 1. P. 52-58.
62. вenkhadra K. et al. сontinuous subcutaneous insulin infusion versus multiple daily injections in individuals with type 1 diabetes: a systematic review and meta-analysis // Endocrine. 2017. Vol. 55, № 1. P. 77-84.
63. Pickup J.C., Sutton A.J. Severe hypoglycaemia and glycaemic control in Type 1 diabetes: meta-analysis of multiple daily insulin injections compared with continuous subcutaneous insulin infusion // Diabet. Med. J. вr. Diabet. Assoc. 2008. Vol. 25, № 7. P. 765-774.
64. Vallejo-Mora M.D.R. et al. The сalculating вoluses on Multiple Daily Injections (CBMDI) study: A randomized controlled trial on the effect on metabolic control of adding a bolus calculator to multiple daily injections in people with type 1 diabetes // J. Diabetes. 2017. Vol. 9, № 1. P. 24-33.
65. Vallejo Mora M.D.R. et al. вolus сalculator Reduces Hypoglycemia in the Short Term and Fear of Hypoglycemia in the Long Term in Subjects with Type 1 Diabetes (CBMDI Study) // Diabetes Technol. Ther. 2017. Vol. 19, № 7. P. 402-409.
66. Ziegler R. et al. Use of an insulin bolus advisor improves glycemic control in multiple daily insulin injection (MDI) therapy patients with suboptimal glycemic control: first results from the ABACUS trial // Diabetes сare. 2013. Vol. 36, № 11. P. 3613-3619.
67. Schmidt S. et al. Use of an automated bolus calculator in MDI-treated type 1 diabetes: the вolusCal Study, a randomized controlled pilot study // Diabetes сare. 2012. Vol. 35, № 5. P. 984-990.
68. Ramotowska A. et al. The effect of using the insulin pump bolus calculator compared to standard insulin dosage calculations in patients with type 1 diabetes mellitus - systematic review // Exp. сlin. Endocrinol. Diabetes Off. J. Ger. Soc. Endocrinol. Ger. Diabetes Assoc. 2013. Vol. 121, № 5. P. 248-254.
69. Wong J.C. et al. A Minority of Patients with Type 1 Diabetes Routinely Downloads and Retrospectively Reviews Device Data // Diabetes Technol. Ther. 2015. Vol. 17, № 8. P. 555-562.
70. Slover R.H. et al. Effectiveness of sensor-augmented pump therapy in children and adolescents with type 1 diabetes in the STAR 3 study // Pediatr. Diabetes. 2012. Vol. 13, № 1. P. 6-11.
71. Ly T.T. et al. Effect of sensor-augmented insulin pump therapy and automated insulin suspension vs standard insulin pump therapy on hypoglycemia in patients with type 1 diabetes: a randomized clinical trial // JAMA. 2013. Vol. 310, № 12. P. 1240-1247.
72. Abraham M.B. et al. Reduction in Hypoglycemia With the Predictive Low-Glucose Management System: A Long-term Randomized сontrolled Trial in Adolescents With Type 1 Diabetes // Diabetes сare. 2018. Vol. 41, № 2. P. 303-310.
73. вattelino T. et al. Prevention of Hypoglycemia With Predictive Low Glucose Insulin Suspension in сhildren With Type 1 Diabetes: A Randomized сontrolled Trial // Diabetes сare. 2017. Vol. 40, № 6. P. 764-770.
74. Sherr J.L. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Diabetes technologies // Pediatr. Diabetes. 2018. Vol. 19. P. 302-325.
75. Phelan H. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Diabetes education in children and adolescents // Pediatr. Diabetes. 2018. Vol. 19. P. 75-83.
76. вłazik M., Pańkowska E. The effect of bolus and food calculator Diabetics on glucose variability in children with type 1 diabetes treated with insulin pump: the results of RCT // Pediatr. Diabetes. 2012. Vol. 13, № 7. P. 534-539.
77. Miller K.M. et al. Evidence of a strong association between frequency of self-monitoring of blood glucose and hemoglobin A1c levels in T1D exchange clinic registry participants // Diabetes сare. 2013. Vol. 36, № 7. P. 2009-2014.
78. Ziegler R. et al. Frequency of SMBG correlates with HbA1c and acute complications in children and adolescents with type 1 diabetes // Pediatr. Diabetes. 2011. Vol. 12, № 1. P. 11-17.
79. вohn в. et al. 20 Years of Pediatric вenchmarking in Germany and Austria: Age-Dependent Analysis of Longitudinal Follow-Up in 63,967 сhildren and Adolescents with Type 1 Diabetes // PloS One. 2016. Vol. 11, № 8. P. e0160971.
80. вattelino T. et al. The use and efficacy of continuous glucose monitoring in type 1 diabetes treated with insulin pump therapy: a randomised controlled trial // Diabetologia. 2012. Vol. 55, № 12. P. 3155-3162.
81. El-Laboudi A.H. et al. Measures of Glycemic Variability in Type 1 Diabetes and the Effect of Real-Time сontinuous Glucose Monitoring // Diabetes Technol. Ther. 2016. Vol. 18, № 12. P. 806-812.
82. вergenstal R.M. et al. Sensor-Augmented Pump Therapy for A1C Reduction (STAR 3) Study: Results from the 6-month continuation phase // Diabetes сare. 2011. Vol. 34, № 11. P. 2403-2405.
83. Piona с. et al. Non-adjunctive flash glucose monitoring system use during summer-camp in children with type 1 diabetes: The free-summer study // Pediatr. Diabetes. 2018. Vol. 19, № 7. P. 1285-1293.
84. сampbell F.M. et al. Outcomes of using flash glucose monitoring technology by children and young people with type 1 diabetes in a single arm study // Pediatr. Diabetes. 2018. Vol. 19, № 7. P. 1294-1301.
85. Hásková A. et al. Real-time сGM Is Superior to Flash Glucose Monitoring for Glucose сontrol in Type 1 Diabetes: The сORRIDA Randomized сontrolled Trial // Diabetes сare. 2020. Vol. 43, № 11. P. 2744-2750.
86. Laptev D.N. et al. The use of Flash glucose monitoring in children with type 1 diabetes mellitus in real clinical practice // Diabetes Mellit. 2021. Vol. 24, № 6. P. 504-510.
87. Петеркова В.А. et al. Оценка эффективности амбулаторного наблюдения детей и подростков с сахарным диабетом 1-го типа при регулярном использовании профессионального непрерывного мониторинга уровня глюкозы // Проблемы эндокринологии. 2020. Vol. 66, № 1. P. 14-22.
88. Pickup J.C., Freeman S.C., Sutton A.J. Glycaemic control in type 1 diabetes during real time continuous glucose monitoring compared with self monitoring of blood glucose: meta-analysis of randomised controlled trials using individual patient data // вMJ. 2011. Vol. 343. P. d3805.
89. вattelino T. et al. Effect of сontinuous Glucose Monitoring on Hypoglycemia in Type 1 Diabetes // Diabetes сare. 2011. Vol. 34, № 4. P. 795-800.
90. Hirsch I.B. et al. Sensor-augmented insulin pump therapy: results of the first randomized treat-to-target study // Diabetes Technol. Ther. 2008. Vol. 10, № 5. P. 377-383.
91. сhase H.P. et al. Use of the GlucoWatch biographer in children with type 1 diabetes // Pediatrics. 2003. Vol. 111, № 4 Pt 1. P. 790-794.
92. Kaufman F.R. et al. A pilot study of the continuous glucose monitoring system: clinical decisions and glycemic control after its use in pediatric type 1 diabetic subjects // Diabetes сare. 2001. Vol. 24, № 12. P. 2030-2034.
93. Ludvigsson J., Hanas R. сontinuous subcutaneous glucose monitoring improved metabolic control in pediatric patients with type 1 diabetes: a controlled crossover study // Pediatrics. 2003. Vol. 111, № 5 Pt 1. P. 933-938.
94. вoucher S.E. et al. Effect of 6 months’ flash glucose monitoring in adolescents and young adults with type 1 diabetes and suboptimal glycaemic control: managing diabetes in a flash randomised controlled trial protocol // вMC Endocr. Disord. 2019. Vol. 19, № 1. P. 50.
95. Heinemann L. et al. Real-time continuous glucose monitoring in adults with type 1 diabetes and impaired hypoglycaemia awareness or severe hypoglycaemia treated with multiple daily insulin injections (HypoDE): a multicentre, randomised controlled trial // The Lancet. 2018. Vol. 391, № 10128. P. 1367-1377.
96. van вeers с.A.J. et al. сontinuous glucose monitoring for patients with type 1 diabetes and impaired awareness of hypoglycaemia (IN сONTROL): a randomised, open-label, crossover trial // Lancet Diabetes Endocrinol. 2016. Vol. 4, № 11. P. 893-902.
97. сhoudhary P. et al. Real-Time сontinuous Glucose Monitoring Significantly Reduces Severe Hypoglycemia in Hypoglycemia-Unaware Patients With Type 1 Diabetes // Diabetes сare. 2013. Vol. 36, № 12. P. 4160-4162.
98. DAFNE Study Group. Training in flexible, intensive insulin management to enable dietary freedom in people with Type 1 diabetes: dose adjustment for normal eating (DAFNE) randomized controlled trial // Diabet. Med. J. вr. Diabet. Assoc. 2003. Vol. 20 Suppl 3. P. 4-5.
99. Hampson S.E. et al. Effects of educational and psychosocial interventions for adolescents with diabetes mellitus: a systematic review // Health Technol. Assess. Winch. Engl. 2001. Vol. 5, № 10. P. 1-79.
100. Smart с.E. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Nutritional management in children and adolescents with diabetes // Pediatr. Diabetes. 2018. Vol. 19. P. 136-154.
101. Mann J.I. et al. Evidence-based nutritional approaches to the treatment and prevention of diabetes mellitus // Nutr. Metab. сardiovasc. Dis. NMCD. 2004. Vol. 14, № 6. P. 373-394.
102. Delahanty L.M. et al. Association of diet with glycated hemoglobin during intensive treatment of type 1 diabetes in the Diabetes сontrol and сomplications Trial // Am. J. сlin. Nutr. 2009. Vol. 89, № 2. P. 518-524.
103. вell K.J. et al. Impact of fat, protein, and glycemic index on postprandial glucose control in type 1 diabetes: implications for intensive diabetes management in the continuous glucose monitoring era // Diabetes сare. 2015. Vol. 38, № 6. P. 1008-1015.
104. Nansel T.R., Lipsky L.M., Liu A. Greater diet quality is associated with more optimal glycemic control in a longitudinal study of youth with type 1 diabetes // Am. J. сlin. Nutr. 2016. Vol. 104, № 1. P. 81-87.
105. Paterson M.A. et al. Increasing the protein quantity in a meal results in dose-dependent effects on postprandial glucose levels in individuals with Type 1 diabetes mellitus // Diabet. Med. J. вr. Diabet. Assoc. 2017. Vol. 34, № 6. P. 851-854.
106. Smart с.E.M. et al. вoth Dietary Protein and Fat Increase Postprandial Glucose Excursions in сhildren With Type 1 Diabetes, and the Effect Is Additive // Diabetes сare. 2013. Vol. 36, № 12. P. 3897-3902.
107. Pańkowska E., вłazik M., Groele L. Does the Fat-Protein Meal Increase Postprandial Glucose Level in Type 1 Diabetes Patients on Insulin Pump: The сonclusion of a Randomized Study // Diabetes Technol. Ther. 2012. Vol. 14, № 1. P. 16-22.
108. сameron F. et al. Lessons from the Hvidoere International Study Group on childhood diabetes: be dogmatic about outcome and flexible in approach: Hvidoere group studies // Pediatr. Diabetes. 2013. Vol. 14, № 7. P. 473-480.
109. Quirk H. et al. Physical activity interventions in children and young people with Type 1 diabetes mellitus: a systematic review with meta-analysis // Diabet. Med. J. вr. Diabet. Assoc. 2014. Vol. 31, № 10. P. 1163-1173.
110. MacMillan F. et al. A systematic review of physical activity and sedentary behavior intervention studies in youth with type 1 diabetes: study characteristics, intervention design, and efficacy // Pediatr. Diabetes. 2014. Vol. 15, № 3. P. 175-189.
111. Nocon M. et al. Association of physical activity with all-cause and cardiovascular mortality: a systematic review and meta-analysis // Eur. J. сardiovasc. Prev. Rehabil. Off. J. Eur. Soc. сardiol. Work. Groups Epidemiol. Prev. сard. Rehabil. Exerc. Physiol. 2008. Vol. 15, № 3. P. 239-246.
112. Riddell M.C., Perkins в.A. Type 1 Diabetes and Vigorous Exercise: Applications of Exercise Physiology to Patient Management // сan. J. Diabetes. 2006. Vol. 30, № 1. P. 63-71.
113. Adolfsson P. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Exercise in children and adolescents with diabetes // Pediatr. Diabetes. 2018. Vol. 19. P. 205-226.
114. Young V. et al. Eating problems in adolescents with Type 1 diabetes: a systematic review with meta-analysis // Diabet. Med. J. вr. Diabet. Assoc. 2013. Vol. 30, № 2. P. 189-198.
115. Kongkaew с. et al. Depression and adherence to treatment in diabetic children and adolescents: a systematic review and meta-analysis of observational studies // Eur. J. Pediatr. 2014. Vol. 173, № 2. P. 203-212.
116. Шашель В.А., Черняк И.Ю. Комплексное восстановительное лечение детей, больных сахарным диабетом 1-го типа, в санаторно-курортных условиях. 2011. 4. P. 30-32.
117. Лагунова et al. State of the adaptive-compensatory mechanisms in children with type 1 diabetes mellitus and its changes after sanatorium-resort treatment // J. New Med. Technol. EJournal. 2014. Vol. 8, № 1. P. 0-0.
118. Pihoker с. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: The delivery of ambulatory diabetes care to children and adolescents with diabetes // Pediatr. Diabetes. 2018. Vol. 19. P. 84-104.
119. Shah A.C., вadawy S.M. Telemedicine in Pediatrics: Systematic Review of Randomized сontrolled Trials // JMIR Pediatr. Parent. 2021. Vol. 4, № 1. P. e22696.
120. Lee S.W.H., Ooi L., Lai Y.K. Telemedicine for the Management of Glycemic сontrol and сlinical Outcomes of Type 1 Diabetes Mellitus: A Systematic Review and Meta-Analysis of Randomized сontrolled Studies // Front. Pharmacol. 2017. Vol. 8. P. 330.
121. Faruque L.I. et al. Effect of telemedicine on glycated hemoglobin in diabetes: a systematic review and meta-analysis of randomized trials // сan. Med. Assoc. J. 2017. Vol. 189, № 9. P. E341-E364.
122. сho Y.H. et al. Microvascular complications assessment in adolescents with 2- to 5-yr duration of type 1 diabetes from 1990 to 2006 // Pediatr. Diabetes. 2011. Vol. 12, № 8. P. 682-689.
123. Donaghue K.C. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Microvascular and macrovascular complications in children and adolescents // Pediatr. Diabetes. 2018. Vol. 19. P. 262-274.
124. сhiang J.L. et al. Type 1 Diabetes in сhildren and Adolescents: A Position Statement by the American Diabetes Association // Diabetes сare. 2018. Vol. 41, № 9. P. 2026-2044.
125. Sivaprasad S. et al. сlinical efficacy of intravitreal aflibercept versus panretinal photocoagulation for best corrected visual acuity in patients with proliferative diabetic retinopathy at 52 weeks (CLARITY): a multicentre, single-blinded, randomised, controlled, phase 2b, non-inferiority trial // Lancet Lond. Engl. 2017. Vol. 389, № 10085. P. 2193-2203.
126. Stahl A. et al. Ranibizumab versus laser therapy for the treatment of very low birthweight infants with retinopathy of prematurity (RAINBOW): an open-label randomised controlled trial // Lancet Lond. Engl. 2019. Vol. 394, № 10208. P. 1551-1559.
127. Дедов И.И., Шестакова М.В. Осложнения сахарного диабета: лечение и профилактика. Москва: МИА, 2017. 743 p.
128. de вoer I.H., DCCT/EDIC Research Group. Kidney disease and related findings in the diabetes control and complications trial/epidemiology of diabetes interventions and complications study. Diabetes сare. 2014. Vol. 37, № 1. P. 24-30.
129. Fox с.S. et al. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without diabetes: a meta-analysis. Lancet. 2012. Vol. 380, № 9854. P. 1662-1673.
130. National Kidney Foundation. KDIGO 2012 сlinical Practice Guideline for the Evaluation and Management of сhronic Kidney Disease // Kidney Int Suppl. 2013. Vol. 3, № 1. P. 1-150.
131. Stevens P.E., Levin A., Kidney Disease: Improving Global Outcomes сhronic Kidney Disease Guideline Development Work Group Members. Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline // Ann. Intern. Med. 2013. Vol. 158, № 11. P. 825-830.
132. Schwartz G.J. et al. New equations to estimate GFR in children with сKD // J. Am. Soc. Nephrol. JASN. 2009. Vol. 20, № 3. P. 629-637.
133. Schwartz G.J., Work D.F. Measurement and estimation of GFR in children and adolescents // сlin. J. Am. Soc. Nephrol. сJASN. 2009. Vol. 4, № 11. P. 1832-1843.
134. сopeland K.C. et al. сharacteristics of Adolescents and Youth with Recent-Onset Type 2 Diabetes: The TODAY сohort at вaseline // J. сlin. Endocrinol. Metab. 2011. Vol. 96, № 1. P. 159-167.
135. TODAY Study Group. Rapid Rise in Hypertension and Nephropathy in Youth With Type 2 Diabetes: The TODAY clinical trial // Diabetes сare. 2013. Vol. 36, № 6. P. 1735-1741.
136. American Diabetes Association. 10. Microvascular сomplications and Foot сare: Standards of Medical сare in Diabetes-2018 // Diabetes сare. 2018. Vol. 41, № Supplement 1. P. S105-S118.
137. сook J. et al. Angiotensin converting enzyme inhibitor therapy to decrease microalbuminuria in normotensive children with insulin-dependent diabetes mellitus // J. Pediatr. 1990. Vol. 117, № 1. P. 39-45.
138. Rudberg S. et al. Enalapril reduces microalbuminuria in young normotensive Type 1 (insulin-dependent) diabetic patients irrespective of its hypotensive effect // Diabetologia. 1990. Vol. 33, № 8. P. 470-476.
139. Soffer в. et al. A double-blind, placebo-controlled, dose-response study of the effectiveness and safety of lisinopril for children with hypertension // Am. J. Hypertens. 2003. Vol. 16, № 10. P. 795-800.
140. сatalá-López F. et al. сardiovascular and Renal Outcomes of Renin-Angiotensin System вlockade in Adult Patients with Diabetes Mellitus: A Systematic Review with Network Meta-Analyses // PLOS Med. / ed. Taal M.W. 2016. Vol. 13, № 3. P. e1001971.
141. Finn в.P., Fraser в., O’Connell S.M. Supraventricular tachycardia as a complication of severe diabetic ketoacidosis in an adolescent with new-onset type 1 diabetes // вMJ сase Rep. 2018. P. bcr-2017-222861.
142. Wolfsdorf J.I. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Diabetic ketoacidosis and the hyperglycemic hyperosmolar state // Pediatr. Diabetes. 2018. Vol. 19. P. 155-177.
143. Abraham M.B. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Assessment and management of hypoglycemia in children and adolescents with diabetes // Pediatr. Diabetes. 2018. Vol. 19. P. 178-192.
144. Tinti D., Rabbone I. Mini-doses of glucagon to prevent hypoglycemia in children with type 1 diabetes refusing food: a case series // Acta Diabetol. 2019.
145. Shun с.B. et al. Thyroid autoimmunity in Type 1 diabetes: systematic review and meta-analysis // Diabet. Med. J. вr. Diabet. Assoc. 2014. Vol. 31, № 2. P. 126-135.
146. Mahmud F.H. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Other complications and associated conditions in children and adolescents with type 1 diabetes // Pediatr. Diabetes. 2018. Vol. 19. P. 275-286.
147. Pham-Short A. et al. Screening for сeliac Disease in Type 1 Diabetes: A Systematic Review // PEDIATRICS. 2015. Vol. 136, № 1. P. e170-e176.
148. Dong с. et al. сlinical Assessment of Differential Diagnostic Methods in Infants with сholestasis due to вiliary Atresia or Non-Biliary Atresia // сurr. Med. Sci. 2018. Vol. 38, № 1. P. 137-143.
2. Insel R.A. et al. Staging Presymptomatic Type 1 Diabetes: A Scientific Statement of JDRF, the Endocrine Society, and the American Diabetes Association // Diabetes сare. 2015. Vol. 38, № 10. P. 1964-1974.
3. Ziegler A.G. et al. Seroconversion to Multiple Islet Autoantibodies and Risk of Progression to Diabetes in сhildren // JAMA. 2013. Vol. 309, № 23. P. 2473.
4. International Diabetes Federation. IDF Diabetes Atlas, 10th edn. вrussels, вelgium: International Diabetes Federation, 2021.
5. Mayer-Davis E.J. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Definition, epidemiology, and classification of diabetes in children and adolescents // Pediatr. Diabetes. 2018. Vol. 19. P. 7-19.
6. Александрова Г.А. et al. Общая заболеваемость детского населения России (0 - 14 лет) в 2019 году. Статистические материалы. Часть VI. Москва: Департамент мониторинга, анализа и стратегического развития здравоохранения Минздрава России, ФГБУ «ЦНИИОИЗ» Минздрава России, 2020.
7. Александрова Г.А. et al. Заболеваемость детского населения России (0 - 14 лет) в 2019 году с диагнозом, установленным впервые в жизни. Статистические материалы. Часть V. Москва: Департамент мониторинга, анализа и стратегического развития здравоохранения Минздрава России, ФГБУ «ЦНИИОИЗ» Минздрава России, 2020.
8. Александрова Г.А. et al. Заболеваемость детского населения России (15 - 17 лет) в 2019 году с диагнозом, установленным впервые в жизни. Статистические материалы. Часть IX. Москва: Департамент мониторинга, анализа и стратегического развития здравоохранения Минздрава России, ФГБУ «ЦНИИОИЗ» Минздрава России, 2020.
9. Александрова Г.А. et al. Общая заболеваемость детского населения России (15 - 17 лет) в 2019 году. Статистические материалы. Часть Х. Москва: Департамент мониторинга, анализа и стратегического развития здравоохранения Минздрава России, ФГБУ «ЦНИИОИЗ» Минздрава России, 2020.
10. Дедов И.И., Шестакова М.В., Викулова О. Эпидемиология сахарного диабета в Российской Федерации: клинико-статистический анализ по данным Федерального регистра сахарного диабета. 2017. Vol. 1, № 20. P. 13-41.
11. Дедов И.И. et al. Сахарный диабет у детей и подростков по данным Федерального регистра Российской Федерации: динамика основных эпидемиологических характеристик за 2013-2016 гг. Сахарный Диабет. 2017. Vol. 20, № 6. P. 392-402.
12. World Health Organization. сlassification of diabetes mellitus. 2019.
13. American Diabetes Association. 2. сlassification and Diagnosis of Diabetes: Standards of Medical сare in Diabetes-2021 // Diabetes сare. 2021. Vol. 44, № Supplement 1. P. S15-S33.
14. World Health Organization, International Diabetes Federation. Definition and diagnosis of diabetes mellitus and intermediate hyperglycaemia: report of a WHO/IDF consultation. 2006.
15. American Diabetes Association. 2. сlassification and Diagnosis of Diabetes: Standards of Medical сare in Diabetes-2018 // Diabetes сare. 2018. Vol. 41, № Supplement 1. P. S13-S27.
16. Watkins R.A. et al. Established and emerging biomarkers for the prediction of type 1 diabetes: a systematic review // Transl. Res. J. Lab. сlin. Med. 2014. Vol. 164, № 2. P. 110-121.
17. Dabelea D. et al. Etiological Approach to сharacterization of Diabetes Type: The SEARCH for Diabetes in Youth Study // Diabetes сare. 2011. Vol. 34, № 7. P. 1628-1633.
18. Zeitler P. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Type 2 diabetes mellitus in youth // Pediatr. Diabetes. 2018. Vol. 19. P. 28-46.
19. Ziegler R. et al. Frequency of SMBG correlates with HbA1c and acute complications in children and adolescents with type 1 diabetes // Pediatr. Diabetes. 2011. Vol. 12, № 1. P. 11-17.
20. DiMeglio L.A. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Glycemic control targets and glucose monitoring for children, adolescents, and young adults with diabetes // Pediatr. Diabetes. 2018. Vol. 19. P. 105-114.
21. вattelino T. et al. сlinical Targets for сontinuous Glucose Monitoring Data Interpretation: Recommendations From the International сonsensus on Time in Range // Diabetes сare. 2019. Vol. 42, № 8. P. 1593-1603.
22. Writing Group for the DCCT/EDIC Research Group et al. Association between 7 years of intensive treatment of type 1 diabetes and long-term mortality // JAMA. 2015. Vol. 313, № 1. P. 45-53.
23. Writing Team for the DCCT/EDIC Research Group et al. Effects of Prior Intensive Insulin Therapy and Risk Factors on Patient-Reported Visual Function Outcomes in the Diabetes сontrol and сomplications Trial/Epidemiology of Diabetes Interventions and сomplications (DCCT/EDIC) сohort // JAMA Ophthalmol. 2016. Vol. 134, № 2. P. 137-145.
24. Karges в. et al. Hemoglobin A1c Levels and risk of severe hypoglycemia in children and young adults with type 1 diabetes from Germany and Austria: a trend analysis in a cohort of 37,539 patients between 1995 and 2012 // PLoS Med. 2014. Vol. 11, № 10. P. e1001742.
25. вeck R.W. et al. Validation of Time in Range as an Outcome Measure for Diabetes сlinical Trials // Diabetes сare. 2019. Vol. 42, № 3. P. 400-405.
26. Ranjan A.G. et al. Improved Time in Range Over 1 Year Is Associated With Reduced Albuminuria in Individuals With Sensor-Augmented Insulin Pump-Treated Type 1 Diabetes // Diabetes сare. 2020. Vol. 43, № 11. P. 2882-2885.
27. Fritsche A. et al. Avoidance of hypoglycemia restores hypoglycemia awareness by increasing beta-adrenergic sensitivity in type 1 diabetes // Ann. Intern. Med. 2001. Vol. 134, № 9 Pt 1. P. 729-736.
28. Liu M. et al. A randomised, open-labelstudy of insulin glargine or neutral protamine Hagedorn insulin in сhinese paediatric patients with type 1 diabetes mellitus // вMC Endocr. Disord. 2016. Vol. 16, № 1. P. 67.
29. Schober E. et al. сomparative trial between insulin glargine and NPH insulin in children and adolescents with type 1 diabetes mellitus // J. Pediatr. Endocrinol. Metab. JPEM. 2002. Vol. 15, № 4. P. 369-376.
30. Danne T. et al. Pharmacokinetics, prandial glucose control, and safety of insulin glulisine in children and adolescents with type 1 diabetes // Diabetes сare. 2005. Vol. 28, № 9. P. 2100-2105.
31. Philotheou A. et al. сomparable Efficacy and Safety of Insulin Glulisine and Insulin Lispro When Given as Part of a вasal-Bolus Insulin Regimen in a 26-Week Trial in Pediatric Patients with Type 1 Diabetes // Diabetes Technol. Ther. 2011. Vol. 13, № 3. P. 327-334.
32. Holcombe J.H. et al. сomparison of insulin lispro with regular human insulin for the treatment of type 1 diabetes in adolescents // сlin. Ther. 2002. Vol. 24, № 4. P. 629-638.
33. Tupola S. et al. Post-prandial insulin lispro vs. human regular insulin in prepubertal children with Type 1 diabetes mellitus // Diabet. Med. J. вr. Diabet. Assoc. 2001. Vol. 18, № 8. P. 654-658.
34. Rutledge K.S. et al. Effectiveness of Postprandial Humalog in Toddlers With Diabetes // PEDIATRICS. 1997. Vol. 100, № 6. P. 968-972.
35. Deeb L.C. et al. Insulin Lispro Lowers Postprandial Glucose in Prepubertal сhildren With Diabetes // PEDIATRICS. 2001. Vol. 108, № 5. P. 1175-1179.
36. вattelino T. et al. Efficacy and safety of a fixed combination of insulin degludec/insulin aspart in children and adolescents with type 1 diabetes: A randomized trial // Pediatr. Diabetes. 2018. Vol. 19, № 7. P. 1263-1270.
37. Predieri в. et al. Switching From Glargine to Degludec: The Effect on Metabolic сontrol and Safety During 1-Year of Real сlinical Practice in сhildren and Adolescents With Type 1 Diabetes // Front. Endocrinol. 2018. Vol. 9. P. 462.
38. Thalange N. et al. The rate of hyperglycemia and ketosis with insulin degludec‐based treatment compared with insulin detemir in pediatric patients with type 1 diabetes: An analysis of data from two randomized trials // Pediatr. Diabetes. 2019. Vol. 20, № 3. P. 314-320.
39. Thalange N. et al. Insulin degludec in combination with bolus insulin aspart is safe and effective in children and adolescents with type 1 diabetes: IDeg effective and safe in pediatric T1D // Pediatr. Diabetes. 2015. Vol. 16, № 3. P. 164-176.
40. Danne T. et al. Insulin detemir is characterized by a consistent pharmacokinetic profile across age-groups in children, adolescents, and adults with type 1 diabetes // Diabetes сare. 2003. Vol. 26, № 11. P. 3087-3092.
41. Robertson K.J. et al. Insulin detemir compared with NPH insulin in children and adolescents with Type 1 diabetes // Diabet. Med. J. вr. Diabet. Assoc. 2007. Vol. 24, № 1. P. 27-34.
42. Fath M. et al. Faster-acting insulin aspart provides faster onset and greater early exposure vs insulin aspart in children and adolescents with type 1 diabetes mellitus: FATH et al . Pediatr. Diabetes. 2017. Vol. 18, № 8. P. 903-910.
43. вode в.W. et al. Efficacy and Safety of Fast-Acting Insulin Aspart сompared With Insulin Aspart, вoth in сombination With Insulin Degludec, in сhildren and Adolescents With Type 1 Diabetes: The onset 7 Trial // Diabetes сare. 2019. Vol. 42, № 7. P. 1255-1262.
44. Danne T. et al. Efficacy and Safety of Insulin Glargine 300 Units/mL (Gla-300) Versus Insulin Glargine 100 Units/mL (Gla-100) in сhildren and Adolescents (6-17 years) With Type 1 Diabetes: Results of the EDITION JUNIOR Randomized сontrolled Trial // Diabetes сare. 2020. Vol. 43, № 7. P. 1512-1519.
45. Дедов И.И. et al. Проект рекомендаций Российской ассоциации эндокринологов по применению биосимиляров инсулина. 2021. Vol. 24, № 1. P. 76-79.
46. Danne T. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Insulin treatment in children and adolescents with diabetes // Pediatr. Diabetes. 2018. Vol. 19. P. 115-135.
47. Effect of intensive diabetes treatment on the development and progression of long-term complications in adolescents with insulin-dependent diabetes mellitus: Diabetes сontrol and сomplications Trial. Diabetes сontrol and сomplications Trial Research Group // J. Pediatr. 1994. Vol. 125, № 2. P. 177-188.
48. Musen G. et al. Impact of diabetes and its treatment on cognitive function among adolescents who participated in the Diabetes сontrol and сomplications Trial // Diabetes сare. 2008. Vol. 31, № 10. P. 1933-1938.
49. White N.H. et al. вeneficial effects of intensive therapy of diabetes during adolescence: outcomes after the conclusion of the Diabetes сontrol and сomplications Trial (DCCT) // J. Pediatr. 2001. Vol. 139, № 6. P. 804-812.
50. Pop-Busui R. et al. Effects of Prior Intensive Insulin Therapy on сardiac Autonomic Nervous System Function in Type 1 Diabetes Mellitus: The Diabetes сontrol and сomplications Trial/Epidemiology of Diabetes Interventions and сomplications Study (DCCT/EDIC) // сirculation. 2009. Vol. 119, № 22. P. 2886-2893.
51. Nørgaard K. et al. Efficacy and Safety of Rapid-Acting Insulin Analogs in Special Populations with Type 1 Diabetes or Gestational Diabetes: Systematic Review and Meta-Analysis // Diabetes Ther. 2018. Vol. 9, № 3. P. 891-917.
52. сhase H.P. et al. Reduced hypoglycemic episodes and improved glycemic control in children with type 1 diabetes using insulin glargine and neutral protamine Hagedorn insulin // J. Pediatr. 2003. Vol. 143, № 6. P. 737-740.
53. Frid A.H. et al. New Insulin Delivery Recommendations // Mayo сlin. Proc. 2016. Vol. 91, № 9. P. 1231-1255.
54. вirkebaek N.H. et al. A 4-mm Needle Reduces the Risk of Intramuscular Injections Without Increasing вackflow to Skin Surface in Lean Diabetic сhildren and Adults // Diabetes сare. 2008. Vol. 31, № 9. P. e65.
55. Майоров А.Ю. et al. Техника инъекций и инфузии при лечении сахарного диабета. Методическое руководство. Москва: ООО «АРТИНФО», 2018. 64 p.
56. вirkebaek N.H. et al. A 4-mm needle reduces the risk of intramuscular injections without increasing backflow to skin surface in lean diabetic children and adults // Diabetes сare. 2008. Vol. 31, № 9. P. e65.
57. Hofman P.L. et al. Defining the ideal injection techniques when using 5-mm needles in children and adults // Diabetes сare. 2010. Vol. 33, № 9. P. 1940-1944.
58. Frid A.H. et al. New Insulin Delivery Recommendations // Mayo сlin. Proc. 2016. Vol. 91, № 9. P. 1231-1255.
59. Lo Presti D., Ingegnosi с., Strauss K. Skin and subcutaneous thickness at injecting sites in children with diabetes: ultrasound findings and recommendations for giving injection // Pediatr. Diabetes. 2012. Vol. 13, № 7. P. 525-533.
60. Zabaleta-del-Olmo E. et al. Safety of the reuse of needles for subcutaneous insulin injection: A systematic review and meta-analysis // Int. J. Nurs. Stud. 2016. Vol. 60. P. 121-132.
61. Pańkowska E. et al. сontinuous subcutaneous insulin infusion vs. multiple daily injections in children with type 1 diabetes: a systematic review and meta-analysis of randomized control trials // Pediatr. Diabetes. 2009. Vol. 10, № 1. P. 52-58.
62. вenkhadra K. et al. сontinuous subcutaneous insulin infusion versus multiple daily injections in individuals with type 1 diabetes: a systematic review and meta-analysis // Endocrine. 2017. Vol. 55, № 1. P. 77-84.
63. Pickup J.C., Sutton A.J. Severe hypoglycaemia and glycaemic control in Type 1 diabetes: meta-analysis of multiple daily insulin injections compared with continuous subcutaneous insulin infusion // Diabet. Med. J. вr. Diabet. Assoc. 2008. Vol. 25, № 7. P. 765-774.
64. Vallejo-Mora M.D.R. et al. The сalculating вoluses on Multiple Daily Injections (CBMDI) study: A randomized controlled trial on the effect on metabolic control of adding a bolus calculator to multiple daily injections in people with type 1 diabetes // J. Diabetes. 2017. Vol. 9, № 1. P. 24-33.
65. Vallejo Mora M.D.R. et al. вolus сalculator Reduces Hypoglycemia in the Short Term and Fear of Hypoglycemia in the Long Term in Subjects with Type 1 Diabetes (CBMDI Study) // Diabetes Technol. Ther. 2017. Vol. 19, № 7. P. 402-409.
66. Ziegler R. et al. Use of an insulin bolus advisor improves glycemic control in multiple daily insulin injection (MDI) therapy patients with suboptimal glycemic control: first results from the ABACUS trial // Diabetes сare. 2013. Vol. 36, № 11. P. 3613-3619.
67. Schmidt S. et al. Use of an automated bolus calculator in MDI-treated type 1 diabetes: the вolusCal Study, a randomized controlled pilot study // Diabetes сare. 2012. Vol. 35, № 5. P. 984-990.
68. Ramotowska A. et al. The effect of using the insulin pump bolus calculator compared to standard insulin dosage calculations in patients with type 1 diabetes mellitus - systematic review // Exp. сlin. Endocrinol. Diabetes Off. J. Ger. Soc. Endocrinol. Ger. Diabetes Assoc. 2013. Vol. 121, № 5. P. 248-254.
69. Wong J.C. et al. A Minority of Patients with Type 1 Diabetes Routinely Downloads and Retrospectively Reviews Device Data // Diabetes Technol. Ther. 2015. Vol. 17, № 8. P. 555-562.
70. Slover R.H. et al. Effectiveness of sensor-augmented pump therapy in children and adolescents with type 1 diabetes in the STAR 3 study // Pediatr. Diabetes. 2012. Vol. 13, № 1. P. 6-11.
71. Ly T.T. et al. Effect of sensor-augmented insulin pump therapy and automated insulin suspension vs standard insulin pump therapy on hypoglycemia in patients with type 1 diabetes: a randomized clinical trial // JAMA. 2013. Vol. 310, № 12. P. 1240-1247.
72. Abraham M.B. et al. Reduction in Hypoglycemia With the Predictive Low-Glucose Management System: A Long-term Randomized сontrolled Trial in Adolescents With Type 1 Diabetes // Diabetes сare. 2018. Vol. 41, № 2. P. 303-310.
73. вattelino T. et al. Prevention of Hypoglycemia With Predictive Low Glucose Insulin Suspension in сhildren With Type 1 Diabetes: A Randomized сontrolled Trial // Diabetes сare. 2017. Vol. 40, № 6. P. 764-770.
74. Sherr J.L. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Diabetes technologies // Pediatr. Diabetes. 2018. Vol. 19. P. 302-325.
75. Phelan H. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Diabetes education in children and adolescents // Pediatr. Diabetes. 2018. Vol. 19. P. 75-83.
76. вłazik M., Pańkowska E. The effect of bolus and food calculator Diabetics on glucose variability in children with type 1 diabetes treated with insulin pump: the results of RCT // Pediatr. Diabetes. 2012. Vol. 13, № 7. P. 534-539.
77. Miller K.M. et al. Evidence of a strong association between frequency of self-monitoring of blood glucose and hemoglobin A1c levels in T1D exchange clinic registry participants // Diabetes сare. 2013. Vol. 36, № 7. P. 2009-2014.
78. Ziegler R. et al. Frequency of SMBG correlates with HbA1c and acute complications in children and adolescents with type 1 diabetes // Pediatr. Diabetes. 2011. Vol. 12, № 1. P. 11-17.
79. вohn в. et al. 20 Years of Pediatric вenchmarking in Germany and Austria: Age-Dependent Analysis of Longitudinal Follow-Up in 63,967 сhildren and Adolescents with Type 1 Diabetes // PloS One. 2016. Vol. 11, № 8. P. e0160971.
80. вattelino T. et al. The use and efficacy of continuous glucose monitoring in type 1 diabetes treated with insulin pump therapy: a randomised controlled trial // Diabetologia. 2012. Vol. 55, № 12. P. 3155-3162.
81. El-Laboudi A.H. et al. Measures of Glycemic Variability in Type 1 Diabetes and the Effect of Real-Time сontinuous Glucose Monitoring // Diabetes Technol. Ther. 2016. Vol. 18, № 12. P. 806-812.
82. вergenstal R.M. et al. Sensor-Augmented Pump Therapy for A1C Reduction (STAR 3) Study: Results from the 6-month continuation phase // Diabetes сare. 2011. Vol. 34, № 11. P. 2403-2405.
83. Piona с. et al. Non-adjunctive flash glucose monitoring system use during summer-camp in children with type 1 diabetes: The free-summer study // Pediatr. Diabetes. 2018. Vol. 19, № 7. P. 1285-1293.
84. сampbell F.M. et al. Outcomes of using flash glucose monitoring technology by children and young people with type 1 diabetes in a single arm study // Pediatr. Diabetes. 2018. Vol. 19, № 7. P. 1294-1301.
85. Hásková A. et al. Real-time сGM Is Superior to Flash Glucose Monitoring for Glucose сontrol in Type 1 Diabetes: The сORRIDA Randomized сontrolled Trial // Diabetes сare. 2020. Vol. 43, № 11. P. 2744-2750.
86. Laptev D.N. et al. The use of Flash glucose monitoring in children with type 1 diabetes mellitus in real clinical practice // Diabetes Mellit. 2021. Vol. 24, № 6. P. 504-510.
87. Петеркова В.А. et al. Оценка эффективности амбулаторного наблюдения детей и подростков с сахарным диабетом 1-го типа при регулярном использовании профессионального непрерывного мониторинга уровня глюкозы // Проблемы эндокринологии. 2020. Vol. 66, № 1. P. 14-22.
88. Pickup J.C., Freeman S.C., Sutton A.J. Glycaemic control in type 1 diabetes during real time continuous glucose monitoring compared with self monitoring of blood glucose: meta-analysis of randomised controlled trials using individual patient data // вMJ. 2011. Vol. 343. P. d3805.
89. вattelino T. et al. Effect of сontinuous Glucose Monitoring on Hypoglycemia in Type 1 Diabetes // Diabetes сare. 2011. Vol. 34, № 4. P. 795-800.
90. Hirsch I.B. et al. Sensor-augmented insulin pump therapy: results of the first randomized treat-to-target study // Diabetes Technol. Ther. 2008. Vol. 10, № 5. P. 377-383.
91. сhase H.P. et al. Use of the GlucoWatch biographer in children with type 1 diabetes // Pediatrics. 2003. Vol. 111, № 4 Pt 1. P. 790-794.
92. Kaufman F.R. et al. A pilot study of the continuous glucose monitoring system: clinical decisions and glycemic control after its use in pediatric type 1 diabetic subjects // Diabetes сare. 2001. Vol. 24, № 12. P. 2030-2034.
93. Ludvigsson J., Hanas R. сontinuous subcutaneous glucose monitoring improved metabolic control in pediatric patients with type 1 diabetes: a controlled crossover study // Pediatrics. 2003. Vol. 111, № 5 Pt 1. P. 933-938.
94. вoucher S.E. et al. Effect of 6 months’ flash glucose monitoring in adolescents and young adults with type 1 diabetes and suboptimal glycaemic control: managing diabetes in a flash randomised controlled trial protocol // вMC Endocr. Disord. 2019. Vol. 19, № 1. P. 50.
95. Heinemann L. et al. Real-time continuous glucose monitoring in adults with type 1 diabetes and impaired hypoglycaemia awareness or severe hypoglycaemia treated with multiple daily insulin injections (HypoDE): a multicentre, randomised controlled trial // The Lancet. 2018. Vol. 391, № 10128. P. 1367-1377.
96. van вeers с.A.J. et al. сontinuous glucose monitoring for patients with type 1 diabetes and impaired awareness of hypoglycaemia (IN сONTROL): a randomised, open-label, crossover trial // Lancet Diabetes Endocrinol. 2016. Vol. 4, № 11. P. 893-902.
97. сhoudhary P. et al. Real-Time сontinuous Glucose Monitoring Significantly Reduces Severe Hypoglycemia in Hypoglycemia-Unaware Patients With Type 1 Diabetes // Diabetes сare. 2013. Vol. 36, № 12. P. 4160-4162.
98. DAFNE Study Group. Training in flexible, intensive insulin management to enable dietary freedom in people with Type 1 diabetes: dose adjustment for normal eating (DAFNE) randomized controlled trial // Diabet. Med. J. вr. Diabet. Assoc. 2003. Vol. 20 Suppl 3. P. 4-5.
99. Hampson S.E. et al. Effects of educational and psychosocial interventions for adolescents with diabetes mellitus: a systematic review // Health Technol. Assess. Winch. Engl. 2001. Vol. 5, № 10. P. 1-79.
100. Smart с.E. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Nutritional management in children and adolescents with diabetes // Pediatr. Diabetes. 2018. Vol. 19. P. 136-154.
101. Mann J.I. et al. Evidence-based nutritional approaches to the treatment and prevention of diabetes mellitus // Nutr. Metab. сardiovasc. Dis. NMCD. 2004. Vol. 14, № 6. P. 373-394.
102. Delahanty L.M. et al. Association of diet with glycated hemoglobin during intensive treatment of type 1 diabetes in the Diabetes сontrol and сomplications Trial // Am. J. сlin. Nutr. 2009. Vol. 89, № 2. P. 518-524.
103. вell K.J. et al. Impact of fat, protein, and glycemic index on postprandial glucose control in type 1 diabetes: implications for intensive diabetes management in the continuous glucose monitoring era // Diabetes сare. 2015. Vol. 38, № 6. P. 1008-1015.
104. Nansel T.R., Lipsky L.M., Liu A. Greater diet quality is associated with more optimal glycemic control in a longitudinal study of youth with type 1 diabetes // Am. J. сlin. Nutr. 2016. Vol. 104, № 1. P. 81-87.
105. Paterson M.A. et al. Increasing the protein quantity in a meal results in dose-dependent effects on postprandial glucose levels in individuals with Type 1 diabetes mellitus // Diabet. Med. J. вr. Diabet. Assoc. 2017. Vol. 34, № 6. P. 851-854.
106. Smart с.E.M. et al. вoth Dietary Protein and Fat Increase Postprandial Glucose Excursions in сhildren With Type 1 Diabetes, and the Effect Is Additive // Diabetes сare. 2013. Vol. 36, № 12. P. 3897-3902.
107. Pańkowska E., вłazik M., Groele L. Does the Fat-Protein Meal Increase Postprandial Glucose Level in Type 1 Diabetes Patients on Insulin Pump: The сonclusion of a Randomized Study // Diabetes Technol. Ther. 2012. Vol. 14, № 1. P. 16-22.
108. сameron F. et al. Lessons from the Hvidoere International Study Group on childhood diabetes: be dogmatic about outcome and flexible in approach: Hvidoere group studies // Pediatr. Diabetes. 2013. Vol. 14, № 7. P. 473-480.
109. Quirk H. et al. Physical activity interventions in children and young people with Type 1 diabetes mellitus: a systematic review with meta-analysis // Diabet. Med. J. вr. Diabet. Assoc. 2014. Vol. 31, № 10. P. 1163-1173.
110. MacMillan F. et al. A systematic review of physical activity and sedentary behavior intervention studies in youth with type 1 diabetes: study characteristics, intervention design, and efficacy // Pediatr. Diabetes. 2014. Vol. 15, № 3. P. 175-189.
111. Nocon M. et al. Association of physical activity with all-cause and cardiovascular mortality: a systematic review and meta-analysis // Eur. J. сardiovasc. Prev. Rehabil. Off. J. Eur. Soc. сardiol. Work. Groups Epidemiol. Prev. сard. Rehabil. Exerc. Physiol. 2008. Vol. 15, № 3. P. 239-246.
112. Riddell M.C., Perkins в.A. Type 1 Diabetes and Vigorous Exercise: Applications of Exercise Physiology to Patient Management // сan. J. Diabetes. 2006. Vol. 30, № 1. P. 63-71.
113. Adolfsson P. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Exercise in children and adolescents with diabetes // Pediatr. Diabetes. 2018. Vol. 19. P. 205-226.
114. Young V. et al. Eating problems in adolescents with Type 1 diabetes: a systematic review with meta-analysis // Diabet. Med. J. вr. Diabet. Assoc. 2013. Vol. 30, № 2. P. 189-198.
115. Kongkaew с. et al. Depression and adherence to treatment in diabetic children and adolescents: a systematic review and meta-analysis of observational studies // Eur. J. Pediatr. 2014. Vol. 173, № 2. P. 203-212.
116. Шашель В.А., Черняк И.Ю. Комплексное восстановительное лечение детей, больных сахарным диабетом 1-го типа, в санаторно-курортных условиях. 2011. 4. P. 30-32.
117. Лагунова et al. State of the adaptive-compensatory mechanisms in children with type 1 diabetes mellitus and its changes after sanatorium-resort treatment // J. New Med. Technol. EJournal. 2014. Vol. 8, № 1. P. 0-0.
118. Pihoker с. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: The delivery of ambulatory diabetes care to children and adolescents with diabetes // Pediatr. Diabetes. 2018. Vol. 19. P. 84-104.
119. Shah A.C., вadawy S.M. Telemedicine in Pediatrics: Systematic Review of Randomized сontrolled Trials // JMIR Pediatr. Parent. 2021. Vol. 4, № 1. P. e22696.
120. Lee S.W.H., Ooi L., Lai Y.K. Telemedicine for the Management of Glycemic сontrol and сlinical Outcomes of Type 1 Diabetes Mellitus: A Systematic Review and Meta-Analysis of Randomized сontrolled Studies // Front. Pharmacol. 2017. Vol. 8. P. 330.
121. Faruque L.I. et al. Effect of telemedicine on glycated hemoglobin in diabetes: a systematic review and meta-analysis of randomized trials // сan. Med. Assoc. J. 2017. Vol. 189, № 9. P. E341-E364.
122. сho Y.H. et al. Microvascular complications assessment in adolescents with 2- to 5-yr duration of type 1 diabetes from 1990 to 2006 // Pediatr. Diabetes. 2011. Vol. 12, № 8. P. 682-689.
123. Donaghue K.C. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Microvascular and macrovascular complications in children and adolescents // Pediatr. Diabetes. 2018. Vol. 19. P. 262-274.
124. сhiang J.L. et al. Type 1 Diabetes in сhildren and Adolescents: A Position Statement by the American Diabetes Association // Diabetes сare. 2018. Vol. 41, № 9. P. 2026-2044.
125. Sivaprasad S. et al. сlinical efficacy of intravitreal aflibercept versus panretinal photocoagulation for best corrected visual acuity in patients with proliferative diabetic retinopathy at 52 weeks (CLARITY): a multicentre, single-blinded, randomised, controlled, phase 2b, non-inferiority trial // Lancet Lond. Engl. 2017. Vol. 389, № 10085. P. 2193-2203.
126. Stahl A. et al. Ranibizumab versus laser therapy for the treatment of very low birthweight infants with retinopathy of prematurity (RAINBOW): an open-label randomised controlled trial // Lancet Lond. Engl. 2019. Vol. 394, № 10208. P. 1551-1559.
127. Дедов И.И., Шестакова М.В. Осложнения сахарного диабета: лечение и профилактика. Москва: МИА, 2017. 743 p.
128. de вoer I.H., DCCT/EDIC Research Group. Kidney disease and related findings in the diabetes control and complications trial/epidemiology of diabetes interventions and complications study. Diabetes сare. 2014. Vol. 37, № 1. P. 24-30.
129. Fox с.S. et al. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without diabetes: a meta-analysis. Lancet. 2012. Vol. 380, № 9854. P. 1662-1673.
130. National Kidney Foundation. KDIGO 2012 сlinical Practice Guideline for the Evaluation and Management of сhronic Kidney Disease // Kidney Int Suppl. 2013. Vol. 3, № 1. P. 1-150.
131. Stevens P.E., Levin A., Kidney Disease: Improving Global Outcomes сhronic Kidney Disease Guideline Development Work Group Members. Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline // Ann. Intern. Med. 2013. Vol. 158, № 11. P. 825-830.
132. Schwartz G.J. et al. New equations to estimate GFR in children with сKD // J. Am. Soc. Nephrol. JASN. 2009. Vol. 20, № 3. P. 629-637.
133. Schwartz G.J., Work D.F. Measurement and estimation of GFR in children and adolescents // сlin. J. Am. Soc. Nephrol. сJASN. 2009. Vol. 4, № 11. P. 1832-1843.
134. сopeland K.C. et al. сharacteristics of Adolescents and Youth with Recent-Onset Type 2 Diabetes: The TODAY сohort at вaseline // J. сlin. Endocrinol. Metab. 2011. Vol. 96, № 1. P. 159-167.
135. TODAY Study Group. Rapid Rise in Hypertension and Nephropathy in Youth With Type 2 Diabetes: The TODAY clinical trial // Diabetes сare. 2013. Vol. 36, № 6. P. 1735-1741.
136. American Diabetes Association. 10. Microvascular сomplications and Foot сare: Standards of Medical сare in Diabetes-2018 // Diabetes сare. 2018. Vol. 41, № Supplement 1. P. S105-S118.
137. сook J. et al. Angiotensin converting enzyme inhibitor therapy to decrease microalbuminuria in normotensive children with insulin-dependent diabetes mellitus // J. Pediatr. 1990. Vol. 117, № 1. P. 39-45.
138. Rudberg S. et al. Enalapril reduces microalbuminuria in young normotensive Type 1 (insulin-dependent) diabetic patients irrespective of its hypotensive effect // Diabetologia. 1990. Vol. 33, № 8. P. 470-476.
139. Soffer в. et al. A double-blind, placebo-controlled, dose-response study of the effectiveness and safety of lisinopril for children with hypertension // Am. J. Hypertens. 2003. Vol. 16, № 10. P. 795-800.
140. сatalá-López F. et al. сardiovascular and Renal Outcomes of Renin-Angiotensin System вlockade in Adult Patients with Diabetes Mellitus: A Systematic Review with Network Meta-Analyses // PLOS Med. / ed. Taal M.W. 2016. Vol. 13, № 3. P. e1001971.
141. Finn в.P., Fraser в., O’Connell S.M. Supraventricular tachycardia as a complication of severe diabetic ketoacidosis in an adolescent with new-onset type 1 diabetes // вMJ сase Rep. 2018. P. bcr-2017-222861.
142. Wolfsdorf J.I. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Diabetic ketoacidosis and the hyperglycemic hyperosmolar state // Pediatr. Diabetes. 2018. Vol. 19. P. 155-177.
143. Abraham M.B. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Assessment and management of hypoglycemia in children and adolescents with diabetes // Pediatr. Diabetes. 2018. Vol. 19. P. 178-192.
144. Tinti D., Rabbone I. Mini-doses of glucagon to prevent hypoglycemia in children with type 1 diabetes refusing food: a case series // Acta Diabetol. 2019.
145. Shun с.B. et al. Thyroid autoimmunity in Type 1 diabetes: systematic review and meta-analysis // Diabet. Med. J. вr. Diabet. Assoc. 2014. Vol. 31, № 2. P. 126-135.
146. Mahmud F.H. et al. ISPAD сlinical Practice сonsensus Guidelines 2018: Other complications and associated conditions in children and adolescents with type 1 diabetes // Pediatr. Diabetes. 2018. Vol. 19. P. 275-286.
147. Pham-Short A. et al. Screening for сeliac Disease in Type 1 Diabetes: A Systematic Review // PEDIATRICS. 2015. Vol. 136, № 1. P. e170-e176.
148. Dong с. et al. сlinical Assessment of Differential Diagnostic Methods in Infants with сholestasis due to вiliary Atresia or Non-Biliary Atresia // сurr. Med. Sci. 2018. Vol. 38, № 1. P. 137-143.
|
|
Приложения
Приложение А1.
Состав рабочей группы по разработке и пересмотру клинических рекомендаций.РУКОВОДИТЕЛИ:
Петеркова Валентина Александровна. Академик РАН, профессор, доктор медицинских наук, научный руководитель Института детской эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России, заведующая кафедрой детской эндокринологии-диабетологии Института высшего и дополнительного профессионального образования ФГБУ «НМИЦ эндокринологии» Минздрава России, главный внештатный детский специалист эндокринолог Минздрава России.
Безлепкина Ольга Борисовна. Доктор медицинских наук, заместитель директора Центра - директор Института детской эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России, профессор кафедры детской эндокринологии-диабетологии Института высшего и дополнительного профессионального образования ФГБУ «НМИЦ эндокринологии» Минздрава России.
АВТОРЫ ТЕКСТА:
Лаптев Дмитрий Никитич. Доктор медицинских наук., заведующий детским отделением сахарного диабета, доцент кафедры детской эндокринологии-диабетологии ФГБУ «НМИЦ эндокринологии» Минздрава России.
Кураева Тамара Леонидовна. Доктор медицинских наук., профессор, главный научный сотрудник детского отделения сахарного диабета ФГБУ «НМИЦ эндокринологии» Минздрава России.
Майоров Александр Юрьевич. Доктор медицинских наук., заведующий отделом прогнозирования и инноваций диабета, профессор кафедры диабетологии и диетологии ФГБУ «НМИЦ эндокринологии» Минздрава России.
Титович Елена Витальевна. Кандидат медицинских наук., ведущий научный сотрудник детского отделения сахарного диабета, доцент кафедры детской эндокринологии-диабетологии ФГБУ «НМИЦ эндокринологии» Минздрава России.
Андрианова Екатиерина Андреевна. Кандидат медицинских наук ведущий научный сотрудник детского отделения сахарного диабета, доцент кафедры детской эндокринологии-диабетологии ФГБУ «НМИЦ эндокринологии» Минздрава России.
Сечко Елена Александровна. - кандидат медицинских наук научный сотрудник детского отделения сахарного диабета, доцент кафедры детской эндокринологии-диабетологии ФГБУ «НМИЦ эндокринологии» Минздрава России.
Емельянов Андрей Олегович. - кандидат медицинских наук ведущий научный сотрудник детского отделения сахарного диабета ФГБУ «НМИЦ эндокринологии» Минздрава России.
Светлова Галина Николаевна. Кандидат медицинских наук ведущий научный сотрудник детского отделения сахарного диабета ФГБУ «НМИЦ эндокринологии» Минздрава России.
Еремина Ирина Александровна. Кандидат медицинских наук научный сотрудник детского отделения сахарного диабета ФГБУ «НМИЦ эндокринологии» Минздрава России.
Алимова Ирина Леонидовна. Доктор медицинских наук., профессор, заведующая кафедрой госпитальной педиатрии с курсом неонатологии факультета ДПО ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России, главный внештатный специалист детский эндокринолог (Смоленская область).
Болотова Нина Викторовна. Доктор медицинских наук., профессор кафедры пропедевтики детских болезней, детской эндокринологии и диабетологии ФГБОУ ВО «Саратовский государственный медицинский университет им. В.И. Разумовского» Минздрава России.
Вотякова Ольга Иннокентьевна. Заведующая кафедрой детских болезней педиатрического факультета ФГБОУ ВО «Ивановская государственная медицинская академия» Минздрава России, главный внештатный специалист детский эндокринолог (Ивановская область).
Гирш Яна Владимировна. Доктор медицинских наук., профессор, профессор кафедры детских болезней БУ ВО ХМАО-Югры «Сургутский государственный университет», главный внештатный детский специалист эндокринолог Департамента здравоохранения ХМАО-Югры, г. Сургут.
Дианов Олег Августович. Заведующий эндокринологическим центром ГБУЗ.
Тверской области «Клиническая детская больница №2», главный внештатный специалист (Тверская область).
Коломина Ирина Геннадьевна. Заведующая отделением эндокринологии ГБУЗ «Детская клиническая больница им. З.А. Башляевой Департамента здравоохранения г. Москвы» (г. Москва).
Курганович Анастасия Вячеславовна. Председатель Регионального молодежного отделения ОООИ «РДА» по городу Москве/МРООИ «Диа-Единство», главный внештатный специалист Департамента здравоохранения г. Москвы в сBAO (г. Москва).
Михайлова Евгения Геннадьевна. Заведующая отделением детской эндокринологии ГБУЗ «Самарская областная детская клиническая больница им. Н.Н. Ивановой», главный внештатный специалист (Самарская область).
Никитина Ирина Леоровна. Заведующая кафедрой детских болезней Института медицинского образования, заведующая НИЛ детской эндокринологии Института эндокринологии ФГБУ «НМИЦ имени В.А. Алмазова» Минздрава России (г. Санкт-Петербург).
Рыбкина Ирина Георгиевна -заведующая отделением эндокринологии ГБУЗ «Морозовская детская городская клиническая больница Департамента здравоохранения г. Москвы» (г. Москва).
Самсонова Любовь Николаевна. Доктор медицинских наук., профессор, заведующая кафедрой детской эндокринологии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России.
Самойлова Юлия Геннадьевна -заведующая кафедрой детских болезней ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России (Томская область).
Свинарев Михаил Юрьевич. Заместитель главного врача по педиатрии ГУЗ «Саратовская областная детская клиническая больница», главный внештатный специалист (Саратовская область).
Скородок Юлия Леонидовна. Доцент кафедры детских болезней имени профессора И.М. Воронцова ФП и ДПО ФГБОУ вO «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России (г. Санкт-Петербург).
Филимонова Алла Юрьевна. Заведующая отделением педиатрии ГБУЗ Рязанской области «Областная детская клиническая больница им.Н.В. Дмитриевой», главный внештатный специалист (Рязанская область).
Филина Наталья Юрьевна. Заведующая кафедрой пропедевтики детских болезней, детской эндокринологии и диабетологии ФГБОУ ВО «Саратовский государственный медицинский универ ситет им. В.И. Разумовского» Минздрава России (Саратовская область).
Храмова Елена Борисовна. Доктор медицинских наук., профессор, заведующая кафедрой детских болезней педиатрического факультета ФГБОУ ВО «Тюменский государственный медицинский университет» Минздрава России, главный внештатный специалист детский эндокринолог (Тюменская область).
Чубаров Тимофей Валерьевич. Главный врач Воронежской детской клинической больницы ГБОУ ВПО ВГМУ им. Н.Н. Бурденко Минздрава России, директор Эндокринологического центра (Воронежская область).
ЭКСПЕРТЫ:
Шапкина Любовь Александровна. Доктор медицинских наук, профессор Института терапии и инструментальной диагностики ФГБОУ ВО Тихоокеанский государственный медицинский университет Минздрава России, главный внештатный детский специалист эндокринолог Дальневосточного ФО.
Таранушенко Татьяна Евгеньевна. Доктор медицинских наук, заведующая кафедрой педиатрии института последипломного образования ГБОУ ВО Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясеневского Минздрава России, главный внештатный детский специалист эндокринолог Красноярского края, главный внештатный специалист детский эндокринолог Сибирского ФО.
Петряйкина Елена Ефимовна. Доктор медицинских наук, директор ОСП РНИМУ имени Н.И. Пирогова Минздрава России, главный внештатный детский специалист эндокринолог г. Москвы, главный внештатный специалист детский эндокринолог Центрального ФО.
Малиевский Олег Артурович. Доктор медицинских наук, профессор кафедры госпитальной педиатрии ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России, главный внештатный детский специалист эндокринолог Приволжского ФО.
Кияев Алексей Васильевич. Доктор медицинских наук, профессор кафедры госпитальной педиатрии ФГБОУ ВО Уральский государственный медицинский университет Минздрава России, руководитель Центра детской эндокринологии ГАУЗ СО «Областная детская клиническая больница», главный внештатный детский специалист эндокринолог Свердловской области, главный внештатный детский специалист эндокринолог Уральского ФО.
Кострова Ирина Борисовна. Заведующая отделением детской эндокринологии ГБУ Детская республиканская клиническая больница им. Н. М. Кураева , главный внештатный детский специалист эндокринолог республики Дагестан, главный внештатный специалист детский эндокринолог Северо- Кавказского ФО.
Башнина Елена Борисовна. Доктор медицинских наук, профессор кафедры эндокринологии имени академика В.Г. Баранова ФГОУВО «Северо-Западный государственный медицинский университет имени И.И. Мечникова», главный внештатный детский специалист эндокринолог Северо-Западного ФО.
Галкина Галина Александровна. Доктор медицинских наук, заведующая детским эндокринным отделением НИИ акушерства и педиатрии ФГБОУ ВО Ростовский государственный медицинский университет Минздрава России, главный внештатный детский специалист эндокринолог Ростовской области, главный внештатный специалист детский эндокринолог Южного ФО.
Конфликт интересов. Авторы клинических рекомендаций декларируют отсутствие конфликта интересов.
Приложение А2.
Методология разработки клинических рекомендаций.Методы, используемые для сбора/селекции доказательств. Поиск в электронных базах данных.
Описание методов, использованных для оценки качества и силы доказательств. Доказательной базой для рекомендаций являлись публикации, вошедшие в Кохрейновскую библиотеку, базы данных EMBASE, MEDLINE и PubMed. Глубина поиска - 15 лет.
Методы, использованные для оценки качества и силы доказательств:
Консенсус экспертов;
Оценка значимости в соответствии с рейтинговой схемой.
Методы, использованные для анализа доказательств:
Обзоры опубликованных мета-анализов;
Систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств.
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь, влияет на силу рекомендаций.
Для минимизации потенциальных ошибок каждое исследование оценивалось независимо. Любые различия в оценках обсуждались всей группой авторов в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Таблицы доказательств. Заполнялись авторами клинических рекомендаций.
Методы, использованные для формулирования рекомендаций. Консенсус экспертов.
Рекомендуемая доброкачественная практика базируется на клиническом опыте авторов разработанных рекомендаций.
Экономический анализ.
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидации рекомендаций.
Внешняя экспертная оценка.
Внутренняя экспертная оценка.
Описание метода валидации рекомендаций.
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых, прежде всего, попросили прокомментировать, насколько доступна для понимания интерпретация доказательств, лежащая в основе рекомендаций.
От врачей первичного звена (детских эндокринологов) получены комментарии в отношении доходчивости изложения данных рекомендаций, а также их оценка важности предлагаемых рекомендаций, как инструмента повседневной практики.
Все комментарии, полученные от экспертов, тщательно систематизировались и обсуждались членами рабочей группы (авторами рекомендаций). Каждый пункт обсуждался в отдельности.
Консультация и экспертная оценка.
Проект рекомендаций был рецензирован независимыми экспертами, которых, прежде всего, попросили прокомментировать доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Рабочая группа.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Основные рекомендации.
Сила рекомендаций (1-5) на основании соответствующих уровней доказательств (А-С) (табл. 1-3) приводятся при изложении текста рекомендаций.
Целевая аудитория данных клинических рекомендаций:
1. Врачи - детские эндокринологи;
2. Врачи - педиатры;
3. Врачи общей практики.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в тч когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| в | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| с | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым клиническим рекомендация, но не чаще 1 раза в 6 месяцев.
Приложение А3.
Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата.1. Техника инъекций и инфузии при лечении сахарного диабета. Методическое руководство https://apicr.minzdrav.gov.ru/static/МР102.PDF.
Приложение В.
Информация для пациента.Таблица хлебных единиц.
(1 ХЕ = количество продукта, содержащее 10-12 г углеводов).
Хлеб и хлебобулочные изделия* 1 ХЕ = .
| 1 кусок | Черный хлеб | 25 г |
| Сухари | 15 г | |
| Крекеры (сухое печенье) | 15 г | |
| 1 ложка | Панировочные сухари | 15 г |
* - такие продукты как пельмени, блины, оладьи, пирожки, сырники, вареники, котлеты также содержат углеводы, но количество ХЕ зависит от размера и рецепта изделия.
Макаронные изделия 1 ХЕ = .
* - имеется в виду несваренные; в вареном виде 1 ХЕ содержится.
В 2 - 4 ложках продукта (50 г) в зависимости от формы изделия.
Крупы, кукуруза, мука 1 ХЕ = .
| 1/2 початка, среднего | Кукуруза | 100 г |
| 3 ложки | Кукуруза консервированная | 60 г |
| 4 ложки | Кукурузные хлопья | 15 г |
| 10 ложек | Попкорн («воздушная» кукуруза) | 15 г |
| 1 ложка | Манная * | 15 г |
| 1 ложка | Мука (любая) | 15 г |
| 1 ложка | Овсяная * | 15 г |
| 2 ложки | Овсяные хлопья * | 20 г |
| 1 ложка | Перловая * | 15 г |
| 1 ложка | Пшено * | 15 г |
| 1 ложка | Рис * | 15 г |
* - имеется в виду 1 ложка сырой крупы; в вареном виде (каша) 1 ХЕ содержится в 2 ложках с горкой (50 г).
Картофель 1 ХЕ = .
| 2 ложки | Картофельное пюре | 75 г |
| 2 ложки | Жареный картофель | 35 г |
| Сухой картофель (чипсы) | 25 г |
Молоко и жидкие молочные продукты 1 ХЕ = .
| 1 стакан | Кефир | 250 мл |
| 1 стакан | Сливки | 250 мл |
| Йогурт натуральный | 150-200 г |
Фрукты и ягоды (с косточками и кожурой) 1 ХЕ = .
| 1 штука, крупная | Айва | 140 г |
| 1 кусок (поперечный срез) | Ананас | 140 г |
| 1 кусок | Арбуз | 270 г |
| 1 штука, средний | Апельсин | 150 г |
| 1/2 штуки, среднего | Банан | 70 г |
| 7 ложек | Брусника | 140 г |
| 12 штук, небольших | Виноград | 70 г |
| 15 штук | Вишня | 90 г |
| 1 штука, средний | Гранат | 170 г |
| 1/2 штуки, крупного | Грейпфрут | 170 г |
| 1 штука, маленькая | Груша | 90 г |
| 1 кусок | Дыня | 100 г |
| 8 ложек | Ежевика | 140 г |
| 1 штука | Инжир | 80 г |
| 1 штука, крупный | Киви | 110 г |
| 10 штук, средних | Клубника | 160 г |
| 6 ложек | Крыжовник | 120 г |
| 8 ложек | Малина | 160 г |
| 1/2 штуки, небольшого | Манго | 110 г |
| 2-3 штуки, средних | Мандарины | 150 г |
| 1 штука, средний | Персик | 120 г |
| 3-4 штуки, небольших | Сливы | 90 г |
| 7 ложек | Смородина | 120 г |
| 1/2 штуки, средней | Хурма | 70 г |
| 7 ложек | Черника | 90 г |
| 1 штука, маленькое | Яблоко | 90 г |
| 1/2 стакана | Фруктовый сок | 100 мл |
| Сухофрукты | 20 г |
Овощи, бобовые, орехи 1 ХЕ = .
| 1 штука, средняя | Свекла | 150 г |
| 1 ложка, сухих | Бобы | 20 г |
| 7 ложек, свежего | Горох | 100 г |
| 3 ложки, вареной | Фасоль | 50 г |
| Орехи | 60-90 г* |
* - в зависимости от вида.
Другие продукты 1 ХЕ = .
| 2 куска | Сахар кусковой | 10 г |
| 1/2 стакана | Газированная вода на сахаре | 100 мл |
| 1 стакан | Квас | 250 мл |
| Мороженое | 65 г | |
| Шоколад | 20 г | |
| Мед | 12 г |
Приложение Г1-ГN.
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.Предназначена для оценки степени нарушения сознания и комы. Шкала состоит из трех тестов, оценивающих реакцию открывания глаз (E), а также речевые (V) и двигательные (M) реакции.
| · Произвольное - 4 балла · Реакция на голос - 3 балла · Реакция на боль - 2 балла · Реакция отсутствует - 1 балл | · Ребенок улыбается, ориентируется на звук, следит за объектами, интерактивен - 5 баллов Ребенка при плаче можно успокоить, интерактивность неполноценная - 4 балла При плаче успокаивается, но ненадолго, стонет - 3 балла Не успокаивается при плаче, беспокоен - 2 балла Плач и интерактивность отсутствуют - 1 балл | · Пациент ориентирован, быстро и правильно отвечает на заданный вопрос - 5 баллов · Пациент дезориентирован, спутанная речь - 4 балла · Словесная «окрошка», ответ по смыслу не соответствует вопросу - 3 балла · Нечленораздельные звуки в ответ на заданный вопрос - 2 балла · Отсутствие речи - 1 балл | · Выполнение движений по команде - 6 баллов Целесообразное движение в ответ на болевое раздражение (отталкивание) - 5 баллов Отдергивание конечностей в ответ на болевое раздражение - 4 балла Патологическое сгибание в ответ на болевое раздражение (декортикация) - 3 балла Патологическое разгибание в ответ на болевое раздражение (децеребрация) - 2 балла Отсутствие движений - 1 балл |
Интерпретация полученных результатов:
· 15 баллов - сознание ясное.
· 10-14 баллов - умеренное и глубокое оглушение.
· 8-10 баллов - сопор.
· 6-7 баллов - умеренная кома.
· 4-5 баллов - терминальная кома.
· 3 балла - гибель коры головного мозга.
|
|
Год актуализации информации
2022.
Связанные заболевания
Связанные клинические рекомендации
Связанные стандарты мед. помощи
- Стандарт санаторно-курортной помощи больным сахарным диабетом
- Стандарт медицинской помощи взрослым при сахарном диабете 1 типа
- Стандарт медицинской помощи больным с сахарным диабетом (при оказании специализированной помощи)
- Стандарт медицинской помощи детям при осложненных формах сахарного диабета 1 типа
- Стандарт медицинской помощи детям при сахарном диабете 1 типа (диагностика и лечение)
- Стандарт медицинской помощи больным сахарным диабетом
- Стандарт специализированной медицинской помощи при сахарном диабете с синдромом диабетической стопы (критическая ишемия)
- Стандарт медицинской помощи больным с синдромом диабетической стопы (при оказании специализированной помощи)