
МКБ-10 коды
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: D59.3.
Год утверждения (частота пересмотра): 2021.
Возрастная категория: Дети.
Пересмотр не позднее: 2023.
ID: 466.
Разработчик клинической рекомендации.
• Союз педиатров России.
• Столичная ассоциация врачей-нефрологов.
• Ассоциация медицинских генетиков.
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2021.
Возрастная категория: Дети.
Пересмотр не позднее: 2023.
ID: 466.
Разработчик клинической рекомендации.
• Союз педиатров России.
• Столичная ассоциация врачей-нефрологов.
• Ассоциация медицинских генетиков.
Одобрено Научно-практическим Советом Минздрава РФ.
|
|
 Список сокращений
Список сокращений
ADAMTS 13 - специфическая металлопротеиназа (а disintegrin and metalloproteinase with thrombospondin motifs 13), ответственная за деградацию фактора фон Виллебранда;
C3 - компонент комплемента С3;
СblC-ГУС - гемолитико-уремический синдром, ассоциированный с дефектным метаболизмом кобаламина;
CFB - фактор в комплемента;
CFH - фактор H комплемента;
CFI - фактор I комплемента;
CH50 - общая гемолитическая активность комплемента;
DGKE - диацилглицеролкиназа ɛ;
ЕНЕС - энтерогеморрагическая Escherichia coli;
Gb3 - глоботриазилцерамид;
IgG - иммуноглобулин G;
IgM - иммуноглобулин М;
INF2 - инвертированный формин-2;
HELLP-синдром. Аббревиатура симптомокомплекса гемолиза ( Hemolysis), повышения активности ферментов печени ( Elevated Liver enzymes) и тромбоцитопении ( Lоw Platelet соunt), ассоциированного с преэклампсией;
HLA - человеческий лейкоцитарный антиген;
KDIGO - инициативная группа по улучшению глобальных исходов заболеваний.
Почек [Kidney Disease: Improving Global Outcomes (KDIGO)];
MCP - мембранный кофакторный протеин;
MLPA - мультиплексная амплификация лигированных проб;
NGS - секвенирование нового поколения (next generation sequencing);
PLG - плазминоген;
PnГУС - гемолитико-уремический синдром, ассоциированный с Streptococcus pneumoniae;
STEC - шига-токсин продуцирующая Escherichia coli;
SD1 - Shigella dysenteriae type1;
Stx - шига-токсин; STEC-ГУС - гемолитико-уремический синдром, ассоциированный с шига-токсин продуцирующей Escherichia coli;
ТF-антиген - антиген Томсена-Фриденрейха;
THBD - тромбомодулин;
АГ - артериальная гипертензия;
АГУС - атипичный гемолитико-уремический синдром;
АЛТ - аланинаминотрансфераза;
Анти-CFH-ат- антитела к сFH.
АСТ - аспартатаминотрансфераза;
АФС - антифосфолипидный синдром;
БРА - антагонисты рецепторов ангиотензина II;
ГУС - гемолитико-уремический синдром;
ДВС - диссеменированное внутрисосудистое свертывание;
ЖКТ - желудочно-кишечный тракт;
ЗПП - заменное переливание плазмы;
ЗПТ - заместительная почечная терапия;
ИАПФ - ингибиторы АПФ (ангиотензин-превращающего фермента);
ИВЛ - искусственная вентиляция легких.
КТ - компьютерная томография;
КФК - креатинфосфокиназа;
КФК-МВ - МВ-изофермент креатинфосфокиназы, наиболее характерный для сердечной мышцы;
ЛДГ - лактатдегидрогеназа;
МАК - мембранно-атакующий комплекс;
МРТ - магнитно-резонансная томография;
ОПП - острое повреждение почек;
ПВВГД - продленный вено-венозный гемодиализ;
ПВВГДФ - продленная вено-венозная гемодиафильтрация;
ПД - перитонеальный диализ;
ПТ - плазмотерапия;
ПЦР - полимеразная цепная реакция;
СЗП - свежезамороженная плазма;
СКВ - системная красная волчанка;
СКФ - скорость клубочковой фильтрации;
СРБ - С-реактивный белок;
ТМА - тромботическая микроангиопатия;
ТТП - тромботическая тромбоцитопеническая пурпура;
ТХПН - терминальная хроническая почечная недостаточность;
УДД - уровень достоверности доказательств.
УУР - уровень убедительности рекомендации.
ХБП - хроническая болезнь почек;
ЦНС - центральная нервная система;
ЩФ - щелочная фосфатаза.
** - лекарственный препарат, входящий в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2020 год (Распоряжение Правительства РФ от 12,10,2019 № 2406-р).
- применение off-label - вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и пациента в возрасте старше 15 лет.
C3 - компонент комплемента С3;
СblC-ГУС - гемолитико-уремический синдром, ассоциированный с дефектным метаболизмом кобаламина;
CFB - фактор в комплемента;
CFH - фактор H комплемента;
CFI - фактор I комплемента;
CH50 - общая гемолитическая активность комплемента;
DGKE - диацилглицеролкиназа ɛ;
ЕНЕС - энтерогеморрагическая Escherichia coli;
Gb3 - глоботриазилцерамид;
IgG - иммуноглобулин G;
IgM - иммуноглобулин М;
INF2 - инвертированный формин-2;
HELLP-синдром. Аббревиатура симптомокомплекса гемолиза ( Hemolysis), повышения активности ферментов печени ( Elevated Liver enzymes) и тромбоцитопении ( Lоw Platelet соunt), ассоциированного с преэклампсией;
HLA - человеческий лейкоцитарный антиген;
KDIGO - инициативная группа по улучшению глобальных исходов заболеваний.
Почек [Kidney Disease: Improving Global Outcomes (KDIGO)];
MCP - мембранный кофакторный протеин;
MLPA - мультиплексная амплификация лигированных проб;
NGS - секвенирование нового поколения (next generation sequencing);
PLG - плазминоген;
PnГУС - гемолитико-уремический синдром, ассоциированный с Streptococcus pneumoniae;
STEC - шига-токсин продуцирующая Escherichia coli;
SD1 - Shigella dysenteriae type1;
Stx - шига-токсин; STEC-ГУС - гемолитико-уремический синдром, ассоциированный с шига-токсин продуцирующей Escherichia coli;
ТF-антиген - антиген Томсена-Фриденрейха;
THBD - тромбомодулин;
АГ - артериальная гипертензия;
АГУС - атипичный гемолитико-уремический синдром;
АЛТ - аланинаминотрансфераза;
Анти-CFH-ат- антитела к сFH.
АСТ - аспартатаминотрансфераза;
АФС - антифосфолипидный синдром;
БРА - антагонисты рецепторов ангиотензина II;
ГУС - гемолитико-уремический синдром;
ДВС - диссеменированное внутрисосудистое свертывание;
ЖКТ - желудочно-кишечный тракт;
ЗПП - заменное переливание плазмы;
ЗПТ - заместительная почечная терапия;
ИАПФ - ингибиторы АПФ (ангиотензин-превращающего фермента);
ИВЛ - искусственная вентиляция легких.
КТ - компьютерная томография;
КФК - креатинфосфокиназа;
КФК-МВ - МВ-изофермент креатинфосфокиназы, наиболее характерный для сердечной мышцы;
ЛДГ - лактатдегидрогеназа;
МАК - мембранно-атакующий комплекс;
МРТ - магнитно-резонансная томография;
ОПП - острое повреждение почек;
ПВВГД - продленный вено-венозный гемодиализ;
ПВВГДФ - продленная вено-венозная гемодиафильтрация;
ПД - перитонеальный диализ;
ПТ - плазмотерапия;
ПЦР - полимеразная цепная реакция;
СЗП - свежезамороженная плазма;
СКВ - системная красная волчанка;
СКФ - скорость клубочковой фильтрации;
СРБ - С-реактивный белок;
ТМА - тромботическая микроангиопатия;
ТТП - тромботическая тромбоцитопеническая пурпура;
ТХПН - терминальная хроническая почечная недостаточность;
УДД - уровень достоверности доказательств.
УУР - уровень убедительности рекомендации.
ХБП - хроническая болезнь почек;
ЦНС - центральная нервная система;
ЩФ - щелочная фосфатаза.
** - лекарственный препарат, входящий в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2020 год (Распоряжение Правительства РФ от 12,10,2019 № 2406-р).
- применение off-label - вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и пациента в возрасте старше 15 лет.
Термины и определения
ADAMTS13. Металлопротеаза, расщепляющая сверхкрупные мультимеры фактора фон Виллебранда, диагностический маркер тромботической тромбоцитопенической пурпуры.
СblC-ГУС. Гемолитико-уремический синдром, ассоциированный с дефектным метаболизмом кобаламина ( у пациентов с метилмалоновой ацидемией (ацидурией)).
PnГУС. Инфекционно-опосредованный гемолитико-уремический синдром, развивающийся вследствие Streptococcus pneumoniae.
STEC-ГУС. Инфекционно-опосредованный гемолитико-уремический синдром, развивающийся вследствие повреждения эндотелия сосудов микроциркуляторного русла шига-токсином, продуцирующимся энтерогеморрагической или энтероаггрегативной E.coli или Shigella dysenteriae type1. Синоним: типичный ГУС.
Атипичный гемолитико-уремический синдром (аГУС). Системное заболевание из группы тромботических микроангиопатий с прогрессирующим течением и неблагоприятным прогнозом, в основе которого лежит неконтролируемая активация альтернативного пути комплемента наследственной (мутации генов, кодирующие белки комплемента) или приобретённой природы (антитела к фактору Н), приводящая к генерализованному тромбообразованию в сосудах микроциркуляторного русла (комплемент-опосредованная тромботическая микроангиопатия).
Метилмалоновая ацидемия (ацидурия). Генетически гетерогенное наследственное заболевание из группы органических ацидемий, обусловленное блокированием обмена пропионатов на уровне перехода метилмалонил-КоА в сукцинил-КоА и нарушением метаболизма ряда аминокислот (изолейцин, валин, треонин, метионин), жирных кислот с нечетным числом атомов углерода и холестерина.
Острое повреждение почек (ОПП). Острое, потенциально обратимое изменение в почечной паренхиме, сопровождающееся снижением функции почек различной степени. Термин, общепринятый в настоящее время вместо устаревшего - острая почечная недостаточность (ОПН). Последнее предложение по своей сути неверное, так как термины ОПП и ОПН не являются синонимами. Международные критерии консенсуса для ОПП предназначены для описания трех уровней почечной недостаточности (риск, травмы, недостаточность) и двух клинических исходов (потеря почечной функции и терминальная стадия).
Синдром полиорганной недостаточности (СПОН). Тяжёлое поражение двух и более функциональных систем организма.
Тромботическая микроангиопатия (ТМА). Клинико-морфологический синдром, характеризующий особый тип поражения сосудов микроциркуляторного русла, в основе которого лежит повреждение эндотелия с последующим тромбообразованием.
Тромботическая тромбоцитопеническая пурпура (ТТП). Системная форма тромботической микроангиопатии, обусловленная сверхкрупными мультимерами фактора фон Виллебранда вследствие приобретённого (аутоантитела) или наследственного (мутации гена) дефицита ADAMTS13.
Хроническая болезнь почек (ХБП). Стойкие нарушения функции почек, продолжающиеся в течение 3-х месяцев и более, определяемые как структурные и/или функциональные изменения с различной степенью снижения клиренсной функции.
СblC-ГУС. Гемолитико-уремический синдром, ассоциированный с дефектным метаболизмом кобаламина ( у пациентов с метилмалоновой ацидемией (ацидурией)).
PnГУС. Инфекционно-опосредованный гемолитико-уремический синдром, развивающийся вследствие Streptococcus pneumoniae.
STEC-ГУС. Инфекционно-опосредованный гемолитико-уремический синдром, развивающийся вследствие повреждения эндотелия сосудов микроциркуляторного русла шига-токсином, продуцирующимся энтерогеморрагической или энтероаггрегативной E.coli или Shigella dysenteriae type1. Синоним: типичный ГУС.
Атипичный гемолитико-уремический синдром (аГУС). Системное заболевание из группы тромботических микроангиопатий с прогрессирующим течением и неблагоприятным прогнозом, в основе которого лежит неконтролируемая активация альтернативного пути комплемента наследственной (мутации генов, кодирующие белки комплемента) или приобретённой природы (антитела к фактору Н), приводящая к генерализованному тромбообразованию в сосудах микроциркуляторного русла (комплемент-опосредованная тромботическая микроангиопатия).
Метилмалоновая ацидемия (ацидурия). Генетически гетерогенное наследственное заболевание из группы органических ацидемий, обусловленное блокированием обмена пропионатов на уровне перехода метилмалонил-КоА в сукцинил-КоА и нарушением метаболизма ряда аминокислот (изолейцин, валин, треонин, метионин), жирных кислот с нечетным числом атомов углерода и холестерина.
Острое повреждение почек (ОПП). Острое, потенциально обратимое изменение в почечной паренхиме, сопровождающееся снижением функции почек различной степени. Термин, общепринятый в настоящее время вместо устаревшего - острая почечная недостаточность (ОПН). Последнее предложение по своей сути неверное, так как термины ОПП и ОПН не являются синонимами. Международные критерии консенсуса для ОПП предназначены для описания трех уровней почечной недостаточности (риск, травмы, недостаточность) и двух клинических исходов (потеря почечной функции и терминальная стадия).
Синдром полиорганной недостаточности (СПОН). Тяжёлое поражение двух и более функциональных систем организма.
Тромботическая микроангиопатия (ТМА). Клинико-морфологический синдром, характеризующий особый тип поражения сосудов микроциркуляторного русла, в основе которого лежит повреждение эндотелия с последующим тромбообразованием.
Тромботическая тромбоцитопеническая пурпура (ТТП). Системная форма тромботической микроангиопатии, обусловленная сверхкрупными мультимерами фактора фон Виллебранда вследствие приобретённого (аутоантитела) или наследственного (мутации гена) дефицита ADAMTS13.
Хроническая болезнь почек (ХБП). Стойкие нарушения функции почек, продолжающиеся в течение 3-х месяцев и более, определяемые как структурные и/или функциональные изменения с различной степенью снижения клиренсной функции.
|
|
Описание
Гемолитико-уремический синдром (ГУС) является одной из ведущих причин развития ОПП у детей [1]. ГУС характеризуется триадой признаков с развитием Кумбс-негативной микроангиопатической гемолитической анемией (МАГА), тромбоцитопенией и острым повреждением почек. Указанные признаки являются составляющими клинико-морфологического синдрома - тромботической микроангиопатии (ТМА), характеризующейся окклюзионным поражением сосудов микроциркуляторного русла, возникшим вследствие повреждения эндотелия. При эндотелиальной дисфункции происходит активация тромбоцитов с образованием тромбов, что приводит к механическому повреждению эритроцитов и к тромбированию просвета сосудов с последующей ишемией органа, в первую очередь почек [1, 2, 3]. В основе ТМА лежит повреждение и дисфункция эндотелия, вызванные различными причинами, что и обуславливает разнообразие её форм [1, 4].
Классификация ГУС сложна, поскольку клиническая картина заболевания может проявляться в широком диапазоне клинических сценариев.
Большинство случаев (до 90%) ГУС возникают в результате инфицирования бактериями, продуцирующими шига-токсин (Stx): энтерогеморрагической Escherichia coli (STEC) или Shigella dysenteriae type 1 [5]. Данная форма ТМА называется типичным ГУС/STEC-ГУС. STEC-ГУС является одним из наиболее распространенных заболеваний, требующих экстренной заместительной почечной терапии (ЗПТ) у детей [2, 6]. Летальность при типичном ГУС во всем мире в период острой фазы достигает 2-5% [7].
Остальные 10% случаев ГУС традиционно были сгруппированы как атипичный ГУС (аГУС). Однако по мере того, как наше понимание патогенеза ГУС улучшилось за последние 20 лет, стало ясно, что аГУС - это не одно, а множество различных заболеваний со схожими клиническими признаками. В большинстве случаев аГУС - ультраредкое (орфанное) заболевание прогрессирующего течения вследствие системной ТМА, обусловленной хронической неконтролируемой активацией альтернативного пути комплемента [1, 5, 8]. аГУС характеризуется рецидивирующим течением на протяжении всей жизни и представляет собой потенциально жизнеугрожающее состояние. Установлено, что при дебюте аГУС в детском возрасте терминальная стадия хронической болезни почек (ХБП) (ХБП 5) развивается реже, но смертность у детей выше, чем у взрослых [1, 5].
Классификация ГУС сложна, поскольку клиническая картина заболевания может проявляться в широком диапазоне клинических сценариев.
Большинство случаев (до 90%) ГУС возникают в результате инфицирования бактериями, продуцирующими шига-токсин (Stx): энтерогеморрагической Escherichia coli (STEC) или Shigella dysenteriae type 1 [5]. Данная форма ТМА называется типичным ГУС/STEC-ГУС. STEC-ГУС является одним из наиболее распространенных заболеваний, требующих экстренной заместительной почечной терапии (ЗПТ) у детей [2, 6]. Летальность при типичном ГУС во всем мире в период острой фазы достигает 2-5% [7].
Остальные 10% случаев ГУС традиционно были сгруппированы как атипичный ГУС (аГУС). Однако по мере того, как наше понимание патогенеза ГУС улучшилось за последние 20 лет, стало ясно, что аГУС - это не одно, а множество различных заболеваний со схожими клиническими признаками. В большинстве случаев аГУС - ультраредкое (орфанное) заболевание прогрессирующего течения вследствие системной ТМА, обусловленной хронической неконтролируемой активацией альтернативного пути комплемента [1, 5, 8]. аГУС характеризуется рецидивирующим течением на протяжении всей жизни и представляет собой потенциально жизнеугрожающее состояние. Установлено, что при дебюте аГУС в детском возрасте терминальная стадия хронической болезни почек (ХБП) (ХБП 5) развивается реже, но смертность у детей выше, чем у взрослых [1, 5].
Причины
ГУС представляет собой серьезную терапевтическую проблему в педиатрии и детской нефрологии, являясь одной из ведущих причин ОПП с потенциальной трансформацией в ХБП 5 в различные сроки от начала заболевания. Несмотря на то, что наиболее распространена STEC-ассоциированная форма ГУС с типичным диарейным продромом, требуется тщательное подтверждение инфекционной этиологии для того, чтобы своевременно исключить аГУС и ГУС, связанный с пневмококковой инфекцией.
Энтероколит в продромальном периоде STEC-ГУС вызывается различными штаммами ЕНЕС: чаще всего серотипом O157:H7 (45-80%), отличающимся от других штаммов неспособностью ферментировать сорбитол, реже - О26:H11/H−, O145:H28/H−, O103:H2/H−, O111:H8/H−, O118:H2/Н−, O113:H21/Н−, O45:H2/Н−, O80:H2/Н− [7, 9].
Ежегодно STEC инфекция диагностируется в 2,8 млн. случаях, которые осложняются развитием ГУС у 3890 пациентов [10]. Заболеваемость ГУС в результате STEC-инфекции зависит от патогенности бактерий и для серотипа E.coli O157:H7 составляет 3-7% в случае спорадической заболеваемости и около 20% − при эпидемической форме. Во время вспышки кишечной инфекции в Европе в 2011г. (n=3816), обусловленной новым гипервирулентным штаммом энтерогеморрагической E.coli (ЕНЕС) О104:H4 с уникальными энтероаггрегативными свойствами, риск ГУС составил 22% (n=845) [11, 12].
Основным резервуаром STEC-инфекции является крупный рогатый скот, а переносчиками могут быть также овцы, козы, лошади, олени, кошки, собаки, птицы и мухи. Причина заражения - бактериальная контаминация воды, мясных и молочных продуктов. Возможна передача инфекции при контакте с животными, а также от человека к человеку и от матери ребенку. STEC-ГУС чаще встречается летом и осенью [6, 9, 13].
После употребления контаминированной пищи бактерии попадают в кишечник, где шига-токсин (Stx) секретируется E.coli. Выделяют два семейства Stx - Stx1 и Stx2. Показано, что E.сoli, выделенная от пациентов с ГУС, продуцирует либо оба токсина (Stx1 и Stx2), либо только Stx2. Гены Stx спонтанно реплицируются на очень низком уровне. Воздействие стимулирующих факторов - перекиси водорода, выделяемой нейтрофилами, антибиотиков - усиливают продукцию Stx. Анализ методом «поверхностного плазмонного резонанса» (surfaсе plasmon rеsonanсe) обнаружил, что Stx1 легко связывается и отсоединяется от гликосфинголипидного рецептора − глоботриазилцеромида (Gb3), в отличие от Stx2, который связывается и диссоциирует очень медленно, оставаясь таким образом на клеточной поверхности достаточно долго, чтобы быть поглощенным. Это может объяснить, почему для эндотелиальных клеток человека in vitro Stx2 в 1000 раз токсичнее, чем Stx1. При выделении Stx происходит лизис бактериальной клетки. Показано, что в течение болезни штаммы Е.coli могут потерять способность к выделению Stx, что приводит к ложноотрицательным результатам при поздней диагностике инфекции [14].
В основе патогенеза ГУС лежит повреждение эндотелия из-за воздействия шига-токсина. После заражения патогенные E.coli связываются с ворсинками терминального отдела подвздошной кишки и эпителием Пейеровых бляшек, затем происходит колонизация толстой кишки. Бактерии адгезируют к эпителиальным клеткам посредством мембранного белка интимина. Stx играет роль в усилении адгезии E.сoli к эпителию за счет увеличения экспрессии нуклеолина, другого поверхностного рецептора интимина По мере постепенного повреждения кишечных ворсинок, развивается сначала диарея калового характера, позже гемоколит [15].
В кровотоке свободный Stx не обнаруживается. Его транспортерами служат полиморфноядерные нейтрофилы, моноциты, эритроциты, тромбоциты, а также тромбоцитарно-моноцитарные и тромбоцитарно-нейтрофильные комплексы. Количество связанного Stx коррелирует с выраженностью почечного повреждения. Нормальные энтероциты не экспрессируют Gb3. Считается, что Stx перемещается через плотное соединение кишечного эпителия за счет связывания с Gb3, экспрессируемым на клетках Панета, которые располагаются в глубоких криптах тонкого кишечника. На клеточном уровне Stx связывается с Gb3, который локализован на клетках гломерулярного эндотелия, мезангиальных клетках, подоцитах, клетках канальцевого эпителия, также он представлен и в других органах, особенно в большом количестве в нейронах и глиальных клетках головного мозга. После этого активная часть Stх, внедряясь в клетку, блокирует синтез белков, вызывая апоптоз клеток [1, 16].
В культуре клеток эндотелий микроциркуляторного русла более подвержен воздействию Stx в сравнении с более крупными сосудами. В результате Stx-опосредованные изменения эндотелиального фенотипа приводят к протромбогенной среде, о чем свидетельствуют более высокие медианные концентрации в плазме фрагментов протромбина, тканевого активатора плазминогена и D-димера у детей со STEC-ГУС. В гломерулярных сосудах, кроме того, экспрессия Gb3 и воздействие Stx возрастает в результате воздействия фактора некроза опухолей альфа (ФНОα) и других провоспалительных цитокинов, которые способны увеличить плотность рецепторов на поверхности клетки [16]. Токсин также активируют Р-селектин, который является молекулой адгезии и участвует в регуляции системы комплемента. Активация комплемента при STEC-ГУС рассматривается как механизм «второго удара», который усиливает повреждение эндотелия микроциркуляторного русла [4, 18, 19].
Еще одним патогенным фактором STEC является липополисахарид клеточной стенки бактерии (О157LPS), связанный в кровотоке с тромбоцитами, моноцитами и нейтрофилами. Связывание O157LPS с тромбоцитами приводит к активации и агрегации последних, а Stx присоединяется к активированным тромбоцитам и моноцитам [20].
Инфекционный энтероколит, предшествующий типичному ГУС, может быть вызван также S.dysenteriae type 1 (SD1), так как Stx E.coli идентичен Stx SD1. S.dysenteriae type 1 продуцирует токсин, почти идентичный Stx1. Но, в отличие от STEC, сама бактерия SD1 обладает энтероинвазивными свойствами, что может привести к бактериемии и септическому шоку [7, 21]. ГУС развивается в 13% случаев шигеллеза, вызванного SD1, встречается в основном в странах Африки и Азии у детей до 5 лет, характеризуется тяжелым течением и в 36% случаев заканчивается летальным исходом [8, 21]. Кроме того, фаги Stx иногда можно обнаружить в других грамотрицательных бактериях, поэтому в литературе можно встретить единичные сообщения о других этиологических факторах ГУС (Citrobacter, Salmonella, сlostridium difficile) [7].
Серотип E.coli O104:H4, продуцирующей Stx, вызвавший вспышку типичного ГУС в Европе в 2011г., в дополнение к продукции Stx E.coli O104:H4 обладает энтероаггрегативными свойствами, что может привести к более длительной колонизации кишечника и выделению токсина в сосудистое русло. Особая вирулентность данного штамма объясняется комбинацией хромосомно интегрированного бактериофага, кодирующего Stx, и плазмидой E.coli, обеспечивающих прочную адгезию энтероагрегативных фимбрий к клеткам эпителия [22]. Исключительная вирулентность штамма O104:H4 подтверждается неблагоприятными исходами вспышки по сравнению со всеми ранее описанными вспышками инфекции E.coli O157:H7 и других энтерогеморрагических штаммов [11, 12, 23].
Система комплемента представляет собой сложную сеть из более чем 40 белков, которая составляет основную часть врожденной иммунной системы и способствует контролю адаптивного иммунного ответа. Комплемент активируется тремя разными путями (приложение А3,3. Общей точкой, на которой сходятся все три пути, является расщепление С3 компонента комплемента. Нарушения, лежащие в основе развития аГУС, касаются альтернативного пути активации.
В отличие от первых двух путей, активация которых начинается после связывания с иммунными комплексами или микроорганизмами, альтернативный путь находится в состоянии постоянной активации, исходный уровень которой низок (т.н. механизм «холостого хода»), что обеспечивается спонтанным гидролизом С3 компонента комплемента. Образующийся при этом фрагмент С3b может связываться как с патогенами, так и с собственными клетками организма. На чужеродной (например, бактериальной) поверхности С3b связывается с фактором В (CFB), в результате чего образуется С3-конвертаза (комплекс С3bВb). Последняя многократно усиливает расщепление С3 за счет формирования так называемой «петли амплификации». При присоединении к С3-конвертазе дополнительных фрагментов С3b образуется С5-конвертаза (С3bВb(С3b)) - энзиматический комплекс, расщепляющий С5-компонент комплемента. При расщеплении С5 образуется С5b фрагмент, запускающий сборку мембраноатакующего комплекса С5b-9 (МАК), который вызывает лизис бактериальных клеток.
Поверхность клеток хозяина в норме защищена от локальной амплификации и депозиции С3b. Эту защиту обеспечивает жесткий контроль со стороны ряда регуляторных факторов комплемента, представленных как плазменными, так и мембраносвязанными белками, фиксированными на поверхности эндотелиальных клеток. Основными плазменными протеинами, регулирующими альтернативный путь активации комплемента, служат факторы Н (CFH) и I (CFI), мембраносвязанными - мембранный кофакторный протеин (MCP) и тромбомодулин (THBD).
CFH - основной регуляторный фактор альтернативного пути активации комплемента. Он блокирует образование С3-конвертазы и напрямую ускоряет ее распад. Кроме того, фактор Н является кофактором сFI в инактивации с3b, которая приводит к образованию неактивного фрагмента iC3b, неспособного связываться с фактором В для образования С3-конвертазы. Молекула сFH имеет две области связывания С3b. Первая локализуется в N-концевой части, где связывание С3b регулирует амплификацию альтернативного пути комплемента в плазме. Вторая область связывания находится в С-концевой части молекулы, в 19 и 20 экзонах, связывание с которыми нарушает способность С3b фиксироваться на поверхности эндотелия, что приводит к локальной инактивации альтернативного пути. Таким образом, сFH принадлежит ключевая роль в защите эндотелиальных клеток от активации комплемента. Кроме того, установлено важное значение сFH в регуляции функции тромбоцитов за счет блокирования активации комплемента на их поверхности, что, в свою очередь, приводит к уменьшению функциональной активности и способствует снижению риска тромбообразования.
CFI - сериновая протеаза, которая расщепляет С3b, приводя к формированию неактивного iC3b в присутствии растворимых и/или мембраносвязанных кофакторов.
MCP - интегральный трансмембранный белок, который экспрессируется на поверхности клеток, где связывает С3b и является дополнительным кофактором для сFI.
THBD - эндотелиальный гликопротеин с антикоагулянтными, противовоспалительными и цитопротективными свойствами, который служит также регуляторным белком системы комплемента, выполняя функции мембраносвязанного кофактора сFI. Связывает С3b, ускоряя его инактивацию сFI в присутствии сFH.
Таким образом, регуляция альтернативного пути комплемента осуществляется четырьмя белками - сFH, сFI, MCP и THBD, взаимодействие которых приводит к преобразованию с3b в неактивную молекулу iC3b, блокируя тем самым ключевой механизм активации - образование все больших количеств С3-конвертазы с последующей безудержной продукцией МАК.
Предполагается, что имеющиеся у пациентов с аГУС мутации в генах, кодирующих регуляторные белки, приводят к нарушению защиты эндотелиальных клеток от активации системы комплемента вследствие дефицита или, чаще, функциональных нарушений этих протеинов. В результате этого на поверхности клеток эндотелия усиливается образование МАК, вызывающее их повреждение с обнажением субэндотелиального матрикса, трансформацией атромботического фенотипа в протромботический и последующим образованием тромбов. Дополнительный вклад в процесс тромбообразования у пациентов с мутациями сFH может вносить также активация комплемента на поверхности тромбоцитов, приводящая к усилению их функциональной активности [1, 5, 8, 24, 25, 27].
Наряду с наиболее часто встречающимися мутациями белков-регуляторов, приводящих к нарушению их функции по контролю за активностью альтернативного пути комплемента (loss-of-function), описаны также мутации фактора В (CFB) и С3 компонента комплемента, обеспечивающие значительное нарастание активности (gain-of-function) за счет стабилизации С3-конвертазы и её резистентности к инактивации, соответственно, что вызывает избыточную активацию системы комплемента. Преимущественное поражение почек при аГУС, по-видимому, обусловлено особенной чувствительностью фенестрированного гломерулярного эндотелия к повреждению, обусловленному нарушенной регуляцией комплемента [1, 5, 18, 24, 25].
Молекулярная диагностика аГУС сложна и включает в настоящее время не менее 9 различных генов (CFH, сD46/MCP, сFI, с3, сFB, THBD, сFHR1-5 и DGKE), включает поиск гаплотипов с высоким риском (CFH-CFHR3 и MCPggaac) и определение количества копий вариации, гибридные гены и другие сложные геномные перестройки в геномной области сFH / сFHRs [24, 28].
AГУС ассоциируется с мутациями сFH у 20-30 % пациентов, MCP у ≈8-10% и сFI у ≈6%. Мутации фактора В (CFB) встречаются в 104% случаев, в то время как мутации с3 фракции комплемента идентифицируется у 6-10% пациентов. Редкими являются мутации гена тромбомодулина (THBD) - 3-5%. Около 12% пациентов с аГУС имеют мутации двух и более генов системы комплемента. Ген сFH существует в кластере генов (кластер регуляторов активации комплемента) вместе с пятью высоко-гомологичными генами, кодирующими белки, связанные с фактором H (CFHR1-5) [27]. В настоящее время известно, что мутации, делеции и геномные перестройки распространены в этой области. Частота встречаемости генов, кодирующих белки сFHR1-5, составляет 3-10%. Более чем у 10% пациентов с аГУС, преимущественно у детей, выявляют аутоантитела к сFH - основному регуляторному протеину альтернативного пути комплемента, наличие которых приводит к тем же последствиям, что и его мутации. Антительный» аГУС склонен к частому рецидивированию. В 30-48% случаев aГУС в настоящее время не находит должного объяснения с позиций молекулярной генетики [29, 30, 31, 32]. Однако данная группа пациентов демонстрирует аналогичную тяжесть заболевания с рецидивирующим характером течения, как и при аГУС, с генетически подтвержденной природой заболевания.
Мутации в генах сFH, сFI, THBD и с3 преобладают у пациентов младше 1 года, в возрасте 1 года и старше помимо вышеописанных мутаций выявляются мутации MCP. У детей с манифестацией в возрастном интервале между 7 и 11 годами чаще определяются антитела к сFH [31].
Семейный или спорадический аГУС носит семейный характер (сибсы, родители, бабушки и дедушки имеют заболевание) у ≈25% пациентов. Спорадические случаи аГУС имеют лучший прогноз, чем семейные формы. Неотягощенный семейный анамнез не исключает возможности генетической передачи заболевания. Лишь половина носителей мутации в семье в течение жизни имеют манифестацию заболевания [29, 33].
В ряде случаев при молекулярно-генетическом тестировании выявляются мутации генов, не связанных с комплементом (DGKЕ - диацилглицеринкиназа ε(INF2 - инвертированный формин-2 (PLG - плазминоген) и мутации в генах, приводящие к дефектному метаболизму кобаламина с (MUT, MMAA, MMAВ, ММАСНС, ММАDHC, MCEE) [28].
В настоящее время установлено, что генетические аномалии комплемента, которые раньше рассматривали как основную причину развития аГУС, являются лишь фактором, предрасполагающим к возникновению ТМА. Для реализации этой предрасположенности требуются дополнительные факторы, которые могут оказать влияние на развитие или прогрессирование аГУС. Такими факторами, инициирующими дополнительную активацию комплемента у предрасположенных лиц и потому называемыми комплемент-активирующими состояниями, служат инфекции дыхательных путей (18% случаев), желудочно-кишечного тракта (24%), беременность (7%), трансплантация органов (5%) и пр. [2, 17, 31, 32]. Однако почти у 1/3 пациентов с аГУС триггерные факторы идентифицировать не удается [34].
1,2,1 Типичный ГУС.
У большинства детей (85-90%) диагностируется типичная форма ГУС (STEC-ГУС), этиологически связанная с кишечной инфекцией шига-токсин (Stx) продуцирующими штаммами энтерогеморрагической E.coli или S.disenteriae type1. Острая кишечная инфекция, вызванная этими штаммами бактерий, осложняется ГУС в 10-15% случаев [2, 8].Энтероколит в продромальном периоде STEC-ГУС вызывается различными штаммами ЕНЕС: чаще всего серотипом O157:H7 (45-80%), отличающимся от других штаммов неспособностью ферментировать сорбитол, реже - О26:H11/H−, O145:H28/H−, O103:H2/H−, O111:H8/H−, O118:H2/Н−, O113:H21/Н−, O45:H2/Н−, O80:H2/Н− [7, 9].
Ежегодно STEC инфекция диагностируется в 2,8 млн. случаях, которые осложняются развитием ГУС у 3890 пациентов [10]. Заболеваемость ГУС в результате STEC-инфекции зависит от патогенности бактерий и для серотипа E.coli O157:H7 составляет 3-7% в случае спорадической заболеваемости и около 20% − при эпидемической форме. Во время вспышки кишечной инфекции в Европе в 2011г. (n=3816), обусловленной новым гипервирулентным штаммом энтерогеморрагической E.coli (ЕНЕС) О104:H4 с уникальными энтероаггрегативными свойствами, риск ГУС составил 22% (n=845) [11, 12].
Основным резервуаром STEC-инфекции является крупный рогатый скот, а переносчиками могут быть также овцы, козы, лошади, олени, кошки, собаки, птицы и мухи. Причина заражения - бактериальная контаминация воды, мясных и молочных продуктов. Возможна передача инфекции при контакте с животными, а также от человека к человеку и от матери ребенку. STEC-ГУС чаще встречается летом и осенью [6, 9, 13].
После употребления контаминированной пищи бактерии попадают в кишечник, где шига-токсин (Stx) секретируется E.coli. Выделяют два семейства Stx - Stx1 и Stx2. Показано, что E.сoli, выделенная от пациентов с ГУС, продуцирует либо оба токсина (Stx1 и Stx2), либо только Stx2. Гены Stx спонтанно реплицируются на очень низком уровне. Воздействие стимулирующих факторов - перекиси водорода, выделяемой нейтрофилами, антибиотиков - усиливают продукцию Stx. Анализ методом «поверхностного плазмонного резонанса» (surfaсе plasmon rеsonanсe) обнаружил, что Stx1 легко связывается и отсоединяется от гликосфинголипидного рецептора − глоботриазилцеромида (Gb3), в отличие от Stx2, который связывается и диссоциирует очень медленно, оставаясь таким образом на клеточной поверхности достаточно долго, чтобы быть поглощенным. Это может объяснить, почему для эндотелиальных клеток человека in vitro Stx2 в 1000 раз токсичнее, чем Stx1. При выделении Stx происходит лизис бактериальной клетки. Показано, что в течение болезни штаммы Е.coli могут потерять способность к выделению Stx, что приводит к ложноотрицательным результатам при поздней диагностике инфекции [14].
В основе патогенеза ГУС лежит повреждение эндотелия из-за воздействия шига-токсина. После заражения патогенные E.coli связываются с ворсинками терминального отдела подвздошной кишки и эпителием Пейеровых бляшек, затем происходит колонизация толстой кишки. Бактерии адгезируют к эпителиальным клеткам посредством мембранного белка интимина. Stx играет роль в усилении адгезии E.сoli к эпителию за счет увеличения экспрессии нуклеолина, другого поверхностного рецептора интимина По мере постепенного повреждения кишечных ворсинок, развивается сначала диарея калового характера, позже гемоколит [15].
В кровотоке свободный Stx не обнаруживается. Его транспортерами служат полиморфноядерные нейтрофилы, моноциты, эритроциты, тромбоциты, а также тромбоцитарно-моноцитарные и тромбоцитарно-нейтрофильные комплексы. Количество связанного Stx коррелирует с выраженностью почечного повреждения. Нормальные энтероциты не экспрессируют Gb3. Считается, что Stx перемещается через плотное соединение кишечного эпителия за счет связывания с Gb3, экспрессируемым на клетках Панета, которые располагаются в глубоких криптах тонкого кишечника. На клеточном уровне Stx связывается с Gb3, который локализован на клетках гломерулярного эндотелия, мезангиальных клетках, подоцитах, клетках канальцевого эпителия, также он представлен и в других органах, особенно в большом количестве в нейронах и глиальных клетках головного мозга. После этого активная часть Stх, внедряясь в клетку, блокирует синтез белков, вызывая апоптоз клеток [1, 16].
В культуре клеток эндотелий микроциркуляторного русла более подвержен воздействию Stx в сравнении с более крупными сосудами. В результате Stx-опосредованные изменения эндотелиального фенотипа приводят к протромбогенной среде, о чем свидетельствуют более высокие медианные концентрации в плазме фрагментов протромбина, тканевого активатора плазминогена и D-димера у детей со STEC-ГУС. В гломерулярных сосудах, кроме того, экспрессия Gb3 и воздействие Stx возрастает в результате воздействия фактора некроза опухолей альфа (ФНОα) и других провоспалительных цитокинов, которые способны увеличить плотность рецепторов на поверхности клетки [16]. Токсин также активируют Р-селектин, который является молекулой адгезии и участвует в регуляции системы комплемента. Активация комплемента при STEC-ГУС рассматривается как механизм «второго удара», который усиливает повреждение эндотелия микроциркуляторного русла [4, 18, 19].
Еще одним патогенным фактором STEC является липополисахарид клеточной стенки бактерии (О157LPS), связанный в кровотоке с тромбоцитами, моноцитами и нейтрофилами. Связывание O157LPS с тромбоцитами приводит к активации и агрегации последних, а Stx присоединяется к активированным тромбоцитам и моноцитам [20].
Инфекционный энтероколит, предшествующий типичному ГУС, может быть вызван также S.dysenteriae type 1 (SD1), так как Stx E.coli идентичен Stx SD1. S.dysenteriae type 1 продуцирует токсин, почти идентичный Stx1. Но, в отличие от STEC, сама бактерия SD1 обладает энтероинвазивными свойствами, что может привести к бактериемии и септическому шоку [7, 21]. ГУС развивается в 13% случаев шигеллеза, вызванного SD1, встречается в основном в странах Африки и Азии у детей до 5 лет, характеризуется тяжелым течением и в 36% случаев заканчивается летальным исходом [8, 21]. Кроме того, фаги Stx иногда можно обнаружить в других грамотрицательных бактериях, поэтому в литературе можно встретить единичные сообщения о других этиологических факторах ГУС (Citrobacter, Salmonella, сlostridium difficile) [7].
Серотип E.coli O104:H4, продуцирующей Stx, вызвавший вспышку типичного ГУС в Европе в 2011г., в дополнение к продукции Stx E.coli O104:H4 обладает энтероаггрегативными свойствами, что может привести к более длительной колонизации кишечника и выделению токсина в сосудистое русло. Особая вирулентность данного штамма объясняется комбинацией хромосомно интегрированного бактериофага, кодирующего Stx, и плазмидой E.coli, обеспечивающих прочную адгезию энтероагрегативных фимбрий к клеткам эпителия [22]. Исключительная вирулентность штамма O104:H4 подтверждается неблагоприятными исходами вспышки по сравнению со всеми ранее описанными вспышками инфекции E.coli O157:H7 и других энтерогеморрагических штаммов [11, 12, 23].
1,2,2 Атипичный ГУС.
Атипичный ГУС. Ультраредкое хроническое системное заболевание генетической природы с прогрессирующим течением и неблагоприятным прогнозом, в основе которого лежит хроническая неконтролируемая активация альтернативного пути комплемента, ведущая к комплемент-опосредованной ТМА [1, 5, 8, 18].Система комплемента представляет собой сложную сеть из более чем 40 белков, которая составляет основную часть врожденной иммунной системы и способствует контролю адаптивного иммунного ответа. Комплемент активируется тремя разными путями (приложение А3,3. Общей точкой, на которой сходятся все три пути, является расщепление С3 компонента комплемента. Нарушения, лежащие в основе развития аГУС, касаются альтернативного пути активации.
В отличие от первых двух путей, активация которых начинается после связывания с иммунными комплексами или микроорганизмами, альтернативный путь находится в состоянии постоянной активации, исходный уровень которой низок (т.н. механизм «холостого хода»), что обеспечивается спонтанным гидролизом С3 компонента комплемента. Образующийся при этом фрагмент С3b может связываться как с патогенами, так и с собственными клетками организма. На чужеродной (например, бактериальной) поверхности С3b связывается с фактором В (CFB), в результате чего образуется С3-конвертаза (комплекс С3bВb). Последняя многократно усиливает расщепление С3 за счет формирования так называемой «петли амплификации». При присоединении к С3-конвертазе дополнительных фрагментов С3b образуется С5-конвертаза (С3bВb(С3b)) - энзиматический комплекс, расщепляющий С5-компонент комплемента. При расщеплении С5 образуется С5b фрагмент, запускающий сборку мембраноатакующего комплекса С5b-9 (МАК), который вызывает лизис бактериальных клеток.
Поверхность клеток хозяина в норме защищена от локальной амплификации и депозиции С3b. Эту защиту обеспечивает жесткий контроль со стороны ряда регуляторных факторов комплемента, представленных как плазменными, так и мембраносвязанными белками, фиксированными на поверхности эндотелиальных клеток. Основными плазменными протеинами, регулирующими альтернативный путь активации комплемента, служат факторы Н (CFH) и I (CFI), мембраносвязанными - мембранный кофакторный протеин (MCP) и тромбомодулин (THBD).
CFH - основной регуляторный фактор альтернативного пути активации комплемента. Он блокирует образование С3-конвертазы и напрямую ускоряет ее распад. Кроме того, фактор Н является кофактором сFI в инактивации с3b, которая приводит к образованию неактивного фрагмента iC3b, неспособного связываться с фактором В для образования С3-конвертазы. Молекула сFH имеет две области связывания С3b. Первая локализуется в N-концевой части, где связывание С3b регулирует амплификацию альтернативного пути комплемента в плазме. Вторая область связывания находится в С-концевой части молекулы, в 19 и 20 экзонах, связывание с которыми нарушает способность С3b фиксироваться на поверхности эндотелия, что приводит к локальной инактивации альтернативного пути. Таким образом, сFH принадлежит ключевая роль в защите эндотелиальных клеток от активации комплемента. Кроме того, установлено важное значение сFH в регуляции функции тромбоцитов за счет блокирования активации комплемента на их поверхности, что, в свою очередь, приводит к уменьшению функциональной активности и способствует снижению риска тромбообразования.
CFI - сериновая протеаза, которая расщепляет С3b, приводя к формированию неактивного iC3b в присутствии растворимых и/или мембраносвязанных кофакторов.
MCP - интегральный трансмембранный белок, который экспрессируется на поверхности клеток, где связывает С3b и является дополнительным кофактором для сFI.
THBD - эндотелиальный гликопротеин с антикоагулянтными, противовоспалительными и цитопротективными свойствами, который служит также регуляторным белком системы комплемента, выполняя функции мембраносвязанного кофактора сFI. Связывает С3b, ускоряя его инактивацию сFI в присутствии сFH.
Таким образом, регуляция альтернативного пути комплемента осуществляется четырьмя белками - сFH, сFI, MCP и THBD, взаимодействие которых приводит к преобразованию с3b в неактивную молекулу iC3b, блокируя тем самым ключевой механизм активации - образование все больших количеств С3-конвертазы с последующей безудержной продукцией МАК.
Предполагается, что имеющиеся у пациентов с аГУС мутации в генах, кодирующих регуляторные белки, приводят к нарушению защиты эндотелиальных клеток от активации системы комплемента вследствие дефицита или, чаще, функциональных нарушений этих протеинов. В результате этого на поверхности клеток эндотелия усиливается образование МАК, вызывающее их повреждение с обнажением субэндотелиального матрикса, трансформацией атромботического фенотипа в протромботический и последующим образованием тромбов. Дополнительный вклад в процесс тромбообразования у пациентов с мутациями сFH может вносить также активация комплемента на поверхности тромбоцитов, приводящая к усилению их функциональной активности [1, 5, 8, 24, 25, 27].
Наряду с наиболее часто встречающимися мутациями белков-регуляторов, приводящих к нарушению их функции по контролю за активностью альтернативного пути комплемента (loss-of-function), описаны также мутации фактора В (CFB) и С3 компонента комплемента, обеспечивающие значительное нарастание активности (gain-of-function) за счет стабилизации С3-конвертазы и её резистентности к инактивации, соответственно, что вызывает избыточную активацию системы комплемента. Преимущественное поражение почек при аГУС, по-видимому, обусловлено особенной чувствительностью фенестрированного гломерулярного эндотелия к повреждению, обусловленному нарушенной регуляцией комплемента [1, 5, 18, 24, 25].
Молекулярная диагностика аГУС сложна и включает в настоящее время не менее 9 различных генов (CFH, сD46/MCP, сFI, с3, сFB, THBD, сFHR1-5 и DGKE), включает поиск гаплотипов с высоким риском (CFH-CFHR3 и MCPggaac) и определение количества копий вариации, гибридные гены и другие сложные геномные перестройки в геномной области сFH / сFHRs [24, 28].
AГУС ассоциируется с мутациями сFH у 20-30 % пациентов, MCP у ≈8-10% и сFI у ≈6%. Мутации фактора В (CFB) встречаются в 104% случаев, в то время как мутации с3 фракции комплемента идентифицируется у 6-10% пациентов. Редкими являются мутации гена тромбомодулина (THBD) - 3-5%. Около 12% пациентов с аГУС имеют мутации двух и более генов системы комплемента. Ген сFH существует в кластере генов (кластер регуляторов активации комплемента) вместе с пятью высоко-гомологичными генами, кодирующими белки, связанные с фактором H (CFHR1-5) [27]. В настоящее время известно, что мутации, делеции и геномные перестройки распространены в этой области. Частота встречаемости генов, кодирующих белки сFHR1-5, составляет 3-10%. Более чем у 10% пациентов с аГУС, преимущественно у детей, выявляют аутоантитела к сFH - основному регуляторному протеину альтернативного пути комплемента, наличие которых приводит к тем же последствиям, что и его мутации. Антительный» аГУС склонен к частому рецидивированию. В 30-48% случаев aГУС в настоящее время не находит должного объяснения с позиций молекулярной генетики [29, 30, 31, 32]. Однако данная группа пациентов демонстрирует аналогичную тяжесть заболевания с рецидивирующим характером течения, как и при аГУС, с генетически подтвержденной природой заболевания.
Мутации в генах сFH, сFI, THBD и с3 преобладают у пациентов младше 1 года, в возрасте 1 года и старше помимо вышеописанных мутаций выявляются мутации MCP. У детей с манифестацией в возрастном интервале между 7 и 11 годами чаще определяются антитела к сFH [31].
Семейный или спорадический аГУС носит семейный характер (сибсы, родители, бабушки и дедушки имеют заболевание) у ≈25% пациентов. Спорадические случаи аГУС имеют лучший прогноз, чем семейные формы. Неотягощенный семейный анамнез не исключает возможности генетической передачи заболевания. Лишь половина носителей мутации в семье в течение жизни имеют манифестацию заболевания [29, 33].
В ряде случаев при молекулярно-генетическом тестировании выявляются мутации генов, не связанных с комплементом (DGKЕ - диацилглицеринкиназа ε(INF2 - инвертированный формин-2 (PLG - плазминоген) и мутации в генах, приводящие к дефектному метаболизму кобаламина с (MUT, MMAA, MMAВ, ММАСНС, ММАDHC, MCEE) [28].
В настоящее время установлено, что генетические аномалии комплемента, которые раньше рассматривали как основную причину развития аГУС, являются лишь фактором, предрасполагающим к возникновению ТМА. Для реализации этой предрасположенности требуются дополнительные факторы, которые могут оказать влияние на развитие или прогрессирование аГУС. Такими факторами, инициирующими дополнительную активацию комплемента у предрасположенных лиц и потому называемыми комплемент-активирующими состояниями, служат инфекции дыхательных путей (18% случаев), желудочно-кишечного тракта (24%), беременность (7%), трансплантация органов (5%) и пр. [2, 17, 31, 32]. Однако почти у 1/3 пациентов с аГУС триггерные факторы идентифицировать не удается [34].
|
|
Эпидемиология
1,3,1 Типичный ГУС.
На долю STEC ежегодно приходится 2,8 миллиона острых заболеваний и 3890 случаев ГУС [7, 23, 28]. STEC-ГУС составляет до 90% случаев ГУС у детей и является самой частой причиной ОПП в детском возрасте. Чаще STEC-ГУС встречается у детей в возрасте 6 мес. 5 лет, хотя заболеваемость этой формой ТМА может отмечаться в любом возрасте. Заболеваемость в мире составляет 0,2 - 8:100000 населения (около 6,1:100000 среди детей до 6 лет). Среди взрослых заболеваемость составляет 0,5 на 100000/год [7, 9].Заболеваемость типичным ГУС остается довольно стабильной с момента его обнаружения в 1980-х годах, лишь незначительно снизившись после 2000 года [10]. Заболеваемость STEC-ГУС в регионах значительно варьирует (в зависимости от числа сельского населения, особенностей водоснабжения ), достигая в эндемичных районах (Аргентине и Уругвае) 10-17 случаев на 100000/год младше 5 лет. В Европе и Северной Америке частота встречаемости заболевания в год составляет 0,6-1,1 случаев на 100000 детей <15-18 лет и 1,9-2,9 случая на 100000 детей <3-5 лет [7, 10].
Для STEC-ГУС характерны подъемы заболеваемости в период с июня по сентябрь и спорадические случаи. В России вспышки STEC-ГУС регистрировались в Московском, Поволжском регионах, Омске, Иваново, Оренбурге.
1,3,2 Атипичный ГУС.
Атипичный ГУС составляет 5-10% от всех случаев ГУС у детей и в основном является следствием нарушения регуляции системы комплемента. В настоящее время известно о более 1000 пациентах с аГУС, у которых выявлены мутации генов, кодирующих белки комплемента [36].По данным различных исследований заболеваемость аГУС в Европе составляет 0,23-1,9 случаев на 1000000/год, в Австралии - 0,44 случая на 1000000/год. Среди лиц <20 лет - 0,26-0,75 на 1000000 /год, а у взрослых -0,42-1,9 случаев на 1000000/год [1, 9, 35, 36].
Распространенность аГУС колеблется от 2 до 10 на 1000000 человек. У лиц в возрасте <20 лет: от 2,21 до 9,4 на 1000000 человек. Среди пациентов до 4 лет распространенность заболевания составила 3 на 1000000 детского населения, у детей с 5 до 15 лет - 0,3 на 1000000 детского населения. Среди взрослых в Европе - 5,75 на 1000000 населения, а Австралии/Новой Зеландии - 2,4 на 1000000 населения. Самая большая референтная популяция пациентов с аГУС зарегистрирована в Европе: 16427365, при этом распространенность заболевания составила 4,96 на 1000000 от общей численности населения [1, 9, 36, 37].
В Российской Федерации точных статистических данных нет. Заболеваемость составляет около 0,8 на 1000000 детского населения/год. Ежегодно диагностируется около 26 новых случаев аГУС. Распространенность заболевания составляет 1 случай на 143000 детского населения.
Среди детей одинаково болеют мальчики и девочки. В 60% случаев дебют аГУС развивается в детском возрасте. Кроме того, в возрасте до 6 мес. и с 6 мес. до 2 лет в равных случаях - 28% и 28%, соответственно. В возрасте 2-15 лет аГУС диагностируется у 44% детей. Инфекция является самым частым комплемент-активирующим состоянием в реализации заболевания. Вакцинации отводится 2 место среди причин, провоцирующих развитие аГУС (только у детей, имеющих генетический дефект) [35, 36, 37].
У взрослых среди болеющих преобладают лица женского пола, так как беременность является частым триггерным событием. Среди пациентов 20-40 лет аГУС диагностируется в 48%, 50-60 лет у ≈ 8% пациентов и >60 лет у ≈ 1% [1, 27, 30].
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
D59,3 -Гемолитико-уремический синдром.Классификация
1,5 Классификация заболевания или состояния (группы заболеваний или состояний).
До настоящего времени вопросы классификации ГУС остаются предметом дискуссий. Предлагаемые различные классификации либо не сфокусированы на основной патофизиологии заболевания, либо слишком сложны.Следует отметить, что ряд авторов рекомендуют называть все формы ТМА, кроме ТТП, как ГУС, при этом выделяя: STEC-ГУС, пневмококк-ассоциированный ГУС, инфекционнообусловленный ГУС (грипп А, вирус иммунодефицита человека, цитомегаловирус, вирус Эпштейн-Барра, парвовирус В19, вирус ветряной оспы, вирус Коксаки, вирусы гепатитов А, В и С, Salmonella typhi, вartonella, лептоспироз, риккетсиоз, малярия, лихорадка Денге), атипичный ГУС, вторичный ГУС и ГУС, обусловленный дефектным метаболизмом кобаламина [38]. Другие исследователи предлагают выделять наследственную и приобретенную ТМА, которые могут иметь перекресты. Так, для развития наследственной ТМА могут потребоваться триггеры, а приобретенная ТМА может иметь генетическую основу. Также рекомендуется классифицировать ТМА в зависимости от ответа на терапию [39].
Принимая во внимание, что патоморфологической основой любой формы ГУС является ТМА, в 2020 г. была предложена этиологическая ее классификация [24]:
• Первичные формы ТМА:
Тромботическая тромбоцитопеническая пурпура (ТТР).
• врожденная.
• приобретенная.
ГУС:
• приобретенные формы: инфекционнообусловленные (STEC-ГУС, Streptococcus pneumoniae, Shigella ), анти сFH-ат (аГУС).
• наследственные формы: мутации генов комплемента (аГУС).
• Вторичные формы ТМА, ассоциированные с:
• аутоиммунными заболеваниями.
• инфекциями.
• беременностью.
• трансплантацией солидных органов.
• трансплантацией гемопоэтических стволовых клеток.
• метилмалоновой ацидемией.
• злокачественными новообразованиями.
• злокачественной гипертензией.
• лекарствами (циклоспорин**, такролимус**, сиролимус, эверолимус**, гемцитабин**, митомицин**, бевацизумаб**, сунитиниб**, бортезомиб**, карфилзомиб**, адалимумаб**, клопидогрел**, симвастатин**, эстрогены, прогестагены, прогестагены и эстрогены в комбинации ).
Традиционно аГУС также подразделяют на семейный и спорадический. В структуре аГУС на долю семейного (диагностируемого, по крайней мере, у 2 членов семьи) приходится, по разным данным, всего 10-20%, тогда как спорадический аГУС, при котором отсутствует семейный анамнез, встречается у 80-90% пациентов с этой патологией. В основном аГУС наследуется по аутосомно-доминантному типу с 50% пенетрантностью, значительно реже - по аутосомно-рецессивному / полигенному типу [28]. Следует помнить, что отсутствие заболевания у родственников не исключает его наследственного характера, поскольку здоровые члены семьи пациента с аГУС могут оказаться носителями патогенных мутаций.
Клиническая картина
Типичный ГУС развивается в основном у детей в возрасте от 6 мес. до 5 лет. При STEC-ГУС - в анамнезе имеются указания на течение или предшествующий эпизод инфекционного процесса в виде повышения температуры, наличия жидкого стула с примесью крови с последующим развитием слабости, снижения аппетита/отказа от еды, повторной рвоты, резкой бледности, иногда - с элементами кожных геморрагий, уменьшение объема мочи/отсутствие мочи, симптомы интоксикации, связанные с ОПП, отеки (периферические, полостные), иногда - макрогематурия. аГУС может манифестировать в любом возрасте, начиная с неонатального периода. аГУС в 31% случаев начинается внезапно. Возможен дебют с неспецифических симптомов - слабости, утомляемости, общего недомогания, гриппоподобного синдрома. У взрослых пациентов в 20% случаев отмечается стертое начало с медленным прогрессированием. Однако у детей чаще дебют аГУС связан с комплемент-активирующим состоянием: диарейным продромом/гастроэнтеритом (23-28%), острым респираторным заболеванием (18%), вакцинацией (вакцины, содержащие живые аттенуированные вирусы, вакцины с иммуноадъювантами), травмой, хирургическим вмещательством Дебют ТМА без диарейного продрома, пневмококковой инфекции очень настораживает в пользу развития аГУС. Также при аГУС возможно относительно постепенное развитие ТМА на фоне гастроэнтероколита (возможен гемоколит) со снижением почечных функций в течение нескольких дней, положительная семейная история, рецидивирующие эпизоды неврологических нарушений (очаговые симптомы, спутанность сознания, транзиторные ишемические атаки). В 30-50% случаев при развитии ОПП при аГУС не отмечается снижение диуреза, иногда может быть макрогематурия. В 17% случаев патологический процесс в почках характеризуется протеинурией, гематурией без развития признаков ОПП. У большинства пациентов с аГУС, ассоциированном с выработкой антител к сFH, имеются признаки поражения желудочно-кишечного тракта (ЖКТ) в продроме заболевания. Следовательно, наличие симптомов поражения ЖКТ не может исключать аГУС.
В течении STEC-ГУС выделяют продромальную фазу и период развернутой клинической картины. Продрома характеризуется диареей у 90-95% пациентов, рвотой - у 30-60%, абдоминальным синдромом. Через 1-2 дня в 70% случаев развивается гемоколит. Установлено, что у пациентов с гемоколитом в продроме STEC-ГУС отмечается большая продолжительность анурии и частое развитие неврологической симптоматики, более высокий уровень летальности [5, 23, 27].
STEC-ГУС манифестирует через 2-14 дней (в среднем на 6-й день) от начала диареи. Характерно ухудшение общего состояния ребенка, нарастание вялости, возникновение бледности и иктеричности кожи, пастозности век и голеней. Возможен геморрагический синдром, проявляющийся петехиальной сыпью, экхимозами, носовыми и желудочно-кишечными кровотечениями [6, 8, 10]. У 5-10% пациентов со STEC-ГУС дебют заболевания не связан с предшествующей диареей в анамнезе, что подчеркивает важность проведения микробиологического исследования у всех пациентов с ТМА независимо от истории болезни [27].
Для STEC-ГУС характерно быстрое развитие олигурии или анурии, возможно изменение цвета мочи за счет гематурии и/или гемоглобинурии. Олигоанурическое ОПП, требующее проведения ЗПТ, развивается примерно у 50-60% пациентов. Как правило, на фоне энтеральных потерь анурия диагностируется поздно. При отсутствии адекватного контроля регидратации возникает гипергидратация: периферические отеки, явления полисерозита, отек легких, объемзависимая артериальная гипертензия (АГ). Возможно прогрессирующее усугубление дыхательной недостаточности вплоть до возникновения потребности в респираторной поддержке [8].
В остром периоде STEC-ГУС в 72% случаев встречается АГ, связанная с гипергидратацией, отличающаяся упорным течением и плохим ответом на терапию. При восстановлении диуреза отмечается второй подъем артериального давления, связанный с повышенной выработкой ренина. Перегрузка объемом, электролитные нарушения, токсический миокардит при ОПП и кардиальная ТМА служат причиной сердечной недостаточности у части пациентов в остром периоде STEC-ГУС. Клинически нарушения гемодинамики проявляются тахикардией, приглушением сердечных тонов, увеличением границ сердца, в ряде случаев - развитием сердечной недостаточности [40]. Острый инфаркт миокарда, хотя и реже, является еще одним потенциально опасным для жизни осложнением STEC-ГУС [41].
Поражение ЦНС развивается в 25% и проявляется психомоторным возбуждением или угнетением, фокальными или генерализованными судорогами, нарушениями сознания различной степени выраженности (делирий, сопор, кома; возможна корковая слепота, децеребрация с вовлечением ствола мозга, очаговая симптоматика - парезы и параличи) [42]. Коагулопатия потребления и АГ могут привести к геморрагическому инсульту [8, 10, 43].
Почки и мозг являются органами, наиболее уязвимыми для STEC-ГУС, но описаны поражения других органов, которые необходимо учитывать при оценке пациентов с данной патологией. Со стороны ЖКТ, как правило, отмечаются проявления энтероколита различной степени тяжести (от незначительного учащения и разжижения стула до профузной кровавой диареи с резкими болями в животе). В некоторых случаях развивается язвенный энтероколит с некрозом и перфорацией кишечной стенки, что обуславливает необходимость оперативного вмешательства. Возможно выявление гепатоспленомегалии. Острый панкреатит, цитолитический синдром (повышение печеночных трансфераз) встречаются у 20% пациентов со STEC-ГУС, но обычно не приводят к органной недостаточности. Тем не менее, около 3% пациентов страдают гипергликемией в острой фазе [44], а у выживших после STEC-ГУС значительно выше частота диабета, возможно, как следствие тромбоза сосудов, кровоснабжающих островки Лангерганса, что подтверждается серией вскрытий. Сахарный диабет может быть транзиторным, но частичная потеря количества островков Лангерганса может привести к повторному возникновению диабета после отдаленного периода [8, 45].
Клиническая картина аГУС характеризуется значительным полиморфизмом симптомов. Однако основными проявлениями болезни являются тромбоцитопения, МАГА и ОПП, составляющие классическую триаду ТМА. Не исключается (в 20% случаев) стертое начало аГУС с медленным прогрессированием. При этом на протяжении нескольких недель или даже месяцев отмечаются слабо выраженная анемия, транзиторная тромбоцитопения, и сохранная функция почек. Возможно также развитие «неполной» ТМА с отсутствием тромбоцитопении (13-40%) или, реже, МАГА (6%) [38]. В ряде случаев описано развитие только почечных признаков ТМА в отсутствие гематологических нарушений.
В большинстве случаев поражение почек манифестирует ОПП с наличием олиго/анурии или без нее. При сохраненном диурезе отмечается протеинурия, иногда массивная, вплоть до развития нефротического синдрома, особенно при постепенном развитии заболевания. Возможно появление гематурии. Следует отметить, что при aГУС ОПП может не быть первым проявлением болезни. Примерно 17% пациентов демонстрируют лишь умеренный мочевой синдром без нарушения функции почек. Заболевание может также дебютировать изолированной протеинурией с признаками начальной ХБП. Половина детей и большинство взрослых пациентов с аГУС нуждаются в проведении ЗПТ в момент госпитализации. ХБП 5 у многих пациентов развивается независимо от характера манифестации болезни [33, 34, 35, 37, 39].
АГ развивается у большинства пациентов вследствие перегрузки объемом при наличии олиго/анурии и/или гиперренинемии из-за ишемии ткани почек, обусловленной ТМА.
Генерализованный характер ТМА при аГУС обусловливает развитие экстраренальных признаков болезни, связанных с поражением микроциркуляторного русла различных органов и систем, в том числе головного мозга, сердца, лёгких, ЖКТ, органа зрения. Внепочечные проявления заболевания наблюдаются у 20% пациентов, из которых почти две трети имеют больше одного экстраренального признака [1, 8, 33, 34, 35]. В некоторых случаях сложно отличить первичное поражение органов вследствие ТМА и вторичные осложнения (артериальная гипертензия/перегрузка жидкостью/электролитные расстройства).
У большинства пациентов имеется выраженный отечный синдром, основными проявлениями которого служат массивные периферические отеки вплоть до анасарки и выпот в полостях (гидроторакс, гидроперикард, асцит). Причиной отеков является резко повышенная сосудистая проницаемость, индуцированная С3а и С5а компонентами комплемента через освобождение больших количеств гистамина.
Почти у половины пациентов диагностируется поражение ЦНС разной степени выраженности (сонливость, раздражительность, судороги, нарушения зрения, гемипарез или гемиплегия, ступор, кома). В ряде случаев возможно развитие отека головного мозга, обусловленное повышенной сосудистой проницаемостью [1, 8, 24].
У 40% пациентов развивается ТМА миокарда, основным проявлением которой может быть дилатационная кардиомиопатия с признаками постепенно нарастающей или острой сердечной недостаточности. Небольшое число (около 3%) пациентов с интрамиокардиальной ТМА демонстрирует развитие острого инфарктa миокарда, который может стать причиной внезапной смерти [46, 47].
Легочная ТМА может стать причиной развития геморрагического альвеолита или острого респираторного дистресс-синдрома взрослых. Нарастающая вследствие этих причин дыхательная недостаточность в ряде случаев требует применения искусственной вентиляции легких. Достаточно часто у пациентов с аГУС развиваются двусторонние инфильтраты в легких, что затрудняет верификацию диагноза и требует дифференциальной диагностики с васкулитами и инфекционной патологией [8, 35, 46, 47].
Поражение ЖКТ встречается приблизительно у 30% пациентов с аГУС. Наиболее часто наблюдается поражение кишечника, проявляющееся диареей, тошнотой и рвотой, хотя возможно развитие абдоминального болевого синдрома. Нередко отмечается развитие острого панкреатита с характерными клиническими признаками вплоть до панкреонекроза. Описано острое развитие сахарного диабета. Реже наблюдаются ишемические некрозы печени [8, 35, 47].
Также, в ряде случаев, диагностируется поражение органа зрения в виде пурчероподобной ретинопатии, проявляющейся преимущественного билатеральным повреждением органа зрения с отеком диска зрительного нерва, интраретинальными кровоизлияниями, мягкими ватообразными экссудатами, макулярным отеком. В настоящее время наиболее принятой теорией является микроэмболизация сосудистой сети сетчатки, приводящая к прекапиллярной окклюзии артериол и микрососудистому инфаркту слоя нервных волокон [49].
Редким проявлением аГУС является поражение кожи с развитием обширных некротических очагов [50]. Встречается также дигитальная ишемическая гангрена, приводящая к ампутации пальцев рук и ног [51].
Примерно у 6% пациентов отмечается полиорганная недостаточность, связанная с диффузной ТМА с поражением ЦНС, ишемией миокарда, легочным кровотечением и дыхательной недостаточностью, панкреатитом, печеночным цитолитическим синдромом, желудочно-кишечным кровотечением [8, 47]. Экстраренальные проявления TMA возникают как в острой фазе, так и после нее (спустя годы) в результате хронического нарушения функции комплемента и при сочетании с факторами повреждения клеток эндотелия (лекарства, гипертензия, облучение ). При этом надо помнить, что тяжелые экстраренальные проявления могут возникнуть при отсутствии явного рецидива заболевания и отклонений гематологических показателей, так как аГУС - хроническое заболевание, течение которого продолжается, даже если состояние пациента кажется стабильным.
1,6,1 Типичный ГУС.
К факторам риска развития ГУС при STEC-инфекции относят возраст от 6 месяцев до 5 лет, женский пол, обезвоживание, лихорадку, рвоту, лейкоцитоз, гемоколит, использование антикислотных препаратов (ингибиторов протонного насоса, антогонистов Н2-рецепторов), антибиотиков (β-лактамные, фторхинолоны) и антиперистальтических препаратов в продромальный период. Адекватная парентеральная регидратация не предотвращает развития STEC-ГУС, но способствует более благоприятному течению болезни [2, 7, 8, 10, 13, 65,].В течении STEC-ГУС выделяют продромальную фазу и период развернутой клинической картины. Продрома характеризуется диареей у 90-95% пациентов, рвотой - у 30-60%, абдоминальным синдромом. Через 1-2 дня в 70% случаев развивается гемоколит. Установлено, что у пациентов с гемоколитом в продроме STEC-ГУС отмечается большая продолжительность анурии и частое развитие неврологической симптоматики, более высокий уровень летальности [5, 23, 27].
STEC-ГУС манифестирует через 2-14 дней (в среднем на 6-й день) от начала диареи. Характерно ухудшение общего состояния ребенка, нарастание вялости, возникновение бледности и иктеричности кожи, пастозности век и голеней. Возможен геморрагический синдром, проявляющийся петехиальной сыпью, экхимозами, носовыми и желудочно-кишечными кровотечениями [6, 8, 10]. У 5-10% пациентов со STEC-ГУС дебют заболевания не связан с предшествующей диареей в анамнезе, что подчеркивает важность проведения микробиологического исследования у всех пациентов с ТМА независимо от истории болезни [27].
Для STEC-ГУС характерно быстрое развитие олигурии или анурии, возможно изменение цвета мочи за счет гематурии и/или гемоглобинурии. Олигоанурическое ОПП, требующее проведения ЗПТ, развивается примерно у 50-60% пациентов. Как правило, на фоне энтеральных потерь анурия диагностируется поздно. При отсутствии адекватного контроля регидратации возникает гипергидратация: периферические отеки, явления полисерозита, отек легких, объемзависимая артериальная гипертензия (АГ). Возможно прогрессирующее усугубление дыхательной недостаточности вплоть до возникновения потребности в респираторной поддержке [8].
В остром периоде STEC-ГУС в 72% случаев встречается АГ, связанная с гипергидратацией, отличающаяся упорным течением и плохим ответом на терапию. При восстановлении диуреза отмечается второй подъем артериального давления, связанный с повышенной выработкой ренина. Перегрузка объемом, электролитные нарушения, токсический миокардит при ОПП и кардиальная ТМА служат причиной сердечной недостаточности у части пациентов в остром периоде STEC-ГУС. Клинически нарушения гемодинамики проявляются тахикардией, приглушением сердечных тонов, увеличением границ сердца, в ряде случаев - развитием сердечной недостаточности [40]. Острый инфаркт миокарда, хотя и реже, является еще одним потенциально опасным для жизни осложнением STEC-ГУС [41].
Поражение ЦНС развивается в 25% и проявляется психомоторным возбуждением или угнетением, фокальными или генерализованными судорогами, нарушениями сознания различной степени выраженности (делирий, сопор, кома; возможна корковая слепота, децеребрация с вовлечением ствола мозга, очаговая симптоматика - парезы и параличи) [42]. Коагулопатия потребления и АГ могут привести к геморрагическому инсульту [8, 10, 43].
Почки и мозг являются органами, наиболее уязвимыми для STEC-ГУС, но описаны поражения других органов, которые необходимо учитывать при оценке пациентов с данной патологией. Со стороны ЖКТ, как правило, отмечаются проявления энтероколита различной степени тяжести (от незначительного учащения и разжижения стула до профузной кровавой диареи с резкими болями в животе). В некоторых случаях развивается язвенный энтероколит с некрозом и перфорацией кишечной стенки, что обуславливает необходимость оперативного вмешательства. Возможно выявление гепатоспленомегалии. Острый панкреатит, цитолитический синдром (повышение печеночных трансфераз) встречаются у 20% пациентов со STEC-ГУС, но обычно не приводят к органной недостаточности. Тем не менее, около 3% пациентов страдают гипергликемией в острой фазе [44], а у выживших после STEC-ГУС значительно выше частота диабета, возможно, как следствие тромбоза сосудов, кровоснабжающих островки Лангерганса, что подтверждается серией вскрытий. Сахарный диабет может быть транзиторным, но частичная потеря количества островков Лангерганса может привести к повторному возникновению диабета после отдаленного периода [8, 45].
1,6,2 Атипичный ГУС.
Для развития аГУС необходимо взаимодействие генетических аномалий в системе комплемента с факторами внешней среды, которые играют роль триггеров, провоцирующих дополнительную активацию комплемента у предрасположенных лиц.Клиническая картина аГУС характеризуется значительным полиморфизмом симптомов. Однако основными проявлениями болезни являются тромбоцитопения, МАГА и ОПП, составляющие классическую триаду ТМА. Не исключается (в 20% случаев) стертое начало аГУС с медленным прогрессированием. При этом на протяжении нескольких недель или даже месяцев отмечаются слабо выраженная анемия, транзиторная тромбоцитопения, и сохранная функция почек. Возможно также развитие «неполной» ТМА с отсутствием тромбоцитопении (13-40%) или, реже, МАГА (6%) [38]. В ряде случаев описано развитие только почечных признаков ТМА в отсутствие гематологических нарушений.
В большинстве случаев поражение почек манифестирует ОПП с наличием олиго/анурии или без нее. При сохраненном диурезе отмечается протеинурия, иногда массивная, вплоть до развития нефротического синдрома, особенно при постепенном развитии заболевания. Возможно появление гематурии. Следует отметить, что при aГУС ОПП может не быть первым проявлением болезни. Примерно 17% пациентов демонстрируют лишь умеренный мочевой синдром без нарушения функции почек. Заболевание может также дебютировать изолированной протеинурией с признаками начальной ХБП. Половина детей и большинство взрослых пациентов с аГУС нуждаются в проведении ЗПТ в момент госпитализации. ХБП 5 у многих пациентов развивается независимо от характера манифестации болезни [33, 34, 35, 37, 39].
АГ развивается у большинства пациентов вследствие перегрузки объемом при наличии олиго/анурии и/или гиперренинемии из-за ишемии ткани почек, обусловленной ТМА.
Генерализованный характер ТМА при аГУС обусловливает развитие экстраренальных признаков болезни, связанных с поражением микроциркуляторного русла различных органов и систем, в том числе головного мозга, сердца, лёгких, ЖКТ, органа зрения. Внепочечные проявления заболевания наблюдаются у 20% пациентов, из которых почти две трети имеют больше одного экстраренального признака [1, 8, 33, 34, 35]. В некоторых случаях сложно отличить первичное поражение органов вследствие ТМА и вторичные осложнения (артериальная гипертензия/перегрузка жидкостью/электролитные расстройства).
У большинства пациентов имеется выраженный отечный синдром, основными проявлениями которого служат массивные периферические отеки вплоть до анасарки и выпот в полостях (гидроторакс, гидроперикард, асцит). Причиной отеков является резко повышенная сосудистая проницаемость, индуцированная С3а и С5а компонентами комплемента через освобождение больших количеств гистамина.
Почти у половины пациентов диагностируется поражение ЦНС разной степени выраженности (сонливость, раздражительность, судороги, нарушения зрения, гемипарез или гемиплегия, ступор, кома). В ряде случаев возможно развитие отека головного мозга, обусловленное повышенной сосудистой проницаемостью [1, 8, 24].
У 40% пациентов развивается ТМА миокарда, основным проявлением которой может быть дилатационная кардиомиопатия с признаками постепенно нарастающей или острой сердечной недостаточности. Небольшое число (около 3%) пациентов с интрамиокардиальной ТМА демонстрирует развитие острого инфарктa миокарда, который может стать причиной внезапной смерти [46, 47].
Легочная ТМА может стать причиной развития геморрагического альвеолита или острого респираторного дистресс-синдрома взрослых. Нарастающая вследствие этих причин дыхательная недостаточность в ряде случаев требует применения искусственной вентиляции легких. Достаточно часто у пациентов с аГУС развиваются двусторонние инфильтраты в легких, что затрудняет верификацию диагноза и требует дифференциальной диагностики с васкулитами и инфекционной патологией [8, 35, 46, 47].
Поражение ЖКТ встречается приблизительно у 30% пациентов с аГУС. Наиболее часто наблюдается поражение кишечника, проявляющееся диареей, тошнотой и рвотой, хотя возможно развитие абдоминального болевого синдрома. Нередко отмечается развитие острого панкреатита с характерными клиническими признаками вплоть до панкреонекроза. Описано острое развитие сахарного диабета. Реже наблюдаются ишемические некрозы печени [8, 35, 47].
Также, в ряде случаев, диагностируется поражение органа зрения в виде пурчероподобной ретинопатии, проявляющейся преимущественного билатеральным повреждением органа зрения с отеком диска зрительного нерва, интраретинальными кровоизлияниями, мягкими ватообразными экссудатами, макулярным отеком. В настоящее время наиболее принятой теорией является микроэмболизация сосудистой сети сетчатки, приводящая к прекапиллярной окклюзии артериол и микрососудистому инфаркту слоя нервных волокон [49].
Редким проявлением аГУС является поражение кожи с развитием обширных некротических очагов [50]. Встречается также дигитальная ишемическая гангрена, приводящая к ампутации пальцев рук и ног [51].
Примерно у 6% пациентов отмечается полиорганная недостаточность, связанная с диффузной ТМА с поражением ЦНС, ишемией миокарда, легочным кровотечением и дыхательной недостаточностью, панкреатитом, печеночным цитолитическим синдромом, желудочно-кишечным кровотечением [8, 47]. Экстраренальные проявления TMA возникают как в острой фазе, так и после нее (спустя годы) в результате хронического нарушения функции комплемента и при сочетании с факторами повреждения клеток эндотелия (лекарства, гипертензия, облучение ). При этом надо помнить, что тяжелые экстраренальные проявления могут возникнуть при отсутствии явного рецидива заболевания и отклонений гематологических показателей, так как аГУС - хроническое заболевание, течение которого продолжается, даже если состояние пациента кажется стабильным.
|
|
Диагностика
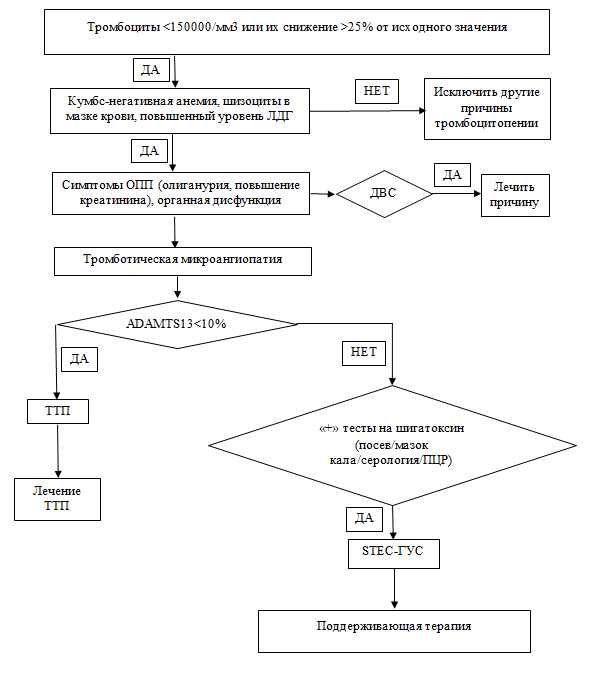
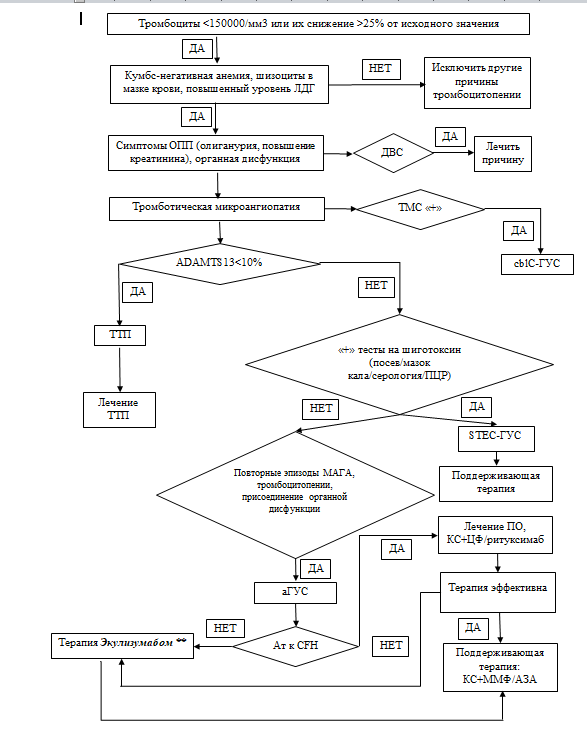
В связи с тем, что все ТМА независимо от их патогенеза имеют сходные клинико-лабораторные проявления и общую гистологическую картину, чрезвычайно важной представляется дифференциальная диагностика между основными формами первичной ТМА - STEC-ГУС, аГУС и ТТП.
У детей в круг дифференциально-диагностического поиска, кроме STEC-ГУС, аГУС и ТТП, следует включать метилмалоновую ацидемию (дефектный метаболизм кобаламина) и ГУС, ассоциированный с пневмококком, продуцирующим нейраминидазу. Таким образом, при диагностике ГУС первоначально необходимо установить наличие ТМА, в последующем - провести дифференциальную диагностику между первичными и вторичными ТМА.
Критерии диагностики типичного гемолитико-уретического синдрома ( STEC-ГУС):
При развитии симптомов ТМА на фоне симптомов со стороны ЖКТ (диарея и/или тошнота/рвота и/или боли в животе и/или гастроэнтерит) необходимо исключить STEC-ГУС. Он устанавливается на основании характерной клинической картины с диарейным продромом и должен быть подтвержден лабораторными данными, исключающими другие ТМА. Диагностика ТМА основана на наличии МАГА и тромбоцитопении в сочетании с признаками поражения почек и/или экстраренальными проявлениями [1, 4, 18, 25, 27, 28].
Наличие МАГА устанавливают на основании выявления у пациентов Кумбс-негативной анемии, шизоцитов - фрагментированных эритроцитов в мазке периферической крови (диагностически значимое их содержание для ТМА >1%), повышения лактатдегидрогеназы (ЛДГ), снижения гаптоглобина. Гипербилирубинемия (за счет повышения непрямой фракции), свободный гемоглобин, ретикулоцитоз также являются неспецифическими индикаторами гемолиза эритроцитов.
Тромбоцитопению диагностируют при количестве тромбоцитов <150000/мм3. Если число тромбоцитов превышает это значение, то об их потреблении можно судить по снижению количества тромбоцитов >25% от базального уровня (если он известен). В мазках периферической крови можно обнаружить гигантские тромбоциты, при трепанобиопсии костного мозга - нормальное количество мегакариоцитов.
У пациентов с МАГА и тромбоцитопенией наличие ОПП, изолированного или в сочетании с симптомами поражения ЖКТ, ЦНС, легких, сердца служит основанием для диагностики ТМА.
Течение STEC-ГУС с поражением других органов и систем помимо почек во многом определяет прогноз и исход. Экстраренальные проявления болезни могут быть связаны с электролитными расстройствами, метаболическими нарушениями, гипергидратацией, интоксикацией, системной воспалительной реакцией, а в ряде случаев - с развитием ТМА.
В случае констатации ТМА диагноз STEC-ГУС можно верифицировать, только исключив аГУС и ТТП. Скрининг на STEC-ГУС показан при наличии симптомов со стороны ЖКТ. Известно, что у 5-10% пациентов может не быть предшествующей диареи в анамнезе, что подчеркивает важность микробиологического исследования всех пациентов с ТМА независимо от истории заболевания. Лабораторные исследования следует выполнять в первые сутки госпитализации пациента в стационар до начала антибактериальной терапии. Диагноз STEC-ГУС может быть отвергнут на основании исключения наличия Stx в крови и стуле. Для исключения STEC-ГУС показаны:
• посев кала для выявления культуры STEC (на среду Mac сonkey для E.coli O157:H7).
• индикация и выделение из клинического материала (кал/ректальный мазок) штаммов энтерогеморрагических E.coli методом ПЦР.
• определение Stx в сыворотке крови.
• определение в сыворотке крови антител к липополисахариду наиболее распространенного в данном регионе серотипа E.coli.
ПЦР-анализ первичных фекальных культур является наиболее чувствительным и специфическим исследованием для скрининга организмов, продуцирующих токсины Отрицательный результат скрининга при подозрении на STEC-ГУС достоверен, если анализ собран до начала антибактериальной терапии. В случаях проведения антибактериальной терапии частота выделения из стула ДНК EHEC методом ПЦР существенно выше только в первые 6 дней диареи. Таким образом, определение шига-токсина в кале/ректальном мазке методом ПЦР в более поздние сроки представляется нецелесообразным.
Перспективным является внедрение в рутинную практику выявление и идентификация генов вирулентности ЕНЕС (rfbO157 - липополисахорид О157, eae - фактор адгезии интимин, Stx1,2 - шига-токсин типа 1,2) с помощью мультиплексной ПЦР.
Присутствие сывороточных антител IgM против специфического липополисахарида E.coli служит важным доказательством недавно перенесенной инфекции STEC (метод ELISA, анализа пассивной гемагглютинации) [38].
STEC-ГУС всегда развивается остро. Волнообразное, рецидивирующее течение не характерно для данной формы ТМА. После первоначального падения гемоглобина и тромбоцитов постепенно их уровень нарастает, хотя признаки почечного повреждения могут сохраняться еще длительное время.
Критерии, позволяющие заподозрить/установить диагноз STEC -ГУС:
• Отсутствие семейного анамнеза.
• Возраст дебюта ГУС: 6 мес.-5 лет.
• Развитие ГУС на фоне кишечной инфекции (признаки поражения ЖКТ, диарея, гемоколит).
• Развитие ГУС во время вспышки инфекции STEC.
• МАГА: снижение гемоглобина, шизоцитоз >1%, ретикулоцитоз, проба Кумбса отрицательная, повышение ЛДГ, снижение концентрации гаптоглобина.
• Потребление тромбоцитов: тромбоциты ˂150000/мм2 или число тромбоцитов уменьшено ˃25%, не выходя за границы нормы.
• Органная дисфункция: поражение почек, сердечно-сосудистой системы, легких, ЖКТ, органа зрения.
• Положительный результат посева кала или наличие Escherichia coli/Shigella dysenteriae type1 в культуре фекалий методом ПЦР.
• Активность ADAMTS13>10%.
• Нет изменений содержания ацилкарнитинов по данным тандемной масс-спектрометрии.
• Безрецидивное течение.
Критерии диагностики атипичного гемолитико-уремического синдрома:
До настоящего времени специфические диагностические маркеры аГУС отсутствуют. Диагноз «аГУС» - это диагноз исключения. Он устанавливается на основании совокупности данных: анамнеза, наличия/отсутствия триггерного события, характерной триады ТМА и должен быть подтвержден лабораторными данными, исключающими другие формы ТМА.Течение аГУС часто ассоциируется сочетанием ОПП с экстраренальными проявлениями. Клиническая настороженность в отношении аГУС необходима при наличии симптомокомплекса гастроэнтероколита у детей в возрасте worse 6 мес., указаний на ранее необъяснимую анемию, стертое начало или относительно постепенное начало со снижением почечной функции в течение нескольких дней, волнообразное течения с повторными падениями уровня гемоглобина и тромбоцитов, подозрения на ранее перенесенный ГУС, семейных случаев ГУС в различное время.
В случае развития ТМА диагноз аГУС можно верифицировать, только исключив другие формы первичных и вторичных ТМА: STEC-ГУС, ТТП, пневмококк-ассоциированный ГУС и ГУС, обусловленный дефектным метаболизмом кобаламина, , на фоне метилмалоновой ацидемии.
Диагноз STEC-ГУС может быть отвергнут на основании исключения наличия Stx в крови и стуле, диагностики вирусной этиологии диареи.
Для исключения ТТП всем пациентам с ТМА необходимо определение активности металлопротеазы ADAMTS13. Исследование активности ADAMTS13 следует выполнять до начала плазмотерапии. Активность ADAMTS13 в норме составляет 80-110%. Снижение её до <10% свидетельствует в пользу ТТП, что требует в последующем в крови анти-ADAMTS13-антител для верификации генетической или аутоиммунной формы заболевания для выбора тактики лечения. У пациентов с аГУС активность ADAMTS13 может быть снижена, однако её показатель всегда превышает 10%. Снижение активности ADAMTS13, помимо аГУС, может наблюдаться при системных заболеваниях (катастрофический АФС, СКВ), сепсисе, ДВС-синдроме. В случаях невозможности немедленного исследования активности ADAMTS13 у пациента с ТМА и крайней тяжестью состояния, обусловливающей угрозу жизни или высокий риск тяжелых почечных и/или внепочечных осложнений, следует использовать правило, в соответствии с которым значения креатинина сыворотки >150-200 мкмоль/л (1,7-2,3мг/дл) в сочетании с числом тромбоцитов >30000/1 мкл практически исключают диагноз ТТП. Поскольку выраженность тромбоцитопении прямо коррелирует с показателем активности ADAMTS13, в последнее время появились сведения о том, что при стабильной умеренной тромбоцитопении не ниже 70000/1 мкл активность металлопротеазы можно не определять [28, 38].
У детей с клинико-лабораторными признаками ТМА также следует проводить дифференциальную диагностику между аГУС, ГУС, ассоциированным с Streptococcus pneumoniae и ГУС, ассоциированным с дефектным метаболизмом кобаламина у детей, с метилмалоновой ацидурией.
ГУС, ассоциированный с Streptococcus pneumoniae (pnГУС), наиболее часто встречается у детей младше 2 лет и составляет около 5% всех случаев ГУС в педиатрической практике. На фоне инвазивной пневмококковой инфекции ГУС развивается в 0,4-0,6% случаев. Несмотря на то, что вакцинация от пневмококковой инфекции изменила «микробный пейзаж», но pnГУС не стал еще более редким. В 72% случаев pnГУС развивается на фоне пневмонии и/или эмпиемы плевры, в 23% - менингита и в 5% - пневмококкового сепсиса [53]. Ранее считалось, что основную роль в патогенезе pnГУС играет антиген Томсена-Фриденрейха (ТF-антиген), локализованный на поверхности эритроцитов, тромбоцитов, эндотелиалиальных клеток и клеток клубочков и покрытый сиаловыми кислотами. Предполагалось, что нейраминидаза А пневмококка разрушает N-ацетил-нейраминовую кислоту поверхности клеток, обнажая ТF-антиген, который атакуют циркулирующие IgM, обуславливая гемолиз, повреждение эндотелиальных клеток и агрегацию тромбоцитов [8]. Однако, в настоящее время доказано, что pnГУС может быть связан с потреблением комплемента на ранней стадии заболевания через альтернативный путь его активации. При десиалировании фактор сFH не может связываться с С3-конвертазой на поверхности клетки, что приводит к активному образованию МАК [54]. Пневмококки эффективно связывают PLG человека через поверхностные белки бактерий Tuf и PspC. При активации плазмина на бактериальной поверхности активная протеаза повреждает эндотелиальные клетки, вызывает ретракцию эндотелия и обнажение матрикса, нарушая местный гомеостаз и способствуя развитию тромбогенного состояния.
Таким образом, связь между десиалированием мембраны и нерегулируемой активацией комплемента возможна без взаимодействия TF-антигена и анти-TF антител [53, 54]. Отсутствие агглютинации эритроцитов при 37°C также свидетельствует против роли анти-TF антител. Кроме того, установлено, что связывание антител к TF значимо выше при температуре ниже 4°C и незначительно при 37°C, что еще раз подтверждает несостоятельность ранее представленной патогенетической модели заболевания в естественных условиях [54]. Развивается pnГУС 3-13 день течения инвазивной пневмококковой инфекции. Диагностическими особенностями pnГУС являются: развитие ОПП, тромбоцитопении и МАГА с положительной прямой пробой Кумбса (60-90%) при отсутствии лабораторных доказательств ДВС-синдрома [1, 8, 28, 38, 55]. Для пациентов с pnГУС характерным является: длительная олигурия, развитие ОПП у всех пациентов с потребностью в ЗПТ в 40-80% случаев, а также наличие экстраренальных проявлений (молниеносная пурпура, панкреатит, холецистит, тромбозы, кардиопатия, глухота) [1, 35].
ГУС, ассоциированный с дефектным метаболизмом кобаламина (сblC-ГУС) - моногенное аутосомно-рецессивное заболевание. Известно 37 случаев ГУС, обусловленного дефектным метаболизмом кобаламина (сblC-ГУС) с манифестацией в возрасте до 1 годав 17 наблюдениях. Данная форма - редкий случай ТМА в детском возрасте, причиной которой является генетическое орфанное заболевание - метилмалоновая ацидемия. Дебют заболевания в 5% случаев у детей ≤1 года, в 25% - старше 1 года. Выделяют 2 формы заболевания: с ранним (<1 год) и поздним началом (1 год) [38, 57]. Особенностями течения сblC-ГУС у детей с ранним началом являются: трудности вскармливания (рвота, срыгивания, отказ от еды), развитие гипотрофии, поражение ЦНС (мышечная гипотония, летаргия, задержка развития, судороги, микроцефалия/гидроцефалия), нарушение зрения (пигментная ретинопатия/нистагм), тяжелая артериальная гипертензия. Летальный исход практически запрограммирован у 100% детей без лечения. При поздней манифестации сblC-ГУС характерно развитие легочной гипертензии (40%), поражение ЦНС (когнитивные нарушения, атаксия, судороги, миелопатия) и тяжелая гипертензия [1, 58].
Диагностика сblC-ГУС основывается на выявлении МАГА, макроцитоза, ретикулоцитоза <3‰, тромбоцитопении с/без лейкопенией и нейтропенией, протеинурии с/без нефротического синдрома, гематурии, ОПП, прогрессирующей ХБП, тяжелого метаболического ацидоза с положительным анионным интервалом, гипергомоцистинемии, повышение уровня метилмалоновой кислоты в крови/моче (газовая хроматография), повышение уровня метилмалонилкарнитина и пропионилкарнитина (тандемная масс-спектрометрия) в крови, патологических мутаций в генах MUT, MMAA, MMAB, ММАСНС, ММАDHC, MCEE [1, 59].
Исключение STEC-ГУС, ТТП, pnГУС и сblC-ГУС у пациента с не вызывающей сомнений ТМА позволяет диагностировать аГУС. Кроме того, необходимо помнить, что в 20% случаев диагностируются неполные формы аГУС в виде диады симптомов вместо триады: сочетание МАГА с ОПП или тромбоцитопении с ОПП. Также и экстраренальные проявления аГУС могут отмечаться без лабораторных признаков ТМА у пациентов с уже установленным диагнозом [60].
Критерии, позволяющие заподозрить аГУС:
• Возраст <6 мес. >5 лет.
• У младенца ˂6 мес. негативный тест на присутствие метилмалоновой кислоты в моче, нормальный уровень метилмалонилкарнитина и пропионилкарнитина в крови по данным тандемной масс-спектрометрии.
• Дебют ТМА без диарейного продрома, пневмококковой инфекции.
• Относительно постепенное начало на фоне гастроэнтероколита (возможен гемоколит) со снижением почечной функции в течение нескольких дней.
• Возможна положительная семейная история.
• Симптомы сильной усталости, задержка развития.
• Эпизоды неврологических нарушений (очаговые симптомы, спутанность сознания ) при активности ADAMTS13 >10%.
• Признаки/симптомы заболеваний других органов (инфаркт миокарда, кардиомиопатия, боли в груди, одышка, дыхательная недостаточность, панкреатит, гепатит, колит ).
• Ранее имевшиеся эпизоды ТМА/ГУС.
• МАГА: снижение гемоглобина, шизоцитоз >1%, ретикулоцитоз, проба Кумбса отрицательная, повышение ЛДГ, снижение концентрации гаптоглобина.
• Потребление тромбоцитов: тромбоциты ˂150000/мм2 или число тромбоцитов уменьшено ˃25% от исходного, не выходя за границы нормы.
• Органная дисфункция: поражение почек, сердечно-сосудистой системы, легких, желудочно-кишечного тракта, органа зрения.
• Развитие нефротического синдрома при отсутствии ОПП на фоне ТМА.
• ОПП без снижения диуреза.
• При диарейном продроме отрицательный результат Escherichia coli / Shigella dysenteriae type1 в культуре фекалий методом ПЦР.
• Активность ADAMTS13>10%.
• ТМА с развитием ОПП и экстраренальных проявлений при условии, что последние не связаны с объемной перегрузкой.
• Отсутствие обратного развития ТМА на фоне плазмотерапии.
• Отсутствие признаков СКВ, АФС, эндотелиотоксичности лекарств.
Критерии, подтверждающие диагноз аГУС:
• Отягощенный семейный анамнез: случаи аГУС в семье.
• Развитие ТМА после вакцинации, ОРЗ, травмы и без триггерного события.
• Развитие ТМА у пациентов при диарейном продроме с отрицательным результатом Escherichia coli / Shigella dysenteriae type1 в культуре фекалий методом ПЦР (исследование проводится до назначения антибиотиков).
• Повторные эпизоды гемолиза и потребления тромбоцитов в период манифестации заболевания.
• Появление экстраренальных симптомов при разрешающейся ТМА.
• Рецидивы, разделенные периодами ремиссии и прогрессированием до ХБП 5.
• Патогенные мутации генов, кодирующих белки комплемента, описанные при аГУС.
• Положительный клинико-лабораторный эффект комплемент-блокирующей терапии (экулизумаб**).
Отсутствие патогенных мутаций генов, кодирующих белки комплемента не препятствует диагностике аГУС из-за возможности вариантов в генах, отличных от классических генов аГУС и вариантов, которые можно пропустить при высокопроизводительном секвенировании (например, большие геномные перестройки или интронные варианты, не охваченные традиционным панельным тестированием).
• Слабость, вялость, быстрая утомляемость, отсутствие аппетита, головокружение.
• Тошнота, рвота, боли в животе, частый жидкий стул.
• Периферические отеки, уменьшение объема отделяемой мочи, изменение цвета мочи.
• Одышка.
• Геморрагический синдром: геморрагические сыпь на коже, кровотечения.
• Головные боли, психомоторное возбуждение, спутанность сознания, судороги,.
• Нарушение зрения разной степени выраженности.
При сборе анамнеза у пациентов с подозрением на типичный/атипичный ГУС обратить внимание на следующую информацию :
• Случаи ТМА в семье.
• Ранее имевшиеся эпизоды ТМА.
• Развитие ТМА после ОКИ (E.coli, S, dysenteriae type 1), пневмококковой инфекции, вакцинации, ОРЗ, ОРВИ с кишечным синдромом, травмы и без триггерного события [38, 66].
(УУР С, УДД 5).
Комментарии. Основной целью осмотра является обнаружение признаков поражения почек и экстраренальных проявлений.
Рекомендуется всем пациентам Исследование уровня буферных веществ в крови, водородных ионов (рН) крови с целью диагностики нарушений кислотно-основного состояния крови, контроля в динамике, в тч лечения [68].
(УУР С; УДД 5).
Комментарий. Частота исследований в динамике определяется клинической ситуацией. Декомпенсированный метаболический ацидоз является показанием для старта ЗПТ, независимо от уровня азотемии. Выявление тяжелого метаболического ацидоза с положительным анионным интервалом может позволить заподозрить сblC-ГУС.
• Рекомендуется всем пациентам проведение Общего (клинического) анализа крови развернутого с исследованием фрагментированных эритроцитов (шизоцитов) по мазку крови, подсчетом ретикулоцитов с целью диагностики, контроля в динамике, в тч лечения, в остром периоде любой формы ТМА, а также при рецидиве аГУС [8, 63, 69, 70].
(УУР С; УДД 5).
Комментарий. Частота исследований в динамике определяется клинической ситуацией. У пациентов с ГУС определяется снижение гемоглобина, ретикулоцитоз, шизоцитоз ≥1%. При STEC-ГУС выявляется лейкоцитоз со сдвигом лейкоцитарной формулы влево, повышение СОЭ.
Международный Совет по Стандартизации в Гематологии (ICSH) разработал рекомендации по идентификации шизоцитов. Фрагментированные эритроциты в мазке крови - это фрагменты эритроцитов в виде полумесяца, шляпы наполеона, шлема (каски), треугольника, с двумя-тремя острыми выступами и маленького неправильной формы фрагмента, имеющего линию разлома. Было также предложено шизоцитами считать микросфероциты при наличии в мазке крови шизоцитов другой формы [52].
Обязательным является оптический контроль тромбоцитов (по Фонио), так как при подсчете на автоматическом гематологическом анализаторе распавшиеся эритроциты идентифицируются как тромбоциты, завышая количество последних в конечном результате анализа. При несоответствии уровня тромбоцитопении тяжести ТМА следует исключить лекарственно-индуцированную тромбоцитопению (вальпроевая кислота** (и препараты на ее основе), Цефоперазон+сульбактам**, гидрохлоротиазид** .
• Рекомендуется всем пациентам однократно для установления природы гемолиза Прямой антиглобулиновый тест (прямая проба Кумбса) и Непрямой антиглобулиновый тест (тест Кумбса) [68, 71, 72].
(УУР С; УДД 4).
Комментарий. Для STEC-ГУС, аГУС, ТТП, сblC-ГУС, вторичных форм ТМА характерна Кумбс-негативная анемия, при pnГУС - проба Кумбса положительная у 60-90% пациентов. При проведении непрямой пробы Кумбса оценивается наличие антиэритроцитарных антител, которые содержатся в свободном виде в плазме крови. Для исключения аутоиммунного характера гемолитической анемии необходимо проведение прямой пробы Кумбса, при которой определяются антиэритроцитарные антитела / компоненты комплемента, зафиксированные на поверхности эритроцитов крови. При положительной прямой пробе Кумбса необходимо исключать аутоиммунную гемолитическую анемию, синдром Фишера-Эванса. Также надо учитывать, что возможными причинами положительного результата пробы Кумбса может быть переливание крови без предварительного типирования (посттрансфузионная гемолитическая реакция), СКВ, лимфома, инфекционный мононуклеоз, микоплазменная инфекция, гемолитическая реакция вследствие применения лекарств (цефалоспорины, аналоги пурина, метилдопа**).
• Рекомендуется всем пациентам при поступлении, в случае коррекции анемии эритроцитарной взвесью и необходимостью хирургического вмешательства Определение основных групп по системе AB0, Определение антигена D системы Резус (резус-фактор)с целью предотвращения реакции гемагглютинации [67].
(УУР С; УДД 5).
• Рекомендовано всем пациентам проведение анализа крови биохимического общетерапевтического (Исследование уровня креатинина в крови (с расчетом скорости клубочковой фильтрации) (Исследование функции нефронов по клиренсу креатинина (проба Реберга)1), Исследование уровня мочевины в крови, Исследование уровня мочевой кислоты в крови, Определение активности лактатдегидрогеназы в крови, Исследование уровня общего белка в крови, Исследование уровня альбумина в крови, Исследование уровня билирубина связанного (конъюгированного) в крови, Исследование уровня билирубина свободного (неконъюгированного) в крови, Определение активности аспартатаминотрансферазы в крови, Определение активности аланинаминотрансферазы в крови, Определение активности щелочной фосфатазы в крови, Исследование уровня натрия в крови, Исследование уровня калия в крови, Исследование уровня общего кальция в крови, Исследование уровня неорганического фосфора в крови, Исследование уровня хлоридов в крови, Исследование уровня железа сыворотки крови, исследование уровня глюкозы в крови, определение активности амилазы в крови), определение активности липазы в сыворотке крови, уровня ферритина в крови, Исследование уровня С-реактивного белка в сыворотке крови, креатинфосфокиназы и КФК-МВ (Определение активности креатинкиназы в крови, Исследование уровня/активности изоферментов креатинкиназы в крови)) с целью диагностики и контроля в динамике, в процессе лечения [68, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85].
(УУР С; УДД 5).
Комментарий. Проводятся всем пациентам с целью диагностики, контроля в динамике, в тч лечения, в острый период заболевания и в период обострения аГУС. Частота исследований в динамике определяется клинической ситуацией.
При развитии ОПП повышается уровень мочевины и креатинина, возможны электролитные нарушения (гипонатриемия, гиперкалиемия, гиперфосфатемия, гипокальциемия). Показанием для инициации ЗПТ является гиперкалиемия >7,5 ммоль/л, независимо от выраженности азотемии. Уровень общего белка и альбумина могут быть несколько снижены. Возможно повышение мочевой кислоты у пациентов с ОПП из-за сниженной ее экскреции. Гиперурикемия также может сопровождать неопластические заболевания кроветворной и лимфатической системы, что требует у ряда пациентов с анемией и тромбоцитопенией проведения трепанобиопсии костного мозга. Гипербилирубинемия как маркер гемолиза не всегда диагностируется у пациентов с ТМА. Возможно повышение трансаминаз.
Маркерами гемолиза также может быть повышение сывороточного железа, ферритина. Однако при сочетании гиперферритинемии (≥500 мкг/л) с гепатоспленомегалией, цитопенией крови ≥2 из 3 линий гемопоэза, гипертриглицеридемией и/или гипофибриногенемией необходимо проведение трепанобиопсии костного мозга для исключения гемофагоцитарного синдрома. У пациентов с ТМА всегда повышена активность ЛДГ. Динамика активности ЛДГ в крови позволяет ориентировочно оценивать уровень активности гемолиза. В норме в сыворотке крови все фракции фермента определяются с небольшой активностью в составе суммарного показателя - общей ЛДГ.
Повышение ЛДГ в сыворотке крови - индикатор практически любого повреждения клеток, в которых локализован фермент (в клетках печени, сердца, почек, скелетных мышцах, эритроцитах). Определяется общая активность ЛДГ, слагаемая из активностей всех имеющихся 5 изоформ (ЛДГ-1, ЛДГ-2, ЛДГ-3, ЛДГ-4, ЛДГ-5). Для миокарда и мозговой ткани основной является ЛДГ-1, для эритроцитов, тромбоцитов, почечной ткани - ЛДГ-1 и ЛДГ-2. В легких, селезенке, щитовидной и поджелудочной железах, надпочечниках, лимфоцитах преобладает ЛДГ-3. ЛДГ-4 находится во всех тканях с ЛДГ-3, а также в гранулоцитах, плаценте и мужских половых клетках, в которых содержится и ЛДГ-5. Соответственно при заболеваниях, сопровождающихся повреждением тканей и разрушением клеток, активность ЛДГ в крови повышается, что и отмечается при развитии ТМА.
Повышение активности креатинфосфокиназы (КФК) в крови при ТМА свидетельствует о повреждении или разрушении клеток, обогащенных ферментом (сердечная мышца, скелетная мускулатура, головной мозг, щитовидная железа, легкие). Определение активности МВ-изофермента креатинфосфокиназы (КФК-МВ) (сердечный изофермент, изменяющийся при повреждении клеток миокарда) имеет значение у пациентов с ТМА для диагностики поражения сердца и проведения мониторинга состояния.
У всех пациентов с признаками дисфункции ЖКТ, независимо от формы ТМА, возможно поражение поджелудочной железы, что требует проведения динамического контроля ферментов поджелудочной железы (липаза, амилаза) и уровня гликемии.
Повышение концентрации СРБ в крови при ТМА может свидетельствовать о течении бактериальной инфекции и поражении миокарда.
1Скорость клубочковой фильтрации следует рассчитывать по формуле (расчетная по формуле Шварца)- (услуга отсутствуют в Номенклатуре медицинских услуг). Исследование функции нефронов по клиренсу креатинина (проба Реберга) детям не проводится.
• Рекомендовано пациентам с подозрением на аГУС провести Исследование уровня С3 фракции комплемента, Исследование уровня С4 фракции комплемента для исключения/подтверждения аГУС с диагностической целью в острый период заболевания [55, 63, 86, 87, 88, 89].
(УУР С; УДД 4).
Комментарии. У 60-80% пациентов с аГУС сывороточный С3 в в пределах референсного диапазона., В 87% наблюдений концентрация сFH остается в пределах нормы. Нормальный показатель С3 не исключает диагноза аГУС, а выявленное снижение этого компонента комплемента может служить дополнительным аргументом в пользу этого диагноза [33, 34, 38, 61]. При STEC-ГУС может наблюдаться снижение уровня с4 в начале заболевания, с нормализацией после 10 дней, что указывает на активацию классического и/или лектинового путей, в которых происходит потребление с4.
• Рекомендуется всем пациентам с ТМА при признаках гемолиза в начальном периоде заболевания, при длительной анемии, подозрении рецидива аГУС, изолированном повышении ЛДГ в отсутствии других признаков гемолиза, анемии Исследование уровня гаптоглобина крови [63].
(УУР С; УДД 5).
• Комментарий. Гаптоглобин связывает свободный гемоглобин, высвобождающийся из разрушенных эритроцитов. Снижение уровня гаптоглобина при ТМА указывает на его избыточное потребление и является признаком усиленного гемолиза, причем именно внутрисосудистого, так как гемолиз вне кровяного русла понижением гаптоглобина не сопровождается. Гаптоглобин снижается при гемолизе раньше, чем повышается ЛДГ, являясь тем самым ранним маркером гемолиза. При нефротическом синдроме у пациентов без признаков гемолиза также может снижаться гаптоглобин из-за его потерь с мочой. На фоне тяжелого бактериального процесса уровень гаптоглобина может быть нормальным при активной ТМА, что связано с тем, что данный белок является острофазовым белком.
• Рекомендуется пациентам, имеющим признаки сепсиса, развития синдрома системной воспалительной реакции, синдрома полиорганной недостаточности; при симптомах тяжелых инфекционных, гнойно-воспалительных процессов различной локализации; при подозрении на развитие генерализованной бактериальной инфекции; при подозрении на развитие инфекционных осложнений у пациентов в условиях хирургических и реанимационных отделений; при подозрении на присоединение вторичной бактериальной инфекции у пациентов с вирусными инфекциями, аллергическими, аутоиммунными заболеваниями; после обширных хирургических вмешательств, остром отторжении трансплантата, при хронической сердечной недостаточности; при назначении и мониторировании специфической антибактериальной терапии проведение исследования уровня прокальцитонина в крови [80].
(УУР с ; УДД 4).
Комментарий. Частота исследований в динамике определяется клинической ситуацией.
• Рекомендуется всем пациентам с целью диагностики, контроля в динамике, в тч лечения, в острый период при наличии геморрагического синдрома, планировании оперативных вмешательств, при использовании антитромботических средств (антикоагулянтов) и применении плазмотерапии исследование Коагулограммы (ориентировочного исследования гемостаза): определение протромбинового (тромбопластинового) времени в плазме, активированное частичное тромбопластиновое время, исследование уровня фибриногена, растворимых фибрин-мономерных комплексов, международного нормализованного отношения, антитромбиновой активности, антиХа-активности, протромбиновой активности, Д-димеров) [63, 68, 86, 90, 91, 92].
(УУР С; УДД 5).
Комментарий. Частота исследований и выбор показателей в динамике определяется клинической ситуацией. Необходимо проведение дифференциальной диагностики с ДВС-синдромом. Снижение продуктов деградации фибрина, антитромбина III при нормальном гаптоглобине, повышение протромбинового времени или активированного частичного тромбопластинового времени, снижение уровня фибриногена, повышение маркеров фибринообразования и активации фибринолиза (растворимые фибрин-мономерные комплексы, Д-димеры), воспаления (СРБ, прокальцитонина, пресепсина), потребление тромбоцитов и факторов свертывания подтверждают ДВС-синдром. Однако дифференциальная диагностика не всегда возможна, так как ГУС тоже может осложниться ДВС-синдромом. Острое повреждение легких и / или шок чаще сопровождаются ДВС-синдромом, а для ТМА более характерна дисфункция ЦНС. Кроме того, МАГА редко встречается при ДВС-синдроме, тогда как при ТМА - практически в 100% случаев. При любой форме ГУС часто развивается АГ, тогда как при сепсисе с ДВС-синдромом имеет место вазоплегия и гипотония. Следует отметить, что если тромбоцитопения или гемолиз сохраняются после разрешения сепсиса, то необходимо продолжить диагностический поиск их причин [93].
• Рекомендуется всем пациентам проведение тромбоэластографии в качестве скрининга гемостаза в предоперационном периоде, перед инвазивными процедурами; для динамического контроля гемостаза при кровопотере и критических состояниях; для контроля гемостатической, антиагрегантной и антикоагулянтной терапии [94].
(УУР С; УДД 5).
Комментарий. В некоторых случаях частота исследований в динамике определяется клинической ситуацией.
• Рекомендуется пациентам с признаками ишемии миокарда Исследование уровня тропонинов I, T в крови (тропонин-I) с диагностической целью [46, 92, 95].
(УУР С; УДД 4).
Комментарий. В большинстве случаев острый инфаркт миокарда у пациентов с аГУС развивается в отсутствие окклюзивного поражения коронарных артерий [41, 46]. Для постановки диагноза острого инфаркта миокарда необходимо подтверждение наличия острого повреждения миокарда (характерная динамика уровня тропонина-I с ростом и/или падением, результат выходит за верхнюю границу нормы хотя бы в одном измерении) в сочетании с доказательством ишемии миокарда (ЭКГ, ЭхоКГ). Однако повышение уровня тропонина-I не является специфичным только для острой ишемии миокарда с развитием инфаркта миокарда. Тропонин-I может повышаться у пациентов с застойной сердечной и почечной недостаточностью, кардиомиопатией. что подчеркивает важность серийного тестирования тропонина и оценки результатов обследования в соответствующем клиническом контексте.
• Рекомендуется однократное определение активности металлопротеиназы ADAMTS13 в плазме крови в острый период заболевания пациентам с ТМА для диагностики/исключения ТТП. [28, 38, 68].
(УУР С; УДД 5).
Комментарий: Активность металлопротеазы оценивается до плазмотерапии. Значения активности ADAMTS13>10% исключает ТТП [38, 60, 63]. При STEC-ГУС/аГУС активность металлопротеазы может быть как снижена, но выше 10%, так и быть в пределах референсного диапазона. Выраженность тромбоцитопении прямо коррелирует с показателем активности ADAMTS13, поэтому при стабильной тромбоцитопении не ниже 70 000/1 мкл активность металлопротеазы можно не определять [28, 38]. Количество тромбоцитов крови >30×109/л и концентрация креатинина >200 мкмоль/л у пациента с ТМА практически исключает диагноз ТТП [61].
• Рекомендовано определение антител к сFH в сыворотке крови всем пациентам с подозрением на аГУС с целью диагностики «аутоиммунной» формы заболевания [35, 38, 62, 63].
(УУР С; УДД 5).
Комментарий. Все пациенты с подозрением на аГУС должны быть обследованы на наличие антител к сFH в образцах крови, взятых до плазмаобмена или инфузии плазмы. Образование антиCFH-антител в 90% случаев связано с делецией сFHR3/CFHR1, что наиболее харатерно для детей, чем для взрослых (25-50% vs 5-10%). Своевременное выявление антиСFH-антител имеет важное значение для выбора тактики лечения, поскольку их высокий титр требует в дополнение к комплемент-блокирующей терапии назначение иммуносупрессантов. При подтверждении антительной формы аГУС, требуется контроль антиСFH-антител каждые 3-6 месяцев на фоне лечения в последующем до нормализации их уровня.
• Рекомендуется пациентам с ТМА при пневмонии /менингите/сепсисе для исключения/подтверждения pnГУС - Микробиологический посев крови на стерильность [60, 96, 70].
(УУР С; УДД 5).
• Рекомендуется Микробиологическое (культуральное) исследование мокроты на аэробные и факультативно-анаэробные микроорганизмы пациентам с ТМА на фоне бактериальной инфекции с поражением лёгких/развитием менингита, сепсиса для исключения/подтверждения pnГУС [60, 96].
(УУР С; УДД 5).
• Рекомендовано проведение молекулярно-биологического исследования методом ПЦР (кровь, плевральный экссудат, спинномозговая жидкость) на пневмококк (Молекулярно-биологическое исследование крови на пневмококк (Streptococcus pneumoniae) методом ПЦР, Определение ДНК пневмококка (Streptococcus pneumoniae) в крови методом ПЦР, Молекулярно-биологическое исследование спинномозговой жидкости на пневмококк (Streptococcus pneumoniae), Определение ДНК пневмококка (Streptococcus pneumoniae) в спинномозговой жидкости методом ПЦР) пациентам с ТМА на фоне бактериальной инфекции с поражением лёгких/развитием менингита, сепсиса для исключения/подтверждения pnГУС [38, 60, 70].
(УУР С; УДД 5).
Комментарий. Молекулярно-генетическое исследование (ПЦР) необходимо для подтверждения диагноза при выделении пневмококков из стерильных жидкостей организма (кровь, плевральный экссудат, спинномозговая жидкость). Данное исследование необходимо для подтверждения инвазивной пневмококковой инфекции как причины развития pnГУС.
Услуга «Молекулярно-биологическое исследование плевральной жидкости на пневмококк (Streptococcus pneumoniae) методом ПЦР» в настоящее время отсутствует в Номенклатуре.
Рекомендуется проведение реакции латекс-агглютинации пациентам с ТМА на фоне бактериальной инфекции с поражением лёгких/развитием менингита, сепсиса для исключения/подтверждения pnГУС [38, 53, 97] (УУР С; УДД 5).
Комментарий. Реакция латекс-агглютинация является методом экспресс-диагностики антигенов пневмококков в крови и ликворе при подозрении на инвазивные формы пневмококковой инфекции для исключения pnГУС.
• Рекомендуется детям школьного возраста с симптомокомплексом ТМА с целью исключения системных заболеваний Иммунологическое обследование для диагностики аутоиммунных заболеваний (Определение содержания антител к антигенам ядра клетки и ДНК, Определение содержания антител к ДНК нативной, Определение содержания антител к ДНК денатурированной, Определение содержания антинуклеарных антител к Sm-антигену, Комплекс исследований для диагностики системной красной волчанки (волчаночный антикоагулянт), Определение содержания антител к бета-2-гликопротеину в крови, Определение содержания антител к кардиолипину в крови) [60, 98].
(УУР С; УДД 5).
Комментарий. В первую очередь необходимо исключить СКВ и АФС. Сочетание клинико-лабораторных проявлений ТМА с наличием антифосфолипидных антител свидетельствует в пользу диагноза «катастрофический АФС», независимо от того, имеются ли у пациента или отсутствуют клинические и иммунологические признаки СКВ. Диагностика системной патологии у пациентов с ТМА необходима, поскольку выявленный спектр маркеров определяет терапевтическую тактику [60].
• Рекомендуется пациентам с ТМА при подозрении на генетически детерминированный дефицит кобаламина С (cblC). Исследование уровня гомоцистеина в крови, уровня витамина В12 в крови и фолиевой кислоты в крови с целью установления возможной причины ТМА и оценки необходимости дальнейшего молекулярно-генетического обследования [38, 57, 60, 99, 100, 101, 103].
(УУР С; УДД 4).
Комментарий: У пациентов с генетическими мутациями, приводящими к дефектному метаболизму кобаламина с (MUT, MMAA, MMAВ, ММАСНС, ММАDHC, MCEE), на фоне генетически детерминированного дефицита кобаламина С может развиваться cblC-ТМА. Выявление повышенного уровня гомоцистеина при нормальных уровнях витамина в12 и фолиевой кислоты является вероятным признаком диагноза сblC-ГУС [38, 57].
Гипергомоцистеинемия также может быть диагностирована при тромбофилии, обусловленной мутацией генов фолатного цикла, дефиците витамина В12 и фолиевой кислоты.
• Рекомендуется однократно пациентам с ТМА при длительной тромбоцитопении, подозрении на метилмалоновую ацидемию и мегалобластную анемию Определение уровня витамина В12 (цианокобаламин) в крови с целью установления возможной причины ТМА и оценки необходимости дальнейшего молекулярно-генетического обследования [99, 100].
(УУР С; УДД 5).
Комментарий. См клинические рекомендации по метилмалоновой ацидемии/ацидурии.
• Рекомендуется всем пациентам с ТМА младше 6 мес.и пациентам независимо от возраста при подозрении на метилмалоновую ацидемию с диагностической целью проведение :
- тандемной масс-спектрометрии, для определения содержания пропионилкарнитина (С3), свободного карнитина (С0) (Исследование уровня свободного L-карнитина методом тандемной масс-спектрометрии в крови),.
- количественного определения 3-гидроксипропионовой, метиллимонной, 3-гидрокси-n-валериановой кислот в моче (Комплексное определение содержания органических кислот в моче, Комплекс исследований для диагностики органических ацидурий)- количественного определения уровня аминокислот (глицин, лейцин, изолейцин, валин, треонин) в крови (Комплексное определение концентрации на аминокислоты и ацилкарнитины в крови, Комплексное определение концентрации на аминокислоты и ацилкарнитины в крови методом тандемной масс-спектрометрии) [63, 99, 100, 103].
(УУР С; УДД 4).
Комментарий. Тандемная масс-спектрометрия - метод исследования вещества, основанный на определении отношения массы вещества к заряду ионов. Позволяет определить состав смеси органических веществ качественно и количественно. Кровь (капиллярная/венозная) собирается на стандартную карточку-фильтр. Образец высушивается 2-3 часа при комнатной температуре (нагревать и подвергать образец прямому воздействию солнечных лучей недопустимо). Диагноз метилмалоновой ацидемии необходимо заподозрить при наличии мегалобластоза, повышении концентрации гомоцистеина и снижении метионина плазмы, повышении экскреции с мочой гомоцистеина и метилмалоновой кислоты. Проведение молекулярно-генетического исследования необходимо для подтверждения диагноза (мутации в генах MUT, MMAA, MMAВ ММАСНС, ММАDHC, MCEE) и проведения медико-генетического консультирования [104].
Следует учитывать, что аГУС у пациентов с комбинированными нарушениями процесса реметилирования может развиваться также у детей старше 6 месяцев и даже у взрослых, в связи с чем данные исследования могут проводиться по клинической потребности в других возрастных категориях пациентов.
Услуга «Исследование уровня пропионилкарнитина методом тандемной масс-спектрометрии в крови» в настоящее время отсутствует в Номенклатуре.
• Рекомендуется Определение общей гемолитической активности комплемента (СН50) только пациентам с аГУС при рецидивах и отсутствии эффекта от комплемент-блокирующей терапии (экулизумаб**) с целью оптимизации режима введения и дозировок экулизумаба**[26,60, 64].
(УУР С; УДД 5).
Комментарий: При СН50>30% у пациентов, получающих экулизумаб**, рекомендуется изменение интервала между инфузиями препарата или увеличение дозы препарата из-за неполной блокады комплемента [64]. До настоящего времени нет надежных биомаркеров, подтверждающих активность заболевания для диагностики аГУС, в том числе рецидива.
• Рекомендуется однократно пациентам с тромбоэмболией легочной артерии, инфарктом миокарда, геморрагическим инсультом и тромбозами другой локализации исследование полиморфных вариантов генов гемостаза и ферментов фолатного цикла, проведение диагностики тромбофилии с целью диагностики и назначения оптимальной терапии [30, 105, 106, 107].
(УУР С; УДД 4).
Комментарий. Могут проводиться - Исследование агрегации тромбоцитов, Исследование агрегации тромбоцитов с помощью агрегат-гемагглютинационной пробы, Определение активности фактора XI в сыворотке крови, Определение активности фактора X в сыворотке крови, Определение активности фактора IX в сыворотке крови, Определение активности фактора VIII в сыворотке крови, Определение активности фактора VII в сыворотке крови, Определение активности фактора V в сыворотке крови, Определение активности антитромбина III в крови, Исследование уровня протеина С в крови, Определение активности протеина S в крови, Определение содержания антител к кардиолипину в крови, Определение содержания антител к фосфолипидам в крови, Исследование уровня плазминогена в крови, Исследование плазминовой (фибринолитической) системы, Определение полиморфизма 675 4G/5G (инсерция гуанина в позиции 675) в гене ингибитора активатора плазминогена I типа (PAI-1) в зависимости от клинической ситуации.
• Рекомендуется всем пациентам (при наличии мочи) в остром периоде, периоде восстановленного диуреза и при купировании признаков ТМА - Общий (клинический) анализ мочи (обнаружение гемоглобина в моче, определение белка в моче, альбумина в моче, микроскопическое исследование осадка мочи) с целью диагностики протеинурии, гематурии и гемоглобинурии [63, 105].
(УУР С; УДД 5).
Комментарий. Частота исследований в динамике определяется клинической ситуацией. В общем анализе мочи при любой форме ТМА может выявляться протеинурия, гематурия. Также исследование проводится в процессе динамического наблюдения, после трансплантации почки, частота определяется индивидуально.
• Рекомендовано исследование альбумин/креатининового соотношения пациентам в острый период STEC-ГУС, аГУС и в период ремиссии при наличии белка в разовых порциях мочи для оценки гломерулярной фильтрации [96, 108].
(УУР С; УДД 4).
Комментарии. Исследование проводится в утренней порции мочи. Частота исследований в динамике определяется клинической ситуацией.
• Рекомендуется пациентам с признаками поражения ЖКТ без диареи и пациентам с диареей, гемоколитом для выявления STEC-инфекции Определение ДНК диарогенных эшерихий (ЕНЕС, ЕРЕС, ЕТЕС, EAgEC, EIEC) в образцах фекалий методом ПЦР ((Молекулярно-биологическое исследование фекалий на диарогенные эшерихии (ЕНЕС, ЕРЕС, ETEC, EAgEC, EIEC, Определение ДНК диарогенных эшерихий (ЕНЕС, ЕРЕС, ЕТЕС, EAgEC, EIEC) в образцах фекалий методом ПЦР, Комплекс исследований на диарогенный эшерихиоз, вызванный инфекцией Escherichia сoli (EPEC/ ETEC/ EIEC/ EHEC/EAgEC)) [86].
(УУР С; УДД 5).
Комментарий. Диарейный продром может быть при аГУС, поэтому всем пациентам показан комплекс исследований, рекомендованных при STEC-ГУС.
• Рекомендуется пациентам с признаками поражения ЖКТ без диареи и пациентам с диареей, гемоколитом для выявления STEC-инфекции Бактериологическое исследование кала для выявления STEC-инфекции: микробиологическое (культуральное) исследование фекалий/ректального мазка на диарогенные эшерихии (ЕНЕС, ЕРЕС, ETEC, EAgEC, EIEC) с определением чувствительности к антибактериальным препаратам [86].
(УУР С; УДД 5).
Комментарий. Диарейный продром может быть при аГУС, поэтому всем пациентам показан комплекс исследований, рекомендованных при STEC-ГУС.
• Рекомендуется пациентам с признаками поражения ЖКТ без диареи / с диареей, пациентам с катаральным синдромом в сочетании с диареей для диагностики комплемент-активирующего состояния при аГУС Диагностика вирусных диарей (ротавирус, реовирус, аденовирус, астровирус, вирус Норволк, аденовирус ) методом ПЦР (Определение РНК ротавирусов (Rotavirus gr.A) в образцах фекалий методом ПЦР, Определение РНК калицивирусов (норовирусов, саповирусов) (Caliciviridae (Norovirus, Sapovirus)) в образцах фекалий методом ПЦР, Определение РНК астровирусов (Astrovirus) в образцах фекалий методом ПЦР, Определение ДНК аденовирусов (Adenovirus) в образцах фекалий методом ПЦР, Определение РНК неполиомиелитных энтеровирусов (Enterovirus) в образцах спинномозговой жидкости методом ПЦР) [27, 109, 110, 111].
(УУР С; УДД 5).
Комментарий. Диарея может быть проявлением в том числе вирусной инфекции, поэтому всем пациентам с подозрением на аГУС показан комплекс исследований, рекомендованных при STEC-ГУС.
• Рекомендуется пациентам с признаками острой респираторной инфекции в продроме ТМА диагностика вирусных инфекций методом ПЦР, ИФА (грипп, аденовирус, ВПГ 1,2,6 типов, ВЭБ, ЦМВ, энтеровирус) с диагностической целью [63, 111].
(УУР С; УДД 5).
Комментарий. Определение РНК вируса гриппа A (Influenza virus А) в мазках со слизистой оболочки носоглотки методом ПЦР и/или Определение РНК вируса гриппа В (Influenza virus В) в мазках со слизистой оболочки носоглотки методом ПЦР и/или Определение РНК вируса гриппа С (Influenza virus С) в мазках со слизистой оболочки носоглотки методом ПЦР и/или Определение ДНК аденовируса (Human Adenovirus) в мазках со слизистой оболочки носоглотки методом ПЦР или Определение ДНК вируса герпеса 6 типа (HHV6) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование и/или Определение ДНК вируса герпеса 6 типа (HHV6) в мазках со слизистой оболочки ротоглотки методом ПЦР, количественное исследование и/или Молекулярно-биологическое исследование соскоба из носоглотки на вирус простого герпеса (Herpes simplex virus) и/или Определение ДНК вируса Эпштейна-Барр (Epstein - вarr virus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование и/или Определение ДНК вируса Эпштейна-Барр (Epstein - вarr virus) в мазках со слизистой оболочки ротоглотки методом ПЦР, количественное исследование и/или Определение ДНК цитомегаловируса (Cytomegalovirus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование и/или Определение ДНК цитомегаловируса (Cytomegalovirus) в мазках со слизистой оболочки ротоглотки методом ПЦР, количественное исследование.
Выбор исследования определяется эпидемиологической ситуацией и возможностями клиники.
(УУР С; УДД 5).
Комментарий. Частота исследований в динамике определяется клинической ситуацией. Наличие жалоб на одышку, боли в грудине, области сердца, при шумном дыхании, кашле, патологических выделениях при кашле (гнойная, кровянистая мокрота), сохраняющаяся высокая температура тела является показаниями к проведению данного исследования.
Может проводиться с теми же целями КТ органов грудной клетки при необходимости (недостаточность сведений при рентгенографии органов грудной клетки, сомнительные ситуации).
• Рекомендуется Ультразвуковое исследование органов брюшной полости (комплексное) всем пациентам с ТМА с целью скрининговой диагностики поражения полых и паренхиматозных органов и/или диагностики кишечной непроходимости и/или перфорации [105, 112, 113].
(УУР С; УДД 5).
Комментарий. Рекомендуемый метод исследования является скрининговым у пациентов как с признаками поражения ЖКТ, так и без них. Для пациентов с ГУС характерно поражение полых (в первую очередь - толстой кишки) и паренхиматозных (печень, поджелудочная железа, селезенка) органов. При гипергидратации определяются эхопризнаки свободной жидкости в брюшной полости (гидроперетонеум). Частота исследований в динамике определяется клинической ситуацией.
• Рекомендуется ультразвуковое исследование почек с дуплексной допплерографией, мочевого пузыря всем пациентам с ГУС с целью диагностики патологических изменений, контроля в динамике, в тч лечения [105].
(УУР С; УДД 5).
Комментарий. Частота исследований в динамике определяется клинической ситуацией. Ультразвуковое исследование почек позволяет установить их размеры, положение, особенности строения и другие параметры. Допплерографическое исследование оценивает состояние ренального кровоотока.
• Рекомендуется регистрация электрокардиограммы всем пациентам в острый период ТМА для регистрации электрической активности сердечной мышцы, диагностики нарушений сердечного ритма, выявления ишемии, гипертрофии желудочков, изменений метаболического характера (гиперкалиемия) [46, 105].
(УУР С; УДД 5).
Комментарий. Частота исследований в динамике определяется клинической ситуацией.
• Рекомендуется эхокардиография всем пациентам для оценки структуры, размеров и состояние сердечной мышцы, клапанов и сосудов (аорта, коронарные сосуды), глобальной сократимости миокарда [46].
(УУР С; УДД 5).
• Комментарий. При любой форме ГУС могут быть выявлены признаки объёмной перегрузки (гидроперикард), АГ и специфических поражений, обусловленных тромбозами мелких и интрамиокардиальных сосудов при ТМА. Пациенты с аГУС, имеющие мутации сFH/CFB/С3, анти-CFH-антитела подвержены риску развития сердечно-сосудистых осложнений [41, 46]. Частота исследований в динамике определяется клинической ситуацией.
• Рекомендуется. Фундоскопия всем пациентам с ТМА для диагностики пурчероподобной ретинопатии, а также при наличии артериальной гипертензии и признаков поражения ЦНС [98, 99].
(УУР С; УДД 5).
Комментарий. При ТМА может развиться одностороннее или билатеральное повреждение органа зрения с отеком ДЗН, интраретинальными кровоизлияниями, мягкими ватообразными экссудатами, макулярным отеком [49]. Частота исследований в динамике определяется клинической ситуацией.
Проводится также при рецидиве аГУС.
• Рекомендуется. МРТ головного мозга с ангиорежимом (без контрастирования) или КТ головного мозга (с внутривенным контрастированием) всем пациентам с признаками поражения ЦНС при любой форме ТМА с целью оценки степени изменений в структуре мозга, состояния и проходимости сосудов головного мозга [105, 114, 115].
(УУР С; УДД 5).
Комментарий. Магнитно-резонасная томография - более чувствительный метод для визуализации ишемических очагов при ТМА. МРТ головного мозга с ангиографическим режимом позволяет не только оценить состояние кровеносных сосудов, но и дать характеристику току крови в динамике у пациентов с эндотелиальной дисфункцией на фоне ТМА. Частота исследований в динамике определяется клинической ситуацией.
Следует избегать применение йодсодержащих контрастных веществ при нарушении функции почек.
При необходимости проводится наркоз.
• Рекомендовано. Проведение электроэнцефалографии детям с поражением ЦНС при ТМА с целью ранней диагностики отклонений электрической активности головного мозга и профилактики последующих осложнений [ 116 ].
(УУР С; УДД 4).
• Рекомендовано Исследование уровня буферных веществ в крови Исследование уровня водородных ионов (рН) крови всем пациентам с подозрением на ГУС и с установленным диагнозом ГУС в процессе терапии с целью диагностики нарушений кислотно-основного состояния [63, 105].
(УУР С; УДД 5).
(УУР С; УДД 5).
• При подозрении на атипичный ГУС и подготовке к трансплантации при любой форме ТМА, приведшей к ХБП 5, рекомендовано проведение молекулярно-генетического исследования методом секвенирования нового поколения (NGS) и секвенирования по Сэнгеру для идентификации генетических мутаций, ассоциированных с аГУС (CFH, MCP, сFI, с3, сFB, THBD, сFHR1, сFHR3, сFHR5). Для выявления делеций или дупликаций проводится мультиплексная зависимая от лигирования амплификация зонда (MLPA) [60].
(УУР С; УДД 5).
TEGb Комментарий: При выявлении методом NGS генотипа, свидетельствующего в пользу постановки диагноза, рекомендуется подтверждение генотипа максимально точным методом. К таким методам, признанным во всем мире, относится секвенирование по Сэнгеру, побуквенное чтение заданного участка ДНК длинной 500-1000 нуклеотидов. У пациентов с аГУС для постановки диагноза и принятия решения о тактике лечения идентификация мутаций факторов комплемента не требуется. Генетическое исследование необходимо для определения прогноза и длительности комплемент-блокирующей терапии (экулизумаб**). Следует помнить, что мутации генов регуляторных белков альтернативного пути активации комплемента выявляются не у всех пациентов с аГУС. Однако, отрицательный результат генетического скрининга у пациента с ТМА не исключает наличия аГУС. В настоящее время рекомендуется проведение генетического анализа даже при наличии антител к сFH. Если мутация идентифицируется у пациента с антителами к сFH, решение о дальнейшем лечении должно приниматься индивидуально в каждом случае, в зависимости от титра антител и функциональных последствий мутации. Кроме того, исследование необходимо провести всем пациентам, нуждающимся в трансплантации почки, независимо от формы ТМА; перед отменой терапии экулизумабом** и для диагностики редких форм ТМА (ADAMTS13, DGKE, INF 2, PLG, MUT, MMAA, MMAВ, ММАСНС, ММАDHC, MCEE). В случаях, если причина ТМА не установлена, рекомендуется секвенирование всего экзома для персонализированного лечения [35]. База данных вариантов генов доступна по ссылке: http://www.complement-db.org/home.php .
• Рекомендовано рассмотреть проведение Нефробиопсии (биопсия почки, биопсия почки под контролем ультразвукового исследования) с целью подтверждения диагноза ТМА в сомнительных и неясных ситуациях [119].
(УУР С; УДД 5).
Комментарий. Биопсия почки не является обязательной для диагностики той или иной формы ТМА. При проведении нефробиопсии у пациентов с ТМА существует высокий риск кровотечения из-за наличия АГ, тромбоцитопении и уремии. Однако биопсия почки может подтвердить диагноз ТМА в сомнительных и неясных ситуациях: сомнений в диагнозе ГУС, массивной протеинурии у пациентов с анемией и тромбоцитопенией, отсутствие полного лабораторного симптомокомплекса ТМА (чаще всего тромбоцитопении), купирование гематологических проявлений ТМА на фоне сохраняющегося снижения функций почек, подозрения на вторичные формы ТМА, неэффективности экулизумаба.
Дифференциальная диагностика типичного ГУС.
• Рекомендовано проведение дифференциальной диагностики типичного ГУС (STEC-ГУС) с заболеваниями со сходной симптоматикой с целью установления диагноза и выбора оптимальной тактики терапии [119].
(УУР С; УДД 5).
Комментарии:
• Атипичный ГУС;
• ТТП;
• Гемолитические анемии;
• Мультисистемный воспалительный синдром у детей, ассоциированный с SARS-CoV-2;
• ГУС, ассоциированный с дефектным метаболизмом кобаламина (сblC-ГУС);
• Сепсис.
Дифференциальная диагностика атипичного ГУС.
Рекомендовано проводить дифференциальную диагностику аГУС с заболеваниями, имеющими сходную симптоматику с целью установления точного диагноза и выбора оптимальной тактики терапии [119].
(УУР С; УДД 5).
Комментарии:
• STEC-ГУС;
• ТТП;
• Пневмококк-ассоциированный ГУС;
• Мультисистемный воспалительный синдром у детей, ассоциированный с SARS-CoV-2;
• Гемолитические анемии;
• Пароксизмальная ночная гемоглобинурия;
• Мегалобластная анемия;
• Синдром Эванса;
• Гемобластоз;
• Гемофагоцитраный лимфогистиоцитоз;
• Острый тубулоинтерстициальный нефрит;
• Вторичные формы ТМА (СКВ, АФС, системная склеродермия, злокачественная гипертензия, лекарственно-ассоциированная ТМА );
• Редкие формы ГУС (DGKE, сblC-ГУС);
• Сепсис.
В случае развития ТМА при наличии симптомов со стороны ЖКТ вначале показан скрининг на STEC-ГУС, далее рекомендовано верифицировать STEC-ГУС после исключения ТТП и «отсутствия подозрения на аГУС». Диагноз STEC-ГУС не может быть исключен только на основании отрицательных результатов инфекционного поиска. Рекомендовано считать отрицательный результат скрининга на STEC-ГУС достоверным, только в случае, если анализ собран до начала антибактериальной терапии. В случаях проведения антибактериальной терапии частота выделения из стула ДНК EHEC методом ПЦР существенно выше в первые 6 дней диареи. Течение с поражением других органов и систем помимо почек во многом определяет исход и прогноз [30, 40, 42, 47]. Для STEC-ГУС не является характерным «волнообразное» (повторные эпизоды гемолиза и потребления тромбоцитов) и рецидивирующее течение ТМА [2, 4, 5, 8, 10, 18, 27].
Исходя из определения аГУС, для постановки его диагноза у ребенка должны быть исключены прочие причины развития ТМА, в первую очередь - STEC-ГУС. В ряде случаев в дебюте аГУС также отмечается диарея или поражение дыхательных путей, поэтому необходимо своевременное исключение STEC-инфекции, равно как и инфекции Streptococcus pneumonia [28, 34, 35, 38, 60]. Кроме этого, следует исключить системную патологию, мультисистемный воспалительный синдром, ассоциированный с SARS-CoV-2, инфекции (ВИЧ, H1N1), предшествующую злокачественную артериальную гипертензию, HELLP-синдром у рожениц, прием лекарств (циклоспорин**, такролимус** ), метилмалоновую ацидемию как возможные причины ТМА (Приложение 1).
Для исключения ТТП необходимо исследование активности ADAMTS13 - естественного регулятора микротромбообразования, ответственного за инактивацию фактора фон Виллебранда у всех пациентов с картиной ТМА, выраженный дефицит которого (ADAMTS13 <10% от нормы) приводит к развитию ТТП. При STEC-ГУС, аГУС и других ТМА активность ADAMTS13 может быть снижена, однако ее показатель всегда превышает 10%. Клинически ТТП и ГУС имеют много сходного. ТТП следует подозревать у пациентов с тяжелой стойкой тромбоцитопенией (<30000/мкл) и легкой формой ОПП или без нее [35, 38]. Однако тяжелая ОПП встречается у 10-12% пациентов с идиопатической ТТП [65]. У детей ТТП может носить как врожденный характер вследствие дефицита ADAMTS13, так и приобретенный - в результате выработки антиADAMTS13 антител. Врожденная TTП (синдром Апшоу-Шульман) имеет различный фенотип и может проявляться у новорожденных с MAГА и желтухой или у детей с необъяснимой тромбоцитопенией. Данная форма ТТП характеризуется активностью ADAMTS13 <5%, отсутствием антител к ADAMTS13 и гомозиготной / гетерозиготной мутацией в ADAMTS13 [120]. Для ТТП характерно превалирование неврологической симптоматики при умеренном нарушении функции почек [4, 24, 25, 35, 37].
Необходимо исследование уровня антиCFH-антител, которые повышаются при антитело-опосредованной форме аГУС [35, 38]. Аутоиммунная» форма аГУС в основном встречается у детей в возрасте от 5 до 15 лет. Действие анти-CFH-антител, как и мутаций сFH, приводит к избыточной активации альтернативного пути комплемента. Выработка антител к сFH связана с дефицитом сFH-связанных белков 1 и 3 (CFHR1, сFHR3). Установлено, что у 90% больных с антительной формой ГУС определяется гомозиготная делеция в генах сFHR1 - 3 . Если возраст пациента на момент дебюта заболевания <3 лет или проводился плазмаобмен перед скринингом, только обнаружение делеции помогает подтвердить опосредованное антителами заболевание у пациентов с низкими титрами аутоантител к сFH. Учитывая терапевтическое значение, необходимо проводить скрининг антител к СFH у всех пациентов с aГУС.
Поскольку многие мутации скорее ведут к нарушению функции белков системы комплемента, нежели к изменению их плазматической концентрации, уровень сFH, сFI, с3 и сFB может оставаться нормальным даже при наличии мутаций. Сам же молекулярно-генетический анализ требует значительного времени и получение его результатов в острой фазе заболевания практически нереально. Поэтому для диагностики аГУС и назначения лечения генетическое исследование значения не имеет. Вместе с тем, генетический скрининг необходим в процессе наблюдения за пациентами для определения стратегии их долгосрочной терапии [35, 59, 60, 62].
Мультисистемный воспалительный синдром у детей, ассоциированный с SARS-CoV-2, является критической формой сOVID-19. При данном синдроме развивается вирус-индуцированный вторичный гемофагоцитарный синдром (цитокиновый шторм), проявляющийся неконтролируемой активацией иммунной системы с высвобождением провоспалительных цитокинов (ФНО-альфа, ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-8, ИЛ-10, гранулоцитарный колоний-стимулирующий фактор, моноцитарный хемоаттрактивный протеин 1) и маркеров воспаления (СРБ, сывороточный ферритин), что может приводить к развитию острого респираторного дистресс-синдрома, полиорганной недостаточности и может быть причиной гибели пациента. Мультисистемный воспалительный синдром нередко развивается в поздние сроки болезни. Положительный ПЦР на SARS-CoV-2 определяется не у всех пациентов с мультисистемным воспалительным синдромом, однако почти у всех можно выявить антитела к возбудителю сOVID-19. Основными клиническими проявлениями мультисистемного воспалительного синдрома у детей являются персистирующая лихорадка и системное воспаление с вовлечением в патологический процесс различных органов и систем - системы крови, сердечно-сосудистой и нервной систем, ЖКТ, почек, кожи. Имеются данные, свидетельствующие о том, что при болезни сOVID-19 ТМА, связанная с нарушением регуляции комплемента, является одним из важных патофизиологических механизмов в дополнение к тромбовоспалению или как его часть [121, 122, 123]. В совокупности коагулопатия, связанная с сOVID-19, по-видимому, представляет собой сложный патологический процесс, вызванный каскадом тромбовоспаления, эндотелиального повреждения и активацией комплемента, что приводит к ТМА.
У детей в круг дифференциально-диагностического поиска, кроме STEC-ГУС, аГУС и ТТП, следует включать метилмалоновую ацидемию (дефектный метаболизм кобаламина) и ГУС, ассоциированный с пневмококком, продуцирующим нейраминидазу. Таким образом, при диагностике ГУС первоначально необходимо установить наличие ТМА, в последующем - провести дифференциальную диагностику между первичными и вторичными ТМА.
Критерии диагностики типичного гемолитико-уретического синдрома ( STEC-ГУС):
При развитии симптомов ТМА на фоне симптомов со стороны ЖКТ (диарея и/или тошнота/рвота и/или боли в животе и/или гастроэнтерит) необходимо исключить STEC-ГУС. Он устанавливается на основании характерной клинической картины с диарейным продромом и должен быть подтвержден лабораторными данными, исключающими другие ТМА. Диагностика ТМА основана на наличии МАГА и тромбоцитопении в сочетании с признаками поражения почек и/или экстраренальными проявлениями [1, 4, 18, 25, 27, 28].
Наличие МАГА устанавливают на основании выявления у пациентов Кумбс-негативной анемии, шизоцитов - фрагментированных эритроцитов в мазке периферической крови (диагностически значимое их содержание для ТМА >1%), повышения лактатдегидрогеназы (ЛДГ), снижения гаптоглобина. Гипербилирубинемия (за счет повышения непрямой фракции), свободный гемоглобин, ретикулоцитоз также являются неспецифическими индикаторами гемолиза эритроцитов.
Тромбоцитопению диагностируют при количестве тромбоцитов <150000/мм3. Если число тромбоцитов превышает это значение, то об их потреблении можно судить по снижению количества тромбоцитов >25% от базального уровня (если он известен). В мазках периферической крови можно обнаружить гигантские тромбоциты, при трепанобиопсии костного мозга - нормальное количество мегакариоцитов.
У пациентов с МАГА и тромбоцитопенией наличие ОПП, изолированного или в сочетании с симптомами поражения ЖКТ, ЦНС, легких, сердца служит основанием для диагностики ТМА.
Течение STEC-ГУС с поражением других органов и систем помимо почек во многом определяет прогноз и исход. Экстраренальные проявления болезни могут быть связаны с электролитными расстройствами, метаболическими нарушениями, гипергидратацией, интоксикацией, системной воспалительной реакцией, а в ряде случаев - с развитием ТМА.
В случае констатации ТМА диагноз STEC-ГУС можно верифицировать, только исключив аГУС и ТТП. Скрининг на STEC-ГУС показан при наличии симптомов со стороны ЖКТ. Известно, что у 5-10% пациентов может не быть предшествующей диареи в анамнезе, что подчеркивает важность микробиологического исследования всех пациентов с ТМА независимо от истории заболевания. Лабораторные исследования следует выполнять в первые сутки госпитализации пациента в стационар до начала антибактериальной терапии. Диагноз STEC-ГУС может быть отвергнут на основании исключения наличия Stx в крови и стуле. Для исключения STEC-ГУС показаны:
• посев кала для выявления культуры STEC (на среду Mac сonkey для E.coli O157:H7).
• индикация и выделение из клинического материала (кал/ректальный мазок) штаммов энтерогеморрагических E.coli методом ПЦР.
• определение Stx в сыворотке крови.
• определение в сыворотке крови антител к липополисахариду наиболее распространенного в данном регионе серотипа E.coli.
ПЦР-анализ первичных фекальных культур является наиболее чувствительным и специфическим исследованием для скрининга организмов, продуцирующих токсины Отрицательный результат скрининга при подозрении на STEC-ГУС достоверен, если анализ собран до начала антибактериальной терапии. В случаях проведения антибактериальной терапии частота выделения из стула ДНК EHEC методом ПЦР существенно выше только в первые 6 дней диареи. Таким образом, определение шига-токсина в кале/ректальном мазке методом ПЦР в более поздние сроки представляется нецелесообразным.
Перспективным является внедрение в рутинную практику выявление и идентификация генов вирулентности ЕНЕС (rfbO157 - липополисахорид О157, eae - фактор адгезии интимин, Stx1,2 - шига-токсин типа 1,2) с помощью мультиплексной ПЦР.
Присутствие сывороточных антител IgM против специфического липополисахарида E.coli служит важным доказательством недавно перенесенной инфекции STEC (метод ELISA, анализа пассивной гемагглютинации) [38].
STEC-ГУС всегда развивается остро. Волнообразное, рецидивирующее течение не характерно для данной формы ТМА. После первоначального падения гемоглобина и тромбоцитов постепенно их уровень нарастает, хотя признаки почечного повреждения могут сохраняться еще длительное время.
Критерии, позволяющие заподозрить/установить диагноз STEC -ГУС:
• Отсутствие семейного анамнеза.
• Возраст дебюта ГУС: 6 мес.-5 лет.
• Развитие ГУС на фоне кишечной инфекции (признаки поражения ЖКТ, диарея, гемоколит).
• Развитие ГУС во время вспышки инфекции STEC.
• МАГА: снижение гемоглобина, шизоцитоз >1%, ретикулоцитоз, проба Кумбса отрицательная, повышение ЛДГ, снижение концентрации гаптоглобина.
• Потребление тромбоцитов: тромбоциты ˂150000/мм2 или число тромбоцитов уменьшено ˃25%, не выходя за границы нормы.
• Органная дисфункция: поражение почек, сердечно-сосудистой системы, легких, ЖКТ, органа зрения.
• Положительный результат посева кала или наличие Escherichia coli/Shigella dysenteriae type1 в культуре фекалий методом ПЦР.
• Активность ADAMTS13>10%.
• Нет изменений содержания ацилкарнитинов по данным тандемной масс-спектрометрии.
• Безрецидивное течение.
Критерии диагностики атипичного гемолитико-уремического синдрома:
До настоящего времени специфические диагностические маркеры аГУС отсутствуют. Диагноз «аГУС» - это диагноз исключения. Он устанавливается на основании совокупности данных: анамнеза, наличия/отсутствия триггерного события, характерной триады ТМА и должен быть подтвержден лабораторными данными, исключающими другие формы ТМА.Течение аГУС часто ассоциируется сочетанием ОПП с экстраренальными проявлениями. Клиническая настороженность в отношении аГУС необходима при наличии симптомокомплекса гастроэнтероколита у детей в возрасте worse 6 мес., указаний на ранее необъяснимую анемию, стертое начало или относительно постепенное начало со снижением почечной функции в течение нескольких дней, волнообразное течения с повторными падениями уровня гемоглобина и тромбоцитов, подозрения на ранее перенесенный ГУС, семейных случаев ГУС в различное время.
В случае развития ТМА диагноз аГУС можно верифицировать, только исключив другие формы первичных и вторичных ТМА: STEC-ГУС, ТТП, пневмококк-ассоциированный ГУС и ГУС, обусловленный дефектным метаболизмом кобаламина, , на фоне метилмалоновой ацидемии.
Диагноз STEC-ГУС может быть отвергнут на основании исключения наличия Stx в крови и стуле, диагностики вирусной этиологии диареи.
Для исключения ТТП всем пациентам с ТМА необходимо определение активности металлопротеазы ADAMTS13. Исследование активности ADAMTS13 следует выполнять до начала плазмотерапии. Активность ADAMTS13 в норме составляет 80-110%. Снижение её до <10% свидетельствует в пользу ТТП, что требует в последующем в крови анти-ADAMTS13-антител для верификации генетической или аутоиммунной формы заболевания для выбора тактики лечения. У пациентов с аГУС активность ADAMTS13 может быть снижена, однако её показатель всегда превышает 10%. Снижение активности ADAMTS13, помимо аГУС, может наблюдаться при системных заболеваниях (катастрофический АФС, СКВ), сепсисе, ДВС-синдроме. В случаях невозможности немедленного исследования активности ADAMTS13 у пациента с ТМА и крайней тяжестью состояния, обусловливающей угрозу жизни или высокий риск тяжелых почечных и/или внепочечных осложнений, следует использовать правило, в соответствии с которым значения креатинина сыворотки >150-200 мкмоль/л (1,7-2,3мг/дл) в сочетании с числом тромбоцитов >30000/1 мкл практически исключают диагноз ТТП. Поскольку выраженность тромбоцитопении прямо коррелирует с показателем активности ADAMTS13, в последнее время появились сведения о том, что при стабильной умеренной тромбоцитопении не ниже 70000/1 мкл активность металлопротеазы можно не определять [28, 38].
У детей с клинико-лабораторными признаками ТМА также следует проводить дифференциальную диагностику между аГУС, ГУС, ассоциированным с Streptococcus pneumoniae и ГУС, ассоциированным с дефектным метаболизмом кобаламина у детей, с метилмалоновой ацидурией.
ГУС, ассоциированный с Streptococcus pneumoniae (pnГУС), наиболее часто встречается у детей младше 2 лет и составляет около 5% всех случаев ГУС в педиатрической практике. На фоне инвазивной пневмококковой инфекции ГУС развивается в 0,4-0,6% случаев. Несмотря на то, что вакцинация от пневмококковой инфекции изменила «микробный пейзаж», но pnГУС не стал еще более редким. В 72% случаев pnГУС развивается на фоне пневмонии и/или эмпиемы плевры, в 23% - менингита и в 5% - пневмококкового сепсиса [53]. Ранее считалось, что основную роль в патогенезе pnГУС играет антиген Томсена-Фриденрейха (ТF-антиген), локализованный на поверхности эритроцитов, тромбоцитов, эндотелиалиальных клеток и клеток клубочков и покрытый сиаловыми кислотами. Предполагалось, что нейраминидаза А пневмококка разрушает N-ацетил-нейраминовую кислоту поверхности клеток, обнажая ТF-антиген, который атакуют циркулирующие IgM, обуславливая гемолиз, повреждение эндотелиальных клеток и агрегацию тромбоцитов [8]. Однако, в настоящее время доказано, что pnГУС может быть связан с потреблением комплемента на ранней стадии заболевания через альтернативный путь его активации. При десиалировании фактор сFH не может связываться с С3-конвертазой на поверхности клетки, что приводит к активному образованию МАК [54]. Пневмококки эффективно связывают PLG человека через поверхностные белки бактерий Tuf и PspC. При активации плазмина на бактериальной поверхности активная протеаза повреждает эндотелиальные клетки, вызывает ретракцию эндотелия и обнажение матрикса, нарушая местный гомеостаз и способствуя развитию тромбогенного состояния.
Таким образом, связь между десиалированием мембраны и нерегулируемой активацией комплемента возможна без взаимодействия TF-антигена и анти-TF антител [53, 54]. Отсутствие агглютинации эритроцитов при 37°C также свидетельствует против роли анти-TF антител. Кроме того, установлено, что связывание антител к TF значимо выше при температуре ниже 4°C и незначительно при 37°C, что еще раз подтверждает несостоятельность ранее представленной патогенетической модели заболевания в естественных условиях [54]. Развивается pnГУС 3-13 день течения инвазивной пневмококковой инфекции. Диагностическими особенностями pnГУС являются: развитие ОПП, тромбоцитопении и МАГА с положительной прямой пробой Кумбса (60-90%) при отсутствии лабораторных доказательств ДВС-синдрома [1, 8, 28, 38, 55]. Для пациентов с pnГУС характерным является: длительная олигурия, развитие ОПП у всех пациентов с потребностью в ЗПТ в 40-80% случаев, а также наличие экстраренальных проявлений (молниеносная пурпура, панкреатит, холецистит, тромбозы, кардиопатия, глухота) [1, 35].
ГУС, ассоциированный с дефектным метаболизмом кобаламина (сblC-ГУС) - моногенное аутосомно-рецессивное заболевание. Известно 37 случаев ГУС, обусловленного дефектным метаболизмом кобаламина (сblC-ГУС) с манифестацией в возрасте до 1 годав 17 наблюдениях. Данная форма - редкий случай ТМА в детском возрасте, причиной которой является генетическое орфанное заболевание - метилмалоновая ацидемия. Дебют заболевания в 5% случаев у детей ≤1 года, в 25% - старше 1 года. Выделяют 2 формы заболевания: с ранним (<1 год) и поздним началом (1 год) [38, 57]. Особенностями течения сblC-ГУС у детей с ранним началом являются: трудности вскармливания (рвота, срыгивания, отказ от еды), развитие гипотрофии, поражение ЦНС (мышечная гипотония, летаргия, задержка развития, судороги, микроцефалия/гидроцефалия), нарушение зрения (пигментная ретинопатия/нистагм), тяжелая артериальная гипертензия. Летальный исход практически запрограммирован у 100% детей без лечения. При поздней манифестации сblC-ГУС характерно развитие легочной гипертензии (40%), поражение ЦНС (когнитивные нарушения, атаксия, судороги, миелопатия) и тяжелая гипертензия [1, 58].
Диагностика сblC-ГУС основывается на выявлении МАГА, макроцитоза, ретикулоцитоза <3‰, тромбоцитопении с/без лейкопенией и нейтропенией, протеинурии с/без нефротического синдрома, гематурии, ОПП, прогрессирующей ХБП, тяжелого метаболического ацидоза с положительным анионным интервалом, гипергомоцистинемии, повышение уровня метилмалоновой кислоты в крови/моче (газовая хроматография), повышение уровня метилмалонилкарнитина и пропионилкарнитина (тандемная масс-спектрометрия) в крови, патологических мутаций в генах MUT, MMAA, MMAB, ММАСНС, ММАDHC, MCEE [1, 59].
Исключение STEC-ГУС, ТТП, pnГУС и сblC-ГУС у пациента с не вызывающей сомнений ТМА позволяет диагностировать аГУС. Кроме того, необходимо помнить, что в 20% случаев диагностируются неполные формы аГУС в виде диады симптомов вместо триады: сочетание МАГА с ОПП или тромбоцитопении с ОПП. Также и экстраренальные проявления аГУС могут отмечаться без лабораторных признаков ТМА у пациентов с уже установленным диагнозом [60].
Критерии, позволяющие заподозрить аГУС:
• Возраст <6 мес. >5 лет.
• У младенца ˂6 мес. негативный тест на присутствие метилмалоновой кислоты в моче, нормальный уровень метилмалонилкарнитина и пропионилкарнитина в крови по данным тандемной масс-спектрометрии.
• Дебют ТМА без диарейного продрома, пневмококковой инфекции.
• Относительно постепенное начало на фоне гастроэнтероколита (возможен гемоколит) со снижением почечной функции в течение нескольких дней.
• Возможна положительная семейная история.
• Симптомы сильной усталости, задержка развития.
• Эпизоды неврологических нарушений (очаговые симптомы, спутанность сознания ) при активности ADAMTS13 >10%.
• Признаки/симптомы заболеваний других органов (инфаркт миокарда, кардиомиопатия, боли в груди, одышка, дыхательная недостаточность, панкреатит, гепатит, колит ).
• Ранее имевшиеся эпизоды ТМА/ГУС.
• МАГА: снижение гемоглобина, шизоцитоз >1%, ретикулоцитоз, проба Кумбса отрицательная, повышение ЛДГ, снижение концентрации гаптоглобина.
• Потребление тромбоцитов: тромбоциты ˂150000/мм2 или число тромбоцитов уменьшено ˃25% от исходного, не выходя за границы нормы.
• Органная дисфункция: поражение почек, сердечно-сосудистой системы, легких, желудочно-кишечного тракта, органа зрения.
• Развитие нефротического синдрома при отсутствии ОПП на фоне ТМА.
• ОПП без снижения диуреза.
• При диарейном продроме отрицательный результат Escherichia coli / Shigella dysenteriae type1 в культуре фекалий методом ПЦР.
• Активность ADAMTS13>10%.
• ТМА с развитием ОПП и экстраренальных проявлений при условии, что последние не связаны с объемной перегрузкой.
• Отсутствие обратного развития ТМА на фоне плазмотерапии.
• Отсутствие признаков СКВ, АФС, эндотелиотоксичности лекарств.
Критерии, подтверждающие диагноз аГУС:
• Отягощенный семейный анамнез: случаи аГУС в семье.
• Развитие ТМА после вакцинации, ОРЗ, травмы и без триггерного события.
• Развитие ТМА у пациентов при диарейном продроме с отрицательным результатом Escherichia coli / Shigella dysenteriae type1 в культуре фекалий методом ПЦР (исследование проводится до назначения антибиотиков).
• Повторные эпизоды гемолиза и потребления тромбоцитов в период манифестации заболевания.
• Появление экстраренальных симптомов при разрешающейся ТМА.
• Рецидивы, разделенные периодами ремиссии и прогрессированием до ХБП 5.
• Патогенные мутации генов, кодирующих белки комплемента, описанные при аГУС.
• Положительный клинико-лабораторный эффект комплемент-блокирующей терапии (экулизумаб**).
Отсутствие патогенных мутаций генов, кодирующих белки комплемента не препятствует диагностике аГУС из-за возможности вариантов в генах, отличных от классических генов аГУС и вариантов, которые можно пропустить при высокопроизводительном секвенировании (например, большие геномные перестройки или интронные варианты, не охваченные традиционным панельным тестированием).
2,1 Жалобы и анамнез.
При осмотре пациентов с подозрением на типичный/атипичный ГУС необходимо обратить внимание на следующие жалобы:• Слабость, вялость, быстрая утомляемость, отсутствие аппетита, головокружение.
• Тошнота, рвота, боли в животе, частый жидкий стул.
• Периферические отеки, уменьшение объема отделяемой мочи, изменение цвета мочи.
• Одышка.
• Геморрагический синдром: геморрагические сыпь на коже, кровотечения.
• Головные боли, психомоторное возбуждение, спутанность сознания, судороги,.
• Нарушение зрения разной степени выраженности.
При сборе анамнеза у пациентов с подозрением на типичный/атипичный ГУС обратить внимание на следующую информацию :
• Случаи ТМА в семье.
• Ранее имевшиеся эпизоды ТМА.
• Развитие ТМА после ОКИ (E.coli, S, dysenteriae type 1), пневмококковой инфекции, вакцинации, ОРЗ, ОРВИ с кишечным синдромом, травмы и без триггерного события [38, 66].
2,2 Физикальное обследование.
• Рекомендуется, наряду со стандартным физикальным осмотром пациентам оценить состояние водного баланса организма, измерять артериальное давление, контролировать состояние дыхательной и сердечной функции. Провести визуальную оценку мочи (при ее наличии) на предмет макрогематурии [67].(УУР С, УДД 5).
Комментарии. Основной целью осмотра является обнаружение признаков поражения почек и экстраренальных проявлений.
2,3 Лабораторные диагностические исследования.
Обследование пациентов с признаками ТМА:Рекомендуется всем пациентам Исследование уровня буферных веществ в крови, водородных ионов (рН) крови с целью диагностики нарушений кислотно-основного состояния крови, контроля в динамике, в тч лечения [68].
(УУР С; УДД 5).
Комментарий. Частота исследований в динамике определяется клинической ситуацией. Декомпенсированный метаболический ацидоз является показанием для старта ЗПТ, независимо от уровня азотемии. Выявление тяжелого метаболического ацидоза с положительным анионным интервалом может позволить заподозрить сblC-ГУС.
• Рекомендуется всем пациентам проведение Общего (клинического) анализа крови развернутого с исследованием фрагментированных эритроцитов (шизоцитов) по мазку крови, подсчетом ретикулоцитов с целью диагностики, контроля в динамике, в тч лечения, в остром периоде любой формы ТМА, а также при рецидиве аГУС [8, 63, 69, 70].
(УУР С; УДД 5).
Комментарий. Частота исследований в динамике определяется клинической ситуацией. У пациентов с ГУС определяется снижение гемоглобина, ретикулоцитоз, шизоцитоз ≥1%. При STEC-ГУС выявляется лейкоцитоз со сдвигом лейкоцитарной формулы влево, повышение СОЭ.
Международный Совет по Стандартизации в Гематологии (ICSH) разработал рекомендации по идентификации шизоцитов. Фрагментированные эритроциты в мазке крови - это фрагменты эритроцитов в виде полумесяца, шляпы наполеона, шлема (каски), треугольника, с двумя-тремя острыми выступами и маленького неправильной формы фрагмента, имеющего линию разлома. Было также предложено шизоцитами считать микросфероциты при наличии в мазке крови шизоцитов другой формы [52].
Обязательным является оптический контроль тромбоцитов (по Фонио), так как при подсчете на автоматическом гематологическом анализаторе распавшиеся эритроциты идентифицируются как тромбоциты, завышая количество последних в конечном результате анализа. При несоответствии уровня тромбоцитопении тяжести ТМА следует исключить лекарственно-индуцированную тромбоцитопению (вальпроевая кислота** (и препараты на ее основе), Цефоперазон+сульбактам**, гидрохлоротиазид** .
• Рекомендуется всем пациентам однократно для установления природы гемолиза Прямой антиглобулиновый тест (прямая проба Кумбса) и Непрямой антиглобулиновый тест (тест Кумбса) [68, 71, 72].
(УУР С; УДД 4).
Комментарий. Для STEC-ГУС, аГУС, ТТП, сblC-ГУС, вторичных форм ТМА характерна Кумбс-негативная анемия, при pnГУС - проба Кумбса положительная у 60-90% пациентов. При проведении непрямой пробы Кумбса оценивается наличие антиэритроцитарных антител, которые содержатся в свободном виде в плазме крови. Для исключения аутоиммунного характера гемолитической анемии необходимо проведение прямой пробы Кумбса, при которой определяются антиэритроцитарные антитела / компоненты комплемента, зафиксированные на поверхности эритроцитов крови. При положительной прямой пробе Кумбса необходимо исключать аутоиммунную гемолитическую анемию, синдром Фишера-Эванса. Также надо учитывать, что возможными причинами положительного результата пробы Кумбса может быть переливание крови без предварительного типирования (посттрансфузионная гемолитическая реакция), СКВ, лимфома, инфекционный мононуклеоз, микоплазменная инфекция, гемолитическая реакция вследствие применения лекарств (цефалоспорины, аналоги пурина, метилдопа**).
• Рекомендуется всем пациентам при поступлении, в случае коррекции анемии эритроцитарной взвесью и необходимостью хирургического вмешательства Определение основных групп по системе AB0, Определение антигена D системы Резус (резус-фактор)с целью предотвращения реакции гемагглютинации [67].
(УУР С; УДД 5).
• Рекомендовано всем пациентам проведение анализа крови биохимического общетерапевтического (Исследование уровня креатинина в крови (с расчетом скорости клубочковой фильтрации) (Исследование функции нефронов по клиренсу креатинина (проба Реберга)1), Исследование уровня мочевины в крови, Исследование уровня мочевой кислоты в крови, Определение активности лактатдегидрогеназы в крови, Исследование уровня общего белка в крови, Исследование уровня альбумина в крови, Исследование уровня билирубина связанного (конъюгированного) в крови, Исследование уровня билирубина свободного (неконъюгированного) в крови, Определение активности аспартатаминотрансферазы в крови, Определение активности аланинаминотрансферазы в крови, Определение активности щелочной фосфатазы в крови, Исследование уровня натрия в крови, Исследование уровня калия в крови, Исследование уровня общего кальция в крови, Исследование уровня неорганического фосфора в крови, Исследование уровня хлоридов в крови, Исследование уровня железа сыворотки крови, исследование уровня глюкозы в крови, определение активности амилазы в крови), определение активности липазы в сыворотке крови, уровня ферритина в крови, Исследование уровня С-реактивного белка в сыворотке крови, креатинфосфокиназы и КФК-МВ (Определение активности креатинкиназы в крови, Исследование уровня/активности изоферментов креатинкиназы в крови)) с целью диагностики и контроля в динамике, в процессе лечения [68, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85].
(УУР С; УДД 5).
Комментарий. Проводятся всем пациентам с целью диагностики, контроля в динамике, в тч лечения, в острый период заболевания и в период обострения аГУС. Частота исследований в динамике определяется клинической ситуацией.
При развитии ОПП повышается уровень мочевины и креатинина, возможны электролитные нарушения (гипонатриемия, гиперкалиемия, гиперфосфатемия, гипокальциемия). Показанием для инициации ЗПТ является гиперкалиемия >7,5 ммоль/л, независимо от выраженности азотемии. Уровень общего белка и альбумина могут быть несколько снижены. Возможно повышение мочевой кислоты у пациентов с ОПП из-за сниженной ее экскреции. Гиперурикемия также может сопровождать неопластические заболевания кроветворной и лимфатической системы, что требует у ряда пациентов с анемией и тромбоцитопенией проведения трепанобиопсии костного мозга. Гипербилирубинемия как маркер гемолиза не всегда диагностируется у пациентов с ТМА. Возможно повышение трансаминаз.
Маркерами гемолиза также может быть повышение сывороточного железа, ферритина. Однако при сочетании гиперферритинемии (≥500 мкг/л) с гепатоспленомегалией, цитопенией крови ≥2 из 3 линий гемопоэза, гипертриглицеридемией и/или гипофибриногенемией необходимо проведение трепанобиопсии костного мозга для исключения гемофагоцитарного синдрома. У пациентов с ТМА всегда повышена активность ЛДГ. Динамика активности ЛДГ в крови позволяет ориентировочно оценивать уровень активности гемолиза. В норме в сыворотке крови все фракции фермента определяются с небольшой активностью в составе суммарного показателя - общей ЛДГ.
Повышение ЛДГ в сыворотке крови - индикатор практически любого повреждения клеток, в которых локализован фермент (в клетках печени, сердца, почек, скелетных мышцах, эритроцитах). Определяется общая активность ЛДГ, слагаемая из активностей всех имеющихся 5 изоформ (ЛДГ-1, ЛДГ-2, ЛДГ-3, ЛДГ-4, ЛДГ-5). Для миокарда и мозговой ткани основной является ЛДГ-1, для эритроцитов, тромбоцитов, почечной ткани - ЛДГ-1 и ЛДГ-2. В легких, селезенке, щитовидной и поджелудочной железах, надпочечниках, лимфоцитах преобладает ЛДГ-3. ЛДГ-4 находится во всех тканях с ЛДГ-3, а также в гранулоцитах, плаценте и мужских половых клетках, в которых содержится и ЛДГ-5. Соответственно при заболеваниях, сопровождающихся повреждением тканей и разрушением клеток, активность ЛДГ в крови повышается, что и отмечается при развитии ТМА.
Повышение активности креатинфосфокиназы (КФК) в крови при ТМА свидетельствует о повреждении или разрушении клеток, обогащенных ферментом (сердечная мышца, скелетная мускулатура, головной мозг, щитовидная железа, легкие). Определение активности МВ-изофермента креатинфосфокиназы (КФК-МВ) (сердечный изофермент, изменяющийся при повреждении клеток миокарда) имеет значение у пациентов с ТМА для диагностики поражения сердца и проведения мониторинга состояния.
У всех пациентов с признаками дисфункции ЖКТ, независимо от формы ТМА, возможно поражение поджелудочной железы, что требует проведения динамического контроля ферментов поджелудочной железы (липаза, амилаза) и уровня гликемии.
Повышение концентрации СРБ в крови при ТМА может свидетельствовать о течении бактериальной инфекции и поражении миокарда.
1Скорость клубочковой фильтрации следует рассчитывать по формуле (расчетная по формуле Шварца)- (услуга отсутствуют в Номенклатуре медицинских услуг). Исследование функции нефронов по клиренсу креатинина (проба Реберга) детям не проводится.
• Рекомендовано пациентам с подозрением на аГУС провести Исследование уровня С3 фракции комплемента, Исследование уровня С4 фракции комплемента для исключения/подтверждения аГУС с диагностической целью в острый период заболевания [55, 63, 86, 87, 88, 89].
(УУР С; УДД 4).
Комментарии. У 60-80% пациентов с аГУС сывороточный С3 в в пределах референсного диапазона., В 87% наблюдений концентрация сFH остается в пределах нормы. Нормальный показатель С3 не исключает диагноза аГУС, а выявленное снижение этого компонента комплемента может служить дополнительным аргументом в пользу этого диагноза [33, 34, 38, 61]. При STEC-ГУС может наблюдаться снижение уровня с4 в начале заболевания, с нормализацией после 10 дней, что указывает на активацию классического и/или лектинового путей, в которых происходит потребление с4.
• Рекомендуется всем пациентам с ТМА при признаках гемолиза в начальном периоде заболевания, при длительной анемии, подозрении рецидива аГУС, изолированном повышении ЛДГ в отсутствии других признаков гемолиза, анемии Исследование уровня гаптоглобина крови [63].
(УУР С; УДД 5).
• Комментарий. Гаптоглобин связывает свободный гемоглобин, высвобождающийся из разрушенных эритроцитов. Снижение уровня гаптоглобина при ТМА указывает на его избыточное потребление и является признаком усиленного гемолиза, причем именно внутрисосудистого, так как гемолиз вне кровяного русла понижением гаптоглобина не сопровождается. Гаптоглобин снижается при гемолизе раньше, чем повышается ЛДГ, являясь тем самым ранним маркером гемолиза. При нефротическом синдроме у пациентов без признаков гемолиза также может снижаться гаптоглобин из-за его потерь с мочой. На фоне тяжелого бактериального процесса уровень гаптоглобина может быть нормальным при активной ТМА, что связано с тем, что данный белок является острофазовым белком.
• Рекомендуется пациентам, имеющим признаки сепсиса, развития синдрома системной воспалительной реакции, синдрома полиорганной недостаточности; при симптомах тяжелых инфекционных, гнойно-воспалительных процессов различной локализации; при подозрении на развитие генерализованной бактериальной инфекции; при подозрении на развитие инфекционных осложнений у пациентов в условиях хирургических и реанимационных отделений; при подозрении на присоединение вторичной бактериальной инфекции у пациентов с вирусными инфекциями, аллергическими, аутоиммунными заболеваниями; после обширных хирургических вмешательств, остром отторжении трансплантата, при хронической сердечной недостаточности; при назначении и мониторировании специфической антибактериальной терапии проведение исследования уровня прокальцитонина в крови [80].
(УУР с ; УДД 4).
Комментарий. Частота исследований в динамике определяется клинической ситуацией.
• Рекомендуется всем пациентам с целью диагностики, контроля в динамике, в тч лечения, в острый период при наличии геморрагического синдрома, планировании оперативных вмешательств, при использовании антитромботических средств (антикоагулянтов) и применении плазмотерапии исследование Коагулограммы (ориентировочного исследования гемостаза): определение протромбинового (тромбопластинового) времени в плазме, активированное частичное тромбопластиновое время, исследование уровня фибриногена, растворимых фибрин-мономерных комплексов, международного нормализованного отношения, антитромбиновой активности, антиХа-активности, протромбиновой активности, Д-димеров) [63, 68, 86, 90, 91, 92].
(УУР С; УДД 5).
Комментарий. Частота исследований и выбор показателей в динамике определяется клинической ситуацией. Необходимо проведение дифференциальной диагностики с ДВС-синдромом. Снижение продуктов деградации фибрина, антитромбина III при нормальном гаптоглобине, повышение протромбинового времени или активированного частичного тромбопластинового времени, снижение уровня фибриногена, повышение маркеров фибринообразования и активации фибринолиза (растворимые фибрин-мономерные комплексы, Д-димеры), воспаления (СРБ, прокальцитонина, пресепсина), потребление тромбоцитов и факторов свертывания подтверждают ДВС-синдром. Однако дифференциальная диагностика не всегда возможна, так как ГУС тоже может осложниться ДВС-синдромом. Острое повреждение легких и / или шок чаще сопровождаются ДВС-синдромом, а для ТМА более характерна дисфункция ЦНС. Кроме того, МАГА редко встречается при ДВС-синдроме, тогда как при ТМА - практически в 100% случаев. При любой форме ГУС часто развивается АГ, тогда как при сепсисе с ДВС-синдромом имеет место вазоплегия и гипотония. Следует отметить, что если тромбоцитопения или гемолиз сохраняются после разрешения сепсиса, то необходимо продолжить диагностический поиск их причин [93].
• Рекомендуется всем пациентам проведение тромбоэластографии в качестве скрининга гемостаза в предоперационном периоде, перед инвазивными процедурами; для динамического контроля гемостаза при кровопотере и критических состояниях; для контроля гемостатической, антиагрегантной и антикоагулянтной терапии [94].
(УУР С; УДД 5).
Комментарий. В некоторых случаях частота исследований в динамике определяется клинической ситуацией.
• Рекомендуется пациентам с признаками ишемии миокарда Исследование уровня тропонинов I, T в крови (тропонин-I) с диагностической целью [46, 92, 95].
(УУР С; УДД 4).
Комментарий. В большинстве случаев острый инфаркт миокарда у пациентов с аГУС развивается в отсутствие окклюзивного поражения коронарных артерий [41, 46]. Для постановки диагноза острого инфаркта миокарда необходимо подтверждение наличия острого повреждения миокарда (характерная динамика уровня тропонина-I с ростом и/или падением, результат выходит за верхнюю границу нормы хотя бы в одном измерении) в сочетании с доказательством ишемии миокарда (ЭКГ, ЭхоКГ). Однако повышение уровня тропонина-I не является специфичным только для острой ишемии миокарда с развитием инфаркта миокарда. Тропонин-I может повышаться у пациентов с застойной сердечной и почечной недостаточностью, кардиомиопатией. что подчеркивает важность серийного тестирования тропонина и оценки результатов обследования в соответствующем клиническом контексте.
• Рекомендуется однократное определение активности металлопротеиназы ADAMTS13 в плазме крови в острый период заболевания пациентам с ТМА для диагностики/исключения ТТП. [28, 38, 68].
(УУР С; УДД 5).
Комментарий: Активность металлопротеазы оценивается до плазмотерапии. Значения активности ADAMTS13>10% исключает ТТП [38, 60, 63]. При STEC-ГУС/аГУС активность металлопротеазы может быть как снижена, но выше 10%, так и быть в пределах референсного диапазона. Выраженность тромбоцитопении прямо коррелирует с показателем активности ADAMTS13, поэтому при стабильной тромбоцитопении не ниже 70 000/1 мкл активность металлопротеазы можно не определять [28, 38]. Количество тромбоцитов крови >30×109/л и концентрация креатинина >200 мкмоль/л у пациента с ТМА практически исключает диагноз ТТП [61].
• Рекомендовано определение антител к сFH в сыворотке крови всем пациентам с подозрением на аГУС с целью диагностики «аутоиммунной» формы заболевания [35, 38, 62, 63].
(УУР С; УДД 5).
Комментарий. Все пациенты с подозрением на аГУС должны быть обследованы на наличие антител к сFH в образцах крови, взятых до плазмаобмена или инфузии плазмы. Образование антиCFH-антител в 90% случаев связано с делецией сFHR3/CFHR1, что наиболее харатерно для детей, чем для взрослых (25-50% vs 5-10%). Своевременное выявление антиСFH-антител имеет важное значение для выбора тактики лечения, поскольку их высокий титр требует в дополнение к комплемент-блокирующей терапии назначение иммуносупрессантов. При подтверждении антительной формы аГУС, требуется контроль антиСFH-антител каждые 3-6 месяцев на фоне лечения в последующем до нормализации их уровня.
• Рекомендуется пациентам с ТМА при пневмонии /менингите/сепсисе для исключения/подтверждения pnГУС - Микробиологический посев крови на стерильность [60, 96, 70].
(УУР С; УДД 5).
• Рекомендуется Микробиологическое (культуральное) исследование мокроты на аэробные и факультативно-анаэробные микроорганизмы пациентам с ТМА на фоне бактериальной инфекции с поражением лёгких/развитием менингита, сепсиса для исключения/подтверждения pnГУС [60, 96].
(УУР С; УДД 5).
• Рекомендовано проведение молекулярно-биологического исследования методом ПЦР (кровь, плевральный экссудат, спинномозговая жидкость) на пневмококк (Молекулярно-биологическое исследование крови на пневмококк (Streptococcus pneumoniae) методом ПЦР, Определение ДНК пневмококка (Streptococcus pneumoniae) в крови методом ПЦР, Молекулярно-биологическое исследование спинномозговой жидкости на пневмококк (Streptococcus pneumoniae), Определение ДНК пневмококка (Streptococcus pneumoniae) в спинномозговой жидкости методом ПЦР) пациентам с ТМА на фоне бактериальной инфекции с поражением лёгких/развитием менингита, сепсиса для исключения/подтверждения pnГУС [38, 60, 70].
(УУР С; УДД 5).
Комментарий. Молекулярно-генетическое исследование (ПЦР) необходимо для подтверждения диагноза при выделении пневмококков из стерильных жидкостей организма (кровь, плевральный экссудат, спинномозговая жидкость). Данное исследование необходимо для подтверждения инвазивной пневмококковой инфекции как причины развития pnГУС.
Услуга «Молекулярно-биологическое исследование плевральной жидкости на пневмококк (Streptococcus pneumoniae) методом ПЦР» в настоящее время отсутствует в Номенклатуре.
Рекомендуется проведение реакции латекс-агглютинации пациентам с ТМА на фоне бактериальной инфекции с поражением лёгких/развитием менингита, сепсиса для исключения/подтверждения pnГУС [38, 53, 97] (УУР С; УДД 5).
Комментарий. Реакция латекс-агглютинация является методом экспресс-диагностики антигенов пневмококков в крови и ликворе при подозрении на инвазивные формы пневмококковой инфекции для исключения pnГУС.
• Рекомендуется детям школьного возраста с симптомокомплексом ТМА с целью исключения системных заболеваний Иммунологическое обследование для диагностики аутоиммунных заболеваний (Определение содержания антител к антигенам ядра клетки и ДНК, Определение содержания антител к ДНК нативной, Определение содержания антител к ДНК денатурированной, Определение содержания антинуклеарных антител к Sm-антигену, Комплекс исследований для диагностики системной красной волчанки (волчаночный антикоагулянт), Определение содержания антител к бета-2-гликопротеину в крови, Определение содержания антител к кардиолипину в крови) [60, 98].
(УУР С; УДД 5).
Комментарий. В первую очередь необходимо исключить СКВ и АФС. Сочетание клинико-лабораторных проявлений ТМА с наличием антифосфолипидных антител свидетельствует в пользу диагноза «катастрофический АФС», независимо от того, имеются ли у пациента или отсутствуют клинические и иммунологические признаки СКВ. Диагностика системной патологии у пациентов с ТМА необходима, поскольку выявленный спектр маркеров определяет терапевтическую тактику [60].
• Рекомендуется пациентам с ТМА при подозрении на генетически детерминированный дефицит кобаламина С (cblC). Исследование уровня гомоцистеина в крови, уровня витамина В12 в крови и фолиевой кислоты в крови с целью установления возможной причины ТМА и оценки необходимости дальнейшего молекулярно-генетического обследования [38, 57, 60, 99, 100, 101, 103].
(УУР С; УДД 4).
Комментарий: У пациентов с генетическими мутациями, приводящими к дефектному метаболизму кобаламина с (MUT, MMAA, MMAВ, ММАСНС, ММАDHC, MCEE), на фоне генетически детерминированного дефицита кобаламина С может развиваться cblC-ТМА. Выявление повышенного уровня гомоцистеина при нормальных уровнях витамина в12 и фолиевой кислоты является вероятным признаком диагноза сblC-ГУС [38, 57].
Гипергомоцистеинемия также может быть диагностирована при тромбофилии, обусловленной мутацией генов фолатного цикла, дефиците витамина В12 и фолиевой кислоты.
• Рекомендуется однократно пациентам с ТМА при длительной тромбоцитопении, подозрении на метилмалоновую ацидемию и мегалобластную анемию Определение уровня витамина В12 (цианокобаламин) в крови с целью установления возможной причины ТМА и оценки необходимости дальнейшего молекулярно-генетического обследования [99, 100].
(УУР С; УДД 5).
Комментарий. См клинические рекомендации по метилмалоновой ацидемии/ацидурии.
• Рекомендуется всем пациентам с ТМА младше 6 мес.и пациентам независимо от возраста при подозрении на метилмалоновую ацидемию с диагностической целью проведение :
- тандемной масс-спектрометрии, для определения содержания пропионилкарнитина (С3), свободного карнитина (С0) (Исследование уровня свободного L-карнитина методом тандемной масс-спектрометрии в крови),.
- количественного определения 3-гидроксипропионовой, метиллимонной, 3-гидрокси-n-валериановой кислот в моче (Комплексное определение содержания органических кислот в моче, Комплекс исследований для диагностики органических ацидурий)- количественного определения уровня аминокислот (глицин, лейцин, изолейцин, валин, треонин) в крови (Комплексное определение концентрации на аминокислоты и ацилкарнитины в крови, Комплексное определение концентрации на аминокислоты и ацилкарнитины в крови методом тандемной масс-спектрометрии) [63, 99, 100, 103].
(УУР С; УДД 4).
Комментарий. Тандемная масс-спектрометрия - метод исследования вещества, основанный на определении отношения массы вещества к заряду ионов. Позволяет определить состав смеси органических веществ качественно и количественно. Кровь (капиллярная/венозная) собирается на стандартную карточку-фильтр. Образец высушивается 2-3 часа при комнатной температуре (нагревать и подвергать образец прямому воздействию солнечных лучей недопустимо). Диагноз метилмалоновой ацидемии необходимо заподозрить при наличии мегалобластоза, повышении концентрации гомоцистеина и снижении метионина плазмы, повышении экскреции с мочой гомоцистеина и метилмалоновой кислоты. Проведение молекулярно-генетического исследования необходимо для подтверждения диагноза (мутации в генах MUT, MMAA, MMAВ ММАСНС, ММАDHC, MCEE) и проведения медико-генетического консультирования [104].
Следует учитывать, что аГУС у пациентов с комбинированными нарушениями процесса реметилирования может развиваться также у детей старше 6 месяцев и даже у взрослых, в связи с чем данные исследования могут проводиться по клинической потребности в других возрастных категориях пациентов.
Услуга «Исследование уровня пропионилкарнитина методом тандемной масс-спектрометрии в крови» в настоящее время отсутствует в Номенклатуре.
• Рекомендуется Определение общей гемолитической активности комплемента (СН50) только пациентам с аГУС при рецидивах и отсутствии эффекта от комплемент-блокирующей терапии (экулизумаб**) с целью оптимизации режима введения и дозировок экулизумаба**[26,60, 64].
(УУР С; УДД 5).
Комментарий: При СН50>30% у пациентов, получающих экулизумаб**, рекомендуется изменение интервала между инфузиями препарата или увеличение дозы препарата из-за неполной блокады комплемента [64]. До настоящего времени нет надежных биомаркеров, подтверждающих активность заболевания для диагностики аГУС, в том числе рецидива.
• Рекомендуется однократно пациентам с тромбоэмболией легочной артерии, инфарктом миокарда, геморрагическим инсультом и тромбозами другой локализации исследование полиморфных вариантов генов гемостаза и ферментов фолатного цикла, проведение диагностики тромбофилии с целью диагностики и назначения оптимальной терапии [30, 105, 106, 107].
(УУР С; УДД 4).
Комментарий. Могут проводиться - Исследование агрегации тромбоцитов, Исследование агрегации тромбоцитов с помощью агрегат-гемагглютинационной пробы, Определение активности фактора XI в сыворотке крови, Определение активности фактора X в сыворотке крови, Определение активности фактора IX в сыворотке крови, Определение активности фактора VIII в сыворотке крови, Определение активности фактора VII в сыворотке крови, Определение активности фактора V в сыворотке крови, Определение активности антитромбина III в крови, Исследование уровня протеина С в крови, Определение активности протеина S в крови, Определение содержания антител к кардиолипину в крови, Определение содержания антител к фосфолипидам в крови, Исследование уровня плазминогена в крови, Исследование плазминовой (фибринолитической) системы, Определение полиморфизма 675 4G/5G (инсерция гуанина в позиции 675) в гене ингибитора активатора плазминогена I типа (PAI-1) в зависимости от клинической ситуации.
• Рекомендуется всем пациентам (при наличии мочи) в остром периоде, периоде восстановленного диуреза и при купировании признаков ТМА - Общий (клинический) анализ мочи (обнаружение гемоглобина в моче, определение белка в моче, альбумина в моче, микроскопическое исследование осадка мочи) с целью диагностики протеинурии, гематурии и гемоглобинурии [63, 105].
(УУР С; УДД 5).
Комментарий. Частота исследований в динамике определяется клинической ситуацией. В общем анализе мочи при любой форме ТМА может выявляться протеинурия, гематурия. Также исследование проводится в процессе динамического наблюдения, после трансплантации почки, частота определяется индивидуально.
• Рекомендовано исследование альбумин/креатининового соотношения пациентам в острый период STEC-ГУС, аГУС и в период ремиссии при наличии белка в разовых порциях мочи для оценки гломерулярной фильтрации [96, 108].
(УУР С; УДД 4).
Комментарии. Исследование проводится в утренней порции мочи. Частота исследований в динамике определяется клинической ситуацией.
• Рекомендуется пациентам с признаками поражения ЖКТ без диареи и пациентам с диареей, гемоколитом для выявления STEC-инфекции Определение ДНК диарогенных эшерихий (ЕНЕС, ЕРЕС, ЕТЕС, EAgEC, EIEC) в образцах фекалий методом ПЦР ((Молекулярно-биологическое исследование фекалий на диарогенные эшерихии (ЕНЕС, ЕРЕС, ETEC, EAgEC, EIEC, Определение ДНК диарогенных эшерихий (ЕНЕС, ЕРЕС, ЕТЕС, EAgEC, EIEC) в образцах фекалий методом ПЦР, Комплекс исследований на диарогенный эшерихиоз, вызванный инфекцией Escherichia сoli (EPEC/ ETEC/ EIEC/ EHEC/EAgEC)) [86].
(УУР С; УДД 5).
Комментарий. Диарейный продром может быть при аГУС, поэтому всем пациентам показан комплекс исследований, рекомендованных при STEC-ГУС.
• Рекомендуется пациентам с признаками поражения ЖКТ без диареи и пациентам с диареей, гемоколитом для выявления STEC-инфекции Бактериологическое исследование кала для выявления STEC-инфекции: микробиологическое (культуральное) исследование фекалий/ректального мазка на диарогенные эшерихии (ЕНЕС, ЕРЕС, ETEC, EAgEC, EIEC) с определением чувствительности к антибактериальным препаратам [86].
(УУР С; УДД 5).
Комментарий. Диарейный продром может быть при аГУС, поэтому всем пациентам показан комплекс исследований, рекомендованных при STEC-ГУС.
• Рекомендуется пациентам с признаками поражения ЖКТ без диареи / с диареей, пациентам с катаральным синдромом в сочетании с диареей для диагностики комплемент-активирующего состояния при аГУС Диагностика вирусных диарей (ротавирус, реовирус, аденовирус, астровирус, вирус Норволк, аденовирус ) методом ПЦР (Определение РНК ротавирусов (Rotavirus gr.A) в образцах фекалий методом ПЦР, Определение РНК калицивирусов (норовирусов, саповирусов) (Caliciviridae (Norovirus, Sapovirus)) в образцах фекалий методом ПЦР, Определение РНК астровирусов (Astrovirus) в образцах фекалий методом ПЦР, Определение ДНК аденовирусов (Adenovirus) в образцах фекалий методом ПЦР, Определение РНК неполиомиелитных энтеровирусов (Enterovirus) в образцах спинномозговой жидкости методом ПЦР) [27, 109, 110, 111].
(УУР С; УДД 5).
Комментарий. Диарея может быть проявлением в том числе вирусной инфекции, поэтому всем пациентам с подозрением на аГУС показан комплекс исследований, рекомендованных при STEC-ГУС.
• Рекомендуется пациентам с признаками острой респираторной инфекции в продроме ТМА диагностика вирусных инфекций методом ПЦР, ИФА (грипп, аденовирус, ВПГ 1,2,6 типов, ВЭБ, ЦМВ, энтеровирус) с диагностической целью [63, 111].
(УУР С; УДД 5).
Комментарий. Определение РНК вируса гриппа A (Influenza virus А) в мазках со слизистой оболочки носоглотки методом ПЦР и/или Определение РНК вируса гриппа В (Influenza virus В) в мазках со слизистой оболочки носоглотки методом ПЦР и/или Определение РНК вируса гриппа С (Influenza virus С) в мазках со слизистой оболочки носоглотки методом ПЦР и/или Определение ДНК аденовируса (Human Adenovirus) в мазках со слизистой оболочки носоглотки методом ПЦР или Определение ДНК вируса герпеса 6 типа (HHV6) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование и/или Определение ДНК вируса герпеса 6 типа (HHV6) в мазках со слизистой оболочки ротоглотки методом ПЦР, количественное исследование и/или Молекулярно-биологическое исследование соскоба из носоглотки на вирус простого герпеса (Herpes simplex virus) и/или Определение ДНК вируса Эпштейна-Барр (Epstein - вarr virus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование и/или Определение ДНК вируса Эпштейна-Барр (Epstein - вarr virus) в мазках со слизистой оболочки ротоглотки методом ПЦР, количественное исследование и/или Определение ДНК цитомегаловируса (Cytomegalovirus) в мазках со слизистой оболочки ротоглотки методом ПЦР, качественное исследование и/или Определение ДНК цитомегаловируса (Cytomegalovirus) в мазках со слизистой оболочки ротоглотки методом ПЦР, количественное исследование.
Выбор исследования определяется эпидемиологической ситуацией и возможностями клиники.
2,4 Инструментальные диагностические исследования.
• Рекомендуется. Рентгенография органов грудной клетки пациентам при развитии /подозрении на отек легких, пневмонию с целью подтверждения/исключения данных состояний [105].(УУР С; УДД 5).
Комментарий. Частота исследований в динамике определяется клинической ситуацией. Наличие жалоб на одышку, боли в грудине, области сердца, при шумном дыхании, кашле, патологических выделениях при кашле (гнойная, кровянистая мокрота), сохраняющаяся высокая температура тела является показаниями к проведению данного исследования.
Может проводиться с теми же целями КТ органов грудной клетки при необходимости (недостаточность сведений при рентгенографии органов грудной клетки, сомнительные ситуации).
• Рекомендуется Ультразвуковое исследование органов брюшной полости (комплексное) всем пациентам с ТМА с целью скрининговой диагностики поражения полых и паренхиматозных органов и/или диагностики кишечной непроходимости и/или перфорации [105, 112, 113].
(УУР С; УДД 5).
Комментарий. Рекомендуемый метод исследования является скрининговым у пациентов как с признаками поражения ЖКТ, так и без них. Для пациентов с ГУС характерно поражение полых (в первую очередь - толстой кишки) и паренхиматозных (печень, поджелудочная железа, селезенка) органов. При гипергидратации определяются эхопризнаки свободной жидкости в брюшной полости (гидроперетонеум). Частота исследований в динамике определяется клинической ситуацией.
• Рекомендуется ультразвуковое исследование почек с дуплексной допплерографией, мочевого пузыря всем пациентам с ГУС с целью диагностики патологических изменений, контроля в динамике, в тч лечения [105].
(УУР С; УДД 5).
Комментарий. Частота исследований в динамике определяется клинической ситуацией. Ультразвуковое исследование почек позволяет установить их размеры, положение, особенности строения и другие параметры. Допплерографическое исследование оценивает состояние ренального кровоотока.
• Рекомендуется регистрация электрокардиограммы всем пациентам в острый период ТМА для регистрации электрической активности сердечной мышцы, диагностики нарушений сердечного ритма, выявления ишемии, гипертрофии желудочков, изменений метаболического характера (гиперкалиемия) [46, 105].
(УУР С; УДД 5).
Комментарий. Частота исследований в динамике определяется клинической ситуацией.
• Рекомендуется эхокардиография всем пациентам для оценки структуры, размеров и состояние сердечной мышцы, клапанов и сосудов (аорта, коронарные сосуды), глобальной сократимости миокарда [46].
(УУР С; УДД 5).
• Комментарий. При любой форме ГУС могут быть выявлены признаки объёмной перегрузки (гидроперикард), АГ и специфических поражений, обусловленных тромбозами мелких и интрамиокардиальных сосудов при ТМА. Пациенты с аГУС, имеющие мутации сFH/CFB/С3, анти-CFH-антитела подвержены риску развития сердечно-сосудистых осложнений [41, 46]. Частота исследований в динамике определяется клинической ситуацией.
• Рекомендуется. Фундоскопия всем пациентам с ТМА для диагностики пурчероподобной ретинопатии, а также при наличии артериальной гипертензии и признаков поражения ЦНС [98, 99].
(УУР С; УДД 5).
Комментарий. При ТМА может развиться одностороннее или билатеральное повреждение органа зрения с отеком ДЗН, интраретинальными кровоизлияниями, мягкими ватообразными экссудатами, макулярным отеком [49]. Частота исследований в динамике определяется клинической ситуацией.
Проводится также при рецидиве аГУС.
• Рекомендуется. МРТ головного мозга с ангиорежимом (без контрастирования) или КТ головного мозга (с внутривенным контрастированием) всем пациентам с признаками поражения ЦНС при любой форме ТМА с целью оценки степени изменений в структуре мозга, состояния и проходимости сосудов головного мозга [105, 114, 115].
(УУР С; УДД 5).
Комментарий. Магнитно-резонасная томография - более чувствительный метод для визуализации ишемических очагов при ТМА. МРТ головного мозга с ангиографическим режимом позволяет не только оценить состояние кровеносных сосудов, но и дать характеристику току крови в динамике у пациентов с эндотелиальной дисфункцией на фоне ТМА. Частота исследований в динамике определяется клинической ситуацией.
Следует избегать применение йодсодержащих контрастных веществ при нарушении функции почек.
При необходимости проводится наркоз.
• Рекомендовано. Проведение электроэнцефалографии детям с поражением ЦНС при ТМА с целью ранней диагностики отклонений электрической активности головного мозга и профилактики последующих осложнений [ 116 ].
(УУР С; УДД 4).
• Рекомендовано Исследование уровня буферных веществ в крови Исследование уровня водородных ионов (рН) крови всем пациентам с подозрением на ГУС и с установленным диагнозом ГУС в процессе терапии с целью диагностики нарушений кислотно-основного состояния [63, 105].
(УУР С; УДД 5).
2,5 Иные диагностические исследования.
• Рекомендуется пациентам с трехростковой панцитопенией, лейкемоидной реакцией, косвенными признаками гемофагоцитарного синдрома для диагностики болезней кроветворной системы Цитологическое исследование пунктата (аспирата) костного мозга (Получение цитологического препарата костного мозга путем пункции) [117, 118].(УУР С; УДД 5).
• При подозрении на атипичный ГУС и подготовке к трансплантации при любой форме ТМА, приведшей к ХБП 5, рекомендовано проведение молекулярно-генетического исследования методом секвенирования нового поколения (NGS) и секвенирования по Сэнгеру для идентификации генетических мутаций, ассоциированных с аГУС (CFH, MCP, сFI, с3, сFB, THBD, сFHR1, сFHR3, сFHR5). Для выявления делеций или дупликаций проводится мультиплексная зависимая от лигирования амплификация зонда (MLPA) [60].
(УУР С; УДД 5).
TEGb Комментарий: При выявлении методом NGS генотипа, свидетельствующего в пользу постановки диагноза, рекомендуется подтверждение генотипа максимально точным методом. К таким методам, признанным во всем мире, относится секвенирование по Сэнгеру, побуквенное чтение заданного участка ДНК длинной 500-1000 нуклеотидов. У пациентов с аГУС для постановки диагноза и принятия решения о тактике лечения идентификация мутаций факторов комплемента не требуется. Генетическое исследование необходимо для определения прогноза и длительности комплемент-блокирующей терапии (экулизумаб**). Следует помнить, что мутации генов регуляторных белков альтернативного пути активации комплемента выявляются не у всех пациентов с аГУС. Однако, отрицательный результат генетического скрининга у пациента с ТМА не исключает наличия аГУС. В настоящее время рекомендуется проведение генетического анализа даже при наличии антител к сFH. Если мутация идентифицируется у пациента с антителами к сFH, решение о дальнейшем лечении должно приниматься индивидуально в каждом случае, в зависимости от титра антител и функциональных последствий мутации. Кроме того, исследование необходимо провести всем пациентам, нуждающимся в трансплантации почки, независимо от формы ТМА; перед отменой терапии экулизумабом** и для диагностики редких форм ТМА (ADAMTS13, DGKE, INF 2, PLG, MUT, MMAA, MMAВ, ММАСНС, ММАDHC, MCEE). В случаях, если причина ТМА не установлена, рекомендуется секвенирование всего экзома для персонализированного лечения [35]. База данных вариантов генов доступна по ссылке: http://www.complement-db.org/home.php .
• Рекомендовано рассмотреть проведение Нефробиопсии (биопсия почки, биопсия почки под контролем ультразвукового исследования) с целью подтверждения диагноза ТМА в сомнительных и неясных ситуациях [119].
(УУР С; УДД 5).
Комментарий. Биопсия почки не является обязательной для диагностики той или иной формы ТМА. При проведении нефробиопсии у пациентов с ТМА существует высокий риск кровотечения из-за наличия АГ, тромбоцитопении и уремии. Однако биопсия почки может подтвердить диагноз ТМА в сомнительных и неясных ситуациях: сомнений в диагнозе ГУС, массивной протеинурии у пациентов с анемией и тромбоцитопенией, отсутствие полного лабораторного симптомокомплекса ТМА (чаще всего тромбоцитопении), купирование гематологических проявлений ТМА на фоне сохраняющегося снижения функций почек, подозрения на вторичные формы ТМА, неэффективности экулизумаба.
Дифференциальная диагностика типичного ГУС.
• Рекомендовано проведение дифференциальной диагностики типичного ГУС (STEC-ГУС) с заболеваниями со сходной симптоматикой с целью установления диагноза и выбора оптимальной тактики терапии [119].
(УУР С; УДД 5).
Комментарии:
• Атипичный ГУС;
• ТТП;
• Гемолитические анемии;
• Мультисистемный воспалительный синдром у детей, ассоциированный с SARS-CoV-2;
• ГУС, ассоциированный с дефектным метаболизмом кобаламина (сblC-ГУС);
• Сепсис.
Дифференциальная диагностика атипичного ГУС.
Рекомендовано проводить дифференциальную диагностику аГУС с заболеваниями, имеющими сходную симптоматику с целью установления точного диагноза и выбора оптимальной тактики терапии [119].
(УУР С; УДД 5).
Комментарии:
• STEC-ГУС;
• ТТП;
• Пневмококк-ассоциированный ГУС;
• Мультисистемный воспалительный синдром у детей, ассоциированный с SARS-CoV-2;
• Гемолитические анемии;
• Пароксизмальная ночная гемоглобинурия;
• Мегалобластная анемия;
• Синдром Эванса;
• Гемобластоз;
• Гемофагоцитраный лимфогистиоцитоз;
• Острый тубулоинтерстициальный нефрит;
• Вторичные формы ТМА (СКВ, АФС, системная склеродермия, злокачественная гипертензия, лекарственно-ассоциированная ТМА );
• Редкие формы ГУС (DGKE, сblC-ГУС);
• Сепсис.
В случае развития ТМА при наличии симптомов со стороны ЖКТ вначале показан скрининг на STEC-ГУС, далее рекомендовано верифицировать STEC-ГУС после исключения ТТП и «отсутствия подозрения на аГУС». Диагноз STEC-ГУС не может быть исключен только на основании отрицательных результатов инфекционного поиска. Рекомендовано считать отрицательный результат скрининга на STEC-ГУС достоверным, только в случае, если анализ собран до начала антибактериальной терапии. В случаях проведения антибактериальной терапии частота выделения из стула ДНК EHEC методом ПЦР существенно выше в первые 6 дней диареи. Течение с поражением других органов и систем помимо почек во многом определяет исход и прогноз [30, 40, 42, 47]. Для STEC-ГУС не является характерным «волнообразное» (повторные эпизоды гемолиза и потребления тромбоцитов) и рецидивирующее течение ТМА [2, 4, 5, 8, 10, 18, 27].
Исходя из определения аГУС, для постановки его диагноза у ребенка должны быть исключены прочие причины развития ТМА, в первую очередь - STEC-ГУС. В ряде случаев в дебюте аГУС также отмечается диарея или поражение дыхательных путей, поэтому необходимо своевременное исключение STEC-инфекции, равно как и инфекции Streptococcus pneumonia [28, 34, 35, 38, 60]. Кроме этого, следует исключить системную патологию, мультисистемный воспалительный синдром, ассоциированный с SARS-CoV-2, инфекции (ВИЧ, H1N1), предшествующую злокачественную артериальную гипертензию, HELLP-синдром у рожениц, прием лекарств (циклоспорин**, такролимус** ), метилмалоновую ацидемию как возможные причины ТМА (Приложение 1).
Для исключения ТТП необходимо исследование активности ADAMTS13 - естественного регулятора микротромбообразования, ответственного за инактивацию фактора фон Виллебранда у всех пациентов с картиной ТМА, выраженный дефицит которого (ADAMTS13 <10% от нормы) приводит к развитию ТТП. При STEC-ГУС, аГУС и других ТМА активность ADAMTS13 может быть снижена, однако ее показатель всегда превышает 10%. Клинически ТТП и ГУС имеют много сходного. ТТП следует подозревать у пациентов с тяжелой стойкой тромбоцитопенией (<30000/мкл) и легкой формой ОПП или без нее [35, 38]. Однако тяжелая ОПП встречается у 10-12% пациентов с идиопатической ТТП [65]. У детей ТТП может носить как врожденный характер вследствие дефицита ADAMTS13, так и приобретенный - в результате выработки антиADAMTS13 антител. Врожденная TTП (синдром Апшоу-Шульман) имеет различный фенотип и может проявляться у новорожденных с MAГА и желтухой или у детей с необъяснимой тромбоцитопенией. Данная форма ТТП характеризуется активностью ADAMTS13 <5%, отсутствием антител к ADAMTS13 и гомозиготной / гетерозиготной мутацией в ADAMTS13 [120]. Для ТТП характерно превалирование неврологической симптоматики при умеренном нарушении функции почек [4, 24, 25, 35, 37].
Необходимо исследование уровня антиCFH-антител, которые повышаются при антитело-опосредованной форме аГУС [35, 38]. Аутоиммунная» форма аГУС в основном встречается у детей в возрасте от 5 до 15 лет. Действие анти-CFH-антител, как и мутаций сFH, приводит к избыточной активации альтернативного пути комплемента. Выработка антител к сFH связана с дефицитом сFH-связанных белков 1 и 3 (CFHR1, сFHR3). Установлено, что у 90% больных с антительной формой ГУС определяется гомозиготная делеция в генах сFHR1 - 3 . Если возраст пациента на момент дебюта заболевания <3 лет или проводился плазмаобмен перед скринингом, только обнаружение делеции помогает подтвердить опосредованное антителами заболевание у пациентов с низкими титрами аутоантител к сFH. Учитывая терапевтическое значение, необходимо проводить скрининг антител к СFH у всех пациентов с aГУС.
Поскольку многие мутации скорее ведут к нарушению функции белков системы комплемента, нежели к изменению их плазматической концентрации, уровень сFH, сFI, с3 и сFB может оставаться нормальным даже при наличии мутаций. Сам же молекулярно-генетический анализ требует значительного времени и получение его результатов в острой фазе заболевания практически нереально. Поэтому для диагностики аГУС и назначения лечения генетическое исследование значения не имеет. Вместе с тем, генетический скрининг необходим в процессе наблюдения за пациентами для определения стратегии их долгосрочной терапии [35, 59, 60, 62].
Мультисистемный воспалительный синдром у детей, ассоциированный с SARS-CoV-2, является критической формой сOVID-19. При данном синдроме развивается вирус-индуцированный вторичный гемофагоцитарный синдром (цитокиновый шторм), проявляющийся неконтролируемой активацией иммунной системы с высвобождением провоспалительных цитокинов (ФНО-альфа, ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-8, ИЛ-10, гранулоцитарный колоний-стимулирующий фактор, моноцитарный хемоаттрактивный протеин 1) и маркеров воспаления (СРБ, сывороточный ферритин), что может приводить к развитию острого респираторного дистресс-синдрома, полиорганной недостаточности и может быть причиной гибели пациента. Мультисистемный воспалительный синдром нередко развивается в поздние сроки болезни. Положительный ПЦР на SARS-CoV-2 определяется не у всех пациентов с мультисистемным воспалительным синдромом, однако почти у всех можно выявить антитела к возбудителю сOVID-19. Основными клиническими проявлениями мультисистемного воспалительного синдрома у детей являются персистирующая лихорадка и системное воспаление с вовлечением в патологический процесс различных органов и систем - системы крови, сердечно-сосудистой и нервной систем, ЖКТ, почек, кожи. Имеются данные, свидетельствующие о том, что при болезни сOVID-19 ТМА, связанная с нарушением регуляции комплемента, является одним из важных патофизиологических механизмов в дополнение к тромбовоспалению или как его часть [121, 122, 123]. В совокупности коагулопатия, связанная с сOVID-19, по-видимому, представляет собой сложный патологический процесс, вызванный каскадом тромбовоспаления, эндотелиального повреждения и активацией комплемента, что приводит к ТМА.
|
|
Лечение
Целью терапии любой формы ГУС, является купирование клинико-лабораторных проявлений ТМА, сохранение и улучшение функции пораженных органов, предотвращение развития ХБП 5, избавление от потребности в диализных методах лечения, недопущение поражения других внутренних органов, кроме почек, улучшение качества жизни пациентов, а также обеспечение лучшей выживаемости пациентов.
• Рекомендуется госпитализация всех пациентов с признаками ТМА, развившимися на фоне симптомов ЖКТ, в диализные центры / многопрофильные стационары с отделением реанимации и интенсивной терапии, оснащенным, в первую очередь, аппаратурой для экстракорпорального очищения крови для проведения диализных методов лечения [60].
(УУР С; УДД 5).
Комментарий. Госпитализация в подобные лечебные учреждения обусловлена необходимостью применения диализных методов лечения (гемодиализ (ГД), продленный вено-венозный гемодиализ / гемодиафильтрация (ПВВГД/ПВВГДФ) (Гемодиализ продолжительный, Гемофильтрация крови, Гемофильтрация крови продленная, Гемофильтрация крови продолжительная), перитонеальный диализ (ПД)), искусственной вентиляции легких (ИВЛ) и плазмотерапии (ПТ).
• Всем пациентам со STEC-ГУС/ТМА рекомендовано проведение коррекции: волемических расстройств, анемии, АГ, электролитного баланса, КЩС, гипоксии и энцефалопатии, судорожного синдрома, а также нутриционной поддержки (вплоть до парентерального питания), с терапевтической целью [124].
(УУР С; УДД 5).
Комментарий. Предпочтение следует отдавать диализу, особенно при наличии выраженной гиперкалиемии и метаболического ацидоза, коррекция которых введением растворов, содержащих натрия гидрокарбонат (например, натрия гидрокарбонат**) и декстрозы** может усугубить гипергидратацию [124].
• Не рекомендуется применять высокие дозы фуросемида** (2-5 мг/кг) и гипотензивную терапию препаратами группы «миолитики прямые» (периферическими вазодилататорами), так как они редко позволяют достичь эффекта [124].
(УУР С; УДД 5).
• Рекомендуется обязательное проведение расчета жидкости с ее ограничением при гипергидратации, и, наоборот, с компенсацией потерь со стулом, рвотой и сохраненном диурезе, так как дегидратация может усугубить ишемическое повреждение почек и других органов [2, 23].
(УУР С; УДД 5).
Комментарий. Небольшое проспективное когортное исследование в 2005 г. продемонстрировало, что количество введенного натрия предупреждает развитие олигоанурического ОПП при ГУС [125]. С тех пор накопились доказательства, и проведенный метаанализ показал, что при гематокрите ≤23% риск развития олигоанурической почечной недостаточности повышается в 2,38 раз [126]. Инфузионная терапия может быть первой эффективной индивидуальной мерой для предотвращения STEC-ГУС и улучшения прогноза, и это представляет собой сдвиг парадигмы, поскольку до недавнего времени ограничение жидкости была основой лечения [127]. Проведение инфузионной терапии способствует улучшению перфузии почек, предотвращает ишемическое повреждение органа и поддерживает тубулярный кровоток. Протоколы проведения инфузионной терапии на разработаны. В большинстве исследований использовался изотонический раствор хлорида натрия. Объем внутривенной жидкости должен рассчитываться исходя из клинической оценки внутрисосудистого объема, чтобы избежать гипергидратации. При этом требуется проведение инвазивного мониторинга гемодинамики, оценка потребления жидкости, диуреза и потерь со стулом, рвотой [7]. Признаками гипергидратации могут быть увеличение массы тела, артериальная гипертензия, отеки, гипонатремия.
• Питание, так же как и воду, и электролиты рекомендуется обеспечивать перорально, при необходимости через желудочный зонд с целью поддержания адекватного функционирования ЖКТ [2, 128].
(УУР С; УДД 5).
Комментарий. Количество калорий и белка должно составить 100% от рекомендованной суточной потребности. Необходимость в парентеральном питании возникает в случае продолжающихся рвоты, диареи и симптомов колита.
• Не рекомендовано применение препаратов, снижающих моторику желудочно-кишечного тракта и антибактериальных препаратов системного действия при гемоколите на фоне EHEC вследствие увеличения риска развития STEC-ГУС [69, 129, 130, 131, 132].
(УУР С, УДД 4).
Комментарий. Использование стимуляторов моторики желудочно-кишечного тракта (прокинетиков) и противомикробных препаратов системного действия (с бактерицидным эффектом) может способствовать усилению токсемии, тем самым повышая риск развития типичного ГУС. Опубликованы данные о целесообразности использования при STEC-инфекции бактериостатических антибиотиков. Известно, что при вспышке типичного ГУС в Германии (2011) в результате инфекции E.coli O104:H4 в центрах, где использовали стратегию комбинированной антибактериальной терапии (меропенем** и ципрофлоксацин**), E. coli выделялась с фекалиями в течение более короткого периода времени, в меньшей степени проявлялся судорожный синдром, был ниже уровень летальности, а также быстро снижался уровень сывороточного креатинина, по сравнению с пациентами, не получавшими лечение антибиотиками, этим пациентам не потребовалось хирургическое вмешательство [133, 134]. Таким образом полученные результаты лечения обосновывают целесообразность назначения антибактериальных препаратов системного действия при уже развившемся ГУС.
• Рекомендовано. Применение антибактериальных препаратов системного действия (широкого спектра) детям с диализ-зависимой, а также проявлениями инфекционно-токсического шока и системной воспалительной реакцией на фоне развившегося STEC-ГУС [69, 135, 136].
(УУР С, УДД 5).
Комментарий. При развитии STEC-ГУС парентеральное использование антибиотиков проводится при катетеризации центральных вен, имплантации перитонеального катетера и других оперативных вмешательствах.
Выбор препарата согласно локальной и индивидуальной чувствительности патогенов.
• Рекомендуется коррекция анемии пациентам со STEC-ГУС, имеющим тяжелую МАГА (Нв менее 70г/л). С этой целью следует применять трансфузии эритроцитной взвеси/средства, стимулирующие эритропоэз [20].
(УУР С, УДД 5).
Комментарий. В остром периоде STEC-ГУС следует применять трансфузии эритроцитной взвеси из расчета 10-15 мл/кг.Переливание эритроцитарной взвеси показано при развитиии гемической гипоксии независимо от уровня гемоглобина. С целью профилактики иммунных реакций, осложнений после трансфузии эритроцитарной взвеси (аллоиммунизация антигенами лейкоцитов, гипертермическая негемолитическая реакция, реакция «трансплантат против хозяина», острое трансфузионно-обусловленное повреждение лёгких) предпочтение отдается лейкоредуцированной эритроцитарной взвеси (эритроциты, обедненные лейкоцитами). При трансфузии иногрупной крови, гиперкалиемии, аллергических реакциях предпочтение отдается отмытым эритроцитам. В периоде разрешения STEC-ГУС при сохраняющейся анемии, не связанной с гемолизом, использовать средства, стимулирующие эритропоэз короткого действия, кратность использования которых определяется уровнем гемоглобина.
• Не рекомендуется проведение трансфузий тромбоцитного концентрата у пациентов со STEC-ГУС, не имеющих геморрагических осложнений, с целью коррекции тромбоцитопении [7, 137].
(УУР С, УДД 5).
Комментарий. Трансфузии тромбоцитного концентрата могут усилить проявления ТМА у детей со STEC-ГУС, поскольку провоцируют новые эпизоды микротромбообразования с дальнейшим потреблением тромбоцитов. Трансфузия тромбоцитного концентрата показана лишь при развитии кровотечения или при использовании инвазивных диагностических процедур / оперативных вмешательств (установление центрального или перитонеального катетера, абдоминальные хирургические вмешательства) с высоким риском кровоточивости [7].
• Рекомендуется. Рассмотреть пациентам с тяжелым течением STEC-ГУС проведение плазмотерапии в режиме трансфузий СЗП [60].
(УУР С, УДД 5).
Комментарий: Критериями тяжелого течения STEC-ГУС является триада симптомов (МАГА, тромбоцитопения, ОПП) в сочетании с анурией длительностью >1 суток или триада симптомов с анурией, артериальной гипертензией и/или судорожным синдромом. Трансфузиями СЗП в условиях окклюзионного микротромбообразования коррегируется недостаточность ряда факторов свертывающей системы гемостаза и одновременно повышается собственная фибринолитическая активность крови пациента.
• Рекомендуется трансфузию СЗП проводить в объеме, в среднем, 20-30 (до 40-45) мл/кг/сут [137].
(УУР С, УДД 5).
Комментарий: объем трансфузии СЗП определяется состоянием сердечно-легочной деятельности.
• Рекомендуется рассмотреть пациентам при STEC-ГУС применение плазмообмена. Показаниями для проведения плазмообмена являются: неврологические нарушения, данные УЗИ, свидетельствующие об угрозе кортикального некроза, анурия >15 суток [42, 137, 138].
(УУР С, УДД 5).
Комментарий: Проведение плазмообменов в ранние сроки от дебюта заболевания приводят к снижению уровня лабораторных маркеров гемолиза и воспаления после процедуры, но не сокращает сроки нормализации картины крови, но способствует сокращению сроков анурии. Противопоказанием к проведению плазмообмена служат ранние сроки после оперативного вмешательства, кровотечение, выраженное язвенное поражение желудочно-кишечного тракта. Абсолютными противопоказаниями к ПО являются: нестабильная гемодинамика, сердечная недостаточность, инфузия симпатомиметиков в массивной дозе (допамин более 20 мкг/кг/мин.), профузное кровотечение любой локализации, церебральный инсульт в острой стадии, отек легких. Относительными противопоказаниями к ПО являются: период новорожденности, анемия при содержании эритроцитов менее 3,0 х1012/мл, гемоглобина 75-90 г/л, гипофибриногенемия (уровень фибриногена менее 2,0 г/л), гипопротеинемия (содержание общего белка в крови менее 55 г/л), некорригированная гиповолемия.
Плазмообмен у детей c ТМА проводят с объемом эксфузии 60-75 мл/кг/с с замещением адекватным объемом СЗП (1,5 объема циркулирующей крови).
Плазмообмен проводится под непрерывным введением препаратов из группы гепарина (нефракционированные) (НФГ), например, гепарин натрия**: болюс 100 Ед/кг, поддерживающая доза - 20 Ед/кг в час. Замещение - 5% альбумин человека** + натрия хлорид (0,9%)** + СЗП.
Сеансы плазмообмена следует продолжить до нормализации числа тромбоцитов, прекращения гемолиза и улучшения функци почек. В связи с этим терапию СЗП необходимо контролировать ежедневным определением количества тромбоцитов и уровня ЛДГ.
Критериями эффективности плазмотерапии служат: купирование тромбоцитопении, прекращение гемолиза, о чем свидетельствует нормализация ЛДГ. Стойкая нормализация уровня тромбоцитов и прекращение гемолиза в течение 3-х дней является показанием к прекращению ПТ.
• При отсутствии выраженной тромбоцитопении и кровоточивости у детей со STEC-ГУС плазмообмен рекомендовано сочетать с назначением препаратов из группы гепарина (низкомолекулярных) (НМГ): далтепарин натрия/надропарин натрия из расчета 50-80 МЕ /кг [139].0,01 мл/кг или 0,8-1,0 мл препаратов из группы гепарина (НМГ) на одну процедуру при плазмаферезе [140] или 60-80 МЕ/кг [140].
(УУР С, УДД 5).
Комментарии. Применение НМГ с большей точностью позволяет предсказать дозозависимый антикоагулянтный эффект, они характеризуются повышенной биодоступностью при подкожном введении, более продолжительным периодом полураспада. Сочетание НМГ с плазмотерапией позволяет опосредованно усилить антитромботический эффект СЗП. Кроме того, НМГ вызывают выделение тканевого ингибитора тромбопластина, подавляют освобождение фактора Виллебранда, устраняют прокоагулянтную активность лейкоцитов, улучшают эндотелиальную функцию.
• Рекомендовано. Всем пациентам со STEC-ГУС, проявляющимся ОПП, рассмотреть вопрос о целесообразности проведения ЗПТ [124, 137].
(УУР С; УДД 5).
Комментарий. Тяжелая форма STEC-ГУС является абсолютным показанием к началу проведения ЗПТ. Ведущую роль в прогнозе жизни и почечной выживаемости играет раннее начало диализа, так как определяется прямая зависимость между сроком начала диализа и исходами. При определении показаний к ЗПТ следует учитывать общеклинические показатели и признаки развития органического ОПП, о чем свидетельствует отсутствие отклика на петлевые диуретики в условиях нормо- или гиперволемии. Повторная стимуляция диуреза противопоказана, поскольку её продолжение только усугубляет почечное повреждение. Абсолютным показанием к началу ЗПТ при STEC-ГУС является ОПП в стадии недостаточности. Если при анурии не остается выбора при решении вопроса о необходимости в ЗПТ, то при олигурии на первый план выходят общеклинические показания: гипергидратация с отеком легкого и/или дыхательной недостаточностью; метаболические расстройства: гиперкалиемия (выше 7 ммоль/л), ацидоз (ВЕ < -12 ммоль/л), азотемия (прирост креатинина более 50-70 мкмоль/л/24ч); уремическая энцефалопатия; неконтролируемая АГ; потребность в обеспечении адекватного питания ребенка при длительной олигурии.
• Рекомендовано. При развитии диализ-зависимого ОПП у пациентов со STEC-ГУС определить показания к выбору вида ЗПТ (ПД, ГД, ПВВГД/ПВВГДФ) [124].
(УУР с ; УДД 5).
Комментарий. При выборе модальности диализа учитывается тяжесть клинического состояния, степень метаболических нарушений, наличие противопоказаний к определенному методу диализа, а также возраст, рост, вес ребенка и доступность видов ЗПТ в конкретном лечебном учреждении. Показаниями к перитонеальному диализу являются: «изолированное ОПП», выраженные неврологические нарушения, наличие или высокий риск геморрагичеких осложнений, выраженная недостаточность кровообращения, невозможность выполнения сосудистого доступа. У маленьких детей поверхность брюшины относительно поверхности тела больше, чем у взрослых, что обеспечивает высокую эффективность процедуры и делает ПД первоочередным методом выбора ЗПТ у детей раннего возраста. В качестве стартового метода ЗПТ ПВВГДФ используется в случаях выраженной гипергидратации с отеком легких, отека мозга, гиперазотемии, декомпенсированного метаболического ацидоз, крайне тяжелого состояния пациента, нестабильной гемодинамики, противопоказаний к проведению ПД. ГД методом выбора является при лечении пациента с сохранной гемодинамикой, выраженной азотемией и гипергидратацией, противопоказаний к другим методам ЗПТ.
• Рекомендовано при наличии у пациентов STEC-ГУС артериальной гипертензии назначения антигипертензивных препаратов ( см рекомендации по лечению АГ у нефрологических пациентов) [141].
(УУР С, УДД 4).
• Комментарий. Артериальная гипертензия - у детей стойкое повышение артериального давления выше 95 перцентиля для данного пола, возраста и роста. Артериальная гипертензия может быть причиной синдрома задней обратимой энцефалопатии (PRES-синдром) [142]. В коррекции АГ при STEC-ГУС следует отдавать предпочтение блокаторам кальциевых каналов и / или диуретикам в случае перегрузки жидкостью. Рекомендовано изменение дозы и кратности введения всех лекарственных средств, элиминируемых с мочой, а также, при диализной терапии, лекарств, которые способны проникать через мембрану диализатора в связи с существенным изменением их фармакодинамики в анурической стадии ОПП при STEC-ГУС. [143, 144, 145].
(УУР С; УДД 5).
• Не рекомендовано при STEC-ГУС с наличием значимой протеинурии проведение кортикостероидной терапии в связи с отсутствием значимого эффекта [146, 147, 148, 149].
(УУР С; УДД 4).
Комментарий. Протеинурия, выявленная в остром периоде, носит транзиторный характер. Отсутствует доказанная польза стероидной терапии, также высок риск вторичной инфекции.
• Рекомендовано. Проведение нефропротективной терапии с использованием иАПФ/БРА: показано после перенесенного STEC-ГУС [150, 151, 152, 153].
(УУР С; УДД 4).
Комментарий: обычно назначаются через 3-6 мес. после перенесенного STEC-ГУС. Ингибиторы иАПФ/БРА могут использоваться предпочтительно после острой фазы STEC-ГУС [151, 152]. Назначение иАПФ противопоказано при рСКФ ≤ 30 мл/мин/1,73м2].
Применение препаратов - off-label - вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и пациента в возрасте старше 15 лет.
• Не рекомендовано при STEC-ГУС рутинное применение нефротоксичных лекарственных средств и рентгенконтрастных агентов с целью предотвращения усиления поражения почек [70].
(УУР С; УДД 5).
(УУР С; УДД 5).
Комментарий. Госпитализация в подобные стационары обусловлена необходимостью применения диализных методов лечения (ГД, ПВВГД/ПВВГДФ, ПД, ИВЛ. Пациенты с аГУС/ТМА нуждаются в коррекции волемических расстройств, анемии, нутритивного статуса (вплоть до парентерального питания), АГ, электролитного баланса, КЩС, гипоксии и энцефалопатии, судорожного синдрома. Предпочтение следует отдавать диализу (гемодиализ), особенно при наличии выраженной гиперкалиемии и метаболического ацидоза, коррекция которых введением препаратов, содержащих натрия гидрокарбонат (например, натрия гидрокарбонат**) и декстрозы** может усугубить гипергидратацию [124].
• Рекомендуется обязательное проведение расчета жидкости с ее ограничением при гипергидратации, и, наоборот, с компенсацией потерь со стулом, рвотой при сохраненном диурезе, так как дегидратация может усугубить ишемическое повреждение почек и других органов [2, 23].
(УУР С, УДД 5).
• Рекомендовано. Всем детям с подтвержденным диагнозом аГУС назначение терапии экулизумабом** : Режим дозирования экулизумаба**для детей и кратность его введения определяется массой тела ребенка (Таблица 1).
Таблица 1. Режим дозирования экулизумаба** у детей с аГУС.
[60, 63, 154, 155, 156, 157, 158].
(УУР в ; УДД 2).
Комментарий: терапевтический подход к аГУС был радикально усовершенствован с открытием и внедрением в клиническую практику экулизумаба**, гуманизированного моноклонального антитела к С5-фракции терминальной стадии каскада комплемента. Экулизумаб** предотвращает расщепление С5, ведущее к образованию провоспалительного С5а и протромботического С5b-9 компонентов, тем самым устраняя их патогенное действие. В опубликованных результатах контролируемых исследований продемонстрирована высокая эффективность экулизумаба** в виде быстрой ликвидации активности гемолиза (в среднем за 7-14 дней) и признаков активной ТМА у 88% пациентов с продолжительностью гематологической ремиссии на протяжении всего курса лечения у большинства пациентов. Отмечено повышение СКФ в среднем на 32 мл/мин/1,73 м2 от исходной с наибольшей выраженностью при раннем начале лечения. У детей повышение СКФ было более выраженным (64 мл/мин/1,73 м2). В ряде случаев наблюдали медленное улучшение почечной функции на протяжении 2 лет. Большинство пациентов избавились от потребности в диализе [15, 16, 27]. Примечательно, что подобный эффект наблюдался независимо от наличия или отсутствия мутаций в генах комплемента. При сравнении групп пациентов, получавших и не получавших экулизумаб** отмечена достоверная разница в проценте достигших терминальной стадии ХБН к году наблюдения (25% и 63% соответственно) [155, 156]. По данным >5 лет наблюдения за пациентами c аГУС, применение экулизумаба** снижает частоту рецидивов ТМА в 13,7 раз, в сравнении с периодом отсутствия лечения [159]. По возможности, лечение экулизумабом должно быть начато в течение 24-48 ч от манифесатции аГУС ил поступления в клинику [157]. Препарат растворяется в 0,9%-ном растворе натрия хлорида**, 0,45%-ном растворе натрия хлорида (препарат не выпускается в готовой форме на территории Российской Федерации, готовится в производственных аптеках) или 5%-ном растворе декстрозы**. Необходимый объем разведенного препарата экулизумаб** до конечной концентрации 5 мг/мл рассчитывается из объема 60 мл раствора на каждые 300 мг препарата Целями терапии экулизумаба** являются: предотвращение летального исхода при своевременном начале терапии, достижение и поддержание гематологической ремиссии, отсутствие потребности в плазмотерапии, улучшение /поддержание / продолжение улучшения функции почек, снятие вопроса о проведении трансплантации в ряде случаев, улучшение качества жизни. При долговременном применении экулизумаб** предотвращает рецидивы острой комплемент-опосредованной ТМА [160].
Введение осуществляется через периферический венозный катетер (катетер периферический) или через порт-систему (порт инфузионный/инъекционный, имплантируемый***), которые устанавливаются согласно методическим руководствам «Венозный доступ, 2019 (https://msestra.ru/download/file.php?id=4763) с использованием необходимых лекарственных средств. Порт-системы устанавливаются согласно Распоряжению Правительства Российской Федерации от 31,12,2018 № 3053-р «Об утверждении перечня медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи, а также перечня медицинских изделий, отпускаемых по рецептам на медицинские изделия при предоставлении набора социальных услуг».
• Рекомендовано при аГУС, опосредованном антиCFH-антителами, рассмотреть комбинированное использование плазмообмена с иммуносупрессивной терапии [11, 38, 161, 162, 163, 164, 165].
(УУР С; УДД 4).
Комментарии: описаны положительные результаты в отношении гематологических изменений и показателей функции почек на фоне сочетанного применения плазмотерапии (плазмообмен с 1,5-кратным объемом плазмы (60-75 мл/кг) за сеанс в течение 5 дней или до достижения гематологической ремиссии, далее через день по 40 мл/кг в течение 2 недель, с последующим переходом на режим - 2 раза в неделю в течение 2-3 недель) с пульсовым внутривенным введением циклофосфамида** - обычно 0,5г/1,73м2 каждые 4 недели №2, до 1г/1,73м2 №5 [162] или 0,5г/м2 каждые 3-4 недели - 5 доз [165] глюкокортикоиды (преднизолон** 1 мг/кг/сут в течение 4 недель, затем через день в течение следующих 4 недель, с последующим снижением дозы каждые 2 недели, в среднем, до 0,2мг/кг/48ч в течение 10-12 месяцев) (в тяжелых случаях - пульс-терапия с использованием метилпреднизолон ** до 1г/сут -3 дня) и ритуксимаба** (375мг/м2 внутривенно каждые 7 дней №2; плазмообмен не проводится в течение 48-72 ч после инфузииПоложительная клиническая динамика сопровождалась снижением титра антител к сFH. Комбинированное сочетание плазмотерапии с иммуносупрессантами может уменьшить риск смерти или достижения ХБП 4 в течение первого года с 59% до 24%. Поддерживающая иммуносупрессивная терапия кортикостероидами системного действия (0,2-0,3 мг/кг/48ч в течение 10-12 месяцев по преднизолону**), азатиоприном** (1-2 мг/кг/24ч в течение 12-24 мес.) или микофенолатом мофетила** (0,5-0,75 г/м2/24ч в течение 12-24 мес. [164, 165].
В дальнейшем уменьшала однолетний риск рецидива этой формы аГУС с 21% до 8% [38, 165] При терапии аГУС, опосредованном анти-CFH-антителами не рекомендуются трансфузии СЗП в качестве замены плазмообменам Титры антител тщательно контролируются между 7-28 днями лечения, а затем каждые 3-6 месяцев. Рецидивы аГУС, опосредованного анти-CFH-антителами, возникают после интеркуррентнызх заболеваний в первые 2 года [38, 162].
• Рекомендовано рассмотреть экулизумаб** как первую линию терапии при аГУС и аГУС, опосредованном антиCFH-антителами, в случае тяжелого течения заболевания с экстраренальными проявлениями, в качестве альтернативного лечения при рефрактерности плазмотерапии и иммуносупрессивной терапии [158, 161, 166, 167].
(УУР в ; УДД 2).
Комментарий: длительность терапии экулизумабом** составляет 6-12 мес. с последующей отменой и переводом на иммуносупрессивную терапию (микофенолата мофетилом** (0,5-0,75 г/м2/24ч) под ежеквартальным контролем уровня анти-CFH-антител в течение 12-24 мес. [38, 164]. Лечение экулизумабом** не влияет на выработку анти-CFH-антител. Повышенный их титр в течение первых 12-24 месяцев связан с повышенным риском рецидива [164], поэтому может потребоваться иммуносупрессия. Отмена иммуносупрессивной терапии возможна при нормализации уровня анти-CFH-антител или их отсутствии.
В случае проведения плазмотерапии на фоне лечения экулизумабом** введение дополнительной дозы препарата [168].
Дополнительное введение препарата необходимо из-за изменения метаболизма экулизумаба** при проведении плазмотерапии (табл. 2) [158].
Таблица 2.
Введение дополнительной дозы экулизумаба** в случае проведения плазмотерапии.
Не следует прерывать комплемент-блокирующую терапию во время интеркуррентного заболевания, не вызванного инкапсулированными бактериями, из-за высокого риска рецидива аГУС [169].
• Рекомендовано. Рассмотреть экулизумаб** как единственное средство лечения при аГУС, опосредованном анти-CFH-антителами при:
• противопоказаниях к иммуносупрессивной терапии и отсутствии эффекта от нее;
• невозможности проведения и неэффективности плазмообменов;
• антительном аГУС, ассоциированном с сопутствующими мутациями белков-регуляторов комплемента [161, 164].
(УУР С; УДД 5).
• Рекомендуется проведение вакцинации против инфекции, вызванной Neisseria meningitidis преимущественно Вакциной для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной **, а также против Haemophilus influenzae type b (Вакцина гемофильная тип b конъюгированная) и Streptococcus pneumoniae (Вакцина для профилактики пневмококковых инфекций**) всех пациентов с аГУС за 2 недели до первого введения экулизумаба** или при стабилизации состояния пациента на фоне проведения комплемент-блокирующей терапии для профилактики заболеваний, вызванных данными патогенами [34, 60, 170, 171].
(УУР С; УДД 5).
Комментарии. С учетом единичных сообщений о риске развития менингококкового менингита на фоне применения Экулизумаба** рекомендуется предварительная вакцинация, так как при блокаде С5 компонента комплемента препаратом Экулизумаб** нарушается иммунный ответ на инкапсулированные бактерии (менингококк, гемофильная палочка типа b, пневмококк). Механизм действия Экулизумаба** влечёт за собой повышение риска развития менингококковой инфекции, что требует проведения вакцинации пациентов с аГУС преимущественно до начала терапии Экулизумабом** или после ее иницииации при стабилизации состояния пациента. Первичная серия вакцинации при применении Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридная конъюгированная серогрупп ACW135Y) предусматривает введение 2 доз с интервалом 3 месяца, при этом вторая доза вакцины не влияет на начало терапии Экулизумабом**. Пациентам в критическом состоянии терапия Экулизумабом** начинается по жизненным показаниям на фоне профилактической антибактериальной терапии. Отсутствие вакцинации не должно отодвигать сроки начала терапии. [172].
Схема вакцинации против менингококковой инфекции за 2 недели до старта терапии экулизумабом**:
• пациентам в возрасте 9 - 23 месяцев вводится 2 дозы Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y)) с интервалом 3 месяца;
• пациентам старше 23 месяцев, не получившим первичную серию вакцинации от менингококковой инфекции, вводятся 2 дозы Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y)) с интервалом 3 месяца или одна доза Вакцины для профилактики менингококковых инфекций серотипов A и с, полисахаридной**;
• пациентам старше 23 месяцев, привитым более 2 лет назад одной дозой Вакцины для профилактики менингококковых инфекций серотипов A и с, полисахаридной ) или более 5 лет назад одной дозой Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакциной для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y), назначается 1 доза Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y).
Схема вакцинации против менингококковой инфекции при менее 2 -х недель до старта терапии Экулизумабом**:
• пациентам в возрасте 9 - 23 месяцев вводят первую дозу Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y) на фоне профилактической антибактериальной терапии в течение двух недель, начиная от старта приема Экулизумаба**. При этом вторая доза вакцины должна быть введена через 3 месяца после первой вакцинации и не влияет на начало терапии Экулизумабом**;
• пациентам старше 23 месяцев, не привитым по завершенной схеме против менингококковой инфекции, вводят первую дозу Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y) или одну дозу Вакцины для профилактики менингококковых инфекций серотипов A и с, полисахаридной**с присоединением профилактической антибактериальной терапии в течение двух недель, начиная от старта приема Экулизумаба**. При этом вторая доза вакцины должна быть введена через 3 месяца после первой вакцинации вакцинации и не влияет на начало терапии Экулизумабом**.
• пациентам старше 23 месяцев, получившим более 2 лет назад одну дозу Вакцины для профилактики менингококковых инфекций серотипов A и с, полисахаридной** или Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или привитым более 5 лет назад одной дозой Вакцины для профилактики менингококковых инфекций (олигосахаридной конъюгированной серогрупп ACW135Y) или Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y**, вводится одна доза Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y) с назначением профилактической антибактериальной терапии в течение 2 недель после старта лечения экулизумабом**.
Схемы вакцинации против менингококковой инфекции при различных клинических ситуациях у пациентов с аГУС:
• При жизненной необходимости терапии Экулизумабом** пациентам в возрасте менее 9 месяцев допускается иммунизация Вакциной для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакциной для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y).
• Пациентам, получившим первичную серию вакцинации против менингококковой инфекции, следует назначать каждые 5 лет дополнительную дозу конъюгированной менингококковой вакцины для обеспечения наиболее эффективной защиты.
• Пациентам, прервавшим терапию Экулизумабом** и возобновившим лечение через определенное время, рекомендуется повторная вакцинация против менингококковой инфекции, если с момента первой дозы Вакцины для профилактики менингококковых инфекций серотипов A и с, полисахаридной**прошло более 2 лет и более 5 лет (после введения Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y).
• Если пациент с аГУС не был вакцинирован ранее, то в порядке подготовки к трансплантации и профилактическому применению Экулизумаба** детям необходима вакцинация против менингококковой, пневмококковой и гемофильной инфекции типа b. Вакцины можно вводить одномоментно в разных шприцах в разные части тела.
• Рекомендована пациентам с аГУС, получающим Экулизумаб**, вакцинация против пневмококковой инфекции по схемам для групп риска с целью профилактики заболеваний, вызванным данным возбудителем [172].
(УУР с ; УДД 5).
Комментарий. Иммунизация против пневмококковой инфекции не служит причиной для отодвигания срока начала терапии Экулизумабом** и может проводиться у пациентов, получающих этот препарат. Пациентам в возрасте от 2-х месяцев вводят 2 дозы пневмококковой конъюгированной вакцины (Вакцины для профилактики пневмококковых инфекций** (конъюгированной, 13-валентной)) по схеме - 2 и 4,5 месяца с последующей ревакцинацией в 15 месяцев. Пациентам в возрасте от 12 до 24 месяцев, ранее не привитым, вводят 2 дозы пневмококковой конъюгированной вакцины ((Вакцины для профилактики пневмококковых инфекций** (конъюгированной, 13-валентной)) с интервалом в 2 месяца (допускается интервал 3 месяца, если можно совместить со 2-ой дозой менингококковой конъюгированной вакцинами).
В соответствии с [173. Пациенты до 2 х-лет с хроническими воспалительными заболеваниями, получающими иммуносупрессивную терапию, вакцинация пневмококковой конъюгированной 13-валентной вакциной осуществляется по схеме 3+1, то есть трехкратно с интервалом 1 мес с последующей ревакцинацией на втором году жизни в 15 мес жизни, но не ранее чем через 4 мес от последней дозы первичной серии вакцинального комплекса.
Пациенты в возрасте от 2 до 18 лет, не получавшие ранее ни одной дозы пневмококковой конъюгированной вакцины (Вакцины для профилактики пневмококковых инфекций** (конъюгированной, 13-валентной)), вакцинируются однократно. Для детей 2-5 лет возможно использование пневмококковой конъюгированной 10-валентной вакцины (Вакцины для профилактики пневмококковых инфекций** (конъюгированной, 10-валентной)) по 2-дозовой схеме, когда 2 дозы вакцины вводятся с интервалом не менее 8 недель между ними. Если пациент уже был ранее привит пневмококковой полисахаридной вакциной (Вакциной для профилактики пневмококковых инфекций** (полисахаридной 23-валентной)), то вакцинация пневмококковой конъюгированной вакциной (Вакциной для профилактики пневмококковых инфекций** (конъюгированной)) проводится не ранее чем через 1 год.
Учитывая высокий риск тяжелого течения пневмококковой инфекции, пациентам с аГУС необходимо дополнительное введение полисахаридной пневмококковой 23-валентной вакцины (ППВ23) с интервалом не менее 8 нед, оптимально - через 12 месяцев после окончания схемы иммунизации пневмококковой конъюгированной вакцины для расширения охвата серотипов возбудителя [173].
• Рекомендована пациентам с аГУС, получающим Экулизумаб**, вакцинация против гемофильной инфекции типа b по схемам для групп риска [172].
(УУР с ; УДД 5).
Комментарий. Пациентам в возрасте до 6 месяцев назначаются 3 дозы - в 3 - 4,5 - 6 месяцев с последующей ревакцинацией в возрасте 18 месяцев. Пациентам в возрасте от 6 до 12 месяцев вводят 2 дозы с интервалом 1 мес. с последующей ревакцинацией в 18 месяцев. Пациентам в возрасте старше 12 месяцев проводят однократную вакцинацию. Ревакцинация не требуется.
• Рекомендуется. Проводить антибиотикопрофилактику препаратами, проникающими через гематоэнцефалический барьер пациентам с аГУС, имеющим показания к срочному началу лечения экулизумабом**, которое исключает возможность предшествующей вакцинации, с целью предотвращения менингококковой инфекции [34, 86, 174, 175, 176, 177, 178, 179, 180].
(УУР С; УДД 5).
Комментарии. Обычно назначаются препараты групп - пенициллины широкого спектра действия, пенициллины, чувствительные к бета-лактамазам, другие бета-лактамные антибактериальные препараты. Профилактическое введение противомикробного средства системного действия необходимо начинать одновременно с вакцинацией и проводить не менее 2-х недель в случаях, если вакцинацию проводят в день первой инфузии экулизумаба**. В случаях невозможности вакцинации к моменту начала лечения антибиотикопрофилактика может быть продлена на срок до нескольких месяцев в зависимости от времени вакцинации. В ряде случаев антибиотики могут назначаться даже своевременно вакцинированным пациентам. Показания к их применению определяет лечащий врач. Необходимость профилактического назначения антибиотиков пациентам с аГУС обусловлена отсутствием вакцины против серотипа В N. meningitides, в связи с чем проведение вакцинации полностью не исключает развития менингита [34].
• Рекомендовано терапию экулизумабом** продолжать пожизненно или рассмотреть возможность в ряде случаев отменить через 2 года от начала лечения с последующей оценкой активности заболевания с целью проведения необходимой и достаточной терапии [63, 171, 181].
(УУР С; УДД 5).
Комментарий. Вопрос об оптимальной продолжительности лечения экулизумабом** окончательно не решен.Риск развития рецидива аГУС определяется типом мутации. Продемонстрировано, что при отмене препарата через 2 года чаще рецидивы аГУС возникают у пациентов с мутациями в генах сFH, с3, THBD, не рецидивируют пациенты, имеющие мутацию в гене MCP и анти сFH-ат. Поэтому отмена препарата в ряде случаев возможна после оценки степени риска рецидива аГУС. Прекращение лечения экулизумабом ** приводит к рецидивам у 60-72% пациентов с мутациями в гене сFH, у 43% - с мутациями с3, 37-50% с мутациями в гене MCP и ~ 10% без выявленных дефектов [166]. Оптимальной стратегии мониторинга активности комплемента и развития аГУС, особенно субклинической его формы в отсутствие выраженных симптомов, на данный момент не существует. Прекращение терапии экулизумабом** потенциально подвергает пациента риску прогрессирования заболевания и развитию нового эпизода ТМА, непредсказуемого по тяжести и времени возникновения, а также риску не получить описанные клинические преимущества продолжительной терапии (например, улучшения почечной функции, которое у некоторых пациентов происходит в течение 2 и более лет). Дети относятся к группе высокого риска, у которых часто встречается комплемент-активирующие состояния (например, инфекции или вакцинация). Отмену терапии экулизумабом** можно рассматривать только при отсутствии активности заболевания и низком риске рецидива, на индивидуальной основе. Риск развития рецидива аГУС зависит от типа мутации. К категории низкого риска относятся пациенты с изолированной мутацией в гене MCP; пациенты с анти-СFH-антителами, в ходе наблюдения имевшие отрицательные результаты анализов на данные антитела в течение длительного времени. К категории средневысокого риска относятся пациенты, имеющие изолированную мутацию в гене сFI; пациенты с постоянно низким уровнем антиCFH-антител; пациенты без идентифицированных мутаций в генах системы комплемента. К категории высокого риска относятся пациенты с рецидивами аГУС в анамнезе; пациенты, имеющие родственников с рецидивирующим течением аГУС; пациенты с мутациями в генах сFH, сFВ и С3. Для решения вопроса отмены терапии необходимо принимать во внимание: тяжесть заболевания, продолжительность периода нормализации / стабилизации функции органов, семейный анамнез, результаты генетического анализа, наличие комплемент-активирующих состояний, комплаентность пациента, возможность быстрого рестарта терапии экулизумабом** [160, 182].
• Не рекомендуется отмена экулизумаба** после достижения ремиссии комплемент-опосредованной ТМА пациентам, у которых при генетическом исследовании идентифицированы мутации генов факторов комплемента сFH, сFB, с3, THBD с целью предотвращения рецидива симптомов [86, 157, 171, 183, 184].
(УУР С; УДД 5).
Комментарии. Длительность терапии экулизумабом** определяется генетическим профилем пациента. Проведенные в настоящее время исследования продемонстрировали, что отмена препарата возможна, хотя примерно у 30% пациентов после прекращения терапии развивается рецидив ТМА, причем чаще у имеющих мутации, ассоциированные с развитием аГУС [169].Следует отметить, что в настоящее время рекомендации по пожизненной длительности терапии экулизумабом** не могут считаться окончательными, продолжается изучение данного вопроса.
• Рекомендуется в случаях отмены экулизумаба** мониторирование, общего (клинического) анализа мочи, общего (клинического) анализа крови развернутого,исследование уровня креатинина в крови, соотношение белок / креатинин в моче (Исследование уровня креатинина в моче, Определение белка в моче) и определением активности лактатдегидрогеназы в крови в течение не менее 12 недель с целью своевременной диагностики возможного рецидива аГУС и возобновления комплемент-блокирующей терапии [157, 155].
(УУР с ; УДД 4).
Комментарии. Установлено, что рецидивы аГУС чаще всего наблюдаются в течение первых 3-х месяцев после отмены экулизумаба**.В этот период пациенты нуждаются в тщательном наблюдении и контроле основных лабораторных критериев ТМА с целью диагностики рецидива и раннего рестарта комплемент-блокирующей терапии. Лабораторные исследования выполняются через 2 недели после последнего применения экулизумаба**, затем еженедельно в течение 1 месяца, каждые 2 недели в течение 2 месяцев, ежемесячно в течение 3 месяцев, далее каждые 3 месяца. Пациентам в амбулаторных условиях также рекомендуется контроль артериального давления, протеинурии по тест-полоскам. Дополнительные лабораторные исследования могут быть выполнены в случае острого заболевания, хирургического вмешательства [186, 187].
• Рекомендовано у пациентов с аГУС выявить возможные триггеры заболевания и назначить лечение, направленное на их подавление [68].
(УУР С; УДД 5).
Комментарий. Особое значение имеет своевременная диагностика инфекций, наиболее часто предшествующих аГУС, и следующая за ней адекватная антибактериальная терапия.
• Рекомендуется коррекция анемии пациентам с аГУС, имеющим тяжелую МАГА (Нв менее 70г/л). С этой целью следует применять трансфузии эритроцитной взвеси/средства, стимулирующие эритропоэз [68, 188,].
(УУР с , УДД 5).
Комментарий. При остром эпизоде аГУС следует применять трансфузии эритроцитной взвеси из расчета 10-15 мл/кг.Переливание эритроцитарной взвеси показано при развитиии гемической гипоксии независимо от уровня Нв. С целью профилактики иммунных реакций, осложнений после трансфузии эритроцитарной взвеси (аллоиммунизация антигенами лейкоцитов, гипертермическая негемолитическая реакция, реакция «трансплантат против хозяина», острое трансфузионно-обусловленное повреждение лёгких) предпочтении отдается лейкоредуцированной эритроцитарной взвеси (эритроциты, обедненные лейкоцитами). При трансфузии иногрупной крови, гиперкалиемии, аллергических реакциях предпочтение отдается отмытым эритроцитам. При сохраняющейся анемии, не связанной с гемолизом, у пациентов с аГУС использовать средства, стимулирующие эритропоэз короткого действия, кратность использования которых определяется уровнем гемоглобина.
• Не рекомендуется проведение трансфузий тромбоцитного концентрата у пациентов с аГУС, не имеющих геморрагических осложнений, с целью коррекции тромбоцитопении [68, 188].
(УУР с , УДД 5).
Комментарий. Трансфузии тромбоцитного концентрата могут усилить проявления ТМА у детей с аГУС, поскольку провоцируют новые эпизоды микротромбообразования с дальнейшим потреблением тромбоцитов. Трансфузия тромбоцитного концентрата показана лишь при развитии кровотечения или при использовании инвазивных диагностических процедур / оперативных вмешательств (установление центрального или перитонеального катетера, абдоминальные хирургические вмешательства) с высоким риском кровоточивости.
• Рекомендовано. Всем пациентам с ОПП на фоне аГУС необходимо решение вопроса о целесообразности проведения ЗПТ [145, 189].
(УУР с ; УДД 5).
Комментарий. При определении показаний к ЗПТ следует учитывать общеклинические показатели и признаки развития органического ОПП, о чем свидетельствует отсутствие отклика на петлевые диуретики в условиях нормо - или гиперволемии. Повторная стимуляция диуреза противопоказана, поскольку её продолжение только усугубляет почечное повреждение. Абсолютным показанием к началу ЗПТ при аГУС является ОПП в стадии недостаточности. Если при анурии не остается выбора при решении вопроса о необходимости в ЗПТ, то при олигурии на первый план выходят общеклинические показания: гипергидратация с отеком легкого и/или дыхательной недостаточностью; метаболические расстройства: гиперкалиемия (выше 7 ммоль/л), ацидоз (ВЕ < -12 ммоль/л), азотемия (прирост креатинина более 50-70 мкмоль/л/24ч); уремическая энцефалопатия; неконтролируемая АГ; потребность в обеспечении адекватного питания ребенка при длительной олигурии.
• Рекомендовано. При развитии диализ-зависимого ОПП у пациентов с аГУС определить показания к выбору вида ЗПТ (ПД, ГД, ПВВГДФ) [124].
(УУР С; УДД 5).
Комментарий. При выборе модальности диализа учитывается тяжесть клинического состояния, степень метаболических нарушений, наличие противопоказаний к определенному методу диализа, а также возраст, рост, вес ребенка и доступность видов ЗПТ в конкретном лечебном учреждении. Показаниями к перитонеальному диализу являются: «изолированное ОПП», выраженные неврологические нарушения, наличие или высокий риск геморрагичеких осложнений, выраженная недостаточность кровообращения, невозможность выполнения сосудистого доступа. У маленьких детей поверхность брюшины относительно поверхности тела больше, чем у взрослых, что обеспечивает высокую эффективность процедуры и делает ПД первоочередным методом выбора ЗПТ у детей раннего возраста. В качестве стартового метода ЗПТ ПВВГДФ используется в случаях выраженной гипергидратации с отеком легких, отека мозга, гиперазотемии, декомпенсированного метаболического ацидоз, крайне тяжелого состояния больного, нестабильной гемодинамики, противопоказаний к проведению ПД. ГД методом выбора является при лечении больного с сохранной гемодинамикой, выраженной азотемией и гипергидратацией, противопоказаний к другим методам ЗПТ.
• Рекомендовано при наличии АГ у пациентов с аГУС применение антигипертензивных средств ( см рекомендации по лечению АГ у нефрологических больных) [141].
(УУР С, УДД 4 ).
Комментарий: Артериальная гипертензия - у детей стойкое повышение артериального давления выше 95 перцентиля для данного пола, возраста и роста. Артериальная гипертензия может быть причиной синдрома задней обратимой энцефалопатии (PRES-синдром) [142]. Назначение иАПФ противопоказано при рСКФ ≤ 30 мл/мин/1,73м2.
• Рекомендовано. Проведение нефропротективной терапии с использованием иАПФ/БРА после разрешения острого эпизода аГУС [151, 152, 190].
(УУР С; УДД 5).
Комментарий. Лечение иАПФ/БРА помогает снизить прогрессирование почечной недостаточности до терминальной стадии почечной недостаточности, одновременно контролируя уровень артериального давления.
• Рекомендовано корректировать изменения дозы и кратности введения препаратов лекарственных средств, элиминируемых с мочой в анурической стадии ОПП при аГУС, а также коррекции дозы тех лекарств, которые способны проникать через мембрану диализатора при диализной терапии в связи с тем, что может изменяться фармакокинетика ряда лекарственных препаратов [143, 144 191, 192].
(УУР С; УДД 5).
(УУР 3; УДД с ).
Комментарий. Риск развития возвратного STEC-ГУС после трансплантации почки отсутствует. Необходимо обсудить возможность трансплантации от живого родственного донора. Циклоспорин** не противопоказан. На основании анализа течения заболевания должен быть исключен атипичный ГУС, при необходимости путем молекулярно-генетического исследования [195].
(УУР с ; УДД 4).
Комментарии: Риск возврата аГУС сразу после трансплантации чрезвычайно высок у пациентов с мутациями сFH (~ 80%), сFI и С3 (>50%). Трансплантация проведена всего 3 пациентам с мутацией сFB, все потеряли почки в результате возвратного аГУС. Поскольку трансплантированная почка не содержит мутированного MCP белка, вероятность возврата аГУС при этих мутациях очень мала. Потеря трансплантата при возврате аГУС происходит у большинства пациентов менее, чем через 1 год.
Лишь у единичных пациентов удалось предотвратить возвратный аГУС путем проведения сеансов ЗПП до операции и в посттрансплантационном периоде. Более оптимистичные перспективы связаны с использованием экулизумаба в до- и послеоперационном периоде трансплантации. Имеются сообщения о 13 пациентах с потерей предыдущего трансплантата, у которых введение экулизумаба** за несколько часов до пересадки и в течение 24 часов после нее с переходом далее на стандартный режим лечения способствовало предотвращению отторжения и возврата ТМА [ 73, 193, 194, 195].
• Не рекомендовано при аГУС проведение родственной трансплантации почки. Однако в некоторых случаях она может выполняться, если у пациента при тщательном исследовании генов системы комплемента выявляются мутации, несомненно имеющие патогенетическое значение в развитии аГУС, а у донора таковых не обнаруживается [34, 63, 60].
(УУР С; УДД 5).
Комментарий. Необходимо максимально информировать донора и реципиента о развитии возможных осложнений трансплантации. В то же время, если мутаций, ответственных за развитие аГУС, не обнаружено ни у донора, ни у потенциального реципиента, от родственной трансплантации следует отказаться.
• Рекомендуется избегать использования для трансплантации органов от доноров «с расширенными критериями» и отложить трансплантацию при высоком проценте предсуществующих анти-HLA антител («панель-реактивных антител») у потенциального реципиента или ABO-несовместимости донора и реципиента при пересадке почки пациентам с аГУС в целях профилактики рецидива аГУС в пересаженной почке [196, 197, 198].
(УУР с УДД 5 ).
• Рекомендовано перед включением в «Лист ожидания» трансплантации почки пациента с аГУС выполнить молекулярно-генетическое исследование методом NGS для определения генетического профиля пациента, а также определить в динамике титр анти-CFH-антител при антительном аГУС с целью оценки риска рецидива заболевания после трансплантации[35,60].
(УУР С; УДД 5).
Комментарий. Низкий риск рецидива аГУС после трансплантации почки имеется в следующих случаях - у пациентов с изолированной мутацией MCP; - у пациентов с аГУС, опосредованным анти-FH-антителами, при нулевых титрах данных антител в течение длительного времени и отсутствии дополнительных мутаций генов-регуляторов комплемента. Средний риск рецидива обусловлен: изолированными мутациями сFI; мутациями с неизученными эффектами; персистирующими низкими титрами анти-FH-антител и отсутствием дополнительных мутаций генов-регуляторов комплемента. Пациенты, у которых не удалось идентифицировать мутации, также относятся к категории среднего риска рецидива. Высокий риск рецидива определяется у пациентов: с наличием в анамнезе ранних рецидивов аГУС у самого пациента или его родственников; с мутациями сFH или при наличии гибридного гена сFH/CFHR1; с мутациями с усилением функции с3 и сFB. В целом риск определяется преимущественно типом мутаций, но частично зависит и от других перитрансплантационных факторов. Способствовать развитию рецидива могут тяжелое ишемически-реперфузионное повреждение трансплантата, высокие концентрации в крови реципиента ингибиторов кальцинейрина (циклоспорина А и такролимуса), острое отторжение трансплантата, особенно гуморальное, вирусные инфекции (цитомегаловирусная инфекция и другие герпес-вирусные инфекции, грипп, вKV-инфекция, инфекция, вызванная парвовирусом в19, инфекционные гастроэнтериты )[60].
• Рекомендовано выполнение трансплантации почки на фоне профилактического применения экулизумаба** пациентам с установленным диагнозом аГУС, имеющим средний и высокий риск рецидива в посттрансплантационном периоде с целью предотвращения рецидива заболевания [199, 200].
(УУР А УДД 2).
Комментарии. В день трансплантации не менее чем за один час до реперфузии донорского органа должна быть выполнена инфузия экулизумаба**. Доза препарата для детей на введение зависит от массы тела. Второе введение препарата осуществляется через 24 часа после трансплантации почки. Последующие введения экулизумаба** осуществляются 1 раз в неделю с переходом на режим 1 раз в 2 недели по индивидуальному протоколу.
• Не рекомендовано отменять терапию экулизумабом** у пациентов, развивших жизнеугрожающие проявления ТМА и перенесших трансплантацию, особенно при отторжении предыдущего трансплантата [60, 184, 201].
(УУР В; УДД 3).
Рекомендовано проведение регулярного мониторинга исследования уровня креатинина в крови, Общего (клинического) анализа крови развернутого, уровня белка в моче, Общий (клинический) анализ мочи или с помощью тест-полосок после трансплантации почки с целью своевременной диагностики отклонений и своевременной коррекции [171, 184].(УУР С; УДД 4).
Комментарии. Также следует контролировать микроскопическое исследование осадка мочи. Частота определяется индивидуально.
• Рекомендовано возобновление терапии экулизумабом** при рецидиве аГУС после трансплантации почки с целью сохранения почечной функции [171].
(УУР С; УДД 5).
3,1 Консервативное лечение.
3,1,1 Типичный ГУС.
До настоящего времени не существует общепринятой схемы лечения STEC-ГУС с клинически доказанной эффективностью. Комплекс лечебных мероприятий при типичном ГУС включает этиотропную, посиндромную, патогенетическую и ЗПТ.• Рекомендуется госпитализация всех пациентов с признаками ТМА, развившимися на фоне симптомов ЖКТ, в диализные центры / многопрофильные стационары с отделением реанимации и интенсивной терапии, оснащенным, в первую очередь, аппаратурой для экстракорпорального очищения крови для проведения диализных методов лечения [60].
(УУР С; УДД 5).
Комментарий. Госпитализация в подобные лечебные учреждения обусловлена необходимостью применения диализных методов лечения (гемодиализ (ГД), продленный вено-венозный гемодиализ / гемодиафильтрация (ПВВГД/ПВВГДФ) (Гемодиализ продолжительный, Гемофильтрация крови, Гемофильтрация крови продленная, Гемофильтрация крови продолжительная), перитонеальный диализ (ПД)), искусственной вентиляции легких (ИВЛ) и плазмотерапии (ПТ).
• Всем пациентам со STEC-ГУС/ТМА рекомендовано проведение коррекции: волемических расстройств, анемии, АГ, электролитного баланса, КЩС, гипоксии и энцефалопатии, судорожного синдрома, а также нутриционной поддержки (вплоть до парентерального питания), с терапевтической целью [124].
(УУР С; УДД 5).
Комментарий. Предпочтение следует отдавать диализу, особенно при наличии выраженной гиперкалиемии и метаболического ацидоза, коррекция которых введением растворов, содержащих натрия гидрокарбонат (например, натрия гидрокарбонат**) и декстрозы** может усугубить гипергидратацию [124].
• Не рекомендуется применять высокие дозы фуросемида** (2-5 мг/кг) и гипотензивную терапию препаратами группы «миолитики прямые» (периферическими вазодилататорами), так как они редко позволяют достичь эффекта [124].
(УУР С; УДД 5).
• Рекомендуется обязательное проведение расчета жидкости с ее ограничением при гипергидратации, и, наоборот, с компенсацией потерь со стулом, рвотой и сохраненном диурезе, так как дегидратация может усугубить ишемическое повреждение почек и других органов [2, 23].
(УУР С; УДД 5).
Комментарий. Небольшое проспективное когортное исследование в 2005 г. продемонстрировало, что количество введенного натрия предупреждает развитие олигоанурического ОПП при ГУС [125]. С тех пор накопились доказательства, и проведенный метаанализ показал, что при гематокрите ≤23% риск развития олигоанурической почечной недостаточности повышается в 2,38 раз [126]. Инфузионная терапия может быть первой эффективной индивидуальной мерой для предотвращения STEC-ГУС и улучшения прогноза, и это представляет собой сдвиг парадигмы, поскольку до недавнего времени ограничение жидкости была основой лечения [127]. Проведение инфузионной терапии способствует улучшению перфузии почек, предотвращает ишемическое повреждение органа и поддерживает тубулярный кровоток. Протоколы проведения инфузионной терапии на разработаны. В большинстве исследований использовался изотонический раствор хлорида натрия. Объем внутривенной жидкости должен рассчитываться исходя из клинической оценки внутрисосудистого объема, чтобы избежать гипергидратации. При этом требуется проведение инвазивного мониторинга гемодинамики, оценка потребления жидкости, диуреза и потерь со стулом, рвотой [7]. Признаками гипергидратации могут быть увеличение массы тела, артериальная гипертензия, отеки, гипонатремия.
• Питание, так же как и воду, и электролиты рекомендуется обеспечивать перорально, при необходимости через желудочный зонд с целью поддержания адекватного функционирования ЖКТ [2, 128].
(УУР С; УДД 5).
Комментарий. Количество калорий и белка должно составить 100% от рекомендованной суточной потребности. Необходимость в парентеральном питании возникает в случае продолжающихся рвоты, диареи и симптомов колита.
• Не рекомендовано применение препаратов, снижающих моторику желудочно-кишечного тракта и антибактериальных препаратов системного действия при гемоколите на фоне EHEC вследствие увеличения риска развития STEC-ГУС [69, 129, 130, 131, 132].
(УУР С, УДД 4).
Комментарий. Использование стимуляторов моторики желудочно-кишечного тракта (прокинетиков) и противомикробных препаратов системного действия (с бактерицидным эффектом) может способствовать усилению токсемии, тем самым повышая риск развития типичного ГУС. Опубликованы данные о целесообразности использования при STEC-инфекции бактериостатических антибиотиков. Известно, что при вспышке типичного ГУС в Германии (2011) в результате инфекции E.coli O104:H4 в центрах, где использовали стратегию комбинированной антибактериальной терапии (меропенем** и ципрофлоксацин**), E. coli выделялась с фекалиями в течение более короткого периода времени, в меньшей степени проявлялся судорожный синдром, был ниже уровень летальности, а также быстро снижался уровень сывороточного креатинина, по сравнению с пациентами, не получавшими лечение антибиотиками, этим пациентам не потребовалось хирургическое вмешательство [133, 134]. Таким образом полученные результаты лечения обосновывают целесообразность назначения антибактериальных препаратов системного действия при уже развившемся ГУС.
• Рекомендовано. Применение антибактериальных препаратов системного действия (широкого спектра) детям с диализ-зависимой, а также проявлениями инфекционно-токсического шока и системной воспалительной реакцией на фоне развившегося STEC-ГУС [69, 135, 136].
(УУР С, УДД 5).
Комментарий. При развитии STEC-ГУС парентеральное использование антибиотиков проводится при катетеризации центральных вен, имплантации перитонеального катетера и других оперативных вмешательствах.
Выбор препарата согласно локальной и индивидуальной чувствительности патогенов.
• Рекомендуется коррекция анемии пациентам со STEC-ГУС, имеющим тяжелую МАГА (Нв менее 70г/л). С этой целью следует применять трансфузии эритроцитной взвеси/средства, стимулирующие эритропоэз [20].
(УУР С, УДД 5).
Комментарий. В остром периоде STEC-ГУС следует применять трансфузии эритроцитной взвеси из расчета 10-15 мл/кг.Переливание эритроцитарной взвеси показано при развитиии гемической гипоксии независимо от уровня гемоглобина. С целью профилактики иммунных реакций, осложнений после трансфузии эритроцитарной взвеси (аллоиммунизация антигенами лейкоцитов, гипертермическая негемолитическая реакция, реакция «трансплантат против хозяина», острое трансфузионно-обусловленное повреждение лёгких) предпочтение отдается лейкоредуцированной эритроцитарной взвеси (эритроциты, обедненные лейкоцитами). При трансфузии иногрупной крови, гиперкалиемии, аллергических реакциях предпочтение отдается отмытым эритроцитам. В периоде разрешения STEC-ГУС при сохраняющейся анемии, не связанной с гемолизом, использовать средства, стимулирующие эритропоэз короткого действия, кратность использования которых определяется уровнем гемоглобина.
• Не рекомендуется проведение трансфузий тромбоцитного концентрата у пациентов со STEC-ГУС, не имеющих геморрагических осложнений, с целью коррекции тромбоцитопении [7, 137].
(УУР С, УДД 5).
Комментарий. Трансфузии тромбоцитного концентрата могут усилить проявления ТМА у детей со STEC-ГУС, поскольку провоцируют новые эпизоды микротромбообразования с дальнейшим потреблением тромбоцитов. Трансфузия тромбоцитного концентрата показана лишь при развитии кровотечения или при использовании инвазивных диагностических процедур / оперативных вмешательств (установление центрального или перитонеального катетера, абдоминальные хирургические вмешательства) с высоким риском кровоточивости [7].
• Рекомендуется. Рассмотреть пациентам с тяжелым течением STEC-ГУС проведение плазмотерапии в режиме трансфузий СЗП [60].
(УУР С, УДД 5).
Комментарий: Критериями тяжелого течения STEC-ГУС является триада симптомов (МАГА, тромбоцитопения, ОПП) в сочетании с анурией длительностью >1 суток или триада симптомов с анурией, артериальной гипертензией и/или судорожным синдромом. Трансфузиями СЗП в условиях окклюзионного микротромбообразования коррегируется недостаточность ряда факторов свертывающей системы гемостаза и одновременно повышается собственная фибринолитическая активность крови пациента.
• Рекомендуется трансфузию СЗП проводить в объеме, в среднем, 20-30 (до 40-45) мл/кг/сут [137].
(УУР С, УДД 5).
Комментарий: объем трансфузии СЗП определяется состоянием сердечно-легочной деятельности.
• Рекомендуется рассмотреть пациентам при STEC-ГУС применение плазмообмена. Показаниями для проведения плазмообмена являются: неврологические нарушения, данные УЗИ, свидетельствующие об угрозе кортикального некроза, анурия >15 суток [42, 137, 138].
(УУР С, УДД 5).
Комментарий: Проведение плазмообменов в ранние сроки от дебюта заболевания приводят к снижению уровня лабораторных маркеров гемолиза и воспаления после процедуры, но не сокращает сроки нормализации картины крови, но способствует сокращению сроков анурии. Противопоказанием к проведению плазмообмена служат ранние сроки после оперативного вмешательства, кровотечение, выраженное язвенное поражение желудочно-кишечного тракта. Абсолютными противопоказаниями к ПО являются: нестабильная гемодинамика, сердечная недостаточность, инфузия симпатомиметиков в массивной дозе (допамин более 20 мкг/кг/мин.), профузное кровотечение любой локализации, церебральный инсульт в острой стадии, отек легких. Относительными противопоказаниями к ПО являются: период новорожденности, анемия при содержании эритроцитов менее 3,0 х1012/мл, гемоглобина 75-90 г/л, гипофибриногенемия (уровень фибриногена менее 2,0 г/л), гипопротеинемия (содержание общего белка в крови менее 55 г/л), некорригированная гиповолемия.
Плазмообмен у детей c ТМА проводят с объемом эксфузии 60-75 мл/кг/с с замещением адекватным объемом СЗП (1,5 объема циркулирующей крови).
Плазмообмен проводится под непрерывным введением препаратов из группы гепарина (нефракционированные) (НФГ), например, гепарин натрия**: болюс 100 Ед/кг, поддерживающая доза - 20 Ед/кг в час. Замещение - 5% альбумин человека** + натрия хлорид (0,9%)** + СЗП.
Сеансы плазмообмена следует продолжить до нормализации числа тромбоцитов, прекращения гемолиза и улучшения функци почек. В связи с этим терапию СЗП необходимо контролировать ежедневным определением количества тромбоцитов и уровня ЛДГ.
Критериями эффективности плазмотерапии служат: купирование тромбоцитопении, прекращение гемолиза, о чем свидетельствует нормализация ЛДГ. Стойкая нормализация уровня тромбоцитов и прекращение гемолиза в течение 3-х дней является показанием к прекращению ПТ.
• При отсутствии выраженной тромбоцитопении и кровоточивости у детей со STEC-ГУС плазмообмен рекомендовано сочетать с назначением препаратов из группы гепарина (низкомолекулярных) (НМГ): далтепарин натрия/надропарин натрия из расчета 50-80 МЕ /кг [139].0,01 мл/кг или 0,8-1,0 мл препаратов из группы гепарина (НМГ) на одну процедуру при плазмаферезе [140] или 60-80 МЕ/кг [140].
(УУР С, УДД 5).
Комментарии. Применение НМГ с большей точностью позволяет предсказать дозозависимый антикоагулянтный эффект, они характеризуются повышенной биодоступностью при подкожном введении, более продолжительным периодом полураспада. Сочетание НМГ с плазмотерапией позволяет опосредованно усилить антитромботический эффект СЗП. Кроме того, НМГ вызывают выделение тканевого ингибитора тромбопластина, подавляют освобождение фактора Виллебранда, устраняют прокоагулянтную активность лейкоцитов, улучшают эндотелиальную функцию.
• Рекомендовано. Всем пациентам со STEC-ГУС, проявляющимся ОПП, рассмотреть вопрос о целесообразности проведения ЗПТ [124, 137].
(УУР С; УДД 5).
Комментарий. Тяжелая форма STEC-ГУС является абсолютным показанием к началу проведения ЗПТ. Ведущую роль в прогнозе жизни и почечной выживаемости играет раннее начало диализа, так как определяется прямая зависимость между сроком начала диализа и исходами. При определении показаний к ЗПТ следует учитывать общеклинические показатели и признаки развития органического ОПП, о чем свидетельствует отсутствие отклика на петлевые диуретики в условиях нормо- или гиперволемии. Повторная стимуляция диуреза противопоказана, поскольку её продолжение только усугубляет почечное повреждение. Абсолютным показанием к началу ЗПТ при STEC-ГУС является ОПП в стадии недостаточности. Если при анурии не остается выбора при решении вопроса о необходимости в ЗПТ, то при олигурии на первый план выходят общеклинические показания: гипергидратация с отеком легкого и/или дыхательной недостаточностью; метаболические расстройства: гиперкалиемия (выше 7 ммоль/л), ацидоз (ВЕ < -12 ммоль/л), азотемия (прирост креатинина более 50-70 мкмоль/л/24ч); уремическая энцефалопатия; неконтролируемая АГ; потребность в обеспечении адекватного питания ребенка при длительной олигурии.
• Рекомендовано. При развитии диализ-зависимого ОПП у пациентов со STEC-ГУС определить показания к выбору вида ЗПТ (ПД, ГД, ПВВГД/ПВВГДФ) [124].
(УУР с ; УДД 5).
Комментарий. При выборе модальности диализа учитывается тяжесть клинического состояния, степень метаболических нарушений, наличие противопоказаний к определенному методу диализа, а также возраст, рост, вес ребенка и доступность видов ЗПТ в конкретном лечебном учреждении. Показаниями к перитонеальному диализу являются: «изолированное ОПП», выраженные неврологические нарушения, наличие или высокий риск геморрагичеких осложнений, выраженная недостаточность кровообращения, невозможность выполнения сосудистого доступа. У маленьких детей поверхность брюшины относительно поверхности тела больше, чем у взрослых, что обеспечивает высокую эффективность процедуры и делает ПД первоочередным методом выбора ЗПТ у детей раннего возраста. В качестве стартового метода ЗПТ ПВВГДФ используется в случаях выраженной гипергидратации с отеком легких, отека мозга, гиперазотемии, декомпенсированного метаболического ацидоз, крайне тяжелого состояния пациента, нестабильной гемодинамики, противопоказаний к проведению ПД. ГД методом выбора является при лечении пациента с сохранной гемодинамикой, выраженной азотемией и гипергидратацией, противопоказаний к другим методам ЗПТ.
• Рекомендовано при наличии у пациентов STEC-ГУС артериальной гипертензии назначения антигипертензивных препаратов ( см рекомендации по лечению АГ у нефрологических пациентов) [141].
(УУР С, УДД 4).
• Комментарий. Артериальная гипертензия - у детей стойкое повышение артериального давления выше 95 перцентиля для данного пола, возраста и роста. Артериальная гипертензия может быть причиной синдрома задней обратимой энцефалопатии (PRES-синдром) [142]. В коррекции АГ при STEC-ГУС следует отдавать предпочтение блокаторам кальциевых каналов и / или диуретикам в случае перегрузки жидкостью. Рекомендовано изменение дозы и кратности введения всех лекарственных средств, элиминируемых с мочой, а также, при диализной терапии, лекарств, которые способны проникать через мембрану диализатора в связи с существенным изменением их фармакодинамики в анурической стадии ОПП при STEC-ГУС. [143, 144, 145].
(УУР С; УДД 5).
• Не рекомендовано при STEC-ГУС с наличием значимой протеинурии проведение кортикостероидной терапии в связи с отсутствием значимого эффекта [146, 147, 148, 149].
(УУР С; УДД 4).
Комментарий. Протеинурия, выявленная в остром периоде, носит транзиторный характер. Отсутствует доказанная польза стероидной терапии, также высок риск вторичной инфекции.
• Рекомендовано. Проведение нефропротективной терапии с использованием иАПФ/БРА: показано после перенесенного STEC-ГУС [150, 151, 152, 153].
(УУР С; УДД 4).
Комментарий: обычно назначаются через 3-6 мес. после перенесенного STEC-ГУС. Ингибиторы иАПФ/БРА могут использоваться предпочтительно после острой фазы STEC-ГУС [151, 152]. Назначение иАПФ противопоказано при рСКФ ≤ 30 мл/мин/1,73м2].
Применение препаратов - off-label - вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и пациента в возрасте старше 15 лет.
• Не рекомендовано при STEC-ГУС рутинное применение нефротоксичных лекарственных средств и рентгенконтрастных агентов с целью предотвращения усиления поражения почек [70].
(УУР С; УДД 5).
3,1,2 Атипичный ГУС.
• Рекомендовано всех пациентов с признаками ТМА госпитализировать в многопрофильные стационары с отделением реанимации и интенсивной терапии с целью оказания оптимальной медицинской помощи [60, 137].(УУР С; УДД 5).
Комментарий. Госпитализация в подобные стационары обусловлена необходимостью применения диализных методов лечения (ГД, ПВВГД/ПВВГДФ, ПД, ИВЛ. Пациенты с аГУС/ТМА нуждаются в коррекции волемических расстройств, анемии, нутритивного статуса (вплоть до парентерального питания), АГ, электролитного баланса, КЩС, гипоксии и энцефалопатии, судорожного синдрома. Предпочтение следует отдавать диализу (гемодиализ), особенно при наличии выраженной гиперкалиемии и метаболического ацидоза, коррекция которых введением препаратов, содержащих натрия гидрокарбонат (например, натрия гидрокарбонат**) и декстрозы** может усугубить гипергидратацию [124].
• Рекомендуется обязательное проведение расчета жидкости с ее ограничением при гипергидратации, и, наоборот, с компенсацией потерь со стулом, рвотой при сохраненном диурезе, так как дегидратация может усугубить ишемическое повреждение почек и других органов [2, 23].
(УУР С, УДД 5).
• Рекомендовано. Всем детям с подтвержденным диагнозом аГУС назначение терапии экулизумабом** : Режим дозирования экулизумаба**для детей и кратность его введения определяется массой тела ребенка (Таблица 1).
Таблица 1. Режим дозирования экулизумаба** у детей с аГУС.
| Масса тела пациента, кг | Начальный цикл | Поддерживающая терапия |
| ≥40 | 900 мг 1 раз в неделю x 4 | 1200 мг на 5-й неделе; затем 1200 мг каждые 2 недели |
| 30 <40 | 600 мг 1 раз в неделю x 2 | 900 мг на 3-й неделе; затем 900 мг каждые 2 недели |
| 20- <30 | 600 мг 1 раз в неделю x 2 | 600 мг на 3-й неделе; затем 600 мг каждые 2 недели |
| 10- <20 | 600 мг 1 раз в неделю x 1 | 300 мг на 2-й неделе; затем 300 мг каждые 2 недели |
| 5 <10 | 300 мг 1 раз в неделю x 1 | 300 мг на 2-й неделе; затем 300 мг каждые 3 недели |
[60, 63, 154, 155, 156, 157, 158].
(УУР в ; УДД 2).
Комментарий: терапевтический подход к аГУС был радикально усовершенствован с открытием и внедрением в клиническую практику экулизумаба**, гуманизированного моноклонального антитела к С5-фракции терминальной стадии каскада комплемента. Экулизумаб** предотвращает расщепление С5, ведущее к образованию провоспалительного С5а и протромботического С5b-9 компонентов, тем самым устраняя их патогенное действие. В опубликованных результатах контролируемых исследований продемонстрирована высокая эффективность экулизумаба** в виде быстрой ликвидации активности гемолиза (в среднем за 7-14 дней) и признаков активной ТМА у 88% пациентов с продолжительностью гематологической ремиссии на протяжении всего курса лечения у большинства пациентов. Отмечено повышение СКФ в среднем на 32 мл/мин/1,73 м2 от исходной с наибольшей выраженностью при раннем начале лечения. У детей повышение СКФ было более выраженным (64 мл/мин/1,73 м2). В ряде случаев наблюдали медленное улучшение почечной функции на протяжении 2 лет. Большинство пациентов избавились от потребности в диализе [15, 16, 27]. Примечательно, что подобный эффект наблюдался независимо от наличия или отсутствия мутаций в генах комплемента. При сравнении групп пациентов, получавших и не получавших экулизумаб** отмечена достоверная разница в проценте достигших терминальной стадии ХБН к году наблюдения (25% и 63% соответственно) [155, 156]. По данным >5 лет наблюдения за пациентами c аГУС, применение экулизумаба** снижает частоту рецидивов ТМА в 13,7 раз, в сравнении с периодом отсутствия лечения [159]. По возможности, лечение экулизумабом должно быть начато в течение 24-48 ч от манифесатции аГУС ил поступления в клинику [157]. Препарат растворяется в 0,9%-ном растворе натрия хлорида**, 0,45%-ном растворе натрия хлорида (препарат не выпускается в готовой форме на территории Российской Федерации, готовится в производственных аптеках) или 5%-ном растворе декстрозы**. Необходимый объем разведенного препарата экулизумаб** до конечной концентрации 5 мг/мл рассчитывается из объема 60 мл раствора на каждые 300 мг препарата Целями терапии экулизумаба** являются: предотвращение летального исхода при своевременном начале терапии, достижение и поддержание гематологической ремиссии, отсутствие потребности в плазмотерапии, улучшение /поддержание / продолжение улучшения функции почек, снятие вопроса о проведении трансплантации в ряде случаев, улучшение качества жизни. При долговременном применении экулизумаб** предотвращает рецидивы острой комплемент-опосредованной ТМА [160].
Введение осуществляется через периферический венозный катетер (катетер периферический) или через порт-систему (порт инфузионный/инъекционный, имплантируемый***), которые устанавливаются согласно методическим руководствам «Венозный доступ, 2019 (https://msestra.ru/download/file.php?id=4763) с использованием необходимых лекарственных средств. Порт-системы устанавливаются согласно Распоряжению Правительства Российской Федерации от 31,12,2018 № 3053-р «Об утверждении перечня медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи, а также перечня медицинских изделий, отпускаемых по рецептам на медицинские изделия при предоставлении набора социальных услуг».
• Рекомендовано при аГУС, опосредованном антиCFH-антителами, рассмотреть комбинированное использование плазмообмена с иммуносупрессивной терапии [11, 38, 161, 162, 163, 164, 165].
(УУР С; УДД 4).
Комментарии: описаны положительные результаты в отношении гематологических изменений и показателей функции почек на фоне сочетанного применения плазмотерапии (плазмообмен с 1,5-кратным объемом плазмы (60-75 мл/кг) за сеанс в течение 5 дней или до достижения гематологической ремиссии, далее через день по 40 мл/кг в течение 2 недель, с последующим переходом на режим - 2 раза в неделю в течение 2-3 недель) с пульсовым внутривенным введением циклофосфамида** - обычно 0,5г/1,73м2 каждые 4 недели №2, до 1г/1,73м2 №5 [162] или 0,5г/м2 каждые 3-4 недели - 5 доз [165] глюкокортикоиды (преднизолон** 1 мг/кг/сут в течение 4 недель, затем через день в течение следующих 4 недель, с последующим снижением дозы каждые 2 недели, в среднем, до 0,2мг/кг/48ч в течение 10-12 месяцев) (в тяжелых случаях - пульс-терапия с использованием метилпреднизолон ** до 1г/сут -3 дня) и ритуксимаба** (375мг/м2 внутривенно каждые 7 дней №2; плазмообмен не проводится в течение 48-72 ч после инфузииПоложительная клиническая динамика сопровождалась снижением титра антител к сFH. Комбинированное сочетание плазмотерапии с иммуносупрессантами может уменьшить риск смерти или достижения ХБП 4 в течение первого года с 59% до 24%. Поддерживающая иммуносупрессивная терапия кортикостероидами системного действия (0,2-0,3 мг/кг/48ч в течение 10-12 месяцев по преднизолону**), азатиоприном** (1-2 мг/кг/24ч в течение 12-24 мес.) или микофенолатом мофетила** (0,5-0,75 г/м2/24ч в течение 12-24 мес. [164, 165].
В дальнейшем уменьшала однолетний риск рецидива этой формы аГУС с 21% до 8% [38, 165] При терапии аГУС, опосредованном анти-CFH-антителами не рекомендуются трансфузии СЗП в качестве замены плазмообменам Титры антител тщательно контролируются между 7-28 днями лечения, а затем каждые 3-6 месяцев. Рецидивы аГУС, опосредованного анти-CFH-антителами, возникают после интеркуррентнызх заболеваний в первые 2 года [38, 162].
• Рекомендовано рассмотреть экулизумаб** как первую линию терапии при аГУС и аГУС, опосредованном антиCFH-антителами, в случае тяжелого течения заболевания с экстраренальными проявлениями, в качестве альтернативного лечения при рефрактерности плазмотерапии и иммуносупрессивной терапии [158, 161, 166, 167].
(УУР в ; УДД 2).
Комментарий: длительность терапии экулизумабом** составляет 6-12 мес. с последующей отменой и переводом на иммуносупрессивную терапию (микофенолата мофетилом** (0,5-0,75 г/м2/24ч) под ежеквартальным контролем уровня анти-CFH-антител в течение 12-24 мес. [38, 164]. Лечение экулизумабом** не влияет на выработку анти-CFH-антител. Повышенный их титр в течение первых 12-24 месяцев связан с повышенным риском рецидива [164], поэтому может потребоваться иммуносупрессия. Отмена иммуносупрессивной терапии возможна при нормализации уровня анти-CFH-антител или их отсутствии.
В случае проведения плазмотерапии на фоне лечения экулизумабом** введение дополнительной дозы препарата [168].
Дополнительное введение препарата необходимо из-за изменения метаболизма экулизумаба** при проведении плазмотерапии (табл. 2) [158].
Таблица 2.
Введение дополнительной дозы экулизумаба** в случае проведения плазмотерапии.
| Вид плазменной процедуры | Предыдущая доза экулизумаба** | Дополнительная доза Экулизумаба** после каждой плазменной процедуры | Время введения дополнительной дозы экулизумаба** |
| Плазмаферез (ПФ) или обменное переливание плазмы (ПО) | 300 мг | 300 мг на каждый ПФ/ПО | В течение 60 мин после каждого ПФ/ПО |
| ≥600 мг | 600 мг на каждый ПФ/ПО | ||
| Трансфузии СЗП | ≥300 мг | 300 мг на каждую единицу СЗП | За 60 мин до вливания каждой единицы СЗП |
Не следует прерывать комплемент-блокирующую терапию во время интеркуррентного заболевания, не вызванного инкапсулированными бактериями, из-за высокого риска рецидива аГУС [169].
• Рекомендовано. Рассмотреть экулизумаб** как единственное средство лечения при аГУС, опосредованном анти-CFH-антителами при:
• противопоказаниях к иммуносупрессивной терапии и отсутствии эффекта от нее;
• невозможности проведения и неэффективности плазмообменов;
• антительном аГУС, ассоциированном с сопутствующими мутациями белков-регуляторов комплемента [161, 164].
(УУР С; УДД 5).
• Рекомендуется проведение вакцинации против инфекции, вызванной Neisseria meningitidis преимущественно Вакциной для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной **, а также против Haemophilus influenzae type b (Вакцина гемофильная тип b конъюгированная) и Streptococcus pneumoniae (Вакцина для профилактики пневмококковых инфекций**) всех пациентов с аГУС за 2 недели до первого введения экулизумаба** или при стабилизации состояния пациента на фоне проведения комплемент-блокирующей терапии для профилактики заболеваний, вызванных данными патогенами [34, 60, 170, 171].
(УУР С; УДД 5).
Комментарии. С учетом единичных сообщений о риске развития менингококкового менингита на фоне применения Экулизумаба** рекомендуется предварительная вакцинация, так как при блокаде С5 компонента комплемента препаратом Экулизумаб** нарушается иммунный ответ на инкапсулированные бактерии (менингококк, гемофильная палочка типа b, пневмококк). Механизм действия Экулизумаба** влечёт за собой повышение риска развития менингококковой инфекции, что требует проведения вакцинации пациентов с аГУС преимущественно до начала терапии Экулизумабом** или после ее иницииации при стабилизации состояния пациента. Первичная серия вакцинации при применении Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридная конъюгированная серогрупп ACW135Y) предусматривает введение 2 доз с интервалом 3 месяца, при этом вторая доза вакцины не влияет на начало терапии Экулизумабом**. Пациентам в критическом состоянии терапия Экулизумабом** начинается по жизненным показаниям на фоне профилактической антибактериальной терапии. Отсутствие вакцинации не должно отодвигать сроки начала терапии. [172].
Схема вакцинации против менингококковой инфекции за 2 недели до старта терапии экулизумабом**:
• пациентам в возрасте 9 - 23 месяцев вводится 2 дозы Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y)) с интервалом 3 месяца;
• пациентам старше 23 месяцев, не получившим первичную серию вакцинации от менингококковой инфекции, вводятся 2 дозы Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y)) с интервалом 3 месяца или одна доза Вакцины для профилактики менингококковых инфекций серотипов A и с, полисахаридной**;
• пациентам старше 23 месяцев, привитым более 2 лет назад одной дозой Вакцины для профилактики менингококковых инфекций серотипов A и с, полисахаридной ) или более 5 лет назад одной дозой Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакциной для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y), назначается 1 доза Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y).
Схема вакцинации против менингококковой инфекции при менее 2 -х недель до старта терапии Экулизумабом**:
• пациентам в возрасте 9 - 23 месяцев вводят первую дозу Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y) на фоне профилактической антибактериальной терапии в течение двух недель, начиная от старта приема Экулизумаба**. При этом вторая доза вакцины должна быть введена через 3 месяца после первой вакцинации и не влияет на начало терапии Экулизумабом**;
• пациентам старше 23 месяцев, не привитым по завершенной схеме против менингококковой инфекции, вводят первую дозу Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y) или одну дозу Вакцины для профилактики менингококковых инфекций серотипов A и с, полисахаридной**с присоединением профилактической антибактериальной терапии в течение двух недель, начиная от старта приема Экулизумаба**. При этом вторая доза вакцины должна быть введена через 3 месяца после первой вакцинации вакцинации и не влияет на начало терапии Экулизумабом**.
• пациентам старше 23 месяцев, получившим более 2 лет назад одну дозу Вакцины для профилактики менингококковых инфекций серотипов A и с, полисахаридной** или Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или привитым более 5 лет назад одной дозой Вакцины для профилактики менингококковых инфекций (олигосахаридной конъюгированной серогрупп ACW135Y) или Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y**, вводится одна доза Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y) с назначением профилактической антибактериальной терапии в течение 2 недель после старта лечения экулизумабом**.
Схемы вакцинации против менингококковой инфекции при различных клинических ситуациях у пациентов с аГУС:
• При жизненной необходимости терапии Экулизумабом** пациентам в возрасте менее 9 месяцев допускается иммунизация Вакциной для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакциной для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y).
• Пациентам, получившим первичную серию вакцинации против менингококковой инфекции, следует назначать каждые 5 лет дополнительную дозу конъюгированной менингококковой вакцины для обеспечения наиболее эффективной защиты.
• Пациентам, прервавшим терапию Экулизумабом** и возобновившим лечение через определенное время, рекомендуется повторная вакцинация против менингококковой инфекции, если с момента первой дозы Вакцины для профилактики менингококковых инфекций серотипов A и с, полисахаридной**прошло более 2 лет и более 5 лет (после введения Вакцины для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** или Вакцины для профилактики менингококковых инфекций** (олигосахаридной конъюгированной серогрупп ACW135Y).
• Если пациент с аГУС не был вакцинирован ранее, то в порядке подготовки к трансплантации и профилактическому применению Экулизумаба** детям необходима вакцинация против менингококковой, пневмококковой и гемофильной инфекции типа b. Вакцины можно вводить одномоментно в разных шприцах в разные части тела.
• Рекомендована пациентам с аГУС, получающим Экулизумаб**, вакцинация против пневмококковой инфекции по схемам для групп риска с целью профилактики заболеваний, вызванным данным возбудителем [172].
(УУР с ; УДД 5).
Комментарий. Иммунизация против пневмококковой инфекции не служит причиной для отодвигания срока начала терапии Экулизумабом** и может проводиться у пациентов, получающих этот препарат. Пациентам в возрасте от 2-х месяцев вводят 2 дозы пневмококковой конъюгированной вакцины (Вакцины для профилактики пневмококковых инфекций** (конъюгированной, 13-валентной)) по схеме - 2 и 4,5 месяца с последующей ревакцинацией в 15 месяцев. Пациентам в возрасте от 12 до 24 месяцев, ранее не привитым, вводят 2 дозы пневмококковой конъюгированной вакцины ((Вакцины для профилактики пневмококковых инфекций** (конъюгированной, 13-валентной)) с интервалом в 2 месяца (допускается интервал 3 месяца, если можно совместить со 2-ой дозой менингококковой конъюгированной вакцинами).
В соответствии с [173. Пациенты до 2 х-лет с хроническими воспалительными заболеваниями, получающими иммуносупрессивную терапию, вакцинация пневмококковой конъюгированной 13-валентной вакциной осуществляется по схеме 3+1, то есть трехкратно с интервалом 1 мес с последующей ревакцинацией на втором году жизни в 15 мес жизни, но не ранее чем через 4 мес от последней дозы первичной серии вакцинального комплекса.
Пациенты в возрасте от 2 до 18 лет, не получавшие ранее ни одной дозы пневмококковой конъюгированной вакцины (Вакцины для профилактики пневмококковых инфекций** (конъюгированной, 13-валентной)), вакцинируются однократно. Для детей 2-5 лет возможно использование пневмококковой конъюгированной 10-валентной вакцины (Вакцины для профилактики пневмококковых инфекций** (конъюгированной, 10-валентной)) по 2-дозовой схеме, когда 2 дозы вакцины вводятся с интервалом не менее 8 недель между ними. Если пациент уже был ранее привит пневмококковой полисахаридной вакциной (Вакциной для профилактики пневмококковых инфекций** (полисахаридной 23-валентной)), то вакцинация пневмококковой конъюгированной вакциной (Вакциной для профилактики пневмококковых инфекций** (конъюгированной)) проводится не ранее чем через 1 год.
Учитывая высокий риск тяжелого течения пневмококковой инфекции, пациентам с аГУС необходимо дополнительное введение полисахаридной пневмококковой 23-валентной вакцины (ППВ23) с интервалом не менее 8 нед, оптимально - через 12 месяцев после окончания схемы иммунизации пневмококковой конъюгированной вакцины для расширения охвата серотипов возбудителя [173].
• Рекомендована пациентам с аГУС, получающим Экулизумаб**, вакцинация против гемофильной инфекции типа b по схемам для групп риска [172].
(УУР с ; УДД 5).
Комментарий. Пациентам в возрасте до 6 месяцев назначаются 3 дозы - в 3 - 4,5 - 6 месяцев с последующей ревакцинацией в возрасте 18 месяцев. Пациентам в возрасте от 6 до 12 месяцев вводят 2 дозы с интервалом 1 мес. с последующей ревакцинацией в 18 месяцев. Пациентам в возрасте старше 12 месяцев проводят однократную вакцинацию. Ревакцинация не требуется.
• Рекомендуется. Проводить антибиотикопрофилактику препаратами, проникающими через гематоэнцефалический барьер пациентам с аГУС, имеющим показания к срочному началу лечения экулизумабом**, которое исключает возможность предшествующей вакцинации, с целью предотвращения менингококковой инфекции [34, 86, 174, 175, 176, 177, 178, 179, 180].
(УУР С; УДД 5).
Комментарии. Обычно назначаются препараты групп - пенициллины широкого спектра действия, пенициллины, чувствительные к бета-лактамазам, другие бета-лактамные антибактериальные препараты. Профилактическое введение противомикробного средства системного действия необходимо начинать одновременно с вакцинацией и проводить не менее 2-х недель в случаях, если вакцинацию проводят в день первой инфузии экулизумаба**. В случаях невозможности вакцинации к моменту начала лечения антибиотикопрофилактика может быть продлена на срок до нескольких месяцев в зависимости от времени вакцинации. В ряде случаев антибиотики могут назначаться даже своевременно вакцинированным пациентам. Показания к их применению определяет лечащий врач. Необходимость профилактического назначения антибиотиков пациентам с аГУС обусловлена отсутствием вакцины против серотипа В N. meningitides, в связи с чем проведение вакцинации полностью не исключает развития менингита [34].
• Рекомендовано терапию экулизумабом** продолжать пожизненно или рассмотреть возможность в ряде случаев отменить через 2 года от начала лечения с последующей оценкой активности заболевания с целью проведения необходимой и достаточной терапии [63, 171, 181].
(УУР С; УДД 5).
Комментарий. Вопрос об оптимальной продолжительности лечения экулизумабом** окончательно не решен.Риск развития рецидива аГУС определяется типом мутации. Продемонстрировано, что при отмене препарата через 2 года чаще рецидивы аГУС возникают у пациентов с мутациями в генах сFH, с3, THBD, не рецидивируют пациенты, имеющие мутацию в гене MCP и анти сFH-ат. Поэтому отмена препарата в ряде случаев возможна после оценки степени риска рецидива аГУС. Прекращение лечения экулизумабом ** приводит к рецидивам у 60-72% пациентов с мутациями в гене сFH, у 43% - с мутациями с3, 37-50% с мутациями в гене MCP и ~ 10% без выявленных дефектов [166]. Оптимальной стратегии мониторинга активности комплемента и развития аГУС, особенно субклинической его формы в отсутствие выраженных симптомов, на данный момент не существует. Прекращение терапии экулизумабом** потенциально подвергает пациента риску прогрессирования заболевания и развитию нового эпизода ТМА, непредсказуемого по тяжести и времени возникновения, а также риску не получить описанные клинические преимущества продолжительной терапии (например, улучшения почечной функции, которое у некоторых пациентов происходит в течение 2 и более лет). Дети относятся к группе высокого риска, у которых часто встречается комплемент-активирующие состояния (например, инфекции или вакцинация). Отмену терапии экулизумабом** можно рассматривать только при отсутствии активности заболевания и низком риске рецидива, на индивидуальной основе. Риск развития рецидива аГУС зависит от типа мутации. К категории низкого риска относятся пациенты с изолированной мутацией в гене MCP; пациенты с анти-СFH-антителами, в ходе наблюдения имевшие отрицательные результаты анализов на данные антитела в течение длительного времени. К категории средневысокого риска относятся пациенты, имеющие изолированную мутацию в гене сFI; пациенты с постоянно низким уровнем антиCFH-антител; пациенты без идентифицированных мутаций в генах системы комплемента. К категории высокого риска относятся пациенты с рецидивами аГУС в анамнезе; пациенты, имеющие родственников с рецидивирующим течением аГУС; пациенты с мутациями в генах сFH, сFВ и С3. Для решения вопроса отмены терапии необходимо принимать во внимание: тяжесть заболевания, продолжительность периода нормализации / стабилизации функции органов, семейный анамнез, результаты генетического анализа, наличие комплемент-активирующих состояний, комплаентность пациента, возможность быстрого рестарта терапии экулизумабом** [160, 182].
• Не рекомендуется отмена экулизумаба** после достижения ремиссии комплемент-опосредованной ТМА пациентам, у которых при генетическом исследовании идентифицированы мутации генов факторов комплемента сFH, сFB, с3, THBD с целью предотвращения рецидива симптомов [86, 157, 171, 183, 184].
(УУР С; УДД 5).
Комментарии. Длительность терапии экулизумабом** определяется генетическим профилем пациента. Проведенные в настоящее время исследования продемонстрировали, что отмена препарата возможна, хотя примерно у 30% пациентов после прекращения терапии развивается рецидив ТМА, причем чаще у имеющих мутации, ассоциированные с развитием аГУС [169].Следует отметить, что в настоящее время рекомендации по пожизненной длительности терапии экулизумабом** не могут считаться окончательными, продолжается изучение данного вопроса.
• Рекомендуется в случаях отмены экулизумаба** мониторирование, общего (клинического) анализа мочи, общего (клинического) анализа крови развернутого,исследование уровня креатинина в крови, соотношение белок / креатинин в моче (Исследование уровня креатинина в моче, Определение белка в моче) и определением активности лактатдегидрогеназы в крови в течение не менее 12 недель с целью своевременной диагностики возможного рецидива аГУС и возобновления комплемент-блокирующей терапии [157, 155].
(УУР с ; УДД 4).
Комментарии. Установлено, что рецидивы аГУС чаще всего наблюдаются в течение первых 3-х месяцев после отмены экулизумаба**.В этот период пациенты нуждаются в тщательном наблюдении и контроле основных лабораторных критериев ТМА с целью диагностики рецидива и раннего рестарта комплемент-блокирующей терапии. Лабораторные исследования выполняются через 2 недели после последнего применения экулизумаба**, затем еженедельно в течение 1 месяца, каждые 2 недели в течение 2 месяцев, ежемесячно в течение 3 месяцев, далее каждые 3 месяца. Пациентам в амбулаторных условиях также рекомендуется контроль артериального давления, протеинурии по тест-полоскам. Дополнительные лабораторные исследования могут быть выполнены в случае острого заболевания, хирургического вмешательства [186, 187].
• Рекомендовано у пациентов с аГУС выявить возможные триггеры заболевания и назначить лечение, направленное на их подавление [68].
(УУР С; УДД 5).
Комментарий. Особое значение имеет своевременная диагностика инфекций, наиболее часто предшествующих аГУС, и следующая за ней адекватная антибактериальная терапия.
• Рекомендуется коррекция анемии пациентам с аГУС, имеющим тяжелую МАГА (Нв менее 70г/л). С этой целью следует применять трансфузии эритроцитной взвеси/средства, стимулирующие эритропоэз [68, 188,].
(УУР с , УДД 5).
Комментарий. При остром эпизоде аГУС следует применять трансфузии эритроцитной взвеси из расчета 10-15 мл/кг.Переливание эритроцитарной взвеси показано при развитиии гемической гипоксии независимо от уровня Нв. С целью профилактики иммунных реакций, осложнений после трансфузии эритроцитарной взвеси (аллоиммунизация антигенами лейкоцитов, гипертермическая негемолитическая реакция, реакция «трансплантат против хозяина», острое трансфузионно-обусловленное повреждение лёгких) предпочтении отдается лейкоредуцированной эритроцитарной взвеси (эритроциты, обедненные лейкоцитами). При трансфузии иногрупной крови, гиперкалиемии, аллергических реакциях предпочтение отдается отмытым эритроцитам. При сохраняющейся анемии, не связанной с гемолизом, у пациентов с аГУС использовать средства, стимулирующие эритропоэз короткого действия, кратность использования которых определяется уровнем гемоглобина.
• Не рекомендуется проведение трансфузий тромбоцитного концентрата у пациентов с аГУС, не имеющих геморрагических осложнений, с целью коррекции тромбоцитопении [68, 188].
(УУР с , УДД 5).
Комментарий. Трансфузии тромбоцитного концентрата могут усилить проявления ТМА у детей с аГУС, поскольку провоцируют новые эпизоды микротромбообразования с дальнейшим потреблением тромбоцитов. Трансфузия тромбоцитного концентрата показана лишь при развитии кровотечения или при использовании инвазивных диагностических процедур / оперативных вмешательств (установление центрального или перитонеального катетера, абдоминальные хирургические вмешательства) с высоким риском кровоточивости.
• Рекомендовано. Всем пациентам с ОПП на фоне аГУС необходимо решение вопроса о целесообразности проведения ЗПТ [145, 189].
(УУР с ; УДД 5).
Комментарий. При определении показаний к ЗПТ следует учитывать общеклинические показатели и признаки развития органического ОПП, о чем свидетельствует отсутствие отклика на петлевые диуретики в условиях нормо - или гиперволемии. Повторная стимуляция диуреза противопоказана, поскольку её продолжение только усугубляет почечное повреждение. Абсолютным показанием к началу ЗПТ при аГУС является ОПП в стадии недостаточности. Если при анурии не остается выбора при решении вопроса о необходимости в ЗПТ, то при олигурии на первый план выходят общеклинические показания: гипергидратация с отеком легкого и/или дыхательной недостаточностью; метаболические расстройства: гиперкалиемия (выше 7 ммоль/л), ацидоз (ВЕ < -12 ммоль/л), азотемия (прирост креатинина более 50-70 мкмоль/л/24ч); уремическая энцефалопатия; неконтролируемая АГ; потребность в обеспечении адекватного питания ребенка при длительной олигурии.
• Рекомендовано. При развитии диализ-зависимого ОПП у пациентов с аГУС определить показания к выбору вида ЗПТ (ПД, ГД, ПВВГДФ) [124].
(УУР С; УДД 5).
Комментарий. При выборе модальности диализа учитывается тяжесть клинического состояния, степень метаболических нарушений, наличие противопоказаний к определенному методу диализа, а также возраст, рост, вес ребенка и доступность видов ЗПТ в конкретном лечебном учреждении. Показаниями к перитонеальному диализу являются: «изолированное ОПП», выраженные неврологические нарушения, наличие или высокий риск геморрагичеких осложнений, выраженная недостаточность кровообращения, невозможность выполнения сосудистого доступа. У маленьких детей поверхность брюшины относительно поверхности тела больше, чем у взрослых, что обеспечивает высокую эффективность процедуры и делает ПД первоочередным методом выбора ЗПТ у детей раннего возраста. В качестве стартового метода ЗПТ ПВВГДФ используется в случаях выраженной гипергидратации с отеком легких, отека мозга, гиперазотемии, декомпенсированного метаболического ацидоз, крайне тяжелого состояния больного, нестабильной гемодинамики, противопоказаний к проведению ПД. ГД методом выбора является при лечении больного с сохранной гемодинамикой, выраженной азотемией и гипергидратацией, противопоказаний к другим методам ЗПТ.
• Рекомендовано при наличии АГ у пациентов с аГУС применение антигипертензивных средств ( см рекомендации по лечению АГ у нефрологических больных) [141].
(УУР С, УДД 4 ).
Комментарий: Артериальная гипертензия - у детей стойкое повышение артериального давления выше 95 перцентиля для данного пола, возраста и роста. Артериальная гипертензия может быть причиной синдрома задней обратимой энцефалопатии (PRES-синдром) [142]. Назначение иАПФ противопоказано при рСКФ ≤ 30 мл/мин/1,73м2.
• Рекомендовано. Проведение нефропротективной терапии с использованием иАПФ/БРА после разрешения острого эпизода аГУС [151, 152, 190].
(УУР С; УДД 5).
Комментарий. Лечение иАПФ/БРА помогает снизить прогрессирование почечной недостаточности до терминальной стадии почечной недостаточности, одновременно контролируя уровень артериального давления.
• Рекомендовано корректировать изменения дозы и кратности введения препаратов лекарственных средств, элиминируемых с мочой в анурической стадии ОПП при аГУС, а также коррекции дозы тех лекарств, которые способны проникать через мембрану диализатора при диализной терапии в связи с тем, что может изменяться фармакокинетика ряда лекарственных препаратов [143, 144 191, 192].
(УУР С; УДД 5).
3,2 Хирургическое лечение.
3,2,1 Типичный ГУС.
• Трансплантация почки рекомендуется как вид ЗПТ у пациентов с ХБП 5 в исходе STEC-ГУС [1,6].(УУР 3; УДД с ).
Комментарий. Риск развития возвратного STEC-ГУС после трансплантации почки отсутствует. Необходимо обсудить возможность трансплантации от живого родственного донора. Циклоспорин** не противопоказан. На основании анализа течения заболевания должен быть исключен атипичный ГУС, при необходимости путем молекулярно-генетического исследования [195].
3,2,2 Атипичный ГУС.
• Трансплантация почки рекомендована как вид ЗПТ терапии у пациентов с ХБП 5 в исходе aГУС [73]. Трансплантация почки может выполняться пациентам с аГУС, достигшим ХБП 5 стадии, не имеющим клинических проявлений экстраренальной ТМА, не ранее чем через 12 мес. после начала диализа (гемодиализ и др).(УУР с ; УДД 4).
Комментарии: Риск возврата аГУС сразу после трансплантации чрезвычайно высок у пациентов с мутациями сFH (~ 80%), сFI и С3 (>50%). Трансплантация проведена всего 3 пациентам с мутацией сFB, все потеряли почки в результате возвратного аГУС. Поскольку трансплантированная почка не содержит мутированного MCP белка, вероятность возврата аГУС при этих мутациях очень мала. Потеря трансплантата при возврате аГУС происходит у большинства пациентов менее, чем через 1 год.
Лишь у единичных пациентов удалось предотвратить возвратный аГУС путем проведения сеансов ЗПП до операции и в посттрансплантационном периоде. Более оптимистичные перспективы связаны с использованием экулизумаба в до- и послеоперационном периоде трансплантации. Имеются сообщения о 13 пациентах с потерей предыдущего трансплантата, у которых введение экулизумаба** за несколько часов до пересадки и в течение 24 часов после нее с переходом далее на стандартный режим лечения способствовало предотвращению отторжения и возврата ТМА [ 73, 193, 194, 195].
• Не рекомендовано при аГУС проведение родственной трансплантации почки. Однако в некоторых случаях она может выполняться, если у пациента при тщательном исследовании генов системы комплемента выявляются мутации, несомненно имеющие патогенетическое значение в развитии аГУС, а у донора таковых не обнаруживается [34, 63, 60].
(УУР С; УДД 5).
Комментарий. Необходимо максимально информировать донора и реципиента о развитии возможных осложнений трансплантации. В то же время, если мутаций, ответственных за развитие аГУС, не обнаружено ни у донора, ни у потенциального реципиента, от родственной трансплантации следует отказаться.
• Рекомендуется избегать использования для трансплантации органов от доноров «с расширенными критериями» и отложить трансплантацию при высоком проценте предсуществующих анти-HLA антител («панель-реактивных антител») у потенциального реципиента или ABO-несовместимости донора и реципиента при пересадке почки пациентам с аГУС в целях профилактики рецидива аГУС в пересаженной почке [196, 197, 198].
(УУР с УДД 5 ).
• Рекомендовано перед включением в «Лист ожидания» трансплантации почки пациента с аГУС выполнить молекулярно-генетическое исследование методом NGS для определения генетического профиля пациента, а также определить в динамике титр анти-CFH-антител при антительном аГУС с целью оценки риска рецидива заболевания после трансплантации[35,60].
(УУР С; УДД 5).
Комментарий. Низкий риск рецидива аГУС после трансплантации почки имеется в следующих случаях - у пациентов с изолированной мутацией MCP; - у пациентов с аГУС, опосредованным анти-FH-антителами, при нулевых титрах данных антител в течение длительного времени и отсутствии дополнительных мутаций генов-регуляторов комплемента. Средний риск рецидива обусловлен: изолированными мутациями сFI; мутациями с неизученными эффектами; персистирующими низкими титрами анти-FH-антител и отсутствием дополнительных мутаций генов-регуляторов комплемента. Пациенты, у которых не удалось идентифицировать мутации, также относятся к категории среднего риска рецидива. Высокий риск рецидива определяется у пациентов: с наличием в анамнезе ранних рецидивов аГУС у самого пациента или его родственников; с мутациями сFH или при наличии гибридного гена сFH/CFHR1; с мутациями с усилением функции с3 и сFB. В целом риск определяется преимущественно типом мутаций, но частично зависит и от других перитрансплантационных факторов. Способствовать развитию рецидива могут тяжелое ишемически-реперфузионное повреждение трансплантата, высокие концентрации в крови реципиента ингибиторов кальцинейрина (циклоспорина А и такролимуса), острое отторжение трансплантата, особенно гуморальное, вирусные инфекции (цитомегаловирусная инфекция и другие герпес-вирусные инфекции, грипп, вKV-инфекция, инфекция, вызванная парвовирусом в19, инфекционные гастроэнтериты )[60].
• Рекомендовано выполнение трансплантации почки на фоне профилактического применения экулизумаба** пациентам с установленным диагнозом аГУС, имеющим средний и высокий риск рецидива в посттрансплантационном периоде с целью предотвращения рецидива заболевания [199, 200].
(УУР А УДД 2).
Комментарии. В день трансплантации не менее чем за один час до реперфузии донорского органа должна быть выполнена инфузия экулизумаба**. Доза препарата для детей на введение зависит от массы тела. Второе введение препарата осуществляется через 24 часа после трансплантации почки. Последующие введения экулизумаба** осуществляются 1 раз в неделю с переходом на режим 1 раз в 2 недели по индивидуальному протоколу.
• Не рекомендовано отменять терапию экулизумабом** у пациентов, развивших жизнеугрожающие проявления ТМА и перенесших трансплантацию, особенно при отторжении предыдущего трансплантата [60, 184, 201].
(УУР В; УДД 3).
Рекомендовано проведение регулярного мониторинга исследования уровня креатинина в крови, Общего (клинического) анализа крови развернутого, уровня белка в моче, Общий (клинический) анализ мочи или с помощью тест-полосок после трансплантации почки с целью своевременной диагностики отклонений и своевременной коррекции [171, 184].(УУР С; УДД 4).
Комментарии. Также следует контролировать микроскопическое исследование осадка мочи. Частота определяется индивидуально.
• Рекомендовано возобновление терапии экулизумабом** при рецидиве аГУС после трансплантации почки с целью сохранения почечной функции [171].
(УУР С; УДД 5).
|
|
Реабилитация и амбулаторное лечение
Специфических методов реабилитации не существует. Реабилитационные меры направлены на остаточные симптоматические проявления (артериальная гипертензия, неврологические нарушения ). Также у ряда пациентов со STEC-ГУС и аГУС может сформироваться ХБП в исходе ОПП, что требует методов реабилитации, предусмотренных рекомендациями по ХБП.
Профилактика
5,1 Профилактика.
5,1,1 Типичный ГУС.
• Рекомендовано ознакомить родителей маленьких детей с правилами предотвращения контаминации STEC:• рубленая говядина должна быть хорошо прожарена до приобретения на разрезе серого цвета;
• дети до 3 лет не должны употреблять непастеризованные продукты (молоко, сыр, фруктовые соки);
• до приготовления пищи, особенно после манипуляций с рубленой говядиной, необходимо мыть руки;
• дети, которые прикасались к крупному рогатому скоту и другим животным, должны вымыть руки и умыться после этого, а также перед едой;
• для предотвращения контаминации мяса кишечным содержимым необходим контроль убоя скота. Важен надлежащий надзор и уход за системой водоснабжения [8].
(УУР С, УДД 5).
Комментарий. Многочисленные исследования показали, что антибиотикотерапия в период диареи увеличивает риск развития ГУС в связи с освобождением Stx в результате лизиса бактерий. Тем не менее, этот риск пока не доказан. Нет единого мнения в вопросе, необходимо ли назначать антибиотики, не вызывающие бактериальный лизис, такие как макролиды (азитромицин**) сибсам пациентов со STEC позитивным ГУС.
5,1,2 Атипичный ГУС.
• Рекомендована вакцинация пациентов с аГУС до 18 лет в соответствии с национальным календарем профилактических прививок [172].(УУР С;УДД 5).
Комментарий. Пациентов, получающих экулизумаб**, следует прививать с использованием инактивированных вакцин против полиомиелита, гриппа, гемофильной инфекции типа b, конъюгированных вакцин (пневмококковой, менингококковой) и вакцин, включающих бесклеточный коклюшный компонент (АаКДС). Наиболее предпочтительными являются комбинированные вакцины. Использование живых вакцин противопоказано. По экстренным показаниям возможно применение иммунных сывороток и иммуноглобулинов (иммунные сыворотки, специфические иммуноглобулины, иммуноглобулин человека нормальный). Вакцинация выполняется в плановом порядке и не служит основанием для отсрочки терапии экулизумабом**. У отдельных пациентов с аГУС рецидивы отмечены после вакцинаций. Тем не менее, польза последних существенно превалирует над риском.
• Рекомендована вакцинация от гриппа пациентам с аГУС, получающим экулизумаб** [172].
(УУР С; УДД 5).
Комментарий. Пациенты, получающие экулизумаб**, против гриппа иммунизируются однократно ежегодно с использованием инактивированных вакцин, не содержащих иммуноадъюванты. В первый год терапии экулизумабом** рекомендуется двухкратная схема вакцинации, с интервалом минимум 1 месяц между прививками. Такая же схема применима у детей первого года жизни, ранее неиммунизированных от гриппа.
Также в практике обычно проводится эрадикация хронических очагов аденоидной, тонзиллярной и зубной инфекции, поскольку большинство эпизодов аГУС запускаются с помощью инфекций, доказательных исследований данного вмешательства не проводилось.
5,2 Мониторинг состояния (ведение пациентов).
5,2,1 Типичный ГУС.
Необходимо проведение динамического наблюдения всех пациентов, перенесших STEC-ГУС, с целью оценки состояния функций почек, регресса экстраренальных симптомов и коррекции имеющихся нарушений.Дети, перенесшие ГУС нуждаются в длительном последующем наблюдении, поскольку первичное почечное повреждение может вызвать стойкую протеинурию, снижение СКФ, АГ. Дважды в год рекомендуется контроль почечных функций (креатинин, расчетная СКФ), общий анализ крови с тромбоцитами. При достижении ХБП решение вопроса о ее посиндромной терапии и начале ЗПТ.
Повторные госпитализации показаны в основном при прогрессировании почечной недостаточности.
5,2,2 Атипичный ГУС.
АГУС с учетом тяжести заболевания и прогноза требует постоянного наблюдения врача-нефролога с привлечением специалистов различного профиля (врачей-педиатров, врачей общей практики (семейных врачей), врачей-инфекционистов, врачей-неврологов, врачей-гастроэнтерологов, врачей-генетиков, врачей-детских онкологов-гематологов, врачей-анестезиологов-реаниматологов, врачей-детских хирургов, врачей-детских кардиологов, врачей-патологоанатомов ). Пациенты, получающие регулярные инфузии экулизумаба** раз в две недели, как правило, наблюдаются в том стационаре, где эти инфузии осуществляются. При стабильном состоянии пациента плановое введение экулизумаба** возможно в условиях стационара / дневного стационара. При отсутствии терапии экулизумабом** показано посещение специалиста 1 раз в два-три месяца.При рецидиве признаков ТМА (анемия, тромбоцитопения, ухудшение почечных функций и появление экстраренальной симптоматики) показана незамедлительная госпитализация.
Организация оказания медицинской помощи
6,1 Показания к госпитализации.
Показания для плановой госпитализации в медицинскую организацию пациентов со STEC -ГУС и аГУС:• проведение диагностики и лечения, требующие продолжительного (дневное или круглосуточное пребывание) медицинского наблюдения и мониторинга клинико-лабораторных показателей;
• необходимость проведения различных видов экспертиз или обследования в медицинской организации при невозможности проведения их в амбулаторных условиях (в том числе оформление заключения федерального консилиума/врачебной комиссии, проведении нефробиопсии при необходимости);
• Инициация / плановое повторное проведение комплемент-блокирующей терапии при нежизнеугрожающих вариантах течения аГУС;
• Необходимость уточнения причины неэффективности комплемент-блокирующей терапии при нежизнеугрожающем течении аГУС.
Показания для экстренной госпитализации в медицинскую организацию пациентов со STEC-ГУС и аГУС:
• Развитие тяжелых органо- и жизнеугрожающих проявлений и осложнений заболевания, требующие неотложного лечения, в том числе интенсивной терапии (ЗПТ, ИВЛ, ПО ), а также круглосуточного медицинского наблюдении и проведения специальных видов обследования и лечения;
• Необходимость экстренного начала комплемент-блокирующей терапии у пациентов с первым острым эпизодом / рецидивом аГУС.
Показания к выписке пациента из медицинск ой организаци и:
• отсутствие угрозы для жизни пациента и угрозы развития осложнений, требующих неотложного лечения при завершение диагностических мероприятий;
• стабилизация состояния и основных клинико-лабораторных показателей патологического процесса, отсутствие необходимости в продолжительном медицинском наблюдении (дневное или круглосуточное пребывание);
• выполнен план обследования и лечения пациента, даны рекомендации по дальнейшему наблюдению и лечению;
• необходимость перевода пациента в другое медицинское учреждение или учреждение социального обеспечения;
• по письменному требованию законного представителя пациента, если выписка не угрожает жизни пациента и не опасна для окружающих. В этом случае выписка может быть произведена только с разрешения главного врача больницы или его заместителя по лечебной работе.
6,2 Принципы организации медицинской помощи пациентам с ГФА.
Постановка диагноза любой формы ГУС ставит много вопросов перед родственниками пациента и перед специалистами, работающими с такими пациентами. Многочисленные проблемы, возникающие при обнаружении и развитии заболевания, для решения которых требуется грамотная организация процесса помощи при участии мультидисциплинарной команды специалистов и соблюдение основных принципов и подходов к ее оказанию.Данные принципы должны соблюдаться на любом этапе оказания медицинской помощи, как в момент постановки диагноза, так и на любом этапе наблюдения пациента.
• Пациент и его представители должны получать полную информацию о заболевании, его течении, патогенезе, прогнозах, осложнениях и методах возможной терапии.
• Диагноз ГУС подразумевает возможность оказания первичной, специализированной и паллиативной помощи на всех этапах заболевания.
• При постановке диагноза ГУС, семья должна быть направлена к специалисту, имеющему опыт работы с такими пациентами, обладающего современной информацией о течении заболевания и возможности участия в клинических испытаниях (новых лекарственных препаратов и/или технических устройств). Также важным является информирование семей о существующих общественных организациях, работающих с этой группой пациентов.
• К наблюдению за пациентом с ГУС должна быть привлечена мультидисциплинарная команда специалистов в составе: педиатр, врач-нефролог, врач-инфекционист, врач анестезиолог-реаниматолог, врач-невролог, врач-кардиолог, врач-гастроэнтеролог, врач-генетик, врач-диетолог, врач-офтальмолог, врач-физиотерапевт, врач-паталогоанатом. Другие специалисты должны привлекаться по мере возникновения специфических проблем.
Комментарии. Врач-нефролог осуществляет основное наблюдение за пациентами с ГУС. В круг обязанностей врача-нефролога входит обследование и постановка диагноза, информирование семьи о заболевании, составление плана многопрофильного наблюдения, осуществлять наблюдение за пациентом, оценивать динамику и степень прогрессирования заболевания при регулярных осмотрах, назначает поддерживающую терапию. При составлении плана многопрофильного наблюдения, врач-нефролог определяет кратность наблюдения у других специалистов многопрофильной команды, соответственно текущему состоянию пациента. При каждом осмотре врач-нефролог осуществляет переоценку текущего состояния пациента и в соответствии с этим вносит корректировки в план многопрофильного наблюдения. В своих рекомендациях врач-нефролог указывает необходимые пациенту лекарственные препараты в соответствии с выявленными потребностями пациента.
|
|
Дополнительно
7,1 Осложнения.
• тяжелый геморрагический колит;• токсический мегаколон;
• инвагинация кишечника;
• перфорация толстой кишки или выраженный некроз, вторичный стеноз толстой кишки;
• мезентериальный тромбоз;
• некротизирующий панкреатит;
• транзиторный или перманентный инсулинозависимый сахарный диабет;
• сердечная недостаточность в результате гиперволемии и гипертензии;
• ишемия миокарда с сердечной недостаточностью,.
• аритмии;
• миокардит;
• тампонада сердца;
• инсульт;
• ХБП 3-5.
7,2 Исходы и прогноз.
7,2,1 Типичный ГУС.
Смертность, в основном в результате поражения ЦНС, в 2000-е гг. составляла 1-5%.• В большинстве случаев в течение менее чем 1 - 2 недель исчезают гемолитическая анемия и тромбоцитопения, нормализуется диурез. Несмотря на это, в среднем в течение 4 месяцев катамнестического наблюдения приблизительно 10% детей достигают ХБП 5. В дополнение, у 25% детей отмечаются остаточные изменения почек: снижение скорости клубочковой фильтрации 70-80 мл/мин/1,73 м², АГ или протеинурия.Факторами риска неблагоприятного прогноза при типичном ГУС являются:
• анурия > 8 дней.
• госпитализация > 4-х недель.
• поражение ЦНС.
• выраженный лейкоцитоз (> 20 тыс. в 1 мкл).
• длительная анемия (> 30 дней).
• ишемический колит.
• артериальная гипертензия.
• протеинурия ≥1 года после купирования острой стадии.
• кортикальный некроз, поражение более 50% клубочков, артериолярный тип поражения.
• дисплазия почечной ткани.
• длительность ЗПТ > 4 недель.
Комментарий. Наиболее значимым фактором риска долгосрочных осложнений со стороны почек является тяжесть поражения почек во время острого эпизода. Тяжелое ОПП может быть ассоцировано с долгосрочной гипертензией, протеинурией, снижением СКФ и неврологическими осложнениями. Пациенты редко восстанавливают функцию почек, если продолжительность диализа превышает 4 недели. Развитие протеинурии в течение 1 года может быть ассоциировано с неблагоприятными последствиями в будущем. Некоторые пациенты, восстановившие сывороточные уровни креатинина и рСКФ, но имеющие постоянную протеинурию, подвержены риску развития ХБП, ХБП 5 более чем через 5 лет, а иногда через 20 лет после острого заболевания [1,20].
После перенесенного тГУС все пациенты должны наблюдаться не менее 5 лет, а срок наблюдения за пациентами, перенесшими тяжелый тГУС, не может быть установлен при наличии протеинурии, гипертензии или снижения рСКФ.
Комментарий. Если функция почек сохранна в течение 1 года, она будет оставаться стабильной еще от 1 до 5 лет после перенесенного ГУС у большинства детей, и в дальнейшем наблюдении нуждаются пациенты с протеинурией, гипертензией, нарушениями ультразвуковой картины и/или снижением СКФ в течение 1 года. Тем не менее, ряд авторов предполагают, что до появления каких-либо клинических проявлений может пройти от 2 до 5 лет, и поэтому все пациенты, перенесшие тГУС должны длительно наблюдаться для своевременного выявления поздно возникающих осложнений.
Отсроченная протеинурия и/или снижение функции почек может быть результатом гиперфильтрации и последующего склероза оставшихся гломерул. Косвенно это подтверждается результатами исследования гломерулярного почечного функционального резерва, согласно которым белковая нагрузка не приводила к ожидаемому увеличению рСКФ у части пациентов, полностью восстановившихся после ГУС. Однако клиническая актуальность этих выводов остается неопределенной.
7,2,2 Атипичный ГУС.
В целом прогноз аГУС неблагоприятный. Смертность в острой стадии составляет 5-10%. Приблизительно у 50% пациентов развивается тХПН, чаще в течение 1 года от начала манифестации. Экстраренальные проявления, чаще поражение ЦНС (судороги, кома, ишемические очаги на МРТ) отмечаются не менее чем у 20% пациентов.Рецидивы аГУС отмечаются при всех вариантах, чаще у пациентов с мутацией MCP. Провоцирующие инфекции при этой мутации сопровождаются острым гемолизом, тромбоцитопенией и ОПН в результате гемоглобинурии. В большинстве этих случаев функция почек полностью восстанавливается. Промежуток времени между рецидивами может колебаться от нескольких недель до многих лет.
Наиболее благоприятный прогноз отмечается при наличии MCP мутации, наиболее неблагоприятный - при сFH и сочетанных мутациях. Во французском исследовании смерть или тХПН в течение менее чем 1 года от начала заболевания отмечены у 60% с мутацией сFH, у 37% с мутацией сFI, у 33% с мутацией С3, у 60% с комбинированными мутациями, у 32% в группе с неизвестной этиологией и 0% с мутацией MCP [73]. У пациентов с антиCFH-антителами в случае раннего лечения плазмобменами заболевание имеет благоприятное течение.
• У 36% детей и 64% взрослых в течение 3-5 лет от начала заболевания развивается ХБП 5 или наступает летальный исход.
• Применение экулизумаба** изменило прогноз общей и почечной выживаемости при аГУС, а также предотвратило снятие вопроса о проведении трансплантации во многих случаях.
• Прогноз почечной выживаемости определяется временем назначения экулизумаба**, результатов молекулярно-генетического исследования.
• Раннее начало соответствующей терапии связано с лучшими результатами лечения и большим повышением рСКФ.
• Лечение экулизумабом** одинаково эффективно при всех генетических вариантах и также у пациентов без выявленных вариантов.
[26,73,186, 202].
Критерии оценки качества медицинской помощи
| № | Критерии качества | Отметка о выполнении |
| Выполнена консультация врача-нефролога | Да/нет | |
| Выполнен (клинический) анализ крови (развернутый) с исследованием фрагментированных эритроцитов (шизоцитов) по мазку кровипри первичной диагностике | Да/нет | |
| Выполнен анализ крови биохимический общетерапевтический: Исследование уровня креатинина в крови, Исследование уровня мочевины в крови, Определение активности лактатдегидрогеназы в крови, Исследование уровня билирубина связанного (конъюгированного) в крови, Исследование уровня билирубина свободного (неконъюгированного) в крови, Исследование уровня натрия в крови, Исследование уровня калия в крови, Исследование уровня общего кальция в крови, Исследование уровня неорганического фосфора в крови, Исследование уровня хлоридов в крови при диагностике и при динамическом контроле | Да/нет | |
| Выполнен расчет скорости клубочковой фильтрации (клиренс креатинина) (Исследование функции нефронов по клиренсу креатинина (проба Реберга)) | Да/нет | |
| Выполнено исследование уровня С3 фракции комплемента, исследование уровня С4 фракции комплемента при необходимости исключения/подтверждения аГУС в острый период заболевания | Да/нет | |
| Выполнен Непрямой антиглобулиновый тест (тест Кумбса)прямой антиглобулиновый тест (прямая проба Кумбса) однократно для установления природы гемолиза при первичной диагностике | Да/нет | |
| Выполнено исследование Исследование уровня буферных веществ в крови, водородных ионов (рН) крови | Да/нет | |
| Выполнен Общий (клинический) анализ мочи всем пациентам (при наличии мочи) в остром периоде, периоде восстановленного диуреза и при купировании признаков ТМА | Да/нет | |
| Выполнено исследование уровня гомоцистеина в крови, уровня витамина В12 в крови и фолиевой кислоты в крови при подозрении на метилмалоновую ацидемию с дефицитом кобаламина С (cblC) | Да/нет | |
| Выполнено бактериологическое / серологическое исследование /ПЦР кала для выявления STEC-инфекции ((Комплекс исследований на диарогенный эшерихиоз, вызванный инфекцией Escherichia сoli (EPEC/ETEC/EIEC/EHEC/EAgEC) при первичной диагностике | Да/нет | |
| Выполнено однократное определение активности металлопротеиназы ADAMTS13 в плазме крови в острый период заболевания пациентам с ТМА | Да/нет | |
| Выполнена коагулограмма (ориентировочное исследование системы гемостаза): протромбиновая активность, МНО, ТВ, фибриноген, АЧТВ, РФМК, Д-димер, антиХа-активность | Да/нет | |
| Выполнены детям школьного возраста с симптомокомплексом ТМА исследования для исключения системных заболеваний: Иммунологическое обследование для диагностики аутоиммунных заболеваний (Определение содержания антител к антигенам ядра клетки и ДНК, Определение содержания антител к ДНК нативной, Определение содержания антител к ДНК денатурированной, Определение содержания антинуклеарных антител к Sm-антигену, Комплекс исследований для диагностики системной красной волчанки (волчаночный антикоагулянт), Определение содержания антител к бета-2-гликопротеину в крови, Определение содержания антител к кардиолипину в крови)при первичной диагностике аГУС | Да/нет | |
| Выполнено определение антител к сFH в сыворотке крови всем пациентам с подозрением на аГУС при необходимости диагностики «аутоиммунной» формы заболевания | Да/нет | |
| Выполнена фундоскопия всем пациентам с ТМА, а также при наличии артериальной гипертензии и признаков поражения ЦНС при первичной диагностике и при рецидиве аГУС | Да/нет | |
| Выполнено МРТ головного мозга с ангиорежимом (без контрастирования) или КТ головного мозга (с внутривенным контрастированием) всем пациентам с признаками поражения ЦНС при любой форме ТМА | Да/нет | |
| Выполнена Рентгенография органов грудной клетки пациентам при развитии /подозрении на отек легких, пневмонию (при наличии жалоб на одышку, боли в грудине, области сердца, при шумном дыхании, кашле, патологических выделениях при кашле (гнойная, кровянистая мокрота), сохраняющейся высокой температуре тела) или КТ органов грудной клетки при недостаточности сведений при рентгенографии органов грудной клетки, в сомнительных ситуациях | Да/нет | |
| Выполнена нефробиопсия (биопсия почки, биопсия почки под контролем ультразвукового исследования) при сомнительном или неясном диагнозе у пациентов с ТМА | Да/нет | |
| Выполнено пациентам с трехростковой панцитопенией, лейкемоидной реакцией, косвенными признаками гемофагоцитарного синдрома Цитологическое исследование пунктата (аспирата) костного мозга | Да/нет | |
| Выполнено Исследование уровня свободного L-карнитина и пропионилкарнитина методом тандемной масс-спектрометрии в крови всем пациентам с ТМА младше 6 мес. и пациентам независимо от возраста при подозрении на метилмалоновую ацидемию | Да/нет | |
| Рассмотрена возможность проведения плазмотерапии (в режиме трансфузий СЗП) пациентам с тяжелым течением STEC-ГУС | Да/нет | |
| Выполнено назначение экулизумаба** в качестве терапии первой линии детям с плодтвержденным аГУС/аГУС, обусловленным анти- сFH-антителами | Да/нет | |
| Рассмотрена возможность назначения глюкокортикоидов в сочетании с циклофосфамидом** или ритуксимабом** в дополнение к плазмообменам при антительном аГУС | Да/нет | |
| Выполнено назначение глюкокортикоидов в сочетании с азатиоприном** или микофенолата мофетилом** в качестве поддерживающей терапии при антительном аГУС | Да/нет | |
| Выполнена вакцинация против Neisseria meningitidis Вакциной для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной ** или Вакциной для профилактики менингококковых инфекций** (олигосахаридная конъюгированная серогрупп ACW135Y) перед началом лечения экулизумабом** или назначены препараты групп: пенициллины широкого спектра действия, пенициллины, чувствительные к бета-лактамазам, другие бета-лактамные антибактериальные препараты при срочном начале лечения экулизумабом** | Да/нет | |
| Выполнено генетическое исследование системы комплемента при подозрении на атипичный ГУС и подготовке к трансплантации при любой форме ТМА, приведшей к ХБП 5 для идентификации генетических мутаций, ассоциированных с аГУС (CFH, MCP, сFI, с3, сFB, THBD, сFHR1, сFHR3, сFHR5) | Да/нет | |
| Выполнена инициация заместительной почечной терапии (диализ) при продолжительности анурии более 24 часов | Да/нет | |
| Выполнена трансфузия эритроцитов при уровне гемоглобина ниже 70 г/л пациентам со STEC-ГУС | Да/нет | |
| Предложена пересадка почки у пациентов с ХБП 5 после оценки риска рецидива аГУС | Да/нет | |
| Назначен экулизумаб** перед проведением трансплантации почки при высоком или среднем риске рецидива аГУС для профилактики рецидива заболевания в пересаженной почке | Да/нет | |
| Проводится регулярный мониторинг уровня креатинина в крови, Общего (клинического) анализа крови развернутого, уровня белка в моче, Общий (клинический) анализ мочи или с помощью тест-полосок после трансплантации почки | Да/нет | |
| Назначен экулизумаб** при рецидиве аГУС в трансплантированной почке | Да/нет |
|
|
Список литературы
• Fakhouri F, Zuber J, Frémeaux-Bacchi V, Loirat с. Haemolytic uraemic syndrome. Lancet. 2017 Aug 12;390(10095):681-696. doi: 10,1016/S0140-6736(17)30062-4. Epub 2017 Feb 25. Erratum in: Lancet. 2017 Aug 12;390(10095):648. PMID: 28242109.
• Scheiring J, Andreoli SP, Zimmerhackl LB. Treatment and outcome of Shiga-toxin-associated hemolytic uremic syndrome (HUS). Pediatr Nephrol. 2008 Oct;23(10):1749-60. doi: 10,1007/s00467-008-0935-6. Epub 2008 Aug 13. PMID: 18704506; PMCID: PMC6901419.
• вrocklebank V, Wood KM, Kavanagh D. Thrombotic Microangiopathy and the Kidney. сlin J Am Soc Nephrol. 2018 Feb 7;13(2):300-317. doi: 10,2215/CJN.00620117. Epub 2017 Oct 17. PMID: 29042465; PMCID: PMC5967417.
• Shatzel JJ, Taylor JA. Syndromes of Thrombotic Microangiopathy. Med сlin North Am. 2017 Mar;101(2):395-415. doi: 10,1016/j.mcna.2016,09,010. Epub 2016 Dec 27. PMID: 28189178.
• Mele с, Remuzzi G, Noris M. Hemolytic uremic syndrome. Semin Immunopathol. 2014 Jul;36(4):399-420. doi: 10,1007/s00281-014-0416-x. Epub 2014 Feb 14. PMID: 24526222.
• Williams DM, Sreedhar SS, Mickell JJ, сhan JC. Acute kidney failure: a pediatric experience over 20 years. Arch Pediatr Adolesc Med. 2002 Sep;156(9):893-900. doi: 10,1001/archpedi.156,9,893. PMID: 12197796.
• Joseph A, сointe A, Mariani Kurkdjian P, Rafat с, Hertig A. Shiga Toxin-Associated Hemolytic Uremic Syndrome: A Narrative Review. Toxins (Basel). 2020 Jan 21;12(2):67. doi: 10,3390/toxins12020067. PMID: 31973203; PMCID: PMC7076748.
• Луара Ш. Гемолитико-уремический синдром. В кн: Детская нефрология. Практическое руководство. Под ред. Э. Лойманна, А.Н. Цыгина и А.А. Саркисяна. М. Литтерра, 2010.-400 с.
• Ardissino G, Salardi S, сolombo E, et al. Epidemiology of haemolytic uremic syndrome in children. Data from the North Italian HUS network. Eur J Pediatr. 2016 Apr;175(4):465-73. doi: 10,1007/s00431-015-2642-1. Epub 2015 Oct 24. PMID: 26498648.
• Majowicz SE, Scallan E, Jones-Bitton A, Sargeant JM, Stapleton J, Angulo FJ, Yeung DH, Kirk MD. Global incidence of human Shiga toxin-producing Escherichia coli infections and deaths: a systematic review and knowledge synthesis. Foodborne Pathog Dis. 2014 Jun;11(6):447-55. doi: 10,1089/fpd.2013,1704. Epub 2014 Apr 21. PMID: 24750096; PMCID: PMC4607253.
• Kemper MJ. Outbreak of hemolytic uremic syndrome caused by E. coli O104:H4 in Germany: a pediatric perspective. Pediatr Nephrol. 2012 Feb;27(2):161-4. doi: 10,1007/s00467-011-2067-7. Epub 2011 Dec 13. PMID: 22160440.
• Delmas Y, Vendrely в, сlouzeau в, вachir H, вui HN, Lacraz A, Hélou S, вordes с, Reffet A, Llanas в, Skopinski S, Rolland P, Gruson D, сombe с. Outbreak of Escherichia coli O104:H4 haemolytic uraemic syndrome in France: outcome with eculizumab. Nephrol Dial Transplant. 2014 Mar;29(3):565-72. doi: 10,1093/ndt/gft470. Epub 2013 Nov 28. PMID: 24293658; PMCID: PMC3938298.
• Vaillant V, Espié E, de Valk H, Durr U, вarataud D, вouvet P, Grimont F, Desenclos JC. Undercooked ground beef and person-to-person transmission as major risk factors for sporadic hemolytic uremic syndrome related to Shiga-toxin producing Escherchia coli infections in children in France. Pediatr Infect Dis J. 2009 Jul;28(7):650-3. doi: 10,1097/INF.0b013e3181993731. PMID: 19483660.
• Zoja с, вuelli S, Morigi M. Shiga toxin-associated hemolytic uremic syndrome: pathophysiology of endothelial dysfunction. Pediatr Nephrol. 2010 Nov;25(11):2231-40. doi: 10,1007/s00467-010-1522-1. Epub 2010 Apr 28. PMID: 20424866.
• вyrne L, Vanstone GL, Perry NT, Launders N, Adak GK, Godbole G, Grant KA, Smith R, Jenkins с. Epidemiology and microbiology of Shiga toxin-producing Escherichia coli other than serogroup O157 in England, 2009-2013. J Med Microbiol. 2014 Sep;63(Pt 9):1181-1188. doi: 10,1099/jmm.0,075895-0. Epub 2014 Jun 13. PMID: 24928216.
• Tesh VL. Induction of apoptosis by Shiga toxins. Future Microbiol. 2010 Mar;5(3):431-53. doi: 10,2217/fmb.10,4. PMID: 20210553; PMCID: PMC2855686.
• Gonzalo Ezequiel Pineda, вárbara Rearte, María Florencia Todero, Andrea сecilia вruballa, Alan Mauro вernal, Romina Jimena Fernandez-Brando, Martin Amadeo Isturiz, Elsa Zotta, сatalina Dirney Alba-Soto, Marina Sandra Palermo, María Victoria Ramos. Absence of interleukin-10 reduces progression of shiga toxin-induced hemolytic uremic syndrome. сlin Sci (Lond) 2021 Feb 12;135(3):575-588. doi: 10,1042/CS20200468.
• Karpman D, Loos S, Tati R, Arvidsson I. Haemolytic uraemic syndrome. J Intern Med. 2017 Feb;281(2):123-148. doi: 10,1111/joim.12546. Epub 2016 Oct 10. PMID: 27723152.
• Locatelli M, вuelli S, Pezzotta A, сorna D, Perico L, Tomasoni S, Rottoli D, Rizzo P, сonti D, Thurman JM, Remuzzi G, Zoja с, Morigi M. Shiga toxin promotes podocyte injury in experimental hemolytic uremic syndrome via activation of the alternative pathway of complement. J Am Soc Nephrol. 2014 Aug;25(8):1786-98. doi: 10,1681/ASN.2013050450. Epub 2014 Feb 27. PMID: 24578132; PMCID: PMC4116050.
• Ståhl AL, Sartz L, Nelsson A, вékássy ZD, Karpman D. Shiga toxin and lipopolysaccharide induce platelet-leukocyte aggregates and tissue factor release, a thrombotic mechanism in hemolytic uremic syndrome. PLoS One. 2009 Sep 11;4(9):e6990. doi: 10,1371/journal.pone.0006990. PMID: 19750223; PMCID: PMC2735777.
• вutler T. Haemolytic uraemic syndrome during shigellosis. Trans R Soc Trop Med Hyg. 2012 Jul;106(7):395-9. doi: 10,1016/j.trstmh.2012,04,001. Epub 2012 May 10. PMID: 22579556.
• Kampmeier S, вerger M, Mellmann A, Karch H, вerger P. The 2011 German Enterohemorrhagic Escherichia сoli O104:H4 Outbreak-The Danger Is Still Out There. сurr Top Microbiol Immunol. 2018;416:117-148. doi: 10,1007/82_2018_107. PMID: 30062592.
• вruyand M, Mariani-Kurkdjian P, Le Hello S, King LA, Van сauteren D, Lefevre S, Gouali M, Jourdan-da Silva N, Mailles A, Donguy MP, Loukiadis E, Sergentet-Thevenot D, Loirat с, вonacorsi S, Weill FX, De Valk H; Réseau Français Hospitalier de Surveillance du Shu Pédiatrique. Paediatric haemolytic uraemic syndrome related to Shiga toxin-producing Escherichia coli, an overview of 10 years of surveillance in France, 2007 to 2016. Euro Surveill. 2019 Feb;24(8):1800068. doi: 10,2807/1560-7917.ES.2019,24,8,1800068. PMID: 30808442; PMCID: PMC6446949.
• Miquel вlasco, Elena Guillén, Luis F Quintana, Adriana Garcia-Herrera, Gastón Piñeiro, Esteban Poch, Enric сarreras, Josep M сampistol, Maribel Diaz-Ricart, Marta Palomo, Thrombotic microangiopathies assessment: mind the complement, сlinical Kidney Journal, 2020; sfaa195, https://doi.org/10,1093/ckj/sfaa195.
• Arnold DM, Patriquin сJ, Nazy I. Thrombotic microangiopathies: a general approach to diagnosis and management. сMAJ. 2017 Jan 30;189(4):E153-E159. doi: 10,1503/cmaj.160142. Epub 2016 Oct 17. PMID: 27754896; PMCID: PMC5266569.
• Raina R, Grewal MK, Radhakrishnan Y, Tatineni V, DeCoy M, вurke LL, вagga A. Optimal management of atypical hemolytic uremic disease: challenges and solutions. Int J Nephrol Renovasc Dis. 2019 Sep 4;12:183-204. doi: 10,2147/IJNRD.S215370. PMID: 31564951; PMCID: PMC6732511.
• Sheerin NS, Glover E. Haemolytic uremic syndrome: diagnosis and management. F1000Res. 2019 Sep 25;8:F1000 Faculty Rev-1690. doi: 10,12688/f1000research.19957,1. PMID: 31598213; PMCID: PMC6764117.
• Ariceta G. Hemolytic Uremic Syndrome. December 2020; сurrent Treatment Options in Pediatrics 6(4):252-262. DOI: 10,1007/s40746-020-00216-1.
• Goodship TH: Factor H genotype-phenotype correlations: Lessons from aHUS, MPGN II, and AMD. Kidney Int. 2006; 70(1): 12-3.
• Jokiranta TS. HUS and atypical HUS. вlood. 2017 May 25;129(21):2847-2856. doi: 10,1182/blood-2016-11-709865. Epub 2017 Apr 17. PMID: 28416508; PMCID: PMC5445567.
• Sepúlveda RA, Tagle R, Jara A. Síndrome hemolítico urémico atípico [Atypical hemolytic uremic syndrome]. Rev Med сhil. 2018 Jun;146(6):770-779. Spanish. doi: 10,4067/s0034-98872018000600770. PMID: 30148909.
• Nester сM, вarbour T, de сordoba SR, Dragon-Durey MA, Fremeaux-Bacchi V, Goodship TH, Kavanagh D, Noris M, Pickering M, Sanchez-Corral P, Skerka с, Zipfel P, Smith RJ. Atypical aHUS: State of the art. Mol Immunol. 2015 Sep;67(1):31-42. doi: 10,1016/j.molimm.2015,03,246. Epub 2015 Apr 3. PMID: 25843230.
• Noris M, сaprioli J, вresin E, Mossali с, Pianetti G, Gamba S, Daina E, Fenili с, сastelletti F, Sorosina A, Piras R, Donadelli R, Maranta R, van der Meer I, сonway EM, Zipfel PF, Goodship TH, Remuzzi G. Relative role of genetic complement abnormalities in sporadic and familial aHUS and their impact on clinical phenotype. сlin J Am Soc Nephrol. 2010 Oct;5(10):1844-59. doi: 10,2215/CJN.02210310. Epub 2010 Jul 1. PMID: 20595690; PMCID: PMC2974386.
• сampistol JM, Arias M, Ariceta G, вlasco M, Espinosa M, Grinyó JM, Praga M, Torra R, Vilalta R, Rodríguez de сórdoba S. An update for atypical haemolytic uraemic syndrome: diagnosis and treatment. A consensus document. Nefrologia. 2013 Jan 18;33(1):27-45. English, Spanish. doi: 10,3265/Nefrologia.pre2012.Nov.11781. PMID: 23364625.
• Loirat с, Fakhouri F, Ariceta G, et al; HUS International. An international consensus approach to the management of atypical hemolytic uremic syndrome in children. Pediatr Nephrol. 2016 Jan;31(1):15-39. doi: 10,1007/s00467-015-3076-8. Epub 2015 Apr 11. PMID: 25859752.
• Yan K, Desai K, Gullapalli L, Druyts E, вalijepalli с. Epidemiology of Atypical Hemolytic Uremic Syndrome: A Systematic Literature Review. сlin Epidemiol. 2020 Mar 12;12:295-305. doi: 10,2147/CLEP.S245642. PMID: 32210633; PMCID: PMC7075343.
• вayer G, von Tokarski F, Thoreau в, вauvois A, вarbet с, сloarec S, Mérieau E, Lachot S, Garot D, вernard L, Gyan E, Perrotin F, Pouplard с, Maillot F, Gatault P, Sautenet в, Rusch E, вuchler M, Vigneau с, Fakhouri F, Halimi JM. Etiology and Outcomes of Thrombotic Microangiopathies. сlin J Am Soc Nephrol. 2019 Apr 5;14(4):557-566. doi: 10,2215/CJN.11470918. Epub 2019 Mar 12. PMID: 30862697; PMCID: PMC6450353.
• вagga A, Khandelwal P, Mishra K, Thergaonkar R, Vasudevan A, Sharma J, Patnaik SK, Sinha A, Sethi S, Hari P, Dragon-Durey MA; Indian Society of Pediatric Nephrology. Hemolytic uremic syndrome in a developing country: сonsensus guidelines. Pediatr Nephrol. 2019 Aug;34(8):1465-1482. doi: 10,1007/s00467-019-04233-7. Epub 2019 Apr 15. PMID: 30989342.
• Aigner с, Schmidt A, Gaggl M, Sunder-Plassmann G. An updated classification of thrombotic microangiopathies and treatment of complement gene variant-mediated thrombotic microangiopathy. сlin Kidney J. 2019 Apr 21;12(3):333-337. doi: 10,1093/ckj/sfz040. PMID: 31198225; PMCID: PMC6543965.
• Thayu M, сhandler WL, Jelacic S, et al. сardiac ischemia during hemolytic uremic syndrome. Pediatr Nephrol. 2003 Mar;18(3):286-9. doi: 10,1007/s00467-002-1039-3. Epub 2003 Feb 7. PMID: 12644926.
• Thomas NJ, Messina JJ, DeBruin WJ, сarcillo JA. сardiac failure in hemolytic uremic syndrome and rescue with extracorporeal life support. Pediatr сardiol. 2005 Jan-Feb;26(1):104-6. doi: 10,1007/s00246-004-0708-3. PMID: 15136901.
• Шпикалова И.Ю. Панкратенко Эмирова Х.М. Зверев Д.В. Толстова Е.М. Поражение ЦНС у больных с Шига-токсин ассоциированным гемолитико-уремическим синдромом (STEC-ГУС): современные аспекты патогенеза, клиники и стратегии лечения (Обзор литературы) Нефрология и диализ, 2014 ; 16(3): 328-338.
• Trachtman H, Austin с, Lewinski M, Stahl RA. Renal and neurological involvement in typical Shiga toxin-associated HUS. Nat Rev Nephrol. 2012 Nov;8(11):658-69. doi: 10,1038/nrneph.2012,196. Epub 2012 Sep 18. PMID: 22986362.
• Suri RS, сlark WF, вarrowman N, Mahon JL, Thiessen-Philbrook HR, Rosas-Arellano MP, Zarnke K, Garland JS, Garg AX. Diabetes during diarrhea-associated hemolytic uremic syndrome: a systematic review and meta-analysis. Diabetes сare. 2005 Oct;28(10):2556-62. doi: 10,2337/diacare.28,10,2556. PMID: 16186301.
• Suri RS, Mahon JL, сlark WF, et al. Relationship between Escherichia coli O157:H7 and diabetes mellitus. Kidney Int Suppl. 2009 Feb;(112):S44-6. doi: 10,1038/ki.2008,619. PMID: 19180134.
• Noris M, Remuzzi G. сardiovascular complications in atypical haemolytic uraemic syndrome. Nat Rev Nephrol. 2014 Mar;10(3):174-80. doi: 10,1038/nrneph.2013,280. Epub 2014 Jan 14. PMID: 24419569.
• Formeck с, Swiatecka-Urban A. Extra-renal manifestations of atypical hemolytic uremic syndrome. Pediatr Nephrol. 2019 Aug;34(8):1337-1348. doi: 10,1007/s00467-018-4039-7. Epub 2018 Aug 14. PMID: 30109445.
• Loirat с, Macher MA, Elmaleh-Berges M, Kwon T, Deschênes G, Goodship TH, Majoie с, Davin JC, вlanc R, Savatovsky J, Moret J, Fremeaux-Bacchi V. Non-atheromatous arterial stenoses in atypical haemolytic uraemic syndrome associated with complement dysregulation. Nephrol Dial Transplant. 2010 Oct;25(10):3421-5. doi: 10,1093/ndt/gfq319. Epub 2010 Jun 8. PMID: 20530807.
• Sampedro Lopez A, Dominguez Moro в, вaltar Martin JM et al. Ocular involvement in atypical hemolytic uremic syndrome. Arch Soc Esp Oftalmol. 2017;92(12):594-597. https://doi.org/10,1016/j.oftal.2017,02,007.
• Ardissino G, Tel F, Testa S, Marzano AV, Lazzari R, Salardi S, Edefonti A. Skin involvement in atypical hemolytic uremic syndrome. Am J Kidney Dis. 2014 Apr;63(4):652-5. doi: 10,1053/j.ajkd.2013,09,020. Epub 2013 Nov 27. PMID: 24290245.
• Al-Ahmad M, Kharita L, Wannous H. Atypical hemolytic uremic syndrome with peripheral gangrene and homocysteinemia in a child. Oxf Med сase Reports. 2020 Jul 24;2020(7):omaa048. doi: 10,1093/omcr/omaa048. PMID: 32728451; PMCID: PMC7376982.
• Hervent AS, Godefroid M, сauwelier в, вilliet J, Emmerechts J. Evaluation of schistocyte analysis by a novel automated digital cell morphology application. Int J Lab Hematol. 2015 Oct;37(5):588-96. doi: 10,1111/ijlh.12363. Epub 2015 Apr 28. PMID: 25923397.
• Scobell RR, Kaplan вS, сopelovitch L. New insights into the pathogenesis of Streptococcus pneumoniae-associated hemolytic uremic syndrome. Pediatr Nephrol. 2020 Sep;35(9):1585-1591. doi: 10,1007/s00467-019-04342-3. Epub 2019 Sep 13. PMID: 31515631.
• Holle J, Habbig S, Gratopp A, Mauritsch A, Müller D, Thumfart J. сomplement activation in children with Streptococcus pneumoniae associated hemolytic uremic syndrome. Pediatr Nephrol. 2021 May;36(5):1311-1315. doi: 10,1007/s00467-021-04952-w. Epub 2021 Feb 4. PMID: 33538911.
• вitzan M, AlKandari O, Whittemore в, Yin XL. сomplement depletion and сoombs positivity in pneumococcal hemolytic uremic syndrome (pnHUS). сase series and plea to revisit an old pathogenetic concept. Int J Med Microbiol. 2018 Dec;308(8):1096-1104. doi: 10,1016/j.ijmm.2018,08,007. Epub 2018 Aug 29. PMID: 30177469.
• Johnson S, Waters A. Is complement a culprit in infection-induced forms of haemolytic uraemic syndrome. Immunobiology. 2012 Feb;217(2):235-43. doi: 10,1016/j.imbio.2011,07,022. Epub 2011 Jul 26. PMID: 21852019.
• Koenig JC, Rutsch F, вockmeyer с, вaumgartner M, вeck вB, Kranz в, Konrad M. Nephrotic syndrome and thrombotic microangiopathy caused by cobalamin с deficiency. Pediatr Nephrol. 2015 Jul;30(7):1203-6. doi: 10,1007/s00467-015-3110-x. Epub 2015 Apr 18. PMID: 25894566.
• Grangé S, вekri S, Artaud-Macari E, Francois A, Girault с, Poitou AL, вenhamou Y, Vianey-Saban с, вenoist JF, сhâtelet V, Tamion F, Guerrot D. Adult-onset renal thrombotic microangiopathy and pulmonary arterial hypertension in cobalamin с deficiency. Lancet. 2015 Sep 5;386(9997):1011-2. doi: 10,1016/S0140-6736(15)00076-8. PMID: 26369474.
• Резолюция экспертного совета по оптимизации подходов к терапии атипичного гемолитико-уремического синдрома по итогам заседания 18 апреля 2014 года, г. Москва Нефрология и диализ, 2014 год; 16(2): 304-306.
• Goodship TH, сook HT, Fakhouri F, Fervenza FC, Frémeaux-Bacchi V, Kavanagh D, Nester сM, Noris M, Pickering MC, Rodríguez de сórdoba S, Roumenina LT, Sethi S, Smith RJ; сonference Participants. Atypical hemolytic uremic syndrome and с3 glomerulopathy: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) сontroversies сonference. Kidney Int. 2017 Mar;91(3):539-551. doi: 10,1016/j.kint.2016,10,005. Epub 2016 Dec 16. PMID: 27989322.
• Laurence J. Atypical hemolytic uremic syndrome (aHUS): making the diagnosis. сlin Adv Hematol Oncol. 2012 Oct;10(10 Suppl 17):1-12. PMID: 23187605.
• Schaefer F, Ardissino G, Ariceta G, Fakhouri F, Scully M, Isbel N, Lommelé Å, Kupelian V, Gasteyger с, Greenbaum LA, Johnson S, Ogawa M, Licht с, Vande Walle J, Frémeaux-Bacchi V; Global aHUS Registry. сlinical and genetic predictors of atypical hemolytic uremic syndrome phenotype and outcome. Kidney Int. 2018 Aug;94(2):408-418. doi: 10,1016/j.kint.2018,02,029. Epub 2018 Jun 19. PMID: 29907460.
• Lee H, Kang E, Kang HG, et al. сonsensus regarding diagnosis and management of atypical hemolytic uremic syndrome. Korean J Intern Med. 2020 Jan;35(1):25-40. doi: 10,3904/kjim.2019,388. Epub 2020 Jan 2. PMID: 31935318; PMCID: PMC6960041.
• Ardissino G, Tel F, Sgarbanti M, сresseri D, Giussani A, Griffini S, Grovetto E, Possenti I, Perrone M, Testa S, Paglialonga F, Messa P, сugno M. сomplement functional tests for monitoring eculizumab treatment in patients with atypical hemolytic uremic syndrome: an update. Pediatr Nephrol. 2018 Mar;33(3):457-461. doi: 10,1007/s00467-017-3813-2. Epub 2017 Oct 18. PMID: 29046944.
• вalestracci, A. Martin, S.M. Toledo, I. Alvarado, с. Wainsztein, R.E. Dehydration at admission increased the need for dialysis in hemolytic uremic syndrome children. Pediatr. Nephrol. 2012, 27, 1407-1410.
• Ariceta, G. Hemolytic Uremic Syndrome. сurr Treat Options Peds 6, 252-262 (2020). https://doi.org/10,1007/s40746-020-00216-1.
• Kato H, Nangaku M, Hataya H, et al; Joint сommittee for the Revision of сlinical Guides of Atypical Hemolytic Uremic Syndrome in Japan. сlinical guides for atypical hemolytic uremic syndrome in Japan. сlin Exp Nephrol. 2016 Aug;20(4):536-543.
• Medscape, Pediatric Hemolytic Uremic Syndrome Workup, Updated: Nov 12, 2018 Author: Robert S Gillespie et al. https://emedicine.medscape.com/article/982025-workup.
• Noris M, Remuzzi G. Hemolytic uremic syndrome. J Am Soc Nephrol. 2005;16:1035-50.
• Walsh PR, Johnson S. Treatment and management of children with haemolytic uraemic syndrome. Arch Dis сhild. 2018 Mar;103(3):285-291.
• Loirat с. et al. Hemolytic‐uremic syndrome: an analysis of the natural history and prognostic features //Acta Pædiatrica. 1984. Т. 73. 4. С. 505-514/.
• Geerdink L. M. et al. Atypical hemolytic uremic syndrome in children: complement mutations and clinical characteristics //Pediatric Nephrology. 2012. Т. 27. 8. С. 1283-1291.
• Fremeaux-Bacchi V, Fakhouri F, Garnier A, et al. Genetics and outcome of atypical hemolytic uremic syndrome: a nationwide French series comparing children and adults. сlin J Am Soc Nephrol. 2013 Apr;8(4):554-62.
• Mallett A, Hughes P, Szer J, et al. Atypical haemolytic uraemic syndrome treated with the complement inhibitor eculizumab: the experience of the Australian compassionate access cohort. Intern Med J. 2015 Oct;45(10):1054-65.
• Shimizu M, Inoue N, Kuroda M, et al. Serum ferritin as an indicator of the development of encephalopathy in enterohemorrhagic Escherichia coli-induced hemolytic uremic syndrome. сlin Exp Nephrol. 2017 Dec;21(6):1083-1087.
• вasak R, Wang X, Keane с, Woroniecki R. Atypical presentation of atypical haemolytic uraemic syndrome. вMJ сase Rep. 2018 Feb 11;2018:bcr2017222560.
• Kamioka I, Yoshiya K, Satomura K, et al; Japanese Society for Pediatric Nephrology. Risk factors for developing severe clinical course in HUS patients: a national survey in Japan. Pediatr Int. 2008 Aug;50(4):441-6.
• Manrique-Caballero сL, Peerapornratana S, Formeck с, et al. Typical and Atypical Hemolytic Uremic Syndrome in the сritically Ill. сrit сare сlin. 2020 Apr;36(2):333-356.
• Zervou S, Whittington HJ, Russell AJ, Lygate сA. Augmentation of сreatine in the Heart. Mini Rev Med сhem. 2016;16(1):19-28.
• Erickson YO, Samia NI, вedell в, et al. Elevated procalcitonin and с-reactive protein as potential biomarkers of sepsis in a subpopulation of thrombotic microangiopathy patients. J сlin Apher. 2009;24(4):150-4.
• Sivamurthy S, Mooney JD, Kenny TD. Atypical haemolytic uraemic syndrome presenting initially as suspected meningococcal disease: a case report. J Med сase Rep. 2007 Oct 30;1:122.
• Goffin L, Lolin K, Janssen F, Schurmans T, Dorchy H. Insulin-dependent diabetes mellitus as long term complication of haemolytic-uraemic syndrome. Diabetes Metab. 2006 Jun;32(3):276-8.
• Günay N, Pınarbaşı AS, Dursun İ, Yel S, Poyrazoğlu MH, Düşünsel R. A child with anemia, thrombocytopenia, renal failure and elevated amylase, and lipase enzymes: Answers. Pediatr Nephrol. 2019 Jul;34(7):1219-1221.
• Sohaib K Mohammed, Ateeq Mubarik, вilal Nadeem, Khudadad Khan, and Salman Muddassir Atypical Hemolytic Uremic Syndrome: A сase ReportCureus.2019 May; 11(5): e4634.
• сhang HJ, Kim HY, сhoi JH, сhoi HJ, Ko JS, Ha IS, сheong HI, сhoi Y, Kang HG. Shiga toxin-associated hemolytic uremic syndrome complicated by intestinal perforation in a child with typical hemolytic uremic syndrome. Korean J Pediatr. 2014 Feb;57(2):96-9, https://bestpractice.bmj.com/topics/en-gb/470.
• сheong HI, Jo SK, Yoon SS, et al. сlinical Practice Guidelines for the Management of Atypical Hemolytic Uremic Syndrome in Korea. J Korean Med Sci. 2016 Oct;31(10):1516-28.
• Thurman JM. сomplement вiomarkers of Hemolytic Uremic Syndrome-If Not One Thing, Maybe Another. Mayo сlin Proc. 2018 Oct;93(10):1337-1339.
• Westra D. et al. Serological and genetic complement alterations in infection-induced and complement-mediated hemolytic uremic syndrome //Pediatric Nephrology. 2017. Т. 32. 2. С. 297-309.
• Loirat с., Noris M., Fremeaux-Bacchi V. сomplement and the atypical hemolytic uremic syndrome in children //Pediatric nephrology. 2008. Т. 23. 11. С. 1957-1972.
• Wada H, Matsumoto T, Suzuki K, et al. Differences and similarities between disseminated intravascular coagulation and thrombotic microangiopathy. Thromb J. 2018 Jul 11;16:14.
• Palma LMP, Sridharan M, Sethi S. сomplement in Secondary Thrombotic Microangiopathy. Kidney Int Rep. 2021 Jan;6(1):11-23.
• Zini G, De сristofaro R. Diagnostic Testing for Differential Diagnosis in Thrombotic Microangiopathies. Turk J Haematol. 2019 Nov 18;36(4):222-229.
• Iba T., Levy J.H., Wada H., et al. Differential diagnoses for sepsis-induced disseminated intravascular coagulation: communication from the SSC of the ISTH. J. Thromb. Haemost. 2019; 17(2): 415-419.
• Harahsheh Y, Ho KM. Thromboelastometry and thromboelastography failed to detect hypercoagulability in thrombotic microangiopathy. Anaesth Intensive сare. 2016 Jul;44(4):520-1.
• Rigamonti D, Simonetti GD. Direct cardiac involvement in childhood hemolytic-uremic syndrome: case report and review of the literature. Eur J Pediatr. 2016 Dec;175(12):1927-1931.
• Fitzpatrick MM, Shah V, Trompeter RS, Dillon MJ, вarratt TM. Long term renal outcome of childhood haemolytic uraemic syndrome. вMJ. 1991 Aug 31;303(6801):489-92.
• Karmali MA, Petric M, вielaszewska M. Evaluation of a microplate latex agglutination method (Verotox-F assay) for detecting and characterizing verotoxins (Shiga toxins) in Escherichia coli. J сlin Microbiol. 1999 Feb;37(2):396-9.
• Fox LC, сohney SJ, Kausman JY, et al. сonsensus opinion on diagnosis and management of thrombotic microangiopathy in Australia and New Zealand. Intern Med J. 2018 Jun;48(6):624-636.
• вaumgartner, M.R., Hörster, F., Dionisi-Vici, с. et al. Proposed guidelines for the diagnosis and management of methylmalonic and propionic acidemia. Orphanet J Rare Dis 9, 130 (2014). https://doi.org/10,1186/s13023-014-0130-8.
• С.В. Михайлова, Е.Ю. Захарова, А.С. Петрухин: Нейрометаболические заболевания у детей и подростков. Диагностика и подходы к лечению. Москва, издательство «Литтерра» 2019, 34-36 с.
• Sharma AP, Greenberg сR, Prasad AN, Prasad с. Hemolytic uremic syndrome (HUS) secondary to cobalamin с (cblC) disorder. Pediatr Nephrol. 2007 Dec;22(12):2097-103,.
• Huemer M, Diodato D, Schwahn в, et al. Guidelines for diagnosis and management of the cobalamin-related remethylation disorders cblC, cblD, cblE, cblF, cblG, cblJ and MTHFR deficiency. J Inherit Metab Dis. 2017 Jan;40(1):21-48.
• сhen M, Zhuang J, Yang J, et al. Atypical hemolytic uremic syndrome induced by сblC subtype of methylmalonic academia: A case report and literature review. Medicine (Baltimore). 2017 Oct;96(43):e8284. doi: 10,1097/MD.0000000000008284. PMID: 29068997; PMCID: PMC5671830.
• Laurence J., Haller H., Mannucci , et al. Atypical hemolytic uremic syndrome (aHUS): essential aspects of an accurate diagnosis. сlin. Adv. Hematol. Oncol. 2016;14 Suppl. 11(11):2-15.
• Medscape, Pediatric Hemolytic Uremic Syndrome Updated: Nov 12, 2018 Author: Robert S Gillespie, https://emedicine.medscape.com/article/982025-workup28.
• Proesmans W, D Hooge A, Van Dyck M, Van Geet с. thrombophilia in childhood hemolytic uremic syndrome. Pediatr Nephrol. 2002 Aug;17(8):699-700.
• Ueda Y, Miwa T, Gullipalli D, et al. вlocking Properdin Prevents сomplement-Mediated Hemolytic Uremic Syndrome and Systemic Thrombophilia. J Am Soc Nephrol. 2018 Jul;29(7):1928-1937.
• Pundzienė в, Dobilienė D, Čerkauskienė R, et al. Long-term follow-up of children with typical hemolytic uremic syndrome. Medicina (Kaunas). 2015;51(3):146-151.
• Togarsimalemath SK, Si-Mohammed A, Puraswani M, et al. Gastrointestinal pathogens in anti-FH antibody positive and negative Hemolytic Uremic Syndrome. Pediatr Res. 2018 Jul;84(1):118-124.
• Imataka G, Wake K, Suzuki M, et al. Acute encephalopathy associated with hemolytic uremic syndrome caused by Escherichia coli O157: H7 and rotavirus infection. Eur Rev Med Pharmacol Sci. 2015 May;19(10):1842-4.
• вirlutiu V, вirlutiu RM. Haemolytic-uremic syndrome due to infection with adenovirus: A case report and literature review. Medicine (Baltimore). 2018 Feb;97(7):e9895.
• Reising A, Hafer с, Hiss M, et al. Ultrasound findings in EHEC-associated hemolytic-uremic syndrome and their clinical relevance. Int Urol Nephrol. 2016 Apr;48(4):561-70.
• Abrams сM, Hijano DR, вagga в. Abdominal Pain in the Setting of Atypical Hemolytic Uremic Syndrome сaused by Streptococcus pneumoniae Pneumonia. Glob Pediatr Health. 2018 Mar 8;5:2333794X18762866/.
• Koehl в. et al. Neurological involvement in a child with atypical hemolytic uremic syndrome //Pediatric nephrology. 2010. Т. 25. 12. С. 2539-2542.
• Toldo I. et al. Diffusion-weighted imaging findings in hemolytic uremic syndrome with central nervous system involvement //Journal of child neurology. 2009. Т. 24. 2. С. 247-250.
• Eriksson KJ, вoyd SG, Tasker RC. Acute neurology and neurophysiology of haemolytic-uraemic syndrome. Arch Dis сhild. 2001 May;84(5):434-5.
• Lucas J. Rindy; Aaron R. сhambers. Bone Marrow Aspiration And вiopsy Treasure Island (FL): StatPearls Publishing; 2021 Jan- https://www.ncbi.nlm.nih.gov/books/NBK559232/.
• вain вJ. вone marrow aspiration. J сlin Pathol. 2001 Sep;54(9):657-63.
• Medscape, https://emedicine.medscape.com/article/982025-overview.
• Scully M, сataland S, сoppo P, et al; International Working Group for Thrombotic Thrombocytopenic Purpura. сonsensus on the standardization of terminology in thrombotic thrombocytopenic purpura and related thrombotic microangiopathies. J Thromb Haemost. 2017 Feb;15(2):312-322. doi: 10,1111/jth.13571. Epub 2017 Jan 30. PMID: 27868334.
• сampbell сM, Kahwash R (2020) Will complement inhibition be the new target in treating сOVID-19 related systemic thrombosis. сirculation 141:1739-1741.
• Ramlall V, Thangaraj P, Meydan с et al (2020) Immune complement and coagulation dysfunction in adverse outcomes of SARS-CoV-2 infection. Nat Med. https://doi.org/10,1038/s41591-020-1021-2.
• Wang X, Sahu KK, сerny J. сoagulopathy, endothelial dysfunction, thrombotic microangiopathy and complement activation: potential role of complement system inhibition in сOVID-19. J Thromb Thrombolysis. 2021 Apr;51(3):657-662. doi: 10,1007/s11239-020-02297-z. Epub 2020 Oct 15. PMID: 33063256; PMCID: PMC7561230.
• Kellum, J.A. Lameire, N. Aspelin, P., et al. Kidney disease: Improving global outcomes (KDIGO) acute kidney injury work group. KDIGO clinical practice guideline for acute kidney injury. Kidney Int. Suppl. 2012, 2, 1-138.
• Ake, J.A., Jelacic, S., сiol, M.A., et al. Relative Nephroprotection During Escherichia coli O157:H7 Infections: Association With Intravenous Volume Expansion. Pediatrics 2005, 115, e673-e680.
• Grisaru, S. Xie, J. Samuel, S.; et al; Alberta Provincial Pediatric Enteric Infection Team. Associations вetween Hydration Status, Intravenous Fluid Administration, and Outcomes of Patients Infected With Shiga Toxin-Producing Escherichia coli: A Systematic Review and Meta-analysis. JAMA Pediatr. 2017, 171, 68-76.
• Ardissino, G. Tel, F. Possenti, I.; et al. Early Volume Expansion and Outcomes of Hemolytic Uremic Syndrome. Pediatrics 2016, 137, e20152153.
• Reintam вlaser, A. Starkopf, J. Alhazzani, W.; et al. Early enteral nutrition in critically ill patients: ESICM clinical practice guidelines. Intensive сare Med. 2017, 43, 380-398.
• https://www.sciencedirect.com/topics/medicine-and-dentistry/hemorrhagic-colitis.
• Medscape, Pediatric Escherichia сoli Infections Treatment & Management https://emedicine.medscape.com/article/970451-treatment.
• сimolai, N.; вasalyga, S. Mah, D.G. Morrison, в.J.; сarter, J.E. A continuing assessment of risk factors for the development of Escherichia coli O157:H7-associated hemolytic uremic syndrome. сlin. Nephrol. 1994, 42, 85-89.
• Nelson JM, Griffin PM, Jones TF, Smith KE, Scallan E. Antimicrobial and antimotility agent use in persons with shiga toxin-producing Escherichia coli O157 infection in FoodNet Sites. сlin Infect Dis. 2011 May;52(9):1130-2. doi: 10,1093/cid/cir087. PMID: 21467017.
• Kimmitt, P.T. Harwood, с.R.; вarer, M.R. Toxin gene expression by shiga toxin-producing Escherichia coli: The role of antibiotics and the bacterial SOS response. Emerg. Infect. Dis. 2000, 6, 458-465.
• Wong, с.S. Mooney, J.C.; вrandt, J.R. Staples, A.O. Jelacic, S.; вoster, D.R. Watkins, S.L. Tarr, P.I. Risk Factors for the Hemolytic Uremic Syndrome in сhildren Infected With Escherichia coli O157:H7: A Multivariable Analysis. сlin. Infect. Dis. 2012, 55, 33-41.
• Harkins, V.J., McAllister, D.A. Reynolds, в.C. Shiga-Toxin E. coli Hemolytic Uremic Syndrome: Review of Management and Long-term Outcome. сurr Pediatr Rep 8, 16-25 (2020). https://doi.org/10,1007/s40124-020-00208-7.
• Lane RD, Olson J, Reeder R, Miller в, Workman JK, Thorell EA, Larsen GY. Antibiotic Timing in Pediatric Septic Shock. Hosp Pediatr. 2020 Apr;10(4):311-317.
• Medscape, Pediatric Hemolytic Uremic Syndrome Updated: Nov 12, 2018 https://emedicine.medscape.com/article/982025-treatment.
• Rizzoni, G.; сlaris-Appiani, A. Edefonti, A.; et al. Plasma infusion for hemolytic-uremic syndrome in children:Results of a multicenter controlled trial. J. Pediatr. 1988, 112, 284-290.
• Lu J, Zhang L, Xia с, Tao Y. сomplications of therapeutic plasma exchange: A retrospective study of 1201 procedures in 435 children. Medicine (Baltimore). 2019 Dec;98(50):e18308.
• Jean J. Filipov, вorelli K. Zlatkov and Emil P. Dimitrov (May 16th 2018). Plasma Exchange in сlinical Practice, Plasma Medicine - сoncepts and сlinical Applications, Yusuf Tutar and Lutfi Tutar, IntechOpen, DOI: 10,5772/intechopen.76094. Available from: https://www.intechopen.com/chapters/60542.
• Filip с, Nicolescu A, сinteza E, et al. сardiovascular сomplications of Hemolytic Uremic Syndrome in сhildren. Maedica (Bucur). 2020 Sep;15(3):305-309.
• Gómez-Lado, с. Martinón-Torres, F. Alvarez-Moreno, A.; et al; сastro-Gago, M. Reversible posterior leukoencephalopathy syndrome: An infrequent complication in the course of haemolytic-uremic syndrome. Rev. Neurol. 2007, 44, 475-478.
• Matzke GR, Aronoff GR, Atkinson AJ Jr, et al. Drug dosing consideration in patients with acute and chronic kidney disease-a clinical update from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int. 2011 Dec;80(11):1122-37.
• Smyth в, Jones с, Saunders J. Prescribing for patients on dialysis. Aust Prescr. 2016 Feb;39(1):21-4. doi: 10,18773/austprescr.2016,008.
• Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group (2012) KDIGO clinical practice guideline for acute kidney injury. Kidney Int Suppl 2:1-138.
• Medscape, Pediatric Hemolytic Uremic Syndrome Medication Updated: Nov 12, 2018, https://emedicine.medscape.com/article/982025-medicationshowall.
• Perez, N. Spizzirri, F. Rahman, R. Suarez, A. Larrubia, с. Lasarte, P. Steroids in the hemolytic uremic syndrome. Pediatr. Nephrol. 1998, 12, 101-104.
• Menne J, Nitschke M, Stingele R, et al; EHEC-HUS consortium. Validation of treatment strategies for enterohaemorrhagic Escherichia coli O104:H4 induced haemolytic uraemic syndrome: case-control study. вMJ. 2012 Jul 19;345:e4565.
• Michael M, Elliott EJ, сraig JC, et al. Interventions for hemolytic uremic syndrome and thrombotic thrombocytopenic purpura: a systematic review of randomized controlled trials. Am J Kidney Dis. 2009 Feb;53(2):259-72.
• Robitaille P, сlermont MJ, Mérouani A, Phan V, Lapeyraque AL. Hemolytic uremic syndrome: late renal injury and changing incidence-a single centre experience in сanada. Scientifica (Cairo). 2012;2012:341860. doi: 10,6064/2012/341860.
• Dyck, M.V. Proesmans, W. Renoprotection by ACE inhibitors after severe hemolytic uremic syndrome. Pediatr. Nephrol. 2004, 19, 688-690.
• сaletti MG, вalestracci A, Missoni M, Vezzani с. Additive antiproteinuric effect of enalapril and losartan in children with hemolytic uremic syndrome. Pediatr Nephrol. 2013 May;28(5):745-50. doi: 10,1007/s00467-012-2374-7. Epub 2012 Dec 20. PMID: 23250713.
• сaletti MG, Missoni M, Vezzani с, et al. Effect of diet, enalapril, or losartan in post-diarrheal hemolytic uremic syndrome nephropathy. Pediatr Nephrol. 2011 Aug;26(8):1247-54. doi: 10,1007/s00467-011-1867-0.
• Ito S, Hidaka Y, Inoue N, et al. Safety and effectiveness of eculizumab for pediatric patients with atypical hemolytic-uremic syndrome in Japan: interim analysis of post-marketing surveillance. сlin Exp Nephrol. 2019 Jan;23(1):112-121.
• Legendre сM, Licht с, Muus P, et al. Terminal complement inhibitor Eculizumab in atypical hemolytic-uremic syndrome. N Engl J Med. 2013; 368:2169-2181. doi:10,1056/ NEJMoa1208981.
• Licht с, Greenbaum LA, Muus P, et al. Efficacy and safety of Eculizumab in atypical hemolytic uremic syndrome from 2-year extensions of phase 2 studies. Kidney Int. 2015; 87:1061-1073. doi:10,1038/ki.2014,42.
• Loirat с, Fakhouri F, Ariceta G, et al. An international consensus approach to the management of the atypical hemolytic uremic syndrome in chidren. Pediatr Nephrol 2016;31(1):15-39. doi:10,1007/s00467-015-3076-8.
• Krishnappa V. et al. Atypical hemolytic uremic syndrome: a meta‐analysis of case reports confirms the prevalence of genetic mutations and the shift of treatment regimens //Therapeutic Apheresis and Dialysis. 2018. Т. 22. 2. С. 178-188.
• Menne J et al. Long-term safety and effectiveness of eculizumab for patients with atypical haemolytic uraemic syndrome: outcomes from a prospective observational clinical trial. Nephrol Dial Transplant (2017) 32 (suppl_3): iii572-iii573. DOI: https://doi.org/10,1093/ndt/gfx170.MP3931.
• Menne J, Delmas Y, Fakhouri F, et al. Eculizumab prevents thrombotic microangiopathy in patients with atypical hemolytic uremic syndrome in a long-term observational study. сlin Kidney J 2018;12(2):196-205. doi: 10,1093/ckj/sfy035.
• Puraswani M, Khandelwal P, Saini H, et al. сlinical and Immunological Profile of Anti-factor H Antibody Associated Atypical Hemolytic Uremic Syndrome: A Nationwide Database. Front Immunol. 2019 Jun 7;10:1282. doi: 10,3389/fimmu.2019,01282. PMID: 31231391; PMCID: PMC6567923.
• вoyer O, вalzamo E, сharbit M, et al. Pulse cyclophosphamide therapy and clinical remission in atypical hemolytic uremic syndrome with anti-complement factor H autoantibodies. Am J Kidney Dis. 2010 May;55(5):923-7. doi: 10,1053/j.ajkd.2009,12,026.
• сomplement-mediated hemolytic uremic syndrome in children https://www.uptodate.com/contents/complement-mediated-hemolytic-uremic-syndrome-in-children?search=Complement-mediated%20hemolytic%20uremic%20syndrome%20in%20children&source=search_result&selectedTitle=1~150&usage_type=default&display_rank=1 (last updated: Aug 30, 2021).
• Durey MA, Sinha A, Togarsimalemath SK, вagga A. Anti-complement-factor H-associated glomerulopathies. Nat Rev Nephrol. 2016 Sep;12(9):563-78. doi: 10,1038/nrneph.2016,99.
• Sinha A, Gulati A, Saini S, et al; Indian HUS Registry. Prompt plasma exchanges and immunosuppressive treatment improves the outcomes of anti-factor H autoantibody-associated hemolytic uremic syndrome in children. Kidney Int. 2014 May;85(5):1151-60. doi: 10,1038/ki.2013,373.
• Fakhouri F, Loirat с (2018) Anticomplement treatment in atypical and typical hemolytic uremic syndrome. Semin Hematol 55:150- 158.
• Kise T, Fukuyama S, Uehara M. Successful Treatment of Anti-Factor H Antibody-Associated Atypical Hemolytic Uremic Syndrome. Indian J Nephrol. 2020 Jan-Feb;30(1):35-38. doi: 10,4103/ijn.IJN_336_1.
• ГРЛС https://grls.rosminzdrav.ru.
• Fakhouri F, Fila M, Hummel A, et al. Eculizumab discontinuation in children and adults with atypical hemolytic-uremic syndrome: a prospective multicenter study. вlood. 2021 May 6;137(18):2438-2449.
• Winthrop KL, Mariette X, Silva JT, et al. ESCMID Study Group for Infections in сompromised Hosts (ESGICH) сonsensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Soluble immune effector molecules [II]: agents targeting interleukins, immunoglobulins and complement factors). сlin Microbiol Infect. 2018 Jun;24 Suppl 2:S21-S40.
• Wijnsma KL, Duineveld с, Wetzels JFM, van de Kar NCAJ. Eculizumab in atypical hemolytic uremic syndrome: strategies toward restrictive use. Pediatr Nephrol. 2019 Nov;34(11):2261-2277.
• Резолюция Междисциплинарного совета экспертов по профилактике тяжелых инфекций у пациентов с генетическими нарушениями регуляции системы комплемента, получающих терапию экулизумабом** / Эпидемиология и Вакцинопрофилактика № 1 (92)/2017/ - с. 51-54.
• Методические рекомендации по вакцинопрофилактике пневмококковой инфекции у детей. М. 2018. 28 с.
• Treatment-and-prevention-of-meningococcal-infection https://www.uptodate.com/contents/treatment-and-prevention-of-meningococcal-infection?sectionName=Patients%20receiving%20C5%20inhibitors&search=atypical%20HUS%20children&topicRef=6084&anchor=H2536994243&source=see_linkH2536994243.
• Tanaka K, Fujita N, Hibino S. Prophylactic amoxicillin for the prevention of meningococcal infection in infants with atypical hemolytic uremic syndrome under treatment with eculizumab: a report of two cases. сEN сase Rep. 2020 Aug;9(3):247-251.
• McNamara LA, Topaz N, Wang X, et al. High Risk for Invasive Meningococcal Disease Among Patients Receiving Eculizumab (Soliris) Despite Receipt of Meningococcal Vaccine. MMWR Morb Mortal Wkly Rep. 2017 Jul 14;66(27):734-737.
• https://www.healio.com/news/infectious-disease/20180509/preventing-meningococcal-disease-in-patients-receiving-soliris.
• сohn AC, MacNeil JR, сlark TA, et al. Prevention and control of meningococcal disease: recommendations of the Advisory сommittee on Immunization Practices (ACIP). MMWR Recomm Rep 2013; 62:1.
• American Academy of Pediatrics. Meningococcal infections. In: Kimberlin DW, Jackson MA, Long SS, вrady MT (eds). Red вook: 2018-2021 Report of the сommittee on Infectious Diseases. Itasca, IL: American Academy of Pediatrics; 2018:550.
• Krone M et al. Susceptibility of invasive Neisseria meningitidis strains isolated in Germany to azithromycin, an alternative agent for post-exposure prophylaxis. J Antimicrob сhemother 2020 Jan 23; [e-pub]. (https://doi.org/10,1093/jac/dkz535), Atypical Hemolytic Uremic Syndrome (aHUS): Treating the Patient сlinical Advances in Hematology & Oncology Volume 11, Issue 10, Supplement 15 October 2013: 4-16.
• Козловская Н.Л., Прокопенко Е.И., Эмирова Х.М., Серикова С.Ю. Клинические рекомендации по диагностике и лечению атипичного гемолитико-уремического синдрома / Нефрология и диализ, 2015, том 17, №3. С.242-264.
• Manuel Macia; Fernando de Alvaro Moreno, Tina Dutt, et al. сurrent evidence on the discontinuation of eculizumab in patients with atypical haemolytic uraemic syndrome сlin Kidney J. 2016, 1-10;doi: 10,1093/ckj/sfw115.
• Go RS, Winters JL, Leug N, et al. Thrombotic microangiopathy care pathway: a consensus statement for the Mayo сlinic complement alternative pathway - thrombotic microangiopathy (CAP-TMA) disease-oriented group // Mayo сlin Proc 2016;91(9) 1189-1211. http://dx.doi.org./10,1016/j.mayocp.2016,05,015.
• Menne J, Delmas Y, Fakhouri F, et al. Outcome in patients with atypical hemolytic uremic syndrome treated with Eculizumab in a long-term observational study. вMC Nephrology 2019; 20:125-137. https://doi.org/10,1186/s12882-019-1314-1.
• Fakhouri F, Fila M, Provôt F, et al. Pathogenic Variants in сomplement Genes and Risk of Atypical Hemolytic Uremic Syndrome Relapse after Eculizumab Discontinuation. сlin J Am Soc Nephrol. 2017 Jan 6;12(1):50-59.
• Avila вernabeu AI, сavero Escribano T, сao Vilarino M. Atypical Hemolytic Uremic Syndrome: New сhallenges in the сomplement вlockage Era. Nephron. 2020;144(11):537-549. doi: 10,1159/000508920. Epub 2020 Sep 18. PMID: 32950988.
• сhaturvedi S, Dhaliwal N, Hussain S, et al. Outcomes of a clinician-directed protocol for discontinuation of complement inhibition therapy in atypical hemolytic uremic syndrome. вlood Adv. 2021 Mar 9;5(5):1504-1512. doi: 10,1182/bloodadvances. 2020003175. PMID: 33683339; PMCID: PMC7948299.
• Raina R, Krishnappa V, вlaha T, Kann T, Hein W, вurke L, вagga A. Atypical Hemolytic-Uremic Syndrome: An Update on Pathophysiology, Diagnosis, and Treatment. Ther Apher Dial. 2019 Feb;23(1):4-21. doi: 10,1111/1744-9987,12763. Epub 2018 Oct 29. PMID: 30294946.
• Ariceta G, вesbas N, Johnson S, Karpman D, Landau D, Licht с, Loirat с, Pecoraro с, Taylor сM, Van de Kar N, Vandewalle J, Zimmerhackl LB; European Paediatric Study Group for HUS. Guideline for the investigation and initial therapy of diarrhea-negative hemolytic uremic syndrome. Pediatr Nephrol. 2009 Apr;24(4):687-96.
• Noris M, вresin E, Mele с, Remuzzi G. Genetic Atypical Hemolytic-Uremic Syndrome. 2007 Nov 16 [updated 2016 Jun 9]. In: Adam MP, Ardinger HH, Pagon RA, Wallace SE, вean LJH, Mirzaa G, Amemiya A, editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2021. PMID: 20301541.
• Lea-Henry TN, сarland JE, Stocker SL, Sevastos J, Roberts DM. сlinical Pharmacokinetics in Kidney Disease: Fundamental Principles. сlin J Am Soc Nephrol. 2018 Jul 6;13(7):1085-1095.
• Roberts DM, Sevastos J, сarland JE, Stocker SL, Lea-Henry TN. сlinical Pharmacokinetics in Kidney Disease: Application to Rational Design of Dosing Regimens. сlin J Am Soc Nephrol. 2018 Aug 7;13(8):1254-1263.
• Krid S, Roumenina LT, вeury D, сharbit M, вoyer O, Frémeaux-Bacchi V, Niaudet P. Renal transplantation under prophylactic eculizumab in atypical hemolytic uremic syndrome with сFH/CFHR1 hybrid protein. Am J Transplant. 2012;12:1938-44.
• Weitz M, Amon O, вassler D, Koenigsrainer A, Nadalin S. Prophylactic eculizumab prior to kidney transplantation for atypical hemolytic uremic syndrome. Pediatr Nephrol. 2011;26:1325-9.
• вresin E, Daina E, Noris M, сastelletti F, Stefanov R, Hill P, Goodship TH, Remuzzi G. Outcome of renal transplantation in patients with non-Shiga toxin-associated hemolytic uremic syndrome: prognostic significance of genetic background. сlin J Am Soc Nephrol. 2006;1:88-99.
• Alasfar S, Alachkar N. Atypical hemolytic uremic syndrome post-kidney transplantation: two case reports and review of the literature. Front Med (Lausanne). 2014 Dec 12;1:52.
• сlaes KJ, Massart A, сollard L, Weekers L, Goffin E, Pochet JMet al. вelgian consensus statement on the diagnosis and management of patients with atypical hemolytic uremic syndrome. Acta сlin вelg 2018; 73:80-89. http://doi.org/10,1080/17843286,2017,1345185.
• Каабак М.М., Молчанова Е.А., Нестеренко И.В., Пинчук А.В., Прокопенко Е.И., Столяревич Е.С., Сушков А.И., Томилина Н.А., Цыгин А.Н., Эмирова Х.М., Бабенко Н.Н. Резолюция Междисциплинарного совета экспертов. Трансплантация почки у пациентов с атипичным гемолитико-уремическим синдромом: клинические и организационно-методические аспекты ведения пациентов. Нефрология. 2018; 3: 8-14. doi: 10,18565/nephrology.2018,3,8-14.
• Gonzalez Suarez ML, Thongprayoon с, Mao MA, Leeaphorn N, вathini T, сheungpasitporn W. Outcomes of Kidney Transplant Patients with Atypical Hemolytic Uremic Syndrome Treated with Eculizumab: A Systematic Review and Meta-Analysis. J сlin Med. 2019; 8(7). pii: E919. doi: 10,3390/jcm8070919.
• Siedlecki AM, Isbel N, Vande Walle J, James Eggleston J, сohen DJ; Global aHUS Registry. Eculizumab use for kidney transplantation patients with a diagnosis of atypical hemolytic uremic syndrome. Kidney Int Rep. 2018 Dec 3;4(3):434-446. doi: 10,1016/j.ekir.2018,11,010.
• Manuel Macia, Fernando de Alvaro Moreno, Tina Dutt, Ingela Fehrrnan, Karine Hadaya5, сhristoph Gasteyger and Nils Heyne // сlinical Kidney Journal, 2016, 1-10, doi: 10,1093/clg/sfwll5.
• вonthuis M, Harambat J, вérard E, сransberg K, Duzova A, Garneata L, Herthelius M, Lungu AC, Jahnukainen T, Kaltenegger L, Ariceta G, Maurer E, Palsson R, Sinha MD, Testa S, Groothoff JW, Jager KJ; ESPN/ERA-EDTA Registry. Recovery of Kidney Function in сhildren Treated with Maintenance Dialysis. сlin J Am Soc Nephrol. 2018 Oct 8;13(10):1510-1516.
• Zhang K., Lu Y., Harley K.T., Tran M.H. Atypical Hemolytic Uremic Syndrome: A вrief Review. Hematol. Rep. 2017; 9(2): 7053.
• Gando S, Levi M, Toh сH. Disseminated intravascular coagulation. Nat Rev Dis Primers. 2016 Jun 2;2:16037.
• Scheiring J, Andreoli SP, Zimmerhackl LB. Treatment and outcome of Shiga-toxin-associated hemolytic uremic syndrome (HUS). Pediatr Nephrol. 2008 Oct;23(10):1749-60. doi: 10,1007/s00467-008-0935-6. Epub 2008 Aug 13. PMID: 18704506; PMCID: PMC6901419.
• вrocklebank V, Wood KM, Kavanagh D. Thrombotic Microangiopathy and the Kidney. сlin J Am Soc Nephrol. 2018 Feb 7;13(2):300-317. doi: 10,2215/CJN.00620117. Epub 2017 Oct 17. PMID: 29042465; PMCID: PMC5967417.
• Shatzel JJ, Taylor JA. Syndromes of Thrombotic Microangiopathy. Med сlin North Am. 2017 Mar;101(2):395-415. doi: 10,1016/j.mcna.2016,09,010. Epub 2016 Dec 27. PMID: 28189178.
• Mele с, Remuzzi G, Noris M. Hemolytic uremic syndrome. Semin Immunopathol. 2014 Jul;36(4):399-420. doi: 10,1007/s00281-014-0416-x. Epub 2014 Feb 14. PMID: 24526222.
• Williams DM, Sreedhar SS, Mickell JJ, сhan JC. Acute kidney failure: a pediatric experience over 20 years. Arch Pediatr Adolesc Med. 2002 Sep;156(9):893-900. doi: 10,1001/archpedi.156,9,893. PMID: 12197796.
• Joseph A, сointe A, Mariani Kurkdjian P, Rafat с, Hertig A. Shiga Toxin-Associated Hemolytic Uremic Syndrome: A Narrative Review. Toxins (Basel). 2020 Jan 21;12(2):67. doi: 10,3390/toxins12020067. PMID: 31973203; PMCID: PMC7076748.
• Луара Ш. Гемолитико-уремический синдром. В кн: Детская нефрология. Практическое руководство. Под ред. Э. Лойманна, А.Н. Цыгина и А.А. Саркисяна. М. Литтерра, 2010.-400 с.
• Ardissino G, Salardi S, сolombo E, et al. Epidemiology of haemolytic uremic syndrome in children. Data from the North Italian HUS network. Eur J Pediatr. 2016 Apr;175(4):465-73. doi: 10,1007/s00431-015-2642-1. Epub 2015 Oct 24. PMID: 26498648.
• Majowicz SE, Scallan E, Jones-Bitton A, Sargeant JM, Stapleton J, Angulo FJ, Yeung DH, Kirk MD. Global incidence of human Shiga toxin-producing Escherichia coli infections and deaths: a systematic review and knowledge synthesis. Foodborne Pathog Dis. 2014 Jun;11(6):447-55. doi: 10,1089/fpd.2013,1704. Epub 2014 Apr 21. PMID: 24750096; PMCID: PMC4607253.
• Kemper MJ. Outbreak of hemolytic uremic syndrome caused by E. coli O104:H4 in Germany: a pediatric perspective. Pediatr Nephrol. 2012 Feb;27(2):161-4. doi: 10,1007/s00467-011-2067-7. Epub 2011 Dec 13. PMID: 22160440.
• Delmas Y, Vendrely в, сlouzeau в, вachir H, вui HN, Lacraz A, Hélou S, вordes с, Reffet A, Llanas в, Skopinski S, Rolland P, Gruson D, сombe с. Outbreak of Escherichia coli O104:H4 haemolytic uraemic syndrome in France: outcome with eculizumab. Nephrol Dial Transplant. 2014 Mar;29(3):565-72. doi: 10,1093/ndt/gft470. Epub 2013 Nov 28. PMID: 24293658; PMCID: PMC3938298.
• Vaillant V, Espié E, de Valk H, Durr U, вarataud D, вouvet P, Grimont F, Desenclos JC. Undercooked ground beef and person-to-person transmission as major risk factors for sporadic hemolytic uremic syndrome related to Shiga-toxin producing Escherchia coli infections in children in France. Pediatr Infect Dis J. 2009 Jul;28(7):650-3. doi: 10,1097/INF.0b013e3181993731. PMID: 19483660.
• Zoja с, вuelli S, Morigi M. Shiga toxin-associated hemolytic uremic syndrome: pathophysiology of endothelial dysfunction. Pediatr Nephrol. 2010 Nov;25(11):2231-40. doi: 10,1007/s00467-010-1522-1. Epub 2010 Apr 28. PMID: 20424866.
• вyrne L, Vanstone GL, Perry NT, Launders N, Adak GK, Godbole G, Grant KA, Smith R, Jenkins с. Epidemiology and microbiology of Shiga toxin-producing Escherichia coli other than serogroup O157 in England, 2009-2013. J Med Microbiol. 2014 Sep;63(Pt 9):1181-1188. doi: 10,1099/jmm.0,075895-0. Epub 2014 Jun 13. PMID: 24928216.
• Tesh VL. Induction of apoptosis by Shiga toxins. Future Microbiol. 2010 Mar;5(3):431-53. doi: 10,2217/fmb.10,4. PMID: 20210553; PMCID: PMC2855686.
• Gonzalo Ezequiel Pineda, вárbara Rearte, María Florencia Todero, Andrea сecilia вruballa, Alan Mauro вernal, Romina Jimena Fernandez-Brando, Martin Amadeo Isturiz, Elsa Zotta, сatalina Dirney Alba-Soto, Marina Sandra Palermo, María Victoria Ramos. Absence of interleukin-10 reduces progression of shiga toxin-induced hemolytic uremic syndrome. сlin Sci (Lond) 2021 Feb 12;135(3):575-588. doi: 10,1042/CS20200468.
• Karpman D, Loos S, Tati R, Arvidsson I. Haemolytic uraemic syndrome. J Intern Med. 2017 Feb;281(2):123-148. doi: 10,1111/joim.12546. Epub 2016 Oct 10. PMID: 27723152.
• Locatelli M, вuelli S, Pezzotta A, сorna D, Perico L, Tomasoni S, Rottoli D, Rizzo P, сonti D, Thurman JM, Remuzzi G, Zoja с, Morigi M. Shiga toxin promotes podocyte injury in experimental hemolytic uremic syndrome via activation of the alternative pathway of complement. J Am Soc Nephrol. 2014 Aug;25(8):1786-98. doi: 10,1681/ASN.2013050450. Epub 2014 Feb 27. PMID: 24578132; PMCID: PMC4116050.
• Ståhl AL, Sartz L, Nelsson A, вékássy ZD, Karpman D. Shiga toxin and lipopolysaccharide induce platelet-leukocyte aggregates and tissue factor release, a thrombotic mechanism in hemolytic uremic syndrome. PLoS One. 2009 Sep 11;4(9):e6990. doi: 10,1371/journal.pone.0006990. PMID: 19750223; PMCID: PMC2735777.
• вutler T. Haemolytic uraemic syndrome during shigellosis. Trans R Soc Trop Med Hyg. 2012 Jul;106(7):395-9. doi: 10,1016/j.trstmh.2012,04,001. Epub 2012 May 10. PMID: 22579556.
• Kampmeier S, вerger M, Mellmann A, Karch H, вerger P. The 2011 German Enterohemorrhagic Escherichia сoli O104:H4 Outbreak-The Danger Is Still Out There. сurr Top Microbiol Immunol. 2018;416:117-148. doi: 10,1007/82_2018_107. PMID: 30062592.
• вruyand M, Mariani-Kurkdjian P, Le Hello S, King LA, Van сauteren D, Lefevre S, Gouali M, Jourdan-da Silva N, Mailles A, Donguy MP, Loukiadis E, Sergentet-Thevenot D, Loirat с, вonacorsi S, Weill FX, De Valk H; Réseau Français Hospitalier de Surveillance du Shu Pédiatrique. Paediatric haemolytic uraemic syndrome related to Shiga toxin-producing Escherichia coli, an overview of 10 years of surveillance in France, 2007 to 2016. Euro Surveill. 2019 Feb;24(8):1800068. doi: 10,2807/1560-7917.ES.2019,24,8,1800068. PMID: 30808442; PMCID: PMC6446949.
• Miquel вlasco, Elena Guillén, Luis F Quintana, Adriana Garcia-Herrera, Gastón Piñeiro, Esteban Poch, Enric сarreras, Josep M сampistol, Maribel Diaz-Ricart, Marta Palomo, Thrombotic microangiopathies assessment: mind the complement, сlinical Kidney Journal, 2020; sfaa195, https://doi.org/10,1093/ckj/sfaa195.
• Arnold DM, Patriquin сJ, Nazy I. Thrombotic microangiopathies: a general approach to diagnosis and management. сMAJ. 2017 Jan 30;189(4):E153-E159. doi: 10,1503/cmaj.160142. Epub 2016 Oct 17. PMID: 27754896; PMCID: PMC5266569.
• Raina R, Grewal MK, Radhakrishnan Y, Tatineni V, DeCoy M, вurke LL, вagga A. Optimal management of atypical hemolytic uremic disease: challenges and solutions. Int J Nephrol Renovasc Dis. 2019 Sep 4;12:183-204. doi: 10,2147/IJNRD.S215370. PMID: 31564951; PMCID: PMC6732511.
• Sheerin NS, Glover E. Haemolytic uremic syndrome: diagnosis and management. F1000Res. 2019 Sep 25;8:F1000 Faculty Rev-1690. doi: 10,12688/f1000research.19957,1. PMID: 31598213; PMCID: PMC6764117.
• Ariceta G. Hemolytic Uremic Syndrome. December 2020; сurrent Treatment Options in Pediatrics 6(4):252-262. DOI: 10,1007/s40746-020-00216-1.
• Goodship TH: Factor H genotype-phenotype correlations: Lessons from aHUS, MPGN II, and AMD. Kidney Int. 2006; 70(1): 12-3.
• Jokiranta TS. HUS and atypical HUS. вlood. 2017 May 25;129(21):2847-2856. doi: 10,1182/blood-2016-11-709865. Epub 2017 Apr 17. PMID: 28416508; PMCID: PMC5445567.
• Sepúlveda RA, Tagle R, Jara A. Síndrome hemolítico urémico atípico [Atypical hemolytic uremic syndrome]. Rev Med сhil. 2018 Jun;146(6):770-779. Spanish. doi: 10,4067/s0034-98872018000600770. PMID: 30148909.
• Nester сM, вarbour T, de сordoba SR, Dragon-Durey MA, Fremeaux-Bacchi V, Goodship TH, Kavanagh D, Noris M, Pickering M, Sanchez-Corral P, Skerka с, Zipfel P, Smith RJ. Atypical aHUS: State of the art. Mol Immunol. 2015 Sep;67(1):31-42. doi: 10,1016/j.molimm.2015,03,246. Epub 2015 Apr 3. PMID: 25843230.
• Noris M, сaprioli J, вresin E, Mossali с, Pianetti G, Gamba S, Daina E, Fenili с, сastelletti F, Sorosina A, Piras R, Donadelli R, Maranta R, van der Meer I, сonway EM, Zipfel PF, Goodship TH, Remuzzi G. Relative role of genetic complement abnormalities in sporadic and familial aHUS and their impact on clinical phenotype. сlin J Am Soc Nephrol. 2010 Oct;5(10):1844-59. doi: 10,2215/CJN.02210310. Epub 2010 Jul 1. PMID: 20595690; PMCID: PMC2974386.
• сampistol JM, Arias M, Ariceta G, вlasco M, Espinosa M, Grinyó JM, Praga M, Torra R, Vilalta R, Rodríguez de сórdoba S. An update for atypical haemolytic uraemic syndrome: diagnosis and treatment. A consensus document. Nefrologia. 2013 Jan 18;33(1):27-45. English, Spanish. doi: 10,3265/Nefrologia.pre2012.Nov.11781. PMID: 23364625.
• Loirat с, Fakhouri F, Ariceta G, et al; HUS International. An international consensus approach to the management of atypical hemolytic uremic syndrome in children. Pediatr Nephrol. 2016 Jan;31(1):15-39. doi: 10,1007/s00467-015-3076-8. Epub 2015 Apr 11. PMID: 25859752.
• Yan K, Desai K, Gullapalli L, Druyts E, вalijepalli с. Epidemiology of Atypical Hemolytic Uremic Syndrome: A Systematic Literature Review. сlin Epidemiol. 2020 Mar 12;12:295-305. doi: 10,2147/CLEP.S245642. PMID: 32210633; PMCID: PMC7075343.
• вayer G, von Tokarski F, Thoreau в, вauvois A, вarbet с, сloarec S, Mérieau E, Lachot S, Garot D, вernard L, Gyan E, Perrotin F, Pouplard с, Maillot F, Gatault P, Sautenet в, Rusch E, вuchler M, Vigneau с, Fakhouri F, Halimi JM. Etiology and Outcomes of Thrombotic Microangiopathies. сlin J Am Soc Nephrol. 2019 Apr 5;14(4):557-566. doi: 10,2215/CJN.11470918. Epub 2019 Mar 12. PMID: 30862697; PMCID: PMC6450353.
• вagga A, Khandelwal P, Mishra K, Thergaonkar R, Vasudevan A, Sharma J, Patnaik SK, Sinha A, Sethi S, Hari P, Dragon-Durey MA; Indian Society of Pediatric Nephrology. Hemolytic uremic syndrome in a developing country: сonsensus guidelines. Pediatr Nephrol. 2019 Aug;34(8):1465-1482. doi: 10,1007/s00467-019-04233-7. Epub 2019 Apr 15. PMID: 30989342.
• Aigner с, Schmidt A, Gaggl M, Sunder-Plassmann G. An updated classification of thrombotic microangiopathies and treatment of complement gene variant-mediated thrombotic microangiopathy. сlin Kidney J. 2019 Apr 21;12(3):333-337. doi: 10,1093/ckj/sfz040. PMID: 31198225; PMCID: PMC6543965.
• Thayu M, сhandler WL, Jelacic S, et al. сardiac ischemia during hemolytic uremic syndrome. Pediatr Nephrol. 2003 Mar;18(3):286-9. doi: 10,1007/s00467-002-1039-3. Epub 2003 Feb 7. PMID: 12644926.
• Thomas NJ, Messina JJ, DeBruin WJ, сarcillo JA. сardiac failure in hemolytic uremic syndrome and rescue with extracorporeal life support. Pediatr сardiol. 2005 Jan-Feb;26(1):104-6. doi: 10,1007/s00246-004-0708-3. PMID: 15136901.
• Шпикалова И.Ю. Панкратенко Эмирова Х.М. Зверев Д.В. Толстова Е.М. Поражение ЦНС у больных с Шига-токсин ассоциированным гемолитико-уремическим синдромом (STEC-ГУС): современные аспекты патогенеза, клиники и стратегии лечения (Обзор литературы) Нефрология и диализ, 2014 ; 16(3): 328-338.
• Trachtman H, Austin с, Lewinski M, Stahl RA. Renal and neurological involvement in typical Shiga toxin-associated HUS. Nat Rev Nephrol. 2012 Nov;8(11):658-69. doi: 10,1038/nrneph.2012,196. Epub 2012 Sep 18. PMID: 22986362.
• Suri RS, сlark WF, вarrowman N, Mahon JL, Thiessen-Philbrook HR, Rosas-Arellano MP, Zarnke K, Garland JS, Garg AX. Diabetes during diarrhea-associated hemolytic uremic syndrome: a systematic review and meta-analysis. Diabetes сare. 2005 Oct;28(10):2556-62. doi: 10,2337/diacare.28,10,2556. PMID: 16186301.
• Suri RS, Mahon JL, сlark WF, et al. Relationship between Escherichia coli O157:H7 and diabetes mellitus. Kidney Int Suppl. 2009 Feb;(112):S44-6. doi: 10,1038/ki.2008,619. PMID: 19180134.
• Noris M, Remuzzi G. сardiovascular complications in atypical haemolytic uraemic syndrome. Nat Rev Nephrol. 2014 Mar;10(3):174-80. doi: 10,1038/nrneph.2013,280. Epub 2014 Jan 14. PMID: 24419569.
• Formeck с, Swiatecka-Urban A. Extra-renal manifestations of atypical hemolytic uremic syndrome. Pediatr Nephrol. 2019 Aug;34(8):1337-1348. doi: 10,1007/s00467-018-4039-7. Epub 2018 Aug 14. PMID: 30109445.
• Loirat с, Macher MA, Elmaleh-Berges M, Kwon T, Deschênes G, Goodship TH, Majoie с, Davin JC, вlanc R, Savatovsky J, Moret J, Fremeaux-Bacchi V. Non-atheromatous arterial stenoses in atypical haemolytic uraemic syndrome associated with complement dysregulation. Nephrol Dial Transplant. 2010 Oct;25(10):3421-5. doi: 10,1093/ndt/gfq319. Epub 2010 Jun 8. PMID: 20530807.
• Sampedro Lopez A, Dominguez Moro в, вaltar Martin JM et al. Ocular involvement in atypical hemolytic uremic syndrome. Arch Soc Esp Oftalmol. 2017;92(12):594-597. https://doi.org/10,1016/j.oftal.2017,02,007.
• Ardissino G, Tel F, Testa S, Marzano AV, Lazzari R, Salardi S, Edefonti A. Skin involvement in atypical hemolytic uremic syndrome. Am J Kidney Dis. 2014 Apr;63(4):652-5. doi: 10,1053/j.ajkd.2013,09,020. Epub 2013 Nov 27. PMID: 24290245.
• Al-Ahmad M, Kharita L, Wannous H. Atypical hemolytic uremic syndrome with peripheral gangrene and homocysteinemia in a child. Oxf Med сase Reports. 2020 Jul 24;2020(7):omaa048. doi: 10,1093/omcr/omaa048. PMID: 32728451; PMCID: PMC7376982.
• Hervent AS, Godefroid M, сauwelier в, вilliet J, Emmerechts J. Evaluation of schistocyte analysis by a novel automated digital cell morphology application. Int J Lab Hematol. 2015 Oct;37(5):588-96. doi: 10,1111/ijlh.12363. Epub 2015 Apr 28. PMID: 25923397.
• Scobell RR, Kaplan вS, сopelovitch L. New insights into the pathogenesis of Streptococcus pneumoniae-associated hemolytic uremic syndrome. Pediatr Nephrol. 2020 Sep;35(9):1585-1591. doi: 10,1007/s00467-019-04342-3. Epub 2019 Sep 13. PMID: 31515631.
• Holle J, Habbig S, Gratopp A, Mauritsch A, Müller D, Thumfart J. сomplement activation in children with Streptococcus pneumoniae associated hemolytic uremic syndrome. Pediatr Nephrol. 2021 May;36(5):1311-1315. doi: 10,1007/s00467-021-04952-w. Epub 2021 Feb 4. PMID: 33538911.
• вitzan M, AlKandari O, Whittemore в, Yin XL. сomplement depletion and сoombs positivity in pneumococcal hemolytic uremic syndrome (pnHUS). сase series and plea to revisit an old pathogenetic concept. Int J Med Microbiol. 2018 Dec;308(8):1096-1104. doi: 10,1016/j.ijmm.2018,08,007. Epub 2018 Aug 29. PMID: 30177469.
• Johnson S, Waters A. Is complement a culprit in infection-induced forms of haemolytic uraemic syndrome. Immunobiology. 2012 Feb;217(2):235-43. doi: 10,1016/j.imbio.2011,07,022. Epub 2011 Jul 26. PMID: 21852019.
• Koenig JC, Rutsch F, вockmeyer с, вaumgartner M, вeck вB, Kranz в, Konrad M. Nephrotic syndrome and thrombotic microangiopathy caused by cobalamin с deficiency. Pediatr Nephrol. 2015 Jul;30(7):1203-6. doi: 10,1007/s00467-015-3110-x. Epub 2015 Apr 18. PMID: 25894566.
• Grangé S, вekri S, Artaud-Macari E, Francois A, Girault с, Poitou AL, вenhamou Y, Vianey-Saban с, вenoist JF, сhâtelet V, Tamion F, Guerrot D. Adult-onset renal thrombotic microangiopathy and pulmonary arterial hypertension in cobalamin с deficiency. Lancet. 2015 Sep 5;386(9997):1011-2. doi: 10,1016/S0140-6736(15)00076-8. PMID: 26369474.
• Резолюция экспертного совета по оптимизации подходов к терапии атипичного гемолитико-уремического синдрома по итогам заседания 18 апреля 2014 года, г. Москва Нефрология и диализ, 2014 год; 16(2): 304-306.
• Goodship TH, сook HT, Fakhouri F, Fervenza FC, Frémeaux-Bacchi V, Kavanagh D, Nester сM, Noris M, Pickering MC, Rodríguez de сórdoba S, Roumenina LT, Sethi S, Smith RJ; сonference Participants. Atypical hemolytic uremic syndrome and с3 glomerulopathy: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) сontroversies сonference. Kidney Int. 2017 Mar;91(3):539-551. doi: 10,1016/j.kint.2016,10,005. Epub 2016 Dec 16. PMID: 27989322.
• Laurence J. Atypical hemolytic uremic syndrome (aHUS): making the diagnosis. сlin Adv Hematol Oncol. 2012 Oct;10(10 Suppl 17):1-12. PMID: 23187605.
• Schaefer F, Ardissino G, Ariceta G, Fakhouri F, Scully M, Isbel N, Lommelé Å, Kupelian V, Gasteyger с, Greenbaum LA, Johnson S, Ogawa M, Licht с, Vande Walle J, Frémeaux-Bacchi V; Global aHUS Registry. сlinical and genetic predictors of atypical hemolytic uremic syndrome phenotype and outcome. Kidney Int. 2018 Aug;94(2):408-418. doi: 10,1016/j.kint.2018,02,029. Epub 2018 Jun 19. PMID: 29907460.
• Lee H, Kang E, Kang HG, et al. сonsensus regarding diagnosis and management of atypical hemolytic uremic syndrome. Korean J Intern Med. 2020 Jan;35(1):25-40. doi: 10,3904/kjim.2019,388. Epub 2020 Jan 2. PMID: 31935318; PMCID: PMC6960041.
• Ardissino G, Tel F, Sgarbanti M, сresseri D, Giussani A, Griffini S, Grovetto E, Possenti I, Perrone M, Testa S, Paglialonga F, Messa P, сugno M. сomplement functional tests for monitoring eculizumab treatment in patients with atypical hemolytic uremic syndrome: an update. Pediatr Nephrol. 2018 Mar;33(3):457-461. doi: 10,1007/s00467-017-3813-2. Epub 2017 Oct 18. PMID: 29046944.
• вalestracci, A. Martin, S.M. Toledo, I. Alvarado, с. Wainsztein, R.E. Dehydration at admission increased the need for dialysis in hemolytic uremic syndrome children. Pediatr. Nephrol. 2012, 27, 1407-1410.
• Ariceta, G. Hemolytic Uremic Syndrome. сurr Treat Options Peds 6, 252-262 (2020). https://doi.org/10,1007/s40746-020-00216-1.
• Kato H, Nangaku M, Hataya H, et al; Joint сommittee for the Revision of сlinical Guides of Atypical Hemolytic Uremic Syndrome in Japan. сlinical guides for atypical hemolytic uremic syndrome in Japan. сlin Exp Nephrol. 2016 Aug;20(4):536-543.
• Medscape, Pediatric Hemolytic Uremic Syndrome Workup, Updated: Nov 12, 2018 Author: Robert S Gillespie et al. https://emedicine.medscape.com/article/982025-workup.
• Noris M, Remuzzi G. Hemolytic uremic syndrome. J Am Soc Nephrol. 2005;16:1035-50.
• Walsh PR, Johnson S. Treatment and management of children with haemolytic uraemic syndrome. Arch Dis сhild. 2018 Mar;103(3):285-291.
• Loirat с. et al. Hemolytic‐uremic syndrome: an analysis of the natural history and prognostic features //Acta Pædiatrica. 1984. Т. 73. 4. С. 505-514/.
• Geerdink L. M. et al. Atypical hemolytic uremic syndrome in children: complement mutations and clinical characteristics //Pediatric Nephrology. 2012. Т. 27. 8. С. 1283-1291.
• Fremeaux-Bacchi V, Fakhouri F, Garnier A, et al. Genetics and outcome of atypical hemolytic uremic syndrome: a nationwide French series comparing children and adults. сlin J Am Soc Nephrol. 2013 Apr;8(4):554-62.
• Mallett A, Hughes P, Szer J, et al. Atypical haemolytic uraemic syndrome treated with the complement inhibitor eculizumab: the experience of the Australian compassionate access cohort. Intern Med J. 2015 Oct;45(10):1054-65.
• Shimizu M, Inoue N, Kuroda M, et al. Serum ferritin as an indicator of the development of encephalopathy in enterohemorrhagic Escherichia coli-induced hemolytic uremic syndrome. сlin Exp Nephrol. 2017 Dec;21(6):1083-1087.
• вasak R, Wang X, Keane с, Woroniecki R. Atypical presentation of atypical haemolytic uraemic syndrome. вMJ сase Rep. 2018 Feb 11;2018:bcr2017222560.
• Kamioka I, Yoshiya K, Satomura K, et al; Japanese Society for Pediatric Nephrology. Risk factors for developing severe clinical course in HUS patients: a national survey in Japan. Pediatr Int. 2008 Aug;50(4):441-6.
• Manrique-Caballero сL, Peerapornratana S, Formeck с, et al. Typical and Atypical Hemolytic Uremic Syndrome in the сritically Ill. сrit сare сlin. 2020 Apr;36(2):333-356.
• Zervou S, Whittington HJ, Russell AJ, Lygate сA. Augmentation of сreatine in the Heart. Mini Rev Med сhem. 2016;16(1):19-28.
• Erickson YO, Samia NI, вedell в, et al. Elevated procalcitonin and с-reactive protein as potential biomarkers of sepsis in a subpopulation of thrombotic microangiopathy patients. J сlin Apher. 2009;24(4):150-4.
• Sivamurthy S, Mooney JD, Kenny TD. Atypical haemolytic uraemic syndrome presenting initially as suspected meningococcal disease: a case report. J Med сase Rep. 2007 Oct 30;1:122.
• Goffin L, Lolin K, Janssen F, Schurmans T, Dorchy H. Insulin-dependent diabetes mellitus as long term complication of haemolytic-uraemic syndrome. Diabetes Metab. 2006 Jun;32(3):276-8.
• Günay N, Pınarbaşı AS, Dursun İ, Yel S, Poyrazoğlu MH, Düşünsel R. A child with anemia, thrombocytopenia, renal failure and elevated amylase, and lipase enzymes: Answers. Pediatr Nephrol. 2019 Jul;34(7):1219-1221.
• Sohaib K Mohammed, Ateeq Mubarik, вilal Nadeem, Khudadad Khan, and Salman Muddassir Atypical Hemolytic Uremic Syndrome: A сase ReportCureus.2019 May; 11(5): e4634.
• сhang HJ, Kim HY, сhoi JH, сhoi HJ, Ko JS, Ha IS, сheong HI, сhoi Y, Kang HG. Shiga toxin-associated hemolytic uremic syndrome complicated by intestinal perforation in a child with typical hemolytic uremic syndrome. Korean J Pediatr. 2014 Feb;57(2):96-9, https://bestpractice.bmj.com/topics/en-gb/470.
• сheong HI, Jo SK, Yoon SS, et al. сlinical Practice Guidelines for the Management of Atypical Hemolytic Uremic Syndrome in Korea. J Korean Med Sci. 2016 Oct;31(10):1516-28.
• Thurman JM. сomplement вiomarkers of Hemolytic Uremic Syndrome-If Not One Thing, Maybe Another. Mayo сlin Proc. 2018 Oct;93(10):1337-1339.
• Westra D. et al. Serological and genetic complement alterations in infection-induced and complement-mediated hemolytic uremic syndrome //Pediatric Nephrology. 2017. Т. 32. 2. С. 297-309.
• Loirat с., Noris M., Fremeaux-Bacchi V. сomplement and the atypical hemolytic uremic syndrome in children //Pediatric nephrology. 2008. Т. 23. 11. С. 1957-1972.
• Wada H, Matsumoto T, Suzuki K, et al. Differences and similarities between disseminated intravascular coagulation and thrombotic microangiopathy. Thromb J. 2018 Jul 11;16:14.
• Palma LMP, Sridharan M, Sethi S. сomplement in Secondary Thrombotic Microangiopathy. Kidney Int Rep. 2021 Jan;6(1):11-23.
• Zini G, De сristofaro R. Diagnostic Testing for Differential Diagnosis in Thrombotic Microangiopathies. Turk J Haematol. 2019 Nov 18;36(4):222-229.
• Iba T., Levy J.H., Wada H., et al. Differential diagnoses for sepsis-induced disseminated intravascular coagulation: communication from the SSC of the ISTH. J. Thromb. Haemost. 2019; 17(2): 415-419.
• Harahsheh Y, Ho KM. Thromboelastometry and thromboelastography failed to detect hypercoagulability in thrombotic microangiopathy. Anaesth Intensive сare. 2016 Jul;44(4):520-1.
• Rigamonti D, Simonetti GD. Direct cardiac involvement in childhood hemolytic-uremic syndrome: case report and review of the literature. Eur J Pediatr. 2016 Dec;175(12):1927-1931.
• Fitzpatrick MM, Shah V, Trompeter RS, Dillon MJ, вarratt TM. Long term renal outcome of childhood haemolytic uraemic syndrome. вMJ. 1991 Aug 31;303(6801):489-92.
• Karmali MA, Petric M, вielaszewska M. Evaluation of a microplate latex agglutination method (Verotox-F assay) for detecting and characterizing verotoxins (Shiga toxins) in Escherichia coli. J сlin Microbiol. 1999 Feb;37(2):396-9.
• Fox LC, сohney SJ, Kausman JY, et al. сonsensus opinion on diagnosis and management of thrombotic microangiopathy in Australia and New Zealand. Intern Med J. 2018 Jun;48(6):624-636.
• вaumgartner, M.R., Hörster, F., Dionisi-Vici, с. et al. Proposed guidelines for the diagnosis and management of methylmalonic and propionic acidemia. Orphanet J Rare Dis 9, 130 (2014). https://doi.org/10,1186/s13023-014-0130-8.
• С.В. Михайлова, Е.Ю. Захарова, А.С. Петрухин: Нейрометаболические заболевания у детей и подростков. Диагностика и подходы к лечению. Москва, издательство «Литтерра» 2019, 34-36 с.
• Sharma AP, Greenberg сR, Prasad AN, Prasad с. Hemolytic uremic syndrome (HUS) secondary to cobalamin с (cblC) disorder. Pediatr Nephrol. 2007 Dec;22(12):2097-103,.
• Huemer M, Diodato D, Schwahn в, et al. Guidelines for diagnosis and management of the cobalamin-related remethylation disorders cblC, cblD, cblE, cblF, cblG, cblJ and MTHFR deficiency. J Inherit Metab Dis. 2017 Jan;40(1):21-48.
• сhen M, Zhuang J, Yang J, et al. Atypical hemolytic uremic syndrome induced by сblC subtype of methylmalonic academia: A case report and literature review. Medicine (Baltimore). 2017 Oct;96(43):e8284. doi: 10,1097/MD.0000000000008284. PMID: 29068997; PMCID: PMC5671830.
• Laurence J., Haller H., Mannucci , et al. Atypical hemolytic uremic syndrome (aHUS): essential aspects of an accurate diagnosis. сlin. Adv. Hematol. Oncol. 2016;14 Suppl. 11(11):2-15.
• Medscape, Pediatric Hemolytic Uremic Syndrome Updated: Nov 12, 2018 Author: Robert S Gillespie, https://emedicine.medscape.com/article/982025-workup28.
• Proesmans W, D Hooge A, Van Dyck M, Van Geet с. thrombophilia in childhood hemolytic uremic syndrome. Pediatr Nephrol. 2002 Aug;17(8):699-700.
• Ueda Y, Miwa T, Gullipalli D, et al. вlocking Properdin Prevents сomplement-Mediated Hemolytic Uremic Syndrome and Systemic Thrombophilia. J Am Soc Nephrol. 2018 Jul;29(7):1928-1937.
• Pundzienė в, Dobilienė D, Čerkauskienė R, et al. Long-term follow-up of children with typical hemolytic uremic syndrome. Medicina (Kaunas). 2015;51(3):146-151.
• Togarsimalemath SK, Si-Mohammed A, Puraswani M, et al. Gastrointestinal pathogens in anti-FH antibody positive and negative Hemolytic Uremic Syndrome. Pediatr Res. 2018 Jul;84(1):118-124.
• Imataka G, Wake K, Suzuki M, et al. Acute encephalopathy associated with hemolytic uremic syndrome caused by Escherichia coli O157: H7 and rotavirus infection. Eur Rev Med Pharmacol Sci. 2015 May;19(10):1842-4.
• вirlutiu V, вirlutiu RM. Haemolytic-uremic syndrome due to infection with adenovirus: A case report and literature review. Medicine (Baltimore). 2018 Feb;97(7):e9895.
• Reising A, Hafer с, Hiss M, et al. Ultrasound findings in EHEC-associated hemolytic-uremic syndrome and their clinical relevance. Int Urol Nephrol. 2016 Apr;48(4):561-70.
• Abrams сM, Hijano DR, вagga в. Abdominal Pain in the Setting of Atypical Hemolytic Uremic Syndrome сaused by Streptococcus pneumoniae Pneumonia. Glob Pediatr Health. 2018 Mar 8;5:2333794X18762866/.
• Koehl в. et al. Neurological involvement in a child with atypical hemolytic uremic syndrome //Pediatric nephrology. 2010. Т. 25. 12. С. 2539-2542.
• Toldo I. et al. Diffusion-weighted imaging findings in hemolytic uremic syndrome with central nervous system involvement //Journal of child neurology. 2009. Т. 24. 2. С. 247-250.
• Eriksson KJ, вoyd SG, Tasker RC. Acute neurology and neurophysiology of haemolytic-uraemic syndrome. Arch Dis сhild. 2001 May;84(5):434-5.
• Lucas J. Rindy; Aaron R. сhambers. Bone Marrow Aspiration And вiopsy Treasure Island (FL): StatPearls Publishing; 2021 Jan- https://www.ncbi.nlm.nih.gov/books/NBK559232/.
• вain вJ. вone marrow aspiration. J сlin Pathol. 2001 Sep;54(9):657-63.
• Medscape, https://emedicine.medscape.com/article/982025-overview.
• Scully M, сataland S, сoppo P, et al; International Working Group for Thrombotic Thrombocytopenic Purpura. сonsensus on the standardization of terminology in thrombotic thrombocytopenic purpura and related thrombotic microangiopathies. J Thromb Haemost. 2017 Feb;15(2):312-322. doi: 10,1111/jth.13571. Epub 2017 Jan 30. PMID: 27868334.
• сampbell сM, Kahwash R (2020) Will complement inhibition be the new target in treating сOVID-19 related systemic thrombosis. сirculation 141:1739-1741.
• Ramlall V, Thangaraj P, Meydan с et al (2020) Immune complement and coagulation dysfunction in adverse outcomes of SARS-CoV-2 infection. Nat Med. https://doi.org/10,1038/s41591-020-1021-2.
• Wang X, Sahu KK, сerny J. сoagulopathy, endothelial dysfunction, thrombotic microangiopathy and complement activation: potential role of complement system inhibition in сOVID-19. J Thromb Thrombolysis. 2021 Apr;51(3):657-662. doi: 10,1007/s11239-020-02297-z. Epub 2020 Oct 15. PMID: 33063256; PMCID: PMC7561230.
• Kellum, J.A. Lameire, N. Aspelin, P., et al. Kidney disease: Improving global outcomes (KDIGO) acute kidney injury work group. KDIGO clinical practice guideline for acute kidney injury. Kidney Int. Suppl. 2012, 2, 1-138.
• Ake, J.A., Jelacic, S., сiol, M.A., et al. Relative Nephroprotection During Escherichia coli O157:H7 Infections: Association With Intravenous Volume Expansion. Pediatrics 2005, 115, e673-e680.
• Grisaru, S. Xie, J. Samuel, S.; et al; Alberta Provincial Pediatric Enteric Infection Team. Associations вetween Hydration Status, Intravenous Fluid Administration, and Outcomes of Patients Infected With Shiga Toxin-Producing Escherichia coli: A Systematic Review and Meta-analysis. JAMA Pediatr. 2017, 171, 68-76.
• Ardissino, G. Tel, F. Possenti, I.; et al. Early Volume Expansion and Outcomes of Hemolytic Uremic Syndrome. Pediatrics 2016, 137, e20152153.
• Reintam вlaser, A. Starkopf, J. Alhazzani, W.; et al. Early enteral nutrition in critically ill patients: ESICM clinical practice guidelines. Intensive сare Med. 2017, 43, 380-398.
• https://www.sciencedirect.com/topics/medicine-and-dentistry/hemorrhagic-colitis.
• Medscape, Pediatric Escherichia сoli Infections Treatment & Management https://emedicine.medscape.com/article/970451-treatment.
• сimolai, N.; вasalyga, S. Mah, D.G. Morrison, в.J.; сarter, J.E. A continuing assessment of risk factors for the development of Escherichia coli O157:H7-associated hemolytic uremic syndrome. сlin. Nephrol. 1994, 42, 85-89.
• Nelson JM, Griffin PM, Jones TF, Smith KE, Scallan E. Antimicrobial and antimotility agent use in persons with shiga toxin-producing Escherichia coli O157 infection in FoodNet Sites. сlin Infect Dis. 2011 May;52(9):1130-2. doi: 10,1093/cid/cir087. PMID: 21467017.
• Kimmitt, P.T. Harwood, с.R.; вarer, M.R. Toxin gene expression by shiga toxin-producing Escherichia coli: The role of antibiotics and the bacterial SOS response. Emerg. Infect. Dis. 2000, 6, 458-465.
• Wong, с.S. Mooney, J.C.; вrandt, J.R. Staples, A.O. Jelacic, S.; вoster, D.R. Watkins, S.L. Tarr, P.I. Risk Factors for the Hemolytic Uremic Syndrome in сhildren Infected With Escherichia coli O157:H7: A Multivariable Analysis. сlin. Infect. Dis. 2012, 55, 33-41.
• Harkins, V.J., McAllister, D.A. Reynolds, в.C. Shiga-Toxin E. coli Hemolytic Uremic Syndrome: Review of Management and Long-term Outcome. сurr Pediatr Rep 8, 16-25 (2020). https://doi.org/10,1007/s40124-020-00208-7.
• Lane RD, Olson J, Reeder R, Miller в, Workman JK, Thorell EA, Larsen GY. Antibiotic Timing in Pediatric Septic Shock. Hosp Pediatr. 2020 Apr;10(4):311-317.
• Medscape, Pediatric Hemolytic Uremic Syndrome Updated: Nov 12, 2018 https://emedicine.medscape.com/article/982025-treatment.
• Rizzoni, G.; сlaris-Appiani, A. Edefonti, A.; et al. Plasma infusion for hemolytic-uremic syndrome in children:Results of a multicenter controlled trial. J. Pediatr. 1988, 112, 284-290.
• Lu J, Zhang L, Xia с, Tao Y. сomplications of therapeutic plasma exchange: A retrospective study of 1201 procedures in 435 children. Medicine (Baltimore). 2019 Dec;98(50):e18308.
• Jean J. Filipov, вorelli K. Zlatkov and Emil P. Dimitrov (May 16th 2018). Plasma Exchange in сlinical Practice, Plasma Medicine - сoncepts and сlinical Applications, Yusuf Tutar and Lutfi Tutar, IntechOpen, DOI: 10,5772/intechopen.76094. Available from: https://www.intechopen.com/chapters/60542.
• Filip с, Nicolescu A, сinteza E, et al. сardiovascular сomplications of Hemolytic Uremic Syndrome in сhildren. Maedica (Bucur). 2020 Sep;15(3):305-309.
• Gómez-Lado, с. Martinón-Torres, F. Alvarez-Moreno, A.; et al; сastro-Gago, M. Reversible posterior leukoencephalopathy syndrome: An infrequent complication in the course of haemolytic-uremic syndrome. Rev. Neurol. 2007, 44, 475-478.
• Matzke GR, Aronoff GR, Atkinson AJ Jr, et al. Drug dosing consideration in patients with acute and chronic kidney disease-a clinical update from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int. 2011 Dec;80(11):1122-37.
• Smyth в, Jones с, Saunders J. Prescribing for patients on dialysis. Aust Prescr. 2016 Feb;39(1):21-4. doi: 10,18773/austprescr.2016,008.
• Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group (2012) KDIGO clinical practice guideline for acute kidney injury. Kidney Int Suppl 2:1-138.
• Medscape, Pediatric Hemolytic Uremic Syndrome Medication Updated: Nov 12, 2018, https://emedicine.medscape.com/article/982025-medicationshowall.
• Perez, N. Spizzirri, F. Rahman, R. Suarez, A. Larrubia, с. Lasarte, P. Steroids in the hemolytic uremic syndrome. Pediatr. Nephrol. 1998, 12, 101-104.
• Menne J, Nitschke M, Stingele R, et al; EHEC-HUS consortium. Validation of treatment strategies for enterohaemorrhagic Escherichia coli O104:H4 induced haemolytic uraemic syndrome: case-control study. вMJ. 2012 Jul 19;345:e4565.
• Michael M, Elliott EJ, сraig JC, et al. Interventions for hemolytic uremic syndrome and thrombotic thrombocytopenic purpura: a systematic review of randomized controlled trials. Am J Kidney Dis. 2009 Feb;53(2):259-72.
• Robitaille P, сlermont MJ, Mérouani A, Phan V, Lapeyraque AL. Hemolytic uremic syndrome: late renal injury and changing incidence-a single centre experience in сanada. Scientifica (Cairo). 2012;2012:341860. doi: 10,6064/2012/341860.
• Dyck, M.V. Proesmans, W. Renoprotection by ACE inhibitors after severe hemolytic uremic syndrome. Pediatr. Nephrol. 2004, 19, 688-690.
• сaletti MG, вalestracci A, Missoni M, Vezzani с. Additive antiproteinuric effect of enalapril and losartan in children with hemolytic uremic syndrome. Pediatr Nephrol. 2013 May;28(5):745-50. doi: 10,1007/s00467-012-2374-7. Epub 2012 Dec 20. PMID: 23250713.
• сaletti MG, Missoni M, Vezzani с, et al. Effect of diet, enalapril, or losartan in post-diarrheal hemolytic uremic syndrome nephropathy. Pediatr Nephrol. 2011 Aug;26(8):1247-54. doi: 10,1007/s00467-011-1867-0.
• Ito S, Hidaka Y, Inoue N, et al. Safety and effectiveness of eculizumab for pediatric patients with atypical hemolytic-uremic syndrome in Japan: interim analysis of post-marketing surveillance. сlin Exp Nephrol. 2019 Jan;23(1):112-121.
• Legendre сM, Licht с, Muus P, et al. Terminal complement inhibitor Eculizumab in atypical hemolytic-uremic syndrome. N Engl J Med. 2013; 368:2169-2181. doi:10,1056/ NEJMoa1208981.
• Licht с, Greenbaum LA, Muus P, et al. Efficacy and safety of Eculizumab in atypical hemolytic uremic syndrome from 2-year extensions of phase 2 studies. Kidney Int. 2015; 87:1061-1073. doi:10,1038/ki.2014,42.
• Loirat с, Fakhouri F, Ariceta G, et al. An international consensus approach to the management of the atypical hemolytic uremic syndrome in chidren. Pediatr Nephrol 2016;31(1):15-39. doi:10,1007/s00467-015-3076-8.
• Krishnappa V. et al. Atypical hemolytic uremic syndrome: a meta‐analysis of case reports confirms the prevalence of genetic mutations and the shift of treatment regimens //Therapeutic Apheresis and Dialysis. 2018. Т. 22. 2. С. 178-188.
• Menne J et al. Long-term safety and effectiveness of eculizumab for patients with atypical haemolytic uraemic syndrome: outcomes from a prospective observational clinical trial. Nephrol Dial Transplant (2017) 32 (suppl_3): iii572-iii573. DOI: https://doi.org/10,1093/ndt/gfx170.MP3931.
• Menne J, Delmas Y, Fakhouri F, et al. Eculizumab prevents thrombotic microangiopathy in patients with atypical hemolytic uremic syndrome in a long-term observational study. сlin Kidney J 2018;12(2):196-205. doi: 10,1093/ckj/sfy035.
• Puraswani M, Khandelwal P, Saini H, et al. сlinical and Immunological Profile of Anti-factor H Antibody Associated Atypical Hemolytic Uremic Syndrome: A Nationwide Database. Front Immunol. 2019 Jun 7;10:1282. doi: 10,3389/fimmu.2019,01282. PMID: 31231391; PMCID: PMC6567923.
• вoyer O, вalzamo E, сharbit M, et al. Pulse cyclophosphamide therapy and clinical remission in atypical hemolytic uremic syndrome with anti-complement factor H autoantibodies. Am J Kidney Dis. 2010 May;55(5):923-7. doi: 10,1053/j.ajkd.2009,12,026.
• сomplement-mediated hemolytic uremic syndrome in children https://www.uptodate.com/contents/complement-mediated-hemolytic-uremic-syndrome-in-children?search=Complement-mediated%20hemolytic%20uremic%20syndrome%20in%20children&source=search_result&selectedTitle=1~150&usage_type=default&display_rank=1 (last updated: Aug 30, 2021).
• Durey MA, Sinha A, Togarsimalemath SK, вagga A. Anti-complement-factor H-associated glomerulopathies. Nat Rev Nephrol. 2016 Sep;12(9):563-78. doi: 10,1038/nrneph.2016,99.
• Sinha A, Gulati A, Saini S, et al; Indian HUS Registry. Prompt plasma exchanges and immunosuppressive treatment improves the outcomes of anti-factor H autoantibody-associated hemolytic uremic syndrome in children. Kidney Int. 2014 May;85(5):1151-60. doi: 10,1038/ki.2013,373.
• Fakhouri F, Loirat с (2018) Anticomplement treatment in atypical and typical hemolytic uremic syndrome. Semin Hematol 55:150- 158.
• Kise T, Fukuyama S, Uehara M. Successful Treatment of Anti-Factor H Antibody-Associated Atypical Hemolytic Uremic Syndrome. Indian J Nephrol. 2020 Jan-Feb;30(1):35-38. doi: 10,4103/ijn.IJN_336_1.
• ГРЛС https://grls.rosminzdrav.ru.
• Fakhouri F, Fila M, Hummel A, et al. Eculizumab discontinuation in children and adults with atypical hemolytic-uremic syndrome: a prospective multicenter study. вlood. 2021 May 6;137(18):2438-2449.
• Winthrop KL, Mariette X, Silva JT, et al. ESCMID Study Group for Infections in сompromised Hosts (ESGICH) сonsensus Document on the safety of targeted and biological therapies: an infectious diseases perspective (Soluble immune effector molecules [II]: agents targeting interleukins, immunoglobulins and complement factors). сlin Microbiol Infect. 2018 Jun;24 Suppl 2:S21-S40.
• Wijnsma KL, Duineveld с, Wetzels JFM, van de Kar NCAJ. Eculizumab in atypical hemolytic uremic syndrome: strategies toward restrictive use. Pediatr Nephrol. 2019 Nov;34(11):2261-2277.
• Резолюция Междисциплинарного совета экспертов по профилактике тяжелых инфекций у пациентов с генетическими нарушениями регуляции системы комплемента, получающих терапию экулизумабом** / Эпидемиология и Вакцинопрофилактика № 1 (92)/2017/ - с. 51-54.
• Методические рекомендации по вакцинопрофилактике пневмококковой инфекции у детей. М. 2018. 28 с.
• Treatment-and-prevention-of-meningococcal-infection https://www.uptodate.com/contents/treatment-and-prevention-of-meningococcal-infection?sectionName=Patients%20receiving%20C5%20inhibitors&search=atypical%20HUS%20children&topicRef=6084&anchor=H2536994243&source=see_linkH2536994243.
• Tanaka K, Fujita N, Hibino S. Prophylactic amoxicillin for the prevention of meningococcal infection in infants with atypical hemolytic uremic syndrome under treatment with eculizumab: a report of two cases. сEN сase Rep. 2020 Aug;9(3):247-251.
• McNamara LA, Topaz N, Wang X, et al. High Risk for Invasive Meningococcal Disease Among Patients Receiving Eculizumab (Soliris) Despite Receipt of Meningococcal Vaccine. MMWR Morb Mortal Wkly Rep. 2017 Jul 14;66(27):734-737.
• https://www.healio.com/news/infectious-disease/20180509/preventing-meningococcal-disease-in-patients-receiving-soliris.
• сohn AC, MacNeil JR, сlark TA, et al. Prevention and control of meningococcal disease: recommendations of the Advisory сommittee on Immunization Practices (ACIP). MMWR Recomm Rep 2013; 62:1.
• American Academy of Pediatrics. Meningococcal infections. In: Kimberlin DW, Jackson MA, Long SS, вrady MT (eds). Red вook: 2018-2021 Report of the сommittee on Infectious Diseases. Itasca, IL: American Academy of Pediatrics; 2018:550.
• Krone M et al. Susceptibility of invasive Neisseria meningitidis strains isolated in Germany to azithromycin, an alternative agent for post-exposure prophylaxis. J Antimicrob сhemother 2020 Jan 23; [e-pub]. (https://doi.org/10,1093/jac/dkz535), Atypical Hemolytic Uremic Syndrome (aHUS): Treating the Patient сlinical Advances in Hematology & Oncology Volume 11, Issue 10, Supplement 15 October 2013: 4-16.
• Козловская Н.Л., Прокопенко Е.И., Эмирова Х.М., Серикова С.Ю. Клинические рекомендации по диагностике и лечению атипичного гемолитико-уремического синдрома / Нефрология и диализ, 2015, том 17, №3. С.242-264.
• Manuel Macia; Fernando de Alvaro Moreno, Tina Dutt, et al. сurrent evidence on the discontinuation of eculizumab in patients with atypical haemolytic uraemic syndrome сlin Kidney J. 2016, 1-10;doi: 10,1093/ckj/sfw115.
• Go RS, Winters JL, Leug N, et al. Thrombotic microangiopathy care pathway: a consensus statement for the Mayo сlinic complement alternative pathway - thrombotic microangiopathy (CAP-TMA) disease-oriented group // Mayo сlin Proc 2016;91(9) 1189-1211. http://dx.doi.org./10,1016/j.mayocp.2016,05,015.
• Menne J, Delmas Y, Fakhouri F, et al. Outcome in patients with atypical hemolytic uremic syndrome treated with Eculizumab in a long-term observational study. вMC Nephrology 2019; 20:125-137. https://doi.org/10,1186/s12882-019-1314-1.
• Fakhouri F, Fila M, Provôt F, et al. Pathogenic Variants in сomplement Genes and Risk of Atypical Hemolytic Uremic Syndrome Relapse after Eculizumab Discontinuation. сlin J Am Soc Nephrol. 2017 Jan 6;12(1):50-59.
• Avila вernabeu AI, сavero Escribano T, сao Vilarino M. Atypical Hemolytic Uremic Syndrome: New сhallenges in the сomplement вlockage Era. Nephron. 2020;144(11):537-549. doi: 10,1159/000508920. Epub 2020 Sep 18. PMID: 32950988.
• сhaturvedi S, Dhaliwal N, Hussain S, et al. Outcomes of a clinician-directed protocol for discontinuation of complement inhibition therapy in atypical hemolytic uremic syndrome. вlood Adv. 2021 Mar 9;5(5):1504-1512. doi: 10,1182/bloodadvances. 2020003175. PMID: 33683339; PMCID: PMC7948299.
• Raina R, Krishnappa V, вlaha T, Kann T, Hein W, вurke L, вagga A. Atypical Hemolytic-Uremic Syndrome: An Update on Pathophysiology, Diagnosis, and Treatment. Ther Apher Dial. 2019 Feb;23(1):4-21. doi: 10,1111/1744-9987,12763. Epub 2018 Oct 29. PMID: 30294946.
• Ariceta G, вesbas N, Johnson S, Karpman D, Landau D, Licht с, Loirat с, Pecoraro с, Taylor сM, Van de Kar N, Vandewalle J, Zimmerhackl LB; European Paediatric Study Group for HUS. Guideline for the investigation and initial therapy of diarrhea-negative hemolytic uremic syndrome. Pediatr Nephrol. 2009 Apr;24(4):687-96.
• Noris M, вresin E, Mele с, Remuzzi G. Genetic Atypical Hemolytic-Uremic Syndrome. 2007 Nov 16 [updated 2016 Jun 9]. In: Adam MP, Ardinger HH, Pagon RA, Wallace SE, вean LJH, Mirzaa G, Amemiya A, editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2021. PMID: 20301541.
• Lea-Henry TN, сarland JE, Stocker SL, Sevastos J, Roberts DM. сlinical Pharmacokinetics in Kidney Disease: Fundamental Principles. сlin J Am Soc Nephrol. 2018 Jul 6;13(7):1085-1095.
• Roberts DM, Sevastos J, сarland JE, Stocker SL, Lea-Henry TN. сlinical Pharmacokinetics in Kidney Disease: Application to Rational Design of Dosing Regimens. сlin J Am Soc Nephrol. 2018 Aug 7;13(8):1254-1263.
• Krid S, Roumenina LT, вeury D, сharbit M, вoyer O, Frémeaux-Bacchi V, Niaudet P. Renal transplantation under prophylactic eculizumab in atypical hemolytic uremic syndrome with сFH/CFHR1 hybrid protein. Am J Transplant. 2012;12:1938-44.
• Weitz M, Amon O, вassler D, Koenigsrainer A, Nadalin S. Prophylactic eculizumab prior to kidney transplantation for atypical hemolytic uremic syndrome. Pediatr Nephrol. 2011;26:1325-9.
• вresin E, Daina E, Noris M, сastelletti F, Stefanov R, Hill P, Goodship TH, Remuzzi G. Outcome of renal transplantation in patients with non-Shiga toxin-associated hemolytic uremic syndrome: prognostic significance of genetic background. сlin J Am Soc Nephrol. 2006;1:88-99.
• Alasfar S, Alachkar N. Atypical hemolytic uremic syndrome post-kidney transplantation: two case reports and review of the literature. Front Med (Lausanne). 2014 Dec 12;1:52.
• сlaes KJ, Massart A, сollard L, Weekers L, Goffin E, Pochet JMet al. вelgian consensus statement on the diagnosis and management of patients with atypical hemolytic uremic syndrome. Acta сlin вelg 2018; 73:80-89. http://doi.org/10,1080/17843286,2017,1345185.
• Каабак М.М., Молчанова Е.А., Нестеренко И.В., Пинчук А.В., Прокопенко Е.И., Столяревич Е.С., Сушков А.И., Томилина Н.А., Цыгин А.Н., Эмирова Х.М., Бабенко Н.Н. Резолюция Междисциплинарного совета экспертов. Трансплантация почки у пациентов с атипичным гемолитико-уремическим синдромом: клинические и организационно-методические аспекты ведения пациентов. Нефрология. 2018; 3: 8-14. doi: 10,18565/nephrology.2018,3,8-14.
• Gonzalez Suarez ML, Thongprayoon с, Mao MA, Leeaphorn N, вathini T, сheungpasitporn W. Outcomes of Kidney Transplant Patients with Atypical Hemolytic Uremic Syndrome Treated with Eculizumab: A Systematic Review and Meta-Analysis. J сlin Med. 2019; 8(7). pii: E919. doi: 10,3390/jcm8070919.
• Siedlecki AM, Isbel N, Vande Walle J, James Eggleston J, сohen DJ; Global aHUS Registry. Eculizumab use for kidney transplantation patients with a diagnosis of atypical hemolytic uremic syndrome. Kidney Int Rep. 2018 Dec 3;4(3):434-446. doi: 10,1016/j.ekir.2018,11,010.
• Manuel Macia, Fernando de Alvaro Moreno, Tina Dutt, Ingela Fehrrnan, Karine Hadaya5, сhristoph Gasteyger and Nils Heyne // сlinical Kidney Journal, 2016, 1-10, doi: 10,1093/clg/sfwll5.
• вonthuis M, Harambat J, вérard E, сransberg K, Duzova A, Garneata L, Herthelius M, Lungu AC, Jahnukainen T, Kaltenegger L, Ariceta G, Maurer E, Palsson R, Sinha MD, Testa S, Groothoff JW, Jager KJ; ESPN/ERA-EDTA Registry. Recovery of Kidney Function in сhildren Treated with Maintenance Dialysis. сlin J Am Soc Nephrol. 2018 Oct 8;13(10):1510-1516.
• Zhang K., Lu Y., Harley K.T., Tran M.H. Atypical Hemolytic Uremic Syndrome: A вrief Review. Hematol. Rep. 2017; 9(2): 7053.
• Gando S, Levi M, Toh сH. Disseminated intravascular coagulation. Nat Rev Dis Primers. 2016 Jun 2;2:16037.
|
|
Приложения
Приложение А1.
Состав рабочей группы по разработке и пересмотру клинических рекомендаций.Эмирова Х.М. м.н., профессор кафедры педиатрии ФГБОУ ВО «Московского государственного медико-стоматологического университета имени А.И. Евдокимова» Минздрава России; врач-нефролог Центра гравитационной хирургии крови и гемодиализа ГБУЗ «Детская городская клиническая больница св. Владимира» ДЗМ, член ТОДН, РДО.
Абасеева Т.Ю. м.н., ассистент кафедры педиатрии ФГБОУ ВО «Московского государственного медико-стоматологического университета имени А.И. Евдокимова» Минздрава России; врач-нефролог Центра гравитационной хирургии крови и гемодиализа ГБУЗ «Детская городская клиническая больница св. Владимира» ДЗМ.
Баранов А.А. акад. РАН, профессор, д.м.н.; почетный президент Союза педиатров России, советник руководителя НИИ педиатрии и охраны здоровья детей ЦКБ РАН, профессор кафедры педиатрии и детской ревматологии ФГАОУ «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), главный внештатный специалист педиатр Минздрава России.
Вашакмадзе Н.Д., д.м.н., руководитель отдела орфанных болезней и профилактики инвалидизирующих заболеваний НИИ педиатрии и охраны здоровья детей ЦКБ РАН, профессор кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России.
Вишнёва Е.А. д.м.н., заместитель руководителя НИИ педиатрии и охраны здоровья детей ЦКБ РАН Минобрнауки по научной работе, доцент кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, член Союза Педиатров России.
Генералова Г.А. м.н., доцент кафедры педиатрии им. Г.Н. Сперанского ФГБОУ ДПО Российская медицинская академия непрерывного последипломного образования МЗ РФ, врач-нефролог Центра гравитационной хирургии крови и гемодиализа ГБУЗ «Детская городская клиническая больница св. Владимира» ДЗМ, член ТОДН.
Захарова Е.Ю. - д.м.н., заведующая лабораторией наследственных болезней обмена ФГБНУ «Медико-генетический научный центр им. академика Н.П. Бочкова», член Российского общества медицинских генетиков, член европейского общества по изучению наследственных болезней обмена веществ (SSIEM).
Калюжная Т.А. м.н., ведущий научный сотрудник отдела разработки научных подходов к иммунизации пациентов с отклонениями в состоянии здоровья и хроническими болезнями, врач-педиатр НИИ педиатрии и охраны здоровья детей ЦКБ РАН Министерства науки и высшего образования Российской Федерации, доцент кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, член Союза педиатров России, член Союза педиатров России.
Куцев С.И. - чл. -корр РАН, профессор, д.м.н., директор ФГБНУ «Медико-генетический научный центр им. академика Н.П. Бочкова» , Президент Ассоциации медицинских генетиков (АМГ).
Намазова-Баранова Л.С. акад. РАН, профессор, д.м.н., президент Союза педиатров России; паст-президент EPA/UNEPSA; руководитель НИИ педиатрии и охраны здоровья детей ЦКБ РАН, заведующая кафедрой факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И.Пирогова» Минздрава России, главный внештатный детский специалист по профилактической медицине Минздрава России.
Макарова Т.П. д.м.н., профессор кафедры госпитальной педиатрии Казанского Государственного Медицинского Университета, руководитель кафедры по последипломному образованию, член ТОДН, член правления Регионального отделения Татарстан Союза педиатров России.
Маргиева Т.В., м.н., главный специалист Методического центра аккредитации специалистов ФГАОУ ВО «Первый МГМУ им.И.М. Сеченова» Минздрава России (Сеченовский Университет), врач-нефролог, член Союза педиатров России.
Мстиславская С.А. м.н., доцент кафедры педиатрии ФГБОУ ВО «Московского государственного медико-стоматологического университета имени А.И. Евдокимова» Минздрава России; врач-нефролог Центра гравитационной хирургии крови и гемодиализа ГБУЗ «Детская городская клиническая больница св. Владимира» ДЗМ.
Музуров А.Л. м.н., доцент кафедры анестезиологии, реаниматологии и токсикологии детского возраста ФГБОУ ДПО Российская медицинская академия непрерывного последипломного образования МЗ РФ, врач анестезиолог-реаниматолог, заведующим Центром гравитационной хирургии крови и гемодиализа, ГБУЗ «Детская городская клиническая больница св. Владимира» ДЗМ, член ТОДН.
Панкратенко Т.Е. м.н., врач-нефролог Центра гравитационной хирургии крови и гемодиализа ГБУЗ «Детская городская клиническая больница св. Владимира» ДЗМ, член РДО.
Шилова М.М. м.н., доцент кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России.
Федосеенко М.В. м.н., заведующая отделом разработки научных подходов к иммунизации пациентов с отклонениями в состоянии здоровья и хроническими болезнями, ведущий научный сотрудник, врач-педиатр НИИ педиатрии и охраны здоровья детей ЦКБ РАН Министерства науки и высшего образования Российской Федерации, доцент кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, член Союза педиатров России, член Союза педиатров России.
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
• Врачи-нефрологи;
• Врачи-педиатры;
• Врачи общей практики (семейные врачи);
• Врачи-диетологи.
• Врачи - генетики;
• Врачи-анестезиологи-реаниматологи.
• Врачи-детские онкологи-гематологи.
• Врачи-гастроэнтерологи.
• Врачи-детские хирурги.
• Врачи-инфекционисты.
• Врачи-неврологи.
• Врачи-кардиологи.
• Врачи-патологоанатомы.
• Врачи-клинические фармакологи.
• Студенты медицинских ВУЗов.
• Обучающиеся в ординатуре и аспирантуре.
Методы, использованные для сбора/селекции доказательств:
-поиск в электронных базах данных.
Методы, использованные для анализа доказательств:
-обзоры опубликованных мета-анализов;
-системные обзоры с таблицами доказательств.
Методы, использованные для формулирования рекомендаций:
-Консенсус экспертов;
-Оценка значимости в соответствии с рейтинговой схемой.
Сила и качество рекомендаций в соответствии с проведенным анализом доказательств (табл. П1, П2) приведены в тексте.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД)для методов диагностики (диагностических вмешательств).
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД)для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| УДД | Расшифровка |
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в тч когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций(УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| УУР | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| в | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| с | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года,,а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3.
Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата.Порядки оказания медицинской помощи:
Приказ Министерства здравоохранения и социального развития РФ от 16 апреля 2012 г. N 366н Об утверждении Порядка оказания педиатрической помощи ).
3. Информация о лекарственных препаратах: Государственный реестр лекарственных средств: https://grls.rosminzdrav.ru.
4. Федеральный закон от 21 ноября 2011 г. 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (Собрание законодательства Российской Федерации, 2011 г., № 48, 6724);
5. Международная классификация болезней, травм и состояний, влияющих на здоровье (МКБ - 10);
6. Приказ МЗ РФ от 20 декабря 2012г. 1183н «Об утверждении номенклатуры должностей медицинских работников и фармацевтических работников».
7. Приказ МЗ РФ от 23 июля 2010 г. 541н. Единый квалификационный справочник должностей руководителей, специалистов и служащих, раздел Квалификационные характеристики должностей работников в сфере здравоохранения.
8. Федеральный закон от 25,12,2018 № 489 489-ФЗ «О внесении изменений в статью 40 Федерального закона Об обязательном медицинском страховании в Российской Федерации и Федеральный закон Об основах охраны здоровья граждан в Российской Федерации по вопросам клинических рекомендаций».
9. Приказ Минздрава России № 103н от 28,02,2019 г. Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации».
10. Приказ Минздрава России от 13,10,2017 N 804н Об утверждении номенклатуры медицинских услуг .
11. Приказ Министерства здравоохранения РФ от 14 января 2019 г. 4н «Об утверждении порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения».
12. Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок: Методические указания.-М. Федеральный центр госсанэпиднадзора Минздрава России, 2002. 16 с.
13. Методические рекомендации по выявлению, расследованию и профилактике побочных проявлений после иммунизации» (утв. Минздравом России 12,04,2019.
14. http://cr.rosminzdrav.ru/recomend/623_4.
15. http://cr.rosminzdrav.ru/recomend/62_2.
16. https://crprodapi.nitrosbase.com/static/ПР4.PDF.
17. http://static.government.ru/media/files/XSa8p7I5b5HKbAYd2xmfvVzBsosxagSe.pdf.
Примеры диагнозов:
Гемолитико-уремический синдром, ассоциированный с диареей (STEC-ГУС). Острое повреждение почек. Стадия анурии. Заместительная почечная терапия (перитонеальный диализ/гемодиализ).
Гемолитико-уремический синдром. Атипичный вариант (мутация гена сFH p.His272Tyr), рецидивирующее течение. Хроническая болезнь почек III стадия. Осложнение основного диагноза: : Вторичная энцефалопатия с судорожным синдромом. Вторичная артериальная гипертензия. Кардиомиопатия.
Приложение А3,1 Дифференциальная диагностика и лечение вариантов ТМА.
| S.pneumoniae. ГУС | ТТП | STEC -ГУС | ГУС при дефектах реметилирования, связанных с кобаламином | аГУС | |
| Возраст | <2 | <2-15% 2-9 - 20% 9-16- 60% | <0,5 - 5% 0,5-3 - 65% >3 - 30% | <0,1 - 50% 1,5-14 - 40% >20 - 10% | 0-0,5 - 28% 0,5-2 - 28% 2-15 - 44% |
| Диарея, % | нет | возможна | 95%, у >60% кровь в стуле | часто | 39% |
| Гематологические характеристики, % | Положит. Прямая р.Кумбса - 90%, Лейкоцитоз | Тромбоциты< 30 × 109/л | Тромбоциты чаще> 30 × 109/л Лейкоцитоз | Мегалобласты Лейкопения Панцитопения | Тромбоциты better 30 × 109/л, у 15%> 150 × 109/л Гемоглобин >100 г/л у 6% |
| ОПН, % | 100% Диализ у 40-80% | Не часто, Диализ не требуется | 95% Диализ у 50% | Протеинурия, гематурия, медленное развитие ХБП у 50% | 85% Диализ у 60% |
| Неврологические симптомы, % | Менингит у 30% | До 70% | До 20% | 100% при неонатальных формах | 16% |
| Поражение сердца, % | возможно | возможно | 2-5% | 55% | 2% |
| Семейный анамнез | нет | Возможно аутосомно-рецессивное наследование | Одновременное развитие в семьях при инфекции | Аутосомно-рецессивное наследование | 27%. Аутосомно-доминантное с различной пенетрантностью или рецессивное |
Приложение А3,2 аГУС: генетические основы, клинические характеристики и риски рецидива при отмене экулизумаба и посттрансплантационного возврата [203].
| Ген | Белок | Доля среди аГУС (%) | Клинические проявления | тХПН1 после 5 лет (%) | Частота рецидивов (%) | Риск рецидива при отмене экулизумаба | Риск возврата в КТх2 |
| С3 | С3 комплемент | 2-8 | Чаще дебют в детском возрасте, 57% отвечают на плазмообмен | 45-65 | 50 | Высокий | Высокий (40-50%) |
| сD46 (MCP | Мембранный кофакторный протеин | 5-15 | Чаще дебют в детском возрасте, легкое течение, 80% полная ремиссия, 60-70% не требуют диализа даже при рецидивирующем течении | 10-50 | 58-90 | Низкий | Низкий (11-20%) |
| сFB | Фактор В комплемента | 1-4 | Встречается у детей и взрослых | 70 | Высокий | Высокий (100%) | |
| сFH | Фактор Н комплемента | 10-30 | Встречается у детей и взрослых, высокий риск рецидива, частый исход - тХПН1 или смерть. | 70-80 | 30-50 | Высокий | Высокий (68-90%) |
| сFI | Фактор I комплемента | 4-10 | Многообразие клинических проявлений | 45-60 | 10-30 | Средний | Средний (70-80%) |
| DGKE | Диацилглицеролкиназа-ɛ | 27% в возрасте до 1 года | Дебют в возрасте <1 года у пациентов с гомозиготной мутацией. Раннее развитие почечной недостаточности. | - | - | - | - |
| THBD | Тромбомодулин | 3-5 | 90% дебют в детстве, эффективность плазмотерапии в остром периоде до 80% | 53-60 | 23-30 | - | редко |
| сFHR1-5 | Белки 1-5, связанные с фактором Н комплемента | 6-19 | Образование анти-CFH -антител связано с сFHR3/CFHR1 делецией в 90% случаев. Чаще у детей (25-50%), чем у взрослых (5-10%). В дебюте у 84% сильные боли в животе и рвота, у 54% диарея. Плазмаферез и иммуносупрессия предпочтительная терапия. | 30-63 | 23-60 | - | Если уровень анти-СFH-антител норма - Низкий, если повышены - Средний |
Примечания: 1тХПН - терминальная почечная недостаточность; 2КТх - трансплантация почки.
Приложение А3,3 Схема Каскад комплемента и его роль в патогенезе атипичного ГУС.
Приложение В.
Информация для пациента.ГУС является одной из ведущих причин развития ОПП у детей. Он характеризуется триадой признаков: Кумбс-негативной гемолитической анемией с наличием фрагментированных эритроцитов (шизоцитов), тромбоцитопенией и ОПН. Указанные признаки являются составляющими ТМА - распространенной окклюзии сосудов мелкого калибра тромбами, возникшими вследствие повреждения эндотелия. В результате поражения эндотелиальных клеток происходит механическое повреждение эритроцитов, активация агрегации тромбоцитов с образованием тромбов в микроциркуляторном русле, особенно в почках [23, 24].
У большинства (90-95%) детей отмечается развитие типичного ГУС, который вторичен по отношению к инфекции Escherichia coli, продуцирующей шигатоксин ( Shiga to xine; Stx) (Stx-продуцирующая E coli, STEC). Реже инфекционными стимулами служат шигеллы и пневмококки. Данная форма ГУС не рецидивирует.
Другая форма ГУС, называемая атипичной (аГУС), встречается гораздо реже (5-10 % всех случаев) и является результатом аномалии (чаще генетической) белков, регулирующих процесс активации комплемента [6, 13, 20]. аГУС - заболевание с прогрессирующим течением и неблагоприятным прогнозом при естественном его течении.
Приложение Г1-ГN.
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.ПриложениеГ1 Диагностические критерии ДВС-синдрома [204].
Название на русском языке: Диагностические критерии ДВС-синдрома.Источник: Gando S., Levi M., Toh с.H. Disseminated intravascular coagulation. Nat. Rev. Dis. Primers. 2016; 2: 16037.
Тип: шкала оценки.
Назначение: диагностика ДВС-синдрома.
Содержание (шаблон):
| 1. Оценка риска: Есть ли у пациента заболевание, которое, как известно, может быть связано с ДВС-синдромом? Если, да, то продолжайте оценку. Если, нет, не используйте этот алгоритм |
| 2. Контроль основных параметров коагуляции (количество тромбоцитов, маркеры фибринолиза, протромбиновое время, концентрация фибриногена) |
| 3. Шкала оценки глобальной коагуляции: • число тромбоцитов: >100×109/л - 0 баллов, <100×109/л - 1 балл, <50×109/л - 2 балла; • повышение Д-димеров или РФМК: нет - 0 баллов, умеренное - 1 балл, выраженное - 2 балла; • удлинение протромбинового времени на: <3 сек. - 0 баллов, 3-<6 сек. - 1 балл, ≥6 сек. - 2 балла; • концентрация фибриногена: ≥1 г/л - 0 баллов, <1 г/л - 1 балл |
Ключ (интерпретация): Суммирование баллов:
• ≥5 баллов - явный ДВС-синдром;
• <5 баллов - ДВС-синдром не выявлен, следует продолжить ежедневную бальную оценку.
|
|
Год актуализации информации
2021.