МКБ-10 коды
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: N08.2*, D59.3, M31.1, N17.0, N17.1.
Год утверждения (частота пересмотра): 2021.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2023.
ID: 550.
Разработчик клинической рекомендации.
• Ассоциация нефрологов.
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2021.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2023.
ID: 550.
Разработчик клинической рекомендации.
• Ассоциация нефрологов.
Одобрено Научно-практическим Советом Минздрава РФ.
|
|
 Список сокращений
Список сокращений
АГУС - атипичный гемолитико-уремический синдром АПК - альтернативный путь активации комплемента.
АТIII - антитромбин III (наименование услуги согласно Приказу Минздрава России от 13,10,2017 № 804н: «Определение активности антитромбина III в крови»).
АФС - антифосфолипидный синдром.
Б-ГУС - ГУС-ассоциированный с беременностью ГУС - гемолитико-уремический синдром.
ДВС - диссеминированное внутрисосудистое свертывание.
ЛДГ - лактатдегидрогеназа (наименование услуги согласно Приказу Минздрава России от 13,10,2017 № 804н: «Определение активности лактатдегидрогеназы в крови»).
МАГА - микроангиопатическая гемолитическая анемия МАК (С5b-9) - мембраноатакующий комплекс.
ОПП - острое повреждение почек.
ПО - плазмообмен (наименование услуги согласно Приказу Минздрава России от 13,10,2017 № 804н: «Плазмообмен»).
СЗП - свежезамороженная плазма СКВ - системная красная волчанка.
ТВ - тромбиновое время (наименование услуги согласно Приказу Минздрава России от 13,10,2017 № 804н: «Определение тромбинового времени в крови»).
ТМА - тромботическая микроангиопатия.
ТТП - тромботическая тромбоцитопеническая пурпура ХБП - хроническая болезнь почек.
ЦНС - центральная нервная система сFH - фактор Н комплемента.
CKD-EPI - формула для расчета скорости клубочковой фильтрации (CKD- Epidemiology сollaboration 2009).
STEC-ГУС - типичный гемолитико на то что мы Яо-уремический синдром.
АТIII - антитромбин III (наименование услуги согласно Приказу Минздрава России от 13,10,2017 № 804н: «Определение активности антитромбина III в крови»).
АФС - антифосфолипидный синдром.
Б-ГУС - ГУС-ассоциированный с беременностью ГУС - гемолитико-уремический синдром.
ДВС - диссеминированное внутрисосудистое свертывание.
ЛДГ - лактатдегидрогеназа (наименование услуги согласно Приказу Минздрава России от 13,10,2017 № 804н: «Определение активности лактатдегидрогеназы в крови»).
МАГА - микроангиопатическая гемолитическая анемия МАК (С5b-9) - мембраноатакующий комплекс.
ОПП - острое повреждение почек.
ПО - плазмообмен (наименование услуги согласно Приказу Минздрава России от 13,10,2017 № 804н: «Плазмообмен»).
СЗП - свежезамороженная плазма СКВ - системная красная волчанка.
ТВ - тромбиновое время (наименование услуги согласно Приказу Минздрава России от 13,10,2017 № 804н: «Определение тромбинового времени в крови»).
ТМА - тромботическая микроангиопатия.
ТТП - тромботическая тромбоцитопеническая пурпура ХБП - хроническая болезнь почек.
ЦНС - центральная нервная система сFH - фактор Н комплемента.
CKD-EPI - формула для расчета скорости клубочковой фильтрации (CKD- Epidemiology сollaboration 2009).
STEC-ГУС - типичный гемолитико на то что мы Яо-уремический синдром.
Термины и определения
Атипичный гемолитико-уремический синдром (аГУС) - системное заболевание из группы тромботических микроангиопатий с прогрессирующим течением и неблагоприятным прогнозом, в основе которого лежит неконтролируемая активация альтернативного пути комплемента наследственной или приобретённой природы, приводящая к генерализованному тромбообразованию в сосудах микроциркуляторного русла.
Комплемент-опосредованная тромботическая микроангиопатия - тромботическая микроангиопатия, вызванная гиперактивацией альтернативного пути комплемента вследствие нарушения регуляции, обусловленной мутациями генов белков-регуляторов или аутоантителами к фактору комплемента H - основному регуляторному протеину альтернативного пути комплемента. Синоним: аГУС.
Комплемент-блокирующая терапия - терапия, направленная на подавление активности системы комплемента и способствующая тем самым прекращению процессов микроциркуляторного тромбообразования.
Микроангиопатический гемолиз - внутрисосудистый неиммунный (Кумбс- негативный) механический гемолиз в результате повреждения эритроцитов при циркуляции в суженных за счет окклюзии тромбами сосудах микроциркуляторного русла. Тромботическая микроангиопатия - клинико-морфологический синдром, характеризующий особый тип поражения сосудов микроциркуляторного русла, в основе которого лежит повреждение эндотелия с последующим тромбообразованием.
Тромботическая тромбоцитопеническая пурпура - системная форма тромботической микроангиопатии, обусловленная сверхкрупными мультимерами фактора фон Виллебранда вследствие приобретенного (аутоантитела) или наследственного (мутации гена) дефицита ADAMTS13.
Экулизумаб** - препарат группы комплемент-ингибирующих антител, представляющий собой рекомбинантное гуманизированное моноклональное антитело класса Ig G к С5 компоненту комплемента. Препарат блокирует расщепление С5 на С5а и С5b, препятствуя тем самым образованию мембрано-атакующего комплекса и подавляя провоспалительное, протромботическое и литическое действия комплемента, что предотвращает повреждение эндотелия и прекращает процессы микроциркуляторного тромбообразования.
ADAMTS13 - металлопротеаза, расщепляющая сверхкрупные мультимеры фактора фон Виллебранда, диагностический маркер тромботической тромбоцитопенической пурпуры.
STEC-ГУС - инфекционно-опосредованный гемолитико-уремический синдром, развивающийся вследствие инфицирования шига-токсин продуцирующими бактериями: энтерогеморрагической или энтероаггрегативной E.coli или Shigella dysenteriae I типа. Синоним: типичный гемолитико-уремический синдром.
CFH (фактор Н комплемента) - основной регуляторный фактор альтернативного пути комплемента, контролирующий его активность.
Комплемент-опосредованная тромботическая микроангиопатия - тромботическая микроангиопатия, вызванная гиперактивацией альтернативного пути комплемента вследствие нарушения регуляции, обусловленной мутациями генов белков-регуляторов или аутоантителами к фактору комплемента H - основному регуляторному протеину альтернативного пути комплемента. Синоним: аГУС.
Комплемент-блокирующая терапия - терапия, направленная на подавление активности системы комплемента и способствующая тем самым прекращению процессов микроциркуляторного тромбообразования.
Микроангиопатический гемолиз - внутрисосудистый неиммунный (Кумбс- негативный) механический гемолиз в результате повреждения эритроцитов при циркуляции в суженных за счет окклюзии тромбами сосудах микроциркуляторного русла. Тромботическая микроангиопатия - клинико-морфологический синдром, характеризующий особый тип поражения сосудов микроциркуляторного русла, в основе которого лежит повреждение эндотелия с последующим тромбообразованием.
Тромботическая тромбоцитопеническая пурпура - системная форма тромботической микроангиопатии, обусловленная сверхкрупными мультимерами фактора фон Виллебранда вследствие приобретенного (аутоантитела) или наследственного (мутации гена) дефицита ADAMTS13.
Экулизумаб** - препарат группы комплемент-ингибирующих антител, представляющий собой рекомбинантное гуманизированное моноклональное антитело класса Ig G к С5 компоненту комплемента. Препарат блокирует расщепление С5 на С5а и С5b, препятствуя тем самым образованию мембрано-атакующего комплекса и подавляя провоспалительное, протромботическое и литическое действия комплемента, что предотвращает повреждение эндотелия и прекращает процессы микроциркуляторного тромбообразования.
ADAMTS13 - металлопротеаза, расщепляющая сверхкрупные мультимеры фактора фон Виллебранда, диагностический маркер тромботической тромбоцитопенической пурпуры.
STEC-ГУС - инфекционно-опосредованный гемолитико-уремический синдром, развивающийся вследствие инфицирования шига-токсин продуцирующими бактериями: энтерогеморрагической или энтероаггрегативной E.coli или Shigella dysenteriae I типа. Синоним: типичный гемолитико-уремический синдром.
CFH (фактор Н комплемента) - основной регуляторный фактор альтернативного пути комплемента, контролирующий его активность.
Описание
Атипичный гемолитико-уремический синдром (аГУС) - это системное заболевание с из группы тромботических микроангиопатий (ТМА) с прогрессирующим течением и неблагоприятным прогнозом, в основе которого лежит неконтролируемая активация альтернативного пути комплемента (АПК) наследственной или приобретенной природы, приводящая к генерализованному тромбообразованию в сосудах микроциркуляторного русла [1,2].
ТМА - гетерогенная группа синдромов/заболеваний, имеющих сходный клинико- морфологический фенотип [1-4]. Клинически ТМА проявляется тромбоцитопенией потребления, микроангиопатической гемолитической анемией (механический гемолиз), лихорадкой и ишемическим поражением различных органов, главным образом, почек и центральной нервной системы (ЦНС). Гистологическая картина острой ТМА представлена отеком эндотелиальных клеток с их отслойкой от базальной мембраны, расширением субэндотелиального пространства с накоплением в нем аморфного мембраноподобного материала и образованием тромбов, содержащих тромбоциты и фибрин, и нередко вызывающих полную окклюзию просвета сосуда.
ТМА - гетерогенная группа синдромов/заболеваний, имеющих сходный клинико- морфологический фенотип [1-4]. Клинически ТМА проявляется тромбоцитопенией потребления, микроангиопатической гемолитической анемией (механический гемолиз), лихорадкой и ишемическим поражением различных органов, главным образом, почек и центральной нервной системы (ЦНС). Гистологическая картина острой ТМА представлена отеком эндотелиальных клеток с их отслойкой от базальной мембраны, расширением субэндотелиального пространства с накоплением в нем аморфного мембраноподобного материала и образованием тромбов, содержащих тромбоциты и фибрин, и нередко вызывающих полную окклюзию просвета сосуда.
Причины
АГУС обусловлен генетическими нарушениями или, реже, аутоиммунными реакциями, приводящими к патологии системы комплемента, что послужило основанием для появления термина «комплемент-опосредованная ТМА», который сегодня является синонимом термина «аГУС». В большинстве случаев аГУС ассоциирован с генетически обусловленными дефектами регуляции АПК, результатом чего является его хроническая неконтролируемая активация [1,5]. Кроме того, почти у 20% пациентов, преимущественно детей, выявляют аутоантитела к фактору Н комплемента (CFH) - основному регуляторному протеину АПК, наличие которых приводит к тем же последствиям, что и его мутации. Антительный» аГУС склонен к частому рецидивированию [1,6,7]. У пациентов с аГУС могут быть идентифицированы следующие дефекты, приводящие к избыточной активации АПК [6-9]:
• Мутации генов регуляторных белков комплемента, нарушающие их функции (loss-of-function): сFH (фактор H), сFI (фактор I), MCP (мембранный кофакторный протеин), THBD (тромбомодулин). Среди всех мутаций, ассоциированных с развитием аГУС, мутации гена сFH обнаруживают наиболее часто (около 30% случаев).
• Мутации генов фактора В (CFB) и С3 компонента комплемента, обеспечивающие значительное нарастание их активности (gain-of-function).
• Антитела к сFH и ассоциированная с ними делеция в генах сFH-связанных белков - сFHR1, сFHR3 или сFHR4 [8,10].
Несмотря на совершенствование методов генетического исследования, идентифицировать мутации удается лишь у 50-70% пациентов с аГУС [7]. При этом отсутствие семейной истории не исключает возможности генетической природы заболевания; поскольку пенетрантность генов составляет лишь 50%.
Имеющиеся у пациентов с аГУС мутации приводят к нарушению защиты эндотелиальных клеток от активации комплемента вследствие дефицита или, чаще, функциональных нарушений белков-регуляторов. В норме регуляторы активности АПК и факторы, усиливающие его активность (CFB и С3), находятся в строго сбалансированном состоянии. Генетический дефект регуляторных протеинов - сFH, сFI, MCP и THBD - вызывает снижение их функциональной активности. Напротив, мутации в генах сFB и С3 усиливают их активность. Дисрегуляция комплемента ведет к непрекращющемуся расщеплению компонента С5 на мощный провоспалительный анафилаксин С5а и С5b, который инициирует образование мембраноатакующего комплекса С5b-9, обладающего протромботическим и цитолитическим действием. Таким образом, у пациентов с аГУС неконтролируемую активацию комплемента вызывают либо сниженная функция факторов, регулирующих действие АПК, либо усиление активности факторов, активирующих его. В обоих случаях развивается дисбаланс между факторами контроля и активации в сторону преобладания последних [8,11]. Результатом избыточной активации АПК на поверхности эндотелиальных клеток является нарастающее образование мембрано-атакующего комплекса, вызывающее их повреждение с обнажением субэндотелиального матрикса, трансформацией атромботического фенотипа в протромботический и провоспалительный и последующим образованием тромбов [1,2,11]. Дополнительный вклад в процесс тромбообразования у пациентов с мутациями сFH может вносить также активация комплемента на поверхности тромбоцитов, приводящая к усилению их функциональной активности. Преимущественное поражение почек при аГУС, по-видимому, связано с особой чувствительностью фенестрированного гломерулярного эндотелия к повреждению, обусловленному нарушенной регуляцией комплемента [1,12,13].
Развитие аГУС полностью соответствует теории двойного удара. Генетические аномалии комплемента следует считать не причиной, а фактором, предрасполагающим к развитию ТМА. Установлено, что мутации генов комплемента или аутоантитела к СFH, которые раньше рассматривали как основную причину аГУС, лишь предрасполагают к развитию ТМА - «первый удар». Для реализации этой предрасположенности требуется дополнительные факторы - «второй удар» - которые могут повлиять на развитие или прогрессирование аГУС [4,14]. Такими факторами, вызывающими дополнительную активацию комплемента у предрасположенных лиц и потому названными комплемент- активирующими состояниями, служат инфекции, в первую очередь, дыхательных путей и желудочно-кишечного тракта (30% случаев), беременность (7-17%), трансплантация солидных органов и костного мозга (у 5%), аутоиммунные заболевания, хирургические операции и пр. Однако почти у половины пациентов с аГУС триггерные факторы идентифицировать не удается [2,15].
• Мутации генов регуляторных белков комплемента, нарушающие их функции (loss-of-function): сFH (фактор H), сFI (фактор I), MCP (мембранный кофакторный протеин), THBD (тромбомодулин). Среди всех мутаций, ассоциированных с развитием аГУС, мутации гена сFH обнаруживают наиболее часто (около 30% случаев).
• Мутации генов фактора В (CFB) и С3 компонента комплемента, обеспечивающие значительное нарастание их активности (gain-of-function).
• Антитела к сFH и ассоциированная с ними делеция в генах сFH-связанных белков - сFHR1, сFHR3 или сFHR4 [8,10].
Несмотря на совершенствование методов генетического исследования, идентифицировать мутации удается лишь у 50-70% пациентов с аГУС [7]. При этом отсутствие семейной истории не исключает возможности генетической природы заболевания; поскольку пенетрантность генов составляет лишь 50%.
Имеющиеся у пациентов с аГУС мутации приводят к нарушению защиты эндотелиальных клеток от активации комплемента вследствие дефицита или, чаще, функциональных нарушений белков-регуляторов. В норме регуляторы активности АПК и факторы, усиливающие его активность (CFB и С3), находятся в строго сбалансированном состоянии. Генетический дефект регуляторных протеинов - сFH, сFI, MCP и THBD - вызывает снижение их функциональной активности. Напротив, мутации в генах сFB и С3 усиливают их активность. Дисрегуляция комплемента ведет к непрекращющемуся расщеплению компонента С5 на мощный провоспалительный анафилаксин С5а и С5b, который инициирует образование мембраноатакующего комплекса С5b-9, обладающего протромботическим и цитолитическим действием. Таким образом, у пациентов с аГУС неконтролируемую активацию комплемента вызывают либо сниженная функция факторов, регулирующих действие АПК, либо усиление активности факторов, активирующих его. В обоих случаях развивается дисбаланс между факторами контроля и активации в сторону преобладания последних [8,11]. Результатом избыточной активации АПК на поверхности эндотелиальных клеток является нарастающее образование мембрано-атакующего комплекса, вызывающее их повреждение с обнажением субэндотелиального матрикса, трансформацией атромботического фенотипа в протромботический и провоспалительный и последующим образованием тромбов [1,2,11]. Дополнительный вклад в процесс тромбообразования у пациентов с мутациями сFH может вносить также активация комплемента на поверхности тромбоцитов, приводящая к усилению их функциональной активности. Преимущественное поражение почек при аГУС, по-видимому, связано с особой чувствительностью фенестрированного гломерулярного эндотелия к повреждению, обусловленному нарушенной регуляцией комплемента [1,12,13].
Развитие аГУС полностью соответствует теории двойного удара. Генетические аномалии комплемента следует считать не причиной, а фактором, предрасполагающим к развитию ТМА. Установлено, что мутации генов комплемента или аутоантитела к СFH, которые раньше рассматривали как основную причину аГУС, лишь предрасполагают к развитию ТМА - «первый удар». Для реализации этой предрасположенности требуется дополнительные факторы - «второй удар» - которые могут повлиять на развитие или прогрессирование аГУС [4,14]. Такими факторами, вызывающими дополнительную активацию комплемента у предрасположенных лиц и потому названными комплемент- активирующими состояниями, служат инфекции, в первую очередь, дыхательных путей и желудочно-кишечного тракта (30% случаев), беременность (7-17%), трансплантация солидных органов и костного мозга (у 5%), аутоиммунные заболевания, хирургические операции и пр. Однако почти у половины пациентов с аГУС триггерные факторы идентифицировать не удается [2,15].
|
|
Эпидемиология
АГУС представляет собой ультраредкое (орфанное) заболевание, которое встречается в любом возрасте, однако чаще поражает детей и молодых взрослых. По данным разных авторов, в мире заболеваемость составляет 0,23-1,9 новых случаев на 1 млн населения в популяции в целом, распространенность - примерно 4,9 на 1 млн с колебаниями от 2,2 до 9,4 на 1 млн среди детей и подростков [16,17]. Заболеваемость и распространенность в нашей стране неизвестны. аГУС одинаково часто развивается у мужчин и женщин. При манифестации в более старшем возрасте болезнь несколько чаще поражает женщин.
M31,1 - Тромботическая микроангиопатия.
N17,0 - Острая почечная недостаточность с тубулярным некрозом.
N17,1 - Острая почечная недостаточность с острым кортикальным некрозом.
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
N08,2* - Гломерулярные поражения при болезнях крови и иммунных нарушениях D59,3 - Гемолитико-уремический синдром.M31,1 - Тромботическая микроангиопатия.
N17,0 - Острая почечная недостаточность с тубулярным некрозом.
N17,1 - Острая почечная недостаточность с острым кортикальным некрозом.
Классификация
1,5 Классификация заболевания или состояния (группы заболеваний или состояний).
Исторически ТМА классифицировали на первичные и вторичные, причем первоначально первичные ТМА включали в себя тромботическую тромбоцитопеническую пурпуру (ТТП) и гемолитико-уремический синдром (ГУС) [18]. Причиной последнего является инфекция шига-токсин продуцирующей Escherihia coli (STEC), из-за чего сегодня он получил название STEC-ГУС. ТТП обусловлена приобретенным или генетическим дефицитом активности металлопротеазы ADAMTS-13 (менее 5 %), расщепляющей сверхкрупные мультимеры фактора фон Виллебранда, которые в условиях недостаточной активности фермента индуцируют образование тромбов в сосудах микроциркуляторного русла [19,20]. STEC-ГУС - наиболее частая форма ГУС, на долю которой приходится почти 90% в его структуре. Около 10% принадлежит ГУС, не связанному со STEC-инфекцией, который и был назван аГУС. В 80-х годах ХХ века была установлена связь аГУС с наследственными или приобретенными аномалиями АПК, которые были обнаружены в 50-60% случаев, что послужило основанием отнести к аГУС только комплемент-опосредованный ГУС. ТМА, ассоциированные с беременностью, аутоиммунными и онкологическими заболеваниями, лекарственными средствами, злокачественной артериальной гипертонией, трансплантацией солидных органов и костного мозга составили группу вторичных ТМА [18]. В настоящее время предпринимаются попытки обновления этой классификации. В частности, решением конференции KDIGO было предложено заменить термин «аГУС» термином «первичный аГУС», обозначая им случаи с четко установленными генетическими дефектами АПК или антителами к сFH, а вторичные ТМА именовать в зависимости от вызвавшей их причины, например, «лекарственный аГУС» или «ассоциированный с беременностью аГУС» [21,22]. Другим предложением, представляющимся более обоснованным, является разделение аГУС на комплемент-опосредованный ГУС (собственно аГУС или первичный аГУС) и вторичный ГУС, под которым понимаются ситуации, обозначаемые ранее как вторичные ТМА [23,24]. В подобных случаях предполагается возможность вторичной активации комплемента как результат повреждения эндотелия, вызванного различными факторами и механизмами у пациента, не имеющего генетических аномалий системы комплемента [25]. Предлагается также новая классификация ТМА, согласно которой ТМА следует разделять на наследственные, приобретенные, ассоциированные с инфекцией и вторичные. В соответствии с этой классификацией аГУС, обусловленный антителами к сFH, относится к группе первичных приобретенных ТМА, а аГУС, ассоциированный с генетическими дефектами АПК, входит в группу первичных наследственных ТМА [25,26]. Таким образом, сегодня не существует общепринятых классификаций ТМА и аГУС. В связи с этим в настоящих рекомендациях используется классификация, в соответствии с которой аГСУ (комплемент-опосредованная ТМА) относится к первичным ТМА, все остальные перечисленные выше ТМА рассматриваются как вторичные. аГУС также подразделяется на семейную и спорадическую формы. В структуре аГУС на долю семейного (диагностируемого по крайней мере у двух членов семьи) приходится, по разным данным, всего 10-20%, тогда как спорадический аГУС, при котором отсутствует семейный анамнез, встречается у 80-90% пациентов с этой патологией. Следует помнить, что отсутствие заболевания у родственников не исключает его наследственный характер [1,16].Клиническая картина
Клиническая картина аГУС отличается значительным полиморфизмом. Основными проявлениями болезни являются тромбоцитопения, микроангиопатическая гемолитическая анемия (МАГА) и острое повреждение почек (ОПП), составляющие классическую триаду ТМА [1,2,15]. Почти у половины пациентов с аГУС заболевание развивается после воздействия триггеров, наиболее частыми из которых служат инфекции: в первую очередь, дыхательных путей (у 18% пациентов) и желудочно- кишечного тракта (23-30% случаев). Нередко аГУС развивается или рецидивирует после перенесенных вирусных инфекций - гриппа H1N1, ветряной оспы. Важным фактором, способствующим развитию или рецидиву аГУС, является беременность, которая предшествует заболеванию у 7-17% пациентов, и трансплантация органов - у 5% пациентов [1,16].
В большинстве случаев аГУС начинается внезапно. Нередко болезнь манифестирует неспецифическими симптомами - слабостью, утомляемостью, общим недомоганием, гриппоподобным синдромом. У взрослых пациентов в 20% случаев отмечается стертое начало с медленным прогрессированием. При этом может длительно, до нескольких месяцев, персистировать анемия легкой степени при незначительной тромбоцитопении или ее отсутствии и сохранной функции почек. Возможно также развитие «неполной» ТМА без тромбоцитопении или, реже, МАГА. В ряде случаев описано развитие только почечных признаков ТМА в отсутствие гематологических нарушений [27].
У большинства пациентов клиническая картина представлена тромбоцитопенией, неиммунной МАГА и ОПП [1,2,16]:
• Тромбоцитопения (менее 150000/мм³ или снижение числа тромбоцитов более чем на 25% от исходного) развивается вследствие потребления тромбоцитов в процессах микроциркуляторного тромбообразования.
• МАГА (гемоглобин, как правило, менее 100 г/л) является результатом механического гемолиза вследствие повреждения мембран эритроцитов при контакте с тромбами и воздействии механизмов shear stress в суженных сосудах малого калибра. Наличие гемолиза подтверждает низкий уровень гаптоглобина и высокий - лактатдегидрогеназы (ЛДГ) в крови, а микроангиопатическую природу гемолиза - наличие шизоцитов (шистоцитов) в мазке периферической крови, и отрицательная реакция Кумбса.
• Поражение почек в большинстве случаев манифестирует ОПП с наличием олиго/анурии или без нее. У пациентов с сохраненным диурезом отмечается протеинурия разной выраженности. При постепенном развитии заболевания может развиться нефротический синдром. Возможно появление гематурии. ОПП не всегда бывает первым проявлением болезни: около 17% пациентов демонстрируют лишь умеренный мочевой синдром без нарушения функции почек. В редких случаях аГУС может дебютировать изолированной протеинурией и умеренным повышением креатинина в крови, которое не нарастает. Большинство взрослых пациентов с аГУС и ОПП в момент госпитализации нуждаются в проведении гемодиализа. Терминальная почечная недостаточность при аГУС развивается независимо от характера манифестации болезни, нередко в исходе первого эпизода ТМА [1,2,16].
• У большинства пациентов с аГУС развивается артериальная гипертония вследствие перегрузки объемом в случае олиго/анурии и/или гиперренинемии вследствие ишемии ткани почек, обусловленной ТМА.
• аГУС представляет собой системную ТМА, при которой развивается поражение не только почек, но и других жизненно важных органов - головного мозга, сердца, легких, пищеварительного тракта, органа зрения [4,28-31]. Экстраренальные проявления заболевания обнаруживают не менее чем у 20-30% пациентов, при этом две трети из них имеют более одного органного поражения, кроме почек.
• Большинство пациентов с аГУС имеет массивные периферические отеки вплоть до анасарки и полостные отеки (гидроторакс, гидроперикард, асцит), основной причиной которых является воздействие анафилотоксинов С3а и С5а, образующихся в процессе активации АПК и вызывающих освобождение гистамина, усиливающего сосудистую проницаемость [32].
• Поражение ЦНС разной степени выраженности (сонливость, раздражительность, судороги, нарушения зрения, гемипарез или гемиплегия, ступор, кома) развивается почти у половины пациентов с аГУС. В ряде случаев возможно развитие отека головного мозга, обусловленное повышенной сосудистой проницаемостью [33].
• У 40% пациентов с аГУС развивается ТМА миокарда, проявляющаяся симптомами дилатационной кардиомиопатии с постепенно нарастающей или острой сердечной недостаточностью, острого инфаркта миокарда, тяжелыми нарушения ритма и проводимости, которые могут привести к внезапной смерти [30,31].
• Легочная ТМА может стать причиной развития геморрагического альвеолита или острого респираторного дистресс-синдрома взрослых. Нарастающая вследствие этих причин дыхательная недостаточность в ряде случаев требует применения искусственной вентиляции легких. Нередко у пациентов с аГУС развиваются двусторонние инфильтраты в легких, что затрудняет верификацию диагноза и требует дифференциальной диагностики с васкулитами и инфекционной патологией [28].
• Поражение желудочно-кишечного тракта встречается приблизительно у 30% пациентов с аГУС. Наиболее часто наблюдается поражение кишечника, проявляющееся диареей, тошнотой и рвотой, хотя возможно развитие абдоминального болевого синдрома. Нередко отмечается развитие острого панкреатита с характерными клиническими признаками вплоть до панкреонекроза. Описано острое развитие сахарного диабета. Реже наблюдаются ишемические некрозы печени [28,29,34].
• Поражение кожи, представленное развитием обширных очагов некроза, у взрослых пациентов встречается редко. Описана также дигитальная ишемическая гангрена, приводящая к ампутации пальцев рук и ног [28].
• Примерно у 5% пациентов, чаще всего при акушерском аГУС, развивается полиорганная недостаточность, обусловленная генерализованной ТМА с поражением сосудов микроциркуляторного русла жизненно важных органов [1].
В большинстве случаев аГУС начинается внезапно. Нередко болезнь манифестирует неспецифическими симптомами - слабостью, утомляемостью, общим недомоганием, гриппоподобным синдромом. У взрослых пациентов в 20% случаев отмечается стертое начало с медленным прогрессированием. При этом может длительно, до нескольких месяцев, персистировать анемия легкой степени при незначительной тромбоцитопении или ее отсутствии и сохранной функции почек. Возможно также развитие «неполной» ТМА без тромбоцитопении или, реже, МАГА. В ряде случаев описано развитие только почечных признаков ТМА в отсутствие гематологических нарушений [27].
У большинства пациентов клиническая картина представлена тромбоцитопенией, неиммунной МАГА и ОПП [1,2,16]:
• Тромбоцитопения (менее 150000/мм³ или снижение числа тромбоцитов более чем на 25% от исходного) развивается вследствие потребления тромбоцитов в процессах микроциркуляторного тромбообразования.
• МАГА (гемоглобин, как правило, менее 100 г/л) является результатом механического гемолиза вследствие повреждения мембран эритроцитов при контакте с тромбами и воздействии механизмов shear stress в суженных сосудах малого калибра. Наличие гемолиза подтверждает низкий уровень гаптоглобина и высокий - лактатдегидрогеназы (ЛДГ) в крови, а микроангиопатическую природу гемолиза - наличие шизоцитов (шистоцитов) в мазке периферической крови, и отрицательная реакция Кумбса.
• Поражение почек в большинстве случаев манифестирует ОПП с наличием олиго/анурии или без нее. У пациентов с сохраненным диурезом отмечается протеинурия разной выраженности. При постепенном развитии заболевания может развиться нефротический синдром. Возможно появление гематурии. ОПП не всегда бывает первым проявлением болезни: около 17% пациентов демонстрируют лишь умеренный мочевой синдром без нарушения функции почек. В редких случаях аГУС может дебютировать изолированной протеинурией и умеренным повышением креатинина в крови, которое не нарастает. Большинство взрослых пациентов с аГУС и ОПП в момент госпитализации нуждаются в проведении гемодиализа. Терминальная почечная недостаточность при аГУС развивается независимо от характера манифестации болезни, нередко в исходе первого эпизода ТМА [1,2,16].
• У большинства пациентов с аГУС развивается артериальная гипертония вследствие перегрузки объемом в случае олиго/анурии и/или гиперренинемии вследствие ишемии ткани почек, обусловленной ТМА.
• аГУС представляет собой системную ТМА, при которой развивается поражение не только почек, но и других жизненно важных органов - головного мозга, сердца, легких, пищеварительного тракта, органа зрения [4,28-31]. Экстраренальные проявления заболевания обнаруживают не менее чем у 20-30% пациентов, при этом две трети из них имеют более одного органного поражения, кроме почек.
• Большинство пациентов с аГУС имеет массивные периферические отеки вплоть до анасарки и полостные отеки (гидроторакс, гидроперикард, асцит), основной причиной которых является воздействие анафилотоксинов С3а и С5а, образующихся в процессе активации АПК и вызывающих освобождение гистамина, усиливающего сосудистую проницаемость [32].
• Поражение ЦНС разной степени выраженности (сонливость, раздражительность, судороги, нарушения зрения, гемипарез или гемиплегия, ступор, кома) развивается почти у половины пациентов с аГУС. В ряде случаев возможно развитие отека головного мозга, обусловленное повышенной сосудистой проницаемостью [33].
• У 40% пациентов с аГУС развивается ТМА миокарда, проявляющаяся симптомами дилатационной кардиомиопатии с постепенно нарастающей или острой сердечной недостаточностью, острого инфаркта миокарда, тяжелыми нарушения ритма и проводимости, которые могут привести к внезапной смерти [30,31].
• Легочная ТМА может стать причиной развития геморрагического альвеолита или острого респираторного дистресс-синдрома взрослых. Нарастающая вследствие этих причин дыхательная недостаточность в ряде случаев требует применения искусственной вентиляции легких. Нередко у пациентов с аГУС развиваются двусторонние инфильтраты в легких, что затрудняет верификацию диагноза и требует дифференциальной диагностики с васкулитами и инфекционной патологией [28].
• Поражение желудочно-кишечного тракта встречается приблизительно у 30% пациентов с аГУС. Наиболее часто наблюдается поражение кишечника, проявляющееся диареей, тошнотой и рвотой, хотя возможно развитие абдоминального болевого синдрома. Нередко отмечается развитие острого панкреатита с характерными клиническими признаками вплоть до панкреонекроза. Описано острое развитие сахарного диабета. Реже наблюдаются ишемические некрозы печени [28,29,34].
• Поражение кожи, представленное развитием обширных очагов некроза, у взрослых пациентов встречается редко. Описана также дигитальная ишемическая гангрена, приводящая к ампутации пальцев рук и ног [28].
• Примерно у 5% пациентов, чаще всего при акушерском аГУС, развивается полиорганная недостаточность, обусловленная генерализованной ТМА с поражением сосудов микроциркуляторного русла жизненно важных органов [1].
|
|
Диагностика
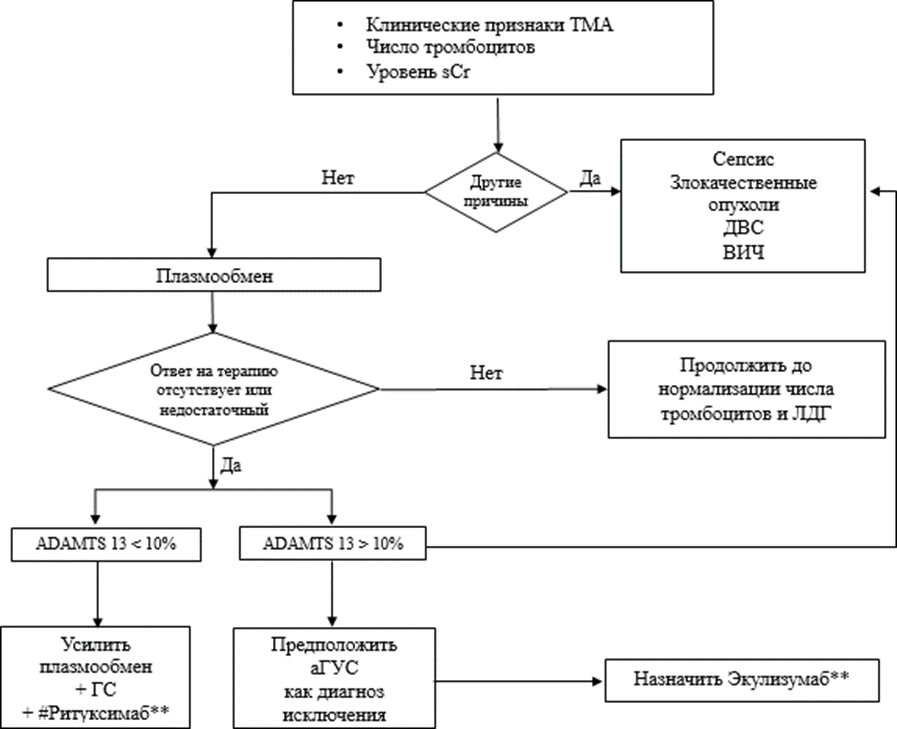
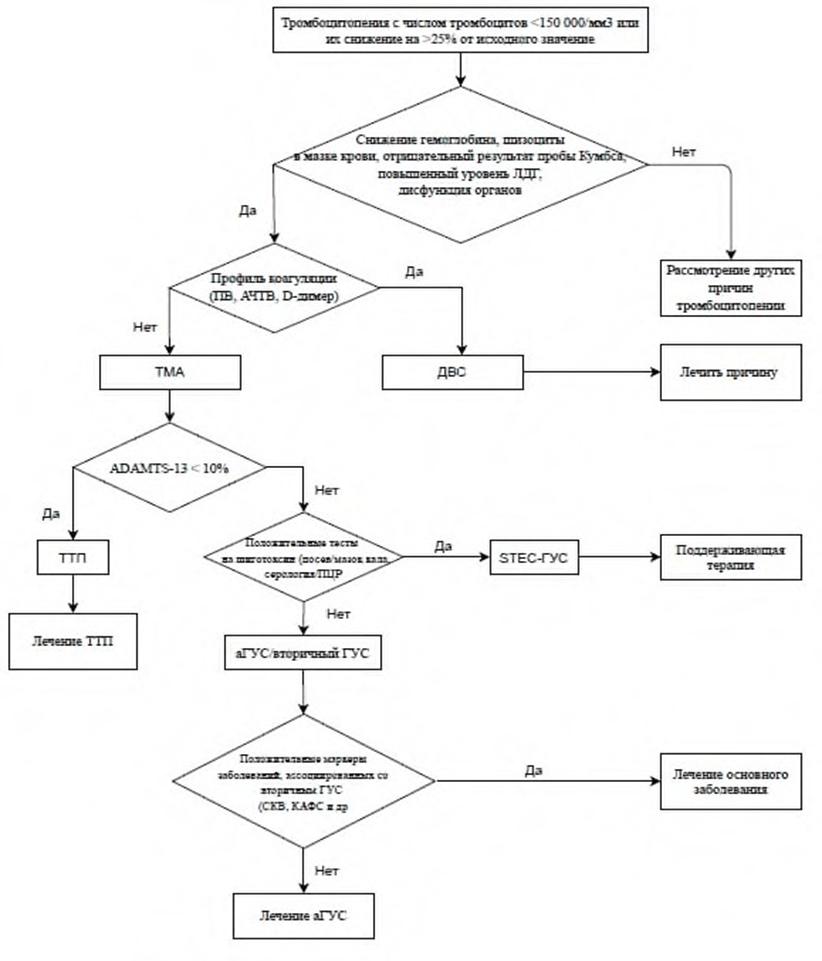
До настоящего времени специфические диагностические маркеры аГУС отсутствуют. Диагноз аГУС - это диагноз исключения. Он устанавливается на основании характерной клинической картины после исключения других форм ТМА, как первичных, так и вторичных. В связи с тем, что все ТМА независимо от их патогенеза имеют сходные клинико-лабораторные проявления и общую гистологическую картину, чрезвычайно важной является дифференциальная диагностика между основными формами первичной ТМА - ТТП, STEC-ГУС и аГУС. У взрослых пациентов с ТМА необходимо также исключить значительное число заболеваний и состояний, при которых возможно развитие вторичных ТМА, в первую очередь, связанных с беременностью и родами, системными заболеваниями (системная красная волчанка (СКВ), антифосфолипидный синдром (АФС), склеродермия), злокачественными новообразованиями, ВИЧ-инфекцией, сепсисом, злокачественной артериальной моя голова наверноегипертензией, лекарственной терапией, синдромом диссеминированного внутрисосудистого свертывания (ДВС-синдромом). Таким образом, диагностику аГУС можно представить как двухуровневый процесс, причем диагностические исследования обоих уровней должны осуществляться не последовательно, а одновременно. Первый уровень предназначен для верификации синдрома ТМА, второй - для верификации нозологического диагноза, и с этой целью необходима дифференциальная диагностика между первичными и вторичными ТМА и первичных ТМА (ТТП, STEC-ГУС и аГУС) между собой [1,2,15,16,35,36].
Алгоритмы действий при подозрении на ТМА и диагностики аГУС представлены в разделе «Приложение Б», п.1 (ТМА) и п.2 (аГУС).
• Мы рекомендуем при осмотре пациентов с подозрением на аГУС с целью диагностики ренальных и экстраненальных проявлений заболевания обратить внимание на следующие жалобы: периферические отеки, уменьшение объема отделяемой мочи, изменение цвета мочи; одышка; геморрагические высыпания на коже; слабость, вялость, быстрая утомляемость, отсутствие аппетита, головокружение; головные боли, нарушение зрения разной выраженности (вплоть до полной слепоты); тошнота, рвота, боли в животе, частый жидкий стул [1,2].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Жалобы пациентов с аГУС неспецифичны. В дебюте заболевание может протекать со стертыми клиническими проявлениями. Нередко единственными жалобами является слабость и утомляемость [2].
• Мы рекомендуем при осмотре пациентов с подозрением на аГУС с целью диагностики ренальных и экстраненальных проявлений заболеваниясоценить наличие: повышенной температуры тела; изменения кожных покровов (бледность, желтуха, геморрагии); периферических отеков; влажных хрипов при аускультации легких; расширения границ сердца; повышенного артериального давления; тахикардии или нарушений ритма сердца [1,2,3].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Комментарии. Жалобы пациентов с аГУС неспецифичны. В дебюте заболевание может протекать со стертыми клиническими проявлениями. Нередко единственными жалобами является слабость и утомляемость [2].
• Мы рекомендуем всем пациентам с подозрением на ТМА для ее диагностики выполнять общий (клинический) анализ крови развернутый с определением количества тромбоцитов и исследованием уровня шизоцитов в крови, анализ крови биохимический общетерапевтический с определением креатинина, активности ЛДГ в крови и исследованием уровня билирубина свободного (неконъюгированного), непрямой антиглобулиновый тест (тест Кумбса), прямой антиглобулиновый тест (прямая проба Кумбса), исследование уровня гаптоглобина [1,14-16,35,37-39,50].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии: диагностика ТМА основана на наличии тромбоцитопении и МАГА в сочетании с признаками поражения почек и/или экстраренального поражения. Тромбоцитопению констатируют при количестве тромбоцитов <150 000/мм³. Если число тромбоцитов превышает это значение, то об их потреблении можно судить по снижению количества тромбоцитов >25% от базального уровня (если он известен). В редких случаях возможно развитие МАГА без тромбоцитопении. Наличие МАГА устанавливают на основании выявления у пациентов с анемией повышенного уровня ЛДГ и/или шизоцитоза (число шизоцитов в мазке периферической крови более 1%) [1,14-16,35,37-39].
• Мы рекомендуем у пациентов с подозрением на ТМА в случае нормального уровня активности ЛДГ в крови проводить исследование уровня гаптоглобина крови как более чувствительного маркера гемолиза, чем ЛДГ [37].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. При подозрении на ТМА необходимо определение всех трех указанных маркеров гемолиза (ЛДГ, шизоциты, гаптоглобин), поскольку в отсутствие изменений одного из них и невыполненных исследованиях двух других диагноз ТМА установить невозможно (ложноотрицательный результат. [37]. Всем пациентам с подозрением на ТМА необходимо также выполнять реакцию Кумбса для исключения иммунной природы гемолиза. У пациентов с МАГА и тромбоцитопенией наличие ОПП или других признаков поражения почек, изолированного или в сочетании с симптомами поражения других органов служит основанием для диагностики ТМА.
• Мы рекомендуем пациентам с симптомокомплексом ТМА устанавливать диагноз аГУС только после исключения диагнозов STEC-ГУС и ТТП, а также вторичных ТМА [1,16].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
• Мы рекомендуем всем пациентам с подозрением на аГУС и признаками поражения желудочно-кишечного тракта, особенно имеющим диарею, с целью исключения STEC-ГУС выполнять необходимые лабораторные исследования ( см комментарии) при поступлении в стационар до начала антибактериальной терапии [2,39,51].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Поскольку около 30% пациентов с аГУС в дебюте болезни имеют симптомы поражения желудочно-кишечного тракта в виде тошноты, рвоты, диареи, болей в животе, необходим скрининг на STEC-ГУС. Диагноз STEC-ГУС основывается на идентификации возбудителя (посев кала) или определении шига- токсина методом полимеразной цепной реакции в стуле или ректальном мазке, определении в сыворотке крови шига-токсина или антител к липополисахариду наиболее распространенного в данном регионе серотипа E. сoli (в России - O157:H7) [2,35,39,51].
• Мы рекомендуем всем пациентам с подозрением на аГУС определение активности металлопротеиназы ADAMTS-13 в плазме крови для исключения ТТП [2,37,39,52,53,54].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии. Металлопротеиназа ADAMTS-13 играет ключевую роль в патогенезе ТТП, поэтому определение ее активности позволяет четко дифференцировать ТТП и аГУС. Активность ADAMTS-13 в норме составляет 50- 150% в зависимости от метода определения. Дефицит активности ADAMTS-13 со снижением менее 10% является диагностическим маркером ТТП. У пациентов с активностью фермента ниже 10% необходимо определять анти-ADAMTS-13-ингибирующие антитела. При их наличии диагностируют идиопатическую (аутоиммунную) ТТП, при отсутствии - наследственную. При любых других ТМА, включая и аГУС, активность ADAMTS-13 может снижаться, но всегда превышает 10% [2,35,37,39,52,53,54]. При исключенных вторичных ТМА значения ADAMTS-13 более 10% позволяют диагностировать аГУС. Исследование активности ADAMTS-13 следует выполнять до начала плазмотерапии.
• Для диффдиагностики аГУС и ТТП в случаях недоступности оперативного определения активности металлопротеиназы ADAMTS-13 в плазме крови у пациентов с ТМА с жизнеугрожюющими проявлениями болезни и/или высоким риском тяжелых почечных и/или внепочечных осложнений, требующими неотложного начала лечения, мы рекомендуем считать маловероятным диагноз ТТП при значениях уровня креатинина крови >150 мкмоль/л (1,7 мг/дл) в сочетании с уровнем тромбоцитов в крови >30 000/1 мкл [52-57].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
• Мы рекомендуем всем пациентам с предполдагаемым диагнозом аГУС с целью дифференциальной диагностики проводить обследование, направленное на исключение наиболее часто встречающихся в клинической практике вторичных ТМА (таблица 1) [16,38-49].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Развитие ТМА во время беременности и после родов требует незамедлительной верификации диагноза, который определяет тактику лечения и прогноз для матери и ребенка. Акушерская ТМА» в большинстве случаев представлена специфическими гестационными видами патологии - преэклампсией и HELLP-синдромом, которые следует исключать в первую очередь. Пациентам с симтомокомплексом ТМА необходимо исключать системные заболевания - СКВ, склеродермию и АФС. Последний может развиться и в рамках СКВ (вторичный АФС), и как самостоятельное заболевание (первичный АФС). Сочетание клинико- лабораторных проявлений ТМА с наличием антифосфолипидных антител безусловно свидетельствует в пользу диагноза «катастрофический АФС», независимо от того, имеются или отсутствуют у пациента клинические и иммунологические признаки СКВ. В связи с этим у пациентов с признаками ТМА следует обязательно определять серологические маркеры и СКВ, и АФС, поскольку выявленный у пациента спектр маркеров определяет терапевтическую тактику. Кроме системных заболеваний, необходимо исключать ВИЧ-инфекцию, так как среди пациентов с ВИЧ-инфекцией частота ТМА выше, чем в общей популяции, и возрастает по мере прогрессирования заболевания. Другие виды патологии, которые следует исключить, прежде чем диагностировать аГУС, указаны в таблице 1. Таблица 1. Наиболее частые вторичные ТМА и подходы к их исключению [38-49].
• Мы рекомендуем выполнять комплекс исследований, необходимый для диагностики ДВС-синдрома, всем пациентам с подозрением на аГУС, особенно в случаях развития полиорганной недостаточности, для исключения ДВС-синдрома [2,39,41,58,59].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. ДВС-синдром представляет собой патологическое состояние, в основе которого лежит тромбообразование в сосудах малого калибра, обусловленное активацией плазменного звена коагуляции с последующей вторичной активацией системы фибринолиза. Именно в этом его главное отличие от других ТМА, и в первую очередь от аГУС, при которых первично поражение эндотелия, приводящее к активации и потреблению тромбоцитов [58]. Панель исследования для диагностики ДВС-синдрома включает в себя определение активированного частичного тромбопластинового времени, протромбинового (тромбопластинового) времени в крови или в плазме, тромбинового времени в крови (ТВ), исследование уровня фибриногена в крови, определение активности антитромбина III в крови (АТIII) и концентрации Д-димера в крови или уровня растворимых фибринмономерных комплексов. В большинстве случаев аГУС показатели коагулограммы (ориентировочное исследование системы гемостаза) не изменены [2,39,41,58,59]. Однако у ряда пациентов аГУС может осложниться развитием ДВС-синдрома, что найдет отражение в удлинении временных параметров свертывания крови, снижении концентрации фибриногена и АТIII, увеличении содержания Д-димера. Сочетание аГУС с ДВС-синдромом возможно из-за тесного взаимодействия систем гемостаза и комплемента, способных взаимно активировать одна другую [60].
• Для выявления дефектов системы комплемента мы рекомендуем исследование уровней общей гемолитической активности комплемента (СН50), С3 фракции комплемента, С4 фракции комплемента в сыворотке крови, всем пациентам с предполагаемым диагнозом аГУС [1,38,39,41,42].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Генетический дефект АПК обусловливает предрасположенность к развитию аГУС, поэтому определение в крови содержания компонентов комплемента и факторов, регулирующих активность АПК, является важным дополнительным методом в диагностике аГУС [1,38,39,41,42]. Панель исследований комплемента включает в себя определение общей гемолитической активности комплемента (СН50), уровней С3 и С4 фракций комплемента, а также регуляторных факторов комплемента сFH, сFI, сFB. В рутинной клинической практике сегодня доступно только определение в крови С3 и С4 фракций комплемента. Снижение содержания С3 при нормальном уровне С4, указывающее на активацию АПК, отмечается не более чем у 50% пациентов с аГУС [61-67]. Нормальный показатель С3 не исключает диагноза аГУС, а выявленное снижение этого компонента комплемента может служить дополнительным аргументом в пользу данного диагноза. В последние годы было предложено с целью дифференциальной диагностики между аГУС и ТТП у пациентов с острым эпизодом ТМА использовать определение в крови фрагмента комплемента С5а и растворимого мембраноатакующего комплекса (МАК, С5b-9), отражающих активацию альтернативного и терминального путей комплемента. Было установлено, что содержание этих факторов повышается при острой комплемент-опосредованной ТМА, что дает основание рассматривать их как биологические маркеры аГУС [35,64,65]. Однако для подтверждения их диагностического значения требуются дополнительные исследования.
Мы рекомендуем определение содержания антител к сFH (анти-CFH-антитела) всем пациентам с предполагаемым диагнозом аГУС для исключения или подтверждения аутоиммунного (антительного) варианта аГУС, забирая кровь для их определения до начала плазмотерапии [1,39,42,67].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии. Аутоантитела к сFH обнаруживают у 5-20% пациентов с аГУС [7,61,66]. Хотя наиболее часто их идентифицируют у детей от 5 до 10 лет, однако нередко выявляют и у взрослых [5]. Действие анти-CFH-антител, как и мутаций сFH, приводит к избыточной активации АПК. Наличие подобных антител связано с дефицитом сFH-связанных белков 1 и 3 (CFHR1 и сFHR3), возникающим вследствие мутаций соответствующих генов. Установлено, что у 90% пациентов с анти-CFH-антителами полностью отсутствуют сFHR1 и сFHR3 вследствие гомозиготной делеции в генах этих протеинов. Достаточно высокая частота обнаружения анти-CFH-антител дает основания для выделения аутоиммунного типа аГУС. Своевременное выявление анти-СFH-антител имеет важное значение для выбора тактики лечения.
Мы рекомендуем проведение исследования для выявления мутаций гена сFHR1 всем пациентам с диагнозом аГУС для прогноза генетического варианта болезни, забирая кровь для их определения до начала плазмотерапии [67].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 2).
Мы рекомендуем у пациентов с предполагаемым аГУС использовать критерии KDIGO 2012 года для диагностики ОПП [39,68].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
• Мы рекомендуем дополнительное обследование с использованием визуализирующих методов исследования по показаниям, определяемым наличием клинико-лабораторных признаков поражения того или иного органа пациентам с экстраренальными проявлениями заболевания [2,3].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарии. Биопсия почки не является обязательной для диагностики аГУС, поскольку заболевание не имеет специфических морфологических признаков, а инвазивная процедура у пациентов даже с небольшой тромбоцитопенией сопряжена с высоким риском кровотечений [35,69]. С другой стороны, инвазивная процедура может стать стимулом дополнительной активации комплемента, что у пациентов с аГУС будет способствовать генерализации микроангиопатического тромбообразования с развитием экстраренального поражения и, в конечном итоге, полиорганной недостаточности. Решение о проведении бипсии почки и его сроках у каждого конкретного пациента является строго индивидуальным. Биопсию почки не следует выполнять пациентам с семейной формой аГУС и с рецидивами острой ТМА, поскольку в этих случаях диагноз очевиден [69]. Однако она может помочь в верификации диагноза в следующих случаях [26,45,49,69,70]:
− Необходимость определения причины ОПП при сомнении в диагнозе аГУС;
− Отсутствие полного лабораторного симптомокомплекса ТМА (чаще всего тромбоцитопении);
− Массивная протеинурия у пациентов с гематологическими проявлениями ТМА;
− Подозрение на вторичные формы ТМА;
− Предполагаемая хроническая ТМА.
• Мы рекомендуем выполнять молекулярно-генетическое исследование мутаций: факторов Н, I, в, СЗ, тромбомодулин, МСР пациентам с клинически установленным диагнозом аГУС для определения прогноза и тактики ведения в отдаленном периоде [42,59,69].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Генетическое исследование не является необходимым для постановки диагноза аГУС и не играет роли в решении вопроса о тактике лечения пациента в момент острого эпизода, однако имеет важное значение для определения прогноза. Отсутствие необходимости генетического скрининга для диагностики аГУС основано на том, что мутации генов регуляторных белков АПК выявляются у пациентов с наследственным аГУС в 60-70% случаев, а при спорадической форме болезни - в 30% [1,15,35,62,63]. Таким образом, отрицательный результат генетического скрининга у пациента с несомненным симптомокомплексом ТМА не исключает наличия аГУС. Выполнение генетического исследования занимает не менее двух месяцев, а прогноз одинаков у пациентов как с идентифицированными, так и с неидентифицированными мутациями [61,62]. Поэтому для диагностики аГУС и назначения лечения генетическое исследование не требуется. Особенное значение это исследование имеет при планировании трансплантации почки, поскольку после нее риск рецидива аГУС, определяющего прогноз, зависит от вида мутаций (таблица 2) [61,62,71,72]. В этом случае оно, кроме определения тактики ведения пациента после операции, может помочь в выборе донора, особенно если обсуждается возможность родственной трансплантации [35].
Таблица 2. Прогноз при аГУС в зависимости от вида мутаций в генах комплемента.
Примечание: ТПН - терминальная почечная недостаточность.
Следует отметить, что генетический скрининг необходим, чтобы подтвердить или опровергнуть связь заболевания с патологией комплемента, что имеет важное значение при развитии терминальной почечной недостаточности, причина которой неясна, в особенности у молодых пациентов, а также для определения прогноза, риска рецидивов и прогрессирования хронической болезни почек (ХБП) (таблица 2) [35]. В настоящее время генетическое исследование проводится методом секвенирования последнего поколения. Панель генов комплемента, исследуемых с целью подтверждения клинического диагноза аГУС, включает в себя гены факторов H (CFH), I (CFI), в(CFB), с3, мембранного кофакторного протеина (MCP), тромбомодулина (THBD), белков, связанных с сFH (CFHR1-R5), а также гены диацилглицеролкиназы эпсилон (DGKE) и ADAMTS13 [35,41,42,59,62,63,69]. При этом необходимо отметить, что отсутствие генетических дефектов не исключает диагноза аГУС, особенно при спорадической форме заболевания.
Алгоритмы действий при подозрении на ТМА и диагностики аГУС представлены в разделе «Приложение Б», п.1 (ТМА) и п.2 (аГУС).
2,1 Жалобы и анамнез.
Клинические данные, полученные при анализе жалоб и анамнеза и указывающие на вероятное наличие аГУС, приведены в разделе 1,6.• Мы рекомендуем при осмотре пациентов с подозрением на аГУС с целью диагностики ренальных и экстраненальных проявлений заболевания обратить внимание на следующие жалобы: периферические отеки, уменьшение объема отделяемой мочи, изменение цвета мочи; одышка; геморрагические высыпания на коже; слабость, вялость, быстрая утомляемость, отсутствие аппетита, головокружение; головные боли, нарушение зрения разной выраженности (вплоть до полной слепоты); тошнота, рвота, боли в животе, частый жидкий стул [1,2].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Жалобы пациентов с аГУС неспецифичны. В дебюте заболевание может протекать со стертыми клиническими проявлениями. Нередко единственными жалобами является слабость и утомляемость [2].
2,2 Физикальное обследование.
Данные физикального обследования, указывающие на вероятное наличие аГУС, приведены в разделе 1,6.• Мы рекомендуем при осмотре пациентов с подозрением на аГУС с целью диагностики ренальных и экстраненальных проявлений заболеваниясоценить наличие: повышенной температуры тела; изменения кожных покровов (бледность, желтуха, геморрагии); периферических отеков; влажных хрипов при аускультации легких; расширения границ сердца; повышенного артериального давления; тахикардии или нарушений ритма сердца [1,2,3].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Комментарии. Жалобы пациентов с аГУС неспецифичны. В дебюте заболевание может протекать со стертыми клиническими проявлениями. Нередко единственными жалобами является слабость и утомляемость [2].
2,3 Лабораторные диагностические исследования.
До настоящего времени не существует каких-либо специфических диагностических маркеров аГУС. В связи с этим диагноз аГУС является диагнозом исключения, и может быть установлен только после тщательного обследования пациента, которое позволит отвергнуть диагнозы любых других первичных (STEC-ГУС, ТТП) и вторичных ТМА, к которым относятся ТМА, ассоциированные с инфекцией, лекарственными препаратами, беременностью и родами, аутоиммунными заболеваниями, опухолями, злокачественной артериальной гипертонией, трансплантацией костного мозга и солидных органов [4,16,25,35,37-49].• Мы рекомендуем всем пациентам с подозрением на ТМА для ее диагностики выполнять общий (клинический) анализ крови развернутый с определением количества тромбоцитов и исследованием уровня шизоцитов в крови, анализ крови биохимический общетерапевтический с определением креатинина, активности ЛДГ в крови и исследованием уровня билирубина свободного (неконъюгированного), непрямой антиглобулиновый тест (тест Кумбса), прямой антиглобулиновый тест (прямая проба Кумбса), исследование уровня гаптоглобина [1,14-16,35,37-39,50].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии: диагностика ТМА основана на наличии тромбоцитопении и МАГА в сочетании с признаками поражения почек и/или экстраренального поражения. Тромбоцитопению констатируют при количестве тромбоцитов <150 000/мм³. Если число тромбоцитов превышает это значение, то об их потреблении можно судить по снижению количества тромбоцитов >25% от базального уровня (если он известен). В редких случаях возможно развитие МАГА без тромбоцитопении. Наличие МАГА устанавливают на основании выявления у пациентов с анемией повышенного уровня ЛДГ и/или шизоцитоза (число шизоцитов в мазке периферической крови более 1%) [1,14-16,35,37-39].
• Мы рекомендуем у пациентов с подозрением на ТМА в случае нормального уровня активности ЛДГ в крови проводить исследование уровня гаптоглобина крови как более чувствительного маркера гемолиза, чем ЛДГ [37].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. При подозрении на ТМА необходимо определение всех трех указанных маркеров гемолиза (ЛДГ, шизоциты, гаптоглобин), поскольку в отсутствие изменений одного из них и невыполненных исследованиях двух других диагноз ТМА установить невозможно (ложноотрицательный результат. [37]. Всем пациентам с подозрением на ТМА необходимо также выполнять реакцию Кумбса для исключения иммунной природы гемолиза. У пациентов с МАГА и тромбоцитопенией наличие ОПП или других признаков поражения почек, изолированного или в сочетании с симптомами поражения других органов служит основанием для диагностики ТМА.
• Мы рекомендуем пациентам с симптомокомплексом ТМА устанавливать диагноз аГУС только после исключения диагнозов STEC-ГУС и ТТП, а также вторичных ТМА [1,16].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
• Мы рекомендуем всем пациентам с подозрением на аГУС и признаками поражения желудочно-кишечного тракта, особенно имеющим диарею, с целью исключения STEC-ГУС выполнять необходимые лабораторные исследования ( см комментарии) при поступлении в стационар до начала антибактериальной терапии [2,39,51].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Поскольку около 30% пациентов с аГУС в дебюте болезни имеют симптомы поражения желудочно-кишечного тракта в виде тошноты, рвоты, диареи, болей в животе, необходим скрининг на STEC-ГУС. Диагноз STEC-ГУС основывается на идентификации возбудителя (посев кала) или определении шига- токсина методом полимеразной цепной реакции в стуле или ректальном мазке, определении в сыворотке крови шига-токсина или антител к липополисахариду наиболее распространенного в данном регионе серотипа E. сoli (в России - O157:H7) [2,35,39,51].
• Мы рекомендуем всем пациентам с подозрением на аГУС определение активности металлопротеиназы ADAMTS-13 в плазме крови для исключения ТТП [2,37,39,52,53,54].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии. Металлопротеиназа ADAMTS-13 играет ключевую роль в патогенезе ТТП, поэтому определение ее активности позволяет четко дифференцировать ТТП и аГУС. Активность ADAMTS-13 в норме составляет 50- 150% в зависимости от метода определения. Дефицит активности ADAMTS-13 со снижением менее 10% является диагностическим маркером ТТП. У пациентов с активностью фермента ниже 10% необходимо определять анти-ADAMTS-13-ингибирующие антитела. При их наличии диагностируют идиопатическую (аутоиммунную) ТТП, при отсутствии - наследственную. При любых других ТМА, включая и аГУС, активность ADAMTS-13 может снижаться, но всегда превышает 10% [2,35,37,39,52,53,54]. При исключенных вторичных ТМА значения ADAMTS-13 более 10% позволяют диагностировать аГУС. Исследование активности ADAMTS-13 следует выполнять до начала плазмотерапии.
• Для диффдиагностики аГУС и ТТП в случаях недоступности оперативного определения активности металлопротеиназы ADAMTS-13 в плазме крови у пациентов с ТМА с жизнеугрожюющими проявлениями болезни и/или высоким риском тяжелых почечных и/или внепочечных осложнений, требующими неотложного начала лечения, мы рекомендуем считать маловероятным диагноз ТТП при значениях уровня креатинина крови >150 мкмоль/л (1,7 мг/дл) в сочетании с уровнем тромбоцитов в крови >30 000/1 мкл [52-57].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
• Мы рекомендуем всем пациентам с предполдагаемым диагнозом аГУС с целью дифференциальной диагностики проводить обследование, направленное на исключение наиболее часто встречающихся в клинической практике вторичных ТМА (таблица 1) [16,38-49].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Развитие ТМА во время беременности и после родов требует незамедлительной верификации диагноза, который определяет тактику лечения и прогноз для матери и ребенка. Акушерская ТМА» в большинстве случаев представлена специфическими гестационными видами патологии - преэклампсией и HELLP-синдромом, которые следует исключать в первую очередь. Пациентам с симтомокомплексом ТМА необходимо исключать системные заболевания - СКВ, склеродермию и АФС. Последний может развиться и в рамках СКВ (вторичный АФС), и как самостоятельное заболевание (первичный АФС). Сочетание клинико- лабораторных проявлений ТМА с наличием антифосфолипидных антител безусловно свидетельствует в пользу диагноза «катастрофический АФС», независимо от того, имеются или отсутствуют у пациента клинические и иммунологические признаки СКВ. В связи с этим у пациентов с признаками ТМА следует обязательно определять серологические маркеры и СКВ, и АФС, поскольку выявленный у пациента спектр маркеров определяет терапевтическую тактику. Кроме системных заболеваний, необходимо исключать ВИЧ-инфекцию, так как среди пациентов с ВИЧ-инфекцией частота ТМА выше, чем в общей популяции, и возрастает по мере прогрессирования заболевания. Другие виды патологии, которые следует исключить, прежде чем диагностировать аГУС, указаны в таблице 1. Таблица 1. Наиболее частые вторичные ТМА и подходы к их исключению [38-49].
| Заболевания и состояния | Подходы к исключению |
| Беременность и ее осложнения: HELLP-синдром, преэклампсия | Срок гестации, тест на беременность в малом сроке, ферменты печени |
| Системная красная волчанка, склеродермия,антифосфолипидный синдром | антинуклеарный фактор на HEp-2 клетках, панель антиядерных антител, антитела к двуспиральной ДНК,антитела к кардиолипину, волчаночный антикоагулянт анти-β2-ГП1-антитела |
| ВИЧ-инфекция | Положительные результаты иммунно- блоттинга на ВИЧ-инфекцию |
| Злокачественная артериальнаягипертония | Анамнез артериальной гипертонии, характерныеизменения глазного дна при офтальмоскопии, электрокардиографии, эхокардиографии |
| Злокачественные новообразования | Онкомаркеры, онкопоиск с использованием различныхвизуализирующих методов |
| ТМА, ассоциированная с лекарствами | Анамнез лекарственной терапии: антибиотики, противоопухолевые средства (препараты платины, ингибиторы VEGF), ингибиторы кальцинейрина, препараты интерферона, антиагреганты тиклопидиновогоряда, оральные контрацептивы и пр. |
| Трансплантация костного мозга исолидных органов | Соответствующий анамнез |
• Мы рекомендуем выполнять комплекс исследований, необходимый для диагностики ДВС-синдрома, всем пациентам с подозрением на аГУС, особенно в случаях развития полиорганной недостаточности, для исключения ДВС-синдрома [2,39,41,58,59].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. ДВС-синдром представляет собой патологическое состояние, в основе которого лежит тромбообразование в сосудах малого калибра, обусловленное активацией плазменного звена коагуляции с последующей вторичной активацией системы фибринолиза. Именно в этом его главное отличие от других ТМА, и в первую очередь от аГУС, при которых первично поражение эндотелия, приводящее к активации и потреблению тромбоцитов [58]. Панель исследования для диагностики ДВС-синдрома включает в себя определение активированного частичного тромбопластинового времени, протромбинового (тромбопластинового) времени в крови или в плазме, тромбинового времени в крови (ТВ), исследование уровня фибриногена в крови, определение активности антитромбина III в крови (АТIII) и концентрации Д-димера в крови или уровня растворимых фибринмономерных комплексов. В большинстве случаев аГУС показатели коагулограммы (ориентировочное исследование системы гемостаза) не изменены [2,39,41,58,59]. Однако у ряда пациентов аГУС может осложниться развитием ДВС-синдрома, что найдет отражение в удлинении временных параметров свертывания крови, снижении концентрации фибриногена и АТIII, увеличении содержания Д-димера. Сочетание аГУС с ДВС-синдромом возможно из-за тесного взаимодействия систем гемостаза и комплемента, способных взаимно активировать одна другую [60].
• Для выявления дефектов системы комплемента мы рекомендуем исследование уровней общей гемолитической активности комплемента (СН50), С3 фракции комплемента, С4 фракции комплемента в сыворотке крови, всем пациентам с предполагаемым диагнозом аГУС [1,38,39,41,42].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Генетический дефект АПК обусловливает предрасположенность к развитию аГУС, поэтому определение в крови содержания компонентов комплемента и факторов, регулирующих активность АПК, является важным дополнительным методом в диагностике аГУС [1,38,39,41,42]. Панель исследований комплемента включает в себя определение общей гемолитической активности комплемента (СН50), уровней С3 и С4 фракций комплемента, а также регуляторных факторов комплемента сFH, сFI, сFB. В рутинной клинической практике сегодня доступно только определение в крови С3 и С4 фракций комплемента. Снижение содержания С3 при нормальном уровне С4, указывающее на активацию АПК, отмечается не более чем у 50% пациентов с аГУС [61-67]. Нормальный показатель С3 не исключает диагноза аГУС, а выявленное снижение этого компонента комплемента может служить дополнительным аргументом в пользу данного диагноза. В последние годы было предложено с целью дифференциальной диагностики между аГУС и ТТП у пациентов с острым эпизодом ТМА использовать определение в крови фрагмента комплемента С5а и растворимого мембраноатакующего комплекса (МАК, С5b-9), отражающих активацию альтернативного и терминального путей комплемента. Было установлено, что содержание этих факторов повышается при острой комплемент-опосредованной ТМА, что дает основание рассматривать их как биологические маркеры аГУС [35,64,65]. Однако для подтверждения их диагностического значения требуются дополнительные исследования.
Мы рекомендуем определение содержания антител к сFH (анти-CFH-антитела) всем пациентам с предполагаемым диагнозом аГУС для исключения или подтверждения аутоиммунного (антительного) варианта аГУС, забирая кровь для их определения до начала плазмотерапии [1,39,42,67].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии. Аутоантитела к сFH обнаруживают у 5-20% пациентов с аГУС [7,61,66]. Хотя наиболее часто их идентифицируют у детей от 5 до 10 лет, однако нередко выявляют и у взрослых [5]. Действие анти-CFH-антител, как и мутаций сFH, приводит к избыточной активации АПК. Наличие подобных антител связано с дефицитом сFH-связанных белков 1 и 3 (CFHR1 и сFHR3), возникающим вследствие мутаций соответствующих генов. Установлено, что у 90% пациентов с анти-CFH-антителами полностью отсутствуют сFHR1 и сFHR3 вследствие гомозиготной делеции в генах этих протеинов. Достаточно высокая частота обнаружения анти-CFH-антител дает основания для выделения аутоиммунного типа аГУС. Своевременное выявление анти-СFH-антител имеет важное значение для выбора тактики лечения.
Мы рекомендуем проведение исследования для выявления мутаций гена сFHR1 всем пациентам с диагнозом аГУС для прогноза генетического варианта болезни, забирая кровь для их определения до начала плазмотерапии [67].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 2).
Мы рекомендуем у пациентов с предполагаемым аГУС использовать критерии KDIGO 2012 года для диагностики ОПП [39,68].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
2,4 Инструментальные диагностические исследования.
Специфическая инструментальная диагностика для аГУС не предусмотрена.• Мы рекомендуем дополнительное обследование с использованием визуализирующих методов исследования по показаниям, определяемым наличием клинико-лабораторных признаков поражения того или иного органа пациентам с экстраренальными проявлениями заболевания [2,3].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
2,5 Иные диагностические исследования.
• Мы рекомендуем пациентам с аГУС в сомнительных и неясных случаях с целью подтверждения диагноза ТМА выполнять биопсии почки под контролем ультразвукового исследования с патолого-анатомическим исследованием биопсийного материала [26,45,49,69,70].Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарии. Биопсия почки не является обязательной для диагностики аГУС, поскольку заболевание не имеет специфических морфологических признаков, а инвазивная процедура у пациентов даже с небольшой тромбоцитопенией сопряжена с высоким риском кровотечений [35,69]. С другой стороны, инвазивная процедура может стать стимулом дополнительной активации комплемента, что у пациентов с аГУС будет способствовать генерализации микроангиопатического тромбообразования с развитием экстраренального поражения и, в конечном итоге, полиорганной недостаточности. Решение о проведении бипсии почки и его сроках у каждого конкретного пациента является строго индивидуальным. Биопсию почки не следует выполнять пациентам с семейной формой аГУС и с рецидивами острой ТМА, поскольку в этих случаях диагноз очевиден [69]. Однако она может помочь в верификации диагноза в следующих случаях [26,45,49,69,70]:
− Необходимость определения причины ОПП при сомнении в диагнозе аГУС;
− Отсутствие полного лабораторного симптомокомплекса ТМА (чаще всего тромбоцитопении);
− Массивная протеинурия у пациентов с гематологическими проявлениями ТМА;
− Подозрение на вторичные формы ТМА;
− Предполагаемая хроническая ТМА.
• Мы рекомендуем выполнять молекулярно-генетическое исследование мутаций: факторов Н, I, в, СЗ, тромбомодулин, МСР пациентам с клинически установленным диагнозом аГУС для определения прогноза и тактики ведения в отдаленном периоде [42,59,69].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Генетическое исследование не является необходимым для постановки диагноза аГУС и не играет роли в решении вопроса о тактике лечения пациента в момент острого эпизода, однако имеет важное значение для определения прогноза. Отсутствие необходимости генетического скрининга для диагностики аГУС основано на том, что мутации генов регуляторных белков АПК выявляются у пациентов с наследственным аГУС в 60-70% случаев, а при спорадической форме болезни - в 30% [1,15,35,62,63]. Таким образом, отрицательный результат генетического скрининга у пациента с несомненным симптомокомплексом ТМА не исключает наличия аГУС. Выполнение генетического исследования занимает не менее двух месяцев, а прогноз одинаков у пациентов как с идентифицированными, так и с неидентифицированными мутациями [61,62]. Поэтому для диагностики аГУС и назначения лечения генетическое исследование не требуется. Особенное значение это исследование имеет при планировании трансплантации почки, поскольку после нее риск рецидива аГУС, определяющего прогноз, зависит от вида мутаций (таблица 2) [61,62,71,72]. В этом случае оно, кроме определения тактики ведения пациента после операции, может помочь в выборе донора, особенно если обсуждается возможность родственной трансплантации [35].
Таблица 2. Прогноз при аГУС в зависимости от вида мутаций в генах комплемента.
| Ген | Риск смерти или ТПН в момент острого эпизода или через год от дебюта | Риск рецидива | Риск смерти или ТПН через 3-5 лет от начала болезни | Риск рецидива после трансплан-тации почки |
| сFH | 50-70% | 50% | 75% | 75-90% |
| сFI | 50% | 10-30% | 50-60% | 45-80% |
| MCP | 0-6% | 70-90% | 6-38% | <20% |
| С3 | 60% | 50% | 75% | 40-70% |
| сFВ | 50% | 3/3 без ТПН | 75% | 100% |
| THBD | 50% | 30% | 54% | 1 пациент |
| Анти-CFH-АТ | 30-40% | 40-60% | 35-60% | Выше у пациентов с высоким уровнем |
Примечание: ТПН - терминальная почечная недостаточность.
Следует отметить, что генетический скрининг необходим, чтобы подтвердить или опровергнуть связь заболевания с патологией комплемента, что имеет важное значение при развитии терминальной почечной недостаточности, причина которой неясна, в особенности у молодых пациентов, а также для определения прогноза, риска рецидивов и прогрессирования хронической болезни почек (ХБП) (таблица 2) [35]. В настоящее время генетическое исследование проводится методом секвенирования последнего поколения. Панель генов комплемента, исследуемых с целью подтверждения клинического диагноза аГУС, включает в себя гены факторов H (CFH), I (CFI), в(CFB), с3, мембранного кофакторного протеина (MCP), тромбомодулина (THBD), белков, связанных с сFH (CFHR1-R5), а также гены диацилглицеролкиназы эпсилон (DGKE) и ADAMTS13 [35,41,42,59,62,63,69]. При этом необходимо отметить, что отсутствие генетических дефектов не исключает диагноза аГУС, особенно при спорадической форме заболевания.
|
|
Лечение
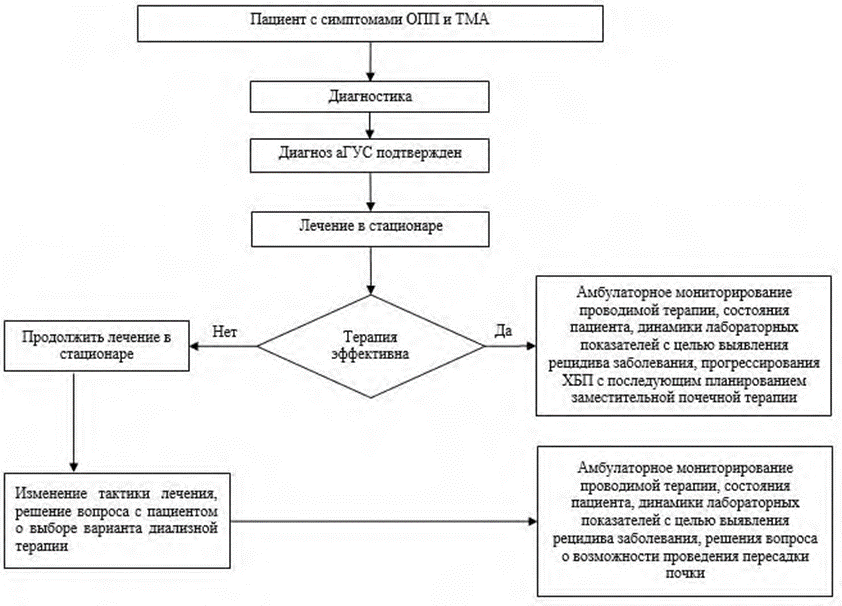
Целями терапии аГУС, помимо обеспечения лучшей выживаемости пациентов, являются ингибиция неконтролируемой активации комплемента, прекращение микроциркуляторного тромбообразования, купирование клинико-лабораторных проявлений ТМА, сохранение и улучшение функции пораженных органов (в том числе, предотвращение развития терминальной почечной недостаточности, избавление от потребности в диализных методах лечения, недопущение поражения других внутренних органов, кроме почек), улучшение качества жизни пациентов. Алгоритм ведения пациента с аГУС представлен в «Приложении Б», п.3.
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 1).
• Пациентам с предполагаемым диагнозом аГУС мы рекомендуем проводить плазмотерапию в виде трансфузий свежезамороженной плазмы (СЗП) только в случае невозможности немедленного начала ПО или его недоступности [39,41,42,59,69,73,74,77].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Комментарии. У пациентов с подозрением на аГУС в момент острого эпизода ТМА эмпирическая плазмотерапия уже в течение нескольких десятилетий остается терапией первой линии, которую следует начинать в течение 4-8 часов от момента констатации ТМА и которая проводится до подтверждения диагноза, до исключения STEC-ГУС и ТТП. Используются два режима плазмотерапии - ПО, который предпочтителен, и трансфузии СЗП в случае недоступности ПО [39,41,42,69,73,74,77]. При трансфузиях СЗП в кровоток попадают функционально активные белки-регуляторы комплемента, которые устраняют дефицит собственных регуляторов - факторов сFH и сFI, а также естественный компонент плазмы - металлопротеаза ADAMTS13, ограничивающая тромбообразование в сосудах микроцируляторного русла за счет расщепления сверхкрупных мультимеров фактора фон Виллебранда [78]. При ПО, кроме того, происходит элиминация измененных эндогенных растворимых ингибиторов комплемента и, в случае антительного аГУС, циркулирующих антител к фактору сFН. Режим ПО также позволяет минимизировать риск перегрузки объемом, что особенно важно у пациентов с олигурией, поражением ЦНС и сердца [69]. Применение плазмотерапии привело к снижению смертности в момент острого эпизода ТМА при аГУС на 50-60%, однако не предотвращает рецидивы заболевания и прогрессирование ХБП с достижением терминальной почечной недостаточности [61,79]. Ответ на плазмотерапию варьирует в довольно широких пределах и зависит от того, в каком факторе комплемента локализованы мутации [42]. Чаще всего - в 55-80% случаев - полный ответ отмечается у пациентов с мутациями в генах С3 и тромбомодулина (THBD) [42,61]. Однако несмотря на то, что восстановление гематологических показателей, в первую очередь, числа тромбоцитов, наблюдается в большинстве случаев, полный гематологический и почечный ответ демонстрируют менее 50% пациентов, а среди пациентов с мутациями сFH и сFI частота полного ответа не превышает 15-25% [61,69]. Принимая во внимание неопределенную длительность терапевтического эффекта плазмотерапии, высокую частоту рецидивов после ее завершения, а также появление препарата для патогенетической терапии аГУС - экулизумаба** - Американское общество афереза изменило категорию терапевтического плазмообмена для комплемент- опосредованного ГУС с II (терапия второй линии) на III (роль ПО точно не установлена) [42,80]. Однако отсутствие полной доступности комплемент- блокирующей терапии для пациентов с аГУС в нашей стране дает основания сохранять ПО как терапию первой линии.
• Пациентам с первым эпизодом аГУС или его рецидивом, не получающим экулизумаб**, мы рекомендуем проводить терапию ПО с объемом эксфузии и замещения СЗП, равном 1,5 объемам циркулирующей плазмы (60-75 мл плазмы/кг) для снижения выраженности клинических проявлений болезни [39,41,42,59,69,73,74].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
• Мы рекомендуем проводить трансфузии СЗП из расчета 25-30 мл/кг/сут в случае невозможности незамедлительного проведения ПО для снижения выраженности клинических проявлений болезни [39,41,42,59,69,73,74].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Об эффективности плазмотерапии при аГУС можно будет судить лишь при четком следовании протоколу лечения, согласно которому сначала в течение 5 дней подряд проводятся сеансы ПО [42,59,69,81], после чего принимается решение о дальнейшей тактике ведения пациента на основании наличия или отсутствия ответа на плазмотерапию. Если наблюдается ответ на терапию, определяемый как рост числа тромбоцитов и снижение ЛДГ, плазмотерапию следует продолжить в прежнем режиме, проводя по 5 сеансов ПО в течение следующих 2-х недель, а затем - по 3 сеанса в неделю еще в течение 2-х недель [15,59]. Критериями эффективности плазмотерапии служат нормализация числа тромбоцитов и прекращение гемолиза, о чем свидетельствует нормализация ЛДГ. Продолжительность лечения СЗП не определена, однако показанием к прекращению плазмотерапии является нормальное количество тромбоцитов и уровень ЛДГ в течение 2-х дней подряд [80]. Следует отметить, что в некоторых случаях показатели ЛДГ остаются повышенными даже после прекращения гемолиза, поскольку основным источником ЛДГ в организме являются не только эритроциты, но и ткани внутренних органов, ишемия которых при развитии ТМА также вносит свой вклад в повышение ЛДГ [82]. Поэтому предлагается также использовать в качестве критерия эффективности плазмотерапии снижение креатинина крови не менее чем на 25% от исходного уровня после 5 сеансов ПО [81,83].
• Мы рекомендуем прекратить лечение СЗП и начать патогенетическую комплемент- блокирующую терапию экулизумабом** пациентам с подтвержденным аГУС с отсутствием ответа на плазмотерапию после 5 процедур полнообъемного ПО или пациентам, демонстрирующим плазмозависимость, для достижения ремиссии и улучшения прогноза [39,41,42,59,69,81,84,91,99].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии. Отсутствие тенденции к увеличению числа тромбоцитов, снижению уровня ЛДГ и/или креатинина крови в ходе лечения СЗП следует рассматривать как рефрактерность к плазмотерапии, что является абсолютным показанием к прекращению ее и назначению экулизумаба** [42,59]. Под плазмозависимостью понимается нормализация числа тромбоцитов в ходе плазмотерапии, но повторное снижение их и повышение уровня креатинина при перерыве в сеансах ПО, что требует возобновления процедур [42].
• Пациентам с аутоиммунным аГУС, определенным на основании обнаружения анти-CFH-антител, мы рекомендуем проводить плазмообмены в комбинации с индукционной терапией глюкокортикоидами и/или иммунодепрессантами для снижения риска неблагоприятных клинических событий [42,59,69,85,86].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Лечение аутоиммунного аГУС требует сочетания плазмотерапии с глюкокортикоидами и противоопухолевыми препаратами [35,42,59,66,82,86]. Добавление к плазмотерапии глюкокортикоидов в виде монотерапии или в сочетании с ритуксимабом** (внутривенно, в дозе 375 мг/м2 1 раз в неделю, 4 введения [125]) или с циклофосфамидом** (внутривенно 6 введений по 500 мг в течение 3 месяцев [126]) может уменьшить риск смерти или достижения ХБП 4 стадии в течение первого года с 59% до 24%. Поддерживающая иммуносупрессивная терапия в дальнейшем снижала однолетний риск рецидива этой формы аГУС с 21% до 8% [86].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии: в основе терапевтического эффекта экулизумаба** лежит прекращение микроциркуляторного тромбообразования вследствие блокады неконтролируемой активации АПК. Применение препарата приводит к уменьшению в крови уровня маркеров воспаления, активации комплемента и эндотелиального повреждения и тромбообразования, а также маркеров повреждения почек [87]. Проведенные исследования продемонстрировали высокую эффективность экулизумаба** в отношении как гематологических (нормализация числа тромбоцитов и прекращение микроангиопатического гемолиза), так и почечных проявлений аГУС [88,89]. У пациентов, получавших экулизумаб**, отмечалось восстановление или улучшение функции почек, исчезала потребность в гемодиализе, причем показатели функции почек улучшались по мере увеличения срока терапии: так, в исследовании с.M. Legendre и соавт. увеличение расчетной скорости клубочковой фильтрации ≥15 мл/мин/1,73 м2 через 26 недель терапии наблюдалось у 5% пациентов, через 1 год - у 15%, а через 2 года - у 40%. Изменение стадии ХБП в сторону более ранних и ≥ чем на одну стадию продемонстрировано у 35%, 45% и 60% пациентов, соответственно [88]. Примечательно, что подобный эффект наблюдался независимо от наличия или отсутствия мутаций в генах комплемента [88]. При долговременном применении экулизумаб** предотвращает рецидивы острой комплемент-опосредованной ТМА [92].
В фазе индукции (начальный цикл) экулизумаб** вводится в дозе 900 мг в виде внутривенной инфузии один раз в неделю в течение первых 4-х недель терапии (всего 4 инфузии). На 5-ой неделе терапии внутривенно вводится 1200 мг препарата (5-я инфузия), а затем по 1200 мг раз в 2 недели неопределенно длительно (таблица 3). Способ применения лекарственного препарата соответствует инструкции по применению («Приложение А3»).
Таблица 3. Режим дозирования экулизумаба** у пациентов с аГУС.
• Мы рекомендуем производить вакцинацию против Neisseria meningitidis вакциной для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** всех пациентов с аГУС за 2 недели до первого введения экулизумаба** [2,69,93].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарии. При блокаде С5 компонента комплемента препаратом экулизумаб** нарушается иммунный ответ на некоторые инкапсулированные бактерии, в первую очередь на один из видов Neisseria - менингококк. Это создает повышенный риск развития менингококковой инфекции во время лечения экулизумабом**, для профилактики которой пациентов с аГУС необходимо иммунизировать до начала терапии [2,69,93].
• Мы рекомендуем пациентам с аГУС, имеющим показания к срочному началу лечения экулизумабом**, которое исключает возможность предшествующей вакцинации против менингококка, проводить антибиотикопрофилактику препаратами, проникающими через гематоэнцефалический барьер, с целью предотвращения менингококковой инфекции [2,69,93].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Лечение антибактериальными препаратами системного действия необходимо начинать одновременно с вакцинацией и проводить не менее 2-х недель в случаях, если вакцинацию проводят в день первой инфузии экулизумаба**. Длительность применения и доза антибиотиков определяется лечащим врачом, исходя из конкретной клинической ситуации. В случаях невозможности вакцинации к моменту начала лечения антибиотикопрофилактика может быть продлена на срок до нескольких месяцев в зависимости от времени вакцинации. В ряде случаев антибиотики могут назначаться даже своевременно вакцинированным пациентам. Показания к их применению определяет лечащий врач. Необходимость профилактического назначения антибиотиков пациентам с аГУС обусловлена отсутствием вакцины против серотипа В N. meningitides, в связи с чем проведение вакцинации полностью не исключает развития менингита [69].
• Мы не рекомендуем отмену экулизумаба** после достижения ремиссии комплемент-опосредованной ТМА пациентам, у которых при генетическом исследовании идентифицированы мутации генов факторов комплемента сFH, сFI, сFB, с3 [42,69,92,93].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Первоначально считалось, что лечение экулизумабом** должно проводиться пожизненно, поскольку основным механизмом развития аГУС является хроническая неконтролируемая гиперактивация комплемента, обусловленная генетическим дефектом. Однако проведенные в последнее время исследования показали, что отмена препарата возможна, хотя примерно у 30% пациентов после прекращения терапии развивается рецидив ТМА, причем чаще у имеющих мутации, ассоциированные с развитием аГУС. Именно поэтому принимать решение об отмене препарата можно, только имея результаты генетического исследования [42,69,86,92,93,94,96].
• Мы рекомендуем тщательное наблюдение пациентов в случаях отмены экулизумаба** с мониторированием общего (клинического) анализа мочи, общего (клинического) анализа крови, исследованием уровня креатинина в крови и определением активности лактатдегидрогеназы в крови в течение не менее 12 недель с целью своевременной диагностики возможного рецидива аГУС и возобновления комплемент-блокирующей терапии [69,92,95,96].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарии. Поскольку рецидивы аГУС чаще всего наблюдаются в течение первых 3х месяцев, и особенно первых 30 дней, после отмены патогенетической терапии, в этот период пациенты нуждаются в особо тщательном наблюдении и контроле основных лабораторных параметров, характеризующих ТМА. Такой режим позволяет обнаружить обострение заболевания в самом его начале, не допуская развития выраженной тромбоцитопении, МАГА и повышения креатинина [69,92,95,96]. По истечении 3 месяцев в отсутствие рецидива исследования могут быть более редкими.
• Пациентам с аГУС с дисфункцией почек, потребовавший проведения диализа, мы рекомендуем продолжить лечение экулизумабом** не менее 3 месяцев после достижения ремиссии болезни, для достижения максимального почечного ответа на комплемент-блокирующую терапию [69].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Экулизумаб** подавляет комплемент после первой же инфузии, и его сниженная активность сохраняется в течение всего срока лечения. Поэтому показатель функциональной активности комплемента (CH50) в процессе лечения стойко приближается к нулю. Критериями клинической эффективности экулизумаба** являются прекращение микроангиопатического гемолиза (снижение уровня ЛДГ до нормальных значений) и нормализация числа тромбоцитов, а также улучшение функции почек. При этом гематологический ответ значительно опережает ответ почечный. Как правило, ЛДГ и число тромбоцитов нормализуются к концу индукционного курса терапии, тогда как креатинин крови снижается значительно медленнее, и пациент может оставаться диализзависимым более длительное время. Постепенное нарастание диуреза к концу 3-го месяца служит важным показанием к продолжению комплемент- блокирующей терапии, поскольку улучшение функции почек нередко происходит замедленно. В этих случаях выполнение биопсии почки может помочь принять решение о продолжении либо отмене терапии. Если же в отмеченный срок ОПП не разрешилась и потребность в диализе сохраняется, экулизумаб** следует отменить. Исключением являются лишь пациенты с полиорганным поражением, в случаях которого решение о продолжении терапии принимается индивидуально [69].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Трансфузии тромбоцитов могут усилить проявления ТМА у пациентов с аГУС, поскольку провоцируют дальнейшее потребление тромбоцитов, потенцируя тромбообразование в сосудах микроциркуляторного русла. Трансфузия тромбоцитов показана лишь при развитии кровотечения или при использовании инвазивных диагностических или терапевтических вмешательств с высоким риском кровоточивости [2,36,37,42,69,74].
• Мы рекомендуем пациентам с аГУС с целью коррекции тяжелой МАГА (гемоглобин менее 75 г/л) проводить трансфузию эритроцитарной массы [2,69].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Мы рекомендуем назначение антигипертензивных препаратов, предусмотренных рекомендациями по лечению гипертонии при ХБП пациентам с аГУС, имеющим артериальную гипертензию [97].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. См рекомендации по лечению артериальной гипертонии при ХБП.
• Мы рекомендуем проводить лечение ОПП пациентам с аГУС в соответствии с рекомендациями по лечению ОПП [68].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. См рекомендации по ОПП.
• Мы рекомендуем выявлять возможные триггеры заболевания у всех пациентов с аГУС для проведения лечения, направленного на их устранение [39,42,59,69,71,74].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Даже у пациентов, имеющих генетический дефект системы комплемента для реализации предрасположенности к аГУС, требуется воздействие триггера, играющего роль «второго удара». Наиболее частыми триггерами являются инфекции, активное воспаление, беременность, хирургические операции, рентгеноконтрастные препараты и даже стресс. Любой идентифицированный триггер следует устранить так быстро, как это возможно. Особое значение имеет своевременная диагностика инфекций, наиболее часто предшествующих аГУС, и следующая за ней адекватная антибактериальная терапия [39,42,59,69,74].
• Мы рекомендуем пересадку почки пациентам с аГУС, достигшим терминальной почечной недостаточности (ХБП 5 стадии) и не имеющим экстраренальных клинических проявлений ТМА [37,39,69].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Пациентам, достигшим терминальной почечной недостаточности, пересадка почки выполняется, если период от начала диализа составляет не менее 6 месяцев [98]. К ограничениям выполнения пересадки почки пациентам с аГУС относятся как общие противопоказаниям к трансплантации (злокачественные новообразования, активные инфекции, тяжелые хронические экстраренальные заболевания ), так и специфические для аГУС: продолжающаяся активация комплемента с внепочечными проявлениями и отсутствие возможности профилактического введения экулизумаба** пациентам группы высокого и среднего риска.
• Мы рекомендуем выполнить оценку риска рецидива заболевания (таблица 4) после операции, включающую, помимо стандартного обследования, генетическое исследование с целью идентификации мутаций, ассоциированных с аГУС (молекулярно-генетическое исследование мутаций: факторов H, I, в, СЗ, тромбомодулин, МСР) и определение в динамике содержания антител к сFH - при антительном аГУС перед включением в «Лист ожидания» трансплантации почки пациента с аГУС [66,72].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Комментарии. Пациенты с аГУС могут иметь высокий, средний или низкий риск рецидива после пересадки почки, при этом степень риска должна определяться как на основании результата генетического тестирования, так и с учетом клинического течения заболевания, частоты рецидивов ТМА и семейного анамнеза (таблица 4). Следует помнить, что пациенты, у которых не выявлены генетические варианты, ассоциированные с развитием аГУС, должны быть отнесены к группе среднего риска рецидива, а пациенты с семейной формой аГУС и/или рецидивами ТМА в анамнезе, в том числе - ранее потерявшие почечный трансплантат из-за ТМА, имеют высокий риск развития рецидива после трансплантации независимо от характера выявленных мутаций. Хотя в целом риск определяется преимущественно типом мутаций, частично он зависит и от других перитрансплантационных факторов. К ним относят тяжелое ишемически-реперфузионное повреждение трансплантата, высокие концентрации в крови реципиента ингибиторов кальцинейрина, острое отторжение трансплантата, особенно гуморальное, вирусные инфекции (цитомегаловирусная и другие герпес-вирусные инфекции, грипп, вKV-инфекция, инфекция, вызванная парвовирусом в19, инфекционные гастроэнтериты ) [20,83].
Таблица 4. Оценка риска рецидива аГУС после трансплантации почки.
• Мы рекомендуем выполнять пересадку почки на фоне профилактического применения экулизумаба** пациентам с установленным диагнозом аГУС, имеющим средний и высокий риск рецидива в посттрансплантационном периоде, чтобы предотвратить рецидив заболевания [91,99].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии. Профилактическое применение экулизумаба** в группах риска рецидива аГУС более эффективно, чем лечение развившегося рецидива - если частота потерь трансплантата из-за ТМА в группе профилактического применения экулизумаба** составила 5,5%, то у реципиентов, получавших препарат по поводу возвратного аГУС, этот показатель достиг 22,5% [99]. Выполнять пересадку почки без проведения таргетной профилактики можно лишь пациентам с подтвержденным низким риском рецидива аГУС. Всем остальным необходимо профилактическое применение комплемент-блокирующей терапии, продолжительность которой пока окончательно не определена. Однако эксперты предполагают, что длительность применения экулизумаба** после пересадки почки также может определяться на основании риска рецидива: пациенты с высоким риском должны получать препарат в течение всего периода функционирования ренального трансплантата, а у пациентов со средним риском при отсутствии даже субклинических рецидивов в посттрансплантационном периоде через 1 год после пересадки почки можно предпринять контролируемую попытку отмены комплемент-блокирующей терапии [20,83,98] (таблица 5).
Таблица 5. Длительность лечения экулизумабом** после трансплантации почки в зависимости от риска рецидива аГУС.
При анализе данных Глобального регистра аГУС было показано, что начало введения экулизумаба** до трансплантации по сравнению со стартом терапии после операции (с отсрочкой более 14 дней) ассоциировано с улучшением функции ренального трансплантата и снижением риска потребности в гемодиализе [100]. В день трансплантации независимо от того, получал пациент экулизумаб** ранее или нет, не менее чем за один час до реперфузии донорского органа должна быть выполнена инфузия препарата. Доза экулизумаба** не зависит от массы тела и составляет 900 мг на введение. Следующая доза вводится через 24 часа после пересадки почки. Последующее введение препарата осуществляется через неделю (900 мг) с дальнейшим переходом на режим 1 раз в 2 недели (1200 мг) длительно (таблица 6) [98].
Таблица 6. Схема профилактического применения экулизумаба** при трансплантации почки пациентам с аГУС.
В то же время у отдельных пациентов с высоким риском рецидива, осложненным течением послеоперационного периода с наличием дополнительных комплемент- активирующих состояний (тяжелое реперфузионное повреждение, отторжение трансплантата, хирургические осложнения, дополнительные оперативные вмешательства) может быть использована более интенсивная схема введения экулизумаба** в ранние сроки после пересадки почки, с переходом на интервал введения 1 раз в 2 недели по 1200 мг после 36-го дня (таблица 7). В случае необходимости проведения по жизненным показаниям ПО или трансфузий СЗП на фоне таргетной терапии экулизумабом** необходимо введение дополнительных доз препарата в соответствии с инструкцией по его применению [98].
Таблица 7. Интенсифицированная схема профилактического применения экулизумаба** при трансплантации почки пациентам с аГУС.
• Мы рекомендуем вакцинацию против менингококковой**, пневмококковой** и гемофильной инфекции типа b** в порядке подготовки к пересадке почки и профилактическому применению экулизумаба** пациентам с аГУС, если они не были вакцинированы ранее, для минимизации риска инфекционных осложнений [39,101].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Механизм действия экулизумаба** предполагает повышение риска развития менингококковой инфекции и других инфекций, вызванных инкапсулированными бактериями, в связи с чем всех пациентов, получающих этот препарат, следует прививать против менингококковой инфекции, а кандидатов на трансплантацию почки - также против пневмококковой и гемофильной инфекции, желательно до начала комплемент-блокирующей терапии. Поскольку пересадка почки выполняется в большинстве случаев планово, вакцинацию целесообразно провести до включения в «Лист ожидания». У пациентов с аГУС следует также применять общие рекомендации по профилактике инфекций у реципиентов солидных органов [102,103]. Кроме того, практические рекомендации первичной и вторичной профилактики инфекций у взрослых и детей с аГУС разработаны российскими экспертами в 2016 и опубликованы в виде документа «Резолюция Междисциплинарного совета экспертов по профилактике тяжелых инфекций у пациентов с генетическими нарушениями регуляции системы комплемента, получающих терапию экулизумабом» [104]. Следует помнить, что после трансплантации вакцинация любыми живыми вакцинами абсолютно противопоказана.
• Мы не рекомендуем использовать органы от доноров «с расширенными критериями», выполнять операцию при высоком проценте предсуществующих анти-HLA антител у потенциального реципиента или ABO-несовместимости донора и реципиента при пересадке почки пациентам с аГУС в целях профилактики рецидива аГУС в пересаженной почке [69,81].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Данная рекомендация обусловлена высоким риском рецидива аГУС при тяжелом ишемически-реперфузионном повреждении почечного трансплантата и на фоне антитело-опосредованного отторжения.
• Мы не рекомендуем выполнение родственной пересадки почки пациентам с аГУС без генетического исследования системы комплемента не только у реципиента, но и у потенциального донора в целях профилактики посттрансплантационного рецидива заболевания [65,69,72,81].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Комментарии. Диагноз аГУС в большинстве случаев является противопоказанием к родственной пересадке почки в связи с практически неизбежным рецидивом ТМА в трансплантате. Однако пересадка почки может выполняться, если у пациента - кандидата на трансплантацию при исследовании генов системы комплемента выявляются мутации, ассоциированные с развитием аГУС, а у потенциального донора таковых не обнаруживается. При этом необходимо максимально информировать донора и реципиента о развитии возможных осложнений трансплантации. В то же время, если мутаций, ответственных за развитие аГУС, не обнаружено ни у донора, ни у возможного реципиента, или обнаружены генетические варианты с неясным клиническим значением, от родственной трансплантации следует отказаться.
• Мы рекомендуем выбирать индукционную и поддерживающую иммунодепрессивную терапию в соответствии с известными факторами риска отторжения трансплантата для реципиентов почечного трансплантата, страдающих аГУС, избегая при этом высоких концентраций ингибиторов кальциневрина в крови, с целью не допустить развития лекарственно-индуцированной ТМА трансплантата [69,81,98].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. У пациентов с аГУС крайне желательна индукционная терапия антилимфоцитарными антителами, как существенно снижающая риск отторжения трансплантата. Применение циклоспорина** и такролимуса** после трансплантации может быть триггером развития ТМА трансплантата, однако данные препараты в настоящее время остаются основой иммуносупрессии. Кроме того, использование схем иммуносупрессии без циклоспорина**/такролимуса** не приводит к значимому снижению риска рецидива аГУС после трансплантации [105]. У реципиентов с диагнозом аГУС следует избегать чрезмерно высоких концентраций ингибиторов кальцинейрина в крови: концентрация такролимуса** не должна превышать 12 нг/мл, циклоспорина** - 200 нг/мл (C0). В большинстве случаев ингибиторы mTOR не следует включать в схему посттрансплантационной иммуносупрессии пациентам с аГУС, поскольку использование данных препаратов может нарушать восстановление поврежденного эндотелия за счет антипролиферативного и прокоагулянтного эффектов [106,107], однако у отдельных пациентов при наличии показаний и тщательной оценке соотношения польза/риск ингибиторы mTOR могут применяться.
• Пациентам с аГУС после пересадки почки мы рекомендуем тщательный мониторинг клинико-лабораторных показателей, способствующих выявлению ТМА, и выполнение биопсий трансплантата под контролем ультразвукового исследования с патолого-анатомическим исследованием биопсийного материала для своевременной диагностики и лечения ТМА трансплантата [69,81,98].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Мониторинг лабораторных показателей ТМА (исследование уровня тромбоцитов в крови, исследование уровня общего гемоглобина в крови, определение активности ЛДГ в крови, исследование уровня креатинина в крови) после пересадки почки следует проводить с частотой 1 раз в неделю в течение первого месяца, 1 раз в 2 недели в течение последующих 2-4 месяцев и далее 1 раз в месяц. Более частый мониторинг необходим при интеркуррентных инфекциях, развитии дисфункции почечного трансплантата и после отмены экулизумаба**. Пациенты с аГУС после пересадки почки, которым прекратили лечение экулизумабом**, должны находиться под тщательным наблюдением врача- нефролога для обеспечения контроля за признаками возможной активации ТМА и развития ее тяжелых осложнений. Признаками рецидива аГУС после отмены экулизумаба** служат (1) любые два или повторно выявляющиеся изменения одного из следующих показателей: снижение числа тромбоцитов на 25% и более от исходного значения или максимального числа тромбоцитов во время лечения препаратом экулизумаб**; увеличение концентрации креатинина сыворотки на 25% и более по сравнению с исходным значением или минимальным уровнем во время терапии препаратом экулизумаб** или увеличение сывороточной активности ЛДГ на 25% и более по сравнению с исходным или минимальным значением во время терапии препаратом экулизумаб**, или (2) любой из следующих симптомов: изменение психики, судороги, стенокардия, одышка, тромбоз, тяжелый панкреатит, внезапное ухудшение зрения. Особое внимание нужно обращать на нарушение функции почек даже при отсутствии экстраренальных проявлений. Эти симптомы могут быть атрибутированы к аГУС после исключения ряда причин, которые также могут сопровождаться изменением перечисленных лабораторных параметров, особенно в раннем посттрансплантационном периоде (например, хирургические осложнения, инфекции, гематологическая токсичность иммуносупрессантов ). В случае изолированного повышения уровня креатинина сыворотки либо неполного симптомокомплекса ТМА обязательна морфологическая верификация причины дисфункции трансплантата, поскольку не исключается развитие ТМА, локализованной только в трансплантате [108,109].
• В случаях рецидива аГУС после пересадки почки с целью его купирования мы рекомендуем в качестве терапии первой линии применять экулизумаб** [69,81,98].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. При возникновении рецидива аГУС после пересадки почки или развитии de novo aГУС (ТМА с мутациями генов комплемента, впервые выявленными после трансплантации) показана высокая эффективность экулизумаба**, особенно при раннем начале терапии [110,111]. Ренальный трансплантат еще менее устойчив к комплемент-опосредованному повреждению, чем собственные почки, поэтому задержка с началом таргетной терапии даже на незначительный срок может привести к неполному восстановлению или потере функции трансплантированного органа. В период ожидания поставки экулизумаба** (при невозможности немедленного его введения) может проводиться ПО с адекватным объемом эксфузии и замещения плазмой - 40-60 мл/кг массы тела пациента. Однократное введение экулизумаба** для лечения рецидива аГУС после трансплантации не поддерживается. Продолжительность применения комплемент-блокирующей терапии у пациентов, перенесших рецидив аГУС после окончательно не установлена, но очевидно, что эти пациенты попадают в группу высокого риска повторного рецидива в случае отмены экулизумаба**.
• Мы не рекомендуем лабораторное мониторирование степени блокады комплемента для оценки эффективности экулизумаба** в ходе комплемент-блокирующей терапии у всех пациентов с аГУС [88].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарии. Блокада комплемента происходит в течение одного часа после первой инфузии экулизумаба** и сохраняется на достигнутом уровне на ротяжении интервала между введениями [88]. Единственным доступным маркером для оценки степени блокады является общая гемолитическая активность комплемента СН50 [112]. Как правило, она остается низкой в течение 12-14 дней, чем и обусловлен двухнедельный интервал в период поддерживающей терапии. Блокада комплемента достигнута, если значения СН50 составляют <10%. Подавляющее большинство пациентов, как было показано в проведенных исследованиях, достигают этого уровня сразу же после первой инфузии экулизумаба**, поэтому в ходе лечения нет необходимости мониторировать СН50, если у пациента во время периода индукции наблюдается нормализация числа тромбоцитов, снижение ЛДГ и уровня креатинина более чем на 25% от исходного [69]. Показатель уровня с3 фракции комплемента не подходит для мониторирования эффективности проводимой терапии, поскольку у пациентов, имеющих мутации сFH и С3, он исходно снижен и повышения его нельзя ожидать в ходе лечения экулизумабом** [65].
• Мы рекомендуем определить общую гемолитическую способность комплемента (СН50) при отсутствии положительной динамики гематологических показателей пациента в период индукционной терапии для оценки эффективности блокады комплемента и для уточнения причины неэффективности экулизумаба** [113].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарии. Показатель СН50 более 10% свидетельствует об отсутствии полной блокады комплемента, являющемся причиной неэффективной терапии. Сегодня известно несколько причин, с которыми связана недостаточная блокада комплемента, причем все они крайне редки. Это могут быть индивидуальная недостаточность дозы (чаще у детей, однако возможно и у очень крупных взрослых пациентов), экскреция экулизумаба** с мочой при наличии у пациента массивной протеинурии и нефротического синдрома. При адекватной дозе препарата причиной отсутствия блокады комплемента может быть генетический вариант С5 компонента, что предотвращает связь с ним экулизумаба** и обеспечивает, таким образом, резистентность к последнему. В ходе комплемент-блокирующей терапии возможно появление антител к экулизумабу**, также приводящих к неэффективности препарата.
• Мы рекомендуем раннее (в течение 24 часов) начало плазмотерапии всем пациенткам с подозрением на Б-ГУС после прерывания беременности/родоразрешения [47,80,114,115,118,121].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 2).
Комментарии. Хотя ASFA (американское общество по аферезу) в качестве терапии 1-ой линии рекомендует ПО только пациентам с ТТП (А1) и пациентам с аГУС, имеющим антитела к сFH (С2), относя при этом практически все остальные причины аГУС ко II и даже III классу (терапия 2-ой линии, 2С) [121], провести дифференциальную диагностику в первые часы и дни заболевания не представляется возможным, в связи с чем может быть потеряно драгоценное время. Принимая во внимание особенно тяжелое, нередко катастрофическое течение акушерского аГУС, необходимо начинать плазмотерапию, как только будет констатирована ТМА.
• Мы рекомендуем начинать комплемент-блокирующую терапию препаратом экулизумаб** пациенткам с Б-ГУС при неэффективности плазмотерапии, проводимой в течение не менее 3 дней для достижения ремиссии [114,115,118,122].Уровень убедительности рекомендаций в (уровень достоверности доказательств - 2).
Комментарии. Протокол лечения акушерского аГУС полностью аналогичен протоколу лечения пациентов с аГУС в отношении доз препарата, интервалов между введениями и продолжительностью терапии. В случае Б-ГУС последняя должна определяться индивидуально.
• Мы рекомендуем назначать терапию антибактериальными препаратами системного действия широкого спектра даже при одном только клиническом подозрении на появление инфекционных осложнений пациенткам с Б-ГУС, имеющим высокий риск развития системной инфекции [123,124].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Развитие ТМА следует рассматривать как фактор риска развития системной инфекции, поскольку ишемическое повреждение органов предрасполагает к инфицированию. Еще одним фактором риска инфекции является операция кесарева сечения, так как в подавляющем большинстве случаев преэклампсия, предшествующая развитию аГУС, служит показанием к оперативному родоразрешению. Таким образом, назначение антибиотиков у пациенток с аГУС является средством профилактики сепсиса [123,124].
3,1 Плазмотерапия.
• Мы рекомендуем проведение плазмотерапии в виде плазмообмена (ПО) в качестве терапии первой линии всем пациентам с предполагаемым диагнозом аГУС или рецидивом заболевания, если диагноз был установлен ранее, в ожидании результатов обследования на STEC-ГУС и определения ADAMTS13 для снижения выраженности жизнеугрожающих клинических проявлений болезни [39,41,42,59,69,73-76].Уровень убедительности рекомендаций в (уровень достоверности доказательств - 1).
• Пациентам с предполагаемым диагнозом аГУС мы рекомендуем проводить плазмотерапию в виде трансфузий свежезамороженной плазмы (СЗП) только в случае невозможности немедленного начала ПО или его недоступности [39,41,42,59,69,73,74,77].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Комментарии. У пациентов с подозрением на аГУС в момент острого эпизода ТМА эмпирическая плазмотерапия уже в течение нескольких десятилетий остается терапией первой линии, которую следует начинать в течение 4-8 часов от момента констатации ТМА и которая проводится до подтверждения диагноза, до исключения STEC-ГУС и ТТП. Используются два режима плазмотерапии - ПО, который предпочтителен, и трансфузии СЗП в случае недоступности ПО [39,41,42,69,73,74,77]. При трансфузиях СЗП в кровоток попадают функционально активные белки-регуляторы комплемента, которые устраняют дефицит собственных регуляторов - факторов сFH и сFI, а также естественный компонент плазмы - металлопротеаза ADAMTS13, ограничивающая тромбообразование в сосудах микроцируляторного русла за счет расщепления сверхкрупных мультимеров фактора фон Виллебранда [78]. При ПО, кроме того, происходит элиминация измененных эндогенных растворимых ингибиторов комплемента и, в случае антительного аГУС, циркулирующих антител к фактору сFН. Режим ПО также позволяет минимизировать риск перегрузки объемом, что особенно важно у пациентов с олигурией, поражением ЦНС и сердца [69]. Применение плазмотерапии привело к снижению смертности в момент острого эпизода ТМА при аГУС на 50-60%, однако не предотвращает рецидивы заболевания и прогрессирование ХБП с достижением терминальной почечной недостаточности [61,79]. Ответ на плазмотерапию варьирует в довольно широких пределах и зависит от того, в каком факторе комплемента локализованы мутации [42]. Чаще всего - в 55-80% случаев - полный ответ отмечается у пациентов с мутациями в генах С3 и тромбомодулина (THBD) [42,61]. Однако несмотря на то, что восстановление гематологических показателей, в первую очередь, числа тромбоцитов, наблюдается в большинстве случаев, полный гематологический и почечный ответ демонстрируют менее 50% пациентов, а среди пациентов с мутациями сFH и сFI частота полного ответа не превышает 15-25% [61,69]. Принимая во внимание неопределенную длительность терапевтического эффекта плазмотерапии, высокую частоту рецидивов после ее завершения, а также появление препарата для патогенетической терапии аГУС - экулизумаба** - Американское общество афереза изменило категорию терапевтического плазмообмена для комплемент- опосредованного ГУС с II (терапия второй линии) на III (роль ПО точно не установлена) [42,80]. Однако отсутствие полной доступности комплемент- блокирующей терапии для пациентов с аГУС в нашей стране дает основания сохранять ПО как терапию первой линии.
• Пациентам с первым эпизодом аГУС или его рецидивом, не получающим экулизумаб**, мы рекомендуем проводить терапию ПО с объемом эксфузии и замещения СЗП, равном 1,5 объемам циркулирующей плазмы (60-75 мл плазмы/кг) для снижения выраженности клинических проявлений болезни [39,41,42,59,69,73,74].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
• Мы рекомендуем проводить трансфузии СЗП из расчета 25-30 мл/кг/сут в случае невозможности незамедлительного проведения ПО для снижения выраженности клинических проявлений болезни [39,41,42,59,69,73,74].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Об эффективности плазмотерапии при аГУС можно будет судить лишь при четком следовании протоколу лечения, согласно которому сначала в течение 5 дней подряд проводятся сеансы ПО [42,59,69,81], после чего принимается решение о дальнейшей тактике ведения пациента на основании наличия или отсутствия ответа на плазмотерапию. Если наблюдается ответ на терапию, определяемый как рост числа тромбоцитов и снижение ЛДГ, плазмотерапию следует продолжить в прежнем режиме, проводя по 5 сеансов ПО в течение следующих 2-х недель, а затем - по 3 сеанса в неделю еще в течение 2-х недель [15,59]. Критериями эффективности плазмотерапии служат нормализация числа тромбоцитов и прекращение гемолиза, о чем свидетельствует нормализация ЛДГ. Продолжительность лечения СЗП не определена, однако показанием к прекращению плазмотерапии является нормальное количество тромбоцитов и уровень ЛДГ в течение 2-х дней подряд [80]. Следует отметить, что в некоторых случаях показатели ЛДГ остаются повышенными даже после прекращения гемолиза, поскольку основным источником ЛДГ в организме являются не только эритроциты, но и ткани внутренних органов, ишемия которых при развитии ТМА также вносит свой вклад в повышение ЛДГ [82]. Поэтому предлагается также использовать в качестве критерия эффективности плазмотерапии снижение креатинина крови не менее чем на 25% от исходного уровня после 5 сеансов ПО [81,83].
• Мы рекомендуем прекратить лечение СЗП и начать патогенетическую комплемент- блокирующую терапию экулизумабом** пациентам с подтвержденным аГУС с отсутствием ответа на плазмотерапию после 5 процедур полнообъемного ПО или пациентам, демонстрирующим плазмозависимость, для достижения ремиссии и улучшения прогноза [39,41,42,59,69,81,84,91,99].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии. Отсутствие тенденции к увеличению числа тромбоцитов, снижению уровня ЛДГ и/или креатинина крови в ходе лечения СЗП следует рассматривать как рефрактерность к плазмотерапии, что является абсолютным показанием к прекращению ее и назначению экулизумаба** [42,59]. Под плазмозависимостью понимается нормализация числа тромбоцитов в ходе плазмотерапии, но повторное снижение их и повышение уровня креатинина при перерыве в сеансах ПО, что требует возобновления процедур [42].
• Пациентам с аутоиммунным аГУС, определенным на основании обнаружения анти-CFH-антител, мы рекомендуем проводить плазмообмены в комбинации с индукционной терапией глюкокортикоидами и/или иммунодепрессантами для снижения риска неблагоприятных клинических событий [42,59,69,85,86].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Лечение аутоиммунного аГУС требует сочетания плазмотерапии с глюкокортикоидами и противоопухолевыми препаратами [35,42,59,66,82,86]. Добавление к плазмотерапии глюкокортикоидов в виде монотерапии или в сочетании с ритуксимабом** (внутривенно, в дозе 375 мг/м2 1 раз в неделю, 4 введения [125]) или с циклофосфамидом** (внутривенно 6 введений по 500 мг в течение 3 месяцев [126]) может уменьшить риск смерти или достижения ХБП 4 стадии в течение первого года с 59% до 24%. Поддерживающая иммуносупрессивная терапия в дальнейшем снижала однолетний риск рецидива этой формы аГУС с 21% до 8% [86].
3,2 Патогенетическая комплемент-блокирующая терапия.
• Пациентам с подтвержденным аГУС мы рекомендуем назначение экулизумаба** в стандартных дозировках, в соответствии с инструкцией по применению лекарственного препарата, для снижения выраженности клинических проявлений болезни, риска смерти и улучшения почечных исходов [20,39,41,42,69,78,84,87-91].Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии: в основе терапевтического эффекта экулизумаба** лежит прекращение микроциркуляторного тромбообразования вследствие блокады неконтролируемой активации АПК. Применение препарата приводит к уменьшению в крови уровня маркеров воспаления, активации комплемента и эндотелиального повреждения и тромбообразования, а также маркеров повреждения почек [87]. Проведенные исследования продемонстрировали высокую эффективность экулизумаба** в отношении как гематологических (нормализация числа тромбоцитов и прекращение микроангиопатического гемолиза), так и почечных проявлений аГУС [88,89]. У пациентов, получавших экулизумаб**, отмечалось восстановление или улучшение функции почек, исчезала потребность в гемодиализе, причем показатели функции почек улучшались по мере увеличения срока терапии: так, в исследовании с.M. Legendre и соавт. увеличение расчетной скорости клубочковой фильтрации ≥15 мл/мин/1,73 м2 через 26 недель терапии наблюдалось у 5% пациентов, через 1 год - у 15%, а через 2 года - у 40%. Изменение стадии ХБП в сторону более ранних и ≥ чем на одну стадию продемонстрировано у 35%, 45% и 60% пациентов, соответственно [88]. Примечательно, что подобный эффект наблюдался независимо от наличия или отсутствия мутаций в генах комплемента [88]. При долговременном применении экулизумаб** предотвращает рецидивы острой комплемент-опосредованной ТМА [92].
В фазе индукции (начальный цикл) экулизумаб** вводится в дозе 900 мг в виде внутривенной инфузии один раз в неделю в течение первых 4-х недель терапии (всего 4 инфузии). На 5-ой неделе терапии внутривенно вводится 1200 мг препарата (5-я инфузия), а затем по 1200 мг раз в 2 недели неопределенно длительно (таблица 3). Способ применения лекарственного препарата соответствует инструкции по применению («Приложение А3»).
Таблица 3. Режим дозирования экулизумаба** у пациентов с аГУС.
| Индукционный период | Поддерживающая терапия | ||
| Пациенты | старше | По 900 мг 1 раз в неделю в течение | 1200 мг через неделю после |
| 18 лет | 4-х недель | завершения курса индукции (5-я | |
| неделя терапии). Далее по 1200 мг | |||
| каждые 2 недели | |||
• Мы рекомендуем производить вакцинацию против Neisseria meningitidis вакциной для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** всех пациентов с аГУС за 2 недели до первого введения экулизумаба** [2,69,93].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарии. При блокаде С5 компонента комплемента препаратом экулизумаб** нарушается иммунный ответ на некоторые инкапсулированные бактерии, в первую очередь на один из видов Neisseria - менингококк. Это создает повышенный риск развития менингококковой инфекции во время лечения экулизумабом**, для профилактики которой пациентов с аГУС необходимо иммунизировать до начала терапии [2,69,93].
• Мы рекомендуем пациентам с аГУС, имеющим показания к срочному началу лечения экулизумабом**, которое исключает возможность предшествующей вакцинации против менингококка, проводить антибиотикопрофилактику препаратами, проникающими через гематоэнцефалический барьер, с целью предотвращения менингококковой инфекции [2,69,93].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Лечение антибактериальными препаратами системного действия необходимо начинать одновременно с вакцинацией и проводить не менее 2-х недель в случаях, если вакцинацию проводят в день первой инфузии экулизумаба**. Длительность применения и доза антибиотиков определяется лечащим врачом, исходя из конкретной клинической ситуации. В случаях невозможности вакцинации к моменту начала лечения антибиотикопрофилактика может быть продлена на срок до нескольких месяцев в зависимости от времени вакцинации. В ряде случаев антибиотики могут назначаться даже своевременно вакцинированным пациентам. Показания к их применению определяет лечащий врач. Необходимость профилактического назначения антибиотиков пациентам с аГУС обусловлена отсутствием вакцины против серотипа В N. meningitides, в связи с чем проведение вакцинации полностью не исключает развития менингита [69].
• Мы не рекомендуем отмену экулизумаба** после достижения ремиссии комплемент-опосредованной ТМА пациентам, у которых при генетическом исследовании идентифицированы мутации генов факторов комплемента сFH, сFI, сFB, с3 [42,69,92,93].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Первоначально считалось, что лечение экулизумабом** должно проводиться пожизненно, поскольку основным механизмом развития аГУС является хроническая неконтролируемая гиперактивация комплемента, обусловленная генетическим дефектом. Однако проведенные в последнее время исследования показали, что отмена препарата возможна, хотя примерно у 30% пациентов после прекращения терапии развивается рецидив ТМА, причем чаще у имеющих мутации, ассоциированные с развитием аГУС. Именно поэтому принимать решение об отмене препарата можно, только имея результаты генетического исследования [42,69,86,92,93,94,96].
• Мы рекомендуем тщательное наблюдение пациентов в случаях отмены экулизумаба** с мониторированием общего (клинического) анализа мочи, общего (клинического) анализа крови, исследованием уровня креатинина в крови и определением активности лактатдегидрогеназы в крови в течение не менее 12 недель с целью своевременной диагностики возможного рецидива аГУС и возобновления комплемент-блокирующей терапии [69,92,95,96].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарии. Поскольку рецидивы аГУС чаще всего наблюдаются в течение первых 3х месяцев, и особенно первых 30 дней, после отмены патогенетической терапии, в этот период пациенты нуждаются в особо тщательном наблюдении и контроле основных лабораторных параметров, характеризующих ТМА. Такой режим позволяет обнаружить обострение заболевания в самом его начале, не допуская развития выраженной тромбоцитопении, МАГА и повышения креатинина [69,92,95,96]. По истечении 3 месяцев в отсутствие рецидива исследования могут быть более редкими.
• Пациентам с аГУС с дисфункцией почек, потребовавший проведения диализа, мы рекомендуем продолжить лечение экулизумабом** не менее 3 месяцев после достижения ремиссии болезни, для достижения максимального почечного ответа на комплемент-блокирующую терапию [69].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Экулизумаб** подавляет комплемент после первой же инфузии, и его сниженная активность сохраняется в течение всего срока лечения. Поэтому показатель функциональной активности комплемента (CH50) в процессе лечения стойко приближается к нулю. Критериями клинической эффективности экулизумаба** являются прекращение микроангиопатического гемолиза (снижение уровня ЛДГ до нормальных значений) и нормализация числа тромбоцитов, а также улучшение функции почек. При этом гематологический ответ значительно опережает ответ почечный. Как правило, ЛДГ и число тромбоцитов нормализуются к концу индукционного курса терапии, тогда как креатинин крови снижается значительно медленнее, и пациент может оставаться диализзависимым более длительное время. Постепенное нарастание диуреза к концу 3-го месяца служит важным показанием к продолжению комплемент- блокирующей терапии, поскольку улучшение функции почек нередко происходит замедленно. В этих случаях выполнение биопсии почки может помочь принять решение о продолжении либо отмене терапии. Если же в отмеченный срок ОПП не разрешилась и потребность в диализе сохраняется, экулизумаб** следует отменить. Исключением являются лишь пациенты с полиорганным поражением, в случаях которого решение о продолжении терапии принимается индивидуально [69].
3,3 Сопутствующая терапия.
• Мы не рекомендуем выполнение трансфузии тромбоконцентрата пациентам с аГУС, не имеющим выраженной тромбоцитопении (число тромбоцитов более 20000/мкл) и геморрагических осложнений (кровотечения) в связи с риском усугубления тромбоцитопении и генерализации микротромбообразования [2,36,37,42,69,74].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Трансфузии тромбоцитов могут усилить проявления ТМА у пациентов с аГУС, поскольку провоцируют дальнейшее потребление тромбоцитов, потенцируя тромбообразование в сосудах микроциркуляторного русла. Трансфузия тромбоцитов показана лишь при развитии кровотечения или при использовании инвазивных диагностических или терапевтических вмешательств с высоким риском кровоточивости [2,36,37,42,69,74].
• Мы рекомендуем пациентам с аГУС с целью коррекции тяжелой МАГА (гемоглобин менее 75 г/л) проводить трансфузию эритроцитарной массы [2,69].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Мы рекомендуем назначение антигипертензивных препаратов, предусмотренных рекомендациями по лечению гипертонии при ХБП пациентам с аГУС, имеющим артериальную гипертензию [97].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. См рекомендации по лечению артериальной гипертонии при ХБП.
• Мы рекомендуем проводить лечение ОПП пациентам с аГУС в соответствии с рекомендациями по лечению ОПП [68].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. См рекомендации по ОПП.
• Мы рекомендуем выявлять возможные триггеры заболевания у всех пациентов с аГУС для проведения лечения, направленного на их устранение [39,42,59,69,71,74].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Даже у пациентов, имеющих генетический дефект системы комплемента для реализации предрасположенности к аГУС, требуется воздействие триггера, играющего роль «второго удара». Наиболее частыми триггерами являются инфекции, активное воспаление, беременность, хирургические операции, рентгеноконтрастные препараты и даже стресс. Любой идентифицированный триггер следует устранить так быстро, как это возможно. Особое значение имеет своевременная диагностика инфекций, наиболее часто предшествующих аГУС, и следующая за ней адекватная антибактериальная терапия [39,42,59,69,74].
3,4 Хирургическое лечение.
К хирургическому лечению аГУС относится трансплантация (пересадка) почки пациентам, достигшим терминальной почечной недостаточности (ХБП 5 стадии).• Мы рекомендуем пересадку почки пациентам с аГУС, достигшим терминальной почечной недостаточности (ХБП 5 стадии) и не имеющим экстраренальных клинических проявлений ТМА [37,39,69].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Пациентам, достигшим терминальной почечной недостаточности, пересадка почки выполняется, если период от начала диализа составляет не менее 6 месяцев [98]. К ограничениям выполнения пересадки почки пациентам с аГУС относятся как общие противопоказаниям к трансплантации (злокачественные новообразования, активные инфекции, тяжелые хронические экстраренальные заболевания ), так и специфические для аГУС: продолжающаяся активация комплемента с внепочечными проявлениями и отсутствие возможности профилактического введения экулизумаба** пациентам группы высокого и среднего риска.
• Мы рекомендуем выполнить оценку риска рецидива заболевания (таблица 4) после операции, включающую, помимо стандартного обследования, генетическое исследование с целью идентификации мутаций, ассоциированных с аГУС (молекулярно-генетическое исследование мутаций: факторов H, I, в, СЗ, тромбомодулин, МСР) и определение в динамике содержания антител к сFH - при антительном аГУС перед включением в «Лист ожидания» трансплантации почки пациента с аГУС [66,72].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Комментарии. Пациенты с аГУС могут иметь высокий, средний или низкий риск рецидива после пересадки почки, при этом степень риска должна определяться как на основании результата генетического тестирования, так и с учетом клинического течения заболевания, частоты рецидивов ТМА и семейного анамнеза (таблица 4). Следует помнить, что пациенты, у которых не выявлены генетические варианты, ассоциированные с развитием аГУС, должны быть отнесены к группе среднего риска рецидива, а пациенты с семейной формой аГУС и/или рецидивами ТМА в анамнезе, в том числе - ранее потерявшие почечный трансплантат из-за ТМА, имеют высокий риск развития рецидива после трансплантации независимо от характера выявленных мутаций. Хотя в целом риск определяется преимущественно типом мутаций, частично он зависит и от других перитрансплантационных факторов. К ним относят тяжелое ишемически-реперфузионное повреждение трансплантата, высокие концентрации в крови реципиента ингибиторов кальцинейрина, острое отторжение трансплантата, особенно гуморальное, вирусные инфекции (цитомегаловирусная и другие герпес-вирусные инфекции, грипп, вKV-инфекция, инфекция, вызванная парвовирусом в19, инфекционные гастроэнтериты ) [20,83].
Таблица 4. Оценка риска рецидива аГУС после трансплантации почки.
| Риск развития рецидива | Фактор риска |
| Высокий | Мутации сFH, сFB, с3, сFH/CFHR1-5, рецидивы аГУС в анамнезе, семейная форма аГУС |
| Средний | Изолированные мутации сFI, мутации с неизученными эффектами, неидентифицированные мутации, персистирующие низкие титры анти-СFH- антител |
| Низкий | Изолированные мутации MCP, нулевые титры анти-СFH-антител в течение длительного времени |
• Мы рекомендуем выполнять пересадку почки на фоне профилактического применения экулизумаба** пациентам с установленным диагнозом аГУС, имеющим средний и высокий риск рецидива в посттрансплантационном периоде, чтобы предотвратить рецидив заболевания [91,99].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
Комментарии. Профилактическое применение экулизумаба** в группах риска рецидива аГУС более эффективно, чем лечение развившегося рецидива - если частота потерь трансплантата из-за ТМА в группе профилактического применения экулизумаба** составила 5,5%, то у реципиентов, получавших препарат по поводу возвратного аГУС, этот показатель достиг 22,5% [99]. Выполнять пересадку почки без проведения таргетной профилактики можно лишь пациентам с подтвержденным низким риском рецидива аГУС. Всем остальным необходимо профилактическое применение комплемент-блокирующей терапии, продолжительность которой пока окончательно не определена. Однако эксперты предполагают, что длительность применения экулизумаба** после пересадки почки также может определяться на основании риска рецидива: пациенты с высоким риском должны получать препарат в течение всего периода функционирования ренального трансплантата, а у пациентов со средним риском при отсутствии даже субклинических рецидивов в посттрансплантационном периоде через 1 год после пересадки почки можно предпринять контролируемую попытку отмены комплемент-блокирующей терапии [20,83,98] (таблица 5).
Таблица 5. Длительность лечения экулизумабом** после трансплантации почки в зависимости от риска рецидива аГУС.
| Риск развития рецидива | Длительность терапии экулизумабом** |
| Высокий | Введение экулизумаба** показано в течение всего срока функционирования трансплантата |
| Средний | Через 12 месяцев после пересадки почки может быть предпринята контролируемая попытка отмены в отсутствие даже субклинических рецидивов |
| Низкий | После пересадки почки пациентам можно не проводить специальной профилактики экулизумабом** |
При анализе данных Глобального регистра аГУС было показано, что начало введения экулизумаба** до трансплантации по сравнению со стартом терапии после операции (с отсрочкой более 14 дней) ассоциировано с улучшением функции ренального трансплантата и снижением риска потребности в гемодиализе [100]. В день трансплантации независимо от того, получал пациент экулизумаб** ранее или нет, не менее чем за один час до реперфузии донорского органа должна быть выполнена инфузия препарата. Доза экулизумаба** не зависит от массы тела и составляет 900 мг на введение. Следующая доза вводится через 24 часа после пересадки почки. Последующее введение препарата осуществляется через неделю (900 мг) с дальнейшим переходом на режим 1 раз в 2 недели (1200 мг) длительно (таблица 6) [98].
Таблица 6. Схема профилактического применения экулизумаба** при трансплантации почки пациентам с аГУС.
| День 0 | День 1 | День 8 | День 22 |
| 900 мг | 900 мг | 900 мг | 1200 мг |
В то же время у отдельных пациентов с высоким риском рецидива, осложненным течением послеоперационного периода с наличием дополнительных комплемент- активирующих состояний (тяжелое реперфузионное повреждение, отторжение трансплантата, хирургические осложнения, дополнительные оперативные вмешательства) может быть использована более интенсивная схема введения экулизумаба** в ранние сроки после пересадки почки, с переходом на интервал введения 1 раз в 2 недели по 1200 мг после 36-го дня (таблица 7). В случае необходимости проведения по жизненным показаниям ПО или трансфузий СЗП на фоне таргетной терапии экулизумабом** необходимо введение дополнительных доз препарата в соответствии с инструкцией по его применению [98].
Таблица 7. Интенсифицированная схема профилактического применения экулизумаба** при трансплантации почки пациентам с аГУС.
| День 0 | День 1 | День 8 | День 15 | День 22 | День 36 |
| 900 мг | 900 мг | 900 мг | 900 мг | 900 мг | 1200 мг |
• Мы рекомендуем вакцинацию против менингококковой**, пневмококковой** и гемофильной инфекции типа b** в порядке подготовки к пересадке почки и профилактическому применению экулизумаба** пациентам с аГУС, если они не были вакцинированы ранее, для минимизации риска инфекционных осложнений [39,101].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Механизм действия экулизумаба** предполагает повышение риска развития менингококковой инфекции и других инфекций, вызванных инкапсулированными бактериями, в связи с чем всех пациентов, получающих этот препарат, следует прививать против менингококковой инфекции, а кандидатов на трансплантацию почки - также против пневмококковой и гемофильной инфекции, желательно до начала комплемент-блокирующей терапии. Поскольку пересадка почки выполняется в большинстве случаев планово, вакцинацию целесообразно провести до включения в «Лист ожидания». У пациентов с аГУС следует также применять общие рекомендации по профилактике инфекций у реципиентов солидных органов [102,103]. Кроме того, практические рекомендации первичной и вторичной профилактики инфекций у взрослых и детей с аГУС разработаны российскими экспертами в 2016 и опубликованы в виде документа «Резолюция Междисциплинарного совета экспертов по профилактике тяжелых инфекций у пациентов с генетическими нарушениями регуляции системы комплемента, получающих терапию экулизумабом» [104]. Следует помнить, что после трансплантации вакцинация любыми живыми вакцинами абсолютно противопоказана.
• Мы не рекомендуем использовать органы от доноров «с расширенными критериями», выполнять операцию при высоком проценте предсуществующих анти-HLA антител у потенциального реципиента или ABO-несовместимости донора и реципиента при пересадке почки пациентам с аГУС в целях профилактики рецидива аГУС в пересаженной почке [69,81].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Данная рекомендация обусловлена высоким риском рецидива аГУС при тяжелом ишемически-реперфузионном повреждении почечного трансплантата и на фоне антитело-опосредованного отторжения.
• Мы не рекомендуем выполнение родственной пересадки почки пациентам с аГУС без генетического исследования системы комплемента не только у реципиента, но и у потенциального донора в целях профилактики посттрансплантационного рецидива заболевания [65,69,72,81].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Комментарии. Диагноз аГУС в большинстве случаев является противопоказанием к родственной пересадке почки в связи с практически неизбежным рецидивом ТМА в трансплантате. Однако пересадка почки может выполняться, если у пациента - кандидата на трансплантацию при исследовании генов системы комплемента выявляются мутации, ассоциированные с развитием аГУС, а у потенциального донора таковых не обнаруживается. При этом необходимо максимально информировать донора и реципиента о развитии возможных осложнений трансплантации. В то же время, если мутаций, ответственных за развитие аГУС, не обнаружено ни у донора, ни у возможного реципиента, или обнаружены генетические варианты с неясным клиническим значением, от родственной трансплантации следует отказаться.
• Мы рекомендуем выбирать индукционную и поддерживающую иммунодепрессивную терапию в соответствии с известными факторами риска отторжения трансплантата для реципиентов почечного трансплантата, страдающих аГУС, избегая при этом высоких концентраций ингибиторов кальциневрина в крови, с целью не допустить развития лекарственно-индуцированной ТМА трансплантата [69,81,98].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. У пациентов с аГУС крайне желательна индукционная терапия антилимфоцитарными антителами, как существенно снижающая риск отторжения трансплантата. Применение циклоспорина** и такролимуса** после трансплантации может быть триггером развития ТМА трансплантата, однако данные препараты в настоящее время остаются основой иммуносупрессии. Кроме того, использование схем иммуносупрессии без циклоспорина**/такролимуса** не приводит к значимому снижению риска рецидива аГУС после трансплантации [105]. У реципиентов с диагнозом аГУС следует избегать чрезмерно высоких концентраций ингибиторов кальцинейрина в крови: концентрация такролимуса** не должна превышать 12 нг/мл, циклоспорина** - 200 нг/мл (C0). В большинстве случаев ингибиторы mTOR не следует включать в схему посттрансплантационной иммуносупрессии пациентам с аГУС, поскольку использование данных препаратов может нарушать восстановление поврежденного эндотелия за счет антипролиферативного и прокоагулянтного эффектов [106,107], однако у отдельных пациентов при наличии показаний и тщательной оценке соотношения польза/риск ингибиторы mTOR могут применяться.
• Пациентам с аГУС после пересадки почки мы рекомендуем тщательный мониторинг клинико-лабораторных показателей, способствующих выявлению ТМА, и выполнение биопсий трансплантата под контролем ультразвукового исследования с патолого-анатомическим исследованием биопсийного материала для своевременной диагностики и лечения ТМА трансплантата [69,81,98].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Мониторинг лабораторных показателей ТМА (исследование уровня тромбоцитов в крови, исследование уровня общего гемоглобина в крови, определение активности ЛДГ в крови, исследование уровня креатинина в крови) после пересадки почки следует проводить с частотой 1 раз в неделю в течение первого месяца, 1 раз в 2 недели в течение последующих 2-4 месяцев и далее 1 раз в месяц. Более частый мониторинг необходим при интеркуррентных инфекциях, развитии дисфункции почечного трансплантата и после отмены экулизумаба**. Пациенты с аГУС после пересадки почки, которым прекратили лечение экулизумабом**, должны находиться под тщательным наблюдением врача- нефролога для обеспечения контроля за признаками возможной активации ТМА и развития ее тяжелых осложнений. Признаками рецидива аГУС после отмены экулизумаба** служат (1) любые два или повторно выявляющиеся изменения одного из следующих показателей: снижение числа тромбоцитов на 25% и более от исходного значения или максимального числа тромбоцитов во время лечения препаратом экулизумаб**; увеличение концентрации креатинина сыворотки на 25% и более по сравнению с исходным значением или минимальным уровнем во время терапии препаратом экулизумаб** или увеличение сывороточной активности ЛДГ на 25% и более по сравнению с исходным или минимальным значением во время терапии препаратом экулизумаб**, или (2) любой из следующих симптомов: изменение психики, судороги, стенокардия, одышка, тромбоз, тяжелый панкреатит, внезапное ухудшение зрения. Особое внимание нужно обращать на нарушение функции почек даже при отсутствии экстраренальных проявлений. Эти симптомы могут быть атрибутированы к аГУС после исключения ряда причин, которые также могут сопровождаться изменением перечисленных лабораторных параметров, особенно в раннем посттрансплантационном периоде (например, хирургические осложнения, инфекции, гематологическая токсичность иммуносупрессантов ). В случае изолированного повышения уровня креатинина сыворотки либо неполного симптомокомплекса ТМА обязательна морфологическая верификация причины дисфункции трансплантата, поскольку не исключается развитие ТМА, локализованной только в трансплантате [108,109].
• В случаях рецидива аГУС после пересадки почки с целью его купирования мы рекомендуем в качестве терапии первой линии применять экулизумаб** [69,81,98].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. При возникновении рецидива аГУС после пересадки почки или развитии de novo aГУС (ТМА с мутациями генов комплемента, впервые выявленными после трансплантации) показана высокая эффективность экулизумаба**, особенно при раннем начале терапии [110,111]. Ренальный трансплантат еще менее устойчив к комплемент-опосредованному повреждению, чем собственные почки, поэтому задержка с началом таргетной терапии даже на незначительный срок может привести к неполному восстановлению или потере функции трансплантированного органа. В период ожидания поставки экулизумаба** (при невозможности немедленного его введения) может проводиться ПО с адекватным объемом эксфузии и замещения плазмой - 40-60 мл/кг массы тела пациента. Однократное введение экулизумаба** для лечения рецидива аГУС после трансплантации не поддерживается. Продолжительность применения комплемент-блокирующей терапии у пациентов, перенесших рецидив аГУС после окончательно не установлена, но очевидно, что эти пациенты попадают в группу высокого риска повторного рецидива в случае отмены экулизумаба**.
3,5 Мониторинг эффективности и безопасности лечения.
В большинстве случаев при аГУС предусматривается пожизненное применение комплемент-блокирующей терапии. Подобный режим лечения абсолютно необходим пациентам с идентифицированными мутациями генов факторов комплемента сFH, сFI, сFB и с3, поскольку они относятся к категории высокого риска рецидива аГУС [42,69,92,93].• Мы не рекомендуем лабораторное мониторирование степени блокады комплемента для оценки эффективности экулизумаба** в ходе комплемент-блокирующей терапии у всех пациентов с аГУС [88].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарии. Блокада комплемента происходит в течение одного часа после первой инфузии экулизумаба** и сохраняется на достигнутом уровне на ротяжении интервала между введениями [88]. Единственным доступным маркером для оценки степени блокады является общая гемолитическая активность комплемента СН50 [112]. Как правило, она остается низкой в течение 12-14 дней, чем и обусловлен двухнедельный интервал в период поддерживающей терапии. Блокада комплемента достигнута, если значения СН50 составляют <10%. Подавляющее большинство пациентов, как было показано в проведенных исследованиях, достигают этого уровня сразу же после первой инфузии экулизумаба**, поэтому в ходе лечения нет необходимости мониторировать СН50, если у пациента во время периода индукции наблюдается нормализация числа тромбоцитов, снижение ЛДГ и уровня креатинина более чем на 25% от исходного [69]. Показатель уровня с3 фракции комплемента не подходит для мониторирования эффективности проводимой терапии, поскольку у пациентов, имеющих мутации сFH и С3, он исходно снижен и повышения его нельзя ожидать в ходе лечения экулизумабом** [65].
• Мы рекомендуем определить общую гемолитическую способность комплемента (СН50) при отсутствии положительной динамики гематологических показателей пациента в период индукционной терапии для оценки эффективности блокады комплемента и для уточнения причины неэффективности экулизумаба** [113].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарии. Показатель СН50 более 10% свидетельствует об отсутствии полной блокады комплемента, являющемся причиной неэффективной терапии. Сегодня известно несколько причин, с которыми связана недостаточная блокада комплемента, причем все они крайне редки. Это могут быть индивидуальная недостаточность дозы (чаще у детей, однако возможно и у очень крупных взрослых пациентов), экскреция экулизумаба** с мочой при наличии у пациента массивной протеинурии и нефротического синдрома. При адекватной дозе препарата причиной отсутствия блокады комплемента может быть генетический вариант С5 компонента, что предотвращает связь с ним экулизумаба** и обеспечивает, таким образом, резистентность к последнему. В ходе комплемент-блокирующей терапии возможно появление антител к экулизумабу**, также приводящих к неэффективности препарата.
3,6 Лечение аГУС, ассоциированного с беременностью.
ГУС-ассоциированный с беременностью (Б-ГУС) - это аГУС, развившийся в период от момента подтверждения факта беременности до 12 недель после родоразрешения или прерывания беременности [47,114]. Более чем у 50% пациенток аГУС развивается при повторных беременностях. Развитие заболевания возможно на любом сроке беременности, однако в подавляющем большинстве случаев (74-94%) аГУС возникает в III триместре и раннем послеродовом периоде, тогда как на I триместр приходится всего 11% случаев, а на II - до 15%. Б-ГУС характеризуется агрессивным течением и крайне неблагоприятным прогнозом: материнская смертность достигает 42% [47,115]. Частота выявления генетических дефектов в системе комплемента при акушерском аГУС сопоставима с таковой в общей популяции пациентов с аГУС, что дает основания рассматривать это заболевание не как вторичную форму аГУС, а как истинную комплемент-опосредованную ТМА, для которой беременность явилась триггером. Проведенные исследования генетического профиля системы комплемента у женщин с акушерским аГУС выявили мутации, ассоциированные с развитием аГУС, у 46- 56% пациенток [116,117]. Коме того, важную роль в манифестации Б-ГУС играют осложнения беременности и родов - преэклампсия, кровотечения, оперативное родоразрешение, - представляющие собой дополнительные комплемент-активирующие состояния, рассматриваемые как триггеры острой ТМА [118-120]. Таким образом, лечение акушерского аГУС, безусловно, являющегося комплемент-опосредованной патологией, должно соответствовать тем же принципам, что и лечение аГУС.• Мы рекомендуем раннее (в течение 24 часов) начало плазмотерапии всем пациенткам с подозрением на Б-ГУС после прерывания беременности/родоразрешения [47,80,114,115,118,121].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 2).
Комментарии. Хотя ASFA (американское общество по аферезу) в качестве терапии 1-ой линии рекомендует ПО только пациентам с ТТП (А1) и пациентам с аГУС, имеющим антитела к сFH (С2), относя при этом практически все остальные причины аГУС ко II и даже III классу (терапия 2-ой линии, 2С) [121], провести дифференциальную диагностику в первые часы и дни заболевания не представляется возможным, в связи с чем может быть потеряно драгоценное время. Принимая во внимание особенно тяжелое, нередко катастрофическое течение акушерского аГУС, необходимо начинать плазмотерапию, как только будет констатирована ТМА.
• Мы рекомендуем начинать комплемент-блокирующую терапию препаратом экулизумаб** пациенткам с Б-ГУС при неэффективности плазмотерапии, проводимой в течение не менее 3 дней для достижения ремиссии [114,115,118,122].Уровень убедительности рекомендаций в (уровень достоверности доказательств - 2).
Комментарии. Протокол лечения акушерского аГУС полностью аналогичен протоколу лечения пациентов с аГУС в отношении доз препарата, интервалов между введениями и продолжительностью терапии. В случае Б-ГУС последняя должна определяться индивидуально.
• Мы рекомендуем назначать терапию антибактериальными препаратами системного действия широкого спектра даже при одном только клиническом подозрении на появление инфекционных осложнений пациенткам с Б-ГУС, имеющим высокий риск развития системной инфекции [123,124].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. Развитие ТМА следует рассматривать как фактор риска развития системной инфекции, поскольку ишемическое повреждение органов предрасполагает к инфицированию. Еще одним фактором риска инфекции является операция кесарева сечения, так как в подавляющем большинстве случаев преэклампсия, предшествующая развитию аГУС, служит показанием к оперативному родоразрешению. Таким образом, назначение антибиотиков у пациенток с аГУС является средством профилактики сепсиса [123,124].
|
|
Реабилитация и амбулаторное лечение
Методы реабилитации пациентов, перенесших аГУС, не разработаны. У части пациентов, несмотря на купирование гематологических проявлений заболевания, функция почек может не восстановиться или восстановиться не полностью, в результате чего они могут остаться диализ-зависимыми, или в исходе ОПП у них сформируется ХБП. В этих случаях следует применять методы реабилитации, предусмотренные рекомендациями по ХБП.
• У пациентов с аГУС и имеющих ХБП мы рекомендуем проводить медицинскую реабилитацию по показаниям и в объеме, предусмотренном рекомендациями по ХБП, для улучшения исходов болезни [97].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
• У пациентов с аГУС и имеющих ХБП мы рекомендуем проводить медицинскую реабилитацию по показаниям и в объеме, предусмотренном рекомендациями по ХБП, для улучшения исходов болезни [97].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Профилактика
Методы первичной профилактики аГУС не разработаны. У пациентов с уже установленным диагнозом и получающим патогенетическую терапию следует реализовать ряд мер, направленных на предотвращение нежелательных явлений терапии, которые изложены в разделе 3,6. Принимая во внимание роль внешних факторов (в первую очередь, инфекции, а также стресс, травмы, внутривенное введение рентгеноконтрастных препаратов, осложнения беременности) в развитии острого эпизода ТМА у предрасположенных лиц, возможна профилактика рецидивов аГУС.
• Мы рекомендуем обучать пациентов, перенесших острый эпизод комплемент- опосредованной ТМА с очевидным или вероятным триггерным фактором, тому, как снизить риск его развития для предупреждения рецидива заболевания [39].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
• Мы рекомендуем осуществлять динамическое наблюдение всех пациентов, перенесших аГУС, независимо от того, получают ли они или нет комплемент- блокирующую терапию экулизумабом** для своевременного выявления и лечения вероятных рецидивов болезни [2,69].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. В течение первых 4-6 месяцев пациентов необходимо обследовать каждые 2-4 недели. В последующем пациента следует наблюдать ежеквартально в течение первых 3 лет, в последствии - 1 раз в 6 мес.
• Мы рекомендуем индивидуализированное динамическое наблюдение всех пациентов, перенесших аГУС, с контролем АД, сывороточных уровней креатинина и альбумина, скорости клубочковой фильтрации, протеинурии и осадка мочи, клинического анализа крови для контроля рецидивов болезни и оценки выраженности дисфункции почек [2,69].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
• Мы рекомендуем всем пациенткам, перенесшим аГУС и планирующим беременность, для прегравидарной подготовки предоставить информацию о возможных рисках рецидива и неблагоприятном исходе беременности, сформировать индивидуальный план ведения беременности с момента зачатия до родоразрешения, включая ранний послеродовый период [114,115,116].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарии. Беременным, ранее перенесшим аГУС, необходимо тщательно мониторировать артериальное давление, в первом и втором триместрах гестации следует ежемесячно выполнять общий (клинический) анализ крови развернутый с обязательным определением числа тромбоцитов, общий (клинический) анализ мочи, исследование уровня креатинина в крови, определение активности аспартатаминотрасферазы, аланинамитрансферазы, ЛДГ. Раз в триместр необходимо выполнять пробу Реберга для определения скорости клубочковой фильтрации, микробиологическое (культуральное) исследование мочи на бактериальные патогены. В третьем триместре общие (клинические) анализы крови и мочи, определение креатинина и печеночных ферментов следует выполнять раз в 2 недели, микробиологическое (культуральное) исследование мочи на бактериальные патогены - ежемесячно. С 12 недели беременности показана профилактика преэклампсии аспиринсодержащими препаратами. В случае протеинурии ≥1 г/сут показано назначение низкомолекулярных гепаринов. В случае выявления инфекции мочевыводящих путей необходимо своевременное начало адекватной антибактериальной терапии в соответствии с чувствительностью возбудителя. Все указанные терапевтические меры направлены на недопущение акушерских осложнений, совокупность которых может привести к развитию акушерского аГУС.
• Мы рекомендуем обучать пациентов, перенесших острый эпизод комплемент- опосредованной ТМА с очевидным или вероятным триггерным фактором, тому, как снизить риск его развития для предупреждения рецидива заболевания [39].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
• Мы рекомендуем осуществлять динамическое наблюдение всех пациентов, перенесших аГУС, независимо от того, получают ли они или нет комплемент- блокирующую терапию экулизумабом** для своевременного выявления и лечения вероятных рецидивов болезни [2,69].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
Комментарии. В течение первых 4-6 месяцев пациентов необходимо обследовать каждые 2-4 недели. В последующем пациента следует наблюдать ежеквартально в течение первых 3 лет, в последствии - 1 раз в 6 мес.
• Мы рекомендуем индивидуализированное динамическое наблюдение всех пациентов, перенесших аГУС, с контролем АД, сывороточных уровней креатинина и альбумина, скорости клубочковой фильтрации, протеинурии и осадка мочи, клинического анализа крови для контроля рецидивов болезни и оценки выраженности дисфункции почек [2,69].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 5).
• Мы рекомендуем всем пациенткам, перенесшим аГУС и планирующим беременность, для прегравидарной подготовки предоставить информацию о возможных рисках рецидива и неблагоприятном исходе беременности, сформировать индивидуальный план ведения беременности с момента зачатия до родоразрешения, включая ранний послеродовый период [114,115,116].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Комментарии. Беременным, ранее перенесшим аГУС, необходимо тщательно мониторировать артериальное давление, в первом и втором триместрах гестации следует ежемесячно выполнять общий (клинический) анализ крови развернутый с обязательным определением числа тромбоцитов, общий (клинический) анализ мочи, исследование уровня креатинина в крови, определение активности аспартатаминотрасферазы, аланинамитрансферазы, ЛДГ. Раз в триместр необходимо выполнять пробу Реберга для определения скорости клубочковой фильтрации, микробиологическое (культуральное) исследование мочи на бактериальные патогены. В третьем триместре общие (клинические) анализы крови и мочи, определение креатинина и печеночных ферментов следует выполнять раз в 2 недели, микробиологическое (культуральное) исследование мочи на бактериальные патогены - ежемесячно. С 12 недели беременности показана профилактика преэклампсии аспиринсодержащими препаратами. В случае протеинурии ≥1 г/сут показано назначение низкомолекулярных гепаринов. В случае выявления инфекции мочевыводящих путей необходимо своевременное начало адекватной антибактериальной терапии в соответствии с чувствительностью возбудителя. Все указанные терапевтические меры направлены на недопущение акушерских осложнений, совокупность которых может привести к развитию акушерского аГУС.
Организация оказания медицинской помощи
Форма. Экстренная, неотложная; условия - стационар.
Показания для экстренной госпитализации в медицинскую организацию:
• развитие тяжелых органо- и жизнеугрожающих проявлений заболевания - ОПП с потребностью в проведении заместительной почечной терапии (гемодиализ), острой сердечной и дыхательной недостаточности, тяжелого поражения желудочно-кишечного, ЦНС, органа зрения, гемолитической анемии, геморрагического синдрома с целью первичной диагностики, плазмотерапии и комплемент-блокирующей терапии;
• необходимость экстренного начала комплемент-блокирующей терапии у пациентов с рецидивом острой ТМА.
Форма. Плановая; условия - стационар, дневной стационар.
Показания для плановой госпитализации в медицинскую организацию:
• инициация комплемент-блокирующей терапии при нежизнеугрожающих вариантах течения заболевания;
• необходимость уточнения причины неэффективности комплемент-блокирующей терапии при нежизнеугрожающем течении заболевания;
• необходимость выполнения биопсии почки;
• проведение планового повторного введения экулизумаба** в отсутствие жизнеугрожающих проявлений заболевания.
Показания к выписке пациента из медицинской организации:
• стойкое улучшение состояния, когда пациент может без ущерба для здоровья продолжить лечение в амбулаторно-поликлиническом учреждении или домашних условиях;
• при необходимости перевода пациента в другую организацию здравоохранения;
• грубое нарушение госпитального режима;
• по письменному требованию пациента либо его законного представителя, если выписка не угрожает жизни пациента и не опасна для окружающих. В этом случае выписка может быть произведена только с разрешения главного врача больницы или его заместителя по лечебной работе.
Показания для экстренной госпитализации в медицинскую организацию:
• развитие тяжелых органо- и жизнеугрожающих проявлений заболевания - ОПП с потребностью в проведении заместительной почечной терапии (гемодиализ), острой сердечной и дыхательной недостаточности, тяжелого поражения желудочно-кишечного, ЦНС, органа зрения, гемолитической анемии, геморрагического синдрома с целью первичной диагностики, плазмотерапии и комплемент-блокирующей терапии;
• необходимость экстренного начала комплемент-блокирующей терапии у пациентов с рецидивом острой ТМА.
Форма. Плановая; условия - стационар, дневной стационар.
Показания для плановой госпитализации в медицинскую организацию:
• инициация комплемент-блокирующей терапии при нежизнеугрожающих вариантах течения заболевания;
• необходимость уточнения причины неэффективности комплемент-блокирующей терапии при нежизнеугрожающем течении заболевания;
• необходимость выполнения биопсии почки;
• проведение планового повторного введения экулизумаба** в отсутствие жизнеугрожающих проявлений заболевания.
Показания к выписке пациента из медицинской организации:
• стойкое улучшение состояния, когда пациент может без ущерба для здоровья продолжить лечение в амбулаторно-поликлиническом учреждении или домашних условиях;
• при необходимости перевода пациента в другую организацию здравоохранения;
• грубое нарушение госпитального режима;
• по письменному требованию пациента либо его законного представителя, если выписка не угрожает жизни пациента и не опасна для окружающих. В этом случае выписка может быть произведена только с разрешения главного врача больницы или его заместителя по лечебной работе.
Дополнительно
Наличие мутаций в генах того или иного фактора комплемента непосредственно влияет на характер течения аГУС, общий и почечный прогноз, а также определяет прогноз у пациентов с трансплантированной почкой ( см таблицу 2). Таким образом, у пациентов с аГУС прогноз варьирует в зависимости от генотипа. Так, пациенты с мутациями сFH имеют худший прогноз, а пациенты с мутациями МСР - лучший. Смертность во время первого эпизода болезни с мутациями сFH составляет 4%. Терминальной почечной недостаточности в исходе острого эпизода среди выживших достигают 48%. Не зафиксировано случаев смерти в момент острого эпизода болезни ни у одного пациента с мутациями МСР независимо от возраста. Терминальная почечная недостаточность развилась у 25% пациентов с этими мутациями [1,35,42,69]. При естественном течении аГУС заболевание отличается неблагоприятным прогнозом независимо от того, в каких регуляторных белках и компонентах комплемента идентифицированы мутации, а также в случаях, когда выявить их не удалось. Применение комплемент-блокирующей терапии кардинально изменило прогноз пациентов с аГУС. Раннее - в течение первых 7 дней от дебюта заболевания - начало лечения экулизумабом** позволяет не только купировать гематологические проявления аГУС, но и восстановить функцию почек, избавив пациентов от потребности в диализной терапии [35,39,42,69,81,93].
|
|
Критерии оценки качества медицинской помощи
| № | Критерии качества | Уровень убедительности рекомендаций | Уровень достоверности доказательств |
| 1. | Пациенту с симптомокомплексом ТМА диагноз аГУС установлен только после исключения диагнозов STEC-ГУС и ТТП, а также вторичных ТМА | с | 5 |
| 2. | Пациенту с предполагаемым диагнозом аГУС выполнен скрининг на выявление дефектов системы комплемента (исследование уровня комплемента и его фракций в крови), определяемых по исследованию уровня С3 фракции комплемента и уровню С4 фракции комплемента в сыворотке крови | с | 5 |
| 3. | Пациенту с предполагаемым диагнозом аГУС выполнено определение содержания антител к сFH (анти-CFH-антитела) для исключения или подтверждения аутоиммунного (антительного) варианта аГУС | A | 2 |
| 4. | Пациенту с диагнозом аГУС проведено исследование для выявления мутаций гена фактора Н для прогноза генетического варианта болезни | A | 2 |
| 5. | Пациенту с предполагаемым диагнозом аГУС или рецидивом заболевания, если диагноз был установлен ранее, в качестве терапии первой проведена плазмотерапия в виде плазмообмена, в ожидании результатов обследования на STEC-ГУС и определения ADAMTS13 для снижения выраженности жизнеугрожающих клинических проявлений болезни | в | 1 |
| 6. | Пациенту с предполагаемым диагнозом аГУС проведена плазмотерапия в виде трансфузий свежезамороженной плазмы только в случае невозможности немедленного начала ПО или его недоступности | с | 3 |
| 7. | Пациенту с аутоиммунным аГУС, диагностированном на основании на основании обнаружения анти-CFH-антител проведена терапия свежезамороженной плазмой в комбинации с глюкокортикоидами или иммунодепрессантами пациентам | с | 5 |
| 8. | Пациенту с подтвержденным диагнозом аГУС с отсутствием ответа на плазмотерапию после 5 процедур полнообъемного ПО или пациентам, демонстрирующим плазмозависимость, для достижения ремиссии и улучшения прогноза заболевания прекращена плазмотерапия и начата патогенетическая комплемент-блокирующая терапия экулизумабом** | в | 2 |
| 9. | Пациенту с аГУС назначен экулизумаб** в стандартных дозировках, не зависящих от массы тела в соответствии с инструкцией по применению лекарственного препарата для достижения эффекта лечения | A | 2 |
| 10. | Пациенту с аГУС за 2 недели до первого введения экулизумаба** произведена вакцинация против Neisseria meningitidis вакциной для профилактики менингококковых инфекций серогрупп A, с, W, Y, полисахаридной, конъюгированной** | с | 5 |
| 11. | Пациенту с аГУС, имеющему показания к срочному началу лечения экулизумабом**, которое исключает возможность предшествующей вакцинации против менингококка, проведена антибиотикопрофилактика препаратами, проникающими через гематоэнцефалический барьер | с | 5 |
| 12. | Пациенту с установленным диагнозом аГУС, имеющему средний и высокий риск рецидива заболевания в посттрансплантационном периоде, пересадка почки выполнена на фоне профилактического применения экулизумаба**, чтобы предотвратить рецидив заболевания | в | 2 |
| 13. | Пациентке с подозрением на Б-ГУС плазмотерапия начата после прерывания беременности или родоразрешения в течение 24 часов | в | 2 |
| 14. | Пациентке с Б-ГУС начата комплемент- блокирующая терапия препаратом экулизумаб** для достижения ремиссии при неэффективности плазмотерапии, проводимой в течение не менее 3 дней | в | 2 |
Список литературы
• Noris M, Remuzzi G. Atypical hemolytic-uremic syndrome. N Engl J Med 2009;361:1676-1687.
• сampistol JM, Arias M, Ariceta G et al. An update for atypical haemolytic uraemic syndrome: diagnosis and treatment. A consensus document. Nephrologia 2013;33(1):27- 45.
• Демьянова КА. Роль изменений комплемента в развитии поражения почек у больных с микроангиопатическими синдромами: дис. канд. мед. наук: 14,01,29. М., 2018. 152 с.
• Gavriilaki E, Anagnostopoulos A, Mastellos DC. сomplement in thrombotic microangoipathies: unreveling Ariadneʾs thread into labyrinth of complement therapeutics. Front Immunol 2019;10:337. doi: 10,3389/fimmu.2019,00337.
• Greenbaum LA. Atypical hemolytic uremic syndrome. Adv Pediatr 2014;61(1):335-356.
• Dragon-Durey MA, Sethi SK, вagga A et al. сlinical features of anti-factor H autoantibody-associated hemolytic uremic syndrome. J Am Soc Nephrol 2010;21:2180- 2187.
• Fremeaux-Bacchi V, Fakhouri F, Garnier A et al. Genetics and outcome of atypical hemolytic uremic syndrome: a nationwide French series comparing children and adults. сlin J Am Soc Nephrol 2013;8(4):554-562.
• Yoshida Y, Kato H, IkedaY, Nangaku M. Pathogenesis of atypical haemolytic uraemic syndrome. J Atheroscler Thromb 2019;26:99-110. doi: 10,5551/jat.RV17026.
• Rodriguez de сordoba S, Hidalgo MS, Pinto S, Tortajada A. Genetics of atypical hemolytic uremic syndrome (aHUS). Semin Thromb Hemost 2014;40:422-430. doi: 10,1055/s-0034-1375296.
• Jozsi M, Licht с, Strobel S et al. Factor F autoantibodies in atypical hemolytic uremic syndrome correlate with сFHR1/CFHR3 deficiency. вlood 2008;111:1512-1514.
• Noris M, Mescia F, Remuzzi G. STEC-HUS, atypical HUS and TTP are all diseases of complement activation. Nat Rev Nephrol 2012;8(11):622-633.
• Meri S. сomplement activation in diseases presenting with thrombotic microangiopathy. Eur J Intern Med 2013;24(6):496-502. doi: 10,1016/j.ejim.2013,05,009.
• Riedl M, Fakhouri F, Le Quintrec M et al. Spectrum of complement-mediated thrombotic microangiopathies: pathogenetic insights identifying novel treatment approaches. Semin Thromb Hemost 2014;40:444-464.
• Fakhouri F, Zuber J, Fremeaux-Bacchi V, Loirat с. Hemolytic uremic syndrome. Lancet 2017;390:681-696. doi: 10,1016/S0140-6736(17)30062-4.
• сataland SR, Wu HM. Diagnosis and management of complement mediated thrombotic microangiopathies. вlood Rev 2014;28(2):67-74.
• Loirat с, Fremeaux-Bacchi V. Atypical hemolytic uremic syndrome. Orphanet J Rare Dis 2011;6:60. doi: 10,1186/1750-1172-6-60.
• Yan K, Desai K, Gullapalli L et al. Epidemiology of atypical hemolytic uremic syndrome: a systematic literature review. сlinical Epidemiology 2020;12:295-305.
• вesbas N, Karpman D, Landau, Daniel LC. A classification of hemolytic uremic syndrome and thrombotic thrombocytopenic purpura, and related disorders. Europian Paediatric Research Group for HUS. Kidney International 2006;70:423-431.
• Tsai HM, Lian EC. Antibodies to von Willebrand factor-cleaving protease in acute thrombotic thrombocytopenic purpura. N Engl J Med 1998;339:1585-1594.
• Moake J. Thrombotic thrombocytopenic purpura and other thrombotic microangiopathies. вest Practice&Research сlinical Haematology 2009;22:567-576.
• Goodship TH, сook HT, Fakhouri F et al. Atypical hemolytic uremic syndrome and с3 glomerulopathy: conclusion from a Kidney Disease: improving Global Outcomes (KDIGO) controversies conference. Kidney Int 2017;91(3):539-551. doi: 10,1016/j.kint.2016,10,005.
• Kato H, Nangaku M, Okada H, Kagami S. сontroversies of the classification of TMA and the terminology of aHUS. сlinical and Experimental Nephrology 2017;22(1). doi: 10,1007/ s10157-017-1524-4.
• Le сlech A, Simon-Tillaux N, Provot F et al. Atypical and secondary hemolytic uremic syndrome have a distinct presentation and no common genetic risk factors. Kidney Int 2019;95:1443-1452. doi: 10,1016/j.kint2019,01,023.
• Praga M, Rodriguez de сordoba S. Secondary atypical hemolytic uremic syndrome in the era of complement blockade. Kidney Int 2019;95:1298-1300. doi: 10,1016/j/kint2019,01,043.
• вrocklebank V, Wood KM, Kavanagh D. Thrombotic microangiopathy and the кidney. сlin J Am Soc Nephrol 2018;13:300-317. doi: 10,2215/CJN.00620117.
• Aigner с, Schmidt A, Gaggl M, Sunder-Plassmann G. An updated classification of thrombotic microangiopathies and treatment of complement gene variant-mediated thrombotic microangiopathy. сlinical Kidney Journal 2019;12(3):333-337. doi: 10,1093/ckj/sfz040.
• Sallée M, Ismail K, Fakhouri F et al. Thrombocytopenia is not mandatory to diagnose haemolytic and uremic syndrome. вMC Nephrol 2013;14(3):1-6.
• Hofer J, Rosales A, Fisher с, Giner T. Extra-renal manifestations of complement- mediated thrombotic microangiopathies. Pediatric Nephrol 2014;2:1-16.
• Swisher KK, Doan JT, Vesely SK et al. Pancreatitis preceding acute episodes of thrombotic thrombocytopenic purpura-hemolytic uremic syndrome: report of five patients with a systematic review of published reports. Haematologica 2007;92:936-943.
• Noris M, Remuzzi G. сardiovascular complications in atypical haemolytic uraemic syndrome. Nat Rev Nephrol 2014;10(3):174-180.
• Sallee M, Daniel L, Piercecchi M et al. Myocardial infarction is a complication of factor H associated atypical HUS. Nephrol Dial Transplant 2010;25:2028-2032.
• Jokiranta S. HUS and atypical HUS. вlood 2017;21(129):2847-2856.
• Gulleroglu K, Fidan K, Hançer VS et al. Neurologic involvement in atypical hemolytic uremic syndrome and successful treatment with eculizumab. Pediatr Nephrol 2013;28(5):827-30. doi: 10,1007/s00467-013-2416-9.
• Кучиева АМ, Козловская НЛ, Демьянова КА, Добросмыслов ИА. Рецидивирующий атипичный гемолитико-уремический синдром, манифестировавший поражением поджелудочной железы. Нефрология и диализ 2013;15(3):236-239.
• Loirat с, Fakhouri F, Ariceta G et al. An international consensus approach to the management of the atypical hemolytic uremic syndrome in chidren. Pediatr Nephrol 2016;31(1):15-39. doi: 10,1007/s00467-015-3076-8.
• Scully M, Goodship T. How I Treat thrombotic thrombocytopenic purpura and atypical hemolytic uremic syndrome. вr J Haematol 2014;164(6):759-766. doi: 10,1111/bjh.12718.
• Azoulay E, Knoeble P, Garnacho-Montero J et al. Expert Statements on the Standard of сare in сritically Ill Adult Patients with Atypical Hemolytic Uremic Syndrome. сhest 2017;152(2):424-434.
• Shen YM. сlinical evaluation of thrombotic microangiopathy: identification of patients with suspected atypical hemolytic uremic syndrome. Thrombosis Journal 2016;14(suppl 1):19. doi: 10,1186/s12959-016-0114-0.
• сheong HI, Jo SK, Yoon SS et al. сlinical practice guidelines for the management of atypical hemolytic uremic syndrome in Korea. J Korean Med Sci 2016;31:1516-1528. doi: 10,3346/jkms.2016,31,10,1516.
• Taylor сM, Machin S, Wigmore SJ, Goodship THJ. сlinical practice guidelines for the management of atypical haemolytic uraemic syndrome in the United Kingdom. вJH 2009;148:37-47.
• Kato H, Nangaku M, Hataya H et al. сlinical guides for atypical haemolytic uraemic syndrome in Japan. сlin Exp Nephrol 2016;20(4):536-543. doi: 10/1007/s10157-016- 1276-6.
• Go RS, Winters JL, Leug N et al. Thrombotic microangiopathy care pathway: a consensus statement for the Mayo сlinic complement alternative pathway - thrombotic microangiopathy (CAP-TMA) disease-oriented group. Mayo сlin Proc 2016;91(9):1189- 1211. doi: 10,1016/j.mayocp.2016,05,015.
• Al-Nouri ZL, Reese JA, Terrell DR et al. Drug-induced thrombotic microangiopathy: a systematic review of published reports. вlood 2015;125(4):616-618.
• Eremina V, Jefferson JA, Kowalewska J et al. VEGF inhibition and renal thrombotic microangiopathy. N Engl J Med 2008;358:1129-1136.
• Asif A, Nayer A, Haas сS. Atypical hemolytic uremic syndrome in the setting of complement-amplifying conditions: case reports and a review of the evidence for treatment with eculizumab. J Nephrol 2017;30(3):347-362. doi: 10,1007/s40620-016- 0357-7.
• El-Husseini A, Hannan S, Awad A et al. Thrombotic microangiopathy in systemic lupus erythematosus: efficacy of eculizumab. Am J Kidney Dis 2015;65(1):127-130.
• Fakhouri F, Roumenina L, Provot F et al. Pregnancy-associated hemolytic uremic syndrome revisited in the era of complement gene mutations. J Am Soc Nephrol 2010;21:859-867.
• Zhang в, Xing с, Yu X et al. Renal thrombotic microangiopathies induced by severe hypertension. Hypertens Res 2008;31:479-483.
• Timmermans SAMEG, Abdul-Hamid MA, Vanderlocht J et al. Patients with hypertension-associated thrombotic microangiopathy may present with complement abnormalities. Kidney Int 2017;91:1420-1425.
• Шевченко ЮЛ, Новик АА, Мельниченко ВЯ. Анемии (руководство по диагностике и лечению). М. РАЕН, 2012. 350 с. https://akusher-lib.ru/wp- content/uploads/2019/07/Anemii-rukovodstvo-po-diagnostike-i-lecheniyu.pdf.
• Menne J, Nitschke M, Stingele R et al. Validation of treatment strategies for enterohaemorrhagic Escherichia coli O104:H4 induced haemolytic uraemic syndrome:case-control study. вMJ 2012;19;345:e4565. doi: 10,1136/bmj.e4565.
• Shah N, Rutherford с, Matevosyan K et al. Role of ADAMTS13 in the management of thrombotic microangiopathies including thrombotic thrombocytopenic purpura (TTP). вr J Haematol 2013;163(4):514-9. doi: 10,1111/bjh.12569.
• вendapudi PK, Li A, Hamdan A et al. Impact of severe ADAMTS13 deficiency on clinical presentation and outcomes in patients with thrombotic microangiopathies: the experience of the Harvard TMA Research сollaborative. вr J Haematol 2015;171(5):836-44. doi: 10,1111/bjh.13658.
• Hassan S, Westwood JP, Ellis D et al. The utility of ADAMTS13 in differentiating TTP from other acute thrombotic microangiopathies: results from the UK TTP Registry. вr J Haematol 2015;171(5):830-5. doi: 10,1111/bjh.13654.
• сoppo P, Schwarzinger M, вuffet M et al. Predictive features of severe acquired ADAMTS13 deficiency in idiopathic thrombotic microangiopathies: the French TMA reference center experience. PLoS One 2010;5(4):e10208.
• сataland SR, Yang S, Wu HM. The use of ADAMTS13 activity, platelet count, and serum creatinine to differentiate acquired thrombotic thrombocytopenic purpura from other thrombotic microangiopathies. вr J Haematol 2012;157(4):501-503.
• Phillips EH, Westwood JP, вrocklebank V et al. The role of ADAMTS-13 activity and complement mutational analysis in differentiating acute thrombotic microangiopathies. J Thromb Haemost 2016;14(1):175-85. doi: 10,1111/jth.13189.
• Wada H, Matsumoto T, Suzuki K et al. Differences and similarities between disseminated intravascular coagulation and thrombotic microangiopathy. Thromb J 2018;16:14. doi: 10,1186/s12959-018-0168-2.
• Lee H, Kang E, Kang HG et al. сonsensus regarding diagnosis and management of atypical hemolytic uremic syndrome. Korean J Intern Med 2020;35(1):25-40. doi: 10,3904/kjim.2019,388.
• Lupu F, Keshari RS, Lambris JD, сoggeshall KM. сrosstalk between the coagulation and complement systems in sepsis. Thromb Res 2014;133(suppl 1):S28-S31.
• Noris M, сaprioli J, вresin E et al. Relative role of genetic complement abnormalities in sporadic and familial aHUS and their impact on clinical phenotype. сlin J Am Soc Nephrol 2010;5(10):1844-1859.
• Fremeaux-Bacchi V, Fakhouri F, Garnier A et al. Genetics and outcome of atypical hemolytic uremic syndrome: a nationwide French series comparing children and adults. сlin J Am Soc Nephrol 2013;8(4):554-62.
• Kavanagh D, Goodship TH, Richards A. Atypical hemolytic uremic syndrome. Semin Nephrol 2013;33:508-530. doi: 10,1016/j.semnephrol.2013,08,003.
• сataland SR, Holers VM, Geyer S et al. вiomarkers of the alternative pathway and terminal complement activity at presentation confirms the clinical diagnosis of aHUS and differentiates aHUS from TTP. вlood 2014;123:3733-3738.
• Noris M, Galbusera M, Gastoldi S et al. Dynamics of complement activation in aHUS and how to monitor eculizumab therapy. вlood 2014;124:1715-1726.
• Schaefer F, Ardissino G, Ariceta G et al. сlinical and genetic predictors of atypical hemolytic uremic syndrome phenotype and outcome. Kidney Int 2018;94:408-418. doi: 10,1016/j.kint.2018,02,029.
• Jiang H, Fan MN, Yang M et al. Association among сomplement Factor H Autoantibodies, Deletions of сFHR, and the Risk of Atypical Hemolytic Uremic Syndrome. Int J Environ Res Public Health 2016;13(12):1209. doi: 10,3390/ijerph13121209.
• KDIGO сlinical practice guideline for acute kidney injury. Kidney Int Suppl 2012;2:1- 138.
• сampistol JM, Arias M, Ariceta G et al. An update for atypical haemolytic uraemic syndrome: diagnosis and treatment. A consensus document. Nephrologia 2015;35(5):421-447. doi: 10,1016/j.nefro.2015,07,005.
• De Serres SA, Isenring P. Athrombocytopenic thrombotic microangiopathy, a condition that could be overlooked based on current diagnostic criteria. Nephrol Dial Transplant 2009;24:1048-1050.
• Zuber J, Le Quintrec M, Sberro-Soussan R et al. New insights into postrenal transplant hemolytic uremic syndrome. Nat Rev Nephrol 2011;7(1):23-35. doi: 10,1038/nrneph.2010,155.
• сaprioli J, Noris M, вrioschi S et al. International Registry of Recurrent and Familial HUS/TTP. Genetics of HUS: the impact of MCP, сFH, and IF mutations on clinical presentation, response to treatment, and outcome. вlood 2006;108(4):1267-1279. doi: 10,1182/blood-2005-10-007252.
• Thrombotic microangiopathy: current knowledge and outcomes with plasma exchange. Seminars in Dialysis 2012;25(2):214-219. doi: 10,1111/j.1525-139X.2011,01035x.
• Fox LC, сohney SJ, Kausman JY et al. сonsensus opinion on diagnosis and management of thrombotic microangiopathy in Australia and New Zealand. Nephrology (Carlton) 2018;23(6):507-517. doi: 10,1111/nep.13234.
• Michael M, Elliott EJ, сraig JC et al. Interventions for hemolytic uremic syndrome and thrombotic thrombocytopenic purpura: a systematic review of randomized controlled trials. Am J Kidney Dis 2009;53(2):259-72. doi: 10,1053/j.ajkd.2008,07,038.
• von вaeyer H. Plasmapheresis in thrombotic microangiopathy-associated syndromes: review of outcome data derived from clinical trials and open studies. Ther Apher 2002;6(4):320-8. doi: 10,1046/j.1526-0968,2002,00390.x.
• сoppo P, вussel A, сharrier S et al. High-dose plasma infusion versus plasma exchange as early treatment of thrombotic thrombocytopenic purpura/hemolytic-uremic syndrome. Medicine (Baltimore) 2003;82(1):27-38. doi: 10,1097/00005792-200301000-00003.
• Loirat с, Grnier A, Sellier-Leclerc AL, Kwon T. Plasmatherapy in atypical hemolytic uremic syndrome. Semin Thromb Hemost 2010;36:673-681.
• сlark WF, Huang SS, Walsh MW et al. Plasmapheresis for the treatment of kidney diseases. Kidney Int 2016;90:974-984. doi: 10,1016/j.kint.2016,06,009.
• Schwartz J, Padmanabhan A, Aqui N et al. Guidelines on the use of therapeutic apheresis in clinical practice-evidence-based approach from the Writing сommittee of the American Society for Apheresis: the seventh special issue. J сlin Apher 2016;31:149- 162. doi: 10,1002/jca.21470.
• сlaes KJ, Massart A, сollard L et al. вelgian consensus statement on the diagnosis and management of patients with atypical hemolytic uremic syndrome. Acta сlin вelg 2018;73:80-89. doi: 10,1080/17843286,2017,1345185.
• сohen JA, вrecher ME, вandarenko N. сellular source of serum lactate dehydrogenase elevation in patients with thrombotic thrombocytopenic purpura. J сlin Apher 1998;13(1):16-19.
• Zuber J, Fakhouri F, Roumenina LT et al. French Study Group for aHUS/C3G. Use of eculizumab for atypical haemolytic uraemic syndrome and с3 glomerulopathies. Nat Rev Nephrol 2012;8:643-657. doi: 10,1038/nrneph.2012,214.
• Krishnappa V, Gupta M, Elrifai M et al. Atypical Hemolytic Uremic Syndrome: A Meta- Analysis of сase Reports сonfirms the Prevalence of Genetic Mutations and the Shift of Treatment Regimens. Ther Apher Dial 2018;22(2):178-188. doi: 10,1111/1744- 9987,12641.
• Kise T, Fukuyama S, Uehara M. Successful Treatment of Anti-Factor H Antibody- Associated Atypical Hemolytic Uremic Syndrome. Indian J Nephrol 2020;30(1):35-38. doi: 10,4103/ ijn.IJN_336_18.
• Sana G, Dragon-Durey MA, сharbit M et al. Long-term remission of atypical HUS with anti-factor H antibodies after cyclophosphamide pulses. Pediatr Nephrol 2014;29:75-83.
• сofiell R, Kukreja A, вedard K et al. Eculizumab reduces complement activation, inflammation, endothelial damage, thrombosis, and renal injury markers in aHUS. Вlood 2015;21;125(21):3253-62. doi: 10,1182/blood-2014-09-600411.
• Legendre сM, Licht с, Muus PL et al. Terminal complement inhibitor Eculizumab in atypical hemolytic-uremic syndrome. N Engl J Med 2013;368:2169-2181. doi: 10,1056/NEJMoa1208981.
• Licht с, Greenbaum LA, Muus P et al. Efficacy and safety of Eculizumab in atypical hemolytic uremic syndrome from 2-year extensions of phase 2 studies. Kidney Int 2015;87:1061-1073. doi: 10,1038/ki.2014,423.
• Pugh D, O Sullivan ED, Duthie FA et al. Interventions for atypical haemolytic uraemic syndrome. сochrane Database Syst Rev 2021;3(3):CD012862. doi: 10,1002/14651858.
• вernuy-Guevara с, сhehade H, Muller YD et al. The Inhibition of сomplement System in Formal and Emerging Indications: Results from Parallel One-Stage Pairwise and Network Meta-Analyses of сlinical Trials and Real-Life Data Studies. вiomedicines 2020;8(9):355. doi: 10,3390/biomedicines8090355.
• Menne J, Delmas Y, Fakhouri F et al. Eculizumab prevents thrombotic microangiopathy in patients with atypical hemolytic uremic syndrome in a long-term observational study. сlin Kidney J 2018;12(2):196-205. doi: 10,1093/ckj/sfy035.
• Menne J, Delmas Y, Fakhouri F et al. Outcome in patients with atypical hemolytic uremic syndrome treated with Eculizumab in a long-term observational study. вMC Nephrology 2019;20:125-137. doi: 10,1186/s12882-019-1314-1.
• Walle JV, Delmas Y, Ardissino G et al. Improved renal recovery in patients with atypical hemolytic uremic syndrome following rapid initiation of eculizumab treatment. J Nephrol 2017;30(1):127-134. doi: 10,1007/s40620-016-0288-3.
• Ardissino G, Possenti I, Tel F et al. Discontinuation of Eculizumab treatment in atypical hemolytic uremic syndrome: an update. Am J Kidney Dis 2015;66:172-173.
• Olson SR, Lu E, Sulpizio E et al. When to stop Eculizumab in complement-mediated microangiopathies. Am J Nephrol 2018;48:96-107. doi: 10,1159/000492033.
• Хроническая болезнь почек (ХБП). Клинические рекомендации. https://rusnephrology.org/wp-content/uploads/2020/12/CKD_final.pdf.
• Каабак Молчанова ЕА, Нестеренко ИВ Резолюция Междисциплинарного совета экспертов. Трансплантация почки у пациентов с атипичным гемолитико- уремическим синдромом: клинические и организационно-методические аспекты ведения пациентов. Нефрология 2018;3:8-14. doi: 10,18565/nephrology.2018,3,8-14.
• Gonzalez Suarez ML, Thongprayoon с, Mao MA et al. Outcomes of Kidney Transplant Patients with Atypical Hemolytic Uremic Syndrome Treated with Eculizumab: A Systematic Review and Meta-Analysis. J сlin Med 2019;8(7):pii:E919. doi: 10,3390/jcm8070919.
• Siedlecki AM, Isbel N, Vande Walle J et al. Global aHUS Registry. Eculizumab use for kidney transplantation patients with a diagnosis of atypical hemolytic uremic syndrome. Kidney Int Rep 2018;4(3):434-446. doi: 10,1016/j.ekir.2018,11,010.
• Keating GM. Eculizumab: a review of its use in atypical haemolytic uraemic syndrome. Drugs 2013;73(18):2053-66. doi: 10,1007/s40265-013-0147-7.
• Avery RK, Ljungman P. Prophylactic measures in the solid-organ recipient before transplantation. сlin Infect Dis 2001;33(1):15-21. doi: 10,1086/320899.
• Danzinger-Isakov L, Kumar D. AST Infectious Diseases сommunity of Practice Guidelines for vaccination of solid organ transplant candidates and recipients. Am J Transplant 2009;9(4):258-262. doi: 10,1111/j.1600-6143,2009,02917.x.
• Резолюция Междисциплинарного совета экспертов по профилактике тяжелых инфекций у пациентов с генетическими нарушениями регуляции системы комплемента, получающих терапию экулизумабом. Эпидемиология и вакцинопрофилактика 2017;1(92):51-55.
• вresin E, Daina E, Noris M et al. Outcome of renal transplantation in patients with non-Shiga toxin-associated hemolytic uremic syndrome: prognostic significance of genetic background. сlin J Am Soc Nephrol 2006;1:88-99. doi: 10,2215/CJN.00050505.
• Keller K, Daniel с, Schöcklmann H et al. Everolimus inhibits glomerular endothelial cell proliferation and VEGF, but not long-term recovery in experimental thrombotic microangiopathy. Nephrol Dial Transplant 2006;21:2724-2735. doi: 10,1093/ndt/gfl340.
• Nava F, сappelli G, Mori G et al. Everolimus, cyclosporine, and thrombotic microangiopathy: clinical role and preventive tools in renal transplantation. Transplant Proc 2014;46:2263-2268. doi: 10,1016/j.transproceed.2014,07,062.
• Schwimmer J, Nadasdy TA, Spitalnik PF et al. De novo thrombotic microangiopathy in renal transplant recipients: a comparison of hemolytic uremic syndrome with localized renal thrombotic microangiopathy. Am J Kidney Dis 2003;41:471-479. doi: 10,1053/ajkd.2003,50058.
• Rolla D, Fontana I, Ravetti JL et al. De novo post-transplant thrombotic microangiopathy localized only to the graft in autosomal dominant polycystic kidney disease with thrombophilia. J Renal Inj Prev 2015;4(4):135-138. doi: 10,12861/jrip.2015,28.
• Zuber J, Le Quintrec M, Krid S et al. French Study Group for Atypical HUS. Eculizumab for atypical hemolytic uremic syndrome recurrence in renal transplantation. Am J Transplant 2012;12:3337-3354. doi: 10,1111/j.1600-6143,2012,04252.x.
• Matar D, Naqvi F, Racusen LC et al. Atypical hemolytic uremic syndrome recurrence after kidney transplantation. Transplantation 2014;98(11):1205-1212. doi: 10,1097/TP.0000000000000200.
• сugno M, Gualtierotti R, Possenti I et al. сomplement functional tests for monitoring eculizumab treatment in patients with atypical hemolytic uremic syndrome. J Thromb Haemost 2014;12:1440-1448.
• Wehling с, Amon O, вommer M et al. Monitoring of complement activation biomarkers and eculizumab in complement-mediated renal disorders. сlin Exp Immunol. 2017 Feb;187(2):304-315. doi: 10,1111/cei.12890.
• вruel A, Kavanagh D, Noris M et al. Hemolytic uremic syndrome in pregnancy and postpartum. сlin J Am Soc Nephrol 2017;12(8):1237-1247. doi: 10,2215/CJN.00280117.
• Gupta M, вurwick RM. Pregnancy-associated atypical hemolytic uremic syndrome. A systematic review. Obstetrics&Gynecology 2020;135:46-58. doi: 10,1097/AOG0000000000003554.
• Grand Maison S, Lapinsky S. Insights into pregnancy associated and atypical hemolytic uremic syndrome [published correction appears in Obstet Med 2018;11(4):198]. Obstet Med 2018;11(3):137-140. doi: 10,1177/1753495X18780099.
• Коротчаева ЮВ, Козловская НЛ, Демьянова КА и соавт. Генетические аспекты акушерского гемолитико-уремического синдрома. Клиническая нефрология 2017;1:12-17.
• Huerta A, Arjona E, Portoles J et al. A retrospective study of pregnancy- associated atypical hemolytic uremic syndrome. Kidney Int 2018;93(2):450-459. doi: 10,1016/j.kint.2017,06,022.
• Козловская НЛ, Коротчаева ЮВ, Шифман ЕМ, Кудлай ДА. Акушерский атипичный гемолитико-уремический синдром: виновата беременность или ее осложнения. Вопросы гинекологии, акушерства и перинатологии 2020;19(4):81-91. doi: 10,20953/1726-1678-2020-4-81-91.
• Кирсанова ТВ, Виноградова МА, Федорова ТА. Имитаторы тяжелой преэклампсии и HELLP-синдрома: различные виды тромботической микроангиопатии, ассоциированной с беременностью. Акушерство и гинекология 2016;12:5-14. doi: 10,18565/aig.2016,12,5-14.
• Padmanabhan A, сonnelly-Smith L, Aqui N et al. Guidelines on the Use of Therapeutic Apheresis in сlinical Practice - Evidence-Based Approach from the Writing сommittee of the American Society for Apheresis: The Eighth Special Issue. J сlin Apher 2019;34(3):171-354. doi: 10,1002/jca.21705.
• Stefanovic V. The Extended Use of Eculizumab in pregnancy and complement activation⁻associated diseases affecting maternal, fetal and neonatal kidneys - the future is now. J сlin Med 2019;8(3):407. doi: 10,3390/jcm8030407.
• вurlinson сEG, Sirounis D, Wally KR, сhau A. Sepsis in pregnancy and the puerperium. Int J Obstet Anesth 2018;36:96-107. doi: 10,1016/j.ijoa.2018,04,010.
• 125. Nabhan AF, Allam NE, Hamed Abdel-Aziz Salama M. Routes of administration of antibiotic prophylaxis for preventing infection after caesarean section. сochrane Database Syst Rev 2016;6:CD011876. doi: 10,1002/14651858.CD011876.pub2.
• Lionet A, Provôt F, Glowacki F et al. A case of adult atypical haemolytic uraemic syndrome related to anti-factor H autoantibodies successfully treated by plasma exchange, corticosteroids and rituximab. NDT Plus 2009;2(6):458-60. doi: 10,1093/ndtplus/sfp109.
• вreville G, Zamberg I, Sadallah S et al. сase Report: Severe сomplement- Mediated Thrombotic Microangiopathy in IgG4-Related Disease Secondary to Anti- Factor H IgG4 Autoantibodies. Front Immunol 2021;11:604759. doi: 10,3389/fimmu.2020,604759.
• сampistol JM, Arias M, Ariceta G et al. An update for atypical haemolytic uraemic syndrome: diagnosis and treatment. A consensus document. Nephrologia 2013;33(1):27- 45.
• Демьянова КА. Роль изменений комплемента в развитии поражения почек у больных с микроангиопатическими синдромами: дис. канд. мед. наук: 14,01,29. М., 2018. 152 с.
• Gavriilaki E, Anagnostopoulos A, Mastellos DC. сomplement in thrombotic microangoipathies: unreveling Ariadneʾs thread into labyrinth of complement therapeutics. Front Immunol 2019;10:337. doi: 10,3389/fimmu.2019,00337.
• Greenbaum LA. Atypical hemolytic uremic syndrome. Adv Pediatr 2014;61(1):335-356.
• Dragon-Durey MA, Sethi SK, вagga A et al. сlinical features of anti-factor H autoantibody-associated hemolytic uremic syndrome. J Am Soc Nephrol 2010;21:2180- 2187.
• Fremeaux-Bacchi V, Fakhouri F, Garnier A et al. Genetics and outcome of atypical hemolytic uremic syndrome: a nationwide French series comparing children and adults. сlin J Am Soc Nephrol 2013;8(4):554-562.
• Yoshida Y, Kato H, IkedaY, Nangaku M. Pathogenesis of atypical haemolytic uraemic syndrome. J Atheroscler Thromb 2019;26:99-110. doi: 10,5551/jat.RV17026.
• Rodriguez de сordoba S, Hidalgo MS, Pinto S, Tortajada A. Genetics of atypical hemolytic uremic syndrome (aHUS). Semin Thromb Hemost 2014;40:422-430. doi: 10,1055/s-0034-1375296.
• Jozsi M, Licht с, Strobel S et al. Factor F autoantibodies in atypical hemolytic uremic syndrome correlate with сFHR1/CFHR3 deficiency. вlood 2008;111:1512-1514.
• Noris M, Mescia F, Remuzzi G. STEC-HUS, atypical HUS and TTP are all diseases of complement activation. Nat Rev Nephrol 2012;8(11):622-633.
• Meri S. сomplement activation in diseases presenting with thrombotic microangiopathy. Eur J Intern Med 2013;24(6):496-502. doi: 10,1016/j.ejim.2013,05,009.
• Riedl M, Fakhouri F, Le Quintrec M et al. Spectrum of complement-mediated thrombotic microangiopathies: pathogenetic insights identifying novel treatment approaches. Semin Thromb Hemost 2014;40:444-464.
• Fakhouri F, Zuber J, Fremeaux-Bacchi V, Loirat с. Hemolytic uremic syndrome. Lancet 2017;390:681-696. doi: 10,1016/S0140-6736(17)30062-4.
• сataland SR, Wu HM. Diagnosis and management of complement mediated thrombotic microangiopathies. вlood Rev 2014;28(2):67-74.
• Loirat с, Fremeaux-Bacchi V. Atypical hemolytic uremic syndrome. Orphanet J Rare Dis 2011;6:60. doi: 10,1186/1750-1172-6-60.
• Yan K, Desai K, Gullapalli L et al. Epidemiology of atypical hemolytic uremic syndrome: a systematic literature review. сlinical Epidemiology 2020;12:295-305.
• вesbas N, Karpman D, Landau, Daniel LC. A classification of hemolytic uremic syndrome and thrombotic thrombocytopenic purpura, and related disorders. Europian Paediatric Research Group for HUS. Kidney International 2006;70:423-431.
• Tsai HM, Lian EC. Antibodies to von Willebrand factor-cleaving protease in acute thrombotic thrombocytopenic purpura. N Engl J Med 1998;339:1585-1594.
• Moake J. Thrombotic thrombocytopenic purpura and other thrombotic microangiopathies. вest Practice&Research сlinical Haematology 2009;22:567-576.
• Goodship TH, сook HT, Fakhouri F et al. Atypical hemolytic uremic syndrome and с3 glomerulopathy: conclusion from a Kidney Disease: improving Global Outcomes (KDIGO) controversies conference. Kidney Int 2017;91(3):539-551. doi: 10,1016/j.kint.2016,10,005.
• Kato H, Nangaku M, Okada H, Kagami S. сontroversies of the classification of TMA and the terminology of aHUS. сlinical and Experimental Nephrology 2017;22(1). doi: 10,1007/ s10157-017-1524-4.
• Le сlech A, Simon-Tillaux N, Provot F et al. Atypical and secondary hemolytic uremic syndrome have a distinct presentation and no common genetic risk factors. Kidney Int 2019;95:1443-1452. doi: 10,1016/j.kint2019,01,023.
• Praga M, Rodriguez de сordoba S. Secondary atypical hemolytic uremic syndrome in the era of complement blockade. Kidney Int 2019;95:1298-1300. doi: 10,1016/j/kint2019,01,043.
• вrocklebank V, Wood KM, Kavanagh D. Thrombotic microangiopathy and the кidney. сlin J Am Soc Nephrol 2018;13:300-317. doi: 10,2215/CJN.00620117.
• Aigner с, Schmidt A, Gaggl M, Sunder-Plassmann G. An updated classification of thrombotic microangiopathies and treatment of complement gene variant-mediated thrombotic microangiopathy. сlinical Kidney Journal 2019;12(3):333-337. doi: 10,1093/ckj/sfz040.
• Sallée M, Ismail K, Fakhouri F et al. Thrombocytopenia is not mandatory to diagnose haemolytic and uremic syndrome. вMC Nephrol 2013;14(3):1-6.
• Hofer J, Rosales A, Fisher с, Giner T. Extra-renal manifestations of complement- mediated thrombotic microangiopathies. Pediatric Nephrol 2014;2:1-16.
• Swisher KK, Doan JT, Vesely SK et al. Pancreatitis preceding acute episodes of thrombotic thrombocytopenic purpura-hemolytic uremic syndrome: report of five patients with a systematic review of published reports. Haematologica 2007;92:936-943.
• Noris M, Remuzzi G. сardiovascular complications in atypical haemolytic uraemic syndrome. Nat Rev Nephrol 2014;10(3):174-180.
• Sallee M, Daniel L, Piercecchi M et al. Myocardial infarction is a complication of factor H associated atypical HUS. Nephrol Dial Transplant 2010;25:2028-2032.
• Jokiranta S. HUS and atypical HUS. вlood 2017;21(129):2847-2856.
• Gulleroglu K, Fidan K, Hançer VS et al. Neurologic involvement in atypical hemolytic uremic syndrome and successful treatment with eculizumab. Pediatr Nephrol 2013;28(5):827-30. doi: 10,1007/s00467-013-2416-9.
• Кучиева АМ, Козловская НЛ, Демьянова КА, Добросмыслов ИА. Рецидивирующий атипичный гемолитико-уремический синдром, манифестировавший поражением поджелудочной железы. Нефрология и диализ 2013;15(3):236-239.
• Loirat с, Fakhouri F, Ariceta G et al. An international consensus approach to the management of the atypical hemolytic uremic syndrome in chidren. Pediatr Nephrol 2016;31(1):15-39. doi: 10,1007/s00467-015-3076-8.
• Scully M, Goodship T. How I Treat thrombotic thrombocytopenic purpura and atypical hemolytic uremic syndrome. вr J Haematol 2014;164(6):759-766. doi: 10,1111/bjh.12718.
• Azoulay E, Knoeble P, Garnacho-Montero J et al. Expert Statements on the Standard of сare in сritically Ill Adult Patients with Atypical Hemolytic Uremic Syndrome. сhest 2017;152(2):424-434.
• Shen YM. сlinical evaluation of thrombotic microangiopathy: identification of patients with suspected atypical hemolytic uremic syndrome. Thrombosis Journal 2016;14(suppl 1):19. doi: 10,1186/s12959-016-0114-0.
• сheong HI, Jo SK, Yoon SS et al. сlinical practice guidelines for the management of atypical hemolytic uremic syndrome in Korea. J Korean Med Sci 2016;31:1516-1528. doi: 10,3346/jkms.2016,31,10,1516.
• Taylor сM, Machin S, Wigmore SJ, Goodship THJ. сlinical practice guidelines for the management of atypical haemolytic uraemic syndrome in the United Kingdom. вJH 2009;148:37-47.
• Kato H, Nangaku M, Hataya H et al. сlinical guides for atypical haemolytic uraemic syndrome in Japan. сlin Exp Nephrol 2016;20(4):536-543. doi: 10/1007/s10157-016- 1276-6.
• Go RS, Winters JL, Leug N et al. Thrombotic microangiopathy care pathway: a consensus statement for the Mayo сlinic complement alternative pathway - thrombotic microangiopathy (CAP-TMA) disease-oriented group. Mayo сlin Proc 2016;91(9):1189- 1211. doi: 10,1016/j.mayocp.2016,05,015.
• Al-Nouri ZL, Reese JA, Terrell DR et al. Drug-induced thrombotic microangiopathy: a systematic review of published reports. вlood 2015;125(4):616-618.
• Eremina V, Jefferson JA, Kowalewska J et al. VEGF inhibition and renal thrombotic microangiopathy. N Engl J Med 2008;358:1129-1136.
• Asif A, Nayer A, Haas сS. Atypical hemolytic uremic syndrome in the setting of complement-amplifying conditions: case reports and a review of the evidence for treatment with eculizumab. J Nephrol 2017;30(3):347-362. doi: 10,1007/s40620-016- 0357-7.
• El-Husseini A, Hannan S, Awad A et al. Thrombotic microangiopathy in systemic lupus erythematosus: efficacy of eculizumab. Am J Kidney Dis 2015;65(1):127-130.
• Fakhouri F, Roumenina L, Provot F et al. Pregnancy-associated hemolytic uremic syndrome revisited in the era of complement gene mutations. J Am Soc Nephrol 2010;21:859-867.
• Zhang в, Xing с, Yu X et al. Renal thrombotic microangiopathies induced by severe hypertension. Hypertens Res 2008;31:479-483.
• Timmermans SAMEG, Abdul-Hamid MA, Vanderlocht J et al. Patients with hypertension-associated thrombotic microangiopathy may present with complement abnormalities. Kidney Int 2017;91:1420-1425.
• Шевченко ЮЛ, Новик АА, Мельниченко ВЯ. Анемии (руководство по диагностике и лечению). М. РАЕН, 2012. 350 с. https://akusher-lib.ru/wp- content/uploads/2019/07/Anemii-rukovodstvo-po-diagnostike-i-lecheniyu.pdf.
• Menne J, Nitschke M, Stingele R et al. Validation of treatment strategies for enterohaemorrhagic Escherichia coli O104:H4 induced haemolytic uraemic syndrome:case-control study. вMJ 2012;19;345:e4565. doi: 10,1136/bmj.e4565.
• Shah N, Rutherford с, Matevosyan K et al. Role of ADAMTS13 in the management of thrombotic microangiopathies including thrombotic thrombocytopenic purpura (TTP). вr J Haematol 2013;163(4):514-9. doi: 10,1111/bjh.12569.
• вendapudi PK, Li A, Hamdan A et al. Impact of severe ADAMTS13 deficiency on clinical presentation and outcomes in patients with thrombotic microangiopathies: the experience of the Harvard TMA Research сollaborative. вr J Haematol 2015;171(5):836-44. doi: 10,1111/bjh.13658.
• Hassan S, Westwood JP, Ellis D et al. The utility of ADAMTS13 in differentiating TTP from other acute thrombotic microangiopathies: results from the UK TTP Registry. вr J Haematol 2015;171(5):830-5. doi: 10,1111/bjh.13654.
• сoppo P, Schwarzinger M, вuffet M et al. Predictive features of severe acquired ADAMTS13 deficiency in idiopathic thrombotic microangiopathies: the French TMA reference center experience. PLoS One 2010;5(4):e10208.
• сataland SR, Yang S, Wu HM. The use of ADAMTS13 activity, platelet count, and serum creatinine to differentiate acquired thrombotic thrombocytopenic purpura from other thrombotic microangiopathies. вr J Haematol 2012;157(4):501-503.
• Phillips EH, Westwood JP, вrocklebank V et al. The role of ADAMTS-13 activity and complement mutational analysis in differentiating acute thrombotic microangiopathies. J Thromb Haemost 2016;14(1):175-85. doi: 10,1111/jth.13189.
• Wada H, Matsumoto T, Suzuki K et al. Differences and similarities between disseminated intravascular coagulation and thrombotic microangiopathy. Thromb J 2018;16:14. doi: 10,1186/s12959-018-0168-2.
• Lee H, Kang E, Kang HG et al. сonsensus regarding diagnosis and management of atypical hemolytic uremic syndrome. Korean J Intern Med 2020;35(1):25-40. doi: 10,3904/kjim.2019,388.
• Lupu F, Keshari RS, Lambris JD, сoggeshall KM. сrosstalk between the coagulation and complement systems in sepsis. Thromb Res 2014;133(suppl 1):S28-S31.
• Noris M, сaprioli J, вresin E et al. Relative role of genetic complement abnormalities in sporadic and familial aHUS and their impact on clinical phenotype. сlin J Am Soc Nephrol 2010;5(10):1844-1859.
• Fremeaux-Bacchi V, Fakhouri F, Garnier A et al. Genetics and outcome of atypical hemolytic uremic syndrome: a nationwide French series comparing children and adults. сlin J Am Soc Nephrol 2013;8(4):554-62.
• Kavanagh D, Goodship TH, Richards A. Atypical hemolytic uremic syndrome. Semin Nephrol 2013;33:508-530. doi: 10,1016/j.semnephrol.2013,08,003.
• сataland SR, Holers VM, Geyer S et al. вiomarkers of the alternative pathway and terminal complement activity at presentation confirms the clinical diagnosis of aHUS and differentiates aHUS from TTP. вlood 2014;123:3733-3738.
• Noris M, Galbusera M, Gastoldi S et al. Dynamics of complement activation in aHUS and how to monitor eculizumab therapy. вlood 2014;124:1715-1726.
• Schaefer F, Ardissino G, Ariceta G et al. сlinical and genetic predictors of atypical hemolytic uremic syndrome phenotype and outcome. Kidney Int 2018;94:408-418. doi: 10,1016/j.kint.2018,02,029.
• Jiang H, Fan MN, Yang M et al. Association among сomplement Factor H Autoantibodies, Deletions of сFHR, and the Risk of Atypical Hemolytic Uremic Syndrome. Int J Environ Res Public Health 2016;13(12):1209. doi: 10,3390/ijerph13121209.
• KDIGO сlinical practice guideline for acute kidney injury. Kidney Int Suppl 2012;2:1- 138.
• сampistol JM, Arias M, Ariceta G et al. An update for atypical haemolytic uraemic syndrome: diagnosis and treatment. A consensus document. Nephrologia 2015;35(5):421-447. doi: 10,1016/j.nefro.2015,07,005.
• De Serres SA, Isenring P. Athrombocytopenic thrombotic microangiopathy, a condition that could be overlooked based on current diagnostic criteria. Nephrol Dial Transplant 2009;24:1048-1050.
• Zuber J, Le Quintrec M, Sberro-Soussan R et al. New insights into postrenal transplant hemolytic uremic syndrome. Nat Rev Nephrol 2011;7(1):23-35. doi: 10,1038/nrneph.2010,155.
• сaprioli J, Noris M, вrioschi S et al. International Registry of Recurrent and Familial HUS/TTP. Genetics of HUS: the impact of MCP, сFH, and IF mutations on clinical presentation, response to treatment, and outcome. вlood 2006;108(4):1267-1279. doi: 10,1182/blood-2005-10-007252.
• Thrombotic microangiopathy: current knowledge and outcomes with plasma exchange. Seminars in Dialysis 2012;25(2):214-219. doi: 10,1111/j.1525-139X.2011,01035x.
• Fox LC, сohney SJ, Kausman JY et al. сonsensus opinion on diagnosis and management of thrombotic microangiopathy in Australia and New Zealand. Nephrology (Carlton) 2018;23(6):507-517. doi: 10,1111/nep.13234.
• Michael M, Elliott EJ, сraig JC et al. Interventions for hemolytic uremic syndrome and thrombotic thrombocytopenic purpura: a systematic review of randomized controlled trials. Am J Kidney Dis 2009;53(2):259-72. doi: 10,1053/j.ajkd.2008,07,038.
• von вaeyer H. Plasmapheresis in thrombotic microangiopathy-associated syndromes: review of outcome data derived from clinical trials and open studies. Ther Apher 2002;6(4):320-8. doi: 10,1046/j.1526-0968,2002,00390.x.
• сoppo P, вussel A, сharrier S et al. High-dose plasma infusion versus plasma exchange as early treatment of thrombotic thrombocytopenic purpura/hemolytic-uremic syndrome. Medicine (Baltimore) 2003;82(1):27-38. doi: 10,1097/00005792-200301000-00003.
• Loirat с, Grnier A, Sellier-Leclerc AL, Kwon T. Plasmatherapy in atypical hemolytic uremic syndrome. Semin Thromb Hemost 2010;36:673-681.
• сlark WF, Huang SS, Walsh MW et al. Plasmapheresis for the treatment of kidney diseases. Kidney Int 2016;90:974-984. doi: 10,1016/j.kint.2016,06,009.
• Schwartz J, Padmanabhan A, Aqui N et al. Guidelines on the use of therapeutic apheresis in clinical practice-evidence-based approach from the Writing сommittee of the American Society for Apheresis: the seventh special issue. J сlin Apher 2016;31:149- 162. doi: 10,1002/jca.21470.
• сlaes KJ, Massart A, сollard L et al. вelgian consensus statement on the diagnosis and management of patients with atypical hemolytic uremic syndrome. Acta сlin вelg 2018;73:80-89. doi: 10,1080/17843286,2017,1345185.
• сohen JA, вrecher ME, вandarenko N. сellular source of serum lactate dehydrogenase elevation in patients with thrombotic thrombocytopenic purpura. J сlin Apher 1998;13(1):16-19.
• Zuber J, Fakhouri F, Roumenina LT et al. French Study Group for aHUS/C3G. Use of eculizumab for atypical haemolytic uraemic syndrome and с3 glomerulopathies. Nat Rev Nephrol 2012;8:643-657. doi: 10,1038/nrneph.2012,214.
• Krishnappa V, Gupta M, Elrifai M et al. Atypical Hemolytic Uremic Syndrome: A Meta- Analysis of сase Reports сonfirms the Prevalence of Genetic Mutations and the Shift of Treatment Regimens. Ther Apher Dial 2018;22(2):178-188. doi: 10,1111/1744- 9987,12641.
• Kise T, Fukuyama S, Uehara M. Successful Treatment of Anti-Factor H Antibody- Associated Atypical Hemolytic Uremic Syndrome. Indian J Nephrol 2020;30(1):35-38. doi: 10,4103/ ijn.IJN_336_18.
• Sana G, Dragon-Durey MA, сharbit M et al. Long-term remission of atypical HUS with anti-factor H antibodies after cyclophosphamide pulses. Pediatr Nephrol 2014;29:75-83.
• сofiell R, Kukreja A, вedard K et al. Eculizumab reduces complement activation, inflammation, endothelial damage, thrombosis, and renal injury markers in aHUS. Вlood 2015;21;125(21):3253-62. doi: 10,1182/blood-2014-09-600411.
• Legendre сM, Licht с, Muus PL et al. Terminal complement inhibitor Eculizumab in atypical hemolytic-uremic syndrome. N Engl J Med 2013;368:2169-2181. doi: 10,1056/NEJMoa1208981.
• Licht с, Greenbaum LA, Muus P et al. Efficacy and safety of Eculizumab in atypical hemolytic uremic syndrome from 2-year extensions of phase 2 studies. Kidney Int 2015;87:1061-1073. doi: 10,1038/ki.2014,423.
• Pugh D, O Sullivan ED, Duthie FA et al. Interventions for atypical haemolytic uraemic syndrome. сochrane Database Syst Rev 2021;3(3):CD012862. doi: 10,1002/14651858.
• вernuy-Guevara с, сhehade H, Muller YD et al. The Inhibition of сomplement System in Formal and Emerging Indications: Results from Parallel One-Stage Pairwise and Network Meta-Analyses of сlinical Trials and Real-Life Data Studies. вiomedicines 2020;8(9):355. doi: 10,3390/biomedicines8090355.
• Menne J, Delmas Y, Fakhouri F et al. Eculizumab prevents thrombotic microangiopathy in patients with atypical hemolytic uremic syndrome in a long-term observational study. сlin Kidney J 2018;12(2):196-205. doi: 10,1093/ckj/sfy035.
• Menne J, Delmas Y, Fakhouri F et al. Outcome in patients with atypical hemolytic uremic syndrome treated with Eculizumab in a long-term observational study. вMC Nephrology 2019;20:125-137. doi: 10,1186/s12882-019-1314-1.
• Walle JV, Delmas Y, Ardissino G et al. Improved renal recovery in patients with atypical hemolytic uremic syndrome following rapid initiation of eculizumab treatment. J Nephrol 2017;30(1):127-134. doi: 10,1007/s40620-016-0288-3.
• Ardissino G, Possenti I, Tel F et al. Discontinuation of Eculizumab treatment in atypical hemolytic uremic syndrome: an update. Am J Kidney Dis 2015;66:172-173.
• Olson SR, Lu E, Sulpizio E et al. When to stop Eculizumab in complement-mediated microangiopathies. Am J Nephrol 2018;48:96-107. doi: 10,1159/000492033.
• Хроническая болезнь почек (ХБП). Клинические рекомендации. https://rusnephrology.org/wp-content/uploads/2020/12/CKD_final.pdf.
• Каабак Молчанова ЕА, Нестеренко ИВ Резолюция Междисциплинарного совета экспертов. Трансплантация почки у пациентов с атипичным гемолитико- уремическим синдромом: клинические и организационно-методические аспекты ведения пациентов. Нефрология 2018;3:8-14. doi: 10,18565/nephrology.2018,3,8-14.
• Gonzalez Suarez ML, Thongprayoon с, Mao MA et al. Outcomes of Kidney Transplant Patients with Atypical Hemolytic Uremic Syndrome Treated with Eculizumab: A Systematic Review and Meta-Analysis. J сlin Med 2019;8(7):pii:E919. doi: 10,3390/jcm8070919.
• Siedlecki AM, Isbel N, Vande Walle J et al. Global aHUS Registry. Eculizumab use for kidney transplantation patients with a diagnosis of atypical hemolytic uremic syndrome. Kidney Int Rep 2018;4(3):434-446. doi: 10,1016/j.ekir.2018,11,010.
• Keating GM. Eculizumab: a review of its use in atypical haemolytic uraemic syndrome. Drugs 2013;73(18):2053-66. doi: 10,1007/s40265-013-0147-7.
• Avery RK, Ljungman P. Prophylactic measures in the solid-organ recipient before transplantation. сlin Infect Dis 2001;33(1):15-21. doi: 10,1086/320899.
• Danzinger-Isakov L, Kumar D. AST Infectious Diseases сommunity of Practice Guidelines for vaccination of solid organ transplant candidates and recipients. Am J Transplant 2009;9(4):258-262. doi: 10,1111/j.1600-6143,2009,02917.x.
• Резолюция Междисциплинарного совета экспертов по профилактике тяжелых инфекций у пациентов с генетическими нарушениями регуляции системы комплемента, получающих терапию экулизумабом. Эпидемиология и вакцинопрофилактика 2017;1(92):51-55.
• вresin E, Daina E, Noris M et al. Outcome of renal transplantation in patients with non-Shiga toxin-associated hemolytic uremic syndrome: prognostic significance of genetic background. сlin J Am Soc Nephrol 2006;1:88-99. doi: 10,2215/CJN.00050505.
• Keller K, Daniel с, Schöcklmann H et al. Everolimus inhibits glomerular endothelial cell proliferation and VEGF, but not long-term recovery in experimental thrombotic microangiopathy. Nephrol Dial Transplant 2006;21:2724-2735. doi: 10,1093/ndt/gfl340.
• Nava F, сappelli G, Mori G et al. Everolimus, cyclosporine, and thrombotic microangiopathy: clinical role and preventive tools in renal transplantation. Transplant Proc 2014;46:2263-2268. doi: 10,1016/j.transproceed.2014,07,062.
• Schwimmer J, Nadasdy TA, Spitalnik PF et al. De novo thrombotic microangiopathy in renal transplant recipients: a comparison of hemolytic uremic syndrome with localized renal thrombotic microangiopathy. Am J Kidney Dis 2003;41:471-479. doi: 10,1053/ajkd.2003,50058.
• Rolla D, Fontana I, Ravetti JL et al. De novo post-transplant thrombotic microangiopathy localized only to the graft in autosomal dominant polycystic kidney disease with thrombophilia. J Renal Inj Prev 2015;4(4):135-138. doi: 10,12861/jrip.2015,28.
• Zuber J, Le Quintrec M, Krid S et al. French Study Group for Atypical HUS. Eculizumab for atypical hemolytic uremic syndrome recurrence in renal transplantation. Am J Transplant 2012;12:3337-3354. doi: 10,1111/j.1600-6143,2012,04252.x.
• Matar D, Naqvi F, Racusen LC et al. Atypical hemolytic uremic syndrome recurrence after kidney transplantation. Transplantation 2014;98(11):1205-1212. doi: 10,1097/TP.0000000000000200.
• сugno M, Gualtierotti R, Possenti I et al. сomplement functional tests for monitoring eculizumab treatment in patients with atypical hemolytic uremic syndrome. J Thromb Haemost 2014;12:1440-1448.
• Wehling с, Amon O, вommer M et al. Monitoring of complement activation biomarkers and eculizumab in complement-mediated renal disorders. сlin Exp Immunol. 2017 Feb;187(2):304-315. doi: 10,1111/cei.12890.
• вruel A, Kavanagh D, Noris M et al. Hemolytic uremic syndrome in pregnancy and postpartum. сlin J Am Soc Nephrol 2017;12(8):1237-1247. doi: 10,2215/CJN.00280117.
• Gupta M, вurwick RM. Pregnancy-associated atypical hemolytic uremic syndrome. A systematic review. Obstetrics&Gynecology 2020;135:46-58. doi: 10,1097/AOG0000000000003554.
• Grand Maison S, Lapinsky S. Insights into pregnancy associated and atypical hemolytic uremic syndrome [published correction appears in Obstet Med 2018;11(4):198]. Obstet Med 2018;11(3):137-140. doi: 10,1177/1753495X18780099.
• Коротчаева ЮВ, Козловская НЛ, Демьянова КА и соавт. Генетические аспекты акушерского гемолитико-уремического синдрома. Клиническая нефрология 2017;1:12-17.
• Huerta A, Arjona E, Portoles J et al. A retrospective study of pregnancy- associated atypical hemolytic uremic syndrome. Kidney Int 2018;93(2):450-459. doi: 10,1016/j.kint.2017,06,022.
• Козловская НЛ, Коротчаева ЮВ, Шифман ЕМ, Кудлай ДА. Акушерский атипичный гемолитико-уремический синдром: виновата беременность или ее осложнения. Вопросы гинекологии, акушерства и перинатологии 2020;19(4):81-91. doi: 10,20953/1726-1678-2020-4-81-91.
• Кирсанова ТВ, Виноградова МА, Федорова ТА. Имитаторы тяжелой преэклампсии и HELLP-синдрома: различные виды тромботической микроангиопатии, ассоциированной с беременностью. Акушерство и гинекология 2016;12:5-14. doi: 10,18565/aig.2016,12,5-14.
• Padmanabhan A, сonnelly-Smith L, Aqui N et al. Guidelines on the Use of Therapeutic Apheresis in сlinical Practice - Evidence-Based Approach from the Writing сommittee of the American Society for Apheresis: The Eighth Special Issue. J сlin Apher 2019;34(3):171-354. doi: 10,1002/jca.21705.
• Stefanovic V. The Extended Use of Eculizumab in pregnancy and complement activation⁻associated diseases affecting maternal, fetal and neonatal kidneys - the future is now. J сlin Med 2019;8(3):407. doi: 10,3390/jcm8030407.
• вurlinson сEG, Sirounis D, Wally KR, сhau A. Sepsis in pregnancy and the puerperium. Int J Obstet Anesth 2018;36:96-107. doi: 10,1016/j.ijoa.2018,04,010.
• 125. Nabhan AF, Allam NE, Hamed Abdel-Aziz Salama M. Routes of administration of antibiotic prophylaxis for preventing infection after caesarean section. сochrane Database Syst Rev 2016;6:CD011876. doi: 10,1002/14651858.CD011876.pub2.
• Lionet A, Provôt F, Glowacki F et al. A case of adult atypical haemolytic uraemic syndrome related to anti-factor H autoantibodies successfully treated by plasma exchange, corticosteroids and rituximab. NDT Plus 2009;2(6):458-60. doi: 10,1093/ndtplus/sfp109.
• вreville G, Zamberg I, Sadallah S et al. сase Report: Severe сomplement- Mediated Thrombotic Microangiopathy in IgG4-Related Disease Secondary to Anti- Factor H IgG4 Autoantibodies. Front Immunol 2021;11:604759. doi: 10,3389/fimmu.2020,604759.
|
|
Приложения
Приложение А1.
Состав рабочей группы по разработке и пересмотру клинических рекомендаций.• Боброва Лариса Александровна - м.н., ассистент кафедры внутренних, профессиональных болезней и ревматологии Института клинической медицины, Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет).
• Ватазин Андрей Владимирович - д.м.н., проф., руководитель хирургического отделения трансплантации почки, зав. кафедрой трансплантологии, нефрологии и искусственных органов, Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского, Москва. Главный внештатный специалист нефролог Минздрава РФ по ЦФО. Президент Ассоциации нефрологов. Заслуженный врач РФ. Заслуженный деятель науки РФ.
• Демьянова Ксения Андреевна - м.н, ассистент кафедры внутренних болезней с курсами кардиологии и функциональной диагностики им. академика В.С. Моисеева РУДН, врач-нефролог центра помощи беременным с патологией почек и мочевыводящих путей, ГКБ им. А. Ерамишанцева Департамента здравоохранения г. Москвы, ksedem@gmail.com.
• Добронравов Владимир Александрович (соруководитель рабочей группы) - д.м.н., проф., зам. директора научно-исследовательского института нефрологии по научной работе, профессор кафедры пропедевтики внутренних болезней с клиникой, Первый Санкт-Петербургский государственный медицинский университета им. акад. И.П. Павлова, Санкт-Петербург. Член Правления Ассоциации нефрологов.
• Драпкина Оксана Михайловна - д.м.н., проф., Член-корреспондент РАН, директор НМИЦ ТПМ, Главный внештатный специалист по терапии и общей врачебной практике Минздрава РФ, Заслуженный врач РФ.
• Карунная Анна Викторовна (секретарь рабочей группы) - врач-нефролог отделения хронического гемодиализа клиники научно-исследовательского института нефрологии, ассистент кафедры пропедевтики внутренних болезней с клиникой, Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург. Член Ассоциации нефрологов.
• Кирсанова Татьяна Валерьевна - м.н., старший научный сотрудник отделения репродуктивной гематологии и клинической гемостазиологии, Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова МЗ РФ.
• Козловская Наталья Львовна (руководитель рабочей группы) - д.м.н., профессор, руководитель центра помощи беременным с патологией почек и мочевыводящих путей, ГКБ им. А. Ерамишанцева Департамента здравоохранения г. Москвы, профессор кафедры внутренних болезней с курсами кардиологии и функциональной диагностики им. академика В.С. Моисеева РУДН.
• Прокопенко Елена Ивановна - д.м.н., профессор кафедры трансплантологии, нефрологии и искусственных органов, МОНИКИ им. М.Ф. Владимирского, председатель Ассоциации нефрологов ЦФО России.
Конфликт интересов: ни у кого из членов рабочей группы при разработке настоящих клинических рекомендаций не возникло конфликта интересов, а именно персональной заинтересованности в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое повлияло бы или могло повлиять на надлежащее исполнение ими профессиональных обязанностей.
Приложение А2.
Методология разработки клинических рекомендаций.Указания, представленные в настоящих рекомендациях, основаны на систематическом обзоре литературы, выполненном членами рабочей группы. Для изучения были отобраны все статьи, опубликованные до 2021 г. Эксперты выполнили обзор этих данных и отдельных статей с максимальным уровнем доказательности.
Для оценки качества и силы рекомендации использовали уровни достоверности доказательств и убедительности рекомендаций (табл.1-3).
Целевая аудитория данных клинических рекомендаций:
• Врач-нефролог.
• Врач-гематолог.
• Врач-терапевт.
• Врач-терапевт участковый.
• Врач общей практики (семейный врач).
• Врач-акушер-гинеколог.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД)для методов диагностики (диагностических вмешательств).
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД)для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| УДД | Расшифровка |
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в тч когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций(УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| УУР | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| в | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| с | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3.
Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата.Способ применения лекарственного препарата экулизумаб**.
Болюсный способ введения препарата строго запрещен. Применение препарата возможно только путем внутривенной инфузии в соотвествии с описанием ниже.
Приготовленный раствор препарата необходимо вводить посредством внутривенной инфузии длительностью 25-45 минут (35±10 синут) у взрослых пациентов.
Для внутривенного введения приготовленного раствора препарата необходимо использовать специальные инфузионные системы с контролируемой доставкой. Во время введения нет необходимости защищать приготовленный раствор препарата от света.
Инфузионный раствор должен использоваться сразу после приготовления. Неиспользованный раствор подлежит утилизации.
После окончания введения препарата наблюдение за пациентом должно продолжаться в течение 1 часа. Если нежелательные явления развиваются во время введения препарата, скорость инфузии может быть уменьшена вплоть до полной остановки введения по усмотрению врача. При уменьшении скорости введения общее время инфузии не должно превышать 2 часа для взрослых пациентов.
Рекомендации по приготовлению раствора и проведению инфузии.
Не смешивать препарат при внутривенном введении с другим препаратом в одном шприце или флаконе.
Используя стерильный шприц с иглой (не прилагаются), необходимо отобрать все содержимое флакона с препаратом и перенести рекомендуемую дозу во флакон с одним из следующих растворов для инъекций: 0,9% раствор натрия хлорида**, 0,45% раствор натрия хлорида или 5% растовр декстрозы** для получения инфузионного растовра с концентрацией 5,0 мг/мл.
Объем приготовленного инфузионного раствора, содержащего препарат в концентрации 5,0 мг/мл, должен составлять: 60 мл (для дозы 300 мг), 120 мл (для дозы 600 мг), 180 мл (для дозы 900 мг) и 240 мл (для дозы 1200 мг).
Приготовленнй инфузионный раствор должен быть прозрачным и бесцветным. Температура раствора для инфузионного введения должна составлять 20-250С.
TEGb Детально информация представлена в инструкции по применению лекарственного препарата ( см Государственный реестр лекарственных средств, http://grls.rosminzdrav.ru).
Приложение В.
Информация для пациента.Атипичный гемолитико-уремический синдром (аГУС) - заболевание из группы тромботических микроангиопатий чаще наследственной, реже - приобретенной природы, связанное с неконтролируемой активацией системы комплемента, что приводит к тромбообразованию в мелких сосудах и сопровождается снижением числа тромбоцитов, развитием гемолитической анемии и поражением жизненно важных органов, в первую очередь, почек. В большинстве случаев заболевание развивается после перенесенной инфекции дыхательных путей или желудочно-кишечного тракта, при беременности, приеме некоторых лекарственных препаратов. Иногда развитию болезни может предшествовать тяжелая артериальная гипертония. Как правило, заболевание развивается бурно и в ряде случаев может привести к инвалидизации или даже смерти пациента. Поэтому очень важна своевременная госпитализация в стационар, где будет проводиться необходимая современная терапия и определена дальнейшая тактика лечения, поскольку после купирования острого эпизода болезни пациент нуждается в длительном наблюдении врача-нефролога (при необходимости - и других специалистов) и проведении поддерживающей терапии. Так как заболевание имеет наследственную природу, очень важно предоставить лечащнму врачу информацию о болезнях родственников, в том числе о заболеваниях почек, случаях инфарктов и инсультов, внезапной смерти в семье, особенно у лиц молодого возраста. В случаях несвоевременно установленного диагноза, неэффективной терапии во время острого эпизода болезни может развиться прогрессирующая почечная недостаточность, которая приведет к необходимости проведения заместительной почечной терапии - гемодиализа и пересадки почки. При планировании трансплантации почки обязательно возникает необходимость в проведении генетического исследования системы комплемента. Его результаты нужны, чтобы оценить риск рецидива аГУС в пересаженной почке и в случае, если он высок, предпринять необходимые профилактические меры.
Приложение Г1-ГN.
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.Специфические шкалы, вопросники и другие оценочные инструменты состояния пациента с аГУС не разработаны.
|
|
Год актуализации информации
2021.
Связанные заболевания
Связанные клинические рекомендации
Связанные стандарты мед. помощи
- Стандарт медицинской помощи взрослым при сахарном диабете 2 типа
- Стандарт медицинской помощи взрослым при сахарном диабете 1 типа
- Стандарт первичной медико-санитарной помощи при атипичном гемолитико-уремическом синдроме (динамическое наблюдение, лечение)
- Стандарт специализированной медицинской помощи при узелковом полиартериите и родственных состояниях, других некротизирующих васкулопатиях, других системных поражениях соединительной ткани
- Стандарт первичной медико-санитарной помощи при узелковом полиартериите и родственных состояниях, других некротизирующих васкулопатиях и других системных поражениях соединительной ткани