ICD-10 codes
- ICD-10
- B46 Zygomycosis
Description
Зигомикоз (фикомикоз)- общее обозначение оппортунистических микозов, вызываемых представителями различных родов класса Zygomycetes.
Зигомикоз не очень часто встречающееся заболевание, по сравнению с другими оппортунистическими микозами, такими как кандидоз и аспергиллез. Первый случай зигомикоза описан Paultauf в 1885 г. Его описание достаточно полное для предположения о том, что возбудителем заболевания является Absidia corymbifera. Первое время большинство возбудителей зигомикоза относили к грибам рода Mucor, однако позднее их повторно классифицировали в различные роды и семейства порядка Mucorales.
Вскоре стало очевидным, что среди возбудителей зигомикоза преобладают Rhizopus spp., а не Mucor spp. По мере накопления информации о данной патологии, стала очевидна связь зигомикоза с онкологическими заболеваниями, сахарным диабетом, длительным применением антибиотиков, кортикостероидов, дефероксамина, иммуносупрессоров.
По мере совершенствования диагностики расширился спектр возбудителей. Наряду с представителями родов Rhizopus, Mucor и Absidia, стали идентифицировать виды родов Rhizomucor, Apophysomyces, Saksenaea, сunninghamella, сokeromyces, и Syncephalastrum spp.
Соответственно, описания клинической картины заболевания также стали более разнообразными. Если ранее выделяли преимущественно риноцеребральный, легочный и диссеминированный формы зигомикоза, то к настоящему времени стали также известны гастроинтестинальная, кожная и подкожная формы, аллергическая реакция и бессимптомная колонизация.
С совершенствованием клинико-лабораторных методов стало возможным установить диагноз на более ранних стадиях заболевания, а благодаря разработкам новых хирургических методов лечения и успехам антимикотической терапии в настоящее время, удается избежать 100% летальности, которая сопутствовала зигомикозу в недалеком прошлом.
Зигомикоз не очень часто встречающееся заболевание, по сравнению с другими оппортунистическими микозами, такими как кандидоз и аспергиллез. Первый случай зигомикоза описан Paultauf в 1885 г. Его описание достаточно полное для предположения о том, что возбудителем заболевания является Absidia corymbifera. Первое время большинство возбудителей зигомикоза относили к грибам рода Mucor, однако позднее их повторно классифицировали в различные роды и семейства порядка Mucorales.
Вскоре стало очевидным, что среди возбудителей зигомикоза преобладают Rhizopus spp., а не Mucor spp. По мере накопления информации о данной патологии, стала очевидна связь зигомикоза с онкологическими заболеваниями, сахарным диабетом, длительным применением антибиотиков, кортикостероидов, дефероксамина, иммуносупрессоров.
По мере совершенствования диагностики расширился спектр возбудителей. Наряду с представителями родов Rhizopus, Mucor и Absidia, стали идентифицировать виды родов Rhizomucor, Apophysomyces, Saksenaea, сunninghamella, сokeromyces, и Syncephalastrum spp.
Соответственно, описания клинической картины заболевания также стали более разнообразными. Если ранее выделяли преимущественно риноцеребральный, легочный и диссеминированный формы зигомикоза, то к настоящему времени стали также известны гастроинтестинальная, кожная и подкожная формы, аллергическая реакция и бессимптомная колонизация.
С совершенствованием клинико-лабораторных методов стало возможным установить диагноз на более ранних стадиях заболевания, а благодаря разработкам новых хирургических методов лечения и успехам антимикотической терапии в настоящее время, удается избежать 100% летальности, которая сопутствовала зигомикозу в недалеком прошлом.
Reasons
Возбудители зигомикоза - низшие грибы в царстве грибов являются представителями самостоятельного отдела - Zygomycota. Этот отдел разделен на два класса: Trichomycetes, которые не являются патогенными для человека, и Zygomycetes, который содержит патогенные виды.
Класс Zygomycetes подразделен на три порядка: Mucorales, Mortierellales и Entomophthorales. Порядок Mucorales разделен на пять семейств: Mucoraceae, сunninghamellaceae, Saksenaeaceae, Thamnidiaceae, Syncephalastraceae. К семейству Mucoraceae относят представителей родов Rhizopus, Mucor, Absidia, Rhizomucor и Apophysomyces - наиболее частых возбудители зигомикозов.
Зигомикоз у людей преимущественно вызывают микромицеты рода Rhizopus, главным образом, Rhizopus oryzae и Rhizopus microsporus. Реже возбудителями заболевания являются Mucor spp. (M. indicus, M. circinelloides и ). В семействе сunninghamellaceae только сunninghamella bertholletiae является патогенным для человека.
Род Saksenaea включает только Saksenaea vasiformis. сokeromyces (представитель семей ства Thamnidiaceae) также имеет один вид, который может колонизировать кишечник и урогенитальный трактат. Syncephalastrum racemosum и Mortierella wolfii не вызывают заболевания у человека, но являются возбудителями зигомикоза у крупного рогатого скота.
Порядок Entomophthorales включает в себя два семейства Ancylistaceae (с родом сonidiobolus) и вasidiobolaceae (с родом вasidiobolus). Все случаи заболевания человека базидиоболомикозом вызваны видом вasidiobolus ranarum. Род сonidiobolus содержит несколько видов, патогенных для млекопитающих. Основным возбудителем заболеваний у человека считается сonidiobolus coronatus. Большинство членов порядка Entomophthorales являются патогенами насекомых и других беспозвоночных. Случаи базидиоболомикоза и конидиоболомикоза у человека отмечены в тропических регионах, преимущественно в Африке, Азии, Центральной Америке.
Как видно из приведенной классификации, основные возбудители зигомикоза принадлежат к семейству Mucoraceae.
Грибы класса Zygomycetes распространены повсеместно. Они обитают в почве, часто встречаются в гниющих отходах и пищевых продуктах, особенно - в хлебе и зерне. Мелкий размер спор (в среднем - 6,6 мкм) способствует распространению по воздуху, даже при помощи незначительных колебаний воздушных потоков, на большие расстояния.
Представители семейства Mucorales могут быть выявлены в лаборатории в качестве контаминатов или загрязнителей исследуемого материала или среды.
Главный путь проникновения зигомицетов в организм больного - дыхательный. Например, неоднократно отмечали вспышки риноцеребральной или легочной форм зигомикоза у рабочих, участвовавших в раскопках, строительстве или контактировавших с загрязненными фильтрами кондиционеров.
Вторым по частоте является чрезкожный путь проникновения зигомицетов (места инъекций, особенно - у наркоманов, при нанесении татуировок, укусах насекомых, ожогах, мацерации).
Возможно проникновение зигомицетов в желудочно-кишечный тракт вместе с продуктами питания (с ферментированным молоком, с высушенными хлебными изделиями, с алкогольными напитками, полученными из зерна), а также при приеме загрязненных спорами фито- или гомеопатических средств.
Отмечали также проникновение в организм спор через загрязненный инструментарий, используемый при различных манипуляциях (инъекции, введение зондов, взятие соскобов ), что особенно актуально у онкологических больных.
В последнее время неоднократно проводили попытки систематизации имеющихся данных об этом заболевании. В одном из ретроспективных исследований, проведенном в США, были рассмотрены все описанные клинические случаи зигомикоза с 1940 по 2003 гг. в США, которых оказалось 929. При исследовании выявлено, что частота зигомикоза составляет 1,7 случаев на 1000000 людей в год, приблизительно 500 случаев в год.
При исследованиях, основанных на паталогоанатомических заключениях, показано, что распространенность зигомикоза составляет от 1 до 5 случаев на 10 000 вскрытий. Инвазивный зигомикоз развивается реже, чем инвазивный кандидоз и аспергиллез. Однако у пациентов с более высоким риском развития оппортунистических инфекций, например, у реципиентов - трансплантантов стволовых кроветворных клеток (ТСКК), распространенность зигомикоза столь же высока - от 2 до 3 %.
Средний возраст больных зигомикозом составляет 38-40 лет, большинство из них (65%) - мужчины. Наиболее часто встречающимися клиническими формами заболевания являются: синусит (39%), поражение легких (24%), кожи (19%) и диссеминированный процесс (23%). Летальность зависит от клинической формы и фонового заболевания и составляет, по данным разных исследователей, от 36% до 85%.
Факторы риска.
Зигомикоз, как и многие другие инвазивные микозы, развивается преимущественно у иммунокомпрометированных пациентов. Главными факторами риска у данной категории больных являются: декомпенсированный сахарный диабет, онко- и гематологическая патология, нейтропения (абсолютное число нейтрофилов менее 0,5×109/л в течение 1 недели или более), СПИД, состояние после трансплантации органов и ТСКК.
Большое значение имеет также длительная иммуносупресивная и цитостатическая терапия, длительный прием глюкокортикоидов и дефероксамина.
Недавно был описан ряд случаев возникновения зигомикоза у реципиентов аллогенных трансплантантов внутренних органов на фоне профилактики вориконазолом. Все эти случаи указывают на увеличение частоты зигомикоза у пациентов, получающих в качестве пред- и послеоперационной подготовки вориконазол, но точная роль этого препарата в увеличении предрасположенности пациентов к зигомикозу не ясна.
Большинство описанных случаев заболевания, на фоне терапии вориконазолом, развились у пациентов, получавших высокие дозы кортикостероидов по поводу основной патологии. Однако заслуживает внимания однородность случаев возникновения зигомикоза у пациентов, получающих данный антимикотик. Вориконазол обладает широким спектром действия в отношении Aspergillus spp., сandida spp., Scedosporium spp., опако(фео)гифомицетов, но он неактивен в отношении зигомицетов. Следовательно, можно предположить, что вориконазол, предотвращая развитие других инвазивных микозов, увеличивает продолжительность жизни пациентов с иммунодефицитами, одновременно повышая вероятность инфицирования их зигомицетами.
Это же явление характерно для профилактики итраконазолом, использование которого также можно расценить как независимый фактор риска для развития зигомикоза. Существуют сообщения о развитии зигомикоза у пациентов, получавших каспофунгин или каспофунгин с вориконазолом.
Класс Zygomycetes подразделен на три порядка: Mucorales, Mortierellales и Entomophthorales. Порядок Mucorales разделен на пять семейств: Mucoraceae, сunninghamellaceae, Saksenaeaceae, Thamnidiaceae, Syncephalastraceae. К семейству Mucoraceae относят представителей родов Rhizopus, Mucor, Absidia, Rhizomucor и Apophysomyces - наиболее частых возбудители зигомикозов.
Зигомикоз у людей преимущественно вызывают микромицеты рода Rhizopus, главным образом, Rhizopus oryzae и Rhizopus microsporus. Реже возбудителями заболевания являются Mucor spp. (M. indicus, M. circinelloides и ). В семействе сunninghamellaceae только сunninghamella bertholletiae является патогенным для человека.
Род Saksenaea включает только Saksenaea vasiformis. сokeromyces (представитель семей ства Thamnidiaceae) также имеет один вид, который может колонизировать кишечник и урогенитальный трактат. Syncephalastrum racemosum и Mortierella wolfii не вызывают заболевания у человека, но являются возбудителями зигомикоза у крупного рогатого скота.
Порядок Entomophthorales включает в себя два семейства Ancylistaceae (с родом сonidiobolus) и вasidiobolaceae (с родом вasidiobolus). Все случаи заболевания человека базидиоболомикозом вызваны видом вasidiobolus ranarum. Род сonidiobolus содержит несколько видов, патогенных для млекопитающих. Основным возбудителем заболеваний у человека считается сonidiobolus coronatus. Большинство членов порядка Entomophthorales являются патогенами насекомых и других беспозвоночных. Случаи базидиоболомикоза и конидиоболомикоза у человека отмечены в тропических регионах, преимущественно в Африке, Азии, Центральной Америке.
Как видно из приведенной классификации, основные возбудители зигомикоза принадлежат к семейству Mucoraceae.
Грибы класса Zygomycetes распространены повсеместно. Они обитают в почве, часто встречаются в гниющих отходах и пищевых продуктах, особенно - в хлебе и зерне. Мелкий размер спор (в среднем - 6,6 мкм) способствует распространению по воздуху, даже при помощи незначительных колебаний воздушных потоков, на большие расстояния.
Представители семейства Mucorales могут быть выявлены в лаборатории в качестве контаминатов или загрязнителей исследуемого материала или среды.
Главный путь проникновения зигомицетов в организм больного - дыхательный. Например, неоднократно отмечали вспышки риноцеребральной или легочной форм зигомикоза у рабочих, участвовавших в раскопках, строительстве или контактировавших с загрязненными фильтрами кондиционеров.
Вторым по частоте является чрезкожный путь проникновения зигомицетов (места инъекций, особенно - у наркоманов, при нанесении татуировок, укусах насекомых, ожогах, мацерации).
Возможно проникновение зигомицетов в желудочно-кишечный тракт вместе с продуктами питания (с ферментированным молоком, с высушенными хлебными изделиями, с алкогольными напитками, полученными из зерна), а также при приеме загрязненных спорами фито- или гомеопатических средств.
Отмечали также проникновение в организм спор через загрязненный инструментарий, используемый при различных манипуляциях (инъекции, введение зондов, взятие соскобов ), что особенно актуально у онкологических больных.
В последнее время неоднократно проводили попытки систематизации имеющихся данных об этом заболевании. В одном из ретроспективных исследований, проведенном в США, были рассмотрены все описанные клинические случаи зигомикоза с 1940 по 2003 гг. в США, которых оказалось 929. При исследовании выявлено, что частота зигомикоза составляет 1,7 случаев на 1000000 людей в год, приблизительно 500 случаев в год.
При исследованиях, основанных на паталогоанатомических заключениях, показано, что распространенность зигомикоза составляет от 1 до 5 случаев на 10 000 вскрытий. Инвазивный зигомикоз развивается реже, чем инвазивный кандидоз и аспергиллез. Однако у пациентов с более высоким риском развития оппортунистических инфекций, например, у реципиентов - трансплантантов стволовых кроветворных клеток (ТСКК), распространенность зигомикоза столь же высока - от 2 до 3 %.
Средний возраст больных зигомикозом составляет 38-40 лет, большинство из них (65%) - мужчины. Наиболее часто встречающимися клиническими формами заболевания являются: синусит (39%), поражение легких (24%), кожи (19%) и диссеминированный процесс (23%). Летальность зависит от клинической формы и фонового заболевания и составляет, по данным разных исследователей, от 36% до 85%.
Факторы риска.
Зигомикоз, как и многие другие инвазивные микозы, развивается преимущественно у иммунокомпрометированных пациентов. Главными факторами риска у данной категории больных являются: декомпенсированный сахарный диабет, онко- и гематологическая патология, нейтропения (абсолютное число нейтрофилов менее 0,5×109/л в течение 1 недели или более), СПИД, состояние после трансплантации органов и ТСКК.
Большое значение имеет также длительная иммуносупресивная и цитостатическая терапия, длительный прием глюкокортикоидов и дефероксамина.
Недавно был описан ряд случаев возникновения зигомикоза у реципиентов аллогенных трансплантантов внутренних органов на фоне профилактики вориконазолом. Все эти случаи указывают на увеличение частоты зигомикоза у пациентов, получающих в качестве пред- и послеоперационной подготовки вориконазол, но точная роль этого препарата в увеличении предрасположенности пациентов к зигомикозу не ясна.
Большинство описанных случаев заболевания, на фоне терапии вориконазолом, развились у пациентов, получавших высокие дозы кортикостероидов по поводу основной патологии. Однако заслуживает внимания однородность случаев возникновения зигомикоза у пациентов, получающих данный антимикотик. Вориконазол обладает широким спектром действия в отношении Aspergillus spp., сandida spp., Scedosporium spp., опако(фео)гифомицетов, но он неактивен в отношении зигомицетов. Следовательно, можно предположить, что вориконазол, предотвращая развитие других инвазивных микозов, увеличивает продолжительность жизни пациентов с иммунодефицитами, одновременно повышая вероятность инфицирования их зигомицетами.
Это же явление характерно для профилактики итраконазолом, использование которого также можно расценить как независимый фактор риска для развития зигомикоза. Существуют сообщения о развитии зигомикоза у пациентов, получавших каспофунгин или каспофунгин с вориконазолом.
Pathogenesis
Зигомицеты, попадая в организм здорового человека, погибают в результате действия мононуклеарных и полиморфоноядерных фагоцитов, а также благодаря воздействию окислительно-восстановительных систем сыворотки крови. При клинических наблюдениях выявлено, что фагоцитам принадлежит основная роль в предотвращении развития инфекции. Эти же исследователи доказали, что пациенты с нейтропенией находятся в группе повышенного риска возникновения зигомикоза. Кроме того, нарушение функциональной способности фагоцитов также является фактором риска развития зигомикоза. Известно, что гипергликемия и ацидоз вызывают нарушение киллерной активности фагоцитов, других механизмов повреждения. Из вестно также, что длительная терапия кортикостероидами нарушает функциональные способности бронхоальвеолярных макрофагов, в результате чего они не могут предотвратить прорастание спор после инфицирования.
Точные механизмы, в результате которых кетоацидоз, гипергликемия и стероиды нарушают функции фагоцитов, остаются неизвестными.
Недавно выявили важную клиническую особенность повышенной восприимчивости к зигомикозу пациентов с увеличенным содержанием свободного железа в сыворотке крови. В течение двух последних десятилетий стало известно, что пациенты, получающие дефероксамин, заметно чаще заболевают зигомикозом. Как оказалось, Rhizopus spp. использует дефероксамин, чтобы обеспечить себя необходимым для жизнедеятельности железом. Было доказано, что Rhizopus spp. может накапливать в 8-40 раз больше железа, чем Aspergillus fumigatus и сandida albicans. Выявили линейную корреляцию между увеличением потребления железа Rhizopus spp. и его ростом.
Дополнительные данные, полученные в экспериментах на животных, подчеркивают потребность Rhizopus spp. в железе. Введение дефероксамина или свободного железа в организм инфицированных Rhizopus spp. животных резко повышает летальность последних. Наконец, в тех же экспериментах продемонстрировано, что другие хелаторы железа не используются как сидерофоры грибами и не обеспечивают возможность возбудителям зигомикоза пролиферировать.
У пациентов с диабетическим кетоацидозом высок риск развития риноцеребрального зигомикоза. Многократными наблюдениями доказано, что у пациентов с метаболическим ацидозом повышается уровень свободного железа в сыворотке крови. Вероятно, в условиях ацидоза высвобождается железо транспортных белков. В сыворотке крови с низким pH, поддерживающим рост R.oryzae, обнаруживали повышенное содержание свободного железа (69 г/дл, N до13 г/дл). Доказано, что сыворотка крови (pH 7,3-6,88), взятая у пациентов с диабетическим кетоацидозом, поддерживает рост Rhizopus oryzae, а щелочная среда (pH 7,78-8,38) - нет.
Суммируя все выше изложенное, можно сделать следующие выводы:
1. Основными механизмами защиты против зигомицетов являются: фагоцитоз патогенов нейтрофилами, тканевыми макрофагами и эндотелиальными клетками, которые регулируют также тонус и проницаемость сосудистой стенки, связывание свободного железа сыворотки крови специализированными белками. Действуя согласованно, эти механизмы предотвращают проникновение инфекции в ткани и последующее эндоваскулярное повреждение.
2. У людей с факторами риска выявляют нарушения механизмов защиты. Например, при диабетическом кетоацидозе низкий pH сыворотки крови является причиной высвобождения железа транспортных белков, что создает благоприятные условия для роста зигомицетов. Дефекты в механизмах фагоцитарной защиты (дефицит количества нейтрофилов или нарушение их функции), вызванные кортикостероидами или гипергликемией с ацидозом, диабетическим кетоацидозом, способствуют пролиферации зигомицетов.
3. Адгезия и повреждение эндотелиальных клеток зигомицетами приводит к ангиоинвазии гриба, сосудистому тромбозу, последующему некрозу тканей и распространению грибковой инфекции.
Повреждение и проникновение микроорганизма через эндотелиальные клетки, выстилающие стенки кровеносных сосудов, вероятно, является одним из основных моментов в патогенезе заболевания. Покоящиеся конидии R. oryzae могут проникать в субэндотелий с помощью матричных белков. Обнаружено, что конидии прикрепляются к субэндотелиальным матричным белкам значительно лучше, чем гифы микромицетов.
Обращает на себя внимание тот факт, что повреждение эндотелиальных клеток происходит и в том случае, когда конидии R. оryzae были нежизнеспособными. Точные механизмы, посредством которых погибшие зигомицеты вызывают повреждение тканей, остается неясным.
Основным патоморфологическим признаком зигомикоза является наличие обширного ангиоинвазивного процесса с повреждением сосудов, тромбозом и некрозом окружающих тканей. Это, вероятно, связано с тропностью зигомицетов к эндотелию артерий, причем вены, как правило, не поражаются.
Перечисленные гистопатологические признаки характерны для любой локализации зигомикоза. Так, при проникновении инфекции в головной мозг наблюдают очаги размягчения тканей, а по периферии - геморрагии. В гистологическом препарате лег кого выявляют массивные геморрагии с эмболами, участки обызвествления, соответствующие старым очагам поражения. При поражении желудочно-кишечного тракта определяют язвы размером от 3 до 4 см с черными некротическими участками в центре очагов.
Точные механизмы, в результате которых кетоацидоз, гипергликемия и стероиды нарушают функции фагоцитов, остаются неизвестными.
Недавно выявили важную клиническую особенность повышенной восприимчивости к зигомикозу пациентов с увеличенным содержанием свободного железа в сыворотке крови. В течение двух последних десятилетий стало известно, что пациенты, получающие дефероксамин, заметно чаще заболевают зигомикозом. Как оказалось, Rhizopus spp. использует дефероксамин, чтобы обеспечить себя необходимым для жизнедеятельности железом. Было доказано, что Rhizopus spp. может накапливать в 8-40 раз больше железа, чем Aspergillus fumigatus и сandida albicans. Выявили линейную корреляцию между увеличением потребления железа Rhizopus spp. и его ростом.
Дополнительные данные, полученные в экспериментах на животных, подчеркивают потребность Rhizopus spp. в железе. Введение дефероксамина или свободного железа в организм инфицированных Rhizopus spp. животных резко повышает летальность последних. Наконец, в тех же экспериментах продемонстрировано, что другие хелаторы железа не используются как сидерофоры грибами и не обеспечивают возможность возбудителям зигомикоза пролиферировать.
У пациентов с диабетическим кетоацидозом высок риск развития риноцеребрального зигомикоза. Многократными наблюдениями доказано, что у пациентов с метаболическим ацидозом повышается уровень свободного железа в сыворотке крови. Вероятно, в условиях ацидоза высвобождается железо транспортных белков. В сыворотке крови с низким pH, поддерживающим рост R.oryzae, обнаруживали повышенное содержание свободного железа (69 г/дл, N до13 г/дл). Доказано, что сыворотка крови (pH 7,3-6,88), взятая у пациентов с диабетическим кетоацидозом, поддерживает рост Rhizopus oryzae, а щелочная среда (pH 7,78-8,38) - нет.
Суммируя все выше изложенное, можно сделать следующие выводы:
1. Основными механизмами защиты против зигомицетов являются: фагоцитоз патогенов нейтрофилами, тканевыми макрофагами и эндотелиальными клетками, которые регулируют также тонус и проницаемость сосудистой стенки, связывание свободного железа сыворотки крови специализированными белками. Действуя согласованно, эти механизмы предотвращают проникновение инфекции в ткани и последующее эндоваскулярное повреждение.
2. У людей с факторами риска выявляют нарушения механизмов защиты. Например, при диабетическом кетоацидозе низкий pH сыворотки крови является причиной высвобождения железа транспортных белков, что создает благоприятные условия для роста зигомицетов. Дефекты в механизмах фагоцитарной защиты (дефицит количества нейтрофилов или нарушение их функции), вызванные кортикостероидами или гипергликемией с ацидозом, диабетическим кетоацидозом, способствуют пролиферации зигомицетов.
3. Адгезия и повреждение эндотелиальных клеток зигомицетами приводит к ангиоинвазии гриба, сосудистому тромбозу, последующему некрозу тканей и распространению грибковой инфекции.
Повреждение и проникновение микроорганизма через эндотелиальные клетки, выстилающие стенки кровеносных сосудов, вероятно, является одним из основных моментов в патогенезе заболевания. Покоящиеся конидии R. oryzae могут проникать в субэндотелий с помощью матричных белков. Обнаружено, что конидии прикрепляются к субэндотелиальным матричным белкам значительно лучше, чем гифы микромицетов.
Обращает на себя внимание тот факт, что повреждение эндотелиальных клеток происходит и в том случае, когда конидии R. оryzae были нежизнеспособными. Точные механизмы, посредством которых погибшие зигомицеты вызывают повреждение тканей, остается неясным.
Основным патоморфологическим признаком зигомикоза является наличие обширного ангиоинвазивного процесса с повреждением сосудов, тромбозом и некрозом окружающих тканей. Это, вероятно, связано с тропностью зигомицетов к эндотелию артерий, причем вены, как правило, не поражаются.
Перечисленные гистопатологические признаки характерны для любой локализации зигомикоза. Так, при проникновении инфекции в головной мозг наблюдают очаги размягчения тканей, а по периферии - геморрагии. В гистологическом препарате лег кого выявляют массивные геморрагии с эмболами, участки обызвествления, соответствующие старым очагам поражения. При поражении желудочно-кишечного тракта определяют язвы размером от 3 до 4 см с черными некротическими участками в центре очагов.
Symptoms
Выделяют 5 основных клинических вариантов заболевания. Как правило, они связанны с локализацией первичного очага и входными воротами инфекции. Различают зигомикоз риноцеребральный (≈ 50% всех случаев), легочный (≈ 20%), кожный (≈ 10%), гастроинтестинальный (≈ 10%) и диссеминированный, а также другие, более редкие, формы заболевания.
Как правило, разные варианты развиваются у пациентов в связи с определенными факторами риска. Например, у пациентов с диабетическим кетоацидозом типично развитие риноцеребрального варианта заболевания и гораздо реже легочного или диссеминированного. Почему при кетоацидозе чаще развивается именно риноцеребральная форма зигомикоза остается неясным. Возможно, у пациентов с кетоацидозом или ацидозом другого происхождения имеет значение увеличение количества свободного железа в сыворотке крови в результате нарушения связывания его транспортными белками.
Среди пациентов, получавших дефероксамин, преобладает диссеминированный вариант течения, а значит, увеличение свободного железа в сыворотке крови не может объяснить более частое возникновение риноцеребрального варианта при кетоацидозе. Нарушения хемотаксиса и фагоцитоза в условиях гипергликемии и ацидоза тоже не может объяснить данный феномен.
У пациентов с нейтропенией чаще развивается легочный, а не риноцеребральный вариант зигомикоза.
Гораздо более очевидна связь факторов риска для кожно/подкожного варианта зигомикоза, так как развитие заболевания связано с повреждением кожного барьера под воздействием любого травмирующего фактора и последующим внедрением возбудителя из почвы, через мацерации, через непосредственный доступ (внутривенный катетер) или места инъекций.
Риноцеребральный зигомикоз остается наиболее частой формой болезни, поскольку составляет от 30 до 50% всех случаев этой инфекции. Приблизительно 70% эпизодов данного варианта зигомикоза диагностируют у больных с диабетическим кетоацидозом, более редко - у пациентов, перенесших трансплантацию костного мозга или с длительной нейтропенией. Клиника неспецифична и схожа на ранних стадиях заболевания с симптоматикой бактериального синусита или воспаления параорбитальной клетчатки. Больных беспокоят боли в глазном яблоке или лицевой части черепа, нарушение чувствительности кожи, гиперемия конъюнктивы, снижение остроты зрения и отек мягких тканей. Лихорадка отсутствует у 50% пациентов, лейкоцитоз отмечают в тех случаях, когда у больных сохранена функция костного мозга. Если инфекцию не диагностируют, процесс обычно распространяется от решетчатого лабиринта к орбите, что приводит к нарушению функции параорбитальных мышц и птозу.
При распространении инфекции формируется некроз твердого неба, прогрессируют нарушения зрения, в конечном счете, завершающиеся слепотой и/или инфарктом сетчатки, тромбозом пещеристого синуса в результате вовлечения в процесс n. oculus или поражения артериол.
Вовлечение в процесс V и VII черепно-мозговых нервов может приводить к потере сенсорной чувствительности лица, птозу. Инфекция может также распространяться через заднюю стенку орбиты или основной пазухи в ЦНС. Первым признаком проникновения инфекции через твердую мозговую оболочку в головной мозг может быть носовое кровотечение. При вовлечении в процесс ЦНС, как результат ангиоинвазивного характера инфекции, возникает тромбоз кавернозного синуса, облитерация и тромбоз внутренней сонной артерии, завершающиеся инфарктом головного мозга. Подобное поражение может вести к гематогенному распространению инфекции с формированием (или без) микотической аневризмы.
Поражение легких наиболее часто выявляют у пациентов с лейкозом, получающих химиотерапию, или у реципиентов ТСКК. У пациентов с диабетическим кетоацидозом также может развиваться легочный зигомикоз, хотя эта форма инфекции у них встречается реже и протекает зачастую подостро.
Легочный вариант развивается в результате ингаляции спор зигомицетов или распространения инфекции гематогенным и/или лимфогенным путем. Клиническая картина также неспецифична. Больные жалуются на одышку, кашель, боли в грудной клетке, лихорадку. Ангиоинвазивный процесс, как правило, завершается некрозом паренхимы легкого, который, в свою очередь, может привести к массивному кровотечению и летальному исходу, при вовлечении в процесс крупного кровеносного сосуда.
Если легочный зигомикоз не диагностируют своевременно, процесс гематогенно распространяется к другим органам. Летальность при данном варианте зигомикоза от 50-70% до 95%, если легочный зигомикоз оказывается частью диссеминированного процесса.
Как уже было упомянуто, риск развития кожного зигомикоза повышен у пациентов с повреждением кожных покровов. Обычно возбудитель проникает в организм во время травмы, когда происходит попадание в рану почвы, фрагментов растений (шипы) У больных, страдающих диабетом, и других иммунокомпрометированных пациентов, поражение кожи может развиваться в местах инъекций или фиксирования катетеров. Возможно проникновение микромицетов через дренажи, загрязненный хирургический инструментарий или через участки фиксирования эндотрахеальной трубки у пациентов, находящихся на искусственной вентиляции легких (ИВЛ).
Кожный зигомикоз протекает локально, но очень агрессивно. Процесс может распространяться в подкожную клетчатку, жировую ткань, мышцы, фасции и, даже, кости. Вторичная сосудистая инвазия может приводить к гемато генному распространению процесса и поражению внутренних органов. Кожный и подкожный зигомикоз приводят к быстрой некротизации тканей и летальному исходу пациентов приблизительно в 50% случаев. В случае своевременно выполненного хирургического вмешательства (удаление пораженных участков) и адекватной антифунгальной терапии локализованный кожный зигомикоз может протекать благоприятно.
Зигомикоз органов ЖКТ - сравнительно редкое заболевание. Оно развивается, главным образом, у новорожденных и детей 1-го года жизни при попадании зигомицетов в организм с пищей. Чаще гастроинтестинальный зигомикоз развивается в раннем неонатальном периоде как проявление диссеминированного процесса.
Некротический энтероколит, вызванный зигомицетами, был впервые описан, у новорожденных в раннем неонатальном периоде. Случаи заболевания взрослых пациентов с нейтропенией единичны. Гатроинтестинальный вариант зигомикоза был описан также у пациентов с другими иммунодефицитами, такими как СПИД и системная красная волчанка, а также у реципиентов ТСКК. Наиболее часто поражаются желудок, толстая и тонкая кишки. Случаи поражения печени были связаны с приемом загрязненных спорами лекарственных трав. Поскольку процесс возникает остро и развивается «стремительно», диагноз устанавливают, как правило, посмертно. Симптоматика в данном случае разнообразна и неспецифична. Наиболее часто больных беспокоят боли в брюшной полости, вздутие живота, тошнота, рвота, лихорадка и наличие неизмененной крови в стуле. Возможно развитие внутрибрюшинного абсцесса. Диагноз может быть установлен при помощи биопсии во время оперативного вмешательства или эндоскопии.
Были описаны случаи ятрогенного гастроинтестинального зигомикоза, возникшие в результате введения пациентам через назогастральный зонд питательных смесей, в процессе приготовления которых использовали загрязненные зигомицетами деревянные аппликаторы. У этих пациентов заболевание дебютировало желудочно-кишечным кровотечением. Диагноз был установлен на основании получения культуры из аспиратов желудочного содержимого.
Диссеминированный процесс возникает в результате гематогенного распространения возбудителя, которое возможно из любого очага первичного инфицирования. Легочный вариант зигомикоза у пациентов с нейтропенией протекает с высокой частотой диссеминации. Реже процесс может распространяться гематогенным и/или лимфогенным путем у пациентов с первичным поражением придаточных пазух носа, ЖКТ или кожи (чаще - у ожоговых больных).
Очаги при диссеминированном зигомикозе чаще локализуются в головном мозге и легочной ткани, значительно реже - в селезенке, сердце, коже и других органах. Поражение головного мозга, в результате гематогенного и/или лимфогенного распространения инфекции, отличается от церебрального зигомикоза, возникшего в результате риноцеребрального процесса. У пациентов с диссеминированной формой, при проникновении зигомицетов в ЦНС, начинает нарастать центральная неврологическая симптоматика и/или развивается кома центрального генеза. Летальность в таких случаях достигает 100%. Даже без поражения ЦНС, при диссеминированном зигомикозе летальность составляет 90%. При зигомикозе у реципиентов ТКСК общая летальность в течение 1-го года составляет 95%.
Имеют место и другие, более редкие, клинические формы зигомикоза. Возбудители зигомикоза могут вызывать инфекционный процесс фактически в любом органе. Например, возможно изолированное поражение головного мозга, эндокарда, почек; эти варианты зигомикоза встречаются, главным образом, у наркоманов. Некоторые авторы описывали случаи поражения зигомицетами костей, органов средостения, трахеи, почек, брюшины (при перитонеальном диализе). В этот же раздел включают обусловленные зигомицетами синдром верхней полой вены и отит наружного уха.
Зигомикоз обычно не характерен для больных СПИД, но периодически сообщают о возникновении этой инфекции у данной группы пациентов.
Ассоциированные симптомы: Боль в грудной клетке. Кашель. Кровохарканье. Нейтропения. Одышка. Рвота. Тошнота.
Как правило, разные варианты развиваются у пациентов в связи с определенными факторами риска. Например, у пациентов с диабетическим кетоацидозом типично развитие риноцеребрального варианта заболевания и гораздо реже легочного или диссеминированного. Почему при кетоацидозе чаще развивается именно риноцеребральная форма зигомикоза остается неясным. Возможно, у пациентов с кетоацидозом или ацидозом другого происхождения имеет значение увеличение количества свободного железа в сыворотке крови в результате нарушения связывания его транспортными белками.
Среди пациентов, получавших дефероксамин, преобладает диссеминированный вариант течения, а значит, увеличение свободного железа в сыворотке крови не может объяснить более частое возникновение риноцеребрального варианта при кетоацидозе. Нарушения хемотаксиса и фагоцитоза в условиях гипергликемии и ацидоза тоже не может объяснить данный феномен.
У пациентов с нейтропенией чаще развивается легочный, а не риноцеребральный вариант зигомикоза.
Гораздо более очевидна связь факторов риска для кожно/подкожного варианта зигомикоза, так как развитие заболевания связано с повреждением кожного барьера под воздействием любого травмирующего фактора и последующим внедрением возбудителя из почвы, через мацерации, через непосредственный доступ (внутривенный катетер) или места инъекций.
Риноцеребральный зигомикоз остается наиболее частой формой болезни, поскольку составляет от 30 до 50% всех случаев этой инфекции. Приблизительно 70% эпизодов данного варианта зигомикоза диагностируют у больных с диабетическим кетоацидозом, более редко - у пациентов, перенесших трансплантацию костного мозга или с длительной нейтропенией. Клиника неспецифична и схожа на ранних стадиях заболевания с симптоматикой бактериального синусита или воспаления параорбитальной клетчатки. Больных беспокоят боли в глазном яблоке или лицевой части черепа, нарушение чувствительности кожи, гиперемия конъюнктивы, снижение остроты зрения и отек мягких тканей. Лихорадка отсутствует у 50% пациентов, лейкоцитоз отмечают в тех случаях, когда у больных сохранена функция костного мозга. Если инфекцию не диагностируют, процесс обычно распространяется от решетчатого лабиринта к орбите, что приводит к нарушению функции параорбитальных мышц и птозу.
При распространении инфекции формируется некроз твердого неба, прогрессируют нарушения зрения, в конечном счете, завершающиеся слепотой и/или инфарктом сетчатки, тромбозом пещеристого синуса в результате вовлечения в процесс n. oculus или поражения артериол.
Вовлечение в процесс V и VII черепно-мозговых нервов может приводить к потере сенсорной чувствительности лица, птозу. Инфекция может также распространяться через заднюю стенку орбиты или основной пазухи в ЦНС. Первым признаком проникновения инфекции через твердую мозговую оболочку в головной мозг может быть носовое кровотечение. При вовлечении в процесс ЦНС, как результат ангиоинвазивного характера инфекции, возникает тромбоз кавернозного синуса, облитерация и тромбоз внутренней сонной артерии, завершающиеся инфарктом головного мозга. Подобное поражение может вести к гематогенному распространению инфекции с формированием (или без) микотической аневризмы.
Поражение легких наиболее часто выявляют у пациентов с лейкозом, получающих химиотерапию, или у реципиентов ТСКК. У пациентов с диабетическим кетоацидозом также может развиваться легочный зигомикоз, хотя эта форма инфекции у них встречается реже и протекает зачастую подостро.
Легочный вариант развивается в результате ингаляции спор зигомицетов или распространения инфекции гематогенным и/или лимфогенным путем. Клиническая картина также неспецифична. Больные жалуются на одышку, кашель, боли в грудной клетке, лихорадку. Ангиоинвазивный процесс, как правило, завершается некрозом паренхимы легкого, который, в свою очередь, может привести к массивному кровотечению и летальному исходу, при вовлечении в процесс крупного кровеносного сосуда.
Если легочный зигомикоз не диагностируют своевременно, процесс гематогенно распространяется к другим органам. Летальность при данном варианте зигомикоза от 50-70% до 95%, если легочный зигомикоз оказывается частью диссеминированного процесса.
Как уже было упомянуто, риск развития кожного зигомикоза повышен у пациентов с повреждением кожных покровов. Обычно возбудитель проникает в организм во время травмы, когда происходит попадание в рану почвы, фрагментов растений (шипы) У больных, страдающих диабетом, и других иммунокомпрометированных пациентов, поражение кожи может развиваться в местах инъекций или фиксирования катетеров. Возможно проникновение микромицетов через дренажи, загрязненный хирургический инструментарий или через участки фиксирования эндотрахеальной трубки у пациентов, находящихся на искусственной вентиляции легких (ИВЛ).
Кожный зигомикоз протекает локально, но очень агрессивно. Процесс может распространяться в подкожную клетчатку, жировую ткань, мышцы, фасции и, даже, кости. Вторичная сосудистая инвазия может приводить к гемато генному распространению процесса и поражению внутренних органов. Кожный и подкожный зигомикоз приводят к быстрой некротизации тканей и летальному исходу пациентов приблизительно в 50% случаев. В случае своевременно выполненного хирургического вмешательства (удаление пораженных участков) и адекватной антифунгальной терапии локализованный кожный зигомикоз может протекать благоприятно.
Зигомикоз органов ЖКТ - сравнительно редкое заболевание. Оно развивается, главным образом, у новорожденных и детей 1-го года жизни при попадании зигомицетов в организм с пищей. Чаще гастроинтестинальный зигомикоз развивается в раннем неонатальном периоде как проявление диссеминированного процесса.
Некротический энтероколит, вызванный зигомицетами, был впервые описан, у новорожденных в раннем неонатальном периоде. Случаи заболевания взрослых пациентов с нейтропенией единичны. Гатроинтестинальный вариант зигомикоза был описан также у пациентов с другими иммунодефицитами, такими как СПИД и системная красная волчанка, а также у реципиентов ТСКК. Наиболее часто поражаются желудок, толстая и тонкая кишки. Случаи поражения печени были связаны с приемом загрязненных спорами лекарственных трав. Поскольку процесс возникает остро и развивается «стремительно», диагноз устанавливают, как правило, посмертно. Симптоматика в данном случае разнообразна и неспецифична. Наиболее часто больных беспокоят боли в брюшной полости, вздутие живота, тошнота, рвота, лихорадка и наличие неизмененной крови в стуле. Возможно развитие внутрибрюшинного абсцесса. Диагноз может быть установлен при помощи биопсии во время оперативного вмешательства или эндоскопии.
Были описаны случаи ятрогенного гастроинтестинального зигомикоза, возникшие в результате введения пациентам через назогастральный зонд питательных смесей, в процессе приготовления которых использовали загрязненные зигомицетами деревянные аппликаторы. У этих пациентов заболевание дебютировало желудочно-кишечным кровотечением. Диагноз был установлен на основании получения культуры из аспиратов желудочного содержимого.
Диссеминированный процесс возникает в результате гематогенного распространения возбудителя, которое возможно из любого очага первичного инфицирования. Легочный вариант зигомикоза у пациентов с нейтропенией протекает с высокой частотой диссеминации. Реже процесс может распространяться гематогенным и/или лимфогенным путем у пациентов с первичным поражением придаточных пазух носа, ЖКТ или кожи (чаще - у ожоговых больных).
Очаги при диссеминированном зигомикозе чаще локализуются в головном мозге и легочной ткани, значительно реже - в селезенке, сердце, коже и других органах. Поражение головного мозга, в результате гематогенного и/или лимфогенного распространения инфекции, отличается от церебрального зигомикоза, возникшего в результате риноцеребрального процесса. У пациентов с диссеминированной формой, при проникновении зигомицетов в ЦНС, начинает нарастать центральная неврологическая симптоматика и/или развивается кома центрального генеза. Летальность в таких случаях достигает 100%. Даже без поражения ЦНС, при диссеминированном зигомикозе летальность составляет 90%. При зигомикозе у реципиентов ТКСК общая летальность в течение 1-го года составляет 95%.
Имеют место и другие, более редкие, клинические формы зигомикоза. Возбудители зигомикоза могут вызывать инфекционный процесс фактически в любом органе. Например, возможно изолированное поражение головного мозга, эндокарда, почек; эти варианты зигомикоза встречаются, главным образом, у наркоманов. Некоторые авторы описывали случаи поражения зигомицетами костей, органов средостения, трахеи, почек, брюшины (при перитонеальном диализе). В этот же раздел включают обусловленные зигомицетами синдром верхней полой вены и отит наружного уха.
Зигомикоз обычно не характерен для больных СПИД, но периодически сообщают о возникновении этой инфекции у данной группы пациентов.
Ассоциированные симптомы: Боль в грудной клетке. Кашель. Кровохарканье. Нейтропения. Одышка. Рвота. Тошнота.
Diagnostics
Зигомикоз характеризуется очень высокой летальностью, поэтому диагностика должна быть незамедлительной, однако этому препятствует неспецифичность клинических и рентгенографических признаков и очень быстрое развитие заболевания.
Прежде всего, необходимо исключить зигомикоз у больных с атипично протекающим синуситом, пневмонией или лихорадкой неясного генеза на фоне декомпенсированного сахарногодиабета, выраженной нейтропении и иммуносупрессии. Диагностика основана на выявлении возбудителя в материале из очагов поражения. На данный момент разрабатываются методики ПЦР диагностики зигомикоза.
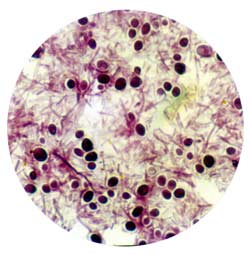
Чаще зигомицеты определяют при микроскопии исследуемых субстратов, реже - при посеве. Возбудитель очень редко выделяют в посевах крови даже при диссеминированном зигомикозе. Поэтому именно микроскопия материала из очагов поражения с окраской калькофлуором белым или специфическими методами является основным методом ранней диагностики зигомикоза. При этом выявляют характерный широкий (10-50 мкм) несептированный или редкосептированный мицелий, ветвящийся под прямым углом. Однако в связи с низкой диагностической значимостью микроскопии и посева аспирата из носа, мокроты и БАЛ, нередко необходимо повторное исследование. Следует отметить, что хранение материала в холодильнике, гомогенизация его перед посевом также могут уменьшать вероятность выделения зигомицетов в культуре.
Помимо микологических методов, важными компонентами успешной диагностики являются компьютерная томография (КТ) и магнитно-резонансная томография (МРТ), которые помогают не только выявить очаги поражения, но и определить объем хирургического вмешательства - основного лечения инвазивного зигомикоза.
Методы диагностики.
- КТ или рентгенография легких;
- МРТ или КТ, рентгенография придаточных пазух носа, при неврологической симптоматике - МРТ или КТ головного мозга;
- получение материала из очагов поражения;
- микроскопия и посев материала из очагов поражения, отделяемого из придаточных пазух, мокроты, БАЛ, биопсийного материала;
- гистологическое исследование биопсийного материала.
Критерии диагностики:
Клинические или рентгенологические (КТ, МРТ и пр.) признаки локальной инфекции в сочетании с выявлением зигомицетов при микроскопии, гистологическом исследовании и/или посеве материала из очага поражения.
Прежде всего, необходимо исключить зигомикоз у больных с атипично протекающим синуситом, пневмонией или лихорадкой неясного генеза на фоне декомпенсированного сахарногодиабета, выраженной нейтропении и иммуносупрессии. Диагностика основана на выявлении возбудителя в материале из очагов поражения. На данный момент разрабатываются методики ПЦР диагностики зигомикоза.
Чаще зигомицеты определяют при микроскопии исследуемых субстратов, реже - при посеве. Возбудитель очень редко выделяют в посевах крови даже при диссеминированном зигомикозе. Поэтому именно микроскопия материала из очагов поражения с окраской калькофлуором белым или специфическими методами является основным методом ранней диагностики зигомикоза. При этом выявляют характерный широкий (10-50 мкм) несептированный или редкосептированный мицелий, ветвящийся под прямым углом. Однако в связи с низкой диагностической значимостью микроскопии и посева аспирата из носа, мокроты и БАЛ, нередко необходимо повторное исследование. Следует отметить, что хранение материала в холодильнике, гомогенизация его перед посевом также могут уменьшать вероятность выделения зигомицетов в культуре.
Помимо микологических методов, важными компонентами успешной диагностики являются компьютерная томография (КТ) и магнитно-резонансная томография (МРТ), которые помогают не только выявить очаги поражения, но и определить объем хирургического вмешательства - основного лечения инвазивного зигомикоза.
Методы диагностики.
- КТ или рентгенография легких;
- МРТ или КТ, рентгенография придаточных пазух носа, при неврологической симптоматике - МРТ или КТ головного мозга;
- получение материала из очагов поражения;
- микроскопия и посев материала из очагов поражения, отделяемого из придаточных пазух, мокроты, БАЛ, биопсийного материала;
- гистологическое исследование биопсийного материала.
Критерии диагностики:
Клинические или рентгенологические (КТ, МРТ и пр.) признаки локальной инфекции в сочетании с выявлением зигомицетов при микроскопии, гистологическом исследовании и/или посеве материала из очага поражения.
Treatment
В тактике лечения зигомикоза необходимо учитывать четыре фактора: быстроту постановки диагноза, лечение основного заболевания (если возможно - полное исключение факторов риска), хирургическое удаление пораженных тканей и соответствующую противогрибковую терапию.
Естественно, результаты терапии существенно зависят от успешного лечения основного заболевания. Так, у пациентов с сахарным диабетом должен быть нормализован уровень сахара и pH сыворотки крови. По возможности, после постановки диагноза «зигомикоз», необходимо прекратить терапию или уменьшить назначаемые дозы дефероксамина, иммуносупрессоров, кортикостероидов. Кроме того, необходимо помнить, что данные обследования на начальных этапах развития заболевания зачастую отрицательны или имеют незначительные изменения.
Мы уже знаем, что рентгенологическая картина отстает от клинических проявлений у данной категории больных, но отрицательные результаты не нацеливают на прекращение диагностического поиска, особенно, если есть характерная симптоматика. Появление характерных изменений в тканях также может запаздывать. Слизистая оболочка в начальной стадии грибкового поражения может выглядеть здоровой и жизнеспособной при эндоскопическом обследовании. Поэтому, если подозрение в отношении зигомикоза достаточно серьезное, то для уточнения диагноза необходимо делать слепые биопсии слизистой оболочки пазух и/или утолщенных параорбитальных мышц.
Часто недооценивают скорость распространения инфекции, поскольку пациенты могут сохранять нормальный интеллект и неадекватно относиться к своему состоянию. Кроме того, нужно помнить, что противогрибковая терапия не является единственным решением проблемы, более правильно - сочетать различные методы лечения.
Зигомикоз - быстро прогрессирующая инфекция, и одной противогрибковой терапии зачастую недостаточно, чтобы контролировать инфекцию.
Возбудители зигомикоза могут быть устойчивыми к амфотерицину в (АмВ) и, даже если возбудитель чувствителен к используемому противогрибковому препарату in vitro, но может быть он не эффективен in vivo.
Кроме того, ангиоинвазия, тромбоз, некроз тканей могут быть как на местах проникновения зигомицетов в макроорганизм, так и на участках, удаленных от входных ворот инфек ции. В данных случаях необходимо, как можно раньше, взять биоптаты со всех подозрительных мест с последующими микроскопией и культуральным исследованием.
Хирургическое вмешательство необходимо при наличии массивного некроза ткани, встречающегося при зигомикозе, который не может быть предотвращен только антимикотиками. При риноцеребральном зигомикозе ранняя хирургическая обработка инфицированной пазухи и соответствующих параорбитальных областей, возможно, позволит предотвратить распространение инфекции. Для подтверждения эффективности проведенной ранее манипуляции может быть необходимым повторное исследование пазух и орбиты.
У пациентов с легочным зигомикозом сочетание хирургического лечения с антимикотическими препаратами также улучшает показатели выживаемости по сравнению с использованием только противогрибкового лечения [60-63]. Авторы одного из исследований установили в своей работе снижение летальности до 11% при сочетании методов, по сравнению с 68%, в случаях, когда пациенты получали только антимикотики.
К сожалению, для клиницистов выбор антимикотиков, используемых для лечения данной патологии, ограничен. Это связано с чрезвычайно высокой летальностью при зигомикозе, с низким процентом излеченности данного заболевания при заведомой монотерапии и с другими причинами.
До сих пор не сделан достоверный анализ эффективности различных стратегий лечения. Это побудило исследователей к проведению испытаний на животных, в которых удалось создать хорошо управляемые модели для применения различных классов антимикотиков.
До недавнего времени в схемы противогрибковой терапии зигомикоза включали только полиены, которые, к сожалению, высоко токсичны: амфотерицин В (АмВ) и его липидный комплекс, оказавшиеся достаточно эффективными в рекомендуемых дозах - от 1 до 1,5 мг/кг/сут.
В настоящее время очень мало сведений о механизмах действия препарата, не известно его молекулярное взаимодействие с резистентными микроорганизмами. Но нужно отметить, что разрабатывают серию новых методов, которые могут изменить имеющиеся на сегодняшний день результаты и вскоре стать вполне доступными.
Липидный комплекс АмВ значительно менее токсичен, чем АмВ, и может быть назначен в более высоких дозах на более длительный период времени. Однако использование высоких доз липидного комплекса АмВ сопряжено с неблагоприятной экономикой, например, для сравнения: стоимость лечения АмВ в дозе 1мг/кг/сут обходится, в среднем, US 5 в день, а АмВ липидного комплекса в терапевтических дозах от 5 до 15 мг/кг/сут колеблется между US 500 и US 3000. Оба препарата достаточно эффективны и входят теперь в стандарты лечения зигомикоза. Принято международное соглашение, согласно которому лечение зигомикоза следует начинать с высоких доз АмВ липидного комплекса.
В экспериментах на животных с диссеминированным зигомикозом (возбудитель - R. оryzae), на фоне диабетического кетоацидоза, для лечения использовали высокие дозы липосомального АмВ (LАмB) - 15 мг/кг/сут, что было эффективнее применения АмВ в дозе 1 мг/кг/сут. Результат исследования - снижение летальности почти вдвое. Далее, в поддержку LАмB как препарата выбора, можно привести результаты недавнего ретроспективного обзора 120 случаев зигомикоза у пациентов с гематологичекой патологией. В данном обзоре при лечении LАмB увеличивалась выживаемость до 67%, по сравнению с 39% случаев, когда пациентам назначали АмB (P ═0,02, χ2). Учитывая ретроспективный характер обзора, существует возможность недостоверности результатов, однако, по основным собранным ретроспективным клиническим данным, менее эффективным был АмВ, по сравнению с LАмB.
В исследованиях на животных показано, что содержание LАмB в головном мозге в 5 раз превышало концентрацию АмВ (липидного комплекса) в этих же тканях. Оказалось, что содержание липидного комплекса АмВ в головном мозге ниже уровня собственно АмВ, несмотря на то, что АмВ липидный комплекс назначали в более высоких дозах (в 5 раз). Кроме того, в экспериментах на животных с диссеминированным зигомикозом (возбудитель - R. оryzae) при применении АмВ липидного комплекса в дозах 5, 20, или 30 мг/кг/сут не улучшались показатели выживаемости (по сравнению с плацебо или АмВ).
Опубликованы отдельные сообщения о сравнительной эффективности LАмB и АмВ (липидного комплекса), но каких-либо однозначных выводов по этому поводу делать нельзя. В настоящее время при анализе экспериментальных данных испытаний на животных и ретроспективном анализе терапии зигомикоза у людей наблюдали наилучший клинический эффект при назначении высоких доз LАмB (особенно - при поражении ЦНС), что свидетельствует о необходимости его использования в качестве препарата выбора, а высоких доз АмВ липидного комплекса - как препарата резерва.
Существуют неоднозначные наблюдения относительно эффективности других антимикотиков при зигомикозе. Например, итраконазол - препарат, который in vitro эффективен против грибов из порядка Mucorales. Опубликовано сообщение об успешной монотерапии зигомикоза итраконазолом, имеются также данные, что профилактическое лечение этим препаратом может быть фактором риска возникновения данного заболевания. Кроме того, при экспериментах на животных показано, что итраконазол неэффективен в отношении Rhizopus и Mucor spp., даже в том случае, когда изолят был чувствителен in vitro; напротив, итраконазол оказался эффективен in vivo против Absidia spp. (MIC 0,03 g/ml). Таким образом, использование итраконазола можно рассматривать как альтернативную терапию в ситуациях, когда возбудители чувствительны к этому препарату.
Относительно недавно предложен вориконазол, обладающий широким спектром действия, но не эффективный in vitro против микромицетов из порядка Mucorales.
В тоже время позаконазол и равуконазол проявляют эффективность в отношении возбудителей зигомикоза. В экспериментах на животных с диссеминированным зигомикозом позаконазол был более эффективным, чем итраконазол, но менее, чем АмВ. Возрастает количество сообщений об удачном лечении позоконазолом в комбинации с АмВ у пациентов с риноцеребральным зигомикозом, возбудители которого ранее были резистентны к терапии.
Каспофунгин является первым представителем класса эхинокандинов. Он был зарегистрирован в США как препарат, имеющий минимальную активность против возбудителей зигомикоза in vitro]. Однако достоверность проведенных испытаний остается не ясной, так как в экспериментах на животных в качестве инфекционного агента использовали R. оryzae, хотя известно, что он вырабатывает фермент, инактивирующий каспофунгин. Опубликованы также данные о комбинированном применении каспофунгина (1 мг/кг/сут) с АмВ липидным комплексом (5 мг/кг/сут), в которых отмечают синергизм их действия. Данная комбинация на 50% повысила выживаемость экспериментальных животных (по сравнению с монотерапией только каспофунгином или АмВ липидным комплексом).
Клинический опыт применения каспофунгина для лечения зигомикоза еще скуден. В литературе имеются данные лишь одного из крупных клинических наблюдений пациентов с зигомикозом, получавших каспофунгин в качестве монотерапии или в сочетании с вориконазолом.
Появление другого препарата из группы эхинокандинов - микафунгина обнадеживает специалистов в перспективах лечения. Микафунгин проходит клинические испытания во многих странах, и существуют сообщения о положительном опыте его применения. Эхинокандины могут играть роль препаратов резерва для лечения зигомикоза, особенно - в комбинации с полиенами.
Важная роль метаболизма железа в патогенезе зигомикоза служит предпосылкой к возможности использования железосвязывающих препаратов в унисон с противогрибковой терапией. Описаны экспериментальные данные воздействия подобных лекарственных средств in vitro на R. oryzae. В отличие от дефероксамина, они предотвращают использование железа микроорганизмом для своего роста. Более того, в то время как дефероксамин значительно ухудшал течение диссеминированного зигомикоза, вызванного R. oryzae, один из упомянутых препаратов, более чем в два раза увеличивал показатель выживаемости. Предлагают использование гипербарической оксигенации в дополнение к стандарту лечения данной патологии, особенно - для пациентов с риноцеребральной и кожной формами зигомикоза. Вероятно, более высокое давление кислорода улучшает киллерную способность нейтрофилов; к тому же, высокое давление кислорода затрудняет прорастание спор и рост мицелия in vitro. Улучшает ли гипербарическая оксигенация фактически результат терапии пациентов с зигомикозом, будет возможно установить посредством проведения соответствующих клинических испытаний.
Некоторые авторы считают необходимым включить в стандарт терапии зигомикоза цитокины, обосновывая это тем, что они увеличивают киллерную способность фагоцитов в отношении зигомицетов in vitro. В недавней публикации описан хороший эффект лечения риноцеребральной формы зигомикоза у ребенка с лейкемией после присоединения к стандартной терапии γ-интерферона и колониестимулирующего фактора.
Естественно, результаты терапии существенно зависят от успешного лечения основного заболевания. Так, у пациентов с сахарным диабетом должен быть нормализован уровень сахара и pH сыворотки крови. По возможности, после постановки диагноза «зигомикоз», необходимо прекратить терапию или уменьшить назначаемые дозы дефероксамина, иммуносупрессоров, кортикостероидов. Кроме того, необходимо помнить, что данные обследования на начальных этапах развития заболевания зачастую отрицательны или имеют незначительные изменения.
Мы уже знаем, что рентгенологическая картина отстает от клинических проявлений у данной категории больных, но отрицательные результаты не нацеливают на прекращение диагностического поиска, особенно, если есть характерная симптоматика. Появление характерных изменений в тканях также может запаздывать. Слизистая оболочка в начальной стадии грибкового поражения может выглядеть здоровой и жизнеспособной при эндоскопическом обследовании. Поэтому, если подозрение в отношении зигомикоза достаточно серьезное, то для уточнения диагноза необходимо делать слепые биопсии слизистой оболочки пазух и/или утолщенных параорбитальных мышц.
Часто недооценивают скорость распространения инфекции, поскольку пациенты могут сохранять нормальный интеллект и неадекватно относиться к своему состоянию. Кроме того, нужно помнить, что противогрибковая терапия не является единственным решением проблемы, более правильно - сочетать различные методы лечения.
Зигомикоз - быстро прогрессирующая инфекция, и одной противогрибковой терапии зачастую недостаточно, чтобы контролировать инфекцию.
Возбудители зигомикоза могут быть устойчивыми к амфотерицину в (АмВ) и, даже если возбудитель чувствителен к используемому противогрибковому препарату in vitro, но может быть он не эффективен in vivo.
Кроме того, ангиоинвазия, тромбоз, некроз тканей могут быть как на местах проникновения зигомицетов в макроорганизм, так и на участках, удаленных от входных ворот инфек ции. В данных случаях необходимо, как можно раньше, взять биоптаты со всех подозрительных мест с последующими микроскопией и культуральным исследованием.
Хирургическое вмешательство необходимо при наличии массивного некроза ткани, встречающегося при зигомикозе, который не может быть предотвращен только антимикотиками. При риноцеребральном зигомикозе ранняя хирургическая обработка инфицированной пазухи и соответствующих параорбитальных областей, возможно, позволит предотвратить распространение инфекции. Для подтверждения эффективности проведенной ранее манипуляции может быть необходимым повторное исследование пазух и орбиты.
У пациентов с легочным зигомикозом сочетание хирургического лечения с антимикотическими препаратами также улучшает показатели выживаемости по сравнению с использованием только противогрибкового лечения [60-63]. Авторы одного из исследований установили в своей работе снижение летальности до 11% при сочетании методов, по сравнению с 68%, в случаях, когда пациенты получали только антимикотики.
К сожалению, для клиницистов выбор антимикотиков, используемых для лечения данной патологии, ограничен. Это связано с чрезвычайно высокой летальностью при зигомикозе, с низким процентом излеченности данного заболевания при заведомой монотерапии и с другими причинами.
До сих пор не сделан достоверный анализ эффективности различных стратегий лечения. Это побудило исследователей к проведению испытаний на животных, в которых удалось создать хорошо управляемые модели для применения различных классов антимикотиков.
До недавнего времени в схемы противогрибковой терапии зигомикоза включали только полиены, которые, к сожалению, высоко токсичны: амфотерицин В (АмВ) и его липидный комплекс, оказавшиеся достаточно эффективными в рекомендуемых дозах - от 1 до 1,5 мг/кг/сут.
В настоящее время очень мало сведений о механизмах действия препарата, не известно его молекулярное взаимодействие с резистентными микроорганизмами. Но нужно отметить, что разрабатывают серию новых методов, которые могут изменить имеющиеся на сегодняшний день результаты и вскоре стать вполне доступными.
Липидный комплекс АмВ значительно менее токсичен, чем АмВ, и может быть назначен в более высоких дозах на более длительный период времени. Однако использование высоких доз липидного комплекса АмВ сопряжено с неблагоприятной экономикой, например, для сравнения: стоимость лечения АмВ в дозе 1мг/кг/сут обходится, в среднем, US 5 в день, а АмВ липидного комплекса в терапевтических дозах от 5 до 15 мг/кг/сут колеблется между US 500 и US 3000. Оба препарата достаточно эффективны и входят теперь в стандарты лечения зигомикоза. Принято международное соглашение, согласно которому лечение зигомикоза следует начинать с высоких доз АмВ липидного комплекса.
В экспериментах на животных с диссеминированным зигомикозом (возбудитель - R. оryzae), на фоне диабетического кетоацидоза, для лечения использовали высокие дозы липосомального АмВ (LАмB) - 15 мг/кг/сут, что было эффективнее применения АмВ в дозе 1 мг/кг/сут. Результат исследования - снижение летальности почти вдвое. Далее, в поддержку LАмB как препарата выбора, можно привести результаты недавнего ретроспективного обзора 120 случаев зигомикоза у пациентов с гематологичекой патологией. В данном обзоре при лечении LАмB увеличивалась выживаемость до 67%, по сравнению с 39% случаев, когда пациентам назначали АмB (P ═0,02, χ2). Учитывая ретроспективный характер обзора, существует возможность недостоверности результатов, однако, по основным собранным ретроспективным клиническим данным, менее эффективным был АмВ, по сравнению с LАмB.
В исследованиях на животных показано, что содержание LАмB в головном мозге в 5 раз превышало концентрацию АмВ (липидного комплекса) в этих же тканях. Оказалось, что содержание липидного комплекса АмВ в головном мозге ниже уровня собственно АмВ, несмотря на то, что АмВ липидный комплекс назначали в более высоких дозах (в 5 раз). Кроме того, в экспериментах на животных с диссеминированным зигомикозом (возбудитель - R. оryzae) при применении АмВ липидного комплекса в дозах 5, 20, или 30 мг/кг/сут не улучшались показатели выживаемости (по сравнению с плацебо или АмВ).
Опубликованы отдельные сообщения о сравнительной эффективности LАмB и АмВ (липидного комплекса), но каких-либо однозначных выводов по этому поводу делать нельзя. В настоящее время при анализе экспериментальных данных испытаний на животных и ретроспективном анализе терапии зигомикоза у людей наблюдали наилучший клинический эффект при назначении высоких доз LАмB (особенно - при поражении ЦНС), что свидетельствует о необходимости его использования в качестве препарата выбора, а высоких доз АмВ липидного комплекса - как препарата резерва.
Существуют неоднозначные наблюдения относительно эффективности других антимикотиков при зигомикозе. Например, итраконазол - препарат, который in vitro эффективен против грибов из порядка Mucorales. Опубликовано сообщение об успешной монотерапии зигомикоза итраконазолом, имеются также данные, что профилактическое лечение этим препаратом может быть фактором риска возникновения данного заболевания. Кроме того, при экспериментах на животных показано, что итраконазол неэффективен в отношении Rhizopus и Mucor spp., даже в том случае, когда изолят был чувствителен in vitro; напротив, итраконазол оказался эффективен in vivo против Absidia spp. (MIC 0,03 g/ml). Таким образом, использование итраконазола можно рассматривать как альтернативную терапию в ситуациях, когда возбудители чувствительны к этому препарату.
Относительно недавно предложен вориконазол, обладающий широким спектром действия, но не эффективный in vitro против микромицетов из порядка Mucorales.
В тоже время позаконазол и равуконазол проявляют эффективность в отношении возбудителей зигомикоза. В экспериментах на животных с диссеминированным зигомикозом позаконазол был более эффективным, чем итраконазол, но менее, чем АмВ. Возрастает количество сообщений об удачном лечении позоконазолом в комбинации с АмВ у пациентов с риноцеребральным зигомикозом, возбудители которого ранее были резистентны к терапии.
Каспофунгин является первым представителем класса эхинокандинов. Он был зарегистрирован в США как препарат, имеющий минимальную активность против возбудителей зигомикоза in vitro]. Однако достоверность проведенных испытаний остается не ясной, так как в экспериментах на животных в качестве инфекционного агента использовали R. оryzae, хотя известно, что он вырабатывает фермент, инактивирующий каспофунгин. Опубликованы также данные о комбинированном применении каспофунгина (1 мг/кг/сут) с АмВ липидным комплексом (5 мг/кг/сут), в которых отмечают синергизм их действия. Данная комбинация на 50% повысила выживаемость экспериментальных животных (по сравнению с монотерапией только каспофунгином или АмВ липидным комплексом).
Клинический опыт применения каспофунгина для лечения зигомикоза еще скуден. В литературе имеются данные лишь одного из крупных клинических наблюдений пациентов с зигомикозом, получавших каспофунгин в качестве монотерапии или в сочетании с вориконазолом.
Появление другого препарата из группы эхинокандинов - микафунгина обнадеживает специалистов в перспективах лечения. Микафунгин проходит клинические испытания во многих странах, и существуют сообщения о положительном опыте его применения. Эхинокандины могут играть роль препаратов резерва для лечения зигомикоза, особенно - в комбинации с полиенами.
Важная роль метаболизма железа в патогенезе зигомикоза служит предпосылкой к возможности использования железосвязывающих препаратов в унисон с противогрибковой терапией. Описаны экспериментальные данные воздействия подобных лекарственных средств in vitro на R. oryzae. В отличие от дефероксамина, они предотвращают использование железа микроорганизмом для своего роста. Более того, в то время как дефероксамин значительно ухудшал течение диссеминированного зигомикоза, вызванного R. oryzae, один из упомянутых препаратов, более чем в два раза увеличивал показатель выживаемости. Предлагают использование гипербарической оксигенации в дополнение к стандарту лечения данной патологии, особенно - для пациентов с риноцеребральной и кожной формами зигомикоза. Вероятно, более высокое давление кислорода улучшает киллерную способность нейтрофилов; к тому же, высокое давление кислорода затрудняет прорастание спор и рост мицелия in vitro. Улучшает ли гипербарическая оксигенация фактически результат терапии пациентов с зигомикозом, будет возможно установить посредством проведения соответствующих клинических испытаний.
Некоторые авторы считают необходимым включить в стандарт терапии зигомикоза цитокины, обосновывая это тем, что они увеличивают киллерную способность фагоцитов в отношении зигомицетов in vitro. В недавней публикации описан хороший эффект лечения риноцеребральной формы зигомикоза у ребенка с лейкемией после присоединения к стандартной терапии γ-интерферона и колониестимулирующего фактора.
Forecast
Ранее, диагноз «зигомикоз» всегда означал летальный исход для пациента. Хотя летальность при данной патологии остается высокой, на данном этапе возможно полное выздоровление при ранней диагностике заболевания и назначении соответствующей антимикотической терапии в совокупности с хирургическим вмешательством. Общая выживаемость при различных формах зигомикоза составляет приблизительно 50%, хотя эта цифра может вырастать до 85% в зависимости от клинического варианта, быстроты диагностики и адекватности терапии. Известно, что риноцеребральный зигомикоз имеет более высокие показатели выживаемости, чем легочный и диссеминированный, потому что его, как правило, диагностируют раньше. При легочном зигомикозе летальность составляет 65%, так как данный вариант труднее диагностировать, и разви вается он чаще у пациентов с серьезной нейтропенией. В одном крупном исследовании показано, что только 44% случаев зигомикоза легких диагностировали при жизни пациентов, процент выживаемости среди них составлял около 20%. В другом исследовании, где 93% случаев заболевания были диагностированы при жизни больных, выживаемость составила 73%. Летальность среди пациентов с диссеминированным зигомикозом приближается к 100%.