Pharmacological Group
Latin name
Ritonavirum ( Ritonavii).
Chemical name
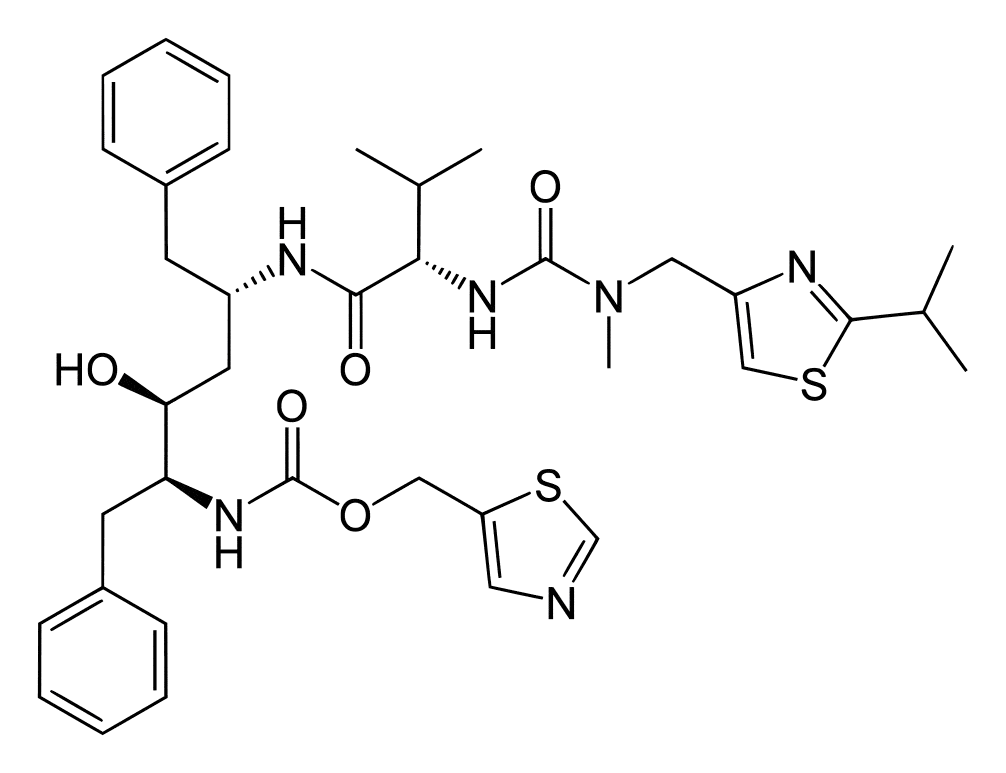
[5S-(5R*,8R*,10R*,11R*)]-10-Гидрокси-2-метил-5-(1-метилэтил)-1-[2-(метилэтил)-4-тиазолил]-3,6-диоксо-8,11-бис(фенилметил)-2,4,7,12-тетраазатридекан-13-тиазолилметил-5-карбоксилат.
Used in the treatment
CAS Code
155213-67-5.
Pharmacological action
Противовирусное, ингибирующее протеазу ВИЧ.
Characteristics of the substance
Порошок от белого до рыжевато-коричневого цвета, с горьким металлическим привкусом. Легко растворим в этаноле и метаноле, растворим в изопропаноле и практически нерастворим в воде. Молекулярная масса 720,95 Да.
Pharmacodynamics
Механизм действия.
Ритонавир является пептидомиметическим ингибитором протеазы ВИЧ-1. Ингибирование протеазы ВИЧ подавляет ее способность модифицировать полипротеиновый предшественник Gag-Pol, что приводит к образованию неинфекционных незрелых частиц ВИЧ.
Микробиология.
Противовирусная активность в культуре клеток.
Активность ритонавира оценивали в остроинфицированных лимфобластоидных клеточных линиях и в лимфоцитах периферической крови. 50IC50 вирусной репликации варьировала от 3,8 до 153 нМ в зависимости от изолята ВИЧ-1 и используемых клеток. Среднее значение 50IC50 для клинических изолятов с низким пассажем составило 22 нМ (n=13). В клетках MT4 ритонавир продемонстрировал аддитивный эффект против ВИЧ-1 в комбинации с диданозином или зидовудином. Исследования по измерению цитотоксичности ритонавира на нескольких клеточных линиях показали, что для подавления роста клеток на 50% требуется более 20 мкМ, что приводит к терапевтическому индексу клеточной культуры не менее 1000.
Резистентность.
В культуре клеток были отобраны изоляты ВИЧ-1 с пониженной чувствительностью к ритонавиру. Генотипический анализ этих изолятов показал мутации в гене протеазы ВИЧ-1, приводящие к аминокислотным заменам I84V, V82F, A71V и M46I. Фенотипические (n=18) и генотипические (n=48) изменения в изолятах ВИЧ-1 от выбранных пациентов, получавших ритонавир, отслеживались в исследованиях I/II фазы в течение периода от 3 до 32 нед. Замены, связанные с вирусной протеазой ВИЧ-1 в изолятах, полученных от 43 пациентов, происходили ступенчато и упорядоченно в позициях V82A/F/T/S, I54V, A71V/T и I36L, за которыми следовали комбинации замен в дополнительных 5 специфических аминокислотных позициях (M46I/L, K20R, I84V, L33F и L90M). Из 18 пациентов, у которых был проведен фенотипический и генотипический анализ свободного вируса, выделенного из плазмы крови, 12 показали пониженную восприимчивость к ритонавиру в культуре клеток. Все 18 пациентов имели одну или несколько замен в гене вирусной протеазы. Замена V82A/F оказалась необходимой, но недостаточной для фенотипической резистентности. Фенотипическая резистентность определялась как 5-кратное или более снижение чувствительности вируса в культуре клеток по сравнению с исходным уровнем.
Перекрестная резистентность к другим антиретровирусным ЛС.
Среди ингибиторов протеазы отмечена переменная перекрестная резистентность. Серийные изоляты ВИЧ-1, полученные от шести пациентов во время терапии ритонавиром, показали снижение чувствительности к ритонавиру в культуре клеток, но не продемонстрировали одновременного снижения восприимчивости к саквинавиру в культуре клеток по сравнению с соответствующими исходными изолятами. Однако изоляты от двух из этих пациентов продемонстрировали снижение восприимчивости к индинавиру в культуре клеток (в 8 раз). Изоляты от 5 пациентов также были протестированы на перекрестную резистентность к ампренавиру и нелфинавиру; изоляты от 3 пациентов имели снижение восприимчивости к нелфинавиру (от 6 до 14 раз), и ни один из них - к ампренавиру.
Перекрестная резистентность между ритонавиром и ингибиторами обратной транскриптазы маловероятна из-за различных мишеней ферментов. Один изолят ВИЧ-1, устойчивый к зидовудину, протестированный в культуре клеток, сохранил полную восприимчивость к ритонавиру.
Фармакодинамика.
Электрофизиология сердца.
Интервал QTcF был оценен в рандомизированном, плацебо-контролируемом и с активным контролем (моксифлоксацин 400 мг 1 раз в день) перекрестном исследовании с участием 45 здоровых взрослых, с 10 измерениями в течение 12 ч в день. Максимальная средняя (95% ДИ) разница в значениях QTcF по сравнению с плацебо после коррекции от исходного уровня составила 5,5 (7,6) мс при дозе ритонавира 400 мг 2 раза в день. Экспозиция ритонавира на 3-й день его введения в дозе 400 мг 2 раза в день была приблизительно в 1,5 раза выше, чем таковая в равновесном состоянии при приеме ритонавира в дозе 600 мг 2 раза в день.
В том же исследовании на 3-й день наблюдалось удлинение интервала PR у пациентов, принимавших ритонавир. Максимальная (95% ДИ) разница с плацебо в величине интервала PR после коррекции исходного уровня составила 22 (25) мс при дозе ритонавира 400 мг 2 раза в день ( см «Меры предосторожности»).
Ритонавир является пептидомиметическим ингибитором протеазы ВИЧ-1. Ингибирование протеазы ВИЧ подавляет ее способность модифицировать полипротеиновый предшественник Gag-Pol, что приводит к образованию неинфекционных незрелых частиц ВИЧ.
Микробиология.
Противовирусная активность в культуре клеток.
Активность ритонавира оценивали в остроинфицированных лимфобластоидных клеточных линиях и в лимфоцитах периферической крови. 50IC50 вирусной репликации варьировала от 3,8 до 153 нМ в зависимости от изолята ВИЧ-1 и используемых клеток. Среднее значение 50IC50 для клинических изолятов с низким пассажем составило 22 нМ (n=13). В клетках MT4 ритонавир продемонстрировал аддитивный эффект против ВИЧ-1 в комбинации с диданозином или зидовудином. Исследования по измерению цитотоксичности ритонавира на нескольких клеточных линиях показали, что для подавления роста клеток на 50% требуется более 20 мкМ, что приводит к терапевтическому индексу клеточной культуры не менее 1000.
Резистентность.
В культуре клеток были отобраны изоляты ВИЧ-1 с пониженной чувствительностью к ритонавиру. Генотипический анализ этих изолятов показал мутации в гене протеазы ВИЧ-1, приводящие к аминокислотным заменам I84V, V82F, A71V и M46I. Фенотипические (n=18) и генотипические (n=48) изменения в изолятах ВИЧ-1 от выбранных пациентов, получавших ритонавир, отслеживались в исследованиях I/II фазы в течение периода от 3 до 32 нед. Замены, связанные с вирусной протеазой ВИЧ-1 в изолятах, полученных от 43 пациентов, происходили ступенчато и упорядоченно в позициях V82A/F/T/S, I54V, A71V/T и I36L, за которыми следовали комбинации замен в дополнительных 5 специфических аминокислотных позициях (M46I/L, K20R, I84V, L33F и L90M). Из 18 пациентов, у которых был проведен фенотипический и генотипический анализ свободного вируса, выделенного из плазмы крови, 12 показали пониженную восприимчивость к ритонавиру в культуре клеток. Все 18 пациентов имели одну или несколько замен в гене вирусной протеазы. Замена V82A/F оказалась необходимой, но недостаточной для фенотипической резистентности. Фенотипическая резистентность определялась как 5-кратное или более снижение чувствительности вируса в культуре клеток по сравнению с исходным уровнем.
Перекрестная резистентность к другим антиретровирусным ЛС.
Среди ингибиторов протеазы отмечена переменная перекрестная резистентность. Серийные изоляты ВИЧ-1, полученные от шести пациентов во время терапии ритонавиром, показали снижение чувствительности к ритонавиру в культуре клеток, но не продемонстрировали одновременного снижения восприимчивости к саквинавиру в культуре клеток по сравнению с соответствующими исходными изолятами. Однако изоляты от двух из этих пациентов продемонстрировали снижение восприимчивости к индинавиру в культуре клеток (в 8 раз). Изоляты от 5 пациентов также были протестированы на перекрестную резистентность к ампренавиру и нелфинавиру; изоляты от 3 пациентов имели снижение восприимчивости к нелфинавиру (от 6 до 14 раз), и ни один из них - к ампренавиру.
Перекрестная резистентность между ритонавиром и ингибиторами обратной транскриптазы маловероятна из-за различных мишеней ферментов. Один изолят ВИЧ-1, устойчивый к зидовудину, протестированный в культуре клеток, сохранил полную восприимчивость к ритонавиру.
Фармакодинамика.
Электрофизиология сердца.
Интервал QTcF был оценен в рандомизированном, плацебо-контролируемом и с активным контролем (моксифлоксацин 400 мг 1 раз в день) перекрестном исследовании с участием 45 здоровых взрослых, с 10 измерениями в течение 12 ч в день. Максимальная средняя (95% ДИ) разница в значениях QTcF по сравнению с плацебо после коррекции от исходного уровня составила 5,5 (7,6) мс при дозе ритонавира 400 мг 2 раза в день. Экспозиция ритонавира на 3-й день его введения в дозе 400 мг 2 раза в день была приблизительно в 1,5 раза выше, чем таковая в равновесном состоянии при приеме ритонавира в дозе 600 мг 2 раза в день.
В том же исследовании на 3-й день наблюдалось удлинение интервала PR у пациентов, принимавших ритонавир. Максимальная (95% ДИ) разница с плацебо в величине интервала PR после коррекции исходного уровня составила 22 (25) мс при дозе ритонавира 400 мг 2 раза в день ( см «Меры предосторожности»).
Pharmacokinetics
Фармакокинетика ритонавира изучалась у здоровых добровольцев и ВИЧ-инфицированных пациентов (CD4 больше или равно 50 клеток на 1 мкл). Фармакокинетические характеристики ритонавира приведены в таблице 1.
Абсорбция.
Абсолютная биодоступность ритонавира не была определена. После применения в дозе 600 мг в виде раствора для приема внутрь Сmax ритонавира достигалась примерно через 2 и 4 ч соответственно после приема натощак и вместе с пищей (514 ккал; 9% жира, 12% белка и 79% углеводов).
Таблетки и капсулы ритонавира не являются биоэквивалентными. При умеренном потреблении жиров (857 ккал; 31% жиров, 13% белков, 56% углеводов), когда разовую дозу ритонавира 100 мг принимали в виде таблеток, по сравнению с капсулами, AUC0-∞ соответствовала критериям эквивалентности, но maxCmax была выше на 26% (92,8% ДИ: ↑15-↑39%).
Нет сравнительной информации о применении ритонавира в виде таблеток и капсул натощак.
После приема одной дозы ритонавира 100 мг в виде порошка для перорального применения с пищей (617 ккал, 29% калорий из жиров) наблюдалась биодоступность, сопоставимая с применением раствора для приема внутрь.
Влияние пищи на всасывание. Биодоступность ритонавира при приеме с пищей снижается по сравнению с приемом натощак.
После приема ритонавира в виде таблеток в дозе 100 мг вместе с умеренно жирной (857 Ккал, 30% калорий из жира) или жирной (917 ккал, 60% калорий из жира) пищей его maxCmax и AUCinf снижались на 21-23% по сравнению с премом натощак.
После перорального приема ритонавира в виде раствора в дозе 600 мг вместе с пищей (514 ккал, 10% жиров) его maxCmax и AUCinf снизились на 23 и 7% по сравнению с приемом натощак.
После перорального приема ритонавира в виде порошка в дозе 100 мг вместе с умеренно жирной (617 ккал, 29% калорий из жиров) или жирной (917 ккал, 60% калорий из жиров) пищей его maxCmax и AUCinf ритонавира снижались на 23-49% по сравнению с приемом натощак.
Метаболизм.
Почти вся радиоактивность плазмы крови после однократного приема раствора 14C-ритонавира (n=5) в дозе 600 мг была отнесена к неизмененному ритонавиру. Пять метаболитов ритонавира были идентифицированы в моче и кале человека. Окисленный метаболит изопропилтиазол (M2) является основным и обладает противовирусной активностью, аналогичной активности исходного вещества, однако концентрация его в плазме крови низкая. Исследования in vitro >in vitro с использованием микросом печени человека показали, что основной изоформой, участвующей в метаболизме ритонавира является сYP3A, хотя сYP2D6 также участвует в образовании М2.
Элиминация.
В исследовании с участием пяти субъектов, принимавших раствор 14C-ритонавира в дозе 600 мг, (11,3±2,8)% дозы выведилось с мочой, при этом (3,5±1,8)% дозы - в виде неизмененного исходного вещества. В этом исследовании (86,4±2,9)% дозы было выведено с калом, причем (33,8±10,8)% дозы - в виде неизмененного исходного вещества. При многократном приеме накопление ритонавира меньше, чем при однократном, возможно, из-за увеличения клиренса в зависимости от времени и дозы.
Таблица 1.
Фармакокинетические параметры ритонавира.
1 Разовая доза ритонавира 600 мг.
2 Пациенты принимали ритонавир в дозе 600 мг каждые 12.
3 Преимущественно связывается с альбумином сыворотки крови человека и альфа1-кислым гликопротеином в диапазоне концентраций ритонавира от 0,01 до 30 мкг/мл.
Особые группы пациентов.
Пол, расы и возраста. У взрослых пациентов (от 18 до 63 лет) возрастных фармакокинетических различий не наблюдалось. Фармакокинетика ритонавира у пожилых пациентов не изучалась.
Исследование фармакокинетики ритонавира у здоровых мужчин и женщин не выявило статистически значимых различий в фармакокинетике ритонавира. Фармакокинетические различия, связанные с расовой принадлежностью, не были выявлены.
Дети. Фармакокинетика в равновесном состояния оценивалась у 37 ВИЧ-инфицированных пациентов от 2 до 14 лет, получавших ритонавир в дозах от 250 до 400 мг/м2 2 раза в день в исследовании PACTG 310, и у 41 ВИЧ-инфицированного пациента от 1 мес до 2 лет при приеме доз 350 и 450 мг/м2 2 раза в день в исследовании PACTG 345. В равновесном состоянии при пероральном введении ритонавира его клиренс (CL/F/m2) был примерно в 1,5-1,7 раза выше у педиатрических пациентов, чем у взрослых. Концентрации ритонавира в крови, определенные после его приема в дозе 350-400 мг/м2 2 раза в день у педиатрических пациентов старше 2 лет, были сопоставимы с концентрациями, полученными у взрослых, принимавших 600 мг (приблизительно 330 мг/м2) 2 раза в день. В отношении концентраций ритонавира после приема 350 или 450 мг/м2 2 раза в день у детей младше 2 лет наблюдались следующие результаты. Более высокая экспозиция ритонавира при приеме в дозе 450 мг/м2 2 раза в день по сравнению с дозой 350 мг/м2 2 раза в день не наблюдалась. Концентрации ритонавира были несколько ниже, чем у взрослых, получавших 600 мг 2 раза в день. AUC и концентрация ритонавира после приема 350 или 450 мг/м2 2 раза в день у детей младше 2 лет были примерно на 16 и 60% ниже соответственно, чем у взрослых, принимавших 600 мг 2 раза в день.
Почечная недостаточность. Фармакокинетика ритонавира не изучалась у пациентов с нарушением функции почек, однако, поскольку почечный клиренс незначителен, снижения общего клиренса у пациентов с нарушением функции почек не ожидается.
Печеночная недостаточность. Нормализованные по дозе ssCss ритонавира у лиц с легкой печеночной недостаточностью (400 мг 2 раза в день, n=6) были аналогичны таковым в контрольной группе, получавшей дозу 500 мг 2 раза в день. Нормализованная по дозе экспозиция ритонавира в равновесном состоянии у людей с умеренной печеночной недостаточностью (400 мг 2 раза в день, n=6) была примерно на 40% ниже, чем у людей с нормальной функцией печени (500 мг 2 раза в день, n=6). Статистически значимого влияния на связывание ритонавира с белками плазмы крови при легком или умеренном нарушении функции печени не наблюдалось. Не рекомендуется корректировать дозу у пациентов с легкой или умеренной печеночной недостаточностью. Однако следует учитывать возможность снижения концентрации ритонавира у пациентов с умеренной печеночной недостаточностью и тщательно следить за реакцией пациента. Ритонавир не изучался у пациентов с тяжелой печеночной недостаточностью.
Беременность. На основании анализа опубликованных данных, действие ритонавира во время беременности снижается по сравнению с послеродовым периодом.
ФКВ ( см также «Противопоказания», «Взаимдействие» и «Меры предосторожности»).
В таблицах 2 и 3 приведены данные о влиянии совместного применения ритонавира и различных ЛС на AUC и maxCmax (95% ДИ). Информация о клинических рекомендациях содержится в разделе «Взаимодействие».
Таблица 2.
Фармакокинетические параметры ритонавира при совместном применении других ЛС.
1 Исследование с параллельными группами - субъекты, получавшие комбинированные и контрольные схемы лечения соответственно.
Таблица 3.
Фармакокинетические параметры ЛС, совместно принимаемых с ритонавиром.
1 Для контрольной группы: n=14 для maxCmax и AUC0-inf, и для контрольной группы: n=13 для maxCmax и n=4 для AUC0-inf.
2 Значительное увеличение экспозиции флутиказона пропионата в плазме привело к значительному снижению (86%) AUC кортизола в плазме.
3 Ритонавир и индинавир принимались совместно в течение 15 дней; дозы 14-го дня принимались после завтрака с 15% жира (757 ккал) и вечернего ужина с 9% жира (236 ккал), а дозы 15-го дня - после завтрака с 15% жира (757 ккал) и ужина с 32% жира (815 ккал). сmin индинавира также была увеличена в 4 раза. Эффекты оценивались по сравнению с режимом приема индинавира 800 мг каждые 8 ч в условиях голодания.
4 Эффекты оценивались в сравнении с разовой дозой метадона 20 мг.
5 90% ДИ представлен для ривароксабана.
6 Параллельный групповой дизайн; записи - субъекты, получавшие комбинированные и контрольные схемы соответственно.
7 90% ДИ представлен для симепревира (изменение экспозиции представлено в виде процентного увеличения).
8 Сульфаметоксазол и триметоприм принимали в виде одной комбинированной таблетки.
9 90% ДИ представлены для соотношений AUC и maxCmax R- и S-варфарина.
Канцерогенность, мутагенность, влияние на фертильность.
Исследования канцерогенности ритонавира проводились на мышах и крысах. У самцов мышей при дозах 50, 100 или 200 мг/кг/сут наблюдалось дозозависимое увеличение частоты возникновения как аденом, так и комбинированных аденом и карцином в печени. На основании измерений AUC, экспозиция при высокой дозе была приблизительно в 0,3 раза выше для самцов, чем экспозиция у людей при рекомендуемой терапевтической дозе (600 мг 2 раза в день). Канцерогенных эффектов у самок животных в испытанных дозах не наблюдалось. При высокой дозе воздействие на самок было примерно в 0,6 раза выше, чем на людей. У крыс, получавших дозу 7, 15 или 30 мг/кг/сут, канцерогенных эффектов не наблюдалось. В этом исследовании воздействие при высокой дозе составило приблизительно 6% от воздействия на человека при рекомендуемой терапевтической дозе. Исходя из экспозиции, достигнутой в исследованиях на животных, значимость наблюдаемых эффектов неизвестна.
Ритонавир был признан отрицательным в отношении мутагенной или кластогенной активности в ряде анализов in vitro >in vitro и in vivo >in vivo, включая бактериальный анализ обратной мутации Эймса с использованием S.typhimurium и E.coli, анализ лимфомы мыши, микроядерный тест на мышах и анализ хромосомных аберраций в лимфоцитах человека.
Ритонавир не оказывал влияния на фертильность крыс при дозах, составляющих примерно 40% (самцы) и 60% (самки) от терапевтической. Более высокие дозы были нецелесообразны из-за печеночной токсичности.
Клинические исследования.
Активность ритонавира в качестве монотерапии или в комбинации с НИОТ была оценена у 1446 пациентов, включенных в два двойных слепых рандомизированных исследования.
Пациенты с предшествующей антиретровирусной терапией.
Исследование 247 представляло собой рандомизированное двойное слепое исследование (с открытым наблюдением), проведенное с участием ВИЧ-инфицированных пациентов с предшествующей антиретровирусной терапией не менее девяти месяцев и исходным количеством клеток сD4 менее или равным 100 клеток на 1 мкл. Ритонавир в дозе 600 мг 2 раза в день или плацебо добавлялись к базовой схеме антиретровирусной терапии каждого пациента, которая могла включать до двух одобренных антиретровирусных препаратов. В исследовании приняли участие 1090 пациентов, исходное количество клеток сD4 на момент начала исследования составляло 32 клетки на 1 мкл. После того как была продемонстрирована клиническая польза терапии ритонавиром, все пациенты имели право перейти на открытое применение ритонавира на весь период наблюдения. Медиана продолжительности двойной слепой терапии ритонавиром и плацебо составила 6 мес. Медиана продолжительности наблюдения до окончания фазы открытого наблюдения составила 13,5 мес для пациентов, рандомизированных в группу ритонавира, и 14 мес для пациентов, рандомизированных в группу плацебо.
Кумулятивная частота клинического прогрессирования заболевания или смерти во время двойной слепой фазы исследования 247 составила 26% для пациентов, первоначально рандомизированных в группу ритонавира, по сравнению с 42% для пациентов, первоначально рандомизированных в группу плацебо. Эта разница в показателях была статистически значимой.
Кумулятивная смертность до конца фазы наблюдения с открытым названием принимаемой таблетки среди пациентов, включенных в исследование 247, составила 18% (99 из 543) для пациентов, первоначально рандомизированных в группу ритонавир, по сравнению с 26% (142 из 547) для пациентов, первоначально рандомизированных в группу плацебо. Эта разница в показателях была статистически значимой. Однако, поскольку анализ в конце фазы с открытым названием принимаемого препарата (open-label) включает пациентов в группе плацебо, которые были переведены с плацебо на терапию ритонавиром, преимущество ритонавира для выживания не может быть точно оценено.
Во время двойной слепой фазы исследования 247 наблюдалось увеличение количества клеток сD4 по сравнению с исходным уровнем у пациентов, принимавших ритонавир, на 2-й и 4-й нед. Начиная с 4-й нед и до 24-й нед среднее количество клеток сD4 у пациентов, рандомизированных в группу ритонавира, достигало плато. В отличие от этого, у пациентов, рандомизированных в группу плацебо, не наблюдалось явного изменения количества клеток сD4 ни на одном из визитов между исходным уровнем и 24-й нед двойной слепой фазы исследования 247.
Пациенты без предварительной антиретровирусной терапии.
В исследовании 245 участвовало 356 антиретровирусных ВИЧ-инфицированных пациентов (исходный уровень сD4 - 364 клеток в 1 мкл), которые были рандомизированы для получения ритонавира 600 мг 2 раза в день, зидовудина 200 мг 3 раза в день или комбинации этих ЛС.
Во время двойного слепого этапа исследования 245 наблюдалось более значительное увеличение количества клеток сD4 от исходного уровня до 12-й нед в группе получавших ритонавир по сравнению с группой, принимавшей зидовудин. После этого количество клеток сD4 в группе ритонавира вышло на плато к 24-й нед, в то время как количество клеток сD4 постепенно снижалось к 24-й нед в группах, принимавших зидовудин и ритонавир плюс зидовудин.
От исходного уровня до 2-й нед наблюдалось более значительное снижение среднего уровня РНК ВИЧ-1 в плазме крови у получавших ритонавир по сравнению с принимавшми зидовудин. После 2-й нед и на 24-й нед уровни РНК ВИЧ-1 в плазме крови либо оставались стабильными у получавших ритонавир и зидовудин, либо постепенно возвращались к исходному уровню в группе получавших ритонавир плюс зидовудин.
Абсорбция.
Абсолютная биодоступность ритонавира не была определена. После применения в дозе 600 мг в виде раствора для приема внутрь Сmax ритонавира достигалась примерно через 2 и 4 ч соответственно после приема натощак и вместе с пищей (514 ккал; 9% жира, 12% белка и 79% углеводов).
Таблетки и капсулы ритонавира не являются биоэквивалентными. При умеренном потреблении жиров (857 ккал; 31% жиров, 13% белков, 56% углеводов), когда разовую дозу ритонавира 100 мг принимали в виде таблеток, по сравнению с капсулами, AUC0-∞ соответствовала критериям эквивалентности, но maxCmax была выше на 26% (92,8% ДИ: ↑15-↑39%).
Нет сравнительной информации о применении ритонавира в виде таблеток и капсул натощак.
После приема одной дозы ритонавира 100 мг в виде порошка для перорального применения с пищей (617 ккал, 29% калорий из жиров) наблюдалась биодоступность, сопоставимая с применением раствора для приема внутрь.
Влияние пищи на всасывание. Биодоступность ритонавира при приеме с пищей снижается по сравнению с приемом натощак.
После приема ритонавира в виде таблеток в дозе 100 мг вместе с умеренно жирной (857 Ккал, 30% калорий из жира) или жирной (917 ккал, 60% калорий из жира) пищей его maxCmax и AUCinf снижались на 21-23% по сравнению с премом натощак.
После перорального приема ритонавира в виде раствора в дозе 600 мг вместе с пищей (514 ккал, 10% жиров) его maxCmax и AUCinf снизились на 23 и 7% по сравнению с приемом натощак.
После перорального приема ритонавира в виде порошка в дозе 100 мг вместе с умеренно жирной (617 ккал, 29% калорий из жиров) или жирной (917 ккал, 60% калорий из жиров) пищей его maxCmax и AUCinf ритонавира снижались на 23-49% по сравнению с приемом натощак.
Метаболизм.
Почти вся радиоактивность плазмы крови после однократного приема раствора 14C-ритонавира (n=5) в дозе 600 мг была отнесена к неизмененному ритонавиру. Пять метаболитов ритонавира были идентифицированы в моче и кале человека. Окисленный метаболит изопропилтиазол (M2) является основным и обладает противовирусной активностью, аналогичной активности исходного вещества, однако концентрация его в плазме крови низкая. Исследования in vitro >in vitro с использованием микросом печени человека показали, что основной изоформой, участвующей в метаболизме ритонавира является сYP3A, хотя сYP2D6 также участвует в образовании М2.
Элиминация.
В исследовании с участием пяти субъектов, принимавших раствор 14C-ритонавира в дозе 600 мг, (11,3±2,8)% дозы выведилось с мочой, при этом (3,5±1,8)% дозы - в виде неизмененного исходного вещества. В этом исследовании (86,4±2,9)% дозы было выведено с калом, причем (33,8±10,8)% дозы - в виде неизмененного исходного вещества. При многократном приеме накопление ритонавира меньше, чем при однократном, возможно, из-за увеличения клиренса в зависимости от времени и дозы.
Таблица 1.
Фармакокинетические параметры ритонавира.
| Параметр | n | Значения (среднее ± стандартное отклонение) |
| Vβ/F1, л/кг | 91 | 0,41±0,25 |
| T1/2, ч | − | 3-5 |
| Средний кажущийся клиренс (CL/F) в состоянии равновесия2, л/ч | 10 | 8,8±3,2 |
| Средний кажущийся клиренс (CL/F)1, л/ч | 91 | 4,6±1,6 |
| Клиренс (CLR), л/ч | 62 | < 0,1 |
| Гематокрит | − | 0,14 |
| Степень связывания3, % | − | от 98 до 99 |
1 Разовая доза ритонавира 600 мг.
2 Пациенты принимали ритонавир в дозе 600 мг каждые 12.
3 Преимущественно связывается с альбумином сыворотки крови человека и альфа1-кислым гликопротеином в диапазоне концентраций ритонавира от 0,01 до 30 мкг/мл.
Особые группы пациентов.
Пол, расы и возраста. У взрослых пациентов (от 18 до 63 лет) возрастных фармакокинетических различий не наблюдалось. Фармакокинетика ритонавира у пожилых пациентов не изучалась.
Исследование фармакокинетики ритонавира у здоровых мужчин и женщин не выявило статистически значимых различий в фармакокинетике ритонавира. Фармакокинетические различия, связанные с расовой принадлежностью, не были выявлены.
Дети. Фармакокинетика в равновесном состояния оценивалась у 37 ВИЧ-инфицированных пациентов от 2 до 14 лет, получавших ритонавир в дозах от 250 до 400 мг/м2 2 раза в день в исследовании PACTG 310, и у 41 ВИЧ-инфицированного пациента от 1 мес до 2 лет при приеме доз 350 и 450 мг/м2 2 раза в день в исследовании PACTG 345. В равновесном состоянии при пероральном введении ритонавира его клиренс (CL/F/m2) был примерно в 1,5-1,7 раза выше у педиатрических пациентов, чем у взрослых. Концентрации ритонавира в крови, определенные после его приема в дозе 350-400 мг/м2 2 раза в день у педиатрических пациентов старше 2 лет, были сопоставимы с концентрациями, полученными у взрослых, принимавших 600 мг (приблизительно 330 мг/м2) 2 раза в день. В отношении концентраций ритонавира после приема 350 или 450 мг/м2 2 раза в день у детей младше 2 лет наблюдались следующие результаты. Более высокая экспозиция ритонавира при приеме в дозе 450 мг/м2 2 раза в день по сравнению с дозой 350 мг/м2 2 раза в день не наблюдалась. Концентрации ритонавира были несколько ниже, чем у взрослых, получавших 600 мг 2 раза в день. AUC и концентрация ритонавира после приема 350 или 450 мг/м2 2 раза в день у детей младше 2 лет были примерно на 16 и 60% ниже соответственно, чем у взрослых, принимавших 600 мг 2 раза в день.
Почечная недостаточность. Фармакокинетика ритонавира не изучалась у пациентов с нарушением функции почек, однако, поскольку почечный клиренс незначителен, снижения общего клиренса у пациентов с нарушением функции почек не ожидается.
Печеночная недостаточность. Нормализованные по дозе ssCss ритонавира у лиц с легкой печеночной недостаточностью (400 мг 2 раза в день, n=6) были аналогичны таковым в контрольной группе, получавшей дозу 500 мг 2 раза в день. Нормализованная по дозе экспозиция ритонавира в равновесном состоянии у людей с умеренной печеночной недостаточностью (400 мг 2 раза в день, n=6) была примерно на 40% ниже, чем у людей с нормальной функцией печени (500 мг 2 раза в день, n=6). Статистически значимого влияния на связывание ритонавира с белками плазмы крови при легком или умеренном нарушении функции печени не наблюдалось. Не рекомендуется корректировать дозу у пациентов с легкой или умеренной печеночной недостаточностью. Однако следует учитывать возможность снижения концентрации ритонавира у пациентов с умеренной печеночной недостаточностью и тщательно следить за реакцией пациента. Ритонавир не изучался у пациентов с тяжелой печеночной недостаточностью.
Беременность. На основании анализа опубликованных данных, действие ритонавира во время беременности снижается по сравнению с послеродовым периодом.
ФКВ ( см также «Противопоказания», «Взаимдействие» и «Меры предосторожности»).
В таблицах 2 и 3 приведены данные о влиянии совместного применения ритонавира и различных ЛС на AUC и maxCmax (95% ДИ). Информация о клинических рекомендациях содержится в разделе «Взаимодействие».
Таблица 2.
Фармакокинетические параметры ритонавира при совместном применении других ЛС.
| Совместно применяемое ЛС и его доза | Доза ритонавира, мг | n | AUC, % (95% ДИ) | сmax, % (95% ДИ) | сmin, % (95% ДИ) |
| Кларитромицин, 500 мг, каждые 12 4 дня | 200, каждые 8 4 дня | 22 | ↑12 (2; 23%) | ↑15 (2; 28%) | ↑14 (−3; 36%) |
| Диданозин, 200 мг, каждые 12 4 дня | 600, каждые 12 4 дня | 12 | ↔ | ↔ | ↔ |
| Флуконазол, 400 мг разовая доза, день 1; 200 мг ежедневно, 4 дня | 200, каждые 6 4 дня | 8 | ↑12 (5; 20%) | ↑15 (7; 22%) | ↑14 (0; 26%) |
| Флуоксетин, 30 мг, каждые 12 8 дней | 600 разовая доза, 1 день | 16 | ↑19 (7; 34%) | ↔ | Не определялась |
| Кетоконазол, 200 мг, ежедневно, 7 дней | 500, каждые 12 10 дней | 12 | ↑18 (−3; 52%) | ↑10 (−11; 36%) | Не определялась |
| Рифампицин, 600 или 300 мг, ежедневно, 10 дней | 500, каждые 12 20 дней | 7, 91 | ↓35 (7; 55%) | ↓25 (−5; 46%) | ↓49 (−14; 91%) |
| Вориконазол, 400 мг, каждые 12 1 день; затем 200 мг, каждые 12 8 дней | 400, каждые 12 9 дней | − | ↔ | ↔ | Не определялась |
| Зидовудин, 200 мг, каждые 8 4 дня | 300, каждые 6 4 дня | 10 | ↔ | ↔ | ↔ |
1 Исследование с параллельными группами - субъекты, получавшие комбинированные и контрольные схемы лечения соответственно.
Таблица 3.
Фармакокинетические параметры ЛС, совместно принимаемых с ритонавиром.
| Совместно применяемое ЛС и его доза | Доза ритонавира, мг | n | AUC, % (95% ДИ) | сmax, % (95% ДИ) | сmin, % (95% ДИ) |
| Алпразолам, 1 мг, разовая доза | 500, каждые 12 10 дней | 12 | ↓12% (−5; 30%) | ↓16 (5; 27%) | Не определялась |
| Аванафил, 50 мг, разовая доза | 600, каждые 12 ч | 141 | ↑13-кратное | ↑2,4-кратное | Не определялась |
| Кларитромицин, 500 мг, каждые 12 4 дня | 200, каждые 8 4 дня | 22 | ↑77 (56; 103%) | ↑31 (15; 51%) | ↑2,8-кратное (2,4; 3,3×) |
| Дезипрамин, 2-гидроксиметаболит дезипрамина, 100 мг, разовая доза | 500, каждые 12 12 дней | 14 | ↓15 (3; 26%) | ↓67 (62; 72%) | Не определялась |
| Диданозин, 200 мг, каждые 12 4 дня | 600, каждые 12 4 дня | 12 | ↓13 (0; 23%) | ↓16 (5; 26%) | − |
| Этинилэстрадиол, 50 мкг, разовая доза | 500, каждые 12 16 дней | 23 | ↓40 (31; 49%) | ↓32 (24; 39%) | Не определялась |
| Флутиказона пропионат водный назальный спрей, 200 мкг/сут, 7 дней | 100, каждые 12 7 дней | 18 | ↑ приблизительно в 350 раз2 | ↑ приблизительно в 25 раз2 | |
| Индинавир3, 400 мг , каждые 12 15 дней | |||||
| День 14 | 400, каждые 12 15 дней | 10 | ↑6 (−14; 29%) | ↓51 (40; 61%) | ↑4-кратное (2,8; 6,8×) |
| День 15 | ↓7 (−22; 28%) | ↓62 (52; 70%) | ↑4-кратное (2,5; 6,5×) | ||
| Кетоконазол, 200 мг, ежедневно, 7 дней | 500, каждые 12 10 дней | 12 | ↑3,4-кратное (2,8; 4,3×) | ↑55 (40; 72%) | Не определялась |
| Меперидин, метаболит нормеперидина, 50 мг, пероральная разовая доза | 500, каждые 12 10 дней | 8 | ↓62 (59; 65%) | ↓59 (42; 72%) | Не определялась |
| 6 | ↑47 (−24;345%) | ↑87 (42; 147%) | Не определялась | ||
| Метадон4, 5 мг, разовая доза | 500, каждые 12 15 дней | 11 | ↓36 (16; 52%) | ↓38 (28; 46%) | Не определялась |
| Ралтегравир, 400 мг, разовая доза | 100, каждые 12 16 дней | 10 | ↓16 (−30; 1%) | ↓24 (−45; 4%) | ↓1 (−30; 40%) |
| Ривароксабан, 10 мг, разовая доза (дни 0 и 7) | 600 , каждые 12 (дни со 2 по 7) | 12 | ↑150 (130-170%)5 | ↑60 (40-70%)5 | Не определялась |
| Рифабутин, 25-O-дезацетильный метаболит рифабутина, 150 мг, ежедневно, 16 дней | 500, каждые 12 10 дней | 5, 116 | ↑4-кратное (2,8; 6,1×) | ↑2,5-кратное (1,9; 3,4×) | ↑6-кратное (3,5; 18,3×) |
| ↑38-кратное (28; 56×) | ↑16-кратное (13; 20×) | ↑181-кратное (не определено) | |||
| Силденафил, 100 мг, разовая доза | 500 дважды в день, 8 дней | 28 | ↑11-кратное | ↑4-кратное | Не определялась |
| Симепревир, 200 мг в день, 7 дней | 100 мг в сутки, 15 дней | 12 | ↑618 (463-815%)7 | ↑370 (284-476%)7 | ↑1335 (929-1901%)7 |
| Сульфаметоксазол8, 800 мг, разовая доза | 500, каждые 12 12 дней | 15 | ↓20 (16; 23%) | ↔ | Не определялась |
| Тадалафил, 20 мг, разовая доза | 200 мг , каждые 12 ч | − | ↑124% | ↔ | Не определялась |
| Теофиллин, 3 мг/кг, каждые 8 15 дней | 500, каждые 12 10 дней | 13, 116 | ↓43 (42; 45%) | ↓32 (29; 34%) | ↓57 (55; 59%) |
| Тразодон, 50 мг, разовая доза | 200 мг , каждые 12 4 дозы | 10 | ↑2,4-кратное | ↑34% | − |
| Триметоприм8, 160 мг, разовая доза | 500, каждые 12 12 дней | 15 | ↑20 (3; 43%) | ↔ | Не определялась |
| Варденафил, 5 мг | 600, каждые 12 ч | − | ↔49-кратное | ↔13-кратное | Не определялась |
| Вориконазол, 400 мг, каждые 12 1 день; затем 200 мг, каждые 12 8 дней | 400, каждые 12 9 дней | − | ↓82% | ↓66% | − |
| Вориконазол, 400 мг, каждые 12 1 день; затем 200 мг, каждые 12 8 дней | 100, каждые 12 часов, 9 дней | − | ↓39% | ↓24% | − |
| Варфарин, S-варфарин, R-варфарин, 5 мг, разовая доза | 400, каждые 12 часов, 12дней | 12 | ↑9 (−17; 44%)9 | ↓9 (−16; −2%)9 | Не определялась |
| ↓33 (−38; −27%)9 | ↔ | Не определялась | |||
| Зидовудин, 200 мг, каждые 8 4 дня | 300, каждые 6 4 дня | 9 | ↓25 (15; 34%) | ↓27 (4; 45%) | Не определялась |
1 Для контрольной группы: n=14 для maxCmax и AUC0-inf, и для контрольной группы: n=13 для maxCmax и n=4 для AUC0-inf.
2 Значительное увеличение экспозиции флутиказона пропионата в плазме привело к значительному снижению (86%) AUC кортизола в плазме.
3 Ритонавир и индинавир принимались совместно в течение 15 дней; дозы 14-го дня принимались после завтрака с 15% жира (757 ккал) и вечернего ужина с 9% жира (236 ккал), а дозы 15-го дня - после завтрака с 15% жира (757 ккал) и ужина с 32% жира (815 ккал). сmin индинавира также была увеличена в 4 раза. Эффекты оценивались по сравнению с режимом приема индинавира 800 мг каждые 8 ч в условиях голодания.
4 Эффекты оценивались в сравнении с разовой дозой метадона 20 мг.
5 90% ДИ представлен для ривароксабана.
6 Параллельный групповой дизайн; записи - субъекты, получавшие комбинированные и контрольные схемы соответственно.
7 90% ДИ представлен для симепревира (изменение экспозиции представлено в виде процентного увеличения).
8 Сульфаметоксазол и триметоприм принимали в виде одной комбинированной таблетки.
9 90% ДИ представлены для соотношений AUC и maxCmax R- и S-варфарина.
Канцерогенность, мутагенность, влияние на фертильность.
Исследования канцерогенности ритонавира проводились на мышах и крысах. У самцов мышей при дозах 50, 100 или 200 мг/кг/сут наблюдалось дозозависимое увеличение частоты возникновения как аденом, так и комбинированных аденом и карцином в печени. На основании измерений AUC, экспозиция при высокой дозе была приблизительно в 0,3 раза выше для самцов, чем экспозиция у людей при рекомендуемой терапевтической дозе (600 мг 2 раза в день). Канцерогенных эффектов у самок животных в испытанных дозах не наблюдалось. При высокой дозе воздействие на самок было примерно в 0,6 раза выше, чем на людей. У крыс, получавших дозу 7, 15 или 30 мг/кг/сут, канцерогенных эффектов не наблюдалось. В этом исследовании воздействие при высокой дозе составило приблизительно 6% от воздействия на человека при рекомендуемой терапевтической дозе. Исходя из экспозиции, достигнутой в исследованиях на животных, значимость наблюдаемых эффектов неизвестна.
Ритонавир был признан отрицательным в отношении мутагенной или кластогенной активности в ряде анализов in vitro >in vitro и in vivo >in vivo, включая бактериальный анализ обратной мутации Эймса с использованием S.typhimurium и E.coli, анализ лимфомы мыши, микроядерный тест на мышах и анализ хромосомных аберраций в лимфоцитах человека.
Ритонавир не оказывал влияния на фертильность крыс при дозах, составляющих примерно 40% (самцы) и 60% (самки) от терапевтической. Более высокие дозы были нецелесообразны из-за печеночной токсичности.
Клинические исследования.
Активность ритонавира в качестве монотерапии или в комбинации с НИОТ была оценена у 1446 пациентов, включенных в два двойных слепых рандомизированных исследования.
Пациенты с предшествующей антиретровирусной терапией.
Исследование 247 представляло собой рандомизированное двойное слепое исследование (с открытым наблюдением), проведенное с участием ВИЧ-инфицированных пациентов с предшествующей антиретровирусной терапией не менее девяти месяцев и исходным количеством клеток сD4 менее или равным 100 клеток на 1 мкл. Ритонавир в дозе 600 мг 2 раза в день или плацебо добавлялись к базовой схеме антиретровирусной терапии каждого пациента, которая могла включать до двух одобренных антиретровирусных препаратов. В исследовании приняли участие 1090 пациентов, исходное количество клеток сD4 на момент начала исследования составляло 32 клетки на 1 мкл. После того как была продемонстрирована клиническая польза терапии ритонавиром, все пациенты имели право перейти на открытое применение ритонавира на весь период наблюдения. Медиана продолжительности двойной слепой терапии ритонавиром и плацебо составила 6 мес. Медиана продолжительности наблюдения до окончания фазы открытого наблюдения составила 13,5 мес для пациентов, рандомизированных в группу ритонавира, и 14 мес для пациентов, рандомизированных в группу плацебо.
Кумулятивная частота клинического прогрессирования заболевания или смерти во время двойной слепой фазы исследования 247 составила 26% для пациентов, первоначально рандомизированных в группу ритонавира, по сравнению с 42% для пациентов, первоначально рандомизированных в группу плацебо. Эта разница в показателях была статистически значимой.
Кумулятивная смертность до конца фазы наблюдения с открытым названием принимаемой таблетки среди пациентов, включенных в исследование 247, составила 18% (99 из 543) для пациентов, первоначально рандомизированных в группу ритонавир, по сравнению с 26% (142 из 547) для пациентов, первоначально рандомизированных в группу плацебо. Эта разница в показателях была статистически значимой. Однако, поскольку анализ в конце фазы с открытым названием принимаемого препарата (open-label) включает пациентов в группе плацебо, которые были переведены с плацебо на терапию ритонавиром, преимущество ритонавира для выживания не может быть точно оценено.
Во время двойной слепой фазы исследования 247 наблюдалось увеличение количества клеток сD4 по сравнению с исходным уровнем у пациентов, принимавших ритонавир, на 2-й и 4-й нед. Начиная с 4-й нед и до 24-й нед среднее количество клеток сD4 у пациентов, рандомизированных в группу ритонавира, достигало плато. В отличие от этого, у пациентов, рандомизированных в группу плацебо, не наблюдалось явного изменения количества клеток сD4 ни на одном из визитов между исходным уровнем и 24-й нед двойной слепой фазы исследования 247.
Пациенты без предварительной антиретровирусной терапии.
В исследовании 245 участвовало 356 антиретровирусных ВИЧ-инфицированных пациентов (исходный уровень сD4 - 364 клеток в 1 мкл), которые были рандомизированы для получения ритонавира 600 мг 2 раза в день, зидовудина 200 мг 3 раза в день или комбинации этих ЛС.
Во время двойного слепого этапа исследования 245 наблюдалось более значительное увеличение количества клеток сD4 от исходного уровня до 12-й нед в группе получавших ритонавир по сравнению с группой, принимавшей зидовудин. После этого количество клеток сD4 в группе ритонавира вышло на плато к 24-й нед, в то время как количество клеток сD4 постепенно снижалось к 24-й нед в группах, принимавших зидовудин и ритонавир плюс зидовудин.
От исходного уровня до 2-й нед наблюдалось более значительное снижение среднего уровня РНК ВИЧ-1 в плазме крови у получавших ритонавир по сравнению с принимавшми зидовудин. После 2-й нед и на 24-й нед уровни РНК ВИЧ-1 в плазме крови либо оставались стабильными у получавших ритонавир и зидовудин, либо постепенно возвращались к исходному уровню в группе получавших ритонавир плюс зидовудин.
Indications for use
Лечение инфекции ВИЧ-1 в комбинации с другими антиретровирусными ЛС у взрослых и детей.
Contraindications
Известная гиперчувствительность (например. токсический эпидермальный некролиз или синдром Стивенса-Джонсона) к ритонавиру. совместное применение с ЛС. клиренс которых сильно зависит от сYP3A и для которых повышенная концентрация в плазме крови связана с серьезными и/или опасными для жизни реакциями ( см «Взаимодействие»). такими как антагонист альфа1-адренорецепторов альфузозин. антиангинальное ЛС ранолазин. антиаритмические ЛС амиодарон. дронедарон. флекаинид. пропафенон и хинидин. противогрибковое средство вориконазол. противоподагрическое средство колхицин. нейролептики луразидон и пимозид. производные спорыньи дигидроэрготамин. эрготамин и метилэргометрин. средство для улучшения моторики ЖКТ цизаприд. ингибиторы ГМГ-КоА-редуктазы ловастатин и симвастатин. ингибитор микросомального белка-переносчика триглицеридов ломитапид. ингибитор ФДЭ-5 силденафил при применении его для лечения легочной артериальной гипертензии. седативные и снотворные средства триазолам. мидазолам. принимаемые перорально. совместное перименение с сильными индукторами сYP3A. когда значительное снижение концентрации ритонавира в плазме может быть связано с потенциальной потерей вирусологического ответа и возможной резистентностью и перекрестной резистентностью. такими как противоопухолевое средство апалутамид. препараты на основе зверобоя продырявленного (Hypericum perforatum).
При совместном применении с другими ингибиторами протеазы необходимо смотреть полную информацию по данному ингибитору протеазы, включая поле «Противопоказания».
При совместном применении с другими ингибиторами протеазы необходимо смотреть полную информацию по данному ингибитору протеазы, включая поле «Противопоказания».
Use during pregnancy and lactation
Категория действия на плод по FDA. в.
Проспективные данные Антиретровирусного регистра беременных (APR) недостаточны для адекватной оценки риска врожденных пороков развития или выкидыша при применении ритонавира. Имеющиеся данные не показывают различий в частоте общих врожденных пороков развития при приеме ритонавира по сравнению с фоновой частотой основных врожденных пороков развития 2,7% в контрольной популяции США в рамках Программы врожденных пороков развития города Атланта.
В исследованиях по репродукции на животных при пероральном введении ритонавира беременным крысам и кроликам не выявлено признаков неблагоприятного воздействия на развитие плода. Во время органогенеза у крыс и кроликов системная экспозиция (AUC) была примерно на 1/3 ниже, чем у человека при применении рекомендуемой суточной дозы. В исследовании пре- и постнатального развития крыс системное воздействие ритонавира на организм матери составляло примерно 1/2 от воздействия на организм человека при рекомендуемой суточной дозе в пересчете на площадь поверхности тела.
Лекарственные формы ритонавира для приема внутрь, содержащие этанол, не рекомендуется принимать во время беременности, поскольку неизвестен безопасный уровень воздействия этанола во время беременности ( см «Меры предосторожности»).
Фоновый риск основных врожденных пороков развития и выкидышей для указанной популяции неизвестен. Все беременности имеют фоновый риск врожденных дефектов, потерь плода или других неблагоприятных исходов. В общей популяции США фоновый риск крупных врожденных пороков развития и выкидыша при клинически установленной беременности составляет 2-4 и 15-20% соответственно.
Клинические наблюдения.
Исследования в человеческой популяции. На основании проспективных отчетов APR о примерно 6100 случаях живорождения после применения ритонавира (включая более 2800 случаев воздействия в I триместре и более 3200 случаев воздействия во II и III триместрах беременности), не было выявлено различий в частоте общих врожденных пороков развития при применении ритонавира по сравнению с фоновой частотой врожденных пороков развития, равной 2,7% в контрольной популяции США. Распространенность врожденных пороков развития у живорожденных составила 2,3% (95% ДИ: 1,7-2,9%) после использования схем лечения с применением ритонавира в I триместре и 2,9% (95% ДИ: 2,3-3,5%) после использования таких схем во II и III триместрах беременности.
Хотя перенос ритонавира через плаценту и концентрация ритонавира у плода обычно низкие, в образцах пуповинной крови и волосах новорожденных его уровни были достаточными для обнаружения.
Исследования на животных. Ритонавир перорально вводили беременным крысам (в дозе 0; 15; 35 и 75 мг/кг/сут) и кроликам (в дозе 0; 25; 50 и 110 мг/кг/сут) в период органогенеза (на 6-17-й и 6-19-й дни беременности соответственно). Не получено доказательств тератогенности, вызванной ритонавиром, у крыс и кроликов при дозах, обеспечивающих системное воздействие (AUC) приблизительно на 1/3 ниже, чем наблюдаемое у человека при рекомендуемой суточной дозе. Токсическое влияние на развитие плода, наблюдаемое у крыс (раннее рассасывание, снижение массы тела плода, задержка оссификации и отклонения в развитии), имело место при материнской дозе, которая приблизительно на 1/3 ниже, чем рекомендуемая суточная доза для человека. Небольшое увеличение частоты развития крипторхизма также было отмечено у крыс (при материнской токсической дозе) при экспозиции приблизительно на 1/5 меньше, чем у человека при рекомендуемой суточной дозе. Токсическое влияние на развитие плода наблюдалось у кроликов (разрывы, уменьшение размера помета и снижение веса плода) при материнской токсичной дозе, примерно в 1,8 раза превышающей рекомендуемую суточную дозу для человека в пересчете на площадь поверхности тела. В исследовании пре- и постнатального развития крыс ритонавир вводили в дозах 0; 15; 35 и 60 мг/кг/сут с 6-го до 20-го дня беременности. При дозе ритонавира 60 мг/кг/сут (эквивалентно 1/2 рекомендуемой суточной дозы для человека в пересчете на площадь поверхности тела) не было отмечено токсического влияния на развитие плода.
ВИЧ-инфицированным матерям рекомендуется не кормить грудью своих младенцев, чтобы избежать риска постнатальной передачи ВИЧ.
Согласно ограниченным опубликованным данным ритонавир присутствует в женском молоке.
Нет информации о воздействии ритонавира на младенца, находящегося на грудном вскармливании, или о его влиянии на выработку молока. В связи с возможностью передачи ВИЧ (у ВИЧ-отрицательных младенцев), развития вирусной устойчивости (у ВИЧ-положительных младенцев) и серьезных побочных реакций у младенца, находящегося на грудном вскармливании, следует проинструктировать матерей не кормить грудью, если они получают ритонавир.
Проспективные данные Антиретровирусного регистра беременных (APR) недостаточны для адекватной оценки риска врожденных пороков развития или выкидыша при применении ритонавира. Имеющиеся данные не показывают различий в частоте общих врожденных пороков развития при приеме ритонавира по сравнению с фоновой частотой основных врожденных пороков развития 2,7% в контрольной популяции США в рамках Программы врожденных пороков развития города Атланта.
В исследованиях по репродукции на животных при пероральном введении ритонавира беременным крысам и кроликам не выявлено признаков неблагоприятного воздействия на развитие плода. Во время органогенеза у крыс и кроликов системная экспозиция (AUC) была примерно на 1/3 ниже, чем у человека при применении рекомендуемой суточной дозы. В исследовании пре- и постнатального развития крыс системное воздействие ритонавира на организм матери составляло примерно 1/2 от воздействия на организм человека при рекомендуемой суточной дозе в пересчете на площадь поверхности тела.
Лекарственные формы ритонавира для приема внутрь, содержащие этанол, не рекомендуется принимать во время беременности, поскольку неизвестен безопасный уровень воздействия этанола во время беременности ( см «Меры предосторожности»).
Фоновый риск основных врожденных пороков развития и выкидышей для указанной популяции неизвестен. Все беременности имеют фоновый риск врожденных дефектов, потерь плода или других неблагоприятных исходов. В общей популяции США фоновый риск крупных врожденных пороков развития и выкидыша при клинически установленной беременности составляет 2-4 и 15-20% соответственно.
Клинические наблюдения.
Исследования в человеческой популяции. На основании проспективных отчетов APR о примерно 6100 случаях живорождения после применения ритонавира (включая более 2800 случаев воздействия в I триместре и более 3200 случаев воздействия во II и III триместрах беременности), не было выявлено различий в частоте общих врожденных пороков развития при применении ритонавира по сравнению с фоновой частотой врожденных пороков развития, равной 2,7% в контрольной популяции США. Распространенность врожденных пороков развития у живорожденных составила 2,3% (95% ДИ: 1,7-2,9%) после использования схем лечения с применением ритонавира в I триместре и 2,9% (95% ДИ: 2,3-3,5%) после использования таких схем во II и III триместрах беременности.
Хотя перенос ритонавира через плаценту и концентрация ритонавира у плода обычно низкие, в образцах пуповинной крови и волосах новорожденных его уровни были достаточными для обнаружения.
Исследования на животных. Ритонавир перорально вводили беременным крысам (в дозе 0; 15; 35 и 75 мг/кг/сут) и кроликам (в дозе 0; 25; 50 и 110 мг/кг/сут) в период органогенеза (на 6-17-й и 6-19-й дни беременности соответственно). Не получено доказательств тератогенности, вызванной ритонавиром, у крыс и кроликов при дозах, обеспечивающих системное воздействие (AUC) приблизительно на 1/3 ниже, чем наблюдаемое у человека при рекомендуемой суточной дозе. Токсическое влияние на развитие плода, наблюдаемое у крыс (раннее рассасывание, снижение массы тела плода, задержка оссификации и отклонения в развитии), имело место при материнской дозе, которая приблизительно на 1/3 ниже, чем рекомендуемая суточная доза для человека. Небольшое увеличение частоты развития крипторхизма также было отмечено у крыс (при материнской токсической дозе) при экспозиции приблизительно на 1/5 меньше, чем у человека при рекомендуемой суточной дозе. Токсическое влияние на развитие плода наблюдалось у кроликов (разрывы, уменьшение размера помета и снижение веса плода) при материнской токсичной дозе, примерно в 1,8 раза превышающей рекомендуемую суточную дозу для человека в пересчете на площадь поверхности тела. В исследовании пре- и постнатального развития крыс ритонавир вводили в дозах 0; 15; 35 и 60 мг/кг/сут с 6-го до 20-го дня беременности. При дозе ритонавира 60 мг/кг/сут (эквивалентно 1/2 рекомендуемой суточной дозы для человека в пересчете на площадь поверхности тела) не было отмечено токсического влияния на развитие плода.
ВИЧ-инфицированным матерям рекомендуется не кормить грудью своих младенцев, чтобы избежать риска постнатальной передачи ВИЧ.
Согласно ограниченным опубликованным данным ритонавир присутствует в женском молоке.
Нет информации о воздействии ритонавира на младенца, находящегося на грудном вскармливании, или о его влиянии на выработку молока. В связи с возможностью передачи ВИЧ (у ВИЧ-отрицательных младенцев), развития вирусной устойчивости (у ВИЧ-положительных младенцев) и серьезных побочных реакций у младенца, находящегося на грудном вскармливании, следует проинструктировать матерей не кормить грудью, если они получают ритонавир.
Side effects
При совместном применении ритонавира с другими ингибиторами протеазы следует ознакомиться с полной информацией о назначении этого ингибитора протеазы, включая побочные реакции.
Результаты клинических исследований.
Поскольку клинические исследования проводятся в различных условиях. частота побочных реакций. наблюдаемая в одном клиническом исследовании. не может напрямую сравниваться с таковой. наблюдаемой в ходе другого клинического исследования. и может не отражать частоту. наблюдаемую на практике.
Побочные реакции у взрослых.
Безопасность применения ритонавира в монотерапии и в комбинации с другими антиретровирусными ЛС была изучена у 1755 взрослых пациентов. В таблице 4 перечислены побочные реакции. связанные с лечением (возможная или вероятная связь с применением исследуемого препарата). которые возникали у ≥1% взрослых пациентов. принимавших ритонавир в исследованиях II/IV фазы.
Наиболее часто у пациентов. принимавших ритонавир в монотерапии или в комбинации с другими антиретровирусными ЛС. отмечались желудочно-кишечные реакции (включая диарею. тошноту. рвоту. боль в верхних и нижних отделах живота). неврологические нарушения (включая параличи и парестезии в полости рта). сыпь и повышенная утомляемость/астения.
Таблица 4.
Побочные реакции, отмечавшиеся у ≥1% взрослых пациентов, получавших ритонавир в объединенных исследованиях II/IV фазы (n=1755).
1 Обобщенное название, включающее несколько предпочтительных терминов по MedDRA >MedDRA.
Отклонения результатов лабораторного обследования у взрослых.
В таблице 5 приведены данные о развитии выраженных отклонений в лабораторных показателях у взрослых пациентов.
Таблица 5.
Доля взрослых пациентов (%) по группам исследования и лечения с отклонениями в биохимическом и общем гематологическом анализах, наблюдавшимися более чем у 3% пациентов, принимавших ритонавир.
Побочные реакции у педиатрических пациентов.
Применение ритонавира изучалось у 265 педиатрических пациентов от 1 мес до 21 года. Профиль побочных реакций, наблюдавшихся в ходе этих исследований, был схожим с таковым у взрослых пациентов.
Рвота. диарея и кожная сыпь/аллергия были единственными. связанными с применением ритонавира. клиническими побочными реакциями умеренной или тяжелой степени. наблюдавшимися у ≥2% педиатрических пациентов. участвовавших в клинических исследованиях ритонавира.
Отклонения результатов лабораторного обследования у пациентов детского возраста.
Следующие отклонения лабораторных показателей 3-4-й степени отмечались более чем у 3% педиатрических пациентов. получавших ритонавир в монотерапии или в комбинации с ингибиторами обратной транскриптазы: нейтропения (9%). гиперамилаземия (7%). тромбоцитопения (5%). анемия (4%) и повышение уровня АСТ (3%).
Результаты пострегистрационных наблюдений.
В ходе пострегистрационного применения ритонавира были получены сообщения о приведенных ниже побочных реакциях (ранее не упоминались в инструкции по медицинскому применению). Поскольку сообщения об этих реакциях поступали в добровольном порядке от популяции неизвестного размера. невозможно достоверно оценить их частоту или установить причинно-следственную связь с воздействием ритонавира.
Со стороны организма в целом. Сообщалось об обезвоживании, обычно связанном с желудочно-кишечными симптомами и иногда приводящем к гипотензии, обмороку или почечной недостаточности. Также сообщалось о синкопальных состояниях, ортостатической гипотензии и почечной недостаточности при отсутствии обезвоживания.
Совместный прием ритонавира с эрготамином или дигидроэрготамином был связан с острой токсичностью спорыньи, характеризующейся вазоспазмом и ишемией конечностей и других тканей, включая ЦНС.
Со стороны ССС. Сообщалось об развитии AV-блокады I, II и III степени, блокаде ветви правого пучка ( см «Меры предосторожности»).
Сообщалось о кардиологических и неврологических явлениях при совместном применении ритонавира с дизопирамидом, мексилетином, нефазодоном, флуоксетином и бета-адреноблокаторами. Нельзя исключить возможность их лекарственного взаимодействия.
Со стороны эндокринной системы. Сообщалось о развитии синдрома Кушинга и подавлении функции надпочечников при совместном применении ритонавира и флутиказона пропионата или будесонида.
Со стороны нервной системы. Имеются пострегистрационные сообщения о развитии судорог.
Со стороны кожи и подкожных тканей. Сообщалось о случаях развития токсического эпидермального некролиза.
Результаты клинических исследований.
Поскольку клинические исследования проводятся в различных условиях. частота побочных реакций. наблюдаемая в одном клиническом исследовании. не может напрямую сравниваться с таковой. наблюдаемой в ходе другого клинического исследования. и может не отражать частоту. наблюдаемую на практике.
Побочные реакции у взрослых.
Безопасность применения ритонавира в монотерапии и в комбинации с другими антиретровирусными ЛС была изучена у 1755 взрослых пациентов. В таблице 4 перечислены побочные реакции. связанные с лечением (возможная или вероятная связь с применением исследуемого препарата). которые возникали у ≥1% взрослых пациентов. принимавших ритонавир в исследованиях II/IV фазы.
Наиболее часто у пациентов. принимавших ритонавир в монотерапии или в комбинации с другими антиретровирусными ЛС. отмечались желудочно-кишечные реакции (включая диарею. тошноту. рвоту. боль в верхних и нижних отделах живота). неврологические нарушения (включая параличи и парестезии в полости рта). сыпь и повышенная утомляемость/астения.
Таблица 4.
Побочные реакции, отмечавшиеся у ≥1% взрослых пациентов, получавших ритонавир в объединенных исследованиях II/IV фазы (n=1755).
| Побочная реакция | n | Частота, % |
| Со стороны органа зрения | ||
| Нарушение зрения | 113 | 6,4 |
| Со стороны ЖКТ | ||
| Боль в животе (в верхних и нижних отделах)1 | 464 | 26,4 |
| Диарея, в тч тяжелая, с нарушением электролитного баланса1 | 1,192 | 67,9 |
| Диспепсия | 201 | 11,5 |
| Метеоризм | 142 | 8,1 |
| Желудочно-кишечное кровотечение1 | 41 | 2,3 |
| ГЭРБ | 19 | 1,1 |
| Тошнота | 1,007 | 57,4 |
| Рвота1 | 559 | 31,9 |
| Со стороны организма в целом | ||
| Повышенная утомляемость, включая астению1 | 811 | 46,2 |
| Гепатобилиарные нарушения | ||
| Повышение уровня билирубина в крови (включая желтуху)1 | 25 | 1,4 |
| Гепатит (включая повышенное содержание АСТ, АЛТ, ГГТ)1 | 153 | 8,7 |
| Со стороны иммунной системы | ||
| Гиперчувствительность, в тч крапивница и отек лица1 | 114 | 8,2 |
| Со стороны обмена веществ и питания | ||
| Отеки и периферические отеки1 | 110 | 6,3 |
| Подагра1 | 24 | 1,4 |
| Гиперхолестеринемия1 | 52 | 3 |
| Гипертриглицеридемия1 | 158 | 9 |
| Приобретенная липодистрофия1 | 51 | 2,9 |
| Со стороны скелетно-мышечной системы и соединительной ткани | ||
| Артралгия и боль в спине1 | 326 | 18,6 |
| Миопатия/повышение активности КФК1 | 66 | 3,8 |
| Миалгия | 156 | 8,9 |
| Со стороны нервной системы | ||
| Головокружение1 | 274 | 15,6 |
| Дисгевзия1 | 285 | 16,2 |
| Парестезия (включая парестезию полости рта)1 | 889 | 50,7 |
| Периферическая нейропатия | 178 | 10,1 |
| Обморок1 | 58 | 3,3 |
| Со стороны психики | ||
| Спутанность сознания1 | 52 | 3 |
| Нарушение внимания | 44 | 2,5 |
| Со сороны почек и мочевыводящих путей | ||
| Учащенное мочеиспускание1 | 74 | 4,2 |
| Со стороны респираторного тракта и органов средостения | ||
| Кашель1 | 380 | 21,7 |
| Боль в ротоглотке1 | 279 | 15,9 |
| Со стороны кожи и подкожных тканей | ||
| Акне1 | 67 | 3,8 |
| Кожный зуд1 | 214 | 12,2 |
| Сыпь (в тч эритематозная и макулопапулезная)1 | 475 | 27,1 |
| Со стороны ССС | ||
| Гиперемия, чувство жара1 | 232 | 13,2 |
| Гипертензия1 | 58 | 3,3 |
| Гипотензия, в тч ортостатическая1 | 30 | 1,7 |
| Похолодание конечностей1 | 21 | 1,2 |
1 Обобщенное название, включающее несколько предпочтительных терминов по MedDRA >MedDRA.
Отклонения результатов лабораторного обследования у взрослых.
В таблице 5 приведены данные о развитии выраженных отклонений в лабораторных показателях у взрослых пациентов.
Таблица 5.
Доля взрослых пациентов (%) по группам исследования и лечения с отклонениями в биохимическом и общем гематологическом анализах, наблюдавшимися более чем у 3% пациентов, принимавших ритонавир.
| Показатель | Референсные значения (верхний или нижний порог) | Исследование с участием 245 пациентов, ранее не получавших лечение | Исследование с участием 247 пациентов с прогрессирующим заболеванием | Исследование с участием 462 пациентов, ранее не получавших ингибитор протеазы | |||
| Ритонавир плюс зидовудин | Ритонавир | Зидовудин | Ритонавир | Плацебо | Ритонавир плюс саквинавир | ||
| Биохимический анализ плазмы крови | |||||||
| Хc | >240 мг/дл | 30,7 | 44,8 | 9,3 | 36,5 | 8 | 65,2 |
| КФК | >1000 МЕ/л | 9,6 | 12,1 | 11 | 9,1 | 6,3 | 9,9 |
| ГГТ | >300 МЕ/л | 1,8 | 5,2 | 1,7 | 19,6 | 11,3 | 9,2 |
| АСТ | >180 МЕ/л | 5,3 | 9,5 | 2,5 | 6,4 | 7 | 7,8 |
| АЛТ | >215 МЕ/л | 5,3 | 7,8 | 3,4 | 8,5 | 4,4 | 9,2 |
| Триглицериды | >800 мг/дл | 9,6 | 17,2 | 3,4 | 33,6 | 9,4 | 23,4 |
| >1500 мг/дл | 1,8 | 2,6 | − | 12,6 | 0,4 | 11,3 | |
| Триглицериды натощак | >1500 мг/дл | 1,5 | 1,3 | − | 9,9 | 0,3 | − |
| Мочевая кислота | >12 мг/дл | − | − | − | 3,8 | 0,2 | 1,4 |
| Общий анализ крови | |||||||
| Гематокрит | <30% | 2,6 | − | 0,8 | 17,3 | 22 | 0,7 |
| Hb | <8 г/дл | 0,9 | − | − | 3,8 | 3,9 | − |
| Нейтрофилы | <0,5×109/л | − | − | − | 6 | 8,3 | − |
| Эритроциты | <3×1012/л | 1,8 | − | 5,9 | 18,6 | 24,4 | − |
| Лейкоциты | <2,5×109/L | − | 0,9 | 6,8 | 36,9 | 59,4 | 3,5 |
Побочные реакции у педиатрических пациентов.
Применение ритонавира изучалось у 265 педиатрических пациентов от 1 мес до 21 года. Профиль побочных реакций, наблюдавшихся в ходе этих исследований, был схожим с таковым у взрослых пациентов.
Рвота. диарея и кожная сыпь/аллергия были единственными. связанными с применением ритонавира. клиническими побочными реакциями умеренной или тяжелой степени. наблюдавшимися у ≥2% педиатрических пациентов. участвовавших в клинических исследованиях ритонавира.
Отклонения результатов лабораторного обследования у пациентов детского возраста.
Следующие отклонения лабораторных показателей 3-4-й степени отмечались более чем у 3% педиатрических пациентов. получавших ритонавир в монотерапии или в комбинации с ингибиторами обратной транскриптазы: нейтропения (9%). гиперамилаземия (7%). тромбоцитопения (5%). анемия (4%) и повышение уровня АСТ (3%).
Результаты пострегистрационных наблюдений.
В ходе пострегистрационного применения ритонавира были получены сообщения о приведенных ниже побочных реакциях (ранее не упоминались в инструкции по медицинскому применению). Поскольку сообщения об этих реакциях поступали в добровольном порядке от популяции неизвестного размера. невозможно достоверно оценить их частоту или установить причинно-следственную связь с воздействием ритонавира.
Со стороны организма в целом. Сообщалось об обезвоживании, обычно связанном с желудочно-кишечными симптомами и иногда приводящем к гипотензии, обмороку или почечной недостаточности. Также сообщалось о синкопальных состояниях, ортостатической гипотензии и почечной недостаточности при отсутствии обезвоживания.
Совместный прием ритонавира с эрготамином или дигидроэрготамином был связан с острой токсичностью спорыньи, характеризующейся вазоспазмом и ишемией конечностей и других тканей, включая ЦНС.
Со стороны ССС. Сообщалось об развитии AV-блокады I, II и III степени, блокаде ветви правого пучка ( см «Меры предосторожности»).
Сообщалось о кардиологических и неврологических явлениях при совместном применении ритонавира с дизопирамидом, мексилетином, нефазодоном, флуоксетином и бета-адреноблокаторами. Нельзя исключить возможность их лекарственного взаимодействия.
Со стороны эндокринной системы. Сообщалось о развитии синдрома Кушинга и подавлении функции надпочечников при совместном применении ритонавира и флутиказона пропионата или будесонида.
Со стороны нервной системы. Имеются пострегистрационные сообщения о развитии судорог.
Со стороны кожи и подкожных тканей. Сообщалось о случаях развития токсического эпидермального некролиза.
Interaction
Совместное применение ритонавира с некоторыми классами ЛС, включая седативные сновтворные, антиаритмические ЛС или препараты алкалоидов спорыньи, может привести к потенциально серьезным и/или опасным для жизни побочным реакциям из-за возможного влияния ритонавира на печеночный метаболизм этих ЛС. Перед назначением ритонавира или при назначении других ЛС пациентам, уже принимающим ритонавир, следует проанализировать свойства принимаемых ими препаратов ( см «Противопоказания» и «Меры предосторожности»).
При совместном применении ритонавира с другими ингибиторами протеазы (атазанавир, дарунавир, фосампренавир, саквинавир и типранавир) следует ознакомиться с полной информацией о назначении конкретного ингибитора протеазы, включая важную информацию о лекарственном взаимодействии.
Возможное влияние ритонавира на действие других ЛС.
Ритонавир является ингибитором изоферментов сYP3A и может повышать плазменные концентрации ЛС, которые в основном метаболизируются с участием сYP3A. ЛС, которые интенсивно метаболизируются сYP3A и имеют высокий уровень метаболизма первого прохождения, наиболее подвержены значительному увеличению AUC (более чем в 3 раза) при совместном применении с ритонавиром. Поэтому совместное назначение ритонавира с ЛС, клиренс которых сильно зависит от сYP3A и для которых повышенные концентрации в плазме крови связаны с серьезными и/или угрожающими жизни реакциями, противопоказано. Совместное назначение с другими субстратами сYP3A может потребовать корректировки дозы или дополнительного контроля, как показано в таблице 6.
Ритонавир ингибирует сYP2D6 в меньшей степени. Совместное применение субстратов сYP2D6 и ритонавира может привести к увеличению (до 2 раз) AUC совместно применяемого ЛС, что, возможно, потребует пропорционального снижения его дозы. Ритонавир также индуцирует сYP3A, сYP1A2, сYP2C9, сYP2C19 и сYP2B6, а также другие ферменты, включая глюкуронозилтрансферазу.
Эти примеры не являются исчерпывающим перечнем всех возможных ЛС, которые могут взаимодействовать с ритонавиром. Для получения полной информации необходимо обратиться к соответствующим источникам информации.
Установленные и другие потенциально значимые лекарственные взаимодействия.
В таблице 6 приведен перечень установленных или потенциально клинически значимых лекарственных взаимодействий. Изменение дозы или режима приема рекомендовано на основании исследований установленного или прогнозируемого взаимодействия с учетом его величины.
Таблица 6.
Установленные и другие потенциально значимые лекарственные взаимодействия.
При совместном применении ритонавира с другими ингибиторами протеазы (атазанавир, дарунавир, фосампренавир, саквинавир и типранавир) следует ознакомиться с полной информацией о назначении конкретного ингибитора протеазы, включая важную информацию о лекарственном взаимодействии.
Возможное влияние ритонавира на действие других ЛС.
Ритонавир является ингибитором изоферментов сYP3A и может повышать плазменные концентрации ЛС, которые в основном метаболизируются с участием сYP3A. ЛС, которые интенсивно метаболизируются сYP3A и имеют высокий уровень метаболизма первого прохождения, наиболее подвержены значительному увеличению AUC (более чем в 3 раза) при совместном применении с ритонавиром. Поэтому совместное назначение ритонавира с ЛС, клиренс которых сильно зависит от сYP3A и для которых повышенные концентрации в плазме крови связаны с серьезными и/или угрожающими жизни реакциями, противопоказано. Совместное назначение с другими субстратами сYP3A может потребовать корректировки дозы или дополнительного контроля, как показано в таблице 6.
Ритонавир ингибирует сYP2D6 в меньшей степени. Совместное применение субстратов сYP2D6 и ритонавира может привести к увеличению (до 2 раз) AUC совместно применяемого ЛС, что, возможно, потребует пропорционального снижения его дозы. Ритонавир также индуцирует сYP3A, сYP1A2, сYP2C9, сYP2C19 и сYP2B6, а также другие ферменты, включая глюкуронозилтрансферазу.
Эти примеры не являются исчерпывающим перечнем всех возможных ЛС, которые могут взаимодействовать с ритонавиром. Для получения полной информации необходимо обратиться к соответствующим источникам информации.
Установленные и другие потенциально значимые лекарственные взаимодействия.
В таблице 6 приведен перечень установленных или потенциально клинически значимых лекарственных взаимодействий. Изменение дозы или режима приема рекомендовано на основании исследований установленного или прогнозируемого взаимодействия с учетом его величины.
Таблица 6.
Установленные и другие потенциально значимые лекарственные взаимодействия.
| Фармакологический класс сопутствующего ЛС и его название | Влияние на концентрацию ритонавира или сопутствующего ЛС | Клинический комментарий |
| Противовирусные ЛС | ||
| Ингибиторы протеазы ВИЧ-1 атазанавир, дарунавир, фосампренавир | ↑Ампренавир ↑Атазанавир ↑Дарунавир | Подробную информацию о совместном назначении с ритонавиром можно получить в инструкции по медицинскому применению фосампренавира, атазанавира, дарунавира |
| Ингибитор протеазы ВИЧ-1 индинавир | ↑Индинавир | Соответствующие дозы для этой комбинации с точки зрения эффективности и безопасности не установлены |
| Ингибитор протеазы ВИЧ-1 саквинавир | ↑Саквинавир | Подробную информацию о совместном применении саквинавира и ритонавира можно получить в инструкции по медицинскому применению саквинавира. Совместное применение саквинавира, ритонавира и рифампицина не рекомендуется из-за риска развития тяжелой гепатотоксичности (повышение уровня печеночных трансаминаз) |
| Ингибитор протеазы ВИЧ-1 типранавир | ↑Типранавир | Подробную информацию о совместном применении типранавира и ритонавира можно получить в инструкции по медицинскому применению типранавира |
| ННИОТ делавирдин | ↑Ритонавир | Соответствующие дозы этой комбинации с точки зрения безопасности и эффективности не установлены |
| Антагонист рецепторов сCR5 маравирок | ↑Маравирок | Подробную информацию о совместном применении маравирока и ритонавирсодержащих ингибиторов протеазы можно получить в инструкции по медицинскому применению маравирока |
| Ингибитор интегразы ралтегравир | ↓Ралтегравир | Влияние ритонавира на концентрацию ралтегравира при приеме ритонавира в дозах более 100 мг 2 раза в день не оценивалось, однако концентрация ралтегравира может снижаться при совместном приеме с ритонавиром |
| Другие ЛС | ||
| Антагонист альфа1-адренорецепторов алфузозин | ↑Алфузозин | Противопоказано из-за возможного развития гипотензии ( см «Противопоказания») |
| Антиангинальное ЛС ранолазин | ↑Ранолазин | Противопоказано в связи с возможностью возникновения серьезных и/или угрожающих жизни реакций ( см «Противопоказания») |
| Наркотические анальгетики трамадол, пропоксифен, метадон, фентанил | ↑Анальгетики ↓Метадон ↑Фентанил | При совместном приеме с ритонавиром может потребоваться снижение дозы этих ЛС. Может быть рассмотрен вопрос об увеличении дозы метадона. При одновременном приеме фентанила и ритонавира рекомендуется тщательный мониторинг терапевтических и побочных эффектов (включая потенциально смертельное угнетение дыхания) |
| Анестетик меперидин | ↓Меперидин ↑Нормеперидин (метаболит) | Увеличение дозы и длительное совместное применение меперидина и ритонавира не рекомендуется из-за повышения концентрации метаболита нормеперидина, который обладает как анальгетической активностью, так и стимулирующей ЦНС активностью (например, развитие судорог) |
| ЛС, применяемые для лечения алкоголизма дисульфирам, метронидазол | − | Препараты ритонавира, содержащие этанол, могут вызывать дисульфирамоподобные реакции при совместном приеме с дисульфирамом или другими ЛС, вызывающими такую реакцию (например, метронидазол) |
| Антиаритмические ЛС амиодарон, дронедарон, флекаинид, пропафенон, хинидин | ↑Антиаритмики | Совместное применение противопоказано из-за возможности возникновения сердечных аритмий ( см «Противопоказания») |
| Антиаритмические ЛС дизопирамид, лидокаин, мексилетин | ↑Антиаритмики | При совместном применении с ритонавиром рекомендуется соблюдать осторожность и по возможности контролировать терапевтическую концентрацию антиаритмических ЛС |
| Противоопухолевые ЛС абемациклиб, апалутамид, дазатиниб, энкорафениб, ибрутиниб, ивозидениб, нератиниб, нилотиниб, венетоклакс, винбластин, винкристин | ↑Противоопухолевые средства ↓Ритонавир (относится к взаимодействию с апалутамидом) | Совместное применение с апалутамидом противопоказано из-за потенциальной потери вирусологического ответа и возможного развития устойчивости к ритонавиру или к классу ингибиторов протеазы ( см «Противопоказания»). Следует избегать совместного применения энкорафениба или ивозидениба с ритонавиром из-за потенциального риска серьезных побочных явлений, таких как удлинение интервала QT. При необходимости совместного применения энкорафениба и ритонавира нужно изменить дозу в соответствии с рекомендациями, содержащимися в инструкции по медицинскому применению энкорафениба. При необходимости совместного применения ивозидениба и ритонавира следует уменьшить дозу ивозидениба до 250 мг 1 раз в день. Следует избегать совместного применения нератиниба, венетоклакса или ибрутиниба и ритонавира. Следует рассмотреть возможность временного прекращения приема ритонавирсодержащего антиретровирусного препарата у пациентов, у которых при одновременном приеме ритонавира с винкристином или винбластином развиваются значительные гематологические или желудочно-кишечные побочные реакции. Снижение дозы или корректировка интервала дозирования нилотиниба и дазатиниба может потребоваться для пациентов, которым требуется совместное применение с сильными ингибиторами сYP3A, такими как ритонавир. Следует ознакомиться с информацией о назначении нилотиниба и дазатиниба для получения инструкций по дозированию |
| Антикоагулянт варфарин | ↑↓Варфарин | В начале совместного применения ритонавира и варфарина рекомендуется частый контроль МНО |
| Антикоагулянт ривароксабан | ↑Ривароксабан | Следует избегать одновременного применения ривароксабана и ритонавира. Совместное назначение ритонавира и ривароксабана может привести к риску усиления кровотечения |
| Противосудорожные ЛС карбамазепин, клоназепам, этосуксимид | ↑Противосудорожные ЛС | При совместном применении с ритонавиром может потребоваться снижение дозы этих ЛС и по возможности рекомендуется мониторинг их терапевтической концентрации |
| Противосудорожные ЛС дивалпроэкс, ламотриджин, фенитоин | ↓Противосудорожные ЛС | При совместном приеме с ритонавиром может потребоваться увеличение дозы этих ЛС и по возможности рекомендуется мониторинг их терапевтической концентрации |
| Антидепрессанты: нефазодон, СИОЗС (например, флуоксетин, пароксетин), трициклические антидепрессанты (например, амитриптилин, нортриптилин) | ↑Антидепрессанты | При совместном приеме с ритонавиром может потребоваться снижение дозы этих ЛС |
| Антидепрессант бупропион | ↓Бупропион ↓Активный метаболит гидроксибупропион | Пациенты, одновременно принимающие ритонавир и бупропион, должны находиться под наблюдением на предмет адекватного клинического ответа на бупропион |
| Антидепрессант дезипрамин | ↑Дезипрамин | Рекомендуется снижение дозировки и контроль концентрации дезипрамина в крови |
| Антидепрессант тразодон | ↑Тразодон | При совместном применении тразодона и ритонавира наблюдались такие побочные реакции, как тошнота, головокружение, гипотония и обморок. Следует рассмотреть возможность применения более низкой дозы тразодона |
| Противорвотное средство дронабинол | ↑Дронабинол | При совместном приеме с ритонавиром может потребоваться снижение дозы дронабинола |
| Противогрибковые ЛС кетоконазол, итраконазол, вориконазол | ↑Кетоконазол ↑Итраконазол ↓Вориконазол | Высокие дозы кетоконазола или итраконазола (более 200 мг/сут) не рекомендуются. Совместное применение вориконазола и ритонавира в дозах 400 мг каждые 12 ч или более противопоказано из-за возможности потери противогрибкового эффекта ( см «Противопоказания»). Совместного назначения вориконазола и ритонавира в дозе 100 мг следует избегать, если только оценка соотношения польза-риск не оправдывает применение вориконазола |
| Противоподагрическое ЛС колхицин | ↑Колхицин | Совместное применение противопоказано из-за возможности возникновения серьезных и/или опасных для жизни реакций у пациентов с почечной и/или печеночной недостаточностью ( см «Противопоказания»). Для пациентов с нормальной почечной или печеночной функцией рекомендуются следующие режимы дозирования при совместном применении с ритонавиром. Лечение вспышек подагры: разовая доза 0,6 мг, затем 0,3 мг через 1 Дозу следует повторить не ранее чем через 3 дня. Профилактика вспышек подагры: если первоначальная схема приема колхицина составляла 0,6 мг 2 раза в день, ее следует скорректировать до 0,3 мг 1 раз в день. Если первоначальный режим приема колхицина составлял 0,6 мг 1 раз в день, дозу следует скорректировать до 0,3 мг 1 раз в 2 дня. Лечение семейной средиземноморской лихорадки: максимальная суточная доза 0,6 мг (можно принимать по 0,3 мг 2 раза в день) |
| Противоинфекционное ЛС кларитромицин | ↑Кларитромицин | Для пациентов с почечной недостаточностью следует корректировать дозу кларитромицина следующим образом: - при сl креатинина от 30 до 60 мл/мин дозу необходимо уменьшить на 50%; - при сl креатинина менее 30 мл/мин доза должна быть снижена на 75%. Корректировка дозы для пациентов с нормальной функцией почек не требуется |
| Антимикобактериальное ЛС бедаквилин | ↑Бедаквилин | Бедаквилин следует применять с ритонавиром только в том случае, если польза от совместного приема перевешивает риск |
| Противотуберкулезное ЛС рифабутин | ↑Рифабутин и метаболит рифабутина | Рекомендуется снизить дозу рифабутина по крайней мере на три четверти от обычной дозы 300 мг в день (например, 150 мг каждый второй день или 3 раза в неделю). Может потребоваться дальнейшее снижение дозы |
| Противотуберкулезное ЛС рифампицин | ↓Ритонавир | Совместное применение может привести к потере противовирусного эффекта. Следует рассмотреть возможность применения альтернативных противотуберкулезных средств, таких как рифабутин |
| Противопаразитарное средство атоваквон | ↓Атоваквон | Клиническое значение неизвестно, однако может потребоваться увеличение дозы атоваквона |
| Противопаразитарное средство хинин | ↑Хинин | При совместном применении с ритонавиром может потребоваться снижение дозы хинина |
| Нейролептики луразидон, пимозид | ↑Луразидон ↑Пимозид | Совместное применение противопоказано из-за возможности развития серьезных и/или угрожающих жизни реакций, таких как сердечная аритмия ( см «Противопоказания»). |
| Нейролептики перфеназин, рисперидон, тиоридазин | ↑Нейролептики | При совместном применении с ритонавиром может потребоваться снижение дозы этих ЛС |
| Нейролептик кветиапин | ↑Кветиапин | В начале применения ритонавира у пациентов, принимающих кветиапин, следует рассмотреть возможность альтернативной антиретровирусной терапии, чтобы избежать увеличения экспозиции кветиапина. Если совместное назначение необходимо, следует уменьшить дозу кветиапина до 1/6 от текущей и контролировать побочные реакции, связанные с кветиапином. Рекомендации по мониторингу побочных реакций указаны в инструкции по медицинскому применению кветиапина. В начале применения кветиапина у пациентов, принимающих ритонавир, следует ознакомиться с информацией по назначению кветиапина, его начальной дозе и ее титрованию |
| Бета-адреноблокаторы метопролол, тимолол | ↑Бета-блокаторы | Следует соблюдать осторожность и рекомендовать клиническое наблюдение за пациентами. При совместном приеме с ритонавиром может потребоваться снижение дозы этих ЛС |
| Бронхолитическое средство теофиллин | ↓Теофиллин | Может потребоваться увеличение дозы теофиллина, следует рассмотреть возможность терапевтического мониторинга |
| БКК дилтиазем, нифедипин, верапамил | ↑БКК | Следует соблюдать осторожность и рекомендуется клиническое наблюдение за пациентами. При совместном приеме с ритонавиром может потребоваться снижение дозы этих ЛС |
| Дигоксин | ↑Дигоксин | Одновременный прием ритонавира и дигоксина может привести к повышению уровня дигоксина в крови. При совместном назначении ритонавира с дигоксином следует соблюдать осторожность и проводить соответствующий мониторинг уровня дигоксина в сыворотке крови |
| Антагонист рецепторов эндотелина бозентан | ↑Бозентан | При совместном применении бозентана у пациентов, получающих ритонавир не менее 10 дней, начинать прием бозентана следует с дозы 62,5 мг 1 раз в день или каждые 2 дня, в зависимости от индивидуальной переносимости. При назначении ритонавира пациентам, принимающим бозентан, следует прекратить прием бозентана не менее чем за 36 ч до начала приема ритонавира. По истечении как минимум 10 дней после начала приема ритонавира следует возобновить прием бозентана в дозе 62,5 мг 1 раз в день или через день, в зависимости от индивидуальной переносимости |
| Антагонист рецепторов ГнРГ элаголикс | ↑Элаголикс ↓Ритонавир | Не рекомендуется одновременное применение элаголикса в дозе 200 мг 2 раза в день и ритонавира в течение более 1 мес из-за потенциального риска побочных явлений, таких как потеря костной массы и повышение уровня печеночных трансаминаз. Следует ограничиться одновременным применением элаголикса в дозе 150 мг 1 раз в день и ритонавира до 6 мес |
| Производные спорыньи дигидроэрготамин, эрготамин, метилэргоновин | ↑Производные спорыньи | Совместное применение противопоказано в связи с возможностью острой токсичности производного спорыньи, характеризующейся вазоспазмом и ишемией конечностей и других тканей, включая ЦНС ( см «Противопоказания») |
| Средство для улучшения моторики ЖКТ цизаприд | ↑Цизаприд | Совместное применение противопоказано из-за возможности возникновения сердечных аритмий ( см «Противопоказания») |
| Противовирусные средства прямого действия против гепатита С глекапревир + пибрентасвир, симепревир | ↑Глекапревир ↑Пибрентасвир ↑Симепревир | Не рекомендуется совместное применение ритонавира и комбинации глекапревир +пибрентасвир или симепревира |
| Растительные ЛС на основе зверобоя продырявленного (Hypericum perforatum) | ↓Ритонавир | Совместное применение противопоказано из-за потенциальной потери противовирусного эффекта и возможной резистентности к ритонавиру или к ЛС класса ингибиторов протеазы ( см «Противопоказания») |
| Гиполипидемические средства класса ингибиторов ГМГ-КоА-редуктазы ловастатин, симвастатин, аторвастатин, розувастатин | ↑Ловастатин ↑Симвастатин ↑Аторвастатин ↑Розувастатин | Совместное применение ритонавира и ловастатина или симвастатина противопоказано в связи с возможностью развития миопатии, включая рабдомиолиз ( см «Противопоказания»). Следует тщательно титровать дозу аторвастатина и розувастатина и использовать самую низкую необходимую дозу. Если ритонавир используется с другим ингибитором протеазы, следует ознакомиться с инструкцией по медицинскому применению сопутствующего ингибитора протеазы для получения подробной информации о совместном приеме с аторвастатином и розувастатином |
| Ингибитор микросомального белка-переносчика триглицеридов ломитапид | ↑Ломитапид | Ломитапид является чувствительным субстратом сYP3A4. Ингибиторы сYP3A4 увеличивают экспозицию ломитапида, причем сильные ингибиторы увеличивают экспозицию примерно в 27 раз. Одновременное применение умеренных или сильных ингибиторов сYP3A4 с ломитапидом противопоказано из-за возможного развития гепатотоксичности ( см «Противопоказания») |
| Иммунодепрессанты циклоспорин, такролимус, сиролимус | ↑Иммунодепрессанты | При совместном применении с ритонавиром рекомендуется контроль концентрации иммунодепрессантов в крови |
| Ингибиторы киназы: фостаматиниб ( см также противоопухолевые ЛС выше) | ↑Метаболит фостаматиниба R406 | Следует контролировать проявления дозозависимой токсичности вещества R406, приводящей к таким побочным реакциям, как гепатотоксичность и нейтропения. Может потребоваться снижение дозы фостаматиниба |
| Агонист бета-адренорецепторов длительного действия салметерол | ↑Сальметерол | Одновременный применение салметерола и ритонавира не рекомендуется. Это сочетание может привести к повышению риска развития сердечно-сосудистых побочных реакций, связанных с салметеролом, включая удлинение интервала QT, учащенное сердцебиение и синусовую тахикардию |
| Пероральные контрацептивы или контрацептивный пластырь: этинилэстрадиол | ↓Этинилэстрадиол | Следует рассмотреть альтернативные методы контрацепции |
| Ингибиторы ФДЭ-5 аванафил, силденафил, тадалафил, варденафил | ↑Аванафил ↑Силденафил ↑Тадалафил ↑Варденафил | Противопоказано совместное применение с силденафилом, применяемым для лечения легочной артериальной гипертензии из-за возможности возникновения побочных реакций, связанных с силденафилом, включая аномалии зрения, гипотензию, длительную эрекцию и обмороки ( см «Противопоказания»). Не следует применять ритонавир совместно с аванафилом, поскольку безопасный и эффективный режим дозирования аванафила не установлен. Следует соблюдать особую осторожность при назначении силденафила, тадалафила или варденафила пациентам, принимающим ритонавир. Совместное назначение ритонавира с этими ЛС может привести к увеличению количества побочных явлений, связанных с ингибиторами ФЭД-5, включая гипотензию, обмороки, изменения зрения и длительную эрекцию. Совместное применение с ингибиторами ФЭД-5 для лечения легочной артериальной гипертензии: - силденафил противопоказан; - при применении тадалафила с ритонавиром рекомендуется корректировка дозы. При совместном применении ритонавира и ингибиторов ФДЭ-5 для лечения эректильной дисфункции рекомендуется не превышать следующие дозы: силденафил 25 мг каждые 48 тадалафил 10 мг каждые 72 варденафил 2,5 мг каждые 72 Применение следует проводить под контролем побочных реакций |
| Седативные/снотворные средства буспирон, клоразепат, диазепам, эстазолам, флуразепам, золпидем | ↑Седативные/снотворные средства | При совместном применении с ритонавиром может потребоваться снижение дозы этих ЛС |
| Седативные/снотворные средства триазолам, мидазолам (перорально) | ↑Триазолам ↑Мидазолам | Совместное применение противопоказано из-за возможности длительной или повышенной седации или угнетения дыхания ( см «Противопоказания») |
| Седативные/снотворные средства: мидазолам (парентерально) | ↑Мидазолам | Совместное применение должно проводиться в условиях, обеспечивающих тщательный клинический мониторинг и соответствующее медицинское лечение в случае угнетения дыхания и/или длительной седации. Следует рассмотреть возможность снижения дозы мидазолама, особенно если назначается более чем однократная доза |
| Психостимулятор метамфетамин | ↑Метамфетамин | Следует соблюдать осторожность. При совместном применении с ритонавиром может потребоваться снижение дозы метамфетамина |
| Системные/ингаляционные/назальные/офтальмологические ГКС, например бетаметазон, будесонид, циклесонид, дексаметазон, флутиказон, метилпреднизолон, мометазон, преднизон, триамцинолон | ↑ГКС | Совместное применение ритонавира и ГКС, экспозиция которых значительно увеличивается под действием сильных ингибиторов сYP3A, может повысить риск развития синдрома Кушинга и супрессии надпочечников. Следует рассмотреть возможность применения альтернативных ГКС, включая беклометазон и преднизолон, на фармакокинетику и/или фармакодинамику которых сильные ингибиторы сYP3A влияют меньше, чем на другие изученные ГКС, особенно при длительном применении |
Overdose
Симптомы. Опыт острой передозировки ритонавира у людей ограничен. Один пациент в ходе клинических исследований принимал ритонавир в дозе1500 мг/сут в течение двух дней. Пациент сообщил о развитии парестезии, которая прошла после снижения дозы. Зарегистрирован пострегистрационный случай почечной недостаточности с эозинофилией при передозировке ритонавира.
Было установлено, что летальная доза у крыс и мышей превышает МРДЧ приблизительно в 20 и 10 раз соответственно.
Лечение. Состоит из общих поддерживающих мер, включая мониторинг жизненно важных функций и наблюдение за клиническим состоянием пациента. Специфического антидота при передозировке ритонавира не существует. При наличии показаний удаление невсосавшегося ритонавира должно быть достигнуто промыванием желудка, при этом следует соблюдать обычные меры предосторожности для поддержания проходимости дыхательных путей. Для выведения неабсорбированного ритонавира можно также применять активированный уголь. Поскольку ритонавир интенсивно метаболизируется печенью и в высокой степени связывается с белками плазмы, диализ вряд ли будет полезен для его значительного выведения. Однако диализ может удалить этанол и пропиленгликоль в случае передозировки ритонавира в виде раствора для приема внутрь.
Было установлено, что летальная доза у крыс и мышей превышает МРДЧ приблизительно в 20 и 10 раз соответственно.
Лечение. Состоит из общих поддерживающих мер, включая мониторинг жизненно важных функций и наблюдение за клиническим состоянием пациента. Специфического антидота при передозировке ритонавира не существует. При наличии показаний удаление невсосавшегося ритонавира должно быть достигнуто промыванием желудка, при этом следует соблюдать обычные меры предосторожности для поддержания проходимости дыхательных путей. Для выведения неабсорбированного ритонавира можно также применять активированный уголь. Поскольку ритонавир интенсивно метаболизируется печенью и в высокой степени связывается с белками плазмы, диализ вряд ли будет полезен для его значительного выведения. Однако диализ может удалить этанол и пропиленгликоль в случае передозировки ритонавира в виде раствора для приема внутрь.
Method of drug use and dosage
Перорально, во время еды, в комбинации с другими антиретровирусными ЛС.
Application precautions
Риск развития серьезных побочных реакций из-за взаимодействия с другими ЛС.
Применение ритонавира (ингибитор сYP3A) у пациентов, получающих ЛС, метаболизируемые сYP3A, или применение ЛС, метаболизируемых с участием сYP3A, у пациентов, получающих ритонавир, может повысить концентрацию этих ЛС в плазме крови. Применение ингибиторов или индукторов сYP3A может увеличить или уменьшить концентрацию ритонавира в крови соответственно. Эти взаимодействия могут привести к развитию клинически значимых побочных реакций, потенциально приводящих к тяжелым, угрожающим жизни или летальным исходам или к потере терапевтического эффекта ритонавира и возможному развитию резистентности.
Рекомендации по предотвращению или устранению известных и возможных значимых лекарственных взаимодействий, включая корректировку дозы, приведены в таблице 6 ( см «Взаимодействие»).
Токсичность у недоношенных новорожденных.
Раствор ритонавира для приема внутрь может содержать этанол и пропиленгликоль. Недоношенные новорожденные могут подвергаться повышенному риску возникновения побочных реакций, связанных с пропиленгликолем, из-за снижения способности метаболизировать пропиленгликоль, что приводит к его накоплению. Пострегистрационные случаи угрожающей жизни сердечной токсичности (включая полную AV-блокаду, брадикардию и кардиомиопатию), молочнокислого ацидоза, острой почечной недостаточности, угнетения ЦНС и респираторных осложнений, приводящих к смерти, были зарегистрированы главным образом у недоношенных новорожденных, получавших раствор комбинации лопинавир + ритонавир, содержащий в качестве вспомогательных веществ этанол и пропиленгликоль.
Раствор ритонавира для приема внутрь не следует применять у недоношенных новорожденных в ближайшем постнатальном периоде из-за возможных токсических эффектов. Однако, если польза от применения этого раствора для лечения ВИЧ-инфекции у новорожденных перевешивает потенциальные риски, следует тщательно наблюдать за состоянием новорожденных на предмет повышения осмоляльности и уровня креатинина в сыворотке крови, а также токсичности, связанной с применением ритонавира, включая гиперосмоляльность с молочнокислым ацидозом или без него, почечную токсичность, угнетение ЦНС (включая ступор, кому и апноэ), судороги, гипотонию, сердечную аритмию и изменения ЭКГ, а также гемолиз.
Гепатотоксичность.
У пациентов, принимавших ритонавир в монотерапии или в комбинации с другими антиретровирусными ЛС наблюдались повышение уровня печеночных трансаминаз более чем в 5×ВГН, клинический гепатит и желтуха. Риск повышения уровня трансаминаз повышен у пациентов с гепатитом В или С. Поэтому следует соблюдать осторожность при назначении ритонавира пациентам с заболеваниями печени, изменениями активности ферментов печени или гепатитом. У таких пациентов, особенно в течение первых 3 мес применения ритонавира, следует проводить более частый контроль уровня АСТ и АЛТ.
Имеются пострегистрационные сообщения о развитии печеночной дисфункции, включая летальные исходы. Как правило, эти сообщения поступали от пациентов, принимающих большое количество сопутствующих ЛС и/или больных СПИДом на поздней стадии.
Панкреатит.
У пациентов, получавших ритонавир, наблюдалось развитие панкреатита, в тч у тех, у кого развилась гипертриглицеридемия. В некоторых случаях сообщалось о летальном исходе. Пациенты с прогрессирующей ВИЧ-инфекцией могут подвергаться повышенному риску повышения уровня триглицеридов и развития панкреатита. Панкреатит следует рассматривать при наличии клинических симптомов (тошнота, рвота, боль в животе) или отклонений в лабораторных показателях (например, повышение уровня липазы или амилазы в сыворотке крови), свидетельствующих о панкреатите. Следует обследовать пациентов с такими признаками или симптомами и прекратить применение ритонавира, если поставлен диагноз «панкреатит».
Аллергические реакции/реакции гиперчувствительности.
Сообщалось об аллергических реакциях, включая крапивницу, легкие кожные высыпания, бронхоспазм и ангионевротический отек. Также сообщалось о случаях развития анафилаксии, токсического эпидермального некролиза и синдрома Стивенса-Джонсона. При развитии тяжелых реакций следует прекратить лечение.
Удлинение интервала PR.
Применение ритонавира приводит к удлинению интервала PR у некоторых пациентов. Сообщалось о случаях возникновения AV-блокады II или III степени.
Следует соблюдать осторожность при применении ритонавира у пациентов со структурными аномалиями сердца, предшествующими нарушениям проводящей системы сердца, ИБС, кардиомиопатиями, поскольку у таких пациентов может быть повышен риск развития нарушений сердечной проводимости.
Влияние совместного применения ритонавира и других ЛС, способствующих удлинению интервала PR (включая БКК, бета-адреноблокаторы, дигоксин и атазанавир), на интервал PR не оценивалось. Поэтому такое применение следует проводить с осторожностью, особенно с применением ЛС, метаболизирующихся с участием сYP3A. Рекомендуется клинический мониторинг.
Нарушения липидного обмена.
Применение ритонавира в монотерапии или в комбинации с саквинавиром приводило к значительному повышению концентрации общего Хс и триглицеридов в крови. До начала применения ритонавира и периодически во время терапии следует проводить анализ на триглицериды и Хс. Лечение нарушений липидного обмена следует проводить в соответствии с клиническими показаниями, принимая во внимание потенциальные взаимодействия ритонавира и ингибиторов ГМГ-КоА-редуктазы ( см «Противопоказания и «Взаимодействие»).
Сахарный диабет/гипергликемия.
В период пострегистрационных наблюдений у ВИЧ-инфицированных пациентов, получавших ингибиторы протеазы, сообщалось о случаях начала сахарного диабета, обострения ранее существовавшего сахарного диабета и развития гипергликемии. Некоторым пациентам для лечения потребовалось введение или корректировка дозы инсулина или пероральных гипогликемических ЛС. В некоторых случаях возникал диабетический кетоацидоз. У пациентов, прекративших терапию ингибиторами протеазы, в некоторых случаях сохранялась гипергликемия. Поскольку сообщения об этих событиях поступали в добровольном порядке в ходе клинической практики, оценить их частоту невозможно, а причинно-следственная связь между применением ингибиторов протеазы и этими событиями не установлена. Следует рассмотреть возможность мониторинга гипергликемии, начала сахарного диабета или обострения сахарного диабета у пациентов, получающих ритонавир.
Синдром восстановления иммунитета.
Сообщалось о синдроме восстановления иммунитета у ВИЧ-инфицированных пациентов, получавших комбинированную антиретровирусную терапию, включая применение ритонавира. На начальном этапе комбинированной антиретровирусной терапии у пациентов, чья иммунная система реагирует, может развиться воспалительная реакция на индолентные или остаточные оппортунистические инфекции (такие как инфекция Mycobacterium avium, ЦМВ-инфекция, пневмония Pneumocystis jiroveci или туберкулез), что может потребовать дальнейшего обследования и лечения.
Сообщалось, что аутоиммунные расстройства, такие как болезнь Грейвса, полимиозит и синдром Гийена-Барре, также возникают в условиях восстановления иммунитета, однако время их возникновения более изменчиво и может наступить через много месяцев после начала лечения.
Перераспределение жира.
Перераспределение/накопление жира в организме, включая центральное ожирение, увеличение дорсоцервикального жира (горб буйвола), периферическое истощение, истощение лица, увеличение молочных желез и кушингоидный вид наблюдались у пациентов, получающих антиретровирусную терапию. Механизм и долгосрочные последствия этих явлений в настоящее время неизвестны. Причинно-следственная связь не установлена.
Пациенты с гемофилией.
Имеются сообщения о развитии повышенной кровоточивости, включая спонтанные гематомы кожи и гемартроз, у пациентов с гемофилией типа А и В, получавших ингибиторы протеазы. Некоторым пациентам вводили дополнительно фактор VIII. Более чем в половине случаев лечение ингибиторами протеазы было продолжено или возобновлено. Причинно-следственная связь между терапией ингибиторами протеазы и этими событиями не установлена.
Устойчивость/перекрестная резистентность.
Наблюдалась различная степень перекрестной резистентности к ингибиторам протеазы. Продолжение приема ритонавира по 600 мг 2 раза в день после потери вирусной супрессии может увеличить вероятность перекрестной резистентности к другим ингибиторам протеазы.
Результаты лабораторного обследования.
Применение ритонавира приводит к повышению уровня триглицеридов, Хс, АСТ, АЛТ, ГГТ, КФК и мочевой кислоты. Соответствующие лабораторные обследования следует проводить до начала терапии ритонавиром и периодически во время лечения или при появлении каких-либо клинических признаков или симптомов.
Особые группы населения.
Дети. У ВИЧ-инфицированных пациентов от 1 мес до 21 года противовирусная активность и профиль побочных реакций, наблюдавшиеся во время клинических исследований и в период пострегистрационных наблюдений, были аналогичны таковым у взрослых пациентов.
Пожилой возраст. Клинические исследования ритонавира не включали достаточного количества испытуемых в возрасте 65 лет и старше, чтобы определить, отличается ли их реакция от реакции более молодых людей. В целом подбор дозы для пожилого пациента должен быть осторожным, обычно начинаться с нижнего предела диапазона дозирования, что отражает бóльшую частоту снижения печеночной, почечной или сердечной функции у пожилых людей, а также наличие сопутствующих заболеваний или другой лекарственной терапии.
Печеночная недостаточность. Корректировка дозы ритонавира для пациентов с легкой (класс А по Чайлд-Пью) или умеренной (класс В по Чайлд-Пью) печеночной недостаточностью не требуется. Фармакокинетические данные и данные о безопасности применения ритонавира у пациентов с тяжелой печеночной недостаточностью (класс С по Чайлд-Пью) отсутствуют, поэтому ритонавир не рекомендуется применять у пациентов с тяжелой печеночной недостаточностью.
Применение ритонавира (ингибитор сYP3A) у пациентов, получающих ЛС, метаболизируемые сYP3A, или применение ЛС, метаболизируемых с участием сYP3A, у пациентов, получающих ритонавир, может повысить концентрацию этих ЛС в плазме крови. Применение ингибиторов или индукторов сYP3A может увеличить или уменьшить концентрацию ритонавира в крови соответственно. Эти взаимодействия могут привести к развитию клинически значимых побочных реакций, потенциально приводящих к тяжелым, угрожающим жизни или летальным исходам или к потере терапевтического эффекта ритонавира и возможному развитию резистентности.
Рекомендации по предотвращению или устранению известных и возможных значимых лекарственных взаимодействий, включая корректировку дозы, приведены в таблице 6 ( см «Взаимодействие»).
Токсичность у недоношенных новорожденных.
Раствор ритонавира для приема внутрь может содержать этанол и пропиленгликоль. Недоношенные новорожденные могут подвергаться повышенному риску возникновения побочных реакций, связанных с пропиленгликолем, из-за снижения способности метаболизировать пропиленгликоль, что приводит к его накоплению. Пострегистрационные случаи угрожающей жизни сердечной токсичности (включая полную AV-блокаду, брадикардию и кардиомиопатию), молочнокислого ацидоза, острой почечной недостаточности, угнетения ЦНС и респираторных осложнений, приводящих к смерти, были зарегистрированы главным образом у недоношенных новорожденных, получавших раствор комбинации лопинавир + ритонавир, содержащий в качестве вспомогательных веществ этанол и пропиленгликоль.
Раствор ритонавира для приема внутрь не следует применять у недоношенных новорожденных в ближайшем постнатальном периоде из-за возможных токсических эффектов. Однако, если польза от применения этого раствора для лечения ВИЧ-инфекции у новорожденных перевешивает потенциальные риски, следует тщательно наблюдать за состоянием новорожденных на предмет повышения осмоляльности и уровня креатинина в сыворотке крови, а также токсичности, связанной с применением ритонавира, включая гиперосмоляльность с молочнокислым ацидозом или без него, почечную токсичность, угнетение ЦНС (включая ступор, кому и апноэ), судороги, гипотонию, сердечную аритмию и изменения ЭКГ, а также гемолиз.
Гепатотоксичность.
У пациентов, принимавших ритонавир в монотерапии или в комбинации с другими антиретровирусными ЛС наблюдались повышение уровня печеночных трансаминаз более чем в 5×ВГН, клинический гепатит и желтуха. Риск повышения уровня трансаминаз повышен у пациентов с гепатитом В или С. Поэтому следует соблюдать осторожность при назначении ритонавира пациентам с заболеваниями печени, изменениями активности ферментов печени или гепатитом. У таких пациентов, особенно в течение первых 3 мес применения ритонавира, следует проводить более частый контроль уровня АСТ и АЛТ.
Имеются пострегистрационные сообщения о развитии печеночной дисфункции, включая летальные исходы. Как правило, эти сообщения поступали от пациентов, принимающих большое количество сопутствующих ЛС и/или больных СПИДом на поздней стадии.
Панкреатит.
У пациентов, получавших ритонавир, наблюдалось развитие панкреатита, в тч у тех, у кого развилась гипертриглицеридемия. В некоторых случаях сообщалось о летальном исходе. Пациенты с прогрессирующей ВИЧ-инфекцией могут подвергаться повышенному риску повышения уровня триглицеридов и развития панкреатита. Панкреатит следует рассматривать при наличии клинических симптомов (тошнота, рвота, боль в животе) или отклонений в лабораторных показателях (например, повышение уровня липазы или амилазы в сыворотке крови), свидетельствующих о панкреатите. Следует обследовать пациентов с такими признаками или симптомами и прекратить применение ритонавира, если поставлен диагноз «панкреатит».
Аллергические реакции/реакции гиперчувствительности.
Сообщалось об аллергических реакциях, включая крапивницу, легкие кожные высыпания, бронхоспазм и ангионевротический отек. Также сообщалось о случаях развития анафилаксии, токсического эпидермального некролиза и синдрома Стивенса-Джонсона. При развитии тяжелых реакций следует прекратить лечение.
Удлинение интервала PR.
Применение ритонавира приводит к удлинению интервала PR у некоторых пациентов. Сообщалось о случаях возникновения AV-блокады II или III степени.
Следует соблюдать осторожность при применении ритонавира у пациентов со структурными аномалиями сердца, предшествующими нарушениям проводящей системы сердца, ИБС, кардиомиопатиями, поскольку у таких пациентов может быть повышен риск развития нарушений сердечной проводимости.
Влияние совместного применения ритонавира и других ЛС, способствующих удлинению интервала PR (включая БКК, бета-адреноблокаторы, дигоксин и атазанавир), на интервал PR не оценивалось. Поэтому такое применение следует проводить с осторожностью, особенно с применением ЛС, метаболизирующихся с участием сYP3A. Рекомендуется клинический мониторинг.
Нарушения липидного обмена.
Применение ритонавира в монотерапии или в комбинации с саквинавиром приводило к значительному повышению концентрации общего Хс и триглицеридов в крови. До начала применения ритонавира и периодически во время терапии следует проводить анализ на триглицериды и Хс. Лечение нарушений липидного обмена следует проводить в соответствии с клиническими показаниями, принимая во внимание потенциальные взаимодействия ритонавира и ингибиторов ГМГ-КоА-редуктазы ( см «Противопоказания и «Взаимодействие»).
Сахарный диабет/гипергликемия.
В период пострегистрационных наблюдений у ВИЧ-инфицированных пациентов, получавших ингибиторы протеазы, сообщалось о случаях начала сахарного диабета, обострения ранее существовавшего сахарного диабета и развития гипергликемии. Некоторым пациентам для лечения потребовалось введение или корректировка дозы инсулина или пероральных гипогликемических ЛС. В некоторых случаях возникал диабетический кетоацидоз. У пациентов, прекративших терапию ингибиторами протеазы, в некоторых случаях сохранялась гипергликемия. Поскольку сообщения об этих событиях поступали в добровольном порядке в ходе клинической практики, оценить их частоту невозможно, а причинно-следственная связь между применением ингибиторов протеазы и этими событиями не установлена. Следует рассмотреть возможность мониторинга гипергликемии, начала сахарного диабета или обострения сахарного диабета у пациентов, получающих ритонавир.
Синдром восстановления иммунитета.
Сообщалось о синдроме восстановления иммунитета у ВИЧ-инфицированных пациентов, получавших комбинированную антиретровирусную терапию, включая применение ритонавира. На начальном этапе комбинированной антиретровирусной терапии у пациентов, чья иммунная система реагирует, может развиться воспалительная реакция на индолентные или остаточные оппортунистические инфекции (такие как инфекция Mycobacterium avium, ЦМВ-инфекция, пневмония Pneumocystis jiroveci или туберкулез), что может потребовать дальнейшего обследования и лечения.
Сообщалось, что аутоиммунные расстройства, такие как болезнь Грейвса, полимиозит и синдром Гийена-Барре, также возникают в условиях восстановления иммунитета, однако время их возникновения более изменчиво и может наступить через много месяцев после начала лечения.
Перераспределение жира.
Перераспределение/накопление жира в организме, включая центральное ожирение, увеличение дорсоцервикального жира (горб буйвола), периферическое истощение, истощение лица, увеличение молочных желез и кушингоидный вид наблюдались у пациентов, получающих антиретровирусную терапию. Механизм и долгосрочные последствия этих явлений в настоящее время неизвестны. Причинно-следственная связь не установлена.
Пациенты с гемофилией.
Имеются сообщения о развитии повышенной кровоточивости, включая спонтанные гематомы кожи и гемартроз, у пациентов с гемофилией типа А и В, получавших ингибиторы протеазы. Некоторым пациентам вводили дополнительно фактор VIII. Более чем в половине случаев лечение ингибиторами протеазы было продолжено или возобновлено. Причинно-следственная связь между терапией ингибиторами протеазы и этими событиями не установлена.
Устойчивость/перекрестная резистентность.
Наблюдалась различная степень перекрестной резистентности к ингибиторам протеазы. Продолжение приема ритонавира по 600 мг 2 раза в день после потери вирусной супрессии может увеличить вероятность перекрестной резистентности к другим ингибиторам протеазы.
Результаты лабораторного обследования.
Применение ритонавира приводит к повышению уровня триглицеридов, Хс, АСТ, АЛТ, ГГТ, КФК и мочевой кислоты. Соответствующие лабораторные обследования следует проводить до начала терапии ритонавиром и периодически во время лечения или при появлении каких-либо клинических признаков или симптомов.
Особые группы населения.
Дети. У ВИЧ-инфицированных пациентов от 1 мес до 21 года противовирусная активность и профиль побочных реакций, наблюдавшиеся во время клинических исследований и в период пострегистрационных наблюдений, были аналогичны таковым у взрослых пациентов.
Пожилой возраст. Клинические исследования ритонавира не включали достаточного количества испытуемых в возрасте 65 лет и старше, чтобы определить, отличается ли их реакция от реакции более молодых людей. В целом подбор дозы для пожилого пациента должен быть осторожным, обычно начинаться с нижнего предела диапазона дозирования, что отражает бóльшую частоту снижения печеночной, почечной или сердечной функции у пожилых людей, а также наличие сопутствующих заболеваний или другой лекарственной терапии.
Печеночная недостаточность. Корректировка дозы ритонавира для пациентов с легкой (класс А по Чайлд-Пью) или умеренной (класс В по Чайлд-Пью) печеночной недостаточностью не требуется. Фармакокинетические данные и данные о безопасности применения ритонавира у пациентов с тяжелой печеночной недостаточностью (класс С по Чайлд-Пью) отсутствуют, поэтому ритонавир не рекомендуется применять у пациентов с тяжелой печеночной недостаточностью.
References
Www.fda.gov и www.rxlist.com, 2021.
Included in the composition
- 15€ Калидавир
- 38.5-39.4€ Norvir (2 firms)
- 46.3-80.9€ Kaletra (5 firms)
- 1499.3€ Viekira Pak (2 firms)
- — Atazor-R (Emcure Pharmaceuticals Ltd. )
- — Lopinavir+Ritonavir (5 firms)
- — Rinvir
- — Ritonavir (11 firms)
- — Ritonavir - TL (3 firms)
- — Ritonavir-100 (5 firms)
- — ЛОПИРИТА (2 firms)
- — Миробивир (Фармасинтез-Тюмень ООО )
- — Ритонавир ПСК (ПСК Фарма ООО )
- — Ритонавир-ФС (Фармасинтез-Тюмень ООО )
- — Скайвира
- — Экструдат лопинавир+ритонавир, 16.7%+ (AbbVie Deutschland GmbH & Co. KG )