Другие названия и синонимы
Boceprevir.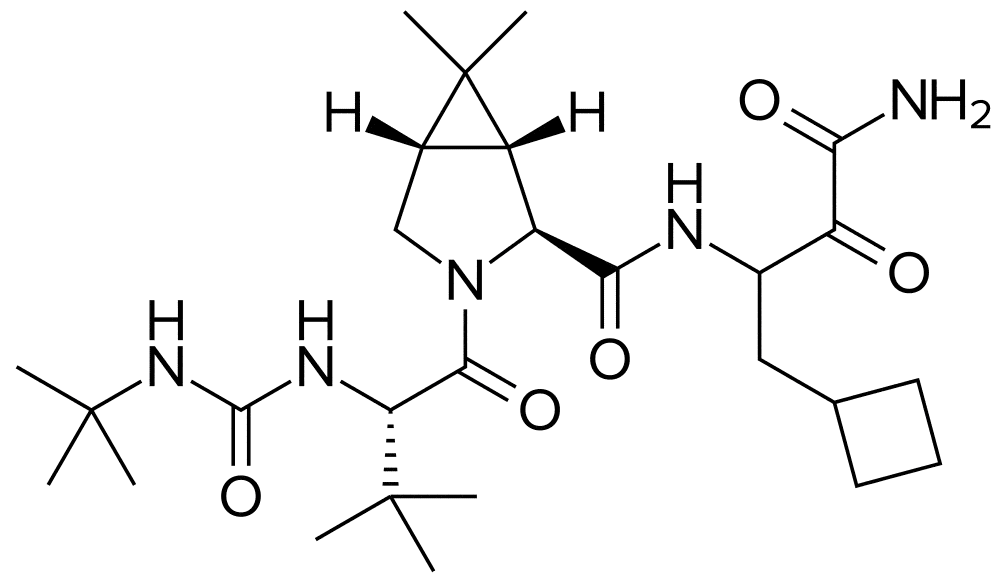
Фармакологическая группа
|
|
Латинское название
Boceprevirum ( вocepreviri).
Химическое название
(1R,5S)-N-[3-Амино-1-(циклобутилметил)-2,3-диоксопропил]-3-[2(S)-[[[(1,1-диметилэтил)амино]карбонил]амино]-3,3-диметил-1-оксобутил]-6,6-диметил-3-азабицикло[3.1.0]гексан-2(S)-карбоксамид.
Используется в лечении
Код CAS
394730-60-0.
Фармакологическое действие
Противовирусное.
Характеристика вещества
Противовирусное средство - ингибитор NS3 (non-structural - неструктурная) протеазы вируса гепатита С (ВГС).
Порошок от белого до почти белого цвета. Является смесью двух диастереоизомеров, которые быстро взаимопревращаются в плазме. Преобладающий диастереоизомер является фармакологически активным веществом, а другой диастереоизомер неактивен.
RxList.com.
Является ингибитором сериновой протеазы - неструктурного белка 3 (NS3) вируса гепатита С (HCV - ВГС).
Изготавливается в виде смеси двух диастереоизомеров в пропорции приблизительно 1:1. Аморфный порошок от белого до желтовато-белого цвета. Легко растворим в метаноле, этаноле и изопропаноле и слабо растворим в воде.
Порошок от белого до почти белого цвета. Является смесью двух диастереоизомеров, которые быстро взаимопревращаются в плазме. Преобладающий диастереоизомер является фармакологически активным веществом, а другой диастереоизомер неактивен.
RxList.com.
Является ингибитором сериновой протеазы - неструктурного белка 3 (NS3) вируса гепатита С (HCV - ВГС).
Изготавливается в виде смеси двух диастереоизомеров в пропорции приблизительно 1:1. Аморфный порошок от белого до желтовато-белого цвета. Легко растворим в метаноле, этаноле и изопропаноле и слабо растворим в воде.
Фармакодинамика
Фармакодинамика.
Боцепревир ковалентно, но обратимо связывается с альфа-кетоамидной функциональной группой активного центра сериновой протеазы NS3 (Ser139) ВГС, что приводит к ингибированию репликации вируса в инфицированных вирусом гепатита С клетках человека.
Противовирусная активность в клеточной культуре.
Противовирусную активность боцепревира оценивали биохимическим анализом, определяя связывание медленных ингибиторов NS3-протеазы, а также в системе репликона вируса гепатита С. Концентрации боцепревира, при которых наблюдали 50% (50IC50) и 90% (IС90) ингибирование вируса, составляли соответственно около 200 нМ и 400 нМ при 72-часовом исследовании в культуре клеток. Предполагается, что потеря PНK-репликона линейно зависит от времени воздействия боцепревира. Применение боцепревира в концентрации, соответствующей IC90, в течение 72 ч привело к снижению концентрации РНК в репликоне в 10 раз. Пролонгированная экспозиция привела к снижению концентрации РНК в репликоне в 100 раз к 15-му дню.
Оценка различных комбинаций боцепревира с интерфероном альфа-2b, которые приводили к 90% ингибированию РНК-репликона, показала аддитивный эффект, при этом никаких признаков синергии или антагонизма не было обнаружено.
Резистентность.
Резистентность вируса к боцепревиру оценивали на основании биохимического анализа и анализа репликонов. Биологическая активность боцепревира снижалась в 2-10 раз при наличии основных аминокислотных замен (RAVs-resistant-associated amino acid variants) V36M, T54A, R155K и V170A, определяющих резистентность. Снижение активности боцепревира более чем в 50 раз наблюдалось при наличии RAVs: А156Т и A156V. Следует отметить, что репликоны, несущие RAV А156Т, обладают меньшей активностью, чем репликоны, несущие другие RAVs. Кратность увеличения резистентности, обусловленная двойными RAVs, была приблизительно равна кратности увеличения резистентности к боцепревиру для отдельных RAVs.
По обобщенным данным исследования пациентов, ранее не получавших противовирусную терапию, и пациентов с неэффективной предшествующей терапией пэгинтерфероном альфа-2b и рибавирином в течение 4 нед с последующей терапией боцепревиром в дозе 800 мг 3 раза в день в комбинации с пэгинтерфероном альфа-2b и рибавирином, участвовавших в клинических исследованиях фазы 3, RAVs были обнаружены у 15% пациентов обеих групп и у 53% пациентов, получавших терапию боцепревиром и не достигших устойчивого вирусологического ответа. Наиболее часто (>25% пациентов) выявляемыми RAVs были V36M (61%) и RI55K (68%) - у пациентов, инфицированных вирусом генотипа 1а, и Т54А (42%), T54S (37%), A156S (26%), V170A (32%) - у пациентов, инфицированных вирусом генотипа lb. У 6% пациентов, принимавших боцепревир, чувствительность к интерферону (снижение >1-log10 вирусной нагрузки на 4 нед лечения) была связана с наличием меньшего количества RAVs по сравнению с 41% пациентов, у которых наблюдалось снижение вирусной нагрузки <1-log10 (низкая чувствительность к интерферону). После окончания курса терапии боцепревиром у пациентов были взяты образцы крови для анализа на наличие RAVs. У 31% пациентов более высокая чувствительность к интерферону была связана с обнаружением меньшего количества RAVs по сравнению с 68% пациентов, у которых на 4-й нед лечения наблюдалось снижение вирусной нагрузки <1-log10. При обобщенном анализе было показано, что количество RAVs перед началом терапии, по-видимому, не имело значимой связи с ответом на лечение у пациентов, принимавших боцепревир в комбинации с пэгинтерфероном альфа-2b и рибавирином.
Результаты продолжающегося долгосрочного наблюдения пациентов, не достигших устойчивого вирусологического ответа при медиане продолжительности наблюдения »2 лет, позволяют предположить, что после окончания терапии боцепревиром с течением времени вирус, содержащий RAVs, может вернуться к дикому типу.
Оценка влияния боцепревира на интервал QТс.
В рандомизированном многодозовом плацебо- и активно-контролируемом перекрестном исследовании проводили оценку боцепревира в отношении его возможного влияния на QT/QTc-интервалы при применении в сверхтерапевтических (1200 мг 3 раза в день) и терапевтических (800 мг 3 раза в день) дозах у 36 здоровых добровольцев.
Существенных различий в интервалах QTc между группами участников, получавших боцепревир и плацебо, не выявлено.
RxList.com.
Оценка влияния боцепревира на интервал QTc.
Влияние приема боцепревира в дозах 800 и 1200 мг на интервал QTc оценивалась в рандомизированном многодозовом плацебо- и активно контролируемом (моксифлоксацин 400 мг) исследовании с 4-компонентным перекрестным дизайном у 36 здоровых испытуемых. В этом исследовании, позволяющем выявить слабые эффекты, верхняя граница одностороннего ДИ 95% для максимального значения среднего различия показателей скорректированного базового уровня интервала QTc (по методу индивидуальной коррекции - QNcI) между группами применения активных ЛС и плацебо была <10 мс - порога, требующего внимания к величине изменения интервала QTc. Применение боцепревира в дозе 1200 мг приводило к увеличению его экспозиции на »15%, что не превышает экспозицию этого ЛС при совместном применении с сильными ингибиторами изофермента сYP3A4 или приеме боцепревира пациентами с тяжелой печеночной недостаточностью. Тем не менее, в данном исследовании очевидного дозозависимого изменения интервала QT от принимаемого боцепревира выявлено не было. Таким образом, не ожидается удлинение интервала QT при повышении экспозиции боцепревира.
Боцепревир ковалентно, но обратимо связывается с альфа-кетоамидной функциональной группой активного центра сериновой протеазы NS3 (Ser139) ВГС, что приводит к ингибированию репликации вируса в инфицированных вирусом гепатита С клетках человека.
Противовирусная активность в клеточной культуре.
Противовирусную активность боцепревира оценивали биохимическим анализом, определяя связывание медленных ингибиторов NS3-протеазы, а также в системе репликона вируса гепатита С. Концентрации боцепревира, при которых наблюдали 50% (50IC50) и 90% (IС90) ингибирование вируса, составляли соответственно около 200 нМ и 400 нМ при 72-часовом исследовании в культуре клеток. Предполагается, что потеря PНK-репликона линейно зависит от времени воздействия боцепревира. Применение боцепревира в концентрации, соответствующей IC90, в течение 72 ч привело к снижению концентрации РНК в репликоне в 10 раз. Пролонгированная экспозиция привела к снижению концентрации РНК в репликоне в 100 раз к 15-му дню.
Оценка различных комбинаций боцепревира с интерфероном альфа-2b, которые приводили к 90% ингибированию РНК-репликона, показала аддитивный эффект, при этом никаких признаков синергии или антагонизма не было обнаружено.
Резистентность.
Резистентность вируса к боцепревиру оценивали на основании биохимического анализа и анализа репликонов. Биологическая активность боцепревира снижалась в 2-10 раз при наличии основных аминокислотных замен (RAVs-resistant-associated amino acid variants) V36M, T54A, R155K и V170A, определяющих резистентность. Снижение активности боцепревира более чем в 50 раз наблюдалось при наличии RAVs: А156Т и A156V. Следует отметить, что репликоны, несущие RAV А156Т, обладают меньшей активностью, чем репликоны, несущие другие RAVs. Кратность увеличения резистентности, обусловленная двойными RAVs, была приблизительно равна кратности увеличения резистентности к боцепревиру для отдельных RAVs.
По обобщенным данным исследования пациентов, ранее не получавших противовирусную терапию, и пациентов с неэффективной предшествующей терапией пэгинтерфероном альфа-2b и рибавирином в течение 4 нед с последующей терапией боцепревиром в дозе 800 мг 3 раза в день в комбинации с пэгинтерфероном альфа-2b и рибавирином, участвовавших в клинических исследованиях фазы 3, RAVs были обнаружены у 15% пациентов обеих групп и у 53% пациентов, получавших терапию боцепревиром и не достигших устойчивого вирусологического ответа. Наиболее часто (>25% пациентов) выявляемыми RAVs были V36M (61%) и RI55K (68%) - у пациентов, инфицированных вирусом генотипа 1а, и Т54А (42%), T54S (37%), A156S (26%), V170A (32%) - у пациентов, инфицированных вирусом генотипа lb. У 6% пациентов, принимавших боцепревир, чувствительность к интерферону (снижение >1-log10 вирусной нагрузки на 4 нед лечения) была связана с наличием меньшего количества RAVs по сравнению с 41% пациентов, у которых наблюдалось снижение вирусной нагрузки <1-log10 (низкая чувствительность к интерферону). После окончания курса терапии боцепревиром у пациентов были взяты образцы крови для анализа на наличие RAVs. У 31% пациентов более высокая чувствительность к интерферону была связана с обнаружением меньшего количества RAVs по сравнению с 68% пациентов, у которых на 4-й нед лечения наблюдалось снижение вирусной нагрузки <1-log10. При обобщенном анализе было показано, что количество RAVs перед началом терапии, по-видимому, не имело значимой связи с ответом на лечение у пациентов, принимавших боцепревир в комбинации с пэгинтерфероном альфа-2b и рибавирином.
Результаты продолжающегося долгосрочного наблюдения пациентов, не достигших устойчивого вирусологического ответа при медиане продолжительности наблюдения »2 лет, позволяют предположить, что после окончания терапии боцепревиром с течением времени вирус, содержащий RAVs, может вернуться к дикому типу.
Оценка влияния боцепревира на интервал QТс.
В рандомизированном многодозовом плацебо- и активно-контролируемом перекрестном исследовании проводили оценку боцепревира в отношении его возможного влияния на QT/QTc-интервалы при применении в сверхтерапевтических (1200 мг 3 раза в день) и терапевтических (800 мг 3 раза в день) дозах у 36 здоровых добровольцев.
Существенных различий в интервалах QTc между группами участников, получавших боцепревир и плацебо, не выявлено.
RxList.com.
Оценка влияния боцепревира на интервал QTc.
Влияние приема боцепревира в дозах 800 и 1200 мг на интервал QTc оценивалась в рандомизированном многодозовом плацебо- и активно контролируемом (моксифлоксацин 400 мг) исследовании с 4-компонентным перекрестным дизайном у 36 здоровых испытуемых. В этом исследовании, позволяющем выявить слабые эффекты, верхняя граница одностороннего ДИ 95% для максимального значения среднего различия показателей скорректированного базового уровня интервала QTc (по методу индивидуальной коррекции - QNcI) между группами применения активных ЛС и плацебо была <10 мс - порога, требующего внимания к величине изменения интервала QTc. Применение боцепревира в дозе 1200 мг приводило к увеличению его экспозиции на »15%, что не превышает экспозицию этого ЛС при совместном применении с сильными ингибиторами изофермента сYP3A4 или приеме боцепревира пациентами с тяжелой печеночной недостаточностью. Тем не менее, в данном исследовании очевидного дозозависимого изменения интервала QT от принимаемого боцепревира выявлено не было. Таким образом, не ожидается удлинение интервала QT при повышении экспозиции боцепревира.
Фармакокинетика
RxList.com.
Боцепревир состоит из двух диастереомеров, SCH534128 и SCH534129, в соотношении 1:1. В плазме их соотношение изменяется до 2:1 в пользу активного диастереомера SCH534128. Плазменные концентрации боцепревира, описанные ниже, включают оба диастереомера SCH534128 и SCH534129, если не указано иное.
У здоровых испытуемых, получавших только боцепревир 800 мг 3 раза в день, экспозиция этого ЛС характеризовалась следующими показателями: AUC0-t - 5408 нг·ч/мл (n=71), сmax - 1723 нг/мл (n=71) и сmin - 88 нг/мл (n=71). Фармакокинетические показатели у здоровых испытуемых и ВГС-инфицированных субъектов были сходны.
Всасывание и биодоступность.
После приема боцепревир всасывался при среднем Тmax в крови, равном 2 Значения AUC, Сmax, Сmin практически дозозависимо не увеличивались. В частности, при дозах, равных 800 и 1200 мг, эти параметры были близки, что предполагает снижение всасывания при применении более высоких доз. Кумуляция боцепревира минимальна, и фармакокинетическое равновесное состояние достигается приблизительно через 1 день после приема боцепревира 3 раза в день.
У здоровых добровольцев, принимавших только боцепревир в дозе 800 мг 3 раза в день, фармакокинетика этого ЛС характеризовалась следующими показателями: AUC - 6147 нг·ч/мл, Сmax - 1913 нг/мл и Сmin - 90 нг/мл. Фармакокинетические показатели у здоровых добровольцев и у пациентов с ВГС были одинаковыми. Абсолютная биодоступность боцепревира не изучена.
Влияние пищи на всасывание.
Боцепревир следует принимать с пищей. Пища увеличивает всасывание этого ЛС на 65% при приеме дозы 800 мг 3 раза в день по сравнению с применением натощак. Биодоступность боцепревира была одинаковой независимо от типа пищи (с высоким или низким содержанием жиров). Время приема боцепревира - перед едой, во время еды или же сразу после еды - также не имело значения, поэтому боцепревир можно принимать вне зависимости от типа и времени приема пищи.
Распределение.
Средний кажущийся ssVss боцепревира составляет приблизительно 772 л. После приема однократной дозы, равной 800 мг, связывание с белками плазмы крови составляет »75%.
Метаболизм.
В исследованиях in vitro >in vitro показано, что боцепревир подвергается метаболизму преимущественно через альдо-кето-редуктазоопосредованный путь с образованием кетонредуцированных метаболитов, которые неактивны в отношении вируса гепатита С. После однократного приема внутрь 800 мг боцепревира, меченного радиоактивным изотопом 14С, наиболее распространенными циркулирующими метаболитами являются диастереоизомерные смеси кетонредуцированных метаболитов со средней концентрацией приблизительно в 4 раза превышающей концентрацию боцепревира. Боцепревир также подвергается окислительному метаболизму, опосредованному изоферментами сYP3A4/5, хотя и в меньшей степени.
Выведение.
Средний 1/2T1/2 боцепревира из плазмы составляет около 3,4 Средний общий клиренс боцепревира равен »161 л/ После однократного приема 800 мг боцепревира, меченного радиоактивным изотопом 14С, кишечником и почками выводилось приблизительно 79 и 9% этой дозы соответственно. При этом в виде неизмененного боцепревира кишечником и почками выводилось приблизительно 8 и 3% дозы боцепревира, меченного радиоактивным изотопом 14С, соответственно. Эти данные указывают, что боцепревир выводится преимущественно печенью.
Фармакокинетика у особых групп пациентов.
Дети. Безопасность, эффективность и фармакокинетика боцепревира у детей в возрасте до 18 лет не изучалась.
Нарушение функции печени. При проведении исследования у пациентов с хронической печеночной недостаточностью различной степени (легкой, средней и тяжелой) клинически значимых различий в фармакокинетических параметрах выявлено не было, и коррекция дозы не требуется. Применение боцепревира в комбинации с пэгинтерфероном альфа и рибавирином противопоказано пациентам с декомпенсированным циррозом печени (функциональный класс цирроза печени В и С по системе Чайлд-Пью более 6 баллов) ( см «Противопоказания», «Меры предосторожности»).
RxList.com.
Печеночная недостаточность. Фармакокинетика боцепревира была изучена у взрослых пациентов, не инфицированных ВГС, с нормальной функцией печени, легкой (5-6 баллов по шкале Чайлд-Пью), средней (7-9 баллов по шкале Чайлд-Пью) и тяжелой (10-12 баллов по шкале Чайлд-Пью) степенью печеночной недостаточности после приема 400 мг боцепревира однократно. Среднее значение AUC активного диастереомера боцепревира, SCH534128, составила на 32 и 45% выше у пациентов с умеренной и тяжелой степенью печеночной недостаточности соответственно, по сравнению с этим значением у субъектов с нормальной функции печени. Среднее значение maxCmax для SCH534128 - на 28 и 62% выше у пациентов с умеренной и тяжелой степенью печеночной недостаточности соответственно. У пациентов с легкой степенью печеночной недостаточности экспозиция SCH534128 была, как у пациентов с нормальной функцией печени. Сходная величина эффекта ожидается и для боцепревира. Коррекция дозировки боцепревира для пациентов с нарушением функции печени не рекомендуется.
Нарушение функции почек. Клинически значимых различий в фармакокинетических параметрах у здоровых добровольцев и у пациентов с терминальной стадией почечной недостаточности не наблюдалось. Коррекция дозы пациентам с любой стадией почечной недостаточности (в тч терминальной) не требуется.
RxList.com.
Почечная недостаточность. Фармакокинетику боцепревира исследовали у пациентов, не инфицированных ВГС, с терминальной стадией почечной недостаточности, нуждающихся в гемодиализе, после однократного приема 800 мг этого ЛС. Среднее значение AUC боцепревира было на 10% ниже у пациентов с ХПН, нуждающихся в гемодиализе, относительно этого значения у пациентов с нормальной функцией почек. При гемодиализе удалялось <1% от дозы боцепревира. Коррекция дозы боцепревира пациентам с любой степенью почечной недостаточности не требуется.
Половая принадлежность. У взрослых пациентов не было отмечено различий в фармакокинетических параметрах в зависимости от половой принадлежности.
Расовая принадлежность. Популяционный фармакокинетический анализ показал, что расовая принадлежность не оказывает явного воздействия на фармакокинетику препарата.
Возраст. Популяционный фармакокинетический анализ показал, что возраст не оказывает очевидного воздействия на фармакокинетику препарата.
RxList.com.
Возраст. Популяционный фармакокинетический анализ показал, что экспозиция боцепревира не различается у пациентов в возрасте от 19 до 65 лет.
Боцепревир состоит из двух диастереомеров, SCH534128 и SCH534129, в соотношении 1:1. В плазме их соотношение изменяется до 2:1 в пользу активного диастереомера SCH534128. Плазменные концентрации боцепревира, описанные ниже, включают оба диастереомера SCH534128 и SCH534129, если не указано иное.
У здоровых испытуемых, получавших только боцепревир 800 мг 3 раза в день, экспозиция этого ЛС характеризовалась следующими показателями: AUC0-t - 5408 нг·ч/мл (n=71), сmax - 1723 нг/мл (n=71) и сmin - 88 нг/мл (n=71). Фармакокинетические показатели у здоровых испытуемых и ВГС-инфицированных субъектов были сходны.
Всасывание и биодоступность.
После приема боцепревир всасывался при среднем Тmax в крови, равном 2 Значения AUC, Сmax, Сmin практически дозозависимо не увеличивались. В частности, при дозах, равных 800 и 1200 мг, эти параметры были близки, что предполагает снижение всасывания при применении более высоких доз. Кумуляция боцепревира минимальна, и фармакокинетическое равновесное состояние достигается приблизительно через 1 день после приема боцепревира 3 раза в день.
У здоровых добровольцев, принимавших только боцепревир в дозе 800 мг 3 раза в день, фармакокинетика этого ЛС характеризовалась следующими показателями: AUC - 6147 нг·ч/мл, Сmax - 1913 нг/мл и Сmin - 90 нг/мл. Фармакокинетические показатели у здоровых добровольцев и у пациентов с ВГС были одинаковыми. Абсолютная биодоступность боцепревира не изучена.
Влияние пищи на всасывание.
Боцепревир следует принимать с пищей. Пища увеличивает всасывание этого ЛС на 65% при приеме дозы 800 мг 3 раза в день по сравнению с применением натощак. Биодоступность боцепревира была одинаковой независимо от типа пищи (с высоким или низким содержанием жиров). Время приема боцепревира - перед едой, во время еды или же сразу после еды - также не имело значения, поэтому боцепревир можно принимать вне зависимости от типа и времени приема пищи.
Распределение.
Средний кажущийся ssVss боцепревира составляет приблизительно 772 л. После приема однократной дозы, равной 800 мг, связывание с белками плазмы крови составляет »75%.
Метаболизм.
В исследованиях in vitro >in vitro показано, что боцепревир подвергается метаболизму преимущественно через альдо-кето-редуктазоопосредованный путь с образованием кетонредуцированных метаболитов, которые неактивны в отношении вируса гепатита С. После однократного приема внутрь 800 мг боцепревира, меченного радиоактивным изотопом 14С, наиболее распространенными циркулирующими метаболитами являются диастереоизомерные смеси кетонредуцированных метаболитов со средней концентрацией приблизительно в 4 раза превышающей концентрацию боцепревира. Боцепревир также подвергается окислительному метаболизму, опосредованному изоферментами сYP3A4/5, хотя и в меньшей степени.
Выведение.
Средний 1/2T1/2 боцепревира из плазмы составляет около 3,4 Средний общий клиренс боцепревира равен »161 л/ После однократного приема 800 мг боцепревира, меченного радиоактивным изотопом 14С, кишечником и почками выводилось приблизительно 79 и 9% этой дозы соответственно. При этом в виде неизмененного боцепревира кишечником и почками выводилось приблизительно 8 и 3% дозы боцепревира, меченного радиоактивным изотопом 14С, соответственно. Эти данные указывают, что боцепревир выводится преимущественно печенью.
Фармакокинетика у особых групп пациентов.
Дети. Безопасность, эффективность и фармакокинетика боцепревира у детей в возрасте до 18 лет не изучалась.
Нарушение функции печени. При проведении исследования у пациентов с хронической печеночной недостаточностью различной степени (легкой, средней и тяжелой) клинически значимых различий в фармакокинетических параметрах выявлено не было, и коррекция дозы не требуется. Применение боцепревира в комбинации с пэгинтерфероном альфа и рибавирином противопоказано пациентам с декомпенсированным циррозом печени (функциональный класс цирроза печени В и С по системе Чайлд-Пью более 6 баллов) ( см «Противопоказания», «Меры предосторожности»).
RxList.com.
Печеночная недостаточность. Фармакокинетика боцепревира была изучена у взрослых пациентов, не инфицированных ВГС, с нормальной функцией печени, легкой (5-6 баллов по шкале Чайлд-Пью), средней (7-9 баллов по шкале Чайлд-Пью) и тяжелой (10-12 баллов по шкале Чайлд-Пью) степенью печеночной недостаточности после приема 400 мг боцепревира однократно. Среднее значение AUC активного диастереомера боцепревира, SCH534128, составила на 32 и 45% выше у пациентов с умеренной и тяжелой степенью печеночной недостаточности соответственно, по сравнению с этим значением у субъектов с нормальной функции печени. Среднее значение maxCmax для SCH534128 - на 28 и 62% выше у пациентов с умеренной и тяжелой степенью печеночной недостаточности соответственно. У пациентов с легкой степенью печеночной недостаточности экспозиция SCH534128 была, как у пациентов с нормальной функцией печени. Сходная величина эффекта ожидается и для боцепревира. Коррекция дозировки боцепревира для пациентов с нарушением функции печени не рекомендуется.
Нарушение функции почек. Клинически значимых различий в фармакокинетических параметрах у здоровых добровольцев и у пациентов с терминальной стадией почечной недостаточности не наблюдалось. Коррекция дозы пациентам с любой стадией почечной недостаточности (в тч терминальной) не требуется.
RxList.com.
Почечная недостаточность. Фармакокинетику боцепревира исследовали у пациентов, не инфицированных ВГС, с терминальной стадией почечной недостаточности, нуждающихся в гемодиализе, после однократного приема 800 мг этого ЛС. Среднее значение AUC боцепревира было на 10% ниже у пациентов с ХПН, нуждающихся в гемодиализе, относительно этого значения у пациентов с нормальной функцией почек. При гемодиализе удалялось <1% от дозы боцепревира. Коррекция дозы боцепревира пациентам с любой степенью почечной недостаточности не требуется.
Половая принадлежность. У взрослых пациентов не было отмечено различий в фармакокинетических параметрах в зависимости от половой принадлежности.
Расовая принадлежность. Популяционный фармакокинетический анализ показал, что расовая принадлежность не оказывает явного воздействия на фармакокинетику препарата.
Возраст. Популяционный фармакокинетический анализ показал, что возраст не оказывает очевидного воздействия на фармакокинетику препарата.
RxList.com.
Возраст. Популяционный фармакокинетический анализ показал, что экспозиция боцепревира не различается у пациентов в возрасте от 19 до 65 лет.
|
|
Показания к применению
Лечение хронического вирусного гепатита С (генотип 1 вируса гепатита С) в комбинации с пэгинтерфероном альфа и рибавирином у взрослых пациентов (18 лет и старше) с компенсированным заболеванием печени. которые ранее не получали противовирусную терапию. либо у пациентов. у которых предшествующее противовирусное лечение оказалось неэффективным.
Противопоказания
Повышенная чувствительность к боцепревиру. аутоиммунный гепатит. печеночная недостаточность (функциональный класс В и С по системе Чайлд-Пью >6 баллов) ( см «Способ применения и дозы». Фармакология»). одновременное применение ЛС. клиренс которых опосредован действием изоферментов сYP3A4/5 и для которых повышенные плазменные концентрации связаны с серьезными и/или опасными для жизни побочными реакциями. а именно - одновременное применение с мидазоламом и триазоламом (для приема внутрь). астемизолом. бепридилом. пимозидом. лумефантрином. галофантрином. пропафеноном. симвастатином. ловастатином. кветиапином. алфузозином. доксазозином. силодозином. тамсулозином. ингибиторами тирозинкиназы и производными спорыньи (дигидроэрготамин. эргометрин. эрготамин. метилэргометрин) ( см «Взаимодействие»). беременность. детский возраст до 18 лет (эффективность и безопасность не изучены).
Дополнительная информация - инструкции по применению пэгинтерферона альфа и рибавирина.
Дополнительная информация - инструкции по применению пэгинтерферона альфа и рибавирина.
Ограничения к использованию
Препараты, содержащие дроспиренон.
Следует соблюдать осторожность при назначении боцепревира пациентам, принимающим калийсберегающие диуретики или ЛС, содержащие дроспиренон, поскольку возможен риск развития гиперкалиемии. Следует рассмотреть возможность применения альтернативных методов контрацепции ( см «Взаимодействие»).
Индукторы изофермента сYP3A4.
Не рекомендуется одновременное применение боцепревира с сильными индукторами изофермента сYP3A4 (рифампицин, карбамазепин, фенобарбитал и фенитоин).
ЛС, удлиняющие интервал QT.
Следует соблюдать осторожность при одновременном применении боцепревира с ЛС, удлиняющими интервал QT, такими как амиодарон, хинидин, метадон, пентамидин и некоторые нейролептики.
Противогрибковые ЛС.
Следует соблюдать осторожность при одновременном применении боцепревира с кетоконазолом или азольными противогрибковыми ЛС (итраконазол, позаконазол, вориконазол).
Ингибиторы протеазы ВИЧ.
Не рекомендуется одновременное применение боцепревира с ингибиторами протеазы ВИЧ (атазанавир/ритонавир, дарунавир/ритонавир, лопинавир/ритонавир).
БКК.
Следует соблюдать осторожность при одновременном применении боцепревира с БКК (амлодипин, дилтиазем, фелодипин, никардипин, нифедипин, нисолдипин, верапамил) вследствие возможного повышения концентрации последних в крови. Такие пациенты должны находиться под наблюдением.
Следует соблюдать осторожность при назначении боцепревира пациентам, принимающим калийсберегающие диуретики или ЛС, содержащие дроспиренон, поскольку возможен риск развития гиперкалиемии. Следует рассмотреть возможность применения альтернативных методов контрацепции ( см «Взаимодействие»).
Индукторы изофермента сYP3A4.
Не рекомендуется одновременное применение боцепревира с сильными индукторами изофермента сYP3A4 (рифампицин, карбамазепин, фенобарбитал и фенитоин).
ЛС, удлиняющие интервал QT.
Следует соблюдать осторожность при одновременном применении боцепревира с ЛС, удлиняющими интервал QT, такими как амиодарон, хинидин, метадон, пентамидин и некоторые нейролептики.
Противогрибковые ЛС.
Следует соблюдать осторожность при одновременном применении боцепревира с кетоконазолом или азольными противогрибковыми ЛС (итраконазол, позаконазол, вориконазол).
Ингибиторы протеазы ВИЧ.
Не рекомендуется одновременное применение боцепревира с ингибиторами протеазы ВИЧ (атазанавир/ритонавир, дарунавир/ритонавир, лопинавир/ритонавир).
БКК.
Следует соблюдать осторожность при одновременном применении боцепревира с БКК (амлодипин, дилтиазем, фелодипин, никардипин, нифедипин, нисолдипин, верапамил) вследствие возможного повышения концентрации последних в крови. Такие пациенты должны находиться под наблюдением.
При беременности и кормлении грудью
Влияние боцепревира на фертильность человека не изучалось.
Боцепревир в комбинации с пэгинтерфероном альфа и рибавирином противопоказан беременным женщинам ( см «Противопоказания»).
Влияние боцепревира на беременных женщин в рамках, отвечающих требованиям контролируемых клинических исследований, не изучалось.
При лечении боцепревиром в комбинации с пэгинтерфероном альфа и рибавирином следует соблюдать особую осторожность, чтобы избежать наступления беременности у пациенток или партнерш пациентов-мужчин. Женщины детородного возраста должны принимать боцепревир только при использовании надежных средств контрацепции, которые следует продолжать использовать в течение 4 мес после прекращения терапии боцепревиром. Пациенты мужского пола и их партнерши должны использовать надежные средства контрацепции во время лечения и в течение 7 мес после лечения.
Дополнительная информация - инструкции по применению пэгинтерферона альфа и рибавирина.
Имеющиеся фармакодинамические/токсикологические данные показали наличие боцепревира и его производных в молоке крыс. Решение относительно прекращения кормления грудью или лечения боцепревиром следует принимать с учетом соотношения пользы грудного вскармливания для ребенка и проводимой терапии для женщины.
RxList.com.
Категория действия на плод по FDA - X (при использовании с пэгинтерфероном альфа и рибавирином).
Категория действия на плод по FDA - в (без использования с пэгинтерфероном альфа и рибавирином).
Использование с рибавирином и пэгинтерфероном альфа: в исследованиях фертильности у самцов животных рибавирин индуцировал обратимую тестикулярную токсичность; в то время как пэгинтерферон альфа может привести к снижению фертильности у самок. Необходимо использовать предписывающую информацию для рибавирина и пэгинтерферона альфа для получения дополнительных данных.
Боцепревир должен применяться только в комбинации с пэгинтерфероном альфа и рибавирином. Значительное тератогенное и/или эмбриотоксическое действие рибавирина наблюдалось у всех видов животных, подвергшихся воздействию этого ЛС; поэтому рибавирин противопоказан беременным женщинам и мужчинам - партнерам беременных женщин ( см «Противопоказания»). Интерфероны обладают абортивным эффектом у животных, и следует предположить, имеют соответствующий потенциал воздействия на людей ( см предписывающую информацию для пегинтерферона альфа).
Необходимо соблюдать особую осторожность во избежание беременности у пациенток и партнерш пациентов мужского пола, принимающих боцепревир с комбинацией пэгинтерферон альфа + рибавирин. Женщины детородного возраста и их партнеры-мужчины не должны принимать рибавирин, если они не используют эффективной контрацепции (2 надежных формы) во время лечения рибавирином и в течение 6 мес после его окончания. Одной из таких надежных форм контрацепции может быть комбинированный контрацептив для перорального применения, содержащий по меньшей мере 1 мг норэтистерона. Контрацептивы для перорального применения, содержащие более низкую дозу норэтистерона, и другие формы гормональной контрацепции не были изучены или являются противопоказанными.
Неизвестно, выделяется ли боцепревир в женское грудное молоко. Уровни боцепревира и/или его метаболитов в молоке кормящих крыс были несколько выше, чем уровни, наблюдаемые в крови этих крыс. maxCmax боцепревира и/или его метаболитов в крови крысят, кормящихся молоком, составлял <1% от соответствующей maxCmax в материнской крови. Из-за возможности возникновения неблагоприятных реакций, вызываемых боцепревиром у грудных младенцев, и принимая во внимание важность терапии для матери, должно быть принято решение о прекращении грудного вскармливания либо лечения боцепревиром.
Боцепревир в комбинации с пэгинтерфероном альфа и рибавирином противопоказан беременным женщинам ( см «Противопоказания»).
Влияние боцепревира на беременных женщин в рамках, отвечающих требованиям контролируемых клинических исследований, не изучалось.
При лечении боцепревиром в комбинации с пэгинтерфероном альфа и рибавирином следует соблюдать особую осторожность, чтобы избежать наступления беременности у пациенток или партнерш пациентов-мужчин. Женщины детородного возраста должны принимать боцепревир только при использовании надежных средств контрацепции, которые следует продолжать использовать в течение 4 мес после прекращения терапии боцепревиром. Пациенты мужского пола и их партнерши должны использовать надежные средства контрацепции во время лечения и в течение 7 мес после лечения.
Дополнительная информация - инструкции по применению пэгинтерферона альфа и рибавирина.
Имеющиеся фармакодинамические/токсикологические данные показали наличие боцепревира и его производных в молоке крыс. Решение относительно прекращения кормления грудью или лечения боцепревиром следует принимать с учетом соотношения пользы грудного вскармливания для ребенка и проводимой терапии для женщины.
RxList.com.
Категория действия на плод по FDA - X (при использовании с пэгинтерфероном альфа и рибавирином).
Категория действия на плод по FDA - в (без использования с пэгинтерфероном альфа и рибавирином).
Использование с рибавирином и пэгинтерфероном альфа: в исследованиях фертильности у самцов животных рибавирин индуцировал обратимую тестикулярную токсичность; в то время как пэгинтерферон альфа может привести к снижению фертильности у самок. Необходимо использовать предписывающую информацию для рибавирина и пэгинтерферона альфа для получения дополнительных данных.
Боцепревир должен применяться только в комбинации с пэгинтерфероном альфа и рибавирином. Значительное тератогенное и/или эмбриотоксическое действие рибавирина наблюдалось у всех видов животных, подвергшихся воздействию этого ЛС; поэтому рибавирин противопоказан беременным женщинам и мужчинам - партнерам беременных женщин ( см «Противопоказания»). Интерфероны обладают абортивным эффектом у животных, и следует предположить, имеют соответствующий потенциал воздействия на людей ( см предписывающую информацию для пегинтерферона альфа).
Необходимо соблюдать особую осторожность во избежание беременности у пациенток и партнерш пациентов мужского пола, принимающих боцепревир с комбинацией пэгинтерферон альфа + рибавирин. Женщины детородного возраста и их партнеры-мужчины не должны принимать рибавирин, если они не используют эффективной контрацепции (2 надежных формы) во время лечения рибавирином и в течение 6 мес после его окончания. Одной из таких надежных форм контрацепции может быть комбинированный контрацептив для перорального применения, содержащий по меньшей мере 1 мг норэтистерона. Контрацептивы для перорального применения, содержащие более низкую дозу норэтистерона, и другие формы гормональной контрацепции не были изучены или являются противопоказанными.
Неизвестно, выделяется ли боцепревир в женское грудное молоко. Уровни боцепревира и/или его метаболитов в молоке кормящих крыс были несколько выше, чем уровни, наблюдаемые в крови этих крыс. maxCmax боцепревира и/или его метаболитов в крови крысят, кормящихся молоком, составлял <1% от соответствующей maxCmax в материнской крови. Из-за возможности возникновения неблагоприятных реакций, вызываемых боцепревиром у грудных младенцев, и принимая во внимание важность терапии для матери, должно быть принято решение о прекращении грудного вскармливания либо лечения боцепревиром.
Побочные эффекты
Профиль безопасности основан на объединенных данных по безопасности 2 клинических исследований с участием около 1500 пациентов. принимавших боцепревир в комбинации с пэгинтерфероном альфа-2b и рибавирином: одного исследования с участием пациентов. не получавших ранее терапию. другого - с участием пациентов. у которых предшествующая терапия оказалась неэффективной.
Наиболее частыми нежелательными реакциями были повышенная утомляемость, анемия, тошнота, головная боль и дисгевзия.
Наиболее распространенной причиной снижения доз этих ЛС была анемия. которая чаще развивалась у пациентов. получавших терапию боцепревиром в комбинации с пэгинтерфероном альфа-2b и рибавирином. чем у пациентов. получавших только пэгинтерферон альфа-2b и рибавирин.
Нежелательные реакции приведены ниже и дифференцированы по системно-органным классам с указанием частоты возникновения: очень часто (≥1/10). часто (≥1/100. <1/10). нечасто (≥/1000. <1/100). редко (≥1/10000. <1/1000). неизвестно (частота не может быть оценена на основе имеющихся данных).
Приведенные нежелательные реакции были выявлены в ходе клинических исследований и в период пострегистрационного применения боцепревира в комбинации с пэгинтерфероном альфа-2b и рибавирином**.
Инфекционные и паразитарные заболевания. Часто - бронхит*. воспаление подкожной жировой клетчатки*. простой герпес. грипп. грибковые инфекции полости рта. синусит. нечасто - гастроэнтерит*. пневмония*. стафилококковая инфекция*. кандидоз. инфекционные заболевания уха. грибковые поражения кожи. назофарингит. онихомикоз. фарингит. инфекции дыхательных путей. ринит. инфекционные поражения кожи. инфекции мочевыводящих путей. редко - эпиглоттит*. средний отит. сепсис.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): редко - новообразования щитовидной железы (узловая форма).
Со стороны крови и лимфатической системы. Очень часто - анемия*. нейтропения*. часто - лейкопения*. тромбоцитопения*. агранулоцитоз. панцитопения. нечасто - геморрагический диатез. лимфаденопатия. лимфопения. редко - гемолиз.
Со стороны иммунной системы. Редко - саркоидоз*, порфирия (за исключением острой).
Со стороны эндокринной системы. Часто - зоб, гипотиреоз; нечасто - гипертиреоз.
Со стороны обмена веществ и питания. Очень часто - снижение аппетита. часто - дегидратация*. гипергликемия*. гипертриглицеридемия. гиперурикемия. нечасто - гипокалиемия*. расстройства аппетита. сахарный диабет. подагра. гиперкальциемия.
Со стороны психики. Очень часто - тревожность*. депрессия*. бессонница. раздражительность. часто - эмоциональная лабильность. ажитация. расстройства либидо. настроения. сна. нечасто - агрессия*. гомицидальные мысли*. панические атаки*. паранойя*. злоупотребление психотропными веществами*. суицидальные мысли*. аномальное поведение. гнев. апатия. спутанность сознания. изменения психического статуса. беспокойство. редко - биполярное расстройство*. завершенное самоубийство*. попытка самоубийства*. слуховые галлюцинации. визуальные галлюцинации. психическая декомпенсация.
Со стороны нервной системы. Очень часто - головокружение*. головная боль*. часто - гипестезия*. парестезия*. обморок*. амнезия. нарушение внимания. ухудшение памяти. мигрень. паросмия. тремор. вертиго. нечасто - периферическая нейропатия*. когнитивные расстройства. гиперестезия. заторможенность. потеря сознания. психические нарушения. невралгия. предобморочное состояние. редко - церебральная ишемия*. энцефалопатия.
Со стороны органа зрения. Часто - сухость глаз. ретинальный экссудат. нечеткость зрения. ухудшение зрения. нечасто - ишемия сетчатки*. ретинопатия*. ощущение инородного тела в глазу. неприятные ощущения в глазу. кровоизлияния в конъюнктиву. конъюнктивит. болезненные ощущения в глазу. зуд. припухлость глаз. отечность век. слезоточивость. гиперемия глаз. светобоязнь. редко - отек диска зрительного нерва.
Со стороны слуха и лабиринтные нарушения. Часто - звон в ушах; нечасто - глухота*, ощущение дискомфорта в ухе, нарушение слуха.
Со стороны сердца. Часто - ощущение сердцебиения. нечасто - тахикардия*. аритмия. сердечно-сосудистые расстройства. редко - острый инфаркт миокарда*. мерцательная аритмия*. ИБС*. перикардит*. экссудативный перикардит.
Со стороны сосудов. Часто - артериальная гипотензия*. артериальная гипертензия. нечасто - тромбоз глубоких вен*. приливы крови. бледность. синдром холодных конечностей. редко - венозный тромбоз.
Со стороны дыхательной системы. органов грудной клетки и средостения: очень часто - кашель*. одышка*. часто - носовое кровотечение. заложенность носа. боли в ротоглотке. заложенность дыхательных путей. придаточных пазух. затруднение дыхания. нечасто - плевральные боли*. легочная эмболия*. сухость в горле. дисфония. повышенная секреция верхних дыхательных путей. образование везикул в области ротоглотки. редко - плевральный фиброз*. ортопноэ. дыхательная недостаточность.
Со стороны ЖКТ. Очень часто - диарея*. тошнота*. рвота*. сухость во рту. извращение вкуса. часто - боли в животе*. боли в верхней части живота *. запор*. ГЭРБ*. геморрой*. дискомфорт в животе. вздутие живота. дискомфорт в аноректальной области. афтозный стоматит. хейлит. диспепсия. метеоризм. глоссалгия. язвы слизистой оболочки полости рта. боли в ротовой полости. стоматит. нарушения со стороны зубов. нечасто - боли в нижней части живота*. гастрит*. панкреатит*. анальный зуд. колит. дисфагия. изменение цвета каловых масс. усиление перистальтики. кровоточивость десен. болевые ощущения в деснах. гингивит. глоссит. сухость губ. одинофагия. прокталгия. ректальные кровотечения. гиперсекреция слюны. повышенная чувствительность зубов. изменение цвета языка. язвы на языке. редко - функциональная недостаточность поджелудочной железы.
Со стороны печени и желчевыводящих путей. Нечасто - гипербилирубинемия; редко - холецистит.
Со стороны кожи и подкожных тканей. Очень часто - алопеция. сухость кожи. зуд. сыпь. часто - дерматит. экзема. эритема. гипергидроз. ночные поты. периферические отеки. псориаз. эритематозная сыпь. макулярная сыпь. пятнисто-папулезная сыпь. папулезная сыпь. зудящая сыпь. поражения кожи. нечасто - фоточувствительность. язвы кожи. крапивница. неизвестно - ангионевротичекий отек. лекарственная сыпь с эозинофилией и системными симптомами (DRESS-синдром). эксфолиативная сыпь. эксфолиативный дерматит. синдром Стивенса-Джонсона. токсические высыпания на коже. токсидермия.
Со стороны скелетно-мышечной и соединительной ткани. Очень часто - артралгия. миалгия. часто - боль в спине*. боль в конечностях*. мышечные спазмы. мышечная слабость. боли в области шеи. нечасто - костно-мышечные боли в грудной клетке*. артрит. боли в костях. отечность суставов. костно-мышечные боли.
Со стороны почек и мочевыводящих путей. Часто - поллакиурия; нечасто - дизурия, никтурия.
Со стороны половых органов и молочной железы. Часто - эректильная дисфункция; нечасто - аменорея, меноррагия, метроррагия; редко - аспермия.
Общие расстройства. Очень часто - астения*. озноб. повышенная утомляемость*. лихорадка*. гриппоподобный синдром. часто - дискомфорт в области грудной клетки*. боль в груди*. недомогание*. ощущение изменения температуры тела. сухость слизистых оболочек. боль. нечасто - ощущение ненормального состояния. ухудшение процессов заживления. некардиальные боли в грудной клетке.
Отклонения в результатах лабораторных исследований. Очень часто - снижение массы тела; нечасто - сердечные шумы, повышение частоты сердечных сокращений.
*Включает нежелательные реакции, возникшие в ходе клинических исследований. По оценке исследователя могут быть серьезными.
**Поскольку боцепревир назначают в комбинации с пэгинтерфероном альфа и рибавирином, необходимо ознакомиться с соответствующим разделом инструкций по применению пэгинтерферона альфа и рибавирина.
Анемия.
Развитие анемии наблюдалось у 49% пациентов, получавших боцепревир в комбинации с пэгинтерфероном альфа-2b и рибавирином, по сравнению с 29% пациентов, получавших только пэгинтерферон альфа-2b и рибавирин. Добавление боцепревира приводило к дополнительному снижению концентрации Hb приблизительно на 1 г/дл (г/децилитр). Среднее снижение концентрации Hb по сравнению с исходным значением было больше у пациентов, ранее получавших терапию, по сравнению с пациентами, не получавшими предшествующую терапию. По причине возникновения анемии/гемолитической анемии производили коррекцию дозы у 26% пациентов. принимавших боцепревир в комбинации с пэгинтерфероном альфа-2b и рибавирином. по сравнению с 13% пациентов. принимавших только пэгинтерферон альфа-2b и рибавирин. В клинических исследованиях доля пациентов. которые получали эритропоэтин для лечения анемии. составила 43% в группе. получавшей боцепревир в комбинации с пэгинтерфероном альфа-2b и рибавирином. по сравнению с 24% в группе. получавшей лечение только пэгинтерфероном альфа-2b и рибавирином. Большинство пациентов с анемией при концентрации Hb ≤10 г/дл (6,2 ммоль/л) получали эритропоэтин. Количество пациентов. которым было сделано переливание крови с целью лечения анемии. составило 3% в группе принимавших боцепревир в комбинации с пэгинтерфероном альфа-2b и рибавирином по сравнению с <1% пациентов. принимавших только пэгинтерферон альфа-2b и рибавирин.
Нейтрофилы.
Количество пациентов с пониженным содержанием нейтрофилов в крови было выше в группе пациентов, получавших боцепревир, по сравнению с группой, получавшей только пэгинтерферон альфа-2b и рибавирин. Процент пациентов с нейтропенией 3-4-й степени (число нейтрофилов <0,75·109 клеток/л) был выше в группе. получавшей боцепревир (29%). по сравнению с группой. получавшей плацебо (17%) в комбинации с пэгинтерфероном альфа-2b и рибавирином. Снижение концентрации нейтрофилов до <0,5·109 клеток/л (4-я степень нейтропении) отмечено у 7% пациентов из группы. получавшей боцепревир в комбинации с пэгинтерфероном альфа-2b и рибавирином. и у 4%. получавших только пэгинтерферон альфа-2b и рибавирин.
Тромбоциты.
Снижение концентрации тромбоцитов наблюдали у 3% пациентов, получавших боцепревир в комбинации с пэгинтерфероном альфа-2b и рибавирином, и у 1% получавших только пэгинтерферон альфа-2b и рибавирин. В обеих группах пациенты с циррозом печени были подвержены большему риску развития тромбоцитопении 3-4-й степени по сравнению с пациентами без цирроза печени.
Другие данные лабораторных исследований.
Добавление боцепревира к терапии пэгинтерфероном альфа-2b и рибавирином было связано с увеличением частоты случаев повышения концентрации мочевой кислоты. триглицеридов и общего холестерина по сравнению с таковой при лечении только пэгинтерфероном альфа-2b и рибавирином.
RxList.com.
Необходимо предварительно ознакомиться с предписывающей информацией по пэгинтерферону альфа и рибавирину с описанием побочных реакций, связанных с использованием этих ЛС.
Клинические испытания.
Так как клинические испытания проведены с различным набором условий. частота встречаемости побочных реакций. наблюдавшихся в этих исследованиях. может не совпадать с полученной в других исследованиях и с наблюдаемой в клинической практике.
Наиболее часто встречаемыми побочными реакциями (у >35% больных независимо от оценки исследователями причинно-следственных связей) у взрослых пациентов при сочетанном применении боцепревира с пэгинтерфероном альфа-2b и рибавирином были усталость. анемия. тошнота. головная боль и дисгевзия (извращение вкуса).
Безопасность сочетанного применения боцепревира в дозе 800 мг 3 раза в день с комбинацией пэгинтерферон альфа-2b + рибавирин оценивалась при лечении 2095 больных с хроническим гепатитом С в открытом испытании фазы 2 и рандомизированном двойном слепом плацебо-контролируемом клиническом испытании фазы 3. В исследовании СПРИНТ-1 (пациенты. ранее не получавшие лечение) оценивали безопасность применения боцепревира в сочетании с комбинацией пэгинтерферон альфа-2b + рибавирин с или без 4-недельного вводного периода лечения комбинацией пэгинтерферон альфа-2b + рибавирин по сравнению с лечением только комбинацией пэгинтерферон альфа-2b + рибавирин. В испытаниях СПРИНТ-2 (пациенты. ранее не получавшие терапию) и РЕСПОНД-2 (пациенты. у которых предыдущая терапия была неэффективна) оценивали безопасность применения боцепревира в дозе 800 мг 3 раза в день в сочетании с комбинацией пэгинтерферон альфа-2b + рибавирин с 4-недельным вводным периодом лечения комбинацией пэгинтерферон альфа-2b + рибавирин по сравнению с лечением только комбинацией пэгинтерферон альфа-2b + рибавирин. Пациенты из изучаемой популяции имели средний возраст 49 лет (3% пациентов были старше 65 лет), 39% составляли женщины, 82% были белыми и 15% - негроидной расы.
В течение 4-недельного вводного периода с применением комбинации пэгинтерферон альфа-2b + рибавирин из 1263 больных. которые должны были в дальнейшем получать сочетанную терапию боцепревиром с комбинацией пэгинтерферон альфа-2b + рибавирин. у 28 пациентов (2%) побочные реакции привели к прекращению лечения. В течение всего курса лечения доля больных. прекративших лечение из-за побочных реакций. составила 13% для пациентов. получавших сочетанную терапию боцепревиром с комбинацией пэгинтерферон альфа-2b + рибавирин. и 12% пациентов. получавших только пэгинтерферон альфа-2b + рибавирин. Побочные действия, приводящие к прекращению терапии были сходны с теми, которые наблюдались в предыдущих исследованиях безопасности комбинации пэгинтерферон альфа-2b + рибавирин. Только анемия и усталость были зарегистрированы как неблагоприятные эффекты, которые привели к прекращению лечения у ≥1% пациентов во всех исследуемых группах.
Побочные действия. которые привели к модификации дозы любого из применяемых ЛС (в первую очередь пэгинтерферона альфа-2b и рибавирина). наблюдались у 39% пациентов. принимавших боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин. по сравнению с 24% пациентов. принимавших только комбинацию пэгинтерферон альфа-2b + рибавирин. Наиболее частой причиной снижения дозы была анемия. которая чаще возникала у пациентов. принимавших боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин. чем у пациентов. которым была назначена только комбинация пэгинтерферон альфа-2b + рибавирин.
Серьезные нежелательные явления были зарегистрированы у 11% пациентов. принимавших боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин. и у 8% пациентов. принимавших только комбинацию пэгинтерферон альфа-2b + рибавирин.
Данные о нежелательных явлениях (независимо от оценки исследователями причинно-следственных связей). произошедших у ≥10% пациентов. принимавших боцепревир в сочетании с комбинацией пэгинтерферон альфа-2b + рибавирин и наблюдавшихся у ≥5% больных. принимавних только комбинацию пэгинтерферон альфа-2b + рибавирин. в исследованиях СПРИНТ-1. СПРИНТ-2 и РЕСПОНД-2 будут представлены далее.
Количество пациентов и среднее время лечения (дни) в исследованиях СПРИНТ-1 + СПРИНТ-2: n=1225. 197 дней - прием боцепревира с комбинацией пэгинтерферон альфа-2b + рибавирин. n=467. 216 дней - прием только комбинации пэгинтерферон альфа-2b + рибавирин.
Количество пациентов и среднее время лечения (дни) в исследовании РЕСПОНД-2: n=323. 253 дней - прием боцепревира с комбинацией пэгинтерферон альфа-2b + рибавирин. n=80. 104 дня - прием только комбинации пэгинтерферон альфа-2b + рибавирин.
Встречаемость (в %) отдельных побочных реакций (прием боцепревира с комбинацией пэгинтерферон альфа-2b + рибавирин или только прием комбинации пэгинтерферон альфа-2b + рибавирин - в скобках) у пациенов. участвовавших в исследованиях СПРИНТ-1+СПРИНТ-2 или РЕСПОНД-2. приведена ниже.
Со стороны крови и лимфотической системы: анемия 50% (30%) и 45% (20%); нейтропения 50% (30%) и 45% (20%).
Со стороны ЖКТ: тошнота 46% (42%) и 43% (38%); дисгевзия 35% (16%) и 44% (11%); диарея 25% (22%) и 24% (16%); рвота 20% (13%) и 15% (8%); сухость во рту 11% (10%) и 15% (9%).
Общие расстройства и состояние в месте введения: усталость 58% (59%) и 55% (50%); озноб 34% (29%) и 33% (30%); астения 15% (18%) и 21% (16%).
Метаболизм и расстройства питания: снижение аппетита 25% (24%) и 26% (16%).
Со стороны скелетно-мышечной системы и соединительной ткани: артралгия 19% (19%) и 23% (16%).
Со стороны нервной системы: головокружение 19% (16%) и 16% (10%).
Со стороны психики: бессонница 34% (34%) и 30% (24%); раздражительность 22% (23%) и 21% (13%).
Со стороны дыхательной системы, грудной клетки и средостения: одышка при физической нагрузке 8% (8%) и 11% (5%).
Со стороны кожи и подкожных тканей: алопеция 27% (27%) и 22% (16%); сухость кожи 18% (18%) и 22% (9%); кожная сыпь 17% (19%) и 16% (6%).
Другие важные побочные реакции, выявленные в клинических испытаниях.
Среди пациентов (ранее не проходивших лечение или с неудачной предшествующей терапией), которые принимали боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин, были зафиксированы следующие побочные реакции. Эти реакции отличаются серьезностью. тяжестью или повышенной частотой встречаемости у пациентов. получающих боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин по сравнению с побочными действиями у тех больных. кто принимал только комбинацию пэгинтерферон альфа-2b + рибавирин.
Желудочно-кишечные расстройства. Дисгевзия (извращение вкуса) - неблагоприятная реакция. которая наблюдалась с повышенной частотой встречаемости у пациентов. принимавших боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин. по сравнению с частотой у больных. получавших только комбинацию пэгинтерферон альфа-2b + рибавирин ( см выше). Побочные эффекты. такие как сухость во рту. тошнота. рвота и диарея. также наблюдались с повышенной частотой у субъектов. принимавших боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин.
Данные лабораторных исследований.
Изменения отдельных гематологических параметров при лечении взрослых пациентов боцепревиром с комбинацией пэгинтерферон альфа-2b + рибавирин представлены ниже.
Hb. При снижении концентрации Hb может потребоваться снижения дозы или прекращения приема рибавирина ( см «Меры предосторожности» и предписывающую информацию для рибавирина). Если лечение рибавирином полностью прекращено, то и терапию пегинтерфероном альфа-2b и боцепревиром следует отменить ( см «Способ применения и дозы»).
Нейтрофилы и тромбоциты. Доля субъектов с уменьшеннным количеством нейтрофилов и тромбоцитов была выше у пациентов. принимавших боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин. по сравнению с пациентами. принимавших только комбинацию пэгинтерферон альфа-2b + рибавирин. У 3% пациентов. принимавших боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин. количество тромбоцитов было <50·109/л по сравнению только с 1% пациентов. получающих комбинацию пэгинтерферон альфа-2b + рибавирин. При снижении количества нейтрофилов или тромбоцитов может потребоваться снижение дозы или полное прекращение лечения пэгинтерфероном альфа-2b или прекращения терапии ( см предписывающее информацию для пэгинтерферона альфа-2b и рибавирина). Если лечение пегинтерфероном альфа-2b будет окончательно прекращено, то терапия рибавирином и боцепревиром также должна быть завершена ( см «Способ применения и дозы»).
Встречаемость (в %) снижения концентрации Hb. количества нейтрофилов и тромбоцитов (прием боцепревира с комбинацией пэгинтерферон альфа-2b + рибавирин или только прием комбинации пэгинтерферон альфа-2b + рибавирин - в скобках) у пациентов. участвовавших в исследованиях СПРИНТ-1 + СПРИНТ-2 или РЕСПОНД-2. приведена ниже.
Hb (<10 г/дл): 49% (29%) и 49% (25%).
Hb (<8,5 г/дл): 6% (3%) и 10% (15).
Нейтрофилы (<0,75·109/л): 31% (18%) и 26% (13).
Нейтрофилы (<0,5·109/л): 8% (4%) и 7% (4%).
Тромбоциты (<50·109/л): 3% (1%) и 4% (0%).
Тромбоциты (<25·109/л): <1% (0%) и 0% (0%).
Данные постмаркетинговых исследований.
Побочные реакции, выявленные в ходе пострегистрационного применения боцепревира с комбинацией пэгинтерферон альфа-2b + рибавирин, приводятся далее. В связи с тем. что данные об этих реакциях добровольно поступают от населения неопределенной численности. не всегда можно достоверно оценить частоту их возникновения или установить причинно-следственную связь с экспозицией исследуемого ЛС.
Со стороны крови и лимфотической системы: агранулоцитоз, панцитопения, тромбоцитопения ( см «Меры предосторожности»).
Со стороны ЖКТ: изъязвления полости рта, стоматит.
Инфекционные и паразитарные заболевания: пневмония, сепсис.
Со стороны кожи и подкожных тканей: ангионевротический отек. крапивница ( см «Меры предосторожности»). лекарственная сыпь с эозинофилией и системными симптомами (синдром лекарственной гиперчувствительности). эксфолиативная сыпь. эксфолиативный дерматит. синдром Стивенса-Джонсона. токсическая сыпь. токсикодермия.
Наиболее частыми нежелательными реакциями были повышенная утомляемость, анемия, тошнота, головная боль и дисгевзия.
Наиболее распространенной причиной снижения доз этих ЛС была анемия. которая чаще развивалась у пациентов. получавших терапию боцепревиром в комбинации с пэгинтерфероном альфа-2b и рибавирином. чем у пациентов. получавших только пэгинтерферон альфа-2b и рибавирин.
Нежелательные реакции приведены ниже и дифференцированы по системно-органным классам с указанием частоты возникновения: очень часто (≥1/10). часто (≥1/100. <1/10). нечасто (≥/1000. <1/100). редко (≥1/10000. <1/1000). неизвестно (частота не может быть оценена на основе имеющихся данных).
Приведенные нежелательные реакции были выявлены в ходе клинических исследований и в период пострегистрационного применения боцепревира в комбинации с пэгинтерфероном альфа-2b и рибавирином**.
Инфекционные и паразитарные заболевания. Часто - бронхит*. воспаление подкожной жировой клетчатки*. простой герпес. грипп. грибковые инфекции полости рта. синусит. нечасто - гастроэнтерит*. пневмония*. стафилококковая инфекция*. кандидоз. инфекционные заболевания уха. грибковые поражения кожи. назофарингит. онихомикоз. фарингит. инфекции дыхательных путей. ринит. инфекционные поражения кожи. инфекции мочевыводящих путей. редко - эпиглоттит*. средний отит. сепсис.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): редко - новообразования щитовидной железы (узловая форма).
Со стороны крови и лимфатической системы. Очень часто - анемия*. нейтропения*. часто - лейкопения*. тромбоцитопения*. агранулоцитоз. панцитопения. нечасто - геморрагический диатез. лимфаденопатия. лимфопения. редко - гемолиз.
Со стороны иммунной системы. Редко - саркоидоз*, порфирия (за исключением острой).
Со стороны эндокринной системы. Часто - зоб, гипотиреоз; нечасто - гипертиреоз.
Со стороны обмена веществ и питания. Очень часто - снижение аппетита. часто - дегидратация*. гипергликемия*. гипертриглицеридемия. гиперурикемия. нечасто - гипокалиемия*. расстройства аппетита. сахарный диабет. подагра. гиперкальциемия.
Со стороны психики. Очень часто - тревожность*. депрессия*. бессонница. раздражительность. часто - эмоциональная лабильность. ажитация. расстройства либидо. настроения. сна. нечасто - агрессия*. гомицидальные мысли*. панические атаки*. паранойя*. злоупотребление психотропными веществами*. суицидальные мысли*. аномальное поведение. гнев. апатия. спутанность сознания. изменения психического статуса. беспокойство. редко - биполярное расстройство*. завершенное самоубийство*. попытка самоубийства*. слуховые галлюцинации. визуальные галлюцинации. психическая декомпенсация.
Со стороны нервной системы. Очень часто - головокружение*. головная боль*. часто - гипестезия*. парестезия*. обморок*. амнезия. нарушение внимания. ухудшение памяти. мигрень. паросмия. тремор. вертиго. нечасто - периферическая нейропатия*. когнитивные расстройства. гиперестезия. заторможенность. потеря сознания. психические нарушения. невралгия. предобморочное состояние. редко - церебральная ишемия*. энцефалопатия.
Со стороны органа зрения. Часто - сухость глаз. ретинальный экссудат. нечеткость зрения. ухудшение зрения. нечасто - ишемия сетчатки*. ретинопатия*. ощущение инородного тела в глазу. неприятные ощущения в глазу. кровоизлияния в конъюнктиву. конъюнктивит. болезненные ощущения в глазу. зуд. припухлость глаз. отечность век. слезоточивость. гиперемия глаз. светобоязнь. редко - отек диска зрительного нерва.
Со стороны слуха и лабиринтные нарушения. Часто - звон в ушах; нечасто - глухота*, ощущение дискомфорта в ухе, нарушение слуха.
Со стороны сердца. Часто - ощущение сердцебиения. нечасто - тахикардия*. аритмия. сердечно-сосудистые расстройства. редко - острый инфаркт миокарда*. мерцательная аритмия*. ИБС*. перикардит*. экссудативный перикардит.
Со стороны сосудов. Часто - артериальная гипотензия*. артериальная гипертензия. нечасто - тромбоз глубоких вен*. приливы крови. бледность. синдром холодных конечностей. редко - венозный тромбоз.
Со стороны дыхательной системы. органов грудной клетки и средостения: очень часто - кашель*. одышка*. часто - носовое кровотечение. заложенность носа. боли в ротоглотке. заложенность дыхательных путей. придаточных пазух. затруднение дыхания. нечасто - плевральные боли*. легочная эмболия*. сухость в горле. дисфония. повышенная секреция верхних дыхательных путей. образование везикул в области ротоглотки. редко - плевральный фиброз*. ортопноэ. дыхательная недостаточность.
Со стороны ЖКТ. Очень часто - диарея*. тошнота*. рвота*. сухость во рту. извращение вкуса. часто - боли в животе*. боли в верхней части живота *. запор*. ГЭРБ*. геморрой*. дискомфорт в животе. вздутие живота. дискомфорт в аноректальной области. афтозный стоматит. хейлит. диспепсия. метеоризм. глоссалгия. язвы слизистой оболочки полости рта. боли в ротовой полости. стоматит. нарушения со стороны зубов. нечасто - боли в нижней части живота*. гастрит*. панкреатит*. анальный зуд. колит. дисфагия. изменение цвета каловых масс. усиление перистальтики. кровоточивость десен. болевые ощущения в деснах. гингивит. глоссит. сухость губ. одинофагия. прокталгия. ректальные кровотечения. гиперсекреция слюны. повышенная чувствительность зубов. изменение цвета языка. язвы на языке. редко - функциональная недостаточность поджелудочной железы.
Со стороны печени и желчевыводящих путей. Нечасто - гипербилирубинемия; редко - холецистит.
Со стороны кожи и подкожных тканей. Очень часто - алопеция. сухость кожи. зуд. сыпь. часто - дерматит. экзема. эритема. гипергидроз. ночные поты. периферические отеки. псориаз. эритематозная сыпь. макулярная сыпь. пятнисто-папулезная сыпь. папулезная сыпь. зудящая сыпь. поражения кожи. нечасто - фоточувствительность. язвы кожи. крапивница. неизвестно - ангионевротичекий отек. лекарственная сыпь с эозинофилией и системными симптомами (DRESS-синдром). эксфолиативная сыпь. эксфолиативный дерматит. синдром Стивенса-Джонсона. токсические высыпания на коже. токсидермия.
Со стороны скелетно-мышечной и соединительной ткани. Очень часто - артралгия. миалгия. часто - боль в спине*. боль в конечностях*. мышечные спазмы. мышечная слабость. боли в области шеи. нечасто - костно-мышечные боли в грудной клетке*. артрит. боли в костях. отечность суставов. костно-мышечные боли.
Со стороны почек и мочевыводящих путей. Часто - поллакиурия; нечасто - дизурия, никтурия.
Со стороны половых органов и молочной железы. Часто - эректильная дисфункция; нечасто - аменорея, меноррагия, метроррагия; редко - аспермия.
Общие расстройства. Очень часто - астения*. озноб. повышенная утомляемость*. лихорадка*. гриппоподобный синдром. часто - дискомфорт в области грудной клетки*. боль в груди*. недомогание*. ощущение изменения температуры тела. сухость слизистых оболочек. боль. нечасто - ощущение ненормального состояния. ухудшение процессов заживления. некардиальные боли в грудной клетке.
Отклонения в результатах лабораторных исследований. Очень часто - снижение массы тела; нечасто - сердечные шумы, повышение частоты сердечных сокращений.
*Включает нежелательные реакции, возникшие в ходе клинических исследований. По оценке исследователя могут быть серьезными.
**Поскольку боцепревир назначают в комбинации с пэгинтерфероном альфа и рибавирином, необходимо ознакомиться с соответствующим разделом инструкций по применению пэгинтерферона альфа и рибавирина.
Анемия.
Развитие анемии наблюдалось у 49% пациентов, получавших боцепревир в комбинации с пэгинтерфероном альфа-2b и рибавирином, по сравнению с 29% пациентов, получавших только пэгинтерферон альфа-2b и рибавирин. Добавление боцепревира приводило к дополнительному снижению концентрации Hb приблизительно на 1 г/дл (г/децилитр). Среднее снижение концентрации Hb по сравнению с исходным значением было больше у пациентов, ранее получавших терапию, по сравнению с пациентами, не получавшими предшествующую терапию. По причине возникновения анемии/гемолитической анемии производили коррекцию дозы у 26% пациентов. принимавших боцепревир в комбинации с пэгинтерфероном альфа-2b и рибавирином. по сравнению с 13% пациентов. принимавших только пэгинтерферон альфа-2b и рибавирин. В клинических исследованиях доля пациентов. которые получали эритропоэтин для лечения анемии. составила 43% в группе. получавшей боцепревир в комбинации с пэгинтерфероном альфа-2b и рибавирином. по сравнению с 24% в группе. получавшей лечение только пэгинтерфероном альфа-2b и рибавирином. Большинство пациентов с анемией при концентрации Hb ≤10 г/дл (6,2 ммоль/л) получали эритропоэтин. Количество пациентов. которым было сделано переливание крови с целью лечения анемии. составило 3% в группе принимавших боцепревир в комбинации с пэгинтерфероном альфа-2b и рибавирином по сравнению с <1% пациентов. принимавших только пэгинтерферон альфа-2b и рибавирин.
Нейтрофилы.
Количество пациентов с пониженным содержанием нейтрофилов в крови было выше в группе пациентов, получавших боцепревир, по сравнению с группой, получавшей только пэгинтерферон альфа-2b и рибавирин. Процент пациентов с нейтропенией 3-4-й степени (число нейтрофилов <0,75·109 клеток/л) был выше в группе. получавшей боцепревир (29%). по сравнению с группой. получавшей плацебо (17%) в комбинации с пэгинтерфероном альфа-2b и рибавирином. Снижение концентрации нейтрофилов до <0,5·109 клеток/л (4-я степень нейтропении) отмечено у 7% пациентов из группы. получавшей боцепревир в комбинации с пэгинтерфероном альфа-2b и рибавирином. и у 4%. получавших только пэгинтерферон альфа-2b и рибавирин.
Тромбоциты.
Снижение концентрации тромбоцитов наблюдали у 3% пациентов, получавших боцепревир в комбинации с пэгинтерфероном альфа-2b и рибавирином, и у 1% получавших только пэгинтерферон альфа-2b и рибавирин. В обеих группах пациенты с циррозом печени были подвержены большему риску развития тромбоцитопении 3-4-й степени по сравнению с пациентами без цирроза печени.
Другие данные лабораторных исследований.
Добавление боцепревира к терапии пэгинтерфероном альфа-2b и рибавирином было связано с увеличением частоты случаев повышения концентрации мочевой кислоты. триглицеридов и общего холестерина по сравнению с таковой при лечении только пэгинтерфероном альфа-2b и рибавирином.
RxList.com.
Необходимо предварительно ознакомиться с предписывающей информацией по пэгинтерферону альфа и рибавирину с описанием побочных реакций, связанных с использованием этих ЛС.
Клинические испытания.
Так как клинические испытания проведены с различным набором условий. частота встречаемости побочных реакций. наблюдавшихся в этих исследованиях. может не совпадать с полученной в других исследованиях и с наблюдаемой в клинической практике.
Наиболее часто встречаемыми побочными реакциями (у >35% больных независимо от оценки исследователями причинно-следственных связей) у взрослых пациентов при сочетанном применении боцепревира с пэгинтерфероном альфа-2b и рибавирином были усталость. анемия. тошнота. головная боль и дисгевзия (извращение вкуса).
Безопасность сочетанного применения боцепревира в дозе 800 мг 3 раза в день с комбинацией пэгинтерферон альфа-2b + рибавирин оценивалась при лечении 2095 больных с хроническим гепатитом С в открытом испытании фазы 2 и рандомизированном двойном слепом плацебо-контролируемом клиническом испытании фазы 3. В исследовании СПРИНТ-1 (пациенты. ранее не получавшие лечение) оценивали безопасность применения боцепревира в сочетании с комбинацией пэгинтерферон альфа-2b + рибавирин с или без 4-недельного вводного периода лечения комбинацией пэгинтерферон альфа-2b + рибавирин по сравнению с лечением только комбинацией пэгинтерферон альфа-2b + рибавирин. В испытаниях СПРИНТ-2 (пациенты. ранее не получавшие терапию) и РЕСПОНД-2 (пациенты. у которых предыдущая терапия была неэффективна) оценивали безопасность применения боцепревира в дозе 800 мг 3 раза в день в сочетании с комбинацией пэгинтерферон альфа-2b + рибавирин с 4-недельным вводным периодом лечения комбинацией пэгинтерферон альфа-2b + рибавирин по сравнению с лечением только комбинацией пэгинтерферон альфа-2b + рибавирин. Пациенты из изучаемой популяции имели средний возраст 49 лет (3% пациентов были старше 65 лет), 39% составляли женщины, 82% были белыми и 15% - негроидной расы.
В течение 4-недельного вводного периода с применением комбинации пэгинтерферон альфа-2b + рибавирин из 1263 больных. которые должны были в дальнейшем получать сочетанную терапию боцепревиром с комбинацией пэгинтерферон альфа-2b + рибавирин. у 28 пациентов (2%) побочные реакции привели к прекращению лечения. В течение всего курса лечения доля больных. прекративших лечение из-за побочных реакций. составила 13% для пациентов. получавших сочетанную терапию боцепревиром с комбинацией пэгинтерферон альфа-2b + рибавирин. и 12% пациентов. получавших только пэгинтерферон альфа-2b + рибавирин. Побочные действия, приводящие к прекращению терапии были сходны с теми, которые наблюдались в предыдущих исследованиях безопасности комбинации пэгинтерферон альфа-2b + рибавирин. Только анемия и усталость были зарегистрированы как неблагоприятные эффекты, которые привели к прекращению лечения у ≥1% пациентов во всех исследуемых группах.
Побочные действия. которые привели к модификации дозы любого из применяемых ЛС (в первую очередь пэгинтерферона альфа-2b и рибавирина). наблюдались у 39% пациентов. принимавших боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин. по сравнению с 24% пациентов. принимавших только комбинацию пэгинтерферон альфа-2b + рибавирин. Наиболее частой причиной снижения дозы была анемия. которая чаще возникала у пациентов. принимавших боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин. чем у пациентов. которым была назначена только комбинация пэгинтерферон альфа-2b + рибавирин.
Серьезные нежелательные явления были зарегистрированы у 11% пациентов. принимавших боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин. и у 8% пациентов. принимавших только комбинацию пэгинтерферон альфа-2b + рибавирин.
Данные о нежелательных явлениях (независимо от оценки исследователями причинно-следственных связей). произошедших у ≥10% пациентов. принимавших боцепревир в сочетании с комбинацией пэгинтерферон альфа-2b + рибавирин и наблюдавшихся у ≥5% больных. принимавних только комбинацию пэгинтерферон альфа-2b + рибавирин. в исследованиях СПРИНТ-1. СПРИНТ-2 и РЕСПОНД-2 будут представлены далее.
Количество пациентов и среднее время лечения (дни) в исследованиях СПРИНТ-1 + СПРИНТ-2: n=1225. 197 дней - прием боцепревира с комбинацией пэгинтерферон альфа-2b + рибавирин. n=467. 216 дней - прием только комбинации пэгинтерферон альфа-2b + рибавирин.
Количество пациентов и среднее время лечения (дни) в исследовании РЕСПОНД-2: n=323. 253 дней - прием боцепревира с комбинацией пэгинтерферон альфа-2b + рибавирин. n=80. 104 дня - прием только комбинации пэгинтерферон альфа-2b + рибавирин.
Встречаемость (в %) отдельных побочных реакций (прием боцепревира с комбинацией пэгинтерферон альфа-2b + рибавирин или только прием комбинации пэгинтерферон альфа-2b + рибавирин - в скобках) у пациенов. участвовавших в исследованиях СПРИНТ-1+СПРИНТ-2 или РЕСПОНД-2. приведена ниже.
Со стороны крови и лимфотической системы: анемия 50% (30%) и 45% (20%); нейтропения 50% (30%) и 45% (20%).
Со стороны ЖКТ: тошнота 46% (42%) и 43% (38%); дисгевзия 35% (16%) и 44% (11%); диарея 25% (22%) и 24% (16%); рвота 20% (13%) и 15% (8%); сухость во рту 11% (10%) и 15% (9%).
Общие расстройства и состояние в месте введения: усталость 58% (59%) и 55% (50%); озноб 34% (29%) и 33% (30%); астения 15% (18%) и 21% (16%).
Метаболизм и расстройства питания: снижение аппетита 25% (24%) и 26% (16%).
Со стороны скелетно-мышечной системы и соединительной ткани: артралгия 19% (19%) и 23% (16%).
Со стороны нервной системы: головокружение 19% (16%) и 16% (10%).
Со стороны психики: бессонница 34% (34%) и 30% (24%); раздражительность 22% (23%) и 21% (13%).
Со стороны дыхательной системы, грудной клетки и средостения: одышка при физической нагрузке 8% (8%) и 11% (5%).
Со стороны кожи и подкожных тканей: алопеция 27% (27%) и 22% (16%); сухость кожи 18% (18%) и 22% (9%); кожная сыпь 17% (19%) и 16% (6%).
Другие важные побочные реакции, выявленные в клинических испытаниях.
Среди пациентов (ранее не проходивших лечение или с неудачной предшествующей терапией), которые принимали боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин, были зафиксированы следующие побочные реакции. Эти реакции отличаются серьезностью. тяжестью или повышенной частотой встречаемости у пациентов. получающих боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин по сравнению с побочными действиями у тех больных. кто принимал только комбинацию пэгинтерферон альфа-2b + рибавирин.
Желудочно-кишечные расстройства. Дисгевзия (извращение вкуса) - неблагоприятная реакция. которая наблюдалась с повышенной частотой встречаемости у пациентов. принимавших боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин. по сравнению с частотой у больных. получавших только комбинацию пэгинтерферон альфа-2b + рибавирин ( см выше). Побочные эффекты. такие как сухость во рту. тошнота. рвота и диарея. также наблюдались с повышенной частотой у субъектов. принимавших боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин.
Данные лабораторных исследований.
Изменения отдельных гематологических параметров при лечении взрослых пациентов боцепревиром с комбинацией пэгинтерферон альфа-2b + рибавирин представлены ниже.
Hb. При снижении концентрации Hb может потребоваться снижения дозы или прекращения приема рибавирина ( см «Меры предосторожности» и предписывающую информацию для рибавирина). Если лечение рибавирином полностью прекращено, то и терапию пегинтерфероном альфа-2b и боцепревиром следует отменить ( см «Способ применения и дозы»).
Нейтрофилы и тромбоциты. Доля субъектов с уменьшеннным количеством нейтрофилов и тромбоцитов была выше у пациентов. принимавших боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин. по сравнению с пациентами. принимавших только комбинацию пэгинтерферон альфа-2b + рибавирин. У 3% пациентов. принимавших боцепревир с комбинацией пэгинтерферон альфа-2b + рибавирин. количество тромбоцитов было <50·109/л по сравнению только с 1% пациентов. получающих комбинацию пэгинтерферон альфа-2b + рибавирин. При снижении количества нейтрофилов или тромбоцитов может потребоваться снижение дозы или полное прекращение лечения пэгинтерфероном альфа-2b или прекращения терапии ( см предписывающее информацию для пэгинтерферона альфа-2b и рибавирина). Если лечение пегинтерфероном альфа-2b будет окончательно прекращено, то терапия рибавирином и боцепревиром также должна быть завершена ( см «Способ применения и дозы»).
Встречаемость (в %) снижения концентрации Hb. количества нейтрофилов и тромбоцитов (прием боцепревира с комбинацией пэгинтерферон альфа-2b + рибавирин или только прием комбинации пэгинтерферон альфа-2b + рибавирин - в скобках) у пациентов. участвовавших в исследованиях СПРИНТ-1 + СПРИНТ-2 или РЕСПОНД-2. приведена ниже.
Hb (<10 г/дл): 49% (29%) и 49% (25%).
Hb (<8,5 г/дл): 6% (3%) и 10% (15).
Нейтрофилы (<0,75·109/л): 31% (18%) и 26% (13).
Нейтрофилы (<0,5·109/л): 8% (4%) и 7% (4%).
Тромбоциты (<50·109/л): 3% (1%) и 4% (0%).
Тромбоциты (<25·109/л): <1% (0%) и 0% (0%).
Данные постмаркетинговых исследований.
Побочные реакции, выявленные в ходе пострегистрационного применения боцепревира с комбинацией пэгинтерферон альфа-2b + рибавирин, приводятся далее. В связи с тем. что данные об этих реакциях добровольно поступают от населения неопределенной численности. не всегда можно достоверно оценить частоту их возникновения или установить причинно-следственную связь с экспозицией исследуемого ЛС.
Со стороны крови и лимфотической системы: агранулоцитоз, панцитопения, тромбоцитопения ( см «Меры предосторожности»).
Со стороны ЖКТ: изъязвления полости рта, стоматит.
Инфекционные и паразитарные заболевания: пневмония, сепсис.
Со стороны кожи и подкожных тканей: ангионевротический отек. крапивница ( см «Меры предосторожности»). лекарственная сыпь с эозинофилией и системными симптомами (синдром лекарственной гиперчувствительности). эксфолиативная сыпь. эксфолиативный дерматит. синдром Стивенса-Джонсона. токсическая сыпь. токсикодермия.
|
|
Взаимодействие
Боцепревир является сильным ингибитором изоферментов сYP3A4/5. Одновременное применение этого средства и ЛС, в основном метаболизируемых изоферментами сYP3A4/5, может привести к повышению их концентрации в плазме и способствовать усилению или продлению их терапевтического эффекта и появлению нежелательных побочных реакций. Боцепревир in vitro >in vitro не ингибирует изоферменты сYP1A2, сYP2A6, сYP2B6, сYP2C8, сYP2C9, сYP2C19, сYP2D6 или сYP2E1 и не индуцирует изоферменты сYP1A2, сYP2B6, сYP2C8, сYP2C9, сYP2C19 или сYP3A4/5.
В исследованиях взаимодействий, включающих дигоксин, боцепревир показал ограниченную способность ингибировать P-gp в клинически значимых концентрациях. Следует ожидать повышения плазменной концентрации субстратов P-gp, осуществляющего их эффлюкс, таких как дигоксин и дабигатран.
В исследованиях in vitro >in vitro было показано, что боцепревир является субстратом P-gp.
Боцепревир частично метаболизируется под действием изоферментов сYP3A4/5. Совместное применение боцепревира с ЛС, индуцирующими или ингибирующими активность изоферментов сYP3A4/5, может способствовать увеличению или уменьшению концентрации боцепревира.
Боцепревир в комбинации с пэгинтерфероном альфа и рибавирином противопоказан для совместного применения с ЛС, выведение которых в большой степени зависит от активности изоферментов сYP3A4/5 и повышенные плазменные концентрации которых связаны с серьезными и/или опасными для жизни побочными реакциями. К ним относятся принимаемые внутрь следующие ЛС: мидазолам, триазолам, астемизол, бепридил, пимозид, лумефантрин, галофантрин, пропафенон, симвастатин, ловастатин, кветиапин, алфузозин, доксазозин, силодозин, тамсулозин, ингибиторы тирозинкиназы и производные спорыньи (дигидроэрготамин, эргометрин, эрготамин, метилэргометрин) ( см «Противопоказания»).
ЛС, применяемые с осторожностью.
ЛС, содержащие дроспиренон.
Следует соблюдать осторожность при назначении боцепревира пациентам, принимающим калийсберегающие диуретики или ЛС, содержащие дроспиренон, поскольку возможен риск развития гиперкалиемии. Следует рассмотреть возможность применения альтернативных методов контрацепции ( см «Ограничения к применению»).
Индукторы изофермента сYP3A4.
Не рекомендуется одновременное применение боцепревира с сильными индукторами изофермента сYP3A4 (рифампицин, карбамазепин, фенобарбитал, фенитоин).
ЛС, удлиняющие интервал QT.
Следует соблюдать осторожность при одновременном применении боцепревира с ЛС, удлиняющими интервал QT, такими как амиодарон, хинидин, метадон, пентамидин и некоторые нейролептики.
Противогрибковые ЛС.
Следует соблюдать осторожность при одновременном применении боцепревира с кетоконазолом или азольными противогрибковыми ЛС (итраконазол, позаконазол, вориконазол).
Ингибиторы протеазы ВИЧ.
Не рекомендуется одновременное применение боцепревира с ингибиторами протеазы ВИЧ (атазанавир/ритонавир, даруновир/ритонавир, лопинавир/ритонавир).
БКК.
Следует соблюдать осторожность при одновременном применении боцепревира с БКК (амлодипин, дилтиазем, фелодипин, никардипин, нифедипин, нисолдипин, верапамил) вследствие возможного повышения концентрации последних в крови. Такие пациенты должны находиться под наблюдением.
Фармакокинетическое взаимодействие боцепревира с другими ЛС.
Антиаритмические ЛС.
При совместном применении дигоксина (0,25 мг дигоксина однократно + 800 мг боцепревира 3 раза в день) AUC дигоксина увеличивалась на 19%, maxCmax дигоксина повышалась на 18%. Коррекция дозы дигоксина или боцепревира при совместном применении не требуется. Пациенты, получающие дигоксин, должны находиться под наблюдением.
Противовирусные средства.
При совместном применении пэгинтерферона альфа-2b (пэгинтерферон альфа-2b 1,5 мкг/кг п/к 1 раз в неделю + боцепревир 400 мг 3 раза в день) AUC0-8 боцепревира не изменялась, Сmax снижалась на 12%; AUC0-8 пэгинтерферона альфа-2b уменьшалась на 1%. Коррекция дозы пэгинтерферона альфа-2b и боцепревира при совместном применении не требуется.
Антибиотики.
При совместном применении кларитромицина в комбинации с дифлунисалом (кларитромицин 500 мг 3 раза в день + дифлунисал 500 мг 2 или 3 раза в день + боцепревир 400 мг 2 раза в день) AUC и Сmax боцепревира возрастали на 21 и 36% соответственно, а Сmin снижалась на 15%. Коррекция дозы боцепревира при совместном применении с кларитромицином или комбинацией кларитромицин + дифлунисал не требуется.
Противогрибковые ЛС.
При совместном применении кетоконазола (кетоконазол 400 мг 2 раза в день + боцепревир 400 мг однократно) AUC боцепревира увеличивалась на 131%, Сmax повышалась на 41% (ингибирование изоферментов сYP3A4 и сYP3A5 и/или P-gp). Фармакокинетическое взаимодействие итраконазола, позаконазола, вориконазола не изучалось. Коррекция дозы боцепревира или кетоконазола при совместном применении не требуется. Следует соблюдать осторожность при совместном применении боцепревира с азольными противогрибковыми ЛС.
Противовирусные (ВИЧ) ЛС.
Ингибиторы интегразы ВИЧ. При совместном применении ралтегравира (ралтегравир 400 мг однократно + боцепревир 800 мг 3 раза в день или ралтегравир 400 мг каждые 12 ч + боцепревир 800 мг 3 раза в день) AUC0-12 ралтегравира увеличивалась на 4%, maxCmax ралтегравира повышалась на 11% и с12 ралтегравира снижалась на 25%; AUC, maxCmax и с8 боцепревира снижались на 2; 4 и 26% соответственно. Коррекция дозы боцепревира или ралтегравира при совместном применении не требуется.
Нуклеозидные ингибиторы обратной транскриптазы ВИЧ. При совместном применении тенофовира (тенофовир 300 мг ежедневно + боцепревир 800 мг 3 раза в день) AUC, maxCmax и сmin боцепревира повышались соответственно на 8; 5 и 8%; AUC и maxCmax тенофовира возрастали на 5 и 32% соответственно. Коррекция дозы боцепревира или тенофовира при совместном применении не требуется.
Ненуклеозидные ингибиторы обратной транскриптазы ВИЧ. При совместном применении эфавиренза (эфавиренз 600 мг ежедневно + боцепревир 800 мг 3 раза в день) AUC0-8 боцепревира уменьшалась на 19%, а Сmах и сmin боцепревира снижались соответственно на 8 и 44%; AUC эфавиренза увеличивалась на 20% и Сmах эфавиренза повышалась на 11% (индукция изофермента сYP3A4 - воздействие на боцепревир). Влияние снижения сmin боцепревира на клинические последствия не оценивалось.
При совместном применении этравирина (этравирин 200 мг каждые 12 ч + боцепревир 800 мг 3 раза в день) AUC боцепревира увеличивалась на 10%, maxCmax боцепревира повышалась на 10% и с8 снижалась на 12%; AUC этравирина уменьшалась на 23%, а maxCmax и сmin этравирина снижались соответственно на 24 и 29%. Непосредственная оценка клинической значимости снижения фармакокинетических параметров этравирина не проводилась.
При совместном применении рилпивирина (рилпивирин 25 мг каждые 24 ч + боцепревир 800 мг 3 раза в день) AUC и maxCmax боцепревира снижались на 6 и 2% соответственно, а С8 увеличивалась на 4%; AUC, maxCmax и с24 рилпивирина возрастали на 39; 15 и 51% соответственно (влияние на рилпивирин обусловлено ингибированием изофермента сYP3A). Коррекция дозы боцепревира и рилпивирина не требуется.
Ингибиторы протеазы ВИЧ. При совместном применении комбинации атазанавир + ритонавир (атазанавир 300 мг + ритонавир 100 мг ежедневно + боцепревир 800 мг 3 раза в день) AUC, maxCmax и сmin боцепревира снижались на 5; 7 и 18% соответственно; AUC, maxCmax и сmin атазанавира снижались на 35; 25 и 49% соответственно; AUC, maxCmax и сmin ритонавира снижались на 36; 27 и 45% соответственно. Совместное применение комбинации атазанавир + ритонавир и боцепревира не рекомендуется.
При совместном применении комбинации дарунавир + ритонавир (дарунавир 600 мг + ритонавир 100 мг 2 раза в день + боцепревир 800 мг 3 раза в день) AUC, maxCmax и сmin боцепревира снижались на 32; 25 и 35% соответственно; AUC, maxCmax и сmin дарунавира снижались на 44; 36 и 59% соответственно; AUC, maxCmax и сmin ритонавира снижались на 27; 13 и 45% соответственно. Совместное применение комбинации дарунавир + ритонавир и боцепревира не рекомендуется.
При совместном применении комбинации лопинавир + ритонавир (лопинавир 400 мг + ритонавир 100 мг 2 раза в день + боцепревир 800 мг 3 раза в день) AUC, maxCmax и сmin боцепревира снижались на 45; 50 и 57% соответственно; AUC, maxCmax и сmin лопинавира снижались на 34; 30 и 43% соответственно; AUC, maxCmax и сmin ритонавира снижались на 22; 12 и 42% соответственно. Совместное применение комбинации лопинавир + ритонавир и боцепревира не рекомендуется.
При совместном применении ритонавира (ритонавир 100 мг 1 раз в день + боцепревир 400 мг 3 раза в день) AUC и сmin боцепревира возрастали на 19 и 4% соответственно, а maxCmax боцепревира снижалась на 27% (за счет ингибирования изоферментов сYP3A4/5).
Нейролептики.
Кветиапин. Взаимодействие не изучалось (влияние на кветиапин обусловлено ингибированием изоферментов сYP3A4/5). При совместном применении кветиапина и боцепревира может повышаться концентрация кветиапина в плазме, что может привести к кветиапиновой токсичности, в тч коме. Совместное применение кветиапина и боцепревира противопоказано ( см «Противопоказания»).
Опиоидные наркотические анальгетики.
При совместном применении комбинации бупренорфин + налоксон (бупренорфин + налоксон 8 + 2 - 24 + 6 мг в день + боцепревир 800 мг 3 раза в день) AUC, maxCmax и сmin боцепревира снижаются на 12; 18 и 5% соответственно; AUC, maxCmax и сmin бупренорфина возрастают на 19; 18 и 31% соответственно; AUC и maxCmax налоксона увеличиваются на 33 и 9% соответственно. Коррекция дозы комбинации бупренорфин + налоксон или боцепревира не требуется. Пациенты должны находиться под контролем в связи с возможным появлением признаков опиатной токсичности, связанной с применением боцепревира.
При совместном применении метадона (метадон 20-150 мг 1 раз в день + боцепревир 800 мг 3 раза в день) AUC и maxCmax боцепревира снижаются на 20 и 38% соответственно, сmin боцепревира повышается на на 3%; AUC, maxCmax и сmin R-метадона уменьшаются на 15; 10 и 19% соответственно; AUC, maxCmax и сmin S-метадона снижаются на 22; 17 и 26% соответственно. Коррекция дозы метадона или боцепревира при совместном применении не требуется. Отдельным пациентам может потребоваться дополнительное титрование дозы метадона в начале/по окончании приема боцепревира для обеспечения клинического эффекта метадона.
НПВС.
При совместном применении дифлунизала (дифлунизал 250 мг 2 раза в день + боцепревир 800 мг 2 или 3 раза в день) AUC, maxCmax и сmin боцепревира снижаются на 4; 14 и 31% соответственно. Коррекция дозы боцепревира или дифлунизала не требуется.
При совместном применении ибупрофена (ибупрофен 600 мг 3 раза в день + боцепревир 400 мг однократно) AUC и maxCmax боцепревира возрастали на 4 и 6% соответственно. Коррекция дозы боцепревира или ибупрофена при совместном применении не требуется.
Антидепрессанты.
При совместном применении эсциталопрама (эсциталопрам 10 мг однократно + боцепревир 800 мг 3 раза в день) AUC боцепревира снижается на 9%, а его maxCmax возрастает на 2%; AUC и maxCmax эсциталопрама снижаются на 21 и 19% соответственно. При совместном применении эсциталопрама с боцепревиром концентрация эсциталопрама немного снижалась. Хотя эсциталопрам - СИОЗС - имеет широкий терапевтический индекс, при совместном применении с боцепревиром может потребоваться коррекция доз этих ЛС.
БКК.
Взаимодействие с амлодипином, дилтиаземом, фелодипином, никардипином, нифедипином, нисолдипином и верапамилом не изучалось. Концентрация в крови этих ЛС из группы БКК может повышаться при одновременном применении с боцепревиром. Следует соблюдать осторожность при их соместном применении с боцепревиром, и в этгм случае пациенты должны находиться под наблюдением.
ГКС.
При совместном применении с преднизоном (преднизон 40 мг однократно + боцепревир 800 мг 3 раза в день) AUC преднизона увеличивалась на 22%, maxCmax снижалась на 1%; AUC и maxCmax преднизолона увеличивались на 37 и 16% соответственно. Коррекция дозы боцепревира не требуется. Пациенты, получающие преднизон и боцепревир, должны находиться под наблюдением.
Гиполипидемические ЛС.
При совместном применении аторвастатина (аторвастатин 40 мг однократно + боцепревир 800 мг 3 раза в день) AUC боцепревира уменьшалась на 5%, Сmax повышалась на 4%; AUC и maxCmax аторвастатина увеличивались на 130 и 166% соответственно (ингибирование изоферментов сYP3A4/5 и OATPBI - мозгоспецифический транспортер органических анионов). Концентрация аторвастатина повышалась при одновременном назначении с боцепревиром, поэтому при одновременном применении следует назначать наименьшую эффективную дозу аторвастатина, но не превышающую суточную - 20 мг.
При совместном применении правастатина (правастатин 40 мг однократно + боцепревир 800 мг 3 раза в день) AUC и maxCmax боцепревира снижались на 6 и 7% соответственно, а AUC и maxCmax правастатина возрастали на 63 и 49% соответственно (ингибирование изофермента OATPBI). Одновременное применение правастатина и боцепревира повышало концентрацию правастатина, при этом лечение правастатином может быть начато в рекомендованных дозах. Пациенты, получающие правастатин и боцепревир, должны находиться под наблюдением.
Иммунодепрессанты.
При совместном применении циклоспорина (циклоспорин 100 мг однократно + боцепревир 800 мг однократно или циклоспорин 100 мг однократно + боцепревир 800 мг 3 раза в день) AUC и maxCmax боцепревира увеличивались на 16 и 8% соответственно, а AUC и maxCmax циклоспорина возрастали на 168 и 101% соответственно (влияние на циклоспорин обусловлено ингибированием изоферментов сYP3A4/5). При одновременном применении с боцепревиром может потребоваться коррекция дозы циклоспорина, при этом следует руководствоваться результатами тщательного контроля концентрации циклоспорина в крови, контроля функции почек и побочных реакций, связанных с приемом циклоспорина.
При совместном применении такролимуса (такролимус 0,5 мг однократно + боцепревир 800 мг однократно или такролимус 0,5 мг однократно + боцепревир 800 мг 3 раза в день) AUC боцепревира не изменялась, maxCmax снижалась на 3%; AUC и Сmax такролимуса повышались на 1610 и 890% соответственно (влияние на такролимус обусловлено ингибированием изоферментов сYP3A4/5). Одновременное применение такролимуса с боцепревиром требует значительного снижения дозы и увеличения интервала дозирования для такролимуса, при этом необходим тщательный контроль концентрации такролимуса в крови, функции почек и побочных эффектов, связанных с применением такролимуса.
При совместном применении сиролимуса (сиролимус 2 мг однократно + боцепревир 800 мг 3 раза в день) AUC и maxCmax боцепревира снижались на 5 и 6% соответственно, а с8 повышалась на 21%; AUC и Сmax сиролимуса повышались на 712 и 384% соответственно (влияние на сиролимус обусловлено ингибированием изоферментов сYP3A4/5). При одновременном применении сиролимуса и боцепревира требуется значительное снижения дозы и увеличение интервала дозирования для сиролимуса, при этом необходим тщательный контроль концентрации сиролимуса в крови, контроль функции почек и контроль побочных эффектов, связанных с применением сиролимуса.
Пероральные антикоагулянты.
Взаимодействие с дабигатраном не изучалось (влияние на транспорт, осуществляемый P-gp в кишечнике). Коррекция дозы боцепревира не требуется. Пациенты, получающие дабигатран и боцепревир, должны находиться под наблюдением.
Контрацептивные ЛС.
При совместном применении комбинации дроспиренон + этинилэстрадиол с боцепревиром (дроспиренон 3 мг 1 раз в день + этинилэстрадиол 0,02 мг 1 раз в день + боцепревир 800 мг 3 раза в день) AUC и maxCmax дросперинона повышались на 99 и 57% соответственно; AUC этинилэстрадиола уменьшалась на 24%, Сmax этинилэстрадиола не изменялась (дроспиренон ингибирует изоферменты сYP3A4/5). Следует соблюдать осторожность при назначении боцепревира пациентам, принимающим калийсберегающие диуретики и ЛС, содержащие дроспиренон, поскольку возможен риск развития гиперкалиемии. Следует рассмотреть возможность применения альтернативных методов контрацепции ( см «Ограничения к применению»).
При совместном применении комбинации норэтистерон + этинилэстрадиол с боцепревиром (норэтистерон 1 мг 1 раз в день + этинилэстрадиол 0,035 мг 1 раз в день + боцепревир 800 мг 3 раза в день) AUC0-24 норэтистерона уменьшалась на 4%, Сmax снижалась на 17%; AUC0-24 этинилэстрадиола уменьшалась на 26%, Сmax снижалась на 21%. Концентрация этинилэстрадиола снижалась при одновременном применении с боцепревиром. На основании величин сывороточных концентраций прогестерона, ЛГ и ФСГ сделан вывод, что при одновременном применении этинилэстрадиола 0,035 мг, норэтистерона 1 мг и боцепревира овуляция подавляется. Маловероятно, что одновременное применение боцепревира и комбинированных пероральных контрацептивов, содержащих этинилэстрадиол и ≥1 мг норэтистерона, влияет на контрацептивный эффект ( см «Применение при беременности и кормлении грудью»). Влияние одновременного применения боцепревира и комбинированных пероральных или других форм гормональных контрацептивов, содержащих более низкие дозы норэтистерона, на подавление овуляции не изучено. Пациенты, применяющие эстрогены в качестве гормональной заместительной терапии, должны находиться под наблюдением врача на предмет развития признаков эстрогенной недостаточности.
Ингибиторы протонного насоса.
При совместном применении омепразола (омепразол 40 мг 1 раз в день + боцепревир 800 мг 3 раза в день) AUC0-8 и maxCmax боцепревира снижались на 8 и 6% соответственно, а С8 боцепревира повышалась на 17%; AUC0-8, maxCmax и С8 омепразола повышались соответственно на 6; 3 и 12%. Коррекция дозы омепразола или боцепревира при совместном применении не требуется.
Анксиолитики.
При совместном применении мидазолама для приема внутрь (мидазолам 4 мг однократно + боцепревир 800 мг 3 раза в день) AUC и Сmax мидазолама повышались на 430 и 177% соответственно (ингибирование изоферментов сYP3A4/5). Одновременное применение мидазолама (для приема внутрь) с боцепревиром противопоказано ( см «Противопоказания»).
Взаимодействие боцепревира и триазолама для приема внутрь не изучалось. Одновременное применение триазолама для приема внутрь с боцепревиром противопоказано ( см «Противопоказания»).
Взаимодействие алпразолама, мидазолама и триазолама (для в/в ведения) с боцепревиром не изучено (ингибирование изоферментов сYP3A4/5). Должно проводиться тщательное клиническое отслеживание случаев угнетения дыхания и/или затянувшегося седативного состояния во время одновременного применения боцепревира с в/в введением бензодиазепинов (алпразолам, мидазолам, триазолам). Необходима коррекция дозы бензодиазепина.
RxList.com.
Возможность влияния боцепревира на другие ЛС.
Боцепревир является сильным ингибитором изоферментов сYP3A4/5. У ЛС, метаболизируемых в основном с участием изоферментов сYP3A4/5, может повышаться экспозиция при совместном применении с боцепревиром, что в свою очередь может привести к усилению или продлению терапевтических и побочных эффектов этих ЛС. Боцепревир не ингибирует изоферменты сYP1A2, сYP2A6, сYP2B6, сYP2C8, сYP2C9, сYP2C19, сYP2D6 или сYP2E1 в in vitro >in vitro. Кроме того, боцепревир in vitro >in vitro не индуцирует изоферменты сYP1A2, сYP2B6, сYP2C8, сYP2C9, сYP2C19 или сYP3A4/5.
Основываясь на исследованиях, проведенных in vitro >in vitro, боцепревир является потенциальным ингибитором P-gp. В исследовании взаимодействия с дигоксином боцепревир обладал в клинически значимых концентрациях ограниченным ингибирующим потенциалом в отношении P-gp.
Возможность влияния других ЛС на боцепревир.
Боцепревир в основном метаболизируется при посредстве альдокеторедуктазы (АКР). В исследованиях взаимодействия, проведенные с ингибиторами AKР дифлунизалом и ибупрофеном, экспозиция боцепревира не увеличивалась до клинически значимой степени. Совместное применение боцепревира с ингибиторами АКР допустимо.
Боцепревир частично метаболизируются изоферментами сYP3A4/5. Он также является субстратом для Р-gp. Сочетанное применение боцепревира с ЛС, которые индуцируют или ингибируют изоферменты сYP3A4/5 может уменьшить или увеличить экспозицию боцепревира.
Установленные и другие потенциально значимые взаимодействия.
Ниже представлены рекомендации, основанные на установленных или потенциально клинически значимых взаимодействиях. Совместное применение боцепревира противопоказано с ЛС, которые являются сильными индукторами изоферментов сYP3A4/5 и ЛС, клиренс которых сильно зависит от изоферментов сYP3A4/5 и для которых их повышенная концентрация в плазме связана с серьезными и/или угрожающими жизни событиями ( см «Противопоказания»).
При совместном применении с антиаримическими ЛС (амиодарон, бепридил, пропафенон, хинидин) их концентрация возрастает. При сочетанном применении с боцепревиром имеется вероятность возникновения серьезных и/или угрожающих жизни побочных эффектов, и это применение не изучено. Рекомендуется соблюдать осторожность и проводить мониторирование терапевтической концентрации этих ЛС, если они применяются одновременно с боцепревиром.
При совместном применении с дигоксином* концентрация этого ЛС возрастает. Следует измерить концентрацию дигоксина в сыворотке крови до начала приема боцепревира. Продолжить мониторинг концентрации дигоксина и при необходимости использовать предписывающую информацию для титрации дозы этого ЛС.
При совместном применении с антикоагулянтом варфарином его концентрация может как повышаться, так и снижаться. Необходимо внимательно следить за значением МНО.
При совместном применении с антидепрессантами тразодоном или дезимипрамином концентрация этих ЛС в плазме может возрастать, что в свою очередь может привести к таким побочным эффектам как головокружение, гипотония и обморок. Следует сочетанное применение проводить с осторожностью и рассмотреть возможность назначения более низкой дозы тразодона или дезипрамина.
При совместном применени с эсциталопрамом* экспозиция этого ЛС незначительно снижалась. СИОЗС, такие как эсциталопрам, имеют широкий терапевтический индекс, но дозирование, возможно, должно быть скорректировано при сочетанном применении с боцепревиром.
При совместном применении с противогрибковыми ЛС (кетоконазол*, итраконазол, вориконазол, позаконазол) их концентрация в плазме может возрасти. Когда необходимо сочетанное применение, доза кетоконазола* и итраконазола не должна превышать 200 мг/сут.
При сочетанном применении с колхицином - противоподагрическим ЛС - ожидается значительное возрастание концентрации этого ЛС. Сообщалось о фатальной токсичности колхицина при его совместном применении с другими сильными ингибиторами изофермента сYP3A4.
Больным с почечной или печеночной недостаточностью не следует назначать совместно колхицин и боцепревир.
Лечение подагрических приступов (во время применения боцепревира): 0,6 мг колхицина, а через 1 ч - еще 0,3 мг. Это лечение не должно быть повторено ранее чем через 3 дня.
Профилактика подагрических приступов (во время применения боцепревира): если исходный режим был 0,6 мг колхицина 2 раза в день, то снизить дозу до 0,3 мг 1 раз в день; если исходный режим был 0,6 мг 1 раз в день, дозу снижают до 0,3 мг 1 раз в день.
Лечение семейной средиземноморской лихорадки (во время применения боцепревира): максимальная суточная доза колхицина - 0,6 мг (можно - 0,3 мг 2 раза в день).
При совместном применении с кларитромицином концентрация этого ЛС может возрасти; однако коррекции дозировки для пациентов с нормальной функцией почек не требуется.
При сочетанном применении с рифабутином ожидается увеличение экспозиции рифабутина, в то время как экспозиция боцепревира может снизится. Дозы для этих ЛС при использовании в комбинации не определены. Одновременное применение не рекомендуется.
При сочетанном применении с БКК, такими как амлодипин, дилтиазем, фелодипин, нифедипин, никардипин, нисолдипин, верапамил, концентрация этих ЛС может возрасти. Рекомендуется клинический мониторинг.
При сочетанном применении с системным ГКС дексаметазоном концентрация боцепревира снижается. Совместное применение боцепревира с индукторами изоферментов сYP3A4/5 может снизить его плазменную концентрацию, что в свою очередь может привести к потере терапевтического эффекта этого ЛС. Таким образом, применения этой комбинации следует избегать, если это возможно, или, при необходимости, использовать средство с осторожностью.
При совместном применении с боцепревиром концентрация системного ГКС преднизона* и его активного метаболита преднизолона увеличивается. Изменения дозы преднизона при этом при сочетанном применении не требуется. Состояние больных, принимающих комбинацию преднизолон с боцепревиром, должно контролироваться надлежащим образом.
Одновременное применение ингаляционных ЛС будесонида или флутиказона с боцепревиром может привести к увеличению концентрации в плазме будесонида или флутиказона, что в свою очередь приводит к значительному снижению концентрации кортизола в сыворотке крови. По возможности следует избегать их совместного применения, особенно в течение длительного периода времени.
Концентрация бозентана - неселективного агониста эндотелиновых рецепторов - может возрасти при сочетанном применении с боцепревиром. Эту комбинацию следует применять с осторожностью и тщательно контролировать состояние больного.
При совместном применении с ралтегравиром* - ингибитором интегразы ВИЧ - концентрация этого ЛС не изменяется.
Cmin боцепревира в плазме снижалется при сочетанном применении с ненуклеозидным ингибитором обратной транскриптазы ВИЧ эфавирензем*, что может привести к потере терапевтического эффекта. Следует избегать этой комбинации.
Концентрация этравирина* - ненуклеозидного ингибитора обратной транскриптазы ВИЧ - снижается при сочетанном применении с боцепревиром. Клиническая значимость снижения уровней фармакокинетических параметров этравирина непосредственно не оценена.
При одновременном применении боцепревира и рилпивирина* - ненуклеозидного ингибитора обратной транскриптазы ВИЧ - увеличивалась экспозиция рилпивирина. Изменение доз боцепревира и рилпивирина не рекомендуется.
Совместное применении комбинации атазановир + ритонавир* (ингибиторы протеазы ВИЧ) приводит к снижению равновесной экспозиции этих ЛС. Сочетанное применение комбинации атазановир + ритонавир и боцепревира не рекомендуется.
Совместное применении боцепревира и комбинации дарунавир + ритонавир* (ингибиторы протеазы ВИЧ) приводит к снижению равновесной экспозиции всех трех этих ЛС. Сочетанное применение комбинации дарунавир + ритонавир и боцепревира не рекомендуется.
Совместное применении боцепревира и комбинации лопинавир + ритонавир* (ингибиторы протеазы ВИЧ) приводит к снижению равновесной экспозиции всех трех этих ЛС. Сочетанное применение комбинации лопинавир + ритонавир и боцепревира не рекомендуется.
При сочетанном применении боцепревира только с ритонавиром*, концентрация боцепревира снижается.
Экспозиция аторвастатина* - ингибитора ГМГ-КоА-редуктазы - возрастала при сочетанном применении с боцепревиром. Следует применять самую низкую эффективную дозу аторвастатина, но не превышающую 40 мг в сутки, при совместном применении с боцепревиром.
Экспозиция правастатина* - ингибитора ГМГ-КоА-редуктазы - возрастала при сочетанном применении с боцепревиром. Лечение правастатином может быть инициировано в рекомендуемой дозе при совместном применении с боцепревиром. Клинический контроль оправдан.
При сочетанном применении с иммунодепрессантом циклоспорином* концентрация циклоспорина возрастает. Следует тщательно мониторировать концентрацию циклоспорина в крови для ожидаемой корректировки дозирования этого ЛС и часто оценивать функцию почек и наличие циклоспоринзависимых побочных эффектов при соместном применении с боцепревиром.
При сочетанном применении с иммунодепрессантом такролимусом* концентрация такролимуса возрастает. Одновременное применение боцепревира и такролимуса требует значительного снижения дозы и удлинения интервала дозирования для такролимуса при тщательном мониторинге концентрации такролимуса в крови и частой оценки почечной функции и такролимусзависимых побочных эффектов.
При сочетанном применении с иммунодепрессантом сиролимусом* концентрация последнего возрастает. Одновременное применение боцепревира и сиролимуса требует значительного снижения дозы и удлинения интервала дозирования для сиролимуса при тщательном мониторинге концентрации сиролимуса в крови и частой оценки функции почек и сиролимусзависимых побочных эффектов.
При сочетанном применении с салметеролом в ингаляционной форме концентрация этого ЛС возрастает. Одновременное применение ингаляционной формы салметерола и боцепревира не рекомендуется из-за риска развития сердечно-сосудистых осложнений (побочные эффекты), связанных с салметеролом.
При сочетанном применении с опиоидным наркотическим анальгетиком метадоном* концентрация R-метадона снижается. Наблюдаемые изменения не считаются клинически значимыми. Регулировка дозы метадона или боцепревира не рекомендуется. Отдельным пациентам может потребоваться дополнительное титрование дозы метадона в начале или завершении лечения метадоном в целях обеспечения клинического эффекта последнего.
Концентрация в плазме бупренорфина и налоксона* увеличивается при сочетанном применении этой комбинации с боцепревиром. Наблюдаемые изменения не считаются клинически значимыми. Изменение дозирования комбинации бупренорфин + налоксон или боцепревира не рекомендуется.
При сочетанном применении с комбинированным контрацептивным ЛС для приема внутрь дроспиренон + этинилэстрадиол* концентрация дроспиренона увеличивалась, а этинилэстрадиола - снижалась. Таким образом, использование ЛС, содержащих дроспиренон, противопоказано во время лечения боцепревиром из-за возможного развития гиперкалиемии ( см «Противопоказания»).
При сочетанном применении с комбинированным контрацептивным ЛС для приема внутрь норэтистерон + этинилэстрадиол* концентрация этинилэстрадиола снижалась. Значение maxCmax норэтистерона в присуствии боцепревира уменьшалось на 17%. Совместное применение боцепревира с комбинированным пероральным контрацептивным ЛС, содержащим этинилэстрадиол и по меньшей мере 1 мг норэтистерона, скорее всего не изменит эффективность этого комбинированного контрацептива для према внутрь. Пациенты, применяющие эстрогены в качестве заместительной гормональной терапии, должны находиться под клиническим контролем для определения наличия признаков дефицита эстрогенов.
При сочетанном применении с ингибиторами ФДЭ-5 (силденафил, тадалафил, варденафил) концентрация этих ЛС повышается, что может усиливать их побочные эффекты, включая гипотонию, обморок, нарушение зрения и приапизм. Применение силденафила или тадалафила для лечения легочной гипертензии противопоказано одновременно с лечением боцепревиром. Применение ингибиторов ФДЭ-5 для лечения эректильной дисфункции: следует использовать эти ЛС с осторожностью при совместом применении с боцепревиром и с усилением контроля за побочными эффектами ингибиторов ФДЭ-5. Не следует превышать следующие дозы: силденафил - 25 мг каждые 48 тадалафил - 10 мг каждые 72 варденафил - 2,5 мг каждые 24.
При совместном применении омепразола* - ингибитора протонного насоса - концентрация омепразола практически не меняется. Коррекция дозы омепразола или боцепревира при их сочетанном применении не требуется.
При сочетанном применении с мидазоламом для в/в ведения (наркозное, снотворное ЛС) и алпразоламом (анксиолитик) концентрация этих ЛС возрастает. Необходим клинический контроль за угнетением дыхания и/или продолжительностю седации во время совместного применения с боцепревиром. Следует рассмотреть возможность снижения дозы мидазолама для в/в введения или алпразолама.
*Эти комбинации были исследованы ( см «Взаимодействие»).
В исследованиях взаимодействий, включающих дигоксин, боцепревир показал ограниченную способность ингибировать P-gp в клинически значимых концентрациях. Следует ожидать повышения плазменной концентрации субстратов P-gp, осуществляющего их эффлюкс, таких как дигоксин и дабигатран.
В исследованиях in vitro >in vitro было показано, что боцепревир является субстратом P-gp.
Боцепревир частично метаболизируется под действием изоферментов сYP3A4/5. Совместное применение боцепревира с ЛС, индуцирующими или ингибирующими активность изоферментов сYP3A4/5, может способствовать увеличению или уменьшению концентрации боцепревира.
Боцепревир в комбинации с пэгинтерфероном альфа и рибавирином противопоказан для совместного применения с ЛС, выведение которых в большой степени зависит от активности изоферментов сYP3A4/5 и повышенные плазменные концентрации которых связаны с серьезными и/или опасными для жизни побочными реакциями. К ним относятся принимаемые внутрь следующие ЛС: мидазолам, триазолам, астемизол, бепридил, пимозид, лумефантрин, галофантрин, пропафенон, симвастатин, ловастатин, кветиапин, алфузозин, доксазозин, силодозин, тамсулозин, ингибиторы тирозинкиназы и производные спорыньи (дигидроэрготамин, эргометрин, эрготамин, метилэргометрин) ( см «Противопоказания»).
ЛС, применяемые с осторожностью.
ЛС, содержащие дроспиренон.
Следует соблюдать осторожность при назначении боцепревира пациентам, принимающим калийсберегающие диуретики или ЛС, содержащие дроспиренон, поскольку возможен риск развития гиперкалиемии. Следует рассмотреть возможность применения альтернативных методов контрацепции ( см «Ограничения к применению»).
Индукторы изофермента сYP3A4.
Не рекомендуется одновременное применение боцепревира с сильными индукторами изофермента сYP3A4 (рифампицин, карбамазепин, фенобарбитал, фенитоин).
ЛС, удлиняющие интервал QT.
Следует соблюдать осторожность при одновременном применении боцепревира с ЛС, удлиняющими интервал QT, такими как амиодарон, хинидин, метадон, пентамидин и некоторые нейролептики.
Противогрибковые ЛС.
Следует соблюдать осторожность при одновременном применении боцепревира с кетоконазолом или азольными противогрибковыми ЛС (итраконазол, позаконазол, вориконазол).
Ингибиторы протеазы ВИЧ.
Не рекомендуется одновременное применение боцепревира с ингибиторами протеазы ВИЧ (атазанавир/ритонавир, даруновир/ритонавир, лопинавир/ритонавир).
БКК.
Следует соблюдать осторожность при одновременном применении боцепревира с БКК (амлодипин, дилтиазем, фелодипин, никардипин, нифедипин, нисолдипин, верапамил) вследствие возможного повышения концентрации последних в крови. Такие пациенты должны находиться под наблюдением.
Фармакокинетическое взаимодействие боцепревира с другими ЛС.
Антиаритмические ЛС.
При совместном применении дигоксина (0,25 мг дигоксина однократно + 800 мг боцепревира 3 раза в день) AUC дигоксина увеличивалась на 19%, maxCmax дигоксина повышалась на 18%. Коррекция дозы дигоксина или боцепревира при совместном применении не требуется. Пациенты, получающие дигоксин, должны находиться под наблюдением.
Противовирусные средства.
При совместном применении пэгинтерферона альфа-2b (пэгинтерферон альфа-2b 1,5 мкг/кг п/к 1 раз в неделю + боцепревир 400 мг 3 раза в день) AUC0-8 боцепревира не изменялась, Сmax снижалась на 12%; AUC0-8 пэгинтерферона альфа-2b уменьшалась на 1%. Коррекция дозы пэгинтерферона альфа-2b и боцепревира при совместном применении не требуется.
Антибиотики.
При совместном применении кларитромицина в комбинации с дифлунисалом (кларитромицин 500 мг 3 раза в день + дифлунисал 500 мг 2 или 3 раза в день + боцепревир 400 мг 2 раза в день) AUC и Сmax боцепревира возрастали на 21 и 36% соответственно, а Сmin снижалась на 15%. Коррекция дозы боцепревира при совместном применении с кларитромицином или комбинацией кларитромицин + дифлунисал не требуется.
Противогрибковые ЛС.
При совместном применении кетоконазола (кетоконазол 400 мг 2 раза в день + боцепревир 400 мг однократно) AUC боцепревира увеличивалась на 131%, Сmax повышалась на 41% (ингибирование изоферментов сYP3A4 и сYP3A5 и/или P-gp). Фармакокинетическое взаимодействие итраконазола, позаконазола, вориконазола не изучалось. Коррекция дозы боцепревира или кетоконазола при совместном применении не требуется. Следует соблюдать осторожность при совместном применении боцепревира с азольными противогрибковыми ЛС.
Противовирусные (ВИЧ) ЛС.
Ингибиторы интегразы ВИЧ. При совместном применении ралтегравира (ралтегравир 400 мг однократно + боцепревир 800 мг 3 раза в день или ралтегравир 400 мг каждые 12 ч + боцепревир 800 мг 3 раза в день) AUC0-12 ралтегравира увеличивалась на 4%, maxCmax ралтегравира повышалась на 11% и с12 ралтегравира снижалась на 25%; AUC, maxCmax и с8 боцепревира снижались на 2; 4 и 26% соответственно. Коррекция дозы боцепревира или ралтегравира при совместном применении не требуется.
Нуклеозидные ингибиторы обратной транскриптазы ВИЧ. При совместном применении тенофовира (тенофовир 300 мг ежедневно + боцепревир 800 мг 3 раза в день) AUC, maxCmax и сmin боцепревира повышались соответственно на 8; 5 и 8%; AUC и maxCmax тенофовира возрастали на 5 и 32% соответственно. Коррекция дозы боцепревира или тенофовира при совместном применении не требуется.
Ненуклеозидные ингибиторы обратной транскриптазы ВИЧ. При совместном применении эфавиренза (эфавиренз 600 мг ежедневно + боцепревир 800 мг 3 раза в день) AUC0-8 боцепревира уменьшалась на 19%, а Сmах и сmin боцепревира снижались соответственно на 8 и 44%; AUC эфавиренза увеличивалась на 20% и Сmах эфавиренза повышалась на 11% (индукция изофермента сYP3A4 - воздействие на боцепревир). Влияние снижения сmin боцепревира на клинические последствия не оценивалось.
При совместном применении этравирина (этравирин 200 мг каждые 12 ч + боцепревир 800 мг 3 раза в день) AUC боцепревира увеличивалась на 10%, maxCmax боцепревира повышалась на 10% и с8 снижалась на 12%; AUC этравирина уменьшалась на 23%, а maxCmax и сmin этравирина снижались соответственно на 24 и 29%. Непосредственная оценка клинической значимости снижения фармакокинетических параметров этравирина не проводилась.
При совместном применении рилпивирина (рилпивирин 25 мг каждые 24 ч + боцепревир 800 мг 3 раза в день) AUC и maxCmax боцепревира снижались на 6 и 2% соответственно, а С8 увеличивалась на 4%; AUC, maxCmax и с24 рилпивирина возрастали на 39; 15 и 51% соответственно (влияние на рилпивирин обусловлено ингибированием изофермента сYP3A). Коррекция дозы боцепревира и рилпивирина не требуется.
Ингибиторы протеазы ВИЧ. При совместном применении комбинации атазанавир + ритонавир (атазанавир 300 мг + ритонавир 100 мг ежедневно + боцепревир 800 мг 3 раза в день) AUC, maxCmax и сmin боцепревира снижались на 5; 7 и 18% соответственно; AUC, maxCmax и сmin атазанавира снижались на 35; 25 и 49% соответственно; AUC, maxCmax и сmin ритонавира снижались на 36; 27 и 45% соответственно. Совместное применение комбинации атазанавир + ритонавир и боцепревира не рекомендуется.
При совместном применении комбинации дарунавир + ритонавир (дарунавир 600 мг + ритонавир 100 мг 2 раза в день + боцепревир 800 мг 3 раза в день) AUC, maxCmax и сmin боцепревира снижались на 32; 25 и 35% соответственно; AUC, maxCmax и сmin дарунавира снижались на 44; 36 и 59% соответственно; AUC, maxCmax и сmin ритонавира снижались на 27; 13 и 45% соответственно. Совместное применение комбинации дарунавир + ритонавир и боцепревира не рекомендуется.
При совместном применении комбинации лопинавир + ритонавир (лопинавир 400 мг + ритонавир 100 мг 2 раза в день + боцепревир 800 мг 3 раза в день) AUC, maxCmax и сmin боцепревира снижались на 45; 50 и 57% соответственно; AUC, maxCmax и сmin лопинавира снижались на 34; 30 и 43% соответственно; AUC, maxCmax и сmin ритонавира снижались на 22; 12 и 42% соответственно. Совместное применение комбинации лопинавир + ритонавир и боцепревира не рекомендуется.
При совместном применении ритонавира (ритонавир 100 мг 1 раз в день + боцепревир 400 мг 3 раза в день) AUC и сmin боцепревира возрастали на 19 и 4% соответственно, а maxCmax боцепревира снижалась на 27% (за счет ингибирования изоферментов сYP3A4/5).
Нейролептики.
Кветиапин. Взаимодействие не изучалось (влияние на кветиапин обусловлено ингибированием изоферментов сYP3A4/5). При совместном применении кветиапина и боцепревира может повышаться концентрация кветиапина в плазме, что может привести к кветиапиновой токсичности, в тч коме. Совместное применение кветиапина и боцепревира противопоказано ( см «Противопоказания»).
Опиоидные наркотические анальгетики.
При совместном применении комбинации бупренорфин + налоксон (бупренорфин + налоксон 8 + 2 - 24 + 6 мг в день + боцепревир 800 мг 3 раза в день) AUC, maxCmax и сmin боцепревира снижаются на 12; 18 и 5% соответственно; AUC, maxCmax и сmin бупренорфина возрастают на 19; 18 и 31% соответственно; AUC и maxCmax налоксона увеличиваются на 33 и 9% соответственно. Коррекция дозы комбинации бупренорфин + налоксон или боцепревира не требуется. Пациенты должны находиться под контролем в связи с возможным появлением признаков опиатной токсичности, связанной с применением боцепревира.
При совместном применении метадона (метадон 20-150 мг 1 раз в день + боцепревир 800 мг 3 раза в день) AUC и maxCmax боцепревира снижаются на 20 и 38% соответственно, сmin боцепревира повышается на на 3%; AUC, maxCmax и сmin R-метадона уменьшаются на 15; 10 и 19% соответственно; AUC, maxCmax и сmin S-метадона снижаются на 22; 17 и 26% соответственно. Коррекция дозы метадона или боцепревира при совместном применении не требуется. Отдельным пациентам может потребоваться дополнительное титрование дозы метадона в начале/по окончании приема боцепревира для обеспечения клинического эффекта метадона.
НПВС.
При совместном применении дифлунизала (дифлунизал 250 мг 2 раза в день + боцепревир 800 мг 2 или 3 раза в день) AUC, maxCmax и сmin боцепревира снижаются на 4; 14 и 31% соответственно. Коррекция дозы боцепревира или дифлунизала не требуется.
При совместном применении ибупрофена (ибупрофен 600 мг 3 раза в день + боцепревир 400 мг однократно) AUC и maxCmax боцепревира возрастали на 4 и 6% соответственно. Коррекция дозы боцепревира или ибупрофена при совместном применении не требуется.
Антидепрессанты.
При совместном применении эсциталопрама (эсциталопрам 10 мг однократно + боцепревир 800 мг 3 раза в день) AUC боцепревира снижается на 9%, а его maxCmax возрастает на 2%; AUC и maxCmax эсциталопрама снижаются на 21 и 19% соответственно. При совместном применении эсциталопрама с боцепревиром концентрация эсциталопрама немного снижалась. Хотя эсциталопрам - СИОЗС - имеет широкий терапевтический индекс, при совместном применении с боцепревиром может потребоваться коррекция доз этих ЛС.
БКК.
Взаимодействие с амлодипином, дилтиаземом, фелодипином, никардипином, нифедипином, нисолдипином и верапамилом не изучалось. Концентрация в крови этих ЛС из группы БКК может повышаться при одновременном применении с боцепревиром. Следует соблюдать осторожность при их соместном применении с боцепревиром, и в этгм случае пациенты должны находиться под наблюдением.
ГКС.
При совместном применении с преднизоном (преднизон 40 мг однократно + боцепревир 800 мг 3 раза в день) AUC преднизона увеличивалась на 22%, maxCmax снижалась на 1%; AUC и maxCmax преднизолона увеличивались на 37 и 16% соответственно. Коррекция дозы боцепревира не требуется. Пациенты, получающие преднизон и боцепревир, должны находиться под наблюдением.
Гиполипидемические ЛС.
При совместном применении аторвастатина (аторвастатин 40 мг однократно + боцепревир 800 мг 3 раза в день) AUC боцепревира уменьшалась на 5%, Сmax повышалась на 4%; AUC и maxCmax аторвастатина увеличивались на 130 и 166% соответственно (ингибирование изоферментов сYP3A4/5 и OATPBI - мозгоспецифический транспортер органических анионов). Концентрация аторвастатина повышалась при одновременном назначении с боцепревиром, поэтому при одновременном применении следует назначать наименьшую эффективную дозу аторвастатина, но не превышающую суточную - 20 мг.
При совместном применении правастатина (правастатин 40 мг однократно + боцепревир 800 мг 3 раза в день) AUC и maxCmax боцепревира снижались на 6 и 7% соответственно, а AUC и maxCmax правастатина возрастали на 63 и 49% соответственно (ингибирование изофермента OATPBI). Одновременное применение правастатина и боцепревира повышало концентрацию правастатина, при этом лечение правастатином может быть начато в рекомендованных дозах. Пациенты, получающие правастатин и боцепревир, должны находиться под наблюдением.
Иммунодепрессанты.
При совместном применении циклоспорина (циклоспорин 100 мг однократно + боцепревир 800 мг однократно или циклоспорин 100 мг однократно + боцепревир 800 мг 3 раза в день) AUC и maxCmax боцепревира увеличивались на 16 и 8% соответственно, а AUC и maxCmax циклоспорина возрастали на 168 и 101% соответственно (влияние на циклоспорин обусловлено ингибированием изоферментов сYP3A4/5). При одновременном применении с боцепревиром может потребоваться коррекция дозы циклоспорина, при этом следует руководствоваться результатами тщательного контроля концентрации циклоспорина в крови, контроля функции почек и побочных реакций, связанных с приемом циклоспорина.
При совместном применении такролимуса (такролимус 0,5 мг однократно + боцепревир 800 мг однократно или такролимус 0,5 мг однократно + боцепревир 800 мг 3 раза в день) AUC боцепревира не изменялась, maxCmax снижалась на 3%; AUC и Сmax такролимуса повышались на 1610 и 890% соответственно (влияние на такролимус обусловлено ингибированием изоферментов сYP3A4/5). Одновременное применение такролимуса с боцепревиром требует значительного снижения дозы и увеличения интервала дозирования для такролимуса, при этом необходим тщательный контроль концентрации такролимуса в крови, функции почек и побочных эффектов, связанных с применением такролимуса.
При совместном применении сиролимуса (сиролимус 2 мг однократно + боцепревир 800 мг 3 раза в день) AUC и maxCmax боцепревира снижались на 5 и 6% соответственно, а с8 повышалась на 21%; AUC и Сmax сиролимуса повышались на 712 и 384% соответственно (влияние на сиролимус обусловлено ингибированием изоферментов сYP3A4/5). При одновременном применении сиролимуса и боцепревира требуется значительное снижения дозы и увеличение интервала дозирования для сиролимуса, при этом необходим тщательный контроль концентрации сиролимуса в крови, контроль функции почек и контроль побочных эффектов, связанных с применением сиролимуса.
Пероральные антикоагулянты.
Взаимодействие с дабигатраном не изучалось (влияние на транспорт, осуществляемый P-gp в кишечнике). Коррекция дозы боцепревира не требуется. Пациенты, получающие дабигатран и боцепревир, должны находиться под наблюдением.
Контрацептивные ЛС.
При совместном применении комбинации дроспиренон + этинилэстрадиол с боцепревиром (дроспиренон 3 мг 1 раз в день + этинилэстрадиол 0,02 мг 1 раз в день + боцепревир 800 мг 3 раза в день) AUC и maxCmax дросперинона повышались на 99 и 57% соответственно; AUC этинилэстрадиола уменьшалась на 24%, Сmax этинилэстрадиола не изменялась (дроспиренон ингибирует изоферменты сYP3A4/5). Следует соблюдать осторожность при назначении боцепревира пациентам, принимающим калийсберегающие диуретики и ЛС, содержащие дроспиренон, поскольку возможен риск развития гиперкалиемии. Следует рассмотреть возможность применения альтернативных методов контрацепции ( см «Ограничения к применению»).
При совместном применении комбинации норэтистерон + этинилэстрадиол с боцепревиром (норэтистерон 1 мг 1 раз в день + этинилэстрадиол 0,035 мг 1 раз в день + боцепревир 800 мг 3 раза в день) AUC0-24 норэтистерона уменьшалась на 4%, Сmax снижалась на 17%; AUC0-24 этинилэстрадиола уменьшалась на 26%, Сmax снижалась на 21%. Концентрация этинилэстрадиола снижалась при одновременном применении с боцепревиром. На основании величин сывороточных концентраций прогестерона, ЛГ и ФСГ сделан вывод, что при одновременном применении этинилэстрадиола 0,035 мг, норэтистерона 1 мг и боцепревира овуляция подавляется. Маловероятно, что одновременное применение боцепревира и комбинированных пероральных контрацептивов, содержащих этинилэстрадиол и ≥1 мг норэтистерона, влияет на контрацептивный эффект ( см «Применение при беременности и кормлении грудью»). Влияние одновременного применения боцепревира и комбинированных пероральных или других форм гормональных контрацептивов, содержащих более низкие дозы норэтистерона, на подавление овуляции не изучено. Пациенты, применяющие эстрогены в качестве гормональной заместительной терапии, должны находиться под наблюдением врача на предмет развития признаков эстрогенной недостаточности.
Ингибиторы протонного насоса.
При совместном применении омепразола (омепразол 40 мг 1 раз в день + боцепревир 800 мг 3 раза в день) AUC0-8 и maxCmax боцепревира снижались на 8 и 6% соответственно, а С8 боцепревира повышалась на 17%; AUC0-8, maxCmax и С8 омепразола повышались соответственно на 6; 3 и 12%. Коррекция дозы омепразола или боцепревира при совместном применении не требуется.
Анксиолитики.
При совместном применении мидазолама для приема внутрь (мидазолам 4 мг однократно + боцепревир 800 мг 3 раза в день) AUC и Сmax мидазолама повышались на 430 и 177% соответственно (ингибирование изоферментов сYP3A4/5). Одновременное применение мидазолама (для приема внутрь) с боцепревиром противопоказано ( см «Противопоказания»).
Взаимодействие боцепревира и триазолама для приема внутрь не изучалось. Одновременное применение триазолама для приема внутрь с боцепревиром противопоказано ( см «Противопоказания»).
Взаимодействие алпразолама, мидазолама и триазолама (для в/в ведения) с боцепревиром не изучено (ингибирование изоферментов сYP3A4/5). Должно проводиться тщательное клиническое отслеживание случаев угнетения дыхания и/или затянувшегося седативного состояния во время одновременного применения боцепревира с в/в введением бензодиазепинов (алпразолам, мидазолам, триазолам). Необходима коррекция дозы бензодиазепина.
RxList.com.
Возможность влияния боцепревира на другие ЛС.
Боцепревир является сильным ингибитором изоферментов сYP3A4/5. У ЛС, метаболизируемых в основном с участием изоферментов сYP3A4/5, может повышаться экспозиция при совместном применении с боцепревиром, что в свою очередь может привести к усилению или продлению терапевтических и побочных эффектов этих ЛС. Боцепревир не ингибирует изоферменты сYP1A2, сYP2A6, сYP2B6, сYP2C8, сYP2C9, сYP2C19, сYP2D6 или сYP2E1 в in vitro >in vitro. Кроме того, боцепревир in vitro >in vitro не индуцирует изоферменты сYP1A2, сYP2B6, сYP2C8, сYP2C9, сYP2C19 или сYP3A4/5.
Основываясь на исследованиях, проведенных in vitro >in vitro, боцепревир является потенциальным ингибитором P-gp. В исследовании взаимодействия с дигоксином боцепревир обладал в клинически значимых концентрациях ограниченным ингибирующим потенциалом в отношении P-gp.
Возможность влияния других ЛС на боцепревир.
Боцепревир в основном метаболизируется при посредстве альдокеторедуктазы (АКР). В исследованиях взаимодействия, проведенные с ингибиторами AKР дифлунизалом и ибупрофеном, экспозиция боцепревира не увеличивалась до клинически значимой степени. Совместное применение боцепревира с ингибиторами АКР допустимо.
Боцепревир частично метаболизируются изоферментами сYP3A4/5. Он также является субстратом для Р-gp. Сочетанное применение боцепревира с ЛС, которые индуцируют или ингибируют изоферменты сYP3A4/5 может уменьшить или увеличить экспозицию боцепревира.
Установленные и другие потенциально значимые взаимодействия.
Ниже представлены рекомендации, основанные на установленных или потенциально клинически значимых взаимодействиях. Совместное применение боцепревира противопоказано с ЛС, которые являются сильными индукторами изоферментов сYP3A4/5 и ЛС, клиренс которых сильно зависит от изоферментов сYP3A4/5 и для которых их повышенная концентрация в плазме связана с серьезными и/или угрожающими жизни событиями ( см «Противопоказания»).
При совместном применении с антиаримическими ЛС (амиодарон, бепридил, пропафенон, хинидин) их концентрация возрастает. При сочетанном применении с боцепревиром имеется вероятность возникновения серьезных и/или угрожающих жизни побочных эффектов, и это применение не изучено. Рекомендуется соблюдать осторожность и проводить мониторирование терапевтической концентрации этих ЛС, если они применяются одновременно с боцепревиром.
При совместном применении с дигоксином* концентрация этого ЛС возрастает. Следует измерить концентрацию дигоксина в сыворотке крови до начала приема боцепревира. Продолжить мониторинг концентрации дигоксина и при необходимости использовать предписывающую информацию для титрации дозы этого ЛС.
При совместном применении с антикоагулянтом варфарином его концентрация может как повышаться, так и снижаться. Необходимо внимательно следить за значением МНО.
При совместном применении с антидепрессантами тразодоном или дезимипрамином концентрация этих ЛС в плазме может возрастать, что в свою очередь может привести к таким побочным эффектам как головокружение, гипотония и обморок. Следует сочетанное применение проводить с осторожностью и рассмотреть возможность назначения более низкой дозы тразодона или дезипрамина.
При совместном применени с эсциталопрамом* экспозиция этого ЛС незначительно снижалась. СИОЗС, такие как эсциталопрам, имеют широкий терапевтический индекс, но дозирование, возможно, должно быть скорректировано при сочетанном применении с боцепревиром.
При совместном применении с противогрибковыми ЛС (кетоконазол*, итраконазол, вориконазол, позаконазол) их концентрация в плазме может возрасти. Когда необходимо сочетанное применение, доза кетоконазола* и итраконазола не должна превышать 200 мг/сут.
При сочетанном применении с колхицином - противоподагрическим ЛС - ожидается значительное возрастание концентрации этого ЛС. Сообщалось о фатальной токсичности колхицина при его совместном применении с другими сильными ингибиторами изофермента сYP3A4.
Больным с почечной или печеночной недостаточностью не следует назначать совместно колхицин и боцепревир.
Лечение подагрических приступов (во время применения боцепревира): 0,6 мг колхицина, а через 1 ч - еще 0,3 мг. Это лечение не должно быть повторено ранее чем через 3 дня.
Профилактика подагрических приступов (во время применения боцепревира): если исходный режим был 0,6 мг колхицина 2 раза в день, то снизить дозу до 0,3 мг 1 раз в день; если исходный режим был 0,6 мг 1 раз в день, дозу снижают до 0,3 мг 1 раз в день.
Лечение семейной средиземноморской лихорадки (во время применения боцепревира): максимальная суточная доза колхицина - 0,6 мг (можно - 0,3 мг 2 раза в день).
При совместном применении с кларитромицином концентрация этого ЛС может возрасти; однако коррекции дозировки для пациентов с нормальной функцией почек не требуется.
При сочетанном применении с рифабутином ожидается увеличение экспозиции рифабутина, в то время как экспозиция боцепревира может снизится. Дозы для этих ЛС при использовании в комбинации не определены. Одновременное применение не рекомендуется.
При сочетанном применении с БКК, такими как амлодипин, дилтиазем, фелодипин, нифедипин, никардипин, нисолдипин, верапамил, концентрация этих ЛС может возрасти. Рекомендуется клинический мониторинг.
При сочетанном применении с системным ГКС дексаметазоном концентрация боцепревира снижается. Совместное применение боцепревира с индукторами изоферментов сYP3A4/5 может снизить его плазменную концентрацию, что в свою очередь может привести к потере терапевтического эффекта этого ЛС. Таким образом, применения этой комбинации следует избегать, если это возможно, или, при необходимости, использовать средство с осторожностью.
При совместном применении с боцепревиром концентрация системного ГКС преднизона* и его активного метаболита преднизолона увеличивается. Изменения дозы преднизона при этом при сочетанном применении не требуется. Состояние больных, принимающих комбинацию преднизолон с боцепревиром, должно контролироваться надлежащим образом.
Одновременное применение ингаляционных ЛС будесонида или флутиказона с боцепревиром может привести к увеличению концентрации в плазме будесонида или флутиказона, что в свою очередь приводит к значительному снижению концентрации кортизола в сыворотке крови. По возможности следует избегать их совместного применения, особенно в течение длительного периода времени.
Концентрация бозентана - неселективного агониста эндотелиновых рецепторов - может возрасти при сочетанном применении с боцепревиром. Эту комбинацию следует применять с осторожностью и тщательно контролировать состояние больного.
При совместном применении с ралтегравиром* - ингибитором интегразы ВИЧ - концентрация этого ЛС не изменяется.
Cmin боцепревира в плазме снижалется при сочетанном применении с ненуклеозидным ингибитором обратной транскриптазы ВИЧ эфавирензем*, что может привести к потере терапевтического эффекта. Следует избегать этой комбинации.
Концентрация этравирина* - ненуклеозидного ингибитора обратной транскриптазы ВИЧ - снижается при сочетанном применении с боцепревиром. Клиническая значимость снижения уровней фармакокинетических параметров этравирина непосредственно не оценена.
При одновременном применении боцепревира и рилпивирина* - ненуклеозидного ингибитора обратной транскриптазы ВИЧ - увеличивалась экспозиция рилпивирина. Изменение доз боцепревира и рилпивирина не рекомендуется.
Совместное применении комбинации атазановир + ритонавир* (ингибиторы протеазы ВИЧ) приводит к снижению равновесной экспозиции этих ЛС. Сочетанное применение комбинации атазановир + ритонавир и боцепревира не рекомендуется.
Совместное применении боцепревира и комбинации дарунавир + ритонавир* (ингибиторы протеазы ВИЧ) приводит к снижению равновесной экспозиции всех трех этих ЛС. Сочетанное применение комбинации дарунавир + ритонавир и боцепревира не рекомендуется.
Совместное применении боцепревира и комбинации лопинавир + ритонавир* (ингибиторы протеазы ВИЧ) приводит к снижению равновесной экспозиции всех трех этих ЛС. Сочетанное применение комбинации лопинавир + ритонавир и боцепревира не рекомендуется.
При сочетанном применении боцепревира только с ритонавиром*, концентрация боцепревира снижается.
Экспозиция аторвастатина* - ингибитора ГМГ-КоА-редуктазы - возрастала при сочетанном применении с боцепревиром. Следует применять самую низкую эффективную дозу аторвастатина, но не превышающую 40 мг в сутки, при совместном применении с боцепревиром.
Экспозиция правастатина* - ингибитора ГМГ-КоА-редуктазы - возрастала при сочетанном применении с боцепревиром. Лечение правастатином может быть инициировано в рекомендуемой дозе при совместном применении с боцепревиром. Клинический контроль оправдан.
При сочетанном применении с иммунодепрессантом циклоспорином* концентрация циклоспорина возрастает. Следует тщательно мониторировать концентрацию циклоспорина в крови для ожидаемой корректировки дозирования этого ЛС и часто оценивать функцию почек и наличие циклоспоринзависимых побочных эффектов при соместном применении с боцепревиром.
При сочетанном применении с иммунодепрессантом такролимусом* концентрация такролимуса возрастает. Одновременное применение боцепревира и такролимуса требует значительного снижения дозы и удлинения интервала дозирования для такролимуса при тщательном мониторинге концентрации такролимуса в крови и частой оценки почечной функции и такролимусзависимых побочных эффектов.
При сочетанном применении с иммунодепрессантом сиролимусом* концентрация последнего возрастает. Одновременное применение боцепревира и сиролимуса требует значительного снижения дозы и удлинения интервала дозирования для сиролимуса при тщательном мониторинге концентрации сиролимуса в крови и частой оценки функции почек и сиролимусзависимых побочных эффектов.
При сочетанном применении с салметеролом в ингаляционной форме концентрация этого ЛС возрастает. Одновременное применение ингаляционной формы салметерола и боцепревира не рекомендуется из-за риска развития сердечно-сосудистых осложнений (побочные эффекты), связанных с салметеролом.
При сочетанном применении с опиоидным наркотическим анальгетиком метадоном* концентрация R-метадона снижается. Наблюдаемые изменения не считаются клинически значимыми. Регулировка дозы метадона или боцепревира не рекомендуется. Отдельным пациентам может потребоваться дополнительное титрование дозы метадона в начале или завершении лечения метадоном в целях обеспечения клинического эффекта последнего.
Концентрация в плазме бупренорфина и налоксона* увеличивается при сочетанном применении этой комбинации с боцепревиром. Наблюдаемые изменения не считаются клинически значимыми. Изменение дозирования комбинации бупренорфин + налоксон или боцепревира не рекомендуется.
При сочетанном применении с комбинированным контрацептивным ЛС для приема внутрь дроспиренон + этинилэстрадиол* концентрация дроспиренона увеличивалась, а этинилэстрадиола - снижалась. Таким образом, использование ЛС, содержащих дроспиренон, противопоказано во время лечения боцепревиром из-за возможного развития гиперкалиемии ( см «Противопоказания»).
При сочетанном применении с комбинированным контрацептивным ЛС для приема внутрь норэтистерон + этинилэстрадиол* концентрация этинилэстрадиола снижалась. Значение maxCmax норэтистерона в присуствии боцепревира уменьшалось на 17%. Совместное применение боцепревира с комбинированным пероральным контрацептивным ЛС, содержащим этинилэстрадиол и по меньшей мере 1 мг норэтистерона, скорее всего не изменит эффективность этого комбинированного контрацептива для према внутрь. Пациенты, применяющие эстрогены в качестве заместительной гормональной терапии, должны находиться под клиническим контролем для определения наличия признаков дефицита эстрогенов.
При сочетанном применении с ингибиторами ФДЭ-5 (силденафил, тадалафил, варденафил) концентрация этих ЛС повышается, что может усиливать их побочные эффекты, включая гипотонию, обморок, нарушение зрения и приапизм. Применение силденафила или тадалафила для лечения легочной гипертензии противопоказано одновременно с лечением боцепревиром. Применение ингибиторов ФДЭ-5 для лечения эректильной дисфункции: следует использовать эти ЛС с осторожностью при совместом применении с боцепревиром и с усилением контроля за побочными эффектами ингибиторов ФДЭ-5. Не следует превышать следующие дозы: силденафил - 25 мг каждые 48 тадалафил - 10 мг каждые 72 варденафил - 2,5 мг каждые 24.
При совместном применении омепразола* - ингибитора протонного насоса - концентрация омепразола практически не меняется. Коррекция дозы омепразола или боцепревира при их сочетанном применении не требуется.
При сочетанном применении с мидазоламом для в/в ведения (наркозное, снотворное ЛС) и алпразоламом (анксиолитик) концентрация этих ЛС возрастает. Необходим клинический контроль за угнетением дыхания и/или продолжительностю седации во время совместного применения с боцепревиром. Следует рассмотреть возможность снижения дозы мидазолама для в/в введения или алпразолама.
*Эти комбинации были исследованы ( см «Взаимодействие»).
|
|
Передозировка
У здоровых добровольцев, принимавших в течение 5 дней суточные дозы боцепревира до 3600 мг, каких-либо последующих неблагоприятных клинически выраженных реакций не возникало.
Специфического антидота для случаев передозировки боцепревиром не существует. Лечение передозировки должно включать в себя общую поддерживающую терапию, мониторинг основных показателей жизненно важных функций и наблюдение за клиническим состоянием пациента.
Специфического антидота для случаев передозировки боцепревиром не существует. Лечение передозировки должно включать в себя общую поддерживающую терапию, мониторинг основных показателей жизненно важных функций и наблюдение за клиническим состоянием пациента.
Способ применения и дозы
Внутрь.
Боцепревир необходимо принимать в комбинации с пэгинтерфероном альфа и рибавирином. Перед применением необходимо ознакомиться с инструкциями по применению пэгинтерферона альфа и рибавирина.
Режим дозирования.
Рекомендуемая доза боцепревира составляет 800 мг 3 раза в день одновременно с приемом пищи. Максимальная суточная доза этого ЛС - 2400 мг.
Пациенты без цирроза печени, не получавшие ранее противовирусную терапию.
Начинают терапию пэгинтерфероном альфа и рибавирином в течение 4 нед (недели лечения 1-4).
На 5-й нед к пэгинтерферону альфа и рибавирину добавляют боцепревир в дозе 800 мг 3 раза в день. Длительность терапии определяют в зависимости от вирусологического ответа (содержание PНK ВГС) через 8; 12 и 24 нед лечения (терапия по ответу).
Ниже описывается продолжительность лечения (терапия по ответу) в зависимости от вирусологического ответа у пациентов без цирроза печени, ранее не получавших противовирусную терапию.
1. Если через 8 и 24 нед лечения в плазме крови больного не определяется* РНК ВГС, то следует завершить терапию всеми тремя ЛС через 28 нед.
2. Если через 8 нед лечения РНК ВГС определяется* в плазме крови, а через 24 нед - нет, то следует продолжить прием всех трех ЛС до окончания 28-й нед лечения, а далее принимать только пэгинтерферон альфа и рибавирин до окончания 48-й нед лечения.
*В клинических исследованиях содержание РНК ВГС определяли с порогом чувствительности, равным 9,3 МЕ/мл.
Правила отмены терапии. Если у пациента через 8 нед лечения содержание РНК ВГС ≥1000 МЕ/мл, все 3 ЛС должны быть отменены. Если у пациента через 12 нед лечения содержание РНК ВГС ≥100 МЕ/мл, все три ЛС должны быть отменены. Если у пациента через 24 нед лечения определяется PНK ВГС, все 3 ЛС должны быть отменены.
Пациенты без цирроза печени с неэффективной предшествующей противовирусной терапией (пациенты, частично ответившие на лечение или имевшие рецидив).
Начинают терапию пэгинтерфероном альфа и рибавирином в течение 4 нед (недели лечения 1-4).
На 5-й нед лечения к пэгинтерферону альфа и рибавирину добавляют боцепревир в дозе 800 мг 3 раза в день. Длительность терапии определяют в зависимости от вирусологического ответа (содержание РНК ВГС) через 8; 12 и 24 нед лечения (терапия по ответу).
Ниже описывается продолжительность лечения (терапия но ответу) в зависимости от вирусологического ответа у пациентов без цирроза печени с неэффективной предшествующей терапией (пациенты, частично ответившие на лечение или имевшие рецидив)*.
1. Если через 8 и 24 нед лечения в плазме крови больного не определяется** РНК ВГС, то следует продолжить терапию тремя ЛС до завершения лечения через 36 нед.
2. Если через 8 нед лечения РНК ВГС определяется** в плазме крови, а через 24 нед - нет, то следует продолжить применение всех трех ЛС до полных 36 нед лечения, а далее далее принимать только пэгинтерферон альфа и рибавирин до полных 48 нед лечения.
*Пациенты частично ответившие на лечение, - больные, у которых вирусная нагрузка снижалась до ≥2-log10 через 12 нед, но устойчивый вирусологический ответ не был достигнут; пациенты, имевшие рецидив, - больные с неопределяемым содержанием РНК ВГС в конце периода терапии и последующим определяемым содержанием РНК ВГС в плазме крови по окончании периода наблюдения.
**В клинических исследованиях содержание РНК ВГС определяли с порогом чувствительности равным 9,3 МЕ/мл.
Правила отмены терапии. Если у пациента через 8 нед лечения содержание РНК ВГС ≥1000 МЕ/мл, все 3 ЛС должны быть отменены. Если у пациента через 12 нед лечения содержание РНК ВГС ≥100 МЕ/мл, все 3 ЛС должны быть отменены. Если у пациента через 24 нед лечения определяется PНK ВГС, все 3 ЛС должны быть отменены.
Пациенты с отсутствием ответа (нулевым ответом) на предшествующее лечение.
Пациенты, у которых при предшествующем лечении пэгинтерфероном альфа и рибавирином через 12 нед содержание РНК ВГС снижалось <2 log10 (пациенты с нулевым ответом), в течение 4 нед должны принимать пэгинтерферон альфа и рибавирин, а затем в течение 44 нед - боцепревир в дозе 800 мг 3 раза в день в комбинации с пэгинтерфероном альфа и рибавирином. Если у этих пациентов через 8 нед лечения содержание РНК ВГС ≥1000 МЕ/мл или через 12 нед лечения уровень вирусной нагрузки ≥100 МЕ/мл, или через 24 нед лечения обнаруживается РНК ВГС, следует прекратить прием всех трех ЛС.
Пациенты с циррозом печени.
Пациентам с компенсированным циррозом печени назначают пэгинтерферон альфа и рибавирин в течение 4 нед с последующим добавлением к этой терапии боцепревира в дозе 800 мг 3 раза в день в течение 44 нед. Если у пациентов через 8 нед лечения содержание РНК ВГС ≥1000 МЕ/мл, или через 12 нед лечения содержание РНК ВГС ≥100 МЕ/мл, или через 24 нед лечения обнаруживается РНК ВГС, следует прекратить прием всех трех ЛС ( см «Меры предосторожности»).
Пропуск приема очередной дозы боцепревира.
Если пациент пропустил прием дозы боцепревира и до следующего приема остается <2 то пропущенную дозу принимать не следует.
Если пациент пропустил прием дозы и до следующего приема остается ≥2 необходимо принять пропущенную дозу вместе с пищей и далее следовать нормальному режиму дозирования.
Изменение дозы. Не рекомендуется снижать дозу боцепревира.
Если у пациента наблюдаются серьезные нежелательные побочные реакции, потенциально связанные с приемом пэгингерферона альфа и рибавирина, следует уменьшить дозу пэгинтерферона альфа и/или рибавирина.
За дополнительной информацией необходимо обратиться к инструкциям по применению пэгинтерферона альфа и рибавирина.
Боцепревир следует принимать только в комбинации с пэгинтерфероном альфа и рибавирином.
Особые группы пациентов.
Почечная недостаточность. Пациентам с любой степенью почечной недостаточности не требуется коррекция дозы боцепревира ( см «Фармакология»).
Печеночная недостаточность. Пациентам с любой степенью печеночной недостаточности не требуется коррекция дозы боцепревира. Боцепревир в комбинации с пэгинтерфероном альфа и рибавирином противопоказан пациентам с декомпенсированным циррозом печени (функциональный класс цирроза печени В и С по системе Чайлд-Пью >6 баллов) ( см «Фармакология», «Противопоказания», «Меры предосторожности»).
Дети. Безопасность, эффективность и фармакокинетика боцепревира у детей в возрасте до 18 лет не изучались.
Пациенты пожилого возраста. Количество пациентов пожилого возраста (65 лет и старше), принимавших участие в клинических испытаниях боцепревира, было недостаточным для определения, отличается ли терапевтический ответ в группе пожилых пациентов от группы молодых пациентов. В результате других клинических исследований не были выявлены различия в реакциях у молодых и пожилых пациентов на исследуемое ЛС.
Коинфицирование вирусом гепатита В. Безопасность и эффективность боцепревира, применяемого отдельно или в комбинации с пэгинтерфероном альфа и рибавирином для лечения хронического ВГС (генотип 1), у пациентов, ко-инфицированных вирусом гепатита В и ВГС, не изучены.
Правила отмены терапии.
Следует прекратить терапию у всех пациентов с содержанием РНК ВГС ≥1000 МЕ/мл через 8 нед лечения, если у пациента содержание РНК ВГС ≥100 МЕ/мл через 12 нед лечения или определяется РНК ВГС через 24 нед лечения.
Боцепревир необходимо принимать в комбинации с пэгинтерфероном альфа и рибавирином. Перед применением необходимо ознакомиться с инструкциями по применению пэгинтерферона альфа и рибавирина.
Режим дозирования.
Рекомендуемая доза боцепревира составляет 800 мг 3 раза в день одновременно с приемом пищи. Максимальная суточная доза этого ЛС - 2400 мг.
Пациенты без цирроза печени, не получавшие ранее противовирусную терапию.
Начинают терапию пэгинтерфероном альфа и рибавирином в течение 4 нед (недели лечения 1-4).
На 5-й нед к пэгинтерферону альфа и рибавирину добавляют боцепревир в дозе 800 мг 3 раза в день. Длительность терапии определяют в зависимости от вирусологического ответа (содержание PНK ВГС) через 8; 12 и 24 нед лечения (терапия по ответу).
Ниже описывается продолжительность лечения (терапия по ответу) в зависимости от вирусологического ответа у пациентов без цирроза печени, ранее не получавших противовирусную терапию.
1. Если через 8 и 24 нед лечения в плазме крови больного не определяется* РНК ВГС, то следует завершить терапию всеми тремя ЛС через 28 нед.
2. Если через 8 нед лечения РНК ВГС определяется* в плазме крови, а через 24 нед - нет, то следует продолжить прием всех трех ЛС до окончания 28-й нед лечения, а далее принимать только пэгинтерферон альфа и рибавирин до окончания 48-й нед лечения.
*В клинических исследованиях содержание РНК ВГС определяли с порогом чувствительности, равным 9,3 МЕ/мл.
Правила отмены терапии. Если у пациента через 8 нед лечения содержание РНК ВГС ≥1000 МЕ/мл, все 3 ЛС должны быть отменены. Если у пациента через 12 нед лечения содержание РНК ВГС ≥100 МЕ/мл, все три ЛС должны быть отменены. Если у пациента через 24 нед лечения определяется PНK ВГС, все 3 ЛС должны быть отменены.
Пациенты без цирроза печени с неэффективной предшествующей противовирусной терапией (пациенты, частично ответившие на лечение или имевшие рецидив).
Начинают терапию пэгинтерфероном альфа и рибавирином в течение 4 нед (недели лечения 1-4).
На 5-й нед лечения к пэгинтерферону альфа и рибавирину добавляют боцепревир в дозе 800 мг 3 раза в день. Длительность терапии определяют в зависимости от вирусологического ответа (содержание РНК ВГС) через 8; 12 и 24 нед лечения (терапия по ответу).
Ниже описывается продолжительность лечения (терапия но ответу) в зависимости от вирусологического ответа у пациентов без цирроза печени с неэффективной предшествующей терапией (пациенты, частично ответившие на лечение или имевшие рецидив)*.
1. Если через 8 и 24 нед лечения в плазме крови больного не определяется** РНК ВГС, то следует продолжить терапию тремя ЛС до завершения лечения через 36 нед.
2. Если через 8 нед лечения РНК ВГС определяется** в плазме крови, а через 24 нед - нет, то следует продолжить применение всех трех ЛС до полных 36 нед лечения, а далее далее принимать только пэгинтерферон альфа и рибавирин до полных 48 нед лечения.
*Пациенты частично ответившие на лечение, - больные, у которых вирусная нагрузка снижалась до ≥2-log10 через 12 нед, но устойчивый вирусологический ответ не был достигнут; пациенты, имевшие рецидив, - больные с неопределяемым содержанием РНК ВГС в конце периода терапии и последующим определяемым содержанием РНК ВГС в плазме крови по окончании периода наблюдения.
**В клинических исследованиях содержание РНК ВГС определяли с порогом чувствительности равным 9,3 МЕ/мл.
Правила отмены терапии. Если у пациента через 8 нед лечения содержание РНК ВГС ≥1000 МЕ/мл, все 3 ЛС должны быть отменены. Если у пациента через 12 нед лечения содержание РНК ВГС ≥100 МЕ/мл, все 3 ЛС должны быть отменены. Если у пациента через 24 нед лечения определяется PНK ВГС, все 3 ЛС должны быть отменены.
Пациенты с отсутствием ответа (нулевым ответом) на предшествующее лечение.
Пациенты, у которых при предшествующем лечении пэгинтерфероном альфа и рибавирином через 12 нед содержание РНК ВГС снижалось <2 log10 (пациенты с нулевым ответом), в течение 4 нед должны принимать пэгинтерферон альфа и рибавирин, а затем в течение 44 нед - боцепревир в дозе 800 мг 3 раза в день в комбинации с пэгинтерфероном альфа и рибавирином. Если у этих пациентов через 8 нед лечения содержание РНК ВГС ≥1000 МЕ/мл или через 12 нед лечения уровень вирусной нагрузки ≥100 МЕ/мл, или через 24 нед лечения обнаруживается РНК ВГС, следует прекратить прием всех трех ЛС.
Пациенты с циррозом печени.
Пациентам с компенсированным циррозом печени назначают пэгинтерферон альфа и рибавирин в течение 4 нед с последующим добавлением к этой терапии боцепревира в дозе 800 мг 3 раза в день в течение 44 нед. Если у пациентов через 8 нед лечения содержание РНК ВГС ≥1000 МЕ/мл, или через 12 нед лечения содержание РНК ВГС ≥100 МЕ/мл, или через 24 нед лечения обнаруживается РНК ВГС, следует прекратить прием всех трех ЛС ( см «Меры предосторожности»).
Пропуск приема очередной дозы боцепревира.
Если пациент пропустил прием дозы боцепревира и до следующего приема остается <2 то пропущенную дозу принимать не следует.
Если пациент пропустил прием дозы и до следующего приема остается ≥2 необходимо принять пропущенную дозу вместе с пищей и далее следовать нормальному режиму дозирования.
Изменение дозы. Не рекомендуется снижать дозу боцепревира.
Если у пациента наблюдаются серьезные нежелательные побочные реакции, потенциально связанные с приемом пэгингерферона альфа и рибавирина, следует уменьшить дозу пэгинтерферона альфа и/или рибавирина.
За дополнительной информацией необходимо обратиться к инструкциям по применению пэгинтерферона альфа и рибавирина.
Боцепревир следует принимать только в комбинации с пэгинтерфероном альфа и рибавирином.
Особые группы пациентов.
Почечная недостаточность. Пациентам с любой степенью почечной недостаточности не требуется коррекция дозы боцепревира ( см «Фармакология»).
Печеночная недостаточность. Пациентам с любой степенью печеночной недостаточности не требуется коррекция дозы боцепревира. Боцепревир в комбинации с пэгинтерфероном альфа и рибавирином противопоказан пациентам с декомпенсированным циррозом печени (функциональный класс цирроза печени В и С по системе Чайлд-Пью >6 баллов) ( см «Фармакология», «Противопоказания», «Меры предосторожности»).
Дети. Безопасность, эффективность и фармакокинетика боцепревира у детей в возрасте до 18 лет не изучались.
Пациенты пожилого возраста. Количество пациентов пожилого возраста (65 лет и старше), принимавших участие в клинических испытаниях боцепревира, было недостаточным для определения, отличается ли терапевтический ответ в группе пожилых пациентов от группы молодых пациентов. В результате других клинических исследований не были выявлены различия в реакциях у молодых и пожилых пациентов на исследуемое ЛС.
Коинфицирование вирусом гепатита В. Безопасность и эффективность боцепревира, применяемого отдельно или в комбинации с пэгинтерфероном альфа и рибавирином для лечения хронического ВГС (генотип 1), у пациентов, ко-инфицированных вирусом гепатита В и ВГС, не изучены.
Правила отмены терапии.
Следует прекратить терапию у всех пациентов с содержанием РНК ВГС ≥1000 МЕ/мл через 8 нед лечения, если у пациента содержание РНК ВГС ≥100 МЕ/мл через 12 нед лечения или определяется РНК ВГС через 24 нед лечения.
|
|
Меры предосторожности применения
Анемия.
Сообщалось о случаях развития анемии при лечении пэгинтерфероном альфа/рибавирином. Добавление боцепревира в схему лечения с пэгинтерфероном альфа и рибавирином приводит к дополнительному снижению концентрации Hb в сыворотке крови. Среднее временя снижения концентрации Hb в сыворотке крови до значения <10 г/дл относительно концентрации в начале терапии было сходным в группах пациентов, принимавших боцепревир в комбинации с пэгинтерфероном альфа и рибавирином (71 день при общей продолжительности курса терапии 15-337 дней), и пациентов, принимавших пэгинтерферон альфа и рибавирин (71 день при общей продолжительности курса терапии 8-337 дней). Перед началом терапии, а также через 2; 4; 8 и 12 нед лечения и далее, при наличии клинической целесообразности, следует проводить полный анализ крови (включая лейкоцитарную формулу). Снижение концентрации Hb в сыворотке крови <10 г/дл может служить основанием для уменьшения дозы рибавирииа и/или назначения терапии эритропоэтином (эпоэтин альфа) ( см «Побочные действия», «Фармакология»). Если требуется прекращение терапии рибавирином, то терапию пэгинтерфероном альфа и боцепревиром также следует прекратить.
При развитии признаков анемии, связанных с терапией, рекомендуется снижение дозы рибавирина.
В проспективном рандомизированном контролируемом исследовании частота достижения устойчивого вирусологическою ответа и общая переносимость боцепревира были сопоставимы при снижении дозы рибавирина или применении эритропоэтина. В этом исследовании в группе пациентов, принимавших эритропоэтин, было отмечено увеличение риска развития тромбоэмболии, включая эмболию легочной артерии, острый инфаркт миокарда, нарушение мозгового кровообращения и тромбоз глубоких вен, по сравнению с группой пациентов, у которых была снижена доза рибавирина.
Для получения информации относительно снижения дозы и/или прекращения лечения рибавирином необходимо обратиться к инструкции по применению рибавирина.
RxList.com.
Анемия (использование с рибавирином и пэгинтерфероном альфа).
Сообщалось о случаях развития анемии при терапии пэгинтерфероном альфа и рибавирином. Добавление применения боцепревира к лечению пэгинтерфероном альфа и рибавирином приводит к дополнительному снижению концентрации Hb. Полный анализ крови (с дифференцированным подсчетом лейкоцитов) следует проводить в предварительный период лечения, через 2; 4; 8 и 12 нед терапии, а также в другие, клинически соответствующие, периоды времени. Если уровень Hb становится <10 г/дл, рекомендуется снижение дозы рибавирина; если уровень Hb составляет <8,5 г/дл, следует прекратить терапию рибавирином ( см «Побочные действия»). Если при наличии анемии лечение рибавирином окончательно прекращено, необходимо прекратить терапию пегинтерфероном альфа и боцепревиром ( см «Способ применения и дозы»).
Необходимо обратиться к предписывающей информации для рибавирина для получения дополнительных данных относительно снижения дозы и/или прекращения терапии.
В клинических испытаниях доля пациентов, у которых концентрация Hb становилась <10 г/дл или <8,5 г/дл, была выше у больных, принимавших боцепревир с комбинацией пегинтерферон альфа + рибавирин, чем у получавших только комбинацию пегинтерферон альфа + рибавирин ( см «Побочные действия»). При дополнительной терапии, применяемой для лечения анемии в клинических испытаниях, среднее дополнительное снижение концентрации Hb составляло примерно 1 г/л.
В клинических испытаниях среднее время до достижения уровня Hb <10 г/дл от начала терапии была одинаковой среди пациентов, принимавших боцепревир с комбинацией пегинтерферон альфа + рибавирин (71 день с диапазоном 15-337 дней), по сравнению с пациентами, получавшими только комбинацию пегинтерферон альфа + рибавирин (71 день с диапазоном 8-337 дней). Некоторые побочные реакции, наблюдаемые совместно с симптомами анемии, такие как одышка, одышка при физической нагрузке, головокружение и обморок, выявлялись чаще у пациентов, принимавших боцепревир с комбинацией пегинтерферон альфа + рибавирин, чем у получавших только комбинацию пегинтерферон альфа + рибавирин ( см «Побочные действия»).
В клинических испытаниях боцепревира изменения дозы, в основном компонентов комбинации пегинтерферон альфа + рибавирин, в связи с развитием анемии, произошло в 2 раза чаще у пациентов, получавших боцепревир с комбинацией пегинтерферон альфа + рибавирин (26%), чем у принимавших только комбинацию пегинтерферон альфа + рибавирин (13%). Доля пациентов, прекративших прием исследуемых ЛС из-за анемии, соответствовала 1% как получавших боцепревир с комбинацией пегинтерферон альфа + рибавирин, так и принимавших только комбинацию пегинтерферон альфа + рибавирин. Использование ЛС, стимулирующих эритропоэз (ЛССЭ), было разрешено (по усмотрению исследователей) для лечения анемии с или без снижения дозы рибавирина в фазе 2 и 3 клинических испытаний. Доля пациентов, принимавших ЛССЭ, составляла 43% от получавших боцепревир с комбинацией пегинтерферон альфа + рибавирин в сравнении с 24% от принимавших только комбинацию пегинтерферон альфа + рибавирин. Доля пациентов, которым проводили переливание для коррекции анемии, составила 3% при лечении боцепревиром с комбинацией пегинтерферон альфа + рибавирин, по сравнению с <1% пациентов, принимавших только комбинацию пегинтерферон альфа + рибавирин.
Случаи тромбоэмболии были выявлены при использовании ЛССЭ для лечения других заболеваний, а также о них сообщалось при применении пегинтерферона альфа для лечения больных гепатитом С. Случаи тромбоэмболии были зарегистрированы в клинических испытаниях при терапии пациентов с гепатитом С, принимавших как боцепревир с комбинацией пегинтерферон альфа + рибавирин, так и только комбинацию пегинтерферон альфа + рибавирин, независимо от использования ЛССЭ. Невозможно достоверно оценить причины и риски возникновения случаев тромбоэмболии в связи с наличием неопределенных сопутствующих факторов и отсутствием рандомизации применения ЛССЭ.
В рандомизированном проспективном открытом клиническом исследовании пациентов с хроническим гепатитом С генотипа 1, ранее не получавших терапию, было изучено применение ЛССЭ в сравнении со снижением дозы рибовирина для коррекции анемии во время дальнейшей терапии боцепревиром с комбинацией пегинтерферон альфа-2b + рибавирин. Пациенты, рандомизированные как для снижения дозы рибавирина, так и получения терапии ЛССЭ, имели аналогичные показатели устойчивого вирусологического ответа. В этом исследовании применение ЛССЭ было связано с повышенным риском развития тромбоэмболических осложнений, включая легочную эмболию, острый инфаркт миокарда, нарушение мозгового кровообращения и тромбоз глубоких вен по сравнению с применением только сниженных доз рибавирина. Частота отмены лечения из-за анемии была сходной как для субъектов, рандомизированных для получения сниженных доз рибавирина, так и для пациентов, рандомизированных для получения ЛССЭ (по 2% в каждой группе). Частота применения переливания крови составила 4% у пациентов, рандомизированных для применения сниженных доз рибавирина, и 2% у пациентов, рандомизированных для получения ЛССЭ.
Снижение дозы рибавирина рекомендуется для первоначальной коррекции анемии.
Нейтропения.
В ходе клинических исследований фаз 2 и 3 у 7% пациентов, получавших лечение комбинацией боцепревира с пэгинтерфероном альфа-2b и рибавирином, концентрация нейтрофилов составила <0,5×109 клеток/л по сравнению с 4% пациентов, получавших лечение только пэгинтерфероном альфа-2b и рибавирином. У 3 пациентов развились связанные с нейтропенией серьезные или угрожающие жизни инфекции. У двух пациентов при приеме боцепревира в комбинации с пэгинтерфероном альфа-2b и рибавирином была зафиксирована угрожающая жизни нейтропения. Полный анализ крови (включая лейкоцитарную формулу) необходимо проводить через 2; 4; 8 и 12 нед лечения и далее - при наличии клинической целесообразности. В случае снижения концентрации нейтрофилов может потребоваться уменьшение дозы пэгинтерферона альфа или прекращение терапии. Если требуется прекращение терапии пэгинтерфероном альфа, то терапию рибавирином и боцепревиром также следует прекратить.
Для получения информации относительно снижения дозы и/или прекращения лечения пэгинтерфероном альфа необходимо обратиться к инструкции по применению пэгинтерферона альфа.
Применение комбинации с пэгинтерфероном альфа-2а по сравнению с пэгинтерфероном альфа-2b. Лечение комбинацией боцепревира с пэгинтерфероном альфа-2а и рибавирином по сравнению с лечением комбинацией боцепревира с пэгинтерфероном альфа-2b и рибавирином было связано с более высокой степенью нейтропении (включая 4-ю степень нейтропении) и более высокой частотой развития инфекций.
Другие нарушения крови.
Сообщалось о случаях развития панцитопении у пациентов, принимавших боцепревир в комбинации с пэгинтерфероном альфа и рибавирином. Полный анализ крови (включая лейкоцитарную формулу) необходимо проводить перед началом терапии, через 2; 4; 8 и 12 нед лечения и далее в процессе лечения при наличии клинической целесообразности.
Гиперчувствительность.
При комбинированной схеме лечения боцепревиром с пэгинтерфероном альфа и рибавирином наблюдались серьезные острые реакции гиперчувствительности (например крапивница, ангионевротический отек). При появлении таких реакций следует отменить комбинированную терапию и немедленно начать соответствующую медикаментозную терапию ( см «Противопоказания», «Побочные действия»).
Печеночная недостаточность.
Эффективность и безопасность боцепревира в комбинации с пэгинтерфероном альфа и рибавирином не изучались у пациентов с декомпенсированным циррозом печени ( см «Противопоказания»).
В опубликованных наблюдательных (обсервационных) исследованиях пациентов с компенсированным циррозом печени, получавших боцепревир или телапревир в комбинации с пэгинтерфероном альфа и рибавирином, было показано, что исходные концентрации тромбоцитов <100000/мм3 и сывороточного альбумина <35 г/л у пациентов с компенсированным циррозом печени являлись основными факторами прогноза летального исхода или серьезных осложнений (тяжелая инфекция или печеночная недостаточность) во время терапии.
Следует тщательно рассмотреть потенциальные пользу и риск от применения боцепревира в комбинации с пэгинтерфероном альфа и рибавирином до начала терапии у пациентов с компенсированным циррозом, у которых в начале исследования концентрация тромбоцитов была <100000/мм3 и сывороточного альбумина - <35 г/л. Если терапия уже начата, то следует осуществлять тщательный контроль за развитием признаков инфекции и ухудшением функции печени.
Пациенты, коинфицированные ВИЧ.
Боцепревир в комбинации с пэгинтерфероном альфа и рибавирином оценивался в исследовании с участием 98 пациентов (64 из которых принимали боцепревир), коинфицированных ВИЧ и ВГС (генотип 1) и не получавших ранее лечения хронического вирусного гепатита С. Данные по взаимодействию с противовирусными (ВИЧ) средствами ( см «Взаимодействие»).
Пациенты после трансплантации органов.
Безопасность и эффективность боцепревира, применяемого отдельно или в комбинации с пэгинтерфероном альфа и рибавирином для лечения хронического ВГС (генотип 1), у пациентов, которым была проведена трансплантация печени или других органов, не изучены. Данные по взаимодействию с иммунодепрессантами ( см «Взаимодействие»).
RxList.com.
Пожилые пациенты.
В клинические исследования боцепревира не было включено достаточное количество пациентов в возрасте 65 лет и старше для определения различий в реакциях на это ЛС в сравнении с более молодыми пациентами. В целом, следует проявлять осторожность при проведении лечения боцепревиром у пожилых пациентов в связи с большей частотой снижения функции печени, сопутствующих заболеваний и наличия другой лекарственной терапии ( см «Фармакология», «Способ применения и дозы»).
ЛС, содержащие дроспиренон.
Следует соблюдать осторожность при назначении боцепревира пациентам, принимающим калийсберегающие диуретики или ЛС, содержащие дроспиренон, поскольку возможен риск развития гиперкалиемии. Следует рассмотреть возможность применения альтернативных методов контрацепции ( см «Взаимодействие»).
Индукторы изофермента сYP3A4.
Не рекомендуется одновременное применение боцепревира с сильными индукторами изофермента сYP3A4 (рифампицин, карбамазепин, фенобарбитал и фенитонин).
Монотерапия ингибиторами протеазы вируса гепатита С.
На основании результатов клинических исследований боцепревир не должен применяться в качестве монотерапии ВГС, поскольку существует большая вероятность возникновения резистентности к этому ЛС ( см «Фармакология»).
Неизвестно, какое действие окажет боцепревир на активность последовательно применяемых ингибиторов протеазы ВГС, включая повторное назначение боцепревира.
Показатели лабораторных исследований.
В соответствии с инструкциями по применению пэгинтерферона альфа и рибавирина, следует проводить лабораторные исследования, включающие гематологические и биохимические тесты (функциональные печеночные показатели), а также контроль беременности до начала, во время и после окончания терапии.
Следует контролировать содержание РНК ВГС во время лечения через 8; 12 и 24 нед и далее при наличии клинической целесообразности.
Полный анализ крови (включая лейкоцитарную формулу) необходимо проводить до начала лечения, а также через 2; 4; 8 и 12 нед лечения и далее при наличии клинической целесообразности.
Дополнительная информация по применению боцепревира у пациентов с компенсированным циррозом печени ( см «Меры предосторожности»).
Проаритмический эффект.
В соответствии с имеющимися данными, боцепревир следует назначать с осторожностью пациентам, находящимся в группе риска удлинения интервала QT (с врожденным удлиненным интервалом QT, гипокалиемией).
Влияние на способность управлять транспортными средствами и работать с механизмами. Влияние боцепревира в комбинации с пэгинтерфероном альфа и рибавирином на способность управлять транспортными средствами и использовать различные механизмы не изучалось. Однако некоторые побочные реакции, наблюдаемые у пациентов, могут оказать воздействие на способность управлять транспортными средствами и работать с различными механизмами. Индивидуальная реакция на боцепревир в комбинации с пэгинтерфероном альфа и рибавирином может различаться. Пациентов следует проинформировать, что применение препарата может вызвать утомляемость, головокружение, обморок и нечеткость зрения ( см «Побочные действия»). За дополнительной информацией необходимо обратиться к инструкциям по применению пэгинтерферона альфа и рибавирина.
Сообщалось о случаях развития анемии при лечении пэгинтерфероном альфа/рибавирином. Добавление боцепревира в схему лечения с пэгинтерфероном альфа и рибавирином приводит к дополнительному снижению концентрации Hb в сыворотке крови. Среднее временя снижения концентрации Hb в сыворотке крови до значения <10 г/дл относительно концентрации в начале терапии было сходным в группах пациентов, принимавших боцепревир в комбинации с пэгинтерфероном альфа и рибавирином (71 день при общей продолжительности курса терапии 15-337 дней), и пациентов, принимавших пэгинтерферон альфа и рибавирин (71 день при общей продолжительности курса терапии 8-337 дней). Перед началом терапии, а также через 2; 4; 8 и 12 нед лечения и далее, при наличии клинической целесообразности, следует проводить полный анализ крови (включая лейкоцитарную формулу). Снижение концентрации Hb в сыворотке крови <10 г/дл может служить основанием для уменьшения дозы рибавирииа и/или назначения терапии эритропоэтином (эпоэтин альфа) ( см «Побочные действия», «Фармакология»). Если требуется прекращение терапии рибавирином, то терапию пэгинтерфероном альфа и боцепревиром также следует прекратить.
При развитии признаков анемии, связанных с терапией, рекомендуется снижение дозы рибавирина.
В проспективном рандомизированном контролируемом исследовании частота достижения устойчивого вирусологическою ответа и общая переносимость боцепревира были сопоставимы при снижении дозы рибавирина или применении эритропоэтина. В этом исследовании в группе пациентов, принимавших эритропоэтин, было отмечено увеличение риска развития тромбоэмболии, включая эмболию легочной артерии, острый инфаркт миокарда, нарушение мозгового кровообращения и тромбоз глубоких вен, по сравнению с группой пациентов, у которых была снижена доза рибавирина.
Для получения информации относительно снижения дозы и/или прекращения лечения рибавирином необходимо обратиться к инструкции по применению рибавирина.
RxList.com.
Анемия (использование с рибавирином и пэгинтерфероном альфа).
Сообщалось о случаях развития анемии при терапии пэгинтерфероном альфа и рибавирином. Добавление применения боцепревира к лечению пэгинтерфероном альфа и рибавирином приводит к дополнительному снижению концентрации Hb. Полный анализ крови (с дифференцированным подсчетом лейкоцитов) следует проводить в предварительный период лечения, через 2; 4; 8 и 12 нед терапии, а также в другие, клинически соответствующие, периоды времени. Если уровень Hb становится <10 г/дл, рекомендуется снижение дозы рибавирина; если уровень Hb составляет <8,5 г/дл, следует прекратить терапию рибавирином ( см «Побочные действия»). Если при наличии анемии лечение рибавирином окончательно прекращено, необходимо прекратить терапию пегинтерфероном альфа и боцепревиром ( см «Способ применения и дозы»).
Необходимо обратиться к предписывающей информации для рибавирина для получения дополнительных данных относительно снижения дозы и/или прекращения терапии.
В клинических испытаниях доля пациентов, у которых концентрация Hb становилась <10 г/дл или <8,5 г/дл, была выше у больных, принимавших боцепревир с комбинацией пегинтерферон альфа + рибавирин, чем у получавших только комбинацию пегинтерферон альфа + рибавирин ( см «Побочные действия»). При дополнительной терапии, применяемой для лечения анемии в клинических испытаниях, среднее дополнительное снижение концентрации Hb составляло примерно 1 г/л.
В клинических испытаниях среднее время до достижения уровня Hb <10 г/дл от начала терапии была одинаковой среди пациентов, принимавших боцепревир с комбинацией пегинтерферон альфа + рибавирин (71 день с диапазоном 15-337 дней), по сравнению с пациентами, получавшими только комбинацию пегинтерферон альфа + рибавирин (71 день с диапазоном 8-337 дней). Некоторые побочные реакции, наблюдаемые совместно с симптомами анемии, такие как одышка, одышка при физической нагрузке, головокружение и обморок, выявлялись чаще у пациентов, принимавших боцепревир с комбинацией пегинтерферон альфа + рибавирин, чем у получавших только комбинацию пегинтерферон альфа + рибавирин ( см «Побочные действия»).
В клинических испытаниях боцепревира изменения дозы, в основном компонентов комбинации пегинтерферон альфа + рибавирин, в связи с развитием анемии, произошло в 2 раза чаще у пациентов, получавших боцепревир с комбинацией пегинтерферон альфа + рибавирин (26%), чем у принимавших только комбинацию пегинтерферон альфа + рибавирин (13%). Доля пациентов, прекративших прием исследуемых ЛС из-за анемии, соответствовала 1% как получавших боцепревир с комбинацией пегинтерферон альфа + рибавирин, так и принимавших только комбинацию пегинтерферон альфа + рибавирин. Использование ЛС, стимулирующих эритропоэз (ЛССЭ), было разрешено (по усмотрению исследователей) для лечения анемии с или без снижения дозы рибавирина в фазе 2 и 3 клинических испытаний. Доля пациентов, принимавших ЛССЭ, составляла 43% от получавших боцепревир с комбинацией пегинтерферон альфа + рибавирин в сравнении с 24% от принимавших только комбинацию пегинтерферон альфа + рибавирин. Доля пациентов, которым проводили переливание для коррекции анемии, составила 3% при лечении боцепревиром с комбинацией пегинтерферон альфа + рибавирин, по сравнению с <1% пациентов, принимавших только комбинацию пегинтерферон альфа + рибавирин.
Случаи тромбоэмболии были выявлены при использовании ЛССЭ для лечения других заболеваний, а также о них сообщалось при применении пегинтерферона альфа для лечения больных гепатитом С. Случаи тромбоэмболии были зарегистрированы в клинических испытаниях при терапии пациентов с гепатитом С, принимавших как боцепревир с комбинацией пегинтерферон альфа + рибавирин, так и только комбинацию пегинтерферон альфа + рибавирин, независимо от использования ЛССЭ. Невозможно достоверно оценить причины и риски возникновения случаев тромбоэмболии в связи с наличием неопределенных сопутствующих факторов и отсутствием рандомизации применения ЛССЭ.
В рандомизированном проспективном открытом клиническом исследовании пациентов с хроническим гепатитом С генотипа 1, ранее не получавших терапию, было изучено применение ЛССЭ в сравнении со снижением дозы рибовирина для коррекции анемии во время дальнейшей терапии боцепревиром с комбинацией пегинтерферон альфа-2b + рибавирин. Пациенты, рандомизированные как для снижения дозы рибавирина, так и получения терапии ЛССЭ, имели аналогичные показатели устойчивого вирусологического ответа. В этом исследовании применение ЛССЭ было связано с повышенным риском развития тромбоэмболических осложнений, включая легочную эмболию, острый инфаркт миокарда, нарушение мозгового кровообращения и тромбоз глубоких вен по сравнению с применением только сниженных доз рибавирина. Частота отмены лечения из-за анемии была сходной как для субъектов, рандомизированных для получения сниженных доз рибавирина, так и для пациентов, рандомизированных для получения ЛССЭ (по 2% в каждой группе). Частота применения переливания крови составила 4% у пациентов, рандомизированных для применения сниженных доз рибавирина, и 2% у пациентов, рандомизированных для получения ЛССЭ.
Снижение дозы рибавирина рекомендуется для первоначальной коррекции анемии.
Нейтропения.
В ходе клинических исследований фаз 2 и 3 у 7% пациентов, получавших лечение комбинацией боцепревира с пэгинтерфероном альфа-2b и рибавирином, концентрация нейтрофилов составила <0,5×109 клеток/л по сравнению с 4% пациентов, получавших лечение только пэгинтерфероном альфа-2b и рибавирином. У 3 пациентов развились связанные с нейтропенией серьезные или угрожающие жизни инфекции. У двух пациентов при приеме боцепревира в комбинации с пэгинтерфероном альфа-2b и рибавирином была зафиксирована угрожающая жизни нейтропения. Полный анализ крови (включая лейкоцитарную формулу) необходимо проводить через 2; 4; 8 и 12 нед лечения и далее - при наличии клинической целесообразности. В случае снижения концентрации нейтрофилов может потребоваться уменьшение дозы пэгинтерферона альфа или прекращение терапии. Если требуется прекращение терапии пэгинтерфероном альфа, то терапию рибавирином и боцепревиром также следует прекратить.
Для получения информации относительно снижения дозы и/или прекращения лечения пэгинтерфероном альфа необходимо обратиться к инструкции по применению пэгинтерферона альфа.
Применение комбинации с пэгинтерфероном альфа-2а по сравнению с пэгинтерфероном альфа-2b. Лечение комбинацией боцепревира с пэгинтерфероном альфа-2а и рибавирином по сравнению с лечением комбинацией боцепревира с пэгинтерфероном альфа-2b и рибавирином было связано с более высокой степенью нейтропении (включая 4-ю степень нейтропении) и более высокой частотой развития инфекций.
Другие нарушения крови.
Сообщалось о случаях развития панцитопении у пациентов, принимавших боцепревир в комбинации с пэгинтерфероном альфа и рибавирином. Полный анализ крови (включая лейкоцитарную формулу) необходимо проводить перед началом терапии, через 2; 4; 8 и 12 нед лечения и далее в процессе лечения при наличии клинической целесообразности.
Гиперчувствительность.
При комбинированной схеме лечения боцепревиром с пэгинтерфероном альфа и рибавирином наблюдались серьезные острые реакции гиперчувствительности (например крапивница, ангионевротический отек). При появлении таких реакций следует отменить комбинированную терапию и немедленно начать соответствующую медикаментозную терапию ( см «Противопоказания», «Побочные действия»).
Печеночная недостаточность.
Эффективность и безопасность боцепревира в комбинации с пэгинтерфероном альфа и рибавирином не изучались у пациентов с декомпенсированным циррозом печени ( см «Противопоказания»).
В опубликованных наблюдательных (обсервационных) исследованиях пациентов с компенсированным циррозом печени, получавших боцепревир или телапревир в комбинации с пэгинтерфероном альфа и рибавирином, было показано, что исходные концентрации тромбоцитов <100000/мм3 и сывороточного альбумина <35 г/л у пациентов с компенсированным циррозом печени являлись основными факторами прогноза летального исхода или серьезных осложнений (тяжелая инфекция или печеночная недостаточность) во время терапии.
Следует тщательно рассмотреть потенциальные пользу и риск от применения боцепревира в комбинации с пэгинтерфероном альфа и рибавирином до начала терапии у пациентов с компенсированным циррозом, у которых в начале исследования концентрация тромбоцитов была <100000/мм3 и сывороточного альбумина - <35 г/л. Если терапия уже начата, то следует осуществлять тщательный контроль за развитием признаков инфекции и ухудшением функции печени.
Пациенты, коинфицированные ВИЧ.
Боцепревир в комбинации с пэгинтерфероном альфа и рибавирином оценивался в исследовании с участием 98 пациентов (64 из которых принимали боцепревир), коинфицированных ВИЧ и ВГС (генотип 1) и не получавших ранее лечения хронического вирусного гепатита С. Данные по взаимодействию с противовирусными (ВИЧ) средствами ( см «Взаимодействие»).
Пациенты после трансплантации органов.
Безопасность и эффективность боцепревира, применяемого отдельно или в комбинации с пэгинтерфероном альфа и рибавирином для лечения хронического ВГС (генотип 1), у пациентов, которым была проведена трансплантация печени или других органов, не изучены. Данные по взаимодействию с иммунодепрессантами ( см «Взаимодействие»).
RxList.com.
Пожилые пациенты.
В клинические исследования боцепревира не было включено достаточное количество пациентов в возрасте 65 лет и старше для определения различий в реакциях на это ЛС в сравнении с более молодыми пациентами. В целом, следует проявлять осторожность при проведении лечения боцепревиром у пожилых пациентов в связи с большей частотой снижения функции печени, сопутствующих заболеваний и наличия другой лекарственной терапии ( см «Фармакология», «Способ применения и дозы»).
ЛС, содержащие дроспиренон.
Следует соблюдать осторожность при назначении боцепревира пациентам, принимающим калийсберегающие диуретики или ЛС, содержащие дроспиренон, поскольку возможен риск развития гиперкалиемии. Следует рассмотреть возможность применения альтернативных методов контрацепции ( см «Взаимодействие»).
Индукторы изофермента сYP3A4.
Не рекомендуется одновременное применение боцепревира с сильными индукторами изофермента сYP3A4 (рифампицин, карбамазепин, фенобарбитал и фенитонин).
Монотерапия ингибиторами протеазы вируса гепатита С.
На основании результатов клинических исследований боцепревир не должен применяться в качестве монотерапии ВГС, поскольку существует большая вероятность возникновения резистентности к этому ЛС ( см «Фармакология»).
Неизвестно, какое действие окажет боцепревир на активность последовательно применяемых ингибиторов протеазы ВГС, включая повторное назначение боцепревира.
Показатели лабораторных исследований.
В соответствии с инструкциями по применению пэгинтерферона альфа и рибавирина, следует проводить лабораторные исследования, включающие гематологические и биохимические тесты (функциональные печеночные показатели), а также контроль беременности до начала, во время и после окончания терапии.
Следует контролировать содержание РНК ВГС во время лечения через 8; 12 и 24 нед и далее при наличии клинической целесообразности.
Полный анализ крови (включая лейкоцитарную формулу) необходимо проводить до начала лечения, а также через 2; 4; 8 и 12 нед лечения и далее при наличии клинической целесообразности.
Дополнительная информация по применению боцепревира у пациентов с компенсированным циррозом печени ( см «Меры предосторожности»).
Проаритмический эффект.
В соответствии с имеющимися данными, боцепревир следует назначать с осторожностью пациентам, находящимся в группе риска удлинения интервала QT (с врожденным удлиненным интервалом QT, гипокалиемией).
Влияние на способность управлять транспортными средствами и работать с механизмами. Влияние боцепревира в комбинации с пэгинтерфероном альфа и рибавирином на способность управлять транспортными средствами и использовать различные механизмы не изучалось. Однако некоторые побочные реакции, наблюдаемые у пациентов, могут оказать воздействие на способность управлять транспортными средствами и работать с различными механизмами. Индивидуальная реакция на боцепревир в комбинации с пэгинтерфероном альфа и рибавирином может различаться. Пациентов следует проинформировать, что применение препарата может вызвать утомляемость, головокружение, обморок и нечеткость зрения ( см «Побочные действия»). За дополнительной информацией необходимо обратиться к инструкциям по применению пэгинтерферона альфа и рибавирина.
|
|
Список литературы
Инструкция по применению лекарственного препарата для медицинского применения ВИКТРЕЛИС®. ЛП-002070, 30.06.2015. - grls.rosminzdrav.ru.
Victrelis® сapsules (boceprevir) - FDA. - rxlist.com.
Victrelis® сapsules (boceprevir) - FDA. - rxlist.com.
Входит в состав
- 44000-72000₽ Виктрелис (Schering-Plough Labo N.V. )