Другие названия и синонимы
Verteporfin.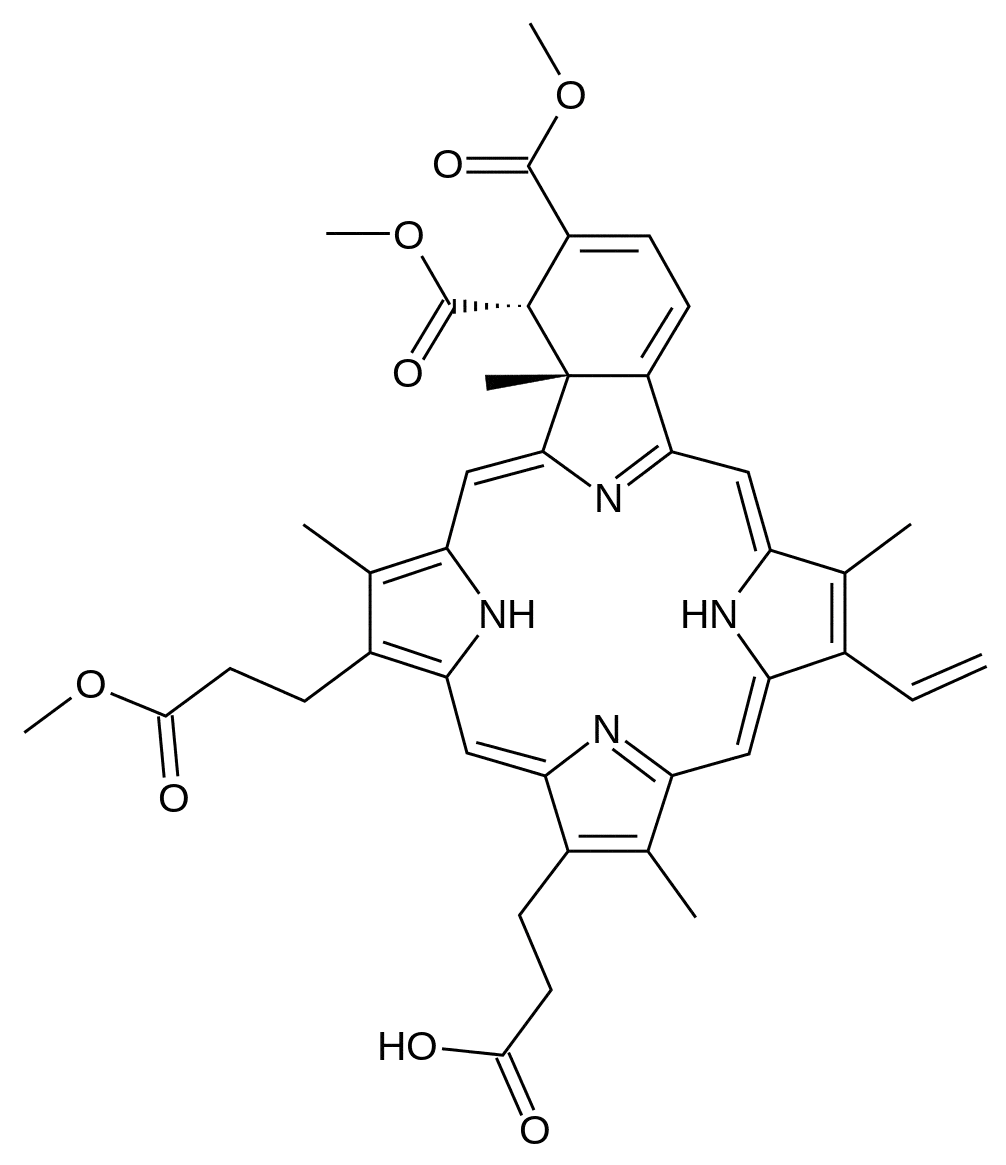
Фармакологическая группа
|
|
Латинское название
Verteporfinum ( Verteporfini).
Используется в лечении
Код CAS
129497-78-5.
ATX код
S01LA01 Вертепорфин.
Фармакологическое действие
Фотосенсибилизирующее.
Характеристика вещества
Препарат для фотодинамической терапии в офтальмологии. Является производным бензопорфирина (BPD-MA), состоит из смеси одинаково активных стереоизомеров вPD-MAC и вPD-MAD в соотношении 1:1.
Фармакодинамика
Вертепорфин - фотосенсибилизатор, при активации светом продуцирует цитотоксические агенты только в присутствии кислорода. Когда поглощаемая порфирином энергия передается кислороду, генерируется высоко активный короткоживущий синглетный кислород. Синглетный кислород разрушает биологические структуры в пределах зоны диффузии, что приводит к локальной закупорке сосудов и гибели клеток.
Вертепорфин в рекомендуемой дозировке (в отсутствии кислорода и без активации светом) не является цитотоксичным.
Селективность фотодинамической терапии (ФДТ) с вертепорфином основана, помимо локализованного воздействия света, на избирательности, быстром поглощении и накоплении вертепорфина быстро пролиферирующими клетками, включая эндотелий вновь образующихся сосудов сетчатки. Предполагается, что это накопление обусловлено повышенной чувствительностью рецепторов в пролиферирующих клетках. В испытаниях на кроликах и обезьянах с вновь образованными сосудами глаз и в клинических исследованиях при в/в введении вертепорфина с последующим облучением светом лазера с длиной волны 689 нм была отмечена избирательная закупорка вновь образованных сосудов, в то время как широкие, нормальные сосуды сетчатки оставались открытыми. Закупорка вновь образованных региональных сосудов в результате терапии Визудином была подтверждена флуоресцентной ангиографией.
Вертепорфин в рекомендуемой дозировке (в отсутствии кислорода и без активации светом) не является цитотоксичным.
Селективность фотодинамической терапии (ФДТ) с вертепорфином основана, помимо локализованного воздействия света, на избирательности, быстром поглощении и накоплении вертепорфина быстро пролиферирующими клетками, включая эндотелий вновь образующихся сосудов сетчатки. Предполагается, что это накопление обусловлено повышенной чувствительностью рецепторов в пролиферирующих клетках. В испытаниях на кроликах и обезьянах с вновь образованными сосудами глаз и в клинических исследованиях при в/в введении вертепорфина с последующим облучением светом лазера с длиной волны 689 нм была отмечена избирательная закупорка вновь образованных сосудов, в то время как широкие, нормальные сосуды сетчатки оставались открытыми. Закупорка вновь образованных региональных сосудов в результате терапии Визудином была подтверждена флуоресцентной ангиографией.
Фармакокинетика
Всасывание. После в/в введения Визудина в течение 10 мин в дозах 6 и 12 мг/м2 поверхности тела Сmax составляет 1,5 и 3,5 мкг/мл соответственно.
Для обоих стереоизомеров значения Сmax и AUC пропорциональны дозировке. Величины Сmax в конце инъекции выше для вPD-MAD, чем для вPD-MAC, что может быть обусловлено более быстрым переносом вPD-MAD от липидного носителя к липопротеинам. Значения AUC для обоих стереоизомеров сходны.
Распределение. В плазме вертепорфин переносится в первую очередь к ЛПНП. Распределение вертепорфина после болюсной инъекции в рекомендуемой дозировке (обычно хорошо переносимой) может изменяться и вследствие этого оказывать влияние на оптимальную эффективность лазерного облучения.
Пролиферирующие клетки задерживают соответственно более высокие количества препарата. Исследования распределения в глазах приматов с помощью ангиографии показали, что вертепорфин поглощается избирательно и быстро вновь образованными региональными сосудами глаза и в меньшей степени - пигментным эпителием сетчатки. Другие структуры глаза задерживают лишь небольшие количества препарата.
Связывание с белками плазмы крови. 90% вертепорфина связывается с белками плазмы крови и 10% - с клетками крови. В плазме крови человека 90% вертепорфина связано с липопротеиновыми фракциями и около 6% - с альбумином. Кажущийся объем распределения (dVd) составляет 0,5 л/кг.
Метаболизм. 5-10% исходной дозы вертепорфина метаболизируется путем гидролиза его эфирной группы до дикислоты бензопорфиринового производного (BPD-DA), которая также обладает фотосенсибилизирующей активностью.
Выведение. Период полураспада в плазме составляет примерно 6-7 ч для вPD-MAC и примерно 4-6 ч для вPD-MAD. Выведение осуществляется в основном с желчью.
У крыс примерно 90% дозы вертепорфина при в/в введении 14C-BPD-MA выводилось с калом за 7 дней. Менее 1% меченого препарата было обнаружено в моче.
Средний 1/2T1/2 вPD-MAD составляет примерно 6,5 ч - у людей с хроническим вирусным гепатитом и около 4,7 ч - у людей, не страдающих заболеваниями печени (статистически значимое отличие; p<0,05). У людей с заболеваниями печени среднее значение AUC в 1,5 раза выше, чем у здоровых добровольцев, не страдающих данной патологией. Это различие не является клинически значимым и не требует коррекции доз для пациентов с легким нарушением функции печени. Исследования у пациентов с заболеваниями печени средней и тяжелой степени не проводились.
Для обоих стереоизомеров значения Сmax и AUC пропорциональны дозировке. Величины Сmax в конце инъекции выше для вPD-MAD, чем для вPD-MAC, что может быть обусловлено более быстрым переносом вPD-MAD от липидного носителя к липопротеинам. Значения AUC для обоих стереоизомеров сходны.
Распределение. В плазме вертепорфин переносится в первую очередь к ЛПНП. Распределение вертепорфина после болюсной инъекции в рекомендуемой дозировке (обычно хорошо переносимой) может изменяться и вследствие этого оказывать влияние на оптимальную эффективность лазерного облучения.
Пролиферирующие клетки задерживают соответственно более высокие количества препарата. Исследования распределения в глазах приматов с помощью ангиографии показали, что вертепорфин поглощается избирательно и быстро вновь образованными региональными сосудами глаза и в меньшей степени - пигментным эпителием сетчатки. Другие структуры глаза задерживают лишь небольшие количества препарата.
Связывание с белками плазмы крови. 90% вертепорфина связывается с белками плазмы крови и 10% - с клетками крови. В плазме крови человека 90% вертепорфина связано с липопротеиновыми фракциями и около 6% - с альбумином. Кажущийся объем распределения (dVd) составляет 0,5 л/кг.
Метаболизм. 5-10% исходной дозы вертепорфина метаболизируется путем гидролиза его эфирной группы до дикислоты бензопорфиринового производного (BPD-DA), которая также обладает фотосенсибилизирующей активностью.
Выведение. Период полураспада в плазме составляет примерно 6-7 ч для вPD-MAC и примерно 4-6 ч для вPD-MAD. Выведение осуществляется в основном с желчью.
У крыс примерно 90% дозы вертепорфина при в/в введении 14C-BPD-MA выводилось с калом за 7 дней. Менее 1% меченого препарата было обнаружено в моче.
Средний 1/2T1/2 вPD-MAD составляет примерно 6,5 ч - у людей с хроническим вирусным гепатитом и около 4,7 ч - у людей, не страдающих заболеваниями печени (статистически значимое отличие; p<0,05). У людей с заболеваниями печени среднее значение AUC в 1,5 раза выше, чем у здоровых добровольцев, не страдающих данной патологией. Это различие не является клинически значимым и не требует коррекции доз для пациентов с легким нарушением функции печени. Исследования у пациентов с заболеваниями печени средней и тяжелой степени не проводились.
Показания к применению
Возрастная дегенерация желтого пятна у пациентов с преимущественно классической субфовеолярной хориоидальной неоваскуляризацией (ХНВ);
Повторная субфовеолярная хориоидальная неоваскуляризация при патологической миопии.
Повторная субфовеолярная хориоидальная неоваскуляризация при патологической миопии.
Противопоказания
Повышенная чувствительность к вертепорфину или любому из компонентов препарата;
Порфирия;
Гепатит тяжелого течения;
Беременность;
Период лактации.
С осторожностью следует назначать больным с заболеваниями печени средней или тяжелой степени, обструкцией желчных путей, при проведении общей анестезии ( см раздел «Особые указания»).
Порфирия;
Гепатит тяжелого течения;
Беременность;
Период лактации.
С осторожностью следует назначать больным с заболеваниями печени средней или тяжелой степени, обструкцией желчных путей, при проведении общей анестезии ( см раздел «Особые указания»).
При беременности и кормлении грудью
Применение Визудина при беременности противопоказано.
Необходимо отказаться от грудного вскармливания в течении как минимум 48 ч после терапии Визудином.
Необходимо отказаться от грудного вскармливания в течении как минимум 48 ч после терапии Визудином.
Побочные эффекты
В плацебо-контролируемых клинических исследованиях у больных с возрастной макулярной дегенерацией (ВМД) и патологической миопией отмечались приведенные ниже одинаковые нежелательные реакции, возможно связанные с применением Визудина. В большинстве случаев побочные реакции были незначительными и носили временный характер. Использовались следующие критерии оценки частоты развития нежелательных явлений: часто - 1-10%, редко - 0,1-1%.
Со стороны органа зрения. Часто - такие нарушения зрения, как затуманивание, расплывчатость или вспышки света, снижение остроты зрения, дефекты поля зрения (серые или темные ореолы, скотомы и черные точки).
Выраженное снижение остроты зрения (на 4 строчки и более по ETDRS оптотипу) в течение 7 дней после применения Визудина отмечалось у 2,1% больных. В большинстве случаев такое снижение остроты зрения выявлялось у больных с ВМД и скрытой хориоидальной неоваскуляризацией. В дальнейшем у некоторых пациентов наблюдалось частичное восстановление остроты зрения. Редко - отслойка сетчатки (нерегматогенного генеза), субретинальные и ретинальные кровоизлияния, гемофтальм. С частотой менее 0,1% наблюдалось нарушение кровотока в сосудах сетчатки и хориоидеи, отслойка пигментного эпителия сетчатки.
Реакции в месте введения. Часто - боль, отек мягких тканей, воспаление, подкожная гематома; редко - геморрагии, обесцвечивание кожи в зоне инъекции, гиперчувствительность. С частотой менее 0,1% отмечалось образование волдырей на коже в месте введения препарата.
Со стороны организма в целом. Часто - боль в спине во время введения препарата, светочувствительные реакции, астения. Редко - гипертензия, гипестезия, тошнота и лихорадка. С частотой менее 0,1% наблюдались вазовагальные реакции, реакции гиперчувствительности (в редких случаях тяжелого течения), включающие головную боль, чувство дискомфорта, обмороки, повышенное потоотделение, головокружение, сыпь, крапивницу, зуд, одышку, гиперемию, изменения АД и ЧСС. Светочувствительные реакции отмечались у 2,2% пациентов и выражались в виде солнечного ожога, как правило, возникающего в первые сутки после инъекции Визудина. Для предотвращения светочувствительных реакций необходимо следовать инструкциям по защите от светового воздействия. Развитие болей в спине у больных не было связано с гемолизом или аллергическими реакциями. Как правило, боль исчезала вскоре после окончания введения препарата. Возникающие при введении препарата боли в спине и груди имели различную иррадиацию (например в плечевой пояс, тазовую область).
Со стороны органа зрения. Часто - такие нарушения зрения, как затуманивание, расплывчатость или вспышки света, снижение остроты зрения, дефекты поля зрения (серые или темные ореолы, скотомы и черные точки).
Выраженное снижение остроты зрения (на 4 строчки и более по ETDRS оптотипу) в течение 7 дней после применения Визудина отмечалось у 2,1% больных. В большинстве случаев такое снижение остроты зрения выявлялось у больных с ВМД и скрытой хориоидальной неоваскуляризацией. В дальнейшем у некоторых пациентов наблюдалось частичное восстановление остроты зрения. Редко - отслойка сетчатки (нерегматогенного генеза), субретинальные и ретинальные кровоизлияния, гемофтальм. С частотой менее 0,1% наблюдалось нарушение кровотока в сосудах сетчатки и хориоидеи, отслойка пигментного эпителия сетчатки.
Реакции в месте введения. Часто - боль, отек мягких тканей, воспаление, подкожная гематома; редко - геморрагии, обесцвечивание кожи в зоне инъекции, гиперчувствительность. С частотой менее 0,1% отмечалось образование волдырей на коже в месте введения препарата.
Со стороны организма в целом. Часто - боль в спине во время введения препарата, светочувствительные реакции, астения. Редко - гипертензия, гипестезия, тошнота и лихорадка. С частотой менее 0,1% наблюдались вазовагальные реакции, реакции гиперчувствительности (в редких случаях тяжелого течения), включающие головную боль, чувство дискомфорта, обмороки, повышенное потоотделение, головокружение, сыпь, крапивницу, зуд, одышку, гиперемию, изменения АД и ЧСС. Светочувствительные реакции отмечались у 2,2% пациентов и выражались в виде солнечного ожога, как правило, возникающего в первые сутки после инъекции Визудина. Для предотвращения светочувствительных реакций необходимо следовать инструкциям по защите от светового воздействия. Развитие болей в спине у больных не было связано с гемолизом или аллергическими реакциями. Как правило, боль исчезала вскоре после окончания введения препарата. Возникающие при введении препарата боли в спине и груди имели различную иррадиацию (например в плечевой пояс, тазовую область).
|
|
Взаимодействие
Специальных исследований по лекарственному взаимодействию у человека не проводилось. Исходя из механизма действия, некоторые препараты могут повлиять на эффект от лечения Визудином.
Совместное применение других фотосенсибилизирующих препаратов (таких как тетрациклины, сульфаниламиды, фенотиазины, гипогликемические препараты-производные сульфонилмочевины, тиазидные диуретики и гризеофульвин) может увеличить риск развития светочувствительных реакций.
Можно ожидать, что соединения, связывающие активный кислород или радикалы, такие как диметилсульфоксид, бетакаротен, этанол, формиат и маннитол, снизят активность вертепорфина.
БКК, полимиксин В или радиационная терапия могут увеличить степень поглощения вертепорфина эндотелием сосудов.
Антикоагулянты, вазоконстрикторы или антиагреганты, такие как ингибиторы тромбоксана А2, способны снизить эффективность Визудина.
Визудин осаждается в солевых растворах. Не следует использовать для растворения и разбавления физиологический раствор или другие парентеральные растворы. Нельзя растворять Визудин в одном растворе с другими препаратами. Следует предохранять раствор от прямого солнечного света.
Совместное применение других фотосенсибилизирующих препаратов (таких как тетрациклины, сульфаниламиды, фенотиазины, гипогликемические препараты-производные сульфонилмочевины, тиазидные диуретики и гризеофульвин) может увеличить риск развития светочувствительных реакций.
Можно ожидать, что соединения, связывающие активный кислород или радикалы, такие как диметилсульфоксид, бетакаротен, этанол, формиат и маннитол, снизят активность вертепорфина.
БКК, полимиксин В или радиационная терапия могут увеличить степень поглощения вертепорфина эндотелием сосудов.
Антикоагулянты, вазоконстрикторы или антиагреганты, такие как ингибиторы тромбоксана А2, способны снизить эффективность Визудина.
Визудин осаждается в солевых растворах. Не следует использовать для растворения и разбавления физиологический раствор или другие парентеральные растворы. Нельзя растворять Визудин в одном растворе с другими препаратами. Следует предохранять раствор от прямого солнечного света.
Передозировка
Симптомы: случаев передозировки препарата не отмечено. Передозировка препарата и/или светового воздействия на подвергнутый лечению глаз может привести к неизбирательному нарушению кровоснабжения нормальных сосудов сетчатки с возможным острым снижением зрения. пролонгированию периода фотосенсибилизации пациента на несколько дней. При дозировке около 20 мг/м2, в 3 раза превышающей нормальную дозу, период фотосенсибилизации увеличивается до 6-7 дней.
Лечение. В таких случаях пациенту следует продлить время защиты кожи и глаз от воздействия прямого солнечного света или яркого освещения внутри помещений в соответствии с количеством передозированного препарата.
Лечение. В таких случаях пациенту следует продлить время защиты кожи и глаз от воздействия прямого солнечного света или яркого освещения внутри помещений в соответствии с количеством передозированного препарата.
Особые указания
Пациенты, принимающие Визудин, остаются фотосенсибилизированными в течение 48 ч после инъекции. В первые 48 ч после терапии пациенты должны избегать воздействия на открытые участки кожи и глаза солнечного и яркого искусственного света. Если пациентам необходимо выйти на улицу в дневное время в первые 48 ч после терапии, им следует защитить кожу светонепроницаемой одеждой, а глаза - темными очками. Обычный свет внутри помещений не опасен. Пациенты не должны находиться в темноте, им следует оставаться в освещенном помещении, поскольку свет внутри помещения способствует выведению препарата через кожу. УФ-защитные кремы не эффективны при защите от проявления светочувствительных реакций.
С осторожностью следует назначать Визудин больным с заболеваниями печени средней или тяжелой степени, поскольку опыт лечения таких пациентов пока отсутствует.
Больным с выраженным снижением остроты зрения (до 40% и более) в течение первой недели после лечения повторный курс можно назначать лишь тогда, когда зрение восстановится до уровня, предшествовавшего лечению. Лечащий врач обязан внимательно оценить соотношение потенциальной пользы и риска от терапии.
У пациентов с преимущественно скрытой дегенерацией желтого пятна (>50% зоны поражения) при промежуточном анализе на III клинической фазе эффект от лечения выявлен не был.
В/в инъекцию следует осуществлять осторожно. Экстравазат Визудина может вызвать сильную боль, воспаление, отек мягких тканей или обесцвечивание кожи в зоне инъекции. Для устранения боли могут потребоваться анальгетики. Если образуется подкожная гематома, инъекцию необходимо немедленно прекратить и наложить на область инъекции холодный компресс. Пораженную зону следует тщательно защищать от прямого яркого света до тех пор, пока не пройдет отек мягких тканей и обесцвечивание кожи.
Следует соблюдать осторожность при рассмотрении вопроса о терапии Визудином в случаях, когда требуется проведение наркоза (клинические данные по введению Визудина пациентам, находящимся под общей анестезией отсутствуют).
Раствор препарата нельзя применять при ярком свете.
Не допускается использование солевых растворов в качестве растворителя.
Если раствор препарата пролился, его нужно собрать и место вытереть влажной тряпкой.
Следует избегать контакта препарата со слизистой оболочкой глаз и кожей.
После растворения и разбавления раствор следует хранить в защищенном от света месте при температуре до 25 °C и использовать не позднее чем через 4.
Влияние на способность к вождению автотранспорта и управлению механизмами. После терапии Визудином у пациента возможно временное нарушение зрения (ослабление зрения и дефекты поля зрения), что может помешать его способности управлять автомобилем или работать с механизмами. Поэтому следует избегать вождения автомобиля или работы с механизмами при развитии таких симптомов.
С осторожностью следует назначать Визудин больным с заболеваниями печени средней или тяжелой степени, поскольку опыт лечения таких пациентов пока отсутствует.
Больным с выраженным снижением остроты зрения (до 40% и более) в течение первой недели после лечения повторный курс можно назначать лишь тогда, когда зрение восстановится до уровня, предшествовавшего лечению. Лечащий врач обязан внимательно оценить соотношение потенциальной пользы и риска от терапии.
У пациентов с преимущественно скрытой дегенерацией желтого пятна (>50% зоны поражения) при промежуточном анализе на III клинической фазе эффект от лечения выявлен не был.
В/в инъекцию следует осуществлять осторожно. Экстравазат Визудина может вызвать сильную боль, воспаление, отек мягких тканей или обесцвечивание кожи в зоне инъекции. Для устранения боли могут потребоваться анальгетики. Если образуется подкожная гематома, инъекцию необходимо немедленно прекратить и наложить на область инъекции холодный компресс. Пораженную зону следует тщательно защищать от прямого яркого света до тех пор, пока не пройдет отек мягких тканей и обесцвечивание кожи.
Следует соблюдать осторожность при рассмотрении вопроса о терапии Визудином в случаях, когда требуется проведение наркоза (клинические данные по введению Визудина пациентам, находящимся под общей анестезией отсутствуют).
Раствор препарата нельзя применять при ярком свете.
Не допускается использование солевых растворов в качестве растворителя.
Если раствор препарата пролился, его нужно собрать и место вытереть влажной тряпкой.
Следует избегать контакта препарата со слизистой оболочкой глаз и кожей.
После растворения и разбавления раствор следует хранить в защищенном от света месте при температуре до 25 °C и использовать не позднее чем через 4.
Влияние на способность к вождению автотранспорта и управлению механизмами. После терапии Визудином у пациента возможно временное нарушение зрения (ослабление зрения и дефекты поля зрения), что может помешать его способности управлять автомобилем или работать с механизмами. Поэтому следует избегать вождения автомобиля или работы с механизмами при развитии таких симптомов.
Дополнительные факты
Описание было автоматически дополнено из инструкции препарата «Визудин», поскольку у самого действующего вещества нет подробного описания.
Входит в состав
- — Визудин (2 фирмы)