Другие названия и синонимы
Tetrofosmin.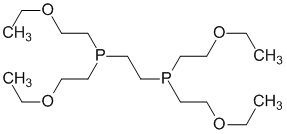
Фармакологическая группа
|
|
Латинское название
Tetrofosminum ( Tetrofosmini).
Химическое название
6,9-бис(2-Этоксиэтил)-3,12-диокса-6,9-дифосфатетрадекан.
Используется в лечении
Код CAS
127502-06-1.
ATX код
V09GA02 Технеция (99mTc) тетрофосмин.
Фармакокинетика
При внутривенном введении 99mTc-тетрофосмин быстро выводится из крови: менее 5%.
Введенной активности остается в крови к 10 минуте после введения.
Препарат отличается высокой скоростью выведения из тканей легких и печени. Его активность в данных органах уменьшается после физической нагрузки, а в скелетных мышцах увеличивается. Около 66% введенной активности экскретируется в течение 48 часов после инъекции, примерно 40% выводится с мочой, 26% с калом.
Накопление в миокарде:
Накопление в миокарде очень быстро достигает максимума 1,2% от введенной активности, что позволяет получить планарное или ОФЭКТ (однофотонная эмиссионная компьютерная томография) изображение в интервале от 15 мин до 4 часов после введения препарата.
Введенной активности остается в крови к 10 минуте после введения.
Препарат отличается высокой скоростью выведения из тканей легких и печени. Его активность в данных органах уменьшается после физической нагрузки, а в скелетных мышцах увеличивается. Около 66% введенной активности экскретируется в течение 48 часов после инъекции, примерно 40% выводится с мочой, 26% с калом.
Накопление в миокарде:
Накопление в миокарде очень быстро достигает максимума 1,2% от введенной активности, что позволяет получить планарное или ОФЭКТ (однофотонная эмиссионная компьютерная томография) изображение в интервале от 15 мин до 4 часов после введения препарата.
Фармакодинамика
Фармакологических эффектов после внутривенного введения приготовленного препарата Миовью.
В рекомендованной дозе не отмечается. Исследования действия препарата на животных показали, что накопление 99mTc‑тетрофосмина миокардом линейно связано с коронарным кровотоком, что подтверждает эффективность комплекса как диагностического препарата для оценки перфузии миокарда.
В рекомендованной дозе не отмечается. Исследования действия препарата на животных показали, что накопление 99mTc‑тетрофосмина миокардом линейно связано с коронарным кровотоком, что подтверждает эффективность комплекса как диагностического препарата для оценки перфузии миокарда.
Показания к применению
Препарат Миовью.
Используется для оценки перфузии миокарда с целью диагностики и локализации ишемии и/или инфаркта миокарда.
Используется для оценки перфузии миокарда с целью диагностики и локализации ишемии и/или инфаркта миокарда.
Противопоказания
Повышенная чувствительность к активному компоненту препарата или любому вспомогательному веществу.
Беременность ( см раздел «Применение во время беременности и в период грудного вскармливания»).
Миовью.
Не рекомендуется для применения у детей и подростков (отсутствуют данные клинического применения).
Беременность ( см раздел «Применение во время беременности и в период грудного вскармливания»).
Миовью.
Не рекомендуется для применения у детей и подростков (отсутствуют данные клинического применения).
При беременности и кормлении грудью
Препарат Миовью.
Противопоказан для применения у беременных женщин. Исследования репродуктивной токсичности на животных не проводились. При введении радиофармацевтических препаратов беременным женщинам дозу радиации получает и плод. Введение 250 МБк 99mTc‑тетрофосмина при физической нагрузке, следующее за введением 750 МБк в состоянии покоя, соответствует поглощенной маткой дозе, равной 8,1 мГр. Радиационная доза выше 0,5 мГр (эквивалент годового радиационного фона облучения) рассматривается потенциально опасной для плода.
При необходимости введения радиофармацевтических препаратов женщине детородного возраста, необходимо получить достоверную информацию об отсутствии у нее беременности. Любая женщина, у которой имеется задержка менструации, должна считаться беременной, пока не доказано обратное. Следует рассмотреть возможность применения альтернативных методов, в которых не используется ионизирующее излучение.
Данные по экскреции 99mTc‑тетрофосмина в грудное молоко отсутствуют, поэтому в случае необходимости введения радиофармацевтического препарата пациентке в период грудного вскармливания, следует рекомендовать ей прекратить грудное вскармливание не менее, чем на 12 часов после введения препарата.
Противопоказан для применения у беременных женщин. Исследования репродуктивной токсичности на животных не проводились. При введении радиофармацевтических препаратов беременным женщинам дозу радиации получает и плод. Введение 250 МБк 99mTc‑тетрофосмина при физической нагрузке, следующее за введением 750 МБк в состоянии покоя, соответствует поглощенной маткой дозе, равной 8,1 мГр. Радиационная доза выше 0,5 мГр (эквивалент годового радиационного фона облучения) рассматривается потенциально опасной для плода.
При необходимости введения радиофармацевтических препаратов женщине детородного возраста, необходимо получить достоверную информацию об отсутствии у нее беременности. Любая женщина, у которой имеется задержка менструации, должна считаться беременной, пока не доказано обратное. Следует рассмотреть возможность применения альтернативных методов, в которых не используется ионизирующее излучение.
Данные по экскреции 99mTc‑тетрофосмина в грудное молоко отсутствуют, поэтому в случае необходимости введения радиофармацевтического препарата пациентке в период грудного вскармливания, следует рекомендовать ей прекратить грудное вскармливание не менее, чем на 12 часов после введения препарата.
Побочные эффекты
Нежелательные реакции, связанные с применением 99mTc‑тетрофосмина, очень редки (менее 1 случая на 10000).
После введения возможны следующие нежелательные реакции:
Со стороны иммунной системы:
Отек лица, реакции повышенной чувствительности, аллергические реакции, анафилактические реакции.
Со стороны нервной системы:
Головная боль, головокружение, металлический привкус, нарушение обоняния и вкуса.
Со стороны сосудистой системы:
Гиперемия, гипотензия.
Со стороны респираторной системы и органов средостенья. Диспноэ.
Со стороны желудочно-кишечного тракта. Тошнота, рвота, чувство жжения во рту.
Кожные покровы. Крапивница, зуд, эритематозная сыпь.
Организм в целом:
Ощущение тепла.
Данные лабораторных обследований. Увеличение количества лейкоцитов.
Некоторые реакции могут носить отсроченный характер, вплоть до нескольких часов после введения 99mTc‑тетрофосмина.
Есть сообщения о единичных случаях серьезных реакций, включая анафилактические реакции (менее 1 на 100000) и тяжелые аллергические реакции (также единичное сообщение).
Количество вводимого вещества очень мало, основную опасность представляет ионизирующее излучение. Ионизирующее излучение способно вызвать рак и генетические нарушения.
Большинство исследований в ядерной медицине проводятся с использованием низких доз радиации, меньше 20 мЗв, поэтому ожидаемая частота побочных реакций очень низкая.
Эффективная доза составляет 8,5 мЗв, в то время как максимальная рекомендованная активность 1200 МБк.
После введения возможны следующие нежелательные реакции:
Со стороны иммунной системы:
Отек лица, реакции повышенной чувствительности, аллергические реакции, анафилактические реакции.
Со стороны нервной системы:
Головная боль, головокружение, металлический привкус, нарушение обоняния и вкуса.
Со стороны сосудистой системы:
Гиперемия, гипотензия.
Со стороны респираторной системы и органов средостенья. Диспноэ.
Со стороны желудочно-кишечного тракта. Тошнота, рвота, чувство жжения во рту.
Кожные покровы. Крапивница, зуд, эритематозная сыпь.
Организм в целом:
Ощущение тепла.
Данные лабораторных обследований. Увеличение количества лейкоцитов.
Некоторые реакции могут носить отсроченный характер, вплоть до нескольких часов после введения 99mTc‑тетрофосмина.
Есть сообщения о единичных случаях серьезных реакций, включая анафилактические реакции (менее 1 на 100000) и тяжелые аллергические реакции (также единичное сообщение).
Количество вводимого вещества очень мало, основную опасность представляет ионизирующее излучение. Ионизирующее излучение способно вызвать рак и генетические нарушения.
Большинство исследований в ядерной медицине проводятся с использованием низких доз радиации, меньше 20 мЗв, поэтому ожидаемая частота побочных реакций очень низкая.
Эффективная доза составляет 8,5 мЗв, в то время как максимальная рекомендованная активность 1200 МБк.
Взаимодействие
Исследования взаимодействия с другими лекарственными средствами не проводились. Тем не менее, сообщений о взаимодействии Миовью с другими препаратами, которые принимали пациенты, не поступало. Лекарства, влияющие на функцию или кровоснабжение миокарда, такие как бета-блокаторы, антагонисты кальция или нитраты, могут привести к ложноотрицательным результатам. В этом случае результаты исследования должны рассматриваться с учетом текущей терапии.
Не рекомендуется смешивать препарат Миовью с другими лекарственными средствами, за исключением тех, которые перечислены в разделе «Процедура приготовления раствора 99mTc‑тетрофосмина».
Не рекомендуется смешивать препарат Миовью с другими лекарственными средствами, за исключением тех, которые перечислены в разделе «Процедура приготовления раствора 99mTc‑тетрофосмина».
Передозировка
В случае передозировки необходимо стимулировать частое мочеиспускание и дефекацию для уменьшения радиационной нагрузки на пациента.
Особые указания
Содержимое флакона предназначено только для приготовления раствора 99mTc‑тетрофосмина и не должно вводиться пациенту без предварительной подготовки.
Если целостность флакона нарушена, его не следует использовать. Адекватное экранирование является обязательным.
Флакон с лиофилизатом не является радиоактивным. Однако после добавления 99mTc‑пертехнетата, последующие этапы приготовления должны проводиться в условиях адекватной защиты от радиации. Флакон с лиофилизатом содержит 0,65 мг натрия / флакон, что следует принять во внимание у пациентов, которые находятся на гипонатриевой диете.
Применение препарата может вызывать реакции гиперчувствительности, включая анафилактические и анафилактоидные реакции. На случай их возникновения необходимо иметь в наличии необходимые препараты и оборудование для оказания немедленной медицинской помощи.
При сцинтиграфии миокарда на пике нагрузки должны учитываться противопоказания, связанные с индукцией стресса.
Для каждого пациента воздействие ионизирующей радиации должно быть оправдано с учетом ожидаемого положительного эффекта. Радиоактивность введенного препарата должна быть таковой, чтобы конечное излучение было настолько низким, насколько это возможно, для получения требуемого диагностического результата.
Препарат должен применяться квалифицированным персоналом в соответствующих клинических условиях асептики. Получение, хранение, использование, перемещение и уничтожение должны осуществляться в соответствии с национальными правилами по обеспечению радиационной безопасности.
Введение радиофармацевтических препаратов создает риски внешнего радиационного загрязнения мочой, рвотными массами Должны соблюдаться обычные меры предосторожности при работе с радиоактивными материалами.
После использования все материалы, связанные с приготовлением и введением радиофармацевтических препаратов, включая неиспользованные остатки продукта и контейнер, должны быть дезактивированы или утилизированы в соответствии с действующим законодательством.
Перед применением препарата, для подтверждения качества, необходимо провести определение радиохимической чистоты препарата по методике, описанной ниже:
Определение радиохимической чистоты.
Для подтверждения качества препарата перед применением необходимо провести определение его радиохимической чистоты по следующей методике:
Оборудование и реагенты:
1. Полоски GMCP-SA*.
Для тонкослойной хроматографии (2см х 20см). Не нагревать.
2. Колонки для восходящей хроматографии с крышкой.
3. Смесь ацетона и дихлорметана в объемном отношении 65:35% (свежеприготовленная).
4. 1 мл шприц с иглами 22-25G.
5. Подходящее счетное оборудование.
* микростекловолоконная хроматографическая бумага, обработанная кремниевой кислотой.
Для определения радиохимической чистоты раствора препарата необходимо использовать хроматографическую систему смеси ацетона и дихлорметана в объемном отношении 65:35%. Смесь помещают в хроматографическую камеру (толщина слоя 1 см) и закрывают для установления равновесия. На полоске для хроматографии GMCP-SA.
(2 см х 20 см) делают отметки карандашом на расстоянии 3 см от нижнего края (линия старта) и чернильным маркером на расстоянии 15 см от линии карандаша (линия финиша). Отметка карандашом показывает место нанесения образца, а размывание границ чернильной линии покажет положение фронта растворителя, когда восходящее элюирование должно быть закончено. На уровне 3,75 см и 12 см выше линии старта (Rfs 0,25 и 0,8 соответственно) сделать отсечки. Используя 1 мл шприц с иглой, отбирают 10 мкл приготовленного образца и переносят на полоску. Образец не должен контактировать с отметкой карандашом. Не давая пятну высохнуть, немедленно помещают полоску в хроматографическую камеру и закрывают крышкой. Необходимо убедиться, что полоска не прилипает к стенке камеры.
Примечание:
10 мкл образца образуют пятно диаметром примерно 10 Другие объемы образца показывают недостоверные значения радиохимической чистоты.
При достижении растворителем чернильной отметки, полоску извлекают из камеры и высушивают.
Полоску разрезают на 3 части по отмеченным ранее насечкам и измеряют активность каждой из них на счетном оборудовании. Необходимо стараться использовать одинаковые геометрические параметры для каждого отрезка и минимизировать потерю времени.
Радиохимическую чистоту вычисляют по формуле:
Свободный 99mTc‑пертехнетат стремится к верхней части отрезка полоски, 99mTc‑тетрофосмин - к центру отрезка. Восстановленный гидролизованный 99mTc и другие гидрофильные примеси остаются в начале колонки.
Не следует использовать препарат, если радиохимическая чистота менее 90%.
Влияние на способность к вождению транспортных средств и работу с машинами и механизмами.
Не изучено влияние препарата, оказываемого препаратом при применении его в соответствии с инструкцией по медицинскому применению, на способность управлять транспортными средствами, а также машинами и механизмами.
Если целостность флакона нарушена, его не следует использовать. Адекватное экранирование является обязательным.
Флакон с лиофилизатом не является радиоактивным. Однако после добавления 99mTc‑пертехнетата, последующие этапы приготовления должны проводиться в условиях адекватной защиты от радиации. Флакон с лиофилизатом содержит 0,65 мг натрия / флакон, что следует принять во внимание у пациентов, которые находятся на гипонатриевой диете.
Применение препарата может вызывать реакции гиперчувствительности, включая анафилактические и анафилактоидные реакции. На случай их возникновения необходимо иметь в наличии необходимые препараты и оборудование для оказания немедленной медицинской помощи.
При сцинтиграфии миокарда на пике нагрузки должны учитываться противопоказания, связанные с индукцией стресса.
Для каждого пациента воздействие ионизирующей радиации должно быть оправдано с учетом ожидаемого положительного эффекта. Радиоактивность введенного препарата должна быть таковой, чтобы конечное излучение было настолько низким, насколько это возможно, для получения требуемого диагностического результата.
Препарат должен применяться квалифицированным персоналом в соответствующих клинических условиях асептики. Получение, хранение, использование, перемещение и уничтожение должны осуществляться в соответствии с национальными правилами по обеспечению радиационной безопасности.
Введение радиофармацевтических препаратов создает риски внешнего радиационного загрязнения мочой, рвотными массами Должны соблюдаться обычные меры предосторожности при работе с радиоактивными материалами.
После использования все материалы, связанные с приготовлением и введением радиофармацевтических препаратов, включая неиспользованные остатки продукта и контейнер, должны быть дезактивированы или утилизированы в соответствии с действующим законодательством.
Перед применением препарата, для подтверждения качества, необходимо провести определение радиохимической чистоты препарата по методике, описанной ниже:
Определение радиохимической чистоты.
Для подтверждения качества препарата перед применением необходимо провести определение его радиохимической чистоты по следующей методике:
Оборудование и реагенты:
1. Полоски GMCP-SA*.
Для тонкослойной хроматографии (2см х 20см). Не нагревать.
2. Колонки для восходящей хроматографии с крышкой.
3. Смесь ацетона и дихлорметана в объемном отношении 65:35% (свежеприготовленная).
4. 1 мл шприц с иглами 22-25G.
5. Подходящее счетное оборудование.
* микростекловолоконная хроматографическая бумага, обработанная кремниевой кислотой.
Для определения радиохимической чистоты раствора препарата необходимо использовать хроматографическую систему смеси ацетона и дихлорметана в объемном отношении 65:35%. Смесь помещают в хроматографическую камеру (толщина слоя 1 см) и закрывают для установления равновесия. На полоске для хроматографии GMCP-SA.
(2 см х 20 см) делают отметки карандашом на расстоянии 3 см от нижнего края (линия старта) и чернильным маркером на расстоянии 15 см от линии карандаша (линия финиша). Отметка карандашом показывает место нанесения образца, а размывание границ чернильной линии покажет положение фронта растворителя, когда восходящее элюирование должно быть закончено. На уровне 3,75 см и 12 см выше линии старта (Rfs 0,25 и 0,8 соответственно) сделать отсечки. Используя 1 мл шприц с иглой, отбирают 10 мкл приготовленного образца и переносят на полоску. Образец не должен контактировать с отметкой карандашом. Не давая пятну высохнуть, немедленно помещают полоску в хроматографическую камеру и закрывают крышкой. Необходимо убедиться, что полоска не прилипает к стенке камеры.
Примечание:
10 мкл образца образуют пятно диаметром примерно 10 Другие объемы образца показывают недостоверные значения радиохимической чистоты.
При достижении растворителем чернильной отметки, полоску извлекают из камеры и высушивают.
Полоску разрезают на 3 части по отмеченным ранее насечкам и измеряют активность каждой из них на счетном оборудовании. Необходимо стараться использовать одинаковые геометрические параметры для каждого отрезка и минимизировать потерю времени.
Радиохимическую чистоту вычисляют по формуле:
Свободный 99mTc‑пертехнетат стремится к верхней части отрезка полоски, 99mTc‑тетрофосмин - к центру отрезка. Восстановленный гидролизованный 99mTc и другие гидрофильные примеси остаются в начале колонки.
Не следует использовать препарат, если радиохимическая чистота менее 90%.
Влияние на способность к вождению транспортных средств и работу с машинами и механизмами.
Не изучено влияние препарата, оказываемого препаратом при применении его в соответствии с инструкцией по медицинскому применению, на способность управлять транспортными средствами, а также машинами и механизмами.
|
|
Дополнительные факты
Описание было автоматически дополнено из инструкции препарата «Миовью», поскольку у самого действующего вещества нет подробного описания.
Год актуализации информации
Особые отметки:
Входит в состав
- — Миовью (2 фирмы)