МКБ-10 коды
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: D18.0.
Год утверждения (частота пересмотра): 2023.
Возрастная категория: Дети.
Пересмотр не позднее: 2025.
ID: 769.
Разработчик клинической рекомендации.
• Национальное общество детских гематологов, онкологов.
• Общероссийская общественная организация Российская ассоциация детских хирургов .
• Всероссийская общественная организация Ассоциация детских кардиологов России .
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2023.
Возрастная категория: Дети.
Пересмотр не позднее: 2025.
ID: 769.
Разработчик клинической рекомендации.
• Национальное общество детских гематологов, онкологов.
• Общероссийская общественная организация Российская ассоциация детских хирургов .
• Всероссийская общественная организация Ассоциация детских кардиологов России .
Одобрено Научно-практическим Советом Минздрава РФ.
|
|
 Список сокращений
Список сокращений
АФП. α-фетопротеин.
ВГ - врожденная гемангиома.
ИГ - инфантильная гемангиома.
КГЭ. Капошиформная гемангиоэндотелиома.
КТ - компьютерная томография.
МРТ. Магниторезонансная томография.
РДС. Респираторный дистресс синдром.
УЗИ. Ультразвуковое исследование.
ЦДК. Цветное дуплексное картирование.
ЭКГ. Электрокардиография.
ЭхоКГ. Эхокардиография.
GLUT1 (Glucose transporter 1). Белок, транспортирующий глюкозу.
FGFa/FGFb (Fibroblastes Growth Factors). Фактор роста фибробластов a/b.
HIF-1 (hypoxia-inducible factor). Фактор, индуцируемый гипоксией.
IH-MAG (Infantile Hemangioma. Minimal or Arrested Growth Hemangioma) -абортивными ИГ, или ретикулярными ИГ.
ISSVA (International Society for the Study of Vascular Anomalies). Интернациональное сообщество по изучению сосудистых опухолей.
LUMBAR (Lower вody hemangioma, Urogenital anomalies, Ulceration, Myelopathy, вony deformities, Anorectal malformations, Arterial anomalies, and Renal anomalies).
ММPs (Matrix Metalloproteinases). Матриксные металлопротеиназы.
NICH (Non Involutive сongenital Heamangioma). Неинволютирующая врожденная гемангиома.
PCNA (proliferating cell nuclear antigen). Ядерный антиген пролиферирующих клеток.
PHACE (Posterior fosse abnormalities/Hemangioma/Arteries anomalies/Coarctation aortic/Eyes troubles/Sternal malformations).
PICH (Partly Involutive сongenital Hemangioma). Частично инволютирующая врожденная гемангиома.
PELVIS (Perineal angioma, External genital malformation, Lipomyelomeningocel, Vesicorenal abnormalities, Imperforate anus, Skin tag).
PP (propranolol). Пропранолол в лекарственной форме «раствор для приема внутрь».
RICH (Rapidly Involutive сongenital Hemangioma). Быстроинволютирующая врожденная гемангиома.
SACRAL (Spinal dysraphism, Anogenital, сutaneous, Renal and urologic malformation, Angioma Lombosacral).
TGFα/β (transforming growth factor α/β). Трансформирующий фактор роста α/β.
TIMP (Tissue inhibitor of metalloproteinase). Тканевой ингибитор металлопротеиназ.
TNF (tumor necrosis factor). Фактор некроза опухоли.
TSH-like factor (Thyroid-stimulating hormone-like factor). TTГ-подобный фактор-тиротропин.
TPA (tissue plasminogen activator). Тканевой активатор плазминогена.
UPA (urokinase plasminogen activator). Урокиназный активатор плазминогена.
VEGF (vascular endothelial growth factor). Эндотелиальный сосудистый фактор роста.
VEGFR1/R2 (Vascular Endothelial Growth Facteur Receptor). Рецептор 1/2 эндотелиального сосудистого фактора роста.
WT1 (Wilms tumor gene1). Опухолевый белок Вильмса.
ВГ - врожденная гемангиома.
ИГ - инфантильная гемангиома.
КГЭ. Капошиформная гемангиоэндотелиома.
КТ - компьютерная томография.
МРТ. Магниторезонансная томография.
РДС. Респираторный дистресс синдром.
УЗИ. Ультразвуковое исследование.
ЦДК. Цветное дуплексное картирование.
ЭКГ. Электрокардиография.
ЭхоКГ. Эхокардиография.
GLUT1 (Glucose transporter 1). Белок, транспортирующий глюкозу.
FGFa/FGFb (Fibroblastes Growth Factors). Фактор роста фибробластов a/b.
HIF-1 (hypoxia-inducible factor). Фактор, индуцируемый гипоксией.
IH-MAG (Infantile Hemangioma. Minimal or Arrested Growth Hemangioma) -абортивными ИГ, или ретикулярными ИГ.
ISSVA (International Society for the Study of Vascular Anomalies). Интернациональное сообщество по изучению сосудистых опухолей.
LUMBAR (Lower вody hemangioma, Urogenital anomalies, Ulceration, Myelopathy, вony deformities, Anorectal malformations, Arterial anomalies, and Renal anomalies).
ММPs (Matrix Metalloproteinases). Матриксные металлопротеиназы.
NICH (Non Involutive сongenital Heamangioma). Неинволютирующая врожденная гемангиома.
PCNA (proliferating cell nuclear antigen). Ядерный антиген пролиферирующих клеток.
PHACE (Posterior fosse abnormalities/Hemangioma/Arteries anomalies/Coarctation aortic/Eyes troubles/Sternal malformations).
PICH (Partly Involutive сongenital Hemangioma). Частично инволютирующая врожденная гемангиома.
PELVIS (Perineal angioma, External genital malformation, Lipomyelomeningocel, Vesicorenal abnormalities, Imperforate anus, Skin tag).
PP (propranolol). Пропранолол в лекарственной форме «раствор для приема внутрь».
RICH (Rapidly Involutive сongenital Hemangioma). Быстроинволютирующая врожденная гемангиома.
SACRAL (Spinal dysraphism, Anogenital, сutaneous, Renal and urologic malformation, Angioma Lombosacral).
TGFα/β (transforming growth factor α/β). Трансформирующий фактор роста α/β.
TIMP (Tissue inhibitor of metalloproteinase). Тканевой ингибитор металлопротеиназ.
TNF (tumor necrosis factor). Фактор некроза опухоли.
TSH-like factor (Thyroid-stimulating hormone-like factor). TTГ-подобный фактор-тиротропин.
TPA (tissue plasminogen activator). Тканевой активатор плазминогена.
UPA (urokinase plasminogen activator). Урокиназный активатор плазминогена.
VEGF (vascular endothelial growth factor). Эндотелиальный сосудистый фактор роста.
VEGFR1/R2 (Vascular Endothelial Growth Facteur Receptor). Рецептор 1/2 эндотелиального сосудистого фактора роста.
WT1 (Wilms tumor gene1). Опухолевый белок Вильмса.
Термины и определения
Новые и узконаправленные профессиональные термины в настоящих клинических рекомендациях не используются.
Описание
Инфантильная гемангиома (ИГ) - это доброкачественное сосудистое новообразование, в основе которой лежит аномальная пролиферация эндотелиальных клеток с нарушенной архитектоникой кровеносных сосудов [1].
Причины
Этиология.
Этиология остается до конца неизвестной. Существуют несколько обсуждаемых гипотез (плацентарная, мутация гена, задействованного в пролиферации эндотелиальных клеток), но совершенно очевидно, что гипоксия как антенатальная, так и перинатальная, является принципиальной гипотезой возникновения ИГ [2]. На это указывают и большая часть предрасполагающих факторов [3-5]:
- антенатальная гипоксия;
- многоплодная беременность;
- осложненная беременность (преэклампсия, патология плаценты/отслойка плаценты);
- вес при рождении менее 1500 грамм/недоношенность (частота встречаемости ИГ - 25%) [6];
- амниоцентез/хориоцентез;
- женский пол;
- европеоидная раса;
- пожилой возраст матери [6].
Патофизиология.
Считается, что ИГ имеет эмбриональное происхождение, образуясь из мезодермы. В норме формирование сосудистой системы в коже заканчивается на последних неделях гестации. Если это созревание не завершено к рождению, некоторые сосуды остаются под действием стимулирующих факторов, что приводит к их чрезмерной пролиферации и формированию сосудистой образования.
В основе формирования ИГ лежит нарушение ангиогенеза, обусловленное дисбалансом между ангиогенными и антиангионными факторами.
Ангиогенез представляет сложно регулируемый процесс, который заключается в ремоделировании (пучкование, объединение, регресс незрелых сосудов) первичного сосудистого сплетения в новые капилляры из предшествующих как в физиологических условиях, так и при патологическом процессе под действием множества стимулирующих и ингибирующих факторов [7].
Три последовательных барьера стоят на пути формирования новых сосудов: базальная мембрана, перициты, соединительнотканные клетки, которые окружают сосуд, и межклеточный матрикс. Для формирования нового сосуда необходимо разрушение этих барьеров путем активации ферментов системы фибринолиза и стимуляции эндотелиальных клеток циркулирующими или локально активными факторами: uPA (urokinase plasminogen activator) и tPA (tissue plasminogen activator). Эти ферменты активируют в свою очередь матриксные металлопротеиназы (ММРs), разрушающие межклеточный матрикс. ММРs способствуют «отслоению» перицитов, лизированию базальной мембраны и освобождению в экстрацеллюлярном матриксе пространства для экспансии нового сосуда. Активированные эндотелиальные клетки мигрируют из «материнского» сосуда и пролиферируют в сформированной нише экстрацеллюлярного матрикса (Рисунок 1).
Рисунок 1. Схематическое изображение различных этапов ангиогенеза.
1,2,3: активация эндотелиальных клеток под действием стимулирующих факторов, разрушение базальной мембраны с последующей протрузией эндотелиальных клеток.
4: миграция эндотелиальных клеток, пролиферация и формирование капиллярной «почки».
5: созревание эндотелиальных клеток с формированием просвета в капиллярной «почке», восстановление базальной мембраны. Образование сосудистой сетки.
В качестве главных факторов, стимулирующих ангиогенез, можно выделить два:
VEGF (Vascular Endothelial Growth Factоr / эндотелиальный сосудистый фактор роста) - мощный специфический фактор роста эндотелиальных клеток, обладающий митогенной и ангиогенной активностью, способный стимулировать образование капилляров. Он фиксируется на специфических рецепторах (VEGFR-1, VEGFR-2), расположенных на эндотелиальных клетках и их предщественниках, приводя к пролиферации и фенотипической трансформации эндотелиальных клеток, выработке протеолитических ферментов, что в совокупности способствует формированию новых сосудов [8]. В условиях гипоксии повышается концентрация и экспрессия VEGF за счет повышения транскрипции фактора HIF-1 (hypoxia-inducible factor). Активная форма последнего индуцирует транскрипцию гена VEGF. Кроме того, в условиях гипоксии секреция VEGF увеличивается под действием интерлейкинов и TGF (Trasforming Gtowth Factor). Все эти факторы способствуют пролиферации эндотелиальных клеток, секреции протеинкиназ (металлопротеиназы), которые необходимы для реорганизации внеклеточного матрикса, координации дифференцировки клеток сосудов и ангиогенеза [8].
FGFa/FGFb (Fibroblastes Growth Factors / фактор роста фибробластов). Это аутокринный фактор роста. Он обладает высокой митогенной активностью в отношении большого спектра клеток мезодермального и нейроэктодермального происхождения, к которым, в том числе, относят эндотелиальные клетки, гладкомышечные и фибробласты. bFGF участвует во всех этапах неоангиогенеза (рисунок 2), включая эмбриональный период формирования сосудов, способствуя дифференцировке ангиобластов мезодермы в эндотелиальные клетки. Кроме того, FGF был выделен из многих тканей, включая опухолевые [8] и эндотелиальные клетки пролиферирующих сосудистых новообразований.
Рисунок 2. FGF регуляция ангиогенеза [9].
Сформированная таким образом гемангиома проходит три cтадии: пролиферации, стабилизации и инволюции, которые регулируются ангиогенными факторами и факторами, игибирующими ангиогенез (интерферон β, ангиостатин, тромбоспондин; TIMP [Tissue inhibitor of Metalloproteinas] - ингибитор неоваскулогенеза) [10]. Фаза инволюции характеризуется повышенной экспрессией маркера зрелости эндотелиальных клеток - ICAM-1 (экспрессируется в пролиферирующих эндотелиальных клетках и представляет собой молекулу межклеточной адгезии). Регресс реализуется путем апоптоза (эндотелиальные и стромальные клетки экспрессируют маркеры апоптоза - протеолитические ферменты - каспазу 3).
Этиология остается до конца неизвестной. Существуют несколько обсуждаемых гипотез (плацентарная, мутация гена, задействованного в пролиферации эндотелиальных клеток), но совершенно очевидно, что гипоксия как антенатальная, так и перинатальная, является принципиальной гипотезой возникновения ИГ [2]. На это указывают и большая часть предрасполагающих факторов [3-5]:
- антенатальная гипоксия;
- многоплодная беременность;
- осложненная беременность (преэклампсия, патология плаценты/отслойка плаценты);
- вес при рождении менее 1500 грамм/недоношенность (частота встречаемости ИГ - 25%) [6];
- амниоцентез/хориоцентез;
- женский пол;
- европеоидная раса;
- пожилой возраст матери [6].
Патофизиология.
Считается, что ИГ имеет эмбриональное происхождение, образуясь из мезодермы. В норме формирование сосудистой системы в коже заканчивается на последних неделях гестации. Если это созревание не завершено к рождению, некоторые сосуды остаются под действием стимулирующих факторов, что приводит к их чрезмерной пролиферации и формированию сосудистой образования.
В основе формирования ИГ лежит нарушение ангиогенеза, обусловленное дисбалансом между ангиогенными и антиангионными факторами.
Ангиогенез представляет сложно регулируемый процесс, который заключается в ремоделировании (пучкование, объединение, регресс незрелых сосудов) первичного сосудистого сплетения в новые капилляры из предшествующих как в физиологических условиях, так и при патологическом процессе под действием множества стимулирующих и ингибирующих факторов [7].
Три последовательных барьера стоят на пути формирования новых сосудов: базальная мембрана, перициты, соединительнотканные клетки, которые окружают сосуд, и межклеточный матрикс. Для формирования нового сосуда необходимо разрушение этих барьеров путем активации ферментов системы фибринолиза и стимуляции эндотелиальных клеток циркулирующими или локально активными факторами: uPA (urokinase plasminogen activator) и tPA (tissue plasminogen activator). Эти ферменты активируют в свою очередь матриксные металлопротеиназы (ММРs), разрушающие межклеточный матрикс. ММРs способствуют «отслоению» перицитов, лизированию базальной мембраны и освобождению в экстрацеллюлярном матриксе пространства для экспансии нового сосуда. Активированные эндотелиальные клетки мигрируют из «материнского» сосуда и пролиферируют в сформированной нише экстрацеллюлярного матрикса (Рисунок 1).
Рисунок 1. Схематическое изображение различных этапов ангиогенеза.
1,2,3: активация эндотелиальных клеток под действием стимулирующих факторов, разрушение базальной мембраны с последующей протрузией эндотелиальных клеток.
4: миграция эндотелиальных клеток, пролиферация и формирование капиллярной «почки».
5: созревание эндотелиальных клеток с формированием просвета в капиллярной «почке», восстановление базальной мембраны. Образование сосудистой сетки.
В качестве главных факторов, стимулирующих ангиогенез, можно выделить два:
VEGF (Vascular Endothelial Growth Factоr / эндотелиальный сосудистый фактор роста) - мощный специфический фактор роста эндотелиальных клеток, обладающий митогенной и ангиогенной активностью, способный стимулировать образование капилляров. Он фиксируется на специфических рецепторах (VEGFR-1, VEGFR-2), расположенных на эндотелиальных клетках и их предщественниках, приводя к пролиферации и фенотипической трансформации эндотелиальных клеток, выработке протеолитических ферментов, что в совокупности способствует формированию новых сосудов [8]. В условиях гипоксии повышается концентрация и экспрессия VEGF за счет повышения транскрипции фактора HIF-1 (hypoxia-inducible factor). Активная форма последнего индуцирует транскрипцию гена VEGF. Кроме того, в условиях гипоксии секреция VEGF увеличивается под действием интерлейкинов и TGF (Trasforming Gtowth Factor). Все эти факторы способствуют пролиферации эндотелиальных клеток, секреции протеинкиназ (металлопротеиназы), которые необходимы для реорганизации внеклеточного матрикса, координации дифференцировки клеток сосудов и ангиогенеза [8].
FGFa/FGFb (Fibroblastes Growth Factors / фактор роста фибробластов). Это аутокринный фактор роста. Он обладает высокой митогенной активностью в отношении большого спектра клеток мезодермального и нейроэктодермального происхождения, к которым, в том числе, относят эндотелиальные клетки, гладкомышечные и фибробласты. bFGF участвует во всех этапах неоангиогенеза (рисунок 2), включая эмбриональный период формирования сосудов, способствуя дифференцировке ангиобластов мезодермы в эндотелиальные клетки. Кроме того, FGF был выделен из многих тканей, включая опухолевые [8] и эндотелиальные клетки пролиферирующих сосудистых новообразований.
Рисунок 2. FGF регуляция ангиогенеза [9].
Сформированная таким образом гемангиома проходит три cтадии: пролиферации, стабилизации и инволюции, которые регулируются ангиогенными факторами и факторами, игибирующими ангиогенез (интерферон β, ангиостатин, тромбоспондин; TIMP [Tissue inhibitor of Metalloproteinas] - ингибитор неоваскулогенеза) [10]. Фаза инволюции характеризуется повышенной экспрессией маркера зрелости эндотелиальных клеток - ICAM-1 (экспрессируется в пролиферирующих эндотелиальных клетках и представляет собой молекулу межклеточной адгезии). Регресс реализуется путем апоптоза (эндотелиальные и стромальные клетки экспрессируют маркеры апоптоза - протеолитические ферменты - каспазу 3).
|
|
Эпидемиология
Самой частой из всех форм сосудистой патологии является ИГ.
Частота встречаемости составляет 5-10% [11] у детей 1-го года жизни и 30% у недоношенных детей с весом менее 1800 грамм. ИГ чаще встречаются у девочек европейской расы (2,5-4:1) [12]. У недоношенных детей соотношение девочки : мальчики меньше - 1,4:1, но это соотношение значимо увеличивается при осложненных и сегментарных формах ИГ и составляет 9:1 [13].
Частота встречаемости составляет 5-10% [11] у детей 1-го года жизни и 30% у недоношенных детей с весом менее 1800 грамм. ИГ чаще встречаются у девочек европейской расы (2,5-4:1) [12]. У недоношенных детей соотношение девочки : мальчики меньше - 1,4:1, но это соотношение значимо увеличивается при осложненных и сегментарных формах ИГ и составляет 9:1 [13].
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
D18,0 - гемангиома любой локализации.Классификация
1,5 Классификация заболевания или состояния (группы заболеваний или состояний).
В настоящее время интернациональным сообществом по изучению сосудистых опухолей ISSVA (International Society for the Study of Vascular Anomalies) введено понятие «сосудистые аномалии». Все сосудистые аномалии разделены на две большие группы: сосудистые опухоли и сосудистые мальформации [14] (Таблица 1).Таблица 1. Сосудистые аномалии, классификация ISSVA.
Сосудистые опухоли с гистологической точки зрения характеризуются пролиферацией эндотелиальных клеток. По биологическому поведению сосудистые опухоли подразделяют на доброкачественные (гемангиомы), локально агрессивные/промежуточной степени злокачественности (гемангиоэндотелиомы, за исключением эпителиоидной ) и злокачественные (эпителиоидная гемангиоэндотелиома и ангиосаркома ) (таблица 2).
Таблица 2. Сосудистые опухоли, классификация ISSVA.
ИГ относится согласно современной классификации к доброкачественным опухолям.
Три гистологические фазы (Рисунок 3 А, в, с, D) следуют одна за другой, соответствуя «жизненному» циклу гемангиомы [15].
1 фаза. Гистологически опухоль высокой клеточности и соответствует клинической фазе пролиферации. Определяется незрелая сосудистая ткань, состоящая преимущественно из компактно расположенных эндотелиальных клеток, занимающих прак-тически всю площадь опухоли, формирующих едва различимые сосудистые полости, для визуализации которых может потребоваться использование дополнительных методов исследования (Рисунок 3 А, В). Стромальные клетки всегда содержат объемное ядро, определяется высокая митотическая активность. Обнаруживается большое количество мастоцитов. Может выявляться периневральная инвазия.
2 фаза. Опухоль становится более дифференцированной и соответствует клинической стадии стабилизации. Гистологически опухоль имеет дольчатое строение, состоит из четко дифференцированных капилляров с хорошо определяемым просветом, выстланным уплощённым эндотелием (Рисунок 3 С). Дольки центрированы артериолами и дренирующими венулами. На этой стадии стромальные клетки не определяются.
3 фаза. Соответствует регрессу. Объём сосудистой пролиферации прогрессивно уменьшается, ткань опухоли замещается волокнистой соединительной и жировой тканью (Рисунок 3 D), среди которых определяются редкие отдельно расположенные капилляры [13].
Рисунок 3 (А, В, С, D). Гистологическая картина на разных стадиях развития ИГ.
A: Пролиферативная фаза. Компактно расположенные мелкие сосуды, не имеющие просветов, построенные из эндотелиальных и клеток другого дифференцировочного ряда (окраска гематоксилином и эозином (Г-Э), увеличение микроскопа х100).
B: Экспрессия GLUT1 в эндотелии (иммуногистохимическое исследование с антителами к GLUT1, ув.х100).
C: Начало инволюция (фаза плато). Капилляры с тонкой стенкой и хорошо видимым просветом сосудов (Г-Э, ув. х100).
D: Изменения после завершения инволюции. Редкие структуры зрелых резидуальных сосудов среди волокнистой соединительной и жировой ткани (Г-Э, ув.х100).
Иммуногистохимическое исследование.
Эндотелиальные клетки составляют преимущественное большинство и имеют фенотип, общий с эндотелиальными клетками плаценты (Fc gamma, merosin, Ag Lewis Y, GLUT1). Самым надежным специфическим маркером, позволяющим провести дифференциальный диагноз с любой другой сосудистой аномалией, является GLUT1 (Glucose transporter 1) - белок, транспортирующий глюкозу 1 типа (Рисунок 3B), который экспрессируется в 100% случаев ИГ на любой стадии эволюции и не выявляется при другой сосудистой патологии [10]. В то же время, как и при любой капиллярной пролиферации, ИГ WT1 (Wilms tumor gene1) позитивна.
Клиническая картина
ИГ имеет плотноэластическую консистенцию, не пульсирует, безболезненна (за исключением случаев, сопровождающихся изъязвлением или периневральной инфильтрацией). Цвет кожи в месте локализации опухоли варьирует в зависимости от типа ИГ.
Клинические формы:
• Фокальная форма, самая частая. Представлена в виде единичного фокуса.
• Сегментарная форма соответствует определенному анатомическому сегменту/дерматому. С этой формой чаще всего ассоциированы синдромальные варианты ИГ.
• Мультифокальные - редкие формы. При наличии более 1, но менее 5 очагов говорят о гемангиоматозе; при наличии множественных мелких (несколько миллиметров в диаметре) гемангиом речь идет о милиарном гемангиоматозе, который ассоциируется с висцеральными поражениями (чаще всего речь идет о поражении печени).
Типы ИГ в зависимости от глубины поражения кожи и подлежащих тканей:
1. Поверхностная (кожная) ИГ (50-60%). Ангиома бугристая, ярко-красная, с четкими краями, выступающая над здоровой кожей, с шероховатой (зернистой) поверхностью (в литературе называют туберозной ангиомой или «клубничной» ангиомой). По форме она может быть локальной (фокальной или сегментарной) или диффузной.
2. Подкожная ИГ (15%) представляет собой опухолевидное образование с четкими границами. Кожа над опухолью от обычной окраски до разной степени синюшности, может быть окружена поверхностной расширенной венозной сетью. Располагается подкожная гемангиома в глубоких слоях дермы и гиподерме. Гемангиома имеет плотноэластическую консистенцию, слегка теплая на ощупь, но безболезненная и не пульсирующая.
3. Смешанная гемангиома (25-35%) имеет две составляющие: поверхностную бугристую и более глубокую - подкожную, которая выходит за границы первой, образуя синюшный ареол [16]. Занимает всю дерму и гиподерму. Как правило, смешанная ИГ представлена в виде единичного фокуса, но бывают и множественные. В последнем случае они могут сочетаться с висцеральным поражением [17].
4. Помимо описанных 3-х классических типов ИГ, выделяют еще 4-ю, атипичную ИГ. Речь идет о наличии с рождения «образования» на коже, которое напоминает изменения, предшествующие развитию ИГ, так называемые инициальные изменения: слегка возвышающееся эритематозное пятно с тоненькими телеангиэктазиями. Особенностью является практически полное отсутствие пролиферативной фазы (менее 25% от общей площади поверхности поражения подвергается пролиферации). Эти гемангиомы называют IH-MAG (Minimal or Arrested Growth Hemangioma), или абортивными ИГ, или ретикулярными ИГ (Классификация ISSVA 2014). Большинство таких ИГ локализуются на коже нижних конечностей. Пораженная конечность отечная с инфильтрацией подлежащих тканей. Этот тип ИГ чаще сопровождается локальными осложнениями в виде изъязвления и может ассоциироваться с аномалиями мочеполовой системы, а также с сердечной недостаточностью [18].
Размеры.
Размеры очень вариабельны: от точечных до гигантских. 80% ИГ имеют небольшие размеры, менее 3 см в диаметре и носят изолированный характер [19]. Что касается гигантских форм, то выделяют 2 вида: располагающиеся поверхностно или пролиферирующие на поверхности и в объеме. Размеры могут быть настолько значимыми, что это приводит к изменениям анатомических границ, особенно при локализации в скуловой области и в области околоушной слюнной железы.
Локализация.
Топография самая разнообразная, но чаще всего ИГ локализуются в области головы и шеи: 40% и 20% соответственно [5]. 76% фокальных форм на лице располагаются на выступающих участках, 60% из которых - по центральной линии лица [20]. Самые частые - это локализованные формы, лишь 24% - сегментарные. Выделяют 4 зоны расположения, согласно условным сегментам (S1-S4) (рисунок 4).
Рисунок 4. Сегментарное деление головы [21].
Некоторые виды локализаций могут указывать на наличие осложнений, при этом сегментарные формы в 11 раз чаще ассоциированы с осложнениями, в частности с изъязвлением и развитием мальформаций [13,22]:
• S1/S4 - риск развития мальформаций головного мозга приблизительно в ¾ случаях [23];
• S2/S3 - риск сердечно-сосудистых аномалий и поражения верхних дыхательных путей [23].
Эволюция.
ИГ представляет собой «динамическую опухоль», то есть она имеет определенную кинетику, претерпевая три фазы развития: фазу роста, стабилизации и регресса, которым соответствует аналогичная гистологическая фаза.
Обычно в 70% случаях ИГ при рождении отсутствуют и начинают проявляться лишь через несколько дней/недель после рождения [24,25]. Необходимо отметить, что подкожные формы могут быть клинически выявлены лишь к возрасту 2-3 месяцев [24]. Инициальные проявления могут быть представлены в 1/3 случаев локальными изменениями кожи в виде бледного пятна, похожего на гамартому, либо в виде бледно-розового пятна/капиллярной сетки, которые в течение последующих нескольких недель/месяцев прогрессивно растут (фаза ранней и быстрой пролиферации сменяется фазой поздней и медленной пролиферации), принимая вид классической гемангиомы.
Фаза пролиферации завершается обычно к 6-8 месяцам для поверхностных форм, или может продлиться до 9-12 месяцев для подкожных и смешанных форм ИГ [25]. В 80% случаев ИГ удваивает свой размер, достигая, как правило, финального объема к возрасту 5 месяцев [25], в 5% случаев размер утраивается. И в очень редких случаях (менее 5%) смешанные ИГ достигают гигантских размеров, а пролиферативная фаза может длиться до 24 месяцев [22].
Приблизительно с возраста 8-9 месяцев начинается фаза стабилизации, которая длится от 12 до 36 месяцев. В этот период завершается рост ИГ и начинается медленная спонтанная инволюция, которая клинически манифестирует с центрального просветления у кожных гемангиом и «оседания» мягких тканей при подкожных формах. Иногда фаза роста и регресса может протекать параллельно. В 60% ИГ полностью регрессирует к 4 годам, в 76% - к 7 годам [24], оставляя после себя резидуальный «дряблый карман» (Рисунок 5).
Рисунок 5. Стереотипные этапы эволюции.
Средний возраст завершения фазы инволюции - 3,5 года [26]. Необходимо отметить, что подкожные формы имеют более медленную инволюцию, чем поверхностные (кожные). Они могут регрессировать не полностью, оставляя после себя фиброзно-жировую ткань. Иногда кожа может стать дряблой из-за потери эластических волокон или развить изменения по типу телеангиэктазий.
Эти особенности течения гемангиом оправдывают позицию наблюдения при условии, если гемангиома не сопровождается осложнениями.
Осложнения.
Несмотря на спонтанный регресс, наблюдающийся в 90% случаях, некоторые виды локализаций могут приводить к развитию осложнений и требовать медицинского вмешательства либо могут указывать на возможность системных проявлений [24] (рисунок 6 a, b, c).
Рисунок 6. Схематичное изображение ИГ, ассоциированных с возможными осложнениями [27].
1. ИГ, приводящие к локальным осложнениям (некроз/изъязвление/вторичное инфицирование/кровотечение)/ функциональным расстройствам.
Локальные осложнения являются самыми частыми по данным одного из крупных исследований [5] и происходят в пролиферативную фазу [24].
Спонтанное изъязвление (с возможным вторичным инфицированием) является самым частым осложнением ИГ. Частота встречаемости составляет 16% [28] и обычно возникает в фазе роста/пролиферации (средний возраст 2-4 месяца) [29]. Изъязвление может привести к кровотечению и вторичному инфицированию, а также к функциональным расстройствам. Изъязвление всегда сопровождается выраженным болевым синдромом. В последующем изъязвленные участки могут оставлять после себя рубцовые изменения. Подкожные формы не склонны к изъязвлению.
При поверхностных и смешанных типах ИГ может развиться некроз, который бывает спонтанным или спровоцированным лечением (криотерапия, склеротерапия, радиотерапия - данные виды лечения в настоящее время не являются приоритетными). Некроз манифестирует с появления черной корки, ускоряет процесс инволюции и оставляет после себя заметный рубец. Причина спонтанно возникающего некроза до конца не известна, но некоторые авторы предполагают, что при больших гемангиомах в стадии пролиферации может отмечаться недостаточный кровоток, необходимый для питания опухоли. Некоторые цитокины могут быть задействованы, как например, фактор некроза опухоли (TNF).
Факторами риска развития локальных осложнений являются большой размер сосудистой опухоли, его кожные характеристики и топография (естественные складки, верхняя губа, шея) (рисунок 6 a), а также локализация на границе со слизистыми.
Гемангиомы особых локализаций [13]:
• Пальпебральная. Окклюзия глаза с риском развития страбизма (в 1/3 случаев), астигматизма или амблиопии пораженного глаза. Последнее осложнение является самым грозным и развивается в 43-60% случаях [30]. Внутриорбитальное и ретроорбитальное распространение ИГ могут привести к дислокации глазного яблока, инфильтрации глазодвигательных мышц и к сдавлению зрительного нерва со вторичной его атрофией. В редких случаях периорбитальное расположение ИГ может сочетаться с ИГ радужной оболочки.
• Лабиальная. Чаще всего отмечается поражение верхней губы (70%), а также перибукальная локализация. Изъязвления, повышенное слюнотечение, расстройство сосания, а также структурные нарушения со стороны формирования челюсти и зубов могут наблюдаться, особенно при распространенных формах [13]. При локализации в области нижней губы (25%) ИГ может приводить к снижению мышечной силы нижней губы и в 30% развитию язв [31], а в 30% случаях может развиться поражение подглоточного пространства. При таких локализациях необходим обязательный осмотр ЛОР врача, а также проведение дополнительных исследований.
• Назальная. Угроза повреждения и деформации нижележащих хрящевых структур в результате некроза, вторичное инфицирование; обтурация воздухоносных путей. Отдельно выделяют ангиому «Сирано» - гемангиома кончика носа. Это форма подкожная. Если гемангиома смешанная, то она может быть причиной некроза хряща (кончика и крыльев носа), приводя к необратимой деформации.
• Аурикулярная. Закрытие наружного слухового прохода, некроз хрящей ушной раковины, вторичное инфицирование, деформация ушной раковины, потеря слуха.
• Околоушная область. Клинически представлена унилатеральным поражением в виде небольшой опухолевой массы при рождении, которая очень быстро увеличивается в размере. Опухоль флюктуирующая, подвижная, безболезненная. Она располагается внутри железы, не выходя за пределы капсулы и не затрагивая ни подлежащие ткани, ни кожу. Эта локализация может приводить к поражению лицевого нерва. Инволюция начинается позже, чем обычно, с возраста 18 месяцев с полным исчезновением к 6-8 годам.
• Перинеальная. Поражение этой области встречается редко, менее чем в 10% случаях, но характеризуется очень высоким риском развития некроза, изъязвления и суперинфекции. Изъязвление отмечается в 80% случаев при достижении ИГ более 5 см2 и лишь в 10%, если площадь поражения не превышает 2 см2. Клинически они могут быть представлены двумя основными формами: в виде опухоли, четко ограниченные, либо поверхностные, но распространенные. Кроме того, данная локализация может сопровождаться различными мальформациями (аногенитальными, урологическими, кожными), включая отсутствие малых половых губ, атрофию больших половых губ, атрезию ануса, наличие липом. Аномалии развития органов промежности может сопровождаться нарушениями микции и дефекации. Данные аномалии могут потребовать хирургической коррекции после купирования проявлений гемангиомы.
• Сакральная. Может сочетаться с интраспинальным распространением, что проявляется снижением мышечной силы в ногах, везико-уринарными расстройствами, а также отмечается частая ассоциация со spina bifida.
• Околососковая область. ИГ с локализацией в области молочной железы, приводит к нарушению развития молочных желез, асимметрии грудной клетки и молочных желез.
• Область стопы/кисти. Нарушение походки/нарушения в хватательных движениях рук.
2. ИГ, сопровождающиеся нарушением витальных функций.
Эти осложнения редки, но о них надо обязательно помнить.
• Респираторный дистресс синдром (РДС). Может наблюдаться при локализации сосудистой опухоли в области верхних дыхательных путей, в частности в подглоточном пространстве. Такую локализацию необходимо исключать при наличии гемангиомы в шейно-лицевой области (передняя поверхность шеи, нижняя губа, подбородок), в области сегмента S3. Осложнение наблюдается в 1/3 случаев [32,33].
• Сердечная недостаточность. Может развиться при экстенсивных формах ИГ, а также при поражении печени. Вовлечение в патологический процесс печени может быть как изолированным, так и сочетаться с поражением кожи [34]. Все эти формы ИГ усиливают обратный венозный возврат крови, увеличивая преднагрузку на правые отделы сердца.
• Желудочно-кишечное кровотечение. В редких случаях массивное желудочно-кишечное кровотечение может осложнить течение ИГ при ее локализациии на слизистых желудочно-кишечного тракта [35].
3. ИГ, сопровождающиеся структурными и висцеральными аномалиями.
Структурные и висцеральные аномалии встречаются, при так называемых, сегментарных ИГ, которые требуют особого внимания, так как представляют собой не только эстетическую проблему, но и могут скрывать грубые функциональные изменения со стороны других органов и систем.
Два больших синдрома, недавно описанных, ассоциированы с различными висцеральными аномалиями (Таблица 3).
Таблица 3.Синдромы, ассоциированные с сегментарными гемангиомами.
Синдромы LUMBAR/PELVIS/SACRAL ассоциируется наличием огромной гемангиомы пояснично и/или крестцовой, и/или перинеальной области с ано-генито-везико-ренальными и спинальными аномалиями [36].
• Синдром PHАCE/PHACES ассоциируется с гигантской гемангиомой лица, неврологическими, кардиоваскулярными и окулярными аномалиями [4] (Рисунок 7). Частота встречаемости составляет 2,3% от всех гемангиом и 20% от гемангиом, локализованных в области лица со значимым преобладанием девочек (9:1). В литературе описано около 300 случаев [37].
Рисунок 7. Основные локусы поражения внутренних органов и систем при PHACE синдрома.
Определенные клинические проявления относят к большим или малым критериям заболевания ( см Приложение Б, таблица 5) [38]. Их совокупность позволяет установить диагноз PHACE/PHACES синдром (таблица 6) [38].
Таблица 6. Критерии диагноза PHACE синдрома [38].
4. ИГ, сопровождающиеся висцеральными поражениями.
Сочетание ИГ с висцеральным поражением возможно в трех случаях:
• при наличии множественных гемангиом (более 5).
• при наличии ИГ с локализацией в области промежности.
• при наличии ИГ с локализацией в сакральной области.
Наиболее частым висцеральным органом, который вовлекается в патологический процесс, является печень. Поражение печени необходимо исключать при:
• наличие более 5 гемангиом на коже или.
• при диссеминированном, милиарном гемангиоматозе.
Образования в печени при ИГ представлены либо мультифокальными формами, либо диффузной [34].
Они могут сопровождаться не только сердечно-сосудистой недостаточностью ( см выше) и абдоминальным компартмент-синдромом, которые чаще встречается при диффузных формах [39], но и тяжелой приобретенной гипофункцией щитовидной железы, связанной с повышенной активностью йодтиронин дейодиназы 3 типа (фермент, разрушающий тироксин) и/или секрецией ТТГ-подобного фактора-тиротропина (TSH-like factor) [40]. Гипотиреоз наблюдается всегда при диффузных формах и в 21,4% случаях при мультифокальном поражении [39]. Гипофункция щитовидной железы регрессирует параллельно инволюции гемангиом в печени [41]. Встречается также сочетание ИГ печени с тяжелой тромбоцитопенией, которая также разрешается параллельно регрессии гемангиом. Инволюция гемангиом печени происходит параллельно инволюции гемангиом на коже.
V. Остаточные проявления ИГ.
В своем исходе ИГ в 55-65% случаях могут привести к значимым локальным изменениям мягких тканей [26,42]:
• телеангиэктазии (84,3%).
• фиброзно-жировые изменения (47,1%).
• атрофия кожи (32,6%).
• рубцовые изменения.
Чаще всего вторичные рубцовые изменения наблюдаются при смешанных формах ИГ. Факторами риска также является объем поверхностной части ИГ (ИГ лица размерами более 2 см либо более 1 см у пациента в возрасте до 3-х месяцев; ИГ волосистой части головы размерами более 2 см) [27] и характеристики ее рельефа (бугристая поверхность по типу «булыжной мостовой») [24,26], а также локализация (ИГ лица с локализацией в области носа и губ).
Таблица 4. Возможные клинические проявления и объем исследований при PHACE синдроме [37].
Таблица 5. Большие и малые диагностические критерии PHACE синдрома [38].
Клинические формы:
• Фокальная форма, самая частая. Представлена в виде единичного фокуса.
• Сегментарная форма соответствует определенному анатомическому сегменту/дерматому. С этой формой чаще всего ассоциированы синдромальные варианты ИГ.
• Мультифокальные - редкие формы. При наличии более 1, но менее 5 очагов говорят о гемангиоматозе; при наличии множественных мелких (несколько миллиметров в диаметре) гемангиом речь идет о милиарном гемангиоматозе, который ассоциируется с висцеральными поражениями (чаще всего речь идет о поражении печени).
Типы ИГ в зависимости от глубины поражения кожи и подлежащих тканей:
1. Поверхностная (кожная) ИГ (50-60%). Ангиома бугристая, ярко-красная, с четкими краями, выступающая над здоровой кожей, с шероховатой (зернистой) поверхностью (в литературе называют туберозной ангиомой или «клубничной» ангиомой). По форме она может быть локальной (фокальной или сегментарной) или диффузной.
2. Подкожная ИГ (15%) представляет собой опухолевидное образование с четкими границами. Кожа над опухолью от обычной окраски до разной степени синюшности, может быть окружена поверхностной расширенной венозной сетью. Располагается подкожная гемангиома в глубоких слоях дермы и гиподерме. Гемангиома имеет плотноэластическую консистенцию, слегка теплая на ощупь, но безболезненная и не пульсирующая.
3. Смешанная гемангиома (25-35%) имеет две составляющие: поверхностную бугристую и более глубокую - подкожную, которая выходит за границы первой, образуя синюшный ареол [16]. Занимает всю дерму и гиподерму. Как правило, смешанная ИГ представлена в виде единичного фокуса, но бывают и множественные. В последнем случае они могут сочетаться с висцеральным поражением [17].
4. Помимо описанных 3-х классических типов ИГ, выделяют еще 4-ю, атипичную ИГ. Речь идет о наличии с рождения «образования» на коже, которое напоминает изменения, предшествующие развитию ИГ, так называемые инициальные изменения: слегка возвышающееся эритематозное пятно с тоненькими телеангиэктазиями. Особенностью является практически полное отсутствие пролиферативной фазы (менее 25% от общей площади поверхности поражения подвергается пролиферации). Эти гемангиомы называют IH-MAG (Minimal or Arrested Growth Hemangioma), или абортивными ИГ, или ретикулярными ИГ (Классификация ISSVA 2014). Большинство таких ИГ локализуются на коже нижних конечностей. Пораженная конечность отечная с инфильтрацией подлежащих тканей. Этот тип ИГ чаще сопровождается локальными осложнениями в виде изъязвления и может ассоциироваться с аномалиями мочеполовой системы, а также с сердечной недостаточностью [18].
Размеры.
Размеры очень вариабельны: от точечных до гигантских. 80% ИГ имеют небольшие размеры, менее 3 см в диаметре и носят изолированный характер [19]. Что касается гигантских форм, то выделяют 2 вида: располагающиеся поверхностно или пролиферирующие на поверхности и в объеме. Размеры могут быть настолько значимыми, что это приводит к изменениям анатомических границ, особенно при локализации в скуловой области и в области околоушной слюнной железы.
Локализация.
Топография самая разнообразная, но чаще всего ИГ локализуются в области головы и шеи: 40% и 20% соответственно [5]. 76% фокальных форм на лице располагаются на выступающих участках, 60% из которых - по центральной линии лица [20]. Самые частые - это локализованные формы, лишь 24% - сегментарные. Выделяют 4 зоны расположения, согласно условным сегментам (S1-S4) (рисунок 4).
Рисунок 4. Сегментарное деление головы [21].
Некоторые виды локализаций могут указывать на наличие осложнений, при этом сегментарные формы в 11 раз чаще ассоциированы с осложнениями, в частности с изъязвлением и развитием мальформаций [13,22]:
• S1/S4 - риск развития мальформаций головного мозга приблизительно в ¾ случаях [23];
• S2/S3 - риск сердечно-сосудистых аномалий и поражения верхних дыхательных путей [23].
Эволюция.
ИГ представляет собой «динамическую опухоль», то есть она имеет определенную кинетику, претерпевая три фазы развития: фазу роста, стабилизации и регресса, которым соответствует аналогичная гистологическая фаза.
Обычно в 70% случаях ИГ при рождении отсутствуют и начинают проявляться лишь через несколько дней/недель после рождения [24,25]. Необходимо отметить, что подкожные формы могут быть клинически выявлены лишь к возрасту 2-3 месяцев [24]. Инициальные проявления могут быть представлены в 1/3 случаев локальными изменениями кожи в виде бледного пятна, похожего на гамартому, либо в виде бледно-розового пятна/капиллярной сетки, которые в течение последующих нескольких недель/месяцев прогрессивно растут (фаза ранней и быстрой пролиферации сменяется фазой поздней и медленной пролиферации), принимая вид классической гемангиомы.
Фаза пролиферации завершается обычно к 6-8 месяцам для поверхностных форм, или может продлиться до 9-12 месяцев для подкожных и смешанных форм ИГ [25]. В 80% случаев ИГ удваивает свой размер, достигая, как правило, финального объема к возрасту 5 месяцев [25], в 5% случаев размер утраивается. И в очень редких случаях (менее 5%) смешанные ИГ достигают гигантских размеров, а пролиферативная фаза может длиться до 24 месяцев [22].
Приблизительно с возраста 8-9 месяцев начинается фаза стабилизации, которая длится от 12 до 36 месяцев. В этот период завершается рост ИГ и начинается медленная спонтанная инволюция, которая клинически манифестирует с центрального просветления у кожных гемангиом и «оседания» мягких тканей при подкожных формах. Иногда фаза роста и регресса может протекать параллельно. В 60% ИГ полностью регрессирует к 4 годам, в 76% - к 7 годам [24], оставляя после себя резидуальный «дряблый карман» (Рисунок 5).
Рисунок 5. Стереотипные этапы эволюции.
Средний возраст завершения фазы инволюции - 3,5 года [26]. Необходимо отметить, что подкожные формы имеют более медленную инволюцию, чем поверхностные (кожные). Они могут регрессировать не полностью, оставляя после себя фиброзно-жировую ткань. Иногда кожа может стать дряблой из-за потери эластических волокон или развить изменения по типу телеангиэктазий.
Эти особенности течения гемангиом оправдывают позицию наблюдения при условии, если гемангиома не сопровождается осложнениями.
Осложнения.
Несмотря на спонтанный регресс, наблюдающийся в 90% случаях, некоторые виды локализаций могут приводить к развитию осложнений и требовать медицинского вмешательства либо могут указывать на возможность системных проявлений [24] (рисунок 6 a, b, c).
Рисунок 6. Схематичное изображение ИГ, ассоциированных с возможными осложнениями [27].
1. ИГ, приводящие к локальным осложнениям (некроз/изъязвление/вторичное инфицирование/кровотечение)/ функциональным расстройствам.
Локальные осложнения являются самыми частыми по данным одного из крупных исследований [5] и происходят в пролиферативную фазу [24].
Спонтанное изъязвление (с возможным вторичным инфицированием) является самым частым осложнением ИГ. Частота встречаемости составляет 16% [28] и обычно возникает в фазе роста/пролиферации (средний возраст 2-4 месяца) [29]. Изъязвление может привести к кровотечению и вторичному инфицированию, а также к функциональным расстройствам. Изъязвление всегда сопровождается выраженным болевым синдромом. В последующем изъязвленные участки могут оставлять после себя рубцовые изменения. Подкожные формы не склонны к изъязвлению.
При поверхностных и смешанных типах ИГ может развиться некроз, который бывает спонтанным или спровоцированным лечением (криотерапия, склеротерапия, радиотерапия - данные виды лечения в настоящее время не являются приоритетными). Некроз манифестирует с появления черной корки, ускоряет процесс инволюции и оставляет после себя заметный рубец. Причина спонтанно возникающего некроза до конца не известна, но некоторые авторы предполагают, что при больших гемангиомах в стадии пролиферации может отмечаться недостаточный кровоток, необходимый для питания опухоли. Некоторые цитокины могут быть задействованы, как например, фактор некроза опухоли (TNF).
Факторами риска развития локальных осложнений являются большой размер сосудистой опухоли, его кожные характеристики и топография (естественные складки, верхняя губа, шея) (рисунок 6 a), а также локализация на границе со слизистыми.
Гемангиомы особых локализаций [13]:
• Пальпебральная. Окклюзия глаза с риском развития страбизма (в 1/3 случаев), астигматизма или амблиопии пораженного глаза. Последнее осложнение является самым грозным и развивается в 43-60% случаях [30]. Внутриорбитальное и ретроорбитальное распространение ИГ могут привести к дислокации глазного яблока, инфильтрации глазодвигательных мышц и к сдавлению зрительного нерва со вторичной его атрофией. В редких случаях периорбитальное расположение ИГ может сочетаться с ИГ радужной оболочки.
• Лабиальная. Чаще всего отмечается поражение верхней губы (70%), а также перибукальная локализация. Изъязвления, повышенное слюнотечение, расстройство сосания, а также структурные нарушения со стороны формирования челюсти и зубов могут наблюдаться, особенно при распространенных формах [13]. При локализации в области нижней губы (25%) ИГ может приводить к снижению мышечной силы нижней губы и в 30% развитию язв [31], а в 30% случаях может развиться поражение подглоточного пространства. При таких локализациях необходим обязательный осмотр ЛОР врача, а также проведение дополнительных исследований.
• Назальная. Угроза повреждения и деформации нижележащих хрящевых структур в результате некроза, вторичное инфицирование; обтурация воздухоносных путей. Отдельно выделяют ангиому «Сирано» - гемангиома кончика носа. Это форма подкожная. Если гемангиома смешанная, то она может быть причиной некроза хряща (кончика и крыльев носа), приводя к необратимой деформации.
• Аурикулярная. Закрытие наружного слухового прохода, некроз хрящей ушной раковины, вторичное инфицирование, деформация ушной раковины, потеря слуха.
• Околоушная область. Клинически представлена унилатеральным поражением в виде небольшой опухолевой массы при рождении, которая очень быстро увеличивается в размере. Опухоль флюктуирующая, подвижная, безболезненная. Она располагается внутри железы, не выходя за пределы капсулы и не затрагивая ни подлежащие ткани, ни кожу. Эта локализация может приводить к поражению лицевого нерва. Инволюция начинается позже, чем обычно, с возраста 18 месяцев с полным исчезновением к 6-8 годам.
• Перинеальная. Поражение этой области встречается редко, менее чем в 10% случаях, но характеризуется очень высоким риском развития некроза, изъязвления и суперинфекции. Изъязвление отмечается в 80% случаев при достижении ИГ более 5 см2 и лишь в 10%, если площадь поражения не превышает 2 см2. Клинически они могут быть представлены двумя основными формами: в виде опухоли, четко ограниченные, либо поверхностные, но распространенные. Кроме того, данная локализация может сопровождаться различными мальформациями (аногенитальными, урологическими, кожными), включая отсутствие малых половых губ, атрофию больших половых губ, атрезию ануса, наличие липом. Аномалии развития органов промежности может сопровождаться нарушениями микции и дефекации. Данные аномалии могут потребовать хирургической коррекции после купирования проявлений гемангиомы.
• Сакральная. Может сочетаться с интраспинальным распространением, что проявляется снижением мышечной силы в ногах, везико-уринарными расстройствами, а также отмечается частая ассоциация со spina bifida.
• Околососковая область. ИГ с локализацией в области молочной железы, приводит к нарушению развития молочных желез, асимметрии грудной клетки и молочных желез.
• Область стопы/кисти. Нарушение походки/нарушения в хватательных движениях рук.
2. ИГ, сопровождающиеся нарушением витальных функций.
Эти осложнения редки, но о них надо обязательно помнить.
• Респираторный дистресс синдром (РДС). Может наблюдаться при локализации сосудистой опухоли в области верхних дыхательных путей, в частности в подглоточном пространстве. Такую локализацию необходимо исключать при наличии гемангиомы в шейно-лицевой области (передняя поверхность шеи, нижняя губа, подбородок), в области сегмента S3. Осложнение наблюдается в 1/3 случаев [32,33].
• Сердечная недостаточность. Может развиться при экстенсивных формах ИГ, а также при поражении печени. Вовлечение в патологический процесс печени может быть как изолированным, так и сочетаться с поражением кожи [34]. Все эти формы ИГ усиливают обратный венозный возврат крови, увеличивая преднагрузку на правые отделы сердца.
• Желудочно-кишечное кровотечение. В редких случаях массивное желудочно-кишечное кровотечение может осложнить течение ИГ при ее локализациии на слизистых желудочно-кишечного тракта [35].
3. ИГ, сопровождающиеся структурными и висцеральными аномалиями.
Структурные и висцеральные аномалии встречаются, при так называемых, сегментарных ИГ, которые требуют особого внимания, так как представляют собой не только эстетическую проблему, но и могут скрывать грубые функциональные изменения со стороны других органов и систем.
Два больших синдрома, недавно описанных, ассоциированы с различными висцеральными аномалиями (Таблица 3).
Таблица 3.Синдромы, ассоциированные с сегментарными гемангиомами.
| Синдром PHАCE/PHACES | Posterior fosse abnormalities, Hemangioma, Arteries anomalies, сoarctation aortic, Eyes troubles/Sternal malformations |
Синдромы LUMBAR/PELVIS/SACRAL ассоциируется наличием огромной гемангиомы пояснично и/или крестцовой, и/или перинеальной области с ано-генито-везико-ренальными и спинальными аномалиями [36].
• Синдром PHАCE/PHACES ассоциируется с гигантской гемангиомой лица, неврологическими, кардиоваскулярными и окулярными аномалиями [4] (Рисунок 7). Частота встречаемости составляет 2,3% от всех гемангиом и 20% от гемангиом, локализованных в области лица со значимым преобладанием девочек (9:1). В литературе описано около 300 случаев [37].
Рисунок 7. Основные локусы поражения внутренних органов и систем при PHACE синдрома.
Определенные клинические проявления относят к большим или малым критериям заболевания ( см Приложение Б, таблица 5) [38]. Их совокупность позволяет установить диагноз PHACE/PHACES синдром (таблица 6) [38].
Таблица 6. Критерии диагноза PHACE синдрома [38].
| Гемангиома головы более 5 см в диаметре + 1 большой или 2 малых критерия | Гемангиомы шеи, верхней части туловища или туловища и проксимальных отделов верхних конечностей + 2 больших критерия | |
| «Возможный» PHACE | ||
| Гемангиома головы более 5 см в диаметре + 1 малый критерий | Гемангиомы шеи, верхней части туловища или туловища и проксимальных отделов верхних конечностей + 1 большой или 2 малых критерия | Отсутствие гемангиомы + два больших критерия. |
4. ИГ, сопровождающиеся висцеральными поражениями.
Сочетание ИГ с висцеральным поражением возможно в трех случаях:
• при наличии множественных гемангиом (более 5).
• при наличии ИГ с локализацией в области промежности.
• при наличии ИГ с локализацией в сакральной области.
Наиболее частым висцеральным органом, который вовлекается в патологический процесс, является печень. Поражение печени необходимо исключать при:
• наличие более 5 гемангиом на коже или.
• при диссеминированном, милиарном гемангиоматозе.
Образования в печени при ИГ представлены либо мультифокальными формами, либо диффузной [34].
Они могут сопровождаться не только сердечно-сосудистой недостаточностью ( см выше) и абдоминальным компартмент-синдромом, которые чаще встречается при диффузных формах [39], но и тяжелой приобретенной гипофункцией щитовидной железы, связанной с повышенной активностью йодтиронин дейодиназы 3 типа (фермент, разрушающий тироксин) и/или секрецией ТТГ-подобного фактора-тиротропина (TSH-like factor) [40]. Гипотиреоз наблюдается всегда при диффузных формах и в 21,4% случаях при мультифокальном поражении [39]. Гипофункция щитовидной железы регрессирует параллельно инволюции гемангиом в печени [41]. Встречается также сочетание ИГ печени с тяжелой тромбоцитопенией, которая также разрешается параллельно регрессии гемангиом. Инволюция гемангиом печени происходит параллельно инволюции гемангиом на коже.
V. Остаточные проявления ИГ.
В своем исходе ИГ в 55-65% случаях могут привести к значимым локальным изменениям мягких тканей [26,42]:
• телеангиэктазии (84,3%).
• фиброзно-жировые изменения (47,1%).
• атрофия кожи (32,6%).
• рубцовые изменения.
Чаще всего вторичные рубцовые изменения наблюдаются при смешанных формах ИГ. Факторами риска также является объем поверхностной части ИГ (ИГ лица размерами более 2 см либо более 1 см у пациента в возрасте до 3-х месяцев; ИГ волосистой части головы размерами более 2 см) [27] и характеристики ее рельефа (бугристая поверхность по типу «булыжной мостовой») [24,26], а также локализация (ИГ лица с локализацией в области носа и губ).
Таблица 4. Возможные клинические проявления и объем исследований при PHACE синдроме [37].
| Задняя черепная ямка / другие аномалии ЦНС | · аномалия Денди-Уокера · аномалии развития полушарий и/или червя мозжечка · арахноидальная киста | · Магнитно-резонансная томография головного мозга / Магнитно-резонансная ангиография (одна область) · КТ-ангиография |
| Гемангиома | · сегментарная гемангиома лица S1+S4 или S3 в ¾ случаях (гемифациальная, возможно билатеральная) · другие возможные локусы: орбита, гортань, подглоточное пространство, гемисфера ЦНС, внутреннее ухо, хориоидальная оболочка орбиты, менингиальная оболочка | · Магнитно-резонансная томография мягких тканей с контрастированием · Ларингоскопия · УЗИ органов брюшной полости |
| Аномалии артериальных сосудов | · аномалии интракраниальных сосудов (вертебральная, внутренняя/наружная сонная артерия); стенозы церебральных сосудов, аномалии развития (агенезия, гипоплазия, аберрантные сосуды, персистенция эмбриональных сосудов, аневризмы, коллатеральные сосуды, аномалия Мойя-Мойя) · аномалии экстракраниальных сосудов (подключичная, аорта ) | · Магнитно-резонансная томография головного мозга с контрастированием / Магнитно-резонансная ангиография (одна область) · Ангио-томоденситомерия шейно-грудного отдела · Эхо-КГ |
| Аномалии сердечно-сосудистой системы | · коарктация аорты. · врожденные мальформации (артериальный проток, атрезия трикуспидального клапана, тетрада Фалло, дефекты межпредсердной/межжелудочковой перегородок, стеноз легочного ствола). | · Эхо-КГ · УЗ ДГ сосудов шеи · КТ-ангиография |
| Аномалии глазного яблока | · колобома, · микрофтальмия, · гипоплазия оптического нерва, · глаукома | · Офтальмоскопия · Магнитно-резонаснсная томография глазниц с контрастированием |
| Срединные аномалии грудной клетки и брюшной стенки | · дефекты грудины (воронкообразная грудь, расщелина грудины) · аномалия белой линии живота | · рентгенография · УЗИ |
| Другие значимые аномалии | · гипопитуитаризм; · гипотиреоз | · эндокринный статус |
Таблица 5. Большие и малые диагностические критерии PHACE синдрома [38].
| Артериальные аномалии | · аномалии большой церебральной или цервикальной артерии · дисплазия крупных церебральных артерий · артериальный стеноз или окклюзия с/или без Мойя-Мойя коллатералий · отсутствие или среднетяжелая гипоплазия больших церебральных или цервикальных артерий · аберрантная природа или ход больших церебральных или цервикальных артерий, исключая частые варианты дуги такие, как «бычья дуга» · персистирущий коротидно-вертебробазилярный анастомоз | аневризма одной из церебральных артерий |
| Структурные аномалии головного мозга | · аномалии задней черепной ямки · комплекс Денди-Уокера · другие гипоплазии/дисплазии среднего и/или заднего мозга | · аномалии средней линии мозга · мальформация кортикального развития |
| Кардиоваскулярные | · аномалии дуги аорты · коарктация аорты · дисплазия · аневризма · аберрантная природа подключичной артерии с/или без сосудистого кольца | · дефект МЖП · правосторонняя дуга аорта/ · двойная дуга аорты · системные венозные аномалии |
| Окулярные | · аномалии заднего сегмента · персистирующий гиперпластический первичный витриус · персистирующие фетальные сосуды · сосудистые аномалии сетчатки · аномалии диска по типу «вьюнка» · гипоплазия зрительного нерва · перипапиллярная стафилома | · аномалии переднего сегмента · микрофтальмия склерокорнеа · колобома · катаракта |
| Вентральные/ Срединные структуры | · срединные аномалии грудной клетки и брюшной стенки - дефекты грудины - воронкообразная грудь - расщелина грудины - аномалия белой линии живота | · эктопический тиреоидный гипопитуитаризм · срединная стернальная папула/гамартома |
|
|
Диагностика
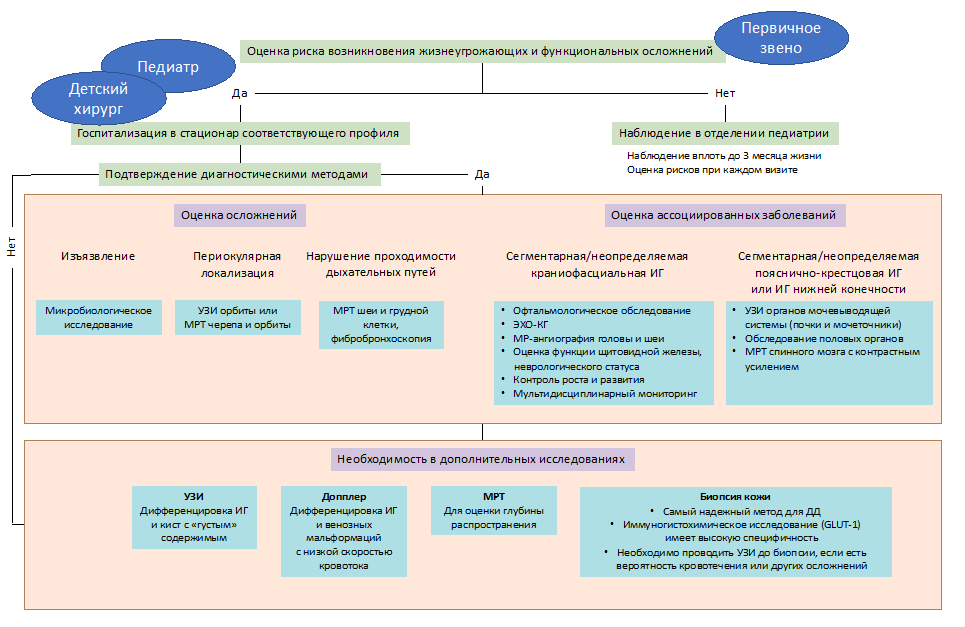
Диагноз ИГ в большинстве случаях не требует дополнительных методов исследования, а устанавливается преимущественно на данных анамнеза и клинических характеристиках опухоли [43]. Дополнительные методы исследования (КТ/МРТ ), включая осмотр узкими специалистами (врач - кардиолог, врач-оториноларинголог, врач-офтальмолог, врач-невролог, врач-детский хирург), необходимы при подозрении:
- на вовлечение в патологический процесс внутренних органов;
- на сдавление жизненно важных органов;
- при сегментарных формах ИГ.
В сомнительных случаях для подтверждения диагноза показана биопсия образования с обязательным иммуногистохимическим исследованием, которые позволяют в 100% случаях достоверно установить диагноз [43].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. При установлении диагноза ИГ одним из важных составляющих является анамнез заболевания и характер жалоб. При сборе анамнеза необходимо обратить внимание на особенности течения беременности и родов, установить время появления сосудистого образования и скорость его роста. Обратить внимание на наличие жалоб, указывающих на боль, беспокойство ребенка, функциональные расстройства (нарушение дыхания, трудности при вскармливании, неврологические отклонения).
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. При осмотре пациента необходимо дать четкое описание характера сосудистого образования, а также провести полный клинический осмотр ребенка, оценив все органы и системы.
При описании сосудистого образования учитывают следующие параметры:
• размер.
• цвет.
• плотность.
• боль.
• четкость краев и спаянность с окружающими тканями.
• наличие воспалительного компонента.
• определение локальной температуры.
Особое внимание надо уделить количеству образований, их локализации и распространенности: некоторые локализации и характер распространенности требуют дополнительных лабораторных и инструментальных методов обследования.
Выявление какой-либо патологии при общеклиническом осмотре органов и систем, требует дополнительной консультации узких специалистов, а также проведения дополнительных инструментальных методов обследования.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ с поражением печени рекомендуется выполнение биохимического анализа крови общетерапевтический с определением следующих параметров: АЛТ, АСТ, креатинин (1 раз в месяц), исследование уровня калия в крови (2 раза в месяц) для оценки общего состояния пациента и возможности проведения лекарственного лечения [44,45].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ перед началом терапии пропранололом в лекарственной форме «раствор для приема внутрь (РР) рекомендуется выполнение биохимического анализа крови общетерапевтический с определением следующих параметров: АЛТ, АСТ, общий билирубин/прямой билирубин для оценки общего состояния пациента и возможности проведения лекарственного лечения [44,46,47].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ с низкой массой тела, недоношенностью, трудностями со вскармливанием, с эпизодами гипогликемии в анамнезе перед началом терапии РР, а также пациентам, получающим комбинированную терапию преднизолоном** и РР рекомендуется исследование уровня глюкозы натощак [48,49].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с мультифокальным/диффузным гемангиоматозом печени или с PHACE синдромом рекомендуется исследование уровня тиреотропного гормона (ТТГ), свободного трийодтиронина (СТ3) и свободного тироксина (СТ4) в крови для выявления дисфункции щитовидной железы [37,50].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
• Пациентам с подозрением на ИГ с локализацией на слизистых желудочно-кишечного тракта рекомендуется исследование кала на скрытую кровь для исключения латентного желудочно-кишечного кровотечения [35,51-53].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с синдромом LUMBAR/PELVIS/SACRAL рекомендуется выполнение общего (клинического) анализа мочи с целью уточнения вовлечения мочевыводящей системы в патологический процесс [27,54].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ с изъязвлениями рекомендуется выполнение микробиологического (культурального) исследования раневого отделяемого на аэробные и факультативно-анаэробные микроорганизмы для подбора релевантной антибактериальной терапии [27,29,55].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
• Пациентам с ИГ рекомендуется ультразвуковое исследование (УЗИ) в следующих ситуациях:
• при фокальной форме ИГ подкожного типа - ультразвуковое исследование мягких тканей (одна анатомическая зона) [56,57];
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• при PHACE синдроме - ультразвуковое исследование щитовидной железы и паращитовидных желез [37,58-60];
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• при наличии множественных гемангиом на коже (5 и более) - ультразвуковое исследование печени [61,62];
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
• при диссеминированном/милиарном гемангиоматозе - ультразвуковое исследование печени [63,64];
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
• при LUMBAR/PELVIS/SACRAL синдроме - ультразвуковое исследование органов брюшной полости (комплексное), ультразвуковое исследование органов малого таза (комплексное) [27,54,65].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
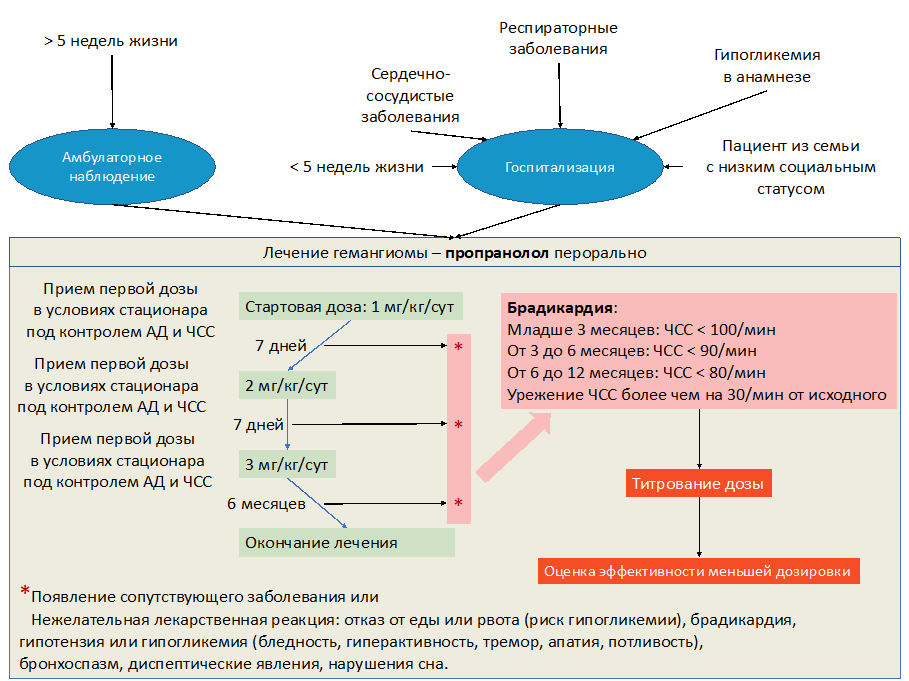
• Пациентам с ИГ рекомендуется регистрация электрокардиограммы до назначения терапии РР, а также после достижения терапевтической дозы и в ходе лечения РР (1 раз в месяц) [49,66,67].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Пациентам с ИГ рекомендуется выполнение эхокардиографии до назначения бета-адреноблокаторов, а также в процессе терапии 1 раз в 3 месяца, для исключения органической патологии сердца и определения сократительной функции миокарда [13,27,37,67-70].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Пациентам с PHACE синдромом рекомендуется выполнение прицельной рентгенографии органов грудной клетки с целью исключения срединных аномалий грудной клетки (дефекты грудины) [37,38,67].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Пациентам с ИГ рекомендуется выполнение магнитно-резонансной томографии с контрастным усилением (МРТ с КУ) или компьютерной томографии с контрастным усилением (КТ с КУ) пораженного участка в следующих ситуациях [71-73]:
• при фокальной форме ИГ подкожного типа в сомнительной клинической ситуации (не подтвержденной УЗИ/УЗ ДГ) для верификации диагноза [61,71];
• при фокальной форме ИГ подкожного типа при локализации в области мягких тканей лица и шеи с целью определения степени возможного распространения патологического процесса вглубь мягких тканей шеи/средостения и соответственно возможного сужения/обтурации верхних дыхательных путей [61,71];
• при фокальной форме ИГ «особых» локализаций, а именно пальпебральной, лабиальной, назальной, аурикулярной, околоушной, перинеальной, сакральной с целью определения области распространения образования и глубины [13];
• при сегментарных формах ИГ [61,71];
• при мультифокальной и диффузных формах поражения печени [63];
• при наличии объемных гигантских образований/очагов висцерального поражения через 6 месяцев от начала терапии бета-адреноблокатором, через 12 месяцев - при необходимости [27];
• пациентам, получающим метрономную терапию - через 2-3 курса метрономной терапии для определения эффективности данной терапии и принятия решения о возможности ее отмены. Если терапию решено продолжить в связи с недостаточным сокращением объема опухоли, повторная визуализация проводится после проведения двух дополнительных курсов МТ [74,75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с синдромальными формами ИГ рекомендуется выполнение МРТ с КУ и/или КТ с КУ [76]:
• при PHACE синдроме [76] ( см Таблица 4; раздел 7,3);
• при синдроме LUMBAR/PELVIS/SACRAL [6,76]: органы брюшной полости/малого таза/спинного мозга.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ с PHACE синдромом, с подозрением на вовлечение задней черепной ямки или других аномалий ЦНС рекомендуется выполнение компьютерно-томографической ангиографии сосудов головного мозга [77,78].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Пациентам с ИГ с PHACE синдромом, с подозрением на аномалии сердечно-сосудистой системы рекомендуется выполнение компьютерно-томографической ангиографии аорты [79].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Пациентам с ИГ с PHACE синдромом рекомендуется выполнение электроэнцефалографии для уточнения/исключения неврологических осложнений [38,78].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ при подозрении на сужение верхних дыхательных путей рекомендуется ларингоскопия под общей анестезией [76,80,81].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Пациентам с ИГ при подозрении на желудочно-кишечное кровотечение рекомендуется фиброгастродуоденоскопия под общей анестезией [27,82].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
• Пациентам с ИГ при наличии PHACE синдрома, при висцеральных формах ИГ с поражением печени (для исключения сердечной недостаточности), а также во всех случаях перед назначением бета-адреноблокаторов (для исключения противопоказаний к их назначению) рекомендуется консультация врача-кардиолога [13,27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ при локализации в области орбиты рекомендуется консультация врача-офтальмолога, выполнение офтальмоскопии [13,27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ при локализации в области передней поверхности шеи, нижней губы, подбородка рекомендуется консультация врача-оториноларинголога [76].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ при сегментарных формах, а также при наличии неврологической симптоматики рекомендуется консультация врача-невролога [13,27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ с синдромом LUMBAR/PELVIS/SACRAL рекомендуется консультация врача-уролога и (у женщин) врача-акушера-гинеколога [13,27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ при развитии вторичного гипотиреоза, а также всем пациентам с PHACE синдромом рекомендуется консультация врача-эндокринолога [13,27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
- на вовлечение в патологический процесс внутренних органов;
- на сдавление жизненно важных органов;
- при сегментарных формах ИГ.
В сомнительных случаях для подтверждения диагноза показана биопсия образования с обязательным иммуногистохимическим исследованием, которые позволяют в 100% случаях достоверно установить диагноз [43].
2,1 Жалобы и анамнез.
• У всех пациентов с подозрением на ИГ рекомендуется сбор жалоб и анамнезa [27].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. При установлении диагноза ИГ одним из важных составляющих является анамнез заболевания и характер жалоб. При сборе анамнеза необходимо обратить внимание на особенности течения беременности и родов, установить время появления сосудистого образования и скорость его роста. Обратить внимание на наличие жалоб, указывающих на боль, беспокойство ребенка, функциональные расстройства (нарушение дыхания, трудности при вскармливании, неврологические отклонения).
2,2 Физикальное обследование.
• У всех пациентов с подозрением на ИГ рекомендуется провести общий физикальный осмотр [27].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. При осмотре пациента необходимо дать четкое описание характера сосудистого образования, а также провести полный клинический осмотр ребенка, оценив все органы и системы.
При описании сосудистого образования учитывают следующие параметры:
• размер.
• цвет.
• плотность.
• боль.
• четкость краев и спаянность с окружающими тканями.
• наличие воспалительного компонента.
• определение локальной температуры.
Особое внимание надо уделить количеству образований, их локализации и распространенности: некоторые локализации и характер распространенности требуют дополнительных лабораторных и инструментальных методов обследования.
Выявление какой-либо патологии при общеклиническом осмотре органов и систем, требует дополнительной консультации узких специалистов, а также проведения дополнительных инструментальных методов обследования.
2,3 Лабораторные диагностические исследования.
• Пациентам с подозрением на ИГ и с диагностированной ИГ до начала метрономной терапии и после ее завершения рекомендуется выполнение общего (клинического) анализа крови для оценки общего состояния пациента и возможности проведения лекарственного лечения [44,45].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ с поражением печени рекомендуется выполнение биохимического анализа крови общетерапевтический с определением следующих параметров: АЛТ, АСТ, креатинин (1 раз в месяц), исследование уровня калия в крови (2 раза в месяц) для оценки общего состояния пациента и возможности проведения лекарственного лечения [44,45].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ перед началом терапии пропранололом в лекарственной форме «раствор для приема внутрь (РР) рекомендуется выполнение биохимического анализа крови общетерапевтический с определением следующих параметров: АЛТ, АСТ, общий билирубин/прямой билирубин для оценки общего состояния пациента и возможности проведения лекарственного лечения [44,46,47].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ с низкой массой тела, недоношенностью, трудностями со вскармливанием, с эпизодами гипогликемии в анамнезе перед началом терапии РР, а также пациентам, получающим комбинированную терапию преднизолоном** и РР рекомендуется исследование уровня глюкозы натощак [48,49].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с мультифокальным/диффузным гемангиоматозом печени или с PHACE синдромом рекомендуется исследование уровня тиреотропного гормона (ТТГ), свободного трийодтиронина (СТ3) и свободного тироксина (СТ4) в крови для выявления дисфункции щитовидной железы [37,50].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
• Пациентам с подозрением на ИГ с локализацией на слизистых желудочно-кишечного тракта рекомендуется исследование кала на скрытую кровь для исключения латентного желудочно-кишечного кровотечения [35,51-53].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с синдромом LUMBAR/PELVIS/SACRAL рекомендуется выполнение общего (клинического) анализа мочи с целью уточнения вовлечения мочевыводящей системы в патологический процесс [27,54].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ с изъязвлениями рекомендуется выполнение микробиологического (культурального) исследования раневого отделяемого на аэробные и факультативно-анаэробные микроорганизмы для подбора релевантной антибактериальной терапии [27,29,55].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
2,4 Инструментальные диагностические исследования.
Инструментальные исследования, такие как УЗИ/УЗ ДГ, МРТ с контрастным усилением (КУ)/КТ с КУ пораженной области являются дополнительными и применяются для подтверждения диагноза или выступают в качестве дообследования при осложненных формах, в частности, сопровождающихся нарушением витальных функций; гемангиоматозе или ИГ, сопряженных с возможными структурными и висцеральными аномалиями (сегментарные формы).• Пациентам с ИГ рекомендуется ультразвуковое исследование (УЗИ) в следующих ситуациях:
• при фокальной форме ИГ подкожного типа - ультразвуковое исследование мягких тканей (одна анатомическая зона) [56,57];
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• при PHACE синдроме - ультразвуковое исследование щитовидной железы и паращитовидных желез [37,58-60];
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• при наличии множественных гемангиом на коже (5 и более) - ультразвуковое исследование печени [61,62];
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
• при диссеминированном/милиарном гемангиоматозе - ультразвуковое исследование печени [63,64];
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
• при LUMBAR/PELVIS/SACRAL синдроме - ультразвуковое исследование органов брюшной полости (комплексное), ультразвуковое исследование органов малого таза (комплексное) [27,54,65].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ рекомендуется регистрация электрокардиограммы до назначения терапии РР, а также после достижения терапевтической дозы и в ходе лечения РР (1 раз в месяц) [49,66,67].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Пациентам с ИГ рекомендуется выполнение эхокардиографии до назначения бета-адреноблокаторов, а также в процессе терапии 1 раз в 3 месяца, для исключения органической патологии сердца и определения сократительной функции миокарда [13,27,37,67-70].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Пациентам с PHACE синдромом рекомендуется выполнение прицельной рентгенографии органов грудной клетки с целью исключения срединных аномалий грудной клетки (дефекты грудины) [37,38,67].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Пациентам с ИГ рекомендуется выполнение магнитно-резонансной томографии с контрастным усилением (МРТ с КУ) или компьютерной томографии с контрастным усилением (КТ с КУ) пораженного участка в следующих ситуациях [71-73]:
• при фокальной форме ИГ подкожного типа в сомнительной клинической ситуации (не подтвержденной УЗИ/УЗ ДГ) для верификации диагноза [61,71];
• при фокальной форме ИГ подкожного типа при локализации в области мягких тканей лица и шеи с целью определения степени возможного распространения патологического процесса вглубь мягких тканей шеи/средостения и соответственно возможного сужения/обтурации верхних дыхательных путей [61,71];
• при фокальной форме ИГ «особых» локализаций, а именно пальпебральной, лабиальной, назальной, аурикулярной, околоушной, перинеальной, сакральной с целью определения области распространения образования и глубины [13];
• при сегментарных формах ИГ [61,71];
• при мультифокальной и диффузных формах поражения печени [63];
• при наличии объемных гигантских образований/очагов висцерального поражения через 6 месяцев от начала терапии бета-адреноблокатором, через 12 месяцев - при необходимости [27];
• пациентам, получающим метрономную терапию - через 2-3 курса метрономной терапии для определения эффективности данной терапии и принятия решения о возможности ее отмены. Если терапию решено продолжить в связи с недостаточным сокращением объема опухоли, повторная визуализация проводится после проведения двух дополнительных курсов МТ [74,75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с синдромальными формами ИГ рекомендуется выполнение МРТ с КУ и/или КТ с КУ [76]:
• при PHACE синдроме [76] ( см Таблица 4; раздел 7,3);
• при синдроме LUMBAR/PELVIS/SACRAL [6,76]: органы брюшной полости/малого таза/спинного мозга.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ с PHACE синдромом, с подозрением на вовлечение задней черепной ямки или других аномалий ЦНС рекомендуется выполнение компьютерно-томографической ангиографии сосудов головного мозга [77,78].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Пациентам с ИГ с PHACE синдромом, с подозрением на аномалии сердечно-сосудистой системы рекомендуется выполнение компьютерно-томографической ангиографии аорты [79].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Пациентам с ИГ с PHACE синдромом рекомендуется выполнение электроэнцефалографии для уточнения/исключения неврологических осложнений [38,78].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ при подозрении на сужение верхних дыхательных путей рекомендуется ларингоскопия под общей анестезией [76,80,81].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Пациентам с ИГ при подозрении на желудочно-кишечное кровотечение рекомендуется фиброгастродуоденоскопия под общей анестезией [27,82].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
2,5 Иные диагностические исследования.
• Пациентам с подозрением на ИГ в исключительных случаях при невозможности постановки диагноза на основании клинических и инструментальных данных рекомендованы выполнение биопсии образования, патолого-анатомического исследования биопсийного (операционного) материала, в том числе с применением иммуногистохимических методов для верификации диагноза [27,83].Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
• Пациентам с ИГ при наличии PHACE синдрома, при висцеральных формах ИГ с поражением печени (для исключения сердечной недостаточности), а также во всех случаях перед назначением бета-адреноблокаторов (для исключения противопоказаний к их назначению) рекомендуется консультация врача-кардиолога [13,27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ при локализации в области орбиты рекомендуется консультация врача-офтальмолога, выполнение офтальмоскопии [13,27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ при локализации в области передней поверхности шеи, нижней губы, подбородка рекомендуется консультация врача-оториноларинголога [76].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ при сегментарных формах, а также при наличии неврологической симптоматики рекомендуется консультация врача-невролога [13,27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ с синдромом LUMBAR/PELVIS/SACRAL рекомендуется консультация врача-уролога и (у женщин) врача-акушера-гинеколога [13,27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Пациентам с ИГ при развитии вторичного гипотиреоза, а также всем пациентам с PHACE синдромом рекомендуется консультация врача-эндокринолога [13,27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
|
|
Лечение
3,1 Лекарственное лечение.
• Пациентам с ИГ рекомендуется начало лекарственной терапии в следующих ситуациях [12,13,27,84]:- ИГ, сопровождающиеся/угрожаемые нарушением витальных функций:
• ИГ подглоточной локализации.
• ИГ гигантских размеров/ИГ печени (риск сердечной недостаточности).
• ИГ ЦНС (риск компрессии).
• ИГ желудочно-кишечного тракта (риск кровотечений),.
• сегментарные формы.
- ИГ, сопровождающиеся/угрожаемые риском функциональных нарушений/косметических дефектов:
• ИГ орбиты или века (риск амблиопии).
• ИГ слухового прохода (снижение слуха).
• ИГ губы.
• ИГ носа.
• ИГ перинеальной области вблизи естественных отверстий;
- ИГ, сопровождающиеся изъязвлением, вторичным инфицированием, кровотечением и болевым синдромом.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Большинство пациентов с ИГ не требуют активного вмешательства, в 85% случаев опухоль подвергается спонтанной регрессии.
• Пациентам с ИГ, которым показано начало лекарственной терапии, рекомендуется в качестве терапии первой линии пропранолол в лекарственной форме «раствор для приема внутрь» (РР) [85-87].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 2).
Комментарии. Принципы назначения, правила назначения и режим дозирования РР - см приложение А3,1 данных рекомендаций.
• Пациентам с ИГ, у которых необходимо достичь максимально быстрого сокращения объема образования (ИГ, сопровождающиеся наличием или угрожаемые по развитию витальных осложнений) рекомендуется назначение терапии II линии с применением одной из следующих комбинаций:
• РР + винкристин** 0,05 мг/кг (1 мг/м2) с кратностью 1 раз в неделю (длительность 6-10 недель до достижения безопасных размеров опухоли) [13,63,84,88].
• РР + метрономная терапия винбластином** (в/в струйно 1 мг/м2 3 раза в неделю, суммарно 6 введений) и циклофосфамидом** (в/в струйно или внутрь 50 мг/м2/сут за два введения ежедневно в течение 14 дней), 2-6 циклов в зависимости от объемов опухоли и скорости ее сокращения [74,75,84,89].
• PP + преднизолон** в пероральной форме [90] в дозе 2-3 мг/кг/сут. в течение 2-х месяцев с последующим постепенным снижением с учетом длительности периода пролиферативной фазы заболевания [13,84,91].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Некоторые формы и локализации (как это было сказано выше) могут приводить к серьезным осложнениям, иногда с нарушением витальных функций (сердечная недостаточность, компартмент-синдром, сдавление верхних дыхательных путей, прорастание в спиномозговой канал с развитием/угрозой развития миелопатии), а также к серьезным косметическим дефектам, требующим последующего коррекционного лечения (пластическая хирургия, лазерная терапия). Для предотвращения этих осложнений, необходимо немедленное и достаточно интенсивное начало терапии с целью достижения максимально быстрого сокращения объема образования. К таким ситуациям относятся [13]:
• ИГ, сопряженные с нарушением витальных функций;
• ИГ с вовлечением внутренних органов (печень, ЖКТ);
• ИГ, осложненные разрушением подлежащих тканей;
• ИГ, осложненные некрозом, изъязвлением, вторичным инфицированием;
• ИГ, сопровождающиеся структурными и висцеральными аномалиями (PHACE или LUMBAR/PELVIS/SACRAL синдромы).
При проведении монотерапии бета-адреноблокаторами невозможно достичь быстрого сокращения образования, особенно при гигантских формах с высокой скоростью пролиферации. Время, затраченное на достижение лечебной дозы и появления первых признаков сокращения опухоли, может оказаться значимым - 4-6 недель (титрование дозы 7-14 дней + 2-5 недель до появления первых значимых признаков сокращения образования) и привести к тяжелым, жизнеугрожающим или серьезным локальным осложнениям (например, необходимость постановки трахеостомической трубки).
Кроме того, существуют резистентные формы ИГ, под которыми подразумевается продолженный рост опухоли или отсутствие сокращения при проведении терапии РР в дозе 3 мг/кг/сут на протяжении 5 недель.
Комбинированная терапия преднизолоном** и РР может увеличить риск развития гипогликемии [92].
• Пациентам с ИГ при наличии противопоказаний к назначению РР, включая тяжелую патологию сосудов головного мозга при PHACE синдроме, рекомендуется применение одной из следующих схем лечения:
• винкристин** 0,05 мг/кг (1 мг/м2) с кратностью 1 раз в неделю (длительность 6-10 недель до достижения безопасных размеров опухоли) [13,63,84,88].
• метрономная терапия винбластином** (в/в струйно 1 мг/м2 3 раза в неделю, суммарно 6 введений) и циклофосфамидом** (в/в струйно или внутрь 50 мг/м2/сут за два введения ежедневно в течение 14 дней), 2-6 циклов в зависимости от объемов опухоли и скорости ее сокращения [74,75,84].
• преднизолон** в пероральной форме в дозе 2-3 мг/кг/сут; длительность терапии не менее 2-х месяцев (определяется скоростью сокращения образования до достижения безопасных для развития витальных осложнений размеров) с последующим постепенным снижением с учетом длительности периода пролиферативной фазы заболевания [84].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Длительная терапия преднизолоном** сопряжена развитием тяжелых осложнений, такие как - вторичная артериальная гипертензия, нарушения всех видов обмена веществ, задержка физического развития, гастроэзофагеальный рефлюкс, обструктивная гипертрофическая кардиомиопатия, надпочечниковую недостаточность, риск развития тяжелых инфекций, включая пневмоцистную пневмонию (в качестве профилактики развития данного осложнения показан прием ко-тримоксазола [сульфаметоксазол+триметоприм]**), сMV инфекцию.
3,2 Хирургические методы лечения.
• Пациентам с ИГ рекомендуется применение хирургических методов в следующих ситуациях [63,84]:• рано развившийся некроз мягких тканей;
• грубые функциональные расстройства (органы зрения и слуха);
• персистенция резидуального объема после спонтанной инволюции;
• деформация анатомических структур;
• хирургическая коррекция мальформаций со стороны внутренних органов при наличии синдромальных форм ИГ.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
3,3 Иные методы лечения.
• Пациентам с наличием/течением бронхообструктивного синдрома, тяжелыми расстройствами сна, рекомендуется назначение атенолола** в дозе 1 мг/кг 1 раз в день (начальная доза 0,5 мг/кг/сут) [93-96].Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарии. Правила назначения препарата аналогичны таковым неселективными бета-адреноблокаторами. В настоящее время нет крупных рандомизированных исследований, подтверждающих эффективность атенолола**, сопоставимую с РР, при лечении ИГ.
• Пациентам с единичными поверхностными ИГ не более 2 см в диаметре рекомендуется назначение тимолола** в лекарственной форме «капли глазные» в дозе не более 2 капель 2 раза в сутки местно [49,97-99].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Местная терапия тимололом** может иметь системное действие. Препарат всасывается через кожу. Лишь 15-20% дозы метаболизируется при первичном прохождении через печень (в основном при участии фермента Р450), что может приводить к созданию определенной концентрации препарата в сыворотке крови, и биодоступность его не всегда может быть достоверно определена. Препарат показал свою эффективность при лечении ИГ в дозе менее, чем 0,2 мг/кг/сут, разделенной на две аппликации. Но местная терапия бета-адреноблокаторами доношенных детей требует дополнительных рандомизированных исследований (кратность назначения препарата? длительность терапий). Данная терапия не должна назначаться у недоношенных пациентов ввиду невозможности прогнозирования побочных эффектов. Препарат противопоказан при наличии локальных осложнений (язв, некрозов, вторичного инфицирования).
• Пациентам с поверхностными ИГ со стойкими резидуальными явлениями в фазе инволюции рекомендуется лазерное лечение [49,84,100-102].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 3).
Комментарии: импульсный лазер на красителе (PDL, длина волны 595 нм) применяется для лечения пострезидуальных изменений кожи в постинволюционной стадии ИГ. Лечение очень болезненно и должно проводиться только под общей анестезией. Возможно развитие пигментации или депигментации кожи в месте воздействия лазера.
|
|
Реабилитация и амбулаторное лечение
Реабилитационных мероприятий для данного заболевания не разработано.
Профилактика
• Пациентам с неосложненными формами ИГ рекомендуется наблюдение в динамике. Повторные осмотры с интервалом в неделях, равным возрасту пациента в месяцах (интервал наблюдения в неделях = возраст в месяцах) [55].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Для таких пациентов показана тактика «активного наблюдения». Оцениваются динамика всех параметров ИГ (размер и скорость увеличения, цвет, появление новых элементов, вторичные изменения), а также возможные риски развития осложнений.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Для таких пациентов показана тактика «активного наблюдения». Оцениваются динамика всех параметров ИГ (размер и скорость увеличения, цвет, появление новых элементов, вторичные изменения), а также возможные риски развития осложнений.
Организация оказания медицинской помощи
Показания для госпитализации в медицинскую организацию:
• Наличие диагноза ИГ с высоким риском осложнений ( см выше).
• В дебюте терапии РР (инициация терапии, подбор дозы препарата).
Показания к выписке пациента из медицинской организации:
• при осложненных формах - купирование осложнений.
• подбор системной лекарственной терапии и перевод на амбулаторное ведение.
Амбулаторное ведение пациента:
В ходе лечения РР показано ведение пациента в амбулаторном режиме с целью коррекции дозы препарата на долженствующий вес ребенка (1 раз в месяц) с проведением контрольных обследований.
• Наличие диагноза ИГ с высоким риском осложнений ( см выше).
• В дебюте терапии РР (инициация терапии, подбор дозы препарата).
Показания к выписке пациента из медицинской организации:
• при осложненных формах - купирование осложнений.
• подбор системной лекарственной терапии и перевод на амбулаторное ведение.
Амбулаторное ведение пациента:
В ходе лечения РР показано ведение пациента в амбулаторном режиме с целью коррекции дозы препарата на долженствующий вес ребенка (1 раз в месяц) с проведением контрольных обследований.
Дополнительно
7,1 Дифференциальная диагностика ИГ.
Другие сосудистые опухоли.Врожденная гемангиома (ВГ) [103].
Термин «Врожденные гемангиомы» объединяет сосудистые опухоли, которые относятся к доброкачественным сосудистым новообразованиям, возникающим внутриутробно, и к моменту рождения ребенка уже полностью сформированы. В отличие от ИГ они не подвергаются пролиферативному процессу в постнатальном периоде. Выделяют три субтипа в зависимости от степени регресса опухоли:
1. RICH - Rаpidly involuting congenital hemangioma.
2. NICH -Non involuting congenital hemangioma.
3. PICH - Partially involuting congenital hemangioma.
Из всех субтипов чаще всего встречается RICH. Сразу после рождения начинается этап инволюции, завершающийся обычно к 6-18 месяцам [104]. Локализуется она с одинаковой частотой на конечностях (вблизи крупных суставов) и в области головы/шеи (лоб, височная область, щечная, волосистая часть головы), преимущественно в околоушной области; крайне редко - на туловище. Опухоль развивается подкожно. Обычно она представлена в виде массивного образования, выступающего над поверхностью, и имеет несколько сантиметров в диаметре. При пальпации, как правило, многоузловая, умеренно плотная, местами разной консистенции, теплая на ощупь [105]. Кожа над образованием тонкая, легко ранимая. Опухоль может быть бледная или иметь синюшно-фиолетовый цвет с перифокальным «Halo», представленным кожей обычного цвета. На ее поверхности могут просматриваться телеангиэктазии, радиально расположенные, или она может быть «усыпана» в центре гладкими красными узлами.
Капошиформная гемангиоэндотелиома (КГЭ).
Очень редкая сосудистая опухоль (0,07 на 100 000) [106-108]. Она может выявляться с рождения и быть незаметной с постепенным увеличением в течение первых месяцев жизни. Это сосудистое образование, которое характеризуется гигантскими размерами с преимущественной локализацией на конечностях, в области верхнего плечевого пояса и шеи. Относится к опухолям с промежуточной степенью злокачественности, обладает локально инфильтративным ростом, но без способности к метастазированию. Характерно увеличение регионарных лимфатических узлов. Образования представлены ярко-красным пятном, слегка возвышающимся, горячим и плотным при пальпации с выраженным инфильтративным компонентом, представляя единое целое с подлежащими тканями. Иногда на поверхности отмечается гипертрихоз и гипергидроз. Опухоль может сопровождаться болевым синдромом, который возникает при кровоизлиянии в ткань опухоли или сдавлении сосудисто-нервного пучка. В настоящее время известно, что КГЭ является основной причиной развития феномена (синдрома) Казабаха-Мерритт: тромбоцитопении и коагулопатии потребления с угрозой кровотечения и кровоизлияния, приводя к летальности в 30% случаев.
«Пучковая» ангиома (ПА).
Врожденная или приобретенная (всегда до 5-тилетнего возраста) [109], больше имеющая хроническое течение и медленно прогрессирующая. Клинически опухоль представлена либо инфильтрирующим подлежащие ткани красным пятном, плохо отграниченным; либо представлена многочисленными с разной степенью интенсивности красными папулами. Может сопровождаться болезненностью при пальпации, иногда достаточно выраженной. Может отмечаться локальный гипертрихоз и/или гипергидроз. Описаны случаи спонтанного регресса. Иногда при локализации опухоли на конечностях происходит инфильтрация и склерозирование кожи. склеротические изменения могут затрагивать подлежащие мышцы и суставы с развитием тяжелых функциональных расстройств. С гистологической точки зрения ПА считается «малой» формой КГЭ. Реже, чем КГЭ, может осложниться развитием СКМ.
Сосудистые мальформации.
Венозные мальформации, в частности, синдром Бина (диссеминированный венозный ангиоматоз Бина). В большинстве случаев образования выявляются уже при рождении/в младенчестве. Представлены единичными или диссеминированными папулезными элементами сине-голубого/фиолетового цвета плотно-эластической консистенции, легко сжимаемые при пальпации. Может отмечаться болевой синдром. Локализация самая разнообразная: кожа (типично поражение подушечек пальцев рук и ног), мышцы, слизистая желудочно-кишечного тракта (типично поражение тонкой кишки), паренхиматозные органы. Одним из основных клинических симптомов этого заболевания являются острые или хронические кровотечения из множественных венозных мальформаций, локализованных в желудочно-кишечном тракте, которые неизбежно приводят к анемии [110].
Лимфатическая мальформация.
Клинически представлены мягко-тканным «образованием/образованиями», как правило, с неизмененной кожей над ними, мягко-эластической консистенции, б/б, легко сжимаемыми и подвижными. Возможно увеличение регионарных лимфоузлов. Неправильно сформированные лимфатические сосуды, образующие микро/макрокистозные/смешанные полости могут иметь самую разнообразную локализацию по отношению как к покровным тканям, так и по отношению к внутренним органам, порой прорастая в полости и затрагивая костную систему. При подкожной локализации могут визуально не отличаться от подкожного типа ИГ.
Капиллярная мальформация.
Самая частая сосудистая мальформация - плоская ангиома («Винное» пятно, «пламенеющий» невус) - 25-40% новорожденных. Выявляется с рождения в виде красно-фиолетового пятна, располагаясь преимущественно на лице (особенно область лба), шее, но могут быть затронуты любые участки, включая слизистые. Как правило, склонны к регрессу еще в детском возрасте. Однако некоторые могут персистировать с образованием иногда на их фоне красных узловых элементов. При особых локализациях капиллярная мальформация может указывать на наличие системной патологии (синдром Sturge-Weber, синдром Klippel-Trenaunay, синдром Parkes-Weber, некоторые виды факоматоза).
Другие заболевания (дифференциальный диагноз с милиарным гемангиоматозом) [63].
Инфантильный миофиброматоз.
Это фиброваскулярная опухоль. Может быть представлена в форме единичного узлового элемента или иметь мультифокальную форму. Кожа в области узлов красного цвета с фиолетовым оттенком, иногда с телеангиэктазиями на поверхности. При солитарных формах, образование может спонтанно регрессировать. При мультифокальных формах, которые могут напоминать милиарный гемангиоматоз, возможно поражение висцеральных органов.
Моноцитарный и миеломоноцитарный лейкоз.
Редко встречается у новорожденных. Изменения на коже представлены плотными папулезно-узловыми элементами с локализацией в дерме и гиподерме, иногда с геморрагическим компонентом и некрозом.
Неонатальный лангергансоклеточный гистиоцитоз Хашимота-Прицкера (Hashimoto-Pritzker).
Клиническая картина полиморфна: с рождения выявляются множественные папулезно-нодулезные элементы темно-красного цвета с преимущественной локализацией на коже верхней половины туловища. Обычно эти элементы сочетаются с везикуло-пустулезными. В течение нескольких недель подвергаются инволюции.
Синдром «черничного пирога» (Blueberry muffin baby).
Множественные узловые элементы темно-синевого цвета, которые выявляются с рождения, обычно связаны с течением инфекции (TORCH синдром) или ассоциированы со злокачественными заболеваниями, такими как, например, лейкоз.
Псевдоангиоматоз.
Редкое заболевание, которое в большинстве случаев возникает в контексте с инфекционным эпизодом. Элементы на коже представлены мономорфными милиарными макуло-папулезными элементами красного цвета, асимптомными, склонными к полному разрешению в течение от 2-х дней до 3-х недель. Излюбленная локализация - щеки и конечности.
В сомнительных случаях показана биопсия образования. Основным отличительным критерием будет являться положительная реакция с GLUT-1 при проведении иммуногистохимического исследования.
7,2 Факторы риска.
К факторам риска относят:• ИГ особых локализаций.
• сегментарные формы.
• поражение висцеральных органов.
|
|
Критерии оценки качества медицинской помощи
| 1. | Пациенту с подозрением на ИГ выполнены сбор жалоб и анамнеза, общий физикальный осмотр | Да/нет |
| 2. | Пациенту с подозрением на ИГ выполнен общий (клинический) анализ крови | Да/нет |
| 3. | Пациенту с ИГ перед началом терапии пропранололом** выполнена электрокардиография | Да/нет |
| 4. | Пациенту с ИГ с PHACE синдромом и/или с поражением печени выполнена эхокардиография перед назначением бета-адреноблокаторов | Да/нет |
| 5. | Пациенту с ИГ с синдромом PHACE выполнены исследование уровня тиреотропного гормона (ТТГ), свободного трийодтиронина (СТ3) и свободного тироксина (СТ4) в крови | Да/нет |
| 6. | Пациенту с ИГ с синдромом PHACE выполнена рентгенография органов грудной клетки в прямой и боковой проекции | Да/нет |
| 7. | Пациенту с ИГ с синдромом PHACE выполнены магнитно-резонансная томография мягких тканей с контрастированием или компьютерная томография мягких тканей с контрастированием | Да/нет |
| 8. | Пациенту с ИГ с синдромом PHACE выполнена электроэнцефалография | Да/нет |
| 9. | Пациенту с ИГ с синдромом LUMBAR/PELVIS/SACRAL выполнен общий (клинический) анализ мочи | Да/нет |
| 10. | Пациенту с ИГ с синдромом LUMBAR/PELVIS/SACRAL выполнено ультразвуковое исследование органов брюшной полости (комплексное), ультразвуковое исследование органов малого таза (комплексное) | Да/нет |
| 11. | Пациенту с ИГ с синдромом LUMBAR/PELVIS/SACRAL выполнена МРТ с контрастным усилением или КТ с контрастным усилением органов брюшной полости/малого таза/спинного мозга | Да/нет |
| 12. | Пациенту с ИГ, которому показано начало лекарственной терапии, при отсутствии противопоказаний назначен РР | Да/нет |
Список литературы
• Léauté-Labrèze с., Harper J.I., Hoeger P.H. Infantile haemangioma // The Lancet. Lancet, 2017. Vol. 390, № 10089. P. 85-94.
• Darrow D.H.D.H. et al. Diagnosis and management of infantile Hemangioma // Pediatrics. Pediatrics, 2015. Vol. 136, № 4. P. e1060-e1104.
• Drolet в.A., Swanson E.A., Frieden I.J. Infantile Hemangiomas: An Emerging Health Issue Linked to an Increased Rate of Low вirth Weight Infants // J. Pediatr. J Pediatr, 2008. Vol. 153, № 5.
• Frieden I.J. et al. Infantile hemangiomas: сurrent knowledge, future directions. Proceedings of a research workshop on infantile hemangiomas // Pediatric Dermatology. Pediatr Dermatol, 2005. Vol. 22, № 5. P. 383-406.
• Haggstrom A.N. et al. Prospective study of infantile hemangiomas: сlinical characteristics predicting complications and treatment // Pediatrics. Pediatrics, 2006. Vol. 118, № 3. P. 882-887.
• Léauté-Labrèze с. Hémangiomes infantiles: Actualités dans le traitement // Archives de Pediatrie. Arch Pediatr, 2013. Vol. 20, № 5. P. 517-522.
• Enjolras O. Angiomes // Revue du Praticien. Rev Prat, 2003. Vol. 53, № 8. P. 899-905.
• Stefan D. et al. Angiogénèse: de la physiologie à la therapeutique. Réanium Urgences. 2000. Vol. 9. P. 534-544.
• Presta M. et al. Fibroblast growth factor/fibroblast growth factor receptor system in angiogenesis // сytokine Growth Factor Rev. сytokine Growth Factor Rev, 2005. Vol. 16, № 2 SPEC. ISS. P. 159-178.
• Léauté-Labrèze с., Taïeb A. Efficacité des bêtabloquants dans les hémangiomes capillaires infantiles : signification physiopathologique et conséquences thérapeutiques // Ann. Dermatol. Venereol. Ann Dermatol Venereol, 2008. Vol. 135, № 12. P. 860-862.
• Wassef M. et al. Vascular tumours and malformations, classification, pathology and imaging // Ann. сhir. Plast. Esthet. Elsevier Masson SAS, 2006. Vol. 51, № 4-5. P. 263-281.
• Drolet в.A. et al. Initiation and use of propranolol for infantile hemangioma: report of a consensus conference // Pediatrics. Pediatrics, 2013. Vol. 131, № 1. P. 128-140.
• Léauté-Labrèze с., Sans-Martin V. Infantile hemangioma // Press. Medicale. Elsevier Masson SAS, 2010. Vol. 39, № 4. P. 499-510.
• Enjolras O., Mulliken J.B. Vascular tumors and vascular malformations (new issues) // Adv. Dermatol. 1997. Vol. 13. P. 375-423.
• Wechsler J. et al. Pathologie cutanée tumorale. P. 697.
• сasanova D. et al. Les hémangiomes cutanés : aspects cliniques // Ann. сhir. Plast. Esthet. Elsevier Masson SAS, 2006. Vol. 4-5, № 51. P. 287-292.
• Philandrianos с. et al. Diagnosis and management of vascular anomalies // Ann. сhir. Plast. Esthet. Elsevier Masson SAS, 2011. Vol. 56, № 3. P. 241-253.
• вianchi A. et al. сongenital ulcerated lip hemangioma treated with a cleft lip technique // сleft Palate-Craniofacial J. сleft Palate сraniofac J, 2017. Vol. 54, № 2. P. 231-234.
• Nakayama H. сLINICAL AND HISTOLOGICAL STUDIES OF THE сLASSIFICATION AND THE NATURAL сOURSE OF THE STRAWBERRY MARK // J. Dermatol. John Wiley & Sons, Ltd, 1981. Vol. 8, № 4. P. 277-291.
• Waner M. et al. The nonrandom distribution of facial hemangiomas // Arch. Dermatol. Arch Dermatol, 2003. Vol. 139, № 7. P. 869-875.
• Haggstrom A.N. et al. Risk for PHACE syndrome in infants with large facial hemangiomas // Pediatrics. Pediatrics, 2010. Vol. 126, № 2.
• сhiller K.G., Passaro D., Frieden I.J. Hemangiomas of infancy: сlinical characteristics, morphologic subtypes, and their relationship to race, ethnicity, and sex // Arch. Dermatol. Arch Dermatol, 2002. Vol. 138, № 12. P. 1567-1576.
• Metry D.W. et al. The many faces of PHACE syndrome // J. Pediatr. J Pediatr, 2001. Vol. 139, № 1. P. 117-123.
• Léauté-Labrèze с., Prey S., Ezzedine K. Infantile haemangioma: Part I. Pathophysiology, epidemiology, clinical features, life cycle and associated structural abnormalities // J. Eur. Acad. Dermatology Venereol. J Eur Acad Dermatol Venereol, 2011. Vol. 25, № 11. P. 1245-1253.
• сhang L.C. et al. Growth characteristics of infantile hemangiomas: implications for management // Pediatrics. Pediatrics, 2008. Vol. 122, № 2. P. 360-367.
• вaselga E. et al. Risk Factors for Degree and Type of Sequelae After Involution of Untreated Hemangiomas of Infancy // JAMA dermatology. JAMA Dermatol, 2016. Vol. 152, № 11. P. 1239-1243.
• Krowchuk D.P. et al. сlinical Practice Guideline for the Management of Infantile Hemangiomas // Pediatrics. 2019. Vol. 143, № 1.
• Haggstrom A.N. et al. Patterns of infantile hemangiomas: new clues to hemangioma pathogenesis and embryonic facial development // Pediatrics. Pediatrics, 2006. Vol. 117, № 3. P. 698-703.
• сhamlin S.L. et al. Multicenter prospective study of ulcerated hemangiomas // J. Pediatr. J Pediatr, 2007. Vol. 151, № 6.
• Dubois J. et al. Orbit and eyelid hemangiomas: Is there a relationship between location and ocular problems. J. Am. Acad. Dermatol. 2006. Vol. 55, № 4. P. 614-619.
• Holland K.E., Drolet в.A. Infantile Hemangioma // Pediatric сlinics of North America. Pediatr сlin North Am, 2010. Vol. 57, № 5. P. 1069-1083.
• Rahbar R. et al. The biology and management of subglottic hemangioma; past, present, future // Laryngoscope. Laryngoscope, 2004. Vol. 114, № 11. P. 1880-1891.
• вadi A.N. et al. Histopathologic and immunophenotypic profile of subglottic hemangioma: Multicenter study // Int. J. Pediatr. Otorhinolaryngol. Int J Pediatr Otorhinolaryngol, 2009. Vol. 73, № 9. P. 1187-1191.
• сhristison-Lagay E.R. et al. Hepatic hemangiomas: subtype classification and development of a clinical practice algorithm and registry // J. Pediatr. Surg. J Pediatr Surg, 2007. Vol. 42, № 1. P. 62-68.
• Levy A.D. et al. Gastrointestinal hemangiomas: Imaging findings with pathologic correlation in pediatric and adult patients // Am. J. Roentgenol. AJR Am J Roentgenol, 2001. Vol. 177, № 5. P. 1073-1081.
• Константинова Н. et al. Случай успешного лечения редкой патологии - LUMBAR синдрома // Педиатрия. 2020. Vol. 99, № 4. P. 279-282.
• Rotter A. et al. PHACE syndrome: clinical manifestations, diagnostic criteria, andmanagement // An. вras. Dermatol. Sociedade вrasileira de Dermatologia, 2018. Vol. 93, № 3. P. 405.
• Garzon M.C. et al. PHACE Syndrome: сonsensus-Derived Diagnosis and сare Recommendations // J. Pediatr. J Pediatr, 2016. Vol. 178. P. 24-33.e2.
• Kulungowski p.m et al. Lessons from a liver hemangioma registry: Subtype classification // J. Pediatr. Surg. J Pediatr Surg, 2012. Vol. 47, № 1. P. 165-170.
• Huang S.A. et al. Severe hypothyroidism caused by type 3 iodothyronine deiodinase in infantile hemangiomas // N. Engl. J. Med. N Engl J Med, 2000. Vol. 343, № 3. P. 185-189.
• Konrad D., Ellis G., Perlman K. Spontaneous Regression of Severe Acquired Infantile Hypothyroidism Associated with Multiple Liver Hemangiomas // Pediatrics. Pediatrics, 2003. Vol. 112, № 6 I. P. 1424-1426.
• вauland с.G. et al. Untreated hemangiomas: growth pattern and residual lesions // Plast. Reconstr. Surg. Plast Reconstr Surg, 2011. Vol. 127, № 4. P. 1643-1648.
• Maruani A. Angiomes // Pédiatre. 6e édition. 2011. P. 252-255.
• Iacobas I. et al. Guidance Document for Hepatic Hemangioma (Infantile and сongenital) Evaluation and Monitoring // J. Pediatr. J Pediatr, 2018. Vol. 203. P. 294-300.e2.
• Grant p.m et al. Rethinking вlood Testing in Pediatric сancer Patients: A Quality Improvement Approach // Pediatr. Qual. Saf. Wolters Kluwer Health, 2022. Vol. 7, № 3. P. e552.
• вabiak-Choroszczak L. et al. Safety assessment during initiation and maintenance of propranolol therapy for infantile hemangiomas // Adv. сlin. Exp. Med. Adv сlin Exp Med, 2019. Vol. 28, № 3. P. 381-390.
• Ainipully p.m et al. Oral Propranolol in Infantile Hemangiomas: Analysis of Factors that Affect the Outcome // J. Indian Assoc. Pediatr. Surg. Wolters Kluwer -- Medknow Publications, 2019. Vol. 24, № 3. P. 170.
• Sethuraman G., Yenamandra V., Gupta V. Management of infantile hemangiomas: current trends // J. сutan. Aesthet. Surg. J сutan Aesthet Surg, 2014. Vol. 7, № 2. P. 75.
• Sebaratnam D.F. et al. Infantile hemangioma. Part 2: Management // J. Am. Acad. Dermatol. J Am Acad Dermatol, 2021. Vol. 85, № 6. P. 1395-1404.
• вongsebandhu-Phubhakdi с., Tempark T., Supornsilpchai V. Endocrine manifestations of PHACE syndrome // J. Pediatr. Endocrinol. Metab. J Pediatr Endocrinol Metab, 2019. Vol. 32, № 8. P. 797-802.
• Kaur K., Adamski J.J. Fecal Occult вlood Test // StatPearls. StatPearls Publishing, 2022.
• ElHassan N.O. et al. A Preterm Infant with Abdominal Distension and вloody Stools // J. Pediatr. J Pediatr, 2019. Vol. 205. P. 289-289.e1.
• Ameen N.N. Gastrointestinal and mesenteric hemangioma; a rare case presentation // J. Sulaimani Med. сoll. 2018. Vol. 8, № 2. P. 127-129.
• вourrat E. et al. PELVIS/SACRAL syndrome avec hémangiome livédoïde et bride amniotique // Ann. Dermatol. Venereol. Elsevier Masson, 2008. Vol. 135, № 12. P. 855-859.
• Nijmegen R. сonsensus document for the treatment of infantile haemangiomas. 2017. 20 p.
• Elajmi A. et al. Prise en charge des anomalies vasculaires chez l’enfant // Ann. сhir. Plast. Esthétique. Elsevier Masson, 2016. Vol. 61, № 5. P. 480-497.
• Ding A.A. et al. Role of ultrasound in diagnosis and differential diagnosis of deep infantile hemangioma and venous malformation // J. Vasc. surgery. Venous Lymphat. Disord. J Vasc Surg Venous Lymphat Disord, 2019. Vol. 7, № 5. P. 715-723.
• Delmotte N. et al. Mise au point sur le traitement de l’hémangiome du nourrisson par bêta-bloquant // Therapies. Elsevier, 2012. Vol. 67, № 3. P. 257-265.
• сarinci S. et al. A case of congenital hypothyroidism in PHACE syndrome // J. Pediatr. Endocrinol. Metab. J Pediatr Endocrinol Metab, 2012. Vol. 25, № 5-6. P. 603-605.
• вongsebandhu-Phubhakdi с. et al. A case of PHACE syndrome with growth hormone deficiency and abnormal thyroid functions // J. Pediatr. Endocrinol. Metab. J Pediatr Endocrinol Metab, 2019. Vol. 32, № 11.
• Eschard с. Hémangiomes infantiles : quand explorer et actualités thérapeutiques // Ann. Dermatol. Venereol. Elsevier Masson, 2015. Vol. 142, № 8-9. P. 476-482.
• Horii K.A. et al. Prospective study of the frequency of hepatic hemangiomas in infants with multiple cutaneous infantile hemangiomas // Pediatr. Dermatol. Pediatr Dermatol, 2011. Vol. 28, № 3. P. 245-253.
• Lacoste A., Léauté-Labrèze с. Formation médicale continue сlinique Hémangiomatose miliaire // Ann Dermatol Venereol. 2007. Vol. 134. P. 694-702.
• сanty K.M. et al. Multiple cutaneous and hepatic hemangiomas in infants // South. Med. J. South Med J, 2014. Vol. 107, № 3. P. 159-164.
• Luu J., сotton с.H. Hemangioma Genetics and Associated Syndromes // Dermatol. сlin. Dermatol сlin, 2022. Vol. 40, № 4. P. 393-400.
• Raphael M.F. et al. Is cardiovascular evaluation necessary prior to and during beta-blocker therapy for infantile hemangiomas. A cohort study // J. Am. Acad. Dermatol. J Am Acad Dermatol, 2015. Vol. 72, № 3. P. 465-472.
• сushing S.L. et al. Initial experience with a multidisciplinary strategy for initiation of propranolol therapy for infantile hemangiomas // Otolaryngol. Head. Neck Surg. Otolaryngol Head Neck Surg, 2011. Vol. 144, № 1. P. 78-84.
• Frongia G. et al. сardiac diagnostics before oral propranolol therapy in infantile hemangioma: retrospective evaluation of 234 infants // World J. Pediatr. World J Pediatr, 2018. Vol. 14, № 3. P. 254-258.
• Zimmermann A.P. et al. Propranolol therapy for infantile haemangiomas: review of the literature // Int. J. Pediatr. Otorhinolaryngol. Int J Pediatr Otorhinolaryngol, 2010. Vol. 74, № 4. P. 338-342.
• Kassarjian A. et al. Infantile hepatic hemangiomas: clinical and imaging findings and their correlation with therapy // AJR. Am. J. Roentgenol. AJR Am J Roentgenol, 2004. Vol. 182, № 3. P. 785-795.
• Kitami M. Diffusion-weighted imaging as a routine MRI protocol for the evaluation of infantile hemangioma // сlin. Imaging. сlin Imaging, 2017. Vol. 46. P. 121.
• Park H.J. et al. Ultrasound and MRI findings as predictors of propranolol therapy response in patients with infantile hemangioma // PLoS One. PLoS One, 2021. Vol. 16, № 3.
• Шептий О.В., Круглова Л.С. Младенческая гемангиома: классификация, клиническая картина и методы коррекции // Российский журнал кожных и венерических болезней. 2016. Vol. 19, № 3. P. 178-183.
• Хачатрян Л.А. et al. Терапия детей с синдромом Казабаха-Мерритт // Педиатрия. 2018. Vol. 97, № 4. P. 125-134.
• Хачатрян Л.А., Николаева Д.М., Щербаков А.П. Когда болезнь выходит за пределы кожи - изменения на коже могут быть признаком системного заболевания // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2020. Vol. 19, № 3. P. 95-104.
• Rodríguez вandera A.I. et al. Infantile hemangioma. Part 1: Epidemiology, pathogenesis, clinical presentation and assessment // J. Am. Acad. Dermatol. J Am Acad Dermatol, 2021. Vol. 85, № 6. P. 1379-1392.
• Hess с.P. et al. сervical and intracranial arterial anomalies in 70 patients with PHACE syndrome // AJNR. Am. J. Neuroradiol. AJNR Am J Neuroradiol, 2010. Vol. 31, № 10. P. 1980-1986.
• Heyer G.L. et al. The cerebral vasculopathy of PHACES syndrome // Stroke. Stroke, 2008. Vol. 39, № 2. P. 308-316.
• Prada F. et al. сomplex Aortic сoarctation and PHACE Syndrome // Rev. Española сardiol. English Ed. Elsevier, 2010. Vol. 63, № 11. P. 1367-1370.
• вuckmiller L., Dyamenahalli U., Richter G.T. Propranolol for airway hemangiomas: case report of novel treatment // Laryngoscope. Laryngoscope, 2009. Vol. 119, № 10. P. 2051-2054.
• Kveton J.F., Pillsbury H.C. сonservative Treatment of Infantile Subglottic Hemangioma With сorticosteroids // Arch. Otolaryngol. American Medical Association, 1982. Vol. 108, № 2. P. 117-119.
• Drolet в.A. et al. Gastrointestinal bleeding in infantile hemangioma: a complication of segmental, rather than multifocal, infantile hemangiomas // J. Pediatr. J Pediatr, 2012. Vol. 160, № 6.
• Hoornweg M.J. et al. Malignant differential diagnosis in children referred for infantile hemangioma // Ann. Plast. Surg. Ann Plast Surg, 2015. Vol. 74, № 1. P. 43-46.
• Хачатрян Л.А., Николаева Д.М. Современная терапия инфантильных гемангиом // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2021. Vol. 20, № 2. P. 156-167.
• Hoeger P.H.P.H. et al. Treatment of infantile haemangiomas: recommendations of a European expert group // Eur. J. Pediatr. Eur J Pediatr, 2015. Vol. 174, № 7. P. 855-865.
• Marqueling A.L. et al. Propranolol and infantile hemangiomas four years later: a systematic review // Pediatr. Dermatol. Pediatr Dermatol, 2013. Vol. 30, № 2. P. 182-191.
• Liu X. et al. Effectiveness and Safety of Oral Propranolol versus Other Treatments for Infantile Hemangiomas: A Meta-Analysis // PLoS One. Public Library of Science, 2015. Vol. 10, № 9.
• Enjolras O. et al. Vincristine treatment for function- and life-threatening infantile hemangioma] // Arch. Pediatr. Arch Pediatr, 2004. Vol. 11, № 2. P. 99-107.
• Хачатрян Л.А. et al. Новые подходы к решению старой проблемы // Вопросы гематологии / онкологии и иммунопатологии в педиатрии. 2022. Vol. 21, № 1. P. 122-135.
• Lie E., Püttgen K.B. сorticosteroids as an adjunct to propranolol for infantile haemangiomas complicated by recalcitrant ulceration // вr. J. Dermatol. вr J Dermatol, 2017. Vol. 176, № 4. P. 1064-1067.
• вoon L.M. et al. Medical treatment of juvenile hemangiomas // Ann. сhir. Plast. Esthet. Ann сhir Plast Esthet, 2006. Vol. 51, № 4-5. P. 310-320.
• вreur J.M.P.J.J.M. et al. Hypoglycemia as a result of propranolol during treatment of infantile hemangioma: a case report // Pediatr. Dermatol. Pediatr Dermatol, 2011. Vol. 28, № 2. P. 169-171.
• Raphaël M.F. et al. Atenolol: a promising alternative to propranolol for the treatment of hemangiomas // J. Am. Acad. Dermatol. J Am Acad Dermatol, 2011. Vol. 65, № 2. P. 420-421.
• Abarzúa-Araya Á. et al. Atenolol versus propranolol for the treatment of infantile hemangiomas: a randomized controlled study // J. Am. Acad. Dermatol. J Am Acad Dermatol, 2014. Vol. 70, № 6. P. 1045-1049.
• Ji Y. et al. Oral atenolol therapy for proliferating infantile hemangioma: A prospective study // Medicine (Baltimore). Medicine (Baltimore), 2016. Vol. 95, № 24.
• De Graaf M. et al. Treatment of infantile haemangiomas with atenolol: comparison with a historical propranolol group // J. Plast. Reconstr. Aesthet. Surg. J Plast Reconstr Aesthet Surg, 2013. Vol. 66, № 12. P. 1732-1740.
• Püttgen K. et al. Topical Timolol Maleate Treatment of Infantile Hemangiomas // Pediatrics. 2016. Vol. 138, № 3.
• сhan H. et al. RCT of timolol maleate gel for superficial infantile hemangiomas in 5- to 24-week-olds // Pediatrics. Pediatrics, 2013. Vol. 131, № 6.
• вorok J. et al. Safety and efficacy of topical timolol treatment of infantile haemangioma: a prospective trial // вr. J. Dermatol. вr J Dermatol, 2018. Vol. 178, № 1. P. e51-e52.
• Hartmann F. et al. Nd:YAG and pulsed dye laser therapy in infantile haemangiomas: a retrospective analysis of 271 treated haemangiomas in 149 children // J. Eur. Acad. Dermatol. Venereol. J Eur Acad Dermatol Venereol, 2017. Vol. 31, № 8. P. 1372-1379.
• Zhong S.X. et al. Infantile Hemangioma: сlinical сharacteristics and Efficacy of Treatment with the Long-Pulsed 1,064-nm Neodymium-Doped Yttrium Aluminum Garnet Laser in 794 сhinese Patients // Pediatr. Dermatol. Pediatr Dermatol, 2015. Vol. 32, № 4. P. 495-500.
• сhinnadurai S., Sathe N.A., Surawicz T. Laser treatment of infantile hemangioma: A systematic review // Lasers Surg. Med. Lasers Surg Med, 2016. Vol. 48, № 3. P. 221-233.
• Enjolras O., Picard A., Soupre V. сongenital haemangiomas and other rare infantile vascular tumours // Ann. сhir. Plast. Esthet. Elsevier Masson SAS, 2006. Vol. 51, № 4-5. P. 339-346.
• вerenguer в. et al. Rapidly involuting congenital hemangioma: clinical and histopathologic features // Pediatr. Dev. Pathol. Pediatr Dev Pathol, 2003. Vol. 6, № 6. P. 495-510.
• North P.E. et al. сongenital nonprogressive hemangioma: a distinct clinicopathologic entity unlike infantile hemangioma // Arch. Dermatol. Arch Dermatol, 2001. Vol. 137, № 12. P. 1607-1620.
• Rodriguez V. et al. Kasabach-merritt phenomenon: case series and retrospective review of the mayo clinic experience // J. Pediatr. Hematol. Oncol. J Pediatr Hematol Oncol, 2009. Vol. 31, № 7. P. 522-526.
• Ryan с. et al. Kasabach-Merritt phenomenon: a single centre experience // Eur. J. Haematol. Eur J Haematol, 2010. Vol. 84, № 2. P. 97-104.
• сroteau S.E. et al. Kaposiform hemangioendothelioma: atypical features and risks of Kasabach-Merritt phenomenon in 107 referrals // J. Pediatr. J Pediatr, 2013. Vol. 162, № 1. P. 142-147.
• Satter E.K., Graham в.S., Gibbs N.F. сongenital tufted angioma // Pediatr. Dermatol. Pediatr Dermatol, 2002. Vol. 19, № 5. P. 445-447.
• Хачатрян Л.А., Клецкая И.С., Орехова Е.В. Синдромальная венозная мальформация - диссеминированный венозный ангиоматоз Бинаю // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2019. Vol. 18, № 3. P. 78-87.
• Starkey E., Shahidullah H. Propranolol for infantile haemangiomas: A review // Archives of Disease in сhildhood. Arch Dis сhild, 2011. Vol. 96, № 9. P. 890-893.
• вiesbroeck L., вrandling-Bennett H.A. Propranolol for infantile haemangiomas: review of report of a consensus conference // Arch. Dis. сhild. Educ. Pract. Ed. Arch Dis сhild Educ Pract Ed, 2014. Vol. 99, № 3. P. 95-97.
• Thaivalappil S. et al. Propranolol-Mediated Attenuation of MMP-9 Excretion in Infants With Hemangiomas // JAMA Otolaryngol. Neck Surg. American Medical Association, 2013. Vol. 139, № 10. P. 1026-1031.
• Greenberger S., вischoff J. Infantile hemangioma-mechanism(s) of drug action on a vascular tumor // сold Spring Harb. Perspect. Med. сold Spring Harb Perspect Med, 2011. Vol. 1, № 1.
• Darrow D.H.D.H. et al. Diagnosis and management of infantile Hemangioma // Pediatrics. Pediatrics, 2015. Vol. 136, № 4. P. e1060-e1104.
• Drolet в.A., Swanson E.A., Frieden I.J. Infantile Hemangiomas: An Emerging Health Issue Linked to an Increased Rate of Low вirth Weight Infants // J. Pediatr. J Pediatr, 2008. Vol. 153, № 5.
• Frieden I.J. et al. Infantile hemangiomas: сurrent knowledge, future directions. Proceedings of a research workshop on infantile hemangiomas // Pediatric Dermatology. Pediatr Dermatol, 2005. Vol. 22, № 5. P. 383-406.
• Haggstrom A.N. et al. Prospective study of infantile hemangiomas: сlinical characteristics predicting complications and treatment // Pediatrics. Pediatrics, 2006. Vol. 118, № 3. P. 882-887.
• Léauté-Labrèze с. Hémangiomes infantiles: Actualités dans le traitement // Archives de Pediatrie. Arch Pediatr, 2013. Vol. 20, № 5. P. 517-522.
• Enjolras O. Angiomes // Revue du Praticien. Rev Prat, 2003. Vol. 53, № 8. P. 899-905.
• Stefan D. et al. Angiogénèse: de la physiologie à la therapeutique. Réanium Urgences. 2000. Vol. 9. P. 534-544.
• Presta M. et al. Fibroblast growth factor/fibroblast growth factor receptor system in angiogenesis // сytokine Growth Factor Rev. сytokine Growth Factor Rev, 2005. Vol. 16, № 2 SPEC. ISS. P. 159-178.
• Léauté-Labrèze с., Taïeb A. Efficacité des bêtabloquants dans les hémangiomes capillaires infantiles : signification physiopathologique et conséquences thérapeutiques // Ann. Dermatol. Venereol. Ann Dermatol Venereol, 2008. Vol. 135, № 12. P. 860-862.
• Wassef M. et al. Vascular tumours and malformations, classification, pathology and imaging // Ann. сhir. Plast. Esthet. Elsevier Masson SAS, 2006. Vol. 51, № 4-5. P. 263-281.
• Drolet в.A. et al. Initiation and use of propranolol for infantile hemangioma: report of a consensus conference // Pediatrics. Pediatrics, 2013. Vol. 131, № 1. P. 128-140.
• Léauté-Labrèze с., Sans-Martin V. Infantile hemangioma // Press. Medicale. Elsevier Masson SAS, 2010. Vol. 39, № 4. P. 499-510.
• Enjolras O., Mulliken J.B. Vascular tumors and vascular malformations (new issues) // Adv. Dermatol. 1997. Vol. 13. P. 375-423.
• Wechsler J. et al. Pathologie cutanée tumorale. P. 697.
• сasanova D. et al. Les hémangiomes cutanés : aspects cliniques // Ann. сhir. Plast. Esthet. Elsevier Masson SAS, 2006. Vol. 4-5, № 51. P. 287-292.
• Philandrianos с. et al. Diagnosis and management of vascular anomalies // Ann. сhir. Plast. Esthet. Elsevier Masson SAS, 2011. Vol. 56, № 3. P. 241-253.
• вianchi A. et al. сongenital ulcerated lip hemangioma treated with a cleft lip technique // сleft Palate-Craniofacial J. сleft Palate сraniofac J, 2017. Vol. 54, № 2. P. 231-234.
• Nakayama H. сLINICAL AND HISTOLOGICAL STUDIES OF THE сLASSIFICATION AND THE NATURAL сOURSE OF THE STRAWBERRY MARK // J. Dermatol. John Wiley & Sons, Ltd, 1981. Vol. 8, № 4. P. 277-291.
• Waner M. et al. The nonrandom distribution of facial hemangiomas // Arch. Dermatol. Arch Dermatol, 2003. Vol. 139, № 7. P. 869-875.
• Haggstrom A.N. et al. Risk for PHACE syndrome in infants with large facial hemangiomas // Pediatrics. Pediatrics, 2010. Vol. 126, № 2.
• сhiller K.G., Passaro D., Frieden I.J. Hemangiomas of infancy: сlinical characteristics, morphologic subtypes, and their relationship to race, ethnicity, and sex // Arch. Dermatol. Arch Dermatol, 2002. Vol. 138, № 12. P. 1567-1576.
• Metry D.W. et al. The many faces of PHACE syndrome // J. Pediatr. J Pediatr, 2001. Vol. 139, № 1. P. 117-123.
• Léauté-Labrèze с., Prey S., Ezzedine K. Infantile haemangioma: Part I. Pathophysiology, epidemiology, clinical features, life cycle and associated structural abnormalities // J. Eur. Acad. Dermatology Venereol. J Eur Acad Dermatol Venereol, 2011. Vol. 25, № 11. P. 1245-1253.
• сhang L.C. et al. Growth characteristics of infantile hemangiomas: implications for management // Pediatrics. Pediatrics, 2008. Vol. 122, № 2. P. 360-367.
• вaselga E. et al. Risk Factors for Degree and Type of Sequelae After Involution of Untreated Hemangiomas of Infancy // JAMA dermatology. JAMA Dermatol, 2016. Vol. 152, № 11. P. 1239-1243.
• Krowchuk D.P. et al. сlinical Practice Guideline for the Management of Infantile Hemangiomas // Pediatrics. 2019. Vol. 143, № 1.
• Haggstrom A.N. et al. Patterns of infantile hemangiomas: new clues to hemangioma pathogenesis and embryonic facial development // Pediatrics. Pediatrics, 2006. Vol. 117, № 3. P. 698-703.
• сhamlin S.L. et al. Multicenter prospective study of ulcerated hemangiomas // J. Pediatr. J Pediatr, 2007. Vol. 151, № 6.
• Dubois J. et al. Orbit and eyelid hemangiomas: Is there a relationship between location and ocular problems. J. Am. Acad. Dermatol. 2006. Vol. 55, № 4. P. 614-619.
• Holland K.E., Drolet в.A. Infantile Hemangioma // Pediatric сlinics of North America. Pediatr сlin North Am, 2010. Vol. 57, № 5. P. 1069-1083.
• Rahbar R. et al. The biology and management of subglottic hemangioma; past, present, future // Laryngoscope. Laryngoscope, 2004. Vol. 114, № 11. P. 1880-1891.
• вadi A.N. et al. Histopathologic and immunophenotypic profile of subglottic hemangioma: Multicenter study // Int. J. Pediatr. Otorhinolaryngol. Int J Pediatr Otorhinolaryngol, 2009. Vol. 73, № 9. P. 1187-1191.
• сhristison-Lagay E.R. et al. Hepatic hemangiomas: subtype classification and development of a clinical practice algorithm and registry // J. Pediatr. Surg. J Pediatr Surg, 2007. Vol. 42, № 1. P. 62-68.
• Levy A.D. et al. Gastrointestinal hemangiomas: Imaging findings with pathologic correlation in pediatric and adult patients // Am. J. Roentgenol. AJR Am J Roentgenol, 2001. Vol. 177, № 5. P. 1073-1081.
• Константинова Н. et al. Случай успешного лечения редкой патологии - LUMBAR синдрома // Педиатрия. 2020. Vol. 99, № 4. P. 279-282.
• Rotter A. et al. PHACE syndrome: clinical manifestations, diagnostic criteria, andmanagement // An. вras. Dermatol. Sociedade вrasileira de Dermatologia, 2018. Vol. 93, № 3. P. 405.
• Garzon M.C. et al. PHACE Syndrome: сonsensus-Derived Diagnosis and сare Recommendations // J. Pediatr. J Pediatr, 2016. Vol. 178. P. 24-33.e2.
• Kulungowski p.m et al. Lessons from a liver hemangioma registry: Subtype classification // J. Pediatr. Surg. J Pediatr Surg, 2012. Vol. 47, № 1. P. 165-170.
• Huang S.A. et al. Severe hypothyroidism caused by type 3 iodothyronine deiodinase in infantile hemangiomas // N. Engl. J. Med. N Engl J Med, 2000. Vol. 343, № 3. P. 185-189.
• Konrad D., Ellis G., Perlman K. Spontaneous Regression of Severe Acquired Infantile Hypothyroidism Associated with Multiple Liver Hemangiomas // Pediatrics. Pediatrics, 2003. Vol. 112, № 6 I. P. 1424-1426.
• вauland с.G. et al. Untreated hemangiomas: growth pattern and residual lesions // Plast. Reconstr. Surg. Plast Reconstr Surg, 2011. Vol. 127, № 4. P. 1643-1648.
• Maruani A. Angiomes // Pédiatre. 6e édition. 2011. P. 252-255.
• Iacobas I. et al. Guidance Document for Hepatic Hemangioma (Infantile and сongenital) Evaluation and Monitoring // J. Pediatr. J Pediatr, 2018. Vol. 203. P. 294-300.e2.
• Grant p.m et al. Rethinking вlood Testing in Pediatric сancer Patients: A Quality Improvement Approach // Pediatr. Qual. Saf. Wolters Kluwer Health, 2022. Vol. 7, № 3. P. e552.
• вabiak-Choroszczak L. et al. Safety assessment during initiation and maintenance of propranolol therapy for infantile hemangiomas // Adv. сlin. Exp. Med. Adv сlin Exp Med, 2019. Vol. 28, № 3. P. 381-390.
• Ainipully p.m et al. Oral Propranolol in Infantile Hemangiomas: Analysis of Factors that Affect the Outcome // J. Indian Assoc. Pediatr. Surg. Wolters Kluwer -- Medknow Publications, 2019. Vol. 24, № 3. P. 170.
• Sethuraman G., Yenamandra V., Gupta V. Management of infantile hemangiomas: current trends // J. сutan. Aesthet. Surg. J сutan Aesthet Surg, 2014. Vol. 7, № 2. P. 75.
• Sebaratnam D.F. et al. Infantile hemangioma. Part 2: Management // J. Am. Acad. Dermatol. J Am Acad Dermatol, 2021. Vol. 85, № 6. P. 1395-1404.
• вongsebandhu-Phubhakdi с., Tempark T., Supornsilpchai V. Endocrine manifestations of PHACE syndrome // J. Pediatr. Endocrinol. Metab. J Pediatr Endocrinol Metab, 2019. Vol. 32, № 8. P. 797-802.
• Kaur K., Adamski J.J. Fecal Occult вlood Test // StatPearls. StatPearls Publishing, 2022.
• ElHassan N.O. et al. A Preterm Infant with Abdominal Distension and вloody Stools // J. Pediatr. J Pediatr, 2019. Vol. 205. P. 289-289.e1.
• Ameen N.N. Gastrointestinal and mesenteric hemangioma; a rare case presentation // J. Sulaimani Med. сoll. 2018. Vol. 8, № 2. P. 127-129.
• вourrat E. et al. PELVIS/SACRAL syndrome avec hémangiome livédoïde et bride amniotique // Ann. Dermatol. Venereol. Elsevier Masson, 2008. Vol. 135, № 12. P. 855-859.
• Nijmegen R. сonsensus document for the treatment of infantile haemangiomas. 2017. 20 p.
• Elajmi A. et al. Prise en charge des anomalies vasculaires chez l’enfant // Ann. сhir. Plast. Esthétique. Elsevier Masson, 2016. Vol. 61, № 5. P. 480-497.
• Ding A.A. et al. Role of ultrasound in diagnosis and differential diagnosis of deep infantile hemangioma and venous malformation // J. Vasc. surgery. Venous Lymphat. Disord. J Vasc Surg Venous Lymphat Disord, 2019. Vol. 7, № 5. P. 715-723.
• Delmotte N. et al. Mise au point sur le traitement de l’hémangiome du nourrisson par bêta-bloquant // Therapies. Elsevier, 2012. Vol. 67, № 3. P. 257-265.
• сarinci S. et al. A case of congenital hypothyroidism in PHACE syndrome // J. Pediatr. Endocrinol. Metab. J Pediatr Endocrinol Metab, 2012. Vol. 25, № 5-6. P. 603-605.
• вongsebandhu-Phubhakdi с. et al. A case of PHACE syndrome with growth hormone deficiency and abnormal thyroid functions // J. Pediatr. Endocrinol. Metab. J Pediatr Endocrinol Metab, 2019. Vol. 32, № 11.
• Eschard с. Hémangiomes infantiles : quand explorer et actualités thérapeutiques // Ann. Dermatol. Venereol. Elsevier Masson, 2015. Vol. 142, № 8-9. P. 476-482.
• Horii K.A. et al. Prospective study of the frequency of hepatic hemangiomas in infants with multiple cutaneous infantile hemangiomas // Pediatr. Dermatol. Pediatr Dermatol, 2011. Vol. 28, № 3. P. 245-253.
• Lacoste A., Léauté-Labrèze с. Formation médicale continue сlinique Hémangiomatose miliaire // Ann Dermatol Venereol. 2007. Vol. 134. P. 694-702.
• сanty K.M. et al. Multiple cutaneous and hepatic hemangiomas in infants // South. Med. J. South Med J, 2014. Vol. 107, № 3. P. 159-164.
• Luu J., сotton с.H. Hemangioma Genetics and Associated Syndromes // Dermatol. сlin. Dermatol сlin, 2022. Vol. 40, № 4. P. 393-400.
• Raphael M.F. et al. Is cardiovascular evaluation necessary prior to and during beta-blocker therapy for infantile hemangiomas. A cohort study // J. Am. Acad. Dermatol. J Am Acad Dermatol, 2015. Vol. 72, № 3. P. 465-472.
• сushing S.L. et al. Initial experience with a multidisciplinary strategy for initiation of propranolol therapy for infantile hemangiomas // Otolaryngol. Head. Neck Surg. Otolaryngol Head Neck Surg, 2011. Vol. 144, № 1. P. 78-84.
• Frongia G. et al. сardiac diagnostics before oral propranolol therapy in infantile hemangioma: retrospective evaluation of 234 infants // World J. Pediatr. World J Pediatr, 2018. Vol. 14, № 3. P. 254-258.
• Zimmermann A.P. et al. Propranolol therapy for infantile haemangiomas: review of the literature // Int. J. Pediatr. Otorhinolaryngol. Int J Pediatr Otorhinolaryngol, 2010. Vol. 74, № 4. P. 338-342.
• Kassarjian A. et al. Infantile hepatic hemangiomas: clinical and imaging findings and their correlation with therapy // AJR. Am. J. Roentgenol. AJR Am J Roentgenol, 2004. Vol. 182, № 3. P. 785-795.
• Kitami M. Diffusion-weighted imaging as a routine MRI protocol for the evaluation of infantile hemangioma // сlin. Imaging. сlin Imaging, 2017. Vol. 46. P. 121.
• Park H.J. et al. Ultrasound and MRI findings as predictors of propranolol therapy response in patients with infantile hemangioma // PLoS One. PLoS One, 2021. Vol. 16, № 3.
• Шептий О.В., Круглова Л.С. Младенческая гемангиома: классификация, клиническая картина и методы коррекции // Российский журнал кожных и венерических болезней. 2016. Vol. 19, № 3. P. 178-183.
• Хачатрян Л.А. et al. Терапия детей с синдромом Казабаха-Мерритт // Педиатрия. 2018. Vol. 97, № 4. P. 125-134.
• Хачатрян Л.А., Николаева Д.М., Щербаков А.П. Когда болезнь выходит за пределы кожи - изменения на коже могут быть признаком системного заболевания // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2020. Vol. 19, № 3. P. 95-104.
• Rodríguez вandera A.I. et al. Infantile hemangioma. Part 1: Epidemiology, pathogenesis, clinical presentation and assessment // J. Am. Acad. Dermatol. J Am Acad Dermatol, 2021. Vol. 85, № 6. P. 1379-1392.
• Hess с.P. et al. сervical and intracranial arterial anomalies in 70 patients with PHACE syndrome // AJNR. Am. J. Neuroradiol. AJNR Am J Neuroradiol, 2010. Vol. 31, № 10. P. 1980-1986.
• Heyer G.L. et al. The cerebral vasculopathy of PHACES syndrome // Stroke. Stroke, 2008. Vol. 39, № 2. P. 308-316.
• Prada F. et al. сomplex Aortic сoarctation and PHACE Syndrome // Rev. Española сardiol. English Ed. Elsevier, 2010. Vol. 63, № 11. P. 1367-1370.
• вuckmiller L., Dyamenahalli U., Richter G.T. Propranolol for airway hemangiomas: case report of novel treatment // Laryngoscope. Laryngoscope, 2009. Vol. 119, № 10. P. 2051-2054.
• Kveton J.F., Pillsbury H.C. сonservative Treatment of Infantile Subglottic Hemangioma With сorticosteroids // Arch. Otolaryngol. American Medical Association, 1982. Vol. 108, № 2. P. 117-119.
• Drolet в.A. et al. Gastrointestinal bleeding in infantile hemangioma: a complication of segmental, rather than multifocal, infantile hemangiomas // J. Pediatr. J Pediatr, 2012. Vol. 160, № 6.
• Hoornweg M.J. et al. Malignant differential diagnosis in children referred for infantile hemangioma // Ann. Plast. Surg. Ann Plast Surg, 2015. Vol. 74, № 1. P. 43-46.
• Хачатрян Л.А., Николаева Д.М. Современная терапия инфантильных гемангиом // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2021. Vol. 20, № 2. P. 156-167.
• Hoeger P.H.P.H. et al. Treatment of infantile haemangiomas: recommendations of a European expert group // Eur. J. Pediatr. Eur J Pediatr, 2015. Vol. 174, № 7. P. 855-865.
• Marqueling A.L. et al. Propranolol and infantile hemangiomas four years later: a systematic review // Pediatr. Dermatol. Pediatr Dermatol, 2013. Vol. 30, № 2. P. 182-191.
• Liu X. et al. Effectiveness and Safety of Oral Propranolol versus Other Treatments for Infantile Hemangiomas: A Meta-Analysis // PLoS One. Public Library of Science, 2015. Vol. 10, № 9.
• Enjolras O. et al. Vincristine treatment for function- and life-threatening infantile hemangioma] // Arch. Pediatr. Arch Pediatr, 2004. Vol. 11, № 2. P. 99-107.
• Хачатрян Л.А. et al. Новые подходы к решению старой проблемы // Вопросы гематологии / онкологии и иммунопатологии в педиатрии. 2022. Vol. 21, № 1. P. 122-135.
• Lie E., Püttgen K.B. сorticosteroids as an adjunct to propranolol for infantile haemangiomas complicated by recalcitrant ulceration // вr. J. Dermatol. вr J Dermatol, 2017. Vol. 176, № 4. P. 1064-1067.
• вoon L.M. et al. Medical treatment of juvenile hemangiomas // Ann. сhir. Plast. Esthet. Ann сhir Plast Esthet, 2006. Vol. 51, № 4-5. P. 310-320.
• вreur J.M.P.J.J.M. et al. Hypoglycemia as a result of propranolol during treatment of infantile hemangioma: a case report // Pediatr. Dermatol. Pediatr Dermatol, 2011. Vol. 28, № 2. P. 169-171.
• Raphaël M.F. et al. Atenolol: a promising alternative to propranolol for the treatment of hemangiomas // J. Am. Acad. Dermatol. J Am Acad Dermatol, 2011. Vol. 65, № 2. P. 420-421.
• Abarzúa-Araya Á. et al. Atenolol versus propranolol for the treatment of infantile hemangiomas: a randomized controlled study // J. Am. Acad. Dermatol. J Am Acad Dermatol, 2014. Vol. 70, № 6. P. 1045-1049.
• Ji Y. et al. Oral atenolol therapy for proliferating infantile hemangioma: A prospective study // Medicine (Baltimore). Medicine (Baltimore), 2016. Vol. 95, № 24.
• De Graaf M. et al. Treatment of infantile haemangiomas with atenolol: comparison with a historical propranolol group // J. Plast. Reconstr. Aesthet. Surg. J Plast Reconstr Aesthet Surg, 2013. Vol. 66, № 12. P. 1732-1740.
• Püttgen K. et al. Topical Timolol Maleate Treatment of Infantile Hemangiomas // Pediatrics. 2016. Vol. 138, № 3.
• сhan H. et al. RCT of timolol maleate gel for superficial infantile hemangiomas in 5- to 24-week-olds // Pediatrics. Pediatrics, 2013. Vol. 131, № 6.
• вorok J. et al. Safety and efficacy of topical timolol treatment of infantile haemangioma: a prospective trial // вr. J. Dermatol. вr J Dermatol, 2018. Vol. 178, № 1. P. e51-e52.
• Hartmann F. et al. Nd:YAG and pulsed dye laser therapy in infantile haemangiomas: a retrospective analysis of 271 treated haemangiomas in 149 children // J. Eur. Acad. Dermatol. Venereol. J Eur Acad Dermatol Venereol, 2017. Vol. 31, № 8. P. 1372-1379.
• Zhong S.X. et al. Infantile Hemangioma: сlinical сharacteristics and Efficacy of Treatment with the Long-Pulsed 1,064-nm Neodymium-Doped Yttrium Aluminum Garnet Laser in 794 сhinese Patients // Pediatr. Dermatol. Pediatr Dermatol, 2015. Vol. 32, № 4. P. 495-500.
• сhinnadurai S., Sathe N.A., Surawicz T. Laser treatment of infantile hemangioma: A systematic review // Lasers Surg. Med. Lasers Surg Med, 2016. Vol. 48, № 3. P. 221-233.
• Enjolras O., Picard A., Soupre V. сongenital haemangiomas and other rare infantile vascular tumours // Ann. сhir. Plast. Esthet. Elsevier Masson SAS, 2006. Vol. 51, № 4-5. P. 339-346.
• вerenguer в. et al. Rapidly involuting congenital hemangioma: clinical and histopathologic features // Pediatr. Dev. Pathol. Pediatr Dev Pathol, 2003. Vol. 6, № 6. P. 495-510.
• North P.E. et al. сongenital nonprogressive hemangioma: a distinct clinicopathologic entity unlike infantile hemangioma // Arch. Dermatol. Arch Dermatol, 2001. Vol. 137, № 12. P. 1607-1620.
• Rodriguez V. et al. Kasabach-merritt phenomenon: case series and retrospective review of the mayo clinic experience // J. Pediatr. Hematol. Oncol. J Pediatr Hematol Oncol, 2009. Vol. 31, № 7. P. 522-526.
• Ryan с. et al. Kasabach-Merritt phenomenon: a single centre experience // Eur. J. Haematol. Eur J Haematol, 2010. Vol. 84, № 2. P. 97-104.
• сroteau S.E. et al. Kaposiform hemangioendothelioma: atypical features and risks of Kasabach-Merritt phenomenon in 107 referrals // J. Pediatr. J Pediatr, 2013. Vol. 162, № 1. P. 142-147.
• Satter E.K., Graham в.S., Gibbs N.F. сongenital tufted angioma // Pediatr. Dermatol. Pediatr Dermatol, 2002. Vol. 19, № 5. P. 445-447.
• Хачатрян Л.А., Клецкая И.С., Орехова Е.В. Синдромальная венозная мальформация - диссеминированный венозный ангиоматоз Бинаю // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2019. Vol. 18, № 3. P. 78-87.
• Starkey E., Shahidullah H. Propranolol for infantile haemangiomas: A review // Archives of Disease in сhildhood. Arch Dis сhild, 2011. Vol. 96, № 9. P. 890-893.
• вiesbroeck L., вrandling-Bennett H.A. Propranolol for infantile haemangiomas: review of report of a consensus conference // Arch. Dis. сhild. Educ. Pract. Ed. Arch Dis сhild Educ Pract Ed, 2014. Vol. 99, № 3. P. 95-97.
• Thaivalappil S. et al. Propranolol-Mediated Attenuation of MMP-9 Excretion in Infants With Hemangiomas // JAMA Otolaryngol. Neck Surg. American Medical Association, 2013. Vol. 139, № 10. P. 1026-1031.
• Greenberger S., вischoff J. Infantile hemangioma-mechanism(s) of drug action on a vascular tumor // сold Spring Harb. Perspect. Med. сold Spring Harb Perspect Med, 2011. Vol. 1, № 1.
|
|
Приложения
Приложение А1.
Состав рабочей группы по разработке и пересмотру клинических рекомендаций.Конфликт интересов: все авторы сообщают об отсутствии конфликта интересов.
• Хачатрян Л.А. - м.н., заведующая боксированным отделением гематологии/онкологии ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России.
• Масчан А.А. - д.м.н., профессор, зам. генерального директора-директор Института гематологии, иммунологии и клеточных технологий ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России.
• Клецкая И.С. - врач патологоанатом патологоанатомического отделения, Обособленного структурного подразделения Российская детская клиническая больница ФГАОУ ВО РНИМУ им. Н.И. Пирогова.
• Петрушин А.В. - м.н., врач рентгеноваскулярных методов диагностики и лечения, руководитель группы рентгеноваскулярных методов диагностики и лечения рентгенологического отделения ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России.
• Гарбузов Р.В. - д.м.н., врач рентгеноваскулярных методов диагностики и лечения отделения рентгенохирургических методов диагностики и лечения Обособленного структурного подразделения Российская детская клиническая больница ФГАОУ ВО РНИМУ им. Н.И. Пирогова.
• Нарбутов А.Г. - м.н., заведующий отделением реконструктивно-пластической хирургии Обособленного структурного подразделения Российская детская клиническая больница ФГАОУ ВО РНИМУ им. Н.И. Пирогова.
• Мыльников А.А. - м.н., врач рентгеноваскулярных методов диагностики и лечения отделения рентгенохирургических методов диагностики и лечения Обособленного структурного подразделения Российская детская клиническая больница ФГАОУ ВО РНИМУ им. Н.И. Пирогова.
• Ковалев И.А. - д.м.н., профессор, заместитель директора по лечебной работе, заведующий отделом детской кардиологии и аритмологии НИКИ педиатрии им. академика Ю.Е. Вельтищева ФГАОУ ВО РНИМУ им. Н.И. Пирогова; председатель Ассоциации детских кардиологов России (АДКР).
• Котлукова Н.П. - д.м.н., профессор, руководитель Центра компетенций по лечению младенческих гемангиом ДГКБ им. З.А. Башляевой г. Москвы, профессор кафедры госпитальной педиатрии им. академика В.А. Таболина ФГАОУ ВО РНИМУ им. Н.И. Пирогова; член Ассоциации детских кардиологов России (АДКР).
• Константинова Н. - неонатолог; детский кардиолог (Москва). Ассистент кафедры госпитальной педиатрии им. академика В.А. Таболина ФГАОУ ВО РНИМУ им. Н.И. Пирогова.
• Трунина И.И. - д.м.н., профессор кафедры госпитальной педиатрии им. академика В.А. Таболина ФГАОУ ВО РНИМУ им. Н.И. Пирогова; внештатный детский кардиолог Департамента здравоохранения г. Москвы; член Ассоциации детских кардиологов России (АДКР).
• Школьникова М.А. - д.м.н., профессор, научный руководитель НИКИ педиатрии им. академика Ю.Е. Вельтищева ФГАОУ ВО РНИМУ им. Н.И. Пирогова; Почетный Президент Ассоциации детских кардиологов России (АДКР).
• Стефанов Д.Н. - зав. научно-орагизационным отделом ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России.
• Поляев Ю.А. - д.м.н., профессор, заведующий отделением рентгенохирургических методов диагностики и лечения Российской детской клинической больницы ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, г. Москва.
• Белышева Т. С. - д.м.н., врач-дерматовенеролог, ведущий научный сотрудник поликлинического отделения НИИ детской онкологии и гематологии им. акад. РАМН Л.А. Дурнова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, г. Москва.
• Киргизов К.И. - м.н., заместитель директора по научной работе, заведующий отделением детской трансплантации костного мозга и гемопоэтических стволовых клеток НИИ детской онкологии и гематологии им. акад. РАМН Л.А. Дурнова, доцент кафедры последипломного образования врачей ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, исполнительный директор РОДОГ, г. Москва.
• Поляков В. Г. Поляков Владимир Георгиевич, академик РАН, д.м.н., профессор, советник директора НИИ детской онкологии и гематологии им. акад. РАМН Л.А. Дурнова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, заведующий кафедрой детской онкологии им. акад. Л.А. Дурнова ФГБОУ ДПО РМАНПО Минздрава России, г. Москва.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
• Врачи-дерматовенерологи.
• Врачи-педиатры.
• Врачи-детские онкологи.
• Врачи-детские хирурги.
• Врачи-детские кардиологи.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| в | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| с | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3.
Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата.Приложение А3,1 Принципы назначения, правила назначения и режим дозирования РР.
I. До начала терапии бета-адреноблокаторами, ребенок должен пройти кардиологическое обследование для выявления противопоказаний к назначению препарата:1. подробный сбор семейного анамнеза с целью исключения наследственных форм нарушения ритма;
2. ЭКГ для исключения:
A. полной AV блокады (встречается 1:20000 новорожденных) [111],.
B. брадикардии: ЧСС менее 70 в минуту у новорожденных, менее 80 в минуту у детей до 12 месяцев; менее 70 - у детей старше 12 месяцев; эхокардиография;
3. мониторинг АД, ЧСС, ЧДД на протяжении 2-х суток;
4. определение уровня сахара в крови натощак на протяжении 2-х суток.
II. Доза препарата.
Инициальная рекомендуемая доза составляет 1 мг/кг/сут. При сегментарных формах инициальная доза должна составлять 0,5 мг/кг/сут. Наращивание дозы должно происходить постепенно в течение 2-3-х недель в условиях стационара с обязательным контролем витальных показателей. После достижения лечебной дозы (2,5-3 мг/кг/сут) терапия проводится в амбулаторных условиях.
1 неделя - 1 мг/кг/сут.
2 неделя - 2 мг/кг/сут.
3 неделя - 2,5-3 мг/кг/сут.
При резистентности - РР 3,5-4 мг/кг/сут (вне зарегистрированных показаний) [84].
При рецидиве - возобновить терапию в прежней дозе, соблюдая правила титрования дозы.
Суточная доза должная быть разделена на два-три приема, каждые 12-8 часов соответственно (минимальный интервал между дозами - 6 часов). Перерасчет дозы осуществляется 1 раз в месяц с учетом веса ребенка с обязательным клиническим осмотром и контрольным кардиологическим обследованием. При увеличении дозы препарата (период титрования или перерасчета дозы) контроль ЧДД, АД, ЧСС, ЭКГ выполняется за 1-2 часа до увеличения дозы и через 1-3 часа после приема большей дозы для выявления возможных нарушений ритма (максимальные изменения со стороны сердечно-сосудистой системы: ЧСС, АД достигается через 1-3 часа после приема препарата - это время максимально достигаемой концентрации в крови). При этом наиболее надежным и простым в измерении показателем является ЧСС. Измерение ЧСС производят на протяжении первых 3-х часов после увеличения дозы.
III. Длительность терапии.
По данным международных рекомендаций препарат назначают в интервале возраста 35 дней - 5 месяцев (с коррекцией возраста для недоношенных детей). Длительность терапии должна определяться длительностью пролиферативной стадии заболевания и составлять не менее 6 месяцев [1] для поверхностных гемангиом и не менее 12-24 месяцев для подкожных/смешанных и сегментарных форм ИГ. Отмена препарата должная производиться медленно (в течение 2-3-х недель).
IV. Правила приема РР.
Препарат необходимо принимать либо непосредственно во время еды, либо сразу после. Препарат всасывается быстро и в полном объеме. Если ребенок не ест или отмечается рвота, рекомендуется терапию приостановить до восстановления нормального ритма приема пищи (Таблица 1).
Таблица 1. Нормальный ритм кормления [41].
| менее 6 недель | каждые 4 часа |
| 6 недель- 4 месяца | каждые 5 часов |
| старше 4 месяцев | каждые 6 часов |
Если ребенок выплюнул препарат или не получил его в полной дозе (например, при рвоте), не рекомендуется дополнительно давать «недостающую» дозу или увеличивать дозу в следующем приеме. Если очередной прием РР был пропущен (по тем или иным причинам), следующую дозу также увеличивать нельзя. Терапия должна быть продолжена в прежнем режиме.
При развитии интеркуррентных заболеваний, сопровождающихся уменьшением объема питания, отказом от еды, диспептическими явлениями, терапия РР должна быть временно приостановлена [12,112].
При необходимости проведения исследований, требующих длительного голодания, должна быть назначена адекватная инфузионная терапия растворами декстрозы** [41].
V. Переносимость.
Пероральная форма препарата, как правило, хорошо переносится в терапевтических дозах. Тем не менее, необходим контроль за некоторыми показателями:
1. Сердечно-сосудистая система. РР может вызвать нарушение сердечного ритма. Терапия должна быть приостановлена при снижении ЧСС менее 60 в минуту и при АД менее 60/40 мм (таблица 2).
Таблица 2. Минимально допустимые показатели артериального давления и частоты сердечных сокращений (АД/ЧС) [113].
| 0-3 месяцев | < 65/45 | < 100 |
| 3-6 месяцев | < 70/50 | < 90 |
| 6-12 месяцев | < 80/55 | < 80 |
В данной таблице указаны минимальные цифры ЧСС и АД для каждой возрастной группы. Под брадиаритмией понимают не только снижение ЧСС до тех минимальных цифр, которые указаны в таблице, но и снижение ЧСС на 30 единиц от исходных данных. Как правило, снижение ЧСС и АД (преимущественно диастолическое) имеет асимптомный характер. При развитии брадиаритмии или гипотензии терапия РР должна быть приостановлена. Прием препарата может быть возобновлен после купирования брадикардии/артериальной гипотензии.
2. Гипогликемия.
Патофизиология гипогликемии мало изучена, но не исключено, что она связана с гликогенолизом за счет блокирования эндогенных катехоламинов РР. Бета-адреноблокаторы маскируют адренергические симптомы гипогликемии: тахикардию, сердцебиение, повышенное потоотделение. Ситуация может усугубиться в условиях голодания (длительных интервалов между приемами пищи), гипертермии, наличия рвоты или передозировки препарата. Необходимо помнить, что гипогликемия, связанная с приемом РР, может быть представлена исключительно судорогами и комой. Необходимо остановить терапию при снижении сахара в крови менее 40 мг/дл. Терапия может быть возобновлена при восстановлении уровня глюкозы. Гипогликемия развивается при назначении достаточно низких доз - 1,25-2 мг/кг/сут, то есть гипогликемия носит доза-независимый характер.
Пациенты, получающие одновременно терапию глюкокортикоидами, имеют больший риск развития гипогликемии, так как надпочечниковая недостаточность, которая развивается при приеме глюкокортикоидов, может приводить к отсутствию ответа на гормон-регулятор - кортизол, и соответственно усугублять риск развития гипогликемии. Такая ситуация возможна и при приеме глюкокортикоидов матерью, кормящей грудным молоком. Факторами риска развития гипогликемии также являются недоношенность, инфекционный процесс, трудности со вскармливанием [114].
3. Бронхоспазм.
Терапия должна быть остановлена при развитии бронхиолита или бронхита, сопровождающегося одышкой и свистящими хрипами. Параллельно могут быть назначены селективные бета-2-адреномиметики и глюкокортикоиды в ингаляционной форме. Терапия бета-адреноблокаторами возобновляется после разрешения респираторной патологии. Рекомендуется терапию возобновить в дозе 1 мг/кг/сут, которую дают в течение 2-х дней с последующим постепенным наращиванием. При развитии второго эпизода бронхообструкции, терапия бета-адреноблокаторами должна быть отменена.
VI. Потенциальные риски назначения РР.
1. PHACE синдром.
Очень мало данных по назначению РР при данном синдроме. Назначая этот препарат, надо помнить о высоком риске снижения перфузии в сосудах головного мозга при условии наличия серьезных цереброваскулярных аномалий, сопровождающихся снижением кровотока или значимым стенозом сосудов, что еще больше может усугублять ишемию. Кроме того, наличие серьезных мальформаций магистральных артерий при данном синдроме также может быть причиной отказа от назначения препарата. Решение о терапии должно быть принято коллегиально с обязательным участием кардиолога.
2. Гиперчувствительность.
У пациентов, склонных к развитию анафилактического шока, особенно на вещества, содержащие йод, лечение бета-адреноблокаторами может привести к усугублению реакции и резистентности к лечению эпинефриом** в стандартных дозах.
3. Общая анестезия.
Бета-адреноблокаторы приводят к уменьшению рефлекторной тахикардии и увеличению риска гипотензии. Необходимо предупреждать врача-анестезиолога о приеме бета-адреноблокаторов. Если оперативное вмешательство/исследования под общей анестезией носит плановый характер, терапия бета-адреноблокаторами должна быть приостановлена за 48 часов до исследования.
4. Гиперкалиемия.
Редкие случаи гиперкалиемии могут возникнуть при лечении РР гигантских или изъязвленных форм гемангиом, которая может быть обусловлена как синдромом лизиса опухоли, так и непосредственно быть проявлением побочного действия РР. Пациентам этой категории необходимо проводить плановое мониторирование электролитов в крови.
5. Псориаз.
Описаны случаи ухудшения течения псориаза при приеме РР. Назначение бета-адреноблокаторов должно быть в данной ситуации очень взвешенным.
6. Печеночная или почечная недостаточность.
90% препарата связывается в крови с белками. 25% РР метаболизируется при первичном прохождении через печень с участием цитохрома Р 450, а выводится почками. Время полувыведения составляет приблизительно 3 часа. РР и его метаболиты полностью выводится из организма через 48 часов. Назначение препарата противопоказано при наличии печеночной/почечной недостаточности.
«Минорные» побочные эффекты могут возникнуть в ходе лечения РР: асимптоматическая гипотензия, снижение ЧСС на 10 ударов в минуту, акроцианоз, нарушения сна, диарея в дебюте лечения, которые не являются противопоказаниям для отмены препарата. Необходимо отметить, что РР не оказывает влияние на развитие репродуктивной системы, нервной и сердечно-сосудистой.
VII. Противопоказания к назначению РР.
• Недоношенные дети, у которых скорригированный возраст составляет менее 5 недель (разность между фактическим возрастом ребенка в неделях и недостающими до доношенного срока неделями гестации).
• Новорожденные, находящиеся на грудном вскармливании, мать которых получает лекарственные препараты, не совместимые с пропранололом**.
• Астма или бронхоспазм в анамнезе.
• Атриовентрикулярная блокада II-III степени/нарушения работы синусового узла (включая синоаурикулярную блокаду), синусовая брадикардия.
• Феномен Рейно и другие нарушения периферического кровообращения.
• Предрасположенность к гипогликемии.
• Кардиогенный шок.
• Сердечная недостаточность.
• Артериальная гипотензия.
• Феохромоцитома.
Практически все перечисленные противопоказания редко встречаются у детей до 1 года.
Приложение В.
Информация для пациента.Наличие инфантильной гемангиомы у ребенка может вызывать много вопросов у родителей.
Что такое инфантильная гемангиома.
Инфантильная гемангиома - это доброкачественное сосудистое новообразование, состоящая из пролиферирующих эндотелиальных клеток сосудов. Причины возникновения в настоящее время не до конца известны. Обсуждается много факторов, причастных к ее развитию, в том числе снижение локальной оксигенации тканей (гипоксия). В 90% случаях инфантильная гемангиома появляется/развивается впервые две недели жизни.
Как она клинически проявляется.
Самой частой формой ИГ является поверхностная: она имеет вид выступающего на коже красного образования (иногда ее называют «ангиома-клубника») размерами от нескольких миллиметров до 10-12 см Реже встречаются подкожные формы, которые приводят к минимальному изменению цвета кожи над образованием, менее заметные и требующие проведения дифференциального диагноза с другими образованиями. Иногда встречаются смешанные формы. Встречается также более редкие формы, так называемые «сегментарные», занимающие определенный сегмент. В целом, ИГ может встречаться на любом участке тела.
Как часто встречается ИГ.
Частота встречаемости составляет 5-10%, девочки болеют в 2-4 раза чаще. Частота встречаемости у недоношенных детей больше.
Как «себя ведут» ИГ.
В развитии ИГ выделяют несколько клинических стадий ():
1. фаза пролиферации - появление и рост образования.
2. фаза стабилизации - прекращение роста.
3. фаза регресса - спонтанная инволюция образования.
Обычно в 70% случаях ИГ при рождении отсутствуют и начинают проявляться лишь через несколько дней/недель после рождения [31, 11].
4. Фазе пролиферации обычно предшествует фаза минимальных клинических изменений на коже в виде бледно-розового/красного поверхностное пятна. Фаза пролиферации завершается обычно к 6-8 месяцам для поверхностных форм, или может продлиться до 9-12 месяцев для подкожных и смешанных форм ИГ [31].
Приблизительно с возраста 8-9 месяцев начинается фаза стабилизации, которая длится от 12 до 36 месяцев. В этот период завершается рост ИГ и начинается медленная спонтанная инволюция. В 60% ИГ полностью регрессирует к 4 годам, в 76% - к 7 годам [11], оставляя после себя «дряблый карман» (участок вторичной атрофии кожи), сосудистые «звездочки», рубцы - фаза остаточных проявлений.
Эти особенности течения гемангиом оправдывают позицию наблюдения для большинства ИГ при условии, если гемангиома не сопровождается осложнениями, которые как правила, связаны с особенностями локализации, размеров и глубины поражения.
Когда надо лечить ИГ.
Показания к проведению системной терапии определяет доктор на основании совокупности клинических данных, характеризующих саму инфантильную гемангиому, а также возможные риски развития осложнений или уже имеющиеся осложнения.
Как надо лечить ИГ.
В настоящее время «золотым», общепринятым стандартом лечения ИГ является назначение бета-адреноблокаторов (пропранолол в лекарственной форме «раствор для приема внутрь»). Терапия должна быть начата в максимально ранние сроки (интервал между 5 неделями и 5 месяцами), в период максимального роста ИГ (пролиферативная фаза). Терапия должна быть инициирована в условиях стационара с последующим переводом на амбулаторное ведение пациента. Перед назначением специфической терапии доктор исключает наличие абсолютных противопоказаний. Доза препарата наращивается постепенно под контролем основных параметров работы сердечно-сосудистой системы (частота сердечных сокращений, артериальное давление) и системы органов дыхания (частота дыхательных движений, сатурация О2). Если ребенок хорошо переносит лечение доза препарата доводится до терапевтической (2-3 мг/кг/сут). Побочные эффекты при лечении бета-адреноблокаторами минимальны (о них подробно проинформирует доктор) и встречаются достаточно редко (приблизительно в 3% случаях).
Осложненные формы могут потребовать более сложной системной терапии и консультации врачей других специальностей.
Каковы результаты лечения.
Ответ на терапию бета-адреноблокаторами - более 90%.
Приложение Г1-ГN.
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.Нет.
|
|
Год актуализации информации
2023.
Связанные заболевания
Связанные стандарты мед. помощи
- Стандарт медицинской помощи больным гемангиомой любой локализации
- Стандарт медицинской помощи больным с гемангиомой, лимфангиомой, доброкачественным новообразованием соединительной и других мягких тканей головы, лица и шеи, доброкачественным новообразованием других уточненных эндокринных желез
- Стандарт медицинской помощи больным с заболеваниями нервной и других систем, требующих дистанционной многоисточниковой прецизионной лучевой терапии со стереотаксическим наведением