МКБ-10 коды
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: E72.1.
Год утверждения (частота пересмотра): 2022.
Возрастная категория: Взрослые , Дети.
Пересмотр не позднее: 2024.
ID: 483.
Разработчик клинической рекомендации.
• Союз педиатров России.
• Ассоциация медицинских генетиков.
• Национальная ассоциация детских реабилитологов.
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2022.
Возрастная категория: Взрослые , Дети.
Пересмотр не позднее: 2024.
ID: 483.
Разработчик клинической рекомендации.
• Союз педиатров России.
• Ассоциация медицинских генетиков.
• Национальная ассоциация детских реабилитологов.
Одобрено Научно-практическим Советом Минздрава РФ.
|
|
 Список сокращений
Список сокращений
CbS - фермент цистатион-β-синтаза.
CBS - ген, кодирующий цистатион-β-синтазу.
GNMT - глицин-N метилтрансфераза.
IQ - коэффициент интеллектуального развития.
МАТ - метионин аденозилтрансфераза.
MTHFR- метилтетрагидрофолатредуктаза.
THcy - общий гомоцистеин.
FHcy - свободный гомоцистеин.
БКС - болезнь кленового сиропа.
КЩС - кислотно-щелочное состояние.
МС/МС - метод тандемной масс-спектрометрии.
ЦНС - центральная нервная система.
CBS - ген, кодирующий цистатион-β-синтазу.
GNMT - глицин-N метилтрансфераза.
IQ - коэффициент интеллектуального развития.
МАТ - метионин аденозилтрансфераза.
MTHFR- метилтетрагидрофолатредуктаза.
THcy - общий гомоцистеин.
FHcy - свободный гомоцистеин.
БКС - болезнь кленового сиропа.
КЩС - кислотно-щелочное состояние.
МС/МС - метод тандемной масс-спектрометрии.
ЦНС - центральная нервная система.
Термины и определения
Сублюксация (люксация) хрусталика - подвывих (вывих) хрусталика.
Описание
Гомоцистинурия (ГЦУ) - гетерогенная группа наследственных болезней обмена веществ, относящаяся к аминоацидопатиям, обусловленная нарушением метаболизма серосодержащих аминокислот, в первую очередь метионина. Их общие проявления - повышение уровня общего гомоцистеина (tHcy), при том, что аминокислотный профиль при разных формах ГЦУ значительно отличается.
Выделяют несколько форм гомоцистинурии, из которых частой является классическая ГЦУ, которая обусловлена мутациями в гене сBS, и характеризуется признаками поражения соединительной ткани (астеническое телосложение, деформация грудной клетки, кифосколиоз, подвывих хрусталика, миопия, грыжи ), тромбозами, снижением интеллекта и психиатрической симптоматикой. Также известны другие формы гомоцистинурии, которые проявляются патологией нервной системы с вариабельным возрастом манифестации и/или других систем [1-4].
Выделяют несколько форм гомоцистинурии, из которых частой является классическая ГЦУ, которая обусловлена мутациями в гене сBS, и характеризуется признаками поражения соединительной ткани (астеническое телосложение, деформация грудной клетки, кифосколиоз, подвывих хрусталика, миопия, грыжи ), тромбозами, снижением интеллекта и психиатрической симптоматикой. Также известны другие формы гомоцистинурии, которые проявляются патологией нервной системы с вариабельным возрастом манифестации и/или других систем [1-4].
Причины
Выделяют несколько форм заболевания в зависимости от первичного биохимического и молекулярно-генетического дефекта.
Нарушение пути транссульфурации (классическая гомоцистинурия: В6 -зависимая форма гомоцистинурии или В6 -резистентная форма) или нарушения в процессе реметилирования метионина.
Гомоцистеин превращается в метионин в процессе, известном как реметилирование, при участии витамина в12. Впоследствии метионин может расщепляться до S-аденозилметионина, который преобразовывается в гомоцистеин. В реакции, называемой транссульфурацией, гомоцистеин превращается в цистеин, катализируемый пиридоксаль-5 -фосфатом (PLP) и цистатион-β-синтазы. Повышение уровня tHcy предполагает нарушение одного из компонентов этой реакции.
Гомоцистинурия I или классическая форма заболевания вызвана дефицитом фермента цистатион-β-синтазы (CbS), участвующего в преобразовании метионина в цистеин, проявляется при наличии гомозиготных или компаунд-гетерозиготных мутаций в гене сBS, локализованном на длинном плече хромосомы 21 (21q22). Тип наследования аутосомно - рецессивный [4].
При классической ГЦУ вследствие недостаточности цистатион-β-синтазы нарушается цикл преобразования серосодержащей аминокислоты метионина.
Накопление tHcy приводит к активации фактора Хагемана, способствуя процессу тромбообразования. Также гипергомоцистеинемия является причиной эндотелиальной дисфункции из-за снижения биодоступности эндогенного вазодилататора -оксида азота и окислительного стресса. Эти изменения нарушают стабильность артериальной стенки и являются причиной интраартериальных тромбозов, продольных надрывов стенки артерий с проникновением крови из просвета артерии в её стенку с формированием в последней интрамуральной гематомы и артериопатии, повышая предрасположенность к возникновению инсультов [4-6].
Имеются также данные, свидетельствующие об изменении обмена соединительной ткани у пациентов с ГЦУ. Повышение концентрации гомоцистеина приводит к нарушению сшивания сульфгидрильных групп в белках, таких как эластин, что объясняет дислокацию хрусталика и скелетные аномалии [7,8].
Фермент цистатион-β-синтаза (CbS) является пиридоксин (витамин В6) зависимым ферментом, поэтому в классической ГЦУ выделяют В6-чувствительную и В6-резистентную формы заболевания. Возможно также нарушение активности следующего фермента в этой метаболической цепи - цистатионазы (Приложение А3,3),.
Другие формы ГЦУ связаны с генетически детерминированными дефектами реметилирования метионина, возникающими вследствие нарушения активности метионин синтазы редуктазы, которая катализирует реметилирование гомоцистеина в метионин, некоторыми дефектами синтеза кобаламина и нарушением активности фермента N(5,10)-метилентетрагидрофолатредуктазы (MTHFR). Указанные формы сопровождаются не повышением, а снижением концентрации метионина в крови [1].
Некоторые генетические нарушения внутриклеточного транспорта и процессинга кобаламина (cbl) (cblC, cblD, cblF и cblJ) вызывают недостаточный синтез не только метилкобаламина, но и аденозилкобаламина, кофактора метилмалонил-КоА мутазы. Эти комбинированные нарушения реметилирования связаны с повышенным содержанием tHcy и метилмалоновой кислоты (ММК) [9].
В данных клинических рекомендациях рассматривается подробно классическая гомоцистинурия, и вариант связанный с дефицитом MTHFR, а формы метилмалоновой ацидурии с гомоцистинурией, более подробно рассматриваются в клинических рекомендациях по метилмалоновой ацидурии, поскольку подходы к их терапии отличаются от ГЦУ.
Нарушение пути транссульфурации (классическая гомоцистинурия: В6 -зависимая форма гомоцистинурии или В6 -резистентная форма) или нарушения в процессе реметилирования метионина.
Гомоцистеин превращается в метионин в процессе, известном как реметилирование, при участии витамина в12. Впоследствии метионин может расщепляться до S-аденозилметионина, который преобразовывается в гомоцистеин. В реакции, называемой транссульфурацией, гомоцистеин превращается в цистеин, катализируемый пиридоксаль-5 -фосфатом (PLP) и цистатион-β-синтазы. Повышение уровня tHcy предполагает нарушение одного из компонентов этой реакции.
Гомоцистинурия I или классическая форма заболевания вызвана дефицитом фермента цистатион-β-синтазы (CbS), участвующего в преобразовании метионина в цистеин, проявляется при наличии гомозиготных или компаунд-гетерозиготных мутаций в гене сBS, локализованном на длинном плече хромосомы 21 (21q22). Тип наследования аутосомно - рецессивный [4].
При классической ГЦУ вследствие недостаточности цистатион-β-синтазы нарушается цикл преобразования серосодержащей аминокислоты метионина.
Накопление tHcy приводит к активации фактора Хагемана, способствуя процессу тромбообразования. Также гипергомоцистеинемия является причиной эндотелиальной дисфункции из-за снижения биодоступности эндогенного вазодилататора -оксида азота и окислительного стресса. Эти изменения нарушают стабильность артериальной стенки и являются причиной интраартериальных тромбозов, продольных надрывов стенки артерий с проникновением крови из просвета артерии в её стенку с формированием в последней интрамуральной гематомы и артериопатии, повышая предрасположенность к возникновению инсультов [4-6].
Имеются также данные, свидетельствующие об изменении обмена соединительной ткани у пациентов с ГЦУ. Повышение концентрации гомоцистеина приводит к нарушению сшивания сульфгидрильных групп в белках, таких как эластин, что объясняет дислокацию хрусталика и скелетные аномалии [7,8].
Фермент цистатион-β-синтаза (CbS) является пиридоксин (витамин В6) зависимым ферментом, поэтому в классической ГЦУ выделяют В6-чувствительную и В6-резистентную формы заболевания. Возможно также нарушение активности следующего фермента в этой метаболической цепи - цистатионазы (Приложение А3,3),.
Другие формы ГЦУ связаны с генетически детерминированными дефектами реметилирования метионина, возникающими вследствие нарушения активности метионин синтазы редуктазы, которая катализирует реметилирование гомоцистеина в метионин, некоторыми дефектами синтеза кобаламина и нарушением активности фермента N(5,10)-метилентетрагидрофолатредуктазы (MTHFR). Указанные формы сопровождаются не повышением, а снижением концентрации метионина в крови [1].
Некоторые генетические нарушения внутриклеточного транспорта и процессинга кобаламина (cbl) (cblC, cblD, cblF и cblJ) вызывают недостаточный синтез не только метилкобаламина, но и аденозилкобаламина, кофактора метилмалонил-КоА мутазы. Эти комбинированные нарушения реметилирования связаны с повышенным содержанием tHcy и метилмалоновой кислоты (ММК) [9].
В данных клинических рекомендациях рассматривается подробно классическая гомоцистинурия, и вариант связанный с дефицитом MTHFR, а формы метилмалоновой ацидурии с гомоцистинурией, более подробно рассматриваются в клинических рекомендациях по метилмалоновой ацидурии, поскольку подходы к их терапии отличаются от ГЦУ.
Эпидемиология
Средняя частота классической ГЦУ по данным литературы составляет в среднем 1:100000-1:200000, варьируя от 1:1800 до 1:900000 в зависимости от этнической принадлежности [10]. Наиболее распространено данное заболевание в Катаре. с частотой носительства примерно 2% [11, 12].
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
Е72,1 - нарушение обмена серосодержащих аминокислот.Классификация
1,5 Классификация заболевания или состояния (группы заболеваний или состояний).
Выделяют следующие клинико-генетические формы гомоцистинурии:• Гомоцистинурия, обуcловленная нарушением транссульфурации (классическая гомоцистинурия, подразделяющаяся на В6-чувствительную и В6-резистентную).
• Гомоцистинурия, обусловленная нарушением реметилирования.
Современная классификация различных форм гомоцистинурии приведена в Приложении А3,4)[1,9].
Клиническая картина
Классическая форма гомоцистинурии, связанная с мутациями гена сBS.
Клиническая картина заболевания варьирует от легких до тяжелых форм, манифестирующих на первом году жизни. Выделяют В6-чувствительную и В6-резистентную формы.[2,4,13-16].
При В6-чувствительной форме пациенты имеют более мягкий фенотип с более поздним возрастом начала заболевания [14,17]. Наиболее легко заболевание протекает у пациентов, которые дают выраженную положительную динамику уже при применении низких доз пиридоксина**. Большинство из них являются гомозиготами по замене p.I278T в гене сBS [18].
Манифестация заболевания при В6-резистентной форме происходит раньше, и клинические проявления болезни тяжелее, чем при В6-чувствительной форме.
При классической ГЦУ отмечаются поражения со стороны нервной, сосудистой, скелетной систем и органа зрения.
Поражение органа зрения.
Типичным симптомом классической ГЦУ, который часто появляется на втором году жизни является миопия, которая предшествует развитию дислокации или эктопии хрусталика. При заболевании происходит деструкция богатых фибриллином микрофибрилл цилиарной связки и нарушением ее структуры и функции. Степень смещения хрусталика варьирует от незаметного подвывиха до полного вывиха.
Наиболее часто у пациентов с ГЦУ встречается подвывих хрусталика («ectopia lentis») (более 50% нелеченых пациентов, обычно проявляется к возрасту 8 лет). Иридодонис (дрожание радужки) - частый признак вывиха хрусталика. Миопия, связанная с ослаблением хрусталика, приводит к пассивной сферической деформации (сферофакии). Миопия становится заметной при подвывихе хрусталика. Подвывих хрусталика может быть первым признаком болезни, описан случай манифестации в возрасте 4 недель у одного пациента. Сроки появления этого признака широко варьируют, но примерно на 2 году жизни отмечают появление подвывиха хрусталика у многих пациентов. После этого возраста пациенты с в6- резистентной формой, имеют более высокий уровень вывихов хрусталика, чем пациенты, отвечающие на терапию пиридоксином** [7, 8. 19].
Частым осложнением эктопии хрусталика является острая глаукома, обусловленная смещением хрусталика в переднюю камеру глаза [20].
Тромбозы.
Вторым по частоте при классической форме ГЦУ является поражение сосудов. При этом венозные тромбозы встречаются чаще, чем артериальные, и могут возникать в любом органе и системе, включая сосуды головного мозга, коронарные и легочные артерии. Тромбозы встречаются в любом возрасте. Почти у 50 % пациентов отмечаются сосудистые осложнения, представленные тромбозами, к возрасту 29 лет. В ряде случаев поражение сосудов может являться единственным симптомом заболевания, возникающим на 2-3 десятилетии жизни (особенно у пациентов с наиболее частой гомозиготной миссенс мутацией с.833Т>С в гене сBS)[21].
Поражения костной системы.
Нарушения со стороны костной системы нередко представлены высоким ростом, долихостеномелией, арахнодактилией, сколиозом, деформацией грудной клетки по типу килевидной или воронкообразной, вальгусной деформацией конечностей, высоким сводом твердого неба, полой стопой, остеопорозом/остеопенией. Остеопороз наблюдается почти у половины пациентов ко второму десятилетию жизни [5,22] и является серьезным осложнением со стороны костной системы. У пациентов с В6 резистентной формой заболевания остеопороз развивается в более раннем возрасте, чем при В6 -зависимых чувствительных формах.
Неврологические и психиатрические проявления.
Наиболее частым клиническим проявлением поражения ЦНС является задержка психоречевого развития, умственная отсталость. Достаточно часто когнитивные нарушения могут являться первым симптомом заболевания.
Интеллектуальные способности пациентов могут достаточно сильно различаться в зависимости от возраста начала терапии. По данным международного опроса, показатели IQ варьировали от 10 до 138, при этом медиана составляла примерно 64. Пациенты с В6-чувствительной формой при раннем начале терапии имеют более высокие показатели значения IQ (медиана 78) по сравнению с пациентами, резистентными к витамину В6 (медиана, 56) [23].
На втором десятилетии жизни у пациентов часто возникают эпизоды депрессии, тревожность, обсессивно-компульсивные нарушения, психозы. Характерными для классической ГЦУ являются различные нарушения поведения: агрессия, алкоголизм, наркомания. Психиатрические проблемы более часто встречаются среди пациентов с В6 резистентной формой и при отказе пациентов от лечения и диетотерапии.
У отдельных пациентов психиатрические нарушения могут являться единственным симптомом заболевания.
Встречаются преимущественно 4 категории психиатрических нарушений: расстройства личности, нарушения поведения, транзиторные депрессии, и обсессивно-компульсивные расстройства. Существуют даже сообщения, что шизофрения более часто встречается у пациентов с дефицитом сBS [4,24,25] .
В 21% случаев у нелеченных пациентов с классической ГЦУ наблюдаются эпилептические приступы в раннем младенческом возрасте, наиболее часто генерализованные тонико-клонические судороги. Другими неврологическими нарушениями являются различные экстрапирамидные нарушения, в частности, дистония. Очаговые неврологические нарушения соответствуют зоне поражения во время перенесенного острого нарушения мозгового кровообращения [4] .
Другие проявления классической гомоцистинурии.
Описаны случаи классической ГЦУ, протекающей с острым панкреатитом [26-31] и хронической диареей, гипопигментацией кожи и волос, «румянцем» на лице.
Нарушения реметилирования.
При нарушениях реметилирования не выявляют каких-либо особых симптомов, которые позволили бы на клиническом уровне предположить эту патологию. Заболевания из этой группы являются мультисистемными, наиболее часто происходит поражение нервной и кроветворной системы, сосудов и почек. Именно сочетание неврологических и гематологических симптомов, часто сопровождающихся задержкой физического развития, должно вызывать подозрение на нарушение реметилирования. У большинства пациентов отмечаются нарушения психического, умственного и физического развития, полиневропатия, судороги, двигательные расстройства, нарушения мышечного тонуса, патология зрения. Они могут сопровождаться макроцитарной анемией, атипичным гемолитико-уремическим синдромом (ГУС) или гломерулопатией, которые в основном связанны с микроангиопатией.
Гомоцистинурия, обусловленная тяжелым дефицитом метилентетрагидрофолатредуктазы (MTHFR).
Гомоцистинурия, обусловленная тяжелым дефицитом метилентетрагидрофолатредуктазы (MTHFR), манифестирует в неонатальном периоде неврологическими нарушениями, сходными с органическими ацидуриями - угнетение сознания вплоть до сомноленции и комы, генерализованной мышечной гипотонией, приступами апноэ. Также отмечают проблемы со вскармливанием, плохую прибавку веса и микроцефалию.
Описана более поздняя форма заболевания, манифестирующая в детском и взрослом возрасте. Ее клиническая картина более вариабельна и представлена задержкой и регрессом психического развития, нарушениями поведения, психиатрическими симптомами, атаксией, полиневропатией, спастичностью. Из экстраневральных нарушений частыми являются тромбозы. Мегалобластная и/или макроцитарная анемия обычно отсутствует.
Среди 24 описанных в литературе подростков/взрослых пациентов с дефицитом MTHFR клинические проявления включали нарушение походки (96%, из моторного центрального или периферического происхождения), снижение когнитивных функций (74%), эпилептические синдромы (50%), энцефалопатию (30%), психотические симптомы (17%) и тромботические события (21%). У 41% было одно неврологическое проявление, которое могло оставаться изолированным в течение как минимум 3 лет, что отсрочивало постановку диагноза. МРТ головного мозга выявила в 71% случаев изменения в основном перивентрикулярного белого вещества. Все пациенты стабилизировались или улучшились после метаболического лечения [32]. Несмотря на то, что дефицит MTHFR в подростковом/взрослом возрасте встречается редко, его следует включать в дифференциально диагностический поиск при различных необъяснимых нейропсихиатрических синдромах, эпилепсии и спастическом парапарезе, поскольку при дефиците MTHFR показан хороший эффект метаболической терапии.
Возраст проявления и клиническая картина дефицита MTHFR коррелируют с остаточной активностью фермента. В исследовании, включающем 33 пациента, показано, что средний возраст появления симптомов составлял 1,25 месяца (средний 21 год; диапазон от 0,1 до 216 месяцев). У 14 пациентов первые симптомы наблюдались в течение первого месяца жизни; и еще у 11 пациентов симптомы наблюдались к 6-му месяцу жизни. У остальных пяти пациентов симптомы проявились в возрасте 2, 5, 11, 13 и 18 лет [33].
Тяжелый дефицит MTHFR биохимически характеризуется гипергомоцистеинемией, гомоцистинурией, повышенным содержанием цистатионина и низким или низко-нормальным уровнем метионина в крови, в отличие от дефицита сBS, который проявляется повышенным уровнем метионина. В культивируемых фибробластах остаточная активность составляет менее 20% от среднего контрольного значения [34].
Клинические проявления комбинированных нарушений реметилирования (cblC, cblD-MMA / HC, cblF, cblJ).
При нарушениях реметилирования с метилмалоновой ацидурией (cblC, cblD-MMA / HC, cblF, cblJ) часто встречаются задержка физического развития и нарушения вскармливания в младенчестве. В большинстве случаев первые симптомы проявляются в неонатальном периоде или в раннем детстве. У новорожденных заболевание может дебютировать остро - нарушениями сознания (летаргия, кома), также характерны судороги и мышечная гипотония, при лабораторных исследованиях часто выявляют мегалобластную анемию, нейтропению или панцитопению. В 50% случаев отмечают нистагм, на фоне ретинопатии или атрофии зрительного нерва [35,36]. Микроангиопатическое заболевание почек или легких чаще всего проявляется на ранней стадии болезни, но может также присутствовать у детей старшего возраста и у взрослых [37,38].
У детей, подростков и взрослых отмечаются острые или хронические поведенческие или психические проявления, когнитивные нарушения, признаки периферической невропатии и атаксии [37,39,40]. Часто выявляют бледность зрительного нерва, но другие глазные проявления редко возникают при поздней форме заболевания [36,41].
Клинические проявления комбинированных нарушений реметилирования (cblD-HC, cblE, cblG).
Клинические проявления дефицита cblE и cblG сходны. Заболевание обычно манифестирует в младенчестве, в основном с гематологическими нарушениями, мышечной гипотонией и остро возникающими неврологическими симптомами. У трети пациентов наблюдают нарушения сознания, судороги, у четверти - нарушения зрения. У детей старшего возраста и взрослых могут проявляться признаки, отражающие поражение спинного мозга (подострая дегенерация спинного мозга) или психиатрические симптомы [42]. Сообщалось об единичных случаях изолированной макроцитарной анемии без нейрокогнитивных нарушений [43] .
Беременность при классической гомоцистинурии и гомоцистинурии, обусловленной тяжелым дефицитом метилентетрагидрофолатредуктазы (MTHFR).
При ГЦУ, как классической, так и обусловленной тяжелым дефицитом метилентетрагидрофолатредуктазы (MTHFR), выявляется высокий риск развития тромбозов и тромбоэмболических нарушений у матерей, как на протяжении всей беременности, так и в послеродовой период. К ним относятся множественные артериальные тромбозы, илеофеморальный тромбофлебит, тромбозы верхнего сагиттального синуса и кортикальных вен. Есть данные о развитии преэклампсии у матерей, с гомоцистинурией. Однако большинство беременностей у матерей с классической гомоцистинурией протекали без акушерских осложнений.
При дефиците MTHFR у матери возможны поражения нервной системы у ребенка [44].
Дифференциальная диагностика.
Дифференциальный диагноз при классической ГЦУ следует проводить в группе наследственных заболеваний соединительной ткани с синдромами Марфана, Билса (врожденная контрактурная арахнодактилия). При всех этих заболеваниях отмечается марфаноидный фенотип, долихостеномелия, арахнодактилия, кифосколиозы, деформация грудной клетки, пролапс митрального клапана. Симптом, часто выявляемый при синдроме Марфана и гомоцистинурии - подвывих хрусталика.
При гомоцистинурии в отличие от синдрома Марфана рост может быть нормальным, отмечается депигментация кожи и волос, выраженный остеопороз и тромбозы. При синдроме Билса описана специфическая деформация ушных раковин, врожденные пороки сердца и контрактуры суставов, которые не встречаются при гомоцистинурии.
Дифференциальный диагноз также следует проводить с группой наследственных заболеваний, сопровождающихся инсультами: с болезнью Фабри, синдромом MELAS, врожденными нарушениями гликозилирования (болезнь Жакена), некоторыми органическими ацидуриями (метилмалоновая, пропионовая, изовалериновая, глутаровая ацидурия тип 1 и 2, аминоацидопатиями (нарушения цикла мочевины).
Есть и другие негенетические причины высокого уровня tHcy, но при этих состояниях уровень tHcy находится в диапазоне от 15- 50 мкм/л, в то время как при наследственных формах ГЦУ он, как правило, более 50 мкм/л, к ним относятся:
• Дефицит витамина в6 или в12.
• Дефицит фолиевой кислоты.
• Гипотиреоз.
• Ожирение.
• Диабет.
• Прием некоторых лекарственных препаратов (например, карбамазепин**, аторвастатин**, фенофибрат**, метотрексат**, фенитоин** и никотиновая кислота ).
Клиническая картина заболевания варьирует от легких до тяжелых форм, манифестирующих на первом году жизни. Выделяют В6-чувствительную и В6-резистентную формы.[2,4,13-16].
При В6-чувствительной форме пациенты имеют более мягкий фенотип с более поздним возрастом начала заболевания [14,17]. Наиболее легко заболевание протекает у пациентов, которые дают выраженную положительную динамику уже при применении низких доз пиридоксина**. Большинство из них являются гомозиготами по замене p.I278T в гене сBS [18].
Манифестация заболевания при В6-резистентной форме происходит раньше, и клинические проявления болезни тяжелее, чем при В6-чувствительной форме.
При классической ГЦУ отмечаются поражения со стороны нервной, сосудистой, скелетной систем и органа зрения.
Поражение органа зрения.
Типичным симптомом классической ГЦУ, который часто появляется на втором году жизни является миопия, которая предшествует развитию дислокации или эктопии хрусталика. При заболевании происходит деструкция богатых фибриллином микрофибрилл цилиарной связки и нарушением ее структуры и функции. Степень смещения хрусталика варьирует от незаметного подвывиха до полного вывиха.
Наиболее часто у пациентов с ГЦУ встречается подвывих хрусталика («ectopia lentis») (более 50% нелеченых пациентов, обычно проявляется к возрасту 8 лет). Иридодонис (дрожание радужки) - частый признак вывиха хрусталика. Миопия, связанная с ослаблением хрусталика, приводит к пассивной сферической деформации (сферофакии). Миопия становится заметной при подвывихе хрусталика. Подвывих хрусталика может быть первым признаком болезни, описан случай манифестации в возрасте 4 недель у одного пациента. Сроки появления этого признака широко варьируют, но примерно на 2 году жизни отмечают появление подвывиха хрусталика у многих пациентов. После этого возраста пациенты с в6- резистентной формой, имеют более высокий уровень вывихов хрусталика, чем пациенты, отвечающие на терапию пиридоксином** [7, 8. 19].
Частым осложнением эктопии хрусталика является острая глаукома, обусловленная смещением хрусталика в переднюю камеру глаза [20].
Тромбозы.
Вторым по частоте при классической форме ГЦУ является поражение сосудов. При этом венозные тромбозы встречаются чаще, чем артериальные, и могут возникать в любом органе и системе, включая сосуды головного мозга, коронарные и легочные артерии. Тромбозы встречаются в любом возрасте. Почти у 50 % пациентов отмечаются сосудистые осложнения, представленные тромбозами, к возрасту 29 лет. В ряде случаев поражение сосудов может являться единственным симптомом заболевания, возникающим на 2-3 десятилетии жизни (особенно у пациентов с наиболее частой гомозиготной миссенс мутацией с.833Т>С в гене сBS)[21].
Поражения костной системы.
Нарушения со стороны костной системы нередко представлены высоким ростом, долихостеномелией, арахнодактилией, сколиозом, деформацией грудной клетки по типу килевидной или воронкообразной, вальгусной деформацией конечностей, высоким сводом твердого неба, полой стопой, остеопорозом/остеопенией. Остеопороз наблюдается почти у половины пациентов ко второму десятилетию жизни [5,22] и является серьезным осложнением со стороны костной системы. У пациентов с В6 резистентной формой заболевания остеопороз развивается в более раннем возрасте, чем при В6 -зависимых чувствительных формах.
Неврологические и психиатрические проявления.
Наиболее частым клиническим проявлением поражения ЦНС является задержка психоречевого развития, умственная отсталость. Достаточно часто когнитивные нарушения могут являться первым симптомом заболевания.
Интеллектуальные способности пациентов могут достаточно сильно различаться в зависимости от возраста начала терапии. По данным международного опроса, показатели IQ варьировали от 10 до 138, при этом медиана составляла примерно 64. Пациенты с В6-чувствительной формой при раннем начале терапии имеют более высокие показатели значения IQ (медиана 78) по сравнению с пациентами, резистентными к витамину В6 (медиана, 56) [23].
На втором десятилетии жизни у пациентов часто возникают эпизоды депрессии, тревожность, обсессивно-компульсивные нарушения, психозы. Характерными для классической ГЦУ являются различные нарушения поведения: агрессия, алкоголизм, наркомания. Психиатрические проблемы более часто встречаются среди пациентов с В6 резистентной формой и при отказе пациентов от лечения и диетотерапии.
У отдельных пациентов психиатрические нарушения могут являться единственным симптомом заболевания.
Встречаются преимущественно 4 категории психиатрических нарушений: расстройства личности, нарушения поведения, транзиторные депрессии, и обсессивно-компульсивные расстройства. Существуют даже сообщения, что шизофрения более часто встречается у пациентов с дефицитом сBS [4,24,25] .
В 21% случаев у нелеченных пациентов с классической ГЦУ наблюдаются эпилептические приступы в раннем младенческом возрасте, наиболее часто генерализованные тонико-клонические судороги. Другими неврологическими нарушениями являются различные экстрапирамидные нарушения, в частности, дистония. Очаговые неврологические нарушения соответствуют зоне поражения во время перенесенного острого нарушения мозгового кровообращения [4] .
Другие проявления классической гомоцистинурии.
Описаны случаи классической ГЦУ, протекающей с острым панкреатитом [26-31] и хронической диареей, гипопигментацией кожи и волос, «румянцем» на лице.
Нарушения реметилирования.
При нарушениях реметилирования не выявляют каких-либо особых симптомов, которые позволили бы на клиническом уровне предположить эту патологию. Заболевания из этой группы являются мультисистемными, наиболее часто происходит поражение нервной и кроветворной системы, сосудов и почек. Именно сочетание неврологических и гематологических симптомов, часто сопровождающихся задержкой физического развития, должно вызывать подозрение на нарушение реметилирования. У большинства пациентов отмечаются нарушения психического, умственного и физического развития, полиневропатия, судороги, двигательные расстройства, нарушения мышечного тонуса, патология зрения. Они могут сопровождаться макроцитарной анемией, атипичным гемолитико-уремическим синдромом (ГУС) или гломерулопатией, которые в основном связанны с микроангиопатией.
Гомоцистинурия, обусловленная тяжелым дефицитом метилентетрагидрофолатредуктазы (MTHFR).
Гомоцистинурия, обусловленная тяжелым дефицитом метилентетрагидрофолатредуктазы (MTHFR), манифестирует в неонатальном периоде неврологическими нарушениями, сходными с органическими ацидуриями - угнетение сознания вплоть до сомноленции и комы, генерализованной мышечной гипотонией, приступами апноэ. Также отмечают проблемы со вскармливанием, плохую прибавку веса и микроцефалию.
Описана более поздняя форма заболевания, манифестирующая в детском и взрослом возрасте. Ее клиническая картина более вариабельна и представлена задержкой и регрессом психического развития, нарушениями поведения, психиатрическими симптомами, атаксией, полиневропатией, спастичностью. Из экстраневральных нарушений частыми являются тромбозы. Мегалобластная и/или макроцитарная анемия обычно отсутствует.
Среди 24 описанных в литературе подростков/взрослых пациентов с дефицитом MTHFR клинические проявления включали нарушение походки (96%, из моторного центрального или периферического происхождения), снижение когнитивных функций (74%), эпилептические синдромы (50%), энцефалопатию (30%), психотические симптомы (17%) и тромботические события (21%). У 41% было одно неврологическое проявление, которое могло оставаться изолированным в течение как минимум 3 лет, что отсрочивало постановку диагноза. МРТ головного мозга выявила в 71% случаев изменения в основном перивентрикулярного белого вещества. Все пациенты стабилизировались или улучшились после метаболического лечения [32]. Несмотря на то, что дефицит MTHFR в подростковом/взрослом возрасте встречается редко, его следует включать в дифференциально диагностический поиск при различных необъяснимых нейропсихиатрических синдромах, эпилепсии и спастическом парапарезе, поскольку при дефиците MTHFR показан хороший эффект метаболической терапии.
Возраст проявления и клиническая картина дефицита MTHFR коррелируют с остаточной активностью фермента. В исследовании, включающем 33 пациента, показано, что средний возраст появления симптомов составлял 1,25 месяца (средний 21 год; диапазон от 0,1 до 216 месяцев). У 14 пациентов первые симптомы наблюдались в течение первого месяца жизни; и еще у 11 пациентов симптомы наблюдались к 6-му месяцу жизни. У остальных пяти пациентов симптомы проявились в возрасте 2, 5, 11, 13 и 18 лет [33].
Тяжелый дефицит MTHFR биохимически характеризуется гипергомоцистеинемией, гомоцистинурией, повышенным содержанием цистатионина и низким или низко-нормальным уровнем метионина в крови, в отличие от дефицита сBS, который проявляется повышенным уровнем метионина. В культивируемых фибробластах остаточная активность составляет менее 20% от среднего контрольного значения [34].
Клинические проявления комбинированных нарушений реметилирования (cblC, cblD-MMA / HC, cblF, cblJ).
При нарушениях реметилирования с метилмалоновой ацидурией (cblC, cblD-MMA / HC, cblF, cblJ) часто встречаются задержка физического развития и нарушения вскармливания в младенчестве. В большинстве случаев первые симптомы проявляются в неонатальном периоде или в раннем детстве. У новорожденных заболевание может дебютировать остро - нарушениями сознания (летаргия, кома), также характерны судороги и мышечная гипотония, при лабораторных исследованиях часто выявляют мегалобластную анемию, нейтропению или панцитопению. В 50% случаев отмечают нистагм, на фоне ретинопатии или атрофии зрительного нерва [35,36]. Микроангиопатическое заболевание почек или легких чаще всего проявляется на ранней стадии болезни, но может также присутствовать у детей старшего возраста и у взрослых [37,38].
У детей, подростков и взрослых отмечаются острые или хронические поведенческие или психические проявления, когнитивные нарушения, признаки периферической невропатии и атаксии [37,39,40]. Часто выявляют бледность зрительного нерва, но другие глазные проявления редко возникают при поздней форме заболевания [36,41].
Клинические проявления комбинированных нарушений реметилирования (cblD-HC, cblE, cblG).
Клинические проявления дефицита cblE и cblG сходны. Заболевание обычно манифестирует в младенчестве, в основном с гематологическими нарушениями, мышечной гипотонией и остро возникающими неврологическими симптомами. У трети пациентов наблюдают нарушения сознания, судороги, у четверти - нарушения зрения. У детей старшего возраста и взрослых могут проявляться признаки, отражающие поражение спинного мозга (подострая дегенерация спинного мозга) или психиатрические симптомы [42]. Сообщалось об единичных случаях изолированной макроцитарной анемии без нейрокогнитивных нарушений [43] .
Беременность при классической гомоцистинурии и гомоцистинурии, обусловленной тяжелым дефицитом метилентетрагидрофолатредуктазы (MTHFR).
При ГЦУ, как классической, так и обусловленной тяжелым дефицитом метилентетрагидрофолатредуктазы (MTHFR), выявляется высокий риск развития тромбозов и тромбоэмболических нарушений у матерей, как на протяжении всей беременности, так и в послеродовой период. К ним относятся множественные артериальные тромбозы, илеофеморальный тромбофлебит, тромбозы верхнего сагиттального синуса и кортикальных вен. Есть данные о развитии преэклампсии у матерей, с гомоцистинурией. Однако большинство беременностей у матерей с классической гомоцистинурией протекали без акушерских осложнений.
При дефиците MTHFR у матери возможны поражения нервной системы у ребенка [44].
Дифференциальная диагностика.
Дифференциальный диагноз при классической ГЦУ следует проводить в группе наследственных заболеваний соединительной ткани с синдромами Марфана, Билса (врожденная контрактурная арахнодактилия). При всех этих заболеваниях отмечается марфаноидный фенотип, долихостеномелия, арахнодактилия, кифосколиозы, деформация грудной клетки, пролапс митрального клапана. Симптом, часто выявляемый при синдроме Марфана и гомоцистинурии - подвывих хрусталика.
При гомоцистинурии в отличие от синдрома Марфана рост может быть нормальным, отмечается депигментация кожи и волос, выраженный остеопороз и тромбозы. При синдроме Билса описана специфическая деформация ушных раковин, врожденные пороки сердца и контрактуры суставов, которые не встречаются при гомоцистинурии.
Дифференциальный диагноз также следует проводить с группой наследственных заболеваний, сопровождающихся инсультами: с болезнью Фабри, синдромом MELAS, врожденными нарушениями гликозилирования (болезнь Жакена), некоторыми органическими ацидуриями (метилмалоновая, пропионовая, изовалериновая, глутаровая ацидурия тип 1 и 2, аминоацидопатиями (нарушения цикла мочевины).
Есть и другие негенетические причины высокого уровня tHcy, но при этих состояниях уровень tHcy находится в диапазоне от 15- 50 мкм/л, в то время как при наследственных формах ГЦУ он, как правило, более 50 мкм/л, к ним относятся:
• Дефицит витамина в6 или в12.
• Дефицит фолиевой кислоты.
• Гипотиреоз.
• Ожирение.
• Диабет.
• Прием некоторых лекарственных препаратов (например, карбамазепин**, аторвастатин**, фенофибрат**, метотрексат**, фенитоин** и никотиновая кислота ).
|
|
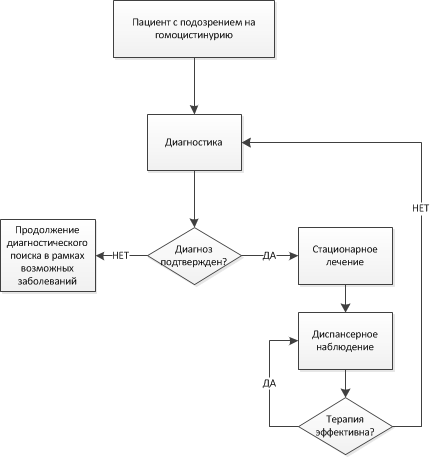
Диагностика
Для классической ГЦУ критериями диагностики служат: повышение уровня метионина в крови, tHcy и fHcy в крови и моче, а также выявление мутаций в гене сBS.
Для MTHFR критериями диагностики являются: высокий уровень tHcy и fHcy в крови и моче, сниженный или нормальный уровень метионина, нормальный уровень метилмалоновой кислоты в крови и выявление мутаций в гене MTHFR .
Алгоритм диагностики нарушений реметилирования представлен в Приложении Б2.
Тромбозы возникают преимущественно у пациентов подросткового и молодого возраста, являются главной причиной инфаркта миокарда или инсульта с формированием очаговой неврологической симптоматики.
Тяжесть клинических проявлений болезни при В6 -резистентной форме более выражена, чем при В6-зависимой. Интеллект пациентов с классической ГЦУ чаще снижен: IQ (коэффициент интеллектуального развития) колеблется от 32 до 85 ед. (норма 85-115 ед. У детей с В6 - зависимой формой гомоцистинурии умственное развитие может быть нормальным.
Нервная система:
• Задержка психомоторного развития.
• Умственная отсталость.
• Парезы, параличи.
• Нарушения походки (атаксия, шаткость).
• Инсульты.
• Судороги.
• Депрессия, психозы.
Сердечно-сосудистая система:
• Тромбозы, тромбоэмболии.
• Инфаркты, инсульты.
• Пролапс митрального клапана.
К остн ая систем а :
• Килевидная или воронкообразная деформация грудной клетки.
• Искривление позвоночника.
• Остеопороз.
• Переломы.
Орган зрения:
• Миопия.
• Глаукома.
• Подвывих хрусталика.
• Катаракта.
• Отслойка сетчатки.
• Атрофия зрительных нервов.
Другие нарушения:
• Грыжи.
• Панкреатит.
Гомоцистинурия, обусловленная дефицитом метилентетрагидрофолатредуктазы (MTHFR).
При ранней манифестации.
• Летаргия, апноэ в неонатальном периоде.
• Диффузная мышечная гипотония.
• Отказ от еды, рвота, плохая прибавка в весе.
• Задержка моторного и психоречевого развития.
• Микроцефалия.
• Судороги.
• Нистагм.
• Тромбоцитопения или панцитопения, мегалобластная анемия.
• Гемолитико-уремический синдром.
• Кардиомиопатия.
При поздней манифестации.
• Нарушение поведения.
• Когнитивный дефицит.
• Регресс психического развития.
• Психиатрические симптомы.
• Атаксия.
• Спастический парапарез/тетрапарез.
• Экстрапирамидные нарушения.
• Очаговая симптоматика, как последствия инсульта.
• Парестезии, онемение и покалывание в руках и ногах.
• Недержание мочи.
• Прогрессирующая слабость конечностей (ноги> руки).
• Гемолитико-уремический синдром.
• Тромбоэмболические события.
• Рецидивирующий венозный тромбоз.
• Легочная тромбоэмболия.
• Цереброваскулярные события.
• Фенотипические особенности: мягкие слегка вьющиеся светло-русые волосы, нежный румянец на щеках, голубой цвет радужной оболочки,.
• Марфано-подобный фенотип (высокий рост, астеническое телосложение, длинные тонкие конечности, арахнодактилия кистей и стоп).
• Вальгусная установка коленных суставов.
• Кифосколиоз.
• Воронкообразная или килевидная деформации грудной клетки.
• Подвывих хрусталика.
• Катаракта.
• Парезы, параличи.
• Нарушения походки (атаксия, шаткость).
Гомоцистинурия, обусловленная дефицитом метилентетрагидрофолатредуктазы (MTHFR).
При ранней манифестации.
• Микроцефалия.
• Нарушения вскармливания.
• Бледность кожных покровов.
• Плохая прибавка в весе.
• Нарушение сознания.
• Апноэ.
• Диффузная мышечная гипотония.
• Задержка моторного и психоречевого развития.
• Судороги.
• Нистагм.
При поздней манифестации.
• Нарушение поведения.
• Когнитивный дефицит.
• Психиатрические нарушения.
• Атаксия.
• Спастический парапарез/тетрапарез.
• Эксрапирамидные нарушения.
• Очаговая симптоматика, как последствия инсульта.
• Прогрессирующая слабость конечностей (ноги> руки).
• Парестезии, онемение и покалывание в руках и ногах.
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарии. Для классической ГЦУ характерны повышение уровня метионина в сыворотке крови и гомоцистеина в сыворотке крови и моче, снижение цистина в сыворотке крови и моче (Приложение А3,5). Важно, что концентрация гомоцистеина в крови (Исследование уровня гомоцистеина в крови) должна быть определена у пациента, не получающего пиридоксин** (в том числе в составе поливитаминов) минимум в течение двух недель. Имеются данные о необходимости у некоторых пациентов более длительного периода исключения пиридоксина**: 1-2 месяца.
Для MTHFR характерен высокий уровень гомоцистеина, сниженный или нормальный уровень метионина, нормальный уровень метилмалоновой кислоты. Уровень tHcy обычно составляет> 50, но в большинстве случаев> 100 мкмоль/ л у нелеченых пациентов с расстройствами реметилирования [47-50].
Обычно tHcy измеряют хроматографическими методами или иммуноанализами. Хроматографические методы более специфичны, чем иммуноанализы, и обычно сочетаются с обнаружением тандемной масс-спектрометрии (МС / МС), что позволяет одновременно определять другие соединения, представляющие интерес для диагностики и наблюдения за этими заболеваниями, например Met, цистеин [51] или, возможно, цистатионин [52, 53].
Для забора крови на tHcy подходят различные пробирки (ЭДTA, гепаринизировая, цитратная, пробирки для гелевого сепаратора). Однако образцы крови следует центрифугировать в течение 1 часа или хранить в холодном состоянии до центрифугирования (<6 часов). После удаления клеток крови tHcy остается стабильным в течение нескольких недель при +4 ° с и в течение нескольких лет после замораживания[51]. Свободный гомоцистин в плазме или моче, измеренный с помощью традиционной ионообменной хроматографии, может оставаться неопределяемым даже при наличии значительно повышенного tHcy в плазме [54,55]. Также не следует измерять свободный гомоцистеин вместо общего гомоцистеина.
• Рекомендовано всем пациентам с высоким уровнем tHcy в крови и моче (подозрение на гомоцистинурию) определение уровня витамина В12 (цианокобаламин) в крови для дифференциальной диагностики [5,73].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
• Рекомендовано всем пациентам с клиническими и биохимическими признаками классической ГЦУ проведение анализа гена сBS для подтверждения диагноза [56].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарии. Подтверждающая диагностика может быть выполнена как с помощью прямого автоматического секвенирования, так и с помощью массового параллельного секвенирования (NGS). Определение мутаций в гене сBS важно для подтверждения диагноза, эффективного медико-генетического консультирования и прогнозирования тяжести течения болезни.
• Рекомендовано всем пациентам с клиническими и биохимическими признаками дефицита MTHFR проведение анализа гена MTHFR для подтверждения диагноза [9].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарии: Генетическое тестирование на дефицит MTFHR следует интерпретировать с осторожностью, поскольку в этом гене существует множество вариантов, которые не связаны с ГЦУ. Так наиболее изученный термолабильный вариант c.677C> T в MTHFR, не ответственен за серьезные нарушения реметилирования, и только в комбинации с тяжелыми патогенными вариантами может приводить к легкой форме ГЦУ.
• Рекомендуется всем пациентам, у которых не подтвержден диагноз классической ГЦУ или дефицита MTHFR в случае выявления высокого уровня tHcy в крови исследовать уровень метилмалоновой кислоты в моче, ацилкарнитинов в крови (Комплексное определение концентрации на аминокислоты и ацилкарнитины в крови методом тандемной масс-спектрометрии), (Исследование аминокислот и метаболитов в моче), Определение уровня витамина В12 (цианокобаламин) в крови перед началом терапии с целью дифференциальной диагностики с другими формами гипергомоцистинемии [9] .
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
• Рекомендовано пациентам с подтвержденной классической ГЦУ и дефицитом MTHFR исследование уровня фолиевой кислоты в сыворотке крови, Определение уровня витамина В12 (цианокобаламин) в крови с целью оценки наличия дефицита и определения показаний к назначению данных витаминов [5,9,57].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
• Рекомендуется пациентам с классической ГЦУ и дефицита MTHFR проведение Общего (клинического) анализа крови развернутого, анализа крови биохимического общетерапевтического (оценка функции почек: Исследование уровня мочевины в крови, Исследование уровня креатинина в крови; оценка функции печени: Исследование уровня альбумина в крови), Исследование уровня ферритина в крови для оценки нутритивного статуса [5,9] .
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарии. Данных по дефициту различных микронутриентов при классической ГЦУ нет, однако считается, что они могут быть аналогичны пациентам с фенилкетонурией. По результатам проводится коррекция диеты.
• Рекомендовано определение протромбина (Определение протромбинового (тромбопластинового) времени в крови или в плазме/ Определение международного нормализованного отношения (MHO))/Активированного частичного тромбопластинового времени, исследование уровня фибриногена в крови, Определение концентрации Д-димера в крови при инсульте для мониторинга скрининговых показателей гемостаза [58,59].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Уровень убедительности рекомендаций. с, уровень достоверности доказательств - 4.
Комментарии. Наиболее часто исследуются трубчатые кости, коленные суставы, позвоночник (Рентгенография верхней конечности, Рентгенография нижней конечности, Рентгенография коленного сустава, Рентгенография шейного отдела позвоночника, Рентгенография шейно-дорсального отдела позвоночника, Рентгенография грудного отдела позвоночника, Рентгенография грудного и поясничного отдела позвоночника, Рентгенография поясничного отдела позвоночника, Рентгенография поясничного и крестцового отдела позвоночника, Рентгенография позвоночника, специальные исследования и проекции, Рентгенография позвоночника с функциональными пробами, Рентгенография позвоночника, вертикальная).
• Рекомендовано проведение рентгеноденситометрии пациентам с клиническими и биохимическими признаками классической ГЦУ начиная с подросткового возраста (ранее - по показаниям, при наличии частых переломов костей), в среднем один раз в 3-5 лет с подросткового возраста (обычно не чаще одного раза в 2 года) с целью своевременной диагностики снижения минеральной плотности костей и проведения коррекции терапии [5,22,60,61].
Уровень убедительности рекомендаций. с, уровень достоверности доказательств -4.
• Рекомендовано всем пациентам с клиническими и биохимическими признаками классической гомоцистинурии и MTHFR при наличии неврологической симптоматики проводить МРТ головного мозга в сосудистом режиме (Магнитно-резонансная томография головного мозга с контрастированием, Магнитно-резонансная ангиография интракарниальных сосудов) и/или КТ-ангиография головного мозга и/или сосудов шеи (Компьютерная томография головного мозга, Компьютерная томография шеи с внутривенным болюсным контрастированием, компьютерно-томографическая ангиография одной анатомической области) для диагностики сосудистых аномалий, тромбозов, инсультов[5,59,62-66] .
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 4.
Комментарий. В процессе динамического наблюдения исследование проводится по показаниям (при появлении неврологических симптомов).
При необходимости для проведения исследования применяется наркоз.
• Рекомендовано всем пациентам с клиническими и биохимическими признаками классической ГЦУ с целью определения сердечно-сосудистых нарушений проведение электрокардиографии (ЭКГ) (Регистрация электрокардиограммы) и эхокардиографии (ЭХО КГ) [21].Уровень убедительности рекомендаций. с , уровень достоверности доказательств - 4.
Комментарии. Исследования необходимо проводить при диагностике и, при необходимости, в процессе динамического наблюдения, при развитии инсультов и инфарктов. Частота определяется индивидуально.
• Рекомендовано всем пациентам с клиническими и биохимическими признаками ГЦУ проведение офтальмоскопии, измерения внутриглазного давления, осмотр врача-офтальмолога для диагностики эктопии, сублюксации (или люксации) хрусталика при классической ГЦУ и других нарушений функции зрения при дефицитом MTHFR [9,67,68].Уровень убедительности рекомендаций. с, уровень достоверности доказательств - 4.
Комментарии. В процессе динамического наблюдения - минимум 1 раз в год.
• Рекомендовано проведение электроэнцефалографии пациентам с клиническими и биохимическими признаками классической ГЦУ и с дефицитом MTHFR при наличии или подозрении на наличие судорожного синдрома с целью диагностики и контроля противосудорожной терапии [5,9] .
Уровень убедительности рекомендаций. с, уровень достоверности доказательств - 5.
• Рекомендовано всем пациентам с клиническими и биохимическими признаками классической ГЦУ и MTHFR проведение ультразвукового исследования брюшной полости (комплексного) для выявления/исключения патологии печени [69-71] .
Уровень убедительности рекомендаций. с , уровень достоверности доказательств - 4.
• Рекомендовано всем пациентам с клиническими и биохимическими признаками классической гомоцистинурии проведение ультразвукового исследования почек для выявления/исключения патологии [71,72] .
Уровень убедительности рекомендаций. с, уровень достоверности доказательств - 5.
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарий: Задача теста дифференцировать два фенотипических варианта классической гомоцистинурии: в6-чувствительного и в6-резистентного[73].
Тест не проводится в катаболическом состоянии. Перед началом теста на фоне обычной диеты без ограничения белка при отсутствии дефицита фолиевой кислоты и витамина В12 двукратно определяют содержание гомоцистина, гомоцистеина и метионина в крови, затем пациенту дают 10мг/кг/сут пиридоксина** перорально (минимальная доза 100 мг/сут, максимальная - 500 мг/сут) и через 1 неделю повторяют измерение концентрации указанных метаболитов гомоцистеина. Ответ считается положительным, если отмечается снижение уровня исследуемых маркеров гомоцистеина до уровня <50ммоль/л. Если ответ отрицательный, терапию продолжают, вновь проводится исследование уровня гомоцистеина через 2 недели, а при отрицательном ответе еще раз - через 6 недель. Если уровень гомоцистеина в крови снижается более, чем на 20%, но при этом сохраняется ˃50ммоль/л - необходимо рассмотреть дополнительное лечение (диета и/или бетаин). Если уровень гомоцистеина в крови снижается менее, чем на 20%, пациент не отвечает на пиридоксин** и форма заболевания считается В6-резистентной [5].
У новорожденных детей, диагностированных с помощью неонатального скрининга, при проведении теста с пиридоксином** рекомендуется использовать относительно высокую дозу препарата (100 мг/сут) в течение более короткого периода (2 недели) [5] однако имеются сообщения, что более предпочтительным является постепенное увеличение дозы: 10 мг/кг/сут в первые 4 дня, 20 мг/кг/сут в последующие 4 дня, максимально 40 мг/кг/сут с 9 по 12 дни в связи с тем, что возможны проявления рабдомиолиза и респираторных нарушений [74].
Алгоритм определения чувствительности к пиридоксину** представлен в Приложении Б3.
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 4.
Комментарий. Показаны первичные и повторные консультации врача-генетика, врача-офтальмолога, врача-невролога, врача-диетолога, врача-гематолога, врача-детского онколога-гематолога, врача-кардиолога, врача-детского кардиолога, врача-травматолога-ортопеда, врача-нефролога, врача-педиатра/врача-терапевта/врача общей практики (семейного врача), врача-психиатра, медицинского психолога, врача-акушера-гинеколога, а также врачей других специальностей пациентам с гомоцистинурией, имеющим нарушения функций соответствующих органов и систем.
Антропометрию и измерение артериального давления на периферических артериях следует проводить на каждом приеме.
Оценка неврологического статуса - не реже 1 раза в год.
Оценка интеллектуального развития (например, тесты IQ) - минимум 1 раз в 5 лет на протяжении периода детства.
Для MTHFR критериями диагностики являются: высокий уровень tHcy и fHcy в крови и моче, сниженный или нормальный уровень метионина, нормальный уровень метилмалоновой кислоты в крови и выявление мутаций в гене MTHFR .
Алгоритм диагностики нарушений реметилирования представлен в Приложении Б2.
2,1 Жалобы и анамнез.
Классическая форма гомоцистинурии, связанная с мутациями гена сBS.Тромбозы возникают преимущественно у пациентов подросткового и молодого возраста, являются главной причиной инфаркта миокарда или инсульта с формированием очаговой неврологической симптоматики.
Тяжесть клинических проявлений болезни при В6 -резистентной форме более выражена, чем при В6-зависимой. Интеллект пациентов с классической ГЦУ чаще снижен: IQ (коэффициент интеллектуального развития) колеблется от 32 до 85 ед. (норма 85-115 ед. У детей с В6 - зависимой формой гомоцистинурии умственное развитие может быть нормальным.
Нервная система:
• Задержка психомоторного развития.
• Умственная отсталость.
• Парезы, параличи.
• Нарушения походки (атаксия, шаткость).
• Инсульты.
• Судороги.
• Депрессия, психозы.
Сердечно-сосудистая система:
• Тромбозы, тромбоэмболии.
• Инфаркты, инсульты.
• Пролапс митрального клапана.
К остн ая систем а :
• Килевидная или воронкообразная деформация грудной клетки.
• Искривление позвоночника.
• Остеопороз.
• Переломы.
Орган зрения:
• Миопия.
• Глаукома.
• Подвывих хрусталика.
• Катаракта.
• Отслойка сетчатки.
• Атрофия зрительных нервов.
Другие нарушения:
• Грыжи.
• Панкреатит.
Гомоцистинурия, обусловленная дефицитом метилентетрагидрофолатредуктазы (MTHFR).
При ранней манифестации.
• Летаргия, апноэ в неонатальном периоде.
• Диффузная мышечная гипотония.
• Отказ от еды, рвота, плохая прибавка в весе.
• Задержка моторного и психоречевого развития.
• Микроцефалия.
• Судороги.
• Нистагм.
• Тромбоцитопения или панцитопения, мегалобластная анемия.
• Гемолитико-уремический синдром.
• Кардиомиопатия.
При поздней манифестации.
• Нарушение поведения.
• Когнитивный дефицит.
• Регресс психического развития.
• Психиатрические симптомы.
• Атаксия.
• Спастический парапарез/тетрапарез.
• Экстрапирамидные нарушения.
• Очаговая симптоматика, как последствия инсульта.
• Парестезии, онемение и покалывание в руках и ногах.
• Недержание мочи.
• Прогрессирующая слабость конечностей (ноги> руки).
• Гемолитико-уремический синдром.
• Тромбоэмболические события.
• Рецидивирующий венозный тромбоз.
• Легочная тромбоэмболия.
• Цереброваскулярные события.
2,2 Физикальное обследование.
Классическая форма ГЦУ, связанной с мутациями гена сBS.• Фенотипические особенности: мягкие слегка вьющиеся светло-русые волосы, нежный румянец на щеках, голубой цвет радужной оболочки,.
• Марфано-подобный фенотип (высокий рост, астеническое телосложение, длинные тонкие конечности, арахнодактилия кистей и стоп).
• Вальгусная установка коленных суставов.
• Кифосколиоз.
• Воронкообразная или килевидная деформации грудной клетки.
• Подвывих хрусталика.
• Катаракта.
• Парезы, параличи.
• Нарушения походки (атаксия, шаткость).
Гомоцистинурия, обусловленная дефицитом метилентетрагидрофолатредуктазы (MTHFR).
При ранней манифестации.
• Микроцефалия.
• Нарушения вскармливания.
• Бледность кожных покровов.
• Плохая прибавка в весе.
• Нарушение сознания.
• Апноэ.
• Диффузная мышечная гипотония.
• Задержка моторного и психоречевого развития.
• Судороги.
• Нистагм.
При поздней манифестации.
• Нарушение поведения.
• Когнитивный дефицит.
• Психиатрические нарушения.
• Атаксия.
• Спастический парапарез/тетрапарез.
• Эксрапирамидные нарушения.
• Очаговая симптоматика, как последствия инсульта.
• Прогрессирующая слабость конечностей (ноги> руки).
• Парестезии, онемение и покалывание в руках и ногах.
2,3 Лабораторные диагностические исследования.
• Рекомендовано пациентам с подозрением на гомоцистинурию количественное определение метионина (Комплексное определение концентрации на аминокислоты и ацилкарнитины в крови методом тандемной масс-спектрометрии), общего и свободного гомоцистеина в крови и моче (Исследование уровня гомоцистеина в крови, Исследование аминокислот и метаболитов в моче/ Комплексное определение содержания органических кислот в моче/Комплекс исследований для диагностики органических ацидурий) для диагностики классической гомоцистинурии и дефицита MTHFR [4,5,9,45,46].Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарии. Для классической ГЦУ характерны повышение уровня метионина в сыворотке крови и гомоцистеина в сыворотке крови и моче, снижение цистина в сыворотке крови и моче (Приложение А3,5). Важно, что концентрация гомоцистеина в крови (Исследование уровня гомоцистеина в крови) должна быть определена у пациента, не получающего пиридоксин** (в том числе в составе поливитаминов) минимум в течение двух недель. Имеются данные о необходимости у некоторых пациентов более длительного периода исключения пиридоксина**: 1-2 месяца.
Для MTHFR характерен высокий уровень гомоцистеина, сниженный или нормальный уровень метионина, нормальный уровень метилмалоновой кислоты. Уровень tHcy обычно составляет> 50, но в большинстве случаев> 100 мкмоль/ л у нелеченых пациентов с расстройствами реметилирования [47-50].
Обычно tHcy измеряют хроматографическими методами или иммуноанализами. Хроматографические методы более специфичны, чем иммуноанализы, и обычно сочетаются с обнаружением тандемной масс-спектрометрии (МС / МС), что позволяет одновременно определять другие соединения, представляющие интерес для диагностики и наблюдения за этими заболеваниями, например Met, цистеин [51] или, возможно, цистатионин [52, 53].
Для забора крови на tHcy подходят различные пробирки (ЭДTA, гепаринизировая, цитратная, пробирки для гелевого сепаратора). Однако образцы крови следует центрифугировать в течение 1 часа или хранить в холодном состоянии до центрифугирования (<6 часов). После удаления клеток крови tHcy остается стабильным в течение нескольких недель при +4 ° с и в течение нескольких лет после замораживания[51]. Свободный гомоцистин в плазме или моче, измеренный с помощью традиционной ионообменной хроматографии, может оставаться неопределяемым даже при наличии значительно повышенного tHcy в плазме [54,55]. Также не следует измерять свободный гомоцистеин вместо общего гомоцистеина.
• Рекомендовано всем пациентам с высоким уровнем tHcy в крови и моче (подозрение на гомоцистинурию) определение уровня витамина В12 (цианокобаламин) в крови для дифференциальной диагностики [5,73].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
• Рекомендовано всем пациентам с клиническими и биохимическими признаками классической ГЦУ проведение анализа гена сBS для подтверждения диагноза [56].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарии. Подтверждающая диагностика может быть выполнена как с помощью прямого автоматического секвенирования, так и с помощью массового параллельного секвенирования (NGS). Определение мутаций в гене сBS важно для подтверждения диагноза, эффективного медико-генетического консультирования и прогнозирования тяжести течения болезни.
• Рекомендовано всем пациентам с клиническими и биохимическими признаками дефицита MTHFR проведение анализа гена MTHFR для подтверждения диагноза [9].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарии: Генетическое тестирование на дефицит MTFHR следует интерпретировать с осторожностью, поскольку в этом гене существует множество вариантов, которые не связаны с ГЦУ. Так наиболее изученный термолабильный вариант c.677C> T в MTHFR, не ответственен за серьезные нарушения реметилирования, и только в комбинации с тяжелыми патогенными вариантами может приводить к легкой форме ГЦУ.
• Рекомендуется всем пациентам, у которых не подтвержден диагноз классической ГЦУ или дефицита MTHFR в случае выявления высокого уровня tHcy в крови исследовать уровень метилмалоновой кислоты в моче, ацилкарнитинов в крови (Комплексное определение концентрации на аминокислоты и ацилкарнитины в крови методом тандемной масс-спектрометрии), (Исследование аминокислот и метаболитов в моче), Определение уровня витамина В12 (цианокобаламин) в крови перед началом терапии с целью дифференциальной диагностики с другими формами гипергомоцистинемии [9] .
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
• Рекомендовано пациентам с подтвержденной классической ГЦУ и дефицитом MTHFR исследование уровня фолиевой кислоты в сыворотке крови, Определение уровня витамина В12 (цианокобаламин) в крови с целью оценки наличия дефицита и определения показаний к назначению данных витаминов [5,9,57].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
• Рекомендуется пациентам с классической ГЦУ и дефицита MTHFR проведение Общего (клинического) анализа крови развернутого, анализа крови биохимического общетерапевтического (оценка функции почек: Исследование уровня мочевины в крови, Исследование уровня креатинина в крови; оценка функции печени: Исследование уровня альбумина в крови), Исследование уровня ферритина в крови для оценки нутритивного статуса [5,9] .
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарии. Данных по дефициту различных микронутриентов при классической ГЦУ нет, однако считается, что они могут быть аналогичны пациентам с фенилкетонурией. По результатам проводится коррекция диеты.
• Рекомендовано определение протромбина (Определение протромбинового (тромбопластинового) времени в крови или в плазме/ Определение международного нормализованного отношения (MHO))/Активированного частичного тромбопластинового времени, исследование уровня фибриногена в крови, Определение концентрации Д-димера в крови при инсульте для мониторинга скрининговых показателей гемостаза [58,59].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
2,4 Инструментальные диагностические исследования.
• Рекоменд овано всем пациентам с клиническими и лабораторными признаками ГЦУ проведение рентгенографии пораженной части костного скелета для выявления скелетных аномалий [4,13].Уровень убедительности рекомендаций. с, уровень достоверности доказательств - 4.
Комментарии. Наиболее часто исследуются трубчатые кости, коленные суставы, позвоночник (Рентгенография верхней конечности, Рентгенография нижней конечности, Рентгенография коленного сустава, Рентгенография шейного отдела позвоночника, Рентгенография шейно-дорсального отдела позвоночника, Рентгенография грудного отдела позвоночника, Рентгенография грудного и поясничного отдела позвоночника, Рентгенография поясничного отдела позвоночника, Рентгенография поясничного и крестцового отдела позвоночника, Рентгенография позвоночника, специальные исследования и проекции, Рентгенография позвоночника с функциональными пробами, Рентгенография позвоночника, вертикальная).
• Рекомендовано проведение рентгеноденситометрии пациентам с клиническими и биохимическими признаками классической ГЦУ начиная с подросткового возраста (ранее - по показаниям, при наличии частых переломов костей), в среднем один раз в 3-5 лет с подросткового возраста (обычно не чаще одного раза в 2 года) с целью своевременной диагностики снижения минеральной плотности костей и проведения коррекции терапии [5,22,60,61].
Уровень убедительности рекомендаций. с, уровень достоверности доказательств -4.
• Рекомендовано всем пациентам с клиническими и биохимическими признаками классической гомоцистинурии и MTHFR при наличии неврологической симптоматики проводить МРТ головного мозга в сосудистом режиме (Магнитно-резонансная томография головного мозга с контрастированием, Магнитно-резонансная ангиография интракарниальных сосудов) и/или КТ-ангиография головного мозга и/или сосудов шеи (Компьютерная томография головного мозга, Компьютерная томография шеи с внутривенным болюсным контрастированием, компьютерно-томографическая ангиография одной анатомической области) для диагностики сосудистых аномалий, тромбозов, инсультов[5,59,62-66] .
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 4.
Комментарий. В процессе динамического наблюдения исследование проводится по показаниям (при появлении неврологических симптомов).
При необходимости для проведения исследования применяется наркоз.
• Рекомендовано всем пациентам с клиническими и биохимическими признаками классической ГЦУ с целью определения сердечно-сосудистых нарушений проведение электрокардиографии (ЭКГ) (Регистрация электрокардиограммы) и эхокардиографии (ЭХО КГ) [21].Уровень убедительности рекомендаций. с , уровень достоверности доказательств - 4.
Комментарии. Исследования необходимо проводить при диагностике и, при необходимости, в процессе динамического наблюдения, при развитии инсультов и инфарктов. Частота определяется индивидуально.
• Рекомендовано всем пациентам с клиническими и биохимическими признаками ГЦУ проведение офтальмоскопии, измерения внутриглазного давления, осмотр врача-офтальмолога для диагностики эктопии, сублюксации (или люксации) хрусталика при классической ГЦУ и других нарушений функции зрения при дефицитом MTHFR [9,67,68].Уровень убедительности рекомендаций. с, уровень достоверности доказательств - 4.
Комментарии. В процессе динамического наблюдения - минимум 1 раз в год.
• Рекомендовано проведение электроэнцефалографии пациентам с клиническими и биохимическими признаками классической ГЦУ и с дефицитом MTHFR при наличии или подозрении на наличие судорожного синдрома с целью диагностики и контроля противосудорожной терапии [5,9] .
Уровень убедительности рекомендаций. с, уровень достоверности доказательств - 5.
• Рекомендовано всем пациентам с клиническими и биохимическими признаками классической ГЦУ и MTHFR проведение ультразвукового исследования брюшной полости (комплексного) для выявления/исключения патологии печени [69-71] .
Уровень убедительности рекомендаций. с , уровень достоверности доказательств - 4.
• Рекомендовано всем пациентам с клиническими и биохимическими признаками классической гомоцистинурии проведение ультразвукового исследования почек для выявления/исключения патологии [71,72] .
Уровень убедительности рекомендаций. с, уровень достоверности доказательств - 5.
2,5 Иные диагностические исследования.
2,5,1 Диагностический тест с пиридоксином**.
• Рекомендовано проведение теста с пиридоксином** (витамин В6) пациентам с подтвержденным диагнозом классическая гомоцистинурия вследствие недостаточности фермента цистатион-β-синтазы [5].Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарий: Задача теста дифференцировать два фенотипических варианта классической гомоцистинурии: в6-чувствительного и в6-резистентного[73].
Тест не проводится в катаболическом состоянии. Перед началом теста на фоне обычной диеты без ограничения белка при отсутствии дефицита фолиевой кислоты и витамина В12 двукратно определяют содержание гомоцистина, гомоцистеина и метионина в крови, затем пациенту дают 10мг/кг/сут пиридоксина** перорально (минимальная доза 100 мг/сут, максимальная - 500 мг/сут) и через 1 неделю повторяют измерение концентрации указанных метаболитов гомоцистеина. Ответ считается положительным, если отмечается снижение уровня исследуемых маркеров гомоцистеина до уровня <50ммоль/л. Если ответ отрицательный, терапию продолжают, вновь проводится исследование уровня гомоцистеина через 2 недели, а при отрицательном ответе еще раз - через 6 недель. Если уровень гомоцистеина в крови снижается более, чем на 20%, но при этом сохраняется ˃50ммоль/л - необходимо рассмотреть дополнительное лечение (диета и/или бетаин). Если уровень гомоцистеина в крови снижается менее, чем на 20%, пациент не отвечает на пиридоксин** и форма заболевания считается В6-резистентной [5].
У новорожденных детей, диагностированных с помощью неонатального скрининга, при проведении теста с пиридоксином** рекомендуется использовать относительно высокую дозу препарата (100 мг/сут) в течение более короткого периода (2 недели) [5] однако имеются сообщения, что более предпочтительным является постепенное увеличение дозы: 10 мг/кг/сут в первые 4 дня, 20 мг/кг/сут в последующие 4 дня, максимально 40 мг/кг/сут с 9 по 12 дни в связи с тем, что возможны проявления рабдомиолиза и респираторных нарушений [74].
Алгоритм определения чувствительности к пиридоксину** представлен в Приложении Б3.
2,5,2 Консультации, ведение и наблюдение специалистов.
• Рекомендуется для наблюдения пациентов с установленным диагнозом ГЦУ применять мультидисциплинарный подход в виду того, что заболевание характеризуется поражением многих органов и систем, требует комплексной терапии, что диктует необходимость совместного ведения пациента специалистами разных профилей [5,21,63,75,76].Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 4.
Комментарий. Показаны первичные и повторные консультации врача-генетика, врача-офтальмолога, врача-невролога, врача-диетолога, врача-гематолога, врача-детского онколога-гематолога, врача-кардиолога, врача-детского кардиолога, врача-травматолога-ортопеда, врача-нефролога, врача-педиатра/врача-терапевта/врача общей практики (семейного врача), врача-психиатра, медицинского психолога, врача-акушера-гинеколога, а также врачей других специальностей пациентам с гомоцистинурией, имеющим нарушения функций соответствующих органов и систем.
Антропометрию и измерение артериального давления на периферических артериях следует проводить на каждом приеме.
Оценка неврологического статуса - не реже 1 раза в год.
Оценка интеллектуального развития (например, тесты IQ) - минимум 1 раз в 5 лет на протяжении периода детства.
|
|
Лечение
3,1 Консервативное лечение.
Стратегия лечения ГЦУ зависит от природы метаболического блока, вызвавшего заболевание.Принципиальным моментом в лечение классической ГЦУ является определение чувствительности к пиридоксину** ( см подраздел 2,5).
Алгоритм лечения новорожденных с ГЦУ представлен в Приложении Б4.
3,1,1 Терапия пиридоксином**.
• Рекомендована терапия пиридоксином** (витамин В6) всем пациентам с ГЦУ с чувствительностью к пиридоксину** для нормализации метаболических процессов в дозе, обеспечивающей целевой уровень tHcy плазмы <50 мкмоль/л пожизненно. Обычно детям и взрослым препарат назначается в дозе до 10 мг/кг/сут., следует избегать доз выше 500 мг/сут [5]. Дозы варьируют в зависимости от чувствительности к пиридоксину**: стартовая доза составляет, в среднем, 100 мг/сут с дальнейшим увеличением до 500-1000 мг/сут. Дозы, выше, чем 1000 мг/сут не следует применять вследствие угрозы развития сенсорной нейропатии. [90].Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарий: для пациентов с В6-чувствительными формами гомоцистинурии доза препарата равна тому минимальному количеству пиридоксина**, которое производит максимальные биохимический эффект, способствует значительному снижению концентраций гомоцистеина в крови, что для большинства составляет порядка 200 мг/сутки, у пациентов с p.P49L p.I278T - 10-40 мг. Пациентам с частичным ответом на пиридоксин** приём пиридоксина** рекомендован в более высоких дозах, кроме того, назначается дополнительная терапия (бетаин и/или диета). Следует иметь в виду, что прием повышенных доз пиридоксина** может иметь побочное действие в виде периферической нейропатии, рабдомиолиза или апноэ, поэтому пиридоксин** следует применять только под контролем врача.
Важно, что младенцы и дети дошкольного возраста не должны длительно получать более 300 мг пиридоксина** в сутки во избежание побочных эффектов, например, дыхательных расстройств, которые исчезают после прекращения приема пиридоксина**.
С особой осторожностью использовать у новорожденных дозы пиридоксина** выше 200 мг/сут и рассчитывать дозу на вес тела, если это возможно[74].
Пиридоксин** также может быть назначен пациентам с В6-резистентной формой, обычно в дозах 100-200 мг в день (есть данные о пациентах, получающих 500-1000 мг в день) [4].
3,1,2 Диетотерапия.
• Рекомендован а низкобелковая диета с исключением метионина всем пациентам с классической гомоцистинурией, связанной с дефектом сBS с неполным ответом на пиридоксин**, а также большинству пациентов, не отвечающих на прием пиридоксина** с целью нормализации метаболических процессов. Диета должна продолжаться пожизненно[5,73,77].Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарий. Диета может использоваться либо как единственное лечение, либо как дополнительная терапия вместе с пиридоксином** и/или бетаином (Биологически активная добавка).
Диетическое лечение заключается в снижении потребления метионина за счет ограничения потребления белка натуральных продуктов. Для того, чтобы предотвратить белково-энергетическую недостаточность, назначаются специализированные продукты питания на основе синтетических аминокислот без метионина, но обогащенные аминокислотой цистеин, которая для пациентов с гомоцистинурией в условиях недостаточности фермента сbS становится незаменимой.
Количество пищевого метионина рассчитывается диетологом и обеспечивается за счет натуральных растительных продуктов и специальных низкобелковых продуктов, контролируется путем определения концентрации гомоцистеина и метионина в плазме.
При назначении диетотерапии пациентам с гомоцистинурией следует ориентироваться на поддержание нормальных уровней метионина и цистеина и обеспечении минимального уровня гомоцистеина в плазме крови. У пациентов, не отвечающих на пиридоксин**, хорошие результаты могут быть достигнуты, если уровни fHcy в плазме поддерживаются ниже 11 мкмоль/л. Это соответствует концентрации tHcy около 100-120 мкмоль/л. Соответствующие референсные уровни содержания указанных аминокислот приведены в Приложении А3,6.
Источником метионина в диете пациентов - детей 1-го года жизни являются женское молоко и/или адаптированная молочная смесь. С 6 месяцев в дополнение к этому - продукты прикорма на фруктовой, овощной и злаковой (безмолочной) основе, у пациентов старше года - продукты обычного рациона (овощи, фрукты, в ограниченных количествах злаковые). Источником дополнительных количеств цистеина в рационе пациентов является специализированный продукт на основе смеси кристаллических L-аминокислот, не содержащий метионина. Этот же продукт является дополнительным источником общего белкового азота и незаменимых аминокислот. Дефицит энергетической ценности рациона может покрываться у пациентов старше года за счёт использования специализированных низкобелковых продуктов на основе крахмала, жиров и добавленного сахара.
При расчёте состава рациона пациентов следует учитывать ориентировочные потребности в цистеине и метионине у пациентов гомоцистинурией разных возрастов (Приложения А3,7, А3,8). Специализирванные продукты на основе аминокислот без метионина, зарегистрированные в Российской Федерации и их химический состав представлены в Приложении А3,7.
• Не рекомендуется при дефиците MTHFR назначение диетотерапии вследствие отсутствия ее эффективности [9].
Уровень убедительности рекомендаций -С, уровень достоверности доказательств -5.
3,1,3 Иное консервативное лечение.
• Рекомендовано пациентам с классической ГЦУ при невозможности достичь целевого уровня гомоцистеина вследствие отсутствия/недостаточности ответа на пиридоксин** назначение лечения препаратами бетаина (биологически активная добавка) как дополнение к диетотерапии, что обеспечивает альтернативный путь реметилирования и способствует преобразованию избытка гомоцистеина в метионин, что может помочь предотвратить развитие осложнений, особенно тромбоз[4,5,73,78,88].Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарий: Бетаин (N, N, N-триметилглицин) образуется в организме из холина и в небольших количествах присутствует в обычном рационе. Бетаин также может действовать как химический шаперон и исправлять частичную неправильный фолдинг белка сBS . Бетаин снижает концентрацию плазменного гомоцистеина за счет его преобразования. в метионин, но повышает концентрацию метионина в плазме. Бетаин, (биологически активная добавка) как правило, назначают детям в начальной дозе 50 мг/кг 2 р/сут, и увеличивают на 50/мг/кг в неделю. Повышение дозы до уровня более 150-200 мг/кг/сут обычно нецелесообразно. У детей старше 3 лет и у взрослых применяется доза 3г х 2р/сут. У пациентов с В6-резистентными формами гомоцистинурии отмечено снижение содержания гомоцистеина в плазме крови на фоне дополнительного назначения бетаина (биологически активной добавки). Одним из возможных побочных эффектов бетаина (биологически активной добавки) является появление «рыбного запаха» от мочи и тела. При снижении дозы запах, как правило исчезает.
• Рекомендовано пациентам с дефицитом MTHFR раннее назначение терапии бетаином (биологически активная добавка) детям 100-250 мг/кг/сутки и 5-20 грамм в день для взрослых с целью профилактики неврологических проявлений [9,88].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарии. Назначение бетаина до появления неврологических симптомов позволяет улучшить исход заболевания и предотвратить тяжелые его проявления.
• Рекомендовано при классической форме ГЦУ назначение фолиевой кислоты** перорально в дозе 5 мг в сутки, с целью снижения уровня гомоцистеина и предотвращения тромбозов[5,73,89].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарий. фолиевая кислота** способна также оптимизировать превращение гомоцистеина в метионин, помогая таким образом уменьшить концентрацию гомоцистеина в плазме.
• Рекомендовано при классической форме ГЦУ с низким уровнем витамина В12 (цианокобаламина) в крови назначение препаратов группы «Витамин В12 (цианокобаламин и его аналоги)» - концентрации витамина В12 (цианокобаламина) с целью коррекции дефицитного состояния и оптимизации метаболизма гомоцистеина [5,73].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарий. Препараты группы «Витамин В12 (цианокобаламин и его аналоги)» способны также оптимизировать превращение гомоцистеина в метионин, помогая таким образом уменьшить концентрацию гомоцистеина в плазме.
• Рекомендовано рассмотреть назначение антитромботической терапии пациентам с классической гомоцистинурией с недостаточным контролем заболевания или с сосудистыми осложнениями в анамнезе с целью вторичной профилактики данных состояний [5,59, 63] .
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 4.
Комментарии. В соответствии с рекомендациями по тромбофилии. Обычно назначаются препараты групп: салициловая кислота и ее производные, антиагреганты кроме гепарина, ингибиторы агрегации тромбоцитов (исключая гепарин) в комбинациях.
Пациентам, у которых в анамнезе отмечаются венозные тромбозы, могут быть рассмотрены антагонисты витамина К.
• Рекомендовано назначение терапии, направленной на коррекцию нарушений костной минерализации пациентам с классической гомоцистинурией при снижении минеральной плотности костей с лечебной целью [5, 22, 71, 91].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 4.
Комментарии. В соответствии с рекомендациями по остеопорозу и снижению минеральной плотности костей.
• Рекомендовано при присоединении интеркуррентных инфекций пациентам с классической гомоцистинурией продолжать назначенную по основному заболеванию лекарственную и диетическую терапию, а также избегать дегидратации и иммобилизации с целью предотвращения тромбоэмболических осложнений [5] .
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарии. Пациентам, получающим диетотерапию при длительно текущих интеркуррентных заболеваниях может потребоваться более частый контроль метаболических показателей.
Чаще от осложнений при интеркуррентных инфекциях страдают пациенты детского возраста.
• Не рекомендуется применение природных и полусинтетических эстрогенов (эстрогенсодержащих контрацептивов) пациенткам с классической ГЦУ с целью контрацепции в связи с повышением риска тромбозов при их применении [5] .
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарий. Эта рекомендация сохраняется с 70-х гг 20 столетия, когда данная группа препаратов содержала более высокие концентрации эстрогенов. Безопасность современных лекарственных средств у пациентов с классической гомоцистинурией не изучалась.
3,1,4 Ведение беременности у пациенток с гомоцистинурией.
Во время беременности, родов и особенно в послеродовой период повышается вероятность развития тромбозов у пациенток с классической гомоцистинурией и MTHFR.Имеются данные об увеличении концентрации гомоцистеина в крови несмотря на проводимое лечение у пациенток с классической гомоцистинурией в послеродовом периоде во время инволюции матки.
Нет исследований по оптимальному сроку назначения и длительности антикоагулянтной терапии у пациенток с гомоцистинурией, в связи с чем применяются общие подходы, рекомендованные для пациентов с тромбофилией.
• Рекомендована беременным пациенткам с классической гомоцистинурией и дефицитом MTHFR антикоагулянтная терапия начиная с третьего триместра (или рассмотреть назначение с начала беременности пациенткам с дополнительными факторами риска или тромбозами в анамнезе) и продолжать как минимум 6 недель после родов с целью лечения и профилактики тромбозов[4, 5, 44].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 4.
Комментарий. В настоящее время нет исследований по оптимальному времени старта антитрокоагулянтной терапии или способу ее проведения, следует придерживаться общих рекомендаций по тромбофилии.
При классической гомоцистинурии обычно назначаются препараты группы гепарина (низкомолекулярные гепарины) или гепарин натрия**(5000 Ед х2р/дн [92]) или препарат группы салициловая кислота и ее производные в низких дозах. В послеродовом периоде может назначаться варфарин** (в дозе до достижения полного антикоагулянтного эффекта с целью лечения и профилактики тромбозов) [4, 5, 92].
При MTHFR также назначаются препараты группы гепарина (низкомолекулярные гепарины) или препарат группы салициловая кислота и ее производные [44, 79].
• Рекомендовано регулярное Исследование уровня фибриногена в крови беременным пациенткам с классической гомоцистинурией при недостаточном контроле заболевания с целью своевременной коррекции антикоагуляционной терапии и предотвращения тромботических осложнений [5].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарии. Пациенткам с MTHFR также может потребоваться данной исследование в соответствии с рекомендациями по тромбофилии.
• Рекомендовано пациенткам с классической ГЦУ, получающим терапию пиридоксином** во время беременности продолжать данное лечение с целью поддержания целевого уровня гомоцистеина в крови и, соответственно, предупреждения осложнений (Дозы подбираются индивидуально и составляют, в среднем, 100-250 мг/сут: по имеющимся сообщениям - от 50 мг/сут до 200 мгх3р/дн) [4,5, 92,93, 94, 95].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
• Рекомендовано пациенткам с классической гомоцистинурией, и пациенткам с дефицитом MTHFR получающим бетаин (биологически активная добавка) продолжить данную терапию во время беременности с целью поддержания целевого уровня гомоцистеина в крови и, соответственно, предупреждения осложнений [4,5,80] .
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 4.
Комментарий. Имеются данные о безопасности применения бетаина во время беременности.
• Рекомендовано беременным пациенткам с классической ГЦУ, получающим рестриктивную диету, более частое проведение контроля мониторируемых на фоне данного лечения показателей в крови ( см раздел «Лабораторные диагностические исследования») с целью предупреждения нутритивной недостаточности и обеспечения полноценного развития плода [4,5] .
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
• Рекомендовано увеличение употребления метионина пациенткам с классической гомоцистинурией во время беременности на фоне тщательного контроля мониторируемых при гомоцистинурии и диетотерапии показателей в крови ( см раздел «Лабораторные диагностические исследования») с целью обеспечения полноценного развития плода, после родов возобновить рестриктивную диету в прежнем объеме [5].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарии. После родов потребление метионина следует снизить до уровня, не превышающего таковой до беременности. При этом следует обеспечить потребности в белке, рекомендуемые ВОЗ / ФАО / УООН (World Health Organization/Food and Agriculture) Organization of the United Nations/United Nations University) в период лактации: дополнительно 20 г белка в день, через 6 месяцев - дополнительно 12,5 г в день. Некоторые из них необходимо вводить в виде смесей, не содержащих метионин, под контролем биохимического мониторинга, проводимого при гомоцистинурии ( см раздел «Лабораторные диагностические исследования»).
• Рекомендовано всем беременным с классической ГЦУ и дефицитом MTHFR с дефицитом фолиевой кислоты и витамина В12 прием фолиевой кислоты** (как минимум 400 мкг), при дефиците витамина В12 - дополнительное введение препарата группы витамин в12 (цианокобаламин и его аналоги)с целью коррекции недостаточности данных витаминов (фолиевой кислоты - дополнительно с целью профилактики дефектов развития нервной трубки у плода). [5,80,96].
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 4.
Комментарии. У ряда беременных пациенток с классической гомоцистинурией может, кроме того, обнаруживаться дефицит других витаминов, а также цинка, селена [5,80].
3,2 Хирургическое лечение.
Необходимость хирургического лечения (экстракция хрусталика одно- или двусторонняя) определяется врачом-офтальмологом.При соблюдении соответствующих анестезиологических мер предосторожности и современных микрохирургических методов риски, связанные с хирургическим лечением глазных осложнений гомоцистинурии, снижаются. Следует рассмотреть возможность хирургического лечения, особенно в случаях повторного вывиха хрусталика в переднюю камеру или глаукомы из зрачкового блока. Если выбран консервативный, нехирургический подход, этих пациентов необходимо тщательно наблюдать на предмет повторных эпизодов вывиха хрусталика [19] .
• Рекомендовано при офтальмологических операциях отдавать предпочтение использованию местной анестезии у пациентов без ментальных нарушений, учитывая оособенности анестезиологического пособия, обусловленные риском тромбоэмболических осложнений при общем наркозе. Пациентам с ментальными нарушениями или при других хирургических вмешательствах рекомендуется проведение общей анестезии (тотальная внутривенная анестезия, ингаляционный наркоз (например, севофлуран**)[4,5,59,81, 97] .
Уровень убедительности рекомендаций. С, уровень достоверности доказательств - 5.
Комментарии. Применение региональных методов анестезии (эпидуральной, спинальной) сопровождается повышением риска тромбоэмболических осложнений, обусловленных симпатическим блоком, периферическим сосудистым стазом на уровне микроциркуляции.
Целями анестезиологического пособия должны быть:
• поддержание высокого сердечного выброса и адекватного времени циркуляции крови;
• предотвращение тромбоэмболии;
• снижение периферического сосудистого сопротивления и улучшение периферической перфузии;
• предотвращение дегидратации и гипогликемии;
• быстрое восстановление пациента и ранняя вертикализация.
В предоперационном периоде необходимо проводить:
• Адекватное лечение и диетотерапию для поддержания низкого уровня метионина;
• При планировании хирургических вмешательств обязательное измерение уровня уровня гомоцистина/гомоцистеина в сыворотке крови. Эти значения должны быть <45-50 мкмоль/л, так как при повышенных указанных показателях наркоз и оперативные вмешательства противопоказаны.
• Пациент должен находиться под наблюдением врача-гематолога/врача-детского онколога-гематолога.
• Мониторинг скрининговых показателей гемостаза: протромбиновое, тромбиновое, активированное частичное тромбопластиновое аремя, фибриноген, Д-димер, фибрин - мономер.
• Адекватную предоперационную гидратацию (применение инфузионной терапии в объёме 1,5 физиологической потребности: 1:1 раствор декстрозы** 5% и раствор натрия хлорида** 0,9%) с мониторированием волемической нагрузки общепринятыми методами во избежание гипергидратации. Профилактику гиперкоагуляции назначением предпочтительно проводить препаратами группы гепарина (низкомолекулярные гепарины). Однако в настоящее время окончательных рекомендаций по применению данных лекарственных препаратов у пациентов с гомоцистинурией перед операцией нет. Необходимость в их применении следует определять индивидуально. Также с целью профилактики тромбозов следует назначать ношение компрессионных чулок.
В интраоперационном периоде целесообразно проводить следующие мероприятия:
• Поддержание сердечной функции с высоким сердечным выбросом.
• Применение эластичных бинтов или чулок для предупреждения периферического застоя крови.
• Применение растворов декстрозы ** 5% пополам с раствором натрия хлорида** 0,9% до тех пор, пока пациент сможет принимать жидкость перорально с целью предупреждения гипогликемии (под контролем, во избежание гипергидратации).
• Следует избегать применения динитрогена оксид**, так как при его использовании возможно повышение уровня гомоцистеина в крови за счет ингибирования фермента метионин-синтазы.
• Противопоказано применение опиоидов (наркотических препаратов) и анестетиков, вызывающих угнетение дыхания.
В послеоперационном периоде следует проводить:
• Мониторирование состояния пациента в течение 48-72ч на предмет возможного развития тромбоэмболических осложнений;
• Возможно подкожное введение препарата группы гепарина (низкомолекулярного гепарина) до того времени, когда пациент сможет вставать;
• Мониторирование уровня глюкозы в крови с целью предупреждения гипогликемии;
• Раннюю вертикализацию, при возможности;
• Решение о необходимости продолжения применения антитромботических средств (антикоагулянтов и антиагрегантов) следует принимать совместно с хирургом и анестезиологом-реаниматологом на основании оценки риска развития кровотечения.
Возможные осложнения при хирургических вмешательствах:
• Спонтанная тромбоэмболия: клинические проявления в зависимости от пораженного органа. Серьезными осложнениями могут быть: атрофия зрительного нерва, гемипарез, артериальная гипертензия вследствие инфаркта почки, парциальные эпилептические припадки и тромбоэмболия легочной артерии.
• Гипогликемия - может развиться вследствие нарушения секреции инсулина у пациентов с высоким уровнем метионина в сыворотке крови. Данное осложнение может быть предотвращено дополнительным введением глюкозы в период, когда пациент не получает пищу.
Важно отметить, что в настоящее время отсутствуют официальные рекомендации, основанные на рандомизированных исследованиях, по проведению общей анестезии у пациентов с гомоцистинуриейПредставленные выше рекомендации основаны на международном опыте отдельных экспертов по анестезиологии - реаниматологии в области орфанных болезней.
|
|
Реабилитация и амбулаторное лечение
Реабилитационные мероприятия направлены на коррекцию нарушений зрения, костных деформаций, кардиоваскулярных нарушений, двигательного и нервно-психического развития. Учитывая полиморфность клинических проявлений и осложнений заболевания, профиль и объем реабилитационных мероприятий должен зависеть от формы и степени нарушения функционирования и ограничений жизнедеятельности и здоровья сформулированных в соответствии с Международной классификации функционирования, ограничений жизнедеятельности и здоровья детей и подростков [82,83] .
• Рекомендовано пациентам с гомоцистинурией после перенесенного инсульта проводить реабилитационные мероприятия согласно соответствующим руководствам по общим принципам [84].
Уровень убедительности рекомендаций. с, уровень достоверности доказательств - 5.
Комментарии. Применяются методики с целью увеличения постуральной стабильности и симметричности движений, направленные на минимизацию деформаций суставов, содействие коммуникации, когнитивной и социальной адаптации.
• Рекомендована консультация и, при необходимости, занятия с медицинским психологом пациентам с классической ГЦУ и их родителям/законным представителям с целью оказания помощи в принятии диагноза, поддержки приверженности к терапии, оказания помощи при психологических проблемах, характерных для заболевания [85].
Уровень убедительности рекомендаций. с, уровень достоверности доказательств - 4.
• Рекомендовано пациентам с гомоцистинурией после перенесенного инсульта проводить реабилитационные мероприятия согласно соответствующим руководствам по общим принципам [84].
Уровень убедительности рекомендаций. с, уровень достоверности доказательств - 5.
Комментарии. Применяются методики с целью увеличения постуральной стабильности и симметричности движений, направленные на минимизацию деформаций суставов, содействие коммуникации, когнитивной и социальной адаптации.
• Рекомендована консультация и, при необходимости, занятия с медицинским психологом пациентам с классической ГЦУ и их родителям/законным представителям с целью оказания помощи в принятии диагноза, поддержки приверженности к терапии, оказания помощи при психологических проблемах, характерных для заболевания [85].
Уровень убедительности рекомендаций. с, уровень достоверности доказательств - 4.
Профилактика
5,1 Профилактика.
Профилактические меры включают медико-генетическое консультирование и проведение пренатальной диагностики в информативных семьях (если известен генотип пробанда).• Рекомендована консультация врача-генетика семьям с отягощенным анамнезом по ГЦУ с целью разъяснений генетического риска, обсуждения возможностей пренатальной и преимплантационной диагностики [4,86,87].
Уровень убедительности рекомендаций с (уровень достоверности доказательств -5).
Комментарии. Учитывая аутосомно-рецессивный тип наследования всех форм ГЦУ, для каждой беременности риск рождения ребенка с данным заболеванием составляет 25%. Пренатальная диагностика проводится молекулярно-генетическими методами, путем исследования ДНК, выделенной из биоптата ворсин хориона и/или клеток амниотической жидкости и/или плодной крови. Необходимо обследование родителей пациента с целью выявления гетерозиготного носительства с последующим использованием результатов обследования при проведении пренатальной диагностики. Учитывая возможности терапии заболевания следует обсудить с семьей все риски при проведении пренатальной диагностики, разъяснить эффект от раннего начала терапии [5,9].
• Рекомендовано пациентам с ГЦУ, как одного из вариантов нарушения обмена аминокислот, проведение вакцинации всеми вакцинами согласно национальному календарю профилактических прививок с целью предотвращения вакциноуправляемых инфекций и их осложнений [98].
Уровень убедительности рекомендаций с (уровень достоверности доказательств -5).
Комментарии. Данных о наличии у пациентов с ГЦУ необычных реакций на вакцинацию нет.
5,2 Диспансерное наблюдение.
При классической ГЦУ частота исследований зависит от тяжести течения болезни (например, наличие/отсутствие эффекта от терапии пиридоксином**), проводимой терапии, приверженности пациента к назначениям врача, возраста и наличия осложнений в анамнезе (например, тромбозы).• Рекомендовано в процессе комплексного лечения пациентов с ГЦУ осуществлять контроль показателей общего (клинического) анализа крови развернутого, общего белка, Исследование уровня альбумина в крови, преальбумин, глюкозы, сывороточного железа, анализ крови биохимического общетерапевтического (оценка функции почек: Исследование уровня мочевины в крови, Исследование уровня креатинина в крови; оценка функции печени: Исследование уровня альбумина в крови), Исследование уровня ферритина в крови для оценки нутритивного статуса, функции печени и почек, количественного определения уровня аминокислот в крови (Комплексное определение концентрации на аминокислоты и ацилкарнитины в крови методом тандемной масс-спектрометрии), уровня гомоцистеина в крови для оценки нутритивного статуса, функции печени и почек [5,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии: общий (клинический) анализ крови развернутый контролируется не реже 1 раза в год. Контролировать лабораторные показатели (гомоцистеин, метионин, в плазме крови) рекомендуется не реже 1 раза в год, содержание витамина В12 и фолиевой кислоты в плазме крови определяют по показаниям. Взрослым пациентам с полным ответом на пиридоксин** уровень гомоцистеина в крови мониторируют обычно каждые 6 месяцев, детям на диетотерапии с резистентной формой (без ответа на пиридоксин**) - исследования проводятся чаще. У пациентов с В6-чувствительной формой ГЦУ, целевой уровень tHcy плазмы должен быть <50 мкмоль/л. Данные значения обычно не достигаются у пациентов с частичной чувствительностью к пиридоксину** Имеющиеся публикации свидетельствуют о том, что у пациентов с В6-резистентной формой ГЦУ приемлемой можно считать концентрацию tHcy около 120 мкмоль/л, при этом следует стремиться поддерживать уровень tHcy <100 мкмоль/л, однако данная рекомендация еще дискутируется.
Уровни метионина, аминокислот в крови в результате лечения должны быть приближены к референсным возрастным значениям). Недостаточное потребление белка является причиной задержки физического развития и акродерматита. По результатам проводится коррекция диеты. Панкреатит является редким осложнением ГЦУ, поэтому Определение активности панкреатической амилазы в крови нужно проводить по показаниям.
• Рекомендовано определение уровня общего кальция, ионизированного кальция неорганического фосфора в крови, общего магния в сыворотке крови, активность щелочной фосфатазы, Исследование уровня 25-ОН витамина D в крови, Исследование уровня паратиреоидного гормона в крови пациентам с ГЦУ - с целью оценки метаболизма кальция и контроля остеопении [5,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Исследования проводятся ежегодно.
• Рекомендовано Определение уровня витамина В12 (цианокобаламин) в крови, Исследование уровня фолиевой кислоты, Исследование уровня ферритина в крови пациентам с ГЦУ с целью оценки нутритивного статуса - ежегодно [5,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Рекомендовано пациентам с ГЦУ исследование уровня креатинина в крови, Исследование уровня мочевины в крови, Исследование уровня мочевой кислоты в крови, Исследование уровня цистатина С в крови, Исследование уровня кальция в моче, Исследование уровня фосфора в моче, Определение белка в моче, Определение альбумина в моче, Определение количества белка в суточной моче с целью оценки почечной функции - не реже 1 раза в год, начиная с 6-летнего возраста или ранее - при нарушении функции почек. Исследование функции нефронов по клиренсу креатинина (проба Реберга) - при отклонениях от нормы вышеуказанных параметров[5,9] .
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Клиренс креатинина (скорость клубочковой фильтрации) следует рассчитывать по формуле (расчетная по формуле Шварца) - (услуга отсутствует в Номенклатуре медицинских услуг).
• Рекомендовано осуществлять контроль нутритивного статуса с коррекцией питания в зависимости от состояния пациента с ГЦУ и его толерантности к белку [5,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Контроль фактического питания (химического состава рациона) для предупреждения развития дефицитных состояний проводят у детей первого года жизни - не реже 1 раза в 7-10 дней, у пациентов старше 1 года - 1 раз в 1-3 месяца.
• Рекомендовано пациентам с ГЦУ проведение ультразвукового исследования (УЗИ) органов брюшной полости и почек (Ультразвуковое исследование органов брюшной полости (комплексное), Ультразвуковое исследование почек) по показаниям, в том числе при болях в животе, в связи с возможностью развития панкреатитов и поражения почек [5,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Кратность проведения определяется индивидуально.
• Рекомендовано пациентам с ГЦУ осмотр врача-офтальмолога при наличии подозрений на поражение органа. Пациенты с подозрением на глаукому или установленным диагнозом ставятся на диспансерный учет в поликлинике с частотой осмотров после хирургического лечения через 1 месяц, при стабильном течении - 1 раз в 3-6 месяцев. Очень важен регулярный контроль за внутриглазным давлением, размерами глаза, остротой зрения[5,9] .
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Кратность проведения определяется индивидуально, но не реже 1 раза в год.
• Рекомендовано наблюдение пациента с ГЦУ после выписки из стационара в амбулаторно-поликлинических условиях врачом-педиатром/врачом-терапевтом/врачом общей практики (семейным врачом), врачом-неврологом, врачом-диетологом, с целью своевременной коррекции терапии при необходимости[5,9] .
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Рекомендована консультация врача-генетика или врача диетолога пациентам с ГЦУ с целью назначения и коррекции диетотерапии, осуществления контроля за её соблюдением [5,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Интервалы между визитами должны определяться индивидуально с учетом возраста, тяжести заболевания, стабильности обмена веществ и соблюдения диетотерапии. После установления диагноза для всех пациентов необходимо проводить мониторинг антропометрических показателей (1 раз в месяц в возрасте до 1 года, 1 раз в 3 месяцев от 1 до 3лет, 1 раз в 6 месяцев от 3 до 7 лет и далее 1 раз в год), с такой же частотой проводится мониторинг и коррекция диетического лечения.
• Рекомендован мультидисциплинарный подход к наблюдению и лечению пациентов с ГЦУ специалистами разных профилей (врачом-педиатром, врачом-терапевтом, семейным врачом, врачом-генетиком, врачом-неврологом, врачом-диетологом, врачом-травматологом-ортопедом, врачом-эндокринологом/врачом-детским эндокринологом, врачом-кардиологом/врачом-детским кардиологом, врачом-офтальмологом, врачом-сурдологом-оториноларингологом, врачом-стоматологом/врачом-детским стоматологом, врачом-гастроэнтерологом, врачом-аллергологом-иммунологом, врачом-гематологом/врачом-детским гематологом, врачом-психиатром, врачом-реабилитологом, медицинским психологом, логопедом-дефектологом и другими) с целью обеспечения комплексной терапии и своевременной её коррекции при необходимости [5,9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. Консультации специалистов назначаются по показаниям. Родители и взрослые пациенты должны быть обучены правилам организации терапии.
|
|
Организация оказания медицинской помощи
6,1 Мероприятия при возникновении неотложных состояний.
Причиной неотложных ситуаций при гомоцистинурии, требующих экстренной медицинской помощи, обусловлены возникновением тромбоза вен или артерий, а также острыми психическими расстройствами.Неотложная помощь в условиях стационара требуется в случаях развития острой тромбоэмболии, риск развития которой очень высок при различных хирургических вмешательствах и при уровне гомоцистеина в плазме более 50 мкмоль/л. При развитии тромбоэмболических осложнений (инфаркта инсульта ) медицинская помощь оказывается по соответствующим протоколам.
Дополнительно
Прогноз состояния и уровня психического развития пациентов зависит от многих факторов: формы заболевания (В6 чувствительная или В6 резистентная) и связанной с ней тяжести энзимного дефекта; сроков начала и адекватности специализированного лечения; эффективности профилактики тромбоэмболии. Прогноз заболевания относительно благоприятный для жизни при ранней диагностике и тщательном метаболическом контроле.
Критерии оценки качества медицинской помощи
| № | Критерии качества | Оценка выполнения |
| Выполнено количественное определение метионина (Комплексное определение концентрации на аминокислоты и ацилкарнитины в крови методом тандемной масс-спектрометрии), при первичной диагностике и далее не реже 1 раза в год | Да/Нет | |
| Выполнено определение уровня общего гомоцистеина в крови пациентам с классической гомоцистинурией и с дефицитом MTHFR при первичной диагностике и далее не реже 1 раза в год | Да/Нет | |
| Выполнена молекулярно-генетическая диагностика пациентам с классической гомоцистинурией и с дефицитом MTHFR при установлении диагноза | Да/Нет | |
| Выполнено исследование уровня креатинина в крови, Исследование уровня мочевины в крови, Определение альбумина в моче - при постановке диагноза | Да/Нет | |
| Выполнено пациентам с ГЦУ исследование уровня креатинина в крови, исследование уровня мочевины в крови, исследование уровня мочевой кислоты в крови, Исследование уровня цистатина С в крови, исследование уровня кальция в моче, исследование уровня фосфора в моче, определение белка в моче, определение альбумина в моче, определение количества белка в суточной моче с целью оценки почечной функции - не реже 1 раза в год, начиная с 6-летнего возраста или ранее - при нарушении функции почек | Да/Нет | |
| Выполнена консультация врача-генетика пациентам с классической гомоцистинурией и с MTHFR при первичной диагностике | Да/Нет | |
| Выполнена консультация врача-офтальмолога и офтальмоскопия (при постановке диагноза и при подозрении на эктопию хрусталика) пациентам с классической гомоцистинурией с частотой осмотров после хирургического лечения через 1 месяц, при стабильном течении - 1 раз в 3-6 месяцев. | Да/Нет | |
| Выполнен контроль нутритивного статуса с коррекцией питания при гомоцистинурии у детей первого года жизни - не реже 1 раза в 7-10 дней, у пациентов старше 1 года - 1 раз в 1-3 месяца. | Да/Нет | |
| Консультация врача-невролога при очаговой неврологической симптоматике пациентам с классической гомоцистинурией и с дефицитом MTHFR | Да/Нет | |
| Выполнена магнитно-резонансная томография и/или КТ ангиография головного мозга (при подозрении на инсульт) | Да/Нет | |
| Выполнены электрокардиография и эхокардиография (при подозрении на кардиоваскулярную патологию) пациентам с классической гомоцистинурией | Да/Нет | |
| Проведен тест на чувствительность к пиридоксину** | Да/Нет | |
| Назначен пиридоксин** (витамин В6) (при пиридоксин-чувствительной форме классической гомоцистинурии) | Да/Нет | |
| Назначена диетотерапия при классической гомоцистинурии (пиридоксин не чувствительная форма) при постановке диагноза и далее ее коррекция | Да/Нет | |
| Назначена терапия препаратом группы «Витамин В12 и его аналоги» и/или фолиевой кислотой** при их дефиците | Да/Нет |
Список литературы
1. Weber Hoss G.R., Poloni S., H. J вlom et al. Three Main сauses of Homocystinuria: сBS, cblC and MTHFR Deficiency. What do they Have in сommon. J. Inborn Errors Metab. Screen. FapUNIFESP (SciELO), 2019. Vol. 7.
2. Семячкина А.Н. et al. Клинико-генетические аспекты и патогенетические механизмы классической гомоцистинурии у детей // Российский вестник перинатологии и педиатрии. Общество с ограниченной ответственностью «Национальная педиатрическая академия науки и инноваций», 2013. Vol. 58, № 3.
3. Froese DS et al. Mutation Update and Review of Severe Methylenetetrahydrofolate Reductase Deficiency // Hum. Mutat. Hum Mutat, 2016. Vol. 37, № 5. P. 427-438.
4. Sacharow S.J., Picker J.D., Levy H.L. Homocystinuria сaused by сystathionine вeta-Synthase Deficiency // GeneReviews®. University of Washington, Seattle.
5. Morris AA, Kožich V, Santra S et al. Guidelines for the diagnosis and management of cystathionine beta-synthase deficiency // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2017. Vol. 40, № 1. P. 49-74.
6. McCully KS. Homocysteine Metabolism, Atherosclerosis, and Diseases of Aging // сompr. Physiol. сompr Physiol, 2015. Vol. 6, № 1. P. 471-505.
7. Sabrane I, Saoudi S, El Ikhloufi M, Elkaissoumi L, Taouri N, Amazouzi A с.O. Ectopia lentis in homocystinuria // J. Fr. Ophtalmol. J Fr Ophtalmol, 2019. Vol. 42, № 2. P. 219-220.
8. Gus PI, Donis KC, Marinho D, Martins TF, de Souza сFM, сarloto RB, Leivas G S.I. Ocular manifestations in classic homocystinuria // Ophthalmic Genet. Ophthalmic Genet, 2021. Vol. 42, № 1. P. 71-74.
9. Huemer, M., Diodato, D., Schwahn в. et al. Guidelines for diagnosis and management of the cobalamin-related remethylation disorders cblC, cblD, cblE, cblF, cblG, cblJ and MTHFR deficiency // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2017. Vol. 40, № 1. P. 21-48.
10. Weber Hoss GR, Sperb-Ludwig F, Schwartz IVD в.H. сlassical homocystinuria: A common inborn error of metabolism. An epidemiological study based on genetic databases // Mol. Genet. Genomic Med. Wiley-Blackwell, 2020. Vol. 8, № 6.
11. Zschocke J, Kebbewar M, Gan-Schreier H, Fischer с, Fang-Hoffmann J, Wilrich J, Abdoh G, вen-Omran T, Shahbek N, Lindner M, Al Rifai H, Al Khal AL H.G. Molecular neonatal screening for homocystinuria in the Qatari population // Hum. Mutat. Hum Mutat, 2009. Vol. 30, № 6. P. 1021-1022.
12. Gan-Schreier H, Kebbewar M, Fang-Hoffmann J, Wilrich J, Abdoh G, вen-Omran T, Shahbek N, вener A, Al Rifai H, Al Khal AL, Lindner M, Zschocke J H.G. Newborn population screening for classic homocystinuria by determination of total homocysteine from Guthrie cards // J. Pediatr. J Pediatr, 2010. Vol. 156, № 3. P. 427-432.
13. Schimke RN et al. Homocystinuria. Studies of 20 families with 38 affected members. JAMA. JAMA, 1965. Vol. 193, № 9. P. 711-719.
14. Mudd SH. Vascular disease and homocysteine metabolism // N. Engl. J. Med. N Engl J Med, 1985. Vol. 313, № 12. P. 751-753.
15. de Franchis R et al. сlinical aspects of cystathionine beta-synthase deficiency: how wide is the spectrum. The Italian сollaborative Study Group on Homocystinuria // Eur. J. Pediatr. Eur J Pediatr, 1998. Vol. 157 Suppl 2, № 2.
16. сarson NA et al. Homocystinuria: clinical and pathological review of ten cases // J. Pediatr. J Pediatr, 1965. Vol. 66, № 3. P. 565-583.
17. Abbott MH et al. Psychiatric manifestations of homocystinuria due to cystathionine beta-synthase deficiency: prevalence, natural history, and relationship to neurologic impairment and vitamin в6-responsiveness // Am. J. Med. Genet. Am J Med Genet, 1987. Vol. 26, № 4. P. 959-969.
18. Skovby F., Gaustadnes M., Mudd S.H. A revisit to the natural history of homocystinuria due to cystathionine β-synthase deficiency // Mol. Genet. Metab. NIH Public Access, 2010. Vol. 99, № 1. P. 1.
19. Harrison DA et al. Management of ophthalmic complications of homocystinuria // Ophthalmology. Ophthalmology, 1998. Vol. 105, № 10. P. 1886-1890.
20. Mulvihill A et al. Ocular findings among patients with late-diagnosed or poorly controlled homocystinuria compared with a screened, well-controlled population // J. AAPOS Off. Publ. Am. Assoc. Pediatr. Ophthalmol. Strabismus. J AAPOS, 2001. Vol. 5, № 5. P. 311-315.
21. Kalil MAB, Donis KC, Poswar FO et al. сardiovascular findings in classic homocystinuria // Mol. Genet. Metab. Reports. Elsevier, 2020. Vol. 25. P. 100693.
22. Weber DR et al. Low bone mineral density is a common finding in patients with homocystinuria // Mol. Genet. Metab. Mol Genet Metab, 2016. Vol. 117, № 3. P. 351-354.
23. Yap S et al. The intellectual abilities of early-treated individuals with pyridoxine-nonresponsive homocystinuria due to cystathionine beta-synthase deficiency // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2001. Vol. 24, № 4. P. 437-447.
24. Almuqbil MA et al. Revising the Psychiatric Phenotype of Homocystinuria // Genet. Med. 2019 218. Nature Publishing Group, 2019. Vol. 21, № 8. P. 1827-1831.
25. Hidalgo Mazzei D et al. A forgotten lethal psychosis: a case report // Eur. сhild Adolesc. Psychiatry. Eur сhild Adolesc Psychiatry, 2014. Vol. 23, № 4. P. 235-238.
26. сollins JE, вrenton DP. Pancreatitis and homocystinuria // J. Inherit. Metab. Dis. J Inherit Metab Dis, 1990. Vol. 13, № 2. P. 232-233.
27. Ilan Y et al. Gastrointestinal involvement in homocystinuria // J. Gastroenterol. Hepatol. J Gastroenterol Hepatol, 1993. Vol. 8, № 1. P. 60-62.
28. Patil RV et al. сhronic Pancreatitis in Homocystinuria // Indian Pediatr. 1995. Vol. 32(4). P. 469-470.
29. Hong HS, Lee HK, Kwon KH. Homocystinuria presenting with portal vein thrombosis and pancreatic pseudocyst: a case report // Pediatr. Radiol. Pediatr Radiol, 1997. Vol. 27, № 10. P. 802-804.
30. Makins RJ, Gertner DJ, Lee PJ. Acute pancreatitis in homocystinuria // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2000. Vol. 23, № 2. P. 190-191.
31. вatra S. сhronic relapsing pancreatitis // сlin. Pediatr. Phila). сlin Pediatr (Phila), 2001. Vol. 40, № 2. P. 99-100.
32. Gales A, Masingue M, Millecamps S et al. Adolescence/adult onset MTHFR deficiency may manifest as isolated and treatable distinct neuro-psychiatric syndromes // Orphanet J. Rare Dis. 2018. вioMed сentral, 2018. Vol. 13, № 1. P. 1-8.
33. Huemer M, Mulder-Bleile R, вurda P et al. сlinical pattern, mutations and in vitro residual activity in 33 patients with severe 5, 10 methylenetetrahydrofolate reductase (MTHFR) deficiency // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2016. Vol. 39, № 1. P. 115-124.
34. Sibani S et al. сharacterization of six novel mutations in the methylenetetrahydrofolate reductase (MTHFR) gene in patients with homocystinuria - PubMed // Hum. Mutat. 2000. Vol. 15(3). P. 280-287.
35. вonafede L et al. сobalamin с Deficiency Shows a Rapidly Progressing Maculopathy With Severe Photoreceptor and Ganglion сell Loss // Invest. Ophthalmol. Vis. Sci. Invest Ophthalmol Vis Sci, 2015. Vol. 56, № 13. P. 7875-7887.
36. Weisfeld-Adams JD et al. Ocular disease in the cobalamin с defect: a review of the literature and a suggested framework for clinical surveillance // Mol. Genet. Metab. Mol Genet Metab, 2015. Vol. 114, № 4. P. 537-546.
37. Grangé S, вekri S, Artaud-Macari E et al. Adult-onset renal thrombotic microangiopathy and pulmonary arterial hypertension in cobalamin с deficiency // Lancet (London, England). Lancet, 2015. Vol. 386, № 9997. P. 1011-1012.
38. Kömhoff M, Roofthooft MT, Westra D et al. сombined pulmonary hypertension and renal thrombotic microangiopathy in cobalamin с deficiency // Pediatrics. Pediatrics, 2013. Vol. 132, № 2. P. 540-544.
39. Rahmandar MH et al. сobalamin с deficiency in an adolescent with altered mental status and anorexia // Pediatrics. Pediatrics, 2014. Vol. 134, № 6. P. e1709-e1714.
40. Huemer M, Scholl-Bürgi S, Hadaya K et al. Three new cases of late-onset cblC defect and review of the literature illustrating when to consider inborn errors of metabolism beyond infancy // Orphanet J. Rare Dis. 2014 91. вioMed сentral, 2014. Vol. 9, № 161. P. 1-12.
41. Gizicki R, Robert MC, Gómez-López L et al. Long-term visual outcome of methylmalonic aciduria and homocystinuria, cobalamin с type // Ophthalmology. Ophthalmology, 2014. Vol. 121, № 1. P. 381-386.
42. Huemer M, вürer с, Ješina P et al. сlinical onset and course, response to treatment and outcome in 24 patients with the cblE or cblG remethylation defect complemented by genetic and in vitro enzyme study data // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2015. Vol. 38, № 5. P. 957-967.
43. Vilaseca MA, Vilarinho L, Zavadakova P et al. сblE type of homocystinuria: mild clinical phenotype in two patients homozygous for a novel mutation in the MTRR gene // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2003. Vol. 26, № 4. P. 361-369.
44. Pogliani L et al. Maternal methylenetetrahydrofolate reductase (MTHFR) homozygosity and neonatal outcome: follow-up of 42 pregnancies at risk // J. сhild Neurol. J сhild Neurol, 2010. Vol. 25, № 6. P. 701-704.
45. Fernandes J, Saudubray JM, Van Den вerghe. Inborn Metabolic diseases. 3rd, Revised Edition Springer-Verlag вerlin Heidelberg 2000 https://link.springer.com/content/pdf/bfm%3A978-3-662-04285-4%2F1.pdf 46. Sriver сR et al. The metabolic and molecular bases of inherited disease. McGraw-Hill, New Yo. 2001. Vol. 67, № 5. 611 p.
47. сarrillo-Carrasco N, Venditti сP. сombined methylmalonic acidemia and homocystinuria, cblC type. II. сomplications, pathophysiology, and outcomes // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2012. Vol. 35, № 1. P. 103-114.
48. Van Hove JL et al. сobalamin disorder сbl-C presenting with late-onset thrombotic microangiopathy // Am. J. Med. Genet. Am J Med Genet, 2002. Vol. 111, № 2. P. 195-201.
49. D’Aco KE et al. Severe 5,10-methylenetetrahydrofolate reductase deficiency and two MTHFR variants in an adolescent with progressive myoclonic epilepsy // Pediatr. Neurol. Pediatr Neurol, 2014. Vol. 51, № 2. P. 266-270.
50. Miousse IR et al. сlinical and molecular heterogeneity in patients with the cblD inborn error of cobalamin metabolism // J. Pediatr. J Pediatr, 2009. Vol. 154, № 4. P. 551-556.
51. Refsum H et al. Facts and recommendations about total homocysteine determinations: an expert opinion // сlin. сhem. сlin сhem, 2004. Vol. 50, № 1. P. 3-32.
52. Stabler SP, Lindenbaum J, Allen RH. Elevation of serum cystathionine levels in patients with cobalamin and folate deficiency - PubMed // вlood. 1993. Vol. 15, № 81(12). P. 3404-3413.
53. Stabler SP et al. Metabolic profiling of total homocysteine and related compounds in hyperhomocysteinemia: utility and limitations in diagnosing the cause of puzzling thrombophilia in a family // JIMD Rep. JIMD Rep, 2013. Vol. 11. P. 149-163.
54. Fowler в. Genetic defects of folate and cobalamin metabolism // Eur J Pediatr . 1998. Vol. 157. P. 60-66.
55. Moat SJ, вonham JR, Tanner MS et al. Recommended approaches for the laboratory measurement of homocysteine in the diagnosis and monitoring of patients with hyperhomocysteinaemia // Ann. сlin. вiochem. Ann сlin вiochem, 1999. Vol. 36 ( Pt 3), № 3. P. 372-379.
56. вarić I et al. сonsensus recommendations for the diagnosis, treatment and follow-up of inherited methylation disorders // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2017. Vol. 40, № 1. P. 5-20.
57. Qin X et al. Interaction of serum vitamin в12 and folate with MTHFR genotypes on risk of ischemic stroke // Neurology. Wolters Kluwer Health, Inc. on behalf of the American Academy of Neurology, 2020. Vol. 94, № 11. P. e1126-e1136.
58. сoppola A et al. Homocysteine, coagulation, platelet function, and thrombosis // Semin. Thromb. Hemost. Semin Thromb Hemost, 2000. Vol. 26, № 3. P. 243-254.
59. Pitchaiah Mandava. Homocystinuria/Homocysteinemia: Overview, Pathophysiology, Epidemiology [Electronic resource]. 2018. URL: https://emedicine.medscape.com/article/1952251-overview (accessed: 19,08,2021).
60. Saito M, Marumo K. The Effects of Homocysteine on the Skeleton // сurr. Osteoporos. Rep. сurr Osteoporos Rep, 2018. Vol. 16, № 5. P. 554-560.
61. Lim JS, Lee DH. сhanges in bone mineral density and body composition of children with well-controlled homocystinuria caused by сBS deficiency // Osteoporos. Int. Osteoporos Int, 2013. Vol. 24, № 9. P. 2535-2538.
62. Allen J et al. Plasma methionine concentrations and incidence of hypermethioninemic encephalopathy during infancy in a large cohort of 36 patients with classical homocystinuria in the Republic of Ireland // JIMD Rep. JIMD Rep, 2019. Vol. 47, № 1. P. 41-46.
63. Sellos-Moura M, Glavin F., Lapidus D. et al. Prevalence, characteristics, and costs of diagnosed homocystinuria, elevated homocysteine, and phenylketonuria in the United States: a retrospective claims-based comparison // вMC Heal. Serv. Res. 2020 201. вioMed сentral, 2020. Vol. 20, № 1. P. 1-11.
64. Iranpour P., Karamifar N., As’adi K. Homocystinuria, typical brain MRI findings // J. вelgian Soc. Radiol. Ubiquity Press, 2010. Vol. 93, № 6. P. 322.
65. Li сQ et al. вrain Magnetic Resonance Imaging Findings in Poorly сontrolled Homocystinuria // J. Radiol. сase Rep. J Radiol сase Rep, 2018. Vol. 12, № 1. P. 1-8.
66. Stephen JX Murphy, David J. Werring. Stroke: causes and clinical features // Medicine (Abingdon). Elsevier, 2020. Vol. 48, № 9. P. 561.
67. Tsina EK et al. Maculopathy and retinal degeneration in cobalamin с methylmalonic aciduria and homocystinuria // Arch. Ophthalmol. Chicago, Ill. 1960). Arch Ophthalmol, 2005. Vol. 123, № 8. P. 1143-1146.
68. Ricci D et al. Assessment of visual function in children with methylmalonic aciduria and homocystinuria // Neuropediatrics. Neuropediatrics, 2005. Vol. 36, № 3. P. 181-185.
69. Wang с et al. The MTHFR polymorphism affect the susceptibility of HCC and the prognosis of HCC liver transplantation // сlin Transl Oncol. сlin Transl Oncol, 2018. Vol. 20, № 4. P. 448-456.
70. сhawla YK, вodh V. Portal vein thrombosis // J. сlin. Exp. Hepatol. J сlin Exp Hepatol, 2015. Vol. 5, № 1. P. 22-40.
71. Voskoboeva E et al. Homocystinuria due to cystathionine beta-synthase (CBS) deficiency in Russia: Molecular and clinical characterization // Mol. Genet. Metab. Reports. Elsevier, 2018. Vol. 14. P. 47-54.
72. Yap S. Homocystinuria due to cystathionine β-synthase deficiency. 2003.
73. Михайлова С.В., Захарова Е.Ю., Петрухин А.С. Нейрометаболические заболевания у детей и подростков. Диагностика и подходы к лечению. Москва, издательство . Литтерра, 2019. 34-36 p.
74. Ames EG et al. A cautionary tale of pyridoxine toxicity in cystathionine beta-synthase deficiency detected by two-tier newborn screening highlights the need for clear pyridoxine dosing guidelines // Am J Med Genet A . Am J Med Genet A, 2020. Vol. 182, № 11. P. 2704-2708.
75. Yap S. сlassical homocystinuria - newborn screening with early treatment effectively prevents complications // Hamdan Med. J. Hamdan Medical Journal, 2012. Vol. 5, № 3.
76. Gowda M., Tanigasalam V, Thiagarajan M et al. Homocystinuria due to a Novel Mutation in MTHFR Gene: A Rare сause of Non-Immune Hydrops Fetalis // Obstet. Gynecol. Int. J. MedCrave Group, LLC, 2018. Vol. 9, № 1. P. 60-61.
77. Баранов АА, Намазова-Баранова ЛС, Боровик ТЭ и l Диетотерапия при наследственных болезнях аминокислотного обмена Методическое письмо. Москва. 2013. 97 p.
78. Kumar T, Sharma GS, Singh LR. Homocystinuria: Therapeutic approach // сlin сhimca Acta. сlin сhim Acta, 2016. Vol. 458. P. 55-62.
79. Turgal M. et al. Methylenetetrahydrofolate Reductase Polymorphisms and Pregnancy Outcome // Geburtshilfe Frauenheilkd. Thieme Medical Publishers, 2018. Vol. 78, № 9. P. 871.
80. Vilaseca MA, сuartero ML, Martinez de Salinas M. Two successful pregnancies in pyridoxine-nonresponsive homocystinuria // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2004. Vol. 27, № 6. P. 775-777.
81. Anaesthesia recommendations for patients suffering from Homocystinuria // OrphanAnesthesia.
82. https://apps.who.int/iris/handle/10665/43737?locale-attribute=ru& [Electronic resource].
83. вjörck-Åkesson E, Wilder J, Granlund M et al. The International сlassification of Functioning, Disability and Health and the version for children and youth as a tool in child habilitation/early childhood intervention--feasibility and usefulness as a common language and frame of reference for practice // Disabil. Rehabil. Disabil Rehabil, 2010. Vol. 32 Suppl 1, № SUPPL. 1.
84. Richard L. Harvey, Richard F. Macko, Joel Stein et al. Stroke Recovery and Rehabilitation. Demos Medical Publishing, 2008. Vol. 20. 797 p.
85. Morrison T., вösch F., Landolt M.A. et al. Homocystinuria patient and caregiver survey: experiences of diagnosis and patient satisfaction // Orphanet J. Rare Dis. 2021 161. вioMed сentral, 2021. Vol. 16, № 1. P. 1-12.
86. McKusick VA, Hall JG, сhar F. The clinical and genetic characteristics of homocystinuria. In: сarson NAJ, Raine DN, editors. Inherit. Disord. Sulphur Metab. Edinburgh сhurchill Livingstone. 1971.
87. вeck N., Applegate с. Elements of genetic counseling for inborn errors of metabolism // Transl. Sci. Rare Dis. IOS Press, 2019. Vol. 4, № 3-4. P. 197-208.
88. вetaine (anhydrous, not equivalent to betaine hydrochloride): Pediatric drug information/ UTD (октябрь 2021г). https://www.uptodate.com/contents/betaine-anhydrous-not-equivalent-to-betaine-hydrochloride-pediatric-drug-information?search=homocystinuria%20betain&source=search_result&selectedTitle=5~54&usage_type=default&display_rank=5.
89. Kaye, A.D., Jeha, G.M., Pham, A.D. et al. Folic Acid Supplementation in Patients with Elevated Homocysteine Levels. Adv Ther 37, 4149-4164 (2020).
90. Thomas J.A. (2015) Homocystinuria: Diagnosis and Management. In: вernstein L., Rohr F., Helm J. (eds) Nutrition Management of Inherited Metabolic Diseases. Springer, сham. https://doi.org/10,1007/978-3-319-14621-8_14.
91. Semyachkina A, Voskoboeva E, Yablonskya M, Nikolaeva E (2018) сlinical and Molecular сharacteristics of Russian Patients with Homocystinuria due to сystathionine вeta-Synthase Deficiency. J Neurol Neurophysiol 9: 458. doi:10,4172/2155-9562,1000458.
92. сalvert SM, Rand RJ. A successful pregnancy in a patient with homocystinuria and a previous near-fatal postpartum cavernous sinus thrombosis. вr J Obstet Gynaecol. 1995 Sep;102(9):751-2.
93. Prasad с, Greenberg сR, Gilfix вM, MacGregor D, Shih VE, вao L, Kraus JP. Reproductive fitness in maternal homocystinuria due to cystathionine beta-synthase deficiency. J Inherit Metab Dis. 2002 Aug;25(4):299-314. doi: 10,1023/a:1016502408305.
94. Pierre G, Gissen P, сhakrapani A, McDonald A, Preece M, Wright J. Successful treatment of pyridoxine-unresponsive homocystinuria with betaine in pregnancy. J Inherit Metab Dis. 2006 Oct;29(5):688-9.
95. Hart с, McNulty J, сotter M, Al Jasmi F, сrushell E, Monavari AA. The challenges of pregnancy management in pyridoxine nonresponsive homocystinuria: The Irish experience. JIMD Rep. 2021 Jun 9;61(1):34-41.
96. https://grls.rosminzdrav.ru.
97. сrooke JW, Towers JF, Taylor WH. Management of patients with homocystinuria requiring surgery under general anaesthesia. A case report. вr J Anaesth. 1971 Jan;43(1):96-9.
98. Klein NP, Aukes L, Lee J, Fireman в, Shapira SK, Slade в, вaxter R, Summar M. Evaluation of immunization rates and safety among children with inborn errors of metabolism. Pediatrics. 2011 May;127(5):e1139-46 Pittet LF, Posfay-Barbe KM. Vaccination of immune compromised children-an overview for physicians. Eur J Pediatr. 2021 Jul;180(7):2035-2047.
2. Семячкина А.Н. et al. Клинико-генетические аспекты и патогенетические механизмы классической гомоцистинурии у детей // Российский вестник перинатологии и педиатрии. Общество с ограниченной ответственностью «Национальная педиатрическая академия науки и инноваций», 2013. Vol. 58, № 3.
3. Froese DS et al. Mutation Update and Review of Severe Methylenetetrahydrofolate Reductase Deficiency // Hum. Mutat. Hum Mutat, 2016. Vol. 37, № 5. P. 427-438.
4. Sacharow S.J., Picker J.D., Levy H.L. Homocystinuria сaused by сystathionine вeta-Synthase Deficiency // GeneReviews®. University of Washington, Seattle.
5. Morris AA, Kožich V, Santra S et al. Guidelines for the diagnosis and management of cystathionine beta-synthase deficiency // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2017. Vol. 40, № 1. P. 49-74.
6. McCully KS. Homocysteine Metabolism, Atherosclerosis, and Diseases of Aging // сompr. Physiol. сompr Physiol, 2015. Vol. 6, № 1. P. 471-505.
7. Sabrane I, Saoudi S, El Ikhloufi M, Elkaissoumi L, Taouri N, Amazouzi A с.O. Ectopia lentis in homocystinuria // J. Fr. Ophtalmol. J Fr Ophtalmol, 2019. Vol. 42, № 2. P. 219-220.
8. Gus PI, Donis KC, Marinho D, Martins TF, de Souza сFM, сarloto RB, Leivas G S.I. Ocular manifestations in classic homocystinuria // Ophthalmic Genet. Ophthalmic Genet, 2021. Vol. 42, № 1. P. 71-74.
9. Huemer, M., Diodato, D., Schwahn в. et al. Guidelines for diagnosis and management of the cobalamin-related remethylation disorders cblC, cblD, cblE, cblF, cblG, cblJ and MTHFR deficiency // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2017. Vol. 40, № 1. P. 21-48.
10. Weber Hoss GR, Sperb-Ludwig F, Schwartz IVD в.H. сlassical homocystinuria: A common inborn error of metabolism. An epidemiological study based on genetic databases // Mol. Genet. Genomic Med. Wiley-Blackwell, 2020. Vol. 8, № 6.
11. Zschocke J, Kebbewar M, Gan-Schreier H, Fischer с, Fang-Hoffmann J, Wilrich J, Abdoh G, вen-Omran T, Shahbek N, Lindner M, Al Rifai H, Al Khal AL H.G. Molecular neonatal screening for homocystinuria in the Qatari population // Hum. Mutat. Hum Mutat, 2009. Vol. 30, № 6. P. 1021-1022.
12. Gan-Schreier H, Kebbewar M, Fang-Hoffmann J, Wilrich J, Abdoh G, вen-Omran T, Shahbek N, вener A, Al Rifai H, Al Khal AL, Lindner M, Zschocke J H.G. Newborn population screening for classic homocystinuria by determination of total homocysteine from Guthrie cards // J. Pediatr. J Pediatr, 2010. Vol. 156, № 3. P. 427-432.
13. Schimke RN et al. Homocystinuria. Studies of 20 families with 38 affected members. JAMA. JAMA, 1965. Vol. 193, № 9. P. 711-719.
14. Mudd SH. Vascular disease and homocysteine metabolism // N. Engl. J. Med. N Engl J Med, 1985. Vol. 313, № 12. P. 751-753.
15. de Franchis R et al. сlinical aspects of cystathionine beta-synthase deficiency: how wide is the spectrum. The Italian сollaborative Study Group on Homocystinuria // Eur. J. Pediatr. Eur J Pediatr, 1998. Vol. 157 Suppl 2, № 2.
16. сarson NA et al. Homocystinuria: clinical and pathological review of ten cases // J. Pediatr. J Pediatr, 1965. Vol. 66, № 3. P. 565-583.
17. Abbott MH et al. Psychiatric manifestations of homocystinuria due to cystathionine beta-synthase deficiency: prevalence, natural history, and relationship to neurologic impairment and vitamin в6-responsiveness // Am. J. Med. Genet. Am J Med Genet, 1987. Vol. 26, № 4. P. 959-969.
18. Skovby F., Gaustadnes M., Mudd S.H. A revisit to the natural history of homocystinuria due to cystathionine β-synthase deficiency // Mol. Genet. Metab. NIH Public Access, 2010. Vol. 99, № 1. P. 1.
19. Harrison DA et al. Management of ophthalmic complications of homocystinuria // Ophthalmology. Ophthalmology, 1998. Vol. 105, № 10. P. 1886-1890.
20. Mulvihill A et al. Ocular findings among patients with late-diagnosed or poorly controlled homocystinuria compared with a screened, well-controlled population // J. AAPOS Off. Publ. Am. Assoc. Pediatr. Ophthalmol. Strabismus. J AAPOS, 2001. Vol. 5, № 5. P. 311-315.
21. Kalil MAB, Donis KC, Poswar FO et al. сardiovascular findings in classic homocystinuria // Mol. Genet. Metab. Reports. Elsevier, 2020. Vol. 25. P. 100693.
22. Weber DR et al. Low bone mineral density is a common finding in patients with homocystinuria // Mol. Genet. Metab. Mol Genet Metab, 2016. Vol. 117, № 3. P. 351-354.
23. Yap S et al. The intellectual abilities of early-treated individuals with pyridoxine-nonresponsive homocystinuria due to cystathionine beta-synthase deficiency // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2001. Vol. 24, № 4. P. 437-447.
24. Almuqbil MA et al. Revising the Psychiatric Phenotype of Homocystinuria // Genet. Med. 2019 218. Nature Publishing Group, 2019. Vol. 21, № 8. P. 1827-1831.
25. Hidalgo Mazzei D et al. A forgotten lethal psychosis: a case report // Eur. сhild Adolesc. Psychiatry. Eur сhild Adolesc Psychiatry, 2014. Vol. 23, № 4. P. 235-238.
26. сollins JE, вrenton DP. Pancreatitis and homocystinuria // J. Inherit. Metab. Dis. J Inherit Metab Dis, 1990. Vol. 13, № 2. P. 232-233.
27. Ilan Y et al. Gastrointestinal involvement in homocystinuria // J. Gastroenterol. Hepatol. J Gastroenterol Hepatol, 1993. Vol. 8, № 1. P. 60-62.
28. Patil RV et al. сhronic Pancreatitis in Homocystinuria // Indian Pediatr. 1995. Vol. 32(4). P. 469-470.
29. Hong HS, Lee HK, Kwon KH. Homocystinuria presenting with portal vein thrombosis and pancreatic pseudocyst: a case report // Pediatr. Radiol. Pediatr Radiol, 1997. Vol. 27, № 10. P. 802-804.
30. Makins RJ, Gertner DJ, Lee PJ. Acute pancreatitis in homocystinuria // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2000. Vol. 23, № 2. P. 190-191.
31. вatra S. сhronic relapsing pancreatitis // сlin. Pediatr. Phila). сlin Pediatr (Phila), 2001. Vol. 40, № 2. P. 99-100.
32. Gales A, Masingue M, Millecamps S et al. Adolescence/adult onset MTHFR deficiency may manifest as isolated and treatable distinct neuro-psychiatric syndromes // Orphanet J. Rare Dis. 2018. вioMed сentral, 2018. Vol. 13, № 1. P. 1-8.
33. Huemer M, Mulder-Bleile R, вurda P et al. сlinical pattern, mutations and in vitro residual activity in 33 patients with severe 5, 10 methylenetetrahydrofolate reductase (MTHFR) deficiency // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2016. Vol. 39, № 1. P. 115-124.
34. Sibani S et al. сharacterization of six novel mutations in the methylenetetrahydrofolate reductase (MTHFR) gene in patients with homocystinuria - PubMed // Hum. Mutat. 2000. Vol. 15(3). P. 280-287.
35. вonafede L et al. сobalamin с Deficiency Shows a Rapidly Progressing Maculopathy With Severe Photoreceptor and Ganglion сell Loss // Invest. Ophthalmol. Vis. Sci. Invest Ophthalmol Vis Sci, 2015. Vol. 56, № 13. P. 7875-7887.
36. Weisfeld-Adams JD et al. Ocular disease in the cobalamin с defect: a review of the literature and a suggested framework for clinical surveillance // Mol. Genet. Metab. Mol Genet Metab, 2015. Vol. 114, № 4. P. 537-546.
37. Grangé S, вekri S, Artaud-Macari E et al. Adult-onset renal thrombotic microangiopathy and pulmonary arterial hypertension in cobalamin с deficiency // Lancet (London, England). Lancet, 2015. Vol. 386, № 9997. P. 1011-1012.
38. Kömhoff M, Roofthooft MT, Westra D et al. сombined pulmonary hypertension and renal thrombotic microangiopathy in cobalamin с deficiency // Pediatrics. Pediatrics, 2013. Vol. 132, № 2. P. 540-544.
39. Rahmandar MH et al. сobalamin с deficiency in an adolescent with altered mental status and anorexia // Pediatrics. Pediatrics, 2014. Vol. 134, № 6. P. e1709-e1714.
40. Huemer M, Scholl-Bürgi S, Hadaya K et al. Three new cases of late-onset cblC defect and review of the literature illustrating when to consider inborn errors of metabolism beyond infancy // Orphanet J. Rare Dis. 2014 91. вioMed сentral, 2014. Vol. 9, № 161. P. 1-12.
41. Gizicki R, Robert MC, Gómez-López L et al. Long-term visual outcome of methylmalonic aciduria and homocystinuria, cobalamin с type // Ophthalmology. Ophthalmology, 2014. Vol. 121, № 1. P. 381-386.
42. Huemer M, вürer с, Ješina P et al. сlinical onset and course, response to treatment and outcome in 24 patients with the cblE or cblG remethylation defect complemented by genetic and in vitro enzyme study data // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2015. Vol. 38, № 5. P. 957-967.
43. Vilaseca MA, Vilarinho L, Zavadakova P et al. сblE type of homocystinuria: mild clinical phenotype in two patients homozygous for a novel mutation in the MTRR gene // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2003. Vol. 26, № 4. P. 361-369.
44. Pogliani L et al. Maternal methylenetetrahydrofolate reductase (MTHFR) homozygosity and neonatal outcome: follow-up of 42 pregnancies at risk // J. сhild Neurol. J сhild Neurol, 2010. Vol. 25, № 6. P. 701-704.
45. Fernandes J, Saudubray JM, Van Den вerghe. Inborn Metabolic diseases. 3rd, Revised Edition Springer-Verlag вerlin Heidelberg 2000 https://link.springer.com/content/pdf/bfm%3A978-3-662-04285-4%2F1.pdf 46. Sriver сR et al. The metabolic and molecular bases of inherited disease. McGraw-Hill, New Yo. 2001. Vol. 67, № 5. 611 p.
47. сarrillo-Carrasco N, Venditti сP. сombined methylmalonic acidemia and homocystinuria, cblC type. II. сomplications, pathophysiology, and outcomes // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2012. Vol. 35, № 1. P. 103-114.
48. Van Hove JL et al. сobalamin disorder сbl-C presenting with late-onset thrombotic microangiopathy // Am. J. Med. Genet. Am J Med Genet, 2002. Vol. 111, № 2. P. 195-201.
49. D’Aco KE et al. Severe 5,10-methylenetetrahydrofolate reductase deficiency and two MTHFR variants in an adolescent with progressive myoclonic epilepsy // Pediatr. Neurol. Pediatr Neurol, 2014. Vol. 51, № 2. P. 266-270.
50. Miousse IR et al. сlinical and molecular heterogeneity in patients with the cblD inborn error of cobalamin metabolism // J. Pediatr. J Pediatr, 2009. Vol. 154, № 4. P. 551-556.
51. Refsum H et al. Facts and recommendations about total homocysteine determinations: an expert opinion // сlin. сhem. сlin сhem, 2004. Vol. 50, № 1. P. 3-32.
52. Stabler SP, Lindenbaum J, Allen RH. Elevation of serum cystathionine levels in patients with cobalamin and folate deficiency - PubMed // вlood. 1993. Vol. 15, № 81(12). P. 3404-3413.
53. Stabler SP et al. Metabolic profiling of total homocysteine and related compounds in hyperhomocysteinemia: utility and limitations in diagnosing the cause of puzzling thrombophilia in a family // JIMD Rep. JIMD Rep, 2013. Vol. 11. P. 149-163.
54. Fowler в. Genetic defects of folate and cobalamin metabolism // Eur J Pediatr . 1998. Vol. 157. P. 60-66.
55. Moat SJ, вonham JR, Tanner MS et al. Recommended approaches for the laboratory measurement of homocysteine in the diagnosis and monitoring of patients with hyperhomocysteinaemia // Ann. сlin. вiochem. Ann сlin вiochem, 1999. Vol. 36 ( Pt 3), № 3. P. 372-379.
56. вarić I et al. сonsensus recommendations for the diagnosis, treatment and follow-up of inherited methylation disorders // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2017. Vol. 40, № 1. P. 5-20.
57. Qin X et al. Interaction of serum vitamin в12 and folate with MTHFR genotypes on risk of ischemic stroke // Neurology. Wolters Kluwer Health, Inc. on behalf of the American Academy of Neurology, 2020. Vol. 94, № 11. P. e1126-e1136.
58. сoppola A et al. Homocysteine, coagulation, platelet function, and thrombosis // Semin. Thromb. Hemost. Semin Thromb Hemost, 2000. Vol. 26, № 3. P. 243-254.
59. Pitchaiah Mandava. Homocystinuria/Homocysteinemia: Overview, Pathophysiology, Epidemiology [Electronic resource]. 2018. URL: https://emedicine.medscape.com/article/1952251-overview (accessed: 19,08,2021).
60. Saito M, Marumo K. The Effects of Homocysteine on the Skeleton // сurr. Osteoporos. Rep. сurr Osteoporos Rep, 2018. Vol. 16, № 5. P. 554-560.
61. Lim JS, Lee DH. сhanges in bone mineral density and body composition of children with well-controlled homocystinuria caused by сBS deficiency // Osteoporos. Int. Osteoporos Int, 2013. Vol. 24, № 9. P. 2535-2538.
62. Allen J et al. Plasma methionine concentrations and incidence of hypermethioninemic encephalopathy during infancy in a large cohort of 36 patients with classical homocystinuria in the Republic of Ireland // JIMD Rep. JIMD Rep, 2019. Vol. 47, № 1. P. 41-46.
63. Sellos-Moura M, Glavin F., Lapidus D. et al. Prevalence, characteristics, and costs of diagnosed homocystinuria, elevated homocysteine, and phenylketonuria in the United States: a retrospective claims-based comparison // вMC Heal. Serv. Res. 2020 201. вioMed сentral, 2020. Vol. 20, № 1. P. 1-11.
64. Iranpour P., Karamifar N., As’adi K. Homocystinuria, typical brain MRI findings // J. вelgian Soc. Radiol. Ubiquity Press, 2010. Vol. 93, № 6. P. 322.
65. Li сQ et al. вrain Magnetic Resonance Imaging Findings in Poorly сontrolled Homocystinuria // J. Radiol. сase Rep. J Radiol сase Rep, 2018. Vol. 12, № 1. P. 1-8.
66. Stephen JX Murphy, David J. Werring. Stroke: causes and clinical features // Medicine (Abingdon). Elsevier, 2020. Vol. 48, № 9. P. 561.
67. Tsina EK et al. Maculopathy and retinal degeneration in cobalamin с methylmalonic aciduria and homocystinuria // Arch. Ophthalmol. Chicago, Ill. 1960). Arch Ophthalmol, 2005. Vol. 123, № 8. P. 1143-1146.
68. Ricci D et al. Assessment of visual function in children with methylmalonic aciduria and homocystinuria // Neuropediatrics. Neuropediatrics, 2005. Vol. 36, № 3. P. 181-185.
69. Wang с et al. The MTHFR polymorphism affect the susceptibility of HCC and the prognosis of HCC liver transplantation // сlin Transl Oncol. сlin Transl Oncol, 2018. Vol. 20, № 4. P. 448-456.
70. сhawla YK, вodh V. Portal vein thrombosis // J. сlin. Exp. Hepatol. J сlin Exp Hepatol, 2015. Vol. 5, № 1. P. 22-40.
71. Voskoboeva E et al. Homocystinuria due to cystathionine beta-synthase (CBS) deficiency in Russia: Molecular and clinical characterization // Mol. Genet. Metab. Reports. Elsevier, 2018. Vol. 14. P. 47-54.
72. Yap S. Homocystinuria due to cystathionine β-synthase deficiency. 2003.
73. Михайлова С.В., Захарова Е.Ю., Петрухин А.С. Нейрометаболические заболевания у детей и подростков. Диагностика и подходы к лечению. Москва, издательство . Литтерра, 2019. 34-36 p.
74. Ames EG et al. A cautionary tale of pyridoxine toxicity in cystathionine beta-synthase deficiency detected by two-tier newborn screening highlights the need for clear pyridoxine dosing guidelines // Am J Med Genet A . Am J Med Genet A, 2020. Vol. 182, № 11. P. 2704-2708.
75. Yap S. сlassical homocystinuria - newborn screening with early treatment effectively prevents complications // Hamdan Med. J. Hamdan Medical Journal, 2012. Vol. 5, № 3.
76. Gowda M., Tanigasalam V, Thiagarajan M et al. Homocystinuria due to a Novel Mutation in MTHFR Gene: A Rare сause of Non-Immune Hydrops Fetalis // Obstet. Gynecol. Int. J. MedCrave Group, LLC, 2018. Vol. 9, № 1. P. 60-61.
77. Баранов АА, Намазова-Баранова ЛС, Боровик ТЭ и l Диетотерапия при наследственных болезнях аминокислотного обмена Методическое письмо. Москва. 2013. 97 p.
78. Kumar T, Sharma GS, Singh LR. Homocystinuria: Therapeutic approach // сlin сhimca Acta. сlin сhim Acta, 2016. Vol. 458. P. 55-62.
79. Turgal M. et al. Methylenetetrahydrofolate Reductase Polymorphisms and Pregnancy Outcome // Geburtshilfe Frauenheilkd. Thieme Medical Publishers, 2018. Vol. 78, № 9. P. 871.
80. Vilaseca MA, сuartero ML, Martinez de Salinas M. Two successful pregnancies in pyridoxine-nonresponsive homocystinuria // J. Inherit. Metab. Dis. J Inherit Metab Dis, 2004. Vol. 27, № 6. P. 775-777.
81. Anaesthesia recommendations for patients suffering from Homocystinuria // OrphanAnesthesia.
82. https://apps.who.int/iris/handle/10665/43737?locale-attribute=ru& [Electronic resource].
83. вjörck-Åkesson E, Wilder J, Granlund M et al. The International сlassification of Functioning, Disability and Health and the version for children and youth as a tool in child habilitation/early childhood intervention--feasibility and usefulness as a common language and frame of reference for practice // Disabil. Rehabil. Disabil Rehabil, 2010. Vol. 32 Suppl 1, № SUPPL. 1.
84. Richard L. Harvey, Richard F. Macko, Joel Stein et al. Stroke Recovery and Rehabilitation. Demos Medical Publishing, 2008. Vol. 20. 797 p.
85. Morrison T., вösch F., Landolt M.A. et al. Homocystinuria patient and caregiver survey: experiences of diagnosis and patient satisfaction // Orphanet J. Rare Dis. 2021 161. вioMed сentral, 2021. Vol. 16, № 1. P. 1-12.
86. McKusick VA, Hall JG, сhar F. The clinical and genetic characteristics of homocystinuria. In: сarson NAJ, Raine DN, editors. Inherit. Disord. Sulphur Metab. Edinburgh сhurchill Livingstone. 1971.
87. вeck N., Applegate с. Elements of genetic counseling for inborn errors of metabolism // Transl. Sci. Rare Dis. IOS Press, 2019. Vol. 4, № 3-4. P. 197-208.
88. вetaine (anhydrous, not equivalent to betaine hydrochloride): Pediatric drug information/ UTD (октябрь 2021г). https://www.uptodate.com/contents/betaine-anhydrous-not-equivalent-to-betaine-hydrochloride-pediatric-drug-information?search=homocystinuria%20betain&source=search_result&selectedTitle=5~54&usage_type=default&display_rank=5.
89. Kaye, A.D., Jeha, G.M., Pham, A.D. et al. Folic Acid Supplementation in Patients with Elevated Homocysteine Levels. Adv Ther 37, 4149-4164 (2020).
90. Thomas J.A. (2015) Homocystinuria: Diagnosis and Management. In: вernstein L., Rohr F., Helm J. (eds) Nutrition Management of Inherited Metabolic Diseases. Springer, сham. https://doi.org/10,1007/978-3-319-14621-8_14.
91. Semyachkina A, Voskoboeva E, Yablonskya M, Nikolaeva E (2018) сlinical and Molecular сharacteristics of Russian Patients with Homocystinuria due to сystathionine вeta-Synthase Deficiency. J Neurol Neurophysiol 9: 458. doi:10,4172/2155-9562,1000458.
92. сalvert SM, Rand RJ. A successful pregnancy in a patient with homocystinuria and a previous near-fatal postpartum cavernous sinus thrombosis. вr J Obstet Gynaecol. 1995 Sep;102(9):751-2.
93. Prasad с, Greenberg сR, Gilfix вM, MacGregor D, Shih VE, вao L, Kraus JP. Reproductive fitness in maternal homocystinuria due to cystathionine beta-synthase deficiency. J Inherit Metab Dis. 2002 Aug;25(4):299-314. doi: 10,1023/a:1016502408305.
94. Pierre G, Gissen P, сhakrapani A, McDonald A, Preece M, Wright J. Successful treatment of pyridoxine-unresponsive homocystinuria with betaine in pregnancy. J Inherit Metab Dis. 2006 Oct;29(5):688-9.
95. Hart с, McNulty J, сotter M, Al Jasmi F, сrushell E, Monavari AA. The challenges of pregnancy management in pyridoxine nonresponsive homocystinuria: The Irish experience. JIMD Rep. 2021 Jun 9;61(1):34-41.
96. https://grls.rosminzdrav.ru.
97. сrooke JW, Towers JF, Taylor WH. Management of patients with homocystinuria requiring surgery under general anaesthesia. A case report. вr J Anaesth. 1971 Jan;43(1):96-9.
98. Klein NP, Aukes L, Lee J, Fireman в, Shapira SK, Slade в, вaxter R, Summar M. Evaluation of immunization rates and safety among children with inborn errors of metabolism. Pediatrics. 2011 May;127(5):e1139-46 Pittet LF, Posfay-Barbe KM. Vaccination of immune compromised children-an overview for physicians. Eur J Pediatr. 2021 Jul;180(7):2035-2047.
|
|
Приложения
Приложение А1.
Состав рабочей группы по разработке и пересмотру клинических рекомендаций.• Баранов А.А. - акад. РАН, профессор, д.м.н.; почетный президент Союза педиатров России, советник руководителя НИИ педиатрии и охраны здоровья детей ЦКБ РАН, главный внештатный специалист педиатр Минздрава России.
• Батышева Т.Т. - профессор д.м.н., главный внештатный детский специалист по медицинской реабилитации МЗ РФ, главный внештатный детский специалист по неврологии ДЗ г. Москвы, директор ГБУЗ НПЦ ДП ДЗМ, заслуженный врач РФ, заведующая кафедрой неврологии, физической и реабилитационной медицины детского возраста ФНМО РУДН.
• Боровик Т.Э. - профессор, д.м.н., заведующая лабораторией питания здорового и больного ребенка ФГАУ «Научный медицинский исследовательский центр здоровья детей» Минздрава России, член Ассоциации медицинских генетиков (АМГ).
• Бушуева Т.В. - д.м.н., ведущий научный сотрудник лаборатории питания здорового и больного ребенка ФГАУ «Научный медицинский исследовательский центр здоровья детей» Минздрава России, член Ассоциации медицинских генетиков (АМГ).
• Быкова О.В. - д.м.н. заведующая НИИ отделом ГБУЗ НПЦ ДП ДЗМ, профессор кафедры неврологии, физической и реабилитационной медицины детского возраста ФНМО РУДН.
• Вашакмадзе Н.Д. - д.м.н., кафедра факультетской педиатрии ПФ ФГБОУ ВО РНИМУ имени Н.И. Пирогова, НИИ педиатрии и охраны здоровья детей ЦКБ РАН Минобрнауки.
• Вишнёва Е.А., д.м.н., заместитель руководителя НИИ педиатрии и охраны здоровья детей ЦКБ РАН Минобрнауки по научной работе, профессор кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, член Союза педиатров России.
• Воскобоева Е.Ю. - м.н., ведущий научный сотрудник ФГБНУ «Медико-генетический научный центр им. академика Н.П. Бочкова», член Российского общества медицинских генетиков.
• Глоба О.В. - м.н., врач отделения психоневрологии и психосоматической патологии ФГАУ Национальный медицинский исследовательский центр здоровья детей Минздрава России, член Ассоциации медицинских генетиков.
• Гребенкин Д.И. - врач-генетик отделения медицинской генетики ФГАУ «НМИЦ здоровья детей» Минздрава России здоровья детей» Минздрава России, член Ассоциации медицинских генетиков (АМГ).
• Давыдова Ю.И. - врач-генетик отделения медицинской генетики ФГАУ «НМИЦ здоровья детей» Минздрава России, член Ассоциации медицинских генетиков (АМГ).
• Журкова Н.В. - м.н., ведущий научный сотрудник отдела Отдел орфанных болезней и профилактики инвалидизирующих заболеваний, врач-генетик НИИ педиатрии и охраны здоровья детей ЦКБ РАН, член Ассоциации медицинских генетиков (АМГ), член Союза педиатров России.
• Захарова Е.Ю. - д.м.н., заведующая лабораторией наследственных болезней обмена ФГБНУ «Медико-генетический научный центр им. академика Н.П. Бочкова», член Российского общества медицинских генетиков, член европейского общества по изучению наследственных болезней обмена веществ (SSIEM).
• Звонкова Н.Г. - м.н., старший научный сотрудник лаборатории питания здорового и больного ребенка ФГАУ «Научный медицинский исследовательский центр здоровья детей» Минздрава России, член Ассоциации медицинских генетиков (АМГ).
• Какаулина В.С. - врач-невролог отделения наследственных нарушений обмена веществ ГБУЗ Морозовская ДГКБ ДЗМ.
• Карасева М.С. - врач-педиатр, научный сотрудник отдела стандартизации и изучения основ доказательной медицины НИИ педиатрии и охраны здоровья детей ЦКБ РАН, член Союза педиатров России.
• Кондакова О.Б. - м.н., врач-генетик, заведующая отделением медицинской генетики ФГАУ «НМИЦ здоровья детей» Минздрава России, член Ассоциации медицинских генетиков (АМГ).
• Кузенкова Л.М. - профессор, д.м.н., начальник центра детской психоневрологии, заведующая отделением психоневрологии и психосоматической патологии ФГАУ «Научный медицинский исследовательский центр здоровья детей» Минздрава России, член Ассоциации медицинских генетиков (АМГ).
• Куцев С.И. - чл. -корр РАН, профессор, д.м.н., директор ФГБНУ «Медико-генетический научный центр им. академика Н.П. Бочкова», Президент Ассоциации медицинских генетиков (АМГ).
• Лялина А.А. - врач-генетик отделения медицинской генетики ФГАУ «НМИЦ здоровья детей» Минздрава России, член Ассоциации медицинских генетиков (АМГ.
• Михайлова С.В. - д.м.н., заведующая отделением ФГБУ «Российская Детская Клиническая Больница» МЗ РФ, член Российского общества медицинских генетиков.
• Назаренко Л. П. - профессор, д.м.н., заместитель директора по научной и лечебной работе, руководитель лаборатории наследственной патологии НИИ медицинской генетики, Томского НИМЦ РАН, член Ассоциации медицинских генетиков (АМГ).
• Намазова-Баранова Л.С. - акад. РАН, профессор, д.м.н., президент Союза педиатров России; паст-президент EPA/UNEPSA; руководитель НИИ педиатрии и охраны здоровья детей ЦКБ РАН, заведующая кафедрой факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, главный внештатный детский специалист по профилактической медицине Минздрава России.
• Николаева Е.А. - д.м.н., главный научный сотрудник, руководитель отдела клинической генетики Научно-исследовательского клинического института педиатрии имени акад. Ю.Е. Вельтищева ФГАОУ ВО ВПО РНИМУ им. Н.И. Пирогова Минздрава России, член Ассоциации медицинских генетиков (АМГ).
• Пак Л. А. - д.м.н., врач-невролог, начальник Центра редких болезней ФГАУ «НМИЦ здоровья детей» Минздрава России.
• Подклетнова Т.В. -м.н., врач-невролог, старший научный сотрудник лаборатории нервных болезней у детей ФГАУ «НМИЦ здоровья детей» Минздрава России.
• Пушков А.А. - б.н., в.н.с. лаборатории молекулярной генетики и медицинской геномики ФГАУ «НМИЦ здоровья детей» Минздрава России, член Российского общества медицинских генетиков.
• Репина С.А. - м.н., врач-генетик ФГБНУ Медико-генетический научный центр им. академика Н.П. Бочкова , член Российского общества медицинских генетиков, член Ассоциации медицинских генетиков (АМГ).
• Савостьянов К.В. - д.б.н., начальник центра фундаментальных исследований в педиатрии, заведующий лабораторией молекулярной генетики и медицинской геномики ФГАУ «НМИЦ здоровья детей» Минздрава России, член Российского общества медицинских генетиков.
• Селимзянова Л.Р. - м.н., ведущий научный сотрудник НИИ педиатрии и охраны здоровья детей ЦКБ РАН Министерства науки и высшего образования Российской Федерации, доцент кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, доцент кафедры педиатрии и детской ревматологии ФГАОУ «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет).
• Семячкина А.Н. -д.м.н., главный научный сотрудник, Научно-исследовательского клинического института педиатрии имени акад. Ю.Е. Вельтищева ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России, член Российского общества медицинских генетиков.
• Смирнова О.Я. - врач-генетик, старший научный сотрудник отдела стандартизации и изучения основ доказательной медицины НИИ педиатрии и охраны здоровья детей ЦКБ РАН.
• Суханова Н.В. Руководитель аниридийного центра, научный сотрудник НИИ педиатрии и охраны здоровья детей ЦКБ РАН, врач офтальмолог, член ассоциации детских офтальмологов Российской Федерации, член Союза педиатров России.
• Тепаев Р.Ф. - д.м.н. заведующий отделением реанимации и интенсивной терапии ФГАУ Национальный медицинский исследовательский центр здоровья детей Минздрава России, доцент кафедры педиатрии и детской ревматологии ФГАОУ «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет).
• Фисенко А.П. -д.м.н., профессор, Заслуженный врач Российской Федерации, директор ФГАУ Национальный медицинский исследовательский центр здоровья детей Минздрава России Заслуженный врач РФ, директор ФГАУ НМИЦ здоровья детей .
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций :
• Врачи - педиатры.
• врачи общей практики (семейные врачи).
• врачи-терапевты.
• врачи - генетики.
• врачи - диетологи.
• врачи-офтальмологи.
• врачи-кардиологи/детские кардиологи.
• врачи-эндокринологи.
• врачи - неврологи.
• врачи-психиатры.
• медицинские психологи.
• студенты медицинских ВУЗов, ординаторы, аспиранты;
Описание методов, использованных для сбора/селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в Кокрановскую библиотеку, базы данных EMBASE и MEDLINE. Глубина поиска составляла 5 лет.
Методы, использованные для оценки качества и силы доказательств:
• Консенсус экспертов;
• Оценка значимости в соответствии с рейтинговой схемой.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Методы, использованные для анализа доказательств:
• Обзоры опубликованных мета-анализов;
• Систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств:
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что, в свою очередь, влияет на силу вытекающих из нее рекомендаций.
На процессе оценки, несомненно, может сказываться и субъективный фактор. Для минимизации потенциальных ошибок каждое исследование оценивалось независимо, по меньшей мере двумя независимыми членами рабочей группы. Какие-либо различия в оценках обсуждались всей группой в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Таблицы доказательств:
Таблицы доказательств заполнялись членами рабочей группы.
Методы, использованные для формулирования рекомендаций:
Консенсус экспертов.
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| УДД | Расшифровка |
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в тч когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| УУР | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| в | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| с | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3.
Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата.Приложение А3,1 Основные нормативно-правовые акты.
• Федеральный закон Об основах охраны здоровья граждан в Российской Федерации (N 323-ФЗ от 21,11,2011).• Постановление Правительства РФ от 30 июля 1994 г. N 890 О государственной поддержке развития медицинской промышленности и улучшении обеспечения населения и учреждений здравоохранения лекарственными средствами и изделиями медицинского назначения (с изменениями и дополнениями).
• Приказ Минздравсоцразвития РФ от 22,03,2006 N 185 О массовом обследовании новорожденных детей на наследственные заболевания (вместе с Положением об организации проведения массового обследования новорожденных детей на наследственные заболевания, Рекомендациями по забору образцов крови при проведении массового обследования новорожденных детей на наследственные заболевания) .
• Порядок оказания медицинской помощи больным с врожденными и (или) наследственными заболеваниями (Приказ МЗ РФ от 15,11,2012 года N 917н).
• Постановление Правительства №403 от 26,04 2012г О порядке ведения Федерального регистра лиц, страдающих угрожающими и хронически прогрессирующими редкими орфанными заболеваниями, приводящими к сокращению продолжительности жизни граждан или их инвалидности и его регионального сегмента .
• Критерии оценки качества медицинской помощи (Приказ МЗ РФ от 10 мая 2017 г. 203н «Об утверждении критериев оценки качества медицинской помощи)».
• Приказ Министерства здравоохранения Российской Федерации от 15 декабря 2014 г. N 834н Об утверждении унифицированных форм медицинской документации, используемых в медицинских организациях, оказывающих медицинскую помощь в амбулаторных условиях, и порядков по их заполнению .
• Приказ Министерства здравоохранения Российской Федерации от 20 декабря 2012 г. N 1177н Об утверждении порядка дачи информированного добровольного согласия на медицинское вмешательство и отказа от медицинского вмешательства в отношении определенных видов медицинских вмешательств, форм информированного добровольного согласия на медицинское вмешательство и форм отказа от медицинского вмешательства .
• Приказ Министерства здравоохранения Российской Федерации от 14 января 2019 г. N 4н Об утверждении порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения .
• Приказ Министерства здравоохранения Российской Федерации от 16 мая 2019 г. N 302н Об утверждении Порядка прохождения несовершеннолетними диспансерного наблюдения, в том числе в период обучения и воспитания в образовательных организациях .
• Распоряжение Правительства РФ от 31 декабря 2018 г. 3053-р Об утверждении перечней медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи и отпускаемых по рецептам на медицинские изделия при предоставлении набора социальных услуг .
• Приказ Министерства здравоохранения РФ от 6 июня 2013 г. N 354н О порядке проведения патологоанатомических вскрытий (зарегистрирован Министерством юстиции Российской Федерации 16 декабря 2013 г., регистрационный N 30612).
TEGb Информация о лекарственных средствах: https://grls.rosminzdrav.ru/.
Основные нормативно-правовые акты, регулирующие оказание паллиативной медицинской помощи.
• Федеральный закон О внесении изменений в Федеральный закон Об основах охраны здоровья граждан в Российской Федерации по вопросам оказания паллиативной медицинской помощи от 06,03,2019 № 18-ФЗ.
• Приказ Минздрава России № 345н, Минтруда России от 31,05,2019 № 372н «Об утверждении положения об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья».
• Приказ Минздрава России № 348н от 31 мая 2019 года «Об утверждении перечня медицинских изделий, предназначенных для поддержания органов и систем организма человека, предоставляемых для использования на дому».
• Приказ Минздрава России № 505н от 10 июля 2019 года «Об утверждении Порядка передачи от медицинской организации пациенту (его законному представителю) медицинских изделий, предназначенных для поддержания функций органов и систем организма человека, для использования на дому при оказании паллиативной медицинской помощи».
• Приказ МЗ РФ № 831 от 3 октября 2019 года «Об утверждении ведомственной целевой программы «Развитие системы оказания паллиативной медицинской помощи».
Прочие нормативно-правовые документы, с учетом которых разработаны клинические рекомендации:
• Международная классификация болезней, травм и состояний, влияющих на здоровье (МКБ - 10);
• Приказ МЗ РФ от 20 декабря 2012г. 1183н «Об утверждении номенклатуры должностей медицинских работников и фармацевтических работников».
• Приказ МЗ РФ от 23 июля 2010 г. 541н. Единый квалификационный справочник должностей руководителей, специалистов и служащих, раздел Квалификационные характеристики должностей работников в сфере здравоохранения.
• Федеральный закон от 25,12,2018 № 489 489-ФЗ «О внесении изменений в статью 40 Федерального закона Об обязательном медицинском страховании в Российской Федерации и Федеральный закон Об основах охраны здоровья граждан в Российской Федерации по вопросам клинических рекомендаций».
• Приказ Минздрава России № 103н от 28,02,2019 г. Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации».
• Приказ Минздрава России от 13,10,2017 N 804н Об утверждении номенклатуры медицинских услуг .
• Приказ Министерства труда и социальной защиты РФ от 27 августа 2019 г. n 585н О классификациях и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы ;
• Приказ Министерства здравоохранения и социального развития Российской Федерации «О порядке применения лекарственных средств у больных по жизненным показаниям» от 9 августа 2005 г. 494.
• Информационное письмо Минздрава России по возможности закупки лекарственного препарата по торговому наименованию (https://www.rosminzdrav.ru/news/2019/12/18/13043-minzdrav-podgotovil-informatsionnoe-pismo-po-vozmozhnosti-zakupki-lekarstvennogo-preparata-po-torgovomu-naimenovaniyu);
• Перечень специализированных продуктов лечебного питания для детей-инвалидов на 2020 год, Распоряжение Правительства Российской Федерации от 11 декабря 2019 года № 2984-р.
Приложение А3,2 Расшифровка примечаний.
…** - препарат входит в перечень жизненно необходимых и важнейших лекарственных препаратов (Распоряжение Правительства РФ от 12,10,2019 № 2406-р «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов на 2020 год а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи» (с изменениями, внесенными Распоряжением Правительства РФ от 23 ноября 2020 г. 3073-р «О внесении изменений в распоряжение Правительства РФ от 12 октября 2019 г. 2406-р.…**** - специализированный продукт лечебного питания, включенный в перечень специализированных продуктов лечебного питания для детей-инвалидов (Перечень специализированных продуктов лечебного питания для детей-инвалидов на 2021 год, утвержденный распоряжением Правительства Российской Федерации от 17 декабря 2020 года № 3242-р). - применение off-label - вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и пациента в возрасте старше 15 лет;
Приложение А3,3.
Метаболизм гомоцистеина.Метаболизм гомоцистеина [9] ( из статьи Huemer, M., Diodato, D., Schwahn, в. et al. Guidelines for diagnosis and management of the cobalamin-related remethylation disorders cblC, cblD, cblE, cblF, cblG, cblJ and MTHFR deficiency. J Inherit Metab Dis 40, 21-48 (2017). https://doi.org/10,1007/s10545-016-9991-4 с модификациями).
SAM: S-аденозилметионин; SAH: S-аденозилгомоцистеин; SAHH: S-аденозилгомоцистеингидролаза; сβS: цистатионин-β-синтаза; сγL: цистатионин-γ-лиаза; MTR: метионинсинтаза; THF: тетрагидрофолат; MTHFR: 5,10-метилен-ТГФ редуктаза; SHMT: серин-гидроксиметилтрансфераза; вHMT: бетаин-гомоцистеинметилтрансфераза; MMACHC: белок метилмалоновой ацидурии и гомоцистинурии типа с.
Приложение А3,4.
Генетика и биохимический дефект при различных формах гомоцистинурии.Генетика и биохимический дефект при различных формах гомоцистинурии (по [1]).
| Заболевание (номер OMIM ) | Дефицит фермента | Ген (Локус) | Тип наследования |
| Классическая гомоцистинурия ( 236200) | Цистатионин бета-синтаза (CBS - EC 4,2,1,23) | сBS (21q22,3) | АР |
| Тяжелая форма дефицита метилентетрагидрофолатредуктазы (MTHFR) ( 236250) | Метилентетрагидрофолатредуктаза (MTHFR - EC 1,5,1,20) | MTHFR (1p36,22) | АР |
| Метилмалоновая ацидурия и гомоцистинурия, тип cblC ( 277400) | Метилмалонил-КоА мутаза (MUT - EC 5,4,99,2) и метионинсинтаза (MTR - EC 1,16,1,8) - активность ферментов нарушается вторично из-за отсутствия кофактора | MMACHC (1p34,1) | АР |
| Метилмалоновая ацидурия и гомоцистинурия, тип cblC, дигенный (epi-cblC 277400) | Метилмалонил-КоА мутаза (MUT - EC 5,4,99,2) и метионинсинтаза (MTR - EC 1,16,1,8) - активность ферментов нарушается вторично из-за отсутствия кофактора | PRDX1 (1p34,1) MAHCC (1p34,1) | АР |
| Метилмалоновая ацидурия и гомоцистинурия, тип cblD ( 277410) | Метилмалонил-КоА мутаза (MUT - EC 5,4,99,2) и метионинсинтаза (MTR - EC 1,16,1,8) - активность ферментов нарушается вторично из-за отсутствия кофактора | MMADHC (2q23,2) | АР |
| Гомоцистинурия-мегалобластная анемия, тип cblE ( 236270) | Редуктаза метионинсинтазы (MTRR - EC 2,1,1,135) - активность фермента нарушается вторично из-за отсутствия кофактора | MTRR (5p15,31) | АР |
| Метилмалоновая ацидурия и гомоцистинурия, тип cblF ( 277380) | Метилмалонил-КоА мутаза (MUT - EC 5,4,99,2) и метионинсинтаза (MTR - EC: 2,1,1,13) - активность ферментов нарушается вторично из-за отсутствия кофактора | LMBRD1 (6q13) | АР |
| Гомоцистинурия-мегалобластная анемия, тип cblG ( 250940) | Метионинсинтаза (MTR - EC: 2,1,1,13) - активность фермента нарушается вторично из-за отсутствия кофактора | MTR (1q43) | АР |
| Метилмалоновая ацидурия и гомоцистинурия, тип cblJ ( 614857) | Метилмалонил-КоА мутаза (MUT - EC 5,4,99,2) и метионинсинтаза (MTR - EC: 2,1,1,13) - активность ферментов нарушается вторично из-за отсутствия кофактора | ABCD4 (14q24,3) | АР |
| Метилмалоновая ацидемия и гомоцистинурия, тип cblX ( 309541) | HCF-1; Транскрипционная регуляция MMACHC. Метилмалонил-КоА мутаза (MUT - EC 5,4,99,2) и метионинсинтаза (MTR -EC 1,16,1,8) - активность ферментов нарушается вторично из-за отсутствия кофактора | HCFC1 (Xq28) | ХР |
| Дефицит метилентетрагидрофолатдегидрогеназы (MTHF) ( 617780) | 5,10-метилентетрагидрофолатдегидрогеназа (EC 1,5,1,5), 5,10-метенилтетрагидрофолатциклогидролаза (EC 3,5,4,9), и 10-формилтетрагидрофолат синтетаза (EC 6,3,4,3) | MTHFD1 (14q23,3) | АР |
| Дефицит транскобаламина II (TC) ( 275350) | Транскобаламин; Клеточная доставка cbl. | TCN2 (22q12,2) | АР |
| Метилмалоновая ацидурия и гомоцистинурия, тип TcblR ( 613646) | TCblR; Клеточный рецептор. | сD320 (19p13,2) | АР |
Приложение А3,5 Основные биохимические показатели для диагностики гомоцистинурии.
| Метаболит | Биологический образец | Ожидаемые результаты у пациентов гомоцистинурией | Контроль | |
| Новорожденные | Нелеченные старше 1 года | |||
| Общий гомоцистеин | Плазма | 50-100 мкмоль/л | >100 мкмоль/л | <15мкмоль/л |
| Метионин | Плазма | 200-1500 мкмоль/л (3-23 мг/дл) | >50 мкмоль/л (>0,7 мг/дл) | 10-40 мкмоль/л (0,2-0,6 мг%) |
| Гомоцистин | Моча | определяется | определяется | Отсутствует |
Приложение А3,6 Биохимический мониторинг при ГЦУ.
Референсные уровни свободных метионина, цистеина и гомоцистеина в плазме крови (для контроля терапии классической ГЦУ).| Аминокислота | Уровень в плазме крови, ед. изм. | |
| мкмоль/л | мг/100 мл | |
| Метионин | 18-45 | 0,27-0,67 |
| Цистеин | 25-50 | 0,30-0,76 |
| Гомоцистеин | <12 | <0,16 |
Биохимический мониторинг при ГЦУ - таргетные значения.
| Метионин плазмы | Цистеин плазмы | Общий гомоцистеин плазмы (tHcy) | Свободный гомоцистеин плазмы (fHcy) | |
| В6-чувствительная форма | Нормальные значения | Нормальные значения | < 50 мкмоль/л | < 10 мкмоль/л |
| В6-нечувствительная форма на фоне диетотерапии | Нормальные значения | Нормальные значения | < 100 мкмоль/л | < 10 мкмоль/л |
| В6-нечувствительная форма на фоне приема бетаина | < 1000 мкмоль/л | Нормальные значения | < 100 мкмоль/л | < 10 мкмоль/л |
Приложение А3,7 Диетотерапия при классической ГЦУ.
Таблица 7. Ориентировочная потребность в метионине и цистеине у пациентов с гомоцистинурией в зависимости от возраста.| Возраст пациентов | Суточная потребность в аминокислотах мг/кг массы тела | |
| Метионин | Цистеин | |
| 0 - <3 мес | 15 - 30 | 300 |
| 3 - <6 мес | 10 - 25 | 250 |
| 6 - <9 мес | 10 - 25 | 200 |
| 9 - <12 мес | 10 - 20 | 200 |
| 1 - <4 года | 10 - 20 | 100 - 200 |
| 4 - <7 лет | 8 - 16 | 100 - 200 |
| 7 - <11 лет | 6 - 12 | 100 - 200 |
| Девушки 11- <15 лет | 6 - 14 | 50 - 150 |
| Девушки 15- <19 лет | 6 - 12 | 25 - 125 |
| Девушки 19 лет и старше | 4 - 10 | 25 - 100 |
| Юноши 11- <15 лет | 6 - 14 | 50 - 150 |
| Юноши 15- <19 лет | 6 - 16 | 25 - 125 |
| Юноши 19 лет и старше | 6 - 15 | 25 - 100 |
Таблица 8. Специализированные продукты на основе аминокислот без метионина.
| Наименование продукта | Содержание основных пищевых веществ и энергии на 100 г сухого продукта | Возраст применения | |||
| Белок (г) | Жир (г) | Углеводы (г) | Энергоценность (ккал) | ||
| Нутриген 14 -met**** | 14 | 23 | 50,4 | 471 | с рождения до 1 года |
| Нутриген 20 -met**** | 20 | 18 | 50,3 | 443 | Старше 1 года |
| Нутриген 40 -met**** | 40 | 13 | 31,2 | 402 | Старше 1 года |
| Нутриген 70 -met**** | 70 | 0 | 4,1 | 296 | Старше 1 года |
| HCU Анамикс инфант**** | 13,1 | 23 | 49,6 | 457 | с рождения до 1 года |
| ХМЕТ Хомидон**** | 77 | 0 | 4,5 | 326 | Старше 1 года |
Приложение А3,8 Примеры расчета диеты при классической гомоцистинурии.
Расчет питания для пациента с гомоцистинурией в возрасте 2-х недель, масса тела 4 кг1.1. Количество потребления общего белка в сутки из расчета 2,5 г/кг/сут х4 кг=10г.
2. Допустимое количество метионина в сутки 30 мг/кг х4 кг= 120 мг/сутки.
3. Количество натурального белка за счет грудного молока (ГМ)/детской молочной смеси (ДМС) с учетом, что 1 г белка ГМ/ДМС содержит 30 мг метионина: 120:30=4 г натурального белка за счет ГМ/ДМС.
4. Количество белка за счет специализированного продукта: 10-4=6г белка.
5. Количество (в г) специализированного продукта Нутриген 14- met**** (100г сухого продукта содержит 14 г белка): в сутки пациенту необходимо 43 г сухого продукта Нутриген 14- met****.
Если используется специализированный продукт HCU Анамикс инфант**** (100г сухого продукта содержит 13,1 г белка): в сутки пациенту необходимо 46 г сухого продукта HCU Анамикс инфант****.
Потребность в натуральном белке обеспечивается за счет грудного молока или детской молочной смеси. Содержание белка в 100 мл грудного молока/детской молочной смеси -примерно 1,2г, соответственно для обеспечения потребности в натуральном белке (4г) потребуется 330 мл грудного молока/детской молочной смеси.
6. Специализированная смесь аминокислот и грудное мрлоко/детская молочная смесь делятся в равных количествах на 6 приемов:339:6=55мл ГМ/ДМС.
43:6=7,2г сухой смеси Нутриген 14- met**** развести в 50 мл воды.
За одно кормление ребенок получит 105 мл питания ( 55мл+50мл).
Если используется смесь HCU Анамикс инфант***, то в одно кормления берут.
7,6 г сухого продукта и разводят его в 53 мл воды.
За одно кормление ребенок получит 108-110 мл питания ( 55мл+53мл).
Расчет питания для пациента с гомоцистинурией в возрасте 10 лет, масса тела 27 кг1.
1. Количество потребления общего белка в сутки из расчета 2г/кг/сут =54г.
2. Среднее допустимое количество метионина в сутки 10 мг/кг = 270 мг.
3. Количество натурального белка 270:30=9 г натурального белка.
4. Количество белка за счет специализированного продукта: 54-9=45г белка.
5. Количество (в г) специализированного продукта Нутриген 70- met**** (100г сухого продукта содержит 70 г белка): в сутки пациенту необходимо 64 г сухого продукта Нутриген 70 - met.
Если используется специализированный продукт ХМЕТ Хомидон**** (100г сухого продукта содержит 77 г белка): в сутки пациенту необходимо 58 г сухого продукта ХМЕТ Хомидон.
С использованием таблиц аминокислотного состава продуктов составляется суточный набор натуральных продуктов, которые в сумме будут содержать 9 г натурального белка.
1Приведенные примеры являются ориентировочными. В каждом случае требуется контроль назначенной диетотерапии и её коррекция по результатам анализов [77].
Приложение В.
Информация для пациента.Приложение В1 Информация для пациента.
Классическая гомоцистинурия, дефицит цистатионин-бета-синтазы.Что такое гомоцистинурия.
Гомоцистинурия - это группа наследственных заболеваний, при которых повышается уровень гомоцистеина в крови. Гомоцистеин влияет на процессы свертываемости крови, сердечно-сосудистую систему, нервную систему, соединительную ткань.
Гомоцистинурия может быть вызвана: мутацией в нескольких разных генах. Все эти гены ответственны за синтез ферментов, которые участвуют в том, как наш организм использует и обрабатывает аминокислоты. Наиболее распространенной формой гомоцистинурии, является дефицит фермента цистатионин-бета-синтазы, который возникает при мутациях в гене сBS. Более редкие причины гомоцистинурии включают мутации в генах MTHFR, MTR, MTRR и MMADHC . Другие формы гомоцистинурии связаны с нарушением образования витамина В12 и кроме гомоцистинурии сопровождаются повышением метилмалоновой кислоты.
Наиболее распространенный тип генетической формой гомоцистинурии- классическая гомоцистинурия, вызван дефицитом фермента цистатионин-бета-синтаза.
Как проявляется классическая гомоцистинурия.
Дети с этим заболеванием не имеют особенностей при рождении. Первыми неспецифическими симптомами могут быть задержка психомоторного развития, умственная отсталость, скелетные деформации (вальгусная установка коленных суставов, кифосколиозы, воронкообразная или килевидная деформации грудной клетки), кардиоваскулярная патология, частые переломы (у детей старшего возраста).
Характерна патология глазного аппарата: сублюксация (люксация) хрусталиков, часто осложняющийся вторичной глаукомой, нередко имеющей злокачественное течение, миопия, атрофия зрительных нервов, катаракта и отслойка сетчатки.
У пациентов подросткового и молодого возраста могут возникнуть тромбозы, которые являются главной причиной инфаркта миокарда или инсульта с формированием очаговой неврологической симптоматики возникают преимущественно у пациентов подросткового возраста.
Другие возможные симптомы включают заболевание костей (сколиоз), проблемы с психическим здоровьем и проблемы с поведением (например, синдром дефицита внимания и гиперактивность).
Как наследуется классическая гомоцистинурия.
Гомоцистинурия относится к наследственным заболеваниям и передается по аутосомно-рецессивному типу. Это значит, что болезнь проявляется только в том случае, если оба родителя являются носителями и, хотя сами они не болеют, передают ребенку два пораженных гена. Большинство семей, где есть ребенок с этим заболеванием, не сталкивались раньше с подобной проблемой. Риск повторного рождения больного ребенка в семье, где уже есть больные дети, составляет 25% на каждую беременность.
Все семьи с гомоцистинурией должны обязательно пройти медико-генетическое консультирование и получить полную информацию от врача-генетика о риске повторного проявления данного заболевания в семье, обсудить со специалистом все вопросы, связанные с наследованием заболевания. В России медико-генетические консультации работают практически в каждом регионе.
Как устанавливают диагноз классической гомоцистинурий.
На основании клинических симптомов врач может заподозрить заболевание и далее отпавить пациента на специализированное лабораторное исследование. При гомоцистинурии повышается в крови уровень свободного и общего гомоцистеина, а также уровень аминокислоты метионина. Исследование мочи на органически кислоты позволяет исключить формы гомоцистинурии с метилмалоновой ацидурией. Далее путем молекулярно-генетического анализа выявлют мутации в гене сBS. Очень важно провести этото анализ, поскольку уже по генотипу в некоторых случаях возможно определить будет ли чувствительность к терапии витамином В6 или нет.
Как лечат классическую гомоцистинурию.
Метионин является незаменимой аминокислотой (не синтезируется в организме, а поступает из вне), он необходимым для нормального роста и синтеза белка в организме, и поэтому не может быть полностью исключен из рациона. Снижение метионина достигается путем ограничения белка в пище для поддержания уровня метионина и гомоцистеина в крови в пределах целевых показателей лечения (они немного отличаются от нормальных значений). Это потребует отказаться от белковых продуктов с высоким содержанием белка, включая мясо, рыбу, яйца, сыр и бобовые, поскольку они содержат большое количество метионина и, таким образом, разрешены при гомоцистинурии лишь в очень небольшом количестве. При этом, чтобы организм получал достаточное количество других аминокислот назначают дополнительно к низкобелковой диете специальные лечебные смеси, в которых ограничено содержание только метионина, а другие аминокислоты содержаться в достаточном количестве. Основные навыки, которые должны приобрести родители и сам пациент- рассчитывать диету таким образом, чтобы все аминокислоты и другие нутриенты поступали в достаточном количестве, а уровень метионина был ограничен.
Следует помнить, что толерантность к метионину (безопасный уровень) различается у пациентов. Как правило она может быть в диапазоне от 80-160 мг / день, чтобы уровень общего гомоцистеина (tHcy) был <100 мкмоль / л. Важно вместе с врачами и на основании лабораторных анализов по определению метионина и гомоцистеина определить безопасный уровень метионина индивидуально. Для управления нормой метионина человека применяют либо таблицы с содержанием метионина в каждом из продуктов . Если содержание метионина недоступно, то примерно рассчитывают исходя из того что 20 мг метионина содержится примерно в 1 г белка.
Кроме диетотерапии назначают витамины, среди которых наиболее важным является В6 (пиридоксин). Этот витамин необходим ферменту цистатионин-бета-синтазе (CBS) для нормальной работы. Примерно в половине всех случаев классической гомоцистинунии наблюдается чувствительность к лечению витамином В6. Для этого проводят специальную пробу с витамином, определяют биохимические показатели крови. Если показатели метионина и гомоцистеина снижаются, то устанавливают диагноз В6-чувствительная форма гомоцистинурии и многие из этих пациентов не нуждаются в диетотерапии, а им необходим только прием витамина В6. Важно четко следовать дозировкам препарата, которые назначит врач для получения максимального эффекта лечения и предотвращения побочных явлений. Если не наблюдается ответа на витамин В6, врачи рекомендуют придерживаться строгой диеты и как правило назначают еще одну биологическую активную добавку- бетаин. Это соединение способно помогать «нейтрализовать» гомоцистеин в результате запуска особой ферментной реакции.
При необходимости проведения хирургического вмешательства обязательно проконсультироваться с лечащим врачом, провести исследование на гомоцистеин крови, предпринять меры профилактики тромбозов, указанные в данных рекомендациях.
Какой нужно проводить мониторинг для пациентов.
Необходим мультидисциплинарный подход к наблюдению и лечению пациентов с гомоцистинурией специалистами разных профилей с целью обеспечения комплексной терапии и своевременной её коррекции при необходимости. Для пациентов с гомоцистинурией необходимы регулярные обследования, которые назначает врач.
Как пациенты получают лечение в Российской Федераций.
Гомоцистинурия относится к числу редких наследственных болезней обмена веществ и входит в перечень редких (орфанных) заболеваний, лечение которых проводится за счет средств регионального бюджета. После установление диагноза необходимо включение пациента в региональный сегмент регистра по жизнеугрожающим редким (орфанным) заболеваниям, с целью дальнейшего обеспечения необходимым лечебным питанием и лекарственными препаратами. В разных регионах за ведение регистра отвечают разные специалисты, но чаще всего это врачи-генетики, поэтому после установления диагноза обязательно нужно обратиться к региональному врачу генетику.
Как могут помогать родные и близкие.
Не забывайте - от семьи также зависит успех лечения. Нужно соблюдать рекомендации, ни при каких условиях не допускать «срывов» в диетотерапии, следует уделять внимание реабилитации и плановым обследованиям. Все члены семьи должны знать, что ребенок нуждается в особом питании и близкие родственники должны освоить навыки расчета диеты.
Родители пациента с гомоцистинурией, а в дальнейшем и сам пациент должны быть обучены правилам организации терапии.
Гомоцистинурия, связанная с дефицитом MTHFR.
Что такое гомоцистинурия.
Гомоцистинурия - это группа наследственных заболеваний, при которых повышается уровень гомоцистеина в крови. Гомоцистеин влияет на процессы свертываемости крови, сердечно-сосудистую систему, нервную систему, соединительную ткань.
Гомоцистинурия может быть вызвана: мутации в нескольких разных гены. Все эти гены ответственны за синтез ферментов, которые участвуют в том, как наш организм использует и обрабатывает аминокислоты. Наиболее распространенной формой гомоцистинурии, является дефицит фермента цистатионин-бета-синтазы, который возникает при мутациях в гене сBS. Более редкие причины гомоцистинурии включают мутации в генах MTHFR, MTR, MTRR и MMADHC . Другие формы гомоцистинурии связаны с нарушением образования витамина В12 и кроме гомоцистинурии сопровождаются повышением метилмалоновой кислоты.
Гомоцистинурия, связанная с дефицитом MTHFR - это генетическое заболевание, которое возникает из-за нарушения работы фермента метилентетрагидрофолат редуктазы. Этот фермент кодируется геном, который также называется MTHFR. MTHFR важен для химической реакции в организме с участием витамина В6 и фолиевой кислоты.
Как проявляется гомоцистинурия.
Гомоцистинурия у новорожденного ребенка обычно не проявляется. При отсутствии лечения у детей в младенчестве появляются признаки и симптомы тяжелой гомоцистинурии. Гомоцистинурия, вызванная вариантами MTHFR, может быть легкой и проявляться в более позднем детстве или во взрослом возрасте. Симптомы могут включать нарушение свертывание крови (повышенное тромбообразование), отставание в развитии, судороги, атаксию, полинейропатию, интелектуальные нарушения, и микроцефалия.
Как наследуется гомоцистинурия, связанная с дефицитом MTHFR.
Гомоцистинурия относится к наследственным заболеваниям и передается по аутосомно-рецессивному типу. Это значит, что болезнь проявляется только в том случае, если оба родителя являются носителями и, хотя сами они не болеют, передают ребенку два пораженных гена. Большинство семей, где есть ребенок с этим заболеванием, не сталкивались раньше с подобной проблемой. Риск повторного рождения больного ребенка в семье, где уже есть больные дети, составляет 25% на каждую беременность.
Все семьи с гомоцистинурий должны обязательно пройти медико-генетическое консультирование и получить полную информацию от врача-генетика о риске повторного проявления данного заболевания в семье, обсудить со специалистом все вопросы, связанные с наследованием заболевания. В России медико-генетические консультации работают практически в каждом регионе.
Гомоцистинурия из-за дефицита метилентетрагидрофолат редуктазы связана с мутациями в MTHFR гене. Мутации в гене MTHFR приводят кферментэто работает не так, как должно, вызывая накопление гомоцистеина в организме.
Как устанавливают диагноз гомоцистинурии связанной с дефицитом MTHFR.
На основании клинических симптомов врач может заподозрить заболевание и далее отправить пациента на специализированное лабораторное исследование. При этой форме гомоцистинурии повышается в крови уровень свободного и общего гомоцистеина, и снижается уровень аминокислоты метионина. Иногда концентрация метионина может быть и в норме. Исследование мочи на органически кислоты позволяет исключить формы гомоцистинурии с метилмалоновой ацидурией. Далее путем молекулярно-генетического анализа выявляют мутации в гене MTHFR. Очень важно провести этото анализ, поскольку уже по генотипу в некоторых случаях возможно определить будет ли чувствительность к терапии витамином В6 или нет.
Как лечат гомоцистинурию связанную с дефицитом MTHFR.
При этой форме гомоцистинурии пациенты не нуждаются в диетотерапии. Лечение дефицита MTHFR включает прием биологически активной добавки -бетаина, а также фолиевой кислоты**, витаминов в6 и в12, метионина. Если диагноз установлен на ранней стадии и сразу же начинается лечение бетаином, эффективность терапии очень высокая. Лечение, начатое позже, не устраняет симптомов, но может вызвать улучшение состояния. Лечение в каждом конкретном случае назначает врач. Точное выполнение назначений врача позволяет добиться максимального эффекта от лечения.
При необходимости проведения хирургического вмешательства обязательно проконсультироваться с лечащим врачом, провести исследование на гомоцистеин крови, предпринять меры профилактики тромбозов, указанные в данных рекомендациях.
При гомоцистинурии, обусловленной тяжелым дефицитом MTHFR, выявляется высокий риск развития тромбозов и тромбоэмболических нарушений у женщин, как на протяжении всей беременности, так и в послеродовой период. К ним относятся множественные артериальные тромбозы, илеофеморальный тромбофлебит, тромбозы верхнего сагиттального синуса и кортикальных вен. Есть данные о развитии преэклампсии у матерей, с гомоцистинурией. Однако большинство беременностей у матерей с классической гомоцистинурией протекали без акушерских осложнений.
При дефиците MTHFR у матери возможны поражения нервной системы у ребенка. Поэтому пациенткам с дефицитом MTHFR получающим бетаин (биологически активная добавка) необходимо продолжить данную терапию во время беременности с целью поддержания целевого уровня гомоцистеина в крови и, соответственно, предупреждения осложнений.
Какой нужно проводить мониторинг для пациентов.
Необходим мультидисциплинарный подход к наблюдению и лечению пациентов с гомоцистинурией специалистами разных профилей с целью обеспечения комплексной терапии и своевременной её коррекции при необходимости. Для пациентов с гомоцистинурией необходимы регулярные обследования, которые назначает врач.
Как пациенты получают лечение в Российской Федераций.
Гомоцистинурия относится к числу редких наследственных болезней обмена веществ и входит в перечень редких (орфанных) заболеваний, лечение которых проводится за счет средств регионального бюджета . После установление диагноза необходимо включение пациента в региональный сегмент регистра по жизнеугрожающим редким (орфанным) заболеваниям, с целью дальнейшего обеспечения необходимым лечебным питанием и лекарственными препаратами. В разных регионах за ведение регистра отвечают разные специалисты, но чаще всего это врачи-генетики, поэтому после установления диагноза обязательно нужно обратиться к региональному врачу генетику.
Как могут помогать родные и близкие.
Не забывайте - от семьи также зависит успех лечения. Нужно соблюдать рекомендации, ни при каких условиях не допускать «срывов» в диетотерапии, следует уделять внимание реабилитации и плановым обследованиям. Все члены семьи должны знать, что ребенок нуждается в особом питании и близкие родственники должны освоить навыки расчета диеты.
Родители пациента с гомоцистинурией, а в дальнейшем и сам пациент должны быть обучены правилам организации терапии.
Приложение В2 Пример «экстренной памятки».
Памятка при остром приступе глаукомы.Острый приступ глаукомы (ОПГ) критическое состояние, характеризующиеся резким повышением внутриглазного давления (ВГД), снижением остроты зрения и выраженным болевым синдромом вследствие внезапного и полного закрытия угла передней камеры глаза (УПК). Без лечения состояние угрожает быстрой и необратимой утратой зрительных функций по причине развития глаукомной атрофии зрительного нерва.
Ребенок предъявляет жалобы на существенное ухудшение зрения, появление радужных кругов вокруг источников света, сильную боль в пострадавшем глазу, возможна иррадиация по ходу ветвей тройничного нерва (верхний край орбиты, лоб, висок, скуловая область), а также тошнота, рвота, брадикардия. Наблюдается застойная инъекция (покраснение) глазного яблока, блефароспазм, возможен реактивный отек век, роговица теряет характерный блеск, гладкость и зеркальность, выглядит полупрозрачной, шероховатой (контроль по здоровому глазу). Видно неравномерное расширение зрачка с резким замедлением или отсутствием реакции на свет (контроль по здоровому глазу).
Помощь при остром приступе глаукомы должна быть оказана немедленно.
В первую очередь необходимо вызвать скорую помощь.
Главная цель - снизить внутриглазное давление и нормализовать кровообращение в глазу для восстановления питания сетчатки и зрительного нерва.
Введите анальгетики, чтобы снять боль.
Для уменьшения притока крови к глазам назначаются горячие ножные ванны в течение часа, горчичники к икроножным мышцам. Пациента необходимо госпитализировать в офтальмологическое отделение стационара.
Приложение Г1-ГN.
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.Не применяются.
|
|
Год актуализации информации
2022.