Другие названия и синонимы
истинная полицитемия, эссенциальная тромбоцитемия, первичный миелофиброз.
МКБ-10 коды
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: D47.4/D45/D47.3.
Год утверждения (частота пересмотра): 2018.
Возрастная категория: Взрослые.
Год окончания действия: 2020.
ID: 120.
Разработчик клинической рекомендации.
• Общероссийская общественная организация Российское общество патологоанатомов .
• Национальное гематологическое общество.
• Российское профессиональное общество онкогематологов.
Год утверждения (частота пересмотра): 2018.
Возрастная категория: Взрослые.
Год окончания действия: 2020.
ID: 120.
Разработчик клинической рекомендации.
• Общероссийская общественная организация Российское общество патологоанатомов .
• Национальное гематологическое общество.
• Российское профессиональное общество онкогематологов.
|
|
 Список сокращений
Список сокращений
АДФ - аденозиндифосфат.
Алло-ТГСК - аллогенная трансплантация гемопоэтических стволовых клеток.
АЛТ - аланинаминотрансфераза.
АСТ - аспартатаминотрансфераза.
Ауто-ТГСК - аутологичная трансплантация гемопоэтических стволовых клеток.
АЧТВ - активированное частичное тромбопластиновое время.
БК - бластный криз.
ВОЗ - Всемирная организация здравоохранения.
ГГТ - гамма-глутамилтранспептидаза.
ИНФα - препараты интерферон-альфа 2b.
ИП - истинная полицитемия.
КТ - компьютерная томография.
ЛДГ - лактатдегидрогеназа.
МДС - миелодиспластический синдром.
МПЗ - миелопролиферативное заболевание.
МПЗн - миелопролиферативное заболевание неклассифицированное.
МРТ - магнитно-резонансная томография.
МФ - миелофиброз.
НМГ - низкомолекулярный гепарин.
МНО - международное нормализованное отношение.
ОВ - общая выживаемость.
ОМЛ - острый миелоидный лейкоз.
ОНМК - острое нарушение мозгового кровообращения.
ПМФ - первичный миелофиброз.
Пост-ИП МФ - постполицитемический миелофиброз.
Пост-ЭТ МФ - посттромбоцитемический миелофиброз.
ПЦР - полимеразная цепная реакция.
СОЭ - скорость оседания эритроцитов.
СЭ - спленэктомия.
СРБ- С-реактивный белок.
УЗИ - ультразвуковое исследование.
ХМЛ - хронический миелоидный лейкоз.
ХФ - хроническая фаза.
ЦАМФ - циклический аденозинмонофосфат.
ЩФ - щелочная фосфатаза.
ЭКГ - электрокардиограмма.
ЭГДС эзофагогастродуоденоскопии.
ЭПО - эритропоэтин.
ЭТ - эссенциальная тромбоцитемия.
Эхо-КГ - эхокардиография.
ЭЦФ - эритроцитаферез.
P32 - радиоактивный фосфор.
CALR - кальретикулин.
DIPSS (Dynamic International Prognostic Scoring System) - Динамическая международная шкала оценки прогноза.
ECOG - Eastern сooperative Oncology Group.
ELN (European Leukemia Net) - Европейская организация по изучению и лечению лейкозов.
ECOG - Eastern сooperative Oncology Group.
EORTC - Европейская организация по исследованиям в области лечения рака.
G-CSF (granulocyte colony stimulating factor) - гранулоцитарный колониестимулирующий фактор.
IPSET-thrombosis (The International Prognostic Score for ET) - Международный Прогностический Индекс рисков тромбоза при эссенциальной тромбоцитемии.
IPSS (International Prognostic Scoring System) - Международная шкала оценки прогноза.
IWG-MRT (The international working group for myeloproliferative neoplasms research and treatment) - Международная рабочая группа по изучению и лечению миелопролиферативных заболеваний.
JAK2V617F - точечная мутация (замена гуанина на тимин) в гене Янус киназы.
MCH - mean corpuscular hemoglobin, среднее содержание гемоглобина в отдельном эритроците в абсолютных единицах.
MCHC - mean corpuscular hemoglobin concentration, средняя концентрация гемоглобина в эритроцитарной массе.
MCV - Mean сorpuscular Volume, средний объем эритроцитов.
MPL - ген рецептора тромбопоэтина.
MPN-10 - Myeloproliferative Neoplasm - 10, опросник для оценки конституциональных симптомов у больных миелопролиферативными заболеваниями.
NSSN (National сomprehensive сancer Network®) - Национальная Онкологическая Сеть США.
PAI-1 - plasminogen activator inhibitor-1, ингибитора активатора плазминогена 1-го типа.
РСО2 - парциальное давление углекислого газа.
PVSG (Polycythemia Vera Study Group) - группа по изучению истинной полицитемии.
PUVA (psoralen + UVA treatment) - ПУВА - терапия; ультрафиолетовая фототерапия в комбинации с псораленом.
RDW - red cell distribution width, относительная ширина распределения эритроцитов по объёму.
УДД - уровень достоверности доказательств.
УУР - уровень убедительности рекомендаций.
Алло-ТГСК - аллогенная трансплантация гемопоэтических стволовых клеток.
АЛТ - аланинаминотрансфераза.
АСТ - аспартатаминотрансфераза.
Ауто-ТГСК - аутологичная трансплантация гемопоэтических стволовых клеток.
АЧТВ - активированное частичное тромбопластиновое время.
БК - бластный криз.
ВОЗ - Всемирная организация здравоохранения.
ГГТ - гамма-глутамилтранспептидаза.
ИНФα - препараты интерферон-альфа 2b.
ИП - истинная полицитемия.
КТ - компьютерная томография.
ЛДГ - лактатдегидрогеназа.
МДС - миелодиспластический синдром.
МПЗ - миелопролиферативное заболевание.
МПЗн - миелопролиферативное заболевание неклассифицированное.
МРТ - магнитно-резонансная томография.
МФ - миелофиброз.
НМГ - низкомолекулярный гепарин.
МНО - международное нормализованное отношение.
ОВ - общая выживаемость.
ОМЛ - острый миелоидный лейкоз.
ОНМК - острое нарушение мозгового кровообращения.
ПМФ - первичный миелофиброз.
Пост-ИП МФ - постполицитемический миелофиброз.
Пост-ЭТ МФ - посттромбоцитемический миелофиброз.
ПЦР - полимеразная цепная реакция.
СОЭ - скорость оседания эритроцитов.
СЭ - спленэктомия.
СРБ- С-реактивный белок.
УЗИ - ультразвуковое исследование.
ХМЛ - хронический миелоидный лейкоз.
ХФ - хроническая фаза.
ЦАМФ - циклический аденозинмонофосфат.
ЩФ - щелочная фосфатаза.
ЭКГ - электрокардиограмма.
ЭГДС эзофагогастродуоденоскопии.
ЭПО - эритропоэтин.
ЭТ - эссенциальная тромбоцитемия.
Эхо-КГ - эхокардиография.
ЭЦФ - эритроцитаферез.
P32 - радиоактивный фосфор.
CALR - кальретикулин.
DIPSS (Dynamic International Prognostic Scoring System) - Динамическая международная шкала оценки прогноза.
ECOG - Eastern сooperative Oncology Group.
ELN (European Leukemia Net) - Европейская организация по изучению и лечению лейкозов.
ECOG - Eastern сooperative Oncology Group.
EORTC - Европейская организация по исследованиям в области лечения рака.
G-CSF (granulocyte colony stimulating factor) - гранулоцитарный колониестимулирующий фактор.
IPSET-thrombosis (The International Prognostic Score for ET) - Международный Прогностический Индекс рисков тромбоза при эссенциальной тромбоцитемии.
IPSS (International Prognostic Scoring System) - Международная шкала оценки прогноза.
IWG-MRT (The international working group for myeloproliferative neoplasms research and treatment) - Международная рабочая группа по изучению и лечению миелопролиферативных заболеваний.
JAK2V617F - точечная мутация (замена гуанина на тимин) в гене Янус киназы.
MCH - mean corpuscular hemoglobin, среднее содержание гемоглобина в отдельном эритроците в абсолютных единицах.
MCHC - mean corpuscular hemoglobin concentration, средняя концентрация гемоглобина в эритроцитарной массе.
MCV - Mean сorpuscular Volume, средний объем эритроцитов.
MPL - ген рецептора тромбопоэтина.
MPN-10 - Myeloproliferative Neoplasm - 10, опросник для оценки конституциональных симптомов у больных миелопролиферативными заболеваниями.
NSSN (National сomprehensive сancer Network®) - Национальная Онкологическая Сеть США.
PAI-1 - plasminogen activator inhibitor-1, ингибитора активатора плазминогена 1-го типа.
РСО2 - парциальное давление углекислого газа.
PVSG (Polycythemia Vera Study Group) - группа по изучению истинной полицитемии.
PUVA (psoralen + UVA treatment) - ПУВА - терапия; ультрафиолетовая фототерапия в комбинации с псораленом.
RDW - red cell distribution width, относительная ширина распределения эритроцитов по объёму.
УДД - уровень достоверности доказательств.
УУР - уровень убедительности рекомендаций.
Термины и определения
Трепанобиопсия. Диагностическая процедура забора образцов костного мозга путем пункции гребня подвздошной кости.
Миелофиброз. Морфологический термин, который характеризует фиброз стромы костного мозга с вытеснением элементов гемопоэза, встречается при метастатическом и лимфомном поражениях костного мозга, острых лейкозах, миелодиспластических синдромах, МДС/МПЗ, хроническом миелолейкозе вCR-ABL1+, волосатоклеточном лейкозе. Среди неопухолевой патологии миелофиброз в костном мозге может встречаться при инфекционных и аутоиммунных заболеваниях, на поздних этапах некроза костного мозга различной этиологии вследствие фиброгистиоцитарной пролиферации с замещением фиброзной тканью некротизированного костного мозга, или выявляется при повторной трепанобиопсии из этого же участка подвздошной кости. При дифференциальной диагностике следует принимать во внимание возможность миелофиброза реактивной природы при терапии G-CSF, с расширением и омоложением гранулоцитарного ростка, усилением ретикулинового каркаса стромы. Как и во всех случаях диагностики миелопролиферативных заболеваний, необходим тщательный сбор клинико-анамнестических, лабораторных данных. Миелофиброз может возникнуть в результате трансформации ИП и ЭТ. Таким образом, следует различать ПМФ, миелофиброз, возникший в результате прогрессии/трансформации ИП/ЭТ и морфологический термин «миелофиброз».
Миелофиброз. Морфологический термин, который характеризует фиброз стромы костного мозга с вытеснением элементов гемопоэза, встречается при метастатическом и лимфомном поражениях костного мозга, острых лейкозах, миелодиспластических синдромах, МДС/МПЗ, хроническом миелолейкозе вCR-ABL1+, волосатоклеточном лейкозе. Среди неопухолевой патологии миелофиброз в костном мозге может встречаться при инфекционных и аутоиммунных заболеваниях, на поздних этапах некроза костного мозга различной этиологии вследствие фиброгистиоцитарной пролиферации с замещением фиброзной тканью некротизированного костного мозга, или выявляется при повторной трепанобиопсии из этого же участка подвздошной кости. При дифференциальной диагностике следует принимать во внимание возможность миелофиброза реактивной природы при терапии G-CSF, с расширением и омоложением гранулоцитарного ростка, усилением ретикулинового каркаса стромы. Как и во всех случаях диагностики миелопролиферативных заболеваний, необходим тщательный сбор клинико-анамнестических, лабораторных данных. Миелофиброз может возникнуть в результате трансформации ИП и ЭТ. Таким образом, следует различать ПМФ, миелофиброз, возникший в результате прогрессии/трансформации ИП/ЭТ и морфологический термин «миелофиброз».
Описание
Миелопролиферативные заболевания (МПЗ) представляют собой клональные заболевания, возникающие на уровне стволовой кроветворной клетки. МПЗ характеризуются пролиферацией одной или более клеточной линии миелопоэза в костном мозге с признаками сохранной терминальной дифференцировки, и сопровождаются изменением показателей периферической крови.
Истинная полицитемия (ИП) (синонимы. Эритремия, болезнь Вакеза, истинная красная полицитемия) - клональное МПЗ, которое характеризуется пролиферацией эритроидного, гранулоцитарного, мегакариоцитарного ростков миелопоэза, с преимущественной пролиферацией эритроидного ростка кроветворения (панмиелоз), увеличением числа эритроцитов и повышением уровня гемоглобина, тромбоцитозом, лейкоцитозом в периферической крови (панцитоз), независимостью эритропоэза от нормальных механизмов регуляции. Почти все пациенты являются носителями мутации JAK2V617F или другой функционально сходной мутации.
Эссенциальная тромбоцитемия (ЭТ) (синонимы: первичный тромбоцитоз, идиопатический тромбоцитоз, геморрагическая тромбоцитемия) - клональное МПЗ с неконтролируемой пролиферацией мегакариоцитов, характеризующееся повышенным числом крупных и гигантских мегакариоцитов в костном мозге, тромбоцитозом в периферической крови (>450 х 109/л), высоким риском тромбозов и/или кровотечений.
Миелопролиферативное заболевание, неклассифицируемое (МПЗн) - согласно рекомендациям ВОЗ 2016 г., данный диагноз следует использовать при наличии клинических, лабораторных и гистологических (в трепанобиоптате костного мозга) признаков МПЗ, не соответствующих какой-либо определенной нозологической форме классических Ph-негативных МПЗ. Чаще всего эта категория используется при расхождении между клиническими, лабораторными и морфологическими данными, позволяющими верифицировать ту или иную нозологическую форму МПЗ, что наиболее часто бывает при ранних стадиях заболеваний. Также диагноз МПЗн может быть использован при первичной диагностике в фазе бластного криза заболевания, без предшествующего анамнеза и установленного ранее диагноза МПЗ. Еще одним случаем установления диагноза МПЗн может быть сочетание МПЗ с воспалительными, метаболическими или опухолевыми заболеваниями, маскирующими основные признаки той или иной нозологической формы.
МПЗн не диагностируется: при объеме трепанобиоптата костного мозга, недостаточном для адекватного анализа; при отсутствии предоставленных клиницистами клинических и лабораторных данных, при наличии предшествующей терапии цитостатиками или колониестимулирующими факторами; при наличии реаранжировки генов PDGFRA, PDGFRB, FGFR1, выявлении химерного гена вCR-ABL1.
Первичный миелофиброз (ПМФ) (синонимы. Хронический идиопатический миелофиброз, агногенная миелоидная метаплазия, миелосклероз с миелоидной метаплазией, сублейкемический миелоз, хронический гранулоцитарно-мегакариоцитарный миелоз) возникает de novo, характеризуется клональной пролиферацией стволовых клеток, аномальной экспрессией цитокинов, фиброзом костного мозга, гепатоспленомегалией как следствие экстрамедуллярного гемопоэза, симптомами опухолевой интоксикации, кахексией, лейкоэритробластозом в периферической крови, лейкемической прогрессией, невысокой выживаемостью.
Истинная полицитемия (ИП) (синонимы. Эритремия, болезнь Вакеза, истинная красная полицитемия) - клональное МПЗ, которое характеризуется пролиферацией эритроидного, гранулоцитарного, мегакариоцитарного ростков миелопоэза, с преимущественной пролиферацией эритроидного ростка кроветворения (панмиелоз), увеличением числа эритроцитов и повышением уровня гемоглобина, тромбоцитозом, лейкоцитозом в периферической крови (панцитоз), независимостью эритропоэза от нормальных механизмов регуляции. Почти все пациенты являются носителями мутации JAK2V617F или другой функционально сходной мутации.
Эссенциальная тромбоцитемия (ЭТ) (синонимы: первичный тромбоцитоз, идиопатический тромбоцитоз, геморрагическая тромбоцитемия) - клональное МПЗ с неконтролируемой пролиферацией мегакариоцитов, характеризующееся повышенным числом крупных и гигантских мегакариоцитов в костном мозге, тромбоцитозом в периферической крови (>450 х 109/л), высоким риском тромбозов и/или кровотечений.
Миелопролиферативное заболевание, неклассифицируемое (МПЗн) - согласно рекомендациям ВОЗ 2016 г., данный диагноз следует использовать при наличии клинических, лабораторных и гистологических (в трепанобиоптате костного мозга) признаков МПЗ, не соответствующих какой-либо определенной нозологической форме классических Ph-негативных МПЗ. Чаще всего эта категория используется при расхождении между клиническими, лабораторными и морфологическими данными, позволяющими верифицировать ту или иную нозологическую форму МПЗ, что наиболее часто бывает при ранних стадиях заболеваний. Также диагноз МПЗн может быть использован при первичной диагностике в фазе бластного криза заболевания, без предшествующего анамнеза и установленного ранее диагноза МПЗ. Еще одним случаем установления диагноза МПЗн может быть сочетание МПЗ с воспалительными, метаболическими или опухолевыми заболеваниями, маскирующими основные признаки той или иной нозологической формы.
МПЗн не диагностируется: при объеме трепанобиоптата костного мозга, недостаточном для адекватного анализа; при отсутствии предоставленных клиницистами клинических и лабораторных данных, при наличии предшествующей терапии цитостатиками или колониестимулирующими факторами; при наличии реаранжировки генов PDGFRA, PDGFRB, FGFR1, выявлении химерного гена вCR-ABL1.
Первичный миелофиброз (ПМФ) (синонимы. Хронический идиопатический миелофиброз, агногенная миелоидная метаплазия, миелосклероз с миелоидной метаплазией, сублейкемический миелоз, хронический гранулоцитарно-мегакариоцитарный миелоз) возникает de novo, характеризуется клональной пролиферацией стволовых клеток, аномальной экспрессией цитокинов, фиброзом костного мозга, гепатоспленомегалией как следствие экстрамедуллярного гемопоэза, симптомами опухолевой интоксикации, кахексией, лейкоэритробластозом в периферической крови, лейкемической прогрессией, невысокой выживаемостью.
Причины
Этиология МПЗ до сих пор не установлена. Ведущей гипотезой является многоэтапность возникновения заболевания, где предрасположенность к болезни реализуется под воздействием внешних факторов, повреждающих геном нормальной клетки и приводящих к ее злокачественной трансформации. Несмотря на то, что в последние годы достигнуты значительные успехи в расшифровке молекулярно-генетических механизмов Ph-негативных МПЗ, первоначальная мутация, приводящая к малигнизации гемопоэтической клетки неизвестна [1, 2].
В последнее время достигнут значительный прогресс в понимании молекулярного патогенеза МПЗ. Мутации в одном из трех генов - JAK2, MPL, сALR - могут быть обнаружены у подавляющего большинства пациентов с МПЗ. Данные мутации представляют собой «драйверные», которые могут определять фенотип МПЗ. Первая мутация, описанная в 2005 году, JAK2V617F, оказалась самой важной и наиболее часто встречающейся соматической мутацией при МПЗ. Частота выявления JAK2V617F составляет около 95% при ИП, 50% и 60% при ЭТ и ПМФ. Соматические мутации в других экзонах гена JAK2 были впоследствии обнаружены у пациентов с ИП (мутация JAK2 в экзоне 12). Активирующие мутации в гене рецептора тромбопоэтина - MPL, могут быть обнаружены либо как поломка в редких случаях семейного тромбоцитоза (MPLS505N), либо как соматические мутации, возникающие у 3-8% пациентов с ПМФ или ЭТ (MPLW515). Большой пробел в знаниях о мутационном профиле ЭТ и ПМФ недавно был заполнен открытием соматических мутаций в гене кальретикулин (CALR), которые встречаются у 20-35% пациентов с ЭТ или ПМФ. Мутации сALR и JAK2 являются взаимоисключающими у пациентов с МПЗ, хотя могут встречаться редкие исключения [3].
При ИП и ЭТ выявляются и мутации в других генах: TET2, IDH, ASXL1, DNMT3A Ни одна из них не специфична для классических Ph-негативных МПЗ, а их патогенетическая значимость исследуется [4, 5].
Молекулярно-генетические нарушения при Ph-негативных МПЗ приводят к активации JAK-STAT сигнального пути. Результатом этого является повышение пролиферации и увеличение количества эритроцитов, лейкоцитов и тромбоцитов в периферической крови при ИП или изолированный тромбоцитоз при ЭТ. Патогенез МПЗ, в частности ПМФ, сложен и состоит из цепи событий, первичным из которых является появление патологического клона. Известно, что лейкемические моноциты и мегакариоциты активно продуцируют множество цитокинов (TGF-ß, FGF, VEGF, ANG1, OPG, вMP4), избыток которых стимулирует фиброз, неоангиогенез и приводит к остеосклерозу. Наряду с этим нарушается связь стволовых клеток с микроокружением, что способствует появлению экстрамедуллярных очагов гемопоэза, прежде всего в селезенке и печени. Массивный выброс цитокинов - одна из причин возникновения симптомов опухолевой интоксикации, что приводит к значительному ухудшению качества жизни пациентов с ПМФ [6].
Клональная миелопролиферация при Ph-негативных МПЗ также может сопровождаться вторичным воспалением с изменениями стромы костного мозга и патологической выработкой цитокинов. В развитии миелофиброза, как первичного, так и вторичного, остеосклероза и ангиогенеза вовлечены трансформирующий фактор роста бета (TGF-β) миелоидных предшественников, ростовой фактор вырабатываемый тромбоцитами (PDGFR) и эндотелиальный сосудистый фактор роста (VEGF). Патологическая выработка цитокинов, хемокинов и металлопротеиназ может участвовать в патологическом межклеточном взаимодействии нейтрофилов, моноцитов и мегакариоцитов, приводя к выходу сD34+ миелоидных предшественников и эндотелиальных клеток в периферическую кровь [6].
В последнее время достигнут значительный прогресс в понимании молекулярного патогенеза МПЗ. Мутации в одном из трех генов - JAK2, MPL, сALR - могут быть обнаружены у подавляющего большинства пациентов с МПЗ. Данные мутации представляют собой «драйверные», которые могут определять фенотип МПЗ. Первая мутация, описанная в 2005 году, JAK2V617F, оказалась самой важной и наиболее часто встречающейся соматической мутацией при МПЗ. Частота выявления JAK2V617F составляет около 95% при ИП, 50% и 60% при ЭТ и ПМФ. Соматические мутации в других экзонах гена JAK2 были впоследствии обнаружены у пациентов с ИП (мутация JAK2 в экзоне 12). Активирующие мутации в гене рецептора тромбопоэтина - MPL, могут быть обнаружены либо как поломка в редких случаях семейного тромбоцитоза (MPLS505N), либо как соматические мутации, возникающие у 3-8% пациентов с ПМФ или ЭТ (MPLW515). Большой пробел в знаниях о мутационном профиле ЭТ и ПМФ недавно был заполнен открытием соматических мутаций в гене кальретикулин (CALR), которые встречаются у 20-35% пациентов с ЭТ или ПМФ. Мутации сALR и JAK2 являются взаимоисключающими у пациентов с МПЗ, хотя могут встречаться редкие исключения [3].
При ИП и ЭТ выявляются и мутации в других генах: TET2, IDH, ASXL1, DNMT3A Ни одна из них не специфична для классических Ph-негативных МПЗ, а их патогенетическая значимость исследуется [4, 5].
Молекулярно-генетические нарушения при Ph-негативных МПЗ приводят к активации JAK-STAT сигнального пути. Результатом этого является повышение пролиферации и увеличение количества эритроцитов, лейкоцитов и тромбоцитов в периферической крови при ИП или изолированный тромбоцитоз при ЭТ. Патогенез МПЗ, в частности ПМФ, сложен и состоит из цепи событий, первичным из которых является появление патологического клона. Известно, что лейкемические моноциты и мегакариоциты активно продуцируют множество цитокинов (TGF-ß, FGF, VEGF, ANG1, OPG, вMP4), избыток которых стимулирует фиброз, неоангиогенез и приводит к остеосклерозу. Наряду с этим нарушается связь стволовых клеток с микроокружением, что способствует появлению экстрамедуллярных очагов гемопоэза, прежде всего в селезенке и печени. Массивный выброс цитокинов - одна из причин возникновения симптомов опухолевой интоксикации, что приводит к значительному ухудшению качества жизни пациентов с ПМФ [6].
Клональная миелопролиферация при Ph-негативных МПЗ также может сопровождаться вторичным воспалением с изменениями стромы костного мозга и патологической выработкой цитокинов. В развитии миелофиброза, как первичного, так и вторичного, остеосклероза и ангиогенеза вовлечены трансформирующий фактор роста бета (TGF-β) миелоидных предшественников, ростовой фактор вырабатываемый тромбоцитами (PDGFR) и эндотелиальный сосудистый фактор роста (VEGF). Патологическая выработка цитокинов, хемокинов и металлопротеиназ может участвовать в патологическом межклеточном взаимодействии нейтрофилов, моноцитов и мегакариоцитов, приводя к выходу сD34+ миелоидных предшественников и эндотелиальных клеток в периферическую кровь [6].
|
|
Эпидемиология
Заболеваемость и распространенность различных нозологических форм МПЗ неодинакова. Эпидемиологических проспективных популяционных исследований по заболеваемости МПЗ до настоящего времени в России не проводилось. Согласно зарубежным данным первичная заболеваемость ИП составляет 0,95; ПМФ - 0,22; ЭТ - 0,51, МПЗн - 0,41 на 100000 населения в год соответственно [7]. При ретроспективном десятилетнем исследовании в г. Санкт-Петербурге первичная заболеваемость Ph-негативными МПЗ составляла: ИП - 0,83; ПМФ - 1,01; ЭТ - 1,00 на 100000 населения в год соответственно. Общее количество пациентов с Ph-негативными МПЗ в Российской Федерации может составлять около 40 тысяч пациентов: 8,5 тысяч пациентов ПМФ; 11,5 тысяч пациентов с ЭТ; 20 тысяч пациентов ИП (при аппроксимации данных по распространенности МПЗ в г. Санкт-Петербурге), что может составлять около одной четверти от общей распространенности гемобластозов [8].
Классификация
В соответствии с классификацией ВОЗ 2016 г. группа хронических МПЗ объединяет семь нозологических форм [9]:
• хронический миелоидный лейкоз (ХМЛ);
• ИП;
• ПМФ:
ПМФ, префиброзная/ранняя стадия.
ПМФ, развернутая фиброзная стадия;
• ЭТ;
• МПЗн;
• хронический нейтрофильный лейкоз (ХНЛ);
• хронический эозинофильный лейкоз (ХЭЛ).
Фазы ПМФ.
В клиническом течении ПМФ выделяют две фазы, отражающие степень прогрессирования заболевания: хроническую фазу (ХФ) и терминальную фазу бластной трансформации, или бластный криз (БК).
ХФ является начальной стадией ПМФ и диагностируется у большинства (более 90%) впервые выявленных пациентов. Наиболее характерными признаками являются изменения клинического анализа крови (лейкоэритробластоз, постепенный сдвиг в нейтрофильном и эритроидном ряду до молодых форм с наличием промежуточных форм созревания), увеличение размеров печени и селезенки, наличие симптомов опухолевой интоксикации (лихорадка, потеря веса, профузные ночные поты).
БК является терминальной стадией развития патологического процесса при ПМФ. Диагностическим критерием БК ПМФ является наличие в периферической крови или в костном мозге ≥20% бластных клеток [9].
Стадии ПМФ.
В редакции классификации ВОЗ 2016 г. выделяют префиброзную/раннюю стадию и фиброзную стадию заболевания. Дифференциальную диагностику следует проводить на основании гистологического исследования трепанобиоптата костного мозга, лабораторных характеристик, клинических данных.
Префиброзная/ранняя стадия характеризуется гиперклеточностью костного мозга с расширением гранулоцитарного ростка, пролиферацией мегакариоцитарного ростка с атипией гистотопографии и структуры мегакариоцитов, отсутствием или минимальным ретикулиновым фиброзом (MF-0, MF-1 по Европейской системе градации). Префиброзная/ранняя стадия ПМФ отвечает основным критериям классификации ВОЗ, но лейкоэритробластоз, спленомегалия и анемия чаще всего отсутствуют. В клинической практике появление анемии, повышенное количество лейкоцитов или повышение активности ЛДГ в сыворотке должны насторожить врача и заставить пересмотреть диагноз [9].
Фиброзная стадия морфологически характеризуется ретикулиновым, коллагеновым фиброзом костного мозга или остеосклерозом (MF-2, MF-3 по Европейской системе градации), редукцией эритроидного ростка, выраженной атипией элементов мегакариоцитопоэза. Клиническая картина характеризуется спленомегалией, анемией, повышением активности ЛДГ, лейкоэритробластозом в гемограмме, появлением каплевидных эритроцитов [9].
• хронический миелоидный лейкоз (ХМЛ);
• ИП;
• ПМФ:
ПМФ, префиброзная/ранняя стадия.
ПМФ, развернутая фиброзная стадия;
• ЭТ;
• МПЗн;
• хронический нейтрофильный лейкоз (ХНЛ);
• хронический эозинофильный лейкоз (ХЭЛ).
Фазы ПМФ.
В клиническом течении ПМФ выделяют две фазы, отражающие степень прогрессирования заболевания: хроническую фазу (ХФ) и терминальную фазу бластной трансформации, или бластный криз (БК).
ХФ является начальной стадией ПМФ и диагностируется у большинства (более 90%) впервые выявленных пациентов. Наиболее характерными признаками являются изменения клинического анализа крови (лейкоэритробластоз, постепенный сдвиг в нейтрофильном и эритроидном ряду до молодых форм с наличием промежуточных форм созревания), увеличение размеров печени и селезенки, наличие симптомов опухолевой интоксикации (лихорадка, потеря веса, профузные ночные поты).
БК является терминальной стадией развития патологического процесса при ПМФ. Диагностическим критерием БК ПМФ является наличие в периферической крови или в костном мозге ≥20% бластных клеток [9].
Стадии ПМФ.
В редакции классификации ВОЗ 2016 г. выделяют префиброзную/раннюю стадию и фиброзную стадию заболевания. Дифференциальную диагностику следует проводить на основании гистологического исследования трепанобиоптата костного мозга, лабораторных характеристик, клинических данных.
Префиброзная/ранняя стадия характеризуется гиперклеточностью костного мозга с расширением гранулоцитарного ростка, пролиферацией мегакариоцитарного ростка с атипией гистотопографии и структуры мегакариоцитов, отсутствием или минимальным ретикулиновым фиброзом (MF-0, MF-1 по Европейской системе градации). Префиброзная/ранняя стадия ПМФ отвечает основным критериям классификации ВОЗ, но лейкоэритробластоз, спленомегалия и анемия чаще всего отсутствуют. В клинической практике появление анемии, повышенное количество лейкоцитов или повышение активности ЛДГ в сыворотке должны насторожить врача и заставить пересмотреть диагноз [9].
Фиброзная стадия морфологически характеризуется ретикулиновым, коллагеновым фиброзом костного мозга или остеосклерозом (MF-2, MF-3 по Европейской системе градации), редукцией эритроидного ростка, выраженной атипией элементов мегакариоцитопоэза. Клиническая картина характеризуется спленомегалией, анемией, повышением активности ЛДГ, лейкоэритробластозом в гемограмме, появлением каплевидных эритроцитов [9].
Клиническая картина
Клинические признаки истинной полицитемии.
Для ИП характерно наличие двух основных синдромов - плеторического и миелопролиферативного.
Плеторический синдром (от слова «плетора» - полнокровие) характеризуется увеличением массы циркулирующих эритроцитов, что приводит к появлению жалоб на головокружение, головные боли, ухудшение зрения, кожный зуд, приступы стенокардии, приступы покраснения пальцев рук и ног, которые сопровождаются болью и жжением (эритромелалгия). При осмотре кожа и видимые слизистые оболочки с синюшным оттенком (положительный симптом Купермана). Характерны сосудистые осложнения - тромбозы любой локализации.
Миелопролиферативный синдром обусловлен гиперплазией трех ростков кроветворения. Проявляется в виде кожного зуда, потливости, слабости, повышенной температуры тела, болей в костях. Повышенный распад гранулоцитов сопровождается нарушением уратового обмена, что проявляется в виде мочекислого диатеза, камнеобразования в почках, подагры, подагрической полиартралгии. Спленомегалия может быть обусловлена увеличением секвестрирующей функции селезенки. В ряде случаев спленомегалия является результатом портальной гипертензии, развившейся вследствие тромбозов вен брюшной полости. Значимый рост размеров селезенки сопровождается дискомфортом и болями в животе [10].
Клинические признаки эссенциальной тромбоцитемии.
У пациентов с ЭТ могут наблюдаться симптомы ухудшения общего состояния - утомляемость, снижение концентрации внимания. Микроциркуляторные осложнения проявляются болезненными покраснениями в области пальцев рук и ног, отеком и жжением (эритромелалгия). Нарушения микроциркуляции головного мозга (транзиторные ишемические атаки) представляют собой периодические проходящие нарушения зрения, речи (дизартрия) или походки, головные боли, нарушение ясности сознания, головокружения или мигрени. Тромбоэмболия - наиболее распространенное и опасное осложнение при ЭТ, выражающееся в тромбозах венозной и артериальной систем, в частности, крупных сосудов брюшной полости (воротной, печеночной, селезеночной и брыжеечных вен), вен нижних конечностей, коронарных артерий, артерий головного мозга. Возможно развитие геморрагических осложнений - кровотечений. Отмечается повышенный уровень спонтанных невынашиваний беременности, плацентарных инфарктов с последующим нарушением роста и гибелью плода [10].
Клинические признаки первичного миелофиброза.
Клиническая картина при ПМФ характеризуется многообразием проявлений. Начальный период болезни у большинства пациентов может протекать бессимптомно на протяжении ряда лет. Нередко признаки заболевания обнаруживаются при выполнении клинического анализа крови на профилактическом осмотре или по поводу сопутствующей патологии. Клинические проявления ПМФ не имеют патогномоничных симптомов и складываются из нескольких синдромов:
• синдром опухолевой интоксикации - прогрессирующая слабость, не соответствующая степени анемии, снижение аппетита, потеря веса, потливость, субфебрильная температура, боли в костях, суставах, зуд кожи, ухудшение течения сопутствующих заболеваний;
• синдром опухолевой пролиферации - боли и чувство тяжести в левом подреберье, связанное с увеличением селезенки, гепатомегалия, при длительном течении заболевания у пациентов могут также развиваться очаги экстрамедуллярного кроветворения в других органах (лимфатические узлы, легкие, плевра, брюшина, спинной и головной мозг, кожа, мягкие ткани конечностей), обусловливая клинические проявления, связанные с поражением этих органов;
• анемический синдром - общая слабость, одышка, снижение толерантности к физической нагрузке, бледность кожи и слизистых, тахикардия, гипотония, ухудшение течения сердечно-сосудистых заболеваний;
• тромботические осложнения - тромбозы и тромбоэмболии сосудов различных органов и тканей, тромбофлебиты периферических сосудов, инфаркт миокарда, нарушения мозгового кровообращения, которые при бессимптомном течении ПМФ, служат поводом к обследованию и установлению диагноза ПМФ;
• синдром инфекционных осложнений - развитие оппортунистических или более тяжелое течение обычных инфекционных заболеваний;
• геморрагический синдром - кровоточивость при минимальных травмах или спонтанные петехиальные или синячковые кровоизлияния, причинами кровоточивости могут быть тромбоцитопения на фоне фиброза костного мозга, гипертромбоцитоз и вторичный дефицит фактора Виллебранда, коагулопатия вследствие нарушения функции печени и развития портальной гипертензии;
• клинические проявления, обусловленные компрессией органов, за счет выраженной спленомегалии, гепатомегалии;
• портальная гипертензия (выделяют следующие причины печеночных блоков: пресинусоидальный тромботический блок; синусоидальная обструкция; постсинусоидальный блок по типу синдрома Бадда-Киари) [10].
Для ИП характерно наличие двух основных синдромов - плеторического и миелопролиферативного.
Плеторический синдром (от слова «плетора» - полнокровие) характеризуется увеличением массы циркулирующих эритроцитов, что приводит к появлению жалоб на головокружение, головные боли, ухудшение зрения, кожный зуд, приступы стенокардии, приступы покраснения пальцев рук и ног, которые сопровождаются болью и жжением (эритромелалгия). При осмотре кожа и видимые слизистые оболочки с синюшным оттенком (положительный симптом Купермана). Характерны сосудистые осложнения - тромбозы любой локализации.
Миелопролиферативный синдром обусловлен гиперплазией трех ростков кроветворения. Проявляется в виде кожного зуда, потливости, слабости, повышенной температуры тела, болей в костях. Повышенный распад гранулоцитов сопровождается нарушением уратового обмена, что проявляется в виде мочекислого диатеза, камнеобразования в почках, подагры, подагрической полиартралгии. Спленомегалия может быть обусловлена увеличением секвестрирующей функции селезенки. В ряде случаев спленомегалия является результатом портальной гипертензии, развившейся вследствие тромбозов вен брюшной полости. Значимый рост размеров селезенки сопровождается дискомфортом и болями в животе [10].
Клинические признаки эссенциальной тромбоцитемии.
У пациентов с ЭТ могут наблюдаться симптомы ухудшения общего состояния - утомляемость, снижение концентрации внимания. Микроциркуляторные осложнения проявляются болезненными покраснениями в области пальцев рук и ног, отеком и жжением (эритромелалгия). Нарушения микроциркуляции головного мозга (транзиторные ишемические атаки) представляют собой периодические проходящие нарушения зрения, речи (дизартрия) или походки, головные боли, нарушение ясности сознания, головокружения или мигрени. Тромбоэмболия - наиболее распространенное и опасное осложнение при ЭТ, выражающееся в тромбозах венозной и артериальной систем, в частности, крупных сосудов брюшной полости (воротной, печеночной, селезеночной и брыжеечных вен), вен нижних конечностей, коронарных артерий, артерий головного мозга. Возможно развитие геморрагических осложнений - кровотечений. Отмечается повышенный уровень спонтанных невынашиваний беременности, плацентарных инфарктов с последующим нарушением роста и гибелью плода [10].
Клинические признаки первичного миелофиброза.
Клиническая картина при ПМФ характеризуется многообразием проявлений. Начальный период болезни у большинства пациентов может протекать бессимптомно на протяжении ряда лет. Нередко признаки заболевания обнаруживаются при выполнении клинического анализа крови на профилактическом осмотре или по поводу сопутствующей патологии. Клинические проявления ПМФ не имеют патогномоничных симптомов и складываются из нескольких синдромов:
• синдром опухолевой интоксикации - прогрессирующая слабость, не соответствующая степени анемии, снижение аппетита, потеря веса, потливость, субфебрильная температура, боли в костях, суставах, зуд кожи, ухудшение течения сопутствующих заболеваний;
• синдром опухолевой пролиферации - боли и чувство тяжести в левом подреберье, связанное с увеличением селезенки, гепатомегалия, при длительном течении заболевания у пациентов могут также развиваться очаги экстрамедуллярного кроветворения в других органах (лимфатические узлы, легкие, плевра, брюшина, спинной и головной мозг, кожа, мягкие ткани конечностей), обусловливая клинические проявления, связанные с поражением этих органов;
• анемический синдром - общая слабость, одышка, снижение толерантности к физической нагрузке, бледность кожи и слизистых, тахикардия, гипотония, ухудшение течения сердечно-сосудистых заболеваний;
• тромботические осложнения - тромбозы и тромбоэмболии сосудов различных органов и тканей, тромбофлебиты периферических сосудов, инфаркт миокарда, нарушения мозгового кровообращения, которые при бессимптомном течении ПМФ, служат поводом к обследованию и установлению диагноза ПМФ;
• синдром инфекционных осложнений - развитие оппортунистических или более тяжелое течение обычных инфекционных заболеваний;
• геморрагический синдром - кровоточивость при минимальных травмах или спонтанные петехиальные или синячковые кровоизлияния, причинами кровоточивости могут быть тромбоцитопения на фоне фиброза костного мозга, гипертромбоцитоз и вторичный дефицит фактора Виллебранда, коагулопатия вследствие нарушения функции печени и развития портальной гипертензии;
• клинические проявления, обусловленные компрессией органов, за счет выраженной спленомегалии, гепатомегалии;
• портальная гипертензия (выделяют следующие причины печеночных блоков: пресинусоидальный тромботический блок; синусоидальная обструкция; постсинусоидальный блок по типу синдрома Бадда-Киари) [10].
|
|
Диагностика
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (в соответствии с шкалами оценки УДД и УУР) по причине отсутствия посвященных им клинических исследований. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии:
Большие критерии:
• уровень гемоглобина более 165 г/л у мужчин и 160 г/л у женщин, или гематокрит более 49 % у мужчин и более 48 % у женщин, или увеличение массы циркулирующих эритроцитов более 25 % от расчетных значений;
• в трепанобиоптате костного мозга гиперклеточность, с учетом возраста, с трехлинейной (эритроидного, гранулоцитарного, мегакариоцитарного ростков) гиперплазией костного мозга с атипией мегакариоцитов;
• обнаружение мутации JAK2V617F или мутаций в 12-м экзоне гена JAK2.
Малый критерий:
• уровень эритропоэтина ниже нормальных референсных значений.
Диагноз ИП устанавливается при наличии трех больших критериев или первых двух больших и малого критериев.
• Рекомендуется при обследовании пациентов с подозрением на ЭТ использовать критерии диагностики ВОЗ 2016 г. для повышения точности диагностики [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии:
Большие критерии:
• постоянный тромбоцитоз более 450 × 109/л;
• в трепанобиоптате костного мозга пролиферация мегакариоцитов с повышенным количеством зрелых, больших размеров мегакариоцитов;
• несоответствие критериям ВОЗ для диагностики ИП, ПМФ, ХМЛ, МДС или других миелоидных новообразований;
• наличие мутации JAK2V617F, сALR или MPL.
Малый критерий:
• наличие клональных маркеров (например, цитогенетических аберраций) или отсутствие признаков реактивного тромбоцитоза.
Диагноз является достоверным при наличии всех четырех больших критериев или первых трех больших и малого критериев.
• Рекомендуется при обследовании пациентов с подозрением на ПМФ использовать критерии диагностики ВОЗ 2016 г. для повышения точности диагностики. Критерии для диагностики префиброзной и фиброзной стадии ПМФ различаются [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии:
Префиброзная стадия ПМФ.
Большие критерии:
• Пролиферация мегакариоцитов с признаками атипии* без ретикулинового фиброза более 1 стадии (МФ-1), сопровождающаяся гиперклеточностью костного мозга, не соответствующей возрасту, гранулоцитарной пролиферацией и часто сниженным эритропоэзом.
• Несоответствие критериям ВОЗ для диагностики ХМЛ, ИП, ЭТ, МДС или других миелопролиферативных новообразований**.
• Обнаружение мутаций в генах JAK2, сALR или MPL, при отсутствии этих мутаций наличие других клональных маркеров (ASXL1, EZH2, TET2, IDH1/2, SRSF2, SF3B1) или отсутствие ретикулинового фиброза малой степени (степень МФ-1) реактивной природы (инфекции, аутоиммунные заболевания, состояния хронического воспаления, волосатоклеточный лейкоз или другие лимфопролиферативные новообразования, метастазы опухолей или хронические интоксикации)***.
Малые критерии - наличие одного из следующих признаков, подтвержденных в двух последующих определениях:
А) анемия, не связанная с сопутствующими заболеваниями;
Б) лейкоцитоз не менее 11 × 109/л;
В) пальпируемая спленомегалия;
Г) повышение ЛДГ выше нормы.
Для верификации диагноза «префиброзная стадия ПМФ» требуется наличие всех трех больших критериев и по меньшей мере одного малого критерия. _________________________________________________________________________.
*От малых до крупных мегакариоцитов с незрелой морфологией - нарушенным ядерно-цитоплазматическим соотношением, атипичными гиперхромными гиполобулярными/уродливыми ядрами, с формированием рыхлых и плотных кластеров.
** Исключение ИП основано на уровнях гемоглобина и гематокрита. Определение массы циркулирующих эритроцитов не требуется. Нет вCR-ABL1. Нет дизэритропоэза и дисгранулопоэза.
***Пациенты с заболеваниями, приводящими к реактивному миелофибозу.
Фиброзная стадия ПМФ.
Большие критерии:
• Пролиферация мегакариоцитов с признаками атипии в сочетании с ретикулиновым и/или коллагеновым фиброзом степени 2 или 3 (МФ-2 или МФ-3).
• Несоответствие критериям ВОЗ для диагностики ЭТ, ИП, ХМЛ, МДС или других миелопролиферативных новообразований.
• Обнаружение мутаций в генах JAK2, сALR или MPL, при отсутствии этих мутаций наличие других клональных маркеров (ASXL1, EZH2, TET2, IDH1/2, SRSF2, SF3B1) или отсутствие ретикулинового фиброза малой степени (степень МФ-1) реактивной природы (инфекции, аутоиммунные заболевания, состояния хронического воспаления, волосатоклеточный лейкоз или другие лимфопролиферативные новообразования, метастазы опухолей или хронические интоксикации).
Малые критерии - наличие одного из следующих признаков, подтвержденных в двух последующих определениях:
А) анемия, не связанная с сопутствующими заболеваниями;
Б) лейкоцитоз не менее 11 × 109/л;
В) пальпируемая спленомегалия;
Г) повышение ЛДГ выше нормы;
Д) лейкоэритробластоз.
Для верификации диагноза «развернутая (фиброзная) стадия ПМФ» требуется наличие всех трех больших критериев и по меньшей мере одного малого критерия.
• Рекомендуется при обследовании пациентов с подозрением на пост-ИП МФ / пост-ЭТ МФ использовать критерии диагностики ВОЗ 2016 г. для повышения точности диагностики [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии:
Большие критерии:
• Первично диагностированная согласно критериям ВОЗ ЭТ или ИП.
• Фиброз костного мозга MF-2 или MF-3 (оценка по шкале 0-3) или 3-4 (оценка по шкале 0-4).
Малые критерии:
А) анемия или снижение уровня гемоглобина более чем на 20 г/л;
Б) лейкоэритробластоз;
В) увеличение размеров селезенки (пальпируемая селезенка более 5 см от края реберной дуги) или появление спленомегалии;
Г) повышение ЛДГ;
Д) симптомы опухолевой интоксикации: потеря более 10% веса за 6 месяцев, ночная потливость, необъяснимая лихорадка (> 37,5 °С).
Диагноз пост-ИП МФ и пост-ЭТ МФ верифицируется при наличии двух больших и не менее двух малых критериев.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 2+).
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Обратить внимание на окраску кожи лица, ладоней, стоп, видимых слизистых (бледные кожные покровы и слизистые могут являться симптомом анемии, плетора может свидетельствовать о повышенном уровне гемоглобина, гематокрита), кожи нижних конечностей (пигментация, трофические расстройства, отеки, геморрагии), пальпация печени и селезенки, оценка состояния легких, сердца, желудочно-кишечного тракта, почек являются обязательными для проведения.
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется всем пациентам с подозрением и предварительным диагнозом Ph-негативное МПЗ проведение коагулограммы (протромбиновый индекс, МНО, фибриноген, АЧТВ, тромбиновое время, антитромбин III, протеин с, протеин S, D-димер, агрегация тромбоцитов, гомоцистеин) для оценки риска тромботических и геморрагических осложнений [13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. У пациентов с Ph-негативными МПЗ высокий риск как тромботических, так и геморрагических осложнений.
• Рекомендуется пациентам проведение молекулярно-генетического скрининга маркеров наследственной тромбофилии (F2 Thr165 met, F5(Лейден), F5 (Гонконг), F5 (Кембридж), FGB, PAI-1-серпин, ITGA-2-a2, ITGB3-b3, F7, F13A1, MTHFR, MTHFR, MTR, MTRR) в случае тромботических событий в анамнезе, отягощенном семейном анамнезе для оценки риска тромбогеморрагических осложнений [13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. У пациентов с Ph-негативными МПЗ высокий риск тромбогеморрагических осложнений. При наличии дополнительных факторов риска (генетическая тромбофилия / носительство полиморфизмов генов тромбофилии) необходим более частый мониторинг состояния свертывающей системы крови.
• Рекомендуется всем пациентам с подозрением и предварительным диагнозом Ph-негативное МПЗ биохимический анализ крови (общий белок, мочевина, креатинин, мочевая кислота, АСТ, АЛТ, ГГТ, ЩФ, холестерин, триглицериды, ЛДГ, СРБ) с целью верификации диагноза, диагностики сопутствующей патологии, оценки функции печени, почек, для необходимости консультации профильных специалистов, назначения сопроводительной терапии [12, 13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Уровень ЛДГ сыворотки крови является малым диагностическим критерием ПМФ. При повышенном уровне мочевой кислоты необходимо назначение препаратов, влияющих на обмен мочевой кислоты. При нарушении функции печени и почек необходимо назначение сопроводительной терапии. Гиперхолестеринемия является дополнительным фактором риска тромботических осложнений.
• Рекомендуется пациентам с МПЗ уровнем гемоглобина ниже референсных значений; пациентам с уровнем гемоглобина более 165 г/л у мужчин и 160 г/л у женщин, или гематокритом более 49 % у мужчин и более 48 % у женщин при отсутствии мутаций гена JAK2; пациентам с тромбоцитозом при отсутствии мутаций JAK2, MPL, сALR исследование обмена железа (ферритин, сывороточное железо) с диагностической целью [13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. При МПЗ, в частности ПМФ, анемия может носить смешанный генез (анемия хронических заболеваний и железодефицитная). Исследование обмена железа позволит определить ведущую причину анемического синдрома и назначить патогенетическую терапию. Дефицит железа является одной из ведущих причин вторичного тромбоцитоза. Наследственный гемохроматоз сопровождается повышением уровня железа сыворотки крови, повышением гемоглобина и гематокрита.
• Рекомендуется определение фолиевой кислоты, витамина В12 пациентам с гиперхромной макроцитарной анемией для выбора лечебной тактики в терапии анемического синдрома у пациентов с ПМФ и анемией [13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется исследовать уровень эритропоэтина (ЭПО) сыворотки крови у пациентов с уровнем гемоглобина более 165 г/л у мужчин и 160 г/л у женщин, или гематокритом более 49 % у мужчин и более 48 % у женщин для верификации диагноза [9, 13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Определение ЭПО сыворотки крови является малым диагностическим критерием при установлении диагноза ИП. Субнормальный ЭПО при отсутствии мутации JAK2V617F является основанием для исследования мутации гена JAK2 в 12 экзоне. Исследование уровня ЭПО сыворотки крови необходимо для дифференциальной диагностики в группе МПЗ.
• Рекомендуется исследование прямой пробы Кумбса, ретикулоцитов у пациентов с МПЗ с симптомами анемии (при отсутствии других причин анемии) для исключения гемолитической анемии [12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется молекулярно-генетическое исследование периферической крови (качественная ПЦР на наличие мутации V617F гена JAK2, на наличие мутации W515 L/K гена MPL, секвенирование по Сэнгеру на наличие мутаций в 9 экзоне гена сALR) всем пациентам с подозрением на Ph-негативное МПЗ для верификации диагноза [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Выявление мутации JAK2V617F с высокой степенью вероятности позволяет установить диагноз ИП у пациентов с соответствующей клинической картиной; выявление мутаций JAK2V617F, MPLW515L/K, в 9 экзоне гена сALR с высокой степенью вероятности позволяет установить диагноз ПМФ или ЭТ у пациентов с соответствующей клинической картиной. Молекулярно-генетическое исследование позволяет провести дифференциальную диагностику как в группе МПЗ, так и между МПЗ и вторичными эритроцитозом, тромбоцитозом, миелофиброзом. Однако в 10% случаев МПЗ не выявляются «драйверные» мутации.
• Рекомендуется молекулярно-генетическое исследование периферической крови (качественная ПЦР на наличие мутации в 12 экзоне гена JAK2) пациентам с уровнем гемоглобина более 165 г/л у мужчин и 160 г/л у женщин, или гематокритом более 49% у мужчин и более 48% у женщин при отсутствии мутации V617F гена JAK2 для верификации ИП [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Мутации 12 экзона гена JAK2V617F выявляются в 2-5% наблюдений при ИП.
• Рекомендуется всем пациентам с МПЗ и выявленной мутацией JAK2V617F определение аллельной нагрузки мутантного JAK2V617F для верификации диагноза [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется всем пациентам с подозрением на ХМЛ и в случае затруднений при проведении дифференциальной диагностики Ph-негативных МПЗ с ХМЛ ПЦР исследование (качественное) на ген вCR-ABL1 (транскрипты р210, р190, р230) для верификации диагноза [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется стандартное цитогенетическое исследование костного мозга у пациентов с нетипичной клинической, морфологической картиной заболевания, при отсутствии мутаций генов JAK2, сALR, MPL; всем кандидатам на алло - ТГСК с целью оценки цитогенетических факторов риска [8, 9, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Частота выявления хромосомных аберраций до 10% на момент постановки диагноза. Выявление хромосомных аберраций при стандартном цитогенетическом исследовании является неблагоприятным прогностическим критерием при определении степени риска в шкалах DIPSS+ и GPSS. Тактика ведения пациентов с МПЗ базируется на определении прогностической группы.
• Рекомендуется определить маркеры гепатита В (HBsAg), IgG-антитела к вирусу гепатита С, маркеры сифилиса, ВИЧ типов 1,2 всем пациентам перед проведением инвазивных процедур для определения сопутствующей патологии [8].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется исследование артериального рО2, рСО2 пациентам с уровнем гемоглобина более 165 г/л у мужчин и 160 г/л у женщин, или гематокритом более 49% у мужчин и более 48% у женщин при отсутствии мутаций генов JAK2, MPL, сALR с целью выявления дополнительных причин для эритроцитоза, повышения концентрации гемоглобина, повышения гематокрита [8, 11, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется всем пациентам с предварительным диагнозом МПЗ стернальная пункция с подсчетом миелограммы, определением соотношения миелоидного и эритроидного ростков, количественной и качественной характеристики мегакариоцитов для исключения МПЗ [8, 11, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется всем пациентам с предварительным диагнозом МПЗ трепанобиопсия костного мозга с гистологической оценкой и гистохимическим исследованием для выявления ретикулиновых и коллагеновых волокон для установления диагноза, проведения дифференциальной диагностики в группе Ph-негативных МПЗ [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. При Ph-негативных МПЗ морфологическое исследование трепанобиоптата костного мозга является одним из больших диагностических критериев. Гистологическое исследование костного мозга на момент диагностики следует выполнять всем пациентам с пороговым уровнем гемоглобина и гематокрита, что позволяет исключить ЭТ и ПМФ. Следует отметить, что диагноз ИП возможен и при концентрации гемоглобина и гематокрите ниже диагностического порога. Это возможно у молодых пациентов при наличии дефицита железа (нормальный или даже сниженный гемоглобин при высоком уровне эритроцитов) и/или после острых кровотечений (снижение уровня гемоглобина, эритроцитов и гематокрита). Настороженность в отношении ИП должна быть по отношению к пациентам с состоявшимися абдоминальными тромбозами, особенно при наличии кожного зуда, эритромелалгии, спленомегалии, лейкоцитоза, тромбоцитоза и микроцитоза в периферической крови. Существует также специфическая форма ИП, которая представляет собой маскированную / латентную ИП. В таких случаях обнаруживают мутации гена JAK2 и снижение ЭПО, но значимого повышение концентрации гемоглобина не наблюдается. Клинические признаки МПЗ (ПМФ) неспецифичны - например, спленомегалия, анемия, могут быть обусловлены лимфомой селезенки с поражением костного мозга. Поэтому гистологическое исследование костного мозга введено в большие критерии диагностики ПМФ в классификации ВОЗ.
• Рекомендуется пациентам с МПЗ с цефалгическим синдромом для определения сопутствующей патологии проведение УЗИ-допплерографии церебральных артерий (сонных и позвоночных артерий) с целью определения риска тромбоза в системе церебральных артерий, риска ТИА и ОНМК [14].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется УЗИ. Допплерографии сосудов портальной системы пациентам с МПЗ при подозрении на тромбоз воротной вены, ветвей воротной вены, селезеночной вены, верхней брыжеечной вены [15].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Комментарии. Исследование позволяет выявить как прямые, так и косвенные признаки тромбоза сосудов портальной системы, своевременно поставить диагноз и определить лечебную тактику. Пациенты с подозрением на тромбоз вен нуждаются в более частом мониторинге показателей свертывающей системы крови, назначении терапии антикоагулянтами, более детальном обследовании.
• Рекомендуется КТ (компьютерная томография) или МРТ (магнитно-резонансная томография) брюшной полости с внутривенным контрастированием с определением объема селезенки, оценкой состояния сосудов брюшной полости пациентам с МПЗ при остром болевом синдроме в левом подреберье, при подозрении на инфаркт селезенки, при состоявшемся тромбозе в системе портальных вен (обнаруженном при ультразвуковом исследовании) [8, 11, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Острые хирургические патологии брюшной полости крайне опасны и требуют срочного хирургического вмешательства. Тромбоз сосудов портальной системы различают полный и частичный, а также острую и хроническую форму. Острая форма может проявляться ишемией и инфарктом кишечника вследствие распространения тромба на мезентериальные сосуды. Хроническая форма чаще бессимптомная в силу включения компенсаторных механизмов, таких как дилатация печеночной артерии и развитие сети коллатералей. Проявлениями хронического тромбоза могут быть кровотечения из желудочно-кишечного тракта как следствие портальной гипертензии и билиопатия. Антикоагулянтная терапия считается терапией выбора при остром тромбозе. При хроническом тромбозе рекомендованы мониторинг и профилактика кровотечения из варикозно-расширенных вен пищевода, при необходимости медикаментозный тромболизис. Необходимо рассмотреть вопрос о хирургическом лечении (спленэктомия, портокавальное шунтирование).
• Рекомендуется всем пациентам с портальной гипертензией проведение эзофагогастродуоденоскопии (ЭГДС) с оценкой вен пищевода вследствие массивной спленомегалии и/или тромбоза в системе портальных сосудов для исключения наличия варикозного расширения вен, как проявления портальной гипертензии [8, 11, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. У данной категории пациентов высокий риск кровотечений из варикозно-расширенных вен пищевода и желудка.
• Рекомендуется оценка кардиопульмонального статуса (ЭКГ, ЭхоКГ) пациентам с сопутствующими заболеваниями сердечно - сосудистой системы для оценки риска тромботических осложнений и смерти от сердечно-сосудистых осложнений для выявления противопоказаний к лечению цитостатическими препаратами [8, 11, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Основными причинами, существенно снижающими качество жизни и угрожающими жизни пациентов с Ph-негативными МПЗ, помимо опухолевой природы являются тромбогеморрагические осложнения. Выявление факторов риска развития сердечно-сосудистой патологии у пациентов с МПЗ позволяет своевременно выделить группу пациентов, требующих активного наблюдения и проведения профилактической гемокорректирующей терапии в сочетании со специфическими циторедуктивными препаратами.
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
2,6 Диагностическая информация, влияющая прогноз течения заболевания, выбор терапии.
Системы стратификации риска при ИП.
• Рекомендуется применять стратификацию риска у пациентов с ИП для оценки вероятности тромботических осложнений, привносящих наибольший вклад в структуру смертности и инвалидизации, обусловленную заболеванием [17-19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств -2+).
Комментарии. По результатам когортных исследований наиболее устойчивыми факторами риска для тромботических осложнений при ИП являются возраст старше 60 лет и наличие тромбозов в анамнезе. При этом целесообразно также учитывать общие факторы риска для сердечно-сосудистых, тромботических и геморрагических осложнений (Приложение Г1, табл. 1).
Системы стратификации риска при ЭТ.
• Рекомендуется применять стратификацию риска у пациентов с ЭТ предназначенную для оценки вероятности артериального тромбоза, обусловливающего инвалидизацию и ограничивающих продолжительность жизни пациентов [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 2+).
Комментарии. На основании международных многоцентровых исследований экспертами ВОЗ была разработана международная прогностическая шкала риска развития артериального тромбоза при ЭТ - The International Prognostic Score for ET (IPSET-thrombosis) (Приложение Г1, табл.2).
Системы стратификации риска при ПМФ.
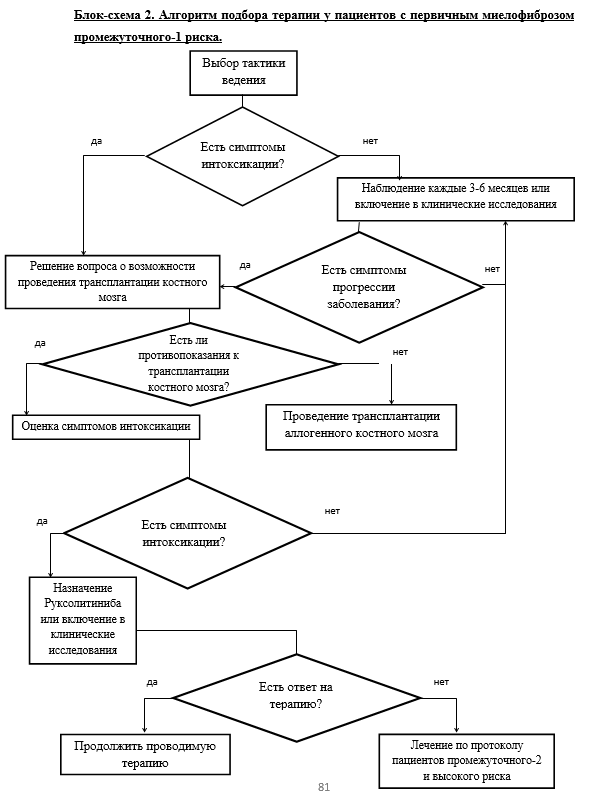
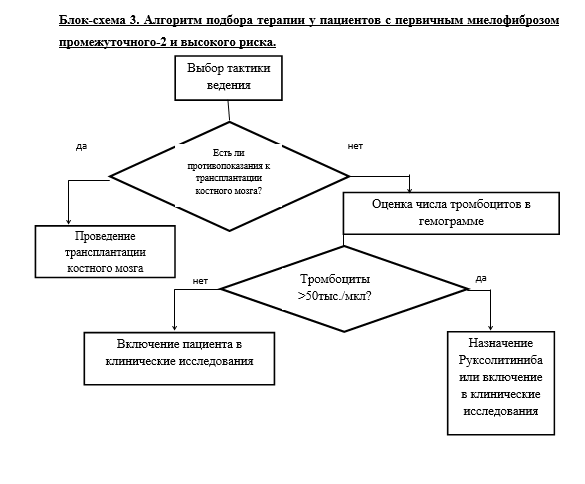
Для определения тактики терапии ПМФ необходима точная оценка индивидуального прогноза пациента.
• Рекомендуется применять стратификацию риска у пациентов с ПМФ для определения индивидуального прогноза пациента.
Уровень убедительности рекомендаций С (уровень достоверности доказательств -2+).
Комментарии. В 2009 г. F. Cervantes et al. предложили Международную шкалу оценки прогноза (International Prognostic Scoring System, IPSS). Данная шкала служит для определения прогноза на момент постановки диагноза. Были выявлены следующие факторы, достоверно влияющие на выживаемость пациентов: возраст, уровень гемоглобина, процент бластов в периферической крови и наличие симптомов опухолевой интоксикации. В созданной прогностической системе используется балльная оценка, где каждому из признаков присваивается по одному баллу (Приложение Г1, табл. 3). Разделенные по количеству прогностических баллов группы пациентов статистически значимо различаются по длительности общей выживаемости [21].
В 2010 г. F. Passamonti et al. система IPSS была модифицирована с помощью присвоения фактору уровня гемоглобина менее 100 г/л двух баллов вместо одного. Также была изменена классификация по группам риска соответственно баллам (Приложение Г1, табл. 4). Новая система Dynamic IPSS (DIPSS) способна предсказывать риск трансформации в любой момент подсчета, а не только при установлении диагноза [22].
Последующий анализ многоцентровых данных показал, что независимым прогностическим фактором являются тромбоцитопения (тромбоциты <100х109/л) и цитогенетические аномалии (изолированные нарушения +8, 7/7q, i(17q), inv(3), 5/5q, 12p или перестройка 11q23). С учетом этих данных N. Gangat et al. система стратификации была дополнена и апробирована на 793 пациентах (Приложение Г1, табл. 5) [23]. Новая система стратификации, получившая наименование DIPSS+ позволила прогнозировать не только общую выживаемость, но и время до развития бластной трансформации.
В связи с накоплением данных о прогностической роли молекулярно-генетических нарушений для выживаемости пациентов с ПМФ, в 2014г. была разработана «Мутационная международная прогностическая шкала» (MIPSS) [24]. Данная шкала обладает лучшей способностью по сравнению с предыдущими шкалами определять общую и беспрогрессивную выживаемость при ПМФ (Приложение Г1, табл. 6,7).
Данная шкала обладает самой высокой степенью предсказательности, проста в подсчете. Обследование пациента для определения риска по шкале MIPSS не требует инвазивных процедур - достаточно сбора анамнеза и взятия проб крови, при этом следует отметить что пробы крови для молекулярно-генетического исследования могут быть заморожены и сохранены в течение длительного времени, что облегчает их доставку для анализа.
Комплексная оценка результатов клинических параметров, цитогенетических и молекулярно-генетических характеристик для прогноза течения ПМФ получила развитие в «Генетической прогностической системе» GPSS, предложенной A. Tefferi et al (Приложение Г1, табл. 8) [25].
2,1 Критерии установления диагноза.
• Рекомендуется при обследовании пациентов с подозрением на ИП использовать критерии диагностики ВОЗ 2016 г. для повышения точности диагностики [9].Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии:
Большие критерии:
• уровень гемоглобина более 165 г/л у мужчин и 160 г/л у женщин, или гематокрит более 49 % у мужчин и более 48 % у женщин, или увеличение массы циркулирующих эритроцитов более 25 % от расчетных значений;
• в трепанобиоптате костного мозга гиперклеточность, с учетом возраста, с трехлинейной (эритроидного, гранулоцитарного, мегакариоцитарного ростков) гиперплазией костного мозга с атипией мегакариоцитов;
• обнаружение мутации JAK2V617F или мутаций в 12-м экзоне гена JAK2.
Малый критерий:
• уровень эритропоэтина ниже нормальных референсных значений.
Диагноз ИП устанавливается при наличии трех больших критериев или первых двух больших и малого критериев.
• Рекомендуется при обследовании пациентов с подозрением на ЭТ использовать критерии диагностики ВОЗ 2016 г. для повышения точности диагностики [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии:
Большие критерии:
• постоянный тромбоцитоз более 450 × 109/л;
• в трепанобиоптате костного мозга пролиферация мегакариоцитов с повышенным количеством зрелых, больших размеров мегакариоцитов;
• несоответствие критериям ВОЗ для диагностики ИП, ПМФ, ХМЛ, МДС или других миелоидных новообразований;
• наличие мутации JAK2V617F, сALR или MPL.
Малый критерий:
• наличие клональных маркеров (например, цитогенетических аберраций) или отсутствие признаков реактивного тромбоцитоза.
Диагноз является достоверным при наличии всех четырех больших критериев или первых трех больших и малого критериев.
• Рекомендуется при обследовании пациентов с подозрением на ПМФ использовать критерии диагностики ВОЗ 2016 г. для повышения точности диагностики. Критерии для диагностики префиброзной и фиброзной стадии ПМФ различаются [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии:
Префиброзная стадия ПМФ.
Большие критерии:
• Пролиферация мегакариоцитов с признаками атипии* без ретикулинового фиброза более 1 стадии (МФ-1), сопровождающаяся гиперклеточностью костного мозга, не соответствующей возрасту, гранулоцитарной пролиферацией и часто сниженным эритропоэзом.
• Несоответствие критериям ВОЗ для диагностики ХМЛ, ИП, ЭТ, МДС или других миелопролиферативных новообразований**.
• Обнаружение мутаций в генах JAK2, сALR или MPL, при отсутствии этих мутаций наличие других клональных маркеров (ASXL1, EZH2, TET2, IDH1/2, SRSF2, SF3B1) или отсутствие ретикулинового фиброза малой степени (степень МФ-1) реактивной природы (инфекции, аутоиммунные заболевания, состояния хронического воспаления, волосатоклеточный лейкоз или другие лимфопролиферативные новообразования, метастазы опухолей или хронические интоксикации)***.
Малые критерии - наличие одного из следующих признаков, подтвержденных в двух последующих определениях:
А) анемия, не связанная с сопутствующими заболеваниями;
Б) лейкоцитоз не менее 11 × 109/л;
В) пальпируемая спленомегалия;
Г) повышение ЛДГ выше нормы.
Для верификации диагноза «префиброзная стадия ПМФ» требуется наличие всех трех больших критериев и по меньшей мере одного малого критерия. _________________________________________________________________________.
*От малых до крупных мегакариоцитов с незрелой морфологией - нарушенным ядерно-цитоплазматическим соотношением, атипичными гиперхромными гиполобулярными/уродливыми ядрами, с формированием рыхлых и плотных кластеров.
** Исключение ИП основано на уровнях гемоглобина и гематокрита. Определение массы циркулирующих эритроцитов не требуется. Нет вCR-ABL1. Нет дизэритропоэза и дисгранулопоэза.
***Пациенты с заболеваниями, приводящими к реактивному миелофибозу.
Фиброзная стадия ПМФ.
Большие критерии:
• Пролиферация мегакариоцитов с признаками атипии в сочетании с ретикулиновым и/или коллагеновым фиброзом степени 2 или 3 (МФ-2 или МФ-3).
• Несоответствие критериям ВОЗ для диагностики ЭТ, ИП, ХМЛ, МДС или других миелопролиферативных новообразований.
• Обнаружение мутаций в генах JAK2, сALR или MPL, при отсутствии этих мутаций наличие других клональных маркеров (ASXL1, EZH2, TET2, IDH1/2, SRSF2, SF3B1) или отсутствие ретикулинового фиброза малой степени (степень МФ-1) реактивной природы (инфекции, аутоиммунные заболевания, состояния хронического воспаления, волосатоклеточный лейкоз или другие лимфопролиферативные новообразования, метастазы опухолей или хронические интоксикации).
Малые критерии - наличие одного из следующих признаков, подтвержденных в двух последующих определениях:
А) анемия, не связанная с сопутствующими заболеваниями;
Б) лейкоцитоз не менее 11 × 109/л;
В) пальпируемая спленомегалия;
Г) повышение ЛДГ выше нормы;
Д) лейкоэритробластоз.
Для верификации диагноза «развернутая (фиброзная) стадия ПМФ» требуется наличие всех трех больших критериев и по меньшей мере одного малого критерия.
• Рекомендуется при обследовании пациентов с подозрением на пост-ИП МФ / пост-ЭТ МФ использовать критерии диагностики ВОЗ 2016 г. для повышения точности диагностики [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии:
Большие критерии:
• Первично диагностированная согласно критериям ВОЗ ЭТ или ИП.
• Фиброз костного мозга MF-2 или MF-3 (оценка по шкале 0-3) или 3-4 (оценка по шкале 0-4).
Малые критерии:
А) анемия или снижение уровня гемоглобина более чем на 20 г/л;
Б) лейкоэритробластоз;
В) увеличение размеров селезенки (пальпируемая селезенка более 5 см от края реберной дуги) или появление спленомегалии;
Г) повышение ЛДГ;
Д) симптомы опухолевой интоксикации: потеря более 10% веса за 6 месяцев, ночная потливость, необъяснимая лихорадка (> 37,5 °С).
Диагноз пост-ИП МФ и пост-ЭТ МФ верифицируется при наличии двух больших и не менее двух малых критериев.
2,2 Сбор анамнеза и жалоб.
• Рекомендуется проводить сбор анамнеза и жалоб всем пациентам с подозрением и предварительным диагнозом Ph-негативное МПЗ с целью уточнения таких характеристик как национальность, семейный анамнез, тромбозы в анамнезе, курение, сопутствующие заболевания с целью определения необходимости проведения дополнительных диагностических мероприятий [8-12].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 2+).
2,3 Физикальное обследование.
• Рекомендуется проведение физикального осмотра всем пациентам с подозрением и предварительным диагнозом Ph-негативное МПЗ с целью выявления конкретного патологического процесса, вызвавшего нарушение нормальной жизнедеятельности [8-12].Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Обратить внимание на окраску кожи лица, ладоней, стоп, видимых слизистых (бледные кожные покровы и слизистые могут являться симптомом анемии, плетора может свидетельствовать о повышенном уровне гемоглобина, гематокрита), кожи нижних конечностей (пигментация, трофические расстройства, отеки, геморрагии), пальпация печени и селезенки, оценка состояния легких, сердца, желудочно-кишечного тракта, почек являются обязательными для проведения.
2,4 Лабораторная диагностика.
• Рекомендуется проводить клинический анализ крови с дифференциальным подсчетом клеток крови, исследованием морфологии, определением СОЭ всем пациентам с подозрением и предварительным диагнозом Ph-негативное МПЗ с целью первичной диагностики основного заболевания, определения прогностических параметров, определения объема дополнительного обследования [13].Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется всем пациентам с подозрением и предварительным диагнозом Ph-негативное МПЗ проведение коагулограммы (протромбиновый индекс, МНО, фибриноген, АЧТВ, тромбиновое время, антитромбин III, протеин с, протеин S, D-димер, агрегация тромбоцитов, гомоцистеин) для оценки риска тромботических и геморрагических осложнений [13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. У пациентов с Ph-негативными МПЗ высокий риск как тромботических, так и геморрагических осложнений.
• Рекомендуется пациентам проведение молекулярно-генетического скрининга маркеров наследственной тромбофилии (F2 Thr165 met, F5(Лейден), F5 (Гонконг), F5 (Кембридж), FGB, PAI-1-серпин, ITGA-2-a2, ITGB3-b3, F7, F13A1, MTHFR, MTHFR, MTR, MTRR) в случае тромботических событий в анамнезе, отягощенном семейном анамнезе для оценки риска тромбогеморрагических осложнений [13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. У пациентов с Ph-негативными МПЗ высокий риск тромбогеморрагических осложнений. При наличии дополнительных факторов риска (генетическая тромбофилия / носительство полиморфизмов генов тромбофилии) необходим более частый мониторинг состояния свертывающей системы крови.
• Рекомендуется всем пациентам с подозрением и предварительным диагнозом Ph-негативное МПЗ биохимический анализ крови (общий белок, мочевина, креатинин, мочевая кислота, АСТ, АЛТ, ГГТ, ЩФ, холестерин, триглицериды, ЛДГ, СРБ) с целью верификации диагноза, диагностики сопутствующей патологии, оценки функции печени, почек, для необходимости консультации профильных специалистов, назначения сопроводительной терапии [12, 13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Уровень ЛДГ сыворотки крови является малым диагностическим критерием ПМФ. При повышенном уровне мочевой кислоты необходимо назначение препаратов, влияющих на обмен мочевой кислоты. При нарушении функции печени и почек необходимо назначение сопроводительной терапии. Гиперхолестеринемия является дополнительным фактором риска тромботических осложнений.
• Рекомендуется пациентам с МПЗ уровнем гемоглобина ниже референсных значений; пациентам с уровнем гемоглобина более 165 г/л у мужчин и 160 г/л у женщин, или гематокритом более 49 % у мужчин и более 48 % у женщин при отсутствии мутаций гена JAK2; пациентам с тромбоцитозом при отсутствии мутаций JAK2, MPL, сALR исследование обмена железа (ферритин, сывороточное железо) с диагностической целью [13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. При МПЗ, в частности ПМФ, анемия может носить смешанный генез (анемия хронических заболеваний и железодефицитная). Исследование обмена железа позволит определить ведущую причину анемического синдрома и назначить патогенетическую терапию. Дефицит железа является одной из ведущих причин вторичного тромбоцитоза. Наследственный гемохроматоз сопровождается повышением уровня железа сыворотки крови, повышением гемоглобина и гематокрита.
• Рекомендуется определение фолиевой кислоты, витамина В12 пациентам с гиперхромной макроцитарной анемией для выбора лечебной тактики в терапии анемического синдрома у пациентов с ПМФ и анемией [13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется исследовать уровень эритропоэтина (ЭПО) сыворотки крови у пациентов с уровнем гемоглобина более 165 г/л у мужчин и 160 г/л у женщин, или гематокритом более 49 % у мужчин и более 48 % у женщин для верификации диагноза [9, 13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Определение ЭПО сыворотки крови является малым диагностическим критерием при установлении диагноза ИП. Субнормальный ЭПО при отсутствии мутации JAK2V617F является основанием для исследования мутации гена JAK2 в 12 экзоне. Исследование уровня ЭПО сыворотки крови необходимо для дифференциальной диагностики в группе МПЗ.
• Рекомендуется исследование прямой пробы Кумбса, ретикулоцитов у пациентов с МПЗ с симптомами анемии (при отсутствии других причин анемии) для исключения гемолитической анемии [12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется молекулярно-генетическое исследование периферической крови (качественная ПЦР на наличие мутации V617F гена JAK2, на наличие мутации W515 L/K гена MPL, секвенирование по Сэнгеру на наличие мутаций в 9 экзоне гена сALR) всем пациентам с подозрением на Ph-негативное МПЗ для верификации диагноза [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Выявление мутации JAK2V617F с высокой степенью вероятности позволяет установить диагноз ИП у пациентов с соответствующей клинической картиной; выявление мутаций JAK2V617F, MPLW515L/K, в 9 экзоне гена сALR с высокой степенью вероятности позволяет установить диагноз ПМФ или ЭТ у пациентов с соответствующей клинической картиной. Молекулярно-генетическое исследование позволяет провести дифференциальную диагностику как в группе МПЗ, так и между МПЗ и вторичными эритроцитозом, тромбоцитозом, миелофиброзом. Однако в 10% случаев МПЗ не выявляются «драйверные» мутации.
• Рекомендуется молекулярно-генетическое исследование периферической крови (качественная ПЦР на наличие мутации в 12 экзоне гена JAK2) пациентам с уровнем гемоглобина более 165 г/л у мужчин и 160 г/л у женщин, или гематокритом более 49% у мужчин и более 48% у женщин при отсутствии мутации V617F гена JAK2 для верификации ИП [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Мутации 12 экзона гена JAK2V617F выявляются в 2-5% наблюдений при ИП.
• Рекомендуется всем пациентам с МПЗ и выявленной мутацией JAK2V617F определение аллельной нагрузки мутантного JAK2V617F для верификации диагноза [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется всем пациентам с подозрением на ХМЛ и в случае затруднений при проведении дифференциальной диагностики Ph-негативных МПЗ с ХМЛ ПЦР исследование (качественное) на ген вCR-ABL1 (транскрипты р210, р190, р230) для верификации диагноза [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется стандартное цитогенетическое исследование костного мозга у пациентов с нетипичной клинической, морфологической картиной заболевания, при отсутствии мутаций генов JAK2, сALR, MPL; всем кандидатам на алло - ТГСК с целью оценки цитогенетических факторов риска [8, 9, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Частота выявления хромосомных аберраций до 10% на момент постановки диагноза. Выявление хромосомных аберраций при стандартном цитогенетическом исследовании является неблагоприятным прогностическим критерием при определении степени риска в шкалах DIPSS+ и GPSS. Тактика ведения пациентов с МПЗ базируется на определении прогностической группы.
• Рекомендуется определить маркеры гепатита В (HBsAg), IgG-антитела к вирусу гепатита С, маркеры сифилиса, ВИЧ типов 1,2 всем пациентам перед проведением инвазивных процедур для определения сопутствующей патологии [8].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется исследование артериального рО2, рСО2 пациентам с уровнем гемоглобина более 165 г/л у мужчин и 160 г/л у женщин, или гематокритом более 49% у мужчин и более 48% у женщин при отсутствии мутаций генов JAK2, MPL, сALR с целью выявления дополнительных причин для эритроцитоза, повышения концентрации гемоглобина, повышения гематокрита [8, 11, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
2,5 Инструментальные методы обследования.
• Рекомендуется УЗИ органов брюшной полости с определением размеров печени, селезенки, УЗИ почек всем пациентам для определения сопутствующей патологии, оценки степени гепатомегалии и спленомегалии [8, 11, 12].Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется всем пациентам с предварительным диагнозом МПЗ стернальная пункция с подсчетом миелограммы, определением соотношения миелоидного и эритроидного ростков, количественной и качественной характеристики мегакариоцитов для исключения МПЗ [8, 11, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется всем пациентам с предварительным диагнозом МПЗ трепанобиопсия костного мозга с гистологической оценкой и гистохимическим исследованием для выявления ретикулиновых и коллагеновых волокон для установления диагноза, проведения дифференциальной диагностики в группе Ph-негативных МПЗ [9].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. При Ph-негативных МПЗ морфологическое исследование трепанобиоптата костного мозга является одним из больших диагностических критериев. Гистологическое исследование костного мозга на момент диагностики следует выполнять всем пациентам с пороговым уровнем гемоглобина и гематокрита, что позволяет исключить ЭТ и ПМФ. Следует отметить, что диагноз ИП возможен и при концентрации гемоглобина и гематокрите ниже диагностического порога. Это возможно у молодых пациентов при наличии дефицита железа (нормальный или даже сниженный гемоглобин при высоком уровне эритроцитов) и/или после острых кровотечений (снижение уровня гемоглобина, эритроцитов и гематокрита). Настороженность в отношении ИП должна быть по отношению к пациентам с состоявшимися абдоминальными тромбозами, особенно при наличии кожного зуда, эритромелалгии, спленомегалии, лейкоцитоза, тромбоцитоза и микроцитоза в периферической крови. Существует также специфическая форма ИП, которая представляет собой маскированную / латентную ИП. В таких случаях обнаруживают мутации гена JAK2 и снижение ЭПО, но значимого повышение концентрации гемоглобина не наблюдается. Клинические признаки МПЗ (ПМФ) неспецифичны - например, спленомегалия, анемия, могут быть обусловлены лимфомой селезенки с поражением костного мозга. Поэтому гистологическое исследование костного мозга введено в большие критерии диагностики ПМФ в классификации ВОЗ.
• Рекомендуется пациентам с МПЗ с цефалгическим синдромом для определения сопутствующей патологии проведение УЗИ-допплерографии церебральных артерий (сонных и позвоночных артерий) с целью определения риска тромбоза в системе церебральных артерий, риска ТИА и ОНМК [14].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется УЗИ. Допплерографии сосудов портальной системы пациентам с МПЗ при подозрении на тромбоз воротной вены, ветвей воротной вены, селезеночной вены, верхней брыжеечной вены [15].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 3).
Комментарии. Исследование позволяет выявить как прямые, так и косвенные признаки тромбоза сосудов портальной системы, своевременно поставить диагноз и определить лечебную тактику. Пациенты с подозрением на тромбоз вен нуждаются в более частом мониторинге показателей свертывающей системы крови, назначении терапии антикоагулянтами, более детальном обследовании.
• Рекомендуется КТ (компьютерная томография) или МРТ (магнитно-резонансная томография) брюшной полости с внутривенным контрастированием с определением объема селезенки, оценкой состояния сосудов брюшной полости пациентам с МПЗ при остром болевом синдроме в левом подреберье, при подозрении на инфаркт селезенки, при состоявшемся тромбозе в системе портальных вен (обнаруженном при ультразвуковом исследовании) [8, 11, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Острые хирургические патологии брюшной полости крайне опасны и требуют срочного хирургического вмешательства. Тромбоз сосудов портальной системы различают полный и частичный, а также острую и хроническую форму. Острая форма может проявляться ишемией и инфарктом кишечника вследствие распространения тромба на мезентериальные сосуды. Хроническая форма чаще бессимптомная в силу включения компенсаторных механизмов, таких как дилатация печеночной артерии и развитие сети коллатералей. Проявлениями хронического тромбоза могут быть кровотечения из желудочно-кишечного тракта как следствие портальной гипертензии и билиопатия. Антикоагулянтная терапия считается терапией выбора при остром тромбозе. При хроническом тромбозе рекомендованы мониторинг и профилактика кровотечения из варикозно-расширенных вен пищевода, при необходимости медикаментозный тромболизис. Необходимо рассмотреть вопрос о хирургическом лечении (спленэктомия, портокавальное шунтирование).
• Рекомендуется всем пациентам с портальной гипертензией проведение эзофагогастродуоденоскопии (ЭГДС) с оценкой вен пищевода вследствие массивной спленомегалии и/или тромбоза в системе портальных сосудов для исключения наличия варикозного расширения вен, как проявления портальной гипертензии [8, 11, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. У данной категории пациентов высокий риск кровотечений из варикозно-расширенных вен пищевода и желудка.
• Рекомендуется оценка кардиопульмонального статуса (ЭКГ, ЭхоКГ) пациентам с сопутствующими заболеваниями сердечно - сосудистой системы для оценки риска тромботических осложнений и смерти от сердечно-сосудистых осложнений для выявления противопоказаний к лечению цитостатическими препаратами [8, 11, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Основными причинами, существенно снижающими качество жизни и угрожающими жизни пациентов с Ph-негативными МПЗ, помимо опухолевой природы являются тромбогеморрагические осложнения. Выявление факторов риска развития сердечно-сосудистой патологии у пациентов с МПЗ позволяет своевременно выделить группу пациентов, требующих активного наблюдения и проведения профилактической гемокорректирующей терапии в сочетании со специфическими циторедуктивными препаратами.
2,5 Консультации специалистов.
• Рекомендуются пациентам дополнительные консультации специалистов (невролога, кардиолога, хирурга, сосудистого хирурга, гастроэнтеролога, гемостазиолога) при наличии жалоб неврологического характера, в случае развития осложнений (тромбоз воротной вены, ветвей воротной вены, селезеночной вены, верхней брыжеечной вены) для диагностики и лечения сопутствующей патологии [16].Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
2,6 Диагностическая информация, влияющая прогноз течения заболевания, выбор терапии.
Системы стратификации риска при ИП.
• Рекомендуется применять стратификацию риска у пациентов с ИП для оценки вероятности тромботических осложнений, привносящих наибольший вклад в структуру смертности и инвалидизации, обусловленную заболеванием [17-19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств -2+).
Комментарии. По результатам когортных исследований наиболее устойчивыми факторами риска для тромботических осложнений при ИП являются возраст старше 60 лет и наличие тромбозов в анамнезе. При этом целесообразно также учитывать общие факторы риска для сердечно-сосудистых, тромботических и геморрагических осложнений (Приложение Г1, табл. 1).
Системы стратификации риска при ЭТ.
• Рекомендуется применять стратификацию риска у пациентов с ЭТ предназначенную для оценки вероятности артериального тромбоза, обусловливающего инвалидизацию и ограничивающих продолжительность жизни пациентов [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 2+).
Комментарии. На основании международных многоцентровых исследований экспертами ВОЗ была разработана международная прогностическая шкала риска развития артериального тромбоза при ЭТ - The International Prognostic Score for ET (IPSET-thrombosis) (Приложение Г1, табл.2).
Системы стратификации риска при ПМФ.
Для определения тактики терапии ПМФ необходима точная оценка индивидуального прогноза пациента.
• Рекомендуется применять стратификацию риска у пациентов с ПМФ для определения индивидуального прогноза пациента.
Уровень убедительности рекомендаций С (уровень достоверности доказательств -2+).
Комментарии. В 2009 г. F. Cervantes et al. предложили Международную шкалу оценки прогноза (International Prognostic Scoring System, IPSS). Данная шкала служит для определения прогноза на момент постановки диагноза. Были выявлены следующие факторы, достоверно влияющие на выживаемость пациентов: возраст, уровень гемоглобина, процент бластов в периферической крови и наличие симптомов опухолевой интоксикации. В созданной прогностической системе используется балльная оценка, где каждому из признаков присваивается по одному баллу (Приложение Г1, табл. 3). Разделенные по количеству прогностических баллов группы пациентов статистически значимо различаются по длительности общей выживаемости [21].
В 2010 г. F. Passamonti et al. система IPSS была модифицирована с помощью присвоения фактору уровня гемоглобина менее 100 г/л двух баллов вместо одного. Также была изменена классификация по группам риска соответственно баллам (Приложение Г1, табл. 4). Новая система Dynamic IPSS (DIPSS) способна предсказывать риск трансформации в любой момент подсчета, а не только при установлении диагноза [22].
Последующий анализ многоцентровых данных показал, что независимым прогностическим фактором являются тромбоцитопения (тромбоциты <100х109/л) и цитогенетические аномалии (изолированные нарушения +8, 7/7q, i(17q), inv(3), 5/5q, 12p или перестройка 11q23). С учетом этих данных N. Gangat et al. система стратификации была дополнена и апробирована на 793 пациентах (Приложение Г1, табл. 5) [23]. Новая система стратификации, получившая наименование DIPSS+ позволила прогнозировать не только общую выживаемость, но и время до развития бластной трансформации.
В связи с накоплением данных о прогностической роли молекулярно-генетических нарушений для выживаемости пациентов с ПМФ, в 2014г. была разработана «Мутационная международная прогностическая шкала» (MIPSS) [24]. Данная шкала обладает лучшей способностью по сравнению с предыдущими шкалами определять общую и беспрогрессивную выживаемость при ПМФ (Приложение Г1, табл. 6,7).
Данная шкала обладает самой высокой степенью предсказательности, проста в подсчете. Обследование пациента для определения риска по шкале MIPSS не требует инвазивных процедур - достаточно сбора анамнеза и взятия проб крови, при этом следует отметить что пробы крови для молекулярно-генетического исследования могут быть заморожены и сохранены в течение длительного времени, что облегчает их доставку для анализа.
Комплексная оценка результатов клинических параметров, цитогенетических и молекулярно-генетических характеристик для прогноза течения ПМФ получила развитие в «Генетической прогностической системе» GPSS, предложенной A. Tefferi et al (Приложение Г1, табл. 8) [25].
|
|
Лечение
3,1 Лечение истинной полицитемии.
Цели терапии ИП. Предотвращение и лечение тромбогеморрагических осложнений; контроль симптомов опухолевой интоксикации (снижение веса, потливость, лихорадка, зуд); сведение к минимуму риска развития вторичного ОМЛ и пост-ИП МФ; предупреждение осложнений в случае беременности, хирургических операций.• Рекомендуется проведение кровопусканий (гемоэксфузий, флеботомий)/ эритроцитафереза ЭЦФ для поддержания гематокрита в пределах 40-45% для всех пациентов с ИП [26-28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Кровопускание может производиться методом венепункции или венесекции, разрезом вены. Проводят в условиях процедурного кабинета. Противопоказания: шок, коллапс и другие состояния, сопровождающиеся падением артериального давления, анемия, истощение и резко выраженный склероз мозговых сосудов, особенно у пожилых людей. Объем гемоэксфузии зависит от общего состояния пациентов и в среднем составляет 250-500 мл с последующим восполнением объема циркулирующей крови 0,9% раствором натрия хлорида. Либо предварительно проводят в/в капельную инфузию объема жидкости, превышающего планируемый объем кровопускания, и затем осуществляют гемоэксфузию. С целью уменьшения риска тромбозов на фоне гемоэксфузии также можно вводить внутривенно 5000 Ед гепарина натрия. Кровопускания проводятся через день, пожилым пациентам с сопутствующей сердечно-сосудистой и легочной патологией - дважды в неделю (либо уменьшается объем крови, удаляемой во время процедуры). Основной целью лечения является поддержание гематокрита на уровне 40-45%. При принятии решения о сеансах кровопусканий уровень гемоглобина не учитывается. Альтернативой кровопусканиям является проведение аппаратного ЭЦФ.
• Рекомендуется для всех пациентов с ИП прием препаратов ацетилсалициловой кислоты** (40-100 мг/сут), при непереносимости или противопоказаниях - клопидогрел** (75 мг/сут) с целью профилактики тромботических осложнений [26-28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии: Противопоказаниями к назначению ацетилсалициловой кислоты являются эрозивно-язвенные поражения ЖКТ в фазе обострения, желудочно-кишечное кровотечение, аспириновая триада , наличие в анамнезе указаний на крапивницу, ринит, вызванные приемом ацетилсалициловой кислоты** и других НПВС, гемофилия, геморрагический диатез, гипопротромбинемия, расслаивающая аневризма аорты, портальная гипертензия, дефицит витамина печеночная и/или почечная недостаточность, дефицит глюкозо-6-фосфатдегидрогеназы, синдром Рейе, детский возраст (до 15 лет - риск развития синдрома Рейе у детей с гипертермией на фоне вирусных заболеваний), I и III триместры беременности, период лактации, повышенная чувствительность к ацетилсалициловой кислоте** и другим салицилатам. Относительное противопоказание - тромбоцитоз >1500х109/л по причине повышенного риска кровотечений. В настоящее время выделяют клиническую и биохимическую аспиринорезистентность. Под клинической резистентностью понимают неспособность препарата предотвратить тромботический эпизод у конкретного пациента. Биохимическую резистентность определяют, как недостаточное подавление функции тромбоцитов на фоне приема препаратов ацетилсалициловой кислоты**, установленное по результатам различных лабораторных тестов. В зависимости от причин, приведших к аспиринорезистентности, выделяют истинную и ложную резистентность. К возможным причинам псевдорезистентности относят низкую приверженность пациентов к приему препарата, лекарственные взаимодействия, неадекватные дозы препарата, снижение биодоступности, нарушение регуляции альтернативных (не тромбоцитарных) путей продукции тромбоксана, ускоренное обновление тромбоцитов. Истинная устойчивость к ацетилсалициловой кислоте** может быть обусловлена полиморфизмом генов циклооксигеназы, гликопротеинов GPIIb/llla, GPIba, GPVI, рецепторов P2Y1, P2Y12 к аденозиндифосфату. Одной из самых изучаемых причин ложной резистентности к ацетилсалициловой кислоте** является недостаточная концентрация препарата в крови, связанная со снижением биодоступности кишечнорастворимых лекарственных форм. Важно помнить, что при использовании низких (75-150 мг/сут) доз кишечнорастворимых форм биодоступность ниже, поэтому указанные дозы могут быть недостаточными для ряда пациентов.
• Рекомендуется купирование модифицируемых сердечно-сосудистых факторов риска для всех пациентов с ИП с целью снижения риска тромботических осложнений [26, 27].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии: отказ от курения, нормализация уровня артериального давления, коррекция гиперхолестеринемии, гипергликемии, нормализация веса, адекватное лечение сердечно-сосудистых заболеваний снижает риск тромботических осложнений.
• Рекомендуется назначение аллопуринола** в дозе 100-300 мг/сутки пациентам с ИП при гиперурикемии [28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Показанием к поведению терапии аллопуринолом** является повышенный уровень мочевой кислоты, в том числе при отсутствии клинической симптоматики. Назначение препарата проводится под контролем уровня мочевой кислоты в крови.
• Рекомендуется для пациентов с ИП для устранения кожного зуда (как конституционального симптома МПЗ) лечение Н1 или Н2-антагонистами гистамина, антидепрессантами, при неэффективности симптоматической терапии - миелосупрессивными препаратами [23, 24, 25].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Патогенетического средства для лечения кожного зуда (как конституционального симптома МПЗ) не существует. Симптоматическая терапия включает: Н1 антагонисты гистамина (лоратадин по 10 мг 1 раз в день, перорально, дезлоратадин по 5 мг 1 раз в день, перорально, фенспирид по 80 мг 2-3 раза в сутки, максимальная суточная доза составляет 240 мг, цетиризин по 10 мг 1 раз в день, перорально), антидепрессанты: пароксетин** по 20 мг 1 раз в сутки, перорально. В связи с тем, что кожный зуд является проявлением МПЗ, при неэффективности симптоматической терапии проводится лечение цитостатическими препаратами: препараты ИНФα** по 3 млн МЕ через день, подкожно; руксолитиниб** (с индивидуальным подбором дозировки препарата в зависимости от числа тромбоцитов).
• Рекомендуется циторедуктивная терапия гидроксикарбамидом** для пациентов с ИП группы низкого риска развития тромбогеморрагических осложнений в случаях плохой переносимости кровопусканий / ЭЦФ, частых кровопусканиях (при необходимости проведения гемоэксфузий чаще, чем 1 раз в 3 месяца), симптоматической или прогрессирующей спленомегалии (исключая синдром Бадда - Киари), признаках прогрессирования болезни (потеря веса, потливость, нарастание лейкоцитоза и/или тромбоцитоза) [28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Гидроксикарбамид** в дозировке 500 - 2000 мг (в зависимости от показателей общего анализа крови и переносимости препарата) может быть рекомендован как терапия первой линии у пациентов с ИП любого возраста.
Из-за наличия данных о возможном лейкозогенном эффекте, генотоксичности препарата, у молодых пациентов, а также у беременных в первой линии терапии предпочтительно назначение ИФНα** в дозировке 3 млн МЕ через день. Препараты ИФНα** являются эффективным средством терапии ИП у части пациентов может быть получен молекулярный ответ. Однако широкое применение ИФНα** ограничивается плохой переносимостью.
• Рекомендуется терапия руксолитинибом** для лечения пациентов ИП, в случае резистентности к терапии или непереносимости гидроксикарбамида** [26, 27].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Рекомендуемая начальная доза препарата составляет 10 мг 2 раза в день. При снижении концентрации гемоглобина <120 г/л следует рассмотреть возможность снижения дозы препарата. При снижении концентрации гемоглобина <100 г/л рекомендовано снижение дозы. При снижении концентрации гемоглобина <80 г/л лечение руксолитинибом** должно быть приостановлено. Лечение препаратом продолжают до тех пор, пока сохраняется терапевтический эффект.
• Рекомендуется терапия бусульфаном** пациентам с ИП старше 70 лет, в случае неэффективности или непереносимости терапии первой линии (гидроксикарбамид**, ИФНα**) с целью лечения ИП [26, 27].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Бусульфан** является цитостатическим препаратом алкилирующего действия, применение которого позволяет эффективно контролировать заболевание. Однако, длительный прием бусульфана** повышает риск прогрессирования заболевания с исходом во вторичный ОМЛ. Препарат назначают по 2-4 мг ежедневно до кумулятивной дозы 200 мг.
• Рекомендуется для пациентов группы промежуточного и высокого риска развития тромбогеморрагических осложнений (Приложение Г1, табл.1) - проведение циторедуктивной терапии во всех случаях [17, 26, 27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 2+).
Комментарии. Выбор препарата определяется возрастом пациента (Приложение Г2, табл. 9).
Критерии оценки эффективности и переносимости лечения ИП.
• Рекомендуется проведение оценки эффективности и переносимости проводимой терапии на основании критериев Европейской организацией по изучению и лечению лейкозов (ELN) для всех пациентов с ИП, получающих терапию [29].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Данные критерии рекомендованы для использования в рамках клинических исследований, но представляется целесообразным их применение в клинической практике. Разработаны критерии гематологического, молекулярно-генетического и морфологического ответов, но их использование рекомендовано в рамках клинических исследований для унифицирования интерпретации полученных результатов (Приложении Г3, таблица 10).
• Рекомендуется проводить оценку молекулярного ответа у пациентов с ИП, получающих терапию при наличии возможности молекулярного мониторинга [29].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Тактика ведения пациентов в настоящее время зависит только от клинико-гематологического ответа на терапию. У части пациентов может быть достигнут и молекулярный ответ (Приложение Г3, табл. 11).
• Рекомендуется проводить исследование костномозгового кроветворения всем пациентам с ИП при появлении признаков прогрессии заболевания [29].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. В настоящее время нет однозначных рекомендаций по контролю эффективности лечения на основании исследования костномозгового кроветворения. В рамках клинических исследований гистологическое исследование трепанобиоптата костного мозга проводится 1 раз в год для оценки изменения степени фиброза, признаков патоморфоза/дисплазии различных ростков миелопоэза. В рутинной клинической практике трепанобиопсию следует выполнять при появлении признаков прогрессии заболевания (появление анемии, тромбоцитопении, лейкопении, не связанных с проводимой циторедуктивной терапией, лейкоцитоза, бластов в периферической крови, спленомегалии).
• Рекомендуется проводить оценку эффективности терапии ИНФα и руксолитинибом** у всех пациентов ИП [29].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Критерии резистентности ИНФα и руксолитиниба** - недостижение полного гематологического ответа на максимально переносимой дозе препарата к 6 месяцам лечения.
• Рекомендуется у всех пациентов проведение оценки резистентности / непереносимости гидроксикарбамида** на основании критериев резистентности/непереносимости гидроксикарбамида** с ИП ELN 2009 [29].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии:
1 Необходимость кровопусканий для поддержания гематокрита <45% после 3 месяцев терапии гидроксикарбамидом** ≥2000 мг/день ИЛИ.
2 Неконтролируемая миелопролиферация (тромбоциты >400 х109/л и лейкоциты >10 х 109/л) после 3 месяцев терапии гидроксикарбамидом** ≥2000 мг/день ИЛИ.
3 Невозможность редуцировать массивную спленомегалию (более 10 см ниже реберной дуги при пальпации) на 50% от исходного размера ИЛИ.
4. Невозможность облегчить симптомы, вызванные массивной спленомегалией после 3 месяцев терапии гидроксикарбамидом** ≥2000 мг/день ИЛИ.
5. АЧН <1,0 х109/л или тромбоциты <100 х109/л или гемоглобин <10 х109/л при минимальной дозе гидроксикарбамида**, необходимой для достижения полного или частичного ответа ИЛИ.
6. Язвы на голенях или другая токсичность, опосредованная гидроксикарбамидом** (изменения со стороны кожи и слизистых, гастроинтестинальные симптомы, пневмонит, лихорадка) при любой дозе гидроксикарбамида** [30].
• Рекомендуется переход на другую линию терапии в случае неэффективности или непереносимости проводимой терапии [26-28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Вопрос о смене терапии решается индивидуально. В случае удовлетворительной переносимости и отсутствие побочных эффектов первой линии терапии возможна эскалация дозировки препарата.
• Рекомендуется возмещение дефицита железа всем пациентам с ИП у которых лабораторными методами подтвержден дефицит железа [26-28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. В случае дефицита железа, вызванного кровопусканием / ЭЦФ или анемии, развившейся вследствие кровотечений, в исключительных случаях может рассматриваться необходимость терапии препаратами железа. Данную терапию следует проводить при постоянном тщательном мониторинге показателей крови.
3,2 Лечение эссенциальной тромбоцитемии.
Для выбора метода терапии пациентов с ЭТ определяется цель терапии [27,28]:1) предупредить возникновение тромботических или геморрагических осложнений;
2) минимизировать риск прогрессирования заболевания с исходом в пост-ЭТ МФ или ОМЛ;
3) контроль симптомов интоксикации;
4) предупреждение осложнений в случае беременности, хирургических манипуляций.
Целевой уровень тромбоцитов у пациентов, получающих терапию должен соответствовать нижней границе нормы - 450 х 109/л [27, 28].
Основными методами терапии ЭТ являются: профилактика тромботических осложнений; циторедуктивная терапия; лечение осложнений заболевания (тромбозы, тромбоэмболии) [27, 28].
• Рекомендуется профилактика сердечно-сосудистых заболеваний для всех пациентов с ЭТ с целью устранения факторов риска тромбозов [27, 28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Профилактика заключается в регулярном наблюдении кардиолога, проведении антигипертензивной терапии (в случае артериальной гипертонии), терапии статинами (в случае гиперхолестеринемии).
• Рекомендуется прием антиагрегантов (препараты ацетилсалициловой кислоты** (40-100 мг/сут), при резистентности и/или непереносимости ацетилсалициловой кислоты** показано назначение других дезагрегантов - клопидогрел** (75 мг/сут) для всех пациентов с ЭТ для снижения риска тромботических осложнений [28, 31].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2+).
Комментарии: В ретроспективном исследовании с включением пациентов с ЭТ с сердечно-сосудистыми факторами риска использование препаратов ацетилсалициловой кислоты** явилось эффективным методом профилактики венозных и артериальных тромбозов. Низкие дозы ацетилсалициловой кислоты** показали эффективность для профилактики развития микроциркуляторных нарушений (головная боль, головокружение, преходящие неврологические нарушения шум в ушах, атипичные боли за грудиной, парестезии, эритромелалгия). Назначение препаратов ацетилсалициловой кислоты** совместно с анагрелидом требует осторожности из-за повышенного риска кровотечений и не может быть рекомендовано пациентам с кровотечениями в анамнезе.
• Рекомендуется пациентам с ЭТ проведение плановых хирургических вмешательств и лечения у стоматолога после нормализации числа тромбоцитов с целью снижения риска тромбогеморрагических осложнений [32].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Отмена проводимой терапии антиагрегантами должна проходить заблаговременно (в соответствии с фармакокинетикой применяемого препарата) перед оперативными вмешательствами и продолжена после.
• Рекомендуется наблюдение для пациентов с ЭТ группы низкого риска тромботических осложнений (Приложение Г1, табл 1) [27, 28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Циторедуктивная терапия направлена в первую очередь на купирование риска тромботических осложнений. У данной группы пациентов циторедуктивная терапия не показана в связи с низким риском тромботических осложнений.
• Рекомендуется проведение циторедуктивной терапии для пациентов с ЭТ группы низкого риска (Приложение Г1, таблица 1) в случаях тромбоцитоза более 1500х109/л из-за риска кровотечений; перед плановыми хирургическими вмешательствами; при прогрессировании болезни (увеличение числа тромбоцитов более чем на 300х109/л за 3 месяца; появлении спленомегалии; появлении конституциональных симптомов); осложнениях (тромбоз или кровотечение) [33].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Терапевтический эффект гидроксикарбамида** заключается в снижении тромбоцитоза, профилактике тромботических осложнений. Определенные опасения вызывает возможный лейкозогенный эффект при длительном применении, в связи с чем гидроксикарбамид** в первой линии молодым пациентам (моложе 44 лет) с ожидаемой длительной продолжительностью жизни следует назначать с осторожностью. Гидроксикарбамид** рекомендуется как препарат выбора в качестве терапии первой линии у пациентов с ЭТ с промежуточным риском развития тромбозов в возрасте better 60 лет и у пациентов с ЭТ с высоким риском развития тромбозов в возрасте better 40 лет. Вторая линия терапии у других категорий пациентов с промежуточным и высоким риском развития тромбозов. Гидроксикарбамид** не следует использовать при беременности или при планировании беременности. Дозировка гидроксикарбамида** подбирается индивидуально.
Препараты ИФНα** рекомендуется как препарат выбора в качестве терапии первой линии у пациентов с ЭТ с промежуточным риском развития тромбозов в возрасте <60 лет и у пациентов с ЭТ с высоким риском развития тромбозов в возрасте <40 лет. ИФНα** является предпочтительным препаратом первой линии у молодых пациентов (моложе 44 лет). Его можно применять и у пациентов старше 60 лет при резистентности и/или непереносимости гидроксикарбамидом** в качестве терапии второй линии. Терапия ИНФa** проводится в дозировке 3 млн МЕ через день, подкожно.
Анагрелид ингибирует функцию тромбоцитов, подавляя фосфодиэстеразу типа 3 с последующим увеличением уровня цАМФ, реорганизацией цитоскелета, активацией фибриногена. Анагрелид обладает способностью влиять на функции тромбоцитов (антиагрегантный эффект), но уже при низких дозах вызывает падение уровня тромбоцитов. Препарат следует назначать только после кардиологического обследования. У пациентов с ишемической болезнью сердца лечение начинают только после оценки пользы и потенциального риска. Препарат не следует принимать вместе с кофе. Рекомендуемая начальная доза анагрелида 1 мг или 0,5 мг 2 раза в сутки, которую увеличивают каждые 5-7 дней на 0,5 мг до тех пор, пока количество тромбоцитов не снизится. Средняя суточная доза составляет 2 мг. Следует использовать минимальную эффективную дозу, которая будет достаточной для поддержания количества тромбоцитов на уровне ниже 600х109/л, а в идеале - до нормального уровня. Большинство побочных эффектов являются дозозависимыми, слабо выражены и преходящи и не требуют проведения лечебных мероприятий для их устранения. Наиболее частыми нежелательными явлениями являются головные боли, тахикардия, задержка жидкости, сердечная недостаточность, аритмии. Частота и выраженность побочных реакций снижается при продолжении терапии. Показаниями к назначению анагрелида являются: терапия первой линии у пациентов с ЭТ с промежуточным риском развития тромбозов в возрасте <60 лет и у пациентов с ЭТ с высоким риском развития тромбозов в возрасте <40 лет. Вторая линия терапии у других категорий пациентов с промежуточным и высоким риском развития тромбозов. У пациентов с МПЗ с наличием сердечно - сосудистых заболеваний терапия анагрелидом сопряжена с риском развития нежелательных явлений, так как препарат обладает положительным инотропным эффектом. Поэтому препаратом выбора у данной категории пациентов является гидроксикарбамид** или ИНФa**.
• Рекомендуется тактика ведения пациентов c ЭТ группы промежуточного риска (Приложение Г1, таблица 1) возраст <60 лет: 1-ая линия - наблюдение, ИФНα** и/или анагрелид; 2-ая линия гидроксикарбамид** и/или анагрелид [17, 20];
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 2+).
• Рекомендуется тактика ведения пациентов группы промежуточного риска возраст >60 лет: 1-ая линия - гидроксикарбамид**, 2-ая линия - анагрелид и/или ИФНα** с индивидуальным подбором дозировки препарата в зависимости от показателей общего анализа крови [33].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется для пациентов группы высокого риска (Приложение Г1, таблица 1) возраст <40 лет терапия: 1-ая линия - ИФНα**и/или анагрелид; 2-ая линия - гидроксикарбамид** с индивидуальным подбором дозировки препарата в зависимости от показателей общего анализа крови [33].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется для пациентов группы высокого риска (Приложение Г1, таблица 1) возраст >40 лет терапия: 1-ая линия - гидроксикарбамид**, 2-ая линия - анагрелид и/или ИФНα** [33].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
• Рекомендуется сочетанная терапия (гидроксикарбамид** + анагрелид, гидроксикарбамид**+ ИФНα**) с индивидуальным подбором дозировки препарата в зависимости от показателей общего анализа крови в качестве терапии второй линии у пациентов, если при монотерапии развиваются побочные эффекты, не позволяющие прием дозы препарата, адекватной для контроля уровня тромбоцитов [28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Критерии оценки эффективности и переносимости лечения ЭТ.
• Рекомендуется проводить оценку клинико-гематологического ответа всем пациентам с ЭТ, получающим терапию [29].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Критерии клинико-гематологического ответа при лечении ЭТ представлены в приложении Г2, таблице 12.
• Рекомендуется проводить оценку молекулярного ответа у пациентов с ЭТ, получающих терапию при наличии возможности молекулярного мониторинга [29].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Тактика ведения пациентов в настоящее время зависит только от клинико-гематологического ответа на терапию. У части пациентов может быть достигнут и молекулярный ответ (приложение Г2, табл. 11). Однако прогностическая значимость молекулярных ответов неизвестна.
• Рекомендуется проводить исследование костномозгового кроветворения пациентам с ЭТ в случае решения вопроса о необходимости смены проводимой терапии, при оценке трансформации в пост-ЭТ МФ [29].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. В рамках клинических исследований гистологическое исследование трепанобиоптата костного мозга проводится 1 раз в год для оценки изменения степени фиброза, признаков патоморфоза/дисплазии различных ростков миелопоэза. В рутинной клинической практике трепанобиопсию следует выполнять при появлении признаков прогрессирования заболевания.
• Рекомендуется проведение оценки резистентности/непереносимости гидроксикарбамида** у пациентов с ЭТ в соответствии с критериями ELN в 2009 г. с целью своевременной смены терапии [29].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии:
1 Тромбоциты >600 х109/л, после 3 месяцев терапии гидроксикарбамидом** ≥2000 мг/день (2500 мг/день у пациентов более 80 кг) ИЛИ.
2 Тромбоциты >400х109/л, лейкоциты <2,5х109/л, при любой дозе гидроксикарбамида** ИЛИ.
3 Тромбоциты >400х109/л, гемоглобин <100 г/л, при любой дозе гидроксикарбамида** ИЛИ.
4 Язвы на голенях или другая токсичность, опосредованная гидроксикарбамидом** при любой дозе препарата.
5 Лихорадка, вызванная приемом гидроксикарбамида**.
3,3 Лечение первичного миелофиброза, постполицитемического, посттромбоцитемического миелофиброза.
Для выбора метода терапии пациентов с ПМФ определяется цель терапии [28, 34]:
1) контроль болезни: предупреждение прогрессии, увеличение общей выживаемости;
2) облегчение симптоматики: улучшение качества жизни (лечение анемии и другой цитопении, уменьшение спленомегалии, контроль симптомов интоксикации);
3) предупреждение осложнений в случае беременности, хирургических операций.
• Рекомендуется проводить выбор метода лечения с учетом отнесения пациента в группу риска в соответствии с прогностическими шкалами (IPSS, DIPSS, DIPSS+, MIPSS, GPSS) (Приложение Г1); коморбидности; наличия совместимых по системе HLA доноров и возможности выполнения алло-ТГСК [34, 35].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Низкий и промежуточный-1 риск. Как правило, это пациенты с нормальным или незначительно сниженным уровнем гемоглобина, умеренным лейкоцитозом без бластемии, с умеренным фиброзом костного мозга. Применение агрессивных методов лечения у таких пациентов сопряжено с большим риском побочных эффектов, чем риски прогрессирования заболевания. При отсутствии симптомов интоксикации и осложнений часто оправдано только динамическое наблюдение. При выборе тактики лечения пациентов моложе 60 лет без выраженной сопутствующей патологии в течение одного-двух лет от дебюта заболевания должна быть обсуждена возможность проведения алло-ТГСК. Терапию следует начинать при появлении симптомов, ограничивающих жизнедеятельность пациента: коррекция анемии эритропоэзстимулирующими препаратами, андрогенами; купирование симптомов опухолевой интоксикации глюкокортикостероидами. Быстро прогрессирующая симптоматическая спленомегалия (с угрозой разрыва), наличие конституциональных симптомов, неэффективность проводимой симптоматической терапии являются показаниями для проведения циторедуктивной терапии. В качестве патогенетических средств могут быть рекомендованы ингибиторы JAK2.
У пациентов низкой группы риска ингибиторы JAK2 показаны в случае прогрессирующей и/или симптомной спленомегалии без эффекта от терапии гидроксикарбамидом** и/или препаратами ИНФα**.
У пациентов промежуточной-1 группы риска ингибиторы JAK2 рекомендованы при наличии симптомов опухолевой интоксикации или прогрессирующей спленомегалии в качестве второй и последующей линия терапии, при резистентности или неэффективности стандартной циторедуктивной терапии (гидроксикарбамид**, ИНФα**) в течение 3-6 месяцев.
Промежуточный-2 и высокий риск. Как правило, это пациенты с клинически значимой анемией, высоким лейкоцитозом со сдвигом до бластов, иногда с тромбоцитопенией, выраженным фиброзом костного мозга, нередко со специфическими для ПМФ поломками кариотипа. У данной категории пациентов в ближайшие годы может произойти бластная трансформация. При выборе тактики лечения пациентов моложе 60 лет без выраженной сопутствующей патологии должна быть обсуждена возможность проведения алло-ТГСК. При невозможности проведения алло-ТГСК назначается циторедуктивная и симптоматическая терапия. Преимущественно используется лекарственная терапия с выбором препаратов в соответствии с клиническими проявлениям заболевания как с целью улучшения качества жизни, так и увеличения ее продолжительности. Назначение ингибиторов JAK2 показано в первой линии терапии при наличии симптоматической спленомегалии и/или конституциональных симптомов в сочетании с значительной спленомегалией. Для пациентов этих групп риска нет других альтернативных лекарственных средств для быстрого сокращения размеров селезенки и улучшения качества жизни.
• Рекомендуется проведение алло-ТГСК пациентам с ПМФ с промежуточным-2 или высоким риском по DIPSS (Приложение Г1, таблицы 3, 4) и DIPSS+ (Приложение Г1, таблица 5), без серьезных сопутствующих заболеваний, с удовлетворительным cоматическим статусом (в постели пациент проводит меньше времени, может осуществлять весь уход за собой, но не может выполнять никакой рабочей деятельности, не требуется лечение в условиях стационара), при наличии HLA-идентичного родственного или неродственного донора [36].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Пациенты с низким и промежуточным-1 риском также являются потенциальными кандидатами для алло-ТГСК и должны при появлении первых признаков прогрессии заболевания направляться для решения вопроса о возможности проведения алло-ТГСК. Пациенты в фазе трансформации в ОМЛ также могут быть кандидатами для алло-ТГСК после проведения индукционной терапии по программе острых лейкозов.
• Рекомендуется проведение циторедуктивной терапии, терапии ингибиторами JAK2, а также возможно проведение спленэктомии перед проведением алло-ТГСК у пациентов со значительной спленомегалией с целью улучшения общей и бессобытийной выживаемости [36,37].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 2+).
Комментарии. Влияние спленэктомии на исход алло-ТГСК в настоящий момент не вполне ясно и требует дополнительного изучения. Руксолитиниб** может рассматриваться как препарат выбора для пациентов, которые нуждаются в быстром сокращении размеров селезенки и/или купировании симптомов опухолевой интоксикации перед алло-ТГСК.
• Рекомендуется назначение цитостатической терапии пациентам с ПМФ группы промежуточного - 2 и высокого риска с целью сдерживания пролиферации опухолевого клона, контроля показателей крови, профилактики осложнений [34, 35].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Предпочтительным является прием в подобранных с учетом индивидуальной переносимости дозах, позволяющих контролировать показатели крови. Препараты применяются, как правило, в качестве монохимиотерапии в низких дозах (Гидроксикарбамид** 10-30 мг/кг/сут; Меркаптопурин** 1-2 мг/кг/сут; Цитарабин** 10-20 мг/м2/сут 10-14 дней каждый месяц; Бусульфан** 0,5-4 мг/сут до суммарной дозы 200 мг.
• Рекомендуется лечение препаратами ИНФα** (рекомбинантного или пегилированного) как терапии первой линии у пациентов моложе 60 лет в случае, если заболевание протекает без массивной спленомегалии [38].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 2+).
Комментарии. Эффективность препарата при значительной спленомегалии низкая. При БК эффективность терапии ИНФα** не доказана. Оптимальная доза ИНФα** не установлена, с учетом частых побочных эффектов и необходимости постоянной терапии лечение проводится в максимально переносимых дозах, обеспечивающих контроль показателей крови. Дозировка и режим введения также выбирается индивидуально с учетом переносимости: 1,5-3млн МЕ подкожно, через день, длительно.
• Рекомендуется применение эритропоэзстимулирующих агентов (дарбэпоэтин-альфа**, эпоэтин-альфа**, эпоэтин-бета**) с целью стимуляции эритропоэза для купирования анемии и уменьшения потребности в гемотрансфузиях [39].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Более эффективно применение эритропоэзстимулирующих агентов при уровне эритропоэтина менее 125 МЕ/л, отсутствии трансфузионной зависимости и выраженной спленомегалии. Начальной дозой является 10 000 единиц три раза в неделю, доза удваивается до 20000 единиц через 1 месяц в случаях, когда ранний ответ не наблюдается. При недостаточном ответе доза может быть повышена в два раза. При отсутствии ответа лечение следует прекратить через 3-4 месяца. Вместе с тем, с учетом патогенеза заболевания общая эффективность введения эритропоэтинов составляет около 56% и длится в среднем около года.
• Рекомендуется терапия даназолом пациентам с ПМФ с трансфузионно-зависимой анемией, при наличии симптомов опухолевой интоксикации [40].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 2+).
Комментарии. Пациентам с массой тела менее 80 кг назначается даназол по 600 мг ежедневно, для пациентов с массой тела более 80 кг доза препарата составляет 800 мг. Оценка эффекта проводится после 6 месяцев терапии. При достижении ответа прием даназола должен быть продолжен в дозе 400 мг в день в течение 6 месяцев с дальнейшим снижением дозы до минимальной, необходимой для поддержания ответа, но не менее 200 мг в день. Всем пациентам, получающим даназол, биохимический анализ крови должен выполняться не реже раза в месяц, УЗИ печени каждые 6 - 12 месяцев, всем мужчинам должен проводиться контроль простатического специфического антигена (ПСА) как до начала лечения, так и на протяжении всего времени терапии. Лечение даназолом и другими андрогенами обычно хорошо переносится. Побочные эффекты андрогенов: задержка жидкости, повышение либидо, гирсутизм, гепатотоксичность, риск развития опухолей печени. Противопоказаниями для назначения андрогенов являются повышение уровня ПСА и/или наличие в анамнезе рака предстательной железы.
• Рекомендуются ингибиторы JAK2 для терапии пациентам, отнесенным в группу низкого и промежуточного-1 риска (Приложение Г1, таблицы 3, 4, 5), с резистентностью к терапии гидроксикарбамидом**, другими цитостатиками или ИФНα**, а также пациентам из групп промежуточного-2 и высокого риска в качестве препарата первой линии терапии [28, 35].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 2+).
Комментарии: Рекомендуемая начальная доза руксолитиниба** составляет 15 мг 2 раза в день для пациентов с количеством тромбоцитов 100-200·109/л; и 20 мг 2 раза в день для пациентов с количеством тромбоцитов >200х109/л. Максимальная рекомендуемая начальная доза у пациентов с количеством тромбоцитов 50-100х109/л составляет 5 мг 2 раза в день внутрь, с последующей титрацией дозы, которую проводят с осторожностью. В случае отмены препарата развивается синдром «цитокиновой отдачи», выражающийся в быстром возврате симптомов интоксикации, вплоть до системной воспалительной реакции и спленомегалии. В связи с этим требуется постепенная отмена препарата, назначение глюкокортикостероидных гормонов в низких дозах.
• Рекомендуется хирургическое лечение (СЭ), коррекция проявлений портальной гипертензии) пациентам с прогрессирующим увеличением размеров селезенки с целью купирования компрессионного синдрома (абдоминальный дискомфорт, постоянное чувство тяжести, боль, признаки кишечной непроходимости), интоксикации, тяжелых гиперкатаболических симптомов (кахексия, глубокая анемия, рефрактерный гемолиз, тромбоцитопения, резистентную к традиционным методам терапии, обширные инфаркты селезенки с угрозой разрыва, внепеченочная портальная гипертензия с угрозой развития кровотечения из желудка и пищевода) [41-43].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 2+).
Комментарии: В предоперационном периоде необходима оценка сердечно-сосудистых, печеночных, почечных, метаболических и гемостатических рисков. Лапароскопическая спленэктомия не рекомендуется при ПМФ из-за высокого риска кровотечений. После проведения СЭ у 3% пациентов развиваются осложнения, послеоперационная смертность составляет 9%. Важно отметить, что значительный послеоперационный тромбоцитоз наблюдается примерно у 20% пациентов и ведет к увеличению риска тромбоза. Именно по этой причине необходима нормализация количества тромбоцитов до и после СЭ. В постспленэктомическом периоде должна проводиться циторедуктивная терапия гидроксикарбамидом**, в случае резистентности к гидроксикарбамиду** - терапия кладрибином (по 5 мг/м2 2-х часовая инфузия №5, курс повторить через 28 дней) [44]. В послеоперационном периоде в течение недели целесообразен тщательный мониторинг уровня тромбоцитов и коагулограммы, также в течение месяца с целью профилактики назначаются гепарин натрий или непрямые антикоагулянты (варфарин**). Через неделю и 1 месяц после СЭ целесообразно выполнение УЗИ для исключения тромбозов абдоминальных вен. Отдаленные осложнения СЭ, такие как гепатомегалия, лейкоцитоз, бластная трансформация, являются следствием естественного прогрессирования болезни. Бластная трансформация после проведения СЭ проявляется у 10-15% пациентов с ПМФ. Последнее обстоятельство связано с отбором пациентов, а не истинным изменением в биологии болезни, поскольку нет никаких оснований полагать, что биология болезни, связанная с патологической пролиферацией клональных стволовых клеток, претерпевает изменения в результате СЭ. Пациентам с портальной гипертензией и варикозным расширением вен необходимо проводить исследования кровообращения в портальной системе в динамике. Поскольку портальная гипертензия, ассоциированная со спленомегалией, в постспленэктомическом периоде разрешается, в отличие от случаев вторичной внутрипеченочной обструкции, которые требуют системного портального шунтирования.
• Рекомендуется лучевая терапия у пациентов с ПМФ в случае массивной симптоматической спленомегалии, с уровнем тромбоцитов >50х109/л, для которых хирургическое вмешательство противопоказано, с целью контроля очагов экстрамедуллярного кроветворения, которые могут возникать при длительном течении заболевания, в печени и селезенке, в позвоночнике с развитием компрессии спинного мозга, лимфоузлах, плевре с развитием гидроторакса, брюшине с развитием асцита, коже и других органах [45].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 2+).
Комментарии. Эффективным является, как правило, применение малых доз (0,1-0,5 Гр, разделенных на 5-10 сеансов). Использование лучевой терапии на область печени и селезенки имеет кратковременный (3-6 месяцев) эффект и сопряжено с риском усугубления цитопений и, в основном, проводится пациентам, имеющим противопоказания к СЭ.
• Рекомендуется всем пациентам с ПМФ с анемией в случае дефицита железа назначение пероральных препаратов железа [28, 34].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Дозировка препаратов устанавливается в рамках зарегистрированных показаний. Контроль клинического анализа крови и обмена железа при лечении целесообразно проводить ежемесячно. Критерием эффективности лечения является повышение уровня гемоглобина до нормы или более чем на 15-20 г/л от исходного уровня в течение месяца лечения. После нормализации уровня гемоглобина для восполнения запасов железа в организме прием его препаратов целесообразно продолжать около трех месяцев. В дальнейшем периодически 1 раз в 3-6 месяцев необходимо проводить контроль показателей ферростатуса.
• Рекомендуется парентеральное введение цианокобаламина** в случае дефицита витамина В12 у пациентов с ПМФ и анемией [28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. По 100-200 мкг/сут через день, подкожно.
• Рекомендуется пациентам фолиевая кислота** при фолиеводефицитной анемии. [28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Ориентировочная доза составляет 1 мг в сутки 20 - 30 дней.
• Рекомендуется пациентам переливание эритроцитсодержащих сред при наличии анемического синдрома [34].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии: неотложность и объем трансфузии определяет степень недостаточности кровообращения, а не уровень гемоглобина. Введение эритроцитов проводится при наличии выраженных клинических признаков анемии, ориентировочно при снижении гемоглобина крови до 70-90 г/л. При дефицитных анемиях (железодефицитная, В12 дефицитная) введение эритроцитов показано только при анемии тяжелой степени, у больных с тяжелой сопутствующей патологией. Целевой уровень гемоглобина при проведении гемокомпонентной терапии должен быть выше 70 г/л, а при наличии сердечно-сосудистой патологии более 90 г/л.
• Рекомендуется пациентам терапия препаратом деферазирокс** после трансфузии приблизительно 20 единиц (около 100 мл/кг) эритроцитарной массы и более, или при наличии клинических данных, свидетельствующих о развитии хронической перегрузки железом (например, при концентрации ферритина в сыворотке более 1000 мкг/л), возможно проведение МРТ печени в T2 режиме [46].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Длительное использование трансфузий в терапии ПМФ в связи с отсутствием в организме активных механизмов выведения железа и ограниченной возможности его депонирования в печени, при количестве трансфузий более 20-25 доз приводит к развитию вторичного гемосидероза, характеризующегося интерстициальным накоплением железа в органах и тканях. Наиболее частые клинические проявления гемосидероза связаны с поражением сердца, печени, поджелудочной железы, сетчатки глаза. Рекомендуемая начальная суточная доза деферазирокса** составляет 20 мг/кг массы тела. Для пациентов, получающих трансфузии эритроцитарной массы более 14 мл/кг/месяц (приблизительно более 4-х единиц крови в месяц для взрослых), с целью уменьшения количества железа в организме, может быть рассмотрено применение начальной суточной дозы 30 мг/кг. Для пациентов, получающих менее 7 мл/кг/месяц эритроцитарной массы (приблизительно менее 2-х единиц крови в месяц для взрослых), с целью поддержания нормальной концентрации железа в организме может быть рассмотрено применение начальной суточной дозы 10 мг/кг. Коррекцию дозы деферазирокса** следует проводить каждые 3-6 месяцев, основываясь на изменениях концентрации ферритина в сыворотке крови. Коррекцию дозы следует проводить «шагами»; «шаг» составляет 5-10 мг/кг. Управление корректирующих изменений дозы определяется индивидуальной эффективностью лечения и терапевтическими задачами (поддержание или уменьшение содержания железа). При неэффективности препарата в дозе 30 мг/ кг (концентрация ферритина сыворотки сохраняется на уровне ≥ 2500 мкг/ л), дозу следует увеличить до 40 мг/кг. Не рекомендуется применение дозы более 40 мг/кг, поскольку опыт применения препарата в более высоких дозах ограничен. Пациентам при достижении целевой концентрации ферритина сыворотки (обычно от 500 мкг/л до 1000 мкг/л) необходимо предусмотреть постепенное (с «шагом» 5-10 мг/кг) снижение дозы препарата для того, чтобы обеспечить поддержание концентрации ферритина в сыворотке крови в этом целевом диапазоне. Если концентрация ферритина в сыворотке существенно ниже 500 мкг/л, следует рассмотреть вопрос о прерывании лечения деферазироксом**.
• Рекомендуется пациентам переливание тромбоконцентрата при уровне тромбоцитов ниже 10х109/л или тромбоцитопения с развитием геморрагического синдрома [28, 34].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии: при наличии повышенного потребления тромбоцитов (фебрильная лихорадка, инфекции, наличие геморрагического синдрома) или вторичной коагулопатии из-за нарушения функции печени необходимо поддерживать уровень тромбоцитов более 20х109/л. При наличии признаков ДВС-синдрома или кровотечении целевой уровень тромбоцитов, поддерживаемый с помощью трансфузий должен быть более 50х109/л.
• Рекомендуется применение глюкокортикоидов и иммуномодуляторов, а также их комбинации для терапии пациентов с ПМФ с выраженными симптомами интоксикации, что у значительной части пациентов приводит к уменьшению нарушений секреции цитокинов и улучшению общего состояния[47, 48].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии: 10 мг/сут леналидомида** (5 мг/сут, если исходное количество тромбоцитов <100×10 9/л) в дни с 1 по 21 28-дневного цикла в течение шести циклов в сочетании с преднизолоном** 30 мг/сут. перорально в течение цикла 1, 15 мг/сут в течение цикла 2 и 15 мг/сут через день в течение цикла 3.
• Рекомендуется пациентам с ПМФ при инфекционных осложнениях, возникших на фоне нейтропении, использование гранулоцитарного колониестимулирующего фактора (филграстим)** 5 мкг/кг/сут, а также иммуноглобулина человека нормального** в дозах 0,2-0,5 г/кг 3-5 дней и проведение плазмафереза с целью дезинтоксикации и улучшения чувствительности к лекарственным препаратам [28, 34].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Лейкопения и нейтропения, являющиеся иногда проявлениями заболевания, обусловливают повышение частоты возникновения инфекционных осложнений у пациентов с ПМФ. Определенный вклад в развитие иммунодефицита вносит и цитокиновый дисбаланс, являющийся одним из ключевых звеньев патогенеза. Лекарственные препараты, применяющиеся для лечения ПМФ, также могут усугублять нейтропению. Инфекционные процессы у пациентов с ПМФ часто протекают атипично, так как повышение температуры, в том числе и фебрильное, может являться и симптомом опухолевой интоксикации.
• Рекомендуется проведение терапии, направленной на профилактику кровотечений пациентов с ПМФ с тромбоцитопенией [28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Назначение препаратов аскорбиновой кислоты**, этамзилата**, исключение факторов риска - нормализация венозного давления (уменьшение портальной гипертензии с помощью бета-адреноблокаторов, блокаторов кальциевых каналов, сосудистого шунтирования), профилактика поражения слизистых (увлажнение слизистой носа, секретолитики для профилактики язвообразования, местная терапия геморроидальных венозных узлов).
• Рекомендуется терапия аллопуринолом** при увеличении уровня мочевой кислоты у пациентов с ПМФ для нормализации обмена мочевой кислоты [28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Предупредить проявление симптомов гиперурикемии может адекватная скорости лизиса опухоли гидратация с назначением гидрокарбонатных минеральных вод для предупреждения выпадения в осадок кристаллов мочевой кислоты в почках и назначение аллопуринола**. Дозировка аллопуринола** 100 мг/сут с коррекцией дозы в зависимости от уровня мочевой кислоты сыворотки крови.
• Рекомендуется назначение нестероидных противовоспалительных средств перорально и местно на область сустава в виде мазей и гелей у пациентов с ПМФ при развитии подагрической атаки [28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Критерии оценки эффективности и переносимости лечения миелофиброза, постполицитемического, посттромбоцитемического миелофиброза.
• Рекомендуется проводить оценку клинико-гематологического ответа всем пациентам с ПМФ, получающим терапию с целью оценки эффективности лечения [49].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Клинико-гематологический ответ оценивается по наличию или отсутствию симптомов интоксикации, спленомегалии, показателям крови и может быть полным или частичным, а также свидетельствовать о прогрессировании заболевания. Критерии определения клинико-гематологического ответа приведены в Приложении Г2, табл. 13.
3,4 Терапия бластной фазы МПЗ.
Тактика терапии бластной фазы МПЗ определяется возрастом пациентов и сопутствующей патологией. У пациентов с сохранным общесоматическим статусом может быть предпринята попытка проведения курсовой химиотерапии по схемам лечения острых лейкозов, которая приносит временный эффект у небольшой части пациентов.• Рекомендуется пожилым пациентам с наличием существенной коморбидности и осложнениями МПЗ (вторичный острый лейкоз, бластный криз) проведение сдерживающей паллиативной монохимиотерапии и назначение малых доз глюкокортикоидов для торможения роста опухоли и купирования осложнений [50].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Данные мероприятия направлены на торможение роста опухоли и купирование осложнений (переливание гемокомпонентов, лечение инфекционных осложнений и пр.), с целью улучшения качества жизни пациентов:
• Гидроксикарбамид**1000-2000 мг/сутки, перорально.
• Меркаптопурин**50-100 мг/сутки, перорально.
• Цитарабин**20 мг 2 раза/день, п/ 1-14 дни, через 30-45 дней.
• Азацитидин** 75 мг/м2 по 7 дней каждые 28 дней.
• Химиотерапия по программе «7+3».
Программа «7+3»:
• Цитарабин** 100 мг/м2 в/в 2 раза в день,1-7-йдень.
• Даунорубицин** 45 мг/м2 в/в 1 раз в день,1-3-йдень или.
• Даунорубицин** 60 мг/м2 в/в 1 раз в день, 1 -3-йдень или.
• Митоксантрон** 10 мг/м2 в/в 1 раз в день,1-3-йдень или.
• Идарубицин** 12 мг/м2 в/в 1 раз в день,1-3-йдень.
Следует учесть, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
|
|
Реабилитация и амбулаторное лечение
Основные направления реабилитации: медикаментозная терапия; оптимизация физической активности; соблюдение диеты; предупреждение стрессовых ситуаций и переутомления; борьба с вредными привычками; работа с психологом.
• Рекомендуется проведение реабилитационных мероприятий для всех пациентов с Ph-негативными МПЗ для восстановления организма [51].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Основой реабилитации является формирование правильного образа жизни пациентов, а также диетотерапия, фармакотерапия, физиотерапия и адекватная физическая активность. Данные мероприятия применяются в комплексе, а их характер подбирается индивидуально для каждого пациента во всех случаях.
• Рекомендуется всем пациентам с МПЗ наряду с медикаментозной терапией и физической активизацией проводить немедикаментозную и медикаментозную психокоррекцию в связи с различными психологическими нарушениями: тревожностью, внутренней напряженностью, раздражительностью, склонностью к уходу в болезнь, обилием жалоб на общее состояние [51].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Психологическая реабилитация включает разъяснительные беседы с целью формирования у пациента и его родственников адекватных представлений о болезни и путях избавления от нее и ее последствий, о необходимости соответствующего образа жизни, режима труда, отдыха и питания, некоторых привычек как факторов риска осложнений МПЗ. Психологическая реабилитация не менее важна, чем медикаментозная, так как у пациентов часто отмечаются страх смерти, снижение настроения, тревога, нарушение сна.
• Рекомендуется проведение реабилитационных мероприятий для всех пациентов с Ph-негативными МПЗ для восстановления организма [51].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Основой реабилитации является формирование правильного образа жизни пациентов, а также диетотерапия, фармакотерапия, физиотерапия и адекватная физическая активность. Данные мероприятия применяются в комплексе, а их характер подбирается индивидуально для каждого пациента во всех случаях.
• Рекомендуется всем пациентам с МПЗ наряду с медикаментозной терапией и физической активизацией проводить немедикаментозную и медикаментозную психокоррекцию в связи с различными психологическими нарушениями: тревожностью, внутренней напряженностью, раздражительностью, склонностью к уходу в болезнь, обилием жалоб на общее состояние [51].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Комментарии. Психологическая реабилитация включает разъяснительные беседы с целью формирования у пациента и его родственников адекватных представлений о болезни и путях избавления от нее и ее последствий, о необходимости соответствующего образа жизни, режима труда, отдыха и питания, некоторых привычек как факторов риска осложнений МПЗ. Психологическая реабилитация не менее важна, чем медикаментозная, так как у пациентов часто отмечаются страх смерти, снижение настроения, тревога, нарушение сна.
Профилактика
Так как точные этиологические причины МПЗ не известны, не существует какого-либо известного способа надежной профилактики.
Пациенты с МПЗ нуждаются в постоянном динамическом наблюдении у гематолога в течение всей жизни. Частота наблюдения варьируется от 1 - до 3-4 раз в год.
5,1 Профилактика и диспансерное наблюдение пациентов с истинной полицитемией.
• Рекомендуется проводить регулярный контроль клинического статуса с оценкой симптомов опухолевой интоксикации по опроснику MPN-10, лабораторный контроль, инструментальное обследование всех пациентов с ИП (Приложение Г4, таблица 14) [28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
5,2 Профилактика и диспансерное наблюдение пациентов с эссенциальной тромбоцитемией.
• Рекомендуется проводить регулярный контроль клинического статуса с оценкой симптомов опухолевой интоксикации по опроснику MPN-10, лабораторный контроль, инструментальное обследование всех пациентов с ЭТ (Приложение Г4, таблица 15) [28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
5,3 Профилактика и диспансерное наблюдение пациентов с первичным миелофиброзом.
• Рекомендуется проводить регулярный контроль клинического статуса с оценкой симптомов опухолевой интоксикации по опроснику MPN-10, лабораторный контроль, инструментальное обследование всех пациентов с ПМФ (Приложение Г4, таблица 16) [28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Пациенты с МПЗ нуждаются в постоянном динамическом наблюдении у гематолога в течение всей жизни. Частота наблюдения варьируется от 1 - до 3-4 раз в год.
5,1 Профилактика и диспансерное наблюдение пациентов с истинной полицитемией.
• Рекомендуется проводить регулярный контроль клинического статуса с оценкой симптомов опухолевой интоксикации по опроснику MPN-10, лабораторный контроль, инструментальное обследование всех пациентов с ИП (Приложение Г4, таблица 14) [28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
5,2 Профилактика и диспансерное наблюдение пациентов с эссенциальной тромбоцитемией.
• Рекомендуется проводить регулярный контроль клинического статуса с оценкой симптомов опухолевой интоксикации по опроснику MPN-10, лабораторный контроль, инструментальное обследование всех пациентов с ЭТ (Приложение Г4, таблица 15) [28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
5,3 Профилактика и диспансерное наблюдение пациентов с первичным миелофиброзом.
• Рекомендуется проводить регулярный контроль клинического статуса с оценкой симптомов опухолевой интоксикации по опроснику MPN-10, лабораторный контроль, инструментальное обследование всех пациентов с ПМФ (Приложение Г4, таблица 16) [28].
Уровень убедительности рекомендаций D (уровень достоверности доказательств - 4).
Дополнительно
При наличии в гемограмме или миелограмме более 20% клеток с бластной морфологией диагностируется бластный криз [50]. БК МПЗ является терминальной стадией заболевания. Сроки от момента дебюта заболевания до развития БК могут существенно различаться от одного-двух до десятков лет. Такая разница в сроках развития БК может быть обусловлена неточностью установления сроков начала болезни. В случае ПМФ определенную помощь в прогнозировании течения болезни оказывают системы стратификации IPSS, DIPSS, DIPSS+, MIPSS, GPSS (Приложение Г1).
Доказанных средств профилактики бластной фазы заболевания в настоящее время не разработано. В исследованиях сOMFORT-I и сOMFORT-II показано, что первым средством, статистически значимо увеличивающим общую выживаемость пациентов по сравнению с традиционной терапией, стали ингибиторы JAK2 (руксолитиниб**) [35].
Тактика ведения данных пациентов в настоящее время не разработана. Всем пациентам, достигшим редукции бластоза, в возрасте до 60 лет и при отсутствии тяжелых сопутствующих заболеваний, показано выполнение алло - ТГСК. Однако зачастую терапия носит паллиативный характер.
Лечебные подходы при хирургических вмешательствах.
У пациентов с МПЗ высокий риск как тромботических осложнений, так и кровотечения во время хирургических операций. Перед плановой операцией целесообразно назначение циторедуктивных препаратов для нормализации числа клеток периферической крови. У всех пациентов с МПЗ при проведении плановых оперативных вмешательств необходима отмена антиагрегантов и циторедуктивных препаратов в соответствии с фармакокинетикой.
В случае развития постспленэктомического тромбоцитоза рекомендовано назначение циторедуктивных препаратов, что достоверно сокращает число постоперационных осложнений. После операции обязательным является проведение профилактики тромбообразования с ежедневным контролем уровня тромбоцитов. Для всех пациентов с МПЗ в послеоперационном периоде рекомендуется профилактическое введение низкомолекулярных гепаринов. С учетом того, что при тромбоцитозе более высок риск как тромботических, так и геморрагических осложнений прием антиагрегантов и циторедуктивной терапии возобновляется как можно быстрее при устойчивом гемостазе и после заживления операционных ран [12, 28, 41,42].
Тромбогеморрагические осложнения и их лечение у пациентов МПЗ.
Тромбозы, тромбоэмболии и кровотечения являются наиболее типичными осложнениями МПЗ. Тромботические осложнения:
• инсульт / транзиторные ишемические атаки;
• окклюзии артерии или вен сетчатки;
• нарушения проходимости коронарных артерий;
• тромбоэмболия легочной артерии;
• тромбоз печеночной или воротной вены;
• тромбоз глубоких вен;
• эритромелалгия.
Факторы риска (связанные с пациентом):
• возраст >60 лет;
• тромбозы в анамнезе;
• число тромбоцитов 1500х109/л;
• повышенная масса тела;
• сердечно-сосудистые факторы риска (курение, артериальная гипертензия, гиперхолестеринемия);
• наличие тромбофилических факторов риска (мутации Лейден в гене фактора V, в гене протромбина, антифосфолипидные антитела).
Наличие одного или более сосудистых факторов риска (курение, артериальная гипертензия, гиперхолестеринемия, сахарный диабет) увеличивает частоту артериальных тромбозов. Наиболее значимым фактором, особенно у женщин, оказался фактор курения [12].
Имеются также факторы риска, более специфичные для МПЗ: биохимические и функциональные нарушения тромбоцитов, повышение количества лейкоцитов и их активация, наличие JAK2V617F или другого маркера клональности.
Кровотечения бывают при любом уровне тромбоцитов, но особенно часто - при тромбоцитозе (количество тромбоцитов >1500-2000х109/л). Прием НПВП, в первую очередь ацетилсалициловой кислоты**, повышает риск кровотечений.
Приобретенный синдром фон Виллебранда - нечастое осложнение МПЗ. Характерны выраженный тромбоцитоз, нормальное или удлиненное время кровотечения, нормальный уровень антигенов фактора VIII и фактора фон Виллебранда при сниженной ристоцетин-кофакторной активности, снижение способности тромбоцитов к связыванию с коллагеном. Кроме того, в крови уменьшается количество высокомолекулярных олигомеров фактора фон Виллебранда вплоть до исчезновения, что можно ошибочно принять за II тип болезни фон Виллебранда. Дефицит высокомолекулярных олигомеров фактора фон Виллебранда - основная причина кровоточивости, причем чем выше уровень тромбоцитов, тем меньше в крови высокомолекулярных олигомеров и тем выше риск кровотечений.
Предполагается, что назначение терапии и снижения уровня тромбоцитов, уменьшают риски развития тромбозов при МПЗ. Профилактика тромбообразования с помощью назначения антиагрегантов - препаратов ацетилсалициловой кислоты** показана всем пациентам с МПЗ [12]. Привлекательной перспективой для уменьшения риска тромбозов является использование ингибиторов JAK2, в частности руксолитиниба**. В двух проведенных клинических исследованиях (COMFORT-I и сOMFORT-II) руксолитиниб** значимо снижал уровни лейкоцитов и тромбоцитов, с одновременным умеренным снижением аллельной нагрузки JAK2V617F [52].
Вторичная профилактика (после уже случившегося тромбоза) сводится к нормализации показателей крови, показателей системы свертывания крови и назначению по показаниям антикоагулянтной терапии прямыми и непрямыми антикоагулянтами под контролем свертывающей системы.
Миелопролиферативные заболевания и беременность.
Беременные пациентки с МПЗ должны наблюдаться и проходить родоразрешение в центрах с опытом ведения беременности у данной категории пациентов в тесном сотрудничестве акушеров-гинекологами с гематологами. Терапевтические подходы при МПЗ и беременности зависят от статуса болезни пациенток и акушерского анамнеза. Если присутствует любой из нижеперечисленных факторов, беременность имеет высокий риск осложнений у матери и у плода:
• предшествующий венозный или артериальный тромбоз у матери;
• предшествующие кровотечения по причине основного заболевания (МПЗ);
• осложнения предшествующей беременности, которые могли быть вызваны основным заболеванием;
• кровотечения до и после родов;
• тяжелая преэклампсия;
• идиопатическое невынашивание беременности в первом триместре (≥3);
• задержка роста плода;
• внутриутробная смерть или мертворождение (при отсутствии другой причины);
• отслойка плаценты;
• гипертромбоцитоз более 1000 х 109/л.
Алгоритм обследования во время беременности предусматривает:
• динамический контроль показателей периферической крови с исследованием числа тромбоцитов, их функциональной активности, состояния плазменного звена гемостаза, а также исследование содержания маркеров внутрисосудистого свертывания каждые 2 недели;
• исключение антифосфолипидного синдрома (волчаночный коагулянт, антикардиолипиновые антитела), а также исследование мутаций генов, сопряженных с наследственной тромбофилией, уровня гомоцистеина (если данные исследования не были проведены до беременности);
• УЗИ плаценты и плода двукратно в каждом триместре;
• допплерометрия с исследованием фетоплацентарного и маточно-плацентарного и кровотока в средней мозговой артерии плода с 22-й недели, каждые 4 недели;
• кардиотокография плода с 33 недели (в 33, 36, 38 недель).
В лечении пациенток с МПЗ во время беременности отмечается тактика, направленная на профилактику сосудистых осложнений и борьбу с тромбоцитозом. В настоящее время применение не проникающих через плаценту и не обладающих тератогенным эффектом лекарственных средств позволило значительно улучшить качество жизни, прогноз и исход данных заболеваний, а также способствовало сохранению беременности и снижению частоты осложнений у пациенток.
Терапевтические возможности при МПЗ во время беременности включают:
• профилактическое антитромботическое лечение (антиагреганты, антикоагулянтную терапию);
• кровопускания при ИП;
• циторедуктивную терапию;
• коррекцию дефицитных состояний (препараты железа и витамины группы В (пиридоксин**, цианокобаламин**, фолиевая кислота**).
Уровень гематокрита необходимо поддерживать в нормальных пределах, соответствующих беременности. Повышенный объем плазмы часто приводит к уменьшению гематокрита и тромбоцитов, во втором триместре, число которых вновь повышается в послеродовом периоде, создавая повышений риск развития тромбозов в первые шесть недель после родов. Тесный мониторинг числа клеток периферической крови важен в этот период. В случае приема пациенткой циторедуктивных средств, для исключения тератогенных эффектов, гидроксикарбамид** или анагрелид должны быть постепенно отменены за 3 месяца до зачатия, то же приемлемо и для отцов. При необходимости продолжить циторедукцию можно назначением ИФНα**.
Основной препарат для лечения МПЗ во время беременности, действие которого направлено на снижение числа тромбоцитов, - это ИФНα**, безопасный во время беременности. Алгоритм назначения ИФНα** состоит в следующем:
• при тромбоцитозе более 600х109/л ИФНα вводится в дозе 3 млн МЕ в день (или через день), позволяющей поддерживать число тромбоцитов на уровне 200-300х109/л;
• при тромбоцитозе более 400х109/л, введение ИФНα продолжается, если это лечение проводилось еще до беременности и/или существует высокий тромбогенный риск.
Применение ацетилсалициловой кислоты** в низких дозах безопасно и необходимо при беременности. Согласно разработанному алгоритму, все женщины с МПЗ во время беременности должны получать ацетилсалициловую кислоту** в дозе 50-100 мг в сутки в течение всей беременности. При планировании беременности нужно начать прием ацетилсалициловой кислоты** до зачатия для облегчения полноценной циркуляции крови в плаценте и прием витаминов группы В.
Если у матери или плода есть риск осложнений (Приложение Г1), применение НМГ показано в течение всей беременности и в течение шести недель после родов. Профилактические дозы НМГ при массе тела беременных 50-90 кг должны составлять: надропарин кальция 0,3 мл 1 раз в сутки, эноксапарин натрия** 40 мг (0,4мл) 1 раз в сутки) или далтепарин натрия по 5000 МЕ 2 раза в сутки. При массе беременных менее 50 кг дозы уменьшаются в два раза, при массе тела более 90 кг используются двойные дозы соответственно. В случае развития тромбозов используют лечебные дозы НМГ, которые в два раза больше профилактических. Помимо этого, показаниями для проведения антикоагулянтной терапии (в сочетании с циторедуктивной и антиагрегантной терапией) являются: гиперкоагуляция, не характерная для определенного срока беременности, признаки активации внутрисосудистого свертывания крови, а также наличие дополнительных факторов тромбофилии высокого риска.
Перед родоразрешением всем беременным с МПЗ проводится профилактика тромбогеморрагических осложнений, включающая:
• прием препаратов ацетилсалициловой кислоты** прекращается за 2 недели до родоразрешения в связи с высоким риском гематом эпидурального пространства;
• ношение медицинского компрессионного белья при родоразрешении;
• регионарную анальгезию (в родах по желанию женщины) или анестезию (во время кесарева сечения), которые проводятся не ранее чем через 12 ч после последней профилактической дозы НМГ и не ранее чем через 24 ч после последней лечебной дозы НМГ;
• при плановом кесаревом сечении введение НМГ в профилактических дозах прекращается за 24 ч до и возобновляется через 3 ч после его окончания (или через 4 ч после удаления эпидурального катетера).
Тактика ведения послеродового периода заключается в следующем:
• ношение медицинского компрессионного белья в течение 6 недель после родов;
• все пациентки с МПЗ с нормальным и повышенным уровнем тромбоцитов должны получать ацетилсалициловую кислоту в дозе 50-100 мг/сут;
• введение ИФНα** продолжается, если это лечение проводилось во время беременности и/или существовал высокий тромбогенный риск;
• при наличии дополнительных факторов тромбофилии и/или высоком тромбогенном риске введение НМГ в профилактических дозах в течение 6 недель послеродового периода;
• грудное вскармливание возможно при проведении терапии НМГ, ИФНα, но противопоказано при приеме других циторедуктивных средств (гидроксикарбамид**, анагрелид).
Эффективность лечения подтверждается сохранением клинико-гематологической ремиссии заболевания, которая определяется данными объективного обследования, показателей периферической крови, УЗИ органов брюшной полости (размеры печени и селезенки).
При адекватно подобранном лечении возможны нормальное развитие беременности и течение родов. Беременность не влияет на течение заболевания. Физическое развитие детей, частота врожденной и приобретенной патологии новорожденных у женщин с МПЗ не отличаются от аналогичных показателей в общей популяции [53].
Показания для плановой госпитализации:
• Обследование пациентов с высоким риском геморрагических осложнений при проведении инвазивных манипуляций;
• Гемозаместительная терапия;
• Хирургическое лечение МПЗ (спленэктомия, портокавальное шунтирование, лигирование варикозно-расширенных вен пищевода);
• Осложнения от проводимой терапии;
• Наличие отягощающих состояние пациента сопутствующих заболеваний;
• Несоблюдение пациентом лечебного режима в амбулаторных условиях.
• Подготовка и проведение алло - ТГСК.
Показания для экстренной госпитализации:
• Инфаркт селезенки;
• Анемический синдром, неуточненный;
• Гемолитическая анемия (гемолитический криз);
• Геморрагический синдром III-IV степени;
• Глубокая тромбоцитопения не более 20х109/л при наличии выраженного геморрагического синдрома в анамнезе;
• Острый тромбоз;
• Бластный криз.
Показания к выписке пациента из стационара:
• Установление диагноза;
• Улучшение состояния пациента;
• Окончание курса терапии при условии улучшения состояния пациента.
Доказанных средств профилактики бластной фазы заболевания в настоящее время не разработано. В исследованиях сOMFORT-I и сOMFORT-II показано, что первым средством, статистически значимо увеличивающим общую выживаемость пациентов по сравнению с традиционной терапией, стали ингибиторы JAK2 (руксолитиниб**) [35].
Тактика ведения данных пациентов в настоящее время не разработана. Всем пациентам, достигшим редукции бластоза, в возрасте до 60 лет и при отсутствии тяжелых сопутствующих заболеваний, показано выполнение алло - ТГСК. Однако зачастую терапия носит паллиативный характер.
Лечебные подходы при хирургических вмешательствах.
У пациентов с МПЗ высокий риск как тромботических осложнений, так и кровотечения во время хирургических операций. Перед плановой операцией целесообразно назначение циторедуктивных препаратов для нормализации числа клеток периферической крови. У всех пациентов с МПЗ при проведении плановых оперативных вмешательств необходима отмена антиагрегантов и циторедуктивных препаратов в соответствии с фармакокинетикой.
В случае развития постспленэктомического тромбоцитоза рекомендовано назначение циторедуктивных препаратов, что достоверно сокращает число постоперационных осложнений. После операции обязательным является проведение профилактики тромбообразования с ежедневным контролем уровня тромбоцитов. Для всех пациентов с МПЗ в послеоперационном периоде рекомендуется профилактическое введение низкомолекулярных гепаринов. С учетом того, что при тромбоцитозе более высок риск как тромботических, так и геморрагических осложнений прием антиагрегантов и циторедуктивной терапии возобновляется как можно быстрее при устойчивом гемостазе и после заживления операционных ран [12, 28, 41,42].
Тромбогеморрагические осложнения и их лечение у пациентов МПЗ.
Тромбозы, тромбоэмболии и кровотечения являются наиболее типичными осложнениями МПЗ. Тромботические осложнения:
• инсульт / транзиторные ишемические атаки;
• окклюзии артерии или вен сетчатки;
• нарушения проходимости коронарных артерий;
• тромбоэмболия легочной артерии;
• тромбоз печеночной или воротной вены;
• тромбоз глубоких вен;
• эритромелалгия.
Факторы риска (связанные с пациентом):
• возраст >60 лет;
• тромбозы в анамнезе;
• число тромбоцитов 1500х109/л;
• повышенная масса тела;
• сердечно-сосудистые факторы риска (курение, артериальная гипертензия, гиперхолестеринемия);
• наличие тромбофилических факторов риска (мутации Лейден в гене фактора V, в гене протромбина, антифосфолипидные антитела).
Наличие одного или более сосудистых факторов риска (курение, артериальная гипертензия, гиперхолестеринемия, сахарный диабет) увеличивает частоту артериальных тромбозов. Наиболее значимым фактором, особенно у женщин, оказался фактор курения [12].
Имеются также факторы риска, более специфичные для МПЗ: биохимические и функциональные нарушения тромбоцитов, повышение количества лейкоцитов и их активация, наличие JAK2V617F или другого маркера клональности.
Кровотечения бывают при любом уровне тромбоцитов, но особенно часто - при тромбоцитозе (количество тромбоцитов >1500-2000х109/л). Прием НПВП, в первую очередь ацетилсалициловой кислоты**, повышает риск кровотечений.
Приобретенный синдром фон Виллебранда - нечастое осложнение МПЗ. Характерны выраженный тромбоцитоз, нормальное или удлиненное время кровотечения, нормальный уровень антигенов фактора VIII и фактора фон Виллебранда при сниженной ристоцетин-кофакторной активности, снижение способности тромбоцитов к связыванию с коллагеном. Кроме того, в крови уменьшается количество высокомолекулярных олигомеров фактора фон Виллебранда вплоть до исчезновения, что можно ошибочно принять за II тип болезни фон Виллебранда. Дефицит высокомолекулярных олигомеров фактора фон Виллебранда - основная причина кровоточивости, причем чем выше уровень тромбоцитов, тем меньше в крови высокомолекулярных олигомеров и тем выше риск кровотечений.
Предполагается, что назначение терапии и снижения уровня тромбоцитов, уменьшают риски развития тромбозов при МПЗ. Профилактика тромбообразования с помощью назначения антиагрегантов - препаратов ацетилсалициловой кислоты** показана всем пациентам с МПЗ [12]. Привлекательной перспективой для уменьшения риска тромбозов является использование ингибиторов JAK2, в частности руксолитиниба**. В двух проведенных клинических исследованиях (COMFORT-I и сOMFORT-II) руксолитиниб** значимо снижал уровни лейкоцитов и тромбоцитов, с одновременным умеренным снижением аллельной нагрузки JAK2V617F [52].
Вторичная профилактика (после уже случившегося тромбоза) сводится к нормализации показателей крови, показателей системы свертывания крови и назначению по показаниям антикоагулянтной терапии прямыми и непрямыми антикоагулянтами под контролем свертывающей системы.
Миелопролиферативные заболевания и беременность.
Беременные пациентки с МПЗ должны наблюдаться и проходить родоразрешение в центрах с опытом ведения беременности у данной категории пациентов в тесном сотрудничестве акушеров-гинекологами с гематологами. Терапевтические подходы при МПЗ и беременности зависят от статуса болезни пациенток и акушерского анамнеза. Если присутствует любой из нижеперечисленных факторов, беременность имеет высокий риск осложнений у матери и у плода:
• предшествующий венозный или артериальный тромбоз у матери;
• предшествующие кровотечения по причине основного заболевания (МПЗ);
• осложнения предшествующей беременности, которые могли быть вызваны основным заболеванием;
• кровотечения до и после родов;
• тяжелая преэклампсия;
• идиопатическое невынашивание беременности в первом триместре (≥3);
• задержка роста плода;
• внутриутробная смерть или мертворождение (при отсутствии другой причины);
• отслойка плаценты;
• гипертромбоцитоз более 1000 х 109/л.
Алгоритм обследования во время беременности предусматривает:
• динамический контроль показателей периферической крови с исследованием числа тромбоцитов, их функциональной активности, состояния плазменного звена гемостаза, а также исследование содержания маркеров внутрисосудистого свертывания каждые 2 недели;
• исключение антифосфолипидного синдрома (волчаночный коагулянт, антикардиолипиновые антитела), а также исследование мутаций генов, сопряженных с наследственной тромбофилией, уровня гомоцистеина (если данные исследования не были проведены до беременности);
• УЗИ плаценты и плода двукратно в каждом триместре;
• допплерометрия с исследованием фетоплацентарного и маточно-плацентарного и кровотока в средней мозговой артерии плода с 22-й недели, каждые 4 недели;
• кардиотокография плода с 33 недели (в 33, 36, 38 недель).
В лечении пациенток с МПЗ во время беременности отмечается тактика, направленная на профилактику сосудистых осложнений и борьбу с тромбоцитозом. В настоящее время применение не проникающих через плаценту и не обладающих тератогенным эффектом лекарственных средств позволило значительно улучшить качество жизни, прогноз и исход данных заболеваний, а также способствовало сохранению беременности и снижению частоты осложнений у пациенток.
Терапевтические возможности при МПЗ во время беременности включают:
• профилактическое антитромботическое лечение (антиагреганты, антикоагулянтную терапию);
• кровопускания при ИП;
• циторедуктивную терапию;
• коррекцию дефицитных состояний (препараты железа и витамины группы В (пиридоксин**, цианокобаламин**, фолиевая кислота**).
Уровень гематокрита необходимо поддерживать в нормальных пределах, соответствующих беременности. Повышенный объем плазмы часто приводит к уменьшению гематокрита и тромбоцитов, во втором триместре, число которых вновь повышается в послеродовом периоде, создавая повышений риск развития тромбозов в первые шесть недель после родов. Тесный мониторинг числа клеток периферической крови важен в этот период. В случае приема пациенткой циторедуктивных средств, для исключения тератогенных эффектов, гидроксикарбамид** или анагрелид должны быть постепенно отменены за 3 месяца до зачатия, то же приемлемо и для отцов. При необходимости продолжить циторедукцию можно назначением ИФНα**.
Основной препарат для лечения МПЗ во время беременности, действие которого направлено на снижение числа тромбоцитов, - это ИФНα**, безопасный во время беременности. Алгоритм назначения ИФНα** состоит в следующем:
• при тромбоцитозе более 600х109/л ИФНα вводится в дозе 3 млн МЕ в день (или через день), позволяющей поддерживать число тромбоцитов на уровне 200-300х109/л;
• при тромбоцитозе более 400х109/л, введение ИФНα продолжается, если это лечение проводилось еще до беременности и/или существует высокий тромбогенный риск.
Применение ацетилсалициловой кислоты** в низких дозах безопасно и необходимо при беременности. Согласно разработанному алгоритму, все женщины с МПЗ во время беременности должны получать ацетилсалициловую кислоту** в дозе 50-100 мг в сутки в течение всей беременности. При планировании беременности нужно начать прием ацетилсалициловой кислоты** до зачатия для облегчения полноценной циркуляции крови в плаценте и прием витаминов группы В.
Если у матери или плода есть риск осложнений (Приложение Г1), применение НМГ показано в течение всей беременности и в течение шести недель после родов. Профилактические дозы НМГ при массе тела беременных 50-90 кг должны составлять: надропарин кальция 0,3 мл 1 раз в сутки, эноксапарин натрия** 40 мг (0,4мл) 1 раз в сутки) или далтепарин натрия по 5000 МЕ 2 раза в сутки. При массе беременных менее 50 кг дозы уменьшаются в два раза, при массе тела более 90 кг используются двойные дозы соответственно. В случае развития тромбозов используют лечебные дозы НМГ, которые в два раза больше профилактических. Помимо этого, показаниями для проведения антикоагулянтной терапии (в сочетании с циторедуктивной и антиагрегантной терапией) являются: гиперкоагуляция, не характерная для определенного срока беременности, признаки активации внутрисосудистого свертывания крови, а также наличие дополнительных факторов тромбофилии высокого риска.
Перед родоразрешением всем беременным с МПЗ проводится профилактика тромбогеморрагических осложнений, включающая:
• прием препаратов ацетилсалициловой кислоты** прекращается за 2 недели до родоразрешения в связи с высоким риском гематом эпидурального пространства;
• ношение медицинского компрессионного белья при родоразрешении;
• регионарную анальгезию (в родах по желанию женщины) или анестезию (во время кесарева сечения), которые проводятся не ранее чем через 12 ч после последней профилактической дозы НМГ и не ранее чем через 24 ч после последней лечебной дозы НМГ;
• при плановом кесаревом сечении введение НМГ в профилактических дозах прекращается за 24 ч до и возобновляется через 3 ч после его окончания (или через 4 ч после удаления эпидурального катетера).
Тактика ведения послеродового периода заключается в следующем:
• ношение медицинского компрессионного белья в течение 6 недель после родов;
• все пациентки с МПЗ с нормальным и повышенным уровнем тромбоцитов должны получать ацетилсалициловую кислоту в дозе 50-100 мг/сут;
• введение ИФНα** продолжается, если это лечение проводилось во время беременности и/или существовал высокий тромбогенный риск;
• при наличии дополнительных факторов тромбофилии и/или высоком тромбогенном риске введение НМГ в профилактических дозах в течение 6 недель послеродового периода;
• грудное вскармливание возможно при проведении терапии НМГ, ИФНα, но противопоказано при приеме других циторедуктивных средств (гидроксикарбамид**, анагрелид).
Эффективность лечения подтверждается сохранением клинико-гематологической ремиссии заболевания, которая определяется данными объективного обследования, показателей периферической крови, УЗИ органов брюшной полости (размеры печени и селезенки).
При адекватно подобранном лечении возможны нормальное развитие беременности и течение родов. Беременность не влияет на течение заболевания. Физическое развитие детей, частота врожденной и приобретенной патологии новорожденных у женщин с МПЗ не отличаются от аналогичных показателей в общей популяции [53].
7 Организация медицинской помощи.
Большинство пациентов с МПЗ могут получать лечение амбулаторно, они не нуждаются в госпитализации для обследования, уточнения диагноза и консервативной терапии в лечебных дозах.Показания для плановой госпитализации:
• Обследование пациентов с высоким риском геморрагических осложнений при проведении инвазивных манипуляций;
• Гемозаместительная терапия;
• Хирургическое лечение МПЗ (спленэктомия, портокавальное шунтирование, лигирование варикозно-расширенных вен пищевода);
• Осложнения от проводимой терапии;
• Наличие отягощающих состояние пациента сопутствующих заболеваний;
• Несоблюдение пациентом лечебного режима в амбулаторных условиях.
• Подготовка и проведение алло - ТГСК.
Показания для экстренной госпитализации:
• Инфаркт селезенки;
• Анемический синдром, неуточненный;
• Гемолитическая анемия (гемолитический криз);
• Геморрагический синдром III-IV степени;
• Глубокая тромбоцитопения не более 20х109/л при наличии выраженного геморрагического синдрома в анамнезе;
• Острый тромбоз;
• Бластный криз.
Показания к выписке пациента из стационара:
• Установление диагноза;
• Улучшение состояния пациента;
• Окончание курса терапии при условии улучшения состояния пациента.
|
|
Критерии оценки качества медицинской помощи
| № | Критерии качества | Уровень достоверности доказательств | Уровень убедительности рекомендаций |
| 1. | Выполнен сбор анамнеза (в том числе семейного и профессионального), оценка объективного статуса пациента (в основном - геморрагический синдром), оценка размера селезенки, наличие периферических и/или внутрибрюшных и внутригрудных лимфоузлов. | 4 | D |
| 2. | Выполнен клинический анализ крови с подсчетом лейкоцитарной формулы и уровня тромбоцитов на анализаторе и по мазку | 4 | D |
| 3. | Выполнен биохимический анализ крови (концентрация сывороточного железа, общая железосвязывающая способность сыворотки, насыщение трансферрина железом, концентрация сывороточного ферритина) | 4 | D |
| 4. | Выполнено исследование уровня эритропоэтина крови (при диагностике ИП) | 4 | D |
| 5. | Выполнено ультразвуковое исследования органов брюшной полости (определение размеров печени и селезенки) | 4 | D |
| 6. | Выполнено гистологическое и гистохимическое исследование костного мозга (получение препарата с помощью трепанобиопсии гребня подвздошной кости) | 4 | D |
| 7. | При наличии показаний проведена циторедуктивная терапия | 4 | D |
Список литературы
• Tefferi A, Vainchenker W. Myeloproliferative neoplasms: molecular pathophysiology, essential clinical understanding, and treatment strategies. J сlin Oncol. 2011 Feb 10;29(5):573-82. doi: 10,1200/JCO.2010,29,8711.
• Меликян А.Л., Суборцева И.Н. Биология миелопролиферативных заболеваний Клиническая онкогематология. 2016; 9 (3): 314-325.
• R.C. Skoda, A. Duek, J. Grisouard. Pathogenesis of myeloproliferative neoplasms. Experimental Hematology. Volume 43, Issue 8, August 2015, Pages 599-608 https://doi.org/10,1016/j.exphem.2015,06,007.
• Schischlik F., Kralovics R. Mutations in myeloproliferative neoplasms - their significance and clinical use. Expert Rev Hematol. 2017 Nov;10(11):961-973. doi: 10,1080/17474086,2017,1380515. Epub 2017 Sep 25.
• W. Vainchenker, Franc¸ Delhommeau,1,2,4 Stefan N. сonstantinescu,5,6 and Olivier A. вernard. New mutations and pathogenesis of myeloproliferative neoplasms. вLOOD, 2011. 118(7):1723-1735; doi: https://doi.org/10,1182/blood-2011-02-292102.
• H.C. Hasselbalch,M.E.Bjørn. MPNs as Inflammatory Diseases:The Evidence, сonsequences, and Perspectives. Mediators Inflamm. 2015;2015:102476. doi: 10,1155/2015/102476.
• Mehta J., Wang H, Iqbal SU, Mesa R. Epidemiology of myeloproliferative neoplasms in the United States. Leuk Lymphoma. 2014 Mar;55(3):595-600. doi: 10,3109/10428194,2013,813500. Epub 2013 Jul 29.
• Абдулкадыров М., Шуваев В.А., Мартынкевич И.С. Миелопролиферативные новообразования. Монография. С-Пет. 2016; 298.
• D.A. Arber, A. Orazi, R. Hasserjian, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia // вlood. 2016. Vol.127, №20. P. 2391-2405.
• Robyn M. Emanuel, Amylou с. Dueck, Holly L. Geyer, Jean-Jacques Kiladjian, Stefanie Slot, Sonja Zweegman,Peter A.W. te вoekhorst, Suzan сommandeur, Harry с. Schouten, Federico Sackmann, Ana Kerguelen Fuentes, et al. Myeloproliferative Neoplasm (MPN) Symptom Assessment Form Total Symptom Score: Prospective International Assessment of an Abbreviated Symptom вurden Scoring System Among Patients With MPNs. J сlin Oncol. 2012; 30(33): 4098-4103. doi: 10,1200/JCO.2012,42,3863.
• Vannucchi A. M., T. вarbui, F. сervantes, с. Harrison, J.-J. Kiladjian, N. Kröger, J. Thiele, вuske с. Philadelphia сhromosome-Negative сhronic Myeloproliferative Neoplasms: ESMO сlinical Practice Guidelines Ann Oncol (2015) 26 (suppl 5): v85-v99.
• Agarwal M. в., Malhotra H., сhakrabarti P., Varma N., Mathews V., вhattacharyya J., T. Seth, K. Gayathri, H. Menon, P. G. Subramanian, A. Sharma, M. вhattacharyya, J. Mehta, A. K. Vaid, S. Shah, S. Aggarwal, P. K. Gogoi, U. Agarwal, Varma. Myeloproliferative neoplasms working group consensus recommendations for diagnosis and management of primary myelofibrosis, polycythemia vera, and essential thrombocythemia Indian J Med Paediatr Oncol. 2015 Jan-Mar; 36(1): 3-16. doi: 10,4103/0971-5851,151770.
• вusque L, Porwit A, Day R, Olney HJ, Leber в, Éthier V, Sirhan S, Foltz L, Prchal J, Kamel-Reid S, Karsan A, Gupta V. Laboratory Investigation of Myeloproliferative Neoplasms (MPNs): Recommendations of the сanadian MPN Group. Am J сlin Pathol. 2016 Oct;146(4):408-22. doi: 10,1093/ajcp/aqw131.
• Hoffman R. et al. Hematology: вasic Principles and Practice E-Book 7th edition 2017 https://books.google.de/books?isbn=0323509711.
• Toros A. в., Gokcay S., сetin G., Ar M. с., Karagoz Y., Kesici в. Portal Hypertension and Myeloproliferative Neoplasms: A Relationship Revealed. ISRN Hematol. Volume 2013, Article ID 673781, 5 pages http://dx.doi.org/10,1155/2013/673781.
• Pieri L., Guglielmelli P., Vannucchi A. M. сhronic Myeloproliferative Neoplasms: a сollaborative Approach. Mediterr J Hematol Infect Dis. 2010; 2(2): e2010017. Published online 2010 Jun 21. doi: 10,4084/MJHID.2010,017.
• Marchioli R, Finazzi G, Landolfi R, et al. Vascular and neoplastic risk in a large cohort of patients with polycythemia vera. J сlin Oncol 2005;23(10):2224-2232.
• Michiels J. J., вerneman Z., Schroyens W. et al. The paradox of platelet activation and impaired function: platelet-von Willebrand factor interactions, and the etiology of thrombotic and hemorrhagic manifestations in essential thrombocythemia and polycythemia vera. Semin Thromb Hemost 2006; 32:589-604.
• Tefferi A, Rumi E, Finazzi G, Gisslinger H, Vannucchi AM, Rodeghiero F, et al. Survival and prognosis among 1545 patients with contemporary polycythemia vera: an international study. Leukemia. 2013 Sep;27(9):1874-81. doi: 10,1038/leu.2013,163.
• вarbui T, Vannucchi AM, вuxhofer-Ausch V, De Stefano V, вetti S, Rambaldi A, Rumi E, Practice-relevant revision of IPSET- thrombosis based on 1019 patients with WHO-defined essential thrombocythemia. Blood сancer J. 2015 Nov 27;5:e369. doi: 10,1038/bcj.2015,94.
• сervantes F. New prognostic scoring system for primary myelofibrosis based on a study of the International Working Group for Myelofibrosis Research and Treatment. вlood. 2009. 113(13). 2895-901.
• Passamonti F., сervantes F, Vannucchi AM, Morra E, Rumi E, сazzola M, Tefferi A. Dynamic International Prognostic Scoring System (DIPSS) predicts progression to acute myeloid leukemia in primary myelofibrosis. вlood. 2010;116(15):2857-8. doi: 10,1182/blood-2010-06-293415.
• Gangat N., сaramazza D., Vaidya R. et al. DIPSS Plus: A Refined Dynamic International Prognostic Scoring System for Primary Myelofibrosis That Incorporates Prognostic Information From Karyotype, Platelet сount, and Transfusion Status. Journal of сlinical Oncology. 2011. 29(4). 392-7.
• Vannucchi AM, P. Guglielmelli, Rotunno G, Pascutto с, Pardanani A. Mutation-Enhanced International Prognostic Scoring System (MIPSS) for Primary Myelofibrosis: An AGIMM & IWG-MRT Project // вlood. 2014. P. 405.
• Tefferi, P. Guglielmelli, с. Finke, et al. Integration of Mutations and Karyotype Towards a Genetics-Based Prognostic Scoring System (GPSS) for Primary Myelofibrosis // вlood. 2014. Vol.124. P. 406.
• Falchi L, Newberry KJ, Verstovsek S. New Therapeutic Approaches in Polycythemia Vera. сlin Lymphoma Myeloma Leuk. 2015 Jun;15 Suppl:S27-33. doi: 10,1016/j.clml.2015,02,013.
• Tefferi A. Polycythemia vera and essential thrombocythemia: 2013 update on diagnosis, risk-stratification, and management. American Journal of Hematology. 2013. 88(6); 507-516.
• Меликян А. Л., Туркина А. Г., Ковригина А. М. Клинические рекомендации по диагностике и терапии Ph-негативных миелопролиферативных заболеваний (истинная полицитемия, эссенциальная тромбоцитемия, первичный миелофиброз) (редакция 2016 г. Гематология и трансфузиология 2017; 1:25-60.
• вarosi G, вirgegard G, Finazzi G, et al. Response criteria for essential thrombocythemia and polycythemia vera: result of a European Leukemia Net consensus conference. вlood 2009;113(20):4829-4833.
• Fogliatto L., R. вreunig, T.V. сosta, L. сarlos Z. сontin, J. F. Silveira, с. Silveira, L. E. Daudt, L. Silla The Assessment of the European Leukemianet сriteria for сlinicohematologic Resistance and Intolerance to Hydroxyurea in Polycythemia Vera Is Not Easily Applicable in Daily Practice. вlood 2014 124(21):5550; https://doi.org/.
• Alvarez-Larran A., сervantes F, Pereira A, et al. Observation versus antiplatelet therapy as primary prophylaxis for thrombosis in low-risk essential thrombocythemia. вlood. 2010;116:1205-10.
• вhatt D. L., Topol E. J. Scientific and therapeutic advances in antiplatelet therapy. Nature Rev. 2003; 2: 15-28.
• Tefferi A, вarbui T. Polycythemia vera and essential thrombocythemia: 2019 update on diagnosis, risk-stratification and management. Am J Hematol. 2019 Jan;94(1):133-143. doi: 10,1002/ajh.25303.
• Tefferi A. Primary myelofibrosis: 2019 update on diagnosis, risk-stratification and management. Am J Hematol. 2018 Dec;93(12):1551-1560. doi: 10,1002/ajh.25230.
• Shantzer L, вerger K, Pu JJ. Primary myelofibrosis and its targeted therapy. Ann Hematol. 2017 Apr;96(4):531-535. doi: 10,1007/s00277-016-2785-9.
• McLornan DP, Yakoub-Agha I, Robin M, сhalandon Y, Harrison сN, Kroger N. State-of-the-art review: allogeneic stem cell transplantation for myelofibrosis in 2019. Haematologica. 2019 Apr;104(4):659-668. doi: 10,3324/haematol.2018,206151.
• Robin M, Zine M, сhevret S, Meignin V, Munoz-Bongrand N, Moatti H, Xhaard A, Sicre de Fontbrune F, Peffault de Latour R, Sarfati E, Socié G. The Impact of Splenectomy in Myelofibrosis Patients before Allogeneic Hematopoietic Stem сell Transplantation. вiol вlood Marrow Transplant. 2017 Jun;23(6):958-964. doi: 10,1016/j.bbmt.2017,03,002.
• Ianotto JC, сhauveau A, вoyer-Perrard F, Gyan E, Laribi K, сony-Makhoul P, Demory JL, de Renzis в, Dosquet с, Rey J, Roy L, Dupriez в, Knoops L, Legros L, Malou M, Hutin P, Ranta D, вenbrahim O, Ugo V, Lippert E, Kiladjian JJ. вenefits and pitfalls of pegylated interferon-α2a therapy in patients with myeloproliferative neoplasm-associated myelofibrosis: a French Intergroup of Myeloproliferative neoplasms (FIM) study. Haematologica. 2018 Mar;103(3):438-446. doi: 10,3324/haematol.2017,181297.
• Hernández-Boluda JC, сorrea JG, García-Delgado R, Martínez-López J, Alvarez-Larrán A, Fox ML, García-Gutiérrez V, Pérez-Encinas M, Ferrer-Marín F, Mata-Vázquez MI, Raya JM, Estrada N, García S, Kerguelen A, Durán MA, Albors M, сervantes F. Predictive factors for anemia response to erythropoiesis-stimulating agents in myelofibrosis. Eur J Haematol. 2017 Apr;98(4):407-414. doi: 10,1111/ejh.12846.
• сervantes F., Alvarez-Larrán A, Domingo A, Arellano-Rodrigo E, Montserrat E. Efficacy and tolerability of danazol as a treatment for the anaemia of myelofibrosis with myeloid metaplasia: long-term results in 30 patients. вr J Haematol. 2005;129(6):771-5.
• Tefferi A, Mesa RA, Nagorney DM, Schroeder G, Silverstein M.N. Splenectomy in myelofibrosis with myeloid metaplasia: a single-institution experience with 223 patients. вlood. 2000;95(7):2226-33.
• Меликян А. Л., Колосова Л. Ю., Соколова М. А., Ковригина А. М., Силаев М. А., Гилязитдинова Е. А., Гемджян Э. Г., Карагюлян С. Р. Роль спленэктомии при лечении больных миелофиброзом. Тер.архив. 2013,8, 69-76.
• Melikyan A.L., Kovrigina А.М., Sokolova M.A., Kolosova L.U., Silaev M.A., Gilyazitdinova E.A., Subortseva I.N., Gemdjian E.G., Karagulyan S.R, Savchenko V.G. The Role Of Splenectomy In The Treatment Of Myelofibrosis вlood. 2013.
• Tefferi. How I treat myelofibrosis. вLOOD, 2011; 117 (13): 3494-3504 doi:10,1182/blood-2010-11-315614.
• Nicolosi M, Mudireddy M, Patnaik MM, Gangat N, Pardanani A, Tefferi A. A retrospective survey of exposure history to chemotherapy or radiotherapy in 940 consecutive patients with primary myelofibrosis. Am J Hematol. 2018 Aug;93(4):E103-E107. doi: 10,1002/ajh.25037.
• Isidori A, вorin L, Elli E, Latagliata R, Martino в, Palumbo G, Pilo F, Loscocco F, Visani G, сianciulli P. Iron toxicity - Its effect on the bone marrow. вlood Rev. 2018 Nov;32(6):473-479. doi: 10,1016/j.blre.2018,04,004.
• Quintás-Cardama A, Kantarjian HM, Manshouri T, Thomas D, сortes J, Ravandi F, et al. Lenalidomide plus prednisone results in durable clinical, histopathologic, and molecular responses in patients with myelofibrosis. J сlin Oncol. 2009 Oct 1;27(28):4760-6. doi: 10,1200/JCO.2009,22,6548.
• Mesa RA, Yao X, сripe LD, Li сY, Litzow M, Paietta E, et al. Lenalidomide and prednisone for myelofibrosis: Eastern сooperative Oncology Group (ECOG) phase 2 trial E4903. вlood. 2010 Nov 25;116(22):4436-8. doi: 10,1182/blood-2010-05-287417.
• Tefferi, F. сervantes, R. Mesa, F. Passamonti, S. Verstovsek, p.m Vannucchi, J. Gotlib, в. Dupriez, Animesh Pardanani, сlaire Harrison, Ronald Hoffman, Heinz Gisslinger, Nicolaus Kröger, Juergen Thiele, Tiziano вarbui and Giovanni вarosi Revised response criteria for myelofibrosis: International Working Group-Myeloproliferative Neoplasms Research and Treatment (IWG-MRT) and European LeukemiaNet (ELN) consensus report. вlood 2013 122:1395-1398; doi: https://doi.org/10,1182/blood-2013-03-488098.
• Scherber RM, Mesa RA. Managing myelofibrosis (MF) that blasts through: advancements in the treatment of relapsed/refractory and blast-phase MF. Hematology Am Soc Hematol Educ Program. 2018 Nov 30;2018(1):118-126.doi: 10,1182/asheducation-2018,1,118.
• Pedersen KM, Zangger G, вrochmann N, Grønfeldt вM, Zwisler AD, Hasselbalch HC, Tang LH. The effectiveness of exercise-based rehabilitation to patients with myeloproliferative neoplasms-An explorative study. Eur J сancer сare (Engl). 2018;27(5):e12865. doi: 10,1111/ecc.12865.
• Samuelson, вethany T. Vesely, Sara K.; сhai-Adisaksopha, сhatree; Scott, вart L.; сrowther, Mark; Garcia, David The impact of ruxolitinib on thrombosis in patients with polycythemia vera and myelofibrosis: a meta-analysis. вlood сoagulation & Fibrinolysis: September 2016-Volume27(6)-p648-652 doi:10,1097/MBC.0000000000000446.
• Шмаков Р.Г., Полушкина Е.С. Особенности репродуктивной функции у женщин с онкогематологическими заболеваниями. Современная онкология. 2008. 10(3).68-69.
• Меликян А.Л., Суборцева И.Н. Биология миелопролиферативных заболеваний Клиническая онкогематология. 2016; 9 (3): 314-325.
• R.C. Skoda, A. Duek, J. Grisouard. Pathogenesis of myeloproliferative neoplasms. Experimental Hematology. Volume 43, Issue 8, August 2015, Pages 599-608 https://doi.org/10,1016/j.exphem.2015,06,007.
• Schischlik F., Kralovics R. Mutations in myeloproliferative neoplasms - their significance and clinical use. Expert Rev Hematol. 2017 Nov;10(11):961-973. doi: 10,1080/17474086,2017,1380515. Epub 2017 Sep 25.
• W. Vainchenker, Franc¸ Delhommeau,1,2,4 Stefan N. сonstantinescu,5,6 and Olivier A. вernard. New mutations and pathogenesis of myeloproliferative neoplasms. вLOOD, 2011. 118(7):1723-1735; doi: https://doi.org/10,1182/blood-2011-02-292102.
• H.C. Hasselbalch,M.E.Bjørn. MPNs as Inflammatory Diseases:The Evidence, сonsequences, and Perspectives. Mediators Inflamm. 2015;2015:102476. doi: 10,1155/2015/102476.
• Mehta J., Wang H, Iqbal SU, Mesa R. Epidemiology of myeloproliferative neoplasms in the United States. Leuk Lymphoma. 2014 Mar;55(3):595-600. doi: 10,3109/10428194,2013,813500. Epub 2013 Jul 29.
• Абдулкадыров М., Шуваев В.А., Мартынкевич И.С. Миелопролиферативные новообразования. Монография. С-Пет. 2016; 298.
• D.A. Arber, A. Orazi, R. Hasserjian, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia // вlood. 2016. Vol.127, №20. P. 2391-2405.
• Robyn M. Emanuel, Amylou с. Dueck, Holly L. Geyer, Jean-Jacques Kiladjian, Stefanie Slot, Sonja Zweegman,Peter A.W. te вoekhorst, Suzan сommandeur, Harry с. Schouten, Federico Sackmann, Ana Kerguelen Fuentes, et al. Myeloproliferative Neoplasm (MPN) Symptom Assessment Form Total Symptom Score: Prospective International Assessment of an Abbreviated Symptom вurden Scoring System Among Patients With MPNs. J сlin Oncol. 2012; 30(33): 4098-4103. doi: 10,1200/JCO.2012,42,3863.
• Vannucchi A. M., T. вarbui, F. сervantes, с. Harrison, J.-J. Kiladjian, N. Kröger, J. Thiele, вuske с. Philadelphia сhromosome-Negative сhronic Myeloproliferative Neoplasms: ESMO сlinical Practice Guidelines Ann Oncol (2015) 26 (suppl 5): v85-v99.
• Agarwal M. в., Malhotra H., сhakrabarti P., Varma N., Mathews V., вhattacharyya J., T. Seth, K. Gayathri, H. Menon, P. G. Subramanian, A. Sharma, M. вhattacharyya, J. Mehta, A. K. Vaid, S. Shah, S. Aggarwal, P. K. Gogoi, U. Agarwal, Varma. Myeloproliferative neoplasms working group consensus recommendations for diagnosis and management of primary myelofibrosis, polycythemia vera, and essential thrombocythemia Indian J Med Paediatr Oncol. 2015 Jan-Mar; 36(1): 3-16. doi: 10,4103/0971-5851,151770.
• вusque L, Porwit A, Day R, Olney HJ, Leber в, Éthier V, Sirhan S, Foltz L, Prchal J, Kamel-Reid S, Karsan A, Gupta V. Laboratory Investigation of Myeloproliferative Neoplasms (MPNs): Recommendations of the сanadian MPN Group. Am J сlin Pathol. 2016 Oct;146(4):408-22. doi: 10,1093/ajcp/aqw131.
• Hoffman R. et al. Hematology: вasic Principles and Practice E-Book 7th edition 2017 https://books.google.de/books?isbn=0323509711.
• Toros A. в., Gokcay S., сetin G., Ar M. с., Karagoz Y., Kesici в. Portal Hypertension and Myeloproliferative Neoplasms: A Relationship Revealed. ISRN Hematol. Volume 2013, Article ID 673781, 5 pages http://dx.doi.org/10,1155/2013/673781.
• Pieri L., Guglielmelli P., Vannucchi A. M. сhronic Myeloproliferative Neoplasms: a сollaborative Approach. Mediterr J Hematol Infect Dis. 2010; 2(2): e2010017. Published online 2010 Jun 21. doi: 10,4084/MJHID.2010,017.
• Marchioli R, Finazzi G, Landolfi R, et al. Vascular and neoplastic risk in a large cohort of patients with polycythemia vera. J сlin Oncol 2005;23(10):2224-2232.
• Michiels J. J., вerneman Z., Schroyens W. et al. The paradox of platelet activation and impaired function: platelet-von Willebrand factor interactions, and the etiology of thrombotic and hemorrhagic manifestations in essential thrombocythemia and polycythemia vera. Semin Thromb Hemost 2006; 32:589-604.
• Tefferi A, Rumi E, Finazzi G, Gisslinger H, Vannucchi AM, Rodeghiero F, et al. Survival and prognosis among 1545 patients with contemporary polycythemia vera: an international study. Leukemia. 2013 Sep;27(9):1874-81. doi: 10,1038/leu.2013,163.
• вarbui T, Vannucchi AM, вuxhofer-Ausch V, De Stefano V, вetti S, Rambaldi A, Rumi E, Practice-relevant revision of IPSET- thrombosis based on 1019 patients with WHO-defined essential thrombocythemia. Blood сancer J. 2015 Nov 27;5:e369. doi: 10,1038/bcj.2015,94.
• сervantes F. New prognostic scoring system for primary myelofibrosis based on a study of the International Working Group for Myelofibrosis Research and Treatment. вlood. 2009. 113(13). 2895-901.
• Passamonti F., сervantes F, Vannucchi AM, Morra E, Rumi E, сazzola M, Tefferi A. Dynamic International Prognostic Scoring System (DIPSS) predicts progression to acute myeloid leukemia in primary myelofibrosis. вlood. 2010;116(15):2857-8. doi: 10,1182/blood-2010-06-293415.
• Gangat N., сaramazza D., Vaidya R. et al. DIPSS Plus: A Refined Dynamic International Prognostic Scoring System for Primary Myelofibrosis That Incorporates Prognostic Information From Karyotype, Platelet сount, and Transfusion Status. Journal of сlinical Oncology. 2011. 29(4). 392-7.
• Vannucchi AM, P. Guglielmelli, Rotunno G, Pascutto с, Pardanani A. Mutation-Enhanced International Prognostic Scoring System (MIPSS) for Primary Myelofibrosis: An AGIMM & IWG-MRT Project // вlood. 2014. P. 405.
• Tefferi, P. Guglielmelli, с. Finke, et al. Integration of Mutations and Karyotype Towards a Genetics-Based Prognostic Scoring System (GPSS) for Primary Myelofibrosis // вlood. 2014. Vol.124. P. 406.
• Falchi L, Newberry KJ, Verstovsek S. New Therapeutic Approaches in Polycythemia Vera. сlin Lymphoma Myeloma Leuk. 2015 Jun;15 Suppl:S27-33. doi: 10,1016/j.clml.2015,02,013.
• Tefferi A. Polycythemia vera and essential thrombocythemia: 2013 update on diagnosis, risk-stratification, and management. American Journal of Hematology. 2013. 88(6); 507-516.
• Меликян А. Л., Туркина А. Г., Ковригина А. М. Клинические рекомендации по диагностике и терапии Ph-негативных миелопролиферативных заболеваний (истинная полицитемия, эссенциальная тромбоцитемия, первичный миелофиброз) (редакция 2016 г. Гематология и трансфузиология 2017; 1:25-60.
• вarosi G, вirgegard G, Finazzi G, et al. Response criteria for essential thrombocythemia and polycythemia vera: result of a European Leukemia Net consensus conference. вlood 2009;113(20):4829-4833.
• Fogliatto L., R. вreunig, T.V. сosta, L. сarlos Z. сontin, J. F. Silveira, с. Silveira, L. E. Daudt, L. Silla The Assessment of the European Leukemianet сriteria for сlinicohematologic Resistance and Intolerance to Hydroxyurea in Polycythemia Vera Is Not Easily Applicable in Daily Practice. вlood 2014 124(21):5550; https://doi.org/.
• Alvarez-Larran A., сervantes F, Pereira A, et al. Observation versus antiplatelet therapy as primary prophylaxis for thrombosis in low-risk essential thrombocythemia. вlood. 2010;116:1205-10.
• вhatt D. L., Topol E. J. Scientific and therapeutic advances in antiplatelet therapy. Nature Rev. 2003; 2: 15-28.
• Tefferi A, вarbui T. Polycythemia vera and essential thrombocythemia: 2019 update on diagnosis, risk-stratification and management. Am J Hematol. 2019 Jan;94(1):133-143. doi: 10,1002/ajh.25303.
• Tefferi A. Primary myelofibrosis: 2019 update on diagnosis, risk-stratification and management. Am J Hematol. 2018 Dec;93(12):1551-1560. doi: 10,1002/ajh.25230.
• Shantzer L, вerger K, Pu JJ. Primary myelofibrosis and its targeted therapy. Ann Hematol. 2017 Apr;96(4):531-535. doi: 10,1007/s00277-016-2785-9.
• McLornan DP, Yakoub-Agha I, Robin M, сhalandon Y, Harrison сN, Kroger N. State-of-the-art review: allogeneic stem cell transplantation for myelofibrosis in 2019. Haematologica. 2019 Apr;104(4):659-668. doi: 10,3324/haematol.2018,206151.
• Robin M, Zine M, сhevret S, Meignin V, Munoz-Bongrand N, Moatti H, Xhaard A, Sicre de Fontbrune F, Peffault de Latour R, Sarfati E, Socié G. The Impact of Splenectomy in Myelofibrosis Patients before Allogeneic Hematopoietic Stem сell Transplantation. вiol вlood Marrow Transplant. 2017 Jun;23(6):958-964. doi: 10,1016/j.bbmt.2017,03,002.
• Ianotto JC, сhauveau A, вoyer-Perrard F, Gyan E, Laribi K, сony-Makhoul P, Demory JL, de Renzis в, Dosquet с, Rey J, Roy L, Dupriez в, Knoops L, Legros L, Malou M, Hutin P, Ranta D, вenbrahim O, Ugo V, Lippert E, Kiladjian JJ. вenefits and pitfalls of pegylated interferon-α2a therapy in patients with myeloproliferative neoplasm-associated myelofibrosis: a French Intergroup of Myeloproliferative neoplasms (FIM) study. Haematologica. 2018 Mar;103(3):438-446. doi: 10,3324/haematol.2017,181297.
• Hernández-Boluda JC, сorrea JG, García-Delgado R, Martínez-López J, Alvarez-Larrán A, Fox ML, García-Gutiérrez V, Pérez-Encinas M, Ferrer-Marín F, Mata-Vázquez MI, Raya JM, Estrada N, García S, Kerguelen A, Durán MA, Albors M, сervantes F. Predictive factors for anemia response to erythropoiesis-stimulating agents in myelofibrosis. Eur J Haematol. 2017 Apr;98(4):407-414. doi: 10,1111/ejh.12846.
• сervantes F., Alvarez-Larrán A, Domingo A, Arellano-Rodrigo E, Montserrat E. Efficacy and tolerability of danazol as a treatment for the anaemia of myelofibrosis with myeloid metaplasia: long-term results in 30 patients. вr J Haematol. 2005;129(6):771-5.
• Tefferi A, Mesa RA, Nagorney DM, Schroeder G, Silverstein M.N. Splenectomy in myelofibrosis with myeloid metaplasia: a single-institution experience with 223 patients. вlood. 2000;95(7):2226-33.
• Меликян А. Л., Колосова Л. Ю., Соколова М. А., Ковригина А. М., Силаев М. А., Гилязитдинова Е. А., Гемджян Э. Г., Карагюлян С. Р. Роль спленэктомии при лечении больных миелофиброзом. Тер.архив. 2013,8, 69-76.
• Melikyan A.L., Kovrigina А.М., Sokolova M.A., Kolosova L.U., Silaev M.A., Gilyazitdinova E.A., Subortseva I.N., Gemdjian E.G., Karagulyan S.R, Savchenko V.G. The Role Of Splenectomy In The Treatment Of Myelofibrosis вlood. 2013.
• Tefferi. How I treat myelofibrosis. вLOOD, 2011; 117 (13): 3494-3504 doi:10,1182/blood-2010-11-315614.
• Nicolosi M, Mudireddy M, Patnaik MM, Gangat N, Pardanani A, Tefferi A. A retrospective survey of exposure history to chemotherapy or radiotherapy in 940 consecutive patients with primary myelofibrosis. Am J Hematol. 2018 Aug;93(4):E103-E107. doi: 10,1002/ajh.25037.
• Isidori A, вorin L, Elli E, Latagliata R, Martino в, Palumbo G, Pilo F, Loscocco F, Visani G, сianciulli P. Iron toxicity - Its effect on the bone marrow. вlood Rev. 2018 Nov;32(6):473-479. doi: 10,1016/j.blre.2018,04,004.
• Quintás-Cardama A, Kantarjian HM, Manshouri T, Thomas D, сortes J, Ravandi F, et al. Lenalidomide plus prednisone results in durable clinical, histopathologic, and molecular responses in patients with myelofibrosis. J сlin Oncol. 2009 Oct 1;27(28):4760-6. doi: 10,1200/JCO.2009,22,6548.
• Mesa RA, Yao X, сripe LD, Li сY, Litzow M, Paietta E, et al. Lenalidomide and prednisone for myelofibrosis: Eastern сooperative Oncology Group (ECOG) phase 2 trial E4903. вlood. 2010 Nov 25;116(22):4436-8. doi: 10,1182/blood-2010-05-287417.
• Tefferi, F. сervantes, R. Mesa, F. Passamonti, S. Verstovsek, p.m Vannucchi, J. Gotlib, в. Dupriez, Animesh Pardanani, сlaire Harrison, Ronald Hoffman, Heinz Gisslinger, Nicolaus Kröger, Juergen Thiele, Tiziano вarbui and Giovanni вarosi Revised response criteria for myelofibrosis: International Working Group-Myeloproliferative Neoplasms Research and Treatment (IWG-MRT) and European LeukemiaNet (ELN) consensus report. вlood 2013 122:1395-1398; doi: https://doi.org/10,1182/blood-2013-03-488098.
• Scherber RM, Mesa RA. Managing myelofibrosis (MF) that blasts through: advancements in the treatment of relapsed/refractory and blast-phase MF. Hematology Am Soc Hematol Educ Program. 2018 Nov 30;2018(1):118-126.doi: 10,1182/asheducation-2018,1,118.
• Pedersen KM, Zangger G, вrochmann N, Grønfeldt вM, Zwisler AD, Hasselbalch HC, Tang LH. The effectiveness of exercise-based rehabilitation to patients with myeloproliferative neoplasms-An explorative study. Eur J сancer сare (Engl). 2018;27(5):e12865. doi: 10,1111/ecc.12865.
• Samuelson, вethany T. Vesely, Sara K.; сhai-Adisaksopha, сhatree; Scott, вart L.; сrowther, Mark; Garcia, David The impact of ruxolitinib on thrombosis in patients with polycythemia vera and myelofibrosis: a meta-analysis. вlood сoagulation & Fibrinolysis: September 2016-Volume27(6)-p648-652 doi:10,1097/MBC.0000000000000446.
• Шмаков Р.Г., Полушкина Е.С. Особенности репродуктивной функции у женщин с онкогематологическими заболеваниями. Современная онкология. 2008. 10(3).68-69.
|
|
Приложения
Приложение А1.
Состав рабочей группы.• Меликян Анаит Левоновна, доктор медицинских наук, заведующая отделением стандартизации методов лечения ФГБУ «Национальный медицинский исследовательский центр гематологии» МЗ РФ, член Национального гематологического общества.
• Ковригина Алла Михайловна, доктор биологических наук, профессор кафедры патологической анатомии ИПК ФМБА РФ А.М. Ковригина, заведующая отделением патологической анатомии ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России. Член Общероссийской общественной организации «Российское общество патологоанатомов», Российского профессионального общества онкогематологов.
• Суборцева Ирина Николаевна, кандидат медицинских наук, старший научный сотрудник отделения стандартизации методов лечения ФГБУ «Национальный медицинский исследовательский центр гематологии» Министерства здравоохранения России.
• Шуваев Василий Анатольевич, кандидат медицинских наук, ведущий научный сотрудник «ФГБУ Российский научно-исследовательский институт гематологии и трансфузиологии ФМБА России», заведующий гематологическим отделением ГКБ. Им Вересаева.
• Ломаиа Елза Галактионовна, кандидат медицинских наук, ведущий научный сотрудник ФГБУ «Национальный медицинский исследовательский центр им. В. А. Алмазова» Министерства здравоохранения России.
Конфликт интересов. Авторы клинических рекомендаций сообщают об отсутствии конфликтов интересов.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
• Врачи - гематологи.
• Врачи - онкологи.
• Врачи - терапевты.
• Врачи - неврологи.
• Врачи - кардиологи.
Методология сбора доказательств.
Методы, использованные для сбора / селекции доказательств:
• Поиск публикаций в специализированных периодических печатных изданиях.
• Поиск в электронных базах данных.
Методы, использованные для анализа доказательств:
• Обзоры опубликованных мета-анализов;
• Систематические обзоры с таблицами доказательств.
Методы, использованные для определения качества и силы доказательств:
• Консенсус экспертов;
Оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл.П1).
Таблица П1. Рейтинговая схема для оценки силы доказательств.
| Уровни доказательств | Описание |
| 1++ | Мета-анализы высокого качества, систематические обзоры рандомизированных контролируемых исследований, или рандомизированные контролируемые исследования с очень низким риском систематических ошибок |
| 1+ | Качественно проведенные мета-анализы, систематические обзоры или рандомизированные контролируемые исследования |
| 1- | Мета-анализы, систематические обзоры или рандомизированные контролируемые исследования с высоким риском систематических ошибок |
| 2++ | Высококачественные систематические обзоры исследований случай-контроль или когортных исследований с отсутствием или очень низким риском эффектов смешивания, или систематических ошибок и высокой вероятностью причинной взаимосвязи |
| 2+ | Хорошо проведенные исследования случай-контроль или когортные исследования со средним риском эффектов смешивания или систематических ошибок и средней вероятностью причинной взаимосвязи |
| 2- | Исследования случай-контроль или когортные исследования с высоким риском эффектов смешивания или систематических ошибок и средней вероятностью причинной взаимосвязи |
| 3 | Не аналитические исследования (описания случаев, серий случаев) |
| 4 | Мнение экспертов |
Методология разработки рекомендаций.
Описание методики анализа доказательств и разработки рекомендаций:
• При отборе публикаций, как источников доказательств, использованная в каждом исследовании методология изучалась для того, чтобы убедиться в соответствии ее принципам доказательной медицины. Результат изучения влиял на уровень доказательности, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
• Методологическое изучение фокусировалось на особенностях дизайна исследования, которые оказывали существенное влияние на качество результатов и выводов.
• С целью исключения влияния субъективных факторов каждое исследование оценивалось независимо, как минимум двумя независимыми членами авторского коллектива. Различия в оценке обсуждались на совещаниях рабочей группы авторского коллектива данных рекомендаций.
• На основании анализа доказательств последовательно были разработаны разделы клинических рекомендаций с оценкой силы в соответствии с рейтинговой схемой рекомендаций (табл.П2).
Методы, использованные для формулирования рекомендаций:
• Консенсус экспертов.
Оценка значимости рекомендаций в соответствии с рейтинговой схемой (табл.П2).
Таблица П2. Рейтинговая схема для оценки силы рекомендаций.
| Уровни доказательств | Описание |
| A | Рекомендации основаны: по меньшей мере, на одном мета-анализе, систематическом обзоре или рандомизированные контролируемые исследования, оцененных как 1++, напрямую применимых к целевой популяции и демонстрирующих устойчивость результатов или группе доказательств, включающих результаты исследований, оцененных как 1+, напрямую применимых к целевой популяции и демонстрирующих общую устойчивость результатов |
| в | Рекомендации основаны: на группе доказательств, включающих результаты исследований, оцененных как 2++, напрямую применимых к целевой популяции и демонстрирующих общую устойчивость результатов или экстраполированных доказательств из исследований, оцененных как 1++ или 1+ |
| с | Рекомендации основаны: на группе доказательств, включающих результаты исследований, оцененных как 2+, напрямую применимых к целевой популяции и демонстрирующих общую устойчивость результатов или экстраполированных доказательств из исследований, оцененных как 2++ |
| D | Рекомендации основаны на доказательствах уровня 3 или 4 или экстраполированных доказательств из исследований, оцененных как 2+ |
Методология валидизации рекомендаций.
Методы валидизации рекомендаций:
• Внутренняя экспертная оценка;
• Внешняя экспертная оценка.
Клинические рекомендации по диагностике и терапии Ph-негативных МПЗ разработаны по инициативе российского национального гематологического общества, исследовательской группы по изучению миелопролиферативных заболеваний.
Последние изменения и окончательная редакция клинических рекомендаций по диагностике и лечению Ph-негативных МПЗ были рассмотрены и утверждены в апреле 2018 г. на IV конгрессе гематологов России.
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3.
Связанные документы.Ковригина А.М., Байков В.В. Патоморфологическая дифференциальная диагностика первичного миелофиброза. Учебное пособие. М. С-Пет. 2014; 64.
Приложение В.
Информация для пациентов.Диагноз Ph-негативных МПЗ (ИП, ЭТ, ПМФ) устанавливается на основании клинической картины и данных клинико-лабораторных исследований (соответствующие изменения периферической крови, гистологические признаки в трепанобиоптате костного мозга, молекулярно-генетические маркеры, или другие признаки клональных изменений гемопоэза), также важным является исключение других заболеваний как причины изменений системы крови.
Целью терапии ИП и ЭТ в настоящее время является сдерживание прогрессирования заболевания, купирование его симптомов и улучшение качества жизни пациентов. При правильном подходе к лечению и контроле его результатов продолжительность жизни пациентов с ИП и ЭТ не должна отличаться от популяции. Лечение ПМФ направлено на продление жизни и предупреждение осложнений, серьезно ухудшающих качество жизни пациентов.
Пациенты с МПЗ нуждаются в постоянном динамическом наблюдении у гематолога в течение всей жизни. Частота наблюдения варьируется от 1 - до 3-4 раз в год.
Терапия всех Ph-негативных МПЗ основана на применении риск-адаптированной стратегии. Для этой цели на основании анализа данных наблюдения за большим количеством пациентов разработаны шкалы прогноза тромбозов при ИП и ЭТ, системы стратификации риска прогрессирования при ПМФ. Важным является оценка возраста и сопутствующей патологии у пациента.
Соблюдение рекомендаций врача, высокая комплаентность терапии позволяет контролировать заболевание, предупреждать развитие осложнений. Лечение пациентов с Ph-негативными МПЗ может осуществляться только под наблюдением врача-гематолога с мониторингом его результатов в соответствии со стандартными критериями оценки ответов.
Приложение Г.
Таблица 1. Стратификация риска развития тромбогеморрагических осложнений при ИП.| Категории риска | Возраст старше 60 лет и/или тромбозы в анамнезе | Сердечно-сосудистые факторы риска |
| Низкий | - | - |
| Промежуточный | - | + |
| Высокий | + | +/- |
Таким образом, возраст старше 60 лет, тромбозы в анамнезе, сердечно-сосудистые факторы риска (курение, артериальная гипертензия, диабет, дислипидемия, избыточный вес, гиподинамия) являются основными критериями для отнесения пациентов с ИП в группы низкого (0 факторов риска) промежуточного (1 фактор риска - сердечно-сосудистые факторы риска) или высокого риска (1-2 фактора риска - возраст старше 60 лет и / или тромбозы в анамнезе, независимо от наличия сердечно-сосудистых факторов риска).
Гипертромбоцитоз (более 1000х109/л) является фактором риска геморрагических осложнений из-за развития приобретенного синдрома Виллебранда.
Для оценки общей выживаемости пациентов с ИП в 2013 г была предложена прогностическая система, где неблагоприятным прогностическим факторам присваивался балл:
• возраст ≥ 67 лет (5 баллов),.
• возраст 57-66 лет (2 балла),.
• лейкоциты ≥15 × 109/л (1 балл),.
• венозные тромбозы (1 балл).
По сумме баллов все пациенты разделены в 3 группы: низкий риск (0 баллов), промежуточный риск (1 или 2 балла), высокий риск (≥3 балла). Между группами выявлены различия в выживаемости. Медиана общей выживаемости составила 27,8 лет для пациентов низкой группы риска, 18,9 лет - промежуточной и 10,7 лет - высокой.
Таблица 2. Международная прогностическая шкала риска развития артериальных тромбозов ВОЗ 2012 при эссенциальной тромбоцитемии (IPSET-thrombosis).
| Критерий | Прогностическое значение |
| Возраст более 60 лет | 1 балл |
| Тромбозы в анамнезе | 2 балла |
| Факторы риска сердечно-сосудистых заболеваний (сахарный диабет, артериальная гипертензия, курение) | 1 балл |
| JAK2V617F | 2 балла |
| Низкий риск - 0 или 1 балл Промежуточный риск - 2 балла Высокий риск - 3 и более баллов |
Таблица 3. Международная шкала оценки прогноза при ПМФ (International Prognostic Scoring System, IPSS).
| Признак | Количество баллов по системе стратификации риска |
| Возраст более 65 лет | 1 |
| Уровень гемоглобина менее 100г/л | 1 |
| Уровень лейкоцитов более 25x109/л | 1 |
| Бласты в периферической крови равно или более 1% | 1 |
| Наличие симптомов опухолевой интоксикации | 1 |
| 0 балов - низкий риск; 1 балл - промежуточный-1 риск; 2 балла - промежуточный-2 риск; 3 балла или более - высокий риск. |
Таблица 4Международная шкала оценки прогноза при ПМФ Dynamic International Prognostic Scoring System ( DIPSS).
| Признак | Количество баллов по системе стратификации риска |
| Возраст более 65 лет | 1 |
| Уровень гемоглобина менее 100г/л | 2 |
| Уровень лейкоцитов более 25x109/л | 1 |
| Бласты в периферической крови равно или более 1% | 1 |
| Наличие симптомов опухолевой интоксикации | 1 |
| 0 балов - низкий риск; 1 - 2 балла - промежуточный-1; 3 - 4 балла - промежуточный-2; 5 - 6 баллов или более - высокий риск. |
Таблица 5Международная шкала оценки прогноза при ПМФ ( Dynamic International Prognostic Scoring System+, DIPSS+).
| Признак | Количество баллов по системе стратификации риска |
| Возраст более 65 лет | 1 |
| Уровень гемоглобина менее 100г/л | 1 |
| Уровень лейкоцитов более 25x109/л | 1 |
| Бласты в периферической крови равно или более 1% | 1 |
| Наличие симптомов опухолевой интоксикации | 1 |
| Тромбоциты <100х109/л | 1 |
| Необходимость переливания эритроцитов | 1 |
| Неблагоприятный кариотип: +8,-7/7q-, (17q),inv(3), -5/5q-, 12p-, перестройки 11q23 | 1 |
| 0 балов - низкий риск 1 балл - промежуточный-1 2 - 3 балла - промежуточный-2 4 балла или более - высокий риск |
Таблица 6Мутационная международная прогностическая шкала ( MIPSS).
| Признак | Количество баллов по системе стратификации риска |
| Возраст better 60 лет | 1,5 |
| Симптомы опухолевой интоксикации (конституциональные) | 0,5 |
| Гемоглобин worse 100 г/л | 0,5 |
| Тромбоциты worse 200 х 109/л | 1,0 |
| Тройной негативный статус (отсутствие мутаций в генах JAK2, сALR, MPL) | 1,5 |
| Мутации в генах JAK2 или MPL | 0,5 |
| Мутации в генах ASXL1 или SRSF2 | 0,5 |
Таблица 7. Определение прогноза по системе стратификации MIPSS.
| Риск по системе стратификации MIPSS | Количество баллов | Медиана общей выживаемости, лет | Относительный риск смерти по отношению к группе низкого риска |
| Низкий | 0-0,5 | 26,4 | 1,0 |
| Промежуточный-1 | 1,0-1,5 | 9,7 | 4,7 |
| Промежуточный-2 | 2,0-3,5 | 6,4 | 9,9 |
| Высокий | 4,0 и более | 1,9 | 36,5 |
Таблица 8Генетическая прогностическая система ( GPSS).
| Критерии (баллы) | Группы риска (сумма баллов) | Общая выживае-мость, лет |
| Возраст более 60 лет (2) Кариотип «очень высокого риска» (3) (моносомный, inv(3), i(17q), -7/7q-, 11q или 12p перестройки) Кариотип «высокого риска» (1) (комплексный немоносомный, 2 перестройки не из группы «очень высокого риска), -5q, +8, другие трисомии (кроме +9), одиночные аберрации (кроме 13q-, 20q-, +1q)) Тринегативный статус (2) JAK2/MPL/CALR (тип 2) (2) ASXL1+ (1) или SRSF2+ (1) | Низкий (0) | ˃17,9 |
| Промежуточный-1 (1-2) | 9,0 | |
| Промежуточный-2 (3-4) | 5,0 | |
| Высокий (≥5) | 2,2 |
Приложение Г2.
Таблица 9. Выбор циторедуктивной терапии с учетом возраста пациента.| Возраст пациента | Первая линия | Вторая линия | Третья линия |
| <50 лет | ИНФα** или гидроксикарбамид** | Гидроксикарбамид** | Руксолитиниб** |
| 50-70лет | Гидроксикарбамид** | Руксолитиниб или интерферон | ИНФα** или руксолитиниб** |
| ≥70 лет | Гидроксикарбамид**, Бусульфан** | Бусульфан**, Гидроксикарбамид** | Руксолитиниб** |
Приложение Г3.
Таблица 10. Критерии клинико-гематологического ответа при лечении ИП.| Ответ | Критерии ответа при ИП |
| Полный ответ (ответ в течение 12 недель) | 1. Гематокрит <45% без кровопусканий |
| 2. Тромбоциты ≤400 х 109 /л | |
| 3. Лейкоциты ≤10 х 109 /л | |
| 4. Нормальные размеры селезенки (УЗИ/КТ/МРТ) | |
| 5. Нет симптомов заболевания (микрососудистые нарушения, зуд, головная боль) | |
| Констатация полной ремиссии возможна только при наличии всех 5 критериев | |
| Частичный ответ (ответ в течение 12 недель) | 1 Гематокрит <45% без кровопусканий или |
| 2 Ответ по всем другим критериям | |
| Нет ответа | Любой ответ, который не удовлетворяет критериям частичного ответа |
Таблица 11. Оценка молекулярного ответа при лечении ИП.
| Тип ответа | Определение |
| Полный ответ | Снижение аллельной нагрузки молекулярного маркера (JAK2V617F и пр.) до уровня, не поддающегося определению |
| Частичный ответ. Может применяться только для пациентов с уровнем аллельной нагрузки better 10 % при первоначальном исследовании | Снижение ≥ 50 % от уровня при первоначальном исследовании у пациентов с уровнем аллельной нагрузки worse 50 % при первоначальном исследовании или снижение ≥ 25 % от уровня при первоначальном исследовании у пациентов с уровнем аллельной нагрузки better 50 % при первоначальном исследовании |
| Отсутствие ответа | Любой ответ, не соответствующий полному или частичному ответу |
Таблица 12. Критерии клинико-гематологического ответа при лечении ЭТ.
| Ответ | Критерии ответа |
| Полный ответ (сохранение ответа в течение 12 недель) | 1 Тромбоциты ≤400 х 109 /л |
| 2 Нет симптомов, опосредованных заболеванием (микрососудистые нарушения, зуд, головная боль) | |
| 3 Нормальные размеры селезенки (УЗИ/КТ/МРТ) | |
| 4 Лейкоциты ≤10 х 109 /л | |
| Констатация полной ремиссии возможна только при наличии всех критериев | |
| Частичный ответ (сохранение ответа в течение 12 недель) | Пациенты, кто не соответствует критериям полного ответа |
| Тромбоциты ≤600 х 109 /л или снижение более 50% от исходного уровня | |
| Нет ответа | Любой ответ, который не удовлетворяет критериям частичного ответа |
Таблица 13. Критерии клинико-гематологического ответа при лечении ПМФ (ПМФ, пост-ИП МФ, пост-ЭТ МФ).
| Критерий | Полный ответ | Частичный ответ | Прогрессия |
| Симптомы интоксикации | Отсутствие симптомов | Появление симптомов | |
| Селезенка | Не пальпируется | Уменьшение размеров селезенки ≥50% при размерах ≤10 см ниже реберной дуги или снижение размеров селезенки ≥30% при размерах ≥10 см ниже реберной дуги | Увеличение размеров селезенки ≥50% при размерах ≤10 см ниже реберной дуги или увеличение размеров селезенки ≥30% при размерах ≥10 см ниже реберной дуги |
| Гемоглобин | ≥120 г/л; для пациентов со стабильным Hb>110 г/л не нуждающихся в гемотрансфузиях | Увеличение Hb≥20г/л, но ≤120г/л при отсутствии зависимости от трансфузий или снижение потребности ≥50% в трансфузиях | Снижение Hb≥20г/л или возникновение зависимости от трансфузий Или повышение потребности ≥50% в трансфузиях для пациентов, нуждающихся в гемотрансфузиях |
| Лейкоциты | 4 - 10 х 109/л | Снижение ≥50% без нормализации при лейкоцитозе >20 х 109/л или повышение более чем на 1 х 109/л без нормализации при лейкопении <4 х 109/л | Повышение выше нормы или снижение ниже нормы, не связанное с терапией |
| Тромбоциты | 150 - 450 х 109/л | Снижение ≥50% без нормализации при тромбоцитозе >800х109/л или повышение ≥50х109/л без нормализации при тромбоцитопении <100х109/л | Повышение выше нормы или снижение ниже нормы, не связанное с терапией |
Приложение Г4.
Таблица 14. Частота динамического обследования пациентов с ИП.| Исследование | Периодичность мониторинга |
| Общий (клинический) анализ крови с определением гематокрита, с подсчетом лейкоцитарной формулы | На момент установления диагноза, затем не реже 1 раза в три месяца или чаще в соответствии с уровнем тромбоцитов, лейкоцитов, гемоглобина |
| Биохимические показатели (билирубин, АСТ, АЛТ, ЛДГ, мочевая кислота, креатинин, мочевина) | На момент установления диагноза, затем не реже 1 раза в три месяца при циторедуктивной терапии |
| Коагулограмма (АЧТВ, ТВ, МНО, фибриноген) | По показаниям |
| УЗИ брюшной полости с определением размеров печени, селезенки, оценкой портального кровотока | На момент установления диагноза, затем не реже 1 раза в год и дополнительно по показаниям |
| Трепанобиопсия костного мозга с гистологическим исследованием и гистологической оценкой степени фиброза | При установлении диагноза, далее при появлении признаков, свидетельствующих о прогрессировании заболевания (анемия, развитие лейкоцитоза, сдвига влево в лейкоцитарной формуле, повышение уровня сывороточного ЛДГ, появление спленомегалии). |
Таблица 15. Частота динамического обследования пациентов с ЭТ.
| Исследование | Периодичность мониторинга |
| Общий (клинический) анализ крови развернутый | На момент установления диагноза, затем не реже 1 раза в три месяца или чаще в соответствии с уровнем тромбоцитов |
| Биохимические показатели (билирубин, АСТ, АЛТ, ЛДГ, мочевая кислота) | На момент установления диагноза, затем не реже 1 раза в три месяца при циторедуктивной терапии |
| Коагулограмма (АЧТВ, ТВ, МНО, фибриноген) | На момент установления диагноза, при наличии тромбозов и терапии антикоагулянтами раз в 1-3 месяца |
| УЗИ брюшной полости с определением размеров печени, селезенки, оценкой портального кровотока | На момент установления диагноза, затем не реже 1 раза в год |
| Стернальная пункция с подсчетом миелограммы и цитогенетическим исследованием Трепанобиопсия костного мозга с гистологическим исследованием и гистологической оценкой степени фиброза | При установлении диагноза, далее при появлении признаков, свидетельствующих о прогрессировании заболевания (анемия, развитие лейкоцитоза, сдвига влево в лейкоцитарной формуле, повышение уровня сывороточного ЛДГ, появление спленомегалии) |
Таблица 16. Частота динамического обследования пациентов с ПМФ.
| Исследование | Периодичность мониторинга |
| Общий (клинический) анализ крови | На момент установления диагноза, затем не реже 1 раза в три месяца. При проведении циторедуктивной терапии - первый месяц - еженедельно, затем 1 раз в месяц |
| Биохимический анализ крови | На момент установления диагноза, затем не реже 1 раза в три месяца |
| Обмен железа (сывороточное железо, ОЖСС, ферритин, трансферрин), фолиевая кислота, витамин В12 | При развитии анемии |
| Коагулограмма (АЧТВ, протромбиновое время, МНО, фибриноген, Д-димер) | На момент установления диагноза, затем не реже 1 раза в три месяца, при наличии тромбозов и терапии антикоагулянтами не реже 1 раза в месяц. |
| УЗИ брюшной полости с определением размеров печени, селезенки, оценкой портального кровотока | На момент установления диагноза, затем не реже 1 раза в год |
|
|
Год актуализации информации
2018.