
МКБ-10 коды
- МКБ-10
- C80 Злокачественное новообразование без уточнения локализации
- C76.0 Злокачественное новообразование головы, лица и шеи
- C76.2 Злокачественное новообразование живота
- C76.7 Злокачественное новообразование других неточно обозначенных локализаций
- C76.8 Злокачественное новообразование других и неточно обозначенных локализаций, выходящее за пределы одной и более вышеуказанных локализаций
- C76.3 Злокачественное новообразование таза
- C76 Злокачественное новообразование других и неточно обозначенных локализаций
- C76.1 Злокачественное новообразование грудной клетки
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: с76-C80.
Год утверждения (частота пересмотра): 2021.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2023.
ID: 504.
Разработчик клинической рекомендации.
• Ассоциация онкологов России.
• Общероссийская общественная организация «Российское общество клинической онкологии».
• Региональная общественная организация Общество Специалистов Поддерживающей Терапии в Онкологии .
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2021.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2023.
ID: 504.
Разработчик клинической рекомендации.
• Ассоциация онкологов России.
• Общероссийская общественная организация «Российское общество клинической онкологии».
• Региональная общественная организация Общество Специалистов Поддерживающей Терапии в Онкологии .
Одобрено Научно-практическим Советом Минздрава РФ.
|
|
 Список сокращений
Список сокращений
АЛТ - аланинаминотрансфераза.
АСТ - аспартатаминотрансфераза.
АФП - альфа-фетопротеин.
ВПО - выявленный первичный очаг.
Г-КСФ - колониестимулирующие факторы.
ИГХ - иммуногистохимическое исследование.
ИЦХ - иммуноцитохимическое исследование.
КТ - компьютерная томография.
ЛДГ - лактатдегидрогеназа.
ЛТ - лучевая терапия.
МРТ - магнитно-резонансная томография.
НЯ - нежелательные явления.
ОНПЛ - опухоли невыявленной первичной локализации.
ПСА - простатспецифический антиген.
ПЭТ - позитронно-эмиссионная томография.
ПЭТ-КТ - позитронно-эмиссионная томография, совмещенная с КТ.
РМЖ - рак молочной железы.
РП - рак печени.
РФП - радиофармацевтический лекарственный препарат.
РЭА - раково-эмбриональный антиген.
РФ - Российская Федерация.
РЯ - рак яичников.
УЗИ - ультразвуковое исследование.
ФН - фебрильная нейтропения.
ХГЧ, β-ХГЧ - хорионический гонадотропин человека.
ЩФ - щелочная фосфатаза.
ЭГДС - эзофагогастродуоденоскопия.
ECOG - шкала оценки общего состояния онкологического пациента по версии Eastern сooperative Oncology Group.
ER/РЭ - эстрогеновые рецепторы.
ERAS - early rehabilitation after surgery, ранняя реабилитация после операции.
ESMO - Европейское общество медицинской онкологии.
NCCN - Национальная комплексная сеть по борьбе с раком (США).
PR/РП - прогестероновые рецепторы.
18F-ФДГ 18 фтордезоксиглюкоза.
** - жизненно необходимые и важнейшие лекарственные препараты.
АСТ - аспартатаминотрансфераза.
АФП - альфа-фетопротеин.
ВПО - выявленный первичный очаг.
Г-КСФ - колониестимулирующие факторы.
ИГХ - иммуногистохимическое исследование.
ИЦХ - иммуноцитохимическое исследование.
КТ - компьютерная томография.
ЛДГ - лактатдегидрогеназа.
ЛТ - лучевая терапия.
МРТ - магнитно-резонансная томография.
НЯ - нежелательные явления.
ОНПЛ - опухоли невыявленной первичной локализации.
ПСА - простатспецифический антиген.
ПЭТ - позитронно-эмиссионная томография.
ПЭТ-КТ - позитронно-эмиссионная томография, совмещенная с КТ.
РМЖ - рак молочной железы.
РП - рак печени.
РФП - радиофармацевтический лекарственный препарат.
РЭА - раково-эмбриональный антиген.
РФ - Российская Федерация.
РЯ - рак яичников.
УЗИ - ультразвуковое исследование.
ФН - фебрильная нейтропения.
ХГЧ, β-ХГЧ - хорионический гонадотропин человека.
ЩФ - щелочная фосфатаза.
ЭГДС - эзофагогастродуоденоскопия.
ECOG - шкала оценки общего состояния онкологического пациента по версии Eastern сooperative Oncology Group.
ER/РЭ - эстрогеновые рецепторы.
ERAS - early rehabilitation after surgery, ранняя реабилитация после операции.
ESMO - Европейское общество медицинской онкологии.
NCCN - Национальная комплексная сеть по борьбе с раком (США).
PR/РП - прогестероновые рецепторы.
18F-ФДГ 18 фтордезоксиглюкоза.
** - жизненно необходимые и важнейшие лекарственные препараты.
Термины и определения
Поддерживающая (сопроводительная) терапия. Профилактика и лечение осложнений, возникающих как в результате злокачественного заболевания, так и при проведении противоопухолевого лечения. Коррекция этих состояний включает восстановление физических и психологических функций на протяжении всего противоопухолевого лечения, а также в период реабилитации.
Предреабилитация (prehabilitation). Реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Первый этап реабилитации. Реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Второй этап реабилитации. Реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации) в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
Третий этап реабилитации. Реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому ( в условиях санаторно-курортных организаций), кабинетах логопеда (учителя-дефектолога).
В случае реабилитации онкологических пациентов тактика восстановительного лечения и выбор ее методов не привязана к срокам госпитализации. На втором и третьем этапах реабилитации не исключается возможность применения гидротерапии, бальнеотерапии. Без уровня доказательности.
Предреабилитация (prehabilitation). Реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Первый этап реабилитации. Реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Второй этап реабилитации. Реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации) в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
Третий этап реабилитации. Реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому ( в условиях санаторно-курортных организаций), кабинетах логопеда (учителя-дефектолога).
В случае реабилитации онкологических пациентов тактика восстановительного лечения и выбор ее методов не привязана к срокам госпитализации. На втором и третьем этапах реабилитации не исключается возможность применения гидротерапии, бальнеотерапии. Без уровня доказательности.
Описание
Опухоли невыявленной первичной локализации (ОНПЛ). Заболевание, проявляющееся метастатическими опухолями, в то время как первичный очаг невозможно установить ни на основании анамнеза, ни по данным обследований [1].
Причины
В связи с большой гетерогенностью опухоли обычно не удается выделить, какой клон клеток является источником метастазирования, так как в биопсийном (операционном) материале отсутствует набор морфологических признаков, позволяющих отличить клетки по органопринадлежности [2-4]. В среднем идентификация первичного источника осуществляется при жизни только у 25% пациентов. В 15-20% случаев первичный очаг не находят даже на аутопсии [5, 6]. Хотя ОНПЛ отличаются своим происхождением из разных органов, биологическое поведение их приблизительно одинаково. Зачастую они характеризуются случайной, нетипичной локализацией (то есть поражением не регионарных лимфатических узлов), а также быстрым прогрессированием процесса на самых ранних этапах развития.
Эпидемиология
По данным различных авторов, пациенты с ОНПЛ составляют от 3 до 5% онкологических пациентов, обратившихся за медицинской помощью [7-9]. ОНПЛ занимают 7-е место по частоте встречаемости и 4-е место в структуре смертности среди всех злокачественных новообразований [6, 10, 11]. У мужчин и женщин ОНПЛ встречаются приблизительно с одинаковой частотой. С увеличением возраста кривая заболеваемости резко поднимается вверх, достигая пика к 65 годам [5, 8, 12].
Злокачественное новообразование других и неточно обозначенных локализаций (C76):
C76,0 - Головы, лица и шеи.
C76,1 - Грудной клетки.
C76,2 - Живота.
C76,3 - Таза.
C76,4 - Верхней конечности.
C76,5 - Нижней конечности.
C76,7 - Других неуточненных локализаций.
C76,8 - Поражение других и неточно обозначенных локализаций, выходящее за пределы одной и более вышеуказанных локализаций.
Вторичное и неуточненное злокачественное новообразование лимфатических узлов (C77):
C77,0 - Лимфатических узлов головы, лица и шеи.
C77,1 - Внутригрудных лимфатических узлов.
C77,2 - Внутрибрюшных лимфатических узлов.
C77,3 - Лимфатических узлов подмышечной впадины и верхней конечности грудных лимфатических узлов.
C77,4 - Лимфатических узлов паховой области и нижней конечности.
C77,5 - Внутритазовых лимфатических узлов.
C77,8 - Лимфатических узлов множественных локализаций.
C77,9 - Лимфатических узлов неуточненной локализации.
Вторичное злокачественное новообразование органов дыхания и пищеварения (C78):
C78,0 - Вторичное злокачественное новообразование легкого.
C78,1 - Вторичное злокачественное новообразование средостения.
C78,2 - Вторичное злокачественное новообразование плевры.
C78,3 - Вторичное злокачественное новообразование других и не уточненных органов дыхания.
C78,4 - Вторичное злокачественное новообразование тонкого кишечника.
C78,5 - Вторичное злокачественное новообразование толстого кишечника и прямой кишки.
C78,6 - Вторичное злокачественное новообразование забрюшинного пространства и брюшины.
C78,7 - Вторичное злокачественное новообразование печени.
C78,8 - Вторичное злокачественное новообразование других и неуточненных органов пищеварения.
Вторичное злокачественное новообразование других локализаций (C79):
C79,0 - Вторичное злокачественное новообразование почки и почечных лоханок.
C79,1 - Вторичное злокачественное новообразование мочевого пузыря, других и неуточненных мочевых органов.
C79,2 - Вторичное злокачественное новообразование кожи.
C79,3 - Вторичное злокачественное новообразование головного мозга и мозговых оболочек.
C79,4 - Вторичное злокачественное новообразование других и неуточненных отделов нервной системы.
C79,5 - Вторичное злокачественное новообразование костей и костного мозга.
C79,6 - Вторичное злокачественное новообразование яичника.
C79,7 - Вторичное злокачественное новообразование надпочечника.
C79,8 - Вторичное злокачественное новообразование других неуточненных локализаций.
C79,9 - Вторичное злокачественное новообразование неуточненной локализации.
Злокачественное новообразование без уточнения локализации (C80).
С80,0 - Злокачественное новообразование, первичная локализация неизвестна.
C80,9 - Злокачественное новообразование неуточненной первичной локализации.
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
Злокачественные новообразования неточно обозначенных, вторичных и неуточненных локализаций (C76-C80).Злокачественное новообразование других и неточно обозначенных локализаций (C76):
C76,0 - Головы, лица и шеи.
C76,1 - Грудной клетки.
C76,2 - Живота.
C76,3 - Таза.
C76,4 - Верхней конечности.
C76,5 - Нижней конечности.
C76,7 - Других неуточненных локализаций.
C76,8 - Поражение других и неточно обозначенных локализаций, выходящее за пределы одной и более вышеуказанных локализаций.
Вторичное и неуточненное злокачественное новообразование лимфатических узлов (C77):
C77,0 - Лимфатических узлов головы, лица и шеи.
C77,1 - Внутригрудных лимфатических узлов.
C77,2 - Внутрибрюшных лимфатических узлов.
C77,3 - Лимфатических узлов подмышечной впадины и верхней конечности грудных лимфатических узлов.
C77,4 - Лимфатических узлов паховой области и нижней конечности.
C77,5 - Внутритазовых лимфатических узлов.
C77,8 - Лимфатических узлов множественных локализаций.
C77,9 - Лимфатических узлов неуточненной локализации.
Вторичное злокачественное новообразование органов дыхания и пищеварения (C78):
C78,0 - Вторичное злокачественное новообразование легкого.
C78,1 - Вторичное злокачественное новообразование средостения.
C78,2 - Вторичное злокачественное новообразование плевры.
C78,3 - Вторичное злокачественное новообразование других и не уточненных органов дыхания.
C78,4 - Вторичное злокачественное новообразование тонкого кишечника.
C78,5 - Вторичное злокачественное новообразование толстого кишечника и прямой кишки.
C78,6 - Вторичное злокачественное новообразование забрюшинного пространства и брюшины.
C78,7 - Вторичное злокачественное новообразование печени.
C78,8 - Вторичное злокачественное новообразование других и неуточненных органов пищеварения.
Вторичное злокачественное новообразование других локализаций (C79):
C79,0 - Вторичное злокачественное новообразование почки и почечных лоханок.
C79,1 - Вторичное злокачественное новообразование мочевого пузыря, других и неуточненных мочевых органов.
C79,2 - Вторичное злокачественное новообразование кожи.
C79,3 - Вторичное злокачественное новообразование головного мозга и мозговых оболочек.
C79,4 - Вторичное злокачественное новообразование других и неуточненных отделов нервной системы.
C79,5 - Вторичное злокачественное новообразование костей и костного мозга.
C79,6 - Вторичное злокачественное новообразование яичника.
C79,7 - Вторичное злокачественное новообразование надпочечника.
C79,8 - Вторичное злокачественное новообразование других неуточненных локализаций.
C79,9 - Вторичное злокачественное новообразование неуточненной локализации.
Злокачественное новообразование без уточнения локализации (C80).
С80,0 - Злокачественное новообразование, первичная локализация неизвестна.
C80,9 - Злокачественное новообразование неуточненной первичной локализации.
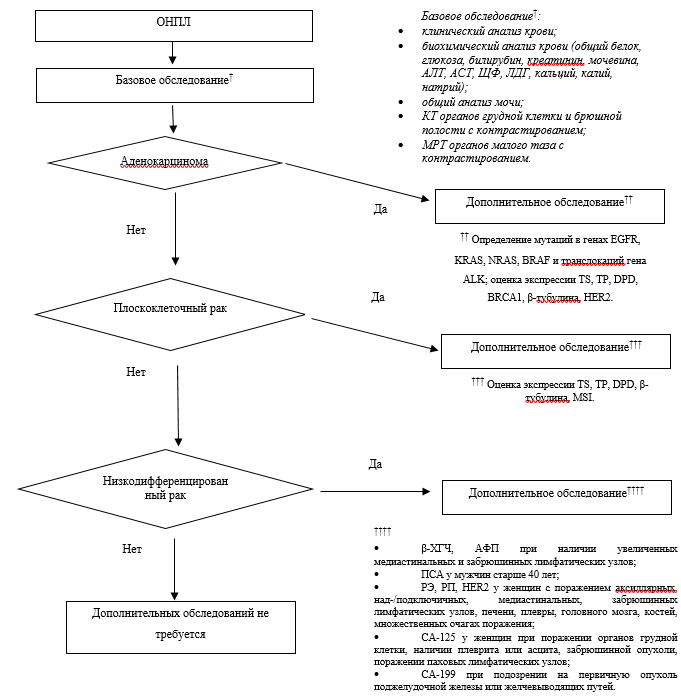
Классификация
1,5 Классификация заболевания или состояния (группы заболеваний или состояний).
Международная гистологическая классификация. В соответствии с гистологическим строением ОНПЛ, согласно рекомендациям ESMO (European Society for Medical Oncology, 2015 г.), целесообразно разделять на следующие группы [13]:1) высокодифференцированные и умеренно дифференцированные аденокарциномы;
2) низкодифференцированные карциномы;
3) плоскоклеточный рак;
4) недифференцированная опухоль;
5) рак с нейроэндокринной дифференцировкой.
Пациенты с опухолями других гистологических типов, несмотря на отсутствие первичного очага, должны обследоваться и лечиться в соответствии с рекомендациями для данного вида опухолей.
Стадирование. Общепринятого стадирования метастазов ОНПЛ в настоящее время не существует. Так как заболевание на первых этапах проявляется метастазами, можно говорить о первично-генерализованном процессе, который к моменту обращения пациента за медицинской помощью, как правило, выходит за пределы органа.
|
|
Клиническая картина
Клинические проявления заболевания неспецифичны и зависят от локализации очагов метастатического поражения и распространенности опухолевого процесса.
Диагностика
Критерии установления диагноза/состояния. Например, на основании патогномоничных данных:
• анамнестических данных,.
• физикального обследования,.
• лабораторных исследований,.
• инструментального обследования,.
• прижизненного патолого-анатомического и генетического исслдований.
• дополнительно - комплексного полногемного секвенирования (услуга не входит в ОМС).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Общий (клинический) анализ крови;
• анализ крови биохимический общетерапевтический (общий белок, глюкоза, билирубин, креатинин, мочевина, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза (ЩФ), лактатдегидрогеназа (ЛДГ), кальций, калий, натрий), С-реактивный протеин;
• общий (клинический) анализ мочи:
• коагулограмма (ориентировочное исследование системы гемостаза), включая оценку активированного частичного тромбопластинового времи (АЧТВ), исследование уровня фибриногена в крови, определение международного нормализованного отношения (МНО), протромбинового (тромбопластинового) времени в крове или в плазме, определение концентрации Д-димера в крови).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам с предполагаемой опухолью с невыявленной первичной локализацией выполнение дополнительных лабораторных исследований по следующим показаниям для подтверждения диагноза и выбора алгоритма дальнейшего обследования [13, 15, 19, 22]:
• исследование уровня хорионического гонадотропина (бета-субъединица) (β-ХГЧ), альфа-фетопротеина (АФП) в сыворотке крови у лиц до 50 лет при наличии увеличенных медиастинальных лимфатических узлов и до 65 лет - при наличии увеличенных забрюшинных лимфатических узлов;
• Хорионический гонадотропин человека (бета-ХГЧ)у женщин репродуктивного возраста, имевших хотя бы одну беременность в анамнезе, независимо от ее исхода и давности;
• Исследование уровня альфа-фетопротеина в сыворотке крови (АФП). При поражении печени;
• Исследование уровня простатспецифического антигена свободного в крови (ПСА). У мужчин старше 40 лет;
• Исследование уровня антигена аденогенных раков сA 125 в крови (СА125) - у женщин при поражении органов грудной клетки, наличии плеврита или асцита, забрюшинной опухоли, поражении паховых лимфатических узлов;
• Исследование уровня антигена аденогенных раков сA 19-9 в крови (СА-19,9) - при подозрении на первичную опухоль поджелудочной железы или желчевыводящих путей;
• Исследование уровня антигена аденогенных раков РЭА (РЭА) - при подозрении на первичную опухоль колоректальной локализации;
• Цитологическое исследование - при наличии асцита или забрюшинной опухоли.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Компьютерной томографии (КТ) органов грудной клетки, брюшной полости с внутривенным болюсным контрастированием [13, 16-18].
• Магнитно-резонансной томографии (МРТ) органов малого таза с контрастированием [15].
• МРТ органов шеи [15].
• Сцинтиграфии с туморотропными РФП в режиме все тело с последующей рентгенографией очагов накопления радиофармацевтического лекарственного препарата (РФП) [1, 19, 20].
• Эзофагогастродуоденоскопии (ЭГДС), колоноскопии [1, 7, 13, 16];
• Ультразвукового исследования (УЗИ) органов мошонки у мужчин - при повышении бета-субъединицы хорионического гонадотропина (β-ХГЧ) или альфа-фетопротеина (АФП) [15];
• Маммографии - у женщин с поражением аксиллярных, над-/подключичных, медиастинальных, забрюшинных лимфатических узлов, печени, головного мозга, костей, при множественных очагах поражения [1, 13, 16].
• КТ/МРТ головного мозга с контрастированием - при наличии подозрения на поражение головного мозга [13, 15, 19].
• Позитронной эмиссионной томографии (ПЭТ) или ПЭТ костей, совмещенной с КТ всего тела (ПЭТ-КТ), для выявления первичной опухоли и степени распространения болезни; при выполнении данного исследования проведение сцинтиграфии костей в режиме «все тело» (остеосцинтиграфии) нецелесообразно [17, 18, 21].
• Цистоскопии при подозрении на локализацию первичного очага в мочевом пузыре [15].
• Биопсия (трепанбиопсия) опухолей наружных локализаций, лимфатических узлов под визуальным контролем или (при необходимости) УЗИ навигацией [1, 8, 16, 20].
• Эндоскопическое исследование верхних дыхательно-пищеварительных путей [16].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии. Применение ПЭТ-КТ при множественных метастазах иногда не дает желаемого результата, так как трудно отличить первичную опухоль от метастазов. Низкая метаболическая активность для 18 фтордезоксиглюкозы (18F-ФДГ) характерна также для бронхоальвеолярного рака, гепатоцеллюлярной карциномы, рака почки, карциноида, низкодифференцированных и некоторых других опухолей. По рекомендациям Национальной комплексной сети по борьбе с раком (NCCN) от 2016 года ПЭТ-КТ не рекомендуется в качестве первичного диагностического теста [16]. Однако существуют благоприятные подгруппы для данного вида исследования: это немногочисленные или единичные метастазы, а также метастазы плоскоклеточного рака в шейных лимфатических узлах. У таких пациентов ПЭТ-КТ может изменить тактику лечения в 30-35% случаев.
• Рекомендуется пациентам с предполагаемой опухолью с невыявленной первичной локализацией выполнять биопсию опухолевых образований для морфологической верификации диагноза. Предпочтительным методом является трепанбиопсия опухолей наружных локализаций, лимфатических узлов под визуальным контролем [1,8,15,16,20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам с предполагаемой опухолью с невыявленной первичной локализацией выполнять патологоанатомическое исследование биопсийного (операционного) материала пораженного органа с применением иммуногистохимических методов (ИГХ) с определением уровня рецепторов стероидных гормонов (рецепторы эстрогена (РЭ), рецепторы прогестерона (РП)), HER2 и других маркёров рака молочной железы у женщин с поражением аксиллярных, над- / подключичных, медиастинальных, забрюшинных лимфатических узлов, печени, брюшины и/или асцитом, плевры, головного мозга, костей, множественных очагах поражения для определения типа опухоли и попытки определения первичного очага [13, 15, 19, 22].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий. Определение ИГХ панели проводится с учетом морфологической картины при окраске гематоксилином и эозином и клинических данных (локализация очага, предположения о локализации первичной опухоли). При недостаточном количестве материала возможно использование иммуноцитохимического исследования биологического материала (ИЦХ). Выполнение ИГХ и ИЦХ исследований целесообразно проводить в национальных медицинских исследовательских центрах, имеющих высококвалифицированную патолого-анатомическую службу. Пациентам с предполагаемой опухолью с невыявленной первичной локализацией рекомендуется выполнять молекулярно-генетическое исследование мутаций в биопсийном (операционном) материале для выявления первичного опухолевого очага, уточнения лечебной тактики, а также идентификации мутаций, определяющих чувствительность опухоли к таргетным препаратам [15]:
• При аденокарциноме: молекулярно-генетические исследования мутаций в генах EGFR, KRAS, NRAS, вRAF в биопсийном (операционном) материале и молекулярно-генетическое исследование транслокаций гена ALK; оценка экспрессии TS, молекулярно-генетическое исследование мутаций в гене TP53 в крови, определение полиморфизма гена DPD, Молекулярно-генетическое исследование мутаций в генах вRCA1 и вRCA2 в крови, патолого-анатомическое исследование белка к рецепторам HER2/neu с применением иммуногистохимических методов или определение амплификации гена ERBB2 (HER2/Neu) в биопсийном (операционном) материале методом флюоресцентной гибридизации in situ (FISH).
• При семейном онкологическом анамнезе: консультация врача-генетика .
• При плоскоклеточном раке: оценка экспрессии TS, TP, определение полиморфизма гена DPD, β-тубулина, определение микросателлитных повторов ДНК в биопсийном (операционном) материале методом ПЦР;
• При опухолях мезенхимального происхождения: транслокации, специфические для различных разновидностей сарком.
• Для определения возможности назначения иммунотерапии (пембролизумаб**): оценка микросателлитных повторов ДНК (MSI) с помощью молекулярно-генетических методов (метод ПЦР с пробами к вAT25, вAT26, NR21, NR24, Mono27 или к вAT25, вAT26, Di5S346, Di2S123, Di 17S250, при котором отличия в размерах выявляются в ≥2 локусах) или ИГХ метода (с антителами к белкам генов MSH2, MSH6, PMS2, MLH1 при экспрессии хотя бы одного белка - определение мутаций в генах MLH1, MSH2, MSH6, PMS2 иммуногистохимическим методом).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с предполагаемой опухолью с невыявленной первичной локализацией рекомендуется выполнять молекулярно-генетические обследования для подтверждения диагноза и выбора алгоритма дальнейшего обследования [15]:
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии. Целесообразность, спектр и последовательность молекулярно-генетических тестов в каждом конкретном случае желательно обсуждать со специалистами по молекулярной генетике, которые выполняют данный анализ. Патолого-анатомическое исследование является основой для установления диагноза злокачественной опухоли и выбора алгоритма дальнейшего обследования. Молекулярно-генетическое исследование является дополнительным и может помочь в выборе лечебной тактики и индивидуализации лечения пациента. Кроме того, отдельные мутации могут помочь в определении характера первичного очага. Данный перечень генетических тестов основан на возможности использования лекарственных средств у пациентов с разными первичными формами злокачественных опухолей, которые могут быть источниками опухолей неясной первичной локализации, для которых выявление или невыявление соответствующего изменения может повлиять на выбор лекарственных средств для лечения конкретного пациента.
• анамнестических данных,.
• физикального обследования,.
• лабораторных исследований,.
• инструментального обследования,.
• прижизненного патолого-анатомического и генетического исслдований.
• дополнительно - комплексного полногемного секвенирования (услуга не входит в ОМС).
2,1 Жалобы и анамнез.
• Рекомендуется сбор жалоб и анамнеза у пациента с предполагаемой опухолью с невыявленной первичной локализацией для установления факторов, которые могут повлиять на выбор тактики лечения. Сбор информациии включает ранее проводимые обследования, результаты биопсии, наличие удаленных или регрессировавших очагов [1, 7, 8, 13-15].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
2,2 Физикальное обследование.
• Рекомендуется выполнять физикальное обследование пациента с предполагаемой опухолью с невыявленной первичной локализацией, включающее осмотр всех кожных покровов и видимых слизистых, пальпацию всех доступных групп лимфатических узлов, щитовидной железы, молочных желез, органов брюшной полости, пальцевое ректальное исследование, осмотр врачом-акушером-гинекологом (женщины), исследование наружных половых органов, пальпация яичек (мужчины), оценка нутритивного статуса для определения тактики ведения пациента [1, 7].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
2,3 Лабораторные диагностические исследования.
• Рекомендуется пациентам с предполагаемой опухолью с невыявленной первичной локализацией выполнять следующие лабораторные тесты для подтверждения диагноза и выбора алгоритма дальнейшего обследования [1, 8, 16, 20]:• Общий (клинический) анализ крови;
• анализ крови биохимический общетерапевтический (общий белок, глюкоза, билирубин, креатинин, мочевина, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза (ЩФ), лактатдегидрогеназа (ЛДГ), кальций, калий, натрий), С-реактивный протеин;
• общий (клинический) анализ мочи:
• коагулограмма (ориентировочное исследование системы гемостаза), включая оценку активированного частичного тромбопластинового времи (АЧТВ), исследование уровня фибриногена в крови, определение международного нормализованного отношения (МНО), протромбинового (тромбопластинового) времени в крове или в плазме, определение концентрации Д-димера в крови).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам с предполагаемой опухолью с невыявленной первичной локализацией выполнение дополнительных лабораторных исследований по следующим показаниям для подтверждения диагноза и выбора алгоритма дальнейшего обследования [13, 15, 19, 22]:
• исследование уровня хорионического гонадотропина (бета-субъединица) (β-ХГЧ), альфа-фетопротеина (АФП) в сыворотке крови у лиц до 50 лет при наличии увеличенных медиастинальных лимфатических узлов и до 65 лет - при наличии увеличенных забрюшинных лимфатических узлов;
• Хорионический гонадотропин человека (бета-ХГЧ)у женщин репродуктивного возраста, имевших хотя бы одну беременность в анамнезе, независимо от ее исхода и давности;
• Исследование уровня альфа-фетопротеина в сыворотке крови (АФП). При поражении печени;
• Исследование уровня простатспецифического антигена свободного в крови (ПСА). У мужчин старше 40 лет;
• Исследование уровня антигена аденогенных раков сA 125 в крови (СА125) - у женщин при поражении органов грудной клетки, наличии плеврита или асцита, забрюшинной опухоли, поражении паховых лимфатических узлов;
• Исследование уровня антигена аденогенных раков сA 19-9 в крови (СА-19,9) - при подозрении на первичную опухоль поджелудочной железы или желчевыводящих путей;
• Исследование уровня антигена аденогенных раков РЭА (РЭА) - при подозрении на первичную опухоль колоректальной локализации;
• Цитологическое исследование - при наличии асцита или забрюшинной опухоли.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
2,4 Инструментальные диагностические исследования.
• Пациентам с предполагаемой опухолью с невыявленной первичной локализацией р екомендуется выполнение следующих диагностических процедур:• Компьютерной томографии (КТ) органов грудной клетки, брюшной полости с внутривенным болюсным контрастированием [13, 16-18].
• Магнитно-резонансной томографии (МРТ) органов малого таза с контрастированием [15].
• МРТ органов шеи [15].
• Сцинтиграфии с туморотропными РФП в режиме все тело с последующей рентгенографией очагов накопления радиофармацевтического лекарственного препарата (РФП) [1, 19, 20].
• Эзофагогастродуоденоскопии (ЭГДС), колоноскопии [1, 7, 13, 16];
• Ультразвукового исследования (УЗИ) органов мошонки у мужчин - при повышении бета-субъединицы хорионического гонадотропина (β-ХГЧ) или альфа-фетопротеина (АФП) [15];
• Маммографии - у женщин с поражением аксиллярных, над-/подключичных, медиастинальных, забрюшинных лимфатических узлов, печени, головного мозга, костей, при множественных очагах поражения [1, 13, 16].
• КТ/МРТ головного мозга с контрастированием - при наличии подозрения на поражение головного мозга [13, 15, 19].
• Позитронной эмиссионной томографии (ПЭТ) или ПЭТ костей, совмещенной с КТ всего тела (ПЭТ-КТ), для выявления первичной опухоли и степени распространения болезни; при выполнении данного исследования проведение сцинтиграфии костей в режиме «все тело» (остеосцинтиграфии) нецелесообразно [17, 18, 21].
• Цистоскопии при подозрении на локализацию первичного очага в мочевом пузыре [15].
• Биопсия (трепанбиопсия) опухолей наружных локализаций, лимфатических узлов под визуальным контролем или (при необходимости) УЗИ навигацией [1, 8, 16, 20].
• Эндоскопическое исследование верхних дыхательно-пищеварительных путей [16].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии. Применение ПЭТ-КТ при множественных метастазах иногда не дает желаемого результата, так как трудно отличить первичную опухоль от метастазов. Низкая метаболическая активность для 18 фтордезоксиглюкозы (18F-ФДГ) характерна также для бронхоальвеолярного рака, гепатоцеллюлярной карциномы, рака почки, карциноида, низкодифференцированных и некоторых других опухолей. По рекомендациям Национальной комплексной сети по борьбе с раком (NCCN) от 2016 года ПЭТ-КТ не рекомендуется в качестве первичного диагностического теста [16]. Однако существуют благоприятные подгруппы для данного вида исследования: это немногочисленные или единичные метастазы, а также метастазы плоскоклеточного рака в шейных лимфатических узлах. У таких пациентов ПЭТ-КТ может изменить тактику лечения в 30-35% случаев.
2,5 Иные диагностические исследования.
Патолого-анатомическая и генетическая диагностика.• Рекомендуется пациентам с предполагаемой опухолью с невыявленной первичной локализацией выполнять биопсию опухолевых образований для морфологической верификации диагноза. Предпочтительным методом является трепанбиопсия опухолей наружных локализаций, лимфатических узлов под визуальным контролем [1,8,15,16,20].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется пациентам с предполагаемой опухолью с невыявленной первичной локализацией выполнять патологоанатомическое исследование биопсийного (операционного) материала пораженного органа с применением иммуногистохимических методов (ИГХ) с определением уровня рецепторов стероидных гормонов (рецепторы эстрогена (РЭ), рецепторы прогестерона (РП)), HER2 и других маркёров рака молочной железы у женщин с поражением аксиллярных, над- / подключичных, медиастинальных, забрюшинных лимфатических узлов, печени, брюшины и/или асцитом, плевры, головного мозга, костей, множественных очагах поражения для определения типа опухоли и попытки определения первичного очага [13, 15, 19, 22].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий. Определение ИГХ панели проводится с учетом морфологической картины при окраске гематоксилином и эозином и клинических данных (локализация очага, предположения о локализации первичной опухоли). При недостаточном количестве материала возможно использование иммуноцитохимического исследования биологического материала (ИЦХ). Выполнение ИГХ и ИЦХ исследований целесообразно проводить в национальных медицинских исследовательских центрах, имеющих высококвалифицированную патолого-анатомическую службу. Пациентам с предполагаемой опухолью с невыявленной первичной локализацией рекомендуется выполнять молекулярно-генетическое исследование мутаций в биопсийном (операционном) материале для выявления первичного опухолевого очага, уточнения лечебной тактики, а также идентификации мутаций, определяющих чувствительность опухоли к таргетным препаратам [15]:
• При аденокарциноме: молекулярно-генетические исследования мутаций в генах EGFR, KRAS, NRAS, вRAF в биопсийном (операционном) материале и молекулярно-генетическое исследование транслокаций гена ALK; оценка экспрессии TS, молекулярно-генетическое исследование мутаций в гене TP53 в крови, определение полиморфизма гена DPD, Молекулярно-генетическое исследование мутаций в генах вRCA1 и вRCA2 в крови, патолого-анатомическое исследование белка к рецепторам HER2/neu с применением иммуногистохимических методов или определение амплификации гена ERBB2 (HER2/Neu) в биопсийном (операционном) материале методом флюоресцентной гибридизации in situ (FISH).
• При семейном онкологическом анамнезе: консультация врача-генетика .
• При плоскоклеточном раке: оценка экспрессии TS, TP, определение полиморфизма гена DPD, β-тубулина, определение микросателлитных повторов ДНК в биопсийном (операционном) материале методом ПЦР;
• При опухолях мезенхимального происхождения: транслокации, специфические для различных разновидностей сарком.
• Для определения возможности назначения иммунотерапии (пембролизумаб**): оценка микросателлитных повторов ДНК (MSI) с помощью молекулярно-генетических методов (метод ПЦР с пробами к вAT25, вAT26, NR21, NR24, Mono27 или к вAT25, вAT26, Di5S346, Di2S123, Di 17S250, при котором отличия в размерах выявляются в ≥2 локусах) или ИГХ метода (с антителами к белкам генов MSH2, MSH6, PMS2, MLH1 при экспрессии хотя бы одного белка - определение мутаций в генах MLH1, MSH2, MSH6, PMS2 иммуногистохимическим методом).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Пациентам с предполагаемой опухолью с невыявленной первичной локализацией рекомендуется выполнять молекулярно-генетические обследования для подтверждения диагноза и выбора алгоритма дальнейшего обследования [15]:
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии. Целесообразность, спектр и последовательность молекулярно-генетических тестов в каждом конкретном случае желательно обсуждать со специалистами по молекулярной генетике, которые выполняют данный анализ. Патолого-анатомическое исследование является основой для установления диагноза злокачественной опухоли и выбора алгоритма дальнейшего обследования. Молекулярно-генетическое исследование является дополнительным и может помочь в выборе лечебной тактики и индивидуализации лечения пациента. Кроме того, отдельные мутации могут помочь в определении характера первичного очага. Данный перечень генетических тестов основан на возможности использования лекарственных средств у пациентов с разными первичными формами злокачественных опухолей, которые могут быть источниками опухолей неясной первичной локализации, для которых выявление или невыявление соответствующего изменения может повлиять на выбор лекарственных средств для лечения конкретного пациента.
|
|
Лечение
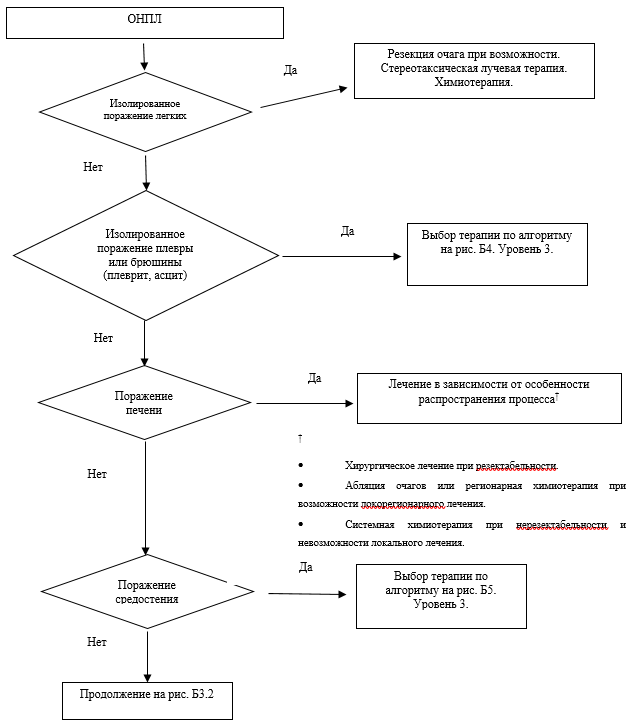
Лечебная тактика определяется, в первую очередь, с учетом общего состояния пациента, локализации метастазов, распространенности опухолевого процесса, морфологического строения метастатической опухоли, предполагаемой локализации первичного очага.
Хирургический метод лечения у пациентов с метастазами злокачественной опухоли без выявленного первичного очага (ВПО) не является радикальным и может быть использован при изолированном поражении лимфоузлов доступной удалению группы и в некоторых случаях изолированного поражения органа; возможна лимфаденэктомия или удаление метастаза с резекцией органа. Также оперативное вмешательство возможно с симптоматической целью.
Лучевая терапия при невозможности применения хирургического метода может быть показана при изолированном поражении лимфатических узлов или органа при потенциальной чувствительности опухоли к облучению. Возможно применение лучевой терапии (ЛТ) и с симптоматической целью.
Основным методом лечения метастатической болезни из невыявленного первичного очага является лекарственная терапия.
Терапия строится на индивидуальной основе с учетом клинико-морфологических данных. Выделяются отдельные подтипы, более чувствительные к лекарственному лечению и сходные с отдельными локализациями злокачественных опухолей, но отличающиеся существенно более плохим прогнозом и чувствительностью к терапии. При выявлении в опухолевой ткани мутаций, определяющих эффективность таргетной терапии, возможно применение соответствующих лекарственных средств. Данные молекулярно-генетического исследования по определению чувствительности к противоопухолевым препаратам могут быть использованы для выбора схемы терапии. Дополнительно, для назначения персонализированной терапии, могут быть использованы данные комплексного полногемного секвенирования (услуга не входит в ОМС). Оценка эффективности терапии проводится каждые 6-8 недель лечения. Для оценки терапии должны использоваться те же методы лучевой диагностики и объективных измерений, что и до начала лечения. Смена режима лечения производится при доказанном объективными методами (КТ, МРТ, УЗИ, ПЭТ-КТ) прогрессировании заболевания. Модификация режима лечения производится при появлении признаков токсичности, не позволяющих провести запланированное лечение в полном объеме.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии. Течение заболевания у таких пациентов соответствует течению соответствующих опухолей головы и шеи.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• У пациентов мужского пола рекомендуется выполнять аксиллярную лимфаденэктомию, возможно проведение лучевой терапии при наличии показаний [18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии. Данный подтип ОНПЛ по течению сходен с герминогенными опухолями неблагоприятной прогностической группы.
Таблица 1. Возможные режимы химиотерапии при низкодифференцированных ОНПЛ с преимущественным поражением лимфоузлов осевой локализации [24].
1Возможны альтернативные варианты назначения данных схем терапии.
2Возможна замена цисплатина** на карбоплатин** в соответствующих дозах.
3 Для подтипа ОНПЛ по течению сходно с герминогенными опухолями.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий. Течение заболевания у таких пациентов соответствует мелкоклеточному раку легкого и проводится в соответствии с рекомендациями, разработанными для нейроэндокринных опухолей с высокой пролиферативной активностью или для мелкоклеточного рака легкого. Основу терапии составляют режимы, включающие производные платины.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий. Течение заболевания у таких пациентов соответствует течению высокодифференцированных нейроэндокринных опухолей ЖКТ.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий. Течение заболевания у пациенток соответствует раку яичников. Ведение пациентов осуществляется на основании рекомендаций для данного заболевания с учетом стадии процесса.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий. Течение заболевания соответствует течению плоскоклеточного рака вышеуказанных локализаций и проводится по стандартам, разработанным для данного заболевания.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий. Течение данного типа ОНПЛ соответствует раку предстательной железы и проводится по стандартам, принятым для данного заболевания.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
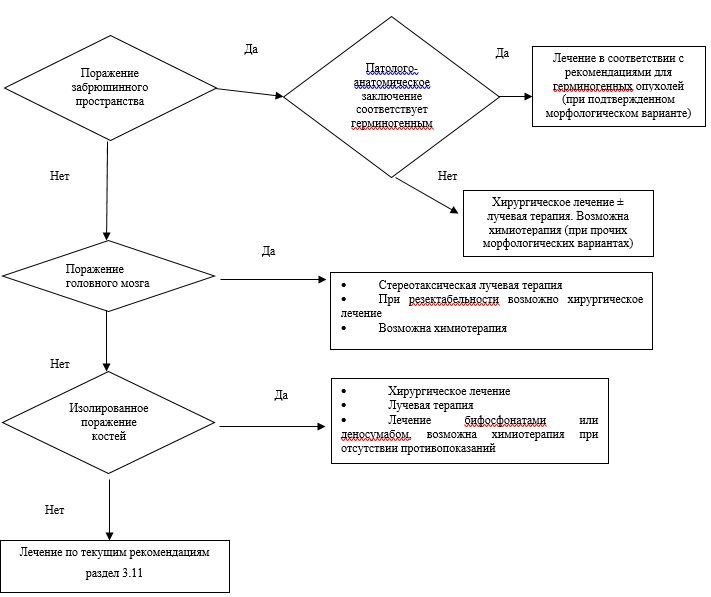
Комментарий. В связи с низкой чувствительностью таких опухолей к терапии предпочтение отдается малотоксичным режимам. Выбор препаратов основывается на предположении о наиболее частом расположении источника ОНПЛ в органах желудочно-кишечного тракта и легких. Использование полихимиотерапии (таблица 2, 3) оправданно только у пациентов в удовлетворительном состоянии с агрессивно протекающим заболеванием. При наличии у пациентов метастатического поражения костей показано применение бифосфонатов или деносумаба** для профилактики осложнений со стороны костной ткани. Их применение также показано при ограничении поражения одной анатомической зоной (например, изолированные метастазы в печени) и доступности локальных или локорегионарных методов лечения данных очагов, например резекции очага, абляции очага, лучевой терапии (в том числе стереотаксической), изолированной перфузии и других [1, 7, 13, 15, 16].
При множественных метастазах в кости (3 и более очагов), сопровождающихся болевым синдромом, подтвержденных данными сцинтиграфии с туморотропными РФП в режиме все тело и верифицированных при КТ, рентгенографии или МРТ, эксперты рекомендуют рассмотреть возможность и необходимость проведения радионуклидной терапии остеотропными РПФ.
У пациентов ОНПЛ с метастазами в костный мозг, подтвержденными аспирационной биопсией методом стернальной пункции и ECOG не более 2 (приложение Г), рассмотреть возможность проведения противоопухолевого лекарственного лечения (монохимиотерапия паклитакселом или антрациклинами (L01DB: Антрациклины и родственные соединения) или аналогами пиримидина (фторпиримидинами), еженедельные режимы паклитаксела или антрациклинов, гормонотерапия, таргетная терапия) в условиях круглосуточного стационара с обеспечением необходимого объема поддерживающей терапии. Для пациентов ECOG 3 и более (приложение Г) - паллиативная помощь по месту жительства. Решение принимается консилиумом врачей.
Таблица 2. Возможные режимы терапии пациентов аденокарциномой неясной первичной локализации [27].
1 Возможны альтернативные варианты назначения данных схем терапии.
2 Возможна замена цисплатина** на карбоплатин** в соответствующих дозах.
3. Только при наличии MSI-H в опухолевой ткани, определенной описанными выше методами. Во второй или последующих линиях лечения.
4. Назначение колониестимулирующего фактора с 9 до 15 дни.
5 Рассмотреть назначение Г-КСФ с 4 до 6 или 8 дня.
6 Назначение данного режима рекомендовано пациентам с ECOG 0-1, возрасте до 65лет и предполагаемой первичной локализацией опухоли в органах ЖКТ.
Таблица 3Возможные режимы терапии пациентов плоскоклеточным раком неясной первичной локализации [27].
1Возможны альтернативные варианты назначения данных схем терапии.
2Только при наличии MSI-H в опухолевой ткани, определенной описанными выше методами. Во второй или последующих линиях терапии.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии. Первичная, вторичная профилактика проводится согласно существующим рекомендациям [28, 29]. Лечение ФН с применением антибактериальных препаратов и колониестимулирующих факторов проводится согласно существующим рекомендациям [28, 29].
• Пациентам с опухолью с невыявленной первичной локализацией профилактику тошноты и рвоты на фоне химиотерапии, лучевой терапии и/или химиолучевой терапии рекомендовано проводить согласно данным о частоте тошноты и рвоты противоопухолевого препарата или зоны облучения. Используют следующие противорвотные препараты: прочие противорвотные препараты (антагонисты NK1-рецепторов) (апрепитант или фосапрепитант), блокаторы серотониновых 5HT3-рецепторов (ондансетрон** и палоносетрон), дексаметазон**, стимуляторов моторики желудочно-кишечного тракта (метоклопрамид**), анксиолитики, блокаторы H2-гистаминовых рецепторов, антипсихотические средства (оланзапин 5 мг**) в соответствии с существующими рекомендациям [26, 30, 31, 32].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
• Применение остеомодифицирующих агентов. Бифосфонатов и деносумаба**, а также препаратов кальция и колекальциферола рекомендуется пациентам с метастатическим поражением костной системы (золедроновая кислота** 4 мг в/в капельно 1 раз в 28 дней или другие бифосфонаты, деносумаб** 120 мг п/к 1 раз в 28 дней) для профилактики осложнений, а также для профилактики потери минеральной плотности костей скелета (золедроновая кислота** 4 мг в/в капельно 1 раз в 6 месяцев или другие бифосфонаты, деносумаб** 60 мг п/к 1 раз в 6 месяцев) при использовании аналогов гонадотропин-рилизинг гормона (антагонистов лютеинизирующего гормона рилизинг-гормона (ЛГРГ)), ингибиторов ароматазы, лучевой или хирургической кастрации согласно существующим рекомендациям [33, 34].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
• Рекомендуется пациентам, получающим лекарственную противоопухолевую терапию, проводить профилактику и лечение анемии согласно существующим рекомендациям с применением антианемических препаратов: рекомбинантных форм человеческого эритропоэтина (АТХ: другие антианемические препараты) (эпоэтин альфа**, эпоэтин бета**, дарбэпоэтин альфа**), препаратов железа для парентерального введения (железа (III) гидроксид сахарозный комплекс** или железа карбоксимальтозат**), заместительной гемотрансфузии, цианокобаламина**, фолиевой кислоты**, энтерального и парентерального питания, коррекции почечной и печеночной недостаточности [ 35,36 ].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Коррекцию осложнений при использовании рибоциклиба**, палбоциклиба**, абемациклиба, пикрея, используемых для лечения метастатических форм люминального, Her-2/neu отрицательного рака, рекомендовано проводить согласно степени тяжести с применением глюкокортикостероидов, редукции дозы и/или отмены препарата в соответствии с инструкцией к препарату и существующими рекомендациями [37].
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
• Для лечения осложнений на фоне терапии противоопухолевыми средствами- моноклональные антитела (ниволумаб **, пембролизумаб **), рекомендуется использовать глюкокортикоиды, инфликсимаб** 5 мг/кг 0,2,6, неделя, далее 5 мг/кг каждые 8 недель ** [38,39].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Лечение и профилактику гастроинтестинальных (диарея и констипация), сердечно-сосудистых, печеночных, почечных, дерматологических, тромбоэмболических осложнений у пациентов с опухолями с невыявленной первичной локализацией, экстравазации рекомендуется проводить согласно существующим рекомендациям [40, 41].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Хирургический метод лечения у пациентов с метастазами злокачественной опухоли без выявленного первичного очага (ВПО) не является радикальным и может быть использован при изолированном поражении лимфоузлов доступной удалению группы и в некоторых случаях изолированного поражения органа; возможна лимфаденэктомия или удаление метастаза с резекцией органа. Также оперативное вмешательство возможно с симптоматической целью.
Лучевая терапия при невозможности применения хирургического метода может быть показана при изолированном поражении лимфатических узлов или органа при потенциальной чувствительности опухоли к облучению. Возможно применение лучевой терапии (ЛТ) и с симптоматической целью.
Основным методом лечения метастатической болезни из невыявленного первичного очага является лекарственная терапия.
Терапия строится на индивидуальной основе с учетом клинико-морфологических данных. Выделяются отдельные подтипы, более чувствительные к лекарственному лечению и сходные с отдельными локализациями злокачественных опухолей, но отличающиеся существенно более плохим прогнозом и чувствительностью к терапии. При выявлении в опухолевой ткани мутаций, определяющих эффективность таргетной терапии, возможно применение соответствующих лекарственных средств. Данные молекулярно-генетического исследования по определению чувствительности к противоопухолевым препаратам могут быть использованы для выбора схемы терапии. Дополнительно, для назначения персонализированной терапии, могут быть использованы данные комплексного полногемного секвенирования (услуга не входит в ОМС). Оценка эффективности терапии проводится каждые 6-8 недель лечения. Для оценки терапии должны использоваться те же методы лучевой диагностики и объективных измерений, что и до начала лечения. Смена режима лечения производится при доказанном объективными методами (КТ, МРТ, УЗИ, ПЭТ-КТ) прогрессировании заболевания. Модификация режима лечения производится при появлении признаков токсичности, не позволяющих провести запланированное лечение в полном объеме.
3,1 Лечение пациентов с аденокарциномой или низкодифференцированной карциномой с изолированным поражением лимфатических узлов шеи (включая надключичную область).
• Рекомендуется использовать для лечения таких пациентов рекомендации для лечения аденокарцином головы и шеи [16].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии. Течение заболевания у таких пациентов соответствует течению соответствующих опухолей головы и шеи.
3,2 Лечение пациентов с аденокарциномой или низкодифференцированной карциномой с изолированным поражением аксиллярных лимфатических узлов.
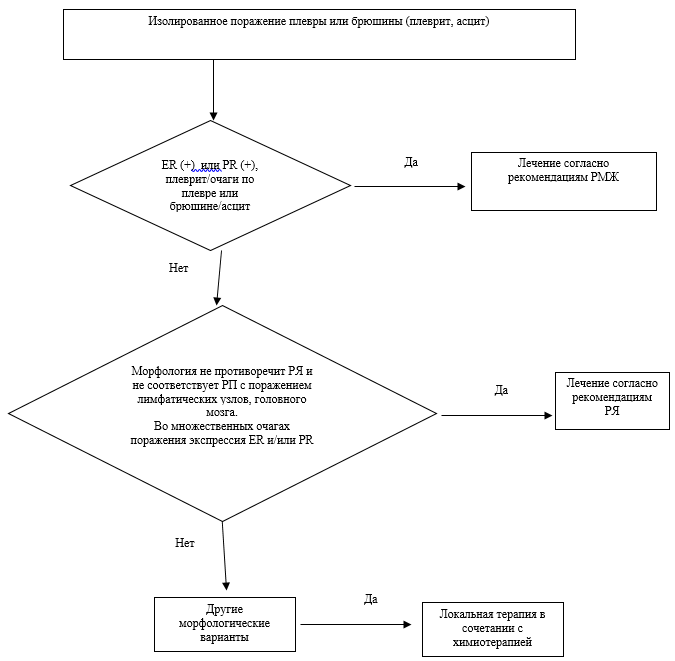
• У пациенток женского пола рекомендуется лечение в соответствии со стандартами, разработанными для рака молочной железы [17].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• У пациентов мужского пола рекомендуется выполнять аксиллярную лимфаденэктомию, возможно проведение лучевой терапии при наличии показаний [18].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3,3 Лечение пациентов с аденокарциномой или низкодифференцированной карциномой с преимущественным поражением лимфоузлов осевой локализации (средостенных - у пациентов моложе 50 лет, забрюшинных).
• Рекомендуется проведение терапии платиносодержащими режимами, представленными в таблице 1 [19].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии. Данный подтип ОНПЛ по течению сходен с герминогенными опухолями неблагоприятной прогностической группы.
Таблица 1. Возможные режимы химиотерапии при низкодифференцированных ОНПЛ с преимущественным поражением лимфоузлов осевой локализации [24].
| Схема терапии | Препарат | Доза | Путь введения | Дни приема | Длительность цикла, дни |
| PaC | Паклитаксел** Карбоплатин** | 175 мг/м2 AUC-5 | В/в В/в | 1-й 1-й | 21 |
| сarD | Доцетаксел** Карбоплатин** | 65 мг/м2 AUC-6 | В/в В/в | 1-й 1-й | 21 |
| GP | Гемцитабин** Цисплатин** | 1250 мг/м2 100 мг/м2 | В/в В/в | 1-й, 8-й 1-й | 21 |
| вEP1,3 | Блеомицин** Этопозид** Цисплатин** | 30 мг 100 мг/м2 20 мг/м2 | В/в В/в В/в | 1-й, 3-й, 5-й 1-й - 5-й 1-й - 5-й | 21 |
| ЕР1, 2 | Этопозид** Цисплатин** | 120 мг/м2 80 мг/м2 | В/в В/в | 1-й - 3-й 1-й | 21 |
1Возможны альтернативные варианты назначения данных схем терапии.
2Возможна замена цисплатина** на карбоплатин** в соответствующих дозах.
3 Для подтипа ОНПЛ по течению сходно с герминогенными опухолями.
3,4 Лечение пациентов старше 50 лет с аденокарциномой или низкодифференцированной карциномой, а также пациентов с плоскоклеточным раком с преимущественным поражением средостения.
• Рекомендуется проводить лечение данной категории пациентов по принципам и рекомендациям, разработанным для немелкоклеточного рака легкого [20].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3,5 Лечение пациентов низкодифференцированной нейроэндокринной карциномой невыясненной первичной локализации.
• Рекомендуется проводить лечение данной категории пациентов по принципам и рекомендациям, разработанным для мелкоклеточного рака легкого [21].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий. Течение заболевания у таких пациентов соответствует мелкоклеточному раку легкого и проводится в соответствии с рекомендациями, разработанными для нейроэндокринных опухолей с высокой пролиферативной активностью или для мелкоклеточного рака легкого. Основу терапии составляют режимы, включающие производные платины.
3,6 Лечение пациентов высокодифференцированными нейроэндокринными опухолями с низкой пролиферативной активностью.
• Рекомендуется проводить лечение данной категории пациентов по принципам и рекомендациям, разработанным для нейроэндокринных опухолей [22].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий. Течение заболевания у таких пациентов соответствует течению высокодифференцированных нейроэндокринных опухолей ЖКТ.
3,7 Канцероматоз брюшины у пациенток женского пола.
• Рекомендуется проводить лечение данной категории пациентов по принципам и рекомендациям, разработанным для рака яичников [23 ].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий. Течение заболевания у пациенток соответствует раку яичников. Ведение пациентов осуществляется на основании рекомендаций для данного заболевания с учетом стадии процесса.
3,8 Плоскоклеточный рак с поражением лимфоузлов головы и шеи.
• Рекомендуется проводить лечение данной категории пациентов по принципам и рекомендациям, разработанным для плоскоклеточного рака головы и шеи [16].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий. Течение заболевания соответствует течению плоскоклеточного рака вышеуказанных локализаций и проводится по стандартам, разработанным для данного заболевания.
3,9 Лечение пациентов мужского пола с аденокарциномой неясной первичной локализации и остеосклеротическими метастазами в костях и/или повышением ПСА.
• Рекомендуется проводить лечение данной категории пациентов по принципам и рекомендациям, разработанным для рака предстательной железы [24 ].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий. Течение данного типа ОНПЛ соответствует раку предстательной железы и проводится по стандартам, принятым для данного заболевания.
3,10 Пациенты с меланомой или саркомой невыясненной первичной локализации.
• Рекомендуется проводить лечение данной категории пациентов по принципам и рекомендациям, разработанным для меланомы кожи и сарком, соответственно [25, 26].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3,11 Лечение пациентов ОНПЛ, не относящейся к вышеперечисленным группам.
• Рекомендуется проводить лечение пациентов с ОНПЛ, не относящейся к вышеперечисленным группам, препаратами и режимами, перечисленными в таблицах 2 и 3, в соответствии с гистологическим видом опухоли [15].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарий. В связи с низкой чувствительностью таких опухолей к терапии предпочтение отдается малотоксичным режимам. Выбор препаратов основывается на предположении о наиболее частом расположении источника ОНПЛ в органах желудочно-кишечного тракта и легких. Использование полихимиотерапии (таблица 2, 3) оправданно только у пациентов в удовлетворительном состоянии с агрессивно протекающим заболеванием. При наличии у пациентов метастатического поражения костей показано применение бифосфонатов или деносумаба** для профилактики осложнений со стороны костной ткани. Их применение также показано при ограничении поражения одной анатомической зоной (например, изолированные метастазы в печени) и доступности локальных или локорегионарных методов лечения данных очагов, например резекции очага, абляции очага, лучевой терапии (в том числе стереотаксической), изолированной перфузии и других [1, 7, 13, 15, 16].
При множественных метастазах в кости (3 и более очагов), сопровождающихся болевым синдромом, подтвержденных данными сцинтиграфии с туморотропными РФП в режиме все тело и верифицированных при КТ, рентгенографии или МРТ, эксперты рекомендуют рассмотреть возможность и необходимость проведения радионуклидной терапии остеотропными РПФ.
У пациентов ОНПЛ с метастазами в костный мозг, подтвержденными аспирационной биопсией методом стернальной пункции и ECOG не более 2 (приложение Г), рассмотреть возможность проведения противоопухолевого лекарственного лечения (монохимиотерапия паклитакселом или антрациклинами (L01DB: Антрациклины и родственные соединения) или аналогами пиримидина (фторпиримидинами), еженедельные режимы паклитаксела или антрациклинов, гормонотерапия, таргетная терапия) в условиях круглосуточного стационара с обеспечением необходимого объема поддерживающей терапии. Для пациентов ECOG 3 и более (приложение Г) - паллиативная помощь по месту жительства. Решение принимается консилиумом врачей.
Таблица 2. Возможные режимы терапии пациентов аденокарциномой неясной первичной локализации [27].
| Схема терапии | Препарат | Доза | Путь введе-ния | Дни приема | Длительность цикла, дни |
| сarPac | Паклитаксел** Карбоплатин ** | 175-200 мг/м2 AUC5-6 | В/в В/в | 1-й 1-й | 21 |
| сarD | Доцетаксел ** Карбоплатин ** | 65 мг/м2 AUC-6 | В/в В/в | 1-й 1-й | 21 |
| GP | Гемцитабин ** Цисплатин ** | 1000-1250 мг/м2 75 мг/м2 | В/в В/в | 1-й, 8-й 1-й | 21 |
| GD | Гемцитабин ** Доцетаксел** 4 | 1000 мг/м2 75 мг/м2 | В/в В/в | 1-й, 8-й 8-й | 21 |
| mFOLFOX61 | Оксалиплатин** Кальция фолинат** Фторурацил** Фторурацил** | 85 мг/м2 200 мг/м2 400 мг/м2 2400 мг/м2 | В/в В/в В/в, стр. В/в, 46-48 | 1-й 1-й 1-й 1-й | 14 |
| сapeOx | Оксалиплатин** Капецитабин** | 130 мг/м2 850-1000 мг/м2 | В/в Р.О. 2 раза в день | 1-й 1-й - 14-й | 21 |
| Пембролизумаб**3 | 2 мг/кг или 200 мг | В/в | 1-й | 21 | |
| Ниволумаб **3 | 3 мг/кг или 240 мг | В/в | 1-й | 14 | |
| Ниволумаб **3 | 480 мг | В/в | 1-й | 28 | |
| FOLFIRI | Иринотекан** Кальция фолинат** Фторурацил** Фторурацил** | 180 мг/м2 200 мг/м2 400 мг/м2 2400 мг/м2 | В/в В/в В/в, стр. В/в, 46-48 | 1-й 1-й 1-й 1-й | 14 |
| FOLFIRINOX 5,6 | Оксалиплатин ** Иринотекан ** Кальция фолинат ** Фторурацил ** Фторурацил ** | 85 мг/м2 180 мг/м2 400 мг/м2 400 мг/м2 2400 мг/м2 | В/в В/в В/в В/в, стр. В/в, 46-48 | 1-й 1-й 1-й 1-й 1-й | 14 |
| Капецитабин** | Капецитабин ** | 850 - 1250 мг/м2 | Внутрь х 2 раза в день | 1-14-й дни | 21 |
| Капецитабин** плюс лучевая терапия (еженедельно - 5 недель) | Капецитабин ** | 625 - 825 мг/м2 | Внутрь х 2 раза в день | С 1 по 5-й дни или С 1 по 7-й дни лучевой терапии | 5 недель |
1 Возможны альтернативные варианты назначения данных схем терапии.
2 Возможна замена цисплатина** на карбоплатин** в соответствующих дозах.
3. Только при наличии MSI-H в опухолевой ткани, определенной описанными выше методами. Во второй или последующих линиях лечения.
4. Назначение колониестимулирующего фактора с 9 до 15 дни.
5 Рассмотреть назначение Г-КСФ с 4 до 6 или 8 дня.
6 Назначение данного режима рекомендовано пациентам с ECOG 0-1, возрасте до 65лет и предполагаемой первичной локализацией опухоли в органах ЖКТ.
Таблица 3Возможные режимы терапии пациентов плоскоклеточным раком неясной первичной локализации [27].
| Схема терапии | Препарат | Доза | Путь введения | Дни приема | Длительность цикла, дни |
| PCF | Паклитаксел** Цисплатин** Фторурацил** | 175 мг/м2 100 мг/м2 500 мг/м2/сут | В/в В/в В/в, 24 | 1-й 1-й 1-й - 5-й | 21 |
| mFOLFOX61 | Оксалиплатин** Кальция фолинат** Фторурацил** Фторурацил** | 85 мг/м2 200 мг/м2 400 мг/м2 2400 мг/м2 | В/в В/в В/в, стр. В/в, 46-48 | 1-й 1-й 1-й 1-й | 14 |
| GP1 | Гемцитабин ** Цисплатин** | 1250 мг/м2 75 мг/м2 | В/в В/в | 1-й,8-й 1-й, | 21 |
| PC | Паклитаксел** Цисплатин** | 175 мг/м2 60 мг/м2 | В/в В/в | 1-й 1-й | 21 |
| PF1 | Цисплатин** Фторурацил** | 20 мг/м2 700 мг/м2 | В/в В/в, 24-часовая инфузия | 1-й - 5-й 1-й - 5-й | 28 |
| DC | Доцетаксел** Цисплатин** | 75 мг/м2 75 мг/м2 | В/в В/в | 1-й 1-й | 21 |
| Пембролизумаб**2 | 2 мг/кг или 200 мг | В/в | 1-й | 21 | |
| Ниволумаб **2 | 3 мг/кг или 240 мг | В/в | 1-й | 14 | |
| Ниволумаб**2 | 480 мг | В/в | 1-й | 28 | |
| Капецитабин | Капецитабин ** | 850 - 1250 мг/м2 | Внутрь х 2 раза в день | 1-14-й дни | 21 |
| Капецитабин** плюс лучевая терапия (еженедельно - 5 недель) | Капецитабин ** | 625 - 825 мг/м2 | Внутрь х 2 раза в день | С 1 по 5-й дни или С 1 по 7-й дни лучевой терапии | 5 недель |
1Возможны альтернативные варианты назначения данных схем терапии.
2Только при наличии MSI-H в опухолевой ткани, определенной описанными выше методами. Во второй или последующих линиях терапии.
3,12 Поддерживающая (сопроводительная) терапия.
• При режимах химиотерапии, сопровождающихся риском развития фебрильной нейтропении (ФН) более 20% пациентам с опухолью с невыявленной первичной локализацией рекомендуется терапия филграстимом**, или эмпэгфилграстимом**, или пэгфилграстимом, или другими колониестимулирующими факторами с целью первичной профилактики фебрильной нейтропении (ФН) [28, 29].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Комментарии. Первичная, вторичная профилактика проводится согласно существующим рекомендациям [28, 29]. Лечение ФН с применением антибактериальных препаратов и колониестимулирующих факторов проводится согласно существующим рекомендациям [28, 29].
• Пациентам с опухолью с невыявленной первичной локализацией профилактику тошноты и рвоты на фоне химиотерапии, лучевой терапии и/или химиолучевой терапии рекомендовано проводить согласно данным о частоте тошноты и рвоты противоопухолевого препарата или зоны облучения. Используют следующие противорвотные препараты: прочие противорвотные препараты (антагонисты NK1-рецепторов) (апрепитант или фосапрепитант), блокаторы серотониновых 5HT3-рецепторов (ондансетрон** и палоносетрон), дексаметазон**, стимуляторов моторики желудочно-кишечного тракта (метоклопрамид**), анксиолитики, блокаторы H2-гистаминовых рецепторов, антипсихотические средства (оланзапин 5 мг**) в соответствии с существующими рекомендациям [26, 30, 31, 32].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 1).
• Применение остеомодифицирующих агентов. Бифосфонатов и деносумаба**, а также препаратов кальция и колекальциферола рекомендуется пациентам с метастатическим поражением костной системы (золедроновая кислота** 4 мг в/в капельно 1 раз в 28 дней или другие бифосфонаты, деносумаб** 120 мг п/к 1 раз в 28 дней) для профилактики осложнений, а также для профилактики потери минеральной плотности костей скелета (золедроновая кислота** 4 мг в/в капельно 1 раз в 6 месяцев или другие бифосфонаты, деносумаб** 60 мг п/к 1 раз в 6 месяцев) при использовании аналогов гонадотропин-рилизинг гормона (антагонистов лютеинизирующего гормона рилизинг-гормона (ЛГРГ)), ингибиторов ароматазы, лучевой или хирургической кастрации согласно существующим рекомендациям [33, 34].
Уровень убедительности рекомендаций - А (уровень достоверности доказательств - 2).
• Рекомендуется пациентам, получающим лекарственную противоопухолевую терапию, проводить профилактику и лечение анемии согласно существующим рекомендациям с применением антианемических препаратов: рекомбинантных форм человеческого эритропоэтина (АТХ: другие антианемические препараты) (эпоэтин альфа**, эпоэтин бета**, дарбэпоэтин альфа**), препаратов железа для парентерального введения (железа (III) гидроксид сахарозный комплекс** или железа карбоксимальтозат**), заместительной гемотрансфузии, цианокобаламина**, фолиевой кислоты**, энтерального и парентерального питания, коррекции почечной и печеночной недостаточности [ 35,36 ].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Коррекцию осложнений при использовании рибоциклиба**, палбоциклиба**, абемациклиба, пикрея, используемых для лечения метастатических форм люминального, Her-2/neu отрицательного рака, рекомендовано проводить согласно степени тяжести с применением глюкокортикостероидов, редукции дозы и/или отмены препарата в соответствии с инструкцией к препарату и существующими рекомендациями [37].
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
• Для лечения осложнений на фоне терапии противоопухолевыми средствами- моноклональные антитела (ниволумаб **, пембролизумаб **), рекомендуется использовать глюкокортикоиды, инфликсимаб** 5 мг/кг 0,2,6, неделя, далее 5 мг/кг каждые 8 недель ** [38,39].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Лечение и профилактику гастроинтестинальных (диарея и констипация), сердечно-сосудистых, печеночных, почечных, дерматологических, тромбоэмболических осложнений у пациентов с опухолями с невыявленной первичной локализацией, экстравазации рекомендуется проводить согласно существующим рекомендациям [40, 41].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3,13 Обезболивание.
• Рекомендуется использовать утвержденные клинические рекомендации «Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи» для оптимального выбора противоболевой терапии у пациентов с хроническим болевым синдромом [42].Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
3,14 Диетотерапия.
Профилактику и лечение нутритивной недостаточности у пациентов с опухолями с невыявленной первичной локализацией необходимо проводить на основании протоколов рекомендаций по поддерживающей терапии с включением энтерального питания для сипинга или перорального приема, а также парентерального питания, препаратов, содержащих витамины и минералы для внутривенного введения [43-45].
Реабилитация и амбулаторное лечение
В настоящее время для большинства видов медицинской реабилитации отсутствуют клинические исследования с участием пациентов с ОНПЛ. Данные рекомендации сделаны на основании того, что во многих исследованиях, в том числе мета-анализах (Steffens, D et al, 2018 и других) и систематических обзорах, (Nicole L. Stout et al, 2017, R. Segal et al, 2017 и других) доказано, что различные виды медицинской реабилитации значительно ускоряют функциональное восстановление, сокращают сроки пребывания в стационаре после операции и снижают частоту развития осложнений и летальных исходов у пациентов с другими злокачественными новообразованиями.
• Рекомендуется всем пациентам с ОНПЛ проводить реабилитацию, ориентируясь на принципы реабилитации в зависимости от предполагаемой локализации первичного очага и проведенного хирургического, лекарственного противоопухолевого и/или лучевого лечения. Данные принципы изложены в соответствующих разделах клинических рекомендаций.
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
• Рекомендуется всем пациентам с ОНПЛ проводить реабилитацию, ориентируясь на принципы реабилитации в зависимости от предполагаемой локализации первичного очага и проведенного хирургического, лекарственного противоопухолевого и/или лучевого лечения. Данные принципы изложены в соответствующих разделах клинических рекомендаций.
Уровень убедительности рекомендаций - с (уровень достоверности доказательств - 5).
|
|
Профилактика
• В первые 1-2 года после завершения лечения рекомендуется обледования пациента проводить каждые 1-3 месяца, однако нет убедительных указаний на необходимый интервал профилактического осмотра после проведенного лечения [1, 7, 13, 15, 16].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется после завершения лечения следующий объем обследования пациента в рамках диспансерного наблюдения [15]:
• Анамнез и физикальное обследование.
• Развернутый клинический и биохимический анализ крови (по клиническим показаниям).
• КТ органов грудной клетки, брюшной полости с в/в контрастированием.
• МРТ органов малого таза с в/в контрастированием.
• УЗИ брюшной полости, малого таза, шейно-надключичных и аксиллярных зон.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
• Рекомендуется после завершения лечения следующий объем обследования пациента в рамках диспансерного наблюдения [15]:
• Анамнез и физикальное обследование.
• Развернутый клинический и биохимический анализ крови (по клиническим показаниям).
• КТ органов грудной клетки, брюшной полости с в/в контрастированием.
• МРТ органов малого таза с в/в контрастированием.
• УЗИ брюшной полости, малого таза, шейно-надключичных и аксиллярных зон.
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5).
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21,11,2011 №323-ФЗ (ред. от 25,05,2019) «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
• в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
• в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
• на основе настоящих клинических рекомендаций;
• с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патолого-анатомическое бюро (отделение).
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи таких пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентов с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациентов в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную медицинскую помощь по профилю «онкология», определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показанием для госпитализации в медицинскую организацию в экстренной или неотложной форме является:
• наличие осложнений онкологического заболевания, требующих оказания пациенту специализированной медицинской помощи в экстренной и неотложной форме;
• наличие осложнений лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия ) онкологического заболевания.
Показанием для госпитализации в медицинскую организацию в плановой форме является:
• необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
• наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, лучевая терапия, в том числе контактная, дистанционная и другие виды лучевой терапии, лекарственная терапия ), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показанием к выписке пациента из медицинской организации является:
• завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной медицинской помощи в условиях круглосуточного или дневного стационара при отсутствии осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
• отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при отсутствии осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
• необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами - специалистами медицинской организации, в которую планируется перевод.
• в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
• в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
• на основе настоящих клинических рекомендаций;
• с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патолого-анатомическое бюро (отделение).
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи таких пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентов с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациентов в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную медицинскую помощь по профилю «онкология», определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показанием для госпитализации в медицинскую организацию в экстренной или неотложной форме является:
• наличие осложнений онкологического заболевания, требующих оказания пациенту специализированной медицинской помощи в экстренной и неотложной форме;
• наличие осложнений лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия ) онкологического заболевания.
Показанием для госпитализации в медицинскую организацию в плановой форме является:
• необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
• наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, лучевая терапия, в том числе контактная, дистанционная и другие виды лучевой терапии, лекарственная терапия ), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показанием к выписке пациента из медицинской организации является:
• завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной медицинской помощи в условиях круглосуточного или дневного стационара при отсутствии осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
• отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при отсутствии осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
• необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи. Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами - специалистами медицинской организации, в которую планируется перевод.
|
|
Дополнительно
• Рекомендуется оценка статуса по шкале оценки общего состояния (ECOG) (Приложение Г) у всех пациентов, которым планируется проведение химиотерапии. При значении статуса ECOG равному 0-1 рекомендуется применение более интенсивных режимов химиотерапии.
• При ECOG равному 1-2 предпочтение отдается монохимиотерапии.
• При ECOG равному 3 проведение лекарственного противоопухолевого лечения решается на основании оценки рисков тяжелой токсичности и пользы для пациента.
• При EGOG 4, рекомендуется направить пациента на паллиативную терапию [15].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
• При ECOG равному 1-2 предпочтение отдается монохимиотерапии.
• При ECOG равному 3 проведение лекарственного противоопухолевого лечения решается на основании оценки рисков тяжелой токсичности и пользы для пациента.
• При EGOG 4, рекомендуется направить пациента на паллиативную терапию [15].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Критерии оценки качества медицинской помощи
При оценке качества медицинской помощи в рамках одного обращения пациента в медицинскую организацию рекомендуется использование только тех критериев, которые имеют отношение к оказанию помощи в рамках оцениваемого обращения.
| № | Критерии качества медицинской помощи | Оценка выполнения |
| 1. | Выполнено КТорганов грудной полости, брюшной полости с контрастирование, МРТ малого таза с контрастированием | Да/Нет |
| 2. | Выполнено патолого-анатомическое исследование биопсийного материала, с применением иммунногистохимических методов | Да/Нет |
| 3 | Проводена ли профилактика фебрильной нейтропении в соответствии с рекомендациями указанными в данных клинических рекомендациях, | Да/Нет |
| 4 | Проводена профилактика тошноты и рвоты в соответствии с рекомендациями указанными в данных клинических рекомендациях | Да/Нет |
| 5 | Назначены ли остеомодифицирующие агенты при метастазах в кости или использования аналогов ЛГРГ, ингибиторов ароматазы, лучевой или хирургичесой кастрации в соответствии с рекомендациями указанными в данных клинических рекомендациях | Да/Нет |
| 6 | Проводена ли профилактика анемии в соответствии с рекомендациями указанными в данных клинических рекомендациях | Да/Нет |
| 7 | Проводена коррекция осложнений при использовании рибоциклиба, палбоциклиба, абемациклиба, ниволумаба, пембролизумаба в соответствии с рекомендациями, указанными в данных клинических рекомендациях | Да/Нет |
| 8 | Проводена коррекция диареи и констипации в соответствии с рекомендациями, указанными в данных клинических рекомендациях | Да/Нет |
| 9. | Проведена оценка эффективности лечения кажждые 6-8 недель | Да/Нет |
| 10. | Проведена смена режима лечения при доказанном объективными методами (КТ, МРТ, УЗИ, ПЭТ-КТ) прогрессировании заболевания. | Да/Нет |
| 11 | Проведена модификация режима лечения при появлении признаков токсичности, не позволяющих провести запланированное лечение в полном объеме. | Да/Нет |
Список литературы
• Комаров И.Г., Комов Д.В. Метастазы злокачественных опухолей без выявленного первичного очага. Онкология справочник практического врача 2009;750-757.
• Abeloff M.D., Armitage J.O., Lichter A.S. et al. Unknown primary in clinical oncology. сhurchill Livingstone 1995;1833-1845.
• Leonard R.J., Nystrom J.S. Diagnostic evaluation of patients with carcinoma of unknown primary site. Semin Oncol 1993;20:244-250.
• Nystrom J.S., Weiner J.M., Heffelfinger-Juttner J. Metastatic and histologic presentation in unknown primary cancer. Semin Oncol 1997;4:53-58.
• Hillen H.F.P. Unknown primary tumours. Postgr Med J 2000;76:690-693.
• Pentheroudakis G., вriasoulis E., Pavlidis N. сancer of Unknown Primary Site: Missing Primary or Missing вiology. Oncologist 2007;12(4):418-425.
• Рак без выявленного первичного очага. Минимальные клинические рекомендации Европейского общества медицинской онкологии (ESMO) 2010;348-353.
• вugat R. et al. Standards, Options and Recommendations for the management of patient with carcinoma of unknown primary site. вull. сancer 2002;89(10):869-875.
• вlaszyk H., Hartmann A., вjornsson J. сancer of unknown primary: clinicopathologic correlations. APMIS 2003;111:1089-1094.
• Pavlidis N., Fizazi K. сarcinoma of Unknown Primary (CUP). сrit Rev Oncol Hematol 2009;69:271-278.
• Pavlidis N., Pentheroudakis G. сancer of unknown primary site: 20 questions to be answered. Ann Oncol 2010;21(SUPPL):7.
• Siegel R., Naishadham D. сancer statistics, 2012. сA сancer J сlin 2012;62(1):10-29. DOI: 10,3322/caac.20138.
• Fizazi K. et al. сancers of unknown primary site: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015;22:133-138.
• Varadhachary G.R., Abbruzzese J.L., Lenzi R. Diagnostic Strategies for Unknown Primary сancer. сancer 2004;100(9):1776-1785.
• Опухоли невыявленной первичной локализации. Практические рекомендации по лекарственному лечению злокачественных опухолей 2018; 250-259.
• Практические рекомендации по лечению злокачественных опухолей головы и шеи, стр. 88 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-05.pdf).
• Практические рекомендации по лекарственному лечению инвазивного рака молочной железы, стр.128-163 ( https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-08.pdf).
• Radiation Therapy for вreast сancer in Men https://www.cancer.org/cancer/breast-cancer-in-men/treating/radiation-therapy.html.
• Практические рекомендации по лечению герминогенных опухолей у мужчин, стр.533-556 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-33.pdf).
• Практические рекомендации по лекарственному лечению немелкоклеточного рака легкого, стр.32-48 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-01.pdf).
• Практические рекомендации по лекарcтвенному лечению мелкоклеточного рака легкого, стр. 49-54 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-02.pdf).
• Практические рекомендации по лекарственному лечению нейроэндокринных опухолей желудочно-кишечного тракта, поджелудочной железы и других локализаций, стр. 486-497 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-29.pdf).
• Практические рекомендации по лекарственному лечению рака яичников, первичного рака брюшины и рака маточных труб, стр. 164-176 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-09.pdf).
• Практические рекомендации по лекарственному лечению рака предстательной железы, стр. 519-532 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-32.pdf) Рекомендации NCCN guidelines version 3,2020 Occult Primary. https:// ://www.nccn.org/professionals/physician_gls/pdf/occult.pdf.
• Практические рекомендации по лекарственному лечению сарком мягких тканей, стр. 272-282 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-17.pdf).
• Практические рекомендации по лекарственному лечению меланомы кожи, стр. 423-258 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-15.pdf).
• Новик А.В., Гладков О.А., Имянитов Е.Н., Копп М.В., Новиков С.Н., Проценко С.А. и соавт. Практические рекомендации по лекарственному лечению больных с опухолями не выявленной первичной локализации. Злокачественные опухоли : Практические рекомендации RUSSCO 3s2, 2019 (том 9). С. 283-293. Рекомендации NCCN guidelines version 3,2020 Occult Primary. https:// ://www.nccn.org/professionals/physician_gls/pdf/occult.pdf.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Профилактика фебрильной нейтропении гранулоцитарными колониестимулирующимим факторами 2019; 21-32. http://rassc.org/ru/recommendations.
• вond Т.С, Mueller U., вarnes G. et al. Meta-analysis and indirect treatment comparison of lipegfilgrastim for the reduction of chemotherapy-induced neutropenia. Value Health 2015 Nov;18(7):A434. DOI: 10,1016/j.jval.2015,09,1041.
• Likhun Z., Xiang J., Xin D., Tao Z.L. A Systematic Review and Meta-Analysis of Intravenous Palonosetron in the Prevention of сhemotherapy-Induced Nausea and Vomiting in Adults. The Oncologist 2011;16:207-216.
• Navari R.M., Nagy с.K., Gray S.E. The use of olanzapine versus metoclopramide for the treatment of breakthrough chemotherapy-induced nausea and vomiting in patients receiving highly emetogenic chemotherapy. Support сare сancer 2013 Jun;21(6):1655-63. DOI: 10,1007/s00520-012-1710-6.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Профилактика тошноты/рвоты, индуцированной химиотерапией и лучевой терапией 2019; 89-103. http://rassc.org/ru/recommendations. Рекомендации NCCN Antiemesis v2,2020, https;// www.nccn.org/professionals/physician_gls/pdf/antiemesis V2,2020.pdf.
• Gnant M., Pfeiler G., Dubsky P.C. Adjuvant denosumab in breast cancer (ABCSG-18): a multicentre, randomized, double blind, placebo-controlled trial. June 1 2015 http://dx.doi.org/10,1016/ S0140-6736(15)60995-3.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Протокол мониторинга и коррекции минеральной плотности костной ткани на фоне лекарственного противоопухолевого лечения рака молочной железы 2019; 110-117. http://rassc.org/ru/recommendations.
• Gafter-Gvili A., Rozen-Zvi в., Vidal L. et al. Intravenous iron supplementation for the treatment of cancer-related anemia - systematic review and meta-analysis. Acta Oncologica 2013;52(1):18-29. DOI: 10,3109/0284186x.2012,702921.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Протокол коррекции анемии у онкологических больных 2019; 11-21. http://rassc.org/ru/recommendations.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Протокол коррекции осоложнений, возникающих при лечении ингибиторами сDK4/6 2019; 209-221. http://rassc.org/ru/recommendations.
• сhampiat S., Lambotte O., вarreau E. et al. Management of immune checkpoint blockade dysimmune toxicities: a collaborative position paper. Annals of Oncology 2016;27:559-574. DOI:10,1093 /annonc /mdv623.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Протокол коррекции иммуноопосредованных нежелательных явлений 2019; 171-209. http://rassc.org/ru/recommendations.
• Maroun J.A., Anthony L.B., вlais N. et al. Prevention and management of chemotherapy-induced diarrhea in patients with colorectal cancer: a consensus statement by the сanadian Working Group on сhemotherapy-Induced Diarrhea. сurr Oncol 2007;14(1):13-20.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Протокол коррекции иммуноопосредованных нежелательных явлений 2019; 55-70. http://rassc.org/ru/recommendations.
• Клинические рекомендации по лечению хронического болевого синдрома у взрослых пациентов при оказании паллиативной медицинской помощи 2016. http://cr.rosminzdrav.ru.
• вosaeus I. Nutritional support in multimodal therapy for cancer cachexia. Support сare сancer 2008;16:447-51.
• Thoresen L., Frykholm G., Lydersen S. et al. Nutritional status, cachexia and survival in patients with advanced colorectal carcinoma. Different assessment criteria for nutritional status provide unequal results. сlin Nutr 2013;32:65-72.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Протокол коррекции нутриттивной недостаточности 2019; 70-87. http://rassc.org/ru/recommendations.
• Abeloff M.D., Armitage J.O., Lichter A.S. et al. Unknown primary in clinical oncology. сhurchill Livingstone 1995;1833-1845.
• Leonard R.J., Nystrom J.S. Diagnostic evaluation of patients with carcinoma of unknown primary site. Semin Oncol 1993;20:244-250.
• Nystrom J.S., Weiner J.M., Heffelfinger-Juttner J. Metastatic and histologic presentation in unknown primary cancer. Semin Oncol 1997;4:53-58.
• Hillen H.F.P. Unknown primary tumours. Postgr Med J 2000;76:690-693.
• Pentheroudakis G., вriasoulis E., Pavlidis N. сancer of Unknown Primary Site: Missing Primary or Missing вiology. Oncologist 2007;12(4):418-425.
• Рак без выявленного первичного очага. Минимальные клинические рекомендации Европейского общества медицинской онкологии (ESMO) 2010;348-353.
• вugat R. et al. Standards, Options and Recommendations for the management of patient with carcinoma of unknown primary site. вull. сancer 2002;89(10):869-875.
• вlaszyk H., Hartmann A., вjornsson J. сancer of unknown primary: clinicopathologic correlations. APMIS 2003;111:1089-1094.
• Pavlidis N., Fizazi K. сarcinoma of Unknown Primary (CUP). сrit Rev Oncol Hematol 2009;69:271-278.
• Pavlidis N., Pentheroudakis G. сancer of unknown primary site: 20 questions to be answered. Ann Oncol 2010;21(SUPPL):7.
• Siegel R., Naishadham D. сancer statistics, 2012. сA сancer J сlin 2012;62(1):10-29. DOI: 10,3322/caac.20138.
• Fizazi K. et al. сancers of unknown primary site: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015;22:133-138.
• Varadhachary G.R., Abbruzzese J.L., Lenzi R. Diagnostic Strategies for Unknown Primary сancer. сancer 2004;100(9):1776-1785.
• Опухоли невыявленной первичной локализации. Практические рекомендации по лекарственному лечению злокачественных опухолей 2018; 250-259.
• Практические рекомендации по лечению злокачественных опухолей головы и шеи, стр. 88 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-05.pdf).
• Практические рекомендации по лекарственному лечению инвазивного рака молочной железы, стр.128-163 ( https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-08.pdf).
• Radiation Therapy for вreast сancer in Men https://www.cancer.org/cancer/breast-cancer-in-men/treating/radiation-therapy.html.
• Практические рекомендации по лечению герминогенных опухолей у мужчин, стр.533-556 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-33.pdf).
• Практические рекомендации по лекарственному лечению немелкоклеточного рака легкого, стр.32-48 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-01.pdf).
• Практические рекомендации по лекарcтвенному лечению мелкоклеточного рака легкого, стр. 49-54 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-02.pdf).
• Практические рекомендации по лекарственному лечению нейроэндокринных опухолей желудочно-кишечного тракта, поджелудочной железы и других локализаций, стр. 486-497 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-29.pdf).
• Практические рекомендации по лекарственному лечению рака яичников, первичного рака брюшины и рака маточных труб, стр. 164-176 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-09.pdf).
• Практические рекомендации по лекарственному лечению рака предстательной железы, стр. 519-532 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-32.pdf) Рекомендации NCCN guidelines version 3,2020 Occult Primary. https:// ://www.nccn.org/professionals/physician_gls/pdf/occult.pdf.
• Практические рекомендации по лекарственному лечению сарком мягких тканей, стр. 272-282 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-17.pdf).
• Практические рекомендации по лекарственному лечению меланомы кожи, стр. 423-258 (https://rosoncoweb.ru/standarts/RUSSCO/2019/2019-15.pdf).
• Новик А.В., Гладков О.А., Имянитов Е.Н., Копп М.В., Новиков С.Н., Проценко С.А. и соавт. Практические рекомендации по лекарственному лечению больных с опухолями не выявленной первичной локализации. Злокачественные опухоли : Практические рекомендации RUSSCO 3s2, 2019 (том 9). С. 283-293. Рекомендации NCCN guidelines version 3,2020 Occult Primary. https:// ://www.nccn.org/professionals/physician_gls/pdf/occult.pdf.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Профилактика фебрильной нейтропении гранулоцитарными колониестимулирующимим факторами 2019; 21-32. http://rassc.org/ru/recommendations.
• вond Т.С, Mueller U., вarnes G. et al. Meta-analysis and indirect treatment comparison of lipegfilgrastim for the reduction of chemotherapy-induced neutropenia. Value Health 2015 Nov;18(7):A434. DOI: 10,1016/j.jval.2015,09,1041.
• Likhun Z., Xiang J., Xin D., Tao Z.L. A Systematic Review and Meta-Analysis of Intravenous Palonosetron in the Prevention of сhemotherapy-Induced Nausea and Vomiting in Adults. The Oncologist 2011;16:207-216.
• Navari R.M., Nagy с.K., Gray S.E. The use of olanzapine versus metoclopramide for the treatment of breakthrough chemotherapy-induced nausea and vomiting in patients receiving highly emetogenic chemotherapy. Support сare сancer 2013 Jun;21(6):1655-63. DOI: 10,1007/s00520-012-1710-6.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Профилактика тошноты/рвоты, индуцированной химиотерапией и лучевой терапией 2019; 89-103. http://rassc.org/ru/recommendations. Рекомендации NCCN Antiemesis v2,2020, https;// www.nccn.org/professionals/physician_gls/pdf/antiemesis V2,2020.pdf.
• Gnant M., Pfeiler G., Dubsky P.C. Adjuvant denosumab in breast cancer (ABCSG-18): a multicentre, randomized, double blind, placebo-controlled trial. June 1 2015 http://dx.doi.org/10,1016/ S0140-6736(15)60995-3.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Протокол мониторинга и коррекции минеральной плотности костной ткани на фоне лекарственного противоопухолевого лечения рака молочной железы 2019; 110-117. http://rassc.org/ru/recommendations.
• Gafter-Gvili A., Rozen-Zvi в., Vidal L. et al. Intravenous iron supplementation for the treatment of cancer-related anemia - systematic review and meta-analysis. Acta Oncologica 2013;52(1):18-29. DOI: 10,3109/0284186x.2012,702921.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Протокол коррекции анемии у онкологических больных 2019; 11-21. http://rassc.org/ru/recommendations.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Протокол коррекции осоложнений, возникающих при лечении ингибиторами сDK4/6 2019; 209-221. http://rassc.org/ru/recommendations.
• сhampiat S., Lambotte O., вarreau E. et al. Management of immune checkpoint blockade dysimmune toxicities: a collaborative position paper. Annals of Oncology 2016;27:559-574. DOI:10,1093 /annonc /mdv623.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Протокол коррекции иммуноопосредованных нежелательных явлений 2019; 171-209. http://rassc.org/ru/recommendations.
• Maroun J.A., Anthony L.B., вlais N. et al. Prevention and management of chemotherapy-induced diarrhea in patients with colorectal cancer: a consensus statement by the сanadian Working Group on сhemotherapy-Induced Diarrhea. сurr Oncol 2007;14(1):13-20.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Протокол коррекции иммуноопосредованных нежелательных явлений 2019; 55-70. http://rassc.org/ru/recommendations.
• Клинические рекомендации по лечению хронического болевого синдрома у взрослых пациентов при оказании паллиативной медицинской помощи 2016. http://cr.rosminzdrav.ru.
• вosaeus I. Nutritional support in multimodal therapy for cancer cachexia. Support сare сancer 2008;16:447-51.
• Thoresen L., Frykholm G., Lydersen S. et al. Nutritional status, cachexia and survival in patients with advanced colorectal carcinoma. Different assessment criteria for nutritional status provide unequal results. сlin Nutr 2013;32:65-72.
• Кононенко И.Б., Снеговой А.В., Клясова Г.А. Под ред. Давыдова М.И. Протоколы клинических рекомендаций поддерживающей терапии в онкологии, регионального общества специалистов поддерживающей терапии в онкологии. Протокол коррекции нутриттивной недостаточности 2019; 70-87. http://rassc.org/ru/recommendations.
|
|
Приложения
Приложение А1.
Состав рабочей группы по разработке и пересмотру клинических рекомендаций.• Снеговой Антон Владимирович, д.м.н., заведующий онкологическим дневным стационаром (химиотерапевтического и хирургического лечения) ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. Профессор кафедры онкологии ФДПО ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России.
• Новик Алексей Викторович, к.м.н., старший научный сотрудник научного отдела онкоиммунологии НМИЦ онкологии им. Н.Н. Петрова Минздрава России, доцент Санкт-Петербургской педиатрической медицинской академии.
• Гладков Олег Александрович, д.м.н., профессор, онколог, заслуженный врач РФ, главный врач клиники ООО «Эвимед», Челябинск.
• Гуторов С.Л., д.м.н., ведущий научный сотрудник отделения химиотерапии и комбинированного лечения злокачественных опухолей ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России.
• Имянитов Евгений Наумович, д.м.н., профессор, член-корреспондент Российской академии наук, заведующий научным отделом биологии опухолевого роста, врач-генетик, врач - лабораторный генетик.
• Комаров Игорь Геннадъевич, профессор, д.м.н., главный научный сотрудник отделения хирургического №2 диагностики опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Комов Дмитрий Владимирович, профессор, д.м.н., руководитель отделения хирургического №2 диагностики опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Копп Михаил Валериевич, д.м.н., профессор, врач-онколог Клиники Медицинского университета «Реавиз».
• Проценко Светлана Анатольевна, д.м.н., профессор, заведующая отделением химиотерапии и инновационных технологий НМИЦ онкологии им. Н.Н. Петрова, ведущий научный сотрудник отдела инновационных методов терапевтической онкологии и реабилитации НМИЦ онкологии им. Н.Н. Петрова.
• Трофимова Оксана Петровна, д.м.н., ведущий научный сотрудник радиологического отделения радиационной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Кононенко Инесса Борисовна, к.м.н., старший научный сотрудник, онкологического дневного стационара (химиотерапевтического и хирургического лечения) ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Сельчук Владимир Юрьевич, д.м.н., профессор, заведующий кафедры онкологии ФДПО ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России.
• Возный Эдуард Кузьмич, д.м.н., профессор, отделение химиотерапии ГБУЗ г. Москвы «Городская клиническая больница им. Д.Д. Плетнева ДЗ г. Москвы».
• Рябчиков Денис Анатольевич, д.м.н., ведущий научный сотрудник, отделение хирургическое №5 опухолей молочных желез ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Малихова Ольга Александровна, д.м.н., профессор, заведующая эндоскопическим отделением ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Шолохов Владимир Николаевич, д.м.н., профессор, ведущий научный сотрудник отделения ультразвуковой диагностики ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Долгушин Михаил Борисович, д.м.н., профессор, отделение позитронно-эмиссионной томографии и циклотронно-радиохимической группы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Козлов Николай Александрович, к.м.н., ведущий научный сотрудник, отделение патологоанатомическое ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Назаренко Алексей Витальевич, к.м.н., заведующий радиологическим отделением ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Бутенко Алексей Владимирович, главный врач НИИ КО им. Н.Н. Трапезникова, ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Обухова Ольга Аркадьевна, к.м.н., врач-физиотерапевт, заведующая отделением реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» МЗ РФ, член европейской ассоциации парентерального и энтерального питания (ESPEN), член Российской ассоциации парентерального и энтерального питания (RESPEN).
• Галин Андрей Павлович, к.м.н., доцент кафедры педиатрии, курс онкологии, медицинского института, ФГБОУ ВО «Сыктывкарского государственного университета имени Питирима Сорокина». Главный внештатный специалист-онколог Министерства здравоохранения Республики Коми, заместитель главного врача по экспертной работе Государственного учреждения «Коми республиканского онкологического диспансера».
• Крылов Валерий Васильевич д.н.м., Заведующий отделением, радиохирургического лечения открытыми нуклидами МРНЦ им. А. Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Феденко Александр Александрович, заведующий Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Болотина Лариса Владимировна, заведующий Отделения химиотерапии Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Фалалеева Наталья Александровна, заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Филоненко Елена Вячеславовна, заведующий Центра лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Блок по организации медицинской помощи.
• Невольских А.А., д.м.н., заместитель директора по лечебной работе МРНЦ.
Им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Иванов С.А., проф. РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Хайлова Ж.В., м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России.
• Геворкян Т.Г., заместитель директора НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Конфликта интересов нет.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
• Врачи-онкологи.
• Врачи-хирурги.
• Врачи-радиологи.
• Врачи-генетики.
• Студенты медицинских вузов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств. Поиск в электронных базах данных; анализ современных научных разработок по проблеме в Российской Федерации (РФ) и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица П1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа. |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа. |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования. |
| 4 | Несравнительные исследования, описание клинического случая. |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов. |
Таблица П2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| УДД | Расшифровка |
| 1 | Систематический обзор рандомизированных клинических исследований с применением мета-анализа. |
| 2 | Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа. |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования. |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследование «случай-контроль». |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов. |
Таблица П3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| УУР | Расшифровка |
| А | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными). |
| В | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными). |
| С | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными). |
Методы, использованные для формулирования рекомендаций,. Консенсус экспертов.
Экономический анализ. Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
• Внешняя экспертная оценка.
• Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций. Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которых попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии врачей - детских онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценка важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и регистрировались вносимые в результате этого изменения в рекомендации. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка: проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что, в свою очередь, влияет на силу вытекающих из нее рекомендаций.
Приложение А3.
Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата.• Федеральный закон от 21 ноября 2011 г. N 323-ФЗ Об основах охраны здоровья граждан в Российской Федерации .
• Приказ Министерства здравоохранения РФ от 15 ноября 2012 г. N 915н.
Об утверждении Порядка оказания медицинской помощи населению по профилю онкология .
• Приказ Минздрава России от 13,10,2017 № 804н (ред. от 16,04,2019) Об утверждении номенклатуры медицинских услуг (Зарегистрировано в Минюсте России 07,11,2017 № 48808).
• Письмо Федерального фонда обязательного медицинского страхования от 23,04,2019 № 5071/26-2/и. http://www.ffoms.ru/documents/the-orders-oms/.
Приложение В.
Информация для пациента.Рекомендации при осложнениях химиотерапии - связаться с лечащим врачом.
• При повышении температуры тела 38° с и выше:
• Проконсультироваться с лечащим врачом.
• При стоматите:
• Диета - механическое, термическое щажение.
• Частое полоскание рта (каждый час) - ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом.
• Обрабатывать полость рта в соотвествии с назначением лечащего врача.
• При диарее:
• Диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье.
• Принимать препараты в соотвествии с назначением лечащего врача.
• При тошноте:
• Принимать препараты в соотвествии с назначениемлечащего врача.
Приложение Г1-ГN.
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Оригинальное название: The Eastern сooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
Источник (официальный сайт разработчиков, публикация с валидацией): TEGb TEGb https://ecog-acrin.org/resources/ecog-performance-status.
Oken MM, сreech RH, Tormey DC, Horton J, Davis TE, McFadden ET, сarbone PP. Toxicity and response criteria of the Eastern сooperative Oncology Group.Am J сlin Oncol 1982, 5(6):649-655.
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа ).
Содержание:
| Балл | Описание |
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания (90-100 % по шкале Карновского) |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70-80 % по шкале Карновского) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно - в вертикальном положении (50-60 % по шкале Карновского) |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30-40 % по шкале Карновского) |
| 4 | Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10-20 % по шкале Карновского) |
| 5 | Смерть |
Ключ (интерпретация): приведен в самой шкале.
|
|
Год актуализации информации
2021.