МКБ-10 коды
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: D47.5.
Год утверждения (частота пересмотра): 2018.
Возрастная категория: Взрослые.
Год окончания действия: 2020.
ID: 143.
Разработчик клинической рекомендации.
• Национальное гематологическое общество.
Год утверждения (частота пересмотра): 2018.
Возрастная категория: Взрослые.
Год окончания действия: 2020.
ID: 143.
Разработчик клинической рекомендации.
• Национальное гематологическое общество.
|
|
 Список сокращений
Список сокращений
Алло-ТГСК - аллогенная трансплантация гемопоэтических стволовых клеток.
АЧТВ - активированное частичное тромбопластиновое время.
ВОЗ - Всемирная организация здравоохранения.
ГЭС - гиперэозинофильный синдром.
ИТК - ингибиторы тирозинкиназ.
ИФ-α - интерферон-альфа.
КТ - компьютерная томография.
ЛПЗ - лимфопролиферативное заболевание.
МО - молекулярный ответ.
МПЗ-эо - миелопролиферативное заболевание с эозинофилией.
МРТ -магнитно-резонансная томография.
ПГО - полный гематологический ответ.
ПЦО - полный цитогенетический ответ.
ПЦР - полимеразная цепная реакция.
РКИ - рандомизированные контролируемые исследования.
СЦИ - стандартное цитогенетическое исследование.
УЗИ -ультразвуковое исследование.
ХМЛ - хронический миелолейкоз.
ЭХО-КГ - эхокардиография.
CEL-NOS - chronic eosinophilic leukemia, not otherwise specified/хронический эозинофильный лейкоз, никак иначе не определяемый.
FGFR1 - ген, кодирующий синтез рецептора к ростовому фактору, продуцируемому фибробластами.
FISH - флуоресцентная гибридизация.
JAK2 - ген, кодирующий синтез тирозинкиназы jak2.
NCI сTCAE - шкала токсичности Национального института Рака Канады.
PDGFRA - ген, кодирующий синтез α-цепи рецептора к ростовому фактору, продуцируемому тромбоцитами/мегакариоцитами.
PDGFRВ - ген, кодирующий синтез β-цепи рецептора к ростовому фактору, продуцируемому тромбоцитами/мегакариоцитами.
Ph - филадельфийская хромосома.
УДД- уровень достоверности доказательств.
УУР - уровень убедительности рекомендаций.
АЧТВ - активированное частичное тромбопластиновое время.
ВОЗ - Всемирная организация здравоохранения.
ГЭС - гиперэозинофильный синдром.
ИТК - ингибиторы тирозинкиназ.
ИФ-α - интерферон-альфа.
КТ - компьютерная томография.
ЛПЗ - лимфопролиферативное заболевание.
МО - молекулярный ответ.
МПЗ-эо - миелопролиферативное заболевание с эозинофилией.
МРТ -магнитно-резонансная томография.
ПГО - полный гематологический ответ.
ПЦО - полный цитогенетический ответ.
ПЦР - полимеразная цепная реакция.
РКИ - рандомизированные контролируемые исследования.
СЦИ - стандартное цитогенетическое исследование.
УЗИ -ультразвуковое исследование.
ХМЛ - хронический миелолейкоз.
ЭХО-КГ - эхокардиография.
CEL-NOS - chronic eosinophilic leukemia, not otherwise specified/хронический эозинофильный лейкоз, никак иначе не определяемый.
FGFR1 - ген, кодирующий синтез рецептора к ростовому фактору, продуцируемому фибробластами.
FISH - флуоресцентная гибридизация.
JAK2 - ген, кодирующий синтез тирозинкиназы jak2.
NCI сTCAE - шкала токсичности Национального института Рака Канады.
PDGFRA - ген, кодирующий синтез α-цепи рецептора к ростовому фактору, продуцируемому тромбоцитами/мегакариоцитами.
PDGFRВ - ген, кодирующий синтез β-цепи рецептора к ростовому фактору, продуцируемому тромбоцитами/мегакариоцитами.
Ph - филадельфийская хромосома.
УДД- уровень достоверности доказательств.
УУР - уровень убедительности рекомендаций.
Термины и определения
Гиперэозинофильный синдром - состояние, при котором абсолютное число эозинофильных лейкоцитов в крови превышает 1,5х109/л, имеются признаки поражения внутренних органов (сердце, легкие, желудочно-кишечный тракт, кожа ).
Миелопролиферативные заболевания, протекающие с эозинофилией. Заболевания, при которых у пациентов с гиперэозинофильным синдромом выявлены молекулярные и цитогенетические маркеры, подтверждающие клональную (опухолевую) природу заболевания.
Эозинофилия - состояние, при котором абсолютное число эозинофильных лейкоцитов в крови превышает 0,6х109/л.
Миелопролиферативные заболевания, протекающие с эозинофилией. Заболевания, при которых у пациентов с гиперэозинофильным синдромом выявлены молекулярные и цитогенетические маркеры, подтверждающие клональную (опухолевую) природу заболевания.
Эозинофилия - состояние, при котором абсолютное число эозинофильных лейкоцитов в крови превышает 0,6х109/л.
Описание
1 Определение.
Миелопролиферативные заболевания, протекающие с эозинофилией (МПЗ-эо) - это группа опухолевых заболеваний миелоидной ткани, в основе которых лежат структурные нарушения ряда генов. Ключевыми являются гены, кодирующие синтез активных белков - тирозинкиназ: PDGFRA, PDGFRB, FGFR1, JAK2. В редких случаях МПЗ-эо патологический клон содержит другие гены в составе различных хромосомных аберраций. До открытия патогенетической роли молекулярных нарушений данные заболевания рассматривались как гиперэозинофильный синдром (ГЭС), то есть, совокупность абсолютной эозинофилии, равной или превышающей 1,5х109/л, и различных клинических симптомов, причина которого осталась неустановленной.
Миелопролиферативные заболевания, протекающие с эозинофилией (МПЗ-эо) - это группа опухолевых заболеваний миелоидной ткани, в основе которых лежат структурные нарушения ряда генов. Ключевыми являются гены, кодирующие синтез активных белков - тирозинкиназ: PDGFRA, PDGFRB, FGFR1, JAK2. В редких случаях МПЗ-эо патологический клон содержит другие гены в составе различных хромосомных аберраций. До открытия патогенетической роли молекулярных нарушений данные заболевания рассматривались как гиперэозинофильный синдром (ГЭС), то есть, совокупность абсолютной эозинофилии, равной или превышающей 1,5х109/л, и различных клинических симптомов, причина которого осталась неустановленной.
Причины
Значительная часть случаев гиперэозинофилии имеет реактивный характер и сопровождает различные заболевания и патологические состояния, перечень которых представлен в Приложении Г1. Это поликлональный процесс, регулируемый эозинофилопоэтическими цитокинами, стимулирующими пролиферацию эозинофилов и их предшественников.
С развитием молекулярных методов исследования значительно расширились представления о природе ГЭС. В 2003 году у нескольких пациентов с ГЭС было подтверждено наличие слитного гена FIP1L1-PDGFRA как следствие интерстициальной делеции фрагмента длинного плеча хромосомы 4 (del 4(q12)) [1]. Выявление этого маркера стало основой установления диагноза клонального новообразования. Подтвердить наличие del 4(q12) при стандартном цитогенетическом исследовании невозможно в связи с ее небольшим размером, поэтому диагностика основывается на обнаружении экспрессии транскрипта FIP1L1-PDGFRα методом полимеразной цепной реакции (ПЦР) и/или делеции фрагмента сHIC2 хромосомы 4 методом FISH. Среди всех клональных новообразований, протекающих с эозинофилией, PDGFRα-позитивныая нозологическая форма является наиболее частой [2-5].
Другой вариант клонального новообразования с эозинофилией связан с аномалией гена PDGFRВ, кодирующего синтез β-цепи рецептора к ростовому фактору, продуцируемому тромбоцитами/мегакариоцитами. Известно порядка 30 вариантов его вовлечения в различные транслокации, но в большинстве случаев встречается химерный ген ETV6-PDGFRВ как следствие транслокации t(5;12) (q31-33;p13). Эозинофилия при этом заболевании не всегда присутствует; напротив, может отмечаться моноцитоз, что иногда приводит к установлению диагноза «хронический миеломоноцитарный лейкоз» [2, 4, 5].
Еще одна нозологическая форма обусловлена структурными нарушениями гена FGFR1, кодирующего синтез рецептора ростового фактора фибробластов. Наиболее часто встречающиеся транслокации с участием этого гена - t(8;13) (p11;q12), t(8;9)(p11;q34), t(6;8)(q27;p11). Развивается патология, описываемая в литературе как «стволовоклеточный лейкоз-лимфома». Процесс отличается крайне агрессивным течением с быстрой трансформацией в острый, чаще миелобластный, лейкоз [5]. Методов эффективного консервативного лечения FGFR1-позитивного новообразования в настоящее время нет. При диагностировании данной нозологии показан поиск HLA-совместимого донора и выполнение аллогенная трансплантации гемопоэтических стволовых клеток (алло-ТГСК). В последние годы ведутся исследования, направленные на создание ингибиторов тирозинкиназ, специфичных для этой патологии [6].
Следствием транслокации t(8;9) (p22;p24) является образование слитного гена PCM1-JAK2. Заболевание обычно проявляется клинико-лабораторными признаками миелопролиферативного заболевания (МПЗ), миелодиспластического синдрома (МДС)/МПЗ, в 50-70% случаев, ассоциированного с эозинофилией и фиброзом костного мозга [7, 8]. Клиническое течение характеризуется агрессивностью с быстрой трансформацией в миелобластный (реже лимфобластный) вариант острого лейкоза. Описаны случаи заболевания, дебютировавшего как острый лейкоз - миелобластный (чаще) или лимфобластный.
По мере накопления данных об этих новых нозологиях выяснилось, что иногда МПЗ-эо может иметь смешанный фенотип с сочетанием миелопролиферативного процесса в костном мозге и лимфопролиферативного - в увеличенных лимфатических узлах, но при этом в обеих клеточных линиях обнаруживается единый молекулярный маркер, что дало основание рассматривать его как единый патологический процесс, в основе которого лежит генетическая мутация в полипотентной клетке-предшественнице. Данный феномен нашел отражение в названии нозологических форм, представленных в ВОЗ-классификации новообразований, протекающих с эозинофилией, 2016 года [9].
При выявлении других генетических аномалий (не включающих эти четыре гена), либо в случаях, когда хромосомные аберрации не обнаружены, но имеется повышение числа бластных клеток (более 2% в периферической крови и/или более 5% - в костном мозге), устанавливается диагноз «хронический эозинофильный лейкоз, никак иначе не определяемый» (Chronic eosinophilic leukemia, not otherwise specified или сEL-NOS) [9].
Таким образом, для установления причины ГЭС требуется комплексная диагностика с использованием различных методов исследования. ГЭС как окончательный диагноз устанавливается методом исключения, и лишь констатирует факт наличия эозинофилии и поражения органов. При этом также предполагается либо реактивная, либо опухолевая (миелопролиферативная) природа синдрома. Так, если имеется симптомокомплекс, характерный для миелопролиферативного процесса (гепатоспленомегалия, миелоцитарный сдвиг в формуле крови, миелоидная гиперплазия в костном мозге), некоторые исследователи [1, 2, 10] рассматривают данный вариант ГЭС как миелопролиферативный. По нашему мнению, выделение миелопролиферативного варианта из группы ГЭС крайне важно для выбора терапевтических подходов.
С развитием молекулярных методов исследования значительно расширились представления о природе ГЭС. В 2003 году у нескольких пациентов с ГЭС было подтверждено наличие слитного гена FIP1L1-PDGFRA как следствие интерстициальной делеции фрагмента длинного плеча хромосомы 4 (del 4(q12)) [1]. Выявление этого маркера стало основой установления диагноза клонального новообразования. Подтвердить наличие del 4(q12) при стандартном цитогенетическом исследовании невозможно в связи с ее небольшим размером, поэтому диагностика основывается на обнаружении экспрессии транскрипта FIP1L1-PDGFRα методом полимеразной цепной реакции (ПЦР) и/или делеции фрагмента сHIC2 хромосомы 4 методом FISH. Среди всех клональных новообразований, протекающих с эозинофилией, PDGFRα-позитивныая нозологическая форма является наиболее частой [2-5].
Другой вариант клонального новообразования с эозинофилией связан с аномалией гена PDGFRВ, кодирующего синтез β-цепи рецептора к ростовому фактору, продуцируемому тромбоцитами/мегакариоцитами. Известно порядка 30 вариантов его вовлечения в различные транслокации, но в большинстве случаев встречается химерный ген ETV6-PDGFRВ как следствие транслокации t(5;12) (q31-33;p13). Эозинофилия при этом заболевании не всегда присутствует; напротив, может отмечаться моноцитоз, что иногда приводит к установлению диагноза «хронический миеломоноцитарный лейкоз» [2, 4, 5].
Еще одна нозологическая форма обусловлена структурными нарушениями гена FGFR1, кодирующего синтез рецептора ростового фактора фибробластов. Наиболее часто встречающиеся транслокации с участием этого гена - t(8;13) (p11;q12), t(8;9)(p11;q34), t(6;8)(q27;p11). Развивается патология, описываемая в литературе как «стволовоклеточный лейкоз-лимфома». Процесс отличается крайне агрессивным течением с быстрой трансформацией в острый, чаще миелобластный, лейкоз [5]. Методов эффективного консервативного лечения FGFR1-позитивного новообразования в настоящее время нет. При диагностировании данной нозологии показан поиск HLA-совместимого донора и выполнение аллогенная трансплантации гемопоэтических стволовых клеток (алло-ТГСК). В последние годы ведутся исследования, направленные на создание ингибиторов тирозинкиназ, специфичных для этой патологии [6].
Следствием транслокации t(8;9) (p22;p24) является образование слитного гена PCM1-JAK2. Заболевание обычно проявляется клинико-лабораторными признаками миелопролиферативного заболевания (МПЗ), миелодиспластического синдрома (МДС)/МПЗ, в 50-70% случаев, ассоциированного с эозинофилией и фиброзом костного мозга [7, 8]. Клиническое течение характеризуется агрессивностью с быстрой трансформацией в миелобластный (реже лимфобластный) вариант острого лейкоза. Описаны случаи заболевания, дебютировавшего как острый лейкоз - миелобластный (чаще) или лимфобластный.
По мере накопления данных об этих новых нозологиях выяснилось, что иногда МПЗ-эо может иметь смешанный фенотип с сочетанием миелопролиферативного процесса в костном мозге и лимфопролиферативного - в увеличенных лимфатических узлах, но при этом в обеих клеточных линиях обнаруживается единый молекулярный маркер, что дало основание рассматривать его как единый патологический процесс, в основе которого лежит генетическая мутация в полипотентной клетке-предшественнице. Данный феномен нашел отражение в названии нозологических форм, представленных в ВОЗ-классификации новообразований, протекающих с эозинофилией, 2016 года [9].
При выявлении других генетических аномалий (не включающих эти четыре гена), либо в случаях, когда хромосомные аберрации не обнаружены, но имеется повышение числа бластных клеток (более 2% в периферической крови и/или более 5% - в костном мозге), устанавливается диагноз «хронический эозинофильный лейкоз, никак иначе не определяемый» (Chronic eosinophilic leukemia, not otherwise specified или сEL-NOS) [9].
Таким образом, для установления причины ГЭС требуется комплексная диагностика с использованием различных методов исследования. ГЭС как окончательный диагноз устанавливается методом исключения, и лишь констатирует факт наличия эозинофилии и поражения органов. При этом также предполагается либо реактивная, либо опухолевая (миелопролиферативная) природа синдрома. Так, если имеется симптомокомплекс, характерный для миелопролиферативного процесса (гепатоспленомегалия, миелоцитарный сдвиг в формуле крови, миелоидная гиперплазия в костном мозге), некоторые исследователи [1, 2, 10] рассматривают данный вариант ГЭС как миелопролиферативный. По нашему мнению, выделение миелопролиферативного варианта из группы ГЭС крайне важно для выбора терапевтических подходов.
|
|
Эпидемиология
Эпидемиологические данные по клональным новообразованиям, протекающим с эозинофилией, в литературе не представлены, но данные по заболеваемости в США миелопролиферативным вариантом гиперэозинофильного синдрома, в большей части случаев которого в ходе молекулярной диагностики верифицируются клональные новообразования, составляет 0,036 на 100 000 взрослого населения [11].
Классификация
Классификация новообразований, протекающих с эозинофилией, предложенная Всемирной организацией здравоохранения (ВОЗ) в 2016 году [9], содержит следующие нозологические формы:
• Миелоидное/лимфоидное новообразование с аномалиями гена PDGFRA;
• Миелоидное/лимфоидное новообразование с аномалиями гена PDGFRВ;
• Миелоидное/лимфоидное новообразование с аномалиями гена FGFR1;
• Миелоидное/лимфоидное новообразование с наличием слитного гена PCM1-JAK2;
• Хронический эозинофильный лейкоз, никак иначе не определяемый (CEL-NOS).
Диагноз «Гиперэозинофильный синдром» впервые был исключен из данной классификации, так как формально его нельзя отнести к новообразованиям. Однако на практике финальным этапом установления диагноза является дифференциальная диагностика с сEL-NOS, который от ГЭС отличает наличие подтвержденного патологического клона и/или повышенного числа бластных клеток (более 2% в периферической крови и/или от 5% до 19% - в костном мозге). Поэтому диагностика ГЭС, в частности, его миелопролиферативного варианта, включена в настоящие Рекомендации как часть общего диагностического процесса.
• Миелоидное/лимфоидное новообразование с аномалиями гена PDGFRA;
• Миелоидное/лимфоидное новообразование с аномалиями гена PDGFRВ;
• Миелоидное/лимфоидное новообразование с аномалиями гена FGFR1;
• Миелоидное/лимфоидное новообразование с наличием слитного гена PCM1-JAK2;
• Хронический эозинофильный лейкоз, никак иначе не определяемый (CEL-NOS).
Диагноз «Гиперэозинофильный синдром» впервые был исключен из данной классификации, так как формально его нельзя отнести к новообразованиям. Однако на практике финальным этапом установления диагноза является дифференциальная диагностика с сEL-NOS, который от ГЭС отличает наличие подтвержденного патологического клона и/или повышенного числа бластных клеток (более 2% в периферической крови и/или от 5% до 19% - в костном мозге). Поэтому диагностика ГЭС, в частности, его миелопролиферативного варианта, включена в настоящие Рекомендации как часть общего диагностического процесса.
Клиническая картина
Клиническая картина миелоидных/лимфоидных новообразований, протекающих с эозинофилией, складывается из симптомокомплекса, свойственного как опухолям гемопоэтической ткани в целом, так и симптомов поражения различных органов и тканей, обусловленных непосредственно гиперэозинофилией [2, 5].
К первому относятся так называемые «симптомы интоксикации» (слабость, утомляемость, повышение температуры, снижение массы тела), а также, признаки внекостномозговой пролиферации опухолевого клона (увеличение размеров селезенки, печени, лимфатических узлов, опухолевые пролифераты в некроветворных органах).
Клинические проявления гиперэозинофилии, представленные в таблице 1, чрезвычайно разнообразны, что связано с возможным поражением любых органов и тканей, обусловленным избыточным количеством эозинофилов, выделяющих целый ряд токсичных белков (большой основный белок, эозинофильный катионный белок, эозинофильный нейротоксин ) и инфильтрирующих ткани сердца, легких, кожи.
Таблица 1. Клинические проявления гиперэозинофилиии [2].
К первому относятся так называемые «симптомы интоксикации» (слабость, утомляемость, повышение температуры, снижение массы тела), а также, признаки внекостномозговой пролиферации опухолевого клона (увеличение размеров селезенки, печени, лимфатических узлов, опухолевые пролифераты в некроветворных органах).
Клинические проявления гиперэозинофилии, представленные в таблице 1, чрезвычайно разнообразны, что связано с возможным поражением любых органов и тканей, обусловленным избыточным количеством эозинофилов, выделяющих целый ряд токсичных белков (большой основный белок, эозинофильный катионный белок, эозинофильный нейротоксин ) и инфильтрирующих ткани сердца, легких, кожи.
Таблица 1. Клинические проявления гиперэозинофилиии [2].
| Орган | Симптомы |
| Сердце | Сердечная недостаточность, гипертрофическая и дилатационная кардиомиопатия, аритмия, перикардиальный выпот могут возникать вследствие некроза миокарда (в течение недель), вовлечения клапанов, тромбозов (месяцы спустя) и фиброза (конечная стадия) - эндокардит Леффлера и миокардиальный фиброз в поздних стадиях |
| Нервная система | Тромбозы сосудов головного мозга - чаще артериальных, транзиторная ишемия, вызванная тромбоэмболией или формированием локального тромба. Энцефалопатия, в частности, когнитивная и/или центральный парез. Периферическая полинейропатия, сенсорная или моторная. |
| Кожа | Уртикарная сыпь, ангионевротический отек, зуд, папулезные или узловатые элементы, изъязвления кожи и или слизистых оболочек |
| Легкие | Хронический, обычно непродуктивный кашель. Иногда может быть гиперактивность бронхов; некоторые симптомы могут быть вторичными, обусловленными поражением сердца. |
| Желудочно-кишечный тракт | Диарея, перемежающаяся или постоянная; различные абдоминальные симптомы; возможно селективное поражение отдельных участков желудочно-кишечного тракта. |
| Ревматологические симптомы | Артралгии, чаще крупных суставов; артриты и миалгии. Аутоиммунные феномены чаще всего развиваются при ревматических заболеваниях с эозинофилией. |
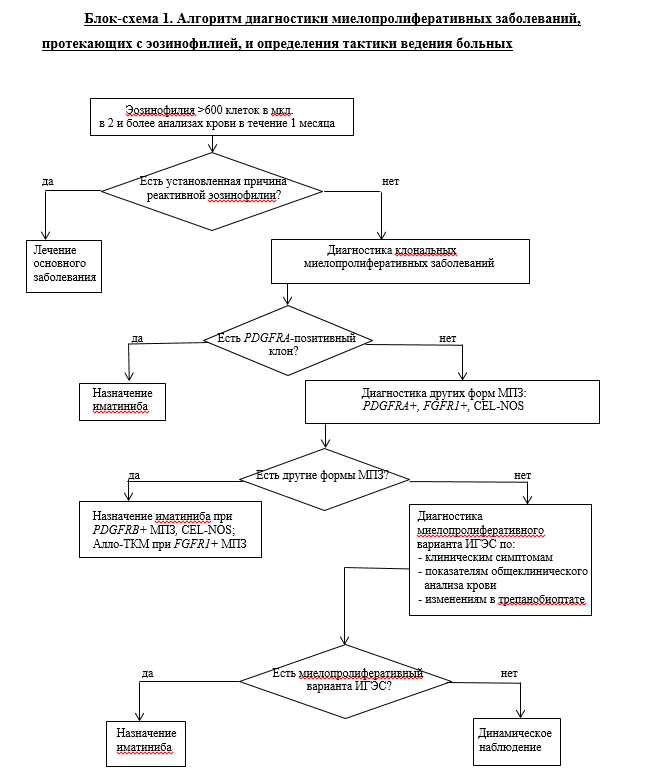
Диагностика
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (в соответствии с шкалами оценки УДД и УУР) по причине отсутствия посвященных им клинических исследований. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
• обращать внимание на наличие анемических жалоб, симптомов гиперметаболического состояния (субфебрилитет, потеря веса);
• собирать информацию о сопутствующих заболеваниях и их терапии;
• оценка анамнестических данных и результатов предшествующего обследования (при наличии) в целом, с целью исключения заболеваний, сопровождающихся реактивной эозинофилией (Приложение Г1) [2].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. Увеличение размеров селезенки, печени, нескольких лимфатических узлов дает основание сразу направить диагностический поиск в сторону онкогематологического процесса.
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. Наличие миелоцитарного сдвига в лейкоцитарной формуле, анемия, тромбоцитопения или тромбоцитоз, дают основания предполагать миелопролиферативный процесс.
• Рекомендуется проводить всем пациентам коагулограмму. Протромбиновый индекс, АЧТВ, фибриноген для диагностики отклонений коагулогических показателей [2, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. Отклонения коагулологических показателей, свидетельствующие о гиперкоагуляции, требуют настороженности в отношении тромботических осложнений как следствие эозинофилии.
• Рекомендуется проводить всем пациентам иммунохимическое исследование белков сыворотки крови с определением уровня IgE для верификации диагноза [2, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. Наличие миелоцитарного сдвига в лейкоцитарной формуле, анемия, тромбоцитопения или тромбоцитоз, нормальный уровень IgE дают основания предполагать миелопролиферативный процесс.
• Рекомендуется проводить всем пациентам исследование уровня сердечного тропонина для диагностики миокардита [2, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. При повышении уровня сердечного тропонина возможно наличие миокардита как возможное осложнение эозинофилии.
• Рекомендуется проводить всем пациентамморфологическое исследование пунктата костного мозга (миелограмму) [2, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии: Наличие в миелограмме увеличенного количества бластов >5% является основанием для установления диагноза сEL-NOS (при отсутствии мутаций генов PDGFRА, PDGFRВ, FGFR1, JAK2).
• Рекомендуется проводить всем пациентам гистологическое исследование биоптата костного мозга (трепанобиопсию) [2, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. Гистологическое исследование костного мозга позволяет выявить характерные диагностические признаки миелопролиферативного процесса с эозинофилией - редукцию жировой ткани, миелоидную гиперплазию с преобладанием эозинофильных форм, иногда незрелых, подавлением эритроидного и мегакариоцитарного ростков, наличие фиброза в ряде случаев.
• Рекомендуется проводить всем пациентам СЦИ костного мозга, лимфатических узлов (при их увеличении) [2, 12,13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. Наличие хромосомных аберраций является основанием для установления диагноза сEL-NOS (при отсутствии мутаций генов PDGFRА, PDGFRВ, FGFR1, JAK2).
• Рекомендуется проводить всем пациентам молекулярно-генетическое исследование костного мозга, лимфатических узлов (при их увеличении) для выявления структурных нарушений генов PDGFRА, PDGFRВ, FGFR1 методом полимеразной цепной реакции (ПЦР) с использованием праймеров FIP1L1-PDGFRА, ETV6-PDGFRВ костного мозга или методом FISH с соответствующими зондами [2, 5, 13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. Целесообразно в первую очередь осуществить поиск наиболее часто встречающихся молекулярных маркеров МПЗ-эо - выполнить FISH анализ и/или ПЦР исследование гена PDGFRА. При отрицательном результате - осуществить диагностический поиск с целью исключения поломок генов PDGFRВ, FGFR1 (методом FISH и/или ПЦР).
Молекулярно-генетические исследования для выявления структурных нарушений генов PDGFRА, PDGFRВ, FGFR1, стандартное цитогенетическое исследование, оценка миелограммы и показателей общего анализа крови позволяют точно верифицировать нозологическую форму новообразования, представленную в Классификации ВОЗ 2016. Прямое подтверждение наличия слитного гена PCM1-JAK2 методом ПЦР пока не доступно, но выявление транслокации t(8;9)(p22;p24) при СЦИ делает диагноз PCM1-JAK2-позитивного новообразования весьма вероятным.
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. УЗИ органов брюшной полости позволяет выявить увеличение размеров печени, селезенки, внутрибрюшных лимфатических узлов. Выполнение ЭХО-КГ показано всем пациентам для оценки исходных изменений в сердце и последующего контроля на фоне терапии - при их наличии.
• Рекомендуется проводить пациентам компьютерную томографию (КТ) органов грудной и брюшной полости, малого таза для исключения других опухолей и заболеваний; при наличии общемозговой и очаговой симптоматики - магнитно-резонансную томографию (МРТ) головного мозга [2, 13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. КТ позволяет диагностировать как гепатоспленомегалию, так и другие патологические изменения органов.
• Рекомендуется проводить всем пациентам биопсию органов и патологических образований с целью верификации характера поражения, в том числе, специфического, обусловленный пролиферацией эозинофилов [2, 13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
• консультации врачей-специалистов (паразитолога, кардиолога, невропатолога, ревматолога и других) для выявления сопутствующей патологии;
• исследование костного мозга или крови методом FISH и/или качественной ПЦР на наличие химерного гена вCR-ABL с целью диагностики ХМЛ - при выявлении характерных клинико-лабораторных симптомов и неинформативности СЦИ;
• исключение системного мастоцитоза при выявлении в трепанобиоптате и/или других биоптатах (кроме кожи) множественных скоплений тучных клеток (≥ 15 в агрегате) - поиск дополнительных диагностических критериев диагноза «системный мастоцитоз»:
- обнаружение в миелограмме >25% тучных клеток с атипичной формой (веретенообразные );
- выявление в биоптатах методом ПЦР D816V-мутации гена с-KIT;
- обнаружение при иммунофенотипировании тучных клеток, экспрессирующих сD2 или сD25;
- повышение уровня сывороточной триптазы более 20 нг/мл;
• комплексное обследование для верификации лимфопролиферативных заболеваний (ЛПЗ) при наличии характерных для них симптомов (гистологические исследование биоптатов лимфатических узлов/удаленной селезенки с иммуногистохимическим исследованием, иммунофенотипированием, ПЦР для выявления реаранжировки генов Т- и В-клеточных рецепторов - IgVH, TCR);
• для проведения алло-ТГСК - HLA-типирование при наличии сиблингов, при их отсутствии поиск HLA-совместимого неродственного донора, для пациентов с:
- обнаруженной методом FISH аномалией гена FGFR1;
- агрессивным течением заболевания;
- резистентностью к иматинибу** у молодых пациентов [2, 5].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
2,1 Жалобы и анамнез.
• Рекомендуется всем пациентам при сборе анамнеза и жалоб для верификации диагноза:• обращать внимание на наличие анемических жалоб, симптомов гиперметаболического состояния (субфебрилитет, потеря веса);
• собирать информацию о сопутствующих заболеваниях и их терапии;
• оценка анамнестических данных и результатов предшествующего обследования (при наличии) в целом, с целью исключения заболеваний, сопровождающихся реактивной эозинофилией (Приложение Г1) [2].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
2,2 Физикальное обследование.
• Рекомендуется проводить всем пациентам для верификации диагноза. Осмотр, включающий измерение роста и массы тела, температуры тела; оценку состояния костно-суставной системы; выявление признаков анемического и геморрагического синдрома; наличие гепатоспленомегалии, лимфоаденопатии; наличие признаков дисфункции сердца, легких, печени, других органов [12].Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. Увеличение размеров селезенки, печени, нескольких лимфатических узлов дает основание сразу направить диагностический поиск в сторону онкогематологического процесса.
2,3 Лабораторная диагностика.
• Рекомендуется выполнять всем пациентам клинический анализ крови с подсчетом лейкоцитарной формулы и определением количества тромбоцитов для верификации диагноза [2, 12].Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. Наличие миелоцитарного сдвига в лейкоцитарной формуле, анемия, тромбоцитопения или тромбоцитоз, дают основания предполагать миелопролиферативный процесс.
• Рекомендуется проводить всем пациентам коагулограмму. Протромбиновый индекс, АЧТВ, фибриноген для диагностики отклонений коагулогических показателей [2, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. Отклонения коагулологических показателей, свидетельствующие о гиперкоагуляции, требуют настороженности в отношении тромботических осложнений как следствие эозинофилии.
• Рекомендуется проводить всем пациентам иммунохимическое исследование белков сыворотки крови с определением уровня IgE для верификации диагноза [2, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. Наличие миелоцитарного сдвига в лейкоцитарной формуле, анемия, тромбоцитопения или тромбоцитоз, нормальный уровень IgE дают основания предполагать миелопролиферативный процесс.
• Рекомендуется проводить всем пациентам исследование уровня сердечного тропонина для диагностики миокардита [2, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. При повышении уровня сердечного тропонина возможно наличие миокардита как возможное осложнение эозинофилии.
• Рекомендуется проводить всем пациентамморфологическое исследование пунктата костного мозга (миелограмму) [2, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии: Наличие в миелограмме увеличенного количества бластов >5% является основанием для установления диагноза сEL-NOS (при отсутствии мутаций генов PDGFRА, PDGFRВ, FGFR1, JAK2).
• Рекомендуется проводить всем пациентам гистологическое исследование биоптата костного мозга (трепанобиопсию) [2, 12].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. Гистологическое исследование костного мозга позволяет выявить характерные диагностические признаки миелопролиферативного процесса с эозинофилией - редукцию жировой ткани, миелоидную гиперплазию с преобладанием эозинофильных форм, иногда незрелых, подавлением эритроидного и мегакариоцитарного ростков, наличие фиброза в ряде случаев.
• Рекомендуется проводить всем пациентам СЦИ костного мозга, лимфатических узлов (при их увеличении) [2, 12,13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. Наличие хромосомных аберраций является основанием для установления диагноза сEL-NOS (при отсутствии мутаций генов PDGFRА, PDGFRВ, FGFR1, JAK2).
• Рекомендуется проводить всем пациентам молекулярно-генетическое исследование костного мозга, лимфатических узлов (при их увеличении) для выявления структурных нарушений генов PDGFRА, PDGFRВ, FGFR1 методом полимеразной цепной реакции (ПЦР) с использованием праймеров FIP1L1-PDGFRА, ETV6-PDGFRВ костного мозга или методом FISH с соответствующими зондами [2, 5, 13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. Целесообразно в первую очередь осуществить поиск наиболее часто встречающихся молекулярных маркеров МПЗ-эо - выполнить FISH анализ и/или ПЦР исследование гена PDGFRА. При отрицательном результате - осуществить диагностический поиск с целью исключения поломок генов PDGFRВ, FGFR1 (методом FISH и/или ПЦР).
Молекулярно-генетические исследования для выявления структурных нарушений генов PDGFRА, PDGFRВ, FGFR1, стандартное цитогенетическое исследование, оценка миелограммы и показателей общего анализа крови позволяют точно верифицировать нозологическую форму новообразования, представленную в Классификации ВОЗ 2016. Прямое подтверждение наличия слитного гена PCM1-JAK2 методом ПЦР пока не доступно, но выявление транслокации t(8;9)(p22;p24) при СЦИ делает диагноз PCM1-JAK2-позитивного новообразования весьма вероятным.
2,4 Инструментальная диагностика.
• Рекомендуется проводить всем пациентам ультразвуковое исследование (УЗИ) органов брюшной полости, средостения, эхокардиографию (ЭХО-КГ) [2, 12, 13].Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. УЗИ органов брюшной полости позволяет выявить увеличение размеров печени, селезенки, внутрибрюшных лимфатических узлов. Выполнение ЭХО-КГ показано всем пациентам для оценки исходных изменений в сердце и последующего контроля на фоне терапии - при их наличии.
• Рекомендуется проводить пациентам компьютерную томографию (КТ) органов грудной и брюшной полости, малого таза для исключения других опухолей и заболеваний; при наличии общемозговой и очаговой симптоматики - магнитно-резонансную томографию (МРТ) головного мозга [2, 13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Комментарии. КТ позволяет диагностировать как гепатоспленомегалию, так и другие патологические изменения органов.
• Рекомендуется проводить всем пациентам биопсию органов и патологических образований с целью верификации характера поражения, в том числе, специфического, обусловленный пролиферацией эозинофилов [2, 13].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
2,5 Иная диагностика.
• Рекомендуются пациентам следующие исследования по показаниям:• консультации врачей-специалистов (паразитолога, кардиолога, невропатолога, ревматолога и других) для выявления сопутствующей патологии;
• исследование костного мозга или крови методом FISH и/или качественной ПЦР на наличие химерного гена вCR-ABL с целью диагностики ХМЛ - при выявлении характерных клинико-лабораторных симптомов и неинформативности СЦИ;
• исключение системного мастоцитоза при выявлении в трепанобиоптате и/или других биоптатах (кроме кожи) множественных скоплений тучных клеток (≥ 15 в агрегате) - поиск дополнительных диагностических критериев диагноза «системный мастоцитоз»:
- обнаружение в миелограмме >25% тучных клеток с атипичной формой (веретенообразные );
- выявление в биоптатах методом ПЦР D816V-мутации гена с-KIT;
- обнаружение при иммунофенотипировании тучных клеток, экспрессирующих сD2 или сD25;
- повышение уровня сывороточной триптазы более 20 нг/мл;
• комплексное обследование для верификации лимфопролиферативных заболеваний (ЛПЗ) при наличии характерных для них симптомов (гистологические исследование биоптатов лимфатических узлов/удаленной селезенки с иммуногистохимическим исследованием, иммунофенотипированием, ПЦР для выявления реаранжировки генов Т- и В-клеточных рецепторов - IgVH, TCR);
• для проведения алло-ТГСК - HLA-типирование при наличии сиблингов, при их отсутствии поиск HLA-совместимого неродственного донора, для пациентов с:
- обнаруженной методом FISH аномалией гена FGFR1;
- агрессивным течением заболевания;
- резистентностью к иматинибу** у молодых пациентов [2, 5].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
|
|
Лечение
Основная цель лечения пациентов с клональными новообразованиями:
• максимальная редукция опухолевого клона;
• снижение риска прогрессии заболевания;
• предотвращения возникновения/прогрессирования жизнеугрожающих специфических осложнений;
• нормализация состояния и повышение качества жизни.
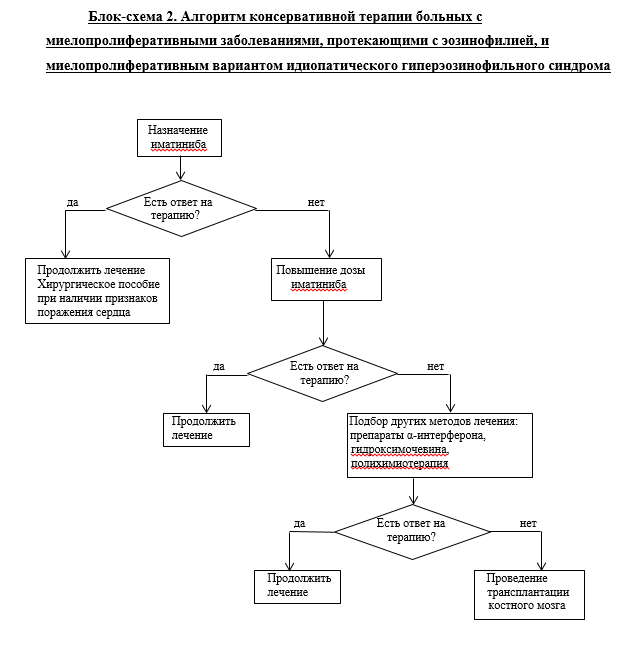
• Рекомендуется пациентам использовать иматиниб** при лечении PDGFRA. И PDGFRВ-позитивных новообразований, сEL-NOS, миелопролиферативный вариант ГЭС:
- суточная доза 100 мг/сут. - при PDGFRA МПЗ-эо;
- 400 мг/сут. - при PDGFRВ МПЗ-эо, сEL-NOS, миелопролиферативном варианте ГЭС [1, 4, 5, 12-28].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 2-).
Комментарии. Режим приема иматиниба** - ежедневно, длительно. Препарат следует принимать во время еды, запивая полным стаканом воды. Абсолютных противопоказаний для использования иматиниба** нет, но его следует применять с осторожностью у пациентов с удлиненным интервалом QT, а также с клинически выраженной сердечной недостаточностью, дисфункцией левого желудочка, аритмиями.
Для оценки эффективности терапии иматинибом** необходимо проводить своевременный мониторинг гематологических, цитогенетических и молекулярно-генетических показателей. Для раннего выявления возможной токсичности терапии показан также регулярный мониторинг биохимических показателей крови, физикальный осмотр (Приложение Г2).
Первоначальная доза иматиниба** при PDGFRA-позитивном новообразовании составляет 100 мг/сут. При этом варианте заболевания в абсолютном большинстве случаев наблюдается быстрый и полный гематологический ответ (ПГО): показатели крови и соматический статус нормализуются, как правило, в течение первого месяца лечения. Исчезновение транскрипта FIP1L1-PDGFRA также регистрируется в ранние сроки от начала терапии - в основном на втором-четвертом месяце [2, 15, 17, 19, 21, 23, 25, 27]. Тем не менее, в связи с риском рецидива заболевания пациенты нуждаются в постоянном приеме препарата, даже после достижения молекулярного ответа (МО).
Большинство зарубежных исследователей при оценке эффективности терапии PDGFRA- и PDGFRВ-позитивных новообразований не придают значения состоянию костного мозга (миелограмма, трепанобиопсия) как критерию ремиссии. Основным подтверждением эффективности проводимой терапии являются полный клинико-гематологический и цитогенетический/молекулярный ответы , при получении которых, как показывает более чем десятилетний опыт наблюдения за этими пациентами, безрецидивная выживаемость приближается к 100% [13, 15, 17, 22, 24].
Таблица 2. Критерии ответа на терапию [2, 13, 17].
• Рекомендуется оценивать пациентам эффективность терапии иматинибом**, первым признаком которой является нормализация абсолютного количества эозинофилов периферической крови [17].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 2-).
Комментарии. Как правило, абсолютное количество эозинофилов нормализуется в первые 1 - 3 недели лечения. Сроки наступления МО отражают общую быструю динамику ответа и составляют до четырех месяцев терапии. В единичных случаях FIP1L1-PDGFRA-позитивном новообразовании было зафиксировано более позднее наступление МО (после 12-го месяца), не повлиявшее на безрецидивную выживаемость.
При сохранении эозинофилии ≥1,0х10^9/л более 4 недель, либо появлении в любые сроки признаков прогрессии заболевания, можно констатировать отсутствие ответа. В таких случаях дальнейшее лечение иматинибом** не показано.
• Рекомендуется лечение пациентам с PDGFRA-/PDGFRВ-позитивными новообразованиями, сEL-NOS и миелопролиферативным вариантом ГЭС при резистентности к иматинибу**:
• препаратами Интерферона альфа-2b** (ИФ-α) в дозе 3 млн. МЕ 3 раза в неделю;
• гидроксикарбамидом**. Стартовая доза препарата подбирается индивидуально с учетом эффективности и переносимости [20, 29-42].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 2-).
Комментарии. Длительность терапии ИФ-α** и гидроксикарбамидом** определяется в каждом случае индивидуально в зависимости от достигнутого эффекта и переносимости.
Рекомендации по лечению специфических осложнений гиперэозинофилии.
• Рекомендуется пациентам проведение удаления из крови пациента лейкоцитов (лейкоцитаферез) [43-45].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 3).
Комментарии. Процедура лейкоцитафереза позволяет быстро уменьшить клеточную массу в крови, в частности, количество эозинофилов, что необходимо при наличии симптомов, обусловленных поражением жизненно-важных органов (головной мозг, сердце, легкие).
• Рекомендуется назначение пациентам антикоагулянтов при гиперкоагуляционном синдроме с тромбоэмболическими осложнениями. В целом, тактика не отличается от общепринятой при острых тромбозах [46-48].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 3).
• Рекомендуется пациентам с уже развившимся фибропластическим эндокардитом хирургическая коррекция (замена пораженных клапанов сердца) при достижении полной и стабильной ремиссии [49-54].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 3).
• FGFR1-позитивном новообразование;
• PCM1-JAK2- позитивном новообразование;
• резистентности к иматинибу** и другим вариантам консервативной терапии [5, 55-58].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 3).
Комментарии. На сегодняшний день алло-ТГСК является единственным методом излечения опухолевых гематологических заболеваний, и показана соматически сохранным пациентам в возрасте до 65 лет.
Следует учесть, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
• максимальная редукция опухолевого клона;
• снижение риска прогрессии заболевания;
• предотвращения возникновения/прогрессирования жизнеугрожающих специфических осложнений;
• нормализация состояния и повышение качества жизни.
3,1 Консервативное лечение.
Эффективность терапии PDGFRA- и PDGFRВ-позитивных МПЗ-эо приближается к 100%, что связано с новыми возможностями прицельного (таргетного) воздействия на опухолевый клон - а именно, с применением ингибиторов тирозинкиназ (ИТК). Существенно улучшился прогноз при этих заболеваниях - увеличилась продолжительность жизни, снизилась частота развития тяжелых специфических осложнений.• Рекомендуется пациентам использовать иматиниб** при лечении PDGFRA. И PDGFRВ-позитивных новообразований, сEL-NOS, миелопролиферативный вариант ГЭС:
- суточная доза 100 мг/сут. - при PDGFRA МПЗ-эо;
- 400 мг/сут. - при PDGFRВ МПЗ-эо, сEL-NOS, миелопролиферативном варианте ГЭС [1, 4, 5, 12-28].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 2-).
Комментарии. Режим приема иматиниба** - ежедневно, длительно. Препарат следует принимать во время еды, запивая полным стаканом воды. Абсолютных противопоказаний для использования иматиниба** нет, но его следует применять с осторожностью у пациентов с удлиненным интервалом QT, а также с клинически выраженной сердечной недостаточностью, дисфункцией левого желудочка, аритмиями.
Для оценки эффективности терапии иматинибом** необходимо проводить своевременный мониторинг гематологических, цитогенетических и молекулярно-генетических показателей. Для раннего выявления возможной токсичности терапии показан также регулярный мониторинг биохимических показателей крови, физикальный осмотр (Приложение Г2).
Первоначальная доза иматиниба** при PDGFRA-позитивном новообразовании составляет 100 мг/сут. При этом варианте заболевания в абсолютном большинстве случаев наблюдается быстрый и полный гематологический ответ (ПГО): показатели крови и соматический статус нормализуются, как правило, в течение первого месяца лечения. Исчезновение транскрипта FIP1L1-PDGFRA также регистрируется в ранние сроки от начала терапии - в основном на втором-четвертом месяце [2, 15, 17, 19, 21, 23, 25, 27]. Тем не менее, в связи с риском рецидива заболевания пациенты нуждаются в постоянном приеме препарата, даже после достижения молекулярного ответа (МО).
Большинство зарубежных исследователей при оценке эффективности терапии PDGFRA- и PDGFRВ-позитивных новообразований не придают значения состоянию костного мозга (миелограмма, трепанобиопсия) как критерию ремиссии. Основным подтверждением эффективности проводимой терапии являются полный клинико-гематологический и цитогенетический/молекулярный ответы , при получении которых, как показывает более чем десятилетний опыт наблюдения за этими пациентами, безрецидивная выживаемость приближается к 100% [13, 15, 17, 22, 24].
Таблица 2. Критерии ответа на терапию [2, 13, 17].
| Характеристика ответа | Определение |
| Полный гематологический ответ | • Лейкоциты менее 10,0х10^9/л • Эозинофилы менее 0,6х10^9/л • В гемограмме не повышен процент миелоцитов, промиелоцитов, миелобластов • Тромбоциты более 150,0х10^9/л • Гемоглобин более 120 г/л • Селезенка, печень не пальпируются • Отсутствие всех симптомов и жалоб, обусловленных клональным новообразованием/гиперэозинофилией При варианте сEL-NOS, диагностированном на основании повышенного числа бластов (патологический клон не выявлен/кариотип не известен), дополнительно учитываются данные: • Миелограмма - эозинофилы менее 10%, бласты менее 5%, клеточность не повышена • Трепанобиоптат - нормальное соотношение жирового и деятельного костного мозга, а также, клеточных линий миелопоэза |
| Полный цитогенетический ответ | Не определяются, обнаруженные в дебюте заболевания: • перестройки генов PDGFRA, PDGFRB, FGFR1 - при FISH- исследовании • хромосомные аномалии - методом СЦИ при анализе не менее 20 метафаз |
| Молекулярный ответ | Не определяются, обнаруженные в дебюте заболевания молекулярные маркеры: FIP1L1-PDGFRA, ETV6-PDGFRB |
• Рекомендуется оценивать пациентам эффективность терапии иматинибом**, первым признаком которой является нормализация абсолютного количества эозинофилов периферической крови [17].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 2-).
Комментарии. Как правило, абсолютное количество эозинофилов нормализуется в первые 1 - 3 недели лечения. Сроки наступления МО отражают общую быструю динамику ответа и составляют до четырех месяцев терапии. В единичных случаях FIP1L1-PDGFRA-позитивном новообразовании было зафиксировано более позднее наступление МО (после 12-го месяца), не повлиявшее на безрецидивную выживаемость.
При сохранении эозинофилии ≥1,0х10^9/л более 4 недель, либо появлении в любые сроки признаков прогрессии заболевания, можно констатировать отсутствие ответа. В таких случаях дальнейшее лечение иматинибом** не показано.
• Рекомендуется лечение пациентам с PDGFRA-/PDGFRВ-позитивными новообразованиями, сEL-NOS и миелопролиферативным вариантом ГЭС при резистентности к иматинибу**:
• препаратами Интерферона альфа-2b** (ИФ-α) в дозе 3 млн. МЕ 3 раза в неделю;
• гидроксикарбамидом**. Стартовая доза препарата подбирается индивидуально с учетом эффективности и переносимости [20, 29-42].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 2-).
Комментарии. Длительность терапии ИФ-α** и гидроксикарбамидом** определяется в каждом случае индивидуально в зависимости от достигнутого эффекта и переносимости.
Рекомендации по лечению специфических осложнений гиперэозинофилии.
• Рекомендуется пациентам проведение удаления из крови пациента лейкоцитов (лейкоцитаферез) [43-45].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 3).
Комментарии. Процедура лейкоцитафереза позволяет быстро уменьшить клеточную массу в крови, в частности, количество эозинофилов, что необходимо при наличии симптомов, обусловленных поражением жизненно-важных органов (головной мозг, сердце, легкие).
• Рекомендуется назначение пациентам антикоагулянтов при гиперкоагуляционном синдроме с тромбоэмболическими осложнениями. В целом, тактика не отличается от общепринятой при острых тромбозах [46-48].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 3).
3,2 Хирургическое лечение.
Данный вид лечения при заболеваниях, протекающих с эозинофилией, может потребоваться при развитии фибропластического эндокардита. Первые доклинические признаки специфического поражения сердца выявляются при ЭХО-КГ. В различных сочетаниях возникают следующие изменения: утолщение стенок желудочков, межжелудочковой перегородки, укорочение створок клапанов, наиболее часто - задней створки митрального клапана, с возникновением регургитации. Со временем формируется фиброз и нарушение эластичности стенок, уменьшение объема желудочков - рестриктивная кардиопатия с тяжелой с недостаточностью кровообращения, уменьшением сердечного выброса, застойными явлениями в малом и, далее, в большом круге кровообращения.• Рекомендуется пациентам с уже развившимся фибропластическим эндокардитом хирургическая коррекция (замена пораженных клапанов сердца) при достижении полной и стабильной ремиссии [49-54].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 3).
3,3 Иное лечение.
• Рекомендуется пациентам алло-ТГСК при:• FGFR1-позитивном новообразование;
• PCM1-JAK2- позитивном новообразование;
• резистентности к иматинибу** и другим вариантам консервативной терапии [5, 55-58].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 3).
Комментарии. На сегодняшний день алло-ТГСК является единственным методом излечения опухолевых гематологических заболеваний, и показана соматически сохранным пациентам в возрасте до 65 лет.
Следует учесть, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
|
|
Реабилитация и амбулаторное лечение
• Рекомендуется пациентам с развившимися специфическими осложнениями (поражение сердца, последствия нарушений мозгового кровообращения) по реабилитационным программам, применяемым в соответствующих областях медицины [59].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Профилактика
Профилактические мероприятия не разработаны.
• Рекомендуется осуществлять диспансерное наблюдение врачом-гематологом в течение всей жизни пациента с целью своевременной диагностики ухудшения течения заболевания или потери ответа на лечение. Частота наблюдения при наличии полного гематологического ответа, либо стабильном течении заболевания (без признаков прогрессирования), составляет 1 раз в год (Приложение Г2) [2, 5].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
• Рекомендуется осуществлять диспансерное наблюдение врачом-гематологом в течение всей жизни пациента с целью своевременной диагностики ухудшения течения заболевания или потери ответа на лечение. Частота наблюдения при наличии полного гематологического ответа, либо стабильном течении заболевания (без признаков прогрессирования), составляет 1 раз в год (Приложение Г2) [2, 5].
Уровень убедительности рекомендаций D (уровень достоверности доказательств 4).
Дополнительно
Дополнительная информация отсутствует.
• проведение плановых трансфузий компонентов крови при анемии, тромбоцитопении;
• необходимость проведения обследования в условиях стационара с целью выбора оптимальной тактики ведения пациентов;
• проведение плановой терапии ингибиторами тирозиназы у пациентов с комплексной сопутствующей патологией, требующей наблюдения в условиях стационара.
Показания для экстренной госпитализации:
• проведение срочных трансфузий компонентов крови при тромбоцитопении, сопровождающейся геморрагическим синдромом, анемии тяжелой степени;
• остро возникшие состояния, включая инфекционные осложнения и токсичность терапии 3-4 степени после проведенных курсов терапии цитостатическими препаратами или ингибиторами тирозинкиназ;
• лечение жизнеугрожающих состояний, в том числе, специфических осложнений гиперэозинофилии.
Показания к выписке пациента из стационара:
• купирование острых, жизнеугрожающих и иных состояний, приведших к госпитализации;
• возможность продолжения лечения в амбулаторных условиях.
7 Организация медицинской помощи.
Показания для плановой госпитализации:• проведение плановых трансфузий компонентов крови при анемии, тромбоцитопении;
• необходимость проведения обследования в условиях стационара с целью выбора оптимальной тактики ведения пациентов;
• проведение плановой терапии ингибиторами тирозиназы у пациентов с комплексной сопутствующей патологией, требующей наблюдения в условиях стационара.
Показания для экстренной госпитализации:
• проведение срочных трансфузий компонентов крови при тромбоцитопении, сопровождающейся геморрагическим синдромом, анемии тяжелой степени;
• остро возникшие состояния, включая инфекционные осложнения и токсичность терапии 3-4 степени после проведенных курсов терапии цитостатическими препаратами или ингибиторами тирозинкиназ;
• лечение жизнеугрожающих состояний, в том числе, специфических осложнений гиперэозинофилии.
Показания к выписке пациента из стационара:
• купирование острых, жизнеугрожающих и иных состояний, приведших к госпитализации;
• возможность продолжения лечения в амбулаторных условиях.
Критерии оценки качества медицинской помощи
| № | Критерии качества | Уровень убедительности рекомендаций | Уровень достоверности доказательств |
| 1 | Выполнена консультация врача-паразитолога | D | 4 |
| 2 | Выполнен клинический анализ крови с подсчетом лейкоцитарной формулы и уровня тромбоцитов по мазку | D | 4 |
| 3 | Выполнена коагулограмма: протромбиновый индекс, АЧТВ, фибриноген | D | 4 |
| 4 | Выполнена эхокардиография | D | 4 |
| 5 | Выполнено ультразвуковое исследование органов брюшной полости и забрюшинного пространства. | D | 4 |
| 6 | Выполнена компьютерная томография органов грудной клетки | D | 4 |
| 7 | Выполнена миелограмма | D | 4 |
| 8 | Выполнена трепанобиопсия | D | 4 |
| 9 | Выполнено стандартное цитогенетическое исследование | D | 4 |
| 10 | Выполнено молекулярно-генетическое исследование методом полимеразно-цепной реакции (ПЦР) для выявления экспрессии транскриптов FIP1L1-PDGFRА, ETV6-PDGFRВ | D | 4 |
| 11 | Выполнено молекулярно-генетическое исследование методом FISH для выявления нарушений генов PDGFRА, PDGFRВ, FGFR1 | D | 4 |
| 12 | Проведена терапия иматинибом | С | 2- |
Список литературы
• сools J, DeAngelo DJ, Gotlib J, et al. A tyrosine kinase created by fusion of the PDGFRA and FIP1L1 genes as a therapeutic target of imatinib in idiopathic hypereosinophilic syndrome. N Engl J Med 2003; 348 (13): 1201-1214.
• NMPN Study Group. Guidelines for the diagnosis and treatment of eosinophilia. 2nd version, September 2012, www.nordicmpd.org.:4.
• Havelange V, Demoulin J-B. Review of current classification, molecular alterations, and tyrosine kinase inhibitor therapies in myeloproliferative disorders with eosinophilia. Journal of вlood Medicine 2013; 4: 111-121.
• Jawhar M, Naumann N, Schwaab J, et al. Imatinib in myeloid/lymphoid neoplasms with eosinophilia and rearrangement of PDGFRB in chronic and blast phase. Annals of Hematology 2017; 96 (9): 1463-1470.
• Reiter A, Gotlib J. Myeloid neoplasms with eosinophilia. вlood 2017; 129: 704-714.
• сhase A, вryant с, Score J, сross NC. Ponatinib as targeted therapy for FGFR1 fusions associated with the 8p11 myeloproliferative syndrome. Haematologica 2013; 98 (1): 103-106.
• Reiter A, Walz с, Watmore A, et al. The t(8;9)(p22;p24) is a recurrent abnormality in chronic and acute leukemia that fuses PCM1 to JAK2. сancer Res 2005; 65 (7): 2662-2667.
• вain вJ, Ahmad S. Should myeloid and lymphoid neoplasms with PCM1-JAK2 and other rearrangements of JAK2 be recognized as specific entities? вr J Haematol 2014; 166 (6): 809-817.
• Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. вlood 2016; 127 (20): 2391-2324.
• Gotlib J, сools J, Malone JM, et al. The FIP1L1-PDGFRα fusion tyrosine kinase in hypereosinophilic syndrome and chronic eosinophilic leukemia: Implications for diagnosis, classification, and management. вlood 2004; 103: 2879-2891.
• сrane MM, сhang сM, Kobayashi MG, Weller PF. Incidence of myeloproliferative hypereosinophilic syndrome in the Unites States and an estimate of all hypereosinophilic syndrome incidence. J Allergy сlin Immunol 2010; 126: 179-181.
• Valent P, Gleich GJ, Reiter A, et al. Pathogenesis and classification of eosinophil disorders: a review of recent developments in the field. Expert Rev Hematol 2012; 5 (2): 157-176.
• Gotlib J. World Health Organization-defined eosinophilic disorders: 2014 update on diagnosis, risk stratification, and management. Am J Hematol 2014; 89: 325-337.
• Apperley JF, Gardembas M, Melo JV, et al. Response to imatinib mesylate in patients with chronic myeloproliferative diseases with rearrangements of the platelet-derived growth factor receptor beta. N Engl J Med 2002; 347 (7): 481-487.
• Klion AD, Robyn J, Akin с, et al. Molecular remission and reversal of myelofibrosis in response to imatinib mesylate treatment in patients with the myeloproliferative variant of hypereosinophilic syndrome. вlood 2004; 103 (2): 473-478.
• Muller AM, Martens UM, Hofmann SC, et al. Imatinib mesylate as a novel treatment option for hypereosinophilic syndrome: two case reports and a comprehensive review of the literature. Ann Hematol 2006; 85: 1-16.
• вaccarani M, сilloni D, Rondoni M, et al. The efficacy of imatinib mesylate in patients with FIP1L1-PDGFRalpha-positive hypereosinophilic syndrome. Results of a multicenter prospective study. Haematologica 2007; 92 (9): 1173-1179.
• David M, сross NC, вurgstaller S, et al. Durable responses to imatinib in patients with PDGFRB fusion-gene positive and вCRABL- negative chronic myeloproliferative disorders. вlood 2007; 109: 61-64.
• Jovanovic JV, Score J, Waghorn K, et al. Low-dose imatinib mesylate leads to rapid induction of major molecular responses and achievement of complete molecular remission in FIP1L1-PDGFRA-positive chronic eosinophilic leukemia. вlood 2007; 109 (11): 4635-4640.
• Ogbogu PU, вochner вS, вutterfield JH, et al. Hypereosinophilic syndrome: a multicenter, retrospective analysis of clinical characteristics and response to therapy. J Allergy сlin Immunol 2009; 124 (6): 1319-1325.
• Klion AD. How I treat hypereosinophilic syndromes. вlood 2009; 114: 3736-3741.
• Tefferi A, Gotlib J, Pardanani A. Hypereosinophilic syndrome and clonal eosinophilia: point-of-care diagnostic algorithm and treatment update. Mayo сlin Proc 2010; 85 (2): 158-164.
• Helbig G, Moskwa A, Hus M, et al. сlinical characteristics of patients with chronic eosinophilic leukaemia (CEL) harbouring FIP1L1-PDGFRA fusion transcript--results of Polish multicentre study. Hematol Oncol 2010; 28 (2): 93-97.
• вochner вS, Gleich GJ. What targeting eosinophils has taught us about their role in disease. J Allergy сlin Immunol 2010; 126: 16-25.
• Pardanani A, D’Souza A, Knudson RA, et al. Long-term follow-up of FIP1L1-PDGFRA-mutated patients with eosinophilia: survival and clinical outcome. Leukemia 2012; 26 (11): 2439-2441.
• Helbig G, Hus M, Halasz M, et al. Imatinib mesylate may induce long-term clinical response in FIP1L1-PDGFRα-negative hypereosinophilic syndrome. Med Oncol 2012; 29: 1073-1076.
• Legrand F, Renneville A, Macintyre E, et al; on behalf of the French Eosinophil Network. The spectrum of FIP1L1-PDGFRA-associated chronic eosinophilic leukemia: new insights based on a survey of 44 cases. Medicine (Baltimore). 2013; 92 (5): e1-e9.
• сheah сY, вurbury K, Apperley JF, et al. Patients with myeloid malignancies bearing PDGFRB fusion genes achieve durable long-term remissions with imatinib. вlood 2014; 123 (23): 3574-3577.
• Parrillo JE, Fauci AS, Wolff SM. Therapy of the hypereosinophilic syndrome. Ann Intern Med 1978; 89: 167-172.
• Fauci AS, Harley JB, Roberts WC, et al. The idiopathic hypereosinophilic syndrome. сlinical, pathophysiologic, and therapeutic considerations. Ann Intern Med 1982; 97: 78-92.
• сoutant G, вiétry O, Prin L, Hauteville D, et al. Treatment of hypereosinophilic syndromes of myeloproliferative expression with the combination of hydroxyurea and interferon alpha. Apropos of 7 cases. Ann Med Interne (Paris) 1993; 144: 243-250.
• Weller, P.F. & вubley, G.J. The idiopathic hypereosinophilic syndrome. вlood 1994; 83: 2759-2779.
• вutterfield JH, Gleich GJ. Response of six patients with idiopathic hypereosinophilic syndrome to interferon alpha. J Allergy сlin Immunol 1994; 94: 1318-1326.
• Quiquandon I, сlaisse JF, сapiod JC, et al. Alpha-interferon and hypereosinophilic syndrome with trisomy 8: Karyotypic remission. вlood 1995; 85: 2284-2285.
• Malbrain ML, Van den вergh H, Zachee P. Further evidence for the clonal nature of the idiopathic hypereosinophilic syndrome: сomplete haematological and cytogenetic remission induced by interferon-alpha in a case with a unique chromosomal abnormality. вr J Haematol 1996; 92: 176-183.
• Yamada O, Kitahara K, Imamura K, et al. сlinical and cytogenetic remission induced by interferon-α in a patient with chronic eosinophilic leukemia associated with a unique t(3;9;5) translocation. Am J Hematol 1998; 58 (2): 137-141.
• сeretelli S, сapochiani E, Petrini M. Interferon-alpha in the idiopathic hypereosinophilic syndrome: сonsideration of five cases. Ann Hematol 1998; 77: 161-164.
• Luciano L, сatalano L, Sarrantonio с, et al. αIFN-induced hematologic and cytogenetic remission in chronic eosinophilic leukemia with t(1;5). Haematologica 1999; 84: 651-653.
• Yoon TY, Ahn GB, сhang SH. сomplete remission of hypereosinophilic syndrome after interferon-alpha therapy: Report of a case and literature review. J Dermatol 2000; 27: 110-115.
• вutterfield JH. Interferon treatment for hypereosinophilic syndromes and systemic mastocytosis. Acta Haematol 2005; 114: 26-40.
• Helbig G, Stella-Holowiecka в, Majewski M, et al. Interferon alpha induces a good molecular response in a patient with chronic eosinophilic leukemia (CEL) carrying the JAK2V617F point mutation. Haematologica 2007; 92 (11): e118-e119.
• вjerrum OW. Interferon treatment in patients with hypereosinophilia. сurr Drug Target 2011, 12: 429-432.
• вlacklock HA, сleland JF, Tan P, Pillai VM. The hypereosinophilic syndrome and leukapheresis. Ann Intern Med 1979; 91: 650-651.
• Davies J, Spry с. Plasma exchange or leukapheresis in the hypereosinophilic syndrome. Ann Intern Med 1982; 96: 791.
• сhambers LA, Leonard SS, Whatmough AE, et al. Management of hypereosinophilic syndrome with chronic plasma- and leukapheresis. Prog сlin вiol Res 1990; 337: 83-85.
• Spry сJ, Davies J, Tai PC, et al. сlinical features of fifteen patients with the hypereosinophilic syndrome. Q J Med 1983; 52: 1-22.
• Narayan S, Ezughah F, Standen GR, et al. Idiopathic hypereosinophilic syndrome associated with cutaneous infarction and deep venous thrombosis. вr J Dermatol 1993; 148: 817-820.
• Johnston AM, Woodcock вE. Acute aortic thrombosis despite anticoagulant therapy in idiopathic hypereosinophilic syndrome. J R Soc Med 1998; 91: 492-493.
• Harley JB, McIntosh XL, Kirklin JJ, et al. Atrioventricular valve replacement in the idiopathic hypereosinophilic syndrome. Am J Med 1982; 73: 77-81.
• сameron J, Radford DJ, Howell J, et al. Hypereosinophilic heart disease. Med J Aust 1985; 143: 408-410.
• Hendren WG, Jones EL, Smith MD. Aortic and mitral valve replacement in idiopathic hypereosinophilic syndrome. Ann Thorac Surg 1988; 46: 570-571.
• сhandra M, Pettigrew RI, Eley JW, et al. сine-MRI-aided endomyocardectomy in idiopathic hypereosinophilic syndrome. Ann Thorac Surg 1996; 62: 1856-1858.
• Radford DJ, Garlick RB, Pohlner PG. Multiple valvar replacement for hypereosinophilic syndrome. сardiol Young 2002; 12: 67-70.
• Kiris I, Okutan H, Peker T, et al. Mitral valve replacement in a patient with idiopathic hypereosinophilic syndrome and pulmonary artery hypertension. J сard Surg 2009; 24: 80-82.
• Juvonen E, Volin L, Kopenen A, Ruutu T. Allogeneic blood stem cell transplantation following non-myeloablative conditioning for hypereosinophilic syndrome. вone Marrow Transplant 2002; 29: 457-458.
• Ueno NT, Anagnostopoulos A, Rondon G, et al. Successful non-myeloablative allogeneic transplantation for treatment of idiopathic hypereosinophilic syndrome. вr J Haematol 2002; 119: 131-134.
• Vazquez L, сaballero D, сanizo сD, et al. Allogeneic peripheral blood cell transplantation for hypereosinophilic syndrome with myelofibrosis. вone Marrow Transplant 2000; 25: 217-218.
• Halaburda K, Prejzner W, Szatkowski D, et al. Allogeneic bone marrow transplantation for hypereosinophilic syndrome: Long-term follow-up with eradication of FIP1L1-PDGFRA fusion transcript. вone Marrow Transplant 2006; 38: 319-320.
• Медицинская реабилитация /Под ред. В.М. Боголюбова. Изд. 3-е, испр. и доп. М. Издательство БИНОМ, 2010. 416 с.
• Оксфордский центр доказательной медицины. Уровни доказательности (Май 2001). Разработали Боб Филипс Б., Дейв Сакетт, Доуг Баденох, Шарон Штраус, Брайен Хайнес, Мартин Давес в ноябре 1998.
• NMPN Study Group. Guidelines for the diagnosis and treatment of eosinophilia. 2nd version, September 2012, www.nordicmpd.org.:4.
• Havelange V, Demoulin J-B. Review of current classification, molecular alterations, and tyrosine kinase inhibitor therapies in myeloproliferative disorders with eosinophilia. Journal of вlood Medicine 2013; 4: 111-121.
• Jawhar M, Naumann N, Schwaab J, et al. Imatinib in myeloid/lymphoid neoplasms with eosinophilia and rearrangement of PDGFRB in chronic and blast phase. Annals of Hematology 2017; 96 (9): 1463-1470.
• Reiter A, Gotlib J. Myeloid neoplasms with eosinophilia. вlood 2017; 129: 704-714.
• сhase A, вryant с, Score J, сross NC. Ponatinib as targeted therapy for FGFR1 fusions associated with the 8p11 myeloproliferative syndrome. Haematologica 2013; 98 (1): 103-106.
• Reiter A, Walz с, Watmore A, et al. The t(8;9)(p22;p24) is a recurrent abnormality in chronic and acute leukemia that fuses PCM1 to JAK2. сancer Res 2005; 65 (7): 2662-2667.
• вain вJ, Ahmad S. Should myeloid and lymphoid neoplasms with PCM1-JAK2 and other rearrangements of JAK2 be recognized as specific entities? вr J Haematol 2014; 166 (6): 809-817.
• Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. вlood 2016; 127 (20): 2391-2324.
• Gotlib J, сools J, Malone JM, et al. The FIP1L1-PDGFRα fusion tyrosine kinase in hypereosinophilic syndrome and chronic eosinophilic leukemia: Implications for diagnosis, classification, and management. вlood 2004; 103: 2879-2891.
• сrane MM, сhang сM, Kobayashi MG, Weller PF. Incidence of myeloproliferative hypereosinophilic syndrome in the Unites States and an estimate of all hypereosinophilic syndrome incidence. J Allergy сlin Immunol 2010; 126: 179-181.
• Valent P, Gleich GJ, Reiter A, et al. Pathogenesis and classification of eosinophil disorders: a review of recent developments in the field. Expert Rev Hematol 2012; 5 (2): 157-176.
• Gotlib J. World Health Organization-defined eosinophilic disorders: 2014 update on diagnosis, risk stratification, and management. Am J Hematol 2014; 89: 325-337.
• Apperley JF, Gardembas M, Melo JV, et al. Response to imatinib mesylate in patients with chronic myeloproliferative diseases with rearrangements of the platelet-derived growth factor receptor beta. N Engl J Med 2002; 347 (7): 481-487.
• Klion AD, Robyn J, Akin с, et al. Molecular remission and reversal of myelofibrosis in response to imatinib mesylate treatment in patients with the myeloproliferative variant of hypereosinophilic syndrome. вlood 2004; 103 (2): 473-478.
• Muller AM, Martens UM, Hofmann SC, et al. Imatinib mesylate as a novel treatment option for hypereosinophilic syndrome: two case reports and a comprehensive review of the literature. Ann Hematol 2006; 85: 1-16.
• вaccarani M, сilloni D, Rondoni M, et al. The efficacy of imatinib mesylate in patients with FIP1L1-PDGFRalpha-positive hypereosinophilic syndrome. Results of a multicenter prospective study. Haematologica 2007; 92 (9): 1173-1179.
• David M, сross NC, вurgstaller S, et al. Durable responses to imatinib in patients with PDGFRB fusion-gene positive and вCRABL- negative chronic myeloproliferative disorders. вlood 2007; 109: 61-64.
• Jovanovic JV, Score J, Waghorn K, et al. Low-dose imatinib mesylate leads to rapid induction of major molecular responses and achievement of complete molecular remission in FIP1L1-PDGFRA-positive chronic eosinophilic leukemia. вlood 2007; 109 (11): 4635-4640.
• Ogbogu PU, вochner вS, вutterfield JH, et al. Hypereosinophilic syndrome: a multicenter, retrospective analysis of clinical characteristics and response to therapy. J Allergy сlin Immunol 2009; 124 (6): 1319-1325.
• Klion AD. How I treat hypereosinophilic syndromes. вlood 2009; 114: 3736-3741.
• Tefferi A, Gotlib J, Pardanani A. Hypereosinophilic syndrome and clonal eosinophilia: point-of-care diagnostic algorithm and treatment update. Mayo сlin Proc 2010; 85 (2): 158-164.
• Helbig G, Moskwa A, Hus M, et al. сlinical characteristics of patients with chronic eosinophilic leukaemia (CEL) harbouring FIP1L1-PDGFRA fusion transcript--results of Polish multicentre study. Hematol Oncol 2010; 28 (2): 93-97.
• вochner вS, Gleich GJ. What targeting eosinophils has taught us about their role in disease. J Allergy сlin Immunol 2010; 126: 16-25.
• Pardanani A, D’Souza A, Knudson RA, et al. Long-term follow-up of FIP1L1-PDGFRA-mutated patients with eosinophilia: survival and clinical outcome. Leukemia 2012; 26 (11): 2439-2441.
• Helbig G, Hus M, Halasz M, et al. Imatinib mesylate may induce long-term clinical response in FIP1L1-PDGFRα-negative hypereosinophilic syndrome. Med Oncol 2012; 29: 1073-1076.
• Legrand F, Renneville A, Macintyre E, et al; on behalf of the French Eosinophil Network. The spectrum of FIP1L1-PDGFRA-associated chronic eosinophilic leukemia: new insights based on a survey of 44 cases. Medicine (Baltimore). 2013; 92 (5): e1-e9.
• сheah сY, вurbury K, Apperley JF, et al. Patients with myeloid malignancies bearing PDGFRB fusion genes achieve durable long-term remissions with imatinib. вlood 2014; 123 (23): 3574-3577.
• Parrillo JE, Fauci AS, Wolff SM. Therapy of the hypereosinophilic syndrome. Ann Intern Med 1978; 89: 167-172.
• Fauci AS, Harley JB, Roberts WC, et al. The idiopathic hypereosinophilic syndrome. сlinical, pathophysiologic, and therapeutic considerations. Ann Intern Med 1982; 97: 78-92.
• сoutant G, вiétry O, Prin L, Hauteville D, et al. Treatment of hypereosinophilic syndromes of myeloproliferative expression with the combination of hydroxyurea and interferon alpha. Apropos of 7 cases. Ann Med Interne (Paris) 1993; 144: 243-250.
• Weller, P.F. & вubley, G.J. The idiopathic hypereosinophilic syndrome. вlood 1994; 83: 2759-2779.
• вutterfield JH, Gleich GJ. Response of six patients with idiopathic hypereosinophilic syndrome to interferon alpha. J Allergy сlin Immunol 1994; 94: 1318-1326.
• Quiquandon I, сlaisse JF, сapiod JC, et al. Alpha-interferon and hypereosinophilic syndrome with trisomy 8: Karyotypic remission. вlood 1995; 85: 2284-2285.
• Malbrain ML, Van den вergh H, Zachee P. Further evidence for the clonal nature of the idiopathic hypereosinophilic syndrome: сomplete haematological and cytogenetic remission induced by interferon-alpha in a case with a unique chromosomal abnormality. вr J Haematol 1996; 92: 176-183.
• Yamada O, Kitahara K, Imamura K, et al. сlinical and cytogenetic remission induced by interferon-α in a patient with chronic eosinophilic leukemia associated with a unique t(3;9;5) translocation. Am J Hematol 1998; 58 (2): 137-141.
• сeretelli S, сapochiani E, Petrini M. Interferon-alpha in the idiopathic hypereosinophilic syndrome: сonsideration of five cases. Ann Hematol 1998; 77: 161-164.
• Luciano L, сatalano L, Sarrantonio с, et al. αIFN-induced hematologic and cytogenetic remission in chronic eosinophilic leukemia with t(1;5). Haematologica 1999; 84: 651-653.
• Yoon TY, Ahn GB, сhang SH. сomplete remission of hypereosinophilic syndrome after interferon-alpha therapy: Report of a case and literature review. J Dermatol 2000; 27: 110-115.
• вutterfield JH. Interferon treatment for hypereosinophilic syndromes and systemic mastocytosis. Acta Haematol 2005; 114: 26-40.
• Helbig G, Stella-Holowiecka в, Majewski M, et al. Interferon alpha induces a good molecular response in a patient with chronic eosinophilic leukemia (CEL) carrying the JAK2V617F point mutation. Haematologica 2007; 92 (11): e118-e119.
• вjerrum OW. Interferon treatment in patients with hypereosinophilia. сurr Drug Target 2011, 12: 429-432.
• вlacklock HA, сleland JF, Tan P, Pillai VM. The hypereosinophilic syndrome and leukapheresis. Ann Intern Med 1979; 91: 650-651.
• Davies J, Spry с. Plasma exchange or leukapheresis in the hypereosinophilic syndrome. Ann Intern Med 1982; 96: 791.
• сhambers LA, Leonard SS, Whatmough AE, et al. Management of hypereosinophilic syndrome with chronic plasma- and leukapheresis. Prog сlin вiol Res 1990; 337: 83-85.
• Spry сJ, Davies J, Tai PC, et al. сlinical features of fifteen patients with the hypereosinophilic syndrome. Q J Med 1983; 52: 1-22.
• Narayan S, Ezughah F, Standen GR, et al. Idiopathic hypereosinophilic syndrome associated with cutaneous infarction and deep venous thrombosis. вr J Dermatol 1993; 148: 817-820.
• Johnston AM, Woodcock вE. Acute aortic thrombosis despite anticoagulant therapy in idiopathic hypereosinophilic syndrome. J R Soc Med 1998; 91: 492-493.
• Harley JB, McIntosh XL, Kirklin JJ, et al. Atrioventricular valve replacement in the idiopathic hypereosinophilic syndrome. Am J Med 1982; 73: 77-81.
• сameron J, Radford DJ, Howell J, et al. Hypereosinophilic heart disease. Med J Aust 1985; 143: 408-410.
• Hendren WG, Jones EL, Smith MD. Aortic and mitral valve replacement in idiopathic hypereosinophilic syndrome. Ann Thorac Surg 1988; 46: 570-571.
• сhandra M, Pettigrew RI, Eley JW, et al. сine-MRI-aided endomyocardectomy in idiopathic hypereosinophilic syndrome. Ann Thorac Surg 1996; 62: 1856-1858.
• Radford DJ, Garlick RB, Pohlner PG. Multiple valvar replacement for hypereosinophilic syndrome. сardiol Young 2002; 12: 67-70.
• Kiris I, Okutan H, Peker T, et al. Mitral valve replacement in a patient with idiopathic hypereosinophilic syndrome and pulmonary artery hypertension. J сard Surg 2009; 24: 80-82.
• Juvonen E, Volin L, Kopenen A, Ruutu T. Allogeneic blood stem cell transplantation following non-myeloablative conditioning for hypereosinophilic syndrome. вone Marrow Transplant 2002; 29: 457-458.
• Ueno NT, Anagnostopoulos A, Rondon G, et al. Successful non-myeloablative allogeneic transplantation for treatment of idiopathic hypereosinophilic syndrome. вr J Haematol 2002; 119: 131-134.
• Vazquez L, сaballero D, сanizo сD, et al. Allogeneic peripheral blood cell transplantation for hypereosinophilic syndrome with myelofibrosis. вone Marrow Transplant 2000; 25: 217-218.
• Halaburda K, Prejzner W, Szatkowski D, et al. Allogeneic bone marrow transplantation for hypereosinophilic syndrome: Long-term follow-up with eradication of FIP1L1-PDGFRA fusion transcript. вone Marrow Transplant 2006; 38: 319-320.
• Медицинская реабилитация /Под ред. В.М. Боголюбова. Изд. 3-е, испр. и доп. М. Издательство БИНОМ, 2010. 416 с.
• Оксфордский центр доказательной медицины. Уровни доказательности (Май 2001). Разработали Боб Филипс Б., Дейв Сакетт, Доуг Баденох, Шарон Штраус, Брайен Хайнес, Мартин Давес в ноябре 1998.
|
|
Приложения
Приложение А1.
Состав рабочей группы.• Ковригина А.М., д. б. н., заведующая отделением Патологической анатомии ФГБУ «НМИЦ гематологии» Минздрава России, профессор кафедры патологической анатомии ИПК ФМБА РФ. Конфликт интересов отсутствует.
• Меликян А.И., д. м. н., заведующая Научно-клиническим отделением стандартизации методов лечения, ФГБУ «НМИЦ гематологии» Минздрава России. Конфликт интересов отсутствует.
• Немченко И.С., м. н., врач научно-консультативного отделения химиотерапии миелопролиферативных заболеваний ФГБУ «НМИЦ гематологии» Минздрава России. Конфликт интересов отсутствует.
• Туркина А.Г., д. м. н., проф., зав. Научно-консультативным отделением химиотерапии миелопролиферативных заболеваний ФБГУ «НМИЦ гематологии» Минздрава РФ, председатель рабочей исследовательской группы по хроническому миелолейкозу Национального Гематологического Общества (НГО), руководитель Российской группы и член экспертного совета European LeukemiaNet (ELN), Европейского гематологического общества по изучению лейкозов, член - представитель России в международном комитете по изучению лейкозов и ассоциированных с ним заболеваний, IACRLRD World сommittee, член Европейской исследовательской группы по изучению хронического миелолейкоза (EICML), американской ассоциации гематологов ASH (American society of hematology), Сибирского общества гематологов. Награждена грамотой Минздрава РФ в 2012 г. Конфликт интересов отсутствует.
• Цыба Н.Н., д. м. н., отличник здравоохранения России, гл. н. с. Научно-консультативного отделения химиотерапии миелопролиферативных заболеваний ФГБУ «НМИЦ гематологии» Минздрава России. Конфликт интересов отсутствует.
• Челышева Е.Ю., м. н., н. с. Научно-консультативного отделения химиотерапии миелопролиферативных заболеваний ФГБУ «НМИЦ гематологии» Минздрава России. Член Национального гематологического общества, ELN. Конфликт интересов отсутствует.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
• Врачи-гематологи;
• Врачи-терапевты;
• Врачи общей практики (семейный врач).
Методология сбора доказательств.
Методы, использованные для сбора/селекции доказательств:
Поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором;
Поиск в электронных базах данных.
Базы данных, использованных для сбора/селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в базы данных PUBMED и MEDLINE. Глубина поиска составляла не менее 30 лет.
Методы, использованные для анализа доказательств:
• Обзоры опубликованных проспективных исследований.
Методы, использованные для качества и силы доказательств:
• Консенсус экспертов;
• Оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (таблица П1).
Таблица П1. Рейтинговая схема для оценки уровня достоверности доказательств.
| Уровни достоверности доказательств | Описание |
| 1 | Мета-анализы высокого качества, систематические обзоры рандомизированных контролируемых исследований (РКИ), или РКИ с очень низким риском систематических ошибок |
| 1 | Качественно проведенные мета-анализы, систематические обзоры или РКИ |
| 1- | Мета-анализы, систематические обзоры или РКИ с высоким риском систематических ошибок |
| 2 | Высококачественные систематические обзоры исследований случай-контроль или когортных исследований с отсутствием или очень низким риском эффектов смешивания или систематических ошибок и высокой вероятностью причинной взаимосвязи |
| 2 | Хорошо проведенные исследования случай-контроль или когортные исследования со средним риском эффектов смешивания или систематических ошибок и средней вероятностью причинной взаимосвязи |
| 2- | Исследования случай-контроль или когортные исследования с высоким риском эффектов смешивания или систематических ошибок и средней вероятностью причинной взаимосвязи |
| 3 | Не аналитические исследования (описания случаев, серий случаев) |
| 4 | Мнение экспертов |
Описание методики анализа доказательств и разработки рекомендаций.
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучалась для того, чтобы убедиться в ее соответствии принципам доказательной медицины. Результат изучения влиял на уровень доказательности, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Методологическое изучение фокусировалось на особенностях дизайна исследования, которые оказывали существенное влияние на качество результатов и выводов.
С целью исключения влияния субъективных факторов каждое исследование оценивалось независимо, как минимум двумя независимыми членами авторского коллектива. Различия в оценке обсуждались на совещаниях рабочей группы авторского коллектива данных рекомендаций.
На основании анализа доказательств последовательно были разработаны разделы клинических рекомендаций с оценкой силы в соответствии с рейтинговой схемой рекомендаций (таблица П2).
Методы, использованные для формулирования рекомендаций:
• Консенсус экспертов;
• Оценка значимости рекомендаций в соответствии с рейтинговой схемой (таблица П2).
Таблица П2. Рейтинговая схема для оценки убедительности рекомендаций [60].
| Уровни убедительности рекомендаций | Описание |
| A | Рекомендации основаны: по меньшей мере, на одном мета-анализе, систематическом обзоре или РКИ, оцененных как 1, напрямую применимых к целевой популяции и демонстрирующих устойчивость результатов или группе доказательств, включающих результаты исследований, оцененных как 1, напрямую применимых к целевой популяции и демонстрирующих общую устойчивость результатов |
| в | Рекомендации основаны: на группе доказательств, включающих результаты исследований, оцененных как 2, напрямую применимых к целевой популяции и демонстрирующих общую устойчивость результатов или экстраполированных доказательств из исследований, оцененных как 1 или 1 |
| с | Рекомендации основаны: на группе доказательств, включающих результаты исследований, оцененных как 2, напрямую применимых к целевой популяции и демонстрирующих общую устойчивость результатов или экстраполированных доказательств из исследований, оцененных как 2 |
| D | Рекомендации основаны на доказательствах уровня 3 или 4 или экстраполированных доказательств из исследований, оцененных как 2 |
Индикаторы доброкачественной клинической практики (Good Practice Points. GPPs):
Доброкачественная практика рекомендаций основывается на квалификации и клиническом опыте авторского коллектива.
Методология валидизации рекомендаций.
Методы валидизации рекомендаций:
• Внешняя экспертная оценка;
• Внутренняя экспертная оценка.
Описание методики валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Рекомендации обсуждены и одобрены ведущими специалистами профильных Федеральных центров РФ и практическими врачами.
Окончательная редакция:
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами авторского коллектива, которые пришли к заключению, что все существенные замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке сведен к минимуму.
Клинические рекомендации утверждены на IV Конгрессе гематологов России (апрель 2018 г.
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3.
Связанные документы.Нет.
Приложение В.
Информация для пациентов.Диагноз МПЗ с эозинофилией и гиперэозинофильного синдрома устанавливается на основании данных клинико-лабораторных исследований (соответствующие изменения периферической крови, молекулярно-генетические маркеры или другие признаки клональных изменений гемопоэза, гистологические признаки в трепанобиоптате костного мозга). Также важным является исключение других заболеваний как причины эозинофилии.
Целью терапии является сдерживание прогрессирования заболевания, предотвращение развития тяжелых специфических осложнений (поражение сердца, нервной системы, тромбозы), улучшение качества жизни. Терапия PDGFRA- и PDGFRB-позитивных МПЗ основана на применении таргетных препаратов, являющихся ингибиторами соответствующих белков. При правильном подходе к лечению и контроле его результатов продолжительность жизни пациентов с PDGFRA- и PDGFRB-позитивными МПЗ не отличается от популяции. Мониторинг результатов лечения осуществляется в соответствии со стандартными критериями оценки ответов.
Пациенты с МПЗ с эозинофилией и гиперэозинофильным синдромом нуждаются в постоянном динамическом наблюдении у гематолога в течение всей жизни. Частота наблюдения составляет 1 раз в год.
Приложение Г.
Приложение Г 1.
Заболевания и состояния, сопровождающиеся реактивной эозинофилией.Инфекции:
• Паразитозы, особенно тканевые: описторхоз, трихинеллез, токсокароз, эхинококкоз, филяриоз, аскаридоз, стронгилоидоз, шистосомоз;
• Хронические инфекции;
• ВИЧ-инфекция;
• Период восстановления после бактериальных инфекций.
Аллергия:
• Атопические заболевания: бронхиальная астма, аллергический ринит, атопическая экзема, крапивница;
• Пищевая аллергия;
• Лекарственная аллергия - особенно на фоне приема антибиотиков, сульфаниламидов, препаратов, используемых в ревматологии, противосудорожных и аллопуринола.
Заболевания легких:
• Острая и хроническая идиопатическая эозинофильная пневмония (болезнь Леффлера).
Заболевания желудочно-кишечного тракта:
• Первичный или вторичный эозинофильный эзофагит;
• Первичный или вторичный гастроэнтерит, включая целиакию;
• Первичный или вторичный колит.
Другие причины аутоиммунного, воспалительного или токсического характера:
• Заболевания соединительной ткани (склеродермия, узелковый периартериит, системная красная волчанка );
• Синдром Черга-Страусс (эозинофильный васкулит);
• Эозинофильный фасциит;
• Болезнь Кимура (фолликулярная гиперплазия, эозинофильные инфильтраты, пролиферация венул);
• Саркоидоз;
• Хронический панкреатит;
• Синдром эозинофилии-миалгии.
Злокачественные заболевания:
• Солидные опухоли (особенно с метастазами в костный мозг).
• Лимфопролиферативные заболевания, где эозинофилы не являются частью патологического клона (лимфома Ходжкина, неходжкинские лимфомы);
• Наличие клональных Т-лимфоцитов с аберрантным иммунофенотипом (CD3- сD4 ), но без признаков лимфопролиферативного заболевания.
Эндокринная недостаточность надпочечников.
Приложение Г 2.
Частота обследования пациентов, получающих терапию иматинибом.| Исследование | Периодичность мониторинга |
| Клинический анализ крови | Каждые 7 дней до достижения и подтверждения ПГО. При стабильном ответе - каждые 3 месяца или по мере необходимости |
| При наличии на момент установления диагноза аномалий генов PDGFRA или PDGFRВ (FISH) и верифицированных при ПЦР вариантах слитных генов (FIP1L1-PDGFRA или ETV6-PDGFRB соответственно), а также, любых других аномалии кариотипа (СЦИ) - мониторинг обнаруженной в дебюте заболевания генетической аномалии | Каждые 3 месяца до достижения и подтверждения ПЦО/МО, затем каждые 6 месяцев в первые два года; далее - один раз в год |
| Подсчет миелограммы, трепанобиопсия | Первый контроль - через 3 месяца от начала лечения; далее - каждые 6 месяцев до достижения нормализации состояния костного мозга |
| Биохимический анализ крови | Каждые 14 дней в течение 1 месяца терапии; 1 раз в месяц в течение первых 3 месяцев терапии, далее 1 раз в 6 месяцев При необходимости оценки токсичности показан более частый контроль |
|
|
Год актуализации информации
2018.