Pharmacological Group
Latin name
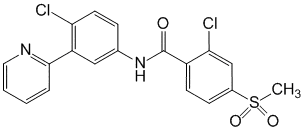
Vismodegibum ( Vismodegibi).
Chemical name
2-Хлор-N-(4-хлор-3-пиридин-2-илфенил)-4-метилсульфонилбензамид.
Used in the treatment
CAS Code
879085-55-9.
Pharmacological action
Противоопухолевое.
Characteristics of the substance
RxList.com.
Противоопухолевое средство, ингибитор сигнального пути Hedgehog.
Молярная масса 421,3 г/моль. Представляет собой кристаллический порошок от белого до желто-коричневого цвета c pH-зависимой растворимостью от 0,1 мкг/мл при pH 7 до 0,99 мг/мл при pH 1.
Противоопухолевое средство, ингибитор сигнального пути Hedgehog.
Молярная масса 421,3 г/моль. Представляет собой кристаллический порошок от белого до желто-коричневого цвета c pH-зависимой растворимостью от 0,1 мкг/мл при pH 7 до 0,99 мг/мл при pH 1.
Pharmacodynamics
Фармакодинамика.
Механизм действия. Висмодегиб - низкомолекулярный пероральный ингибитор сигнального пути Hedgehog. Активация сигнального пути Hedgehog через трансмембранный белок Smoothened (Smoothened transmembrane protein, SMO) приводит к активации и внутриядерной локализации факторов транскрипции онкогена, ассоциированного с глиомой (glioma-associated oncogene, GLI) и индукции генов-мишеней сигнального пути Hedgehog. Многие из этих генов вовлечены в пролиферацию, выживание и дифференцировку клеток. Висмодегиб связывается с SMO и препятствует передаче сигнала по пути Hedgehog.
Механизм действия. Висмодегиб - низкомолекулярный пероральный ингибитор сигнального пути Hedgehog. Активация сигнального пути Hedgehog через трансмембранный белок Smoothened (Smoothened transmembrane protein, SMO) приводит к активации и внутриядерной локализации факторов транскрипции онкогена, ассоциированного с глиомой (glioma-associated oncogene, GLI) и индукции генов-мишеней сигнального пути Hedgehog. Многие из этих генов вовлечены в пролиферацию, выживание и дифференцировку клеток. Висмодегиб связывается с SMO и препятствует передаче сигнала по пути Hedgehog.
Pharmacokinetics
Всасывание. Висмодегиб - это вещество с высокой проницаемостью и низкой растворимостью в воде (класс 2 по системе биофармацевтической классификации). Абсолютная биодоступность висмодегиба после приема одной дозы составляет 31,8% (коэффициент вариации 14,5%). Абсорбция происходит с насыщением, о чем свидетельствует отсутствие пропорционального дозе увеличения экспозиции висмодегиба после однократного приема в дозе 270 и 540 мг. В клинически значимых условиях (равновесное состояние) фармакокинетические параметры висмодегиба не изменяются под воздействием пищи. Таким образом, висмодегиб можно принимать независимо от приема пищи.
Распределение. dVd висмодегиба - от 16,4 до 26,6 л. Висмодегиб в клинически значимых концентрациях обладает высокой степенью связи с белками плазмы крови человека (97%) in vitro >in vitro. Висмодегиб связывается как с альбумином плазмы, так и с альфа1-кислым гликопротеином. связывание с альфа1-кислым гликопротеином in vitro >in vitro происходит с насыщением в клинически значимых концентрациях. Связывание с белками плазмы у пациентов ex vivo составляет >99%. Концентрация висмодегиба в значительной степени коррелирует с концентрацией альфа1-кислого гликопротеина в плазме крови: изменения концентрации альфа1-кислого гликопротеина и общего количества висмодегиба в плазме происходят параллельно, а концентрация несвязанного висмодегиба в плазме неизменно низкая.
Метаболизм. Висмодегиб медленно выводится путем биотрансформации, а также экскреции в неизмененном виде.
В плазме висмодегиб преобладает в неизмененном виде, его концентрация составляет более 98% от всех циркулирующих компонентов (висмодегиб в неизмененном виде и его метаболиты).
Пути метаболизма висмодегиба в организме человека включают окисление, глюкуронизацию и в незначительной степени расщепление пиридинового кольца. Два наиболее распространенных метаболита окислительного процесса, обнаруживаемые в каловых массах, образуются in vitro >in vitro с участием рекомбинантных изоферментов цитохрома Р450 сYP2С9 и сYP3A4/5.
Выведение. После перорального приема одной дозы висмодегиба наблюдается следующий фармакокинетический профиль: концентрация висмодегиба в плазме крови поддерживается на постоянном уровне, а рассчитанный конечный 1/2T1/2 составляет 12 дней.
При продолжительном приеме висмодегиба 1 раз в день его фармакокинетика, по-видимому, нелинейна. При приеме одной дозы ssCss достигается у пациентов быстрее (обычно в течение примерно 7 дней непрерывного ежедневного приема), чем теоретически ожидается, учитывая Т1/2. При этом кумуляция препарата оказывается ниже ожидаемой. Подсчитано, что при непрерывном ежедневном приеме Т1/2 висмодегиба в равновесном состоянии составляет 4 дня.
После перорального приема висмодегиба с радиоактивной меткой он абсорбируется и медленно выводится как путем биотрансформации, так и в неизмененном виде, при этом 82% введенной дозы определяется в кале и 4,4% - в моче. Висмодегиб и связанные продукты метаболизма выводятся главным образом с желчью.
Фармакокинетика у особых групп пациентов.
Пациенты детского возраста и подростки. Данные по фармакокинетике у детей и подростков отсутствуют.
Пациенты пожилого возраста. Имеются ограниченные данные по фармакокинетике у пациентов пожилого возраста. Данные популяционного анализа фармакокинетических параметров позволяют предположить, что возраст не оказывает клинически значимое влияние на ssCss висмодегиба.
Пациенты с нарушением функции почек. Висмодегиб выводится почками в незначительных количествах. На основании данных популяционного анализа фармакокинетических параметров, функция почек (клиренс креатинина) не влияет на фармакокинетику висмодегиба. В связи с этим не ожидается влияние на экспозицию висмодегиба нарушения функции почек легкой и средней степени тяжести. Имеется недостаточный объем данных у пациентов с тяжелым нарушением функции почек.
Пациенты с нарушением функции печени. На основании данных популяционного анализа фармакокинетических параметров, функция печени (активность АЛТ, АСТ, концентрация общего белка или общего билирубина) не влияет на фармакокинетику висмодегиба. Согласно ограниченным данным у пациентов с нарушением функции печени легкой, средней и тяжелой степени тяжести, экспозиция висмодегиба не повышается.
Пол. На основании данных популяционного анализа фармакокинетических параметров, пол не влияет на фармакокинетику висмодегиба.
Раса. Данные по фармакокинетике у пациентов, не принадлежащих к европеоидной расе, ограничены.
Распределение. dVd висмодегиба - от 16,4 до 26,6 л. Висмодегиб в клинически значимых концентрациях обладает высокой степенью связи с белками плазмы крови человека (97%) in vitro >in vitro. Висмодегиб связывается как с альбумином плазмы, так и с альфа1-кислым гликопротеином. связывание с альфа1-кислым гликопротеином in vitro >in vitro происходит с насыщением в клинически значимых концентрациях. Связывание с белками плазмы у пациентов ex vivo составляет >99%. Концентрация висмодегиба в значительной степени коррелирует с концентрацией альфа1-кислого гликопротеина в плазме крови: изменения концентрации альфа1-кислого гликопротеина и общего количества висмодегиба в плазме происходят параллельно, а концентрация несвязанного висмодегиба в плазме неизменно низкая.
Метаболизм. Висмодегиб медленно выводится путем биотрансформации, а также экскреции в неизмененном виде.
В плазме висмодегиб преобладает в неизмененном виде, его концентрация составляет более 98% от всех циркулирующих компонентов (висмодегиб в неизмененном виде и его метаболиты).
Пути метаболизма висмодегиба в организме человека включают окисление, глюкуронизацию и в незначительной степени расщепление пиридинового кольца. Два наиболее распространенных метаболита окислительного процесса, обнаруживаемые в каловых массах, образуются in vitro >in vitro с участием рекомбинантных изоферментов цитохрома Р450 сYP2С9 и сYP3A4/5.
Выведение. После перорального приема одной дозы висмодегиба наблюдается следующий фармакокинетический профиль: концентрация висмодегиба в плазме крови поддерживается на постоянном уровне, а рассчитанный конечный 1/2T1/2 составляет 12 дней.
При продолжительном приеме висмодегиба 1 раз в день его фармакокинетика, по-видимому, нелинейна. При приеме одной дозы ssCss достигается у пациентов быстрее (обычно в течение примерно 7 дней непрерывного ежедневного приема), чем теоретически ожидается, учитывая Т1/2. При этом кумуляция препарата оказывается ниже ожидаемой. Подсчитано, что при непрерывном ежедневном приеме Т1/2 висмодегиба в равновесном состоянии составляет 4 дня.
После перорального приема висмодегиба с радиоактивной меткой он абсорбируется и медленно выводится как путем биотрансформации, так и в неизмененном виде, при этом 82% введенной дозы определяется в кале и 4,4% - в моче. Висмодегиб и связанные продукты метаболизма выводятся главным образом с желчью.
Фармакокинетика у особых групп пациентов.
Пациенты детского возраста и подростки. Данные по фармакокинетике у детей и подростков отсутствуют.
Пациенты пожилого возраста. Имеются ограниченные данные по фармакокинетике у пациентов пожилого возраста. Данные популяционного анализа фармакокинетических параметров позволяют предположить, что возраст не оказывает клинически значимое влияние на ssCss висмодегиба.
Пациенты с нарушением функции почек. Висмодегиб выводится почками в незначительных количествах. На основании данных популяционного анализа фармакокинетических параметров, функция почек (клиренс креатинина) не влияет на фармакокинетику висмодегиба. В связи с этим не ожидается влияние на экспозицию висмодегиба нарушения функции почек легкой и средней степени тяжести. Имеется недостаточный объем данных у пациентов с тяжелым нарушением функции почек.
Пациенты с нарушением функции печени. На основании данных популяционного анализа фармакокинетических параметров, функция печени (активность АЛТ, АСТ, концентрация общего белка или общего билирубина) не влияет на фармакокинетику висмодегиба. Согласно ограниченным данным у пациентов с нарушением функции печени легкой, средней и тяжелой степени тяжести, экспозиция висмодегиба не повышается.
Пол. На основании данных популяционного анализа фармакокинетических параметров, пол не влияет на фармакокинетику висмодегиба.
Раса. Данные по фармакокинетике у пациентов, не принадлежащих к европеоидной расе, ограничены.
Indications for use
Метастатическая или местнораспространенная базальноклеточная карцинома у взрослых при рецидиве после хирургического лечения или нецелесообразности хирургического лечения или лучевой терапии.
Contraindications
Повышенная чувствительность к висмодегибу. беременность и период грудного вскармливания. возраст до 18 лет. тяжелое нарушение функции почек (Cl креатинина <30 мл/мин). одновременное применение ЛС. содержащих зверобой продырявленный.
Restrictions on use
Пациенты с редкими наследственными заболеваниями, такими как непереносимость галактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция; нарушение функции печени от средней до тяжелой степени тяжести (сумма баллов >7 по шкале Чайлд-Пью).
Use during pregnancy and lactation
Категория действия на плод по FDA. D.
Беременность. Висмодегиб противопоказан в период беременности в связи с эмбриотоксическим действием. Доклинические исследования показали, что ингибиторы сигнального пути Hedgehog, такие как висмодегиб, являются эмбриотоксичными и/или тератогенными у различных видов животных и могут вызывать тяжелые пороки развития, такие как кранио-фасциальные аномалии, дефекты срединных структур, дефекты конечностей.
В случае наступления беременности, отсутствия менструации или при подозрении на возможную беременность пациентка должна немедленно сообщить об этом своему лечащему врачу.
Контрацепция у мужчин и женщин. Женщины репродуктивного возраста в период лечения и в течение 24 мес после завершения лечения висмодегибом, а также в случае отсутствия менструаций или их нерегулярности должны использовать два рекомендуемых метода контрацепции (один высокоэффективный + барьерный).
Пациенты мужского пола. Висмодегиб проникает в семенную жидкость. Для предотвращения потенциального воздействия висмодегиба на плод пациенты мужского пола (даже после вазэктомии) должны всегда использовать презерватив (по возможности со спермицидным средством) при половом акте в период терапии висмодегибом и в течение 2 мес после его последнего приема.
Рекомендуемые высокоэффективные методы контрацепции (с учетом медицинской целесообразности):
- комбинированные гормональные контрацептивы;
- подкожные гормональные импланты;
- гормональные пластыри;
- гормональные контрацептивы (левоноргестрел-высвобождающая внутриматочная система, депо-медроксипрогестерона ацетат);
- трубная стерилизация, вазэктомия;
- внутриматочная спираль (ВМС).
Рекомендуемые методы барьерной контрацепции:
- презерватив (по возможности со спермицидным средством);
- диафрагма (по возможности со спермицидным средством).
Период грудного вскармливания. Висмодегиб противопоказан в период грудного вскармливания в связи с возможностью вызывать серьезные пороки развития у детей. Женщины должны воздерживаться от грудного вскармливания во время терапии висмодегибом и в течение 24 мес после его последнего приема.
Фертильность. Специальные исследования по изучению возможного негативного влияния висмодегиба на фертильность не проводились. Однако данные, полученные в исследованиях на животных, свидетельствуют о том, что фертильность у самок и самцов может быть необратимо нарушена в результате терапии висмодегибом. Кроме того, у женщин репродуктивного возраста в клинических исследованиях наблюдалась аменорея.
Вследствие возможности развития необратимой потери фертильности в результате лечения висмодегибом пациентам должна быть дана рекомендация по консервации спермы и яйцеклеток до начала лечения висмодегибом.
Беременность. Висмодегиб противопоказан в период беременности в связи с эмбриотоксическим действием. Доклинические исследования показали, что ингибиторы сигнального пути Hedgehog, такие как висмодегиб, являются эмбриотоксичными и/или тератогенными у различных видов животных и могут вызывать тяжелые пороки развития, такие как кранио-фасциальные аномалии, дефекты срединных структур, дефекты конечностей.
В случае наступления беременности, отсутствия менструации или при подозрении на возможную беременность пациентка должна немедленно сообщить об этом своему лечащему врачу.
Контрацепция у мужчин и женщин. Женщины репродуктивного возраста в период лечения и в течение 24 мес после завершения лечения висмодегибом, а также в случае отсутствия менструаций или их нерегулярности должны использовать два рекомендуемых метода контрацепции (один высокоэффективный + барьерный).
Пациенты мужского пола. Висмодегиб проникает в семенную жидкость. Для предотвращения потенциального воздействия висмодегиба на плод пациенты мужского пола (даже после вазэктомии) должны всегда использовать презерватив (по возможности со спермицидным средством) при половом акте в период терапии висмодегибом и в течение 2 мес после его последнего приема.
Рекомендуемые высокоэффективные методы контрацепции (с учетом медицинской целесообразности):
- комбинированные гормональные контрацептивы;
- подкожные гормональные импланты;
- гормональные пластыри;
- гормональные контрацептивы (левоноргестрел-высвобождающая внутриматочная система, депо-медроксипрогестерона ацетат);
- трубная стерилизация, вазэктомия;
- внутриматочная спираль (ВМС).
Рекомендуемые методы барьерной контрацепции:
- презерватив (по возможности со спермицидным средством);
- диафрагма (по возможности со спермицидным средством).
Период грудного вскармливания. Висмодегиб противопоказан в период грудного вскармливания в связи с возможностью вызывать серьезные пороки развития у детей. Женщины должны воздерживаться от грудного вскармливания во время терапии висмодегибом и в течение 24 мес после его последнего приема.
Фертильность. Специальные исследования по изучению возможного негативного влияния висмодегиба на фертильность не проводились. Однако данные, полученные в исследованиях на животных, свидетельствуют о том, что фертильность у самок и самцов может быть необратимо нарушена в результате терапии висмодегибом. Кроме того, у женщин репродуктивного возраста в клинических исследованиях наблюдалась аменорея.
Вследствие возможности развития необратимой потери фертильности в результате лечения висмодегибом пациентам должна быть дана рекомендация по консервации спермы и яйцеклеток до начала лечения висмодегибом.
Side effects
Наиболее часто возникавшими (у >30% пациентов) нежелательными реакциями были мышечные спазмы, алопеция, дисгевзия, снижение массы тела, повышенная утомляемость и тошнота.
Для описания частоты нежелательных реакций используется следующая классификация: очень часто (больше или равно 10%). часто (больше или равно 1% и меньше 10%). нечасто (больше или равно 0,1% и меньше 1%). редко (больше или равно 0,01% и меньше 0,1%). очень редко (меньше 0,01%).
В целом у пациентов с метастатической и местнораспространенной базальноклеточной карциномой профиль безопасности не отличался и описан ниже.
Со стороны обмена веществ. Очень часто - снижение аппетита; часто - дегидратация.
Со стороны нервной системы. Очень часто - дисгевзия (искажение вкусовых восприятий), агевзия; часто - гипогевзия.
Со стороны ЖКТ. Очень часто - тошнота. диарея. запор. рвота. часто - боль в животе. боль в верхней части живота. диспепсия.
Со стороны кожи и подкожных тканей. Очень часто - алопеция; часто - выпадение бровей и ресниц, нарушение роста волос, сыпь, зуд.
Со стороны костно-мышечной и соединительной ткани. Очень часто - мышечные спазмы. часто - артралгия. костно-мышечная боль. боль в конечностях. боль в спине. боль в груди. миалгия. боль в боку.
Со стороны репродуктивной системы. Очень часто - аменорея (наблюдалась у 3 из 10 пациенток, находящихся в пременопаузальном периоде).
Лабораторные и инструментальные данные. Часто - гипокалиемия. гипонатриемия и азотемия (3-й степени тяжести в соответствии с критериями токсичности по шкале Национального института рака (NCI-CTCAE) версия 3,0). нарушения лабораторных показателей функции печени (такие как повышение активности печеночных трансаминаз. ЩФ. ГГТ и повышение билирубина в крови). Частота отдельных нежелательных реакций может отличаться от категории «часто».
Прочие. Очень часто - повышенная утомляемость, снижение массы тела; часто - слабость, боли.
RxList.com.
Результаты клинических испытаний.
Так как клинические испытания проведены с различным набором условий. частота встречаемости побочных реакций. наблюдавшихся в этих исследованиях. может не совпадать с полученной в других исследованиях и с наблюдаемой в клинической практике.
Висмодегиб в форме капсул назначался в виде монотерапии в суточной дозе более или равной 150 мг перорально в четырех открытых неконтролируемых клинических испытаниях по изучению диапазона доз и с фиксированной разовой дозой. в которые было вовлечено 138 пациентов с распространенной формой базальноклеточной карциномы. Средний возраст пациентов составлял 61 год (от 21 до 101 года), 100% пациентов были белой расы (включая выходцев из Латинской Америки) и 64% - мужчины. Средняя продолжительность лечения составила приблизительно 10 мес (305 дней, в интервале от 0,7 до 36 мес); 111 пациентов получали висмодегиб в течение 6 мес или дольше.
Чаще всего (частота 10% и выше) отмечались такие побочные реакции. как мышечные спазмы. алопеция. дисгевзия. потеря массы тела. повышенная утомляемость. тошнота. диарея. снижение аппетита. запор. артралгия. рвота и агевзия.
Ниже суммированы случаи побочных реакций. возникавших с частотой 10% и выше у пациентов (N=138) с распространенной формой базальноклеточной карциномы (первая цифра - число случаев побочных явлений всех степеней тяжести. в скобках в процентах. вторая цифра - для степени тяжести 3 и третья - для степени тяжести 4). Термины приведены в классификации MedDRA >MedDRA, классификация по степени тяжести - по NCI-CTCAE, версия 3,0.
Со стороны ЖКТ: тошнота 42 (30,4%) и 1 (0,7%), диарея 40 (29%) и 1 (0,7%), запор 29 (21%), рвота 19 (13,8%).
Общие нарушения и реакции в месте введения: повышенная утомляемость 55 (39,9%), 7 (5,1%) и 1 (0,7%).
Последствия применения: потеря массы тела 62 (44,9%) и 10 (7,2%).
Со стороны обмена веществ и нарушения питания: снижение аппетита 35 (25,4%) и 3 (2,2%).
Со стороны скелетно-мышечной системы и соединительной ткани: мышечные спазмы 99 (71,7%) и 5 (3,6%), артралгия 22 (15,9%) и 1 (0,7%).
Со стороны нервной системы: дисгевзия 76 (55,1%), агевзия 15 (10,9%).
Со стороны кожи и подкожных тканей: алопеция 88 (63,8%).
Аменорея.
В клинических испытаниях у 3 из 10 женщин пременопаузного периода развилась аменорея в ходе лечения висмодегибом.
Отклонения лабораторных показателей.
В ходе клинических испытаний наблюдались следующие отклонения лабораторных показателей 3-й степени тяжести, связанные с лечением: гипонатриемия у 6 пациентов (4%), гипокалиемия у 2 пациентов (1%) и азотемия у 3 пациентов (2%).
Для описания частоты нежелательных реакций используется следующая классификация: очень часто (больше или равно 10%). часто (больше или равно 1% и меньше 10%). нечасто (больше или равно 0,1% и меньше 1%). редко (больше или равно 0,01% и меньше 0,1%). очень редко (меньше 0,01%).
В целом у пациентов с метастатической и местнораспространенной базальноклеточной карциномой профиль безопасности не отличался и описан ниже.
Со стороны обмена веществ. Очень часто - снижение аппетита; часто - дегидратация.
Со стороны нервной системы. Очень часто - дисгевзия (искажение вкусовых восприятий), агевзия; часто - гипогевзия.
Со стороны ЖКТ. Очень часто - тошнота. диарея. запор. рвота. часто - боль в животе. боль в верхней части живота. диспепсия.
Со стороны кожи и подкожных тканей. Очень часто - алопеция; часто - выпадение бровей и ресниц, нарушение роста волос, сыпь, зуд.
Со стороны костно-мышечной и соединительной ткани. Очень часто - мышечные спазмы. часто - артралгия. костно-мышечная боль. боль в конечностях. боль в спине. боль в груди. миалгия. боль в боку.
Со стороны репродуктивной системы. Очень часто - аменорея (наблюдалась у 3 из 10 пациенток, находящихся в пременопаузальном периоде).
Лабораторные и инструментальные данные. Часто - гипокалиемия. гипонатриемия и азотемия (3-й степени тяжести в соответствии с критериями токсичности по шкале Национального института рака (NCI-CTCAE) версия 3,0). нарушения лабораторных показателей функции печени (такие как повышение активности печеночных трансаминаз. ЩФ. ГГТ и повышение билирубина в крови). Частота отдельных нежелательных реакций может отличаться от категории «часто».
Прочие. Очень часто - повышенная утомляемость, снижение массы тела; часто - слабость, боли.
RxList.com.
Результаты клинических испытаний.
Так как клинические испытания проведены с различным набором условий. частота встречаемости побочных реакций. наблюдавшихся в этих исследованиях. может не совпадать с полученной в других исследованиях и с наблюдаемой в клинической практике.
Висмодегиб в форме капсул назначался в виде монотерапии в суточной дозе более или равной 150 мг перорально в четырех открытых неконтролируемых клинических испытаниях по изучению диапазона доз и с фиксированной разовой дозой. в которые было вовлечено 138 пациентов с распространенной формой базальноклеточной карциномы. Средний возраст пациентов составлял 61 год (от 21 до 101 года), 100% пациентов были белой расы (включая выходцев из Латинской Америки) и 64% - мужчины. Средняя продолжительность лечения составила приблизительно 10 мес (305 дней, в интервале от 0,7 до 36 мес); 111 пациентов получали висмодегиб в течение 6 мес или дольше.
Чаще всего (частота 10% и выше) отмечались такие побочные реакции. как мышечные спазмы. алопеция. дисгевзия. потеря массы тела. повышенная утомляемость. тошнота. диарея. снижение аппетита. запор. артралгия. рвота и агевзия.
Ниже суммированы случаи побочных реакций. возникавших с частотой 10% и выше у пациентов (N=138) с распространенной формой базальноклеточной карциномы (первая цифра - число случаев побочных явлений всех степеней тяжести. в скобках в процентах. вторая цифра - для степени тяжести 3 и третья - для степени тяжести 4). Термины приведены в классификации MedDRA >MedDRA, классификация по степени тяжести - по NCI-CTCAE, версия 3,0.
Со стороны ЖКТ: тошнота 42 (30,4%) и 1 (0,7%), диарея 40 (29%) и 1 (0,7%), запор 29 (21%), рвота 19 (13,8%).
Общие нарушения и реакции в месте введения: повышенная утомляемость 55 (39,9%), 7 (5,1%) и 1 (0,7%).
Последствия применения: потеря массы тела 62 (44,9%) и 10 (7,2%).
Со стороны обмена веществ и нарушения питания: снижение аппетита 35 (25,4%) и 3 (2,2%).
Со стороны скелетно-мышечной системы и соединительной ткани: мышечные спазмы 99 (71,7%) и 5 (3,6%), артралгия 22 (15,9%) и 1 (0,7%).
Со стороны нервной системы: дисгевзия 76 (55,1%), агевзия 15 (10,9%).
Со стороны кожи и подкожных тканей: алопеция 88 (63,8%).
Аменорея.
В клинических испытаниях у 3 из 10 женщин пременопаузного периода развилась аменорея в ходе лечения висмодегибом.
Отклонения лабораторных показателей.
В ходе клинических испытаний наблюдались следующие отклонения лабораторных показателей 3-й степени тяжести, связанные с лечением: гипонатриемия у 6 пациентов (4%), гипокалиемия у 2 пациентов (1%) и азотемия у 3 пациентов (2%).
Interaction
Влияние сопутствующих ЛС на висмодегиб. ЛС, которые изменяют кислотность (pH) в верхних отделах ЖКТ (например ингибиторы протонного насоса, блокаторы Н2-гистаминовых рецепторов или антациды), могут изменять растворимость висмодегиба и снижать его биодоступность. Однако специальные клинические исследования для изучения эффекта ЛС, изменяющих pH в желудке, на системную экспозицию висмодегиба не проводились. Маловероятно, что увеличение дозы висмодегиба при одновременном приеме с такими ЛС компенсирует снижение его экспозиции. При одновременном применении висмодегиба с ингибиторами протонного насоса, блокаторами H2-гистаминовых рецепторов или антацидами системная экспозиция висмодегиба может снижаться; влияние на эффективность висмодегиба неизвестно. Подобный эффект может также наблюдаться у пациентов с ахлогидрией.
Результаты исследований in vitro >in vitro свидетельствуют о том, что висмодегиб является субстратом эффлюксного переносчика P-gp и изоферментов сYP2C9 и сYP3A4. Системная экспозиция и частота нежелательных явлений висмодегиба могут увеличиваться при его одновременном применении с ЛС, способными ингибировать P-gp (например кларитромицин, эритромицин, азитромицин, верапамил, циклоспорин), изоферменты сYP2C9 (амиодарон, флуконазол) и сYP3A4 (боцепревир, кониваптан, индинавир, итраконазол, кетоконазол, лопинавир/ритонавир, нелфинавир, позаконазол, ритонавир, саквинавир, телапревир, телитромицин, вориконазол). Экспозиция висмодегиба может уменьшаться при его одновременном применении с индукторами сYP3A4 (рифампицин, карбамазепин, фенитоин, препараты, содержащие зверобой продырявленный); влияние на эффективность висмодегиба неизвестно.
Влияние висмодегиба на сопутствующие лекарственные препараты. Системная экспозиция росиглитазона (субстрат изофермента сYP2C8) или пероральных контрацептивов (этинилэстрадиол и норэтистерон) не изменяется при применении совместно с висмодегибом у онкологических пациентов.
Согласно исследованиям in vitro, висмодегиб потенциально способен ингибировать белок устойчивости рака молочной железы (BCRP).
RxList.com.
Влияние других ЛС на висмодегиб.
ЛС, ингибирующие или индуцирующие ферменты, метаболизирующие висмодегиб. В элиминацию висмодегиба вовлечены разные механизмы. Главным образом висмодегиб экскретируется в неизмененном виде. Некоторые минорные метаболиты продуцируются многими изоферментами сYP. Несмотря на то что висмодегиб является субстратом сYP2C9 и сYP3A4 in vitro >in vitro, не предполагается, что ингибирование сYP влияет на системную экспозицию висмодегиба, в клинических испытаниях с сопутствующим применением как индукторов сYP3A4 (например карбамазепин, модафинил, фенобарбитал), так и ингибиторов сYP3A4 (например эритромицин, флуконазол) у пациентов наблюдались схожие концентрации висмодегиба в плазме крови в равновесном состоянии.
ЛС, ингибирующие транспортные системы лекарств. Исследования in vitro >in vitro указывают на то, что висмодегиб является субстратом активного переносчика P-gp. При совместном применении висмодегиба с ЛС, ингибирующими P-gp (например кларитромицин, эритромицин, азитромицин), возможно увеличение системной экспозиции висмодегиба и частоты случаев побочных явлений.
ЛС, влияющие на pH желудка. ЛС, изменяющие pH верхних отделов ЖКТ (например ингибиторы протонного насоса, антагонисты H2-рецепторов гистамина и антациды), могут изменить растворимость висмодегиба и уменьшить его биодоступность. Однако формальные клинические исследования по оценке влияния ЛС, изменяющих pH желудка, на системную экспозицию висмодегиба не проводились. Маловероятно, что увеличение дозы висмодегиба при совместном применении с такими ЛС компенсирует уменьшение экспозиции. Совместное применение висмодегиба с ингибиторами протонного насоса, антагонистами H2-рецепторов гистамина или антацидами может увеличить системную экспозицию висмодегиба; влияние на эффективность висмодегиба неизвестно.
Влияние висмодегиба на другие ЛС.
Результаты исследования лекарственных взаимодействий, выполненного с участием пациентов со злокачественными новообразованиями, показали, что системная экспозиция росиглитазона (субстрат сYP2C8) или пероральных контрацептивов (этинилэстрадиол и норэтиндрон) не изменялась при их совместном применении с висмодегибом.
Исследования in vitro >in vitro указывают, что висмодегиб является индуктором сYP1A2, сYP2B6, сYP2C19 и транспортера вCRP. Висмодегиб не индуцирует сYP1A2, сYP2B6 или сYP3A4/5 в человеческих гепатоцитах.
Результаты исследований in vitro >in vitro свидетельствуют о том, что висмодегиб является субстратом эффлюксного переносчика P-gp и изоферментов сYP2C9 и сYP3A4. Системная экспозиция и частота нежелательных явлений висмодегиба могут увеличиваться при его одновременном применении с ЛС, способными ингибировать P-gp (например кларитромицин, эритромицин, азитромицин, верапамил, циклоспорин), изоферменты сYP2C9 (амиодарон, флуконазол) и сYP3A4 (боцепревир, кониваптан, индинавир, итраконазол, кетоконазол, лопинавир/ритонавир, нелфинавир, позаконазол, ритонавир, саквинавир, телапревир, телитромицин, вориконазол). Экспозиция висмодегиба может уменьшаться при его одновременном применении с индукторами сYP3A4 (рифампицин, карбамазепин, фенитоин, препараты, содержащие зверобой продырявленный); влияние на эффективность висмодегиба неизвестно.
Влияние висмодегиба на сопутствующие лекарственные препараты. Системная экспозиция росиглитазона (субстрат изофермента сYP2C8) или пероральных контрацептивов (этинилэстрадиол и норэтистерон) не изменяется при применении совместно с висмодегибом у онкологических пациентов.
Согласно исследованиям in vitro, висмодегиб потенциально способен ингибировать белок устойчивости рака молочной железы (BCRP).
RxList.com.
Влияние других ЛС на висмодегиб.
ЛС, ингибирующие или индуцирующие ферменты, метаболизирующие висмодегиб. В элиминацию висмодегиба вовлечены разные механизмы. Главным образом висмодегиб экскретируется в неизмененном виде. Некоторые минорные метаболиты продуцируются многими изоферментами сYP. Несмотря на то что висмодегиб является субстратом сYP2C9 и сYP3A4 in vitro >in vitro, не предполагается, что ингибирование сYP влияет на системную экспозицию висмодегиба, в клинических испытаниях с сопутствующим применением как индукторов сYP3A4 (например карбамазепин, модафинил, фенобарбитал), так и ингибиторов сYP3A4 (например эритромицин, флуконазол) у пациентов наблюдались схожие концентрации висмодегиба в плазме крови в равновесном состоянии.
ЛС, ингибирующие транспортные системы лекарств. Исследования in vitro >in vitro указывают на то, что висмодегиб является субстратом активного переносчика P-gp. При совместном применении висмодегиба с ЛС, ингибирующими P-gp (например кларитромицин, эритромицин, азитромицин), возможно увеличение системной экспозиции висмодегиба и частоты случаев побочных явлений.
ЛС, влияющие на pH желудка. ЛС, изменяющие pH верхних отделов ЖКТ (например ингибиторы протонного насоса, антагонисты H2-рецепторов гистамина и антациды), могут изменить растворимость висмодегиба и уменьшить его биодоступность. Однако формальные клинические исследования по оценке влияния ЛС, изменяющих pH желудка, на системную экспозицию висмодегиба не проводились. Маловероятно, что увеличение дозы висмодегиба при совместном применении с такими ЛС компенсирует уменьшение экспозиции. Совместное применение висмодегиба с ингибиторами протонного насоса, антагонистами H2-рецепторов гистамина или антацидами может увеличить системную экспозицию висмодегиба; влияние на эффективность висмодегиба неизвестно.
Влияние висмодегиба на другие ЛС.
Результаты исследования лекарственных взаимодействий, выполненного с участием пациентов со злокачественными новообразованиями, показали, что системная экспозиция росиглитазона (субстрат сYP2C8) или пероральных контрацептивов (этинилэстрадиол и норэтиндрон) не изменялась при их совместном применении с висмодегибом.
Исследования in vitro >in vitro указывают, что висмодегиб является индуктором сYP1A2, сYP2B6, сYP2C19 и транспортера вCRP. Висмодегиб не индуцирует сYP1A2, сYP2B6 или сYP3A4/5 в человеческих гепатоцитах.
Overdose
При использовании висмодегиба в дозе, в 3,6 раза превышающей рекомендованную суточную (150 мг), не наблюдалось повышение концентрации висмодегиба в плазме крови или усиление токсичности.
RxList.com.
Информация о передозировке висмодегиба у человека отсутствует. В клинических испытаниях висмодегиб назначался перорально в дозе до 540 мг 1 раз в день; экспозиция висмодегиба не увеличивалась в интервале 150-540 мг/сут.
RxList.com.
Информация о передозировке висмодегиба у человека отсутствует. В клинических испытаниях висмодегиб назначался перорально в дозе до 540 мг 1 раз в день; экспозиция висмодегиба не увеличивалась в интервале 150-540 мг/сут.
Method of drug use and dosage
Внутрь, стандартный режим дозирования - 150 мг 1 раз в сутки независимо от приема пищи.
Application precautions
Гибель эмбриона или плода или тяжелые врожденные пороки. Висмодегиб при приеме беременными женщинами может вызывать гибель эмбриона или плода, а также тяжелые врожденные пороки развития. Прием висмодегиба противопоказан во время беременности.
Согласно разработанной компанией-производителем программе по предотвращению беременности при терапии висмодегибом, женщина, обладающая репродуктивным потенциалом, определяется как половозрелая при следующих условиях:
- возраст менее 50 лет;
- наличие менструаций в предыдущие 12 последовательных месяцев;
- отсутствие гистерэктомии или двусторонней овариэктомии или отсутствие медицински подтвержденного стойкого синдрома преждевременного истощения яичников;
- отсутствие XY генотипа, синдрома Тернера или агенезии матки;
- отсутствие менструаций вследствие проведения противоопухолевой терапии.
Рекомендации для женщин, обладающих репродуктивным потенциалом. Висмодегиб противопоказан пациенткам, которые не способны выполнять рекомендации Программы по предотвращению беременности при терапии висмодегибом. Женщина, обладающая репродуктивным потенциалом, должна соблюдать следующие условия:
- понимать, что существует риск тератогенного воздействия висмодегиба на еще не родившегося ребенка;
- не принимать висмодегиб, если она беременная или планирует беременность;
- иметь отрицательный результат достоверного теста на беременность, проведенного под руководством медицинского специалиста в пределах 7 дней до начала терапии висмодегибом и ежемесячно в течение терапии;
- избегать беременности во время терапии висмодегибом и в течение 24 мес после приема последней дозы;
- следовать рекомендациям по использованию эффективных методов контрацепции;
- использовать два рекомендуемых метода контрацепции во время терапии висмодегибом при сохранении половой жизни;
- сообщить врачу, если в период терапии или в течение 24 мес после приема последней дозы висмодегиба наступила беременность или есть подозрение на наступление беременности; если отсутствует ожидаемая менструация; если имел место половой контакт без применения контрацепции, что может привести к беременности; если пациентка нуждается в изменении контрацепции;
- отказаться от грудного вскармливания во время терапии висмодегибом и в течение 24 мес после приема последней дозы.
Рекомендации для мужчин. Висмодегиб проникает в семенную жидкость.
Для предотвращения потенциального воздействия висмодегиба на плод пациент мужского пола должен соблюдать следующие условия:
- понимать, что существует риск тератогенного воздействия висмодегиба на еще не родившегося ребенка при незащищенном половом контакте с беременной женщиной;
- всегда использовать рекомендуемые методы контрацепции;
- сообщить врачу в случае наступления беременности у его партнерши во время его терапии висмодегибом или в течение 2 мес после приема последней дозы.
Рекомендации для медицинских специалистов. Специалист должен обучить пациентов, чтобы они понимали все вышеперечисленные положения программы по предотвращению беременности при терапии висмодегибом.
Контрацепция. Женщины репродуктивного возраста в период лечения и в течение 24 мес после завершения лечения висмодегибом, а также при отсутствии менструаций или их нерегулярности, должны использовать два рекомендуемых метода контрацепции (один высокоэффективный + барьерный).
Мужчины должны всегда использовать презерватив (по возможности со спермицидным средством), даже после вазэктомии, при половом контакте во время терапии висмодегибом и в течение 2 мес после приема последней дозы.
Тест на беременность. Женщины, обладающие репродуктивным потенциалом, в пределах 7 дней до начала терапии и ежемесячно во время проведения терапии должны проводить тест на беременность. Тест на беременность должен обладать чувствительностью как минимум 50 мМЕ/мл и проводиться под руководством медицинского специалиста. При возникновении аменореи во время приема висмодегиба пациентки должны продолжать проводить тест на беременность.
Ограничения в назначении и отпуске висмодегиба женщинам, обладающим репродуктивным потенциалом. Первичное назначение и отпуск висмодегиба должны проходить в течение 7 дней после отрицательного результата на беременность. Рецепт на висмодегиб может быть выписан только на 28 дней лечения, продолжение терапии требует нового назначения препарата врачом.
Влияние на постнатальное развитие. Доклинические данные свидетельствуют о наличии потенциального риска задержки роста и деформации зубов у новорожденных и детей.
Донорство крови. Пациентам не следует сдавать кровь или ее компоненты в период лечения и в течение 24 мес после последнего приема висмодегиба.
RxList.com.
Гибель эмбриона и плода и тяжелые врожденные дефекты.
Из механизма действия висмодегиба следует, что его прием при беременности может причинить вред плоду. До начала лечения висмодегибом следует провести тест на беременность. Пациентов женского и мужского пола необходимо предупреждать о риске гибели эмбриона и плода и тяжелых врожденных дефектах и необходимости контрацепции в период лечения и после его окончания. Следует информировать пациенток о необходимости незамедлительного обращения к лечащему врачу, если они предположили наступление беременности (или для пациентов мужчин - если это предположение сделал их половой партнер). Пациенты женского и мужского пола с репродуктивным потенциалом должны получить консультацию по поводу планирования и предотвращения беременности. Если висмодегиб применяется во время или при возникновении беременности (или для пациентов мужчин - если их половой партнер подвергается такому риску), необходимо информировать пациентов о потенциальном риске для плода.
Донорство крови.
Следует информировать пациентов, что они не должны являться донорами крови или ее компонентов в период приема висмодегиба и по крайней мере в течение 7 мес после приема последней дозы висмодегиба.
Донорство спермы. Донорство спермы запрещено в период лечения и в течение 2 мес после последнего приема висмодегиба.
Влияние на электрокардиографические параметры. Висмодегиб в терапевтической дозе не влияет на корригированный интервал QT (QTc).
Влияние на способность управлять транспортными средствами и механизмами. Прием висмодегиба не влияет на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций с учетом профиля побочных эффектов.
Согласно разработанной компанией-производителем программе по предотвращению беременности при терапии висмодегибом, женщина, обладающая репродуктивным потенциалом, определяется как половозрелая при следующих условиях:
- возраст менее 50 лет;
- наличие менструаций в предыдущие 12 последовательных месяцев;
- отсутствие гистерэктомии или двусторонней овариэктомии или отсутствие медицински подтвержденного стойкого синдрома преждевременного истощения яичников;
- отсутствие XY генотипа, синдрома Тернера или агенезии матки;
- отсутствие менструаций вследствие проведения противоопухолевой терапии.
Рекомендации для женщин, обладающих репродуктивным потенциалом. Висмодегиб противопоказан пациенткам, которые не способны выполнять рекомендации Программы по предотвращению беременности при терапии висмодегибом. Женщина, обладающая репродуктивным потенциалом, должна соблюдать следующие условия:
- понимать, что существует риск тератогенного воздействия висмодегиба на еще не родившегося ребенка;
- не принимать висмодегиб, если она беременная или планирует беременность;
- иметь отрицательный результат достоверного теста на беременность, проведенного под руководством медицинского специалиста в пределах 7 дней до начала терапии висмодегибом и ежемесячно в течение терапии;
- избегать беременности во время терапии висмодегибом и в течение 24 мес после приема последней дозы;
- следовать рекомендациям по использованию эффективных методов контрацепции;
- использовать два рекомендуемых метода контрацепции во время терапии висмодегибом при сохранении половой жизни;
- сообщить врачу, если в период терапии или в течение 24 мес после приема последней дозы висмодегиба наступила беременность или есть подозрение на наступление беременности; если отсутствует ожидаемая менструация; если имел место половой контакт без применения контрацепции, что может привести к беременности; если пациентка нуждается в изменении контрацепции;
- отказаться от грудного вскармливания во время терапии висмодегибом и в течение 24 мес после приема последней дозы.
Рекомендации для мужчин. Висмодегиб проникает в семенную жидкость.
Для предотвращения потенциального воздействия висмодегиба на плод пациент мужского пола должен соблюдать следующие условия:
- понимать, что существует риск тератогенного воздействия висмодегиба на еще не родившегося ребенка при незащищенном половом контакте с беременной женщиной;
- всегда использовать рекомендуемые методы контрацепции;
- сообщить врачу в случае наступления беременности у его партнерши во время его терапии висмодегибом или в течение 2 мес после приема последней дозы.
Рекомендации для медицинских специалистов. Специалист должен обучить пациентов, чтобы они понимали все вышеперечисленные положения программы по предотвращению беременности при терапии висмодегибом.
Контрацепция. Женщины репродуктивного возраста в период лечения и в течение 24 мес после завершения лечения висмодегибом, а также при отсутствии менструаций или их нерегулярности, должны использовать два рекомендуемых метода контрацепции (один высокоэффективный + барьерный).
Мужчины должны всегда использовать презерватив (по возможности со спермицидным средством), даже после вазэктомии, при половом контакте во время терапии висмодегибом и в течение 2 мес после приема последней дозы.
Тест на беременность. Женщины, обладающие репродуктивным потенциалом, в пределах 7 дней до начала терапии и ежемесячно во время проведения терапии должны проводить тест на беременность. Тест на беременность должен обладать чувствительностью как минимум 50 мМЕ/мл и проводиться под руководством медицинского специалиста. При возникновении аменореи во время приема висмодегиба пациентки должны продолжать проводить тест на беременность.
Ограничения в назначении и отпуске висмодегиба женщинам, обладающим репродуктивным потенциалом. Первичное назначение и отпуск висмодегиба должны проходить в течение 7 дней после отрицательного результата на беременность. Рецепт на висмодегиб может быть выписан только на 28 дней лечения, продолжение терапии требует нового назначения препарата врачом.
Влияние на постнатальное развитие. Доклинические данные свидетельствуют о наличии потенциального риска задержки роста и деформации зубов у новорожденных и детей.
Донорство крови. Пациентам не следует сдавать кровь или ее компоненты в период лечения и в течение 24 мес после последнего приема висмодегиба.
RxList.com.
Гибель эмбриона и плода и тяжелые врожденные дефекты.
Из механизма действия висмодегиба следует, что его прием при беременности может причинить вред плоду. До начала лечения висмодегибом следует провести тест на беременность. Пациентов женского и мужского пола необходимо предупреждать о риске гибели эмбриона и плода и тяжелых врожденных дефектах и необходимости контрацепции в период лечения и после его окончания. Следует информировать пациенток о необходимости незамедлительного обращения к лечащему врачу, если они предположили наступление беременности (или для пациентов мужчин - если это предположение сделал их половой партнер). Пациенты женского и мужского пола с репродуктивным потенциалом должны получить консультацию по поводу планирования и предотвращения беременности. Если висмодегиб применяется во время или при возникновении беременности (или для пациентов мужчин - если их половой партнер подвергается такому риску), необходимо информировать пациентов о потенциальном риске для плода.
Донорство крови.
Следует информировать пациентов, что они не должны являться донорами крови или ее компонентов в период приема висмодегиба и по крайней мере в течение 7 мес после приема последней дозы висмодегиба.
Донорство спермы. Донорство спермы запрещено в период лечения и в течение 2 мес после последнего приема висмодегиба.
Влияние на электрокардиографические параметры. Висмодегиб в терапевтической дозе не влияет на корригированный интервал QT (QTc).
Влияние на способность управлять транспортными средствами и механизмами. Прием висмодегиба не влияет на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций с учетом профиля побочных эффектов.
References
Обобщенные материалы www.grls.rosminzdrav.ru, 2013 и www.rxlist.com, 2015.
Included in the composition
- 3112.5€ Erivedge (Patheon Inc. )