Другие названия и синонимы
Telaprevir.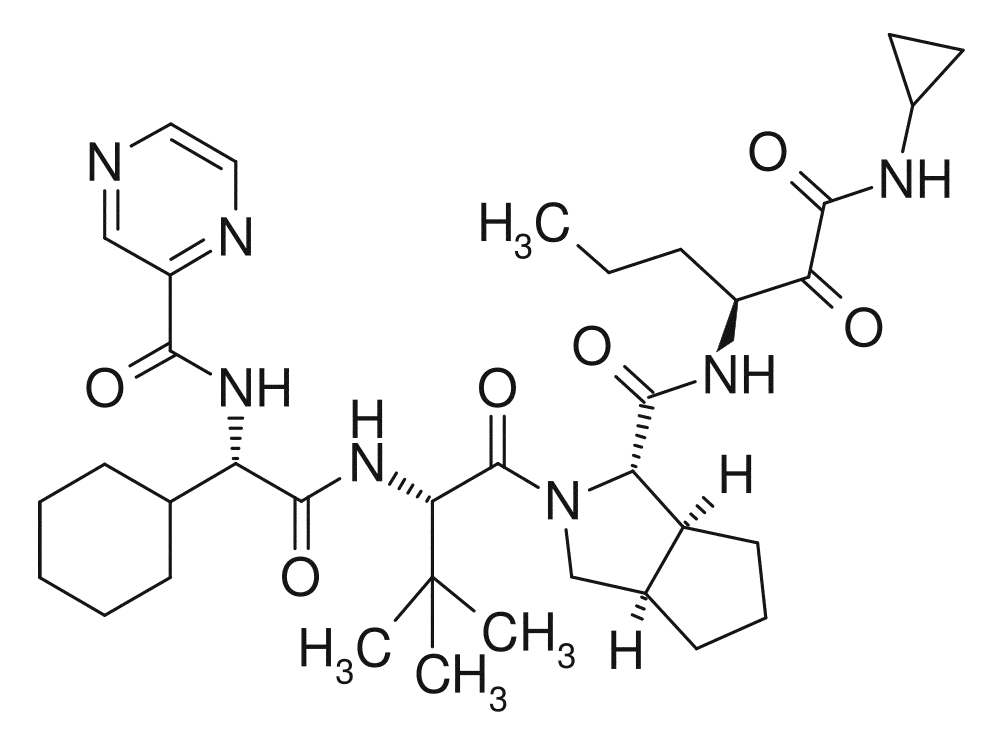
Фармакологическая группа
|
|
Латинское название
Telaprevir* ( ).
Химическое название
(1S,3aR,6aS)-2[(2S)-2-[[(2S)-2-Циклогексил-2-(пиразин-2-карбониламино)ацетил]амино]-3,3-диметилбутаноил]-N-[(3S)-1-(циклопропиламино)-1,2-диоксогексан-3-ил]-3,3a,4,5,6,6a-гексагидро-1H-циклопента[c]пиррол-1-карбоксамид.
Используется в лечении
Код CAS
402957-28-2.
Характеристика вещества
Противовирусное средство.
RxList.com.
Ингибитор NS3/4A протеазы вируса гепатита С. Телапревир - порошок от белого до почти белого цвета, растворимость в воде 0,0047 мг/мл. Молекулярная масса 679,85.
RxList.com.
Ингибитор NS3/4A протеазы вируса гепатита С. Телапревир - порошок от белого до почти белого цвета, растворимость в воде 0,0047 мг/мл. Молекулярная масса 679,85.
Фармакодинамика
Фармакодинамика.
Механизм действия.
Телапревир - ингибитор сериновой NS3/4A протеазы вируса гепатита С, которая необходима для репликации вируса.
Активность телапревира в отношении вируса гепатита С (ВГС) (исследования in vitro).
При использовании метода биологической оценки репликона ВГС подтипа 1В значение 50IC50 по отношению к ВГС дикого типа составило 0,354 мкМ, что было сопоставимо со значением 50IC50 по отношению к вирусу подтипа 1А, которое составило 0,28 мкМ.
Резистентность.
Варианты ВГС, ассоциированные с отсутствием вирусологического ответа на терапию или с возникновением рецидива, были выявлены методом биологической оценки репликона - сайт-направленного мутагенеза. Варианты V36A/M, T54A/S, R155K/T и A156S обеспечивали in vitro >in vitro меньшую резистентность к телапревиру (3-25-кратное увеличение 50IC50 телапревира), а варианты A156V/T и V36M+R155K были ассоциированы с более высоким уровнем резистентности к телапревиру (>25-кратное увеличение 50IC50 телапревира). Варианты репликона, созданные с использованием последовательностей, полученных из материала пациента, продемонстрировали сходные результаты.
In vitro способность к репликации телапревиррезистентных вариантов была меньшей, чем способность к репликации таких вариантов при анализе вируса дикого типа.
Перекрестная резистентность (устойчивость).
Резистентные к телапревиру варианты были проанализированы на предмет перекрестной резистентности к представителям класса ингибиторов протеазы в системе репликона ВГС. Репликоны с единичными заменами в позиции 155 или 156 и двойными вариантами с заменами в остатках 36 и 155 продемонстрировали перекрестную резистентность ко всем использованным в эксперименте ингибиторам протеазы с широким диапазоном чувствительности. Все изученные резистентные к телапревиру варианты оставались полностью чувствительными к интерферону альфа, рибавирину и нуклеозидным и ненуклеозидным ингибиторам полимеразы ВГС в системе репликона. Отсутствуют клинические данные о повторной терапии пациентов, у которых отмечалась неэффективность терапии на основе ингибитора протеазы NS3/4A ВГС, такого как телапревир, а также на данный момент нет клинических данных, свидетельствующих о целесообразности повторного проведения курса терапии телапревиром.
RxList.com.
Оценка ЭКГ. Эффект телапревира в дозе 750 и 1875 мг на интервал QTc был оценен в исчерпывающем клиническом испытании интервала QT (двойное слепое, с двойной имитацией, рандомизированное плацебо- и актив-контролируемое (моксифлоксацин 400 мг) перекрестное исследование с четырьмя периодами) у 44 людей. В исследовании с доказанной способностью обнаруживать малые эффекты верхняя граница одностороннего 95% ДИ для наибольшего плацебо-скорректированного корригированного интервала QTc при коррекции по формуле Fridericia (QTcF) была ниже порогового значения 10 мс. Доза 1875 мг достаточна для представления клинического сценария высокой экспозиции.
Механизм действия.
Телапревир - ингибитор сериновой NS3/4A протеазы вируса гепатита С, которая необходима для репликации вируса.
Активность телапревира в отношении вируса гепатита С (ВГС) (исследования in vitro).
При использовании метода биологической оценки репликона ВГС подтипа 1В значение 50IC50 по отношению к ВГС дикого типа составило 0,354 мкМ, что было сопоставимо со значением 50IC50 по отношению к вирусу подтипа 1А, которое составило 0,28 мкМ.
Резистентность.
Варианты ВГС, ассоциированные с отсутствием вирусологического ответа на терапию или с возникновением рецидива, были выявлены методом биологической оценки репликона - сайт-направленного мутагенеза. Варианты V36A/M, T54A/S, R155K/T и A156S обеспечивали in vitro >in vitro меньшую резистентность к телапревиру (3-25-кратное увеличение 50IC50 телапревира), а варианты A156V/T и V36M+R155K были ассоциированы с более высоким уровнем резистентности к телапревиру (>25-кратное увеличение 50IC50 телапревира). Варианты репликона, созданные с использованием последовательностей, полученных из материала пациента, продемонстрировали сходные результаты.
In vitro способность к репликации телапревиррезистентных вариантов была меньшей, чем способность к репликации таких вариантов при анализе вируса дикого типа.
Перекрестная резистентность (устойчивость).
Резистентные к телапревиру варианты были проанализированы на предмет перекрестной резистентности к представителям класса ингибиторов протеазы в системе репликона ВГС. Репликоны с единичными заменами в позиции 155 или 156 и двойными вариантами с заменами в остатках 36 и 155 продемонстрировали перекрестную резистентность ко всем использованным в эксперименте ингибиторам протеазы с широким диапазоном чувствительности. Все изученные резистентные к телапревиру варианты оставались полностью чувствительными к интерферону альфа, рибавирину и нуклеозидным и ненуклеозидным ингибиторам полимеразы ВГС в системе репликона. Отсутствуют клинические данные о повторной терапии пациентов, у которых отмечалась неэффективность терапии на основе ингибитора протеазы NS3/4A ВГС, такого как телапревир, а также на данный момент нет клинических данных, свидетельствующих о целесообразности повторного проведения курса терапии телапревиром.
RxList.com.
Оценка ЭКГ. Эффект телапревира в дозе 750 и 1875 мг на интервал QTc был оценен в исчерпывающем клиническом испытании интервала QT (двойное слепое, с двойной имитацией, рандомизированное плацебо- и актив-контролируемое (моксифлоксацин 400 мг) перекрестное исследование с четырьмя периодами) у 44 людей. В исследовании с доказанной способностью обнаруживать малые эффекты верхняя граница одностороннего 95% ДИ для наибольшего плацебо-скорректированного корригированного интервала QTc при коррекции по формуле Fridericia (QTcF) была ниже порогового значения 10 мс. Доза 1875 мг достаточна для представления клинического сценария высокой экспозиции.
Фармакокинетика
Фармакокинетика телапревира изучалась у здоровых взрослых добровольцев и пациентов с хронической инфекцией вирусом гепатита С. Телапревир назначался внутрь во время еды в дозировке 3 табл. по 375 мг (1125 мг суммарно) два раза в день в течение 12 нед, в комбинации с пэгинтерфероном альфа и рибавирином. Концентрации телапревира в крови были выше при одновременном приеме с пэгинтерфероном альфа и рибавирином, чем при приеме только телапревира. Концентрации телапревира были одинаковы как при одновременном приеме с пэгинтерфероном альфа-2а и рибавирином, так и одновременном приеме с пэгинтерфероном альфа-2b и рибавирином.
Всасывание.
При приеме внутрь телапревир, вероятнее всего, всасывается в тонком кишечнике. Данные о всасывании в толстом кишечнике отсутствуют. maxCmax телапревира в плазме достигается через 4-5 Исследования in vitro >in vitro на клетках человека Сасо-2 показали, что телапревир является субстратом Р-gp.
AUC0-24 телапревира в равновесном состоянии была одинаковой, независимо от того, принималась ли суточная доза 2250 мг в три (по 750 мг каждые 8 ч) или два (по 1250 мг 2 раза в день) приема. Концентрация телапревира увеличивалась на 20% при одновременном приеме с высококалорийной пищей с высоким содержанием жиров (56 г жиров, 928 ккал) по сравнению с одновременным приемом пищи стандартной калорийности (21 г жиров, 561 ккал).
Телапревир следует принимать во время еды, при приеме телапревира натощак AUC уменьшалась на 73%, на 26% - при одновременном приеме с низкокалорийной пищей с высоким содержанием белка (9 г жиров, 260 ккал) и на 39% - при одновременном приеме с низкокалорийной пищей с низким содержанием жиров (3,6 г жиров, 249 ккал) по сравнению с одновременным приемом пищи нормальной калорийности.
Распределение.
Телапревир на 59-76% связывается с белками плазмы, в основном с альфа1-кислым гликопротеином и альбумином. После приема внутрь кажущийся dVd составляет 252 л с индивидуальной вариабельностью 72,2%.
Метаболизм.
Телапревир подвергается интенсивному метаболизму в печени путем гидролиза, окисления и восстановления. Его многочисленные метаболиты обнаруживались в кале, плазме крови и моче. При повторном приеме внутрь основными метаболитами телапревира считаются R-диастереомер телапревира, который в 30 раз менее активен по сравнению с телапревиром, пиразиновая кислота и восстановленный по альфа-кетоамидной связи неактивный метаболит телапревира.
Исследования in vitro >in vitro с использованием изоформ рекомбинантного человеческого цитохрома Р450 (CYP) показали, что изофермент сYP3A4 является основной изоформой сYP, ответственной за сYP-опосредованный метаболизм телапревира.
Исследования in vitro >in vitro с использованием рекомбинантных альдокеторедуктаз показали, что эти и, возможно, другие редуктазы также ответственны за метаболизм телапревира. Другие протеолитические ферменты также участвуют в гидролизе телапревира. Исследования с использованием рекомбинантных человеческих изоферментных систем сYP показали, что телапревир является ингибитором изофермента сYP3A4. Свидетельств ингибирования телапревиром изоферментов сYP1A2, сYP2C9, сYP2C19 и сYP2D6 in vitro >in vitro нет. In vitro не обнаружена индукция телапревиром изоферментов сYP1A2, сYP2B6, сYP2C и сYP3A. Тем не менее, основываясь на результатах клинических исследований лекарственных взаимодействий, индукция метаболических ферментов телапревиром не может быть исключена.
Исследования in vitro >in vitro показали, что телапревир не является ингибитором UGT1A9 или UGT2B7. Исследования in vitro >in vitro рекомбинантного UGT1A3 показали, что телапревир может ингибировать этот фермент. Клиническое значение этого явления неясно, одновременный прием телапревира с одной дозой бупренорфина, частичного субстрата UGT1A3, здоровыми взрослыми добровольцами не приводил к увеличению системного воздействия бупренорфина. In vitro не обнаружено ингибирования телапревиром алкогольдегидрогеназы.
Транспортные белки. Согласно данным исследований in vitro >in vitro, телапревир является ингибитором полипептидных переносчиков органических анионов - ОАТР1В1 и ОАТР2В1.
In vitro не наблюдалось ингибирования телапревиром переносчиков органических катионов (OCT) ОСТ2, или переносчиков органических анионов (OAT) ОАТ1.
Телапревир является слабым in vitro >in vitro ингибитором белков-переносчиков семейства MATE (multidrug and toxin extrusion) MATE1 и MATE2K, отвечающих за множественную лекарственную устойчивость и выведение токсинов из клетки, с 50IC50 28,3 и 32,5 мкМ соответственно. Клиническая значимость данного эффекта в настоящее время неизвестна.
Выведение.
После приема внутрь однократной дозы 750 мг 14С-меченного телапревира у здоровых добровольцев 90% общей радиоактивности было обнаружено в кале, моче и в выдыхаемом воздухе в течение 96 Среднее значение введенной радиоактивной дозы, обнаруженной в кале, составляет 82%, в выдыхаемом воздухе - 9% и в моче - 1%. Соотношение неизмененного 14С-меченного телапревира и VRT-127394 в радиоактивности, обнаруженной в кале, составляет 31,8 и 18,7% соответственно.
После приема внутрь кажущийся общий клиренс составляет 32,4 л с индивидуальной вариабельностью 27,2%. Средний 1/2T1/2 после приема внутрь однократной дозы 750 мг телапревира составляет 4-4,7.
Линейность.
Концентрация телапревира увеличивается более чем пропорционально дозе после однократного приема внутрь доз в диапазоне от 375 до 1875 мг во время еды, возможно, по причине насыщения метаболических путей или выхода транспортных белков.
Особые группы пациентов.
Дети. В настоящий момент данных о применении телапревира у детей и подростков до 18 лет нет.
Нарушение функции почек. Фармакокинетику телапревира изучали у ВГС-негативных добровольцев с тяжелым нарушением функции почек (Cl креатинина менее 30 мл/мин) после приема разовой дозы 750 мг. Средние значения Сmах и AUC телапревира были выше на 10 и 21% соответственно по сравнению с этими же показателями у здоровых добровольцев.
Нарушение функции печени. Телапревир в основном метаболизируется в печени. ssCss телапревира уменьшается на 15% у больных с легким нарушением функции печени (класс А, 5-6 баллов по шкале Чайлд-Пью) по сравнению со здоровыми добровольцами.
Css телапревира уменьшается на 46% у больных с нарушением функции печени средней степени тяжести (класс В, 7-9 баллов по шкале Чайлд-Пью) по сравнению со здоровыми добровольцами.
Пол. Коррекция дозы в зависимости от пола пациента не требуется.
Раса. Данные фармакокинетического анализа показали, что раса не влияет на концентрацию телапревира в крови.
Пожилые пациенты. В настоящее время недостаточно данных об эффективности и безопасности применения телапревира у пациентов старше 65 лет.
RxList.com.
Применение в гериатрии. Популяционный фармакокинетический анализ у инфицированных вирусом гепатита С пациентов показал, что в исследованной возрастной группе (19-70 лет, 35 пациентов в возрасте 65 лет и старше) возраст не имел клинически значимого эффекта на экспозицию телапревира.
Всасывание.
При приеме внутрь телапревир, вероятнее всего, всасывается в тонком кишечнике. Данные о всасывании в толстом кишечнике отсутствуют. maxCmax телапревира в плазме достигается через 4-5 Исследования in vitro >in vitro на клетках человека Сасо-2 показали, что телапревир является субстратом Р-gp.
AUC0-24 телапревира в равновесном состоянии была одинаковой, независимо от того, принималась ли суточная доза 2250 мг в три (по 750 мг каждые 8 ч) или два (по 1250 мг 2 раза в день) приема. Концентрация телапревира увеличивалась на 20% при одновременном приеме с высококалорийной пищей с высоким содержанием жиров (56 г жиров, 928 ккал) по сравнению с одновременным приемом пищи стандартной калорийности (21 г жиров, 561 ккал).
Телапревир следует принимать во время еды, при приеме телапревира натощак AUC уменьшалась на 73%, на 26% - при одновременном приеме с низкокалорийной пищей с высоким содержанием белка (9 г жиров, 260 ккал) и на 39% - при одновременном приеме с низкокалорийной пищей с низким содержанием жиров (3,6 г жиров, 249 ккал) по сравнению с одновременным приемом пищи нормальной калорийности.
Распределение.
Телапревир на 59-76% связывается с белками плазмы, в основном с альфа1-кислым гликопротеином и альбумином. После приема внутрь кажущийся dVd составляет 252 л с индивидуальной вариабельностью 72,2%.
Метаболизм.
Телапревир подвергается интенсивному метаболизму в печени путем гидролиза, окисления и восстановления. Его многочисленные метаболиты обнаруживались в кале, плазме крови и моче. При повторном приеме внутрь основными метаболитами телапревира считаются R-диастереомер телапревира, который в 30 раз менее активен по сравнению с телапревиром, пиразиновая кислота и восстановленный по альфа-кетоамидной связи неактивный метаболит телапревира.
Исследования in vitro >in vitro с использованием изоформ рекомбинантного человеческого цитохрома Р450 (CYP) показали, что изофермент сYP3A4 является основной изоформой сYP, ответственной за сYP-опосредованный метаболизм телапревира.
Исследования in vitro >in vitro с использованием рекомбинантных альдокеторедуктаз показали, что эти и, возможно, другие редуктазы также ответственны за метаболизм телапревира. Другие протеолитические ферменты также участвуют в гидролизе телапревира. Исследования с использованием рекомбинантных человеческих изоферментных систем сYP показали, что телапревир является ингибитором изофермента сYP3A4. Свидетельств ингибирования телапревиром изоферментов сYP1A2, сYP2C9, сYP2C19 и сYP2D6 in vitro >in vitro нет. In vitro не обнаружена индукция телапревиром изоферментов сYP1A2, сYP2B6, сYP2C и сYP3A. Тем не менее, основываясь на результатах клинических исследований лекарственных взаимодействий, индукция метаболических ферментов телапревиром не может быть исключена.
Исследования in vitro >in vitro показали, что телапревир не является ингибитором UGT1A9 или UGT2B7. Исследования in vitro >in vitro рекомбинантного UGT1A3 показали, что телапревир может ингибировать этот фермент. Клиническое значение этого явления неясно, одновременный прием телапревира с одной дозой бупренорфина, частичного субстрата UGT1A3, здоровыми взрослыми добровольцами не приводил к увеличению системного воздействия бупренорфина. In vitro не обнаружено ингибирования телапревиром алкогольдегидрогеназы.
Транспортные белки. Согласно данным исследований in vitro >in vitro, телапревир является ингибитором полипептидных переносчиков органических анионов - ОАТР1В1 и ОАТР2В1.
In vitro не наблюдалось ингибирования телапревиром переносчиков органических катионов (OCT) ОСТ2, или переносчиков органических анионов (OAT) ОАТ1.
Телапревир является слабым in vitro >in vitro ингибитором белков-переносчиков семейства MATE (multidrug and toxin extrusion) MATE1 и MATE2K, отвечающих за множественную лекарственную устойчивость и выведение токсинов из клетки, с 50IC50 28,3 и 32,5 мкМ соответственно. Клиническая значимость данного эффекта в настоящее время неизвестна.
Выведение.
После приема внутрь однократной дозы 750 мг 14С-меченного телапревира у здоровых добровольцев 90% общей радиоактивности было обнаружено в кале, моче и в выдыхаемом воздухе в течение 96 Среднее значение введенной радиоактивной дозы, обнаруженной в кале, составляет 82%, в выдыхаемом воздухе - 9% и в моче - 1%. Соотношение неизмененного 14С-меченного телапревира и VRT-127394 в радиоактивности, обнаруженной в кале, составляет 31,8 и 18,7% соответственно.
После приема внутрь кажущийся общий клиренс составляет 32,4 л с индивидуальной вариабельностью 27,2%. Средний 1/2T1/2 после приема внутрь однократной дозы 750 мг телапревира составляет 4-4,7.
Линейность.
Концентрация телапревира увеличивается более чем пропорционально дозе после однократного приема внутрь доз в диапазоне от 375 до 1875 мг во время еды, возможно, по причине насыщения метаболических путей или выхода транспортных белков.
Особые группы пациентов.
Дети. В настоящий момент данных о применении телапревира у детей и подростков до 18 лет нет.
Нарушение функции почек. Фармакокинетику телапревира изучали у ВГС-негативных добровольцев с тяжелым нарушением функции почек (Cl креатинина менее 30 мл/мин) после приема разовой дозы 750 мг. Средние значения Сmах и AUC телапревира были выше на 10 и 21% соответственно по сравнению с этими же показателями у здоровых добровольцев.
Нарушение функции печени. Телапревир в основном метаболизируется в печени. ssCss телапревира уменьшается на 15% у больных с легким нарушением функции печени (класс А, 5-6 баллов по шкале Чайлд-Пью) по сравнению со здоровыми добровольцами.
Css телапревира уменьшается на 46% у больных с нарушением функции печени средней степени тяжести (класс В, 7-9 баллов по шкале Чайлд-Пью) по сравнению со здоровыми добровольцами.
Пол. Коррекция дозы в зависимости от пола пациента не требуется.
Раса. Данные фармакокинетического анализа показали, что раса не влияет на концентрацию телапревира в крови.
Пожилые пациенты. В настоящее время недостаточно данных об эффективности и безопасности применения телапревира у пациентов старше 65 лет.
RxList.com.
Применение в гериатрии. Популяционный фармакокинетический анализ у инфицированных вирусом гепатита С пациентов показал, что в исследованной возрастной группе (19-70 лет, 35 пациентов в возрасте 65 лет и старше) возраст не имел клинически значимого эффекта на экспозицию телапревира.
|
|
Показания к применению
Лечение хронического гепатита С генотипа 1 у взрослых пациентов с компенсированным заболеванием печени (включая цирроз печени) в комбинации с пэгинтерфероном альфа и рибавирином: ранее не получавших противовирусную терапию против вируса гепатита С. ранее получавших интерферон альфа (обычный или пэгинтерферон) изолированно или в комбинации с рибавирином. в тч имеющих предшествующий рецидив или частичный ответ на терапию или не имевших ответа на терапию.
Телапревир нельзя применять в качестве монотерапии или только с пэгинтерфероном альфа или только с рибавирином.
Телапревир нельзя применять в качестве монотерапии или только с пэгинтерфероном альфа или только с рибавирином.
Противопоказания
Гиперчувствительность. безопасность и эффективность телапревира у пациентов до 18 и старше 65 лет в настоящее время не установлена. поэтому телапревир не следует применять у данных групп пациентов. пока не будут получены дополнительные данные. телапревир нельзя принимать одновременно с ЛС. клиренс которых зависит от активности изофермента сYP3A и повышение концентрации в плазме крови которых сопровождается серьезными и/или угрожающими жизни явлениями ( имеющих узкий терапевтический индекс). телапревир нельзя принимать одновременно с антиаритмическими средствами IА. IС или III класса. за исключением лидокаина для в/в введения. телапревир нельзя принимать одновременно с ЛС. активирующими изофермент сYP3A. это может сопровождаться потерей эффекта телапревира.
ЛС, которые нельзя применять одновременно с телапревиром, перечислены ниже ( см также «Взаимодействие»).
ЛС. которые нельзя применять одновременно с телапревиром: блокаторы α1-адренорецепторов (алфузозин). антиаритмические средства IА. IС и III классов (амиодарон. бепридил. флекаинид. пропафенон. хинидин). антигистаминные средства (астемизол. терфенадин). противосудорожные средства (карбамазепин. фенобарбитал. фенитоин). противотуберкулезные средства (рифампицин). производные алкалоидов спорыньи (дигидроэрготамин. эргоновин. эрготамин. метилэргоновин). средства. влияющие на моторику ЖКТ (цизаприд). растительные ЛС (ЛС на основе зверобоя продырявленного (Hypericum perforatum). ингибиторы ГМГ-КоА редуктазы (ловастатин. симвастатин. аторвастатин). нейролептики (пимозид). ингибиторы ФДЭ-5 - силденафил. тадалафил (только при применении для лечения легочной гипертензии). седативные/снотворные средства (пероральный мидазолам. триазолам).
ЛС, которые нельзя применять одновременно с телапревиром, перечислены ниже ( см также «Взаимодействие»).
ЛС. которые нельзя применять одновременно с телапревиром: блокаторы α1-адренорецепторов (алфузозин). антиаритмические средства IА. IС и III классов (амиодарон. бепридил. флекаинид. пропафенон. хинидин). антигистаминные средства (астемизол. терфенадин). противосудорожные средства (карбамазепин. фенобарбитал. фенитоин). противотуберкулезные средства (рифампицин). производные алкалоидов спорыньи (дигидроэрготамин. эргоновин. эрготамин. метилэргоновин). средства. влияющие на моторику ЖКТ (цизаприд). растительные ЛС (ЛС на основе зверобоя продырявленного (Hypericum perforatum). ингибиторы ГМГ-КоА редуктазы (ловастатин. симвастатин. аторвастатин). нейролептики (пимозид). ингибиторы ФДЭ-5 - силденафил. тадалафил (только при применении для лечения легочной гипертензии). седативные/снотворные средства (пероральный мидазолам. триазолам).
Ограничения к использованию
Телапревир должен применяться с осторожностью в следующих случаях.
1. При удлинении интервала QT:
- врожденное удлинение интервала QT;
- приобретенное удлинение интервала QT в анамнезе;
- клинически значимая брадикардия (стойкая ЧСС менее 50 уд./мин);
- сердечная недостаточность со снижением фракции выброса левого желудочка в анамнезе;
- применение ЛС, которые способны удлинять интервал QT, но метаболизм которых незначительно зависит от изофермента сYP3A4 (например метадон).
2. При наличии электролитных нарушений (гипокалиемия, гипомагниемия).
3. При одновременном приеме с субстратами полипептидных переносчиков органических анионов (например флувастатин, правастатин, розувастатин, репаглинид).
1. При удлинении интервала QT:
- врожденное удлинение интервала QT;
- приобретенное удлинение интервала QT в анамнезе;
- клинически значимая брадикардия (стойкая ЧСС менее 50 уд./мин);
- сердечная недостаточность со снижением фракции выброса левого желудочка в анамнезе;
- применение ЛС, которые способны удлинять интервал QT, но метаболизм которых незначительно зависит от изофермента сYP3A4 (например метадон).
2. При наличии электролитных нарушений (гипокалиемия, гипомагниемия).
3. При одновременном приеме с субстратами полипептидных переносчиков органических анионов (например флувастатин, правастатин, розувастатин, репаглинид).
При беременности и кормлении грудью
Телапревир не оказывает тератогенное действие у крыс и мышей и не считается токсичным для развивающегося потомства этих видов животных.
Неизвестно, выводится ли телапревир с грудным молоком женщин. Из-за возможного неблагоприятного воздействия телапревира на грудных детей до начала лечения следует прекратить кормление грудью.
RxList.com.
Категория действия на плод по FDA - в.
Категория действия на плод по FDA - X (в комбинации с пэгинтерфероном альфа и рибавирином).
Неизвестно, выводится ли телапревир с грудным молоком женщин. Из-за возможного неблагоприятного воздействия телапревира на грудных детей до начала лечения следует прекратить кормление грудью.
RxList.com.
Категория действия на плод по FDA - в.
Категория действия на плод по FDA - X (в комбинации с пэгинтерфероном альфа и рибавирином).
Побочные эффекты
При приеме телапревира следующие нежелательные реакции возникали с частотой ≥1%: анемия (≥5%). сыпь (≥5%). тромбоцитопения. лимфопения. зуд (≥5%). тошнота (≥5%). диарея (≥5%).
Данные о безопасности применения телапревира. полученные из клинических исследований. систематизированы относительно каждой из систем органов. в зависимости от частоты встречаемости. с использованием следующей классификации: очень часто (≥1/10). часто (≥1/100. <1/10). нечасто (≥1/1000. <1/100). редко (≥1/10000. <1/1000). очень редко (менее 1/10000).
Инфекции и паразитарные заболевания. Часто - кандидоз ротовой полости.
Со стороны крови и лимфатической системы. Очень часто - анемия.
Со стороны иммунной системы. Нечасто - крапивница; редко - синдром Стивенса-Джонсона.
Со стороны эндокринной системы. Часто - гипотиреоз.
Со стороны обмена веществ и питания. Нечасто - подагра.
Со стороны нервной системы. Часто - обморок.
Со стороны органов зрения. Нечасто - ретинопатия.
Со стороны ЖКТ. Очень часто - тошнота. диарея. рвота. геморрой. прокталгия. часто - извращение вкуса. ректальное кровотечение. анальная трещина. аноректальный зуд. нечасто - проктит.
Со стороны кожи и подкожных тканей. Очень часто - зуд. сыпь. часто - экзема. отек лица. эксфолиативная сыпь. нечасто - лекарственная сыпь с эозинофилией и системными (DRESS-) симптомами.
Общие расстройства. Нечасто - периферический отек.
Со стороны лабораторных показателей. Часто - гипербилирубинемия. тромбоцитопения. лимфопения. гиперурикемия. гиперкалиемия. снижение концентрации Hb в крови. снижение количества лейкоцитов в крови. увеличение концентрации ЛПНП. увеличение концентрации общего холестерина. нечасто - увеличение концентрации креатинина в крови.
Следует отметить, что к 24-й нед лечения большинство лабораторных показателей возвращались к значениям, сопоставимым с таковыми при терапии только пэгинтерфероном альфа и рибавирином. Исключение составлял показатель числа тромбоцитов, который оставался ниже значения, наблюдаемого при терапии только пэгинтерфероном альфа и рибавирином, вплоть до 48 нед комбинированной терапии.
Увеличение концентрации мочевой кислоты в плазме крови очень часто отмечалось во время терапии комбинацией телапревира, пэгинтерферона альфа и рибавирина. Концентрация мочевой кислоты обычно уменьшалась в течение следующих 8 нед и была сопоставима со значениями, которые наблюдались у пациентов, получающих лечение только пэгинтерфероном альфа и рибавирином.
Было показано, что профиль безопасности телапревира одинаков как при приеме по 1125 мг (3 табл. по 375 мг) 2 раза в день, так и при приеме по 750 мг (2 табл. по 375 мг) каждые 8.
Сыпь. Случаи возникновения сыпи чаще наблюдались у пациентов, принимавших телапревир с пэгинтерфероном альфа и рибавирином, чем у пациентов, принимающих только пэгинтерферон альфа и рибавирин. В 90% случаев наблюдалась сыпь легкой или средней степени тяжести, при которой не требовалась отмена телапревира. Обычно на фоне приема телапревира имела место экзематозная сыпь с зудом, захватывающая менее 30% поверхности тела. Некоторые случаи сыпи были описаны как макулопапулезная или эритематозная. Более половины случаев нежелательных кожных реакций обнаруживались в течение первых 4 нед терапии, однако сыпь могла появляться в любой период приема комбинированной терапии.
По мониторингу сыпи и правилам отмены телапревира, рибавирина и пэгинтерферона альфа - см «Меры предосторожности». Пациенты с сыпью легкой и средней степени тяжести должны наблюдаться на предмет прогрессирования выраженности кожных симптомов; однако прогрессирование наблюдается редко (менее чем в 10% случаев). Для коррекции нежелательных кожных реакций рекомендуется назначение антигистаминных ЛС и местных ГКС. Разрешение сыпи наблюдалось после прекращения приема телапревира. Однако в некоторых случаях для этого могло потребоваться несколько недель.
Анемия. Снижение концентрации Hb было сильнее и чаще наблюдалось у пациентов, принимающих телапревир в комбинации с пэгинтерфероном альфа и рибавирином, чем у пациентов, принимающих только пэгинтерферон альфа и рибавирин. Анемия тяжелой степени отмечалась у 2-3% пациентов, получавших телапревир.
Аноректальный синдром. Большинство описанных случаев возникновения аноректального синдрома (геморрой. аноректальный дискомфорт. аноректальный зуд и аноректальное жжение) были легкой или средней степени тяжести. очень редко приводили к отмене ЛС и. как правило. проходили после завершения комбинированной терапии.
RxList.com.
Аноректальный синдром. В контролируемых клинических испытаниях у 29% пациентов. получавших комбинированное лечение с телапревиром. возникал аноректальный синдром. по сравнению с 7% пациентов. получавших только пэгинтерферон альфа и рибавирин. Большинство из этих случаев (например геморрой. аноректальный дискомфорт. анальный зуд и ректальное жжение) были от легкой до умеренной степени тяжести. менее чем 1% пациентов прекратили лечение. и все симптомы разрешились во время или после окончания приема телапревира.
Нежелательные побочные реакции, выявленные в ходе пострегистрационного применения комбинации телапревира, пэгинтерферона альфа и рибавирина.
Нижеперечисленные нежелательные побочные реакции были выявлены в ходе пострегистрационного применения комбинации телапревира, пэгинтерферона альфа и рибавирина. Частота встречаемости данных нежелательных реакций и их связь с приемом ЛС не установлена, поскольку информация о данных нежелательных побочных реакциях получена из спонтанных сообщений.
Со стороны кожи и подкожных тканей. Частота не установлена - полиморфная экссудативная эритема, токсический эпидермальный некролиз.
Со стороны выделительной системы. Частота не установлена - преренальная азотемия с острой почечной недостаточностью или без нее, мочекислая нефропатия.
RxList.com.
Опыт клинических исследований.
Поскольку клинические исследования проводятся с различным набором условий. частота встречаемости побочных реакций. наблюдаемых в этих исследованиях. не может непосредственно сравниваться с частотой в других клинических испытаниях и прогнозировать возникновение побочных эффектов в клинической практике.
Оценка безопасности основана на объединенных данных адекватных и хорошо контролируемых клинических испытаний. включающих 1797 пациентов. получавших телапревир при комбинированном лечении. и 493 пациента. которые получали пэгинтерферон альфа и рибавирин.
Серьезные побочные реакции отмечены у 3% пациентов, получавших комбинированное лечение с телапревиром, по сравнению с отсутствием таких реакций у пациентов, получавших пэгинтерферон альфа и рибавирин. Наиболее частыми серьезными побочными реакциями у пациентов, получавших комбинированное лечение с телапревиром, были кожные заболевания (сыпь и/или зуд) и анемия ( см «Меры предосторожности»). Прекратили лечение телапревиром из-за неблагоприятных реакций 14% испытуемых. Сыпь. анемия. утомляемость. зуд. тошнота и рвота были наиболее частыми побочными лекарственными реакциями. ведущими к прекращению приема телапревира.
Телапревир применяли в комбинации с пэгинтерфероном альфа и рибавирином (N=1797). Ниже перечислены побочные реакции. которые отмечались у пациентов. получавших телапревир. с частотой по крайней мере на 5% выше. чем у пациентов. получавших только пэгинтерферон альфа и рибавирин (N=493).
Клинические побочные лекарственные реакции, наблюдавшиеся с частотой по крайней мере на 5% выше при комбинированном лечении с телапревиром.
Телапревир. пэгинтерферон альфа и рибавирин (комбинированное лечение. N=1797). через запятую - пэгинтерферон альфа и рибавирин (N=493): сыпь1 - 56. 34%. утомляемость - 56. 50%. зуд - 47. 28%. тошнота - 39. 28%. анемия1 - 36. 17%. диарея - 26. 17%. рвота - 13. 8%. геморрой - 12. 3%. аноректальный дискомфорт - 11. 3%. извращение вкуса - 10. 3%. анальный зуд - 6. 1%.
1 сыпь и анемия в соответствии с SSC (Специальные поисковые категории) группировочных терминов.
Описание отдельных побочных реакций.
Лабораторные показатели.
Лейкоциты. Лечение пэгинтерфероном альфа ассоциировано с уменьшением среднего значения общего числа лейкоцитов, абсолютного числа нейтрофилов и абсолютного числа лимфоцитов. У большого числа пациентов, получавших терапию с телапревиром, было снижено число лимфоцитов до 499/мм3 или менее (15 по сравнению с 5%). Уменьшение общего числа лейкоцитов до 1499 мм3 или менее было сопоставимо (8 по сравнению с 5%). Частота снижения абсолютного числа нейтрофилов до 749/мм3 и меньше у пациентов. получавших только пэгинтерферон альфа и рибавирин. составила 15 по сравнению с 12% у пациентов. получавших комбинированное лечение с телапревиром.
Тромбоциты. Лечение с пэгинтерфероном альфа связано с уменьшением среднего количества тромбоцитов. У большого количества пациентов при комбинированной терапии с телапревиром отмечалось снижение числа тромбоцитов всех степеней: 47 по сравнению с 36%, получавших только пэгинтерферон альфа и рибавирин. У 3% пациентов при комбинированном лечении с телапревиром отмечалось снижение до 49999/мм3 или меньше по сравнению с 1% пациентов, получавших только пэгинтерферон альфа и рибавирин.
Билирубин. У 41% пациентов. получавших телапревир. по сравнению с 28% пациентов. применявших только пэгинтерферон альфа и рибавирин. было отмечено повышение уровня билирубина всех степеней. у 4 и 2% пациентов соответственно уровень превышал ВГН в 2,6 раза. Уровень билирубина повышался наиболее резко в течение первых 1-2 нед приема телапревира, затем стабилизировался и между 12-16 нед возвращался к исходному.
Мочевая кислота. В течение всего периода комбинированного лечения с телапревиром 73% пациентов имели повышенные уровни мочевой кислоты по сравнению с 29% пациентов, получавших только пэгинтерферон альфа и рибавирин. Изменения уровня мочевой кислоты больше или равные 12,1 мг/дл от исходного уровня были также более часто среди пациентов. получавших телапревир (7%). по сравнению с пациентами. получавшими только пэгинтерферон альфа и рибавирин (1%). Менее чем у 1% пациентов отмечались клинически выраженные подагра/подагрический артрит; ни один из случаев не был серьезным и не привел к прекращению лечения.
Дополнительные данные клинических исследований.
При анализе дополнительного исследования (Trial с211) профиль безопасности комбинированной терапии с телапревиром в дозе 1125 мг дважды в день был сходен с профилем безопасности у пациентов. получавших комбинированное лечение с телапревиром в дозе 750 мг каждые 8.
Данные о безопасности применения телапревира. полученные из клинических исследований. систематизированы относительно каждой из систем органов. в зависимости от частоты встречаемости. с использованием следующей классификации: очень часто (≥1/10). часто (≥1/100. <1/10). нечасто (≥1/1000. <1/100). редко (≥1/10000. <1/1000). очень редко (менее 1/10000).
Инфекции и паразитарные заболевания. Часто - кандидоз ротовой полости.
Со стороны крови и лимфатической системы. Очень часто - анемия.
Со стороны иммунной системы. Нечасто - крапивница; редко - синдром Стивенса-Джонсона.
Со стороны эндокринной системы. Часто - гипотиреоз.
Со стороны обмена веществ и питания. Нечасто - подагра.
Со стороны нервной системы. Часто - обморок.
Со стороны органов зрения. Нечасто - ретинопатия.
Со стороны ЖКТ. Очень часто - тошнота. диарея. рвота. геморрой. прокталгия. часто - извращение вкуса. ректальное кровотечение. анальная трещина. аноректальный зуд. нечасто - проктит.
Со стороны кожи и подкожных тканей. Очень часто - зуд. сыпь. часто - экзема. отек лица. эксфолиативная сыпь. нечасто - лекарственная сыпь с эозинофилией и системными (DRESS-) симптомами.
Общие расстройства. Нечасто - периферический отек.
Со стороны лабораторных показателей. Часто - гипербилирубинемия. тромбоцитопения. лимфопения. гиперурикемия. гиперкалиемия. снижение концентрации Hb в крови. снижение количества лейкоцитов в крови. увеличение концентрации ЛПНП. увеличение концентрации общего холестерина. нечасто - увеличение концентрации креатинина в крови.
Следует отметить, что к 24-й нед лечения большинство лабораторных показателей возвращались к значениям, сопоставимым с таковыми при терапии только пэгинтерфероном альфа и рибавирином. Исключение составлял показатель числа тромбоцитов, который оставался ниже значения, наблюдаемого при терапии только пэгинтерфероном альфа и рибавирином, вплоть до 48 нед комбинированной терапии.
Увеличение концентрации мочевой кислоты в плазме крови очень часто отмечалось во время терапии комбинацией телапревира, пэгинтерферона альфа и рибавирина. Концентрация мочевой кислоты обычно уменьшалась в течение следующих 8 нед и была сопоставима со значениями, которые наблюдались у пациентов, получающих лечение только пэгинтерфероном альфа и рибавирином.
Было показано, что профиль безопасности телапревира одинаков как при приеме по 1125 мг (3 табл. по 375 мг) 2 раза в день, так и при приеме по 750 мг (2 табл. по 375 мг) каждые 8.
Сыпь. Случаи возникновения сыпи чаще наблюдались у пациентов, принимавших телапревир с пэгинтерфероном альфа и рибавирином, чем у пациентов, принимающих только пэгинтерферон альфа и рибавирин. В 90% случаев наблюдалась сыпь легкой или средней степени тяжести, при которой не требовалась отмена телапревира. Обычно на фоне приема телапревира имела место экзематозная сыпь с зудом, захватывающая менее 30% поверхности тела. Некоторые случаи сыпи были описаны как макулопапулезная или эритематозная. Более половины случаев нежелательных кожных реакций обнаруживались в течение первых 4 нед терапии, однако сыпь могла появляться в любой период приема комбинированной терапии.
По мониторингу сыпи и правилам отмены телапревира, рибавирина и пэгинтерферона альфа - см «Меры предосторожности». Пациенты с сыпью легкой и средней степени тяжести должны наблюдаться на предмет прогрессирования выраженности кожных симптомов; однако прогрессирование наблюдается редко (менее чем в 10% случаев). Для коррекции нежелательных кожных реакций рекомендуется назначение антигистаминных ЛС и местных ГКС. Разрешение сыпи наблюдалось после прекращения приема телапревира. Однако в некоторых случаях для этого могло потребоваться несколько недель.
Анемия. Снижение концентрации Hb было сильнее и чаще наблюдалось у пациентов, принимающих телапревир в комбинации с пэгинтерфероном альфа и рибавирином, чем у пациентов, принимающих только пэгинтерферон альфа и рибавирин. Анемия тяжелой степени отмечалась у 2-3% пациентов, получавших телапревир.
Аноректальный синдром. Большинство описанных случаев возникновения аноректального синдрома (геморрой. аноректальный дискомфорт. аноректальный зуд и аноректальное жжение) были легкой или средней степени тяжести. очень редко приводили к отмене ЛС и. как правило. проходили после завершения комбинированной терапии.
RxList.com.
Аноректальный синдром. В контролируемых клинических испытаниях у 29% пациентов. получавших комбинированное лечение с телапревиром. возникал аноректальный синдром. по сравнению с 7% пациентов. получавших только пэгинтерферон альфа и рибавирин. Большинство из этих случаев (например геморрой. аноректальный дискомфорт. анальный зуд и ректальное жжение) были от легкой до умеренной степени тяжести. менее чем 1% пациентов прекратили лечение. и все симптомы разрешились во время или после окончания приема телапревира.
Нежелательные побочные реакции, выявленные в ходе пострегистрационного применения комбинации телапревира, пэгинтерферона альфа и рибавирина.
Нижеперечисленные нежелательные побочные реакции были выявлены в ходе пострегистрационного применения комбинации телапревира, пэгинтерферона альфа и рибавирина. Частота встречаемости данных нежелательных реакций и их связь с приемом ЛС не установлена, поскольку информация о данных нежелательных побочных реакциях получена из спонтанных сообщений.
Со стороны кожи и подкожных тканей. Частота не установлена - полиморфная экссудативная эритема, токсический эпидермальный некролиз.
Со стороны выделительной системы. Частота не установлена - преренальная азотемия с острой почечной недостаточностью или без нее, мочекислая нефропатия.
RxList.com.
Опыт клинических исследований.
Поскольку клинические исследования проводятся с различным набором условий. частота встречаемости побочных реакций. наблюдаемых в этих исследованиях. не может непосредственно сравниваться с частотой в других клинических испытаниях и прогнозировать возникновение побочных эффектов в клинической практике.
Оценка безопасности основана на объединенных данных адекватных и хорошо контролируемых клинических испытаний. включающих 1797 пациентов. получавших телапревир при комбинированном лечении. и 493 пациента. которые получали пэгинтерферон альфа и рибавирин.
Серьезные побочные реакции отмечены у 3% пациентов, получавших комбинированное лечение с телапревиром, по сравнению с отсутствием таких реакций у пациентов, получавших пэгинтерферон альфа и рибавирин. Наиболее частыми серьезными побочными реакциями у пациентов, получавших комбинированное лечение с телапревиром, были кожные заболевания (сыпь и/или зуд) и анемия ( см «Меры предосторожности»). Прекратили лечение телапревиром из-за неблагоприятных реакций 14% испытуемых. Сыпь. анемия. утомляемость. зуд. тошнота и рвота были наиболее частыми побочными лекарственными реакциями. ведущими к прекращению приема телапревира.
Телапревир применяли в комбинации с пэгинтерфероном альфа и рибавирином (N=1797). Ниже перечислены побочные реакции. которые отмечались у пациентов. получавших телапревир. с частотой по крайней мере на 5% выше. чем у пациентов. получавших только пэгинтерферон альфа и рибавирин (N=493).
Клинические побочные лекарственные реакции, наблюдавшиеся с частотой по крайней мере на 5% выше при комбинированном лечении с телапревиром.
Телапревир. пэгинтерферон альфа и рибавирин (комбинированное лечение. N=1797). через запятую - пэгинтерферон альфа и рибавирин (N=493): сыпь1 - 56. 34%. утомляемость - 56. 50%. зуд - 47. 28%. тошнота - 39. 28%. анемия1 - 36. 17%. диарея - 26. 17%. рвота - 13. 8%. геморрой - 12. 3%. аноректальный дискомфорт - 11. 3%. извращение вкуса - 10. 3%. анальный зуд - 6. 1%.
1 сыпь и анемия в соответствии с SSC (Специальные поисковые категории) группировочных терминов.
Описание отдельных побочных реакций.
Лабораторные показатели.
Лейкоциты. Лечение пэгинтерфероном альфа ассоциировано с уменьшением среднего значения общего числа лейкоцитов, абсолютного числа нейтрофилов и абсолютного числа лимфоцитов. У большого числа пациентов, получавших терапию с телапревиром, было снижено число лимфоцитов до 499/мм3 или менее (15 по сравнению с 5%). Уменьшение общего числа лейкоцитов до 1499 мм3 или менее было сопоставимо (8 по сравнению с 5%). Частота снижения абсолютного числа нейтрофилов до 749/мм3 и меньше у пациентов. получавших только пэгинтерферон альфа и рибавирин. составила 15 по сравнению с 12% у пациентов. получавших комбинированное лечение с телапревиром.
Тромбоциты. Лечение с пэгинтерфероном альфа связано с уменьшением среднего количества тромбоцитов. У большого количества пациентов при комбинированной терапии с телапревиром отмечалось снижение числа тромбоцитов всех степеней: 47 по сравнению с 36%, получавших только пэгинтерферон альфа и рибавирин. У 3% пациентов при комбинированном лечении с телапревиром отмечалось снижение до 49999/мм3 или меньше по сравнению с 1% пациентов, получавших только пэгинтерферон альфа и рибавирин.
Билирубин. У 41% пациентов. получавших телапревир. по сравнению с 28% пациентов. применявших только пэгинтерферон альфа и рибавирин. было отмечено повышение уровня билирубина всех степеней. у 4 и 2% пациентов соответственно уровень превышал ВГН в 2,6 раза. Уровень билирубина повышался наиболее резко в течение первых 1-2 нед приема телапревира, затем стабилизировался и между 12-16 нед возвращался к исходному.
Мочевая кислота. В течение всего периода комбинированного лечения с телапревиром 73% пациентов имели повышенные уровни мочевой кислоты по сравнению с 29% пациентов, получавших только пэгинтерферон альфа и рибавирин. Изменения уровня мочевой кислоты больше или равные 12,1 мг/дл от исходного уровня были также более часто среди пациентов. получавших телапревир (7%). по сравнению с пациентами. получавшими только пэгинтерферон альфа и рибавирин (1%). Менее чем у 1% пациентов отмечались клинически выраженные подагра/подагрический артрит; ни один из случаев не был серьезным и не привел к прекращению лечения.
Дополнительные данные клинических исследований.
При анализе дополнительного исследования (Trial с211) профиль безопасности комбинированной терапии с телапревиром в дозе 1125 мг дважды в день был сходен с профилем безопасности у пациентов. получавших комбинированное лечение с телапревиром в дозе 750 мг каждые 8.
|
|
Взаимодействие
Телапревир в основном метаболизируется в печени изоферментом сYP3A, а также является субстратом Р-gp. Все ЛС, метаболизируемые этим изоферментом и/или Р-gp или влияющие на его активность, могут изменять фармакокинетику телапревира.
Одновременный прием телапревира и ЛС, являющихся ингибиторами изофермента сYP3A и/или Р-gp, может привести к повышению концентрации телапревира в плазме крови. Прием телапревира может повышать системное воздействие ЛС, метаболизируемых изоферментом сYP3A и/или Р-gp, что может усиливать или удлинять их терапевтический эффект и нежелательные лекарственные реакции. Согласно данным исследований in vitro >in vitro, телапревир не является субстратом полипептидных переносчиков органических анионов - ОАТР1В1 и ОАТР2В1, но является их ингибитором. Таким образом, следует с осторожностью назначать одновременный прием телапревира и субстратов полипептидных переносчиков органических анионов (например флувастатин, правастатин, розувастатин и репаглинид).
Исследования in vitro >in vitro оценки in situ-индуцирования показали, что телапревир не является индуктором изоферментов сYP1A2, сYP2B6, сYP2C и сYP3A. Однако, основываясь на результатах клинических исследований лекарственных взаимодействий, индукция метаболических ферментов телапревиром не может быть исключена.
ЛС, прием которых противопоказан одновременно с приемом телапревира.
Субстраты изофермента сYP3A с узким терапевтическим диапазоном. Телапревир нельзя применять одновременно с ЛС, являющимися субстратами изофермента сYP3A и имеющими узкий терапевтический диапазон. Это может приводить к повышению концентрации этих ЛС в плазме крови и возникновению серьезных и/или угрожающих жизни нежелательных реакций, в тч нарушению ритма сердца (амиодарон, астемизол, бепридил, цизаприд, пимозид, хинидин, терфенадин), спазму периферических сосудов или ишемии (эрготамин, дигидроэрготамин, эргоновин, метилэргоновин), миопатии, включая рабдомиолиз (ловастатин, симвастатин, аторвастатин), длительному или усиленному седативному действию или угнетению дыхания (пероральный мидазолам, триазолам), падению АД и нарушению ритма сердца (алфузозин и силденафил, применяемые для лечения легочной гипертензии). Телапревир нельзя применять одновременно ни с одним ЛС из класса IA, IС или класса III антиаритмических средств, за исключением лидокаина для в/в введения.
Рифампицин. Рифампицин уменьшает AUC телапревира в плазме крови примерно на 92%. Поэтому телапревир нельзя применять одновременно с рифампицином.
ЛС на основе зверобоя продырявленного (Hypericum perforatum). Прием растительных препаратов на основе зверобоя продырявленного одновременно с телапревиром может снижать концентрацию последнего в плазме крови. Поэтому растительные ЛС на основе зверобоя продырявленного нельзя применять одновременно с телапревиром.
Карбамазепин, фенитоин и фенобарбитал. Одновременное применение телапревира и индукторов печеночных ферментов может приводить к уменьшению экспозиции телапревира и вероятному снижению эффективности. Противопоказаны потенциальные индукторы изофермента сYP3A, такие как карбамазепин, фенитоин и фенобарбитал.
Индукторы изофермента сYP3A слабого и среднего действия. Следует избегать одновременного применения тройной терапии и индукторов изофермента сYP3A слабого и среднего действия, в частности у пациентов, у которых ранее не наблюдался ответ на терапию (частичное или полное отсутствие ответа на терапию пэгинтерфероном альфа и рибавирином), за исключением тех случаев, когда даются конкретные рекомендации по дозировке.
Рекомендации по дозированию ЛС, проявляющих лекарственное взаимодействие с телапревиром.
Ниже приведены рекомендации по дозированию ЛС, проявляющих лекарственное взаимодействие с телапревиром. Эти рекомендации основаны на исследованиях лекарственного взаимодействия (обозначены*) или на прогнозе взаимодействия с учетом ожидаемой степени взаимодействия и возможности серьезных неблагоприятных явлений или потери эффективности. Направление изменения (увеличение, уменьшение, без изменения) каждого фармакокинетического показателя соответствует значению среднего геометрического фармакокинетического показателя, находящемуся выше, ниже или в пределах интервала 80-125% от изначального показателя с ДИ 90%.
Большинство исследований лекарственных взаимодействий было проведено при приеме телапревира по 2 табл. по 375 мг каждые 8 Принимая во внимание тот факт, что в стационарном состоянии AUC0-24 была одинаковой, независимо от того, принималась ли суточная доза 2250 мг в три (по 750 мг каждые 8 ч) или два (по 1125 мг 2 раза в день) приема, лекарственное взаимодействие телапревира с другими ЛС не должно зависеть от режима дозирования.
Приведены класс сопутствующего(-щих) ЛС/название ДВ, влияние на экспозицию, клинические комментарии.
Анальгетики.
Алфентанил, фентанил (в тч пролонгированные трансдермальные или трансмукозальные препараты фентанила). Увеличение концентрации алфентанила, увеличение концентрации фентанила. При одновременном приеме телапревира с алфентанилом или фентанилом рекомендован тщательный контроль побочных эффектов и клинического состояния пациента (в тч возможного проявления дыхательной недостаточности).
Антиаритмические средства.
Лидокаин (системный). Увеличение концентрации лидокаина (ингибирование изофермента сYP3A). Необходимо проявлять осторожность и контролировать состояние пациента при в/в введении лидокаина.
Дигоксин*. Увеличение экспозиции дигоксина - AUC - 1,85 (1,7-2), Сmах - 1,5 (1,36-1,65) (воздействие на транспорт Р-gp в кишечнике). При одновременном приеме телапревира концентрация дигоксина повышается. Следует назначать наименьшую дозу дигоксина. Следует контролировать концентрацию дигоксина в сыворотке крови и по ней титровать дозу дигоксина для достижения желаемого клинического эффекта.
Антибиотики.
Кларитромицин, эритромицин, телитромицин, тролеандомицин. Увеличение концентрации телапревира; увеличение концентрации антибиотиков (ингибирование изофермента сYP3A). Концентрации телапревира и антибиотиков могут повышаться при их одновременном приеме. Необходимо проявлять осторожность и контролировать состояние пациента при одновременном назначении телапревира и антибиотиков. Известны случаи увеличения интервала QT при одновременном приеме с кларитромицином и эритромицином. Также описаны случаи возникновения желудочковой тахикардии типа «пируэт» при одновременном приеме с кларитромицином и эритромицином. Описаны случаи удлинения интервала QT при одновременном приеме телапревира с телитромицином.
Антикоагулянты.
Варфарин. Увеличение или уменьшение концентрации варфарина (модуляция метаболических ферментов). При одновременном приеме телапревира и варфарина концентрация варфарина может изменяться. При одновременном приеме этих ЛС рекомендуется контролировать МНО.
Дабигатран. Увеличение концентрации дабигатрана; концентрация телапревира - без изменения (воздействие на транспорт Р-gp в кишечнике). Одновременный прием телапревира и дабигатрана следует назначать с осторожностью. При этом следует контролировать клиническое состояние больного.
Противосудорожные средства.
Карбамазепин, фенобарбитал, фенитоин. Уменьшение концентрации телапревира; увеличение концентрации карбамазепина; уменьшение или увеличение концентрации фенитоина; уменьшение или увеличение концентрации фенобарбитала (индуцирование изофермента сYP3A противосудорожными ЛС и ингибирование изофермента сYP3A телапревиром). При одновременном приеме противосудорожных средств и телапревира концентрации противосудорожных средств могут изменяться, а концентрация телапревира может уменьшаться. Одновременный прием телапревира и противосудорожных средств противопоказан, поскольку при одновременном приеме этих ЛС терапевтический эффект телапревира может ослабляться.
Антидепрессанты.
Эсциталопрам*, тразодон. Концентрация телапревира - без изменения; уменьшение экспозиции эсциталопрама - AUC - 0,65 (0,6-0,7), Сmах - 0,7 (0,65-0,76), Сmin - 0,58 (0,52-0,64) (механизм взаимодействия неизвестен); увеличение концентрации тразодона (механизм взаимодействия неизвестен). Концентрация эсциталопрама при одновременном приеме с телапревиром снижается. СИОЗС, в частности эсциталопрам, имеют широкий терапевтический диапазон, при одновременном приеме с телапревиром может потребоваться коррекция их дозы. Прием тразодона вместе с телапревиром может повышать концентрации тразодона в плазме крови, что может приводить к таким неблагоприятным эффектам, как тошнота, головокружение, падение АД и обморок. Одновременный прием тразодона и телапревира нужно назначать с осторожностью, при этом следует рассмотреть возможность снижения дозы тразодона.
Противогрибковые средства.
Кетоконазол*, итраконазол, позаконазол, вориконазол. Увеличение экспозиции кетоконазола (200 мг) - AUC - 2,25 (1,93-2,61), Сmах - 1,75 (1,51-2,03); увеличение экспозиции кетоконазола (400 мг) - AUC - 1,46 (1,35-1,58), Сmах - 1,23 (1,14-1,33); увеличение экспозиции телапревира (при приеме с кетоконазолом 400 мг) - AUC - 1,62 (1,45-1,81), Сmах - 1,24 (1,1-1,41); увеличение концентрации итраконазола; увеличение концентрации позаконазола; увеличение или уменьшение концентрации вориконазола (ингибирование изофермента сYP3A4). При одновременном применении кетоконазол повышает концентрацию телапревира в плазме крови. Системное применение итраконазола или позаконазола с телапревиром может повышать концентрацию последнего в плазме крови. В свою очередь телапревир может повышать концентрацию итраконазола, кетоконазола или позаконазола в плазме крови. При необходимости совместного применения не рекомендуется назначать высокие дозы (>200 мг) итраконазола или кетоконазола. Описаны случаи удлинения интервала QT и возникновения желудочковой тахикардии типа «пируэт» при одновременном приеме с вориконазолом и позаконазолом. Также описаны случаи удлинения интервала QT при одновременном приеме с кетоконазолом. Из-за того что в метаболизме вориконазола участвует большое количество ферментов, его взаимодействие с телапревиром трудно предсказать. Вориконазол нельзя назначать пациентам, получающим телапревир. Прием вориконазола оправдан лишь в том случае, если польза от его приема превышает возможный риск.
Противорвотные средства.
Домперидон. Увеличение концентрации домперидона (ингибирование изофермента сYP3A). Концентрация домперидона может возрастать при одновременном приеме с телапревиром. Не следует принимать домперидон одновременно с телапревиром.
Антиподагрические средства.
Колхицин. Увеличение концентрации колхицина (ингибирование изофермента сYP3A). Не следует назначать колхицин одновременно с телапревиром пациентам с недостаточностью функции печени и почек, это может приводить к повышению токсичности колхицина. Пациентам с нормальной функцией печени и почек рекомендуется временное прекращение приема колхицина или сокращенный курс колхицина со снижением его дозы.
Противотуберкулезные средства.
Рифабутин. Уменьшение концентрации телапревира; увеличение концентрации рифабутина (индуцирование изофермента сYP3A рифабутином, ингибирование изофермента сYP3A телапревиром). При одновременном приеме телапревира и рифабутина концентрация первого может снижаться, а второго - повышаться. Из-за снижения концентрации телапревир может быть менее эффективен. Одновременный прием телапревира и рифабутина не рекомендуется.
Рифампицин. Уменьшение экспозиции телапревира - AUC - 0,08 (0,07-0,11), Сmах - 0,14 (0,11-0,18); увеличение концентрации рифампицина (индуцирование изофермента сYP3A рифабутином, ингибирование изофермента сYP3A телапревиром). Одновременный прием телапревира и рифампицина противопоказан.
Антипсихотические средства.
Кветиапин. Увеличение концентрации кветиапина. Одновременное применение кветиапина и телапревира может увеличить системное воздействие кветиапина. Доза кветиапина должна быть существенно уменьшена при совместном применении с телапревиром.
Бензодиазепины.
Алпразолам*, парентеральный мидазолам*, пероральный мидазолам*, пероральный триазолам. Увеличение экспозиции алпразолама - AUC - 1,35 (1,23-1,49), Сmах - 0,97 (0,92-1,03); увеличение экспозиции мидазолама (в/в введение) AUC - 3,4 (3,04-3,79), Сmах - 1,02 (0,8-1,31); увеличение экспозиции мидазолама (пероральный прием) AUC - 8,96 (7,75-10,35), Сmах - 2,86 (2,52-3,25); увеличение концентрации триазолама (ингибирование изофермента сYP3A4). При одновременном применении алпразолама и телапревира системное воздействие алпразолама повышается на 35%. Необходимо контролировать клиническое состояние больного. При совместном применении парентерального мидазолама и телапревира системное воздействие мидазолама увеличивается в 3,4 раза. Эти ЛС можно применять совместно только в условиях, когда обеспечен контроль клинического состояния больного и необходимое медицинское лечение в случае угнетения дыхания и/или длительного седативного действия. Следует рассмотреть возможность снижения дозы мидазолама, особенно если он применяется неоднократно. Одновременный прием пероральных мидазолама и триазолама с телапревиром противопоказан.
Золпидем (небензодиазепиновое седативное средство)*. Уменьшение экспозиции золпидема - AUC - 0,53 (0,45-0,64), Сmах - 0,58 (0,52-0,66) (механизм взаимодействия неизвестен). При применении совместно с телапревиром системное воздействие золпидема снижается на 47%. Рекомендуется контролировать клиническое состояние больного и титровать дозу золпидема для достижения желаемого клинического эффекта.
БКК.
Амлодипин*, дилтиазем, фелодипин, никардипин, нифедипин, нисолдипин, верапамил. Увеличение экспозиции амлодипина - AUC - 2,79 (2,58-3,01), Сmах - 1,27 (1,21-1,33) (ингибирование изофермента сYP3А); увеличение концентрации БКК (ингибирование изофермента сYP3A и/или влияние на транспорт P-gp в кишечнике). При одновременном приеме с телапревиром системное воздействие амлодипина повышается в 2,8 раза. Следует проявлять осторожность и рассмотреть возможность снижения дозы амлодипина. Рекомендуется контролировать клиническое состояние больного. При применении одновременно с телапревиром может повышаться концентрация и других БКК. Необходимо проявлять осторожность. Рекомендуется контролировать клиническое состояние больного.
ГКС.
Системные. Дексаметазон; ингаляционные/интраназальные - флутиказон, будесонид. Уменьшение концентрации телапревира (индуцирование изофермента сYP3A); увеличение концентрации флутиказона и будесонида (ингибирование изофермента сYP3A). Системный дексаметазон активирует изофермент сYP3A и может снижать концентрацию телапревира в плазме крови. Это может приводить к потере терапевтического эффекта телапревира. Данную комбинацию следует принимать с осторожностью либо рассмотреть возможность приема альтернативных ЛС. При одновременном приеме ингаляционного флутиказона или будесонида с телапревиром возможно повышение концентрации в крови флутиказона и будесонида, что приводит к значительному снижению концентрации кортизола в сыворотке крови. Прием флутиказона или будесонида совместно с телапревиром не рекомендуется. Прием флутиказона или будесонида одновременно с телапревиром оправдан лишь в том случае, если польза от приема данных ЛС превышает возможный риск.
Блокаторы рецепторов эндотелина.
Бозентан. Увеличение концентрации бозентана; уменьшение концентрации телапревира (индуцирование изофермента сYP3A бозентаном, ингибирование изофермента сYP3A телапревиром). При одновременном приеме с телапревиром концентрация бозентана может повышаться. Необходимо проявлять осторожность. Рекомендуется контролировать клиническое состояние больного.
Средства для лечения ВИЧ-инфекции. Ингибиторы протеазы ВИЧ.
Атазанавир/ритонавир*. Уменьшение экспозиции телапревира - AUC - 0,8 (0,76-0,85), Сmах - 0,79 (0,74-0,84), Сmin - 0,85 (0,75-0,98); увеличение экспозиции атазанавира - AUC - 1,17 (0,97-1,43), Сmах - 0,85 (0,73-0,98), Сmin - 1,85 (1,4-2,44) (ингибирование изофермента сYP3A телапревиром). В исследовании лекарственного взаимодействия у здоровых добровольцев прием телапревира одновременно с атазанавиром/ритонавиром сопровождался снижением системного воздействия телапревира в равновесном состоянии на 20% и повышением системного воздействия атазанавира в равновесном состоянии на 17%. Рекомендуется клинический и лабораторный мониторинг концентрации билирубина.
Дарунавир/ритонавир*. Уменьшение экспозиции телапревира - AUC - 0,65 (0,61-0,69), Сmах - 0,64 (0,61-0,67), Сmin - 0,68 (0,63-0,74); уменьшение экспозиции дарунавира - AUC - 0,6 (0,57-0,63), Сmах - 0,6 (0,56-0,64), Сmin - 0,58 (0,52-0,63) (механизм взаимодействия неизвестен). В исследовании лекарственного взаимодействия у здоровых добровольцев прием телапревира одновременно с дарунавиром/ритонавиром сопровождался снижением системного воздействия телапревира в равновесном состоянии на 35% и снижением системного воздействия дарунавира в равновесном состоянии на 40%. Не рекомендуется одновременный прием дарунавира/ритонавира и телапревира ( см «Меры предосторожности»).
Фосампренавир/ритонавир*. Уменьшение экспозиции телапревира - AUC - 0,68 (0,63-0,72), Сmах - 0,67 (0,63-0,71), Сmin - 0,7 (0,64-0,77); уменьшение экспозиции ампренавира - AUC - 0,53 (0,49-0,58), Сmах - 0,65 (0,59-0,7), Сmin - 0,44 (0,4-0,5) (механизм взаимодействия неизвестен). В исследовании лекарственного взаимодействия у здоровых добровольцев прием телапревира совместно с фосампренавиром/ритонавиром сопровождался снижением системного воздействия телапревира в равновесном состоянии на 32% и снижением системного воздействия фосампренавира в равновесном состоянии на 47%. Не рекомендуется одновременный прием фосампренавира/ритонавира и телапревира ( см «Меры предосторожности»).
Лопинавир/ритонавир*. Уменьшение экспозиции телапревира - AUC - 0,46 (0,41-0,52), Сmах - 0,47 (0,41-0,52), Сmin - 0,48 (0,4-0,56); экспозиция лопинавира - без изменения - AUC - 1,06 (0,96-1,17), Сmах - 0,96 (0,87-1,05), Сmin - 1,14 (0,96-1,36) (механизм взаимодействия неизвестен). В исследовании лекарственного взаимодействия у здоровых добровольцев прием телапревира одновременно с лопинавиром/ритонавиром сопровождался снижением системного воздействия телапревира в равновесном состоянии на 54%, а системное воздействие лопинавира в равновесном состоянии не изменялось. He рекомендуется одновременный прием лопинавира/ритонавира и телапревира ( см «Меры предосторожности»).
Средства для лечения ВИЧ-инфекции. Ингибиторы обратной транскриптазы.
Эфавиренз*. Уменьшение экспозиции телапревира (1125 мг каждые 8 ч) - AUC - 0,82 (0,73-0,92), Сmах - 0,86 (0,76-0,97), Сmin - 0,75 (0,66-0,86); уменьшение экспозиции эфавиренза (+телапревир 1125 мг каждые 8 ч) - AUC - 0,82 (0,74-0,9), Сmах - 0,76 (0,68-0,85), Сmin - 0,9 (0,81-1,01) (индуцирование изофермента сYP3A эфавирензом). В исследовании лекарственного взаимодействия у здоровых добровольцев прием телапревира (1125 мг каждые 8 ч) одновременно с эфавирензом сопровождался снижением системного воздействия эфавиренза в равновесном состоянии на 18%, а системное воздействие телапревира в равновесном состоянии снижалось на 18% по сравнению с приемом телапревира в дозе 750 мг каждые 8.
Этравирин. Уменьшение экспозиции телапревира (750 мг каждые 8 ч) - AUC - 0,84 (0,71-0,98), Сmах - 0,9 (0,79-1,02), Сmin - 0,75 (0,61-0,92); экспозиция этравирина (+телапревир 750 мг каждые 8 ч) - без изменения - AUC - 0,94 (0,85-1,04), Сmах - 0,93 (0,84-1,03), Сmin - 0,97 (0,86-1,1). В исследованиях лекарственного взаимодействия у здоровых добровольцев было показано, что ssCss телапревира в плазме крови сокращается на 16%, что не считается клинически значимым. Не было обнаружено клинически значимое влияние данного лекарственного взаимодействия на концентрацию этравирина в плазме крови. Не требуется коррекция дозы при одновременном приеме этравирина и телапревира.
Рилпивирин. Уменьшение экспозиции телапревира (750 мг каждые 8 ч) - AUC - 0,95 (0,76-1,18), Сmах - 0,97 (0,79-1,21), Сmin - 0,89 (0,67-1,18); увеличение экспозиции рилпивирина (+телапревир 750 мг каждые 8 ч) - AUC - 1,78 (1,44-2,2), Сmах - 1,49 (1,2-1,84), Сmin - 1,93 (1,55-2,41). В исследовании лекарственного взаимодействия у здоровых добровольцев при одновременном приеме телапревира и рилпивирина ssCss телапревира снижалась на 5%, ssCss рилпивирина в плазме крови увеличилась на 1,78 раза. Эти различия не считаются клинически значимыми. Не требуется коррекция дозы при одновременном приеме рилпивирина и телапревира.
Тенофовира дизопроксил фумарат. Экспозиция телапревира - без изменения - AUC - 1 (0,94-1,07), Сmах - 1,01 (0,96-1,05), Сmin - 1,03 (0,93-1,14); увеличение экспозиции тенофовир дизопроксил фумарата - AUC - 1,3 (1,22-1,39), Сmах - 1,3 (1,16-1,45), Сmin - 1,41 (1,29-1,54) (воздействие на транспорт P-gp в кишечнике). В исследовании лекарственного взаимодействия у здоровых добровольцев прием телапревира одновременно с тенофовир дизопроксил фумаратом сопровождался повышением системного воздействия тенофовира дизопроксил фумарата примерно на 30%. Рекомендуется осуществлять тщательный контроль клинического состояния и лабораторных показателей больного.
Абакавир, зидовудин. Взаимодействие не изучалось. Воздействие телапревира на УДФ-ГТ не может быть оценено. Телапревир может влиять на концентрации абакавира и зидовудина в крови.
Ингибитор переноса молекулярной цепочки интегразы.
Ралтегравир. Экспозиция телапревира - без изменения - AUC - 1,07 (1-1,15), Сmах - 1,07 (0,98-1,16), Сmin - 1,14 (1,04-1,26); увеличение экспозиции ралтегравира - AUC - 1,31 (1,03-1,67), Сmах - 1,26 (0,97-1,62), Сmin - 1,78 (1,26-2,53). Не требуется коррекция дозы при одновременном приеме ралтегравира и телапревира.
Ингибиторы ГМГ-КоА редуктазы.
Аторвастатин*. Увеличение экспозиции аторвастатина - AUC - 7,88 (6,82-9,07), Сmах - 10,3 (8,74-12,85) (ингибирование изофермента сYP3A4). При одновременном приеме с телапревиром системное воздействие аторвастатина повышается в 8 раз. Одновременный прием аторвастатина и телапревира противопоказан.
Флувастатин, правастатин, розувастатин. Увеличение экспозиции статина. Одновременный прием рекомендуется с осторожностью. При одновременном приеме следует контролировать клиническое состояние пациента. также «Противопоказания», где приведен список ингибиторов ГМГ-КоА-редуктазы , прием которых одновременно с телапревиром противопоказан.
Гормональные контрацептивы/эстроген.
Этинилэстрадиол*, норэтиндрон. Уменьшение экспозиции этинилэстрадиола - AUC - 0,72 (0,69-0,75), Сmах - 0,74 (0,68-0,8), Сmin - 0,67 (0,63-0,71); экспозиция норэтиндрона - без изменения - AUC - 0,89 (0,86-0,93), Сmах - 0,85 (0,81-0,89), Сmin - 0,94 (0,87-1) (механизм взаимодействия неизвестен). При одновременном приеме с телапревиром системное воздействие этинилэстрадиола снижается на 28%. При использовании контрацептивов на основе эстрогена в период лечения телапревиром следует выбрать альтернативные, негормональные методы контрацепции. Если больная получает заместительную гормональную терапию эстрогенами, то следует контролировать клинические признаки дефицита эстрогенов.
Циклоспорин*, сиролимус, такролимус*. Увеличение экспозиции циклоспорина - AUC - 4,64 (3,9-5,51), Сmах - 1,32 (1,08-1,6); увеличение экспозиции сиролимуса; увеличение экспозиции такролимуса - AUC - 70,3 (52,9-93,4), Сmах - 9,35 (6,73-13) (ингибирование изофермента сYP3A, ингибирование транспортных белков. При одновременном приеме с телапревиром концентрации циклоспорина, сиролимуса и такролимуса в плазме крови могут заметно повышаться. В данном случае следует значительно снижать дозу иммуносупрессоров и увеличивать интервал дозирования. Рекомендуется контролировать концентрацию иммуносупрессоров в крови, функцию почек и побочные эффекты иммуносупрессоров. Такролимус может увеличивать интервал QT. Не рекомендован прием телапревира кандидатам на трансплантацию органов ( см «Меры предосторожности»).
Ингаляционный бета-агонист.
Салметерол. Увеличение концентрации салметерола (ингибирование изофермента сYP3A). При применении одновременно с телапревиром концентрация салметерола может повышаться. Одновременный прием телапревира и салметерола не рекомендуется. Эта комбинация может повышать риск возникновения сердечно-сосудистых неблагоприятных эффектов салметерола, включая удлинение интервала QT, сердцебиение и синусовую тахикардию.
Гипогликемические средства для перорального применения.
Репаглинид. Увеличение экспозиции репаглинида. Одновременный прием данных ЛС рекомендуется с осторожностью. При одновременном приеме следует контролировать клиническое состояние пациента.
Наркотические анальгетики.
Метадон. Уменьшение экспозиции R-метадона - AUC - 0,71 (0,66-0,76), Сmах - 0,71 (0,66-0,76), Сmin - 0,69 (0,64-0,75) (отсутствие эффекта на концентрации несвязанного R-метадона. Вытеснение метадона из связи с белками плазмы). При одновременном приеме с телапревиром концентрация метадона снижается на 29%. В начале одновременного применения телапревира коррекция дозы метадона не требуется. Тем не менее, рекомендуется контролировать клиническое состояние больных, в период поддерживающей терапии некоторым больным может потребоваться коррекция дозы метадона. Описаны случаи удлинения интервала QT и возникновения желудочковой тахикардии типа «пируэт» при одновременном приеме с метадоном.
Бупренорфин. Экспозиция бупренорфина - без изменения - AUC - 0,96 (0,84-1,1), Сmах - 0,8 (0,69-0,93), Сmin - 0,94 (0,87-1,3). Не требуется коррекция дозы при одновременном приеме бупренорфина и телапревира.
Ингибиторы ФДЭ-5.
Силденафил, тадалафил, варденафил. Увеличение концентрации ингибитора ФДЭ-5 (ингибирование изофермента сYP3A). Не рекомендуется одновременное применение силденафила и варденафила с телапревиром. Для лечения нарушений эрекции можно принимать с осторожностью тадалафил в разовой дозе не более 10 мг (не чаще 1 раза в 72 ч). При этом следует тщательно контролировать неблагоприятные эффекты ингибиторов ФДЭ-5. При лечении легочной гипертензии одновременный прием силденафила или тадалафила и телапревира противопоказан.
Ингибиторы протонного насоса.
Эзомепразол. Экспозиция телапревира - без изменения - AUC - 0,98 (0,91-1,05), Сmах - 0,95 (0,86-1,06). Поскольку эзомепразол не влияет на концентрацию телапревира в плазме крови, то ингибиторы протонного насоса можно принимать без коррекции дозы.
Одновременный прием телапревира и ЛС, являющихся ингибиторами изофермента сYP3A и/или Р-gp, может привести к повышению концентрации телапревира в плазме крови. Прием телапревира может повышать системное воздействие ЛС, метаболизируемых изоферментом сYP3A и/или Р-gp, что может усиливать или удлинять их терапевтический эффект и нежелательные лекарственные реакции. Согласно данным исследований in vitro >in vitro, телапревир не является субстратом полипептидных переносчиков органических анионов - ОАТР1В1 и ОАТР2В1, но является их ингибитором. Таким образом, следует с осторожностью назначать одновременный прием телапревира и субстратов полипептидных переносчиков органических анионов (например флувастатин, правастатин, розувастатин и репаглинид).
Исследования in vitro >in vitro оценки in situ-индуцирования показали, что телапревир не является индуктором изоферментов сYP1A2, сYP2B6, сYP2C и сYP3A. Однако, основываясь на результатах клинических исследований лекарственных взаимодействий, индукция метаболических ферментов телапревиром не может быть исключена.
ЛС, прием которых противопоказан одновременно с приемом телапревира.
Субстраты изофермента сYP3A с узким терапевтическим диапазоном. Телапревир нельзя применять одновременно с ЛС, являющимися субстратами изофермента сYP3A и имеющими узкий терапевтический диапазон. Это может приводить к повышению концентрации этих ЛС в плазме крови и возникновению серьезных и/или угрожающих жизни нежелательных реакций, в тч нарушению ритма сердца (амиодарон, астемизол, бепридил, цизаприд, пимозид, хинидин, терфенадин), спазму периферических сосудов или ишемии (эрготамин, дигидроэрготамин, эргоновин, метилэргоновин), миопатии, включая рабдомиолиз (ловастатин, симвастатин, аторвастатин), длительному или усиленному седативному действию или угнетению дыхания (пероральный мидазолам, триазолам), падению АД и нарушению ритма сердца (алфузозин и силденафил, применяемые для лечения легочной гипертензии). Телапревир нельзя применять одновременно ни с одним ЛС из класса IA, IС или класса III антиаритмических средств, за исключением лидокаина для в/в введения.
Рифампицин. Рифампицин уменьшает AUC телапревира в плазме крови примерно на 92%. Поэтому телапревир нельзя применять одновременно с рифампицином.
ЛС на основе зверобоя продырявленного (Hypericum perforatum). Прием растительных препаратов на основе зверобоя продырявленного одновременно с телапревиром может снижать концентрацию последнего в плазме крови. Поэтому растительные ЛС на основе зверобоя продырявленного нельзя применять одновременно с телапревиром.
Карбамазепин, фенитоин и фенобарбитал. Одновременное применение телапревира и индукторов печеночных ферментов может приводить к уменьшению экспозиции телапревира и вероятному снижению эффективности. Противопоказаны потенциальные индукторы изофермента сYP3A, такие как карбамазепин, фенитоин и фенобарбитал.
Индукторы изофермента сYP3A слабого и среднего действия. Следует избегать одновременного применения тройной терапии и индукторов изофермента сYP3A слабого и среднего действия, в частности у пациентов, у которых ранее не наблюдался ответ на терапию (частичное или полное отсутствие ответа на терапию пэгинтерфероном альфа и рибавирином), за исключением тех случаев, когда даются конкретные рекомендации по дозировке.
Рекомендации по дозированию ЛС, проявляющих лекарственное взаимодействие с телапревиром.
Ниже приведены рекомендации по дозированию ЛС, проявляющих лекарственное взаимодействие с телапревиром. Эти рекомендации основаны на исследованиях лекарственного взаимодействия (обозначены*) или на прогнозе взаимодействия с учетом ожидаемой степени взаимодействия и возможности серьезных неблагоприятных явлений или потери эффективности. Направление изменения (увеличение, уменьшение, без изменения) каждого фармакокинетического показателя соответствует значению среднего геометрического фармакокинетического показателя, находящемуся выше, ниже или в пределах интервала 80-125% от изначального показателя с ДИ 90%.
Большинство исследований лекарственных взаимодействий было проведено при приеме телапревира по 2 табл. по 375 мг каждые 8 Принимая во внимание тот факт, что в стационарном состоянии AUC0-24 была одинаковой, независимо от того, принималась ли суточная доза 2250 мг в три (по 750 мг каждые 8 ч) или два (по 1125 мг 2 раза в день) приема, лекарственное взаимодействие телапревира с другими ЛС не должно зависеть от режима дозирования.
Приведены класс сопутствующего(-щих) ЛС/название ДВ, влияние на экспозицию, клинические комментарии.
Анальгетики.
Алфентанил, фентанил (в тч пролонгированные трансдермальные или трансмукозальные препараты фентанила). Увеличение концентрации алфентанила, увеличение концентрации фентанила. При одновременном приеме телапревира с алфентанилом или фентанилом рекомендован тщательный контроль побочных эффектов и клинического состояния пациента (в тч возможного проявления дыхательной недостаточности).
Антиаритмические средства.
Лидокаин (системный). Увеличение концентрации лидокаина (ингибирование изофермента сYP3A). Необходимо проявлять осторожность и контролировать состояние пациента при в/в введении лидокаина.
Дигоксин*. Увеличение экспозиции дигоксина - AUC - 1,85 (1,7-2), Сmах - 1,5 (1,36-1,65) (воздействие на транспорт Р-gp в кишечнике). При одновременном приеме телапревира концентрация дигоксина повышается. Следует назначать наименьшую дозу дигоксина. Следует контролировать концентрацию дигоксина в сыворотке крови и по ней титровать дозу дигоксина для достижения желаемого клинического эффекта.
Антибиотики.
Кларитромицин, эритромицин, телитромицин, тролеандомицин. Увеличение концентрации телапревира; увеличение концентрации антибиотиков (ингибирование изофермента сYP3A). Концентрации телапревира и антибиотиков могут повышаться при их одновременном приеме. Необходимо проявлять осторожность и контролировать состояние пациента при одновременном назначении телапревира и антибиотиков. Известны случаи увеличения интервала QT при одновременном приеме с кларитромицином и эритромицином. Также описаны случаи возникновения желудочковой тахикардии типа «пируэт» при одновременном приеме с кларитромицином и эритромицином. Описаны случаи удлинения интервала QT при одновременном приеме телапревира с телитромицином.
Антикоагулянты.
Варфарин. Увеличение или уменьшение концентрации варфарина (модуляция метаболических ферментов). При одновременном приеме телапревира и варфарина концентрация варфарина может изменяться. При одновременном приеме этих ЛС рекомендуется контролировать МНО.
Дабигатран. Увеличение концентрации дабигатрана; концентрация телапревира - без изменения (воздействие на транспорт Р-gp в кишечнике). Одновременный прием телапревира и дабигатрана следует назначать с осторожностью. При этом следует контролировать клиническое состояние больного.
Противосудорожные средства.
Карбамазепин, фенобарбитал, фенитоин. Уменьшение концентрации телапревира; увеличение концентрации карбамазепина; уменьшение или увеличение концентрации фенитоина; уменьшение или увеличение концентрации фенобарбитала (индуцирование изофермента сYP3A противосудорожными ЛС и ингибирование изофермента сYP3A телапревиром). При одновременном приеме противосудорожных средств и телапревира концентрации противосудорожных средств могут изменяться, а концентрация телапревира может уменьшаться. Одновременный прием телапревира и противосудорожных средств противопоказан, поскольку при одновременном приеме этих ЛС терапевтический эффект телапревира может ослабляться.
Антидепрессанты.
Эсциталопрам*, тразодон. Концентрация телапревира - без изменения; уменьшение экспозиции эсциталопрама - AUC - 0,65 (0,6-0,7), Сmах - 0,7 (0,65-0,76), Сmin - 0,58 (0,52-0,64) (механизм взаимодействия неизвестен); увеличение концентрации тразодона (механизм взаимодействия неизвестен). Концентрация эсциталопрама при одновременном приеме с телапревиром снижается. СИОЗС, в частности эсциталопрам, имеют широкий терапевтический диапазон, при одновременном приеме с телапревиром может потребоваться коррекция их дозы. Прием тразодона вместе с телапревиром может повышать концентрации тразодона в плазме крови, что может приводить к таким неблагоприятным эффектам, как тошнота, головокружение, падение АД и обморок. Одновременный прием тразодона и телапревира нужно назначать с осторожностью, при этом следует рассмотреть возможность снижения дозы тразодона.
Противогрибковые средства.
Кетоконазол*, итраконазол, позаконазол, вориконазол. Увеличение экспозиции кетоконазола (200 мг) - AUC - 2,25 (1,93-2,61), Сmах - 1,75 (1,51-2,03); увеличение экспозиции кетоконазола (400 мг) - AUC - 1,46 (1,35-1,58), Сmах - 1,23 (1,14-1,33); увеличение экспозиции телапревира (при приеме с кетоконазолом 400 мг) - AUC - 1,62 (1,45-1,81), Сmах - 1,24 (1,1-1,41); увеличение концентрации итраконазола; увеличение концентрации позаконазола; увеличение или уменьшение концентрации вориконазола (ингибирование изофермента сYP3A4). При одновременном применении кетоконазол повышает концентрацию телапревира в плазме крови. Системное применение итраконазола или позаконазола с телапревиром может повышать концентрацию последнего в плазме крови. В свою очередь телапревир может повышать концентрацию итраконазола, кетоконазола или позаконазола в плазме крови. При необходимости совместного применения не рекомендуется назначать высокие дозы (>200 мг) итраконазола или кетоконазола. Описаны случаи удлинения интервала QT и возникновения желудочковой тахикардии типа «пируэт» при одновременном приеме с вориконазолом и позаконазолом. Также описаны случаи удлинения интервала QT при одновременном приеме с кетоконазолом. Из-за того что в метаболизме вориконазола участвует большое количество ферментов, его взаимодействие с телапревиром трудно предсказать. Вориконазол нельзя назначать пациентам, получающим телапревир. Прием вориконазола оправдан лишь в том случае, если польза от его приема превышает возможный риск.
Противорвотные средства.
Домперидон. Увеличение концентрации домперидона (ингибирование изофермента сYP3A). Концентрация домперидона может возрастать при одновременном приеме с телапревиром. Не следует принимать домперидон одновременно с телапревиром.
Антиподагрические средства.
Колхицин. Увеличение концентрации колхицина (ингибирование изофермента сYP3A). Не следует назначать колхицин одновременно с телапревиром пациентам с недостаточностью функции печени и почек, это может приводить к повышению токсичности колхицина. Пациентам с нормальной функцией печени и почек рекомендуется временное прекращение приема колхицина или сокращенный курс колхицина со снижением его дозы.
Противотуберкулезные средства.
Рифабутин. Уменьшение концентрации телапревира; увеличение концентрации рифабутина (индуцирование изофермента сYP3A рифабутином, ингибирование изофермента сYP3A телапревиром). При одновременном приеме телапревира и рифабутина концентрация первого может снижаться, а второго - повышаться. Из-за снижения концентрации телапревир может быть менее эффективен. Одновременный прием телапревира и рифабутина не рекомендуется.
Рифампицин. Уменьшение экспозиции телапревира - AUC - 0,08 (0,07-0,11), Сmах - 0,14 (0,11-0,18); увеличение концентрации рифампицина (индуцирование изофермента сYP3A рифабутином, ингибирование изофермента сYP3A телапревиром). Одновременный прием телапревира и рифампицина противопоказан.
Антипсихотические средства.
Кветиапин. Увеличение концентрации кветиапина. Одновременное применение кветиапина и телапревира может увеличить системное воздействие кветиапина. Доза кветиапина должна быть существенно уменьшена при совместном применении с телапревиром.
Бензодиазепины.
Алпразолам*, парентеральный мидазолам*, пероральный мидазолам*, пероральный триазолам. Увеличение экспозиции алпразолама - AUC - 1,35 (1,23-1,49), Сmах - 0,97 (0,92-1,03); увеличение экспозиции мидазолама (в/в введение) AUC - 3,4 (3,04-3,79), Сmах - 1,02 (0,8-1,31); увеличение экспозиции мидазолама (пероральный прием) AUC - 8,96 (7,75-10,35), Сmах - 2,86 (2,52-3,25); увеличение концентрации триазолама (ингибирование изофермента сYP3A4). При одновременном применении алпразолама и телапревира системное воздействие алпразолама повышается на 35%. Необходимо контролировать клиническое состояние больного. При совместном применении парентерального мидазолама и телапревира системное воздействие мидазолама увеличивается в 3,4 раза. Эти ЛС можно применять совместно только в условиях, когда обеспечен контроль клинического состояния больного и необходимое медицинское лечение в случае угнетения дыхания и/или длительного седативного действия. Следует рассмотреть возможность снижения дозы мидазолама, особенно если он применяется неоднократно. Одновременный прием пероральных мидазолама и триазолама с телапревиром противопоказан.
Золпидем (небензодиазепиновое седативное средство)*. Уменьшение экспозиции золпидема - AUC - 0,53 (0,45-0,64), Сmах - 0,58 (0,52-0,66) (механизм взаимодействия неизвестен). При применении совместно с телапревиром системное воздействие золпидема снижается на 47%. Рекомендуется контролировать клиническое состояние больного и титровать дозу золпидема для достижения желаемого клинического эффекта.
БКК.
Амлодипин*, дилтиазем, фелодипин, никардипин, нифедипин, нисолдипин, верапамил. Увеличение экспозиции амлодипина - AUC - 2,79 (2,58-3,01), Сmах - 1,27 (1,21-1,33) (ингибирование изофермента сYP3А); увеличение концентрации БКК (ингибирование изофермента сYP3A и/или влияние на транспорт P-gp в кишечнике). При одновременном приеме с телапревиром системное воздействие амлодипина повышается в 2,8 раза. Следует проявлять осторожность и рассмотреть возможность снижения дозы амлодипина. Рекомендуется контролировать клиническое состояние больного. При применении одновременно с телапревиром может повышаться концентрация и других БКК. Необходимо проявлять осторожность. Рекомендуется контролировать клиническое состояние больного.
ГКС.
Системные. Дексаметазон; ингаляционные/интраназальные - флутиказон, будесонид. Уменьшение концентрации телапревира (индуцирование изофермента сYP3A); увеличение концентрации флутиказона и будесонида (ингибирование изофермента сYP3A). Системный дексаметазон активирует изофермент сYP3A и может снижать концентрацию телапревира в плазме крови. Это может приводить к потере терапевтического эффекта телапревира. Данную комбинацию следует принимать с осторожностью либо рассмотреть возможность приема альтернативных ЛС. При одновременном приеме ингаляционного флутиказона или будесонида с телапревиром возможно повышение концентрации в крови флутиказона и будесонида, что приводит к значительному снижению концентрации кортизола в сыворотке крови. Прием флутиказона или будесонида совместно с телапревиром не рекомендуется. Прием флутиказона или будесонида одновременно с телапревиром оправдан лишь в том случае, если польза от приема данных ЛС превышает возможный риск.
Блокаторы рецепторов эндотелина.
Бозентан. Увеличение концентрации бозентана; уменьшение концентрации телапревира (индуцирование изофермента сYP3A бозентаном, ингибирование изофермента сYP3A телапревиром). При одновременном приеме с телапревиром концентрация бозентана может повышаться. Необходимо проявлять осторожность. Рекомендуется контролировать клиническое состояние больного.
Средства для лечения ВИЧ-инфекции. Ингибиторы протеазы ВИЧ.
Атазанавир/ритонавир*. Уменьшение экспозиции телапревира - AUC - 0,8 (0,76-0,85), Сmах - 0,79 (0,74-0,84), Сmin - 0,85 (0,75-0,98); увеличение экспозиции атазанавира - AUC - 1,17 (0,97-1,43), Сmах - 0,85 (0,73-0,98), Сmin - 1,85 (1,4-2,44) (ингибирование изофермента сYP3A телапревиром). В исследовании лекарственного взаимодействия у здоровых добровольцев прием телапревира одновременно с атазанавиром/ритонавиром сопровождался снижением системного воздействия телапревира в равновесном состоянии на 20% и повышением системного воздействия атазанавира в равновесном состоянии на 17%. Рекомендуется клинический и лабораторный мониторинг концентрации билирубина.
Дарунавир/ритонавир*. Уменьшение экспозиции телапревира - AUC - 0,65 (0,61-0,69), Сmах - 0,64 (0,61-0,67), Сmin - 0,68 (0,63-0,74); уменьшение экспозиции дарунавира - AUC - 0,6 (0,57-0,63), Сmах - 0,6 (0,56-0,64), Сmin - 0,58 (0,52-0,63) (механизм взаимодействия неизвестен). В исследовании лекарственного взаимодействия у здоровых добровольцев прием телапревира одновременно с дарунавиром/ритонавиром сопровождался снижением системного воздействия телапревира в равновесном состоянии на 35% и снижением системного воздействия дарунавира в равновесном состоянии на 40%. Не рекомендуется одновременный прием дарунавира/ритонавира и телапревира ( см «Меры предосторожности»).
Фосампренавир/ритонавир*. Уменьшение экспозиции телапревира - AUC - 0,68 (0,63-0,72), Сmах - 0,67 (0,63-0,71), Сmin - 0,7 (0,64-0,77); уменьшение экспозиции ампренавира - AUC - 0,53 (0,49-0,58), Сmах - 0,65 (0,59-0,7), Сmin - 0,44 (0,4-0,5) (механизм взаимодействия неизвестен). В исследовании лекарственного взаимодействия у здоровых добровольцев прием телапревира совместно с фосампренавиром/ритонавиром сопровождался снижением системного воздействия телапревира в равновесном состоянии на 32% и снижением системного воздействия фосампренавира в равновесном состоянии на 47%. Не рекомендуется одновременный прием фосампренавира/ритонавира и телапревира ( см «Меры предосторожности»).
Лопинавир/ритонавир*. Уменьшение экспозиции телапревира - AUC - 0,46 (0,41-0,52), Сmах - 0,47 (0,41-0,52), Сmin - 0,48 (0,4-0,56); экспозиция лопинавира - без изменения - AUC - 1,06 (0,96-1,17), Сmах - 0,96 (0,87-1,05), Сmin - 1,14 (0,96-1,36) (механизм взаимодействия неизвестен). В исследовании лекарственного взаимодействия у здоровых добровольцев прием телапревира одновременно с лопинавиром/ритонавиром сопровождался снижением системного воздействия телапревира в равновесном состоянии на 54%, а системное воздействие лопинавира в равновесном состоянии не изменялось. He рекомендуется одновременный прием лопинавира/ритонавира и телапревира ( см «Меры предосторожности»).
Средства для лечения ВИЧ-инфекции. Ингибиторы обратной транскриптазы.
Эфавиренз*. Уменьшение экспозиции телапревира (1125 мг каждые 8 ч) - AUC - 0,82 (0,73-0,92), Сmах - 0,86 (0,76-0,97), Сmin - 0,75 (0,66-0,86); уменьшение экспозиции эфавиренза (+телапревир 1125 мг каждые 8 ч) - AUC - 0,82 (0,74-0,9), Сmах - 0,76 (0,68-0,85), Сmin - 0,9 (0,81-1,01) (индуцирование изофермента сYP3A эфавирензом). В исследовании лекарственного взаимодействия у здоровых добровольцев прием телапревира (1125 мг каждые 8 ч) одновременно с эфавирензом сопровождался снижением системного воздействия эфавиренза в равновесном состоянии на 18%, а системное воздействие телапревира в равновесном состоянии снижалось на 18% по сравнению с приемом телапревира в дозе 750 мг каждые 8.
Этравирин. Уменьшение экспозиции телапревира (750 мг каждые 8 ч) - AUC - 0,84 (0,71-0,98), Сmах - 0,9 (0,79-1,02), Сmin - 0,75 (0,61-0,92); экспозиция этравирина (+телапревир 750 мг каждые 8 ч) - без изменения - AUC - 0,94 (0,85-1,04), Сmах - 0,93 (0,84-1,03), Сmin - 0,97 (0,86-1,1). В исследованиях лекарственного взаимодействия у здоровых добровольцев было показано, что ssCss телапревира в плазме крови сокращается на 16%, что не считается клинически значимым. Не было обнаружено клинически значимое влияние данного лекарственного взаимодействия на концентрацию этравирина в плазме крови. Не требуется коррекция дозы при одновременном приеме этравирина и телапревира.
Рилпивирин. Уменьшение экспозиции телапревира (750 мг каждые 8 ч) - AUC - 0,95 (0,76-1,18), Сmах - 0,97 (0,79-1,21), Сmin - 0,89 (0,67-1,18); увеличение экспозиции рилпивирина (+телапревир 750 мг каждые 8 ч) - AUC - 1,78 (1,44-2,2), Сmах - 1,49 (1,2-1,84), Сmin - 1,93 (1,55-2,41). В исследовании лекарственного взаимодействия у здоровых добровольцев при одновременном приеме телапревира и рилпивирина ssCss телапревира снижалась на 5%, ssCss рилпивирина в плазме крови увеличилась на 1,78 раза. Эти различия не считаются клинически значимыми. Не требуется коррекция дозы при одновременном приеме рилпивирина и телапревира.
Тенофовира дизопроксил фумарат. Экспозиция телапревира - без изменения - AUC - 1 (0,94-1,07), Сmах - 1,01 (0,96-1,05), Сmin - 1,03 (0,93-1,14); увеличение экспозиции тенофовир дизопроксил фумарата - AUC - 1,3 (1,22-1,39), Сmах - 1,3 (1,16-1,45), Сmin - 1,41 (1,29-1,54) (воздействие на транспорт P-gp в кишечнике). В исследовании лекарственного взаимодействия у здоровых добровольцев прием телапревира одновременно с тенофовир дизопроксил фумаратом сопровождался повышением системного воздействия тенофовира дизопроксил фумарата примерно на 30%. Рекомендуется осуществлять тщательный контроль клинического состояния и лабораторных показателей больного.
Абакавир, зидовудин. Взаимодействие не изучалось. Воздействие телапревира на УДФ-ГТ не может быть оценено. Телапревир может влиять на концентрации абакавира и зидовудина в крови.
Ингибитор переноса молекулярной цепочки интегразы.
Ралтегравир. Экспозиция телапревира - без изменения - AUC - 1,07 (1-1,15), Сmах - 1,07 (0,98-1,16), Сmin - 1,14 (1,04-1,26); увеличение экспозиции ралтегравира - AUC - 1,31 (1,03-1,67), Сmах - 1,26 (0,97-1,62), Сmin - 1,78 (1,26-2,53). Не требуется коррекция дозы при одновременном приеме ралтегравира и телапревира.
Ингибиторы ГМГ-КоА редуктазы.
Аторвастатин*. Увеличение экспозиции аторвастатина - AUC - 7,88 (6,82-9,07), Сmах - 10,3 (8,74-12,85) (ингибирование изофермента сYP3A4). При одновременном приеме с телапревиром системное воздействие аторвастатина повышается в 8 раз. Одновременный прием аторвастатина и телапревира противопоказан.
Флувастатин, правастатин, розувастатин. Увеличение экспозиции статина. Одновременный прием рекомендуется с осторожностью. При одновременном приеме следует контролировать клиническое состояние пациента. также «Противопоказания», где приведен список ингибиторов ГМГ-КоА-редуктазы , прием которых одновременно с телапревиром противопоказан.
Гормональные контрацептивы/эстроген.
Этинилэстрадиол*, норэтиндрон. Уменьшение экспозиции этинилэстрадиола - AUC - 0,72 (0,69-0,75), Сmах - 0,74 (0,68-0,8), Сmin - 0,67 (0,63-0,71); экспозиция норэтиндрона - без изменения - AUC - 0,89 (0,86-0,93), Сmах - 0,85 (0,81-0,89), Сmin - 0,94 (0,87-1) (механизм взаимодействия неизвестен). При одновременном приеме с телапревиром системное воздействие этинилэстрадиола снижается на 28%. При использовании контрацептивов на основе эстрогена в период лечения телапревиром следует выбрать альтернативные, негормональные методы контрацепции. Если больная получает заместительную гормональную терапию эстрогенами, то следует контролировать клинические признаки дефицита эстрогенов.
Циклоспорин*, сиролимус, такролимус*. Увеличение экспозиции циклоспорина - AUC - 4,64 (3,9-5,51), Сmах - 1,32 (1,08-1,6); увеличение экспозиции сиролимуса; увеличение экспозиции такролимуса - AUC - 70,3 (52,9-93,4), Сmах - 9,35 (6,73-13) (ингибирование изофермента сYP3A, ингибирование транспортных белков. При одновременном приеме с телапревиром концентрации циклоспорина, сиролимуса и такролимуса в плазме крови могут заметно повышаться. В данном случае следует значительно снижать дозу иммуносупрессоров и увеличивать интервал дозирования. Рекомендуется контролировать концентрацию иммуносупрессоров в крови, функцию почек и побочные эффекты иммуносупрессоров. Такролимус может увеличивать интервал QT. Не рекомендован прием телапревира кандидатам на трансплантацию органов ( см «Меры предосторожности»).
Ингаляционный бета-агонист.
Салметерол. Увеличение концентрации салметерола (ингибирование изофермента сYP3A). При применении одновременно с телапревиром концентрация салметерола может повышаться. Одновременный прием телапревира и салметерола не рекомендуется. Эта комбинация может повышать риск возникновения сердечно-сосудистых неблагоприятных эффектов салметерола, включая удлинение интервала QT, сердцебиение и синусовую тахикардию.
Гипогликемические средства для перорального применения.
Репаглинид. Увеличение экспозиции репаглинида. Одновременный прием данных ЛС рекомендуется с осторожностью. При одновременном приеме следует контролировать клиническое состояние пациента.
Наркотические анальгетики.
Метадон. Уменьшение экспозиции R-метадона - AUC - 0,71 (0,66-0,76), Сmах - 0,71 (0,66-0,76), Сmin - 0,69 (0,64-0,75) (отсутствие эффекта на концентрации несвязанного R-метадона. Вытеснение метадона из связи с белками плазмы). При одновременном приеме с телапревиром концентрация метадона снижается на 29%. В начале одновременного применения телапревира коррекция дозы метадона не требуется. Тем не менее, рекомендуется контролировать клиническое состояние больных, в период поддерживающей терапии некоторым больным может потребоваться коррекция дозы метадона. Описаны случаи удлинения интервала QT и возникновения желудочковой тахикардии типа «пируэт» при одновременном приеме с метадоном.
Бупренорфин. Экспозиция бупренорфина - без изменения - AUC - 0,96 (0,84-1,1), Сmах - 0,8 (0,69-0,93), Сmin - 0,94 (0,87-1,3). Не требуется коррекция дозы при одновременном приеме бупренорфина и телапревира.
Ингибиторы ФДЭ-5.
Силденафил, тадалафил, варденафил. Увеличение концентрации ингибитора ФДЭ-5 (ингибирование изофермента сYP3A). Не рекомендуется одновременное применение силденафила и варденафила с телапревиром. Для лечения нарушений эрекции можно принимать с осторожностью тадалафил в разовой дозе не более 10 мг (не чаще 1 раза в 72 ч). При этом следует тщательно контролировать неблагоприятные эффекты ингибиторов ФДЭ-5. При лечении легочной гипертензии одновременный прием силденафила или тадалафила и телапревира противопоказан.
Ингибиторы протонного насоса.
Эзомепразол. Экспозиция телапревира - без изменения - AUC - 0,98 (0,91-1,05), Сmах - 0,95 (0,86-1,06). Поскольку эзомепразол не влияет на концентрацию телапревира в плазме крови, то ингибиторы протонного насоса можно принимать без коррекции дозы.
|
|
Передозировка
Симптомы. При приеме телапревира в дозе 1875 мг каждые 8 ч в течение 4 дней наблюдались следующие побочные реакции - тошнота, головная боль, диарея, снижение аппетита, извращение вкуса и рвота.
Лечение. Специфического антидота для телапревира нет. Лечение передозировки включает общие поддерживающие меры, в тч контроль показателей жизненных функций и клинического состояния больного. При необходимости невсосавшееся активное вещество удаляют путем стимуляции рвоты или промыванием желудка. Также эффективен прием активированного угля.
Неизвестно, удаляется ли телапревир путем перитонеального диализа или гемодиализа.
Лечение. Специфического антидота для телапревира нет. Лечение передозировки включает общие поддерживающие меры, в тч контроль показателей жизненных функций и клинического состояния больного. При необходимости невсосавшееся активное вещество удаляют путем стимуляции рвоты или промыванием желудка. Также эффективен прием активированного угля.
Неизвестно, удаляется ли телапревир путем перитонеального диализа или гемодиализа.
Способ применения и дозы
Лечение должен проводить врач, обладающий достаточным опытом терапии хронического гепатита С.
Внутрь, по 2 табл. 375 мг (750 мг суммарно) 3 раза в день (каждые 8 ч) или по 3 табл. 375 мг (1125 мг суммарно) 2 раза в день во время еды. Общая суточная доза - 6 табл. (2250 мг). Прием натощак, а также несоблюдение режима дозирования может привести к снижению концентрации телапревира в плазме крови, что в результате может снизить его терапевтический эффект.
Телапревир следует назначать в комбинации с пэгинтерфероном альфа и рибавирином.
Внутрь, по 2 табл. 375 мг (750 мг суммарно) 3 раза в день (каждые 8 ч) или по 3 табл. 375 мг (1125 мг суммарно) 2 раза в день во время еды. Общая суточная доза - 6 табл. (2250 мг). Прием натощак, а также несоблюдение режима дозирования может привести к снижению концентрации телапревира в плазме крови, что в результате может снизить его терапевтический эффект.
Телапревир следует назначать в комбинации с пэгинтерфероном альфа и рибавирином.
Меры предосторожности применения
Общие. Телапревир следует применять только в комбинации с пэгинтерфероном альфа и рибавирином, в противном случае лечение будет неэффективно. Дозу телапревира нельзя снижать, это может привести к неэффективности терапии.
Телапревир нельзя применять в качестве монотерапии или только с пэгинтерфероном альфа или только с рибавирином.
Перед началом терапии телапревиром следует изучить инструкции по применению пэгинтерферона альфа и рибавирина. Клинических данных о применении телапревира у пациентов, не имевших эффекта терапии, включавшей ингибитор протеазы NS3/4A ВГС, или о повторном применении нет. Если требуется прекратить применение телапревира из-за возникновения серьезных нежелательных побочных реакций на ЛС или недостаточного вирусологического ответа, то впоследствии возобновлять лечение телапревиром нельзя.
Сыпь. На фоне лечения комбинацией телапревир, пэгинтерферон альфа и рибавирин были зафиксированы тяжелые формы кожных реакций (в тч токсический эпидермальный некролиз), потенциально способные создать угрозу жизни пациента или привести к летальному исходу. Летальные исходы наблюдались у пациентов с прогрессирующей сыпью, сопровождающейся системными проявлениями, продолжающих получать телапревир в составе комбинированной терапии после обнаружения сыпи тяжелой степени.
В ходе плацебо-контролируемых клинических исследований фазы 2 и 3 случаи возникновения лекарственной сыпи с эозинофилией и системной симптоматикой (DRESS-синдром) были отмечены у 0,4% пациентов. Случаи возникновения синдрома Стивенса-Джонсона были отмечены менее чем у 0,1% пациентов. Во всех случаях сыпь разрешалась после прекращения терапии. Пациент должен быть проинформирован о вероятности развития тяжелой сыпи и необходимости консультации с лечащим врачом при появлении новых высыпаний или усиления степени тяжести уже имеющейся сыпи.
Рекомендации по оценке степени тяжести и коррекции сыпи.
Сыпь легкой степени. Локализованная сыпь и/или локализованная сыпь с поражением ограниченной части поверхности тела (может появляться на нескольких изолированных участках тела). Следует контролировать прогрессию сыпи до полного разрешения симптомов.
Сыпь умеренной степени. Диффузная сыпь, охватывающая ≤50% поверхности тела. Следует контролировать прогрессию сыпи или системные симптомы до тех пор, пока сыпь не исчезнет. Рассмотреть возможность получения консультации дерматолога. В случае прогрессирования сыпи следует рассмотреть возможность прекращения применения телапревира. Если сыпь умеренной степени тяжести продолжает развиваться и улучшение не наступает в течение 7 дней после отмены телапревира, следует прекратить применение рибавирина. Может потребоваться более раннее прекращение приема рибавирина в случае значительного прогрессирования сыпи после отмены телапревира. Можно продолжить применение пэгинтерферона альфа, за исключением случаев, когда по медицинским показаниям требуется прекращение применения пэгинтерферона альфа. В случае прогрессирования сыпи умеренной степени до тяжелой (при поражении >50% площади тела) необходимо окончательно отменить прием телапревира.
Сыпь тяжелой степени. Сыпь захватывает >50% поверхности тела или связана со значительными системными симптомами, возникновением пузырьков, волдырей, язв на слизистых оболочках, поражением органов-мишеней, отслоением эпидермиса. Следует немедленно прекратить прием телапревира, проконсультироваться с дерматологом, контролировать состояние больного до исчезновения сыпи. Терапия рибавирином и пэгинтерфероном альфа может быть продолжена. Если не наблюдается улучшение состояния больного в течение 7 дней после отмены телапревира, рекомендуется одновременное или последовательное временное или постоянное прекращение приема рибавирина и/или пэгинтерферона альфа. По медицинским показаниям может потребоваться более раннее прекращение приема или отмена рибавирина и/или пэгинтерферона альфа.
Диагностирование или подозрение на генерализованную буллезную сыпь, DRESS-синдром, синдром Стивенса-Джонсона/токсический эпидермальный некролиз, острый генерализованный экзантематозный пустулез, полиморфную экссудативную эритему. Симптомы синдрома Стивенса-Джонсона: распространенная сыпь тяжелой степени с шелушением кожи, которая может сопровождаться лихорадкой, гриппоподобными симптомами, волдырями в ротовой полости, области глаз и/или на гениталиях. Следует немедленно полностью прекратить применение телапревира, пэгинтерферона альфа и рибавирина, обратиться за консультацией к дерматологу. Необходимо также рассмотреть возможность отмены других принимаемых ЛС, обладающих побочным действием в виде кожной сыпи тяжелой степени.
Нельзя возобновлять лечение телапревиром снова после его отмены.
Анемия. При применении телапревира в комбинации с пэгинтерфероном альфа и рибавирином повышается частота возникновения анемии, в тч тяжелой степени. Рекомендуется контролировать концентрацию Hb перед началом и во время терапии.
В случае отмены рибавирина в связи с развитием анемии также следует отменить терапию телапревиром. При отмене телапревира в связи с развитием анемии пациенты могут продолжать лечение рибавирином и пэгинтерфероном альфа в течение назначенного срока.
Лечение рибавирином можно возобновить согласно рекомендации по применению рибавирина. Нельзя уменьшать дозу телапревира и возобновлять лечение телапревиром в случае его отмены.
RxList.com.
Анемия. О развитии анемии сообщалось при терапии пэгинтерфероном альфа и рибавирином. Добавление телапревира к пэгинтерферону альфа и рибавирину ассоциировано с дополнительным снижением концентрации Hb. Снижение уровня Hb происходило в течение первых 4 нед лечения, достигая самых низких значений в конце лечения телапревиром. После прекращения приема телапревира содержание Hb постепенно возвращалось к уровням, наблюдавшимся при применении пэгинтерферона альфа и рибавирина. Значения Hb ≤10 г/дл наблюдались у 36% пациентов, получавших комбинированное лечение с телапревиром, по сравнению с 17% пациентов, получавших только пэгинтерферон альфа и рибавирин. В клинических испытаниях снижение Hb ≤10 г/дл отмечалось по времени раньше у пациентов, получавших комбинированное лечение с телапревиром, по сравнению с теми, кто получал пэгинтерферон альфа и рибавирин: 56 дней (диапазон 8-365 дней) против 63 дней (диапазон 13-341 дней) соответственно. Значения Hb <8,5 г/дл наблюдались у 14% пациентов, получавших комбинированное лечение с телапревиром, по сравнению с 5% пациентов, получавших пэгинтерферон альфа и рибавирин.
Среди пациентов, получавших комбинированное лечение с телапривиром, у 32% было необходимым изменение дозы рибавирина (снижение, приостановка или прекращение) из-за развития анемии, у 6% - переливание крови, у 4% - отмена телапривира и у 1% лечение данной комбинацией с телапривиром было прекращено. Среди пациентов, получавших только пэгинтерферон альфа и рибавирин, у 12% было необходимо изменение дозы рибавирина вследствие анемии, у 1% - переливание крови и менее 1% прекратили лечение. Сообщалось, что анемия, потребовавшая снижения дозы рибавирина, переливания крови и/или применения средств, стимулирующих эритропоэз, развивалась через 10 дней после начала комбинированной терапии с телапривиром.
Уровень Hb следует контролировать до и по меньшей мере на 2, 4, 8 и 12-й нед в течение проведения комбинированной терапии с телапревиром и по клиническим показаниям. Для некоторых пациентов может понадобиться более раннее и частое наблюдение. Для устранения анемии следует использовать снижение дозы рибавирина. Если снижение дозы рибавирина является недостаточным, следует рассмотреть вопрос о прекращении приема телапривира. Если с целью устранения анемии применение рибавирина прекращено, то прием телапревира также должен быть прекращен. Впоследствии применение рибавирина можно возобновить. Дозу телапривира нельзя снижать, и в случае отмены телапривира его прием не должен быть возобновлен.
Беременность и требования к контрацепции. Поскольку телапревир принимается вместе с пэгинтерфероном альфа и рибавирином, то противопоказания и меры предосторожности, относящиеся к этим ЛС, также относятся и к комбинированной терапии.
Лечение можно начинать только после получения отрицательного результата теста на беременность, проведенного непосредственно перед началом лечения.
Тест на отсутствие беременности следует проводить ежемесячно в период комбинированной терапии и в течение 6 мес после завершения лечения. Применение телапревира одновременно с гормональными контрацептивами, содержащими эстроген, снижает системное воздействие этинилэстрадиола. Поскольку гормональные контрацептивы в период лечения телапревиром могут быть ненадежны, то пациентки, способные к деторождению, должны пользоваться двумя другими эффективными негормональными методами контрацепции в период проведения комбинированной терапии, включающей телапревир, и в течение 2 мес после последнего приема телапревира. Например, можно использовать мужской презерватив со спермицидным гелем или женский презерватив со спермицидным гелем (не оба одновременно), диафрагму со спермицидным гелем, колпачок на шейку матки со спермицидным гелем. Через 2 мес после завершения лечения телапревиром можно возобновить прием гормональных контрацептивов, содержащих эстроген, как один из двух необходимых эффективных методов контрацепции, однако следует учитывать рекомендации, приводимые в описаниях соответствующих ЛС.
Пациенты, чьи партнерши беременны, должны использовать презерватив для минимизации воздействия рибавирина на партнершу.
Лекарственные взаимодействия. Список ЛС, которые нельзя принимать одновременно с телапревиром из-за возможных угрожающих жизни неблагоприятных явлений, значительных лекарственных взаимодействий или потери терапевтического эффекта телапревира, приведен в разделе «Противопоказания». Другие известные и потенциально значимые лекарственные взаимодействия описаны в разделе «Взаимодействие». Согласно данным исследований in vitro >in vitro, телапревир не является субстратом полипептидных переносчиков органических анионов - ОАТР1В1 и ОАТР2В1, но является их ингибитором. Таким образом, следует с осторожностью применять телапревир одновременно с субстратами полипептидных переносчиков органических анионов (например флувастатин, правастатин, розувастатин и репаглинид).
Удлинение интервала QТ. Следует соблюдать осторожность при одновременном назначении телапревира с ЛС, являющимися субстратами изофермента сYP3A и увеличивающими интервал QT, такими как эритромицин, кларитромицин, телитромицин, позаконазол, вориконазол, кетоконазол, такролимус, салметерол. Следует избегать одновременного назначения домперидона и телапревира. Поскольку телапревир также является субстратом изофермента сYP3A, он может ингибировать метаболизм этих ЛС. Результатом этого может быть усиление или пролонгирование их действия, в тч и побочных эффектов со стороны ССС. В случае, если одновременное назначение телапревира и таких ЛС является необходимым, следует проводить тщательный контроль клинического состояния больного, в тч контроль ЭКГ.
Телапревир не должен применяться одновременно с пропафеноном и флекаинидом ( см «Противопоказания»).
Следует избегать назначения телапревира пациентам, имеющим врожденное удлинение интервала QT или врожденное удлинение интервала QT и случаи внезапной смерти в семейном анамнезе. В том случае, если назначение телапревира таким пациентам является необходимым, следует проводить тщательный контроль клинического состояния больного, в тч контроль ЭКГ.
Телапревир следует с осторожностью назначать следующим группам пациентов:
- с приобретенным удлинением интервала QT в анамнезе;
- с клинически значимой брадикардией (стойкая ЧСС менее 50 уд./мин);
- с сердечной недостаточностью со снижением фракции выброса левого желудочка в анамнезе;
- нуждающихся в применении ЛС, которые способны удлинять интервал QT, но метаболизм которых не сильно зависит от изофермента сYP3A4 (например метадон).
Электролитные нарушения (такие как гипокалиемия, гипомагниемия и гипокальциемия) подлежат контролю и при необходимости коррекции - до начала и на всем протяжении терапии телапревиром.
Лабораторные показатели. Наличие РНК ВГС следует контролировать на 4-й и 12-й нед, а также в соответствии с клиническими показаниями. У всех пациентов до начала комбинированного лечения с применением телапревира необходимо провести следующие лабораторные исследования: полный анализ крови с лейкоцитарной формулой, концентрация электролитов, сывороточного креатинина, ТТГ, мочевой кислоты.
Ниже приведены рекомендованные исходные значения лабораторных показателей, при которых возможно начало комбинированного лечения с применением телапревира:
- Hb ≥12 г/дл (женщины); ≥13 г/дл (мужчины);
- тромбоциты ≥90000/мм3;
- абсолютное число нейтрофилов >1500/мм3;
- адекватно контролируемая функция щитовидной железы (ТТГ);
- расчетный сl креатинина ≥50 мл/мин;
- концентрация калия ≥3,5 ммоль/л;
- альбумин >3,3 г/дл.
Проведение общих анализов крови (в тч с анализом лейкоцитарной формулы) рекомендуется на 2, 4, 8 и 12-й нед, а далее по клиническим показаниям.
Биохимический анализ крови (концентрация электролитов, сывороточного креатинина, мочевой кислоты, печеночных ферментов, билирубина, ТТГ) рекомендуется проводить с той же частотой, что и общие анализы крови, или в соответствии с клиническими показаниями.
Недостаточный ответ на лечение. У пациентов с неудовлетворительным ответом на противовирусную терапию следует прекратить лечение.
Использование телапревира в комбинации с пэгинтерфероном альфа-2b. Все клинические исследования фазы 3 проводились с использованием пэгинтерферона альфа-2а в комбинации с телапревиром и рибавирином. Данные по применению телапревира в комбинации с пэгинтерфероном альфа-2b у пациентов, ранее получавших лечение, отсутствуют, а данные по применению у пациентов, ранее не получавших лечение, ограничены. У пациентов, ранее не получавших лечение, при проведении терапии пэгинтерфероном альфа-2а/рибавирином (n=80) или пэгинтерфероном альфа-2b/рибавирином (n=81) в комбинации с телапревиром в открытом исследовании отмечена сопоставимая частота стойкого вирусологического ответа. Однако у пациентов, получавших терапию пэгинтерфероном альфа-2b, чаще наблюдалось увеличение вирусной нагрузки, и они реже соответствовали критериям сокращения общей продолжительности терапии.
Применение телапревира при лечении других генотипов ВГС. Не имеется достаточных клинических данных о лечении пациентов с другими генотипами ВГС, помимо 1-го. В связи с этим применение телапревира у пациентов с другими генотипами ВГС, помимо 1-го, не рекомендуется.
Использование у пациентов с запущенными заболеваниями печени. Гипоальбуминемия и снижение числа тромбоцитов были отмечены как предвестники серьезных осложнений болезней печени, также, как и при терапии интерферонами (в тч печеночная недостаточность, тяжелые бактериальные инфекции). Кроме того, у пациентов с данными характеристиками, получающих телапревир в комбинации с пэгинтерфероном и рибавирином, отмечалась высокая частота анемий. Телапревир в комбинации с пэгинтерфероном и рибавирином не рекомендован к применению у пациентов с показателями тромбоцитов <90000/мм3 и/или альбумина <3,3 г/дл. Если телапревир применяют в лечении пациентов с запущенными заболеваниями печени, рекомендованы тщательный мониторинг и раннее отслеживание побочных эффектов.
Нарушение функции почек. Безопасность и эффективность не были установлены в отношении пациентов с нарушением функции почек средней или тяжелой степени (Cl креатинина <50 мл/мин) или пациентов, находящихся на гемодиализе.
Нарушение функции печени. Применение телапревира у пациентов с тяжелым нарушением функции печени (класс С, >10 баллов по шкале Чайлд-Пью) или декомпенсированным циррозом печени (асцит, кровотечение вследствие портальной гипертензии, энцефалопатия или желтуха, не обусловленная синдромом Жильбера) не изучалось. Поэтому применение телапревира у таких пациентов не рекомендуется.
Применение телапревира также не изучено у пациентов с нарушением функции печени средней степени тяжести (класс В, 7-9 баллов по шкале Чайлд-Пью). Рекомендуемые дозы телапревира для этой категории пациентов не установлены. Поэтому назначение телапревира данной категории пациентов не рекомендуется.
Описания пэгинтерферона альфа и рибавирина, которые должны назначаться одновременно с телапревиром.
Трансплантация. Были проведены исследования по применению телапревира в комбинации с пэгинтерфероном альфа и рибавирином у пациентов с ВГС 1-го генотипа, перенесших трансплантацию печени, без цирроза, со стабильным печеночным трансплантантом, получающих такролимус или циклоспорин А. Профиль безопасности при лечении пациентов, не получавших ранее терапии, а также уже получавших ее, подвергшихся трансплантации донорской печени, при постоянном введении иммунодспрессантов такролимуса или циклоспорина А был сопоставим с профилем безопасности у пациентов, не подвергавшихся трансплантации.
Не имеется клинических данных относительно лечения пациентов телапревиром в комбинации с пэгинтерфероном альфа и рибавирином перед трансплантацией или в перитрансплантационном периоде.
Коинфекция ВГС/ВИЧ (вирусом иммунодефицита человека). Применение телапревира в комбинации с пэгинтерфероном альфа и рибавирином у пациентов с коинфекцией ВГС/ВИЧ было оценено в исследовании с участием ВИЧ-инфицированных больных, при этом одна группа пациентов ранее не получала антиретровирусное лечение, другая группа - получала. Профиль безопасности телапревира при лечении пациентов с коинфекцией, которые ранее не получали или получали антиретровирусную терапию, был сопоставим с профилем безопасности телапревира при лечении моноинфицированных пациентов (только ВГС). Исключением были пациенты, получавшие одновременно антиретровирусную терапию атазанавиром/ритонавиром, у которых наблюдалось кратковременное повышение концентрации билирубина на 2-й нед лечения. Концентрация билирубина возвращалась к норме к 12-й нед лечения.
Сопутствующая инфекция ВГС/ВГВ (вирусом гепатита В). Не имеется данных о применении телапревира у пациентов с сопутствующей инфекцией ВГС/ВГВ.
Применение у детей. Телапревир не рекомендуется применять у детей и подростков младше 18 лет, поскольку его безопасность и эффективность в этой популяции не установлены.
Заболевания щитовидной железы. Во время комбинированного лечения, включающего телапревир, возможно повышение в крови концентрации ТТГ, которое может свидетельствовать об усугублении или рецидиве ранее имевшегося или перенесенного в прошлом гипотиреоза или о возникновении гипотиреоза de novo. Концентрацию ТТГ в крови следует контролировать до и во время лечения комбинацией, включающей телапревир. Лечение проводится в соответствии с клинической целесообразностью, в тч может потребоваться коррекция дозы заместительной терапии тиреоидными гормонами у пациентов с уже существующим гипотиреозом.
Важная информация о некоторых вспомогательных веществах, входящих в состав таблеток телапревира. Данная лекарственная форма содержит 2,3 мг натрия в одной таблетке, что необходимо принимать во внимание при лечении пациентов, получающих диету с контролируемым содержанием натрия.
Влияние на способность управлять транспортными средствами, механизмами. Телапревир не оказывает или оказывает незначительное влияние на способность управлять транспортными средствами и работать с механизмами. Соответствующих исследований не проводилось. Обморок и ретинопатия были зарегистрированы у некоторых пациентов, принимающих телапревир, что необходимо учитывать при оценке способности пациента управлять транспортными средствами или работать с механизмами.
Телапревир нельзя применять в качестве монотерапии или только с пэгинтерфероном альфа или только с рибавирином.
Перед началом терапии телапревиром следует изучить инструкции по применению пэгинтерферона альфа и рибавирина. Клинических данных о применении телапревира у пациентов, не имевших эффекта терапии, включавшей ингибитор протеазы NS3/4A ВГС, или о повторном применении нет. Если требуется прекратить применение телапревира из-за возникновения серьезных нежелательных побочных реакций на ЛС или недостаточного вирусологического ответа, то впоследствии возобновлять лечение телапревиром нельзя.
Сыпь. На фоне лечения комбинацией телапревир, пэгинтерферон альфа и рибавирин были зафиксированы тяжелые формы кожных реакций (в тч токсический эпидермальный некролиз), потенциально способные создать угрозу жизни пациента или привести к летальному исходу. Летальные исходы наблюдались у пациентов с прогрессирующей сыпью, сопровождающейся системными проявлениями, продолжающих получать телапревир в составе комбинированной терапии после обнаружения сыпи тяжелой степени.
В ходе плацебо-контролируемых клинических исследований фазы 2 и 3 случаи возникновения лекарственной сыпи с эозинофилией и системной симптоматикой (DRESS-синдром) были отмечены у 0,4% пациентов. Случаи возникновения синдрома Стивенса-Джонсона были отмечены менее чем у 0,1% пациентов. Во всех случаях сыпь разрешалась после прекращения терапии. Пациент должен быть проинформирован о вероятности развития тяжелой сыпи и необходимости консультации с лечащим врачом при появлении новых высыпаний или усиления степени тяжести уже имеющейся сыпи.
Рекомендации по оценке степени тяжести и коррекции сыпи.
Сыпь легкой степени. Локализованная сыпь и/или локализованная сыпь с поражением ограниченной части поверхности тела (может появляться на нескольких изолированных участках тела). Следует контролировать прогрессию сыпи до полного разрешения симптомов.
Сыпь умеренной степени. Диффузная сыпь, охватывающая ≤50% поверхности тела. Следует контролировать прогрессию сыпи или системные симптомы до тех пор, пока сыпь не исчезнет. Рассмотреть возможность получения консультации дерматолога. В случае прогрессирования сыпи следует рассмотреть возможность прекращения применения телапревира. Если сыпь умеренной степени тяжести продолжает развиваться и улучшение не наступает в течение 7 дней после отмены телапревира, следует прекратить применение рибавирина. Может потребоваться более раннее прекращение приема рибавирина в случае значительного прогрессирования сыпи после отмены телапревира. Можно продолжить применение пэгинтерферона альфа, за исключением случаев, когда по медицинским показаниям требуется прекращение применения пэгинтерферона альфа. В случае прогрессирования сыпи умеренной степени до тяжелой (при поражении >50% площади тела) необходимо окончательно отменить прием телапревира.
Сыпь тяжелой степени. Сыпь захватывает >50% поверхности тела или связана со значительными системными симптомами, возникновением пузырьков, волдырей, язв на слизистых оболочках, поражением органов-мишеней, отслоением эпидермиса. Следует немедленно прекратить прием телапревира, проконсультироваться с дерматологом, контролировать состояние больного до исчезновения сыпи. Терапия рибавирином и пэгинтерфероном альфа может быть продолжена. Если не наблюдается улучшение состояния больного в течение 7 дней после отмены телапревира, рекомендуется одновременное или последовательное временное или постоянное прекращение приема рибавирина и/или пэгинтерферона альфа. По медицинским показаниям может потребоваться более раннее прекращение приема или отмена рибавирина и/или пэгинтерферона альфа.
Диагностирование или подозрение на генерализованную буллезную сыпь, DRESS-синдром, синдром Стивенса-Джонсона/токсический эпидермальный некролиз, острый генерализованный экзантематозный пустулез, полиморфную экссудативную эритему. Симптомы синдрома Стивенса-Джонсона: распространенная сыпь тяжелой степени с шелушением кожи, которая может сопровождаться лихорадкой, гриппоподобными симптомами, волдырями в ротовой полости, области глаз и/или на гениталиях. Следует немедленно полностью прекратить применение телапревира, пэгинтерферона альфа и рибавирина, обратиться за консультацией к дерматологу. Необходимо также рассмотреть возможность отмены других принимаемых ЛС, обладающих побочным действием в виде кожной сыпи тяжелой степени.
Нельзя возобновлять лечение телапревиром снова после его отмены.
Анемия. При применении телапревира в комбинации с пэгинтерфероном альфа и рибавирином повышается частота возникновения анемии, в тч тяжелой степени. Рекомендуется контролировать концентрацию Hb перед началом и во время терапии.
В случае отмены рибавирина в связи с развитием анемии также следует отменить терапию телапревиром. При отмене телапревира в связи с развитием анемии пациенты могут продолжать лечение рибавирином и пэгинтерфероном альфа в течение назначенного срока.
Лечение рибавирином можно возобновить согласно рекомендации по применению рибавирина. Нельзя уменьшать дозу телапревира и возобновлять лечение телапревиром в случае его отмены.
RxList.com.
Анемия. О развитии анемии сообщалось при терапии пэгинтерфероном альфа и рибавирином. Добавление телапревира к пэгинтерферону альфа и рибавирину ассоциировано с дополнительным снижением концентрации Hb. Снижение уровня Hb происходило в течение первых 4 нед лечения, достигая самых низких значений в конце лечения телапревиром. После прекращения приема телапревира содержание Hb постепенно возвращалось к уровням, наблюдавшимся при применении пэгинтерферона альфа и рибавирина. Значения Hb ≤10 г/дл наблюдались у 36% пациентов, получавших комбинированное лечение с телапревиром, по сравнению с 17% пациентов, получавших только пэгинтерферон альфа и рибавирин. В клинических испытаниях снижение Hb ≤10 г/дл отмечалось по времени раньше у пациентов, получавших комбинированное лечение с телапревиром, по сравнению с теми, кто получал пэгинтерферон альфа и рибавирин: 56 дней (диапазон 8-365 дней) против 63 дней (диапазон 13-341 дней) соответственно. Значения Hb <8,5 г/дл наблюдались у 14% пациентов, получавших комбинированное лечение с телапревиром, по сравнению с 5% пациентов, получавших пэгинтерферон альфа и рибавирин.
Среди пациентов, получавших комбинированное лечение с телапривиром, у 32% было необходимым изменение дозы рибавирина (снижение, приостановка или прекращение) из-за развития анемии, у 6% - переливание крови, у 4% - отмена телапривира и у 1% лечение данной комбинацией с телапривиром было прекращено. Среди пациентов, получавших только пэгинтерферон альфа и рибавирин, у 12% было необходимо изменение дозы рибавирина вследствие анемии, у 1% - переливание крови и менее 1% прекратили лечение. Сообщалось, что анемия, потребовавшая снижения дозы рибавирина, переливания крови и/или применения средств, стимулирующих эритропоэз, развивалась через 10 дней после начала комбинированной терапии с телапривиром.
Уровень Hb следует контролировать до и по меньшей мере на 2, 4, 8 и 12-й нед в течение проведения комбинированной терапии с телапревиром и по клиническим показаниям. Для некоторых пациентов может понадобиться более раннее и частое наблюдение. Для устранения анемии следует использовать снижение дозы рибавирина. Если снижение дозы рибавирина является недостаточным, следует рассмотреть вопрос о прекращении приема телапривира. Если с целью устранения анемии применение рибавирина прекращено, то прием телапревира также должен быть прекращен. Впоследствии применение рибавирина можно возобновить. Дозу телапривира нельзя снижать, и в случае отмены телапривира его прием не должен быть возобновлен.
Беременность и требования к контрацепции. Поскольку телапревир принимается вместе с пэгинтерфероном альфа и рибавирином, то противопоказания и меры предосторожности, относящиеся к этим ЛС, также относятся и к комбинированной терапии.
Лечение можно начинать только после получения отрицательного результата теста на беременность, проведенного непосредственно перед началом лечения.
Тест на отсутствие беременности следует проводить ежемесячно в период комбинированной терапии и в течение 6 мес после завершения лечения. Применение телапревира одновременно с гормональными контрацептивами, содержащими эстроген, снижает системное воздействие этинилэстрадиола. Поскольку гормональные контрацептивы в период лечения телапревиром могут быть ненадежны, то пациентки, способные к деторождению, должны пользоваться двумя другими эффективными негормональными методами контрацепции в период проведения комбинированной терапии, включающей телапревир, и в течение 2 мес после последнего приема телапревира. Например, можно использовать мужской презерватив со спермицидным гелем или женский презерватив со спермицидным гелем (не оба одновременно), диафрагму со спермицидным гелем, колпачок на шейку матки со спермицидным гелем. Через 2 мес после завершения лечения телапревиром можно возобновить прием гормональных контрацептивов, содержащих эстроген, как один из двух необходимых эффективных методов контрацепции, однако следует учитывать рекомендации, приводимые в описаниях соответствующих ЛС.
Пациенты, чьи партнерши беременны, должны использовать презерватив для минимизации воздействия рибавирина на партнершу.
Лекарственные взаимодействия. Список ЛС, которые нельзя принимать одновременно с телапревиром из-за возможных угрожающих жизни неблагоприятных явлений, значительных лекарственных взаимодействий или потери терапевтического эффекта телапревира, приведен в разделе «Противопоказания». Другие известные и потенциально значимые лекарственные взаимодействия описаны в разделе «Взаимодействие». Согласно данным исследований in vitro >in vitro, телапревир не является субстратом полипептидных переносчиков органических анионов - ОАТР1В1 и ОАТР2В1, но является их ингибитором. Таким образом, следует с осторожностью применять телапревир одновременно с субстратами полипептидных переносчиков органических анионов (например флувастатин, правастатин, розувастатин и репаглинид).
Удлинение интервала QТ. Следует соблюдать осторожность при одновременном назначении телапревира с ЛС, являющимися субстратами изофермента сYP3A и увеличивающими интервал QT, такими как эритромицин, кларитромицин, телитромицин, позаконазол, вориконазол, кетоконазол, такролимус, салметерол. Следует избегать одновременного назначения домперидона и телапревира. Поскольку телапревир также является субстратом изофермента сYP3A, он может ингибировать метаболизм этих ЛС. Результатом этого может быть усиление или пролонгирование их действия, в тч и побочных эффектов со стороны ССС. В случае, если одновременное назначение телапревира и таких ЛС является необходимым, следует проводить тщательный контроль клинического состояния больного, в тч контроль ЭКГ.
Телапревир не должен применяться одновременно с пропафеноном и флекаинидом ( см «Противопоказания»).
Следует избегать назначения телапревира пациентам, имеющим врожденное удлинение интервала QT или врожденное удлинение интервала QT и случаи внезапной смерти в семейном анамнезе. В том случае, если назначение телапревира таким пациентам является необходимым, следует проводить тщательный контроль клинического состояния больного, в тч контроль ЭКГ.
Телапревир следует с осторожностью назначать следующим группам пациентов:
- с приобретенным удлинением интервала QT в анамнезе;
- с клинически значимой брадикардией (стойкая ЧСС менее 50 уд./мин);
- с сердечной недостаточностью со снижением фракции выброса левого желудочка в анамнезе;
- нуждающихся в применении ЛС, которые способны удлинять интервал QT, но метаболизм которых не сильно зависит от изофермента сYP3A4 (например метадон).
Электролитные нарушения (такие как гипокалиемия, гипомагниемия и гипокальциемия) подлежат контролю и при необходимости коррекции - до начала и на всем протяжении терапии телапревиром.
Лабораторные показатели. Наличие РНК ВГС следует контролировать на 4-й и 12-й нед, а также в соответствии с клиническими показаниями. У всех пациентов до начала комбинированного лечения с применением телапревира необходимо провести следующие лабораторные исследования: полный анализ крови с лейкоцитарной формулой, концентрация электролитов, сывороточного креатинина, ТТГ, мочевой кислоты.
Ниже приведены рекомендованные исходные значения лабораторных показателей, при которых возможно начало комбинированного лечения с применением телапревира:
- Hb ≥12 г/дл (женщины); ≥13 г/дл (мужчины);
- тромбоциты ≥90000/мм3;
- абсолютное число нейтрофилов >1500/мм3;
- адекватно контролируемая функция щитовидной железы (ТТГ);
- расчетный сl креатинина ≥50 мл/мин;
- концентрация калия ≥3,5 ммоль/л;
- альбумин >3,3 г/дл.
Проведение общих анализов крови (в тч с анализом лейкоцитарной формулы) рекомендуется на 2, 4, 8 и 12-й нед, а далее по клиническим показаниям.
Биохимический анализ крови (концентрация электролитов, сывороточного креатинина, мочевой кислоты, печеночных ферментов, билирубина, ТТГ) рекомендуется проводить с той же частотой, что и общие анализы крови, или в соответствии с клиническими показаниями.
Недостаточный ответ на лечение. У пациентов с неудовлетворительным ответом на противовирусную терапию следует прекратить лечение.
Использование телапревира в комбинации с пэгинтерфероном альфа-2b. Все клинические исследования фазы 3 проводились с использованием пэгинтерферона альфа-2а в комбинации с телапревиром и рибавирином. Данные по применению телапревира в комбинации с пэгинтерфероном альфа-2b у пациентов, ранее получавших лечение, отсутствуют, а данные по применению у пациентов, ранее не получавших лечение, ограничены. У пациентов, ранее не получавших лечение, при проведении терапии пэгинтерфероном альфа-2а/рибавирином (n=80) или пэгинтерфероном альфа-2b/рибавирином (n=81) в комбинации с телапревиром в открытом исследовании отмечена сопоставимая частота стойкого вирусологического ответа. Однако у пациентов, получавших терапию пэгинтерфероном альфа-2b, чаще наблюдалось увеличение вирусной нагрузки, и они реже соответствовали критериям сокращения общей продолжительности терапии.
Применение телапревира при лечении других генотипов ВГС. Не имеется достаточных клинических данных о лечении пациентов с другими генотипами ВГС, помимо 1-го. В связи с этим применение телапревира у пациентов с другими генотипами ВГС, помимо 1-го, не рекомендуется.
Использование у пациентов с запущенными заболеваниями печени. Гипоальбуминемия и снижение числа тромбоцитов были отмечены как предвестники серьезных осложнений болезней печени, также, как и при терапии интерферонами (в тч печеночная недостаточность, тяжелые бактериальные инфекции). Кроме того, у пациентов с данными характеристиками, получающих телапревир в комбинации с пэгинтерфероном и рибавирином, отмечалась высокая частота анемий. Телапревир в комбинации с пэгинтерфероном и рибавирином не рекомендован к применению у пациентов с показателями тромбоцитов <90000/мм3 и/или альбумина <3,3 г/дл. Если телапревир применяют в лечении пациентов с запущенными заболеваниями печени, рекомендованы тщательный мониторинг и раннее отслеживание побочных эффектов.
Нарушение функции почек. Безопасность и эффективность не были установлены в отношении пациентов с нарушением функции почек средней или тяжелой степени (Cl креатинина <50 мл/мин) или пациентов, находящихся на гемодиализе.
Нарушение функции печени. Применение телапревира у пациентов с тяжелым нарушением функции печени (класс С, >10 баллов по шкале Чайлд-Пью) или декомпенсированным циррозом печени (асцит, кровотечение вследствие портальной гипертензии, энцефалопатия или желтуха, не обусловленная синдромом Жильбера) не изучалось. Поэтому применение телапревира у таких пациентов не рекомендуется.
Применение телапревира также не изучено у пациентов с нарушением функции печени средней степени тяжести (класс В, 7-9 баллов по шкале Чайлд-Пью). Рекомендуемые дозы телапревира для этой категории пациентов не установлены. Поэтому назначение телапревира данной категории пациентов не рекомендуется.
Описания пэгинтерферона альфа и рибавирина, которые должны назначаться одновременно с телапревиром.
Трансплантация. Были проведены исследования по применению телапревира в комбинации с пэгинтерфероном альфа и рибавирином у пациентов с ВГС 1-го генотипа, перенесших трансплантацию печени, без цирроза, со стабильным печеночным трансплантантом, получающих такролимус или циклоспорин А. Профиль безопасности при лечении пациентов, не получавших ранее терапии, а также уже получавших ее, подвергшихся трансплантации донорской печени, при постоянном введении иммунодспрессантов такролимуса или циклоспорина А был сопоставим с профилем безопасности у пациентов, не подвергавшихся трансплантации.
Не имеется клинических данных относительно лечения пациентов телапревиром в комбинации с пэгинтерфероном альфа и рибавирином перед трансплантацией или в перитрансплантационном периоде.
Коинфекция ВГС/ВИЧ (вирусом иммунодефицита человека). Применение телапревира в комбинации с пэгинтерфероном альфа и рибавирином у пациентов с коинфекцией ВГС/ВИЧ было оценено в исследовании с участием ВИЧ-инфицированных больных, при этом одна группа пациентов ранее не получала антиретровирусное лечение, другая группа - получала. Профиль безопасности телапревира при лечении пациентов с коинфекцией, которые ранее не получали или получали антиретровирусную терапию, был сопоставим с профилем безопасности телапревира при лечении моноинфицированных пациентов (только ВГС). Исключением были пациенты, получавшие одновременно антиретровирусную терапию атазанавиром/ритонавиром, у которых наблюдалось кратковременное повышение концентрации билирубина на 2-й нед лечения. Концентрация билирубина возвращалась к норме к 12-й нед лечения.
Сопутствующая инфекция ВГС/ВГВ (вирусом гепатита В). Не имеется данных о применении телапревира у пациентов с сопутствующей инфекцией ВГС/ВГВ.
Применение у детей. Телапревир не рекомендуется применять у детей и подростков младше 18 лет, поскольку его безопасность и эффективность в этой популяции не установлены.
Заболевания щитовидной железы. Во время комбинированного лечения, включающего телапревир, возможно повышение в крови концентрации ТТГ, которое может свидетельствовать об усугублении или рецидиве ранее имевшегося или перенесенного в прошлом гипотиреоза или о возникновении гипотиреоза de novo. Концентрацию ТТГ в крови следует контролировать до и во время лечения комбинацией, включающей телапревир. Лечение проводится в соответствии с клинической целесообразностью, в тч может потребоваться коррекция дозы заместительной терапии тиреоидными гормонами у пациентов с уже существующим гипотиреозом.
Важная информация о некоторых вспомогательных веществах, входящих в состав таблеток телапревира. Данная лекарственная форма содержит 2,3 мг натрия в одной таблетке, что необходимо принимать во внимание при лечении пациентов, получающих диету с контролируемым содержанием натрия.
Влияние на способность управлять транспортными средствами, механизмами. Телапревир не оказывает или оказывает незначительное влияние на способность управлять транспортными средствами и работать с механизмами. Соответствующих исследований не проводилось. Обморок и ретинопатия были зарегистрированы у некоторых пациентов, принимающих телапревир, что необходимо учитывать при оценке способности пациента управлять транспортными средствами или работать с механизмами.
|
|
Список литературы
Обобщенные материалы www.grls.rosminzdrav.ru, 2015 и www.rxlist.com, 2016.