Другие названия и синонимы
Ixabepilone.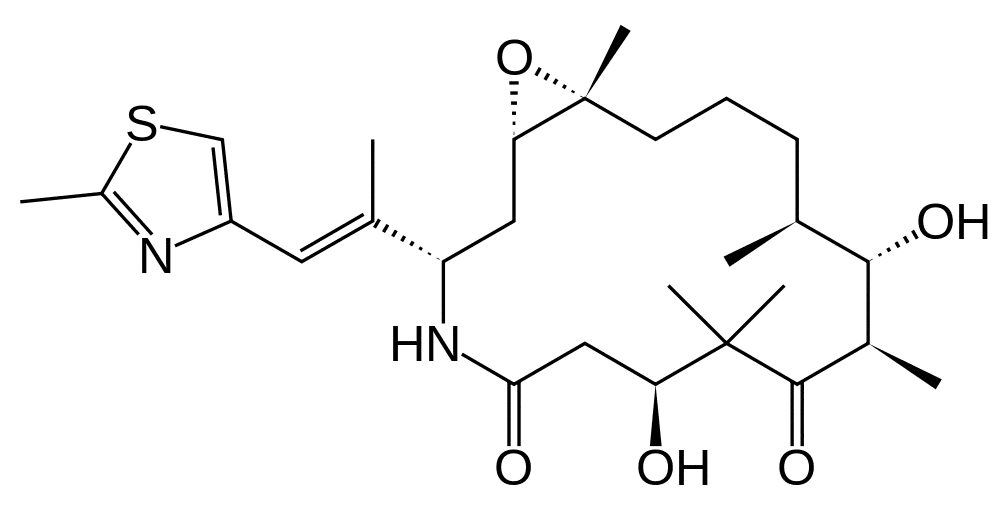
Фармакологическая группа
|
|
Латинское название
Ixabepilonum ( Ixabepiloni)[[c.
(1R,5S,6S,7R,10S,14S,16S)-6,10-Дигидрокси-1,5,7,9,9-пентаметил-14-[(E)-1-(2-метил-1,3-тиазол-4-ил)проп-1-ен-2-ил]-17-окса-13-азабицикло[14.1.0] гептадекан-8,12-дион.
(1R,5S,6S,7R,10S,14S,16S)-6,10-Дигидрокси-1,5,7,9,9-пентаметил-14-[(E)-1-(2-метил-1,3-тиазол-4-ил)проп-1-ен-2-ил]-17-окса-13-азабицикло[14.1.0] гептадекан-8,12-дион.
Код CAS
219989-84-1.
При беременности и кормлении грудью
Данные по адекватным и хорошо контролируемым исследованиям препарата Икземпра у беременных женщин отсутствуют.
Согласно результатам доклинических исследований у животных, препарат обладает эмбриотоксическим действием. При применении препарата Икземпра женщинам следует рекомендовать отказаться от зачатия. Если это лекарство используют во время беременности или беременность наступила в период лечения препаратом Икземпра, то пациентка должна быть извещена о потенциальном вреде для плода.
Неизвестно, проникает ли иксабепилон в грудное молоко. На основании оценки соотношения пользы/риска для организма пациентки, лечащий врач должен принять решение либо о прекращении терапии, либо о прекращении грудного вскармливания.[[t.
L01DC04 Иксабепилон.
Согласно результатам доклинических исследований у животных, препарат обладает эмбриотоксическим действием. При применении препарата Икземпра женщинам следует рекомендовать отказаться от зачатия. Если это лекарство используют во время беременности или беременность наступила в период лечения препаратом Икземпра, то пациентка должна быть извещена о потенциальном вреде для плода.
Неизвестно, проникает ли иксабепилон в грудное молоко. На основании оценки соотношения пользы/риска для организма пациентки, лечащий врач должен принять решение либо о прекращении терапии, либо о прекращении грудного вскармливания.[[t.
L01DC04 Иксабепилон.
Нозологии
Список кодов МКБ-10.
Фармакодинамика
Препарат Икземпра (иксабепилон) является представителем нового класса противоопухолевых препаратов - эпотилонов и их аналогов. Природные эпотилоны выделены из миксобактерии Sorangium cellulosum. Эпотилоны обладают способностью стабилизировать динамику микротрубочек, что приводит к блокаде митоза опухолевых клеток и в конечном счете к их апоптозу и гибели. Механизм связывания природных эпотилонов и их аналогов с тубулином отличается от такового у других веществ, стабилизирующих микротрубочки. Иксабепилон - полусинтетический аналог эпотилона В, 16-членного поликетидного макролида, в котором лактон заменен на химически модифицированный лактам, что позволило повысить его стабильность, степень связывания с белками и противоопухолевое действие.
Иксабепилон обладает низкой чувствительностью ко многим факторам опухолевой устойчивости, в тч к таким переносчикам, как протеин множественной лекарственной устойчивости (MRP-1) и Р-гликопротеин (P-gp) , участвующим в формировании врожденной и приобретенной устойчивости к действию противоопухолевых средств. Связываясь с тубулином, иксабепилон активно ингибирует динамику микротрубочек различных изоформ β-тубулина, в тч βIII-изоформ тубулина, избыточную экспрессию которого связывают с развитием устойчивости к таксанам.
В условиях in vivo иксабепилон активен на различных моделях опухоли человека, включая устойчивые к действию противоопухолевых средств типы опухоли, вызывающие избыточную экспрессию P-gp, MRP-1, βIII-изоформ тубулина либо индуцируемые мутациями тубулина. Иксабепилон проявляет активность на моделях опухолей, устойчивых к действию различных препаратов, в тч таксанов, антрациклинов и алкалоидов барвинка. В сочетании с капецитабином в условиях in vivo наблюдается синергизм противоопухолевой активности обоих препаратов. Помимо непосредственного противоопухолевого действия, иксабепилон обладает антиангиогенным эффектом.[[k.
Абсорбция. При назначении препарата Икземпра в виде монотерапии в дозировке 40 мг/м2 максимальная концентрация (Cmax) иксабепилона в плазме составила 252 нг/мл (коэффициент вариации, сV 56%) и значение AUC - 2143 нг·ч/мл (CV 48%). Обычно указанная величина сmax достигалась по окончании 3-часовой внутривенной (в/в) инфузии. При в/в введении препарата в диапазоне доз от 15 до 57 мг/м2 фармакокинетика иксабепилона является линейной.
Распределение. Объем распределения (Vd) превышает 1000 л, что свидетельствует об активной абсорбции и связывании иксабепилона тканями. In vitro связывание иксабепилона с белками сыворотки человека составляет 67-77%; соотношение концентраций в крови/плазме составляет 0,65/0,85 в диапазоне концентраций в крови от 50 до 5000 нг/мл.
Метаболизм. Интенсивно метаболизируется в печени, in vitro - при помощи изофермента сYP3A4 с образованием более 30 метаболитов, выводящихся с мочой и калом. Исследования in vitro цитотоксичности метаболитов иксабепилона, образованных в микросомах печени человека, показало, что они не обладали цитотоксической активностью против клеточных линий опухолей человека.
Выведение. Период полувыведения иксабепилона при его введении в дозе 40 мг/м2 в виде 3-часовой внутривенной инфузии составляет около 52 часов. Выводится преимущественно в виде метаболитов. Примерно 86% введенной дозы выводится в течение 7 дней через кишечник (65% дозы) и почками (21% дозы), в тч в неизмененном виде примерно 1,6 и 5,6% соответственно. При рекомендованном режиме дозирования (в/в инфузии каждые 3 недели) аккумулирования в плазме не ожидается.
Фармакокинетика у особых групп пациентов.
Пожилые пациенты. Различий фармакокинетических параметров у пациентов пожилого и молодого возраста не выявлено.
Дети и подростки. Фармакокинетика у пациентов младше 18 лет изучалась в рамках открытого клинического исследования I фазы с целью определения дозы и изучения безопасности иксабепилона у 19 детей с распространенными или рефрактерными сóлидными опухолями и у двух педиатрических пациентов с острыми лейкозами.
В данном исследовании иксабепилон назначался в виде внутривенной инфузии в течение 1 часа в течение 1-5 дней 21-дневного цикла в одной из 5 доз от 3 до 10 мг/м2. Возраст 12 из 21 пациента составил 2-12 лет, а 9 из 21 пациента - от 13 до 18 лет.
Максимальная переносимая доза составила 8 мг/м2 при в/в введении ежедневно в течение 5 последовательных дней в начале каждого 21-дневного цикла. Фармакокинетика иксабепилона была охарактеризована с помощью популяционного фармакокинетического анализа данных, полученных у 16 пациентов со средним возрастом 12 лет (2-18 лет). Фармакокинетические параметры иксабепилона, собранные у этой группы педиатрических больных, сравнивали с соответствующими данными 130 взрослых пациентов, участвующих в клиническом исследовании иксабепилона, назначаемого в аналогичном режиме дозирования. Медиана клиренса иксабепилона, нормализованного по площади поверхности тела, у детей и подростков (17 л/ч/м2) не отличался от медианы клиренса у взрослых пациентов (20 л/ч/м2).
Пациенты с нарушениями функции печени. Показатель площади под кривой концентрация-время увеличивался на 22% у пациентов с сывороточной концентрацией билирубина, превышающей верхнюю границу нормы не более чем в 1-1,5 раза, и у пациентов с повышенным уровнем АСТ и с сывороточной концентрацией билирубина, превышающей верхнюю границу нормы менее чем в 1,5 раза, на 30% у пациентов с сывороточной концентрацией билирубина, превышающей верхнюю границу нормы от 1,5 до 3 раз, и на 81% - при сывороточной концентрации билирубина, троекратно превышающей верхнюю границу нормы.
Пациенты с почечной недостаточностью. Контролируемых фармакокинетических исследований иксабепилона не проводилось у пациентов с почечной недостаточностью. Фармакокинетика иксабепилона при его назначении в комбинации с капецитабином не оценивалась у пациентов с рассчитанным клиренсом креатинина менее 50 мл/мин. Фармакокинетика иксабепилона в виде монотерапии не изучалась у пациентов с уровнем креатинина, в 1,5 раза превышающем верхнюю границу нормы. В популяционном фармакокинетическом исследовании иксабепилона в режиме монотерапии у пациентов с почечной недостаточностью легкой и умеренной степени (Cl креатинина более 30 мл/мин) изменений фармакокинетики иксабепилона не выявлено.[[p.
Местнораспространенный или метастазирующий рак молочной железы при неэффективности предшествующей терапии:
- в комбинации с капецитабином при неэффективности предшествующей терапии таксанами и антрациклинами, при резистентности к таксанам или при отсутствии показаний к дальнейшей терапии антрациклинами;
- в виде монотерапии при неэффективности ранее проводимой терапии таксанами, капецитабином и антрациклинами.[[r.
Выраженная (3-4-я степень согласно общепринятым критериям токсичности) гиперчувствительность в анамнезе к кремофору EL или другим препаратам. содержащим кремофор EL или его производные (например полиоксиэтилированное касторовое масло);
Абсолютное количество нейтрофилов менее 1500 клеток/мкл или тромбоцитов менее 100000 клеток/мкл;
В комбинации с капецитабином: при активности сывороточных ACT или АЛТ, в 2,5 раза превышающей ВГН, или при сывороточной концентрации билирубина, превышающей ВГН;
Беременность и период кормления грудью;
Возраст до 18 лет (эффективность и безопасность не установлены).
С осторожностью: сахарный диабет; нейропатия; печеночная недостаточность; нарушения функции сердечно-сосудистой системы в анамнезе.[[e.
Наиболее частыми (у более 20% пациентов) нежелательными явлениями при монотерапии препаратом Икземпра были периферическая сенсорная нейропатия, утомляемость/астения, миалгия/артралгия, алопеция, тошнота, рвота, стоматит/мукозит, диарея, скелетно-мышечные боли.
У более 20% пациентов, получавших комбинированную терапию, дополнительно развивались следующие реакции: ладонно-подошвенная эритродизэстезия, анорексия, боли в животе, поражения ногтей, запор.
Лекарственно индуцированные нарушения системы крови наблюдались у 40% пациентов и включали нейтропению, лейкопению, анемию и тромбоцитопению.
Побочные явления при применении препарата Икземпра представлены по частоте их регистрации: очень часто (≥1/10); часто (≥1/100, < 1/10); нечасто (≥1/1000,.
Инфекционные и паразитарные заболевания. Часто - инфекции верхних дыхательных путей; нечасто - сепсис, инфекции на фоне нейтропении, пневмония, инфекции мочевыводящих путей, инфекции; редко - инфекции нижних дыхательных путей, энтероколит, бактериальная инфекция, ларингит.
Cо стороны крови и лимфатической системы. Очень часто - нейтропения, тромбоцитопения, анемия, лейкопения; часто - фебрильная нейтропения; редко - коагулопатия, лимфопения.
Со стороны иммунной системы. Часто - гиперчувствительность.
Со стороны обмена веществ и питания. Очень часто - анорексия; часто - дегидратация; нечасто - гипонатриемия, метаболический ацидоз; редко - гипокалиемия, гиповолемия.
Cо стороны нервной системы. Очень часто - периферическая сенсорная нейропатия, головные боли; часто - периферическая двигательная нейропатия, головокружение, изменение вкуса, бессонница; нечасто - обморок, когнитивные нарушения; редко - геморрагический инсульт, нарушения координации движений, сонливость; частота неизвестна - синкопальные состояния.
Со стороны сердца. Нечасто - инфаркт миокарда, дисфункция желудочков, наджелудочковая аритмия; редко - ишемия миокарда, стенокардия, кардиомиопатия, мерцательная аритмия.
Нарушения со стороны сосудов. Часто - приливы с ощущением жара; нечасто - тромбоз, снижение артериального давления; редко - гиповолемический шок, тромбоэмболия легочной артерии, кровотечение, васкулит; частота неизвестна - тромбоз.
Со стороны дыхательной системы, органов грудной клетки и средостения. Часто - одышка, кашель; нечасто - дыхательная недостаточность, пневмонит, гипоксия; редко - острый отек легких, дисфония, боль в области гортани и глотки.
Со стороны желудочно-кишечного тракта. Очень часто - стоматит/мукозит, диарея, рвота, запор, абдоминальные боли, тошнота; часто - гастроэзофагеальная рефлюксная болезнь; нечасто - кишечная непроходимость, колит, нарушение эвакуации содержимого желудка, эзофагит; редко - желудочно-кишечное кровотечение, дисфагия, гастрит.
Со стороны печени и желчевыводящих путей. Редко - острая печеночная недостаточность, желтуха.
Со стороны кожи и подкожных тканей. Очень часто - алопеция; часто - синдром эритродизэстезии пальцев рук и ног, кожные высыпания, гиперпигментация кожи, зуд, шелушение кожи, поражение ногтей; редко - мультиформная эритема.
Со стороны скелетно-мышечной системы и соединительной ткани. Очень часто - миалгия/артралгия, боли скелетных мышц; нечасто - мышечная слабость; редко - мышечные спазмы, тризм.
Нарушения со стороны почек и мочевыводящих путей. Редко - почечная недостаточность, нефролитиаз.
Общие расстройства и нарушения в месте введения. Очень часто - усталость/астения; часто - лихорадка, отек, боли в области грудины, боли, слезотечение; редко - озноб.
Лабораторные и инструментальные данные. Часто - снижение массы тела; нечасто - повышение активности трансаминаз; редко - повышение активности щелочной фосфатазы в крови, повышение активности гамма-глутамилтрансферазы в сыворотке.
Постмаркетинговый опыт применения.
Частота неизвестна. Местная воспалительная реакция в ранее облученной зоне.
Влияние иксабепилона на QT/QTc. Интервал.
Как часть неконтролируемого открытого исследования однократной дозы у пациентов с раком на поздних стадиях, была проведена оценка потенциала иксабепилона удлинять интервал QT. Четырнадцать пациентов получали однократную дозу препарата Икземпра 40 мг/м2 внутривенно в течение 3 часов и в течение 24 часов собирали серийные ЭКГ.
Максимальное среднее ΔQTcF наблюдалось через 1 час после окончания инфузии и составляло 8 мсек (верхний 95% ДИ: 12 мс). После введения препарата Икземпра ни один из пациентов не имел интервал QTcF 450 мс или ΔQTcF 30 мс. Однако из-за ограничений, накладываемых дизайном исследования, небольшое увеличение интервала QTc при использовании иксабепилона исключить нельзя.[[v.
Капецитабин.
У онкологических больных, получавших иксабепилон в сочетании с капецитабином, значения сmax и AUC иксабепилона снижались на 19 и 6%, капецитабина - на 27 и 5%, фторурацила - увеличивались на 1 и 14% соответственно, по сравнению с назначением иксабепилона или капецитабина по отдельности. Это влияние не признано клинически значимым.
Препараты, которые могут повышать концентрацию иксабепилона в плазме крови.
Ингибиторы изофермента P450 (CYP) 3A4, могут замедлять метаболизм иксабепилона и повышать его концентрацию в плазме. При назначении препарата Икземпра с мощными ингибиторами изофермента сYP3A4 (например, кетоконазол, итраконазол, ритонавир, ампренавир, индинавир, нелфинавир, делавирдин, вориконазол) его дозу следует снижать.
Грейпфрутовый сок также может повышать концентрацию иксабепилона в плазме, и следует его избегать. Фармакокинетические исследования показали, что при необходимости назначения препарата Икземпра с мощными ингибиторами изофермента сYP3A4, дозу иксабепилона следует снизить до 20 мг/м2, что позволит поддержать показатели AUC иксабепилона в границах, наблюдаемых при назначении иксабепилона без сопутствующей терапии ингибиторами сYP3A4.
Влияние слабых или умеренных ингибиторов (например, эритромицин, флуконазол, верапамил) на системную концентрацию иксабепилона не изучалось. Поэтому следует соблюдать осторожность при их совместном приеме с препаратом Икземпра, а также по возможности назначать альтернативные препараты, не являющиеся ингибиторами изофермента сYP3A4.
При совместной терапии ингибиторами изофермента сYP3A4 и препаратом Икземпра следует более тщательно контролировать развитие острых токсических реакций (например, регулярный контроль формулы крови в промежутках между курсами лечения).
Препараты, которые могут снижать концентрацию иксабепилона в плазме.
Препараты, индуцирующие изофермент сYP3A4 (например, дексаметазон, фенитоин, карбамазепин, рифабутин, рифампицин, фенобарбитал, препараты зверобоя продырявленного), могут ускорять метаболизм иксабепилона и тем самым снижать его концентрацию в плазме крови до субтерапевтических значений. Следовательно, необходимо рассмотреть возможность назначения одновременно с иксабепилоном препаратов, слабо индуцирующих этот изофермент.
По результатам исследования лекарственного взаимодействия иксабепилона и рифампицина, можно предложить следующие рекомендации для назначения иксабепилона пациентам, которым также необходима сопутствующая терапия препаратами, обладающими мощным потенциалом индукции сYP3A4: доза иксабепилона может быть поэтапно увеличена с 40 до 60 мг/м2 в зависимости от переносимости препарата. В случае увеличения дозы до 60 мг/м2 длительность внутривенной инфузии также следует увеличить до 4 часов. Введение иксабепилона в дозе 60 мг/м2 в течение 4 часов позволит поддержать показатели AUC иксабепилона в границах, наблюдаемых при назначении иксабепилона без сопутствующей терапии индукторами сYP3A4. Однако клинических данных по применению увеличенной дозы иксабепилона в сочетании с препаратами, обладающими мощным потенциалом индукции сYP3A4, по указанной рекомендации нет. Пациенты, которым доза иксабепилона увеличена до 40 мг/м2, требуют более тщательного наблюдения с целью выявления признаков токсичности препарата. При отмене сопутствующей терапии индукторами сYP3A4, доза иксабепилона должна быть снижена до стандартной дозы.
Влияние препарата Икземпра на другие препараты.
Иксабепилон в концентрациях, применяемых в клинической практике, не подавляет изоферменты цитохрома Р450, поэтому его влияние на концентрацию других лекарственных средств в плазме не ожидается.[[a.
Описаны единичные случаи передозировки препарата Икземпра. Наблюдаемые при этом побочные реакции включали периферическую нейропатию. усталость. костно-мышечные боли/миалгию и желудочно-кишечные симптомы (тошнота. анорексия. диарея. абдоминальные боли. стоматит). Антидота при передозировке препарата нет. Лечение при передозировке должно заключаться в симптоматической лекарственной терапии в соответствии с клиническими проявлениями и в тщательном наблюдении за пациентом.[[o.
Реакции гиперчувствительности.
Пациентам с гиперчувствительностью в анамнезе к Кремофору EL или другим препаратам, содержащим Кремофор EL или его производные (например, полиоксиэтилированное касторовое масло), противопоказано лечение препаратом Икземпра. Всем пациентам до инфузии препаратом Икземпраследует провести премедикацию блокаторами H1- и H2 - гистаминовых рецепторов и проводить наблюдение для выявления реакций гиперчувствительности (например, гиперемии, высыпаний, одышки, бронхоспазма, снижения артериального давления). В случае развития тяжелых реакций гиперчувствительности, например, требующих лечения, вливание препарата следует немедленно прекратить и начать соответствующую симптоматическую терапию (например, эпинефрином, глюкокортикостероидами). Из 1323 пациентов, пролеченных иксабепилоном в рамках клинических исследований, только у 9 (1%) развилась тяжелая реакция гиперчувствительности (включая анафилактическую реакцию). Трем из 9 пациентов было возобновлено лечение иксабепилоном. При развитии реакций гиперчувствительности в рамках одного цикла при последующих циклах следует провести премедикацию, помимо блокаторов H1- и H2 - гистаминовых рецепторов, глюкокортикостероидами и рассмотреть возможность увеличения времени инфузии.
Миелосупрессия.
Миелосупрессия зависит от дозы и в первую очередь проявляется в виде нейтропении. В клинических исследованиях нейтропения 4-й степени ( < 500 клеток/мм3) наблюдалась у 36% пациентов, получавших лечение препаратом Икземпра в комбинации с капецитабином, и у 23% пациентов, получавших монотерапию препаратом Икземпра. Фебрильная нейтропения и нейтропения с инфекцией отмечалась у 5 и 6% пациентов, получавших лечение препаратом Икземпра в комбинации с капецитабином, соответственно и у 3 и 5% пациентов, получавших монотерапию препаратом Икземпра, соответственно. Смерть, связанная с нейтропенией, наступила у 1,9% из 414 пациентов с нормальной функцией печени или умеренным ее нарушением, получавших лечение препаратом Икземпра в комбинации с капецитабином. Смерть, связанная с нейтропенией, наступила у 0,4% из 240 пациентов, получавших монотерапию препаратом Икземпра. Препарат Икземпра нельзя вводить пациентам с уровнем нейтрофилов < 1500 клеток/мм3. Для контроля миелосупрессии всем пациентам, получающим препарат Икземпра, рекомендуется проводить частый подсчет количества клеток в периферической крови. Пациентам с тяжелой нейтропенией или тромбоцитопенией в анамнезе следует уменьшить их дозу.
Периферическая нейропатия.
Нейропатия, главным образом периферическая сенсорная нейропатия, развивается часто и обычно бывает легкой и умеренной.
При лечении препаратом Икземпра следует проводить наблюдение за развитием симптомов нейропатии, такими как ощущения жжения, гиперестезия, гипестезия, парестезия, дискомфорт, нейропатическая боль. Нейропатия развивается на ранних этапах лечения препаратом Икземпра. В 75% случаев впервые возникала или усугублялась уже наблюдаемая периферическая нейропатия уже в течение первых 3 циклов терапии. При впервые возникшей или усугубляющейся периферической нейропатии может потребоваться снизить дозу, прервать курс лечения либо отменить препарат.
При сахарном диабете или уже имеющейся нейропатии риск развития тяжелой нейропатии повышен. При лечении таких пациентов следует соблюдать осторожность.
Предшествующая терапия нейротоксичными химиотерапевтическими препаратами фактором риска не является.
Поражение печени.
В исследованиях при раке молочной железы при активности сывороточных АСТ или АЛТ выше 2,5 × ВГН или билирубина выше 1,5 × ВГН токсичность препарата Икземпра в дозе 40 мг/м2 в качестве монотерапии или в сочетании с капецитабином оказывалась более выраженной, чем при активности сывороточных АСТ или АЛТ ≤2,5 × ВГН или билирубина ≤1,5 ВГН. При монотерапии чаще развивались нейтропения 4-й степени, фебрильная нейтропения, другие серьезные нежелательные явления (тромбоцитопения, запор, желудочно-кишечные боли, нарушение опорожнения желудка, стоматит, гипертермия, гипербилирубинемия, обморок). При комбинированной терапии с капецитабином общая частота развития нежелательных явлений 3-4-й степени (анемия, лейкопения, тромбоцитопения, диссеминированное внутрисосудистое свертывание, нейтропения, остановка дыхания и сердечной деятельности, абдоминальные боли, диарея, тошнота, эзофагит, рвота, астения, усталость, воспаление слизистых оболочек, инфекции, вызванные нейтропенией, пневмония, инфекции дыхательных путей, сепсис, септический шок, дегидратация, анорексия, гиповолемия, метаболический ацидоз, нарушение функции почек, нарушение функции дыхательной системы), фебрильной нейтропении, серьезных нежелательных явлений (нарушение функции костного мозга, стенокардия, трепетание предсердий, кардиомиопатия, инфаркт миокарда, ишемия миокарда, желудочковая дисфункция, колит, запор, диспепсия, гастрит, кишечная непроходимость, желудочно-кишечное кровотечение, стоматит, боли в груди, озноб, боли в груди не сердечно-сосудистого происхождения, гипертермия, острое нарушение функции печени, гиперчувствительность, реакции гиперчувствительности IV типа, бактериальные инфекции, цистит, инфекционный энтероколит, инфекции, ларингит, затруднение доступа к сосудам при внутривенном введении, снижение количества гранулоцитов, гемоглобина, нейтрофилов, эритроцитов, лейкоцитов в крови, гипокалиемия, гипонатриемия, боли в костях, мышечные спазмы, костно-мышечная боль в груди, миалгия, тризм, нарушение координации, гипестезия, летаргия, невралгия, периферическая нейропатия, парестезия, периферическая сенсорная нейропатия, обморок, спутанность сознания, острый отек легких, дисфония, диспноэ, фаринголарингеальные боли, многоформная эритема, ладонно-подошвенная эритродизэстезия, сыпь, снижение артериального давления, гиповолемический шок, тромбоз, васкулит) и случаев смерти, связанных с токсичностью иксабепилона, увеличивалась.
Препарат Икземпра в сочетании с капецитабином не следует назначать при активности сывороточных АСТ или АЛТ выше 2,5 × ВГН или сывороточной концентрации билирубина выше 1 × ВГН, поскольку при этом увеличиваются риск развития токсических реакций и смертность, связанная с нейтропенией.
Следует с осторожностью назначать препарат Икземпра в качестве монотерапии при нарушениях функции печени и снижать дозу согласно рекомендациям.
Нарушения функции сердца.
Частота развития нарушений функции сердца (например ишемия миокарда и дисфункция желудочков) при совместном приеме иксабепилона и капецитабина была выше (1,9%) по сравнению с монотерапией капецитабином (0,3%). Следует соблюдать осторожность при применении препарата Икземпра у пациентов с заболеваниями сердца в анамнезе. При развитии ишемии миокарда или нарушении функции сердца следует прервать курс лечения препаратом Икземпра или отменить препарат.
Дети и подростки.
Терапевтическая эффективность лекарственного препарата Икземпра у пациентов младше 18 лет не установлена. Профиль безопасность лекарственного препарата Икземпра изучался в исследованиях I и II фазы и соответствует таковому у взрослых пациентов.
Возможность нарушения когнитивной функции вследствие действия вспомогательных веществ.
Поскольку в состав препарата Икземпра входит этанол, следует учитывать возможность его влияния на центральную нервную систему (ЦНС) и другие эффекты.
Пожилые пациенты.
Эффективность и безопасность препарата Икземпра при монотерапии у пациентов старше 65 лет и более молодых людей одинаковы.
Необходимая эффективность достигалась как у молодых, так и у пожилых пациентов, использовавших препарат Икземпра совместно с капецитабином, однако вероятность развития неблагоприятных побочных реакций 3-4-й степени у пожилых пациентов была выше. В связи с этим при комбинированной терапии следует тщательно следить за развитием побочных реакций у пожилых пациентов.
Влияние на способность к вождению автотранспорта и управлению механизмами. Специальных исследований, изучающих влияние препарата Икземпра на возможность управлять автотранспортом и работать с механизмами, не проводилось. Учитывая содержание этанола в растворителе, прилагаемом к препарату Икземпра, а также возможность возникновения побочных эффектов со стороны ЦНС, которые могут повлиять на способность управлять автотранспортом и работать с механизмами, следует отказаться от управления автомобилем и другими механизмами во время лечения препаратом.[[ф.
Описание было автоматически дополнено из инструкции препарата «Икземпра», поскольку у самого действующего вещества нет подробного описания.
Иксабепилон обладает низкой чувствительностью ко многим факторам опухолевой устойчивости, в тч к таким переносчикам, как протеин множественной лекарственной устойчивости (MRP-1) и Р-гликопротеин (P-gp) , участвующим в формировании врожденной и приобретенной устойчивости к действию противоопухолевых средств. Связываясь с тубулином, иксабепилон активно ингибирует динамику микротрубочек различных изоформ β-тубулина, в тч βIII-изоформ тубулина, избыточную экспрессию которого связывают с развитием устойчивости к таксанам.
В условиях in vivo иксабепилон активен на различных моделях опухоли человека, включая устойчивые к действию противоопухолевых средств типы опухоли, вызывающие избыточную экспрессию P-gp, MRP-1, βIII-изоформ тубулина либо индуцируемые мутациями тубулина. Иксабепилон проявляет активность на моделях опухолей, устойчивых к действию различных препаратов, в тч таксанов, антрациклинов и алкалоидов барвинка. В сочетании с капецитабином в условиях in vivo наблюдается синергизм противоопухолевой активности обоих препаратов. Помимо непосредственного противоопухолевого действия, иксабепилон обладает антиангиогенным эффектом.[[k.
Абсорбция. При назначении препарата Икземпра в виде монотерапии в дозировке 40 мг/м2 максимальная концентрация (Cmax) иксабепилона в плазме составила 252 нг/мл (коэффициент вариации, сV 56%) и значение AUC - 2143 нг·ч/мл (CV 48%). Обычно указанная величина сmax достигалась по окончании 3-часовой внутривенной (в/в) инфузии. При в/в введении препарата в диапазоне доз от 15 до 57 мг/м2 фармакокинетика иксабепилона является линейной.
Распределение. Объем распределения (Vd) превышает 1000 л, что свидетельствует об активной абсорбции и связывании иксабепилона тканями. In vitro связывание иксабепилона с белками сыворотки человека составляет 67-77%; соотношение концентраций в крови/плазме составляет 0,65/0,85 в диапазоне концентраций в крови от 50 до 5000 нг/мл.
Метаболизм. Интенсивно метаболизируется в печени, in vitro - при помощи изофермента сYP3A4 с образованием более 30 метаболитов, выводящихся с мочой и калом. Исследования in vitro цитотоксичности метаболитов иксабепилона, образованных в микросомах печени человека, показало, что они не обладали цитотоксической активностью против клеточных линий опухолей человека.
Выведение. Период полувыведения иксабепилона при его введении в дозе 40 мг/м2 в виде 3-часовой внутривенной инфузии составляет около 52 часов. Выводится преимущественно в виде метаболитов. Примерно 86% введенной дозы выводится в течение 7 дней через кишечник (65% дозы) и почками (21% дозы), в тч в неизмененном виде примерно 1,6 и 5,6% соответственно. При рекомендованном режиме дозирования (в/в инфузии каждые 3 недели) аккумулирования в плазме не ожидается.
Фармакокинетика у особых групп пациентов.
Пожилые пациенты. Различий фармакокинетических параметров у пациентов пожилого и молодого возраста не выявлено.
Дети и подростки. Фармакокинетика у пациентов младше 18 лет изучалась в рамках открытого клинического исследования I фазы с целью определения дозы и изучения безопасности иксабепилона у 19 детей с распространенными или рефрактерными сóлидными опухолями и у двух педиатрических пациентов с острыми лейкозами.
В данном исследовании иксабепилон назначался в виде внутривенной инфузии в течение 1 часа в течение 1-5 дней 21-дневного цикла в одной из 5 доз от 3 до 10 мг/м2. Возраст 12 из 21 пациента составил 2-12 лет, а 9 из 21 пациента - от 13 до 18 лет.
Максимальная переносимая доза составила 8 мг/м2 при в/в введении ежедневно в течение 5 последовательных дней в начале каждого 21-дневного цикла. Фармакокинетика иксабепилона была охарактеризована с помощью популяционного фармакокинетического анализа данных, полученных у 16 пациентов со средним возрастом 12 лет (2-18 лет). Фармакокинетические параметры иксабепилона, собранные у этой группы педиатрических больных, сравнивали с соответствующими данными 130 взрослых пациентов, участвующих в клиническом исследовании иксабепилона, назначаемого в аналогичном режиме дозирования. Медиана клиренса иксабепилона, нормализованного по площади поверхности тела, у детей и подростков (17 л/ч/м2) не отличался от медианы клиренса у взрослых пациентов (20 л/ч/м2).
Пациенты с нарушениями функции печени. Показатель площади под кривой концентрация-время увеличивался на 22% у пациентов с сывороточной концентрацией билирубина, превышающей верхнюю границу нормы не более чем в 1-1,5 раза, и у пациентов с повышенным уровнем АСТ и с сывороточной концентрацией билирубина, превышающей верхнюю границу нормы менее чем в 1,5 раза, на 30% у пациентов с сывороточной концентрацией билирубина, превышающей верхнюю границу нормы от 1,5 до 3 раз, и на 81% - при сывороточной концентрации билирубина, троекратно превышающей верхнюю границу нормы.
Пациенты с почечной недостаточностью. Контролируемых фармакокинетических исследований иксабепилона не проводилось у пациентов с почечной недостаточностью. Фармакокинетика иксабепилона при его назначении в комбинации с капецитабином не оценивалась у пациентов с рассчитанным клиренсом креатинина менее 50 мл/мин. Фармакокинетика иксабепилона в виде монотерапии не изучалась у пациентов с уровнем креатинина, в 1,5 раза превышающем верхнюю границу нормы. В популяционном фармакокинетическом исследовании иксабепилона в режиме монотерапии у пациентов с почечной недостаточностью легкой и умеренной степени (Cl креатинина более 30 мл/мин) изменений фармакокинетики иксабепилона не выявлено.[[p.
Местнораспространенный или метастазирующий рак молочной железы при неэффективности предшествующей терапии:
- в комбинации с капецитабином при неэффективности предшествующей терапии таксанами и антрациклинами, при резистентности к таксанам или при отсутствии показаний к дальнейшей терапии антрациклинами;
- в виде монотерапии при неэффективности ранее проводимой терапии таксанами, капецитабином и антрациклинами.[[r.
Выраженная (3-4-я степень согласно общепринятым критериям токсичности) гиперчувствительность в анамнезе к кремофору EL или другим препаратам. содержащим кремофор EL или его производные (например полиоксиэтилированное касторовое масло);
Абсолютное количество нейтрофилов менее 1500 клеток/мкл или тромбоцитов менее 100000 клеток/мкл;
В комбинации с капецитабином: при активности сывороточных ACT или АЛТ, в 2,5 раза превышающей ВГН, или при сывороточной концентрации билирубина, превышающей ВГН;
Беременность и период кормления грудью;
Возраст до 18 лет (эффективность и безопасность не установлены).
С осторожностью: сахарный диабет; нейропатия; печеночная недостаточность; нарушения функции сердечно-сосудистой системы в анамнезе.[[e.
Наиболее частыми (у более 20% пациентов) нежелательными явлениями при монотерапии препаратом Икземпра были периферическая сенсорная нейропатия, утомляемость/астения, миалгия/артралгия, алопеция, тошнота, рвота, стоматит/мукозит, диарея, скелетно-мышечные боли.
У более 20% пациентов, получавших комбинированную терапию, дополнительно развивались следующие реакции: ладонно-подошвенная эритродизэстезия, анорексия, боли в животе, поражения ногтей, запор.
Лекарственно индуцированные нарушения системы крови наблюдались у 40% пациентов и включали нейтропению, лейкопению, анемию и тромбоцитопению.
Побочные явления при применении препарата Икземпра представлены по частоте их регистрации: очень часто (≥1/10); часто (≥1/100, < 1/10); нечасто (≥1/1000,.
Инфекционные и паразитарные заболевания. Часто - инфекции верхних дыхательных путей; нечасто - сепсис, инфекции на фоне нейтропении, пневмония, инфекции мочевыводящих путей, инфекции; редко - инфекции нижних дыхательных путей, энтероколит, бактериальная инфекция, ларингит.
Cо стороны крови и лимфатической системы. Очень часто - нейтропения, тромбоцитопения, анемия, лейкопения; часто - фебрильная нейтропения; редко - коагулопатия, лимфопения.
Со стороны иммунной системы. Часто - гиперчувствительность.
Со стороны обмена веществ и питания. Очень часто - анорексия; часто - дегидратация; нечасто - гипонатриемия, метаболический ацидоз; редко - гипокалиемия, гиповолемия.
Cо стороны нервной системы. Очень часто - периферическая сенсорная нейропатия, головные боли; часто - периферическая двигательная нейропатия, головокружение, изменение вкуса, бессонница; нечасто - обморок, когнитивные нарушения; редко - геморрагический инсульт, нарушения координации движений, сонливость; частота неизвестна - синкопальные состояния.
Со стороны сердца. Нечасто - инфаркт миокарда, дисфункция желудочков, наджелудочковая аритмия; редко - ишемия миокарда, стенокардия, кардиомиопатия, мерцательная аритмия.
Нарушения со стороны сосудов. Часто - приливы с ощущением жара; нечасто - тромбоз, снижение артериального давления; редко - гиповолемический шок, тромбоэмболия легочной артерии, кровотечение, васкулит; частота неизвестна - тромбоз.
Со стороны дыхательной системы, органов грудной клетки и средостения. Часто - одышка, кашель; нечасто - дыхательная недостаточность, пневмонит, гипоксия; редко - острый отек легких, дисфония, боль в области гортани и глотки.
Со стороны желудочно-кишечного тракта. Очень часто - стоматит/мукозит, диарея, рвота, запор, абдоминальные боли, тошнота; часто - гастроэзофагеальная рефлюксная болезнь; нечасто - кишечная непроходимость, колит, нарушение эвакуации содержимого желудка, эзофагит; редко - желудочно-кишечное кровотечение, дисфагия, гастрит.
Со стороны печени и желчевыводящих путей. Редко - острая печеночная недостаточность, желтуха.
Со стороны кожи и подкожных тканей. Очень часто - алопеция; часто - синдром эритродизэстезии пальцев рук и ног, кожные высыпания, гиперпигментация кожи, зуд, шелушение кожи, поражение ногтей; редко - мультиформная эритема.
Со стороны скелетно-мышечной системы и соединительной ткани. Очень часто - миалгия/артралгия, боли скелетных мышц; нечасто - мышечная слабость; редко - мышечные спазмы, тризм.
Нарушения со стороны почек и мочевыводящих путей. Редко - почечная недостаточность, нефролитиаз.
Общие расстройства и нарушения в месте введения. Очень часто - усталость/астения; часто - лихорадка, отек, боли в области грудины, боли, слезотечение; редко - озноб.
Лабораторные и инструментальные данные. Часто - снижение массы тела; нечасто - повышение активности трансаминаз; редко - повышение активности щелочной фосфатазы в крови, повышение активности гамма-глутамилтрансферазы в сыворотке.
Постмаркетинговый опыт применения.
Частота неизвестна. Местная воспалительная реакция в ранее облученной зоне.
Влияние иксабепилона на QT/QTc. Интервал.
Как часть неконтролируемого открытого исследования однократной дозы у пациентов с раком на поздних стадиях, была проведена оценка потенциала иксабепилона удлинять интервал QT. Четырнадцать пациентов получали однократную дозу препарата Икземпра 40 мг/м2 внутривенно в течение 3 часов и в течение 24 часов собирали серийные ЭКГ.
Максимальное среднее ΔQTcF наблюдалось через 1 час после окончания инфузии и составляло 8 мсек (верхний 95% ДИ: 12 мс). После введения препарата Икземпра ни один из пациентов не имел интервал QTcF 450 мс или ΔQTcF 30 мс. Однако из-за ограничений, накладываемых дизайном исследования, небольшое увеличение интервала QTc при использовании иксабепилона исключить нельзя.[[v.
Капецитабин.
У онкологических больных, получавших иксабепилон в сочетании с капецитабином, значения сmax и AUC иксабепилона снижались на 19 и 6%, капецитабина - на 27 и 5%, фторурацила - увеличивались на 1 и 14% соответственно, по сравнению с назначением иксабепилона или капецитабина по отдельности. Это влияние не признано клинически значимым.
Препараты, которые могут повышать концентрацию иксабепилона в плазме крови.
Ингибиторы изофермента P450 (CYP) 3A4, могут замедлять метаболизм иксабепилона и повышать его концентрацию в плазме. При назначении препарата Икземпра с мощными ингибиторами изофермента сYP3A4 (например, кетоконазол, итраконазол, ритонавир, ампренавир, индинавир, нелфинавир, делавирдин, вориконазол) его дозу следует снижать.
Грейпфрутовый сок также может повышать концентрацию иксабепилона в плазме, и следует его избегать. Фармакокинетические исследования показали, что при необходимости назначения препарата Икземпра с мощными ингибиторами изофермента сYP3A4, дозу иксабепилона следует снизить до 20 мг/м2, что позволит поддержать показатели AUC иксабепилона в границах, наблюдаемых при назначении иксабепилона без сопутствующей терапии ингибиторами сYP3A4.
Влияние слабых или умеренных ингибиторов (например, эритромицин, флуконазол, верапамил) на системную концентрацию иксабепилона не изучалось. Поэтому следует соблюдать осторожность при их совместном приеме с препаратом Икземпра, а также по возможности назначать альтернативные препараты, не являющиеся ингибиторами изофермента сYP3A4.
При совместной терапии ингибиторами изофермента сYP3A4 и препаратом Икземпра следует более тщательно контролировать развитие острых токсических реакций (например, регулярный контроль формулы крови в промежутках между курсами лечения).
Препараты, которые могут снижать концентрацию иксабепилона в плазме.
Препараты, индуцирующие изофермент сYP3A4 (например, дексаметазон, фенитоин, карбамазепин, рифабутин, рифампицин, фенобарбитал, препараты зверобоя продырявленного), могут ускорять метаболизм иксабепилона и тем самым снижать его концентрацию в плазме крови до субтерапевтических значений. Следовательно, необходимо рассмотреть возможность назначения одновременно с иксабепилоном препаратов, слабо индуцирующих этот изофермент.
По результатам исследования лекарственного взаимодействия иксабепилона и рифампицина, можно предложить следующие рекомендации для назначения иксабепилона пациентам, которым также необходима сопутствующая терапия препаратами, обладающими мощным потенциалом индукции сYP3A4: доза иксабепилона может быть поэтапно увеличена с 40 до 60 мг/м2 в зависимости от переносимости препарата. В случае увеличения дозы до 60 мг/м2 длительность внутривенной инфузии также следует увеличить до 4 часов. Введение иксабепилона в дозе 60 мг/м2 в течение 4 часов позволит поддержать показатели AUC иксабепилона в границах, наблюдаемых при назначении иксабепилона без сопутствующей терапии индукторами сYP3A4. Однако клинических данных по применению увеличенной дозы иксабепилона в сочетании с препаратами, обладающими мощным потенциалом индукции сYP3A4, по указанной рекомендации нет. Пациенты, которым доза иксабепилона увеличена до 40 мг/м2, требуют более тщательного наблюдения с целью выявления признаков токсичности препарата. При отмене сопутствующей терапии индукторами сYP3A4, доза иксабепилона должна быть снижена до стандартной дозы.
Влияние препарата Икземпра на другие препараты.
Иксабепилон в концентрациях, применяемых в клинической практике, не подавляет изоферменты цитохрома Р450, поэтому его влияние на концентрацию других лекарственных средств в плазме не ожидается.[[a.
Описаны единичные случаи передозировки препарата Икземпра. Наблюдаемые при этом побочные реакции включали периферическую нейропатию. усталость. костно-мышечные боли/миалгию и желудочно-кишечные симптомы (тошнота. анорексия. диарея. абдоминальные боли. стоматит). Антидота при передозировке препарата нет. Лечение при передозировке должно заключаться в симптоматической лекарственной терапии в соответствии с клиническими проявлениями и в тщательном наблюдении за пациентом.[[o.
Реакции гиперчувствительности.
Пациентам с гиперчувствительностью в анамнезе к Кремофору EL или другим препаратам, содержащим Кремофор EL или его производные (например, полиоксиэтилированное касторовое масло), противопоказано лечение препаратом Икземпра. Всем пациентам до инфузии препаратом Икземпраследует провести премедикацию блокаторами H1- и H2 - гистаминовых рецепторов и проводить наблюдение для выявления реакций гиперчувствительности (например, гиперемии, высыпаний, одышки, бронхоспазма, снижения артериального давления). В случае развития тяжелых реакций гиперчувствительности, например, требующих лечения, вливание препарата следует немедленно прекратить и начать соответствующую симптоматическую терапию (например, эпинефрином, глюкокортикостероидами). Из 1323 пациентов, пролеченных иксабепилоном в рамках клинических исследований, только у 9 (1%) развилась тяжелая реакция гиперчувствительности (включая анафилактическую реакцию). Трем из 9 пациентов было возобновлено лечение иксабепилоном. При развитии реакций гиперчувствительности в рамках одного цикла при последующих циклах следует провести премедикацию, помимо блокаторов H1- и H2 - гистаминовых рецепторов, глюкокортикостероидами и рассмотреть возможность увеличения времени инфузии.
Миелосупрессия.
Миелосупрессия зависит от дозы и в первую очередь проявляется в виде нейтропении. В клинических исследованиях нейтропения 4-й степени ( < 500 клеток/мм3) наблюдалась у 36% пациентов, получавших лечение препаратом Икземпра в комбинации с капецитабином, и у 23% пациентов, получавших монотерапию препаратом Икземпра. Фебрильная нейтропения и нейтропения с инфекцией отмечалась у 5 и 6% пациентов, получавших лечение препаратом Икземпра в комбинации с капецитабином, соответственно и у 3 и 5% пациентов, получавших монотерапию препаратом Икземпра, соответственно. Смерть, связанная с нейтропенией, наступила у 1,9% из 414 пациентов с нормальной функцией печени или умеренным ее нарушением, получавших лечение препаратом Икземпра в комбинации с капецитабином. Смерть, связанная с нейтропенией, наступила у 0,4% из 240 пациентов, получавших монотерапию препаратом Икземпра. Препарат Икземпра нельзя вводить пациентам с уровнем нейтрофилов < 1500 клеток/мм3. Для контроля миелосупрессии всем пациентам, получающим препарат Икземпра, рекомендуется проводить частый подсчет количества клеток в периферической крови. Пациентам с тяжелой нейтропенией или тромбоцитопенией в анамнезе следует уменьшить их дозу.
Периферическая нейропатия.
Нейропатия, главным образом периферическая сенсорная нейропатия, развивается часто и обычно бывает легкой и умеренной.
При лечении препаратом Икземпра следует проводить наблюдение за развитием симптомов нейропатии, такими как ощущения жжения, гиперестезия, гипестезия, парестезия, дискомфорт, нейропатическая боль. Нейропатия развивается на ранних этапах лечения препаратом Икземпра. В 75% случаев впервые возникала или усугублялась уже наблюдаемая периферическая нейропатия уже в течение первых 3 циклов терапии. При впервые возникшей или усугубляющейся периферической нейропатии может потребоваться снизить дозу, прервать курс лечения либо отменить препарат.
При сахарном диабете или уже имеющейся нейропатии риск развития тяжелой нейропатии повышен. При лечении таких пациентов следует соблюдать осторожность.
Предшествующая терапия нейротоксичными химиотерапевтическими препаратами фактором риска не является.
Поражение печени.
В исследованиях при раке молочной железы при активности сывороточных АСТ или АЛТ выше 2,5 × ВГН или билирубина выше 1,5 × ВГН токсичность препарата Икземпра в дозе 40 мг/м2 в качестве монотерапии или в сочетании с капецитабином оказывалась более выраженной, чем при активности сывороточных АСТ или АЛТ ≤2,5 × ВГН или билирубина ≤1,5 ВГН. При монотерапии чаще развивались нейтропения 4-й степени, фебрильная нейтропения, другие серьезные нежелательные явления (тромбоцитопения, запор, желудочно-кишечные боли, нарушение опорожнения желудка, стоматит, гипертермия, гипербилирубинемия, обморок). При комбинированной терапии с капецитабином общая частота развития нежелательных явлений 3-4-й степени (анемия, лейкопения, тромбоцитопения, диссеминированное внутрисосудистое свертывание, нейтропения, остановка дыхания и сердечной деятельности, абдоминальные боли, диарея, тошнота, эзофагит, рвота, астения, усталость, воспаление слизистых оболочек, инфекции, вызванные нейтропенией, пневмония, инфекции дыхательных путей, сепсис, септический шок, дегидратация, анорексия, гиповолемия, метаболический ацидоз, нарушение функции почек, нарушение функции дыхательной системы), фебрильной нейтропении, серьезных нежелательных явлений (нарушение функции костного мозга, стенокардия, трепетание предсердий, кардиомиопатия, инфаркт миокарда, ишемия миокарда, желудочковая дисфункция, колит, запор, диспепсия, гастрит, кишечная непроходимость, желудочно-кишечное кровотечение, стоматит, боли в груди, озноб, боли в груди не сердечно-сосудистого происхождения, гипертермия, острое нарушение функции печени, гиперчувствительность, реакции гиперчувствительности IV типа, бактериальные инфекции, цистит, инфекционный энтероколит, инфекции, ларингит, затруднение доступа к сосудам при внутривенном введении, снижение количества гранулоцитов, гемоглобина, нейтрофилов, эритроцитов, лейкоцитов в крови, гипокалиемия, гипонатриемия, боли в костях, мышечные спазмы, костно-мышечная боль в груди, миалгия, тризм, нарушение координации, гипестезия, летаргия, невралгия, периферическая нейропатия, парестезия, периферическая сенсорная нейропатия, обморок, спутанность сознания, острый отек легких, дисфония, диспноэ, фаринголарингеальные боли, многоформная эритема, ладонно-подошвенная эритродизэстезия, сыпь, снижение артериального давления, гиповолемический шок, тромбоз, васкулит) и случаев смерти, связанных с токсичностью иксабепилона, увеличивалась.
Препарат Икземпра в сочетании с капецитабином не следует назначать при активности сывороточных АСТ или АЛТ выше 2,5 × ВГН или сывороточной концентрации билирубина выше 1 × ВГН, поскольку при этом увеличиваются риск развития токсических реакций и смертность, связанная с нейтропенией.
Следует с осторожностью назначать препарат Икземпра в качестве монотерапии при нарушениях функции печени и снижать дозу согласно рекомендациям.
Нарушения функции сердца.
Частота развития нарушений функции сердца (например ишемия миокарда и дисфункция желудочков) при совместном приеме иксабепилона и капецитабина была выше (1,9%) по сравнению с монотерапией капецитабином (0,3%). Следует соблюдать осторожность при применении препарата Икземпра у пациентов с заболеваниями сердца в анамнезе. При развитии ишемии миокарда или нарушении функции сердца следует прервать курс лечения препаратом Икземпра или отменить препарат.
Дети и подростки.
Терапевтическая эффективность лекарственного препарата Икземпра у пациентов младше 18 лет не установлена. Профиль безопасность лекарственного препарата Икземпра изучался в исследованиях I и II фазы и соответствует таковому у взрослых пациентов.
Возможность нарушения когнитивной функции вследствие действия вспомогательных веществ.
Поскольку в состав препарата Икземпра входит этанол, следует учитывать возможность его влияния на центральную нервную систему (ЦНС) и другие эффекты.
Пожилые пациенты.
Эффективность и безопасность препарата Икземпра при монотерапии у пациентов старше 65 лет и более молодых людей одинаковы.
Необходимая эффективность достигалась как у молодых, так и у пожилых пациентов, использовавших препарат Икземпра совместно с капецитабином, однако вероятность развития неблагоприятных побочных реакций 3-4-й степени у пожилых пациентов была выше. В связи с этим при комбинированной терапии следует тщательно следить за развитием побочных реакций у пожилых пациентов.
Влияние на способность к вождению автотранспорта и управлению механизмами. Специальных исследований, изучающих влияние препарата Икземпра на возможность управлять автотранспортом и работать с механизмами, не проводилось. Учитывая содержание этанола в растворителе, прилагаемом к препарату Икземпра, а также возможность возникновения побочных эффектов со стороны ЦНС, которые могут повлиять на способность управлять автотранспортом и работать с механизмами, следует отказаться от управления автомобилем и другими механизмами во время лечения препаратом.[[ф.
Описание было автоматически дополнено из инструкции препарата «Икземпра», поскольку у самого действующего вещества нет подробного описания.
|
|
Входит в состав
- 22049-64259₽ Икземпра (4 фирмы)