Другие названия и синонимы
Lenalidomide.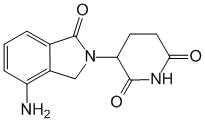
Фармакологическая группа
|
|
Латинское название
Lenalidomidum ( Lenalidomidi).
Код CAS
191732-72-6.
Фармакологическое действие
Иммуномодулирующее.
ATX код
L04AX04 Леналидомид.
Нозологии
Список кодов МКБ-10.
• с90.0 Множественная миелома.
• с90.0 Множественная миелома.
Фармакокинетика
Леналидомид представляет собой рацемическую смесь двух оптически активных форм: S(‑) и R(-) с суммарным оптическим вращением, равным нулю.
Всасывание.
После приема внутрь здоровыми добровольцами леналидомид быстро всасывается; при этом максимальная концентрация достигается через 0,5-2 часа после однократного приема.
Фармакокинетическое распределение имеет линейный характер. Максимальная концентрация (maxCmax) и площадь под кривой «концентрация‑время» (AUC) повышаются пропорционально увеличению дозы. Повторные приемы леналидомида не приводят к его кумуляции. Леналидомид можно принимать вне зависимости от приема пищи. maxCmax и AUC повышаются пропорционально как при однократном, так и при повторном приеме леналидомида.
По данным maxCmax и AUC экспозиция леналидомида у пациентов с множественной миеломой выше, чем у здоровых добровольцев, что объясняется более низким отношением клиренса к фильтрации (CL/F) у пациентов с множественной миеломой по сравнению со здоровыми добровольцами.
Распределение.
In vitro связывание (14C)‑леналидомида с белками плазмы крови пациентов с множественной миеломой и здоровых добровольцев составляет 23% и 29% соответственно.
Леналидомид присутствует в семенной жидкости (<0,01% от дозы) после приема его в дозе 25 мг в сутки, но не определяется в семенной жидкости спустя 3 дня после прекращения приема.
Метаболизм.
Результаты исследований метаболизма in vitro >in vitro указывают, что изоферменты системы цитохрома P450 не принимают участия в метаболизме леналидомида у человека, поэтому метаболические лекарственные взаимодействия при совместном применении леналидомида и лекарственных средств, ингибирующих изоферменты системы цитохрома P450, маловероятны.
Результаты исследований in vitro >in vitro демонстрируют отсутствие ингибирующего действия леналидомида на изоферменты сYP1A2, сYP2C9, сYP2C19, сYP2D6, сYP2E1, сYP3A или UGT1A1. Таким образом, маловероятно, что леналидомид будет способствовать развитию любых клинически значимых лекарственных взаимодействий при одновременном назначении с субстратами этих изоферментов.
По данным исследований in vitro >in vitro леналидомид не является субстратом белка резистентности рака молочной железы человека (BCRP), переносчиков белка множественной лекарственной устойчивости (MRP) MRP1, MRP2 или MRP3, переносчиков органических анионов (OAT) OAT1 или OAT3, полипептида -.
Переносчика органических анионов 1B1 (OATP1B1), переносчиков органических катионов (OCT) OCT1 и OCT2, белка‑переносчика семейства MATE (multidrug and toxin extrusion protein), MATE1 и оригинальных переносчиков органических катионов (OCTN), OCTN1 и OCTN2.
Неизвестно, проявляет ли леналидомид ингибирующие свойства в отношении энергозависимых переносчиков вSEP (Bile Salt Export Pump - насос экспорта желчных кислот), вCRP, MRP2, OAT1, OAT3, OATP1B1, OATP1B3 или OCT2 in vivo, при том, что ингибиторного действия in vitro >in vitro в концентрациях до 20 мкмоль у него не отмечается.
Выведение.
Леналидомид практически не метаболизируется в организме, так как 82% его дозы выделяется почками в неизменном виде. Таким образом, почечный клиренс превышает скорость гломерулярной фильтрации, тем не менее, процесс выведения носит и активный характер.
При приеме в рекомендованных дозах (5-25 мг/сутки) период полувыведения леналидомида составляет приблизительно 3 часа у здоровых добровольцев и от 3‑х до 5‑ти часов у пациентов с множественной миеломой.
Фармакокинетика у отдельных групп пациентов.
Пациенты пожилого возраста.
Специальных клинических исследований для оценки фармакокинетики леналидомида у пациентов пожилого и старшего возраста не проводилось. Учитывая повышенную вероятность нарушений функции почек в пожилом возрасте, следует соблюдать осторожность при подборе дозы леналидомида и осуществлять тщательный контроль функции почек на фоне проведения терапии.
Пациенты с нарушениями функции почек.
Cmax не различается у пациентов с нормальной и с нарушенной функцией почек. При этом выведение леналидомида замедляется пропорционально степени нарушения почечной функции.
Снижение клиренса креатинина (КК) ниже 50 мл/мин сопровождается повышением AUC. Значения AUC примерно в 2,5, 4 и 5 раз выше у пациентов с почечной недостаточностью средней и тяжелой степени тяжести и терминальной стадией почечной недостаточности (ТСПН) соответственно по сравнению с группой, объединяющей пациентов с нормальной функцией почек и пациентов с почечной недостаточностью легкой степени тяжести.
Период полувыведения леналидомида повышается примерно с 3,5 часов (у пациентов с КК выше 50 мл/мин) до приблизительно 9 часов (у пациентов с КК менее 50 мл/мин). Примерно 30% леналидомида выводится из организма в ходе 4‑часового сеанса диализа.
Пациенты с нарушениями функции печени.
Популяционный анализ фармакокинетических данных пациентов с печеночной недостаточностью легкой степени тяжести показал отсутствие влияния печеночной недостаточности легкой степени тяжести на клиренс леналидомида (экспозиция в плазме крови).
Данные в отношении пациентов с печеночной недостаточностью средней и тяжелой степени тяжести отсутствуют.
Другие факторы.
Популяционный анализ фармакокинетических данных показал отсутствие клинически значимого влияния массы тела (33-135 кг), пола, расы и вида онкогематологического заболевания на клиренс леналидомида у взрослых пациентов.
Данные о поступлении леналидомида в грудное молоко отсутствуют.
Всасывание.
После приема внутрь здоровыми добровольцами леналидомид быстро всасывается; при этом максимальная концентрация достигается через 0,5-2 часа после однократного приема.
Фармакокинетическое распределение имеет линейный характер. Максимальная концентрация (maxCmax) и площадь под кривой «концентрация‑время» (AUC) повышаются пропорционально увеличению дозы. Повторные приемы леналидомида не приводят к его кумуляции. Леналидомид можно принимать вне зависимости от приема пищи. maxCmax и AUC повышаются пропорционально как при однократном, так и при повторном приеме леналидомида.
По данным maxCmax и AUC экспозиция леналидомида у пациентов с множественной миеломой выше, чем у здоровых добровольцев, что объясняется более низким отношением клиренса к фильтрации (CL/F) у пациентов с множественной миеломой по сравнению со здоровыми добровольцами.
Распределение.
In vitro связывание (14C)‑леналидомида с белками плазмы крови пациентов с множественной миеломой и здоровых добровольцев составляет 23% и 29% соответственно.
Леналидомид присутствует в семенной жидкости (<0,01% от дозы) после приема его в дозе 25 мг в сутки, но не определяется в семенной жидкости спустя 3 дня после прекращения приема.
Метаболизм.
Результаты исследований метаболизма in vitro >in vitro указывают, что изоферменты системы цитохрома P450 не принимают участия в метаболизме леналидомида у человека, поэтому метаболические лекарственные взаимодействия при совместном применении леналидомида и лекарственных средств, ингибирующих изоферменты системы цитохрома P450, маловероятны.
Результаты исследований in vitro >in vitro демонстрируют отсутствие ингибирующего действия леналидомида на изоферменты сYP1A2, сYP2C9, сYP2C19, сYP2D6, сYP2E1, сYP3A или UGT1A1. Таким образом, маловероятно, что леналидомид будет способствовать развитию любых клинически значимых лекарственных взаимодействий при одновременном назначении с субстратами этих изоферментов.
По данным исследований in vitro >in vitro леналидомид не является субстратом белка резистентности рака молочной железы человека (BCRP), переносчиков белка множественной лекарственной устойчивости (MRP) MRP1, MRP2 или MRP3, переносчиков органических анионов (OAT) OAT1 или OAT3, полипептида -.
Переносчика органических анионов 1B1 (OATP1B1), переносчиков органических катионов (OCT) OCT1 и OCT2, белка‑переносчика семейства MATE (multidrug and toxin extrusion protein), MATE1 и оригинальных переносчиков органических катионов (OCTN), OCTN1 и OCTN2.
Неизвестно, проявляет ли леналидомид ингибирующие свойства в отношении энергозависимых переносчиков вSEP (Bile Salt Export Pump - насос экспорта желчных кислот), вCRP, MRP2, OAT1, OAT3, OATP1B1, OATP1B3 или OCT2 in vivo, при том, что ингибиторного действия in vitro >in vitro в концентрациях до 20 мкмоль у него не отмечается.
Выведение.
Леналидомид практически не метаболизируется в организме, так как 82% его дозы выделяется почками в неизменном виде. Таким образом, почечный клиренс превышает скорость гломерулярной фильтрации, тем не менее, процесс выведения носит и активный характер.
При приеме в рекомендованных дозах (5-25 мг/сутки) период полувыведения леналидомида составляет приблизительно 3 часа у здоровых добровольцев и от 3‑х до 5‑ти часов у пациентов с множественной миеломой.
Фармакокинетика у отдельных групп пациентов.
Пациенты пожилого возраста.
Специальных клинических исследований для оценки фармакокинетики леналидомида у пациентов пожилого и старшего возраста не проводилось. Учитывая повышенную вероятность нарушений функции почек в пожилом возрасте, следует соблюдать осторожность при подборе дозы леналидомида и осуществлять тщательный контроль функции почек на фоне проведения терапии.
Пациенты с нарушениями функции почек.
Cmax не различается у пациентов с нормальной и с нарушенной функцией почек. При этом выведение леналидомида замедляется пропорционально степени нарушения почечной функции.
Снижение клиренса креатинина (КК) ниже 50 мл/мин сопровождается повышением AUC. Значения AUC примерно в 2,5, 4 и 5 раз выше у пациентов с почечной недостаточностью средней и тяжелой степени тяжести и терминальной стадией почечной недостаточности (ТСПН) соответственно по сравнению с группой, объединяющей пациентов с нормальной функцией почек и пациентов с почечной недостаточностью легкой степени тяжести.
Период полувыведения леналидомида повышается примерно с 3,5 часов (у пациентов с КК выше 50 мл/мин) до приблизительно 9 часов (у пациентов с КК менее 50 мл/мин). Примерно 30% леналидомида выводится из организма в ходе 4‑часового сеанса диализа.
Пациенты с нарушениями функции печени.
Популяционный анализ фармакокинетических данных пациентов с печеночной недостаточностью легкой степени тяжести показал отсутствие влияния печеночной недостаточности легкой степени тяжести на клиренс леналидомида (экспозиция в плазме крови).
Данные в отношении пациентов с печеночной недостаточностью средней и тяжелой степени тяжести отсутствуют.
Другие факторы.
Популяционный анализ фармакокинетических данных показал отсутствие клинически значимого влияния массы тела (33-135 кг), пола, расы и вида онкогематологического заболевания на клиренс леналидомида у взрослых пациентов.
Данные о поступлении леналидомида в грудное молоко отсутствуют.
Фармакодинамика
Леналидомид является ведущим соединением нового класса иммуномодуляторов, который обладает как иммуномодулирующими, так и антиангиогенными свойствами. Леналидомид ингибирует секрецию провоспалительных цитокинов, включая фактор некроза опухоли‑альфа (ФНО‑α), интерлейкин‑1β (ИЛ‑1β), ИЛ‑6 и ИЛ‑12, из липосахарид (ЛПС)‑стимулированных периферических мононуклеарных клеток крови (ПМКК).
Леналидомид повышает продукцию противовоспалительного цитокина ИЛ‑10 из ЛПС‑стимулированных ПМКК, вследствие чего происходит ингибирование экспрессии, но не ферментной активности циклооксигеназы‑2 (ЦОГ‑2).
Леналидомид индуцирует пролиферацию T‑клеток и повышает синтез ИЛ‑2 и интерферона‑1γ, а также повышает цитотоксическую активность собственных клеток‑киллеров.
Леналидомид ингибирует пролиферацию клеток различных линий гемопоэтических опухолей, главным образом тех, которые имеют цитогенетические дефекты хромосомы 5.
На модели дифференциации эритроидных клеток‑предшественниц леналидомид индуцирует экспрессию фетального гемоглобина, о чем можно судить по дифференциации сD34+.
Стволовых гемопоэтических клеток.
Леналидомид ингибирует ангиогенез, блокируя образование микрососудов и эндотелиальных каналов, а также миграцию эндотелиальных клеток на модели ангиогенеза in vitro. Кроме того, леналидомид ингибирует синтез проангиогенного сосудистого эндотелиального фактора роста посредством PC‑3 клеток опухоли предстательной железы.
Леналидомид повышает продукцию противовоспалительного цитокина ИЛ‑10 из ЛПС‑стимулированных ПМКК, вследствие чего происходит ингибирование экспрессии, но не ферментной активности циклооксигеназы‑2 (ЦОГ‑2).
Леналидомид индуцирует пролиферацию T‑клеток и повышает синтез ИЛ‑2 и интерферона‑1γ, а также повышает цитотоксическую активность собственных клеток‑киллеров.
Леналидомид ингибирует пролиферацию клеток различных линий гемопоэтических опухолей, главным образом тех, которые имеют цитогенетические дефекты хромосомы 5.
На модели дифференциации эритроидных клеток‑предшественниц леналидомид индуцирует экспрессию фетального гемоглобина, о чем можно судить по дифференциации сD34+.
Стволовых гемопоэтических клеток.
Леналидомид ингибирует ангиогенез, блокируя образование микрососудов и эндотелиальных каналов, а также миграцию эндотелиальных клеток на модели ангиогенеза in vitro. Кроме того, леналидомид ингибирует синтез проангиогенного сосудистого эндотелиального фактора роста посредством PC‑3 клеток опухоли предстательной железы.
|
|
Показания к применению
Леналидомид в комбинации с дексаметазоном показан для лечения пациентов с множественной миеломой (ММ), которые получили, по крайней мере, одну линию терапии.
Противопоказания
-.
Повышенная чувствительность к леналидомиду или другим компонентам препарата.
Беременность и период грудного вскармливания.
Сохраненный репродуктивный потенциал, за исключением случаев, когда возможно соблюдение всех необходимых условий Программы предохранения от беременности, указанной в разделе «Особые указания».
Невозможность или неспособность соблюдать необходимые меры контрацепции, указанные в разделе «Особые указания».
Детский возраст (данные по применению отсутствуют).
С осторожностью.
У пожилых пациентов с почечной и/или печеночной недостаточностью, а также у пациентов, имеющих тромбоз глубоких вен (в том числе в анамнезе).
При совместном приеме с лекарственными средствами. повышающими риск тромбозов. а именно. с лекарственными средствами. обладающими эритропоэтической активностью. и гормонозаместительной терапией.
У пациентов с наследственной непереносимостью лактозы, дефицитом лактазы или нарушенным всасыванием глюкозо‑галактозы, так как капсулы препарата Леналидомид‑натив.
Содержат лактозу.
Повышенная чувствительность к леналидомиду или другим компонентам препарата.
Беременность и период грудного вскармливания.
Сохраненный репродуктивный потенциал, за исключением случаев, когда возможно соблюдение всех необходимых условий Программы предохранения от беременности, указанной в разделе «Особые указания».
Невозможность или неспособность соблюдать необходимые меры контрацепции, указанные в разделе «Особые указания».
Детский возраст (данные по применению отсутствуют).
С осторожностью.
У пожилых пациентов с почечной и/или печеночной недостаточностью, а также у пациентов, имеющих тромбоз глубоких вен (в том числе в анамнезе).
При совместном приеме с лекарственными средствами. повышающими риск тромбозов. а именно. с лекарственными средствами. обладающими эритропоэтической активностью. и гормонозаместительной терапией.
У пациентов с наследственной непереносимостью лактозы, дефицитом лактазы или нарушенным всасыванием глюкозо‑галактозы, так как капсулы препарата Леналидомид‑натив.
Содержат лактозу.
При беременности и кормлении грудью
Леналидомид -.
Структурный аналог талидомида, который обладает выраженным тератогенным действием. Известно, что прием талидомида беременными женщинами вызывает тяжелые и жизнеугрожающие нарушения внутренних органов плода. Экспериментальные исследования на обезьянах показали результаты, сходные с описанными ранее результатами для талидомида. Риск развития врожденных дефектов очень высок, если леналидомид применяется во время беременности. Женщинам с сохраненным репродуктивным потенциалом в период лечения леналидомидом следует использовать эффективные методы контрацепции. Применение леналидомида должно быть прекращено, если у женщины диагностирована беременность, а пациентку необходимо направить на консультацию к врачу, имеющему опыт наблюдения беременных женщин для оценки и клинических рекомендаций. В случае, когда у женщины, являющейся партнером пациента, получающего лечение леналидомидом, диагностируют беременность, женщину также направляют к врачу‑специалисту в области тератологии для оценки ситуации и клинических рекомендаций.
Неизвестно, проникает ли леналидомид в грудное молоко. В связи с этим в период лечения леналидомидом грудное вскармливание должно быть прекращено.
Результаты исследования репродуктивной функции, которое проводили на крысах с применением леналидомида в дозе 500 мг/кг (эта доза превышает терапевтические дозы для человека - 25 мг и 10 мг, приблизительно в 200-500 раз с учетом площади поверхности тела), не продемонстрировали нарушения фертильности или токсичности для организма родителей.
Структурный аналог талидомида, который обладает выраженным тератогенным действием. Известно, что прием талидомида беременными женщинами вызывает тяжелые и жизнеугрожающие нарушения внутренних органов плода. Экспериментальные исследования на обезьянах показали результаты, сходные с описанными ранее результатами для талидомида. Риск развития врожденных дефектов очень высок, если леналидомид применяется во время беременности. Женщинам с сохраненным репродуктивным потенциалом в период лечения леналидомидом следует использовать эффективные методы контрацепции. Применение леналидомида должно быть прекращено, если у женщины диагностирована беременность, а пациентку необходимо направить на консультацию к врачу, имеющему опыт наблюдения беременных женщин для оценки и клинических рекомендаций. В случае, когда у женщины, являющейся партнером пациента, получающего лечение леналидомидом, диагностируют беременность, женщину также направляют к врачу‑специалисту в области тератологии для оценки ситуации и клинических рекомендаций.
Неизвестно, проникает ли леналидомид в грудное молоко. В связи с этим в период лечения леналидомидом грудное вскармливание должно быть прекращено.
Результаты исследования репродуктивной функции, которое проводили на крысах с применением леналидомида в дозе 500 мг/кг (эта доза превышает терапевтические дозы для человека - 25 мг и 10 мг, приблизительно в 200-500 раз с учетом площади поверхности тела), не продемонстрировали нарушения фертильности или токсичности для организма родителей.
Побочные эффекты
У пациентов с множественной миеломой, получающих леналидомид в комбинации с дексаметазоном, наиболее часто встречаются следующие нежелательные реакции: слабость (43,9%), нейтропения (42,2%), запоры (40,5%), диарея (38,5%), мышечные судороги (33,4%), анемия (31,4%), тромбоцитопения (21,5%) и сыпь (21,2%).
К наиболее тяжелым нежелательным реакциям относятся:
-.
Венозная тромбоэмболия (тромбоз глубоких вен, тромбоэмболия легочной артерии).
Нейтропения 4 степени тяжести.
Нейтропения и тромбоцитопения имеют наибольшую зависимость от дозы леналидомида, что позволяет их контролировать путем снижения дозы леналидомида/дексаметазона.
Нежелательные реакции, представленные ниже, перечислены в соответствии с поражением органов и систем органов. Частота возникновения нежелательных реакций оценивается следующим образом: возникновение «очень часто» - >10%; «часто» - >1% и <10%, «нечасто» - >0,1% и <1%, «редко» - >0,01% и <0,1%, «очень редко» - <0,01%, включая отдельные сообщения, «частота неизвестна».
Нежелательные реакции (суммарно).
Нарушения со стороны крови и лимфатической системы:
Очень часто. Тромбоцитопения, нейтропения, анемия, геморрагические нарушения, лейкопения;
Часто. Фебрильная нейтропения, панцитопения;
Нечасто. Гемолиз, аутоиммунная гемолитическая анемия, гемолитическая анемия.
Нарушения со стороны иммунной системы:
Нечасто. Реакции гиперчувствительности.
Нарушения со стороны эндокринной системы:
Часто. Гипотиреоз, гипертиреоз.
Нарушения со стороны обмена веществ и питания:
Очень часто. Гипокалиемия, снижение аппетита;
Часто. Гипомагниемия, гипокальциемия, обезвоживание.
Нарушения психики:
Очень часто. Депрессия, бессонница;
Нечасто. Потеря либидо.
Нарушения со стороны нервной системы:
Очень часто. Периферическая нейропатия (за исключением двигательной нейропатии), головокружение, тремор, извращение вкуса, головная боль;
Часто. Атаксия, нарушение равновесия.
Нарушения со стороны органа зрения:
Очень часто. Нечеткость зрительного восприятия;
Часто. Снижение остроты зрения, катаракта.
Нарушения со стороны органа слуха и лабиринтные нарушения:
Часто. Глухота (в том числе тугоухость), шум в ушах.
Нарушения со стороны сердца:
Часто. Фибрилляция предсердий, брадикардия;
Нечасто. Аритмия, удлинение интервала QT, трепетание предсердий, желудочковая экстрасистолия.
Нарушения со стороны сосудов:
Очень часто -.
Тромбоэмболические нарушения (преимущественно тромбоз глубоких вен и тромбоэмболия легочной артерии);
Часто. Артериальная гипотензия, артериальная гипертензия, экхимозы.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:
Очень часто. Одышка, назофарингит, фарингит, бронхит, носовое кровотечение.
Нарушения со стороны желудочно-кишечного тракта:
Очень часто. Запор, диарея, тошнота, рвота;
Часто -.
Желудочно-кишечное кровотечение (включая ректальное, геморроидальное, гингивальное кровотечение и кровотечение при пептической язве), боль в животе, сухость во рту, стоматит, дисфагия;
Нечасто. Колит, тифлит.
Нарушения со стороны печени и желчевыводящих путей:
Часто. Отклонение значений функциональных проб печени от нормы;
Нечасто. Печеночная недостаточность;
Частота неизвестна -.
Острая печеночная недостаточность, токсический гепатит, цитолитический гепатит, холестатический гепатит, смешанный цитолитический/холестатический гепатит.
Нарушения со стороны кожи и подкожных тканей:
Очень часто. Сыпь;
Часто. Крапивница, гипергидроз, сухость кожи, кожный зуд, гиперпигментация кожи, экзема, эритема;
Нечасто. Нарушение цвета кожи, реакция фотосенсибилизации.
Нарушения со стороны скелетно-мышечной и соединительной ткани:
Очень часто. Мышечные судороги, боль в костях, боль и дискомфорт со стороны костно‑мышечной и соединительной ткани, артралгия;
Часто. Припухание суставов, мышечная слабость, миалгия.
Нарушения со стороны почек и мочевыводящих путей:
Часто. Гематурия, задержка мочи, недержание мочи;
Нечасто. Приобретенный синдром Фанкони.
Нарушения со стороны половых органов и молочной железы:
Часто. Эректильная дисфункция.
Инфекционные и паразитарные заболевания:
Очень часто. Пневмония, инфекции верхних дыхательных путей;
Часто. Сепсис, бактериальные, вирусные и грибковые инфекции (включая оппортунистические), синусит.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы):
Нечасто. Базалиома, плоскоклеточный рак кожи.
Общие расстройства и нарушения в месте введения:
Очень часто. Повышенная утомляемость, отеки (включая периферические), лихорадка, гриппоподобный синдром (включающий лихорадку, миалгию, скелетно‑мышечную боль, головную боль и озноб);
Часто. Боль в груди, летаргия, астения.
Нежелательные реакции 3-4 степени тяжести.
Очень часто. Тромбоцитопения, нейтропения, лейкопения;
Часто. Фебрильная нейтропения, панцитопения, анемия;
Нечасто -.
Гиперкоагуляция, коагулопатия.
Часто. Гипокалиемия, гипокальциемия, гипофосфатемия, гипергликемия, сахарный диабет, гипонатриемия, гиперурикемия, подагра, снижение аппетита, снижение массы тела.
Часто. Депрессия, бессонница.
Часто. Инсульт, головокружение, обморок;
Нечасто. Внутричерепное кровоизлияние, транзиторная ишемическая атака, ишемия головного мозга.
Часто. Катаракта;
Нечасто. Слепота.
Часто. Инфаркт миокарда, ишемия миокарда, фибрилляция предсердий, сердечная недостаточность, застойная сердечная недостаточность, тахикардия.
Часто. Васкулит;
Нечасто. Ишемия, периферическая ишемия, тромбоз внутричерепного венозного синуса.
Часто. Респираторный дистресс‑синдром, одышка;
Частота неизвестна. Интерстициальный пневмонит.
Часто. Диарея, запор, тошнота, боль в животе;
Панкреатит, перфорация желудочно‑кишечного тракта (включая перфорацию дивертикула, тонкой и толстой кишки).
Острая печеночная недостаточность, токсический гепатит.
Часто. Сыпь;
Нечасто. Ангионевротический отек;
Редко. Синдром Стивенса-Джонсона, токсический эпидермальный некролиз;
Лейкоцитокластический васкулит.
Часто. Мышечная слабость, боль в костях;
Нечасто. Припухание суставов.
Часто. Почечная недостаточность;
Нечасто. Тубулярный почечный некроз.
Часто. Пневмония, бактериальные, вирусные и грибковые инфекции (включая оппортунистические), сепсис, бронхит.
Часто. Острый миелоидный лейкоз, миелодиспластический синдром, плоскоклеточный рак кожи;
Нечасто. Острый T‑клеточный лейкоз, базалиома;
Редко. Синдром лизиса опухоли, базалиома.
Часто. Повышенная утомляемость, лихорадка, астения.
Дополнительная информация.
Тератогенность.
Леналидомид является структурным аналогом талидомида - вещества, обладающего активным тератогенным эффектом и вызывающего тяжелые жизнеугрожающие аномалии развития.
Леналидомид индуцировал у обезьян появление врожденных аномалий, схожих с теми, что описаны для талидомида. Если леналидомид принимается во время беременности, то можно прогнозировать тератогенный эффект, поэтому леналидомид противопоказан при беременности.
Нейтропения и тромбоцитопения.
Применение комбинации леналидомида с дексаметазоном у пациентов с множественной миеломой сопровождается повышением частоты развития нейтропении 4 степени тяжести.
Фебрильная нейтропения 4 степени тяжести у пациентов, принимающих комбинацию леналидомида с дексаметазоном, отмечается нечасто. Применение комбинации леналидомида с дексаметазоном при множественной миеломе сопровождается повышением вероятности развития тромбоцитопении 3 и 4 степени тяжести.
Венозная тромбоэмболия.
Применение комбинации леналидомида с дексаметазоном у пациентов с множественной миеломой сопровождается повышенным риском развития тромбоза глубоких вен и тромбоэмболии легочной артерии. Одновременное назначение эритропоэтических средств или наличие тромбоза глубоких вен в анамнезе также могут увеличить риск тромботических осложнений у данной группы пациентов.
Инфаркт миокарда.
У пациентов, принимающих леналидомид, отмечаются случаи развития инфаркта миокарда особенно при наличии известных факторов риска.
Геморрагические осложнения.
Геморрагические осложнения приведены в соответствие системно‑органным классам: нарушения со стороны крови и лимфатической системы; нарушения со стороны нервной системы (внутричерепное кровоизлияние); нарушения со стороны дыхательной системы, органов грудной клетки и средостения (носовое кровотечение); нарушения со стороны желудочно‑кишечного тракта (ректальное, геморроидальное, гингивальное кровотечения); нарушения со стороны почек и мочевыводящих путей (гематурия); нарушения со стороны сосудов (экхимозы).
Аллергические реакции.
Имеются сообщения о развитии аллергических реакций/реакций гиперчувствительности.
Возможна перекрестная реакция между леналидомидом и талидомидом.
Тяжелые кожные реакции.
Имеются сообщения о развитии синдрома Стивенса-Джонсона (ССД) и токсического эпидермального некролиза (ТЭН). Леналидомид не следует назначать пациентам, у которых отмечались тяжелые формы сыпи при приеме талидомида в анамнезе.
Первичные злокачественные опухоли другой локализации.
Новые злокачественные новообразования, отмечавшиеся у пациентов с миеломой после применения комбинации леналидомида с дексаметазоном, представляли, главным образом базальноклеточный или плоскоклеточный рак кожи.
Острый миелолейкоз.
Множественная миелома.
Случаи острого миелолейкоза наблюдаются у пациентов с впервые диагностированной множественной миеломой, получающих леналидомид в комбинации с мелфаланом, или сразу же после высокой дозы мелфалана и трансплантации аутологичных гемопоэтических стволовых клеток (аутоТГСК).
Нарушения со стороны печени и желчевыводящих путей.
Имеются сообщения о следующих нарушениях со стороны печени (частота неизвестна): острая печеночная недостаточность и холестаз (оба потенциально фатальные), токсический гепатит, цитолитический гепатит, смешанный цитолитический/холестатический гепатит.
Рабдомиолиз.
Имеются сообщения о редких случаях развития рабдомиолиза, в некоторых из них леналидомид применяли совместно со статинами.
Заболевания щитовидной железы.
Имеются сообщения о случаях развития гипотиреоза и гипертиреоза.
Заболевания желудочно-кишечного тракта.
Имеются сообщения о возникновении перфорации желудочно‑кишечного тракта на фоне применения леналидомида. Перфорация желудочно‑кишечного тракта может приводить к септическим осложнениям и фатальному исходу.
К наиболее тяжелым нежелательным реакциям относятся:
-.
Венозная тромбоэмболия (тромбоз глубоких вен, тромбоэмболия легочной артерии).
Нейтропения 4 степени тяжести.
Нейтропения и тромбоцитопения имеют наибольшую зависимость от дозы леналидомида, что позволяет их контролировать путем снижения дозы леналидомида/дексаметазона.
Нежелательные реакции, представленные ниже, перечислены в соответствии с поражением органов и систем органов. Частота возникновения нежелательных реакций оценивается следующим образом: возникновение «очень часто» - >10%; «часто» - >1% и <10%, «нечасто» - >0,1% и <1%, «редко» - >0,01% и <0,1%, «очень редко» - <0,01%, включая отдельные сообщения, «частота неизвестна».
Нежелательные реакции (суммарно).
Нарушения со стороны крови и лимфатической системы:
Очень часто. Тромбоцитопения, нейтропения, анемия, геморрагические нарушения, лейкопения;
Часто. Фебрильная нейтропения, панцитопения;
Нечасто. Гемолиз, аутоиммунная гемолитическая анемия, гемолитическая анемия.
Нарушения со стороны иммунной системы:
Нечасто. Реакции гиперчувствительности.
Нарушения со стороны эндокринной системы:
Часто. Гипотиреоз, гипертиреоз.
Нарушения со стороны обмена веществ и питания:
Очень часто. Гипокалиемия, снижение аппетита;
Часто. Гипомагниемия, гипокальциемия, обезвоживание.
Нарушения психики:
Очень часто. Депрессия, бессонница;
Нечасто. Потеря либидо.
Нарушения со стороны нервной системы:
Очень часто. Периферическая нейропатия (за исключением двигательной нейропатии), головокружение, тремор, извращение вкуса, головная боль;
Часто. Атаксия, нарушение равновесия.
Нарушения со стороны органа зрения:
Очень часто. Нечеткость зрительного восприятия;
Часто. Снижение остроты зрения, катаракта.
Нарушения со стороны органа слуха и лабиринтные нарушения:
Часто. Глухота (в том числе тугоухость), шум в ушах.
Нарушения со стороны сердца:
Часто. Фибрилляция предсердий, брадикардия;
Нечасто. Аритмия, удлинение интервала QT, трепетание предсердий, желудочковая экстрасистолия.
Нарушения со стороны сосудов:
Очень часто -.
Тромбоэмболические нарушения (преимущественно тромбоз глубоких вен и тромбоэмболия легочной артерии);
Часто. Артериальная гипотензия, артериальная гипертензия, экхимозы.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:
Очень часто. Одышка, назофарингит, фарингит, бронхит, носовое кровотечение.
Нарушения со стороны желудочно-кишечного тракта:
Очень часто. Запор, диарея, тошнота, рвота;
Часто -.
Желудочно-кишечное кровотечение (включая ректальное, геморроидальное, гингивальное кровотечение и кровотечение при пептической язве), боль в животе, сухость во рту, стоматит, дисфагия;
Нечасто. Колит, тифлит.
Нарушения со стороны печени и желчевыводящих путей:
Часто. Отклонение значений функциональных проб печени от нормы;
Нечасто. Печеночная недостаточность;
Частота неизвестна -.
Острая печеночная недостаточность, токсический гепатит, цитолитический гепатит, холестатический гепатит, смешанный цитолитический/холестатический гепатит.
Нарушения со стороны кожи и подкожных тканей:
Очень часто. Сыпь;
Часто. Крапивница, гипергидроз, сухость кожи, кожный зуд, гиперпигментация кожи, экзема, эритема;
Нечасто. Нарушение цвета кожи, реакция фотосенсибилизации.
Нарушения со стороны скелетно-мышечной и соединительной ткани:
Очень часто. Мышечные судороги, боль в костях, боль и дискомфорт со стороны костно‑мышечной и соединительной ткани, артралгия;
Часто. Припухание суставов, мышечная слабость, миалгия.
Нарушения со стороны почек и мочевыводящих путей:
Часто. Гематурия, задержка мочи, недержание мочи;
Нечасто. Приобретенный синдром Фанкони.
Нарушения со стороны половых органов и молочной железы:
Часто. Эректильная дисфункция.
Инфекционные и паразитарные заболевания:
Очень часто. Пневмония, инфекции верхних дыхательных путей;
Часто. Сепсис, бактериальные, вирусные и грибковые инфекции (включая оппортунистические), синусит.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы):
Нечасто. Базалиома, плоскоклеточный рак кожи.
Общие расстройства и нарушения в месте введения:
Очень часто. Повышенная утомляемость, отеки (включая периферические), лихорадка, гриппоподобный синдром (включающий лихорадку, миалгию, скелетно‑мышечную боль, головную боль и озноб);
Часто. Боль в груди, летаргия, астения.
Нежелательные реакции 3-4 степени тяжести.
Очень часто. Тромбоцитопения, нейтропения, лейкопения;
Часто. Фебрильная нейтропения, панцитопения, анемия;
Нечасто -.
Гиперкоагуляция, коагулопатия.
Часто. Гипокалиемия, гипокальциемия, гипофосфатемия, гипергликемия, сахарный диабет, гипонатриемия, гиперурикемия, подагра, снижение аппетита, снижение массы тела.
Часто. Депрессия, бессонница.
Часто. Инсульт, головокружение, обморок;
Нечасто. Внутричерепное кровоизлияние, транзиторная ишемическая атака, ишемия головного мозга.
Часто. Катаракта;
Нечасто. Слепота.
Часто. Инфаркт миокарда, ишемия миокарда, фибрилляция предсердий, сердечная недостаточность, застойная сердечная недостаточность, тахикардия.
Часто. Васкулит;
Нечасто. Ишемия, периферическая ишемия, тромбоз внутричерепного венозного синуса.
Часто. Респираторный дистресс‑синдром, одышка;
Частота неизвестна. Интерстициальный пневмонит.
Часто. Диарея, запор, тошнота, боль в животе;
Панкреатит, перфорация желудочно‑кишечного тракта (включая перфорацию дивертикула, тонкой и толстой кишки).
Острая печеночная недостаточность, токсический гепатит.
Часто. Сыпь;
Нечасто. Ангионевротический отек;
Редко. Синдром Стивенса-Джонсона, токсический эпидермальный некролиз;
Лейкоцитокластический васкулит.
Часто. Мышечная слабость, боль в костях;
Нечасто. Припухание суставов.
Часто. Почечная недостаточность;
Нечасто. Тубулярный почечный некроз.
Часто. Пневмония, бактериальные, вирусные и грибковые инфекции (включая оппортунистические), сепсис, бронхит.
Часто. Острый миелоидный лейкоз, миелодиспластический синдром, плоскоклеточный рак кожи;
Нечасто. Острый T‑клеточный лейкоз, базалиома;
Редко. Синдром лизиса опухоли, базалиома.
Часто. Повышенная утомляемость, лихорадка, астения.
Дополнительная информация.
Тератогенность.
Леналидомид является структурным аналогом талидомида - вещества, обладающего активным тератогенным эффектом и вызывающего тяжелые жизнеугрожающие аномалии развития.
Леналидомид индуцировал у обезьян появление врожденных аномалий, схожих с теми, что описаны для талидомида. Если леналидомид принимается во время беременности, то можно прогнозировать тератогенный эффект, поэтому леналидомид противопоказан при беременности.
Нейтропения и тромбоцитопения.
Применение комбинации леналидомида с дексаметазоном у пациентов с множественной миеломой сопровождается повышением частоты развития нейтропении 4 степени тяжести.
Фебрильная нейтропения 4 степени тяжести у пациентов, принимающих комбинацию леналидомида с дексаметазоном, отмечается нечасто. Применение комбинации леналидомида с дексаметазоном при множественной миеломе сопровождается повышением вероятности развития тромбоцитопении 3 и 4 степени тяжести.
Венозная тромбоэмболия.
Применение комбинации леналидомида с дексаметазоном у пациентов с множественной миеломой сопровождается повышенным риском развития тромбоза глубоких вен и тромбоэмболии легочной артерии. Одновременное назначение эритропоэтических средств или наличие тромбоза глубоких вен в анамнезе также могут увеличить риск тромботических осложнений у данной группы пациентов.
Инфаркт миокарда.
У пациентов, принимающих леналидомид, отмечаются случаи развития инфаркта миокарда особенно при наличии известных факторов риска.
Геморрагические осложнения.
Геморрагические осложнения приведены в соответствие системно‑органным классам: нарушения со стороны крови и лимфатической системы; нарушения со стороны нервной системы (внутричерепное кровоизлияние); нарушения со стороны дыхательной системы, органов грудной клетки и средостения (носовое кровотечение); нарушения со стороны желудочно‑кишечного тракта (ректальное, геморроидальное, гингивальное кровотечения); нарушения со стороны почек и мочевыводящих путей (гематурия); нарушения со стороны сосудов (экхимозы).
Аллергические реакции.
Имеются сообщения о развитии аллергических реакций/реакций гиперчувствительности.
Возможна перекрестная реакция между леналидомидом и талидомидом.
Тяжелые кожные реакции.
Имеются сообщения о развитии синдрома Стивенса-Джонсона (ССД) и токсического эпидермального некролиза (ТЭН). Леналидомид не следует назначать пациентам, у которых отмечались тяжелые формы сыпи при приеме талидомида в анамнезе.
Первичные злокачественные опухоли другой локализации.
Новые злокачественные новообразования, отмечавшиеся у пациентов с миеломой после применения комбинации леналидомида с дексаметазоном, представляли, главным образом базальноклеточный или плоскоклеточный рак кожи.
Острый миелолейкоз.
Множественная миелома.
Случаи острого миелолейкоза наблюдаются у пациентов с впервые диагностированной множественной миеломой, получающих леналидомид в комбинации с мелфаланом, или сразу же после высокой дозы мелфалана и трансплантации аутологичных гемопоэтических стволовых клеток (аутоТГСК).
Нарушения со стороны печени и желчевыводящих путей.
Имеются сообщения о следующих нарушениях со стороны печени (частота неизвестна): острая печеночная недостаточность и холестаз (оба потенциально фатальные), токсический гепатит, цитолитический гепатит, смешанный цитолитический/холестатический гепатит.
Рабдомиолиз.
Имеются сообщения о редких случаях развития рабдомиолиза, в некоторых из них леналидомид применяли совместно со статинами.
Заболевания щитовидной железы.
Имеются сообщения о случаях развития гипотиреоза и гипертиреоза.
Заболевания желудочно-кишечного тракта.
Имеются сообщения о возникновении перфорации желудочно‑кишечного тракта на фоне применения леналидомида. Перфорация желудочно‑кишечного тракта может приводить к септическим осложнениям и фатальному исходу.
|
|
Взаимодействие
Эритропоэтические лекарственные средства, а также другие средства, которые могут повышать риск тромбоза, например, препараты для гормонозаместительной терапии, следует применять с осторожностью у пациентов с множественной миеломой, принимающих леналидомид в комбинации с дексаметазоном.
Дигоксин.
Одновременное назначение леналидомида с дигоксином сопровождается увеличением плазменной концентрации дигоксина (Cmax дигоксина составляет 114%, а AUC0-∞ 108%). Таким образом, на фоне лечения леналидомидом рекомендуется мониторировать концентрацию дигоксина.
Статины.
Существует повышенный риск рабдомиолиза в случае совместного применения статинов и леналидомида, который может объясняться суммацией действия этих лекарственных средств. Необходимо тщательное клиническое и лабораторное наблюдение особенно в течение первых недель лечения.
Дексаметазон.
Одновременный однократный или многократный прием дексаметазона (40 мг/сутки) не оказывает клинически значимого эффекта на фармакокинетику леналидомида при многократном приеме в дозе 25 мг/сутки.
Пероральные контрацептивы.
Дексаметазон, который является обязательным компонентом схемы терапии леналидомидом, может уменьшать эффективность пероральных контрацептивов. Для эффективного предупреждения беременности необходимо использовать средства, описанные в Программе предохранения от беременности, указанной в разделе «Особые указания».
Варфарин.
Не отмечено взаимного влияния на фармакокинетические параметры леналидомида и варфарина.
Учитывая использование в комплексе с леналидомидом дексаметазона, нельзя исключить влияние последнего на эффекты варфарина. Таким образом, на фоне комбинированной терапии леналидомидом и дексаметазоном рекомендуется тщательный контроль концентрации варфарина.
Взаимодействие с ингибиторами P‑гликопротеина (P‑gp).
Леналидомид in vitro является субстратом P‑gp, но не ингибитором P‑gp. Одновременное многократное применение сильного ингибитора P‑gp - хинидина (600 мг 2 раза в сутки), или умеренного ингибитора P‑gp/субстрата -.
Темсиролимуса (25 мг), не оказывает клинически значимого эффекта на фармакокинетику леналидомида (25 мг/сутки). Фармакокинетика темсиролимуса не изменяется при совместном применении с леналидомидом.
Дигоксин.
Одновременное назначение леналидомида с дигоксином сопровождается увеличением плазменной концентрации дигоксина (Cmax дигоксина составляет 114%, а AUC0-∞ 108%). Таким образом, на фоне лечения леналидомидом рекомендуется мониторировать концентрацию дигоксина.
Статины.
Существует повышенный риск рабдомиолиза в случае совместного применения статинов и леналидомида, который может объясняться суммацией действия этих лекарственных средств. Необходимо тщательное клиническое и лабораторное наблюдение особенно в течение первых недель лечения.
Дексаметазон.
Одновременный однократный или многократный прием дексаметазона (40 мг/сутки) не оказывает клинически значимого эффекта на фармакокинетику леналидомида при многократном приеме в дозе 25 мг/сутки.
Пероральные контрацептивы.
Дексаметазон, который является обязательным компонентом схемы терапии леналидомидом, может уменьшать эффективность пероральных контрацептивов. Для эффективного предупреждения беременности необходимо использовать средства, описанные в Программе предохранения от беременности, указанной в разделе «Особые указания».
Варфарин.
Не отмечено взаимного влияния на фармакокинетические параметры леналидомида и варфарина.
Учитывая использование в комплексе с леналидомидом дексаметазона, нельзя исключить влияние последнего на эффекты варфарина. Таким образом, на фоне комбинированной терапии леналидомидом и дексаметазоном рекомендуется тщательный контроль концентрации варфарина.
Взаимодействие с ингибиторами P‑гликопротеина (P‑gp).
Леналидомид in vitro является субстратом P‑gp, но не ингибитором P‑gp. Одновременное многократное применение сильного ингибитора P‑gp - хинидина (600 мг 2 раза в сутки), или умеренного ингибитора P‑gp/субстрата -.
Темсиролимуса (25 мг), не оказывает клинически значимого эффекта на фармакокинетику леналидомида (25 мг/сутки). Фармакокинетика темсиролимуса не изменяется при совместном применении с леналидомидом.
Передозировка
Специального алгоритма действий при передозировке леналидомидом у пациентов с множественной миеломой в настоящее время не выработано. несмотря на то. что в исследованиях по определению диапазона доз часть пациентов получала дозы от 150 мг. а в исследованиях воздействия однократной дозы - до 400 мг леналидомида.
Токсические проявления, лимитировавшие величину дозы в этих исследованиях, были исключительно гематологическими.
Токсические проявления, лимитировавшие величину дозы в этих исследованиях, были исключительно гематологическими.
Особые указания
Лечение леналидомидом необходимо проводить под наблюдением опытного гематолога или химиотерапевта.
Программа предохранения от беременности.
Неукоснительное соблюдение всех требований Программы предохранения от беременности должно распространяться и на женщин, и на мужчин.
Для женщин с несохраненным репродуктивным потенциалом.
Женщина-пациент или женщина, являющаяся партнером мужчины‑пациента, не считаются способными к деторождению при наличии хотя бы одного из следующих факторов:
-.
Возраст ≥50 лет и длительность естественной аменореи ≥1 года;
Ранняя недостаточность яичников, подтвержденная гинекологом;
Двусторонняя сальпингоофорэктомия или гистерэктомия в анамнезе;
Генотип XY, синдром Тернера, анатомический дефект матки;
Аменорея вследствие противораковой терапии или в период грудного вскармливания не исключает наличие репродуктивного потенциала.
Применение леналидомида у женщин с сохраненным репродуктивным потенциалом противопоказано в тех случаях, если не соблюдены следующие условия:
Женщина должна знать о возможном тератогенном действии леналидомида на нерожденного ребенка;
Женщина должна понимать необходимость непрерывного использования эффективных методов контрацепции в течение 4 недель до начала лечения, во время лечения и 4 недель после лечения леналидомидом;
Даже в случае аменореи женщина должна соблюдать все правила эффективной контрацепции;
Женщина должна быть способной к соблюдению всех правил эффективной контрацепции;
Женщина должна знать и понимать возможные последствия беременности, а также необходимость срочного обращения за консультацией при подозрении на наступившую беременность;
Женщина должна понимать необходимость соблюдения всех правил эффективной контрацепции на фоне приема леналидомида, который можно начинать сразу же после получения отрицательных результатов теста на беременность;
Женщина должна осознавать необходимость проведения теста на беременность и выполнять тест каждые 4 недели;
Женщина должна подтвердить, что понимает риск возможных нежелательных последствий и необходимость их предупреждения в период лечения леналидомидом.
Применение у мужчин.
Данные изучения фармакокинетики леналидомида у мужчин‑добровольцев свидетельствуют о том, что леналидомид может содержаться в семенной жидкости пациентов в период лечения в предельно низких концентрациях и не определяется через 3 дня после прекращения применения препарата у здоровых добровольцев. В качестве меры предосторожности, учитывая возможное снижение скорости выведения леналидомида у отдельных групп пациентов (у пациентов с нарушениями функции почек), у всех пациентов‑мужчин, принимающих леналидомид, должны быть соблюдены следующие условия:
Мужчина должен понимать возможный риск тератогенного действия леналидомида при сексуальном контакте с беременной женщиной или женщиной с сохраненным репродуктивным потенциалом;
Мужчина должен понимать необходимость использования презервативов (даже после перенесенной вазэктомии) при сексуальном контакте с беременными женщинами или женщинами с сохраненным репродуктивным потенциалом, не использующими надежные методы контрацепции, в период лечения и в течение 1 недели после приостановки лечения и/или завершения лечения;
Мужчина должен понимать, что если его партнерша забеременела во время его лечения леналидомидом или сразу же после прекращения терапии леналидомидом, то он должен сразу же проинформировать об этом своего лечащего врача, и что его партнерше рекомендуется обратиться за консультацией к врачу-тератологу.
Врач, назначающий лечение препаратом Леналидомид‑натив женщинам с сохраненным репродуктивным потенциалом, должен удостовериться в том, что пациентка удовлетворяет всем требованиям Программы предохранения от беременности, включая подтверждение того, что она адекватно понимает ситуацию, и получить согласие пациентки на обязательное соблюдение ею всех условий вышеуказанной Программы.
Правила контрацепции.
Женщины с сохраненным репродуктивным потенциалом должны использовать один из высокоэффективных методов контрацепции в течение 4 недель до начала лечения, во время терапии леналидомидом и в течение 4 недель после окончания лечения даже в случае перерывов в лечении. Исключение составляют лишь пациентки, которые воздерживаются от гетеросексуальных отношений на протяжении всего указанного срока, что подтверждается документально ежемесячно. Если пациентке не подобран эффективный метод контрацепции, ее необходимо направить к врачу‑гинекологу для подбора метода эффективной контрацепции.
К высокоэффективным методам контрацепции относятся:
Подкожные гормональные импланты;
Внутриматочные системы, выделяющие левоноргестрел;
Депо-препараты медроксипрогестерон ацетата;
Перевязка маточных труб;
Вазэктомия партнера (подтверждается двумя отрицательными анализами семенной жидкости);
Прогестерон-содержащие таблетки, ингибирующие овуляцию (например, дезогестрел).
Прием комбинированных пероральных контрацептивов не показан пациенткам с множественной миеломой в связи с повышенным риском тромбоэмболических осложнений на фоне лечения леналидомидом и дексаметазоном. Для эффективной контрацепции этим пациенткам рекомендуется использовать один из перечисленных выше методов. Повышенный риск развития тромбоэмболий сохраняется в течение 4-6 недель после прекращения приема комбинированных противозачаточных средств.
Эффективность гормональных противозачаточных препаратов может быть снижена при одновременном назначении дексаметазона.
Пациенткам с нейтропенией, использующим в качестве противозачаточного средства подкожные гормональные импланты или внутриматочные системы, выделяющие левоноргестрел, необходимо профилактически назначать антибиотики в связи с повышенным риском инфекционных осложнений в момент установки этих терапевтических систем.
Использование внутриматочных систем, выделяющих медь, как правило, не рекомендуется в связи с высоким риском развития инфекционных осложнений в момент имплантации и повышенной кровопотери во время менструации, которая может усилить выраженность нейтропении или тромбоцитопении у пациентки.
Тесты на беременность (чувствительность не менее 25 мМЕ/мл) должны выполняться в присутствии врача для всех женщин с сохраненным репродуктивным потенциалом, включая тех, которые полностью и непрерывно воздерживаются от гетеросексуальных отношений. После того, как пациентки используют эффективный метод контрацепции в течение 4 или более недель, тесты выполняются в день назначения лечения или за 3 дня до визита к лечащему врачу, а затем каждые 4 недели, в том числе и после окончания приема леналидомида. Результаты теста должны подтвердить отсутствие беременности у пациентки на фоне лечения леналидомидом.
Мужчины-пациенты должны пользоваться презервативами в течение всего курса лечения препаратом Леналидомид‑натив,.
Во время перерыва в лечении и в течение 1 недели после прекращения лечения в том случае, если сексуальный партнер - беременная женщина или женщина с сохраненным репродуктивным потенциалом, не использующая высокоэффективные методы контрацепции (даже если мужчина перенес вазэктомию).
Дополнительные меры предосторожности.
Пациенты не должны передавать препарат Леналидомид‑натив другим лицам.
Неиспользованный препарат необходимо возвратить в медицинское учреждение по окончании лечения.
Пациентам не разрешается сдавать кровь или сперму в качестве донора на протяжении всего лечения препаратом Леналидомид‑натив и в течение 1 недели после его окончания.
Ограничения в назначении и выдаче препарата.
Врач должен информировать пациентов мужского и женского полов о тератогенном риске леналидомида и строгих мерах по предохранению от беременности, как указано в Программе предохранения от беременности, и обеспечить пациентов обучающей брошюрой, карточкой пациента и/или эквивалентным инструментом в соответствии с национальной системой карточек пациентов. Контролируемая система распределения включает использование карточек пациентов и/или эквивалентного инструмента для контролирования назначения и/или выдачи препарата и сбора подробных данных, относящихся к показанию, с целью тщательного мониторирования случаев применения по неодобренным показаниям в Российской Федерации. Тест на беременность, назначение лечения и выдача леналидомида должны происходить в один и тот же день, но также допустима выдача леналидомида женщинам с сохраненным репродуктивным потенциалом в течение 7 дней после назначения терапии и получения отрицательного результата теста на беременность, выполненного под наблюдением врача. Женщинам с сохраненным репродуктивным потенциалом леналидомид может быть выдан/выписан максимально на срок до 4 недель, в то время как другим пациентам - на срок до 12 недель.
Сердечно-сосудистые заболевания.
Инфаркт миокарда.
Имеются сообщения о случаях инфаркта миокарда у пациентов, принимающих леналидомид, в частности, у лиц, имеющих факторы риска сердечно‑сосудистых заболеваний.
В случае наличия факторов риска, включая в первую очередь тромбозы в анамнезе, необходимо контролировать состояние пациентов, а также предпринимать действия, направленные на возможное уменьшение влияния факторов риска (курение, артериальная гипертензия, гиперлипидемия).
Венозная и артериальная тромбоэмболия.
На фоне комбинированной терапии леналидомидом и дексаметазоном отмечается повышение частоты венозных тромбоэмболий (в основном тромбозов глубоких вен и тромбоэмболии легочной артерии), а также артериальных тромбоэмболий (главным образом инфаркта миокарда и инсульта) у пациентов с множественной миеломой.
Следовательно, необходимо наблюдать за пациентами, имеющими факторы риска развития тромбоэмболий, в том числе и тромбозы в анамнезе. Следует предпринимать меры по возможному устранению таких факторов риска, как курение, артериальная гипертензия, гиперлипидемия. Наибольшее прогностическое значение имеют тромбоэмболические осложнения в анамнезе, сопутствующая терапия эритропоэтином, заместительная гормональная терапия. Таким образом, препараты, обладающие эритропоэтической активностью, а также другие препараты, которые могут повышать риск развития тромбозов (например, гормонозаместительная терапия), должны назначаться с осторожностью пациентам с множественной миеломой, принимающим леналидомид вместе с дексаметазоном. Концентрация гемоглобина выше 120 г/л предполагает прекращение терапии эритропоэтином.
Врачи и пациенты должны внимательно оценивать клинические симптомы, свидетельствующие о возможной тромбоэмболии. Пациенты должны быть предупреждены о необходимости немедленного обращения к врачу в случае появления таких симптомов, как одышка, боль в грудной клетке, отек верхней или нижней конечности.
Для профилактики венозных тромбоэмболий особенно у пациентов, имеющих дополнительные факторы риска, рекомендуется использовать, низкомолекулярные гепарины или варфарин. Решение о назначении противотромботической терапии следует принимать после тщательной оценки индивидуальных факторов риска.
Если у пациента появляются симптомы тромбоэмболии, необходимо прекратить лечение леналидомидом и назначить стандартную антикоагулянтную терапию. После того, как состояние пациента стабилизируется на антикоагулянтной терапии, и симптомы тромбоэмболии будут устранены, можно вновь начать лечение леналидомидом в той же дозе при благоприятной оценке соотношения польза/риск. Пациенту следует продолжить антикоагулянтную терапию в течение всего дальнейшего периода лечения леналидомидом.
Нейтропения и тромбоцитопения.
Тяжелыми дозо-лимитирующими токсическими явлениями леналидомида являются нейтропения и тромбоцитопения. Развернутый анализ крови, включая определение количества лейкоцитов, формулы крови, количества тромбоцитов, гемоглобина, гематокрита, необходимо выполнять до начала терапии, каждую неделю в течение первых 8 недель терапии леналидомидом и затем ежемесячно для мониторинга цитопений. При развитии нейтропении может потребоваться снижение дозы леналидомида. В случае развития нейтропении целесообразно назначение лекарственных средств фактора роста. Пациенты должны быть проинформированы о необходимости своевременно сообщать лечащему врачу о любых повышениях температуры. Следует с осторожностью назначать леналидомид с другими миелодепрессивными лекарственными средствами.
Риск развития нейтропении 4 степени тяжести у пациентов с множественной миеломой при одновременном назначении леналидомида и дексаметазона очень высок.
Эпизоды фебрильной нейтропении 4 степени тяжести регистрируются нечасто. Высокая частота развития тромбоцитопении 3 и 4 степени тяжести отмечается у пациентов с множественной миеломой при одновременном назначении леналидомида и дексаметазона. Рекомендуется тщательный контроль со стороны и врача, и пациента симптомов повышенной кровоточивости, включая петехии и кровохарканье, особенно в случаях, когда одновременно применяемые лекарственные средства способны повышать склонность к кровотечениям.
Почечная недостаточность.
Учитывая преимущественное выделение леналидомида почками, у пациентов с почечной недостаточностью необходимо тщательно контролировать состояние функции почек и дозу леналидомида.
Заболевания щитовидной железы.
Имеются сообщения о случаях гипотиреоза и гипертиреоза. Перед началом лечения следует оценить сопутствующие заболевания, способные оказывать влияние на функцию щитовидной железы. Рекомендуется проводить оценку функции щитовидной железы перед началом лечения и ее регулярный контроль на фоне применения леналидомида.
Периферическая нейропатия.
Нельзя исключить возможность нейротоксического действия препарата Леналидомид‑натив.
При длительном его приеме, учитывая структурное подобие молекул леналидомида и талидомида, который известен своей выраженной нейротоксической нежелательной реакцией.
Синдром лизиса опухоли.
В связи с выраженной антинеопластической активностью леналидомида возможно развитие синдрома лизиса опухоли особенно у пациентов, имеющих большую опухолевую массу.
За этими пациентами должно быть организовано соответствующее наблюдение и применение общепринятых профилактических мер.
Аллергические реакции.
Имеются сообщения о случаях аллергических реакций/реакций повышенной чувствительности.
В связи с тем, что имеются научные публикации о возможных перекрестных реакциях между леналидомидом и талидомидом, следует с особой тщательностью контролировать состояние пациентов, у которых в анамнезе есть указания на аллергические реакции в период лечения талидомидом.
Тяжелые кожные реакции.
Имеются сообщения о случаях синдрома Стивенса‑Джонсона и токсического эпидермального некролиза. При появлении эксфолиативных и буллезных высыпаний на коже или подозрении на развитие ССД и ТЭН следует немедленно прекратить применение леналидомида, лечение которым не следует возобновлять и после исчезновения кожных проявлений.
Необходимость перерыва или отмены леналидомида следует рассмотреть в случае появления других видов кожных реакций в зависимости от их выраженности. Леналидомид нельзя назначать пациентам, у которых имеются в анамнезе указания на тяжелые кожные реакции на фоне применения талидомида.
Развитие первичных злокачественных опухолей другой локализации (ПОДЛ).
Имеются данные о более высокой частоте возникновения первичных злокачественных опухолей другой локализации у пациентов, ранее получавших лечение леналидомидом и дексаметазоном. Неинвазивные ПОДЛ включали базалиому и плоскоклеточный рак кожи. Большая часть инвазивных ПОДЛ относилась к солидным опухолям.
У пациентов с вновь диагностированной множественной миеломой, получающих леналидомид, отмечается увеличение случаев ПОДЛ. Из инвазивных ПОДЛ у пациентов, получающих комбинированное лечение леналидомидом и мелфаланом, или сразу после применения высоких доз мелфалана и аутологичной трансплантации стволовых клеток отмечаются случаи острого миелоидного лейкоза, синдрома миелоидной дисплазии и солидных опухолей. Случаи развития в‑клеточных опухолей (включая лимфому Ходжкина) отмечаются при применении леналидомида после трансплантации стволовых клеток.
Риск развития ПОДЛ следует учитывать перед назначением препарата Леналидомид‑натив.
Врачи должны внимательно обследовать пациентов с использованием стандартных диагностических методов для выявления ПОДЛ как перед принятием решения о назначении леналидомида, так и в течение всего периода лечения леналидомидом.
Лечение следует проводить согласно общепринятым рекомендациям.
Нарушения со стороны печени.
Печеночная недостаточность, включая случаи со смертельным исходом, отмечается у пациентов, получающих лечение леналидомидом в комбинации с дексаметазоном: острая печеночная недостаточность, токсический гепатит, цитолитический гепатит, холестатический гепатит и смешанный цитолитический/холестатический гепатит.
Механизмы тяжелой лекарственной гепатотоксичности остаются неизвестными, хотя в некоторых случаях предыдущее вирусное заболевание печени, исходное повышение активности ферментов печени и, возможно, лечение антибиотиками могут быть факторами риска.
Часто регистрируются отклонения в результатах оценки функции печени, но обычно они бессимптомные и обратимые после прекращения терапии. После восстановления показателей до исходного уровня терапию можно возобновить в более низкой дозе.
Леналидомид выводится почками, поэтому важно скорректировать дозу препарата у пациентов с почечной недостаточностью, чтобы избежать достижения концентраций в плазме крови, которые могут повысить риск развития гематологических нежелательных реакций или гепатотоксичности. Рекомендуется контролировать функцию печени особенно при наличии сопутствующего вирусного заболевания печени или указания на него в анамнезе или при применении леналидомида в комбинации с препаратами, вызывающими нарушения функции печени.
Влияние на способность управлять транспортными средствами и механизмами.
Некоторые нежелательные реакции, развивающиеся при применении леналидомида, такие как головокружение, слабость, сонливость и неясное зрение, могут отрицательно влиять на способность управлять транспортными средствами и выполнять потенциально опасные виды деятельности, требующие повышенной концентрации внимания и быстроты психомоторных реакций. При появлении описанных нежелательных реакций следует воздержаться от выполнения данных видов деятельности.
Программа предохранения от беременности.
Неукоснительное соблюдение всех требований Программы предохранения от беременности должно распространяться и на женщин, и на мужчин.
Для женщин с несохраненным репродуктивным потенциалом.
Женщина-пациент или женщина, являющаяся партнером мужчины‑пациента, не считаются способными к деторождению при наличии хотя бы одного из следующих факторов:
-.
Возраст ≥50 лет и длительность естественной аменореи ≥1 года;
Ранняя недостаточность яичников, подтвержденная гинекологом;
Двусторонняя сальпингоофорэктомия или гистерэктомия в анамнезе;
Генотип XY, синдром Тернера, анатомический дефект матки;
Аменорея вследствие противораковой терапии или в период грудного вскармливания не исключает наличие репродуктивного потенциала.
Применение леналидомида у женщин с сохраненным репродуктивным потенциалом противопоказано в тех случаях, если не соблюдены следующие условия:
Женщина должна знать о возможном тератогенном действии леналидомида на нерожденного ребенка;
Женщина должна понимать необходимость непрерывного использования эффективных методов контрацепции в течение 4 недель до начала лечения, во время лечения и 4 недель после лечения леналидомидом;
Даже в случае аменореи женщина должна соблюдать все правила эффективной контрацепции;
Женщина должна быть способной к соблюдению всех правил эффективной контрацепции;
Женщина должна знать и понимать возможные последствия беременности, а также необходимость срочного обращения за консультацией при подозрении на наступившую беременность;
Женщина должна понимать необходимость соблюдения всех правил эффективной контрацепции на фоне приема леналидомида, который можно начинать сразу же после получения отрицательных результатов теста на беременность;
Женщина должна осознавать необходимость проведения теста на беременность и выполнять тест каждые 4 недели;
Женщина должна подтвердить, что понимает риск возможных нежелательных последствий и необходимость их предупреждения в период лечения леналидомидом.
Применение у мужчин.
Данные изучения фармакокинетики леналидомида у мужчин‑добровольцев свидетельствуют о том, что леналидомид может содержаться в семенной жидкости пациентов в период лечения в предельно низких концентрациях и не определяется через 3 дня после прекращения применения препарата у здоровых добровольцев. В качестве меры предосторожности, учитывая возможное снижение скорости выведения леналидомида у отдельных групп пациентов (у пациентов с нарушениями функции почек), у всех пациентов‑мужчин, принимающих леналидомид, должны быть соблюдены следующие условия:
Мужчина должен понимать возможный риск тератогенного действия леналидомида при сексуальном контакте с беременной женщиной или женщиной с сохраненным репродуктивным потенциалом;
Мужчина должен понимать необходимость использования презервативов (даже после перенесенной вазэктомии) при сексуальном контакте с беременными женщинами или женщинами с сохраненным репродуктивным потенциалом, не использующими надежные методы контрацепции, в период лечения и в течение 1 недели после приостановки лечения и/или завершения лечения;
Мужчина должен понимать, что если его партнерша забеременела во время его лечения леналидомидом или сразу же после прекращения терапии леналидомидом, то он должен сразу же проинформировать об этом своего лечащего врача, и что его партнерше рекомендуется обратиться за консультацией к врачу-тератологу.
Врач, назначающий лечение препаратом Леналидомид‑натив женщинам с сохраненным репродуктивным потенциалом, должен удостовериться в том, что пациентка удовлетворяет всем требованиям Программы предохранения от беременности, включая подтверждение того, что она адекватно понимает ситуацию, и получить согласие пациентки на обязательное соблюдение ею всех условий вышеуказанной Программы.
Правила контрацепции.
Женщины с сохраненным репродуктивным потенциалом должны использовать один из высокоэффективных методов контрацепции в течение 4 недель до начала лечения, во время терапии леналидомидом и в течение 4 недель после окончания лечения даже в случае перерывов в лечении. Исключение составляют лишь пациентки, которые воздерживаются от гетеросексуальных отношений на протяжении всего указанного срока, что подтверждается документально ежемесячно. Если пациентке не подобран эффективный метод контрацепции, ее необходимо направить к врачу‑гинекологу для подбора метода эффективной контрацепции.
К высокоэффективным методам контрацепции относятся:
Подкожные гормональные импланты;
Внутриматочные системы, выделяющие левоноргестрел;
Депо-препараты медроксипрогестерон ацетата;
Перевязка маточных труб;
Вазэктомия партнера (подтверждается двумя отрицательными анализами семенной жидкости);
Прогестерон-содержащие таблетки, ингибирующие овуляцию (например, дезогестрел).
Прием комбинированных пероральных контрацептивов не показан пациенткам с множественной миеломой в связи с повышенным риском тромбоэмболических осложнений на фоне лечения леналидомидом и дексаметазоном. Для эффективной контрацепции этим пациенткам рекомендуется использовать один из перечисленных выше методов. Повышенный риск развития тромбоэмболий сохраняется в течение 4-6 недель после прекращения приема комбинированных противозачаточных средств.
Эффективность гормональных противозачаточных препаратов может быть снижена при одновременном назначении дексаметазона.
Пациенткам с нейтропенией, использующим в качестве противозачаточного средства подкожные гормональные импланты или внутриматочные системы, выделяющие левоноргестрел, необходимо профилактически назначать антибиотики в связи с повышенным риском инфекционных осложнений в момент установки этих терапевтических систем.
Использование внутриматочных систем, выделяющих медь, как правило, не рекомендуется в связи с высоким риском развития инфекционных осложнений в момент имплантации и повышенной кровопотери во время менструации, которая может усилить выраженность нейтропении или тромбоцитопении у пациентки.
Тесты на беременность (чувствительность не менее 25 мМЕ/мл) должны выполняться в присутствии врача для всех женщин с сохраненным репродуктивным потенциалом, включая тех, которые полностью и непрерывно воздерживаются от гетеросексуальных отношений. После того, как пациентки используют эффективный метод контрацепции в течение 4 или более недель, тесты выполняются в день назначения лечения или за 3 дня до визита к лечащему врачу, а затем каждые 4 недели, в том числе и после окончания приема леналидомида. Результаты теста должны подтвердить отсутствие беременности у пациентки на фоне лечения леналидомидом.
Мужчины-пациенты должны пользоваться презервативами в течение всего курса лечения препаратом Леналидомид‑натив,.
Во время перерыва в лечении и в течение 1 недели после прекращения лечения в том случае, если сексуальный партнер - беременная женщина или женщина с сохраненным репродуктивным потенциалом, не использующая высокоэффективные методы контрацепции (даже если мужчина перенес вазэктомию).
Дополнительные меры предосторожности.
Пациенты не должны передавать препарат Леналидомид‑натив другим лицам.
Неиспользованный препарат необходимо возвратить в медицинское учреждение по окончании лечения.
Пациентам не разрешается сдавать кровь или сперму в качестве донора на протяжении всего лечения препаратом Леналидомид‑натив и в течение 1 недели после его окончания.
Ограничения в назначении и выдаче препарата.
Врач должен информировать пациентов мужского и женского полов о тератогенном риске леналидомида и строгих мерах по предохранению от беременности, как указано в Программе предохранения от беременности, и обеспечить пациентов обучающей брошюрой, карточкой пациента и/или эквивалентным инструментом в соответствии с национальной системой карточек пациентов. Контролируемая система распределения включает использование карточек пациентов и/или эквивалентного инструмента для контролирования назначения и/или выдачи препарата и сбора подробных данных, относящихся к показанию, с целью тщательного мониторирования случаев применения по неодобренным показаниям в Российской Федерации. Тест на беременность, назначение лечения и выдача леналидомида должны происходить в один и тот же день, но также допустима выдача леналидомида женщинам с сохраненным репродуктивным потенциалом в течение 7 дней после назначения терапии и получения отрицательного результата теста на беременность, выполненного под наблюдением врача. Женщинам с сохраненным репродуктивным потенциалом леналидомид может быть выдан/выписан максимально на срок до 4 недель, в то время как другим пациентам - на срок до 12 недель.
Сердечно-сосудистые заболевания.
Инфаркт миокарда.
Имеются сообщения о случаях инфаркта миокарда у пациентов, принимающих леналидомид, в частности, у лиц, имеющих факторы риска сердечно‑сосудистых заболеваний.
В случае наличия факторов риска, включая в первую очередь тромбозы в анамнезе, необходимо контролировать состояние пациентов, а также предпринимать действия, направленные на возможное уменьшение влияния факторов риска (курение, артериальная гипертензия, гиперлипидемия).
Венозная и артериальная тромбоэмболия.
На фоне комбинированной терапии леналидомидом и дексаметазоном отмечается повышение частоты венозных тромбоэмболий (в основном тромбозов глубоких вен и тромбоэмболии легочной артерии), а также артериальных тромбоэмболий (главным образом инфаркта миокарда и инсульта) у пациентов с множественной миеломой.
Следовательно, необходимо наблюдать за пациентами, имеющими факторы риска развития тромбоэмболий, в том числе и тромбозы в анамнезе. Следует предпринимать меры по возможному устранению таких факторов риска, как курение, артериальная гипертензия, гиперлипидемия. Наибольшее прогностическое значение имеют тромбоэмболические осложнения в анамнезе, сопутствующая терапия эритропоэтином, заместительная гормональная терапия. Таким образом, препараты, обладающие эритропоэтической активностью, а также другие препараты, которые могут повышать риск развития тромбозов (например, гормонозаместительная терапия), должны назначаться с осторожностью пациентам с множественной миеломой, принимающим леналидомид вместе с дексаметазоном. Концентрация гемоглобина выше 120 г/л предполагает прекращение терапии эритропоэтином.
Врачи и пациенты должны внимательно оценивать клинические симптомы, свидетельствующие о возможной тромбоэмболии. Пациенты должны быть предупреждены о необходимости немедленного обращения к врачу в случае появления таких симптомов, как одышка, боль в грудной клетке, отек верхней или нижней конечности.
Для профилактики венозных тромбоэмболий особенно у пациентов, имеющих дополнительные факторы риска, рекомендуется использовать, низкомолекулярные гепарины или варфарин. Решение о назначении противотромботической терапии следует принимать после тщательной оценки индивидуальных факторов риска.
Если у пациента появляются симптомы тромбоэмболии, необходимо прекратить лечение леналидомидом и назначить стандартную антикоагулянтную терапию. После того, как состояние пациента стабилизируется на антикоагулянтной терапии, и симптомы тромбоэмболии будут устранены, можно вновь начать лечение леналидомидом в той же дозе при благоприятной оценке соотношения польза/риск. Пациенту следует продолжить антикоагулянтную терапию в течение всего дальнейшего периода лечения леналидомидом.
Нейтропения и тромбоцитопения.
Тяжелыми дозо-лимитирующими токсическими явлениями леналидомида являются нейтропения и тромбоцитопения. Развернутый анализ крови, включая определение количества лейкоцитов, формулы крови, количества тромбоцитов, гемоглобина, гематокрита, необходимо выполнять до начала терапии, каждую неделю в течение первых 8 недель терапии леналидомидом и затем ежемесячно для мониторинга цитопений. При развитии нейтропении может потребоваться снижение дозы леналидомида. В случае развития нейтропении целесообразно назначение лекарственных средств фактора роста. Пациенты должны быть проинформированы о необходимости своевременно сообщать лечащему врачу о любых повышениях температуры. Следует с осторожностью назначать леналидомид с другими миелодепрессивными лекарственными средствами.
Риск развития нейтропении 4 степени тяжести у пациентов с множественной миеломой при одновременном назначении леналидомида и дексаметазона очень высок.
Эпизоды фебрильной нейтропении 4 степени тяжести регистрируются нечасто. Высокая частота развития тромбоцитопении 3 и 4 степени тяжести отмечается у пациентов с множественной миеломой при одновременном назначении леналидомида и дексаметазона. Рекомендуется тщательный контроль со стороны и врача, и пациента симптомов повышенной кровоточивости, включая петехии и кровохарканье, особенно в случаях, когда одновременно применяемые лекарственные средства способны повышать склонность к кровотечениям.
Почечная недостаточность.
Учитывая преимущественное выделение леналидомида почками, у пациентов с почечной недостаточностью необходимо тщательно контролировать состояние функции почек и дозу леналидомида.
Заболевания щитовидной железы.
Имеются сообщения о случаях гипотиреоза и гипертиреоза. Перед началом лечения следует оценить сопутствующие заболевания, способные оказывать влияние на функцию щитовидной железы. Рекомендуется проводить оценку функции щитовидной железы перед началом лечения и ее регулярный контроль на фоне применения леналидомида.
Периферическая нейропатия.
Нельзя исключить возможность нейротоксического действия препарата Леналидомид‑натив.
При длительном его приеме, учитывая структурное подобие молекул леналидомида и талидомида, который известен своей выраженной нейротоксической нежелательной реакцией.
Синдром лизиса опухоли.
В связи с выраженной антинеопластической активностью леналидомида возможно развитие синдрома лизиса опухоли особенно у пациентов, имеющих большую опухолевую массу.
За этими пациентами должно быть организовано соответствующее наблюдение и применение общепринятых профилактических мер.
Аллергические реакции.
Имеются сообщения о случаях аллергических реакций/реакций повышенной чувствительности.
В связи с тем, что имеются научные публикации о возможных перекрестных реакциях между леналидомидом и талидомидом, следует с особой тщательностью контролировать состояние пациентов, у которых в анамнезе есть указания на аллергические реакции в период лечения талидомидом.
Тяжелые кожные реакции.
Имеются сообщения о случаях синдрома Стивенса‑Джонсона и токсического эпидермального некролиза. При появлении эксфолиативных и буллезных высыпаний на коже или подозрении на развитие ССД и ТЭН следует немедленно прекратить применение леналидомида, лечение которым не следует возобновлять и после исчезновения кожных проявлений.
Необходимость перерыва или отмены леналидомида следует рассмотреть в случае появления других видов кожных реакций в зависимости от их выраженности. Леналидомид нельзя назначать пациентам, у которых имеются в анамнезе указания на тяжелые кожные реакции на фоне применения талидомида.
Развитие первичных злокачественных опухолей другой локализации (ПОДЛ).
Имеются данные о более высокой частоте возникновения первичных злокачественных опухолей другой локализации у пациентов, ранее получавших лечение леналидомидом и дексаметазоном. Неинвазивные ПОДЛ включали базалиому и плоскоклеточный рак кожи. Большая часть инвазивных ПОДЛ относилась к солидным опухолям.
У пациентов с вновь диагностированной множественной миеломой, получающих леналидомид, отмечается увеличение случаев ПОДЛ. Из инвазивных ПОДЛ у пациентов, получающих комбинированное лечение леналидомидом и мелфаланом, или сразу после применения высоких доз мелфалана и аутологичной трансплантации стволовых клеток отмечаются случаи острого миелоидного лейкоза, синдрома миелоидной дисплазии и солидных опухолей. Случаи развития в‑клеточных опухолей (включая лимфому Ходжкина) отмечаются при применении леналидомида после трансплантации стволовых клеток.
Риск развития ПОДЛ следует учитывать перед назначением препарата Леналидомид‑натив.
Врачи должны внимательно обследовать пациентов с использованием стандартных диагностических методов для выявления ПОДЛ как перед принятием решения о назначении леналидомида, так и в течение всего периода лечения леналидомидом.
Лечение следует проводить согласно общепринятым рекомендациям.
Нарушения со стороны печени.
Печеночная недостаточность, включая случаи со смертельным исходом, отмечается у пациентов, получающих лечение леналидомидом в комбинации с дексаметазоном: острая печеночная недостаточность, токсический гепатит, цитолитический гепатит, холестатический гепатит и смешанный цитолитический/холестатический гепатит.
Механизмы тяжелой лекарственной гепатотоксичности остаются неизвестными, хотя в некоторых случаях предыдущее вирусное заболевание печени, исходное повышение активности ферментов печени и, возможно, лечение антибиотиками могут быть факторами риска.
Часто регистрируются отклонения в результатах оценки функции печени, но обычно они бессимптомные и обратимые после прекращения терапии. После восстановления показателей до исходного уровня терапию можно возобновить в более низкой дозе.
Леналидомид выводится почками, поэтому важно скорректировать дозу препарата у пациентов с почечной недостаточностью, чтобы избежать достижения концентраций в плазме крови, которые могут повысить риск развития гематологических нежелательных реакций или гепатотоксичности. Рекомендуется контролировать функцию печени особенно при наличии сопутствующего вирусного заболевания печени или указания на него в анамнезе или при применении леналидомида в комбинации с препаратами, вызывающими нарушения функции печени.
Влияние на способность управлять транспортными средствами и механизмами.
Некоторые нежелательные реакции, развивающиеся при применении леналидомида, такие как головокружение, слабость, сонливость и неясное зрение, могут отрицательно влиять на способность управлять транспортными средствами и выполнять потенциально опасные виды деятельности, требующие повышенной концентрации внимания и быстроты психомоторных реакций. При появлении описанных нежелательных реакций следует воздержаться от выполнения данных видов деятельности.
|
|
Дополнительные факты
Описание было автоматически дополнено из инструкции препарата «Леналидомид-натив», поскольку у самого действующего вещества нет подробного описания.
Год актуализации информации
Особые отметки:
Входит в состав
- 132800₽ Ревлимид (4 фирмы)
- — Ландотекс
- — Леналидомид (11 фирм)
- — Леналидомид (форма-Н1) (Hetero Labs Limited )
- — Леналидомид Канон
- — Леналидомид-КРКА (КРКА-Рус )
- — Леналидомид-ТЛ (2 фирмы)
- — Леналидомид-Тева (Pliva Hrvatska d.o.o. )
- — Леналидомид-натив
- — Леналидомид-промомед
- — Ленанжио
- — Леноалромид (Биофарм Право-Альфа ООО )
- — Метибластан (3 фирмы)
- — Миеланикс (3 фирмы)
- — Мулмилида
- — РУПСУЛИМИД