Другие названия и синонимы
Ceftobiprole.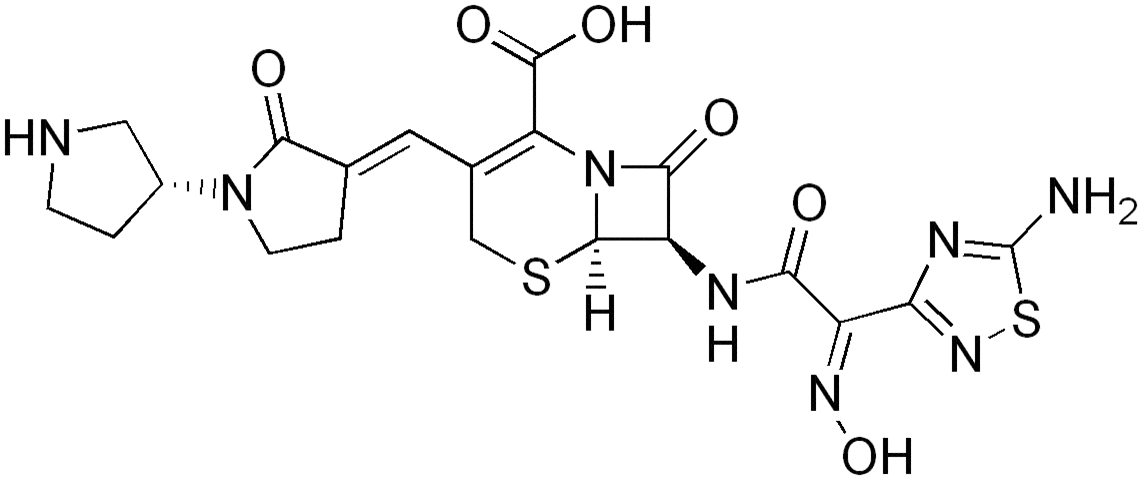
Фармакологическая группа
|
|
Латинское название
Ceftobiprolum ( сeftobiproli)[[c.
(6R,7R)-7-[(2Z)-2-(5-Амино-1,2,4-тиадиазол-3-ил)-2-(гидроксиимино)ацетамид]-8-оксо-3-[(E)[(3 R)-2-оксо-[1,3 -бипирролидин]-3-илиден]метил]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновая кислота.
(6R,7R)-7-[(2Z)-2-(5-Амино-1,2,4-тиадиазол-3-ил)-2-(гидроксиимино)ацетамид]-8-оксо-3-[(E)[(3 R)-2-оксо-[1,3 -бипирролидин]-3-илиден]метил]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновая кислота.
Код CAS
209467-52-7.
Характеристика вещества
Цефалоспориновый антибиотик 5-го поколения.[[n.
Список кодов МКБ-10.
Список кодов МКБ-10.
Фармакологическое действие
Фармакологическое действие - бактерицидное, антибактериальное широкого спектра.[[f.
Механизм действия. Цефтобипрола медокарил является водорастворимым пролекарством цефтобипрола - цефалоспорина, обладающего бактерицидной активностью в отношении широкого спектра грамположительных бактерий, включая резистентные к метициллину виды Staphylococcus, резистентные к пенициллину Streptococcus pneumoniae, а также чувствительные к ампициллину Enterococcus faecalis. Активен также в отношении многих грамотрицательных бактерий, включая многие штаммы семейства Enterobacteriaceae и Pseudomonas aeruginosa.
Прочно связывается со многими важными пенициллинсвязывающими белками (PBP) как грамположительных, так и грамотрицательных бактерий. Обладает ярко выраженной бактерицидной активностью в отношении Staphylococcus, резистентных к метициллину, благодаря прочному связыванию с PBP стафилококков группы 2a, включая метициллин-резистентные Staphylococcus aureus (MRSA).
Установлено, что цефтобипрол активен в отношении большинства изолятов перечисленных ниже микроорганизмов как in vitro, так и при внутрибольничных инфекциях.
Грамположительные аэробы: Enterococcus faecalis (только изоляты, чувствительные к ванкомицину), Staphylococcus aureus (изоляты, чувствительные и резистентные к метициллину), Staphylococcus epidermidis, Streptococcus agalactiae, Streptococcus pyogenes, Enterococcus faecalis (изоляты, резистентные к ванкомицину); Staphylococcus коагулазонегативные (изоляты, чувствительные и резистентные к метициллину, включая Staphylococcus haemolyticus, Staphylococcus hominis, Staphylococcus lugdunensis и Staphylococcus saprophyticus), Streptococcus pneumoniae (изоляты, чувствительные к пенициллину, умеренно резистентные и резистентные к пенициллину); Streptococcus группы viridans.
Грамотрицательные аэробы: Enterobacter cloacae, Escherichia coli, Klebsiella pneumoniae; Proteus mirabilis, Pseudomonas aeruginosa; виды рода сitrobacter (включая сitrobacter freundii и сitrobacter koseri), Enterobacter aerogenes, Klebsiella oxytoca, Moraxella catarrhalis, Morganella morganii; виды рода Neisseria; виды рода Providencia, Serratia marcescens.
Механизм устойчивости. Цефтобипрол устойчив к гидролизу пенициллиназами S. aureus, а также к гидролизу многими бета-лактамазами класса С и класса А, продуцируемыми грамотрицательными бактериями. Как и большинство цефалоспоринов, цефтобипрол гидролизуется бета-лактамазами расширенного спектра (ESBL), карбапенемазами и металло-бета-лактамазами. In vitro не наблюдалась селекция высокоуровневой резистентности у стафилококков, стрептококков и Haemophilus influenzae.
Перекрестная резистентность. Резистентность к цефтобипролу, вызванная спонтанной мутацией in vitro, наблюдается редко. Описана перекрестная резистентность между цефтобипролом и некоторыми другими цефалоспоринами последних поколений. Вместе с тем, некоторые микроорганизмы, резистентные к другим цефалоспоринам, могут быть чувствительными к цефтобипролу.[[k.
Концентрации в плазме. Средние фармакокинетические параметры.
Цефтобипрола у взрослых после введения одной дозы 500 мг в виде 60-минутной инфузии и.
Многократных доз 500 мг, вводившихся каждые 8 ч в виде 120-минутных инфузий, приведены в.
Таблице 1. Фармакокинетические характеристики сходны после введения одной дозы и после введения.
Многократных доз.
Таблица 1.
Средние (стандартное отклонение) фармакокинетические параметры цефтобипрола у.
Взрослых.
Cmax и AUC цефтобипрола увеличиваются пропорционально дозе в.
Диапазоне доз 125 мг-1 г. Стационарные (равновесные) концентрации достигаются в.
Первый день лечения; у людей с нормальной функцией почек введение цефтобипрола каждые 8 и 12 ч.
Не вызывает его кумуляции.
Распределение. Цефтобипрол на 16% связывается с белками плазмы и.
Эта степень связывания не зависит от его концентрации. Стационарный объем распределения (18 л).
Цефтобипрола приближается к объему внеклеточной жидкости у человека.
Метаболизм. Биопревращение из пролекарства цефтобипрола.
Медокарила в активное лекарство - цефтобипрол происходит быстро и катализируется.
Эстеразами плазмы. Концентрации пролекарства ничтожно малы, и его удается обнаружить в плазме и моче.
Только во время инфузии.
Цефтобипрол подвергается минимальному метаболизму до нециклического.
Метаболита, который микробиологически неактивен. Концентрация этого метаболита ниже концентрации.
Самого цефтобипрола и составляет около 4% от последней.
Выведение. Цефтобипрол выводится преимущественно в неизмененном.
Виде посредством почечной экскреции, и Т1/2 составляет около 3 Главным механизмом.
Почечной экскреции является клубочковая фильтрация, небольшая часть дозы подвергается канальцевой.
Реабсорбции. В доклинических исследованиях пробенецид не влиял на фармакокинетику цефтобипрола,.
Что указывает на отсутствие активной канальцевой секреции последнего. После введения 1 дозы примерно.
89% ее обнаруживается в моче в виде активного цефтобипрола (83%), метаболита с открытым кольцом (5%) и.
Цефтобипрола медокарила (.
Особые группы пациентов.
Пациенты с почечной недостаточностью. Фармакокинетика цефтобипрола.
Сходна у здоровых добровольцев и у пациентов с легкой почечной недостаточностью (Cl креатинина 50.
-80 мл/мин). По сравнению с AUC у здоровых добровольцев с нормальной функцией почек, AUC.
Цефтобипрола была в 2,5 и 3,3 раза выше у пациентов с почечной недостаточностью средней тяжести (Cl.
Креатинина 30-≤50 мл/мин) и тяжелой почечной недостаточностью (Cl креатинина < 30.
Мл/мин) соответственно. У пациентов со среднетяжелой и тяжелой почечной недостаточностью.
Рекомендуется снижать дозу цефтобипрола.
AUC цефтобипрола и его микробиологически неактивного метаболита со.
Структурой открытого кольца возрастает у пациентов, которым необходим гемодиализ, по сравнению с AUC.
У здоровых добровольцев.
Пациенты с печеночной недостаточностью. У пациентов с печеночной.
Недостаточностью фармакокинетику цефтобипрола не изучали. Цефтобипрол подвергается минимальному.
Печеночному метаболизму и экскретируется в основном почками в неизмененном виде, и поэтому нет.
Оснований считать, что клиренс цефтобипрола у пациентов с печеночной недостаточностью будет снижен.
Пожилые пациенты. Популяционные исследования фармакокинетики.
Цефтобипрола не выявили независимого влияния возраста на его фармакокинетические параметры. У.
Пожилых пациентов с нормальной функцией почек дозу этого препарата снижать не нужно.
Мужчины и женщины. Системные фармакокинетические параметры.
Цефтобипрола у женщин были выше, чем у мужчин (Cmax на 21% и AUC на 15%); вместе с тем.
Показатель tМИК (где t - время, в течение которого концентрация препарата превышает.
Величину минимальной ингибирующей концентрации) был сходным у мужчин и женщин. Следовательно нет.
Необходимости корректировать дозу этого препарата в зависимости от пола пациента.
Расовая принадлежность. Популяционные исследования.
Фармакокинетики (включавшие европеоидов и небольшое число негроидов и представителей других рас) не.
Выявили влияния расовой принадлежности на фармакокинетические параметры цефтобипрола.
Следовательно, нет необходимости корректировать дозу этого препарата в зависимости от расовой.
Принадлежности пациента.[[p.
Лечение осложненных инфекций кожи и ее придатков, включая инфицированную диабетическую стопу без сопутствующего остеомиелита.[[r.
Гиперчувствительность к цефтобипролу, любому вспомогательному веществу, входящему в состав препарата и другим цефалоспоринам;
Пациенты, у которых в анамнезе наблюдались аллергические реакции на бета-лактамные антибиотики;
Детский возраст до 18 лет.
С осторожностью:
Почечная недостаточность (Cl креатинина < 50 мл/мин);
Эпилепсия;
Судорожные припадки (в анамнезе);
Псевдомембранозный колит (в анамнезе).[[b.
Доклинические исследования показали, что цефтобипрол не обладает тератогенной активностью и не влияет на оссификацию, массу тела плода и внутриутробное развитие. Исследования применения цефтобипрола у беременных женщин не проводили. Результаты исследования влияния ЛС на репродуктивную функцию животных не всегда могут быть интерполированы на соответствующую функцию человека, и поэтому цефтобипрол можно назначать беременным женщинам только в тех случаях, когда ожидаемая польза применения для будущей матери перевешивает потенциальный риск для плода.
Неизвестно, способен ли цефтобипрол проникать в грудное молоко кормящих женщин. Исследования на животных показали, что препарат проникает в молоко. Учитывая это, женщины, получающие препарат Зефтера, должны воздерживаться от грудного вскармливания.[[e.
Нежелательные эффекты, наблюдавшиеся в клинических исследованиях. Нежелательные эффекты, возникавшие с частотой ≥1 % у пациентов, которые получали 500 мг цефтобипрола каждые 8-12 ч в виде 60 или 120-минутных инфузий, перечислены в таблице 2.
Нежелательными эффектами, обусловившими отмену цефтобипрола, были кожная сыпь (0,6%), тошнота (0,5%), рвота (0,4%), реакции гиперчувствительности (0,3%) и гипонатриемия (0,3%).
Таблица 2.
Частота (проценты) нежелательных эффектов, наблюдавшихся в 2 клинических испытаниях фазы III с частотой ≥1%.
* Ванкомицин и ванкомицин + цефтазидим в исследованиях, которые включали пациентов как с грамположительными, так и с грамотрицательными инфекциями.
В большинстве случаев тошнота была легкой, проходила сама по себе и не требовала отмены цефтобипрола. Тошнота реже наблюдалась у пациентов, которые получали 120-минутные инфузии (10%), чем у тех, кто получал 60-минутные инфузии (14%).
Частота возникновения судорожных припадков, анафилаксии и псевдомембранозного колита, вызванного сlostridium difficile, составила менее 1% .[[v.
Исследования взаимодействия цефтобипрола с другими препаратами не проводили. Препарат Зефтера обладает минимальной способностью к взаимодействию с другими ЛС.
Цефтобипрол показал минимальную способность ингибировать изоферменты сYP1A2, сYP2C9, сYP2C19, сYP2D6 и сYP3A4, а также отсутствие способности индуцировать эти изоферменты. Благодаря этому и вследствие того, что распределение цефтобипрола ограничено внеклеточной жидкостью, он обладает низкой способностью влиять на сYP450-зависимый метаболический клиренс одновременно вводимых препаратов. Способность других препаратов взаимодействовать с цефтобипролом тоже минимальна, поскольку метаболизму подвергается лишь небольшая часть дозы этого препарата. Таким образом, нет оснований бояться возникновения клинически значимых лекарственных взаимодействий цефтобипрола.
Цефтобипрол не секретируется почечными канальцами, и реабсорбируется лишь незначительная часть его дозы, и поэтому лекарственные взаимодействия на уровне почек мало вероятны.
Не было выявлено влияния на фармакокинетику цефтобипрола следующих одновременно применяемых препаратов: фентанил, лидокаин, парацетамол, диклофенак, ацетилсалициловая кислота, гепарин, дифенгидрамин, пропофол, гидроморфона гидрохлорид, метадон, гидрокодона битартрат, метамизола натрий и фуросемид.
Совместимость цефтобипрола с другими препаратами не изучали. Цефтобипрол не следует смешивать с другими препаратами или добавлять к растворам, содержащим другие ЛС.[[a.
В настоящее время нет информации о передозировке у человека. Самая высокая суточная доза, которая была введена в фазе I клинических исследований составила 3 г (1 г каждые 8 ч).
Лечение. Общая поддерживающая терапия с мониторированием основных физиологических показателей. Понижение уровня цефтобипрола в плазме крови с помощью гемодиализа.[[m.
Описаны серьезные и иногда летальные реакции гиперчувствительности (анафилактические реакции) у пациентов, получавших бета-лактамные антибиотики. Эти реакции чаще возникают у пациентов с гиперчувствительностью на большое число аллергенов. Перед началом лечения препаратом Зефтера пациента необходимо подробно расспросить, чтобы установить, были ли у него ранее реакции гиперчувствительности на другие цефалоспорины, пенициллины или иные аллергены. В случае возникновения аллергической реакции на препарат Зефтера его необходимо сразу же отменить. Серьезные острые реакции гиперчувствительности (анафилаксия) требуют соответствующего лечения.
Необходимо провести бактериологическое исследование с целью выделения и идентификации возбудителей инфекций и определения их чувствительности к цефтобипролу. При отсутствии таких данных следует проводить эмпирическую терапию, руководствуясь местными эпидемиологическими данными и информацией о местной структуре чувствительности микроорганизмов.
У пациентов, получающих антибактериальные средства, включая цефтобипрол, может возникнуть псевдомембранозный колит разной степени тяжести. В связи с этим, следует помнить о возможности развития псевдомембранозного колита у пациентов, у которых на фоне лечения цефтобипролом возникает диарея.
Длительное применение цефтобипрола, как и других антибиотиков, может вызвать чрезмерное размножение нечувствительных микроорганизмов, включая грибы, и поэтому необходимо периодически оценивать состояние пациента. При возникновении суперинфекции во время лечения цефтобипролом необходимо принять соответствующие меры.
При применении цефтобипрола, как и других бета-лактамов, пациенты могут испытывать приступы судорожных припадков. Возникновение припадков, связанных с применением цефтобипрола, чаще всего наблюдается у пациентов с уже имеющимися заболеваниями ЦНС. Поэтому рекомендуется соблюдать осторожность при лечении таких больных.[[o.
Влияние на способность вождения автомобиля и работу с механизмами.
Не было проведено ни одного исследования влияния препарата Зефтера на вождение автомобиля и работу с механизмами. Однако прием препарата Зефтера может вызвать головокружение, что может оказать воздействие на способность к вождению автомобиля и работе с механизмами. Поэтому не рекомендуется применять препарат Зефтера во время вождения автомобиля и работы с механизмами.
Хранение приготовленного и инфузионного раствора. Приготовленный раствор может храниться в течение 1 ч при температуре 25 °C и 24 ч при температуре 2-8 °C.
Растворение, разведение и инфузию необходимо осуществлять в течение времени, указанного в таблице 3.
Таблица 3.
Стабильность инфузионных растворов препарата Зефтера.
Приготовленный и инфузионный раствор нельзя замораживать и выставлять на открытые солнечные лучи.
После извлечения из холодильника инфузионным растворам нужно дать нагреться до комнатной температуры и только после этого делать инфузию. В процессе применения инфузионного раствора не требуется его защита от света.
Инфузионный раствор должен быть приготовлен в соответствии с инструкциями по приготовлению раствора и обращению с ним ( см «Способ применения и дозы»).[[ф.
Описание было автоматически дополнено из инструкции препарата «Зефтера», поскольку у самого действующего вещества нет подробного описания.
Механизм действия. Цефтобипрола медокарил является водорастворимым пролекарством цефтобипрола - цефалоспорина, обладающего бактерицидной активностью в отношении широкого спектра грамположительных бактерий, включая резистентные к метициллину виды Staphylococcus, резистентные к пенициллину Streptococcus pneumoniae, а также чувствительные к ампициллину Enterococcus faecalis. Активен также в отношении многих грамотрицательных бактерий, включая многие штаммы семейства Enterobacteriaceae и Pseudomonas aeruginosa.
Прочно связывается со многими важными пенициллинсвязывающими белками (PBP) как грамположительных, так и грамотрицательных бактерий. Обладает ярко выраженной бактерицидной активностью в отношении Staphylococcus, резистентных к метициллину, благодаря прочному связыванию с PBP стафилококков группы 2a, включая метициллин-резистентные Staphylococcus aureus (MRSA).
Установлено, что цефтобипрол активен в отношении большинства изолятов перечисленных ниже микроорганизмов как in vitro, так и при внутрибольничных инфекциях.
Грамположительные аэробы: Enterococcus faecalis (только изоляты, чувствительные к ванкомицину), Staphylococcus aureus (изоляты, чувствительные и резистентные к метициллину), Staphylococcus epidermidis, Streptococcus agalactiae, Streptococcus pyogenes, Enterococcus faecalis (изоляты, резистентные к ванкомицину); Staphylococcus коагулазонегативные (изоляты, чувствительные и резистентные к метициллину, включая Staphylococcus haemolyticus, Staphylococcus hominis, Staphylococcus lugdunensis и Staphylococcus saprophyticus), Streptococcus pneumoniae (изоляты, чувствительные к пенициллину, умеренно резистентные и резистентные к пенициллину); Streptococcus группы viridans.
Грамотрицательные аэробы: Enterobacter cloacae, Escherichia coli, Klebsiella pneumoniae; Proteus mirabilis, Pseudomonas aeruginosa; виды рода сitrobacter (включая сitrobacter freundii и сitrobacter koseri), Enterobacter aerogenes, Klebsiella oxytoca, Moraxella catarrhalis, Morganella morganii; виды рода Neisseria; виды рода Providencia, Serratia marcescens.
Механизм устойчивости. Цефтобипрол устойчив к гидролизу пенициллиназами S. aureus, а также к гидролизу многими бета-лактамазами класса С и класса А, продуцируемыми грамотрицательными бактериями. Как и большинство цефалоспоринов, цефтобипрол гидролизуется бета-лактамазами расширенного спектра (ESBL), карбапенемазами и металло-бета-лактамазами. In vitro не наблюдалась селекция высокоуровневой резистентности у стафилококков, стрептококков и Haemophilus influenzae.
Перекрестная резистентность. Резистентность к цефтобипролу, вызванная спонтанной мутацией in vitro, наблюдается редко. Описана перекрестная резистентность между цефтобипролом и некоторыми другими цефалоспоринами последних поколений. Вместе с тем, некоторые микроорганизмы, резистентные к другим цефалоспоринам, могут быть чувствительными к цефтобипролу.[[k.
Концентрации в плазме. Средние фармакокинетические параметры.
Цефтобипрола у взрослых после введения одной дозы 500 мг в виде 60-минутной инфузии и.
Многократных доз 500 мг, вводившихся каждые 8 ч в виде 120-минутных инфузий, приведены в.
Таблице 1. Фармакокинетические характеристики сходны после введения одной дозы и после введения.
Многократных доз.
Таблица 1.
Средние (стандартное отклонение) фармакокинетические параметры цефтобипрола у.
Взрослых.
| Параметры | 1 доза 500 мг в виде 60-минутной инфузии | Многократные дозы 500 мг в виде 120-минутных инфузий каждые 8 ч |
| сmax, мкг/мл | 34,2 (6,05) | 33,0 (4,83) |
| AUC, мкг/ч/мл | 116 (20,2) | 102 (11,9) |
| Т1/2, ч | 2,85 (0,55) | 3,3 (0,3) |
| сl, л/ч | 4,46 (0,84) | 4,98 (0,58) |
Cmax и AUC цефтобипрола увеличиваются пропорционально дозе в.
Диапазоне доз 125 мг-1 г. Стационарные (равновесные) концентрации достигаются в.
Первый день лечения; у людей с нормальной функцией почек введение цефтобипрола каждые 8 и 12 ч.
Не вызывает его кумуляции.
Распределение. Цефтобипрол на 16% связывается с белками плазмы и.
Эта степень связывания не зависит от его концентрации. Стационарный объем распределения (18 л).
Цефтобипрола приближается к объему внеклеточной жидкости у человека.
Метаболизм. Биопревращение из пролекарства цефтобипрола.
Медокарила в активное лекарство - цефтобипрол происходит быстро и катализируется.
Эстеразами плазмы. Концентрации пролекарства ничтожно малы, и его удается обнаружить в плазме и моче.
Только во время инфузии.
Цефтобипрол подвергается минимальному метаболизму до нециклического.
Метаболита, который микробиологически неактивен. Концентрация этого метаболита ниже концентрации.
Самого цефтобипрола и составляет около 4% от последней.
Выведение. Цефтобипрол выводится преимущественно в неизмененном.
Виде посредством почечной экскреции, и Т1/2 составляет около 3 Главным механизмом.
Почечной экскреции является клубочковая фильтрация, небольшая часть дозы подвергается канальцевой.
Реабсорбции. В доклинических исследованиях пробенецид не влиял на фармакокинетику цефтобипрола,.
Что указывает на отсутствие активной канальцевой секреции последнего. После введения 1 дозы примерно.
89% ее обнаруживается в моче в виде активного цефтобипрола (83%), метаболита с открытым кольцом (5%) и.
Цефтобипрола медокарила (.
Особые группы пациентов.
Пациенты с почечной недостаточностью. Фармакокинетика цефтобипрола.
Сходна у здоровых добровольцев и у пациентов с легкой почечной недостаточностью (Cl креатинина 50.
-80 мл/мин). По сравнению с AUC у здоровых добровольцев с нормальной функцией почек, AUC.
Цефтобипрола была в 2,5 и 3,3 раза выше у пациентов с почечной недостаточностью средней тяжести (Cl.
Креатинина 30-≤50 мл/мин) и тяжелой почечной недостаточностью (Cl креатинина < 30.
Мл/мин) соответственно. У пациентов со среднетяжелой и тяжелой почечной недостаточностью.
Рекомендуется снижать дозу цефтобипрола.
AUC цефтобипрола и его микробиологически неактивного метаболита со.
Структурой открытого кольца возрастает у пациентов, которым необходим гемодиализ, по сравнению с AUC.
У здоровых добровольцев.
Пациенты с печеночной недостаточностью. У пациентов с печеночной.
Недостаточностью фармакокинетику цефтобипрола не изучали. Цефтобипрол подвергается минимальному.
Печеночному метаболизму и экскретируется в основном почками в неизмененном виде, и поэтому нет.
Оснований считать, что клиренс цефтобипрола у пациентов с печеночной недостаточностью будет снижен.
Пожилые пациенты. Популяционные исследования фармакокинетики.
Цефтобипрола не выявили независимого влияния возраста на его фармакокинетические параметры. У.
Пожилых пациентов с нормальной функцией почек дозу этого препарата снижать не нужно.
Мужчины и женщины. Системные фармакокинетические параметры.
Цефтобипрола у женщин были выше, чем у мужчин (Cmax на 21% и AUC на 15%); вместе с тем.
Показатель tМИК (где t - время, в течение которого концентрация препарата превышает.
Величину минимальной ингибирующей концентрации) был сходным у мужчин и женщин. Следовательно нет.
Необходимости корректировать дозу этого препарата в зависимости от пола пациента.
Расовая принадлежность. Популяционные исследования.
Фармакокинетики (включавшие европеоидов и небольшое число негроидов и представителей других рас) не.
Выявили влияния расовой принадлежности на фармакокинетические параметры цефтобипрола.
Следовательно, нет необходимости корректировать дозу этого препарата в зависимости от расовой.
Принадлежности пациента.[[p.
Лечение осложненных инфекций кожи и ее придатков, включая инфицированную диабетическую стопу без сопутствующего остеомиелита.[[r.
Гиперчувствительность к цефтобипролу, любому вспомогательному веществу, входящему в состав препарата и другим цефалоспоринам;
Пациенты, у которых в анамнезе наблюдались аллергические реакции на бета-лактамные антибиотики;
Детский возраст до 18 лет.
С осторожностью:
Почечная недостаточность (Cl креатинина < 50 мл/мин);
Эпилепсия;
Судорожные припадки (в анамнезе);
Псевдомембранозный колит (в анамнезе).[[b.
Доклинические исследования показали, что цефтобипрол не обладает тератогенной активностью и не влияет на оссификацию, массу тела плода и внутриутробное развитие. Исследования применения цефтобипрола у беременных женщин не проводили. Результаты исследования влияния ЛС на репродуктивную функцию животных не всегда могут быть интерполированы на соответствующую функцию человека, и поэтому цефтобипрол можно назначать беременным женщинам только в тех случаях, когда ожидаемая польза применения для будущей матери перевешивает потенциальный риск для плода.
Неизвестно, способен ли цефтобипрол проникать в грудное молоко кормящих женщин. Исследования на животных показали, что препарат проникает в молоко. Учитывая это, женщины, получающие препарат Зефтера, должны воздерживаться от грудного вскармливания.[[e.
Нежелательные эффекты, наблюдавшиеся в клинических исследованиях. Нежелательные эффекты, возникавшие с частотой ≥1 % у пациентов, которые получали 500 мг цефтобипрола каждые 8-12 ч в виде 60 или 120-минутных инфузий, перечислены в таблице 2.
Нежелательными эффектами, обусловившими отмену цефтобипрола, были кожная сыпь (0,6%), тошнота (0,5%), рвота (0,4%), реакции гиперчувствительности (0,3%) и гипонатриемия (0,3%).
Таблица 2.
Частота (проценты) нежелательных эффектов, наблюдавшихся в 2 клинических испытаниях фазы III с частотой ≥1%.
| Системы органов | Процент нежелательных эффектов | |
| Цефтобипрол 500 мг каждые 12 или 8 ч (n = 932) | Препараты сравнения (n = 661)* | |
| Инфекции и инвазии | ||
| Грибковые инфекции (грибковые инфекции вульвы и влагалища, полости рта и кожи) | 2 | 2 |
| Иммунная система | ||
| Гиперчувствительность (включает крапивницу, зудящую сыпь и лекарственную гиперчувствительность) | 1 | 3 |
| Метаболические нарушения | ||
| Гипонатриемия | 1 | 0 |
| Нервная система | ||
| Головная боль | 7 | 6 |
| Головокружение | 3 | 2 |
| Извращение вкуса | 6 | 1 |
| ЖКТ | ||
| Тошнота | 12 | 7 |
| Диарея | 7 | 5 |
| Рвота | 7 | 4 |
| Диспепсия | 2 | 1 |
| Кожа и подкожные ткани | ||
| Сыпь (включает макулезную, папулезную, макулопапулезную и генерализованную сыпь) | 4 | 3 |
| Зуд | 3 | 8 |
| Общие нарушения и местные реакции | ||
| Кожные реакции в месте инфузии | 8 | 6 |
| Лабораторные показатели | ||
| Повышение уровней печеночных ферментов (включает повышение уровней АЛТ и АСТ) | 3 | 3 |
* Ванкомицин и ванкомицин + цефтазидим в исследованиях, которые включали пациентов как с грамположительными, так и с грамотрицательными инфекциями.
В большинстве случаев тошнота была легкой, проходила сама по себе и не требовала отмены цефтобипрола. Тошнота реже наблюдалась у пациентов, которые получали 120-минутные инфузии (10%), чем у тех, кто получал 60-минутные инфузии (14%).
Частота возникновения судорожных припадков, анафилаксии и псевдомембранозного колита, вызванного сlostridium difficile, составила менее 1% .[[v.
Исследования взаимодействия цефтобипрола с другими препаратами не проводили. Препарат Зефтера обладает минимальной способностью к взаимодействию с другими ЛС.
Цефтобипрол показал минимальную способность ингибировать изоферменты сYP1A2, сYP2C9, сYP2C19, сYP2D6 и сYP3A4, а также отсутствие способности индуцировать эти изоферменты. Благодаря этому и вследствие того, что распределение цефтобипрола ограничено внеклеточной жидкостью, он обладает низкой способностью влиять на сYP450-зависимый метаболический клиренс одновременно вводимых препаратов. Способность других препаратов взаимодействовать с цефтобипролом тоже минимальна, поскольку метаболизму подвергается лишь небольшая часть дозы этого препарата. Таким образом, нет оснований бояться возникновения клинически значимых лекарственных взаимодействий цефтобипрола.
Цефтобипрол не секретируется почечными канальцами, и реабсорбируется лишь незначительная часть его дозы, и поэтому лекарственные взаимодействия на уровне почек мало вероятны.
Не было выявлено влияния на фармакокинетику цефтобипрола следующих одновременно применяемых препаратов: фентанил, лидокаин, парацетамол, диклофенак, ацетилсалициловая кислота, гепарин, дифенгидрамин, пропофол, гидроморфона гидрохлорид, метадон, гидрокодона битартрат, метамизола натрий и фуросемид.
Совместимость цефтобипрола с другими препаратами не изучали. Цефтобипрол не следует смешивать с другими препаратами или добавлять к растворам, содержащим другие ЛС.[[a.
В настоящее время нет информации о передозировке у человека. Самая высокая суточная доза, которая была введена в фазе I клинических исследований составила 3 г (1 г каждые 8 ч).
Лечение. Общая поддерживающая терапия с мониторированием основных физиологических показателей. Понижение уровня цефтобипрола в плазме крови с помощью гемодиализа.[[m.
Описаны серьезные и иногда летальные реакции гиперчувствительности (анафилактические реакции) у пациентов, получавших бета-лактамные антибиотики. Эти реакции чаще возникают у пациентов с гиперчувствительностью на большое число аллергенов. Перед началом лечения препаратом Зефтера пациента необходимо подробно расспросить, чтобы установить, были ли у него ранее реакции гиперчувствительности на другие цефалоспорины, пенициллины или иные аллергены. В случае возникновения аллергической реакции на препарат Зефтера его необходимо сразу же отменить. Серьезные острые реакции гиперчувствительности (анафилаксия) требуют соответствующего лечения.
Необходимо провести бактериологическое исследование с целью выделения и идентификации возбудителей инфекций и определения их чувствительности к цефтобипролу. При отсутствии таких данных следует проводить эмпирическую терапию, руководствуясь местными эпидемиологическими данными и информацией о местной структуре чувствительности микроорганизмов.
У пациентов, получающих антибактериальные средства, включая цефтобипрол, может возникнуть псевдомембранозный колит разной степени тяжести. В связи с этим, следует помнить о возможности развития псевдомембранозного колита у пациентов, у которых на фоне лечения цефтобипролом возникает диарея.
Длительное применение цефтобипрола, как и других антибиотиков, может вызвать чрезмерное размножение нечувствительных микроорганизмов, включая грибы, и поэтому необходимо периодически оценивать состояние пациента. При возникновении суперинфекции во время лечения цефтобипролом необходимо принять соответствующие меры.
При применении цефтобипрола, как и других бета-лактамов, пациенты могут испытывать приступы судорожных припадков. Возникновение припадков, связанных с применением цефтобипрола, чаще всего наблюдается у пациентов с уже имеющимися заболеваниями ЦНС. Поэтому рекомендуется соблюдать осторожность при лечении таких больных.[[o.
Влияние на способность вождения автомобиля и работу с механизмами.
Не было проведено ни одного исследования влияния препарата Зефтера на вождение автомобиля и работу с механизмами. Однако прием препарата Зефтера может вызвать головокружение, что может оказать воздействие на способность к вождению автомобиля и работе с механизмами. Поэтому не рекомендуется применять препарат Зефтера во время вождения автомобиля и работы с механизмами.
Хранение приготовленного и инфузионного раствора. Приготовленный раствор может храниться в течение 1 ч при температуре 25 °C и 24 ч при температуре 2-8 °C.
Растворение, разведение и инфузию необходимо осуществлять в течение времени, указанного в таблице 3.
Таблица 3.
Стабильность инфузионных растворов препарата Зефтера.
| Растворитель (для приготовления инфузионного раствора) | Температура, условия и время хранения | ||
| 25 °C | 2-8 °C (холодильник) | ||
| в защищенном от света месте | на свету | в защищенном от света месте | |
| 0,9% раствор хлорида натрия | 24 ч | 8 ч | 96 ч |
| 5% раствор декстрозы | 12 ч | 8 ч | 96 ч |
| Раствор Рингера | 24 ч | 8 ч | не держать в холодильнике |
Приготовленный и инфузионный раствор нельзя замораживать и выставлять на открытые солнечные лучи.
После извлечения из холодильника инфузионным растворам нужно дать нагреться до комнатной температуры и только после этого делать инфузию. В процессе применения инфузионного раствора не требуется его защита от света.
Инфузионный раствор должен быть приготовлен в соответствии с инструкциями по приготовлению раствора и обращению с ним ( см «Способ применения и дозы»).[[ф.
Описание было автоматически дополнено из инструкции препарата «Зефтера», поскольку у самого действующего вещества нет подробного описания.
|
|
Входит в состав
- — Зефтера