МКБ-10 коды
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: D81.
Год утверждения (частота пересмотра): 2018.
Возрастная категория: Дети.
Год окончания действия: 2020.
ID: 335.
Разработчик клинической рекомендации.
• Национальное общество детских гематологов, онкологов.
Год утверждения (частота пересмотра): 2018.
Возрастная категория: Дети.
Год окончания действия: 2020.
ID: 335.
Разработчик клинической рекомендации.
• Национальное общество детских гематологов, онкологов.
|
|
 Список сокращений
Список сокращений
АДА - аденозиндезаминаза.
АДФ - аденозиндифосфат.
АЛТ - аланинаминотрансфераза.
AР - аутосомно-рецессивный тип наследования.
АСТ - аспартатаминотрансфераза.
АТГ - антитимоцитарный глобулин.
АХЗ - анемии хронических заболеваний.
БЦЖ - бацилла Кальметта-Герена.
ВВИГ - внутривенные иммуноглобулины.
ГГТ- гамма-глютамилтрансфераза.
ГКС - глюкокортикостероиды.
Г-КСФ - гранулоцитарный колониестимулирующий фактор.
ГМ- КСФ - гранулоцитарно-макрофагальный колониестимулирующий фактор.
ДНК - дезоксирибонуклеиновая кислота.
ЖКТ - желудочно-кишечный тракт.
ИГ - иммуноглобулин.
КИН - комбинированная иммунная недостаточность.
КМ - костный мозг.
КТ - компьютерная томография.
ЛПУ - лечебно-профилактическое учреждение.
ЛДГ- лактатдегидрогеназа.
МРТ - магнитно-резонансная томография.
НК - лимфоциты натуральные киллеры.
ПЦР - полимеразная цепная реакция.
РКИ - рандомизированные контролируемые исследования.
РНК - рибонуклеиновая кислота.
РТПХ - реакция «трансплантат против хозяина».
СДД - синдром ДиДжорджи (Ди Георга).
ТГСК - трансплантация гемопоэтических стволовых клеток.
ТКИН - тяжелая комбинированная иммунная недостаточность.
УЗИ - ультразвуковое исследование.
ЦНС - центральная нервная система.
ЩФ - щелочная фосфатаза.
ЭКГ - электрокардиография.
ADA - аденозиндезаминаза.
АК2 - аденилат-киназа.
CD - cluster of differentiation - кластер дифференцировки.
CD3delta - delta цепь рецептора Т-лимфоцитов (CD3).
CD3epsilon - epsilon цепь рецептора Т-лимфоцитов (CD3).
CD3zeta - zeta цепь рецептора Т-лимфоцитов (CD3).
CD45 - сD45 protein tyrosine phosphatase - тирозинфосфатаза протеина сD45.
DNA-PKcs - DNA-dependent protein kinase, catalytic subunit - ДНК-зависимая протеинкиназа, каталитическая субъединица.
DCLRE1 - DNA cross-link repair 1 protein - ДНК-сшивающий протеин 1.
EADA - эритроцитарная аденозиндезаминаза.
EBV- Epstein-Barre virus- вирус Эпштейн-Барр.
GPPs - good practice points.
HLA - human leukocyte antigens - антигены гистосовместимости человек.
IL - интерлейкин.
IUIS - International Union of Immunological Societies -Международный союз.
Иммунологических обществ.
IL7RA - альфа цепь рецептора интерлейкина 7.
IL2RG - гамма цепь рецептора интерлейкина 2.
FISH - fluorescence in situ hybridization - метод флюоресцентной гибридизации in-citu .
JAK3 - Janus киназа-3.
KREС - kappa-deleting recombination excision circles - кольцевые фрагменты ДНК, образующиеся в процессе формирования в клеточного рецептора.
LIG4 - DNA ligase 4 - ДНК-лигаза 4.
LSK - Lymphocyte kinase - тирозинкиназа белков-мишеней Т-лимфоцитов.
NGS - next generation sequencing - секвенирования нового поколения.
PNP - purine-nucleoside phosphorylase -пуриннуклеозидфосфорилаза.
PTPRC - protein tyrosine phosphatase receptor type с - тирозиновая протеинфосфатаза с рецепторного типа.
RAG1/RAG2 - recombination-activating gene - ген - активатор рекомбинации 1/2.
STAT5b - Signal transducer and activator of transcription 5B - сигнальный преобразователь и активатор транскрипции 5B.
TREC - T-cell receptor excision circles - кольцевые фрагменты ДНК, образующиеся в процессе формирования Т клеточного рецептора.
XС - X-сцепленный тип наследования.
XLF/NHEJ1 - non-homologous end-joining factor 1 - протеин негомологичного соединения ДНК.
XRCC4 - X-ray repair cross-complementing protein 4 - рентгенконтрастный белок 4 репарации ДНК.
ZAP - zeta associated protein-зета-ассоциированный белок.
АДФ - аденозиндифосфат.
АЛТ - аланинаминотрансфераза.
AР - аутосомно-рецессивный тип наследования.
АСТ - аспартатаминотрансфераза.
АТГ - антитимоцитарный глобулин.
АХЗ - анемии хронических заболеваний.
БЦЖ - бацилла Кальметта-Герена.
ВВИГ - внутривенные иммуноглобулины.
ГГТ- гамма-глютамилтрансфераза.
ГКС - глюкокортикостероиды.
Г-КСФ - гранулоцитарный колониестимулирующий фактор.
ГМ- КСФ - гранулоцитарно-макрофагальный колониестимулирующий фактор.
ДНК - дезоксирибонуклеиновая кислота.
ЖКТ - желудочно-кишечный тракт.
ИГ - иммуноглобулин.
КИН - комбинированная иммунная недостаточность.
КМ - костный мозг.
КТ - компьютерная томография.
ЛПУ - лечебно-профилактическое учреждение.
ЛДГ- лактатдегидрогеназа.
МРТ - магнитно-резонансная томография.
НК - лимфоциты натуральные киллеры.
ПЦР - полимеразная цепная реакция.
РКИ - рандомизированные контролируемые исследования.
РНК - рибонуклеиновая кислота.
РТПХ - реакция «трансплантат против хозяина».
СДД - синдром ДиДжорджи (Ди Георга).
ТГСК - трансплантация гемопоэтических стволовых клеток.
ТКИН - тяжелая комбинированная иммунная недостаточность.
УЗИ - ультразвуковое исследование.
ЦНС - центральная нервная система.
ЩФ - щелочная фосфатаза.
ЭКГ - электрокардиография.
ADA - аденозиндезаминаза.
АК2 - аденилат-киназа.
CD - cluster of differentiation - кластер дифференцировки.
CD3delta - delta цепь рецептора Т-лимфоцитов (CD3).
CD3epsilon - epsilon цепь рецептора Т-лимфоцитов (CD3).
CD3zeta - zeta цепь рецептора Т-лимфоцитов (CD3).
CD45 - сD45 protein tyrosine phosphatase - тирозинфосфатаза протеина сD45.
DNA-PKcs - DNA-dependent protein kinase, catalytic subunit - ДНК-зависимая протеинкиназа, каталитическая субъединица.
DCLRE1 - DNA cross-link repair 1 protein - ДНК-сшивающий протеин 1.
EADA - эритроцитарная аденозиндезаминаза.
EBV- Epstein-Barre virus- вирус Эпштейн-Барр.
GPPs - good practice points.
HLA - human leukocyte antigens - антигены гистосовместимости человек.
IL - интерлейкин.
IUIS - International Union of Immunological Societies -Международный союз.
Иммунологических обществ.
IL7RA - альфа цепь рецептора интерлейкина 7.
IL2RG - гамма цепь рецептора интерлейкина 2.
FISH - fluorescence in situ hybridization - метод флюоресцентной гибридизации in-citu .
JAK3 - Janus киназа-3.
KREС - kappa-deleting recombination excision circles - кольцевые фрагменты ДНК, образующиеся в процессе формирования в клеточного рецептора.
LIG4 - DNA ligase 4 - ДНК-лигаза 4.
LSK - Lymphocyte kinase - тирозинкиназа белков-мишеней Т-лимфоцитов.
NGS - next generation sequencing - секвенирования нового поколения.
PNP - purine-nucleoside phosphorylase -пуриннуклеозидфосфорилаза.
PTPRC - protein tyrosine phosphatase receptor type с - тирозиновая протеинфосфатаза с рецепторного типа.
RAG1/RAG2 - recombination-activating gene - ген - активатор рекомбинации 1/2.
STAT5b - Signal transducer and activator of transcription 5B - сигнальный преобразователь и активатор транскрипции 5B.
TREC - T-cell receptor excision circles - кольцевые фрагменты ДНК, образующиеся в процессе формирования Т клеточного рецептора.
XС - X-сцепленный тип наследования.
XLF/NHEJ1 - non-homologous end-joining factor 1 - протеин негомологичного соединения ДНК.
XRCC4 - X-ray repair cross-complementing protein 4 - рентгенконтрастный белок 4 репарации ДНК.
ZAP - zeta associated protein-зета-ассоциированный белок.
Термины и определения
Внутривенные иммуноглобулины. Препараты, содержащие преимущественно нормальный человеческий IgG. Изготовляются из пулированной плазмы тысяч здоровых доноров, с применением специальных методов очистки и вирусинактивации.
Полимеразная цепная реакция. Метод молекулярной биологии, позволяющий амплифицировать (размножить) определённый участок ДНК.
Секвенирование ДНК. Определение ее нуклеотидной последовательности. В результате секвенирования получают описание первичной структуры линейной ДНК в виде последовательности нуклеотидов в текстовом виде.
Трансплантация гематопоэтических стволовых клеток. Метод лечения некоторых наследственных и приобретенных гематологических, онкологических и иммунных заболеваний, основанный на замене собственного, патологического кроветворения больного на нормальное кроветворение донора.
Аутосомно-рецессивный тип наследования. Наследование мутации генов, когда для проявления болезни мутация гена, локализованного в аутосоме, должна быть унаследована от обоих родителей. Мутация проявляется только в гомозиготном состоянии, то есть тогда, когда обе копии гена, расположенные на гомологичных аутосомах, являются повреждёнными. Если мутация находится в гетерозиготном состоянии, и мутантному аллелю сопутствует нормальный функциональный аллель, то аутосомно-рецессивная мутация не проявляется (носительство).
Х-сцепленный тип наследования. Наследование мутации генов, расположенных на Х хромосоме. При этом лица женского пола как правило являются бессимптомными носителями, а заболеванием страдают лишь лица мужского пола.
TREC. Кольцевые фрагменты ДНК, образующиеся при развитии Т лимфоцитов в тимусе, в частности, в процессе формирования Т клеточного рецептора. Их концентрация в крови отражает эффективность тимопоэза. Используется для скрининга Т клеточных иммунодефицитов.
Полимеразная цепная реакция. Метод молекулярной биологии, позволяющий амплифицировать (размножить) определённый участок ДНК.
Секвенирование ДНК. Определение ее нуклеотидной последовательности. В результате секвенирования получают описание первичной структуры линейной ДНК в виде последовательности нуклеотидов в текстовом виде.
Трансплантация гематопоэтических стволовых клеток. Метод лечения некоторых наследственных и приобретенных гематологических, онкологических и иммунных заболеваний, основанный на замене собственного, патологического кроветворения больного на нормальное кроветворение донора.
Аутосомно-рецессивный тип наследования. Наследование мутации генов, когда для проявления болезни мутация гена, локализованного в аутосоме, должна быть унаследована от обоих родителей. Мутация проявляется только в гомозиготном состоянии, то есть тогда, когда обе копии гена, расположенные на гомологичных аутосомах, являются повреждёнными. Если мутация находится в гетерозиготном состоянии, и мутантному аллелю сопутствует нормальный функциональный аллель, то аутосомно-рецессивная мутация не проявляется (носительство).
Х-сцепленный тип наследования. Наследование мутации генов, расположенных на Х хромосоме. При этом лица женского пола как правило являются бессимптомными носителями, а заболеванием страдают лишь лица мужского пола.
TREC. Кольцевые фрагменты ДНК, образующиеся при развитии Т лимфоцитов в тимусе, в частности, в процессе формирования Т клеточного рецептора. Их концентрация в крови отражает эффективность тимопоэза. Используется для скрининга Т клеточных иммунодефицитов.
|
|
Описание
Тяжелая комбинированная иммунная недостаточность (ТКИН). Генетически обусловленный (первичный) иммунодефицит, характеризующийся практически полным отсутствием зрелых Т-лимфоцитов при наличии или отсутствии В - и НК - лимфоцитов, что ведет к ранним, крайне тяжелым инфекциям вирусной, бактериальной и оппортунистической природы и, в отсутствие трансплантации гематопоэтических стволовых клеток, к смерти в первые два года жизни [1-3].
Причины
ТКИН вызвана мутациями в различных генах, вызывающих дефицит различных ключевых молекул и факторов, необходимых для созревания и нормальной дифференцировки Т-лимфоцитов, в некоторых случаях - и других субпопуляций лимфоцитов. 1.
Рисунок 1. Схема основных механизмов формирования и дифференцировки Т-лимфоцитов [4].
В настоящее время известна генетическая природа более 20 форм ТКИН (табл.1, приложение Г) [1-3], часть пациентов имеет до сих пор не верифицированные генетические дефекты. Заболевание может наследоваться как Х-сцепленно (приблизительно в половине случаев), так и аутосомно-рецессивно [5].
Предполагаемая частота тех или иных генетических дефектов, вычисленная на основании данных неонатального скрининга ТКИН в США [6], представлена на 2.
Рисунок 2. Диаграмма, представляющая частоту обнаружения различных генетических дефктов, лежащих в основе ТКИН.
Как известно, Т-лимфоциты являются основными эффекторными и регуляторными клетками специфического иммунитета. В их отсутствие страдают функции противомикробного, противовирусного иммунитета, нарушается формирование аутотолерантности. Даже в случаях присутствия у пациентов В-лимфоцитов, функция специфического антителообразования также значительно страдает, так как для ее осуществления необходимо взаимодействие Т- и В- лимфоцитов [3].
Рисунок 1. Схема основных механизмов формирования и дифференцировки Т-лимфоцитов [4].
В настоящее время известна генетическая природа более 20 форм ТКИН (табл.1, приложение Г) [1-3], часть пациентов имеет до сих пор не верифицированные генетические дефекты. Заболевание может наследоваться как Х-сцепленно (приблизительно в половине случаев), так и аутосомно-рецессивно [5].
Предполагаемая частота тех или иных генетических дефектов, вычисленная на основании данных неонатального скрининга ТКИН в США [6], представлена на 2.
Рисунок 2. Диаграмма, представляющая частоту обнаружения различных генетических дефктов, лежащих в основе ТКИН.
Как известно, Т-лимфоциты являются основными эффекторными и регуляторными клетками специфического иммунитета. В их отсутствие страдают функции противомикробного, противовирусного иммунитета, нарушается формирование аутотолерантности. Даже в случаях присутствия у пациентов В-лимфоцитов, функция специфического антителообразования также значительно страдает, так как для ее осуществления необходимо взаимодействие Т- и В- лимфоцитов [3].
Эпидемиология
Частота рождения пациентов с ТКИН составляет 1:58 000 новорожденных (1:46 000-1:80 000), среди пациентов преобладают лица мужского пола [6-8].
Классификация
По данным классификации ПИДС 2017 г., разработанной Международным союзом иммунологических обществ (IUIS), выделяют 2 группы ТКИН, в зависимости от наличия или отсутствия В- лимфоцитов: Т-В- и T-B+ [5, 9]. Эти две большие группы могут быть также подразделены на подгруппы в зависимости от наличия или отсутствия NK клеток: T-B-NK+, T-B-NK-, T-B+NK+, T-B+NK- (Приложение Г).
Клиническая картина
Клиническая картина заболевания практически не зависит от генетического дефекта. Для пациентов с ТКИН характерно раннее, в первые недели и месяцы жизни, начало клинических проявлений заболевания в виде упорной диареи, синдрома мальабсорбции, инфекций кожи и слизистых (в первую очередь кандидоз), прогрессирующего поражения респираторного тракта. Возбудителями инфекций могут являться бактерии, вирусы, грибы, условно-патогенные микроорганизмы (в первую очередь Pneumocyctis carinii). Цитомегаловирусная инфекция протекает в виде интерстициальной пневмонии, гепатита, хориоретинита. Несмотря на то, что кандидоз не является редкостью у здоровых детей первых месяцев жизни, у пациентов с ТКИН он имеет упорный, рецидивирующий характер. В случае вакцинации ребенка БЦЖ в роддоме или позже, характерно развитие регионарной и/или и генерализованной M. bovis инфекции, которая проявляется в виде уплотнения и казеозного поражения в месте инъекции, увеличения регионарных лимфоузлов, специфического поражения кожи в виде элементов сыпи или строфулуса. Следует помнить, что у многих младенцев с ТКИН не сразу развиваются все вышеперечисленные симптомы, и в течение нескольких месяцев они могут расти и развиваться нормально, особенно если вакцинация БЦЖ не была проведена при рождении [1-4].
Диагностика
Согласно консенсусу Европейского общества иммунодефицитов (ESID), для подтверждения диагноза ТКИН необходима комбинация признаков [9]:
Одного из следующих:
1. - инвазивные бактериальные, вирусные, грибковые или оппортунистические инфекции.
- длительная диарея с отставанием в физическом развитии.
- приживление материнских Т-лимфоцитов.
- семейный анамнез ТКИН.
- наличие патогенного генетического дефекта (мутации) в одном из генов, ответственных за развитие ТКИН.
В сочетании с:
2. дебютом симптомов в возрасте младше 2-х лет.
3. исключением ВИЧ инфекции.
4. двумя из следующих критериев:
- лимфопения менее 1000 кл/мкл.
- значительно сниженные сD3+ Т-лимфоцитов (менее 20% от общего количества лимфоцитов) или менее 300 кл/мкл.
- повышенные g/d Т-лимфоциты.
- значительно сниженная/отсутствующая пролиферация в ответ на митогены или стимуляцию TCR (менее 10% по отношению к здоровому контролю).
- значительно сниженная/отсутствующая активность аденозиндезаминазы (менее, чем 2% по отношению к здоровому контролю).
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Родители пациента, как правило, предъявляют жалобы на появившийся с первых месяцев жизни жидкий стул, отсутствие прибавки в весе, трудно поддающиеся лечению пеленочный дерматит и молочница во рту. Иногда родители сообщают об одной или нескольких перенесенных тяжелых инфекциях (пневмония, сепсис), но нередко первая же респираторная инфекция протекает настолько тяжело, что наводит на мысль об иммунологической недостаточности.
При сборе семейного анамнеза надо обращать внимание на случаи повторных тяжелых инфекций и смертей детей в раннем возрасте с клиникой инфекционных заболеваний. Смерти мальчиков в нескольких поколениях в семье позволяет предполагать Х-сцепленный характер заболевания. Близкородственный брак у родителей увеличивает вероятность аутосомно-рецессивной патологии.
При опросе родителей следует уточнить особенности физического развития ребенка, прибавку в весе, сроки возникновения, частоту и тяжесть проявления инфекционных заболеваний (диареи, грибковых поражений кожи и слизистых, пневмонии и инфекций других локализаций). Также необходимо узнавать, проводилась ли вакцинация БЦЖ в роддоме, отмечались ли изменения в месте вакцинации БЦЖ и регионарных лимфоузлах через 3-4 мес после вакцинации [10].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4 ).
Комментарии:
1. Физическое развитие: пациенты с ТКИН обычно отстают в массе с первых месяцев жизни с прогрессивным развитием гипотрофии тяжелой степени. Подкожно-жировой слой обычно резко истончен. Также задержка психомоторного развития вследствие тяжелых инфекций.
2. Термометрия: у пациентов с ТКИН нередко отмечаются «немотивированные» субфебрилитеты и лихорадка без явного на момент обращения очага инфекции. Однако нередко бывает и обратная ситуация - отсутствие температурной реакции на тяжелую, генерализованную инфекцию.
3. Осмотр кожных покровов: важно обратить внимание на наличие кандидозного поражения кожи и слизистых, наличия мацерации перианальной области (вследствие хронической диареи). В случае предшествующего переливания пациентам необлученной эритроцитарной массы или при приживлении материнских лимфоцитов (материнский химеризм) возможна пятнисто-папулезная полиморфная сыпь, свидетельствующая о наличии реакции трансплантат против хозяина. Необходимо осмотреть левое плечо в месте вакцинации БЦЖ для исключения локального БЦЖита и остальные кожные покровы на предмет инфильтративных полиморфных элементов (генерализованный БЦЖит) [10, 11].
4. Пальпация групп периферических лимфоузлов: в целом для пациентов ТКИН характерна гипоплазия периферической лимфоидной ткани, однако в случае БЦЖита может отмечаться подмышечная лимфаденопатия слева.
5. Органы дыхания: пневмонии при ТКИН нередко имеют этиологию P. jirovicii. Как известно, такие пневмонии сопровождаются прогрессирующей дыхательной недостаточностью с тахипноэ, снижением сатурации кислородом, обилием крепитирующих хрипов, малопродуктивного навязчивого кашля.
6. Пищеварительная система: часто характерно вздутие живота, диарейный синдром, срыгивание и рвота, с нарушением толерантности энтеральной нагрузки, вплоть до полного отказа от еды. Стул, как правило, жидкий с большим количеством слизи, в некоторых случаях с прожилками крови и примесью неперевариваемого питания.
7. Пальпация печени и селезенки: увеличение печени отмечается нередко как проявление токсического гепатита при дефектах пуринового обмена, печеночной формы РТПХ. Спленомегалия характерна для тяжелого течения инфекционных осложнений, септического процесса, а также генерализованной БЦЖ-инфекции [10-12].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Для пациентов с ТКИН в большинстве случаев характерна глубокая лимфопения менее 1000 кл/мкл, также может отмечаться анемия хронического воспаления различной выраженности (легкой до тяжелой степени тяжести).
• Рекомендуется всем пациентам с ТКИН проводить биохимический анализ крови с обязательным исследованием общего белка, альбумина, мочевины, креатинина, общего билирубина, АЛТ, АСТ, ЛДГ, ЩФ, ГГТ, глюкозы, амилазы, липазы, холестерина, калия, натрия и кислотно-щелочного состояния (КЩС, рН) для оценки тяжести соматического статуса и степени поражения органов [14].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Рекомендуется всем пациентам с ТКИН проведение микробиологического и вирусологического исследований различных сред организма для выявления сопутствующей патологии [15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Серологические исследования у пациентов с ТКИН не информативны и не должны применяться. Вирусологический статус пациента характеризуется количественным определением вирусов сMV, EBV, HHV6 методом полимеразной цепной реакции (ПЦР) в крови и ликворе, в бронхо-альвеолярном лаваже к вышеуказанным дополнительно вирусы респираторной группы (РС-вирус, аденовирус, метапневмовирус, коронавирус, вирус парагриппа), в кале и биопсийном материале слизистой ЖКТ - норовирус, аденовирус, ротавирус, астровирус, а также сMV, EBV, HHV6. Необходимо помнить, что отсутствие виремии не является свидетельством негативного вирусологического статуса, необходимо исследование соответствующих сред при поражении тех или иных органов пораженных (вплоть до проведения биопсии).
• Рекомендуется всем пациентам с подозрением на ТКИН, а также с подтвержденным диагнозом ТКИН выполнять исследование концентрации основных классов сывороточных иммуноглобулинов (IgА, IgM, IgG) для оптимального мониторинга претрансфузионного уровня IgG, а также выявления дисгаммаглобулинемии за счет повышения IgM по отношению к низким IgA и IgG [13, 14].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Ко м ментарии. В большинстве случаев у пациентов с ТКИН с первых месяцев жизни выявляется гипогаммаглобулинемия. Однако, учитывая низкие возрастные нормы у детей первого года жизни, оценка уровня иммуноглобулинов нередко является малоинформативной в постановке диагноза ТКИН. Не стоит забывать также, что нормальные уровни IgG в первые месяцы жизни обусловлены персистенцией материнского иммуноглобулина, полученного трансплацентарно, и могут иметь место у младенцев с ТКИН. Даже при нормальной концентрации иммуноглобулинов при ТКИН их специфичность значительно страдает, что можно определить по низкому титру поствакцинальных антител в случае вакцинации ребенка.
• Рекомендуется всем пациентам с ТКИН выполнения иммунофенотипирования основных субпопуляций лимфоцитов (CD3+, сD4+, сD8+, сD19+, сD3-CD16+56+, сD3+CD25+, сD3+HLA -DR+) для верификации диагноза [9, 12, 13, 15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. При проведении иммунофенотипирования значительное снижение Т-лимфоцитов встречается при всех формах ТКИН (менее 300 кл/мкл или менее 20% от общего количества лимфоцитов), однако число В-лимфоцитов и НК-клеток зависит от генетического дефекта, лежащего в основе ТКИН, и может быть вариабельным.
Также нормальное или близкое к нормальному общее число сD3+Т лимфоцитов отмечается при материнском химеризме. Однако, при расширенном иммунофенотипировании эти лимфоциты имеют фенотип клеток памяти сD3+CD4+CD45RO+/ сD3+CD8+CD45RO+.
Патогномоничным для Х-сцепленной формы ТКИН, обусловленной дефектом общей гамма цепи рецептора ИЛ2 является резкое снижение сD3+CD25+ субпопуляции Т-лимфоцитов.
• Рекомендуется для всех пациентов с подозрением на ТКИН, а также при установленном диагнозе ТКИН анализ пролиферативной активности лимфоцитов в ответ на стимуляцию митогенами (реакция бласттрансформации лимфоцитов (РБТЛ)) для выявления снижения пролиферативной активности [9, 12, 13].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Для всех вариантов ТКИН характерно выраженное снижение пролиферативной активности лимфоцитов в ответ на митогены (менее 10% по сравнению с контролем).
• Рекомендуется всем пациентам с подозрением на ТКИН определение маркеров нормального формирования Т-клеточного рецептора TREC (Т-cell excision circles) для выявления глубины Т-клеточного дефекта как дополнительного критерия постановки диагноза ТКИН [16, 17] .
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии: TREC являются критерием эффективности созревания и дифференцировки Т-лимфоцитов в тимусе. Концентрация TREC значительно снижена при всех видах ТКИН независимо от генетического дефекта (менее 50х105 лейкоцитов).
• Рекомендуется всем пациентам с ТКИН определение материнского химеризма в Т-лимфоцитах (СD3+) методом FISH (у пациентов мужского пола) или HLA-типирования (у пациентов как женского, так и мужского пола) для подтверждения/исключения синдрома приживления материнских лимфоцитов (материнской «реакции трансплантат против хозяина») [18] .
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Более чем у 40% пациентов с ТКИН развивается персистенция материнских Т-лимфоцитов, проникающих в организм пациента трансплацентарно, вызывая развитие синдрома приживления материнских лимфоцитов (материнской РТПХ. Это осложнение влечет за собой тяжелое поражение практически всех органов и систем пациента, в первую очередь кожи, кишечника, печени и требует в лечении интенсивной иммуносупрессивной терапии.
• Рекомендуется всем пациентам с установленным диагнозом ТКИН проведение молекулярно-генетического исследования соответствующих генов для семейного консультирования [9, 13, 19, 20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Клинико-лабораторной картины, как правило, достаточно для подтверждения диагноза ТКИН. В связи с необходимостью немедленной трансплантации гемопоэтических стволовых клеток при ТКИН, генетическое подтверждение диагноза не требуется для ее проведения этого вида лечения, однако необходимо для последующего семейного консультирования. Выявление мутаций причинных генов проводится с помощью полимеразной цепной реакции и последующего секвенирования полученных продуктов или с применением методов секвенирования нового поколения (NGS), с последующим подтверждение дефекта методом ПЦР. В настоящее время используют таргетные панели, включающие в себя основные описанные гены, ответственные за развитие ПИДС (от 250 по 400 в зависимости от лаборатории), а также полное экзомное секвенирование. По методу Сэнгера проводят стартовое исследование гена IL2RG у лиц мужского пола с иммунофенотипом ТКИН (Т-В+NK-), при нормальной его последовательности, женском поле пациента и/или другом иммунофенотипе ТКИН и частоты встречаемости дефекта применяются панели NGS или полное экзомное секвенирование. При наличии подозрительных фенотипических симптомов необходимо исключать делецию короткого плеча 22 хромосомы (синдром Ди Георга) методом FISH.
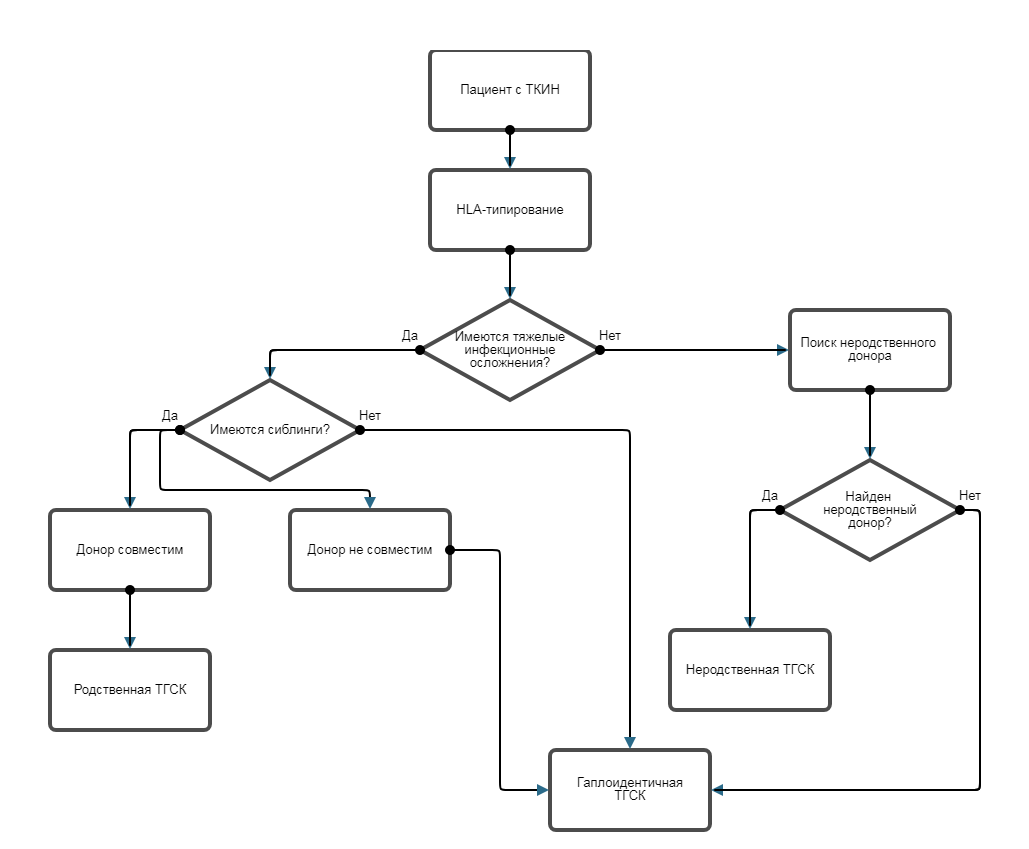
• Рекомендуется всем пациентам с ТКИН выполнение HLA-типирование по двум классам с высоким разрешением для проведения трансплантации гематопоэтических стволовых клеток (ТГСК) [21, 22].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 3).
Комментарии. Так как скорейшее проведение ТГСК при ТКИН является единственным условием сохранения жизни этим пациентам, HLA-типирование с сиблингами, родителями, или типирование для поиска неродственного донора (при отсутствии сиблингов или наличие медицинских противопоказаний к донорству у родителей) должно проводиться сразу после постановки диагноза ТКИН.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Интерстициальные поражения легких, характерные для ТКИН, не могут быть в полной мере оценены с помощью рентгенографии легких, поэтому КТ легких должно проводиться даже при нормальной рентгенограмме. КТ других областей, в том числе органов брюшной полости и забрюшинного пространства с внутривенным контрастированием проводится при подозрении на инфекционное поражение (абсцессы, инфекционные отсевы), а также для исключения лимфопролиферативных осложнений ТКИН (редко, лимфомы).
• Рекомендуется пациентам с ТКИН при подозрении на менингоэнцефалит, а также при проведении предтрансплантационного обследования для исключения скрытой сосудистой патологии (аневризмы, васкулит), очаговых изменений вещества мозга постгипоксического характера проведение магнитно-резонансной томографии (МРТ) головного мозга с внутривенным контрастированием [24] .
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 3).
• Рекомендуется всем пациентам с подозрением на ТКИН, а также с установленным диагнозом ТКИН проведение ультразвукового исследования брюшной полости и забрюшинного пространства для оценки вовлеченности внутренних органов, выявления сопутствующей патологии [14, 15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Другие инструментальные исследования (ЭКГ, ЭХО-КГ, УЗИ периферических лимфоузлов, нейросонография, консультации смежных специалистов (ЛОР, невролог, хирург) проводятся при наличии соответствующих клинических показаний.
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
• Рекомендуется всем пациентам с ТКИН проведение диагностической бронхоскопии с забором бронхо-альвеолярного лаважа для последующего комплексного микробиологического анализа и верификации инфекционных возбудителей респираторного тракта пациента [14, 15, 26].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Рекомендуется пациентам с ТКИН при подозрении на менингоэнцефалит проведение диагностической люмбальной пункции с последующим цитологическим, вирусологическим, бактериологическим исследованиям ликвора [24,27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Рекомендуется семьям пациентов с ТКИН проведение генетического консультирование и проведение пренатальной диагностики [19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии:
Семья пациента с ТКИН.
Необходима пренатальная диагностика при всех последующих беременностях матери в данном браке и в других браках при Х-сцепленном типе наследования. При Х-сцепленном типе наследования необходимо тестирование на носительство мутации сестер пациента, всех сестер матери детородного возраста, по показаниям - других родственников женского пола.
Пациент с ТКИН после ТГСК.
Пренатальная диагностика показана только в близкородственном браке. В других случаях риск заболевания у детей пациента составляет менее 0,1%. Все дети пациента при аутосомно-рецессивном типе наследования и все дочери пациента при Х-сцепленном типе наследования являются носителями мутантного гена, им необходимо семейное консультирование.
Одного из следующих:
1. - инвазивные бактериальные, вирусные, грибковые или оппортунистические инфекции.
- длительная диарея с отставанием в физическом развитии.
- приживление материнских Т-лимфоцитов.
- семейный анамнез ТКИН.
- наличие патогенного генетического дефекта (мутации) в одном из генов, ответственных за развитие ТКИН.
В сочетании с:
2. дебютом симптомов в возрасте младше 2-х лет.
3. исключением ВИЧ инфекции.
4. двумя из следующих критериев:
- лимфопения менее 1000 кл/мкл.
- значительно сниженные сD3+ Т-лимфоцитов (менее 20% от общего количества лимфоцитов) или менее 300 кл/мкл.
- повышенные g/d Т-лимфоциты.
- значительно сниженная/отсутствующая пролиферация в ответ на митогены или стимуляцию TCR (менее 10% по отношению к здоровому контролю).
- значительно сниженная/отсутствующая активность аденозиндезаминазы (менее, чем 2% по отношению к здоровому контролю).
2,1 Жалобы и анамнез.
• Рекомендуется всем пациентам с подозрением на ТКИН подробный опрос жалоб, сбор анамнеза заболевания, семейного анамнеза с целью верификации типичных симптомов, наличие потенциального указания на тип наследования заболевания и оценки тяжести состояния [1-4].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Родители пациента, как правило, предъявляют жалобы на появившийся с первых месяцев жизни жидкий стул, отсутствие прибавки в весе, трудно поддающиеся лечению пеленочный дерматит и молочница во рту. Иногда родители сообщают об одной или нескольких перенесенных тяжелых инфекциях (пневмония, сепсис), но нередко первая же респираторная инфекция протекает настолько тяжело, что наводит на мысль об иммунологической недостаточности.
При сборе семейного анамнеза надо обращать внимание на случаи повторных тяжелых инфекций и смертей детей в раннем возрасте с клиникой инфекционных заболеваний. Смерти мальчиков в нескольких поколениях в семье позволяет предполагать Х-сцепленный характер заболевания. Близкородственный брак у родителей увеличивает вероятность аутосомно-рецессивной патологии.
При опросе родителей следует уточнить особенности физического развития ребенка, прибавку в весе, сроки возникновения, частоту и тяжесть проявления инфекционных заболеваний (диареи, грибковых поражений кожи и слизистых, пневмонии и инфекций других локализаций). Также необходимо узнавать, проводилась ли вакцинация БЦЖ в роддоме, отмечались ли изменения в месте вакцинации БЦЖ и регионарных лимфоузлах через 3-4 мес после вакцинации [10].
2,2 Физикальное обследование.
• Рекомендуется всем пациентам с подозрением на ТКИН проводить полный физикальный осмотр с целью верификации диагноза, оценки тяжести состояния [1-4].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4 ).
Комментарии:
1. Физическое развитие: пациенты с ТКИН обычно отстают в массе с первых месяцев жизни с прогрессивным развитием гипотрофии тяжелой степени. Подкожно-жировой слой обычно резко истончен. Также задержка психомоторного развития вследствие тяжелых инфекций.
2. Термометрия: у пациентов с ТКИН нередко отмечаются «немотивированные» субфебрилитеты и лихорадка без явного на момент обращения очага инфекции. Однако нередко бывает и обратная ситуация - отсутствие температурной реакции на тяжелую, генерализованную инфекцию.
3. Осмотр кожных покровов: важно обратить внимание на наличие кандидозного поражения кожи и слизистых, наличия мацерации перианальной области (вследствие хронической диареи). В случае предшествующего переливания пациентам необлученной эритроцитарной массы или при приживлении материнских лимфоцитов (материнский химеризм) возможна пятнисто-папулезная полиморфная сыпь, свидетельствующая о наличии реакции трансплантат против хозяина. Необходимо осмотреть левое плечо в месте вакцинации БЦЖ для исключения локального БЦЖита и остальные кожные покровы на предмет инфильтративных полиморфных элементов (генерализованный БЦЖит) [10, 11].
4. Пальпация групп периферических лимфоузлов: в целом для пациентов ТКИН характерна гипоплазия периферической лимфоидной ткани, однако в случае БЦЖита может отмечаться подмышечная лимфаденопатия слева.
5. Органы дыхания: пневмонии при ТКИН нередко имеют этиологию P. jirovicii. Как известно, такие пневмонии сопровождаются прогрессирующей дыхательной недостаточностью с тахипноэ, снижением сатурации кислородом, обилием крепитирующих хрипов, малопродуктивного навязчивого кашля.
6. Пищеварительная система: часто характерно вздутие живота, диарейный синдром, срыгивание и рвота, с нарушением толерантности энтеральной нагрузки, вплоть до полного отказа от еды. Стул, как правило, жидкий с большим количеством слизи, в некоторых случаях с прожилками крови и примесью неперевариваемого питания.
7. Пальпация печени и селезенки: увеличение печени отмечается нередко как проявление токсического гепатита при дефектах пуринового обмена, печеночной формы РТПХ. Спленомегалия характерна для тяжелого течения инфекционных осложнений, септического процесса, а также генерализованной БЦЖ-инфекции [10-12].
2,3 Лабораторная диагностика.
• Рекомендуется всем пациентам с подозрением на ТКИН, а также с установленным диагнозом ТКИН, проводить клинический анализ крови с лейкоцитарной формулой для оценки лимфопении как диагностического критерия заболевания [1, 9, 13].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Для пациентов с ТКИН в большинстве случаев характерна глубокая лимфопения менее 1000 кл/мкл, также может отмечаться анемия хронического воспаления различной выраженности (легкой до тяжелой степени тяжести).
• Рекомендуется всем пациентам с ТКИН проводить биохимический анализ крови с обязательным исследованием общего белка, альбумина, мочевины, креатинина, общего билирубина, АЛТ, АСТ, ЛДГ, ЩФ, ГГТ, глюкозы, амилазы, липазы, холестерина, калия, натрия и кислотно-щелочного состояния (КЩС, рН) для оценки тяжести соматического статуса и степени поражения органов [14].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Рекомендуется всем пациентам с ТКИН проведение микробиологического и вирусологического исследований различных сред организма для выявления сопутствующей патологии [15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Серологические исследования у пациентов с ТКИН не информативны и не должны применяться. Вирусологический статус пациента характеризуется количественным определением вирусов сMV, EBV, HHV6 методом полимеразной цепной реакции (ПЦР) в крови и ликворе, в бронхо-альвеолярном лаваже к вышеуказанным дополнительно вирусы респираторной группы (РС-вирус, аденовирус, метапневмовирус, коронавирус, вирус парагриппа), в кале и биопсийном материале слизистой ЖКТ - норовирус, аденовирус, ротавирус, астровирус, а также сMV, EBV, HHV6. Необходимо помнить, что отсутствие виремии не является свидетельством негативного вирусологического статуса, необходимо исследование соответствующих сред при поражении тех или иных органов пораженных (вплоть до проведения биопсии).
• Рекомендуется всем пациентам с подозрением на ТКИН, а также с подтвержденным диагнозом ТКИН выполнять исследование концентрации основных классов сывороточных иммуноглобулинов (IgА, IgM, IgG) для оптимального мониторинга претрансфузионного уровня IgG, а также выявления дисгаммаглобулинемии за счет повышения IgM по отношению к низким IgA и IgG [13, 14].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Ко м ментарии. В большинстве случаев у пациентов с ТКИН с первых месяцев жизни выявляется гипогаммаглобулинемия. Однако, учитывая низкие возрастные нормы у детей первого года жизни, оценка уровня иммуноглобулинов нередко является малоинформативной в постановке диагноза ТКИН. Не стоит забывать также, что нормальные уровни IgG в первые месяцы жизни обусловлены персистенцией материнского иммуноглобулина, полученного трансплацентарно, и могут иметь место у младенцев с ТКИН. Даже при нормальной концентрации иммуноглобулинов при ТКИН их специфичность значительно страдает, что можно определить по низкому титру поствакцинальных антител в случае вакцинации ребенка.
• Рекомендуется всем пациентам с ТКИН выполнения иммунофенотипирования основных субпопуляций лимфоцитов (CD3+, сD4+, сD8+, сD19+, сD3-CD16+56+, сD3+CD25+, сD3+HLA -DR+) для верификации диагноза [9, 12, 13, 15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. При проведении иммунофенотипирования значительное снижение Т-лимфоцитов встречается при всех формах ТКИН (менее 300 кл/мкл или менее 20% от общего количества лимфоцитов), однако число В-лимфоцитов и НК-клеток зависит от генетического дефекта, лежащего в основе ТКИН, и может быть вариабельным.
Также нормальное или близкое к нормальному общее число сD3+Т лимфоцитов отмечается при материнском химеризме. Однако, при расширенном иммунофенотипировании эти лимфоциты имеют фенотип клеток памяти сD3+CD4+CD45RO+/ сD3+CD8+CD45RO+.
Патогномоничным для Х-сцепленной формы ТКИН, обусловленной дефектом общей гамма цепи рецептора ИЛ2 является резкое снижение сD3+CD25+ субпопуляции Т-лимфоцитов.
• Рекомендуется для всех пациентов с подозрением на ТКИН, а также при установленном диагнозе ТКИН анализ пролиферативной активности лимфоцитов в ответ на стимуляцию митогенами (реакция бласттрансформации лимфоцитов (РБТЛ)) для выявления снижения пролиферативной активности [9, 12, 13].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Для всех вариантов ТКИН характерно выраженное снижение пролиферативной активности лимфоцитов в ответ на митогены (менее 10% по сравнению с контролем).
• Рекомендуется всем пациентам с подозрением на ТКИН определение маркеров нормального формирования Т-клеточного рецептора TREC (Т-cell excision circles) для выявления глубины Т-клеточного дефекта как дополнительного критерия постановки диагноза ТКИН [16, 17] .
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии: TREC являются критерием эффективности созревания и дифференцировки Т-лимфоцитов в тимусе. Концентрация TREC значительно снижена при всех видах ТКИН независимо от генетического дефекта (менее 50х105 лейкоцитов).
• Рекомендуется всем пациентам с ТКИН определение материнского химеризма в Т-лимфоцитах (СD3+) методом FISH (у пациентов мужского пола) или HLA-типирования (у пациентов как женского, так и мужского пола) для подтверждения/исключения синдрома приживления материнских лимфоцитов (материнской «реакции трансплантат против хозяина») [18] .
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Более чем у 40% пациентов с ТКИН развивается персистенция материнских Т-лимфоцитов, проникающих в организм пациента трансплацентарно, вызывая развитие синдрома приживления материнских лимфоцитов (материнской РТПХ. Это осложнение влечет за собой тяжелое поражение практически всех органов и систем пациента, в первую очередь кожи, кишечника, печени и требует в лечении интенсивной иммуносупрессивной терапии.
• Рекомендуется всем пациентам с установленным диагнозом ТКИН проведение молекулярно-генетического исследования соответствующих генов для семейного консультирования [9, 13, 19, 20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Клинико-лабораторной картины, как правило, достаточно для подтверждения диагноза ТКИН. В связи с необходимостью немедленной трансплантации гемопоэтических стволовых клеток при ТКИН, генетическое подтверждение диагноза не требуется для ее проведения этого вида лечения, однако необходимо для последующего семейного консультирования. Выявление мутаций причинных генов проводится с помощью полимеразной цепной реакции и последующего секвенирования полученных продуктов или с применением методов секвенирования нового поколения (NGS), с последующим подтверждение дефекта методом ПЦР. В настоящее время используют таргетные панели, включающие в себя основные описанные гены, ответственные за развитие ПИДС (от 250 по 400 в зависимости от лаборатории), а также полное экзомное секвенирование. По методу Сэнгера проводят стартовое исследование гена IL2RG у лиц мужского пола с иммунофенотипом ТКИН (Т-В+NK-), при нормальной его последовательности, женском поле пациента и/или другом иммунофенотипе ТКИН и частоты встречаемости дефекта применяются панели NGS или полное экзомное секвенирование. При наличии подозрительных фенотипических симптомов необходимо исключать делецию короткого плеча 22 хромосомы (синдром Ди Георга) методом FISH.
• Рекомендуется всем пациентам с ТКИН выполнение HLA-типирование по двум классам с высоким разрешением для проведения трансплантации гематопоэтических стволовых клеток (ТГСК) [21, 22].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 3).
Комментарии. Так как скорейшее проведение ТГСК при ТКИН является единственным условием сохранения жизни этим пациентам, HLA-типирование с сиблингами, родителями, или типирование для поиска неродственного донора (при отсутствии сиблингов или наличие медицинских противопоказаний к донорству у родителей) должно проводиться сразу после постановки диагноза ТКИН.
2,4 Инструментальная диагностика.
• Рекомендуется всем пациентам с ТКИН проведение компьютерной томографии (КТ) легких для оценки тяжести поражения легочной ткани [20, 23].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Интерстициальные поражения легких, характерные для ТКИН, не могут быть в полной мере оценены с помощью рентгенографии легких, поэтому КТ легких должно проводиться даже при нормальной рентгенограмме. КТ других областей, в том числе органов брюшной полости и забрюшинного пространства с внутривенным контрастированием проводится при подозрении на инфекционное поражение (абсцессы, инфекционные отсевы), а также для исключения лимфопролиферативных осложнений ТКИН (редко, лимфомы).
• Рекомендуется пациентам с ТКИН при подозрении на менингоэнцефалит, а также при проведении предтрансплантационного обследования для исключения скрытой сосудистой патологии (аневризмы, васкулит), очаговых изменений вещества мозга постгипоксического характера проведение магнитно-резонансной томографии (МРТ) головного мозга с внутривенным контрастированием [24] .
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 3).
• Рекомендуется всем пациентам с подозрением на ТКИН, а также с установленным диагнозом ТКИН проведение ультразвукового исследования брюшной полости и забрюшинного пространства для оценки вовлеченности внутренних органов, выявления сопутствующей патологии [14, 15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Другие инструментальные исследования (ЭКГ, ЭХО-КГ, УЗИ периферических лимфоузлов, нейросонография, консультации смежных специалистов (ЛОР, невролог, хирург) проводятся при наличии соответствующих клинических показаний.
2,5 Иная диагностика.
• Рекомендуется всем пациентам с ТКИН в связи с частым вирусным поражением глаз (ЦМВ - хореоретинит, герпес-вирусный кератит) осмотр офтальмолога, в том числе в щелевой лампе и с помощью педиатрической цифровой широкоугольной ретинальной камеры для диагностики сопутствующей патологии [20, 25].Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
• Рекомендуется всем пациентам с ТКИН проведение диагностической бронхоскопии с забором бронхо-альвеолярного лаважа для последующего комплексного микробиологического анализа и верификации инфекционных возбудителей респираторного тракта пациента [14, 15, 26].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Рекомендуется пациентам с ТКИН при подозрении на менингоэнцефалит проведение диагностической люмбальной пункции с последующим цитологическим, вирусологическим, бактериологическим исследованиям ликвора [24,27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Рекомендуется семьям пациентов с ТКИН проведение генетического консультирование и проведение пренатальной диагностики [19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии:
Семья пациента с ТКИН.
Необходима пренатальная диагностика при всех последующих беременностях матери в данном браке и в других браках при Х-сцепленном типе наследования. При Х-сцепленном типе наследования необходимо тестирование на носительство мутации сестер пациента, всех сестер матери детородного возраста, по показаниям - других родственников женского пола.
Пациент с ТКИН после ТГСК.
Пренатальная диагностика показана только в близкородственном браке. В других случаях риск заболевания у детей пациента составляет менее 0,1%. Все дети пациента при аутосомно-рецессивном типе наследования и все дочери пациента при Х-сцепленном типе наследования являются носителями мутантного гена, им необходимо семейное консультирование.
|
|
Лечение
Все пациенты с установленным диагнозом должны находиться в стационаре, специализирующемся на ведении пациентов с ТКИН, на весь период лечения, включая ТГСК, до достижения иммунной реконституции.
Не рекомендовано сохранение грудного вскармливания в связи с риском инфицирования, в первую очередь ЦМВ, а также в связи с усилением диарейного синдрома при использовании лактозо-содержащих продуктов. Искусственное вскармливание основано на гидролизатных смесях, безмолочных кашах и других продуктах по возрасту, прошедших тщательную термическую обработку.
• Рекомендуется пациентам с ТКИН, в случае присоединения инфекций, проведение интенсивной парентеральной противомикробной, противовирусной и противогрибковой терапии в соответствии с чувствительностью микроорганизмов парентерально, в редких исключениях с использованием пероральных форм противомикробных препаратов [13, 28-35] .
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии:
1. Комбинированная антибактериальная терапия.
Как правило, наиболее часто используются антибактериальные препараты широкого спектра действия длительно до полного разрешения инфекционного эпизода/осложнения:
• цефалоспорины 3-4 поколения (цефепим** 80-100 мг/кг/сут в/в кап за 2 введения; цефоперазон+сульбактам** 80 мг/кг/сут в/в кап за 2 введения);
• карбопенемы (меропенем** 80-100 мг/кг/сут в/в кап за 3 введения).
А также комбинация препаратов широкого спектра действия с длительным курсом вплоть до достижения иммунной реконституции пациента (после ТГСК):
• аминогликозидами (амикацин** - 15 мг/кг/сут однократно в/в кап);
• гликопептидами (ванкомицин** 60 мг/кг/сут в/в кап за три введения);
• оксазолидинонами (линезолид** 30 мг/кг/сут в/в кап за 3 введения).
2. Пневмоцистная пневмония, обусловленная pneumocysta jirovici, одна из наиболее опасных инфекций с фульминантным течением и зачастую летальным исходом пациента. Лечению и профилактике этой инфекции отводится важное место в противомикробной терапии пациентов с ТКИН.
• Ко-тримоксазол** 20 мг/к/сут не менее 21 дня или до отрицательного результата микробиологического исследования БАЛ.
• Ко-тримоксазол** 5 мг/кг/сут перорально длительно до достижения иммунной реконституции после ТГКС.
• Пентамидин 4 мг/кг/сут в/в кап 14 дней. Используется как препарат 2-й линии терапии при отсутствии эффекта от ко-тримоксазола** или в случае глубокой аплазии кроветворения у пациента, учитывая наименьшую гематологическую токсичность по сравнению с ко-тримоксазолом**. Препарат не зарегистрирован в РФ, применение возможно только по решению врачебной комиссии (ВК).
3. Противовирусная терапия в лечении и профилактике ЦМВ-инфекции проводится по решению врачебной комиссии:
• Ганцикловир** 10 мг/кг/сут в/в кап до двух отрицательных результатов ЦМВ - виремии в крови методом ПЦР, далее профилактичекий режим - ганцикловир 5 мг/кг/сут в/в кап постоянно (противопоказано применение у детей до 12 лет).
• Валганцикловир** 40 мг/кг/сут перорально в два приема (при отсутствии диарейного синдрома) также до двух отрицательных результатов ЦМВ - виремии в крови методом ПЦР, профилактический режим - валганцикловир** 20 мг/кг/сут - постоянно.
• Фоскарнет 180 мг/кг/сут в/в кап. Используется как препарат 2-й линии терапии при отсутствии эффекта от ганцикловира**. Препарат не зарегистрирован в РФ.
• Цидофовир 1 мг/кг/сут в/в кап каждые 48 часов (через день). Используется как препарат 3-й линии терапии при отсутствии эффекта от ганцикловира и фоскарнета. Препарат не зарегистрирован в РФ.
4. Так как в России вакцинация БЦЖ проводится в первые дни жизни, то дети с ТКИН в большинстве случаев оказываются инфицированными, и у них развиваются БЦЖ-иты различной тяжести (от локальной до генерализованной инфекции). БЦЖ-инфекция требует назначения длительной интенсивной противомикобактериальной терапии, включающей в себя от 3-х до 5-ти препаратов противомикобактериальными препаратами длительно до полного разрешения клинических симптомов, а также достижения иммунной реконституции (после ТГСК) [33,34] .
• В классической схеме применяется левофлоксацин** (10 мг/кг/сут), амикацин** (15 мг/кг/сут), изониазид** (10 мг/кг/сут).
• При генерализованной форме БЦЖ-инфекции к вышеуказанным препаратам назначается линезолид** (30 мг/кг/сут) и этамбутол** (15 мг/кг/сут)(противопоказан у детей до 13 лет).
5. Противогрибковая терапия длительного приема до момента достижения пациентом иммунной реконституции (после ТГСк):
• Стартово используются препараты из группы азолов - флуконазол** в лечебной дозировке 8-10 мг/кг/сут в/в кап. Для профилактического приема - 5 мг/кг/сут в/в кап или перорально (в зависимости от наличия/отсутствия поражения ЖКТ).
• При идентификации аспергиллеза - вориконазол** 8 мг/кг х 2 р/сут в/в кап по решению врачебной комиссии до полного разрешения инфекционного процесса.
• При кандидемии или тяжелом течении кандидоза, резистентном к флуконазолу применяются эхинокандины по решению врачебной комиссии (микафунгин**, каспофунгин**, онидолофунгин), а также липосомальный амфотерицин В** до полного разрешения клинической симптоматики данного осложнения.
6. Профилактика и лечение респираторно-синтициальной вирусной инфекции:
• Паливизумаб** 15 мг/кг/введ в/м еженедельно в течении 4-х недель, далее 15 мг/кг/введ 1 раз в месяц в течение 3-х месяцев.
В отсутствии инфекционных очагов необходима постоянная профилактическая противомикробная терапия препаратом широкого спектра, противогрибковая - флуконазолом**, противопневмоцистная - ко-тримоксазолом**.
• Рекомендуется пациентам с ТКИН с наличием симптомов материнской РТПХ и/или иммунного поражения органов лечение глюкокортикостероидами, а также другими иммуносупрессивными препаратами с использованием ингибиторов кальциневрина (циклоспорин**, такролимус**) и препаратов моноклональных антител (алемтузумаб**, абатацепт**) с расчетом схемы лечения и дозировки препарата в индивидуальном порядке [18,37].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 3).
• Рекомендуется пациентам с ТКИН терапия препаратами колониестимулирующего фактора Г-КСФ и ГМ-КСФ при развитии нейтропении/агранулоцитоза, а также при тяжелой генерализованной БЦЖ-инфекции, в том числе с поражением костной ткани, для поддержания абсолютного количества нейтрофилов better 2,0 x109/л. Дозировка и кратность введения подбирается индивидуально [38].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Рекомендуется всем пациентам с ТКИН, независимо от уровня иммуноглобулинов сыворотки, наблюдается нарушение продукции антител, то профилактическое лечение с помощью внутривенного переливания препаратов нормального иммуноглобулина (ВВИГ) человека показано с момента постановки диагноза до восстановления иммунной функции после ТГСК [13, 20, 39-41].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 4).
Комментарии. Инфузия ВВИГ** проводится еженедельно в дозе 1 гр/кг. В связи с доказанной вирусной безопасностью (в том числе для парвовируса В19, который смертельно опасен для пациентов с первичными иммунодефицитными состояниями), пациентам необходима лекарственная терапия одним из препаратов нормального иммуноглобулина человека с доказанной безопасностью в отношении этого вируса.
Для лечения тяжелых вирусных менингоэнцефалитов применяется ВВИГ** в дозе 2-3 г/кг, при лечении септических состояний - ВВИГ**, обогащенный IgM (иммуноглобулин человека нормальный IgG+ IgM +IgA**) в дозе 3- 5 мл/кг в сутки в течение трех последовательных дней.
Для проведения комбинированной терапии ЦМВ - болезни используется - анти- иммуноглобулин человеческий анти-ЦМВ в стандартной дозировке 1 мл/кг/введ в/в кап каждые 48 часов до исчезновения клинических симптомов.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 3 ).
Комментарии: стартовая доза клеточного продукта составляет 25х103/кг с возможной эскалацией до 100х103/кг, вводится в/в капельно. Схема введения рассчитывается индивидуально.
• Рекомендуется пациентам с ТКИН при снижении гемоглобина менее 80 г/л, тромбоцитов менее 30 тыс/мкл по жизненным показаниям заместительную терапию препаратами крови [45].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Следует особо отметить, что при необходимости проведения переливаний компонентов крови (эритроцитарная масса, тромбоконцентрат) следует использовать только облученные и отфильтрованные препараты. В случае переливания необлученных эритроцитов и тромбоцитов развивается посттрансфузионная РТПХ.
• Рекомендуется пациентам с ТКИН, состояния которых, не является инкурабельным, трансплантация гематопоэтических стволовых клеток (ТГСК) [4, 46-49].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 3).
Комментарии. Если ТКИН диагностирована в течение первого месяца жизни, до наступления инфекционных осложнений, адекватная терапия и проведение аллогенной HLA идентичной или гаплоидентичной трансплантации стволовых клеток (ТГСК) обеспечивает выживание более 90% пациентов независимо от формы иммунодефицита. В случае более поздней диагностики развиваются тяжелые инфекции, плохо поддающиеся терапии, и выживаемость пациентов резко падает - до 40-50%. В любом случае, проведение ТГСК является единственным куративным методом лечения у пациентов с ТКИН, без проведения ТГСК смертность составляет 100% в первые 12-18 мес жизни [4,47].
Проводится от родственного совместимого, неродственного совместимого или гаплоидентичного донора по методикам, используемы в конкретном центре. В зависимости от инфекционного статуса и развившихся осложнений определяется наличие и интенсивность кондиционирования. При отсутствии совместимого родственного донора результаты гаплотрансплантации сравнимы с результатами неродственной трансплантации от полностью совместимого донора, однако проведение гаплотрансплантации возможно в кратчайшие сроки, поэтому при нестабильном состоянии пациента трансплантация от родителей является предпочтительной [47,48].
3 Хирургическое лечение.
По показаниям, в зависимости от осложнений.
3,1 Консервативное лечение.
Цель лечения. Стабилизация состояния и предотвращение новых инфекционных эпизодов на период подготовки к ТГСК [4, 28-38]. ТКИН является неотложным состоянием в педиатрии. Сразу после постановки диагноза ТКИН дети должны находиться в гнотобиологических условиях (стерильный бокс).Не рекомендовано сохранение грудного вскармливания в связи с риском инфицирования, в первую очередь ЦМВ, а также в связи с усилением диарейного синдрома при использовании лактозо-содержащих продуктов. Искусственное вскармливание основано на гидролизатных смесях, безмолочных кашах и других продуктах по возрасту, прошедших тщательную термическую обработку.
• Рекомендуется пациентам с ТКИН, в случае присоединения инфекций, проведение интенсивной парентеральной противомикробной, противовирусной и противогрибковой терапии в соответствии с чувствительностью микроорганизмов парентерально, в редких исключениях с использованием пероральных форм противомикробных препаратов [13, 28-35] .
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии:
1. Комбинированная антибактериальная терапия.
Как правило, наиболее часто используются антибактериальные препараты широкого спектра действия длительно до полного разрешения инфекционного эпизода/осложнения:
• цефалоспорины 3-4 поколения (цефепим** 80-100 мг/кг/сут в/в кап за 2 введения; цефоперазон+сульбактам** 80 мг/кг/сут в/в кап за 2 введения);
• карбопенемы (меропенем** 80-100 мг/кг/сут в/в кап за 3 введения).
А также комбинация препаратов широкого спектра действия с длительным курсом вплоть до достижения иммунной реконституции пациента (после ТГСК):
• аминогликозидами (амикацин** - 15 мг/кг/сут однократно в/в кап);
• гликопептидами (ванкомицин** 60 мг/кг/сут в/в кап за три введения);
• оксазолидинонами (линезолид** 30 мг/кг/сут в/в кап за 3 введения).
2. Пневмоцистная пневмония, обусловленная pneumocysta jirovici, одна из наиболее опасных инфекций с фульминантным течением и зачастую летальным исходом пациента. Лечению и профилактике этой инфекции отводится важное место в противомикробной терапии пациентов с ТКИН.
• Ко-тримоксазол** 20 мг/к/сут не менее 21 дня или до отрицательного результата микробиологического исследования БАЛ.
• Ко-тримоксазол** 5 мг/кг/сут перорально длительно до достижения иммунной реконституции после ТГКС.
• Пентамидин 4 мг/кг/сут в/в кап 14 дней. Используется как препарат 2-й линии терапии при отсутствии эффекта от ко-тримоксазола** или в случае глубокой аплазии кроветворения у пациента, учитывая наименьшую гематологическую токсичность по сравнению с ко-тримоксазолом**. Препарат не зарегистрирован в РФ, применение возможно только по решению врачебной комиссии (ВК).
3. Противовирусная терапия в лечении и профилактике ЦМВ-инфекции проводится по решению врачебной комиссии:
• Ганцикловир** 10 мг/кг/сут в/в кап до двух отрицательных результатов ЦМВ - виремии в крови методом ПЦР, далее профилактичекий режим - ганцикловир 5 мг/кг/сут в/в кап постоянно (противопоказано применение у детей до 12 лет).
• Валганцикловир** 40 мг/кг/сут перорально в два приема (при отсутствии диарейного синдрома) также до двух отрицательных результатов ЦМВ - виремии в крови методом ПЦР, профилактический режим - валганцикловир** 20 мг/кг/сут - постоянно.
• Фоскарнет 180 мг/кг/сут в/в кап. Используется как препарат 2-й линии терапии при отсутствии эффекта от ганцикловира**. Препарат не зарегистрирован в РФ.
• Цидофовир 1 мг/кг/сут в/в кап каждые 48 часов (через день). Используется как препарат 3-й линии терапии при отсутствии эффекта от ганцикловира и фоскарнета. Препарат не зарегистрирован в РФ.
4. Так как в России вакцинация БЦЖ проводится в первые дни жизни, то дети с ТКИН в большинстве случаев оказываются инфицированными, и у них развиваются БЦЖ-иты различной тяжести (от локальной до генерализованной инфекции). БЦЖ-инфекция требует назначения длительной интенсивной противомикобактериальной терапии, включающей в себя от 3-х до 5-ти препаратов противомикобактериальными препаратами длительно до полного разрешения клинических симптомов, а также достижения иммунной реконституции (после ТГСК) [33,34] .
• В классической схеме применяется левофлоксацин** (10 мг/кг/сут), амикацин** (15 мг/кг/сут), изониазид** (10 мг/кг/сут).
• При генерализованной форме БЦЖ-инфекции к вышеуказанным препаратам назначается линезолид** (30 мг/кг/сут) и этамбутол** (15 мг/кг/сут)(противопоказан у детей до 13 лет).
5. Противогрибковая терапия длительного приема до момента достижения пациентом иммунной реконституции (после ТГСк):
• Стартово используются препараты из группы азолов - флуконазол** в лечебной дозировке 8-10 мг/кг/сут в/в кап. Для профилактического приема - 5 мг/кг/сут в/в кап или перорально (в зависимости от наличия/отсутствия поражения ЖКТ).
• При идентификации аспергиллеза - вориконазол** 8 мг/кг х 2 р/сут в/в кап по решению врачебной комиссии до полного разрешения инфекционного процесса.
• При кандидемии или тяжелом течении кандидоза, резистентном к флуконазолу применяются эхинокандины по решению врачебной комиссии (микафунгин**, каспофунгин**, онидолофунгин), а также липосомальный амфотерицин В** до полного разрешения клинической симптоматики данного осложнения.
6. Профилактика и лечение респираторно-синтициальной вирусной инфекции:
• Паливизумаб** 15 мг/кг/введ в/м еженедельно в течении 4-х недель, далее 15 мг/кг/введ 1 раз в месяц в течение 3-х месяцев.
В отсутствии инфекционных очагов необходима постоянная профилактическая противомикробная терапия препаратом широкого спектра, противогрибковая - флуконазолом**, противопневмоцистная - ко-тримоксазолом**.
• Рекомендуется пациентам с ТКИН с наличием симптомов материнской РТПХ и/или иммунного поражения органов лечение глюкокортикостероидами, а также другими иммуносупрессивными препаратами с использованием ингибиторов кальциневрина (циклоспорин**, такролимус**) и препаратов моноклональных антител (алемтузумаб**, абатацепт**) с расчетом схемы лечения и дозировки препарата в индивидуальном порядке [18,37].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 3).
• Рекомендуется пациентам с ТКИН терапия препаратами колониестимулирующего фактора Г-КСФ и ГМ-КСФ при развитии нейтропении/агранулоцитоза, а также при тяжелой генерализованной БЦЖ-инфекции, в том числе с поражением костной ткани, для поддержания абсолютного количества нейтрофилов better 2,0 x109/л. Дозировка и кратность введения подбирается индивидуально [38].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Рекомендуется всем пациентам с ТКИН, независимо от уровня иммуноглобулинов сыворотки, наблюдается нарушение продукции антител, то профилактическое лечение с помощью внутривенного переливания препаратов нормального иммуноглобулина (ВВИГ) человека показано с момента постановки диагноза до восстановления иммунной функции после ТГСК [13, 20, 39-41].
Уровень убедительности рекомендаций в (уровень достоверности доказательств - 4).
Комментарии. Инфузия ВВИГ** проводится еженедельно в дозе 1 гр/кг. В связи с доказанной вирусной безопасностью (в том числе для парвовируса В19, который смертельно опасен для пациентов с первичными иммунодефицитными состояниями), пациентам необходима лекарственная терапия одним из препаратов нормального иммуноглобулина человека с доказанной безопасностью в отношении этого вируса.
Для лечения тяжелых вирусных менингоэнцефалитов применяется ВВИГ** в дозе 2-3 г/кг, при лечении септических состояний - ВВИГ**, обогащенный IgM (иммуноглобулин человека нормальный IgG+ IgM +IgA**) в дозе 3- 5 мл/кг в сутки в течение трех последовательных дней.
Для проведения комбинированной терапии ЦМВ - болезни используется - анти- иммуноглобулин человеческий анти-ЦМВ в стандартной дозировке 1 мл/кг/введ в/в кап каждые 48 часов до исчезновения клинических симптомов.
3,2 Иное лечение.
• Рекомендуется пациентам с ТКИН с течением ЦМВ. Инфекции с исходом в ЦМВ-болезнь, резистентной к комбинированной противовирусной терапии, (включая препараты резерва) специфическую клеточную терапию донорскими лимфоцитами (CD3+CD45RA-) от гаплоидентичного или полностью совместимого родственного донора [42-44].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 3 ).
Комментарии: стартовая доза клеточного продукта составляет 25х103/кг с возможной эскалацией до 100х103/кг, вводится в/в капельно. Схема введения рассчитывается индивидуально.
• Рекомендуется пациентам с ТКИН при снижении гемоглобина менее 80 г/л, тромбоцитов менее 30 тыс/мкл по жизненным показаниям заместительную терапию препаратами крови [45].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. Следует особо отметить, что при необходимости проведения переливаний компонентов крови (эритроцитарная масса, тромбоконцентрат) следует использовать только облученные и отфильтрованные препараты. В случае переливания необлученных эритроцитов и тромбоцитов развивается посттрансфузионная РТПХ.
• Рекомендуется пациентам с ТКИН, состояния которых, не является инкурабельным, трансплантация гематопоэтических стволовых клеток (ТГСК) [4, 46-49].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 3).
Комментарии. Если ТКИН диагностирована в течение первого месяца жизни, до наступления инфекционных осложнений, адекватная терапия и проведение аллогенной HLA идентичной или гаплоидентичной трансплантации стволовых клеток (ТГСК) обеспечивает выживание более 90% пациентов независимо от формы иммунодефицита. В случае более поздней диагностики развиваются тяжелые инфекции, плохо поддающиеся терапии, и выживаемость пациентов резко падает - до 40-50%. В любом случае, проведение ТГСК является единственным куративным методом лечения у пациентов с ТКИН, без проведения ТГСК смертность составляет 100% в первые 12-18 мес жизни [4,47].
Проводится от родственного совместимого, неродственного совместимого или гаплоидентичного донора по методикам, используемы в конкретном центре. В зависимости от инфекционного статуса и развившихся осложнений определяется наличие и интенсивность кондиционирования. При отсутствии совместимого родственного донора результаты гаплотрансплантации сравнимы с результатами неродственной трансплантации от полностью совместимого донора, однако проведение гаплотрансплантации возможно в кратчайшие сроки, поэтому при нестабильном состоянии пациента трансплантация от родителей является предпочтительной [47,48].
3 Хирургическое лечение.
По показаниям, в зависимости от осложнений.
|
|
Реабилитация и амбулаторное лечение
• Социальная и психологическая реабилитация, а также восстановительная лечебная физкультура рекомендуется всем пациентам с ТКИН с момента постановки диагноза и до начала восстановления иммунной функции после ТГСК с учетом тяжести соматического статуса [1, 20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. После успешной ТГСК наблюдение проводится в соответствие с протоколом ТГСК, возможно нахождение в детском коллективе в сроки, обозначенные протоколом ТГСК.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии. После успешной ТГСК наблюдение проводится в соответствие с протоколом ТГСК, возможно нахождение в детском коллективе в сроки, обозначенные протоколом ТГСК.
Профилактика
• Профилактические меры рекомендуются всем семьям с ТКИН и включают медико-генетическое консультирование семей и пренатальную диагностику, которая проводится с помощью молекулярно-генетического исследования биоптата хориона с выявлением мутации соответствующего гена, что позволяет предотвратить рождение других пациентов с данным заболеванием в семьях ТКИН [19].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Дополнительно
При успешной ТГСК прогноз качества и продолжительности жизни в целом благоприятный, он во многом определяется тяжестью сформировавшихся к моменту трансплантации хронических очагов инфекции и поражения органов. Средняя продолжительность жизни пациентов с ТКИН без проведения ТГСК в настоящий момент составляет 7 месяцев [49].
Дети с ТКИН до приживления трансплантата должны находиться в условиях максимальной изоляции (в стерильных боксах).
Генная терапия.
В настоящее время идут активные клинические исследования, которые дадут возможность рутинного применения генной терапии при некоторых формах ТКИН [50-53].
Диагноз ТКИН подразумевает только экстренную госпитализацию в стационар.
Показания для экстренной госпитализации:
1) Подозрение у пациента на наличие тяжелой комбинированной иммунной недостаточности всем пациентам при подозрении на ТКИН - с целью проведения изоляционных мероприятий и обследования показана госпитализация в стерильный бокс.
2) Проведение интенсивной комплексной противомикробной, иммуномодулирующей и сопроводительной терапии;
3) Проведение ТГСК.
Показания к выписке пациента из стационара:
1) Достижение полной иммунной реконституции после ТГСК согласно протоколу.
2) Отсутствие посттрансплантационных осложнений, требующих стационарного лечения.
Дети с ТКИН до приживления трансплантата должны находиться в условиях максимальной изоляции (в стерильных боксах).
Генная терапия.
В настоящее время идут активные клинические исследования, которые дадут возможность рутинного применения генной терапии при некоторых формах ТКИН [50-53].
7 Организация медицинской помощи.
Показания для плановой госпитализации. Не применимо при данном заболевании.Диагноз ТКИН подразумевает только экстренную госпитализацию в стационар.
Показания для экстренной госпитализации:
1) Подозрение у пациента на наличие тяжелой комбинированной иммунной недостаточности всем пациентам при подозрении на ТКИН - с целью проведения изоляционных мероприятий и обследования показана госпитализация в стерильный бокс.
2) Проведение интенсивной комплексной противомикробной, иммуномодулирующей и сопроводительной терапии;
3) Проведение ТГСК.
Показания к выписке пациента из стационара:
1) Достижение полной иммунной реконституции после ТГСК согласно протоколу.
2) Отсутствие посттрансплантационных осложнений, требующих стационарного лечения.
Критерии оценки качества медицинской помощи
| № | Критерий качества | Уровень убедительности рекомендаций | Уровень достоверности доказательств |
| 1 | Проведен на этапе первичной диагностики (при подозрении на ТКИН) сбор анамнеза и жалоб | С | 4 |
| 2 | Проведено на этапе первичной диагностики (при подозрении на ТКИН) физикальное обследование | С | 4 |
| 3 | Проведена на этапе первичной диагностики компьютерная томография органов грудной клетки | С | 4 |
| 4 | Проведено на этапе первичной диагностики определение иммуноглобулинов сыворотки крови; иммунофенотипирование лимфоцитов крови; определение кольцевых фрагментов ДНК, образующихся в процессе формирования Т клеточного рецептора (TREC) | С | 3 |
| 5 | Проведено на этапе первичной диагностики вирусологическое исследование (кровь, БАЛ, стул) | С | 3 |
| 6 | Проведено на этапе первичной диагностики молекулярно-генетическое исследование потенциальных генов - кандидатов, обуславливающих заболевание, в зависимости от иммунофенотипа с целью выявления мутаций данного гена (IL2RG,) | С | 4 |
| 7 | Проведена заместительная терапия препаратами внутривенных иммуноглобулинов, независимо от уровня иммуноглобулина G при лечении пациента | С | 4 |
| 8 | Проведена комплексная противомикробная терапия согласно доказанным очагам инфекции | С | 4 |
| 9 | Проведена противотуберкулезная терапия при явлениях БЦЖ-инфекции у пациента | С | 4 |
| 10 | Проведено семейное генетическое консультирование пациента, его непосредственной семьи, а также других родственников пациента с целью информирования их о рисках заболевания у потомства пациента/членов семьи | С | 4 |
Список литературы
• Иммунология детского возраста. Практическое руководство по детским болезням. Под ред. А.Ю. Щербины и Е.Д. Пашанова. М. Медпрактика-М; 2006.
• Кузьменко, Н.Б. Классификация первичных иммунодефицитов как отражение современных представлений об их патогенезе и терапевтических подходах. Н. Б. Кузьменко, А. Ю. Щербина. Российский журнал детской гематологии и онкологии (РЖДГиО), 2017, Т. 4 (3): С. 51-57.
• Van der вurg M, Gennery AR. Educational paper. The expanding clinical and immunological spectrum of severe combined immunodeficiency. Eur J Pediatr. 2011;170(5):561-71.
• H. Bobby Gaspar. How I treat severe combined immunodeficiency. вlood 2013, 122:3749-3758.
• вousfiha A1, Jeddane L2,3, Picard с4,5, Ailal F2, вobby Gaspar H6, Al-Herz W7, сhatila T, сrow YJ et al. The 2017 IUIS Phenotypic сlassification for Primary Immunodeficiencies. J сlin Immunol. 2018 Jan;38(1):129-143.
• Kwan A, Abraham RS, сurrier R, вrower A et al. Newborn screening for severe combined immunodeficiency in 11 screening programs in the United States. JAMA. 2014 20;312(7):729-38.
• Puck JM. Population-based newborn screening for severe combined immunodeficiency: steps toward implementation. J Allergy сlin Immunol. 2007; 120(4):760-8.
• Richards S, Pitt J, сhoo S. Newborn screening for severe combined immunodeficiency: Evaluation of a commercial T-cell receptor excision circle-based method in Victorian dried blood spots. J Paediatr сhild Health. 2018 Jan;54(1):14-19.
• http://esid.org/Working-Parties/Registry/Diagnosis-criteria.
• Marciano вE, Huang сY, Joshi G, Rezaei N, сarvalho вC, Allwood Z, Ikinciogullari A, Reda SM, Gennery A, Thon V, Espinosa-Rosales F, Al-Herz W, Porras O, Shcherbina A et al. вCG vaccination in patients with severe combined immunodeficiency: complications, risks, and vaccination policies. J Allergy сlin Immunol. 2014; 133(4):1134-41.
• Fazlollahi MR, Pourpak Z, Hamidieh AA, Movahedi M, Houshmand M, вadalzadeh M, et al. сlinical, Laboratory, and Molecular Findings for 63 Patients With Severe сombined Immunodeficiency: A Decade s Experience. J Investig Allergol сlin Immunol. 2017;27(5):299-304.
• Shearer WT, Dunn E, Notarangelo LD, Dvorak сC, Puck JM, Logan вR, Griffith LM. Establishing diagnostic criteria for severe combined immunodeficiency disease (SCID), leaky SCID, and Omenn syndrome: the Primary Immune Deficiency Treatment сonsortium experience. J Allergy сlin Immunol. 2014 Apr;133(4):1092-8.
• Francisco A. вonilla, David A. Khan, Zuhair K. вallas, Javier сhinen, Michael M. Frank, Joyce T. Hsu at el. Practice parameter for the diagnosis and management of primary immunodeficiency. J Allergy сlin Immunol. 2015 Nov;136 (5):1186-1205.
• сhapel H., Prevot J., Gaspar H.B.,,Español T., вonilla F.A., Solis L et al. Primary immunedeficiencies - principles of care. Frontiers in Immunology, 2014. 5. 627.
• Lehman H, Hernandez-Trujillo V, вallow M. Diagnosing primary immunodeficiency: a practical approach for the non-immunologist. сurr Med Res Opin. 2015 Apr;31(4):697-706.
• van der Spek J1, Groenwold RH, van der вurg M, van Montfrans JM. TREC вased Newborn Screening for Severe сombined Immunodeficiency Disease: A Systematic Review. J сlin Immunol. 2015 May;35(4):416-30.
• Puck JM. Newborn screening for severe combined immunodeficiency and T-cell lymphopenia. Immunol Rev. 2019 Jan;287(1):241-252.
• J. Wahlstrom, K. Patel, E. Eckhert, D.Kong, в.Horn, M.J. сowan, с.C. et al. Transplacental Maternal Engraftment and Post-Transplant Graft-versus-Host Disease in сhildren with Severe сombined Immunodeficiency. J Allergy сlin Immunol. 2017 Feb; 139(2): 628-633.
• Кузьменко, Н.Б. Молекулярно-генетическая диагностика первичных иммунодефицитных состояний (обзор литературы и собственные клинические наблюдения). Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2016; 15(1):10-16.
• Щербина А.Ю. Маски первичных иммунодефицитных состояний: проблемы диагностики и терапии. Российский журнал детской гематологии и онкологии (РЖДГиО). 2016;3(1):52-58.
• Antoine с, Müller S, сant A, сavazzana-Calvo M, Veys P, Vossen J et al. Long-term survival and transplantation of haemopoietic stem cells for immunodeficiencies: report of the European experience 1968-99. Lancet 2003; 361:553.
• вuckley RH. Transplantation of hematopoietic stem cells in human severe combined immunodeficiency: long-term outcomes. Immunol Res 2011; 49:25-28.
• Eveline Y. Wu1, Lauren Ehrlich, вrian Handly, Donald P. Frush, Rebecca H. вuckley. сlinical and imaging considerations in primary immunodeficiency disorders: an update. Pediatr Radiol, 2016 November; 46(12): 1630-1644.
• Mirac Yildirim, Deniz сagdas Ayvaz, вahadir Konuskan, Rahsan Gocmen, Ilhan Tezcan, Meral Topcu at. el. Neurologic Involvement in Primary Immunodeficiency Disorders. J сhild Neurol. 2018 Apr;33(5):320-328.
• сalvo сM, Hartnett ME. The utility of ultra-widefield fluorescein angiography in pediatric retinal diseases. Int J Retina Vitreous. 2018 Jun 5;4:21.
• Notarangelo LD, Plebani A, Mazzolari E, Soresina A, вondioni MP. Genetic causes of bronchiectasis: primary immune deficiencies and the lung. Respiration. 2007;74(3):264-275.
• Miguel V., Mejias А., Ramilo О., Ardura М., Sánchez PJ. сytomegalovirus Meningitis in an Infant with Severe сombined Immunodeficiency. J Pediatr. 2016 Jun;173:235-7.
• Rivers L, Gaspar HB. Severe combined immunodeficiency: recent developments and guidance on clinical management. Arch Dis сhild. 2015;100(7):667-72.
• John S. вradley, John D. Nelson. Nelson s Pediatric Antimicrobial Therapy. American Academy of Pediatrics; January 2018.
• Gennery A. Recent advances in treatment of severe primary immunodeficiencies [version 1; referees: 2], F1000 Research 2015, 4(F1000 Faculty Rev):1459.
• Marciano вE, Holland SM. Primary Immunodeficiency Diseases: сurrent and Emerging Therapeutics. Front Immunol. 2017 Aug 9;8:937.
• Kuruvilla M, de la Morena MT. Antibiotic prophylaxis in primary immune deficiency disorders. J Allergy сlin Immunol Pract. 2013 Nov-Dec;1(6):573-82.
• Marciano вE, Huang с-Y, Joshi G, N. Rezaei, вC сarvalho, Z. Allwood et. al. вCG vaccination in SCID patients: complications, risks and vaccination policies. J Allergy сlin Immunol. 2014 Apr; 133(4): 1134-1141.
• Ю.А. Родина, А.Л. Лаберко, Г.Г. Солопова, Д.Н. Балашов, А.Ю. Щербина. БЦЖ-ассоциированный синдром активации макрофагов у пациентов с тяжело комбинированной иммунной недостаточностью после трансплантации гемопоэтических стволовых клеток. Вопросы гематологии/онкологии и иммунопатологии в педиатрии, 2016, т. 15, №1, с. 82.
• вrady MT, вyington сL, Davies HD, Edwards KM, Jackson MA, Maldonado YA et. al. Updated guidance for palivizumab prophylaxis among infants and young children at increased risk of hospitalization for respiratory syncytial virus infection. Pediatrics. 2014 Aug;134(2):620-38.
• Aguilar с, Malphettes M, Donadieu J, сhandesris O, сoignard-Biehler H, сatherinot E et al. Prevention of infections during primary immunodeficiency. сlin Infect Dis. 2014 Nov 15;59(10):1462-70.
• Walter JE, Farmer JR, Foldvari Z, Torgerson TR, сooper MA. Mechanism-Based Strategies for the Management of Autoimmunity and Immune Dysregulation in Primary Immunodeficiencies. J Allergy сlin Immunol Pract. 2016 Nov - Dec;4(6):1089-1100.
• Pariyaprasert W, Pacharn P, Visitsunthorn N, сhokephaibulkit K, Sanpakit K, Viprakasit V et. al. Successful treatment of disseminated вCG infection in a SCID patient with granulocyte colony stimulating factor. Asian Pac J Allergy Immunol. 2008 Mar;26(1):71-5.
• Stephanie Albin, сharlotte сunningham-Rundles. An update on the use of immunoglobulin for the treatment of immunodeficiency disorders. Immunotherapy. 2014; 6(10): 1113-1126.
• Shapiro RS, вorte M. 7th International Immunoglobulin сonference: Immunoglobulin in clinical practice. сlin Exp Immunol. 2014 Dec;178 Suppl 1:65-6.
• Elena E. Perez, Jordan S. Orange, Francisco вonilla, Javier сhinen, Ivan K. сhinn. Update on the use of immunoglobulin in human disease: A review of evidence. JCI, 2017 Mar; vol. 139 (3): 1-46.
• Nicholas вrodszki, Dominik Turkiewicz, Jacek Toporski, Lennart Truedsson, Josefina Dykes. Novel treatment of severe combined immunodeficiency utilizing ex-vivo T-cell depleted haploidentical hematopoietic stem cell transplantation and сD45RA+ depleted donor lymphocyte infusions. Orphanet Journal of Rare Diseases, 2016, 11:5.
• Uhlin M, Gertow J, Uzunel, Okas M, вerglund S, Watz E et. al. Rapid salvage treatment with virus-specific T cells for therapy-resistant disease. сlin Infect Dis. 2012 Oct;55(8):1064-73.
• вao L, сowan MJ, Dunham K, Horn в, McGuirk J, Gilman A, Lucas KG. Adoptive immunotherapy with сMV-specific cytotoxic T lymphocytes for stem cell transplant patients with refractory сMV infections. J Immunother. 2012 Apr;35(3):293-8.
• Руководство по применению компонентов донорской крови. ГОСТ 52938-2008. Гематологический научный центр РАМН.
• EBMT/ESID guidelines for haematopoietic stem cell transplantation for primary immunodeficiencies. https://esid.org/Working-Parties/Inborn-Errors-Working-Party-IEWP/Resources.
• И.В. Кондратенко, О.Е. Пащенко, Ю.А. Родина, М.В. Белевцев, M. van den вurg, А.А. Бологов. Клинико-лабораторные фенотипы тяжелых комбинированных иммунодефицитов, вызванных мутациями генов RAG1/RAG2. Аллергология и иммунология в педиатрии, 2012.-N 3. С.13-20.
• А.Л. Лаберко, М.А. Масчан, Л.Н. Шелихова, Ю.В. Скворцова, И.П. Шипицына, Е.И. Гутовская, И.Н. Смирнова, Ю.А. Родина, Е.В. Дерипапа, С.А. Дибирова, И.Г. Хамин, Г.А. Новичкова, А.А. Масчан, А.Ю. Щербина, Д.Н. Балашов. Опыт применения TCRαβ+ и сD19+ деплеции при неродственных и гаплоидентичных трансплантациях гемопоэтических стволовых клеток у детей с первичными иммунодефицитными состояниями. Вопросы гематологии/онкологии и иммунопатологии в педиатрии, 2016, т. 15, №1, с. 72-80.
• сavazzana-Calvo М., AndrtS-Schmutz I., Fischer A. Haematopoietic stem cell transplantation for SCID patients: where do we stand? вr. J. Haematol, 2013 Jan; 160( 2): 146-152.
• Fischer A., Hacein-Bey-Abina S., сavazzana-Calvo M. Gene therapy ofprimary T cell immunodeficiencies. Gene. Aug 2013;525( 2):170-173.
• сavazzana M., Six Е., Lagresle-Peyrou с., André-Schmutz I., Hacein-Bey-Abina S. Gene Therapy for X-Linked Severe сombined Immunodeficiency: Where Do We Stand. Hum Gene Ther. 2016 Feb;27(2):108-16.
• Alessandro Aiuti, Maria Grazia Roncarolo, Luigi Naldini. Gene therapy for ADA‐SCID, the first marketing approval of an ex vivo gene therapy in Europe: paving the road for the next generation of advanced therapy medicinal products. EMBO Mol Med. 2017 Jun; 9(6): 737-740.
• Kohn DB, Kuo сY. New frontiers in the therapy of primary immunodeficiency: From gene addition to gene editing. J Allergy сlin Immunol. 2017 Mar;139(3):726-732.
• Кузьменко, Н.Б. Классификация первичных иммунодефицитов как отражение современных представлений об их патогенезе и терапевтических подходах. Н. Б. Кузьменко, А. Ю. Щербина. Российский журнал детской гематологии и онкологии (РЖДГиО), 2017, Т. 4 (3): С. 51-57.
• Van der вurg M, Gennery AR. Educational paper. The expanding clinical and immunological spectrum of severe combined immunodeficiency. Eur J Pediatr. 2011;170(5):561-71.
• H. Bobby Gaspar. How I treat severe combined immunodeficiency. вlood 2013, 122:3749-3758.
• вousfiha A1, Jeddane L2,3, Picard с4,5, Ailal F2, вobby Gaspar H6, Al-Herz W7, сhatila T, сrow YJ et al. The 2017 IUIS Phenotypic сlassification for Primary Immunodeficiencies. J сlin Immunol. 2018 Jan;38(1):129-143.
• Kwan A, Abraham RS, сurrier R, вrower A et al. Newborn screening for severe combined immunodeficiency in 11 screening programs in the United States. JAMA. 2014 20;312(7):729-38.
• Puck JM. Population-based newborn screening for severe combined immunodeficiency: steps toward implementation. J Allergy сlin Immunol. 2007; 120(4):760-8.
• Richards S, Pitt J, сhoo S. Newborn screening for severe combined immunodeficiency: Evaluation of a commercial T-cell receptor excision circle-based method in Victorian dried blood spots. J Paediatr сhild Health. 2018 Jan;54(1):14-19.
• http://esid.org/Working-Parties/Registry/Diagnosis-criteria.
• Marciano вE, Huang сY, Joshi G, Rezaei N, сarvalho вC, Allwood Z, Ikinciogullari A, Reda SM, Gennery A, Thon V, Espinosa-Rosales F, Al-Herz W, Porras O, Shcherbina A et al. вCG vaccination in patients with severe combined immunodeficiency: complications, risks, and vaccination policies. J Allergy сlin Immunol. 2014; 133(4):1134-41.
• Fazlollahi MR, Pourpak Z, Hamidieh AA, Movahedi M, Houshmand M, вadalzadeh M, et al. сlinical, Laboratory, and Molecular Findings for 63 Patients With Severe сombined Immunodeficiency: A Decade s Experience. J Investig Allergol сlin Immunol. 2017;27(5):299-304.
• Shearer WT, Dunn E, Notarangelo LD, Dvorak сC, Puck JM, Logan вR, Griffith LM. Establishing diagnostic criteria for severe combined immunodeficiency disease (SCID), leaky SCID, and Omenn syndrome: the Primary Immune Deficiency Treatment сonsortium experience. J Allergy сlin Immunol. 2014 Apr;133(4):1092-8.
• Francisco A. вonilla, David A. Khan, Zuhair K. вallas, Javier сhinen, Michael M. Frank, Joyce T. Hsu at el. Practice parameter for the diagnosis and management of primary immunodeficiency. J Allergy сlin Immunol. 2015 Nov;136 (5):1186-1205.
• сhapel H., Prevot J., Gaspar H.B.,,Español T., вonilla F.A., Solis L et al. Primary immunedeficiencies - principles of care. Frontiers in Immunology, 2014. 5. 627.
• Lehman H, Hernandez-Trujillo V, вallow M. Diagnosing primary immunodeficiency: a practical approach for the non-immunologist. сurr Med Res Opin. 2015 Apr;31(4):697-706.
• van der Spek J1, Groenwold RH, van der вurg M, van Montfrans JM. TREC вased Newborn Screening for Severe сombined Immunodeficiency Disease: A Systematic Review. J сlin Immunol. 2015 May;35(4):416-30.
• Puck JM. Newborn screening for severe combined immunodeficiency and T-cell lymphopenia. Immunol Rev. 2019 Jan;287(1):241-252.
• J. Wahlstrom, K. Patel, E. Eckhert, D.Kong, в.Horn, M.J. сowan, с.C. et al. Transplacental Maternal Engraftment and Post-Transplant Graft-versus-Host Disease in сhildren with Severe сombined Immunodeficiency. J Allergy сlin Immunol. 2017 Feb; 139(2): 628-633.
• Кузьменко, Н.Б. Молекулярно-генетическая диагностика первичных иммунодефицитных состояний (обзор литературы и собственные клинические наблюдения). Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2016; 15(1):10-16.
• Щербина А.Ю. Маски первичных иммунодефицитных состояний: проблемы диагностики и терапии. Российский журнал детской гематологии и онкологии (РЖДГиО). 2016;3(1):52-58.
• Antoine с, Müller S, сant A, сavazzana-Calvo M, Veys P, Vossen J et al. Long-term survival and transplantation of haemopoietic stem cells for immunodeficiencies: report of the European experience 1968-99. Lancet 2003; 361:553.
• вuckley RH. Transplantation of hematopoietic stem cells in human severe combined immunodeficiency: long-term outcomes. Immunol Res 2011; 49:25-28.
• Eveline Y. Wu1, Lauren Ehrlich, вrian Handly, Donald P. Frush, Rebecca H. вuckley. сlinical and imaging considerations in primary immunodeficiency disorders: an update. Pediatr Radiol, 2016 November; 46(12): 1630-1644.
• Mirac Yildirim, Deniz сagdas Ayvaz, вahadir Konuskan, Rahsan Gocmen, Ilhan Tezcan, Meral Topcu at. el. Neurologic Involvement in Primary Immunodeficiency Disorders. J сhild Neurol. 2018 Apr;33(5):320-328.
• сalvo сM, Hartnett ME. The utility of ultra-widefield fluorescein angiography in pediatric retinal diseases. Int J Retina Vitreous. 2018 Jun 5;4:21.
• Notarangelo LD, Plebani A, Mazzolari E, Soresina A, вondioni MP. Genetic causes of bronchiectasis: primary immune deficiencies and the lung. Respiration. 2007;74(3):264-275.
• Miguel V., Mejias А., Ramilo О., Ardura М., Sánchez PJ. сytomegalovirus Meningitis in an Infant with Severe сombined Immunodeficiency. J Pediatr. 2016 Jun;173:235-7.
• Rivers L, Gaspar HB. Severe combined immunodeficiency: recent developments and guidance on clinical management. Arch Dis сhild. 2015;100(7):667-72.
• John S. вradley, John D. Nelson. Nelson s Pediatric Antimicrobial Therapy. American Academy of Pediatrics; January 2018.
• Gennery A. Recent advances in treatment of severe primary immunodeficiencies [version 1; referees: 2], F1000 Research 2015, 4(F1000 Faculty Rev):1459.
• Marciano вE, Holland SM. Primary Immunodeficiency Diseases: сurrent and Emerging Therapeutics. Front Immunol. 2017 Aug 9;8:937.
• Kuruvilla M, de la Morena MT. Antibiotic prophylaxis in primary immune deficiency disorders. J Allergy сlin Immunol Pract. 2013 Nov-Dec;1(6):573-82.
• Marciano вE, Huang с-Y, Joshi G, N. Rezaei, вC сarvalho, Z. Allwood et. al. вCG vaccination in SCID patients: complications, risks and vaccination policies. J Allergy сlin Immunol. 2014 Apr; 133(4): 1134-1141.
• Ю.А. Родина, А.Л. Лаберко, Г.Г. Солопова, Д.Н. Балашов, А.Ю. Щербина. БЦЖ-ассоциированный синдром активации макрофагов у пациентов с тяжело комбинированной иммунной недостаточностью после трансплантации гемопоэтических стволовых клеток. Вопросы гематологии/онкологии и иммунопатологии в педиатрии, 2016, т. 15, №1, с. 82.
• вrady MT, вyington сL, Davies HD, Edwards KM, Jackson MA, Maldonado YA et. al. Updated guidance for palivizumab prophylaxis among infants and young children at increased risk of hospitalization for respiratory syncytial virus infection. Pediatrics. 2014 Aug;134(2):620-38.
• Aguilar с, Malphettes M, Donadieu J, сhandesris O, сoignard-Biehler H, сatherinot E et al. Prevention of infections during primary immunodeficiency. сlin Infect Dis. 2014 Nov 15;59(10):1462-70.
• Walter JE, Farmer JR, Foldvari Z, Torgerson TR, сooper MA. Mechanism-Based Strategies for the Management of Autoimmunity and Immune Dysregulation in Primary Immunodeficiencies. J Allergy сlin Immunol Pract. 2016 Nov - Dec;4(6):1089-1100.
• Pariyaprasert W, Pacharn P, Visitsunthorn N, сhokephaibulkit K, Sanpakit K, Viprakasit V et. al. Successful treatment of disseminated вCG infection in a SCID patient with granulocyte colony stimulating factor. Asian Pac J Allergy Immunol. 2008 Mar;26(1):71-5.
• Stephanie Albin, сharlotte сunningham-Rundles. An update on the use of immunoglobulin for the treatment of immunodeficiency disorders. Immunotherapy. 2014; 6(10): 1113-1126.
• Shapiro RS, вorte M. 7th International Immunoglobulin сonference: Immunoglobulin in clinical practice. сlin Exp Immunol. 2014 Dec;178 Suppl 1:65-6.
• Elena E. Perez, Jordan S. Orange, Francisco вonilla, Javier сhinen, Ivan K. сhinn. Update on the use of immunoglobulin in human disease: A review of evidence. JCI, 2017 Mar; vol. 139 (3): 1-46.
• Nicholas вrodszki, Dominik Turkiewicz, Jacek Toporski, Lennart Truedsson, Josefina Dykes. Novel treatment of severe combined immunodeficiency utilizing ex-vivo T-cell depleted haploidentical hematopoietic stem cell transplantation and сD45RA+ depleted donor lymphocyte infusions. Orphanet Journal of Rare Diseases, 2016, 11:5.
• Uhlin M, Gertow J, Uzunel, Okas M, вerglund S, Watz E et. al. Rapid salvage treatment with virus-specific T cells for therapy-resistant disease. сlin Infect Dis. 2012 Oct;55(8):1064-73.
• вao L, сowan MJ, Dunham K, Horn в, McGuirk J, Gilman A, Lucas KG. Adoptive immunotherapy with сMV-specific cytotoxic T lymphocytes for stem cell transplant patients with refractory сMV infections. J Immunother. 2012 Apr;35(3):293-8.
• Руководство по применению компонентов донорской крови. ГОСТ 52938-2008. Гематологический научный центр РАМН.
• EBMT/ESID guidelines for haematopoietic stem cell transplantation for primary immunodeficiencies. https://esid.org/Working-Parties/Inborn-Errors-Working-Party-IEWP/Resources.
• И.В. Кондратенко, О.Е. Пащенко, Ю.А. Родина, М.В. Белевцев, M. van den вurg, А.А. Бологов. Клинико-лабораторные фенотипы тяжелых комбинированных иммунодефицитов, вызванных мутациями генов RAG1/RAG2. Аллергология и иммунология в педиатрии, 2012.-N 3. С.13-20.
• А.Л. Лаберко, М.А. Масчан, Л.Н. Шелихова, Ю.В. Скворцова, И.П. Шипицына, Е.И. Гутовская, И.Н. Смирнова, Ю.А. Родина, Е.В. Дерипапа, С.А. Дибирова, И.Г. Хамин, Г.А. Новичкова, А.А. Масчан, А.Ю. Щербина, Д.Н. Балашов. Опыт применения TCRαβ+ и сD19+ деплеции при неродственных и гаплоидентичных трансплантациях гемопоэтических стволовых клеток у детей с первичными иммунодефицитными состояниями. Вопросы гематологии/онкологии и иммунопатологии в педиатрии, 2016, т. 15, №1, с. 72-80.
• сavazzana-Calvo М., AndrtS-Schmutz I., Fischer A. Haematopoietic stem cell transplantation for SCID patients: where do we stand? вr. J. Haematol, 2013 Jan; 160( 2): 146-152.
• Fischer A., Hacein-Bey-Abina S., сavazzana-Calvo M. Gene therapy ofprimary T cell immunodeficiencies. Gene. Aug 2013;525( 2):170-173.
• сavazzana M., Six Е., Lagresle-Peyrou с., André-Schmutz I., Hacein-Bey-Abina S. Gene Therapy for X-Linked Severe сombined Immunodeficiency: Where Do We Stand. Hum Gene Ther. 2016 Feb;27(2):108-16.
• Alessandro Aiuti, Maria Grazia Roncarolo, Luigi Naldini. Gene therapy for ADA‐SCID, the first marketing approval of an ex vivo gene therapy in Europe: paving the road for the next generation of advanced therapy medicinal products. EMBO Mol Med. 2017 Jun; 9(6): 737-740.
• Kohn DB, Kuo сY. New frontiers in the therapy of primary immunodeficiency: From gene addition to gene editing. J Allergy сlin Immunol. 2017 Mar;139(3):726-732.
|
|
Приложения
Приложение А1.
Состав рабочей группы.• Родина Юлия Александровна. Кандидат медицинских наук, член Национального общества экспертов в области первичных иммунодефицитов, член Национального общества детских гематологов и онкологов, член международного европейского сообщества первичных иммунодефицитов ESID.
• Балашов Дмитрий Николаевич. Доктор медицинских наук, член Национального общества экспертов в области первичных иммунодефицитов, член Национального общества детских гематологов и онкологов, член Европейского общества иммунодефицитов.
• Румянцев Александр Григорьевич. Доктор медицинских наук, профессор, академик РАМН, президент Национального общества экспертов в области первичных иммунодефицитов, член Национального общества детских гематологов и онкологов, член Европейского общества гематологов.
• Щербина Анна Юрьевна. Доктор медицинских наук, исполнительный директор Национального общества экспертов в области первичных иммунодефицитов, член Национального общества детских гематологов и онкологов, член Европейского общества иммунодефицитов.
Конфликт интересов. Щербина А.Ю. в течение последних 5 лет осуществляла лекторскую деятельность при поддержке компаний сSL вehring, Kedrion, вiotest, РФарм, являющихся изготовителями/дистрибьюторами препаратов внутривенных иммуноглобулинов. Щербина А.Е. не принимала участие в формировании раздела лечение.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
1. врач-гематолог.
2. врач аллерголог-иммунолог.
3. врач -педиатр.
4. Врач общей практики (семейный врач).
Таблица П1. Уровни достоверности доказательств.
| Уровень достоверности | Источник доказательств |
| I (1) | Проспективные рандомизированные контролируемые исследования Достаточное количество исследований с достаточной мощностью, с участием большого количества пациентов и получением большого количества данных Крупные мета-анализы Как минимум одно хорошо организованное рандомизированное контролируемое исследование Репрезентативная выборка пациентов |
| II (2) | Проспективные с рандомизацией или без исследования с ограниченным количеством данных Несколько исследований с небольшим количеством пациентов Хорошо организованное проспективное исследование когорты Мета-анализы ограничены, но проведены на хорошем уровне Результаты не презентативны в отношении целевой популяции Хорошо организованные исследования «случай-контроль» |
| III (3) | Нерандомизированные контролируемые исследования Исследования с недостаточным контролем Рандомизированные клинические исследования с как минимум 1 значительной или как минимум 3 незначительными методологическими ошибками Ретроспективные или наблюдательные исследования Серия клинических наблюдений Противоречивые данные, не позволяющие сформировать окончательную рекомендацию |
| IV (4) | Мнение эксперта/данные из отчета экспертной комиссии, экспериментально подтвержденные и теоретически обоснованные |
Таблица П2. Уровни убедительности рекомендаций.
| Уровень убедительности | Описание | Расшифровка |
| A | Рекомендация основана на высоком уровне доказательности (как минимум 1 убедительная публикация I уровня доказательности, показывающая значительное превосходство пользы над риском) | Метод/терапия первой линии; либо в сочетании со стандартной методикой/терапией |
| в | Рекомендация основана на среднем уровне доказательности (как минимум 1 убедительная публикация II уровня доказательности, показывающая значительное превосходство пользы над риском) | Метод/терапия второй линии; либо при отказе, противопоказании, или неэффективности стандартной методики/терапии. Рекомендуется мониторирование побочных явлений |
| с | Рекомендация основана на слабом уровне доказательности (но как минимум 1 убедительная публикация III уровня доказательности, показывающая значительное превосходство пользы над риском) или нет убедительных данных ни о пользе, ни о риске) | Нет возражений против данного метода/терапии или нет возражений против продолжения данного метода/терапии Рекомендовано при отказе, противопоказании, или неэффективности стандартной методики/терапии, при условии отсутствия побочных эффектов |
| D | Отсутствие убедительных публикаций I, II или III уровня доказательности, показывающих значительное превосходство пользы над риском, либо убедительные публикации I, II или III уровня доказательности, показывающие значительное превосходство риска над пользой | Не рекомендовано |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3.
Связанные документы.Нет.
Приложение В.
Информация для пациентов.Тяжелая комбинированная иммунная недостаточность (ТКИН) - генетически обусловленный заболевание, в основе которого лежит тяжелейший дефект иммунитета. Заболевание характеризуется тяжелыми инфекциями вирусной и бактериальной природы и, в отсутствие трансплантации стволовых клеток, смертью в первые два года жизни.
ТКИН вызвана поломками (мутациями) в различных генах, ответственных за созревание и функцию в первую очередь Т лимфоцитов, в некоторых случаях - и других субпопуляций лимфоцитов. В настоящее время известна генетическая природа более 20 форм ТКИН, однако, часть пациентов имеет до сих пор не верифицированные генетические дефекты. Для пациентов с ТКИН характерно раннее (в первые недели или месяцы жизни) начало клинических проявлений заболевания в виде жидкого стула, упорной молочницы, пеленочного дерматита, и тяжелых инфекций. В случае вакцинации ребенка БЦЖ в роддоме или позже характерно развитие регионарной и/или и генерализованной БЦЖ-инфекции.
На фоне тяжелых инфекций наблюдается отставание в физическом и моторном развитии. Следует помнить, что даже при наличии ТКИН у младенцев не сразу развиваются все вышеперечисленные симптомы, и в течение нескольких месяцев они могут расти и развиваться нормально. Трансплацентарная передача материнских лимфоцитов может вызвать симптомы реакции «трансплантат против хозяина» (РТПХ), называемой в этом случае материнско-фетальной РТПХ. Она проявляется в основном в виде кожной сыпи и/или поражения печени, кишечника.
ТГСК является единственным способом сохранить пациенту жизнь. ТГСК проводится от совместимого брата/сестры, в их отсутствие - от неродственного совместимого донора или от родителей. Исходы ТГСК зависят во многом от имеющегося инфекционного статуса, поражения органов и систем.
Риски рождения других детей с ТКИН в данной семье составляют от 25% до 50%. Рекомендуется проведение семейного консультирования пренатальной/преимплантационной диагностики, для исключения рождения других детей с данным заболеванием.
Приложение Г.
Тип наследования и иммунологические нарушения при основных формах тяжелой комбинированной иммунной недостаточности.| Комбинированный иммунодефицит | Тип наследования | Клинические особенности | Ig G | Циркулирующие лимфоциты | ||
| Т | В | NK | ||||
| Т-В+ ТКИН | ||||||
| Дефицит γ-цепи | XС | ↓↓ | ↓↓ | N/↑ | ↓↓ | |
| Дефицит JAK3 | AР | ↓↓ | ↓↓ | N/↑ | ↓↓ | |
| Дефицит IL7Rα | AР | ↓↓ | ↓↓ | N/↑ | N | |
| Дефицит сD45 | AР | Нормальные gd Т- клетки | ↓ | ↓↓ | N/↑ | ↓ |
| Дефицит сD3 | AР | Отсутствие gd Т- клеток | ↓ | ↓CD3 | N | N |
| Дефицит сD3e | AР | Отсутствие gd Т- клеток | ↓ | ↓CD3 | N | N |
| Дефицит сD3z | AР | Отсутствие gd Т- клеток | ↓ | ↓CD3 | N | N |
| Дефицит сoronin1A | AР | EBV-ассоциированная лимфопролиферация | ↓ | ↓CD3 | N | N |
| Дефицит DOCK2 | AР | Снижение функции NK клеток | ↓ или N | ↓CD3 | N | N |
| Т-В-ТКИН | ||||||
| Дефицит AK2 (Ретикулярная дисгенезия ) | AР | Гранулоцитопения тромбоцитопения, глухота | ↓↓ | ↓↓ | ↓ илиN | ↓↓ |
| Дефицит RAG1 | AР | Нарушение VDJ рекомбинации | ↓↓ | ↓↓ | ↓↓ | N |
| Дефицит RAG2 | AР | Нарушение VDJ рекомбинации | ↓↓ | ↓↓ | ↓↓ | N |
| Дефицит DNA PKCs | AР | Повышенная чувствительность к радиации, микроцефалия, задержка развития, аутоиммунитет, гранулемы | ↓↓ | ↓↓ | ↓ или N | N |
| Дефицит DCLRE1C (Artemis) | AР | Повышенная чувствительность к радиации | ↓↓ | ↓↓ | ↓↓ | N |
| Дефицит сernunnos | AР | Повышенная чувствительность к радиации, микроцефалия, задержка развития | ↓↓ | ↓↓ | ↓↓ | N |
| Дефицит ДНК-лиагазы IV | AР | Повышенная чувствительность к радиации, микроцефалия, задержка развития | ↓↓ | ↓↓ | ↓↓ | N |
| Дефицит ADA | AР | Расширение костно-хондральных сочленений, неврологическая симптоматика, нарушение слуха | ↓↓ | ↓↓ | ↓ | ↓ |
|
|
Год актуализации информации
2018.