МКБ-10 коды
- МКБ-10
- K25 Язва желудка
- K26 Язва двенадцатиперстной кишки
- K25.5 Язва желудка хроническая или неуточненная с прободением
- K25.2 Язва желудка острая с кровотечением и прободением
- K25.1 Язва желудка острая с прободением
- K26.5 Язва двенадцатиперстной кишки хроническая или неуточненная с прободением
- K26.2 Язва двенадцатиперстной кишки острая с кровотечением и прободением
- K26.6 Язва двенадцатиперстной кишки хроническая или неуточненная с кровотечением и прободением
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: K25, K26.
Год утверждения (частота пересмотра): 2021.
Возрастная категория: Дети.
Пересмотр не позднее: 2023.
ID: 388.
Разработчик клинической рекомендации.
• Союз педиатров России.
• Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии.
• Общероссийская общественная организация Российская ассоциация детских хирургов .
• Автономная некоммерческая организация Общество детских гастроэнтерологов, гепатологов и нутрициологов .
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2021.
Возрастная категория: Дети.
Пересмотр не позднее: 2023.
ID: 388.
Разработчик клинической рекомендации.
• Союз педиатров России.
• Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии.
• Общероссийская общественная организация Российская ассоциация детских хирургов .
• Автономная некоммерческая организация Общество детских гастроэнтерологов, гепатологов и нутрициологов .
Одобрено Научно-практическим Советом Минздрава РФ.
|
|
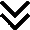 Список сокращений
Список сокращений
АБС - абдоминальный болевой синдром.
АД - артериальное давление.
АЛТ - аланинаминотрансфераза.
АСТ - аспартатаминотрансфераза.
АФК - активные формы кислорода.
БУТ - быстрый уреазный тест.
ВНС- вегетативная нервная система.
ВОПТ - верхние отделы пищеварительного тракта.
ДПК - двенадцатиперстная кишка.
ЖКТ - желудочно-кишечный тракт.
ИПН - ингибиторы протонного насоса.
ЛФК - лечебная физкультура.
НПВП - нестероидные противовоспалительные препараты.
H. pylori - Helicobacter pylori.
СО -слизистая оболочка.
УЗИ - ультразвуковое исследование.
ЭГДС - эзофагогастродуоденоскопия.
ЭКГ - электрокардиография.
Эхо-КГ - эхокардиография.
ЯБ - язвенная болезнь.
ЯБДПК - язвенная болезнь двенадцатиперстной кишки.
ЯБЖ - язвенная болезнь желудка.
CMV - цитомегаловирус (герпес-вирус 5 типа).
EBV - Эпштейн-Барр вирус (герпес-вирус 4 типа).
HHV 1 типа - герпес-вирус человека 1 типа.
HHV 2 типа - герпес-вирус человека 2 типа.
АД - артериальное давление.
АЛТ - аланинаминотрансфераза.
АСТ - аспартатаминотрансфераза.
АФК - активные формы кислорода.
БУТ - быстрый уреазный тест.
ВНС- вегетативная нервная система.
ВОПТ - верхние отделы пищеварительного тракта.
ДПК - двенадцатиперстная кишка.
ЖКТ - желудочно-кишечный тракт.
ИПН - ингибиторы протонного насоса.
ЛФК - лечебная физкультура.
НПВП - нестероидные противовоспалительные препараты.
H. pylori - Helicobacter pylori.
СО -слизистая оболочка.
УЗИ - ультразвуковое исследование.
ЭГДС - эзофагогастродуоденоскопия.
ЭКГ - электрокардиография.
Эхо-КГ - эхокардиография.
ЯБ - язвенная болезнь.
ЯБДПК - язвенная болезнь двенадцатиперстной кишки.
ЯБЖ - язвенная болезнь желудка.
CMV - цитомегаловирус (герпес-вирус 5 типа).
EBV - Эпштейн-Барр вирус (герпес-вирус 4 типа).
HHV 1 типа - герпес-вирус человека 1 типа.
HHV 2 типа - герпес-вирус человека 2 типа.
Термины и определения
Новые и узконаправленные профессиональные термины в настоящих клинических рекомендациях не используются.
Описание
Язвенная болезнь (ЯБ). Хроническое рецидивирующее мультифакторное заболевание, проявляющееся образованием язвенных дефектов в желудке и/или двенадцатиперстной кишке (ДПК) с возможным прогрессированием и развитием осложнений.
Причины
Патогенез ЯБ сводится к нарушению равновесия между факторами защиты слизистой оболочки желудка и ДПК и агрессивными свойствами желудочного и дуоденального содержимого [1].
Основными факторами, усиливающими агрессивные свойства желудочного и дуоденального содержимого, являются:
• увеличение массы обкладочных клеток желудка (часто наследственно обусловленное);
• гиперпродукция гастрина;
• нарушение нервной и гуморальной регуляции желудочной кислотопродукции;
• повышение выработки пепсиногена и пепсина;
• нарушение гастродуоденальной моторики (замедление или ускорение);
• заброс желчи в желудок.
• обсеменение слизистой оболочки желудка H. pylori.
Основными факторами, ослабляющими защитные свойства слизистой оболочки желудка и ДПК являются:
• нарушение клеточной регенерации;
• нарушение местного кровотока (локальная ишемия);
• снижение продукции слизи и интенсивности муцинообразования и продукции сиаловых кислот;
• снижение продукции бикарбонатов поджелудочной железой;
• антродуоденальный кислотный тормоз;
• уменьшение содержания простагландинов в слизистой оболочке желудка и ДПК;
• прием препаратов групп «Другие анальгетики и антипиретики» и/или «Нестероидные противовоспалительные и противоревматические препараты» (нестероидные противовоспалительные препараты - НПВП).
Кроме НПВП причиной развития язвенного процесса является прием анаболических стероидов (стероидных препаратов), противоопухолевых препаратов (цитостатических препаратов) и иммунодепрессантов [2].
На состояние равновесия между факторами защиты и агрессии также влияют такие инфекционные агенты, как сandida albicans, герпес-вирусы (HHV 1 и 2 типа, EBV, сMV).
Представители Prevotella spp. и Streptococcus spp. в составе бактериальных сообществ могут принимать участие в развитии гастродуоденальной патологии [11].
Большое значение в развитии ЯБ имеет наследственная предрасположенность: при ЯБЖ она составляет 15-40%, а при ЯБДПК она может достигать 60-80% [3].
Наследственно-генетические факторы ассоциированы с увеличением желудочной кислотопродукции (генетически детерминированное увеличение массы обкладочных клеток и гиперактивностью секреторного аппарата СО); увеличением уровня гастрина и пепсиногена (сывороточного пепсиногена I), которое передаётся по аутосомно-доминантному типу; дефектом слизеобразования СОЖ и СОДК, проявляющимся в виде дефицита мукополисахаридов, в том числе фукогликопротеинов, синдрохондроитинсульфатов и глюкозаминогликанов; наличием определенных фенотипических полиморфизмов (группа крови I и II, отрицательный Rh-фактор, определенные виды HLA антигенов); в формировании ЯБ имеет значение полиморфизм генов матриксных металлопротеиназ-1, -3, -9 и тканевого ингибитора металлопротеиназ-3, носительство 607С- и -251Т/А-аллелей гена провоспалительного IL-8, полиморфизм HLA - (HLA-DQB1*0602, DQB1*0301), особенности строения TLR-9 и TLR-4, белка теплового шока 70-2 [4, 5, 6].
В современной гастроэнтерологии решающая роль в развитии ЯБ отводится микроорганизму H. pylori, обнаруженному в 1983 г. австралийскими учеными Б. Маршаллом (B. Marshall) и Дж. Уорреном (J. Warren); позднее была доказана роль этой бактерии в том числе и в развитии язвенной болезни. Следует подчеркнуть, что у детей в отличие от взрослых инфицирование H. pylori намного реже сопровождается изъязвлением слизистой оболочки желудка и двенадцатиперстной кишки. По данным крупного европейского многоцентрового исследования, у 1233 детей с симптоматической H. pylori -инфекцией, ЯБ была диагностирована менее чем у 5% детей до 12 лет и лишь у 10% подростков [19].
Доказано как прямое повреждающее действие H. pylori на слизистую оболочку желудка и ДПК за счет выработки комплекса ферментов (уреаза, протеазы, фосфолипазы) и цитотоксинов (VacA, сagA), так и опосредованное повреждение слизистой оболочки за счет высвобождения интерлейкинов, лизосомальных энзимов, фактора некроза опухоли с развитием воспалительных процессов. Развитие в процессе персистирования в слизистой и подслизистой оболочках желудка и ДПК H. pylori приводит к формированию хронического гастрита и дуоденита с повышением продукции гастрина, усиливающего секрецию соляной кислоты. В то же время, избыточное закисление ДПК соляной кислотой при относительном дефиците панкреатических бикарбонатов, приводит к поддержанию воспалительного процесса в ДПК (прежде всего в луковице), появлению участков метаплазии слизистой оболочки ДПК с замещением кишечного эпителия на желудочный, который в свою очередь заселяется H. pylori. В дальнейшем при персистировании H. pylori именно на участках с метаплазией эпителия желудочного типа формируются язвенные дефекты. У детей до 18 лет обсеменённость слизистой оболочки антрального отдела желудка H. pylori при обострении ЯБДК отмечается у 33-100% (медиана 92%), при ЯБЖ - у 11-75% (медиана 25%); обсеменённость H. pylori при рецидивирующем язвенном процессе фиксируется от 0 до 81% случаев (медиана 22%) [7].
Более 2/3 детей развивающихся стран инфицируются до 2 летнего возраста и распространенность инфекции достигает 80-100% при этом наиболее важными факторами распространения являются плохие социально-экономические условия и плохое гигиеническое состояние [8, 9].
В развитии ЯБ немаловажную роль играет состояние иммунитета ребенка и связано как с дефектами иммунной реактивности организма (наследственной или приобретённой природы), так и воздействием на иммунную систему факторов патогенности Н.pylori и расстройством микробиоты верхних отделов пищеварительного тракта (ВОПТ). Исследования состояния иммунной системы у детей с ЯБДК, ассоциированной с H. pylori инфекцией, выявили наличие нарушений иммунного статуса, связанных с дисбалансом в системе цитокинов (IL-1, IL-4, IL-6, IL-8, IL-10, IL-12, TGF-β, IFN-γ), повышением уровня IgG-антител к тканевым (органоспецифическим и органонеспецифическим) и бактериальным антигенам, усилением продукции нейтрофилами активных форм кислорода (АФК). Выявленная у детей с ЯБДК продукция антител класса IgG к структурам тканей организма (эластину, коллагену, денатурированной ДНК) и к антигенам тканей желудочно-кишечного тракта (ЖКТ) - к антигенам желудка, тонкой и толстой кишки, поджелудочной железы, может служить указанием на развитие аутоиммунного процесса при обострении ЯБДК у детей. Выработка аутоантител к тканям желудка при инфицировании H. pylori доказана и у взрослых. Усиление продукции АФК нейтрофилами у детей с ЯБДК указывает на участие секретируемых нейтрофилами токсических веществ в деструктивном процессе при ЯБДК [12].
Неблагоприятное течение может быть обусловлено такими дополнительными факторами как, нейроэндокринные - реализуются факторами APUD-системы (гастрин, бомбезин, соматостатин, секретин, холецистокинин, мотилин, энкефалины, ацетилхолин), мелатонин; нейропсихические - связаны с психотравмами, устойчивыми стрессами, в том числе конфликтами в семье. Выявляются особенности реагирования нервной системы больных с ЯБ (астенический и астеноневротический, ипохондрический, депрессивный синдромы), интраверсия и экстраверсия, эмоциональная неустойчивость, дистимические расстройства;
Этиологическая роль алиментарных факторов, ассоциированных с нерегулярным приёмом пищи, употреблением жареной, копчёной пищи, продуктов с большим содержанием соли, экстрактивных веществ, ксенобиотиков (консервантов, усилителей вкуса ) хотя и обсуждается, однако в настоящее время не доказана.
Выделяется особая форма первичной ЯБ, называемая «идиопатической», развитие которой не ассоциировано с доказанным инфекционным процессом. Распространённость этой формы ЯБ по данным различных авторов колеблется от 39% до 73%. Причина развития язвенного процесса у этих больных до конца не выяснена и возможно связана с нарушением процессов нейро-гуморально-эндокринно-иммунной регуляции слизистой оболочки ЖКТ.
Таким образом, формирование ЯБ или возникновение рецидива заболевания может быть связано с течением H. pylori инфекции, у иммунокомпрометированных пациентов - персистированием герпетической инфекции, воздействием изменённых сигнальных систем на местном и системном уровне, нарушением баланса между факторами агрессии и защиты слизистой оболочки ВОПТ. Наличие индивидуальных особенностей естественной резистентности слизистой оболочки, в том числе и к H. pylori, позволяет нейтрализовать или уменьшить «агрессивность» триггерных факторов развития ЯБ [13].
Основными факторами, усиливающими агрессивные свойства желудочного и дуоденального содержимого, являются:
• увеличение массы обкладочных клеток желудка (часто наследственно обусловленное);
• гиперпродукция гастрина;
• нарушение нервной и гуморальной регуляции желудочной кислотопродукции;
• повышение выработки пепсиногена и пепсина;
• нарушение гастродуоденальной моторики (замедление или ускорение);
• заброс желчи в желудок.
• обсеменение слизистой оболочки желудка H. pylori.
Основными факторами, ослабляющими защитные свойства слизистой оболочки желудка и ДПК являются:
• нарушение клеточной регенерации;
• нарушение местного кровотока (локальная ишемия);
• снижение продукции слизи и интенсивности муцинообразования и продукции сиаловых кислот;
• снижение продукции бикарбонатов поджелудочной железой;
• антродуоденальный кислотный тормоз;
• уменьшение содержания простагландинов в слизистой оболочке желудка и ДПК;
• прием препаратов групп «Другие анальгетики и антипиретики» и/или «Нестероидные противовоспалительные и противоревматические препараты» (нестероидные противовоспалительные препараты - НПВП).
Кроме НПВП причиной развития язвенного процесса является прием анаболических стероидов (стероидных препаратов), противоопухолевых препаратов (цитостатических препаратов) и иммунодепрессантов [2].
На состояние равновесия между факторами защиты и агрессии также влияют такие инфекционные агенты, как сandida albicans, герпес-вирусы (HHV 1 и 2 типа, EBV, сMV).
Представители Prevotella spp. и Streptococcus spp. в составе бактериальных сообществ могут принимать участие в развитии гастродуоденальной патологии [11].
Большое значение в развитии ЯБ имеет наследственная предрасположенность: при ЯБЖ она составляет 15-40%, а при ЯБДПК она может достигать 60-80% [3].
Наследственно-генетические факторы ассоциированы с увеличением желудочной кислотопродукции (генетически детерминированное увеличение массы обкладочных клеток и гиперактивностью секреторного аппарата СО); увеличением уровня гастрина и пепсиногена (сывороточного пепсиногена I), которое передаётся по аутосомно-доминантному типу; дефектом слизеобразования СОЖ и СОДК, проявляющимся в виде дефицита мукополисахаридов, в том числе фукогликопротеинов, синдрохондроитинсульфатов и глюкозаминогликанов; наличием определенных фенотипических полиморфизмов (группа крови I и II, отрицательный Rh-фактор, определенные виды HLA антигенов); в формировании ЯБ имеет значение полиморфизм генов матриксных металлопротеиназ-1, -3, -9 и тканевого ингибитора металлопротеиназ-3, носительство 607С- и -251Т/А-аллелей гена провоспалительного IL-8, полиморфизм HLA - (HLA-DQB1*0602, DQB1*0301), особенности строения TLR-9 и TLR-4, белка теплового шока 70-2 [4, 5, 6].
В современной гастроэнтерологии решающая роль в развитии ЯБ отводится микроорганизму H. pylori, обнаруженному в 1983 г. австралийскими учеными Б. Маршаллом (B. Marshall) и Дж. Уорреном (J. Warren); позднее была доказана роль этой бактерии в том числе и в развитии язвенной болезни. Следует подчеркнуть, что у детей в отличие от взрослых инфицирование H. pylori намного реже сопровождается изъязвлением слизистой оболочки желудка и двенадцатиперстной кишки. По данным крупного европейского многоцентрового исследования, у 1233 детей с симптоматической H. pylori -инфекцией, ЯБ была диагностирована менее чем у 5% детей до 12 лет и лишь у 10% подростков [19].
Доказано как прямое повреждающее действие H. pylori на слизистую оболочку желудка и ДПК за счет выработки комплекса ферментов (уреаза, протеазы, фосфолипазы) и цитотоксинов (VacA, сagA), так и опосредованное повреждение слизистой оболочки за счет высвобождения интерлейкинов, лизосомальных энзимов, фактора некроза опухоли с развитием воспалительных процессов. Развитие в процессе персистирования в слизистой и подслизистой оболочках желудка и ДПК H. pylori приводит к формированию хронического гастрита и дуоденита с повышением продукции гастрина, усиливающего секрецию соляной кислоты. В то же время, избыточное закисление ДПК соляной кислотой при относительном дефиците панкреатических бикарбонатов, приводит к поддержанию воспалительного процесса в ДПК (прежде всего в луковице), появлению участков метаплазии слизистой оболочки ДПК с замещением кишечного эпителия на желудочный, который в свою очередь заселяется H. pylori. В дальнейшем при персистировании H. pylori именно на участках с метаплазией эпителия желудочного типа формируются язвенные дефекты. У детей до 18 лет обсеменённость слизистой оболочки антрального отдела желудка H. pylori при обострении ЯБДК отмечается у 33-100% (медиана 92%), при ЯБЖ - у 11-75% (медиана 25%); обсеменённость H. pylori при рецидивирующем язвенном процессе фиксируется от 0 до 81% случаев (медиана 22%) [7].
Более 2/3 детей развивающихся стран инфицируются до 2 летнего возраста и распространенность инфекции достигает 80-100% при этом наиболее важными факторами распространения являются плохие социально-экономические условия и плохое гигиеническое состояние [8, 9].
В развитии ЯБ немаловажную роль играет состояние иммунитета ребенка и связано как с дефектами иммунной реактивности организма (наследственной или приобретённой природы), так и воздействием на иммунную систему факторов патогенности Н.pylori и расстройством микробиоты верхних отделов пищеварительного тракта (ВОПТ). Исследования состояния иммунной системы у детей с ЯБДК, ассоциированной с H. pylori инфекцией, выявили наличие нарушений иммунного статуса, связанных с дисбалансом в системе цитокинов (IL-1, IL-4, IL-6, IL-8, IL-10, IL-12, TGF-β, IFN-γ), повышением уровня IgG-антител к тканевым (органоспецифическим и органонеспецифическим) и бактериальным антигенам, усилением продукции нейтрофилами активных форм кислорода (АФК). Выявленная у детей с ЯБДК продукция антител класса IgG к структурам тканей организма (эластину, коллагену, денатурированной ДНК) и к антигенам тканей желудочно-кишечного тракта (ЖКТ) - к антигенам желудка, тонкой и толстой кишки, поджелудочной железы, может служить указанием на развитие аутоиммунного процесса при обострении ЯБДК у детей. Выработка аутоантител к тканям желудка при инфицировании H. pylori доказана и у взрослых. Усиление продукции АФК нейтрофилами у детей с ЯБДК указывает на участие секретируемых нейтрофилами токсических веществ в деструктивном процессе при ЯБДК [12].
Неблагоприятное течение может быть обусловлено такими дополнительными факторами как, нейроэндокринные - реализуются факторами APUD-системы (гастрин, бомбезин, соматостатин, секретин, холецистокинин, мотилин, энкефалины, ацетилхолин), мелатонин; нейропсихические - связаны с психотравмами, устойчивыми стрессами, в том числе конфликтами в семье. Выявляются особенности реагирования нервной системы больных с ЯБ (астенический и астеноневротический, ипохондрический, депрессивный синдромы), интраверсия и экстраверсия, эмоциональная неустойчивость, дистимические расстройства;
Этиологическая роль алиментарных факторов, ассоциированных с нерегулярным приёмом пищи, употреблением жареной, копчёной пищи, продуктов с большим содержанием соли, экстрактивных веществ, ксенобиотиков (консервантов, усилителей вкуса ) хотя и обсуждается, однако в настоящее время не доказана.
Выделяется особая форма первичной ЯБ, называемая «идиопатической», развитие которой не ассоциировано с доказанным инфекционным процессом. Распространённость этой формы ЯБ по данным различных авторов колеблется от 39% до 73%. Причина развития язвенного процесса у этих больных до конца не выяснена и возможно связана с нарушением процессов нейро-гуморально-эндокринно-иммунной регуляции слизистой оболочки ЖКТ.
Таким образом, формирование ЯБ или возникновение рецидива заболевания может быть связано с течением H. pylori инфекции, у иммунокомпрометированных пациентов - персистированием герпетической инфекции, воздействием изменённых сигнальных систем на местном и системном уровне, нарушением баланса между факторами агрессии и защиты слизистой оболочки ВОПТ. Наличие индивидуальных особенностей естественной резистентности слизистой оболочки, в том числе и к H. pylori, позволяет нейтрализовать или уменьшить «агрессивность» триггерных факторов развития ЯБ [13].
|
|
Эпидемиология
По данным эпидемиологических исследований инфекция H. pylori в РФ обнаруживается у 65-92% взрослого населения. Инфицирование H. pylori среди детей РФ в возрасте 5-10 лет было выявлено у 29%, в возрасте 11-14 лет - у 56% [14, 15, 16, 17, 18].
По данным зарубежных авторов, риск развития ЯБДК или ЯБЖ у инфицированных H. pylori в течение жизни варьирует от 3% в США до 25% в Японии [10];
В Российской Федерации распространенность ЯБ у детей в последнее десятилетие снизилась в 1,5 раза и составляет 1,1-1,5 на 1000 детского населения [20]. ЯБЖ выявляется у 2 из 10 000 детей (в 8 раз реже, чем ЯБДПК). ЯБЖ и ЯБДК преимущественно встречаются у детей старше 7 лет. Единичные случаи обнаружения язв в дошкольном и раннем возрасте наиболее часто могут быть отнесены к симптоматическим язвам [3].
В тоже время следует отметить, что, например, в США частота пептической язвы у детей снизилась в период 2000 г - 2012 г с 2,07 на 100 000 до 1,66 на 100 000 детского населения [21].
В структуре заболеваний ВОПТ ЯБ составляет 7-12%, встречается в 7 раз чаще в школьном возрасте и в 2 раза чаще среди жителей крупных городов. ЯБДПК диагностируется в 3-4 раза чаще, чем ЯБЖ. Дуоденальная локализация язвенного дефекта отмечается в 81-87% случаев (из них постбульбарная - в 2,4-2,8%), желудочная локализация - в 11-13%, двойная локализация - в 4-6% случаев [22].
Максимальная частота ЯДПК отмечается у девочек в 12-13 лет, а у мальчиков - в 14-15 лет. Половые различия в распространённости ЯБ у детей 4-8 летнего возраста отсутствуют, к 12-14 годам отмечается преобладание мальчиков над девочками 3:1, а к 18 годам оно составляет 5:1 [3, 23].
K25,0 - Острая с кровотечением.
K25,1 - Острая с прободением.
K25,2 - Острая с кровотечением и прободением.
K25,3 - Острая без кровотечения или прободения.
K25,4 - Хроническая или неуточненная с кровотечением.
K25,5 - Хроническая или неуточненная с прободением.
K25,6 - Хроническая или неуточненная с кровотечением и прободением.
K25,7 - Хроническая без кровотечения или прободения.
K25,9 - Не уточненная как острая или хроническая без кровотечения или прободения.
Язва двенадцатиперстной кишки (K26):
K26,0 - Острая с кровотечением.
K26,1 - Острая с прободением.
K26,2 - Острая с кровотечением и прободением.
K26,3 - Острая без кровотечения или прободения.
K26,4 - Хроническая или неуточненная с кровотечением.
K26,5 - Хроническая или неуточненная с прободением.
K26,6 - Хроническая или неуточненная с кровотечением и прободением.
K26,7 - Хроническая без кровотечения или прободения.
K26,9 - Не уточненная как острая или хроническая без кровотечения или прободения.
По данным зарубежных авторов, риск развития ЯБДК или ЯБЖ у инфицированных H. pylori в течение жизни варьирует от 3% в США до 25% в Японии [10];
В Российской Федерации распространенность ЯБ у детей в последнее десятилетие снизилась в 1,5 раза и составляет 1,1-1,5 на 1000 детского населения [20]. ЯБЖ выявляется у 2 из 10 000 детей (в 8 раз реже, чем ЯБДПК). ЯБЖ и ЯБДК преимущественно встречаются у детей старше 7 лет. Единичные случаи обнаружения язв в дошкольном и раннем возрасте наиболее часто могут быть отнесены к симптоматическим язвам [3].
В тоже время следует отметить, что, например, в США частота пептической язвы у детей снизилась в период 2000 г - 2012 г с 2,07 на 100 000 до 1,66 на 100 000 детского населения [21].
В структуре заболеваний ВОПТ ЯБ составляет 7-12%, встречается в 7 раз чаще в школьном возрасте и в 2 раза чаще среди жителей крупных городов. ЯБДПК диагностируется в 3-4 раза чаще, чем ЯБЖ. Дуоденальная локализация язвенного дефекта отмечается в 81-87% случаев (из них постбульбарная - в 2,4-2,8%), желудочная локализация - в 11-13%, двойная локализация - в 4-6% случаев [22].
Максимальная частота ЯДПК отмечается у девочек в 12-13 лет, а у мальчиков - в 14-15 лет. Половые различия в распространённости ЯБ у детей 4-8 летнего возраста отсутствуют, к 12-14 годам отмечается преобладание мальчиков над девочками 3:1, а к 18 годам оно составляет 5:1 [3, 23].
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
Язва желудка (К25):K25,0 - Острая с кровотечением.
K25,1 - Острая с прободением.
K25,2 - Острая с кровотечением и прободением.
K25,3 - Острая без кровотечения или прободения.
K25,4 - Хроническая или неуточненная с кровотечением.
K25,5 - Хроническая или неуточненная с прободением.
K25,6 - Хроническая или неуточненная с кровотечением и прободением.
K25,7 - Хроническая без кровотечения или прободения.
K25,9 - Не уточненная как острая или хроническая без кровотечения или прободения.
Язва двенадцатиперстной кишки (K26):
K26,0 - Острая с кровотечением.
K26,1 - Острая с прободением.
K26,2 - Острая с кровотечением и прободением.
K26,3 - Острая без кровотечения или прободения.
K26,4 - Хроническая или неуточненная с кровотечением.
K26,5 - Хроническая или неуточненная с прободением.
K26,6 - Хроническая или неуточненная с кровотечением и прободением.
K26,7 - Хроническая без кровотечения или прободения.
K26,9 - Не уточненная как острая или хроническая без кровотечения или прободения.
Классификация
1,5 Классификация заболевания или состояния (группы заболеваний или состояний).
Общепринятой классификации ЯБ не существует.В педиатрической практике наибольшее распространение получила классификация ЯБ по А.В. Мазурину, представленная в таблице 1.
Таблица 1. Классификация язвенной болезни.
(по А.В. Мазурину 1984 г., с дополнениями В.Ф. Приворотского и Н.Е. Лупповой 2005 г., Цветковой Л.Н., 2009 г.
| Фазы: 1. Обострение 2. Неполная клиническая ремиссия 3. Клиническая ремиссия | Локализация: • Желудок • Двенадцатиперстная кишка • Постбульбарные отделы • Двойная локализация | Форма: 1. Неосложнённая 2. Осложнённая • Кровотечение • Пенетрация • Перфорация • Стеноз привратника • Перивисцерит |
| Инфицирование H. pylori: 1. H. pylori - позитивная 2. H. pylori - негативная | ||
| Течение: 1. Впервые выявленная 2. Редко рецидивирующая (ремиссия более 3-х лет) 3. Непрерывно рецидивирующая (ремиссия менее 1 года) | ||
| Функциональная характеристика: Кислотность желудочного содержимого и моторика могут быть повышены, понижены или нормальными | ||
| Клинико-эндоскопические стадии язвенной болезни: 1 стадия - свежая язва 2 стадия - начало эпителизации язвенного дефекта 3 стадия - заживление язвенного дефекта при выраженном гастродуодените 4 стадия - клинико-эндоскопическая ремиссия | ||
| По клиническому течению: 1. Классическое 2. Атипичное 3. Бессимптомное | ||
| Сопутствующие заболевания: • Панкреатит • Эзофагит • Холецистохолангит | ||
Также различают ЯБ, которые возникают на фоне других заболеваний и связаны с особыми этиопатогенетическими факторами (Таблица 2).
Таблица 2.
Типы язв и их характеристика.
| Типы язв | Причины | Клинические проявления |
| Стрессовые (вследствие ишемии слизистой оболочки) Локализация в желудке | Травма, в том числе черепно-мозговая (язвы Кушинга), при ожогах (язвы Курлинга), шоке, обморожениях | Болевой синдром чаще отсутствует, первым признаком является остро возникшее кровотечение, реже -перфорация. |
| Медикаментозные (вследствие нарушения выработки простагландинов и слизи, снижения темпов регенерации) | Терапия НПВП, кортикостероидами системного действия Противоопухолевыми препаратами (цитостатиками) | Чаще протекают бессимптомно, проявляются внезапно возникшим кровотечением. Иногда сопровождаются изжогой, болями в эпигастрии, тошнотой |
| Эндокринные | Сахарный диабет (изменяются сосуды подслизистого слоя по типу микроангиопатии, снижается уровень трофических процессов) Синдром Золлингера-Эллисона (выявляется выраженная гиперацидность, повышение гастрина в сыворотке крови) Гиперпаратиреоз | Локализуются в желудке, малосимптомны, иногда осложняются кровотечением. Имеет крайне тяжёлое течение, множественная локализация язв, упорная диарея. Локализация чаще в ДПК, тяжёлое течение с частыми рецидивами и склонностью к кровотечению и перфорации, характерны признаки повышенной функции паращитовидных желёз: мышечная слабость, боли в костях, чувство жажды, полиурия. |
| Гепатогенные (нарушение кровотока в воротной вене, нарушение инактивации гистамина в печени, трофические и микроциркуляторные расстройства) | Цирроз печени, хронический гепатит | Локализуются чаще в желудке, реже в ДПК. Клиническая картина обычно стерта и атипична, язвы плохо поддаются терапии, отличаются торпидностью течения |
| Панкреатогенные (нарушение поступления бикарбонатов в кишечник при одновременном увеличении высвобождения кининов, гастрина) | Панкреатит | Локализуются обычно в ДПК. Для язв характерен выраженный болевой синдром, связь с приемом пищи. Течение язвенного процесса упорное, но осложнения наблюдаются редко. |
| Гипоксические (длительная гипоксия желудка) | Хронические заболевания легких и сердечно-сосудистой системы | Выраженная клиническая симптоматика, склонность к кровотечению |
По числу язвенных дефектов различают одиночные и множественные язвы; в зависимости от размеров язвенного дефекта выделяют язвы малых (до 0,5 см в диаметре), средних (0,6-1,9 см в диаметре) и больших (более 2,0 см в диаметре) размеров.
В диагнозе указывается стадия течения заболевания (обострения, заживления, рубцевания, ремиссия), а также наличие осложнений ЯБ (кровотечения, прободения, рубцово-язвенная деформация/стенозы желудка, двенадцатиперстной кишки.
|
|
Клиническая картина
Клинические симптомы обострения ЯБ (боль в животе, диспептические расстройства и функциональные нарушения ВНС) не являются строго специфичными.
Наиболее частым, но наименее специфичным симптомом ЯБ является боль в животе. Только у 15-20% детей с болями в животе при обращении к врачам-гастроэнтерологам выявляются эрозивно-язвенные процессы.
Боль при типичном течении ЯБ достаточно интенсивная, локализуются в основном в эпигастральной и параумбиликальной области, возникает регулярно. Боль принимает ночной, «голодный» характер. Боль может быть ранней (возникает после приема пищи в течение 30-60 мин) и поздней (через 2-3 часа после еды). Возможна иррадиация боли в спину, правое плечо, лопатку, «мойнигановский» ритм боли: голод- боль-прием пищи - облегчение.
По характеру боли могут быть различными от ноющих до режущих и приступообразных, часто выявляется положительный симптом Менделя. Характер АБС зависит от возраста, индивидуальных особенностей больного, состояния его нервной и эндокринной систем, анатомических особенностей язвенного дефекта, степени выраженности функциональных нарушений ЖКТ. У 50% больных детей отсутствует параллелизм между эндоскопической стадией язвенного процесса и его клиническими проявлениями.
При атипичном течении заболевания (чаще в младшем возрасте) не определяется какая-либо закономерность возникновения и трансформации АБС, могут отсутствовать диспепсические жалобы, клиническая картина ЯБ протекает под «маской» болей в груди, холецистита, панкреатита, печёночной или почечной колики.
Согласно последним исследованиям, у 3% детей с впервые выявленной ЯБДК имеет место отсутствие АБС, что расценивается как первично безболевое течение заболевания, а у 27% детей отмечается вторично безболевое течение, когда на фоне повторного обострения язвенного процесса у детей, ранее получивших терапию, АБС отсутствует [12].
Желудочная диспепсия при ЯБ проявляется в виде рвоты, чувства тяжести или давления в подложечной области после еды, отрыжки, тошноты, жжения в эпигастрии и изжоги. В то же время следует отметить, что диспепсические расстройства у детей встречаются реже, чем у взрослых. С увеличением продолжительности заболевания частота симптомов диспепсии возрастает.
У части больных ЯБДК имеет место снижение аппетита, задержка физического развития, а также склонность к запорам или неустойчивый характер стула. Прогрессирование заболевания так же, как и персистирование АБС сопровождается усилением эмоциональной лабильности, нарушением сна, повышенной утомляемостью и другими проявлениями астенического и депрессивного синдромов.
Рецидив ЯБДК проявляется аналогичной клинической картиной, однако самостоятельный АБС выявляется реже, а болезненность при пальпации живота отмечается примерно у 2/3 детей [13].
Наиболее частым, но наименее специфичным симптомом ЯБ является боль в животе. Только у 15-20% детей с болями в животе при обращении к врачам-гастроэнтерологам выявляются эрозивно-язвенные процессы.
Боль при типичном течении ЯБ достаточно интенсивная, локализуются в основном в эпигастральной и параумбиликальной области, возникает регулярно. Боль принимает ночной, «голодный» характер. Боль может быть ранней (возникает после приема пищи в течение 30-60 мин) и поздней (через 2-3 часа после еды). Возможна иррадиация боли в спину, правое плечо, лопатку, «мойнигановский» ритм боли: голод- боль-прием пищи - облегчение.
По характеру боли могут быть различными от ноющих до режущих и приступообразных, часто выявляется положительный симптом Менделя. Характер АБС зависит от возраста, индивидуальных особенностей больного, состояния его нервной и эндокринной систем, анатомических особенностей язвенного дефекта, степени выраженности функциональных нарушений ЖКТ. У 50% больных детей отсутствует параллелизм между эндоскопической стадией язвенного процесса и его клиническими проявлениями.
При атипичном течении заболевания (чаще в младшем возрасте) не определяется какая-либо закономерность возникновения и трансформации АБС, могут отсутствовать диспепсические жалобы, клиническая картина ЯБ протекает под «маской» болей в груди, холецистита, панкреатита, печёночной или почечной колики.
Согласно последним исследованиям, у 3% детей с впервые выявленной ЯБДК имеет место отсутствие АБС, что расценивается как первично безболевое течение заболевания, а у 27% детей отмечается вторично безболевое течение, когда на фоне повторного обострения язвенного процесса у детей, ранее получивших терапию, АБС отсутствует [12].
Желудочная диспепсия при ЯБ проявляется в виде рвоты, чувства тяжести или давления в подложечной области после еды, отрыжки, тошноты, жжения в эпигастрии и изжоги. В то же время следует отметить, что диспепсические расстройства у детей встречаются реже, чем у взрослых. С увеличением продолжительности заболевания частота симптомов диспепсии возрастает.
У части больных ЯБДК имеет место снижение аппетита, задержка физического развития, а также склонность к запорам или неустойчивый характер стула. Прогрессирование заболевания так же, как и персистирование АБС сопровождается усилением эмоциональной лабильности, нарушением сна, повышенной утомляемостью и другими проявлениями астенического и депрессивного синдромов.
Рецидив ЯБДК проявляется аналогичной клинической картиной, однако самостоятельный АБС выявляется реже, а болезненность при пальпации живота отмечается примерно у 2/3 детей [13].
Диагностика
Критерии установления диагноза/состояния.
При постановке диагноза следует обратить внимание на:
• анамнестические данные (характерные жалобы, рефрактерная к терапии железодефицитная анемия, семейный анамнез);
• физикальное обследование (обнаружение болезненности с характерной локализацией, диспепсические расстройства, снижение веса);
Диагноз подтверждается.
Инструментальным обследованием (обнаружение язвенного дефекта при эндоскопическом исследовании желудка и двенадцатиперстной кишки).
Клинические проявления ЯБ многообразны, типичная картина наблюдается не всегда, что значительно затрудняет диагностику. Так, у детей раннего возраста заболевание нередко протекает атипично. При этом, чем моложе ребенок, тем менее специфичны жалобы. В старшем возрасте симптоматика ЯБДПК сходна с таковой у взрослых, хотя может быть и более стертой.
Нередко отсутствует характерный «язвенный» анамнез, что объясняется отчасти тем, что дети быстро забывают боли, не умеют их дифференцировать, не могут указать их локализацию и причину, их вызвавшую. Увеличение числа нетипичных форм заболевания, отсутствие настороженности в формировании язвенного процесса, особенно у детей с отягощенной наследственностью по патологии ВОПТ, способствует росту процента пациентов с поздней диагностикой ЯБ, что приводит к более частому рецидивированию заболевания у этой категории пациентов и раннему формированию его осложнений, приводящих к снижению качества жизни детей с ЯБ.
При пальпации следует обратить внимание на болезненность в пилородуоденальной зоне.
Независимо от локализации язвы у детей очень часто отмечается болезненность в эпигастральной области и в правом подреберье.
В фазе обострения ЯБ следует оценить наличие положительного симптома Менделя (локальная перкуторная болезненность в эпигастральной области) [1, 24, 25].
Комментарии. Симптом мышечной защиты передней брюшной стенки выявляется редко, чаще во время сильных болей.
• Рекомендовано проведение всем пациентам с ЯБ общего (клинического) анализа крови развернутого с целью комплексной диагностики анемии (гемоглобин, гематокрит, эритроциты, тромбоциты) [26].
(УУР С; УДД - 4).
Комментарий. Исследование проводится также в процессе динамического наблюдения - частота определяется клинической ситуацией.
• Пациентам с ЯБ с дефицитом железа/анемией рекомендовано проведение исследования кала на скрытую кровь с целью диагностики скрытого кровотечения [27, 58] (УУР - с ; УДД - 5).
Комментарии. При интерпретации исследования кала на скрытую кровь необходимо учитывать, что положительная реакция может встречаться при многих других заболеваниях, приеме некоторых лекарственных препаратов, употреблении в пищу мяса, зеленых частей растений.
• При рефрактерном течении ЯБ с целью исключения синдрома Золлингера-Эллисона рекомендуется исследование уровня гастрина в сыворотке крови и внутрижелудочное определение концентрации водородных ионов (рН) в желудочном содержимом (тощакового гастрина в сыворотке крови и определение pH в желудочном содержимом) [27].
(УУР С, УДД - 5).
Комментарий. Синдром Золлингера-Эллисона характеризуется резким увеличеним секреции соляной кислоты в результате развития у пациента гастринпродуцирующей опухоли, которая чаще всего локализуется, либо в проксимальной части 12-перстной кишки, либо в поджелудочной железе. В большинстве случаев синдром Золлингера-Эллисона ассоциируется с MEN-1 (синдромом Вермера) [28]. При синдроме Золлингера-Эллисона часто развиваются множественные язвы с локализацией не только в желудке и ДПК, но и в тощей кишке и пищеводе, протекающие с выраженным болевым синдромом и диареей. Обследование таких пациентов выявляет резкое повышение базального уровня желудочной секреции соляной кислоты и увеличение концентрации гастрина в сыворотке крови натощак в 10 раз и более относительно верхней границы нормы. Уровень тощакового гастрина 1000 пг/мл в сочетании с pH в желудке ниже 2 является диагностическим критерием для постановки диагноза [29].
• Всем пациентам с ЯБ для определения показаний к проведению эрадикационной терапии показано обследование на наличие инфицированности H. pylori с помощью 13С-уреазного дыхательного теста и/или определения антигена хеликобактера пилори в фекалиях или Иммунохроматографическое экспресс-исследование кала на геликобактер пилори (Helicobacter pylori), при одновременном проведении в ходе ЭГДС быстрого уреазного теста (БУТ). Для контроля успешности эрадикации через 4-6 недель после окончания лечения рекомендовано применение 13С-уреазного дыхательного теста или определение антигена хеликобактера пилори в фекалиях [11].
(УУР С; УДД - 5).
Комментарии: Чувствительность 13С-уреазного дыхательного теста по данным Кокрейновского обзора и мета-анализа составляет 94% (95% ДИ: 0,89-0,97), а определение антигена H. pylori в кале - 83% (95% ДИ: 0,73-0,90) при фиксированной специфичности в 90% [30].
Следует помнить, что проведение 13С-уреазного дыхательного теста может дать ложноположительный результат у детей младше 6 лет из-за меньшего объема распределения и другой скорости продукции сO2 [31].
При использовании быстрого уреазного теста для диагностики H. pylori во время эндоскопического вмешательства необходимо осуществлять забор не менее 2 биоптатов: 1- из тела и 1 - из антрального отдела желудка [32].
Использование микробиологического (культурального) исследования биоптатов стенки желудка на H. pylori с определением чувствительности к антибактериальным препаратам ( при необходимости и возможности, молекулярно-биологическими методами (ПЦР) и методами флуоресцентной гибридизации) возможно в случае неэффективности эрадикационной терапии первой и второй линии [11]. Также при наличии возможности, следует сделать тесты для определения чувствительности или резистентности к кларитромицину (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) и метронидазолу**. С этой целью при исследовании полученных в ходе ЭГДС биоптатов, могут быть использованы E-test, диско-диффузионный метод, ПЦР в реальном времени, FISH-тест [11, 33].
• Не рекомендуется применение серологических тестов для первичной диагностики H. pylori инфекции и контроля эрадикации у детей в связи с недостаточной информативностью [33, 34].
(УУР С; УДД - 5).
Комментарии. Клиническое применение теста ограничено тем, что он не позволяет дифференцировать факт инфицирования в анамнезе от наличия H.pylori в настоящий момент и контролировать эффективность эрадикации. Не все серологические тесты равноценны.
• У пациентов, которые получают ингибиторы протонного насоса (ИПН) и/или антибактериальные препараты системного действия, рекомендовано приостановить прием ИПН на 2 недели, а антибактериальных препаратов системного действия и препаратов висмута на 4 недели перед тестированием с помощью бактериологического, патолого-анатомического (гистологического) методов, быстрого уреазного теста, 13С-уреазного дыхательного теста или выявления антигена H. pylori в кале [11, 33, 35, 36].
(УУР в; УДД - 2).
• При наличии у пациента язвенного кровотечения для определения инфицированности H.pylori рекомендуется проведение 13С-уреазного дыхательного теста в связи с низкой чувствительностью БУТ и патолого-анатомического (гистологического) исследования биоптатов слизистой оболочки желудка [37, 38].
(УУР А; УДД 1).
Комментарии. На фоне кровотечения чувствительность диагностики H.pylori снижается, поэтому при отрицательном результате теста рекомендуется обследование и лечение инфекции в период ремиссии.
(УУР С; УДД - 5).
Комментарии. ЭГДС позволяет достоверно диагностировать и охарактеризовать язвенный дефект, контролировать его локализацию, форму, размеры, глубину, состояние дна и краев язвы, заживление дефекта, позволяет выявить признаки пенетрации, рубцовой деформации и стенозирования просвета органа, проводить патолого-анатомическую (гистологическую) оценку морфологической структуры слизистой оболочки, исключать злокачественный характер изъязвления.
При локализации язвенного процесса в желудке рекомендуется проведение биопсий из краев язвенного дефекта с последующим патологоанатомическим исследованием биопсийного материала, позволяющим исключить злокачественный характер язвенного поражения.
Контрольное эндоскопическое исследование со взятием биопсии по окончании курса консервативного лечения ЯБЖ проводится пациентам, у которых сохраняются симптомы язвенной болезни или этиологическая причина язвенного процесса остается недостаточно ясной.
Контрольное эндоскопическое исследование со взятием биопсии по окончании курса консервативного лечения ЯБЖ следует проводить при персистировании симптомов для исключения рефрактерной язвы, если этиология язвы не была установлена при первичном обследовании и в том случае, если язва была диагностирована рентгенологически, а лечение было назначено без проведения эндоскопии [41].
При локализации язвенного процесса в ДПК, выполнение биопсии из краев язвенного дефекта не рекомендуется, так как озлокачествление язв ДПК является редким. В то же время, проведение патолого-анатомического (гистологического) исследования обязательно при подозрении на наличие изъязвленных формах нейроэндокринных и субэпителиальных опухолей, прорастание в ДПК опухолей соседних органов.
Контрольное патолого-анатомическое (гистологическое) исследование при ЯБДПК рекомендуется выполнить для исключения рефрактерной язвенной болезни и непептической этиологии язвы, если в процессе лечения сохраняется клиническая симптоматика.
Эндоскопическая картина стадий язвенного поражения приводится в Приложении А3,3.
• Проведение ЭГДС пациентам с язвенным кровотечением с целью верификации источника кровотечения и выполнения эндоскопического гемостаза рекомендуется проводить в течение 24 часов после госпитализации и только после стабилизации гемодинамики (при наличии гемодинамических нарушений) [42] Более раннее проведение ЭГДС показано при отсутствии контроля над кровотечением на фоне консервативной терапии [43, 44].
(УУР. С; УДД - 5).
• В случае невозможности выполнения эндоскопического исследования пациенту с подозрением на ЯБ, с целью подтверждения диагноза рекомендуется проведение рентгенографии желудка и двенадцатиперстной кишки с контрастом (Рентгенография желудка и двенадцатиперстной кишки, с двойным контрастированием) [34, 45].
(УУР С; УДД - 5).
Комментарии. Основным признаком ЯБ при проведении рентгенологического исследования является выявление «ниши» на контуре или на рельефе слизистой оболочки, а косвенными признаками являются - выявление местного циркулярного спазма мышечных волокон на контралатеральной по отношению к язвенному дефекту стенке желудка в виде «указующего перста», конвергенция складок слизистой оболочки к «нише», рубцово-язвенная деформация желудка и луковицы ДПК, гиперсекреция натощак, нарушения гастродуоденальной моторики. В то же время рентгенологическое исследование позволяет оценить выраженность сужения просвета кишки, нарушения моторики и эвакуации из желудка и ДПК.
• Для диагностики осложнений и при подозрении на перфорацию или пенетрацию язвы рекомендуется выполнение ультразвукового исследования брюшной полости комплексного (УЗИ) [48, 49].
(УУР с; УДД - 4).
Комментарии. По данным УЗИ обращается вниманием на наличие пузырьков газа над передней поверхностью печени, что свидетельствует о наличии перфорации. Основным признаком является также наличие свободной жидкости со взвесью в левом поддиафрагмальном пространстве, вокруг селезенки, в полости малого сальника (при перфорации задней стенки желудка) и в малом тазу. При подозрении на наличие перечисленных ультразвуковых признаков показано выполнение компьютерной томографии органов брюшной полости.
Чувствительность и специфичность ультразвуковой диагностики ниже таковых по сравнению с компьютерной томографией и во многом зависит от квалификации специалиста по ультразвуковой диагностике, однако данный метод является неинвазивным, не несет лучевую нагрузку и может применяться повторно [49].
• При подозрении на перфорацию язвы с целью подтверждения диагноза рекомендуется проведение компьютерной томографии органов брюшной полости [46, 47].
(УУР С; УДД - 5).
Комментарии. Компьютерная томография позволяет определить наличие и локализацию перфорационного отверстия, наличие свободного газа в брюшной полости, объем и характер выпота и других патологических изменений.
Язвенную болезнь необходимо дифференцировать с симптоматическими язвами, патогенез которых связан с определёнными фоновыми заболеваниями или конкретными этиологическими факторами. Клиническая картина обострения этих язв стёрта, отсутствует сезонность и периодичность заболевания.
Язвы желудка и 12-перстной кишки могут являться клиническими проявлениями болезни Крона и специфических заболеваний желудочно-кишечного тракта.
Это может быть как при изолированном поражении желудка, так и в сочетании с любыми другими локализациями поражения при болезни Крона.
При постановке диагноза следует обратить внимание на:
• анамнестические данные (характерные жалобы, рефрактерная к терапии железодефицитная анемия, семейный анамнез);
• физикальное обследование (обнаружение болезненности с характерной локализацией, диспепсические расстройства, снижение веса);
Диагноз подтверждается.
Инструментальным обследованием (обнаружение язвенного дефекта при эндоскопическом исследовании желудка и двенадцатиперстной кишки).
2,1 Жалобы и анамнез.
Раздел «Клиническая картина».Клинические проявления ЯБ многообразны, типичная картина наблюдается не всегда, что значительно затрудняет диагностику. Так, у детей раннего возраста заболевание нередко протекает атипично. При этом, чем моложе ребенок, тем менее специфичны жалобы. В старшем возрасте симптоматика ЯБДПК сходна с таковой у взрослых, хотя может быть и более стертой.
Нередко отсутствует характерный «язвенный» анамнез, что объясняется отчасти тем, что дети быстро забывают боли, не умеют их дифференцировать, не могут указать их локализацию и причину, их вызвавшую. Увеличение числа нетипичных форм заболевания, отсутствие настороженности в формировании язвенного процесса, особенно у детей с отягощенной наследственностью по патологии ВОПТ, способствует росту процента пациентов с поздней диагностикой ЯБ, что приводит к более частому рецидивированию заболевания у этой категории пациентов и раннему формированию его осложнений, приводящих к снижению качества жизни детей с ЯБ.
2,2 Физикальное обследование.
При осмотре следует обратить внимание на наличие белого налета на языке.При пальпации следует обратить внимание на болезненность в пилородуоденальной зоне.
Независимо от локализации язвы у детей очень часто отмечается болезненность в эпигастральной области и в правом подреберье.
В фазе обострения ЯБ следует оценить наличие положительного симптома Менделя (локальная перкуторная болезненность в эпигастральной области) [1, 24, 25].
Комментарии. Симптом мышечной защиты передней брюшной стенки выявляется редко, чаще во время сильных болей.
2,3 Лабораторные диагностические исследования.
Патогномоничных для язвенной болезни лабораторных маркеров нет. Лабораторные исследования детям с ЯБ проводятся для исключения/подтверждения осложнений.• Рекомендовано проведение всем пациентам с ЯБ общего (клинического) анализа крови развернутого с целью комплексной диагностики анемии (гемоглобин, гематокрит, эритроциты, тромбоциты) [26].
(УУР С; УДД - 4).
Комментарий. Исследование проводится также в процессе динамического наблюдения - частота определяется клинической ситуацией.
• Пациентам с ЯБ с дефицитом железа/анемией рекомендовано проведение исследования кала на скрытую кровь с целью диагностики скрытого кровотечения [27, 58] (УУР - с ; УДД - 5).
Комментарии. При интерпретации исследования кала на скрытую кровь необходимо учитывать, что положительная реакция может встречаться при многих других заболеваниях, приеме некоторых лекарственных препаратов, употреблении в пищу мяса, зеленых частей растений.
• При рефрактерном течении ЯБ с целью исключения синдрома Золлингера-Эллисона рекомендуется исследование уровня гастрина в сыворотке крови и внутрижелудочное определение концентрации водородных ионов (рН) в желудочном содержимом (тощакового гастрина в сыворотке крови и определение pH в желудочном содержимом) [27].
(УУР С, УДД - 5).
Комментарий. Синдром Золлингера-Эллисона характеризуется резким увеличеним секреции соляной кислоты в результате развития у пациента гастринпродуцирующей опухоли, которая чаще всего локализуется, либо в проксимальной части 12-перстной кишки, либо в поджелудочной железе. В большинстве случаев синдром Золлингера-Эллисона ассоциируется с MEN-1 (синдромом Вермера) [28]. При синдроме Золлингера-Эллисона часто развиваются множественные язвы с локализацией не только в желудке и ДПК, но и в тощей кишке и пищеводе, протекающие с выраженным болевым синдромом и диареей. Обследование таких пациентов выявляет резкое повышение базального уровня желудочной секреции соляной кислоты и увеличение концентрации гастрина в сыворотке крови натощак в 10 раз и более относительно верхней границы нормы. Уровень тощакового гастрина 1000 пг/мл в сочетании с pH в желудке ниже 2 является диагностическим критерием для постановки диагноза [29].
• Всем пациентам с ЯБ для определения показаний к проведению эрадикационной терапии показано обследование на наличие инфицированности H. pylori с помощью 13С-уреазного дыхательного теста и/или определения антигена хеликобактера пилори в фекалиях или Иммунохроматографическое экспресс-исследование кала на геликобактер пилори (Helicobacter pylori), при одновременном проведении в ходе ЭГДС быстрого уреазного теста (БУТ). Для контроля успешности эрадикации через 4-6 недель после окончания лечения рекомендовано применение 13С-уреазного дыхательного теста или определение антигена хеликобактера пилори в фекалиях [11].
(УУР С; УДД - 5).
Комментарии: Чувствительность 13С-уреазного дыхательного теста по данным Кокрейновского обзора и мета-анализа составляет 94% (95% ДИ: 0,89-0,97), а определение антигена H. pylori в кале - 83% (95% ДИ: 0,73-0,90) при фиксированной специфичности в 90% [30].
Следует помнить, что проведение 13С-уреазного дыхательного теста может дать ложноположительный результат у детей младше 6 лет из-за меньшего объема распределения и другой скорости продукции сO2 [31].
При использовании быстрого уреазного теста для диагностики H. pylori во время эндоскопического вмешательства необходимо осуществлять забор не менее 2 биоптатов: 1- из тела и 1 - из антрального отдела желудка [32].
Использование микробиологического (культурального) исследования биоптатов стенки желудка на H. pylori с определением чувствительности к антибактериальным препаратам ( при необходимости и возможности, молекулярно-биологическими методами (ПЦР) и методами флуоресцентной гибридизации) возможно в случае неэффективности эрадикационной терапии первой и второй линии [11]. Также при наличии возможности, следует сделать тесты для определения чувствительности или резистентности к кларитромицину (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) и метронидазолу**. С этой целью при исследовании полученных в ходе ЭГДС биоптатов, могут быть использованы E-test, диско-диффузионный метод, ПЦР в реальном времени, FISH-тест [11, 33].
• Не рекомендуется применение серологических тестов для первичной диагностики H. pylori инфекции и контроля эрадикации у детей в связи с недостаточной информативностью [33, 34].
(УУР С; УДД - 5).
Комментарии. Клиническое применение теста ограничено тем, что он не позволяет дифференцировать факт инфицирования в анамнезе от наличия H.pylori в настоящий момент и контролировать эффективность эрадикации. Не все серологические тесты равноценны.
• У пациентов, которые получают ингибиторы протонного насоса (ИПН) и/или антибактериальные препараты системного действия, рекомендовано приостановить прием ИПН на 2 недели, а антибактериальных препаратов системного действия и препаратов висмута на 4 недели перед тестированием с помощью бактериологического, патолого-анатомического (гистологического) методов, быстрого уреазного теста, 13С-уреазного дыхательного теста или выявления антигена H. pylori в кале [11, 33, 35, 36].
(УУР в; УДД - 2).
• При наличии у пациента язвенного кровотечения для определения инфицированности H.pylori рекомендуется проведение 13С-уреазного дыхательного теста в связи с низкой чувствительностью БУТ и патолого-анатомического (гистологического) исследования биоптатов слизистой оболочки желудка [37, 38].
(УУР А; УДД 1).
Комментарии. На фоне кровотечения чувствительность диагностики H.pylori снижается, поэтому при отрицательном результате теста рекомендуется обследование и лечение инфекции в период ремиссии.
2,4 Инструментальные диагностические исследования.
• Всем пациентам с подозрением на ЯБ, при отсутствии противопоказаний, для подтверждения диагноза рекомендуется проведение эзофагогастродуоденоскопии (ЭГДС) [38, 39, 40].(УУР С; УДД - 5).
Комментарии. ЭГДС позволяет достоверно диагностировать и охарактеризовать язвенный дефект, контролировать его локализацию, форму, размеры, глубину, состояние дна и краев язвы, заживление дефекта, позволяет выявить признаки пенетрации, рубцовой деформации и стенозирования просвета органа, проводить патолого-анатомическую (гистологическую) оценку морфологической структуры слизистой оболочки, исключать злокачественный характер изъязвления.
При локализации язвенного процесса в желудке рекомендуется проведение биопсий из краев язвенного дефекта с последующим патологоанатомическим исследованием биопсийного материала, позволяющим исключить злокачественный характер язвенного поражения.
Контрольное эндоскопическое исследование со взятием биопсии по окончании курса консервативного лечения ЯБЖ проводится пациентам, у которых сохраняются симптомы язвенной болезни или этиологическая причина язвенного процесса остается недостаточно ясной.
Контрольное эндоскопическое исследование со взятием биопсии по окончании курса консервативного лечения ЯБЖ следует проводить при персистировании симптомов для исключения рефрактерной язвы, если этиология язвы не была установлена при первичном обследовании и в том случае, если язва была диагностирована рентгенологически, а лечение было назначено без проведения эндоскопии [41].
При локализации язвенного процесса в ДПК, выполнение биопсии из краев язвенного дефекта не рекомендуется, так как озлокачествление язв ДПК является редким. В то же время, проведение патолого-анатомического (гистологического) исследования обязательно при подозрении на наличие изъязвленных формах нейроэндокринных и субэпителиальных опухолей, прорастание в ДПК опухолей соседних органов.
Контрольное патолого-анатомическое (гистологическое) исследование при ЯБДПК рекомендуется выполнить для исключения рефрактерной язвенной болезни и непептической этиологии язвы, если в процессе лечения сохраняется клиническая симптоматика.
Эндоскопическая картина стадий язвенного поражения приводится в Приложении А3,3.
• Проведение ЭГДС пациентам с язвенным кровотечением с целью верификации источника кровотечения и выполнения эндоскопического гемостаза рекомендуется проводить в течение 24 часов после госпитализации и только после стабилизации гемодинамики (при наличии гемодинамических нарушений) [42] Более раннее проведение ЭГДС показано при отсутствии контроля над кровотечением на фоне консервативной терапии [43, 44].
(УУР. С; УДД - 5).
• В случае невозможности выполнения эндоскопического исследования пациенту с подозрением на ЯБ, с целью подтверждения диагноза рекомендуется проведение рентгенографии желудка и двенадцатиперстной кишки с контрастом (Рентгенография желудка и двенадцатиперстной кишки, с двойным контрастированием) [34, 45].
(УУР С; УДД - 5).
Комментарии. Основным признаком ЯБ при проведении рентгенологического исследования является выявление «ниши» на контуре или на рельефе слизистой оболочки, а косвенными признаками являются - выявление местного циркулярного спазма мышечных волокон на контралатеральной по отношению к язвенному дефекту стенке желудка в виде «указующего перста», конвергенция складок слизистой оболочки к «нише», рубцово-язвенная деформация желудка и луковицы ДПК, гиперсекреция натощак, нарушения гастродуоденальной моторики. В то же время рентгенологическое исследование позволяет оценить выраженность сужения просвета кишки, нарушения моторики и эвакуации из желудка и ДПК.
• Для диагностики осложнений и при подозрении на перфорацию или пенетрацию язвы рекомендуется выполнение ультразвукового исследования брюшной полости комплексного (УЗИ) [48, 49].
(УУР с; УДД - 4).
Комментарии. По данным УЗИ обращается вниманием на наличие пузырьков газа над передней поверхностью печени, что свидетельствует о наличии перфорации. Основным признаком является также наличие свободной жидкости со взвесью в левом поддиафрагмальном пространстве, вокруг селезенки, в полости малого сальника (при перфорации задней стенки желудка) и в малом тазу. При подозрении на наличие перечисленных ультразвуковых признаков показано выполнение компьютерной томографии органов брюшной полости.
Чувствительность и специфичность ультразвуковой диагностики ниже таковых по сравнению с компьютерной томографией и во многом зависит от квалификации специалиста по ультразвуковой диагностике, однако данный метод является неинвазивным, не несет лучевую нагрузку и может применяться повторно [49].
• При подозрении на перфорацию язвы с целью подтверждения диагноза рекомендуется проведение компьютерной томографии органов брюшной полости [46, 47].
(УУР С; УДД - 5).
Комментарии. Компьютерная томография позволяет определить наличие и локализацию перфорационного отверстия, наличие свободного газа в брюшной полости, объем и характер выпота и других патологических изменений.
2,5 Иные диагностические исследования.
2,5,1 Дифференциальная диагностика.
Дифференциальная диагностика язвенной болезни с функциональными нарушениями желудочно-кишечного тракта, хроническим гастродуоденитом, хроническими заболеваниями печени, желчевыводящих путей и поджелудочной железы проводится по данным анамнеза, осмотра, результатов лабораторного, эндоскопического, рентгенологического и ультразвукового исследований.Язвенную болезнь необходимо дифференцировать с симптоматическими язвами, патогенез которых связан с определёнными фоновыми заболеваниями или конкретными этиологическими факторами. Клиническая картина обострения этих язв стёрта, отсутствует сезонность и периодичность заболевания.
Язвы желудка и 12-перстной кишки могут являться клиническими проявлениями болезни Крона и специфических заболеваний желудочно-кишечного тракта.
Это может быть как при изолированном поражении желудка, так и в сочетании с любыми другими локализациями поражения при болезни Крона.
|
|
Лечение
3,1 Консервативное лечение.
3,1,1 Диетотерапия.
• С целью ускорения заживления язв всем пациентам с ЯБ рекомендуется диетотерапия [50, 51, 58].(УУР С; УДД - 5).
Комментарии. Основные принципы диетического питания пациентов с язвенной болезнью включают частое (5-6 раз в сутки), дробного питания, механического термического и химического щажения. Из пищевого рациона необходимо исключить продукты, способные повышать секрецию пищеварительных ферментов и соляной кислоты и/или раздражающие слизистую оболочку: крепкие мясные и рыбные бульоны, жареную и копченую, соленую, маринованную пищу, продукты содержащие экстрактивные вещества (перец, горчица, приправы, специи, лук, чеснок).
Предпочтение необходимо отдавать продуктам, обладающим способностью связывать и нейтрализовать соляную кислоту ( обладающим буферным действием): мясо и рыба (отварные или приготовленные на пару), яйца, молоко и молочные продукты. Разрешаются макаронные изделия, черствый белый хлеб, сухой бисквит и сухое печенье, молочные и вегетарианские супы, овощи (картофель, морковь, кабачки, цветная капуста), каши, кисели из сладких ягод, муссы, желе, сырые тертые и печеные яблоки, некрепкий чай. Предпочтительным способом приготовления пищи является варка, тушение, приготовление на пару.
3,1,2 Медикаментозная терапия.
Схемы терапии см Приложение А3,4.• Всем пациентам с обострением ЯБ с целью заживления язвенного дефекта рекомендуется проведение антисекреторной терапии ингибиторами протонного насоса (ИПН) [52, 53].
(УУР - С; УДД - 5).
Комментарии: Предпочтение при выборе среди препаратов для лечения язвенной болезни желудка и двенадцатиперстной кишки и гастроэзофагеальной рефлюксной болезни (антисекреторных препаратов) группе ИПН в сравнении с блокаторами Н2-гистаминовых рецепторов объясняется более высокой эффективностью первых в устранении клинических симптомов и достижении рубцевания язв по данным рандомизированных сравнительных исследований (включая мета-анализы) [53, 54].
Применяются.
• эзомепразол**(дозировки. Дети весом 15-24 кг по 20 мг х 2 раза в сутки; 25-34 кг - по 30 мг х 2 раза в сут; better 35 кг по 40 мг х 2 раза в сут [ 33] или детям с 4 лет с массой тела <30 кг - 20 мг/сут в 2 приема; с массой тела ≥30 кг - 40 мг/сут (максимальная суточная доза 40 мг) [59]; эзомепразол** в форме пеллет, покрытых кишечнорастворимой оболочкой, и гранул для приготовления суспензии для приема внутрь - при язвенной болезни двенадцатиперстной кишки - разрешен к применению детям с 4 лет согласно инструкции;
• рабепразол (0,5 мг/кг/сут в 2 приема, максимальная суточная доза 20 мга) [59];
• омепразол** (капсулы разрешены к применению для детей с 2-х летнего возраста и массой тела не менее 20 кг; дозировка: дети весом 15-24 кг по 20 мг х 2 раза в сутки; 25-34 кг - по 30 мг х 2 раза в сут; better 35 кг по 40 мг х 2 раза в сут)) [33] или доза 1 мг/кг/сут в 2 приема, максимальная суточная доза 40мг [59];
• лансопразол 1,5 мг/кг/сут в 2 приема (максимальная суточная доза 60мг)[59].
Если язвенная болезнь ассоциирована с инфекцией Helicobacter pylori предпочтение следует отдавать эзомепразолу** и рабепразолу, поскольку эти препараты имеют более высокий синергетический эффект с антибиотиками и в меньшей степени зависят от часто встречающегося в европейской популяции усиливающего метаболизм фенотипа сYP2C19 (быстрые метаболизаторы) [33] Если эзомепразол** и рабепразол не доступны, могут быть назначены омепразол** или лансопразол. Высокие дозы ИПН лучше подавляют кислотопродукцию, увеличивая pH, что повышает эффективность наиболее часто назначаемых амоксициллина** и кларитромицина (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) [60].
• При неосложненной язве луковицы 12-перстной кишки длительность назначения ИПН совпадает с длительностью антибактериальной терапии (14 дней). Для заживления язвенного дефекта нет необходимости в назначении более длительного курса антисекреторной терапии [61]. Более длительное назначение ИПН показано пациентам, у которых после завершения курса лечения инфекции H. pylori сохраняются диспептические симптомы [62].
• При неосложненной язве желудка длительность антисекреторной терапии должна составлять не менее 8 недель (2 недели вместе с антибиотиками и еще 6 недель) [62].
• При осложненной язве луковицы 12-перстной кишки и желудка продолжительность антисекреторной терапии должна составлять 8-12 недель (включая прием ИПН в составе антихеликобактерной терапии) [63].
Схемы терапии см Приложение А3,4.
• Не рекомендовано рутинное назначение блокаторов Н2-гистаминовых рецепторов, данные препараты могут применяться при язвенной болезни, не ассоциированной с H. pylori, при невозможности применения ИПН (или в комбинации с ними) с целью усиления антисекреторного действия [55].
• (УУР С; УДД - 5).
Комментарий. Данные препараты утратили свои позиции и в настоящее время применяются редко.
• Рекомендовано проведение эрадикационной терапии при ЯБ, ассоциированной с H. pylori с лечебной целью [33, 55].
(УУР С; УДД - 5).
Комментарии. Проведение эрадикационной терапии H. pylori у инфицированных пациентов среди взрослого населения снижает риск рецидива ЯБДПК (ОР=0,20;95% ДИ:0,15-0,26) и ЯБЖ (ОР=0,29; 95% ДИ:0,20-0,42) в сравнении с плацебо [57]. У детей подобные исследования не проводились.
При выборе схемы лечения инфекции H. pylori необходимо учитывать следующие факторы: наличие лекарственной аллергии (в частности, к пенициллинам), возраст, наличие/отсутствие данных о чувствительности/резистентности к антибиотикам у пациента, региональные особенности антибиотикорезистентности H. pylori, наличие факторов риска вторичной резистентности H. pylori [11, 33].
Следует выбирать схемы лечения, эффективность которых выше 90% [64, 65].
Продолжительность лечения инфекции H. pylori должна составлять 14 дней [11,33].
Увеличение продолжительности эрадикационной терапии до 14 дней обеспечивает более высокую эффективность в сравнении с применяемой ранее 7-10 дневной терапией.
Наибольшей активностью в отношении инфекции H. pylori у детей обладают амоксициллин**, метронидазол**(дозировка: дети весом 15-24 кг - 250 мг х 2 раза в сут; 25-34 кг - 500 мг утро - 250 мг вечер; >35 кг - по 500 мг х 2 раза в сутки), кларитромицин** (таблетки для детей с12 лети гранулы для приготовления суспензии для приема внутрь**) (дозировка: дети весом 15-24 кг - 250 мг х 2 раза в сутки; 25-34 кг - 500 мг утро- 250 мг вечер (750 мг в сутки),либо 375 мг х 2 раза в сутки если доступна суспензия; >35 кг - по 500 мг х 2 раза в сутки), тетрациклин (детям, начиная с 8-летнего возраста; дозировка: 25-50 мг/кг/сут, разделив на 4 приема (макс. доза 2000 мг)), фуразолидон (<30 кг - по 100 мг 2 раза в день; >30 кг - по 200 мг 2 раза в день или 6-10 мг/кг/сут, разделив на 4 приема) [33, 56].
Среди макролидов наибольшей активностью в отношении к H. pylori обладает кларитромицин** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**), а наименьшей - джозамицин** [66, 67].
• Наибольшее влияние на эффективность лечения инфекции оказывает резистентность H. pylori к кларитромицину** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**), метронидазолу**, а также резистентность к обоим антибиотикам (двойная резистентность) [64].
• По данным метаанализа, включающим данные 11 исследований в 8 городах России, резистентность H. pylori к кларитромицину** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) у взрослых пациентов в Москве, Смоленске, Новосибирске, Казани, Ярославле и Владивостоке составляет менее 15%,, что позволяет в этих городах включать данный антибиотик в схемы первой линии без предварительного тестирования. [68].
• У детей, проживающих в Санкт-Петербурге и Уфе, резистентность H. pylori к кларитромицину** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) превышает пороговые 15% [69], что при включении в схему этого препарата, не позволяет достичь целевой (>90%) эффективности лечения инфекции в этих городах [64].
• Преодолеть устойчивость к кларитромицину** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) не представляется возможным [64].
• Резистеность к метронидазолу** во многих регионах России находится в диапазоне 15,3% - 55,6% [68, 70].
• Устойчивость к метронидазолу** может быть преодолена с помощью назначения высоких доз препарата, включением в схему лечения висмута трикалия дицитрата** и увеличением продолжительности лечения до 14 дней [71, 72].
• Риск вторичной устойчивости к кларитромицину** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) и метронидазолу** существенно повышается в случае приема любых макролидов (эритромицина**, азитромицина**, джозамицина** и кларитромицина** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**)) и/или производные имидазола в анамнезе [73, 74].
• Для выбора оптимальной схемы и снижения риска неудачного лечения инфекции H. pylori следует выяснить принимал ли пациент ранее макролиды и производные имидазола [75].
При наличии возможности, следует сделать тесты для определения чувствительности или резистентности к кларитромицину** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) и метронидазолу**. С этой целью при исследовании полученных в ходе ЭГДС биоптатов, могут быть использованы E-test, диско-диффузионный метод, ПЦР в реальном времени, FISH-тест [33].
При отсутствии технической возможности проведения бактериологического исследования, ПЦР или FISH-теста, выбор схемы лечения должен быть основан на данных о распространенности устойчивых штаммов H. pylori в конкретном регионе [33, 65].
Резистентность к амоксициллину**, тетрациклину, фуразолидону встречается редко, что позволяет включать эти препараты в первую линию терапии, а также повторно их использовать в случае неудачи [76, 77, 78].
• В качестве терапии первой линии согласно рекомендациям V Маастрихтского соглашения (2016 г. ESPGHAN/NASPGHAN (2016 г.), в большинстве случаев, можно без предварительного тестирования использовать стандартную тройную терапию в течение 14 дней: ИПН (эзомепразол**, рабепразол, омепразол** ) + амоксициллин** + кларитромицин** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) или метронидазол** Дозировки препаратов указаны в Приложении А3,4 [11].
• Добавление висмута трикалия дицитрата** (дозировка 8 мг/кг/сут, разделив на 4 приема) к стандартной тройной терапии повышает её эффективность. Схема висмута трикалия дицитрат** + ИПН + амоксициллин** + кларитромицин** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) или метронидазол** так же рекомендуется в качестве терапии первой линии [58].
(УУР С; УДД - 5).
Комментарии. Имеются данные по возможности применения джозамицина** в качестве альтернативы кларитромицину (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**), преимущественно у взрослых пациентов [79, 80], показания к применению при хеликобактерной инфекции у детей включены в инструкцию к препарату. Применение джозамицина** возможно, однако требуется проведение дальнейших исследований для уточнения места данного препарата в схемах антихеликобактерной терапии.
В регионах с высоким уровнем резистентности хеликобактера к кларитромицину** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) используются схемы без макролидов.
• При непереносимости Бета-лактамных антибактериальных препаратов: пенициллинов** в регионах с уровнем резистентности к кларитромицину** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) ниже порогового рекомендовано рассмотреть использование схемы ИПН + кларитромицин** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) + метронидазол** [ 58].
(УУР С; УДД - 5).
Комментарии. Учитывая высокую резистентность к метронидазолу** на территории Российской Федерации данная схема является альтернативной и должна применяться с осторожностью [81].
Возможно применение комбинации ИПН+тетрациклин+метронидазол**, ИПН+кларитромицин (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**)+тетрациклин, ИПН+метронидазол**+фуразолидон, в сочетании с висмута трикалия дицитратом** (Приложение А3,4).
• Как вариант эрадикационной терапии (например, при непереносимости Бета-лактамных антибактериальных препаратов: пенициллинов** и при неэффективности стандартной тройной терапии) может быть назначена классическая четырехкомпонентная терапия на основе висмута трикалия дицитрата** в комбинации с ИПН, тетрациклином (разрешен детям с 8 лет) и метронидазолом** (вторая линия терапии или альтернативный вариант первой линии терапии) [11, 81].
( УРР С УДД 5).
Комментарии. Квадротерапия с висмута трикалия дицитратом** применяется так же, как основная схема терапии второй линии при неэффективности стандартной тройной терапии.
В случае плохой переносимости тетрациклина у детей по рекомендациям российских экспертов как вариант эрадикационной терапии второй линии может быть рассмотрена для использования схема висмута трикалия дицитрат** + ИПН + амоксициллин** + нифурател (30 мг/кг/сут)[82,83, 84].
По данным немногочисленных исследований у взрослых и детей эффективность 3х-компонентных 10-14-дневных схем, включавших нифурател в комбинации с амоксициллином**, ИПН или висмута трикалия дицитратом** составляет 82,9-86,0% (ITT) [84, 85, 86]. Учитывая небольшое количество пациентов, включенных в исследования, недостатки дизайна (отсутствие определения чувствительности H. pylori, контроль эффективности терапии одним тестом (а не двумя), а также показатель эффективности менее пороговых 90%, необходимо проведение более масштабных хорошо спланированных исследований для определения места нифуратела в лечении инфекции H. pylori [77].
Фуразолидон является недорогим и высоко эффективным в отношении H. pylori препаратом, к которому, практически не встречается ни первичная, ни вторичная резистентность [78]. фуразолидон может быть включен в 4х-компонентные схемы вместо кларитромицина** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) и тетрациклина в качестве терапии второй линии [87]. Эффективность 14-дневной 4х-компонентной схемы лечения, включающей фуразолидон (ИПН + висмута трикалия дицитрат**+ амоксициллин** + фуразолидон) составляет 90-99%, в том числе у пациентов с резистентностью штаммов H. pylori к метронидазолу** и кларитромицину** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) [78]. Ограничивают широкое применение фуразолидона частые побочные эффекты (тошнота, рвота ) [88, 89].
• При неэффективности эрадикационной терапии рекомендовано проводить индивидуальный подбор препарата на основе чувствительности H.pylori к антибактериальным препаратам. Терапия третьей линии [55].
(УУР. С; УДД -5).
Комментарии. Неудачное лечение может быть связано с несоблюдением режима приема препаратов и развитием побочных эффектов [75]. Частота нежелательных эффектов эрадикационной терапии по результатам систематического обзора 43 исследований (6093 взрослых пациента) - 60%: диарея - 8%, изменение вкуса - 7%, тошнота и рвота - 5%, боль в эпигастрии - 5%, головная боль - 3%, стоматит - 2,5%, крапивница - 2% [57].
В ряде работ показана более высокая эффективность и безопасность антихеликобактерной терапии на фоне пребиотической или пробиотической терапии [90, 91]. Это, вероятно, связано со снижением частоты и выраженности побочных эффектов антибиотиков (диарея, тошнота, рвота, диспепсия, дисфагия) на фоне назначении Lactobacillus rhamnosus и Saccharomyces boulardii (p<0,05) [11, 92, 93, 94]. Опубликован ряд мета-анализов по данной теме [98, 99, 100, 101, 102].
Контроль эффективности эрадикации определяется не ранее чем через 4-6 нед. после окончания лечения антибактериальными препаратами системного действия и через 2 недели после окончания приема ИПН [33].
• Для оценки эффективности антихеликобактерной терапии у детей с ЯБ рекомендовано применять следующие неинвазивные тесты: 13С-уреазный дыхательный тест или определение антигенов Хеликобактер пилори в фекалиях (2х-этапный тест) [33].
(УУР С; УДД - 5).
• Не рекомендуется в большинстве случаев проведение эндоскопического контроля заживления язвенного дефекта у детей. Контрольная ЭГДС рекомендована в следующих ситуациях: персистирование симптомов после отмены ИПН (исключение рефрактерной язвы), осложненное течение язвы, неизвестна этиология язвы, язва была диагностирована рентгенологически (ЭГДС не проводили), есть подозрение на злокачественную природу язвы (чаще у взрослых) [34].
(УУР С; УДД - 5).
• В случае неэффективности терапии первой линии, при наличии возможности, рекомендуется повторить ЭГДС и биопсию с целью определения чувствительности H. pylori к антибиотикам. Если проведение тестов для определения чувствительности/резистентности H. pylori к антибиотикам не возможно, то при назначении терапии второй линии рекомендуется исходить из предположения о наличии у пациента устойчивости к макролидам и метронидазолу** и отдавать предпочтение 14-дневным 4х-компонентным схемам на основе висмута трикалия дицитрата**, высоких доз ИПН, высоких доз амоксициллина** и метронидазола**, тетрациклина и фуразолидона [26, 78, 87].
(УУР С; УДД - 5).
Комментарий. После неудачной терапии инфекции H. pylori вторичная резистентность для кларитромицина (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) составляет 15-67%, а для метронидазола** - 30-65% [76].
Для детей старше 8 лет наиболее эффективными схемами лечения являются:
• Висмута трикалия дицитрат + ИПН + Метронидазол** + Тетрациклин.
• Висмута трикалия дицитрат + ИПН + Амоксициллин** + Метронидазол**.
Детям младше 8 лет могут быть назначены следующие схемы лечения:
• Висмута трикалия дицитрат + ИПН + Амоксициллин** + Метронидазол**.
• Висмута трикалия дицитрат + ИПН + Амоксициллин** + Фуразолидон1.
• Висмут а трикалия дицитрат + ИПН + Метронидазол** + Фуразолидон1.
1 - комбинация с Фуразолидоном - наименее желательный вариант в связи с не очень хорошей переносимостью данного препарата.
Дозировки препаратов см Приложение А3,4 «Схемы лечения инфекции H.pyloriи рекомендуемые дозы препаратов для антихеликобактерной терапии».
• В лечении НПВП-индуцированных язв рекомендовано применять ИПН в стандартных дозах. Если НПВП отменены, то продолжительность антисекреторной терапии составляет 4-8 недель. Если пациент вынужден длительно принимать нестероидные противовоспалительные препараты, то рекомендуется продолжить прием ИПН в течение всего курса НПВП [55].
(УУР с; УДД - 5).
• В лечении язв, не ассоциированных ни с H. pylori, ни с НПВП рекомендовано применять стандартные дозы ИПН [95]. Через 4-8 недель после начала антисекреторной терапии следует сделать повторную ЭГДС и еще раз проанализировать возможные причины ульцерогенеза (не выявленная инфекция H. pylori, прием ульцерогенных препаратов, мастоцитоз, болезнь Крона, эозинофильный гастрооэнтерит, васкулит, синдром Золлингера-Эллисона, цирроз, хроническая почечная недостаточность, диабет 1 типа, вирусные и грибковые инфекции у иммунокопрометированных пациентов). Если гастродуоденальные язвы являются вторичными или не удается выявить причину ульцерогенеза, то рекомендуется длительная антисекреторная терапия [96].
(УУР с; УДД - 5).
• С целью остановки кровотечения всем пациентам с лабораторно и эндоскопически подтвержденным язвенным кровотечением рекомендуется внутривенное введение ИПН (например, омепразол**, эзомепразол**, рабепразол - в дозе 1-3 мг/кг в течение 1 часа) [103, 104, 105] (УУР С; УДД - 5).
Комментарии. Внутривенное введение ИПН способствует значительному снижению риска повторных кровотечений (ОШ 2,24, 95% ДИ - 1,02-4,90). Доза ИПН, вводимая внутривенно болюсно аналогична таковой, рекомендуемой для перорального приема. Эрадикационная терапия проводится при переходе на пероральный прием препаратов.
3,2 Хирургическое лечение.
• Рекомендовано. Проведение хирургического лечения язвенной болезни желудка при наличии осложнения болезни: перфорация язвы, декомпенсированный рубцово-язвенный стеноз привратника, сопровождающийся выраженными эвакуаторными нарушениями; профузные желудочно-кишечные кровотечения, которые не удается остановить консервативными методами, в том числе и с применением эндоскопического гемостаза [104, 106, 107, 108] (УУР в; УДД - 3).Комментарии. Пациентам с осложненным течение ЯБ необходима госпитализация в хирургический стационар в экстренном порядке. При выборе метода хирургического лечения предпочтение отдают органосохраняющим операциям.
Эндоскопическая остановка кровотечения является «золотым стандартом» в лечении пациентов с язвенным кровотечением, позволяющим достичь устойчивого гемостаза в 82-92% случаев. Наиболее эффективным эндоскопическим способом остановки кровотечения является клипирование кроветочащего сосуда и аргоно-плазменная коагуляция. Другие методы эндоскопической остановки кровотечения, такие как нанесение Препаратов для лечения язвенной болезни желудка и двенадцатиперстной кишки и гастроэзофагеальной рефлюксной болезни- пленкообразующих препаратов, использование полисахаридной гемостатической системы, электрокоагуляция, обкалывание язвы должны использоваться в комбинации с основными методами.
Случаи язвенных кровотечений у детей встречаются редко. По данным, основанным на взрослой популяции, факторами риска рецидива язвенного кровотечения являются:
- размер язвы более 1.
- расположение язвы на малой кривизне желудка;
- расположение язвы на задней стенке ДПК;
- нестабильная гемодинамика (снижение артериального давления во время кровотечения с последующим повышением на фоне восполнения объема циркулирующей крови [109].
• При неэффективности эндоскопического гемостаза, развитии перфорации, пенетрации язвы необходимо проведение экстренной операции [ 110].
(УУР С; УДД - 5).
|
|
Реабилитация и амбулаторное лечение
В настоящее время убедительных доказательств того, что санаторно-курортное лечение, а также лечебная физкультура, улучшает прогноз или влияет на исходы нет,.
Для окончательного вывода о необходимости данного лечения необходимо проведение более качественных исследований.
• санаторно-курортное лечение рекомендуется рассмотреть после купирования обострения язвенного процесса, обычно через 2-3 месяца после обострения [111].
(УУР. С ; УДД - 5).
Комментарии. Продолжительность санаторно-курортного лечения - 14-21 день. В ранний период реабилитации предпочтение следует отдавать местным санаториям. Направление на курортное лечение в санатории, удаленные от места проживания возможно при формировании стойкой клинической ремиссии.
• Рекомендовано рассмотреть проведение лечебной физкультуры (ЛФК) (Лечебная физкультура при заболеваниях пищевода, желудка, двенадцатиперстной кишки) для улучшения крово- и лимфообращения в брюшной полости; нормализации моторики желудка и двенадцатиперстной кишки, секреторной и нейрогуморальной регуляции пищеварительных процессов; создания благоприятных условий для репаративных процессов в слизистой оболочке желудка и двенадцатиперстной кишки при отсутствии противопоказаний [111, 112, 113].
(УУР С; УДД - 5).
Для окончательного вывода о необходимости данного лечения необходимо проведение более качественных исследований.
• санаторно-курортное лечение рекомендуется рассмотреть после купирования обострения язвенного процесса, обычно через 2-3 месяца после обострения [111].
(УУР. С ; УДД - 5).
Комментарии. Продолжительность санаторно-курортного лечения - 14-21 день. В ранний период реабилитации предпочтение следует отдавать местным санаториям. Направление на курортное лечение в санатории, удаленные от места проживания возможно при формировании стойкой клинической ремиссии.
• Рекомендовано рассмотреть проведение лечебной физкультуры (ЛФК) (Лечебная физкультура при заболеваниях пищевода, желудка, двенадцатиперстной кишки) для улучшения крово- и лимфообращения в брюшной полости; нормализации моторики желудка и двенадцатиперстной кишки, секреторной и нейрогуморальной регуляции пищеварительных процессов; создания благоприятных условий для репаративных процессов в слизистой оболочке желудка и двенадцатиперстной кишки при отсутствии противопоказаний [111, 112, 113].
(УУР С; УДД - 5).
Профилактика
5,1 Профилактика.
• С целью профилактики обострения ЯБ всем пациентам с диагностированной хеликобактерной инфекцией рекомендуется проведение эрадикации H.pylori [11, 33, 114] (УУР С; УДД - 5).Комментарии. Признание ведущей роли H. pylori в развитии и прогрессировании ЯБ делает эрадикацию основным методом профилактики данного заболевания.
5,2 Диспансерное наблюдение.
• Рекомендуется. Проводить диспансерное наблюдение всех пациентов с ЯБ с целью профилактики обострений заболевания и своевременной терапии, снятие с диспансерного учета возможно при полной ремиссии в течение 5 лет от начала заболевания или обострения [24, 115, 116] (УУР - С; УДД - 5).Комментарий. Диспансерному учету подлежат даже пациенты с отсутствием морфологического субстрата язвы (клинико-эндоскопическая ремиссия).
Проводятся консультации врача-гастроэнтеролога, врача-педиатра или врача общей практики (семейного врача), в среднем, 1 раз в год, при необходимости - проводится обследование в соответствии с рекомендациями ( см раздел «Диагностика»).
Организация оказания медицинской помощи
Медицинская помощь детям с ЯБ может оказываться амбулаторно, в дневном стационаре, стационарно.
Виды медицинской помощи: плановая, неотложная, экстренная.
Дети с впервые выявленной ЯБ в фазе обострения должны пройти обследование и лечение в условиях отделений гастроэнтерологического или педиатрического профиля, при неосложненных язвах - амбулаторно, при наличии выявленных хирургических осложнений - в отделениях хирургического профиля [13].
Комментарии. Длительность пребывания в стационаре определяется индивидуально. Стационарное лечение пациентов с ЯБ в фазе ремиссии, как правило, нецелесообразно.
Дети с неосложнённым течением язвенной болезни подлежат консервативному лечению в амбулаторно-поликлинических условиях.
Дети в стадии ремиссии наблюдаются в амбулаторных условиях.
Детей с язвенной болезнью наблюдает врач-гастроэнтеролог или врач-педиатр, при необходимости осуществляется консультация/лечение врачом-детским хирургом.
Показания для стационарного лечения:
• ЯБ вне зависимости от фазы заболевания при наличии выраженных клинических проявлений обострения (выраженный болевой абдоминальный синдром, диспепсические жалобы); Осложненное и/или рецидивирующее течение ЯБ;
• Сочетание ЯБ с соматической патологией, в том числе желудочно-кишечного тракта;
• Необходимость проведения дифференциальной диагностики с доброкачественными и злокачественными новообразованиями.
Виды медицинской помощи: плановая, неотложная, экстренная.
Дети с впервые выявленной ЯБ в фазе обострения должны пройти обследование и лечение в условиях отделений гастроэнтерологического или педиатрического профиля, при неосложненных язвах - амбулаторно, при наличии выявленных хирургических осложнений - в отделениях хирургического профиля [13].
Комментарии. Длительность пребывания в стационаре определяется индивидуально. Стационарное лечение пациентов с ЯБ в фазе ремиссии, как правило, нецелесообразно.
Дети с неосложнённым течением язвенной болезни подлежат консервативному лечению в амбулаторно-поликлинических условиях.
Дети в стадии ремиссии наблюдаются в амбулаторных условиях.
Детей с язвенной болезнью наблюдает врач-гастроэнтеролог или врач-педиатр, при необходимости осуществляется консультация/лечение врачом-детским хирургом.
Показания для стационарного лечения:
• ЯБ вне зависимости от фазы заболевания при наличии выраженных клинических проявлений обострения (выраженный болевой абдоминальный синдром, диспепсические жалобы); Осложненное и/или рецидивирующее течение ЯБ;
• Сочетание ЯБ с соматической патологией, в том числе желудочно-кишечного тракта;
• Необходимость проведения дифференциальной диагностики с доброкачественными и злокачественными новообразованиями.
Дополнительно
7,1 Исходы и прогноз.
Прогноз благоприятный при неосложнённой язвенной болезни. У большинства детей уже первый курс лечения в стационаре приводит к полному заживлению язвы и выздоровлению. В случае успешной эрадикации рецидивы язвенной болезни возникают у 6-7% пациентов. Прогноз ухудшается при большой давности заболевания в сочетании с частыми, длительными рецидивами, при осложнённых формах язвенной болезни.7,2 Осложнения.
Осложнения ЯБ в детском возрасте отмечаются у 7-10% пациентов. У мальчиков осложнения отмечаются чаще, чем у девочек в случае ЯБ ДПК (при изолированной ЯБДПК - в 2,3 раза, при сочетании ЯБ желудка и ДПК - в 8 раз). Удельный вес осложненных форм ЯБ наблюдается у детей всех возрастных групп с одинаковой частотой. В структуре осложнений преобладают кровотечения (80%), реже наблюдаются стенозы (11%), перфорации (8%) и пенетрации язвы (1,5%) [25, 116].Кровотечение характеризуется кровью в рвотных массах (алая или рвота кофейной гущей ), черным дегтеобразным стулом. При большой кровопотере характерны слабость, тошнота, бледность, тахикардия, снижение АД, иногда обморок. При скрытом кровотечении в кале определяется положительная реакция на скрытую кровь.
Стеноз пилоробульбарной зоны развивается обычно в процессе заживления язвы. В результате задержки пищи в желудке происходит его расширение с последующим развитием интоксикации, истощения. Клинически это проявляется рвотой пищей, съеденной накануне, усилением перистальтики желудка, особенно при пальпации и «шумом плеска», определяемого при толчкообразной пальпации брюшной стенки.
Пенетрация (проникновение язвы в соседние органы) возникает обычно на фоне длительного и тяжелого течения заболевания, неадекватной терапии. Сопровождается усилением болевого синдрома с иррадиацией в спину. Наблюдается рвота, не приносящая облегчения, возможна лихорадка.
Перфорация язвы в 2 раза чаще встречается при желудочной локализации язвы. Основной клинический признак перфорации - резкая внезапная («кинжальная») боль в эпигастральной области и в правом подреберье, часто сопровождающаяся шоковым состоянием. Отмечается слабый пульс, резкая болезненность в пилородуоденальной зоне, исчезновение печеночной тупости вследствие выхода воздуха в свободную брюшную полость. Наблюдается тошнота, рвота, задержка стула [25, 116].
Критерии оценки качества медицинской помощи
Таблица 1. Критерии качества специализированной медицинской помощи детям при ЯБ.
| № п/п | Критерии качества | Уровень достоверности доказательсв | Уровень убедительности рекомендаций |
| Проведена ЭГДС всем пациентам с подозрением на язвенную болезнь (при отсутствии противопоказаний) | С | 5 | |
| Выполнено определение инфицированности H. pylori при первичной диагностике - 13С-уреазный дыхательный тест или быстрый уреазный тест, или определение антигена H. pylori в фекалиях (Иммунохроматографическое экспресс-исследование кала на геликобактер пилори (Helicobacter pylori) или (при одновременном проведении ЭГДС) - с помощью быстрого уреазного теста (БУТ) и/или патолого-анатомическое (гистологическое) исследование биоптатов слизистой оболочки желудка | В | 2 | |
| Проведена эрадикационная терапия (при выявлении Helicobacter pylori) | В | 2 | |
| Выполнено лечение лекарственными препаратами группы ингибиторов протонного насоса (при отсутствии медицинских противопоказаний) | В | 2 |
|
|
Список литературы
• Shay H., Sun D.C.H. Etiology and pathology of gastric and duodenal ulcer. In: вockus H.L. Gastroenterology, Philadelphia-London: Saunders Elsevier, 1968: 420-465.
• Guariso G., Gasparetto M. Update on Peptic Ulcers in the Pediatric Age. Hindawi Publishing сorporation. Ulcers, 2012. Article ID 896509, 9 pages. doi:10,1155/2012/896509.
• Детская гастроэнтерология: руководство для врачей / под ред. проф. Н.П. Шабалова. 3-е изд., перераб. и доп. М. МЕДпресс-информ, 2019. 792 с.: ил.
• Shaymardanova E.K, Nurgalieva A.K, Khidiyativa I. M et al. Role of Allelic Genes of Matrix Metalloproteinases and Their Tissue Inhibitors in the Peptic Ulcer Disease Development. Genetika, 2016, 52 (3): 364-75.
• Yin Y.W., Hu p.m, Sun Q.Q. et al Association between interleukin-8 gene - 251T/A polymorphism and the risk of peptic ulcer disease: a meta-analysis. Hum Immunol, 2013, 74(1):125-30. doi:10,1016/j. humimm.2012,09,006.
• Trejo-de la O.A., Torres J., Sanchez-Zauco N. et al. Polimorphisms in TLR9 but not in TLR5 increase the risk for duodenal ulcer and after cytokine expression in the gastric mucosa. Innate Immun, 2015, 21(7): 706-13. doi:10,1177/1753425915587130.
• Macartur с., Saunders N., Feldman W. Helicobacter pylori, gastroduodenal disease and recurrent abdominal pain in children. JAMA. 1995; vol. 273: 729-734.
• Rothenbacher D., Inceoglu J., вode G. et al. Acquisition of Helicobacter pylori infection in a high-risk population occurs within the first 2 years of life. J Pediatr 2000; 136: 744-9.
• Iwańczak в., Francavailla R. Helicobacter pylori Infection in Pediatrics. Helicobacter 2014; 19 (s1):46-51. doi: 10,1111/hel.12158.
• Suerbaum S., Michetti P. Helicobacter pylori infection. N. Engl. J. Med. 2002; 347: 1175-86.
• Malfertheiner P., Megraud F., O’Morain с.A. et al. Management of Helicobacter pylori infection - the Maastricht V/Florence сonsensus Report. Gut 2017; 66(1): 6-30.
• Гуреев А.Н. Роль факторов иммунитета в развитии язвенной болезни двенадцатиперстной кишки у детей. Автореф. дисс. … канд. мед. наук., М.:2007. 25 с.
• Цветкова Л.Н. Язвенная болезнь у детей (алгоритм диагностики и лечебной тактики). ГОУ ВПО РГМУ Росздрава, 2009. 46 с.
• Герман С.В. Распространенность инфекции H. pylori среди населения Москвы. С.В. Герман, И.Е. Зыкова, А.В. Модестова [] // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2010. Т. 20, № 2. С. 25-30.
• Захарова Н.В. Распространенность хеликобактерной инфекции у пациентов гастроэнтерологического профиля в Санкт-Петербурге / Н.В. Захарова, В.И. Симаненков, О.А. Саблин [] // Фарматека. 2016. 5, Вып. 16. С. 33-39.
• Ивашкин В.Т. Лечение инфекции Helicobacter pylori: Мейнстрим и новации / В.Т. Ивашкин, И.В. Маев, Т.Л. Лапина [] // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2017. Т. 27, № 4. С. 4-21.
• Курилович С.А. Эпидемиология заболеваний органов пишеварения в Западной Сибири / С.А. Курилович, О.В. Решетников // Педиатрия. 2002. 2. С. 65-71.
• Щербаков П.Л. Эпидемиология инфекции Helicobacter pylori / П.Л. Щербаков // В кн. Ивашкин В.Т., Мегро Ф., Лапина Т.Л., ред. Helicobacter pylori: революция в гастроэнтерологии. М. Триада-X, 1999. С. 14-20.
• Koletzko S., Richy F., вontems P. et al. Prospective multicenter study on antibiotic resistance of Helicobacter pylori strains obtained from children living in Europe. Gut. 2006; 55 (12): 1711-1716.
• Корниенко Е.А., Шабалов Н.П., Эрман Л.В. Заболевания органов пищеварения / в кн. Детские болезни: в 2 т. 8-е изд. СПб. Питер, 2017. Т.1. - с. 585-796.
• Munoz Abraham A.S., Osey H., Martino A., et al. Incidence and Outcomes of Perforated Peptic Ulcers in сhildren: Analysis of the Kid s Inpatient Database and Report of Two сases Treated by Laparoscopic Omental Patch Repair. Journal of Laparoendoscopic & Advanced Surgical Techniques. 2018. Vol.00. - p. 248-255. doi: 10,1089/lap.2018,0186.
• Мельникова И.Ю., Новикова В.П. Язвенная болезнь желудка и двенадцатиперстной кишки. / в кн. Детская гастроэнтерология: практическое руководство / под ред. И.Ю. Мельниковой. М. ГЭОТАР-Медиа, 2018. - с.221-233.
• Цветкова Л.Н., Филин В.А., Нечаева Л.В., Горячева О.А., Гуреев А.Н. Язвенная болезнь у детей: особенности течения и выбора медикаментозной терапии на современном этапе // Рос вестн перинатол и педиат. 2008. №5.
• Авдеева Т.Г., Рябухин Ю.В., Парменова Л.П. Детская гастроэнтерология. ГЭОТАР-Москва, 2009, С. 32-61.
• Гастроэнтерология детского возраста (под редакцией С.В. Бельмера и А.И. Хавкина) - Москва: ИД Медпрактика-М, 2011.-420 с.
• Tomizawa M., Shinozaki F., Hasegawa R.et al. Low haemoglobin levels are associated with upper gastrointestinal bleeding. вiomed Rep 2016; vol.5 (3): 349-352.
• Romano с, Oliva S, Martellossi S, Miele E, Arrigo S, Graziani MG, сardile S, Gaiani F, de Angelis GL, Torroni F. Pediatric gastrointestinal bleeding: Perspectives from the Italian Society of Pediatric Gastroenterology. World J Gastroenterol. 2017 Feb 28;23(8):1328-1337 Kim Н. Diagnostic and treatment approaches for refractory ulcers. сlin Endoscop 2015; vol.48 (4): 285-290.
• Zhuang Z, Vortmeyer AO, Pack S, et al. Somatic mutations of the MEN1 tumor suppressor gene in sporadic gastrinomas and insulinomas. сancer Res. 1997 Nov 1;57(21):4682-6. PMID: 9354421.
• вerna MJ, Hoffmann KM, Serrano J, et al. Serum gastrin in Zollinger-Ellison syndrome: I. Prospective study of fasting serum gastrin in 309 patients from the National Institutes of Health and comparison with 2229 cases from the literature. Medicine (Baltimore). 2006 Nov;85(6):295-330. doi: 10,1097/01.md.0000236956,74128,76. PMID: 17108778.
• вest L.M., Takwoingi Y., Siddique S. et al. Non-invasive diagnostic tests for Helicobacter pylori infection. сochrane Database Syst Rev 2018; vol. 3: сD012080.
• Leal Y.A., Flores L.L., Fuentes Panana E.M., сedillo Rivera R., Torres J. 13C-urea breath test for the diagnosis of Helicobacter pylori infection in children: a systematic review and metaanalysis. Helicobacter. 2011;16:327-337.
• Moon SW, Moon SW, Kim TH, et al. United rapid urease test is superior than separate test in detecting Helicobacter pylori at the gastric antrum and body specimens. сlin Endosc 2012;45:392-6.
• Jones NL, Koletzko S, Goodman K, вontems P, сadranel S, сasswall T, сzinn S, Gold вD, Guarner J, Elitsur Y, Homan M, Kalach N, Kori M, Madrazo A, Megraud F, Papadopoulou A, Rowland M; ESPGHAN, NASPGHAN. Joint ESPGHAN/NASPGHAN Guidelines for the Management of Helicobacter pylori in сhildren and Adolescents (Update 2016). J Pediatr Gastroenterol Nutr. 2017 Jun;64(6):991-1003.
• вak-Romaniszyn L, Wojtuń S, Gil J, Płaneta-Małecka I. сhoroba wrzodowa--etiopatogeneza, rozpoznawanie i leczenie [Peptic ulcer disease etiology, diagnosis and treatment]. Pol Merkur Lekarski. 2004;17 Suppl 1:128-32.
• сalvet X. Diagnosis of Helicobacter pylori infection in the proton pump inhibitor era. Gastroenterol сlin N Am. 2015;44:507-518.
• Peng с., Hu Y., Ge Z-M., Zou Q-M., Lyu N-H. Diagnosis and treatment of Helicobacter pylori infections in children and elderly populations. сhronic Diseases and Translational Medicine. 2019; 5: 243-251 https://doi.org/10,1016/j.cdtm.2019,12,003.
• Gisbert, J.P., Abraira V., Accuracy of Helicobacter pylori diagnostic tests in patients with bleeding peptic ulcer: a systematic review and meta-analysis. Am J Gastroenterol 2006; vol.101(4): 848-863.
• Tam PK, Saing H, Lau JT. Diagnosis of peptic ulcer in children: the past and present. J Pediatr Surg. 1986 Jan;21(1):15-6.
• ASGE Standards of Practice сommittee, Lightdale JR, Acosta R, Shergill AK, сhandrasekhara V, сhathadi K, Early D, Evans JA, Fanelli RD, Fisher DA, Fonkalsrud L, Hwang JH, Kashab M, Muthusamy VR, Pasha S, Saltzman JR, сash вD; American Society for Gastrointestinal Endoscopy. Modifications in endoscopic practice for pediatric patients. Gastrointest Endosc. 2014 May;79(5):699-710.
• Суринов В.А. Диагностические критерии язвенной болезни у детей // Пермский медицинский журнал. 2010. №5. URL: https://cyberleninka.ru/article/n/diagnosticheskie-kriterii-yazvennoy-bolezni-u-detey (дата обращения: 28,06,2021).
• ASGE Standards of Practice сommittee, вanerjee S, сash вD, Dominitz JA, вaron TH, Anderson MA, вen-Menachem T, Fisher L, Fukami N, Harrison ME, Ikenberry SO, Khan K, Krinsky ML, Maple J, Fanelli RD, Strohmeyer L. The role of endoscopy in the management of patients with peptic ulcer disease. Gastrointest Endosc. 2010 Apr;71(4):663-8. doi: 10,1016/j.gie.2009,11,026. PMID: 20363407.
• Gralnek IM, Stanley AJ, Morris AJ, et al. Endoscopic diagnosis and management of nonvariceal upper gastrointestinal hemorrhage (NVUGIH): European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2021. Endoscopy. 2021 Mar;53(3):300-332. doi: 10,1055/a-1369-5274. Epub 2021 Feb 10. PMID: 33567467.
• Thomson M, вelsha D. Endoscopic management of acute gastrointestinal bleeding in children: Time for a radical rethink. J Pediatr Surg. 2016 Feb;51(2):206-10.
• Fox VL. Gastrointestinal bleeding in infancy and childhood. Gastroenterol сlin North Am. 2000 Mar;29(1):37-66, v.
• И.Н. Захарова, И.М. Османов, М.И. Пыков Инструментальная диагностика функциональных нарушений желудочно-кишечного тракта в практике педиатра и детского гастроэнтеролога. Педиатрия (Прил. к журн. сonsilium Medicum). 2018; 1: 79-89.
• Ishiguro T., Kumagai Y., вaba H. et al. Predicting the amount of intraperitoneal fluid accumulation by computed tomography and its clinical use in patients with perforated peptic ulcer. Int Surg.2014; vol. 99(6): 824-829.
• вaghdanian A.H., вaghdanian A.A., Puppala A.A. et al. Imaging manifestations of peptic ulcer disease on computed tomography. Semin Ultrasound сT MR 2018; vol. 39(2): 183-192.
• сoppolino F., Gatta G., Di Grezia G. et al. Gastrointestinal perforation: ultrasonographic diagnosis. сrit Ultrasound J. 2013; vol. 5 (Suppl 1): S4.
• Picone D., Rusignuolo R., Midiri F. et al. Imaging assessment of gastroduodenal perforations. Semin Ultrasound сT MR 2016; vol.37(1), № 1: 16-22.
• Vomero M.D., сolpo E. Nutritional care in peptic ulcer. Arq вras сir Dig 2014; vol. 7 (4): 298-302.
• Н.Н. Семенова, Т.Э. Боровик, Л.И. Дмитриенко Лечебное питание детей при заболеваниях желудка и двенадцатиперстной кишки. Медицинский совет. 2007; 3:64-70.
• сhan F.K.L., Lau J.Y.W. Peptic ulcer disease. In: Sleisenger and Fordtran’s Gastrointestinal and Liver Disease. 10th ed. Philadelphia: Saunders Elsevier; 2015: chap 14.
• Scally в., Emberson J.R., Spata E., et al. Effects of gastroprotectant drugs for the prevention and treatment of peptic ulcer disease and its complications: a meta-analysis of randomized trials //Lancet Gastroenterol Hepatol 2018; vol. 3(4): 231-241.
• Hu Z.H., Shi p.m, Hu D.M., вao J.J. Efficacy of proton pump inhibitors for patients with duodenal ulcers: A pairwise and network meta-analysis of randomized controlled trial. Saudi J Gastroenterol 2017; vol. 23(1): 11-19.
Ва З. Принципы лечения при язвенной болезни желудка у детей // Здоровье и образование в XXI веке. 2019. №9.
• Бельмер С.В., Хавкин А.И. Гастроэнтерология детского возраста. Практическое руководства по детским болезням. Под ред. В.Ф. Коколиной, А.Г. Румянцева М: Медпрактика-М 2003; 2: 121-149.
• П.Л. Щербаков, А.С. Потапов, Е.С. Дублина, М.Ю. Щербакова, Г.А. Самсыгина, С.И. Эрдес, А.И. Логвинова, Л.В. Кудрявцева. Схема эрадикации штаммов Helicobacter pylori, резистентных к метронидазолу у детей. Вопросы современной педиатрии. 2007. Том 6. №5.
• Ford A., Gurusamy K.S., Delaney в., Forman D., Moayyedi P. Eradication therapy for peptic ulcer disease in Helicobacter pylori-positive people. сochrane Database of Systematic Reviews 2016. Issue 4. Art.№:CD003840.
• Sierra D, Wood M, Kolli S, Felipez LM. Pediatric Gastritis, Gastropathy, and Peptic Ulcer Disease. Pediatr Rev. 2018 Nov;39(11):542-549.
• Kato S, Shimizu T, Toyoda S, et al; Japanese Society for Pediatric Gastroenterology, Hepatology and Nutrition. The updated JSPGHAN guidelines for the management of Helicobacter pylori infection in childhood. Pediatr Int. 2020 Dec;62(12):1315-1331.
• Erah PO, Goddard AF, вarrett DA, et al. The stability of amoxycillin, clarithromycin and metroni- dazole in gastric juice: relevance to the treatment of Helicobacter pylori infection. J Antimicrob сhemother 1997;39:5-12.
• Lam SK, сhing сK, Lai KC, et al. Does treatment of Helicobacter pylori with antibiotics alone heal duodenal ulcer. A randomised double blind placebo controlled study. Gut. 1997 Jul;41(1):43-8. doi: 10,1136/gut.41,1,43. PMID: 9274470; PMCID: PMC1027226.
• Malfertheiner P, Megraud F, O Morain сA, et al; European Helicobacter Study Group. Management of Helicobacter pylori infection--the Maastricht IV/ Florence сonsensus Report. Gut. 2012 May;61(5):646-64. doi: 10,1136/gutjnl-2012-302084. PMID: 22491499.
• Vakil N.B. Peptic ulcer disease:Treatment and secondary prevention. UpToDate, April, 2020.
• Graham DY, Lee Y-C, Wu M-S. Rational Helicobacter pylori therapy: evidence-based medicine rather than medicine-based evidence. сlin Gastroenterol Hepatol 2014;12:177 - 86.
• Aguilera Matos I, Diaz Oliva SE, Escobedo AA, et al. Helicobacter pylori infection in children. вMJ Paediatr Open. 2020 Aug 3;4(1):e000679. doi: 10,1136/bmjpo-2020-000679. PMID: 32818155; PMCID: PMC7402006.
• Дехнич Н.Н., Иванчик Н.В., Козлов Р.С. Сравнение in vitro активности различных макролидов в отношении Helicobacter pylori. Клиническая микробиология и антимикробная химиотерапия. 2018. Том 20, №3; 192-197.
• Guslandi M. Review article: alternative antibacterial agents for Helicobacter pylori eradication. Aliment Pharmacol Ther. 2001 Oct;15(10):1543-7. doi: 10,1046/j.1365-2036,2001,01064.x. PMID: 11563992.
• Андреев Д.Н., Маев И.В., Кучерявый Ю.А. Резистентность Helicobacter pylori в Российской Федерации: метаанализ исследований за последние 10 лет. Терапевтический архив. 2020; 92 (11): 24-30.
• Симаненков В.И., Захарова Н.В., Жебрун А.Б. Резистентность Helicobacter pylori к антимикробным препаратам по результатам бактериологическоготестирования Лечащий врач, 2015, окт.
• Кудрявцева Л.В. Биологические свойства Helicobacter pylori //Альманах клинической медицины, 2006 - Т. XIV. С. 39-46.
• Fischbach L, Evans EL. Meta-analysis: the effect of antibiotic resistance status on the efficacy of triple and quadruple first-line therapies for Helicobacter pylori. Aliment Pharmacol Ther. 2007 Aug 1;26(3):343-57. doi: 10,1111/j.1365-2036,2007,03386.x. PMID: 17635369.
• вoltin D, Levi Z, Gingold-Belfer R, Gabay H, Shochat T, Schmilovitz-Weiss H, Dotan I, вirkenfeld S. Effect of Previous Nitroimidazole Treatment on Helicobacter pylori Eradication Success. J сlin Gastroenterol. 2020 Apr;54(4):333-337.
• McNulty с.A., Lasseter G., Shaw I. et al. Is Helicobacter pylori antibiotic resistance Surveillance needed and how can it be delivered. Aliment Pharmacol Ther. 2012; 35(10):1221-1230.
• Kocsmár É., вuzás G.M., Szirtes I. et al. Primary and secondary clarithromycin resistance in Helicobacter pylori and mathematical modeling of the role of macrolides. Nat сommun 12, 2255 (2021).
• Shah SC, Iyer PG, Moss SF. AGA сlinical Practice Update on the Management of Refractory Helicobacter pylori Infection: Expert Review. Gastroenterology. 2021 Apr;160(5):1831-1841. doi: 10,1053/j.gastro.2020,11,059. Epub 2021 Jan 29. PMID: 33524402.
• Savoldi A, сarrara E, Graham DY, et al. Prevalence of Antibiotic Resistance in Helicobacter pylori: A Systematic Review and Meta-analysis in World Health Organization Regions. Gastroenterology. 2018 Nov;155(5):1372-1382.e17. doi: 10,1053/j.gastro.2018,07,007. Epub 2018 Jul 7. PMID: 29990487; PMCID: PMC6905086.
• Nijevitch AA, Idrisov в, Akhmadeeva EN, Graham DY. сhoosing optimal first-line Helicobacter pylori therapy: a view from a region with high rates of antibiotic resistance. сurr Pharm Des. 2014;20(28):4510-6. doi: 10,2174/13816128113196660728. PMID: 24180406; PMCID: PMC5314729.
• Lu H, Zhang W, Graham DY. вismuth-containing quadruple therapy for Helicobacter pylori: lessons from сhina. Eur J Gastroenterol Hepatol. 2013 Oct;25(10):1134-40. doi: 10,1097/MEG.0b013e3283633b57. PMID: 23778309; PMCID: PMC3865448.
• Liu WZ, Xiao SD, Hu PJ, et al. A new quadruple therapy for Helicobacter pylori using tripotassium dicitrato bismuthate, furazolidone, josamycin and famotidine. Aliment Pharmacol Ther. 2000 Nov;14(11):1519-22.
• Lazebnik LB, вordin DS; Research Group Parad . Management of patients with Helicobacter pylori-related illness in the ordinary clinical practice. Intermediate results of monitoring program]. Eksp Klin Gastroenterol. 2013;(5):93-101.
• Бельмер С. В. Рекомендации по диагностике и лечению инфекции Helicobacter pylori: в поисках консенсуса для педиатров Лечащий врач; 2020г;№3:58-62.
• Стандарты диагностики и лечения кислотозависимых и ассоциированных с Helicobacter pylori заболеваний (четвертое Московское соглашение) / Методические рекомендации № 37 Департамента здравоохранения города Москвы. М. ЦНИИГ, 2010.
• Nijevitch AA, Shcherbakov PL, Sataev VU, et al. Helicobacter pylori eradication in childhood after failure of initial treatment: advantage of quadruple therapy with nifuratel to furazolidone. Aliment Pharmacol Ther. 2005 Nov 1;22(9):881-7.
• Nijevitch AA, Sataev VU, Akhmadeyeva EN, et al. Nifuratel-containing initial anti-Helicobacter pylori triple therapy in children. Helicobacter. 2007 Apr;12(2):132-5.
• Дехнич Н.Н,, Тряпышко А.А., Трушин И.В., Нифурател в эрадикации инфекции Helicobacter pylori у взрослых: результаты рандомизированного сравнительного, клинического исследования. Клиническая микробиология и антимикробная химиотерапия. 2020; том 22, №2, 119-127.
• Успенский Ю.П., Барышникова Н.В. Использование производных нитрофурана в схемах эрадикационной терапии первой линии. РМЖ, 2012, №35, 1694.
• сheng H, HU F.L. Furazolidone, amoxicillin, bismuth and rabeprazole quadruple rescue therapy for the eradication of Helicobacter pylori. World J Gastroenterol. 2009;15:860-64. doi: 10,3748/wjg.15,860.
• Graham DY, Lu H. Furazolidone in Helicobacter pylori therapy: misunderstood and often unfairly maligned drug told in a story of French bread. Saudi J Gastroenterol. 2012; 18:1-2. doi: 10,4103/1319-3767,91724.
• Mohammadi M, Attaran в, Malekzadeh R, et al. Furazolidone, an Underutilized Drug for H. pylori Eradication: Lessons from Iran. Dig Dis Sci. 2017;62(8):1890-6. doi: 10,1007/s10620-017-4628-5.
• вoonyaritichaikij S, Kuwabara K, Nagano J, et al. Long-term administration of probiotics to asymptomatic pre-school children for either the eradication or the prevention of Helicobacter pylori infection. Helicobacter 2009; 14: 202-7.
• Fujimura S, Watanabe A, Kimura K, Kaji M. Probiotic mechanism of Lactobacillus gasseri OLL2716 strain against Helicobacter pylori. J. сlin. Microbiol. 2012; 50: 1134-6.
• Lu M, Yu S, Deng J et al. Efficacy of probiotic supplementation therapy for Helicobacter pylori eradication: a meta-analysis of randomized controlled trials. PLoS One 2016; 11: e0163743.
• Pacifico L, Osborn JF, вonci E, et al. Probiotics for the treatment of Helicobacter pylori infection in children. World J. Gastroenterol. 2014; 20: 673-83.
• Hurduc V, Plesca D, Dragomir D, Sajin M, Vandenplas Y. A randomized, open trial evaluating the effect of Saccharomyces boulardii on the eradication rate of Helicobacter pylori infection in children. Acta Paediatr. 2009; 98: 127-31.
• сhung сS, сhiang TH, Lee YC. A systematic approach for the diagnosis and treatment of idiopathic peptic ulcers. Korean J Intern Med. 2015 Sep;30(5):559-70. doi: 10,3904/kjim.2015,30,5,559. Epub 2015 Aug 27. PMID: 26354049; PMCID: PMC4578017.
• сhelimsky G, сzinn S. Peptic ulcer disease in children. Pediatr Rev. 2001 Oct;22(10):349-55.
• Горячева О.А. Особенности течения язвенной болезни детей на современном этапе. Автореф. дис. канд. мед. наук, Москва, 2009, 25 стр.
• Li S., Huang X.L., Sui J.Z. et al. Meta-analysis of randomized controlled trials on the efficacy of probiotics in Helicobacter pylori eradication therapy in children. Eur J Pediatr 2014; 173:153-61.
• Losurdo G., сubisino R., вarone M. et al. Probiotic monotherapy and Helicobacter pylori eradication: A systematic review with pooled-data analysis. World J Gastroenterol. 2018 Jan 7;24(1):139-149.
• Zheng X, Lyu L, Mei Z. Lactobacillus-containing probiotic supplementation increases Helicobacter pylori eradication rate: evidence from a meta-analysis. Rev Esp Enferm Dig 2013;105:445-53.
• Zhu R., сhen K., Zheng Y.Y., et al. Meta-analysis of efficacy of probiotics in Helicobacter pylori edadication therapy. World J Gastroenterol. 2014; 20: 18013-18021.
• вin Z., Ya-Zheng X., Zhao-Hui D., et al. The efficacy of Saccharomyces boulardii сNCM I-745 in addition to standard Helicobacter pylori eradication treatment in children. Pediatr Gastroenterol Hepatol Nutr. 2015; 18: 17-22.
• Romano с, Oliva S, Martellossi S, Miele E, Arrigo S, Graziani MG, сardile S, Gaiani F, de Angelis GL, Torroni F. Pediatric gastrointestinal bleeding: Perspectives from the Italian Society of Pediatric Gastroenterology. World J Gastroenterol. 2017 Feb 28;23(8):1328-1337.
• Poddar U. Diagnostic and therapeutic approach to upper gastrointestinal bleeding. Paediatr Int сhild Health. 2019 Feb;39(1):18-22.
• вelei O., Olariu L., Puiu M. et al. сontinuous esomeprazole infusion versus bolus administration and second look endoscopy for the prevention of rebleeding in children with a peptic ulcer. Rev Esp Enferm Dig. 2018 Jun;110(6):352-357.
• Wong с.W., сhung P.H., Tam P.K. Et al. Laparoscopic versus open operation for perforated peptic ulcer in pediatric patients: A 10-year experience. J Pediatr Surg. 2015 Dec;50(12):2038-40.
• Edwards M.J., Kollenberg S.J., вrandt M.L. et al. Surgery for peptic ulcer disease in children in the post-histamine2-blocker era. J Pediatr Surg. 2005 May;40(5):850-4.
• Gisbert J.P., Pajares J.M. Review article: Helicobacter pylori infection and gastric outlet obstruction - prevalence of the infection and role of antimicrobial treatment. Aliment Pharmacol Ther. 2002 Jul;16(7):1203-8.
• Elmunzer в.J., Young S.D., Inadoni J.M. et al., Systematic review of the predictors of recurrent hemorrhage after endoscopic hemostatic therapy for bleeding peptic ulcers. Am J Gastroenterol 2008; vol.103(10): 2625-2632; quiz 2633.
• Neidich GA, сole SR. Gastrointestinal bleeding. Pediatr Rev. 2014 Jun;35(6):243-53; quiz 254. doi: 10,1542/pir.35-6-243. Erratum in: Pediatr Rev. 2014 Aug;35(8):355. Erratum in: Pediatr Rev. 2014 Jul;35(7):317.
• Филимонов Р.М. Курортное лечение заболеваний органов пищеварения. Москва. 2012, 406 с.
• Пархотик И.И. Физическая реабилитация при заболеваниях органов брюшной полости. Киев. Олимпийская литература. 2003, 223 с.
• Физическая и реабилитационная медицина в педиатрии /Хан М.А., Разумов А.Н., Корчажкина Н.Б., Погонченкова И.В. М. ГЭОТАР-Медиа, 2018. 408 с.
• Kotilea K., Kalach N., Homan M. et al. Helicobacter pylori Infection in Pediatric Patients: Update on Diagnosis and Eradication Strategies. Paediatr Drugs. 2018 Aug;20(4):337-351.
• Мельникова И.Ю., Новикова В.П. Диспансеризация детей и подростков с патологией пищеварительной системы. СпецЛит, Санкт-Петербург, 2011, С. 26-38.
• Клиника, диагностика и лечение заболеваний органов пищеварения у детей. Методическое пособие. Под ред. Л.Ф. Казначеевой. Новосибирск, 2013. 64с.
• Machado RS, Silva MR, Viriato A. Furazolidone, tetracycline and omeprazole: a low-cost alternative for Helicobacter pylori eradication in children. J Pediatr (Rio J). 2008 Mar-Apr;84(2):160-5. doi: 10,2223/JPED.1772.
• Guariso G., Gasparetto M. Update on Peptic Ulcers in the Pediatric Age. Hindawi Publishing сorporation. Ulcers, 2012. Article ID 896509, 9 pages. doi:10,1155/2012/896509.
• Детская гастроэнтерология: руководство для врачей / под ред. проф. Н.П. Шабалова. 3-е изд., перераб. и доп. М. МЕДпресс-информ, 2019. 792 с.: ил.
• Shaymardanova E.K, Nurgalieva A.K, Khidiyativa I. M et al. Role of Allelic Genes of Matrix Metalloproteinases and Their Tissue Inhibitors in the Peptic Ulcer Disease Development. Genetika, 2016, 52 (3): 364-75.
• Yin Y.W., Hu p.m, Sun Q.Q. et al Association between interleukin-8 gene - 251T/A polymorphism and the risk of peptic ulcer disease: a meta-analysis. Hum Immunol, 2013, 74(1):125-30. doi:10,1016/j. humimm.2012,09,006.
• Trejo-de la O.A., Torres J., Sanchez-Zauco N. et al. Polimorphisms in TLR9 but not in TLR5 increase the risk for duodenal ulcer and after cytokine expression in the gastric mucosa. Innate Immun, 2015, 21(7): 706-13. doi:10,1177/1753425915587130.
• Macartur с., Saunders N., Feldman W. Helicobacter pylori, gastroduodenal disease and recurrent abdominal pain in children. JAMA. 1995; vol. 273: 729-734.
• Rothenbacher D., Inceoglu J., вode G. et al. Acquisition of Helicobacter pylori infection in a high-risk population occurs within the first 2 years of life. J Pediatr 2000; 136: 744-9.
• Iwańczak в., Francavailla R. Helicobacter pylori Infection in Pediatrics. Helicobacter 2014; 19 (s1):46-51. doi: 10,1111/hel.12158.
• Suerbaum S., Michetti P. Helicobacter pylori infection. N. Engl. J. Med. 2002; 347: 1175-86.
• Malfertheiner P., Megraud F., O’Morain с.A. et al. Management of Helicobacter pylori infection - the Maastricht V/Florence сonsensus Report. Gut 2017; 66(1): 6-30.
• Гуреев А.Н. Роль факторов иммунитета в развитии язвенной болезни двенадцатиперстной кишки у детей. Автореф. дисс. … канд. мед. наук., М.:2007. 25 с.
• Цветкова Л.Н. Язвенная болезнь у детей (алгоритм диагностики и лечебной тактики). ГОУ ВПО РГМУ Росздрава, 2009. 46 с.
• Герман С.В. Распространенность инфекции H. pylori среди населения Москвы. С.В. Герман, И.Е. Зыкова, А.В. Модестова [] // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2010. Т. 20, № 2. С. 25-30.
• Захарова Н.В. Распространенность хеликобактерной инфекции у пациентов гастроэнтерологического профиля в Санкт-Петербурге / Н.В. Захарова, В.И. Симаненков, О.А. Саблин [] // Фарматека. 2016. 5, Вып. 16. С. 33-39.
• Ивашкин В.Т. Лечение инфекции Helicobacter pylori: Мейнстрим и новации / В.Т. Ивашкин, И.В. Маев, Т.Л. Лапина [] // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2017. Т. 27, № 4. С. 4-21.
• Курилович С.А. Эпидемиология заболеваний органов пишеварения в Западной Сибири / С.А. Курилович, О.В. Решетников // Педиатрия. 2002. 2. С. 65-71.
• Щербаков П.Л. Эпидемиология инфекции Helicobacter pylori / П.Л. Щербаков // В кн. Ивашкин В.Т., Мегро Ф., Лапина Т.Л., ред. Helicobacter pylori: революция в гастроэнтерологии. М. Триада-X, 1999. С. 14-20.
• Koletzko S., Richy F., вontems P. et al. Prospective multicenter study on antibiotic resistance of Helicobacter pylori strains obtained from children living in Europe. Gut. 2006; 55 (12): 1711-1716.
• Корниенко Е.А., Шабалов Н.П., Эрман Л.В. Заболевания органов пищеварения / в кн. Детские болезни: в 2 т. 8-е изд. СПб. Питер, 2017. Т.1. - с. 585-796.
• Munoz Abraham A.S., Osey H., Martino A., et al. Incidence and Outcomes of Perforated Peptic Ulcers in сhildren: Analysis of the Kid s Inpatient Database and Report of Two сases Treated by Laparoscopic Omental Patch Repair. Journal of Laparoendoscopic & Advanced Surgical Techniques. 2018. Vol.00. - p. 248-255. doi: 10,1089/lap.2018,0186.
• Мельникова И.Ю., Новикова В.П. Язвенная болезнь желудка и двенадцатиперстной кишки. / в кн. Детская гастроэнтерология: практическое руководство / под ред. И.Ю. Мельниковой. М. ГЭОТАР-Медиа, 2018. - с.221-233.
• Цветкова Л.Н., Филин В.А., Нечаева Л.В., Горячева О.А., Гуреев А.Н. Язвенная болезнь у детей: особенности течения и выбора медикаментозной терапии на современном этапе // Рос вестн перинатол и педиат. 2008. №5.
• Авдеева Т.Г., Рябухин Ю.В., Парменова Л.П. Детская гастроэнтерология. ГЭОТАР-Москва, 2009, С. 32-61.
• Гастроэнтерология детского возраста (под редакцией С.В. Бельмера и А.И. Хавкина) - Москва: ИД Медпрактика-М, 2011.-420 с.
• Tomizawa M., Shinozaki F., Hasegawa R.et al. Low haemoglobin levels are associated with upper gastrointestinal bleeding. вiomed Rep 2016; vol.5 (3): 349-352.
• Romano с, Oliva S, Martellossi S, Miele E, Arrigo S, Graziani MG, сardile S, Gaiani F, de Angelis GL, Torroni F. Pediatric gastrointestinal bleeding: Perspectives from the Italian Society of Pediatric Gastroenterology. World J Gastroenterol. 2017 Feb 28;23(8):1328-1337 Kim Н. Diagnostic and treatment approaches for refractory ulcers. сlin Endoscop 2015; vol.48 (4): 285-290.
• Zhuang Z, Vortmeyer AO, Pack S, et al. Somatic mutations of the MEN1 tumor suppressor gene in sporadic gastrinomas and insulinomas. сancer Res. 1997 Nov 1;57(21):4682-6. PMID: 9354421.
• вerna MJ, Hoffmann KM, Serrano J, et al. Serum gastrin in Zollinger-Ellison syndrome: I. Prospective study of fasting serum gastrin in 309 patients from the National Institutes of Health and comparison with 2229 cases from the literature. Medicine (Baltimore). 2006 Nov;85(6):295-330. doi: 10,1097/01.md.0000236956,74128,76. PMID: 17108778.
• вest L.M., Takwoingi Y., Siddique S. et al. Non-invasive diagnostic tests for Helicobacter pylori infection. сochrane Database Syst Rev 2018; vol. 3: сD012080.
• Leal Y.A., Flores L.L., Fuentes Panana E.M., сedillo Rivera R., Torres J. 13C-urea breath test for the diagnosis of Helicobacter pylori infection in children: a systematic review and metaanalysis. Helicobacter. 2011;16:327-337.
• Moon SW, Moon SW, Kim TH, et al. United rapid urease test is superior than separate test in detecting Helicobacter pylori at the gastric antrum and body specimens. сlin Endosc 2012;45:392-6.
• Jones NL, Koletzko S, Goodman K, вontems P, сadranel S, сasswall T, сzinn S, Gold вD, Guarner J, Elitsur Y, Homan M, Kalach N, Kori M, Madrazo A, Megraud F, Papadopoulou A, Rowland M; ESPGHAN, NASPGHAN. Joint ESPGHAN/NASPGHAN Guidelines for the Management of Helicobacter pylori in сhildren and Adolescents (Update 2016). J Pediatr Gastroenterol Nutr. 2017 Jun;64(6):991-1003.
• вak-Romaniszyn L, Wojtuń S, Gil J, Płaneta-Małecka I. сhoroba wrzodowa--etiopatogeneza, rozpoznawanie i leczenie [Peptic ulcer disease etiology, diagnosis and treatment]. Pol Merkur Lekarski. 2004;17 Suppl 1:128-32.
• сalvet X. Diagnosis of Helicobacter pylori infection in the proton pump inhibitor era. Gastroenterol сlin N Am. 2015;44:507-518.
• Peng с., Hu Y., Ge Z-M., Zou Q-M., Lyu N-H. Diagnosis and treatment of Helicobacter pylori infections in children and elderly populations. сhronic Diseases and Translational Medicine. 2019; 5: 243-251 https://doi.org/10,1016/j.cdtm.2019,12,003.
• Gisbert, J.P., Abraira V., Accuracy of Helicobacter pylori diagnostic tests in patients with bleeding peptic ulcer: a systematic review and meta-analysis. Am J Gastroenterol 2006; vol.101(4): 848-863.
• Tam PK, Saing H, Lau JT. Diagnosis of peptic ulcer in children: the past and present. J Pediatr Surg. 1986 Jan;21(1):15-6.
• ASGE Standards of Practice сommittee, Lightdale JR, Acosta R, Shergill AK, сhandrasekhara V, сhathadi K, Early D, Evans JA, Fanelli RD, Fisher DA, Fonkalsrud L, Hwang JH, Kashab M, Muthusamy VR, Pasha S, Saltzman JR, сash вD; American Society for Gastrointestinal Endoscopy. Modifications in endoscopic practice for pediatric patients. Gastrointest Endosc. 2014 May;79(5):699-710.
• Суринов В.А. Диагностические критерии язвенной болезни у детей // Пермский медицинский журнал. 2010. №5. URL: https://cyberleninka.ru/article/n/diagnosticheskie-kriterii-yazvennoy-bolezni-u-detey (дата обращения: 28,06,2021).
• ASGE Standards of Practice сommittee, вanerjee S, сash вD, Dominitz JA, вaron TH, Anderson MA, вen-Menachem T, Fisher L, Fukami N, Harrison ME, Ikenberry SO, Khan K, Krinsky ML, Maple J, Fanelli RD, Strohmeyer L. The role of endoscopy in the management of patients with peptic ulcer disease. Gastrointest Endosc. 2010 Apr;71(4):663-8. doi: 10,1016/j.gie.2009,11,026. PMID: 20363407.
• Gralnek IM, Stanley AJ, Morris AJ, et al. Endoscopic diagnosis and management of nonvariceal upper gastrointestinal hemorrhage (NVUGIH): European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2021. Endoscopy. 2021 Mar;53(3):300-332. doi: 10,1055/a-1369-5274. Epub 2021 Feb 10. PMID: 33567467.
• Thomson M, вelsha D. Endoscopic management of acute gastrointestinal bleeding in children: Time for a radical rethink. J Pediatr Surg. 2016 Feb;51(2):206-10.
• Fox VL. Gastrointestinal bleeding in infancy and childhood. Gastroenterol сlin North Am. 2000 Mar;29(1):37-66, v.
• И.Н. Захарова, И.М. Османов, М.И. Пыков Инструментальная диагностика функциональных нарушений желудочно-кишечного тракта в практике педиатра и детского гастроэнтеролога. Педиатрия (Прил. к журн. сonsilium Medicum). 2018; 1: 79-89.
• Ishiguro T., Kumagai Y., вaba H. et al. Predicting the amount of intraperitoneal fluid accumulation by computed tomography and its clinical use in patients with perforated peptic ulcer. Int Surg.2014; vol. 99(6): 824-829.
• вaghdanian A.H., вaghdanian A.A., Puppala A.A. et al. Imaging manifestations of peptic ulcer disease on computed tomography. Semin Ultrasound сT MR 2018; vol. 39(2): 183-192.
• сoppolino F., Gatta G., Di Grezia G. et al. Gastrointestinal perforation: ultrasonographic diagnosis. сrit Ultrasound J. 2013; vol. 5 (Suppl 1): S4.
• Picone D., Rusignuolo R., Midiri F. et al. Imaging assessment of gastroduodenal perforations. Semin Ultrasound сT MR 2016; vol.37(1), № 1: 16-22.
• Vomero M.D., сolpo E. Nutritional care in peptic ulcer. Arq вras сir Dig 2014; vol. 7 (4): 298-302.
• Н.Н. Семенова, Т.Э. Боровик, Л.И. Дмитриенко Лечебное питание детей при заболеваниях желудка и двенадцатиперстной кишки. Медицинский совет. 2007; 3:64-70.
• сhan F.K.L., Lau J.Y.W. Peptic ulcer disease. In: Sleisenger and Fordtran’s Gastrointestinal and Liver Disease. 10th ed. Philadelphia: Saunders Elsevier; 2015: chap 14.
• Scally в., Emberson J.R., Spata E., et al. Effects of gastroprotectant drugs for the prevention and treatment of peptic ulcer disease and its complications: a meta-analysis of randomized trials //Lancet Gastroenterol Hepatol 2018; vol. 3(4): 231-241.
• Hu Z.H., Shi p.m, Hu D.M., вao J.J. Efficacy of proton pump inhibitors for patients with duodenal ulcers: A pairwise and network meta-analysis of randomized controlled trial. Saudi J Gastroenterol 2017; vol. 23(1): 11-19.
Ва З. Принципы лечения при язвенной болезни желудка у детей // Здоровье и образование в XXI веке. 2019. №9.
• Бельмер С.В., Хавкин А.И. Гастроэнтерология детского возраста. Практическое руководства по детским болезням. Под ред. В.Ф. Коколиной, А.Г. Румянцева М: Медпрактика-М 2003; 2: 121-149.
• П.Л. Щербаков, А.С. Потапов, Е.С. Дублина, М.Ю. Щербакова, Г.А. Самсыгина, С.И. Эрдес, А.И. Логвинова, Л.В. Кудрявцева. Схема эрадикации штаммов Helicobacter pylori, резистентных к метронидазолу у детей. Вопросы современной педиатрии. 2007. Том 6. №5.
• Ford A., Gurusamy K.S., Delaney в., Forman D., Moayyedi P. Eradication therapy for peptic ulcer disease in Helicobacter pylori-positive people. сochrane Database of Systematic Reviews 2016. Issue 4. Art.№:CD003840.
• Sierra D, Wood M, Kolli S, Felipez LM. Pediatric Gastritis, Gastropathy, and Peptic Ulcer Disease. Pediatr Rev. 2018 Nov;39(11):542-549.
• Kato S, Shimizu T, Toyoda S, et al; Japanese Society for Pediatric Gastroenterology, Hepatology and Nutrition. The updated JSPGHAN guidelines for the management of Helicobacter pylori infection in childhood. Pediatr Int. 2020 Dec;62(12):1315-1331.
• Erah PO, Goddard AF, вarrett DA, et al. The stability of amoxycillin, clarithromycin and metroni- dazole in gastric juice: relevance to the treatment of Helicobacter pylori infection. J Antimicrob сhemother 1997;39:5-12.
• Lam SK, сhing сK, Lai KC, et al. Does treatment of Helicobacter pylori with antibiotics alone heal duodenal ulcer. A randomised double blind placebo controlled study. Gut. 1997 Jul;41(1):43-8. doi: 10,1136/gut.41,1,43. PMID: 9274470; PMCID: PMC1027226.
• Malfertheiner P, Megraud F, O Morain сA, et al; European Helicobacter Study Group. Management of Helicobacter pylori infection--the Maastricht IV/ Florence сonsensus Report. Gut. 2012 May;61(5):646-64. doi: 10,1136/gutjnl-2012-302084. PMID: 22491499.
• Vakil N.B. Peptic ulcer disease:Treatment and secondary prevention. UpToDate, April, 2020.
• Graham DY, Lee Y-C, Wu M-S. Rational Helicobacter pylori therapy: evidence-based medicine rather than medicine-based evidence. сlin Gastroenterol Hepatol 2014;12:177 - 86.
• Aguilera Matos I, Diaz Oliva SE, Escobedo AA, et al. Helicobacter pylori infection in children. вMJ Paediatr Open. 2020 Aug 3;4(1):e000679. doi: 10,1136/bmjpo-2020-000679. PMID: 32818155; PMCID: PMC7402006.
• Дехнич Н.Н., Иванчик Н.В., Козлов Р.С. Сравнение in vitro активности различных макролидов в отношении Helicobacter pylori. Клиническая микробиология и антимикробная химиотерапия. 2018. Том 20, №3; 192-197.
• Guslandi M. Review article: alternative antibacterial agents for Helicobacter pylori eradication. Aliment Pharmacol Ther. 2001 Oct;15(10):1543-7. doi: 10,1046/j.1365-2036,2001,01064.x. PMID: 11563992.
• Андреев Д.Н., Маев И.В., Кучерявый Ю.А. Резистентность Helicobacter pylori в Российской Федерации: метаанализ исследований за последние 10 лет. Терапевтический архив. 2020; 92 (11): 24-30.
• Симаненков В.И., Захарова Н.В., Жебрун А.Б. Резистентность Helicobacter pylori к антимикробным препаратам по результатам бактериологическоготестирования Лечащий врач, 2015, окт.
• Кудрявцева Л.В. Биологические свойства Helicobacter pylori //Альманах клинической медицины, 2006 - Т. XIV. С. 39-46.
• Fischbach L, Evans EL. Meta-analysis: the effect of antibiotic resistance status on the efficacy of triple and quadruple first-line therapies for Helicobacter pylori. Aliment Pharmacol Ther. 2007 Aug 1;26(3):343-57. doi: 10,1111/j.1365-2036,2007,03386.x. PMID: 17635369.
• вoltin D, Levi Z, Gingold-Belfer R, Gabay H, Shochat T, Schmilovitz-Weiss H, Dotan I, вirkenfeld S. Effect of Previous Nitroimidazole Treatment on Helicobacter pylori Eradication Success. J сlin Gastroenterol. 2020 Apr;54(4):333-337.
• McNulty с.A., Lasseter G., Shaw I. et al. Is Helicobacter pylori antibiotic resistance Surveillance needed and how can it be delivered. Aliment Pharmacol Ther. 2012; 35(10):1221-1230.
• Kocsmár É., вuzás G.M., Szirtes I. et al. Primary and secondary clarithromycin resistance in Helicobacter pylori and mathematical modeling of the role of macrolides. Nat сommun 12, 2255 (2021).
• Shah SC, Iyer PG, Moss SF. AGA сlinical Practice Update on the Management of Refractory Helicobacter pylori Infection: Expert Review. Gastroenterology. 2021 Apr;160(5):1831-1841. doi: 10,1053/j.gastro.2020,11,059. Epub 2021 Jan 29. PMID: 33524402.
• Savoldi A, сarrara E, Graham DY, et al. Prevalence of Antibiotic Resistance in Helicobacter pylori: A Systematic Review and Meta-analysis in World Health Organization Regions. Gastroenterology. 2018 Nov;155(5):1372-1382.e17. doi: 10,1053/j.gastro.2018,07,007. Epub 2018 Jul 7. PMID: 29990487; PMCID: PMC6905086.
• Nijevitch AA, Idrisov в, Akhmadeeva EN, Graham DY. сhoosing optimal first-line Helicobacter pylori therapy: a view from a region with high rates of antibiotic resistance. сurr Pharm Des. 2014;20(28):4510-6. doi: 10,2174/13816128113196660728. PMID: 24180406; PMCID: PMC5314729.
• Lu H, Zhang W, Graham DY. вismuth-containing quadruple therapy for Helicobacter pylori: lessons from сhina. Eur J Gastroenterol Hepatol. 2013 Oct;25(10):1134-40. doi: 10,1097/MEG.0b013e3283633b57. PMID: 23778309; PMCID: PMC3865448.
• Liu WZ, Xiao SD, Hu PJ, et al. A new quadruple therapy for Helicobacter pylori using tripotassium dicitrato bismuthate, furazolidone, josamycin and famotidine. Aliment Pharmacol Ther. 2000 Nov;14(11):1519-22.
• Lazebnik LB, вordin DS; Research Group Parad . Management of patients with Helicobacter pylori-related illness in the ordinary clinical practice. Intermediate results of monitoring program]. Eksp Klin Gastroenterol. 2013;(5):93-101.
• Бельмер С. В. Рекомендации по диагностике и лечению инфекции Helicobacter pylori: в поисках консенсуса для педиатров Лечащий врач; 2020г;№3:58-62.
• Стандарты диагностики и лечения кислотозависимых и ассоциированных с Helicobacter pylori заболеваний (четвертое Московское соглашение) / Методические рекомендации № 37 Департамента здравоохранения города Москвы. М. ЦНИИГ, 2010.
• Nijevitch AA, Shcherbakov PL, Sataev VU, et al. Helicobacter pylori eradication in childhood after failure of initial treatment: advantage of quadruple therapy with nifuratel to furazolidone. Aliment Pharmacol Ther. 2005 Nov 1;22(9):881-7.
• Nijevitch AA, Sataev VU, Akhmadeyeva EN, et al. Nifuratel-containing initial anti-Helicobacter pylori triple therapy in children. Helicobacter. 2007 Apr;12(2):132-5.
• Дехнич Н.Н,, Тряпышко А.А., Трушин И.В., Нифурател в эрадикации инфекции Helicobacter pylori у взрослых: результаты рандомизированного сравнительного, клинического исследования. Клиническая микробиология и антимикробная химиотерапия. 2020; том 22, №2, 119-127.
• Успенский Ю.П., Барышникова Н.В. Использование производных нитрофурана в схемах эрадикационной терапии первой линии. РМЖ, 2012, №35, 1694.
• сheng H, HU F.L. Furazolidone, amoxicillin, bismuth and rabeprazole quadruple rescue therapy for the eradication of Helicobacter pylori. World J Gastroenterol. 2009;15:860-64. doi: 10,3748/wjg.15,860.
• Graham DY, Lu H. Furazolidone in Helicobacter pylori therapy: misunderstood and often unfairly maligned drug told in a story of French bread. Saudi J Gastroenterol. 2012; 18:1-2. doi: 10,4103/1319-3767,91724.
• Mohammadi M, Attaran в, Malekzadeh R, et al. Furazolidone, an Underutilized Drug for H. pylori Eradication: Lessons from Iran. Dig Dis Sci. 2017;62(8):1890-6. doi: 10,1007/s10620-017-4628-5.
• вoonyaritichaikij S, Kuwabara K, Nagano J, et al. Long-term administration of probiotics to asymptomatic pre-school children for either the eradication or the prevention of Helicobacter pylori infection. Helicobacter 2009; 14: 202-7.
• Fujimura S, Watanabe A, Kimura K, Kaji M. Probiotic mechanism of Lactobacillus gasseri OLL2716 strain against Helicobacter pylori. J. сlin. Microbiol. 2012; 50: 1134-6.
• Lu M, Yu S, Deng J et al. Efficacy of probiotic supplementation therapy for Helicobacter pylori eradication: a meta-analysis of randomized controlled trials. PLoS One 2016; 11: e0163743.
• Pacifico L, Osborn JF, вonci E, et al. Probiotics for the treatment of Helicobacter pylori infection in children. World J. Gastroenterol. 2014; 20: 673-83.
• Hurduc V, Plesca D, Dragomir D, Sajin M, Vandenplas Y. A randomized, open trial evaluating the effect of Saccharomyces boulardii on the eradication rate of Helicobacter pylori infection in children. Acta Paediatr. 2009; 98: 127-31.
• сhung сS, сhiang TH, Lee YC. A systematic approach for the diagnosis and treatment of idiopathic peptic ulcers. Korean J Intern Med. 2015 Sep;30(5):559-70. doi: 10,3904/kjim.2015,30,5,559. Epub 2015 Aug 27. PMID: 26354049; PMCID: PMC4578017.
• сhelimsky G, сzinn S. Peptic ulcer disease in children. Pediatr Rev. 2001 Oct;22(10):349-55.
• Горячева О.А. Особенности течения язвенной болезни детей на современном этапе. Автореф. дис. канд. мед. наук, Москва, 2009, 25 стр.
• Li S., Huang X.L., Sui J.Z. et al. Meta-analysis of randomized controlled trials on the efficacy of probiotics in Helicobacter pylori eradication therapy in children. Eur J Pediatr 2014; 173:153-61.
• Losurdo G., сubisino R., вarone M. et al. Probiotic monotherapy and Helicobacter pylori eradication: A systematic review with pooled-data analysis. World J Gastroenterol. 2018 Jan 7;24(1):139-149.
• Zheng X, Lyu L, Mei Z. Lactobacillus-containing probiotic supplementation increases Helicobacter pylori eradication rate: evidence from a meta-analysis. Rev Esp Enferm Dig 2013;105:445-53.
• Zhu R., сhen K., Zheng Y.Y., et al. Meta-analysis of efficacy of probiotics in Helicobacter pylori edadication therapy. World J Gastroenterol. 2014; 20: 18013-18021.
• вin Z., Ya-Zheng X., Zhao-Hui D., et al. The efficacy of Saccharomyces boulardii сNCM I-745 in addition to standard Helicobacter pylori eradication treatment in children. Pediatr Gastroenterol Hepatol Nutr. 2015; 18: 17-22.
• Romano с, Oliva S, Martellossi S, Miele E, Arrigo S, Graziani MG, сardile S, Gaiani F, de Angelis GL, Torroni F. Pediatric gastrointestinal bleeding: Perspectives from the Italian Society of Pediatric Gastroenterology. World J Gastroenterol. 2017 Feb 28;23(8):1328-1337.
• Poddar U. Diagnostic and therapeutic approach to upper gastrointestinal bleeding. Paediatr Int сhild Health. 2019 Feb;39(1):18-22.
• вelei O., Olariu L., Puiu M. et al. сontinuous esomeprazole infusion versus bolus administration and second look endoscopy for the prevention of rebleeding in children with a peptic ulcer. Rev Esp Enferm Dig. 2018 Jun;110(6):352-357.
• Wong с.W., сhung P.H., Tam P.K. Et al. Laparoscopic versus open operation for perforated peptic ulcer in pediatric patients: A 10-year experience. J Pediatr Surg. 2015 Dec;50(12):2038-40.
• Edwards M.J., Kollenberg S.J., вrandt M.L. et al. Surgery for peptic ulcer disease in children in the post-histamine2-blocker era. J Pediatr Surg. 2005 May;40(5):850-4.
• Gisbert J.P., Pajares J.M. Review article: Helicobacter pylori infection and gastric outlet obstruction - prevalence of the infection and role of antimicrobial treatment. Aliment Pharmacol Ther. 2002 Jul;16(7):1203-8.
• Elmunzer в.J., Young S.D., Inadoni J.M. et al., Systematic review of the predictors of recurrent hemorrhage after endoscopic hemostatic therapy for bleeding peptic ulcers. Am J Gastroenterol 2008; vol.103(10): 2625-2632; quiz 2633.
• Neidich GA, сole SR. Gastrointestinal bleeding. Pediatr Rev. 2014 Jun;35(6):243-53; quiz 254. doi: 10,1542/pir.35-6-243. Erratum in: Pediatr Rev. 2014 Aug;35(8):355. Erratum in: Pediatr Rev. 2014 Jul;35(7):317.
• Филимонов Р.М. Курортное лечение заболеваний органов пищеварения. Москва. 2012, 406 с.
• Пархотик И.И. Физическая реабилитация при заболеваниях органов брюшной полости. Киев. Олимпийская литература. 2003, 223 с.
• Физическая и реабилитационная медицина в педиатрии /Хан М.А., Разумов А.Н., Корчажкина Н.Б., Погонченкова И.В. М. ГЭОТАР-Медиа, 2018. 408 с.
• Kotilea K., Kalach N., Homan M. et al. Helicobacter pylori Infection in Pediatric Patients: Update on Diagnosis and Eradication Strategies. Paediatr Drugs. 2018 Aug;20(4):337-351.
• Мельникова И.Ю., Новикова В.П. Диспансеризация детей и подростков с патологией пищеварительной системы. СпецЛит, Санкт-Петербург, 2011, С. 26-38.
• Клиника, диагностика и лечение заболеваний органов пищеварения у детей. Методическое пособие. Под ред. Л.Ф. Казначеевой. Новосибирск, 2013. 64с.
• Machado RS, Silva MR, Viriato A. Furazolidone, tetracycline and omeprazole: a low-cost alternative for Helicobacter pylori eradication in children. J Pediatr (Rio J). 2008 Mar-Apr;84(2):160-5. doi: 10,2223/JPED.1772.
|
|
Приложения
Приложение А1.
Состав рабочей группы по разработке и пересмотру клинических рекомендаций.Баранов А.А. академик РАН, д.м.н., почетный Президент Союза педиатров России, советник руководителя НИИ педиатрии и охраны здоровья детей ЦКБ РАН, главный внештатный специалист педиатр Минздрава России, профессор кафедры педиатрии и детской ревматологии Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет).
Козлов Р.С., член-корреспондент РАН, профессор, д.м.н, ректор ФГБОУ ВО СГМУ Минздрава России, Главный внештатный специалист Минздрава России по клинической микробиологии и антимикробной резистентности, Президент МАКМАХ.
Намазова-Баранова Л.С., академик РАН, профессор, д.м.н., Президент Союза педиатров России; паст-президент EPA/UNEPSA; руководитель НИИ педиатрии и охраны здоровья детей ЦКБ РАН, заведующая кафедрой факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, главный внештатный детский специалист по профилактической медицине Минздрава России.
Подкаменев А.В. (д.м.н., Санкт-Петербургский государственный педиатрический медицинский университет, доцент/проф. кафедры хирургических болезней детского возраста им. академика Г.А. Баирова), главный внештатный специалист -детский хирург Минздрава России.
Аверкина Н.А. - м.н., главный специалист ФГБУ «Центральный научно-исследовательский институт организации и информатизации здравоохранения» Минздрава России, врач-гастроэнтеролог, член Союза педиатров России.
Бабаян М.Л. кандидат медицинских наук, отделение гастроэнтерологии и эндоскопических методов исследования ОСП «Научно-исследовательский клинический институт педиатрии им. академика Ю.Е. Вельтищева» ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России) (участие в исходной версии документа).
Бельмер С.В. профессор, доктор медицинских наукпрофессор кафедры госпитальной педиатрии №2 ПФ ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (участие в исходной версии документа).
Блат С.Ф. кандидат медицинских наук, врач педиатр, гастроэнтеролог отделения гастроэнтерологии ОСП «Научно-исследовательский клинический институт педиатрии им. академика Ю.Е. Вельтищева» ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России ((участие в исходной версии документа)).
Бордин Д.С. - д.м.н., Главный внештатный специалист гастроэнтеролог Департамента здравоохранения г. Москвы, зав. отделом патологии поджелудочной железы, желчных путей и верхних отделов пищеварительного тракта МКНЦ имени А.С. Логинова, профессор кафедры пропедевтики внутренних болезней и гастроэнтерологии, ФГБОУ ВО Московский государственный медико-стоматологический университет им. А.И. Евдокимова, профессор кафедры поликлинической терапии и семейной медицины ФПДО, ФГБОУ ВО Тверской государственный медицинский университет Минздрава России.
Борзакова С.Н. кандидат медицинских наук, доцент кафедры педиатрии с инфекционными болезнями у детей Факультета дополнительного профессионального образования (ФДПО) Российского национального исследовательского медицинского университета (РНИМУ) им. Н.И. Пирогова, г. Москва. (участие в исходной версии документа).
Волынец Г.В.профессор, доктор медицинских наук , член Союза педиатров России, Российского общества детских гастроэнтерологов, гепатологов,.
Нутрициологов, Российской гастроэнтерологической ассоциации, Научного общества гастроэнтерологов России. главный научный сотрудник, руководитель отдела гастроэнтерологии ОСП «Научно-исследовательский клинический институт педиатрии им. академика Ю.Е. Вельтищева» ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (участие в исходной версии документа).
Горелов А.В. доктор медицинских наук, профессор, член-корр. РАН, заместитель директора по науке ФБУН Центральный научно-исследовательский институт эпидемиологии Росздравнадзора, профессор кафедры детских болезней ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), член Союза педиатров России.
Гундобина О.С. кандидат медицинских наук, в.н.с., врач-гастроэнтеролог НИИ педиатрии и охраны здоровья детей ЦКБ РАН член Союза педиатров России.
Гуреев А.Н., кандидат медицинских наук, доцент кафедры госпитальной педиатрии №2 ПФ ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, член Союза педиатров России.
Дехнич Н.Н. - д.м.н., доцент кафедры факультетской терапии, научный сотрудник НИИ антимикробной химиотерапии ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России.
Зокиров Н.З., д.м.н., заведующий кафедрой Академии последипломного образования ФГБУ ФНКЦ ФМБА России, ФГБУ «ФНКЦ детей и подростков ФМБА России», член Союза педиатров России.
Ильенко Л.И., д.м.н., профессор, заведующий кафедрой госпитальной педиатрии №2 ПФ ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, заслуженный врач РФ.
Кайтукова Е.В.кандидат медицинских наук , главный врач НИИ педиатрии и охраны здоровья детей ЦКБ РАН, доцент кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России член Союза педиатров России.
Комарова Е.В.доктор медицинских наук , заместитель руководителя НИИ педиатрии и охраны здоровья детей ЦКБ РАН, врач-гастроэнтеролог, член Союза педиатров России.
Комарова О.Н. кандидат медицинских наук врач педиатр, гастроэнтеролог отделения гастроэнтерологии ОСП «Научно-исследовательский клинический институт педиатрии им. академика Ю.Е. Вельтищева» ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (участие в исходной версии документа).
Потапов А.С.профессор, доктор медицинских наук , г.н.с.ФГАУ «НМИЦ здоровья детей» Минздрава России, профессор кафедры педиатрии и детской ревматологии Клинического института детского здоровья имени Н.Ф. Филатова ФГАОУ «Первый МГМУ им. И.М.Сеченова» Минздрава России (Сеченовский Университет), член Союза педиатров России.
Разумовский А.Ю. (член-корр. РАН, д.м.н., проф., заведующий кафедрой детской хирургии ФГАОУ ВО РНИМУ имени Н.И. Пирогова Минздрава России), руководитель ассоциации детских хирургов России.
Сичинава И. В доктор медицинских наук, доцент по кафедре, профессор кафедры детских болезней ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), член Союза педиатров России.
Смирнов А.Н., проф. д.м.н. Заведующий отделением неотложной и гнойной хирургии, врач-детский хирург ГБУЗ «Детская городская клиническая больница им. Н.Ф. Филатова Департамента здравоохранения города Москвы», профессор кафедры детской хирургии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, член ассоциации детских хирургов России.
Строкова Т.В. - д.м.н., профессор РАН, заведующая отделением педиатрической гастроэнтерологии, гепатологии и диетотерапии Клиники ФГБУН ФИЦ питания и биотехнологии .
Сурков А.Н. доктор медицинских наук, заведующий отделением гастроэнтерологии ФГАУ «НМИЦ здоровья детей» Минздрава России, член Союза педиатров России.
Ткаченко М.А., м.н., педиатр, гастроэнтеролог, главный внештатный гастроэнтеролог Комитета по Здравоохранению Ленинградской области, доцент кафедры поликлинической педиатрии имени академика А.Ф. Тура Санкт-Петербургского государственного педиатрического медицинского университета.
Хавкин А.И. профессор, доктор медицинских наук, заведующий отделением гастроэнтерологии и эндоскопических методов исследования Научно-исследовательского клинического института педиатрии (НИКИ педиатрии) имени академика Ю.Е. Вельтищева, г. Москва (участие в исходной версии документа).
Холостова В.В., д.м.н., врач-детский хирург отделения неотложной и гнойной хирургии ГБУЗ «Детская городская клиническая больница им. Н.Ф. Филатова Департамента здравоохранения города Москвы», член ассоциации детских хирургов России.
Яблокова Е.А. кандидат медицинских наук, доцент кафедры детских болезней ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), член Союза педиатров России.
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
• Врачи-педиатры.
• Врачи общей врачебной практики (семейные врачи).
• Врачи-гастроэнтерологи.
• Врачи-эндоскописты.
• Студенты медицинских ВУЗов.
• Обучающиеся в ординатуре.
Методы, используемые для сбора/селекции доказательств: поиск в электронных базах данных. Описание методов, использованных для оценки качества и силы доказательств: доказательной базой для рекомендаций являются публикации, вошедшие в Кохрейновскую библиотеку, базы данных EMBASE, MEDLINE и PubMed. Глубина поиска - 10 лет.
Методы, использованные для оценки качества и силы доказательств:
• консенсус экспертов;
• оценка значимости в соответствии с рейтинговой схемой.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД)для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| УДД | Расшифровка |
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в тч когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций(УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| УУР | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| в | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| с | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Методы, использованные для анализа доказательств:
• Обзоры опубликованных мета-анализов;
• Систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств:
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что, в свою очередь, влияет на силу вытекающих из нее рекомендаций.
На процессе оценки, несомненно, может сказываться и субъективный фактор. Для минимизации потенциальных ошибок каждое исследование оценивалось независимо, по меньшей мере двумя независимыми членами рабочей группы. Какие-либо различия в оценках обсуждались уже всей группой в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Таблицы доказательств:
Таблицы доказательств заполнялись членами рабочей группы.
Методы, использованные для формулирования рекомендаций:
Консенсус экспертов.
Экономический анализ:
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
• Внешняя экспертная оценка;
• Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать прежде всего то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Предварительная версия была также направлена рецензенту, не имеющему медицинского образования, для получения комментариев с точки зрения перспектив пациентов.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка:
Проект рекомендаций был рецензирован независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Рабочая группа:
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3.
Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата.Приложение А3,1 Документы и ресурсы, использованные при подготовке клинических рекомендаций.
• Государственный реестр лекарственных средств: https://grls.rosminzdrav.ru.• Приказ МЗ РФ от 20 декабря 2012г. 1183н «Об утверждении номенклатуры должностей медицинских работников и фармацевтических работников».
• Приказ МЗ РФ от 23 июля 2010 г. 541н. Единый квалификационный справочник должностей руководителей, специалистов и служащих, раздел Квалификационные характеристики должностей работников в сфере здравоохранения.
• Федеральный закон от 25,12,2018 № 489 489-ФЗ «О внесении изменений в статью 40 Федерального закона Об обязательном медицинском страховании в Российской Федерации и Федеральный закон Об основах охраны здоровья граждан в Российской Федерации по вопросам клинических рекомендаций».
• Приказ Минздрава России № 103н от 28,02,2019 г. Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации».
• Приказ Минздрава России от 13,10,2017 N 804н Об утверждении номенклатуры медицинских услуг .
• Приказ Министерства здравоохранения РФ от 14 января 2019 г. 4н «Об утверждении порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения».
• Приказ Министерства здравоохранения и социального развития РФ от 16 апреля 2012 г. N 366н «Об утверждении Порядка оказания педиатрической помощи».
• Приказ Минздрава России 203н от 10 мая 2017г «Об утверждении критериев оценки качества медицинской помощи».
Приложение А3,2 Примеры диагнозов.
• Язвенная болезнь двенадцатиперстной кишки с локализацией в луковице, H. pylori. -позитивная, впервые выявленная, с повышенной кислотообразующей функцией, фаза обострения.• Язвенная болезнь желудка, H. pylori -негативная, нормальная кислотообразующая функция желудка, часто рецидивирующее течение, фаза обострения, состоявшееся желудочное кровотечение.
При формулировке диагноза указывается локализация язвы (желудок, двенадцатиперстная кишка или двойное поражение), фаза заболевания (обострение, неполная клиническая ремиссия и клиническая ремиссия), эндоскопическая характеристика дефектов и стадия эволюции язвенного процесса, наличие H.pylori, осложнения.
Основной морфологический субстрат язвенной болезни в фазе обострения - язвенный дефект слизистой оболочки и сопряженный с ним активный гастродуоденит,, а в фазе ремиссии - постязвенные рубцовые изменения и гастродуоденит.
Отражение в клиническом диагнозе локализации и исхода заживления язвенных дефектов весьма важно как для определения тактики лечения больных, так и для прогнозирования дальнейшего течения заболевания, планирования адекватной программы диспансерных мероприятий.
Приложение А3,3 Эндоскопическая картина стадий язвенного поражения.
• Фаза обострения:І стадия - острая язва. На фоне выраженных воспалительных изменений СОЖ и ДПК - дефект (дефекты) округлой формы, окруженные воспалительным валом; выраженный отек. Дно язвы с наслоением фибрина.
II стадия - начало эпителизации. Уменьшается гиперемия, сглаживается воспалительный вал, края дефекта становятся неровными, дно язвы начинает очищаться от фибрина, намечается конвергенция складок к язве.
• Фаза неполной ремиссии:
III стадия - заживление язвы. На месте репарации - остатки грануляций, рубцы красного цвета разнообразной формы, с деформацией или без нее.
• Ремиссия:
Полная эпителизация язвенного дефекта (или спокойный рубец), отсутствуют признаки сопутствующего гастродуоденита.
Приложение А3,4 Схемы лечения инфекции H.pylori и рекомендуемые дозы препаратов для антихеликобактерной терапии (по 11,33).
Таблица 1. Возможные схемы антихеликобактерной терапии.| Кларитромицин (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) | Метронидазол** | Рекомендуемая схема лечения (14 дней) |
| Пациенты без аллергии к пенициллинам | ||
| Чувствительность | Чувствительность | ИПН + Амоксициллин** + Кларитромицин (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) |
| Резистентность | Чувствительность | ИПН + Амоксициллин** + Метронидазол** |
| Чувствительность | Резистентность | ИПН + Амоксициллин** + Кларитромицин (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) |
| Двойная резистентность или нет информации о чувствительности/резистентности | ≥ 8 лет: Висмута трикалия дицитрат**+ ИПН + Метронидазол**+ Тетрациклин < 8 лет: Висмута трикалия дицитрат** + ИПН + Амоксициллин** + Метронидазол** (с высокой дозой амоксициллина**) Висмута трикалия дицитрат** + ИПН + Амоксициллин** + Фуразолидон | |
| Пациенты с аллергией к пенициллинам | ||
| Чувствительность | Чувствительность | ИПН + Метронидазол** + Кларитромицин(таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) |
| Резистентность | Чувствительность | ≥ 8 лет: Висмута трикалия дицитрат** + ИПН + Метронидазол** + Тетрациклин < 8 лет: Висмута трикалия дицитрат** + ИПН + Метронидазол** + Фуразолидон |
| Чувствительность | Резистентность | ≥ 8 лет. Висмута трикалия дицитрат** + ИПН + Кларитромицин (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) + Тетрациклин Висмута трикалия дицитрат** + ИПН + Метронидазол**2 + Тетрациклин < 8 лет. Висмута трикалия дицитрат**+ ИПН + Кларитромицин** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) + Фуразолидон |
| Двойная резистентность или нет информации о чувствительности/резистентности | ≥ 8 лет. Висмута трикалия дицитрат** + ИПН + Метронидазол** + Тетрациклин < 8 лет: Висмута трикалия дицитрат** + ИПН + Метронидазол** + Фуразолидон | |
1 комбинация с Фуразолидоном - наименее желательный вариант в связи с не очень хорошей переносимостью данного препарата.
2 Высокая суточная доза, разделенная на 3 приема.
Таблица 2Дозы препаратов для лечения инфекции Hpylori у детей [33,117].
| Препарат | Масса тела (кг) | Утренняя доза (мг) | Вечерняя доза (мг) |
| Эзомепразол** или омепразол**1,2 | 15-24 | 20 | 20 |
| 25-34 | 30 | 30 | |
| >35 | 40 | 40 | |
| Амоксициллин** (стандартная доза) | 15-24 | 500 | 500 |
| 25-34 | 750 | 750 | |
| >35 | 1000 | 1000 | |
| Амоксициллин** (высокая доза) | 15-24 | 750 | 750 |
| 25-34 | 1000 | 1000 | |
| >35 | 1500 | 1500 | |
| Кларитромицин** (таблетки с 12 лет** и гранулы для приготовления суспензии для приема внутрь**) | 15-24 | 250 | 250 |
| 25-34 | 500 (3753) | 250 (375) | |
| >35 | 500 | 500 | |
| Метронидазол** | 15-24 | 250 | 250 |
| 25-34 | 500 | 250 | |
| >35 | 500 | 500 | |
| Тетрациклин | 25-50 мг/кг/сут, разделив на 4 приема (макс. доза 2000 мг) | ||
| Фуразолидон | <30 кг - по 100 мг 2 раза в день; >30 кг - по 200 мг 2 раза в день или 6-10 мг/кг/сут, разделив на 4 приема | ||
| Висмута трикалия дицитрат** | 8 мг/кг/сут, разделив на 4 приема | ||
1 Дозы других ИПН должны быть эквиваленты указанным дозам эзомепразола** и омепразола**.
2 Эзомепразол** в форме пеллет, покрытых кишечнорастворимой оболочкой, и гранул для приготовления суспензии для приема внутрь - при язвенной болезни двенадцатиперстной кишки - разрешен к применению детям с 4 лет согласно инструкции.
3 Если доступна суспензия, то суточную дозу нужно разделить на две равные дозы по 375 мг утром и вечером.
Таблица 3Дозы ингибиторов протонного насоса для лечения инфекции Hpylori, возможные для использования у детей [59].
| Препарат | Доза мг/кг/сут (разделенная на 2 приема) | Максимальная суточная доза (мг/сут) |
| Эзомепразол**1 | ≥4 лет Масса тела <30 кг, 20 мг/сут (в 2 приема) Масса тела ≥30 кг, 40 мг/сут (в 2 приема) | 40 |
| Рабепразол** | 0,5 мг/кг/сут (разделенная на 2 приема) | 20 |
| Омепразол** | 1,0 мг/кг/сут (разделенная на 2 приема) | 40 |
| Лансопразол | 1,5 мг/кг/сут (разделенная на 2 приема) | 60 |
1 Эзомепразол** в форме пеллет, покрытых кишечнорастворимой оболочкой, и гранул для приготовления суспензии для приема внутрь - при язвенной болезни двенадцатиперстной кишки - разрешен к применению детям с 4 лет согласно инструкции.
Приложение А3,5 Расшифровка примечаний.
** - лекарственный препарат, входящий в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2021 год (Распоряжение Правительства РФ от 12,10,2019 № 2406-р, от 23 ноября 2020 г. 3073-р).- применение off-label - вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и пациента в возрасте старше 15 лет.
Приложение В.
Информация для пациента.Язвенная болезнь желудка и 12-перстной кишки - хроническое рецидивирующее заболевание, опасное возможностью возникновения осложнений.
• Возникновение и прогрессирование болезни, ее рецидивы обусловлены комплексом факторов, некоторые из которых (наследственность ) не зависят от пациента, другие же полностью или частично управляются пациентом и его семьей (образ жизни, рабочие стереотипы, семейные традиции питания ).
• Язвы желудка часто являются побочным эффектом приема спасзмолитиков в комбинации с анальгетиками (обезболивающих) и нестероидных противовоспалительных препаратов.
• Алкоголь, пища, курение и эмоциональный стресс могут влиять на развитие язвенной болезни или на процесс её излечения.
• Боли в верхней части живота является наиболее распространенным симптомом язвы желудка, но многие язвы не вызывают никаких симптомов.
• Язвы могут быть причиной кровотечения в желудочно-кишечном тракте, что проявляется чёрным цветом кала. Развитие язвенной болезни желудка может стать причиной непроходимости между желудком и тонкой кишкой, следствием которой являются частые сильные рвоты.
• Язва желудка и ДПК почти всегда может быть успешно вылечена, как правило, без хирургического вмешательства. Во многих случаях язвенная болезнь может быть предотвращена.
• Лекарства, которыми лечат язву желудка и двенадцатиперстной кишки, включают средства, нейтрализующие или уменьшающие секрецию кислоты желудочного сока и антибиотики,(при наличии хеликобактерной инфекции) а также препараты, улучшающие сопротивляемость желудка и двенадцатиперстной кишки.
Советы пациенту и его семье:
• В течение всего периода обострения - режим физического и психологического покоя.
• Исключается прием ряда лекарственных препаратов (при отсутствии абсолютных показаний, необходимо посоветоваться с врачом).
• Питание дробное, 4-5 раз в день, с исключением жареного, жирного, соленого, острого. В течение первых 4-5 дней пища, механически и химически щадящая, затем диета с достаточным содержанием белка. Предпочтение отдается вареным блюдам.
• Диета должна соблюдаться и в период ремиссии.
• Отказ от вредных привычек.
Приложение Г1-ГN.
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.Не применяются.
|
|
Год актуализации информации
2021.
Связанные заболевания
Связанные клинические рекомендации
Связанные стандарты мед. помощи
- Стандарт санаторно-курортной помощи больным с болезнями пищевода, желудка и двенадцатиперстной кишки, кишечника
- Стандарт специализированной медицинской помощи при язвенной болезни желудка, двенадцатиперстной кишки
- Стандарт специализированной медицинской помощи детям при язвенной болезни желудка и двенадцатиперстной кишки
- Стандарт медицинской помощи больным с язвой желудка (при оказании специализированной помощи)
- Стандарт медицинской помощи больным язвой желудка и двенадцатиперстной кишки
- Стандарт первичной медико-санитарной помощи детям при язве желудка и двенадцатиперстной кишки (ремиссия)
- Стандарт первичной медико-санитарной помощи детям при язве желудка и двенадцатиперстной кишки (обострение)
- Стандарт медицинской помощи больным с язвой двенадцатиперстной кишки (при оказании специализированной помощи)