Другие названия и синонимы
Autoimmune hepatitis, Люпоидный гепатит.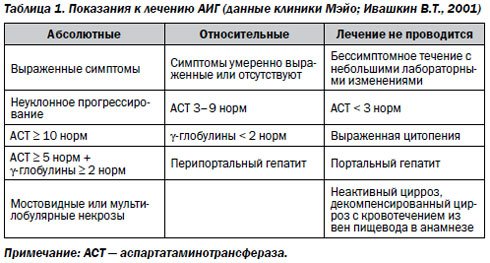
МКБ-10 коды
- МКБ-10
- K75.4 Аутоиммунный гепатит
|
|
Описание
Аутоиммунный гепатит (АИГ) представляет собой хроническое иммунно-опосредованное заболевание печени, характеризующееся развитием воспаления, фиброза, цирроза , в ряде случаев печеночной недостаточности.
Выделение АИГ в группе хронических заболеваний печени обусловлено существованием хронического гепатита с яркой системностью поражения и выработкой широкого спектра сывороточных аутоантител. Первое описание АИГ относится к 1950 году. У 6 молодых женщин отмечались сосудистые звездочки , высокие показатели СОЭ, хороший эффект от лечения гормональными препараты. В конце 60-х годов -начале 70-х годов проведены ряд исследований, показывающих высокую эффективность терапии гормонами и азатиоприном при АИГ.
Выделение АИГ в группе хронических заболеваний печени обусловлено существованием хронического гепатита с яркой системностью поражения и выработкой широкого спектра сывороточных аутоантител. Первое описание АИГ относится к 1950 году. У 6 молодых женщин отмечались сосудистые звездочки , высокие показатели СОЭ, хороший эффект от лечения гормональными препараты. В конце 60-х годов -начале 70-х годов проведены ряд исследований, показывающих высокую эффективность терапии гормонами и азатиоприном при АИГ.
Причины
Этиология данного заболевания неизвестна.
Распространенность. АИГ относится к редким заболеваниям: в Европе и Северной Америке заболеваемость составляет от 50 до 200 случаев на 1 млн населения. По данным европейской и североамериканской статик, больные аутоиммунным гепатитом составляют до 20 % всех больныххроническим гепатитом. В Японии АИГ диагностируется в 85 % всехслучаев хронического гепатита.
Распространенность. АИГ относится к редким заболеваниям: в Европе и Северной Америке заболеваемость составляет от 50 до 200 случаев на 1 млн населения. По данным европейской и североамериканской статик, больные аутоиммунным гепатитом составляют до 20 % всех больныххроническим гепатитом. В Японии АИГ диагностируется в 85 % всехслучаев хронического гепатита.
Патогенез
Болеют преимущественно женщины в молодом возрасте. Соотношение женщин и мужчин среди заболевших 8:1. Для аутоиммунного гепатита характерна тесная связь с рядом антигенов главного комплекса гистосовместимости (МНС; HLA у человека), участвующих в иммунорегуляторных процессах. В частности, ассоциированы аллели HLA DR3, Al, В8, DR4, DQ2, В14, с4AQ0. Имеются доказательства о значении дефекта транскрипционного фактора (AIRE-1) в развитии аутоиммунного гепатита (предполагается его роль в формировании и поддержании иммунологической толерантности). В связи с тем, что аутоиммунный гепатит развивается не у всех носителей указанных ваше аллелей, обсуждается роль дополнительных триггерных (пусковых) факторов, запускающих аутоиммунный процесс, среди которых вирусы гепатита А, В, С, герпеса (HHV-6 и HSV-1), Эпштейна-Барр, реактивные метаболиты лекарственных препаратов и Сущность патологического процесса сводится к дефициту иммунорегуляции. У больных, как правило, наблюдается снижение Т-супрессорной субпопуляции лимфоцитов, позже в крови и тканях появляются антиядерные антитела к гладким мышцам, к специфическому липопротеиду печени. Частое обнаружение LE-клеточного феномена с наличием выраженных системных (внепеченочных) поражений, свойственных системной красной волчанке, дало основание J. Mackay назвать это заболевание люпоидным гепатитом .
Клиническая картина
Проявления АИГ варьируют от тяжелого острого гепатита, хронического гепатита различной степени тяжести и выраженности воспалительной активности в печени до атипично протекающих наблюдений. У 50% выявляются лишь лабораторные признаки хронического гепатита, у 30% больных при первом обследовании выявляется цирроз печени, а у 20-40% внепеченочные проявления.
Начало заболевания, как правило, с неспецифических симптомов: слабости, тошноты, желтухи, болей в животе, болей в суставах. 30-40% больных демонстрируют острое начало заболевания по типу острого вирусного или токсического гепатита с выраженной желтухой, при несвоевременном лечении может развиться печеночная недостаточность с необходимостью неотложной пересадки печени.
Ассоциированные симптомы: Билирубинурия. Гипербилирубинемия. Гипофибриногенемия. Горький привкус во рту. Жажда. Истощение. Кал желтого цвета. Кал серовато-белого цвета. Кожный зуд. Лихорадка. Недомогание. Опсоурия. Отсутствие аппетита. Покалывание в боку. Постоянная жажда. Привкус во рту. Общая слабость. Тошнота. Тяжесть в подреберье. Увеличение СОЭ.
Начало заболевания, как правило, с неспецифических симптомов: слабости, тошноты, желтухи, болей в животе, болей в суставах. 30-40% больных демонстрируют острое начало заболевания по типу острого вирусного или токсического гепатита с выраженной желтухой, при несвоевременном лечении может развиться печеночная недостаточность с необходимостью неотложной пересадки печени.
Ассоциированные симптомы: Билирубинурия. Гипербилирубинемия. Гипофибриногенемия. Горький привкус во рту. Жажда. Истощение. Кал желтого цвета. Кал серовато-белого цвета. Кожный зуд. Лихорадка. Недомогание. Опсоурия. Отсутствие аппетита. Покалывание в боку. Постоянная жажда. Привкус во рту. Общая слабость. Тошнота. Тяжесть в подреберье. Увеличение СОЭ.
Диагностика
В диагностике аутоиммунного гепатита имеет значение определение таких маркеров, как антинуклеарные антитела (ANA), антитела к микросомам печени и почек (анти-LKM), антитела к гладкомышечным клеткам (SMA), растворимым печеночным (SLA) и печеночно-панкреатическим (LP) антигенам, асиало-гликопротеин к рецепторам (печеночному лектину) и антигенам плазматической мембраны гепатоцитов (LM).
Международная группа по изучению аутоиммунного гепатита (1993) опубликовала диагностические критерии этого заболевания, выделив диагнозы определенного и вероятного аутоиммунного гепатита.
Для постановки определенного диагноза необходимо отсутствие в анамнезе гемотрансфузий, приема гепатотоксических лекарств, злоупотребления алкоголем; отсутствие сывороточных маркеров активной вирусной инфекции; уровни у-глобулинов и IgG, более чем в 1,5 раза превышающие нормальные; титры ANA, SMA и LKM-1 1:88 для взрослых и выше 1: 20 для детей; значительное повышение активности АсАТ, АлАТ и менее выраженное повышение щелочной фосфатазы.
Как известно, у 95 % больных ПБЦ определение AM А представляет собой главный серологический диагностический маркер заболевания. У оставшейся части больных с характерными клинико-биохимическими и гистологическими признаками ПБЦ АМА не выявляются. При этом, по данным ряда авторов, нередко обнаруживаются ANA (до 71 %), SMA (до 37 %) и другие аутоантитела. До настоящего времени не сформировалось единого мнения, которое позволило бы отнести эту патологию к той или иной нозологической форме. Наиболее часто данный синдром обозначают как аутоиммунный холангит, течение которого лишено специфических черт, что дает основания для предположения о возможной секреции АМА в допороговой концентрации.
Истинный перекрестный синдром или АИГ/ПБЦ характеризуется смешанной картиной обоих заболеваний и наблюдается у 9 % от общего числа больных ПБЦ. У больного с доказанным ПБЦ диагноз перекрестного синдрома устанавливают при наличии не менее двух из четырех следующих критериев:
АлАТ не менее 5 норм,.
IgG не менее 2 норм.
SMA в диагностическом титре (> 1: 40).
Перипортальные ступенчатые некрозы в биоптате,.
Имеется четкая ассоциация синдрома АИГ/ПБЦ с HLA В8, DR3 и DR4. В сыворотке определяются разнообразные аутоантитела с наиболее типичной комбинацией в виде АМА, ANA и SMA. Частота выявления АМА у больных АИГ, по данным некоторых авторов, составляет 25 %, однако их титр обычно не достигает диагностического значения. Кроме того, АМА при АИГ, как правило, не обладают специфичностью для ПБЦ, хотя в 8 % случаев наблюдается выработка типичных антител к антигену внутренней мембраны митохондрий М2. Следует отметить возможность ложнопозитивного результата анализа на АМА при применении метода непрямой иммуиофлюоресценции ввиду сходной флюоресцентной картины с анти-LKM-l.
В то время как комбинация АИГ и ПБЦ встречается в основном У взрослых пациентов, перекрестный синдром (АИГ/ПСХ) наблюдается преимущественно в педиатрической практике, хотя описаны случаи заболевания и у взрослых. Начало АИГ/ПСХ обычно проявляется клинико-биохимическими признаками АИГ с последующим присоединением симптомов ПСХ. Спектр сывороточных аутоантител практически аналогичен АИГ-1. В развернутой стадии наряду с серологическими и гистологическими признаками АИГ выявляют биохимический синдром холестаза и фиброзные изменения желчных протоков в биоптате печени. Для данного состояния характерна ассоциация с воспалительными заболеваниями кишечника, обнаруживаемая, однако, относительно редко к моменту установления диагноза. Как и в случае изолированного ПСХ, важнейшим методом диагностики служит хонгиография (эндоскопическая ретроградная, чрескожная чреспечечная или магнитно-резонансная), позволяющая обнаружить мультифокальные кольцевидные стриктуры внутри- и внепеченочных желчных протоков. В то же время нормальная холангиографическая картина должна в случае изолированного поражения мелких протоков. В этой ситуации решающее диагностическое значение принадлежит биопсии печени. Изменения мелких внутрипеченочных протоков на ранней стадии представлены пролиферацией и отеком в одних портальных трактах и исчезновением их в других, часто в сочетании с фиброзирующщ, перихолангитом. Наряду с этим выявляется картина перипортального гепатита со ступенчатыми или мостовидными некрозами и массивной лимфомакрофагальной инфильтрацией портальной и перипортальной областей.
К диагностическим критериям перекрестного синдрома АИГ/ПСХ относят следующие:
Ассоциация с язвенным колитом реже, чем при ПСХ;
Ассоциация с болезнью Крона очень редка;
Повышение ЩФ, АлАТ, АсАТ;
ЩФ у 50 % в пределах нормы;
Высокая концентрация IgG;
Выявление ANA, SMA, pANCA в сыворотке;
Холангиографическая картина ПСХ;
Гистологическая картина ПСХ, АИГ (реже) или комбинация признаков.
При аутоиммунном гепатите при гистологическом исследовании в ткани печени обычно выявляется картина хронического гепатита с выраженной активностью. Типичны мостовидные некрозы паренхимы, большое количество плазматических клеток в воспалительном инфильтрате в портальных трактах и участках некроза гепатоцитов. Лимфоциты инфильтрата нередко образуют лимфоидные фолликулы в портальных трактах, а перипортальные гепатоциты создают так называемые гландулярные (железистоподобные) структуры. Массивная лимфоидная инфильтрация отмечается и в центрах долек с обширными некрозами гепатоцитов. Нередко встречается воспаление мелких желчных протоков и холангиол портальных трактов при сохранности междольковых и септальных протоков. Изменения гепатоцитов проявляются гидропической или жировой дистрофией.
При истинном перекрестном синдроме гистологически выявляют ступенчатые некрозы в сочетании с перидуктулярной инфильтрацией портальных трактов и деструкцией желчных протоков. СинДРоА АИГ/ПБЦ прогрессирует быстрее, чем типичный ПБЦ, при этом скорость прогрессировать коррелирует с выраженностью воспалительно некротических изменений паренхимы печени.
Иногда в качестве отдельного перекрестного синдрома выделяют также сочетание АИГ с аутоиммунным холангитом, протекавшее аналогично синдрому АИГ/ПБЦ, но в отсутствие сывороточных АМА.
Выявление сывороточных аутоантител отражает наиболее частый феномен аутоиммунизации при HCV-инфекции и наблюдается у 40-65 % больных. Спектр аутоантител достаточно широк и включает ANA (до 28 %), SMA (до 11 %), анти-LKM-l (до 7%), антифосфолипидные (до 25 %), антитиреоидные (до 12,5 %), pANCA (5-12 %), ревматоидный фактор, АМА, антитела к асиалогликопротеиновому рецептору (анти-ASGP-R) и Чаще всего титры этих антител не достигают диагностических значений, показательных для той или иной аутоиммунной патологии. У 89 % больных титры ANA и SMA не превышают 1 : 80. Серопозитивность одновременно по ANA и SMA отмечается не более чем в 4 % случаев. Кроме того, нередко аутоантитела при HCV-инфекции оказываются поликлональными, в то время как при аутоиммунных заболеваниях они реагируют со строго определенными эпитопами.
Исследование антител к HCV должно осуществляться с помощью иммуноферментного анализа (ИФА), как минимум, второго поколения, желательно с последующим подтверждением результатов рекомбинантным иммуноблоттингом. В начале 90-х гг., на заре изучения гепатита С, в литературе появились сообщения о том, что до 40 % больных АИГ-1 и до 80 % больных АИГ-2 позитивны по анти-HCV. Впоследствии, однако, выяснилось, что применение ИФА первого поколения у большинства больных дало ложноположительный результат, обусловленный неспецифической реакцией на фоне выраженной гипер-гаммаглобулинемии.
Вместе с тем у 11 % больных, которые соответствуют критериям Международной группы по изучению АИГ и не отвечают на иммуно-супрессивную терапию или у которых развивается рецидив после отмены кортикостероидов, наблюдается положительный результат полимеразной цепной реакции на HCV РНК, что дает основание рассматривать их как больных вирусным гепатитом С с аутоиммунными проявлениями.
Международная группа по изучению аутоиммунного гепатита (1993) опубликовала диагностические критерии этого заболевания, выделив диагнозы определенного и вероятного аутоиммунного гепатита.
Для постановки определенного диагноза необходимо отсутствие в анамнезе гемотрансфузий, приема гепатотоксических лекарств, злоупотребления алкоголем; отсутствие сывороточных маркеров активной вирусной инфекции; уровни у-глобулинов и IgG, более чем в 1,5 раза превышающие нормальные; титры ANA, SMA и LKM-1 1:88 для взрослых и выше 1: 20 для детей; значительное повышение активности АсАТ, АлАТ и менее выраженное повышение щелочной фосфатазы.
Как известно, у 95 % больных ПБЦ определение AM А представляет собой главный серологический диагностический маркер заболевания. У оставшейся части больных с характерными клинико-биохимическими и гистологическими признаками ПБЦ АМА не выявляются. При этом, по данным ряда авторов, нередко обнаруживаются ANA (до 71 %), SMA (до 37 %) и другие аутоантитела. До настоящего времени не сформировалось единого мнения, которое позволило бы отнести эту патологию к той или иной нозологической форме. Наиболее часто данный синдром обозначают как аутоиммунный холангит, течение которого лишено специфических черт, что дает основания для предположения о возможной секреции АМА в допороговой концентрации.
Истинный перекрестный синдром или АИГ/ПБЦ характеризуется смешанной картиной обоих заболеваний и наблюдается у 9 % от общего числа больных ПБЦ. У больного с доказанным ПБЦ диагноз перекрестного синдрома устанавливают при наличии не менее двух из четырех следующих критериев:
АлАТ не менее 5 норм,.
IgG не менее 2 норм.
SMA в диагностическом титре (> 1: 40).
Перипортальные ступенчатые некрозы в биоптате,.
Имеется четкая ассоциация синдрома АИГ/ПБЦ с HLA В8, DR3 и DR4. В сыворотке определяются разнообразные аутоантитела с наиболее типичной комбинацией в виде АМА, ANA и SMA. Частота выявления АМА у больных АИГ, по данным некоторых авторов, составляет 25 %, однако их титр обычно не достигает диагностического значения. Кроме того, АМА при АИГ, как правило, не обладают специфичностью для ПБЦ, хотя в 8 % случаев наблюдается выработка типичных антител к антигену внутренней мембраны митохондрий М2. Следует отметить возможность ложнопозитивного результата анализа на АМА при применении метода непрямой иммуиофлюоресценции ввиду сходной флюоресцентной картины с анти-LKM-l.
В то время как комбинация АИГ и ПБЦ встречается в основном У взрослых пациентов, перекрестный синдром (АИГ/ПСХ) наблюдается преимущественно в педиатрической практике, хотя описаны случаи заболевания и у взрослых. Начало АИГ/ПСХ обычно проявляется клинико-биохимическими признаками АИГ с последующим присоединением симптомов ПСХ. Спектр сывороточных аутоантител практически аналогичен АИГ-1. В развернутой стадии наряду с серологическими и гистологическими признаками АИГ выявляют биохимический синдром холестаза и фиброзные изменения желчных протоков в биоптате печени. Для данного состояния характерна ассоциация с воспалительными заболеваниями кишечника, обнаруживаемая, однако, относительно редко к моменту установления диагноза. Как и в случае изолированного ПСХ, важнейшим методом диагностики служит хонгиография (эндоскопическая ретроградная, чрескожная чреспечечная или магнитно-резонансная), позволяющая обнаружить мультифокальные кольцевидные стриктуры внутри- и внепеченочных желчных протоков. В то же время нормальная холангиографическая картина должна в случае изолированного поражения мелких протоков. В этой ситуации решающее диагностическое значение принадлежит биопсии печени. Изменения мелких внутрипеченочных протоков на ранней стадии представлены пролиферацией и отеком в одних портальных трактах и исчезновением их в других, часто в сочетании с фиброзирующщ, перихолангитом. Наряду с этим выявляется картина перипортального гепатита со ступенчатыми или мостовидными некрозами и массивной лимфомакрофагальной инфильтрацией портальной и перипортальной областей.
К диагностическим критериям перекрестного синдрома АИГ/ПСХ относят следующие:
Ассоциация с язвенным колитом реже, чем при ПСХ;
Ассоциация с болезнью Крона очень редка;
Повышение ЩФ, АлАТ, АсАТ;
ЩФ у 50 % в пределах нормы;
Высокая концентрация IgG;
Выявление ANA, SMA, pANCA в сыворотке;
Холангиографическая картина ПСХ;
Гистологическая картина ПСХ, АИГ (реже) или комбинация признаков.
При аутоиммунном гепатите при гистологическом исследовании в ткани печени обычно выявляется картина хронического гепатита с выраженной активностью. Типичны мостовидные некрозы паренхимы, большое количество плазматических клеток в воспалительном инфильтрате в портальных трактах и участках некроза гепатоцитов. Лимфоциты инфильтрата нередко образуют лимфоидные фолликулы в портальных трактах, а перипортальные гепатоциты создают так называемые гландулярные (железистоподобные) структуры. Массивная лимфоидная инфильтрация отмечается и в центрах долек с обширными некрозами гепатоцитов. Нередко встречается воспаление мелких желчных протоков и холангиол портальных трактов при сохранности междольковых и септальных протоков. Изменения гепатоцитов проявляются гидропической или жировой дистрофией.
При истинном перекрестном синдроме гистологически выявляют ступенчатые некрозы в сочетании с перидуктулярной инфильтрацией портальных трактов и деструкцией желчных протоков. СинДРоА АИГ/ПБЦ прогрессирует быстрее, чем типичный ПБЦ, при этом скорость прогрессировать коррелирует с выраженностью воспалительно некротических изменений паренхимы печени.
Иногда в качестве отдельного перекрестного синдрома выделяют также сочетание АИГ с аутоиммунным холангитом, протекавшее аналогично синдрому АИГ/ПБЦ, но в отсутствие сывороточных АМА.
Выявление сывороточных аутоантител отражает наиболее частый феномен аутоиммунизации при HCV-инфекции и наблюдается у 40-65 % больных. Спектр аутоантител достаточно широк и включает ANA (до 28 %), SMA (до 11 %), анти-LKM-l (до 7%), антифосфолипидные (до 25 %), антитиреоидные (до 12,5 %), pANCA (5-12 %), ревматоидный фактор, АМА, антитела к асиалогликопротеиновому рецептору (анти-ASGP-R) и Чаще всего титры этих антител не достигают диагностических значений, показательных для той или иной аутоиммунной патологии. У 89 % больных титры ANA и SMA не превышают 1 : 80. Серопозитивность одновременно по ANA и SMA отмечается не более чем в 4 % случаев. Кроме того, нередко аутоантитела при HCV-инфекции оказываются поликлональными, в то время как при аутоиммунных заболеваниях они реагируют со строго определенными эпитопами.
Исследование антител к HCV должно осуществляться с помощью иммуноферментного анализа (ИФА), как минимум, второго поколения, желательно с последующим подтверждением результатов рекомбинантным иммуноблоттингом. В начале 90-х гг., на заре изучения гепатита С, в литературе появились сообщения о том, что до 40 % больных АИГ-1 и до 80 % больных АИГ-2 позитивны по анти-HCV. Впоследствии, однако, выяснилось, что применение ИФА первого поколения у большинства больных дало ложноположительный результат, обусловленный неспецифической реакцией на фоне выраженной гипер-гаммаглобулинемии.
Вместе с тем у 11 % больных, которые соответствуют критериям Международной группы по изучению АИГ и не отвечают на иммуно-супрессивную терапию или у которых развивается рецидив после отмены кортикостероидов, наблюдается положительный результат полимеразной цепной реакции на HCV РНК, что дает основание рассматривать их как больных вирусным гепатитом С с аутоиммунными проявлениями.
|
|
Лечение
Абсолютными ползаниями к лечению аутоиммунного гепатита являются:
- клинические симптомы;
- прогрессирование патологического процесса;
- АлАТ > норм;
- АсАТ > 5 норм;
- у-глобулины > 2 норм;
- гистологически в ткани печени обнаруживаются мостовидные или мультилобулярные некрозы.
Относительными показаниями служат:
Отсутствие и умеренно выраженная симптоматика заболевания;
- АсАТ от 3 до 9 норм;
- у-глобулины < 2 норм;
- морфологически-перипортальный гепатит.
Лечение не проводится в случае бессимптомного течения заболевания декомпенсированного цирроза с кровотечением из вен пищевода в анамнезе, при АсАТ < 3 норм, выраженной цитопении, наличии гистологических признаков портального гепатита, неактивного цирроза.
В качестве патогенетической терапии чаще используют глюкокортикостероиды. Препараты данной группы снижают активность патологического процесса в печени, что обусловлено иммуносупрессивным влиянием на К-клетки, повышением активности Т-супрессоров, значительным снижением интенсивности аутоиммунных реакций, направленных против гепатоцитов.
Препаратами выбора служат преднизолон или метилпреднизолон. Начальная суточная доза преднизолона составляет 60 мг (реже 50 мг) в течение 1-й недели, 40 мг - в течение 2-й недели, на протяжении 3-й и 4-й недель - 30 мг, поддерживающая доза - 20 мг. Суточную дозу препарата уменьшают медленно (под контролем клинического течения заболевания, показателей активности процесса), на 2,5 мг каждые 1-2 нед, до поддерживающей, которую больной принимает до достижения полной клинико-лабораторной и гистологической ремиссии. Лечение поддерживающими дозами преднизолона проводится длительно: от 6 мес до 2 лет, а у ряда больных - в течение всей жизни.
При достижении поддерживающей дозы во избежание угнетения надпочечников целесообразно проводить альтернирующую терапию преднизолоном, принимать препарат в двойной дозе через день. Перспективным представляется использование кортикостероида нового поколения будесонида, обладающего высокой аффинностью к корти-костероидным рецепторам и минимальными местными побочными эффектами.
Относительными противопоказаниями к приему глюкокортикосте-роидов являются диабет, артериальная гипертензия, остеопороз, постменопауза, кушингоидный синдром.
Терапию делагилом начинают вместе с преднизолоном.
Длительность курса лечения делагилом - от 1,5 до 6 мес, у отдельных вольных - до 1,5-2 лет. Прием указанных препаратов провидится по следующей схеме: преднизолон в течение 1-й недели используется в дозе 30 мг, 2-й недели - 20 мг, 3-й и 4-й недель - 15 мг. Поддерживающая доза составляет 10 мг. Азатиоприн применяется по 5№ мг постоянно после первой недели. Противопоказаниями являются злокачественные новообразования, беременность, цитопения, непереносимость азатиоприна. При недостаточной эффективности схемы целесообразно повышение дозы азатиоприна до 150 мг в сутки. Поддерживающая доза предиизолона составляет 5-10 мг, азатиоирбина - 25-50 мг.
Показаниями к трансплантации печени служат неэффективность первичного курса лечения в течение 4 лет, множественные рецидивы, побочные эффекты стероидной и цитостатической терапии МПрогноз трансплантации, как правило, благоприятный, 5-летняя выживаемость превышает 90 %. Риск рецидива выше у больных АИГ типа 1, особенно HLA DRS-позитивных, возрастающих по мере увеличения срока после трансплантации. В настоящее время имеются экспериментальные схемы лечения АИГ, включающие такие препараты, как циклоспорин, такролимус, микофенолата мофетил, будесониац и Однако их применение не вышло за рамки клинических испытаний.
У многих больных с истинным перекрестным синдромом АИГ/ПКп эффективны кортикостероиды, что при неясности диагноза позволяе рекомендовать пробное назначение преднизолона в дозах, применяв мых для лечения АИГ, на срок 3-6 мес. Большинство авторов указы вают на высокую эффективность комбинации преднизолона с УДХК которая приводит к полной ремиссии у большинства пациентов после индукции ремиссии пациенты должны получать поддерживающую терапию преднизолоном (10-15 мг) и УДХК (10-15 мг/ki в сутки) неопределенно длительное время. Вопрос об отмене препаратов, как и в случае изолированного АИГ, можно ставить при полном исчезновении биохимических, серологических и гистологических признаков заболевания.
Недостаточная эффективность преднизолона или тяжелые побочные эффекты при его назначении служат основанием для подключения к терапии азатиоприна.
Сведения об эффективности иммуносупрессоров при синдроме АИГ/ПСХ противоречивы. В то время как одни исследователи указывают на резистентность к кортикостероидной терапии большинства больных, другие приводят противоположные данные о хорошем ответе на монотерапию преднизолоном или его комбинацию с азатиоприном. Недавно опубликованные статистические данные свидетельствуют о том, что на фоне лечения иммуносупрессорами умирают или подвергаются трансплантации печени более 30 % пациентов (при изолированном АИГ только 8 %). Следует принимать во внимание, что больные ПСХ относятся к категории лиц с повышенным риском остеопороза и билиарного сепсиса, что существенно ограничивает возможности применения у них кортикостероидов и азатиоприна.
УДХК (урсосан) в дозе не менее 15-20 мг/кг, по-видимому, может рассматриваться в качестве препарата выбора при синдроме АИГ/ПСХ. Представляется целесообразным проведение пробной терапии УДХК в комбинации с преднизолоном, учитывая предварительные положительные результаты клинических исследований. При отсутствии значимого эффекта преднизолон следует отменить во избежание развития побочного действия pi продолжить лечение повышенными дозами УДХК.
Лечение верифицированной HCV-инфекции с выраженным аутоиммунным компонентом представляет особые трудности.
Назначение ИФН-сс, который сам по себе является индуктором аутоиммунных процессов, может привести к ухудшению клинического течения заболевания вплоть до развития прогрессирующей печеночной недостаточно описаны случаи фульминантной печеночной недостаточности.
На фоне применения ИФН-а у больных ХГС с наличием маркеров утоиммунизации, при этом важным серологическим признаком было нарастание титра антител к ASGP-R. Анти-ASGP-R не только характерны для АИГ-1, но и, вероятно, играют роль в патогенезе повреждения печени при этом заболевании. В то же время кортикостероиды при вирусном гепатите способствуют усилению репликации вируса за счет подавления механизмов естественной противовирусной резистентности.
Клиника Мейо предлагает применение кортикостероидов при титрах ANA или SMA более 1 : 320, в случае же меньшей выраженности аутоиммунного компонента и выявления сывороточной HCV РНК рекомендуется назначение ИФН-а. Другие авторы предпочитают не придерживаться столь строгих критериев, указывая на хороший эффект иммуносупрессоров (преднизолона и азатиоприна) при HCV-инфекции с выраженным аутоиммунным компонентом.
Таким образом, возможные варианты тактики лечения больных HCV-инфекцией с аутоиммунным компонентом предусматривают ориентацию на титры аутоантител, проведение иммуносупрессивной терапии, подавление иммуносупрессорами аутоиммунного компонента с последующим применением ИФН-а.
В случае принятия решения о начале интерферонотерапии больные из групп риска подлежат тщательному мониторингу на протяжении всего курса лечения. Следует отметить, что терапия ИФН-а даже У больных без исходного аутоиммунного компонента может приводить к появлению разнообразных аутоиммунных синдромов. Их выраженность варьирует от бессимптомного образования аутоантител до развернутой клинической картины классического аутоиммунного заболевания. По крайней мере один вид аутоантител появляется на фоне интерферонотерапии у 33-87 % больных хроническим гепатитом С. аиболее частым из аутоиммунных синдромов является нарушение Функции щитовидной железы в форме гипо- или гипертиреоидизма, Развивающееся у 2,5-20 % пациентов.
- клинические симптомы;
- прогрессирование патологического процесса;
- АлАТ > норм;
- АсАТ > 5 норм;
- у-глобулины > 2 норм;
- гистологически в ткани печени обнаруживаются мостовидные или мультилобулярные некрозы.
Относительными показаниями служат:
Отсутствие и умеренно выраженная симптоматика заболевания;
- АсАТ от 3 до 9 норм;
- у-глобулины < 2 норм;
- морфологически-перипортальный гепатит.
Лечение не проводится в случае бессимптомного течения заболевания декомпенсированного цирроза с кровотечением из вен пищевода в анамнезе, при АсАТ < 3 норм, выраженной цитопении, наличии гистологических признаков портального гепатита, неактивного цирроза.
В качестве патогенетической терапии чаще используют глюкокортикостероиды. Препараты данной группы снижают активность патологического процесса в печени, что обусловлено иммуносупрессивным влиянием на К-клетки, повышением активности Т-супрессоров, значительным снижением интенсивности аутоиммунных реакций, направленных против гепатоцитов.
Препаратами выбора служат преднизолон или метилпреднизолон. Начальная суточная доза преднизолона составляет 60 мг (реже 50 мг) в течение 1-й недели, 40 мг - в течение 2-й недели, на протяжении 3-й и 4-й недель - 30 мг, поддерживающая доза - 20 мг. Суточную дозу препарата уменьшают медленно (под контролем клинического течения заболевания, показателей активности процесса), на 2,5 мг каждые 1-2 нед, до поддерживающей, которую больной принимает до достижения полной клинико-лабораторной и гистологической ремиссии. Лечение поддерживающими дозами преднизолона проводится длительно: от 6 мес до 2 лет, а у ряда больных - в течение всей жизни.
При достижении поддерживающей дозы во избежание угнетения надпочечников целесообразно проводить альтернирующую терапию преднизолоном, принимать препарат в двойной дозе через день. Перспективным представляется использование кортикостероида нового поколения будесонида, обладающего высокой аффинностью к корти-костероидным рецепторам и минимальными местными побочными эффектами.
Относительными противопоказаниями к приему глюкокортикосте-роидов являются диабет, артериальная гипертензия, остеопороз, постменопауза, кушингоидный синдром.
Терапию делагилом начинают вместе с преднизолоном.
Длительность курса лечения делагилом - от 1,5 до 6 мес, у отдельных вольных - до 1,5-2 лет. Прием указанных препаратов провидится по следующей схеме: преднизолон в течение 1-й недели используется в дозе 30 мг, 2-й недели - 20 мг, 3-й и 4-й недель - 15 мг. Поддерживающая доза составляет 10 мг. Азатиоприн применяется по 5№ мг постоянно после первой недели. Противопоказаниями являются злокачественные новообразования, беременность, цитопения, непереносимость азатиоприна. При недостаточной эффективности схемы целесообразно повышение дозы азатиоприна до 150 мг в сутки. Поддерживающая доза предиизолона составляет 5-10 мг, азатиоирбина - 25-50 мг.
Показаниями к трансплантации печени служат неэффективность первичного курса лечения в течение 4 лет, множественные рецидивы, побочные эффекты стероидной и цитостатической терапии МПрогноз трансплантации, как правило, благоприятный, 5-летняя выживаемость превышает 90 %. Риск рецидива выше у больных АИГ типа 1, особенно HLA DRS-позитивных, возрастающих по мере увеличения срока после трансплантации. В настоящее время имеются экспериментальные схемы лечения АИГ, включающие такие препараты, как циклоспорин, такролимус, микофенолата мофетил, будесониац и Однако их применение не вышло за рамки клинических испытаний.
У многих больных с истинным перекрестным синдромом АИГ/ПКп эффективны кортикостероиды, что при неясности диагноза позволяе рекомендовать пробное назначение преднизолона в дозах, применяв мых для лечения АИГ, на срок 3-6 мес. Большинство авторов указы вают на высокую эффективность комбинации преднизолона с УДХК которая приводит к полной ремиссии у большинства пациентов после индукции ремиссии пациенты должны получать поддерживающую терапию преднизолоном (10-15 мг) и УДХК (10-15 мг/ki в сутки) неопределенно длительное время. Вопрос об отмене препаратов, как и в случае изолированного АИГ, можно ставить при полном исчезновении биохимических, серологических и гистологических признаков заболевания.
Недостаточная эффективность преднизолона или тяжелые побочные эффекты при его назначении служат основанием для подключения к терапии азатиоприна.
Сведения об эффективности иммуносупрессоров при синдроме АИГ/ПСХ противоречивы. В то время как одни исследователи указывают на резистентность к кортикостероидной терапии большинства больных, другие приводят противоположные данные о хорошем ответе на монотерапию преднизолоном или его комбинацию с азатиоприном. Недавно опубликованные статистические данные свидетельствуют о том, что на фоне лечения иммуносупрессорами умирают или подвергаются трансплантации печени более 30 % пациентов (при изолированном АИГ только 8 %). Следует принимать во внимание, что больные ПСХ относятся к категории лиц с повышенным риском остеопороза и билиарного сепсиса, что существенно ограничивает возможности применения у них кортикостероидов и азатиоприна.
УДХК (урсосан) в дозе не менее 15-20 мг/кг, по-видимому, может рассматриваться в качестве препарата выбора при синдроме АИГ/ПСХ. Представляется целесообразным проведение пробной терапии УДХК в комбинации с преднизолоном, учитывая предварительные положительные результаты клинических исследований. При отсутствии значимого эффекта преднизолон следует отменить во избежание развития побочного действия pi продолжить лечение повышенными дозами УДХК.
Лечение верифицированной HCV-инфекции с выраженным аутоиммунным компонентом представляет особые трудности.
Назначение ИФН-сс, который сам по себе является индуктором аутоиммунных процессов, может привести к ухудшению клинического течения заболевания вплоть до развития прогрессирующей печеночной недостаточно описаны случаи фульминантной печеночной недостаточности.
На фоне применения ИФН-а у больных ХГС с наличием маркеров утоиммунизации, при этом важным серологическим признаком было нарастание титра антител к ASGP-R. Анти-ASGP-R не только характерны для АИГ-1, но и, вероятно, играют роль в патогенезе повреждения печени при этом заболевании. В то же время кортикостероиды при вирусном гепатите способствуют усилению репликации вируса за счет подавления механизмов естественной противовирусной резистентности.
Клиника Мейо предлагает применение кортикостероидов при титрах ANA или SMA более 1 : 320, в случае же меньшей выраженности аутоиммунного компонента и выявления сывороточной HCV РНК рекомендуется назначение ИФН-а. Другие авторы предпочитают не придерживаться столь строгих критериев, указывая на хороший эффект иммуносупрессоров (преднизолона и азатиоприна) при HCV-инфекции с выраженным аутоиммунным компонентом.
Таким образом, возможные варианты тактики лечения больных HCV-инфекцией с аутоиммунным компонентом предусматривают ориентацию на титры аутоантител, проведение иммуносупрессивной терапии, подавление иммуносупрессорами аутоиммунного компонента с последующим применением ИФН-а.
В случае принятия решения о начале интерферонотерапии больные из групп риска подлежат тщательному мониторингу на протяжении всего курса лечения. Следует отметить, что терапия ИФН-а даже У больных без исходного аутоиммунного компонента может приводить к появлению разнообразных аутоиммунных синдромов. Их выраженность варьирует от бессимптомного образования аутоантител до развернутой клинической картины классического аутоиммунного заболевания. По крайней мере один вид аутоантител появляется на фоне интерферонотерапии у 33-87 % больных хроническим гепатитом С. аиболее частым из аутоиммунных синдромов является нарушение Функции щитовидной железы в форме гипо- или гипертиреоидизма, Развивающееся у 2,5-20 % пациентов.
|
|