Другие названия и синонимы
Raltegravir.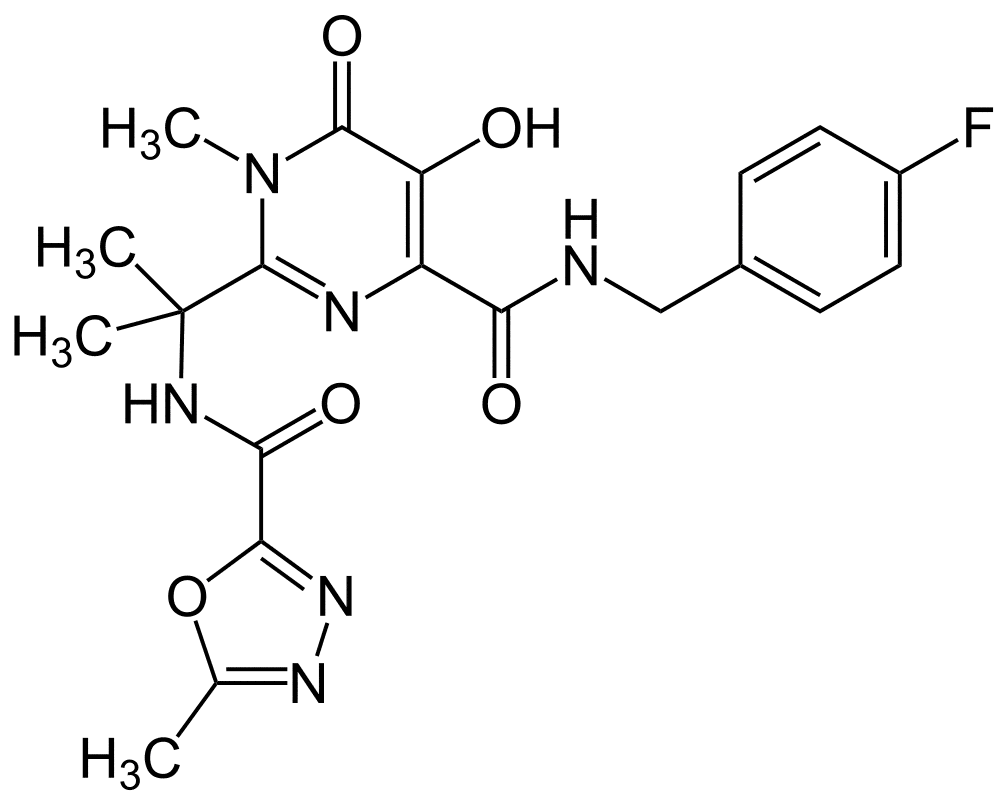
Фармакологическая группа
|
|
Латинское название
Raltegravirum ( Raltegraviri).
Химическое название
N-(2-(4-(4-Фторбензилкарбамоил)-5-гидрокси-1-метил-6-оксо-1,6-дигидропиримидин-2-ил)пропан-2-ил)-5-метил-1,3,4-оксадиазол-2-карбоксамид (в виде калиевой соли).
Используется в лечении
Код CAS
871038-72-1.
Фармакологическое действие
Антиретровирусное.
Характеристика вещества
Противовирусное средство - ингибитор интегразы ВИЧ.
Фармакодинамика
Фармакодинамика.
Ралтегравир ингибирует каталитическую активность ВИЧ-интегразы - фермента, участвующего в репликации вируса ВИЧ. Ингибирование интегразы предотвращает ковалентное введение (интеграцию) генома ВИЧ в геном клетки хозяина на ранних стадиях развития инфекции. Не включенные в ДНК человека геномы ВИЧ не способны индуцировать продукцию новых вирусных частиц, поэтому подавление процесса интеграции предотвращает распространение вирусной инфекции в организме. Ингибирующая способность ралтегравира в отношении фосфотрансфераз человека, включая ДНК-полимеразы α, β и γ, выражена незначительно.
Микробиология.
При плазменной концентрации (31±20) нмоль/л ралтегравир обеспечивал подавление репликации вируса на 95% (IC95) в клеточных культурах человеческих Т-лимфоцитов, инфицированных адаптированным к культурам клеток вариантом H9IIIB ВИЧ-1 по сравнению с контрольной вирусинфицированной культурой клеток. IC95 достигалась в концентрациях от 6 до 50 нмоль/л в культурах человеческих митогенактивированных мононуклеаров периферической крови, инфицированных различными первичными клиническими штаммами ВИЧ-1, включая штаммы 5 не-В-подтипов ВИЧ-1, а также штаммы, резистентные к ингибиторам обратной транскриптазы и ингибиторам протеазы ВИЧ. При анализе одного цикла инфекции ралтегравир подавлял инфицирование, вызванное 23 штаммами ВИЧ, представляющими 5 не-В-подтипов и 5 циркулирующих рекомбинантных форм, с 50IC50 = 5-12 нмоль/л. Ралтегравир также подавлял репликацию штаммов ВИЧ-2 при тестировании на клетках линии СЕМх174 (IC95 = 6 нмоль/л). При одновременном введении в культуру человеческих Т-лимфоцитов, инфицированных вариантом Н9IIIВ вируса ВИЧ-1, ралтегравира и НИОТ (зидовудин, зальцитабин, ставудин, абакавир, тенофовир, диданозин и ламивудин), ННИОТ (эфавиренз, невирапин и делавирдин), ингибиторов протеазы ВИЧ (индинавир, саквинавир, ритонавир, ампренавир, лопинавир, нелфинавир и атазанавир) или ингибитора слияния (энфувиртид) наблюдалась антиретровирусная активность от аддитивной до синергичной.
Мутации интегразы ВИЧ-1, способствующие появлению резистентных к ралтегравиру штаммов вируса (развивались in vitro >in vitro или у пациентов, принимавших ралтегравир), в основном включают замены в положениях 155 (N155 замена на H), 148 (Q148 замена на Н, К или R) или 143 (Y143 замена на С, H или R) в сочетании с одной или более дополнительными мутациями (например L74M, E92Q, Т97А, Е138А/ G140A/S, V151I, G163R, S230R).
Рекомбинантные вирусы с одной первичной мутацией (Q148H, К или R или N155H) отличались сниженной способностью к репликации и сниженной чувствительностью к ралтегравиру in vitro >in vitro. Вторичные мутации вируса еще больше снижали чувствительность к ралтегравиру, иногда компенсируя сниженную способность вируса к репликации. Мутации, ассоциированные с развитием резистентности к ралтегравиру, также могут приводить к формированию резистентности к другому ингибитору переноса цепи интегразой - элвитегравиру. При замене в положении 143 чувствительность к ралтегравиру снижается в большей степени, чем чувствительность к элвитегравиру, тогда как мутации в E92Q вызывают бóльшую резистентность к элвитегравиру, чем к ралтегравиру. У вирусов с мутацией в положении 148 в сочетании с одной и более дополнительными мутациями, вызывающими резистентность к ралтегравиру, также может наблюдаться клинически значимая резистентность к долутегравиру.
Влияние на электрофизиологическую активность сердца или показатели ЭКГ.
В плацебо-контролируемом клиническом исследовании с участием здоровых добровольцев однократный прием 1600 мг ралтегравира не оказывал влияние на продолжительность интервала QTc, несмотря на то что Сmax ралтегравира в плазме крови была в 4 раза больше, чем при однократном приеме ралтегравира в дозе 400 мг.
Ралтегравир ингибирует каталитическую активность ВИЧ-интегразы - фермента, участвующего в репликации вируса ВИЧ. Ингибирование интегразы предотвращает ковалентное введение (интеграцию) генома ВИЧ в геном клетки хозяина на ранних стадиях развития инфекции. Не включенные в ДНК человека геномы ВИЧ не способны индуцировать продукцию новых вирусных частиц, поэтому подавление процесса интеграции предотвращает распространение вирусной инфекции в организме. Ингибирующая способность ралтегравира в отношении фосфотрансфераз человека, включая ДНК-полимеразы α, β и γ, выражена незначительно.
Микробиология.
При плазменной концентрации (31±20) нмоль/л ралтегравир обеспечивал подавление репликации вируса на 95% (IC95) в клеточных культурах человеческих Т-лимфоцитов, инфицированных адаптированным к культурам клеток вариантом H9IIIB ВИЧ-1 по сравнению с контрольной вирусинфицированной культурой клеток. IC95 достигалась в концентрациях от 6 до 50 нмоль/л в культурах человеческих митогенактивированных мононуклеаров периферической крови, инфицированных различными первичными клиническими штаммами ВИЧ-1, включая штаммы 5 не-В-подтипов ВИЧ-1, а также штаммы, резистентные к ингибиторам обратной транскриптазы и ингибиторам протеазы ВИЧ. При анализе одного цикла инфекции ралтегравир подавлял инфицирование, вызванное 23 штаммами ВИЧ, представляющими 5 не-В-подтипов и 5 циркулирующих рекомбинантных форм, с 50IC50 = 5-12 нмоль/л. Ралтегравир также подавлял репликацию штаммов ВИЧ-2 при тестировании на клетках линии СЕМх174 (IC95 = 6 нмоль/л). При одновременном введении в культуру человеческих Т-лимфоцитов, инфицированных вариантом Н9IIIВ вируса ВИЧ-1, ралтегравира и НИОТ (зидовудин, зальцитабин, ставудин, абакавир, тенофовир, диданозин и ламивудин), ННИОТ (эфавиренз, невирапин и делавирдин), ингибиторов протеазы ВИЧ (индинавир, саквинавир, ритонавир, ампренавир, лопинавир, нелфинавир и атазанавир) или ингибитора слияния (энфувиртид) наблюдалась антиретровирусная активность от аддитивной до синергичной.
Мутации интегразы ВИЧ-1, способствующие появлению резистентных к ралтегравиру штаммов вируса (развивались in vitro >in vitro или у пациентов, принимавших ралтегравир), в основном включают замены в положениях 155 (N155 замена на H), 148 (Q148 замена на Н, К или R) или 143 (Y143 замена на С, H или R) в сочетании с одной или более дополнительными мутациями (например L74M, E92Q, Т97А, Е138А/ G140A/S, V151I, G163R, S230R).
Рекомбинантные вирусы с одной первичной мутацией (Q148H, К или R или N155H) отличались сниженной способностью к репликации и сниженной чувствительностью к ралтегравиру in vitro >in vitro. Вторичные мутации вируса еще больше снижали чувствительность к ралтегравиру, иногда компенсируя сниженную способность вируса к репликации. Мутации, ассоциированные с развитием резистентности к ралтегравиру, также могут приводить к формированию резистентности к другому ингибитору переноса цепи интегразой - элвитегравиру. При замене в положении 143 чувствительность к ралтегравиру снижается в большей степени, чем чувствительность к элвитегравиру, тогда как мутации в E92Q вызывают бóльшую резистентность к элвитегравиру, чем к ралтегравиру. У вирусов с мутацией в положении 148 в сочетании с одной и более дополнительными мутациями, вызывающими резистентность к ралтегравиру, также может наблюдаться клинически значимая резистентность к долутегравиру.
Влияние на электрофизиологическую активность сердца или показатели ЭКГ.
В плацебо-контролируемом клиническом исследовании с участием здоровых добровольцев однократный прием 1600 мг ралтегравира не оказывал влияние на продолжительность интервала QTc, несмотря на то что Сmax ралтегравира в плазме крови была в 4 раза больше, чем при однократном приеме ралтегравира в дозе 400 мг.
Фармакокинетика
Всасывание. Ралтегравир быстро всасывается после приема натощак, Сmax в плазме крови определяется примерно через 3 Значения AUC и Сmax ралтегравира увеличиваются пропорционально дозе в диапазоне от 100 до 1600 мг. Значения С12 ралтегравира возрастают пропорционально дозе в диапазоне от 100 до 800 мг и - в несколько меньшей степени в диапазоне от 100 до 1600 мг. При режиме приема 2 раза в сутки равновесное состояние достигается быстро, примерно в течение 2 дней после начала лечения. Значения AUC и Сmax свидетельствуют в пользу отсутствия или минимальной кумуляции ралтегравира, значение С12 - в пользу незначительной кумуляции. В режиме монотерапии по 400 мг 2 раза в сутки значение среднего геометрического для AUC0-12 составляло 14,3 мкмоль/ч×л, значение С12 - 142 нмоль/л.
Абсолютная биодоступность ралтегравира не установлена. Ралтегравир можно принимать вне зависимости от режима приема пищи.
Распределение. Примерно 83% ралтегравира связывается с белками плазмы в диапазоне концентраций от 2 до 10 мкмоль/л.
Ралтегравир легко преодолевал плацентарный барьер в экспериментальных исследованиях на крысах, но не проникал через ГЭБ в заметной степени.
В двух клинических исследованиях с участием пациентов, инфицированных ВИЧ-1, которые принимали ралтегравир в дозе 400 мг 2 раза в сутки, ралтегравир быстро определялся в спинномозговой жидкости. В первом исследовании средняя концентрация ралтегравира в спинномозговой жидкости составила 5,8% (от 1 до 53,5%) от соответствующей концентрации в плазме крови, а во втором исследовании - 3% (от 1 до 61%) от соответствующей концентрации в плазме крови. Медианы полученных значений были приблизительно в 3-6 раз ниже, чем концентрации свободной фракции ралтегравира в плазме крови.
Метаболизм и выведение. Исследования с использованием селективных ингибиторов изоформы фермента УДФ-ГТ, полученной путем экспрессии комплементарной ДНК, показали, что УДФ-ГТ1А1 является основным ферментом, участвующим в образовании ралтегравир-глюкуронида. Эти данные показали, что основной путь метаболизма ралтегравира у человека представлен процессом глюкуронирования, опосредованного УДФ-ГТ1А1. Длительность конечной фазы 1/2T1/2 ралтегравира составляет около 9 бóльшая часть AUC соответствует более короткой α-фазе кажущегося 1/2T1/2 ралтегравира (составляет примерно 1 ч). После приема внутрь радиоактивно меченого ралтегравира примерно 51% от принятой дозы выводилось через кишечник и 32% - через почки. В кале обнаруживался только ралтегравир, который, вероятно, образовывался путем гидролиза ралтегравир-глюкуронида, выделившегося с желчью. В моче определялись ралтегравир и ралтегравир-глюкуронид в количестве 9 и 23% от принятой дозы соответственно. В плазме крови основным циркулирующим радиоактивным компонентом был ралтегравир (примерно 70% от общей радиоактивности), в то время как на ралтегравир-глюкуронид приходилось только 30%.
Особые группы пациентов.
Пол. Пол не оказывает клинически значимое влияние на фармакокинетические параметры ралтегравира. Коррекция дозы в зависимости от пола пациента не требуется.
Возраст. В исследованиях у пациентов от 18 лет и старше не была обнаружена значимая зависимость фармакокинетических параметров ралтегравира от возраста, поэтому коррекция дозы в зависимости от возраста не требуется.
Дети и подростки. По результатам сравнительного исследования у здоровых взрослых добровольцев, жевательная форма ралтегравира обладает более высокой пероральной биодоступностью по сравнению с формой для проглатывания. В этом исследовании применение жевательной формы с пищей, содержащей высокое содержание жиров, приводило к повышению AUC в среднем на 6%, снижению Сmax на 62% и повышению с12 на 188% по сравнению с приемом натощак. Прием жевательной формы ралтегравира с пищей с высоким содержанием жиров не оказывал клинически значимое влияние на фармакокинетику ралтегравира, поэтому такая форма может применяться независимо от приема пищи.
Фармакокинетические параметры ралтегравира у детей и подростков сопоставимы с таковыми у взрослых пациентов. Фармакокинетика ралтегравира у детей младше 2 лет не изучалась.
Расово-этнические группы. Расово-этническая принадлежность не оказывала клинически значимое влияние на фармакокинетические параметры ралтегравира. Коррекция дозы не требуется.
ИМТ не оказывал клинически значимое влияние на фармакокинетические параметры ралтегравира у взрослых пациентов. Коррекция дозы препарата в зависимости от ИМТ пациента не требуется.
Печеночная недостаточность. Ралтегравир выводится преимущественно путем глюкуронирования в печени. Фармакокинетика ралтегравира была изучена у взрослых пациентов с печеночной недостаточностью средней степени тяжести, а также в комбинированном фармакокинетическом анализе. Клинически значимые отклонения фармакокинетических параметров у взрослых пациентов с печеночной недостаточностью средней степени тяжести по сравнению со здоровыми добровольцами не выявлены. Таким образом, коррекция дозы ралтегравира при печеночной недостаточности легкой и средней степени тяжести не требуется. Влияние печеночной недостаточности тяжелой степени на фармакокинетические параметры ралтегравира не изучалось.
Почечная недостаточность. На почечный клиренс приходится незначительная доля в выведении ралтегравира из организма. Фармакокинетика ралтегравира была изучена у взрослых пациентов с тяжелой степенью почечной недостаточности, а также в сложном фармакокинетическом анализе. Клинически значимые отклонения фармакокинетических параметров у пациентов с тяжелой степенью почечной недостаточности по сравнению со здоровыми добровольцами не выявлены. Таким образом, коррекция дозы пациентам с тяжелой степенью почечной недостаточности не требуется. Поскольку эффективность диализа ралтегравира неизвестна, принимать его накануне сеанса диализа не рекомендуется.
Полиморфизм УДФ-ГТ1А1. Доказательства или какие-либо данные, свидетельствующие, что наличие полиморфизма у фермента УДФ-ГТ1А1 может оказывать клинически значимое влияние на фармакокинетические параметры ралтегравира, не были получены. По данным сравнительного исследования с участием 30 взрослых здоровых добровольцев с генетически-детерминированной сниженной активностью УДФ-ГТ1А1 и 27 взрослых здоровых добровольцев с неизмененным генотипом УДФ-ГТ1А1, отношение средних геометрических AUC ралтегравира составило 1,41 (90% ДИ: 0,96; 2,09).
Абсолютная биодоступность ралтегравира не установлена. Ралтегравир можно принимать вне зависимости от режима приема пищи.
Распределение. Примерно 83% ралтегравира связывается с белками плазмы в диапазоне концентраций от 2 до 10 мкмоль/л.
Ралтегравир легко преодолевал плацентарный барьер в экспериментальных исследованиях на крысах, но не проникал через ГЭБ в заметной степени.
В двух клинических исследованиях с участием пациентов, инфицированных ВИЧ-1, которые принимали ралтегравир в дозе 400 мг 2 раза в сутки, ралтегравир быстро определялся в спинномозговой жидкости. В первом исследовании средняя концентрация ралтегравира в спинномозговой жидкости составила 5,8% (от 1 до 53,5%) от соответствующей концентрации в плазме крови, а во втором исследовании - 3% (от 1 до 61%) от соответствующей концентрации в плазме крови. Медианы полученных значений были приблизительно в 3-6 раз ниже, чем концентрации свободной фракции ралтегравира в плазме крови.
Метаболизм и выведение. Исследования с использованием селективных ингибиторов изоформы фермента УДФ-ГТ, полученной путем экспрессии комплементарной ДНК, показали, что УДФ-ГТ1А1 является основным ферментом, участвующим в образовании ралтегравир-глюкуронида. Эти данные показали, что основной путь метаболизма ралтегравира у человека представлен процессом глюкуронирования, опосредованного УДФ-ГТ1А1. Длительность конечной фазы 1/2T1/2 ралтегравира составляет около 9 бóльшая часть AUC соответствует более короткой α-фазе кажущегося 1/2T1/2 ралтегравира (составляет примерно 1 ч). После приема внутрь радиоактивно меченого ралтегравира примерно 51% от принятой дозы выводилось через кишечник и 32% - через почки. В кале обнаруживался только ралтегравир, который, вероятно, образовывался путем гидролиза ралтегравир-глюкуронида, выделившегося с желчью. В моче определялись ралтегравир и ралтегравир-глюкуронид в количестве 9 и 23% от принятой дозы соответственно. В плазме крови основным циркулирующим радиоактивным компонентом был ралтегравир (примерно 70% от общей радиоактивности), в то время как на ралтегравир-глюкуронид приходилось только 30%.
Особые группы пациентов.
Пол. Пол не оказывает клинически значимое влияние на фармакокинетические параметры ралтегравира. Коррекция дозы в зависимости от пола пациента не требуется.
Возраст. В исследованиях у пациентов от 18 лет и старше не была обнаружена значимая зависимость фармакокинетических параметров ралтегравира от возраста, поэтому коррекция дозы в зависимости от возраста не требуется.
Дети и подростки. По результатам сравнительного исследования у здоровых взрослых добровольцев, жевательная форма ралтегравира обладает более высокой пероральной биодоступностью по сравнению с формой для проглатывания. В этом исследовании применение жевательной формы с пищей, содержащей высокое содержание жиров, приводило к повышению AUC в среднем на 6%, снижению Сmax на 62% и повышению с12 на 188% по сравнению с приемом натощак. Прием жевательной формы ралтегравира с пищей с высоким содержанием жиров не оказывал клинически значимое влияние на фармакокинетику ралтегравира, поэтому такая форма может применяться независимо от приема пищи.
Фармакокинетические параметры ралтегравира у детей и подростков сопоставимы с таковыми у взрослых пациентов. Фармакокинетика ралтегравира у детей младше 2 лет не изучалась.
Расово-этнические группы. Расово-этническая принадлежность не оказывала клинически значимое влияние на фармакокинетические параметры ралтегравира. Коррекция дозы не требуется.
ИМТ не оказывал клинически значимое влияние на фармакокинетические параметры ралтегравира у взрослых пациентов. Коррекция дозы препарата в зависимости от ИМТ пациента не требуется.
Печеночная недостаточность. Ралтегравир выводится преимущественно путем глюкуронирования в печени. Фармакокинетика ралтегравира была изучена у взрослых пациентов с печеночной недостаточностью средней степени тяжести, а также в комбинированном фармакокинетическом анализе. Клинически значимые отклонения фармакокинетических параметров у взрослых пациентов с печеночной недостаточностью средней степени тяжести по сравнению со здоровыми добровольцами не выявлены. Таким образом, коррекция дозы ралтегравира при печеночной недостаточности легкой и средней степени тяжести не требуется. Влияние печеночной недостаточности тяжелой степени на фармакокинетические параметры ралтегравира не изучалось.
Почечная недостаточность. На почечный клиренс приходится незначительная доля в выведении ралтегравира из организма. Фармакокинетика ралтегравира была изучена у взрослых пациентов с тяжелой степенью почечной недостаточности, а также в сложном фармакокинетическом анализе. Клинически значимые отклонения фармакокинетических параметров у пациентов с тяжелой степенью почечной недостаточности по сравнению со здоровыми добровольцами не выявлены. Таким образом, коррекция дозы пациентам с тяжелой степенью почечной недостаточности не требуется. Поскольку эффективность диализа ралтегравира неизвестна, принимать его накануне сеанса диализа не рекомендуется.
Полиморфизм УДФ-ГТ1А1. Доказательства или какие-либо данные, свидетельствующие, что наличие полиморфизма у фермента УДФ-ГТ1А1 может оказывать клинически значимое влияние на фармакокинетические параметры ралтегравира, не были получены. По данным сравнительного исследования с участием 30 взрослых здоровых добровольцев с генетически-детерминированной сниженной активностью УДФ-ГТ1А1 и 27 взрослых здоровых добровольцев с неизмененным генотипом УДФ-ГТ1А1, отношение средних геометрических AUC ралтегравира составило 1,41 (90% ДИ: 0,96; 2,09).
|
|
Показания к применению
Лечение ВИЧ-1 инфекции в комбинации с другими антиретровирусными препаратами у детей в возрасте 2-11 лет (жевательная форма) и у взрослых. детей и подростков. начиная с 6 лет и с массой тела не менее 25 кг (форма для проглатывания). ранее получавших или не получавших антиретровирусную терапию.
Противопоказания
Повышенная чувствительность; беременность; период лактации; детский возраст до 2 лет и масса тела менее 7 кг (жевательная форма) и до 6 лет и масса тела до 25 кг (форма для проглатывания).
Ограничения к использованию
Миопатия и рабдомиолиз (в тч в анамнезе), наличие состояний и факторов, предрасполагающих к их развитию; тяжелая печеночная недостаточность; одновременное применение с сильными индукторами УДФ-ГТ1А1 (рифампицин), антацидами, содержащими алюминий или магний; депрессия, включая суицидальные идеи и поведение, или психиатрические заболевания в анамнезе; пожилой возраст (информация о применении ралтегравира у пациентов старше 65 лет ограничена).
При беременности и кормлении грудью
Категория действия на плод по FDA. с.
Контролируемых исследований ралтегравира у беременных не проводилось, поэтому ралтегравир противопоказан к применению во время беременности.
Отсутствуют данные о поступлении ралтегравира в грудное молоко человека. Однако обнаружено поступление ралтегравира в молоко у крыс: при введении ралтегравира в суточной дозе 600 мг/кг его концентрация в молоке превышала плазменную концентрацию примерно в 3 раза. Грудное вскармливание не рекомендуется ВИЧ-инфицированным матерям во избежание постнатальной передачи ВИЧ-инфекции детям. При необходимости применения ралтегравира в период лактации рекомендуется прекратить грудное вскармливание.
Контролируемых исследований ралтегравира у беременных не проводилось, поэтому ралтегравир противопоказан к применению во время беременности.
Отсутствуют данные о поступлении ралтегравира в грудное молоко человека. Однако обнаружено поступление ралтегравира в молоко у крыс: при введении ралтегравира в суточной дозе 600 мг/кг его концентрация в молоке превышала плазменную концентрацию примерно в 3 раза. Грудное вскармливание не рекомендуется ВИЧ-инфицированным матерям во избежание постнатальной передачи ВИЧ-инфекции детям. При необходимости применения ралтегравира в период лактации рекомендуется прекратить грудное вскармливание.
Побочные эффекты
Профиль безопасности ралтегравира основан на результатах обобщенных данных по безопасности. полученных в ходе клинических исследований с участием пациентов. ранее получавших антиретровирусную терапию. и пациентов. ранее не получавших антиретровирусную терапию.
В объединенном анализе результатов клинических исследований у взрослых пациентов. ранее получавших антиретровирусную терапию. частота отмены терапии по причине нежелательных реакций составила 3,9% в группе пациентов. получавших ралтегравир и оптимизированную дополнительную терапию. и 4,6% в группе пациентов. получавших плацебо и оптимизированную дополнительную терапию. Частота отмены терапии по причине нежелательных реакций у взрослых пациентов. ранее не получавших антиретровирусную терапию. составила 5% в группе пациентов. принимавших ралтегравир одновременно с эмтрицитабином и тенофовиром. и 10% в группе пациентов. принимавших одновременно эфавиренз. эмтрицитабин и тенофовир.
Ниже представлены данные о нежелательных явлениях. наблюдавшихся в клинических исследованиях. с различной степенью вероятности связанных с применением ралтегравира или его комбинации с другой антиретровирусной терапией. Нежелательные явления перечислены в соответствии с системно-органными классами и классификацией по частоте: часто (≥1/100 и <1/10); нечасто (≥1/1000 и <1/100).
Инфекционные и паразитарные заболевания. Нечасто - генитальный герпес. фолликулит. гастроэнтерит. простой герпес. герпетическая инфекция. опоясывающий лишай. грипп. абсцесс лимфоузла. контагиозный моллюск. назофарингит. инфекция верхних дыхательных путей.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): нечасто - папилломатоз кожи.
Со стороны крови и лимфатической системы: нечасто - анемия. железодефицитная анемия. болезненность лимфоузлов. лимфаденопатия. нейтропения. тромбоцитопения1.
Со стороны иммунной системы. Нечасто - синдром восстановления иммунитета, гиперчувствительность, реакции гиперчувствительности.
Со стороны обмена веществ и нарушение питания. Часто - снижение аппетита. нечасто - кахексия. сахарный диабет. дислипидемия. гиперхолестеринемия. гипергликемия. гиперлипидемия. гиперфагия. повышение аппетита. полидипсия. нарушение жирового обмена.
Нарушения психики: часто - необычные сновидения. бессонница. ночные кошмары. нарушение поведения2. депрессия. нечасто - психические расстройства. суицидальные попытки. чувство тревоги. спутанность сознания. подавленное настроение. большое депрессивное расстройство. бессонница середины ночи. изменения настроения. панические атаки. нарушения сна. суицидальные идеи1. суицидальное поведение1 (особенно у пациентов с психиатрическими заболеваниями в анамнезе).
Со стороны нервной системы: часто - головокружение. головная боль. психомоторная гиперреактивность2. нечасто - амнезия. синдром запястного канала. когнитивные расстройства. нарушения внимания. постуральное головокружение. дисгевзия. гиперсомния. гипестезия. летаргия. расстройство памяти. мигрень. периферическая нейропатия. парестезии. сонливость. головная боль напряжения. тремор. снижение качества сна.
Со стороны органа зрения. Нечасто - снижение остроты зрения.
Со стороны органа слуха и лабиринтные нарушения. Часто - вертиго; нечасто - шум в ушах.
Со стороны сердца. Нечасто - ощущение сердцебиения, синусовая брадикардия, желудочковая экстрасистолия.
Со стороны сосудов. Нечасто - приливы крови к коже лица с ощущением жара, артериальная гипертензия.
Со стороны дыхательной системы, органов грудной клетки и средостения. Нечасто - дисфония, носовое кровотечение, заложенность носа.
Со стороны ЖКТ. Часто - чувство распирания в животе. боль в животе. диарея. метеоризм. тошнота. рвота. диспепсия. нечасто - гастрит. ощущение дискомфорта в животе. боль в верхних отделах живота. болезненность в области живота. чувство дискомфорта в области заднего прохода. запор. сухость во рту. ощущение дискомфорта в эпигастральной области. эрозивный дуоденит. отрыжка. гастроэзофагеальный рефлюкс. гингивит. глоссит. болезненность при глотании. острый панкреатит. пептическая язва. ректальные кровотечения.
Со стороны печени и желчевыводящих путей: нечасто - гепатит, стеатоз печени, алкогольный гепатит, печеночная недостаточность1.
Со стороны кожи и подкожных тканей: часто - кожная сыпь. нечасто - акне. алопеция. угревидная сыпь. сухость кожи. эритема. гипергидроз. липоатрофия. в тч лица. приобретенная липодистрофия. липогипертрофия. ночная потливость. пруриго. зуд (локальный и генерализованный). макулярная сыпь. макулопапулезная сыпь. зудящая сыпь. крапивница. ксеродермия. другие поражения кожи. синдром Стивенса-Джонсона1. лекарственная сыпь с эозинофилией и системными симптомами (DRESS-синдром)1.
Со стороны скелетно-мышечной системы и соединительной ткани: нечасто - артралгия. артрит. боль в спине. боль в боку. скелетно-мышечная боль. миалгия. боль в области шеи. остеопения. боль в конечностях. остеопороз. полиартрит. тендинит. миопатия. рабдомиолиз1.
Со стороны почек и мочевыводящих путей. Нечасто - почечная недостаточность. нефрит. нефролитиаз. никтурия. киста почки. нарушение функции почек. тубулоинтерстициальный нефрит.
Со стороны половых органов и молочной железы. Нечасто - эректильная дисфункция, гинекомастия, симптомы менопаузы.
Общие расстройства и нарушения в месте введения. Часто - астения. слабость. лихорадка. нечасто - дискомфорт в груди. озноб. отек лица. увеличение объема жировой ткани. состояние беспокойства. недомогание. подчелюстное новообразование. периферические отеки. боль.
Лабораторные и инструментальные данные. Часто - повышение активности в плазме АЛТ. ACT. липазы и амилазы поджелудочной железы. повышение концентрации триглицеридов и количества атипичных лимфоцитов. нечасто - снижение абсолютного числа нейтрофилов плазмы. повышение активности в плазме ЩФ. КФК. снижение концентрации альбумина. повышение концентрации билирубина. Хс. креатинина. глюкозы (в тч определяемой натощак). азота мочевины. Хс ЛПВП. Хс ЛПНП. повышение значения МНО. снижение количества тромбоцитов и лейкоцитов в крови. наличие глюкозы в моче. наличие эритроцитов в моче. увеличение окружности талии. увеличение или снижение массы тела.
Травмы, интоксикации и осложнения манипуляций. Нечасто - непреднамеренная передозировка.
1 Нежелательные явления, не связанные с применением ралтегравира, которые наблюдались в пострегистрационном периоде и не наблюдались в ходе клинических исследований.
2 У одного пациента детского возраста наблюдались связанные с применением ралтегравира нежелательные реакции: психомоторная гиперреактивность 3-й степени тяжести и нарушение поведения. также у данного пациента наблюдалась бессонница.
В ходе клинических исследований у пациентов. ранее получавших и не получавших антиретровирусную терапию. наблюдались случаи развития злокачественных новообразований при использовании комбинации ралтегравира с другими антиретровирусными средствами. Характеристика и частота злокачественных новообразований соответствовали таковым для пациентов с тяжелым иммунодефицитом. Риск развития злокачественных новообразований в клинических исследованиях был одинаков как в группах пациентов, принимавших ралтегравир, так и в группах сравнения.
У пациентов, принимавших ралтегравир, наблюдалось повышение активности КФК 2-4-й степени. Наблюдались случаи развития миопатии и рабдомиолиза. Пациентам с миопатией или рабдомиолизом в анамнезе, а также имеющим другие факторы риска (включая сопутствующую терапию), ралтегравир следует назначать с осторожностью.
Сообщалось о случаях развития остеонекроза, особенно у пациентов с общепризнанными факторами риска, поздней стадией ВИЧ-заболевания или длительным воздействием комбинированной антиретровирусной терапии. Частота его развития неизвестна.
В клинических исследованиях у пациентов. ранее получавших антиретровирусную терапию. кожная сыпь. вне зависимости от этиологии. чаще наблюдалась при применении ралтегравира одновременно с дарунавиром. чем при применении данных средств по отдельности. Тем не менее частота развития кожной сыпи, связанной с приемом этих средств, была сопоставима во всех трех группах лечения. Кожная сыпь была легкой и умеренной степени тяжести и не влияла на продолжение антиретровирусной терапии. У пациентов. ранее не получавших антиретровирусную терапию. при лечении ралтегравиром в комбинации с эмтрицитабином и тенофовиром развитие сыпи наблюдалось реже. чем при лечении эфавирензом в комбинации с эмтрицитабином и тенофовиром.
Пациенты с коинфекцией вирусом гепатита В и/или гепатита С.
В целом профиль безопасности ралтегравира у пациентов. как ранее получавших. так и не получавших антиретровирусную терапию. коинфицированных хроническим (но не острым) активным гепатитом В и/или гепатитом С. был аналогичен профилю безопасности у пациентов без коинфекции вирусом гепатита В и/или гепатита С. хотя частота отклонения активностей AЛT и ACT иногда была выше в группах с коинфекцией вирусом гепатита В и/или гепатита С.
Дети.
По результатам клинических исследований применения ралтегравира в рекомендованных дозах в комбинации с другими антиретровирусными ЛС у ВИЧ-1-инфицированных детей и подростков от 2 до 18 лет было установлено. что частота. тип и выраженность нежелательных реакций. связанных с приемом ралтегравира. были сопоставимы с таковыми у взрослых пациентов.
У одного пациента наблюдались следующие связанные с приемом ралтегравира нежелательные реакции: психомоторная гиперактивность 3-й степени, нарушение поведения и бессонница. У другого пациента наблюдалась серьезная нежелательная реакция 2-й степени - аллергическая сыпь.
Еще у одного пациента наблюдалось повышение активности ACT 4-й степени и AЛT 3-й степени, которое было расценено как серьезное.
В объединенном анализе результатов клинических исследований у взрослых пациентов. ранее получавших антиретровирусную терапию. частота отмены терапии по причине нежелательных реакций составила 3,9% в группе пациентов. получавших ралтегравир и оптимизированную дополнительную терапию. и 4,6% в группе пациентов. получавших плацебо и оптимизированную дополнительную терапию. Частота отмены терапии по причине нежелательных реакций у взрослых пациентов. ранее не получавших антиретровирусную терапию. составила 5% в группе пациентов. принимавших ралтегравир одновременно с эмтрицитабином и тенофовиром. и 10% в группе пациентов. принимавших одновременно эфавиренз. эмтрицитабин и тенофовир.
Ниже представлены данные о нежелательных явлениях. наблюдавшихся в клинических исследованиях. с различной степенью вероятности связанных с применением ралтегравира или его комбинации с другой антиретровирусной терапией. Нежелательные явления перечислены в соответствии с системно-органными классами и классификацией по частоте: часто (≥1/100 и <1/10); нечасто (≥1/1000 и <1/100).
Инфекционные и паразитарные заболевания. Нечасто - генитальный герпес. фолликулит. гастроэнтерит. простой герпес. герпетическая инфекция. опоясывающий лишай. грипп. абсцесс лимфоузла. контагиозный моллюск. назофарингит. инфекция верхних дыхательных путей.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): нечасто - папилломатоз кожи.
Со стороны крови и лимфатической системы: нечасто - анемия. железодефицитная анемия. болезненность лимфоузлов. лимфаденопатия. нейтропения. тромбоцитопения1.
Со стороны иммунной системы. Нечасто - синдром восстановления иммунитета, гиперчувствительность, реакции гиперчувствительности.
Со стороны обмена веществ и нарушение питания. Часто - снижение аппетита. нечасто - кахексия. сахарный диабет. дислипидемия. гиперхолестеринемия. гипергликемия. гиперлипидемия. гиперфагия. повышение аппетита. полидипсия. нарушение жирового обмена.
Нарушения психики: часто - необычные сновидения. бессонница. ночные кошмары. нарушение поведения2. депрессия. нечасто - психические расстройства. суицидальные попытки. чувство тревоги. спутанность сознания. подавленное настроение. большое депрессивное расстройство. бессонница середины ночи. изменения настроения. панические атаки. нарушения сна. суицидальные идеи1. суицидальное поведение1 (особенно у пациентов с психиатрическими заболеваниями в анамнезе).
Со стороны нервной системы: часто - головокружение. головная боль. психомоторная гиперреактивность2. нечасто - амнезия. синдром запястного канала. когнитивные расстройства. нарушения внимания. постуральное головокружение. дисгевзия. гиперсомния. гипестезия. летаргия. расстройство памяти. мигрень. периферическая нейропатия. парестезии. сонливость. головная боль напряжения. тремор. снижение качества сна.
Со стороны органа зрения. Нечасто - снижение остроты зрения.
Со стороны органа слуха и лабиринтные нарушения. Часто - вертиго; нечасто - шум в ушах.
Со стороны сердца. Нечасто - ощущение сердцебиения, синусовая брадикардия, желудочковая экстрасистолия.
Со стороны сосудов. Нечасто - приливы крови к коже лица с ощущением жара, артериальная гипертензия.
Со стороны дыхательной системы, органов грудной клетки и средостения. Нечасто - дисфония, носовое кровотечение, заложенность носа.
Со стороны ЖКТ. Часто - чувство распирания в животе. боль в животе. диарея. метеоризм. тошнота. рвота. диспепсия. нечасто - гастрит. ощущение дискомфорта в животе. боль в верхних отделах живота. болезненность в области живота. чувство дискомфорта в области заднего прохода. запор. сухость во рту. ощущение дискомфорта в эпигастральной области. эрозивный дуоденит. отрыжка. гастроэзофагеальный рефлюкс. гингивит. глоссит. болезненность при глотании. острый панкреатит. пептическая язва. ректальные кровотечения.
Со стороны печени и желчевыводящих путей: нечасто - гепатит, стеатоз печени, алкогольный гепатит, печеночная недостаточность1.
Со стороны кожи и подкожных тканей: часто - кожная сыпь. нечасто - акне. алопеция. угревидная сыпь. сухость кожи. эритема. гипергидроз. липоатрофия. в тч лица. приобретенная липодистрофия. липогипертрофия. ночная потливость. пруриго. зуд (локальный и генерализованный). макулярная сыпь. макулопапулезная сыпь. зудящая сыпь. крапивница. ксеродермия. другие поражения кожи. синдром Стивенса-Джонсона1. лекарственная сыпь с эозинофилией и системными симптомами (DRESS-синдром)1.
Со стороны скелетно-мышечной системы и соединительной ткани: нечасто - артралгия. артрит. боль в спине. боль в боку. скелетно-мышечная боль. миалгия. боль в области шеи. остеопения. боль в конечностях. остеопороз. полиартрит. тендинит. миопатия. рабдомиолиз1.
Со стороны почек и мочевыводящих путей. Нечасто - почечная недостаточность. нефрит. нефролитиаз. никтурия. киста почки. нарушение функции почек. тубулоинтерстициальный нефрит.
Со стороны половых органов и молочной железы. Нечасто - эректильная дисфункция, гинекомастия, симптомы менопаузы.
Общие расстройства и нарушения в месте введения. Часто - астения. слабость. лихорадка. нечасто - дискомфорт в груди. озноб. отек лица. увеличение объема жировой ткани. состояние беспокойства. недомогание. подчелюстное новообразование. периферические отеки. боль.
Лабораторные и инструментальные данные. Часто - повышение активности в плазме АЛТ. ACT. липазы и амилазы поджелудочной железы. повышение концентрации триглицеридов и количества атипичных лимфоцитов. нечасто - снижение абсолютного числа нейтрофилов плазмы. повышение активности в плазме ЩФ. КФК. снижение концентрации альбумина. повышение концентрации билирубина. Хс. креатинина. глюкозы (в тч определяемой натощак). азота мочевины. Хс ЛПВП. Хс ЛПНП. повышение значения МНО. снижение количества тромбоцитов и лейкоцитов в крови. наличие глюкозы в моче. наличие эритроцитов в моче. увеличение окружности талии. увеличение или снижение массы тела.
Травмы, интоксикации и осложнения манипуляций. Нечасто - непреднамеренная передозировка.
1 Нежелательные явления, не связанные с применением ралтегравира, которые наблюдались в пострегистрационном периоде и не наблюдались в ходе клинических исследований.
2 У одного пациента детского возраста наблюдались связанные с применением ралтегравира нежелательные реакции: психомоторная гиперреактивность 3-й степени тяжести и нарушение поведения. также у данного пациента наблюдалась бессонница.
В ходе клинических исследований у пациентов. ранее получавших и не получавших антиретровирусную терапию. наблюдались случаи развития злокачественных новообразований при использовании комбинации ралтегравира с другими антиретровирусными средствами. Характеристика и частота злокачественных новообразований соответствовали таковым для пациентов с тяжелым иммунодефицитом. Риск развития злокачественных новообразований в клинических исследованиях был одинаков как в группах пациентов, принимавших ралтегравир, так и в группах сравнения.
У пациентов, принимавших ралтегравир, наблюдалось повышение активности КФК 2-4-й степени. Наблюдались случаи развития миопатии и рабдомиолиза. Пациентам с миопатией или рабдомиолизом в анамнезе, а также имеющим другие факторы риска (включая сопутствующую терапию), ралтегравир следует назначать с осторожностью.
Сообщалось о случаях развития остеонекроза, особенно у пациентов с общепризнанными факторами риска, поздней стадией ВИЧ-заболевания или длительным воздействием комбинированной антиретровирусной терапии. Частота его развития неизвестна.
В клинических исследованиях у пациентов. ранее получавших антиретровирусную терапию. кожная сыпь. вне зависимости от этиологии. чаще наблюдалась при применении ралтегравира одновременно с дарунавиром. чем при применении данных средств по отдельности. Тем не менее частота развития кожной сыпи, связанной с приемом этих средств, была сопоставима во всех трех группах лечения. Кожная сыпь была легкой и умеренной степени тяжести и не влияла на продолжение антиретровирусной терапии. У пациентов. ранее не получавших антиретровирусную терапию. при лечении ралтегравиром в комбинации с эмтрицитабином и тенофовиром развитие сыпи наблюдалось реже. чем при лечении эфавирензом в комбинации с эмтрицитабином и тенофовиром.
Пациенты с коинфекцией вирусом гепатита В и/или гепатита С.
В целом профиль безопасности ралтегравира у пациентов. как ранее получавших. так и не получавших антиретровирусную терапию. коинфицированных хроническим (но не острым) активным гепатитом В и/или гепатитом С. был аналогичен профилю безопасности у пациентов без коинфекции вирусом гепатита В и/или гепатита С. хотя частота отклонения активностей AЛT и ACT иногда была выше в группах с коинфекцией вирусом гепатита В и/или гепатита С.
Дети.
По результатам клинических исследований применения ралтегравира в рекомендованных дозах в комбинации с другими антиретровирусными ЛС у ВИЧ-1-инфицированных детей и подростков от 2 до 18 лет было установлено. что частота. тип и выраженность нежелательных реакций. связанных с приемом ралтегравира. были сопоставимы с таковыми у взрослых пациентов.
У одного пациента наблюдались следующие связанные с приемом ралтегравира нежелательные реакции: психомоторная гиперактивность 3-й степени, нарушение поведения и бессонница. У другого пациента наблюдалась серьезная нежелательная реакция 2-й степени - аллергическая сыпь.
Еще у одного пациента наблюдалось повышение активности ACT 4-й степени и AЛT 3-й степени, которое было расценено как серьезное.
|
|
Взаимодействие
В исследованиях in vitro >in vitro было показано, что ралтегравир не является субстратом изоферментов системы цитохрома Р450 и не ингибирует сYP1A2, сYP2B6, сYP2C8, сYP2C9, сYP2C19, сYP2D6 или сYP3A. Кроме этого, in vitro >in vitro ралтегравир не индуцирует сYP3A4 и не является ингибитором P-gp-опосредованного транспорта. На основании этих данных можно сделать вывод, что ралтегравир не влияет на фармакокинетические параметры ЛС, которые являются субстратами указанных ферментов или P-gp.
Как показали исследования in vitro >in vitro и in vivo >in vivo, ралтегравир выводится в основном посредством метаболизма (глюкуронирования) по УДФ-ГТ1А1-опосредованному пути. Хотя исследования in vitro >in vitro показали, что ралтегравир не является ингибитором УДФ-ГТ1А1 и 2В7, в одном клиническом исследовании были выявлены некоторые признаки ингибирования УДФ-ГТ1А1 in vivo >in vivo на основе наблюдаемого влияния на глюкуронирование билирубина. Тем не менее маловероятно, что данный эффект приводит к клинически значимым межлекарственным взаимодействиям.
В фармакокинетике ралтегравира наблюдалась значимая интер- и интраиндивидуальная изменчивость. Приведенная ниже информация о взаимодействии с ЛС основана на средних геометрических значениях; эффект у отдельного пациента точно предсказать нельзя.
Влияние ралтегравира на фармакокинетику других ЛС.
В исследованиях по изучению лекарственного взаимодействия ралтегравир не оказывал клинически значимое влияние на фармакокинетику этравирина, маравирока, тенофовира, гормональных контрацептивов, метадона, мидазолама и боцепревира.
В некоторых исследованиях при одновременном применении ралтегравира с дарунавиром наблюдалось незначительное снижение концентрации дарунавира в плазме крови. Механизм данного явления неизвестен. Тем не менее влияние ралтегравира на концентрацию дарунавира в плазме крови не считается клинически значимым.
Влияние других ЛС на фармакокинетику ралтегравира.
Следует соблюдать осторожность при одновременном применении ралтегравира с сильными индукторами УДФ-ГТ1А1 (например рифампицин), учитывая, что ралтегравир метаболизируется в основном посредством УДФ-ГТ1А1. Рифампицин снижает концентрацию ралтегравира в плазме крови. Влияние на эффективность ралтегравира неизвестно. Тем не менее, если одновременного применения с рифампицином избежать невозможно, можно удвоить дозу ралтегравира у взрослых. Данные по одновременному применению ралтегравира и рифампицина у пациентов младше 18 лет отсутствуют. Влияние других сильных индукторов изоферментов, метаболизирующих ЛС, таких как фенитоин и фенобарбитал, на систему УДФ-ГТ1А1 неизвестно. Менее сильные индукторы (например эфавиренз, невирапин, этравирин, рифабутин, ГКС, зверобой продырявленный, пиоглитазон) могут применяться одновременно с ралтегравиром в рекомендованной дозе.
Одновременное применение ралтегравира с сильными ингибиторами УДФ-ГТ1А1 (например атазанавир) может повысить концентрацию ралтегравира в плазме крови. Менее сильные ингибиторы УДФ-ГТ1А1 (например индинавир и саквинавир) также могут повысить концентрацию ралтегравира в плазме крови, но в меньшей степени по сравнению с атазанавиром. Кроме того, тенофовир может повысить концентрацию ралтегравира в плазме крови, однако механизм этого влияния неизвестен. Профиль безопасности, наблюдаемый у пациентов, получавших атазанавир и/или тенофовир, в целом идентичен профилю безопасности у пациентов, которые не принимали данные средства, поэтому коррекция дозы не требуется.
Одновременное применение ралтегравира с антацидами, содержащими бивалентные ионы металлов, может снижать абсорбцию ралтегравира путем хелатирования, что приводит к снижению концентрации ралтегравира в плазме крови. Так как прием антацидов, содержащих алюминий или магний, через 6 ч после приема ралтегравира приводит к значительному снижению концентрации ралтегравира в плазме крови, одновременное применение ралтегравира и антацидов, содержащих алюминий или магний, не рекомендуется.
Одновременное применение ралтегравира с антацидами, содержащими карбонат кальция, снижает концентрацию ралтегравира в плазме крови, однако данное взаимодействие не рассматривается как клинически значимое. Вследствие этого при одновременном применении ралтегравира с антацидами, содержащими карбонат кальция, коррекция дозы не требуется.
Одновременное применение ралтегравира с другими ЛС, повышающими значение pH желудочного сока (например омепразол или фамотидин), может повысить скорость абсорбции ралтегравира и, соответственно, концентрацию ралтегравира в плазме крови. В клиническом исследовании профиль безопасности в подгруппе пациентов, принимавших ингибиторы протонного насоса или блокаторы Н2-гистаминовых рецепторов, был сопоставим с профилем безопасности в подгруппе пациентов, не принимавших данные ЛС. Коррекция дозы ралтегравира не требуется при одновременном применении с ингибиторами протонного насоса или блокаторами Н2-гистаминовых рецепторов.
Все исследования взаимодействия ЛС проводились с участием взрослых пациентов.
Ниже приведены данные по фармакокинетическому взаимодействию ЛС у взрослых пациентов и рекомендации по коррекции режима дозирования.
Антиретровирусные ЛС.
Ингибиторы протеазы (ИП).
Атазанавир/ритонавир (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - повышение AUC на 41%, с12 на 77% и Сmax на 24% (ингибирование УДФ-ГТ1А1). Коррекция дозы ралтегравира не требуется.
Типранавир/ритонавир (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - понижение AUC на 24%, с12 на 55% и Сmax на 18% (индукция УДФ-ГТ1А1). Коррекция дозы ралтегравира не требуется.
ННИОТ.
Эфавиренз (ралтегравир 400 мг 1 раз в сутки). Ралтегравир - понижение AUC на 36%, с12 на 21% и Сmax на 11% (индукция УДФ-ГТ1А1). Коррекция дозы ралтегравира не требуется.
Этравирин (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - понижение AUC на 10%, с12 на 34% и Сmax на 11% (индукция УДФ-ГТ1А1); этравирин - повышение AUC на 10%, с12 на 17% и Сmax на 4%. Коррекция доз ралтегравира или этравирина не требуется.
НИОТ.
Тенофовир (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - повышение AUC на 49%, с12 на 3% и Сmax на 64% (механизм взаимодействия неизвестен); тенофовир - понижение AUC на 10%, с24 на 13% и Сmax на 23%. Коррекция доз ралтегравира или тенофовира дизопроксила фумарата не требуется.
Антагонисты хемокиновых рецепторов сCR5.
Маравирок (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - понижение AUC на 37%, с12 на 28% и Сmax на 33% (механизм взаимодействия неизвестен); маравирок - понижение AUC на 14%, с12 на 10% и Сmax на 21%. Коррекция доз ралтегравира или маравирока не требуется.
ЛС против вируса гепатита с.
Боцепревир (ингибитор протеазы NS3/A4 вируса гепатита с)(ралтегравир 400 мг 1 раз в сутки). Ралтегравир - повышение AUC на 4%, понижение с12 на 24% и повышение Сmax на 64% (механизм взаимодействия неизвестен). Коррекция доз ралтегравира или боцепревира не требуется.
Противомикробные средства.
Рифампицин (противотуберкулезное средство)(ралтегравир 400 мг 1 раз в сутки). Ралтегравир - понижение AUC на 40%, с12 на 61% и Сmax на 38% (индукция УДФ-ГТ1А1). Рифампицин снижает концентрацию ралтегравира в плазме крови. Если комбинированной терапии с рифампицином избежать невозможно, необходимо рассмотреть возможность увеличения дозы ралтегравира в 2 раза.
Седативные средства.
Мидазолам (ралтегравир 400 мг 2 раза в сутки). Мидазолам - понижение AUC на 8%, повышение maxCmax на 3%. Коррекция доз ралтегравира или мидазолама не требуется. Полученные данные указывают на то, что ралтегравир не является индуктором или ингибитором сYP3A4 и не влияет на фармакокинетику ЛС, являющихся субстратами сYP3A4.
Антациды.
Антациды, содержащие алюминий или магний (ралтегравир 400 мг 2 раза в сутки). Понижение AUC, с12 и maxCmax на 49, 63 и 44% соответственно (одновременный прием); на 51, 56 и 51% соответственно (за 2 ч до приема ралтегравира); на 30, 57 и 22% соответственно (через 2 ч после приема ралтегравира); на 13, 50 и 10% соответственно (за 6 ч до приема ралтегравира) и на 11, 49 и 10% соответственно (через 6 ч после приема ралтегравира) (хелатирование катионами металлов). Антациды, содержащие алюминий или магний, снижают концентрацию ралтегравира в плазме крови. Одновременное применение не рекомендовано.
Антациды, содержащие кальция карбонат (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - понижение AUC на 55%, с12 на 32% и maxCmax на 52% (хелатирование катионами металлов). Коррекция дозы ралтегравира не требуется.
Блокаторы H2-гистаминовых рецепторов и ингибиторы протонного насоса.
Омепразол (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - повышение AUC на 37%, с12 на 24% и maxCmax на 51% (увеличение растворимости). Коррекция дозы ралтегравира не требуется.
Фамотидин (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - повышение AUC на 44%, с12 на 6% и maxCmax на 60% (увеличение растворимости). Коррекция дозы ралтегравира не требуется.
Гормональные контрацептивы.
Этинилэстрадиол/норэлгестромин (ралтегравир 400 мг 2 раза в сутки). Этинилэстрадиол - понижение AUC на 2% и повышение maxCmax на 6%; норэлгестромин - повышение AUC на 14% и maxCmax на 29%. Коррекция доз ралтегравира или гормональных контрацептивов (эстроген- и/или прогестагенсодержащих) не требуется.
Опиоидные анальгетики.
Метадон (ралтегравир 400 мг 2 раза в сутки). Метадон - AUC и maxCmax без изменений. Коррекция доз ралтегравира или метадона не требуется.
Как показали исследования in vitro >in vitro и in vivo >in vivo, ралтегравир выводится в основном посредством метаболизма (глюкуронирования) по УДФ-ГТ1А1-опосредованному пути. Хотя исследования in vitro >in vitro показали, что ралтегравир не является ингибитором УДФ-ГТ1А1 и 2В7, в одном клиническом исследовании были выявлены некоторые признаки ингибирования УДФ-ГТ1А1 in vivo >in vivo на основе наблюдаемого влияния на глюкуронирование билирубина. Тем не менее маловероятно, что данный эффект приводит к клинически значимым межлекарственным взаимодействиям.
В фармакокинетике ралтегравира наблюдалась значимая интер- и интраиндивидуальная изменчивость. Приведенная ниже информация о взаимодействии с ЛС основана на средних геометрических значениях; эффект у отдельного пациента точно предсказать нельзя.
Влияние ралтегравира на фармакокинетику других ЛС.
В исследованиях по изучению лекарственного взаимодействия ралтегравир не оказывал клинически значимое влияние на фармакокинетику этравирина, маравирока, тенофовира, гормональных контрацептивов, метадона, мидазолама и боцепревира.
В некоторых исследованиях при одновременном применении ралтегравира с дарунавиром наблюдалось незначительное снижение концентрации дарунавира в плазме крови. Механизм данного явления неизвестен. Тем не менее влияние ралтегравира на концентрацию дарунавира в плазме крови не считается клинически значимым.
Влияние других ЛС на фармакокинетику ралтегравира.
Следует соблюдать осторожность при одновременном применении ралтегравира с сильными индукторами УДФ-ГТ1А1 (например рифампицин), учитывая, что ралтегравир метаболизируется в основном посредством УДФ-ГТ1А1. Рифампицин снижает концентрацию ралтегравира в плазме крови. Влияние на эффективность ралтегравира неизвестно. Тем не менее, если одновременного применения с рифампицином избежать невозможно, можно удвоить дозу ралтегравира у взрослых. Данные по одновременному применению ралтегравира и рифампицина у пациентов младше 18 лет отсутствуют. Влияние других сильных индукторов изоферментов, метаболизирующих ЛС, таких как фенитоин и фенобарбитал, на систему УДФ-ГТ1А1 неизвестно. Менее сильные индукторы (например эфавиренз, невирапин, этравирин, рифабутин, ГКС, зверобой продырявленный, пиоглитазон) могут применяться одновременно с ралтегравиром в рекомендованной дозе.
Одновременное применение ралтегравира с сильными ингибиторами УДФ-ГТ1А1 (например атазанавир) может повысить концентрацию ралтегравира в плазме крови. Менее сильные ингибиторы УДФ-ГТ1А1 (например индинавир и саквинавир) также могут повысить концентрацию ралтегравира в плазме крови, но в меньшей степени по сравнению с атазанавиром. Кроме того, тенофовир может повысить концентрацию ралтегравира в плазме крови, однако механизм этого влияния неизвестен. Профиль безопасности, наблюдаемый у пациентов, получавших атазанавир и/или тенофовир, в целом идентичен профилю безопасности у пациентов, которые не принимали данные средства, поэтому коррекция дозы не требуется.
Одновременное применение ралтегравира с антацидами, содержащими бивалентные ионы металлов, может снижать абсорбцию ралтегравира путем хелатирования, что приводит к снижению концентрации ралтегравира в плазме крови. Так как прием антацидов, содержащих алюминий или магний, через 6 ч после приема ралтегравира приводит к значительному снижению концентрации ралтегравира в плазме крови, одновременное применение ралтегравира и антацидов, содержащих алюминий или магний, не рекомендуется.
Одновременное применение ралтегравира с антацидами, содержащими карбонат кальция, снижает концентрацию ралтегравира в плазме крови, однако данное взаимодействие не рассматривается как клинически значимое. Вследствие этого при одновременном применении ралтегравира с антацидами, содержащими карбонат кальция, коррекция дозы не требуется.
Одновременное применение ралтегравира с другими ЛС, повышающими значение pH желудочного сока (например омепразол или фамотидин), может повысить скорость абсорбции ралтегравира и, соответственно, концентрацию ралтегравира в плазме крови. В клиническом исследовании профиль безопасности в подгруппе пациентов, принимавших ингибиторы протонного насоса или блокаторы Н2-гистаминовых рецепторов, был сопоставим с профилем безопасности в подгруппе пациентов, не принимавших данные ЛС. Коррекция дозы ралтегравира не требуется при одновременном применении с ингибиторами протонного насоса или блокаторами Н2-гистаминовых рецепторов.
Все исследования взаимодействия ЛС проводились с участием взрослых пациентов.
Ниже приведены данные по фармакокинетическому взаимодействию ЛС у взрослых пациентов и рекомендации по коррекции режима дозирования.
Антиретровирусные ЛС.
Ингибиторы протеазы (ИП).
Атазанавир/ритонавир (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - повышение AUC на 41%, с12 на 77% и Сmax на 24% (ингибирование УДФ-ГТ1А1). Коррекция дозы ралтегравира не требуется.
Типранавир/ритонавир (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - понижение AUC на 24%, с12 на 55% и Сmax на 18% (индукция УДФ-ГТ1А1). Коррекция дозы ралтегравира не требуется.
ННИОТ.
Эфавиренз (ралтегравир 400 мг 1 раз в сутки). Ралтегравир - понижение AUC на 36%, с12 на 21% и Сmax на 11% (индукция УДФ-ГТ1А1). Коррекция дозы ралтегравира не требуется.
Этравирин (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - понижение AUC на 10%, с12 на 34% и Сmax на 11% (индукция УДФ-ГТ1А1); этравирин - повышение AUC на 10%, с12 на 17% и Сmax на 4%. Коррекция доз ралтегравира или этравирина не требуется.
НИОТ.
Тенофовир (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - повышение AUC на 49%, с12 на 3% и Сmax на 64% (механизм взаимодействия неизвестен); тенофовир - понижение AUC на 10%, с24 на 13% и Сmax на 23%. Коррекция доз ралтегравира или тенофовира дизопроксила фумарата не требуется.
Антагонисты хемокиновых рецепторов сCR5.
Маравирок (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - понижение AUC на 37%, с12 на 28% и Сmax на 33% (механизм взаимодействия неизвестен); маравирок - понижение AUC на 14%, с12 на 10% и Сmax на 21%. Коррекция доз ралтегравира или маравирока не требуется.
ЛС против вируса гепатита с.
Боцепревир (ингибитор протеазы NS3/A4 вируса гепатита с)(ралтегравир 400 мг 1 раз в сутки). Ралтегравир - повышение AUC на 4%, понижение с12 на 24% и повышение Сmax на 64% (механизм взаимодействия неизвестен). Коррекция доз ралтегравира или боцепревира не требуется.
Противомикробные средства.
Рифампицин (противотуберкулезное средство)(ралтегравир 400 мг 1 раз в сутки). Ралтегравир - понижение AUC на 40%, с12 на 61% и Сmax на 38% (индукция УДФ-ГТ1А1). Рифампицин снижает концентрацию ралтегравира в плазме крови. Если комбинированной терапии с рифампицином избежать невозможно, необходимо рассмотреть возможность увеличения дозы ралтегравира в 2 раза.
Седативные средства.
Мидазолам (ралтегравир 400 мг 2 раза в сутки). Мидазолам - понижение AUC на 8%, повышение maxCmax на 3%. Коррекция доз ралтегравира или мидазолама не требуется. Полученные данные указывают на то, что ралтегравир не является индуктором или ингибитором сYP3A4 и не влияет на фармакокинетику ЛС, являющихся субстратами сYP3A4.
Антациды.
Антациды, содержащие алюминий или магний (ралтегравир 400 мг 2 раза в сутки). Понижение AUC, с12 и maxCmax на 49, 63 и 44% соответственно (одновременный прием); на 51, 56 и 51% соответственно (за 2 ч до приема ралтегравира); на 30, 57 и 22% соответственно (через 2 ч после приема ралтегравира); на 13, 50 и 10% соответственно (за 6 ч до приема ралтегравира) и на 11, 49 и 10% соответственно (через 6 ч после приема ралтегравира) (хелатирование катионами металлов). Антациды, содержащие алюминий или магний, снижают концентрацию ралтегравира в плазме крови. Одновременное применение не рекомендовано.
Антациды, содержащие кальция карбонат (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - понижение AUC на 55%, с12 на 32% и maxCmax на 52% (хелатирование катионами металлов). Коррекция дозы ралтегравира не требуется.
Блокаторы H2-гистаминовых рецепторов и ингибиторы протонного насоса.
Омепразол (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - повышение AUC на 37%, с12 на 24% и maxCmax на 51% (увеличение растворимости). Коррекция дозы ралтегравира не требуется.
Фамотидин (ралтегравир 400 мг 2 раза в сутки). Ралтегравир - повышение AUC на 44%, с12 на 6% и maxCmax на 60% (увеличение растворимости). Коррекция дозы ралтегравира не требуется.
Гормональные контрацептивы.
Этинилэстрадиол/норэлгестромин (ралтегравир 400 мг 2 раза в сутки). Этинилэстрадиол - понижение AUC на 2% и повышение maxCmax на 6%; норэлгестромин - повышение AUC на 14% и maxCmax на 29%. Коррекция доз ралтегравира или гормональных контрацептивов (эстроген- и/или прогестагенсодержащих) не требуется.
Опиоидные анальгетики.
Метадон (ралтегравир 400 мг 2 раза в сутки). Метадон - AUC и maxCmax без изменений. Коррекция доз ралтегравира или метадона не требуется.
|
|
Передозировка
Специфических симптомов передозировки ралтегравира не выявлено.
Ралтегравир хорошо переносился здоровыми добровольцами в режиме 1600 мг 1 раз в сутки и 800 мг 2 раза в сутки без проявлений токсичности.
Однократный прием дозы 1800 мг в сутки в исследованиях II/III фазы не оказывал токсического воздействия. На основании имеющихся данных можно заключить, что ралтегравир хорошо переносится в дозах до 800 мг 2 раза в сутки, а также при приеме с ЛС, увеличивающими его экспозицию на 50-70% (например тенофовир и атазанавир). Ралтегравир имеет широкий терапевтический диапазон, поэтому потенциал токсического действия в результате передозировки ограничен.
Лечение: в случае передозировки необходимо следовать стандартным рекомендациям. таким как удаление невсосавшегося препарата из ЖКТ. наблюдение за показателями жизнедеятельности. включая ЭКГ. назначение симптоматической терапии. Данных об эффективности диализа при передозировке ралтегравира нет.
Ралтегравир хорошо переносился здоровыми добровольцами в режиме 1600 мг 1 раз в сутки и 800 мг 2 раза в сутки без проявлений токсичности.
Однократный прием дозы 1800 мг в сутки в исследованиях II/III фазы не оказывал токсического воздействия. На основании имеющихся данных можно заключить, что ралтегравир хорошо переносится в дозах до 800 мг 2 раза в сутки, а также при приеме с ЛС, увеличивающими его экспозицию на 50-70% (например тенофовир и атазанавир). Ралтегравир имеет широкий терапевтический диапазон, поэтому потенциал токсического действия в результате передозировки ограничен.
Лечение: в случае передозировки необходимо следовать стандартным рекомендациям. таким как удаление невсосавшегося препарата из ЖКТ. наблюдение за показателями жизнедеятельности. включая ЭКГ. назначение симптоматической терапии. Данных об эффективности диализа при передозировке ралтегравира нет.
Способ применения и дозы
Внутрь, независимо от приема пищи. Рекомендуемая доза зависит от возраста и массы тела.
Меры предосторожности применения
Пациентов следует информировать о том, что современные антиретровирусные средства не излечивают ВИЧ-инфекцию и не предотвращают передачу ВИЧ другим людям с кровью или при половых контактах. Во время лечения ралтегравиром пациенты должны продолжать соблюдать соответствующие меры безопасности.
Также пациенты должны быть проинформированы о том, что у них все еще могут развиться инфекции или другие состояния, распространенные среди ВИЧ-инфицированных пациентов (оппортунистические инфекции). Во время терапии ралтегравиром очень важно оставаться под наблюдением врача.
Ралтегравир имеет относительно низкий генетический барьер к развитию резистентности, поэтому для повышения эффективности лечения и снижения риска развития резистентности ралтегравир необходимо назначать в комбинации с двумя другими активными антиретровирусными средствами.
Пациенты должны быть проинформированы о необходимости сообщать врачу о появлении каких-либо необычных симптомов, а также о сохранении или ухудшении любого известного симптома.
Синдром восстановления иммунитета.
На начальных этапах комбинированной антиретровирусной терапии у ВИЧ-инфицированных пациентов с тяжелым иммунодефицитом может развиться т.н. синдром восстановления иммунитета, воспалительная реакция на бессимптомно текущие или остаточные оппортунистические инфекции (в тч цитомегаловирусный ретинит, пневмоцистная пневмония, вызванная Pneumocystis jiroveci, диссеминированные или очаговые микобактериальные инфекции ). Это может способствовать ухудшению клинического состояния и усилению имеющихся симптомов. Обычно такая реакция может наблюдаться в первые недели или месяцы после начала комбинированной терапии. Любые воспалительные симптомы должны быть оценены и при необходимости назначено лечение.
При развитии синдрома восстановления иммунитета были описаны такие аутоиммунные расстройства, как Базедова болезнь. Развитие таких нарушений может наблюдаться через много месяцев после начала лечения.
Остеонекроз.
Несмотря на то что этиология данного осложнения считается многофакторной (включая терапию кортикостероидами, употребление алкоголя, тяжелый иммунодефицит, высокий ИМТ), описаны случаи развития остеонекроза, особенно на поздних стадиях ВИЧ-инфекции и/или при длительном применении комбинированной антиретровирусной терапии. Пациентам, у которых появились такие симптомы, как боль в суставах, скованность или ограничение подвижности, нужна срочная консультация специалиста.
Тяжелые реакции со стороны кожи и реакции гинерчувствительности.
Получены данные о тяжелых (потенциально жизнеугрожающих) и фатальных нежелательных реакциях со стороны кожи у пациентов, принимавших ралтегравир в составе комбинированной терапии с другими ЛС, ассоциирующимися с этими нежелательными реакциями, такими как синдром Стивенса-Джонсона и токсический эпидермальный некролиз. Также сообщалось о реакциях гиперчувствительности, которые проявлялись в виде сыпи генерализованного характера и иногда органной дисфункции, включая печеночную недостаточность. Следует немедленно прекратить применение ралтегравира и других средств, предположительно способных вызвать такие реакции, если появились признаки или симптомы тяжелых реакций со стороны кожи или реакции гиперчувствительности (включая, но не ограничиваясь только ими, тяжелую кожную сыпь или сыпь, сопровождающуюся лихорадкой, общее недомогание, слабость, боль в мышцах или суставах, появление волдырей на коже, повреждения в ротовой полости, конъюнктивит, отек лица, гепатит, эозинофилию, ангионеврогический отек). В этих случаях необходимо мониторировать клинический статус, включая активность печеночных аминотрансфераз, и начать соответствующую терапию. Несвоевременное прекращение терапии ралтегравиром или другими ЛС, ассоциирующимися с этими нежелательными реакциями, после появления тяжелой сыпи может привести к жизнеугрожающим реакциям.
Миоиатия и рабдомиолиз.
Сообщалось о развитии миопатии и рабдомиолиза. Следует соблюдать осторожность при назначении ралтегравира пациентам с миопатией и рабдомиолизом в анамнезе или какими-либо факторами, предрасполагающими к их развитию, в частности при сопутствующей терапии ЛС, способными вызвать эти нежелательные реакции.
Нарушение функции печени.
Безопасность и эффективность ралтегравира у пациентов с тяжелыми сопутствующими заболеваниями печени не установлены. Следует соблюдать осторожность при назначении ралтегравира пациентам с тяжелыми нарушениями функции печени.
У пациентов с существующей дисфункцией печени, включая хронический гепатит, повышается частота нарушений функции печени на фоне комбинированной антиретровирусной терапии, и они подлежат мониторингу в соответствии со стандартной практикой. При появлении у таких пациентов признаков ухудшения заболевания печени должен быть рассмотрен вопрос о прерывании или прекращении лечения.
Пациенты с хроническим гепатитом В или С, также получающие комбинированную антиретровирусную терапию, входят в группу риска развития тяжелых и потенциально фатальных нежелательных явлений со стороны печени.
Кожная сыпь.
У пациентов, ранее получавших антиретровирусную терапию, при применении ралтегравира одновременно с дарунавиром кожная сыпь наблюдается чаще, чем у пациентов, применяющих эти средства по отдельности ( см «Побочные действия»).
Депрессия.
Депрессия, включая суицидальные идеи и поведение, наблюдалась в основном у пациентов с депрессией или психиатрическими заболеваниями в анамнезе. Следует соблюдать осторожность при назначении ралтегравира пациентам с депрессией или психиатрическими заболеваниями в анамнезе.
Одновременное применение с другими ЛС.
Сильные индукторы УДФ-ГТ1А1. Следует соблюдать осторожность при назначении ралтегравира одновременно с сильными индукторами УДФ-ГТ1А1, такими как рифампицин, вследствие вызываемого ими снижения плазменной концентрации ралтегравира. При необходимости проведения комбинированной терапии рифампицином и ралтегравиром доза ралтегравира должна быть увеличена в 2 раза у взрослых пациентов. Нет данных для корректировки доз при одновременном применении ралтегравира и рифампицина у пациентов младше 18 лет ( см «Взаимодействие»).
Антациды. Одновременное применение ралтегравира с антацидами, содержащими алюминий или магний, не рекомендуется, оно приводит к снижению концентрации ралтегравира в плазме крови ( см «Взаимодействие»).
Влияние на способность управлять транспортными средствами и работать с механизмами. Исследования по изучению влияния на способность к управлению транспортными средствами и работе с механизмами не проводились. Учитывая возможность развития на фоне лечения ралтегравиром головокружения, слабости, сонливости и нечеткости зрения, которые могут влиять на указанные способности, нужно проявлять особую осторожность при управлении автомобилем и работе с механизмами.
Также пациенты должны быть проинформированы о том, что у них все еще могут развиться инфекции или другие состояния, распространенные среди ВИЧ-инфицированных пациентов (оппортунистические инфекции). Во время терапии ралтегравиром очень важно оставаться под наблюдением врача.
Ралтегравир имеет относительно низкий генетический барьер к развитию резистентности, поэтому для повышения эффективности лечения и снижения риска развития резистентности ралтегравир необходимо назначать в комбинации с двумя другими активными антиретровирусными средствами.
Пациенты должны быть проинформированы о необходимости сообщать врачу о появлении каких-либо необычных симптомов, а также о сохранении или ухудшении любого известного симптома.
Синдром восстановления иммунитета.
На начальных этапах комбинированной антиретровирусной терапии у ВИЧ-инфицированных пациентов с тяжелым иммунодефицитом может развиться т.н. синдром восстановления иммунитета, воспалительная реакция на бессимптомно текущие или остаточные оппортунистические инфекции (в тч цитомегаловирусный ретинит, пневмоцистная пневмония, вызванная Pneumocystis jiroveci, диссеминированные или очаговые микобактериальные инфекции ). Это может способствовать ухудшению клинического состояния и усилению имеющихся симптомов. Обычно такая реакция может наблюдаться в первые недели или месяцы после начала комбинированной терапии. Любые воспалительные симптомы должны быть оценены и при необходимости назначено лечение.
При развитии синдрома восстановления иммунитета были описаны такие аутоиммунные расстройства, как Базедова болезнь. Развитие таких нарушений может наблюдаться через много месяцев после начала лечения.
Остеонекроз.
Несмотря на то что этиология данного осложнения считается многофакторной (включая терапию кортикостероидами, употребление алкоголя, тяжелый иммунодефицит, высокий ИМТ), описаны случаи развития остеонекроза, особенно на поздних стадиях ВИЧ-инфекции и/или при длительном применении комбинированной антиретровирусной терапии. Пациентам, у которых появились такие симптомы, как боль в суставах, скованность или ограничение подвижности, нужна срочная консультация специалиста.
Тяжелые реакции со стороны кожи и реакции гинерчувствительности.
Получены данные о тяжелых (потенциально жизнеугрожающих) и фатальных нежелательных реакциях со стороны кожи у пациентов, принимавших ралтегравир в составе комбинированной терапии с другими ЛС, ассоциирующимися с этими нежелательными реакциями, такими как синдром Стивенса-Джонсона и токсический эпидермальный некролиз. Также сообщалось о реакциях гиперчувствительности, которые проявлялись в виде сыпи генерализованного характера и иногда органной дисфункции, включая печеночную недостаточность. Следует немедленно прекратить применение ралтегравира и других средств, предположительно способных вызвать такие реакции, если появились признаки или симптомы тяжелых реакций со стороны кожи или реакции гиперчувствительности (включая, но не ограничиваясь только ими, тяжелую кожную сыпь или сыпь, сопровождающуюся лихорадкой, общее недомогание, слабость, боль в мышцах или суставах, появление волдырей на коже, повреждения в ротовой полости, конъюнктивит, отек лица, гепатит, эозинофилию, ангионеврогический отек). В этих случаях необходимо мониторировать клинический статус, включая активность печеночных аминотрансфераз, и начать соответствующую терапию. Несвоевременное прекращение терапии ралтегравиром или другими ЛС, ассоциирующимися с этими нежелательными реакциями, после появления тяжелой сыпи может привести к жизнеугрожающим реакциям.
Миоиатия и рабдомиолиз.
Сообщалось о развитии миопатии и рабдомиолиза. Следует соблюдать осторожность при назначении ралтегравира пациентам с миопатией и рабдомиолизом в анамнезе или какими-либо факторами, предрасполагающими к их развитию, в частности при сопутствующей терапии ЛС, способными вызвать эти нежелательные реакции.
Нарушение функции печени.
Безопасность и эффективность ралтегравира у пациентов с тяжелыми сопутствующими заболеваниями печени не установлены. Следует соблюдать осторожность при назначении ралтегравира пациентам с тяжелыми нарушениями функции печени.
У пациентов с существующей дисфункцией печени, включая хронический гепатит, повышается частота нарушений функции печени на фоне комбинированной антиретровирусной терапии, и они подлежат мониторингу в соответствии со стандартной практикой. При появлении у таких пациентов признаков ухудшения заболевания печени должен быть рассмотрен вопрос о прерывании или прекращении лечения.
Пациенты с хроническим гепатитом В или С, также получающие комбинированную антиретровирусную терапию, входят в группу риска развития тяжелых и потенциально фатальных нежелательных явлений со стороны печени.
Кожная сыпь.
У пациентов, ранее получавших антиретровирусную терапию, при применении ралтегравира одновременно с дарунавиром кожная сыпь наблюдается чаще, чем у пациентов, применяющих эти средства по отдельности ( см «Побочные действия»).
Депрессия.
Депрессия, включая суицидальные идеи и поведение, наблюдалась в основном у пациентов с депрессией или психиатрическими заболеваниями в анамнезе. Следует соблюдать осторожность при назначении ралтегравира пациентам с депрессией или психиатрическими заболеваниями в анамнезе.
Одновременное применение с другими ЛС.
Сильные индукторы УДФ-ГТ1А1. Следует соблюдать осторожность при назначении ралтегравира одновременно с сильными индукторами УДФ-ГТ1А1, такими как рифампицин, вследствие вызываемого ими снижения плазменной концентрации ралтегравира. При необходимости проведения комбинированной терапии рифампицином и ралтегравиром доза ралтегравира должна быть увеличена в 2 раза у взрослых пациентов. Нет данных для корректировки доз при одновременном применении ралтегравира и рифампицина у пациентов младше 18 лет ( см «Взаимодействие»).
Антациды. Одновременное применение ралтегравира с антацидами, содержащими алюминий или магний, не рекомендуется, оно приводит к снижению концентрации ралтегравира в плазме крови ( см «Взаимодействие»).
Влияние на способность управлять транспортными средствами и работать с механизмами. Исследования по изучению влияния на способность к управлению транспортными средствами и работе с механизмами не проводились. Учитывая возможность развития на фоне лечения ралтегравиром головокружения, слабости, сонливости и нечеткости зрения, которые могут влиять на указанные способности, нужно проявлять особую осторожность при управлении автомобилем и работе с механизмами.
|
|
Список литературы
Обобщенные материалы www.grls.rosminzdrav.ru, 2015-2016 гг.
Входит в состав
- 2386-33232₽ Исентресс (5 фирм)
- — Ралтегра
- — Ралтегравир ПСК (ПСК Фарма ООО )
- — Ралтегравир калия (2 фирмы)
- — Ролнавир