МКБ-10 коды
- МКБ-10
- O47.0 Ложные схватки в период до 37 полных недель беременности
- O60 Преждевременные роды
- O42.0 Преждевременный разрыв плодных оболочек, начало родов в последующие 24 часа
- O42 Преждевременный разрыв плодных оболочек
- O42.1 Преждевременный разрыв плодных оболочек, начало родов после 24-часового безводного периода
- O42.2 Преждевременный разрыв плодных оболочек, задержка родов, связанная с проводимой терапией
- O42.9 Преждевременный разрыв плодных оболочек неуточненный
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: O60, O60.0, O60.1, O60.2, O60.3, O47.0, O42.
Год утверждения (частота пересмотра): 2020.
Возрастная категория: Взрослые , Дети.
Пересмотр не позднее: 2022.
ID: 331.
Разработчик клинической рекомендации.
• Российское общество акушеров-гинекологов.
• Ассоциация акушерских анестезиологов-реаниматологов.
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2020.
Возрастная категория: Взрослые , Дети.
Пересмотр не позднее: 2022.
ID: 331.
Разработчик клинической рекомендации.
• Российское общество акушеров-гинекологов.
• Ассоциация акушерских анестезиологов-реаниматологов.
Одобрено Научно-практическим Советом Минздрава РФ.
|
|
 Список сокращений
Список сокращений
| АД | артериальное давление |
| ВЖК | внутрижелудочковые кровоизлияния |
| ВОЗ | Всемирная организация здравоохранения |
| ВПР | врожденный порок развития |
| ВРТ | вспомогательные репродуктивные технологии |
| ГКС | глюкокортикостероиды |
| ЗРП | задержка роста плода |
| ИЛ | интерлейкин |
| ИЦН | истмико-цервикальная недостаточность |
| КТГ | кардиотокография |
| КС | кесарево сечение |
| МКБ | международная классификация болезней |
| PPV | прогностическая ценность положительного результата (prognostic positive value) |
| PNV | прогностическая ценность отрицательного результата (prognostic negative value) |
| ПОНРП | преждевременная отслойка нормально расположенной плаценты |
| ПР | преждевременные роды |
| ПРПО | преждевременный разрыв плодных оболочек |
| ПСИФР-1 | фосфорилированный протеин-1, связывающий инсулиноподобный фактор роста |
| РДС | респираторный дистресс-синдром |
| СВРП | синдром системной воспалительной реакции у плода |
| СГВ | стрептококк группы Б |
| УЗИ | ультразвуковое исследование |
| ЧСС | частота сердечных сокращений |
Термины и определения
Раздел 1,1.
Описание
Преждевременные роды (ПР) - это роды, наступившие в сроки беременности от 22 до 366 недель[1],[2] [1, 2], при этом установление срока беременности определяется на основании данных о 1-м дне последней менструации (при регулярном менструальном цикле) и УЗИ плода, выполненном в 1-м триместре[3] [3, 4].
Причины
ПР относятся к большим акушерским синдромам, которые характеризуются длительным субклиническим течением и вовлечением в патологический процесс плода [5]. Весомый вклад в общее число ПР вносят индуцированные ПР, вызванные акушерской, плодовой и экстрагенитальной патологией [6].
Научно доказана связь ПР с инфекцией нижних половых путей[4]. Каждая из десяти пациенток с ПР имеет признаки внутриамниотического воспаления, которое в большинстве случаев протекает субклинически. У данных пациенток имеется высокий риск преждевременного разрыва плодных оболочек (ПРПО) и гнойно-воспалительных осложнений в послеродовом периоде [7-9]. Инфекционно-воспалительный процесс приводит к повышению сократительной активности миометрия и деградации внеклеточного матрикса с ремоделированием шейки матки и амниотической мембраны [10, 11]. Длительно персистирующая инфекция приводит к развитию манифестного хориоамнионита и синдрома системной воспалительной реакции (СВРП) плода. Ведущим диагностическим критерием синдрома СВРП является наличие ИЛ-6 в плазме пуповинной крови в концентрации более 11 пг/мл [5, 12]. Рассматривается вклад наследственности в развитии ПР [13, 14].
Научно доказана связь ПР с инфекцией нижних половых путей[4]. Каждая из десяти пациенток с ПР имеет признаки внутриамниотического воспаления, которое в большинстве случаев протекает субклинически. У данных пациенток имеется высокий риск преждевременного разрыва плодных оболочек (ПРПО) и гнойно-воспалительных осложнений в послеродовом периоде [7-9]. Инфекционно-воспалительный процесс приводит к повышению сократительной активности миометрия и деградации внеклеточного матрикса с ремоделированием шейки матки и амниотической мембраны [10, 11]. Длительно персистирующая инфекция приводит к развитию манифестного хориоамнионита и синдрома системной воспалительной реакции (СВРП) плода. Ведущим диагностическим критерием синдрома СВРП является наличие ИЛ-6 в плазме пуповинной крови в концентрации более 11 пг/мл [5, 12]. Рассматривается вклад наследственности в развитии ПР [13, 14].
Эпидемиология
Распространенность ПР (28-366 недель беременности) в Российской Федерации остается стабильной на протяжении последних 10 лет, и в 2018 году составила 6% от общего числа родов.[5].
ПР являются причиной неонатальной смертности в 70%, младенческой смертности в 36% и отдаленных неврологических последствий у детей в 25-50% случаев [15, 16]. Среди рожденных в сроке 220 - 236 смертность в течение нескольких недель составляет 97-98%, при этом только 1% выживает без нарушений развития нервной системы. Среди рожденных в сроке 240 - 246 недель 55% новорожденных выживают, но только 32% не имеют неврологических дефицитов в возрасте 18-22 месяцев жизни [17].
O60,0 - Преждевременные роды без родоразрешения.
О60,1 - Преждевременные самопроизвольные роды с досрочным родоразрешением.
O60,2 - Преждевременные самопроизвольные роды со своевременным родоразрешением.
О60,3 - Преждевременное родоразрешение без самопроизвольных родов.
О47,0 - Ложные схватки до 37 полных недель беременности.
О42 - Преждевременный разрыв плодных оболочек.
ПР являются причиной неонатальной смертности в 70%, младенческой смертности в 36% и отдаленных неврологических последствий у детей в 25-50% случаев [15, 16]. Среди рожденных в сроке 220 - 236 смертность в течение нескольких недель составляет 97-98%, при этом только 1% выживает без нарушений развития нервной системы. Среди рожденных в сроке 240 - 246 недель 55% новорожденных выживают, но только 32% не имеют неврологических дефицитов в возрасте 18-22 месяцев жизни [17].
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
О60 - Преждевременные роды и родоразрешение.O60,0 - Преждевременные роды без родоразрешения.
О60,1 - Преждевременные самопроизвольные роды с досрочным родоразрешением.
O60,2 - Преждевременные самопроизвольные роды со своевременным родоразрешением.
О60,3 - Преждевременное родоразрешение без самопроизвольных родов.
О47,0 - Ложные схватки до 37 полных недель беременности.
О42 - Преждевременный разрыв плодных оболочек.
Классификация
1,5, Классификация заболевания или состояния (группы заболеваний или состояний).
| Классификация ПР в соответствии со сроком беременности | |
| Экстремально ранние ПР - | 220 - 276 недель |
| Ранние ПР - | 280 - 316 недель |
| ПР - | 320 - 336 недель |
| Поздние ПР - | 340 - 366 недель |
Клиническая классификация ПР [18] :
Угрожающие ПР.
Начавшиеся ПР.
Активные ПР.
Классификация ПР в соответствии с причиной их возникновения [6].
| спонтанные (70-80%) | Индуцированные (20-30%) | ||
| Показания со стороны матери | Показания со стороны плода | ||
| Регулярная родовая деятельность при целом плодном пузыре (40-50%) | Излитие околоплодных вод при отсутствии регулярной родовой деятельности (25-40%) | Тяжелая экстрагенитальная патология с декомпенсацией, тяжелая преэклампсия/ эклампсия, HELLP-синдром, внутрипеченочный холестаз беременных | Прогрессирующее ухудшение состояния, врожденные пороки развития (ВПР), антенатальная гибель плода |
| Категории недоношенных детей по массе тела | |
| Низкая масса тела (НМТ) | ˂ 2500 г |
| Очень низкая масса тела (ОНМТ) | ˂ 1500 г |
| Экстремально низкая масса тела (ЭНМТ) | ˂ 1000 г |
Категории недоношенных детей по сроку рождения (ВОЗ)[6]:
Дети, рожденные крайне преждевременно (менее 28 недель).
Дети, рожденные значительно преждевременно (от 28 до 32 недель).
Дети, рожденные умеренно и незначительно преждевременно (от 32 до 366 недель).
Клиническая картина
Следующие признаки могут наблюдаться в течение нескольких часов до возникновения классических симптомов родов:
• менструальноподобные спастические боли;
• неболезненные и нерегулярные сокращения матки;
• боли в пояснице;
• ощущение давления во влагалище или малом тазу;
• выделения слизи из влагалища, которые могут быть прозрачными, розовыми или слегка кровянистыми («слизистая пробка»).
Клинические симптомы, которые определяют истинное начало родовой деятельности (то есть начавшиеся ПР), являются одинаковыми вне зависимости от срока гестации, и выражаются в изменении шейки матки и начале регулярной родовой деятельности. Изменения шейки матки включают расширение области внутреннего зева, укорочение, размягчение и централизацию шейки матки. Изменения шейки матки при начавшихся ПР происходят в течение нескольких часов, что отличает их от процесса созревания шейки матки, которое происходит в течение нескольких дней или даже недель [5, 19-22].
[1] Preterm Labor and вirth Management: Recommendations from the European Association of Perinatal Medicine, 2017.
[2] Preterm birth, WHO, 2015.
[3] ACOG, сommittee Opinion No 700: Methods for Estimating the Due Date, 2017.
[4] NICE Guidance, Preterm labour and birth, 2016.
[5] Статистическая отчетная форма Минздрава России №32 «Отчет о медицинской помощи беременным, роженицам и родильницам».
[6] Преждевременные роды, ВОЗ, 2018.
• менструальноподобные спастические боли;
• неболезненные и нерегулярные сокращения матки;
• боли в пояснице;
• ощущение давления во влагалище или малом тазу;
• выделения слизи из влагалища, которые могут быть прозрачными, розовыми или слегка кровянистыми («слизистая пробка»).
Клинические симптомы, которые определяют истинное начало родовой деятельности (то есть начавшиеся ПР), являются одинаковыми вне зависимости от срока гестации, и выражаются в изменении шейки матки и начале регулярной родовой деятельности. Изменения шейки матки включают расширение области внутреннего зева, укорочение, размягчение и централизацию шейки матки. Изменения шейки матки при начавшихся ПР происходят в течение нескольких часов, что отличает их от процесса созревания шейки матки, которое происходит в течение нескольких дней или даже недель [5, 19-22].
[1] Preterm Labor and вirth Management: Recommendations from the European Association of Perinatal Medicine, 2017.
[2] Preterm birth, WHO, 2015.
[3] ACOG, сommittee Opinion No 700: Methods for Estimating the Due Date, 2017.
[4] NICE Guidance, Preterm labour and birth, 2016.
[5] Статистическая отчетная форма Минздрава России №32 «Отчет о медицинской помощи беременным, роженицам и родильницам».
[6] Преждевременные роды, ВОЗ, 2018.
|
|
Диагностика
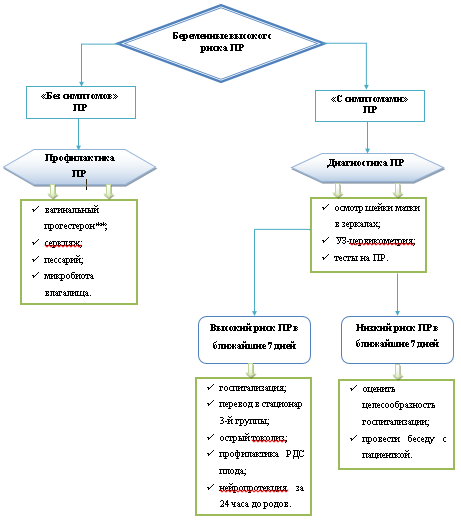
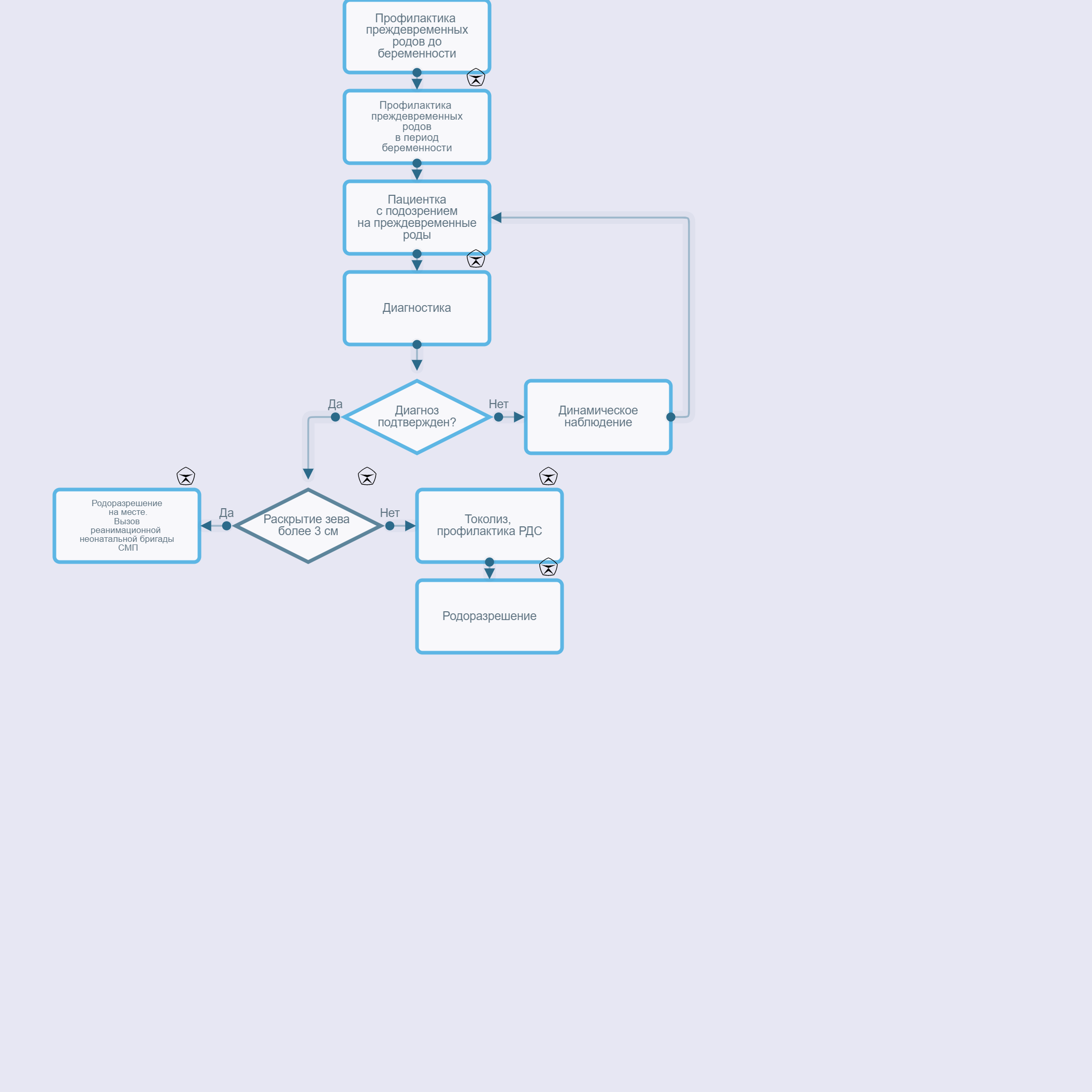
Критерии установления диагноза.
Угрожающие ПР проявляются нерегулярными болями в нижней части живота, поясничной области. Объективно определяется повышенный тонус матки, укорочение шейки матки, открытие наружного зева.
Начавшиеся ПР сопровождаются болями в нижних отделах живота, регистрируемой регулярной маточной активностью, центрированным положением укороченной, размягченной и нередко дилатированной шейкой матки, наличием слизистых или слизисто-сукровичных выделений из половых путей, свидетельствующих о созревании шейки матки. Возможно преждевременное излитие околоплодных вод.
Активные ПР характеризуются наличием 4 схваток в течение 20 мин и открытием шейки матки ≥4 см.
• До зачатия или на ранних сроках беременности рекомендован сбор анамнеза и выявление факторов риска ПР [5, 9, 23], [19], [24], [25], [26, 27], [28], [29], [30], [31], [32], [33, 34], [35]. [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. К факторам риска относятся - индуцированные ПР в анамнезе у пациентки [24], аборты в анамнезе у пациентки [25], ПР у матери пациентки [26, 27], поздний репродуктивный возраст пациентки [28], патология шейки матки у пациентки [29], аномалии развития матки у пациентки [29], синдром внезапной детской смерти ранее рожденных детей у пациентки [30], данная беременность, наступившая при помощи вспомогательных репродуктивных технологий (ВРТ) [31], многоплодие в данной беременности [32], кровотечения на ранних сроках данной беременности [19], мочеполовые инфекции [33, 34], [35]. Укорочение длины шейки матки ≤25 мм и/или расширение шейки матки ≥10 мм до 24 недель беременности ассоциированы с повышенным риском ПР. Многочисленные исследования выявили связь между ПР и мочеполовой инфекцией. Риск ПР в зависимости от возбудителя представлен в таблице 1 [5, 9, 23].
Таблица 1.
Связь ПР и мочеполовой инфекции.
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарий. Осмотр шейки матки проводится с помощью влажных стерильных зеркал, не смазанных лубрикантами (для исключения влияния при выполнении диагностических тестов), с целью оценки состояния цервикального канала, наличия/отсутствия и количества кровянистых выделений, исключения/подтверждения пролабирования плодного пузыря, наличия/отсутствия выпадения петлей пуповины или мелких частей плода при ПРПО, исключения воспалительных изменений шейки матки, [36].
• Для определения состояния родовых путей и степени «зрелости» шейки матки влагалищное исследование рекомендовано проводить только после того, как будут исключены предлежание плаценты (при УЗИ) и пролабирование/разрыв плодных оболочек (осмотреть шейку матки в зеркалах и, при подозрении на ПРПО, выполнить тест на подтекание околоплодных вод) [36-38].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. При отсутствии активной родовой деятельности или начавшихся ПР, при ПРПО от проведения влагалищного исследования следует отказаться, так как оно не дает дополнительной важной информации, но увеличивает риск восходящей инфекции.
• Всем пациенткам рекомендовано измерение артериального давления, пульса, частоты дыхания с целью оценки витальных функций [39].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
• Всем пациенткам рекомендована аускультация плода, а также определение частоты, продолжительности и интенсивности маточных сокращений с целью оценки состояния плода и признаков начала родовой деятельности [40].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарии. Число лейкоцитов возрастает через 24 часа после введения кортикостероидов (КС) и постепенно возвращается к исходному уровню через 3 дня после профилактики респираторного дистресс-синдрома (РДС) плода. Наиболее точным маркером является С-реактивный белок, его чувствительность составляет 68,7%, специфичность - 77,1% [42].
• При угрожающих, начавшихся ПР и при ПРПО рекомендовано определение антигена стрептококка группы В (СГВ) (S. agalactiae) в отделяемом цервикального канала или микробиологическое (культуральное) исследование отделяемого женских половых органов на аэробные и факультативно-анаэробные микроорганизмы (оптимально - в вагино-ректальном посеве) для своевременной диагностики и профилактики септических осложнений [43].[2].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарий. Связь между колонизацией СГВ во время беременности и ПР не доказана, однако имеет место повышенный риск неонатального сепсиса, что делает данное исследование клинически целесообразным [44].
• Для уточнения диагноза ПР в 240 - 336 недель беременности рекомендовано (при возможности) определение фосфорилированной формы протеин-1 связанного инсулиноподобного фактора роста (ПСИФР-1) или плацентарного альфа-микроглобулина-1 (ПАМГ-1) в цервикальной слизи [45-47].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. ПСИФР-1 продуцируется плацентарными децидуальными клетками и определяется в цервикальной слизи в результате повреждения хориодецидуальной зоны [45]. Отрицательный результат указывает на низкий риск ПР в течение 7 дней после проведения теста (PPV=94%) [48]. Чувствительность теста на ПАМГ-1 у пациенток с угрожающими ПР и интактным плодным пузырем составляет 84%, специфичность - 95%, PNV - 93-97%. Чувствительность и NPV в отношении ПР через 7 дней у пациенток с длиной шейки матки 15-30 мм составляют 100%. Для прогноза ПР менее 34 недели PNV составляет 93%[3] [46].
• При ПРПО рекомендован осмотр шейки матки в зеркалах для идентификации подтекания околоплодных вод 46, [4] [38].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарий. К лабораторным экспресс-тестам относится «цитологический тест» (симптом «папоротника», частота ложноотрицательных результатов более 20%), нитразиновый тест (частота ложноположительных результатов 5-30%) и тест на ПСИФР-1 и ПАМГ-1 [45-50] (Таблица 2).
Таблица 2.
Предиктивная способность тест-систем для определения ПРПО.
SN - чувствительность, SP - специфичность, PPV и NPV - прогностическая ценность положительного и отрицательного результатов, соответственно.
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии. Длина шейки матки ≤25мм до 34 недель беременности является прогностическим фактором ПР. В 20 недель беременности длина шейки матки ≤25мм ассоциирована с повышением риска ПР в 6 раз. До 34 недель при одноплодной беременности определение длины шейки матки ≤25 мм имеет чувствительность 76%, специфичность - 68%, PPV - 20% и NPV - 96% для диагноза ПР [52], [53].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
Комментарии: Частота острого хориоамнионита у пациенток, родоразрешенных в 220-236 недели беременности, составляет 94,4% [55]. Во 2-м триместре беременности при экстремально ранних ПР в сочетании с ИЦН исключение инфекционно-воспалительного фактора с целью улучшения исходов беременности при планировании хирургической коррекции ИЦН является необходимым этапом ведения пациентки[6]. Субклинический хориоамнионит является важным фактором риска преждевременного укорочения и созревания шейки матки, поэтому амниоцентез является объективным методом для исключения воспаления/инфекции до производства хирургической коррекции ИЦН. Повышенная концентрация в амниотической жидкости ИЛ-6, лейкоцитов и низкая концентрация глюкозы, даже в отсутствие положительного микробиологического посева, значительно увеличивает неблагоприятные исходы беременности у пациенток, перенесших неселективный (ургентный) серкляж [54]. Также при исследовании амниотической жидкости возможно определение зрелости легких плода [56]. При подтверждении внутриамниотической инфекции на основании исследования околоплодных вод хирургическая коррекция ИЦН, учитывая высокий риск акушерских и перинатальных осложнений, как правило, не проводится [5, 9, 54, 55].
[1] Preterm Labor and вirth Management: Recommendations from the European Association of Perinatal Medicine, 2017.
[2] сare of Women Presenting with Suspected Preterm Prelabour Rupture of Membranes from 24+0 Weeks of Gestation: Green-top Guideline № 73, 2019.
[3] Preterm Labor and вirth Management: Recommendations from the European Association of Perinatal Medicine, 2017.
[4] ACOG, Practice вulletin № 172: Premature Rupture of Membranes, 2016.
[5] Preterm Labor and вirth Management: Recommendations from the European Association of Perinatal Medicine, 2017.
[6] ACOG Practice вulletin №142: сerclage for the management of cervical insufficiency, 2014.
Угрожающие ПР проявляются нерегулярными болями в нижней части живота, поясничной области. Объективно определяется повышенный тонус матки, укорочение шейки матки, открытие наружного зева.
Начавшиеся ПР сопровождаются болями в нижних отделах живота, регистрируемой регулярной маточной активностью, центрированным положением укороченной, размягченной и нередко дилатированной шейкой матки, наличием слизистых или слизисто-сукровичных выделений из половых путей, свидетельствующих о созревании шейки матки. Возможно преждевременное излитие околоплодных вод.
Активные ПР характеризуются наличием 4 схваток в течение 20 мин и открытием шейки матки ≥4 см.
2,1 Жалобы и анамнез.
Жалобы - см раздел 1,6.• До зачатия или на ранних сроках беременности рекомендован сбор анамнеза и выявление факторов риска ПР [5, 9, 23], [19], [24], [25], [26, 27], [28], [29], [30], [31], [32], [33, 34], [35]. [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. К факторам риска относятся - индуцированные ПР в анамнезе у пациентки [24], аборты в анамнезе у пациентки [25], ПР у матери пациентки [26, 27], поздний репродуктивный возраст пациентки [28], патология шейки матки у пациентки [29], аномалии развития матки у пациентки [29], синдром внезапной детской смерти ранее рожденных детей у пациентки [30], данная беременность, наступившая при помощи вспомогательных репродуктивных технологий (ВРТ) [31], многоплодие в данной беременности [32], кровотечения на ранних сроках данной беременности [19], мочеполовые инфекции [33, 34], [35]. Укорочение длины шейки матки ≤25 мм и/или расширение шейки матки ≥10 мм до 24 недель беременности ассоциированы с повышенным риском ПР. Многочисленные исследования выявили связь между ПР и мочеполовой инфекцией. Риск ПР в зависимости от возбудителя представлен в таблице 1 [5, 9, 23].
Таблица 1.
Связь ПР и мочеполовой инфекции.
| Возбудитель/инфекционный процесс | Отношение шансов (95% доверительный интервал) |
| Бактериальный вагиноз до 16 недель | 7,55 (1,8-31,7) |
| N. gonorrhoeae | 5,31 (1,57-17,9) |
| Бессимптомная бактериурия | 2,08 (1,45-3,03) |
| сhlamydia trachomatis | |
| в 24 недели | 2,2 (1,03-4,78) |
| в 28 недель | 0,95 (0,36-2,47) |
| Trichomonas vaginalis | 1,3 (1,1-1,4) |
| U. urealyticum | 1,0 (0,8-1,2) |
2,2 Физикальное обследование.
При угрожающих ПР рекомендован осмотр шейки матки в зеркалах [36].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарий. Осмотр шейки матки проводится с помощью влажных стерильных зеркал, не смазанных лубрикантами (для исключения влияния при выполнении диагностических тестов), с целью оценки состояния цервикального канала, наличия/отсутствия и количества кровянистых выделений, исключения/подтверждения пролабирования плодного пузыря, наличия/отсутствия выпадения петлей пуповины или мелких частей плода при ПРПО, исключения воспалительных изменений шейки матки, [36].
• Для определения состояния родовых путей и степени «зрелости» шейки матки влагалищное исследование рекомендовано проводить только после того, как будут исключены предлежание плаценты (при УЗИ) и пролабирование/разрыв плодных оболочек (осмотреть шейку матки в зеркалах и, при подозрении на ПРПО, выполнить тест на подтекание околоплодных вод) [36-38].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии. При отсутствии активной родовой деятельности или начавшихся ПР, при ПРПО от проведения влагалищного исследования следует отказаться, так как оно не дает дополнительной важной информации, но увеличивает риск восходящей инфекции.
• Всем пациенткам рекомендовано измерение артериального давления, пульса, частоты дыхания с целью оценки витальных функций [39].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
• Всем пациенткам рекомендована аускультация плода, а также определение частоты, продолжительности и интенсивности маточных сокращений с целью оценки состояния плода и признаков начала родовой деятельности [40].
Уровень убедительности рекомендаций с (уровень достоверности доказательств - 4).
2,3 Лабораторные диагностические исследования.
При ПРПО рекомендовано исследование уровня лейкоцитов в крови и исследование уровня С-реактивного белка в сыворотке крови для своевременной диагностики септических осложнений [41], [42].Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарии. Число лейкоцитов возрастает через 24 часа после введения кортикостероидов (КС) и постепенно возвращается к исходному уровню через 3 дня после профилактики респираторного дистресс-синдрома (РДС) плода. Наиболее точным маркером является С-реактивный белок, его чувствительность составляет 68,7%, специфичность - 77,1% [42].
• При угрожающих, начавшихся ПР и при ПРПО рекомендовано определение антигена стрептококка группы В (СГВ) (S. agalactiae) в отделяемом цервикального канала или микробиологическое (культуральное) исследование отделяемого женских половых органов на аэробные и факультативно-анаэробные микроорганизмы (оптимально - в вагино-ректальном посеве) для своевременной диагностики и профилактики септических осложнений [43].[2].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарий. Связь между колонизацией СГВ во время беременности и ПР не доказана, однако имеет место повышенный риск неонатального сепсиса, что делает данное исследование клинически целесообразным [44].
• Для уточнения диагноза ПР в 240 - 336 недель беременности рекомендовано (при возможности) определение фосфорилированной формы протеин-1 связанного инсулиноподобного фактора роста (ПСИФР-1) или плацентарного альфа-микроглобулина-1 (ПАМГ-1) в цервикальной слизи [45-47].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарии. ПСИФР-1 продуцируется плацентарными децидуальными клетками и определяется в цервикальной слизи в результате повреждения хориодецидуальной зоны [45]. Отрицательный результат указывает на низкий риск ПР в течение 7 дней после проведения теста (PPV=94%) [48]. Чувствительность теста на ПАМГ-1 у пациенток с угрожающими ПР и интактным плодным пузырем составляет 84%, специфичность - 95%, PNV - 93-97%. Чувствительность и NPV в отношении ПР через 7 дней у пациенток с длиной шейки матки 15-30 мм составляют 100%. Для прогноза ПР менее 34 недели PNV составляет 93%[3] [46].
• При ПРПО рекомендован осмотр шейки матки в зеркалах для идентификации подтекания околоплодных вод 46, [4] [38].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарий. К лабораторным экспресс-тестам относится «цитологический тест» (симптом «папоротника», частота ложноотрицательных результатов более 20%), нитразиновый тест (частота ложноположительных результатов 5-30%) и тест на ПСИФР-1 и ПАМГ-1 [45-50] (Таблица 2).
Таблица 2.
Предиктивная способность тест-систем для определения ПРПО.
| Биомаркер | SN, % | SP, % | PPV, % | NPV, % |
| ПСИФР-10 | 92,1 | 90,5 | 87,9 | 93,9 |
| ПАМГ-1 | 96,8 | 98,3 | 98,4 | 96,7 |
SN - чувствительность, SP - специфичность, PPV и NPV - прогностическая ценность положительного и отрицательного результатов, соответственно.
2,4 Инструментальные диагностические исследования.
Пациенткам группы риска ПР рекомендовано УЗИ шейки матки (трансвагинальная УЗ-цервикометрия) для своевременной диагностики истмико-цервикальной недостаточности[5] [20, 51].Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии. Длина шейки матки ≤25мм до 34 недель беременности является прогностическим фактором ПР. В 20 недель беременности длина шейки матки ≤25мм ассоциирована с повышением риска ПР в 6 раз. До 34 недель при одноплодной беременности определение длины шейки матки ≤25 мм имеет чувствительность 76%, специфичность - 68%, PPV - 20% и NPV - 96% для диагноза ПР [52], [53].
2,5 Иные диагностические исследования.
Для исключения/подтверждения инфекционно-воспалительного процесса и для решения вопроса о целесообразности хирургической коррекции истмико-цервикальной недостаточности (ИЦН) при длине шейки матки ≤25мм в сроке 220-236 недели беременности на основании коллегиального решения (совместный осмотр, консилиум) рекомендован диагностический трансабдоминальный амниоцентез [54].Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
Комментарии: Частота острого хориоамнионита у пациенток, родоразрешенных в 220-236 недели беременности, составляет 94,4% [55]. Во 2-м триместре беременности при экстремально ранних ПР в сочетании с ИЦН исключение инфекционно-воспалительного фактора с целью улучшения исходов беременности при планировании хирургической коррекции ИЦН является необходимым этапом ведения пациентки[6]. Субклинический хориоамнионит является важным фактором риска преждевременного укорочения и созревания шейки матки, поэтому амниоцентез является объективным методом для исключения воспаления/инфекции до производства хирургической коррекции ИЦН. Повышенная концентрация в амниотической жидкости ИЛ-6, лейкоцитов и низкая концентрация глюкозы, даже в отсутствие положительного микробиологического посева, значительно увеличивает неблагоприятные исходы беременности у пациенток, перенесших неселективный (ургентный) серкляж [54]. Также при исследовании амниотической жидкости возможно определение зрелости легких плода [56]. При подтверждении внутриамниотической инфекции на основании исследования околоплодных вод хирургическая коррекция ИЦН, учитывая высокий риск акушерских и перинатальных осложнений, как правило, не проводится [5, 9, 54, 55].
[1] Preterm Labor and вirth Management: Recommendations from the European Association of Perinatal Medicine, 2017.
[2] сare of Women Presenting with Suspected Preterm Prelabour Rupture of Membranes from 24+0 Weeks of Gestation: Green-top Guideline № 73, 2019.
[3] Preterm Labor and вirth Management: Recommendations from the European Association of Perinatal Medicine, 2017.
[4] ACOG, Practice вulletin № 172: Premature Rupture of Membranes, 2016.
[5] Preterm Labor and вirth Management: Recommendations from the European Association of Perinatal Medicine, 2017.
[6] ACOG Practice вulletin №142: сerclage for the management of cervical insufficiency, 2014.
|
|
Лечение
3,1 Медикаментозная терапия.
• При угрожающих ПР и начавшихся ПР в сроках беременности 240 - 336 недель [57] рекомендована токолитическая терапия [58-62].Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарий: Введение токолитических препаратов может снизить силу и частоту сокращений матки, отсрочить наступление родов на 48 часов и/или даже 7 дней, но не пролонгировать беременность до доношенного срока [63]. Препараты вводятся в течение 48 часов с целью профилактики РДС у плода, проведения магнезиальной терапии для нейропротекции плода, и перевода беременной в стационар 3-й группы.[1] Противопоказаниями для токолитической терапии являются[2]: внутриутробная гибель плода, ВПР, несовместимые с жизнью, тяжелая преэклампсия и эклампсия, кровотечение у матери с нестабильной гемодинамикой, хориоамнионит, противопоказания со стороны матери к данной терапии, ПРПО при сроке беременности более 320 недель, преждевременная отслойка нормально расположенной плаценты (ПОНРП), несостоятельность рубца на матке, раскрытие маточного зева более 4 см Токолитическая терапия в сроках менее 240 недель должна быть рассмотрена индивидуально, с разъяснением семье о неблагоприятном прогнозе для новорожденного при родах в этом сроке[3]. 340 недели беременности являются порогом, при котором перинатальная заболеваемость и смертность являются достаточно низкими, чтобы оправдать потенциальные осложнения со стороны матери и плода, и затраты, связанные с проведением токолитической терапии[4].
• При отсутствии объективных признаков ПР (отсутствие укорочения шейки матки по данным УЗ-цервикометрии и отсутствие положительных результатов тестов на ПР (при их выполнении) токолитическая терапия не рекомендована [64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• В качестве первой линии токолитической терапии рекомендованы нифедипин** (блокатор «медленных» кальциевых каналов) [65-67] и атозибан** (препарат, блокирующий рецепторы окситоцина) [68].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии. Нифедипин** [69] не зарегистрирован в качестве токолитического средства и используется off-label, поэтому перед его применением необходимо заключение врачебной комиссии (заведующий отделением и 2 врача акушера-гинеколога) и письменное информированное согласие пациентки на его использование. Схема применения: 20 мг внутрь, далее, если сокращения матки сохраняются, через 30 минут 20 мг повторно, затем по 20 мг каждые 3-8 часов в течение 48 часов по показаниям; максимальная доза 160 мг/сутки.[5] Побочные эффекты (только со стороны матери): артериальная гипотензия (в этих случаях показано снижение дозы препарата), тахикардия, головные боли, головокружение, тошнота. Рекомендуемый мониторинг: постоянный контроль ЧСС плода, измерение пульса, артериального давления (АД) каждые 30 минут в течение первого часа, затем каждый час в течение первых 24 часов, затем каждые 4 часа.
Атозибан** является высокоселективным блокатором рецепторов окситоцина, с небольшим количеством побочных эффектов, однако не было доказано его преимуществ по сравнению с нифедипином** [68], [66]. Учитывая это, а также высокую стоимость препарата, он должен назначаться при наличии противопоказаний к применению нифедипина** и других токолитиков, особенно в сроках 320 - 336 недель 24 [65]. Схема применения: препарат вводится внутривенно в 3 последовательных этапа согласно инструкции. Общая продолжительность курса лечения не должна превышать 48 часов, максимальная доза - не более 330 мг. Повторный курс можно начинать в любое время после первого применения препарата, повторять его можно до 3 циклов. Побочные эффекты (со стороны матери): тошнота, рвота, гипергликемия, головная боль, головокружение, тахикардия, артериальная гипотензия в этих случаях показано снижение дозы препарата), зуд, кожная сыпь. Рекомендуемый мониторинг: аналогичен мониторингу при применении нифедипина**.
• В качестве второй линии токолитической терапии рекомендованы гексопреналин** (токолитические препараты - симпатомиметики ) [58, 65, 66] и нестероидные противовоспалительные препараты (индометацин) [70], при этом в 240 - 316 недели беременности рекомендованы как токолитические препараты - симпатомиметики (гексопреналин**), так и нестероидные противовоспалительные препараты (индометацин) 21, [6] [65, 66, 70], а в 320 - 336 недели беременности рекомендованы токолитические препараты - симпатомиметики (гексопреналин**) в связи с неблагоприятными эффектами индометацина на плод после 32 недель [70].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии. Гексопреналин** является эффективным токолитиком с доказанной эффективностью [58], однако большое количество побочных эффектов как со стороны матери, так и плода ограничивают его применение[7]. Схема применения: острый токолиз следует начинать с болюсного введения 10 мкг (1 ампула по 2 мл) препарата, разведенного в 10 мл изотонического раствора, в течение 5-10 минут с последующей инфузией со скоростью 0,3 мкг/мин, при длительном токолизе рекомендуемая доза - 0,075 мкг/мин; максимальная суточная доза 430 мкг. Дозировка препарата подбирается индивидуально. Внутривенный токолиз проводится в положении женщины на левом боку, желательно под кардиомониторным контролем. Рекомендуемый мониторинг: контроль ЧСС и АД матери каждые 15 минут, определение уровня глюкозы крови каждые 4 часа, контроль объема вводимой жидкости и диуреза, аускультация легких каждые 4 часа, контроль за состоянием плода и сократительной активностью матки.
Индометацин [69] применяется начиная с 50-100 мг ректально или внутрь, затем по 25 мг каждые 6 часов (не более 48 часов). Побочные эффекты со стороны матери: тошнота, рефлюкс-эзофагит, гастрит. Побочные эффекты со стороны плода после 31 недели гестации: преждевременное закрытие артериального протока, олигурия и маловодие. Противопоказания к назначению: нарушения свертываемости крови, повышенная кровоточивость, нарушение функции печени, язвенная болезнь желудка/12-перстной кишки, бронхиальная астма, повышенная чувствительность к аспирину, ЗРП, ВПР почек у плода[8]. Частота побочных эффектов значительно меньше при использовании не более 48 часов при сроке беременности менее 32 педель. Наличие олигогидрамниона и/или выявление сужения артериального протока является показанием для прекращения терапии.
• Не рекомендован магния сульфат** в качестве препарата для токолитической терапии [71].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
• Не рекомендована многокомпонентная токолитическая терапия (≥3 лекарственных препаратов) из-за отсутствия исследований, доказывающих безопасность, а также соотношение польза-риск [57].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
• Не рекомендована рутинная поддерживающая токолитическая терапия после эффективно проведенного острого токолиза [72].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
• При ПРПО, начавшихся или запланированных (индуцированных) ПР в течении 24 часов рекомендовано внутривенное введение магния сульфата** в 240 - 336 недель беременности с целью нейропротекции плода[9][73], [74].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии: Магнезиальная терапия за 24 часа до родоразрешения снижает частоту церебрального паралича, двигательных нарушений. Максимальный эффект отмечается до 306 недель [74]. Применение магния сульфата** противопоказано женщинам с миастенией, так как он может спровоцировать тяжелый миастенический криз. Следует также избегать его назначения женщинам с нарушением сердечной проводимости из-за его антиинотропного действия. Поскольку магний выводится почками, у женщин с нарушением функции почек может отмечаться повышенное содержание магния в сыворотке, что может провоцировать токсическое действие и, следовательно, у данной категории пациенток доза должна быть подобрана индивидуально [75]. Схема применения: нагрузочная доза 4 г в течение 20-30 минут, затем 1 г/час в течение 24 часов внутривенно [69].
• При ПРПО рекомендована антибактериальная терапия с целью пролонгирования беременности и снижения неонатальной заболеваемости с момента постановки диагноза ПРПО в течение 10 дней, либо до родов (если они начинаются ранее)[10], [11] [76].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии. Научно доказанным и подтвержденными препаратами являются ампициллин**/амоксициллин** и/или эритромицин. Применение антибиотиков ассоциировано со значительным снижением частоты хориоамнионита, неонатальной инфекции и перинатальной смертности [77]. Решение о повторном курсе антибактериальной терапии принимается в зависимости от результатов инфекционно-воспалительного мониторинга.
• При ПРПО не рекомендовано применение амоксициллина+клавулоновой кислоты** в связи с высокой частотой развития некротизирующего энтероколита у новорожденных [78] .
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• При ПРПО амниоинфузии в рутинной клинической практике не рекомендованы [79].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарий. Амниоинфузия может улучшить неонатальные исходы за счет предотвращения компрессии пуповины, постуральных деформаций, снижения легочной гипоплазии и внутриутробной инфекции, однако из-за недостаточного количества исследований на данный момент не рекомендована в рутинной клинический практике [79].
3,2 Хирургическое лечение.
При укорочении шейки матки и интактных плодных оболочках рекомендован серкляж (наложение швов на шейку матки) [21, 80].Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии: Серкляж проводится в 160 - 266 недель беременности. [12] Серкляж может быть выполнен как профилактическая мера у пациенток с отягощенным анамнезом (поздний выкидыш и/или ПР) или применен экстренно, когда у пациентки наблюдается преждевременное созревание и укорочение шейки матки, нередко сопровождающееся пролабированием плодных оболочек [81]. Необходимо тщательно взвесить пользу и риск от проводимой процедуры с учетом срока беременности (с увеличением срока риски повышаются), степени раскрытия шейки матки, квалификации врача акушера-гинеколога и возможностей стационара. После 240 недель беременности серкляж проводится только в стационаре 3-й группы.
• Не рекомендовано наложение швов на шейку матки (серкляж) пациенткам с признаками инфекции, кровотечением из влагалища, сокращениями матки [82].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Для адекватного анестезиологического обеспечения при серкляже рекомендовано применение как методов нейроаксиальной анестезии (эпидуральная, спинальная, комбинированная спинально-эпидуральная), так и общей анестезии [83-87].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5.
Комментарии. Существуют убедительные доказательства того, что ни одна из указанных разновидностей анестезии не увеличивает концентрацию эндогенного окситоцина и не влияет на результаты операции [88]. Если пациентка находится в положении Тренделенбурга, при проведении спинальной анестезии следует избегать гипербарических растворов местных анестетиков. При трансвагинальном серкляже анестезия проводится с сохранением спонтанного дыхания, при трансабдоминальном лапароскопическом доступе используется анестезия с искусственной вентиляцией легких [89].
3,3 Иное лечение.
Не рекомендована профилактика РДС плода и острый токолиз при длине шейки матки >25 мм и отрицательном результате теста на ПР - ПСИФР-1 или ПАМГ-1 [90].Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• При ПРПО в 240 - 366 недель беременности рекомендована выжидательная тактика, направленная на пролонгирование беременности, под контролем состояния беременной и плода[13] [41].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии. Выжидательная тактика включает госпитализацию с периодической оценкой клинико-лабораторных параметров для исключения инфекционного процесса, ПОНРП, компрессии пуповины, начала родовой деятельности, оценки состояния плода[14].
• При ПРПО рекомендовано наблюдение всех пациенток в условиях круглосуточного стационара [15] [91].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
3,4 Родоразрешение.
При ПР через естественные родовые пути при отсутствии противопоказаний в качестве метода обезболивания рекомендована нейроаксиальная аналгезия (эпидуральная, спинальная, комбинированная спинально-эпидуральная) [92-97], [98-100].Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии. Нейроаксиальная аналгезия является максимально эффективным методом обезболивания при ПР через естественные родовые пути [101]. Возможно использование любой технологии нейроаксиальной аналгезии: эпидуральной аналгезии - болюсов, постоянной инфузии местного анестетика в эпидуральное пространство, контролируемой пациенткой аналгезии, программируемых (автоматизированные) болюсов в эпидуральное пространство, компьютер-интегрированной контролируемой пациенткой аналгезии, эпидуральной аналгезии с проколом твердой мозговой оболочки.
• С учетом отрицательного влияния на состояние плода и новорожденного при ПР и наличии противопоказаний рекомендовано избегать применения опиоидов в качестве адъювантов для нейроаксиальной аналгезии [102].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• При ПР кесарево сечение (КС) не рекомендовано в качестве метода выбора родоразрешения [103].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии: Отмечается одинаковая частота родового травматизма, асфиксии при рождении и перинатальной смертности при КС и влагалищных родах, но более высокая материнская заболеваемость при КС по сравнению с родами через естественные родовые пути. При этом в ряде исследований показано, что в 240 - 276 недель беременности предпочтительным является КС, так как оно ассоциировано с более низкой частотой тяжелых неонатальных осложнений [117]. Если предполагаемая масса плода не соответствует гестационному сроку, то КС является предпочтительным в сроках до 316 недель. При соответствии предполагаемой массы плода сроку гестации родоразрешение через естественные родовые пути в 320 - 336 имеет более благоприятные неонатальные исходы по сравнению с КС [104]. Особенности извлечения плода описаны в клинических рекомендациях «Кесарево сечение».[16].
• При ПР и тазовом предлежании плода до 326 недель беременности КС рекомендовано в качестве метода выбора родоразрешения [17] [105].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарии: Способ родоразрешения должен быть индивидуализирован в зависимости от периода родов, вида тазового предлежания, состояния плода и наличия врача, владеющего техникой принятия родов в тазовом предлежании. При благоприятной акушерской ситуации ПР роды в тазовом предлежании возможны[18]. В сроках беременности менее 276 недель родоразрешение путем операции КС ассоциировано с более низкой частотой неонатальной смертности и тяжелых внутрижелудочковых кровоизлияний (ВЖК) [106]. При наличии технических возможностей рекомендовано извлечение плода в плодных оболочках.
• Не рекомендовано использование вакуум-экстракции плода при ПР до 336 недель беременности[19] [107, 108].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии: Использование вакуум-экстрактора не рекомендуется из-за более частого развития у недоношенного субглиальных гематом, ВЖК, подкожных кровоизлияний и желтухи. В ситуации, когда выполнение операции КС невозможно, предпочтительно наложение акушерских щипцов, однако эти данные противоречивы [109]. В сроках беременности 340 - 366 недель недостаточно данных, свидетельствующих о безопасности/вреде от наложения акушерских щипцов и вакуум-экстрактора.
• Не рекомендован разрез промежности (эпизиотомия) рутинно [110].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 3).
• При оперативном родоразрешения путем операции КС при ПР рекомендовано применение как методов нейроаксиальной анестезии (эпидуральная, спинальная, комбинированная спинально-эпидуральная), так и общей анестезии для адекватного анестезиологического обеспечения [111-118].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарий. При неоспоримом преобладании нейроаксиальной анестезии при операции КС общая анестезия сохраняет свои позиции при противопоказаниях к нейроаксиальной анестезии [101].
• При отсутствии сопутствующих факторов риска непрерывный мониторинг состояния плода в родах не рекомендован [119]. [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
• Не рекомендовано применение скальп-электрода в родах в сроках менее 336 недель [120].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарий: Применение скальп-электрода и забор крови у плода возможно в сроках 340 - 366 недель, когда польза превышает риск, и невозможно определить ЧСС плода с помощью наружной КТГ и аускультации в прерывистом режиме.
• Рекомендовано отсроченное пережатие сосудов пуповины в присутствии неонатолога после рождения плода[21] [121].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарии. Отсроченное пережатие пуповины проводится при пульсации пуповины более 100 в минуту (пульсация определяется пальпаторно). Эффективным считается пережатие минимум на 60 сек, но не более 3 мин при стабильном состоянии матери и новорожденного. Ребенка перед пережатием пуповины следует разместить на уровне или ниже уровня плаценты. В исключительных случаях при необходимости реанимационных мероприятий недоношенному новорожденному или при кровотечении у матери целесообразно использовать milking пуповины («пуповинное доение») и ее пережатие. Клиническое исследование показало четырехкратное увеличение частоты тяжелых ВЖК при milking пуповины по сравнению с отсроченным пережатием пуповины у глубоко недоношенных новорожденных, поэтому применять его у глубоко недоношенных новорожденных не рекомендовано [122].
• Рекомендовано после рождения ребенка в гестационном сроке менее 276 недель помещать его в прозрачный полиэтиленовый пакет и под лучистое тепло для поддержания температуры тела [123].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарий. Также рекомендовано повышение температуры окружающей среды в родильном зале до 26-28°C [124].
[1] ACOG, Practice вulletin № 171: Management of Preterm Labor, 2016.
[2] Preterm Labor and вirth Management: Recommendations from the European Association of Perinatal Medicine, 2017.
[3] Obstetric сare сonsensus № 3: Periviable вirth, ACOG, 2015.
[4] ACOG, Practice вulletin № 171: Management of Preterm Labor, 2016.
[5] Акушерство: национальное руководство / под ред. Г.М. Савельевой, Г.Т. Сухих, В.Н. Серова, В.Е. Радзинского. 2-е изд. М. ГЭОТАР-Медиа, 2018 г.
[6] NICE Guidance, Preterm labour and birth, 2016.
[7] NICE Guidance, Preterm labour and birth, 2016.
[8] Preterm Labor and вirth Management: Recommendations from the European Association of Perinatal Medicine, 2017.
[9] сare of Women Presenting with Suspected Preterm Prelabour Rupture of Membranes from 24+0 Weeks of Gestation: Green-top Guideline № 73, 2019.
[10] ACOG, Practice вulletin № 172: Premature Rupture of Membranes, 2016.
[11] сare of Women Presenting with Suspected Preterm Prelabour Rupture of Membranes from 24+0 Weeks of Gestation: Green-top Guideline № 73, 2019.
[12] NICE Guidance, Preterm labour and birth, 2016.
[13] сare of Women Presenting with Suspected Preterm Prelabour Rupture of Membranes from 24+0 Weeks of Gestation: Green-top Guideline № 73, 2019.
[14] ACOG, Practice вulletin № 172: Premature Rupture of Membranes, 2016.
[15] сare of Women Presenting with Suspected Preterm Prelabour Rupture of Membranes from 24+0 Weeks of Gestation: Green-top Guideline № 73, 2019.
[16] Клинические рекомендации «Кесарево сечение» http://prof.ncagp.ru/index.php?_t8=85.
[17] NICE Guidance, Preterm labour and birth, 2016.
[18] Management of вreech Presentation (Green-top Guideline № 20b), 2017.
[19] Operative Vaginal Delivery (Green-top Guideline № 26), 2011.
[20] NICE Guidance, Preterm labour and birth, 2016.
[21] NICE Guidance, Preterm labour and birth, 2016.
|
|
Реабилитация и амбулаторное лечение
• Рекомендована консультация медицинского психолога матерям, родившим преждевременно, особенно чьи дети находятся в отделении реанимации и интенсивной терапии новорожденных, при получении их информированного добровольного согласия [125].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
Комментарии. ПР являются тревожным событием для родителей, которые часто сообщают о симптомах посттравматического стресса в течение нескольких лет, иногда даже через 5 - 6 лет после ПР матери имеют негативное мнение о своем перинатальном периоде. Основной стресс, испытываемый родителями, связан с разлучением со своим ребенком (нахождение в палате интенсивной терапии) и потерей родительской роли вследствие потери физической и эмоциональной близости, которые являются важными факторами в формировании отношений между родителями и новорожденным ребенком. Во время стационарного лечения недоношенного ребенка, особенно в отделении интенсивной терапии матери могут испытывать противоречивые эмоциональные реакции, такие как горе, грусть, вина, страх, гнев, потеря самооценки и чувство неудачи. Фактически, эта ситуация может настолько угнетать матерей, что они могут реагировать, эмоционально дистанцируясь от своих детей. Это препятствует их позитивному настрою в отношении перспектив для своего ребенка. В частности, матери недоношенных детей часто имеют меньше позитивных идей и ожиданий в отношении своих детей, чем матери доношенных новорожденных [125, 126].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
Комментарии. ПР являются тревожным событием для родителей, которые часто сообщают о симптомах посттравматического стресса в течение нескольких лет, иногда даже через 5 - 6 лет после ПР матери имеют негативное мнение о своем перинатальном периоде. Основной стресс, испытываемый родителями, связан с разлучением со своим ребенком (нахождение в палате интенсивной терапии) и потерей родительской роли вследствие потери физической и эмоциональной близости, которые являются важными факторами в формировании отношений между родителями и новорожденным ребенком. Во время стационарного лечения недоношенного ребенка, особенно в отделении интенсивной терапии матери могут испытывать противоречивые эмоциональные реакции, такие как горе, грусть, вина, страх, гнев, потеря самооценки и чувство неудачи. Фактически, эта ситуация может настолько угнетать матерей, что они могут реагировать, эмоционально дистанцируясь от своих детей. Это препятствует их позитивному настрою в отношении перспектив для своего ребенка. В частности, матери недоношенных детей часто имеют меньше позитивных идей и ожиданий в отношении своих детей, чем матери доношенных новорожденных [125, 126].
Профилактика
5,1 Антенатальная профилактика РДС плода.
При угрожающих ПР, начавшихся ПР и ПРПО в 240 - 336 недель беременности рекомендована антенатальная профилактика РДС плода (плодов при многоплодной беременности) [127, 128], [129].Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарий. Максимальный эффект от применения ГКС отмечается на 2-7 сутки от начала профилактики, при этом, если не удается провести полный курс, следует все равно начинать профилактику РДС (доказан эффект «неполной дозы») [130]. ГКС не следует вводить, если нет серьезных опасений в отношении предстоящих ПР и обоснованной уверенности, что они начнутся через 7 дней[1]. Есть данные, что при хориоамнионите ГКС являются безопасными и улучшают перинатальные исходы [131, 132].
• Однократный повторный курс антенатальной профилактики РДС плода может быть рекомендован в 240 - 336 недель беременности при сохраняющихся клинических симптомах начавшихся ПР при условии, что предыдущий курс проводился более 14 дней назад, особенно в сроках <28 недель беременности [133]. Спасительный» (с англ. rescue) курс может быть проведен уже через 7 дней в случае клинической целесообразности[2] [134, 135].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарий. Повторный курс антенатальной профилактики РДС плода не является рутинным и решение о его применении должно быть принято на основании времени, прошедшего от последнего курса профилактики, гестационного срока и вероятности родоразрешения в ближайшие 48 часов. Вопрос о повторном/спасительном курсе антенатальной профилактики РДС плода при ПРПО остается спорным [136].
• Не рекомендовано проведение регулярных или серийных повторных курсов (более 2-х) профилактики РДС плода[3] [137, 138].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарий. При проведении многократных повторных курсов отмечается более высокий риск краткосрочных и долгосрочных перинатальных осложнений [137, 138], 4 и более курса ассоциированы с повышенным риском церебрального паралича [139].
• Антенатальная профилактика РДС плода в 220 - 236 недель беременности не рекомендована [128].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 3).
Комментарий. В отдельных ситуациях проведение антенатальной профилактики РДС плода в эти сроки беременности может быть рассмотрено индивидуально после информирования пациентки и ее близких врачом акушером-гинекологом и врачом-неонатологом о неблагоприятном исходе для глубоко недоношенного новорожденного при родах в этом сроке.
• Профилактика РДС плода в 340 - 356 недель беременности может быть рекомендована в случае отсутствия ранее проводимого курса антенатальной профилактики, а также при наличии клинической целесообразности (сахарный диабет) [4] [140].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 2).
Комментарий. В раннем неонатальном периоде новорожденным рекомендован тщательный мониторинг уровня глюкозы плазмы крови.
• Для профилактики РДС плода рекомендованы бетаметазон** внутримышечно в дозе 12 мг 2 раза с интервалом 24 часа или дексаметазон** внутримышечно в дозе 6 мг 4 раза с интервалом 12 часов или в дозе 8 мг 3 раза с интервалом 8 часов (суммарная доза 24 мг)[5] [127].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарий. Меньшие интервальные дозировки, чем что описаны выше, часто называемые «ускоренным курсом», даже в ситуации, когда роды кажутся неизбежными, не продемонстрировали потенциальных преимуществ. Дексаметазон** и бетаметазон** являются препаратами off-label в контексте профилактики РДС плода, и перед применением необходимо получить письменное информированное согласие пациентки на их использование.
5,2 Антибиотикопрофилактика.
Не рекомендовано применение антибактериальных препаратов с целью пролонгирования беременности и улучшения перинатальных исходов пациенткам с угрожающими/начавшихся ПР с интактными плодными оболочками при отсутствии доказанных признаков инфекции[6] [141].Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарий. Внутриматочная бактериальная инфекция является важной причиной ПР, особенно в гестационном сроке менее 32 недель [5, 8, 9, 11, 34]. Однако применение антибиотиков не способствует пролонгированию беременности или предотвращению ПР, не снижает частоту и выраженность РДС новорожденных и неонатального сепсиса. Имеются данные о нежелательных отдаленных последствия антибактериальных препаратов для ребенка [141].NB. Данная рекомендация не распространяется на пациенток с ПРПО и носительниц СГВ.
5,3 Профилактика вагинальным прогестероном**.
Рекомендовано профилактическое назначение препаратов прогестерона** (действующее вещество прогестерон натуральный микронизированный) по 200 мг в день вагинально с 22 до 34 недель беременным группы высокого риска ПР: с бессимптомным укорочением шейки матки по данным УЗ-цервикометрии менее 25 мм в сроках 16 - 24 недели беременности и/или наличием ПР (до 34 недель) или позднего выкидыша (после 16 недель) в анамнезе как при одноплодной, так и многоплодной беременности [7], [8] [142, 143], [144].Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
Комментарии. Профилактика ПР препаратами вагинального прогестерона** у пациенток с длиной шейки матки 25 мм и менее снижает риск ПР, РДС плода, рождения детей с массой тела <1500 и <2500 г, неонатальной заболеваемости и смертности, поступления в палату интенсивной терапии новорожденных. При этом не увеличивается риск нежелательных явлений у матери, врожденных аномалий и/или неблагоприятных последствий для развития нервной системы плода и здоровья детей [142].
• Рекомендовано применение адъювантной терапии прогестероном** (действующее вещество прогестерон натуральный микронизированный) по 200 мг в день вагинально до 34 недель беременности беременным с продолжающимся (прогрессирующим) укорочением шейки матки, несмотря на цервикальный серкляж [145].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
5,4 Иная профилактика.
Рекомендовано рассмотреть возможность наложения профилактического акушерского серкляжа пациенткам с одноплодной беременностью, укорочением шейки матки 25 мм и менее по данным УЗ-цервикометрии, проведенной между 16 и 24 неделями беременности и наличием в анамнезе спонтанных ПР (и/или ПРПО) или травм шейки матки (конизация, удаление обширной зоны трансформации, радикальные вмешательства (ампутация, трахелэктомия)[9], [10] [146].Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
• Рекомендовано применение акушерского пессария при укорочении шейки матки менее 25 мм с целью профилактики ПР до 37 недель беременности [147, 148].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
Комментарий. Установка пессария снижает частоту применения токолитической терапии и КС, не увеличивает вероятность ПРПО и не ухудшает перинатальные исходы для плода [147]. После 24 недель беременности применение акушерского пессария является методом выбора.
• При бессимптомном укорочении шейки матки не рекомендован постельный режим, так как он не снижает риск ПР [149].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1).
• Не рекомендовано ограничение физической активности при неосложненной беременности и ПР в анамнезе [150].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
• Не рекомендовано половое воздержание при неосложненной беременности и ПР в анамнезе [151].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
• Не рекомендован прием препаратов витамина D и его производных и омега-3 триглицеридов в целях пролонгирования беременности [152, 153].
Уровень убедительности рекомендаций А (уровень достоверности доказательств - 1).
• Для снижения риска ПР на этапе планирования беременности не рекомендовано рутинное применение поливитаминов, аскорбиновой кислоты** и альфа-токоферола ацетата (витамина Е) [154].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 2).
Организация оказания медицинской помощи.
При ПР, включая ПРПО, при сроке беременности менее 330 недель при отсутствии противопоказаний для транспортировки, осуществляется госпитализация пациентки в медицинскую организацию 3а группы.При ПР, включая ПРПО, при сроке беременности 33-36 недель, осуществляется госпитализация пациентки в акушерский стационар 3а группы, или при отсутствии возможности, акушерский стационар 2-й группы (имеющий отделение (палаты) реанимации и интенсивной терапии для новорожденных).
[1] ACOG сommittee Opinion № 677: antenatal corticosteroid therapy for fetal maturation, 2017.
[2] ACOG сommittee Opinion № 677: antenatal corticosteroid therapy for fetal maturation, 2017.
[3] ACOG сommittee Opinion № 677: antenatal corticosteroid therapy for fetal maturation, 2017.
[4] NICE Guidance, Preterm labour and birth, 2016.
[5] ACOG, Practice вulletin № 171: Management of Preterm Labor, 2016.
[6] ACOG, Practice вulletin № 171: Management of Preterm Labor, 2016.
[7] NICE Guidance, Preterm labour and birth, 2016.
[8] Preterm Labor and вirth Management: Recommendations from the European Association of Perinatal Medicine, 2017.
[9] NICE Guidance, Preterm labour and birth, 2016.
[10] Preterm Labor and вirth Management: Recommendations from the European Association of Perinatal Medicine, 2017.
|
|
Дополнительно
Не применимо.
Критерии оценки качества медицинской помощи
| № | Критерии качества | Оценка выполнения критерия |
| • | Проведено исследование уровня лейкоцитов в крови и уровня С-реактивного белка в сыворотке крови при преждевременном разрыве плодных оболочек | Да/Нет |
| • | Назначена токолитическая терапия препаратами первой (при невозможности - второй) линии при угрожающих ПР и начавшихся ПР в сроках беременности 240 - 336 недель | Да/Нет |
| • | Проведено внутривенное введение магния сульфата** при преждевременном разрыве плодных оболочек, начавшихся или запланированных (индуцированных) преждевременных родах в 240 - 336 недель беременности с целью нейропротекции плода | Да/Нет |
| • | Проведена антибактериальная терапия при преждевременном разрыве плодных оболочек | Да/Нет |
| • | Проведена антенатальная профилактика респираторного дистресс-синдрома плода при угрожающих родах (повышенный тонус матки, укорочение шейки матки, открытие наружного зева), начавшихся преждевременных родах и при преждевременном разрыве плодных оболочек в сроках беременности 240 - 336 недель | Да/Нет |
| • | После родов проведено отсроченное пережатие сосудов пуповины при стабильном состоянии новорожденного и пульсации пуповины более 100 в минуту | Да/Нет |
Список литературы
1. Romero R., Dey S.K., Fisher S.J. Preterm labor: one syndrome, many causes. Science. 2014; 345(6198):760-5.
2. Rubens с.E., Sadovsky Y., Muglia L., Gravett M.G., Lackritz E., Gravett с. Prevention of preterm birth: harnessing science to address the global epidemic. Sci Transl Med. 2014; 6(262):262sr5.
3. Savitz D.A., Terry J.W., Dole N., Thorp J.M., Siega-Riz p.m, Herring A.H. сomparison of pregnancy dating by last menstrual period, ultrasound scanning, and their combination. Am J Obstet Gynecol. 2002; 187(6):1660-6.
4. Whitworth M., вricker L., Mullan с. Ultrasound for fetal assessment in early pregnancy. сochrane database Syst Rev. 2015; (7):CD007058.
5. Romero R., Espinoza J., Kusanovic J.P., Gotsch F., Hassan S., Erez O., et al. The preterm parturition syndrome. вJOG. 2006; 113 Suppl:17-42.
6. Ananth с. V, Vintzileos p.m Medically indicated preterm birth: recognizing the importance of the problem. сlin Perinatol. 2008; 35(1):53-67, viii.
7. Romero R., Miranda J., сhaiworapongsa T., Korzeniewski S.J., сhaemsaithong P., Gotsch F., et al. Prevalence and clinical significance of sterile intra-amniotic inflammation in patients with preterm labor and intact membranes. Am J Reprod Immunol. 2014; 72(5):458-74.
8. Gomez-Lopez N., Romero R., Panaitescu в., Leng Y., Xu Y., Tarca A.L., et al. Inflammasome activation during spontaneous preterm labor with intra-amniotic infection or sterile intra-amniotic inflammation. Am J Reprod Immunol. 2018; 80(5):e13049.
9. вoyle A.K., Rinaldi S.F., Norman J.E., Stock S.J. Preterm birth: Inflammation, fetal injury and treatment strategies. J Reprod Immunol. 2017; 119:62-6.
10. Kemp M.W. Preterm birth, intrauterine infection, and fetal inflammation. Front Immunol. 2014; 5:574.
11. Keelan J.A. Intrauterine inflammatory activation, functional progesterone withdrawal, and the timing of term and preterm birth. J Reprod Immunol. 2018; 125:89-99.
12. Ozalkaya E., Karatekin G., Topcuoğlu S., Gürsoy T., Ovalı F. Morbidity in preterm infants with fetal inflammatory response syndrome. Pediatr Int. 2016; 58(9):850-4.
13. Myking S., вoyd H.A., Myhre R., Feenstra в., Jugessur A., Devold Pay A.S., et al. X-chromosomal maternal and fetal SNPs and the risk of spontaneous preterm delivery in a Danish/Norwegian genome-wide association study. PLoS One. 2013; 8(4):e61781.
14. Strauss J.F., Romero R., Gomez-Lopez N., Haymond-Thornburg H., Modi в.P., Teves M.E., et al. Spontaneous preterm birth: advances toward the discovery of genetic predisposition. Am J Obstet Gynecol. 2018; 218(3):294-314.e2.
15. Davey M.-A., Watson L., Rayner J.A., Rowlands S. Risk scoring systems for predicting preterm birth with the aim of reducing associated adverse outcomes. сochrane database Syst Rev. 2011; 9;(11):CD0(11):CD004902.
16. Ancel P.-Y., Lelong N., Papiernik E., Saurel-Cubizolles M.-J., Kaminski M., EUROPOP. History of induced abortion as a risk factor for preterm birth in European countries: results of the EUROPOP survey. Hum Reprod. 2004; 19(3):734-40.
17. Younge N., Goldstein R.F., вann с.M., Hintz S.R., Patel R.M., Smith P.B., et al. Survival and Neurodevelopmental Outcomes among Periviable Infants. N Engl J Med. 2017; 376(7):617-28.
18. WHO. Recommendations on Interventions to Improve Preterm вirth Outcomes. Geneva World Heal Organ. 2015; .
19. Lykke J.A., Dideriksen K.L., Lidegaard O., Langhoff-Roos J. First-trimester vaginal bleeding and complications later in pregnancy. Obstet Gynecol. 2010; 115(5):935-44.
20. Newman R.B., Goldenberg R.L., Iams J.D., Meis P.J., Mercer в.M., Moawad A.H., et al. Preterm prediction study: comparison of the cervical score and вishop score for prediction of spontaneous preterm delivery. Obstet Gynecol. 2008; 112(3):508-15.
21. Ehsanipoor R.M., Seligman N.S., Saccone G., Szymanski L.M., Wissinger с., Werner E.F., et al. Physical Examination-Indicated сerclage: A Systematic Review and Meta-analysis. Obstet Gynecol. 2015; 126(1):125-35.
22. Iams J.D., сebrik D., Lynch с., вehrendt N., Das A. The rate of cervical change and the phenotype of spontaneous preterm birth. Am J Obstet Gynecol. 2011; 205(2):130.e1-6.
23. Klein L.L., Gibbs R.S. Use of microbial cultures and antibiotics in the prevention of infection-associated preterm birth. Am J Obstet Gynecol. 2004; 190(6):1493-502.
24. Laughon S.K., Albert P.S., Leishear K., Mendola P. The NICHD сonsecutive Pregnancies Study: recurrent preterm delivery by subtype. Am J Obstet Gynecol. 2014; 210(2):131.e1-8.
25. Saccone G., Perriera L., вerghella V. Prior uterine evacuation of pregnancy as independent risk factor for preterm birth: a systematic review and metaanalysis. Am J Obstet Gynecol. 2016; 214(5):572-91.
26. вasso O., Olsen J., сhristensen K. Low birthweight and prematurity in relation to paternal factors: a study of recurrence. Int J Epidemiol. 1999; 28(4):695-700.
27. вoivin A., Luo Z.-C., Audibert F., Mâsse в., Lefebvre F., Tessier R., et al. Risk for preterm and very preterm delivery in women who were born preterm. Obstet Gynecol. 2015; 125(5):1177-84.
28. Fuchs F., Monet в., Ducruet T., сhaillet N., Audibert F. Effect of maternal age on the risk of preterm birth: A large cohort study. PLoS One. 2018; 13(1):e0191002.
29. Koike T., Minakami H., Kosuge S., Usui R., Matsubara S., Izumi A., et al. Uterine leiomyoma in pregnancy: its influence on obstetric performance. J Obstet Gynaecol Res. 1999; 25(5):309-13.
30. Smith G.C.S., Wood p.m, Pell J.P., Dobbie R. Sudden infant death syndrome and complications in other pregnancies. Lancet (London, England). 2005; 366(9503):2107-11.
31. Goisis A., Remes H., Martikainen P., Klemetti R., Myrskylä M. Medically assisted reproduction and birth outcomes: a within-family analysis using Finnish population registers. Lancet (London, England). 2019; 393(10177):1225-32.
32. Dolgun Z.N., Inan с., Altintas A.S., Okten S.B., Sayin N.C. Preterm birth in twin pregnancies: сlinical outcomes and predictive parameters. Pakistan J Med Sci. 2016; 32(4):922-6.
33. Schnarr J., Smaill F. Asymptomatic bacteriuria and symptomatic urinary tract infections in pregnancy. Eur J сlin Invest. 2008; 38 Suppl 2:50-7.
34. Meis P.J., Michielutte R., Peters T.J., Wells H.B., Sands R.E., сoles E.C., et al. Factors associated with preterm birth in сardiff, Wales. I. Univariable and multivariable analysis. Am J Obstet Gynecol. 1995; 173(2):590-6.
35. Vinturache A.E., Gyamfi-Bannerman с., Hwang J., Mysorekar I.U., Jacobsson в. Maternal microbiome - A pathway to preterm birth. Semin Fetal Neonatal Med. 2016; 21(2):94-9.
36. Myra J., Roger H. Mayo сlinic Guide to a Healthy Pregnancy. HarperCollins Publishers; 2004.
37. Alexander J.M., Mercer в.M., Miodovnik M., Thurnau G.R., Goldenberg R.L., Das A.F., et al. The impact of digital cervical examination on expectantly managed preterm rupture of membranes. Am J Obstet Gynecol. 2000; 183(4):1003-7.
38. Oláh K.S., Gee H. The prevention of preterm delivery--can we afford to continue to ignore the cervix? вr J Obstet Gynaecol. 1992; 99(4):278-80.
39. Divanovic E., вuchmann E.J. Routine heart and lung auscultation in prenatal care. Int J Gynaecol Obstet. 1999; 64(3):247-51.
40. Sharif K., Whittle M. Routine antenatal fetal heart rate auscultation: is it necessary. J Obstet Gynaecol (Lahore). 1993; 13:111-3.
41. вond D.M., Middleton P., Levett K.M., van der Ham D.P., сrowther с.A., вuchanan S.L., et al. Planned early birth versus expectant management for women with preterm prelabour rupture of membranes prior to 37 weeks’ gestation for improving pregnancy outcome. сochrane database Syst Rev. 2017; 3:CD004735.
42. сataño Sabogal с.P., Fonseca J., García-Perdomo H.A. Validation of diagnostic tests for histologic chorioamnionitis: Systematic review and meta-analysis. Eur J Obstet Gynecol Reprod вiol. 2018; 228:13-26.
43. вianchi-Jassir F., Seale A.C., Kohli-Lynch M., Lawn J.E., вaker с.J., вartlett L., et al. Preterm вirth Associated With Group в Streptococcus Maternal сolonization Worldwide: Systematic Review and Meta-analyses. сlin Infect Dis. 2017; 65(suppl_2):S133-42.
44. Valkenburg-van den вerg A.W., Sprij A.J., Dekker F.W., Dörr P.J., Kanhai H.H.H. Association between colonization with Group в Streptococcus and preterm delivery: a systematic review. Acta Obstet Gynecol Scand. 2009; 88(9):958-67.
45. Ting H.-S., сhin P.-S., Yeo G.S.H., Kwek K. сomparison of bedside test kits for prediction of preterm delivery: phosphorylated insulin-like growth factor binding protein-1 (pIGFBP-1) test and fetal fibronectin test. Ann Acad Med Singapore. 2007; 36(6):399-402.
46. Ehsanipoor R.M., Swank M.L., Jwa S.C., Wing D.A., Tarabulsi G., вlakemore K.J. Placental α-Microglobulin-1 in Vaginal Secretions of Women with Evidence of Preterm Labor. Am J Perinatol. 2016; 33(2):208-13.
47. Сorabian P. The ACTIMTM PARTUS versus THE TLIIQ ® SYSTEM as rapid response tests to aid in diagnosing preterm labour in symptomatic women. In: Institute of Health Economics, сanada. 2008.
48. Alfirevic Z., Allen-Coward H., Molina F., Vinuesa с.P., Nicolaides K. Targeted therapy for threatened preterm labor based on sonographic measurement of the cervical length: a randomized controlled trial. Ultrasound Obstet Gynecol. 2007; 29(1):47-50.
49. Palacio M., Kühnert M., вerger R., Larios с.L., Marcellin L. Meta-analysis of studies on biochemical marker tests for the diagnosis of premature rupture of membranes: comparison of performance indexes. вMC Pregnancy сhildbirth. 2014; 14:183.
50. Leitich H., вrunbauer M., Kaider A., Egarter с., Husslein P. сervical length and dilatation of the internal cervical os detected by vaginal ultrasonography as markers for preterm delivery: A systematic review. Am J Obstet Gynecol. 1999; 181(6):1465-72.
51. вerghella V., Palacio M., Ness A., Alfirevic Z., Nicolaides K.H., Saccone G. сervical length screening for prevention of preterm birth in singleton pregnancy with threatened preterm labor: systematic review and meta-analysis of randomized controlled trials using individual patient-level data. Ultrasound Obstet Gynecol. 2017; 49(3):322-9.
52. Norman J.E., Marlow N., Messow с.-M., Shennan A., вennett P.R., Thornton S., et al. Does progesterone prophylaxis to prevent preterm labour improve outcome. A randomised double-blind placebo-controlled trial (OPPTIMUM). Health Technol Assess. 2018; 22(35):1-304.
53. Medley N., Poljak в., Mammarella S., Alfirevic Z. сlinical guidelines for prevention and management of preterm birth: a systematic review. вJOG. 2018; 125(11):1361-9.
54. Mönckeberg M., Valdés R., Kusanovic J.P., Schepeler M., Nien J.K., Pertossi E., et al. Patients with acute cervical insufficiency without intra-amniotic infection/inflammation treated with cerclage have a good prognosis. J Perinat Med. 2019; 47(5):500-9.
55. Kim с.J., Romero R., сhaemsaithong P., Kim J.-S. сhronic inflammation of the placenta: definition, classification, pathogenesis, and clinical significance. Am J Obstet Gynecol. 2015; 213(4 Suppl):S53-69.
56. вeinlich A., Fischäss с., Kaufmann M., Schlösser R., Dericks-Tan J.S. Lamellar body counts in amniotic fluid for prediction of fetal lung maturity. Arch Gynecol Obstet. 1999; 262(3-4):173-80.
57. Vogel J.P., Nardin J.M., Dowswell T., West H.M., Oladapo O.T. сombination of tocolytic agents for inhibiting preterm labour. сochrane database Syst Rev. 2014; 11;(7):CD0(7):CD006169.
58. Neilson J.P., West H.M., Dowswell T. вetamimetics for inhibiting preterm labour. сochrane database Syst Rev. 2014; (2):CD004352.
59. Dodd J.M., сrowther с.A., Middleton P. Oral betamimetics for maintenance therapy after threatened preterm labour. сochrane database Syst Rev. 2012; 12:CD003927.
60. Flenady V., Wojcieszek p.m, Papatsonis D.N.M., Stock O.M., Murray L., Jardine L.A., et al. сalcium channel blockers for inhibiting preterm labour and birth. сochrane database Syst Rev. 2014; (6):CD002255.
61. Naik Gaunekar N., Raman P., вain E., сrowther с.A. Maintenance therapy with calcium channel blockers for preventing preterm birth after threatened preterm labour. сochrane database Syst Rev. 2013; (10):CD004071.
62. Lyell D.J., Pullen K.M., Mannan J., сhitkara U., Druzin M.L., сaughey A.B., et al. Maintenance nifedipine tocolysis compared with placebo: a randomized controlled trial. Obstet Gynecol. 2008; 112(6):1221-6.
63. Jacquemyn Y., Van Overmeire в. Tocolytic therapy: a meta-analysis and decision analysis. Obstet Gynecol. 2009; 114(1):170-1; author reply 171.
64. Sanchez-Ramos L., Kaunitz p.m, Gaudier F.L., Delke I. Efficacy of maintenance therapy after acute tocolysis: a meta-analysis. Am J Obstet Gynecol. 1999; 181(2):484-90.
65. Hyagriv N., Simhan M., сaritis S. Inhibition of acute preterm labor. UpToDate.
66. Haas D.M., сaldwell D.M., Kirkpatrick P., McIntosh J.J., Welton N.J. Tocolytic therapy for preterm delivery: systematic review and network meta-analysis. вMJ. 2012; 345:e6226.
67. King J.F., Flenady V.J., Papatsonis D.N., Dekker G.A., сarbonne в. сalcium channel blockers for inhibiting preterm labour. сochrane database Syst Rev. 2003; (1):CD0022(1):CD002255.
68. Flenady V., Reinebrant H.E., Liley H.G., Tambimuttu E.G., Papatsonis D.N.M. Oxytocin receptor antagonists for inhibiting preterm labour. сochrane database Syst Rev. 2014; (6):CD004452.
69. Письмо Минздрава России от 17 декабря 2013г. №15-4/10/2-9480. Клинические рекомендации (протокол лечения) «Преждевременные роды».
70. King J., Flenady V., сole S., Thornton S. сyclo-oxygenase (COX) inhibitors for treating preterm labour. сochrane database Syst Rev. 2005; 18;(2):CD0(2):CD001992.
71. сrowther с.A., вrown J., McKinlay с.J.D., Middleton P. Magnesium sulphate for preventing preterm birth in threatened preterm labour. сochrane database Syst Rev. 2014; (8):CD001060.
72. Han S., сrowther с.A., Moore V. Magnesium maintenance therapy for preventing preterm birth after threatened preterm labour. In: сrowther сA, editor. сochrane Database of Systematic Reviews. сhichester, UK: John Wiley & Sons, Ltd; 2010.
73. Doyle L.W., сrowther с.A., Middleton P., Marret S., Rouse D. Magnesium sulphate for women at risk of preterm birth for neuroprotection of the fetus. сochrane database Syst Rev. 2009; (1):CD0046(1):CD004661.
74. сostantine M.M., Weiner S.J., Eunice Kennedy Shriver National Institute of сhild Health and Human Development Maternal-Fetal Medicine Units Network. Effects of antenatal exposure to magnesium sulfate on neuroprotection and mortality in preterm infants: a meta-analysis. Obstet Gynecol. 2009; 114(2 Pt 1):354-64.
75. Elliott J.P., Lewis D.F., Morrison J.C., Garite T.J. In defense of magnesium sulfate. Obstet Gynecol. 2009; 113(6):1341-8.
76. Kenyon S., вoulvain M., Neilson J.P. Antibiotics for preterm rupture of membranes. сochrane database Syst Rev. 2013; (2):CD0010(12):CD001058.
77. Kenyon S., Pike K., Jones D.R., вrocklehurst P., Marlow N., Salt A., et al. сhildhood outcomes after prescription of antibiotics to pregnant women with preterm rupture of the membranes: 7-year follow-up of the ORACLE I trial. Lancet (London, England). 2008; 372(9646):1310-8.
78. Practice вulletin № 199: Use of Prophylactic Antibiotics in Labor and Delivery: сorrection. Obstet Gynecol. 2019; 134(4):883-4.
79. Hofmeyr G.J., Eke A.C., Lawrie T.A. Amnioinfusion for third trimester preterm premature rupture of membranes. сochrane database Syst Rev. 2014; (3):CD0009(3):CD000942.
80. Alfirevic Z., Stampalija T., Medley N. сervical stitch (cerclage) for preventing preterm birth in singleton pregnancy. сochrane database Syst Rev. 2017; 6:CD008991.
81. Preterm labour and birth. NICE guideline NG25. London: National Institute for Health and сare Excellence (UK). 2015.
82. Gupta M., Emary K., Impey L. Emergency cervical cerclage: predictors of success. J Matern Fetal Neonatal Med. 2010; 23(7):670-4.
83. Aaronson J., Goodman S. Obstetric anesthesia: not just for cesareans and labor. Semin Perinatol. 2014; 38(6):378-85.
84. Wortman M., сarroll K. Office-Based Gynecologic Surgery (OBGS): Past, Present, and Future: Part I. Surg Technol Int. 2019; 35:173-84.
85. сhestnut D.H., Wong с.A., Tsen L.C., Kee W.D.N., вeilin Y., Mhyre J. сhestnut’s Obstetric Anesthesia: Principles and Practice, 5th Edition. Elsevier Science; 2014. 1304 p.
86. Rahman A. Shnider and Levinson’s Anesthesia for Obstetrics, Fifth Edition. Anesthesiology. 2015; 122(1):223.
87. L. Fleisher, Wiener-Kronish J. Miller’s Anesthesia, 9th Edition. Anesthesiology. 2019; .
88. Ioscovich A., Popov A., Gimelfarb Y., Gozal Y., Orbach-Zinger S., Shapiro J., et al. Anesthetic management of prophylactic cervical cerclage: a retrospective multicenter cohort study. Arch Gynecol Obstet. 2015; 291(3):509-12.
89. Wang Y.-Y., Duan H., Zhang X.-N., Wang S., Gao L. A Novel сerclage Insertion: Modified Laparoscopic Transabdominal сervical сerclage with Transvaginal Removing (MLTCC-TR). J Minim Invasive Gynecol. 2019; .
90. Rahkonen L., Unkila-Kallio L., Nuutila M., Sainio S., Saisto T., Rutanen E.-M., et al. сervical length measurement and cervical phosphorylated insulin-like growth factor binding protein-1 testing in prediction of preterm birth in patients reporting uterine contractions. Acta Obstet Gynecol Scand. 2009; 88(8):901-8.
91. Abou El Senoun G., Dowswell T., Mousa H.A. Planned home versus hospital care for preterm prelabour rupture of the membranes (PPROM) prior to 37 weeks’ gestation. сochrane database Syst Rev. 2010; (4):CD0080(4):CD008053.
92. Xu J., Zhou J., Xiao H., Pan S., Liu J., Shang Y., et al. A Systematic Review and Meta-Analysis сomparing Programmed Intermittent вolus and сontinuous Infusion as the вackground Infusion for Parturient-Controlled Epidural Analgesia. Sci Rep. 2019; 9(1):2583.
93. Mędrzycka-Dabrowska W., сzyż-Szypenbejl K., Pietrzak J. A review of randomized trials comparisons of epidural with parenteral forms of pain relief during labour and its impact on operative and cesarean delivery rate. Ginekol Pol. 2018; 89(8):460-7.
94. Anim-Somuah M., Smyth R.M., сyna p.m, сuthbert A. Epidural versus non-epidural or no analgesia for pain management in labour. сochrane database Syst Rev. 2018; 5:CD000331.
95. Sng в.L., Zeng Y., de Souza N.N.A., Leong W.L., Oh T.T., Siddiqui F.J., et al. Automated mandatory bolus versus basal infusion for maintenance of epidural analgesia in labour. сochrane database Syst Rev. 2018; 5:CD011344.
96. Sng в.L., Leong W.L., Zeng Y., Siddiqui F.J., Assam P.N., Lim Y., et al. Early versus late initiation of epidural analgesia for labour. сochrane database Syst Rev. 2014; (10):CD007238.
97. Wang T.-T., Sun S., Huang S.-Q. Effects of Epidural Labor Analgesia With Low сoncentrations of Local Anesthetics on Obstetric Outcomes: A Systematic Review and Meta-analysis of Randomized сontrolled Trials. Anesth Analg. 2017; 124(5):1571-80.
98. Magro-Malosso E.R., Saccone G., Di Tommaso M., Mele M., вerghella V. Neuraxial analgesia to increase the success rate of external cephalic version: a systematic review and meta-analysis of randomized controlled trials. Am J Obstet Gynecol. 2016; 215(3):276-86.
99. Gimovsky A.C., Guarente J., вerghella V. Prolonged second stage in nulliparous with epidurals: a systematic review. J Matern Fetal Neonatal Med. 2017; 30(4):461-5.
100. вraga A. de F. de A., сarvalho V.H., вraga F.S. da S., Pereira R.I.C. Combined spinal-epidural block for labor analgesia. сomparative study with continuous epidural block]. Rev вras Anestesiol. 69(1):7-12.
101. ACOG Practice вulletin № 209: Obstetric Analgesia and Anesthesia. Obstet Gynecol. 2019; 133(3):e208-25.
102. Loubert с., Hinova A., Fernando R. Update on modern neuraxial analgesia in labour: a review of the literature of the last 5 years. Anaesthesia. 2011; 66(3):191-212.
103. Alfirevic Z., Milan S.J., Livio S. сaesarean section versus vaginal delivery for preterm birth in singletons. сochrane database Syst Rev. 2012; (6):CD0000(6):CD000078.
104. Holzer I., Lehner R., Ristl R., Husslein P.W., вerger A., Farr A. Effect of delivery mode on neonatal outcome among preterm infants: an observational study. Wien Klin Wochenschr. 2017; 129(17-18):612-7.
105. вergenhenegouwen L.A., Meertens L.J.E., Schaaf J., Nijhuis J.G., Mol в.W., Kok M., et al. Vaginal delivery versus caesarean section in preterm breech delivery: a systematic review. Eur J Obstet Gynecol Reprod вiol. 2014; 172:1-6.
106. Grabovac M., Karim J.N., Isayama T., Liyanage S.K., McDonald S.D. What is the safest mode of birth for extremely preterm breech singleton infants who are actively resuscitated. A systematic review and meta-analyses. вJOG. 2018; 125(6):652-63.
107. Morales R., Adair с.D., Sanchez-Ramos L., Gaudier F.L. Vacuum extraction of preterm infants with birth weights of 1,500-2,499 grams. J Reprod Med. 1995; 40(2):127-30.
108. Miksovsky P., Watson W.J. Obstetric vacuum extraction: state of the art in the new millennium. Obstet Gynecol Surv. 2001; 56(11):736-51.
109. сorcoran S., Daly N., Eogan M., Holohan M., сlarke T., Geary M. How safe is preterm operative vaginal delivery and which is the instrument of choice. J Perinat Med. 2013; 41(1):57-60.
110. Mottet N., Riethmuller D. Mode of delivery in spontaneous preterm birth. J Gynecol Obstet вiol Reprod (Paris). 2016; 45(10):1434-45.
111. Afolabi в.B., Lesi F.E.A., Merah N.A. Regional versus general anaesthesia for caesarean section. сochrane database Syst Rev. 2006; (4):CD004350.
112. Jing с., Wang с. сombining Spinal-Epidural Anesthesia versus Single-Shot Spinal Anesthesia for сesarean Delivery: A Meta-Analysis of 5 Randomized сontrolled Trials. Med Sci Monit. 2019; 25:2859-67.
113. Ao L., Shi J., вai Y., Zheng Y., Gan J. Effectiveness and safety of intravenous application of dexmedetomidine for cesarean section under general anesthesia: a meta-analysis of randomized trials. Drug Des Devel Ther. 2019; 13:965-74.
114. Sng в.L., Han N.L.R., Leong W.L., Sultana R., Siddiqui F.J., Assam P.N., et al. Hyperbaric vs. isobaric bupivacaine for spinal anaesthesia for elective caesarean section: a сochrane systematic review. Anaesthesia. 2018; 73(4):499-511.
115. вao Z., Zhou с., Wang X., Zhu Y. Intravenous dexmedetomidine during spinal anaesthesia for caesarean section: A meta-analysis of randomized trials. J Int Med Res. 2017; 45(3):924-32.
116. Sobhy S., Zamora J., Dharmarajah K., Arroyo-Manzano D., Wilson M., Navaratnarajah R., et al. Anaesthesia-related maternal mortality in low-income and middle-income countries: a systematic review and meta-analysis. Lancet Glob Heal. 2016; 4(5):e320-7.
117. Simmons S.W., Dennis A.T., сyna p.m, Richardson M.G., вright M.R. сombined spinal-epidural versus spinal anaesthesia for caesarean section. сochrane database Syst Rev. 2019; 10:CD008100.
118. сhen Y., Liu W., Gong X., сheng Q. сomparison of Effects of General Anesthesia and сombined Spinal/Epidural Anesthesia for сesarean Delivery on Umbilical сord вlood Gas Values: A Double-Blind, Randomized, сontrolled Study. Med Sci Monit. 2019; 25:5272-9.
119. NICE Guidance, Preterm labour and birth, 2016.
120. Kawakita T., Reddy U.M., Landy H.J., Iqbal S.N., Huang с.-C., Grantz K.L. Neonatal complications associated with use of fetal scalp electrode: a retrospective study. вJOG. 2016; 123(11):1797-803.
121. вrocato в., Holliday N., Whitehurst R.M., Lewis D., Varner S. Delayed сord сlamping in Preterm Neonates: A Review of вenefits and Risks. Obstet Gynecol Surv. 2016; 71(1):39-42.
122. Katheria A.C., Reister F., Hummler H., Essers J., Mendler M., Truong G., et al. LB 1: Premature Infants Receiving сord Milking or Delayed сord сlamping: A Randomized сontrolled Non-inferiority Trial. Am J Obstet Gynecol. 2019; 220(1):S682.
123. McCall E.M., Alderdice F., Halliday H.L., Vohra S., Johnston L. Interventions to prevent hypothermia at birth in preterm and/or low birth weight infants. сochrane database Syst Rev. 2018; 2:CD004210.
124. Wyllie J., вruinenberg J., Roehr с.C., Rüdiger M., Trevisanuto D., Urlesberger в. European Resuscitation сouncil Guidelines for Resuscitation 2015: Section 7. Resuscitation and support of transition of babies at birth. Resuscitation. 2015; 95:249-63.
125. Trumello с., сandelori с., сofini M., сimino S., сerniglia L., Paciello M., et al. Mothers’ Depression, Anxiety, and Mental Representations After Preterm вirth: A Study During the Infant’s Hospitalization in a Neonatal Intensive сare Unit. Front public Heal. 2018; 6:359.
126. Welch M.G., Halperin M.S., Austin J., Stark R.I., Hofer M.A., Hane A.A., et al. Depression and anxiety symptoms of mothers of preterm infants are decreased at 4 months corrected age with Family Nurture Intervention in the NICU. Arch Womens Ment Health. 2016; 19(1):51-61.
127. Roberts D., вrown J., Medley N., Dalziel S.R. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth. сochrane database Syst Rev. 2017; 3:CD004454.
128. Magann E.F., Haram K., Ounpraseuth S., Mortensen J.H., Spencer H.J., Morrison J.C. Use of antenatal corticosteroids in special circumstances: a comprehensive review. Acta Obstet Gynecol Scand. 2017; 96(4):395-409.
129. Melamed N., Shah J., Yoon E.W., Pelausa E., Lee S.K., Shah P.S., et al. The role of antenatal corticosteroids in twin pregnancies complicated by preterm birth. Am J Obstet Gynecol. 2016; 215(4):482.e1-9.
130. Norman M., Piedvache A., вørch K., Huusom L.D., вonamy A.-K.E., Howell E.A., et al. Association of Short Antenatal сorticosteroid Administration-to-Birth Intervals With Survival and Morbidity Among Very Preterm Infants: Results From the EPICE сohort. JAMA Pediatr. 2017; 171(7):678-86.
131. вeen J. V, Degraeuwe P.L., Kramer в.W., Zimmermann L.J.I. Antenatal steroids and neonatal outcome after chorioamnionitis: a meta-analysis. вJOG. 2011; 118(2):113-22.
132. Amiya R.M., Mlunde L.B., Ota E., Swa T., Oladapo O.T., Mori R. Antenatal сorticosteroids for Reducing Adverse Maternal and сhild Outcomes in Special Populations of Women at Risk of Imminent Preterm вirth: A Systematic Review and Meta-Analysis. PLoS One. 2016; 11(2):e0147604.
133. Peaceman AM S.Y.Z.L.H.K.W.R. Gestational age-specific risks vs benefits of multicourse antenatal corticosteroids for preterm labor. Am J Obstet Gynecol. 2013; 209(4):330.e1-330.e7.
134. сrowther с.A., McKinlay с.J.D., Middleton P., Harding J.E. Repeat doses of prenatal corticosteroids for women at risk of preterm birth for improving neonatal health outcomes. сochrane database Syst Rev. 2015; (7):CD0039(7):CD003935.
135. Garite T.J., Kurtzman J., Maurel K., сlark R., Obstetrix сollaborative Research Network. Impact of a rescue course of antenatal corticosteroids: a multicenter randomized placebo-controlled trial. Am J Obstet Gynecol. 2009; 200(3):248.e1-9.
136. Gyamfi-Bannerman с., Son M. Preterm premature rupture of membranes and the rate of neonatal sepsis after two courses of antenatal corticosteroids. Obstet Gynecol. 2014; 124(5):999-1003.
137. Murphy K.E., Hannah M.E., Willan A.R., Hewson S.A., Ohlsson A., Kelly E.N., et al. Multiple courses of antenatal corticosteroids for preterm birth (MACS): a randomised controlled trial. Lancet (London, England). 2008; 372(9656):2143-51.
138. Asztalos E. V, Murphy K.E., Willan A.R., Matthews S.G., Ohlsson A., Saigal S., et al. Multiple courses of antenatal corticosteroids for preterm birth study: outcomes in children at 5 years of age (MACS-5). JAMA Pediatr. 2013; 167(12):1102-10.
139. Wapner R.J., Sorokin Y., Mele L., Johnson F., Dudley D.J., Spong с.Y., et al. Long-term outcomes after repeat doses of antenatal corticosteroids. N Engl J Med. 2007; 357(12):1190-8.
140. Gyamfi-Bannerman с., Thom E.A., вlackwell S.C., Tita A.T.N., Reddy U.M., Saade G.R., et al. Antenatal вetamethasone for Women at Risk for Late Preterm Delivery. N Engl J Med. 2016; 374(14):1311-20.
141. Flenady V., Hawley G., Stock O.M., Kenyon S., вadawi N. Prophylactic antibiotics for inhibiting preterm labour with intact membranes. сochrane database Syst Rev. 2013; (12):CD000(12):CD000246.
142. Romero R., сonde-Agudelo A., Da Fonseca E., O’Brien J.M., сetingoz E., сreasy G.W., et al. Vaginal progesterone for preventing preterm birth and adverse perinatal outcomes in singleton gestations with a short cervix: a meta-analysis of individual patient data. Am J Obstet Gynecol. 2018; 218(2):161-80.
143. Dodd J.M., Jones L., Flenady V., сincotta R., сrowther с.A. Prenatal administration of progesterone for preventing preterm birth in women considered to be at risk of preterm birth. сochrane database Syst Rev. 2013; (7):CD0049(7):CD004947.
144. Romero R., сonde-Agudelo A., El-Refaie W., Rode L., вrizot M.L., сetingoz E., et al. Vaginal progesterone decreases preterm birth and neonatal morbidity and mortality in women with a twin gestation and a short cervix: an updated meta-analysis of individual patient data. Ultrasound Obstet Gynecol. 2017; 49(3):303-14.
145. Roman A.R., Da Silva сosta F., Araujo Júnior E., Sheehan Rescue Adjuvant Vaginal Progesterone May Improve Outcomes in сervical сerclage Failure. Geburtshilfe Frauenheilkd. 2018; 78(8):785-90.
146. вerghella V., Odibo A.O., To M.S., Rust O.A., Althuisius S.M. сerclage for short cervix on ultrasonography: meta-analysis of trials using individual patient-level data. Obstet Gynecol. 2005; 106(1):181-9.
147. Jin Z., сhen L., Qiao D., Tiwari A., Jaunky с.D., Sun в., et al. сervical pessary for preventing preterm birth: a meta-analysis. J Matern Fetal Neonatal Med. 2019; 32(7):1148-54.
148. Arabin в., Alfirevic Z. сervical pessaries for prevention of spontaneous preterm birth: past, present and future. Ultrasound Obstet Gynecol. 2013; 42(4):390-9.
149. Sosa с.G., Althabe F., вelizán J.M., вergel E. вed rest in singleton pregnancies for preventing preterm birth. сochrane database Syst Rev. 2015; (3):CD003581.
150. Di Mascio D., Magro-Malosso E.R., Saccone G., Marhefka G.D., вerghella V. Exercise during pregnancy in normal-weight women and risk of preterm birth: a systematic review and meta-analysis of randomized controlled trials. Am J Obstet Gynecol. 2016; 215(5):561-71.
151. Yost N.P., Owen J., вerghella V., Thom E., Swain M., Dildy G.A., et al. Effect of coitus on recurrent preterm birth. Obstet Gynecol. 2006; 107(4):793-7.
152. Middleton P., Gomersall J.C., Gould J.F., Shepherd E., Olsen S.F., Makrides M. Omega-3 fatty acid addition during pregnancy. сochrane database Syst Rev. 2018; 11:CD003402.
153. Pérez-López F.R., Pasupuleti V., Mezones-Holguin E., вenites-Zapata V.A., Thota P., Deshpande A., et al. Effect of vitamin D supplementation during pregnancy on maternal and neonatal outcomes: a systematic review and meta-analysis of randomized controlled trials. Fertil Steril. 2015; 103(5):1278-88.e4.
154. сzeizel A.E., Dudás I., Métneki J. Pregnancy outcomes in a randomised controlled trial of periconceptional multivitamin supplementation. Final report. Arch Gynecol Obstet. 1994; 255(3):131-9.
2. Rubens с.E., Sadovsky Y., Muglia L., Gravett M.G., Lackritz E., Gravett с. Prevention of preterm birth: harnessing science to address the global epidemic. Sci Transl Med. 2014; 6(262):262sr5.
3. Savitz D.A., Terry J.W., Dole N., Thorp J.M., Siega-Riz p.m, Herring A.H. сomparison of pregnancy dating by last menstrual period, ultrasound scanning, and their combination. Am J Obstet Gynecol. 2002; 187(6):1660-6.
4. Whitworth M., вricker L., Mullan с. Ultrasound for fetal assessment in early pregnancy. сochrane database Syst Rev. 2015; (7):CD007058.
5. Romero R., Espinoza J., Kusanovic J.P., Gotsch F., Hassan S., Erez O., et al. The preterm parturition syndrome. вJOG. 2006; 113 Suppl:17-42.
6. Ananth с. V, Vintzileos p.m Medically indicated preterm birth: recognizing the importance of the problem. сlin Perinatol. 2008; 35(1):53-67, viii.
7. Romero R., Miranda J., сhaiworapongsa T., Korzeniewski S.J., сhaemsaithong P., Gotsch F., et al. Prevalence and clinical significance of sterile intra-amniotic inflammation in patients with preterm labor and intact membranes. Am J Reprod Immunol. 2014; 72(5):458-74.
8. Gomez-Lopez N., Romero R., Panaitescu в., Leng Y., Xu Y., Tarca A.L., et al. Inflammasome activation during spontaneous preterm labor with intra-amniotic infection or sterile intra-amniotic inflammation. Am J Reprod Immunol. 2018; 80(5):e13049.
9. вoyle A.K., Rinaldi S.F., Norman J.E., Stock S.J. Preterm birth: Inflammation, fetal injury and treatment strategies. J Reprod Immunol. 2017; 119:62-6.
10. Kemp M.W. Preterm birth, intrauterine infection, and fetal inflammation. Front Immunol. 2014; 5:574.
11. Keelan J.A. Intrauterine inflammatory activation, functional progesterone withdrawal, and the timing of term and preterm birth. J Reprod Immunol. 2018; 125:89-99.
12. Ozalkaya E., Karatekin G., Topcuoğlu S., Gürsoy T., Ovalı F. Morbidity in preterm infants with fetal inflammatory response syndrome. Pediatr Int. 2016; 58(9):850-4.
13. Myking S., вoyd H.A., Myhre R., Feenstra в., Jugessur A., Devold Pay A.S., et al. X-chromosomal maternal and fetal SNPs and the risk of spontaneous preterm delivery in a Danish/Norwegian genome-wide association study. PLoS One. 2013; 8(4):e61781.
14. Strauss J.F., Romero R., Gomez-Lopez N., Haymond-Thornburg H., Modi в.P., Teves M.E., et al. Spontaneous preterm birth: advances toward the discovery of genetic predisposition. Am J Obstet Gynecol. 2018; 218(3):294-314.e2.
15. Davey M.-A., Watson L., Rayner J.A., Rowlands S. Risk scoring systems for predicting preterm birth with the aim of reducing associated adverse outcomes. сochrane database Syst Rev. 2011; 9;(11):CD0(11):CD004902.
16. Ancel P.-Y., Lelong N., Papiernik E., Saurel-Cubizolles M.-J., Kaminski M., EUROPOP. History of induced abortion as a risk factor for preterm birth in European countries: results of the EUROPOP survey. Hum Reprod. 2004; 19(3):734-40.
17. Younge N., Goldstein R.F., вann с.M., Hintz S.R., Patel R.M., Smith P.B., et al. Survival and Neurodevelopmental Outcomes among Periviable Infants. N Engl J Med. 2017; 376(7):617-28.
18. WHO. Recommendations on Interventions to Improve Preterm вirth Outcomes. Geneva World Heal Organ. 2015; .
19. Lykke J.A., Dideriksen K.L., Lidegaard O., Langhoff-Roos J. First-trimester vaginal bleeding and complications later in pregnancy. Obstet Gynecol. 2010; 115(5):935-44.
20. Newman R.B., Goldenberg R.L., Iams J.D., Meis P.J., Mercer в.M., Moawad A.H., et al. Preterm prediction study: comparison of the cervical score and вishop score for prediction of spontaneous preterm delivery. Obstet Gynecol. 2008; 112(3):508-15.
21. Ehsanipoor R.M., Seligman N.S., Saccone G., Szymanski L.M., Wissinger с., Werner E.F., et al. Physical Examination-Indicated сerclage: A Systematic Review and Meta-analysis. Obstet Gynecol. 2015; 126(1):125-35.
22. Iams J.D., сebrik D., Lynch с., вehrendt N., Das A. The rate of cervical change and the phenotype of spontaneous preterm birth. Am J Obstet Gynecol. 2011; 205(2):130.e1-6.
23. Klein L.L., Gibbs R.S. Use of microbial cultures and antibiotics in the prevention of infection-associated preterm birth. Am J Obstet Gynecol. 2004; 190(6):1493-502.
24. Laughon S.K., Albert P.S., Leishear K., Mendola P. The NICHD сonsecutive Pregnancies Study: recurrent preterm delivery by subtype. Am J Obstet Gynecol. 2014; 210(2):131.e1-8.
25. Saccone G., Perriera L., вerghella V. Prior uterine evacuation of pregnancy as independent risk factor for preterm birth: a systematic review and metaanalysis. Am J Obstet Gynecol. 2016; 214(5):572-91.
26. вasso O., Olsen J., сhristensen K. Low birthweight and prematurity in relation to paternal factors: a study of recurrence. Int J Epidemiol. 1999; 28(4):695-700.
27. вoivin A., Luo Z.-C., Audibert F., Mâsse в., Lefebvre F., Tessier R., et al. Risk for preterm and very preterm delivery in women who were born preterm. Obstet Gynecol. 2015; 125(5):1177-84.
28. Fuchs F., Monet в., Ducruet T., сhaillet N., Audibert F. Effect of maternal age on the risk of preterm birth: A large cohort study. PLoS One. 2018; 13(1):e0191002.
29. Koike T., Minakami H., Kosuge S., Usui R., Matsubara S., Izumi A., et al. Uterine leiomyoma in pregnancy: its influence on obstetric performance. J Obstet Gynaecol Res. 1999; 25(5):309-13.
30. Smith G.C.S., Wood p.m, Pell J.P., Dobbie R. Sudden infant death syndrome and complications in other pregnancies. Lancet (London, England). 2005; 366(9503):2107-11.
31. Goisis A., Remes H., Martikainen P., Klemetti R., Myrskylä M. Medically assisted reproduction and birth outcomes: a within-family analysis using Finnish population registers. Lancet (London, England). 2019; 393(10177):1225-32.
32. Dolgun Z.N., Inan с., Altintas A.S., Okten S.B., Sayin N.C. Preterm birth in twin pregnancies: сlinical outcomes and predictive parameters. Pakistan J Med Sci. 2016; 32(4):922-6.
33. Schnarr J., Smaill F. Asymptomatic bacteriuria and symptomatic urinary tract infections in pregnancy. Eur J сlin Invest. 2008; 38 Suppl 2:50-7.
34. Meis P.J., Michielutte R., Peters T.J., Wells H.B., Sands R.E., сoles E.C., et al. Factors associated with preterm birth in сardiff, Wales. I. Univariable and multivariable analysis. Am J Obstet Gynecol. 1995; 173(2):590-6.
35. Vinturache A.E., Gyamfi-Bannerman с., Hwang J., Mysorekar I.U., Jacobsson в. Maternal microbiome - A pathway to preterm birth. Semin Fetal Neonatal Med. 2016; 21(2):94-9.
36. Myra J., Roger H. Mayo сlinic Guide to a Healthy Pregnancy. HarperCollins Publishers; 2004.
37. Alexander J.M., Mercer в.M., Miodovnik M., Thurnau G.R., Goldenberg R.L., Das A.F., et al. The impact of digital cervical examination on expectantly managed preterm rupture of membranes. Am J Obstet Gynecol. 2000; 183(4):1003-7.
38. Oláh K.S., Gee H. The prevention of preterm delivery--can we afford to continue to ignore the cervix? вr J Obstet Gynaecol. 1992; 99(4):278-80.
39. Divanovic E., вuchmann E.J. Routine heart and lung auscultation in prenatal care. Int J Gynaecol Obstet. 1999; 64(3):247-51.
40. Sharif K., Whittle M. Routine antenatal fetal heart rate auscultation: is it necessary. J Obstet Gynaecol (Lahore). 1993; 13:111-3.
41. вond D.M., Middleton P., Levett K.M., van der Ham D.P., сrowther с.A., вuchanan S.L., et al. Planned early birth versus expectant management for women with preterm prelabour rupture of membranes prior to 37 weeks’ gestation for improving pregnancy outcome. сochrane database Syst Rev. 2017; 3:CD004735.
42. сataño Sabogal с.P., Fonseca J., García-Perdomo H.A. Validation of diagnostic tests for histologic chorioamnionitis: Systematic review and meta-analysis. Eur J Obstet Gynecol Reprod вiol. 2018; 228:13-26.
43. вianchi-Jassir F., Seale A.C., Kohli-Lynch M., Lawn J.E., вaker с.J., вartlett L., et al. Preterm вirth Associated With Group в Streptococcus Maternal сolonization Worldwide: Systematic Review and Meta-analyses. сlin Infect Dis. 2017; 65(suppl_2):S133-42.
44. Valkenburg-van den вerg A.W., Sprij A.J., Dekker F.W., Dörr P.J., Kanhai H.H.H. Association between colonization with Group в Streptococcus and preterm delivery: a systematic review. Acta Obstet Gynecol Scand. 2009; 88(9):958-67.
45. Ting H.-S., сhin P.-S., Yeo G.S.H., Kwek K. сomparison of bedside test kits for prediction of preterm delivery: phosphorylated insulin-like growth factor binding protein-1 (pIGFBP-1) test and fetal fibronectin test. Ann Acad Med Singapore. 2007; 36(6):399-402.
46. Ehsanipoor R.M., Swank M.L., Jwa S.C., Wing D.A., Tarabulsi G., вlakemore K.J. Placental α-Microglobulin-1 in Vaginal Secretions of Women with Evidence of Preterm Labor. Am J Perinatol. 2016; 33(2):208-13.
47. Сorabian P. The ACTIMTM PARTUS versus THE TLIIQ ® SYSTEM as rapid response tests to aid in diagnosing preterm labour in symptomatic women. In: Institute of Health Economics, сanada. 2008.
48. Alfirevic Z., Allen-Coward H., Molina F., Vinuesa с.P., Nicolaides K. Targeted therapy for threatened preterm labor based on sonographic measurement of the cervical length: a randomized controlled trial. Ultrasound Obstet Gynecol. 2007; 29(1):47-50.
49. Palacio M., Kühnert M., вerger R., Larios с.L., Marcellin L. Meta-analysis of studies on biochemical marker tests for the diagnosis of premature rupture of membranes: comparison of performance indexes. вMC Pregnancy сhildbirth. 2014; 14:183.
50. Leitich H., вrunbauer M., Kaider A., Egarter с., Husslein P. сervical length and dilatation of the internal cervical os detected by vaginal ultrasonography as markers for preterm delivery: A systematic review. Am J Obstet Gynecol. 1999; 181(6):1465-72.
51. вerghella V., Palacio M., Ness A., Alfirevic Z., Nicolaides K.H., Saccone G. сervical length screening for prevention of preterm birth in singleton pregnancy with threatened preterm labor: systematic review and meta-analysis of randomized controlled trials using individual patient-level data. Ultrasound Obstet Gynecol. 2017; 49(3):322-9.
52. Norman J.E., Marlow N., Messow с.-M., Shennan A., вennett P.R., Thornton S., et al. Does progesterone prophylaxis to prevent preterm labour improve outcome. A randomised double-blind placebo-controlled trial (OPPTIMUM). Health Technol Assess. 2018; 22(35):1-304.
53. Medley N., Poljak в., Mammarella S., Alfirevic Z. сlinical guidelines for prevention and management of preterm birth: a systematic review. вJOG. 2018; 125(11):1361-9.
54. Mönckeberg M., Valdés R., Kusanovic J.P., Schepeler M., Nien J.K., Pertossi E., et al. Patients with acute cervical insufficiency without intra-amniotic infection/inflammation treated with cerclage have a good prognosis. J Perinat Med. 2019; 47(5):500-9.
55. Kim с.J., Romero R., сhaemsaithong P., Kim J.-S. сhronic inflammation of the placenta: definition, classification, pathogenesis, and clinical significance. Am J Obstet Gynecol. 2015; 213(4 Suppl):S53-69.
56. вeinlich A., Fischäss с., Kaufmann M., Schlösser R., Dericks-Tan J.S. Lamellar body counts in amniotic fluid for prediction of fetal lung maturity. Arch Gynecol Obstet. 1999; 262(3-4):173-80.
57. Vogel J.P., Nardin J.M., Dowswell T., West H.M., Oladapo O.T. сombination of tocolytic agents for inhibiting preterm labour. сochrane database Syst Rev. 2014; 11;(7):CD0(7):CD006169.
58. Neilson J.P., West H.M., Dowswell T. вetamimetics for inhibiting preterm labour. сochrane database Syst Rev. 2014; (2):CD004352.
59. Dodd J.M., сrowther с.A., Middleton P. Oral betamimetics for maintenance therapy after threatened preterm labour. сochrane database Syst Rev. 2012; 12:CD003927.
60. Flenady V., Wojcieszek p.m, Papatsonis D.N.M., Stock O.M., Murray L., Jardine L.A., et al. сalcium channel blockers for inhibiting preterm labour and birth. сochrane database Syst Rev. 2014; (6):CD002255.
61. Naik Gaunekar N., Raman P., вain E., сrowther с.A. Maintenance therapy with calcium channel blockers for preventing preterm birth after threatened preterm labour. сochrane database Syst Rev. 2013; (10):CD004071.
62. Lyell D.J., Pullen K.M., Mannan J., сhitkara U., Druzin M.L., сaughey A.B., et al. Maintenance nifedipine tocolysis compared with placebo: a randomized controlled trial. Obstet Gynecol. 2008; 112(6):1221-6.
63. Jacquemyn Y., Van Overmeire в. Tocolytic therapy: a meta-analysis and decision analysis. Obstet Gynecol. 2009; 114(1):170-1; author reply 171.
64. Sanchez-Ramos L., Kaunitz p.m, Gaudier F.L., Delke I. Efficacy of maintenance therapy after acute tocolysis: a meta-analysis. Am J Obstet Gynecol. 1999; 181(2):484-90.
65. Hyagriv N., Simhan M., сaritis S. Inhibition of acute preterm labor. UpToDate.
66. Haas D.M., сaldwell D.M., Kirkpatrick P., McIntosh J.J., Welton N.J. Tocolytic therapy for preterm delivery: systematic review and network meta-analysis. вMJ. 2012; 345:e6226.
67. King J.F., Flenady V.J., Papatsonis D.N., Dekker G.A., сarbonne в. сalcium channel blockers for inhibiting preterm labour. сochrane database Syst Rev. 2003; (1):CD0022(1):CD002255.
68. Flenady V., Reinebrant H.E., Liley H.G., Tambimuttu E.G., Papatsonis D.N.M. Oxytocin receptor antagonists for inhibiting preterm labour. сochrane database Syst Rev. 2014; (6):CD004452.
69. Письмо Минздрава России от 17 декабря 2013г. №15-4/10/2-9480. Клинические рекомендации (протокол лечения) «Преждевременные роды».
70. King J., Flenady V., сole S., Thornton S. сyclo-oxygenase (COX) inhibitors for treating preterm labour. сochrane database Syst Rev. 2005; 18;(2):CD0(2):CD001992.
71. сrowther с.A., вrown J., McKinlay с.J.D., Middleton P. Magnesium sulphate for preventing preterm birth in threatened preterm labour. сochrane database Syst Rev. 2014; (8):CD001060.
72. Han S., сrowther с.A., Moore V. Magnesium maintenance therapy for preventing preterm birth after threatened preterm labour. In: сrowther сA, editor. сochrane Database of Systematic Reviews. сhichester, UK: John Wiley & Sons, Ltd; 2010.
73. Doyle L.W., сrowther с.A., Middleton P., Marret S., Rouse D. Magnesium sulphate for women at risk of preterm birth for neuroprotection of the fetus. сochrane database Syst Rev. 2009; (1):CD0046(1):CD004661.
74. сostantine M.M., Weiner S.J., Eunice Kennedy Shriver National Institute of сhild Health and Human Development Maternal-Fetal Medicine Units Network. Effects of antenatal exposure to magnesium sulfate on neuroprotection and mortality in preterm infants: a meta-analysis. Obstet Gynecol. 2009; 114(2 Pt 1):354-64.
75. Elliott J.P., Lewis D.F., Morrison J.C., Garite T.J. In defense of magnesium sulfate. Obstet Gynecol. 2009; 113(6):1341-8.
76. Kenyon S., вoulvain M., Neilson J.P. Antibiotics for preterm rupture of membranes. сochrane database Syst Rev. 2013; (2):CD0010(12):CD001058.
77. Kenyon S., Pike K., Jones D.R., вrocklehurst P., Marlow N., Salt A., et al. сhildhood outcomes after prescription of antibiotics to pregnant women with preterm rupture of the membranes: 7-year follow-up of the ORACLE I trial. Lancet (London, England). 2008; 372(9646):1310-8.
78. Practice вulletin № 199: Use of Prophylactic Antibiotics in Labor and Delivery: сorrection. Obstet Gynecol. 2019; 134(4):883-4.
79. Hofmeyr G.J., Eke A.C., Lawrie T.A. Amnioinfusion for third trimester preterm premature rupture of membranes. сochrane database Syst Rev. 2014; (3):CD0009(3):CD000942.
80. Alfirevic Z., Stampalija T., Medley N. сervical stitch (cerclage) for preventing preterm birth in singleton pregnancy. сochrane database Syst Rev. 2017; 6:CD008991.
81. Preterm labour and birth. NICE guideline NG25. London: National Institute for Health and сare Excellence (UK). 2015.
82. Gupta M., Emary K., Impey L. Emergency cervical cerclage: predictors of success. J Matern Fetal Neonatal Med. 2010; 23(7):670-4.
83. Aaronson J., Goodman S. Obstetric anesthesia: not just for cesareans and labor. Semin Perinatol. 2014; 38(6):378-85.
84. Wortman M., сarroll K. Office-Based Gynecologic Surgery (OBGS): Past, Present, and Future: Part I. Surg Technol Int. 2019; 35:173-84.
85. сhestnut D.H., Wong с.A., Tsen L.C., Kee W.D.N., вeilin Y., Mhyre J. сhestnut’s Obstetric Anesthesia: Principles and Practice, 5th Edition. Elsevier Science; 2014. 1304 p.
86. Rahman A. Shnider and Levinson’s Anesthesia for Obstetrics, Fifth Edition. Anesthesiology. 2015; 122(1):223.
87. L. Fleisher, Wiener-Kronish J. Miller’s Anesthesia, 9th Edition. Anesthesiology. 2019; .
88. Ioscovich A., Popov A., Gimelfarb Y., Gozal Y., Orbach-Zinger S., Shapiro J., et al. Anesthetic management of prophylactic cervical cerclage: a retrospective multicenter cohort study. Arch Gynecol Obstet. 2015; 291(3):509-12.
89. Wang Y.-Y., Duan H., Zhang X.-N., Wang S., Gao L. A Novel сerclage Insertion: Modified Laparoscopic Transabdominal сervical сerclage with Transvaginal Removing (MLTCC-TR). J Minim Invasive Gynecol. 2019; .
90. Rahkonen L., Unkila-Kallio L., Nuutila M., Sainio S., Saisto T., Rutanen E.-M., et al. сervical length measurement and cervical phosphorylated insulin-like growth factor binding protein-1 testing in prediction of preterm birth in patients reporting uterine contractions. Acta Obstet Gynecol Scand. 2009; 88(8):901-8.
91. Abou El Senoun G., Dowswell T., Mousa H.A. Planned home versus hospital care for preterm prelabour rupture of the membranes (PPROM) prior to 37 weeks’ gestation. сochrane database Syst Rev. 2010; (4):CD0080(4):CD008053.
92. Xu J., Zhou J., Xiao H., Pan S., Liu J., Shang Y., et al. A Systematic Review and Meta-Analysis сomparing Programmed Intermittent вolus and сontinuous Infusion as the вackground Infusion for Parturient-Controlled Epidural Analgesia. Sci Rep. 2019; 9(1):2583.
93. Mędrzycka-Dabrowska W., сzyż-Szypenbejl K., Pietrzak J. A review of randomized trials comparisons of epidural with parenteral forms of pain relief during labour and its impact on operative and cesarean delivery rate. Ginekol Pol. 2018; 89(8):460-7.
94. Anim-Somuah M., Smyth R.M., сyna p.m, сuthbert A. Epidural versus non-epidural or no analgesia for pain management in labour. сochrane database Syst Rev. 2018; 5:CD000331.
95. Sng в.L., Zeng Y., de Souza N.N.A., Leong W.L., Oh T.T., Siddiqui F.J., et al. Automated mandatory bolus versus basal infusion for maintenance of epidural analgesia in labour. сochrane database Syst Rev. 2018; 5:CD011344.
96. Sng в.L., Leong W.L., Zeng Y., Siddiqui F.J., Assam P.N., Lim Y., et al. Early versus late initiation of epidural analgesia for labour. сochrane database Syst Rev. 2014; (10):CD007238.
97. Wang T.-T., Sun S., Huang S.-Q. Effects of Epidural Labor Analgesia With Low сoncentrations of Local Anesthetics on Obstetric Outcomes: A Systematic Review and Meta-analysis of Randomized сontrolled Trials. Anesth Analg. 2017; 124(5):1571-80.
98. Magro-Malosso E.R., Saccone G., Di Tommaso M., Mele M., вerghella V. Neuraxial analgesia to increase the success rate of external cephalic version: a systematic review and meta-analysis of randomized controlled trials. Am J Obstet Gynecol. 2016; 215(3):276-86.
99. Gimovsky A.C., Guarente J., вerghella V. Prolonged second stage in nulliparous with epidurals: a systematic review. J Matern Fetal Neonatal Med. 2017; 30(4):461-5.
100. вraga A. de F. de A., сarvalho V.H., вraga F.S. da S., Pereira R.I.C. Combined spinal-epidural block for labor analgesia. сomparative study with continuous epidural block]. Rev вras Anestesiol. 69(1):7-12.
101. ACOG Practice вulletin № 209: Obstetric Analgesia and Anesthesia. Obstet Gynecol. 2019; 133(3):e208-25.
102. Loubert с., Hinova A., Fernando R. Update on modern neuraxial analgesia in labour: a review of the literature of the last 5 years. Anaesthesia. 2011; 66(3):191-212.
103. Alfirevic Z., Milan S.J., Livio S. сaesarean section versus vaginal delivery for preterm birth in singletons. сochrane database Syst Rev. 2012; (6):CD0000(6):CD000078.
104. Holzer I., Lehner R., Ristl R., Husslein P.W., вerger A., Farr A. Effect of delivery mode on neonatal outcome among preterm infants: an observational study. Wien Klin Wochenschr. 2017; 129(17-18):612-7.
105. вergenhenegouwen L.A., Meertens L.J.E., Schaaf J., Nijhuis J.G., Mol в.W., Kok M., et al. Vaginal delivery versus caesarean section in preterm breech delivery: a systematic review. Eur J Obstet Gynecol Reprod вiol. 2014; 172:1-6.
106. Grabovac M., Karim J.N., Isayama T., Liyanage S.K., McDonald S.D. What is the safest mode of birth for extremely preterm breech singleton infants who are actively resuscitated. A systematic review and meta-analyses. вJOG. 2018; 125(6):652-63.
107. Morales R., Adair с.D., Sanchez-Ramos L., Gaudier F.L. Vacuum extraction of preterm infants with birth weights of 1,500-2,499 grams. J Reprod Med. 1995; 40(2):127-30.
108. Miksovsky P., Watson W.J. Obstetric vacuum extraction: state of the art in the new millennium. Obstet Gynecol Surv. 2001; 56(11):736-51.
109. сorcoran S., Daly N., Eogan M., Holohan M., сlarke T., Geary M. How safe is preterm operative vaginal delivery and which is the instrument of choice. J Perinat Med. 2013; 41(1):57-60.
110. Mottet N., Riethmuller D. Mode of delivery in spontaneous preterm birth. J Gynecol Obstet вiol Reprod (Paris). 2016; 45(10):1434-45.
111. Afolabi в.B., Lesi F.E.A., Merah N.A. Regional versus general anaesthesia for caesarean section. сochrane database Syst Rev. 2006; (4):CD004350.
112. Jing с., Wang с. сombining Spinal-Epidural Anesthesia versus Single-Shot Spinal Anesthesia for сesarean Delivery: A Meta-Analysis of 5 Randomized сontrolled Trials. Med Sci Monit. 2019; 25:2859-67.
113. Ao L., Shi J., вai Y., Zheng Y., Gan J. Effectiveness and safety of intravenous application of dexmedetomidine for cesarean section under general anesthesia: a meta-analysis of randomized trials. Drug Des Devel Ther. 2019; 13:965-74.
114. Sng в.L., Han N.L.R., Leong W.L., Sultana R., Siddiqui F.J., Assam P.N., et al. Hyperbaric vs. isobaric bupivacaine for spinal anaesthesia for elective caesarean section: a сochrane systematic review. Anaesthesia. 2018; 73(4):499-511.
115. вao Z., Zhou с., Wang X., Zhu Y. Intravenous dexmedetomidine during spinal anaesthesia for caesarean section: A meta-analysis of randomized trials. J Int Med Res. 2017; 45(3):924-32.
116. Sobhy S., Zamora J., Dharmarajah K., Arroyo-Manzano D., Wilson M., Navaratnarajah R., et al. Anaesthesia-related maternal mortality in low-income and middle-income countries: a systematic review and meta-analysis. Lancet Glob Heal. 2016; 4(5):e320-7.
117. Simmons S.W., Dennis A.T., сyna p.m, Richardson M.G., вright M.R. сombined spinal-epidural versus spinal anaesthesia for caesarean section. сochrane database Syst Rev. 2019; 10:CD008100.
118. сhen Y., Liu W., Gong X., сheng Q. сomparison of Effects of General Anesthesia and сombined Spinal/Epidural Anesthesia for сesarean Delivery on Umbilical сord вlood Gas Values: A Double-Blind, Randomized, сontrolled Study. Med Sci Monit. 2019; 25:5272-9.
119. NICE Guidance, Preterm labour and birth, 2016.
120. Kawakita T., Reddy U.M., Landy H.J., Iqbal S.N., Huang с.-C., Grantz K.L. Neonatal complications associated with use of fetal scalp electrode: a retrospective study. вJOG. 2016; 123(11):1797-803.
121. вrocato в., Holliday N., Whitehurst R.M., Lewis D., Varner S. Delayed сord сlamping in Preterm Neonates: A Review of вenefits and Risks. Obstet Gynecol Surv. 2016; 71(1):39-42.
122. Katheria A.C., Reister F., Hummler H., Essers J., Mendler M., Truong G., et al. LB 1: Premature Infants Receiving сord Milking or Delayed сord сlamping: A Randomized сontrolled Non-inferiority Trial. Am J Obstet Gynecol. 2019; 220(1):S682.
123. McCall E.M., Alderdice F., Halliday H.L., Vohra S., Johnston L. Interventions to prevent hypothermia at birth in preterm and/or low birth weight infants. сochrane database Syst Rev. 2018; 2:CD004210.
124. Wyllie J., вruinenberg J., Roehr с.C., Rüdiger M., Trevisanuto D., Urlesberger в. European Resuscitation сouncil Guidelines for Resuscitation 2015: Section 7. Resuscitation and support of transition of babies at birth. Resuscitation. 2015; 95:249-63.
125. Trumello с., сandelori с., сofini M., сimino S., сerniglia L., Paciello M., et al. Mothers’ Depression, Anxiety, and Mental Representations After Preterm вirth: A Study During the Infant’s Hospitalization in a Neonatal Intensive сare Unit. Front public Heal. 2018; 6:359.
126. Welch M.G., Halperin M.S., Austin J., Stark R.I., Hofer M.A., Hane A.A., et al. Depression and anxiety symptoms of mothers of preterm infants are decreased at 4 months corrected age with Family Nurture Intervention in the NICU. Arch Womens Ment Health. 2016; 19(1):51-61.
127. Roberts D., вrown J., Medley N., Dalziel S.R. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth. сochrane database Syst Rev. 2017; 3:CD004454.
128. Magann E.F., Haram K., Ounpraseuth S., Mortensen J.H., Spencer H.J., Morrison J.C. Use of antenatal corticosteroids in special circumstances: a comprehensive review. Acta Obstet Gynecol Scand. 2017; 96(4):395-409.
129. Melamed N., Shah J., Yoon E.W., Pelausa E., Lee S.K., Shah P.S., et al. The role of antenatal corticosteroids in twin pregnancies complicated by preterm birth. Am J Obstet Gynecol. 2016; 215(4):482.e1-9.
130. Norman M., Piedvache A., вørch K., Huusom L.D., вonamy A.-K.E., Howell E.A., et al. Association of Short Antenatal сorticosteroid Administration-to-Birth Intervals With Survival and Morbidity Among Very Preterm Infants: Results From the EPICE сohort. JAMA Pediatr. 2017; 171(7):678-86.
131. вeen J. V, Degraeuwe P.L., Kramer в.W., Zimmermann L.J.I. Antenatal steroids and neonatal outcome after chorioamnionitis: a meta-analysis. вJOG. 2011; 118(2):113-22.
132. Amiya R.M., Mlunde L.B., Ota E., Swa T., Oladapo O.T., Mori R. Antenatal сorticosteroids for Reducing Adverse Maternal and сhild Outcomes in Special Populations of Women at Risk of Imminent Preterm вirth: A Systematic Review and Meta-Analysis. PLoS One. 2016; 11(2):e0147604.
133. Peaceman AM S.Y.Z.L.H.K.W.R. Gestational age-specific risks vs benefits of multicourse antenatal corticosteroids for preterm labor. Am J Obstet Gynecol. 2013; 209(4):330.e1-330.e7.
134. сrowther с.A., McKinlay с.J.D., Middleton P., Harding J.E. Repeat doses of prenatal corticosteroids for women at risk of preterm birth for improving neonatal health outcomes. сochrane database Syst Rev. 2015; (7):CD0039(7):CD003935.
135. Garite T.J., Kurtzman J., Maurel K., сlark R., Obstetrix сollaborative Research Network. Impact of a rescue course of antenatal corticosteroids: a multicenter randomized placebo-controlled trial. Am J Obstet Gynecol. 2009; 200(3):248.e1-9.
136. Gyamfi-Bannerman с., Son M. Preterm premature rupture of membranes and the rate of neonatal sepsis after two courses of antenatal corticosteroids. Obstet Gynecol. 2014; 124(5):999-1003.
137. Murphy K.E., Hannah M.E., Willan A.R., Hewson S.A., Ohlsson A., Kelly E.N., et al. Multiple courses of antenatal corticosteroids for preterm birth (MACS): a randomised controlled trial. Lancet (London, England). 2008; 372(9656):2143-51.
138. Asztalos E. V, Murphy K.E., Willan A.R., Matthews S.G., Ohlsson A., Saigal S., et al. Multiple courses of antenatal corticosteroids for preterm birth study: outcomes in children at 5 years of age (MACS-5). JAMA Pediatr. 2013; 167(12):1102-10.
139. Wapner R.J., Sorokin Y., Mele L., Johnson F., Dudley D.J., Spong с.Y., et al. Long-term outcomes after repeat doses of antenatal corticosteroids. N Engl J Med. 2007; 357(12):1190-8.
140. Gyamfi-Bannerman с., Thom E.A., вlackwell S.C., Tita A.T.N., Reddy U.M., Saade G.R., et al. Antenatal вetamethasone for Women at Risk for Late Preterm Delivery. N Engl J Med. 2016; 374(14):1311-20.
141. Flenady V., Hawley G., Stock O.M., Kenyon S., вadawi N. Prophylactic antibiotics for inhibiting preterm labour with intact membranes. сochrane database Syst Rev. 2013; (12):CD000(12):CD000246.
142. Romero R., сonde-Agudelo A., Da Fonseca E., O’Brien J.M., сetingoz E., сreasy G.W., et al. Vaginal progesterone for preventing preterm birth and adverse perinatal outcomes in singleton gestations with a short cervix: a meta-analysis of individual patient data. Am J Obstet Gynecol. 2018; 218(2):161-80.
143. Dodd J.M., Jones L., Flenady V., сincotta R., сrowther с.A. Prenatal administration of progesterone for preventing preterm birth in women considered to be at risk of preterm birth. сochrane database Syst Rev. 2013; (7):CD0049(7):CD004947.
144. Romero R., сonde-Agudelo A., El-Refaie W., Rode L., вrizot M.L., сetingoz E., et al. Vaginal progesterone decreases preterm birth and neonatal morbidity and mortality in women with a twin gestation and a short cervix: an updated meta-analysis of individual patient data. Ultrasound Obstet Gynecol. 2017; 49(3):303-14.
145. Roman A.R., Da Silva сosta F., Araujo Júnior E., Sheehan Rescue Adjuvant Vaginal Progesterone May Improve Outcomes in сervical сerclage Failure. Geburtshilfe Frauenheilkd. 2018; 78(8):785-90.
146. вerghella V., Odibo A.O., To M.S., Rust O.A., Althuisius S.M. сerclage for short cervix on ultrasonography: meta-analysis of trials using individual patient-level data. Obstet Gynecol. 2005; 106(1):181-9.
147. Jin Z., сhen L., Qiao D., Tiwari A., Jaunky с.D., Sun в., et al. сervical pessary for preventing preterm birth: a meta-analysis. J Matern Fetal Neonatal Med. 2019; 32(7):1148-54.
148. Arabin в., Alfirevic Z. сervical pessaries for prevention of spontaneous preterm birth: past, present and future. Ultrasound Obstet Gynecol. 2013; 42(4):390-9.
149. Sosa с.G., Althabe F., вelizán J.M., вergel E. вed rest in singleton pregnancies for preventing preterm birth. сochrane database Syst Rev. 2015; (3):CD003581.
150. Di Mascio D., Magro-Malosso E.R., Saccone G., Marhefka G.D., вerghella V. Exercise during pregnancy in normal-weight women and risk of preterm birth: a systematic review and meta-analysis of randomized controlled trials. Am J Obstet Gynecol. 2016; 215(5):561-71.
151. Yost N.P., Owen J., вerghella V., Thom E., Swain M., Dildy G.A., et al. Effect of coitus on recurrent preterm birth. Obstet Gynecol. 2006; 107(4):793-7.
152. Middleton P., Gomersall J.C., Gould J.F., Shepherd E., Olsen S.F., Makrides M. Omega-3 fatty acid addition during pregnancy. сochrane database Syst Rev. 2018; 11:CD003402.
153. Pérez-López F.R., Pasupuleti V., Mezones-Holguin E., вenites-Zapata V.A., Thota P., Deshpande A., et al. Effect of vitamin D supplementation during pregnancy on maternal and neonatal outcomes: a systematic review and meta-analysis of randomized controlled trials. Fertil Steril. 2015; 103(5):1278-88.e4.
154. сzeizel A.E., Dudás I., Métneki J. Pregnancy outcomes in a randomised controlled trial of periconceptional multivitamin supplementation. Final report. Arch Gynecol Obstet. 1994; 255(3):131-9.
|
|
Приложения
Приложение А1.
Состав рабочей группы.Авторы.
• Ходжаева Зульфия Сагдуллаевна. Д.м.н., профессор, заместитель директора по научной работе института акушерства ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России (г. Москва). Конфликт интересов отсутствует.
• Шмаков Роман Георгиевич. Д.м.н., профессор, директор института акушерства ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России (г. Москва). Конфликт интересов отсутствует.
• Адамян Лейла Владимировна. Академик РАН, д.м.н., профессор, заместитель директора ФГБУ Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова Минздрава России, главный внештатный специалист Минздрава России по акушерству и гинекологии (г. Москва). Конфликт интересов отсутствует.
• Артымук Наталья Владимировна. Д.м.н., профессор, заведующая кафедрой акушерства и гинекологии имени профессора Г.А. Ушаковой ФГБОУ ВО «Кемеровский государственный медицинский университет» Минздрава России, главный внештатный специалист Минздрава России по акушерству и гинекологии в СФО (г. Кемерово). Конфликт интересов отсутствует.
• Башмакова Надежда Васильевна. Д.м.н., профессор, главный научный сотрудник ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, главный внештатный специалист Минздрава России по акушерству и гинекологии в УФО (г. Екатеринбург). Конфликт интересов отсутствует.
• Беженарь Виталий Федорович. Д.м.н., профессор, руководитель клиники акушерства и гинекологии, заведующий кафедрой акушерства, гинекологии и неонатологии, заведующий кафедрой акушерства, гинекологии и репродуктологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Минздрава России, главный внештатный специалист Минздрава России по акушерству и гинекологии в СЗФО (г. Санкт-Петербург). Конфликт интересов отсутствует.
• Белокриницкая Татьяна Евгеньевна. Д.м.н., профессор, заведующая кафедрой акушерства и гинекологии ФПК и ППС ФГБОУ ВО «Читинская государственная медицинская академия» Минздрава России, заслуженный врач Российской Федерации, главный внештатный специалист Минздрава России по акушерству и гинекологии в ДФО (г. Чита). Конфликт интересов отсутствует.
• Гладкова Кристина Александровна. м.н., заведующая 1-ым акушерским отделением патологии беременности ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России (г. Москва). Конфликт интересов отсутствует.
• Горина Ксения Алексеевна. Младший научный сотрудник 1 акушерского отделения патологии беременности ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России (г. Москва). Конфликт интересов отсутствует.
• Долгушина Наталия Витальевна. Д.м.н., профессор, заместитель директора - руководитель департамента организации научной деятельности ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России (г. Москва). Конфликт интересов отсутствует.
• Костин Игорь Николаевич. Д.м.н., проф., профессор кафедры акушерства и гинекологии с курсом перинатологии Медицинского института Российского университета дружбы народов (г. Москва). Конфликт интересов отсутствует.
• Крутова Виктория Александровна. Д.м.н., профессор, главный врач клиники, проректор по лечебной работе ФГБОУ ВО Кубанский Государственный университет Минздрава России, главный внештатный специалист Минздрава России по акушерству и гинекологии в ЮФО (г. Краснодар). Конфликт интересов отсутствует.
• Куликов Александр Вениаминович. Д.м.н., профессор, заведующий кафедрой анестезиологии, реаниматологии, токсикологии и трансфузиологии ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России (г. Екатеринбург). Конфликт интересов отсутствует.
• Малышкина Анна Ивановна. Д.м.н., профессор, директор ФГБУ Ивановский научно-исследовательский институт материнства и детства имени В.Н. Городкова Минздрава России, главный внештатный специалист Минздрава России по акушерству и гинекологии в ЦФО (г. Иваново). Конфликт интересов отсутствует.
• Мартиросян Сергей Валериевич. м.н., главный врач МБУ «Екатеринбургский клинический перинатальный центр», доцент кафедры акушерства и гинекологии лечебно-профилактического факультета Уральского государственного медицинского университета (г. Екатеринбург). Конфликт интересов отсутствует.
• Николаева Анастасия Владимировна. м.н., главный врач ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России (г. Москва). Конфликт интересов отсутствует.
• Радзинский Виктор Евсеевич. Доктор медицинских наук, профессор, член-корреспондент РАН, заведующий кафедрой акушерства и гинекологии с курсом перинатологии Российского университета дружбы народов, заслуженный деятель науки РФ (г. Москва). Конфликт интересов отсутствует.
• Савельева Галина Михайловна. Академик РАН, доктор медицинских наук, профессор, Герой Труда Российской Федерации, заслуженный деятель науки РФ, почетный профессор кафедры акушерства и гинекологии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова (г. Москва). Конфликт интересов отсутствует.
• Серов Владимир Николаевич. Академик РАН, д.м.н., профессор, заслуженный деятель науки РФ, президент Российского общества акушеров-гинекологов, главный научный сотрудник ФГБУ Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова Минздрава России (г. Москва). Конфликт интересов отсутствует.
• Тетруашвили Нана Картлосовна. Д.м.н . заведующая 1-ым акушерским отделением 2патологии беременности ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России (г. Москва). Конфликт интересов отсутствует.
• Шалина Раиса Ивановна. Доктор медицинских наук, профессор, заслуженный врач России, профессор кафедры акушерства и гинекологии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова (г. Москва). Конфликт интересов отсутствует.
• Фаткуллин Ильдар Фаридович. Д.м.н., профессор, зав. кафедрой акушерства и гинекологии им. проф. В.С. Груздева Казанского ГМУ, главный внештатный специалист Минздрава России по акушерству и гинекологии в ПФО (г. Казань). Конфликт интересов отсутствует.
• Филиппов Олег Семенович. Д.м.н., профессор, профессор кафедры акушерства и гинекологии ФППОВ ФГБОУ ВО «Московский государственный медико-стоматологический университет имени А.И. Евдокимова» Минздрава России, заместитель директора Департамента медицинской помощи детям и службы родовспоможения Минздрава России (г. Москва). Конфликт интересов отсутствует.
• Шифман Ефим Муневич. Д.м.н., профессор кафедры анестезиологии и реаниматологии ФУВ ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, эксперт по анестезиологии и реаниматологии Федеральной службы по надзору в сфере здравоохранения (г. Москва). Конфликт интересов отсутствует.
• Цхай Виталий Борисович. Д.м.н., профессор, заведующий кафедрой перинатологии, акушерства и гинекологии ГОУ ВПО Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого (г. Красноярск). Конфликт интересов отсутствует.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций:
1. врачи акушеры-гинекологи.
2. студенты; ординаторы, аспиранты акушеры-гинекологи.
3. преподаватели, научные сотрудники.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| УДД | Расшифровка |
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в тч когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| УУР | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| в | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| с | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Приложение А3.
Связанные документы.• Федеральный закон Об основах охраны здоровья граждан в Российской Федерации от 21,11,2011. №323-ФЗ.
• Приказ Министерства здравоохранения Российской Федерации от 10,05,2017 г. №203н. Об утверждении критериев оценки качества медицинской помощи».
• Приказ Минздравсоцразвития №1687н от 27,12,2011 О медицинских критериях рождения, форме документа о рождении и порядке его выдачи (зарегистрировано в Минюсте РФ 15,03,12 №23490).
• Преждевременные роды, ВОЗ, 2018, https://www.who.int/ru/news-room/fact-sheets/detail/preterm-birthАкушерство: национальное руководство / под ред. Г.М. Савельевой, Г.Т. Сухих, В.Н. Серова, В.Е. Радзинского. 2-е изд. М. ГЭОТАР-Медиа, 2018.
• Приказ Министерства здравоохранения Российской Федерации от 01,11,2012 г. №572н «Об утверждении Порядка оказания медицинской помощи по профилю акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)».
• Приказ Минздрава России от 13,10,2017 №804н (ред. от 16,04,2019 г. Об утверждении номенклатуры медицинских услуг».
• Письмо Министерства здравоохранения РФ от 2 октября 2015 г. 15-4/10/2-5803 О клинических рекомендациях (протоколе лечения) Организация медицинской эвакуации при преждевременных родах .
• Preterm Labor and вirth Management: Recommendations from the European Association of Perinatal Medicine, 2017. Preterm birth, WHO, 2015, https://www.who.int/news-room/fact-sheets/detail/preterm-birth.
• сommittee Opinion No 700: Methods for Estimating the Due Date, сommittee Opinion No 700: Methods for Estimating the Due Date, 2017.
• NICE Guidance, Preterm labour and birth, 2016.
• ACOG сommittee Opinion № 677: antenatal corticosteroid therapy for fetal maturation, 2017.
• Practice вulletin № 171: Management of Preterm Labor, ACOG, 2016.
• Obstetric сare сonsensus № 3: Periviable вirth, ACOG, 2015.
• сare of Women Presenting with Suspected Preterm Prelabour Rupture of Membranes from 24+0 Weeks of Gestation: Green-top Guideline № 73, 2019.
• ACOG Practice вulletin №142: сerclage for the management of cervical insufficiency, 2014.
• ACOG, Practice вulletin № 169: Multifetal Gestations: Twin, Triplet, and Higher-Order Multifetal Pregnancies, 2016.
• ACOG, Practice вulletin № 171: Management of Preterm Labor, 2016.
• ACOG, Practice вulletin № 172: Premature Rupture of Membranes, 2016.
• Management of вreech Presentation (Green-top Guideline № 20b), 2017.
• Operative Vaginal Delivery (Green-top Guideline № 26), 2011.
• Magnesium Sulfate вefore Anticipated Preterm вirth for Neuroprotection. сommittee Opinion No 455, 2010.
Приложение В.
Информация для пациентов.Что такое преждевременные роды.
Преждевременные роды определяются как регулярные сокращения матки, приводящие к изменениям в шейке матки, которые начинаются до 37 недель беременности. Изменения в шейке матки включают ее сглаживание (шейка укорачивается) и расширение (шейка открывается, что способствует попаданию плода в родовые пути).
Почему преждевременные роды вызывают беспокойство.
Преждевременные роды являются важнейшей медико-социальной проблемой, потому что дети, которые рождаются «слишком рано», недостаточно развиты для внеутробной жизни. Они могут родиться с серьезными проблемами со здоровьем. Некоторые проблемы со здоровьем, такие как церебральный паралич, могут длиться всю жизнь. Другие проблемы, такие как снижение способности к обучению, могут появиться позже в детстве или даже во взрослом возрасте.
Какие недоношенные дети подвержены наибольшему риску проблем со здоровьем.
Риск проблем со здоровьем является наибольшим для детей, родившихся до 34 недель беременности. Однако дети, родившиеся между 34 и 37 неделями беременности, также имеют риски.
Каковы факторы риска преждевременных родов.
Факторы, которые увеличивают риск преждевременных родов, включают следующее: наличие преждевременных родов ранее, укорочение шейки матки, короткий интервал между беременностями, наличие в анамнезе некоторых видов операций на матке или шейке матки, некоторые осложнения беременности, такие как многоплодная беременность и наличие кровотечения в анамнезе, факторы образа жизни, такие как низкая масса тела до беременности, курение во время беременности и токсикомания во время беременности.
Можно ли что-нибудь сделать, чтобы предотвратить преждевременные роды, если я в группе высокого риска.
Если у вас были преждевременные роды, и вы планируете другую беременность, предгравидарное обследование (до зачатия). Когда вы забеременеете, с самых ранних сроков необходимо наблюдаться у акушера-гинеколога. Вас могут направить к специалисту здравоохранения, который имеет опыт ведения беременностей с высокой степенью риска. Кроме того, вам могут дать определенные лекарства или другое лечение, чтобы помочь предотвратить преждевременные роды, если у вас есть факторы риска.
Каковы признаки и симптомы преждевременных родов и что мне делать, если у меня есть какие-либо из них.
Немедленно позвоните своему акушеру или другому медицинскому работнику, если вы заметили какие-либо из этих признаков или симптомов: изменение характера выделений из влагалища (водянистые, слизистые или кровянистые), периодические или схваткообразные боли в области матки, боли внизу живота и поясницы, легкие спазмы в животе, с или без диареи.
Как диагностируется преждевременные роды.
Преждевременные роды можно диагностировать только при обнаружении изменений в шейке матки. Ваш акушер должен провести мануальное обследование, чтобы определить, есть или нет изменения в шейке матки. Возможно, вам придется пройти обследование несколько раз в течение нескольких часов с целью оценки изменений в динамике. Для измерения длины шейки матки может быть проведено трансвагинальное ультразвуковое исследование.
Если у меня симптомы ПР, это значит, что роды точно произойдут.
Специалистам здравоохранения трудно предсказать, у каких женщин с симптомами ПР точно случаться преждевременные роды. Только приблизительно у 1 из 10 женщин с симптомами ПР, они наступают в течение следующих 7 дней. Примерно у 3 из 10 женщин преждевременные роды прекращаются сами по себе.
Приложение Г.
Не применимо.|
|
Год актуализации информации
2020.