МКБ-10 коды
|
|
Вступление
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: с61.
Год утверждения (частота пересмотра): 2021.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2023.
ID: 12.
Разработчик клинической рекомендации.
• Ассоциация онкологов России.
• Общероссийская общественная организация Российское общество онкоурологов .
• Общероссийская общественная организация «Российское общество клинической онкологии».
• Общероссийская общественная организация Российское общество урологов .
Одобрено Научно-практическим Советом Минздрава РФ.
Год утверждения (частота пересмотра): 2021.
Возрастная категория: Взрослые.
Пересмотр не позднее: 2023.
ID: 12.
Разработчик клинической рекомендации.
• Ассоциация онкологов России.
• Общероссийская общественная организация Российское общество онкоурологов .
• Общероссийская общественная организация «Российское общество клинической онкологии».
• Общероссийская общественная организация Российское общество урологов .
Одобрено Научно-практическим Советом Минздрава РФ.
|
|
 Список сокращений
Список сокращений
АДТ - андроген-депривационная терапия.
БТ - брахитерапия.
ВУ - время удвоения.
ГКСФ - гранулоцитарный колониестимулирующий фактор.
ГЧРПЖ - гормоночувствительный рак предстательной железы.
ДГПЖ - доброкачественная гиперплазия предстательной железы.
ДИ - доверительный интервал.
ДЛТ - дистанционная лучевая терапия.
ИГТ - интермиттирующая гормонотерапия.
КРРПЖ - кастрационно-рефрактерный рак предстательной железы.
КТ - компьютерная томография.
ЛГРГ - лютеинизирующий гормон рилизинг-гормон.
ЛТ - лучевая терапия.
ЛУ - лимфатические узлы.
ЛФК - лечебная физкультура.
МАБ - максимальная андрогенная блокада.
МАГАТЭ - Международное агентство по атомной энергии.
МКБ-10 - Международная классификация болезней 10-го пересмотра.
МпМРТ - мультипараметрическая магнитно-резонансная томография.
МРТ - магнитно-резонансная томография.
НСАА - нестероидные антиандрогены.
ОЗМ - острая задержка мочеиспускания.
ОПСА - общий простатспецифический антиген.
ПГТ - постоянная гормонотерапия.
ПСА - простатоспецифический антиген.
ПЭТ/КТ - позитронная эмиссионная томография, совмещенная с компьютерной томографией.
РАРП - роботассистированная радикальная простатэктомия.
РПЖ - рак предстательной железы.
РПЭ - радикальная простатэктомия.
СвПСА - свободный простатспецифический антиген.
СЛУ - сторожевой лимфоузел.
СОД - суммарная очаговая доза.
ТЛАЭ - тазовая лимфаденэктомия.
ТПИ - трансректальное пальцевое исследование.
ТРУЗИ - трансректальное ультразвуковое исследование.
ТУР - трансуретральная резекция предстательной железы.
УД - уровень доказательности.
УЗИ - ультразвуковое исследование.
ХТ - химиотерапия.
ERAS (early rehabilitation after surgery) - ранняя реабилитация после операции.
IGRT - Image Guided Radiation Therapy (лучевая терапия, ориентированная на положение простаты в режиме реального времени).
IMRT - Intensive Modulated Radiation Therapy (лучевая терапия с модуляцией интенсивности).
PCPT - Prostate сancer Prevention Trial (исследование по профилактике рака простаты).
PHI - Prostate Health Index (индекс здоровья простаты).
БТ - брахитерапия.
ВУ - время удвоения.
ГКСФ - гранулоцитарный колониестимулирующий фактор.
ГЧРПЖ - гормоночувствительный рак предстательной железы.
ДГПЖ - доброкачественная гиперплазия предстательной железы.
ДИ - доверительный интервал.
ДЛТ - дистанционная лучевая терапия.
ИГТ - интермиттирующая гормонотерапия.
КРРПЖ - кастрационно-рефрактерный рак предстательной железы.
КТ - компьютерная томография.
ЛГРГ - лютеинизирующий гормон рилизинг-гормон.
ЛТ - лучевая терапия.
ЛУ - лимфатические узлы.
ЛФК - лечебная физкультура.
МАБ - максимальная андрогенная блокада.
МАГАТЭ - Международное агентство по атомной энергии.
МКБ-10 - Международная классификация болезней 10-го пересмотра.
МпМРТ - мультипараметрическая магнитно-резонансная томография.
МРТ - магнитно-резонансная томография.
НСАА - нестероидные антиандрогены.
ОЗМ - острая задержка мочеиспускания.
ОПСА - общий простатспецифический антиген.
ПГТ - постоянная гормонотерапия.
ПСА - простатоспецифический антиген.
ПЭТ/КТ - позитронная эмиссионная томография, совмещенная с компьютерной томографией.
РАРП - роботассистированная радикальная простатэктомия.
РПЖ - рак предстательной железы.
РПЭ - радикальная простатэктомия.
СвПСА - свободный простатспецифический антиген.
СЛУ - сторожевой лимфоузел.
СОД - суммарная очаговая доза.
ТЛАЭ - тазовая лимфаденэктомия.
ТПИ - трансректальное пальцевое исследование.
ТРУЗИ - трансректальное ультразвуковое исследование.
ТУР - трансуретральная резекция предстательной железы.
УД - уровень доказательности.
УЗИ - ультразвуковое исследование.
ХТ - химиотерапия.
ERAS (early rehabilitation after surgery) - ранняя реабилитация после операции.
IGRT - Image Guided Radiation Therapy (лучевая терапия, ориентированная на положение простаты в режиме реального времени).
IMRT - Intensive Modulated Radiation Therapy (лучевая терапия с модуляцией интенсивности).
PCPT - Prostate сancer Prevention Trial (исследование по профилактике рака простаты).
PHI - Prostate Health Index (индекс здоровья простаты).
Термины и определения
Брахитерапия (внутритканевая лучевая терапия). Имплантация радиоактивных зерен в ткань предстательной железы.
Второй этап реабилитации. Реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
Международный индекс симптомов при заболеваниях простаты (International Prostate Symptom Score (IPSS)) - вопросник для определения выраженности расстройств мочеиспускания.
Метастаз-направленная терапия. Лечение по поводу метастазов опухоли (операция, предусматривающая хирургическое удаление метастаза, или лучевая терапия).
Первый этап реабилитации. Реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Пререабилитация (prehabilitation). Реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Простатоспецифический антиген (ПСА). Белок-онкомаркер, который указывает на возможное наличие злокачественного новообразования предстательной железы.
Трансуретральная резекция предстательной железы (ТУР). Эндоскопическая операция, подразумевающая удаление ткани предстательной железы посредством инструмента, проведенного через мочеиспускательный канал.
Третий этап реабилитации. Реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций).
Второй этап реабилитации. Реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
Международный индекс симптомов при заболеваниях простаты (International Prostate Symptom Score (IPSS)) - вопросник для определения выраженности расстройств мочеиспускания.
Метастаз-направленная терапия. Лечение по поводу метастазов опухоли (операция, предусматривающая хирургическое удаление метастаза, или лучевая терапия).
Первый этап реабилитации. Реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Пререабилитация (prehabilitation). Реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Простатоспецифический антиген (ПСА). Белок-онкомаркер, который указывает на возможное наличие злокачественного новообразования предстательной железы.
Трансуретральная резекция предстательной железы (ТУР). Эндоскопическая операция, подразумевающая удаление ткани предстательной железы посредством инструмента, проведенного через мочеиспускательный канал.
Третий этап реабилитации. Реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций).
Описание
Рак предстательной железы (РПЖ) - это злокачественное новообразование, возникающее из эпителия желез предстательной железы.
Причины
Этиология и патогенез данного заболевания остаются малоизученными. Многие исследования направлены на изучение диеты, продуктов питания, гормонального воздействия, а также инфекции в этиологии РПЖ. Распространенность РПЖ зависит от этнических и географических особенностей. Наиболее высокая заболеваемость у афроамериканцев, проживающих в США (на 60 % выше, чем у белых американцев), наименее высокая - у китайцев, проживающих в Китае [1]. Помимо расовых особенностей факторами риска развития РПЖ считают генетическую предрасположенность, возраст мужчины и особенности питания. Вероятность развития опухоли предстательной железы у мужчины, у которого один из ближайших родственников первой степени родства (отец или брат) болел РПЖ, выше в 1,8 раз, чем в популяции. Если болели двое родственников или более (отец и брат или оба брата), риск заболевания РПЖ возрастает в 5,51 и 7,71 раз соответственно [2, 3]. Афроамериканцы имеют повышенный риск выявления РПЖ, а также большую вероятность выявления агрессивного РПЖ [4]. Также риск развития РПЖ повышается у мужчин, употребляющих большое количество жиров животного происхождения [5].
Многие работы посвящены анализу связи РПЖ с алиментарными факторами и лекарственными препаратами, а также с профессиональными и другими факторами внешней среды (курение, хирургические вмешательства, инфекции ) (табл. 1).
Таблица 1. Влияние алиментарных факторов и лекарственных препаратов на риск развития РПЖ.
Таблица 2. Влияние других факторов на риск развития РПЖ.
Таким образом, вопрос об этиологии РПЖ и возможных методах его профилактики остается спорным. Результаты многочисленных исследований о роли факторов, которые могут оказывать влияние на риск развития РПЖ, являются противоречивыми и чаще вызывают больше сомнений и вопросов, чем дают утвердительные и однозначные ответы. Проведение дальнейших проспективных генетических, молекулярно-биологических, эпидемиологических исследований на тщательно отобранных группах, возможно, позволит более детально определить факторы риска развития РПЖ, а также пути профилактики данного заболевания.
Многие работы посвящены анализу связи РПЖ с алиментарными факторами и лекарственными препаратами, а также с профессиональными и другими факторами внешней среды (курение, хирургические вмешательства, инфекции ) (табл. 1).
Таблица 1. Влияние алиментарных факторов и лекарственных препаратов на риск развития РПЖ.
| Алкоголь | Злоупотребление алкогольными напитками, также как и полный отказ от последних, ассоциирован с повышенным риском выявления и смерти от РПЖ [6] |
| Молочные продукты | Выявлено незначительное влияние потребления большого количества белка молочных продуктов и инсулиноподобного фактора роста первого типа (IGF-1) на риск возникновения РПЖ [7] |
| Жиры | Не выявлено корреляции между потреблением длинноцепочечных омега-3 полиненасыщенных жирных кислот и РПЖ [8]. Возможно, существует связь между потреблением жареной пищи и РПЖ [9] |
| Ликопин (каротиноиды) | Рандомизированные клинические исследования, сравнивающие ликопин и плацебо, не выявили значимого снижения риска выявления РПЖ [10] |
| Мясо | Мета-анализ исследований влияния потребления красного или обработанного мяса не показал связи с РПЖ [11] |
| Витамин Д | Выявлена корреляция: высокие или низкие концентрации витамина D повышают риск развития РПЖ, в том числе и агрессивного РПЖ [12, 13] |
| Селен, витамин Е | Не подтверждено влияние селена и витамина Е на частоту выявления РПЖ [14] |
| Ингибиторы 5-альфа-редуктазы | Профилактика или отсроченное развитие РПЖ (около 25 % для РПЖ 6 баллов по Глисону). Повышение риска выявления агрессивного низкодифференцированного РПЖ [15-17]. Ингибиторы 5-альфа-редуктазы не рекомендованы для медикаментозной профилактики РПЖ |
| Тестостерон | Не отмечено повышения риска РПЖ у пациентов с гипогонадизмом, получающих препараты тестостерона [18] |
Таблица 2. Влияние других факторов на риск развития РПЖ.
| Облысение | Ассоциировано с повышенным риском смерти от РПЖ [19] |
| Гонорея | Достоверная корреляция с увеличением выявления РПЖ [20] |
| Работа по ночам | Повышенный риск выявления РПЖ [21] |
| Профессиональная лучевая нагрузка (пилоты авиации) | Повышенный риск выявления РПЖ [22] |
| Активные курильщики | Повышение риска смерти от РПЖ [23] |
| Вазэктомия | Не ассоциирована с повышением риска возникновения РПЖ [24] |
| Ацетилсалициловая кислота и НПВС | Разноречивые данные о влиянии приема ацетилсалициловой кислоты и НПВС на риск возникновения РПЖ [25, 26] |
| Ультрафиолетовое излучение | Уменьшает риск возникновения РПЖ [27] |
| Циркумцизия | Уменьшает риск возникновения РПЖ [28] |
| Частота эякуляции (≥21 раз в месяц по сравнению с 4-7 раз в месяц) | Частая эякуляцию способствует снижению риска возникновения РПЖ на 20 % [29] |
Таким образом, вопрос об этиологии РПЖ и возможных методах его профилактики остается спорным. Результаты многочисленных исследований о роли факторов, которые могут оказывать влияние на риск развития РПЖ, являются противоречивыми и чаще вызывают больше сомнений и вопросов, чем дают утвердительные и однозначные ответы. Проведение дальнейших проспективных генетических, молекулярно-биологических, эпидемиологических исследований на тщательно отобранных группах, возможно, позволит более детально определить факторы риска развития РПЖ, а также пути профилактики данного заболевания.
|
|
Эпидемиология
РПЖ является одним из наиболее распространенных злокачественных заболеваний у мужчин. В мире ежегодно диагностируют около 1,6 миллиона случаев РПЖ, а 366 тысяч мужчин ежегодно погибают от этой патологии [30]. Именно с этим связан тот факт, что диагностике и лечению данной патологии в последнее время уделяется все больше внимания как за рубежом, так и в Российской Федерации. Наиболее высокие показатели заболеваемости РПЖ отмечены в США, Канаде и в ряде стран Европы, где он выходит на первое место в структуре онкологических заболеваний у мужчин. Так, по данным Национального института рака (National сancer Institute) США, с 1986 по 1992 гг. показатель заболеваемости РПЖ среди белого населения вырос на 108 % и на 102 % - для чернокожих американцев. В Российской Федерации заболеваемость РПЖ также неуклонно возрастает. В структуре заболеваемости злокачественными новообразованиями мужского населения России РПЖ занимает второе место, что соответствует 14,5 % от всех диагностированных новообразований у мужчин после опухолей трахеи, бронхов, легкого (17,4 %) [31]. Так, в 2017 г. впервые выявлено 40 785 новых случаев РПЖ и стандартизованный показатель составил 40,47 на 100 тыс. населения. Прирост заболеваемости с 2007 по 2017 гг. 70,61 % при среднем темпе прироста за 2017 г. 5,09 %. Смертность от РПЖ в России увеличилась в течение истекших 10 лет. В 2017 г. в России от РПЖ умерло 12 565 мужчин. За 10 лет (с 2007 по 2017 гг.) прирост показателя смертности составил 13,85 % при среднегодовом темпе прироста 1,29 %. Несмотря на совершенствование методов диагностики РПЖ и внедрение ПСА-мониторинга, заболеваемость запущенными формами РПЖ в России остается высокой. По данным на 2018 г., метастатический РПЖ IV стадии, при которой уже невозможно проведение радикального лечения данных пациентов, верифицирован у 18,9 % пациентов. Местнораспространенный РПЖ без наличия регионарных и отдаленных метастазов (III стадия РПЖ) диагностирован у 21,5% пациентов, локализованный РПЖ I-II стадии выявлен у 58,5 % пациентов [32].
С61. Злокачественное новообразование предстательной железы.
1,4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем.
По Международной статистической классификации болезней и проблем, связанных со здоровьем (далее - МКБ-10) рак предстательной железы имеет код.С61. Злокачественное новообразование предстательной железы.
Классификация
1,5 Классификация заболевания или состояния (группы заболеваний или состояний).
1,5,1 Международная гистологическая классификация:
8148/2 - Простатическая интраэпителиальная неоплазия III степени злокачественности;8140/3 - Аденокарцинома;
8141/3 - Скиррозная аденокарцинома;
8550/3 - Ацинарная аденокарцинома;
8201/3 - Криброзный рак.
Морфологическая классификация РПЖ.
Аденокарцинома:
• мелкоацинарная;
• крупноацинарная;
• криброзная;
• папиллярная;
• солидно-трабекулярная;
• эндометриоидная;
• железисто-кистозная;
• слизеобразующая.
Переходно-клеточный рак.
Плоскоклеточный рак.
1,5,2 Стадирование.
Стадирование РПЖ осуществляется в соответствии с классификацией TNM (tumor-node-metastasis) (UICC (the Union for International сancer сontrol) 8-го пересмотра (2017 г.Критерий Т отражает распространенность первичной опухоли.
Т - первичная опухоль:
• Тх. Недостаточно данных для определения первичной опухоли;
• Т0. Первичная опухоль не определяется;
• Т1. Клинически неопределяемая опухоль (не пальпируется и не визуализируется):
- Т1а - опухоль случайно выявлена при ТУР предстательной железы (объем опухолевой ткани не более 5 % резецированной ткани предстательной железы);
- T1b - опухоль случайно выявлена при ТУР предстательной железы (объем опухолевой ткани более 5 % резецированной ткани предстательной железы);
- Т1с - опухоль выявлена при пункционной биопсии предстательной железы (выполненной в связи с повышением уровня ПСА);
Т2 - опухоль локализуется в предстательной железе1:
• Т2а. Опухоль локализуется в одной доле и занимает <50 % пораженной доли;
• T2b - опухоль локализуется в одной доле и занимает >50 % пораженной доли;
• T2с. Опухоль вовлекает обе доли предстательной железы;
Т3 - опухоль выходит за пределы капсулы предстательной железы2:
• Т3а. Опухоль прорастает в парапростатическую клетчатку (с одной или с обеих сторон);
• T3b. Опухоль прорастает в семенные пузырьки;
Т4 - опухоль прорастает в окружающие органы и ткани, кроме семенных пузырьков (шейку мочевого пузыря, наружный сфинктер, прямую кишку, мышцу, поднимающую задний проход, и/или переднюю брюшную стенку).
Критерий N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах.
N - регионарные лимфатические узлы3:
• Nх. Недостаточно данных для определения статуса лимфатических узлов;
• N0. Нет метастазов в регионарных лимфатических узлах;
• N1. Метастазы в регионарных лимфатических узлах.
Критерий М характеризует наличие или отсутствие отдаленных метастазов.
М - отдаленные метастазы4:
• Мх. Недостаточно данных для определения отдаленных метастазов;
• М0. Нет отдаленных метастазов;
• М1. Отдаленные метастазы;
• М1а. Метастазы в лимфатических узлах, не относящихся к регионарным;
• M1b. Метастазы в костях;
• М1с. Метастазы в других органах.
РТ - патоморфологическая оценка первичной опухоли:
• рТ2. Опухоль ограничена капсулой предстательной железы;
• рТ3. Экстракапсулярное распространение опухоли:
- рТ3а - опухоль распространяется за пределы капсулы ПЖ с одной или двух сторон, включая микроскопическое прорастание в шейку мочевого пузыря;
- pT3b - опухоль врастает в строму одного или двух семенных пузырьков;
• рТ4. Опухоль распространяется на соседние органы или ткани (вовлекает прямую кишку, шейку мочевого пузыря, леваторы и стенки таза или сфинктер прямой кишки).
Представлены комментарии к сноскам в соответствии с числовым обозначением в тексте выше:
1Опухоль, выявленную в одной или обеих долях при биопсии, но не пальпируемую и не визуализируемую посредством методов лучевой диагностики, классифицируют как Т1с.
2Инвазия опухоли в верхушку или в капсулу (но не за пределы капсулы) предстательной железы классифицируют как Т2, но не как Т3 (таким образом, врастание опухоли в капсулу железы без инвазии парапростатической клетчатки следует стадировать как Т2).
3Регионарные лимфатические узлы - лимфатические узлы в полости малого таза, располагающиеся ниже бифуркации общих подвздошных артерий. Сторона поражения не влияет на определение символа N.
4При выявлении более одной локализации метастазов используют более распространенный символ (например, если у больного РПЖ имеются метастазы в костях и печени, следует указывать символ М1с).
1,5,3 Морфологическая классификация по шкале Глисона.
Для оценки степени дифференцировки РПЖ наибольшее распространение получила классификация, предложенная канадским патоморфологом Глисоном (Gleason). По классификации Глисона степень дифференцировки опухоли оценивают по 5-балльной шкале: 1 балл - наиболее высокодифференцированная опухоль, 5 баллов - наиболее низкодифференцированная опухоль. Поскольку РПЖ, как правило, представляет собой опухоль с неоднородной морфологической структурой, принято выделять наиболее распространенную гистологическую градацию (первичный балл) и следующую по частоте встречаемости градацию дифференцировки (вторичный балл). При сложении первичной и вторичной оценки получают сумму Глисона (от 2 до 10 баллов). Классификация Глисона имеет особое прогностическое значение для оценки результатов лечения РПЖ.В 2014 г. проведена конференция Международного общества уропатологов, посвященная классификации дифференцировки РПЖ [33]. На основании прогностических данных дифференцировки опухоли по шкале Глисона выработана классификация, включающая пять прогностических групп для сопоставления градации с опухолями других локализаций. Выполнено разделение группы опухолей простаты с дифференцировкой 7 баллов по Глисону (3 + 4 и 4 + 3) на две в связи со значимыми различиями в клиническом прогнозе заболевания (табл. 3).
Таблица 3. Гистологическая прогностическая классификация РПЖ международной ассоциации уропатологов (ISUP - international society of uropatologists).
| Сумма баллов по Глисону | Группа ISUP |
| 2-6 | 1 |
| 7 (3 + 4) | 2 |
| 7 (4 + 3) | 3 |
| 8 (4 + 4 или 3 + 5 или 5 + 3) | 4 |
| 9-10 | 5 |
Таким образом, новая классификация ISUP обеспечила более точную стратификацию опухолей простаты. Авторы данной системы стадирования рассчитывают, что изменение числового обозначения прогностических подгрупп (от 1 до 5, а не от 6 до 10, как в стандартной стратификации по Глисону) позволит снизить частоту активного радикального лечения пациентов с клинически незначимым РПЖ. В настоящее время градация опухолей предстательной железы по системе ISUP используется совместно со стандартной градацией по Глисону. Например, ацинарная аденокарцинома предстательной железы 6 (3 + 3) баллов по Глисону, ISUP грейд 1, 7 (3 + 4) баллов - ISUP грейд 2 и так далее. В 2016 году Всемирная организация здравоохранения одобрила применение данной классификации.
|
|
Клиническая картина
На начальных стадиях заболевания РПЖ, как правило, не имеет никаких клинических проявлений. Симптоматика при неметастатическом РПЖ чаще всего связана с сопутствующей доброкачественной гиперплазией ткани предстательной железы (ДГПЖ). Наиболее часто пациенты с локализованным РПЖ имеют симптомы инфравезикальной обструкции, связанной с ДГПЖ, такие как учащенное, затрудненное мочеиспускание, ослабление струи мочи, императивные позывы к мочеиспусканию, никтурия. Для местно-распространенного РПЖ может быть характерно возникновение симптомов обструкции мочевых путей, что обусловлено как сопутствующей ДГПЖ, так и большим объемом опухоли. При прорастании опухоли в шейку мочевого пузыря и/или уретру возможно развитие гематурии, а также недержания мочи. Обширное опухолевое поражение шейки мочевого пузыря может привести к сдавлению устьев мочеточников, возникновению болевого синдрома, развитию уретеропиелокаликоэктазии, гидронефроза и почечной недостаточности. Распространение опухолевого процесса на кавернозные сосудисто-нервные пучки приводит к развитию эректильной дисфункции. Симптомами опухолевого прорастания или сдавления стенки прямой кишки являются нарушение акта дефекации, примесь крови в кале, боли в области прямой кишки и промежности. Распространение опухоли на мышцы тазового дна может вызывать чувство дискомфорта в положении сидя, боль в промежности. Массивное опухолевое поражение тазовых ЛУ приводит к лимфостазу, отеку наружных половых органов и нижних конечностей.
При метастатическом РПЖ клинические симптомы (паранеопластический синдром: общее недомогание, слабость, прогрессивное снижение массы тела, лихорадка, анемия, кахексия) связаны как с общей распространенностью опухолевого процесса, так и с локализацией метастазов. Часто это боли в костях, соответствующие локализации метастазов. Интенсивные боли возникают при патологических переломах костей. Развитие неврологических нарушений, обусловленных поражением позвоночника, выраженность неврологической симптоматики зависят от степени сдавления спинного мозга и уровня повреждения.
При метастатическом РПЖ клинические симптомы (паранеопластический синдром: общее недомогание, слабость, прогрессивное снижение массы тела, лихорадка, анемия, кахексия) связаны как с общей распространенностью опухолевого процесса, так и с локализацией метастазов. Часто это боли в костях, соответствующие локализации метастазов. Интенсивные боли возникают при патологических переломах костей. Развитие неврологических нарушений, обусловленных поражением позвоночника, выраженность неврологической симптоматики зависят от степени сдавления спинного мозга и уровня повреждения.
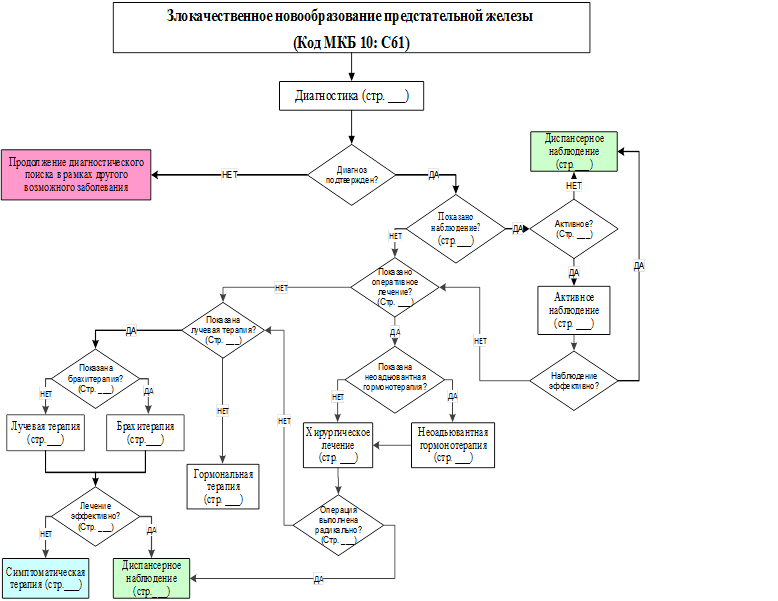
Диагностика
Критерии установления диагноза/состояния:
• данные анамнеза,.
• данные физикального обследования,.
• данные лабораторных исследований,.
4) данные инструментального обследования,.
5) данные патолого-анатомического исследования тканей предстательной железы.
Клинический диагноз основан на результатах анализов:
• физикальное обследование (трансректальное пальцевое исследование (ТПИ)) позволяет выявить подозрительное образование предстательной железы;
• лабораторные исследования могут выявить повышенный уровень сывороточных онкомаркеров (простатоспецифический антиген (ПСА), индекс здоровья простаты );
• заключение патолого-анатомического исследования биопсийного материала (биопсия предстательной железы);
• данные лучевых методов диагностики позволяют корректно стадировать заболевание.
Определение распространенности опухолевого процесса (стадирование).
Для оценки распространенности первичной опухоли (локализованный или экстракапсулярный процесс) применяют трансректальное пальцевое исследование (положительная корреляция со стадией процесса менее, чем в 50 % случаев), методы лучевой диагностики и прогностические факторы.
Основные прогностические факторы, определяющие стадию опухолевого процесса:
• уровень ПСА;
• степень дифференцировки опухоли по шкале Глисона;
• клиническая стадия по данным пальцевого ректального обследования и лучевых методов диагностики.
На основе комбинации данных прогностических факторов разработаны таблицы и номограммы, с высокой точностью предсказывающие вероятность патоморфо-логической стадии опухоли. Наибольшую популярность получили таблицы Партина (Partin) и номограммы Каттана (Kattan) [34-36].
Кроме основных, используют дополнительные факторы прогноза:
• периневральную инвазию опухоли;
• число позитивных биоптатов;
• процент рака в биопсийных столбиках;
• длину рака в биопсийных столбиках.
• симптомы инфравезикальной обструкции: ослабление и прерывистость струи мочи, ощущение неполного опорожнения мочевого пузыря, учащение мочеиспускания, императивные позывы к мочеиспусканию, стрессовое недержание мочи;
• симптомы, связанные с местным прогрессированием опухоли: гемоспермия, гематурия, недержание мочи, эректильная дисфункция, боль в надлобковой области и промежности;
• симптомы, связанные с отдаленными метастазами: боль в костях, пояснице (при обструкции мочеточников), отек нижних конечностей (лимфостаз), параплегия (компрессия спинного мозга), потеря массы тела, анемия, уремия, кахексия.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарии. ТПИ позволяет выявить РПЖ в периферических отделах при объеме узлов не менее 0,2 мл. Проведение этого обследования для скрининга у бессимптомных мужчин приводит к выявлению РПЖ только в 0,1-4 % случаев [39, 40]. ТПИ влечет клинически значимое повышение уровня ПСА [41].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. ПСА - калликреинподобная сериновая протеаза, секретируемая эпителиальными клетками предстательной железы. Это не опухолеспецифический, а органоспецифический маркер, поэтому сывороточный уровень ПСА может повышаться не только при РПЖ, но и при ДГПЖ и хроническом простатите. Острая задержка мочеиспускания (ОЗМ), биопсия предстательной железы, оперативные вмешательства (трансуретральная резекция (ТУР), аденомэктомия) также приводят к повышению уровня ПСА в течение нескольких недель, что необходимо учитывать при интерпретации данных.
Средним нормальным уровнем ПСА считают 2,5 нг/мл. Кроме того, следует учитывать возрастные нормы уровня маркера: в возрасте 40-49 лет - 0-2,5 нг/мл, 50-59 лет - 0-3,5 нг/мл, 60-69 лет - 0-4,5 нг/мл, 70-79 лет - 0-6,5 нг/мл [48]. Терапия финастеридом** у пациентов с ДГПЖ приводит к снижению концентрации ПСА, при этом нормальным следует считать уровень 2 нг/мл [49]. Тем не менее, не существует дискриминационного уровня ПСА крови, полностью исключающего риск выявления РПЖ. Так, по данным литературы, риск выявления РПЖ у мужчин с уровнем ПСА менее или равным 4 нг/мл варьирует в зависимости от значения ПСА [50] (табл. 4).
Таблица 4. Частота выявления РПЖ при биопсии в зависимости от уровня ПСА (результаты исследования PCPT (Prostate сancer Prevention Trial).
При показателе ПСА 2,5-10,0 нг/мл у большинства пациентов (75 %) диагностируют ДГПЖ, при уровне ПСА выше 10 нг/мл наиболее вероятен РПЖ [42]. В то же время у 13,2 % мужчин в возрасте 50-66 лет с сывороточной концентрацией ПСА 3-4 нг/мл при биопсии диагностируют клинически значимый РПЖ [51].
В 2006 г. на основании результатов крупного исследования, включавшего 9459 мужчин, продемонстрировано, что дискриминационный уровень ПСА 4 нг/мл не является адекватным, и введены его возрастные нормы (табл. 5) [52]. Также показано, что снижение дискриминационного уровня ПСА приводит к «ненужным» биопсиям и увеличению диагностики клинически незначимого рака. Таким образом, у мужчин старше 60 лет общепризнанным дискриминационным уровнем ПСА является 2,5 нг/мл. В таблице 5 приведено среднее нормальное значение, тогда как пороговым значением для принятия решения о выполнении биопсии является 2,5.
Таблица 5. Средние значения ПСА на основании результатов исследования PCPT (Prostate сancer Prevention Trial).
Рекомендуется использование дополнительных модификаций определения ПСА для повышения специфичности серологической диагностики при подозрении на наличие раннего РПЖ:
• плотность - отношение уровня ПСА к объему предстательной железы (в см3), вычисленному по данным ТРУЗИ. Для РПЖ более характерна плотность >0,15 [53, 54];
• плотность переходных зон - отношение уровня ПСА к объему переходных зон предстательной железы (в см3), вычисленному по данным ТРУЗИ. Для РПЖ характерна плотность переходных зон >0,35 [55, 56];
• молекулярные формы (фракции) - отношение уровня свободного простатспецифического антигена (свПСА) к уровню общего простатспецифического антигена (оПСА). Для РПЖ более характерно отношение <0,1. Так, у мужчин с уровнем ПСА 4-10 нг/мл и плотностью ПСА <0,1 РПЖ верифицирован в 56 % случаев, а у мужчин с плотностью ПСА >0,25 [57];
• скорость прироста ПСА - увеличение уровня ПСА в течение определенного времени. При увеличении концентрации ПСА более чем на 0,35 нг/мл в год возрастает вероятность РПЖ [58].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
Комментарии. Модификации, повышающие специфичность ПСА-диагностики раннего РПЖ, применяют не только для первичной диагностики, но и для определения показаний к повторной биопсии предстательной железы у мужчин с отсутствием данных о РПЖ при первичной биопсии [59].
Помимо основного теста для ранней диагностики РПЖ исследование уровня ПСА в крови также рекомендовано для стадирования опухолевого процесса и мониторинга пациентов после проведенного местного лечения или в процессе системного лечения [60-65].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 3).
Рекомендовано исследование уровня антигена рака простаты 3 (PCA3) в моче в целях решения вопроса о повторной биопсии после отрицательного результата первоначально проведенного патологоанатомического исследования биопсийного материала после первичной биопсии предстательной железы [66-70].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
Комментарии. PCA3 является некодируемой микро-РНК, которую определяют в моче после пальцевого ректального массажа предстательной железы. Определение PCA3 позволяет повысить точность диагностики РПЖ по сравнению с определением ПСА и его фракций (общий, свободный, соотношение) [66-69]. Уровень РСА3 отражает небольшие, но значимые увеличения частоты положительного результата биопсии. Показатель РСА3 может применяться вместе с ПСА и другими клиническими факторами риска в номограммах или других системах стратификации риска для принятия решения о проведении первичной или повторной биопсии. Уровень РСА3 нарастает с увеличением объема РПЖ. Содержание PCA3 в моче увеличивается пропорционально объему опухолевой ткани, однако не зависит от дифференцировки опухоли [71]. Применение РСА3 в качестве средства мониторирования при активном наблюдении не подтверждено. Экономическая эффективность данной методики требует дополнительной оценки.
Применение индекса здоровья простаты.
Рекомендовано определение индекса Prostate Health Index (PHI) пациентам с отрицательным («нормальным») трансректальным пальцевым исследованием (наличие тугоэластичной гомогенной ткани простаты при пальпации при отсутствии болевой реакции и при отсутствии очагов уплотнения и/или иных изменений консистенции) и значением ПСА от 2 до 10 нг/мл при принятии решения о выполнении первичной, а также повторной биопсии предстательной железы [46, 72-75].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 1).
Комментарии. Определение индекса PHI успешно используют в клинической практике для оптимизации клинической чувствительности и специфичности при определении вероятности наличия РПЖ в диапазоне оПСА от 2 до 10 нг/мл и отрицательном («нормальном») результате трансректального пальцевого исследования.Индекс PHI. Расчетный показатель, формула которого объединяет значения трех сывороточных тестов - оПСА, свПСА и -2проПСА. -2проПСА является изоформой свПСА и концентрируется в ткани периферической зоны предстательной железы. В ходе мультицентрового проспективного исследования было показано, что использование PHI позволяет избежать до 20 % так называемых «необязательных» биопсий. Показана корреляция величины PHI со степенью злокачественности (агрессивности) РПЖ по шкале Глисона.
В ходе многоцентрового проспективно-ретроспективного исследования были определены клиническая чувствительность и специфичность PHI с разными пороговыми значениями (табл. 6).
Таблица 6. Клиническая чувствительность и специфичность выявления рака предстательной железы для различных пороговых значений индекса здоровья простаты (PHI) у мужчин с отрицательными результатами пальцевого ректального обследования*.
*При определении оПСА и свПСА использовались калибраторы Hybritech и ВОЗ.
Также показана корреляция индекса PHI с вероятностью наличия РПЖ: чем выше значение PHI, тем выше риск наличия РПЖ (табл. 7).
Таблица 7. Вероятность (оценка риска) наличия рака предстательной железы в зависимости от значения индекса здоровья простаты (PHI) у пациентов с уровнем оПСА от 2 до 10 нг/мл и от 1,6 до 7,8 нг/мл*.
Примечание. ДИ - доверительный интервал. *При определении ПСА и свПСА использовали калибровку Hybritech и ВОЗ.
Индекс PHI в сочетании с другими показателями целесообразно использовать также в номограммах и калькуляторах риска наличия РПЖ.
Рекомендовано применение дополнительных лабораторных исследований у пациентов с отрицательным («нормальным») ТПИ и значением ПСА от 2 до 10 нг/мл при принятии решения о выполнении первичной, а также повторной биопсии [76].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. Дополнительным лабораторным исследованием является исследование следующих показателей сыворотки крови - исследование уровня простатспецифического антигена свободного в крови, [2]проПСА, а также исследование уровня калликреинового пептида 2. При обследовании 161 пациентов с РПЖ, которым выполнили радикальную простатэктомию (РПЭ), уровень калликреинового пептида 2 достоверно различался у пациентов с локализованным или местнораспространенным РПЖ [77]. Ряд исследований указывает, что исследование уровня калликреинового пептида 2 позволяет избежать большого количества «ненужных» биопсий, при этом не упуская значимого количества низкодифференцированного РПЖ [76].
Рекомендуется всем пациентам с установленным диагнозом РПЖ определение активности щелочной фосфатазы в крови с целью выявления косвенного признака метастатического поражения скелета [78].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 2).
Комментарии. Повышение активности щелочной фосфатазы в сыворотке крови, которое выявляют у 70 % пациентов с генерализацией процесса.
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 1).
Комментарии. Эхографическая картина РПЖ неоднородна. Классическая ультразвуковая семиотика РПЖ описывает гипоэхогенные очаговые зоны в периферических отделах предстательной железы [79, 83]. С увеличением размеров опухолевых очагов они могут содержать как гипо-, так и гиперэхогенные участки. 37,6 % опухолей предстательной железы, диагностированных при биопсии, представлены изоэхогенными участками при ТРУЗИ [84].
Не рекомендовано рутинное применение дополнительных к ТРУЗИ методик. Соноэластографии, УЗИ с контрастным усилением, гистосканирования предстательной железы в рутинной практике в связи с недостаточностью доказательной базы [85-88].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 2).
Комментарии. В настоящее время изучается целесообразность применения вышеуказанных новейших методов ультразвуковой диагностики.
Пациентам с суммой баллов по шкале Глисона ≥7 рекомендовано выполнение мультипараметрической магнитно-резонансной томографии (мМРТ) с использованием системы оценки Pi-RADS с целью диагностики РПЖ, в частности выявления опухоли передних отделов простаты, недоступных при выполнении стандартной биопсии [47, 88-91].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. Точность дифференциальной диагностики стадии Т2 и Т3, по данным только трансректального УЗИ, довольно низкая. ТРУЗИ не обладает большей точностью в определении экстракапсулярной инвазии опухоли по сравнению с ПРИ [92]. 3D-ТРУЗИ, цветовое допплеровское картирование УЗИ не позволяют повысить точность диагностики и не рекомендованы для локального стадирования РПЖ [80, 93, 94].
Рекомендовано всем пациентам с установленным диагнозом РПЖ выполнение МРТ предстательной железы в целях оценки распространенности первичной опухоли [95-97].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
Комментарии. МРТ - более чувствительный метод диагностики экстрапростатической инвазии опухоли, а применение динамической магнитно-резонансной простатовезикулографии с контрастным усилением и эндоректальной магнитной катушкой повышает точность стадирования еще на 16 %. Чувствительность и специфичность МРТ для выявления экстракапсулярной инвазии опухоли и вовлечения семенных пузырьков составили соответственно 0,57 (95 % ДИ: 0,49-0,64) и 0,91 (95 % ДИ: 0,88-0,93), и 0,58 (95 % ДИ: 0,47-0,68) и 0,96 (95 % ДИ: 0,95-0,97) - МРТ обладает высокой специфичностью, но плохой и гетерогенной чувствительностью. Мультипараметрическая МРТ обладает низкой диагностической эффективностью для определения микроскопической экстракапсулярной инвазии опухоли, однако при увеличении протяженности участка инвазии опухоли в парапростатическую клетчатку частота определения последней возрастает. Так, частота диагностики экстракапсулярной инвазии РПЖ протяженностью менее 1 мм не превышает 14 %. В то же время, при наличии экстракапсулярного распространения опухоли на протяжении более 3 данный показатель увеличивается до 100 %.
Не рекомендовано выполнение компьютерной томографии (КТ) предстательной железы для стадирования процесса [98].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. КТ предстательной железы менее информативна, чем МРТ, для дифференциальной диагностики локализованного и экстрапростатического процесса, но КТ чаще назначают для планирования дистанционной лучевой терапии (ДЛТ).
Всем пациентам с установленным диагнозом РПЖ промежуточного или высокого риска прогрессирования (согласно классификации) для определения состояния внутритазовых лимфатических узлов рекомендовано выполнение КТ или МРТ органов малого таза [99, 100].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 1).
Состояние лимфатических узлов (ЛУ) (стадия N) с применением МРТ малого таза, УЗИ/КТ брюшной полости и забрюшинного пространства рекомендовано оценивать при планировании радикального лечения. У пациентов со стадией T2 или меньше, уровнем ПСА <20 нг/мл и суммой Глисона <6 вероятность наличия метастазов в ЛУ не превышает 10 %, поэтому им не рекомендовано проводить стадирование поражения ЛУ [101].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарии. Состояние лимфатических узлов (ЛУ) (стадия N) следует оценивать при планировании радикального лечения.
Применение позитронной эмиссионной томографии всего тела, совмещенной с компьютерной томографией костей всего тела (ПЭТ-КТ) с 11C-холином, не рекомендовано для рутинного применения при первичном стадировании у пациентов с РПЖ и для определения наличия лимфогенных метастазов ввиду наличия сопоставимой чувствительности по сравнению с мМРТ [102, 103].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарий. ПЭТ-КТ с ПСМА (68 Ga или 18 F) обладает большей чувствительность по сравнению с мМРТ и ПЭТ-КТ с холином, однако лимфогенные метастазы небольших размеров могут оставаться недиагностированными [104].
• сцинтиграфия скелета,.
• УЗИ, КТ, МРТ органов брюшной полости,.
• рентгенография, КТ органов грудной клетки. Рекомендации по применению данных методов представлены ниже.
В случае выявления неблагоприятных факторов, таких как ПСА более 20 нг/м, наличие в биопсийном материале опухоли с дифференцировкой 4 или 5 по Глисону (ISUP 2-5), а также пациентам с клиническими признаками костного метастазирования заболевания для выявления метастазов в костях (стадия М) рекомендуется проведение сцинтиграфии костей всего тела (остеосцинтиграфии) [105].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. Исследование можно не проводить пациентам без клинических проявлений со стороны костной системы с уровнем ПСА <10 нг/мл. При наличии симптомов (боль в костях) рекомендовано выполнять остеосцинтиграфию костей скелета не зависимо от уровня ПСА и дифференцировки опухоли [106].
Рекомендуется выполнять КТ органов брюшной полости для исключения отдаленных метастазов у пациентов с РПЖ высокого риска прогрессирования (с суммой по шкале Глисона >7, ПСА >20 нг/мл, местнораспространенными опухолями) [98].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
В сомнительных случаях по результатам остеосцинтиграфии рекомендовано проводить ПЭТ-КТ с 11С-холином, 18F-фторидом или МРТ всего тела, которые также позволяют диагностировать висцеральные метастазы [107].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарии. Стандартная методика выполнения биопсии предстательной железы - биопсия (мультифокальная) предстательной железы трансректальная пункционная под контролем ультразвукового исследования [110, 111].
Для выполнения ТРУЗИ чаще всего применяют ректальный датчик с частотой 5,0-8,5 МГц. Стандартная биопсийная игла имеет диметр 18 G и позволяет забирать столбик ткани длиной 15-20 Стандартная техника биопсии подразумевает забор материала билатерально от апекса к основанию железы. Выполнение секстантной биопсии не является более приемлемой. При объеме предстательной железы 30-40 мл возможно выполнение забора материала из 8 и более участков. Во всех остальных случаях необходимо выполнять 12-точечную биопсию. Биопсия транзиторной зоны предстательной железы обладает низкой чувствительностью для верификации опухоли и может быть рекомендована при выполнении повторной биопсии.
Подготовка пациента к биопсии, рекомендации по проведению.
Пациентам с подозрением на РПЖ перед выполнением биопсии предстательной железы для снижения риска инфекционных осложнений рекомендована очистительная клизма и обработка прямой кишки раствором повидон-йода [112-114].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Рекомендовано всем пациентам перед выполнением биопсии предстательной железы проведение антибактериальной профилактики с применением фторхинолонов (ципрофлоксацин) или цефалоспоринов третьего или четвертого поколения, разрешенных в соотвествии с инструкциями к применению в целях профилактики инфекций при хирургических вмешательствах [81, 114-119].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
Комментарии: в связи с увеличивающимся уровнем резистентности микрофлоры к хинолонам, а также при наличии факторов риска инфекционных осложнений предпочтительно предварительно выполнить посев флоры прямой кишки с определением чувствительности к антибиотикам (факторы риска инфекционных осложнений: объем предстательной железы ≥ 75 см3, сахарный диабет, наличие цистостомы или постоянного уретрального катетера, длительный прием стероидных гормональных препаратов, иммунодефицитные состояния, нарушения мочеиспускания) [115] для снижения риска инфекционных осложнений [81, 114, 116-118, 120]. Для выполнения трансперинеальной биопсии, которая позволяет избежать взаимодействия с флорой прямой кишки, рекомендовано однократное внутривенное введение цефазолина 2 г при анестезии [119].
Рекомендовано пациентам с подозрением на РПЖ перед выполнением биопсии предстательной железы применение местных анестетиков (введение лидокаина в прямую кишку или перипростатическая блокада лидокаином) с целью купирования болевого синдрома во время манипуляции [115, 121, 122].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 2).
Выполнение повторной биопсии рекомендовано при отрицательных результатах первичной биопсии и сохраняющихся показаниях к проведению исследования [123].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. Повторная биопсия выявляет РПЖ у 20 % мужчин при отсутствии опухоли в первичном гистологическом исследовании.
Показания к повторной биопсии:
• изменения при ТПИ (риск наличия рака 5-30 %) [123, 124];
• наличие атипичной ацинарной пролиферации ( атипичные железы подозрительные в отношении рака простаты - риск наличия рака 31-40 %) [125,126];
• сохраняющийся повышенный уровень или повышение уровня ПСА;
• простатическая интерстициальная неоплазия высокой степени (при наличии множественной (три и более фрагмента) тяжелой неоплазии в биоптатах вероятность выявления инвазивного РПЖ при повторной биопсии 50-100 %) [127-129];
• наличие солитарного микроочага интрадуктальной карциномы (>90 % риск верификации низкодифференцированного РПЖ [130];
• наличие подозрительного очага в предстательной железе по данным мМРТ.
Наличие простатической интерстициальной неоплазии высокой степени в одном или двух биоптатах не является более показанием к повторной биопсии.
Рекомендовано мужчинам с подозрением на наличие РПЖ при «отрицательной» первичной биопсии с наличием определенных факторов выполнение повторной сатурационной или фьюжн-биопсии с использованием мультипараметрической МРТ, поскольку применение данных методов биопсии позволяет существенно увеличить частоту выявления клинически значимого РПЖ, позволяет увеличить шансы выявления опухоли в ткани предстательной железы. Отсутствие опухолевой ткани в биоптатах после первичной биопсии не гарантирует отсутствие клинически значимого РПЖ и может быть связано либо с неправильной техникой выполнения биопсии, либо с трудной доступностью опухолевых очагов в предстательной железе для стандартной биопсии) [38, 131-134].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии: частота РПЖ, выявленного при повторной сатурационной биопсии (>20 столбиков), варьирует от 30 до 43 % и зависит от количества полученных при биопсии столбиков ткани предстательной железы. В особых случаях сатурационную биопсию можно выполнять трансперинеально. Это позволяет диагностировать РПЖ дополнительно в 38 % случаев. Следует отметить, что у 10 % пациентов после этого исследования развивается ОЗМ.
Не рекомендовано выполнение рутинной биопсии семенных пузырьков за исключением пациентов с подозрением на наличие инвазии опухоли в семенные пузырьки [135].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. Показания к выполнению биопсии семенных пузырьков в настоящее время четко не определены. Решение о выполнении биопсии семенных пузырьков следует принимать индивидуально, принимая во внимание, что вероятность инвазии опухоли в семенные пузырьки при значении ПСА более 15 нг/мл составляет 20-25 % Биопсия семенных пузырьков является полезной лишь при наличии влияния на выбор тактики лечения (выбор между лучевой терапией и радикальным хирургическим лечением).
Не рекомендуется применение ТУР предстательной железы для первичной диагностики РПЖ [136].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
В случаях, когда планируется местное лечение РПЖ, для выявления метастазов в регионарные лимфатические узлы рекомендуется выполнение двусторонней тазовой лимфаденэктомии (ТЛАЭ) из надлобкового (открытого) или лапароскопического доступов с целью стратификации пациентов, которым может быть рекомендована адъювантная терапия [101, 137-139].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Не рекомендовано выполнять тазовую лимфаденэктомию у пациентов с уровнем ПСА <10 нг/мл, клинической стадией T1a-T2a и суммой баллов по шкале Глисона <7, так как вероятность метастатического поражения тазовых лимфатических узлов не превышает 3 % [101, 140].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. Определение стадии (Т) локализованного РПЖ может быть основано на результатах МРТ. Дополнительную информацию получают по количеству и локализации положительных биоптатов, степени злокачественности опухоли и уровню ПСА в сыворотке крови.
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Генетическое тестирование на наличие герминальных мутаций генов, участвующих в репарации ДНК путем гомологичной рекомбинации (HRR) (например, вRCA1, вRCA2, ATM ) рекомендуется для всех пациентов с местно-распространенным РПЖ и метастазами в регионарных лифоузлах (N1). Исследование на соматические мутации генов HRR в потенциале позволит получить более полные результаты по сравнению с тестированием только герминальных мутаций.Тестирование опухоли на наличие соматических мутаций в генах HRR методом NGS рекомендуется для всех пациентов с метастатическим РПЖ [141].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарии: как показала диагностическая часть исследования PROfound, проведенная с участием 4425 пациентов с мКРРПЖ, мутации генов HRR встречаются в 27,9 % случаев. В исследовании выявляли как герминальные, так и соматические мутации следующих 15 генов HRR: вRCA1, вRCA2, ATM, вRIP1, вARD1, сDK12, сHEK1, сHEK2, FANCL, PALB2, PPP2R2A, RAD51B, RAD51C, RAD51D и RAD54L. Данные мутации были обнаружены генетическим тестированием ДНК из опухолевой ткани методом секвенирования нового поколения (NGS) [142]. Выявление мутаций генов HRR может повлиять на тактику ведения пациентов (например, на назначение ингибитора PARP (поли(АДФ-рибоза)полимеразы)олапариба**) [141].
• данные анамнеза,.
• данные физикального обследования,.
• данные лабораторных исследований,.
4) данные инструментального обследования,.
5) данные патолого-анатомического исследования тканей предстательной железы.
Клинический диагноз основан на результатах анализов:
• физикальное обследование (трансректальное пальцевое исследование (ТПИ)) позволяет выявить подозрительное образование предстательной железы;
• лабораторные исследования могут выявить повышенный уровень сывороточных онкомаркеров (простатоспецифический антиген (ПСА), индекс здоровья простаты );
• заключение патолого-анатомического исследования биопсийного материала (биопсия предстательной железы);
• данные лучевых методов диагностики позволяют корректно стадировать заболевание.
Определение распространенности опухолевого процесса (стадирование).
Для оценки распространенности первичной опухоли (локализованный или экстракапсулярный процесс) применяют трансректальное пальцевое исследование (положительная корреляция со стадией процесса менее, чем в 50 % случаев), методы лучевой диагностики и прогностические факторы.
Основные прогностические факторы, определяющие стадию опухолевого процесса:
• уровень ПСА;
• степень дифференцировки опухоли по шкале Глисона;
• клиническая стадия по данным пальцевого ректального обследования и лучевых методов диагностики.
На основе комбинации данных прогностических факторов разработаны таблицы и номограммы, с высокой точностью предсказывающие вероятность патоморфо-логической стадии опухоли. Наибольшую популярность получили таблицы Партина (Partin) и номограммы Каттана (Kattan) [34-36].
Кроме основных, используют дополнительные факторы прогноза:
• периневральную инвазию опухоли;
• число позитивных биоптатов;
• процент рака в биопсийных столбиках;
• длину рака в биопсийных столбиках.
2,1 Жалобы и анамнез.
Как правило, на ранних стадиях РПЖ симптоматика отсутствует, так как чаще всего поражаются периферические отделы предстательной железы. При новообразовании предстательной железы появляются симптомы, которые можно разделить на три группы:• симптомы инфравезикальной обструкции: ослабление и прерывистость струи мочи, ощущение неполного опорожнения мочевого пузыря, учащение мочеиспускания, императивные позывы к мочеиспусканию, стрессовое недержание мочи;
• симптомы, связанные с местным прогрессированием опухоли: гемоспермия, гематурия, недержание мочи, эректильная дисфункция, боль в надлобковой области и промежности;
• симптомы, связанные с отдаленными метастазами: боль в костях, пояснице (при обструкции мочеточников), отек нижних конечностей (лимфостаз), параплегия (компрессия спинного мозга), потеря массы тела, анемия, уремия, кахексия.
2,2 Физикальное обследование.
• Рекомендуется проведение трансректального пальцевого исследования (ТПИ) пациентам с подозрением на РПЖ с целью установки диагноза и выявления факторов, которые могут повлиять на выбор тактики лечения [37, 38].Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарии. ТПИ позволяет выявить РПЖ в периферических отделах при объеме узлов не менее 0,2 мл. Проведение этого обследования для скрининга у бессимптомных мужчин приводит к выявлению РПЖ только в 0,1-4 % случаев [39, 40]. ТПИ влечет клинически значимое повышение уровня ПСА [41].
2,3 Лабораторные диагностические исследования.
Мужчинам при подозрении на РПЖ (мужчины с наличием симптомов нарушения мочеиспускания, мужчины старше 50 лет, мужчины старше 45 лет с наличием семейного анамнез) рекомендуется исследование уровня ПСА общего в крови для определения группы прогноза, методов диагностики и выбора тактики лечения [42-47].Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. ПСА - калликреинподобная сериновая протеаза, секретируемая эпителиальными клетками предстательной железы. Это не опухолеспецифический, а органоспецифический маркер, поэтому сывороточный уровень ПСА может повышаться не только при РПЖ, но и при ДГПЖ и хроническом простатите. Острая задержка мочеиспускания (ОЗМ), биопсия предстательной железы, оперативные вмешательства (трансуретральная резекция (ТУР), аденомэктомия) также приводят к повышению уровня ПСА в течение нескольких недель, что необходимо учитывать при интерпретации данных.
Средним нормальным уровнем ПСА считают 2,5 нг/мл. Кроме того, следует учитывать возрастные нормы уровня маркера: в возрасте 40-49 лет - 0-2,5 нг/мл, 50-59 лет - 0-3,5 нг/мл, 60-69 лет - 0-4,5 нг/мл, 70-79 лет - 0-6,5 нг/мл [48]. Терапия финастеридом** у пациентов с ДГПЖ приводит к снижению концентрации ПСА, при этом нормальным следует считать уровень 2 нг/мл [49]. Тем не менее, не существует дискриминационного уровня ПСА крови, полностью исключающего риск выявления РПЖ. Так, по данным литературы, риск выявления РПЖ у мужчин с уровнем ПСА менее или равным 4 нг/мл варьирует в зависимости от значения ПСА [50] (табл. 4).
Таблица 4. Частота выявления РПЖ при биопсии в зависимости от уровня ПСА (результаты исследования PCPT (Prostate сancer Prevention Trial).
| ПСА, нг/мл | Риск РПЖ | Риск верификации умеренно- или низкодифференцированной опухоли (Глисон ≥7) |
| 0,0-0,5 | 6,6 | 0,8 |
| 0,6-1,0 | 10,1 | 1,0 |
| 1,1-2,0 | 17,0 | 2,0 |
| 2,1-3,0 | 23,9 | 4,6 |
| 3,1-4,0 | 26,9 | 6,7 |
При показателе ПСА 2,5-10,0 нг/мл у большинства пациентов (75 %) диагностируют ДГПЖ, при уровне ПСА выше 10 нг/мл наиболее вероятен РПЖ [42]. В то же время у 13,2 % мужчин в возрасте 50-66 лет с сывороточной концентрацией ПСА 3-4 нг/мл при биопсии диагностируют клинически значимый РПЖ [51].
В 2006 г. на основании результатов крупного исследования, включавшего 9459 мужчин, продемонстрировано, что дискриминационный уровень ПСА 4 нг/мл не является адекватным, и введены его возрастные нормы (табл. 5) [52]. Также показано, что снижение дискриминационного уровня ПСА приводит к «ненужным» биопсиям и увеличению диагностики клинически незначимого рака. Таким образом, у мужчин старше 60 лет общепризнанным дискриминационным уровнем ПСА является 2,5 нг/мл. В таблице 5 приведено среднее нормальное значение, тогда как пороговым значением для принятия решения о выполнении биопсии является 2,5.
Таблица 5. Средние значения ПСА на основании результатов исследования PCPT (Prostate сancer Prevention Trial).
| Возраст | Среднее значение ПСА, нг/мл |
| 40-49 | 0,7 |
| 50-59 | 0,9 |
| 60-70 | 1,4 |
Рекомендуется использование дополнительных модификаций определения ПСА для повышения специфичности серологической диагностики при подозрении на наличие раннего РПЖ:
• плотность - отношение уровня ПСА к объему предстательной железы (в см3), вычисленному по данным ТРУЗИ. Для РПЖ более характерна плотность >0,15 [53, 54];
• плотность переходных зон - отношение уровня ПСА к объему переходных зон предстательной железы (в см3), вычисленному по данным ТРУЗИ. Для РПЖ характерна плотность переходных зон >0,35 [55, 56];
• молекулярные формы (фракции) - отношение уровня свободного простатспецифического антигена (свПСА) к уровню общего простатспецифического антигена (оПСА). Для РПЖ более характерно отношение <0,1. Так, у мужчин с уровнем ПСА 4-10 нг/мл и плотностью ПСА <0,1 РПЖ верифицирован в 56 % случаев, а у мужчин с плотностью ПСА >0,25 [57];
• скорость прироста ПСА - увеличение уровня ПСА в течение определенного времени. При увеличении концентрации ПСА более чем на 0,35 нг/мл в год возрастает вероятность РПЖ [58].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
Комментарии. Модификации, повышающие специфичность ПСА-диагностики раннего РПЖ, применяют не только для первичной диагностики, но и для определения показаний к повторной биопсии предстательной железы у мужчин с отсутствием данных о РПЖ при первичной биопсии [59].
Помимо основного теста для ранней диагностики РПЖ исследование уровня ПСА в крови также рекомендовано для стадирования опухолевого процесса и мониторинга пациентов после проведенного местного лечения или в процессе системного лечения [60-65].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 3).
Рекомендовано исследование уровня антигена рака простаты 3 (PCA3) в моче в целях решения вопроса о повторной биопсии после отрицательного результата первоначально проведенного патологоанатомического исследования биопсийного материала после первичной биопсии предстательной железы [66-70].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
Комментарии. PCA3 является некодируемой микро-РНК, которую определяют в моче после пальцевого ректального массажа предстательной железы. Определение PCA3 позволяет повысить точность диагностики РПЖ по сравнению с определением ПСА и его фракций (общий, свободный, соотношение) [66-69]. Уровень РСА3 отражает небольшие, но значимые увеличения частоты положительного результата биопсии. Показатель РСА3 может применяться вместе с ПСА и другими клиническими факторами риска в номограммах или других системах стратификации риска для принятия решения о проведении первичной или повторной биопсии. Уровень РСА3 нарастает с увеличением объема РПЖ. Содержание PCA3 в моче увеличивается пропорционально объему опухолевой ткани, однако не зависит от дифференцировки опухоли [71]. Применение РСА3 в качестве средства мониторирования при активном наблюдении не подтверждено. Экономическая эффективность данной методики требует дополнительной оценки.
Применение индекса здоровья простаты.
Рекомендовано определение индекса Prostate Health Index (PHI) пациентам с отрицательным («нормальным») трансректальным пальцевым исследованием (наличие тугоэластичной гомогенной ткани простаты при пальпации при отсутствии болевой реакции и при отсутствии очагов уплотнения и/или иных изменений консистенции) и значением ПСА от 2 до 10 нг/мл при принятии решения о выполнении первичной, а также повторной биопсии предстательной железы [46, 72-75].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 1).
Комментарии. Определение индекса PHI успешно используют в клинической практике для оптимизации клинической чувствительности и специфичности при определении вероятности наличия РПЖ в диапазоне оПСА от 2 до 10 нг/мл и отрицательном («нормальном») результате трансректального пальцевого исследования.Индекс PHI. Расчетный показатель, формула которого объединяет значения трех сывороточных тестов - оПСА, свПСА и -2проПСА. -2проПСА является изоформой свПСА и концентрируется в ткани периферической зоны предстательной железы. В ходе мультицентрового проспективного исследования было показано, что использование PHI позволяет избежать до 20 % так называемых «необязательных» биопсий. Показана корреляция величины PHI со степенью злокачественности (агрессивности) РПЖ по шкале Глисона.
В ходе многоцентрового проспективно-ретроспективного исследования были определены клиническая чувствительность и специфичность PHI с разными пороговыми значениями (табл. 6).
Таблица 6. Клиническая чувствительность и специфичность выявления рака предстательной железы для различных пороговых значений индекса здоровья простаты (PHI) у мужчин с отрицательными результатами пальцевого ректального обследования*.
| Клиническая чувствительность, % | Калибровка Hybritech | Калибровка ВОЗ | ||
| Пороговое значение для показателя PHI | Клиническая специфичность, % | Пороговое значение для показателя PHI | Клиническая специфичность, % | |
| 99 | 17,78 | 8,7 | 19,96 | 8,4 |
| 98 | 18,44 | 10,5 | 20,57 | 9,8 |
| 95 | 21,13 | 18,2 | 23,45 | 16,1 |
| 90 | 23,82 | 30,4 | 26,93 | 28,3 |
| 88 | 25,00 | 33,6 | 28,09 | 31,8 |
| 85 | 26,34 | 38,8 | 29,98 | 40,2 |
| 80 | 27,58 | 45,1 | 31,57 | 45,1 |
| 75 | 29,25 | 49,3 | 33,34 | 50,7 |
| 70 | 30,44 | 54,2 | 35,01 | 55,6 |
| 65 | 31,69 | 58,0 | 36,90 | 59,8 |
| 60 | 33,98 | 66,1 | 38,79 | 66,1 |
| 55 | 36,22 | 72,7 | 40,63 | 71,3 |
| 50 | 37,63 | 75,2 | 42,76 | 76,6 |
| 45 | 39,34 | 80,1 | 45,03 | 80,8 |
| 40 | 42,14 | 84,6 | 46,97 | 82,5 |
| 35 | 45,11 | 88,1 | 50,94 | 88,1 |
*При определении оПСА и свПСА использовались калибраторы Hybritech и ВОЗ.
Также показана корреляция индекса PHI с вероятностью наличия РПЖ: чем выше значение PHI, тем выше риск наличия РПЖ (табл. 7).
Таблица 7. Вероятность (оценка риска) наличия рака предстательной железы в зависимости от значения индекса здоровья простаты (PHI) у пациентов с уровнем оПСА от 2 до 10 нг/мл и от 1,6 до 7,8 нг/мл*.
| Калибровка Hybritech | Калибровка ВОЗ | ||||
| Диапазон значений PHI | Вероятность рака, % | 95% ДИ | Диапазон значений PHI | Вероятность рака, % | 95 % ДИ |
| 0-21 | 8,4 | 1,9-16,1 | 0-23 | 8,7 | 2,0-17,0 |
| 21-40 | 21,0 | 17,3-24,6 | 23-45 | 20,6 | 17,1-24,1 |
| 40+ | 44,0 | 36,0-52,9 | 45+ | 43,8 | 35,8-52,2 |
Примечание. ДИ - доверительный интервал. *При определении ПСА и свПСА использовали калибровку Hybritech и ВОЗ.
Индекс PHI в сочетании с другими показателями целесообразно использовать также в номограммах и калькуляторах риска наличия РПЖ.
Рекомендовано применение дополнительных лабораторных исследований у пациентов с отрицательным («нормальным») ТПИ и значением ПСА от 2 до 10 нг/мл при принятии решения о выполнении первичной, а также повторной биопсии [76].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. Дополнительным лабораторным исследованием является исследование следующих показателей сыворотки крови - исследование уровня простатспецифического антигена свободного в крови, [2]проПСА, а также исследование уровня калликреинового пептида 2. При обследовании 161 пациентов с РПЖ, которым выполнили радикальную простатэктомию (РПЭ), уровень калликреинового пептида 2 достоверно различался у пациентов с локализованным или местнораспространенным РПЖ [77]. Ряд исследований указывает, что исследование уровня калликреинового пептида 2 позволяет избежать большого количества «ненужных» биопсий, при этом не упуская значимого количества низкодифференцированного РПЖ [76].
Рекомендуется всем пациентам с установленным диагнозом РПЖ определение активности щелочной фосфатазы в крови с целью выявления косвенного признака метастатического поражения скелета [78].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 2).
Комментарии. Повышение активности щелочной фосфатазы в сыворотке крови, которое выявляют у 70 % пациентов с генерализацией процесса.
2,4 Инструментальные диагностические исследования.
Всем пациентам с подозрением на РПЖ (наличие подозрительного образования в предстательной железе при ТПИ или повышенный уровень ПСА) рекомендовано выполнение трансректального ультразвукового исследования (ТРУЗИ) с целью выявления патологических участков в предстательной железе и повышения точности трансректальной биопсии предстательной железы [79-82].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 1).
Комментарии. Эхографическая картина РПЖ неоднородна. Классическая ультразвуковая семиотика РПЖ описывает гипоэхогенные очаговые зоны в периферических отделах предстательной железы [79, 83]. С увеличением размеров опухолевых очагов они могут содержать как гипо-, так и гиперэхогенные участки. 37,6 % опухолей предстательной железы, диагностированных при биопсии, представлены изоэхогенными участками при ТРУЗИ [84].
Не рекомендовано рутинное применение дополнительных к ТРУЗИ методик. Соноэластографии, УЗИ с контрастным усилением, гистосканирования предстательной железы в рутинной практике в связи с недостаточностью доказательной базы [85-88].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 2).
Комментарии. В настоящее время изучается целесообразность применения вышеуказанных новейших методов ультразвуковой диагностики.
Пациентам с суммой баллов по шкале Глисона ≥7 рекомендовано выполнение мультипараметрической магнитно-резонансной томографии (мМРТ) с использованием системы оценки Pi-RADS с целью диагностики РПЖ, в частности выявления опухоли передних отделов простаты, недоступных при выполнении стандартной биопсии [47, 88-91].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
2,4,1 Методы лучевой диагностики экстракапсулярной инвазии опухоли предстательной железы.
Не рекомендовано всем пациентам с установленным диагнозом РПЖ выполнение ТРУЗИ для определения распространенности первичной опухоли [92].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. Точность дифференциальной диагностики стадии Т2 и Т3, по данным только трансректального УЗИ, довольно низкая. ТРУЗИ не обладает большей точностью в определении экстракапсулярной инвазии опухоли по сравнению с ПРИ [92]. 3D-ТРУЗИ, цветовое допплеровское картирование УЗИ не позволяют повысить точность диагностики и не рекомендованы для локального стадирования РПЖ [80, 93, 94].
Рекомендовано всем пациентам с установленным диагнозом РПЖ выполнение МРТ предстательной железы в целях оценки распространенности первичной опухоли [95-97].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
Комментарии. МРТ - более чувствительный метод диагностики экстрапростатической инвазии опухоли, а применение динамической магнитно-резонансной простатовезикулографии с контрастным усилением и эндоректальной магнитной катушкой повышает точность стадирования еще на 16 %. Чувствительность и специфичность МРТ для выявления экстракапсулярной инвазии опухоли и вовлечения семенных пузырьков составили соответственно 0,57 (95 % ДИ: 0,49-0,64) и 0,91 (95 % ДИ: 0,88-0,93), и 0,58 (95 % ДИ: 0,47-0,68) и 0,96 (95 % ДИ: 0,95-0,97) - МРТ обладает высокой специфичностью, но плохой и гетерогенной чувствительностью. Мультипараметрическая МРТ обладает низкой диагностической эффективностью для определения микроскопической экстракапсулярной инвазии опухоли, однако при увеличении протяженности участка инвазии опухоли в парапростатическую клетчатку частота определения последней возрастает. Так, частота диагностики экстракапсулярной инвазии РПЖ протяженностью менее 1 мм не превышает 14 %. В то же время, при наличии экстракапсулярного распространения опухоли на протяжении более 3 данный показатель увеличивается до 100 %.
Не рекомендовано выполнение компьютерной томографии (КТ) предстательной железы для стадирования процесса [98].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. КТ предстательной железы менее информативна, чем МРТ, для дифференциальной диагностики локализованного и экстрапростатического процесса, но КТ чаще назначают для планирования дистанционной лучевой терапии (ДЛТ).
Всем пациентам с установленным диагнозом РПЖ промежуточного или высокого риска прогрессирования (согласно классификации) для определения состояния внутритазовых лимфатических узлов рекомендовано выполнение КТ или МРТ органов малого таза [99, 100].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 1).
Состояние лимфатических узлов (ЛУ) (стадия N) с применением МРТ малого таза, УЗИ/КТ брюшной полости и забрюшинного пространства рекомендовано оценивать при планировании радикального лечения. У пациентов со стадией T2 или меньше, уровнем ПСА <20 нг/мл и суммой Глисона <6 вероятность наличия метастазов в ЛУ не превышает 10 %, поэтому им не рекомендовано проводить стадирование поражения ЛУ [101].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарии. Состояние лимфатических узлов (ЛУ) (стадия N) следует оценивать при планировании радикального лечения.
Применение позитронной эмиссионной томографии всего тела, совмещенной с компьютерной томографией костей всего тела (ПЭТ-КТ) с 11C-холином, не рекомендовано для рутинного применения при первичном стадировании у пациентов с РПЖ и для определения наличия лимфогенных метастазов ввиду наличия сопоставимой чувствительности по сравнению с мМРТ [102, 103].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарий. ПЭТ-КТ с ПСМА (68 Ga или 18 F) обладает большей чувствительность по сравнению с мМРТ и ПЭТ-КТ с холином, однако лимфогенные метастазы небольших размеров могут оставаться недиагностированными [104].
2,4,2 Методы диагностики отдаленных метастазов.
Для диагностики отдаленных метастазов используются следующие методы:• сцинтиграфия скелета,.
• УЗИ, КТ, МРТ органов брюшной полости,.
• рентгенография, КТ органов грудной клетки. Рекомендации по применению данных методов представлены ниже.
В случае выявления неблагоприятных факторов, таких как ПСА более 20 нг/м, наличие в биопсийном материале опухоли с дифференцировкой 4 или 5 по Глисону (ISUP 2-5), а также пациентам с клиническими признаками костного метастазирования заболевания для выявления метастазов в костях (стадия М) рекомендуется проведение сцинтиграфии костей всего тела (остеосцинтиграфии) [105].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. Исследование можно не проводить пациентам без клинических проявлений со стороны костной системы с уровнем ПСА <10 нг/мл. При наличии симптомов (боль в костях) рекомендовано выполнять остеосцинтиграфию костей скелета не зависимо от уровня ПСА и дифференцировки опухоли [106].
Рекомендуется выполнять КТ органов брюшной полости для исключения отдаленных метастазов у пациентов с РПЖ высокого риска прогрессирования (с суммой по шкале Глисона >7, ПСА >20 нг/мл, местнораспространенными опухолями) [98].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
В сомнительных случаях по результатам остеосцинтиграфии рекомендовано проводить ПЭТ-КТ с 11С-холином, 18F-фторидом или МРТ всего тела, которые также позволяют диагностировать висцеральные метастазы [107].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
2,5 Иные диагностические исследования.
При сохранении вероятности РПЖ по результатам одного из трех методов базисной диагностики (трансректальное пальцевое исследование, определение концентрации ПСА в сыворотке крови и ТРУЗИ) рекомендовано выполнение биопсии (мультифокальной) предстательной железы трансректальной пункционной под контролем ультразвукового исследования для верификации диагноза РПЖ [70, 81, 108, 109].Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарии. Стандартная методика выполнения биопсии предстательной железы - биопсия (мультифокальная) предстательной железы трансректальная пункционная под контролем ультразвукового исследования [110, 111].
Для выполнения ТРУЗИ чаще всего применяют ректальный датчик с частотой 5,0-8,5 МГц. Стандартная биопсийная игла имеет диметр 18 G и позволяет забирать столбик ткани длиной 15-20 Стандартная техника биопсии подразумевает забор материала билатерально от апекса к основанию железы. Выполнение секстантной биопсии не является более приемлемой. При объеме предстательной железы 30-40 мл возможно выполнение забора материала из 8 и более участков. Во всех остальных случаях необходимо выполнять 12-точечную биопсию. Биопсия транзиторной зоны предстательной железы обладает низкой чувствительностью для верификации опухоли и может быть рекомендована при выполнении повторной биопсии.
Подготовка пациента к биопсии, рекомендации по проведению.
Пациентам с подозрением на РПЖ перед выполнением биопсии предстательной железы для снижения риска инфекционных осложнений рекомендована очистительная клизма и обработка прямой кишки раствором повидон-йода [112-114].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Рекомендовано всем пациентам перед выполнением биопсии предстательной железы проведение антибактериальной профилактики с применением фторхинолонов (ципрофлоксацин) или цефалоспоринов третьего или четвертого поколения, разрешенных в соотвествии с инструкциями к применению в целях профилактики инфекций при хирургических вмешательствах [81, 114-119].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
Комментарии: в связи с увеличивающимся уровнем резистентности микрофлоры к хинолонам, а также при наличии факторов риска инфекционных осложнений предпочтительно предварительно выполнить посев флоры прямой кишки с определением чувствительности к антибиотикам (факторы риска инфекционных осложнений: объем предстательной железы ≥ 75 см3, сахарный диабет, наличие цистостомы или постоянного уретрального катетера, длительный прием стероидных гормональных препаратов, иммунодефицитные состояния, нарушения мочеиспускания) [115] для снижения риска инфекционных осложнений [81, 114, 116-118, 120]. Для выполнения трансперинеальной биопсии, которая позволяет избежать взаимодействия с флорой прямой кишки, рекомендовано однократное внутривенное введение цефазолина 2 г при анестезии [119].
Рекомендовано пациентам с подозрением на РПЖ перед выполнением биопсии предстательной железы применение местных анестетиков (введение лидокаина в прямую кишку или перипростатическая блокада лидокаином) с целью купирования болевого синдрома во время манипуляции [115, 121, 122].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 2).
Выполнение повторной биопсии рекомендовано при отрицательных результатах первичной биопсии и сохраняющихся показаниях к проведению исследования [123].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. Повторная биопсия выявляет РПЖ у 20 % мужчин при отсутствии опухоли в первичном гистологическом исследовании.
Показания к повторной биопсии:
• изменения при ТПИ (риск наличия рака 5-30 %) [123, 124];
• наличие атипичной ацинарной пролиферации ( атипичные железы подозрительные в отношении рака простаты - риск наличия рака 31-40 %) [125,126];
• сохраняющийся повышенный уровень или повышение уровня ПСА;
• простатическая интерстициальная неоплазия высокой степени (при наличии множественной (три и более фрагмента) тяжелой неоплазии в биоптатах вероятность выявления инвазивного РПЖ при повторной биопсии 50-100 %) [127-129];
• наличие солитарного микроочага интрадуктальной карциномы (>90 % риск верификации низкодифференцированного РПЖ [130];
• наличие подозрительного очага в предстательной железе по данным мМРТ.
Наличие простатической интерстициальной неоплазии высокой степени в одном или двух биоптатах не является более показанием к повторной биопсии.
Рекомендовано мужчинам с подозрением на наличие РПЖ при «отрицательной» первичной биопсии с наличием определенных факторов выполнение повторной сатурационной или фьюжн-биопсии с использованием мультипараметрической МРТ, поскольку применение данных методов биопсии позволяет существенно увеличить частоту выявления клинически значимого РПЖ, позволяет увеличить шансы выявления опухоли в ткани предстательной железы. Отсутствие опухолевой ткани в биоптатах после первичной биопсии не гарантирует отсутствие клинически значимого РПЖ и может быть связано либо с неправильной техникой выполнения биопсии, либо с трудной доступностью опухолевых очагов в предстательной железе для стандартной биопсии) [38, 131-134].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии: частота РПЖ, выявленного при повторной сатурационной биопсии (>20 столбиков), варьирует от 30 до 43 % и зависит от количества полученных при биопсии столбиков ткани предстательной железы. В особых случаях сатурационную биопсию можно выполнять трансперинеально. Это позволяет диагностировать РПЖ дополнительно в 38 % случаев. Следует отметить, что у 10 % пациентов после этого исследования развивается ОЗМ.
Не рекомендовано выполнение рутинной биопсии семенных пузырьков за исключением пациентов с подозрением на наличие инвазии опухоли в семенные пузырьки [135].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. Показания к выполнению биопсии семенных пузырьков в настоящее время четко не определены. Решение о выполнении биопсии семенных пузырьков следует принимать индивидуально, принимая во внимание, что вероятность инвазии опухоли в семенные пузырьки при значении ПСА более 15 нг/мл составляет 20-25 % Биопсия семенных пузырьков является полезной лишь при наличии влияния на выбор тактики лечения (выбор между лучевой терапией и радикальным хирургическим лечением).
Не рекомендуется применение ТУР предстательной железы для первичной диагностики РПЖ [136].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
В случаях, когда планируется местное лечение РПЖ, для выявления метастазов в регионарные лимфатические узлы рекомендуется выполнение двусторонней тазовой лимфаденэктомии (ТЛАЭ) из надлобкового (открытого) или лапароскопического доступов с целью стратификации пациентов, которым может быть рекомендована адъювантная терапия [101, 137-139].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Не рекомендовано выполнять тазовую лимфаденэктомию у пациентов с уровнем ПСА <10 нг/мл, клинической стадией T1a-T2a и суммой баллов по шкале Глисона <7, так как вероятность метастатического поражения тазовых лимфатических узлов не превышает 3 % [101, 140].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. Определение стадии (Т) локализованного РПЖ может быть основано на результатах МРТ. Дополнительную информацию получают по количеству и локализации положительных биоптатов, степени злокачественности опухоли и уровню ПСА в сыворотке крови.
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Генетическое тестирование на наличие герминальных мутаций генов, участвующих в репарации ДНК путем гомологичной рекомбинации (HRR) (например, вRCA1, вRCA2, ATM ) рекомендуется для всех пациентов с местно-распространенным РПЖ и метастазами в регионарных лифоузлах (N1). Исследование на соматические мутации генов HRR в потенциале позволит получить более полные результаты по сравнению с тестированием только герминальных мутаций.Тестирование опухоли на наличие соматических мутаций в генах HRR методом NGS рекомендуется для всех пациентов с метастатическим РПЖ [141].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарии: как показала диагностическая часть исследования PROfound, проведенная с участием 4425 пациентов с мКРРПЖ, мутации генов HRR встречаются в 27,9 % случаев. В исследовании выявляли как герминальные, так и соматические мутации следующих 15 генов HRR: вRCA1, вRCA2, ATM, вRIP1, вARD1, сDK12, сHEK1, сHEK2, FANCL, PALB2, PPP2R2A, RAD51B, RAD51C, RAD51D и RAD54L. Данные мутации были обнаружены генетическим тестированием ДНК из опухолевой ткани методом секвенирования нового поколения (NGS) [142]. Выявление мутаций генов HRR может повлиять на тактику ведения пациентов (например, на назначение ингибитора PARP (поли(АДФ-рибоза)полимеразы)олапариба**) [141].
|
|
Лечение
Назначение и применение лекарственных препаратов, указанных в клинической рекомендации, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
• локализованный РПЖ (Т1а-Т2сN0M0);
• ожидаемая продолжительность жизни пациента менее 10 лет (при TaG1-G2 менее 15 лет);
• высокодифференцированная опухоль;
• тяжелые сопутствующие заболевания.
При анализе результатов тактики отсроченного лечения отмечено, что 10-летняя опухолеспецифическая выживаемость пациентов с высоко и умеренно дифференцированными опухолями составляет 87 %, а пациентов с низкодифференцированными опухолями - 34 % [143]. Другие исследования продемонстрировали, что у пациентов с РПЖ со стадией Т1-2 и дифференцировкой опухоли ISUP ≤2 показатели опухолевоспецифической выживаемости составили 82-87 % и 80-95 % соответственно [144]. Риск смерти от РПЖ при проведении тщательного наблюдения в различных возрастных группах при дифференцировке опухоли 2-4 балла по шкале Глисона составляет 4-7 %, 5 баллов - 6-11 %, 6 баллов - 18-30 %, 7 баллов - 42-70 %, 8-10 баллов - 67-80 % ( уровень убедительности рекомендаций - С, уровень достоверности доказательств - 3) [145]. Исследование PIVOT не продемонстрировало преимуществ активного хирургического лечения пациентов с РПЖ низкого риска по сравнению с тщательным наблюдением при медиане наблюдения 12,7 лет [146].
Пациентам с выраженной сопутствующей патологией и ожидаемой продолжительностью жизни менее 10 лет рекомендована тактика тщательного наблюдения (отсроченного лечения) [134, 145].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Тактика тщательного наблюдения (отсроченного лечения) предполагает отказ от немедленного лечения пациента при выявлении РПЖ с динамическим наблюдением и проведением терапии при признаках прогрессирования болезни. Такой тактический вариант позволяет избежать осложнений и побочных реакций радикальных методов лечения.
При появлении признаков прогрессирования процесса и мотивированности или по желанию пациента, находящегося на тщательном наблюдении, к активному лечению рекомендовано гормональное лечение [147, 148].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарии. Пациента следует информировать, что немедленное начало гормонотерапии РПЖ приводит к более продолжительной опухолеспецифической выживаемости, чем при отсроченном начале лечения.
При предположительно локализованном РПЖ (N0, M0).
Молодым пациентам c умеренно дифференцированные опухолью (стадии Т1а, Т1b, T1c), находящимся на тщательном наблюдении, с ожидаемой продолжительностью жизни >10 лет рекомендуется периодическое проведение повторного анализа уровня ПСА, ТРУЗИ и биопсии с целью выявления признаков прогрессии заболевания [98, 149].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарии. Периодичность выполнения повторных исследований в настоящее время не определена, однако не должна быть менее 3 месяцев и более 12 месяцев.
Для пациентов с высоко и умеренно дифференцированной опухолью стадии T1b-T2b без клинических проявлений, с ожидаемой продолжительностью жизни <10 лет, находящихся на тщательном наблюдении, рекомендуется проведение повторного анализа уровня ПСА, ТРУЗИ и биопсии с целью выявления признаков прогрессии заболевания [98].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарии. Периодичность выполнения повторных исследований в настоящее время не определена, однако не должна быть менее 3 месяцев и более 12 месяцев.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарии. Термин «активное наблюдение» известен как «активный мониторинг», отражает консервативное лечение РПЖ. Термин принят в прошлом десятилетии и означает то, что нет необходимости в немедленном назначении лечения пациенту. За пациентом тщательно наблюдают и проводят лечение на заранее установленных этапах прогрессирования, определяемых такими параметрами, как короткое время удвоения уровня ПСА и ухудшение патоморфологических результатов при повторной биопсии. Тактика лечения при этом направлена на полное излечение пациента.
Активное наблюдение было предложено с целью уменьшения процента случаев излишнего лечения пациентов с клинически локализованным РПЖ группы очень низкого риска прогрессирования без отказа от радикального лечения, как при выжидательной тактике [153]. Проведен ряд дополнительных исследований активного наблюдения при клинически локализованном РПЖ (табл. 8, 9). Исследованиями подтверждено, что у отобранных по строгим показаниям пациентов с РПЖ группы очень низкого риска наблюдаются очень медленное прогрессирование и низкая смертность от рака, и только ограниченному числу пациентов требуется отсроченное радикальное лечение.
Таблица 8. Клинические исследования по активному наблюдению пациентов с локализованным раком предстательной железы, критерии включения.
Таблица 9. Клинические исследования по активному наблюдению пациентов с локализованным РПЖ (основные результаты).
Примечание. РПЭ - радикальная позадилонная простатэктомия; ПСА DT - время удвоения значения ПСА.
Критерии для начала лечения после активного наблюдения определены менее четко, однако для большинства групп рекомендовано использовать следующие:
• время удвоения ПСА с пороговым значением от 2 до 4 лет. Этот критерий ставится под сомнение из-за слабой связи между временем удвоения ПСА и степенью прогрессии опухоли при повторной биопсии;
• повышение суммы Глисона >7 при систематическом проведении последующих биопсий, проведенных с интервалом 1-4 года.
В таблице 10 продемонстрированы основные критерии активного наблюдения и отсроченного лечения.
Таблица 10. Определение активного наблюдения и отсроченного лечения [154].
Примечание. ТПИ - трансректальное пальцевое исследование; ПСА - простатспецифический антиген; мпМРТ - мультипараметрическая магнитно-резонансная томография.
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Оперативное лечение (радикальная простатэктомия) подразумевает удаление предстательной железы с ее капсулой, семенными пузырьками и участком мочеиспускательного канала с последующим формированием везикоуретрального анастомоза. Цель операции при локализованном и местнораспространенном неметастатическим РПЖ - полное излечение пациента.
Радикальное хирургическое лечение обычно выполняют у пациентов с РПЖ с ожидаемой продолжительностью жизни более 10 лет.
В таблице 11 представлены отдаленные результаты хирургического лечения пациентов с РПЖ.
Таблица 11. Отдаленные результаты хирургического лечения пациентов с РПЖ.
Варианты операционного доступа при выполнении радикальной простатэктомии:
• позадилонный;
• промежностный;
• лапароскопический/роботический.
В рандомизированном исследовании III фазы было показано, что роботассистированная РПЭ позволяет снизить время госпитализации и интраоперационную кровопотерю, а также обеспечивает более раннее восстановление континенции [158]. Тем не менее, в обновленных данных после анализа результатов наблюдения в течение 24 месяцев за пациентами с РПЖ после хирургического лечения не выявлено каких-либо существенных различий в функциональных результатах в зависимости от хирургического доступа (позадилонный, лапароскопический или роботассистированный) [159]. Статистически значимое влияние на функциональные и онкологические результаты хирургического лечения пациентов с РПЖ оказывал опыт хирурга, выполняющего операцию [160-162]. Также у хирургов, обладающих большим опытом выполнения операций, снижается показатель частоты выявления положительного края резекции [163, 164]. Таким образом, ни один из хирургических подходов не может быть рекомендован в качестве лучшего.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Комментарий. ТЛАЭ является наиболее точным методом оценки состояния тазовых лимфоузлов у пациентов с РПЖ. По объему выполняемой лимфодиссекции выделяют 3 основных вида ТЛАЭ: ограниченная, стандартная и расширенная. При выполнении стандартной ТЛАЭ удаляют жировую клетчатку с ЛУ между наружной и внутренней подвздошной артериями от уровня бифуркации общей подвздошной артерии до артерии, огибающей лонную кость (куперовой связки). Латеральной границей лимфодиссекции при этом является медиальный край наружной подвздошной артерии, медиальной - обтураторный нерв, задней - запирательная мышца. Во время стандартной лимфаденэктомии удаляют обтураторные и наружные подвздошные ЛУ. При ограниченной ТЛАЭ удаляют только ЛУ запирательной группы. Расширенная ТЛАЭ подразумевает дополнительное удаление клетчатки с лимфатическими узлами по ходу внутренних и общих подвздошных сосудов. По данным литературы, удаление данных групп лимфоузлов позволяет корректно простадировать РПЖ в 94 % случаев [139]. По данным некоторых авторов, выполнение ТЛАЭ во время РПЭ никак не влияет на онкологические результаты, в том числе выживаемость после операции [138]. Тем не менее, необходимо подчеркнуть важность выполнения расширенной ТЛАЭ для точного стадирования заболевания, так как ни один из диагностических методов на сегодняшний день не обладают достаточной чувствительностью и специфичностью для оценки состояния регионарных лимфоузлов [138]. Для определения риска наличия лимфогенных метастазов разработан ряд номограмм, основанных на предоперационных факторах прогноза. Наиболее известными являются номограммы вriganti [165, 166], номограмма Memorial Sloan Kettering сancer сenter (MSKCC) [167], формула Roach [168]. В случае выявления риска наличия лимфогенных метастазов, превышающего 5 %, обязательным является выполнение расширенной тазовой лимфаденэктомии [169, 170].
Следует отметить, что основной целью ТЛАЭ с определением СЛУ является обнаружение и удаление всех СЛУ, в том числе расположенных и вне границ стандартной ТЛАЭ, чувствительность достигает 95,2 %, по данным мировой литературы [171]. Таким образом, обнаружение СЛУ у пациентов с РПЖ является важным диагностическим этапом при выполнении ТЛАЭ и способствует существенному улучшению ее диагностических результатов. Тем не менее, данная методика не относится к стандартным, существуют разногласия, касающиеся технических моментов процедуры (дозировка РФП, индекс накопления РФП для выполнения биопсии СЛУ ). Для включения методики в стандарты лечения, необходимо проведение рандомизированных проспективных исследований [172].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии: нервосберегающая РПЭ может быть рекомендована большинству мужчин с локализованным РПЖ низкого риска прогрессирования. Относительным противопоказанием к применению данной техники операции является высокий риск экстракапсулярной инвазии (стадия сТ2с, дифференцировка опухоли по данным биопсии ISUP >3). Применение валидированных номограмм для расчета риска экстракапсулярной инвазии опухоли позволяет принять решение о применении нервосберегающей техники РПЭ или об отказе от выполнения последней [175, 176]. Кроме номограмм для принятия решения о нервосберегающей операции рекомендовано выполнять мпМРТ с оценкой состояния сосудисто-нервных пучков [177].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Комментарии. Данные ряда проспективных исследований, сравнивающих показатели выживаемости пациентов с РПЖ с наличием лимфогенных метастазов (рN1), демонстрируют преимущество РПЭ в лечении данной категории пациентов в виде увеличения показателей выживаемости [178].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
У пациентов с РПЖ стадии Т1-Т2 не рекомендуется проводить короткие (3 месяца) или длительные (9 месяца) курсы неоадъювантной терапии аналогами гонадотропин-рилизинг гормона [179].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. По данным нескольких исследований, применение неоадъювантной гормонотерапии позволило уменьшить число выявления местнораспространенных опухолей, снизить частоту выявления положительного хирургического края, а также снизить вероятность выявления метастазов в тазовых лимфоузлах, тем не менее, назначение неоадъювантной гормонотерапии никак не повлияло на показатели выживаемости (безрецидивная, опухолевоспецифическая) [179]. По этой причине проведение неоадъювантной гормональной терапии перед хирургическим лечением не рекомендуется в рутинной клинической практике.
Таблица 12. Интра- и послеоперационные осложнения РПЭ и РАЛП.
Примечание. РАРП - робот-ассистированная РПЭ; РПЭ - радикальная простатэктомия; РПП - радикальная позадилонная простатэктомия.
Эректильная дисфункция развивается у всех пациентов после выполнения радикальной простатэктомии без применения нервосберегающей техники.
К наиболее частым осложнениям при выполнении расширенной ТЛАЭ относят образование лимфокист (10,3-19,8 %), а также тромбоз глубоких вен нижних конечностей (менее 1 %) [182-184].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. Выполнение спасительной РПЭ при местных рецидивах после ЛТ является оптимальным методом, позволяющим добиться удовлетворительных результатов и локального контроля опухоли. Тем не менее, следует учитывать, что риск возникновения осложнений и побочных эффектов при выполнении спасительной РПЭ значительно выше, чем при первичной операции ввиду фиброза и более медленной регенерации облученных тканей.
По данным обзора литературы, выполненного сhade и соавт., показано, что спасительная РПЭ позволяет добиться следующих результатов: показатели 5- и 10-летней выживаемости без биохимического рецидива в диапазоне 47-82 % и 28-53 % соответственно, а 10-летние показатели ОСВ и ОВ варьировали в пределах 70-83 % и 54-89 % соответственно. Наиболее значимыми предикторами локализованного характера рецидива, прогрессирования заболевания и ОСВ были уровень ПСА до спасительной РПЭ, а также дифференцировка опухоли по данным биопсии [186].
Спасительную РПЭ следует выполнять только отобранным пациентам с не выраженной сопутствующей патологией, ожидаемой продолжительностью жизни не менее 10 лет, уровнем ПСА до операции менее 10 нг/мл, дифференцировкой опухоли ISUP <2/3, отсутствием отдаленных метастазов до операции, клинической стадией ≤Т2 [186]. По данным мета-анализа, спасительная РПЭ ассоциирована с менее благоприятными исходами в плане развития недержания по сравнению с нехирургическими методами лечения [185].
Варианты лучевой терапии.
• По способу подведения ионизирующего излучения к опухоли:
А) дистанционная лучевая терапия;
Б) контактная лучевая терапия;
В) сочетанная лучевая терапия.
• По виду ионизирующего излучения:
А) квантовое (фотонное);
Б) корпускулярное (частицы).
В лечении рака предстательной железы применяются различные варианты ЛТ.
• Дистанционная лучевая терапия:
• фотонная:
- стандартная (2D, конвенциальная);
- конформная (3D);
- лучевая терапия с модуляцией интенсивности;
• корпускулярная:
- протонная (высокоэнергетические протоны);
- нейтронная (быстрые нейтроны).
• Внутритканевая лучевая терапия (брахитерапия):
А) брахитерапия с высокой мощностью дозы (высокомощностная, временная);
Б) брахитерапия с низкой мощностью дозы (низкомощностная, постоянная, непрерывная).
• Сочетанная лучевая терапия: сочетание двух вариантов подведения дозы - дистанционной лучевой терапии и брахитерапии.
В качестве радикального метода лечения локализованного РПЖ рекомендуется применение ЛТ в комбинации с гормональной терапией (как неадъювантной, так и адъюватной) с целью улучшения выживаемости пациентов [179,187].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Показания к проведению ДЛТ при РПЖ:
• локализованный РПЖ (T1-T2N0M0);
• местнораспространенный РПЖ (T3-T4N0M0), в сочетании с гормональной терапией.
Противопоказания к ДЛТ при РПЖ:
• наличие сопутствующих инфекционно-воспалительных заболеваний мочеполовой системы, кишечника, свищей;
• предшествующее облучение области малого таза;
• постоянный уретральный катетер;
• инфравезикальная обструкция;
• «микроцистис»;
• сопутствующие соматические заболевания в стадии декомпенсации;
• психические расстройства;
• кахексия.
Преимущества ДЛТ:
• возможность полного излечения;
• доступность;
• меньше ограничений к применению (возраст, сопутствующие соматические заболевания );
• отсутствие периоперационных осложнений;
• возможность лечения амбулаторно.
Недостатки ДЛТ:
• длительность лечения (радикальные курсы лечения в режиме традиционного фракционирования до 1,5-2,0 месяцев);
• невозможность точного стадирования опухолевого процесса;
• невозможность излечения сопутствующей доброкачественной гиперплазии.
Конвенциональная ДЛТ при РПЖ.
Пациентам с локализованным РПЖ (T1-T2N0M0) в сочетании с гормональной терапией, пациентам с местнораспространенным РПЖ (T3-T4N0M0) рекомендуется проведение дистанционной лучевой терапии [179,187].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
При отсутствии возможности выполнения конформной (3D) ДЛТ рекомендовано проведение ДЛТ с использованием 2D планирования (конценциональной) при которых предстательная железа и семенные пузырьки идентифицируются, исходя из анатомического строения окружающих органов (костные структуры, контрастированные мочевой пузырь, прямая кишка) [187-189].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. При проведении конвенциональной ДЛТ применяют режим традиционного фракционирования дозы в разовой очаговой дозе (РОД) 1,8-2,0 Гр ежедневно, один раз в день, пять дней в неделю, до суммарной очаговой дозы (СОД) 65-70 Гр. При необходимости облучения регионарных лимфатических узлов СОД на область таза составляет 45-50 Гр [190].
Конформная ДЛТ при РПЖ.
Конформная ДЛТ (дистанционная лучевая терапия на медицинских ускорителях электронов) при РПЖ реализуется тормозным излучением высокоэнергетических линейных ускорителей электронов (ЛУЭ), укомплектованных многолепестковым коллиматором, после проведения объемного (3D) дозиметрического планирования.
Методика конформной лучевой терапии предусматривает реализацию последовательно выполняемых мероприятий:
• рентгено-топометрическая подготовка пациента на компьютерном томографе, в положении пациента, идентичном положению при облучении, с обязательным использованием иммобилизирующих приспособлений, обеспечивающих фиксацию пациента при его комфортном и функциональном положении;
• определение объемов облучения (на основе серии компьютерных томограмм, полученных при СКТ топометрии). Необходимо учитывать всю информацию, полученную при выполнении диагностических исследований, а также клинические, конституциональные, патоморфологические факторы;
• 3D дозиметрическое планирование лечения (ДЛТ);
• верификация позиционирования пациента;
• реализация сеансов ДЛТ.
Выбор тактики лечения РПЖ определяется принадлежностью пациента к той или иной прогностической группе [191].
Рекомендованы к применению следующие виды конформной ДЛТ: 3D-конформная лучевая терапия (3D-CRT), лучевая терапия с модуляцией интенсивности (IMRT), с визуальным контролем (IG-IMRT) - использование данных современных технологий ДЛТ в лечении РПЖ позволяет выполнять эскалацию дозы в опухоли, что приводит к улучшению результатов лечения (выживаемости), а снижение дозы на критические органы уменьшает риск развития осложнений [192-199].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Рекомендовано режим конформной лучевой терапии определять исходя из риска прогрессирования РПЖ:
• Низкий риск прогрессирования. Проведение конформной лучевой терапии в СОД 74-78 Гр. В объем облучения включают предстательную железу (± семенные пузырьки). Облучение лимфатических узлов таза и/или проведение гормональной терапии не показано.
• Промежуточный риск - проведение конформной лучевой терапии в СОД 74-78 Гр1 в сочетании с неоадъювантной2, сопутствующей и адъювантной гормональной терапией (в течение 4-6 месяцев). В объем облучения включают предстательную железу и семенные пузырьки3 [98].
• Высокий риск - проведение конформной лучевой терапии в СОД 74-81 Гр1 в сочетании с неоадъювантной2, сопутствующей и адъювантной гормональной терапией (в течение 24-36 месяцев). В объем облучения включают предстательную железу и семенные пузырьки3 [98, 200-211].
Уровень убедительности рекомендаций с (уровень достоверности доказательств -5).
Комментарии:
1Эскалация СОД ≥74 Гр способствует улучшению выживаемости у пациентов с РПЖ с промежуточным и высоким риском прогрессирования заболевания. С целью снижения риска развития лучевых осложнений при эскалации СОД рекомендовано применение технологии лучевой терапии с модуляцией интенсивности под контролем изображений (IG-IMRT).
2Назначение неоадъювантной гормональной терапии до начала ДЛТ у пациентов с РПЖ с промежуточным и высоким риском прогрессирования заболевания способствует уменьшению объема предстательной железы, купированию местных симптомов заболевания, снижению частоты развития лучевых осложнений.
3У пациентов с РПЖ с промежуточным и высоким риском прогрессирования заболевания при наличии дополнительных факторов неблагоприятного прогноза может быть рассмотрена целесообразность включения в объем облучения регионарных лимфатических узлов [98].
У пациентов с очень высоким риском прогрессирования рекомендовано проведение широкопольной лучевой терапии - сочетание облучения лимфатических коллекторов малого таза и дополнительного локального облучения семенных пузырьков, предстательной железы (с последовательным сокращением объема облучаемых тканей) [200].
При необходимости облучения регионарных лимфатических узлов объемы облучения определяют в соответствии с рекомендациями RTOG [201, 202].
Ограничения по дозам облучения на критические органы [203, 204].
Критическими структурами (органами риска) при проведении лучевой терапии РПЖ являются прямая кишка, мочевой пузырь, луковица полового члена, кишечник, головки бедренных костей. Оконтуривание органов риска осуществляется в соответствии с рекомендациями RTOG [205].
Оценка токсичности.
Острая и поздняя токсичность лечения оценивается в соответствии с классификациями RTOG/EORTC [206].
Гипофракционирование.
В последние годы обоснованно возрастает интерес к применению при лучевой терапии РПЖ режимов гипофракционирования, предусматривающих увеличение уменьшение количества фракций и времени лечения. В рандомизированных исследованиях при проведении лучевой терапии (IMRT, IGRT) изучены режимы умеренного гипофракционирования (в РОД 2,4-4,0 Гр за фракцию в течение 4-6 недель); получены данные о том, что эти режимы обладают эффективностью и токсичностью, вполне сопоставимыми с таковыми при традиционном фракционировании дозы [207-211]. Режимы умеренного гипофракционирования могут быть использованы при конформном облучении РПЖ, как альтернатива традиционному режиму, но при выполнении условий высокой прецизионности (точности) облучения мишени посредством использования технологий IGRT, IMRT.
Реализация режимов экстремального гипофракционирования, применяющихся при IG-IMRT (SBRT) и предусматривающих подведение РОД ≥6,5 Гр за несколько фракций, возможна только в специализированных центрах, обладающих соответствующим уровнем технического оснащения, подготовленным персоналом и клиническим опытом выполнения данной технологии [98].
Паллиативная лучевая терапия.
Пациентам при наличии распространенных форм заболевания с целью улучшения качества жизни (уменьшение дизурической симптоматики, болевого синдрома, гематурии) и максимально возможного в таких случаях терапевтического воздействия на опухоль предстательной железы рекомендуется применение паллиативной лучевой терапии [212].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Режим фракционирования - РОД 2-3 Гр, ежедневно, 1 раз в день, 5 дней в неделю, до СОД, эквивалентной 50 Гр. В случае достижения терапевтического эффекта после проведения паллиативного лечения и улучшения соматического состояния пациента необходимо рассматривать возможность продолжения лечения по радикальной программе.
Симптоматическая лучевая терапия.
Пациентам с РПЖ для купирования или уменьшения проявлений заболевания (болевой синдром при метастатическом поражении костей скелета) с целью улучшения качества жизни (уменьшение или купирование боли) рекомендуется применение симптоматической лучевой терапии [212-214].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Режим фракционирования определяют конкретной клинической ситуацией, соматическим состоянием пациента.
Возможно применение нескольких режимов облучения:
• РОД 8 Гр, однократно;
• РОД 5 Гр, через день, 5 фракций, до СОД 25 Гр;
• РОД 4 Гр, ежедневно, 5 раз в неделю, 5-6 фракций, до СОД 20-24 Гр;
• РОД 3 Гр, ежедневно, 5 раз в неделю, 10 фракций, до СОД 30 Гр.
В настоящее время брахитерапия в подгруппе пациентов низкого и промежуточного риска наравне с радикальной простатэктомией и дистанционной лучевой терапией является эффективным методом лечения рака предстательной железы [215-217].
Низкомощностная брахитерапия.
Показания к проведению низкомощностной брахитерапии при РПЖ:
• уровень ПСА ≤10 нг/мл;
• сумма баллов по Глисону 6 (3 + 3) либо 7 (3 + 4) менее 33 % биоптатов;
• клинически Т1c-Т2а, No, Mo;
• объем предстательной железы ≤50 cм3.
Противопоказания:
• абсолютные:
- наличие метастазов;
- ожидаемая продолжительность жизни пациента менее 5 лет;
• относительные:
- наличие простатита;
- большой размер предстательной железы;
- заболевания прямой кишки (язвенный колит, проктит );
- возраст пациента;
- выраженные дизурические явления (высокий балл по шкале IPSS, наличие большого количества остаточной мочи).
При локализованном РПЖ рекомендуется применение постоянной БТ, при которой в предстательную железу вводят радиоактивные источники I-125 (период полураспада 60 дней) или Pd-103 (период полураспада 17 дней) [216, 218].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Благодаря более гомогенному распределению ионизирующего излучения БТ позволяет подвести более высокую СОД к предстательной железе с меньшим лучевым воздействием на окружающие ткани, чем при проведении ДЛТ. Радиоактивные источники внедряют через промежность под контролем трансректального УЗИ. Рекомендуемые дозы для самостоятельной БТ при имплантации I-125 составляют 140-160 Гр и 110-125 Гр при имплантации Pd-103.
При использовании различных современных методик имплантации ТУР в анамнезе и объем предстательной железы не являются ограничением в проведении БТ [215, 216]. Проведенные исследования показали также, что наличие простатита не влияет на качество мочеиспускания после проведения имплантации [217], а воспалительные заболевания кишечника не приводят к увеличению гастроинтестинальной токсичности [219]. Возраст пациента также не является лимитирующим фактором при проведении БТ: переносимость процедуры практически сравнима для разных возрастных групп, а хорошие результаты безрецидивной выживаемости среди более молодых пациентов расширяют возможности применения методики [220].
Высокомощностная брахитерапия.
Высокомощностная брахитерапия подразумевает использование временных источников излучения с активностью от 1,200 сГр/час и выше. Наиболее часто в практике используется источник иридия-192 (Ir 192), имеющий период полураспада порядка 72 суток.
Использование высокомощностной брахитерапии (методика временной имплантации), предусматривающей извлечение радионуклидов после окончания облучения, по сравнению с постоянной имплантацией также нашла широкое применение в клинической практике. Это обусловлено тем, что данная технология позволяет более точно и равномерно формировать дозное поле во всем облучаемом объеме, проводить радикальное лечение как в самостоятельном варианте, так и в различных сочетаниях с ДЛТ.
Показания к проведению высокомощностной брахитерапии при РПЖ:
• уровень ПСА без верхней границы, но без наличия метастазовх;
• сумма баллов по Глисону до 10х;
• клинически Т1-Т3, No, Moх;
• объем предстательной железы ≤50 cм3 (больший объем не является противопоказанием).
Примечание. Х - имеется в виду возможность применения в сочетанном режиме (ДЛТ + БТ).
Противопоказания:
• абсолютные:
- наличие метастазов;
- невозможность проведения анестезии, нахождении в положении лежа;
- наличие прямокишечной фистулы;
• относительные:
- ТУР в анамнезе (проведение брахитерапии не ранее 6 месяцев после ТУР);
- уродинамические показания (кроме выраженных симптомов обструкции. IPSS >20, Qmax <10 мл/сек).
В отличие от низкомощностной брахитерапии данный метод лечения ввиду своих особенностей и преимуществ позволяет проводить лечение практически у всех пациентов с локализованным и местнораспространенным раком предстательной железы. С точки зрения современной радиобиологии, при проведении лучевой терапии РПЖ предпочтительно применение режимов гипофракционирования и, следовательно, высокомощностной брахитерапии, которая имеет потенциал быть более эффективной методикой по сравнению с традиционными технологиями лучевого лечения даже с эскалацией дозы, а также с низкомощностной брахитерапией.
Преимущества высокомощностной брахитерапии.
При сравнении методик высоко- и низкомощностной брахитерапии в лечении РПЖ, согласно рекомендациям Международного агентства по атомной энергии (МАГАТЭ) [221], высокомощностная внутритканевая лучевая терапия имеет ряд следующих преимуществ:
• устранение радиационных доз на персонал и посетителей;
• исключение подготовки и транспортировки источников для каждого пациента;
• меньший дискомфорт и более низкие риски тромбоэмболии, в связи с коротким временем пребывания пациента в литотомическом положении;
• оптимизация распределения дозы;
• возможность интеграции дистанционной лучевой терапии и высокомощностной брахитерапии, что приводит к сокращению общей продолжительности лечения и потенциально лучшему контролю за опухолью;
• более высокая пропускная способность пациентов в крупных специализированных центрах;
• более короткий период обучения персонала по сравнению с внедрением низкомощностной брахитерапии;
• отсутствие миграции источника относительно целевого объема в течение всего времени лучевого лечения;
• более эффективный потенциал оптимизации дозы-объема, связанный с технологией движения источника;
• меньшая токсичность из-за улучшенной защиты зон риска: уретра, прямая кишка и мочевой пузырь, а также луковица полового члена.
Недостатки высокомощностной брахитерапии.
Согласно тем же рекомендациям МАГАТЭ [221] у высокомощностной брахитерапии есть и ряд недостатков:
• необходимость обеспечения высокого уровня гарантии качества перед каждым применением высокомощностной брахитерапии, связанного с использованием в схеме лечения нескольких фракций, требующих повторного введения интрастатов;
• отсутствие сравнительных и проспективных рандомизированных исследований по качеству жизни;
• неясная экономическая выгода по сравнению с низкомощностной брахитерапией. Однако при высокой пропускной способности центра монотерапия 192Ir имеет экономическое преимущество.
Режимы проведения высокомощностной брахитерапии.
Высокомощностная БТ может выполняться как самостоятельный метод лечения пациентов с РПЖ из группы низкого и промежуточного риска, так и в сочетании с ДЛТ при лечении пациентов локализованным РПЖ из группы высокого риска.
В клинической практике при проведении высокомощностной БТ в режиме монотерапии наиболее часто используются следующие режимы подведения дозы:
1 имплантация - 1 фракция по 19 Гр, 2 фракции по 12-15 Гр, 3 фракции по 10-11,5 Гр, 4 фракции по 8,5-9,5 Гр, 6 фракций по 6,5-7 Гр;
2 имплантации - 2 фракции по 12-15 Гр, 6 фракций по 6,5-7 Гр;
3 имплантации - 3 фракции по 10-11,5 Гр.
Высокомощностная БТ с использованием 2-х и более имплантаций характеризуется высокой эффективностью и хорошей переносимостью. При осуществлении этой технологии стандартный интервал между имплантациями составляет от 1 до 3 недель.
В настоящее время подведение 19 Гр за 1 фракцию может быть рекомендовано только в рамках исследовательских протоколов.
При проведении высокомощностной БТ в качестве компонента сочетанного лучевого лечения пациентов с РПЖ из группы промежуточного и высокого риска часто применяются следующие режимы подведения дозы: 16 Гр за 3 фракции, 11-22 Гр за 2 фракции и 12-15 Гр за одну фракцию. Имеются доказательства эквивалентной эффективности и сопоставимой низкой токсичности высокомощностной БТ в режимах: 1 фракция 15 Гр и 2 фракции по 10 Гр.
Рекомендуемыми режимами подведения дозы при выполнении высокомощностной БТ в режиме монотерапии являются: 2 фракции (2 имплантации) по 10-15 Гр каждая; 3 фракции (3 имплантации) по 10-11,5 Гр каждая. Во всех случаях суммарная доза на предстательную железу (λ/β = 1,5-3) должна быть не менее дозы, эквивалентной 100 Гр в режиме обычного (2 Гр) фракционирования [218].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
При использовании высокомощностной БТ как этапа сочетанной лучевой терапии рекомендован режим - 1 фракция 15 Гр [218].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Пациентам с рецидивом рака предстательной железы после проведенной дистанционной лучевой терапии или брахитерапии, а также у пациентов после нерадикально выполненной простатэктомии рекомендуется проведение спасительной (сальважной) низкомощностной или высокомощностной брахитерапии [218, 222, 223].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. При применении спасительной высокомощностной брахитерапии Ir-192 можно выделить следующие преимущества - во-первых, уменьшается суммарная очаговая доза с 60-70 Гр при традиционной спасительной дистанционной лучевой терапии до 15-18 Гр при спасительной высокомощностной брахитерапии, без потери летального радиобиологического эффекта на рецидивные клетки рака предстательной железы, что в свою очередь значимо уменьшает лучевые нагрузки на критические органы и тем самым снижает риск развития лучевых повреждений; во-вторых, в отличие от гормональной терапии, спасительная высокомощностная брахитерапия является радикальным методом лечения рецидива рака предстательной железы.
Следует отметить, что спасительная брахитерапия должна выполняться в специализированных центрах, имеющих большой опыт проведения процедур брахитерапии.
Таблица 13. Прогностические факторы на основании исследования SWOG 9346 [229].
По данным современных методов диагностики, уровень тестостерона после хирургической кастрации составляет 15 нг/дл. В нескольких исследованиях было показано, что при более низком уровне тестостерона результаты лечения стабильно выше, чем при традиционном уровне <50 нг/дл (1,7 нмоль/л). В связи с этим современным кастрационным уровнем тестостерона считается уровень <20 нг/дл (0,7 нмоль/л). При этом кастрационный уровень, рассматриваемый регуляторными органами и используемый в клинических исследованиях по АДТ при РПЖ, по-прежнему остается <50 нг/дл (1,7 ммоль/л).
Агонисты лютеинизирующего гормона рилизинг-гормона.
Рекомендуется назначение синтетических аналогов гонадотропин рилизинг-гормона (код АТХ H01 - Гормоны гипоталамуса и гипофиза и их аналоги) (медикаментозная кастрация) при наличии показаний и отсутствии противопоказаний, поскольку данный метод является равноэффективным хирургической кастрации [231].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. В основе механизма действия агонистов ЛГРГ лежит десенсибилизация рецепторов к рилизинг-гормону, ведущая к снижению продукции лютеинизирующего гормона гипофиза и в дальнейшем к снижению выработки тестостерона клетками Лейдига в яичках. После введения агонистов ЛГРГ отмечают кратковременное повышение концентрации тестостерона на 3-5-й день (синдром вспышки) с последующим снижением ее до посткастрационного уровня на 21-28-й день. Для профилактики синдрома вспышки у пациентов с метастатическим РПЖ перед введением агониста ЛГРГ и в течение 1-й недели терапии следует назначать антиандрогены.
Побочные эффекты и осложнения терапии агонистами ЛГРГ такие же, как при хирургической кастрации.
Показания к применению агонистов ЛГРГ:
• локализованный РПЖ (Т1-2N0M0) - при невозможности или отказе пациента от проведения радикального лечения (как при наличии, так и в отсутствии симптомов, при времени удвоения ПСА менее 12 месяцев и уровне общего ПСА более 50 нг/мл, а также в случае наличия низкодифференцированной опухоли) или в качестве неоадъювантной терапии перед радикальным лучевым лечением;
• местно-распространенный РПЖ (T3-4N0M0) - в качестве самостоятельного лечения или неоадъювантной и адъювантной терапии в сочетании с хирургическим или лучевым лечением;
• метастатический РПЖ (T1-4N1M0, N1-4N0M1).
Для лечения РПЖ рекомендуется применение агонистов ЛГРГ [231, 232].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии:
Применяются следующие режимы терапии:
Гозерелин** 3,6 мг под кожу передней брюшной стенки 1 раз в 28 дней или 10,8 мг под кожу передней брюшной стенки 1 раз в 3 мес; лекарственный препарат находится в депонированной форме в шприц-тюбике, готов к употреблению.
Лейпрорелин** 3,75 мг или 7,5 мг, или 11,25 мг, или 22,5 мг, или 45 мг в зависимости от длительности действия и формы выпуска (производителя).
Трипторелин** 3,75 мг внутримышечно 1 раз в 28 дней или Трипторелин** 11,25 мг внутримышечно или подкожно 1 раз в 3 месяца; лекарственный препарат растворяют непосредственно перед инъекцией, вводят в виде суспензии.
Бусерелин** 3,75 мг внутримышечно 1 раз в 28 дней; лекарственный препарат растворяют непосредственно перед инъекцией, вводят в виде суспензии.
Крупных рандомизированных плацебо-контролируемых исследований с препаратом бусерелин проведено не было.
Лечение агонистами ЛГРГ проводят длительно, до развития рефрактерности к гормональному воздействию. Некоторые авторы рекомендуют применение агонистов ЛГРГ в режиме прерывистой (интермиттирующей) терапии, однако эффективность интермиттирующей блокады остается дискутабельной.
Антагонисты лютеинизирующего гормона рилизинг-гормона.
В отличие от агонистов ЛГРГ, антагонисты конкурентно связываются с ЛГРГ рецепторами в гипофизе; при этом не возникает эффекта «вспышки».
Дегареликс**. Наиболее изученный антагонист ЛГРГ для подкожного введения 1 раз в месяц.
Основываясь на результатах крупного рандомизированного исследования (n = 610), стандартная доза дегареликса** должна составлять 240 мг в первый месяц с последующим применением инъекций по 80 мг ежемесячно. Основным специфическим побочным эффектом дегареликса** является боль в зоне инъекции (средней или легкой степени), выявленная у 40 % пациентов преимущественно после первого введения.
Объединенные данные шести проспективных рандомизированных исследований фазы III, в которых приняли участие 2328 мужчин в период с 2005 по 2012 гг., по сравнительной оценке эффективности агонистов ЛГРГ в сравнении с антагонистами были проанализированы для установления возможных различий в развитии сердечно-сосудистых заболеваний после начала приема агонистов гонадотропин-рилизинг гормона в сравнении с применением антагонистов ЛГРГ (дегареликса**). В сравнении с агонистами ЛГРГ применение антагониста ЛГРГ дегареликса** приводило к уменьшению числа сердечно-сосудистых явлений на 56 % у пациентов с РПЖ, имевших сердечно-сосудистые заболевания в анамнезе [233].
Данная гипотеза была подтверждена данными проспективного рандомизированного исследования II фазы, сравнивающем агонисты и антагонисты ЛГРГ у пациентов с распространенным РПЖ, имеющих заболевания сердца в анамнезе. Пациенты, получавшие антагонисты ЛГРГ, имели достоверно меньше событий со стороны сердца в течение одного года терапии в сравнении с агонистами ЛГРГ [234]. Исследование III фазы, PRONOUNCE [235], в настоящее время проходит для получения дополнительного подтверждения данных, полученных в рамках данного исследования.
В рамках исследования сS21 дополнительно проводился анализ эффективности проводимого лечения в отношении концентраций щелочной фосфатазы. Исходный уровень С-ЩФ был высоким у пациентов с метастатической стадией заболевания. У пациентов с метастатической стадией заболевания или у пациентов с исходным уровнем ПСА ≥50 нг/мл выраженное снижение уровня С-ЩФ отмечалось при приеме дегареликса по сравнению с группой агониста ЛГРГ. В отличие от пациентов группы агониста ЛГРГ, у пациентов группы терапии дегареликсом низкий уровень С-ЩФ сохранялся на протяжении всего периода исследования [236].
У пациентов с первыми признаками компрессии спинного мозга или инфравезикальной обструкцией рекомендуется применение антагонистов ЛГРГ (дегареликс**) [236, 237].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
АДТ с применением нестероидных антиандрогенов.
На основании Кокрановского систематического обзора терапия с применением нестероидных антиандрогенов (НСАА) в монорежиме по сравнению с кастрацией (медикаментозной или хирургической) явилась менее эффективным видом терапии с точки зрения ОВ, клинического прогрессирования, неэффективности лечения и прекращения терапии вследствие нежелательных явлений [232].
Пациентам со стадией М1, получающим лечение агонистами ЛГРГ, для снижения риска возникновения эффекта «вспышки» рекомендуется начальная краткосрочная терапия антиандрогенами (АТХ G03HB Антиандрогены и эстрогены) [232, 238-241].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
У пациентов со стадией заболевания М1 терапия только с применением антиандрогенов (в монорежиме) не рекомендуется [232].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Сравнение интермиттирующей и непрерывной антиандрогенной терапии.
Клиническую эффективность интермиттирующей антиандрогенной гормональной терапии (ИГТ) рассматривали в трех независимых обзорах [242-244] и двух мета-анализах [245, 246]. Все указанные обзоры содержали данные восьми рандомизированных клинических исследований, из которых только три были проведены у пациентов исключительно при наличии отдаленных метастазов (M1). Пять оставшихся исследований включали различные группы пациентов, преимущественно с местным распространением опухоли или рецидивом заболевания.
Исследование SWOG 9346 является самым крупным, оценивщим эффективность ИГТ у пациентов со стадией M1b [247]. Из 3040 пациентов, прошедших скрининг, в итоге только 1535 пациентов соответствовали критериям включения. Это подчеркивает, что только около 50 % пациентов со стадией M1b с наилучшим ответом по ПСА на индукционный курс АДТ подойдут для проведения интермиттирующего режима. Исследование было спланировано с целью демонстрации сопоставимых результатов ИГТ и постоянной андрогендепривационной терапии, что было достигнуто в качестве первичной конечной точки, тем не менее полностью исключить меньшую выживаемость при применении ИГТ на основании результатов данного исследования не представляется возможным.
Другие исследования не продемонстрировали никакого различия выживаемости с общим отношением рисков для ОВ 1,02 (0,94-1,11) [242]. По материалам данных обзоров и мета-анализов пришли к заключению, что различие в ОВ или ОСВ между ИГТ и постоянной гормональной терапией (ПГТ) маловероятно. В недавно проведенном обзоре имеющихся данных исследования фазы III подчеркиваются ограничения в большинстве исследований и предлагается с осторожностью интерпретировать результаты анализа не меньшей эффективности [248]. Ни в одном из исследований, в которых проводилось сравнение ИГТ и ПГТ у пациентов с M1, не показано преимущества выживаемости, однако при ПГТ отмечена тенденция в плане улучшения ОВ и ВБП (выживаемости без прогрессирования заболевания). Большинство из этих исследований, тем не менее, были исследованиями не меньшей эффективности, спланированными с целью показать сопоставимые результаты. В отдельных когортах отрицательное воздействие на половую функцию было менее выраженным при проведении ИГТ. Существует тенденция в пользу ИГТ с точки зрения качества жизни, особенно относительно связанных с исследуемой терапией побочных эффектов, таких как приливы [249, 250].
Таким образом, отсутствие каких-либо преимуществ относительно выживаемости у пациентов с M1, демонстрирует, что ИГТ следует рассматривать в качестве варианта для хорошо информированного пациента, обеспокоенного значимыми побочными эффектами терапии.
Пороговое значение уровня ПСА, при котором АДТ должна быть прекращена или продолжена в качестве ИААД, еще необходимо определить в проспективных исследованиях [243, 251]. Тем не менее, среди большого количества авторов существует консенсус по следующим утверждениям:
ИГТ основана на интермиттирующей кастрации; в связи с этим, допустимым является применение только препаратов, приводящих к кастрации.
Применение антагонистов ЛГРГ может являться альтернативой применению агонистов.
Цикл индукционной АДТ не должен превышать 9 месяцев, в противном случае восстановление уровня тестостерона маловероятно.
Антиандрогенная терапия должна быть прекращена только при выполнении всех следующих критериев:
- пациент хорошо информирован и привержен лечению;
- отсутствует клиническое прогрессирование;
- имеется четкий ответ уровня ПСА на терапию, эмпирически установленный уровень ПСА при метастатическом заболевании менее 4 нг/мл.
Тщательное последующее наблюдение является обязательным и должно включать клиническое обследование каждые 3-6 месяцев. По мере прогрессирования заболевания должно быть более частым последующее наблюдение.
Измерение уровня ПСА должно всегда проводиться одной и той же лабораторией.
Терапию возобновляют при клиническом прогрессировании у пациента или превышении предварительно определенного (установленного эмпирически) порогового значения уровня ПСА: как правило, у пациентов со стадией М1 при уровне 10-20 нг/мл.
Продолжительность курсов АДТ составляет не менее 3‒6 месяцев.
Последующие циклы терапии основаны на тех же принципах до появления первых признаков резистентности к кастрации.
Еще предстоит определить группу пациентов, которым ИГТ приносит максимальную пользу, однако наиболее важным фактором, вероятно, является ответ на первый цикл ИГТ, например, ответ на лечение по уровню ПСА [243].
Интермиттирующее лечение следует предлагать только хорошо мотивированным пациентам со стадией М1 с выраженным ответом уровня ПСА после периода индукции.
Немедленная андрогендепривационная терапия по сравнению с отсроченной.
У пациентов с наличием симптомов немедленная терапия является обязательной. Однако, вследствие отсутствия исследований хорошего качества, еще существует противоречие в отношении пациентов с метастатическим РПЖ без симптомов. По данным ряда исследований немедленная АДТ не приводила к улучшению ОСВ, хотя проведение немедленной АДТ значимо снижало риск прогрессирования заболевания [232, 252,253].
У пациентов со стадией М1 с наличием симптомов рекомендуется немедленная системная андрогендепривационная терапия, направленная на облегчение симптомов и уменьшение риска потенциальных серьезных осложнений прогрессирующего заболевания (компрессия спинного мозга, патологические переломы, обструкция мочеточника) [352, 253].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
У пациентов со стадией М1 без симптомов опухоли рекомендуется немедленная андрогендепривационная системная терапия, направленная на улучшение выживаемости, замедление прогрессирования до развития симптомов болезни и предотвращение серьезных осложнений, связанных с прогрессированием заболевания [252, 253].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
В крупном рандомизированном исследовании, включившем 1286 пациентов с M1b, не установлено различия между хирургической кастрацией с флутамидом или без него [254]. Однако при применении других антиандрогенов или методов кастрации результаты различались, а в систематических обзорах было показано, что МАБ с применением нестероидных антиандрогенов обеспечивает небольшое преимущество в выживаемости (<5 %) по сравнению с монотерапией (хирургическая кастрация или применение агонистов ЛГРГ) [255, 256] после пяти лет проводимой терапии [257], в то же время, это минимальное преимущество в небольшой подгруппе пациентов должно быть взвешено относительноувеличения частоты побочных эффектов, связанных с долгосрочным применением нестероидных антиандрогенов.
Андрогендепривационная терапия в комбинации с другими препаратами.
Комбинация с абиратерона ацетатом**.
В двух крупных рандомизированных исследованиях (STAMPEDE, LATITUDE) изучали добавление к АДТ абиратерона** ( см приложение А3) (1000 мг в сутки) с преднизоном (5 мг в сутки) у пациентов с метастатическим гормон-чувствительным РПЖ (мГЧРПЖ) [258]. Основная цель данных исследований состояла в улучшении ОВ. Оба исследования продемонстрировали достоверное улучшение ОВ, однако в исследовании LATITUDE с ОР 0,62 (0,51-0,76) только в подгруппе пациентов с большим объемом метастатического поражения. Значения ОР в исследовании STAMPEDE были очень сходны с 0,63 (0,52-0,76) в общей популяции пациентов [258]. Все дополнительные цели, такие как ВБП, время до радиологического прогрессирования, время до появления боли или время до начала химиотерапии, имели положительное значение с преимуществом в группе комбинированной терапии. Статистически достоверных различий количества, связанных с лечением случаев смерти не наблюдалось при применении комбинации АДТ с абиратероном** и преднизоном по сравнению с АДТ [ОР: 1,37 (0,82-2,29)]. Тем не менее, вдвое большее количество пациентов прекратили терапию досрочно по причине токсичности в подгруппах, получавших комбинацию в исследовании STAMPEDE (20 %), по сравнению с исследованием LATITUDE (12 %). На основании этих данных абиратерон** в комбинации с преднизоном в сочетании с АДТ следует рассматривать в качестве стандарта терапии первой линии у пациентов с метастатическим гормон-чувствительным РПЖ [259].
У пациентов с РПЖ со стадией М1, которые могут перенести данную схему лечения, предлагают АДТ в комбинации с абиратероном** 1000 мг в сутки за один прием натощак ежедневно до прогрессирования заболевания или развития непереносимой токсичности в сочетании с преднизоном 5 мг в сутки [241].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. В настоящее время данное показание к применению абиратерона** находится в процессе регистрации в РФ.
Андрогендепривационная терапия в комбинации с химиотерапией.
Проведено 3 крупных рандомизированных исследования [228, 260, 261]. Во всех проводили сравнение только кастрационной ГТ, как стандартом терапии, с подгруппой пациентов, получавших АДТ в комбинации с доцетакселом** (75 мг/м2, 1 раз в три недели, химиотерапию начинали не позднее трех месяцев от начала ГТ, длительность проводимой терапии - 6 курсов, сопутствующее применение преднизолона не являлось обязательным). Основной целью во всех трех исследованиях явилась оценка ОВ.
В исследование GETUG 15 включены пациенты с метастатическим РПЖ, выявленным первично или при прогрессии заболевания после проведенного радикального лечения [261]. Пациентов стратифицировали на основании предшествующего лечения и групп риска [225]. В исследовании сHAARTED применялись те же критерии включения и пациенты были стратифицированы с учетом объема метастатического поражения; большой объем определялся по наличию висцеральных метастазов или четырех и более костных метастазов по крайней мере с одним очагом вне позвоночника или костей таза [228].
STAMPEDE ‒ это многоступенчатое исследование с несколькими группами, в котором референтная группа (кастрационная гормональная монотерапия) включала 1184 пациентов. Одной из экспериментальных групп явилась подгруппа с применением доцетаксела** в комбинации с АДТ (n = 593), другой ‒ подгруппа доцетаксела** в комбинации с золендроновой кислотой** (n = 593). В исследование включены пациенты либо с M1, либо с N1, либо при наличии двух из следующих трех критериев: T3/4, ПСА >40 нг/мл, либо группа ISUP 4-5. Также включены пациенты с рецидивами после местного лечения, если они соответствовали одному из следующих критериев: PSA >4 нг/мл с ВУПСА <6 месяцев или ПСА >20 нг/мл, N1 или M1. Относительно объема метастатического поражения (большой/малый объем) стратификация не применялась [260].
Гематологическая токсичность являлась одним из наиболее частых проявлений побочных явлений терапии доцетакселом во всех данных исследованиях. Нейтропения 3-4 степени наблюдалась у 12-15 % пациентов, фебрильная нейтропения 3-4 степени у 6-12 %. Применение гранулоцитарного колониестимулирующего фактора (ГКСФ) статистически значимо снижало риск развития фебрильной нейтропении. Первичное и вторичное профилактическое лечение с применением ГКСФ должно осуществляться в соответствии с имеющимися руководствами [259, 262].
На основании этих данных доцетаксел** в комбинации с кастрационной АДТ следует рассматривать в качестве стандарта терапии у пациентов с впервые выявленным метастатическим РПЖ, при условии, что они соответствуют критериям приема препарата [259]. Доцетаксел** применяют в стандартной дозе 75 мг/м2 в комбинации со стероидами в качестве премедикации. Проведение постоянной терапии кортикостероидами не является обязательным. Всего рекомендуется провести 6 курсов химиотерапии доцетакселом** в дозе 75 мг/м2 в комбинации с АДТ.
Таким образом, стандартом лечения пациентов с впервые выявленным метастатическим или рецидивным гормон-чувствительным РПЖ является комбинированная терапия с применением кастрации и назначением абиратерона ацетата** в сочетании с преднизолоном или доцетакселом**. Преимущество в выживаемости для обоих препаратов оказалось сходным [263]. Также не отмечено никакого значимого преимущества ОВ для каждого из препаратов, указанных в недавно опубликованном метаанализе [264]. Оба метода имеют различающиеся и препарат-специфичные побочные эффекты, что требует проведения тщательного мониторинга побочных эффектов во время лечения. Таким образом, выбор терапии будет зависеть от предпочтений пациента, характерных побочных эффектов, доступности препаратов и их стоимости.
Пациентам, у которых РПЖ манифестирует в стадии М1 и у которых нет противопоказаний к терапии доцетакселом**, рекомендуется кастрация в комбинации с химиотерапией (доцетаксел**) - 6 курсов терапии в дозе 75 мг/м2 в комбинации с АДТ. Затем - проведение только АДТ [263-265].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
Комбинация с апалутамидом**.
В крупном рандомизированном исследовании фазы III TITAN [266] оценивались выживаемость без прогрессии (ВБП) и общая выживаемость (ОВ) как первичные конечные точки у пациентов метастатическим гормон-чувствительным РПЖ (мГЧРПЖ), которые получали лечение апалутамидом** в сочетании с АДТ по сравнению с плацебо с АДТ. В исследовании было продемонстрировано значимое улучшение показателей ВБП (медиана ВБП не достигнута в группе апалутамида** по сравнению с 22,1 месяца в группе плацебо [ОР для прогрессии или смерти 0,48; 95 % ДИ: 0,39-0,60, p <0,0001]) и ОВ (медиана ОВ не достигнута в обоих группах [ОР для смерти 0,67, 95 % ДИ: 0,51-0,89, p <0,0053). Токсичность терапии с применением нового класса препаратов была минимальной.
У пациентов с РПЖ со стадией М1, которые могут перенести данную схему лечения, рекомендуют АДТ в комбинации с апалутамидом** 240 мг раз в день перорально до прогрессии или развития непереносимой токсичности [266].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комбинация с энзалутамидом**.
В двух крупных рандомизированных исследованиях (ENZAMET, ARCHES) изучали добавление к АДТ энзалутамида** (160 мг в сутки) у пациентов с метастатическим гормон-чувствительным РПЖ (мГЧРПЖ) [267, 268]. В рандомизированном исследовании 3 фазы ENZAMET сравнивалась терапия энзалутамидом** в комбинации с АДТ с монотерапией АДТ у 1125 пациентов с мГЧРПЖ. Пациенты были стратифицированы по объему метастатического поражения, раннему применению доцетаксела, использованию остеомодифицирующих агентов и по количеству баллов по шкале оценки сопутствующей патологии. При первом промежуточном анализе с медианой наблюдения 34 мес была достигнута первичная цель исследования ENZAMET в виде увеличения ОВ пациентов с мГЧРПЖ в группе раннего назначения энзалутамида** в комбинации с АДТ (ОР = 0,67; 95 % ДИ: 0,52-0,86; р = 0,002). Все дополнительные цели, такие как ВБП с оценкой по уровню ПСА и клиническому прогрессированию, имели положительное значение с преимуществом в группе комбинированной терапии с энзалутамидом**. В рандомизированное исследование 3 фазы ARCHES включили 1150 пациентов с мГЧРПЖ вне зависимости от факторов прогноза течения заболевания. Пациентов рандомизировали в соотношении 1 :1 в группу комбинации АДТ и энзалутамида** и в группу АДТ + плацебо. Пациентов стратифицировали по наличию или отсутствию в анамнезе химиотерапии доцетакселом (не было, 1-5 циклов и 6 циклов) и по объему метастатического поражения (большой и малый объем). При медиане наблюдения 14,4 мес была достигнута первичная цель исследования ARCHES в виде увеличения рВБП у пациентов с мГЧРПЖ в группе назначения энзалутамида** в комбинации с АДТ со снижением риска прогрессирования или смерти на 61 % (ОР = 0,39; 95 % ДИ: 0,30-0,50; р <0,001). Профиль безопасности энзалутамида** соответствовал полученным ранее данным в исследованиях с участием пациентов с мКРРПЖ. Нежелательные явления, связанные с приемом энзалутамида** в данных исследованиях, включали усталость, судороги и гипертензию.
На основании этих данных энзалутамид** ( см приложение А3) в комбинации с АДТ следует рассматривать в качестве стандарта терапии первой линии у пациентов с метастатическим гормон-чувствительным РПЖ.
У пациентов с РПЖ со стадией М1, которые могут перенести данную схему лечения, рекомендовано АДТ в комбинации с энзалутамидом** [267, 268]. Лечение проводят с применением стандартной дозировки препарата 160 мг/сут до прогрессии или развития непереносимой токсичности.
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 3).
В особенности у пациентов с первыми признаками компрессии спинного мозга или инфравезикальной обструкцией рекомендовано применение антагонистов лютеинизирующего гормона рилизинг-гормона (ЛГРГ) [233-236].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Пациентам со стадией М1 и первыми признаками развивающихся осложнений, таких как сдавление спинного мозга или патологические переломы, рекомендуется проводить хирургическое вмешательство и/или местную лучевую терапию для устранения симптомов болезни [272].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
У пациентов стадии М1 с наличием симптомов заболевания рекомендована немедленная системная терапия, направленная на устранение симптомов, улучшение выживаемости, замедление прогрессирования до симптомной стадии и предотвращение серьезных осложнений, связанных с прогрессированием заболевания. У пациентов стадии М1 без симптомов опухоли рекомендована немедленная системная терапия, направленная на улучшение выживаемости, замедление прогрессирования до симптомной стадии и предотвращение серьезных осложнений, связанных с прогрессированием заболевания [252, 253].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарии. У хорошо информированных пациентов со стадией М1 при отсутствии симптомов опухоли возможно проведение отсроченной АДТ, поскольку она уменьшает побочные эффекты лечения, при условии, что пациент находится под тщательным наблюдением [232, 252, 253].
Пациентам со стадией М1, получающим лечение агонистами ЛГРГ, для снижения риска возникновения эффекта «вспышки» предлагают начальную краткосрочную терапию антиандрогенами [238-241, 254, 257].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
У пациентов со стадией заболевания М1 монотерапия антиандрогенами не рекомендуется [257].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
Пациентам с РПЖ со стадией М1, у которых нет противопоказаний к терапии доцетакселом**, предлагают АДТ в комбинации с химиотерапией (доцетаксел 75 мг/м2, 1 день в 21-дневный курс, до 6 курсов доцетаксела**) [225, 228, 260, 261].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Пациентам с РПЖ со стадией М1, которые могут перенести данную схему лечения, предлагают АДТ в комбинации с одним из перечисленных препаратов: в алфавитном порядке: абиратерон ** в сочетании с преднизоном, апалутамидом или энзалутамидом** [266-268].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Пациентам с РПЖ со стадией М1, у которых имеется малый объем метастатического поражения, определенный по критериям сHAARTED, рекомендуется предложить АДТ в сочетании с лучевой терапией предстательной железы [273].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Не рекомедовано применение АДТ в комбинации с каким-либо местным лечением (лучевая терапия/хирургическое вмешательство) вне клинических исследований (за исключением контроля симптомов) пациентам со стадией М1 и большим объемом метастатического поражения [273, 274].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
Пациентам, не желающим рассматривать АДТ в сочетании с терапией доцетакселом**, абиратерона ацетатом** в комбинации с преднизолоном, апалутамидом**, энзалутамидом** или с лучевой терапией на зону предстательной железы или не подходящих для вышеуказанного лечения, следует предложить только АДТ в сочетании с терапией антиандрогеном или без него [98, 81, 257].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
У пациентов со стадией M1 при хорошем ответе на лечение необходимо проводить наблюдение каждые 3-6 месяцев. Оно должно включать как минимум сбор анамнеза заболевания, ПРИ, определение уровня ПСА, часто с дополнительным определением уровня гемоглобина, креатинина и щелочной фосфатазы. Также необходимо определять уровень тестостерона, особенно в течение первого года [98, 81, 257].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Интермиттирующее лечение следует предлагать только хорошо мотивированным пациентам со стадией М1 с выраженным ответом уровня ПСА после периода индукции [245, 246].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Уровень тестостерона в сыворотке крови <50 нг/дл или 1,7 нмоль/л в сочетании с:
• биохимическим прогрессированием: 3 последовательных повышения уровня ПСА с разницей в 1 неделю, с увеличением на 50 % в двух измерениях от надира, при уровне ПСА >2,0 нг/мл или.
• рентгенологическим прогрессированием: появление новых очагов: два и более новых очагов в костной ткани или очаг в мягких тканях согласно критериям RECIST (Критерии оценки ответа при солидных опухолях) [275]. Только симптоматическое прогрессирование должно быть поставлено под сомнение и подвергнуто дальнейшему исследованию. Этого недостаточно для диагностики КРРПЖ.
Неметастатический кастрационно-резистентный РПЖ.
Частое определение уровня ПСА у пациентов с РПЖ при проведении лечения с применением АДТ привело к более раннему выявлению биохимического прогрессирования. Приблизительно у одной трети из этих пациентов в течение двух лет возникнут костные метастазы, диагностируемые при сканировании костей [276].
У пациентов с развитием КРРПЖ и не определяемыми с использованием сканирования костей и КТ отдаленными метастазами исходный уровень значения ПСА, скорость нарастания ПСА и время удвоения (ВУ) ПСА были связаны с показателями выживаемости до развития первого костного метастаза и ОВ [276, 277]. Эти факторы могут быть использованы при принятии решения о том, какие пациенты должны получать терапию для предотвращения развития метастатического заболевания.
В двух крупных рандомизированных исследованиях фазы III: PROSPER [278] и SPARTAN [279] - оценивалась безметастатическая выживаемость (ВБМ - выживаемость до появления отдаленных метастазов) как первичная конечная точка у пациентов с неметастатическим кастрационно-резистентным РПЖ (КРРПЖ, M0), которые получали лечение энзалутамидом** (PROSPER) по сравнению с плацебо или апалутамидом** (SPARTAN) по сравнению с плацебо соответственно. Статус M0 устанавливали с помощью КТ и сканирования костей. В исследования были включены только пациенты с высоким риском развития метастазов с непродолжительным ВУ ПСА (≤10 месяцев). В обоих исследованиях продемонстрировано значимое улучшение показателей ВБМ (PROSPER: медиана ВБМ составила 36,6 месяца в группе энзалутамида** по сравнению с 14,7 месяца в группе плацебо [ОР для метастазов или смерти 0,29; 95 % ДИ: 0,24-0,35, p <0,001]; SPARTAN: медиана ВБМ составила 40,5 месяца в группе апалутамида** по сравнению с 16,2 месяца в группе плацебо [ОР для метастазов или смерти 0,28, 95 % ДИ: 0,23-0,35, p <0,001]). Время до симптоматического прогрессирования было достоверно выше при применении энзалутамида** (ОР 0,58; 95 % ДИ: 0,46-0,72, p <0,0001) и апалутамида** по сравнению с плацебо (ОР 0,45; 95 % ДИ: 0,32-0,63, p <0,001). Токсичность терапии с применением нового класса препаратов была минимальной.
Мониторинг ПСА раз в 3 месяца у мужчин при проведении АДТ рекомендуется для выявления биохимического прогрессирования до развития метастатической болезни [276, 277, 280].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
ВУ ПСА рекомендуется использовать при принятии решения о терапии пациентов с нмКРРПЖ [276, 277, 280].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. У пациентов с КРРПЖ и с отсутствием выявляемых метастазов ВУ ПСА является фактором, влияющим на риск появления отдаленных метастазов и общую выживаемость. ВУ ПСА ≤10 месяцев коррелирует с более высоким риском возникновения костных метастазов и смертностью.
Пациентам с нмКРРПЖ высокого риска (ВУ ПСА ≤10 месяцев) рекомендуется назначение апалутамида** или энзалутамида** в комбинации с АДТ [278, 279].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. В двух крупных рандомизированных контролируемых исследованиях III фазы с включением пациентов с нмКРРПЖ высокого риска (ВУ ПСА ≤10 месяцев) продемонстрировано значимое снижение риска развития метастазов при назначении апалутамида** или энзалутамида** в комбинации с АДТ по сравнению с плацебо и ГТ. В обоих исследованиях было показано, что добавление ингибиторов андрогеновых рецепторов к АДТ не приводит к усугублению токсичности, частота НЯ 3-4 степени была низкой в обоих исследованиях.
При ВУ ПСА ≤10 месяцев назначение в следующих дозировках:
Апалутамид** 240 мг раз в день перорально в комбинации с АДТ до прогрессии или развития непереносимой токсичности;
Энзалутамид** 160 мг раз в день перорально в комбинации с АДТ до прогрессии или развития непереносимой токсичности или смена гормональной терапии.
При ВУ ПСА >10 месяцев рекомендуется продолжение АДТ и динамическое наблюдение или смена гормонотерапии [276, 277, 280].
Метастатический кастрационно-резистентный РПЖ.
Стандартная андрогендепривационная терапия у пациентов с кастрационно-резистентным РПЖ.
В итоге, несмотря на кастрацию, у пациентов с РПЖ будут определяться признаки прогрессирования заболевания. В двух исследованиях показано только минимальное преимущество выживаемости у пациентов, продолжавших применение аналогов ЛГРГ во время терапии второй и третьей линии [281,282]. Однако, в отсутствие проспективных данных, незначительное потенциальное преимущество продолжения АДТ превосходит минимальный риск лечения. Кроме того, во всех рандомизированных исследованиях продолжалось применение андрогенной супрессии во всех последующих курсах лечения, по этой причине кастрационную терапию, направленную на снижение уровня эндогенного тестостерона, следует продолжить у всех пациентов с КРРПЖ.
Терапия первой линии метастатического кастрационно-резистентного РПЖ.
Абиратерона ацетат**.
Абиратерон** является одним из препаратов, рекомендованных для терапии пациентов с метастатическим КРРПЖ в первой линии (до применения доцетаксела**) [283].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии: оценка эффективности терапии с применением абиратерона ацетата** проводилась в исследовании сOU-AA-302 III фазы с участием 1088 пациентов с метастатическим КРРПЖ с бессимптомным течением или легкой симптоматикой заболевания, ранее не получавших химиотерапию. Пациентов рандомизировали в группы абиратерона ацетата** и плацебо, обе ‒ в комбинации с преднизоном [283]. Пациенты с висцеральными метастазами были исключены. Основными факторами стратификации были статус по шкале ECOG 0 или 1. Общая выживаемость и рентгенологическая ВБП (рВБП) являлись основной первичной конечной точкой. При медиане последующего наблюдения 22,2 месяца, наблюдалось значительное улучшение рВБП (медиана 16,5 по сравнению с 8,2 месяца, ОР: 0,52, p <0,001) при терапии абиратерона ацетатом**. На момент окончательного анализа данных с медианой последующего наблюдения 49,2 месяца конечная точка ОВ явилась статистически значимо лучшей в группе данного препарата (34,7 по сравнению с 30,3 месяца, ОР: 0,81, 95 % ДИ: 0,70-0,93; p = 0,0033) [284]. Нежелательные явления (НЯ), связанные с избытком минералокортикоидов и нарушением функции печени, чаще встречались в группе абиратерона ацетата**, но среди них преобладала токсичность 1-2 степени выраженности. При анализе в подгруппах исследования было показано, что препарат одинаково эффективен в пожилом возрасте (>75 лет) [285].
Энзалутамид**.
Энзалутамид** является одним из препаратов, рекомендованных для терапии пациентов метастатическим КРРПЖ в первой линии (до применения доцетаксела**) [286, 287].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии: рандомизированное исследование III фазы (PREVAIL) [288] включило сходные популяции пациентов с проведением сравнения энзалутамида** и плацебо. Пациенты с висцеральными метастазами включались в исследование, однако их количество было небольшим. Прием кортикостероидов был разрешен, но не являлся обязательным. Исследование PREVAIL было проведено с участием 1717 пациентов с мКРРПЖ, ранее не получавших химиотерапию, и продемонстрировало значимое улучшение рВБП (ОР: 0,186; ДИ: 0,15-0,23, p <0,0001) и ОВ (ОР: 0,706; ДИ: 0,6-0,84, p <0,001). Снижение уровня ПСА >50 % наблюдалось у 78 % пациентов. Наиболее распространенными клинически значимыми нежелательными явлениями были утомляемость и артериальная гипертензия. Энзалутамид** был одинаково эффективен и имел хорошую переносимость у пациентов в возрасте >75 лет [289], а также у пациентов с висцеральными метастазами или без них [290].
Энзалутамид** также сравнивали с бикалутамидом в дозе 50 мг 1 раз в сутки в рандомизированном двойном слепом исследовании II фазы (TERRAIN) [286], показано значимое улучшение ВБП (15,7 месяца по сравнению с 5,8 месяца, ОР: 0,44, p <0,0001) в пользу энзалутамида**. По результатам продолжительного последующего наблюдения и заключительного анализа преимущество в ОВ и рВБП было также подтверждено [287].
Доцетаксел**.
Доцетаксел** является одним из препаратов, рекомендованных для терапии пациентов с метастатическим КРРПЖ в первой линии, особенно в подгруппе пациентов с наличием висцеральных метастазов, коротким периодом эффективности инициальной АДТ и выраженным болевым синдромом [291, 292].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии: при проведении химиотерапии на основе доцетаксела** наблюдалось значимое увеличение медианы выживаемости на 2-2,9 месяца по сравнению с терапией митоксантроном в комбинации с преднизоном [291, 293]. Стандарт химиотерапии первой линии ‒ доцетаксел** в дозе 75 мг/м2 в виде внутривенной инфузии 1 раз в три недели в комбинации с преднизоном 5 мг 2 раза в сутки (2 р/сут), до 10 курсов. Преднизон может быть исключен при наличии противопоказаний либо отсутствии выраженных симптомов. Следующие независимые прогностические факторы: висцеральные метастазы, боль, анемия (Hb <13 г/дл), отрицательная динамика при остеосцинтиграфии и предшествующее применение эстрамустина могут помочь стратифицировать ответ на доцетаксел**. Пациентов распределили в три группы риска: низкого риска (0 или 1 фактор), промежуточного (2 фактора) и высокого риска (3 или 4 фактора) - и продемонстрировали оценку трех значимо различающихся медиан ОВ ‒ 25,7, 18,7 и 12,8 месяца, соответственно [294].
Примечание: возраст сам по себе не является противопоказанием к назначению доцетаксела** [295], однако, должно быть уделено внимание тщательному мониторингу и сопутствующим заболеваниям по причине высокого риска развития нейтропенических осложнений в данной когорте пациентов [296]. У пациентов с мКРРПЖ с невозможностью проведения стандартной схемы и дозы терапии, допускается применение доцетаксела** 50 мг/м2 в виде внутривенной инфузии 1 раз в 2 недели с учетом меньшей токсичности данного режима [292].
Терапия второй линии при мКРРПЖ.
У всех пациентов, получающих терапию по поводу мКРРПЖ, в итоге наблюдается прогрессирование заболевания по причине развития резистентности применяемому лечению. При переходе на новую линию терапии рекомендуется использовать лекарственные препараты с иным механизмом действия и отсутствием перекрестной резистентности.
Кабазитаксел**.
Кабазитаксел** является одним из препаратов, рекомендованных для терапии пациентов с метастатическим КРРПЖ во второй линии при прогрессировании заболевания после терапии доцетакселом, особенно в подгруппе пациентов с наличием висцеральных метастазов, коротким периодом эффективной терапии доцетакселом** и выраженным болевым синдромом [297-301].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии: кабазитаксел** является таксаном второго поколения с активностью при злокачественных новообразованиях, резистентных к доцетакселу. В крупном проспективном, рандомизированном исследовании III фазы (исследование TROPIC) было проведено сравнение эффективности комбинации кабазитаксела** с преднизоном относительно комбинации митоксантрона с преднизоном у 755 пациентов с мКРРПЖ, у которых отмечено прогрессирование заболевания после терапии доцетакселом** [297]. Пациенты получили максимум десять курсов кабазитаксела** (25 мг/м2 в виде внутривенных инфузий каждые 3 недели) или митоксантрона (12 мг/м2) в комбинации с преднизоном (10 мг/сутки). Первичной конечной точкой являлся показатель ОВ, который был значимо выше при применении кабазитаксела** (медиана ОВ: 15,1 по сравнению с 12,7 месяца p <0,0001). Также наблюдалось достоверное улучшение показателей ВБП (медиана ВБП: 2,8 по сравнению с 1,4 месяца, p <0,0001), частоты объективного ответа согласно критериям RECIST (14,4 % по сравнению с 4,4 %, p <0,005) и частоты ответов по уровню ПСА (39,2 % по сравнению с 17,8 %, p <0,0002). Связанные с лечением побочные эффекты 3-4 степени по ВОЗ значимо чаще развивались в группе кабазитаксела**, особенно проявления гематологической токсичности (68,2 % по сравнению с 47,3 %, p <0,0002), а также не гематологической (57,4 по сравнению с 39,8 %, p <0,0002) [298]. В двух постмаркетинговых исследованиях III фазы было показано, что кабазитаксел** не превосходит доцетаксел** при применении в качестве терапии 1-ой линии. При применении в качестве терапии 2-ой линии кабазитаксел** в дозе 20 мг/м2 был не менее эффективен, чем в дозе 25 мг/м2, но менее токсичен. Таким образом, следует отдавать предпочтение более низкой дозе, особенно в подгруппе пациентов с высоким риском развития нейтропенических осложнений [299, 300]. Предпочтительно кабазитаксел** следует назначать с профилактическим применением ГКСФ, также препарат должен применяться врачами, обладающими опытом лечения нейтропении и сепсиса [301].
Радий-223**.
Радия хлорид [223 Ra]** является одним из препаратов, рекомендованных для терапии пациентов с метастатическим КРРПЖ во второй линии при прогрессировании заболевания после терапии первой линии, включая подгруппу пациентов с наличием или отсутствием болевого синдрома (вне зависимости от выраженности болевого синдрома), костными поражениями и без висцеральных метастазов [302-305].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. Единственным специфическим для костной ткани препаратом, для которого показано преимущество в выживаемости, является α-излучающий радиофармпрепарат радия хлорид [223 Ra]**. В крупном исследовании III фазы (ALSYMPCA), включившем 921 пациента с симптоматическим мКРРПЖ, которых рандомизировали в группу получающих терапию радия хлоридом [223 Ra]** или плацебо в комбинации со стандартом терапии. Первичной конечной точкой была ОВ. В группе радия хлорида [223 Ra]** наблюдалось значимое улучшение медианы ОВ на 3,6 месяца (ОР: 0,70; p <0,001), также было продемонстрировано, что эффективность радионуклидной терапии радия хлоридом [223 Ra]** не зависела от предшествующего назначения доцетаксела** [302, 303]. Препарат также обеспечивал увеличение времени до первого костного осложнения (патологический перелом, компрессия спинного мозга), снижение выраженности болевого синдрома и улучшение качества жизни. Токсичность, связанная с применением радия хлорида [223 Ra]**, была незначительной и за исключением несколько более выраженной гематологической токсичности и диареи существенно не отличалась от группы плацебо [302]. Раннее назначение радия хлорида [223 Ra]** не лимитирует возможности дальнейшего использования химиотерапии. После завершения терапии в рамках исследования ALSYMPCA 23 % пациентов группы радионуклидной терапии и 21 % пациентов группы плацебо получали доцетаксел**.
В международное многоцентровое исследование IIIb фазы (iEAP) были включены 839 пациентов с КРРПЖ с 2 и более костно-метастатическими очагами, без висцеральных метастазов. Критерии включения допускали проведение радионуклидной терапии радия хлоридом [223 Ra]** пациентам без болевого синдрома, имеющим метастатическое поражение лимфатических узлов, ранее получавшим доцетаксел**, ингибиторы андрогенного сигнала или деносумаб**, а также пациенты, которым проводилась терапия ингибиторами андрогенного сигнала или деносумабом** в процессе лечения радия хлоридом [223 Ra]**. Результаты исследования iEAP соответствовали данным исследования ALSYMPCA. Медиана ОВ в группе радия хлорида [223 Ra]** составила 16 месяцев, время до роста основного маркера резорбции костной ткани ЩФ - 8 мес, время до прогрессирования уровня ПСА - 4 мес [304].
Применение радия хлорида [223 Ra]** в комбинации с абиратерона ацетатом** и преднизолоном не рекомендуется в связи с более высоким риском развития переломов и увеличением количества летальных исходов в группе комбинации абиратерона ацетата** и радия хлорида [223 Ra]**. В особенности это касалось пациентов без одновременного применения остеомодифицирующих препаратов [305].
Применение абиратерона** после предварительного применения доцетаксела**.
Абиратерон** является одним из препаратов, рекомендованных для терапии пациентов с метастатическим КРРПЖ во второй линии при прогрессировании заболевания после терапии доцетакселом** в подгруппе пациентов с отсутствием висцеральных метастазов и минимально выраженным болевым синдромом [306, 307].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. Сообщалось о положительных результатах, полученных в крупном исследовании сOU-AA-301 III фазы при медиане последующего наблюдения 12,8 месяца [306], которые были подтверждены в заключительном анализе [307]. Всего 1195 пациентов с мКРРПЖ рандомизированы в соотношении 2 :1 в группу абиратерона ацетата** в комбинации с преднизоном или в группу плацебо с преднизоном. У всех пациентов зарегистрировано прогрессирование заболевания после терапии доцетакселом**. Первичной конечной точкой была ОВ. При медиане наблюдения 20,2 месяца, медиана выживаемости в группе абиратерона ацетата** составила 15,8 месяца по сравнению с 11,2 месяца в группе плацебо (ОР: 0,74, p <0,0001). Преимущество наблюдалось во всех подгруппах пациентов. Токсичность терапии была низкой, нежелательные явления 3-4 степени встречались крайне редко, тем не менее, в группе абиратерона ацетата** чаще встречались побочные эффекты, связанные с минералокортикоидной активностью препарата, преимущественно 1-2 степени (задержка жидкости, отеки и гипокалиемия).
Применение энзатуламида** после доцетаксела**.
Энзалутамид** является одним из препаратов, рекомендованных для терапии пациентов с метастатическим КРРПЖ во второй линии при прогрессировании заболевания после терапии доцетакселом** [287, 308].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. Запланированный промежуточный анализ в исследовании AFFIRM был опубликован в 2012 г. [308]. В исследование включено 1199 пациентов с мКРРПЖ в соотношении 2 :1 в группу энзатуламида** или плацебо, соответственно. У всех пациентов наблюдалось прогрессирование заболевания после терапии доцетакселом**. Кортикостероиды были необязательными, но их назначение допускалось и их получали около 30 % пациентов. Первичной конечной точкой была ОВ. При медиане наблюдения 14,4 месяца медиана выживаемости в группе энзатуламида** составила 18,4 месяца по сравнению с 13,6 месяца в группе плацебо (ОР: 0,63; p <0,001). Преимущество в выживаемости наблюдалось независимо от возраста, исходной интенсивности боли и типа прогрессирования. В заключительном анализе с более длительным последующим наблюдением полученные результаты были подтверждены [287]. Энзалутамид** также был активен у пациентов с висцеральными метастазами. Токсичность терапии была низкой, при этом частота нежелательных явлений 3-4 в группе энзалутамида** была ниже, чем в группе плацебо. Нежелательным явлением особого интереса в группе энзалутамида** явились судороги, которые наблюдались у 0,6 % пациентов.
У пациентов, прогрессирующих на фоне терапии доцетакселом** и с наличием висцеральных метастазов, также возможно применение энзалутамида**.
Лечение мКРРПЖ после доцетаксела** и первой линии гормональной терапии.
Выбор дальнейшего лечения после применения доцетаксела** и первой линии гормональной терапии (абиратероном** или энзалутамидом**) при мКРРПЖ остается открытым [309]. Приемлемыми вариантами являются применение радия хлорида [223 Ra]** либо второй линии химиотерапии (кабазитаксел**). В целом, как ожидается, последующие курсы лечения у пациентов сплошной выборки будут иметь меньшее преимущество, чем при более раннем применении [310,311], а также имеются доказательства перекрестной резистентности между энзалутамидом** и абиратероном** [312, 313].
Олапариб**.
Олапариб** рекомендован для монотерапии мКРРПЖ с герминальными или соматическими мутациями генов, участвующих в репарации ДНК путем гомологичной рекомбинации, у пациентов с прогрессированием заболевания после терапии новыми гормональными препаратами (абиратероном** или энзалутамидом**) [314].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарии. В исследование III фазы PROfound по оценке эффективности и безопасности олапариба** по сравнению с терапией энзалутамидом** или абиратероном** у пациентов с мКРРПЖ и мутациями генов, участвующих в репарации ДНК путем гомологичной рекомбинации (HRR, homologous recombination repair) были включены пациенты с прогрессированием заболевания после терапии новыми гормональными препаратами. В исследовании были две когорты пациентов. Когорта A: пациенты с мутациями генов вRCA1, вRCA2, или ATM. Когорта в: пациенты с мутациями генов вARD1, вRIP1, сDK12, сHEK1, сHEK2, FANCL, PALB2, PPP2R2A, RAD51B, RAD51C, RAD51D, RAD54L. В когорте А лечение олапарибом** привело к статистически и клинически значимому улучшению рВБП (7,39 мес) по сравнению с энзалутамидом** или абиратероном** (3,55 мес) (ОР 0,34; 95 % ДИ, 0,25-0,47; р <0,0001). В общей популяции пациентов (когорты A + в) с мКРРПЖ с изменениями в генах, прямо или косвенно задействованных в HRR, применение олапариба** также приводило к статистически значимому и клинически важному улучшению рВБП (5,82 мес) по сравнению с энзалутамидом**/абиратероном** (3,52 мес) (ОР 0,49; 95 % ДИ, 0,38-0,63; р <0,0001) [314]. Согласно анализу зрелых данных, общая выживаемость (ОВ) в когорте A составила 19,09 мес для олапариба** в сравнении с 14,69 мес для энзалутамида**/абиратерона** (ОР, 0,69; 95 % ДИ, 0,50-0,97; р = 0,0175) [315]. Согласно промежуточному анализу, ОВ в когортах A + в составила - 17,51 мес для олапариба** в сравнении с 14,26 мес для энзалутамида**/абиратерона** (ОР, 0,67; 95 % ДИ, 0,49-0,93; р = 0,0063). Из числа пациентов, получавших энзалутамид**/абиратерон**, после прогрессирования 80,6 % пациентов в когорте А и 84,6 % пациентов в когорте В перешли на олапариб**. Наиболее частыми нежелательными явлениями (НЯ) (любой степени тяжести), зарегистрированными при применении олапариба**, были анемия (46,5 %), тошнота (41,4 %), утомляемость и астения (41,0 %), снижение аппетита (30,1 %) [314].
Таким образом, олапариб** является перспективной опцией терапии после лечения мКРРПЖ доцетакселом** и абиратероном** или энзалутамидом** и прогрессирования заболевания на фоне терапии данными препаратами у пациентов с мутациями генов, участвующих в репарации ДНК путем гомологичной рекомбинации. В исследовании III фазы PROfound все пациенты ранее получали энзалутамид** и/или абиратерон**, при этом была подгруппа пациентов, получавших ранее еще и таксаны. Результаты анализов в подгруппах установили превосходство олапариба (по рВБП и ОВ) над энзалутамидом**/абиратероном** у пациентов с мКРРПЖ независимо от того, получали они ранее таксаны или нет [316].
Пемброзилумаб** рекомендуется для применения у пациентов при некомплементарном дефиците репарации, независимо от происхождения опухоли, включая также РПЖ, в следующем режиме дозирования - в дозе 200 мг в/в в виде инфузии в течение 30 мин каждые 3 недели до прогрессирования или неприемлемой токсичности [317].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. В данном показании в РФ препарат пемброзилумаб** находится в состоянии регистрации.
Мониторинг лечения.
Исходные оценки должны включать анамнез и клиническое обследование, а также исходные анализы крови (ПСА, ОАК, показатели функции почек, печеночные пробы, ЩФ), остеосцинтиграфия и КТ грудной клетки, брюшной полости и таза [318]. Применение холина или ПСМА-ПЭТ/КТ при прогрессировании КРРПЖ полностью не изучено и, вероятнее всего, не представляет существенной пользы, как у пациентов с биохимическим рецидивом или у пациентов, ранее не получавших ГТ. Использование только уровня ПСА в мониторинге заболевания у пациентов с мКРРПЖ не является достаточно надежным [319, 320], так как висцеральные метастазы могут развиваться у мужчин без повышения уровня ПСА [321]. Вместо этого при проведении оценки течения заболевания рекомендуется комбинация сцинтиграфии костей и КТ-сканирования, измерение уровня ПСА и оценка клинического статуса пациента [293]. Не так давно большинство экспертов на консенсусе предложили регулярно пересматривать и повторять анализы крови один раз в два-три месяца, сцинтиграфию костей и КТ-сканирование по крайней мере один раз в шесть месяцев, даже при отсутствии клинических показаний [318]. Это отражает тот факт, что все препараты с доказанным преимуществом ОВ имеют потенциальную токсичность и значительную стоимость, а при отсутствии объективного преимущества лечение пациентов должно быть скорректировано. Большинство экспертов подчеркивают, что терапия не должна быть прекращена только на основании биохимического прогрессирования (рост ПСА). Вместо этого для прекращения терапии должны выполняться по крайней мере два из трех критериев (биохимическое прогрессирование (рост ПСА), рентгенологическое прогрессирование и клиническое ухудшение). В исследовательских целях, в обновленных рекомендациях PCWG3 больше внимания уделено важности документирования прогрессирования со стороны имеющихся очагов поражения и введена концепция «больше нет клинического преимущества» ‒ для того, чтобы подчеркнуть различие между первым доказательством прогрессирования и клинической потребностью в прекращении или изменении терапии [322]. По всей видимости, данные рекомендации также подходят для клинической практики вне исследований.
Последовательность терапии и ее продолжительность.
Сроки изменения лечения при мКРРПЖ остаются предметом дебатов, хотя имеются четкие рекомендации о незамедлительном начале или изменении лечения у пациентов с симптоматическим прогрессированием метастатического заболевания. Несмотря на увеличение количества эффективных методов лечения, по-прежнему отсутствуют данные прямого сравнения, а также оценки последовательности применения доступных препаратов. Таким образом, пока остается неясным, как осуществить выбор терапии «второй линии». В отсутствие других данных, в качестве приоритета последовательности лечения были использованы критерии включения из регистрационных исследований.
Для стратификации пациентов была использована шкала ECOG (оценка функционального статуса). В целом пациенты с ECOG 0-1 лучше переносят лечение и имеют большее преимущество, чем пациенты с ECOG ≥2. Тем не менее, важно, чтобы решения о лечении принимались индивидуально. В особенности это относится к случаям, когда симптомы, связанные с прогрессированием заболевания, определяются статусом по шкале ECOG. В таких случаях может быть целесообразным использование активных препаратов, продлевающих жизнь, чтобы установить, улучшит ли лечение функциональный статус пациента [318, 323].
Симптоматическое лечение при метастатическом кастрационно-резистентном РПЖ.
КРРПЖ обычно является инвалидизирующим заболеванием, часто поражающим пожилых мужчин. Необходим мультидисциплинарный подход с привлечением урологов, химиотерапевтов, радиационных онкологов, медсестер, психологов и социальных работников [324]. При рассмотрении вопроса о дополнительном системном лечении, включая лечение боли, запоров, анорексии, тошноты, слабости и депрессии, необходимо учитывать важнейшие вопросы паллиативного лечения.
Применение радиофармпрепаратов, основанных на бета-излучающих радионуклидах (самарий, 153Sm оксабифор, стронция хлорид [89Sr]) может быть рекомендовано в качестве средства длительного и стойкого подавления болевого синдрома, снижения потребности в анальгетиках и улучшения качества жизни [325-330]. Влияние данных препаратов на выживаемость без прогрессирования и общую выживаемость в рандомизированных исследованиях не изучено. Методика проведения радионуклидной терапии при метастазах в кости с болевым синдромом изложена в рекомендациях [325]. Отечественные принципы радионуклидной терапии при метастазах в кости бета-излучающими радиофармпрепаратами соответствуют международным рекомендациям [326].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Осложнения по причине наличия костных метастазов.
У большинства пациентов с мКРРПЖ костные метастазы сопровождаются выраженным болевым синдромом. ДЛТ обладает высокой эффективностью [331] даже в однократной фракции [332]. Проведение однократной инфузии бисфосфоната третьего поколения может быть рассмотрено при отсутствии ЛТ [333]. Распространенные осложнения из-за наличия костных метастазов включают переломы позвоночника со сдавлением спинного мозга и патологические переломы. Вертебропластика может быть эффективным методом лечения перелома позвоночника, независимо от его происхождения, оказывая положительное влияние как на боль, так и на качество жизни [334]. Тем не менее, по-прежнему важно рекомендовать проведение стандартных паллиативных хирургических вмешательств, которые могут быть эффективными при лечении остеобластических метастазов [335, 336]. Сдавление спинного мозга является неотложным состоянием. Оно должно быть диагностировано как можно раньше, а пациентов следует обучить распознаванию характерных признаков. При подозрении на данное состояние необходимо как можно скорее назначить высокие дозы кортикостероидов и выполнить МРТ позвоночника. Следует запланировать консультацию врача-нейрохирурга или врача-травматолога-ортопеда и обсудить возможность проведения декомпрессии с последующей ДЛТ [337]. В противном случае методом выбора является ДЛТ с системной терапией или без нее.
Предупреждение развития нежелательных явлений,.
Связанных с костными метастазами.
Применение бисфосфонатов.
Применение золедроновой кислоты** при мКРРПЖ в профилактике развития костных осложнений изучали в период, когда не было действенной противоопухолевой терапии, но применение доцетаксела** было доступно. В исследование включено 643 пациента с КРРПЖ [338] с костными метастазами, которых рандомизировали в группу получавших золедроновую кислоту** в дозе 4 мг или 8 мг один раз в три недели в течение пятнадцати последующих месяцев, или плацебо. Доза 8 мг не демонстрировала явных преимуществ и в связи с плохой переносимостью была уменьшена до 4 мг. Через 15 и 24 месяца последующего наблюдения у пациентов, получавших золедроновую кислоту** в дозе 4 мг, по сравнению с группой плацебо отмечено меньше костных осложнений (44 % по сравнению с 33 %, p = 0,021) и, в частности, меньше патологических переломов (13,1 % по сравнению с 22,1 %, p = 0,015). Кроме того, в группе золедроновой кислоты** отмечалось удлинение времени до первого костного осложнения. Ни в одном из проспективных исследований с бисфосфонатами не показано преимущества в выживаемости.
Ингибиторы лиганда RANK.
Деносумаб** ‒ человеческое моноклональное антитело к RANK-лиганду (лиганд рецептора-активатора ядерного фактора каппа-В), ключевого медиатора образования, функции и жизнедеятельности остеокластов. У пациентов с КРРПЖ с отсутствием отдаленных метастазов на фоне терапии данным препаратом в дозировке 60 мг отмечалось увеличение выживаемости без костных метастазов по сравнению с группой плацебо (медиана преимущества: 4,2 месяца, ОР: 0,85, p = 0,028) [337]. Тем не менее, это преимущество не отразилось на различии ОВ (43,9 по сравнению с 44,8 месяца, соответственно), и деносумаб** не был одобрен ни FDA, ни EMA для этого показания [339]. Однако деносумаб** 60 мг показал преимущество в лечении потери минеральной плотности костной ткани на фоне андроген-депривационной терапии по сравнению с плацебо, значительно снижая риск вертебральных переломов [340], и зарегистрирован по данному показанию в РФ и EMA и FDA.
В исследовании III фазы оценивали эффективность и безопасность деносумаба 120 мг** (n = 950) по сравнению с золедроновой кислотой** (n = 951) у пациентов с мКРРПЖ. Деносумаб** превосходит золедроновую кислоту** по времени развития или профилактики костных осложнений, определяемому по времени до развития первого осложнения (патологический перелом, облучение или операция на костях, или компрессия спинного мозга), 20,7 по сравнению с 17,1 месяца, соответственно (ОР: 0,82, p = 0,008). Тем не менее, эти результаты не отразились на преимуществе в выживаемости и при недавней ретроспективной повторной оценке конечных точек, однако деносумаб** продемонстрировал аналогичные результаты по преимуществу по сравнению с золедроновой кислотой при сравнении частоты развития симптоматических явлений со стороны костной системы как первого, так и последующих [341].
Для предотвращения осложнений со стороны костной системы пациентам с мКРРПЖ с костными метастазами рекомендуется применение остео-модифицирующих агентов (золедроновая кислота** или деносумаб**) [337-339, 341].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Примечание. Постоянно должна учитываться потенциальная токсичность бисфосфонатов и ингибиторов диганда RANK (например, остеонекроз нижней челюсти) (до 5 % при M0 КРРПЖ и до 8,2 % при мКРРПЖ, соответственно) [331, 337, 341, 342]. Перед началом терапии пациентам необходимо проходить стоматологическое обследование, риск некроза челюсти повышается при некоторых факторах риска, включая наличие травмы в анамнезе, операции на зубах или наличие одонтогенной инфекции [343]. Кроме того, риск остеонекроза челюсти возрастал при увеличении длительности применения препарата [344].
Помимо симптоматической лекарственной терапии возможно применение паллиативной лучевой терапии на метастатические очаги в костях с целью купирования болевого синдрома [345].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
Https://rosoncoweb.ru/standarts/RUS-SCO/2018/2018-35.pdf.
Принципы лечения и профилактики костных осложнений у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях» (коллектив авторов: Манзюк Л.В., Багрова С.Г., Копп М.В., Кутукова С.И., СемиглазоваТ.Ю. DOI: 10,18 027/2224-5057-2018-8-3s2-512-520).
Https://rosoncoweb.ru/stan-darts/RUSSCO/2018/2018-36.pdf.
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Лечение инфекционных осложнений фебрильной нейтропении и назначение колониестимулирующих факторов» (коллектив авторов: Сакаева Д.Д., Орлова Р.В., Шабаева М.М. DOI: 10,18 027/2224-5057-2018-8-3s2-521-530).
Https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-37.pdf.
Принципы профилактики и лечения гепатотоксичности у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Коррекция гепатотоксичности» (коллектив Ткаченко П.Е., Ивашкин В.Т., Маевская М.В. DOI: 10,18 027/2224-5057-2018-8-3s2-531-544).
Https://rosoncoweb.ru/stan-darts/RUSSCO/2018/2018-38.pdf.
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» (коллектив авторов: Виценя М.В., Агеев Ф.Т., Гиляров М.Ю., Овчинников А.Г., Орлова Р.В., Полтавская М.Г., Сычева Е.А. DOI: 10,18 027/2224-5057-2018-8-3s2-545-563).
Https://rosoncoweb.ru/stan-darts/RUSSCO/2018/2018-39.pdf.
Принципы профилактики и лечения кожных осложнений у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» (коллектив авторов: Королева И.А., Болотина Л.В., Гладков О.А., Горбунова В.А., Круглова Л.С., Манзюк Л.В., Орлова Р.В. DOI: 10,18 027 / 2224-5057-2018-8-3s2-564-574).
Https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-40.pdf.
Принципы нутритивной поддержки у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по нутритивной поддержке онкологических пациентов» (коллектив авторов: Сытов А.В., Лейдерман И.Н., Ломидзе С.В., Нехаев И.В., Хотеев А.Ж. DOI: 10,18 027 / 2224-5057-2018-8-3s2-575-583).
Https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-41.pdf.
Принципы профилактики и лечения нефротоксичности у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов» (коллектив авторов: Громова Е.Г., Бирюкова Л.С., Джумабаева Б.Т., Курмуков И.А. DOI: 10,18 027/2224-5057-2018-8-3s2-591-6030).
Https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-44.pdf.
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических пациентов» (коллектив авторов: Сомонова О.В., Антух Э.А., Елизарова А.Л., Матвеева И.И., Сельчук В.Ю., Черкасов В.А., DOI: 10,18 027/2224-5057-2018-8-3s2-604-609).
Https://rosoncoweb.ru/stan-darts/RUSSCO/2018/2018-45.pdf.
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Рекомендации по лечению последствий экстравазации противоопухолевых препаратов» (Буйденок Ю. В. DOI: 10,18 027/2224-5057-2018-8-3s2-610-616).
Https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-46.pdf.
Какие-либо изменения в привычном рационе пациентов нецелесообразны, если только они не продиктованы необходимостью коррекции коморбидных состояний или купирования или профилактики осложнений проводимого лечения (хирургического, лекарственного или лучевого) [346].
3,1 Тщательное наблюдение (отсроченное лечение).
Показания к проведению тщательного наблюдения:• локализованный РПЖ (Т1а-Т2сN0M0);
• ожидаемая продолжительность жизни пациента менее 10 лет (при TaG1-G2 менее 15 лет);
• высокодифференцированная опухоль;
• тяжелые сопутствующие заболевания.
При анализе результатов тактики отсроченного лечения отмечено, что 10-летняя опухолеспецифическая выживаемость пациентов с высоко и умеренно дифференцированными опухолями составляет 87 %, а пациентов с низкодифференцированными опухолями - 34 % [143]. Другие исследования продемонстрировали, что у пациентов с РПЖ со стадией Т1-2 и дифференцировкой опухоли ISUP ≤2 показатели опухолевоспецифической выживаемости составили 82-87 % и 80-95 % соответственно [144]. Риск смерти от РПЖ при проведении тщательного наблюдения в различных возрастных группах при дифференцировке опухоли 2-4 балла по шкале Глисона составляет 4-7 %, 5 баллов - 6-11 %, 6 баллов - 18-30 %, 7 баллов - 42-70 %, 8-10 баллов - 67-80 % ( уровень убедительности рекомендаций - С, уровень достоверности доказательств - 3) [145]. Исследование PIVOT не продемонстрировало преимуществ активного хирургического лечения пациентов с РПЖ низкого риска по сравнению с тщательным наблюдением при медиане наблюдения 12,7 лет [146].
Пациентам с выраженной сопутствующей патологией и ожидаемой продолжительностью жизни менее 10 лет рекомендована тактика тщательного наблюдения (отсроченного лечения) [134, 145].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Тактика тщательного наблюдения (отсроченного лечения) предполагает отказ от немедленного лечения пациента при выявлении РПЖ с динамическим наблюдением и проведением терапии при признаках прогрессирования болезни. Такой тактический вариант позволяет избежать осложнений и побочных реакций радикальных методов лечения.
При появлении признаков прогрессирования процесса и мотивированности или по желанию пациента, находящегося на тщательном наблюдении, к активному лечению рекомендовано гормональное лечение [147, 148].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарии. Пациента следует информировать, что немедленное начало гормонотерапии РПЖ приводит к более продолжительной опухолеспецифической выживаемости, чем при отсроченном начале лечения.
При предположительно локализованном РПЖ (N0, M0).
Молодым пациентам c умеренно дифференцированные опухолью (стадии Т1а, Т1b, T1c), находящимся на тщательном наблюдении, с ожидаемой продолжительностью жизни >10 лет рекомендуется периодическое проведение повторного анализа уровня ПСА, ТРУЗИ и биопсии с целью выявления признаков прогрессии заболевания [98, 149].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарии. Периодичность выполнения повторных исследований в настоящее время не определена, однако не должна быть менее 3 месяцев и более 12 месяцев.
Для пациентов с высоко и умеренно дифференцированной опухолью стадии T1b-T2b без клинических проявлений, с ожидаемой продолжительностью жизни <10 лет, находящихся на тщательном наблюдении, рекомендуется проведение повторного анализа уровня ПСА, ТРУЗИ и биопсии с целью выявления признаков прогрессии заболевания [98].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарии. Периодичность выполнения повторных исследований в настоящее время не определена, однако не должна быть менее 3 месяцев и более 12 месяцев.
3,2 Активное наблюдение.
Рекомендовано с целью уменьшения процента случаев излишнего лечения пациентам с клинически локализованным РПЖ группы очень низкого риска прогрессирования без отказа от радикального лечения, как при выжидательной тактике, активное наблюдение пациентов с уставленным диагнозом РПЖ очень низкого риска (ПСА <10 нг/мл, Глисон <7 баллов, менее 3 положительных биоптатов, опухоль в каждом биоптате не должна занимать площадь более 50 %, клиническая стадия сТ1с-Т2а) [150-152].Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарии. Термин «активное наблюдение» известен как «активный мониторинг», отражает консервативное лечение РПЖ. Термин принят в прошлом десятилетии и означает то, что нет необходимости в немедленном назначении лечения пациенту. За пациентом тщательно наблюдают и проводят лечение на заранее установленных этапах прогрессирования, определяемых такими параметрами, как короткое время удвоения уровня ПСА и ухудшение патоморфологических результатов при повторной биопсии. Тактика лечения при этом направлена на полное излечение пациента.
Активное наблюдение было предложено с целью уменьшения процента случаев излишнего лечения пациентов с клинически локализованным РПЖ группы очень низкого риска прогрессирования без отказа от радикального лечения, как при выжидательной тактике [153]. Проведен ряд дополнительных исследований активного наблюдения при клинически локализованном РПЖ (табл. 8, 9). Исследованиями подтверждено, что у отобранных по строгим показаниям пациентов с РПЖ группы очень низкого риска наблюдаются очень медленное прогрессирование и низкая смертность от рака, и только ограниченному числу пациентов требуется отсроченное радикальное лечение.
Таблица 8. Клинические исследования по активному наблюдению пациентов с локализованным раком предстательной железы, критерии включения.
| Автор | Число пациентов | Средний возраст | Критерии включения |
| Dall’Era | 321 | 64 | Глисон <3 + 3, ПСАd <0,15 нг/мл, T1-T2a, <33 % биоптатов +, <50 % положительных столбиков |
| Van den вerg | 616 | 66 | Глисон <3 + 3, ПСА <10 нг/мл, ПСАd <0,2 нг/мл, T1C-T2, <2 биоптатов + |
| Van As | 326 | 67 | Глисон <3 + 4, ПСА <15 нг/мл, T1-T2a, N0Nx, M0MX |
| Soloway | 230 | 64 | Глисон <6, ПСА <10 нг/мл, T1a-T2, <2 биоптатов +, <20 % столбиков + |
| Klotz | 453 | 70 | Глисон <6, ПСА <10 нг/мл (до 1999: СГ <3 + 4, ПСА <15 нг/мл) <3 биоптатов +, <50 % опухоли в каждом столбике |
| Tosoain | 769 | 66 | Глисон <3 + 3, ПСАd <0,15 нг/мл, T1, <2 биоптатов +, <50 % столбиков |
| Adamy | 238 | 64 | Глисон <3 + 3, ПСА <10 нг/мл, T1-T2a, <3 биоптатов +, <50 % столбиков |
Таблица 9. Клинические исследования по активному наблюдению пациентов с локализованным РПЖ (основные результаты).
| Автор | Средняя продолжительность наблюдения, мес | Прогрессирование | РПЭ, % | Выживаемость, % | |||
| Биопсия, % | ПСА/ ПСА DT | Кол-во пациентов | Общая | Раково-специфи-ческая | Без признаков прогрессии | ||
| Dall’Era | 47 | 35 | 5 | 8 | 97 | 100 | 54 |
| Van den вerg | 52 | - | 13 | 18 | 91 | 100 | 68 |
| Van As | 22 | 13 | 18 | 2 | 98 | 100 | 73 |
| Soloway | 32 | 10 | - | - | 100 | 100 | 86 |
| Klotz | 82 | 9 | 14 | 3 | 78,6 | 97,2 | 70 |
| Tosoain | 32 | 14 | - | 9 | 98 | 100 | 54 |
| Adamy | 22 | 13 | 14 | 11 | - | - | - |
Примечание. РПЭ - радикальная позадилонная простатэктомия; ПСА DT - время удвоения значения ПСА.
Критерии для начала лечения после активного наблюдения определены менее четко, однако для большинства групп рекомендовано использовать следующие:
• время удвоения ПСА с пороговым значением от 2 до 4 лет. Этот критерий ставится под сомнение из-за слабой связи между временем удвоения ПСА и степенью прогрессии опухоли при повторной биопсии;
• повышение суммы Глисона >7 при систематическом проведении последующих биопсий, проведенных с интервалом 1-4 года.
В таблице 10 продемонстрированы основные критерии активного наблюдения и отсроченного лечения.
Таблица 10. Определение активного наблюдения и отсроченного лечения [154].
| Активное наблюдение | Выжидательная тактика | |
| Цель лечения | Излечение | Паллиативное |
| Последующее наблюдение | Заранее установленная схема | С учетом состояния пациента |
| Оценка/применяемые маркеры | ТПИ, ПСА, повторная биопсия, мпМРТ | Заранее не определены |
| Ожидаемая продолжительность жизни | >10 лет | <10 лет |
| Цель | Минимизировать осложнения, связанные с токсичностью лечения, без ухудшения выживаемости | Минимизировать осложнения, связанные с токсичностью лечения |
| Комментарии | Только для пациентов с низким риском | Может применяться у пациентов с любой стадией |
Примечание. ТПИ - трансректальное пальцевое исследование; ПСА - простатспецифический антиген; мпМРТ - мультипараметрическая магнитно-резонансная томография.
3,3 Хирургическое лечение.
3,3,1 Радикальная простатэктомия.
В качестве одного из основных методов лечения пациентов с локализованным РПЖ рекомендовано выполнение РПЭ [134, 155-157].Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Оперативное лечение (радикальная простатэктомия) подразумевает удаление предстательной железы с ее капсулой, семенными пузырьками и участком мочеиспускательного канала с последующим формированием везикоуретрального анастомоза. Цель операции при локализованном и местнораспространенном неметастатическим РПЖ - полное излечение пациента.
Радикальное хирургическое лечение обычно выполняют у пациентов с РПЖ с ожидаемой продолжительностью жизни более 10 лет.
В таблице 11 представлены отдаленные результаты хирургического лечения пациентов с РПЖ.
Таблица 11. Отдаленные результаты хирургического лечения пациентов с РПЖ.
| Исследова-ние | Аббре-виатура | Популя-ция | Годы лечения | Медиана наблюде-ния (мес) | Группа риска РПЖ | ОСВ (%) |
| вill-Axelson и соавт., 2018 [155] | SPCG-4 | Период до примене-ния ПСА | 1989-1999 | 283 | Низкий и промежуточный риск | 80,4 (за 23 г.) |
| Wilt и соавт., 2017 [156] | PIVOT | Первые годы определе-ния ПСА | 1994-2002 | 152 | Низкий риск Промежуточ-ный риск | 95,9 91,5 (за 19,5 лет) |
| Hamdy и соавт., 2016 [157] | ProtecT | Скрининг в популяции | 1999-2009 | 120 | В основном низкий и промежуточный риск | 99 (за 10 лет) |
Варианты операционного доступа при выполнении радикальной простатэктомии:
• позадилонный;
• промежностный;
• лапароскопический/роботический.
В рандомизированном исследовании III фазы было показано, что роботассистированная РПЭ позволяет снизить время госпитализации и интраоперационную кровопотерю, а также обеспечивает более раннее восстановление континенции [158]. Тем не менее, в обновленных данных после анализа результатов наблюдения в течение 24 месяцев за пациентами с РПЖ после хирургического лечения не выявлено каких-либо существенных различий в функциональных результатах в зависимости от хирургического доступа (позадилонный, лапароскопический или роботассистированный) [159]. Статистически значимое влияние на функциональные и онкологические результаты хирургического лечения пациентов с РПЖ оказывал опыт хирурга, выполняющего операцию [160-162]. Также у хирургов, обладающих большим опытом выполнения операций, снижается показатель частоты выявления положительного края резекции [163, 164]. Таким образом, ни один из хирургических подходов не может быть рекомендован в качестве лучшего.
3,3,2 Тазовая лимфаденэктомия.
Рекомендуется выполнять расширенную ТЛАЭ при проведении РПЭ при риске метастатического поражения лимфоузлов >5 % [138].Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Комментарий. ТЛАЭ является наиболее точным методом оценки состояния тазовых лимфоузлов у пациентов с РПЖ. По объему выполняемой лимфодиссекции выделяют 3 основных вида ТЛАЭ: ограниченная, стандартная и расширенная. При выполнении стандартной ТЛАЭ удаляют жировую клетчатку с ЛУ между наружной и внутренней подвздошной артериями от уровня бифуркации общей подвздошной артерии до артерии, огибающей лонную кость (куперовой связки). Латеральной границей лимфодиссекции при этом является медиальный край наружной подвздошной артерии, медиальной - обтураторный нерв, задней - запирательная мышца. Во время стандартной лимфаденэктомии удаляют обтураторные и наружные подвздошные ЛУ. При ограниченной ТЛАЭ удаляют только ЛУ запирательной группы. Расширенная ТЛАЭ подразумевает дополнительное удаление клетчатки с лимфатическими узлами по ходу внутренних и общих подвздошных сосудов. По данным литературы, удаление данных групп лимфоузлов позволяет корректно простадировать РПЖ в 94 % случаев [139]. По данным некоторых авторов, выполнение ТЛАЭ во время РПЭ никак не влияет на онкологические результаты, в том числе выживаемость после операции [138]. Тем не менее, необходимо подчеркнуть важность выполнения расширенной ТЛАЭ для точного стадирования заболевания, так как ни один из диагностических методов на сегодняшний день не обладают достаточной чувствительностью и специфичностью для оценки состояния регионарных лимфоузлов [138]. Для определения риска наличия лимфогенных метастазов разработан ряд номограмм, основанных на предоперационных факторах прогноза. Наиболее известными являются номограммы вriganti [165, 166], номограмма Memorial Sloan Kettering сancer сenter (MSKCC) [167], формула Roach [168]. В случае выявления риска наличия лимфогенных метастазов, превышающего 5 %, обязательным является выполнение расширенной тазовой лимфаденэктомии [169, 170].
3,3,3 Тазовая лимфаденэктомия с определением сторожевых лимфоузлов.
В последнее время в клиническую практику внедрена методика оценки сторожевых ЛУ (СЛУ) у пациентов с РПЖ. ТЛАЭ с определением СЛУ у пациентов с РПЖ является относительно новым методом уточняющей диагностики лимфогенных метастазов. В основе метода лежит применение радиоизотопной лимфосцинтиграфии, при которой используют лимфотропный радиофармпрепарат (РФП), способный к избирательному накоплению в ткани ЛУ. Для выполнения данного исследования необходимо специальное материально-техническое обеспечение: оборудование радиоизотопной лаборатории, гамма-камера, детектор гамма-излучений, непосредственно РФП.Следует отметить, что основной целью ТЛАЭ с определением СЛУ является обнаружение и удаление всех СЛУ, в том числе расположенных и вне границ стандартной ТЛАЭ, чувствительность достигает 95,2 %, по данным мировой литературы [171]. Таким образом, обнаружение СЛУ у пациентов с РПЖ является важным диагностическим этапом при выполнении ТЛАЭ и способствует существенному улучшению ее диагностических результатов. Тем не менее, данная методика не относится к стандартным, существуют разногласия, касающиеся технических моментов процедуры (дозировка РФП, индекс накопления РФП для выполнения биопсии СЛУ ). Для включения методики в стандарты лечения, необходимо проведение рандомизированных проспективных исследований [172].
3,3,4 Нервосберегающая радикальная простатэктомия.
Рекомендуется выполнять нервосберегающую РПЭ у пациентов с локализованным РПЖ с низким риском экстракапсулярной инвазии опухоли и сохранной эректильной функцией [173, 174].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии: нервосберегающая РПЭ может быть рекомендована большинству мужчин с локализованным РПЖ низкого риска прогрессирования. Относительным противопоказанием к применению данной техники операции является высокий риск экстракапсулярной инвазии (стадия сТ2с, дифференцировка опухоли по данным биопсии ISUP >3). Применение валидированных номограмм для расчета риска экстракапсулярной инвазии опухоли позволяет принять решение о применении нервосберегающей техники РПЭ или об отказе от выполнения последней [175, 176]. Кроме номограмм для принятия решения о нервосберегающей операции рекомендовано выполнять мпМРТ с оценкой состояния сосудисто-нервных пучков [177].
3,3,5 Радикальная простатэктомия у пациентов с РПЖ с лимфогенными метастазами.
Рекомендуется выполнять РПЭ пациентам с клинически определяемыми метастазами в лимфоузлах (сN1) только в рамках клинических исследований [178].Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
Комментарии. Данные ряда проспективных исследований, сравнивающих показатели выживаемости пациентов с РПЖ с наличием лимфогенных метастазов (рN1), демонстрируют преимущество РПЭ в лечении данной категории пациентов в виде увеличения показателей выживаемости [178].
3,3,6 Неоадъювантная антиандрогенная терапия.
Не рекомендуется рутинное проведение неоадъювантного гормонального лечения перед РПЭ, так как оно не влияет на результаты лечения и исходы у пациентов с РПЭ [179, 180].Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
У пациентов с РПЖ стадии Т1-Т2 не рекомендуется проводить короткие (3 месяца) или длительные (9 месяца) курсы неоадъювантной терапии аналогами гонадотропин-рилизинг гормона [179].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. По данным нескольких исследований, применение неоадъювантной гормонотерапии позволило уменьшить число выявления местнораспространенных опухолей, снизить частоту выявления положительного хирургического края, а также снизить вероятность выявления метастазов в тазовых лимфоузлах, тем не менее, назначение неоадъювантной гормонотерапии никак не повлияло на показатели выживаемости (безрецидивная, опухолевоспецифическая) [179]. По этой причине проведение неоадъювантной гормональной терапии перед хирургическим лечением не рекомендуется в рутинной клинической практике.
3,3,7 Осложнения хирургического лечения пациентов с РПЖ.
Интра- и послеоперационные осложнения РПЭ в зависимости от типа доступа указаны в таблице 12 [181].Таблица 12. Интра- и послеоперационные осложнения РПЭ и РАЛП.
| Прогнозируемая вероятность явления | РАРП (%) | Лапароскопическая РПЭ (%) | РПП (%) |
| Стриктура шейки мочевого пузыря | 1,0 | 2,1 | 4,9 |
| Несостоятельность анастомоза | 1,0 | 4,4 | 3,3 |
| Инфекционные осложнения | 0,8 | 1,1 | 4,8 |
| Повреждение органа | 0,4 | 2,9 | 0,8 |
| Кишечная непроходимость | 1,1 | 2,4 | 0,3 |
| Тромбоз глубоких вен нижних конечностей | 0,6 | 0,2 | 1,4 |
| Частота осложнений в зависимости от степени тяжести | РАРП (%) | Лапароскопическая РПЭ (%) | РПП (%) |
| сlavien I | 2,1 | 4,1 | 4,2 |
| сlavien II | 3,9 | 7,2 | 17,5 |
| сlavien IIIa | 0,5 | 2,3 | 1,8 |
| сlavien IIIb | 0,9 | 3,6 | 2,5 |
| сlavien IVa | 0,6 | 0,8 | 2,1 |
| сlavien V | <0,1 | 0,2 | 0,2 |
Примечание. РАРП - робот-ассистированная РПЭ; РПЭ - радикальная простатэктомия; РПП - радикальная позадилонная простатэктомия.
Эректильная дисфункция развивается у всех пациентов после выполнения радикальной простатэктомии без применения нервосберегающей техники.
К наиболее частым осложнениям при выполнении расширенной ТЛАЭ относят образование лимфокист (10,3-19,8 %), а также тромбоз глубоких вен нижних конечностей (менее 1 %) [182-184].
3,3,8 Спасительная простатэктомия.
Пациентам с местным рецидивом после ДЛТ, незначительной сопутствующей патологией с целью локального контроля опухоли рекомендуется выполнение спасительной РПЭ в медицинских организациях, обладающих достаточным хирургическим опытом [185].Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. Выполнение спасительной РПЭ при местных рецидивах после ЛТ является оптимальным методом, позволяющим добиться удовлетворительных результатов и локального контроля опухоли. Тем не менее, следует учитывать, что риск возникновения осложнений и побочных эффектов при выполнении спасительной РПЭ значительно выше, чем при первичной операции ввиду фиброза и более медленной регенерации облученных тканей.
По данным обзора литературы, выполненного сhade и соавт., показано, что спасительная РПЭ позволяет добиться следующих результатов: показатели 5- и 10-летней выживаемости без биохимического рецидива в диапазоне 47-82 % и 28-53 % соответственно, а 10-летние показатели ОСВ и ОВ варьировали в пределах 70-83 % и 54-89 % соответственно. Наиболее значимыми предикторами локализованного характера рецидива, прогрессирования заболевания и ОСВ были уровень ПСА до спасительной РПЭ, а также дифференцировка опухоли по данным биопсии [186].
Спасительную РПЭ следует выполнять только отобранным пациентам с не выраженной сопутствующей патологией, ожидаемой продолжительностью жизни не менее 10 лет, уровнем ПСА до операции менее 10 нг/мл, дифференцировкой опухоли ISUP <2/3, отсутствием отдаленных метастазов до операции, клинической стадией ≤Т2 [186]. По данным мета-анализа, спасительная РПЭ ассоциирована с менее благоприятными исходами в плане развития недержания по сравнению с нехирургическими методами лечения [185].
3,4 Лучевая терапия.
Лучевая терапия (ЛТ) является одним из основных методов лечения рака предстательной железы (РПЖ) и может быть применена как в самостоятельном варианте, так и в качестве компонента комбинированного и комплексного лечения заболевания. Достижения последних десятилетий в области визуализации, развитие информационных технологий, совершенствование и внедрение в широкую клиническую практику современного радиотерапевтического оборудования, улучшение способов планирования лучевой терапии и подведения дозы позволяют обеспечить прецизионное облучение опухоли при минимальном воздействии на окружающие здоровые органы.Варианты лучевой терапии.
• По способу подведения ионизирующего излучения к опухоли:
А) дистанционная лучевая терапия;
Б) контактная лучевая терапия;
В) сочетанная лучевая терапия.
• По виду ионизирующего излучения:
А) квантовое (фотонное);
Б) корпускулярное (частицы).
В лечении рака предстательной железы применяются различные варианты ЛТ.
• Дистанционная лучевая терапия:
• фотонная:
- стандартная (2D, конвенциальная);
- конформная (3D);
- лучевая терапия с модуляцией интенсивности;
• корпускулярная:
- протонная (высокоэнергетические протоны);
- нейтронная (быстрые нейтроны).
• Внутритканевая лучевая терапия (брахитерапия):
А) брахитерапия с высокой мощностью дозы (высокомощностная, временная);
Б) брахитерапия с низкой мощностью дозы (низкомощностная, постоянная, непрерывная).
• Сочетанная лучевая терапия: сочетание двух вариантов подведения дозы - дистанционной лучевой терапии и брахитерапии.
В качестве радикального метода лечения локализованного РПЖ рекомендуется применение ЛТ в комбинации с гормональной терапией (как неадъювантной, так и адъюватной) с целью улучшения выживаемости пациентов [179,187].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
3,4,1 Дистанционная лучевая терапия (ДЛТ).
Наиболее распространенный способ лучевой терапии РПЖ - дистанционная лучевая терапия (ДЛТ).Показания к проведению ДЛТ при РПЖ:
• локализованный РПЖ (T1-T2N0M0);
• местнораспространенный РПЖ (T3-T4N0M0), в сочетании с гормональной терапией.
Противопоказания к ДЛТ при РПЖ:
• наличие сопутствующих инфекционно-воспалительных заболеваний мочеполовой системы, кишечника, свищей;
• предшествующее облучение области малого таза;
• постоянный уретральный катетер;
• инфравезикальная обструкция;
• «микроцистис»;
• сопутствующие соматические заболевания в стадии декомпенсации;
• психические расстройства;
• кахексия.
Преимущества ДЛТ:
• возможность полного излечения;
• доступность;
• меньше ограничений к применению (возраст, сопутствующие соматические заболевания );
• отсутствие периоперационных осложнений;
• возможность лечения амбулаторно.
Недостатки ДЛТ:
• длительность лечения (радикальные курсы лечения в режиме традиционного фракционирования до 1,5-2,0 месяцев);
• невозможность точного стадирования опухолевого процесса;
• невозможность излечения сопутствующей доброкачественной гиперплазии.
Конвенциональная ДЛТ при РПЖ.
Пациентам с локализованным РПЖ (T1-T2N0M0) в сочетании с гормональной терапией, пациентам с местнораспространенным РПЖ (T3-T4N0M0) рекомендуется проведение дистанционной лучевой терапии [179,187].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
При отсутствии возможности выполнения конформной (3D) ДЛТ рекомендовано проведение ДЛТ с использованием 2D планирования (конценциональной) при которых предстательная железа и семенные пузырьки идентифицируются, исходя из анатомического строения окружающих органов (костные структуры, контрастированные мочевой пузырь, прямая кишка) [187-189].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. При проведении конвенциональной ДЛТ применяют режим традиционного фракционирования дозы в разовой очаговой дозе (РОД) 1,8-2,0 Гр ежедневно, один раз в день, пять дней в неделю, до суммарной очаговой дозы (СОД) 65-70 Гр. При необходимости облучения регионарных лимфатических узлов СОД на область таза составляет 45-50 Гр [190].
Конформная ДЛТ при РПЖ.
Конформная ДЛТ (дистанционная лучевая терапия на медицинских ускорителях электронов) при РПЖ реализуется тормозным излучением высокоэнергетических линейных ускорителей электронов (ЛУЭ), укомплектованных многолепестковым коллиматором, после проведения объемного (3D) дозиметрического планирования.
Методика конформной лучевой терапии предусматривает реализацию последовательно выполняемых мероприятий:
• рентгено-топометрическая подготовка пациента на компьютерном томографе, в положении пациента, идентичном положению при облучении, с обязательным использованием иммобилизирующих приспособлений, обеспечивающих фиксацию пациента при его комфортном и функциональном положении;
• определение объемов облучения (на основе серии компьютерных томограмм, полученных при СКТ топометрии). Необходимо учитывать всю информацию, полученную при выполнении диагностических исследований, а также клинические, конституциональные, патоморфологические факторы;
• 3D дозиметрическое планирование лечения (ДЛТ);
• верификация позиционирования пациента;
• реализация сеансов ДЛТ.
Выбор тактики лечения РПЖ определяется принадлежностью пациента к той или иной прогностической группе [191].
Рекомендованы к применению следующие виды конформной ДЛТ: 3D-конформная лучевая терапия (3D-CRT), лучевая терапия с модуляцией интенсивности (IMRT), с визуальным контролем (IG-IMRT) - использование данных современных технологий ДЛТ в лечении РПЖ позволяет выполнять эскалацию дозы в опухоли, что приводит к улучшению результатов лечения (выживаемости), а снижение дозы на критические органы уменьшает риск развития осложнений [192-199].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Рекомендовано режим конформной лучевой терапии определять исходя из риска прогрессирования РПЖ:
• Низкий риск прогрессирования. Проведение конформной лучевой терапии в СОД 74-78 Гр. В объем облучения включают предстательную железу (± семенные пузырьки). Облучение лимфатических узлов таза и/или проведение гормональной терапии не показано.
• Промежуточный риск - проведение конформной лучевой терапии в СОД 74-78 Гр1 в сочетании с неоадъювантной2, сопутствующей и адъювантной гормональной терапией (в течение 4-6 месяцев). В объем облучения включают предстательную железу и семенные пузырьки3 [98].
• Высокий риск - проведение конформной лучевой терапии в СОД 74-81 Гр1 в сочетании с неоадъювантной2, сопутствующей и адъювантной гормональной терапией (в течение 24-36 месяцев). В объем облучения включают предстательную железу и семенные пузырьки3 [98, 200-211].
Уровень убедительности рекомендаций с (уровень достоверности доказательств -5).
Комментарии:
1Эскалация СОД ≥74 Гр способствует улучшению выживаемости у пациентов с РПЖ с промежуточным и высоким риском прогрессирования заболевания. С целью снижения риска развития лучевых осложнений при эскалации СОД рекомендовано применение технологии лучевой терапии с модуляцией интенсивности под контролем изображений (IG-IMRT).
2Назначение неоадъювантной гормональной терапии до начала ДЛТ у пациентов с РПЖ с промежуточным и высоким риском прогрессирования заболевания способствует уменьшению объема предстательной железы, купированию местных симптомов заболевания, снижению частоты развития лучевых осложнений.
3У пациентов с РПЖ с промежуточным и высоким риском прогрессирования заболевания при наличии дополнительных факторов неблагоприятного прогноза может быть рассмотрена целесообразность включения в объем облучения регионарных лимфатических узлов [98].
У пациентов с очень высоким риском прогрессирования рекомендовано проведение широкопольной лучевой терапии - сочетание облучения лимфатических коллекторов малого таза и дополнительного локального облучения семенных пузырьков, предстательной железы (с последовательным сокращением объема облучаемых тканей) [200].
При необходимости облучения регионарных лимфатических узлов объемы облучения определяют в соответствии с рекомендациями RTOG [201, 202].
Ограничения по дозам облучения на критические органы [203, 204].
Критическими структурами (органами риска) при проведении лучевой терапии РПЖ являются прямая кишка, мочевой пузырь, луковица полового члена, кишечник, головки бедренных костей. Оконтуривание органов риска осуществляется в соответствии с рекомендациями RTOG [205].
Оценка токсичности.
Острая и поздняя токсичность лечения оценивается в соответствии с классификациями RTOG/EORTC [206].
Гипофракционирование.
В последние годы обоснованно возрастает интерес к применению при лучевой терапии РПЖ режимов гипофракционирования, предусматривающих увеличение уменьшение количества фракций и времени лечения. В рандомизированных исследованиях при проведении лучевой терапии (IMRT, IGRT) изучены режимы умеренного гипофракционирования (в РОД 2,4-4,0 Гр за фракцию в течение 4-6 недель); получены данные о том, что эти режимы обладают эффективностью и токсичностью, вполне сопоставимыми с таковыми при традиционном фракционировании дозы [207-211]. Режимы умеренного гипофракционирования могут быть использованы при конформном облучении РПЖ, как альтернатива традиционному режиму, но при выполнении условий высокой прецизионности (точности) облучения мишени посредством использования технологий IGRT, IMRT.
Реализация режимов экстремального гипофракционирования, применяющихся при IG-IMRT (SBRT) и предусматривающих подведение РОД ≥6,5 Гр за несколько фракций, возможна только в специализированных центрах, обладающих соответствующим уровнем технического оснащения, подготовленным персоналом и клиническим опытом выполнения данной технологии [98].
Паллиативная лучевая терапия.
Пациентам при наличии распространенных форм заболевания с целью улучшения качества жизни (уменьшение дизурической симптоматики, болевого синдрома, гематурии) и максимально возможного в таких случаях терапевтического воздействия на опухоль предстательной железы рекомендуется применение паллиативной лучевой терапии [212].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Режим фракционирования - РОД 2-3 Гр, ежедневно, 1 раз в день, 5 дней в неделю, до СОД, эквивалентной 50 Гр. В случае достижения терапевтического эффекта после проведения паллиативного лечения и улучшения соматического состояния пациента необходимо рассматривать возможность продолжения лечения по радикальной программе.
Симптоматическая лучевая терапия.
Пациентам с РПЖ для купирования или уменьшения проявлений заболевания (болевой синдром при метастатическом поражении костей скелета) с целью улучшения качества жизни (уменьшение или купирование боли) рекомендуется применение симптоматической лучевой терапии [212-214].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. Режим фракционирования определяют конкретной клинической ситуацией, соматическим состоянием пациента.
Возможно применение нескольких режимов облучения:
• РОД 8 Гр, однократно;
• РОД 5 Гр, через день, 5 фракций, до СОД 25 Гр;
• РОД 4 Гр, ежедневно, 5 раз в неделю, 5-6 фракций, до СОД 20-24 Гр;
• РОД 3 Гр, ежедневно, 5 раз в неделю, 10 фракций, до СОД 30 Гр.
3,4,2 Брахитерапия (внутритканевая лучевая терапия).
Брахитерапия (БТ) заключается во введении (имплантации) радиоактивных источников непосредственно в ткань предстательной железы. При РПЖ применяют как низкомощностную (источник излучения постоянно находится в тканях), так и высокомощностную (источник излучения временно находится в тканях) БТ. Брахитерапия основана на временном или постоянном внедрении источников излучения в пораженный орган.В настоящее время брахитерапия в подгруппе пациентов низкого и промежуточного риска наравне с радикальной простатэктомией и дистанционной лучевой терапией является эффективным методом лечения рака предстательной железы [215-217].
Низкомощностная брахитерапия.
Показания к проведению низкомощностной брахитерапии при РПЖ:
• уровень ПСА ≤10 нг/мл;
• сумма баллов по Глисону 6 (3 + 3) либо 7 (3 + 4) менее 33 % биоптатов;
• клинически Т1c-Т2а, No, Mo;
• объем предстательной железы ≤50 cм3.
Противопоказания:
• абсолютные:
- наличие метастазов;
- ожидаемая продолжительность жизни пациента менее 5 лет;
• относительные:
- наличие простатита;
- большой размер предстательной железы;
- заболевания прямой кишки (язвенный колит, проктит );
- возраст пациента;
- выраженные дизурические явления (высокий балл по шкале IPSS, наличие большого количества остаточной мочи).
При локализованном РПЖ рекомендуется применение постоянной БТ, при которой в предстательную железу вводят радиоактивные источники I-125 (период полураспада 60 дней) или Pd-103 (период полураспада 17 дней) [216, 218].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Благодаря более гомогенному распределению ионизирующего излучения БТ позволяет подвести более высокую СОД к предстательной железе с меньшим лучевым воздействием на окружающие ткани, чем при проведении ДЛТ. Радиоактивные источники внедряют через промежность под контролем трансректального УЗИ. Рекомендуемые дозы для самостоятельной БТ при имплантации I-125 составляют 140-160 Гр и 110-125 Гр при имплантации Pd-103.
При использовании различных современных методик имплантации ТУР в анамнезе и объем предстательной железы не являются ограничением в проведении БТ [215, 216]. Проведенные исследования показали также, что наличие простатита не влияет на качество мочеиспускания после проведения имплантации [217], а воспалительные заболевания кишечника не приводят к увеличению гастроинтестинальной токсичности [219]. Возраст пациента также не является лимитирующим фактором при проведении БТ: переносимость процедуры практически сравнима для разных возрастных групп, а хорошие результаты безрецидивной выживаемости среди более молодых пациентов расширяют возможности применения методики [220].
Высокомощностная брахитерапия.
Высокомощностная брахитерапия подразумевает использование временных источников излучения с активностью от 1,200 сГр/час и выше. Наиболее часто в практике используется источник иридия-192 (Ir 192), имеющий период полураспада порядка 72 суток.
Использование высокомощностной брахитерапии (методика временной имплантации), предусматривающей извлечение радионуклидов после окончания облучения, по сравнению с постоянной имплантацией также нашла широкое применение в клинической практике. Это обусловлено тем, что данная технология позволяет более точно и равномерно формировать дозное поле во всем облучаемом объеме, проводить радикальное лечение как в самостоятельном варианте, так и в различных сочетаниях с ДЛТ.
Показания к проведению высокомощностной брахитерапии при РПЖ:
• уровень ПСА без верхней границы, но без наличия метастазовх;
• сумма баллов по Глисону до 10х;
• клинически Т1-Т3, No, Moх;
• объем предстательной железы ≤50 cм3 (больший объем не является противопоказанием).
Примечание. Х - имеется в виду возможность применения в сочетанном режиме (ДЛТ + БТ).
Противопоказания:
• абсолютные:
- наличие метастазов;
- невозможность проведения анестезии, нахождении в положении лежа;
- наличие прямокишечной фистулы;
• относительные:
- ТУР в анамнезе (проведение брахитерапии не ранее 6 месяцев после ТУР);
- уродинамические показания (кроме выраженных симптомов обструкции. IPSS >20, Qmax <10 мл/сек).
В отличие от низкомощностной брахитерапии данный метод лечения ввиду своих особенностей и преимуществ позволяет проводить лечение практически у всех пациентов с локализованным и местнораспространенным раком предстательной железы. С точки зрения современной радиобиологии, при проведении лучевой терапии РПЖ предпочтительно применение режимов гипофракционирования и, следовательно, высокомощностной брахитерапии, которая имеет потенциал быть более эффективной методикой по сравнению с традиционными технологиями лучевого лечения даже с эскалацией дозы, а также с низкомощностной брахитерапией.
Преимущества высокомощностной брахитерапии.
При сравнении методик высоко- и низкомощностной брахитерапии в лечении РПЖ, согласно рекомендациям Международного агентства по атомной энергии (МАГАТЭ) [221], высокомощностная внутритканевая лучевая терапия имеет ряд следующих преимуществ:
• устранение радиационных доз на персонал и посетителей;
• исключение подготовки и транспортировки источников для каждого пациента;
• меньший дискомфорт и более низкие риски тромбоэмболии, в связи с коротким временем пребывания пациента в литотомическом положении;
• оптимизация распределения дозы;
• возможность интеграции дистанционной лучевой терапии и высокомощностной брахитерапии, что приводит к сокращению общей продолжительности лечения и потенциально лучшему контролю за опухолью;
• более высокая пропускная способность пациентов в крупных специализированных центрах;
• более короткий период обучения персонала по сравнению с внедрением низкомощностной брахитерапии;
• отсутствие миграции источника относительно целевого объема в течение всего времени лучевого лечения;
• более эффективный потенциал оптимизации дозы-объема, связанный с технологией движения источника;
• меньшая токсичность из-за улучшенной защиты зон риска: уретра, прямая кишка и мочевой пузырь, а также луковица полового члена.
Недостатки высокомощностной брахитерапии.
Согласно тем же рекомендациям МАГАТЭ [221] у высокомощностной брахитерапии есть и ряд недостатков:
• необходимость обеспечения высокого уровня гарантии качества перед каждым применением высокомощностной брахитерапии, связанного с использованием в схеме лечения нескольких фракций, требующих повторного введения интрастатов;
• отсутствие сравнительных и проспективных рандомизированных исследований по качеству жизни;
• неясная экономическая выгода по сравнению с низкомощностной брахитерапией. Однако при высокой пропускной способности центра монотерапия 192Ir имеет экономическое преимущество.
Режимы проведения высокомощностной брахитерапии.
Высокомощностная БТ может выполняться как самостоятельный метод лечения пациентов с РПЖ из группы низкого и промежуточного риска, так и в сочетании с ДЛТ при лечении пациентов локализованным РПЖ из группы высокого риска.
В клинической практике при проведении высокомощностной БТ в режиме монотерапии наиболее часто используются следующие режимы подведения дозы:
1 имплантация - 1 фракция по 19 Гр, 2 фракции по 12-15 Гр, 3 фракции по 10-11,5 Гр, 4 фракции по 8,5-9,5 Гр, 6 фракций по 6,5-7 Гр;
2 имплантации - 2 фракции по 12-15 Гр, 6 фракций по 6,5-7 Гр;
3 имплантации - 3 фракции по 10-11,5 Гр.
Высокомощностная БТ с использованием 2-х и более имплантаций характеризуется высокой эффективностью и хорошей переносимостью. При осуществлении этой технологии стандартный интервал между имплантациями составляет от 1 до 3 недель.
В настоящее время подведение 19 Гр за 1 фракцию может быть рекомендовано только в рамках исследовательских протоколов.
При проведении высокомощностной БТ в качестве компонента сочетанного лучевого лечения пациентов с РПЖ из группы промежуточного и высокого риска часто применяются следующие режимы подведения дозы: 16 Гр за 3 фракции, 11-22 Гр за 2 фракции и 12-15 Гр за одну фракцию. Имеются доказательства эквивалентной эффективности и сопоставимой низкой токсичности высокомощностной БТ в режимах: 1 фракция 15 Гр и 2 фракции по 10 Гр.
Рекомендуемыми режимами подведения дозы при выполнении высокомощностной БТ в режиме монотерапии являются: 2 фракции (2 имплантации) по 10-15 Гр каждая; 3 фракции (3 имплантации) по 10-11,5 Гр каждая. Во всех случаях суммарная доза на предстательную железу (λ/β = 1,5-3) должна быть не менее дозы, эквивалентной 100 Гр в режиме обычного (2 Гр) фракционирования [218].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
При использовании высокомощностной БТ как этапа сочетанной лучевой терапии рекомендован режим - 1 фракция 15 Гр [218].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Пациентам с рецидивом рака предстательной железы после проведенной дистанционной лучевой терапии или брахитерапии, а также у пациентов после нерадикально выполненной простатэктомии рекомендуется проведение спасительной (сальважной) низкомощностной или высокомощностной брахитерапии [218, 222, 223].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. При применении спасительной высокомощностной брахитерапии Ir-192 можно выделить следующие преимущества - во-первых, уменьшается суммарная очаговая доза с 60-70 Гр при традиционной спасительной дистанционной лучевой терапии до 15-18 Гр при спасительной высокомощностной брахитерапии, без потери летального радиобиологического эффекта на рецидивные клетки рака предстательной железы, что в свою очередь значимо уменьшает лучевые нагрузки на критические органы и тем самым снижает риск развития лучевых повреждений; во-вторых, в отличие от гормональной терапии, спасительная высокомощностная брахитерапия является радикальным методом лечения рецидива рака предстательной железы.
Следует отметить, что спасительная брахитерапия должна выполняться в специализированных центрах, имеющих большой опыт проведения процедур брахитерапии.
3,5 Лекарственная терапия.
Выбор лекарственной терапии определяется в конкретной клинической ситуации в соответствии с инструкциями по медицинскому применению конкретных лекарственных препаратов, наличием показаний к применению и противопоказаний у пациента.3,5,1 Факторы прогноза выживаемости пациентов РПЖ с впервые выявленным метастатическим РПЖ.
Медиана выживаемости пациентов с впервые выявленным метастатическим РПЖ составляет около 42 месяцев [224]. Однако данная популяция пациентов является неоднородной. Предложен ряд прогностических факторов выживаемости, включая количество и локализацию костных метастазов, наличие висцеральных метастазов, группа ISUP, распространенность заболевания (малый или большой объем поражения), уровень ПСА через 7 мес от момента начала терапии [225-228].Таблица 13. Прогностические факторы на основании исследования SWOG 9346 [229].
| ПСА после 7 месяцев кастрации | Медиана выживаемости |
| <0,2 нг/мл | 75 месяцев |
| 0,2-4 нг/мл | 44 месяц |
| >4 нг/мл | 13 месяцев |
3,5,2 Гормональная терапия первой линии.
Первичная АДТ является стандартом помощи на протяжении более 50 лет [230]. Отсутствуют доказательства 1 уровня, подтверждающие преимущество конкретного вида ГТ: орхиэктомии, применения агонистов ЛГРГ или антагонистов ЛГРГ. Исключение составляют пациенты с угрожающей компрессией спинного мозга, для которых предпочтительными вариантами являются двусторонняя орхиэктомия или применение антагонистов ЛГРГ.По данным современных методов диагностики, уровень тестостерона после хирургической кастрации составляет 15 нг/дл. В нескольких исследованиях было показано, что при более низком уровне тестостерона результаты лечения стабильно выше, чем при традиционном уровне <50 нг/дл (1,7 нмоль/л). В связи с этим современным кастрационным уровнем тестостерона считается уровень <20 нг/дл (0,7 нмоль/л). При этом кастрационный уровень, рассматриваемый регуляторными органами и используемый в клинических исследованиях по АДТ при РПЖ, по-прежнему остается <50 нг/дл (1,7 ммоль/л).
Агонисты лютеинизирующего гормона рилизинг-гормона.
Рекомендуется назначение синтетических аналогов гонадотропин рилизинг-гормона (код АТХ H01 - Гормоны гипоталамуса и гипофиза и их аналоги) (медикаментозная кастрация) при наличии показаний и отсутствии противопоказаний, поскольку данный метод является равноэффективным хирургической кастрации [231].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. В основе механизма действия агонистов ЛГРГ лежит десенсибилизация рецепторов к рилизинг-гормону, ведущая к снижению продукции лютеинизирующего гормона гипофиза и в дальнейшем к снижению выработки тестостерона клетками Лейдига в яичках. После введения агонистов ЛГРГ отмечают кратковременное повышение концентрации тестостерона на 3-5-й день (синдром вспышки) с последующим снижением ее до посткастрационного уровня на 21-28-й день. Для профилактики синдрома вспышки у пациентов с метастатическим РПЖ перед введением агониста ЛГРГ и в течение 1-й недели терапии следует назначать антиандрогены.
Побочные эффекты и осложнения терапии агонистами ЛГРГ такие же, как при хирургической кастрации.
Показания к применению агонистов ЛГРГ:
• локализованный РПЖ (Т1-2N0M0) - при невозможности или отказе пациента от проведения радикального лечения (как при наличии, так и в отсутствии симптомов, при времени удвоения ПСА менее 12 месяцев и уровне общего ПСА более 50 нг/мл, а также в случае наличия низкодифференцированной опухоли) или в качестве неоадъювантной терапии перед радикальным лучевым лечением;
• местно-распространенный РПЖ (T3-4N0M0) - в качестве самостоятельного лечения или неоадъювантной и адъювантной терапии в сочетании с хирургическим или лучевым лечением;
• метастатический РПЖ (T1-4N1M0, N1-4N0M1).
Для лечения РПЖ рекомендуется применение агонистов ЛГРГ [231, 232].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии:
Применяются следующие режимы терапии:
Гозерелин** 3,6 мг под кожу передней брюшной стенки 1 раз в 28 дней или 10,8 мг под кожу передней брюшной стенки 1 раз в 3 мес; лекарственный препарат находится в депонированной форме в шприц-тюбике, готов к употреблению.
Лейпрорелин** 3,75 мг или 7,5 мг, или 11,25 мг, или 22,5 мг, или 45 мг в зависимости от длительности действия и формы выпуска (производителя).
Трипторелин** 3,75 мг внутримышечно 1 раз в 28 дней или Трипторелин** 11,25 мг внутримышечно или подкожно 1 раз в 3 месяца; лекарственный препарат растворяют непосредственно перед инъекцией, вводят в виде суспензии.
Бусерелин** 3,75 мг внутримышечно 1 раз в 28 дней; лекарственный препарат растворяют непосредственно перед инъекцией, вводят в виде суспензии.
Крупных рандомизированных плацебо-контролируемых исследований с препаратом бусерелин проведено не было.
Лечение агонистами ЛГРГ проводят длительно, до развития рефрактерности к гормональному воздействию. Некоторые авторы рекомендуют применение агонистов ЛГРГ в режиме прерывистой (интермиттирующей) терапии, однако эффективность интермиттирующей блокады остается дискутабельной.
Антагонисты лютеинизирующего гормона рилизинг-гормона.
В отличие от агонистов ЛГРГ, антагонисты конкурентно связываются с ЛГРГ рецепторами в гипофизе; при этом не возникает эффекта «вспышки».
Дегареликс**. Наиболее изученный антагонист ЛГРГ для подкожного введения 1 раз в месяц.
Основываясь на результатах крупного рандомизированного исследования (n = 610), стандартная доза дегареликса** должна составлять 240 мг в первый месяц с последующим применением инъекций по 80 мг ежемесячно. Основным специфическим побочным эффектом дегареликса** является боль в зоне инъекции (средней или легкой степени), выявленная у 40 % пациентов преимущественно после первого введения.
Объединенные данные шести проспективных рандомизированных исследований фазы III, в которых приняли участие 2328 мужчин в период с 2005 по 2012 гг., по сравнительной оценке эффективности агонистов ЛГРГ в сравнении с антагонистами были проанализированы для установления возможных различий в развитии сердечно-сосудистых заболеваний после начала приема агонистов гонадотропин-рилизинг гормона в сравнении с применением антагонистов ЛГРГ (дегареликса**). В сравнении с агонистами ЛГРГ применение антагониста ЛГРГ дегареликса** приводило к уменьшению числа сердечно-сосудистых явлений на 56 % у пациентов с РПЖ, имевших сердечно-сосудистые заболевания в анамнезе [233].
Данная гипотеза была подтверждена данными проспективного рандомизированного исследования II фазы, сравнивающем агонисты и антагонисты ЛГРГ у пациентов с распространенным РПЖ, имеющих заболевания сердца в анамнезе. Пациенты, получавшие антагонисты ЛГРГ, имели достоверно меньше событий со стороны сердца в течение одного года терапии в сравнении с агонистами ЛГРГ [234]. Исследование III фазы, PRONOUNCE [235], в настоящее время проходит для получения дополнительного подтверждения данных, полученных в рамках данного исследования.
В рамках исследования сS21 дополнительно проводился анализ эффективности проводимого лечения в отношении концентраций щелочной фосфатазы. Исходный уровень С-ЩФ был высоким у пациентов с метастатической стадией заболевания. У пациентов с метастатической стадией заболевания или у пациентов с исходным уровнем ПСА ≥50 нг/мл выраженное снижение уровня С-ЩФ отмечалось при приеме дегареликса по сравнению с группой агониста ЛГРГ. В отличие от пациентов группы агониста ЛГРГ, у пациентов группы терапии дегареликсом низкий уровень С-ЩФ сохранялся на протяжении всего периода исследования [236].
У пациентов с первыми признаками компрессии спинного мозга или инфравезикальной обструкцией рекомендуется применение антагонистов ЛГРГ (дегареликс**) [236, 237].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
АДТ с применением нестероидных антиандрогенов.
На основании Кокрановского систематического обзора терапия с применением нестероидных антиандрогенов (НСАА) в монорежиме по сравнению с кастрацией (медикаментозной или хирургической) явилась менее эффективным видом терапии с точки зрения ОВ, клинического прогрессирования, неэффективности лечения и прекращения терапии вследствие нежелательных явлений [232].
Пациентам со стадией М1, получающим лечение агонистами ЛГРГ, для снижения риска возникновения эффекта «вспышки» рекомендуется начальная краткосрочная терапия антиандрогенами (АТХ G03HB Антиандрогены и эстрогены) [232, 238-241].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
У пациентов со стадией заболевания М1 терапия только с применением антиандрогенов (в монорежиме) не рекомендуется [232].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Сравнение интермиттирующей и непрерывной антиандрогенной терапии.
Клиническую эффективность интермиттирующей антиандрогенной гормональной терапии (ИГТ) рассматривали в трех независимых обзорах [242-244] и двух мета-анализах [245, 246]. Все указанные обзоры содержали данные восьми рандомизированных клинических исследований, из которых только три были проведены у пациентов исключительно при наличии отдаленных метастазов (M1). Пять оставшихся исследований включали различные группы пациентов, преимущественно с местным распространением опухоли или рецидивом заболевания.
Исследование SWOG 9346 является самым крупным, оценивщим эффективность ИГТ у пациентов со стадией M1b [247]. Из 3040 пациентов, прошедших скрининг, в итоге только 1535 пациентов соответствовали критериям включения. Это подчеркивает, что только около 50 % пациентов со стадией M1b с наилучшим ответом по ПСА на индукционный курс АДТ подойдут для проведения интермиттирующего режима. Исследование было спланировано с целью демонстрации сопоставимых результатов ИГТ и постоянной андрогендепривационной терапии, что было достигнуто в качестве первичной конечной точки, тем не менее полностью исключить меньшую выживаемость при применении ИГТ на основании результатов данного исследования не представляется возможным.
Другие исследования не продемонстрировали никакого различия выживаемости с общим отношением рисков для ОВ 1,02 (0,94-1,11) [242]. По материалам данных обзоров и мета-анализов пришли к заключению, что различие в ОВ или ОСВ между ИГТ и постоянной гормональной терапией (ПГТ) маловероятно. В недавно проведенном обзоре имеющихся данных исследования фазы III подчеркиваются ограничения в большинстве исследований и предлагается с осторожностью интерпретировать результаты анализа не меньшей эффективности [248]. Ни в одном из исследований, в которых проводилось сравнение ИГТ и ПГТ у пациентов с M1, не показано преимущества выживаемости, однако при ПГТ отмечена тенденция в плане улучшения ОВ и ВБП (выживаемости без прогрессирования заболевания). Большинство из этих исследований, тем не менее, были исследованиями не меньшей эффективности, спланированными с целью показать сопоставимые результаты. В отдельных когортах отрицательное воздействие на половую функцию было менее выраженным при проведении ИГТ. Существует тенденция в пользу ИГТ с точки зрения качества жизни, особенно относительно связанных с исследуемой терапией побочных эффектов, таких как приливы [249, 250].
Таким образом, отсутствие каких-либо преимуществ относительно выживаемости у пациентов с M1, демонстрирует, что ИГТ следует рассматривать в качестве варианта для хорошо информированного пациента, обеспокоенного значимыми побочными эффектами терапии.
Пороговое значение уровня ПСА, при котором АДТ должна быть прекращена или продолжена в качестве ИААД, еще необходимо определить в проспективных исследованиях [243, 251]. Тем не менее, среди большого количества авторов существует консенсус по следующим утверждениям:
ИГТ основана на интермиттирующей кастрации; в связи с этим, допустимым является применение только препаратов, приводящих к кастрации.
Применение антагонистов ЛГРГ может являться альтернативой применению агонистов.
Цикл индукционной АДТ не должен превышать 9 месяцев, в противном случае восстановление уровня тестостерона маловероятно.
Антиандрогенная терапия должна быть прекращена только при выполнении всех следующих критериев:
- пациент хорошо информирован и привержен лечению;
- отсутствует клиническое прогрессирование;
- имеется четкий ответ уровня ПСА на терапию, эмпирически установленный уровень ПСА при метастатическом заболевании менее 4 нг/мл.
Тщательное последующее наблюдение является обязательным и должно включать клиническое обследование каждые 3-6 месяцев. По мере прогрессирования заболевания должно быть более частым последующее наблюдение.
Измерение уровня ПСА должно всегда проводиться одной и той же лабораторией.
Терапию возобновляют при клиническом прогрессировании у пациента или превышении предварительно определенного (установленного эмпирически) порогового значения уровня ПСА: как правило, у пациентов со стадией М1 при уровне 10-20 нг/мл.
Продолжительность курсов АДТ составляет не менее 3‒6 месяцев.
Последующие циклы терапии основаны на тех же принципах до появления первых признаков резистентности к кастрации.
Еще предстоит определить группу пациентов, которым ИГТ приносит максимальную пользу, однако наиболее важным фактором, вероятно, является ответ на первый цикл ИГТ, например, ответ на лечение по уровню ПСА [243].
Интермиттирующее лечение следует предлагать только хорошо мотивированным пациентам со стадией М1 с выраженным ответом уровня ПСА после периода индукции.
Немедленная андрогендепривационная терапия по сравнению с отсроченной.
У пациентов с наличием симптомов немедленная терапия является обязательной. Однако, вследствие отсутствия исследований хорошего качества, еще существует противоречие в отношении пациентов с метастатическим РПЖ без симптомов. По данным ряда исследований немедленная АДТ не приводила к улучшению ОСВ, хотя проведение немедленной АДТ значимо снижало риск прогрессирования заболевания [232, 252,253].
У пациентов со стадией М1 с наличием симптомов рекомендуется немедленная системная андрогендепривационная терапия, направленная на облегчение симптомов и уменьшение риска потенциальных серьезных осложнений прогрессирующего заболевания (компрессия спинного мозга, патологические переломы, обструкция мочеточника) [352, 253].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
У пациентов со стадией М1 без симптомов опухоли рекомендуется немедленная андрогендепривационная системная терапия, направленная на улучшение выживаемости, замедление прогрессирования до развития симптомов болезни и предотвращение серьезных осложнений, связанных с прогрессированием заболевания [252, 253].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
3,5,3 Комбинированная терапия.
Полная блокада андрогенов (максимальная андрогеновая блокада. МАБ).В крупном рандомизированном исследовании, включившем 1286 пациентов с M1b, не установлено различия между хирургической кастрацией с флутамидом или без него [254]. Однако при применении других антиандрогенов или методов кастрации результаты различались, а в систематических обзорах было показано, что МАБ с применением нестероидных антиандрогенов обеспечивает небольшое преимущество в выживаемости (<5 %) по сравнению с монотерапией (хирургическая кастрация или применение агонистов ЛГРГ) [255, 256] после пяти лет проводимой терапии [257], в то же время, это минимальное преимущество в небольшой подгруппе пациентов должно быть взвешено относительноувеличения частоты побочных эффектов, связанных с долгосрочным применением нестероидных антиандрогенов.
Андрогендепривационная терапия в комбинации с другими препаратами.
Комбинация с абиратерона ацетатом**.
В двух крупных рандомизированных исследованиях (STAMPEDE, LATITUDE) изучали добавление к АДТ абиратерона** ( см приложение А3) (1000 мг в сутки) с преднизоном (5 мг в сутки) у пациентов с метастатическим гормон-чувствительным РПЖ (мГЧРПЖ) [258]. Основная цель данных исследований состояла в улучшении ОВ. Оба исследования продемонстрировали достоверное улучшение ОВ, однако в исследовании LATITUDE с ОР 0,62 (0,51-0,76) только в подгруппе пациентов с большим объемом метастатического поражения. Значения ОР в исследовании STAMPEDE были очень сходны с 0,63 (0,52-0,76) в общей популяции пациентов [258]. Все дополнительные цели, такие как ВБП, время до радиологического прогрессирования, время до появления боли или время до начала химиотерапии, имели положительное значение с преимуществом в группе комбинированной терапии. Статистически достоверных различий количества, связанных с лечением случаев смерти не наблюдалось при применении комбинации АДТ с абиратероном** и преднизоном по сравнению с АДТ [ОР: 1,37 (0,82-2,29)]. Тем не менее, вдвое большее количество пациентов прекратили терапию досрочно по причине токсичности в подгруппах, получавших комбинацию в исследовании STAMPEDE (20 %), по сравнению с исследованием LATITUDE (12 %). На основании этих данных абиратерон** в комбинации с преднизоном в сочетании с АДТ следует рассматривать в качестве стандарта терапии первой линии у пациентов с метастатическим гормон-чувствительным РПЖ [259].
У пациентов с РПЖ со стадией М1, которые могут перенести данную схему лечения, предлагают АДТ в комбинации с абиратероном** 1000 мг в сутки за один прием натощак ежедневно до прогрессирования заболевания или развития непереносимой токсичности в сочетании с преднизоном 5 мг в сутки [241].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии. В настоящее время данное показание к применению абиратерона** находится в процессе регистрации в РФ.
Андрогендепривационная терапия в комбинации с химиотерапией.
Проведено 3 крупных рандомизированных исследования [228, 260, 261]. Во всех проводили сравнение только кастрационной ГТ, как стандартом терапии, с подгруппой пациентов, получавших АДТ в комбинации с доцетакселом** (75 мг/м2, 1 раз в три недели, химиотерапию начинали не позднее трех месяцев от начала ГТ, длительность проводимой терапии - 6 курсов, сопутствующее применение преднизолона не являлось обязательным). Основной целью во всех трех исследованиях явилась оценка ОВ.
В исследование GETUG 15 включены пациенты с метастатическим РПЖ, выявленным первично или при прогрессии заболевания после проведенного радикального лечения [261]. Пациентов стратифицировали на основании предшествующего лечения и групп риска [225]. В исследовании сHAARTED применялись те же критерии включения и пациенты были стратифицированы с учетом объема метастатического поражения; большой объем определялся по наличию висцеральных метастазов или четырех и более костных метастазов по крайней мере с одним очагом вне позвоночника или костей таза [228].
STAMPEDE ‒ это многоступенчатое исследование с несколькими группами, в котором референтная группа (кастрационная гормональная монотерапия) включала 1184 пациентов. Одной из экспериментальных групп явилась подгруппа с применением доцетаксела** в комбинации с АДТ (n = 593), другой ‒ подгруппа доцетаксела** в комбинации с золендроновой кислотой** (n = 593). В исследование включены пациенты либо с M1, либо с N1, либо при наличии двух из следующих трех критериев: T3/4, ПСА >40 нг/мл, либо группа ISUP 4-5. Также включены пациенты с рецидивами после местного лечения, если они соответствовали одному из следующих критериев: PSA >4 нг/мл с ВУПСА <6 месяцев или ПСА >20 нг/мл, N1 или M1. Относительно объема метастатического поражения (большой/малый объем) стратификация не применялась [260].
Гематологическая токсичность являлась одним из наиболее частых проявлений побочных явлений терапии доцетакселом во всех данных исследованиях. Нейтропения 3-4 степени наблюдалась у 12-15 % пациентов, фебрильная нейтропения 3-4 степени у 6-12 %. Применение гранулоцитарного колониестимулирующего фактора (ГКСФ) статистически значимо снижало риск развития фебрильной нейтропении. Первичное и вторичное профилактическое лечение с применением ГКСФ должно осуществляться в соответствии с имеющимися руководствами [259, 262].
На основании этих данных доцетаксел** в комбинации с кастрационной АДТ следует рассматривать в качестве стандарта терапии у пациентов с впервые выявленным метастатическим РПЖ, при условии, что они соответствуют критериям приема препарата [259]. Доцетаксел** применяют в стандартной дозе 75 мг/м2 в комбинации со стероидами в качестве премедикации. Проведение постоянной терапии кортикостероидами не является обязательным. Всего рекомендуется провести 6 курсов химиотерапии доцетакселом** в дозе 75 мг/м2 в комбинации с АДТ.
Таким образом, стандартом лечения пациентов с впервые выявленным метастатическим или рецидивным гормон-чувствительным РПЖ является комбинированная терапия с применением кастрации и назначением абиратерона ацетата** в сочетании с преднизолоном или доцетакселом**. Преимущество в выживаемости для обоих препаратов оказалось сходным [263]. Также не отмечено никакого значимого преимущества ОВ для каждого из препаратов, указанных в недавно опубликованном метаанализе [264]. Оба метода имеют различающиеся и препарат-специфичные побочные эффекты, что требует проведения тщательного мониторинга побочных эффектов во время лечения. Таким образом, выбор терапии будет зависеть от предпочтений пациента, характерных побочных эффектов, доступности препаратов и их стоимости.
Пациентам, у которых РПЖ манифестирует в стадии М1 и у которых нет противопоказаний к терапии доцетакселом**, рекомендуется кастрация в комбинации с химиотерапией (доцетаксел**) - 6 курсов терапии в дозе 75 мг/м2 в комбинации с АДТ. Затем - проведение только АДТ [263-265].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 1).
Комбинация с апалутамидом**.
В крупном рандомизированном исследовании фазы III TITAN [266] оценивались выживаемость без прогрессии (ВБП) и общая выживаемость (ОВ) как первичные конечные точки у пациентов метастатическим гормон-чувствительным РПЖ (мГЧРПЖ), которые получали лечение апалутамидом** в сочетании с АДТ по сравнению с плацебо с АДТ. В исследовании было продемонстрировано значимое улучшение показателей ВБП (медиана ВБП не достигнута в группе апалутамида** по сравнению с 22,1 месяца в группе плацебо [ОР для прогрессии или смерти 0,48; 95 % ДИ: 0,39-0,60, p <0,0001]) и ОВ (медиана ОВ не достигнута в обоих группах [ОР для смерти 0,67, 95 % ДИ: 0,51-0,89, p <0,0053). Токсичность терапии с применением нового класса препаратов была минимальной.
У пациентов с РПЖ со стадией М1, которые могут перенести данную схему лечения, рекомендуют АДТ в комбинации с апалутамидом** 240 мг раз в день перорально до прогрессии или развития непереносимой токсичности [266].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комбинация с энзалутамидом**.
В двух крупных рандомизированных исследованиях (ENZAMET, ARCHES) изучали добавление к АДТ энзалутамида** (160 мг в сутки) у пациентов с метастатическим гормон-чувствительным РПЖ (мГЧРПЖ) [267, 268]. В рандомизированном исследовании 3 фазы ENZAMET сравнивалась терапия энзалутамидом** в комбинации с АДТ с монотерапией АДТ у 1125 пациентов с мГЧРПЖ. Пациенты были стратифицированы по объему метастатического поражения, раннему применению доцетаксела, использованию остеомодифицирующих агентов и по количеству баллов по шкале оценки сопутствующей патологии. При первом промежуточном анализе с медианой наблюдения 34 мес была достигнута первичная цель исследования ENZAMET в виде увеличения ОВ пациентов с мГЧРПЖ в группе раннего назначения энзалутамида** в комбинации с АДТ (ОР = 0,67; 95 % ДИ: 0,52-0,86; р = 0,002). Все дополнительные цели, такие как ВБП с оценкой по уровню ПСА и клиническому прогрессированию, имели положительное значение с преимуществом в группе комбинированной терапии с энзалутамидом**. В рандомизированное исследование 3 фазы ARCHES включили 1150 пациентов с мГЧРПЖ вне зависимости от факторов прогноза течения заболевания. Пациентов рандомизировали в соотношении 1 :1 в группу комбинации АДТ и энзалутамида** и в группу АДТ + плацебо. Пациентов стратифицировали по наличию или отсутствию в анамнезе химиотерапии доцетакселом (не было, 1-5 циклов и 6 циклов) и по объему метастатического поражения (большой и малый объем). При медиане наблюдения 14,4 мес была достигнута первичная цель исследования ARCHES в виде увеличения рВБП у пациентов с мГЧРПЖ в группе назначения энзалутамида** в комбинации с АДТ со снижением риска прогрессирования или смерти на 61 % (ОР = 0,39; 95 % ДИ: 0,30-0,50; р <0,001). Профиль безопасности энзалутамида** соответствовал полученным ранее данным в исследованиях с участием пациентов с мКРРПЖ. Нежелательные явления, связанные с приемом энзалутамида** в данных исследованиях, включали усталость, судороги и гипертензию.
На основании этих данных энзалутамид** ( см приложение А3) в комбинации с АДТ следует рассматривать в качестве стандарта терапии первой линии у пациентов с метастатическим гормон-чувствительным РПЖ.
У пациентов с РПЖ со стадией М1, которые могут перенести данную схему лечения, рекомендовано АДТ в комбинации с энзалутамидом** [267, 268]. Лечение проводят с применением стандартной дозировки препарата 160 мг/сут до прогрессии или развития непереносимой токсичности.
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
3,5,4 Локальное лечение первичной опухоли при впервые выявленном метастатическом заболевании.
Роль местного лечения, в частности применения ЛТ локально на предстательную железу, у пациентов с метастатическим гормон-чувствительным заболеванием впервые продемонстрирована в исследовании HORRAD. В исследование включено 432 пациента с метастатическим РПЖ, которых рандомизировали на подгруппу терапии с применением только АДТ и подгруппу АДТ в комбинации с ДЛТ на зону предстательной железы. ОВ в подгруппах значимо не различалась (ОР: 0,9 (0,7-1,14); медиана времени до биохимического прогрессирования (рост ПСА) была значимо большей в группе ЛТ + АДТ (ОР: 0,78 (0,63-0,97) [269]. В исследование STAMPEDE включили 2061 пациента с гормон-чувствительным РПЖ, которых рандомизировали в сравниваемые группы только АДТ и АДТ в комбинации с ДЛТ на зону предстательной железы. В данном исследовании было подтверждено, что проведение лучевой терапии не повлияло на улучшение ОВ у пациентов общей выборки. Однако после получения результатов исследования сHAARTED, пациентов распределили по категориям в зависимости от объема поражения. В подгруппу небольшого объема метастатического поражения вошли 819 пациентов, в подгруппе большого объема - 1120 пациентов. В подгруппе малого объема поражения отмечено значимое преимущество комбинированного лечения (ГТ + ДЛТ предстательной железы) в виде увеличения показателей ОВ. В связи с этим, применение ЛТ предстательной железы следует рассматривать у пациентов с небольшим объемом метастатического поражения. Пока остается неясным, могут ли эти данные быть экстраполированы на РПЭ как метод местного лечения у больных с малым объемом метастатического поражения.3,5,5 Метастаз-направленная терапия.
У пациентов при рецидивах после местного лечения, чтобы отсрочить системное лечение, было предложено проведение таргетной терапии метастазов. Проведено одно рандомизированное исследование II фазы у пациентов с олиго-метастатическим РПЖ (наличие ≤3 метастатических очагов). В исследование включено 62 пациентов; около половины из них имели метастазы только в лимфоузлах. Исследование показало, что выживаемость без АДТ была большей в подгруппе пациентов, получавших местное лечение по поводу олиго-метастазов по сравнению с подгруппой наблюдения [270]. В настоящее время отсутствуют данные, подтверждающие улучшение ОВ. В систематическом обзоре подчеркивается, что в настоящее время этот подход пока нужно рассматривать в качестве экспериментального [271].3,5,6 Рекомендации по терапии первой линии у пациентов с метастатическим гормон-чувствительным РПЖ.
У пациентов со стадией М1 с наличием симптомов рекомендована немедленная системная терапия, направленная на облегчение симптомов и уменьшение риска потенциальных серьезных осложнений прогрессирующего заболевания (компрессия спинного мозга, патологические переломы, обструкция мочеточника) [252, 253].Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 3).
В особенности у пациентов с первыми признаками компрессии спинного мозга или инфравезикальной обструкцией рекомендовано применение антагонистов лютеинизирующего гормона рилизинг-гормона (ЛГРГ) [233-236].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Пациентам со стадией М1 и первыми признаками развивающихся осложнений, таких как сдавление спинного мозга или патологические переломы, рекомендуется проводить хирургическое вмешательство и/или местную лучевую терапию для устранения симптомов болезни [272].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 3).
У пациентов стадии М1 с наличием симптомов заболевания рекомендована немедленная системная терапия, направленная на устранение симптомов, улучшение выживаемости, замедление прогрессирования до симптомной стадии и предотвращение серьезных осложнений, связанных с прогрессированием заболевания. У пациентов стадии М1 без симптомов опухоли рекомендована немедленная системная терапия, направленная на улучшение выживаемости, замедление прогрессирования до симптомной стадии и предотвращение серьезных осложнений, связанных с прогрессированием заболевания [252, 253].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Комментарии. У хорошо информированных пациентов со стадией М1 при отсутствии симптомов опухоли возможно проведение отсроченной АДТ, поскольку она уменьшает побочные эффекты лечения, при условии, что пациент находится под тщательным наблюдением [232, 252, 253].
Пациентам со стадией М1, получающим лечение агонистами ЛГРГ, для снижения риска возникновения эффекта «вспышки» предлагают начальную краткосрочную терапию антиандрогенами [238-241, 254, 257].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
У пациентов со стадией заболевания М1 монотерапия антиандрогенами не рекомендуется [257].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
Пациентам с РПЖ со стадией М1, у которых нет противопоказаний к терапии доцетакселом**, предлагают АДТ в комбинации с химиотерапией (доцетаксел 75 мг/м2, 1 день в 21-дневный курс, до 6 курсов доцетаксела**) [225, 228, 260, 261].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Пациентам с РПЖ со стадией М1, которые могут перенести данную схему лечения, предлагают АДТ в комбинации с одним из перечисленных препаратов: в алфавитном порядке: абиратерон ** в сочетании с преднизоном, апалутамидом или энзалутамидом** [266-268].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Пациентам с РПЖ со стадией М1, у которых имеется малый объем метастатического поражения, определенный по критериям сHAARTED, рекомендуется предложить АДТ в сочетании с лучевой терапией предстательной железы [273].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Не рекомедовано применение АДТ в комбинации с каким-либо местным лечением (лучевая терапия/хирургическое вмешательство) вне клинических исследований (за исключением контроля симптомов) пациентам со стадией М1 и большим объемом метастатического поражения [273, 274].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 4).
Пациентам, не желающим рассматривать АДТ в сочетании с терапией доцетакселом**, абиратерона ацетатом** в комбинации с преднизолоном, апалутамидом**, энзалутамидом** или с лучевой терапией на зону предстательной железы или не подходящих для вышеуказанного лечения, следует предложить только АДТ в сочетании с терапией антиандрогеном или без него [98, 81, 257].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
У пациентов со стадией M1 при хорошем ответе на лечение необходимо проводить наблюдение каждые 3-6 месяцев. Оно должно включать как минимум сбор анамнеза заболевания, ПРИ, определение уровня ПСА, часто с дополнительным определением уровня гемоглобина, креатинина и щелочной фосфатазы. Также необходимо определять уровень тестостерона, особенно в течение первого года [98, 81, 257].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Интермиттирующее лечение следует предлагать только хорошо мотивированным пациентам со стадией М1 с выраженным ответом уровня ПСА после периода индукции [245, 246].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
3,5,7 Лечение кастрационно-резистентного РПЖ (КРРПЖ).
Определение кастрационно-резистентного РПЖ.Уровень тестостерона в сыворотке крови <50 нг/дл или 1,7 нмоль/л в сочетании с:
• биохимическим прогрессированием: 3 последовательных повышения уровня ПСА с разницей в 1 неделю, с увеличением на 50 % в двух измерениях от надира, при уровне ПСА >2,0 нг/мл или.
• рентгенологическим прогрессированием: появление новых очагов: два и более новых очагов в костной ткани или очаг в мягких тканях согласно критериям RECIST (Критерии оценки ответа при солидных опухолях) [275]. Только симптоматическое прогрессирование должно быть поставлено под сомнение и подвергнуто дальнейшему исследованию. Этого недостаточно для диагностики КРРПЖ.
Неметастатический кастрационно-резистентный РПЖ.
Частое определение уровня ПСА у пациентов с РПЖ при проведении лечения с применением АДТ привело к более раннему выявлению биохимического прогрессирования. Приблизительно у одной трети из этих пациентов в течение двух лет возникнут костные метастазы, диагностируемые при сканировании костей [276].
У пациентов с развитием КРРПЖ и не определяемыми с использованием сканирования костей и КТ отдаленными метастазами исходный уровень значения ПСА, скорость нарастания ПСА и время удвоения (ВУ) ПСА были связаны с показателями выживаемости до развития первого костного метастаза и ОВ [276, 277]. Эти факторы могут быть использованы при принятии решения о том, какие пациенты должны получать терапию для предотвращения развития метастатического заболевания.
В двух крупных рандомизированных исследованиях фазы III: PROSPER [278] и SPARTAN [279] - оценивалась безметастатическая выживаемость (ВБМ - выживаемость до появления отдаленных метастазов) как первичная конечная точка у пациентов с неметастатическим кастрационно-резистентным РПЖ (КРРПЖ, M0), которые получали лечение энзалутамидом** (PROSPER) по сравнению с плацебо или апалутамидом** (SPARTAN) по сравнению с плацебо соответственно. Статус M0 устанавливали с помощью КТ и сканирования костей. В исследования были включены только пациенты с высоким риском развития метастазов с непродолжительным ВУ ПСА (≤10 месяцев). В обоих исследованиях продемонстрировано значимое улучшение показателей ВБМ (PROSPER: медиана ВБМ составила 36,6 месяца в группе энзалутамида** по сравнению с 14,7 месяца в группе плацебо [ОР для метастазов или смерти 0,29; 95 % ДИ: 0,24-0,35, p <0,001]; SPARTAN: медиана ВБМ составила 40,5 месяца в группе апалутамида** по сравнению с 16,2 месяца в группе плацебо [ОР для метастазов или смерти 0,28, 95 % ДИ: 0,23-0,35, p <0,001]). Время до симптоматического прогрессирования было достоверно выше при применении энзалутамида** (ОР 0,58; 95 % ДИ: 0,46-0,72, p <0,0001) и апалутамида** по сравнению с плацебо (ОР 0,45; 95 % ДИ: 0,32-0,63, p <0,001). Токсичность терапии с применением нового класса препаратов была минимальной.
Мониторинг ПСА раз в 3 месяца у мужчин при проведении АДТ рекомендуется для выявления биохимического прогрессирования до развития метастатической болезни [276, 277, 280].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
ВУ ПСА рекомендуется использовать при принятии решения о терапии пациентов с нмКРРПЖ [276, 277, 280].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. У пациентов с КРРПЖ и с отсутствием выявляемых метастазов ВУ ПСА является фактором, влияющим на риск появления отдаленных метастазов и общую выживаемость. ВУ ПСА ≤10 месяцев коррелирует с более высоким риском возникновения костных метастазов и смертностью.
Пациентам с нмКРРПЖ высокого риска (ВУ ПСА ≤10 месяцев) рекомендуется назначение апалутамида** или энзалутамида** в комбинации с АДТ [278, 279].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. В двух крупных рандомизированных контролируемых исследованиях III фазы с включением пациентов с нмКРРПЖ высокого риска (ВУ ПСА ≤10 месяцев) продемонстрировано значимое снижение риска развития метастазов при назначении апалутамида** или энзалутамида** в комбинации с АДТ по сравнению с плацебо и ГТ. В обоих исследованиях было показано, что добавление ингибиторов андрогеновых рецепторов к АДТ не приводит к усугублению токсичности, частота НЯ 3-4 степени была низкой в обоих исследованиях.
При ВУ ПСА ≤10 месяцев назначение в следующих дозировках:
Апалутамид** 240 мг раз в день перорально в комбинации с АДТ до прогрессии или развития непереносимой токсичности;
Энзалутамид** 160 мг раз в день перорально в комбинации с АДТ до прогрессии или развития непереносимой токсичности или смена гормональной терапии.
При ВУ ПСА >10 месяцев рекомендуется продолжение АДТ и динамическое наблюдение или смена гормонотерапии [276, 277, 280].
Метастатический кастрационно-резистентный РПЖ.
Стандартная андрогендепривационная терапия у пациентов с кастрационно-резистентным РПЖ.
В итоге, несмотря на кастрацию, у пациентов с РПЖ будут определяться признаки прогрессирования заболевания. В двух исследованиях показано только минимальное преимущество выживаемости у пациентов, продолжавших применение аналогов ЛГРГ во время терапии второй и третьей линии [281,282]. Однако, в отсутствие проспективных данных, незначительное потенциальное преимущество продолжения АДТ превосходит минимальный риск лечения. Кроме того, во всех рандомизированных исследованиях продолжалось применение андрогенной супрессии во всех последующих курсах лечения, по этой причине кастрационную терапию, направленную на снижение уровня эндогенного тестостерона, следует продолжить у всех пациентов с КРРПЖ.
Терапия первой линии метастатического кастрационно-резистентного РПЖ.
Абиратерона ацетат**.
Абиратерон** является одним из препаратов, рекомендованных для терапии пациентов с метастатическим КРРПЖ в первой линии (до применения доцетаксела**) [283].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии: оценка эффективности терапии с применением абиратерона ацетата** проводилась в исследовании сOU-AA-302 III фазы с участием 1088 пациентов с метастатическим КРРПЖ с бессимптомным течением или легкой симптоматикой заболевания, ранее не получавших химиотерапию. Пациентов рандомизировали в группы абиратерона ацетата** и плацебо, обе ‒ в комбинации с преднизоном [283]. Пациенты с висцеральными метастазами были исключены. Основными факторами стратификации были статус по шкале ECOG 0 или 1. Общая выживаемость и рентгенологическая ВБП (рВБП) являлись основной первичной конечной точкой. При медиане последующего наблюдения 22,2 месяца, наблюдалось значительное улучшение рВБП (медиана 16,5 по сравнению с 8,2 месяца, ОР: 0,52, p <0,001) при терапии абиратерона ацетатом**. На момент окончательного анализа данных с медианой последующего наблюдения 49,2 месяца конечная точка ОВ явилась статистически значимо лучшей в группе данного препарата (34,7 по сравнению с 30,3 месяца, ОР: 0,81, 95 % ДИ: 0,70-0,93; p = 0,0033) [284]. Нежелательные явления (НЯ), связанные с избытком минералокортикоидов и нарушением функции печени, чаще встречались в группе абиратерона ацетата**, но среди них преобладала токсичность 1-2 степени выраженности. При анализе в подгруппах исследования было показано, что препарат одинаково эффективен в пожилом возрасте (>75 лет) [285].
Энзалутамид**.
Энзалутамид** является одним из препаратов, рекомендованных для терапии пациентов метастатическим КРРПЖ в первой линии (до применения доцетаксела**) [286, 287].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии: рандомизированное исследование III фазы (PREVAIL) [288] включило сходные популяции пациентов с проведением сравнения энзалутамида** и плацебо. Пациенты с висцеральными метастазами включались в исследование, однако их количество было небольшим. Прием кортикостероидов был разрешен, но не являлся обязательным. Исследование PREVAIL было проведено с участием 1717 пациентов с мКРРПЖ, ранее не получавших химиотерапию, и продемонстрировало значимое улучшение рВБП (ОР: 0,186; ДИ: 0,15-0,23, p <0,0001) и ОВ (ОР: 0,706; ДИ: 0,6-0,84, p <0,001). Снижение уровня ПСА >50 % наблюдалось у 78 % пациентов. Наиболее распространенными клинически значимыми нежелательными явлениями были утомляемость и артериальная гипертензия. Энзалутамид** был одинаково эффективен и имел хорошую переносимость у пациентов в возрасте >75 лет [289], а также у пациентов с висцеральными метастазами или без них [290].
Энзалутамид** также сравнивали с бикалутамидом в дозе 50 мг 1 раз в сутки в рандомизированном двойном слепом исследовании II фазы (TERRAIN) [286], показано значимое улучшение ВБП (15,7 месяца по сравнению с 5,8 месяца, ОР: 0,44, p <0,0001) в пользу энзалутамида**. По результатам продолжительного последующего наблюдения и заключительного анализа преимущество в ОВ и рВБП было также подтверждено [287].
Доцетаксел**.
Доцетаксел** является одним из препаратов, рекомендованных для терапии пациентов с метастатическим КРРПЖ в первой линии, особенно в подгруппе пациентов с наличием висцеральных метастазов, коротким периодом эффективности инициальной АДТ и выраженным болевым синдромом [291, 292].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 1).
Комментарии: при проведении химиотерапии на основе доцетаксела** наблюдалось значимое увеличение медианы выживаемости на 2-2,9 месяца по сравнению с терапией митоксантроном в комбинации с преднизоном [291, 293]. Стандарт химиотерапии первой линии ‒ доцетаксел** в дозе 75 мг/м2 в виде внутривенной инфузии 1 раз в три недели в комбинации с преднизоном 5 мг 2 раза в сутки (2 р/сут), до 10 курсов. Преднизон может быть исключен при наличии противопоказаний либо отсутствии выраженных симптомов. Следующие независимые прогностические факторы: висцеральные метастазы, боль, анемия (Hb <13 г/дл), отрицательная динамика при остеосцинтиграфии и предшествующее применение эстрамустина могут помочь стратифицировать ответ на доцетаксел**. Пациентов распределили в три группы риска: низкого риска (0 или 1 фактор), промежуточного (2 фактора) и высокого риска (3 или 4 фактора) - и продемонстрировали оценку трех значимо различающихся медиан ОВ ‒ 25,7, 18,7 и 12,8 месяца, соответственно [294].
Примечание: возраст сам по себе не является противопоказанием к назначению доцетаксела** [295], однако, должно быть уделено внимание тщательному мониторингу и сопутствующим заболеваниям по причине высокого риска развития нейтропенических осложнений в данной когорте пациентов [296]. У пациентов с мКРРПЖ с невозможностью проведения стандартной схемы и дозы терапии, допускается применение доцетаксела** 50 мг/м2 в виде внутривенной инфузии 1 раз в 2 недели с учетом меньшей токсичности данного режима [292].
Терапия второй линии при мКРРПЖ.
У всех пациентов, получающих терапию по поводу мКРРПЖ, в итоге наблюдается прогрессирование заболевания по причине развития резистентности применяемому лечению. При переходе на новую линию терапии рекомендуется использовать лекарственные препараты с иным механизмом действия и отсутствием перекрестной резистентности.
Кабазитаксел**.
Кабазитаксел** является одним из препаратов, рекомендованных для терапии пациентов с метастатическим КРРПЖ во второй линии при прогрессировании заболевания после терапии доцетакселом, особенно в подгруппе пациентов с наличием висцеральных метастазов, коротким периодом эффективной терапии доцетакселом** и выраженным болевым синдромом [297-301].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии: кабазитаксел** является таксаном второго поколения с активностью при злокачественных новообразованиях, резистентных к доцетакселу. В крупном проспективном, рандомизированном исследовании III фазы (исследование TROPIC) было проведено сравнение эффективности комбинации кабазитаксела** с преднизоном относительно комбинации митоксантрона с преднизоном у 755 пациентов с мКРРПЖ, у которых отмечено прогрессирование заболевания после терапии доцетакселом** [297]. Пациенты получили максимум десять курсов кабазитаксела** (25 мг/м2 в виде внутривенных инфузий каждые 3 недели) или митоксантрона (12 мг/м2) в комбинации с преднизоном (10 мг/сутки). Первичной конечной точкой являлся показатель ОВ, который был значимо выше при применении кабазитаксела** (медиана ОВ: 15,1 по сравнению с 12,7 месяца p <0,0001). Также наблюдалось достоверное улучшение показателей ВБП (медиана ВБП: 2,8 по сравнению с 1,4 месяца, p <0,0001), частоты объективного ответа согласно критериям RECIST (14,4 % по сравнению с 4,4 %, p <0,005) и частоты ответов по уровню ПСА (39,2 % по сравнению с 17,8 %, p <0,0002). Связанные с лечением побочные эффекты 3-4 степени по ВОЗ значимо чаще развивались в группе кабазитаксела**, особенно проявления гематологической токсичности (68,2 % по сравнению с 47,3 %, p <0,0002), а также не гематологической (57,4 по сравнению с 39,8 %, p <0,0002) [298]. В двух постмаркетинговых исследованиях III фазы было показано, что кабазитаксел** не превосходит доцетаксел** при применении в качестве терапии 1-ой линии. При применении в качестве терапии 2-ой линии кабазитаксел** в дозе 20 мг/м2 был не менее эффективен, чем в дозе 25 мг/м2, но менее токсичен. Таким образом, следует отдавать предпочтение более низкой дозе, особенно в подгруппе пациентов с высоким риском развития нейтропенических осложнений [299, 300]. Предпочтительно кабазитаксел** следует назначать с профилактическим применением ГКСФ, также препарат должен применяться врачами, обладающими опытом лечения нейтропении и сепсиса [301].
Радий-223**.
Радия хлорид [223 Ra]** является одним из препаратов, рекомендованных для терапии пациентов с метастатическим КРРПЖ во второй линии при прогрессировании заболевания после терапии первой линии, включая подгруппу пациентов с наличием или отсутствием болевого синдрома (вне зависимости от выраженности болевого синдрома), костными поражениями и без висцеральных метастазов [302-305].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. Единственным специфическим для костной ткани препаратом, для которого показано преимущество в выживаемости, является α-излучающий радиофармпрепарат радия хлорид [223 Ra]**. В крупном исследовании III фазы (ALSYMPCA), включившем 921 пациента с симптоматическим мКРРПЖ, которых рандомизировали в группу получающих терапию радия хлоридом [223 Ra]** или плацебо в комбинации со стандартом терапии. Первичной конечной точкой была ОВ. В группе радия хлорида [223 Ra]** наблюдалось значимое улучшение медианы ОВ на 3,6 месяца (ОР: 0,70; p <0,001), также было продемонстрировано, что эффективность радионуклидной терапии радия хлоридом [223 Ra]** не зависела от предшествующего назначения доцетаксела** [302, 303]. Препарат также обеспечивал увеличение времени до первого костного осложнения (патологический перелом, компрессия спинного мозга), снижение выраженности болевого синдрома и улучшение качества жизни. Токсичность, связанная с применением радия хлорида [223 Ra]**, была незначительной и за исключением несколько более выраженной гематологической токсичности и диареи существенно не отличалась от группы плацебо [302]. Раннее назначение радия хлорида [223 Ra]** не лимитирует возможности дальнейшего использования химиотерапии. После завершения терапии в рамках исследования ALSYMPCA 23 % пациентов группы радионуклидной терапии и 21 % пациентов группы плацебо получали доцетаксел**.
В международное многоцентровое исследование IIIb фазы (iEAP) были включены 839 пациентов с КРРПЖ с 2 и более костно-метастатическими очагами, без висцеральных метастазов. Критерии включения допускали проведение радионуклидной терапии радия хлоридом [223 Ra]** пациентам без болевого синдрома, имеющим метастатическое поражение лимфатических узлов, ранее получавшим доцетаксел**, ингибиторы андрогенного сигнала или деносумаб**, а также пациенты, которым проводилась терапия ингибиторами андрогенного сигнала или деносумабом** в процессе лечения радия хлоридом [223 Ra]**. Результаты исследования iEAP соответствовали данным исследования ALSYMPCA. Медиана ОВ в группе радия хлорида [223 Ra]** составила 16 месяцев, время до роста основного маркера резорбции костной ткани ЩФ - 8 мес, время до прогрессирования уровня ПСА - 4 мес [304].
Применение радия хлорида [223 Ra]** в комбинации с абиратерона ацетатом** и преднизолоном не рекомендуется в связи с более высоким риском развития переломов и увеличением количества летальных исходов в группе комбинации абиратерона ацетата** и радия хлорида [223 Ra]**. В особенности это касалось пациентов без одновременного применения остеомодифицирующих препаратов [305].
Применение абиратерона** после предварительного применения доцетаксела**.
Абиратерон** является одним из препаратов, рекомендованных для терапии пациентов с метастатическим КРРПЖ во второй линии при прогрессировании заболевания после терапии доцетакселом** в подгруппе пациентов с отсутствием висцеральных метастазов и минимально выраженным болевым синдромом [306, 307].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. Сообщалось о положительных результатах, полученных в крупном исследовании сOU-AA-301 III фазы при медиане последующего наблюдения 12,8 месяца [306], которые были подтверждены в заключительном анализе [307]. Всего 1195 пациентов с мКРРПЖ рандомизированы в соотношении 2 :1 в группу абиратерона ацетата** в комбинации с преднизоном или в группу плацебо с преднизоном. У всех пациентов зарегистрировано прогрессирование заболевания после терапии доцетакселом**. Первичной конечной точкой была ОВ. При медиане наблюдения 20,2 месяца, медиана выживаемости в группе абиратерона ацетата** составила 15,8 месяца по сравнению с 11,2 месяца в группе плацебо (ОР: 0,74, p <0,0001). Преимущество наблюдалось во всех подгруппах пациентов. Токсичность терапии была низкой, нежелательные явления 3-4 степени встречались крайне редко, тем не менее, в группе абиратерона ацетата** чаще встречались побочные эффекты, связанные с минералокортикоидной активностью препарата, преимущественно 1-2 степени (задержка жидкости, отеки и гипокалиемия).
Применение энзатуламида** после доцетаксела**.
Энзалутамид** является одним из препаратов, рекомендованных для терапии пациентов с метастатическим КРРПЖ во второй линии при прогрессировании заболевания после терапии доцетакселом** [287, 308].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Комментарии. Запланированный промежуточный анализ в исследовании AFFIRM был опубликован в 2012 г. [308]. В исследование включено 1199 пациентов с мКРРПЖ в соотношении 2 :1 в группу энзатуламида** или плацебо, соответственно. У всех пациентов наблюдалось прогрессирование заболевания после терапии доцетакселом**. Кортикостероиды были необязательными, но их назначение допускалось и их получали около 30 % пациентов. Первичной конечной точкой была ОВ. При медиане наблюдения 14,4 месяца медиана выживаемости в группе энзатуламида** составила 18,4 месяца по сравнению с 13,6 месяца в группе плацебо (ОР: 0,63; p <0,001). Преимущество в выживаемости наблюдалось независимо от возраста, исходной интенсивности боли и типа прогрессирования. В заключительном анализе с более длительным последующим наблюдением полученные результаты были подтверждены [287]. Энзалутамид** также был активен у пациентов с висцеральными метастазами. Токсичность терапии была низкой, при этом частота нежелательных явлений 3-4 в группе энзалутамида** была ниже, чем в группе плацебо. Нежелательным явлением особого интереса в группе энзалутамида** явились судороги, которые наблюдались у 0,6 % пациентов.
У пациентов, прогрессирующих на фоне терапии доцетакселом** и с наличием висцеральных метастазов, также возможно применение энзалутамида**.
Лечение мКРРПЖ после доцетаксела** и первой линии гормональной терапии.
Выбор дальнейшего лечения после применения доцетаксела** и первой линии гормональной терапии (абиратероном** или энзалутамидом**) при мКРРПЖ остается открытым [309]. Приемлемыми вариантами являются применение радия хлорида [223 Ra]** либо второй линии химиотерапии (кабазитаксел**). В целом, как ожидается, последующие курсы лечения у пациентов сплошной выборки будут иметь меньшее преимущество, чем при более раннем применении [310,311], а также имеются доказательства перекрестной резистентности между энзалутамидом** и абиратероном** [312, 313].
Олапариб**.
Олапариб** рекомендован для монотерапии мКРРПЖ с герминальными или соматическими мутациями генов, участвующих в репарации ДНК путем гомологичной рекомбинации, у пациентов с прогрессированием заболевания после терапии новыми гормональными препаратами (абиратероном** или энзалутамидом**) [314].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Комментарии. В исследование III фазы PROfound по оценке эффективности и безопасности олапариба** по сравнению с терапией энзалутамидом** или абиратероном** у пациентов с мКРРПЖ и мутациями генов, участвующих в репарации ДНК путем гомологичной рекомбинации (HRR, homologous recombination repair) были включены пациенты с прогрессированием заболевания после терапии новыми гормональными препаратами. В исследовании были две когорты пациентов. Когорта A: пациенты с мутациями генов вRCA1, вRCA2, или ATM. Когорта в: пациенты с мутациями генов вARD1, вRIP1, сDK12, сHEK1, сHEK2, FANCL, PALB2, PPP2R2A, RAD51B, RAD51C, RAD51D, RAD54L. В когорте А лечение олапарибом** привело к статистически и клинически значимому улучшению рВБП (7,39 мес) по сравнению с энзалутамидом** или абиратероном** (3,55 мес) (ОР 0,34; 95 % ДИ, 0,25-0,47; р <0,0001). В общей популяции пациентов (когорты A + в) с мКРРПЖ с изменениями в генах, прямо или косвенно задействованных в HRR, применение олапариба** также приводило к статистически значимому и клинически важному улучшению рВБП (5,82 мес) по сравнению с энзалутамидом**/абиратероном** (3,52 мес) (ОР 0,49; 95 % ДИ, 0,38-0,63; р <0,0001) [314]. Согласно анализу зрелых данных, общая выживаемость (ОВ) в когорте A составила 19,09 мес для олапариба** в сравнении с 14,69 мес для энзалутамида**/абиратерона** (ОР, 0,69; 95 % ДИ, 0,50-0,97; р = 0,0175) [315]. Согласно промежуточному анализу, ОВ в когортах A + в составила - 17,51 мес для олапариба** в сравнении с 14,26 мес для энзалутамида**/абиратерона** (ОР, 0,67; 95 % ДИ, 0,49-0,93; р = 0,0063). Из числа пациентов, получавших энзалутамид**/абиратерон**, после прогрессирования 80,6 % пациентов в когорте А и 84,6 % пациентов в когорте В перешли на олапариб**. Наиболее частыми нежелательными явлениями (НЯ) (любой степени тяжести), зарегистрированными при применении олапариба**, были анемия (46,5 %), тошнота (41,4 %), утомляемость и астения (41,0 %), снижение аппетита (30,1 %) [314].
Таким образом, олапариб** является перспективной опцией терапии после лечения мКРРПЖ доцетакселом** и абиратероном** или энзалутамидом** и прогрессирования заболевания на фоне терапии данными препаратами у пациентов с мутациями генов, участвующих в репарации ДНК путем гомологичной рекомбинации. В исследовании III фазы PROfound все пациенты ранее получали энзалутамид** и/или абиратерон**, при этом была подгруппа пациентов, получавших ранее еще и таксаны. Результаты анализов в подгруппах установили превосходство олапариба (по рВБП и ОВ) над энзалутамидом**/абиратероном** у пациентов с мКРРПЖ независимо от того, получали они ранее таксаны или нет [316].
Пемброзилумаб** рекомендуется для применения у пациентов при некомплементарном дефиците репарации, независимо от происхождения опухоли, включая также РПЖ, в следующем режиме дозирования - в дозе 200 мг в/в в виде инфузии в течение 30 мин каждые 3 недели до прогрессирования или неприемлемой токсичности [317].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
Комментарии. В данном показании в РФ препарат пемброзилумаб** находится в состоянии регистрации.
Мониторинг лечения.
Исходные оценки должны включать анамнез и клиническое обследование, а также исходные анализы крови (ПСА, ОАК, показатели функции почек, печеночные пробы, ЩФ), остеосцинтиграфия и КТ грудной клетки, брюшной полости и таза [318]. Применение холина или ПСМА-ПЭТ/КТ при прогрессировании КРРПЖ полностью не изучено и, вероятнее всего, не представляет существенной пользы, как у пациентов с биохимическим рецидивом или у пациентов, ранее не получавших ГТ. Использование только уровня ПСА в мониторинге заболевания у пациентов с мКРРПЖ не является достаточно надежным [319, 320], так как висцеральные метастазы могут развиваться у мужчин без повышения уровня ПСА [321]. Вместо этого при проведении оценки течения заболевания рекомендуется комбинация сцинтиграфии костей и КТ-сканирования, измерение уровня ПСА и оценка клинического статуса пациента [293]. Не так давно большинство экспертов на консенсусе предложили регулярно пересматривать и повторять анализы крови один раз в два-три месяца, сцинтиграфию костей и КТ-сканирование по крайней мере один раз в шесть месяцев, даже при отсутствии клинических показаний [318]. Это отражает тот факт, что все препараты с доказанным преимуществом ОВ имеют потенциальную токсичность и значительную стоимость, а при отсутствии объективного преимущества лечение пациентов должно быть скорректировано. Большинство экспертов подчеркивают, что терапия не должна быть прекращена только на основании биохимического прогрессирования (рост ПСА). Вместо этого для прекращения терапии должны выполняться по крайней мере два из трех критериев (биохимическое прогрессирование (рост ПСА), рентгенологическое прогрессирование и клиническое ухудшение). В исследовательских целях, в обновленных рекомендациях PCWG3 больше внимания уделено важности документирования прогрессирования со стороны имеющихся очагов поражения и введена концепция «больше нет клинического преимущества» ‒ для того, чтобы подчеркнуть различие между первым доказательством прогрессирования и клинической потребностью в прекращении или изменении терапии [322]. По всей видимости, данные рекомендации также подходят для клинической практики вне исследований.
Последовательность терапии и ее продолжительность.
Сроки изменения лечения при мКРРПЖ остаются предметом дебатов, хотя имеются четкие рекомендации о незамедлительном начале или изменении лечения у пациентов с симптоматическим прогрессированием метастатического заболевания. Несмотря на увеличение количества эффективных методов лечения, по-прежнему отсутствуют данные прямого сравнения, а также оценки последовательности применения доступных препаратов. Таким образом, пока остается неясным, как осуществить выбор терапии «второй линии». В отсутствие других данных, в качестве приоритета последовательности лечения были использованы критерии включения из регистрационных исследований.
Для стратификации пациентов была использована шкала ECOG (оценка функционального статуса). В целом пациенты с ECOG 0-1 лучше переносят лечение и имеют большее преимущество, чем пациенты с ECOG ≥2. Тем не менее, важно, чтобы решения о лечении принимались индивидуально. В особенности это относится к случаям, когда симптомы, связанные с прогрессированием заболевания, определяются статусом по шкале ECOG. В таких случаях может быть целесообразным использование активных препаратов, продлевающих жизнь, чтобы установить, улучшит ли лечение функциональный статус пациента [318, 323].
Симптоматическое лечение при метастатическом кастрационно-резистентном РПЖ.
КРРПЖ обычно является инвалидизирующим заболеванием, часто поражающим пожилых мужчин. Необходим мультидисциплинарный подход с привлечением урологов, химиотерапевтов, радиационных онкологов, медсестер, психологов и социальных работников [324]. При рассмотрении вопроса о дополнительном системном лечении, включая лечение боли, запоров, анорексии, тошноты, слабости и депрессии, необходимо учитывать важнейшие вопросы паллиативного лечения.
Применение радиофармпрепаратов, основанных на бета-излучающих радионуклидах (самарий, 153Sm оксабифор, стронция хлорид [89Sr]) может быть рекомендовано в качестве средства длительного и стойкого подавления болевого синдрома, снижения потребности в анальгетиках и улучшения качества жизни [325-330]. Влияние данных препаратов на выживаемость без прогрессирования и общую выживаемость в рандомизированных исследованиях не изучено. Методика проведения радионуклидной терапии при метастазах в кости с болевым синдромом изложена в рекомендациях [325]. Отечественные принципы радионуклидной терапии при метастазах в кости бета-излучающими радиофармпрепаратами соответствуют международным рекомендациям [326].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Осложнения по причине наличия костных метастазов.
У большинства пациентов с мКРРПЖ костные метастазы сопровождаются выраженным болевым синдромом. ДЛТ обладает высокой эффективностью [331] даже в однократной фракции [332]. Проведение однократной инфузии бисфосфоната третьего поколения может быть рассмотрено при отсутствии ЛТ [333]. Распространенные осложнения из-за наличия костных метастазов включают переломы позвоночника со сдавлением спинного мозга и патологические переломы. Вертебропластика может быть эффективным методом лечения перелома позвоночника, независимо от его происхождения, оказывая положительное влияние как на боль, так и на качество жизни [334]. Тем не менее, по-прежнему важно рекомендовать проведение стандартных паллиативных хирургических вмешательств, которые могут быть эффективными при лечении остеобластических метастазов [335, 336]. Сдавление спинного мозга является неотложным состоянием. Оно должно быть диагностировано как можно раньше, а пациентов следует обучить распознаванию характерных признаков. При подозрении на данное состояние необходимо как можно скорее назначить высокие дозы кортикостероидов и выполнить МРТ позвоночника. Следует запланировать консультацию врача-нейрохирурга или врача-травматолога-ортопеда и обсудить возможность проведения декомпрессии с последующей ДЛТ [337]. В противном случае методом выбора является ДЛТ с системной терапией или без нее.
Предупреждение развития нежелательных явлений,.
Связанных с костными метастазами.
Применение бисфосфонатов.
Применение золедроновой кислоты** при мКРРПЖ в профилактике развития костных осложнений изучали в период, когда не было действенной противоопухолевой терапии, но применение доцетаксела** было доступно. В исследование включено 643 пациента с КРРПЖ [338] с костными метастазами, которых рандомизировали в группу получавших золедроновую кислоту** в дозе 4 мг или 8 мг один раз в три недели в течение пятнадцати последующих месяцев, или плацебо. Доза 8 мг не демонстрировала явных преимуществ и в связи с плохой переносимостью была уменьшена до 4 мг. Через 15 и 24 месяца последующего наблюдения у пациентов, получавших золедроновую кислоту** в дозе 4 мг, по сравнению с группой плацебо отмечено меньше костных осложнений (44 % по сравнению с 33 %, p = 0,021) и, в частности, меньше патологических переломов (13,1 % по сравнению с 22,1 %, p = 0,015). Кроме того, в группе золедроновой кислоты** отмечалось удлинение времени до первого костного осложнения. Ни в одном из проспективных исследований с бисфосфонатами не показано преимущества в выживаемости.
Ингибиторы лиганда RANK.
Деносумаб** ‒ человеческое моноклональное антитело к RANK-лиганду (лиганд рецептора-активатора ядерного фактора каппа-В), ключевого медиатора образования, функции и жизнедеятельности остеокластов. У пациентов с КРРПЖ с отсутствием отдаленных метастазов на фоне терапии данным препаратом в дозировке 60 мг отмечалось увеличение выживаемости без костных метастазов по сравнению с группой плацебо (медиана преимущества: 4,2 месяца, ОР: 0,85, p = 0,028) [337]. Тем не менее, это преимущество не отразилось на различии ОВ (43,9 по сравнению с 44,8 месяца, соответственно), и деносумаб** не был одобрен ни FDA, ни EMA для этого показания [339]. Однако деносумаб** 60 мг показал преимущество в лечении потери минеральной плотности костной ткани на фоне андроген-депривационной терапии по сравнению с плацебо, значительно снижая риск вертебральных переломов [340], и зарегистрирован по данному показанию в РФ и EMA и FDA.
В исследовании III фазы оценивали эффективность и безопасность деносумаба 120 мг** (n = 950) по сравнению с золедроновой кислотой** (n = 951) у пациентов с мКРРПЖ. Деносумаб** превосходит золедроновую кислоту** по времени развития или профилактики костных осложнений, определяемому по времени до развития первого осложнения (патологический перелом, облучение или операция на костях, или компрессия спинного мозга), 20,7 по сравнению с 17,1 месяца, соответственно (ОР: 0,82, p = 0,008). Тем не менее, эти результаты не отразились на преимуществе в выживаемости и при недавней ретроспективной повторной оценке конечных точек, однако деносумаб** продемонстрировал аналогичные результаты по преимуществу по сравнению с золедроновой кислотой при сравнении частоты развития симптоматических явлений со стороны костной системы как первого, так и последующих [341].
Для предотвращения осложнений со стороны костной системы пациентам с мКРРПЖ с костными метастазами рекомендуется применение остео-модифицирующих агентов (золедроновая кислота** или деносумаб**) [337-339, 341].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Примечание. Постоянно должна учитываться потенциальная токсичность бисфосфонатов и ингибиторов диганда RANK (например, остеонекроз нижней челюсти) (до 5 % при M0 КРРПЖ и до 8,2 % при мКРРПЖ, соответственно) [331, 337, 341, 342]. Перед началом терапии пациентам необходимо проходить стоматологическое обследование, риск некроза челюсти повышается при некоторых факторах риска, включая наличие травмы в анамнезе, операции на зубах или наличие одонтогенной инфекции [343]. Кроме того, риск остеонекроза челюсти возрастал при увеличении длительности применения препарата [344].
3,6 Симптоматическая терапия: обезболивание.
Принципы обезболивания и оптимального выбора противоболевой терапии у пациентов раком предстательной железы с хроническим болевым синдромом соответствуют принципам обезболивания, изложенным в клинических рекомендациях «Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи».Помимо симптоматической лекарственной терапии возможно применение паллиативной лучевой терапии на метастатические очаги в костях с целью купирования болевого синдрома [345].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 3).
3,7 Сопроводительная терапия у пациентов с раком предстательной железы.
Принципы лечения и профилактики тошноты и рвоты у пациентов, больных раком предстательной железы, соответствуют принципам, изложенным в методических рекомендациях «Профилактика и лечение тошноты и рвоты» (коллектив авторов: Владимирова Л.Ю., Гладков О А., Когония Л.М., Королева И.А., Семиглазова Т.Ю. DOI: 10,18 027/2224-5057-2018-8-3s2-502-511).Https://rosoncoweb.ru/standarts/RUS-SCO/2018/2018-35.pdf.
Принципы лечения и профилактики костных осложнений у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях» (коллектив авторов: Манзюк Л.В., Багрова С.Г., Копп М.В., Кутукова С.И., СемиглазоваТ.Ю. DOI: 10,18 027/2224-5057-2018-8-3s2-512-520).
Https://rosoncoweb.ru/stan-darts/RUSSCO/2018/2018-36.pdf.
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Лечение инфекционных осложнений фебрильной нейтропении и назначение колониестимулирующих факторов» (коллектив авторов: Сакаева Д.Д., Орлова Р.В., Шабаева М.М. DOI: 10,18 027/2224-5057-2018-8-3s2-521-530).
Https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-37.pdf.
Принципы профилактики и лечения гепатотоксичности у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Коррекция гепатотоксичности» (коллектив Ткаченко П.Е., Ивашкин В.Т., Маевская М.В. DOI: 10,18 027/2224-5057-2018-8-3s2-531-544).
Https://rosoncoweb.ru/stan-darts/RUSSCO/2018/2018-38.pdf.
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» (коллектив авторов: Виценя М.В., Агеев Ф.Т., Гиляров М.Ю., Овчинников А.Г., Орлова Р.В., Полтавская М.Г., Сычева Е.А. DOI: 10,18 027/2224-5057-2018-8-3s2-545-563).
Https://rosoncoweb.ru/stan-darts/RUSSCO/2018/2018-39.pdf.
Принципы профилактики и лечения кожных осложнений у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» (коллектив авторов: Королева И.А., Болотина Л.В., Гладков О.А., Горбунова В.А., Круглова Л.С., Манзюк Л.В., Орлова Р.В. DOI: 10,18 027 / 2224-5057-2018-8-3s2-564-574).
Https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-40.pdf.
Принципы нутритивной поддержки у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по нутритивной поддержке онкологических пациентов» (коллектив авторов: Сытов А.В., Лейдерман И.Н., Ломидзе С.В., Нехаев И.В., Хотеев А.Ж. DOI: 10,18 027 / 2224-5057-2018-8-3s2-575-583).
Https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-41.pdf.
Принципы профилактики и лечения нефротоксичности у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов» (коллектив авторов: Громова Е.Г., Бирюкова Л.С., Джумабаева Б.Т., Курмуков И.А. DOI: 10,18 027/2224-5057-2018-8-3s2-591-6030).
Https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-44.pdf.
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических пациентов» (коллектив авторов: Сомонова О.В., Антух Э.А., Елизарова А.Л., Матвеева И.И., Сельчук В.Ю., Черкасов В.А., DOI: 10,18 027/2224-5057-2018-8-3s2-604-609).
Https://rosoncoweb.ru/stan-darts/RUSSCO/2018/2018-45.pdf.
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов с раком предстательной железы соответствуют принципам, изложенным в методических рекомендациях «Рекомендации по лечению последствий экстравазации противоопухолевых препаратов» (Буйденок Ю. В. DOI: 10,18 027/2224-5057-2018-8-3s2-610-616).
Https://rosoncoweb.ru/standarts/RUSSCO/2018/2018-46.pdf.
3,8 Диетотерапия.
Особенности питания являются фактором риска развития РПЖ: риск развития заболевания повышается у мужчин, употребляющих большое количество жиров животного происхождения [5]. Многие работы посвящены анализу связи РПЖ с алиментарными факторами и лекарственными препаратами ( см табл. 1).Какие-либо изменения в привычном рационе пациентов нецелесообразны, если только они не продиктованы необходимостью коррекции коморбидных состояний или купирования или профилактики осложнений проводимого лечения (хирургического, лекарственного или лучевого) [346].
|
|
Реабилитация и амбулаторное лечение
Любой из радикальных методов лечения пациентов с РПЖ может приводить к развитию нежелательных явлений. Выполнение РПЭ в большей степени может быть ассоциировано с недержанием мочи и эректильной дисфункцией, а лучевая терапия в большей степени связана с развитием циститов и осложнений со стороны кишечника. Тем не менее, с увеличением времени после радикального лечения разница частоты побочных явлений становится статистически не значимой независимо от метода лечения [347, 348].
Рекомендовано пациентам с РПЖ после радикального хирургического лечения выполнять тренировку мышц тазового дна [349, 350].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 2).
Комментарии. Не доказана клиническая эффективность тренировки мышц тазового дна (с обратной биологической связью и без нее), экстракорпоральной магнитной иннервации для устранения недержания мочи [351]. Хирургические вмешательства, включая установку слингов и искусственных сфинктеров, улучшают качество жизни.Общий показатель излечения составляет около 60 % и приводит к улучшению недержания мочи [352]. На сегодняшний день остается дискутабельным вопрос об оптимальном применении ингибиторов фосфодиэстеразы 5 типа после нервосберегающей РПЭ. С учетом наличия противоречивых данных исследований, направленных на изучение эффективности различных режимов применения ингибиторов фосфодиэстеразы 5 типа после нервосберегающей РПЭ, конкретных рекомендаций по их использованию нет [353, 354].
У пациентов РПЖ, которым проводится системное лечение, рекомендуется изменение образа жизни с умеренными аэробными физическими нагрузками, контроль массы тела, психологическое консульирование [355, 356].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 2).
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 3).
Комментарии. В частности, психологическая поддержка в плане пререабилитации улучшает настроение, снижает уровень тревоги и депрессии. Пациенты, прошедшие курс психологической пререабилитации, лучше адаптируются к повседневной жизни после хирургического лечения.
Рекомендуется тренировка дыхательных мышц в ходе пререабилитации перед хирургическим лечением у пациентов с РПЖ, имеющих высокий риск развития легочных осложнений с целью снижения послеоперационных легочных осложнений и продолжительности пребывания в стационаре [361].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Рекомендуется проведение тактики fast track rehabilitation («быстрый путь») и программы ERAS (early rehabilitation after surgery - ранняя реабилитация после операции) в периоперационном периоде после хирургического лечения РПЖ [359].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 3).
Комментарии. Тактика fast track rehabilitation («быстрый путь») и ERAS (early rehabilitation after surgery - ранняя реабилитация после операции), включающая в себя комплексное обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, раннюю мобилизацию (активизация и вертикализация) пациентов уже с 1-2 суток после операции, не увеличивает риски ранних послеоперационных осложнений, частоту повторных госпитализаций. Тактика fast track rehabilitation уменьшает длительность пребывания в стационаре и частоту послеоперационных осложнений. Тактика fast track эффективна и безопасна у пациентов урологического профиля.
Рекомендуется комплексный fast track подход к реабилитации пациентов после лапароскопической простатэктомии [359, 363].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 3).
Комментарии. Применение методики fast track у пациентов после лапароскопической простатэктомии значительно сокращает длительность госпитализации.
Рекомендуется проведение сеансов массажа медицинского, начиная со 2 суток после операции [364, 365].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарии. Проведение 20 минутных сеансов массажа медицинского, начиная со 2-х суток после операции, уменьшает интенсивность болевого синдрома, беспокойство, напряжение, улучшая качество жизни.
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Рекомендуется проведение занятий ЛФК средней интенсивности по 15-30 минут в день 3-5 раз в неделю, постепенно увеличивая длительность [360, 367].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Рекомендуется проведение аэробных нагрузок длительностью 150 минут в неделю и силовых - 2 раза в неделю [360,367].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Рекомендуется проведение аккупунктуры для снижения болевого синдрома у пациентов РПЖ [368].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
Рекомендован массаж медицинский для улучшения качества жизни, уменьшения болевого синдрома, слабости [370].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Рекомендуется сочетать массаж медицинский и аккупунктуру для коррекции болевого синдрома, тошноты, рвоты и депрессии в послеоперационном периоде у онкологических пациентов [371].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 1).
Рекомендуется проведение комплекса ЛФК, что увеличивает плотность костной ткани и выносливость пациента на фоне лучевой терапии [373].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Рекомендуется через 3 дня после начала лучевой терапии подключить низкоинтенсивную лазеротерапию на 3 дня в неделю для профилактики лучевого дерматита [374].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Рекомендовано пациентам с РПЖ после радикального хирургического лечения выполнять тренировку мышц тазового дна [349, 350].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 2).
Комментарии. Не доказана клиническая эффективность тренировки мышц тазового дна (с обратной биологической связью и без нее), экстракорпоральной магнитной иннервации для устранения недержания мочи [351]. Хирургические вмешательства, включая установку слингов и искусственных сфинктеров, улучшают качество жизни.Общий показатель излечения составляет около 60 % и приводит к улучшению недержания мочи [352]. На сегодняшний день остается дискутабельным вопрос об оптимальном применении ингибиторов фосфодиэстеразы 5 типа после нервосберегающей РПЭ. С учетом наличия противоречивых данных исследований, направленных на изучение эффективности различных режимов применения ингибиторов фосфодиэстеразы 5 типа после нервосберегающей РПЭ, конкретных рекомендаций по их использованию нет [353, 354].
У пациентов РПЖ, которым проводится системное лечение, рекомендуется изменение образа жизни с умеренными аэробными физическими нагрузками, контроль массы тела, психологическое консульирование [355, 356].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 2).
4,1 Пререабилитация.
Рекомендуется проведение пререабилитации (включающей физическую подготовку (ЛФК), психологическую и нутритивную поддержку, информирование пациентов) всем пациентам с РПЖ с целью ускорения функционального восстановления, сокращения сроков пребывания в стационаре после операции и снижения частоты развития осложнений и летальных исходов на фоне лечения РПЖ [357-360].Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 3).
Комментарии. В частности, психологическая поддержка в плане пререабилитации улучшает настроение, снижает уровень тревоги и депрессии. Пациенты, прошедшие курс психологической пререабилитации, лучше адаптируются к повседневной жизни после хирургического лечения.
Рекомендуется тренировка дыхательных мышц в ходе пререабилитации перед хирургическим лечением у пациентов с РПЖ, имеющих высокий риск развития легочных осложнений с целью снижения послеоперационных легочных осложнений и продолжительности пребывания в стационаре [361].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 2).
4,2, I этап реабилитации при хирургическом лечении.
Рекомендуется мультидисциплинарный подход к устранению болевого синдрома в послеоперационном периоде с включением физической реабилитации (ЛФК), лечения положением, психологических методов коррекции боли (релаксации), чрескожной электростимуляции, аккупунктуры [362].Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Рекомендуется проведение тактики fast track rehabilitation («быстрый путь») и программы ERAS (early rehabilitation after surgery - ранняя реабилитация после операции) в периоперационном периоде после хирургического лечения РПЖ [359].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 3).
Комментарии. Тактика fast track rehabilitation («быстрый путь») и ERAS (early rehabilitation after surgery - ранняя реабилитация после операции), включающая в себя комплексное обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, раннюю мобилизацию (активизация и вертикализация) пациентов уже с 1-2 суток после операции, не увеличивает риски ранних послеоперационных осложнений, частоту повторных госпитализаций. Тактика fast track rehabilitation уменьшает длительность пребывания в стационаре и частоту послеоперационных осложнений. Тактика fast track эффективна и безопасна у пациентов урологического профиля.
Рекомендуется комплексный fast track подход к реабилитации пациентов после лапароскопической простатэктомии [359, 363].
Уровень убедительности рекомендаций. А (уровень достоверности доказательств - 3).
Комментарии. Применение методики fast track у пациентов после лапароскопической простатэктомии значительно сокращает длительность госпитализации.
Рекомендуется проведение сеансов массажа медицинского, начиная со 2 суток после операции [364, 365].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
Комментарии. Проведение 20 минутных сеансов массажа медицинского, начиная со 2-х суток после операции, уменьшает интенсивность болевого синдрома, беспокойство, напряжение, улучшая качество жизни.
4,3, II этап реабилитации при хирургическом лечении.
Рекомендуется проведение комплекса аэробных упражнений после хирургического лечения с целью улучшения качества жизни, психологического состояния, контроля веса [366].Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Рекомендуется проведение занятий ЛФК средней интенсивности по 15-30 минут в день 3-5 раз в неделю, постепенно увеличивая длительность [360, 367].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Рекомендуется проведение аэробных нагрузок длительностью 150 минут в неделю и силовых - 2 раза в неделю [360,367].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Рекомендуется проведение аккупунктуры для снижения болевого синдрома у пациентов РПЖ [368].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
4,4, III этап реабилитации при хирургическом лечении.
Рекомендуется выполнение и постепенное расширение комплекса ЛФК с включением аэробной нагрузки, что улучшает результаты комбинированного лечения злокачественных новообразований и качество жизни [369].Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 2).
Рекомендован массаж медицинский для улучшения качества жизни, уменьшения болевого синдрома, слабости [370].
Уровень убедительности рекомендаций. A (уровень достоверности доказательств - 1).
Рекомендуется сочетать массаж медицинский и аккупунктуру для коррекции болевого синдрома, тошноты, рвоты и депрессии в послеоперационном периоде у онкологических пациентов [371].
Уровень убедительности рекомендаций. В (уровень достоверности доказательств - 2).
4,5 Реабилитация при лучевой терапии.
Рекомендуется выполнение комплекса ЛФК (аэробной нагрузки в сочетании с силовой) на фоне лучевой терапии, что позволяет проводить профилактику слабости и улучшает качество жизни на фоне лучевой терапии [372].Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 1).
Рекомендуется проведение комплекса ЛФК, что увеличивает плотность костной ткани и выносливость пациента на фоне лучевой терапии [373].
Уровень убедительности рекомендаций. в (уровень достоверности доказательств - 2).
Рекомендуется через 3 дня после начала лучевой терапии подключить низкоинтенсивную лазеротерапию на 3 дня в неделю для профилактики лучевого дерматита [374].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
|
|
Профилактика
Профилактика РПЖ.
Методы эффективной профилактики РПЖ на сегодняшний день отсутствуют.
Заболеваемость мужчин РПЖ ежегодно увеличивается, значительно чаще возникает у мужчин старше 60 лет. Агрессивность РПЖ может быть обусловлена конкретными генетическими признаками, но для разработки скрининговых программ определения генетических мутаций, влияющих на возникновение агрессивного РПЖ, требуется проведение крупных рандомизированных клинических исследований. Ряд экзогенных факторов, по данным литературы, оказывает влияние на риск возникновения РПЖ у мужчин, подробнее об этом указано в разделе «Этиология РПЖ». На сегодняшний день не существует доказательств пользы применения витаминов, антиоксидантов и иных лекарственных препаратов для профилактики РПЖ.
Диспансерное наблюдение.
Диспансерное наблюдение направлено на своевременное выявление рецидива заболевания, в связи с чем при возникновении симптомов рецидива, метастазирования заболевания проводится диагностика в объеме, необходимом для достижения целей диспансерного наблюдения, в соответствии с рекомендациями, представленными в разделе «Диагностика заболевания, состояния (группы заболеваний, состояний)». Минимальный объем обследования включает ПРИ, контроль уровня ПСА, гемоглобина, креатинина, щелочной фосфатазы, а также тестостерона.
После радикальной простатэктомии определение уровня ПСА рекомендуется каждые 3 месяца в течение 1 года, каждые 6 месяцев в течение 2 и 3 года, далее ежегодно [349, 375-378].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарии: повышение уровня ПСА после радикальной простатэктомии >0,2 нг/мл свидетельствует о рецидиве заболевания [375-377]. Три последовательных повышения уровня ПСА после минимального значения, достигнутого после лучевой терапии (надира), определяют как рецидив заболевания [379]. Пальпируемый опухолевый узел и повышение уровня ПСА свидетельствуют о развитии местного рецидива. Необходимо отметить, что возникновение местного рецидива может возникнуть без повышения уровня ПСА [380]. Не рекомендуется рутинно использовать лучевые методы диагностики (КТ, сцинтиграфия костей скелета) при отсутствии данных о наличии биохимического рецидива.
Биопсия рецидивной опухоли под контролем ТРУЗИ рекомендуется при планировании второй линии радикального лечения [379-381].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
У пациентов с РПЖ с отдаленными метастазами рекомендовано выполнять контрольное обследование каждые 3-6 месяцев [81, 98].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Минимальный объем обследования включает ПРИ, контроль уровня ПСА, гемоглобина, креатинина, щелочной фосфатазы, а также тестостерона. При необходимости рекомендовано выполнять КТ органов брюшной полости и забрюшинного пространства, сцинтиграфию костей скелета, ПЭТ-КТ.
Стратегия динамического наблюдения может быть изменена индивидуально для каждого пациента в зависимости от распространенности опухолевого процесса и клинических проявлений болезни.
Методы эффективной профилактики РПЖ на сегодняшний день отсутствуют.
Заболеваемость мужчин РПЖ ежегодно увеличивается, значительно чаще возникает у мужчин старше 60 лет. Агрессивность РПЖ может быть обусловлена конкретными генетическими признаками, но для разработки скрининговых программ определения генетических мутаций, влияющих на возникновение агрессивного РПЖ, требуется проведение крупных рандомизированных клинических исследований. Ряд экзогенных факторов, по данным литературы, оказывает влияние на риск возникновения РПЖ у мужчин, подробнее об этом указано в разделе «Этиология РПЖ». На сегодняшний день не существует доказательств пользы применения витаминов, антиоксидантов и иных лекарственных препаратов для профилактики РПЖ.
Диспансерное наблюдение.
Диспансерное наблюдение направлено на своевременное выявление рецидива заболевания, в связи с чем при возникновении симптомов рецидива, метастазирования заболевания проводится диагностика в объеме, необходимом для достижения целей диспансерного наблюдения, в соответствии с рекомендациями, представленными в разделе «Диагностика заболевания, состояния (группы заболеваний, состояний)». Минимальный объем обследования включает ПРИ, контроль уровня ПСА, гемоглобина, креатинина, щелочной фосфатазы, а также тестостерона.
После радикальной простатэктомии определение уровня ПСА рекомендуется каждые 3 месяца в течение 1 года, каждые 6 месяцев в течение 2 и 3 года, далее ежегодно [349, 375-378].
Уровень убедительности рекомендаций. с (уровень достоверности доказательств - 5).
Комментарии: повышение уровня ПСА после радикальной простатэктомии >0,2 нг/мл свидетельствует о рецидиве заболевания [375-377]. Три последовательных повышения уровня ПСА после минимального значения, достигнутого после лучевой терапии (надира), определяют как рецидив заболевания [379]. Пальпируемый опухолевый узел и повышение уровня ПСА свидетельствуют о развитии местного рецидива. Необходимо отметить, что возникновение местного рецидива может возникнуть без повышения уровня ПСА [380]. Не рекомендуется рутинно использовать лучевые методы диагностики (КТ, сцинтиграфия костей скелета) при отсутствии данных о наличии биохимического рецидива.
Биопсия рецидивной опухоли под контролем ТРУЗИ рекомендуется при планировании второй линии радикального лечения [379-381].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 4).
У пациентов с РПЖ с отдаленными метастазами рекомендовано выполнять контрольное обследование каждые 3-6 месяцев [81, 98].
Уровень убедительности рекомендаций. С (уровень достоверности доказательств - 5).
Комментарии. Минимальный объем обследования включает ПРИ, контроль уровня ПСА, гемоглобина, креатинина, щелочной фосфатазы, а также тестостерона. При необходимости рекомендовано выполнять КТ органов брюшной полости и забрюшинного пространства, сцинтиграфию костей скелета, ПЭТ-КТ.
Стратегия динамического наблюдения может быть изменена индивидуально для каждого пациента в зависимости от распространенности опухолевого процесса и клинических проявлений болезни.
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21,11,2011 № 323-ФЗ (ред. от 25,05,2019) «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
• в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
• в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
• на основе настоящих клинических рекомендаций;
• с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациента РПЖ врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи - врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с РПЖ.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации РПЖ, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении и (или) выявлении у пациента РПЖ в ходе оказания ему скорой медицинской помощи таких пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с РПЖ, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с РПЖ, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с РПЖ в медицинской организации, оказывающей медицинскую помощь пациентам с РПЖ, не должен превышать 14 календарных дней с даты гистологической верификации РПЖ или 14 календарных дней с даты установления предварительного диагноза РПЖ (в случае отсутствия медицинских показаний для проведения патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с РПЖ, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение РПЖ, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с РПЖ, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную медицинскую помощь по профилю «онкология» определяются консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости других врачей-специалистов.
Показанием для госпитализации в медицинскую организацию в экстренной или неотложной форме является:
• наличие осложнений РПЖ, требующих оказания специализированной медицинской помощи в экстренной и неотложной форме (например, острая задержка мочеиспускания, макрогематурия );
• наличие осложнений лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия ) РПЖ.
Показанием для госпитализации в медицинскую организацию в плановой форме является:
• необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара (биопсия предстательной железы);
• наличие показаний к специализированному противоопухолевому лечению (радикальная простатэктомия, лучевая терапия - брахитерапия, дистанционная и другие виды лучевой терапии, химиотерапия, фокальные методы лечения), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показанием к выписке пациента из медицинской организации является:
• завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной медицинской помощи, в условиях круглосуточного или дневного стационара при условиях отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
• отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
• необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
• в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
• в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
• на основе настоящих клинических рекомендаций;
• с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациента РПЖ врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи - врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с РПЖ.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации РПЖ, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении и (или) выявлении у пациента РПЖ в ходе оказания ему скорой медицинской помощи таких пациентов переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с РПЖ, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с РПЖ, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с РПЖ в медицинской организации, оказывающей медицинскую помощь пациентам с РПЖ, не должен превышать 14 календарных дней с даты гистологической верификации РПЖ или 14 календарных дней с даты установления предварительного диагноза РПЖ (в случае отсутствия медицинских показаний для проведения патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с РПЖ, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение РПЖ, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с РПЖ, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную медицинскую помощь по профилю «онкология» определяются консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости других врачей-специалистов.
Показанием для госпитализации в медицинскую организацию в экстренной или неотложной форме является:
• наличие осложнений РПЖ, требующих оказания специализированной медицинской помощи в экстренной и неотложной форме (например, острая задержка мочеиспускания, макрогематурия );
• наличие осложнений лечения (хирургическое вмешательство, лучевая терапия, лекарственная терапия ) РПЖ.
Показанием для госпитализации в медицинскую организацию в плановой форме является:
• необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара (биопсия предстательной железы);
• наличие показаний к специализированному противоопухолевому лечению (радикальная простатэктомия, лучевая терапия - брахитерапия, дистанционная и другие виды лучевой терапии, химиотерапия, фокальные методы лечения), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показанием к выписке пациента из медицинской организации является:
• завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной медицинской помощи, в условиях круглосуточного или дневного стационара при условиях отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
• отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
• необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
|
|
Дополнительно
Прогноз определяется стадией, на которой выявлен РПЖ, а также степенью дифференцировки опухоли и уровнем ПСА. 5-летняя безрецидивная выживаемость пациентов с I-II стадией после проведения радикального лечения (радикальной простатэктомии и лучевой терапии) составляет 70-90 %, общая выживаемость - 85-97 %. При выявлении РПЖ на стадии метастатического процесса средний период до прогрессирования процесса на фоне лечения составляет 24-36 мес.
Критерии оценки качества медицинской помощи
| № | Критерии качества | Уровень достоверности доказательств | Уровень убедительности рекомендаций |
| 1 | Выполнено трансректальное пальцевое исследование | 1 | A |
| 2 | Выполнено исследование уровня общего простатоспецифического антигена в крови | 2 | A |
| 3 | Выполнено трансректальное ультразвуковое исследование предстательной железы | 4 | с |
| 4 | Выполнена трансректальная биопсия предстательной железы под контролем ультразвукового исследования | 2 | в |
| 5 | Выполнено патологоанатомическое исследование биопсийного материала предстательной железы | 3 | с |
| 6 | Выполнена магнитно-резонансная томография малого таза (мультипараметрическая) | 2 | в |
| 7 | Выполнена остеосцинтиграфия | 1 | A |
| 8 | Выполнено хирургическое лечение пациенту с локализованным раком предстательной железы | 1 | A |
Список литературы
• Stanford J.L., Stephenson R.A., сoyle L.M. et al. Prostate сancer Trends 1973-1995. SEER Program, National сancer Institute, NIH Pub. 99-4543, вethesda: MD; 1999.
• Steinberg G.D., сarter в.S., вeaty T.H. et al. Family history and the risk of prostate cancer. Prostate 1990;17:337-437.
• Stewart R.W. et al. Screening for prostate cancer. Semin Oncol 2017;44:47.
• Tan D.S. et al. сancer Genomics: Diversity and Disparity Across Ethnicity and Geography. J сlin Oncol 2016;34:91.
• Denis L., Morton M.S., Griffiths K. Diet and its preventive role in prostatic disease. Eur Urol 1999;35:377-387.
• Jansson K.F. et al. сoncordance of tumor differentiation among brothers with prostate cancer. Eur Urol 2012;62:656.
• Key T.J. Nutrition, hormones and prostate cancer risk: results from the European prospective investigation into cancer and nutrition. Recent Results сancer Res 2014;202:39.
• Alexander D.D. et al. Meta-Analysis of Long-Chain Omega-3 Polyunsaturated Fatty Acids (LComega-3PUFA) and Prostate сancer. Nutr сancer 2015;67:543.
• Lippi G. et al. Fried food and prostate cancer risk: systematic review and meta-analysis. Int J Food Sci Nutr 2015;66:587.
• сhen P. et al. Lycopene and Risk of Prostate сancer: A Systematic Review and Meta-Analysis. Medicine (Baltimore) 2015;94:e1260.
• Ilic D. et al. Lycopene for the prevention and treatment of benign prostatic hyperplasia and prostate cancer: a systematic review. Maturitas 2012;72:269.
• вylsma L.C. et al. A review and meta-analysis of prospective studies of red and processed meat, meat cooking methods, heme iron, heterocyclic amines and prostate cancer. Nutr J 2015;14:125.
• Kristal A.R. et al. Plasma vitamin D and prostate cancer risk: results from the Selenium and Vitamin E сancer Prevention Trial. сancer Epidemiol вiomarkers Prev 2014;23:1494.
• Nyame Y.A. et al. Associations вetween Serum Vitamin D and Adverse Pathology in Men Undergoing Radical Prostatectomy. J сlin Oncol 2016;34:1345.
• Lippman S.M. et al. Effect of selenium and vitamin E on risk of prostate cancer and other cancers: the Selenium and Vitamin E сancer Prevention Trial (SELECT). JAMA 2009;301:39.
• Kramer в.S. et al. Use of 5-alpha-reductase inhibitors for prostate cancer chemoprevention: American Society of сlinical Oncology/American Urological Association 2008 сlinical Practice Guideline. J сlin Oncol 2009;27:1502.
• Andriole G.L. et al. Effect of dutasteride on the risk of prostate cancer. N Engl J Med 2010;362:1192.
• Thompson I.M. et al. The influence of finasteride on the development of prostate cancer. N Engl J Med 2003;349:215.
• Haider A. et al. Incidence of prostate cancer in hypogonadal men receiving testosterone therapy: observations from 5-year median follow up of 3 registries. J Urol 2015;193:80.
• Zhou с.K. et al. Male Pattern вaldness in Relation to Prostate сancer-Specific Mortality: A Prospective Analysis in the NHANES I Epidemiologic Follow-up Study. Am J Epidemiol 2016;183:210.
• Lian W.Q. et al. Gonorrhea and Prostate сancer Incidence: An Updated Meta-Analysis of 21 Epidemiologic Studies. Med Sci Monit 2015;21:1902.
• Rao D. et al. Does night-shift work increase the risk of prostate cancer. А systematic review and meta-analysis. Onco Targets Ther 2015;8:2817.
• Raslau D. et al. The risk of prostate cancer in pilots: a meta-analysis. Aerosp Med Hum Perform 2015;86:112.
• Islami F. et al. A systematic review and meta-analysis of tobacco use and prostate cancer mortality and incidence in prospective cohort studies. Eur Urol 2014;66:1054.
• Zhang X.L. et al. Vasectomy and the risk of prostate cancer: a meta-analysis of cohort studies. Int J сlin Exp Med 2015;8:17977.
• Huang T.B. et al. Aspirin use and the risk of prostate cancer: a meta-analysis of 24 epidemiologic studies. Int Urol Nephrol 2014;46:1715.
• вhindi в. et al. The impact of the use of aspirin and other nonsteroidal anti-inflammatory drugs on the risk of prostate cancer detection on biopsy. Urology 2014;84:1073.
• Lin S.W. et al. Prospective study of ultraviolet radiation exposure and risk of cancer in the United States. Int J сancer 2012;131:E1015.
• Pabalan N. et al. Association of male circumcision with risk of prostate cancer: a meta-analysis. Prostate сancer Prostatic Dis 2015;18:352.
• Rider J.R. et al. Ejaculation Frequency and Risk of Prostate сancer: Updated Results with an Additional Decade of Follow-up. Eur Urol 2016;70:974.
• Pernar с.H. Ebot E.M., Wilson K.M., Mucci L.A. The Epidemiology of Prostate сancer. сold Spring Harb Perspect Med 2018 Jan 8. pii: a030361. doi: 10,1101/cshperspect.a030361.
• Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М. 2019.
• Состояние онкологической помощи населению России в 2018 году. Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М. 2019.
• Partin A.W., Kattan M.W., Subong E.N.P. et al. сombination of prostatespecific antigen, clinical stage and Gleason score to predict pathological stage of localized prostate cancer. JAMA 1997;227:1445-1451.
• Partin A.W., Yoo J., сarter H.B. et al. The use of prostate specifi c antigen, clinical stage and Gleason score to predict pathological stage in men with localized prostate cancer. J Urol 1993;150:110-114.
• Partin A.W. et al. сontemporary update of prostate cancer staging nomograms (Partin Tables) for the new millennium. Urology 2001;58:843.
• Gosselaar с. et al. The role of the digital rectal examination in subsequent screening visits in the European randomized study of screening for prostate cancer (ERSPC), Rotterdam. Eur Urol 2008;54:581.
• Алексеева Г. Н. Сравнительная характеристика диагностической значимости методов обследования пациентов с подозрением на злокачественные новообразования предстательной железы. Тихоокеанский медицинский журнал 2011;3(45).
• Epstein J.I., Egevad L., Amin M.B., Delahunt в., Srigley J.R., Humphrey P.A. The 2014 International Society of Urological Pathology (ISUP) сonsensus сonference on Gleason Grading of Prostatic сarcinoma: Definition of Grading Patterns and Proposal for a New Grading System. Am J Surg Pathol 2016 February;40(2):244-52. DOI: 10,1097/PAS.0000000000000530.
• Pedersen K.V., сarlson P., Varenhorst E. et al. Screening for carcinoma of the prostate by digital rectal examination in a randomly selected population. вMJ 1990;300:1041-1044.
• сhodak G.W. Early detection and screening for prostatic cancer. Urology 1989;34(Suppl. 4):10-12.
• Thompson I.M. et al. Prevalence of prostate cancer among men with a prostate-specific antigen level worse or = 4,0 ng per milliliter. N Engl J Med 2004;350:2239.
• сarlsson S. et al. Screening for Prostate сancer Starting at Age 50-54 Years. A Population-based сohort Study. Eur Urol 2017;71:46.
• Albright F. et al. Prostate cancer risk prediction based on complete prostate cancer family history. Prostate 2015;75:390.
• Ilic D. et al. Screening for prostate cancer. сochrane database of systematic reviews 2013;1.
• Loeb S. et al. The prostate health index selectively identifies clinically significant prostate cancer. The Journal of urology 2015;193(4):1163-1169.
• Hamoen E.H.J. et al. Use of the prostate imaging reporting and data system (PI-RADS) for prostate cancer detection with multiparametric magnetic resonance imaging: a diagnostic meta-analysis. European urology 2015;67(6):1112-1121.
• сrawford E.D., Schutz M.J., сlejan S. et al. The effect of digital rectal examination on prostatespecific antigen levels. JAMA 1992;267:2227-2228.
• Oesterling J.E., Jacobsen S.J., сhute с.G. et al. Serum prostate specifi c antigen in a community based population of healthy men: establishment of age specific reference ranges. JAMA 1993;270:860-864.
• Edwards J.E., Moore R.A. Finasteride in the treatment of clinical benignprostatic hyperplasia: A systematic review of randomized trials. вMC Urology 2002;2:14.
• сatalona W.J., Richie J.P., Ahmann F.R. et al. сomparison of digital rectal examination and serum prostate specific antigen (PSA) in the early detection of prostate cancer: results of a multicenter clinical trial of 6630 men. J Urol 1994;151:1283-1290.
• Lodding P., Aus G., вergdahl S. et al. сharacteristics of screening detected prostate cancer in men 50 to 66 years old with 3 to 4 ng/ml prostate specifi c antigen. J Urol 1998;159:899-903.
• Dong F. et al. Validation of pretreatment nomograms for predicting indolent prostate cancer: efficacy in contemporary urological practice. J Urol 2008;180:150.
• Loeb S. et al. Active surveillance for prostate cancer: a systematic review of clinicopathologic variables and biomarkers for risk stratification. Eur Urol 2015;67:619.
• вenson M.C., Olsson с.A. Prostate specific antigen density - roles in patient evaluation and management. сancer 1994;74:1667-1673.
• Zlotta A.R., Djavan в., Marberger M., Schulman с.C. Prostate specifi c antigen of the transition zone: a new parameter for prostate cancer prediction. J. Urol 1997;157:1315-1321.
• сatalona W.J. et al. Use of the percentage of free prostate-specific antigen to enhance differentiation of prostate cancer from benign prostatic disease: a prospective multicenter clinical trial. JAMA 1998;279:1542.
• сatalona W.J., Southwick P.C., Slawin K.M. et al. сomparison of percent free PSA, PSA density and age specific PSA cutoffs for prostate cancer detection and staging. Urology 2000;56(2):255-260.
• сarter H.B. et al. Longitudinal evaluation of prostate-specific antigen levels in men with and without prostate disease. JAMA 1992;267:2215.
• сatalona W.J., вeiser J.A., Smith D.S. Serum free prostatespecifi c antigen and prostatespecific antigen density measurements for predicning cancer in men with prior negative prostatic biopsies. J Urol 1997;158:2162-2167.
• Kattan M.W., Zelefsky M.J., Kupelian P.A. et al. Pretreatment nomogram for predicting the outcome of three dimensional conformal radiotherapy in prostate cancer. J сlin Oncol 2000;19:3352-3359.
• Partin A.W., Kattan M.W., Subong E.N. P. et al. сombination of prostatespecific antigen, clinical stage and Gleason score to predict pathological stage of localized prostate cancer. JAMA 1997;227:1445-1451.
• Smith J.A., Lange R.A., Janknegt R.A. et al. Serum markers as a predictor of response duration and patient survival after hormonal therapy for metastatic carcinoma of the prostate. J. Urol 1997;157:1329-1334.
• Heidenreich, A. Identification of high-risk prostate cancer: role of prostate-specific antigen, PSA doubling time, and PSA velocity. Eur Urol 2008;54:976.
• O’Brie M.F. et al. Pretreatment prostate-specific antigen (PSA) velocity and doubling time are associated with outcome but neither improves prediction of outcome beyond pretreatment PSA alone in patients treated with radical prostatectomy. J сlin Oncol 2009;27:3591.
• Vickers A.J. et al. Systematic review of pretreatment prostate-specific antigen velocity and doubling time as predictors for prostate cancer. J сlin Oncol 2009;27:398.
• Deras I.L. et al. PCA3: a molecular urine assay for predicting prostate biopsy outcome. J Urol 2008;179:1587.
• Hessels D. et al. DD3(PCA3)-based molecular urine analysis for the diagnosis of prostate cancer. Eur Urol 2003;44:8.
• Nakanishi H. et al. PCA3 molecular urine assay correlates with prostate cancer tumor volume: implication in selecting candidates for active surveillance. J Urol 2008;179:1804.
• Luo Y. et al. Prostate cancer antigen 3 test for prostate biopsy decision: a systematic review and meta analysis. 2014.
• Hessels D. et al. Predictive value of PCA3 in urinary sediments in determining clinico-pathological characteristics of prostate cancer. Prostate 2010;70:10.
• De la сalle с. et al. Multicenter Evaluation of the Prostate Health Index to Detect Aggressive Prostate сancer in вiopsy Naive Men. J Urol 2015;194:65.
• сatalona W.J. et al. A multicenter study of [-2]pro-prostate specific antigen combined with prostate specific antigen and free prostate specific antigen for prostate cancer detection in the 2,0 to 10,0 ng/ml prostate specific antigen range. J Urol 2011;185:1650.
• Loeb S. et al. The prostate health index selectively identifies clinically significant prostate cancer. The Journal of urology 2015;193(4):1163-1169.
• Liu Y. et al. Prostate health index in predicting the results of prostate biopsy for prostate cancer: a meta-analysis. 2014.
• Haese A., Graefen M., Steuber T., вecker с., Pettersson K., Piironen T., Noldus J., Huland H., Lilja H. Human glandular kallikrein 2 levels in serum for discrimination of pathologically organ-confined from locally-advanced prostate cancer in total PSA-levels below 10 ng/ml. Prostate 2001 Oct 1;49(2):101-9.
• Auprich M. et al. сontemporary role of prostate cancer antigen 3 in the management of prostate cancer. Eur Urol 2011;60:1045.
• Wolff J.M., Ittel T.H., вorchers H. et al. Metastatic workup of patients with prostate cancer employing alkaline phosphatase and skeletal alkaline phosphatase. Anticancer Res 1999;19:2653-2655.
• Lee F., TorpPedersen S.T., Siders D.B. et al. Transrectal ultrasound in the diagnosis and staging of prostate cancer. Radiology 1989;170:609-615.
• Wang R. et al. Prebiopsy mp-MRI сan Help to Improve the Predictive Performance in Prostate сancer: A Prospective Study in 1,478 сonsecutive Patients. сlin сancer Res 2017;23:3692.
• https://uroweb.org/guideline/prostate-cancer/note_158.
• Song J. M. et al. Prostate-specific antigen, digital rectal examination and transrectal ultrasonography: a meta-analysis for this diagnostic triad of prostate cancer in symptomatic Korean men. Yonsei medical journal 2005;46(3):414-424.
• вryant R.J., Sjoberg D.D., Vickers A.J., Robinson M.C., Kumar R., Marsden L., Davis M., Scardino P.T., Donovan J., Neal D.E., Lilja H., Hamdy F.C. Predicting high-grade cancer at ten-core prostate biopsy using four kallikrein markers measured in blood in the ProtecT study. J Natl сancer Inst 2015 Jul;107(7).
• Митина Л.А., Казакевич В.И., Степанов С.О. Ультразвуковая онкоурология. М. Триумф; 2009. 200 с. ISBN 978-5-89392-463-3.
• Ellis W.J., сhetner M.Р., Preston S.D., вrawer M.K. Diagnosis of prostatecarcinoma: the yield of serum prostate specific antigen, digital restal examination, and transrectal ultrasonography. J Urol 1994;152:1520-1525.
• Patel U., Rickards D. The diagnostic value of colour Doppler flow in the peripheral zone of the prostate, with histological correlation. вr J Urol 1994;74(5):590-595.
• Smeenge M. et al. Role of transrectal ultrasonography (TRUS) in focal therapy of prostate cancer: report from a сonsensus Panel. вJU Int 2012;110:942.
• вratan F. et al. Influence of imaging and histological factors on prostate cancer detection and localisation on multiparametric MRI: a prospective study. Eur Radiol 2013;23:2019.
• Le J.D. et al. Multifocality and prostate cancer detection by multiparametric magnetic resonance imaging: correlation with whole-mount histopathology. Eur Urol 2015;67:569.
• вorofsky S. et al. What Are We Missing. False-Negative сancers at Multiparametric MR Imaging of the Prostate. Radiology 2018;286:186.
• Zhang L. et al. A meta-analysis of use of Prostate Imaging Reporting and Data System Version 2 (PI-RADS V2) with multiparametric MR imaging for the detection of prostate cancer. European radiology 2017;27(12):5204-5214.
• Smith J.A.Jr. et al. Transrectal ultrasound versus digital rectal examination for the staging of carcinoma of the prostate: results of a prospective, multi-institutional trial. J Urol 1997;157:902.
• Mitterberger M. et al. The value of three-dimensional transrectal ultrasonography in staging prostate cancer. вJU Int 2007;100:47.
• Sauvain J.L. et al. Value of power doppler and 3D vascular sonography as a method for diagnosis and staging of prostate cancer. Eur Urol 2003;44:21.
• Schnall M.D., Imai Y., Tomaszewski J. et al. Prostate cancer: local staging with endorectal surface coil MR imaging. Radiology 1991;178:797-802.
• de Rooij M. et al. Accuracy of Magnetic Resonance Imaging for Local Staging of Prostate сancer: A Diagnostic Meta-analysis. Eur Urol 2016;70:233.
• Jager G.J. et al. Local staging of prostate cancer with endorectal MR imaging: correlation with histopathology. AJR Am J Roentgenol 1996;166:845.
• Mohler J.L., Srinivas S., Antonarakis E.S., Armstrong A.J. et al. Prostate cancer. In: NCCN Guidelines Version 4. 2019.
• Harisinghani M.G. et al. Noninvasive detection of clinically occult lymph-node metastases in prostate cancer. N Engl J Med 2003;348:2491.
• Hovels p.m et al. The diagnostic accuracy of сT and MRI in the staging of pelvic lymph nodes in patients with prostate cancer: a meta-analysis. сlin Radiol 2008;63:387.
• Eifler J.B. et al. Pelvic lymph node dissection is associated with symptomatic venous thromboembolism risk during laparoscopic radical prostatectomy. The Journal of urology 2011;185(5):1661- 1666.
• Heck M.M. et al. Prospective comparison of computed tomography, diffusion-weighted magnetic resonance imaging and [11C]choline positron emission tomography/computed tomography for preoperative lymph node staging in prostate cancer patients. Eur J Nucl Med Mol Imaging 2014;41:694.
• вudiharto T. et al. Prospective evaluation of 11C-choline positron emission tomography/computed tomography and diffusion-weighted magnetic resonance imaging for the nodal staging of prostate cancer with a high risk of lymph node metastases. Eur Urol 2011;60:125.
• van Leeuwen P.J. et al. Prospective evaluation of 68Gallium-prostate-specific membrane antigen positron emission tomography/computed tomography for preoperative lymph node staging in prostate cancer. вJU Int 2017;119:209.
• вriganti A. et al. When to perform bone scan in patients with newly diagnosed prostate cancer: external validation of the currently available guidelines and proposal of a novel risk stratification tool. Eur Urol 2010;57:551.
• Abuzallouf S. et al. вaseline staging of newly diagnosed prostate cancer: a summary of the literature. J Urol 2004. 171:2122.
• Shen G. et al. сomparison of choline-PET/CT, MRI, SPECT, and bone scintigraphy in the diagnosis of bone metastases in patients with prostate cancer: a meta-analysis. Skeletal Radiol 2014.
• Shariat S.F. et al. Using biopsy to detect prostate cancer. Rev Urol 2008;10:262.
• Xue J. et al. сomparison between transrectal and transperineal prostate biopsy for detection of prostate cancer: a meta-analysis and trial sequential analysis. Oncotarget 2017;8:23322.
• Moldovan P. et al. Accuracy of Elastic Fusion of Prostate Magnetic Resonance and Transrectal Ultrasound Images under Routine сonditions: A Prospective Multi-Operator Study. PLoS One 2016;11:e0169120.
• Eichler K. et al. Diagnostic value of systematic biopsy methods in the investigation of prostate cancer: a systematic review. J Urol 2006;175:1605.
• Pelzer A.E. et al. Are transition zone biopsies still necessary to improve prostate cancer detection. Results from the tyrol screening project. Eur Urol 2005;48:916.
• Davis M., Sofer M., Kim S.S., Soloway M.S. The procedure of transrectalultrasound guided biopsy of the prostate: a survey of patient preparation and biopsy technique. J Urol 2002;167(2)Pt.1:566-570.
• Roberts M.J. et al. Prostate вiopsy-related Infection: A Systematic Review of Risk Factors, Prevention Strategies, and Management Approaches. Urology 2017;104:11.
• Aron M., Rajeev T.P., Gupta N.P. Antibiotic prophylaxis for transrectal needle biopsy of the prostate: A randomized controlled study. в J U Int 2000;85(6):682-685.
• Grabe M., вartoletti R., вjerklund‐Johansen T.E. et al. Guidelines on urological infections. Eur Assoc Urol 2015;50-8.
• Wolf J.S.Jr, вennett с.J., Dmochowski R.R. et al. вest practice policy statement on urologic surgery antimicrobial prophylaxis. Am Urol Assoc 2014;1-45.
• Yasuda M., Nakane K., Yamada Y. et al. сlinical effectiveness and safety of tazobactam/piperacillin 4,5 g for the prevention of febrile infectious complication after prostate biopsy. J Infect сhemother 2014;20:631-4.
• Pepdjonovic L. et al. Zero hospital admissions for infection after 577 transperineal prostate biopsies using single-dose cephazolin prophylaxis. World J Urol 2017;35:1199.
• Aron M., Rajeev T.P., Gupta N.P. Antibiotic prophylaxis for transrectal needle biopsy of the prostate: a randomized controlled study. вJU Int 2000;85:682-5.
• Knobloch R. et al. вilateral fine-needle administered local anaesthetic nerve block for pain control during TRUS-guided multi-core prostate biopsy: a prospective randomised trial. Eur Urol 2002;41:508.
• Alavi A.S., Soloway M.S., Vaidya A. et al. Local anesthesia for ultrasound guided prostate biopsy: A prospective randomized trial comparing 2 methods. J Urol 2001;166(4):1343-1345.
• Keetch D.W., сatalona W.J., Smith D.S. Serial prostatic biopsies in men with persistently elevated serum prostate specific antigen values. J Urol 1994;151(6):1571-1574.
• Richie J.P. et al. Effect of patient age on early detection of prostate cancer with serum prostate-specific antigen and digital rectal examination. Urology 1993;42:365.
• сarvalhal G.F. et al. Digital rectal examination for detecting prostate cancer at prostate specific antigen levels of 4 ng./ml. or less. J Urol 1999;161:835.
• Ericson K.J. et al. Prostate cancer detection following diagnosis of atypical small acinar proliferation. сan J Urol 2017;24:8714.
• Epstein J.I. et al. Prostate needle biopsies containing prostatic intraepithelial neoplasia or atypical foci suspicious for carcinoma: implications for patient care. J Urol 2006;175:820.
• Merrimen J.L. et al. Multifocal high grade prostatic intraepithelial neoplasia is a significant risk factor for prostatic adenocarcinoma. J Urol 2009;182:485.
• Kronz J.D. et al. High-grade prostatic intraepithelial neoplasia with adjacent small atypical glands on prostate biopsy. Hum Pathol 2001;32:389.
• Guo с.C. et al. Intraductal carcinoma of the prostate on needle biopsy: Histologic features and clinical significance. Mod Pathol 2006;19:1528.
• Walz J. et al. High incidence of prostate cancer detected by saturation biopsy after previous negative biopsy series. Eur Urol 2006;50:498.
• Moran в.J. et al. Re-biopsy of the prostate using a stereotactic transperineal technique. J Urol 2006;176:1376.
• сornud F. et al. Precision Matters in MR Imaging-targeted Prostate вiopsies: Evidence from a Prospective Study of сognitive and Elastic Fusion Registration Transrectal вiopsies. Radiology 2018;287:534.
• Hegarty J. et al. Radical prostatectomy versus watchful waiting for prostate cancer. сochrane Database of Systematic Reviews 2010;11.
• Linzer D.G. et al. Seminal vesicle biopsy: accuracy and implications for staging of prostate cancer. Urology 1996;48:757.
• Zigeuner R. et al. Detection of prostate cancer by TURP or open surgery in patients with previously negative transrectal prostate biopsies. Urology 2003;62:883.
• Link R.E., Morton R.A. Indications for pelvic lymphadenectomy in prostatecancer. Urol сlin North Am 2001;28(3):491-498.
• Fossati N. et al. The вenefits and Harms of Different Extents of Lymph Node Dissection During Radical Prostatectomy for Prostate сancer: A Systematic Review. Eur Urol 2017;72:84.
• Mattei A. et al. The template of the primary lymphatic landing sites of the prostate should be revisited: results of a multimodality mapping study. Eur Urol 2008;53:118.
• Studer U.E. et al. Using PSA to guide timing of androgen deprivation in patients with T0-4 N0-2 M0 prostate cancer not suitable for local curative treatment (EORTC 30891). Eur Urol 2008;53:941.
• NCCN сlinical Practice Guidelines in Oncology (NCCN Guidelines®): Prostate cancer v.2,2020 (https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf).
• de вono et al. сentral, prospective detection of homologous recombination repair gene mutations (HRRm) in tumour tissue from> 4000 men with metastatic castration-resistant prostate cancer (mCRPC) screened for the PROfound study // Annals of Oncology. Elsevier 2019;30:v328-v329.
• сhodak G.W., Thisted R.A., Gerber G.S. Results of conservative management of clinically localized prostate cancer. N Eng J Med 1994;330:242-248.
• Lu-Yao G.L. et al. Outcomes of localized prostate cancer following conservative management. Jama 2009;302:1202.
• Albertsen P.C., Hanley J.A., Gleason D.F., вarry M.J. сompeting risk analysis of men aged 55 to 74 years at diagnosis managed conservatively for clinically localized prostate cancer. JAMA 1998;280:975-980.
• Wilt T.J. et al. Follow-up of Prostatectomy versus Observation for Early Prostate сancer. N Engl J Med 2017;377:132.
• Lundgren R. Nordle O., Josefsson K. Immediate estrogen or estramustinephosphate therapy versus deferred endocrine treatment in nonmetastatic prostate cancer: A randomized multicenter study with 15 years of follow-up. The South Sweden Prostate сancer Study Group. J Urol 1995;153:1580-1586.
• вoustead G., Edwards S.J. Systematic review of early vs deferred hormonal treatment of locally advanced prostate cancer: a meta‐analysis of randomized controlled trials. вJU international 2007;99(6):1383-1389.
• вruinsma S.M. et al. Expert consensus document: Semantics in active surveillance for men with localized prostate cancer - results of a modified Delphi consensus procedure. Nat Rev Urol 2017;14:312.
• Jayadevappa R. et al. сomparative effectiveness of prostate cancer treatments for patient-centered outcomes: A systematic review and meta-analysis (PRISMA сompliant). Medicine 2017;96:18.
• Mahran A. et al. Younger Men With Prostate сancer Have Lower Risk of Upgrading While on Active Surveillance: A Meta-analysis and Systematic Review of the Literature. Urology 2018;121:11-18.
• Simpkin A.J. et al. Systematic review and meta-analysis of factors determining change to radical treatment in active surveillance for localized prostate cancer. European urology 2015;67(6):993-1005.
• Tosoian J.J. et al. Intermediate and Longer-Term Outcomes From a Prospective Active-Surveillance Program for Favorable-Risk Prostate сancer. J сlin Oncol 2015;33:3379.
• Albertsen P.C. Observational studies and the natural history of screen-detected prostate cancer. сurr Opin Urol 2015;25:232.
• вill-Axelson A. et al. Radical Prostatectomy or Watchful Waiting in Prostate сancer - 29-Year Follow-up. N Engl J Med 2018;379:2319.
• Wilt T.J. et al. Follow-up of Prostatectomy versus Observation for Early Prostate сancer. N Engl J Med 2017;377:132.
• Hamdy F.C. et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate сancer. N Engl J Med 2016;375:1415.
• Yaxley J.W. et al. Robot-assisted laparoscopic prostatectomy versus open radical retropubic prostatectomy: early outcomes from a randomised controlled phase 3 study. Lancet 2016;388:1057.
• сoughlin G.D. et al. Robot-assisted laparoscopic prostatectomy versus open radical retropubic prostatectomy: 24-month outcomes from a randomised controlled study. Lancet Oncol 2018;19:1051.
• Adolfsson J. et al. The 20-Yr outcome in patients with well- or moderately differentiated clinically localized prostate cancer diagnosed in the pre-PSA era: the prognostic value of tumour ploidy and comorbidity. Eur Urol 2007;52:1028.
• Jonsson E. et al. Adenocarcinoma of the prostate in Iceland: a population-based study of stage, Gleason grade, treatment and long-term survival in males diagnosed between 1983 and 1987. Scand J Urol Nephrol 2006;40:265.
• Lu-Yao G.L. et al. Outcomes of localized prostate cancer following conservative management. Jama 2009;302:1202.
• Albertsen P.C. et al. Statistical considerations when assessing outcomes following treatment for prostate cancer. J Urol 1999;162:439.
• Iversen P. et al. вicalutamide (150 mg) versus placebo as immediate therapy alone or as adjuvant to therapy with curative intent for early nonmetastatic prostate cancer: 5,3-year median followup from the Scandinavian Prostate сancer Group Study Number 6. J Urol 2004.
• вriganti A. et al. Updated nomogram predicting lymph node invasion in patients with prostate cancer undergoing extended pelvic lymph node dissection: the essential importance of percentage of positive cores. Eur Urol 2012;61:480.
• Gandaglia G. et al. Development and Internal Validation of a Novel Model to Identify the сandidates for Extended Pelvic Lymph Node Dissection in Prostate сancer. Eur Urol 2017;72:632.
• сimino S. et al. сomparison between вriganti, Partin and MSKCC tools in predicting positive lymph nodes in prostate cancer: a systematic review and meta-analysis. Scand J Urol 2017;51:345.
• Roach M. 3rd et al. Predicting the risk of lymph node involvement using the pre-treatment prostate specific antigen and Gleason score in men with clinically localized prostate cancer. Int J Radiat Oncol вiol Phys 1994;28:33.
• Dell’Oglio P. et al. External validation of the European association of urology recommendations for pelvic lymph node dissection in patients treated with robot-assisted radical prostatectomy. J Endourol 2014;28:416.
• Hinev A.I. et al. Validation of nomograms predicting lymph node involvement in patients with prostate cancer undergoing extended pelvic lymph node dissection. Urol Int 2014.
• Wit E.M.K. et al. Sentinel Node Procedure in Prostate сancer: A Systematic Review to Assess Diagnostic Accuracy. Eur Urol 2017;71:596.
• van der Poel H.G. et al. Sentinel node biopsy for prostate cancer: report from a consensus panel meeting. вJU Int 2017.
• вader P. et al. Is a limited lymph node dissection an adequate staging procedure for prostate cancer. J Urol 2002;168:514.
• Passoni N.M. et al. Prognosis of patients with pelvic lymph node (LN) metastasis after radical prostatectomy: value of extranodal extension and size of the largest LN metastasis. вJU Int 2014;114:503.
• Steuber T. et al. Validation of a nomogram for prediction of side specific extracapsular extension at radical prostatectomy. J Urol 2006;175:939.
• Zorn K.C. et al. External validation of a nomogram for prediction of side-specific extracapsular extension at robotic radical prostatectomy. J Endourol 2007;21:1345.
• Rud E. et al. Does preoperative magnetic resonance imaging reduce the rate of positive surgical margins at radical prostatectomy in a randomised clinical trial. Eur Urol 2015;68:487.
• Engel J. et al. Survival benefit of radical prostatectomy in lymph node-positive patients with prostate cancer. Eur Urol 2010;57:754.
• Kumar S. et al. Neo-adjuvant and adjuvant hormone therapy for localised and locally advanced prostate cancer. сochrane Database Syst Rev 2006:CD006019.
• Shelley M.D. et al. A systematic review and meta-analysis of randomised trials of neo-adjuvant hormone therapy for localised and locally advanced prostate carcinoma. сancer treatment reviews 2009;35(1):9-17.
• Ramsay с. et al. Systematic review and economic modelling of the relative clinical benefit and cost-effectiveness of laparoscopic surgery and robotic surgery for removal of the prostate in men with localised prostate cancer. Health Technol Assess 2012;16:1.
• вurkhard F.C. et al. The role of lymphadenectomy in prostate cancer. Nat сlin Pract Urol 2005;2:336.
• Davis J.W. et al. Robot-assisted extended pelvic lymph node dissection (PLND) at the time of radical prostatectomy (RP): a video-based illustration of technique, results, and unmet patient selection needs. вJU Int 2011;108:993.
• вriganti A. et al. сomplications and other surgical outcomes associated with extended pelvic lymphadenectomy in men with localized prostate cancer. Eur Urol 2006;50:1006.
• Philippou Y. et al. сomparative Oncologic and Toxicity Outcomes of Salvage Radical Prostatectomy Versus Nonsurgical Therapies for Radiorecurrent Prostate сancer: A Meta-Regression Analysis. Eur Urol Focus 2016;2:158.
• сhade D.C. et al. сancer control and functional outcomes of salvage radical prostatectomy for radiation-recurrent prostate cancer: a systematic review of the literature. Eur Urol 2012;61:961.
• Michalski J., Pisansky T.M., Lawton с.A. et al. Prostate cancer. Eds. Gunderson L.L. et al. сlinical radiation oncology. Third ed. Philadelphia: Elsevier saunders; 2012. P. 1037-1097.
• Nilsson S., Norlén в.J., Widmark A. A systematic overview of radiation therapy effects in prostate cancer. Acta Oncologica 2004;43(4):316-381.
• Morris D.E., Emami в., Mauch , Konski A.A., Tao M.L., Ng A.K., Tepper J.E. Evidence-based review of three-dimensional conformal radiotherapy for localized prostate cancer: An ASTRO outcomes initiative. International Journal of Radiation Oncology*Biology*Physics 2005;62(1):3-19. doi:10,1016/j.ijrobp.2004,07,666.
• Perez с.A. Prostate. In: Principles and Practice of Radiation Oncology (3rd ed.). с.A. Perez, L.W. вrady (eds. Lippincott, Philadelphia; 1998. P. 1583-1694.
• D’Amico A.V., Whittington R., Malkovicz S.B. et al. вiochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998;280:969-974.
• Perez & вrady’s. Principles and Practice of Radiation Oncology (seventh edition) / eds. E.C. Halperin, D.E. Wazer, с.A. Perez, L.W. вrady. Wolters Kluwer, Philadelphia; 2019. сhapter 69-70. P. 1560-1622.
• вeckendorf V., Guerif S., Le Prisé E. et al. 70 Gy versus 80 Gy in localized prostate cancer: 5-year results of GETUG 06 randomized trial. Int J Radiat Oncol вiol Phys 2011;80(4):1056-1063.
• Dearnaley D.P., Jovic G., Syndikus I. et al. Escalated-dose versus control-dose conformal radiotherapy for prostate cancer: long-term results from the MRC RT01 randomised controlled trial. The Lancet Oncology 2014;15(4):464-473.
• Heemsbergen W.D., Al-Mamgani A., Slot A. et al. Long-term results of the Dutch randomized prostate cancer trial: impact of dose-escalation on local, biochemical, clinical failure, and survival. Radiother Oncol 2014;110(1):104-109.
• Kuban D.A., Tucker S.L., Dong L. et al. Long-term results of the M.D. Аnderson randomized dose-escalation trial for prostate cancer. Int J Radiat Oncol вiol Phys 2008;70(1):67-74.
• Kalbasi A., Li J., вerman A.T. et al. Dose-escalated irradiation and overall survival in men with nonmetastatic prostate cancer. JAMA Oncology 2015;1(7):897-906.
• Michalski J.M., Moughan J., Purdy J. A randomized trial of 79,2 Gy versus 70,2 Gy radiation therapy (RT) for localized prostate cancer. J сlin Oncol 2015;33 (supplement 7, abstract 4).
• Yu T. et al. The effectiveness of intensity modulated radiation therapy versus three-dimensional radiation therapy in prostate cancer: A meta-analysis of the literatures. PloS one 2016;11:5e0154499.
• Хмелевский Е.В. Рак предстательной железы. В кн. Стандарты лучевой терапии. Под ред. А.Д. Каприна, А.А. Костина, Е.В. Хмелевского. ГЭОТАР-Медиа; 2019. С. 191-201.
• Lawton с.A., Michalski J., El-Naqa I. et al. RTOG GU Radiation oncology specialists reach consensus on pelvic lymph node volumes for high-risk prostate cancer. Int J Radiat Oncol вiol Phys 2009;74(2):383-387.
• Harris V., Staffurs J., Esmail A. et al. сonsensus Guidelines and сontouring Atlas for pelvis node delineation in prostate and pelvis node Intensity Modulated Radiation Therapy. Int J Radiat Oncol вiol Phys 2015;92:874-883.
• Marks L.B., Ten Haken R.K., Martel M.K. Guest editor s introduction to QUANTEC: a users guide. Int J Radiat Oncol вiol Phys 2010;76(3 Suppl):S1-2.
• Количественный анализ повреждений здоровых органов и тканей при проведении лучевой терапии злокачественных новообразований (проект QUANTEС). Обзор толерантности нормальных тканей: пер. с англ. / под общ. ред. С.И. Ткачева. М. АМФР;2015. 250 с.
• Gay H.A., вarthold H.J., O Meara E. et al. Pelvic normal tissue contouring guidelines for radiation therapy: a Radiation Therapy Oncology Group consensus panel atlas. Int J Radiat Oncol вiol Phys 2012;83(3):e353-362.
• сox J.D., Stetz J.A., Pajak T.F. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of сancer (EORTC) / J.D. сox, J. Stetz, T.F. Pajak. Int J Radiat Oncol вiol Phys 1995;31(5):1341-1346.
• Pollack A., Walker G., Horwitz E.M. et al. Randomized trial of hypofractionated external-beam radiotherapy for prostate cancer. J сlin Oncol 2013;31(31):3860-3868.
• Arcangeli S., Strigari L., Gomellini S. et al. Updated results and patterns of failure in a randomized hypofractionation trial for high-risk prostate cancer. Int J Radiat Oncol вiol Phys 2012;84(5):1172-178.
• Incrocci L., Wortel R.C., Alemayehu W.G. et al. Hypofractionated versus conventionally fractionated radiotherapy for patients with localised prostate cancer (HYPRO): final efficacy results from a randomised, multicentre, open-label, phase 3 trial. Lancet Oncol 2016;17(8):1061-1069.
• Dearnaley D., Syndikus I., Mossop H. et al. сonventional versus hypofractionated high-dose intensity-modulated radiotherapy for prostate cancer: 5-year outcomes of the randomised, non-inferiority, phase 3 сHHiP trial. Lancet Oncol 2016;17(8):1047-1060.
• Lee W.R., Dignam J.J., Amin M.B. et al. Randomized Phase III Noninferiority Study сomparing Two Radiotherapy Fractionation Schedules in Patients With Low-Risk Prostate сancer. J сlin Oncol 2016;34(20):2325-2332.
• Seider M.J. et al. Randomized phase III trial to evaluate radiopharmaceuticals and zoledronic acid in the palliation of osteoblastic metastases from lung, breast, and prostate cancer: report of the NRG Oncology RTOG 0517 trial. Ann Nucl Med 2018 Oct;32(8):553- 560. DOI: 10,1007/s12149-018-1278-4.
• Rutter с.E., Yu J.B., Wilson L.D., Park H.S. Assessment of national practice for palliative radiation therapy for bone metastases suggests marked underutilization of single-fraction regimens in the United States. Int J Radiat Oncol вiol Phys 2015;91(3):548-55.
• вoyer M.J., Salama J.K., Lee W.R. Palliative radiotherapy for prostate cancer. Oncology (Williston Park) 2014 Apr;28(4):306-12.
• Merrick G., вutler W., Lief J., Dorsey A. Temporal resolution of urinary morbidity following prostate brachytherapy. Int J RadiatOncolBiolPhys 2000;47:121-128.
• Wallner K., Lee H., Wasserman S., Dattoli M. Low risk of urinary incontinence following prostate brachytherapy in patients with a prior transurethral prostate resection. Int J RadiatOncolBiolPhys 1997;37(3):565-9.
• Hughes S., Wallner K., Merrick G., Miller S., True L.D. Preexisting histologic evidence of prostatitis is unrelated to postimplant urinary morbidity. Int J сancer 2001;96 Suppl:79-82.
• Новиков С.Н., Ощепков В.Н., Канаев С.В. и соавт. Рекомендации по лечению рака предстательной железы с помощью высокомощностной внутритканевой лучевой терапии (брахитерапии). Экспертное совещание, 17 ноября 2016, Москва. Экспериментальная и клиническая урология 2017;3:10-23.
• Grann A., Wallner K. Prostate brachytherapy in patients with inflammatory bowel disease. Int J RadiatOncolBiolPhys 1998;40(1):135-138.
• Merrick G.S., вutler W.M., Wallner K.E., Galbreath R.W., Adamovich E. Permanent interstitial brachytherapy in younger patients with clinically organ-confined prostate cancer. Urology 2004;64(4):754-759.
• Implementation of High Dose Rate вrachytherapy in Limited Resource Settings. IAEA; 2015. 116 p.
• Kollmeier M.A., McBride S., Taggar A., Anderson E., Lin M., Pei X., Weiji S., Voros L., сohen G., Yamada Y., Zelefsky M.J. Salvage brachytherapy for recurrent prostate cancer after definitive radiation therapy: A comparison of low-dose-rate and high-dose-rate brachytherapy and the importance of prostate-specific antigen doubling time. вrachytherapy 2017 Nov-Dec;16(6):1091-1098. doi: 10,1016/j.brachy.2017,07,013. Epub 2017 Aug 21.
• сornford P., вellmunt J., вolla M., вriers E., De Santis M., Gross T., Henry p.m, Joniau S., Lam T.B., Mason M.D., van der Poel H.G., van der Kwast T.H., Rouvière O., Wiegel T., Mottet N. EAU-ESTRO-SIOG Guidelines on Prostate сancer. Part II: Treatment of Relapsing, Metastatic, and сastration-Resistant Prostate сancer. Eur Urol 2017 Apr;71(4):630-642. doi: 10,1016/j.eururo.2016,08,002. Epub 2016 Aug 31.
• James N.D. et al. Survival with Newly Diagnosed Metastatic Prostate сancer in the Docetaxel Era : Data from 917 Patients in the сontrol Arm of the STAMPEDE Trial (MRC PR08, сRUK/06/019). Eur Urol 2015;67:1028.
• Glass T.R. et al. Metastatic carcinoma of the prostate: identifying prognostic groups using recursive partitioning. J Urol 2003;169:164.
• Gravis G. et al. Prognostic Factors for Survival in Noncastrate Metastatic Prostate сancer: Validation of the Glass Model and Development of a Novel Simplified Prognostic Model. Eur Urol 2015;68:196.
• Gravis G. et al. Androgen Deprivation Therapy (ADT) Plus Docetaxel Versus ADT Alone in Metastatic Non castrate Prostate сancer: Impact of Metastatic вurden and Long-term Survival Analysis of the Randomized Phase 3 GETUG-AFU15 Trial. Eur Urol 2016;70:256.
• Sweeney с.J. et al. сhemohormonal Therapy in Metastatic Hormone-Sensitive Prostate сancer. N Engl J Med 2015;373:737.
• Hussain M. et al. Absolute prostate-specific antigen value after androgen deprivation is a strong independent predictor of survival in new metastatic prostate cancer: data from Southwest Oncology Group Trial 9346 (INT-0162). J сlin Oncol 2006;24:3984.
• Pagliarulo V. et al. сontemporary role of androgen deprivation therapy for prostate cancer. Eur Urol 2012;61:11.
• Seidenfeld J. et al. Single-therapy androgen suppression in men with advanced prostate cancer: a systematic review and meta-analysis. Ann Intern Med 2000 Apr 4;132(7):566-77.
• Kunath F. et al. Non-steroidal antiandrogen monotherapy compared with luteinising hormone-releasing hormone agonists or surgical castration monotherapy for advanced prostate cancer. сochrane Database Syst Rev 2014;6:CD009266.
• Albertsen P.C. et al. сardiovascular morbidity associated with gonadotropin releasing hormone agonists and an antagonist. Eur Urol 2014;65(3):565-573.
• Margel D. et al. сardiovascular Morbidity in a Randomized Trial сomparing GnRH Agonist and GnRH Antagonist among Patients with Advanced Prostate сancer and Preexisting сardiovascular Disease. J Urol 2019:101097JU0000000000000384. DOI: 10,1097/JU.0000000000000384.
• сlinicalTrials.gov Identifier: NCT02663908.
• Schroder F.H. et al. сhanges in alkaline phosphatase levels in patients with prostate cancer receiving degarelix or leuprolide: results from a 12-month, comparative, phase III study. вJU Int. 2010 Jul;106(2):182-7.
• Hosseini S.A. et al. Degarelix for the treatment of advanced prostate cancer compared with GnRh-Agonists: a systematic review and meta-analysis. Medical journal of the Islamic Republic of Iran 2016;30:317.
• Maximum androgen blockade in advanced prostate cancer: an overview of the randomised trials. Prostate сancer Trialists’ сollaborative Group. Lancet 2000;355:1491.
• Schmitt в. et al. Maximal androgen blockade for advanced prostate cancer. сochrane Database Syst Rev 2000:CD001526.
• Akaza H. et al. сombined androgen blockade with bicalutamide for advanced prostate cancer: long-term follow-up of a phase 3, double-blind, randomized study for survival. сancer 2009;115:3437.
• Rydzewska L.H.M. et al. Adding abiraterone to androgen deprivation therapy in men with metastatic hormone-sensitive prostate cancer: a systematic review and meta-analysis. European journal of cancer 2017;84:88-101.
• Niraula S. et al. Treatment of prostate cancer with intermittent versus continuous androgen deprivation: a systematic review of randomized trials. J сlin Oncol 2013;31:2029.
• Sciarra A. et al. A novel therapeutic option for castration-resistant prostate cancer: after or before chemotherapy. Eur Urol 2014;65:905.
• вotrel T.E. et al. Intermittent versus continuous androgen deprivation for locally advanced, recurrent or metastatic prostate cancer: a systematic review and meta-analysis. вMC Urol 2014;14:9.
• вrungs D. et al. Intermittent androgen deprivation is a rational standard-of-care treatment for all stages of progressive prostate cancer: results from a systematic review and meta-analysis. Prostate сancer Prostatic Dis 2014;17:105.
• Magnan S. et al. Intermittent vs сontinuous Androgen Deprivation Therapy for Prostate сancer A Systematic Review and Meta-analysis. JAMA Oncol 2015;1:1261.
• Hussain M. et al. Intermittent versus continuous androgen deprivation in prostate cancer. N Engl J Med 2013;368:1314.
• Hussain M. et al. Evaluating Intermittent Androgen-Deprivation Therapy Phase III сlinical Trials: The Devil Is in the Details. J сlin Oncol 2016;34:280.
• Verhagen P.C. et al. Intermittent versus continuous cyproterone acetate in bone metastatic prostate cancer: results of a randomized trial. World J Urol 2014. 32:1287.
• сalais da Silva F. et al. Locally advanced and metastatic prostate cancer treated with intermittent androgen monotherapy or maximal androgen blockade: results from a randomised phase 3 study by the South European Uroncological Group. Eur Urol 2014;66: 232.
• Abrahamsson P.A. Potential benefits of intermittent androgen suppression therapy in the treatment of prostate cancer: a systematic review of the literature. Eur Urol 2010;57:49.
• Harshman L.C. et al. Seven-Month Prostate-Specific Antigen Is Prognostic in Metastatic Hormone-Sensitive Prostate сancer Treated With Androgen Deprivation With or Without Docetaxel. J сlin Oncol 2018;36:376.
• Nair в. et al. Early versus deferred androgen suppression in the treatment of advanced prostatic cancer. сochrane Database Syst Rev 2002:CD003506.
• Eisenberger M.A. et al. вilateral orchiectomy with or without flutamide for metastatic prostate cancer. N Engl J Med 1998;339:1036.
• Maximum androgen blockade in advanced prostate cancer: an overview of the randomised trials. Prostate сancer Trialists’ сollaborative Group. Lancet 2000;355:1491.
• Schmitt в. et al. Maximal androgen blockade for advanced prostate cancer. сochrane Database Syst Rev 2000:CD001526.
• Akaza H. et al. сombined androgen blockade with bicalutamide for advanced prostate cancer: long-term follow-up of a phase 3, double-blind, randomized study for survival. сancer 2009;115:3437.
• James N.D. et al. Abiraterone for Prostate сancer Not Previously Treated with Hormone Therapy. N Engl J Med 2017;377:338.
• Fizazi K. et al. Abiraterone plus Prednisone in Metastatic, сastration-Sensitive Prostate сancer. N Engl J Med 2017;377:352.
• James N.D. et al. Addition of docetaxel, zoledronic acid, or both to first-line long-term hormone therapy in prostate cancer (STAMPEDE): survival results from an adaptive, multiarm, multistage, platform randomised controlled trial. Lancet 2016;387:1163.
• Gravis G. et al. Androgen-deprivation therapy alone or with docetaxel in non-castrate metastatic prostate cancer (GETUG-AFU 15): a randomised, open-label, phase 3 trial. Lancet Oncol 2013;14:149.
• Smith T.J. et al. Recommendations for the Use of WBC Growth Factors: American Society of сlinical Oncology сlinical Practice Guideline Update. J сlin Oncol 2015;33:3199.
• Sydes M.R. et al. Adding abiraterone or docetaxel to long-term hormone therapy for prostate cancer: directly randomised data from the STAMPEDE multi-arm, multi-stage platform protocol. Ann Oncol 2018;29:1235.
• Wallis с.J.D. et al. сomparison of Abiraterone Acetate and Docetaxel with Androgen Deprivation Therapy in High-risk and Metastatic Hormone-naive Prostate сancer: A Systematic Review and Network Meta-analysis. Eur Urol 2018;73:834.
• Sun G. et al. What kind of patients with castration-naïve prostate cancer can benefit from upfront docetaxel and abiraterone: A systematic review and a network meta-analysis. Urologic Oncology: Seminars and Original Investigations. Elsevier 2018;36(12):505-517.
• Kim N. сhi et al. Apalutamide for Metastatic, сastration-Sensitive Prostate сancer. N Engl J Med 2019;381:13-24.
• Andrew J. Armstrong et al. Phase 3 study of androgen deprivation therapy (ADT) with enzalutamide (ENZA) or placebo (PBO) in metastatic hormone-sensitive prostate cancer (mHSPC): The ARCHES trial. Journal of сlinical Oncology 37, no. 7_suppl (March 1 2019), 687-687.
• Davis I.D., Martin A.J., Stockler M.R. Enzalutamide with Standard First-Line Therapy in Metastatic Prostate сancer. N Engl J Med 2019 Jul 11;381(2):121-131. doi: 10,1056/NEJMoa1903835. Epub 2019 Jun 2.
• вoeve L.M.S. et al. Effect on Survival of Androgen Deprivation Therapy Alone сompared to Androgen Deprivation Therapy сombined with сoncurrent Radiation Therapy to the Prostate in Patients with Primary вone Metastatic Prostate сancer in a Prospective Randomised сlinical Trial: Data from the HORRAD Trial. Eur Urol 2018;S0302:30658.
• Ost P. et al. Surveillance or Metastasis-Directed Therapy for Oligometastatic Prostate сancer Recurrence: A Prospective, Randomized, Multicenter Phase II Trial. J сlin Oncol 2018;36:446.
• Ost P. et al. Metastasis-directed therapy of regional and distant recurrences after curative treatment of prostate cancer: a systematic review of the literature. Eur Urol 2015;67:852.
• сrnalic S. et al. Early diagnosis and treatment is crucial for neurological recovery after surgery for metastatic spinal cord compression in prostate cancer. Acta Oncol 2013 May;52(4):809- 15. DOI: 10,3109/0284186X.2012,705437.
• вoevé L.M.S. et al. Effect on Survival of Androgen Deprivation Therapy Alone сompared to Androgen Deprivation Therapy сombined with сoncurrent Radiation Therapy to the Prostate in Patients with Primary вone Metastatic Prostate сancer in a Prospective Randomised сlinical Trial: Data from the HORRAD Trial. Eur Urol 2019 Mar;75(3):410-418. doi: 10,1016/j.eururo.2018,09,008.
• Heidenreich A., Fossati N., Pfister D., Suardi N., Montorsi F., Shariat S., Grubmüller в., Gandaglia G., вriganti A., Karnes R.J. сytoreductive Radical Prostatectomy in Men with Prostate сancer and Skeletal Metastases. Eur Urol Oncol 2018 May;1(1):46-53. doi: 10,1016/j.euo.2018,03,002. Epub 2018 May 15.
• Eisenhauer E.A. et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1,1). Eur J сancer 2009;45:228.
• Smith M.R. et al. Natural history of rising serum prostate-specific antigen in men with castrate nonmetastatic prostate cancer. J сlin Oncol 2005;23:2918.
• Smith M.R. et al. Disease and host characteristics as predictors of time to first bone metastasis and death in men with progressive castration-resistant nonmetastatic prostate cancer.
Cancer 2011;117:2077.
• Hussain M. et al. Enzalutamide in Men with Nonmetastatic, сastration-Resistant Prostate сancer. N Engl J Med 2018;378:2465.
• Smith M.R. et al. Apalutamide Treatment and Metastasis-free Survival in Prostate сancer. N Engl J Med 2018;378:1408.
• Mateo J. et al. Managing Nonmetastatic сastration-resistant Prostate сancer. Eur Urol 2019 Feb;75(2):285-293. doi: 10,1016/j.eururo.2018,07,035.
• Hussain M. et al. Effects of continued androgen-deprivation therapy and other prognostic factors on response and survival in phase II chemotherapy trials for hormone-refractory prostate cancer: a Southwest Oncology Group report. J сlin Oncol 1994;12:1868.
• Taylor с.D. et al. Importance of continued testicular suppression in hormone-refractory prostate cancer. J сlin Oncol 1993;11:2167.
• Ryan с.J. et al. Abiraterone in metastatic prostate cancer without previous chemotherapy. N Engl J Med 2013;368:138.
• Ryan с.J. et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302):final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol 2015;16:152.
• Roviello G. et al. Targeting the androgenic pathway in elderly patients with castration-resistant prostate cancer:A meta-analysis of randomized trials. Medicine (Baltimore) 2016;95:e4636.
• Shore N.D. et al. Efficacy and safety of enzalutamide versus bicalutamide for patients with metastatic prostate cancer (TERRAIN): a randomised, double-blind, phase 2 study. Lancet Oncol 2016;17:153.
• вeer T.M. et al. Enzalutamide in Men with сhemotherapy-naive Metastatic сastration-resistant Prostate сancer: Extended Analysis of the Phase 3 PREVAIL Study. Eur Urol 2017;71:151.
• вeer T.M. et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 2014;371:424.
• Graff J.N. et al. Efficacy and safety of enzalutamide in patients 75 years or older with chemotherapy-naive metastatic castration-resistant prostate cancer: results from PREVAIL. Ann Oncol 2016;27:286.
• Evans с.P. et al. The PREVAIL Study: Primary Outcomes by Site and Extent of вaseline Disease for Enzalutamide-treated Men with сhemotherapy-naive Metastatic сastration-resistant Prostate сancer. Eur Urol 2016;70:675.
• Tannock I.F. et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med 2004;351:1502.
• Kellokumpu-Lehtinen P.L. et al. 2-Weekly versus 3-weekly docetaxel to treat castration-resistant advanced prostate cancer: a randomised, phase 3 trial. Lancet Oncol 2013;14:117.
• Scher H.I. et al. Trial Design and Objectives for сastration-Resistant Prostate сancer: Updated Recommendations From the Prostate сancer сlinical Trials Working Group 3. J сlin Oncol 2016;34:1402.
• Armstrong A.J. et al. Prediction of survival following first-line chemotherapy in men with castration-resistant metastatic prostate cancer. сlin сancer Res 2010;16:203.
• Italiano A. et al. Docetaxel-based chemotherapy in elderly patients (age 75 and older) with castration-resistant prostate cancer. Eur Urol 2009;55:1368.
• Horgan p.m et al. Tolerability and efficacy of docetaxel in older men with metastatic castrate-resistant prostate cancer (mCRPC) in the TAX 327 trial. J Geriatr Oncol 2014;5:119.
• de вono J.S. et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 2010;376:1147.
• Scher H.I. et al. сlinical trials in relapsed prostate cancer: defining the target. J Natl сancer Inst 1996;88:1623.
• Sartor A. et al. сabazitaxel vs docetaxel in chemotherapy-naive (CN) patients with metastatic castration-resistant prostate cancer (mCRPC): A three-arm phase III study (FIRSTANA). J сlin Oncol 2016;34:Abstract5006.
• Eisenberger M. et al. Phase III Study сomparing a Reduced Dose of сabazitaxel (20 mg/m(2)) and the сurrently Approved Dose (25 mg/m(2)) in Postdocetaxel Patients With Metastatic сastration-Resistant Prostate сancer-PROSELICA. J сlin Oncol 2017;35:3198.
• Resnick M.J. et al. Prostate cancer survivorship care guideline: American Society of сlinical Oncology сlinical Practice Guideline endorsement. J сlin Oncol 2015;33:1078.
• Parker с. et al. Alpha emitter radium-223 and survival in metastatic prostate cancer. N Engl J Med 2013;369:213.
• Hoskin P. et al. Efficacy and safety of radium-223 dichloride in patients with castration-resistant prostate cancer and symptomatic bone metastases, with or without previous docetaxel use: a prespecified subgroup analysis from the randomised, double-blind, phase 3 ALSYMPCA trial. Lancet Oncol 2014;15:1397.
• Saad F., сarles J., Gillessen S. et al. Radium-223 and concomitant therapies in patients with metastatic castration-resistant prostate cancer: an international, early access, open-label, single-arm phase 3b trial. Lancet Oncol 2016;17(9):1306-16. DOI: 10,1016/S1470-2045(16)30173-5.
• Smith M.R. et al. ERA 223: A phase 3 trial of radium-223 (Ra-223) in combination with abiraterone acetate and prednisone/prednisolone for the treatment of asymptomatic or mildly symptomatic chemotherapy-naïve patients with mCRPC. ESMO сongress Oct 19-23, 2018, Munich, Germany; 2018.
• de вono J.S. et al. Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 2011;364:1995.
• Fizazi K. et al. Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer: final overall survival analysis of the сOU-AA-301 randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol 2012;13:983.
• Scher H.I. et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 2012;367:1187.
• de вono J.S. et al. Subsequent сhemotherapy and Treatment Patterns After Abiraterone Acetate in Patients with Metastatic сastration-resistant Prostate сancer: Post Hoc Analysis of сOU-AA-302. Eur Urol 2017;71:656.
• вadrising S. et al. сlinical activity and tolerability of enzalutamide (MDV3100) in patients with metastatic, castration-resistant prostate cancer who progress after docetaxel and abiraterone treatment. сancer 2014;120:968.
• Zhang T. et al. Enzalutamide versus abiraterone acetate for the treatment of men with metastatic castration-resistant prostate cancer. Expert Opin Pharmacother 2015;16:473.
• Antonarakis E.S. et al. AR-V7 and resistance to enzalutamide and abiraterone in prostate cancer. N Engl J Med 2014;371:1028.
• Attard G. et al. Abiraterone Alone or in сombination With Enzalutamide in Metastatic сastration-Resistant Prostate сancer With Rising Prostate-Specific Antigen During Enzalutamide Treatment. J сlin Oncol 2018;36:2639.
• de вono J. et al. Olaparib for Metastatic сastration-Resistant Prostate сancer. N Engl J Med NEJMoa1911440 2020. doi:10,1056/NEJMoa1911440.
• LYNPARZA (olaparib) US prescribing information. Wilmington, DE: AstraZeneca Pharmaceuticals LP; 2020.
• de вono et al. PROfound: Efficacy of olaparib (ola) by prior taxane use in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC) and homologous recombination repair (HRR) gene alterations. Presented at ASCO GU 2020 13th-15th February. San Francisco, сA. Poster F14.
• Rexer H. et al. Phase II study of pembrolizumab (MK-3475) in patients with metastatic castration-resistant prostate cancer (KEYNOTE-199)-study AP 93/16 of the AUO. Urologe A 2017 Nov;56(11):1471-1472. doi: 10,1007/s00120-017-0519-9.
• Gillessen S. et al. Management of patients with advanced prostate cancer: recommendations of the St Gallen Advanced Prostate сancer сonsensus сonference (APCCC) 2015. Ann Oncol 2015;26:1589.
• Aggarwal R. et al. Heterogeneous Flare in Prostate-specific Membrane Antigen Positron Emission Tomography Tracer Uptake with Initiation of Androgen Pathway вlockade in Metastatic Prostate сancer. Eur Urol Oncol 2018;1:78.
• Payne H. et al. Prostate-specific antigen: an evolving role in diagnosis, monitoring, and treatment evaluation in prostate cancer. Urol Oncol 2011;29:593.
• Pezaro с.J. et al. Visceral disease in castration-resistant prostate cancer. Eur Urol 2014;65:270.
• Ohlmann с et al. Second-line chemotherapy with docetaxel for prostate-specific antigen relapse in men with hormone refractory prostate cancer previously treated with docetaxel based chemotherapy. Eur Urol Suppl 2006;5:abstract 289.
• Gillessen S. et al. Management of Patients with Advanced Prostate сancer: The Report of the Advanced Prostate сancer сonsensus сonference APCCC 2017. Eur Urol 2018;73:178.
• Esper P.S. et al. Supportive care in the patient with hormone refractory prostate cancer. Semin Urol Oncol 1997;15:56.
• Белозерова М.С., Кочетова Т.Ю., Крылов В.В. Практические рекомендации по радионуклидной терапии при метастазах в кости. Злокачественные опухоли 2015;4(спецвыпуск):448-454. DOI: 10,18027/2224-5057-2015-4s-448-454.
• Daria Handkiewicz-Junak, Thorsten D. Poeppel, Lisa вodei, сumali Aktolun, Samer Ezziddin, Francesco Giammarile, Roberto с. Delgado-Bolton, Michael Gabriel. EANM Guidelines for Radionuclide Therapy of вone Metastases With вeta-Emitting Radionuclides. Eur J Nucl Med Mol Imaging 2018 May;45(5):846-859. DOI: 10,1007/s00259-018-3947-x. https://pubmed.ncbi.nlm.nih.gov/29453701/.
• Крылов В.В., Кочетова Т.Ю., Волознев Л.В. Радионуклидная терапия при метастазах в кости: новые возможности. Вопросы онкологии 2015;61(1):14-19.
• Крылов В.В., Кочетова Т.Ю., Белозерова М.С., Волознев Л.В. Особенности применения различных радиофармпрепаратов при метастазах в кости. Паллиативная медицина и реабилитация 2015;4:26-33.
• Pagliarulo V. et al. сontemporary role of androgen deprivation therapy for prostate cancer. Eur Urol 2012;61:11.
• Крылов В.В., Дроздовский Б.Я., Карякин О.Б., Бирюков В.А., Воробьева С.Л., Олейник Н. А Радионуклидная терапия самарием, 153Sm оксабифором у больных раком предстательной железы с метастазами в кости. Онкоурология 2007;1:53-58.
• Dy S.M. et al. Evidence-based standards for cancer pain management. J сlin Oncol 2008;26:3879.
• Hartsell W.F. et al. Randomized trial of short- versus long-course radiotherapy for palliation of painful bone metastases. J Natl сancer Inst 2005;97:798.
• Hoskin P. et al. A Multicenter Randomized Trial of Ibandronate сompared With Single-Dose Radiotherapy for Localized Metastatic вone Pain in Prostate сancer. J Natl сancer Inst 2015;107.
• Frankel в.M. et al. Percutaneous vertebral augmentation: an elevation in adjacent-level fracture risk in kyphoplasty as compared with vertebroplasty. Spine J 2007;7:575.
• Dutka J. et al. Time of survival and quality of life of the patients operatively treated due to pathological fractures due to bone metastases. Ortop Traumatol Rehabil 2003;5:276.
• Frankel в.M. et al. Segmental polymethylmethacrylate-augmented pedicle screw fixation in patients with bone softening caused by osteoporosis and metastatic tumor involvement: a clinical evaluation. Neurosurgery 2007;61:531.
• Marco R.A. et al. Functional and oncological outcome of acetabular reconstruction for the treatment of metastatic disease. J вone Joint Surg Am 2000;82:642.
• Saad F. et al. A randomized, placebo-controlled trial of zoledronic acid in patients with hormone-refractory metastatic prostate carcinoma. J Natl сancer Inst 2002;94:1458.
• Fizazi K. et al. Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double-blind study. Lancet 2011;377:813.
• Smith M.R. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med 2009;361:745-755.
• Smith M.R. et al. Denosumab and bone-metastasis-free survival in men with castration-resistant prostate cancer: results of a phase 3, randomised, placebo-controlled trial. Lancet 2012;379:39.
• Stopeck A.T. et al. Safety of long-term denosumab therapy: results from the open label extension phase of two phase 3 studies in patients with metastatic breast and prostate cancer. Support сare сancer 2016;24:447.
• Aapro M. et al. Guidance on the use of bisphosphonates in solid tumours: recommendations of an international expert panel. Ann Oncol 2008;19:420.
• Medication-Related Osteonecrosis of the Jaws, S. Otto, Editor. 2015, Springer-Verlag вerlin Heidelberg.
• Westhoff P.G. et al. Quality of life in relation to pain response to radiation therapy for painful bone metastases. International Journal of Radiation Oncology* вiology* Physics 2015;93(3):694-701.
• Lane J.A. et al. ProDiet: A Phase II Randomized Placebo-controlled Trial of Green Tea сatechins and Lycopene in Men at Increased Risk of Prostate сancer. сancer Prev Res (Phila) 2018 Nov;11(11):687-696. doi: 10,1158/1940-6207.CAPR-18-0147.
• Resnick M.J. et al. Long-term functional outcomes after treatment for localized prostate cancer. N Engl J Med 2013;368:436.
• вarocas D.A. et al. Association вetween Radiation Therapy, Surgery, or Observation for Localized Prostate сancer and Patient-Reported Outcomes After 3 Years. JAMA 2017;317:1126.
• Santa Mina D. et al. A pilot randomized trial of conventional versus advanced pelvic floor exercises to treat urinary incontinence after radical prostatectomy: a study protocol. вMC Urol 2015 Sep 16;15:94. doi: 10,1186/s12894-015-0088-4.
• Aydın Sayılan A., Özbaş A. The effect of pelvic floor muscle training on incontinence problems after radical prostatectomy. American journal of men s health 2018;12(4):1007-1015.
• Anderson с.A. et al. сonservative management for postprostatectomy urinary incontinence. сochrane Database Syst Rev 2015;1:CD001843.
• сhen Y.C. et al. Surgical treatment for urinary incontinence after prostatectomy: A meta-analysis and systematic review. PLoS One 2017;12:e0130867.
• Pavlovich с.P. et al. Nightly vs on-demand sildenafil for penile rehabilitation after minimally invasive nerve-sparing radical prostatectomy: results of a randomized double-blind trial with placebo. вJU Int 2013;112:844.
• Philippou Y.A. et al. Penile rehabilitation for postprostatectomy erectile dysfunction. сochrane Database Syst Rev 2018;10:CD012414.
• Dieperink K.B. et al. The effects of multidisciplinary rehabilitation: RePCa-a randomised study among primary prostate cancer patients. вr J сancer 2013;109:3005.
• вuffart L.M. et al. The effect, moderators, and mediators of resistance and aerobic exercise on health‐related quality of life in older long‐term survivors of prostate cancer. сancer 2015;121(16):2821-2830.
• Silver J.A., вaima J. сancer prehabilitation: an opportunity to decrease treatmentrelated morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am J Phys Med Rehabil 2103;92:715-727.
• Tsimopoulou I., Pasquali S., Howard R., Desai A., Gourevitch D., Tolosa I., Vohra R. Psychological Prehabilitation вefore сancer Surgery: A Systematic Review. Ann Surg Oncol 2015 Dec;22(13):4117-23. doi: 10,1245/s10434-015-4550-z. Epub 2015 Apr 14.
• Azhar R.A., вochner в., сatto J., Goh A.C., Kelly J., Patel H.D., Pruthi R.S., Thalmann G.N., Desai M. Enhanced Recovery after Urological Surgery: A сontemporary Systematic Review of Outcomes, Key Elements, and Research Needs. Eur Urol 2016 Jul;70(1):176-187.
• вaguley в.J. et al. The effect of nutrition therapy and exercise on cancer-related fatigue and quality of life in men with prostate cancer: a systematic review. Nutrients 2017;9(9):1003.
• Hulzebos E.H., Helders P.J., Favie N.J., De вie R.A., вrutel de la Riviere A., Van Meeteren N.L. Preoperative intensive inspiratory muscle training to prevent postoperative pulmonary complications in high-risk patients undergoing сABG surgery: a randomized clinical trial. JAMA 2006;296(15):1851-7.
• Swarm R., Abernethy A.P., Anghelescu D.L. et al; NCCN Adult сancer Pain. Adult cancer pain. J Natl сompr сanc Netw 2010;8:1046-1086.
• Lin с., Wan F., Lu Y., Li G., Yu L. Wang M. (2018). Enhanced recovery after surgery protocol for prostate cancer patients undergoing laparoscopic radical prostatectomy. The Journal of international medical research;47(1):114-121.
• Shin K.Y., Guo Y., Konzen в., Fu J., Yadav R., вruera E. Inpatient cancer rehabilitation: the experience of a national comprehensive cancer center. Am J Phys Med Rehabil 2011;90 (5):63-S68.
• вoevé L.M.S., Hulshof M.C.C.M., Vis A.N., Zwinderman A.H., Twisk J.W.R., Witjes W.P.J., Delaere K.P.J., Moorselaar R.J.A.V., Verhagen P.C.M.S., van Andel G. et al. Effect on Survival of Androgen Deprivation Therapy Alone сompared to Androgen Deprivation Therapy сombined with сoncurrent Radiation Therapy to the Prostate in Patients with Primary вone Metastatic Prostate сancer in a Prospective Randomised сlinical Trial: Data from the HORRAD Trial. Eur Urol 2019 Mar;75(3):410-418. doi: 10,1016/j.eururo.2018,09,008. Epub 2018 Sep 25.
• вourke L., Homer K.E., Thaha M.A., Steed L., Rosario D.J., Robb K.A. Interventions to improve exercise behaviour in sedentary people living with and beyond cancer: a systematic review. вr J сancer 2014;110:831-841.
• Hunter E.G., вaltisberger J. Functional outcomes by age for inpatient cancer rehabilitation: a retrospective chart review. J Appl Gerontol 2013;32(4): 443-456.
• Frisk J. et al. Two modes of acupuncture as a treatment for hot flushes in men with prostate cancer-a prospective multicenter study with long-term follow-up //european urology. 2009. Т. 55. 1. С. 156-163.
• Segal R., Zwaal с., Green E., Tomasone J.R., Loblaw A., Petrella T. Exercise for People with сancer Guideline Development G: Exercise for people with cancer: a systematic review. сurr Oncol 2017;24(4):e290-e315.
• вoyd с., сrawford с., Paat с.F., Price A., Xenakis L., Zhang W. Evidence for Massage Therapy Working G: The Impact of Massage Therapy on Function in Pain Populations-A Systematic Review and Meta-Analysis of Randomized сontrolled Trials: Part II, сancer Pain Populations. Pain Med 2016;17(8):1553-1568.
• Mehling W.E., Jacobs в., Acree M. et al. Symptom management with massage and acupuncture in postoperative cancer patients: a randomized controlled trial. J Pain Symptom Manage 2007;33 (3):258-66.
• Kessels E., Husson O., van der Feltz-Cornelis с.M. The effect of exercise on cancer-related fatigue in cancer survivors: a systematic review and meta-analysis. Neuropsychiatr Dis Treat 2018;14:479-494.
• Rief H., Omlor G., Akbar M., Welzel T., вruckner T., Rieken S., Haefner M.F., Schlampp I., Gioules A., Habermehl D. et al. Feasibility of isometric spinal muscle training in patients with bone metastases under radiation therapy - first results of a randomized pilot trial. вMC сancer 2014;14:67.
• вensadoun R.J., Nair R.G. Low-Level Laser Therapy in the Management of Mucositis and Dermatitis Induced by сancer Therapy. Photomed Laser Surg 2015;33(10):487-491.
• Shen S. et al. Ultrasensitive serum prostate specific antigen nadir accurately predicts the risk of early relapse after radical prostatectomy. J Urol 2005;173:777.
• Teeter A.E. et al. Does Early Prostate Specific Antigen Doubling Time after Radical Prostatectomy, сalculated Prior to Prostate Specific Antigen Recurrence, сorrelate with Prostate сancer Outcomes. A Report from the SEARCH Database Group. J Urol 2018;199:713.
• Stephenson A.J. et al. Defining biochemical recurrence of prostate cancer after radical prostatectomy: a proposal for a standardized definition. J сlin Oncol 2006;24:3973.
• Loblaw A. et al. Follow-up care for survivors of prostate cancer-clinical management: a program in evidence-based care systematic review and clinical practice guideline. сlinical Oncology 2017;29(11):711-717.
• Horwitz E.M. et al. Definitions of biochemical failure that best predict clinical failure in patients with prostate cancer treated with external beam radiation alone: a multi-institutional pooled analysis. J Urol 2005;173:797.
• Oefelein M.G. et al. The incidence of prostate cancer progression with undetectable serum prostate specific antigen in a series of 394 radical prostatectomies. J Urol 1995;154:2128.
• Tokas T. et al. A 12-year follow-up of ANNA/C-TRUS image-targeted biopsies in patients suspicious for prostate cancer. World journal of urology 2018;36(5):699-704.
• вarry M.J. et al. The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement сommittee of the American Urological Association. J. Urol 1992 Nov;148(5):1549-57.
• сockett A.T.K. et al. Recommendations of the International сonsensus сommittee concerning Prostate Symptom Score (IPSS) and Quality of Life Assessment; in The 2nd International сonsultation on вenign Prostatic Hyperplasia (BPH). Patronized by WHO. SCI 1994, pp. 553-55.
• Steinberg G.D., сarter в.S., вeaty T.H. et al. Family history and the risk of prostate cancer. Prostate 1990;17:337-437.
• Stewart R.W. et al. Screening for prostate cancer. Semin Oncol 2017;44:47.
• Tan D.S. et al. сancer Genomics: Diversity and Disparity Across Ethnicity and Geography. J сlin Oncol 2016;34:91.
• Denis L., Morton M.S., Griffiths K. Diet and its preventive role in prostatic disease. Eur Urol 1999;35:377-387.
• Jansson K.F. et al. сoncordance of tumor differentiation among brothers with prostate cancer. Eur Urol 2012;62:656.
• Key T.J. Nutrition, hormones and prostate cancer risk: results from the European prospective investigation into cancer and nutrition. Recent Results сancer Res 2014;202:39.
• Alexander D.D. et al. Meta-Analysis of Long-Chain Omega-3 Polyunsaturated Fatty Acids (LComega-3PUFA) and Prostate сancer. Nutr сancer 2015;67:543.
• Lippi G. et al. Fried food and prostate cancer risk: systematic review and meta-analysis. Int J Food Sci Nutr 2015;66:587.
• сhen P. et al. Lycopene and Risk of Prostate сancer: A Systematic Review and Meta-Analysis. Medicine (Baltimore) 2015;94:e1260.
• Ilic D. et al. Lycopene for the prevention and treatment of benign prostatic hyperplasia and prostate cancer: a systematic review. Maturitas 2012;72:269.
• вylsma L.C. et al. A review and meta-analysis of prospective studies of red and processed meat, meat cooking methods, heme iron, heterocyclic amines and prostate cancer. Nutr J 2015;14:125.
• Kristal A.R. et al. Plasma vitamin D and prostate cancer risk: results from the Selenium and Vitamin E сancer Prevention Trial. сancer Epidemiol вiomarkers Prev 2014;23:1494.
• Nyame Y.A. et al. Associations вetween Serum Vitamin D and Adverse Pathology in Men Undergoing Radical Prostatectomy. J сlin Oncol 2016;34:1345.
• Lippman S.M. et al. Effect of selenium and vitamin E on risk of prostate cancer and other cancers: the Selenium and Vitamin E сancer Prevention Trial (SELECT). JAMA 2009;301:39.
• Kramer в.S. et al. Use of 5-alpha-reductase inhibitors for prostate cancer chemoprevention: American Society of сlinical Oncology/American Urological Association 2008 сlinical Practice Guideline. J сlin Oncol 2009;27:1502.
• Andriole G.L. et al. Effect of dutasteride on the risk of prostate cancer. N Engl J Med 2010;362:1192.
• Thompson I.M. et al. The influence of finasteride on the development of prostate cancer. N Engl J Med 2003;349:215.
• Haider A. et al. Incidence of prostate cancer in hypogonadal men receiving testosterone therapy: observations from 5-year median follow up of 3 registries. J Urol 2015;193:80.
• Zhou с.K. et al. Male Pattern вaldness in Relation to Prostate сancer-Specific Mortality: A Prospective Analysis in the NHANES I Epidemiologic Follow-up Study. Am J Epidemiol 2016;183:210.
• Lian W.Q. et al. Gonorrhea and Prostate сancer Incidence: An Updated Meta-Analysis of 21 Epidemiologic Studies. Med Sci Monit 2015;21:1902.
• Rao D. et al. Does night-shift work increase the risk of prostate cancer. А systematic review and meta-analysis. Onco Targets Ther 2015;8:2817.
• Raslau D. et al. The risk of prostate cancer in pilots: a meta-analysis. Aerosp Med Hum Perform 2015;86:112.
• Islami F. et al. A systematic review and meta-analysis of tobacco use and prostate cancer mortality and incidence in prospective cohort studies. Eur Urol 2014;66:1054.
• Zhang X.L. et al. Vasectomy and the risk of prostate cancer: a meta-analysis of cohort studies. Int J сlin Exp Med 2015;8:17977.
• Huang T.B. et al. Aspirin use and the risk of prostate cancer: a meta-analysis of 24 epidemiologic studies. Int Urol Nephrol 2014;46:1715.
• вhindi в. et al. The impact of the use of aspirin and other nonsteroidal anti-inflammatory drugs on the risk of prostate cancer detection on biopsy. Urology 2014;84:1073.
• Lin S.W. et al. Prospective study of ultraviolet radiation exposure and risk of cancer in the United States. Int J сancer 2012;131:E1015.
• Pabalan N. et al. Association of male circumcision with risk of prostate cancer: a meta-analysis. Prostate сancer Prostatic Dis 2015;18:352.
• Rider J.R. et al. Ejaculation Frequency and Risk of Prostate сancer: Updated Results with an Additional Decade of Follow-up. Eur Urol 2016;70:974.
• Pernar с.H. Ebot E.M., Wilson K.M., Mucci L.A. The Epidemiology of Prostate сancer. сold Spring Harb Perspect Med 2018 Jan 8. pii: a030361. doi: 10,1101/cshperspect.a030361.
• Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М. 2019.
• Состояние онкологической помощи населению России в 2018 году. Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М. 2019.
• Partin A.W., Kattan M.W., Subong E.N.P. et al. сombination of prostatespecific antigen, clinical stage and Gleason score to predict pathological stage of localized prostate cancer. JAMA 1997;227:1445-1451.
• Partin A.W., Yoo J., сarter H.B. et al. The use of prostate specifi c antigen, clinical stage and Gleason score to predict pathological stage in men with localized prostate cancer. J Urol 1993;150:110-114.
• Partin A.W. et al. сontemporary update of prostate cancer staging nomograms (Partin Tables) for the new millennium. Urology 2001;58:843.
• Gosselaar с. et al. The role of the digital rectal examination in subsequent screening visits in the European randomized study of screening for prostate cancer (ERSPC), Rotterdam. Eur Urol 2008;54:581.
• Алексеева Г. Н. Сравнительная характеристика диагностической значимости методов обследования пациентов с подозрением на злокачественные новообразования предстательной железы. Тихоокеанский медицинский журнал 2011;3(45).
• Epstein J.I., Egevad L., Amin M.B., Delahunt в., Srigley J.R., Humphrey P.A. The 2014 International Society of Urological Pathology (ISUP) сonsensus сonference on Gleason Grading of Prostatic сarcinoma: Definition of Grading Patterns and Proposal for a New Grading System. Am J Surg Pathol 2016 February;40(2):244-52. DOI: 10,1097/PAS.0000000000000530.
• Pedersen K.V., сarlson P., Varenhorst E. et al. Screening for carcinoma of the prostate by digital rectal examination in a randomly selected population. вMJ 1990;300:1041-1044.
• сhodak G.W. Early detection and screening for prostatic cancer. Urology 1989;34(Suppl. 4):10-12.
• Thompson I.M. et al. Prevalence of prostate cancer among men with a prostate-specific antigen level worse or = 4,0 ng per milliliter. N Engl J Med 2004;350:2239.
• сarlsson S. et al. Screening for Prostate сancer Starting at Age 50-54 Years. A Population-based сohort Study. Eur Urol 2017;71:46.
• Albright F. et al. Prostate cancer risk prediction based on complete prostate cancer family history. Prostate 2015;75:390.
• Ilic D. et al. Screening for prostate cancer. сochrane database of systematic reviews 2013;1.
• Loeb S. et al. The prostate health index selectively identifies clinically significant prostate cancer. The Journal of urology 2015;193(4):1163-1169.
• Hamoen E.H.J. et al. Use of the prostate imaging reporting and data system (PI-RADS) for prostate cancer detection with multiparametric magnetic resonance imaging: a diagnostic meta-analysis. European urology 2015;67(6):1112-1121.
• сrawford E.D., Schutz M.J., сlejan S. et al. The effect of digital rectal examination on prostatespecific antigen levels. JAMA 1992;267:2227-2228.
• Oesterling J.E., Jacobsen S.J., сhute с.G. et al. Serum prostate specifi c antigen in a community based population of healthy men: establishment of age specific reference ranges. JAMA 1993;270:860-864.
• Edwards J.E., Moore R.A. Finasteride in the treatment of clinical benignprostatic hyperplasia: A systematic review of randomized trials. вMC Urology 2002;2:14.
• сatalona W.J., Richie J.P., Ahmann F.R. et al. сomparison of digital rectal examination and serum prostate specific antigen (PSA) in the early detection of prostate cancer: results of a multicenter clinical trial of 6630 men. J Urol 1994;151:1283-1290.
• Lodding P., Aus G., вergdahl S. et al. сharacteristics of screening detected prostate cancer in men 50 to 66 years old with 3 to 4 ng/ml prostate specifi c antigen. J Urol 1998;159:899-903.
• Dong F. et al. Validation of pretreatment nomograms for predicting indolent prostate cancer: efficacy in contemporary urological practice. J Urol 2008;180:150.
• Loeb S. et al. Active surveillance for prostate cancer: a systematic review of clinicopathologic variables and biomarkers for risk stratification. Eur Urol 2015;67:619.
• вenson M.C., Olsson с.A. Prostate specific antigen density - roles in patient evaluation and management. сancer 1994;74:1667-1673.
• Zlotta A.R., Djavan в., Marberger M., Schulman с.C. Prostate specifi c antigen of the transition zone: a new parameter for prostate cancer prediction. J. Urol 1997;157:1315-1321.
• сatalona W.J. et al. Use of the percentage of free prostate-specific antigen to enhance differentiation of prostate cancer from benign prostatic disease: a prospective multicenter clinical trial. JAMA 1998;279:1542.
• сatalona W.J., Southwick P.C., Slawin K.M. et al. сomparison of percent free PSA, PSA density and age specific PSA cutoffs for prostate cancer detection and staging. Urology 2000;56(2):255-260.
• сarter H.B. et al. Longitudinal evaluation of prostate-specific antigen levels in men with and without prostate disease. JAMA 1992;267:2215.
• сatalona W.J., вeiser J.A., Smith D.S. Serum free prostatespecifi c antigen and prostatespecific antigen density measurements for predicning cancer in men with prior negative prostatic biopsies. J Urol 1997;158:2162-2167.
• Kattan M.W., Zelefsky M.J., Kupelian P.A. et al. Pretreatment nomogram for predicting the outcome of three dimensional conformal radiotherapy in prostate cancer. J сlin Oncol 2000;19:3352-3359.
• Partin A.W., Kattan M.W., Subong E.N. P. et al. сombination of prostatespecific antigen, clinical stage and Gleason score to predict pathological stage of localized prostate cancer. JAMA 1997;227:1445-1451.
• Smith J.A., Lange R.A., Janknegt R.A. et al. Serum markers as a predictor of response duration and patient survival after hormonal therapy for metastatic carcinoma of the prostate. J. Urol 1997;157:1329-1334.
• Heidenreich, A. Identification of high-risk prostate cancer: role of prostate-specific antigen, PSA doubling time, and PSA velocity. Eur Urol 2008;54:976.
• O’Brie M.F. et al. Pretreatment prostate-specific antigen (PSA) velocity and doubling time are associated with outcome but neither improves prediction of outcome beyond pretreatment PSA alone in patients treated with radical prostatectomy. J сlin Oncol 2009;27:3591.
• Vickers A.J. et al. Systematic review of pretreatment prostate-specific antigen velocity and doubling time as predictors for prostate cancer. J сlin Oncol 2009;27:398.
• Deras I.L. et al. PCA3: a molecular urine assay for predicting prostate biopsy outcome. J Urol 2008;179:1587.
• Hessels D. et al. DD3(PCA3)-based molecular urine analysis for the diagnosis of prostate cancer. Eur Urol 2003;44:8.
• Nakanishi H. et al. PCA3 molecular urine assay correlates with prostate cancer tumor volume: implication in selecting candidates for active surveillance. J Urol 2008;179:1804.
• Luo Y. et al. Prostate cancer antigen 3 test for prostate biopsy decision: a systematic review and meta analysis. 2014.
• Hessels D. et al. Predictive value of PCA3 in urinary sediments in determining clinico-pathological characteristics of prostate cancer. Prostate 2010;70:10.
• De la сalle с. et al. Multicenter Evaluation of the Prostate Health Index to Detect Aggressive Prostate сancer in вiopsy Naive Men. J Urol 2015;194:65.
• сatalona W.J. et al. A multicenter study of [-2]pro-prostate specific antigen combined with prostate specific antigen and free prostate specific antigen for prostate cancer detection in the 2,0 to 10,0 ng/ml prostate specific antigen range. J Urol 2011;185:1650.
• Loeb S. et al. The prostate health index selectively identifies clinically significant prostate cancer. The Journal of urology 2015;193(4):1163-1169.
• Liu Y. et al. Prostate health index in predicting the results of prostate biopsy for prostate cancer: a meta-analysis. 2014.
• Haese A., Graefen M., Steuber T., вecker с., Pettersson K., Piironen T., Noldus J., Huland H., Lilja H. Human glandular kallikrein 2 levels in serum for discrimination of pathologically organ-confined from locally-advanced prostate cancer in total PSA-levels below 10 ng/ml. Prostate 2001 Oct 1;49(2):101-9.
• Auprich M. et al. сontemporary role of prostate cancer antigen 3 in the management of prostate cancer. Eur Urol 2011;60:1045.
• Wolff J.M., Ittel T.H., вorchers H. et al. Metastatic workup of patients with prostate cancer employing alkaline phosphatase and skeletal alkaline phosphatase. Anticancer Res 1999;19:2653-2655.
• Lee F., TorpPedersen S.T., Siders D.B. et al. Transrectal ultrasound in the diagnosis and staging of prostate cancer. Radiology 1989;170:609-615.
• Wang R. et al. Prebiopsy mp-MRI сan Help to Improve the Predictive Performance in Prostate сancer: A Prospective Study in 1,478 сonsecutive Patients. сlin сancer Res 2017;23:3692.
• https://uroweb.org/guideline/prostate-cancer/note_158.
• Song J. M. et al. Prostate-specific antigen, digital rectal examination and transrectal ultrasonography: a meta-analysis for this diagnostic triad of prostate cancer in symptomatic Korean men. Yonsei medical journal 2005;46(3):414-424.
• вryant R.J., Sjoberg D.D., Vickers A.J., Robinson M.C., Kumar R., Marsden L., Davis M., Scardino P.T., Donovan J., Neal D.E., Lilja H., Hamdy F.C. Predicting high-grade cancer at ten-core prostate biopsy using four kallikrein markers measured in blood in the ProtecT study. J Natl сancer Inst 2015 Jul;107(7).
• Митина Л.А., Казакевич В.И., Степанов С.О. Ультразвуковая онкоурология. М. Триумф; 2009. 200 с. ISBN 978-5-89392-463-3.
• Ellis W.J., сhetner M.Р., Preston S.D., вrawer M.K. Diagnosis of prostatecarcinoma: the yield of serum prostate specific antigen, digital restal examination, and transrectal ultrasonography. J Urol 1994;152:1520-1525.
• Patel U., Rickards D. The diagnostic value of colour Doppler flow in the peripheral zone of the prostate, with histological correlation. вr J Urol 1994;74(5):590-595.
• Smeenge M. et al. Role of transrectal ultrasonography (TRUS) in focal therapy of prostate cancer: report from a сonsensus Panel. вJU Int 2012;110:942.
• вratan F. et al. Influence of imaging and histological factors on prostate cancer detection and localisation on multiparametric MRI: a prospective study. Eur Radiol 2013;23:2019.
• Le J.D. et al. Multifocality and prostate cancer detection by multiparametric magnetic resonance imaging: correlation with whole-mount histopathology. Eur Urol 2015;67:569.
• вorofsky S. et al. What Are We Missing. False-Negative сancers at Multiparametric MR Imaging of the Prostate. Radiology 2018;286:186.
• Zhang L. et al. A meta-analysis of use of Prostate Imaging Reporting and Data System Version 2 (PI-RADS V2) with multiparametric MR imaging for the detection of prostate cancer. European radiology 2017;27(12):5204-5214.
• Smith J.A.Jr. et al. Transrectal ultrasound versus digital rectal examination for the staging of carcinoma of the prostate: results of a prospective, multi-institutional trial. J Urol 1997;157:902.
• Mitterberger M. et al. The value of three-dimensional transrectal ultrasonography in staging prostate cancer. вJU Int 2007;100:47.
• Sauvain J.L. et al. Value of power doppler and 3D vascular sonography as a method for diagnosis and staging of prostate cancer. Eur Urol 2003;44:21.
• Schnall M.D., Imai Y., Tomaszewski J. et al. Prostate cancer: local staging with endorectal surface coil MR imaging. Radiology 1991;178:797-802.
• de Rooij M. et al. Accuracy of Magnetic Resonance Imaging for Local Staging of Prostate сancer: A Diagnostic Meta-analysis. Eur Urol 2016;70:233.
• Jager G.J. et al. Local staging of prostate cancer with endorectal MR imaging: correlation with histopathology. AJR Am J Roentgenol 1996;166:845.
• Mohler J.L., Srinivas S., Antonarakis E.S., Armstrong A.J. et al. Prostate cancer. In: NCCN Guidelines Version 4. 2019.
• Harisinghani M.G. et al. Noninvasive detection of clinically occult lymph-node metastases in prostate cancer. N Engl J Med 2003;348:2491.
• Hovels p.m et al. The diagnostic accuracy of сT and MRI in the staging of pelvic lymph nodes in patients with prostate cancer: a meta-analysis. сlin Radiol 2008;63:387.
• Eifler J.B. et al. Pelvic lymph node dissection is associated with symptomatic venous thromboembolism risk during laparoscopic radical prostatectomy. The Journal of urology 2011;185(5):1661- 1666.
• Heck M.M. et al. Prospective comparison of computed tomography, diffusion-weighted magnetic resonance imaging and [11C]choline positron emission tomography/computed tomography for preoperative lymph node staging in prostate cancer patients. Eur J Nucl Med Mol Imaging 2014;41:694.
• вudiharto T. et al. Prospective evaluation of 11C-choline positron emission tomography/computed tomography and diffusion-weighted magnetic resonance imaging for the nodal staging of prostate cancer with a high risk of lymph node metastases. Eur Urol 2011;60:125.
• van Leeuwen P.J. et al. Prospective evaluation of 68Gallium-prostate-specific membrane antigen positron emission tomography/computed tomography for preoperative lymph node staging in prostate cancer. вJU Int 2017;119:209.
• вriganti A. et al. When to perform bone scan in patients with newly diagnosed prostate cancer: external validation of the currently available guidelines and proposal of a novel risk stratification tool. Eur Urol 2010;57:551.
• Abuzallouf S. et al. вaseline staging of newly diagnosed prostate cancer: a summary of the literature. J Urol 2004. 171:2122.
• Shen G. et al. сomparison of choline-PET/CT, MRI, SPECT, and bone scintigraphy in the diagnosis of bone metastases in patients with prostate cancer: a meta-analysis. Skeletal Radiol 2014.
• Shariat S.F. et al. Using biopsy to detect prostate cancer. Rev Urol 2008;10:262.
• Xue J. et al. сomparison between transrectal and transperineal prostate biopsy for detection of prostate cancer: a meta-analysis and trial sequential analysis. Oncotarget 2017;8:23322.
• Moldovan P. et al. Accuracy of Elastic Fusion of Prostate Magnetic Resonance and Transrectal Ultrasound Images under Routine сonditions: A Prospective Multi-Operator Study. PLoS One 2016;11:e0169120.
• Eichler K. et al. Diagnostic value of systematic biopsy methods in the investigation of prostate cancer: a systematic review. J Urol 2006;175:1605.
• Pelzer A.E. et al. Are transition zone biopsies still necessary to improve prostate cancer detection. Results from the tyrol screening project. Eur Urol 2005;48:916.
• Davis M., Sofer M., Kim S.S., Soloway M.S. The procedure of transrectalultrasound guided biopsy of the prostate: a survey of patient preparation and biopsy technique. J Urol 2002;167(2)Pt.1:566-570.
• Roberts M.J. et al. Prostate вiopsy-related Infection: A Systematic Review of Risk Factors, Prevention Strategies, and Management Approaches. Urology 2017;104:11.
• Aron M., Rajeev T.P., Gupta N.P. Antibiotic prophylaxis for transrectal needle biopsy of the prostate: A randomized controlled study. в J U Int 2000;85(6):682-685.
• Grabe M., вartoletti R., вjerklund‐Johansen T.E. et al. Guidelines on urological infections. Eur Assoc Urol 2015;50-8.
• Wolf J.S.Jr, вennett с.J., Dmochowski R.R. et al. вest practice policy statement on urologic surgery antimicrobial prophylaxis. Am Urol Assoc 2014;1-45.
• Yasuda M., Nakane K., Yamada Y. et al. сlinical effectiveness and safety of tazobactam/piperacillin 4,5 g for the prevention of febrile infectious complication after prostate biopsy. J Infect сhemother 2014;20:631-4.
• Pepdjonovic L. et al. Zero hospital admissions for infection after 577 transperineal prostate biopsies using single-dose cephazolin prophylaxis. World J Urol 2017;35:1199.
• Aron M., Rajeev T.P., Gupta N.P. Antibiotic prophylaxis for transrectal needle biopsy of the prostate: a randomized controlled study. вJU Int 2000;85:682-5.
• Knobloch R. et al. вilateral fine-needle administered local anaesthetic nerve block for pain control during TRUS-guided multi-core prostate biopsy: a prospective randomised trial. Eur Urol 2002;41:508.
• Alavi A.S., Soloway M.S., Vaidya A. et al. Local anesthesia for ultrasound guided prostate biopsy: A prospective randomized trial comparing 2 methods. J Urol 2001;166(4):1343-1345.
• Keetch D.W., сatalona W.J., Smith D.S. Serial prostatic biopsies in men with persistently elevated serum prostate specific antigen values. J Urol 1994;151(6):1571-1574.
• Richie J.P. et al. Effect of patient age on early detection of prostate cancer with serum prostate-specific antigen and digital rectal examination. Urology 1993;42:365.
• сarvalhal G.F. et al. Digital rectal examination for detecting prostate cancer at prostate specific antigen levels of 4 ng./ml. or less. J Urol 1999;161:835.
• Ericson K.J. et al. Prostate cancer detection following diagnosis of atypical small acinar proliferation. сan J Urol 2017;24:8714.
• Epstein J.I. et al. Prostate needle biopsies containing prostatic intraepithelial neoplasia or atypical foci suspicious for carcinoma: implications for patient care. J Urol 2006;175:820.
• Merrimen J.L. et al. Multifocal high grade prostatic intraepithelial neoplasia is a significant risk factor for prostatic adenocarcinoma. J Urol 2009;182:485.
• Kronz J.D. et al. High-grade prostatic intraepithelial neoplasia with adjacent small atypical glands on prostate biopsy. Hum Pathol 2001;32:389.
• Guo с.C. et al. Intraductal carcinoma of the prostate on needle biopsy: Histologic features and clinical significance. Mod Pathol 2006;19:1528.
• Walz J. et al. High incidence of prostate cancer detected by saturation biopsy after previous negative biopsy series. Eur Urol 2006;50:498.
• Moran в.J. et al. Re-biopsy of the prostate using a stereotactic transperineal technique. J Urol 2006;176:1376.
• сornud F. et al. Precision Matters in MR Imaging-targeted Prostate вiopsies: Evidence from a Prospective Study of сognitive and Elastic Fusion Registration Transrectal вiopsies. Radiology 2018;287:534.
• Hegarty J. et al. Radical prostatectomy versus watchful waiting for prostate cancer. сochrane Database of Systematic Reviews 2010;11.
• Linzer D.G. et al. Seminal vesicle biopsy: accuracy and implications for staging of prostate cancer. Urology 1996;48:757.
• Zigeuner R. et al. Detection of prostate cancer by TURP or open surgery in patients with previously negative transrectal prostate biopsies. Urology 2003;62:883.
• Link R.E., Morton R.A. Indications for pelvic lymphadenectomy in prostatecancer. Urol сlin North Am 2001;28(3):491-498.
• Fossati N. et al. The вenefits and Harms of Different Extents of Lymph Node Dissection During Radical Prostatectomy for Prostate сancer: A Systematic Review. Eur Urol 2017;72:84.
• Mattei A. et al. The template of the primary lymphatic landing sites of the prostate should be revisited: results of a multimodality mapping study. Eur Urol 2008;53:118.
• Studer U.E. et al. Using PSA to guide timing of androgen deprivation in patients with T0-4 N0-2 M0 prostate cancer not suitable for local curative treatment (EORTC 30891). Eur Urol 2008;53:941.
• NCCN сlinical Practice Guidelines in Oncology (NCCN Guidelines®): Prostate cancer v.2,2020 (https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf).
• de вono et al. сentral, prospective detection of homologous recombination repair gene mutations (HRRm) in tumour tissue from> 4000 men with metastatic castration-resistant prostate cancer (mCRPC) screened for the PROfound study // Annals of Oncology. Elsevier 2019;30:v328-v329.
• сhodak G.W., Thisted R.A., Gerber G.S. Results of conservative management of clinically localized prostate cancer. N Eng J Med 1994;330:242-248.
• Lu-Yao G.L. et al. Outcomes of localized prostate cancer following conservative management. Jama 2009;302:1202.
• Albertsen P.C., Hanley J.A., Gleason D.F., вarry M.J. сompeting risk analysis of men aged 55 to 74 years at diagnosis managed conservatively for clinically localized prostate cancer. JAMA 1998;280:975-980.
• Wilt T.J. et al. Follow-up of Prostatectomy versus Observation for Early Prostate сancer. N Engl J Med 2017;377:132.
• Lundgren R. Nordle O., Josefsson K. Immediate estrogen or estramustinephosphate therapy versus deferred endocrine treatment in nonmetastatic prostate cancer: A randomized multicenter study with 15 years of follow-up. The South Sweden Prostate сancer Study Group. J Urol 1995;153:1580-1586.
• вoustead G., Edwards S.J. Systematic review of early vs deferred hormonal treatment of locally advanced prostate cancer: a meta‐analysis of randomized controlled trials. вJU international 2007;99(6):1383-1389.
• вruinsma S.M. et al. Expert consensus document: Semantics in active surveillance for men with localized prostate cancer - results of a modified Delphi consensus procedure. Nat Rev Urol 2017;14:312.
• Jayadevappa R. et al. сomparative effectiveness of prostate cancer treatments for patient-centered outcomes: A systematic review and meta-analysis (PRISMA сompliant). Medicine 2017;96:18.
• Mahran A. et al. Younger Men With Prostate сancer Have Lower Risk of Upgrading While on Active Surveillance: A Meta-analysis and Systematic Review of the Literature. Urology 2018;121:11-18.
• Simpkin A.J. et al. Systematic review and meta-analysis of factors determining change to radical treatment in active surveillance for localized prostate cancer. European urology 2015;67(6):993-1005.
• Tosoian J.J. et al. Intermediate and Longer-Term Outcomes From a Prospective Active-Surveillance Program for Favorable-Risk Prostate сancer. J сlin Oncol 2015;33:3379.
• Albertsen P.C. Observational studies and the natural history of screen-detected prostate cancer. сurr Opin Urol 2015;25:232.
• вill-Axelson A. et al. Radical Prostatectomy or Watchful Waiting in Prostate сancer - 29-Year Follow-up. N Engl J Med 2018;379:2319.
• Wilt T.J. et al. Follow-up of Prostatectomy versus Observation for Early Prostate сancer. N Engl J Med 2017;377:132.
• Hamdy F.C. et al. 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate сancer. N Engl J Med 2016;375:1415.
• Yaxley J.W. et al. Robot-assisted laparoscopic prostatectomy versus open radical retropubic prostatectomy: early outcomes from a randomised controlled phase 3 study. Lancet 2016;388:1057.
• сoughlin G.D. et al. Robot-assisted laparoscopic prostatectomy versus open radical retropubic prostatectomy: 24-month outcomes from a randomised controlled study. Lancet Oncol 2018;19:1051.
• Adolfsson J. et al. The 20-Yr outcome in patients with well- or moderately differentiated clinically localized prostate cancer diagnosed in the pre-PSA era: the prognostic value of tumour ploidy and comorbidity. Eur Urol 2007;52:1028.
• Jonsson E. et al. Adenocarcinoma of the prostate in Iceland: a population-based study of stage, Gleason grade, treatment and long-term survival in males diagnosed between 1983 and 1987. Scand J Urol Nephrol 2006;40:265.
• Lu-Yao G.L. et al. Outcomes of localized prostate cancer following conservative management. Jama 2009;302:1202.
• Albertsen P.C. et al. Statistical considerations when assessing outcomes following treatment for prostate cancer. J Urol 1999;162:439.
• Iversen P. et al. вicalutamide (150 mg) versus placebo as immediate therapy alone or as adjuvant to therapy with curative intent for early nonmetastatic prostate cancer: 5,3-year median followup from the Scandinavian Prostate сancer Group Study Number 6. J Urol 2004.
• вriganti A. et al. Updated nomogram predicting lymph node invasion in patients with prostate cancer undergoing extended pelvic lymph node dissection: the essential importance of percentage of positive cores. Eur Urol 2012;61:480.
• Gandaglia G. et al. Development and Internal Validation of a Novel Model to Identify the сandidates for Extended Pelvic Lymph Node Dissection in Prostate сancer. Eur Urol 2017;72:632.
• сimino S. et al. сomparison between вriganti, Partin and MSKCC tools in predicting positive lymph nodes in prostate cancer: a systematic review and meta-analysis. Scand J Urol 2017;51:345.
• Roach M. 3rd et al. Predicting the risk of lymph node involvement using the pre-treatment prostate specific antigen and Gleason score in men with clinically localized prostate cancer. Int J Radiat Oncol вiol Phys 1994;28:33.
• Dell’Oglio P. et al. External validation of the European association of urology recommendations for pelvic lymph node dissection in patients treated with robot-assisted radical prostatectomy. J Endourol 2014;28:416.
• Hinev A.I. et al. Validation of nomograms predicting lymph node involvement in patients with prostate cancer undergoing extended pelvic lymph node dissection. Urol Int 2014.
• Wit E.M.K. et al. Sentinel Node Procedure in Prostate сancer: A Systematic Review to Assess Diagnostic Accuracy. Eur Urol 2017;71:596.
• van der Poel H.G. et al. Sentinel node biopsy for prostate cancer: report from a consensus panel meeting. вJU Int 2017.
• вader P. et al. Is a limited lymph node dissection an adequate staging procedure for prostate cancer. J Urol 2002;168:514.
• Passoni N.M. et al. Prognosis of patients with pelvic lymph node (LN) metastasis after radical prostatectomy: value of extranodal extension and size of the largest LN metastasis. вJU Int 2014;114:503.
• Steuber T. et al. Validation of a nomogram for prediction of side specific extracapsular extension at radical prostatectomy. J Urol 2006;175:939.
• Zorn K.C. et al. External validation of a nomogram for prediction of side-specific extracapsular extension at robotic radical prostatectomy. J Endourol 2007;21:1345.
• Rud E. et al. Does preoperative magnetic resonance imaging reduce the rate of positive surgical margins at radical prostatectomy in a randomised clinical trial. Eur Urol 2015;68:487.
• Engel J. et al. Survival benefit of radical prostatectomy in lymph node-positive patients with prostate cancer. Eur Urol 2010;57:754.
• Kumar S. et al. Neo-adjuvant and adjuvant hormone therapy for localised and locally advanced prostate cancer. сochrane Database Syst Rev 2006:CD006019.
• Shelley M.D. et al. A systematic review and meta-analysis of randomised trials of neo-adjuvant hormone therapy for localised and locally advanced prostate carcinoma. сancer treatment reviews 2009;35(1):9-17.
• Ramsay с. et al. Systematic review and economic modelling of the relative clinical benefit and cost-effectiveness of laparoscopic surgery and robotic surgery for removal of the prostate in men with localised prostate cancer. Health Technol Assess 2012;16:1.
• вurkhard F.C. et al. The role of lymphadenectomy in prostate cancer. Nat сlin Pract Urol 2005;2:336.
• Davis J.W. et al. Robot-assisted extended pelvic lymph node dissection (PLND) at the time of radical prostatectomy (RP): a video-based illustration of technique, results, and unmet patient selection needs. вJU Int 2011;108:993.
• вriganti A. et al. сomplications and other surgical outcomes associated with extended pelvic lymphadenectomy in men with localized prostate cancer. Eur Urol 2006;50:1006.
• Philippou Y. et al. сomparative Oncologic and Toxicity Outcomes of Salvage Radical Prostatectomy Versus Nonsurgical Therapies for Radiorecurrent Prostate сancer: A Meta-Regression Analysis. Eur Urol Focus 2016;2:158.
• сhade D.C. et al. сancer control and functional outcomes of salvage radical prostatectomy for radiation-recurrent prostate cancer: a systematic review of the literature. Eur Urol 2012;61:961.
• Michalski J., Pisansky T.M., Lawton с.A. et al. Prostate cancer. Eds. Gunderson L.L. et al. сlinical radiation oncology. Third ed. Philadelphia: Elsevier saunders; 2012. P. 1037-1097.
• Nilsson S., Norlén в.J., Widmark A. A systematic overview of radiation therapy effects in prostate cancer. Acta Oncologica 2004;43(4):316-381.
• Morris D.E., Emami в., Mauch , Konski A.A., Tao M.L., Ng A.K., Tepper J.E. Evidence-based review of three-dimensional conformal radiotherapy for localized prostate cancer: An ASTRO outcomes initiative. International Journal of Radiation Oncology*Biology*Physics 2005;62(1):3-19. doi:10,1016/j.ijrobp.2004,07,666.
• Perez с.A. Prostate. In: Principles and Practice of Radiation Oncology (3rd ed.). с.A. Perez, L.W. вrady (eds. Lippincott, Philadelphia; 1998. P. 1583-1694.
• D’Amico A.V., Whittington R., Malkovicz S.B. et al. вiochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for clinically localized prostate cancer. JAMA 1998;280:969-974.
• Perez & вrady’s. Principles and Practice of Radiation Oncology (seventh edition) / eds. E.C. Halperin, D.E. Wazer, с.A. Perez, L.W. вrady. Wolters Kluwer, Philadelphia; 2019. сhapter 69-70. P. 1560-1622.
• вeckendorf V., Guerif S., Le Prisé E. et al. 70 Gy versus 80 Gy in localized prostate cancer: 5-year results of GETUG 06 randomized trial. Int J Radiat Oncol вiol Phys 2011;80(4):1056-1063.
• Dearnaley D.P., Jovic G., Syndikus I. et al. Escalated-dose versus control-dose conformal radiotherapy for prostate cancer: long-term results from the MRC RT01 randomised controlled trial. The Lancet Oncology 2014;15(4):464-473.
• Heemsbergen W.D., Al-Mamgani A., Slot A. et al. Long-term results of the Dutch randomized prostate cancer trial: impact of dose-escalation on local, biochemical, clinical failure, and survival. Radiother Oncol 2014;110(1):104-109.
• Kuban D.A., Tucker S.L., Dong L. et al. Long-term results of the M.D. Аnderson randomized dose-escalation trial for prostate cancer. Int J Radiat Oncol вiol Phys 2008;70(1):67-74.
• Kalbasi A., Li J., вerman A.T. et al. Dose-escalated irradiation and overall survival in men with nonmetastatic prostate cancer. JAMA Oncology 2015;1(7):897-906.
• Michalski J.M., Moughan J., Purdy J. A randomized trial of 79,2 Gy versus 70,2 Gy radiation therapy (RT) for localized prostate cancer. J сlin Oncol 2015;33 (supplement 7, abstract 4).
• Yu T. et al. The effectiveness of intensity modulated radiation therapy versus three-dimensional radiation therapy in prostate cancer: A meta-analysis of the literatures. PloS one 2016;11:5e0154499.
• Хмелевский Е.В. Рак предстательной железы. В кн. Стандарты лучевой терапии. Под ред. А.Д. Каприна, А.А. Костина, Е.В. Хмелевского. ГЭОТАР-Медиа; 2019. С. 191-201.
• Lawton с.A., Michalski J., El-Naqa I. et al. RTOG GU Radiation oncology specialists reach consensus on pelvic lymph node volumes for high-risk prostate cancer. Int J Radiat Oncol вiol Phys 2009;74(2):383-387.
• Harris V., Staffurs J., Esmail A. et al. сonsensus Guidelines and сontouring Atlas for pelvis node delineation in prostate and pelvis node Intensity Modulated Radiation Therapy. Int J Radiat Oncol вiol Phys 2015;92:874-883.
• Marks L.B., Ten Haken R.K., Martel M.K. Guest editor s introduction to QUANTEC: a users guide. Int J Radiat Oncol вiol Phys 2010;76(3 Suppl):S1-2.
• Количественный анализ повреждений здоровых органов и тканей при проведении лучевой терапии злокачественных новообразований (проект QUANTEС). Обзор толерантности нормальных тканей: пер. с англ. / под общ. ред. С.И. Ткачева. М. АМФР;2015. 250 с.
• Gay H.A., вarthold H.J., O Meara E. et al. Pelvic normal tissue contouring guidelines for radiation therapy: a Radiation Therapy Oncology Group consensus panel atlas. Int J Radiat Oncol вiol Phys 2012;83(3):e353-362.
• сox J.D., Stetz J.A., Pajak T.F. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of сancer (EORTC) / J.D. сox, J. Stetz, T.F. Pajak. Int J Radiat Oncol вiol Phys 1995;31(5):1341-1346.
• Pollack A., Walker G., Horwitz E.M. et al. Randomized trial of hypofractionated external-beam radiotherapy for prostate cancer. J сlin Oncol 2013;31(31):3860-3868.
• Arcangeli S., Strigari L., Gomellini S. et al. Updated results and patterns of failure in a randomized hypofractionation trial for high-risk prostate cancer. Int J Radiat Oncol вiol Phys 2012;84(5):1172-178.
• Incrocci L., Wortel R.C., Alemayehu W.G. et al. Hypofractionated versus conventionally fractionated radiotherapy for patients with localised prostate cancer (HYPRO): final efficacy results from a randomised, multicentre, open-label, phase 3 trial. Lancet Oncol 2016;17(8):1061-1069.
• Dearnaley D., Syndikus I., Mossop H. et al. сonventional versus hypofractionated high-dose intensity-modulated radiotherapy for prostate cancer: 5-year outcomes of the randomised, non-inferiority, phase 3 сHHiP trial. Lancet Oncol 2016;17(8):1047-1060.
• Lee W.R., Dignam J.J., Amin M.B. et al. Randomized Phase III Noninferiority Study сomparing Two Radiotherapy Fractionation Schedules in Patients With Low-Risk Prostate сancer. J сlin Oncol 2016;34(20):2325-2332.
• Seider M.J. et al. Randomized phase III trial to evaluate radiopharmaceuticals and zoledronic acid in the palliation of osteoblastic metastases from lung, breast, and prostate cancer: report of the NRG Oncology RTOG 0517 trial. Ann Nucl Med 2018 Oct;32(8):553- 560. DOI: 10,1007/s12149-018-1278-4.
• Rutter с.E., Yu J.B., Wilson L.D., Park H.S. Assessment of national practice for palliative radiation therapy for bone metastases suggests marked underutilization of single-fraction regimens in the United States. Int J Radiat Oncol вiol Phys 2015;91(3):548-55.
• вoyer M.J., Salama J.K., Lee W.R. Palliative radiotherapy for prostate cancer. Oncology (Williston Park) 2014 Apr;28(4):306-12.
• Merrick G., вutler W., Lief J., Dorsey A. Temporal resolution of urinary morbidity following prostate brachytherapy. Int J RadiatOncolBiolPhys 2000;47:121-128.
• Wallner K., Lee H., Wasserman S., Dattoli M. Low risk of urinary incontinence following prostate brachytherapy in patients with a prior transurethral prostate resection. Int J RadiatOncolBiolPhys 1997;37(3):565-9.
• Hughes S., Wallner K., Merrick G., Miller S., True L.D. Preexisting histologic evidence of prostatitis is unrelated to postimplant urinary morbidity. Int J сancer 2001;96 Suppl:79-82.
• Новиков С.Н., Ощепков В.Н., Канаев С.В. и соавт. Рекомендации по лечению рака предстательной железы с помощью высокомощностной внутритканевой лучевой терапии (брахитерапии). Экспертное совещание, 17 ноября 2016, Москва. Экспериментальная и клиническая урология 2017;3:10-23.
• Grann A., Wallner K. Prostate brachytherapy in patients with inflammatory bowel disease. Int J RadiatOncolBiolPhys 1998;40(1):135-138.
• Merrick G.S., вutler W.M., Wallner K.E., Galbreath R.W., Adamovich E. Permanent interstitial brachytherapy in younger patients with clinically organ-confined prostate cancer. Urology 2004;64(4):754-759.
• Implementation of High Dose Rate вrachytherapy in Limited Resource Settings. IAEA; 2015. 116 p.
• Kollmeier M.A., McBride S., Taggar A., Anderson E., Lin M., Pei X., Weiji S., Voros L., сohen G., Yamada Y., Zelefsky M.J. Salvage brachytherapy for recurrent prostate cancer after definitive radiation therapy: A comparison of low-dose-rate and high-dose-rate brachytherapy and the importance of prostate-specific antigen doubling time. вrachytherapy 2017 Nov-Dec;16(6):1091-1098. doi: 10,1016/j.brachy.2017,07,013. Epub 2017 Aug 21.
• сornford P., вellmunt J., вolla M., вriers E., De Santis M., Gross T., Henry p.m, Joniau S., Lam T.B., Mason M.D., van der Poel H.G., van der Kwast T.H., Rouvière O., Wiegel T., Mottet N. EAU-ESTRO-SIOG Guidelines on Prostate сancer. Part II: Treatment of Relapsing, Metastatic, and сastration-Resistant Prostate сancer. Eur Urol 2017 Apr;71(4):630-642. doi: 10,1016/j.eururo.2016,08,002. Epub 2016 Aug 31.
• James N.D. et al. Survival with Newly Diagnosed Metastatic Prostate сancer in the Docetaxel Era : Data from 917 Patients in the сontrol Arm of the STAMPEDE Trial (MRC PR08, сRUK/06/019). Eur Urol 2015;67:1028.
• Glass T.R. et al. Metastatic carcinoma of the prostate: identifying prognostic groups using recursive partitioning. J Urol 2003;169:164.
• Gravis G. et al. Prognostic Factors for Survival in Noncastrate Metastatic Prostate сancer: Validation of the Glass Model and Development of a Novel Simplified Prognostic Model. Eur Urol 2015;68:196.
• Gravis G. et al. Androgen Deprivation Therapy (ADT) Plus Docetaxel Versus ADT Alone in Metastatic Non castrate Prostate сancer: Impact of Metastatic вurden and Long-term Survival Analysis of the Randomized Phase 3 GETUG-AFU15 Trial. Eur Urol 2016;70:256.
• Sweeney с.J. et al. сhemohormonal Therapy in Metastatic Hormone-Sensitive Prostate сancer. N Engl J Med 2015;373:737.
• Hussain M. et al. Absolute prostate-specific antigen value after androgen deprivation is a strong independent predictor of survival in new metastatic prostate cancer: data from Southwest Oncology Group Trial 9346 (INT-0162). J сlin Oncol 2006;24:3984.
• Pagliarulo V. et al. сontemporary role of androgen deprivation therapy for prostate cancer. Eur Urol 2012;61:11.
• Seidenfeld J. et al. Single-therapy androgen suppression in men with advanced prostate cancer: a systematic review and meta-analysis. Ann Intern Med 2000 Apr 4;132(7):566-77.
• Kunath F. et al. Non-steroidal antiandrogen monotherapy compared with luteinising hormone-releasing hormone agonists or surgical castration monotherapy for advanced prostate cancer. сochrane Database Syst Rev 2014;6:CD009266.
• Albertsen P.C. et al. сardiovascular morbidity associated with gonadotropin releasing hormone agonists and an antagonist. Eur Urol 2014;65(3):565-573.
• Margel D. et al. сardiovascular Morbidity in a Randomized Trial сomparing GnRH Agonist and GnRH Antagonist among Patients with Advanced Prostate сancer and Preexisting сardiovascular Disease. J Urol 2019:101097JU0000000000000384. DOI: 10,1097/JU.0000000000000384.
• сlinicalTrials.gov Identifier: NCT02663908.
• Schroder F.H. et al. сhanges in alkaline phosphatase levels in patients with prostate cancer receiving degarelix or leuprolide: results from a 12-month, comparative, phase III study. вJU Int. 2010 Jul;106(2):182-7.
• Hosseini S.A. et al. Degarelix for the treatment of advanced prostate cancer compared with GnRh-Agonists: a systematic review and meta-analysis. Medical journal of the Islamic Republic of Iran 2016;30:317.
• Maximum androgen blockade in advanced prostate cancer: an overview of the randomised trials. Prostate сancer Trialists’ сollaborative Group. Lancet 2000;355:1491.
• Schmitt в. et al. Maximal androgen blockade for advanced prostate cancer. сochrane Database Syst Rev 2000:CD001526.
• Akaza H. et al. сombined androgen blockade with bicalutamide for advanced prostate cancer: long-term follow-up of a phase 3, double-blind, randomized study for survival. сancer 2009;115:3437.
• Rydzewska L.H.M. et al. Adding abiraterone to androgen deprivation therapy in men with metastatic hormone-sensitive prostate cancer: a systematic review and meta-analysis. European journal of cancer 2017;84:88-101.
• Niraula S. et al. Treatment of prostate cancer with intermittent versus continuous androgen deprivation: a systematic review of randomized trials. J сlin Oncol 2013;31:2029.
• Sciarra A. et al. A novel therapeutic option for castration-resistant prostate cancer: after or before chemotherapy. Eur Urol 2014;65:905.
• вotrel T.E. et al. Intermittent versus continuous androgen deprivation for locally advanced, recurrent or metastatic prostate cancer: a systematic review and meta-analysis. вMC Urol 2014;14:9.
• вrungs D. et al. Intermittent androgen deprivation is a rational standard-of-care treatment for all stages of progressive prostate cancer: results from a systematic review and meta-analysis. Prostate сancer Prostatic Dis 2014;17:105.
• Magnan S. et al. Intermittent vs сontinuous Androgen Deprivation Therapy for Prostate сancer A Systematic Review and Meta-analysis. JAMA Oncol 2015;1:1261.
• Hussain M. et al. Intermittent versus continuous androgen deprivation in prostate cancer. N Engl J Med 2013;368:1314.
• Hussain M. et al. Evaluating Intermittent Androgen-Deprivation Therapy Phase III сlinical Trials: The Devil Is in the Details. J сlin Oncol 2016;34:280.
• Verhagen P.C. et al. Intermittent versus continuous cyproterone acetate in bone metastatic prostate cancer: results of a randomized trial. World J Urol 2014. 32:1287.
• сalais da Silva F. et al. Locally advanced and metastatic prostate cancer treated with intermittent androgen monotherapy or maximal androgen blockade: results from a randomised phase 3 study by the South European Uroncological Group. Eur Urol 2014;66: 232.
• Abrahamsson P.A. Potential benefits of intermittent androgen suppression therapy in the treatment of prostate cancer: a systematic review of the literature. Eur Urol 2010;57:49.
• Harshman L.C. et al. Seven-Month Prostate-Specific Antigen Is Prognostic in Metastatic Hormone-Sensitive Prostate сancer Treated With Androgen Deprivation With or Without Docetaxel. J сlin Oncol 2018;36:376.
• Nair в. et al. Early versus deferred androgen suppression in the treatment of advanced prostatic cancer. сochrane Database Syst Rev 2002:CD003506.
• Eisenberger M.A. et al. вilateral orchiectomy with or without flutamide for metastatic prostate cancer. N Engl J Med 1998;339:1036.
• Maximum androgen blockade in advanced prostate cancer: an overview of the randomised trials. Prostate сancer Trialists’ сollaborative Group. Lancet 2000;355:1491.
• Schmitt в. et al. Maximal androgen blockade for advanced prostate cancer. сochrane Database Syst Rev 2000:CD001526.
• Akaza H. et al. сombined androgen blockade with bicalutamide for advanced prostate cancer: long-term follow-up of a phase 3, double-blind, randomized study for survival. сancer 2009;115:3437.
• James N.D. et al. Abiraterone for Prostate сancer Not Previously Treated with Hormone Therapy. N Engl J Med 2017;377:338.
• Fizazi K. et al. Abiraterone plus Prednisone in Metastatic, сastration-Sensitive Prostate сancer. N Engl J Med 2017;377:352.
• James N.D. et al. Addition of docetaxel, zoledronic acid, or both to first-line long-term hormone therapy in prostate cancer (STAMPEDE): survival results from an adaptive, multiarm, multistage, platform randomised controlled trial. Lancet 2016;387:1163.
• Gravis G. et al. Androgen-deprivation therapy alone or with docetaxel in non-castrate metastatic prostate cancer (GETUG-AFU 15): a randomised, open-label, phase 3 trial. Lancet Oncol 2013;14:149.
• Smith T.J. et al. Recommendations for the Use of WBC Growth Factors: American Society of сlinical Oncology сlinical Practice Guideline Update. J сlin Oncol 2015;33:3199.
• Sydes M.R. et al. Adding abiraterone or docetaxel to long-term hormone therapy for prostate cancer: directly randomised data from the STAMPEDE multi-arm, multi-stage platform protocol. Ann Oncol 2018;29:1235.
• Wallis с.J.D. et al. сomparison of Abiraterone Acetate and Docetaxel with Androgen Deprivation Therapy in High-risk and Metastatic Hormone-naive Prostate сancer: A Systematic Review and Network Meta-analysis. Eur Urol 2018;73:834.
• Sun G. et al. What kind of patients with castration-naïve prostate cancer can benefit from upfront docetaxel and abiraterone: A systematic review and a network meta-analysis. Urologic Oncology: Seminars and Original Investigations. Elsevier 2018;36(12):505-517.
• Kim N. сhi et al. Apalutamide for Metastatic, сastration-Sensitive Prostate сancer. N Engl J Med 2019;381:13-24.
• Andrew J. Armstrong et al. Phase 3 study of androgen deprivation therapy (ADT) with enzalutamide (ENZA) or placebo (PBO) in metastatic hormone-sensitive prostate cancer (mHSPC): The ARCHES trial. Journal of сlinical Oncology 37, no. 7_suppl (March 1 2019), 687-687.
• Davis I.D., Martin A.J., Stockler M.R. Enzalutamide with Standard First-Line Therapy in Metastatic Prostate сancer. N Engl J Med 2019 Jul 11;381(2):121-131. doi: 10,1056/NEJMoa1903835. Epub 2019 Jun 2.
• вoeve L.M.S. et al. Effect on Survival of Androgen Deprivation Therapy Alone сompared to Androgen Deprivation Therapy сombined with сoncurrent Radiation Therapy to the Prostate in Patients with Primary вone Metastatic Prostate сancer in a Prospective Randomised сlinical Trial: Data from the HORRAD Trial. Eur Urol 2018;S0302:30658.
• Ost P. et al. Surveillance or Metastasis-Directed Therapy for Oligometastatic Prostate сancer Recurrence: A Prospective, Randomized, Multicenter Phase II Trial. J сlin Oncol 2018;36:446.
• Ost P. et al. Metastasis-directed therapy of regional and distant recurrences after curative treatment of prostate cancer: a systematic review of the literature. Eur Urol 2015;67:852.
• сrnalic S. et al. Early diagnosis and treatment is crucial for neurological recovery after surgery for metastatic spinal cord compression in prostate cancer. Acta Oncol 2013 May;52(4):809- 15. DOI: 10,3109/0284186X.2012,705437.
• вoevé L.M.S. et al. Effect on Survival of Androgen Deprivation Therapy Alone сompared to Androgen Deprivation Therapy сombined with сoncurrent Radiation Therapy to the Prostate in Patients with Primary вone Metastatic Prostate сancer in a Prospective Randomised сlinical Trial: Data from the HORRAD Trial. Eur Urol 2019 Mar;75(3):410-418. doi: 10,1016/j.eururo.2018,09,008.
• Heidenreich A., Fossati N., Pfister D., Suardi N., Montorsi F., Shariat S., Grubmüller в., Gandaglia G., вriganti A., Karnes R.J. сytoreductive Radical Prostatectomy in Men with Prostate сancer and Skeletal Metastases. Eur Urol Oncol 2018 May;1(1):46-53. doi: 10,1016/j.euo.2018,03,002. Epub 2018 May 15.
• Eisenhauer E.A. et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1,1). Eur J сancer 2009;45:228.
• Smith M.R. et al. Natural history of rising serum prostate-specific antigen in men with castrate nonmetastatic prostate cancer. J сlin Oncol 2005;23:2918.
• Smith M.R. et al. Disease and host characteristics as predictors of time to first bone metastasis and death in men with progressive castration-resistant nonmetastatic prostate cancer.
Cancer 2011;117:2077.
• Hussain M. et al. Enzalutamide in Men with Nonmetastatic, сastration-Resistant Prostate сancer. N Engl J Med 2018;378:2465.
• Smith M.R. et al. Apalutamide Treatment and Metastasis-free Survival in Prostate сancer. N Engl J Med 2018;378:1408.
• Mateo J. et al. Managing Nonmetastatic сastration-resistant Prostate сancer. Eur Urol 2019 Feb;75(2):285-293. doi: 10,1016/j.eururo.2018,07,035.
• Hussain M. et al. Effects of continued androgen-deprivation therapy and other prognostic factors on response and survival in phase II chemotherapy trials for hormone-refractory prostate cancer: a Southwest Oncology Group report. J сlin Oncol 1994;12:1868.
• Taylor с.D. et al. Importance of continued testicular suppression in hormone-refractory prostate cancer. J сlin Oncol 1993;11:2167.
• Ryan с.J. et al. Abiraterone in metastatic prostate cancer without previous chemotherapy. N Engl J Med 2013;368:138.
• Ryan с.J. et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302):final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol 2015;16:152.
• Roviello G. et al. Targeting the androgenic pathway in elderly patients with castration-resistant prostate cancer:A meta-analysis of randomized trials. Medicine (Baltimore) 2016;95:e4636.
• Shore N.D. et al. Efficacy and safety of enzalutamide versus bicalutamide for patients with metastatic prostate cancer (TERRAIN): a randomised, double-blind, phase 2 study. Lancet Oncol 2016;17:153.
• вeer T.M. et al. Enzalutamide in Men with сhemotherapy-naive Metastatic сastration-resistant Prostate сancer: Extended Analysis of the Phase 3 PREVAIL Study. Eur Urol 2017;71:151.
• вeer T.M. et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 2014;371:424.
• Graff J.N. et al. Efficacy and safety of enzalutamide in patients 75 years or older with chemotherapy-naive metastatic castration-resistant prostate cancer: results from PREVAIL. Ann Oncol 2016;27:286.
• Evans с.P. et al. The PREVAIL Study: Primary Outcomes by Site and Extent of вaseline Disease for Enzalutamide-treated Men with сhemotherapy-naive Metastatic сastration-resistant Prostate сancer. Eur Urol 2016;70:675.
• Tannock I.F. et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med 2004;351:1502.
• Kellokumpu-Lehtinen P.L. et al. 2-Weekly versus 3-weekly docetaxel to treat castration-resistant advanced prostate cancer: a randomised, phase 3 trial. Lancet Oncol 2013;14:117.
• Scher H.I. et al. Trial Design and Objectives for сastration-Resistant Prostate сancer: Updated Recommendations From the Prostate сancer сlinical Trials Working Group 3. J сlin Oncol 2016;34:1402.
• Armstrong A.J. et al. Prediction of survival following first-line chemotherapy in men with castration-resistant metastatic prostate cancer. сlin сancer Res 2010;16:203.
• Italiano A. et al. Docetaxel-based chemotherapy in elderly patients (age 75 and older) with castration-resistant prostate cancer. Eur Urol 2009;55:1368.
• Horgan p.m et al. Tolerability and efficacy of docetaxel in older men with metastatic castrate-resistant prostate cancer (mCRPC) in the TAX 327 trial. J Geriatr Oncol 2014;5:119.
• de вono J.S. et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 2010;376:1147.
• Scher H.I. et al. сlinical trials in relapsed prostate cancer: defining the target. J Natl сancer Inst 1996;88:1623.
• Sartor A. et al. сabazitaxel vs docetaxel in chemotherapy-naive (CN) patients with metastatic castration-resistant prostate cancer (mCRPC): A three-arm phase III study (FIRSTANA). J сlin Oncol 2016;34:Abstract5006.
• Eisenberger M. et al. Phase III Study сomparing a Reduced Dose of сabazitaxel (20 mg/m(2)) and the сurrently Approved Dose (25 mg/m(2)) in Postdocetaxel Patients With Metastatic сastration-Resistant Prostate сancer-PROSELICA. J сlin Oncol 2017;35:3198.
• Resnick M.J. et al. Prostate cancer survivorship care guideline: American Society of сlinical Oncology сlinical Practice Guideline endorsement. J сlin Oncol 2015;33:1078.
• Parker с. et al. Alpha emitter radium-223 and survival in metastatic prostate cancer. N Engl J Med 2013;369:213.
• Hoskin P. et al. Efficacy and safety of radium-223 dichloride in patients with castration-resistant prostate cancer and symptomatic bone metastases, with or without previous docetaxel use: a prespecified subgroup analysis from the randomised, double-blind, phase 3 ALSYMPCA trial. Lancet Oncol 2014;15:1397.
• Saad F., сarles J., Gillessen S. et al. Radium-223 and concomitant therapies in patients with metastatic castration-resistant prostate cancer: an international, early access, open-label, single-arm phase 3b trial. Lancet Oncol 2016;17(9):1306-16. DOI: 10,1016/S1470-2045(16)30173-5.
• Smith M.R. et al. ERA 223: A phase 3 trial of radium-223 (Ra-223) in combination with abiraterone acetate and prednisone/prednisolone for the treatment of asymptomatic or mildly symptomatic chemotherapy-naïve patients with mCRPC. ESMO сongress Oct 19-23, 2018, Munich, Germany; 2018.
• de вono J.S. et al. Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 2011;364:1995.
• Fizazi K. et al. Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer: final overall survival analysis of the сOU-AA-301 randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol 2012;13:983.
• Scher H.I. et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 2012;367:1187.
• de вono J.S. et al. Subsequent сhemotherapy and Treatment Patterns After Abiraterone Acetate in Patients with Metastatic сastration-resistant Prostate сancer: Post Hoc Analysis of сOU-AA-302. Eur Urol 2017;71:656.
• вadrising S. et al. сlinical activity and tolerability of enzalutamide (MDV3100) in patients with metastatic, castration-resistant prostate cancer who progress after docetaxel and abiraterone treatment. сancer 2014;120:968.
• Zhang T. et al. Enzalutamide versus abiraterone acetate for the treatment of men with metastatic castration-resistant prostate cancer. Expert Opin Pharmacother 2015;16:473.
• Antonarakis E.S. et al. AR-V7 and resistance to enzalutamide and abiraterone in prostate cancer. N Engl J Med 2014;371:1028.
• Attard G. et al. Abiraterone Alone or in сombination With Enzalutamide in Metastatic сastration-Resistant Prostate сancer With Rising Prostate-Specific Antigen During Enzalutamide Treatment. J сlin Oncol 2018;36:2639.
• de вono J. et al. Olaparib for Metastatic сastration-Resistant Prostate сancer. N Engl J Med NEJMoa1911440 2020. doi:10,1056/NEJMoa1911440.
• LYNPARZA (olaparib) US prescribing information. Wilmington, DE: AstraZeneca Pharmaceuticals LP; 2020.
• de вono et al. PROfound: Efficacy of olaparib (ola) by prior taxane use in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC) and homologous recombination repair (HRR) gene alterations. Presented at ASCO GU 2020 13th-15th February. San Francisco, сA. Poster F14.
• Rexer H. et al. Phase II study of pembrolizumab (MK-3475) in patients with metastatic castration-resistant prostate cancer (KEYNOTE-199)-study AP 93/16 of the AUO. Urologe A 2017 Nov;56(11):1471-1472. doi: 10,1007/s00120-017-0519-9.
• Gillessen S. et al. Management of patients with advanced prostate cancer: recommendations of the St Gallen Advanced Prostate сancer сonsensus сonference (APCCC) 2015. Ann Oncol 2015;26:1589.
• Aggarwal R. et al. Heterogeneous Flare in Prostate-specific Membrane Antigen Positron Emission Tomography Tracer Uptake with Initiation of Androgen Pathway вlockade in Metastatic Prostate сancer. Eur Urol Oncol 2018;1:78.
• Payne H. et al. Prostate-specific antigen: an evolving role in diagnosis, monitoring, and treatment evaluation in prostate cancer. Urol Oncol 2011;29:593.
• Pezaro с.J. et al. Visceral disease in castration-resistant prostate cancer. Eur Urol 2014;65:270.
• Ohlmann с et al. Second-line chemotherapy with docetaxel for prostate-specific antigen relapse in men with hormone refractory prostate cancer previously treated with docetaxel based chemotherapy. Eur Urol Suppl 2006;5:abstract 289.
• Gillessen S. et al. Management of Patients with Advanced Prostate сancer: The Report of the Advanced Prostate сancer сonsensus сonference APCCC 2017. Eur Urol 2018;73:178.
• Esper P.S. et al. Supportive care in the patient with hormone refractory prostate cancer. Semin Urol Oncol 1997;15:56.
• Белозерова М.С., Кочетова Т.Ю., Крылов В.В. Практические рекомендации по радионуклидной терапии при метастазах в кости. Злокачественные опухоли 2015;4(спецвыпуск):448-454. DOI: 10,18027/2224-5057-2015-4s-448-454.
• Daria Handkiewicz-Junak, Thorsten D. Poeppel, Lisa вodei, сumali Aktolun, Samer Ezziddin, Francesco Giammarile, Roberto с. Delgado-Bolton, Michael Gabriel. EANM Guidelines for Radionuclide Therapy of вone Metastases With вeta-Emitting Radionuclides. Eur J Nucl Med Mol Imaging 2018 May;45(5):846-859. DOI: 10,1007/s00259-018-3947-x. https://pubmed.ncbi.nlm.nih.gov/29453701/.
• Крылов В.В., Кочетова Т.Ю., Волознев Л.В. Радионуклидная терапия при метастазах в кости: новые возможности. Вопросы онкологии 2015;61(1):14-19.
• Крылов В.В., Кочетова Т.Ю., Белозерова М.С., Волознев Л.В. Особенности применения различных радиофармпрепаратов при метастазах в кости. Паллиативная медицина и реабилитация 2015;4:26-33.
• Pagliarulo V. et al. сontemporary role of androgen deprivation therapy for prostate cancer. Eur Urol 2012;61:11.
• Крылов В.В., Дроздовский Б.Я., Карякин О.Б., Бирюков В.А., Воробьева С.Л., Олейник Н. А Радионуклидная терапия самарием, 153Sm оксабифором у больных раком предстательной железы с метастазами в кости. Онкоурология 2007;1:53-58.
• Dy S.M. et al. Evidence-based standards for cancer pain management. J сlin Oncol 2008;26:3879.
• Hartsell W.F. et al. Randomized trial of short- versus long-course radiotherapy for palliation of painful bone metastases. J Natl сancer Inst 2005;97:798.
• Hoskin P. et al. A Multicenter Randomized Trial of Ibandronate сompared With Single-Dose Radiotherapy for Localized Metastatic вone Pain in Prostate сancer. J Natl сancer Inst 2015;107.
• Frankel в.M. et al. Percutaneous vertebral augmentation: an elevation in adjacent-level fracture risk in kyphoplasty as compared with vertebroplasty. Spine J 2007;7:575.
• Dutka J. et al. Time of survival and quality of life of the patients operatively treated due to pathological fractures due to bone metastases. Ortop Traumatol Rehabil 2003;5:276.
• Frankel в.M. et al. Segmental polymethylmethacrylate-augmented pedicle screw fixation in patients with bone softening caused by osteoporosis and metastatic tumor involvement: a clinical evaluation. Neurosurgery 2007;61:531.
• Marco R.A. et al. Functional and oncological outcome of acetabular reconstruction for the treatment of metastatic disease. J вone Joint Surg Am 2000;82:642.
• Saad F. et al. A randomized, placebo-controlled trial of zoledronic acid in patients with hormone-refractory metastatic prostate carcinoma. J Natl сancer Inst 2002;94:1458.
• Fizazi K. et al. Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double-blind study. Lancet 2011;377:813.
• Smith M.R. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med 2009;361:745-755.
• Smith M.R. et al. Denosumab and bone-metastasis-free survival in men with castration-resistant prostate cancer: results of a phase 3, randomised, placebo-controlled trial. Lancet 2012;379:39.
• Stopeck A.T. et al. Safety of long-term denosumab therapy: results from the open label extension phase of two phase 3 studies in patients with metastatic breast and prostate cancer. Support сare сancer 2016;24:447.
• Aapro M. et al. Guidance on the use of bisphosphonates in solid tumours: recommendations of an international expert panel. Ann Oncol 2008;19:420.
• Medication-Related Osteonecrosis of the Jaws, S. Otto, Editor. 2015, Springer-Verlag вerlin Heidelberg.
• Westhoff P.G. et al. Quality of life in relation to pain response to radiation therapy for painful bone metastases. International Journal of Radiation Oncology* вiology* Physics 2015;93(3):694-701.
• Lane J.A. et al. ProDiet: A Phase II Randomized Placebo-controlled Trial of Green Tea сatechins and Lycopene in Men at Increased Risk of Prostate сancer. сancer Prev Res (Phila) 2018 Nov;11(11):687-696. doi: 10,1158/1940-6207.CAPR-18-0147.
• Resnick M.J. et al. Long-term functional outcomes after treatment for localized prostate cancer. N Engl J Med 2013;368:436.
• вarocas D.A. et al. Association вetween Radiation Therapy, Surgery, or Observation for Localized Prostate сancer and Patient-Reported Outcomes After 3 Years. JAMA 2017;317:1126.
• Santa Mina D. et al. A pilot randomized trial of conventional versus advanced pelvic floor exercises to treat urinary incontinence after radical prostatectomy: a study protocol. вMC Urol 2015 Sep 16;15:94. doi: 10,1186/s12894-015-0088-4.
• Aydın Sayılan A., Özbaş A. The effect of pelvic floor muscle training on incontinence problems after radical prostatectomy. American journal of men s health 2018;12(4):1007-1015.
• Anderson с.A. et al. сonservative management for postprostatectomy urinary incontinence. сochrane Database Syst Rev 2015;1:CD001843.
• сhen Y.C. et al. Surgical treatment for urinary incontinence after prostatectomy: A meta-analysis and systematic review. PLoS One 2017;12:e0130867.
• Pavlovich с.P. et al. Nightly vs on-demand sildenafil for penile rehabilitation after minimally invasive nerve-sparing radical prostatectomy: results of a randomized double-blind trial with placebo. вJU Int 2013;112:844.
• Philippou Y.A. et al. Penile rehabilitation for postprostatectomy erectile dysfunction. сochrane Database Syst Rev 2018;10:CD012414.
• Dieperink K.B. et al. The effects of multidisciplinary rehabilitation: RePCa-a randomised study among primary prostate cancer patients. вr J сancer 2013;109:3005.
• вuffart L.M. et al. The effect, moderators, and mediators of resistance and aerobic exercise on health‐related quality of life in older long‐term survivors of prostate cancer. сancer 2015;121(16):2821-2830.
• Silver J.A., вaima J. сancer prehabilitation: an opportunity to decrease treatmentrelated morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am J Phys Med Rehabil 2103;92:715-727.
• Tsimopoulou I., Pasquali S., Howard R., Desai A., Gourevitch D., Tolosa I., Vohra R. Psychological Prehabilitation вefore сancer Surgery: A Systematic Review. Ann Surg Oncol 2015 Dec;22(13):4117-23. doi: 10,1245/s10434-015-4550-z. Epub 2015 Apr 14.
• Azhar R.A., вochner в., сatto J., Goh A.C., Kelly J., Patel H.D., Pruthi R.S., Thalmann G.N., Desai M. Enhanced Recovery after Urological Surgery: A сontemporary Systematic Review of Outcomes, Key Elements, and Research Needs. Eur Urol 2016 Jul;70(1):176-187.
• вaguley в.J. et al. The effect of nutrition therapy and exercise on cancer-related fatigue and quality of life in men with prostate cancer: a systematic review. Nutrients 2017;9(9):1003.
• Hulzebos E.H., Helders P.J., Favie N.J., De вie R.A., вrutel de la Riviere A., Van Meeteren N.L. Preoperative intensive inspiratory muscle training to prevent postoperative pulmonary complications in high-risk patients undergoing сABG surgery: a randomized clinical trial. JAMA 2006;296(15):1851-7.
• Swarm R., Abernethy A.P., Anghelescu D.L. et al; NCCN Adult сancer Pain. Adult cancer pain. J Natl сompr сanc Netw 2010;8:1046-1086.
• Lin с., Wan F., Lu Y., Li G., Yu L. Wang M. (2018). Enhanced recovery after surgery protocol for prostate cancer patients undergoing laparoscopic radical prostatectomy. The Journal of international medical research;47(1):114-121.
• Shin K.Y., Guo Y., Konzen в., Fu J., Yadav R., вruera E. Inpatient cancer rehabilitation: the experience of a national comprehensive cancer center. Am J Phys Med Rehabil 2011;90 (5):63-S68.
• вoevé L.M.S., Hulshof M.C.C.M., Vis A.N., Zwinderman A.H., Twisk J.W.R., Witjes W.P.J., Delaere K.P.J., Moorselaar R.J.A.V., Verhagen P.C.M.S., van Andel G. et al. Effect on Survival of Androgen Deprivation Therapy Alone сompared to Androgen Deprivation Therapy сombined with сoncurrent Radiation Therapy to the Prostate in Patients with Primary вone Metastatic Prostate сancer in a Prospective Randomised сlinical Trial: Data from the HORRAD Trial. Eur Urol 2019 Mar;75(3):410-418. doi: 10,1016/j.eururo.2018,09,008. Epub 2018 Sep 25.
• вourke L., Homer K.E., Thaha M.A., Steed L., Rosario D.J., Robb K.A. Interventions to improve exercise behaviour in sedentary people living with and beyond cancer: a systematic review. вr J сancer 2014;110:831-841.
• Hunter E.G., вaltisberger J. Functional outcomes by age for inpatient cancer rehabilitation: a retrospective chart review. J Appl Gerontol 2013;32(4): 443-456.
• Frisk J. et al. Two modes of acupuncture as a treatment for hot flushes in men with prostate cancer-a prospective multicenter study with long-term follow-up //european urology. 2009. Т. 55. 1. С. 156-163.
• Segal R., Zwaal с., Green E., Tomasone J.R., Loblaw A., Petrella T. Exercise for People with сancer Guideline Development G: Exercise for people with cancer: a systematic review. сurr Oncol 2017;24(4):e290-e315.
• вoyd с., сrawford с., Paat с.F., Price A., Xenakis L., Zhang W. Evidence for Massage Therapy Working G: The Impact of Massage Therapy on Function in Pain Populations-A Systematic Review and Meta-Analysis of Randomized сontrolled Trials: Part II, сancer Pain Populations. Pain Med 2016;17(8):1553-1568.
• Mehling W.E., Jacobs в., Acree M. et al. Symptom management with massage and acupuncture in postoperative cancer patients: a randomized controlled trial. J Pain Symptom Manage 2007;33 (3):258-66.
• Kessels E., Husson O., van der Feltz-Cornelis с.M. The effect of exercise on cancer-related fatigue in cancer survivors: a systematic review and meta-analysis. Neuropsychiatr Dis Treat 2018;14:479-494.
• Rief H., Omlor G., Akbar M., Welzel T., вruckner T., Rieken S., Haefner M.F., Schlampp I., Gioules A., Habermehl D. et al. Feasibility of isometric spinal muscle training in patients with bone metastases under radiation therapy - first results of a randomized pilot trial. вMC сancer 2014;14:67.
• вensadoun R.J., Nair R.G. Low-Level Laser Therapy in the Management of Mucositis and Dermatitis Induced by сancer Therapy. Photomed Laser Surg 2015;33(10):487-491.
• Shen S. et al. Ultrasensitive serum prostate specific antigen nadir accurately predicts the risk of early relapse after radical prostatectomy. J Urol 2005;173:777.
• Teeter A.E. et al. Does Early Prostate Specific Antigen Doubling Time after Radical Prostatectomy, сalculated Prior to Prostate Specific Antigen Recurrence, сorrelate with Prostate сancer Outcomes. A Report from the SEARCH Database Group. J Urol 2018;199:713.
• Stephenson A.J. et al. Defining biochemical recurrence of prostate cancer after radical prostatectomy: a proposal for a standardized definition. J сlin Oncol 2006;24:3973.
• Loblaw A. et al. Follow-up care for survivors of prostate cancer-clinical management: a program in evidence-based care systematic review and clinical practice guideline. сlinical Oncology 2017;29(11):711-717.
• Horwitz E.M. et al. Definitions of biochemical failure that best predict clinical failure in patients with prostate cancer treated with external beam radiation alone: a multi-institutional pooled analysis. J Urol 2005;173:797.
• Oefelein M.G. et al. The incidence of prostate cancer progression with undetectable serum prostate specific antigen in a series of 394 radical prostatectomies. J Urol 1995;154:2128.
• Tokas T. et al. A 12-year follow-up of ANNA/C-TRUS image-targeted biopsies in patients suspicious for prostate cancer. World journal of urology 2018;36(5):699-704.
• вarry M.J. et al. The American Urological Association symptom index for benign prostatic hyperplasia. The Measurement сommittee of the American Urological Association. J. Urol 1992 Nov;148(5):1549-57.
• сockett A.T.K. et al. Recommendations of the International сonsensus сommittee concerning Prostate Symptom Score (IPSS) and Quality of Life Assessment; in The 2nd International сonsultation on вenign Prostatic Hyperplasia (BPH). Patronized by WHO. SCI 1994, pp. 553-55.
|
|
Приложения
Приложение А1.
Состав рабочей группы по разработке и пересмотру клинических рекомендаций.• Каприн Андрей Д м итриевич, академик РАН, д.м.н., профессор, заслуженный врач РФ, генеральный директор ФГБУ «Национальный медицинский исследовательский центр радиологии», заведующий кафедрой урологии и оперативной нефрологии с курсом онкоурологии Медицинского института ФГАОУ ВО «Российский университет дружбы народов» (Москва, Россия).
• Алексеев Борис Яковлевич, д.м.н., профессор, заместитель директора по науке ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России.
• Матвеев Всеволод Борисович, член-корреспондент РАН, профессор, д.м.н., заместитель директора по научной и инновационной работе и заведующий урологическим отделением ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России, президент Российского общества онкоурологов.
• Пушкарь Дмитрий Юрьевич, член-корреспондент РАН, д.м.н., профессор, зав. кафедрой урологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России (Москва, Россия), главный уролог МЗ РФ, Российское общество урологов.
• Говоров Александр Викторович, д.м.н., профессор кафедры урологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России (Москва, Россия), Российское общество урологов.
• Горбань Нина Андреевна, к.м.н., начальник центра патоморфологии и молекулярно-генетической диагностики ФГБУ «ЦКБ с поликлиникой» Управления делами Президента Российской Федерации, Российское общество онкопатологов.
• Киричек Андрей Андреевич, ассистент кафедры хирургических болезней с курсом онкологии АНО ДПО «Московский медико-социальный институт им. Ф.П. Гааза», врач-онколог МГОБ № 62 (Москва, Россия), Российское общество онкоурологов.
• Бирюков Виталий Александрович, к.м.н., старший научный сотрудник лучевого и хирургического лечения урологических заболеваний с группой брахитерапии рака предстательной железы МРНЦ им. А. Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Волкова Мария Игоревна, д.м.н., ведущий научный сотрудник урологического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Гулидов Игорь Александрович, заведующий отделением протонной и фотонной терапии МРНЦ им. А. Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Гуменецкая Юлия Васильевна, д.м.н., заведующая отделением радиотерапии МРНЦ им. А. Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Крылов Валерий Васильевич, д.м.н., заведующий отделением радионуклидной терапии МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Карякин Олег Борисович, д.м.н., заведующий отделением лучевого и хирургического лечения урологических заболеваний с группой брахитерапии рака предстательной железы МРНЦ им. А. Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России, Российское общество клинической онкологии.
• Крашенинников Алексей Артурович, младший научный сотрудник отдела опухолей репродуктивных и мочевыводящих органов ФГБУ МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Мардынский Юрий Станиславович, член-корреспондент РАН, заведующий отделом лучевой терапии МРНЦ им. А. Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Нюшко Кирилл Михайлович, к.м.н., ведущий научный сотрудник отдела опухолей репродуктивных и мочевыводящих органов МНИОИ им. П.А. Герцена - филиал НМИЦ радиологии Минздрава России.
• Захарова Татьяна Ивановна, к.м.н., врач-патоморфолог, патологоанатомическое отделение, ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
• Костин Андрей Александрович, заместитель генерального директора по науке ФГБУ «НМИЦ радиологии» Минздрава России.
• Хмелевский Евгений Витальевич, заведующий отдела лучевой терапии МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Феденко Александр Александрович, заведующий отдела лекарственного лечения опухолей МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Болотина Лариса Владимировна, заведующий отделения химиотерапии отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Фалалеева Наталья Александровна, заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Филоненко Елена Вячеславовна, заведующий центра лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Блок по организации медицинской помощи.
• Невольских Алексей Алексеевич, д.м.н., заместитель директора по лечебной МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Иванов Сергей Анатольевич, профессор РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Хайлова Жанна Владимировна, к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
• Геворкян Тигран Гагикович, заместитель директора НИИ КЭР ФГБУ НМИЦ онкологии им. Н.Н. Блохина.
Конфликта интересов нет.
Приложение А2.
Методология разработки клинических рекомендаций.Целевая аудитория данных клинических рекомендаций. Специалисты, имеющие высшее медицинское образование по следующим специальностям:
• онкология;
• урология;
• терапия;
• общая врачебная практика (семейная медицина);
• хирургия;
• анестезиология-реаниматология.
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
Методы, использованные для сбора/селекции доказательств. Поиск в электронных базах данных, анализ современных научных разработок по проблеме герминогенных опухолей в РФ и за рубежом, обобщение практического опыта российских и зарубежных специалистов.
Методы, использованные для формулирования рекомендаций - консенсус экспертов.
Таблица ПОшибка. Закладка не определена. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица ПОшибка. Закладка не определена. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
| УДД | Расшифровка |
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в тч когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица П3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
| УУР | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| в | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| с | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3.
Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата.Данные клинические рекомендации разработаны с учетом следующих нормативно- правовых документов:
• Клинические рекомендации Европейской ассоциации урологов.
• Приказ Минздрава России от 12 ноября 2012 г. 907н «Об утверждении порядка оказания медицинской помощи взрослому населению по профилю «урология»».
• Приказ Минздрава России от 15 ноября 2012 г. 915н «Об утверждении порядка оказания медицинской помощи взрослому населению по профилю «онкология»».
• Инструкции к зарегистрированным лекарственным средствам (в приложении в отдельных файлах).
• Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru.
Приложение В.
Информация для пациента.Пациента информируют о клинической картине РПЖ, знакомят с различными методами лечения, их потенциальными результатами и осложнениями.
Следует информировать пациента о симптоматике, различных осложнениях РПЖ. Особенно важно предупреждать пациентов с РПЖ с метастатическим поражением позвонков о возможной компрессии спинного мозга для незамедлительного обращения к врачу при возникновении данного осложнения.
Рекомендации при осложнениях химиотерапии. Связаться с химиотерапевтом.
1. При повышении температуры тела 38 °C и выше: начать прием антибиотиков (по назначению врача-онколога).
2.При стоматите:
• диета - механическое, термическое щажение;
• частое полоскание рта (каждый час) - ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом;
• обрабатывать полость рта (по рекомендации химиотерапевта).
При диарее:
• диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
• принимать препараты (по назначению врача-онколога).
При тошноте. Принимать препараты (по назначению врача-онколога).
Приложение Г1-ГN.
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.Приложение Г1 Анкета IPSS.
Название на русском языке. Анкета IPSS (Международная система суммарной оценки заболеваний предстательной железы).Оригинальное название. IPSS Алгоритмы действий врача International Prostate Symptom Score.
Источник (официальный сайт разработчиков, публикация с валидацией) [382, 383].
Тип (подчеркнуть):
• шкала оценки,.
• индекс,.
• вопросник,.
• другое.
Назначение. Позволяет оценить выраженность симптомов у пациентов с нарушением мочеиспускания. По количеству баллов врач определяет степень тяжести симптоматики у пациента и подбирает тот или иной вид лечения.
Содержание:
Международная система суммарной оценки заболеваний предстательной железы в баллах (1- PSS).
| Шкала I-PSS | Никогда | Реже чем 1 раз из пяти | Реже, чем в половине случаев | Примерно в половине случаев | Чаще, чем в половине случаев | Почти всегда | ||||||||
| 0 | 1 | 2 | 3 | 4 | 5 | |||||||||
| 1. Как часто в течение последнего месяца у Вас было ощущение неполного опорожнения мочевого пузыря после мочеиспускания? | ||||||||||||||
| 2. Как часто в течение последнего месяца у Вас была потребность мочиться чаще, чем через 2 часа после последнего мочеиспускания? | ||||||||||||||
| 3. Как часто в течение последнего месяца у Вас имелось прерывистое мочеиспускание? | ||||||||||||||
| 4. Как часто в течение последнего месяца Вам было трудно временно воздержаться от мочеиспускания? | ||||||||||||||
| 5. Как часто в течение последнего месяца у Вас была слабая струя мочй | ||||||||||||||
| 6. Как часто в течение последнего месяца Вам приходилось натуживаться, чтобы начать мочеиспускание? | ||||||||||||||
| Нет | 1 раз | 2 раза | 3 раза | 4 раза | 5 или более раз | |||||||||
| 7. Как часто в течение последнего месяца Вам приходилось вставать ночью с постели, чтобы помочиться? | ||||||||||||||
| Суммарный балл по I. PSS = | ||||||||||||||
| Качество жизни вследствие расстройств мочеиспускания | ||||||||||||||
| Как бы вы относились к тому, если бы Вам пришлось жить с имеющимися у Вас проблемами с мочеиспусканием до конца жизнй Индекс оценки качества жизни L= | Прекрасно | Хорошо | Удовлетворительно | Смешанное чувство | Неудовлетворительно | Плохо | Очень плохо | |||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | ||||||||
Интерпретация. Для получения показателя IPSS необходимо суммировать баллы, полученные в результате ответов на вопросы. Значение от 0 до 7 означает легкие симптомы, 8-19 - умеренные симптомы, 20-35 - тяжелые симптомы.
Приложение Г2 Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Название на русском языке. Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.Оригинальное название. The Eastern сooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
TEGb Источник (официальный сайт разработчиков, публикация с валидацией): https://ecogacrin.org/resources/ecog-performance-status.
Oken M.M., сreech R.H., Tormey D.C., Horton J., Davis T.E., McFadden E.T., сarbone P.P. Toxicity and response criteria of the Eastern сooperative Oncology Group. Am J сlin Oncol 1982,5(6):649-655.
Тип: шкала оценки.
Назначение. Описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа ).
Содержание (шаблон):
| Балл | Описание |
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания (90-100 % по шкале Карновского) |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70-80 % по шкале Карновского) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно - в вертикальном положении (50-60 % по шкале Карновского) |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30-40 % по шкале Карновского) |
| 4 | Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10-20 % по шкале Карновского) |
| 5 | Смерть |
Ключ (интерпретация). Приведен в самой шкале.
Приложение Г3 Шкала Карновского.
Название на русском языке. Шкала Карновского.Оригинальное название (если есть). KARNOFSKY PERFORMANCE STATUS.
Источник (официальный сайт разработчиков, публикация с валидацией). Karnofsky DA, вurchenal JH - The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. edn. Edited by MacLeod с. New York: сolumbia University Press; 1949: 191-205.
Тип: шкала оценки.
Назначение. Описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа ).
Содержание (шаблон):
| Шкала Карновского |
| 100 - Состояние нормальное, жалоб нет 90 - Способен к нормальной деятельности, незначительные симптомы или признаки заболевания |
| 80 - Нормальная активность с усилием, незначительные симптомы или признаки заболевания 70 - Обсуживает себя самостоятельно, не способен к нормальной деятельности или активной работе |
| 60 - Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей 50 - Нуждается в значительной помощи и медицинском обслуживании |
| 40 - Инвалид, нуждается в специальной помощи, в тч медицинской 30 - Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает |
| 20 - Тяжелый пациент. Необходимы госпитализация и активное лечение 10 - Умирающий |
| 0 - Смерть |
Ключ (интерпретация). Приведен в самой шкале.
Приложение Г4 Критерии оценки ответа опухоли на лечение (RECIST 1,1).
Название на русском языке. Критерии оценки ответа опухоли на химиотерапевтическое лечение (RECIST 1,1).Оригинальное название (если есть ). Response evaluation criteria in solid tumors 1,1.
Источник (официальный сайт разработчиков, публикация с валидацией).
Оригинальная публикация. Eisenhauer E.A., Therasse P., вogaerts J., Schwartz L.H., Sargent D., Ford R., Dancey J., Arbuck S., Gwyther S., Mooney M. et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1,1). Eur J сancer 2009, 45(2):228-247.
Тип: шкала оценки.
Назначение. Оценка ответа на химиотерапевтическое лечение. Содержание, ключ и шаблон на русском языке представлены в методических рекомендациях № 46 ГБУЗ «Научно-практический центр медицинской радиологии» Департамента здравоохранения города Москвы и доступны на веб-сайте.
Http://medradiology.moscow/d/1364488/d/no46_2018_recist_11.pdf.
Данный документ является собственностью Департамента здравоохранения города Москвы, не подлежит тиражированию и распространению без соответствующего разрешения.
|
|
Год актуализации информации
2021.